Производные пурина
Номер патента: 4987
Опубликовано: 28.10.2004
Авторы: Мэнтэлл Саймон Джон, Монаган Сандра Марина, Стефенсон Питер Томас
Формула / Реферат
1. Соединение формулы
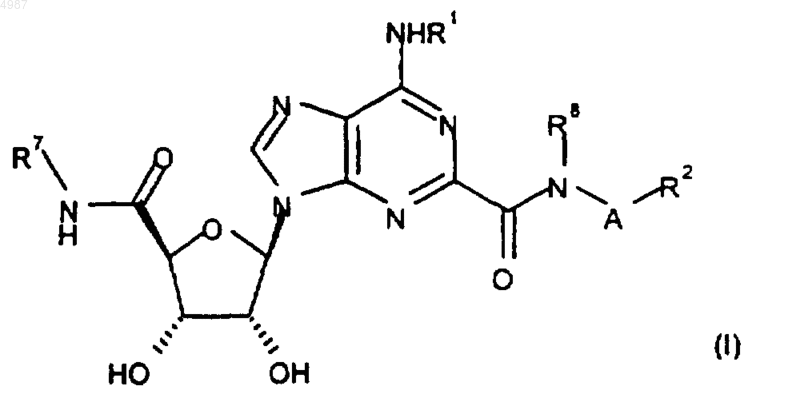
или его фармацевтически приемлемая соль или сольват,
где R1 является водородом, C1-C6алкилом или C3-C7циклоалкилом, каждый из которых необязательно замещен 1 или 2 заместителями, каждый из которых независимо выбирают из гидроксила, флуоренила, фенила и нафтила, где указанные фенил и нафтил необязательно замещены C1-C6алкилом, C1-C6алкокси, галогеном или циано;
A является связью или C1-C6алкиленом;
R2 является (i) водородом, C1-C6алкилом, C3-C7циклоалкилом, фенилом или нафтилом, где указанные C3-C7циклоалкил, фенил и нафтил необязательно замещены C1-C6алкилом, фенилом, C1-C6алкокси-(C1-C6)алкилом, амино-(C1-C6)алкилом, фтор-(C1-C6)алкилом, фтор-(C1-C6)алкокси, C2-C5алканоилом, галогеном, -OR3, циано, -COOR3, C3-C7циклоалкилом, -S(O)mR4, -NR3R3, -SO2NR3R3, -CONR3R3, -NR3COR4 или -NR3SO2R4, при условии, что R2 не является водородом, если A является связью,
или (ii) если A является C2-C6алкиленом, -NR3R3, -OR3, -COOR3, -OCOR4, -SO2R4, -CN, -SO2NR3R3, -NR3SO2R4, -NR3COR4 или -CONR3R3,
или (iii) C-связанным 4-11-членным, моно- или бициклическим гетероциклом, имеющим либо от 1 до 4 атомов азота в кольце, либо от 1 до 2 атомов азота и 1 атом кислорода или 1 атом серы в кольце, необязательно C-замещенным оксо, C1-C6алкокси-(C1-C6)алкилом, амино-(C1-C6)алкилом, фтор-(C1-C6)алкилом, фтор-(C1-C6)алкокси, фтор-(C2-C5)алканоилом, галогеном, циано, -OR5, R6, -COR5, -NR5R5, -COOR5, -S(O)mR6, -SO2NR5R5, -CONR5R5, -NR5SO2R6 или -NR5COR6 и необязательно N-замещенным C1-C6алкокси-(C1-C6)алкилом, амино-(C2-C6)алкилом, фтор-(C1-C6)алкилом, фтор-(C2-C5)алканоилом, R6, -COR5, -COOR6, -SO2R6, -SO2NR5R5 или -CONR5R5,
или (iv) если A является C2-C6алкиленом, N-связанным азетидинилом, пирролидинилом, морфолинилом, тетрагидроизохинолинилом, пиперидинилом или пиперазинилом, где каждый необязательно C-замещен C1-C6алкилом, фенилом, C1-C6алкокси-(C1-C6)алкилом, амино-(C1-C6)алкилом, фтор-(C1-C6)алкилом, фтор-(C1-C6)алкокси, C2-C5алканоилом, галогеном, -OR3, циано, -COOR3, C3-C7циклоалкилом, -S(O)mR4, -NR3R3, -SO2NR3R3, -CONR3R3, -NR3COR4 или -NR3SO2R4, где указанный пиперазинил необязательно N-замещен C1-C6алкилом, фенилом, C1-C6алкокси-(C1-C6)алкилом, амино-(C2-C6) алкилом, фтор-(C1-C6)алкилом, C2-C5алканоилом, -COOR4, C3-C7циклоалкилом, -SO2R4, -SO2NR3R3 или -CONR3R3;
каждый R3 независимо выбирают из H, C1-C6алкила, фенила или пиридинила;
R4 является C1-C6алкилом или фенилом;
R5 является H, C1-C6алкилом, C3-C7циклоалкилом, фенилом, нафтилом или гет;
R6 является C1-C6алкилом, C3-C7циклоалкилом, фенилом, нафтилом или гет;
m равно 0, 1 или 2;
R7 является водородом, C1-C6алкилом, C3-C7циклоалкилом, фенилом, нафтилом, азетидин-3-илом, пирролидин-3-илом, пиперидин-3-илом, пиперидин-4-илом или гет, где указанные азетидин-3-ил, пирролидин-3-ил, пиперидин-3-ил и пиперидин-4-ил необязательно замещены C1-C6 алкилом;
R8 является H или C1-C6алкилом и
"гет", используемый в определениях R5, R6 и R7, означает C-связанный пирролил, имидазолил, триазолил, тиенил, фурил, тиазолил, оксазолил, тиадиазолил, оксадиазолил, пиридинил, пиримидинил, пиридазинил, пиразинил, хинолинил, изохинолинил, бензимидазолил, хиназолинил, фталазинил, бензоксазолил или хиноксалинил, каждый из которых необязательно замещен C1-C6алкилом, C1-C6алкокси, циано или галогеном.
2. Соединение по п.1, в котором R1 является циклогексилом или необязательно замещенным C1-C6алкилом.
3. Соединение по п.2, в котором R1 является необязательно замещенным C1-C5алкилом.
4. Соединение по п.3, в котором R1 является необязательно замещенным C1-C2алкилом.
5. Соединение по любому из пп. 2, 3 или 4, в котором заместители C1-C6, C1-C5 или C1-C2 алкила выбирают из бензила, флуоренила, фенила и гидроксила.
6. Соединение по п.5, в котором, если R1 замещен фенилом, существуют 1 или 2 фенильные группы.
7. Соединение по любому из пп.2-5, в котором R1 выбирают из 2,2-дифенилэтила, циклогексила, 1-этилпропила, 1-бензил-2-гидроксиэтила, 9H-флуорен-9-илметила и 1-бензил-2-фенилэтила.
8. Соединение по п.7, в котором R1 является дифенилэтилом.
9. Соединение по п.8, в котором R1 является 2,2-дифенилэтилом.
10. Соединение по любому из предшествующих пунктов, в котором A является C1-C6алкиленом.
11. Соединение по п.10, в котором A является C1-C4алкиленом.
12. Соединение по п.11, в котором A выбирают из метилена, 1,2-этилена, 1,3-пропилена и 1,4-бутилена.
13. Соединение по п.12, в котором A является 1,2-этиленом.
14. Соединение по любому из предшествующих пунктов, в котором R2 выбирают из фенила, пирролидинила, пиридинила, необязательно замещенного пиперидинила, необязательно замещенного пиперазинила, необязательно замещенного имидазолила, морфолинила, тетрагидроизохинолила, C1-C6алкиламино, ди-C1-C6алкиламино, пиридиниламино и -NR3SO2R4.
15. Соединение по п.14, в котором R2 выбирают из фенила, 2-пиридинила, 1-пиперидинила, 4-пиперазинила, 1-пирролидинила, 4-морфолинила, 3,4-тетрагидро-2(1H)-изохинолинила, C1-C3алкиламино, ди-C1-C3алкиламино и замещенного 1H-имидазол-4-ила.
16. Соединение по п.15, в котором R2 выбирают из 3-изопропиламино, метиламино, диметиламино, диэтиламино, 1-метил-1H-имидазол-4-ила, 5-метил-1H-имидазол-4-ила, 4-метилпиперазин-1-иыр, 1-(2-пропил)пиперидин-4-ила и 2-пиридиламино.
17. Соединение по п.15, в котором R2 является пиперидинилом, необязательно замещенным C1-C6алкилом или метокси.
18. Соединение по п.17, в котором R2 является пиперидинилом, необязательно замещенным в положении 1 или положении 4 C1-C6алкилом или метокси.
19. Соединение по п.18, в котором R2 является N-связанным пиперидинилом, необязательно C-замещенным C1-C6алкилом или метокси.
20. Соединение по п.19, в котором R2 является N-связанным пиперидинилом, необязательно C-замещенным C1-C3алкилом или метокси.
21. Соединение по п.20, в котором R2 является N-связанным пиперидинилом, необязательно C-замещенным метилом, метокси или пропилом.
22. Соединение по п.21, в котором R2 является N-связанным пиперидинилом, необязательно замещенным в положении 4 метилом, метокси или пропилом.
23. Соединение по п.22, в котором R2 является пиперидин-1-илом, 4-(метил)пиперидин-1-илом, 4-(метокси)пиперидин-1-илом или 4-(проп-2-ил)пиперидин-1-илом.
24. Соединение по любому из предшествующих пунктов, в котором R3 является метилом.
25. Соединение по любому из предшествующих пунктов, в котором R4 является метилом или фенилом.
26. Соединение по любому из предшествующих пунктов, в котором R7 является C1-C6 алкилом.
27. Соединение по п.26, в котором R7 является C1-C4алкилом.
28. Соединение по п.27, в котором R7 является этилом или н-пропилом.
29. Соединение по любому из предшествующих пунктов, в котором R8 является H.
30. Соединение по п.1, выбранное из группы, включающей
6-[(2,2-дифенилэтил)амино]-9-{(2R,3R,4S,5S)-5-[(этиламино)карбонил]-3,4-дигидрокситетрагидро-2-фуранил}-N-(2-пиридинилметил)-9H-пурин-2-карбоксамид;
N-бензил-6-[(2,2-дифенилэтил)амино]-9-{(2R,3R,4S,5S)-5-[(этиламино)карбонил]-3,4-дигидрокситетрагидро-2-фуранил}-9H-пурин-2-карбоксамид;
6-[(2,2-дифенилэтил)амино]-9-{(2R,3R,4S,5S)-5-[(этиламино)карбонил]-3,4-дигидрокситетрагидро-2-фуранил}-N-(2-фенилэтил)-9H-пурин-2-карбоксамид;
N-[2-(диметиламино)этил]-6-[(2,2-дифенилэтил)амино]-9-{(2R,3R,4S,5S)-5-[(этиламино)карбонил]-3,4-дигидрокситетрагидро-2-фуранил}-9H-пурин-2-карбоксамид;
6-[(2,2-дифенилэтил)амино]-9-{(2R,3R,4S,5S)-5-[(этиламино)карбонил]-3,4-дигидрокситетрагидро-2-фуранил}-N-[3-(1-пирролидинил)пропил]-9H-пурин-2-карбоксамид;
6-[(2,2-дифенилэтил)амино]-9-{(2R,3R,4S,5S)-5-[(этиламино)карбонил]-3,4-дигидрокситетрагидро-2-фуранил}-N-[2-(2-пиридинил)этил]-9H-пурин-2-карбоксамид;
6-[(2,2-дифенилэтил)амино]-9-{(2R,3R,4S,5S)-5-[(этиламино)карбонил]-3,4-дигидрокситетрагидро-2-фуранил}-N-[2-(4-морфолинил)этил]-9H-пурин-2-карбоксамид;
9-{(2R,3R,4S,5S)-5-[(этиламино)карбонил]-3,4-дигидрокситетрагидро-2-фуранил}-6-[(1-этилпропил)амино]-N-[2-(1-пиперидинил)этил]-9H-пурин-2-карбоксамид;
6-{[(1S)-1-бензил-2-гидроксиэтил]амино}-9-{(2R,3R,4S,5S)-5-[(этиламино)карбонил]-3,4-дигидрокситетрагидро-2-фуранил}-N-[2-(1-пиперидинил)этил]-9H-пурин-2-карбоксамид;
6-[(2,2-дифенилэтил)амино]-9-{(2R,3R,4S,5S)-5-[(этиламино)карбонил]-3,4-дигидрокситетрагидро-2-фуранил}-N-[2-(4-изопропил-1-пиперидинил)этил]-9H-пурин-2-карбоксамид;
N-[2-(3,4-дигидро-2(1H)-изохинолинил)этил]-6-[(2,2-дифенилэтил)амино]-9-{(2R,3R,4S,5S)-5-[(этиламино)карбонил]-3,4-дигидрокситетрагидро-2-фуранил}-9H-пурин-2-карбоксамид;
6-[(2,2-дифенилэтил)амино]-9-{(2R,3R,4S,5S)-5-[(этиламино)карбонил]-3,4-дигидрокситетрагидро-2-фуранил}-N-(4-пиперидинилметил)-9H-пурин-2-карбоксамид;
6-[(2,2-дифенилэтил)амино]-9-{(2R,3R,4S,5S)-5-[(этиламино)карбонил]-3,4-дигидрокситетрагидро-2-фуранил}-N-[4-(1-пиперидинил)бутил]-9H-пурин-2-карбоксамид;
6-[(2,2-дифенилэтил)амино]-9-{(2R,3R,4S,5S)-5-[(этиламино)карбонил]-3,4-дигидрокситетрагидро-2-фуранил}-N-[3-(изопропиламино)пропил]-9H-пурин-2-карбоксамид;
6-[(2,2-дифенилэтил)амино]-9-{(2R,3R,4S,5S)-5-[(этиламино)карбонил]-3,4-дигидрокситетрагидро-2-фуранил}-N-[3-(2-пиридиниламино)пропил]-9H-пурин-2-карбоксамид;
6-[(2,2-дифенилэтил)амино]-9-{(2R,3R,4S,5S)-5-[(этиламино)карбонил]-3,4-дигидрокситетрагидро-2-фуранил}-N-{3-[метил(фенилсульфонил)амино]пропил}-9H-пурин-2-карбоксамид;
6-[(2,2-дифенилэтил)амино]-9-{(2R,3R,4S,5S)-5-[(этиламино)карбонил]-3,4-дигидрокситетрагидро-2-фуранил}-N-{3-[метил(метилсульфонил)амино]пропил}-9H-пурин-2-карбоксамид;
9-{(2R,3R,4S,5S)-5-[(этиламино)карбонил]-3,4-дигидрокситетрагидро-2-фуранил}-6-[(9H-флуорен-9-илметил)амино]-N-[2-(1-пиперидинил)этил]-9H-пурин-2-карбоксамид;
N-[3-(диэтиламино)пропил]-6-[(2,2-дифенилэтил)амино]-9-{(2R,3R,4S,5S)-5-[(этиламино)карбонил]-3,4-дигидрокситетрагидро-2-фуранил}-9H-пурин-2-карбоксамид;
6-[(2,2-дифенилэтил)амино]-9-{(2R,3R,4S,5S)-5-[(этиламино)карбонил]-3,4-дигидрокситетрагидро-2-фуранил}-N-[3-(4-морфолинил)пропил]-9H-пурин-2-карбоксамид;
6-[(2,2-дифенилэтил)амино]-9-{(2R,3R,4S,5S)-5-[(этиламино)карбонил]-3,4-дигидрокситетрагидро-2-фуранил}-N-[3-(метиламино)пропил]-9H-пурин-2-карбоксамид;
6-[(2,2-дифенилэтил)амино]-9-{(2R,3R,4S,5S)-5-[(этиламино)карбонил]-3,4-дигидрокситетрагидро-2-фуранил}-N-[2-(5-метил-1H-имидазол-4-ил)этил]-9H-пурин-2-карбоксамид;
N-[4-(диметиламино)бутил]-6-[(2,2-дифенилэтил)амино]-9-{(2R,3R,4S,5S)-5-[(этиламино)карбонил]-3,4-дигидрокситетрагидро-2-фуранил}-9H-пурин-2-карбоксамид;
6-[(2,2-дифенилэтил)амино]-9-{(2R,3R,4S,5S)-5-[(этиламино)карбонил]-3,4-дигидрокситетрагидро-2-фуранил}-N-[3-(4-метил-1-пиперазинил)пропил]-9H-пурин-2-карбоксамид;
N-[3-(диметиламино)пропил]-6-[(2,2-дифенилэтил)амино]-9-{(2R,3R,4S,5S)-5-[(этиламино)карбонил]-3,4-дигидрокситетрагидро-2-фуранил}-9H-пурин-2-карбоксамид;
6-[(1-бензил-2-фенилэтил)амино]-9-{(2R,3R,4S,5S)-5-[(этиламино)карбонил]-3,4-дигидрокситетрагидро-2-фуранил}-N-[2-(1-пиперидинил)этил]-9H-пурин-2-карбоксамид;
9-{(2R,3R,4S,5S)-3,4-дигидрокси-5-[(пропиламино)карбонил]тетрагидро-2-фуранил}-6-[(2,2-дифенилэтил)амино]-N-[2-(1-пиперидинил)этил]-9H-пурин-2-карбоксамид;
6-[(2,2-дифенилэтил)амино]-9-{(2R,3R,4S,5S)-5-[(этиламино)карбонил]-3,4-дигидрокситетрагидро-2-фуранил}-N-[2-(1-изопропил-4-пиперидинил)этил]-9H-пурин-2-карбоксамид;
6-[(2,2-дифенилэтил)амино]-9-{(2R,3R,4S,5S)-5-[(этиламино)карбонил]-3,4-дигидрокситетрагидро-2-фуранил}-N-[2-(4-метил-1-пиперидинил)этил]-9H-пурин-2-карбоксамид;
6-[(2,2-дифенилэтил)амино]-9-{(2R,3R,4S,5S)-5-[(этиламино)карбонил]-3,4-дигидрокситетрагидро-2-фуранил}-N-[2-(4-метокси-1-пиперидинил)этил]-9H-пурин-2-карбоксамид;
6-[(2,2-дифенилэтил)амино]-9-{(2R,3R,4S,5S)-5-[(этиламино)карбонил]-3,4-дигидрокситетрагидро-2-фуранил}-N-[(1-метил-1H-имидазол-4-ил)метил]-9H-пурин-2-карбоксамид и
6-(циклогексиламино)-9-{(2R,3R,4S,5S)-5-[(этиламино)карбонил]-3,4-дигидрокситетрагидро-2-фуранил}-N-[2-(1-пиперидинил)этил]-9H-пурин-2-карбоксамид
или их фармацевтически приемлемые соль или сольват.
31. Фармацевтическая композиция, включающая соединение формулы (I) по любому из предшествующих пунктов или его фармацевтически приемлемую соль или сольват, вместе с фармацевтически приемлемым наполнителем, разбавителем или носителем.
32. Применение соединения формулы (I) по любому из пп.1-30 или его фармацевтически приемлемой соли или сольвата для производства лекарственного средства для лечения заболеваний, для которых показан агонист A2a рецептора.
33. Применение соединения формулы (I) по любому из пп.1-30 или его фармацевтически приемлемой соли или сольвата для производства противовоспалительного агента.
34. Применение соединения формулы (I) по любому из пп.1-30 или его фармацевтически приемлемой соли или сольвата для производства лекарственного средства для лечения респираторного заболевания.
35. Применение по п.34, где заболевание выбирают из группы, включающей респираторный дистресс-синдром у взрослых (РДСВ), бронхшт, хронический бронхит, хроническое обструктивное заболевание легких, муковисцидоз, астму, эмфизему, бронхоэктаз, хронический синусит и ринит.
36. Применение соединения формулы (I) по любому из пп.1-30 или его фармацевтически приемлемой соли или сольвата для производства лекарственного средства для лечения септического шока, дисфункции эрекции у мужчин, гипертензии, удара, эпилепсии, церебральной ишемии, заболеваний периферических сосудов, постишемической реперфузии, диабета, ревматоидного артрита, рассеянного склероза, псориаза, аллергических дерматитов, экземы, язвенного колита, болезни Крона, воспаления толстой кишки, Heliobacter pylori-гастрита, не Heliobacter pylori-гастрита, повреждений желудочно-кишечного тракта, вызванных нестероидными противовоспалительными средствами или психиатрических расстройств, или для заживления ран.
37. Способ лечения млекопитающих, включая человека, для лечения заболеваний, для которых показан агонист A2a рецептора, включающий лечение указанного млекопитающего эффективным количеством соединения формулы (I) по любому из пп.1-30 или его фармацевтически приемлемой соли, сольвата или их композиции.
38. Способ лечения млекопитающих, включая человека, для лечения воспалительных заболеваний, включающий лечение указанного млекопитающего эффективным количеством соединения формулы (I) по любому из пп.1-30 или его фармацевтически приемлемой соли, сольвата или их композиции.
39. Способ лечения млекопитающих, включая человека, для лечения респираторных заболеваний, включающий лечение указанного млекопитающего эффективным количеством соединения формулы (I) по любому из пп.1-30 или его фармацевтически приемлемой соли, сольвата или их композиции.
40. Способ по п.39, где заболевание выбирают из группы, включающей респираторный дистресс-синдром у взрослых (РДСВ), бронхит, хронический бронхит, хроническое обструктивное заболевание легких, муковисцидоз, астму, эмфизему, бронхоэктаз, хронический синусит и ринит.
41. Способ лечения млекопитающих, включая человека, для лечения септического шока, дисфункции эрекции у мужчин, гипертензии, удара, эпилепсии, церебральной ишемии, заболеваний периферических сосудов, постишемической реперфузии, диабета, ревматоидного артрита, рассеянного склероза, псориаза, аллергических дерматитов, экземы, язвенного колита, болезни Крона, воспаления толстой кишки, Heliobacter pylori-гастрита, не Heliobacter pylori-гастрита, повреждений желудочно-кишечного тракта, вызванных нестероидными противовоспалительными средствами или психиатрических расстройств, или для заживления ран, включающий лечение указанного млекопитающего эффективным количеством соединения формулы (I) по любому из пп.1-30 или его фармацевтически приемлемой соли, сольвата или их композиции.
42. Способ получения соединения формулы (I) или его фармацевтически приемлемой соли по п.1, включающий стадии взаимодействия сложного эфира формулы (II)
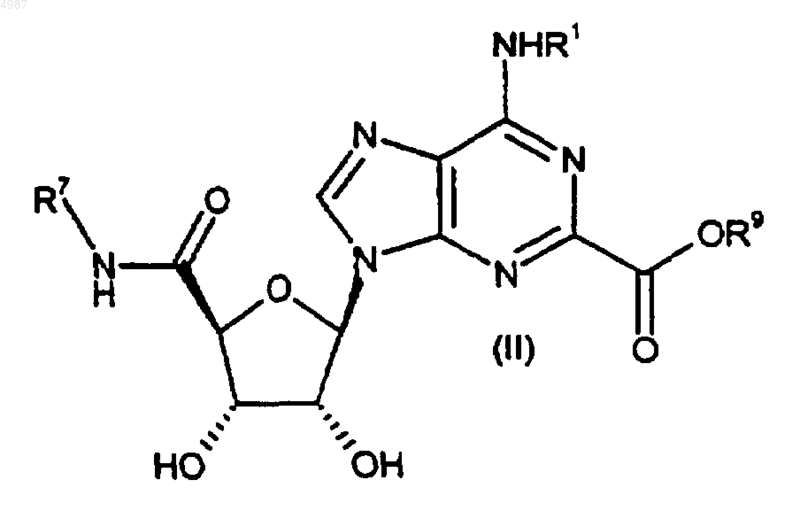
с амином формулы R2-A-NHR8 (X), где R1-R8, A, "гет" и m, если присутствуют, имеют значения, определенные в п.1.
43. Способ получения соединения формулы (I) или его фармацевтически приемлемой соли по п.1, включающий снятие защиты у соединения формулы (XIII)
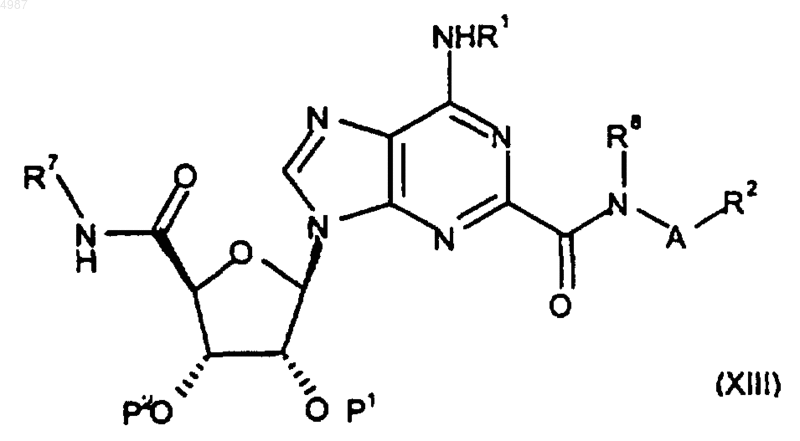
где P1 и P2 являются защитными группами и где R1-R8, A, "гет" и m, если присутствуют, имеют значения, определенные в п.1.
44. Способ получения соединения формулы (I) или его фармацевтически приемлемой соли по п.1, включающий конденсацию кислоты формулы (XIX) с амином формулы R2-A-NHR8 (X)
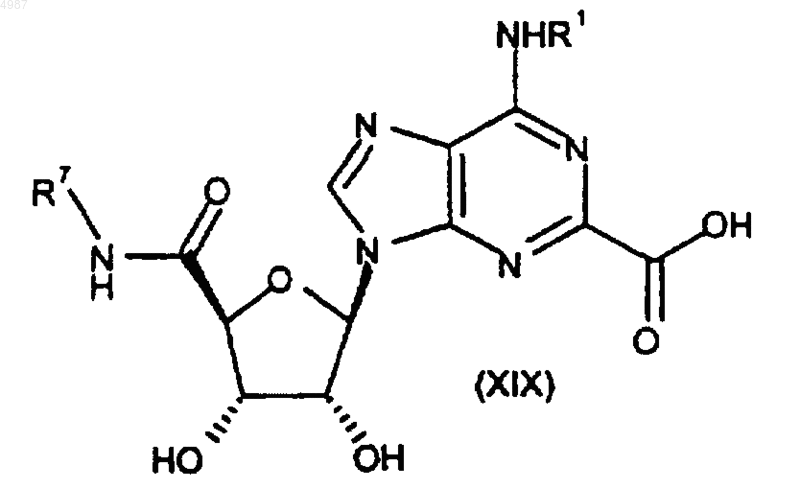
45. Способ получения соединения формулы (I) или его фармацевтически приемлемой соли по п.1, включающий реакцию аминокарбонилирования соединения формулы (XIXb)
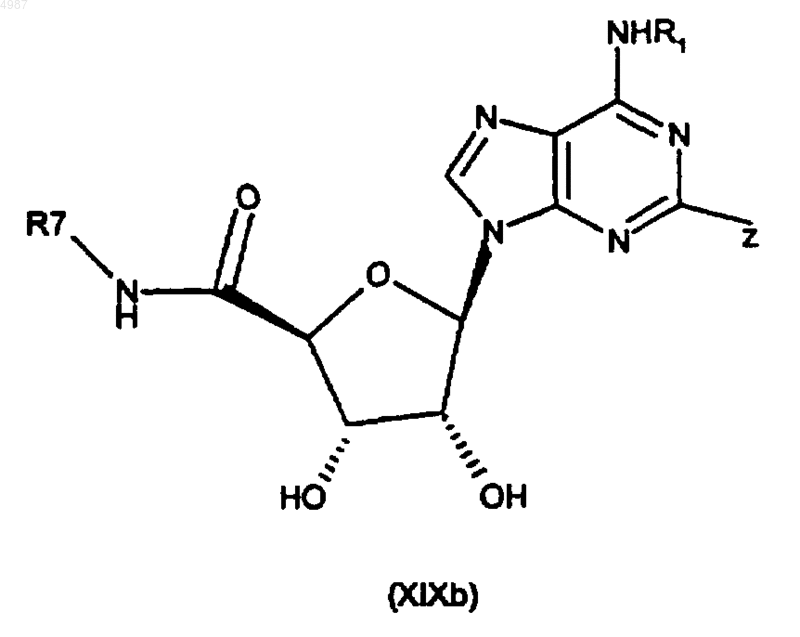
где Z является подходящей уходящей группой, с соединением формулы R2-A-NHR8 (X) в присутствии окиси углерода.
Текст
1 Данное изобретение относится к определенным производным пурина. Более конкретно,данное изобретение относится к производным пурин-2-илкарбоксамида, к их получению и к композициям, использованию и промежуточным соединениям, используемым для их получения. Данные производные являются селективными функциональными агонистами А 2 а рецептора аденозина человека и могут быть использованы в качестве противовоспалительных агентов при лечении, среди прочих, заболеваний дыхательных путей. Аденозин представляет собой убиквитарную молекулу, играющую центральную роль в промежуточном обмене у млекопитающих. Независимо аденозин действует на множественные поверхностные рецепторы, вызывая различные реакции. Классификация рецепторов показывает присутствие по крайней мере четырех подтипов: А 1, А 2 а, А 2b и A3. Описано, что стимуляция А 2 рецепторов аденозина на поверхности нейтрофилов человека значительно ингибирует ряд функций нейтрофила. Активированные нейтрофилы могут повредить ткань легких, выделяя реакционноспособные частицы кислорода, такие как радикалы анионов надперекиси (О 2-) и гранулированные продукты, такие как эластаза нейтрофила человека (ЭНЧ), среди других воспалительных медиаторов. Кроме того, активированные нейтрофилы осуществляют как denovo синтез, так и выделение продуктов арахидоната, таких как лейкотриен В 4 (ЛТВ 4). ЛТВ 4 является мощным химическим аттрактантом,который вовлекает дополнительные нейтрофилы в воспалительный фокус, в то время как выделяемые О 2- и ЭНЧ неблагоприятно влияют на внеклеточную матрицу легких. Подтип рецептора А 2, медиирующий многие из этих реакций(О 2- и ЛТВ 4/ЭНЧ выделение и клеточную адгезию), определен как А 2 а. Подтип А 2 (А 2 а или А 2b), медиирующий другие эффекты, еще устанавливается. Считается, что селективное агонистическое действие на рецептор А 2 а имеет большой терапевтический потенциал по сравнению с неселективными агонистами рецептора аденозина,так как взаимодействие с другими подтипами рецептора связано с неблагоприятными эффектами на легкие при изучении животных моделей и ткани легких человека. Например, у астматиков, в отличие от не астматиков, при введении аденозина ингаляцией, возникает бронхостеноз. Такая реакция возникает, по крайней мере, частично из-за активации подтипа рецептора А 1. Активация A1 рецептора также содействует хемотаксису нейтрофилов и адгезии к эндотелиальным клеткам, тем самым вызывая повреждение легких. Более того, многим пациентам с респираторными заболеваниями также прописывают агонисты 2, и при изучении на животных было показано отрицательное взаимодействие между изопреналином и рецепторами аде 004987 2 нозина, отрицательно связанными с аденилат циклазой. Дегранулирование клеток молочных желез человека промотируется активацией А 2b рецепторов аденозина, таким образом, селективность по отношению к данному рецептору является преимуществом. Было неожиданно обнаружено, что данные производные пурина настоящего изобретения ингибируют функцию нейтрофила и являются селективными агонистами А 2 а рецептора аденозина. Соединения в соответствии с настоящим изобретением могут быть использованы для лечения любых заболеваний, для которых показан агонист А 2 а рецептора аденозина. Они могут быть использованы для лечения заболеваний, в которых имеет место повреждение тканей, вызванное лейкоцитами (например, нейтрофилом, эозинофилом, базофилом, лимфоцитом, макрофагом). Они используются в качестве противовоспалительных агентов при лечении заболеваний дыхательных путей, таких как респираторный дистресс-синдром у взрослых(РДСВ), бронхит, хронический бронхит, хроническое обструктивное заболевание легких, муковисцидоз, астма, эмфизема, бронхоэктаз, хронический синусит и ринит. Соединения в соответствии с данным изобретением также могут быть использованы при лечении септического шока, дисфункции эрекции у мужчин, гипертензии, удара, эпилепсии, церебральной ишемии,заболеваний периферических сосудов, постишемической реперфузии, диабета, ревматоидного артрита, рассеянного склероза, псориаза,аллергических дерматитов, экземы, язвенного колита, болезни Крона, воспаления толстой кишки, Heliobacter pylori-гастрита, не Heliobacter pylori-гастрита, повреждений желудочнокишечного тракта, вызванных нестероидными противовоспалительными средствами или психиатрических расстройств, или для заживления ран. Следовательно, в одном аспекте данное изобретение относится к соединению формулы или его фармацевтически приемлемой соли или сольвату,где R1 является водородом, C1-С 6 алкилом или С 3-С 7 циклоалкилом, каждый необязательно замещенный 1 или 2 заместителями, каждый из которых независимо выбирают из гидроксила,флуоренила, фенила и нафтила, где указанные фенил и нафтил необязательно замещены C1-С 6 алкилом, C1-C6 алкокси, галогеном или циано; А является связью или С 1-С 6 алкиленом;R2 является (i) водородом, C1-C6 алкилом,С 3-С 7 циклоалкилом, фенилом или нафтилом,где указанные С 3-С 7 циклоалкил, фенил и нафтил необязательно замещены C1-С 6 алкилом,фенилом, С 1-С 6 алкокси-(C1-C6)алкилом, амино(C1-С 6)алкилом, фтор-(C1-С 6)алкилом, фтор-(C1C6)алкокси, С 2-С 5 алканоилом, галогеном, -OR3,циано, -COOR3, C3-C7 циклоалкилом, -S(O)mR4,-NR3R3, -SO2NR3R3, -CONR3R3, -NR3COR4 или-CONR R ,или (iii) С-связанным 4-11-членным, моноили бициклическим гетероциклом, имеющим либо от 1 до 4 атомов азота в кольце, либо от 1 до 2 атомов азота и 1 атом кислорода или 1 атом серы в кольце, необязательно С-замещенным оксо, C1-С 6 алкокси-(C1-С 6)алкилом, амино-(C1C6)алкилом, фтор-(С 1-С 6)алкилом, фтор-(C1C6)алкокси, фтор-(С 2-С 5)алканоилом, галогеном,циано, -OR5, R6, -COR5, -NR5R5, -COOR5,-S(O)mR6, -SO2NR5R5, -CONR5R5, -NR5SO2R6 или-NR5COR6 и необязательно N-замещенным (C1 С 6)алкокси-(C1-C6)алкилом, амино-(C1-C6)алкилом, фтор-(C1-С 6)алкилом, фтор-(С 2-С 5)алканоилом, R6, -COR5, -COOR6, -SO2R6, -SO2NR5R5 или -CONR5R5,или (iv) если А является С 2-С 6 алкиленом,N-связанным азетидинилом, пирролидинилом,морфолинилом,тетрагидроизохинолинилом,пиперидинилом или пиперазинилом, где каждый необязательно С-замещен С 1-С 6 алкилом,фенилом, С 1-С 6 алкокси-(C1-C6)алкилом, амино(C1-С 6)алкилом, фтор-(C1-C6)алкилом, фтор-(С 1 С 6)алкокси, С 2-С 5 алканоилом, галогеном, -OR3,циано, -COOR3, С 3-С 7 циклоалкилом, -S(O)mR4,-NR3R3, -SO2NR3R3, -CONR3R3, -NR3COR4 или-NR3SO2R4, где указанный пиперазинил необязательно N-замещен C1-C6 алкилом, фенилом,C1-С 6 алкокси-(C1-C6)алкилом, амино-(С 2-С 6)алкилом, фтор-(C1-C6)алкилом, C2-C5 алканоилом,-COOR4,С 3-С 7 циклоалкилом,-SO2R4,3 3 3 3-SO2NR R или -CONR R ; каждый R3 независимо выбирают из Н, C1C6 алкила, фенила или пиридинила; 4 гет, используемый в определениях R5, R6 и R , означает С-связанный пирролил, имидазолил, триазолил, тиенил, фурил, тиазолил, оксазолил, тиадиазолил, оксадиазолил, пиридинил,пиримидинил, пиридазинил, пиразинил, хинолинил, изохинолинил, бензимидазолил, хиназолинил, фталазинил, бензоксазолил или хиноксалинил, каждый из которых необязательно замещен C1-C6 алкилом, C1-С 6 алкокси, циано или галогеном. Предпочтительно R1 является циклогексилом или необязательно замещенным C1C6 алкилом. Более предпочтительно R1 является необязательно замещенным C1-C5 алкилом и наиболее предпочтительно R1 является необязательно замещенным C1-C2 алкилом. Предпочтительно заместители C1-С 6, C1-C5 или C1-C2 алкилов выбирают из бензила, флуоренила, фенила и гидроксила. Предпочтительно, если R1 замещен фенилом, существуют 1 или 2 фенильные группы. Предпочтительно R1 выбирают из 2,2 дифенилэтила, циклогексила, 1-этилпропила, 1 бензил-2-гидроксиэтила, 9 Н-флуорен-9-илметила и 1-бензил-2-фенилэтила. ПредпочтительноC1-С 3 алкилом или метокси. Предпочтительно R2 является N-связанным пиперидинилом, необязательно С-замещенным метилом, метокси или пропилом. Предпочтительно R2 является N-связанным пиперидинилом, необязательно замещенным в положении 4 метилом, метокси или пропилом. Предпочтительно R2 является пиперидин 1-илом, 4-(метил)пиперидин-1-илом, 4-(метокси)пиперидин-1-илом или 4-(проп-2-ил)пиперидин-1-илом. Предпочтительно R3 является метилом. Предпочтительно R4 является метилом или фенилом. Предпочтительно R7 является C1-C6 алкилом. Предпочтительно R7 является C1-C4 алкилом. Предпочтительно R7 является этилом или н-пропилом. Предпочтительно R8 является Н. В другом аспекте данное изобретение представляет соединение формулы (II), (III),(XI), (XIII), (XIV), (XV), (XVI), (XIX), (XIXb),(XIXc) или (XIXd). где R1-R8, А, гет и m, если присутствуют,имеют значения, определенные выше; Р 1, Р 2 и Р 3 являются защитными группами; и Z является уходящей группой. В другом аспекте данного изобретения представлен способ получения соединения формулы (I) или его фармацевтически приемлемой соли, включающий стадии взаимодействия сложного эфира формулы (II) с амином формулы R2-A-NHR8 (X), где R1-R8, А,гет и m, если присутствуют, имеют значения,определенные выше. В другом аспекте данного изобретения,представлен способ получения соединения формулы (II) включающий стадию снятия защиты с соединения формулы (III) где Р 1 и Р 2 являются защитными группами, которые могут быть одинаковыми или разными или могут быть частью одной и той же защитной группы, и где R1-R8, А, гет и m, если присутствуют, имеют значения, определенные выше. В другом аспекте данного изобретения представлен способ получения соединения формулы (III) где соединение формулы (IV) получают из N,Oбис(триметилсилил)ацетамида и затем подвергают взаимодействию с соединением формулы(XI), и где R1-R8, А, гет и m, если присутствуют, имеют значения, определенные выше. В другом аспекте данного изобретения представлен способ получения соединения формулы (IV) включающий алкоголиз и последующий гидролиз нитрила формулы (V) где R1-R8, А, гет и m, если присутствуют,имеют значения, определенные выше. В другом аспекте данного изобретения представлен способ получения соединения формулы (V) включающий снятие защиты у соединения формулы (VI) включающий стадию взаимодействия соединения формулы (XI) где P3 является защитной группой, и R1-R8, А,гет и m, если присутствуют, имеют значения,определенные выше. В другом аспекте данного изобретения представлен способ получения соединения формулы (VI) включающий замещение хлора в соединении формулы (VII) цианогруппой, где R1-R8, А, гет и m, если присутствуют, имеют значения, определенные выше. В другом аспекте данного изобретения представлен способ получения соединения формулы (VII) включающий взаимодействие соединения формулы (VIII) с амином формулы R1NH2 (XII), где R1-R6, А,гет и m, если присутствуют, имеют значения,определенные выше. В другом аспекте данного изобретения представлен способ получения соединения формулы (VIII) В представленных выше определениях галоген означает фтор, хлор, бром или йод и алкил, алкилен, алканоил и алкоксигруппы, со 004987 10 держащие указанное количество атомов углерода, могут иметь неразветвленную или разветвленную цепь. Гетероцикл, определенный в R2,часть (iii), может быть ароматическим или полностью, или частично насыщенным. Выражение С-связанный, используемое в определенияхR2 и гет, означает, что группа связана с соседним атомом через атом углерода кольца. Выражение N-связанный, используемое в определениях R2, означает, что группа связана с соседним атомом через атом азота кольца. Примеры алкила включают метил, этил, н-пропил, изопропил, н-бутил, изобутил, втор-бутил и третбутил. Примеры алкокси включают метокси,этокси, н-пропокси, изопропокси, н-бутокси,изобутокси, втор-бутокси и трет-бутокси. Примеры алкилена включают метилен, 1,1-этилен,1,2-этилен, 1,3-пропилен и 1,2-пропилен. Примеры циклоалкила включают циклопропил,циклобутил, циклопентил, циклогексил и циклогептил. Фармацевтически приемлемые соли соединений формулы (I) включают их кислотноаддитивные соли и основные соли. Подходящие кислотно-аддитивные соли получают из кислот,которые дают нетоксичные соли, примерами которых являются гидрохлорид, гидробромид,гидройодид, сульфат, бисульфат, нитрат, фосфат, кислый фосфат, ацетат, малеат, фумарат,лактат, тартрат, цитрат, глюконат, сукцинат,сахарат, бензоат, метансульфонат, этансульфонат, бензолсульфонат, п-толуолсульфонат и пальмоат. Подходящие основные соли получают из оснований, которые дают нетоксичные соли,примерами которых являются соли натрия, калия, алюминия, кальция, магния, цинка и диэтаноламина. Обзор подходящих солей можно найти вBerge et al., J. Pharm. Sci., 1977, 66, 1-19. Фармацевтически приемлемые сольваты соединения формулы (I) включают его гидраты. Также в объем данного изобретения включены полиморфы соединений формулы (I). Соединение формулы (I) может содержать один или более дополнительных асимметричных атома углерода и, следовательно, существовать в двух или более стереоизомерных формах. Данное изобретение охватывает отдельные стереоизомеры соединений формулы (I), а также их смеси, где это возможно, вместе с отдельными таутомерами соединений формулы (I) и их смесями. Разделение диастереоизомеров может быть проведено обычными методами, например,фракционной кристаллизацией, хроматографией или ВЭЖХ стереоизомерной смеси соединения формулы (I) или его подходящей соли или производного. Отдельный энантиомер соединения формулы (I) также может быть получен из соответствующего оптически чистого промежуточного соединения или разделением, таким как 11 ВЭЖХ, соответствующего рацемата с использованием подходящей хиральной подложки, или фракционной кристаллизацией диастереоизомерных солей, полученных взаимодействием соответствующего рацемата с подходящей оптически активной кислотой или основанием,подходящим образом. Все соединения формулы (I) могут быть получены обычными методами, такими как методики, описанные в общих методах, представленных ниже, или специальными методами,описанными в примерах, или подобными методами. Данное изобретение также охватывает любой один или большинство этих способов получения соединения формулы (I), в дополнение к любым новым промежуточным соединениям, использованным в них. В описанных общих методах R1, R2, R7, R8 и А имеют значения,определенные выше для соединения формулы(I), если не указано иначе. Все соединения формулы (I) могут быть получены методом, описанным на схеме 1, гдеR9 является C1-C4 алкилом, предпочтительно метилом или этилом, и Р 1, Р 2 и P3 являются защитными группами. Схема 1 Согласно схеме 1 соединения формулы (I) могут быть получены взаимодействием сложного эфира формулы (II) с амином формулы(X) Реакция может проводиться при повышенной температуре, предпочтительно от 100 до 150 С и необязательно в присутствии подходящего растворителя, такого как этанол. В обычной методике, соединение формулы (II) и амин формулы (X) нагревают вместе при температуре около 120 С. Соединения формулы (II) могут быть получены снятием защиты у соединения формулы (III), где защитные группы Р 1 и Р 2 могут быть одинаковыми или разными и необязательно могут образовывать часть одной и той же защитной группы. Примеры подходящих 12 защитных групп известны специалистам в данной области техники [например, см. ProtectingWiley and Sons, 1991]. Предпочтительными индивидуальными защитными группами являются алканоил и ароил. Предпочтительными защитными группами, когда Р 1 и Р 2 образуют часть одной и той же защитной группы, являются такие, в которых Р 1 и Р 2, взятые вместе, являютсяC1-С 6 алкиленом. Особенно предпочтительными отдельными защитными группами являются ацетил и бензоил. Особенно предпочтительно защитной группой, когда Р 1 и Р 2 образуют часть одной и той же защитной группы, является такая, в которой Р 1 и Р 2, взятые вместе, являются диметилметиленом. Подходящие условия для снятия защиты хорошо известны в данной области техники [например, см. Protecting GroupsSons, 1991]. В обычной методике, если Р 1 и Р 2 каждая является бензоилом, защитные группы могут быть удалены обработкой раствора соединения формулы (III) в подходящем растворителе, таком как метанол, основанием, таким как карбонат калия, обычно при комнатной температуре. Соединения формулы (III) могут быть получены взаимодействием соединения формулы (XI)N,О-бис(триметилсилил)ацетамида. В обычной методике соединение формулы (IV) нагревают в присутствии подходящего растворителя, такого как 1,1,1 трихлорэтан, и N,О-бис(триметилсилил)ацетамида при повышенной температуре, предпочтительно при температуре кипения. Затем смесь охлаждают и растворитель удаляют. Остаток обрабатывают раствором соединения формулы(XI) в подходящем растворителе, таком как толуол, с последующей обработкой триметилсилилтрифторметансульфонатом и смесь нагревают в атмосфере азота при температуре между комнатной температурой и температурой кипения выбранного растворителя, с получением соединения формулы (III). При использовании толуола, например, предпочтительна температура 110 С. Соединения формулы (IV) могут быть получены последовательным алкоголизом и гидролизом нитрила формулы (V). В обычной методике раствор нитрила формулы (V) в спиртовом растворителе R9OH обрабатывают алкок 13 сидом натрия формулы R9ONa и нагревают при температуре кипения (R9 такой, как определен выше). Полученную смесь охлаждают, выпаривают, растворяют в подходящем растворителе,таком как тетрагидрофуран и обрабатывают кислотой, такой как хлористо-водородная кислота,предпочтительно 2 н. хлористоводородная кислота, с получением соединения формулы (IV). Соединения формулы (V) могут быть получены снятием защиты у соединения формулы (VI), где P3 является подходящей защитной группой. Примеры подходящих защитных групп очевидны для специалистов в данной области техники [например, см. ProtectingWiley and Sons, 1991]. Предпочтительной защитной группой является такая, в которой P3 является тетрагидропиран-2-илом. Подходящие условия для снятия защиты хорошо известны в данной области техники [например, см. Protecting Groups in Organic Synthesis (второе издание), Theodora W. Green and Peter G.M. Wuts,John Wiley and Sons, 1991]. В обычной методике, где Р 3 является тетрагиропиран-2-илом, защитная группа может быть удалена обработкой раствора соединения формулы (VI) в подходящем растворителе, таком как этанол, кислотой,такой как хлористо-водородная кислота. Соединения формулы (VI) могут быть получены замещением группы хлора в соединении формулы(VII) цианогруппой. В обычной методике раствор соединения формулы (VII) в подходящем растворителе, таком как N,N-диметилформамид,обрабатывают цианидом цинка, тетракис(трифенилфосфин)палладием(0) и акцептором кислоты, таким как триметиламин, и нагревают в атмосфере азота до температуры от 80 до 120 С, предпочтительно до 100 С. Продукт реакции обычно загрязнен некоторым количеством соответствующего соединения формулы(V), которое может быть отделено обычной хроматографией. Соединения формулы (VII) могут быть получены взаимодействием соединения формулы(XII) В обычной методике раствор соединения формулы (VIII) в подходящем растворителе,таком как изопропиловый спирт, обрабатывают соединением формулы (XII) и нагревают до кипения, не обязательно в присутствии акцептора кислоты, такого как N-этил-N-изопропил-2 пропиламин. Соединения формулы (VIII) могут быть получены снятием защиты у 2,6-дихлор 9 Н-пурина (IX). Примеры подходящих защитных групп Р 3 очевидны для специалистов в данной области техники [например, см. ProtectingWiley and Sons, 1991]. Предпочтительной защитной группой является такая, в которой Р 3 14 является тетрагидропиран-2-илом. Подходящие условия для снятия защиты хорошо известны в данной области техники [например, см. Protecting Groups in Organic Synthesis (второе издание), Theodora W. Green and Peter G.M. Wuts,John Wiley and Sons, 1991] . В обычной методике, где P3 является тетрагиропиран-2-илом, раствор 2,6-дихлор-9 Н-пурина (IX) и кислого катализатора, такого как моногидрат 4-толуолсульфокислоты, в подходящем растворителе,таком как этилацетат, нагревают до температуры от 30 до 70 С, предпочтительно до 50 С, и обрабатывают раствором 2,3-дигидропирана в подходящем растворителе, таком как этилацетат. Все соединения формулы (I) могут быть получены способом, описанным на схеме 2, где Согласно схеме 2, соединения формулы (I) могут быть получены снятием защиты с соединения формулы (XIII). Подходящие условия для снятия защиты хорошо известны специалистам в данной области техники [например, см. Protecting Groups in Organic Synthesis (второе издание), Theodora W. Green and Peter G.M. Wuts,John Wiley and Sons, 1991]. В обычной методике, где Р 1 и Р 2 каждая является бензоилом, защитные группы могут быть удалены обработкой раствора соединения формулы (XIII) в подходящем растворителе, таком как метанол, основанием, таким как карбонат калия, обычно при комнатной температуре. Соединения формулы(XIII) могут быть получены взаимодействием соединения формулы (XI)(где Р 1 и Р 2 имеют значения, определенные выше) с триметилсилилтрифторметансульфонатом и соединением формулы (XIV), которое является производным N,O-биc(триметилсилил)ацет 15 амида. В обычной методике соединение формулы (XIV) нагревают в присутствии подходящего растворителя, такого как 1,1,1-трихлорэтан, иN,О-бис(триметилсилил)ацетамида при повышенной температуре, предпочтительно при температуре кипения. Затем смесь охлаждают и растворитель удаляют. Остаток обрабатывают раствором соединения формулы (XI) в подходящем растворителе, таком как толуол, с последующей обработкой триметилсилилтрифторметансульфонатом и смесь нагревают в атмосфере азота при температуре между комнатной температурой и температурой кипения выбранного растворителя, с получением соединения формулы (XIII). При использовании толуола, например, предпочтительна температура 90 С. Соединения формулы (XIV) могут быть получены снятием защиты у соединения формулы (XV). Подходящие условия для снятия защиты хорошо известны в данной области техники [например, см. Protecting Groups in Organic SynthesisG.M. Wuts, John Wiley and Sons, 1991]. В обычной методике, где Р 3 является тетрагидропиран 2-илом, защитная группа может быть удалена обработкой раствора соединения формулы (XV) в подходящем растворителе, таком как этанол,кислотой, такой как хлористо-водородная кислота. Соединения формулы (XV) могут быть получены взаимодействием сложного эфира формулы (XVI) с амином формулы (X)(X) при повышенной температуре, предпочтительно при 100-150 С. В обычной методике соединения формулы (XVI) и амин формулы (X) нагревают вместе при температуре 130 С. Соединения формулы (XVI) могут быть получены алкоголизом с последующим гидролизом нитрила формулы (VI). В обычной методике раствор нитрила формулы (VI) в спиртовом растворителеR9OH обрабатывают алкоксидом натрия формулы R9ONa и нагревают до кипения. Полученную смесь охлаждают, выпаривают, растворяют в подходящем растворителе, таком как смесь тетрагидрофурана и воды (предпочтительно 3:1 по объему) и обрабатывают кислотой, такой как уксусная кислота. Полученную смесь нагревают при повышенной температуре, предпочтительно при температуре кипения, с получением соединения формулы (XVI). Соединения формулы (XI), используемые в схемах 1 и 2, могут быть получены согласно схеме 3, где Р 1 и Р 2 имеют значения, определенные выше. Схема 3 Соединения формулы (XI) могут быть получены обработкой соединения формулы (XVII) смесью уксусной кислоты, уксусного ангидрида 16 и сильной кислоты, такой как хлористоводородная кислота или серная кислота, при охлаждении (обычно до -10 С). Соединение формулы (XVII) может быть получено из кислоты формулы (XVIII) активацией кислоты как,например, хлорангидрида, и обработкой такого активированного промежуточного соединения амином формулы (ХIХа)(XIXa) В обычной методике соединение формулы(XVIII) растворяют в подходящем инертном растворителе (например, дихлорметане) и обрабатывают оксалилхлоридом и каталитическим количеством N,N-диметилформамида. После удаления избытка растворителя и реагента выпариванием при пониженном давлении, остаток растворяют в безводном дихлорметане и обрабатывают амином формулы (XIXa). Что касается условий, используемых на последующих стадиях, может быть полезным заменить защитные группы Р 1 и Р 2 в соединениях формулы (XVII). Альтернативно, подходящие защитные группы хорошо известны специалистам в данной области техники [например, см. Protecting Groups inSons, 1991]. В обычной методике раствор соединения формулы (XVII), где Р 1 и Р 2, взятые вместе, являются диметилметиленом, в подходящем растворителе, таком как метанол, может быть обработан кислотой, такой как пиридиний паратолуолсульфонат, с получением соединения формулы (XVII), где Р 1 и Р 2 обе заменены Н,который далее может быть защищен другими функциональными группами. Например, соединение формулы (XVII), где Р 1 и Р 2 обе заменены Н, может быть растворено в подходящем растворителе, таком как дихлорметан, и полученный раствор может быть обработан акцептором кислоты, таким как пиридин, и бензоилхлоридом, с получением соединения формулы (XVII),где Р 1 и Р 2 обе являются бензоилом. Соединения формулы (XVIII) известны в данной области техники, например, см. J. Amer.Chem.Soc, 1958,80, 5168, где Р 1 и Р 2, взятые вместе, являются диметилметиленом. Амины формул R7NH2 (XIXa), RJNH2 (XII) 2 и R -A-NHR8 (X) являются либо коммерчески доступными, либо могут быть получены стандартными способами, хорошо известными специалистам в данной области техники. Все соединения формулы (I) альтернативно могут быть получены конденсацией кислоты формулы (XIX) с амином формулы (X), как показано на схеме 4. Схема 4 17 Конденсацию обычно проводят в обычных условиях сочетания пептидов. Например, раствор кислоты (XIX) в подходящем растворителе, таком как дихлорметан, может быть обработан сначала подходящим агентом сочетания,таким как карбонилдиимидазол, и затем соединением формулы (X). Кислота формулы (XIX) может быть получена гидролизом соединения формулы (II). Для проведения гидролиза, соединение формулы (II) обычно растворяют в подходящем растворителе, таком как этанол, и обрабатывают подходящим основанием, таким как водный гидроксид натрия. Соединения формулы (I) альтернативно могут быть получены аминокарбонилированием соединения формулы (XIXb) где Z является подходящей уходящей группой,такой как бром, йод, Sn(C1-C12 алкил)3 илиCF3SO2O-, предпочтительно йодом, с соединением формулы R2-A-NHR8 (X) в присутствии окиси углерода и подходящего катализатора сочетания. Предпочтительно катализатором является палладиевый (II) катализатор, более предпочтительно 1,1'-бис(дифенилфосфино) ферроцендихлорпалладий (II) (необязательно в 1:1 комплексе с дихлорметаном). Альтернативно может быть использован ацетат палладия (II) в присутствии подходящего лиганда, такого как 1,1'-бис(дифенилфосфино)ферроцен, трифенилфосфин, три(о-толил)фосфин или (R)-, (S)- или рацемический 2,2'-бис(дифенилфосфино)-1,1'бинафтил. В обычной методике реакцию проводят в герметичном сосуде в присутствии окиси углерода при повышенном давлении, например,около 345 кПа (50 ф/д 2), при повышенной температуре, например, около 60 С, и в подходящем растворителе, например, тетрагидрофуране, метаноле или этаноле. Необязательно может присутствовать подходящее органическое основание, такое как третичный амин, например,триэтиламин, N-этилдиизопропиламин или 4 метилморфолин. Промежуточные соединения формулы(XIXc) могут быть получены, как показано на схеме 5. где Z имеет значения, определенные выше для соединения формулы (XIXb), и Ас является ацетилом. В обычной методике соединение формулыR3NH2 (XII) в присутствии подходящего акцептора кислоты, например, триэтиламина, и в подходящем растворителе, например, ацетонитриле, при повышенной температуре, при необходимости. Полученный продукт формулы (XIXc) может быть лишен защиты гидролизом с получением соединения формулы (XIXb) обычным способом, таким как использование подходящего неорганического основания, например, карбоната натрия, гидроксида натрия, гидроксида калия, гидроксида лития, карбоната натрия,карбоната калия или карбоната цезия, и в подходящем растворителе, например, метаноле,этаноле, изопропаноле, 1,2-диметоксиэтане,тетрагидрофуране, диметилформамиде, ацетоне,2-бутаноне или 4-метил-2-пентаноне, необязательно в водных условиях, при температуре от 0 С до температуры кипения растворителя, например, при комнатной температуре. Альтернативно, снятие защиты может быть проведено с использованием подходящего основания амина,такого как триэтиламин, диизопропилэтиламин,4-метилморфолин, аммиак, метиламин, этиламин или диметиламин, в подходящем растворителе, таком как метанол, этанол, н-пропанол,изопропанол, тетрагидрофуран или дихлорметан, при температуре от 0 С до температуры кипения растворителя. Соединения формулы(XIXd) могут быть получены обычным способом. Фармацевтически приемлемая соль соединения формулы (I) может быть легко получена смешиванием растворов соединения формулы(I) и желаемой кислоты или основания, подходящим образом. Соль может быть осаждена из раствора и собрана фильтрацией, или может быть выделена выпариванием растворителя. Противовоспалительные свойства соединений формулы (I) подтверждаются их способностью ингибировать функцию нейтрофила, что означает агонистическое действие в отношении А 2 а рецептора. Эта способность оценивается 19 определением действия соединения в исследовании, в котором измеряют продуцирование надперекиси из нейтрофилов, активированныхfMLP. Нейтрофилы выделяют из периферической крови человека, используя осаждение декстраном с последующим центрифугированием через раствор Фиколь-Гипак. Любые загрязняющие эритроциты в осадке гранулоцитов удаляют лизисом с ледяной дистиллированной водой. Продуцирование надперекиси из нейтрофилов индуцируется fMLP в присутствии начальной концентрации цитохалазина В. Аденозин деаминазу включают в исследование для удаления любого полученного эндогенно аденозина, который может подавлять продуцирование надперекиси. Действие соединения на fMLPвызванную реакцию контролируют колориметрически по снижению цитохрома С в экспериментальном буфере. Активность соединений оценивают как концентрацию, дающую 50% ингибирование (IC50), по сравнению с контрольной реакцией на fMLP. В данном исследовании соединения в соответствии с данным изобретением имели IC50 менее 200 нМ. Соединения примеров 7, 10, 12,16, 20, 21, 27 и 31 являются наиболее эффективными и имеют значения IС 50 менее 40 нМ. Данное изобретения также относится к фармацевтической композиции, включающей соединения формулы (I), определенное выше,или его фармацевтически приемлемую соль или сольват, вместе с фармацевтически приемлемым наполнителем, разбавителем или носителем. Данное изобретение также относится к соединению формулы (I), определенному выше,или его фармацевтически приемлемой соли,сольвату или их композиции, для использования в качестве лекарственного средства. Данное изобретение также относится к соединению формулы (I), определенному выше,или его фармацевтически приемлемой соли,сольвату или их композиции, для использования в качестве лекарственного средства для лечения заболеваний, для которых показан агонист А 2 а рецептора. Данное изобретение также относится к применению соединения формулы (I), определенного выше, или его фармацевтически приемлемой соли, сольвата или их композиции, для производства лекарственного средства для лечения заболеваний, для которых показан агонист А 2 а рецептора. Данное изобретение также относится к соединению формулы (I), определенному выше,или его фармацевтически приемлемой соли,сольвату или их композиции, для использования в качестве противовоспалительного агента. Данное изобретение также относится к применению соединения формулы (I), определенного выше, или его фармацевтически приемлемой соли, сольвата или их композиции, для производства противовоспалительного агента. 20 Данное изобретение также относится к применению соединения формулы (I), определенного выше, или его фармацевтически приемлемей соли, сольвата или их композиции, для производства лекарственного средства для лечения респираторного заболевания. Данное изобретение также относится к применению соединения формулы (I), описанному выше, где заболевание выбирают из группы, включающей респираторный дистресс-синдром у взрослых(РДСВ), бронхит, хронический бронхит, хроническое обструктивное заболевание легких, муковисцидоз, астму, эмфизему, бронхоэктаз, хронический синусит и ринит. Данное изобретение также относится к применению соединения формулы (I), определенного выше, или его фармацевтически приемлемой соли, сольвата или их композиции, для производства лекарственного средства для лечения септического шока, дисфункции эрекции у мужчин, гипертензии, удара, эпилепсии, церебральной ишемии, заболеваний периферических сосудов, пост-ишемической реперфузии,диабета, ревматоидного артрита, рассеянного склероза, псориаза, аллергических дерматитов,экземы, язвенного колита, болезни Крона, воспаления толстой кишки, Heliobacter pyloriгастрита, не Heliobacter pylori-гастрита, повреждений желудочно-кишечного тракта, вызванных нестероидными противовоспалительными средствами или психиатрических расстройств, или для заживления ран. Данное изобретение также включает способ лечения млекопитающих, включая человека,для лечения заболеваний, для которых показан агонист А 2 а рецептора, который состоит в лечении указанного млекопитающего эффективным количеством соединения формулы (I), такого как определено выше, или его фармацевтически приемлемой соли, сольвата или их композиции. Данное изобретение также включает способ лечения млекопитающих, включая человека,для лечения воспалительных заболеваний, который состоит в лечении указанного млекопитающего эффективным количеством соединения формулы (I), такого как определено выше, или его фармацевтически приемлемой соли, сольвата или их композиции. Данное изобретение также включает способ лечения млекопитающих, включая человека,для лечения респираторных заболеваний, который состоит в лечении указанного млекопитающего эффективным количеством соединения формулы (I), такого как определено выше, или его фармацевтически приемлемой соли, сольвата или их композиции. Данное изобретение также представляет метод, такой как описан выше, где заболевание выбирают из группы,включающей респираторный дистресс-синдром у взрослых (РДСВ), бронхит, хронический бронхит, хроническое обструктивное заболева 21 ние легких, муковисцидоз, астму, эмфизему,бронхоэктаз, хронический синусит и ринит. Данное изобретение также включает способ лечения млекопитающих, включая человека,для лечения септического шока, дисфункции эрекции у мужчин, гипертензии, удара, эпилепсии, церебральной ишемии, заболеваний периферических сосудов, пост-ишемической реперфузии, диабета, ревматоидного артрита, рассеянного склероза, псориаза, аллергических дерматитов, экземы, язвенного колита, болезни Крона, воспаления толстой кишки, Heliobacterpylori-гастрита, не Heliobacter pylori-гастрита,повреждений желудочно-кишечного тракта,вызванных нестероидными противовоспалительными средствами или психиатрических расстройств, или для заживления ран, который состоит в лечении указанного млекопитающего эффективным количеством соединения формулы (I), такого как определено выше, или его фармацевтически приемлемой соли, сольвата или их композиции. Соединения формулы (I) могут вводиться в чистом виде, но обычно вводят в смеси с подходящим фармацевтически приемлемым наполнителем, разбавителем или носителем, выбранным в соответствии с предполагаемым способом введения и стандартной фармацевтической практикой. Например, соединения формулы (I) могут вводиться перорально, трансбуккально или подъязычно в виде таблеток, капсул, шариков,эликсиров, растворов или суспензий, которые могут содержать вкусовую добавку или краситель, для немедленного, отсроченного, пролонгированного или контролируемого выделения. Такие таблетки могут содержать наполнители, такие как микрокристаллическая целлюлоза, лактоза, цитрат натрия, карбонат кальция,двухосновный фосфат кальция и глицин, разрыхлители, такие как крахмал (предпочтительно, кукурузный, картофельный или тапиоковый крахмал), гликолят натрий крахмала, кросскармеллозу натрия и определенный комплекс силикатов, и связывающие агенты гранулирования,такие как поливинилпирролидон, гидроксипропилметилцеллюлоза (ГПМЦ), гидроксипропилцеллюлоза (ГПЦ), сахароза, желатин и аравийская камедь. Дополнительно могут быть включены смазывающие агенты, такие как стеарат магния, стеариновая кислота, глицерилбегенат и тальк. Твердые композиции подобного типа также могут быть использованы как наполнители для желатиновых капсул. Предпочтительные наполнители в данном случае включают лактозу, крахмал, целлюлозу, молочный сахар или полиэтиленгликоль с высоким молекулярным весом. Для водных суспензий и/или эликсиров,соединения формулы (I) могут быть объединены с различными подсластителями или вкусовыми добавками, красящими веществами или краси 004987 22 телями, с эмульгирующими и/или суспендирующими агентами и с разбавителями, такими как вода, этанол, пропиленгликоль или глицерин, и их комбинациями. Соединения формулы (I) также могут вводиться парентерально, например, внутривенно,внутриартериально, внутрибрюшинно, подоболочечно, внутрь желудка, внутрь груди, внутрь черепа, внутримышечно или подкожно, или они могут вводиться вливанием. Наиболее предпочтительно использовать их в виде стерильного водного раствора, который может содержать другие вещества, например, достаточное количество солей или глюкозы для того, чтобы сделать раствор изотоническим по отношению к крови. Водные растворы должны быть соответствующим образом буферированы (предпочтительно, до рН от 3 до 9), при необходимости. Получение таких подходящих для парентерального введения препаративных форм в стерильных условиях может быть легко осуществлено стандартными фармацевтическими методами,хорошо известными специалистам в данной области техники. Для перорального и парентерального введения человеку, суточная доза соединения формулы (I) обычно составляет от 0,01 до 100 мг/кг веса тела подвергаемого лечению пациента,предпочтительно от 0,1 до 100 мг/кг (одной или несколькими дозами). Таким образом, таблетки или капсулы соединения формулы (I) могут содержать от 5 до 500 мг активного соединения для введения одной или двумя или более дозами одновременно,если это приемлемо. В любом случае, терапевт должен определить дозу, которая наиболее подходит для каждого конкретного пациента, и которая будет варьироваться в зависимости от возраста, веса и реакции конкретного пациента. Указанные выше дозы являются примерными и усредненными. Конечно, могут быть случаи, в которых необходимо применение более высоких или низких доз по отношению к указанному диапазону, которые также включены в объем данного изобретения. Соединения формулы (I) также могут вводиться интраназально или ингаляциями и, соответственно, иметь форму ингалятора с сухим порошком или аэрозольного распылителя из контейнера, находящегося под давлением, насоса, спрея, пульверизатора или распылителя с использованием подходящего пропеллента, например, дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, гидрофторалкана,такого как 1,1,1,2-тетрафторэтан (HFA 134A) или 1,1,1,2,3,3,3-гептафторпропана(HFA 227EA), двуокиси углерода или других подходящих газов. При использовании аэрозоля под давлением, дозированная форма может быть определена дозировочным клапаном. Контейнер под давлением, насос, спрей, пульверизатор или распылитель могут содержать раствор или сус 23 пензию активного соединения, например, используя смесь этанола и пропеллента в качестве растворителя, которые могут дополнительно содержать смазывающий агент, например, сорбитана триолеат. Капсулы и картриджи (например, из желатина) для использования в ингаляторе или инсуффляторе, могут содержать порошковую смесь соединения формулы (I) и подходящего порошка, такого как лактоза или крахмал. Аэрозоль или порошковые препаративные формы предпочтительно сделаны так,чтобы каждая отмеренная доза или пшик содержала от 20 до 4000 мкг соединения формулы(I) для доставки пациенту. Общая суточная доза при использовании аэрозоля может составлять от 20 мкг до 20 мг, которые могут вводиться одной дозой или, более часто, несколькими дозами в течение дня. Альтернативно соединения формулы (I) могут вводиться в виде суппозиториев или пессариев, или они могут наноситься местно в виде лосьона, раствора, крема, мази, геля, суспензии,распыляемого порошка, спрея или повязки, содержащей лекарственное средство (например,сетчатого перевязочного материала, марли, пропитанной белым мягким парафином или полиэтиленгликолем, или гидрогеля, гидроколлоида,альгината или пленки). Соединения формулы (I) также могут вводиться чрескожно, например,при использовании пластыря. Для местного введения на кожу соединения формулы (I) могут быть сформованы в виде подходящей мази, содержащей активное соединение, суспендированное или растворенное,например, в смеси с одним или более из минерального масла, жидкого вазелина, белого вазелина, пропиленгиколя, соединения полиоксиэтилен полиоксипропилена, эмульгирующего парафина и воды. Альтернативно, они могут быть сформованы в подходящий лосьон или крем, суспендированный или растворенный,например, в смеси одного или более из минерального масла, сорбитан моностеарата, полиэтиленгликоля, жидкого парафина, полисорбата 60, цетиловых сложных эфиров, цетеарилового спирта, 2-октилдодеканола, бензилового спирта и воды. Они также могут быть сформованы в виде гидрогеля с производными целлюлозы или полиакрилата, или другими вязкими модификаторами. Необходимо понимать, что все приведенные здесь ссылки на лечение включают исцеляющее, паллиативное и профилактическое лечение. Примеры Представленные ниже примеры иллюстрируют получение соединений формулы (I). Спектры 1 Н ядерного магнитного резонанса (ЯМР) во всех случаях соответствуют предложенным структурам. Характеристические химические сдвиги даны в частях на миллион на фоне тетраме 004987 24 тилсилана, используя обычные аббревиатуры для определения основных пиков, например, с,синглет; д, дублет; т, триплет; кв, квартет; м,мультиплет; ш, широкий. Масс-спектр (m/z) снимают в режиме тепловой распылительной ионизации. Для основных растворителей использованы следующие аббревиатуры: CDCl3,дейтерохлороформ; ДМСО, диметилсульфоксид; ТГФ, тетрагидрофуран. Если используется тонкослойная хроматография (ТСХ), она представляет собой ТСХ на селикагеле с использованием пластинок с силикагелем 60 F254, Rf является расстоянием, пройденным соединением,деленным на расстояние, пройденное растворителем на пластинке ТСХ. Пример 1. 6-[(2,2-Дифенилэтил)амино]-9(2R,3R,4S,5S)-5-[(этиламино)карбонил]-3,4 дигидрокситетрагидро-2-фуранил-N-[2-(1 пиперидинил)этил]-9 Н-пурин-2-карбоксамид. Раствор бензоата (2R,3R,4R,5S)-4-(бензоилокси)-2-[6-[(2,2-дифенилэтил)амино]-2-([2(1-пиперидинил)этил]аминокарбонил)-9 Нпурин-9-ил]-5-[(этиламино)карбонил]тетрагидро-3-фуранила (пример получения 7) (104 мг,0,12 ммоль) в метаноле (3 мл) обрабатывают карбонатом калия (100 мг, 0,72 ммоль). Смесь перемешивают при комнатной температуре в течение 30 мин. Растворитель удаляют при пониженном давлении и остаток разделяют между этилацетатом и водой. Органический слой отделяют, сушат над безводным сульфатом магния,фильтруют и выпаривают при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем, элюируя дихлорметаном:метанолом (90:10 по объему) с получением указанного в заголовке соединения в виде белого твердого вещества (44 мг). 1 Н ЯМP (400 МГц, CDCl3) : 8,76 (1 Н, с),8,67 (1 Н, шир. м), 7,63 (1 Н, шир. м), 7,38-7,19 Метил 6-[(2,2-дифенилэтил)амино]-9(2R,3R,4S,5S)-5-[(этиламино)карбонил]-3,4 дигидрокситетрагидро-2-фуранил-9H-пурин-2 карбоксилат (пример получения 11) (100 мг,0,18 ммоль) и 2-(4-изопропил-1-пиперидинил)этиламин (пример получения 17) (300 мг,1,76 ммоль) нагревают при температуре 120 С в атмосфере азота в течение 3 ч. Реакционную смесь охлаждают до комнатной температуры и очищают хроматографией на колонке с силикагелем, элюируя дихлорметаном:метанолом: концентрированным водным аммиаком (90:10:1 по объему) с получением указанного в заголовке соединения в виде белого твердого веществаLRMS (термоспрей): m/z [MH+] 686. Примеры 3-34. Соединения примеров 3-33 получают по способу примера 2 или примера 34 (для примеров 10, 11, 20 и 28). Данные масс-спектроскопии получены методом электрораспыления. Пример 3. 6-[(2,2-Дифенилэтил)амино]-9(2R,3R,4S,5S)-5-[(этиламино)карбонил]-3,4 дигидрокситетрагидро-2-фуранил-N-(2 пиридинилметил)-9 Н-пурин-2-карбоксамид. Раствор (2S,3S,4R,5R)-5-[6-(циклогексиламино)-2-йод-9 Н-пурин-9-ил]-N-этил-3,4-дигидрокситетрагидро-2-фуранкарбоксамида (пример получения 31) (125 мг, 0,24 ммоль), 2-(1 пиперидинил)этиламина (0,14 мл, 0,96 ммоль) и тетракис(трифенилфосфин)палладия(0) (20 мг,0,024 ммоль) в ТГФ (5 мл) карбонилируют при температуре 60 С и 345 кПа окиси углерода в течение 18 ч. Растворитель выпаривают при пониженном давлении и остаток очищают хроматографией на колонке с силикагелем, элюируя дихлорметаном:метанолом:концентрированным водным аммиаком (95:5:1 по объему). После выпаривания соответствующих фракций остаток растирают с диэтиловым эфиром,фильтруют и сушат с получением целевого соединения в виде бежевого порошка (77 мг,58%). 1 Н ЯМР (400 МГц, CDCl3) : 8,45 (1 Н, с),6,15-6,10 (1 Н, м), 4,90-4,85 (1 Н, м), 4,50-4,30(3 Н, м), 3,65-3,50 (2 Н, м), 3,45-3,25 (2 Н, м), 2,652,45 (6 Н, м), 2,10-2,00 (2 Н, м), 1,90-1,80 (2 Н, м),1,75-1,30 (13 Н, м), 1,10-1,05 (3 Н, м). В следующих примерах получения описано получение определенных промежуточных соединений, используемых в указанных выше примерах. Пример получения 1. 2,6-Дихлор-9 тетрагидро-2 Н-пиран-2-ил-9 Н-пурин. 2,6-Дихлор-9 Н-пурин (20 г, 0,11 моль) и моногидрат 4-толуолсульфокислоты (0,2 г) растворяют в этилацетате (300 мл), смесь нагревают до температуры 50 С и медленно добавляют раствор 2,3-дигидропирана (12,6 мл, 0,14 моль) в этилацетате (50 мл) в течение 30 мин. Реакционную смесь затем охлаждают до комнатной температуры, добавляют воду (100 мл) и рН раствора доводят до 7 добавлением насыщенного водного раствора гидрокарбоната натрия. Органический слой отделяют, последовательно промывают водой и насыщенным раствором соли, сушат над безводным сульфатом магния,фильтруют и выпаривают при пониженном давлении. Остаток перегоняют азеотропно с пентаном (х 2) с получением указанного в заголовке соединения в виде немного загрязненного белого твердого вещества (30,9 г). 1 Н ЯМР (400 МГц, CDCl3) : 8,30 (1 Н, с),5,75 (1 Н, дд), 4,25-4,15 (1 Н, м), 3,85-3,70 (1 Н, м),2,20-1,60 (6 Н, м). Пример получения 2. 2-Хлор-N-(2,2 дифенилэтил)-9-тетрагидро-2 Н-пиран-2-ил-9 Нпурин-6-амин.N-этил-N-изопропил-2 пропанамином (47,5 мл, 0,27 моль) и 2,2 дифенилэтиламином (24,8 г, 0,13 моль) и полученную смесь кипятят с обратным холодильником в течение 3 ч. Растворитель удаляют при пониженном давлении и остаток азеотропно перегоняют с этилацетатом. Затем остаток очищают хроматографией на колонке с силикагелем, элюируя градиентной системой этилацетат:гексан (40:60 по объему) постепенно изменяющейся до этилацетат:гексан (60:40 по объему) с получением указанного в заголовке соединения в виде пены (49,7 г). 1 Н ЯМР (400 МГц, CDCl3) : 7,95-7,75 (1 Н,шир. с), 7,35-7,15 (10 Н, м), 5,80-5,70 (1 Н, шир. с), 5,65 (1 Н, д), 4,35 (1 Н, м), 4,30-4,18 (1 Н, шир.(трифенилфосфин)палладия (0) (0,133 г, 0,12 ммоль) в N,N-диметилформамиде (3 мл) нагревают в атмосфере азота при температуре 100 С в течение 6 ч. Реакционную смесь охлаждают и разделяют между этилацетатом (100 мл) и 2 М раствором гидроксида натрия (100 мл). Органический слой отделяют, сушат над безводным сульфатом магния и выпаривают при пониженном давлении. Полученную смесь 1:1 6-[(2,2 дифенилэтил)амино]-9-тетрагидро-2 Н-пиран-2 ил-9 Н-пурин-2-карбонитрила и 6-[(2,2 дифенилэтил)амино]-9 Н-пурин-2-карбонитрила(пример получения 8) разделяют хроматографией на колонке с силикагелем, элюируя градиентной системой этилацетат:гексан (40:60 по объему) постепенно изменяющейся до этилацетат:гексан (60:40 по объему) с получением указанного в заголовке соединения в виде белого твердого вещества (0,4 г). 1 Н ЯМР (400 МГц, CDCl3) : 8,00 (1 Н, с),7,40-7,20 (10 Н, м), 6,00-5,75 (1 Н, шир. с), 5,70 Суспензию 6-[(2,2-дифенилэтил)амино]-9 тетрагидро-2 Н-пиран-2-ил-9 Н-пурин-2-карбонитрила (пример получения 3) (1,00 г, 2,36 ммоль) в метаноле (20 мл) обрабатывают метоксидом натрия (0,14 г, 2,59 ммоль) и полученную 40 смесь кипятят с обратным холодильником в атмосфере азота в течение 20 ч. ТСХ анализ показывает, что некоторое количество исходного материала еще остается, поэтому опять добавляют метоксид натрия (64 мг, 1,18 ммоль) и смесь кипятят с обратным холодильником в атмосфере азота еще час. Затем смесь охлаждают до комнатной температуры и растворитель удаляют при пониженном давлении. К остатку добавляют тетрагидрофуран (30 мл) и воду (10 мл) и рН доводят до 4 добавлением уксусной кислоты (1 мл). Смесь кипятят с обратным холодильником в течение 1 ч. ТСХ анализ показывает, что некоторое количество исходного материала еще остается,поэтому опять добавляют уксусную кислоту (0,5 мл) и кипячение с обратным холодильником продолжают в течение 18 ч. Реакционную смесь охлаждают до комнатной температуры и разделяют между этилацетатом и насыщенным водным раствором гидрокарбоната натрия. Органическую фазу отделяют, промывают насыщенным раствором соли, сушат над безводным сульфатом магния, фильтруют и выпаривают при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем,элюируя дихлорметаном:метанолом (98,5:1,5 по объему) с получением указанного в заголовке соединения (521 мг). 1 Н ЯМР (400 МГц, CDCl3) : 8,05 (1 Н, шир. с), 7,37-7,18 (10 Н, м), 5,84 (2 Н, м), 4,40 (3 Н, м),4,14 (1 Н, д), 4,00 (3 Н, с), 3,78 (1 Н, т), 2,17-1,60 Метил 6-[(2,2-дифенилэтил)амино]-9 тетрагидро-2 Н-пиран-2-ил-9 Н-пурин-2-карбоксилат (пример получения 4) (100 мг, 0,22 ммоль) и 1-(2-аминоэтил)пиперидин (0,31 мл, 2,19 ммоль) нагревают вместе при температуре 130 С в течение 2 ч. Избыток амина удаляют при пониженном давлении и остаток очищают хроматографией на колонке с силикагелем,элюируя дихлорметаном:метанолом (95:5 по объему) с получением указанного в заголовке соединения в виде желтой пены (104 мг).(2 М, 0,9 мл). Смесь кипятят с обратным холодильником в течение 30 мин, после чего образуется белый осадок. Смесь охлаждают до комнатной температуры и растворитель удаляют при пониженном давлении. Остаток разделяют между дихлорметаном и 10% об. водным аммиаком. Органическую фазу отделяют, сушат над безводным сульфатом магния, фильтруют и выпаривают при пониженном давлении с получением указанного в заголовке соединения в виде белого твердого вещества (319 мг). 1 Н ЯМP (400 МГц, CDCl3) : 8,57 (1 Н, шир. м), 8,30 (1H, с), 7,40-7,20 (10 Н, м), 5,93 (1 Н,шир. с), 4,39 (3 Н, м), 3,62 (2 Н, м), 2,56 (2 Н, т),2,40 (4 Н, шир. м), 1,47-1,24 (6 Н, шир. м). 42 Суспензию 6-[(2,2-дифенилэтил)амино]-N[2-(1-пиперидинил)этил]-9 Н-пурин-2-карбоксамида (пример получения 6) (100 мг, 0,21 ммоль) в 1,1,1-трихлорэтане (2 мл) обрабатывают N,O-бис(триметилсилил)ацетамидом (0,21 мл, 0,85 ммоль). Смесь кипятят с обратным холодильником в течение 90 мин. Раствор охлаждают до комнатной температуры и растворитель удаляют при пониженном давлении. Остаток обрабатывают раствором (2S,3R,4R,5R)- и(2S,3R,4R,5S)-5-(ацетилокси)-4-(бензоилокси)2-[(этиламино)карбонил]тетрагидро-3-фуранил бензоата (пример получения 15) (111 мг, 0,25 ммоль) в безводном толуоле (2 мл) и триметилсилилтрифторметансульфонатом (0,05 мл, 0,30 ммоль). Полученный раствор затем нагревают до температуры 90 С в атмосфере азота в течение 1 ч. ТСХ анализ показывает, что осталось некоторое количество исходного материала,поэтому опять добавляют триметилсилилтрифторметансульфонат (0,05 мл, 0,30 ммоль) и нагревание продолжают в течение 2 ч. Опять ТСХ анализ показывает, что осталось некоторое количество исходного материала, поэтому опять добавляют триметилсилилтрифторметансульфонат (0,025 мл, 0,15 ммоль) и нагревание продолжают в течение еще 1 ч. Смесь охлаждают до комнатной температуры, разбавляют этилацетатом (20 мл) и промывают насыщенным водным раствором гидрокарбоната натрия. Органический слой отделяют, сушат над безводным сульфатом магния, фильтруют и выпаривают при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем, элюируя дихлорметаном:метанолом (90:10 по объему) с получением указанного в заголовке соединения в виде пены (109 мг). 1 Н ЯМР (400 МГц, CDCl3) : 8,35 (1 Н, шир. м), 8,06 (3 Н, д), 7,93 (2 Н, д), 7,69-7,18 (15 Н, м),6,44 (1 Н, д), 6,23 (2 Н, шир. м), 5,91 (1 Н, шир. м),4,92 (1 Н, д), 4,37 (3 Н, м), 3,53 (4 Н, м), 2,60 (2 Н,шир. м), 2,44 (4 Н, шир. м), 1,40 (6 Н, м), 1,13 Раствор 6-[(2,2-дифенилэтил)амино]-9 тетрагидро-2 Н-пиран-2-ил-9 Н-пурин-2-карбонитрила (пример получения 3) (17 г, 40,1 ммоль) в этаноле (850 мл) обрабатывают 2 М водный хлористо-водородной кислотой (50 мл) и смесь перемешивают при комнатной температуре в течение 24 ч. Растворитель удаляют при пони 43 женном давлении, остаток растворяют в этаноле и растворитель снова удаляют при пониженном давлении. Остаток растирают с диэтиловым эфиром, фильтруют, промывают диэтиловым эфиром и пентаном и сушат с получением указанного в заголовке соединения в виде твердого вещества (13,6 г). 1 Н ЯМР (400 МГц, ДМСО-d6) : 8,30 (1 Н,с), 8,20-8,05 (1 Н, шир. с), 7,40-7,10 (10 Н, м),4,60-4,40 (1,4 Н, м), 4,20-4,00 (1,6 Н, м).(5,0 г, 14,7 ммоль) и метоксида натрия (4,0 г,74,1 ммоль) в метаноле (300 мл) кипятят с обратным холодильником в течение 24 ч. Опять добавляют метоксид натрия (2,0 г, 37 ммоль) и метанол (100 мл) и нагревание продолжают в течение еще 24 ч. Реакционную смесь охлаждают и растворитель удаляют при пониженном давлении. Остаток растворяют в ТГФ (375 мл),добавляют 2 М хлористо-водородную кислоту(125 мл) и смесь перемешивают при комнатной температуре в течение 24 ч. ТГФ удаляют при пониженном давлении и суспензию доводят до рН 7 насыщенным водным раствором бикарбоната натрия. Затем добавляют этилацетат (100 мл) и белое твердое вещество, содержащее в основном желаемый продукт, фильтруют, промывают небольшим количеством воды и этилацетата и сушат. Очистка хроматографией на колонке с силикагелем с элюированием градиентной системой дихлорметан:метанол (90:10 по объему), постепенно изменяющейся до дихлорметан:метанол (75:25 по объему), дает указанное в заголовке соединение в виде белого твердого вещества (1,25 г). Выпаривание этилацетата из фильтрата дает 2,6 г исходного материала. 1 Н ЯМР (400 МГц, CDCl3) : 12,40 (1 Н,шир. с), 8,05 (1 Н, с), 7,55 (1 Н, с), 7,30-7,20 (10 Н,м), 4,80 (2 Н, м), 4,75 (1 Н, м), 3,80 (3 Н, с). Суспензию метил 6-[(2,2-дифенилэтил) амино]-9 Н-пурин-2-карбоксилата (пример получения 9) (440 мг, 1,18 ммоль) в 1,1,1-трихлорэтане (25 мл) обрабатывают N,О-бис(триметилсилил)ацетамидом (1,7 мл, 6,95 ммоль). Смесь кипятят с обратным холодильником в течение 1 ч. Раствор охлаждают до комнатной температуры и растворитель удаляют при пониженном давлении. Остаток обрабатывают раствором(0,26 мл, 1,42 ммоль). Полученный раствор затем нагревают до температуры 110 С в атмосфере азота в течение 2,5 ч. Смесь охлаждают до комнатной температуры, разбавляют этилацетатом (200 мл) и промывают насыщенным водным раствором гидрокарбоната натрия. Органический слой отделяют, сушат над безводным сульфатом магния, фильтруют и выпаривают при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем,элюируя дихлорметаном:этилацетатом (5:1 по объему), затем дихлорметаном: этилацетатом (1:1 по объему) с получением указанного в заголовке соединения в виде пены(бензоилокси)-5-[(этиламино)карбонил]тетрагидро-2-фуранил-6-[(2,2-дифенилэтил)амино]9 Н-пурин-2-карбоксилата (пример получения 10) (3,4 г, 4,5 ммоль) и карбоната натрия (50 мг) в сухом метаноле (60 мл) перемешивают при комнатной температуре в течение 4 ч. Растворитель удаляют при пониженном давлении и остаток помещают в смесь дихлорметана:метанола(95:5 по объему, 60 мл). Неорганические соли отфильтровывают и фильтрат выпаривают при пониженном давлении. Остаток растирают с эфиром, отфильтровывают и сушат с получением целевого соединения в виде белого твердого вещества (2,4 г). 1 Н ЯМР (400 МГц, d6-ДMCO) : 8,60 (1 Н,м), 8,15 (2 Н, шир. с), 7,40-7,15 (10 Н, м), 6,00 Оксалилхлорид (14,0 мл, 160 ммоль) по каплям добавляют в перемешиваемый раствор(120 мл) и N,N-диметилформамиде (2 капли) и смесь перемешивают при комнатной температуре в течение 3 ч до тех пор, пока не прекратится выделение газа. ТСХ анализ показывает, что некоторое количество исходного материала еще остается, поэтому опять добавляют N,Nдиметилформамид (2 капли) и перемешивание продолжают в течение 1 ч. Растворитель удаляют при пониженном давлении и остаток перегоняют азеотропно с безводным дихлорметаном(х 2). Затем остаток растворяют в безводном дихлорметане (200 мл) и раствор по каплям обрабатывают этиламином (2 М в тетрагидрофуране,140 мл, 280 ммоль). Этот раствор оставляют при 46 комнатной температуре на 48 ч. Добавляют диэтиловый эфир (250 мл) и смесь перемешивают в течение 15 мин. Смесь фильтруют и растворитель удаляют из фильтрата при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем, элюируя градиентной системой дихлорметан:этилацетат (100:0 по объему), постепенно изменяющейся до дихлорметан:этилацетат (44:66 по объему), с получением указанного в заголовке соединения в виде желтого твердого вещества (24,70 г). 1 Н ЯМР (400 МГц, CDCl3) : 6,53 (1 Н, шир. м), 5,12 (1 Н, дд), 5,07 (1 Н, д), 4,60 (1 Н, д), 4,54(2,50 г, 10 ммоль) в метаноле (500 мл) кипятят с обратным холодильником в течение 18 ч. ЯМР анализ показывает, что некоторое количество исходного материала еще остается. Растворитель удаляют при пониженном давлении. Остаток растворяют в метаноле (500 мл) и кипятят с обратным холодильником в течение 8 ч. ЯМР анализ показывает, что некоторое количество исходного материала еще остается, поэтому растворитель опять удаляют при пониженном давлении. Остаток растворяют в метаноле (500 мл) и полученный раствор кипятят с обратным холодильником в течение 24 ч. Затем растворитель удаляют при пониженном давлении и остаток перегоняют азеотропно с дихлорметаном(33,0 мл, 409 ммоль) в дихлорметане (400 мл) и полученную смесь перемешивают при комнатной температуре в течение 18 ч. Растворитель удаляют при пониженном давлении, и остаток разделяют между диэтиловым эфиром и хлористо-водородной кислотой (1 М, 300 мл). Слои разделяют и водный слой повторно экстрагируют диэтиловым эфиром. Органические слои объединяют, последовательно промывают водой и насыщенным раствором соли, сушат над безводным сульфатом магния, фильтруют и выпаривают при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем, элюируя градиентной системой дихлорметан:диэтиловый эфир (95:5 по объему) постепенно изменяющейся до дихлорметан:диэтиловый эфир (80:20 по объему) с получением указанного в заголовке соединения в виде масла и в виде смесиианомеров (37,0 г). 1 Н ЯМР (400 МГц, CDCl3) : 8,16 (0,5 Н, д),7,95 (1,5 Н, д), 7,88 (1,5 Н, д), 7,81 (0,5 Н, д), 7,667,25 (6 Н, м), 6,65 (1 Н, шир. м), 5,88 (1 Н, м), 5,60 Раствор (2S,3R,4R,5S)- и (2R,3R,4R,5S)-4(бензоилокси)-5-[(этиламино)карбонил]-2 метокситетрагидро-3-фуранил бензоата (пример получения 14) (37,0 г, 89,6 ммоль) в смеси уксусной кислоты (330 мл, 5,77 моль) и уксусного ангидрида (67 мл, 709 ммоль) охлаждают до температуры -10 С и обрабатывают по каплям хлористо-водородной кислотой (12 н, 7,0 мл,132 ммоль). Смесь перемешивают в течение 18 48 ч, одновременно нагревая ее до комнатной температуры. После охлаждения смеси до 0 С ее разбавляют водой (1000 мл) и затем экстрагируют этилацетатом (3 х 500 мл). Органические слои объединяют, последовательно промывают водой, насыщенным водным раствором гидрокарбоната натрия и насыщенным раствором соли, сушат над безводным сульфатом магния,фильтруют и выпаривают при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем, элюируя градиентной системой диэтиловый эфир:пентан (66:44 по объему), постепенно изменяющейся до диэтиловый эфир:пентан (100:0 по объему). Остаток снова очищают хроматографией на колонке с силикагелем, элюируя градиентной системой дихлорметан:диэтиловый эфир (95:5 по объему) постепенно изменяющейся до дихлорметан:диэтиловый эфир (90:10 по объему) с получением указанного в заголовке соединения в виде смесиианомеров (15,40 г). 1 Н ЯМР (400 МГц, CDCl3) : 8,12 (0,8 Н, д),7,97 (1,2 Н, д), 7,92 (1,2 Н, д), 7,79 (0,8 Н, д), 7,657,24 (6 Н, м), 6,73 (0,4 Н, д), 6,62 (0,4 Н, шир. м),6,46 (0,6 Н, шир. м), 6,42 (0,6 Н, д), 6,07 (0,4 Н,дд), 5,95 (0,6 Н, т), 5,72 (0,6 Н, д), 5,44 (0,4 Н, т),4,94 (0,4 Н, д), 4,86 (0,6 Н, д), 3,36 (2 Н, м), 2,17(2S,3R,4R,5R)- и (2S,3R,4R,5S)-5-(Ацетилокси)-4-(бензоилокси)-2-[(пропиламино)карбонил]тетрагидро-3-фуранил бензоат получают по аналогичной методике. Пример получения 16. 2-[2-(4-Изопропил 1-пиперидинил)этил]-1 Н-изоиндол-1,3(2 Н)дион. Раствор 4-изопропилпиперидина (3,3 г,20,2 ммоль) и 2-бромэтилфталимида (5,4 г, 21,3 ммоль) в ацетонитриле (100 мл) обрабатывают карбонатом калия (5,9 г, 4 5,4 ммоль), кипятят с обратным холодильником в течение 2,5 ч и затем перемешивают при комнатной температуре в течение ночи. Растворитель удаляют при пониженном давлении и остаток разделяют между этилацетатом (100 мл) и водой (100 мл). Органический слой отделяют, и водный слой опять экстрагируют этилацетатом (100 мл). Объединенные органические экстракты сушат над сульфатом натрия и растворитель удаляют при пониженном давлении. Полученное масло очищают хроматографией на колонке с силикагелем, элюируя градиентной системой дихлорметан:диэтиловый эфир (50:50 по объему) постепенно изменяющейся до чистого диэтилового эфира с получением указанного в заголовке соединения (3,3 г). Раствор 2-[2-(4-изопропил-1-пиперидинил) этил]-1 Н-изоиндол-1,3(2 Н)-диона (пример получения 16) (3,2 г, 10,6 ммоль) в 33% растворе метиламина в этаноле (60 мл) кипятят с обратным холодильником в течение 3 ч. Растворитель удаляют при пониженном давлении, опять добавляют этанол (60 мл) и растворитель снова удаляют при пониженном давлении. Остаток суспендируют в дихлорметане (100 мл) и твердое вещество отфильтровывают и опять промывают дихлорметаном (100 мл). Фильтрат выпаривают при пониженном давлении и очищают хроматографией на колонке с силикагелем,элюируя дихлорметаном:метанолом:концентрированным водным аммиаком (90:10:1 по объему) с получением бесцветного масла. Дистилляция при интенсивном кипении (с образованием пузырьков) (150-160 С, 30 мм рт.ст.) дает указанное в заголовке соединения (1,0 г). 1 Н ЯМР (400 МГц, CDCl3) : 2,90 (2 Н, м),2,80 (2 Н, т), 2,40 (2 Н, т), 1,95 (2 Н, м), 1,65 (2 Н,м), 1,40 (1 Н, м), 1,30-1,20 (4 Н, м), 1,00 (1 Н, м),0,85 (6 Н, д). Суспензию 2-амино-6-хлорпурина (4,60 г,27,13 ммоль) в 1,1,1-трихлорэтане (230 мл) обрабатывают N,О-бис(триметилсилил)ацетамидом (20 мл, 81,4 ммоль). Смесь кипятят с обратным холодильником в течение 6 ч. Раствор охлаждают до комнатной температуры и растворитель удаляют при пониженном давлении. Остаток обрабатывают раствором (2S,3R,4R,5R)- и 50 тилсилилтрифторметансульфонатом (20 мл,108,5 ммоль). Полученный раствор затем нагревают до температуры 90 С в атмосфере азота в течение 90 мин. Смесь охлаждают до комнатной температуры, разбавляют этилацетатом (250 мл) и промывают насыщенным водным раствором гидрокарбоната натрия (350 мл), затем насыщенным раствором соли (350 мл). Органический слой отделяют, сушат над безводным сульфатом магния, фильтруют и выпаривают при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем, элюируя дихлорметаном:метанолом (98:2 по объему) с получением указанного в заголовке соединения в виде белой пены (8,1 г). 1 Н ЯМP (400 МГц, CDCl3) : 8,10-7,95 (3 Н,м), 7,80 (2 Н, м), 7,50-7,30 (6 Н, м), 6,90 (1 Н, м),6,40-6,20 (3 Н, м), 5,20 (2 Н, шир. с), 4,90 (1 Н, м),3,45 (1 Н, м), 3,30 (1 Н, м), 1,15 (3 Н, т). н-Бутилнитрил (4,65 мл, 39,7 ммоль) добавляют к суспензии (2R,3R,4S,5S)-2-(2-амино 6-хлор-9 Н-пурин-9-ил)-4-(бензоилокси)-5[(этиламино)карбонил]тетрагидро-3-фуранил бензоата (пример получения 18) (8,10 г, 14,7 ммоль), йода (3,73 г, 14,7 ммоль), йодида меди(I) (6,16 г, 32,3 ммоль) и дийодметана (12,55 мл, 155,8 ммоль) в ТГФ (100 мл) и смесь кипятят с обратным холодильником в течение 2,5 ч. Раствор охлаждают до комнатной температуры и растворитель удаляют при пониженном давлении. Остаток разделяют между водным раствором метабисульфита натрия (5%, 100 мл) и дихлорметаном (100 мл). Органический слой отделяют, фильтруют через арбацель, сушат(MgSO4) и растворитель выпаривают при пониженном давлении. Остаток очищают хроматографией на колонке с силикагелем, элюируя дихлорметаном:метанолом (99:1 по объему) с получением указанного в заголовке соединения в виде желтой пены (7,55 г, 78%). 1 Н ЯМР (400 МГц, CDCl3) : 8,55 (1 Н, с),8,05 (2 Н, м), 7,80 (2 Н, м), 7,65-7,30 (6 Н, м), 6,75 Раствор (2R,3R,4S,5S)-4-(бензоилокси)-2(6-хлор-2-йод-9 Н-пурин-9-ил)-5-[(этиламино) карбонил]тетрагидро-3-фуранил бензоата (пример получения 19) (0,25 г, 0,38 ммоль) и 2 бензил-3-фенилпропиламина (0,16 г, 0,76 ммоль) в изопропаноле (10 мл) перемешивают при комнатной температуре в течение 48 ч. Растворитель удаляют при пониженном давлении и остаток очищают хроматографией на колонке с силикагелем, элюируя дихлорметаном:метанолом (99:1 по объему) с получением указанного в заголовке соединения в виде желтой пены (0,26 г, 83%). 1 Н ЯМР (400 МГц, CDCl3) : 8,00 (2 Н, м),7,80 (3 Н, м), 7,60-7,40 (5 Н, м), 7,35-7,15 (9 Н, м),6,25 (1 Н, м), 6,15-6,05 (2 Н, м), 5,75 (1 Н, шир. с),4,90-4,80 (2 Н, м), 3,65 (1 Н, м), 3,50 (1 Н, м), 3,002,85 (4 Н, м), 1,20 (3 Н, т). Соединение получают из (2R,3R,4S,5S)-4(бензоилокси)-2-(6-хлор-2-йод-9 Н-пурин-9-ил)5-[(этиламино)карбонил]тетрагидро-3-фуранил бензоата (пример получения 19) и 2,2 004987 52 бис(фенил)этиламина по методике примера получения 20. Указанное в заголовке соединение получают в виде желтой пены. 1 Н ЯМР (400 МГц, CDCl3) : 8,05 (2 Н, м),7,80 (3 Н, м), 7,60-7,40 (5 Н, м), 7,35-7,15 (9 Н, м),6,25 (1 Н, м), 6,15-6,05 (2 Н, м), 5,75 (1 Н, шир. с),4,90 (1 Н, м), 4,40 (1H, м), 4,25 (1 Н, шир. с), 3,65 Соединение получают из (2R,3R, 4S, 5S)-4(бензоилокси)-2-(6-хлор-2-йод-9 Н-пурин-9-ил)5-[(этиламино)карбонил]тетрагидро-3-фуранил бензоата (пример получения 19) и 1-этилпропиламина по методике примера получения 20. Указанное в заголовке соединение получают в виде желтой пены. 1 Н ЯМР (400 МГц, CDCl3) : 8,10-8,00 (3 Н,м), 7,80 (2 Н, м), 7,60 (1H, м), 7,50-7,40 (3 Н, м),7,30 (2 Н, м), 6,40 (1 Н, м), 6,15-6,05 (2 Н, м), 5,75 Соединение получают из (2R,3R,4S,5S)-4(бензоилокси)-2-(6-хлор-2-йод-9 Н-пурин-9-ил)5-[(этиламино)карбонил]тетрагидро-3-фуранил бензоата (пример получения 19) и (2S)-2-амино 3-фенил-1-пропанола по методике примера по 53 лучения 20. Указанное в заголовке соединение получают в виде желтой пены. 1 Н ЯМР (400 МГц, CDCl3) : 8,20 (1 Н, с),8,05 (2 Н, д), 7,80 (2 Н, д), 7,60 (1 Н, м), 7,50-7,35 Соединение получают из (2R,3R,4S,5S)-4(бензоилокси)-2-(6-хлор-2-йод-9 Н-пурин-9-ил)5-[(этиламино)карбонил]тетрагидро-3-фуранил бензоата (пример получения 19) и 9 Н-флуорен 9-илметиламина по методике примера получения 20. Указанное в заголовке соединение получают в виде желтой пены. 1 Н ЯМР (400 МГц, CDCl3) : 8,05 (2 Н, м),7,83 (4 Н, м), 7,70-7,25 (13 Н, м), 6,25 (1 Н, м),6,15-6,05 (2 Н, м), 5,35 (1 Н, шир. с), 4,90 (1 Н, м),4,40 (1 Н, м), 4,15 (1 Н, шир. с), 3,65 (1 Н, м), 3,50 Соединение получают из (2R,3R,4S,5S)-4(бензоилокси)-2-(6-хлор-2-йод-9 Н-пурин-9-ил)5-[(этиламино)карбонил]тетрагидро-3-фуранил бензоата (пример получения 19) и циклогексиламина по методике примера получения 20. 54 Указанное в заголовке соединение получают в виде желтой пены. 1 Н ЯМР (400 МГц, CDCl3) : 8,05 (2 Н, м),7,80 (3 Н, м), 7,60 (1 Н, м), 7,50-7,40 (4 Н, м), 7,307,25 (2 Н, м), 6,25 (1 Н, м), 6,15-6,05 (2 Н, м), 5,70(0,26 г, 0,31 ммоль) и карбоната натрия (33 мг,0,3 ммоль) в метаноле (5 мл) перемешивают при комнатной температуре в течение 14 ч. Растворитель удаляют при пониженном давлении и остаток растворяют в дихлорметане:метаноле(99:1 по объему; 5 мл) и фильтруют. Растворитель опять выпаривают при пониженном давлении и остаток растирают с диэтиловым эфиром с получением указанного в заголовке соединения в виде бежевого порошка (0,17 г, 86%). 1 Соединение получают из (2R,3R,4S,5S)-4(бензоилокси)-2-(6-[2,2-бис(3-фенил)этил]амино-2-йод-9 Н-пурин-9-ил)-5-[(этиламино)карбонил]тетрагидро-3-фуранил бензоата (пример 55 получения 21) по методике примера получения 26. Указанное в заголовке соединение получают в виде желтого порошка. 1 Н ЯМР (400 МГц, CD3OD) : 8,10 (1 Н, м),7,35-7,15 (10 Н, м), 5,90 (1 Н, м), 4,75 (1 Н, м), 4,45 Соединение получают из (2R,3R,4S,5S)-4(бензоилокси)-5-[(этиламино)карбонил]-2-6[(1-этилпропил)амино]-2-йод-9 Н-пурин-9-ил тетрагидро-3-фуранил бензоата (пример получения 22) по методике примера получения 26. Указанное в заголовке соединение получают в виде желтого порошка. 1 Н ЯМР (400 МГц, CDCl3) : 8,10 (1 Н, м),7,75 (1 Н, шир. с), 5,95 (1 Н, д), 5,70 (1 Н, м), 5,15 Соединение получают из (2R,3R,4S,5S)-4(бензоилокси)-2-(6-[(1S)-1-бензил-2-гидроксиэтил]амино-2-йод-9 Н-пурин-9-ил)-5-[(этиламино)карбонил]тетрагидро-3-фуранил бензоата(пример получения 23) по методике примера получения 26. Указанное в заголовке соединение получают в виде желтого порошка. 1 Н ЯМР (400 МГц, CDCl3) : 8,10 (1 Н, шир. с), 7,50-7,10 (5 Н, м), 6,65 (1 Н, шир. с), 5,95 (1 Н,м), 4,80 (1 Н, м), 4,60-4,40 (2 Н, м), 3,70 (1 Н, м),3,50 (1 Н, м), 3,35 (1 Н, м), 3,10 (2 Н, м), 1,15 (3 Н,т). Соединение получают из (2R,3R,4S,5S)-4(бензоилокси)-5-[(этиламино)карбонил]-2-6[(9 Н-флуорен-9-илметил)амино]-2-йод-9 Нпурин-9-илтетрагидро-3-фуранил бензоата(пример получения 24) по методике примера получения 26. Указанное в заголовке соединение получают в виде желтого порошка. 1 Н ЯМР (400 МГц, CD3OD) : 8,10 (1 Н, с),7,80 (2 Н, д), 7,65 (2H, м), 7,40-7,20 (4 Н, м), 5,90 Соединение получают из (2R,3R,4S,5S)-4(бензоилокси)-2-[6-(циклогексиламино)-2-йод 9 Н-пурин-9-ил]-5-[(этиламино)карбонил]тетрагидро-3-фуранил бензоата (пример получения 25) по методике примера получения 26. Указанное в заголовке соединение получают в виде желтого порошка. 1 Н ЯМР (400 МГц, CD3OD) : 8,15 (1 Н, с),5,90 (1 Н, д), 4,70 (1 Н, м), 4,40 (1 Н, с), 4,30 (1 Н,д), 4,05 (1 Н, шир. с), 3,50-3,40 (2 Н, м), 2,00 (2 Н,м), 1,80 (2 Н, м), 1,60 (1 Н, м), 1,50-1,20 (6 Н, м),1,15 (3 Н, т). или его фармацевтически приемлемая соль или сольват,где R1 является водородом, C1-С 6 алкилом или С 3-С 7 циклоалкилом, каждый из которых необязательно замещен 1 или 2 заместителями,каждый из которых независимо выбирают из гидроксила, флуоренила, фенила и нафтила, где указанные фенил и нафтил необязательно замещены C1-С 6 алкилом, C1-С 6 алкокси, галогеном или циано; А является связью или C1-C6 алкиленом;R2 является (i) водородом, С 1-С 6 алкилом,С 3-С 7 циклоалкилом, фенилом или нафтилом,где указанные С 3-С 7 циклоалкил, фенил и нафтил необязательно замещены С 1-С 6 алкилом,фенилом, С 1-С 6 алкокси-(C1-C6)алкилом, амино(C1-C6)алкилом, фтор-(C1-C6)алкилом, фтор-(C1C6)алкокси, С 2-С 5 алканоилом, галогеном, -OR3,циано, -COOR3, С 3-С 7 циклоалкилом, -S(O)mR4,-NR3R3, -SO2NR3R3, -CONR3R3, -NR3COR4 или-CONR R ,или (iii) С-связанным 4-11-членным, моноили бициклическим гетероциклом, имеющим либо от 1 до 4 атомов азота в кольце, либо от 1 до 2 атомов азота и 1 атом кислорода или 1 атом серы в кольце, необязательно С-замещенным оксо, C1-С 6 алкокси-(C1-С 6)алкилом, амино-(C1 С 6)алкилом, фтор-(C1-C6)алкилом, фтор-(C1-С 6) алкокси, фтор-(С 2-С 5)алканоилом, галогеном,циано, -OR5, R6, -COR5, -NR5R5, -COOR5,-S(O)mR6, -SO2NR5R5, -CONR5R5, -NR5SO2R6 или-NR5COR6 и необязательно N-замещенным C1C6 алкокси-(C1-С 6)алкилом, амино-(С 2-С 6)алкилом, фтор-(C1-C6)алкилом, фтор-(С 2-С 5)алканоилом, R6, -COR5, -COOR6, -SO2R6, -SO2NR5R5 или -CONR5R5,или (iv) если А является С 2-С 6 алкиленом,N-связанным азетидинилом, пирролидинилом,морфолинилом,тетрагидроизохинолинилом,пиперидинилом или пиперазинилом, где каждый необязательно С-замещен C1-C6 алкилом,фенилом, C1-C6 алкокси-(C1-C6)алкилом, амино(C1-С 6)алкилом, фтор-(C1-C6)алкилом, фтор-(C1C6)алкокси, С 2-С 5 алканоилом, галогеном, -OR3,циано, -COOR3, C3-C7 циклоалкилом, -S(O)mR4,-NR3R3, -SO2NR3R3, -CONR3R3, -NR3COR4 или-NR3SO2R4, где указанный пиперазинил необязательно N-замещен C1-С 6 алкилом, фенилом,C1-С 6 алкокси-(C1-C6)алкилом,амино-(С 2-С 6) алкилом, фтор-(C1-C6)алкилом, C2-C5 алканои 004987 58 лом, -COOR4, C3-C7 циклоалкилом, -SO2R4,-SO2NR3R3 или -CONR3R3; каждый R3 независимо выбирают из Н, C1C6 алкила, фенила или пиридинила;R8 является Н или C1-С 6 алкилом и гет, используемый в определениях R5, R6 7 и R , означает С-связанный пирролил, имидазолил, триазолил, тиенил, фурил, тиазолил, оксазолил, тиадиазолил, оксадиазолил, пиридинил,пиримидинил, пиридазинил, пиразинил, хинолинил, изохинолинил, бензимидазолил, хиназолинил, фталазинил, бензоксазолил или хиноксалинил, каждый из которых необязательно замещен C1-С 6 алкилом, C1-С 6 алкокси, циано или галогеном. 2. Соединение по п.1, в котором R1 является циклогексилом или необязательно замещенным C1-С 6 алкилом. 3. Соединение по п.2, в котором R1 является необязательно замещенным С 1-С 5 алкилом. 4. Соединение по п.3, в котором R1 является необязательно замещенным C1-С 2 алкилом. 5. Соединение по любому из пп. 2, 3 или 4,в котором заместители C1-C6, C1-C5 или C1-С 2 алкила выбирают из бензила, флуоренила, фенила и гидроксила. 6. Соединение по п.5, в котором, если R1 замещен фенилом, существуют 1 или 2 фенильные группы. 7. Соединение по любому из пп.2-5, в котором R1 выбирают из 2,2-дифенилэтила, циклогексила, 1-этилпропила, 1-бензил-2-гидроксиэтила, 9 Н-флуорен-9-илметила и 1-бензил-2 фенилэтила. 8. Соединение по п.7, в котором R1 является дифенилэтилом. 9. Соединение по п.8, в котором R1 является 2,2-дифенилэтилом. 10. Соединение по любому из предшествующих пунктов, в котором А является C1-С 6 алкиленом. 11. Соединение по п.10, в котором А является C1-С 4 алкиленом. 12. Соединение по п.11, в котором А выбирают из метилена, 1,2-этилена, 1,3-пропилена и 1,4-бутилена. 13. Соединение по п.12, в котором А является 1,2-этиленом. 59 14. Соединение по любому из предшествующих пунктов, в котором R2 выбирают из фенила, пирролидинила, пиридинила, необязательно замещенного пиперидинила, необязательно замещенного пиперазинила, необязательно замещенного имидазолила, морфолинила, тетрагидроизохинолила, C1-C6 алкиламино,ди-С 1-С 6 алкиламино,пиридиниламино и-NR3SO2R4. 15. Соединение по п.14, в котором R2 выбирают из фенила, 2-пиридинила, 1-пиперидинила, 4-пиперазинила, 1-пирролидинила, 4 морфолинила,3,4-тетрагидро-2(1 Н)-изохинолинила, C1-C3 алкиламино, ди-C1-С 3 алкиламино и замещенного 1 Н-имидазол-4-ила. 16. Соединение по п.15, в котором R2 выбирают из 3-изопропиламино, метиламино, диметиламино, диэтиламино, 1-метил-1 Н-имидазол-4-ила, 5-метил-1 Н-имидазол-4-ила, 4-метилпиперазин-1-ила, 1-(2-пропил)пиперидин-4-ила и 2-пиридиламино. 17. Соединение по п.15, в котором R2 является пиперидинилом, необязательно замещенным C1-С 6 алкилом или метокси. 18. Соединение по п.17, в котором R2 является пиперидинилом, необязательно замещенным в положении 1 или положении 4 C1-С 6 алкилом или метокси. 19. Соединение по п.18, в котором R2 является N-связанным пиперидинилом, необязательно С-замещенным C1-С 6 алкилом или метокси. 20. Соединение по п.19, в котором R2 является N-связанным пиперидинилом, необязательно С-замещенным C1-С 3 алкилом или метокси. 21. Соединение по п.20, в котором R2 является N-связанным пиперидинилом, необязательно С-замещенным метилом, метокси или пропилом. 22. Соединение по п.21, в котором R2 является N-связанным пиперидинилом, необязательно замещенным в положении 4 метилом,метокси или пропилом. 23. Соединение по п.22, в котором R2 является пиперидин-1-илом, 4-(метил)пиперидин-1 илом, 4-(метокси)пиперидин-1-илом или 4(проп-2-ил)пиперидин-1-илом. 24. Соединение по любому из предшествующих пунктов, в котором R3 является метилом. 25. Соединение по любому из предшествующих пунктов, в котором R4 является метилом или фенилом. 26. Соединение по любому из предшествующих пунктов, в котором R7 является С 1-С 6 алкилом. 27. Соединение по п.26, в котором R7 является С 1-С 4 алкилом. 28. Соединение по п.27, в котором R7 является этилом или н-пропилом. 60 29. Соединение по любому из предшествующих пунктов, в котором R8 является Н. 30. Соединение по п.1, выбранное из группы, включающей 6-[(2,2-дифенилэтил)амино]-9-(2R,3R,4S,5S)-5-[(этиламино)карбонил]-3,4-дигидрокситетрагидро-2-фуранил-N-(2-пиридинилметил)9 Н-пурин-2-карбоксамид;
МПК / Метки
МПК: C07D 473/34, A61K 31/70, C07H 19/167, A61P 11/06
Метки: пурина, производные
Код ссылки
<a href="https://eas.patents.su/30-4987-proizvodnye-purina.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пурина</a>
Предыдущий патент: N-(гетероциклил)бензол- или пиридинсульфонамиды в качестве антитромботических агентов и антикоагулянтов
Следующий патент: Азабициклоалканы как модуляторы рецептора хемокинов ccr5
Случайный патент: Механизм для преобразования возвратно-поступательного движения во вращательное и наоборот












