Производные 2-амино-4-(пиридин-2-ил)-5,6-дигидро-4h-1,3-оксазинов и их использование в качестве ингибиторов bace-1 и/или bace-2
Номер патента: 24580
Опубликовано: 30.09.2016
Авторы: Махауер Райнер, Люенд Райнер Мартин, Венстра Сим Якоб, Рюэгер Хайнрих
Формула / Реферат
1. Соединение формулы (I) или его фармацевтически приемлемая соль

где R1 и R2 независимо представляют собой водород или галоген;
R3 и R4 независимо представляют собой водород или C1-3алкил;
R5 представляет собой C1-3алкил, галоген-C1-3алкил или C1-3алкокси-C1-3алкил и
R6 представляет собой 5- или 6-членный моноциклический гетероарил, содержащий 1, 2, 3 или 4 гетероатома, независимо выбранные из N, О и S, и где указанный гетероарил необязательно замещен 1, 2, 3 или 4 заместителями, независимо выбранными из галогена, циано, амино, гидрокси, C1-4алкила, галоген-C1-4алкила, галоген-C1-4алкилтио, галоген-C1-4алкокси, C1-4алкокси, C1-4алкокси-C1-4алкила, C1-4алкокси-C1-4алкокси, C1-4алкокси-C1-4алкилтио, C1-4алкокси-C2-4алкенила, C1-4алкокси-С2-4алкинила, гидрокси-C1-4алкила, гидрокси-С2-4алкенила и гидрокси-C2-4алкинила.
2. Соединение по п.1 или его фармацевтически приемлемая соль, где R1 и R2 оба представляют собой фтор.
3. Соединение по п.1 или 2 или его фармацевтически приемлемая соль, где R3 и R4 оба представляют собой водород.
4. Соединение по любому одному из пп.1-3 или его фармацевтически приемлемая соль, где R5 представляет собой метил.
5. Соединение по любому одному из пп.1-4 или его фармацевтически приемлемая соль, где R6 представляет собой 6-членный моноциклический гетероарил, содержащий 1, 2, 3 или 4 гетероатома, независимо выбранные из N, О и S, и где указанный гетероарил необязательно замещен 1, 2, 3 или 4 заместителями, независимо выбранными из галогена, циано, амино, гидрокси, C1-4алкила, галоген-C1-4алкила, галоген-C1-4алкилтио, галоген-C1-4алкокси, C1-4алкокси, C1-4алкокси-C1-4алкила, C1-4алкокси-C1-4алкокси и C1-4алкокси-C1-4алкилтио.
6. Соединение по любому одному из пп.1-4 или его фармацевтически приемлемая соль, где R6 представляет собой группу пиридин-2-ила, которая замещена 2 заместителями, и где один из заместителей расположен в пара-положении и один из заместителей расположен в орто-положении группы пиридин-2-ила относительно амидного линкера, и где указанные заместители независимо выбраны из галогена, циано, амино, гидрокси, метила, трифторметила, метокси и трифторметокси.
7. Соединение по п.1, которое выбирают из
[6-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-5-фторпиридин-2-ил]амида 5-циано-3-метилпиридин-2-карбоновой кислоты;
[6-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-5-фторпиридин-2-ил]амида 3-хлор-5-цианопиридин-2-карбоновой кислоты;
[6-((R)-2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-5-фторпиридин-2-ил]амида 3-хлор-5-цианопиридин-2-карбоновой кислоты;
{6-[(R)-2-амино-5,5-дифтор-4-(2-метоксиэтил)-5,6-дигидро-4Н-[1,3]оксазин-4-ил]-5-фторпиридин-2-ил}амида 5-циано-3-метилпиридин-2-карбоновой кислоты;
{6-[(R)-2-амино-5,5-дифтор-4-(2-метоксиэтил)-5,6-дигидро-4Н-[1,3]оксазин-4-ил]-5-фторпиридин-2-ил}амида 3-хлор-5-трифторметилпиридин-2-карбоновой кислоты;
[6-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-5-фторпиридин-2-ил]амида 3-хлор-5-трифторметилпиридин-2-карбоновой кислоты;
[6-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-5-фторпиридин-2-ил]амида 3-амино-5-трифторметилпиразин-2-карбоновой кислоты;
[6-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-5-фторпиридин-2-ил]амида 3,5-дихлорпиридин-2-карбоновой кислоты;
[6-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-5-фторпиридин-2-ил]амида 3-амино-5-(2,2,2-трифторэтокси)пиразин-2-карбоновой кислоты;
[6-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-5-фторпиридин-2-ил]амида 3-амино-5-(2,2-дифторэтокси)пиразин-2-карбоновой кислоты;
[6-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-5-фторпиридин-2-ил]амида 3-амино-5-(3-фторпропокси)пиразин-2-карбоновой кислоты;
[6-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-5-фторпиридин-2-ил]амида 5-метокси-3-метилпиридин-2-карбоновой кислоты;
[6-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-5-фторпиридин-2-ил]амида 3-амино-5-(3-метоксипроп-1-инил)пиридин-2-карбоновой кислоты;
[6-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-5-фторпиридин-2-ил]амида 3-амино-5-фторметоксипиразин-2-карбоновой кислоты;
[6-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-5-фторпиридин-2-ил]амида 3-амино-5-(2-метоксиэтокси)пиразин-2-карбоновой кислоты;
[6-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-5-фторпиридин-2-ил]амида 3-амино-5-(3-гидроксипроп-1-инил)пиридин-2-карбоновой кислоты;
[6-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-5-фторпиридин-2-ил]амида 3-амино-5-фторпиридин-2-карбоновой кислоты;
[6-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-5-фторпиридин-2-ил]амида 3-амино-5-хлорпиридин-2-карбоновой кислоты;
[6-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-5-фторпиридин-2-ил]амида 3-хлорпиридин-2-карбоновой кислоты;
[6-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-5-фторпиридин-2-ил]амида 3-хлор-5-(3-метоксипроп-1-инил)пиридин-2-карбоновой кислоты;
[6-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-5-фторпиридин-2-ил]амида 3-амино-5-дифторметилпиразин-2-карбоновой кислоты;
[6-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-5-фторпиридин-2-ил]амида 3-амино-5-(2-хлорэтокси)пиразин-2-карбоновой кислоты;
[6-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-5-фторпиридин-2-ил]амида 3-хлор-5-(2,2-дифторэтокси)пиридин-2-карбоновой кислоты;
[6-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-5-фторпиридин-2-ил]амида 3-амино-5-(2-фторэтокси)пиразин-2-карбоновой кислоты;
[6-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-5-фторпиридин-2-ил]амида 3-хлор-5-фторметоксипиридин-2-карбоновой кислоты;
[6-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-5-фторпиридин-2-ил]амида 3-хлор-5-этоксипиридин-2-карбоновой кислоты;
[6-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-5-фторпиридин-2-ил]амида 3-амино-5-(2-метоксиэтил)пиразин-2-карбоновой кислоты;
[6-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-5-фторпиридин-2-ил]амида 4-хлор-1-дифторметил-1Н-пиразол-3-карбоновой кислоты;
[6-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-5-фторпиридин-2-ил]амида 3-аминопиразин-2-карбоновой кислоты;
[6-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-5-фторпиридин-2-ил]амида 3-хлор-5-(3-гидроксипроп-1-инил)пиридин-2-карбоновой кислоты;
[6-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-5-фторпиридин-2-ил]амида 3-амино-5-дифторметилпиридин-2-карбоновой кислоты;
[6-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-5-фторпиридин-2-ил]амида 3-амино-6-хлор-5-(1,1-дифторэтил)пиразин-2-карбоновой кислоты;
[6-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-5-фторпиридин-2-ил]амида 5-цианопиридин-2-карбоновой кислоты;
[6-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-5-фторпиридин-2-ил]амида 3-хлор-5-(1,1-дифторэтил)пиридин-2-карбоновой кислоты;
[6-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-5-фторпиридин-2-ил]амида 3-амино-5-(1,1-дифторэтил)пиразин-2-карбоновой кислоты
и их фармацевтически приемлемых солей.
8. Соединение по п.1, которое представляет собой [6-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-5-фторпиридин-2-ил]амид 5-циано-3-метилпиридин-2-карбоновой кислоты, формулы
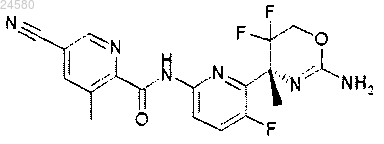
или его фармацевтически приемлемую соль.
9. Соединение по п.1, которое представляет собой [6-((R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4Н-[1,3]оксазин-4-ил)-5-фторпиридин-2-ил]амид 3-хлор-5-трифторметилпиридин-2-карбоновой кислоты, формулы
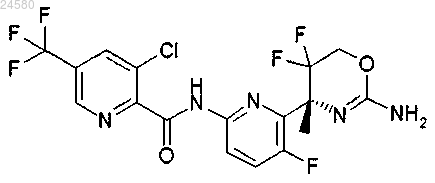
или его фармацевтически приемлемую соль.
10. Фармацевтическая композиция, включающая соединение по любому одному из пп.1-9 или его фармацевтически приемлемую соль в качестве активного фармацевтического ингредиента в ассоциации по меньшей мере с одним фармацевтически приемлемым носителем или разбавителем.
11. Применение соединения по любому одному из пп.1-9 или его фармацевтически приемлемой соли в качестве лекарственного средства для лечения или профилактики болезни Альцгеймера или умеренных когнитивных нарушений.
Текст
Изобретение относится к новым производным оксазина формулы (I) и к их фармацевтически приемлемым солям, в которых все переменные определены в описании, к их фармацевтическим композициям, к их комбинациям и к их использованию в качестве лекарственных средств, особенно для лечения болезни Альцгеймера или диабета за счет ингибирования ВАСЕ-1 или ВАСЕ-2. Люенд Райнер Мартин, Махауэр Райнер, Рюэгер Хайнрих, Венстра Сим Якоб (CH) Медведев В.Н. (RU) Область техники, к которой относится настоящее изобретение Изобретение относится к новым производным оксазина и к их фармацевтически приемлемым солям, к содержащим их фармацевтическим композициям, их фармацевтическим комбинациям, и к их использованию в качестве лекарственных средств, особенно для лечения нейродегенерации путем ингибирования ВАСЕ-1, или лечения диабета путем ингибирования ВАСЕ-2. Уровень техники, к которой относится настоящее изобретение Болезнь Альцгеймера представляет собой изнуряющее нейродегенеративное нарушение. Его спорадические формы поражают население старших возрастов (резкое повышение случаев в возрасте 75 лет),кроме того, существуют различные семейные формы, при которых заболевание развивается на четвертом или пятом десятилетии жизни. Патологически болезнь характеризуется наличием внеклеточных старческих бляшек и внутриклеточных нейрофибриллярных сплетений в мозгу пациентов. Ядра старческих бляшек малы и состоят из 4 кДа амилоидных пептидов. Они вырабатываются в результате протеолитического процессинга крупных трансмембранных белков, белков-предшественников амилоидов (АРР). Расщепление АРР бета-секретазой (ВАСЕ-1) высвобождает растворимый АРР-бета фрагмент, тогда как Сконец длиной в 99-аминокислот остается связанным с мембраной. Такой С-концевой фрагмент затем протеолитически процессируется гамма-секретазой (мембранный мультиферментный комплекс) с образованием амилоидных пептидов различной длины, преимущественно длиной в 40 и 42 аминокислоты(Hardy J, Selkoe DJ (2002) Science; 297 (5580):353-356). Если в патологических условиях образование указанных пептидов происходит с повышенной скоростью или если их удаление из мозга нарушается, повышенная концентрация амилоидных пептидов мозга приводит к образованию олигомеров, фибрилл и впоследствии бляшек (Farris W, et al (2007) Am. J.Pathol.; 171 (1):241-251). Было показано, что отложение амилоидных пептидов и бляшек в мозгу является первым ощутимым событием в патогенезе болезни Альцгеймера, и что это является триггером, приводящим к утрате синапсов, синапсических контактов и нейронов (Grimmer T, et al (2009) Neurobiology ofAging; 30 (12): 1902-1909). Атрофия мозга, вызываемая массивной утратой нейронов, сопровождается нарушениями познавательных способностей, памяти, ориентации и способности решать задачи повседневной жизни, т.е. клиническими проявлениями деменции (Okello A. et al (2009) Neurology; 73 (10):754760). ВАСЕ-1, также известная как Asp2 или мемапсин 2, представляет собой трансмембранную аспарагиновую протеазу, которая интенсивно экспрессируется в нейронах. Она локализуется совместно со своим субстратом АРР в комплексе Гольджи и в эндоцитозных отделах (Willem M, Lammich S, Haass С(2009) Semin.Cell Dev.Biol; 20 (2):175-182). Исследования нокаутных мышей продемонстрировали отсутствие образования амилоидных пептидов, хотя животные оставались здоровыми и фертильными (Ohno M, et al (2007) Neurobiol.Dis.; 26(1):134-145). Генетическая абляция ВАСЕ-1 у АРР-сверхэкспрессирующих мышей продемонстрировала отсутствие образования бляшек и уменьшение когнитивного дефицита (Ohno M, et al (2004) Neuron; 41(1):27-33). Уровни ВАСЕ-1 повышены в мозгу пациентов, страдающих спорадической болезнью Альцгеймера (Hampel H, Shen Y (2009) Scand. J. Clin. Lab. Invest.; 69 (1) :8-12). Взятые вместе, указанные факты позволяют предположить, что ингибирование ВАСЕ-1 может оказаться успешной терапевтической стратегией при лечении болезни Альцгеймера. Фермент 2 (ВАСЕ-2), расщепляющий бета-сайт белка-предшественника амилоида, представляет собой трансмембранную аспарагиновую протеазу, которая интенсивно экспрессируется в панкреатических -клетках и других периферических тканях (Brian D. Bennett, Safura Babu-Khan, Richard Loeloff,Jean-Claude Louis, Eileen Curran; Martin Citron, and Robert Vassar (2000) JJ. Biol. Chem. 275 (27) 2064720651). BACE-2 является близким родственником ВАСЕ-1 или бета-секретазы. Однако, несмотря на структурное сходство и сходство последовательностей, специфичность субстратов ВАСЕ-1 и ВАСЕ-2,по-видимому, отличается. Хотя А или -амилоидный пептид представляет собой основной субстрат для ВАСЕ-1, ВАСЕ-2 не создает ни одной формы А (Vassar, R., Bennett, B.D., Babu-Khan, S., Kahn, S., Mendiaz, E.A., Denis, P., Teplow, D.B., Ross, S., Amarante, P., Loeloff, R., Luo, Y., Fisher, S., Fuller, J., Edenson,S., Lile, J., Jarosinski, M.A., Biere, A.L., Curran, E., Burgess, Т., Louis, J.-C, Collins, F., Treanor, J., Rogers,G., and Citron, M. (1999) Science 286, 735-741). Трансмембранный белок 27 (TMEM27 или коллектрин) играет важную роль в -клеточной пролиферации и секреция инсулина (Pinar Akpinar, Satoru Kuwajima, Jan Krutzfeldt, and Markus Stoffel (2005)Tmem27: Cell Metabolism. 2(6) 385-397) и был идентифицирован как субстрат для ВАСЕ-2 (WO 2010/063718). Tmem27 существует в виде димера и внеклеточный домен расщепляется и удаляется из плазмы специфическим дляклеток образом. Сверхэкспрессия полной длины Tmem27, но не усеченного или растворимого белка, усиливает -клеточную пролиферацию, что предполагает, что полной длины белок необходим для указанной биологической функции. Tcf1 (ядерный фактор гепатоцитов-1, HNF1) контролирует транскрипцию ТМЕМ 27. Мыши с целевой делецией Tcf1 демонстрируют уменьшенную массуклеток, и резкое уменьшение Tmem27, за счет использования RNAi приводит к уменьшению клеточной пролиферации. Трансгенные мыши с повышенной экспрессией Tmem27 в панкреатических клетках демонстрируют повышенную массуклеток по сравнению с однопометными дикого типа мышами. Полученные результаты свидетельствуют о том, что ТМЕМ 27 играет роль в контроле массыклеток, и что ингибирование ВАСЕ-2, которые расщепляют ТМЕМ 27, может быть полезно для лечения снижения массы и функцийклеток, лежащих в основе причин диабета. Взятые вместе, полученные результаты, позволяют предположить, что ингибирование ВАСЕ-2 может оказаться удачной терапевтической стратегией для лечения и профилактики метаболических нарушений, связанных с пониженной массой и/или функциейклеток, таких как диабет 2 типа. Производные оксазина, обладающие ВАСЕ-1 и/или ВАСЕ-2 активностью, раскрыты в литературе,например, в WO 2011/069934 А 1. Однако существует настоятельная потребность в создании дальнейших структурно отличающихся ингибиторов ВАСЕ, которые могли бы иметь улучшенные свойства с точки зрения их ингибирующей активности, селективности, растворимости, метаболизма, фармакокинетики и/или профиля безопасности. Может также оказаться удачным идентифицировать соединения, которые демонстрируют селективную ингибирующую активность в отношении ВАСЕ-1 по сравнению с ВАСЕ-2,или ВАСЕ-2 по сравнению с ВАСЕ-1. Сущность настоящего изобретения Поэтому настоящее соединение относится к новым производным оксазина обладающим ВАСЕ ингибирующей активностью, к их получению, к их использованию в медицине и к содержащим их лекарственным средствам. Более конкретно, первый аспект настоящего изобретения относится к соединению формулы (I), или к его фармацевтически приемлемой соли где R1 и R2 независимо представляют собой водород или галоген;R3 и R4 независимо представляют собой водород или C1-3 алкил;R6 представляет собой 5- или 6-членный моноциклический гетероарил, содержащий 1, 2, 3 или 4 гетероатома, независимо выбранные из N, О и S, и где указанный гетероарил необязательно замещен 1, 2, 3 или 4 заместителями, независимо выбранными из галогена, циано, амино, гидрокси, C1-4 алкила, галогенC1-4 алкила, галоген-C1-4 алкилтио, галоген-C1-4 алкокси, C1-4 алкокси, C1-4 алкокси-C1-4 алкила, C1-4 алкоксиC1-4 алкокси, C1-4 алкокси-C1-4 алкилтио, C1-4 алкокси-С 2-4 алкенила, C1-4 алкокси-C2-4 алкинила, гидрокси-C14 алкила, гидрокси-С 2-4 алкенила и гидрокси-С 2-4 алкинила. Определения В том смысле, как здесь использован, термин "C1-4 алкил" относится к разветвленной или неразветвленной углеводородной цепи радикала, состоящей только из атомов углерода и водорода, не содержащей ненасыщенности, содержащей от одного до четырех атомов углерода, и которая присоединена к остальной части молекулы простой связью. Примеры C1-4 алкилов включают метил, (R)-метил, этил, н-пропил,1-метилэтил (изопропил), н-бутил и 1,1-диметилэтил (трет-бутил). Термин "C1-3 алкил" относится к алкильным радикалам, как определено в описании, содержащим от одного до трех атомов углерода. В том смысле, как здесь использован, термин "С 2-4 алкенил" относится к разветвленной или неразветвленной углеводородной цепи группы радикала, состоящей только из атомов углерода и водорода,содержащей по меньшей мере одну двойную связь, содержащей от двух до четырех атомов углерода, и которая присоединена к остальной части молекулы простой связью. Примеры C2-6 алкенилов включают этенил, проп-1-енил и бут-1-енил. В том смысле, как здесь использован, термин "С 2-4 алкинил" относится к разветвленной или неразветвленной углеводородной цепи группы радикала, состоящей только из атомов углерода и водорода,содержащей по меньшей мере одну тройную связь, содержащей от двух до четырех атомов углерода, и которая присоединена к остальной части молекулы простой связью. Примеры С 2-4 алкинилов включают этинил, проп-1-инил и бут-1-инил. В том смысле, как здесь использован, термин "С 1-4 алкокси" относится к радикалу формулы -O-Ra,где Ra представляет собой C1-4 алкильный радикал, как определено выше. Примеры C1-4 алкокси включают метокси, этокси, пропокси, изопропокси, бутокси и изобутокси. Термин "C1-3 алкокси" представляет собой соответствующую конструкцию. Как использовано в описании, термин "C1-4 алкокси-C1-4 алкил" относится к радикалу формулы -RaO-Ra, где каждый Ra независимо представляет собой C1-4 алкильный радикал, как определено выше. Указанный атом кислорода может быть связан с любым атомом углерода в любом алкильном радикале. Примеры C1-4 алкокси-C1-4 алкилов включают метоксиметил, метоксиэтил, этоксиэтил, 1-этоксипропил и 2-метоксибутил. Термин "C1-3 алкокси-C1-3 алкил" образован соответствующим образом. В том смысле, как здесь использован, термин "C1-4 алкокси-C1-4 алкокси" относится к радикалу формулы -O-Ra-O-Ra, где каждый Ra независимо представляет собой C1-4 алкильный радикал, как определено выше. Атомы кислорода могут быть связаны с любым из атомов углерода алкильных радикалов. Примеры C1-4 алкокси-C1-4 алкокси включают метоксиметокси, метоксиэтокси, этоксиэтокси, 1-этоксиприлокси и 2-метоксибутокси. Как использовано в описании, термин "C1-4 алкокси-C1-4 алкилтио" относится к радикалу формулы S-Ra-O-Ra, где каждый Ra независимо представляет собой C1-4 алкильный радикал, как определено выше. Атомы кислорода и серы могут быть связаны с любым из атомов углерода алкильных радикалов. Примеры C1-4 алкокси-C1-4 алкилтио включают метоксиметилтио, метоксиэтилтио, этоксиэтилтио, 1-этоксипропилтио и 2-метоксибутилтио. В том смысле, как здесь использован, термин "C1-4 алкокси-С 2-4 алкенил" относится к радикалу формулы -Rb-O-Ra, где Ra представляет собой C1-4 алкильный радикал, как определено выше, и Rb представляет собой C1-4 алкенильный радикал, как определено выше. Указанный атом кислорода может быть связан с любым атомом углерода в указанном алкильном радикале, и с любым атомом углерода в указанном алкенильном радикале. Примеры C1-4 алкокси-C1-4 алкенилов включают метоксиэтенил, этоксиэтенил, 3 метоксипропенил, 1-этоксипропенил и 2-метоксибутенил. В том смысле, как здесь использован, термин "C1-4 алкокси-C2-4 алкинил" относится к радикалу формулы -Rb-O-Ra, где Ra представляет собой C1-4 алкильный радикал, как определено выше, и Rb представляет собой C1-4 алкинильный радикал, как определено выше. Указанный атом кислорода может быть связан с любым атомом углерода в указанном алкильном радикале и с любым доступным атомом углерода в указанном алкинильном радикале. Примеры C1-4 алкокси-С 2-4 алкинилов включают метоксиэтинил, этоксиэтинил, 3-метоксипропинил, 1-этоксипропинил и 2-метоксибутинил. Термин "галоген" относится к брому, хлору, фтору или иоду. Как использовано в описании, термин "галоген-C1-4 алкил" относится к C1-4 алкильному радикалу,как определено выше, замещенному одним или более из галогеновых радикалов, как определено выше. Примеры галоген-C1-4 алкилов включают трифторметил, дифторметил, фторметил, трихлорметил, 2,2,2 трифторэтил, 1-фторметил-2-фторэтил, 3-бром-2-фторпропил и 1-бромметил-2-бромэтил. Термин "галоген-C1-3 алкил" образуется соответствующим образом. В том смысле, как здесь использован, термин "галоген-C1-4 алкилтио" относится к радикалу формулы -S-Ra, где Ra представляет собой галоген-C1-4 алкильный радикал, как определено выше. Примеры галоген-C1-4 алкилтио включают трифторметилтио, дифторметилтио, фторметилтио, трихлорметилтио,2,2,2-трифторэтилтио, 1-фторметил-2-фторэтилтио, 3-бром-2-фторпропилтио и 1-бромметил-2-бромэтилтио. В том смысле, как здесь использован, термин "галоген-C1-4 алкокси" относится к C1-4 алкокси радикалу, как определено выше, замещенному одним или более из галогеновых радикалов, как определено выше. Примеры галоген-C1-4 алкокси включают трифторметокси, дифторметокси, фторметокси, трихлорметокси, 2, 2,2-трифторэтокси, 1-фторметил-2-фторэтокси, 3-бром-2-фторпропокси и 1-бромметил-2 бромэтокси. В том смысле, как здесь использован, термин "гетероарил" относится к 5- или 6-членному ароматическому моноциклическому кольцевому радикалу, который включает 1, 2, 3 или 4 гетероатома, индивидуально выбранные из азота, кислорода и серы. Указанный гетероарильный радикал может быть связан через атом углерода или гетероатом. Примеры гетероарилов включают фурил, пирролил, тиенил, пиразолил, имидазолил, тиазолил, изотиазолил, оксазолил, изоксазолил, триазолил, тетразолил, пиразинил,пиридазинил, пиримидил и пиридил. Как использовано в описании, термин "гидроксиС 1-4 алкил" относится к C1-4 алкильному радикалу,как определено выше, где один из атомов водорода C1-4 алкильного радикала заменен на ОН. Примеры гидроксиС 1-4 алкилов включают гидроксиметил, 2-гидроксиэтил, 2-гидроксипропил, 3-гидроксипропил и 2-гидроксибутил. В том смысле, как здесь использован, термин "гидроксиС 2-4 алкенил" относится к C1-4 алкенильному радикалу, как определено выше, где один из атомов водорода C2-4 алкенильного радикала заменен на ОН. Примеры гидроксиС 2-4 алкенилов включают 2-гидроксиэтенил, 2-гидроксипропенил, 3-гидроксипропенил и 2-гидроксибутенил. В том смысле, как здесь использован, термин "гидроксиС 2-4 алкинил" относится к C2-4 алкинильному радикалу, как определено выше, где один из атомов водорода указанного С 2-4 алкинильного радикала заменен на ОН. Примеры гидроксиС 2-4 алкинилов включают 2-гидроксиэтинил, 3-гидроксипропинил и 2 гидроксибутинил. В том смысле, как здесь использованы, термины обозначают как единственное, так и множественное число, если не указано иначе, или если это не противоречит контексту. Использование любого или всех из встречающихся в описании примеров или примеров выражений (например, "такой как") предназначено просто для лучшего разъяснения изобретения и это не следует рассматривать как ограничение объема настоящего изобретения иначе, чем это заявлено в формуле настоящего изобретения. Термин "соединения настоящего изобретения" (если конкретно не определено иначе) относится к соединениям формул (I), (Ia), (Ib) или (Ic), соединениям примеров, фармацевтически приемлемым солям таких соединений и/или гидратам или сольватам таких соединений, также как ко всем стереоизомерам(включая диастереоизомеры и энантиомеры), таутомерам и меченным изотопами соединениям (включая дейтерий). Термин "агенты настоящего изобретения" имеет те же самые значения, что и термин "соединения настоящего изобретения". В том смысле, как здесь использованы, термины "ингибировать", "ингибирование" или "ингибирующий" относятся к уменьшению или подавлению указанных состояний, симптомов или нарушений,или заболеваний, или к значительному снижению базовой активности биологической активности или процесса. В том смысле, как здесь использован, термин "фармацевтически приемлемый носитель" включает любой или все растворители, дисперсионные среды, покрытия, поверхностно-активные агенты, антиоксиданты, консерванты (например, антибактериальные агенты, противогрибковые агенты), изотонические агенты, задерживающие абсорбцию агенты, соли, консерванты, лекарственные средства, стабилизаторы лекарственных средств, связующие, эксципиенты, разрыхляющие агенты, смазывающие агенты, подсластители, вкусовые агенты, красители, и тому подобное и их комбинации, которые должны быть хорошо известны специалистам в данной области (см., например, Remington's Pharmaceutical Sciences, 18th Ed.Mack Printing Company, 1990, pp. 1289-1329). За исключением тех случаев, когда какой-либо обычный носитель несовместим с активным ингредиентом, и его использование в терапевтических или фармацевтических композициях не предусматривается. В том смысле, как здесь использован, термин "профилактика" любого конкретного заболевания или нарушения относится к введению соединения настоящего изобретения субъекту до того как проявляются какие-либо симптомы указанного заболевания или нарушения. В том смысле, как здесь использован, термин "субъект" относится к животному. Обычно указанным животным является млекопитающее. Термин субъект также относится, например, к приматам (например,людям, мужчинам или женщинам), коровам, овцам, козам, лошадям, собакам, кошкам, кроликам, крысам, мышам, рыбам, птицам и т.п. В некоторых вариантах субъектом является примат. В других вариантах субъектом является человек. Как использовано в описании, субъект "нуждается" в лечении, если в результате такого лечения улучшится биологическое или медицинское состояние субъекта, или улучшится качество его жизни. Термин "терапевтически эффективное количество" соединения настоящего изобретения относится к такому количеству соединения настоящего изобретения, которое вызывает биологическую или медицинскую реакцию субъекта, например, уменьшение или ингибирование активности фермента или белка,или облегчение симптомов, улучшение состояния, замедление или приостановку заболевания, или профилактику заболевания и так далее. В одном нелимитирующем варианте термин "терапевтически эффективное количество" относится к такому количеству соединения настоящего изобретения, которое, будучи введено субъекту, оказывается эффективным для (1) по меньшей мере частичного ослабления, ингибирования, предотвращения и/или облегчения состояния, или нарушения, или заболевания (i) опосредованного ВАСЕ-1 или (ii) связанного с ВАСЕ-1 активностью, или (iii) характеризующегося активностью (нормальной или ненормальной) ВАСЕ-1; или (2) уменьшения или ингибирования активности ВАСЕ-1. В другом нелимитирующем варианте термин "терапевтически эффективное количество" относится к такому количеству соединения настоящего изобретения, которое, будучи введено в клетки или ткани, или в неклеточный биологический материал или в среду, оказывается эффективным для по меньшей мере частичного уменьшения или ингибирования активности ВАСЕ-1. Значение термина "терапевтически эффективное количество", как это проиллюстрировано в вышеприведенных вариантах для ВАСЕ-1, также применимо в тех же значениях к любым другим родственным белкам/пептидам/ферментам, таким как ВАСЕ-2, или катепсин D. В том смысле, как здесь использован, термин "лечить", "лечение" или "обработка" любого заболевания или нарушения относится в одном варианте к облегчению заболевания или нарушения (т.е. к замедлению или остановке или к уменьшению развития заболевания или по меньшей мере одного из его клинических симптомов). В другом варианте термины "лечить", "лечение" или "обработка" относятся к регулированию заболевания или нарушения, или физически (например, путем стабилизации очевидных симптомов), психологически (например, путем стабилизации психических параметров) или и того и другого. Подробное описание предпочтительного варианта осуществления настоящего изобретения В настоящем изобретении предложены соединения и их фармацевтические композиции, которые могут быть полезны для лечения или профилактики заболеваний, состояний и/или нарушений путем ингибирования ВАСЕ. В предпостительном варианте предложены соединения формулы (I) или их фармацевтически приемлемые соли-4 024580 где R1 и R2 независимо представляют собой водород или галоген;R3 и R4 независимо представляют собой водород или C1-3 алкил;R6 представляет собой 5- или 6-членный моноциклический гетероарил, содержащий 1, 2, 3 или 4 гетероатома, независимо выбранные из N, О и S, и где указанный гетероарил необязательно замещен 1, 2, 3 или 4 заместителями, независимо выбранными из галогена, циано, амино, гидрокси, C1-4 алкила, галогенC1-4 алкила, галоген-C1-4 алкилтио, галоген-C1-4 алкокси, C1-4 алкокси, C1-4 алкокси-C1-4 алкила, C1-4 алкоксиC1-4 алкокси, C1-4 алкокси-C1-4 алкилтио, C1-4 алкокси-С 2-4 алкенила, C1-4 алкокси-С 2-4 алкинила, гидрокси-C14 алкила, гидрокси-С 2-4 алкенила и гидрокси-С 2-4 алкинила. В более предпочтительном варианте предложены соединения или их фармацевтически приемлемые соли, где R1 и R2 оба представляют собой фтор. В более предпочтительном варианте предложены соединения или их фармацевтически приемлемая соль, где R3 и R4 оба представляют собой водород. В еще более предпочтительном варианте предложены соединения или их фармацевтически приемлемые соли, где R5 представляет собой метил. В еще более предпочтительном варианте предложены соединения, или их фармацевтически приемлемые соли, где R6 представляет собой 6-членный моноциклический гетероарил, содержащий 1, 2, 3 или 4 гетероатома, независимо выбранные из N, О и S, и где указанный гетероарил необязательно замещен 1,2, 3 или 4 заместителями, независимо выбранными из галогена, циано, амино, гидрокси, C1-4 алкила, галоген-C1-4 алкила, галоген-C1-4 алкилтио, галоген-C1-4 алкокси, C1-4 алкокси, C1-4 алкокси-C1-4 алкила, C14 алкокси-C1-4 алкокси и C1-4 алкокси-C1-4 алкилтио. В наиболее предпочтительном варианте предложены соединения или их фармацевтически приемлемые соли, где R6 представляет собой группу пиридин-2-ила, которая замещена 2 заместителями, и где один из заместителей расположен в пара-положении и один из заместителей расположен в ортоположении группы пиридин-2-ила относительно амидного линкера, и где указанные заместители независимо выбраны из галогена, циано, амино, гидрокси, метила, трифторметила, метокси и трифторметокси. В одном из наиболее предпочтительных вариантов предложены соединения или их фармацевтически, которые выбирают из и их фармацевтически приемлемых солей. В одном из наиболее предпочтительных вариантов предложено соединение, или его фармацевтически приемлемая соль, которое представляет собой [6-R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4 Н[1,3]оксазин-4-ил)-5-фторпиридин-2-ил]амид 5-циано-3-метилпиридин-2-карбоновой кислоты, формулы В наиболее предпочтительном варианте предложено соединение или его фармацевтически приемлемая соль, которое представляет сабой [6-R)-2-амино-5,5-дифтор-4-метил-5,6-дигидро-4 Н-[1,3] оксазин-4-ил)-5-фторпиридин-2-ил]амид 3-хлор-5-трифторметилпиридин-2-карбоновой кислоты, формулы Вследствие того, что один или более одного из асимметрических атомов углерода могут присутствовать в соединениях формулы (I), соответствующие соединения формулы (I) могут существовать в оптически чистой активной форме или в форме смеси оптических изомеров, например, в форме рацемической смеси. Все такие оптически чистые изомеры и все их смеси, включая рацемические смеси, представляют собой смеси настоящего изобретения, если контекст не диктует иначе (например, в таком варианте настоящего изобретения, когда четко указывается один энантиомер). В том смысле, как здесь использован, термин "изомеры" относится к различным соединениям, у которых одна и та же молекулярная формула, но они отличаются расположением и конфигурацией указанных атомов. Также, в том смысле, как здесь использован, термин "оптический изомер" или "стереоизомер" относится к любому из различных стереоизомерных конфигураций, которые могут существовать для данного соединения настоящего изобретения и включают геометрические изомеры. Следует понимать, что заместитель может быть присоединен к атому углерода хирального центра. Термин "хиральный" относится к молекулам, которые обладают свойством не совмещаться в пространстве со своим зеркальным отражением, тогда как термин "ахиральный" относится к молекулам, которые совмещаются в пространстве со своим зеркальным отражением. Поэтому, если из контекста не следует иначе (например,если в варианте настоящего изобретения точно указан определенный энантиомер), настоящее изобретение включает энантиомеры, диастереоизомеры или рацематы соединений. "Энантиомеры" представляют собой пары стереоизомеров, которые не совмещаются в пространстве со своим зеркальным отражением. Смесь 1:1 пары энантиомеров представляет собой "рацемическую" смесь. Указанный термин используют при необходимости для обозначения рацемической смеси."Диастереоизомеры" представляют собой стереоизомеры, которые имеют по меньшей мере два асимметрических атома, но которые не являются зеркальными пространственными изображениями друг друга. Абсолютная стереохимия определяется в соответствии с системой номенклатуры Кана-ИнгольдаПрелога R-S. Если соединение является чистым энантиомером, стереохимия у каждого хирального углерода может определяться как R, так и S. Разделение соединений, абсолютная конфигурация которых неизвестна, может обозначаться как (+) или (-), в зависимости от того, в каком направлении (право- или левовращение) они вращают плоскость поляризации света при длине волны D линии натрия. Некоторые раскрытые в описании соединения содержат один или более из асимметрических центров или осей, и поэтому могут образовывать энантиомеры, диастереоизомеры и другие стереоизомерные формы, которые можно определить в терминах абсолютной стереохимии как (R)- или (S)-. В зависимости от выбора исходных материалов и процедур соединения могут присутствовать в форме одного из возможных изомеров или в виде их смесей, например, в виде чистых оптических изомеров, или в виде смесей изомеров, таких как рацематы и диастереоизомерные смеси, в зависимости от числа асимметрических атомов углерода. Подразумевается, что настоящее изобретение включает все такие возможные изомеры, включая рацемические смеси, диастереоизомерные смеси и оптически чистые формы. Оптически активные (R)- и (S)-изомеры можно получить, используя хиральные синтоны или хиральные реагенты, или разделяя изомеры, используя обычные методики. Если соединения содержат двойную связь, заместитель может находиться в Е или Z конфигурации. Если соединение содержит дизамещенный циклоалкил, циклоалкильный заместитель может иметь цис- или трансконфигурацию. В одном варианте настоящего изобретения предложено соединение примеров, содержащее один хиральный центр, в виде выделенного стереоизомера в R-конфигурации. В одном варианте настоящего изобретения предложено соединение примеров, содержащее один хиральный центр, в виде выделенного стереоизомера в S конфигурации. В одном варианте настоящего изобретения предложено соединение примеров, содержащее один хиральный центр, в виде рацемической смеси. Возможен также вариант, когда промежуточные соединения и соединения настоящего изобретения могут существовать в различных таутомерных формах, и все такие формы включены в объем настоящего изобретения. Термин "таутомеры" или "таутомерные формы" относится к структурным изомерам различных энергий, взаимопревращение которых происходит благодаря низкому энергетическому барьеру. Например, протонные таутомеры (известные также как прототропические таутомеры) включают взаимопревращения за счет миграции протона, такие как кето-енольная и имин-енаминная изомеризации. Конкретным примером протонных таутомеров является имидазольный фрагмент, в котором протон может мигрировать между двумя атомами азота. Валентные таутомеры включают взаимопревращения за счет реорганизации некоторых из связывающих электронов. Любые полученные смеси изомеров можно разделить, используя физико-химические различия их составляющих, на чистые или практически чистые геометрические или оптические изомеры, диастереомеры, рацематы, например, с помощью хроматографии и/или фракционной кристаллизации. Любые полученные рацематы конечных продуктов или промежуточных соединений можно разделить на оптические антиподы известными способами, например, путем разделения их диастереомерных солей, полученных с оптически активными кислотами или основаниями, и затем высвобождая соединение в виде оптически активной кислоты или основания. В частности, таким образом можно использовать основные фрагменты для разделения соединений настоящего изобретения на их оптические антиподы,например, путем фракционной кристаллизация солей, образованных с оптически активными кислотами,например, винной кислотой, дибензоилвинной кислотой, диацетилвинной кислотой, ди-О,О'-птолуоилвинной кислотой, миндальной кислотой, яблочной кислотой или камфор-10-сульфоновой кислотой. Рацемические продукты можно также разделить с помощью хиральной хроматографии, например,высокоэффективной жидкостной хроматографии (ВЭЖХ) с использованием хирального адсорбента. Как использовано в описании, термины "соль" или "соли" относятся к солям присоединения кислот соединений настоящего изобретения. Термин "соли" включает в частности "фармацевтически приемлемые соли". Термин "фармацевтически приемлемые соли" относится к солям, которые сохраняют биологическую эффективность и свойства соединений настоящего изобретения и которые не являются нежелательными с биологической или какой-либо другой точки зрения. Соединения настоящего изобретения могут образовывать кислые соли за счет присутствия аминогрупп или аналогичных им групп. В одном варианте настоящее изобретение относится к соединениям формул (I), как раскрыто в описании, в свободной форме. В другом варианте настоящее изобретение относится к соединениям формул(I), как раскрыто в описании, в форме фармацевтически приемлемых солей. В еще одном варианте на-9 024580 стоящее изобретение относится к соединениям формул (I), как раскрыто в описании, в форме фармацевтически приемлемых солей присоединения кислот. В еще одном варианте настоящее изобретение относится к соединениям формул (I), как раскрыто в описании, в форме гидрохлоридных солей. В еще одном варианте настоящее изобретение относится к любому одному из соединений примеров в свободной форме. В еще одном варианте настоящее изобретение относится к любому одному из соединений примеров в форме соли. В еще одном варианте настоящее изобретение относится к любому одному из соединений примеров в форме соли присоединения кислоты. В еще одном варианте настоящее изобретение относится к любому одному из соединения примеров в форме фармацевтически приемлемой соли. В другом варианте настоящее изобретение относится к любому одному из соединений примеров в форме фармацевтически приемлемой соли присоединения кислоты. В еще одном варианте настоящее изобретение относится к любому одному из соединений примеров в форме гидрохлоридной соли. Фармацевтически приемлемые соли присоединения кислот можно получить с неорганическими кислотами и органическими кислотами, например, в форме ацетата, аспартата, бензоата, безилата, бромида/гидробромида, бикарбоната/карбоната, бисульфата/сульфата, камфорсульфоната, хлорида/гидрохлорида, хлортеофиллоната, цитрата, этандисульфоната, фумарата, глуцептата, глюконата, глюкуроната,гиппурата, гидроиодида/иодида, изетионата, лактата, лактобионата, лаурилсульфата, малата, малеата,малоната, манделата, мезилата, метилсульфата, нафтоата, напсилата, никотината, нитрата, октадеканоата, олеата, оксалата, пальмитата, памоата, фосфата/гидрофосфата, фосфата/дигидрофосфата, полигалактуроната, пропионата, стеарата, сукцината, сульфосалицилата, тартрата, тозилата и трифторацетата. Неорганические кислоты, с которыми можно получить соли, включают, например, хлористоводородную кислоту, бромистоводородную кислоту, серную кислоту, азотную кислоту, фосфорную кислоту и т.п. Органические кислоты, с которыми можно получить соли, включают, например, уксусную кислоту,пропионовую кислоту, гликолевую кислоту, щавелевую кислоту, малеиновую кислоту, малоновую кислоту, янтарную кислоту, фумаровую кислоту, винную кислоту, лимонную кислоту, бензойную кислоту,миндальную кислоту, метансульфоновую кислоту, этансульфоновую кислоту, толуолсульфоновую кислоту, сульфосалициловую кислоту, и т.п. Фармацевтически приемлемые соли присоединения оснований можно получить с неорганическими или органическими основаниями. Фармацевтически приемлемые соли настоящего изобретения можно синтезировать на основании кислотного фрагмента обычными химическими способами. Обычно такие соли можно получить, осуществляя взаимодействие формы свободного основания указанного соединения со стехиометрическим количеством соответствующей кислоты. Такие реакции обычно проводят в воде или в органических растворителях или в смеси обоих. Обычно желательно использовать неводные среды, такие как эфир, этилацетат, этанол, изопропанол или ацетонитрил, где это возможно. Списки дополнительных подходящих солей можно найти, например, в "Remington's Pharmaceutical Sciences", 20th ed., Mack Publishing Company, Easton, Pa., (1985); и в "Handbook of Pharmaceutical Salts: Properties, Selection, and Use" by Stahl andWermuth (Wiley-VCH, Weinheim, Germany, 2002). Кроме того, соединения настоящего изобретения, включая их соли, можно также получить в форме их гидратов, или включая другие растворители, используемые для их кристаллизации. Соединения настоящего изобретения могут естественным образом или в результате получения образовывать сольваты с фармацевтически приемлемыми растворителями (включая воду); поэтому следует понимать, что настоящее изобретение включает как сольватированные, так и несольватированные формы. Термин "сольват" относится к молекулярным комплексам соединений настоящего изобретения (включая их фармацевтически приемлемые соли) с одной или более из молекул растворителя. Такие молекулы растворителя являются молекулами, которые обычно используют в области фармацевтики и которые, как известно,являются безопасными для пациентов, например, вода, этанол и т.п. Термин "гидрат" относится к комплексам, в которых молекулами растворителя является вода. Соединения настоящего изобретения, т.е. соединения формулы (I), которые содержат группы, способные проявлять себя как доноры и/или акцепторы в водородных связях, могут оказаться способными образовывать совместные кристаллы с подходящими образующими совместные кристаллы агентами. Указанные совместные кристаллы можно получить из соединений формулы (I), используя известные способы совместной кристаллизации. Такие способы включают измельчение, нагревание, совместное сублимирование, совместное плавление или контактирование в растворе соединения формулы (I) с совместно кристаллизующимся агентом в условиях кристаллизации и выделение образовавшихся при этом совместных кристаллов. Подходящие агенты для совместной кристаллизации включают те, что раскрыты в WO 2004/078163. Следовательно, в настоящем изобретении предложены далее совместные кристаллы,включающие соединения формулы (I). Соединения настоящего изобретения, включая их соли, гидраты и сольваты, могут естественным образом или в результате получения образовывать полиморфы. Соединения настоящего изобретения можно синтезировать обычными способами, которые включают способы, аналогичные способам, хорошо известным специалистам в области химии, особенно в свете раскрытого здесь описания. Исходные материалы обычно доступны из коммерческих источников,- 10024580 таких Sigma-Aldrich, или их легко получить, используя способы, хорошо известные специалистам в данной области (например, получить способами, раскрытыми у Louis F. Fieser and Mary Fieser, Reagens forOrganic Synthesis, v. 1-19, Wiley, New York (1967-1999 ed.), или Beilsteins Handbuch der organischen Chemie, 4, Aufl. ed. Springer-Verlag, Berlin, включая приложения (также доступные через он-лайн базу данных Beilstein. Для иллюстративных целей на приводимых далее схемах реакций 1 и 2 предложены возможные пути синтеза соединений настоящего изобретения, также как ключевых промежуточных соединений. Для более полного описания отдельных стадий реакций следует смотреть приведенный далее раздел примеров. Специалистам в данной области должно быть понятно, что для синтеза соединений настоящего изобретения можно использовать и другие пути синтеза. Хотя на приведенных далее схемах указаны и обсуждаются конкретные исходные материалы, и реагенты, другие исходные материалы и реагенты и/или условия реакций можно легко использовать для. получения различных производных. Кроме того, многие соединения, полученные раскрытыми далее способами, можно далее модифицировать в свете раскрытого изобретения, используя обычные химические методы, хорошо известные специалистам в данной области. Схема 1 В следующем аспекте настоящее изобретение относится к способу получения соединения формулы(I), в свободной форме или в форме фармацевтически приемлемой соли, включающему а) осуществление взаимодействия соединения формулы (II) в свободной форме или в форме соли, где R1, R2, R3, R4 и R5 имеют указанные для соединения формулы I значения и PG представляет собой защитную группу, например, N-трет-бутоксикарбонил, с соединением формулы (III) в свободной форме или в форме соли, где R6 имеет указанные для соединений формулы I значения и L представляет собой уходящую группу, например, гидроксильную группу,b) осуществление взаимодействия соединения формулы (На) в свободной форме или в форме соли, где R1, R2, R3, R4 и R5 имеют указанные для соединений формулы значения I, Hal представляет собой галоген, например, бром, и PG представляет собой защитную группу, например, N-трет-бутоксикарбонил, с соединением формулы (IIIa) в свободной форме или в форме соли, где R6 имеет указанные для соединений формулы I значения,c) необязательное восстановление, окисление или другую функционализацию полученного соединения,- 12024580d) отщепление любой необязательно присутствующей защитной группы (защитных групп) и е) выделение полученного таким образом соединения формулы I в свободной форме или в форме соли. Приведенные выше реакции можно осуществить обычными способами. Например, реакцию, раскрытую на стадии (а), можно вести в присутствии подходящего сочетающего агента, например, 1 гидрокси-7-азабензотриазола, подходящего активирующего агента, например, гидрохлорида 1-(3-диметиламинопропил)-3-этилкарбодиимида, и необязательно подходящего основания, например, диизопропилэтиламина, в подходящем растворителе, например, в диметилформамиде, и при соответствующей температуре, например, от 0 до 50 С, более предпочтительно от 0 до 25 С. Реакцию, раскрытую на стадии (b), можно вести:(i) в присутствии подходящего катализатора, например, трис(дибензилиденацетон)дипалладия,подходящего лиганда, например, ксантфоса, подходящего основания, например, карбоната цезия, подходящего растворителя, например, диоксана, и при соответствующей температуре, например, от 10 до 100 С, более предпочтительно от 30 до 85 С; или(ii) в присутствии подходящего катализатора, например, иодида меди, подходящего лиганда, например, rac-транс-N,N'-диметилциклогексан-1,2-диамина, подходящего основания, например, карбоната калия, подходящего растворителя, например, диоксана, и при соответствующей температуре, например,температуре кипения с обратным холодильником. Исходные материалы формул II, IIa, III и IIIa известны или их можно получить в соответствии с обычными способами, исходя из известных соединений, как раскрыто в примерах, или можно получить,используя способы, аналогичные способам, раскрытым в примерах. Дальнейшее необязательное восстановление, окисление или другую функционализацию соединений формулы (I) можно вести в соответствии со способами, хорошо известными специалистам в данной области. В объеме рассматриваемого текста только легко удаляемые группы, которые не являются составляющими конкретного целевого продукта соединений настоящего изобретения, обозначают как "защитная группа", если из контекста не следует иначе. Защита функциональных групп такими защитными группами, сами защитные группы и реакции их удаления раскрыты, например, в стандартных ссылочных работах, таких как J.F.W. McOmie, "Protective Groups in Organic Chemistry", Plenum Press, London andBeach, and Basel 1982. Отличительной характеристикой защитных групп является простота их удаления(т.е. без возникновения нежелательных вторичных реакций), например, путем сольволиза, восстановления, фотолиза или альтернативно в физиологических условиях (например, ферментативным расщеплением). Соли соединений настоящего изобретения, содержащие по меньшей мере одну солеобразующую группу, можно получить способами, хорошо известными специалистам в данной области. Например,соли присоединения кислот соединений настоящего изобретения получают обычным способом, например, обрабатывая соединения кислотой или подходящим анионообменным реагентом. Соли можно превратить в свободные соединения в соответствии со способами, хорошо известными специалистам в данной области. Соли присоединения кислоты можно превратить, например, путем обработки подходящим основным агентом. Соединения, содержащие асимметрический атом углерода, могут существовать в виде индивидуальных оптически активных изомерных форм или в виде их смесей, например, в виде рацемических или диастереоизомерных смесей. Диастереоизомерные смеси можно разделить на их индивидуальные диастереоизомеры на основании разности их физико-химических характеристик способами, хорошо известными специалистам в данной области, такими как хроматография и/или фракционная кристаллизация. Энантиомеры можно разделить, превращая энантиомерную смесь в диастереоизомерную смесь, используя реакцию с соответствующим оптически активным соединением (например, хиральными вспомогательными агентами, такими как хиральный спирт или хлорангидрид Мошера), выделение диастереоизомеров и превращение (например, гидролизом) отдельных диастереоизомеров в энантиомеры соответствующей степени чистоты. Энантиомеры можно также разделить, используя коммерчески доступные хиральные ВЭЖХ колонки. Настоящее изобретение далее включает любой вариант рассматриваемых процессов, в которых компоненты реакции используют в форме их солей или оптически чистых материалов. Соединения настоящего изобретения и промежуточные соединения можно также превратить в любые другие в соответствии со способами, обычно хорошо известными специалистам в данной области. Соединения формулы (I) в свободной форме или в форме фармацевтически приемлемых солей,- 13024580 здесь и далее часто называемые как "агенты настоящего изобретения", демонстрируют ценные фармакологические свойства, при тестировании in vitro, и поэтому могут быть полезными в лекарственных средствах, при лечении или для использования в качестве химических соединений для исследований, например, соединений, являющихся исследовательскими инструментами. Например, агенты настоящего изобретения являются ингибиторами ВАСЕ-1 и ВАСЕ-2 и могут быть использованы для лечения или профилактики состояний, заболеваний или нарушений, включающих процессинг указанными ферментами, особенно образование бета-амилоида и последующую агрегацию в олигомеры и фибриллы, и утрату массы и/или функцийклеток. Ингибирующие свойства агентов настоящего изобретения в отношении протеаз можно оценить в представленных в описании тестах. Тест 1. Ингибирование человеческой ВАСЕ-1. Рекомбинантную ВАСЕ-1 (внеклеточный домен, экспрессированный в бакуловирус и очищенный стандартными способами) в концентрации от 0,1 до 1 нМ инкубируют с различными концентрациями тестируемых соединений в течение 1 часа при комнатной температуре в 100 мМ ацетатном буфере, рН 4,5, содержащем 0,1% CHAPS. Активность измеряют, используя конечную концентрацию 3 мкМ гасящего флуоресценцию субстрата Q-C(HSO3)-Ile-Asp-Leu-Ala-Val-Leu-Asp-HN-CH2-CH2-Mca, где Q = 2 нитро-5-аминобензойная кислота и Мса = 7-метокси-4-кумаринилуксусная кислота. Каталитическое превращение контролируют, используя флуоресцентное планшетное считывающее устройство SpectramaxGemini (Molecular Devices) в черных 96-луночных микропланшетах, используя возбуждение/эмиссию на длинах волн 325 нм и 400 нм, соответственно. Увеличение флуоресценции регистрируют в течение 15 минут с 1-минутными интервалами. Кривые зависимости флуоресценция/время рассчитывают, используя результаты для дубликатных лунок и лунок без ингибитора, и значения ИК 50 рассчитывают, используя логистическую 4-параметрическую модель. Тест 2. Ингибирование человеческой ВАСЕ-2. Рекомбинантную ВАСЕ-2 (внеклеточный домен, экспрессированный в бакуловирус и очищенный стандартными способами) в концентрации от 0,1 до 1 нМ инкубируют с различными концентрациями тестируемых соединений в течение 1 часа при комнатной температуре в 100 мМ ацетатном буфере, рН 4,5, содержащем 0,1% CHAPS. Активность измеряют, используя конечную концентрацию 3 мкМ гасящего флуоресценцию субстрата Q-C(HSO3)-Ile-Asp-Leu-Ala-Val-Leu-Asp-HN-CH2-CH2-Mca, где Q = 2 нитро-5-аминобензойная кислота и Мса = 7-метокси-4-кумаринилуксусная кислота. Каталитическое превращение контролируют, используя флуоресцентное планшетное считывающее устройство SpectramaxGemini (Molecular Devices) в черных 96-луночных микропланшетах, используя возбуждение/эмиссию на длинах волн 325 нм и 400 нм, соответственно. Увеличение флуоресценции регистрируют в течение 15 минут с 1-минутными интервалами. Кривые зависимости флуоресценция/время рассчитывают, используя результаты для дубликатных лунок и лунок без ингибитора и значения ИК 50 рассчитывают, используя логистическую 4-параметрическую модель. Тест 3. Ингибирование человеческого катепсина D. Рекомбинантный катепсин D (экспрессированный как прокатепсин D в бакуловирусах, очищенный стандартными способами и активированный путем инкубирования в натрийформиатном буфере рН 3,7) инкубируют с различными концентрациями тестируемых соединений в течение 1 часа при комнатной температуре в натрийформиатном или натрийацетатном буфере при соответствующем рН в интервале значений рН от 3,0 до 5,0. Синтетический пептидный субстрат Mca-Gly-Lys-Pro-Ile-Leu-Phe-Phe-Arg-LeuLys(DNP)-D-Arg-NH2 добавляют до конечной концентрации 1-5 мкМ, и увеличение флуоресценции регистрируют при длине волны возбуждения 325 нм и эмиссии при 400 нм в микропланшетном спектрофлуориметре в течение от 5 до 30 мин с 1-минутными интервалами. Значения ИК 50 рассчитывают из процента ингибирования активности катепсина D, как функции концентрации тестируемого соединения. Тест 4. Ингибирование клеточного высвобождения амилоидного пептида 1-40. Клетки яичников китайского хомяка трансфицируют человеческим геном для белкапредшественника амилоида. Клетки высевают с плотностью 8000 клеток/лунку в 96-луночные микротитровальные планшеты и культивируют в течение 24 ч в клеточной культуральной среде DMEM, содержащей 10% FCS. Тестируемые соединения добавляют к клеткам в различных концентрациях, и клетки культивируют в течение 24 ч в присутствии тестируемых соединений. Надосадочные жидкости собирают, и концентрации амилоидного пептида 1-40 определяют, используя известные методики иммуноанализа, например, иммуноферментный сэндвич-анализ (ELISA), гомогенный иммуноанализ флуоресценции с разрешением по времени (НТИР), или электро-хемилюминисцентный иммуноанализ. Эффективность соединений рассчитывают из процента ингибирования высвобождения амилоидного пептида как функции концентрации тестируемых соединений. Соединения примеров демонстрируют значения ИК 50, представленные ниже в табл. 1, полученные в тестах 1, 2 и 4. NT = не тестировали. Тест 5. In vivo ингибирующая активность соединений примеров. Самцам крыс штамма Sprague-Dawley массой 220-280 г (Charles River, France) перорально через желудочный зонд вводят только один носитель (0,1% Твин 80, 0,5% метилцеллюлоза в воде) или соединение, суспендированное в носителе в дозе 10 мкмоль соединения на килограмм массы тела за 4 ч до умерщвления. Временную точку 4 ч выбирают для сравнения активности соединений, которые обладают достаточными фармакокинетическими и биораспределительными характеристиками, чтобы снизить полное содержание в мозгу пептида Abeta при приблизительно трех с половиной часах полу-жизни пептидаAbeta40 в мозгу крыс. Непосредственно перед умерщвлением анестезированных крыс (спонтанная ингаляция, 2-5% изофлуран и воздух) фиксируют в стереотаксическом аппарате на приподнятой платформе, причем анестезию продолжают через нос. Голову наклоняют вниз, располагая перпендикулярно корпусу, и гиподермическую иглу вводят через кожу позади затылочного гребня, в мостомозжечковую цистерну. Отсасывают спинномозговую жидкость (CSF) (50-100 мкл), распределяют в пробирки (Lo-bind пробирки Эппендор- 15024580 фа для белка для анализа Abeta40, нормальные пробирки Эппендорфа для анализа соединений), замораживают, используя сухой лед, и хранят при -80 С до анализов. Затем крыс сразу обезглавливают под анестезией, кровь из туловища собирают для анализа уровней содержания соединений, и извлекают мозг. Одну половину переднего мозга рассекают, удаляя мозжечок и обонятельные луковицы, замораживают тремя порциями на металлической плите, предварительно охлажденной на замороженном CO2, и хранят в пробирках при -80 С до анализа Abeta40. Из другой половины мозга извлекают обонятельные луковицы, осуществляют саггитальный срез из середины массой 200-400 мг, помещают в ВЭЖХ ампулы и замораживают, используя сухой лед до проведения анализа на уровни содержания соединений. Уровни содержания растворимого Abeta40 в мозгу крыс и CSF количественно определяют, используя сверхчувствительный анализ Meso Scale Discovery (MSD) 96-луночный MULTI-ARRAY человеческих/крысиных (4G8) Abeta40 (K110FTE-3, Meso Scale Discovery, Gaithersburg, USA). Гомогенаты образцов переднего мозга получают путем обработки ультразвуком в 9 объемах (мас./об.) охлажденного льдом ТВА. Пятьдесят мкл 2% ТХ-100 в полном TBS добавляют к 50 мкл аликвотам гомогената для достижения конечной концентрации 1% ТХ-100 в разбавлении 1:20. Образцы инкубируют на льду в течение 15 мин, прерывая 3 короткими стадиями вращения, затем центрифугируют (100000g, 4 С, 15 минут), и собирают 50 мкл надосадочной жидкости. Жидкость далее разбавляют в отношении 1:5 3% раствором блокатора A (Blocker А) из набора MSD до конечного разбавления 1:100 и наносят на MSD планшет. CSF образцы, содержащие кровь, исключают. Все остальные CSF образцы разбавляют 1% раствором блокатора А (из набора изготовителей) до достижения CSF разбавления 1:20. Калибровочные кривые получают в 1% растворе блокатора А с добавлением синтетического пептида Abeta1-40. Образцы и калибровочные стандарты обрабатывают в дубликате при объеме 25 мкл на лунку. Концентрации Abeta40 в образцах определяют из стандартной кривой, используя программное обеспечение SOFTmax PRO 4.0. Соединения примеров 2, 3, 7 и 30 настоящего изобретения и соединения примеров 22, 39 и 71 WO 2011/069934 А 1 демонстрируют эффекты представленные далее в табл. 2, относительно уменьшенияAbeta в мозгу крыс и CSF, полученные при тестировании в тесте 5 (n.s. = статистически незначимый (tтест Стьюдента Таблица 2 Образцы крови, CSF и мозга также анализируют в отношении уровней содержания соединений, ис- 16024580 пользуя метод жидкостной хроматографии в тандеме с масс-спектрометрией (ЖХ/МС/МС). Образцы мозга смешивают с 2 объемами буфера KH2PO4 и гомогенизируют, используя устройство Covaris. В объем или 30, или 50 мкл крови, CSF или гомогената ткани вводят структурно родственный внутренний стандарт и затем смешивают с по меньшей мере 4-кратным объемным избытком ацетонитрила (белок осаждается). Надосадочную жидкость или непосредственно, или после разбавления водой вводят в систему ЖХ/МС/МС для анализа. Благодаря своим ингибирующим свойствам в отношении протеаз и ВАСЕ-1, в частности, агенты настоящего изобретения могут быть полезны, например, для лечения или профилактики различных нарушений психиатрических, психических, психотических, нейрологических или сосудистых состояний,например состояний, заболеваний или нарушений сосудистой системы или нервной системы, в которых важную роль играет выработка бета-амилоидов или агрегация. На основании ингибирования ВАСЕ-2(бета-сайта АРР-расщепляющего фермента 2) или катепсина D, которые представляют собой близкие гомологи пепсинового типа аспартилпротеаз и бета-секретазы, и корреляции экспрессии ВАСЕ-2 или катепсина D с более онкогенным или метастатическим потенциалом опухолевых клеток, агенты настоящего изобретения можно также использовать в качестве противораковых лекарственных средств, например, супрессии процесса метастазирования, связанного с опухолевыми клетками. Кроме того, на основании ингибирования ВАСЕ-2 и корреляции ВАСЕ-2 активности с ТМЕ 27 расщеплением и массойклеток, агенты настоящего изобретения можно также использовать для лечения или профилактики утраты массы и/или функцийклеток, например, при лечении диабета. Указанные состояния, заболевания или нарушения сосудистой системы или нервной системы, например, включают, без ограничения, тревожные расстройства, такие как панические расстройства с агарофобией или без нее, агарофобии без истории панических расстройств, животные или другие специфические фобии, включая социальные фобии, социальные тревожные расстройства, беспокойства, обсессивно-компульсивные расстройства, стрессовые расстройства, включая посттравматические или острые стрессовые расстройства, или генерализованные или вызванные препаратами тревожные расстройства; неврозы; эпилептические припадки; эпилепсию, особенно парциальную эпилепсию, простые, комплексные или парциальные припадки, включая вторичные генерализованные припадки или генерализованные припадки [отсутствие (типичное или атипичное), миоклонических, клонических, тонических, тоникоклонических или атонических припадков]; конвульсии; мигрени; аффективные расстройства, включая депрессивные или биполярные расстройства, например, однократные или рецидивирующие большие депрессивные расстройства, большие депрессии, дистимические расстройства, дистемию, депрессивные расстройства NOS, биполярные I или биполярные II маниакальные расстройства или циклотимические расстройства; психотические расстройства, включая шизофрению или депрессию; нейродегенерации,например, нейродегенерации, возникающие в результате церебральной ишемии; острые, травматические или хронические дегенеративные процессы нервной системы, такие как болезнь Паркинсона, синдром Дауна, деменцию, например, старческую деменцию, деменцию с тельцами Леви или фронтотемпоральную деменцию, когнитивные нарушения, нарушение когнитивные функций, например, умеренные когнитивные нарушение, нарушения памяти, амилоидную нейропатию, периферическую нейропатию, болезнь Альцгеймера, синдром Герстманна-Штраусслер-Шейнкера, болезнь Ниманна-Пика, например, болезнь Ниманна-Пика типа С, воспаления мозга, поражения мозга, спинного мозга или нервов,например, травматические поражения мозга (TBI), нервные травмы или травмы мозга, сосудистый амилоидоз, геморрагический инсульт с амилоидозом, хорею Хантингтона, амиотрофический латеральный склероз, рассеянный склероз или синдром ломкой X хромосомы; скрепи; церебральную амилоидную ангиопатию; энцефалопатию, например, трансмиссивную губчатую энцефалопатию; удар; расстройства внимания, например, дефицит внимания, расстройство гиперактивности; синдром Тауретта; речевые расстройства, включая заикание; нарушения циркадиального ритма, например, у субъектов, страдающих от эффекта смены часовых поясов или посменной работы; боль; ноцицепцию; чесотку; рвоту, включая острую, замедленную или ожидаемую рвоту, такую как рвота, вызванная химиотерапией или радиацией,локомоционная болезнь, или послеоперационная тошнота или рвота; расстройства питания, включая нервную анорексию или нервную булемию; предменструальный синдром; мышечные спазмы или спастичность, например, у параплегических пациентов; расстройства слуха, например, тиннитус или возрастное нарушение слуха; недержание мочи; глаукому; миозит с включенными тельцами; или нарушения,связанные с наркотиками, включая токсикоманию или наркозависимость, включая зависимость от веществ, таких как спирт, включая расстройства, связанные с отменой препаратов. Агенты настоящего изобретения можно также использовать для повышения когниции, например, у субъектов, страдающих потерей рассудка, таких как болезнь Альцгеймера; в качестве премедикации перед анестезией или перед второстепенными медицинскими вмешательствами, такими, как эндоскопия, включая эндоскопию желудка; или в качестве лигандов, например, радиолиганды или лиганды для позитронной эмиссионной томографии (PET). Благодаряингибирующим свойствам в отношении ВАСЕ-2, соединения настоящего изобретения можно использовать для лечения или профилактики заболеваний или нарушений, опосредованных ВА- 17024580 СЕ-2. Заболевания и нарушения, связанные с ВАСЕ-2, включают: метаболический синдром (такой как дислипидемия, ожирение, резистентность к инсулину, гипертензия, микроальбуминемия, гиперурикаремия, и гиперкоагуляционная способность), резистентность к инсулину, непереносимость глюкозы (также известная как нарушенная толерантность к глюкозе, IGT), ожирение, гипертензия или диабетические осложнения (такие как ретинопатия, нефропатия, диабетическая стопа, язвы, макроангиопатии, метаболический ацидоз или кетоз, реактивная гипогликемия, гиперинсулинемия), метаболические нарушения уровня глюкозы, дислипидемии различных происхождений, атеросклероз и родственные заболевания,высокое кровяное давление, хроническая сердечная недостаточность, синдром X, диабет, неинсулинозависимый сахарный диабет, диабет 2 типа, диабет 1 типа, нарушения массы тела, потерю массы тела, заболевания, связанные с индексом массы тела и лептином. Соединения настоящего изобретения можно использовать для профилактики дегенерации бетаклеток, такой как апоптоз или некроз бета-клеток поджелудочной железы, для улучшения или восстановления функциональности клеток поджелудочной железы, и/или повышения числа и/или размеров бета-клеток поджелудочной железы. Как использовано в описании, пациент страдает от "ожирения", если пациент демонстрирует по меньшей мере один из следующих признаков: индекс массы тела (BMI), т.е. масса тела пациента (в кг) деленная на квадрат роста пациента (в м),составляет 30 или более; абсолютный объем талии 102 см у мужчин или 88 см у женщин; отношение объема талии к объему бедер 0,9 у мужчин или 0,85 у женщин; или процент жира в теле составляет 25% у мужчин или 30% у женщин. Как использовано в описании, у пациента наблюдается "диабет 2 типа", если он отвечает критерию Всемирной организации здравоохранения для диагноза диабет (определение и диагноз сахарного диабета и промежуточной гипергликемии, WHO, 2006), т.е. у пациента наблюдается по меньшей мере один из следующих признаков: глюкоза плазмы натощак 7,0 ммоль/л (126 мг/дл); или венозная глюкоза плазмы 11,1 ммоль/л (200 мг/дл) через 2 ч после перорального приема 75 г глюкозы. Как использовано в описании, у пациента наблюдается "IGT", если он отвечает критерию Всемирной организации здравоохранения для диагноза IGT (определение и диагноз сахарного диабета и промежуточной гипергликемии, WHO, 2006), т.е. у пациента наблюдаются оба признака: глюкоза плазмы натощак 7,0 ммоль/л (126 мг/дл); и венозная глюкоза плазмы 7,8 и 11,1 ммоль/л (200 мг/дл) через 2 ч после перорального приема 75 г глюкозы. В том смысле, как здесь использован, термин "метаболический синдром" представляет собой известный клинический термин, который используют для описания состояния, включающего комбинацию диабета 2 типа, ухудшенную переносимость глюкозы, резистентность к инсулину, гипертензию, ожирение, повышенный абдоминальный обхват, гипертриглицеридемию, низкое значение ЛПВП, гиперурикаемию, гиперкоагуляционную способность и/или микроальбуминемию. Американская ассоциация кардиологов опубликовала методическое руководство для диагностики метаболического синдрома, Grundy,S., et al., (2006) Cardiol. Rev. Vol. 13, No. 6, pp. 322-327. Для вышеперечисленных показаний соответствующие дозы будут меняться в зависимости от, например, соединений, которые используют в качестве активных фармацевтических ингредиентов, хозяина, способа введения, природы и тяжести состояния, болезни или нарушения или от необходимого эффекта. Однако обычно, как показано, удовлетворительные результаты для животных достигаются при ежедневной дозе от около 0,1 до около 100, предпочтительно от около 1 до около 50 мг/кг массы тела животного. Для крупных млекопитающих, например, людей, рекомендуемая ежедневная доза находится в интервале значений от около 0,5 до около 2000, предпочтительно от около 2 до около 200 мг агента настоящего изобретения, введенного обычным способом, например, в разделенных дозах вплоть до четырех раз в день или в форме с замедленным высвобождением. Агенты настоящего изобретения можно вводить обычными способами, в частности, энтерально,предпочтительно перорально, например, в форме таблеток или капсул, или парентерально, например, в форме растворов или суспензий для инъекций. В следующем аспекте настоящее изобретение относится к фармацевтическим композициям, включающим агенты настоящего изобретения в качестве активных фармацевтических ингредиентов в ассоциации с по меньшей мере одним фармацевтически приемлемым носителем или разбавителем, и необязательно в ассоциации с другими вспомогательными веществами, такими как ингибиторы цитохромных Р 450 ферментов, агенты, предотвращающие разложение активных фармацевтических ингредиентов цитохромом Р 450, агенты, улучшающие или усиливающие фармакокинетику активных фармацевтических ингредиентов, агенты, улучшающие или усиливающие биодоступность активных фармацевтических ингредиентов, и т.п., например, грейпфрутовый сок, кетоконазол или, предпочтительно, ритонавир. Такие композиции можно получить обычными способами, например, смешивая их компоненты. Единичные дозовые формы содержат, например, от около 0,1 до около 1000, предпочтительно от около 1 до около 500 мг агента настоящего изобретения. Кроме того, фармацевтические композиции настоящего изобретения можно получить в форме твердого вещества (включая, без ограничений, капсулы, таблетки, пилюли, гранулы, порошки или суппозитории), или в жидкой форме (включая без ограничений, растворы, суспензии или эмульсии). Такие фармацевтические композиции можно подвергнуть обычным фармацевтическим операциям, таким как стерилизация, и/или они могут содержать обычные инертные разбавители, смазывающие агенты или буферные агенты, также как адъюванты, такие как консерванты, стабилизаторы, смачивающие агенты,эмульгаторы и буферы, и т.д. Обычно указанные фармацевтические композиции представляют собой таблетки или желатиновые капсулы, включающие активный ингредиент вместе с а) разбавителями, например, лактозой, декстрозой, сахарозой, маннитом, сорбитом, целлюлозой и/или глицином;b) смазывающими агентами, например, двуокисью кремния, тальком, стеариновой кислотой, ее магниевыми или кальциевыми солями и/или полиэтиленгликолем; для таблеток также используютd) разрыхлители, например, крахмалы, агар, альгиновую кислоту или ее натриевую соль, или шипучие смеси; и/илиe) абсорбенты, красители, вкусовые агенты и подсластители. Таблетки могут быть или покрыты пленкой, или покрыты желудочно-резистентной оболочкой в соответствии со способами, хорошо известными специалистам в данной области. Подходящие композиции для перорального введения включают эффективное количество соединения настоящего изобретения в форме таблеток, пастилок, водных или масляных суспензий, диспергируемых порошков или гранул, эмульсий, твердых или мягких капсул или сиропов или эликсиров. Композиции, предназначенные для перорального введения, приготавливают в соответствии с любым из способов, известных специалистам в данной области для приготовления фармацевтических композиций, и такие композиции могут содержать один или более из агентов, выбранных из группы, состоящей из подсластителей, вкусовых агентов, красящих агентов и консервантов для получения фармацевтически элегантных и приятных на вкус препаратов. Таблетки могут содержать активный ингредиент в смеси с нетоксичными фармацевтически приемлемыми эксципиентами, которые пригодны для изготовления таблеток. Указанные эксципиенты представляют собой, например, инертные разбавители, такие как карбонат кальция, карбонат натрия, лактоза, фосфат кальция или фосфат натрия; агенты, способствующие гранулированию и разрушению, например, кукурузный крахмал или альгиновая кислота; связывающие агенты, например, крахмал, желатин или смола акации; и смазывающие агенты, например, стеарат магния,стеариновая кислота или тальк. Таблетки могут быть без оболочки или на них могут быть известными способами нанесены покрытия для задержки разрушения и абсорбции в желудочно-кишечном тракте, и,тем самым, обеспечить продолжительное действие в течение более длительного периода времени. Например, можно использовать материалы, обеспечивающие задержку по времени, такие как глицерилмоностеарат или глицерилдистеарат. Лекарственные формы для перорального введения могут иметь вид твердых желатиновых капсул, в которых активный ингредиент смешан с инертным твердым веществом разбавителя, например, карбонатом кальция, фосфатом кальция или каолином, или могут иметь вид мягких желатиновых капсул, в которых активный ингредиент смешан с водой или масляной средой, например, арахисовым маслом, жидким парафином или оливковым маслом. Некоторые композиции для инъекций представляют собой водные изотонические растворы или суспензии, и суппозитории, предпочтительно, приготавленные из жирных суспензий или эмульсий. Указанные композиции можно стерилизовать и/или они могут содержать адъюванты, такие как консерванты,стабилизирующие, смачивающие или эмульгирующие агенты, промотеры растворения, соли для регулирования осмотического давления и/или буферы. Кроме того, они также могут содержать другие терапевтически ценные вещества. Указанные композиции приготавливают в соответствии с обычными способами смешивания, гранулирования или нанесения покрытий, соответственно, и они могут содержать около 0,1-75%, или около 1-50%, активного ингредиента. Подходящие композиции для трансдермального введения включают эффективное количество соединения настоящего изобретения с соответствующим носителем. Носители, подходящие для трансдермальной доставки, включают абсорбируемые фармакологически приемлемые растворители, для того чтобы способствовать прохождению через кожу хозяина. Например, трансдермальные приспособления могут быть в форме повязок, включающих базовый элемент, резервуар, содержащий соединение необязательно с носителями, необязательно с регулирующим скорость барьером для доставки соединения через кожу хозяина с регулируемой и заранее определенной скоростью в течение продолжительного промежутка времени, и средства для фиксации устройства на коже. Подходящие композиции для местного применения, например, на коже или на глазах, включают водные растворы, суспензии, мази, кремы, гели или распыляемые лекарственные формы, например, для доставки с использованием аэрозолей или т.п. Такие системы местной доставки могут быть, в частности,подходящими для нанесения на кожу, например, для лечения рака кожи, например, для профилактического применения в защитных от солнца кремах, лосьонах, спреях и т.п. Таким образом, они особенно подходят для использования в средствах для местного применения, включая косметические, лекарственные формы, хорошо известные специалистам в данной области. Такие средства могут содержать солюбилизаторы, стабилизаторы, повышающие тоничность агенты, буферы и консерванты. Как использовано в описании, местное применение может также относиться к ингаляциям или к внутриназальному введению. Обычно они поставляются в виде сухих порошков (или отдельно, в виде смеси, например, в виде сухой смеси с лактозой, или в виде смеси частиц компонентов, например, с фосфолипидами) из сухих порошковых ингаляторов или в виде аэрозольных распылителей с контейнерами под давлением, помп, спреев, атомизаторов или распылителей, содержащих или не содержащих сжатый воздух или подходящий газ. Кроме того, в настоящем изобретении предложены безводные фармацевтические композиции и дозированные формы, содержащие соединения настоящего изобретения в качестве активных ингредиентов,так как вода может способствовать разложению некоторых соединений. Безводные фармацевтические композиции и дозовые формы настоящего изобретения можно получить, используя безводные или с низким содержанием влаги ингредиенты, и в условиях с низким содержанием влаги или с низкой влажностью. Безводные фармацевтические композиции можно получить и хранить в таких условиях, в которых поддерживается их безводная природа. Соответственно, композиции упаковывают, используя хорошо известные специалистам материалы, чтобы предотвратить их экспонирование воде, таким образом, чтобы их можно было включать в соответствующие формулярные наборы. Примеры подходящих упаковок включают, но ими не ограничиваются, герметически запаянную фольгу, пластики, единичные дозовые контейнеры (например, ампулы), блистеры и контурные безъячейковые упаковки. В настоящем изобретении далее предложены фармацевтические композиции и дозовые формы, которые включают один или более из агентов, которые снижают скорость, с которой разлагается соединение настоящего изобретения, используемое в качестве активного ингредиента. Такие агенты, которые в описании именуют как "стабилизаторы", включают, но ими не ограничиваются, антиоксиданты, такие как аскорбиновая кислота, рН буферы, или солевые буферы и т.д. В соответствии с вышеизложенным, в дальнейшем аспекте настоящее изобретение относится к применению заявленных соединений, в качестве лекарственного средства для лечения или профилактики болезни Альцгеймера или умеренных когнитивных нарушений. Примеры Методы ЯМР Протонные спектры записаны на спектрометре Bruker 400 MHz ultrashield, если не указано иначе. Химические сдвиги выражены в м.д. относительно сигналов метанола ( 3,31), диметилсульфоксида ( 2,50) или хлороформа ( 7,29). Небольшое количество сухого образца (1-5 мг) растворяют в апротонном дейтерированном растворителе (0,7 мл). Магнитное шиммирование осуществляется автоматически, и спектры записывают в соответствии с обычной процедурой. Общие условия хроматографических измерений Метод UPLC H1 (RtH1) (далее как СЭЖХ, сверхэффективная жидкостная хроматография)NMR (ЯМР) - спектроскопия ядерного магнитного резонанса а) 2-Бром-5-фтор-4-триэтилсиланилпиридин. К раствору диизопропиламина (25,3 г, 250 ммоль) в ТГФ (400 мл) добавляют n-BuLi (100 мл, 2,5 моль/л в гексанах) при температуре ниже -50 С. Раствор 2-бром-5-фторпиридина (41,9 г, 238 ммоль) в ТГФ (60 мл) добавляют к LDA-раствору при -78 С по каплям при температуре ниже -63 С. Через 60 мин при -78 С быстро добавляют триэтилхлорсилан (44 мл, 262 ммоль), поддерживая температуру ниже 50 С. Охлаждающую баню удаляют, и полученную реакционную смесь оставляют нагреваться до -20 С. Полученную реакционную смесь выливают в смесь 1 М водного раствора HCl (250 мл) и водного раствора NH4Cl (10%). Добавляют трет-бутилметиловый эфир и слои разделяют. Органическую фазу промывают солевым раствором, сушат над сульфатом магния, фильтруют и выпаривают, получая жидкость желтого цвета. В результате дистилляции (Т. кипения 99-101 С, 0,5 мм рт.ст.) получают указанное в заголовке соединение в виде жидкости слегка желтоватого цвета: 66,26 г (96% выход). 1 Н-ЯМР (400 МГц, CDCl3):8,17 (с, 1 Н), 7,42 (д, 1 Н), 1,01-0,97 (м, 9 Н), 0,92-0,87 (м, 6 Н).-50 С. Раствор 2-бром-5-фтор-4-триэтилсиланилпиридина (56,04 г, 193 ммоль) в ТГФ (60 мл) добавляют к LDA-раствору при -7 8 С по каплям при температуре ниже -65 С. Через 70 мин при -78 С DMA (23,51 мл, 251 ммоль) быстро добавляют по каплям к темно-красному раствору, поддерживая температуру ниже-57 С. Через 15 мин охлаждающую баню удаляют, и полученную реакционную смесь оставляют нагреваться до -40 С. Холодную реакционную смесь выливают в смесь 2 М водного раствора HCl (250 мл)/вода (200 мл)/солевой раствор (100 мл). Добавляют трет-бутилметиловый эфир, и слои разделяют. Органическую фазу дважды промывают солевым раствором, сушат над сульфатом магния, фильтруют и выпаривают, получая масло желтого цвета. Сырой продукт (64,7 6 г) обрабатывают хроматографически на силикагеле (гексан/ТВМЕ), получая указанное в заголовке соединение в виде жидкости желтого цвета: 58,3 г (91% выход). ТСХ (гексан/ТВМЕ 99:1): Rf=0,25; 1 Н-ЯМР (400 МГц, CDCl3):7,55 (д, 1 Н), 2,67 (3, 3H), 0,98-0,93(м, 9 Н), 0,91-0,85 (м, 6 Н). с) [1-(6-Бром-3-фтор-4-триэтилсиланилпиридин-2-ил)-эт-(Е)-илиден]амид (R)-2-метилпропан-2 сульфиновой кислоты. Смесь тетраэтоксида титана (4,26 г, 18,69 ммоль), (R)-трет-бутилсульфинамида (1,246 г, 10,28 ммоль) и 1-(6-бром-3-фтор-4-триэтилсиланилпиридин-2-ил)этанона (3,45 г, 9,34 ммоль, 90% степень чистоты) в ТГФ (25 мл) кипятят с обратным холодильником в атмосфере азота в течение 6 ч. Холодную реакционную смесь выливают в охлажденный льдом солевой раствор (200 мл) при осторожном перемешивании. Осадок фильтруют через фильтр hiflo и промывают этилацетатом. Полученный фильтрат разбавляют этилацетатом и промывают солевым раствором, сушат над сульфатом натрия, фильтруют и выпаривают. Сырое масло желтого цвета (4,55 г) обрабатывают хроматографически на силикагеле (циклогексан/этилацетат 94:6), получая указанное в заголовке соединение в виде масла желтого цвета. 3,35 г (82% выход). ТСХ (циклогексан/этилацетат 5:1): Rf=0,50; ВЭЖХ: RtH1 = 1,56 мин; ESIMS (тандемная массспектрометрия с ионизацией электрораспылением): 435, 437 [(М+Н)+, 1Br]; 1d) Этиловый эфир (R)-3-(6-бром-3-фтор-4-триэтилсиланилпиридин-2-ил)-2,2-дифтор-3-R)-2-метилпропан-2-сульфиниламино)масляной кислоты. К суспензии цинка (466 мг, 7,12 ммоль) и хлорида меди(I) (34 мг, 0,344 ммоль) в сухом ТГФ (20 мл) добавляют 3 капли триметилхлорсилана в атмосфере азота для активации цинка. Через 10 мин этил 2 бром-2,2-дифторацетат (1,398 г, 6,89 ммоль) медленно добавляют через шприц в течение промежутка времени 10 мин при 25 С (реакция слегка экзотермическая). Полученную реакционную смесь выдерживают в ультразвуковой ванне в течение 45 мин. Полученную тонкую суспензию черного цвета добавляют по каплям к раствору [1-(6-бром-3-фтор-4-триэтилсиланилпиридин-2-ил)-эт-(Е)-илиден]амида (R)-2 метилпропан-2-сульфиновой кислоты (1 г, 2,296 ммоль) в сухом ТГФ (10 мл) при комнатной температуре в инертной атмосфере. После 4 ч при комнатной температуре полученную реакционную смесь добавляют к холодному водному раствору аммонийхлорида (5%) и разбавляют этилацетатом. Органическую фазу промывают водным раствором лимонной кислоты (5% раствор), водой, насыщенным раствором бикарбоната натрия и солевым раствором, сушат над сульфатом натрия, фильтруют и концентрируют. Сырое масло коричневого цвета (1,5 г) обрабатывают хроматографически на силикагеле (циклогексан/ этилацетат 83:17), получая указанное в заголовке соединение в виде масла светло-желтого цвета. 984 мг(77% выход). ТСХ (циклогексан/этилацетат 2:1): Rf=0,46; ВЭЖХ: RtH1 = 1,54 мин; ESIMS: 559, 561 [(М+Н)+, 1Br]; 1 Н-ЯМР (400 МГц, CDCl3) :7,40 (д, 1 Н), 5,48 (с, NH), 4,38 (кв, 2 Н), 2,07 (с, 3H), 1,26 (с, 9 Н), 1,000,96 (м, 9 Н), 0,90-0, 86 (м, 6 Н). Второстепенный диастереоизомер Rf=0,64 (2:1 циклогексан:этилацетат). е) Этиловый эфир (R)-3-(6-бром-3-фторпиридин-2-ил)-2,2-дифтор-3-R)-2-метилпропан-2-сульфиниламино)масляной кислоты. Свежеизмельченный KF (195 мг, 3,36 ммоль) добавляют к раствору этилового эфира (R)-3-(6-бром 3-фтор-4-триэтилсиланилпиридин-2-ил)-2,2-дифтор-3-R)-2-метилпропан-2-сульфиниламино)масляной кислоты (940 мг, 1,68 ммоль) и уксусной кислоты (0,192 мл, 3,36 ммоль) в ТГФ (7 мл). Добавляют ДМФ(7 мл), и полученную суспензию перемешивают при комнатной температуре. Через 2 ч полученную реакционную смесь разбавляют этилацетатом, и промывают насыщенным раствором бикарбоната натрия и солевым раствором, сушат над сульфатом натрия, фильтруют и выпаривают. Сырой продукт (733 мг) обрабатывают хроматографически на силикагеле (циклогексан/этилацетат 7:3), получая указанное в заголовке соединение в виде масла слегка желтоватого цвета. 664 мг (88% выход). ТСХ (циклогексан/этилацетат 1:1): Rf=0,38; ВЭЖХ: RtH1 = 1,08 мин; ESIMS: 445, 447 [(М+Н)+, 1Br]; 1 Н-ЯМР (400 МГц, CDCl3):7,51-7,46 (дд, 1 Н), 7,35 (т, 1 Н), 5,38 (ушир.с, 1 Н, NH), 4,37 (кв, 2 Н), 2,07 (с,3H), 1,39 (т, 3H), 1,26 (с, 9 Н).f) [(R)-1-(6-Бром-3-фторпиридин-2-ил)-2,2-дифтор-3-гидрокси-1-метилпропил]амид (R)-2-метилпропан-2-сульфиновой кислоты. К раствору этилового эфира (R)-3-(6-бром-3-фторпиридин-2-ил)-2,2-дифтор-3-R)-2-метилпропан 2-сульфиниламино)масляной кислоты (513 мг, 1,15 ммоль) в ТГФ (11,5 мл) добавляют боргидрид лития(52,8 мг, 2,30 ммоль). Реакция протекает слегка экзотермически и реакционную смесь перемешивают в течение 2,5 ч при комнатной температуре. Добавляют измельченный лед, и полученную реакционную смесь разбавляют этилацетатом. Органическую фазу промывают водой и солевым раствором, сушат над сульфатом натрия, фильтруют и выпаривают; получают 465 мг (количественный выход) смолы слегка желтоватого цвета, которую используют на следующей стадии без дополнительной очистки. ТСХ (толуол/этилацетат 7:3): Rf=0,16; ВЭЖХ: RtH1 = 0,93 мин; ESIMS: 403, 405 [(М+Н)+, 1Br]; 1 Н-ЯМР (400 МГц, CDCl3) :7,52 (дд, 1 Н), 7,38 (дд, 1 Н), 5,84 (ушир.с, 1 Н), 4,32 (дд, 1 Н), 4,02 (м,1 Н), 3,81 (м, 1 Н), 2,05 (с, 3H), 1,31 (с, 9 Н).g) (R)-3-Амино-3-(6-бром-3-фторпиридин-2-ил)-2,2-дифторбутан-1-ол. К раствору [(R)-1-(6-бром-3-фторпиридин-2-ил)-2,2-дифтор-3-гидрокси-1-метилпропил]амида (R)2-метилпропан-2-сульфиновой кислоты (1,33 г, 3,30 ммоль) в диоксане (26,6 мл) добавляют HCl/диоксан 4 н (3,3 мл, 13,19 ммоль). Полученную реакционную смесь перемешивают в течение 21 часа при комнатной температуре. Растворитель выпаривают и к остатку добавляют этилацетат и измельченный лед. Органическую фазу экстрагируют водой и подщеллачивают твердым карбонатом калия. Водную фазу экстрагируют этилацетатом, сушат над сульфатом натрия, фильтруют и выпаривают. Получают 930 мг бесцветного твердого вещества (94% выход). ТСХ (толуол/этилацетат 7:3): Rf=0,25; ВЭЖХ: RtH1 = 0,44 мин; ESIMS: 299, 301 [(М+Н)+, 1Br]; 1 Н-ЯМР (400 МГц, ДМСО-D6) :7,73 (м, 2 Н, Ar), 7,29 (ушир.с, 1 Н), 6,69 (ушир.с, 1 Н), 5,30 (т, 1 Н),3,79 (м, 2 Н), 1,57 (д, 3 Н).h) (R)-4-(6-Бром-3-фторпиридин-2-ил)-5,5-дифтор-4-метил-5,6-дигидро-4 Н-[1,3]оксазин-2-иламин. Раствор (R)-3-амино-3-(6-бром-3-фторпиридин-2-ил)-2,2-дифторбутан-1-ола (150 мг, 0,49 ммоль) и бромциана (106 мг, 1 ммоль) в этаноле (5 мл) нагревают в течение 19 ч при 85 С в закрытой микроволновой ампуле. Растворитель выпаривают, и остаток растворяют в этилацетате. Органическую фазу промывают водным аммиаком, водой и солевым раствором, сушат над сульфатом натрия, фильтруют и выпаривают. Сырой продукт (136 мг) обрабатывают хроматографически на силикагеле (толуол/этилацетат 1:1), получая выделенный исходный материал (27 мг) и указанное в заголовке соединение: 64 мг (40% выход). ТСХ (толуол/этилацетат 1:1): Rf=0,17; ВЭЖХ: RtH1 = 0,56 мин; ESIMS: 324, 326 [(М+Н)+, 1Br]; 1 Н-ЯМР (400 МГц, ДМСО-D6) :7,69 (м,2 Н), 5,82 (ушир.с, 2 Н), 4,36 (м, 1 Н), 4,17 (м, 1 Н), 1,63 (с, 3 Н).(R)-4-(6-бром-3-фторпиридин-2-ил)-5,5-дифтор-4-метил-5,6-дигидро-4 Н-[1,3]оксазин-2 иламина (60 мг, 0,185 ммоль), Вос-ангидрида (42,3 мг, 0,194 ммоль) и основания Хунига (64,7 мкл, 0,37 ммоль) в дихлорметане (1,9 мл) перемешивают при комнатной температуре в течение 3 дней. Полученную реакционную смесь разбавляют этилацетатом, промывают раствором бикарбоната, водой и солевым раствором, сушат над сульфатом натрия, фильтруют и выпаривают. Получают 76 мг (85% выход). ТСХ(2,9 мл) при 60 С в течение 5 ч. Полученную реакционную смесь (суспензию серо-коричневого цвета) разбавляют этилацетатом и водным раствором бикарбоната и затем фильтруют. Полученный фильтрат промывают водой и солевым раствором, сушат над сульфатом натрия, фильтруют и выпаривают. Получают 166 мг твердого вещества коричневого цвета. Сырой продукт обрабатывают хроматографически на силикагеле (толуол/этилацетат 7:3), получая указанное в заголовке соединение в виде твердого вещества белого цвета. Получают 28 мг (38% выход). ТСХ (толуол/этилацетат 7:3): Rf=0,25; ВЭЖХ: RtH1 = 1,18 мин; ESIMS: 505 [(М+Н)+]; 1[6-R)-2-Амино-5,5-дифтор-4-метил-5,6-дигидро-4 Н-[1,3]оксазин-4-ил)-5-фторпиридин-2-ил] амид 5-циано-3-метилпиридин-2-карбоновой кислоты. Раствор трет-бутилового эфира R)-4-6-[(5-циано-3-метилпиридин-2-карбонил)амино]-3-фторпиридин-2-ил-5,5-дифтор-4-метил-5,6-дигидро-4 Н-[1,3]оксазин-2-ил)карбаминовой кислоты (26 мг, 0,052 ммоль) и TFA (200 мкл, 2,6 ммоль) в дихлорметане (1,3 мл) перемешивают при комнатной температуре в течение 5 ч. Полученную реакционную смесь выпаривают, и остаток разбавляют водным аммиаком и этилацетатом, промывают водой и солевым раствором, сушат над сульфатом натрия, фильтруют и выпаривают. Получают 24 мг желтоватого твердого вещества. В результате тщательного растирания с циклогексаном получают указанное в заголовке соединение в виде слегка желтоватого твердого вещества. Получают 17 мг (80% выход). ВЭЖХ: RtH1 = 0,72 мин; ESIMS: 405 [(М+Н)+]; 1 Н-ЯМР (400 МГц, ДМСО-D6) :10,71 (ушир.с, 1 Н, NH), 9,01 (ушир.с, 1 Н), 8,43 (ушир.с, 1 Н), 8,19(R)-2 метилпропан-2-сульфиновой кислоты. К метилмагнийхлориду 3M в ТГФ (38,3 мл, 115 ммоль) добавляют раствор этилового эфира (R)-3(6-бром-3-фторпиридин-2-ил)-2,2-дифтор-3-R)-2-метилпропан-2-сульфиниламино)масляной кислоты реакцию гасят, добавляя водный раствор аммонийхлорида. Полученную смесь разбавляют этилацетатом и промывают водой и солевым раствором, сушат над сульфатом натрия, фильтруют и выпаривают. Сырой продукт (4,78 г) обрабатывают хроматографически на силикагеле (циклогексан/этилацетат 6:4), получая указанное в заголовке соединение в виде бесцветного твердого вещества. 2,97 г (59,9% выход). ТСХ (циклогексан/этилацетат 6:4, силикагель, УФ 254): Rf = 0,32; ЖХ-МС: RtH1 =1,09 мин; (100% степень чистоты; ESI+-MS: m/z 431 [(М+Н)+]); 1b) (R)-4-(6-Бром-3-фторпиридин-2-ил)-5,5-дифтор-4 ,6,6-триметил-5,6-дигидро-4 Н-[1,3]оксазин-2 иламин. Раствор [(R)-l-(6-бром-3-фторпиридин-2-ил)-2,2-дифтор-3-гидрокси-1,3-диметилбутил]амида (R)-2 метилпропан-2-сульфиновой кислоты (2,95 г, 6,84 ммоль) и цианогенбромида- (2,24 г, 20,52 ммоль) в сухом этаноле (68 мл) закрывают стеклянной пробкой и нагревают при 85 С в течение 9 ч. Реакционный раствор выпаривают в вакууме, и сырой продукт помещают в этилацетат и 2 М водный аммиак. Органическую фазу промывают водой и солевым раствором, сушат над сульфатом натрия, фильтруют и выпаривают. Сырой продукт (2,74 г) обрабатывают хроматографически на силикагеле (толуол/этилацетат 6:4), получая указанное в заголовке соединение в виде бесцветного твердого вещества. 1,19 г (48,9% выход). ЖХ-МС: RtH1 = 67 мин; (99% степень чистоты; ESI + -MS: m/z 352 [(М+Н)+], 354); 1H-ЯМР (400 МГц, ДМСО-d6)= 7,72-7,59 (м, 2 Н), 5,83 (ушир.с, 2 Н), 1,67 (д, J=4,0 Гц, 3H), 1,48 (с,3H), 1,27 (д, J=2,0 Гц, 3 Н). с) [Бис-(4-метоксифенил)фенилметил]-[(R)-4-(6-бром-3-фторпиридин-2-ил)-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4 Н-[1,3]оксазин-2-ил]амин. К раствору (R)-4-(6-бром-3-фторпиридин-2-ил)-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4 Н-[1,3]оксазин-2-иламина (106 мг, 0,301 ммоль) и триэтиламина (60,9 мг, 0,602 ммоль) в дихлорметане (3 мл) добавляют твердое вещество 4,4'-диметокситритилхлорид (112 мг, 0,331 ммоль) в атмосфере аргона. Раствор зеленого цвета перемешивают при комнатной температуре в течение 2 ч и затем выпаривают в вакууме. Сырой продукт собирают этилацетатом и промывают водным раствором бикарбоната натрия, водой и солевым раствором. Органическую фазу сушат над сульфатом натрия, фильтруют и выпаривают. В результате фильтрования через силикагель (4,4 г, толуол/этилацетат 6:4) получают указанное в заголовке соединение в виде пены серо-зеленого цвета (202 мг, 96%). ТСХ (толуол/этилацетат 6:4, силикагель, УФ 254): Rf = 0,60; ЖХ-МС: RtH1 = 1,22 мин; (94% степень чистоты; ESI+-MS: m/z 654 [(М+Н)+]; 656); 1[6-R)-2-[бис-(4-Метоксифенил)фенилметил]амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро 4 Н-[1,3]оксазин-4-ил)-5-фторпиридин-2-ил]амид 3-хлор-5-цианопиридин-2-карбоновой кислоты. Дегазированную смесь [бис-(4-метоксифенил)фенилметил]-[(R)-4-(6-бром-3-фторпиридин-2-ил)5,5-дифтор-4,6,6-триметил-5,6-дигидро-4 Н-[1,3]оксазин-2-ил]амина (196 мг, 0,299 ммоль), амида 5 циано-3-метилпиридин-2-карбоновой кислоты (59,8 мг, 0,329 ммоль), ксантфоса (62,4 мг, 0,108 ммоль),карбоната цезия (139 мг, 0,419 ммоль) и Pd2(dba)3 (33,9 мг, 0,036 ммоль) нагревают в атмосфере аргона в диоксане (6 мл) при 60 С в течение 20 ч. Полученную реакционную смесь разбавляют этилацетатом и водным раствором бикарбоната и затем фильтруют через hiflo. Полученный фильтрат промывают водой и солевым раствором, сушат над сульфатом натрия, фильтруют и выпаривают, получая 226 мг желтоватой пены. Сырой продукт обрабатывают хроматографически на силикагеле (толуол/этилацетат 8:2), получая указанное в заголовке соединение в виде пены светло-желтого цвета. 92 мг (38,6% выход). ЖХ-МС: RtH1 = 1,20 мин (95% степень чистоты; ESI+-MC: 755, [(М+Н)+]; 756, 757, 758); 1(ушир.с, 3 Н). е) [6-R)-2-амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4 Н-[1,3]оксазин-4-ил)-5-фторпиридин-2 ил]амид 3-хлор-5-цианопиридин-2-карбоновой кислоты. Раствор [6-R)-2-[бис-(4-метоксифенил)фенилметил]амино-5,5-дифтор-4,6,6-триметил-5,6-дигидро-4 Н-[1,3]оксазин-4-ил)-5-фторпиридин-2-ил]амида 3-хлор-5-цианопиридин-2-карбоновой кислоты (85 мг, 0,113 ммоль), TFA (572 мкл, 7,43 ммоль) и триэтилсилана (54 мкл, 0,338 ммоль) в дихлорметане (1,1 мл) перемешивают при комнатной температуре в течение 24 ч. Полученную реакционную смесь выпаривают, и остаток разбавляют этилацетатом, промывают водой и солевым раствором, сушат над сульфатом натрия, фильтруют и выпаривают, получая 119 мг коричневато-желтоватой смолы. Полученный продукт обрабатывают хроматографически на силикагеле (RediSep 12 г, кондиционируют смесью этилацетат/метанол 95:5 и элюируют этилацетатом), получая указанное в заголовке соединение в виде твердого вещества светло-желтого цвета. 38 мг (74,6% выход). а) 1-(6-Бром-3-фтор-4-триэтилсиланилпиридин-2-ил)-3-метоксипропан-1-он. К раствору 1-(6-бром-3-фтор-4-триэтилсиланилпиридин-2-ил)этанона (11,6 г, 33,9 ммоль, пример 1,стадия b) в дихлорметане (50 мл) добавляют основание Хунига (6,21 мл, 35,6 ммоль) при 0 С, затемTMS-трифлат (6,43 мл, 35,52 ммоль, 1,05 экв.) в атмосфере азота. Полученную реакционную смесь перемешивают при 0 С в течение 40 мин. Диметоксиметан (2,71 г, 35,6 ммоль) и 2,6-ди-трет-бутилпиридин(0,648 г, 3,39 ммоль) добавляют по каплям при 0 С. Затем к реакционной смеси добавляют TMS-трифлат(0,61 мл, 3,39 ммоль). Через 30 мин охлаждающую баню удаляют, и перемешивание продолжают при комнатной температуре в течение ночи (18 часов). Полученную реакционную смесь выливают на холодный солевой раствор, разбавляют этилацетатом и органическую фазу тщательно промывают 10% раствором NaHSO4, насыщенным раствором бикарбоната натрия (насыщенный NaCl) и солевым, раствором,сушат над сульфатом натрия, фильтруют и выпаривают. Сырой продукт (13,52 г) обрабатывают хроматографически на силикагеле (320 г, циклогексан/этилацетат 95:5), получая указанное в заголовке соединение в виде жидкости желтого цвета: 9,18 г (72% выход). ТСХ (циклогексан/этилацетат 5:1): Rf = 0,61; ЖХ-МС: RtH1 = 1,43 мин (100% степень чистоты;b) [1-(6-Бром-3-фтор-4-триэтилсиланилпиридин-2-ил)-3-метоксипроп-(Е)-илиден]амид (S)-2-метилпропан-2-сульфиновой кислоты. Смесь тетразтоксида титана (11,03 г, 48,4 ммоль), (S)-трет-бутилсульфинамида (3,52 г, 29 ммоль) и 1-(6-бром-3-фтор-4-триэтилсиланилпиридин-2-ил)-3-метоксипропан-1-она (9,1 г, 24,18 ммоль) в ТГФ(100 мл) перемешивают при 60 С в атмосфере азота в течение 34 ч. Холодную реакционную смесь разбавляют этилацетатом и выливают в охлажденный льдом солевой раствор (200 мл) при осторожном перемешивании. Осадок фильтруют через слой hiflo и промывают этилацетатом. Полученный фильтрат разбавляют этилацетатом и промывают солевым раствором, сушат над сульфатом натрия, фильтруют и выпаривают. Сырое желтовато-коричневатое масло (10,67 г) обрабатывают хроматографически на силикагеле (Redisep колонка 120 г, циклогексан/этилацетат 95:5), получая указанное в заголовке соединение в виде масла желто-оранжевого цвета. 7,51 г (63,5% выход). ТСХ (циклогексан/этилацетат 10:1): Rf = 0,23; ЖХ-МС: RtH1 = 1,53 мин (98%, ESI + -MS: m/z 479c) Этиловый эфир (R)-3-(6-бром-3-фтор-4-триэтилсиланилпиридин-2-ил)-2,2-дифтор-5-метокси-3S)-2-метилпропан-2-сульфиниламино)пентановой кислоты. К суспензии цинка (3,07 г, 47 ммоль) и хлорида меди(I) (233 мг, 2,349 ммоль) в сухом ТГФ (90 мл) добавляют 4 капли триметилхлорсилана в атмосфере азота для активации цинка. Через 10 мин медленно добавляют через шприц этил 2-бром-2,2-дифторацетат (9,54 г, 47 ммоль) в течение промежутка времени 20 минут, и устанавливают температуру между 25 и 30 С, используя внешнюю охлаждающую баню(реакция экзотермическая). Полученную реакционную смесь выдерживают в ультразвуковой ванне в течение 30 мин. Полученную тонкодисперсную суспензию черного цвета добавляют по каплям к раствору [1-(6-бром-3-фтор-4-триэтилсиланилпиридин-2-ил)-3-метоксипроп-(Е)-илиден]амида (S)-2-метилпропан-2-сульфиновой кислоты (7,51 г, 15,66 ммоль) в сухом ТГФ (75 мл) при 0 С в инертной атмосфере. Через 15 мин реакционную смесь выдерживают при 50 С в течение 2 ч и затем добавляют к холодному водному раствору хлорида аммония (5%). Добавляют этилацетат, и органическую фазу промывают водным раствором лимонной кислоты (5% раствор), водой, насыщенным раствором бикарбоната натрия и солевым раствором, сушат над сульфатом натрия, фильтруют и концентрируют. Сырое желтоватое масло(9,77 г, приблизительно 4:1 смесь диастереоизомероов) обрабатывают хроматографически на силикагеле(Redisep колонка 120 г, циклогексан/этилацетат 85:15), получая указанное в заголовке соединение в виде масла желтого цвета. 6,11 г. (64,6% выход). ТСХ (циклогексан/этилацетат 2:1): Rf=0,47; ЖХ-МС: RtH1 = 1,54 мин (100%, ESI+-MS: m/z 604d) Этиловый эфир (R)-3-(6-бром-3-фторпиридин-2-ил)-2,2-дифтор-5-метокси-3-S)-2-метилпропан 2-сульфиниламино)пентановой кислоты. Свежеизмельченный KF (1,174, 20,21 ммоль) добавляют к раствору этилового эфира (R)-3-(6-бром 3-фтор-4-триэтилсиланилпиридин-2-ил)-2,2-дифтор-5-метокси-3-S)-2-метилпропан-2-сульфиниламино) пентановой кислоты (6,10 г, 10,11 ммоль) и уксусной кислоты (1,157 мл, 20,21 ммоль) в ТГФ (39,8 мл). Добавляют ДМФ (39,8 мл) и полученную суспензию перемешивают при комнатной температуре. Через 6 ч реакционную смесь разбавляют этилацетатом и промывают насыщенным раствором бикарбоната натрия и солевым раствором, сушат над сульфатом натрия, фильтруют и выпаривают. Сырой продукт (4,85 г, 98% выход) используют без дополнительной очистки на следующей стадии. ТСХ (циклогексан/этилацетат 1:1): Rf=0,33; ЖХ-МС: RtH1 = 1,11 мин (100%, ESI+-MS: m/z 489(т, J=7,3 Гц, 3 Н). е) [(R)-1-(6-Бром-3-фторпиридин-2-ил)-2,2-дифтор-3-гидрокси-1- (2-метоксиэтил)пропил]амид (S)2-метилпропан-2-сульфиновой кислоты. К раствору этилового эфира (R)-3-(6-бром-3-фторпиридин-2-ил)-2,2-дифтор-5-метокси-3-S)-2 метилпропан-2-сульфиниламино)пентановой кислоты (2,4 г, 4,90 ммоль) в ТГФ (38 мл) добавляют боргидрид лития (214 мг, 9,81 ммоль) двумя порциями. Реакция протекает слегка экзотермически, и реакционную смесь перемешивают в течение 6 ч при комнатной температуре. Осторожно добавляют измельченный лед, и полученную реакционную смесь разбавляют этилацетатом. Органическую фазу промывают водой и солевым раствором, сушат над сульфатом натрия, фильтруют и выпаривают. Сырую желтоватую смолу (2,05 г) обрабатывают хроматографически на силикагеле (Redisep колонка 40 г, циклогексан/этилацетат 4:6), получая указанное в заголовке соединение в виде бесцветной смолы. 1,50 г (68,4% выход). ТСХ (циклогексан/этилацетат 1:1): Rf=0,13; ЖХ-МС: RtH1 = 0,84 мин (100%, ESI + -MS: m/z 447HCl в диэтиловом эфире (6,56 мл, 13,11 ммоль). Полученную реакционную смесь перемешивают в течение 1,5 ч при комнатной температуре. К полученной реакционной смеси добавляют 7 М аммиак в метаноле (2,7 мл) и полученную бесцветную суспензию выпаривают в вакууме. Оставшееся твердое вещество тщательно растирают с теплым дихлорметаном, охлаждают до комнатной температуры, фильтруют и промывают дихлорметаном. Полученный фильтрат выпаривают, получая указанное в заголовке соединение, которое используют без дополнительной очистки на следующей стадии. 1,42 г бесцветного вязкого масла. 100% выход. ТСХ (циклогексан/этилацетат 4:6): Rf=0,41; ЖХ-МС: RtH1 = 0,52 мин (100%, ESI+-MS: m/z 343g) N-[(R)-4-(6-Бром-3-фторпиридин-2-ил)-5,5-дифтор-4-(2-метоксиэтил)-5,6-дигидро-4 Н-[1,3]оксазин-2-ил]-4-нитробензамид. К раствору (R)-3-амино-3-(6-бром-3-фторпиридин-2-ил)-2,2-дифтор-5-метоксипентан-1-ола (1,15 г,3,35 ммоль) в ТГФ (27,9 мл) добавляют нитробензоилизотиоцианат (767 мг, 3,69 ммоль). После перемешивания при комнатной температуре в течение 4 ч добавляют DCC (760 мг, 3,69 ммоль) и триэтиламин(34,1 мг, 0,337 ммоль). Перемешивание продолжают при комнатной температуре в течение 19 часов, и в конце полученную реакционную смесь выдерживают при 70 С в течение 5 ч. Раствор желто-оранжевого цвета охлаждают и выпаривают в вакууме. Сырой продукт (2,7 г) обрабатывают хроматографически на силикагеле (Redisep колонка 120 г, циклогексан/этилацетат 7:3), получая указанное в заголовке соединение в виде пены светло-желтого цвета. 650 мг (35,6% выход). ТСХ (циклогексан/этилацетат 7:3): Rf=0,17; ЖХ-МС: RtH1 = 1,15 мин (95%, ESI+-MS: m/z 517 2-иламин. Суспензию N-[(R)-4-(6-бром-3-фторпиридин-2-ил)-5,5-дифтор-4-(2-метоксиэтил)-5,6-дигидро-4 Н[1,3]оксазин-2-ил]-4-нитробензамида (640 мг, 1,237 ммоль) и карбоната калия (513 мг, 3,71 ммоль) в метаноле (18,7 мл) перемешивают в течение 22 часов при комнатной температуре. Полученный желтый раствор выпаривают, разбавляют этилацетатом и промывают водой и солевым раствором, сушат над сульфатом натрия, фильтруют и выпаривают. 400 мг твердого вещества желтого цвета (88% выход). Сурой продукт используют на следующей стадии без дополнительной очистки. ТСХ (циклогексан/этилацетат 1:1): Rf=0,14; ЖХ-МС: RtH1 = 0,59 мин (100%, ESI + -MS: m/z 368i) [Бис-(4-метоксифенил)фенилметил]-[(R)-4-(6-бром-3-фторпиридин-2-ил)-5,5-дифтор-4-(2-метоксиэтил)-5,6-дигидро-4 Н-[1,3]оксазин-2-ил]амин. К раствору (R)-4-(6-бром-3-фторпиридин-2-ил)-5,5-дифтор-4-(2-метоксиэтил)-5,6-дигидро-4 Н-[1,3] оксазин-2-иламина (200 мг, 0,543 ммоль) и триэтиламина (110 мг, 1,087 ммоль) в дихлорметане (5,4 мл) добавляют твердое вещество 4,4'-диметокситритилхлорид (202 мг, 0,598 ммоль) в атмосфере аргона. Полученный раствор зеленого цвета перемешивают при комнатной температуре в течение 16 ч и затем выпаривают в вакууме. Сырой продукт собирают этилацетатом и промывают водным раствором лимонной кислоты, водным раствором бикарбоната натрия, водой и солевым раствором. Органическую фазу высушивают над сульфатом натрия, фильтруют и выпаривают. Сырой продукт (380 мг) обрабатывают хроматографически на силикагеле (Redisep колонка 12 г, циклогексан/этилацетат 8:2), получая указанное в заголовке соединение в виде бесцветной пены. 339 мг (93% выход). ТСХ (циклогексан/этилацетат 8:2): Rf=0,29; ЖХ-МС: RtH1 = 1,23 мин (100%, ESI+-MS: m/z 670j) 6-[(R)-2-[бис-(4-Метоксифенил)фенилметил]амино-5,5-дифтор-4-(2-метоксиэтил)-5,6-дигидро 4 Н-[1,3]оксазин-4-ил]-5-фторпиридин-2-иламид 5-циано-3-метилпиридин-2-карбоновой кислоты. Дегазированную смесь [бис-(4-метоксифенил)фенилметил]-[(R)-4-(6-бром-3-фторпиридин-2-ил)5,5-дифтор-4-(2-метоксиэтил)-5,6-дигидро-4 Н-[1,3]оксазин-2-ил]амина (330 мг, 0,492 ммоль), амида 5 циано-3-метилпиридин-2-карбоновой кислоты (95 мг, 0,591 ммоль), rac-транс-N,N'-диметилциклогексан 1,2-диамина (21,65 мг, 0,148 ммоль), карбоната калия (150 мг, 1,083 ммоль) и иодида меди (28,1 мг, 0,148 ммоль) кипятят с обратным холодильником в атмосфере аргона в диоксане (12,3 мл) в течение 20 ч. Полученную реакционную смесь выпаривают, переносят в этилацетат и промывают водный раствором бикарбоната натрия, водой и солевым раствором, сушат над сульфатом натрия, фильтруют и выпаривают,получая 406 мг красно-коричневой пены. Сырой продукт обрабатывают хроматографически на силикагеле (Redisep колонка 12 г, толуол/этилацетат 8:2), получая указанное в заголовке соединение в виде розоватой пены. 152 мг (37,4% выход). ТСХ (толуол/этилацетат 8:2): Rf=0,37; ЖХ-МС: RtH1 = 1,22 мин (91% степень чистоты; ESI+-MS: 751).k) 6-[(R)-2-Амино-5,5-дифтор-4-(2-метоксиэтил)-5,6-дигидро-4 Н-[1,3]оксазин-4-ил]-5-фторпиридин-2-иламид 5-циано-3-метилпиридин-2-карбоновой кислоты. Раствор 6-[(R)-2-[бис-(4-метоксифенил)фенилметил]амино-5,5-дифтор-4-(2-метоксиэтил)-5,6 дигидро-4 Н-[1,3]оксазин-4-ил]-5-фторпиридин-2-иламида 5-циано-3-метилпиридин-2-карбоновой кислоты (146 мг, 0,194 ммоль), TFA (0,989 мл, 12,83 ммоль) и триэтилсилана (0,093 мл, 0,583 ммоль) в дихлорметане (1,9 мл) перемешивают при комнатной температуре в течение 18 ч. Полученную реакционную смесь выпаривают, и остаток разбавляют этилацетатом, промывают насыщенным водным раствором бикарбоната натрия, водой и солевым раствором, сушат над сульфатом натрия, фильтруют и выпаривают. 142 мг бесцветной смолы. Полученный продукт обрабатывают хроматографически на препаративной пластине силикагеля (2 мм, 2020 см, Merck, дихлорметан/метанол 95:5), получая указанное в заголовке соединение в виде бесцветной пены. 74 мг (8 5% выход). ТСХ (дихлорметан/метанол 95:5, силикагель, УФ 254): Rf=0,28; ЖХ-МС: RtH1 = 0,76 мин (100% степень чистоты; ESI+-MS: 449 [(М+Н)+]); 1H-ЯМР (400 МГц, ДМСО-d6):= 10,70 (ушир.с, 1 Н, NH), 9,00 (ушир.с, 1 Н), 8,45 (ушир.с, 1 Н), 8,308,13 (м, 1 Н), 7,84-7,66 (м, 1 Н), 5,88 (ушир.с, 3H), 4,45-4,25 (м, 1 Н), 4,19-4,00 (м, 1 Н), 3,62-3,44 (м, 1 Н),3,27-3,18 (м, 1 Н), 3,16 (с, 3H), 2,96-2,83 (м, 1 Н), 2,61 (с, 3H), 2,00-1,88 (м, 1 Н). Примеры 5-6. Соединения, перечисленные в табл. 3, получают способом, который аналогичен способу, использованному в примере 4. Однако для примера 5 используют (R)-трет-бутилсульфинамид для получения сульфоксимина на стадии 4b.
МПК / Метки
МПК: C07D 413/14, A61P 3/10, A61K 31/5355, A61P 9/12, A61P 25/28, A61P 3/04
Метки: качестве, 2-амино-4-(пиридин-2-ил)-5,6-дигидро-4h-1,3-оксазинов, bace-1, производные, bace-2, использование, ингибиторов
Код ссылки
<a href="https://eas.patents.su/30-24580-proizvodnye-2-amino-4-piridin-2-il-56-digidro-4h-13-oksazinov-i-ih-ispolzovanie-v-kachestve-ingibitorov-bace-1-i-ili-bace-2.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 2-амино-4-(пиридин-2-ил)-5,6-дигидро-4h-1,3-оксазинов и их использование в качестве ингибиторов bace-1 и/или bace-2</a>
Предыдущий патент: Устройство для растворения фармацевтических соединений и способ его наполнения
Следующий патент: Октаноповышающая добавка к бензину
Случайный патент: Тарное стекло












