8-[-3-аминопиперидин-1-ил]ксантины, способ их получения и их применение в качестве лекарственных средств
Номер патента: 24251
Опубликовано: 31.08.2016
Авторы: Химмельсбах Франк, Марк Михаэль, Лотц Ральф Рихард Германн, Эккхард Маттиас, Лангкопф Эльке, Тадайён Мохаммад, Майер Роланд
Формула / Реферат
1. Соединение формулы (III)
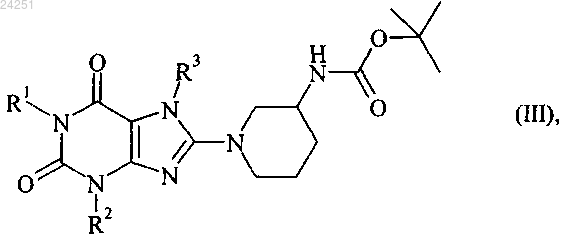
в котором R1 обозначает 4-метил-2-хиназолинилметил,
R2 обозначает метил и
R3 обозначает 2-бутин-1-ильную группу.
2. Соединение по п.1, которое представляет собой 1-[(4-метилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-((R)-3-трет-бутилоксикарбониламино)пиперидин-1-ил)ксантин.
3. Соединение по п.1, которое представляет собой 1-[(4-метилхиназолин-2-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-((S)-3-трет-бутилоксикарбониламино)пиперидин-1-ил)ксантин.
4. Способ получения лекарственной формы, характеризующийся
i) удалением защитной группы в соединении формулы (III)
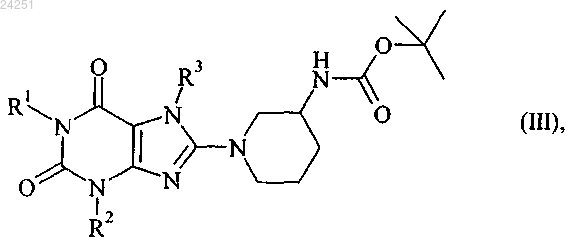
в котором R1 обозначает 4-метил-2-хиназолинилметил,
R2 обозначает метил и
R3 обозначает 2-бутин-1-ильную группу,
с получением соединения формулы (I)
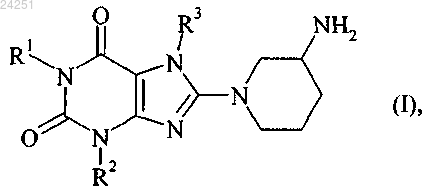
в котором R1 обозначает 4-метил-2-хиназолинилметил,
R2 обозначает метил и
R3 обозначает 2-бутин-1-ильную группу, и
ii) переработкой соединения формулы (I) совместно с одним или несколькими обычными инертными носителями и/или разбавителями в галеновые формы, которые представляют собой таблетки, драже, капсулы, порошки, суспензии или суппозитории.
5. Способ по п.4, в котором соединение формулы (I) в сочетании с другим действующим веществом перерабатывают совместно с одним или несколькими обычными инертными носителями и/или разбавителями в галеновые формы.
6. Способ по п.4 или 5, в котором трет-бутилоксикарбонильную группу отщепляют обработкой кислотой, такой как трифторуксусная кислота или соляная кислота, либо обработкой бромтриметилсиланом или иодтриметилсиланом при температуре от 0 до 80°C.
7. Способ по п.6, в котором используется растворитель, такой как метиленхлорид, этилацетат, диоксан, метанол, изопропанол или диэтиловый эфир.
Текст
8-[-3-АМИНОПИПЕРИДИН-1-ИЛ]КСАНТИНЫ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ЛЕКАРСТВЕННЫХ СРЕДСТВ В патенте описаны замещенные ксантины общей формулы (I) Химмельсбах Франк, Лангкопф Эльке, Эккхард Маттиас, Марк Михаэль, Майер Роланд, Лотц Ральф Рихард Германн, Тадайн Мохаммад в которой R1-R3 имеют указанные в пп.1-16 формулы изобретения значения, их таутомеры,их стереоизомеры, их смеси, их пролекарства и их соли, которые обладают ценными фармакологическими свойствами, прежде всего ингибирующим действием на активность дипептидилпептидазы-IV (DPP-1V).(71)(73) Заявитель и патентовладелец: БРИНГЕР ИНГЕЛЬХАЙМ ФАРМА ГМБХ УНД КО. КГ (DE) Изобретение относится к новым замещенным ксантинам общей формулы их таутомерам, энантиомерам, диастереомерам, их смесям, их пролекарствам и их солям, прежде всего их физиологически совместимым солям с неорганическими или органическими кислотами или основаниями, обладающим ценными фармакологическими свойствами, прежде всего ингибирующим действием на активность такого фермента, как дипептидилпептидаза-IV (DPP-IV), к их получению, их применению для профилактики или лечения заболеваний или состояний, которые взаимосвязаны с повышенной активностью DPP-IV или которые можно предупредить или облегчить за счет уменьшения активности DPP-IV, прежде всего сахарного диабета типа I или типа II, к содержащим соединение общей формулы (I) или его физиологически совместимую соль лекарственным средствам, а также к их получению. Уровень техники В US 6303661 описаны новые схемы лечения, предусматривающие введение в организм в терапевтически эффективных количествах ингибитора дипептидилпептидазы (DPP-IV) или ингибиторов обладающих сходной с ней активностью ферментов, что позволяет уменьшить способность таких ферментов к расщеплению инкретинов, GLP-1 и GIP. В результате благодаря улучшению процесса высвобождения инсулина можно уменьшить гипергликемию, например, гипергликемию, связанную с приемом пищи. В WO 02/02560, WO 03/004496, WO 03/024965 и WO 03/057200 описаны гетероциклические соединения, являющиеся ингибиторами фермента DPP-IV. Эти соединения по своей структуре отличаются от предлагаемых в изобретени соединений, особенно в отношении заместителя в положении 7 и/или 8 ксантина. Соединения, описанные в EP 0149578 в качестве анальгетиков, также отличаются от предлагаемых в изобретении соединений по положению 8 ксантина. В WO 91/07945 описаны производные ксантина, которые могут использоваться в качестве веществ,способствующих пигментации кожи или волос. Описание изобретения В приведенной выше общей формуле I заместители имеют следующие значения:R1 обозначает метильную группу, метильную группу, которая замещена диметиламинокарбонильной, пирролидин-1-илкарбонильной, пиперидин-1-илкарбонильной, трет-бутилкарбонильной или циклогексилкарбонильной группой, метильную группу, которая замещена нафтильной, метилнафтильной, метоксинафтильной, нитронафтильной или диметиламинонафтильной группой, метильную группу, которая замещена 2-фенилэтенильной или бифенилильной группой, метильную группу, которая замещена фенилоксадиазолильной, 5-метил-3-фенилизоксазолильной, фенилпиридинильной, индолильной, бензотиофенильной, хинолинильной, изохинолинильной, метилизохинолинильной, (метоксикарбонилметиламино)изохинолинильной, циннолинильной, хиназолинильной, метилхиназолинильной, 1,2-дигидро-1 метил-2-оксохинолинильной, 1,2-дигидро-2-метил-1-оксоизохинолинильной, 3,4-дигидро-4-оксофталазинильной, 3,4-дигидро-3-метил-4-оксофталазинильной, 3,4-дигидро-4-оксохиназолинильной, 3,4-дигидро-3-метил-4-оксохиназолинильной или 2-оксо-2H-хроменильной группой, 2-метоксиэтильную, 2 фенилоксиэтильную или 2-цианоэтильную группу, фенилкарбонилметильную либо 1-(фенилкарбонил) этильную группу, фенилкарбонилметильную группу, в которой фенильный фрагмент замещен аминогруппой, цианометиламиногруппой, метилкарбониламиногруппой, этилкарбониламиногруппой, изопропилкарбониламиногруппой, метоксикарбониламиногруппой, (этилоксикарбониламино)карбониламиногруппой или 2-оксоимидазолидин-1-ильной группой, фенилкарбонилметильную группу, в которой фенильный фрагмент замещен карбоксигруппой, метоксикарбонильной, этилоксикарбонильной, аминокарбонильной, метиламинокарбонильной, диметиламинокарбонильной или морфолин-4-илкарбонильной группой, фенилкарбонилметильную группу, в которой фенильный фрагмент замещен метилсульфанильной, метилсульфинильной или метилсульфонильной группой, фенилкарбонилметильную группу, в которой фенильный фрагмент замещен карбоксиметоксигруппой, этилоксикарбонилметоксигруппой, изопропилоксикарбонилметоксигруппой, аминокарбонилметоксигруппой, метиламинокарбонилметоксигруппой, этиламинокарбонилметоксигруппой, изопропиламинокарбонилметоксигруппой, диметиламинокарбонилметоксигруппой, пирролидин-1-илкарбонилметоксигруппой или морфолин-4-илкарбонилметоксигруппой, фенилкарбонилметильную группу, в которой фенильный фрагмент замещен 1(метоксикарбонил)этилоксигруппой или 1-(аминокарбонил)этилоксигруппой, фенилкарбонилметильную группу, в которой фенильный фрагмент замещен метилсульфинилметоксигруппой, фенилкарбонилметильную группу, в которой фенильный фрагмент замещен двумя метоксигруппами, или фенилкарбонилметильную группу, в которой в фенильном фрагменте два смежных атома водорода заменены на группу или фенильную группу, или цианометильную, или метоксикарбонилметильную группу иR3 обозначает 2-цианобензильную или 2,6-дицианобензильную группу, 2-метил-2-пропен-1-ильную,2-хлор-2-пропен-1-ильную или 3-бром-2-пропен-1-ильную группу, 2-бутен-1-ильную, 3-метил-2-бутен-1 ильную или 2,3-диметил-2-бутен-1-ильную группу, 2-бутин-1-ильную группу, 1-циклопентен-1 илметильную группу или 2-фуранилметильную группу. Упомянутые среди значений указанных выше остатков карбоксигруппы могут быть заменены на переводимую in vivo в карбоксигруппу группу или на отрицательно заряженную в физиологических условиях группу, и помимо этого упомянутые среди значений указанных выше остатков аминогруппы и иминогруппы могут быть замещены отщепляемым in vivo остатком. Подобные группы описаны, например, в WO 98/46576 и у N.M. Nielsen и др. в International Journal of Pharmaceutics, 39, 1987, cc. 75-85. Соединения, содержащие отщепляемую in vivo группу, являются пролекарствами соответствующих соединений, у которых эта отщепляемая in vivo группа отщеплена. Под переводимой in vivo в карбоксигруппу группой подразумевается, например, гидроксиметильная группа либо этерифицированная спиртом карбоксигруппа, в которой спиртовой фрагмент предпочтительно представляет собой С 1-С 6 алканол, фенил-С 1-С 3 алканол, С 3-С 9 циклоалканол, при этом C5 С 8 циклоалканол дополнительно может быть замещен одной или двумя С 1-С 3 алкильными группами, C5 С 8 циклоалканол, в котором метиленовая группа в положении 3 или 4 заменена на атом кислорода или на необязательно замещенную С 1-С 3 алкилом, фенил-C1-С 3 алкилом, фенил-С 1-С 3 алкоксикарбонилом или С 1 С 6 алкилкарбонилом иминогруппу, а циклоалканольный фрагмент дополнительно может быть замещен одной или двумя С 1-С 3 алкильными группами, С 4-С 7 циклоалкенол, С 3-С 5 алкенол, фенил-C3-С 5 алкенол,С 3-С 5 алкинол или фенил-С 3-С 5 алкинол при условии, что с атомом кислорода не связан атом углерода,несущий двойную или тройную связь, С 3-С 8 циклоалкил-С 1-С 3 алканол, бициклоалканол, который содержит в общей сложности от 8 до 10 атомов углерода и который в бициклоалкильном фрагменте дополнительно может быть замещен одной или двумя С 1-С 3 алкильными группами, 1,3-дигидро-3-оксо-1 изобензфуранол либо спирт формулы Rp-CO-O-(RqCRr)-OH, в которой Ra обозначает С 1-С 8 алкил, C5 С 7 циклоалкил, С 1-С 8 алкилоксигруппу, С 5-С 7 циклоалкилоксигруппу, фенил или фенил-С 1-С 3 алкил, Rb обозначает атом водорода, С 1-С 3 алкил, С 5-С 7 циклоалкил или фенил и Rc обозначает атом водорода или С 1-С 3 алкил, под отрицательно заряженной в физиологических условиях группой подразумевается тетразол-5-ильная группа, фенилкарбониламинокарбонильная группа, трифторметилкарбониламинокарбонильная группа, С 1-С 6 алкилсульфониламиногруппа, фенилсульфониламиногруппа, бензилсульфониламиногруппа, трифторметилсульфониламиногруппа, C1-С 6 алкилсульфониламинокарбонильная группа,фенилсульфониламинокарбонильная группа, бензилсульфониламинокарбонильная группа или перфторC1-С 6 алкилсульфониламинокарбонильная группа, а под отщепляемым in vivo от имино- или аминогруппы остатком подразумевается, например, гидроксигруппа, ацильная группа, такая как фенилкарбонильная группа, одно- или двузамещенная идентичными или различными заместителями, выбранными из атомов фтора, хлора, брома и иода, С 1-С 3 алкила и С 1-С 3 алкилоксигруппы, пиридиноильная группа либо С 1-С 16 алканоильная группа, такая как формил, ацетил, пропионил, бутаноил, пентаноил или гексаноил,3,3,3-трихлорпропионильная группа либо аллилоксикарбонильная группа, С 1-С 16 алкилоксикарбонильная либо С 1-С 16 алкилкарбонилоксигруппа, в которых атомы водорода полностью или частично могут быть заменены на атомы фтора или хлора и в качестве примера которых можно назвать метоксикарбонил,этоксикарбонил, пропоксикарбонил, изопропоксикарбонил, бутоксикарбонил, трет-бутоксикарбонил,пентоксикарбонил, гексоксикарбонил, октилоксикарбонил, нонилоксикарбонил, децилоксикарбонил,ундецилоксикарбонил, додецилоксикарбонил, гексадецилоксикарбонил, метилкарбонилоксигруппу,этилкарбонилоксигруппу, 2,2,2-трихлорэтилкарбонилоксигруппу, пропилкарбонилоксигруппу, изопропилкарбонилоксигруппу, бутилкарбонилоксигруппу, трет-бутилкарбонилоксигруппу, пентилкарбонилоксигруппу, гексилкарбонилоксигруппу, октилкарбонилоксигруппу, нонилкарбонилоксигруппу, децилкарбонилоксигруппу, ундецилкарбонилоксигруппу, додецилкарбонилоксигруппу или гексадецилкарбонилоксигруппу, фенил-С 1-С 6 алкилоксикарбонильная группа, такая как бензилоксикарбонил, фенилэтоксикарбонил или фенилпропоксикарбонил, 3-аминопропионильная группа, в которой аминогруппа одноили двузамещена идентичными или различными заместителями, выбранными из С 1-С 6 алкила и C3 С 7 циклоалкила,С 1-С 3 алкилсульфонил-С 2-С 4 алкилоксикарбонильная группа,С 1-С 3 алкилокси-C2 С 4 алкилокси-С 2-С 4 алкилоксикарбонильная группа либо группа Rp-CO-O-(RqCRr)-O-CO, С 1-С 6 алкил-CONH-(RsCRt)-O-CO или С 1-С 6 алкил-CO-O-(RsCRt)-(RsCRt)-O-CO, где Rp-Rr имеют указанные выше значения, a Rs и Rt могут иметь идентичные или различные значения и обозначают атомы водорода или C1 С 3 алкильные группы. Первым объектом настоящего изобретения являются соединения общей формулы I, в которыхR1 обозначает метильную группу, которая замещена диметиламинокарбонильной, пирролидин-1 илкарбонильной, пиперидин-1-илкарбонильной, трет-бутилкарбонильной или циклогексилкарбонильной группой, метильную группу, которая замещена нафтильной, метилнафтильной, метоксинафтильной,нитронафтильной или (диметиламино)нафтильной группой, метильную группу, которая замещена 2 фенилэтенильной или бифенилильной группой, метильную группу, которая замещена фенилоксадиазолильной, 5-метил-3-фенилизоксазолильной, фенилпиридинильной, индолильной, бензотиофенильной,-2 024251 хинолинильной, изохинолинильной, метилизохинолинильной, (метоксикарбонилметиламино)изохинолинильной, циннолинильной, хиназолинильной, метилхиназолинильной, 1,2-дигидро-1-метил-2-оксохинолинильной, 1,2-дигидро-2-метил-1-оксоизохинолинильной, 3,4-дигидро-4-оксофталазинильной, 3,4 дигидро-3-метил-4-оксофталазинильной, 3,4-дигидро-4-оксохиназолинильной, 3,4-дигидро-3-метил-4 оксохиназолинильной или 2-оксо-2H-хроменильной группой, 2-метоксиэтильную, 2-фенилоксиэтильную или 2-цианоэтильную группу, фенилкарбонилметильную или 1-(фенилкарбонил)этильную группу, фенилкарбонилметильную группу, в которой фенильный фрагмент замещен аминогруппой, цианометиламиногруппой, метилкарбониламиногруппой, этилкарбониламиногруппой, изопропилкарбониламиногруппой, метоксикарбониламиногруппой, (этилоксикарбониламино)карбониламиногруппой или 2 оксоимидазолидин-1-ильной группой, фенилкарбонилметильную группу, в которой фенильный фрагмент замещен карбоксигруппой, метоксикарбонильной, этилоксикарбонильной, аминокарбонильной,метиламинокарбонильной, диметиламинокарбонильной или морфолин-4-илкарбонильной группой, фенилкарбонилметильную группу, в которой фенильный фрагмент замещен метилсульфанильной, метилсульфинильной или метилсульфонильной группой, фенилкарбонилметильную группу, в которой фенильный фрагмент замещен карбоксиметоксигруппой, этилоксикарбонилметоксигруппой, изопропилоксикарбонилметоксигруппой, аминокарбонилметоксигруппой, метиламинокарбонилметоксигруппой, этиламинокарбонилметоксигруппой, изопропиламинокарбонилметоксигруппой, диметиламинокарбонилметоксигруппой, пирролидин-1-илкарбонилметоксигруппой или морфолин-4-илкарбонилметоксигруппой,фенилкарбонилметильную группу, в которой фенильный фрагмент замещен 1-(метоксикарбонил)этилоксигруппой или 1-(аминокарбонил)этилоксигруппой, фенилкарбонилметильную группу, в которой фенильный фрагмент замещен метилсульфинилметоксигруппой, фенилкарбонилметильную группу, в которой фенильный фрагмент замещен двумя метоксигруппами, или фенилкарбонилметильную группу,в которой в фенильном фрагменте два смежных атома водорода заменены на группу -O-CH2-O-, -O-CH2CH2-O- или -N(CH3)-CO-O-;R2 обозначает метильную, изопропильную или фенильную группу и их таутомеры, энантиомеры, диастереомеры, их смеси, их пролекарства и их соли. Первую предпочтительную подгруппу соединений общей формулы I, являющихся первым объектом изобретения, образуют соединения, в которыхR2 обозначает метильную группу иR3 обозначает 2-бутен-1-ильную или 2-бутин-1-ильную группу, их таутомеры, энантиомеры, диастереомеры, их смеси и их соли. Вторую предпочтительную подгруппу соединений общей формулы I, являющихся первым объектом изобретения, образуют соединения, в которыхR2 обозначает метильную группу иR3 обозначает 2-бутен-1-ильную или 2-бутин-1-ильную группу, их таутомеры, энантиомеры, диастереомеры, их смеси и их соли. Третью предпочтительную подгруппу соединений общей формулы I, являющихся первым объектом изобретения, образуют соединения, в которыхR2 обозначает метильную группу иR3 обозначает 2-бутен-1-ильную, 2-бутин-1-ильную или 1-циклопентен-1-илметильную группу, их таутомеры, энантиомеры, диастереомеры, их смеси и их соли. Вторым объектом настоящего изобретения являются соединения общей формулы I, в которыхR1 обозначает метильную группу, которая замещена нафтильной, фторнафтильной, метилнафтильной, метоксинафтильной, (дифторметокси)нафтильной, цианонафтильной, нитронафтильной или (диметиламино)нафтильной группой, метильную группу, которая замещена фенантренильной группой, метильную группу, которая замещена 2-фенилэтенильной, 2-[(трифторметил)фенил]этенильной, 2(нитрофенил)этенильной, 2-(пентафторфенил)этенильной или бифенилильной группой, метильную группу, которая замещена фенилоксадиазолильной, фенилпиридинильной, индолильной, метилиндолильной, диметил-6,7-дигидро-5H-[2]пириндинильной, бензимидазолильной, метилбензимидазолильной,(цианоэтил)бензимидазолильной, (метиламинокарбонилметил)бензимидазолильной, бензилбензимидазолильной, бензофуранильной, ацегилбензофуранильной, цианобензофуранильной, бензоксазолильной,нитробензоксазолильной, бензотиофенильной, метилбензотиазолильной, хинолинильной, метоксихинолинильной, изохинолинильной, метилизохинолинильной, (дифторметил)изохинолинильной, (трифторметил)изохинолинильной, диметилизохинолинильной, (1-циано-1-метилэтил)изохинолинильной, фенилизохинолинильной, метоксиизохинолинильной, метоксихлоризохинолинильной, метоксибромизохинолинильной,(метоксикарбонилметиламино)изохинолинильной,диметил-5,6,7,8-тетрагидроизохинолинильной, 1,2,3,4-тетрагидрофенантридинильной, циннолинильной, хиназолинильной, метилхиназолинильной, изопропилхиназолинильной, циклопропилхиназолинильной, фенилхиназолинильной, аминохиназолинильной, (диметиламино)хиназолинильной, пирролидин-1-илхиназолинильной, пиперидин-1 илхиназолинильной, пиперазин-1-илхиназолинильной, морфолин-4-илхиназолинильной, этоксихиназолинильной, изопропилоксихиназолинильной, фенилоксихиназолинильной, имидазо[1,2-a]пиридинильной, метилимидазо[1,2-a]пиридинильной, фенилимидазо[1,2-a]пиридинильной, бензилимидазо[1,2a]пиридинильной, пиразоло[1,5-a]пиридинильной, хиноксалинильной, метилхиноксалинильной, диметилхиноксалинильной, триметилхиноксалинильной, фенилхиноксалинильной, метилфталазинильной,нафтиридинильной, 2,3-дигидробензо[1,4]диоксинильной, 1,2-дигидро-2-оксохинолинильной, 1,2 дигидро-1-метил-2-оксохинолинильной, 1,2-дигидро-2-метил-1-оксоизохинолинильной, 3,4-дигидро-4 оксофталазинильной, 3,4-дигидро- 3-метил-4-оксофталазинильной, 3,4-дигидро-4-оксохиназолинильной,3,4-дигидро-3-метил-4-оксохиназолинильной или 2-оксо-2H-хроменильной группой, фенилкарбонилметильную группу, фенилкарбонилметильную группу, в которой фенильный фрагмент замещен аминогруппой, цианометиламиногруппой, (этилоксикарбонилметил)аминогруппой, (метиламинокарбонил) метиламиногруппой, метилкарбониламиногруппой, этилкарбониламиногруппой, изопропилкарбониламиногруппой, фенилкарбониламиногруппой, метоксикарбониламиногруппой, (этилоксикарбониламино)карбониламиногруппой или 2-оксоимидазолидин-1-ильной группой, фенилкарбонилметильную группу, в которой фенильный фрагмент замещен фенильной группой, фенилкарбонилметильную группу, в которой фенильный фрагмент замещен карбоксигруппой, метоксикарбонильной, этилоксикарбонильной,аминокарбонильной, метиламинокарбонильной, диметиламинокарбонильной или морфолин-4-илкарбонильной группой, фенилкарбонилметильную группу, в которой фенильный фрагмент замещен метилсульфанильной, метилсульфинильной или метилсульфонильной группой, фенилкарбонилметильную группу, в которой фенильный фрагмент замещен метоксигруппой, дифторметоксигруппой, трифторметоксигруппой, этилоксигруппой, изопропилоксигруппой или фенилоксигруппой, фенилкарбонилметильную группу, в которой фенильный фрагмент замещен метилсульфинилметоксигруппой, карбоксиметоксигруппой, этилоксикарбонилметоксигруппой, изопропилоксикарбонилметоксигруппой, аминокарбонилметоксигруппой, метиламинокарбонилметоксигруппой, этиламинокарбонилметоксигруппой, изопропиламинокарбонилметоксигруппой, диметиламинокарбонилметоксигруппой, пирролидин-1-илкарбонилметоксигруппой или морфолин-4-илкарбонилметоксигруппой, фенилкарбонилметильную группу, в которой фенильный фрагмент замещен 1-(этилоксикарбонил)-1-метилэтилоксигруппой, 1-(метоксикарбонил)этилоксигруппой или 1-(аминокарбонил)этилоксигруппой, фенилкарбонилметильную группу, в которой фенильный фрагмент замещен двумя метоксигруппами, фенилкарбонилметильную группу, в которой фенильный фрагмент замещен метоксигруппой и нитрогруппой, фенилкарбонилметильную группу, в которой фенильный фрагмент замещен метоксигруппой и аминогруппой, фенилкарбонилметильную группу, в которой в фенильном фрагменте два смежных атома водорода заменены на группу -OCH2-O-, -O-CF2-O-, -O-CH2-CH2-O-, -NH-CO-NH-, -N(CH3)-CO-NH-, -N(CH3)-CO-N(CH3)-, -NH-CO-Oили -N(CH3)-CO-O-, (2-фенилэтил)карбонилметильную группу, нафтилкарбонилметильную, индолилкарбонилметильную или хинолинилкарбонилметильную группу или 2-цианоимино-2-фенилэтильную группу;R2 обозначает метильную, изопропильную, циклопропильную, фенильную или фторфенильную группу иR3 обозначает 2-метил-2-пропен-1-ильную, 2-хлор-2-пропен-1-ильную или 3-бром-2-пропен-1 ильную группу, 1-бутен-1-ильную, 3-метил-1-бутен-1-ильную, 2-бутен-1-ильную, 2-метил-2-бутен-1 ильную или 2,3-диметил-2-бутен-1-ильную группу, 2-бутин-1-ильную группу, 1-циклопентен-1 илметильную группу или 2-фуранилметильную группу,их таутомеры, энантиомеры, диастереомеры, их смеси, их пролекарства и их соли. Предпочтительную подгруппу соединений общей формулы I, являющихся вторым объектом изобретения, образуют соединения, в которых R1 и R2 имеют указанные выше значения, а R3 обозначает 1 бутен-1-ильную, 2-бутен-1-ильную или 2-бутин-1-ильную группу, их таутомеры, энантиомеры, диастереомеры, их смеси и их соли. Наиболее предпочтительную подгруппу соединений общей формулы I, являющихся вторым объектом изобретения, образуют соединения, в которыхR1 обозначает метильную группу, которая замещена нафтильной, фторнафтильной, метилнафтильной, метоксинафтильной, (дифторметокси)нафтильной, цианонафтильной или нитронафтильной группой, метильную группу, которая замещена 2-(пентафторфенил)этенильной группой, метильную группу,которая замещена бензофуранильной, метилбензотиазолильной, хинолинильной, метоксихинолинильной, изохинолинильной, метилизохинолинильной, (дифторметил)изохинолинильной, (трифторметил)изохинолинильной, диметилизохинолинильной, (1-циано-1-метилэтил)изохинолинильной, фенилизохинолинильной, метоксиизохинолинильной, 1,2,3,4-тетрагидрофенантридинильной, хиназолинильной,метилхиназолинильной, изопропилхиназолинильной, циклопропилхиназолинильной, фенилхиназолинилыюй, аминохиназолинильной, (диметиламино)хиназолинильной, пирролидин-1-илхиназолинильной,пиперидин-1-илхиназолинильной, пиперазин-1-илхиназолинильной, морфолин-4-илхиназолинильной,этоксихиназолинильной, изопропилоксихиназолинильной, хиноксалинильной, метилхиноксалинильной,диметилхиноксалинильной, триметилхиноксалинильной, фенилхиноксалинильной, [1,5]нафтиридинильной, [1,6]нафтиридинильной, [1,8]нафтиридинильной или 1,2-дигидро-1-метил-2-оксохинолинильной группой, фенилкарбонилметильную группу, фенилкарбонилметильную группу, в которой фенильный фрагмент замещен фенильной группой, фенилкарбонилметильную группу, в которой фенильный фрагмент замещен метоксигруппой, дифторметоксигруппой, трифторметоксигруппой, этилоксигруппой, изопропилоксигруппой или фенилоксигруппой, фенилкарбонилметильную группу, в которой в фенильном фрагменте два смежных атома водорода заменены на группу -O-CH2-O-, -O-CF2-O-, -O-CH2CH2-O-, -N(CH3)-CO-N(CH3)- или -N(CH3)-CO-O-, нафтилкарбонилметильную, индолилкарбонилметильную или хинолинилкарбонилметильную группу или 2-цианоимино-2-фенилэтильную группу, R2 обозначает метильную, изопропильную, циклопропильную, фенильную или 4-фторфенильную группу и R3 обозначает 1-бутен-1-ильную, 2-бутен-1-ильную или 2-бутин-1-ильную группу, их таутомеры, энантиомеры,диастереомеры, их смеси и их соли. Вторую предпочтительную подгруппу соединений общей формулы I, являющихся вторым объектом изобретения, образуют соединения, в которых R1 и R2 имеют непосредственно указанные выше значения, a R3 обозначает 1-бутен-1-ильную группу, их таутомеры, энантиомеры, диастереомеры, их смеси и их соли. Третью предпочтительную подгруппу соединений общей формулы I, являющихся вторым объектом изобретения, образуют соединения, в которых R1 и R2 имеют непосредственно указанные выше значения,a R3 обозначает 2-бутен-1-ильную группу, их таутомеры, энантиомеры, диастереомеры, их смеси и их соли. Четвертую предпочтительную подгруппу соединений общей формулы I, являющихся вторым объ-7 024251 ектом изобретения, образуют соединения, в которых R1 и R2 имеют непосредственно указанные выше значения, a R3 обозначает 2-бутин-1-ильную группу, их таутомеры, энантиомеры, диастереомеры, их смеси и их соли. Третьим объектом настоящего изобретения являются соединения общей формулы I, в которых R1 обозначает метильную группу, которая замещена нафтильной, фторнафтильной, метилнафтильной, метоксинафтильной, (дифторметокси)нафтильной, цианонафтильной или нитронафтильной группой, метильную группу, которая замещена 2-(пентафторфенил)этенильной группой, или метильную группу, которая замещена бензофуранильной, метилбензотиазолильной, хинолинильной, метоксихинолинильной,изохинолинильной, метилизохинолинильной, (дифторметил)изохинолинильной, (трифторметил)изохинолинильной, диметилизохинолинильной, (1-циано-1-метилэтил)изохинолинильной, фенилизохинолинильной, метоксиизохинолинильной, 1,2,3,4-тетрагидрофенантридинильной, хиназолинильной, метилхиназолинильной, изопропилхиназолинильной, циклопропилхиназолинильной, фенилхиназолинильной,аминохиназолинильной, (диметиламино)хиназолинильной, пирролидин-1-илхиназолинильной, пиперидин-1-илхиназолинильной, пиперазин-1-илхиназолинильной, морфолин-4-илхиназолинильной, этоксихиназолинильной, изопропилоксихиназолинильной, хиноксалинильной, метилхиноксалинильной, диметилхиноксалинильной, триметилхиноксалинильной, фенилхиноксалинильной, [1,5]нафтиридинильной,[1,6]нафтиридинильной, [1,8]нафтиридинильной или 1,2-дигидро-1-метил-2-оксохинолинильной группой, R2 обозначает метильную, изопропильную, циклопропильную или фенильную группу и R3 обозначает 2-хлорбензильную, 2-бромбензильную, 2-этинилбензильную или 2-цианобензильную группу, их таутомеры, энантиомеры, диастереомеры, их смеси и их соли. Первую предпочтительную подгруппу соединений общей формулы I, являющихся третьим объектом изобретения, образуют соединения, в которых R1 обозначает (3-метилизохинолин-1-ил)метильную группу, R2 обозначает метильную группу и R3 обозначает 2-хлорбензильную, 2-бромбензильную, 2 этинилбензильную или 2-цианобензильную группу, их таутомеры, энантиомеры, диастереомеры, их смеси и их соли. Вторую предпочтительную подгруппу соединений общей формулы I, являющихся третьим объектом изобретения, образуют соединения, в которых R1 и R2 имеют указанные выше значения, a R3 обозначает 2-хлорбензильную группу, их таутомеры, энантиомеры, диастереомеры, их смеси и их соли. Третью предпочтительную подгруппу соединений общей формулы I, являющихся третьим объектом изобретения, образуют соединения, в которых R1 и R2 имеют указанные выше значения, a R3 обозначает 2-бромбензильную группу, их таутомеры, энантиомеры, диастереомеры, их смеси и их соли. Четвертую предпочтительную подгруппу соединений общей формулы I, являющихся третьим объектом изобретения, образуют соединения, в которых R1 и R2 имеют указанные выше значения, a R3 обозначает 2-этинилбензильную группу, их таутомеры, энантиомеры, диастереомеры, их смеси и их соли. Пятую предпочтительную подгруппу соединений общей формулы I, являющихся третьим объектом изобретения, образуют соединения, в которых R1 и R2 имеют указанные выше значения, a R3 обозначает 2-цианобензильную группу, их таутомеры, энантиомеры, диастереомеры, их смеси и их соли. Особенно предпочтительны следующие соединения общей формулы I: а также их таутомеры, энантиомеры, диастереомеры, их смеси и их соли. Соединения общей формулы I получают согласно изобретению известными способами, например,описанными ниже способами. а) В этом варианте соединение общей формулы нилоксигруппа, например атом хлора или брома, метансульфонильная или метансульфонилоксигруппа,подвергают взаимодействию с 3-аминопиперидином, его энантиомерами или его солями. Описанное выше взаимодействие целесообразно проводить в растворителе, таком как изопропанол,бутанол, тетрагидрофуран, диоксан, диметилформамид, диметилсульфоксид, монометиловый эфир этиленгликоля, диэтиловый эфир этиленгликоля или сульфолан, необязательно в присутствии неорганического основания, например карбоната натрия, карбоната калия или гидроксида калия, третичного органического основания, например триэтиламина, или в присутствии N-этилдиизопропиламина (основания Хюнига), при этом указанные органические основания одновременно могут также служить растворителем, и необязательно в присутствии катализатора, например галогенида щелочного металла или катализатора на основе палладия. при температуре от -20 до +180C, предпочтительно, однако, при температуре от -10 до +120C. Вместе с тем реакцию можно проводить и без растворителя или в избытке 3 аминопиперидина. б) В этом варианте в соединении общей формулы в которой R1, R2 и R3 имеют указанные в начале описания значения, удаляют защитную группу. трет-Бутилоксикарбонильную группу предпочтительно отщеплять обработкой кислотой, такой как трифторуксусная кислота или соляная кислота, либо обработкой бромтриметилсиланом или иодтриметилсиланом, необязательно с использованием растворителя, такого как метиленхлорид, этилацетат, диоксан, метанол, изопропанол или диэтиловый эфир, при температуре от 0 до 80C. в) В этом варианте для получения соединения общей формулы I, в которой R1 согласно указанному в начале описания определению содержит карбоксигруппу, в соединении общей формулы в которой R2 и R3 имеют указанные в начале описания значения, a R1 содержит защищенную C1 С 4 алкильной группой карбоксигруппу, удаляют защитную группу. Защитную группу при этом предпочтительно отщеплять, например, гидролитическим путем с помощью кислоты, такой как соляная кислота или серная кислота, либо гидроксида щелочного металла,такого как гидроксид лития, гидроксид натрия или гидроксид калия, в растворителе, таком как метанол,этанол, изопропанол, тетрагидрофуран или диоксан, в присутствии воды. При проведении описанных выше реакций присутствующие при определенных условиях реакционноспособные группы, такие как карбокси-, амино-, алкиламино- или иминогруппы, можно защищать на время протекания реакции обычными защитными группами и вновь отщеплять их по завершении реакции. В качестве примера защитной группы для карбоксигруппы можно назвать триметилсилильную, метильную, этильную, трет-бутильную, бензильную или тетрагидропиранильную группу, в качестве примера защитной группы для амино-, алкиламино- или иминогруппы можно назвать формильную, ацетильную, трифторацетильную, этоксикарбонильную, трет-бутоксикарбонильную, бензилоксикарбонильную, бензильную, метоксибензильную или 2,4-диметоксибензильную группу, а для аминогруппы дополнительно фталильную группу. При необходимости последующее отщепление используемой защитной группы можно осуществлять, например, гидролитическим путем в водном растворителе, например в воде, изопропаноле/воде,уксусной кислоте/воде, тетрагидрофуране/воде или диоксане/воде, в присутствии кислоты, такой как трифторуксусная кислота, соляная кислота или серная кислота, либо в присутствии гидроксида щелочного металла, такого как гидроксид натрия или гидроксид калия, или апротонным путем, например в присутствии иодтриметилсилана, при температуре от 0 до 120C, предпочтительно от 10 до 100C. Однако бензильную, метоксибензильную или бензилоксикарбонильную группу отщепляют, например, путем гидрогенолиза, в частности под действием водорода в присутствии катализатора, такого как палладий на угле, в приемлемом растворителе, таком как метанол, этанол, этилацетат или ледяная уксусная кислота, необязательно с добавлением кислоты, такой как соляная кислота, при температуре от 0 до 100C, но предпочтительно при комнатных температурах в пределах от 20 до 60C, и при давлении водорода от 1 до 7 бар, предпочтительно, однако, от 3 до 5 бар, 2,4-диметоксибензильную группу предпочтительно, однако, отщеплять в трифторуксусной кислоте в присутствии анизола. трет-Бутильную или трет-бутилоксикарбонильную группу предпочтительно отщеплять обработкой кислотой, такой как трифторуксусная кислота или соляная кислота, либо обработкой иодтриметилсиланом, необязательно с использованием растворителя, такого как метиленхлорид, диоксан, этилацетат или диэтиловый эфир. Трифторацетильную группу предпочтительно отщеплять обработкой кислотой, такой как соляная кислота, необязательно в присутствии растворителя, такого как уксусная кислота, при температуре от 50 до 120C, либо обработкой едким натром, необязательно в присутствии растворителя, такого как тетрагидрофуран, при температуре от 0 до 50C. Фталильную группу предпочтительно отщеплять в присутствии гидразина или первичного амина,такого как метиламин, этиламин или н-бутиламин, в растворителе, таком как метанол, этанол, изопропанол, толуол/вода или диоксан, при температуре от 20 до 50C. Кроме того, полученные соединения общей формулы I можно разделять, как уже указывалось в начале описания, на их энантиомеры и/или диастереомеры. Так, например, цис-/транс-смеси можно разделять на их отдельные цис- и транс-изомеры, а соединения по меньшей мере с одним оптически активным атомом углерода можно разделять на их энантиомеры. Так, в частности, полученные цис-/транс-смеси можно разделять путем хроматографии на их отдельные цис- и транс-изомеры, полученные соединения общей формулы I, которые образуются в виде рацематов, можно разделять по известным методам (см. AllingerN.L. и Eliel EX., "Topics in Stereochemistry", т. 6, изд-во Wiley Interscience, 1971) на их оптические антиподы, а соединения общей формулы I по меньшей мере с 2 асимметрическими атомами углерода можно на основе различий их физикохимических свойств разделять по известным методам, например хроматографией и/или фракционированной кристаллизацией, на их диастереомеры, которые при их образовании в рацемической форме в последующем можно разделять, как это описано выше, на энантиомеры. Разделение на энантиомеры предпочтительно осуществлять путем колоночного разделения на хиральных фазах либо путем перекристаллизации из оптически активного растворителя или взаимодействием с образующим с рацемическим соединением соли или производные, такие как сложные эфиры или амиды, оптически активным веществом, прежде всего с кислотами и их активированными производными или спиртами, и разделением полученной в результате смеси диастереомерных солей или производного,например на основе различий в растворимости, при этом из чистых диастереомерных солей или производных можно высвобождать свободные антиподы воздействием пригодными для этой цели средствами. В качестве примера наиболее часто используемых в вышеуказанных целях оптически активных кислот можно назвать D- и L-формы винной либо дибензоилвинной кислоты, ди-O-n-толилвинной кислоты, яблочной кислоты, миндальной кислоты, камфорсульфоновой кислоты, глутаминовой кислоты, аспарагиновой кислоты или хинной кислоты. Примером оптически активного спирта служит (+)- или (-)-ментол, а в качестве примера оптически активного ацильного фрагмента в амидах можно назвать (+)- или (-)ментилоксикарбонил. Помимо этого полученные соединения формулы I можно переводить в их соли, прежде всего в их пригодные для фармацевтического применения физиологически совместимые соли с неорганическими или органическими кислотами. В качестве примера пригодных для этой цели кислот можно назвать соляную кислоту, бромистоводородную кислоту, серную кислоту, метансульфоновую кислоту, фосфорную кислоту, фумаровую кислоту, янтарную кислоту, молочную кислоту, лимонную кислоту, винную кислоту или малеиновую кислоту. Кроме того, полученные таким путем новые соединения формулы I, если они содержат карбоксигруппу, в последующем при необходимости можно переводить в их соли с неорганическими или органическими основаниями, прежде всего в их пригодные для фармацевтического применения физиологически приемлемые соли. В качестве примера пригодных для этой цели оснований можно назвать гидроксид натрия, гидроксид калия, аргинин, циклогексиламин, этаноламин, диэтаноламин и триэтаноламин. Используемые в качестве исходных веществ соединения общих формул II-IV либо известны из литературы, либо их получают по известным из литературы методам (см. примеры I-LXXI). Предлагаемые в изобретении соединения общей формулы I и их физиологически совместимые соли обладают, как уже указывалось выше, ценными фармакологическми свойствами, прежде всего ингибирующим действием на фермент DPP-IV. Биологические свойства новых соединений исследовали по описанной ниже методике. Способность предлагаемых в изобретении соединений и их соответствующих солей подавлять активность DPP-IV можно продемонстрировать экспериментально с использованием в качестве источникаDPP-IV экстракта человеческих клеток рака толстой кишки линии Caco-2. Для дифференцировки клеток с целью индуцировать экспрессию DPP-IV использовали метод, описанный у Reiher и др. в статье "Increased expression of intestinal cell line Сасо-2", опубликованной в Proc. Natl. Acad. Sci., т. 90, 1993, cc. 5757-5761. Клеточный экстракт получали из солюбилизированных в буфере (10 мМ трис-HCl, 0,15 МNaCl, апротинин в количестве, соответствующем 0,04 единиц ингибирования трипсина (ЕИТ), 0,5% Nonidet-P40, pH 8,0) клеток путем центрифугирования при 35000g в течение 30 мин при 4C (для удаления клеточного дебриса). Ниже рассмотрена методика проведения опыта по подавлению активности DPP-IV. В черные титрационные микропланшеты вносили 50 мкл раствора субстрата (амидо-4 трифторметилкумарина, конечная концентрация 100 мкМ). Далее с помощью пипетки добавляли 20 мкл буфера для анализа (конечные концентрации: 50 мМ трис-HCl с pH 7,8, 50 мМ NaCl, 1% ДМСО). Реакцию инициировали добавлением 30 мкл солюбилизированного белка из клеток линии Caco-2 (конечная концентрация 0,14 мкг белка на лунку). Анализируемые тестируемые вещества обычно добавляли в предварительно разведенном в 20 мкл виде, причем в этом случае на соответствующую величину уменьшали объем используемого буфера для анализа. Реакцию проводили при комнатной температуре при продолжительности инкубации, равной 60 мин. По истечении этого промежутка времени измеряли интенсивность флуоресценции в приборе типа Victor 1420 Multilabel Counter при длине волны возбуждения 405 нм и длине волны испускания 535 нм. "Холостые" значения (соответствуют активности, равной 0%) получали в смесях без белка из клеток линии Сасо-2 (недостающий объем восполняли добавлением соответствующего количества буфера для анализа), а контрольные значения (соответствуют активности,равной 100%) получали в смесях, к которым не добавляли анализируемые вещества. Степень проявляемого каждым из тестируемых веществ действия, выраженную в виде значений ингибирующей концентрации IC50, рассчитывали на основе кривых зависимости эффекта от дозы, каждую из которых строили по 11 экспериментальным точкам. При этом были получены следующие результаты: Предлагаемые в изобретении соединения обладают хорошей переносимостью, поскольку, например, после перорального введения крысам соединения из примера 2(80) в дозе 10 мг/кг не наблюдалось никаких изменений в поведении животных. Предлагаемые в изобретении соединения общей формулы I и их соответствующие фармацевтически приемлемые соли с учетом их способности подавлять активность DPP-IV позволяют влиять на все те состояния или заболевания, на которые можно воздействовать за счет подавления активности DPP-IV. Поэтому можно ожидать, что предлагаемые в изобретении соединения пригодны для профилактики или лечения таких заболеваний или состояний, как сахарный диабет типа I и типа II, диабетические осложнения (например ретинопатия, нефропатия или невропатия), метаболический ацидоз или кетоз, реактивная гипогликемия, резистентность к инсулину, метаболический синдром, дислипидимии различного генеза,артрит, атеросклероз и родственные заболевания, ожирение, отторжение аллотрансплантата и вызванный кальцитонином остеопороз. Помимо этого предлагаемые в изобретении соединения позволяют предупреждать дегенерацию B-клеток, например апоптоз или некроз панкреатических B-клеток. Предлагаемые в изобретении соединения пригодны далее для улучшения или восстановления функциональной активности панкреатических клеток и наряду с этим для увеличения количества и размера панкреатическихB-клеток. Кроме того, исходя из той роли, которую играют глюкагоноподобные пептиды, такие, например, как GLP-1 и GLP-2, и их связи с ингибированием DPP-IV, ожидается, что предлагаемые в изобретении соединения пригодны помимо прочего для достижения седативного или устраняющего состояние страха эффекта и, кроме того, способны благоприятно влиять на катаболические состояния после хирургических операций или на гормональные стрессовые реакции или позволяют снизить смертность и заболеваемость после инфаркта миокарда. Помимо этого предлагаемые в изобретении соединения пригодны для лечения всех состояний, взаимосвязанных с вышеописанными эффектами и опосредуемых пептидомGLP-1 или GLP-2. Предлагаемые в изобретении соединения равным образом могут использоваться в качестве мочегонных или гипотензивных средств и пригодны для предупреждения и лечения острой почечной недостаточности. Предлагаемые в изобретении соединения могут далее использоваться для лечения воспалительных заболеваний дыхательных путей. Равным образом они пригодны для предупреждения и терапии хронических воспалительных заболеваний кишечника, таких, например, как синдром раздраженного кишечника (СРК), болезнь Крона или язвенный колит, а также для применения при панкреатите. Помимо этого ожидается, что они могут использоваться при любого типа повреждениях или нарушениях в желудочно-кишечном тракте, в том числе и, например, при колитах и энтеритах. Кроме того,ожидается, что ингибиторы DPP-IV, а тем самым и предлагаемые в изобретении соединения могут применяться для лечения бесплодия или для улучшения репродуктивной способности человека или млекопитающих и прежде всего в том случае, когда бесплодие взаимосвязано с резистентностью к инсулину или с синдромом поликистоза яичников. С другой стороны эти соединения способны влиять на подвижность сперматозоидов и поэтому могут использоваться в качестве мужских контрацептивов. Такие соединения способны помимо этого положительно влиять на состояния, связанные с дефицитом соматотропных гормонов и проявляющиеся в карликовом росте, а также их целесообразно использовать при всех показаниях, при которых допускается применение соматотропных гормонов. Предлагаемые в изобретении соединения благодаря их ингибирующему действию на DPP-IV пригодны также для лечения различных аутоиммунных заболеваний, таких, например, как ревматоидный артрит, множественный склероз, тиреоидиты, базедова болезнь и другие. Помимо этого они могут использоваться при вирусных заболеваниях, в том числе, например, и при ВИЧ-инфекциях, для стимуляции гемопоэза, при доброкачественной гиперплазии простаты, при гингивитах, а также для лечения нейронных нарушений и нейродегенеративных заболеваний, таких, например, как болезнь Альцгеймера. Предлагаемые в изобретении соединения можно использовать и для терапии опухолей, прежде всего для изменения процесса инвазии опухоли, в том числе и метастазирования. В качестве примера при этом можно назвать применение приT-клеточных лимфомах, остром лимфобластном лейкозе, клеточном раке щитовидной железы, базалиоме или раке молочной железы. К числу других показаний относятся апоплексический удар, ишемии различного генеза, болезнь Паркинсона и мигрень. Помимо этого к другим показаниям относятся фолликулярный и эпидермолитический гиперкератозы, повышенная пролиферация кератиноцитов, псориаз, энцефаломиелиты, гломерулонефриты, липодистрофии, а также психосоматические, депрессивные и нейропсихические заболевания различного генеза. Предлагаемые в изобретении соединения можно также использовать в сочетании с другими действующими веществами. К подобного рода терапевтическим средствам, которые могут использоваться в комбинации с предлагаемыми в изобретении соединениями, относятся, например, антидиабетические средства, такие как метформин, сульфонилмочевины (например глибенкламид, толбутамид, глимепирид), натеглинид, репаглинид, тиазолидиндионы (например росиглитазон, пиоглитазон), агонисты PPAR (например GI 262570) и антагонисты PPAR-, модуляторы PPAR-/ (например KRP 297), ингибиторы-глюкозидазы (например акарбоза, воглибоза), иные ингибиторы DPP-IV, 2-антагонисты, инсулин и его аналоги, GLP-1 и аналоги GLP-1 (например эксендин-4) или амилин. Наряду с указанными выше в комбинации с предлагаемыми в изобретении соединениями могут также использоваться ингибиторыSGLT2, такие как Т-1095, ингибиторы протеинтирозинфосфатазы 1, вещества, влияющие на дерегуляцию продуцирования глюкозы в печени, такие как ингибиторы глюкозо-6-фосфатазы, фруктозо-1,6 бисфосфатазы или гликогенфосфорилазы, антагонисты глюкагонового рецептора и ингибиторы фосфоенолпируваткарбоксикиназы, киназы гликогенсинтазы (протеинкиназы) или пируватдегидрогеназы, средства, понижающие уровень липидов в крови, такие как ингибиторы HMG-CoA-редуктазы (например симвастатин, аторвастатин), фибраты (например безафибрат, фенофибрат), никотиновая кислота и ее производные, агонисты PPAR-, агонисты PPAR-, ингибиторы ACAT (например авасимиб) или ингибиторы всасывания холестерина, такие как эзетимиб, связывающие желчные кислоты вещества, такие как колестирамин, ингибиторы подвздошного транспорта желчных кислот, повышающие уровень альфалипопротеинов высокой плотности в крови соединения, такие как ингибиторы CETP или регуляторыABC1, либо действующие вещества для лечения ожирения, такие как сибутрамин, тетрагидролипстатин,дексфенфлурамин или аксокин, антагонисты рецептора каннбиноида 1, антагонисты рецептора MCH-1,агонисты рецептора MC4, антагонисты NPY5 либо NPY2 или 3-агонисты, такие как SB-418790 или AD9677, а также агонисты рецептора 5HT2C. Помимо этого в сочетании с предлагаемыми в изобретении соединениями можно использовать медикаменты, влияющие на повышенное кровяное давление, такие, например, как антагонисты AII или ингибиторы ACE, диуретики, -блокаторы, Ca-антагонисты и другие или их комбинации. Для достижения соответствующего действия предлагаемые в изобретении соединения целесообразно вводить в организм от 1 до 4 раз в день в дозе, которая при внутривенном введении составляет от 1 до 100 мг, предпочтительно от 1 до 30 мг, а при пероральном введении составляет от 1 до 1000 мг, предпочтительно от 1 до 100 мг. С этой целью предлагаемые в изобретении соединения формулы I, необязательно в сочетании с другими действующими веществами, перерабатывают совместно с одним или несколькими обычными инертными носителями и/или разбавителями, например с кукурузным крахмалом, лактозой, тростниковым сахаром, микрокристаллической целлюлозой, стеаратом магния, поливинилпирролидоном, лимонной кислотой, винной кислотой, водой, водой/этанолом, водой/глицерином, водой/сорбитом, водой/полиэтиленгликолем, пропиленгликолем, цетилстеариловым спиртом, карбоксиметилцеллюлозой или жиросодержащими веществами, такими как отвержденный жир, или их приемлемыми смесями, в обычные галеновы формы, такие как таблетки, драже, капсулы, порошки, суспензии или суппозитории. Ниже изобретение проиллюстрировано на примерах. Получение исходных соединений Пример I. 1,3-Диметил-7-(2,6-дицианобензил)-8-бромксантин. Смесь из 555 мг 8-бромтеофиллина и 0,39 мл основания Хюнига в 9 мл N,N-диметилформамида смешивают с 600 мг 2-бромметилизофталонитрила и оставляют на ночь перемешиваться при комнатной температуре. Для переработки реакционную смесь сливают в воду. Выпавший осадок отделяют вакуумфильтрацией, затем промывают водой и сушат. Выход: 686 мг (83% от теории). Значение Rf: 0,56 (силикагель, метиленхлорид/метанол в соотношении 95:5). Масс-спектр (ESI+): m/z = 399, 401 [M+Н]+. Аналогично примеру I получают следующие соединения:(19) 3-метил-7-(3-метил-1-фенилсульфанилбутил)-8-бромксантин (используемый в реакции в качестве исходного материала [(1-хлор-3-метилбутил)сульфанил]бензол получают хлорированием [(3 метилбутил)сульфанил]бензола N-хлорсукцинимидом в четыреххлористом углероде): значение Rf: 0,38(22) 3-циклопропил-7-(2-бутин-1-ил)-8-бромксантин: значение Rf: 0,45 (готовая пластина для TCX с обращенной фазой (фирма E. Merck), ацетонитрил/вода/трифторуксусная кислота в соотношении 50:50:1), масс-спектр (ESI+): m/z = 223/225 [M+H]+. Пример II. 1-(2-2-[(Этоксикарбонил)метокси-[фенил]-2-оксоэтил)-3-метил-7-(3-метил-2-бутен-1 ил)-8-[3-(трет-бутилоксикарбониламино)пиперидин-1-ил]ксантин. К смеси из 200 мг 1-[2-(2-гидроксифенил)-2-оксоэтил]-3-метил-7-(3-метил-2-бутен-1-ил)-8-[3-(третбутилоксикарбониламино)пиперидин-1-ил]ксантина и 63 мг карбоната калия в 3 мл N,N-диметилформамида добавляют 63 мг этилового эфира бромуксусной кислоты. Реакционную смесь перемешивают в течение пяти часов при комнатной температуре. Для переработки смесь смешивают с водой и выпавший осадок отделяют вакуум-фильтрацией, затем промывают водой и в течение трех часов сушат в сушильном шкафу при 80C. Выход: 216 мг (94% от теории). Масс-спектр (ESI+): m/z = 653 [M+H]+. Аналогично примеру II получают следующие соединения:(14) 1-(2-2-[(метиламинокарбонил)метокси]фенил-2-оксоэтил)-3-метил-7-E)-2-бутен-1-ил)-8-[3(трет-бутилоксикарбониламино)пиперидин-1-ил]ксантин (продукт содержит некоторое количество Zизомера): значение Rf: 0,35 (силикагель, циклогексан/этилацетат/метанол в соотношении 5:4:1), массспектр (ESI+): m/z = 624 [M+H]+;(27) 1-[2-(трет-бутилкарбонил)бензофуран-3-ил]метил-3-метил-7-(2-бутин-1-ил)-8-[3-(трет-бутилоксикарбониламино)пиперидин-1-ил]ксантин (образуется в качестве основного продукта при взаимодействии 1-[2-(2-гидроксифенил)-2-оксоэтил]-3-метил-7-(2-бутин-1-ил)-8-[3-(трет-бутилоксикарбониламино)пиперидин-1-ил]ксантина с 1-хлор-3,3-диметилбутан-2-оном): масс-спектр (ESI+): m/z = 631III. 1-[2-(2-Гидроксифенил)-2-оксоэтил]-3-метил-7-(3-метил-2-бутен-1-ил)-8-[3-(третбутилоксикарбониламино)пиперидин-1-ил]ксантин. К смеси из 2,51 г 1-[2-(2-гидроксифенил)-2-оксоэтил]-3-метил-7-(3-метил-2-бутен-1-ил)-8-хлорксантина и 880 мг карбоната натрия в 8 мл диметилсульфоксида добавляют 1,30 г 3-трет-бутилоксикарбониламинопиперидина. Реакционную смесь перемешивают в течение 18 ч при 60C. Для переработки смесь смешивают с водой и выпавший осадок отделяют вакуум-фильтрацией. Твердый сырой продукт растворяют в этилацетате, раствор сушат над сульфатом магния и концентрируют. Остаток в колбе хроматографируют на силикагелевой колонке с использованием в качестве элюента смеси циклогексан/этилацетат (в соотношении, изменяющемся от 10:1 до 1:1). Выход: 2,56 г (91% от теории). Масс-спектр (ESI+): m/z = 567 [M+H]+. Аналогично примеру III получают следующие соединения:(14) 1-(4-оксо-3-[(2-триметилсиланилэтокси)метил]-3,4-дигидрофталазин-1-илметил)-3-метил-7(3-метил-2-бутен-1-ил)-8-[3-(трет-бутилоксикарбониламино)пиперидин-1-ил]ксантин (реакцию проводят с использованием карбоната калия в присутствии основания Хюнига): значение Rf: 0.27 (силикагель,циклогексан/этилацетат в соотношении 1:1), масс-спектр (ESI+): m/z = 720 [M+H]+;(21) 1-[(изохинолин-1-ил)метил]-3-метил-7-E)-2-бутен-1-ил)-8-[3-(трет-бутилоксикарбониламино) пиперидин-1-ил]ксантин (реакцию проводят с использованием карбоната калия, продукт содержит около 20% Z-изомера): значение Rf: 0,24 (силикагель, этилацетат/петролейный эфир в соотношении 1:1), массспектр (ESI+): m/z = 560 [M+H]+;(35) 1-[2-(2-гидроксифенил)-2-оксоэтил]-3-метил-7-E)-2-бутен-1-ил)-8-[3-(трет-бутилоксикарбониламино)пиперидин-1-ил]ксантин (продукт содержит некоторое количество Z-изомера): значение Rf: 0,30 (силикагель, циклогексан/этилацетат в соотношении 4:6), масс-спектр (ESI+): m/z = 553 [M+H]+;(74) 1-[(4-метилхиназолин-2-ил)метил]-3-метил-7-(2-хлорбензил)-8-[(R)-3-(трет-бутилоксикарбониламино)пиперидин-1-ил]ксантин: указанное соединение получают взаимодействием между (4 метилхиназолин-2-ил)метилхлоридом и 3-метил-7-(2-хлорбензил)-8-бромксантином и последующим взаимодействием с (R)-3-(трет-бутилоксикарбониламино)пиперидином, масс-спектр (ESI+): m/z = 645,647 [M+H]+;(75) 1-[(4-фенилхиназолин-2-ил)метил]-3-метил-7-(2-хлорбензил)-8-[(R)-3-(трет-бутилоксикарбониламино)пиперидин-1-ил]ксантин: указанное соединение получают взаимодействием между (4 фенилхиназолин-2-ил)метилхлоридом и 3-метил-7-(2-хлорбензил)-8-бромксантином и последующим взаимодействием с (R)-3-(трет-бутилоксикарбониламино)пиперидином, масс-спектр (ESI+): m/z = 707,709 [M+H]+. Пример IV. 1-[2-(2-Гидроксифенил)-2-оксоэтил]-3-метил-7-(3-метил-2-бутен-1-ил)-8-хлорксантин. Указанное соединение получают обработкой 1-[2-(2-метоксифенил)-2-оксоэтил]-3-метил-7-(3- 19024251 метил-2-бутен-1-ил)-8-хлорксантина трибромидом бора в метиленхлориде. Целевой продукт содержит в качестве примеси 1-[2-(2-гидроксифенил)-2-оксоэтил]-3-метил-7-(3-бром-3-метилбутил)-8-хлорксантин в количестве около 20%. Масс-спектр (ESI+): m/z = 403, 405 [M+H]+. Аналогично примеру IV получают следующие соединения:(3) 1-[2-(2-гидроксифенил)-2-оксоэтил]-3-метил-7-E)-2-бутен-1-ил)-8-бромксантин (продукт содержит некоторое количество Z-изомера): значение Rf: 0,60 (силикагель, циклогексан/этилацетат в соотношении 4:6), масс-спектр (ESI+): m/z = 433, 435 [M+H]+;(4) 1-[2-(2-гидроксифенил)-2-оксоэтил]-3-метил-7-(3-метил-2-бутен-1-ил)-8-бромксантин: массспектр (ESI+): m/z = 447, 449 [M+H]+. Пример V. 1-[2-(2-метоксифенил)-2-оксоэтил]-3-метил-7-(3-метил-2-бутен-1-ил)-8-хлорксантин. К смеси из 2,00 г 3-метил-7-(3-метил-2-бутен-1-ил)-8-хлорксантина и 1,38 мг карбоната калия в 15 мл N,N-диметилформамида добавляют 1,71 г 2-бром-1-(2-метоксифенил)этанона. Реакционную смесь перемешивают в течение восьми часов при комнатной температуре. После водной переработки полученный сырой продукт очищают хроматографией на силикагелевой колонке с использованием в качестве элюента смеси циклогексан/этилацетат (в соотношении, изменяющемся от 8:1 до 1:8). Выход: 2,61 г (84% от теории). Масс-спектр (ESI+): m/z = 417, 419 [M+H]+. Аналогично примеру V получают следующие соединения:(65) 1-[2-(2-метоксифенил)-2-оксоэтил]-3-метил-7-E)-2-бутен-1-ил)-8-бромксантин (продукт содержит некоторое количество Z-изомера): значение Rf: 0,30 (силикагель, циклогексан/этилацетат в соотношении 1:1), масс-спектр (ESI+): m/z = 447, 449 [M+H]+;(118) 1-[(3-дифторметилизохинолин-1-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-[3-(трет-бутилоксикарбониламино)пиперидин-1-ил]ксантин (побочный продукт, образующийся при взаимодействии 3 метил-7-(2-бутин-1-ил)-8-[3-(трет-бутилоксикарбониламино)пиперидин-1-ил]ксантина с 1 -хлорметил-3 трифторметил-3,4-дигидроизохинолином): значение Rf: 0,75 (оксид алюминия, петролейный эфир/этилацетат в соотношении 1:2), масс-спектр (ESI+): m/z = 608 [M+H]+;(129) 1-[(3-дифторметилизохинолин-1-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-[3-(трет-бутилоксикарбониламино)пиперидин-1-ил]ксантин (побочный продукт, образующийся при взаимодействии 3-метил 7-(2-бутин-1-ил)-8-[3-(трет-бутилоксикарбониламино)пиперидин-1-ил]ксантина с 1-хлорметил-3-трифторметил-3,4-дигидроизохинолином): значение Rf: 0,75 (оксид алюминия, петролейный эфир/этилацетат в соотношении 1:2), масс-спектр (ESI+): m/z = 608 [M+H]+;(197) 1-[(1,2,3,4-тетрагидрофенантридин-6-ил)метил]-3-метил-7-(2-бутин-1-ил)-8-[3-(трет-бутилоксикарбониламино)пиперидин-1-ил]ксантин: значение Rf: 0,55 (силикагель, этилацетат/ петролейный эфир в соотношении 2:1), масс-спектр (ESI+): m/z = 612 [M+H]+. Пример VI. 1-(2-(3-[(Метансульфинил)метокси]фенил-2-оксоэтил)-3-метил-7-(3-метил-2-бутен-1 ил)-8-[3-(трет-бутилоксикарбониламино)пиперидин-1-ил]ксантин. К раствору 402 мг 1-(2-3-[(метилсульфанил)метокси]фенил-2-оксоэтил)-3-метил-7-(3-метил-2 бутен-1-ил)-8-[3-(трет-бутилоксикарбонил-амино)пиперидин-1-ил]ксантина в 10 мл гексафторизопропанола добавляют 0,15 мл 35%-ного раствора пероксида водорода. Реакционную смесь перемешивают в течение получаса при комнатной температуре. Затем добавляют 5 мл 10%-ного раствора тиосульфата натрия. Водную фазу дважды экстрагируют метиленхлоридом порциями по 5 мл. Объединенные экстракты сушат над сульфатом натрия и концентрируют. Желтый остаток очищают хроматографией на силикагелевой колонке с использованием в качестве элюента смеси циклогексан/этилацетат/метанол (в соотношении 5:4:1). Выход: 299 мг (73% от теории). Значение Rf: 0,28 (силикагель, циклогексан/этилацетат/метанол в соотношении 5:4:1). Масс-спектр (ESI+): m/z = 643 [M+H]+. Аналогично примеру VI получают следующие соединения:(2) 1-(2-2-[(метансульфинил)метокси]фенил-2-оксоэтил)-3-метил-7-(2-бутин-1-ил)-8-[3-(третбутилоксикарбониламино)пиперидин-1-ил]ксантин: масс-спектр (ESI+): m/z = 627 [M+H]+. Пример VII. 3-[(2-Триметилсиланилэтокси)метил]-7-(3-метил-2-бутен-1-ил)-8-[3-(трет-бутилоксикарбониламино)пиперидин-1-ил]ксантин. К 630 мг 7-(3-метил-2-бутен-1-ил)-8-[3-(трет-бутилоксикарбониламино)пиперидин-1-ил]ксантина в 11 мл ацетонитрила по каплям добавляют 236 мкл 1,8-диазабицикло[5.4.0]ундец-7-ена. Раствор перемешивают в течение двух часов при комнатной температуре, после чего ацетонитрил отгоняют в вакууме. Остаток в колбе растворяют в 11 мл N,N-димегилформамида и смешивают с 258 мг (2-триметилсиланилэтокси)метилхлорида. Реакционную смесь перемешивают в течение трех часов при 120C. Для переработки добавляют воду, выпавший осадок отфильтровывают и растворяют в этилацетате. Раствор сушат над сульфатом магния, концентрируют и хроматографируют на силикагелевой колонке с использованием в качестве элюента смеси циклогексан/этилацетат/метанол (в соотношении, изменяющемся от 6:1:0 до 0:5:1). Выход: 435 мг (53% от теории). Масс-спектр (ESI+): m/z = 549 [M+H]+. Аналогично примеру VII получают следующие соединения:(2) 3-[(метоксикарбонил)метил]-7-(3-метил-2-бутен-1-ил)-8-[3-(трет-бутилоксикарбониламино)пиперидин-1-ил]ксантин: значение Rf: 0,31 (силикагель, метиленхлорид/метанол/конц. водный аммиак в соотношении 90:10:1), масс-спектр (ESI+): m/z = 491 [M+H]+. Пример VIII. 7-(3-Метил-2-бутен-1-ил)-8-[3-(трет-бутилоксикарбониламино)пиперидин-1-ил]ксантин. К 2,32 г 2-[3-(трет-бутилоксикарбониламино)пиперидин-1-ил]-3-(3-метил-2-бутен-1-ил)-4-этоксикарбонил-5-[(этоксикарбониламино)карбонил]амино-3H-имидазола в 35 мл этанола добавляют 510 мг трет-бутилата калия. Желтый раствор в течение пяти часов кипятят с обратным холодильником. После охлаждения до комнатной температуры разбавляют метиленхлоридом. Органическую фазу промывают насыщенным раствором хлорида аммония и насыщенным раствором хлорида натрия, сушат над сульфатом магния и концентрируют. Сырой продукт очищают хроматографией на силикагелевой колонке с использованием в качестве элюента смеси метиленхлорид/метанол/конц. метанольный аммиак (в соотношении, изменяющемся от 95:5:1 до 90:10:1). Выход: 630 мг (35% от теории). Значение Rf: 0,24 (силикагель, метиленхлорид/метанол/конц. водный аммиак в соотношении 90:10:1). Масс-спектр (ESI+): m/z = 419 [M+H]+. Пример
МПК / Метки
МПК: C07D 473/04, A61P 3/06, A61P 37/06, A61P 3/10, A61K 31/522, A61P 31/10
Метки: качестве, применение, лекарственных, средств, способ, 8-[3-аминопиперидин-1-ил]ксантины, получения
Код ссылки
<a href="https://eas.patents.su/30-24251-8-3-aminopiperidin-1-ilksantiny-sposob-ih-polucheniya-i-ih-primenenie-v-kachestve-lekarstvennyh-sredstv.html" rel="bookmark" title="База патентов Евразийского Союза">8-[-3-аминопиперидин-1-ил]ксантины, способ их получения и их применение в качестве лекарственных средств</a>
Следующий патент: Ингибиторы фосфоинозитид-3-киназ с цинксвязывающей группой












