Карбоксамиды, модулирующие андрогенные рецепторы
Номер патента: 24245
Опубликовано: 31.08.2016
Авторы: Рамасубраманиан Ратха Дурга, Термякангас Олли, Хейккинен Тери, Мойланен Ану, Карьялайнен Арья, Мартин Арпутхарай Эбенезер, Вольфарт Герд, Сало Харри, Весалайнен Анниина, Патра Пранаб Кумар
Формула / Реферат
1. Соединение формулы (I)
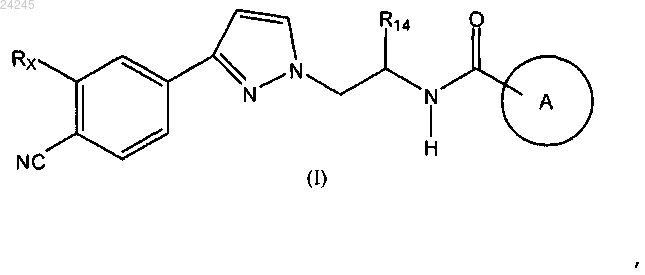
где кольцо А является любой одной из следующих групп или их таутомеров:
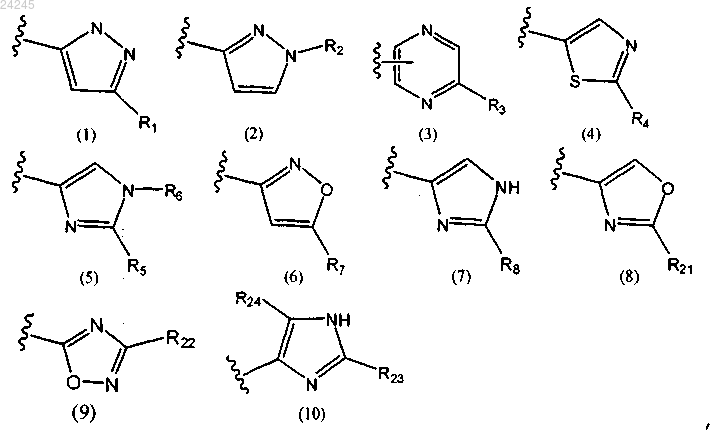
где Rx означает галоген или CF3;
R1 означает гидрокси-C3-7алкил, имидазолил или -RA-OC(O)-RB;
RA означает C1-7алкил;
RB означает C1-7алкил, гидрокси-C1-7алкил или карбокси-C1-7алкил;
R2 означает C1-7алкил, C2-7алкенил, C3-7циклоалкил, C3-7циклоалкил-C1-7алкил, метилпиразолил или пиримидинил;
R3 означает галоген или пиридинил;
R4 означает пиридинил;
R5 означает C1-7алкил, C2-7алкенил, C3-7циклоалкил, C3-7циклоалкил-C1-7алкил, циано, гидрокси-C1-7алкил, оксо-C1-7алкил, галоген или метилпиразолил;
R6 означает C1-7алкил, C2-7алкенил, C3-7циклоалкил, С3-7циклоалкил-C1-7алкил, гидрокси, гидрокси-C1-7алкил, циано-C1-7алкил или C1-7алкоксикарбомоил-C1-7алкил;
R7 означает гидрокси-С4алкил;
R8 означает галоген, C2-7алкил, C2-7алкенил, C3-7циклоалкил, C3-7циклоалкил-C1-7алкил, циано, карбокси, оксо-C1-7алкил, галоген-C1-7алкил, гидрокси-C1-7алкил, тетрагидро-2Н-тиопиран или -C(O)-NHR20;
R14 означает водород или C1-7алкил;
R20 означает водород, C1-7алкил, C2-7алкенил, C3-7циклоалкил или C3-7циклоалкил-C1-7алкил или C1-7алкокси;
R21 означает циано-C1-7алкил или, в случае если Rx означает CF3, R21 может означать гидрокси-C1-7алкил;
R22 означает гидрокси-C1-7алкил;
R23 означает C1-7алкил или гидрокси-C1-7алкил;
R24 означает гидрокси, галоген или C1-7алкокси;
и его фармацевтически приемлемые соли.
2. Соединение по п.1, где Rx является галогеном, R14 означает C1-7алкил и кольцо А является любой из групп (1), (2), (3), (5), (6), (7) или (8).
3. Соединение по п.2, где Rx означает хлор, R14 является метилом и кольцо А является любой из групп (1), (2), (5), (6) или (7), Rx означает гидрокси-C3-7алкил, имидазолил или карбокси-C1-7алкил, карбонилокси-C1-7алкил, R2 означает C1-7алкил, C2-7алкенил или метилпиразолил, R5 означает С1-7алкил, C3-7циклоалкил, гидрокси-C1-7алкил или метилпиразолил, R6 является C1-7алкилом, циано-C1-7алкилом или гидрокси-C1-7алкилом и R8 означает C1-7алкил, галоген, оксо-C1-7алкил или гидрокси-C1-7алкил.
4. Соединение по п.1, представляющее собой
4-(1-(3-((S)-1-(3-(3-хлор-4-цианофенил)-1Н-пиразол-1-ил)пропан-2-илкарбамоил)-1Н-пиразол-5-ил)этокси-4-оксобутановую кислоту;
(S)-5-хлор-N-(1-(3-(3-хлор-4-цианофенил)-1Н-пиразол-1-ил)пропан-2-ил)пиразин-2-карбоксамид;
N-((S)-1-(3-(3-хлор-4-цианофенил)-1Н-пиразол-1-ил)пропан-2-ил)-1-((S)-2-гидроксипропил)-2-метил-1Н-имидазол-4-карбоксамид;
(S)-1-бутил-N-(1-(3-(3-хлор-4-цианофенил)-1Н-пиразол-1-ил)пропан-2-ил)-2-метил-1Н-имидазол-4-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-цианофенил)-1Н-пиразол-1-ил)пропан-2-ил)-5-(2-гидроксипропан-2-ил)-1Н-пиразол-3-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-цианофенил)-1Н-пиразол-1-ил)пропан-2-ил)-1-метил-1'Н-1,4'-бипиразол-3-карбоксамид;
N-((S)-1-(3-(3-хлор-4-цианофенил)-1Н-пиразол-1-ил)пропан-2-ил)-1-((R)-2-гидроксипропил)-2-метил-1Н-имидазол-4-карбоксамид;
(S)-2-бром-N-(1-(3-(3-хлор-4-цианофенил)-1Н-пиразол-1-ил)пропан-2-ил)-1Н-имидазол-4-карбоксамид;
N-((S)-1-(3-(3-хлор-4-цианофенил)-1Н-пиразол-1-ил)пропан-2-ил)-5-(1-гидрокси-2-метилпропил)изоксазол-3-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-цианофенил)-1Н-пиразол-1-ил)пропан-2-ил)-1-(2-цианоэтил)-2-метил-1Н-имидазол-4-карбоксамид;
N-((S)-1-(3-(3-хлор-4-цианофенил)-1Н-пиразол-1-ил)пропан-2-ил)-1-(1-цианоэтил)-2-метил-1Н-имидазол-4-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-цианофенил)-1Н-пиразол-1-ил)пропан-2-ил)-1-(2-метилпроп-1-енил)-1Н-пиразол-3-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-цианофенил)-1Н-пиразол-1-ил)пропан-2-ил)-3-(1Н-имидазол-4-ил)-1Н-пиразол-5-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-цианофенил)-1Н-пиразол-1-ил)пропан-2-ил)-1-циклопропил-1Н-пиразол-3-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-цианофенил)-1Н-пиразол-1-ил)пропан-2-ил)-1-(6-(диметиламино)пиридин-3-ил)-1Н-пиразол-3-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-цианофенил)-1Н-пиразол-1-ил)пропан-2-ил)-4,5,6,7-тетрагидропиразоло[1,5-а]пиридин-2-карбоксамид;
N-((S)-1-(3-(3-хлор-4-цианофенил)-1Н-пиразол-1-ил)пропан-2-ил)-2-(1-гидроксиэтил)-1Н-имидазол-4-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-цианофенил)-1Н-пиразол-1-ил)пропан-2-ил)-2-изопропил-1Н-имидазол-4-карбоксамид;
(S)-2-бутил-N-(1-(3-(3-хлор-4-цианофенил)-1Н-пиразол-1-ил)пропан-2-ил)-1-метил-1Н-имидазол-4-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-цианофенил)-1Н-пиразол-1-ил)пропан-2-ил)-2-(2-гидроксипропан-2-ил)-1-метил-1Н-имидазол-4-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-цианофенил)-1Н-пиразол-1-ил)пропан-2-ил)-1-метил-2-(1-метил-1Н-пиразол-4-ил)-1Н-имидазол-4-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-цианофенил)-1Н-пиразол-1-ил)пропан-2-ил)-2-циклопропил-1-метил-1Н-имидазол-4-карбоксамид;
(S)-N4-(1-(3-(3-хлор-4-цианофенил)-1Н-пиразол-1-ил)пропан-2-ил)-1Н-имидазол-2,4-дикарбоксамид;
(S)-N-(1-(3-(4-циано-3-(трифторметил)фенил)-1Н-пиразол-1-ил)пропан-2-ил)-2-(2-гидроксипропан-2-ил)оксазол-4-карбоксамид,
или его фармацевтически приемлемая соль.
5. Соединение формулы (II)
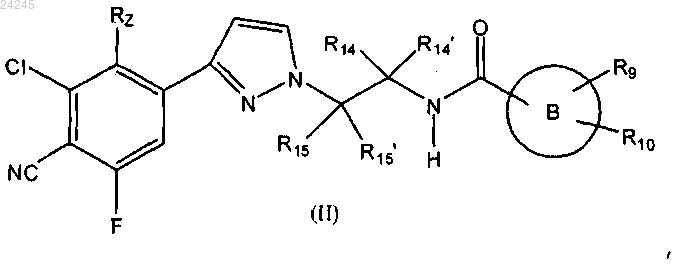
где Rz означает водород или галоген;
R9 означает водород, гидрокси, галоген, нитро, амино, циано, оксо, C1-7алкил, C2-7алкенил, C3-7циклоалкил, C1-7алкокси, галоген-C1-7алкил, гидрокси-C1-7алкил, циано-C1-7алкил, амино-C1-7алкил, оксо-C1-7алкил, C1-7алкокси-C1-7алкил, C1-7алкиламино, гидрокси-C1-7алкиламино, C1-7алкокси-C1-7алкиламино, C1-7алкиламино-C1-7алкил, гидрокси-C1-7алкиламино-C1-7алкил, гидроксиимино-C1-7алкил, C1-7алкоксикарбомоил-C1-7алкил, -C(O)R11, -OC(O)R17, -NH-C(O)R18, -NH-SO2-R19 или 5-12-членное карбоциклическое кольцо или 5-12-членное гетероциклическое кольцо, содержащее от 1 до 4 гетероатомов, выбранных из группы, состоящей из N, O и S, кольца необязательно замещены 1-3 атомами галогена, C1-7алкилом, C2-7алкенилом, С3-7циклоалкилом, гидрокси, амино, гало-C1-7алкилом, гидрокси-C1-7алкилом, C1-7алкокси, оксо-C1-7алкилом, C1-7алкиламино, амино-C1-7алкилом, метилсульфонилом, нитро, циано или тиолом, каждая группа связана с В-кольцом посредством связи или C1-7алкиленового линкера;
R10 означает водород, галоген, C1-7алкил, C2-7алкенил, C3-7циклоалкил, C3-7циклоалкил-C1-7алкил, оксо, гидрокси-C1-7алкил, оксо-C1-7алкил или необязательно замещенное 5- или 6-членное карбоциклическое кольцо или 5- или 6-членное гетероциклическое кольцо, содержащее от 1 до 3 гетероатомов, выбранных из группы, состоящей из N, O и S, кольца необязательно замещены 1-3 атомами галогена, C1-7алкилом, C2-7алкенилом, С3-7циклоалкилом, гидрокси, амино, гало-C1-7алкилом, гидрокси-C1-7алкилом, C1-7алкокси, оксо-C1-7алкилом, C1-7алкиламино, амино-C1-7алкилом, метилсульфонилом, нитро, циано или тиолом;
R11 означает водород, гидрокси, C1-7алкил, гидрокси-C1-7алкил, C2-7алкенил, С2-7циклоалкил, галоген-C1-7алкил, C1-7алкокси, NR12R13 или 5-12-членное карбоциклическое кольцо или 5-12-членное гетероциклическое кольцо, содержащее от 1 до 4 гетероатомов, выбранных из группы, состоящей из N, O и S, кольца необязательно замещены 1-3 атомами галогена, C1-7алкилом, C2-7алкенилом, С3-7циклоалкилом, гидрокси, амино, гало-C1-7алкилом, гидрокси-C1-7алкилом, C1-7алкокси, оксо-C1-7алкилом, C1-7алкиламино, амино-C1-7алкилом, метилсульфонилом, нитро, циано или тиолом;
R12 означает водород, C1-7алкил, C2-7алкенил, C3-7циклоалкил, C3-7циклоалкил-C1-7алкил, C1-7алкокси, гидрокси-C1-7алкил, амино-C1-7алкил или C1-7алкиламино-C1-7алкил;
R13 означает водород или C1-7алкил;
R14 и R15 означают, независимо, водород или C1-7алкил;
R14' и R15' означают, независимо, водород или C1-7алкил или R14' и R15' вместе образуют связь;
R17 означает C1-7алкил, C2-7алкенил, C3-7циклоалкил, C3-7циклоалкил-C1-7алкил, C1-7алкокси, амино-C1-7алкил, C1-7алкиламино или C1-7алкиламино-C1-7алкил;
R18 означает C1-7алкил, C2-7алкенил, C3-7циклоалкил, C3-7циклоалкил-C1-7алкил, амино-C1-7алкил, C1-7алкиламино или C1-7алкиламино-C1-7алкил;
R19 означает C1-7алкил, C2-7алкенил, C3-7циклоалкил или С3-7циклоалкил-C1-7алкил;
кольцо В означает любую одну из следующих групп или их таутомеры:
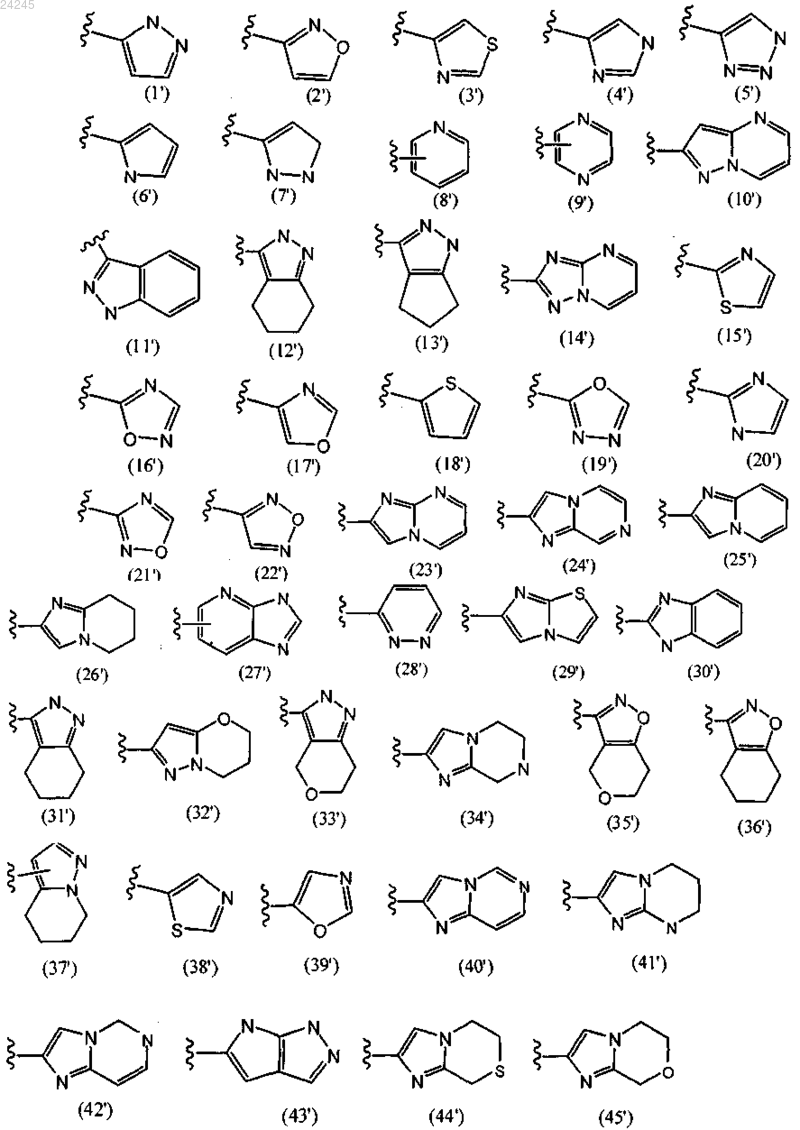
и его фармацевтически приемлемые соли,
при условии, что соединение формулы (II) не является любым из следующих соединений:
(S)-3-ацетил-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-1Н-пиразол-5-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-1-(пиридин-4-ил)-1Н-пиразол-3-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-1-(2-фторэтил)-2-метил-1Н-имидазол-4-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-3-(1Н-имидазол-4-ил)-1,2,4-оксадиазол-5-карбоксамид;
(S)-5-ацетил-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)изоксазол-3-карбоксамид;
N-((S)-1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-5-(1-гидроксиэтил)изоксазол-3-карбоксамид;
(S)-5-ацетил-N-(2-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропил)изоксазол-3-карбоксамид;
(S)-N-(2-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропил)-2-метил-1Н-имидазол-4-карбоксамид;
N-((S)-1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-3-(1-гидроксиэтил)-1Н-пиразол-5-карбоксамид;
(R)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-2-метил-1Н-имидазол-4-карбоксамид;
(S)-N-{1-[3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил]пропан-2-ил}-2-метил-1Н-имидазол-4-карбоксамид;
(S)-N-{1-[3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил]пропан-2-ил}-1-метил-1Н-имидазол-4-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-3Н-имидазо[4,5-b]пиридин-5-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-2-(пиридин-3-ил)тиазол-4-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-1-(пиридин-3-ил)-1Н-пиразол-3-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-2-метил-1-(3-оксобутил)-1Н-имидазол-4-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-1-(3-гидрокси-3-метилбутил)-2-метил-1Н-имидазол-4-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)имидазо[1,2-а]пиридин-2-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-1-(пиридин-3-ил)-1Н-имидазол-4-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-2-(2-гидроксипропан-2-ил)оксазол-4-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)имидазо[1,2-а]пиримидин-2-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-3-фторимидазо[1,2-а]пиридин-2-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-4,5,6,7-тетрагидро-2Н-индазол-3-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-6,7-дигидро-5Н-пиразоло[5,1-b][1,3]оксазин-2-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-2,4,6,7-тетрагидропирано[4,3-е]пиразол-3-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-1-(6-метилпиридин-2-ил)-1Н-имидазол-4-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-6,7-дигидро-4Н-пирано[3,4-d]изоксазол-3-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-5-(2-гидроксипропан-2-ил)изоксазол-3-карбоксамид.
6. Соединение по п.5, где
R14 означает C1-7алкил;
R14', R15 и R15' означают водород,
кольцо В является любой из групп (1'), (2'), (3'), (4'), (8'), (16'), (17'), (21'), (23'), (24'), (25'), (26'), (29'), (39'), (40'), (42') или (43');
R9 означает водород, галоген, циано, оксо, C1-7алкил, C2-7алкенил, C3-7циклоалкил, галоген-C1-7алкил, циано-C1-7алкил, гидрокси-C1-7алкил, оксо-C1-7алкил, -NH-SO2-R19 или 5-12-членное гетероциклическое кольцо, содержащее от 1 до 4 гетероатомов, выбранных из группы, состоящей из N, O и S, кольца необязательно замещены 1-3 атомами галогена, C1-7алкилом, C2-7алкенилом, С3-7циклоалкилом, гидрокси, амино, гало-C1-7алкилом, гидрокси-C1-7алкилом, C1-7алкокси, оксо-C1-7алкилом, C1-7алкиламино, амино-C1-7алкилом, метилсульфонилом, нитро, циано или тиолом;
каждая R9 группа связана с В-кольцом посредством связи или C1-7алкиленового линкера;
R10 означает водород, C1-7алкил или C3-7циклоалкил;
R19 означает C1-7алкил.
7. Соединение по п.6, где 5-12-членное гетероциклическое кольцо является пиразольным, пиридиновым, изоксазольным или имидазольным кольцом, которое соединено с В-кольцом посредством связи или C1-7алкиленового линкера.
8. Соединение по п.7, где 5-12-членное гетероциклическое кольцо замещено 1-3 заместителями, выбранными из C1-7алкила, C3-7циклоалкила, галогена или гидрокси-C1-7алкила.
9. Соединение по п.6, где
Rz означает водород или фтор;
R14 является метилом;
R14', R15 и R15' означают водород;
кольцо В является любой из групп (1'), (2'), (4'), (17'), (21') или (25');
R9 означает водород, галоген, циано, оксо, C1-7алкил, C2-7алкенил, C3-7циклоалкил, галоген-C1-7алкил, гидрокси-C1-3алкил, циано-C1-7алкил, пиразолил, N-метилпиразолил, пиридинил, изоксазолил, имидазолил или имидазолилметил;
R10 означает водород, C1-7алкил или C3-7циклоалкил.
10. Соединение по п.5, представляющее собой
(S)-N-(1-(3-(3-хлор-4-циано-2,5-дифторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-2-метил-1Н-имидазол-5-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-2,5-дифторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-2-(2-гидроксипропан-2-ил)оксазол-5-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-6-цианоимидазо[1,2-а]пиридин-2-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-7-оксо-5,6,7,8-тетрагидроимидазо[1,2-а]пиримидин-2-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-3-изопропил-1,2,4-оксадиазол-5-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-5,7-диметилимидазо[1,2-c]пиримидин-2-карбоксамид;
(S)-5-((1Н-имидазол-1-ил)метил)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)изоксазол-3-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-5-оксо-5,6-дигидроимидазо[1,2-c]пиримидин-2-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-1,6-дигидропирроло[2,3-с]пиразол-5-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)имидазо[2,1-b]тиазол-6-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-6-нитроимидазо[1,2-а]пиридин-2-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-5,6,7,8-тетрагидроимидазо[1,2-а]пиридин-2-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-1-изопропил-2-метил-1Н-имидазол-4-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-5-(2-гидроксипропан-2-ил)-1Н-пиразол-3-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-1-(2,2-дифторэтил)-2-метил-1Н-имидазол-4-карбоксамид;
N-((S)-1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-1-((R)-2-гидроксипропил)-2-метил-1Н-имидазол-4-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-1'-метил-1'Н-1,4'-бипиразол-3-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-1Н,2'Н-3,3'-бипиразол-5-карбоксамид;
N-((S)-1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-1-((S)-2-гидроксипропил)-2-метил-1Н-имидазол-4-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-3,3'-бипиридин-6-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-6-(3,3-диметилуреидо)имидазо[1,2-а]пиридин-2-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-6-(метилсульфонамидо)имидазо[1,2-а]пиридин-2-карбоксамид;
N-((S)-1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-5-(1-гидрокси-2-метилпропил)изоксазол-3-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-5-(1,5-диметил-1Н-пиразол-3-ил)-1,2,4-оксадиазол-3-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-5-(изоксазол-3-ил)-1,2,4-оксадиазол-3-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-3-(1Н-имидазол-4-ил)-1Н-пиразол-5-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-2-(хлорпропан-2-ил)оксазол-4-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-2-(2-пропен-2-ил)оксазол-4-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-N5-циклопропилизоксазол-3,5-дикарбоксамид;
(S)-2-бром-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-1Н-имидазол-4-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-1-(2-метилпроп-1-енил)-1Н-пиразол-3-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-1-циклопропил-1Н-пиразол-3-карбоксамид;
N-((S)-1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-2-(1-гидроксиэтил)-1Н-имидазол-4-карбоксамид;
(S)-2-ацетил-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-1Н-имидазол-4-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-2-(2-гидроксипропан-2-ил)-1Н-имидазол-4-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-2-циклопропил-1-метил-1Н-имидазол-4-карбоксамид;
(S)-N4-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-1Н-имидазол-2,4-дикарбоксамид,
или его фармацевтически приемлемая соль.
11. Соединение по п.5, представляющее собой
(S)-N-(2-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропил)-2-(2-гидроксипропан-2-ил)оксазол-4-карбоксамид;
(R)-N-(2-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропил)-2-(2-гидроксипропан-2-ил)оксазол-4-карбоксамид;
(R)-N-(2-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропил)-2-(2-гидроксипропан-2-ил)-1Н-имидазол-4-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-2-(2,2,2-трифторэтил)-1Н-имидазол-4-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-2-(трифторметил)-1Н-имидазол-4-карбоксамид;
N-((S)-1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-3-((S)-1-гидроксиэтил)-1,2,4-оксадиазол-5-карбоксамид;
N-((S)-1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-3-((R)-1-гидроксиэтил)-1,2,4-оксадиазол-5-карбоксамид;
(S)-N-(2-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропил)-3-(2-гидроксипропан-2-ил)-1,2,4-оксадиазол-5-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-3-(2-гидроксипропан-2-ил)-1,2,4-оксадиазол-5-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-2-циклопропил-1Н-имидазол-4-карбоксамид;
(S)-N4-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-N2,N2-диметил-1Н-имидазол-2,4-дикарбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-2-(2-этоксипропан-2-ил)-1Н-имидазол-4-карбоксамид;
N-((S)-1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-2-(1-этоксиэтил)-1Н-имидазол-4-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-2-(2-этоксипропан-2-ил)оксазол-4-карбоксамид;
(S)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1Н-пиразол-1-ил)пропан-2-ил)-5-(2-гидрокси-2-метилпропил)-1Н-пиразол-3-карбоксамид
или его фармацевтически приемлемая соль.
12. Фармацевтическая композиция для лечения или предотвращения состояний, зависимых от андрогенных рецепторов, содержащая соединение по любому из пп.1 или 5 вместе с фармацевтически приемлемым носителем.
13. Способ лечения или предотвращения состояний, зависимых от андрогенных рецепторов, включающий введение субъекту, по необходимости, терапевтически эффективного количества соединения по любому из пп.1 или 5.
14. Способ по п.13, где состоянием, зависимым от андрогенных рецепторов, является рак простаты.
Текст
Раскрыты соединения формулы (I) или (II): Термякангас Олли, Вольфарт Герд,Сало Харри, Рамасубраманиан Ратха Дурга (FI), Патра Пранаб Кумар, Мартин Арпутхарай Эбенезер (IN), Хейккинен Тери,Весалайнен Анниина, Мойланен Ану,Карьялайнен Арья (FI) и их фармацевтически приемлемые соли, где Rx, Rz, R9, R10, R14, R14', R15, R15', А и В являются такими,как определено в формуле изобретения. Соединения имеют практическую ценность в качестве тканеселективных модуляторов андрогенных рецепторов и являются особенно пригодными как лекарственные препараты в лечении рака простаты и других АР-зависимых состояний и заболеваний, где антагонизм по отношению к АР является желательным. Область техники Настоящее изобретение относится к терапевтически активным соединениям и к их фармацевтически приемлемым солям и сложным эфирам, пригодным в лечении зависимых от ядерных рецепторов,особенно стероидных рецепторов, в частности андрогенных рецепторов (АР), состояний и заболеваний, и к фармацевтическим композициям, содержащим такие соединения. В частности, изобретение раскрывает нестероидные карбоксамидные и родственные по структуре соединения, имеющие применение в качестве тканеселективных модуляторов андрогенных рецепторов (SARM). Соединения согласно изобретению,которые обладают активностью антагонистов АР, являются пригодными для лечения больных, нуждающихся в терапии антагонистами рецепторов андрогена. В частности, антагонисты АР согласно изобретению являются пригодными в лечении или предотвращении рака, конкретнее АР-зависимого рака, такого как рак простатической железы, и других заболеваний, где антагонизм АР является желательным. Предшествующий уровень техники в данной области В последнее время растет интерес исследователей к созданию нестероидных модуляторов стероидных рецепторов с целью терапевтического использования. Было показано, что нестероидные лиганды могут достичь лучшей селективности по отношению к рецепторам и иметь лучшие физико-химические,фармакокинетические и фармакологические характеристики. Для андрогенных рецепторов (АР) нестероидные антагонисты (антиандрогены) теперь используют клинически, чтобы нейтрализовать нежелательные действия избыточных андрогенов. Андрогены, функционирующие через АР, играют существенную роль в возникновении и развитии рака простаты. Таким образом, лечение распространенного рака простаты включает подавляющие андрогены терапии, такие как хирургическая кастрация или воздействие гормонов, используя агонисты гонадотропинрилизинг гормона (GnRH), антиандрогены или и те и другие. Хотя вначале такие терапии приводят к регрессии заболевания, в конечном счете, у всех больных развивается устойчивая к кастрации поздняя стадия заболевания, которая не поддается лечению современными терапиями. Устойчивый к кастрации рак предстательной железы (CRPC) ассоциирован с повышенными уровнями АР. Первое поколение антиандрогенов, таких как бикалутамид, проявляет агонистические свойства в клетках, созданных с целью экспрессии повышенных уровней АР. Было показано, что in vitro и in vivo повышенная экспрессия придает устойчивость линиям клеток рака простаты к антиандрогенной терапии. Для преодоления проблем с устойчивостью клеток второе поколение антиандрогенов, сохраняющих антагонизм в клетках, экспрессирующих избыток АР, может найти применение в лечении CRPC. Нестероидные антагонисты андрогенных рецепторов были описаны ранее, например, в патентных публикациях ЕР 100172, ЕР 1790640, США 6087509, США 6673799, США 7271188, международных публикациях WO 03/057669, WO 2004/099188, WO 2006/133567, WO 2008/124000, WO 2009/028543 иWO 2009/055053. Родственные по структуре карбоксамиду соединения были описаны в международной публикацииWO 2008/0 62 878. Сущность изобретения Было обнаружено, что соединения формулы (I) или (II) являются сильными модуляторами андрогенных рецепторов (АР), в частности, антагонистами АР. Соединения формулы (I) или (II) проявляют поразительно высокое сродство и значительную антагонистическую активность по отношению к андрогенным рецепторам. Кроме того, в клетках, которые отличаются повышенной экспрессией АР ("сверхэкспрессирующие АР клетки"), соединения согласно изобретению обладают антагонизмом по отношению к АР с активностью от высокого до полного антагонизма, в то же время проявляют только незначительный агонизм. Соединения согласно изобретению также эффективно ингибируют пролиферацию линии клеток рака простатической железы. Кроме того, соединения согласно изобретению имеют низкий потенциал для межлекарственных взаимодействий, высокое сродство к андрогенным рецепторам, подходящий профиль безопасности и достаточную растворимость в воде. Поэтому соединения согласно изобретению являются особенно пригодными в качестве лекарственных препаратов в лечении рака предстательной железы и других, зависимых от АР состояний и заболеваний, где антагонизм АР является желательным.-1 024245 Настоящее изобретение предоставляет новые родственные по структуре карбоксамиду соединения формулы (I) или (II): где кольцо А является любой одной из следующих групп или их таутомеров: где Rx означает галоген или CF3;Rz означает водород или галоген;R3 означает галоген или пиридинилR9 означает водород, гидрокси, галоген, нитро, амино, циано, оксо, C1-7 алкил, C2-7 алкенил,C3-7 циклоалкил, C1-7 алкокси, галоген-C1-7 алкил, гидрокси-C1-7 алкил, циано-C1-7 алкил, амино-C1-7 алкил,оксо-C1-7 алкил,C1-7 алкокси-C1-7 алкил,C1-7 алкиламино,гидрокси-C1-7 алкиламино,C1-7 алкокси-C1-7 алкиламино, C1-7 алкиламино-C1-7 алкил, гидрокси-C1-7 алкиламино-C1-7 алкил, гидроксиимино-C1-7 алкил, C1-7 алкоксикарбомоил-C1-7 алкил, -C(O)R11, -OC(O)R17, -NH-C(O)R18, -NH-SO2-R19 или необязательно замещенное 5-12-членное карбоциклическое или гетероциклическое кольцо, каждая группа связана с В-кольцом посредством связи или посредством C1-7 алкиленового линкера;R10 означает водород, галоген, C1-7 алкил, C2-7 алкенил, C3-7 циклоалкил, C3-7 циклоалкил-C1-7 алкил,оксо, гидрокси-C1-7 алкил, оксо-C1-7 алкил или необязательно замещенное 5- или 6-членное карбоциклическое или гетероциклическое кольцо;R11 означает водород, гидрокси, C1-7 алкил, гидрокси-C1-7 алкил, C2-7 алкенил, C3-7 циклоалкил, галоген-C1-7 алкил, C1-7 алкокси, NR12R13 или необязательно замещенное 5-12-членное карбоциклическое илиR13 означает водород или C1-7 алкил;R21 означает циано-C1-7 алкил или, в случае если Rx означает CF3, R21 может также означать гидрокси-C1-7 алкил;R24 означает гидрокси, галоген или C1-7 алкокси; кольцо В является любой одной из следующих групп или их таутомеров: и их фармацевтически приемлемые соли,-3 024245 при условии, что соединение формулы (II) не является любым из следующих соединений: Понятно, что каждое B-кольцо от (1') до (45'), представленное выше, замещено R9 и R10, как показано в формуле (II). В подклассе соединений формулы (I) или (II) представлены соединения формулы (I') или (II') и их фармацевтически приемлемые соли, где Rx, Rz, R9, R10, А и В являются такими, как определено выше. В подклассе предпочтительных соединений формулы (I) или (I) представлены соединения и их фармацевтически приемлемые соли, где Rx означает галоген, R14 является C1-7 алкилом и кольцо А означает любую из групп (1), (2), (3), (5), (6), (7) или (8). Другой подкласс предпочтительных соединений формулы (I) или (I') представлен соединениями и их фармацевтически приемлемыми солями, где Rx является хлором, R14 означает метил и кольцо А означает любую из групп (1), (2), (5), (6) или (7), R1 означает гидрокси-C3-7 алкил, имидазолил или карбокси-C1-7 алкил, карбонилокси-C1-7 алкил, R2 означаетC1-7 алкил, галоген, оксо-C1-7 алкил или гидрокси-C1-7 алкил. В подклассе предпочтительных соединений формулы (II) или (II') представлены соединения и их фармацевтически приемлемые соли, где R14 означает C1-7 алкил, R14', R15 и R15' означают водород, кольцо В является любой из групп (1'), (2'), (3'), (4'), (8'), (16'), (17'), (21'), (23'), (24'), (25'), (26'), (29'), (39'), (40'),(42') или (43'), R9 означает водород, галоген, циано, оксо, C1-7 алкил, C2-7 алкенил, C3-7 циклоалкил, галогенC1-7 алкил, циано-C1-7 алкил, гидрокси-C1-7 алкил, оксо-C1-7 алкил, NH-SO2-R19 или необязательно замещенное 5-12-членное гетероциклическое кольцо, каждая R9 группа связана с В-кольцом посредством связи или посредством C1-7 алкиленового линкера, R10 означает водород, C1-7 алкил или C3-7 циклоалкил и R19 означает C1-7 алкил. Особенно предпочтительным 5-12-членным гетероциклическим кольцом в R9 является пиразольное, пиридиновое, изоксазольное или имидазольное кольцо, которое соединено с B-кольцом посредством связи или посредством C1-7 алкиленового линкера. Наиболее предпочтительными заместителями в 5-12-членном гетероциклическом кольце в R9 являются от 1 до 3 заместителей, выбранных изC1-7 алкильных, C3-7 циклоалкильных, галогеновых или гидрокси-C1-7 алкильных групп. Еще другим классом предпочтительных соединений являются соединения формулы (II) или (II') и их фармацевтически приемлемые соли, где Rz означает водород или фтор, R14 является метилом, R14', R15 и R15' означают водород, кольцо В является любой из групп (1'), (2'), (4'), (17'), (21') или (25'), R9 означает-5 024245 водород, галоген, циано, оксо, C1-7 алкил, C2-7 алкенил, C3-7 циклоалкил, галоген-C1-7 алкил,гидрокси-C1-3 алкил, циано-C1-7 алкил, пиразолил, N-метилпиразолил, пиридинил, изоксазолил, имидазолил или имидазолилметил и R10 означает водород, C1-7 алкил или C3-7 циклоалкил. Настоящее изобретение также предоставляет способ лечения или предотвращения зависимых от андрогенных рецепторов (АР) состояний, включающий введение субъекту, при необходимости, терапевтически эффективного количества соединения формулы (I) или (II) или его фармацевтически приемлемых солей. Например, АР-зависимым состоянием, которое подвергается лечению, является рак, конкретнее АР-зависимый рак, такой как рак простаты, доброкачественная гиперплазия простаты, андрогенная алопеция и акне. Согласно одному варианту осуществления изобретения АР-зависимым состоянием, которое подвергается лечению, является устойчивый к кастрации рак простаты (CRPC). Настоящее изобретение также предоставляет фармацевтическую композицию, содержащую соединение формулы (I) или (II) или его фармацевтически приемлемые соли вместе с фармацевтически приемлемым носителем. Подробное описание изобретения Соединения согласно изобретению могут быть получены разнообразными способами, аналогично способам, известным в литературе, при использовании подходящих исходных материалов. Например,соединения формулы (I) или (II) могут быть получены согласно схеме реакции 1, где Rz, R14, R14', R15, R15',В, R9 и R10 являются такими, как определено выше, и X означает галоген. Получение соединений формулы (II) представлено на схемах 1 и 2, но соединения формулы (I) могут быть получены аналогичными способами, представленными на схемах 1 и 2. Оптически активные энантиомеры или диастереомеры соединений формулы (I) или (II) могут быть получены, например, путем использования подходящих оптически активных исходных материалов. Подобным образом, рацемические соединения формулы (I) или(II) могут быть получены при использовании рацемических исходных материалов. Некоторые соединения, включенные в формулу (I) или (II), могут быть получены путем превращения функциональных групп других соединений формулы (I) или (II), полученных в соответствии со схемой 1, посредством хорошо известных стадий реакции, таких как окисление, восстановление, гидролиз, ацилирование, алкилирование, амидирование, аминирование и другие. Схема 1 Альтернативно, соединения формулы (I) или (II) могут быть получены согласно схеме 2, где Rz, R14,R14', R15, R15', В, R9 и R10 являются такими, как определено выше, и X означает галоген. Исходное соединение [11] из схемы 2 может быть подходящим образом получено из 3-хлор-5 фторанилина согласно схеме 3, где X означает галоген. Схема 3 Другие исходные материалы, представленные на схемах выше, являются коммерчески доступными или могут быть получены известными способами. Фармацевтически приемлемые соли, например, соли присоединения кислоты, как с органическими,так и с неорганическими кислотами являются хорошо известными в области приготовления лекарственных препаратов. Неограниченные примеры указанных солей включают хлориды, бромиды, сульфаты,нитраты, фосфаты, сульфонаты, формиаты, тартраты, малеаты, цитраты, бензоаты, салицилаты и аскорбаты. Фармацевтически приемлемые сложные эфиры, когда применимы, могут быть получены известными способами при использовании фармацевтически приемлемых сложных эфиров, которые являются обычными в области лекарственных препаратов, и которые сохраняют фармакологические свойства в свободном виде. Неограниченные примеры указанных сложных эфиров включают сложные эфиры алифатических или ароматических спиртов, например, метиловый, этиловый, пропиловый, изопропиловый,бутиловый, изобутиловый, сек-бутиловый, трет-бутиловый эфиры. Фосфатные эфиры и сложные эфиры угольной кислоты также входят в объем изобретения. Определение формулы (I) или (II) выше охватывает все возможные изотопы и стереоизомеры соединений, включая геометрические изомеры, например Z- и Е-изомеры (цис- и транс-изомеры), и оптические изомеры, например диастереомеры и энантиомеры, и все сложные эфиры пролекарств, например фосфатные эфиры и сложные эфиры угольной кислоты. Кроме того, изобретение включает в свой объем как индивидуальные изомеры, так и любые их смеси, например рацемические смеси. В одном варианте осуществления изобретения термин "изомер" подразумевает охватить оптические изомеры соединений согласно изобретению. Специалистам ясно, что соединения согласно настоящему изобретению содержат по меньшей мере один хиральный центр. Соответственно, соединения согласно изобретению могут существовать в оптически активных или рацемических формах. Понятно, что настоящее изобретение охватывает любую рацемическую или оптически активную форму или их смеси. В одном варианте осуществления изобретения соединения согласно изобретению являются чистыми(R)-изомерами. В другом варианте осуществления изобретения соединения согласно изобретению являются чистыми (S)-изомерами. В другом варианте осуществления изобретения соединения согласно изобретению представляют собой смесь (R)- и (S)-изомеров. В другом варианте осуществления изобретения соединения согласно изобретению представляют собой рацемическую смесь, содержащую равное количество (R)- и (S)-изомеров. Соединения согласно изобретению могут содержать два хиральных центра. В таком случае согласно одному варианту осуществления изобретения соединения согласно изобретению являются чистыми диастереомерами. Согласно другому варианту осуществления изобретения соедине-7 024245 ния согласно изобретению представляют собой смесь нескольких диастереомеров. Индивидуальные изомеры могут быть получены при использовании соответствующих изомерных форм исходного материала,или они могут быть разделены после получения конечного соединения обычными способами разделения. Для разделения оптических изомеров, например энантиомеров или диастереомеров, из их смеси обычные способы разделения, например фракционная кристаллизация, могут быть использованы. Термины, используемые в данном документе, имеют следующие значения. Термин "галоид" или "галоген", употребляемый в данном документе как таковой или как часть другой группы, относится к хлору, брому, фтору или йоду. Термины "C1-7 алкил", "C2-7 алкил" и "С 4 алкил", употребляемые в данном документе как таковые или как часть другой группы, относятся к насыщенной прямой или разветвленной углеродной цепи, содержащей от 1 до 7 атомов углерода, от 2 до 7 атомов углерода и 4 атома углерода соответственно. Типичные примеры C1-7 алкила включают, но не ограничиваются ими, метил, этил, н-пропил, изопропил,н-бутил, изобутил, сек-бутил, трет-бутил, н-пентил, изопентил, неопентил, н-гексил и т.п. Термин "C2-7 алкенил", употребляемый в данном документе как таковой или как часть другой группы, относится к радикалу с прямой или разветвленной цепью, содержащему от 2 до 7 атомы углерода,цепью, которая включает по меньшей мере одну двойную связь. Типичные примеры C2-7 алкенила включают, но не ограничиваются ими, этенил, пропенил, бутенил и т.п. Термин "C1-7 алкиленовый линкер" означает насыщенную прямую или разветвленнуюC1-7 алкильную цепь, которая соединяет две группы вместе. Типичными примерами C1-7 алкиленового линкера являются метиленовые (-СН 2-) и этиленовые (-СН 2-СН 2-) цепи. Термин "C3-7 циклоалкил", употребляемый в данном документе как таковой или как часть другой группы, относится к насыщенной циклической углеводородной группе, содержащей от 3 до 7 углеродов. Типичные примеры C3-7 циклоалкила включают, но не ограничиваются ими, циклопропил, циклобутил,циклопентил, циклогексил и т.п. Термин "C3-7 циклоалкил-C1-7 алкил", употребляемый в данном документе, относится кC3-7 циклоалкильной группе, как определено в описании, присоединенной к фрагменту родительской молекулы через C1-7 алкильную группу, как определено в описании. Термин "гидрокси", употребляемый в данном документе как таковой или как часть другой группы,относится к -ОН-группе. Термин "циано", употребляемый в данном документе как таковой или как часть другой группы, относится к -CN-группе. Термин "гидрокси-C1-7 алкил", употребляемый в данном документе как таковой или как часть другой группы, относится по крайней мере к одной гидроксигруппе, как определено в описании, присоединенной к фрагменту родительской молекулы через C1-7 алкильную группу, как определено в описании. Типичные примеры гидрокси-C1-7 алкила включают, но не ограничиваются ими, гидроксиметил,2,2-дигидроксиэтил, 1-гидроксиэтил, 3-гидроксипропил, 1-гидроксипропил, 1-метил-1-гидроксиэтил,1-метил-1-гидроксипропил и т.п. Термин "галоген-C1-7 алкил", употребляемый в данном документе как таковой или как часть другой группы, относится по меньшей мере к одному галогену, как определено в описании, присоединенному к фрагменту родительской молекулы через C1-7 алкильную группу, как определено в описании. Типичные примеры галоген-C1-7 алкила включают, но не ограничиваются ими, фторметил, дифторметил, трифторметил, 2-хлорэтил, 3-бромпропил и т.п. Термин "циано-C1-7 алкил", употребляемый в данном документе как таковой или как часть другой группы, относится по крайней мере к одной цианогруппе, присоединенной к фрагменту родительской молекулы через C1-7 алкильную группу, как определено в описании. Типичные примеры включают, но не ограничиваются ими, цианометил, 3-цианопропил и т.п. Термин "C1-7 алкокси-C1-7 алкил", относится к C1-7 алкоксигруппе, как определено в описании, присоединенной к фрагменту родительской молекулы через C1-7 алкильную группу, как определено в описании. Термин "оксо", употребляемый в данном документе как таковой или как часть другой группы, относится к группе (=O), присоединенной в качестве заместителя. Термин "карбоксил", употребляемый в данном документе как таковой или как часть другой группы,относится к -СООН-группе. Термин "карбомоил", употребляемый в данном документе как таковой или как часть другой группы, относится к -(С=O)-NH2-группе. Термин "карбомоил-C1-7 алкил", употребляемый в данном документе как таковой или как часть другой группы, относится к карбомоильной группе, присоединенной к фрагменту родительской молекулы через C1-7 алкильную группу. Термин "карбокси-C1-7 алкил", употребляемый в данном документе, относится к -СООН-группе,присоединенной к фрагменту родительской молекулы через C1-7 алкильную группу, как определено в описании. Термин "C1-7 алкоксикарбомоил-C1-7 алкил", употребляемый в данном документе, относится кC1-7 алкил-(С=O)-NH-O-C1-7 алкильной группе, где C1-7 алкил является таким, как определено в описании. Термин "амино", употребляемый в данном документе как таковой или как часть другой группы, относится к -NH2-группе. Термин "оксо-C1-7 алкил", употребляемый в данном документе сам по себе или как часть другой группы, относится к C1-7 алкильной группе, как определено в описании, содержащей карбонильный радикал где-либо в алкильной цепи. Примеры такого соединения включают ацетил, пропаноил, изопропаноил, бутаноил, сек-бутаноил, трет-бутаноил и пентаноил. Термин "амино-C1-7 алкил", употребляемый в данном документе, относится по крайней мере к одной аминогруппе, как определено в описании, присоединенной к фрагменту родительской молекулы черезC1-7 алкильную группу, как определено в описании. Типичные примеры амино-C1-7 алкила включают, но не ограничиваются ими, аминометил, 2-аминоэтил, 1-аминоэтил, 2,2-диаминоэтил, 3-аминопропил,2-аминопропил, 4-аминобутил, 1-метил-1-аминоэтил и т.п. Термин "C1-7 алкиламино", употребляемый в данном документе как таковой или как часть другой группы, относится к одной или двум C1-7 алкильной группе(группам), как определено в описании, присоединенной к фрагменту родительской молекулы через аминогруппу, как определено в описании. Типичные примеры C1-7 алкиламино включают, но не ограничиваются ими, метиламино, этиламино,пропиламино, диметиламино, диэтиламино, N-этил-N-метиламино и т.п. Термин "C1-7 алкиламино-C1-7 алкил", употребляемый в данном документе, относится кC1-7 алкиламиногруппе, как определено в описании, присоединенной к фрагменту родительской молекулы через C1-7 алкильную группу, как определено в описании. Типичные примерыC1-7 алкиламино-C1-7 алкила включают, но не ограничиваются ими, N,N-диметиламинометил,N,N-диэтиламинометил, N-метиламиноэтил, N-метиламинопропил, N-этил-N-метиламинометил и т.п. Термин "гидрокси-C1-7 алкиламино", употребляемый в данном документе, относится по крайней мере к одной гидроксигруппе, присоединенной к фрагменту родительской молекулы черезC1-7 алкиламиногруппу, как определено в описании. Типичные примеры C1-7 алкиламино-C1-7 алкила включают, но не ограничиваются ими, N-гидроксиметиламино, N-этил-N-гидроксиметиламино и т.п. Термин "C1-7 алкокси-C1-7 алкиламино", употребляемый в данном документе, относится по крайней мере к одной C1-7 алкоксигруппе, присоединенной к фрагменту родительской молекулы черезC1-7 алкиламиногруппу, как определено в описании. Типичные примеры включают, но не ограничиваются ими, N-этоксиметиламино, N-этил-N-метоксиметиламино и т.п. Термин "гидрокси-C1-7 алкиламино-C1-7 алкил", употребляемый в данном документе, относится к гидрокси-C1-7 алкиламиногруппе, как определено в описании, присоединенной к фрагменту родительской молекулы через C1-7 алкильную группу, как определено в описании. Типичные примеры C1-7 алкиламиноC1-7 алкила включают, но не ограничиваются ими, N-гидроксиметиламиноэтил, N-этил-Nгидроксиметиламинометил и т.п. Термин "C1-7 алкокси-C1-7 алкил", употребляемый в данном документе, относится по крайней мере к одной C1-7 алкоксигруппе, как определено в описании, присоединенной к фрагменту родительской молекулы через C1-7 алкильную группу, как определено в описании. Типичные примерыC1-7 алкокси-C1-7 алкила включают, но не ограничиваются ими, метоксиметил, этоксиметил,2-метоксиэтил, 2-этоксиэтил, 3,3-диметоксипропил, 2,4-диметоксибутил и т.п. Термин "имино-C1-7 алкил", употребляемый в данном документе, относится по крайней мере к одной иминогруппе (=NH), присоединенной к фрагменту родительской молекулы через C1-7 алкильную группу,как определено в описании. Термин "гидроксиимино-C1-7 алкил", употребляемый в данном документе, относится к =N-OHгруппе, присоединенной к фрагменту родительской молекулы через C1-7 алкильную группу, как определено в описании. Термин "5- или 6-членное гетероциклическое кольцо", употребляемый в данном документе, относится к насыщенному, частично насыщенному или ароматическому кольцу с 5 или 6 атомами в кольце,из которых 1-3 атома являются гетероатомами, выбранными из группы, состоящей из N, O и S. Типичные примеры 5- или 6-членного гетероциклического кольца включают, но не ограничиваются ими, пиразолильное, пиридинильное, изоксазолильное, имидазолильное, фуранильное, пиперазинильное, пиперидинильное кольца и т.п. Термин "5- или 6-членное карбоциклическое кольцо", употребляемый в данном документе, относится к насыщенному, частично насыщенному или ароматическому кольцу с 5 или 6 атомами в кольце,состоящему только из атомов углерода. Типичные примеры 5- или 6-членного карбоциклического кольца включают, но не ограничиваются ими, фенильное и циклогексильное кольца и т.п. Термин "5-12-членное гетероциклическое кольцо", употребляемый в данном документе, относится к моноциклическому или бициклическому насыщенному, частично насыщенному или ароматическому кольцу с от 5 до 12 атомами в кольце, из которых 1-4 атома являются гетероатомами, выбранными из группы, состоящей из N, O и S. Типичные примеры 5-12-членного гетероциклического кольца включают,но не ограничиваются ими, пиразолильное, пиридинильное, изоксазолильное, имидазолильное, фуранильное, пиперазинильное, пиперидинильное, морфолинильное, пиразинильное, индазолильное, пиразо-9 024245 ло[1,5-а]пиримидинильное и тиазолильное кольца и т.п. Термин "5-12-членное карбоциклическое кольцо", употребляемый в данном документе, относится к моноциклическому или бициклическому насыщенному, частично насыщенному или ароматическому кольцу с от 5 до 12 атомами в кольце, состоящему только из атомов углерода. Типичные примеры 5-12 членных карбоциклических колец включают, но не ограничиваются ими, фенильное и нафтильное кольца и т.п. Термин "необязательно замещенные", употребляемый в данном документе в связи с различными остатками, относится к заместителям галогену, C1-7 алкилу, C2-7 алкенилу, C3-7 циклоалкилу, гидрокси,амино, галоген-C1-7 алкилу, гидрокси-C1-7 алкилу, C1-7 алкокси, оксо-C1-7 алкилу, C1-7 алкиламино,амино-C1-7 алкилу, метилсульфонилу, нитро, циано или тиолу. Предпочтительными заместителями являются галогеновые, C1-7 алкильные, C3-7 циклоалкильные,гидрокси-C1-7 алкильные, оксо-C1-7 алкильные заместители. "Необязательно замещенные" группы могут содержать от 1 до 3, предпочтительно 1 или 2, наиболее предпочтительно 1 из перечисленных выше заместителей. Примеры предпочтительных соединений формулы (I) или (II) включают и их фармацевтически приемлемые соли.- 13024245 Другие примеры предпочтительных соединений формулы (I) или (II) включают и их фармацевтически приемлемые соли. Соединения согласно изобретению могут быть введены больному в терапевтически эффективных количествах, которые колеблются обычно приблизительно от 0,1 до 5000 мг, предпочтительно приблизительно от 1 до 2000 мг в день в зависимости от возраста, массы тела, этнической группы, состояния больного, состояния, подвергаемого лечению, способа введения и используемого андрогенного (АР) модулятора. Соединения согласно изобретению могут быть составлены в лекарственные формы, используя известные в данной области принципы. Они могут быть даны больному как таковые или в комбинации с подходящими фармацевтическими наполнителями в виде таблеток, гранул, капсул, суппозиториев,эмульсий, суспензий или растворов. Выбор подходящих ингредиентов для композиции представляется обычным для специалистов в данной области. Очевидно, что подходящие носители, растворители, гелеобразующие ингредиенты, образующие дисперсию ингредиенты, антиоксиданты, красители, подсластители, увлажняющие соединения и другие ингредиенты, обычно применяемые в данной области техники,могут быть использованы. Композиции, содержащие активное соединение, могут быть даны энтерально или парентерально, причем предпочтительным способом является пероральный способ введения. Содержание активного соединения в композиции составляет приблизительно от 0,5 до 100%, предпочтительно приблизительно от 1 до 85% на массу всей композиции.- 14024245 Соединения согласно изобретению могут быть даны субъекту в виде единственного активного ингредиента или в комбинации с одним или более другими активными ингредиентами, подходящими для лечения или предотвращения зависимого от АР состояния, например АР-зависимого рака, такого как рак простаты, и других заболеваний, где антагонизм относительно АР является желательным. Настоящее изобретение будет изложено более подробно с использованием нижеследующих примеров. Примеры приведены только для иллюстрации и не ограничивают объем изобретения, определенного в формуле изобретения. Примеры Конечные продукты следующих примеров были получены в виде смеси диастереомеров, если не указано иное. Пример 1.a) 4-Бром-2-хлор-3,6-дифторанилин. 2-Хлор-3,6-дифторанилин (18,34 ммоль, 3 г) растворяли в ACN и охлаждали до 0C на бане со льдом. Раствор N-бромсукцинимида (18,34 ммоль, 3,26 г), растворенного в ACN, добавляли, используя капельную воронку, поддерживающую внутреннюю температуру реакционной смеси ниже 5C. После добавления смесь перемешивали в течение 15 мин, в течение которых температура медленно поднималась до температуры окружающей среды. Реакционную смесь разбавляли 10% водным растворомNaHSO3, перемешивали в течение 10 мин и упаривали до 1/3 первоначального объема. Остаток разбавляли водой и экстрагировали дважды избытком этилацетата. Органические экстракты сушили, фильтровали и упаривали. Продукт очищали флэш-хроматографией. В результате получали 4,087 г указанного в заголовке соединения. 1(12,37 ммоль, 1,311 г) добавляли. Реакционную смесь кипятили с обратным холодильником при 80C в течение 4 ч и перемешивание продолжали при 50C в течение ночи. Растворитель упаривали и остаток экстрагировали три раза EtOAc. Объединенные органические экстракты промывали водой и насыщенным раствором соли. Органические экстракты сушили, фильтровали и упаривали. Сырой продукт очищали флэш-хроматографией. В результате получали 1,935 г указанного в заголовке соединения. 1ACN. Смесь нагревали до 75C. 2-Хлор-3,6-дифтор-4-(1-(тетрагидро-2 Н-пиран-2-ил)-1 Н-пиразол-5 ил)анилин (6,17 ммоль, 1,935 г), растворенный в ACN, добавляли по каплям в течение 20 мин. Образующуюся смесь перемешивали в течение 6 ч при 75C. Смесь охлаждали до КТ и водный раствор тиосульфата натрия добавляли. Смесь экстрагировали три раза этилацетатом. Объединенные органические экстракты промывали насыщенным раствором соли, сушили, фильтровали и упаривали. Сырой продукт очищали флэш-хроматографией. В результате получали 0,716 г указанного в заголовке соединения. 1(1,686 ммоль,0,716 г) и цианид меди(I) (1,686 ммоль, 0,151 г) суспендировали в NMP. Образующуюся смесь перемешивали при 170C в течение 7 ч. Реакцию гасили путем выливания смеси в 12% раствор аммиака и реакционную смесь перемешивали в течение 20 мин. Образованный осадок фильтровали и промывали водой. В результате получали 0,276 г указанного в заголовке продукта. Идентификация после следующей стадии в связи с низкой растворимостью продукта.e) 2-Хлор-3,6-дифтор-4-(1 Н-пиразол-5-ил)бензонитрил. 2-Хлор-3,6-дифтор-4-(1-(тетрагидро-2 Н-пиран-2-ил)-1 Н-пиразол-5-ил)бензонитрил (0,853 ммоль,0,276 г) перемешивали в этаноле. Раствор 10% HCl/EtOH (5 мл) медленно добавляли. Образующуюся смесь перемешивали при КТ в течение ночи. Реакционную смесь нейтрализовали NaHCO3 и экстрагировали дважды EtOAc. Объединенные органические экстракты промывали водой, сушили, фильтровали и упаривали. В результате получали 0,219 г указанного в заголовке соединения. 1 Н-ЯМР (400 МГц, ДМСО-d6):6,86 (широкий с, 1 Н), 7,88-8,10 (м, 2 Н), 13,57 (широкий с, 1 Н).(1,252 ммоль, 0,328 г) растворяли в ТГФ и добавляли к полученной выше смеси. Образующуюся смесь охлаждали до 0C. Ди-трет-бутил азодикарбоксилат (1,252 ммоль, 0,288 г) добавляли малыми порциями и перемешивали в условиях пониженной температуры в течение 10 мин. Колбу нагревали до КТ и перемешивали в течение ночи. Растворитель упаривали. Остаток растворяли в этаноле и 10% раствор HCl(г)/EtOH (15 мл) медленно добавляли. Образующуюся смесь перемешивали в течение ночи. Смесь разбавляли водой и экстрагировали дважды DCM. Объединенные органические экстракты промывали водой. Водные фазы объединяли и pH доводили до 12 раствором 2 М NaOH. Водную фазу экстрагировали три раза DCM. Объединенные органические экстракты сушили, фильтровали и упаривали. В результате получали 0,167 г указанного в заголовке соединения. 1 Н-ЯМР (400 МГц, CDCl3):1,17 (д, 3H), 1,31 (широкий с, 2 Н), 3,53 (широкий с, 1 Н), 3,88-4,04 (м,1 Н), 4,09-4,26 (м, 1 Н), 6,82 (дд, 1 Н), 7,55 (д, 1 Н), 7,88 (дд, 1 Н).(S)-N-(1-(3-(3-Хлор-4-циано-2,5-дифторфенил)-1 Н-пиразол-1-ил)пропан-2-ил)-2-метил-1 Нимидазол-5-карбоксамид. 2-Метил-1 Н-имидазол-4-карбоновую кислоту (0,202 ммоль, 0,026 г) растворяли в ДМФ (5 мл) в атмосфере азота. EDCI (0,202 ммоль, 0,039 г), DIPEA (0,270 ммоль, 0,035 г) и HBTU (0,034 ммоль, 0,013 г) добавляли и образующуюся смесь перемешивали в течение 20 мин при КТ. (S)-4-(1-(2-Аминопропил)1 Н-пиразол-3-ил)-2-хлор-3,6-дифторбензонитрил (0,135 ммоль, 0,04 г), растворенный в ДМФ (2 мл), добавляли и образующуюся смесь перемешивали при КТ в течение 3 дней. Смесь разбавляли водой иEtOAc, промывали 2 М Na2CO3, водой и насыщенным раствором соли. Объединенные органические экстракты сушили, фильтровали и упаривали. Сырой продукт очищали флэш-хроматографией. В результате получали 0,0324 г указанного в заголовке соединения. 1a) Этил 2-хлороксазол-4-карбоксилат. Этил 2-аминооксазол-4-карбоксилат (20 г, 128 ммоль) добавляли к раствору хлорида меди (32,8 г,192 ммоль) и t-бутилнитрита (23 мл, 192 ммоль) в ACN (500 мл) при 80C и образующуюся смесь кипятили с обратным холодильником в течение 4 ч. Реакционную смесь концентрировали и обрабатывали концентрированной HCl и экстрагировали EtOAc. Продукт очищали флэш-хроматографией. Выход: 10,5 г. 1 Н-ЯМР (400 МГц; CDCl3):1,36 (т, 3H), 4,39 (кв, 2 Н), 8,47 (с, 1 Н).d) Этил 2-(2-гидроксипропан-2-ил)оксазол-4-карбоксилат. В колбу, содержащую раствор этил 2-ацетилоксазол-4-карбоксилата (2,0 г, 10,9 ммоль) в ТГФ(50 мл), 3 М раствор MeMgI в эфире (5,0 мл, 13,11 ммоль) добавляли при 0C. Образующуюся смесь перемешивали при КТ в течение 5 ч. Реакцию гасили водным раствором NH4Cl и смесь экстрагировалиEtOAc. Органический слой концентрировали и очищали флэш-хроматографией. Выход: 1,0 г. 1e) 2-(2-Гидроксипропан-2-ил)оксазол-4-карбоновая кислота. 2-(2-Гидроксипропан-2-ил)оксазол-4-карбоновую кислоту получали, используя методику, описанную в примере 32(d), исходя из этил 2-(2-гидроксипропан-2-ил)оксазол-4-карбоксилата (1,0 г,5,02 ммоль). Выход: 500 мг. 1(0,214 ммоль, 0,029 г) добавляли и образующуюся смесь перемешивали в течение 20 мин при КТ.(S)-4-(1-(2-Аминопропил)-1 Н-пиразол-3-ил)-2-хлор-3,6-дифторбензонитрил (0,428 ммоль, 0,127 г), растворенный в ДМФ (5 мл), добавляли и образующуюся смесь перемешивали при КТ в течение 3 дней. Смесь разбавляли водой и EtOAc, промывали 2 М Na2CO3, водой и насыщенным раствором соли. Объединенные органические экстракты сушили, фильтровали и упаривали. Сырой продукт очищали флэшхроматографией. В результате получали 0,059 г указанного в заголовке соединения. 1a) 4-Бром-3-хлор-5-фторанилин. 3-Хлор-5-фторанилин (2061 ммоль, 300 г) растворяли в ACN (3000 мл) и раствор охлаждали до 0C.NBS (2061 ммоль, 367 г) добавляли к реакционной смеси малыми порциями, поддерживая температуру ниже 10C. Реакционную смесь перемешивали при 105C в течение 3,5 ч. 10% водный раствор NaHSO3 добавляли и реакционную смесь концентрировали в вакууме для удаления органических растворителей. Воду и DCM добавляли, смесь перемешивали в течение 15 мин и фазы разделяли. Водную фазу экстрагировали DCM. Объединенные органические экстракты промывали водой. Органическую фазу упаривали. 2-Пропанол добавляли к остатку и перегоняли до тех пор, пока температура пара не достигала 80C. Воду добавляли и температуру смеси поддерживали при 4010C. Смесь охлаждали до 5C и перемешивали в течение 4 ч. Осадок удаляли фильтрованием, промывали водой и сушили в вакууме. В результате получали 440,7 г указанного в заголовке соединения. 1b) 4-Амино-2-хлор-6-фторбензонитрил. 4-Бром-3-хлор-5-фторанилин (980 ммоль, 220 г), цианид меди(I) (980 ммоль, 88 г) и NMP (1000 мл) добавляли в реакционную колбу, нагревали вплоть до 160C и перемешивали в течение 3 ч до завершения реакции. Реакционную смесь охлаждали до КТ. Воду и 25% раствор аммиака добавляли, поддерживая температуру смеси при КТ. Смесь перемешивали в течение ночи и образовавшийся осадок отделяли фильтрованием и промывали водой. Отфильтрованный осадок сушили в вакууме с получением 117,7 г указанного в заголовке соединения. 1 Н-ЯМР (400 МГц, ДМСО-d6):6,41-6,47 (м, 1 Н), 6,58-6,62 (м, 1 Н), 6,86 (широкий с, 2 Н).c) 2-Хлор-6-фтор-4-йодбензонитрил. 4-Амино-2-хлор-6-фторбензонитрил (293 ммоль, 50 г) растворяли в ACN (1550 мл) и воде (460 мл). Серную кислоту (879 ммоль, 46,9 мл) осторожно добавляли. Реакционную смесь охлаждали до 0C. Нитрит натрия (322 ммоль, 22,25 г), растворенный в воде (150 мл), медленно добавляли, поддерживая температуру реакции ниже 10C. После этого йодид калия (586 ммоль, 97 г), растворенный в 150 мл воды, добавляли медленно, в то же время поддерживали температуру реакции ниже 10C. Реакционную смесь оставляли нагреваться вплоть до КТ и перемешивали в течение ночи при КТ. Фазы разделяли и органическую фазу упаривали. Этилацетат добавляли к остатку после упаривания и промывали три раза 10% водным раствором NaHSO3. Органическую фазу упаривали и остаток растворяли в DCM. 5 г активированного угля добавляли и перемешивали в течение 2 ч. Смесь фильтровали через слой целита и промывали DCM. DCM-фазу упаривали и гептаны добавляли к остатку. Смесь нагревали до 60C и перемешивали в течение 2 ч. Слои масла и гептанов разделяли декантацией. Гептановую фазу упаривали и 39,6 г указанного в заголовке соединения получали. 1 Н-ЯМР (400 МГц, ДМСО-d6):8,06-8,10 (м, 1 Н), 8,10-8,11 (м, 1 Н).(699 ммоль, 74,1 г) и воду (350 мл) добавляли. Образующуюся смесь нагревали до 60C и перемешивали в течение 2 ч. Растворители упаривали. Воду добавляли и смесь оставляли перемешиваться в течение ночи. EtOAc и воду добавляли и нерастворимый осадок удаляли фильтрованием. Органическую фазу отделяли от фильтрата и водную фазу экстрагировали дополнительно EtOAc. Объединенные органические экстракты упаривали и остаток объединяли с ранее отфильтрованным твердым веществом. Собранные твердые частицы суспендировали в EtOH и воде. Смесь нагревали до температуры кипения, оставляли охлаждать до КТ и перемешивали в течение 1 ч при температуре окружающей среды. Смесь охлаждали до 0C и еще перемешивали в течение другого часа. Осадок промывали малым количеством холод- 17024245 ной смеси 1:1 вода/EtOH. Отфильтрованные твердые частицы сушили в вакууме. В результате получили 91,2 г указанного в заголовке соединения. 1 Н-ЯМР (400 МГц, ДМСО-d6):1,50-1,70 (м, 3H), 1,79-1,89 (м, 1 Н), 1,92-2,03 (м, 1 Н), 2,30-2,44 (м,1 Н), 3,56-3,67 (м, 1 Н), 3,93-4,02 (м, 1 Н), 5,36 (дд, 1 Н), 6,78 (д, 1 Н), 7,66 (д, 1 Н), 7,73 (дд, 1 Н), 7,80-7,83 (м,1 Н).e) 2-Хлор-6-фтор-4-(1 Н-пиразол-5-ил)бензонитрила гидрохлорид. 2-Хлор-6-фтор-4-(1-(тетрагидро-2 Н-пиран-2-ил)-1 Н-пиразол-5-ил) бензонитрил (298 ммоль, 91 г) и 10% HCl/EtOH (339 мл) смешивали в колбе в атмосфере азота. Образующуюся смесь кипятили с обратным холодильником в течение 5 ч, в течение которых 113 мл 10% HCl/EtOH добавляли. Смесь охлаждали до КТ и перемешивали в течение ночи. На следующее утро, 40 мл 10% HCl/EtOH добавляли и смесь кипятили с обратным холодильником в течение 3,5 ч, охлаждали до 0C и перемешивали в течение 1 ч. Осадок удаляли фильтрованием и сушили в вакууме. Половину растворителей в фильтрате упаривали и оставшуюся смесь перемешивали при 0C в течение 3 ч. Осадки вновь удаляли фильтрованием и сушили в вакууме. Собранные твердые частицы объединяли с получением 51,8 г указанного в заголовке соединения. 1f) 2-Хлор-6-фтор-4-(1 Н-пиразол-5-ил)бензонитрил. 2-Хлор-6-фтор-4-(1 Н-пиразол-5-ил)бензонитрила гидрохлорид (201 ммоль, 51,8 г) растворяли в ТГФ (510 мл). Гидроксид натрия 50% (401 ммоль, 32,1 г) добавляли и образующуюся смесь перемешивали при КТ в течение 3 ч. Почти весь растворитель упаривали и воду добавляли к остатку. Смесь перемешивали в течение ночи при КТ. Осадок удаляли фильтрованием и твердое вещество промывали дважды водой. Твердое вещество сушили в вакууме. В результате получали 35,8 г указанного в заголовке соединения. 1(259 ммоль, 68,0 г) смешивали в сухом EtOAc (380 мл) в атмосфере азота. 2-Хлор-6-фтор-4-(1 Н-пиразол 3-ил)бензонитрил (130 ммоль, 35,9 г) добавляли и образующуюся смесь перемешивали в течение 10 мин.DIAD (259 ммоль, 52,4 г) добавляли медленно, в то же время поддерживали температуру между 15-25C на бане со льдом. После добавления смесь оставляли нагреваться до КТ и перемешивали в течение 4 ч. Воду и концентрированную HCl (1296 ммоль, 106 мл) добавляли к смеси и перемешивали в течение 6 дней, в течение которых дополнительное количество HCl (107 мл в целом) добавляли. Воду и DCM добавляли и смесь перемешивали в течение некоторого времени до разделения фаз. Органическую фазу экстрагировали дважды водой. Водные фазы объединяли и промывали дважды DCM. DCM добавляли к водной фазе и pH водной фазы доводили до 12,5 50% раствором NaOH. Фазы разделяли и водную фазу экстрагировали повторно DCM. DCM-фазы объединяли и промывали один раз водой. Выделеннуюh) (S)-N-(1-(3-(3-Хлор-4-циано-5-фторфенил)-1 Н-пиразол-1-ил)пропан-2-ил)-6-цианоимидазо[1,2 а]пиридин-2-карбоксамид ORM-19702. 6-Цианоимидазо[1,2-а]пиридин-2-карбоновую кислоту (0,770 ммоль, 0,144 г), HOBt (0,770 ммоль,0,104 г) и DIPEA (1,539 ммоль, 0,199 г) растворяли в DCM (5 мл) и ДМФ (1 мл). EDCI (0,770 ммоль,0,148 г) добавляли и образующуюся смесь перемешивали в течение 10 мин при КТ.(S)-4-(1-(2-Аминопропил)-1 Н-пиразол-3-ил)-2-хлор-6-фторбензонитрил (0,592 ммоль, 0,22 г), растворенный в небольшом количестве DCM, добавляли и реакционную смесь перемешивали в течение ночи при КТ. Смесь разбавляли DCM, промывали 1 М раствором Na2CO3 и водой. Органическую фазу сушили,фильтровали и упаривали. Сырой продукт очищали растиранием в ACN. В результате получали 0,054 г указанного в заголовке соединения. 1 Н-ЯМР (400 МГц, ДМСО-d6):1,15 (д, 3H), 4,31-4,45 (м, 2 Н), 4,46-4,57 (м, 1 Н), 7,00 (д, 1 Н), 7,617,66 (м, 1 Н), 7,72-7,77 (м, 1 Н), 7,86-7,92 (м, 2 Н), 7,93-7,96 (м, 1 Н), 8,35-8,37 (м, 1 Н), 8,69 (д, 1 Н), 9,34-9,37a) Этил 7-оксо-5,6,7,8-тетрагидроимидазо[1,2-а]пиримидин-2-карбоксилат. Этил 2-амино-1 Н-имидазол-4-карбоксилат (6,45 ммоль, 1 г) и триэтиламин (10,04 ммоль, 1,016 г) суспендировали в сухом ACN (30 мл) и охлаждали до 0C. Акрилоилхлорид (9,67 ммоль, 0,875 г), растворенный в сухом ACN (4 мл), добавляли к суспензии по каплям. Образующуюся смесь медленно на- 18024245 гревали до КТ и далее нагревали до 50C в течение 16 ч. Растворитель упаривали и остаток очищали флэш-хроматографией. В результате получали 0,358 г указанного в заголовке соединения. 1 Н-ЯМР (400 МГц, CDCl3):1,37 (т, 3H), 2,92 (т, 2 Н), 4,18 (т, 2 Н), 4,37 (кв, 2 Н), 7,40 (с, 1 Н), 8,78b) 7-Оксо-5,6,7,8-тетрагидроимидазо[1,2-а]пиримидин-2-карбоновая кислота. Этил 7-оксо-5,6,7,8-тетрагидроимидазо[1,2-а]пиримидин-2-карбоксилат (1,711 ммоль, 0,358 г) растворяли в этаноле (5 мл) и охлаждали до 0C. 1 н. раствор NaOH (5 мл) медленно добавляли. Образующуюся смесь нагревали до 60C в течение 1,5 ч. Этанол упаривали, остаток разбавляли третбутилметиловым эфиром и подкисляли 2 н. раствором HCl в условиях низкой температуры. Смесь перемешивали в течение ночи. DCM и воду добавляли и выпавший осадок фильтровали. Фазы в фильтрате разделяли и водную фазу упаривали. Остаток после упаривания водной фазы и осадок объединяли. В результате получали 0,592 г указанного в заголовке соединения. 1HOBt (1,891 ммоль, 0,255 г) добавляли и образующуюся смесь перемешивали в течение 20 мин при КТ.(S)-4-(1-(2-Аминопропил)-1 Н-пиразол-3-ил)-2-хлор-6-фторбензонитрил (1,260 ммоль, 0,351 г), растворенный в ДМФ (5 мл), добавляли и образующуюся смесь перемешивали при КТ в течение 2 дней. Смесь разбавляли водой и EtOAc, промывали 2 М Na2CO3, водой и насыщенным раствором соли. Объединенные органические экстракты сушили, фильтровали и упаривали. Сырой продукт очищали препаративной ВЭЖХ. В результате получали 0,0089 г указанного в заголовке соединения. 1(Е)-N'-Гидроксиизобутиримидамид (27,6 ммоль, 2,82 г) растворяли в пиридине (10 мл) и охлаждали до 0C. Этилоксалилхлорид (35,9 ммоль, 4,90 г) добавляли по каплям к приготовленной выше смеси и перемешивали в течение 10 мин при 0C, нагревали до КТ и затем нагревали до 70C в течение 1,5 ч. Смесь выливали в охлажденную льдом воду. Остаток экстрагировали дважды t-бутилметиловым эфиром и водой. Органическую фазу сушили, фильтровали и упаривали. Сырой продукт очищали флэшхроматографией. В результате получали 1,919 г указанного в заголовке соединения. 1b) 3-Изопропил-1,2,4-оксадиазол-5-карбоновая кислота. Этил 3-изопропил-1,2,4-оксадиазол-5-карбоксилат (10,42 ммоль, 1,919 г) растворяли в EtOH (20 мл). Гранулы гидроксида натрия (12,50 ммоль, 0,500 г) растворяли в холодной воде (10 мл) и раствор медленно добавляли. Образовавшийся раствор нагревали при 60C в течение 1,5 ч. EtOH удаляли в вакууме. Остаток разбавляли трет-бутилметиловым эфиром. Смесь подкисляли в условиях низкой температуры путем добавления 2 н. раствора HCl. Смесь перемешивали в течение ночи и промывали DCM. Водную фазу упаривали, при этом осаждался продукт. В результате получали 1,673 г указанного в заголовке соединения. 1 Н-ЯМР (400 МГц, D2O):1,33 (д, 6 Н), 3,10-3,25 (м, 1 Н).(S)-N-(1-(3-(3-Хлор-4-циано-5-фторфенил)-1 Н-пиразол-1-ил)пропан-2-ил)-3-изопропил-1,2,4 оксадиазол-5-карбоксамид. 3-Изопропил-1,2,4-оксадиазол-5-карбоновую кислоту (1,281 ммоль, 0,2 г) растворяли в ДМФ (5 мл) в атмосфере азота. EDCI (1,601 ммоль, 0,307 г), DIPEA (3,20 ммоль, 0,414 г) и HOBt (1,601 ммоль,0,216 г) добавляли и образующуюся смесь перемешивали в течение 20 мин при КТ.(S)-4-(1-(2-Аминопропил)-1 Н-пиразол-3-ил)-2-хлор-6-фторбензонитрил (1,067 ммоль, 0,298 г), растворенный в ДМФ (5 мл), добавляли и образующуюся смесь перемешивали при КТ в течение 2 дней. Смесь разбавляли водой и EtOAc, промывали 2 М Na2CO3, водой и насыщенным раствором соли. Объединенные органические экстракты сушили, фильтровали и упаривали. Сырой продукт очищали препаративной ВЭЖХ. В результате получали 0,0056 г указанного в заголовке соединения. 1a) Этил 5,7-диметилимидазо[1,2-c]пиримидин-2-карбоксилат. 4-Амино-2,6-диметилпиримидин (16,24 ммоль, 2 г) смешивали с этанолом (30 мл) и хорошо перемешивали. Этилбромпируват (20,30 ммоль, 3,96 г) добавляли маленькими порциями. Образующуюся смесь кипятили с обратным холодильником в течение 5,5 ч и перемешивали при КТ в течение ночи. Растворитель упаривали, DCM добавляли и промывали Na2HCO3. Органическую фазу сушили, фильтровали и упаривали. Сырой продукт очищали флэш-хроматографией и растирали в EtOAc/гептан в указанном порядке. В результате получали 0,287 г указанного в заголовке продукта. 1b) 5,7-Диметилимидазо[1,2-c]пиримидин-2-карбоновая кислота. Этил 5,7-диметилимидазо[1,2-c]пиримидин-2-карбоксилат (1,268 ммоль, 0,278 г) растворяли в этаноле (10 мл) и охлаждали до 0C. 2 М NaOH раствор добавляли к реакционной смеси. Образующуюся смесь перемешивали при 0C в течение 30 мин и в течение 1 ч при КТ. Растворитель упаривали и воду добавляли к остатку. Водную фазу подкисляли 1 M HCl и экстрагировали три раза EtOAc. Объединенные органические экстракты сушили, фильтровали и упаривали. В результате получали 0,292 г указанного в заголовке соединения. 1 Н-ЯМР (400 МГц, ДМСО-d6):2,46 (с, 3H), 2,83 (с, 3H), 7,39 (с, 1 Н), 8,57 (с, 1 Н).(S)-4-(1-(2-аминопропил)-1 Н-пиразол-3-ил)-2-хлор-6-фторбензонитрила (0,538 ммоль, 0,2 г). ДМФ (6 мл) использовали в качестве растворителя и HBTU (0,054 ммоль, 0,020 г) использовали вместо HOBt. Сырой продукт очищали путем растирания в ACN. В результате получали 0,045 г указанного в заголовке соединения. 1a) 5-(Бромметил)изоксазол-3-карбоновая кислота. Этил 5-(бромметил)изоксазол-3-карбоксилат (4,27 ммоль, 1 г) и гидроксид лития (10,68 ммоль,0,256 г) растворяли в ТГФ (6,5 мл) и воде (6,5 мл). Образующуюся смесь перемешивали в течение 30 мин при КТ. pH доводили до 4 добавлением 1 M HCl и разбавляли водой. Смесь экстрагировали три разаEtOAc. Объединенные органические экстракты сушили, фильтровали и упаривали. В результате получали 0,543 г указанного в заголовке соединения. 1(S)-5-(Бромметил)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1 Н-пиразол-1-ил)пропан-2 ил)изоксазол-3-карбоксамид. 5-(Бромметил)изоксазол-3-карбоновую кислоту (0,718 ммоль, 0,148 г) растворяли в DCM (5 мл) и ТГФ (1 мл). 1,3-Дициклогексилкарбодиимид (0,718 ммоль, 0,14 8 г) добавляли и образующуюся смесь перемешивали при КТ. Образованный осадок фильтровали и (S)-4-(1-(2-аминопропил)-1 Н-пиразол-3-ил)2-хлор-6-фторбензонитрил (0,359 ммоль, 0,1 г), триэтиламин (0,359 ммоль, 0,036 г) и сухой DCM (5 мл) добавляли к фильтрату. Фильтрат перемешивали при КТ в атмосфере азота в течение двух дней, в течение которых дополнительное количество 1,3-дициклогексилкарбодиимида (0,148 г), триэтиламина(0,050 мл) и 5-(бромметил)изоксазол-3-карбоновой кислоты (0,1 г) добавляли. Реакционную смесь разбавляли DCM и промывали NaHCO3. Органическую фазу сушили, фильтровали и упаривали. Сырой продукт очищали флэш-хроматографией. В результате получали 0,064 г указанного в заголовке соединения. 1 Н-ЯМР (400 МГц, CDCl3):1,25 (д, 3H), 4,00-4,09 (м, 2 Н), 4,23-4,31 (м, 1 Н), 4,41-4,48 (м, 1 Н), 4,534,63 (м, 1 Н), 6,60-6,66 (м, 1 Н), 6,74-6,78 (м, 1 Н), 7,48-7,53 (м, 1 Н), 7,64 (д, 1 Н), 7,79-7,88 (м, 2 Н). с)(S)-5-(Бромметил)-N-(1-(3-(3-хлор-4-циано-5-фторфенил)-1 Н-пиразол-1-ил)пропан-2-ил)изоксазол 3-карбоксамид (0,137 ммоль, 0,064 г) суспендировали в ДМФ (5 мл). Имидазол (2,74 ммоль, 0,187 г) добавляли и образующуюся смесь перемешивали при КТ в течение 2,5 ч. Реакционную смесь нагревали до 60C в течение 1,5 ч. Смесь разбавляли EtOAc и промывали четыре раза водой. Органическую фазу су- 20024245 шили, фильтровали и упаривали. Сырой продукт очищали препаративной ВЭЖХ. В результате получали 0,017 г указанного в заголовке соединения. 1 Н-ЯМР (400 МГц, ДМСО-d6):1,15 (д, 3H), 4,31 (д, 2 Н), 4,37-4,50 (м, 1 Н), 5,50 (с, 2 Н), 6,63 (с, 1 Н),6,94 (с, 1 Н), 6,99 (д, 1 Н), 7,22-7,24 (м, 1 Н), 7,76 (с, 1 Н), 7,83 (д, 1 Н), 7,84-7,88 (м, 1 Н), 7,96 (с, 1 Н), 8,81 (д,1 Н). Пример 8.a) Этил 5-оксо-5,6-дигидроимидазо[1,2-c]пиримидин-2-карбоксилат. Этил бромпируват (18,00 ммоль, 3,51 г) растворяли в этаноле (50 мл). Цитозин (18,00 ммоль, 2 г) добавляли и образующуюся смесь кипятили с обратным холодильником в течение 5,5 ч. Смесь упаривали и DCM добавляли. Осадок фильтровали и промывали водой. Фильтрат промывали NaHCO3, водой и упаривали. Остаток после упаривания и ранее отфильтрованный осадок очищали флэш-хроматографией и растирали в воде в указанном порядке. В результате получали 0,526 г указанного в заголовке соединения. 1b) 5-Оксо-5,6-дигидроимидазо[1,2-c]пиримидин-2-карбоновая кислота. Этил 5-оксо-5,6-дигидроимидазо[1,2-c]пиримидин-2-карбоксилат (2,510 ммоль, 0,52 г) суспендировали в этаноле (20 мл). Карбонат цезия (5,02 ммоль, 1,635 г), растворенный в воде (4 мл), добавляли и образующуюся смесь перемешивали при КТ в течение 3,5 ч, после чего смесь кипятили с обратным холодильником в течение 8 ч. Этанол упаривали и остаток разбавляли водой. pH доводили до 4 добавлением 1 M HCl и растворитель упаривали. Остаток очищали путем растирания в ДМФ. В результате получали 0,137 г указанного в заголовке соединения. 1(0,027 ммоль, 10,21 мг), DIPEA (0,323 ммоль, 0,042 г) и EDCI (0,323 ммоль, 0,062 г) суспендировали в ДМФ (2 мл) и образующуюся смесь перемешивали при КТ в течение 10 мин. (S)-4-(1-(2-Аминопропил)1 Н-пиразол-3-ил)-2-хлор-6-фторбензонитрил (0,269 ммоль, 0,1 г), растворенный в ДМФ (2 мл), добавляли и образующуюся смесь перемешивали в течение 17 ч при КТ. На данном этапе дополнительное количество исходных материалов добавляли, так что количество каждого исходного материала увеличивалось в полтора раза от первоначального количества. Количество (S)-4-(1-(2-аминопропил)-1 Н-пиразол-3 ил)-2-хлор-6-фторбензонитрила не изменялось. Реакцию продолжали в течение дополнительных 22 ч,после чего температуру повышали до 80C в течение 4,5 ч. Реакционную смесь разбавляли EtOAc и промывали 1 М Na2CO3, насыщенным раствором соли и водой. Органическую фазу сушили, фильтровали и упаривали. Сырой продукт очищали препаративной ВЭЖХ. В результате получали 0,006 г указанного в заголовке соединения. 1(10 мл). Карбонат цезия (2,66 ммоль, 0,866 г), растворенный в воде (2 мл), добавляли и образующуюся смесь перемешивали при КТ в течение дня, после чего дополнительное количество карбоната цезия(2,66 ммоль, 0,866 г), растворенного в воде (2 мл), добавляли. Температуру повышали до 80C в течение 7 ч. Этанол упаривали и остаток разбавляли водой. pH доводили до 4 добавлением 2 М HCl, экстрагировали три раза EtOAc и промывали водой. Объединенные органические экстракты сушили, фильтровали и упаривали. В результате получали 0,041 г указанного в заголовке соединения. ЖХ-МС [М+1]: 152.(S)-4-(1-(2-аминопропил)-1 Н-пиразол-3-ил)-2-хлор-6-фторбензонитрила (0,215 ммоль, 0,080 г). Сырой продукт очищали препаративной ВЭЖХ. В результате получали 0,0164 г указанного в заголовке соединения. 1(S)-N-(1-(3-(3-Хлор-4-циано-5-фторфенил)-1 Н-пиразол-1-ил)пропан-2-ил)имидазо[2,1-b]тиазол-6 карбоксамид. Указанное в заголовке соединение получали, используя методику, описанную в примере 3(h), исходя из имидазо[2,1-b]тиазол-6-карбоновой кислоты (1,041 ммоль, 0,175 г) и (S)-4-(1-(2-аминопропил)-1 Нпиразол-3-ил)-2-хлор-6-фторбензонитрила (1,041 ммоль, 0,290 г). ДМФ (10 мл) использовали в качестве растворителя и время реакции составляло 2 дня. Обработку выполняли путем разбавления реакционной смеси водой и этилацетатом и промывания ее 2 М Na2CO3, водой и насыщенным раствором соли. Объединенные органические экстракты сушили, фильтровали и упаривали. Сырой продукт очищали флэшхроматографией. В результате получали 0,186 г указанного в заголовке соединения. 1(S)-N-(1-(3-(3-Хлор-4-циано-5-фторфенил)-1 Н-пиразол-1-ил)пропан-2-ил)-6-нитроимидазо[1,2 а]пиридин-2-карбоксамид. Указанное в заголовке соединение получали, используя методику, описанную в примере 3(h), исходя из 6-нитроимидазо[1,2-а]пиридин-2-карбоновой кислоты (0,551 ммоль, 0,114 г) и (S)-4-(1-(2 аминопропил)-1 Н-пиразол-3-ил)-2-хлор-6-фторбензонитрила (0,459 ммоль, 0,128 г). ДМФ (4 мл) использовали в качестве растворителя и HBTU (0,046 ммоль, 0,017 г) использовали вместо HOBt. Сырой продукт очищали препаративной ВЭЖХ. В результате получали 0,0405 г указанного в заголовке соединения. 1(10 мл) использовали в качестве растворителя. Реакционную смесь разбавляли водой и экстрагировали три раза DCM. Объединенные органические экстракты промывали дважды водой. Органическую фазу упаривали. Сырой продукт очищали флэш-хроматографией. В результате получали 515 мг указанного в заголовке соединения. 1(+98%, 0,973 ммоль, 165 мг), добавляли и образующуюся смесь перемешивали при КТ в течение ночи. Раствор NH4Cl добавляли и смесь экстрагировали три раза EtOAc. Объединенные органические экстракты промывали водой, сушили, фильтровали и упаривали. Сырой продукт очищали флэшхроматографией. В результате получали 83 мг указанного в заголовке соединения. 1(0,5 мл) и ТГФ (4 мл). Раствор 2 М NaOH (2,115 ммоль, 1,057 мл) добавляли и образующуюся смесь перемешивали при КТ в течение ночи. pH реакционной смеси доводили приблизительно до 5 добавлением 1M HCl и смесь упаривали. Этанол добавляли и соль удаляли фильтрованием. Соль промывали несколь- 22024245 ко раз этанолом. В результате получали 51 мг указанного в заголовке соединения. 1(0,303 ммоль,51 мг),(S)-4-(1-(2-аминопропил)-1 Н-пиразол-3-ил)-2-хлор-6-фторбензонитрила (0,253 ммоль, 70,4 мг) и только каталитического количества HOBt (0,025 ммоль, 3,41 мг). ДМФ (2 мл) использовали в качестве растворителя в реакции. Обработку осуществляли путем добавления воды к реакционной смеси и экстрагирования ее три раза DCM. Объединенные органические экстракты промывали дважды водой. Органическую фазу упаривали и остаток очищали флэш-хроматографией. В результате получали 86 мг указанного в заголовке соединения. 1 Н-ЯМР (400 МГц, ДМСО-d6):1,06 (д, 3H), 1,34 (д, 6 Н), 2,35 (с, 3H), 4,23-4,47 (м, 4 Н), 7,02 (д, 1 Н),7,62 (с, 1 Н), 7,86 (д, 1 Н), 7,90-7,96 (м, 1 Н), 8, 00 (с, 1 Н), 8,04 (д, 1 Н). Пример 14.(S)-N-(1-(3-(3-Хлор-4-циано-5-фторфенил)-1 Н-пиразол-1-ил)пропан-2-ил)-5-(2-гидроксипропан-2 ил)-1 Н-пиразол-3-карбоксамид. а) Этил 5-(2-гидроксипропан-2-ил)-1 Н-пиразол-3-карбоксилат. Трифторметансульфонат цинка (2,378 ммоль, 0,864 г), 2-метил-3-бутан-2-ол (11,89 ммоль, 1 г) и триэтиламин (17,83 ммоль, 1,804 г) добавляли в колбу в атмосфере азота. Этилдиазоацетат (14,27 ммоль,1,628 г) добавляли медленно и температуру с осторожностью повышали до 100C и перемешивали в течение 8 ч. Воду добавляли и смесь экстрагировали дважды DCM. Объединенные DCM-фазы сушили,фильтровали и упаривали. Сырой продукт очищали флэш-хроматографией. В результате получали 0,658 г указанного в заголовке соединения. 1 Н-ЯМР (400 МГц, ДМСО-d6):1,28 (т, 3H), 1,45 (с, 6 Н), 4,24 (кв, 2 Н), 5,34 (с, 1 Н), 6,52 (с, 1 Н),13,22 (широкий с, 1 Н).b) 5-(2-Гидроксипропан-2-ил)-1 Н-пиразол-3-карбоновая кислота. Этил 5-(2-гидроксипропан-2-ил)-1 Н-пиразол-3-карбоксилат (1,609 ммоль, 0,319 г) растворяли в этаноле (1 мл) и ТГФ (4 мл). Раствор 2 М NaOH (8,05 ммоль, 4,02 мл) добавляли и образующуюся смесь перемешивали в течение ночи при КТ. Реакционную смесь с осторожностью нейтрализовали HCl и упаривали. Остаток растворяли в небольшом количестве этанола и соли удаляли фильтрованием. Фильтрат упаривали. В результате получали 0,227 г указанного в заголовке соединения. 1 Н-ЯМР (400 МГц, ДМСО-d6):1,39 (с, 6 Н), 4,72 (широкий с, 1 Н), 6,24 (с, 1 Н), 12,20 (широкий с,1 Н).(S)-4-(1-(2-аминопропил)-1 Н-пиразол-3-ил)-2-хлор-6-фторбензонитрила (0,539 ммоль, 150 мг) и только каталитического количества HOBt (0,054 ммоль, 7,28 мг). ДМФ использовали в качестве растворителя. Воду добавляли к реакционной смеси и смесь экстрагировали три раза DCM. Объединенные органические экстракты промывали дважды водой. Органическую фазу упаривали и остаток очищали флэшхроматографией и препаративной ВЭЖХ в указанном порядке. В результате получали 45,4 мг указанного в заголовке соединения. 1a) Этил 1-(2,2-дифторэтил)-2-метил-1 Н-имидазол-4-карбоксилат. Этил 2-метил-1 Н-имидазол-4-карбоксилат (1,622 ммоль, 250 мг) и KOH (2,432 ммоль, 136 мг) суспендировали в ДМФ (2 мл). 1,1-Дифтор-2-йодэтан (4,86 ммоль, 934 мг) добавлял и образующуюся смесь перемешивали в течение ночи при КТ. В течение перемешивания дополнительные 0,3 мл 1,1-дифтор-2 йодэтана добавляли для завершения реакции. Водный раствор NH4Cl добавляли и смесь экстрагировали три раза EtOAc. Объединенные органические экстракты промывали водой, сушили, фильтровали и упаривали. Сырой продукт очищали флэш-хроматографией. В результате получали 0,3 г указанного в заголовке соединения. В результате реакции получали два изомера и разделяли на последующих стадиях. Изомер 1: 1H-ЯМР (400 МГц, ДМСО-d6):1,28 (т, 3H), 2,33 (с, 3H), 4,25 (кв, 2 Н), 4,45-4,58 (м, 2 Н),6,23-6,53 (м, 1 Н), 7,80 (с, 1 Н). Изомер 2: 1H-ЯМР (400 МГц, ДМСО-d6): 5 1,25 (т, 3H), 2,39 (с, 3H), 4,19 (кв, 2 Н), 4,70-4,83 (м, 2 Н),- 23024245 6,18-6,49 (м, 1 Н), 7,59 (с, 1 Н).b) 1-(2,2-Дифторэтил)-2-метил-1 Н-имидазол-4-карбоновая кислота. Этил 1-(2,2-дифторэтил)-2-метил-1 Н-имидазол-4-карбоксилат (1,375 ммоль, 300 мг) растворяли в метаноле (0,5 мл) и ТГФ (4 мл). Раствор 2 М NaOH (4,12 ммоль, 2,062 мл) добавляли и образующуюся смесь перемешивали в течение 2,5 ч при КТ. pH смеси доводили приблизительно до 6 добавлением 5 Мc) (S)-N-(1-(3-(3-Хлор-4-циано-5-фторфенил)-1 Н-пиразол-1-ил)пропан-2-ил)-1-(2,2-дифторэтил)-2 метил-1 Н-имидазол-4-карбоксамид. Указанное в заголовке соединение получали, используя методику, описанную в примере 3(h), исходя из 1-(2,2-дифторэтил)-2-метил-1 Н-имидазол-4-карбоновой кислоты (0,926 ммоль, 176 мг),(S)-4-(1-(2-аминопропил)-1 Н-пиразол-3-ил)-2-хлор-6-фторбензола (0,617 ммоль, 172 мг) и только каталитического количества HOBt (0,062 ммоль, 8,34 мг). ДМФ использовали в качестве растворителя. Воду добавляли к реакционной смеси и смесь экстрагировали три раза DCM. Объединенные органические экстракты промывали дважды водой. Органическую фазу упаривали и остаток очищали флэшхроматографией и препаративной ВЭЖХ в указанном порядке. В результате получали 15,5 мг указанного в заголовке соединения. 1a) (R)-Этил 1-(2-гидроксипропил)-2-метил-1 Н-имидазол-4-карбоксилат. Этил 2-метил-1 Н-имидазол-4-карбоксилат (3,24 ммоль, 500 мг) и карбонат калия (32,4 ммоль,4482 мг) растворяли в ДМФ (10 мл). (R)-(+)-Пропиленоксид (48,6 ммоль, 3,41 мл) добавляли и образующуюся смесь перемешивали при 60C в течение 5,5 ч. Дополнительное количество(R)-Этил 1-(2-гидроксипропил)-2-метил-1 Н-имидазол-4-карбоксилат (2,474 ммоль, 525 мг) растворяли в метаноле (1 мл) и ТГФ (8 мл). Раствор 2 М NaOH (7,42 ммоль, 3,71 мл) добавляли и образующуюся смесь перемешивали в течение ночи при КТ. pH смеси доводили приблизительно до 5 добавлением 1 М HCl и растворители упаривали. Этанол добавляли и выпавшие в осадок соли удаляли фильтрованием. Фильтрат упаривали. В результате получали 393 мг указанного в заголовке соединения. 1 Н-ЯМР (400 МГц, ДМСО-d6):1,03 (м, 6 Н), 2,30 (с, 3H), 3,71-3,80 (м, 1 Н), 3,81-3,97 (м, 2 Н), 4,95(S)-4-(1-(2-аминопропил)-1 Н-пиразол-3-ил)-2-хлор-6-фторбензонитрила (0,882 ммоль, 246 мг) и используя сухой ДМФ (2 мл) в качестве растворителя. По окончании реакции DCM добавляли и реакционную смесь концентрировали. Сырой продукт очищали флэш-хроматографией и препаративной ВЭЖХ в указанном порядке. В результате получали 177,8 мг указанного в заголовке соединения. 1(S)-N-(1-(3-(3-Хлор-4-циано-5-фторфенил)-1 Н-пиразол-1-ил)пропан-2-ил)-1'-метил-1'Н-1,4'бипиразол-3-карбоксамид. а) Метил 1'-метил-1'Н-1,4'-бипиразол-3-карбоксилат. В раствор метил 1 Н-пиразол-3-карбоксилата (10 г, 79,3 ммоль) в ДМФ (80 мл) добавляли оксид меди (0,567 г, 3,96 ммоль), салицилальдоксим (1,08 г, 7,93 ммоль), Cs2CO3 (64,4 г, 198,4 ммоль) и 1-метил-4-йодпиразол (16,5 г, 79,9 ммоль) и смесь перемешивали при 110C в течение 48 ч. Реакцию га- 24024245 сили насыщенным водным раствором NaHCO3 и реакционную смесь экстрагировали EtOAc. Органический слой концентрировали и очищали флэш-хроматографией. Выход: 2,9 г. 1 Н-ЯМР (400 МГц, ДМСО-d6):3,83 (с, 3H), 3,88 (с, 3H), 7,90 (с, 1 Н), 8,29 (д, 2 Н). ЖХ-МС: [М+Н]=207.b) 1'-Метил-1'Н-1,4'-бипиразол-3-карбоновая кислота. Указанное в заголовке соединение получали, используя методику, описанную в примере 33(с), исходя из метил 1'-метил-1'Н-1,4'-бипиразол-3-карбоксилата (2,9 г, 13,5 ммоль). Выход: 1,4 г. 1(S)-4-(1-(2-аминопропил)-1 Н-пиразол-3-ил)-2-хлор-6-фторбензонитрила (0,718 ммоль, 200 мг) и используя ДМФ (2 мл) в качестве растворителя. DCM добавляли и реакционную смесь упаривали. Остаток очищали флэш-хроматографией. Очищенный продукт растворяли в DCM и промывали три раза 1 М раствором NaHCO3. Объединенные органические экстракты упаривали. В результате получали 134 мг указанного в заголовке соединения. 1 Н-ЯМР (400 МГц, ДМСО-d6):1,15 (д, 3H), 3,88 (с, 3H), 4,28-4,42 (м, 2 Н), 4,42-4,52 (м, 1 Н), 6,75(S)-N-(1-(3-(3-Хлор-4-циано-5-фторфенил)-1 Н-пиразол-1-ил)пропан-2-ил)-1 Н,2'Н-3,3'-бипиразол-5 карбоксамид. а) Этил 1 Н,2'Н-3,3'-бипиразол-5-карбоксилат. Кусочки натрия (0,26 г) медленно добавляли к этанолу (12 мл) при перемешивании до тех пор, пока весь натрий не растворялся. 1-(1 Н-Пиразол-5-ил)этанон (8,61 ммоль, 0,948 г) и диэтилоксалат(8,61 ммоль, 1,258 г) добавляли. Смесь нагревали до 75C в течение 3 ч, после чего перемешивание продолжали при KT в течение ночи. Солянокислый гидразин (8,61 ммоль, 0,590 г), растворенный в воде(6 мл), добавляли. Образующуюся смесь вновь нагревали до 75C в течение 3 ч. Смесь охлаждали до КТ и нейтрализовали путем добавления 2 М NaOH. Смесь экстрагировали дважды EtOAc и объединенные органические экстракты промывали водой и насыщенным раствором соли. Органическую фазу сушили,фильтровали и упаривали. Сырой продукт очищали флэш-хроматографией. В результате получали 0,404 г указанного в заголовке соединения. 1b) 1H,2'Н-3,3'-Бипиразол-5-карбоновая кислота. Этил 1 Н,2'Н-3,3'-бипиразол-5-карбоксилат (1,959 ммоль, 0,404 г) растворяли в этаноле (5 мл) и охлаждали на бане со льдом. Раствор 1 М NaOH (1,959 ммоль, 4 мл) медленно добавляли. Раствор нагревали до 60C в течение 1 ч. Этанол удаляли в вакууме и остаток разбавляли трет-бутилметиловым эфиром. Раствор вновь охлаждали на бане со льдом и подкисляли 2 н. раствором HCl. Раствор оставляли нагреваться до температуры окружающей среды и перемешивали в течение ночи. Воду и DCM добавляли и фазы разделяли. Обе фазы упаривали и объединяли. В результате получали 0,551 г указанного в заголовке соединения. 1c) (S)-N-(1-(3-(3-Хлор-4-циано-5-фторфенил)-1 Н-пиразол-1-ил)пропан-2-ил)-1 Н,2'Н-3,3'-бипиразол 5-карбоксамид. Указанное в заголовке соединение получали, используя методику, описанную в примере 3(h), исходя из 1 Н, 2'Н-3,3'-бипиразол-5-карбоновой кислоты (2,245 ммоль, 0,4 г) и (S)-4-(1-(2-аминопропил)-1 Нпиразол-3-ил)-2-хлор-6-фторбензонитрила (1,871 ммоль, 0,521 г) и используя ДМФ (10 мл) в качестве растворителя. Воду добавляли к реакционной смеси и смесь экстрагировали EtOAc. Органическую фазу промывали 2 М Na2CO3, водой и насыщенным раствором соли. Органическую фазу сушили, фильтровали и упаривали. Сырой продукт очищали флэш-хроматографией и препаративной ВЭЖХ в указанном порядке. В результате получали 0,1277 г указанного в заголовке соединения. 1a) (S)-Этил 1-(2-гидроксипропил)-2-метил-1 Н-имидазол-4-карбоксилат. Этил 2-метил-1 Н-имидазол-4-карбоксилат (1,622 ммоль, 250 мг) и карбонат калия (16,22 ммоль,2241 мг) растворяли в сухом ДМФ (5 мл) в атмосфере азота. (S)-2-Метилоксиран (24,32 ммоль, 1,723 мл) добавляли и образующуюся смесь нагревали до 60C и перемешивали в течение 5,5 ч. Дополнительное количество (S)-2-метилоксирана (1 мл) добавляли и перемешивание продолжали при 60C в течение одного дополнительного часа. Растворитель упаривали. Сырой продукт очищали флэш-хроматографией. В результате получали 139 мг указанного в заголовке соединения. 1(S)-Этил 1-(2-гидроксипропил)-2-метил-1 Н-имидазол-4-карбоксилат (0,655 ммоль, 139 мг) растворяли в метаноле (0,5 мл) и ТГФ (4 мл). Раствор 2 М NaOH (1,965 ммоль, 0,982 мл) добавляли и образующуюся смесь перемешивали в течение ночи при КТ. Смесь подкисляли (pH 5) 1 M HCl и упаривали. Этанол добавляли и выпавшие в осадок соли удаляли фильтрованием. Фильтрат упаривали. В результате получали 112 мг указанного в заголовке соединения. 1(S)-4-(1-(2-аминопропил)-1 Н-пиразол-3-ил)-2-хлор-6-фторбензонитрила (0,507 ммоль, 141 мг), используя ДМФ (2 мл) в качестве растворителя. По окончании реакции DCM добавляли и реакционную смесь упаривали. Остаток очищали флэш-хроматографией. Очищенный продукт растворяли в смеси MeOH/DCM и промывали дважды 1 М раствором NaHCO3. Органическую фазу сушили, фильтровали и упаривали. Продукт затем очищали путем растирания в диэтиловом эфире, фильтровали и сушили в вакууме. В результате получали 31 мг указанного в заголовке соединения. 1(0,303 г, 2,47 ммоль), (Вос)2O (8,1 г, 37,12 ммоль) добавляли и перемешивали при 50C в течение ночи. Растворитель концентрировали при пониженном давлении. Остаток разбавляли Н 2 О и экстрагировалиb) трет-Бутил 3,3'-бипиридин-6-карбоксилат. К раствору трет-бутил 5-бромпиколината (3,5 г, 13,56 ммоль) в ДМФ (40 мл), Pd(OAc)2 (0,152 г,0,68 ммоль), dppf (0,753 г, 1,37 ммоль), CuCl (1,4 г, 13,57 ммоль), Cs2CO3 (8,9 г, 27,13 ммоль) и пиридин 3-ил-бороновую кислоту (3,4 г, 27,13 ммоль) добавляли в атмосфере инертного газа. Реакционную смесь перемешивали при 110C в течение ночи и разбавляли H2O. Смесь фильтровали через слой целита и фильтрат экстрагировали EtOAc. Органический слой концентрировали. Выход: 1,75 г. 1 Н-ЯМР (400 МГц; CDCl3):1,67 (с, 9 Н), 7,43-7,47 (м, 1 Н), 7,91 (д, J=8,0 Гц, 1 Н), 8,01 (дд, 1 Н), 8,17(100 мл) перемешивали при 110C в течение ночи. Реакционную смесь упаривали полностью при пониженном давлении и растирали дважды в диэтиловом эфире. Выход: 3,2 г. 1H-ЯМР (400 МГц; D2O):8,23-8,27 (м, 1 Н), 8,50 (д, 1 Н), 8,84 (д, 1 Н), 8,93 (д, 1 Н), 8,98(S)-N-(1-(3-(3-Хлор-4-циано-5-фторфенил)-1 Н-пиразол-1-ил)пропан-2-ил)-3,3'-бипиридин-6 карбоксамид. Указанное в заголовке соединение получали, используя методику, описанную в примере 3(h), исходя из 3,3'-бипиридин-6-карбоновой кислоты (0,861 ммоль, 172 мг) и (S)-4-(1-(2-аминопропил)-1 Нпиразол-3-ил)-2-хлор-6-фторбензонитрила (0,718 ммоль, 200 мг), используя ДМФ (2 мл) в качестве рас- 26024245 творителя. После остановки реакции DCM добавляли и реакционную смесь упаривали. Остаток очищали флэш-хроматографией и растиранием в метаноле в указанном порядке. В результате получали 75 мг указанного в заголовке соединения. 1 Н-ЯМР (400 МГц, ДМСО-d6):1,18 (д, 3H), 4,35-4,59 (м, 3H), 7,02 (д, 1 Н), 7,55-7,62 (м, 1 Н), 7,877,93 (м, 2 Н), 7,98 (с, 1 Н), 8,06-8,10 (м, 1 Н), 8,19-8,25 (м, 1 Н), 8,35 (дд, 1 Н), 8,68 (дд, 1 Н), 8,99-9,05 (м, 2 Н),9,13 (д, 1 Н). Пример 21.(S)-N-(1-(3-(3-Хлор-4-циано-5-фторфенил)-1 Н-пиразол-1-ил)пропан-2-ил)-6-(3,3 диметилуреидо)имидазо[1,2-а]пиридин-2-карбоксамид. а) Этил 6-(3,3-диметилуреидо)имидазо[1,2-а]пиридин-2-карбоксилат. Этил 6-аминоимидазо[1,2-а]пиридин-2-карбоксилат (0,975 ммоль, 0,2 г) растворяли в ТГФ (10 мл). Триэтиламин (2,92 ммоль, 0,296 г) добавляли и реакционную смесь охлаждали до 0C. Диметилкарбамилхлорид (1,462 ммоль, 0,135 мл) добавляли с осторожностью и смесь оставляли нагреваться до температуры окружающей среды при перемешивании. Дополнительное количество диметилкарбамилхлорида(1,462 ммоль, 0,135 мл) добавляли и перемешивание продолжали в течение еще 1 ч. Растворитель упаривали, DCM добавляли и образующуюся смесь промывали раствором NaHCO3 и водой. Органическую фазу сушили, фильтровали и упаривали. Сырой продукт очищали флэш-хроматографией. В результате получали 0,066 г указанного в заголовке соединения. 1b) 6-(3,3-Диметилуреидо)имидазо[1,2-а]пиридин-2-карбоновая кислота. Этил 6-(3,3-диметилуреидо)имидазо[1,2-а]пиридин-2-карбоксилат (0,239 ммоль, 0,066 г) растворяли в этаноле (5 мл). Раствор охлаждали до 0C и 2 М раствор NaOH (0,478 ммоль, 0,239 мл) добавляли. Образующуюся смесь перемешивали при 0C. Этанол упаривали и воду добавляли. pH водной фазы доводили до 4 добавлением HCl. Смесь экстрагировали EtOAc и органическую фазу сушили, фильтровали и упаривали. Остаток растирали в MeOH/DCM 1/9. Отфильтрованный осадок сушили в вакууме. В результате получали 0,067 г указанного в заголовке соединения. ЖХ-МС: [М-1]=247,24.(S)-4-(1-(2-аминопропил)-1 Н-пиразол-3-ил)-2-хлор-6-фторбензонитрила (0,108 ммоль, 0,04 г), используя ДМФ (4 мл) в качестве растворителя. HBTU (0,027 ммоль, 10,24 мг) использовали вместо HOBt. Продукт осаждался в водной фазе и был отделен фильтрованием. Органическая фаза также содержала продукт. Органическую фазу сушили, фильтровали и упаривали. Объединенные осадки очищали препаративной ВЭЖХ. В результате получали 0,0192 г указанного в заголовке соединения. 1 Н-ЯМР (400 МГц, ДМСО-d6):м.д. 1,13 (д, 3H), 2,95 (с, 6 Н), 4,30-4,54 (м, 3H), 7,01 (д, 1 Н), 7,407,45 (м, 1 Н), 7,47-7,52 (м, 1 Н), 7,87 (д, 1 Н), 7,93 (дд, 1 Н), 7,97 (с, 1 Н), 8,30 (с, 1 Н), 8,39 (широкий с, 1 Н),8,49 (д, 1 Н), 8,87-8,91 (м, 1 Н). Пример 22.a) Этил 6-(N-(метилсульфонил)метилсульфонамидо)имидазо[1,2-а]пиридин-2-карбоксилат. Этил 6-аминоимидазо[1,2-а]пиридин-2-карбоксилат (0,975 ммоль, 0,2 г) растворяли в ТГФ (10 мл). Триэтиламин (9,75 ммоль, 0,986 г) добавляли и смесь охлаждали до 0C. Метансульфонилхлорид(9,75 ммоль, 1,116 г) медленно добавляли и смесь оставляли охлаждать до КТ. Перемешивание продолжали при КТ до окончания реакции. Растворитель упаривали, DCM добавляли и смесь промывали раствором NaHCO3 и водой. Органическую фазу сушили, фильтровали и упаривали. Сырой продукт очищали флэш-хроматографией. В результате получали 0,149 г указанного в заголовке соединения. 1(0,412 ммоль, 0,149 г) растворяли в этаноле (10 мл) и охлаждали до 0C на бане со льдом. Раствор 2 МNaOH (0,825 ммоль, 0,412 мл) добавляли и перемешивали при 0C в течение 3,5 ч, после чего смесь оставляли нагреваться до КТ. Перемешивание продолжали в течение ночи. Температуру повышали до 50C и перемешивали в течение 5 ч. Смесь вновь перемешивали при КТ в течение ночи. Этанол упаривали и воду добавляли. pH доводили до 4 добавлением 1 M HCl, после чего продукт начинал выпадать в осадок. Осадок удаляли фильтрованием и сушили в вакууме. В результате получали 0,057 г указанного в заголовке соединения.DCM (10 мл) в качестве растворителя. HBTU (0,018 ммоль, 6,80 мг) использовали вместо HOBt. Смесь разбавляли DCM и промывали раствором Na2CO3 и водой. Органическую фазу упаривали. Водную фазу и Na2CO3-фазу экстрагировали EtOAc. Сгущенные органические фазы объединяли и очищали препаративной ВЭЖХ. В результате получали 0,0174 г указанного в заголовке соединения. 1 Н-ЯМР (400 МГц, ДМСО-d6):1,14 (д, 3H), 3,04 (с, 3H), 4,27-4,58 (м, 3H), 7,00 (д, 1 Н), 7,27 (дд,1 Н), 7,57-7,62 (м, 1 Н), 7,87 (д, 1 Н), 7,91 (дд, 1 Н), 7,95-7,97 (м, 1 Н), 8,36 (д, 1 Н), 8,49-8,51 (м, 1 Н), 8,55 (д,1 Н), 9,77 (с, 1 Н). Пример 23.N-S)-1-(3-(3-Хлор-4-циано-5-фторфенил)-1 Н-пиразол-1-ил)пропан-2-ил)-5-(1-гидрокси-2 метилпропил)изоксазол-3-карбоксамид. а) Этил 5-(1-гидрокси-2-метилпропил)изоксазол-3-карбоксилат. Этил хлороксимидоацетат (6,79 ммоль, 1,029 г) и 4-метил-1-пентин-3-ол (20,38 ммоль, 2 г) растворяли в толуоле (20 мл). Et3N (6,79 ммоль, 0,947 мл), растворенный в толуоле, добавляли по каплям. Смесь перемешивали в течение ночи при КТ. Смесь разбавляли EtOAc и промывали водой. Органическую фазу сушили, фильтровали и упаривали. Сырой продукт очищали флэш-хроматографией. В результате получали 0,828 г указанного в заголовке соединения. 1b) 5-(1-Гидрокси-2-метилпропил)изоксазол-3-карбоновая кислота. Этил 5-(1-гидрокси-2-метилпропил)изоксазол-3-карбоксилат (2,345 ммоль, 0,5 г) растворяли в этаноле (5 мл) и охлаждали до 0C. Раствор 1 М NaOH (5 мл) медленно добавляли и образующуюся смесь оставляли нагреваться до КТ. Раствор нагревали до 60C в течение 3 ч. Этанол удаляли упариванием и остаток разбавляли трет-бутилметиловым эфиром. Смесь охлаждали до 0C и подкисляли 2 н. растворомHCl. Смесь оставляли нагреваться до температуры окружающей среды и перемешивали в течение ночи. Смесь экстрагировали DCM. И органическая, и водная фазы содержали продукт, поэтому их объединяли и упаривали. В результате получали 0,691 г указанного в заголовке соединения. 1 Н-ЯМР (400 МГц, ДМСО-d6):0,85 (д, 3H), 0,91 (д, 3H), 2,03 (квд, 1 Н), 4,54 (д, 1 Н), 6,66 (с, 1 Н).(S)-4-(1-(2-аминопропил)-1 Н-пиразол-3-ил)-2-хлор-6-фторбензонитрила (1,800 ммоль, 0,502 г), используя ДМФ (10 мл) в качестве растворителя. Реакционную смесь разбавляли водой и EtOAc, фазы разделяли и органическую фазу промывали 2 М раствором Na2CO3, водой и насыщенным раствором соли. Органическую фазу сушили, фильтровали и упаривали. Сырой продукт очищали флэш-хроматографией и препаративной ВЭЖХ в указанном порядке. В результате получали 0,0146 г указанного в заголовке соединения. 1DCM (70 мл) в атмосфере азота. Смесь перемешивали при КТ в течение дня. Растворитель упаривали и пиридин добавляли к остатку. Образующуюся смесь кипятили с обратным холодильником в течение 6 ч и перемешивали при КТ в течение ночи. Пиридин упаривали и остаток разбавляли DCM и водой. Фазы разделяли и водную фазу экстрагировали четыре раза DCM. Объединенные органические вещества промывали водным раствором HCl, насыщенным раствором NaHCO3, водой и насыщенным раствором соли. Органическую фазу сушили, фильтровали и упаривали. Сырой продукт очищали флэш-хроматографией. В результате получали 0,285 г указанного в заголовке соединения. 1b) 5-(1,5-Диметил-1 Н-пиразол-3-ил)-1,2,4-оксадиазол-3-карбоновая кислота. Этил 5-(1,5-диметил-1 Н-пиразол-3-ил)-1,2,4-оксадиазол-3-карбоксилат (1,206 ммоль, 0,285 г) растворяли в этаноле (7 мл) и охлаждали до 0C на бане со льдом. Раствор 1 М NaOH (3 мл) добавляли, баню отставляли и смесь нагревали до 60C в течение 1,5 ч. Этанол упаривали и остаток разбавляли МТВЕ. Смесь вновь охлаждали на бане со льдом и подкисляли 2 М HCl. Смесь нагревали до КТ и перемешивали в течение ночи. Воду, МТВЕ и DCM добавляли, но осадок не растворился. Органическую фазу и водную фазу объединяли и упаривали. В результате получали 0,336 г указанного в заголовке соединения. 1 Н-ЯМР (400 МГц, ДМСО-d6):2,27 (с, 3H), 4,16 (с, 3H), 7,01 (с, 1 Н). с)(S)-4-(1-(2-аминопропил)-1 Н-пиразол-3-ил)-2-хлор-6-фторбензонитрила (1,345 ммоль, 0,375 г), используя ДМФ (10 мл) в качестве растворителя. Реакционную смесь разбавляли водой и EtOAc, фазы разделяли и органическую фазу промывали 2 М раствором Na2CO3, водой и насыщенным раствором соли. Органическую фазу сушили, фильтровали и упаривали. Сырой продукт очищали флэш-хроматографией и препаративной ВЭЖХ в указанном порядке. В результате получали 0,003 г указанного в заголовке соединения. 1(S)-N-(1-(3-(3-Хлор-4-циано-5-фторфенил)-1 Н-пиразол-1-ил)пропан-2-ил)-5-(изоксазол-3-ил)-1,2,4 оксадиазол-3-карбоксамид. а) Этил 5-(изоксазол-3-ил)-1,2,4-оксадиазол-3-карбоксилат. Этил аминогидроксииминоацетат (3,78 ммоль, 0,5 г), 3-изоксазолкарбоновую кислоту (3,78 ммоль,0,428 г) и 1,3-диизопропилкарбодиимид (4,16 ммоль, 0,525 г) растворяли в DCM (70 мл) в атмосфере азота. Смесь перемешивали при КТ в течение дня. Растворитель упаривали досуха и остаток растворяли в пиридине и кипятили с обратным холодильником в течение 6 ч и в течение ночи при КТ. Пиридин упаривали и остаток разбавляли DCM и водой. Водную фазу экстрагировали четыре раза DCM. Объединенные органические экстракты промывали водным раствором HCl, насыщенным раствором NaHCO3, водой и насыщенным раствором соли. Органическую фазу сушили, фильтровали и упаривали. Сырой продукт очищали флэш-хроматографией. В результате получали 0,396 г указанного в заголовке соединения. Ротамеры были получены, исходя из 1 Н-ЯМР, и анализ повторяли при повышенной температуре. 1(5 мл) и охлаждали до 0C на бане со льдом. Раствор 1 М NaOH (4 мл) медленно добавляли и смесь нагревали до 60C в течение 3 ч. Этанол упаривали и остаток разбавляли МТВЕ. Смесь охлаждали до 0C и подкисляли путем добавления 2 М HCl. Смесь перемешивали при КТ в течение ночи. Воду добавляли,фазы разделяли и водную фазу упаривали. В результате получали 0,533 г указанного в заголовке соединения. 1(S)-4-(1-(2-аминопропил)-1 Н-пиразол-3-ил)-2-хлор-6-фторбензонитрила (1,610 ммоль, 0,449 г), используя ДМФ (10 мл) в качестве растворителя. Реакционную смесь разбавляли водой и EtOAc, фазы разделяли и органическую фазу промывали 2 М раствором Na2CO3, водой и насыщенным раствором соли. Органическую фазу сушили, фильтровали и упаривали. Сырой продукт очищали флэш-хроматографией и препаративной ВЭЖХ в указанном порядке. В результате получали 0,0065 г указанного в заголовке соединения. 1a) Лития (Z)-4-(1-бензил-1 Н-имидазол-4-ил)-1-этокси-1,4-диоксобут-2-ен-2-олат. 5-Ацетил-1-бензилимидазол (24,97 ммоль, 5 г) растворяли в сухом диэтиловом эфире (100 мл) в атмосфере азота. Смесь охлаждали до -75C и лития бис-(триметилсилил)амид (27,5 ммоль, 27,5 мл) добавляли по каплям. Образующуюся смесь перемешивали при -75C в течение 1 ч. Диэтилоксалат(32,5 ммоль, 4,74 г) добавляли и смесь оставляли нагреваться до температуры окружающей среды, после
МПК / Метки
МПК: C07D 513/04, C07D 413/14, A61K 31/4164, C07D 413/12, C07D 487/04, C07D 471/04, C07D 401/04, A61P 35/00, C07D 403/04, C07D 403/12
Метки: модулирующие, андрогенные, рецепторы, карбоксамиды
Код ссылки
<a href="https://eas.patents.su/30-24245-karboksamidy-moduliruyushhie-androgennye-receptory.html" rel="bookmark" title="База патентов Евразийского Союза">Карбоксамиды, модулирующие андрогенные рецепторы</a>
Предыдущий патент: Способ получения порошка целлюлозы
Следующий патент: Способ прогнозирования эффективности лечения пациентов с неходжкинской лимфомой высокой степени злокачественности
Случайный патент: Способ и система оценивания набора данных (варианты)












