Макроциклические соединения и способы их получения
Номер патента: 23907
Опубликовано: 29.07.2016
Авторы: Грегори Мэттью Алан, Уилкинсон Барри, Мосс Стивен Джеймс
Формула / Реферат
1. Соединение формулы (I)
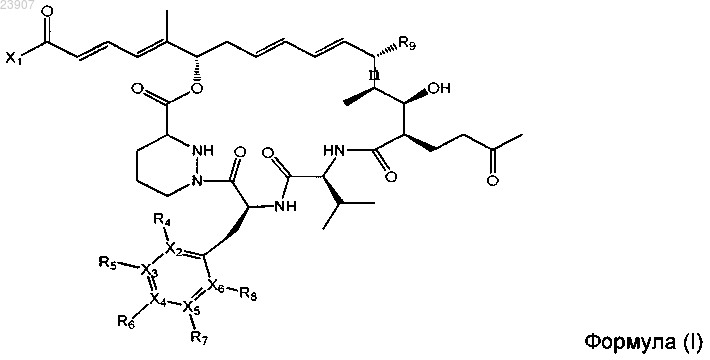
в которой
группа X1 представляет собой -OR1, -NR1R2 или R3;
R1, R2 и R3 независимо представляют собой C1-10алкил, С2-10алкенил, С3-10циклоС1-10алкил, С3-10циклоС2-10алкенил, C1-10алкилС3-10циклоС1-10алкил, С1-10алкилС3-10циклоС2-10алкенил, С2-10алкенилС3-10циклоС1-10алкил, С2-10алкенилС3-10циклоС2-10алкенил, С5-10арил, С5-10гетероарил, содержащий 1-4 гетероатома, C1-10алкил
С5-10арил, C1-10алкилС5-10гетероарил, содержащий 1-4 гетероатома, С2-10алкенилС5-10арил или С2-10алкенилС5-10гетероарил, содержащий 1-4 гетероатома, при этом любая из указанных групп может быть необязательно замещена моноциклическим С5-10арилом или моноциклическим С5-10гетероарилом;
и где один или более атомов углерода в R1, R2 и R3, не являющихся частью С5-10арильной или С5-10гетероарильной группы, необязательно замещены гетероатомом, выбранным из О, N и S(O)p, где р обозначает 0, 1 или 2, и один или более атомов углерода в R1, R2 и R3 необязательно замещены карбонилом;
или R1 и R2 связаны таким образом, что NR1R2 представляет собой насыщенное или ненасыщенное С4-8гетероциклическое кольцо, содержащее указанный атом азота, и где один или более атомов углерода указанного кольца необязательно замещены другим гетероатомом, выбранным из О, N и S(O)p, где р обозначает 0, 1 или 2, и где один или более атомов углерода указанного кольца необязательно замещены карбонилом, при этом такое гетероциклическое кольцо необязательно может быть сконденсировано с С5-10арильным или С5-10гетероарильным кольцом;
и где один или более атомов углерода группы R1, R2 и R3 необязательно могут быть замещены одним или более атомами галогена;
или R1 и/или R2 представляют собой водород;
R9 представляет собой Н или ОН;
n представляет собой одинарную или двойную связь, за исключением того, что когда n представляет собой двойную связь, R9 представляет собой Н;
R4, R5, R6, R7 и R8 независимо представляют собой Н, F, Cl, Br, С2-10алкенил или C1-10алкил, где один или более атомов углерода указанной алкильной группы необязательно замещены гетероатомом, выбранным из О, N и S(O)p, где р обозначает 0, 1 или 2, и где один или более атомов углерода указанной алкильной группы необязательно замещены карбонилом, при этом такая алкильная группа необязательно может быть замещена одним или более атомами галогена;
Х2, Х3, Х4, Х5 и Х6 независимо представляют собой С или N, при этом в том случае, когда любая из указанных групп представляет собой N, присоединенный заместитель отсутствует;
при условии, что когда все R4, R6, R7 и R8 представляют собой Н, а все Х2, Х3, Х4, Х5 и Х6 представляют собой С, то тогда R5 не может представлять собой ОН, -OC1-10алкил или -O(СО)C1-10алкил;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, где n представляет собой одинарную связь.
3. Соединение по п.1 или 2, где R9 представляет собой ОН.
4. Соединение по любому из пп.1-3, где Х2 представляет собой С.
5. Соединение по любому из пп.1-4, где Х3 представляет собой С.
6. Соединение по любому из пп.1-5, где Х4 представляет собой С.
7. Соединение по любому из пп.1-6, где Х5 представляет собой С.
8. Соединение по любому из пп.1-7, где Х6 представляет собой С.
9. Соединение по любому из пп.1-8, где R4 представляет собой Н.
10. Соединение по любому из пп.1-9, где R8 представляет собой Н.
11. Соединение по любому из пп.1-10, где R5 представляет собой ОН.
12. Соединение по любому из пп.1-11, где R6 представляет собой Н, Me или F.
13. Соединение по любому из пп.1-12, где R7 представляет собой Н или F.
14. Соединение по любому из пп.1-13, где R6 и/или R7 представляет собой F.
15. Соединение по любому из пп.1-14, где Х1 представляет собой NR1R2.
16. Соединение по п.15, где R1 представляет собой C1-10алкил, C2-10алкенил, C3-10циклоС1-10алкил, C3-10циклоС2-10алкенил, C1-10алкилС3-10циклоС1-10алкил, C1-10алкилС3-10циклоС2-10алкенил, С2-10алкенилС3-10циклоС1-10алкил, C2-10алкенилС3-10циклоС2-10алкенил, С5-10арил, С5-10гетероарил, содержащий от 1 до 4 гетероатомов, C1-10алкилС5-10арил, C1-10алкилС5-10гетероарил, содержащий от 1 до 4 гетероатомов, С2-10алкенилС5-10арил или С2-10алкенилС5-10гетероарил, содержащий от 1 до 4 гетероатомов, a R2 представляет собой Н, C1-10алкил, С2-10алкенил или -ОС1-10алкил.
17. Соединение по п.15, где NR1R2 представляет собой морфолинил, оксазинан или одну из групп, раскрытых в следующей таблице:
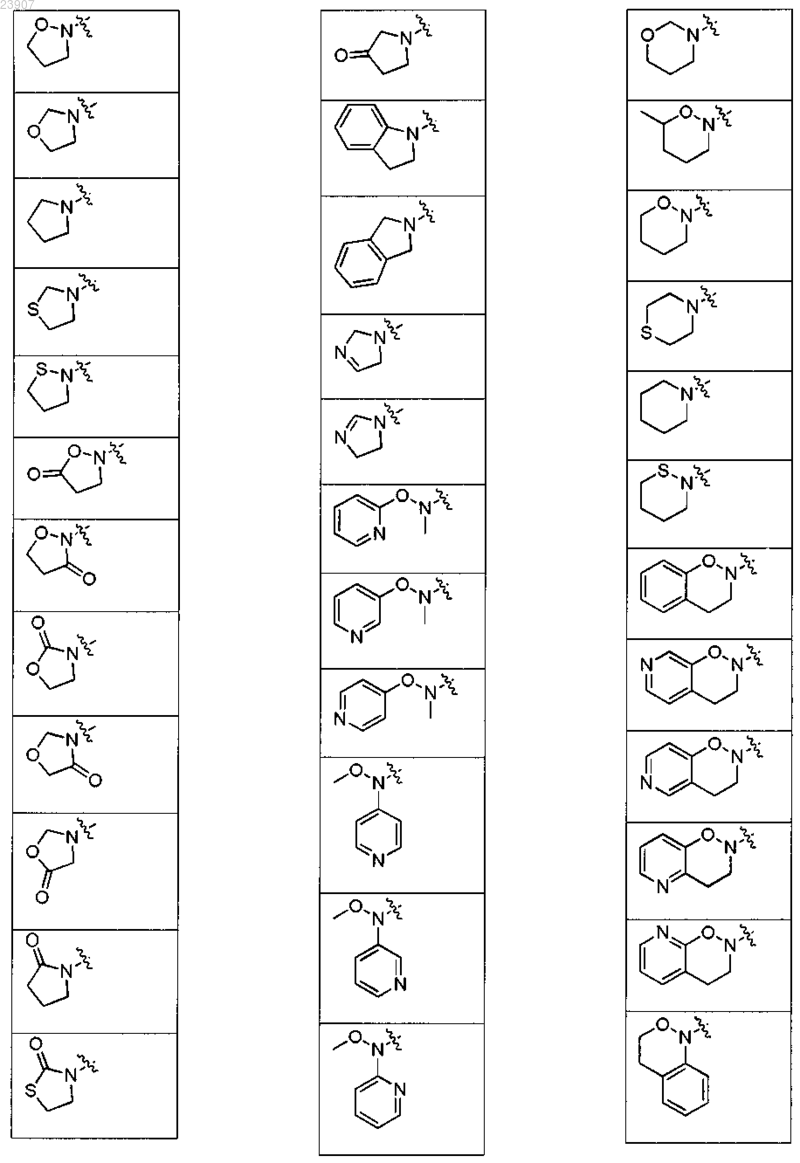
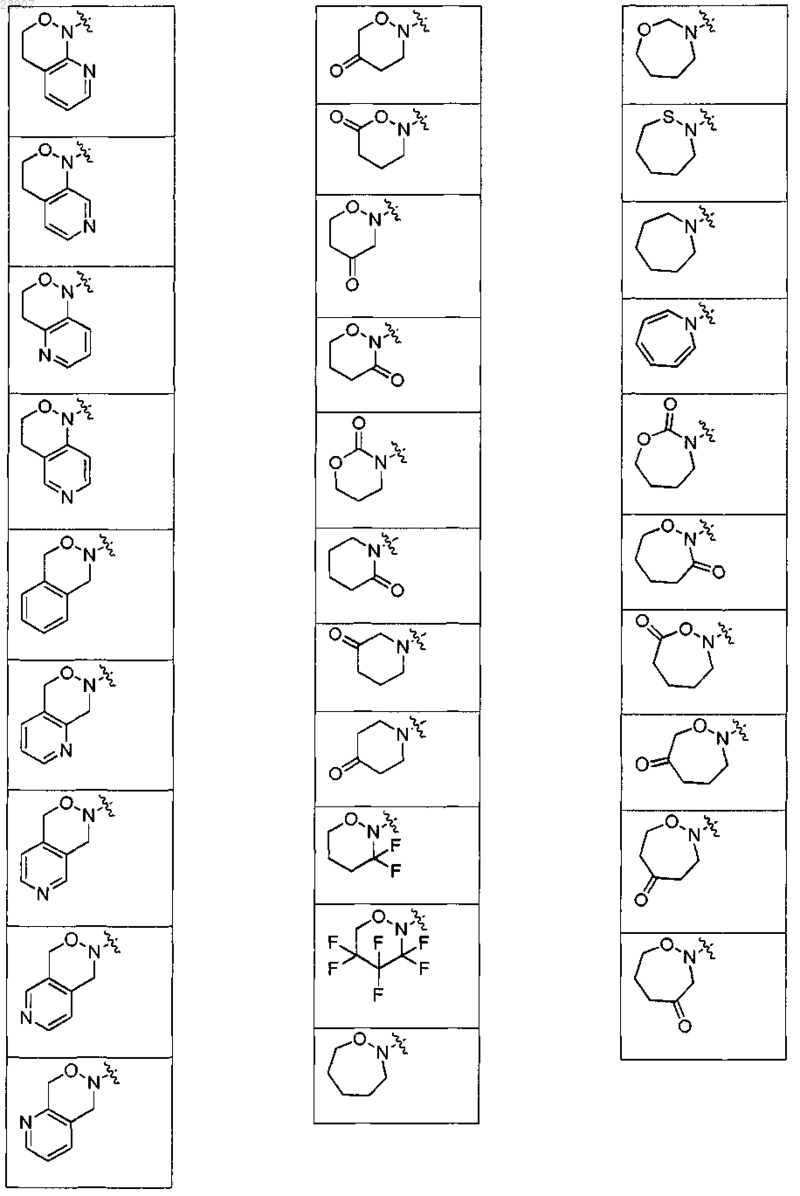
18. Соединение по п.1, выбранное из
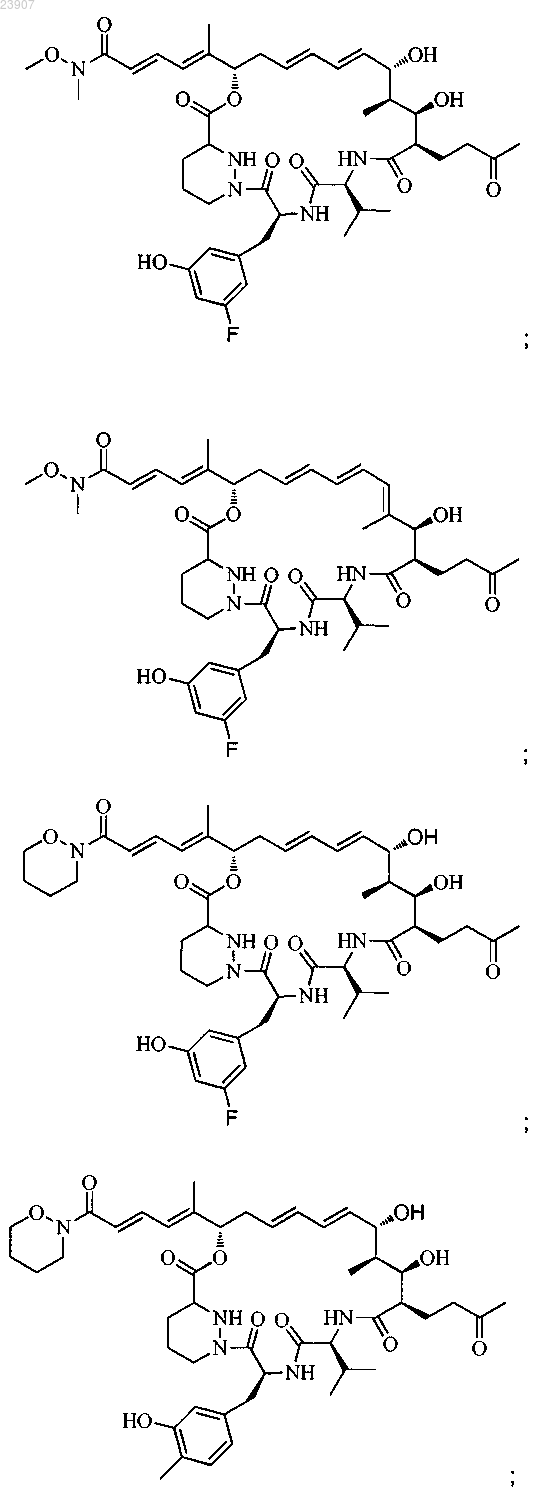
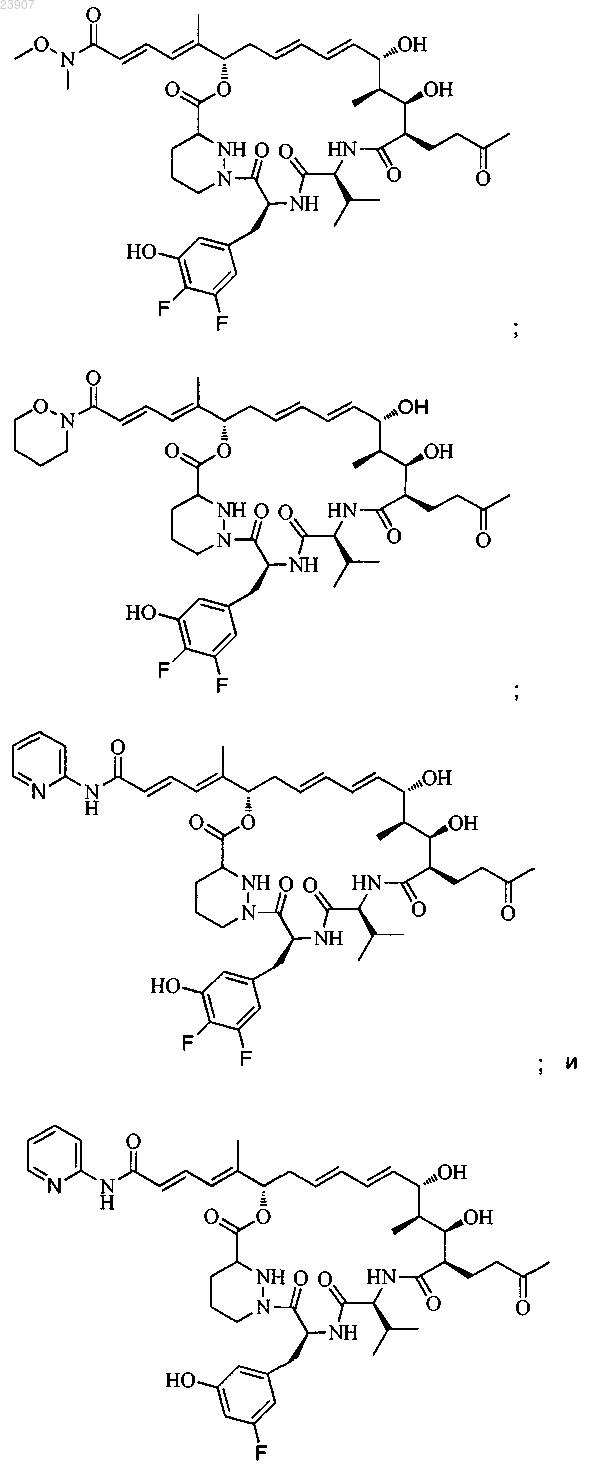
включая любой его таутомер или изомер, в которых С26, 27 С=С связь, показанная как транс, является цис-связью; и включая его метанольный аддукт, в котором кеталь образуется при соединении С-53 кето (если таковая присутствует) и С-15 гидроксильной группы и метанола;
или его фармацевтически приемлемая соль.
19. Применение соединения по любому из пп.1-18 в качестве фармацевтического средства для лечения вирусных инфекций, таких как HCV или ВИЧ-инфекция, или в качестве иммунодепрессанта или противовоспалительного средства.
20. Фармацевтическая композиция для лечения вирусных инфекций, таких как HCV или ВИЧ-инфекция, или в качестве иммунодепрессанта или противовоспалительного средства, включающая соединение по любому из пп.1-18 вместе с фармацевтически приемлемым разбавителем или носителем.
21. Способ лечения вирусных инфекций, таких как HCV или ВИЧ инфекция, который включает введение субъекту терапевтически эффективного количества соединения по любому из пп.1-18.
22. Способ получения соединения по любому из пп.1-18, который включает реакцию соединения формулы V
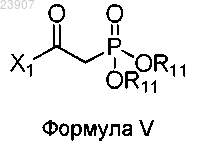
в которой X1 определен в любом из пп.1-18, а каждый R11 независимо является C1-4 алкилом или бензилом;
с альдегидным макроциклом (соединение формулы VI)

где Х2, Х3, Х4, Х5, Х6, R4, R5, R6, R7, R9, R9 и n определены в любом из пп.1-18.
23. Соединение формулы (VI)
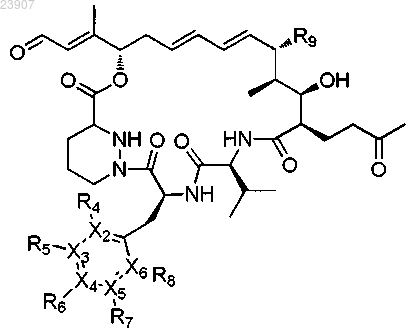
в которой Х2, Х3, Х4, Х5, Х6, R4, R5, R6, R7, R9, R9 и n определены в любом из пп.1-18.
Текст
Среди прочего предложены соединения формулы (I) для применения в лечении вирусной инфекции или в качестве иммунодепрессанта.(71)(73) Заявитель и патентовладелец: НЬЮРОУВИВ ФАРМАСЬЮТИКАЛ АБ (SE) Введение Настоящее изобретение относится к аналогам санглиферина, которые могут применяться в качестве ингибиторов циклофилина, например, при лечении вирусной инфекции, вызываемой такими вирусами,как вирус гепатита С (HCV), вирус гепатита В (HBV) и вирус иммунодефицита человека (ВИЧ), и/или в качестве иммунодепрессантов, например, для применения в профилактике отторжения трансплантата, а также в качестве противовоспалительных средств, например, для применения при воспалительных нарушениях. В настоящем изобретении также предложены способы их применения в медицине, в особенности для лечения HCV или ВИЧ инфекции, и применения в качестве иммунодепрессанта или противовоспалительного средства при заболеваниях, при которых может применяться ингибирование митохондриальной поры транзиентной проницаемости (mPTP), таких как мышечная дистрофия, или в качестве промежуточных соединений при получении других применяемых в медицине соединений. Уровень техники Гепатит С. Вирус гепатита С (HCV) представляет собой вирус с позитивным РНК геномом, а вызываемая им инфекция является основной причиной посттрансфузионного гепатита. HCV является наиболее распространенной хронической инфекцией, передаваемой через кровь, и основной причиной смерти от заболеваний печени в США. По оценке Всемирной организации здравоохранения существует более 170 миллионов хронических носителей HCV инфекции, что составляет приблизительно 3% населения Земли. Приблизительно у 70-85% инфицированных HCV пациентов, не проходивших лечение, развивается хроническая HCV инфекция, и поэтому они подвергаются высокому риску развития цирроза печени и гепатоцеллюлярной карциномы. В развитых странах 50-76% всех случаев рака печени и две трети всех пересадок печени вызваны хронической инфекцией HCV (Manns et al., 2007). В дополнение к болезням печени у пациентов с хронической инфекцией также могут развиваться другие заболевания, ассоциированные с хроническим HCV, при этом они являются источником при передаче HCV другим людям. Инфекция HCV вызывает не связанные с печенью осложнения, такие как артралгии (боль в суставах), кожную сыпь и повреждение внутренних органов, преимущественно почек. Инфекция HCV представляет важную проблему мирового здравоохранения, и в настоящее время не существует ни одной доступной вакцины против гепатита С (Strader et al., 2004; Jacobson et al. 2007; Mannset al., 2007; Pawlotsky, 2005; ZeuzemHermann, 2002). Лечение HCV. Современным стандартом лечения (SoC) являются подкожные инъекции пэгилированного интерферона- (pIFN) и пероральное введение противовирусного средства рибавирина в течение 24-48 недель. Успешное лечение определяется наличием стойкого вирологического ответа (SVR), который определяется отсутствием РНК HCV в сыворотке в конце периода лечения и 6 месяцев спустя. Суммарная эффективность SoC, главным образом, зависит от генотипа и уровней РНК HCV перед лечением. Пациенты с генотипом 2 и 3 будут с большей вероятностью реагировать на SoC, чем пациенты, инфицированные генотипом 1 (Melnikova, 2008; Jacobson et al., 2007). Существенное количество пациентов с HCV не реагирует на терапию SoC должным образом или не может переносить терапию из-за побочных эффектов, что ведет к частым проблемам с прохождением полного курса лечения. Общая клиническая частота SVR при SoC составляет лишь приблизительно 50%(Melnikova, 2008). Развитие резистентности является другим основным фактором неудачной терапии(Jacobson et al., 2007). Для SoC также имеются противопоказания у некоторых пациентов, которых не рассматривают в качестве кандидатов на терапию, таких как пациенты, имевшие случаи тяжелой депрессии или болезни сердца. Побочные эффекты SoC, которые часто приводят к прекращению лечения,включают гриппоподобные симптомы, лихорадку, усталость, гематологическое заболевание, анемию,лейкопению, тромбоцитопению, алопецию и депрессию (Manns et al., 2007). Принимая во внимание побочные эффекты, связанные с длительными терпиями с применениемSoC, развитие резистентности и субоптимальный общий процент случаев успешного лечения, для лечения HCV инфекции срочно требуются более эффективные и более безопасные новые способы лечения. Цели новых способов лечения включают улучшенную эффективность, улучшенный профиль токсичности, улучшенный профиль резистентности, улучшенное качество жизни и итоговое повышение соблюдения пациентом режима лечения. HCV имеет короткий жизненный цикл и поэтому распространено развитие резистентности к лекарственным средствам в ходе лекарственной терапии. Разрабатывается новая, специфично направленная противовирусная терапия против гепатита С(STAT-C), также известная как противовирусные лекарственные средства прямого действия (DAA), которые направлены против вирусных белков, таких как вирусная РНК-полимераза NS5B или вирусная протеаза NS3 (Jacobson et al., 2007; Parfieniuk et al., 2007). Кроме того, также разрабатываются новые соединения, которые направлены против белков человека (например, циклофилины), а не против вирусных мишеней, что может привести к снижению частоты случаев развития резистентности при лекарственной терапии (Manns et al., 2007; Pockros, 2008; Pawlotsky J-M, 2005). Ингибиторы циклофилинов. Циклофилины (СуР) являются семейством клеточных белков, которые проявляют пептидил-пролил цис-транс-изомеразную активность, облегчающую изменения конформации и фолдинг белка. Белки СуР участвуют в клеточных процессах, таких как регуляция транскрипции, иммунный ответ, секреция белков и митохондриальная функция. Вирус HCV использует белки СуР в своем жизненном цикле при заражении человека. Первоначально считалось, что белки СуР стимулируют РНК-связывающую активность неструктурного белка HCV NS5B, РНК-полимеразы, которая способствует репликации РНК, хотя были предложены несколько альтернативных гипотез, включая необходимость для РР 1-азной активности СуР. Различные изоформы СуР, включая А и В, как полагают, вовлечены в жизненный цикл HCV (Yang et al.,2008; Appel et al., 2006; Chatterji et al., 2009; Gaither et al., 2010). Способность вызывать нокауты в мышиных (Colgan et al., 2000) и человеческих Т-клетках (Braaten and Luban, 2001) указывает, что СуРА не обязателен для роста и выживания клеток. Подобные результаты наблюдали при прерывании гомологов СуРА в бактериях (Herrler et al., 1994), Neurospora (Tropschug et al., 1989) и Saccharomyces cerevisiae (Dolinski et al., 1997). Таким образом, ингибирование белков СуР представляет новую и привлекательную хозяйскую мишень для лечения инфекции HCV, a также новое потенциальное дополнение к существующим лекарственным средствам SoC или STAT-C/DAA с целью увеличения SVR, предотвращения развития резистентности и уменьшения побочных эффектов при лечении. Циклоспорин A (Inoue et al., 2003) (CsA) и его близкие структурные неиммунодепрессивные клинические аналоги DEBIO-025 (Paeshuyse et al., 2006; Flisiak et al., 2008), NIM811 (Mathy et al., 2008) и SCY635 (Hopkins et al., 2009), как известно, связываются с циклофилинами и в качестве ингибиторов циклофилина показали in vitro и клиническую эффективность при лечении инфекции HCV (Crabbe et al., 2009;Flisiak et al., 2008; Mathy et al., 2008; Inoue et al., 2007; Ishii et al., 2006; Paeshuyse et al., 2006). Хотя предшествующие исследования резистентности к CsA выявили мутации в РНК-полимеразе NS5B HCV и привели к предположению, что только циклофилин В будет участвовать в процессе репликации HCV (Robida et al., 2007), недавние исследования указали на существенную роль циклофилина А в репликацииHCV (Chatterji et al., 2009; Yang et al., 2008). Принимая во внимание то, что мутации в вирусном белкеNS5A также связаны с резистентностью к CsA, и что NS5A взаимодействует и с СуРА, и с СурВ для их специфичной пептидил-пролил цис/транс-изомеразной (PPI-азной) активности, также предполагается роль обоих циклофилинов в вирусном жизненном цикле (Hanoulle et al., 2009). Действие аналогов циклоспорина против HCV не зависит от иммунодепрессивных свойств, которые зависят от кальциневрина. Это означает, что существенным требованием для активности HCV является связывание СуР, и связывание кальциневрина не требуется. DEBIO-025, наиболее клинически совершенный ингибитор циклофилина для лечения HCV, показал in vitro и in vivo активность против четырех самых распространенных генотипов HCV (генотипы 1, 2, 3 и 4). Исследования резистентности показали,что мутации, придающие устойчивость к DEBIO-025, отличались от мутаций, описанных для ингибиторов полимераз и протеаз, и что не было никакой перекрестной резистентности со STAT-C/DAA рези-2 023907 стентными вирусными репликонами. Что еще более важно, DEBIO-025 также предотвращал развитие мутаций ускользания, которые придают резистентность к ингибиторам протеаз и полимераз (Crabbe etal., 2009). Впрочем, ингибиторы циклофилина на основе CsA в клиническом исследовании имеют множество проблем, которые, как полагают, связаны с их общим структурным классом и включают некоторые нежелательные явления, которые могут приводить к прекращению терапии и ограничивать уровни клинической дозы; переменная фармакокинетика, которая может приводить к переменной эффективности; и повышенный риск взаимодействий между лекарственными средствами, что может привести к сложностям с введением доз. Наиболее частые нежелательные явления (АЕ) у пациентов, которые получали DEBIO-025, включали желтуху, боль в животе, рвоту, усталость и повышенную температуру. Наиболее клинически важными АЕ являлись гипербилирубинемия и снижение количества тромбоцитов (тромбоцитопения). ПЭГ-IFN может вызывать сильную тромбоцитопению, и комбинация с DEBIO-025 может представлять существенную клиническую проблему. Одновременное повышение билирубина и снижение тромбоцитов также было описано в ранних клинических исследованиях с NIM-811 (Ke et al., 2009). Хотя гипербилирубинемия, наблюдаемая в ходе клинических исследований DEBIO-025, устранялась после прекращения терапии, она стала причиной прекращения терапии у 4 из 16 пациентов и снижения уровней дозы в будущих испытаниях. Поскольку противовирусное действие ингибиторов циклофилина при HCV зависит от дозы,снижение дозы привело к уменьшению противовирусного действия, при этом в ряде последующих испытаний с ингибиторами циклофилина на основе CsA не было показано никаких или показано слабое снижение вирусной нагрузки HCV при введении доз в качестве монотерапии (Lawitz et al., 2009; Hopkins etal., 2009; Nelson et al., 2009). DEBIO-025 и циклоспорин А, как известно, являются ингибиторами транспортеров желчи, таких как экспортирующие помпы солей желчных кислот, и других транспортеров печени (в особенности OAT1B1/OAT1B3/MRP2/MRP3/cMOAT/ABCC2) (Crabbe et al., 2009). Было выдвинуто предположение, что взаимодействие с транспортерами желчи, в частности с MRP2, может являться причиной гипербилирубинемии, наблюдаемой при высоких уровнях дозы DEBIO-025 (Nelson et al., 2009,Wring et al., 2010). Межлекарственные взаимодействия (DDI) с соединениями класса CsA через ингибирование других транспортеров лекарственных веществ, таких как Р-гликопротеин (Pgp/MDR1), BSEP,OAT1B1 и ОАТ 1 В 3 (Konig et al., 2010), также могут представлять проблему, потенциально ограничивая некоторые комбинации и применение у некоторых пациентов, подвергающихся терапии при сопутствующих инфекциях, таких как ВИЧ-инфекция (Seden et al., 2010). Кроме того, DEBIO-025 и циклоспорин А являются субстратами для метаболизма под действием цитохрома Р 450 (в особенности CYP3A4) и, как известно, являются субстратами и ингибиторами человеческого Р-гликопротеина (MDR1) (Crabbe et al., 2009). Также было показано, что циклоспорин А является ингибитором CYP3A4 in vitro (Niwa et al., 2007). Это указывает на то, что мог существовать повышенный риск межлекарственных взаимодействий с другими лекарственными средствами, которые являются субстратами, индукторами или ингибиторами CYP3A4, такими как, например, кетоконазол, циметидин и рифампицин. Кроме того, также ожидаются взаимодействия с лекарственными средствами, которые подвергаются транспорту Р-гликопротеином (например, дигоксин), что может вызывать сильные межлекарственные взаимодействия у пациентов с HCV, получающих лекарственную терапию для лечения других сопутствующих заболеваний (Crabbe et al., 2009). CsA, как также известно, имеет высоковариабельную фармакокинетику, причем предшествующие лекарственные формы демонстрировали биодоступность 1-89% при приеме внутрь (Kapurtzak et al., 2004). Без дорогостоящего контроля уровней в крови пациента это может привести к увеличению частоты возникновения побочных эффектов, вследствие повышенных уровней в плазме или к уменьшению клинического эффекта, вследствие пониженных уровней в плазме. С учетом того, что ингибирование циклофилинов представляет новый многообещающий подход к лечению HCV, существует потребность в открытии и создании более эффективных и безопасных ингибиторов СуР для применения в комбинированной терапии против HCV инфекции. Санглиферины. Санглиферин A (SfA) и родственные ему природные соединения относятся к классу смешанных нерибосомных пептид/поликетидов, продуцируемых Streptomyces. sp. A92-308110 (также известным какDSM 9954) (см., WO 97/02285), которые первоначально были обнаружены, благодаря их высокой аффинности к циклофилину А (СуРА). SfA является наиболее распространенным компонентом в ферментативных питательных средах и демонстрирует приблизительно в 20 раз более высокую аффинность к СуРА по сравнению с CsA. Это привело к предположению, что санглиферины могли бы применяться для лечения HCV (WO 2006/138507). Также было показано, что санглиферины проявляют более низкую иммунодепрессивную активность, чем CsA, при анализе in vitro (Sanglier et al., 1999; Fehr et al., 1999). SfA связывается с высокой аффинностью с CsA-связывающим сайтом СуРА (Kallen et al., 2005). Биосинтез санглиферинов. Санглиферины биосинтезируются смешанной поликетидсинтазой (PKS)/нерибосомной пептидсинтетазой (NRPS) (см. WO 2010/034243). 22-Членный макролидный каркас состоит из поликетидной углеродной цепи и трипептидной цепи. Пептидная цепь состоит из одной природной аминокислоты, валина,и двух неприродных аминокислот: (S)-метатирозина и (S)-пиперазиновой кислоты, связанных амидной связью. Гидроксилирование фенилаланина (in situ на NRPS или перед биосинтезом), с образованием (S)метатирозина, как полагают, проходит через продукт гена sfaA. Иммунодепрессивное действие санглиферинов. Иммунодепрессивный механизм действия SfA отличается от механизма действия других известных иммунофилин-связывающих иммунодепрессивных лекарственных средств, таких как CsA, FK506 и рапамицин. SfA не ингибирует фосфатазную активность кальциневрина, мишени CsA (Zenke et al., 2001),вместо этого его иммунодепрессивную активность связывали с ингибированием интерлейкина-6 (Hartel etal., 2005), интерлейкина-12 (Steinschulte et al., 2003) и ингибированием пролиферации интерлейкин-2 зависимых Т-клеток (ZhangLiu, 2001). Однако молекулярная мишень и механизм, посредством которогоSfA проявляет свое иммунодепрессивное действие, до настоящего времени остаются не известными. Молекулярная структура SfA сложна и его взаимодействие с СуРА, как полагают, в значительной степени опосредовано макроциклической частью молекулы. Фактически, макроциклическое соединение(гидроксимакроцикл), полученное в результате окислительного расщепления SfA, показало сильную аффинность к СуРА (Sedrani et al., 2003). Данные рентгено-кристаллографического анализа показали, что гидроксимакроцикл связывается с тем же активным сайтом СуРА, что и CsA. Аналоги на основе макроциклической группы SfA, как было также показано ранее, не обладают иммунодепрессивными свойствами (Sedrani et al., 2003), что обеспечивает возможность создания неиммунодепрессивных ингибиторов СуР для потенциального применения в терапии HCV. В противоположность этому также существует возможность создания иммунодепрессивных средств с низкой токсичностью для применения в таких областях, как профилактика отторжения трансплантата, аутоиммунных, воспалительных и дыхательных нарушений, включая, без ограничения, болезнь Крона, синдром Бехчета, увеит, псориаз, атопический дерматит, ревматоидный артрит, нефритический синдром, апластическую анемию, билиарный цирроз печени, астму, фиброз легких, хроническую обструктивную болезнь легких (ХОБЛ) и глютеновую энтеропатию. Было показано, что санглиферины имеют новый механизм иммунодепрессивной активности (Zenke et al., 2001), потенциально действуя через хемокины дендритных клеток (Immecke et al., 2011), и поэтому существует возможность создания средств, механизм действия которых отличается от механизма действия существующих клинических средств, таких как циклоспорин А, рапамицин и FK506. Было показано, что санглиферин А в 10 раз менее активен, чем циклоспорин А, таким образом, идеальное новое средство могло бы иметь улучшенную активность и/или терапевтическое окно. Другие терапевтические применения ингибиторов циклофилинов. Вирус иммунодефицита человека (ВИЧ). Было также показано, что ингибиторы циклофилинов, такие как CsA и DEBIO-025, могут потенциально применяться при ингибировании репликации ВИЧ. Ингибиторы циклофилинов, как полагают, нарушают функцию СуРА в процессе/завершении обратной транскрипции ВИЧ (Ptak et al., 2008). Впрочем,при клинической проверке DEBIO-025 лишь снижал уровни РНК ВИЧ-1 0,5 и 1 log10 копий/мл у девяти и двух пациентов соответственно, тогда как у 27 из проходивших терапию пациентов не было показано никакого уменьшения уровней РНК ВИЧ-1 (Steyn et al., 2006). После этого DEBIO-025 испытывали у пациентов с сочетанной инфекцией HCV/ВИЧ, при этом он показал лучшую эффективность противHCV, и клинические испытания по ВИЧ были прекращены (см. Watashi et al., 2010). Лечение ВИЧ. Более 30 млн человек в мире инфицированы ВИЧ-1, при этом каждый год регистрируют 3 млн новых случаев. Варианты лечения были существенно усовершенствованы с введением высокоактивной антиретровирусной терапии (HAAPT) (Schopman et al., 2010). К 2008 г. было лицензировано почти 25 антиретровирусных средств для лечения ВИЧ-1, включая девять нуклеозидных ингибиторов обратной транскриптазы (NRTI), четыре ненуклеозидных ингибитора обратной транскриптазы (NNRTI), девять ингибиторов протеазы (PI), один ингибитор слияния, один ингибитор CCR5 и один ингибитор интегразы(ShaferSchapiro, 2008). Однако ни один из этих существующих режимов не приводит к полному устранению вируса, при этом они могут вызывать тяжелые побочные эффекты, и резистентность к противовирусным средствам все еще остается главной проблемой. Таким образом, сохраняется потребность в новых противовирусных терапиях, в особенности по механизму действия таких классов, в которых нет никаких разрешенных лекарственных средств, как в случае ингибиторов циклофилинов. Вирус гепатита В. Вирус гепатита В является ДНК-вирусом семейства Hepadnaviridae (гепаднавирусы) и возбудителем гепатита В. В противоположность случаям с HCV и ВИЧ, было очень мало опубликованных сообщений относительно активности ингибиторов циклофилинов против вируса гепатита В. Ptak с сотр. (2008) описывали слабую активность DEBIO-025 против HBV (IC50 4,1 мкМ), тогда как Xie с сотр. (2007) описывали некоторую активность CsA против HBV (IC501,3 мкг/мл). Это отличается от ВИЧ и HCV, по которым имеются многочисленные сообщения о наномолярной противовирусной активности ингибиторов циклофилинов. Лечение HBV. Вирус HBV инфицирует до 400 млн человек во всем мире и является главной причиной хронического вирусного гепатита и гепатоцеллюлярной карциномы. На 2008 г. было зарегистрировано шесть лекарственных средств, лицензированных для лечения HBV; интерферон- и пэгилированный интерферон-, три аналога нуклеозидов (ламивудин, энтекавир и телбивудин) и один аналог нуклеотидов (адефовир дипивоксил). Однако из-за высокой частоты устойчивости, плохой переносимости и возможных побочных эффектов необходимы новые терапевтические варианты (Ferir et al., 2008). Ингибирование митохондриальной поры транзиентной проницаемости (mPTP). Открытие высокопроводящих пор транзиентной проницаемости в митохондриях инициирует митохондриальную транзиентную проницаемость (МРТ). Это является причинным фактором, ведущим к некрозу и апоптозу в гепатоцитах после окислительного стресса, Са 2+ токсичности и ишемии/реперфузии. Ингибирование циклофилина D (также известно как циклофилин F) ингибиторами циклофилинов, как было показано, блокирует открытие пор транзиентной проницаемости и защищает от гибели клеток после таких стрессов. Ингибиторы циклофилина D поэтому могут применяться при таких показаниях, в которых вовлечено открытие mPTP, таких как мышечная дистрофия, в частности врожденная мышечная дистрофия Ульриха и миопатия Бетлема (Millay et al., 2008, WO 2008/084368, Palma et al., 2009), рассеянный склероз (Forte et al., 2009), диабет (Fujimoto et al., 2010), амиотрофический боковой склероз (Martin 2009), биполярное расстройство (Kubota et al., 2010), болезнь Альцгеймера (Du and Yan, 2010), болезнь Хантингтона (Perry et al., 2010), восстановление после инфаркта миокарда (Gomez et al., 2007) и хроническое потребление алкоголя (King et al., 2010). Другие терапевтические применения. Ингибиторы циклофилинов обладают потенциальной активностью против других вирусов и поэтому при лечении вызываемых ими инфекций, например вируса ветряной оспы (Ptak et al., 2008), вируса гриппа A (Liu et al., 2009), коронавируса, вызывающего тяжелый острый респираторный синдром, а также других коронавирусов человека и кошек (Chen et al., 2005, Ptak et al., 2008), вируса лихорадки денге(Kaul et al., 2009), вируса желтой лихорадки (Qing et al., 2009), вируса Западного Нила (Qing et al., 2009),вируса западного энцефалита лошадей (Qing и др., 2009), цитомегаловируса (Kawasaki et al., 2007) и вируса осповакцины (Castro et al., 2003). Также имеются сообщения о применимости ингибиторов циклофилинов и ингибирования циклофилинов в других терапевтических областях, например при раке (Han et al., 2009). Общие замечания по поводу санглиферинов. Одной из проблем при создании лекарственных препаратов на основе таких соединений, как санглиферины, является быстрый метаболизм и глюкуронидация, приводящие к низкой биодоступности при приеме внутрь. Это может привести к увеличению вероятности влияния пищи, к более высокой частоте неполного высвобождения из лекарственной формы и более высокой вариации в зависимости от пациента. Таким образом, сохраняется потребность в идентификации новых ингибиторов циклофилинов, которые могут применяться в частности в лечении HCV инфекции, но также и в лечении других заболеваний, при которых ингибирование циклофилинов может быть полезным, например, при ВИЧ инфекции,мышечной дистрофии, или для восстановления после инфаркта миокарда, или в тех случаях, когда полезны иммунодепрессия или противовоспалительное действие. Предпочтительно такие ингибиторы циклофилинов обладают улучшенными свойствами по сравнению с доступными в настоящее время ингиби-5 023907 торами циклофилинов, включая одно или более следующих свойств: более длительный полупериод существования или увеличенная биодоступность при приеме внутрь, возможно в результате сниженного метаболизма под действием Р 4 50 и/или пониженной глюкуронидации, повышенная растворимость в воде, повышенная активность против HCV, сниженная токсичность (включая гепатотоксичность), улучшенный фармакологический профиль, например высокая экспозиция в целевых органах (например, печени в случае HCV), и/или длительный полупериод существования (позволяющий выполнять менее частое введение доз), пониженная частота взаимодействий между лекарственными средствами, например,посредством сниженных уровней метаболизма под действием CYP3A4 и ингибирования и уменьшенное(Pgp) ингибирование (что позволяет с большей легкостью получать комбинации нескольких лекарственных средств) и улучшенный профиль побочных эффектов, например слабое связывание с MRP2, что приводит к уменьшению вероятности гипербилирубинемии, пониженное иммунодепрессивное действие,повышенная активность против резистентных вирусных штаммов, в частности резистентных к CsA и аналогу CsA (например, DEBIO-025) вирусных штаммов, а также более высокий терапевтический (и/или селективный) индекс. В настоящем изобретении раскрыты новые аналоги санглиферинов, которые могут обладать одним или более вышеуказанными свойствами. В частности в настоящем изобретении раскрыты новые мутасинтетические аналоги санглиферинов, которые, как ожидают, будут характеризоваться уменьшенным метаболизмом под действием Р 450 или глюкуронидацией, что, например, выражается в увеличенном полупериоде существования в микросомах и/или сниженной повышенной активностью против HCV, например, как показано низким ЕС 50 репликонов. Кроме того, также существует потребность в создании новых иммунодепрессивных средств, которые могут применяться в профилактике отторжения трансплантата или в лечении аутоиммунных, воспалительных и дыхательных нарушений. Предпочтительно такие иммунодепрессанты обладают улучшенными свойствами по сравнению с известными природными санглиферинами, включая одно или более следующих свойств: более длительный полупериод существования или увеличенная биодоступность при приеме внутрь, возможно в результате сниженного метаболизма под действием Р 450 и/или пониженной глюкуронидации, повышенная растворимость в воде, повышенная активность иммунодепрессивного действия, что можно наблюдать в анализах пролиферации Т-клеток, сниженная токсичность (включая гепатотоксичность), улучшенный фармакологический профиль, например высокая экспозиция в целевом органе и/или длительный полупериод существования (позволяющий выполнять менее частое введение доз), пониженная частота взаимодействий между лекарственными средствами, например, посредством сниженных уровней метаболизма под действием CYP3A4 и ингибирования и уменьшенное (Pgp) ингибирование (что позволяет с большей легкостью получать комбинации нескольких лекарственных средств) и улучшенный профиль побочных эффектов. В настоящем изобретении раскрыты новые аналоги санглиферинов, которые могут обладать одним или более вышеуказанными свойствами. В частности в настоящем изобретении раскрыты новые производные, которые характеризуются уменьшенным метаболизмом под действием Р 450 или глюкуронидацией, что, например, выражается в увеличенном полупериоде существования в микросомах и/или повышенной иммунодепрессивной активности, например, как показано низким IC50 пролиферации Тклеток. Таким образом, как может быть замечено из примеров, соединения изобретения обладают следующими благоприятными терапевтически релевантными свойствами: улучшенной противовирусной активностью против HCV и ВИЧ по сравнению с ингибиторами циклофилинов циклоспорином А, DEBIO-025 (алиспоривир) и санглиферином А предшествующего уровня техники; уменьшенным клиренсом и увеличенной экспозицией при приеме внутрь по сравнению с соединением предшествующего уровня техники санглиферином А; более активным ингибированием PPI-азной активности СурА по сравнению с ингибиторами циклофилинов циклоспорином А, DEBIO-025 (алиспоривир) и санглиферином А предшествующего уровня техники; улучшенным профилем побочных эффектов и уменьшенной частотой взаимодействий между лекарственными средствами, что демонстрируется уменьшенным ингибированием транспортеров билирубина (ОАТР-1 В 1, ОАТР-1 В 3, MRP2 и MRP3) и уменьшенным ингибированием транспортеров ксенобиотиков (Pgp и BSEP). Сущность изобретения В настоящем изобретении предложены новые макроциклические аналоги санглиферинов, которые были получены посредством полусинтетической модификации мутасинтетических санглиферинов. Указанные аналоги могут быть получены при дигидроксилировании мутасинтетического санглиферина, например, описанного в формуле IIA и формуле IIB, с последующим расщеплением с образованием альдегидного макроцикла, сопровождаемым дальнейшими химическими реакциями, включая реакции по типу Хорнера-Эммонса и другие реакции конденсации с участием альдегида, с получением молекул с разнообразными заместителями, замещающими альдегид. В результате в настоящем изобретении предложены макроциклические аналоги санглиферинов, способы получения указанных соединений и способы приме-6 023907 нения таких соединений в медицине или в качестве промежуточных соединений при получении других соединений. Таким образом, в первом аспекте настоящего изобретения предложены макроциклические аналоги санглиферинов и их производные согласно формуле (I) ниже или их фармацевтически приемлемая сольR1, R2 и R3 независимо представляют собой C1-10 алкил, С 2-10 алкенил, С 3-10 циклоС 1-10 алкил, С 3-10 циклоС 2-10 алкенил, С 1-10 алкилС 3-10 циклоС 1-10 алкил, С 1-10 алкилС 3-10 циклоС 2-10 алкенил, С 2-10 алкенилС 3-10 циклоС 1-10 алкил, С 2-10 алкенилС 3-10 циклоС 2-10 алкенил, С 5-10 арил, С 5-10 гетероарил, содержащий 1-4 гетероатома, C1-10 алкилС 5-10 арил, C1-10 алкилС 5-10 гетероарил, содержащий 1-4 гетероатома, С 2-10 алкенилС 5-10 арил или С 2-10 алкенилС 5-10 гетероарил, содержащий 1-4 гетероатома, при этом любая из указанных групп может быть необязательно замещена моноциклическим С 5-10 арилом или моноциклическим С 5-10 гетероарилом; и где один или более атомов углерода в R1, R2 и R3, не являющихся частью С 5-10 арильной или С 5-10 гетероарильной группы, необязательно замещены гетероатомом, выбранным из О, N и S(O)p, где р обозначает 0, 1 или 2, и где один или более атомов углерода в R1, R2 и R3 необязательно замещены карбонилом; или R1 и R2 связаны таким образом, что NR1R2 представляет собой насыщенное или ненасыщенное С 4-8 гетероциклическое кольцо, содержащее указанный атом азота, и где один или более атомов углерода указанного кольца необязательно замещены другим гетероатомом, выбранным из О, N и S(O)p, где р обозначает 0, 1 или 2, и где один или более атомов углерода указанного кольца необязательно замещены карбонилом, при этом такое гетероциклическое кольцо необязательно может быть сконденсировано с С 5-10 арильным или С 5-10 гетероарильным кольцом; и где один или более атомов углерода группы R1, R2 и R3 необязательно могут быть замещены одним или более атомами галогена; или R1 и/или R2 представляют собой водород;n представляет собой одинарную или двойную связь, за исключением того, что когда n представляет собой двойную связь, R9 представляет собой Н;R4, R5, R6, R7 и R8 независимо представляют собой Н, F, Cl, Br, С 2-10 алкенил или C1-10 алкил, где один или более атомов углерода указанной алкильной группы необязательно замещены гетероатомом, выбранным из О, N и S(O)p, где р обозначает 0, 1 или 2, и где один или более атомов углерода указанной алкильной группы необязательно замещены карбонилом, при этом такая алкильная группа необязательно может быть замещена одним или более атомами галогена; Х 2, Х 3, Х 4, Х 5 и Х 6 независимо представляют собой С или N, при этом в том случае, когда любая из указанных групп представляет собой N, присоединенный заместитель отсутствует; при условии, что когда все R4, R6, R7 и R8 представляют собой Н, а все Х 2, Х 3, Х 4, Х 5 и Х 6 представляют собой С, то тогда R5 не может представлять собой ОН, -OC1-10 алкил или -O(CO)C1-10 алкил; или его фармацевтически приемлемая соль. Определения. Используемый в настоящем описании термин "аналог(и)" относится к химическим соединениям,которые структурно подобны другому соединению, но которые несколько отличаются по составу (как,например, в случае замены одного атома другим атомом или в случае присутствия или отсутствия конкретной функциональной группы). Используемый в настоящем описании термин "санглиферин(ы)" относится к химическим соединениям, которые структурно подобны санглиферину А, но которые несколько отличаются по составу (как,например, в случае замены одного атома другим атомом или в случае присутствия или отсутствия конкретной функциональной группы), в особенности продуцируемым при ферментации Streptomyces sp. А 92-308110. Примеры включают санглиферинподобные соединения, описанные в WO 97/02285 и WO 98/07743, такие как санглиферин В. Используемый в настоящем описании термин "мутасинтетический санглиферин(ы)" или "мутасинтетический аналог(и) санглиферина" относится к химическим соединениям, которые структурно подобны санглиферину А, В, С или D, но которые несколько отличаются по составу (как, например, в случае замены одного или более атомов другим атомом или в случае присутствия или отсутствия конкретной функциональной группы), в частности продуцируемым при ферментации Streptomyces sp. A92-308110 или их мутанта, где в культуру подается аналог метатирозина. Используемый в настоящем описании термин "аналог(и) метатирозина" относится к химическим соединениям, которые структурно подобны метатирозину, но которые несколько отличаются по составу(как, например, в случае замены одного или более атомов другим атомом или в случае присутствия или отсутствия конкретной функциональной группы), в частности описанным в формуле (III). Используемый в настоящем описании термин "макроциклический аналог", "макроциклический аналог санглиферина" или "макроциклический санглиферин" относится к соединению, указанному выше,представляющему изобретение в его самом широком аспекте, например соединение согласно формуле (I) выше или его фармацевтически приемлемую соль. Указанные соединения также именуются как "соединения изобретения" или "производные санглиферина" или "аналоги санглиферина", при этом указанные термины используются в настоящей заявке попеременно. Используемый в настоящем описании термин "HCV" относится к вирусу гепатита С, однонитевому РНК-вирусу с оболочкой из вирусного семейства Flaviviridae. Используемый в настоящем описании термин "ВИЧ" относится к вирусу иммунодефицита человека, возбудителю синдрома приобретенного иммунодефицита человека. Используемый в настоящем описании термин "биодоступность" относится к степени или скорости,с которой лекарственное средство или другое вещество адсорбируется или становится доступным на участке биологической активности после введения. Данная характеристика зависит от множества факторов, включая растворимость соединения, скорость адсорбции в кишечнике, степень связывания с белками и метаболизм и т.д. в настоящей заявке описаны различные тесты на биодоступность, которые известны специалисту в данной области (см. также Egorin et al. 2002). Термин "растворимость в воде", используемый в настоящем описании, относится к растворимости в водных средах, например фосфатно-солевом буфере (PBS) при рН 7,4, или в 5%-м растворе глюкозы. Тесты на растворимость в воде приведены ниже в примерах как "анализ растворимости в воде". Фармацевтически приемлемые соли соединений изобретения, таких как соединения формулы (I),включают обычные соли, образованные из фармацевтически приемлемых неорганических или органических кислот или оснований, а также четвертичных аммониевых солей присоединения кислот. Более конкретные примеры подходящих солей кислот включают соляную, бромисто-водородную, серную, фосфорную, азотную, хлорную, фумаровую, уксусную, пропионовую, янтарную, гликолевую, муравьиную,молочную, малеиновую, винную, лимонную, памовую, малоновую, гидроксималеиновую, фенилуксусную, глутаминовую, бензойную, салициловую, фумаровую, толуолсульфоновую, метансульфоновую,нафталин-2-сульфоновую, бензолсульфоновую, гидроксинафтойную, иодоводородную, яблочную, стеариновую, дубильную и т.п. Соли соляной кислоты представляют наибольший интерес. Другие кислоты,такие как щавелевая кислота, хотя и не являются сами по себе фармацевтически приемлемыми, могут применяться при получении солей, используемых в качестве промежуточных соединений при получении соединений изобретения и их фармацевтически приемлемых солей. Более конкретные примеры подходящих солей оснований включают соли натрия, лития, калия, магния, алюминия, кальция, цинка, N,N'дибензилэтилендиамина, хлорпрокаина, холина, диэтаноламина, этилендиамина, N-метилглюкамина и прокаина. В дальнейшем ссылки на соединение согласно изобретению включают как соединения формулы (I), так и их фармацевтически приемлемые соли. Используемый в настоящем описании термин "алкил" представляет собой алкильную группу с нормальной или разветвленной цепью, обычно содержащую 1-10 атомов углерода, например C1-6 алкильную группу. "Алкенил" относится к алкильной группе, содержащей два или более атомов углерода (например, 2-10 атома углерода, например C2-6 алкенильная группа), которая является ненасыщенной, с одной или более двойными связями. Примеры алкильных групп включают C1-4 алкильные группы, такие как метил, этил, н-пропил, изопропил и н-бутил. Примеры алкенильных групп включают С 2-4 алкенильные группы, такие как -СН=СН 2 и -СН 2 СН=СН 2. Используемый в настоящем описании термин "циклоалкил" обозначает циклическую алкильную группу, обычно содержащую 3-10 атомов углерода, необязательно разветвленную, например циклобутил, циклопентил, циклогексил или циклогептил. Примером разветвленной группы является 2 метилциклопентил. "Циклоалкенил" относится к циклической алкенильной группе, обычно содержащей 5-10 атомов углерода, например циклопентил, циклогексенил или циклогептенил. Циклоалкильные и циклоалкенильные группы могут быть, например, моноциклическими или бициклическими (включая спироциклические), но предпочтительно являются моноциклическими. Используемый в настоящем описании термин "циклоалкил" обозначает циклическую алкильную группу, обычно содержащую 3-10 атомов углерода, необязательно разветвленную, например циклобутил, циклопентил, циклогексил или циклогептил. Примером разветвленной группы является 2 метилциклопентил. "Циклоалкенил" относится к циклической алкенильной группе, обычно содержащей 5-10 атомов углерода, например циклопентил, циклогексенил или циклогептенил. Циклоалкильные и циклоалкенильные группы могут быть, например, моноциклическими, или бициклическими (включая спироциклические), но предпочтительно являются моноциклическими. Используемый в настоящем описании термин "гетероциклил" обозначает циклоалкильную группу,в которой один или более атомов углерода в кольце (например, 1, 2 или 3 атома углерода в кольце, как 1 или 2, например 1) замещены гетероатомами, выбранными из О, N и S. Примеры включают морфолинил,пиперидинил, пирролидинил, пиперазинил и N-метилпиперазинил. Используемый в настоящем описании термин "гетероцикленил" обозначает циклоалкенильную группу, в которой один или более атомов углерода в кольце (например, 1, 2 или 3 атома углерода в кольце, как 1 или 2, например 1) замещены гетероатомами, выбранным из О, N и S. Примеры арильных групп включают (за исключением случаев, о которых указано) моноциклические группы, то есть фенил, и бициклические кольца (например, 9- и 10-членные кольца), которые являются ароматическими, или (в случае бициклических колец) содержат по меньшей мере одно ароматическое кольцо. Например, бициклическое кольцо может быть полностью ароматическим, например нафтильным, или может быть частично ароматическим (например, содержать одно ароматическое кольцо),таким как тетралин, инден или индан. Предпочтительным арилом является фенил. Арильные группы необязательно могут быть замещены, например, одним или более (например, 1, 2 или 3) заместителями,выбранными, например, из алкила (например, C1-4 алкила), гидроксила, CF3, галогена, алкокси (например,C1-4 алкокси), нитро, -SO2Me, циано и -CONH2. Примеры гетероарильных групп включают (за исключением случаев, о которых указано) моноциклические группы (например, 5- и 6-членные кольца) и бициклические кольца (например, 9- и 10-членные кольца), которые являются ароматическими, или (в случае бициклических колец) содержат по меньшей мере одно ароматическое кольц, и содержат один или более гетероатомов (например, 1, 2, 3 или 4 гетероатома), выбранных из N, О и S. Примеры 5-членных гетероарильных колец включают пиррол, фуран,тиофен, оксазол, оксадиазол, тиазол и триазол. Примеры 6-членных гетероарильных колец включают пиридин, пиримидин и пиразин. Примеры бициклических колец включают полностью ароматические кольца, такие как хинолин, хиназолин, изохинолин, индол, циннолин, бензтиазол, бензимидазол, пурин и хиноксалин, а также частично ароматические кольца, такие как хромен, хроман, тетрагидрохинолин, дигидрохинолин, изоиндолин и индолин. Моноциклические гетероарильные группы являются предпочтительными. Вышеуказанные гетероарильные группы необязательно могут быть замещены, как описано выше для арильных групп. В случае, когда бициклические арильные и гетероарильные группы являются частично ароматическими, связь с остальной частьют молекулы может идти через ароматическую часть или через неароматическую часть. Термин "лечение" включает как профилактическую, так и терапевтическую обработку. Термин "формула II" относится к формуле IIA и формуле IIB в совокупности. Описание фигур Фиг. 1 - 1 Н-ЯМР соединения 23,Фиг. 2 - 1 Н-ЯМР соединения 24,Фиг. 3 - 1 Н-ЯМР соединения 25,Фиг. 4 - 1 Н-ЯМР соединения 26,Фиг. 5 - 1 Н-ЯМР соединения 27,Фиг. 6 - 1 Н-ЯМР соединения 28,Фиг. 7 - 1 Н-ЯМР соединения 29,Фиг. 8 - 1 Н-ЯМР соединения 30. Описание изобретения В настоящем изобретении предложены макроциклические аналоги санглиферинов, как изложено выше, способы получения указанных соединений и способы применения таких соединений в медицине. В одном варианте осуществления соединение является соответствующим метанольным аддуктом, в котором полукеталь образован комбинацией С-53 кето и С-15 гидроксильных групп и метанола. В другом варианте осуществления оно не является метанольным аддуктом. Переменные n, Х 2-Х 6 и R4-R9. Предпочтительно n обозначает одинарную связь. Предпочтительно R9 представляет собой ОН. Предпочтительно R4, R5, R6, R7 и R8 независимо представляют собой Н, F, Cl, Br, С 2-6 алкенил илиC1-10 алкил, где один или более атомов углерода указанной алкильной группы необязательно замещены гетероатомом, выбранным из О, N и S(O)p, где р обозначает 0, 1 или 2 и где один или более атомов углерода указанной алкильной группы необязательно замещены карбонилом, при этом указанная алкильная группа необязательно может быть замещена одним или более атомами галогена. В некоторых вариантах осуществления атом углерода C1-10 алкильной группы (например, C1-6 алкильной группы), которую может обозначать один или больше R4, R5, R6, R7 и R8, замещен гетероатомом. Если -СН 3 замещен N, формируемой группой является -NH2. Если -СН 2- замещен N, формируемой группой является -NH-. Если -CHR- замещен N, формируемой группой является -NR-. Следовательно,атомы азота в группе R4, R5, R6, R7 или R8 могут быть первичными, вторичными или третичными атомами азота. Если -СН 3 замещен О, формируемой группой является -ОН. В случае, когда атом углерода C1-10 алкильной группы (например, С 1-6 алкильной группы), которую может обозначать один или больше R4, R5, R6, R7 и R8, замещен гетероатомом, он предпочтительно замещается О, S или N, в особенности N или О, в частности О. В случае, когда любой из R4, R5, R6, R7 и R8 содержит группу S(O)p, переменная р соответственно обозначает 0 или 1. В одном варианте осуществления р обозначает 0. В другом варианте осуществления р обозначает 1. В другом варианте осуществления р обозначает 2. В случае, когда C1-10 алкильная группа (например, C1-6 алкильная группа), которую может обозначать один или больше R4, R5, R6, R7 и R8, содержит больше одного гетероатома, они обычно могут отделяться двумя или более атомами углерода. Предпочтительно атомы углерода C1-10 алкильной группы (например, C1-6 алкильной группы), которую может обозначать один или больше R4, R5, R6, R7 и R8, не замещены никаким гетероатомом. В случае, когда атом углерода C1-10 алкильной группы (например, C1-6 алкильной группы), которую может обозначать один или больше R4, R5, R6, R7 и R8, замещен карбонилом, карбонил соответственно расположен смежно с другим атомом углерода или атомом азота. Предпочтительно карбонильные группы не расположены смежно с атомами серы или кислорода. Например, один или более R4, R5, R6, R7 и R8 могут представлять собой -COC1-3 алкил, например-СОМе. Предпочтительно атомы углерода C1-10 алкильной группы (например, С 1-6 алкильной группы), которую может обозначать один или больше R4, R5, R6, R7 и R8, не замещены карбонилом.C1-10 алкильная группа (например, С 1-6 алкильная группа), которую может обозначать один или больше R4, R5, R6, R7 и R8, может быть замещена одним или более атомами галогена. Например, один или более R1, R2, R3, R4 и R5 могут представлять собой -CF3. В альтернативе один или более R4, R5, R6, R7 и R8 могут представлять собой C1-10 алкил (например, С 1-6 алкил), замещенный одним или более (например,одним) атомом Cl или F (например, -CH2CH2Cl). Предпочтительно C1-10 алкильные группы (например, C1-6 алкильные группы), которые могут обозначать R4, R5, R6, R7 и R8, не замещены галогеном. В случае, когда одна или более групп R4, R5, R6, R7 и R8 представляют собой C1-10 алкильную группу(например, C1-6 алкильную группу), предпочтительно группа(ы) представляет собой C1-4 алкил (например,С 1-2 алкил, такой как метил). В варианте осуществления один или более из R4, R5, R6, R7 и R8 представляют собой C1-6 алкил (такой как C1-2 алкил) или С 2-3 алкенил, например один или более из R4, R5, R6, R7 и R8 представляют собой метил. Предпочтительно R4 представляет собой Н, F, Cl, CF3, ОН или C1-6 алкил (например, метил). Наиболее предпочтительно R4 представляет собой Н или F, в особенности Н. Предпочтительно R5 представляет собой Н, F, Cl, CF3, ОН, NH2 или C1-6 алкил (например, метил). Более предпочтительно R5 представляет собой Н, F, ОН или NH2, в особенности ОН. Предпочтительно R6 представляет собой Н, F, Cl, CF3, ОН или C1-6 алкил (например, метил). Более предпочтительно R6 представляет собой Н, Me или F. Предпочтительно R7 представляет собой Н, F, Cl, CF3, ОН или C1-6 алкил (например, метил). Более предпочтительно R7 представляет собой Н или F. Предпочтительно R8 представляет собой Н, F, Cl, CF3, ОН или C1-6 алкил (например, метил). Более предпочтительно R8 представляет собой Н или F, в особенности Н. Предпочтительно один или более, более предпочтительно два или более (например, три или больше) из R4, R5, R6, R7 и R8 не являются Н. Предпочтительно один или более, например два или более из R4, R5, R6, R7 и R8 представляют собой F. Предпочтительно R6 и/или R7 представляют собой F. Предпочтительно по меньшей мере два из Х 2, Х 3, Х 4, Х 5 и Х 6 представляют собой С; более предпочтительно по меньшей мере три, более предпочтительно по меньшей мере четыре и наиболее предпочтительно все пять представляют собой С. В одном варианте осуществления Х 2 представляет собой N (таким образом, R4 отсутствует). В другом более предпочтительном варианте осуществления Х 2 представляет собой С. Предпочтительно Х 3 представляет собой С. Предпочтительно Х 4 представляет собой С. Предпочтительно Х 5 представляет собой С. Предпочтительно Х 6 представляет собой С. В варианте осуществления каждый Х 2, Х 3, Х 4, Х 5 и Х 6 представляет собой С, R4 представляет собой Н,R5 представляет собой ОН, R6 представляет собой Н, R7 представляет собой F и R8 представляет собой Н. В варианте осуществления каждый Х 2, Х 3, Х 4, Х 5 и Х 6 представляет собой С, R4 представляет собой Н, R5 представляет собой ОН, R6 представляет собой Me, R7 представляет собой Н и R8 представляет собой Н. В варианте осуществления каждый Х 2, Х 3, Х 4, Х 5 и Х 6 представляет собой С, R4 представляет собой Н,R5 представляет собой ОН, R6 представляет собой F, R7 представляет собой F и R8 представляет собой Н. Переменная Х 1. В одном варианте осуществления Х 1 представляет собой -R3. В одном варианте осуществления X1 представляет собой -NR1R2. В одном варианте осуществления X1 представляет собой -OR1. В некоторых вариантах осуществления атом углерода в R1, и/или R2, и/или R3 замещен гетероатомом. Если -СН 3 замещен N, формируемой группой является -NH2. Если -СН 2- замещен N, формируемой группой является -NH-. Если -CHR- замещен N, формируемой группой является -NR-. Следовательно,атомы азота в группе R1, R2, R3 могут быть первичными, вторичными или третичными атомами азота. Если -СН 3 замещен О, формируемой группой является -ОН. В случае, когда атом углерода в R1, и/или R2, и/или R3 замещен гетероатомом, он предпочтительно замещен О или N, в особенности О. В случае, когда атом углерода в R1, и/или R2, и/или R3 замещен группой S(O)p, переменная р соответственно обозначает 0 или 1. В одном варианте осуществления р обозначает 0, в другом варианте осуществления р обозначает 1. В другом варианте осуществления р обозначает 2. В случае, когда R1, и/или R2, и/или R3 содержат больше одного гетероатома, они могут быть, например, отделены двумя или больше атомами углерода. Предпочтительно ни один атом углерода в R1, R2 и R3 не замещен гетероатомами. В случае, когда атом углерода R1, и/или R2, и/или R3 замещен карбонилом, карбонил предпочтительно расположен смежно с другим атомом углерода или атомом азота. Предпочтительно карбонильные группы не расположены смежно с атомами серы или кислорода. Например, R1, и/или R2, и/или R3 могут представлять собой -СОС 1-4 алкил, например, -СОМе. Предпочтительно атом углерода в R1 не замещен карбонилом. Предпочтительно атом углерода в R2 не замещен карбонилом. Предпочтительно атом углерода в R3 не замещен карбонилом. В случае, когда один или более атомов углерода в группе R1, и/или R2, и/или R3 замещен одним или более атомами галогена, примерами атомов галогена является F, Cl и Br, в особенности F и Cl, в частности F. Примером галогенированной группы R1, и/или R2, и/или R3 является -CF3. Например, один или более R1, R2 и R3 может обозначать C1-10 алкил (например, C1-6 алкил), замещенный одним или более (например, одним) атомом Cl или F (например, -CH2CH2Cl). Предпочтительно атом углерода в R1, R2 и R3 не замещен галогеном. В случае, когда одна или более групп R1, R2 и R3 представляют собой C1-10 алкильную группу (например, C1-6 алкильную группу), предпочтительно группы представляют собой C1-4 алкил (например, C1-2 алкил, такой как метил). В случае, когда R1, и/или R2, и/или R3 представляют собой -алкиларил, пример включает С 1-2 алкиларил, например бензил. В случае, когда R1, и/или R2, и/или R3 представляют собой -алкениларил, пример включает С 2-3 алкениларил, например этенилфенил. В случае, когда R1, и/или R2, и/или R3 представляют собой -алкилгетероарил, пример включает С 1-2 алкилгетероарил, например -метилпиридинил. В случае, когда R1, и/или R2, и/или R3 представляют собой -алкенилгетероарил, пример включает С 2-3 алкенилгетероарил, например - этенилпиридинил. Предпочтительно R1 не является водородом. Предпочтительно оба, R1 и R2, не являются водородом. Предпочтительно атом углерода в R2 не замещен никаким гетероатомом. Когда X1 представляет собой NR1R2. В случае, когда X1 представляет NR1R2, R1 может представлять собой, например, алкил, алкенил,циклоалкил, циклоалкенил, алкилциклоалкил, алкилциклоалкенил, алкенилциклоалкил, алкенилциклоалкенил, арил, гетероарил, алкиларил, алкилгетероарил, алкениларил или алкенилгетероарил.R2 может представлять собой, например, Н, алкил (например, C1-4 алкил), алкенил (например, С 2-4 алкенил), или -Оалкил (например, -OC1-4 алкил), в особенности Н или алкил. Примерные группы R1 включают арил или гетероарил, замещенные моноциклическим арилом или моноциклическим гетероарилом, -С 1-4 алкил, -ОС 1-4 алкил, -СОС 1-4 алкил или -С 2-4 алкенил, или R1 может представлять собой алкил или -Оалкил. Вышеуказанные примерные группы могут быть, например, взяты вместе с R2, представляющим Н или алкил. Другие примерные группы R1 включают метил, -CF3, этил, изопропил, -СН 2 СН=СН, изобутил, циклогексил. Вышеуказанные примерные группы могут быть, например, взяты вместе с R2, представляющим Н или Me. Другие примерные группы R1 включают необязательно замещенный пиридинил или фенил, например фенил, замещенный фенилом. Вышеуказанные примерные группы могут быть, например, взяты вместе с R2, представляющим Н, Me или -ОМе. Другие примерные группы R1 включают -ОМе, -OCF3, -О-этил, O-изопропил, -SMe, O-н-пропил,-O-н-бутил, -О-трет-бутил, O-изобутил, О-СН 2 С(Ме)3. Вышеуказанные примерные группы могут быть,например, взяты вместе с R2, представляющим Н, Me, этил, изопропил или трет-бутил. Другие примерные группы R1 включают -О-(необязательно замещенный фенил). Вышеуказанные примерные группы могут быть, например, взяты вместе с R2, представляющим Н или Me. В альтернативе R1 и R2 могут быть связаны таким образом, что NR1R2 представляет собой насыщенное или ненасыщенное гетероциклическое кольцо, содержащее определенный показанный атом азота. Гетероциклическое кольцо, которое может обозначать NR1R2, обычно содержит 4-8 атомов в кольце, например 5-7 атомов в кольце, в частности 5 или 6 атомов в кольце. Гетероциклическое кольцо, которое, например, может обозначать NR1R2, обычно содержит только определенный атом азота (например, оно представляет собой пирролидин или пиперидин), или один или два (например, один) дополнительных гетероатома, в частности атом азота или кислорода. Например, гетероциклическое кольцо, которое может обозначать NR1R2, может быть морфолинилом или 1,2-оксазинаном (шестичленным насыщенным кольцом, содержащим О, смежный с N). В случаях, когда NR1R2 представляет собой насыщенное или ненасыщенное гетероциклическое кольцо, содержащее определенный атом азота, в котором один или более атомов углерода указанного кольца необязательно замещены гетероатомом, выбранным из О, N и S(O)P, где р обозначает 0, 1 или 2, и где один или более атомов углерода указанного кольца необязательно замещены карбонилом, и указанное гетероциклическое кольцо сконденсировано с арильным или гетероарильным кольцом, примером является тетрагидрохинолинил. В альтернативе, NR1R2 предпочтительно представляет собой 5-7-членное гетероциклическое кольцо, такое как пирролидиновое, пиперидиновое, морфолиновое или пиперазиновое кольцо, в котором 4 азот пиперазина необязательно замещен C1-4 алкилом. В другом варианте осуществления NR1R2 предпочтительно представляет собой 5-7-членное гетероциклическое кольцо, такое как пирролидиновое, пиперидиновое, морфолиновое или пиперазиновое кольцо, в котором 4-азот пиперазина необязательно замещен C1-4 алкилом и в котором атом углерода,смежный с атомом азота в кольце, замещен карбонилом. Таким образом, например, R1 и R2 вместе с азотом, к которому они присоединены, представляют собой пиперидинон. В другом варианте осуществления атом кислорода является смежным с атомом азота, к которому присоединены R1 и R2. Например, R1 может представлять собой алкил или алкенил, в котором метилен,смежный с атомом азота, к которому присоединен R1, замещен О. Например, R1 может представлять собой -ОС 1-4 алкил, например ОМе. В альтернативе R1 и R2 соединены, и атом углерода, смежный с атомом азота, к которому присоединен R1, замещен О, например, с образованием 1,2-оксазинанового кольца или 1,2-изоксазолидина. В другом варианте осуществления R1 и R2 связаны таким образом, что NR1R2 представляет собой насыщенное или ненасыщенное гетероциклическое кольцо, содержащее указанный атом азота, и где один или более атомов углерода указанного кольца необязательно замещены дополнительным гетероатомом, выбранным из О, N и S(O)p, где р обозначает 0, 1 или 2 и где один или более атомов углерода указанного кольца необязательно замещены карбонилом, при этом указанное гетероциклическое кольцо сконденсировано с арильным или гетероарильным кольцом (например, сконденсировано с фенильным или пиридинильным кольцом). Примеры групп, которые может вместе формировать NR1R2, включают морфолинил, оксазинан (например, 1,2-оксазинан) и группы, представленные в следующей таблице: Вышеуказанные группы -NR1R2, которые включают арильные или гетероарильные группы, также необязательно могут на указанных группах нести один или более (например, один или два, например один) заместителей в кольце, например группы, выбранные из C1-4 алкил (например, метил), галоген (например, Cl или F), C1-4 алкокси (например, метокси), гидроксил, CF3, циано, нитро, SO2Me и CONH2. Вышеуказанные группы -NR1R2 необязательно могут быть замещены одним или более (например,одним или двумя) атомами галогена (например, F или Cl). Когда X1 представляет собой OR1. В случае, когда X1 представляет собой OR1, R1 может, например, представлять собой алкил, алкенил, циклоалкил, циклоалкенил, алкилциклоалкил, алкилциклоалкенил, алкенилциклоалкил, алкенилциклоалкенил, арил, гетероарил, алкиларил, алкилгетероарил, алкениларил или алкенилгетероарил. В одном варианте осуществления R1 представляет собой арил или гетероарил, необязательно замещенный моноциклическим арилом или моноциклическим гетероарилом. R1 может, например, представлять собой 4-бифенилил, в котором необязательно замещено одно из фенильных колец. В варианте осуществления R1 может представлять собой арил или гетероарил, замещенный моноциклическим арилом или моноциклическим гетероарилом, -C1-4 алкил, -OC1-4 алкил, -COC1-4 алкил или -С 2-4 алкенил. В варианте осуществления R1 представляет собой C1-6 алкил (такой как С 4-6 алкил), С 2-6 алкенил, С 1-4 алкилС 4-7 циклоалкил или C1-4 алкилС 5-7 циклоалкенил. Предпочтительно R1 выбран из С 2-10 алкила (например, С 2-6 алкила, такого как С 4-6 алкил), С 2-10 алкенила (например, С 2-6 алкенила, такого как С 4-6 алкенил), гетероарила и арила. Таким образом, в одном варианте осуществления R1 выбран из С 4-6 алкила, С 2-6 алкенила, гетероарила и арила. В одном варианте осуществления R1 выбран из С 4-7 циклоалкила, С 1-2 алкиларила и С 1-2 алкилгетероарила. Примерные группы R1 включают циклогексил, -метилциклопентил, -СН 2 СН=СН 2, этил, н-пропил,н-бутил, трет-бутил, изобутил, СН 2 С(Ме)3, н-пентил, -СН 2 СН 2 С(Me)3, н-гексил, н-гептил, циклопентил,-метилциклогексил, фенил, -метилфенил, метилпиридинил, тиазол, триазол, имидазол, оксазол, фуран,тиофен и тетразол, например, выбранные из -СН 2 СН=СН 2, н-бутила, трет-бутила, изобутила,-СН 2 С(Ме)3, н-пентила, -СН 2 СН 2 С(Me)3, н-гексила, н-гептила, -циклопентила, -метилциклогексила, фенила, -метилфенила, -метилпиридинила, тиазола, триазола, имидазола, оксазола, фурана, тиофена и тетразола. Другие примерные группы R1 включают указанные выше арильные или гетероарильные группы, в которых арильная или гетероарильная группа замещена. Когда Х 1 представляет собой R3. В случае, когда X1 представляет собой R3, R3 может, например, представлять собой алкил, алкенил,циклоалкил, циклоалкенил, алкилциклоалкил, алкилциклоалкенил, алкенилциклоалкил, алкенилциклоалкенил, арил, гетероарил, алкиларил, алкилгетероарил, алкениларил или алкенилгетероарил, при этом любая из указанных групп необязательно может быть замещена моноциклическим арилом или моноциклическим гетероарилом; и где один или более атомов углерода в R3, не являющемся частью арильной или гетероарильной группы, необязательно замещены гетероатомом, выбранным из О, N и S(O)p, где р обозначает 0, 1 или 2, за исключением случаев, когда смежный с карбонильной группой, к которой присоединен R3, не является О или N, и где один или более атомов углерода в R3 необязательно замещены карбонилом. Предпочтительно R3 может, например, представлять собой алкил, алкенил, циклоалкил, циклоалкенил, алкилциклоалкил, алкилциклоалкенил, алкенилциклоалкил, алкенилциклоалкенил, арил, гетероарил, алкиларил, алкилгетероарил, алкениларил или алкенилгетероарил. Предпочтительно R3 представляет собой С 1-6 алкил, С 2-6 алкенил, C1-4 алкилС 4-7 циклоалкил или С 1-4 алкилС 5-7 циклоалкенил. Примерные группы R3 включают -метилциклопентил, этилциклопентил, н-пропил, -СН(Ме)(этил),трет-бутил, -СН(этил)2, -СН(этил)(изопропил), -СН(Ме)(изобутил), СН(Ме)(н-пропил), СН(Ме)(н-бутил),-СН(метил)(н-пентил), -СН(этил)(н-пропил), циклопентил, тетрагидрофуран, циклогексил, циклогептил,гексагидрооксепин, -метилциклогексил, -этилциклогексил, СН(Ме)(Оэтил), -СН(Ме)(О-изопропил),-СН(ОМе)(этил), СН(Me)(О-этил), -СН(ОМе)(изопропил), -СН(Me)(ОМе), -СН(Ме)(О-н-пропил),-СН(Ме)(О-н-бутил), -СН(этил)(О-этил), -СН 2 С(Ме)3, СН 2 СН 2 С(Me)3, тиазол, имидазол, триазол, тетразол, оксазол, фуран, пиридин и фенил. Другие примерные группы R1 включают указанные выше арильные или гетероарильные группы, в которых арильная или гетероарильная группа замещена. Другие предпочтительные варианты осуществления. В предпочтительном варианте осуществления изобретения Х 1 представляет собой NMe(OMe), R4 представляет собой Н, R5 представляет собой ОН, R6 представляет собой Н, R7 представляет собой F, R8 представляет собой Н, Х 2 представляет собой С, Х 3 представляет собой С, Х 4 представляет собой С, Х 5 представляет собой С, Х 6 представляет собой С, n обозначает одинарную связь и R9 представляет собой ОН, как представлено следующей структурой: В другом предпочтительном варианте осуществления изобретения X1 представляет собойNMe(OMe), R4 представляет собой Н, R5 представляет собой ОН, R6 представляет собой Н, R7 представляет собой F, R8 представляет собой Н, Х 2 представляет собой С, Х 3 представляет собой С, Х 4 представляет собой С, Х 5 представляет собой С, Х 6 представляет собой С, n обозначает двойную связь и R9 представляет собой Н, как представлено следующей структурой: В другом предпочтительном варианте осуществления изобретения X1 представляет собой NR1R2, в котором R1 и R2 вместе представляют собой СН 2 СН 2 СН 2 СН 2 О, которые соединены с формированием гетероцикла, R4 представляет собой Н, R5 представляет собой ОН, R6 представляет собой Н, R7 представляет собой F, R8 представляет собой Н, Х 2 представляет собой С, Х 3 представляет собой С, Х 4 представляет собой С, Х 5 представляет собой С, Х 6 представляет собой С, n обозначает одинарную связь и R9 представляет собой ОН, как представлено следующей структурой: В другом предпочтительном варианте осуществления изобретения X1 представляет собой NR1R2, в котором R1 и R2 вместе представляют собой СН 2 СН 2 СН 2 СН 2 О, которые соединены с формированием гетероцикла, R4 представляет собой Н, R5 представляет собой ОН, R6 представляет собой Me, R7 представляет собой Н, R8 представляет собой Н, Х 2 представляет собой С, Х 3 представляет собой С, Х 4 представляет собой С, Х 5 представляет собой С, Х 6 представляет собой С, n обозначает одинарную связь и R9 представляет собой ОН, как представлено следующей структурой: В другом предпочтительном варианте осуществления изобретения X1 представляет собойNMe(OMe), R4 представляет собой Н, R5 представляет собой ОН, R6 представляет собой F, R7 представляет собой F, R8 представляет собой Н, Х 2 представляет собой С, Х 3 представляет собой С, Х 4 представляет собой С, Х 5 представляет собой С, X6 представляет собой С, n обозначает одинарную связь и R9 представляет собой ОН, как представлено следующей структурой: В другом предпочтительном варианте осуществления изобретения Х 1 представляет собой NR1R2, в котором R1 и R2 вместе представляют собой СН 2 СН 2 СН 2 СН 2 О, которые соединены с формированием гетероцикла, R4 представляет собой Н, R5 представляет собой ОН, R6 представляет собой F, R7 представляет собой F, R8 представляет собой Н, Х 2 представляет собой С, Х 3 представляет собой С, Х 4 представляет собой С, Х 5 представляет собой С, Х 6 представляет собой С, n обозначает одинарную связь и R9 представляет собой ОН, как представлено следующей структурой: В другом предпочтительном варианте осуществления изобретения X1 представляет собой (2 пиридинил)NH, R4 представляет собой Н, R5 представляет собой ОН, R6 представляет собой F, R7 представляет собой F, R8 представляет собой Н, Х 2 представляет собой С, Х 3 представляет собой С, Х 4 представляет собой С, Х 5 представляет собой С, X6 представляет собой С, n обозначает одинарную связь и R9 представляет собой ОН, как представлено следующей структурой: В другом предпочтительном варианте осуществления изобретения X1 представляет собой (2 пиридинил)NH, R4 представляет собой Н, R5 представляет собой ОН, R6 представляет собой F, R7 представляет собой Н, R8 представляет собой Н, Х 2 представляет собой С, Х 3 представляет собой С, Х 4 представляет собой С, Х 5 представляет собой С, Х 6 представляет собой С, n обозначает одинарную связь и R9 представляет собой ОН, как представлено следующей структурой: В некоторых вариантах осуществления двойная связь в положении С 26, 27 (относительно структуры санглиферина А) может находиться в цис-форме вместо транс-формы. В подходящем варианте осуществления изобретения двойная связь находится в цис-форме, как представлено следующей формулой: Такие соединения могут быть получены в процессе химического синтеза. Как правило, соединения изобретения получают при помощи мутасинтеза с образованием соединений формулы (II) с последующим полусинтезом. Подходящие группы Х 2, Х 3, Х 4, Х 5, Х 6, R4, R5, R6, R7 и R8 в формуле (II) соответствуют группам, определенным для соединений формулы (I). Как правило, способ получения предшественников соединений формулы (I) или их фармацевтически приемлемой соли включает инокуляцию ферментационной питательной среды культурой продуцента санглиферина (такого какStreptomyces sp. А 92-308110, также известного как DSM 9954) или более предпочтительно продуцента санглиферина с инактивированным или удаленным геном sfaA или гомологом гена sfaA; введение в ферментационную питательную среду аналога метатирозина (как показано в формуле(III; продолжение ферментации до получения соединений формулы IIA и формулы IIB; экстракцию и выделение соединений формулы IIA и формулы IIB; полусинтетическую дериватизацию соединений формулы IIA и формулы IIB с получением соединения формулы I. Соединения формулы (III) определены следующим образом: в которой R10 представляет собой Н или группу, образующую сложный эфир, такую как алкильная группа, например C1-6 алкил, такой как Me. Подходящие группы Х 2, Х 3, Х 4, Х 5, Х 6, R4, R5, R6, R7 и R8 в формуле (III) соответствуют группам,определенным для соединений формулы (I). Вводимое соединение может быть рацемическим или являться L-формой соединения формулы (III). Соединения формулы (III) доступны коммерчески или могут быть получены стандартными метода- 17023907 ми химии органического синтеза. Один из общих способов получения соединений формулы (III) показан на следующей схеме. Схема: а) конденсация альдегида формулы (IV) с подходящим фрагментом, например(R11O)2 Р(О)СН(NHPG)CO2R10, и b) гидрирование и снятие защитных групп при необходимости. PG = защитная группа. Альдегиды формулы (IV) могут быть доступны коммерчески или могут быть с легкостью синтезированы специалистом, квалифицированным в данной области. Химия защиты и снятия защиты может использоваться при получении соединений формулы (III) из соединений формулы (IV). Указанные методы известны специалисту, квалифицированному в данной области, и подходящие защитные группы описаны в Greene's Protective Groups in Organic Synthesis (Wuts and Greene, 4th Edition, 2007). После образования соединений формулы (IIA) и формулы (IIB) соединения изобретения получают с помощью полусинтетической дериватизации. Полусинтетические методы получения макроциклического альдегида санглиферина описаны в US 6124453, Metternich et al., 1999, Banteli et al., 2001 и Sedrani et al.,2003. Обычно полусинтетический способ получения некоторых соединений формулы (I) или их фармацевтически приемлемой соли из мутасинтетического аналога санглиферина включает:(c) конденсацию указанного альдегида со стабилизированным карбанионом (или его канонической формой), таким как фосфонатный карбанион, с использованием соединения формулы V. Это ретросинтетически показано ниже где для мутасинтетических аналогов санглиферина A,R12 = Группы R11, которые могут быть одинаковыми или различными, независимо представляют собой алкил (например, С 1-4 алкил) или бензил. Следовательно, способ получения соединений изобретения включает реакцию соединения формулы(V) с альдегидным макроциклом (соединение формулы (VI. Получение соединений формулы (VI) может быть выполнено способом, аналогичным описанному, предварительно в отношении превращения санглиферина А в его соответствующий альдегидный макроцикл (Metternich et al. 1999). Вкратце, соединение формулы (II) дигидроксилируют с использованием измененных условий Шарплесса (каталитический тетраоксид осмия). Использование хиральных лигандов способствует повышению селективности. Затем образующийся диол может быть подвергнут окислительному расщеплению с использованием, например, периодата натрия. Полученное соединение формулы VI может затем использоваться в качестве субстрата для дериватизации в соответствующий амид, сложный эфир или кетон. Обычно соединение формулы (V) растворяют в апротонном растворителе, охлаждают и обрабатывают основанием, например гидридом натрия. Затем добавляют соединение формулы (VI) и нагревают реакционную смесь. По истечении подходящего промежутка времени реакцию останавливают и очищают соединение формулы I в стандартных условиях (например, с помощью препаративной ВЭЖХ, препаративной ТСХ и т.д., флешхроматографии с нормальными фазами). Дериватизации с целью введения изменений в группы R9 и n могут быть выполнены перед получением соединения формулы VI или после реакции с формированием соответствующего амида. Вкратце,гидроксил в R9 может быть удален при обработке подходящего субстрата в кислых условиях с получением конъюгированного триена. Соединения формулы (V) могут быть известны или могут быть получены с использованием известных методов. Например, соединения формулы (V), в которой X1 представляет собой NR1R2, могут быть с легкостью синтезированы из доступных аминов (например, R1R2NH). Как показано на схеме 1 (ниже), амин может использоваться для обработки хлорацетилхлорида или подобного, с образованием -хлорамида. Затем -хлорамид обрабатывают в реакции Арбузова с получением соединения формулы V. Другие пути к соединениям формулы V будут очевидны специалисту, квалифицированному в данной области. Схема 1 Другие соединения формулы (V), в которой X1 представляет собой R3, могут быть известны или с легкостью могут быть синтезированы из доступных производных карбоновых кислот (например,R3COX). Как показано на схеме 2 (ниже), производное карбоновой кислоты может взаимодействовать с метилфосфонатом после обработки фосфоната основанием. Это приводит к соединению формулы (V),хотя другие пути к соединениям формулы V будут очевидны специалисту, квалифицированному в данной области. Схема 2 Другие соединения формулы (V), в которой X1 представляет собой OR1, могут быть известны или с легкостью могут быть синтезированы из доступных спиртов (например, R1OH). Как показано на схеме 3(ниже), спирт может использоваться для обработки хлорацетилхлорида или подобного, с образованием сложного -хлорэфира. Затем -хлорэфир обрабатывают в реакции Арбузова с получением соединения формулы II. Другие пути к соединениям формулы II будут очевидны специалисту, квалифицированному в данной области. Если желательно или необходимо, защитные группы могут применяться для защиты функциональных групп в альдегидном макроцикле, макроцикле, спирте (R1OH), производном карбоновой кислотыWuts, Protective Groups in Organic Synthesis, Wiley-Interscience, New York, 1999. В дополнение к определенным методам и ссылкам, предствленным в настоящей заявке, специалист в данной области также может обратиться к стандартным руководствам по методам синтеза, включая,без ограничения, Vogel's Textbook of Practical Organic Chemistry (Furniss et al., 1989) и March's AdvancedOrganic Chemistry (Smith and March, 2001). Аналог санглиферина согласно изобретению можно вводить один или в комбинации с другими терапевтическими средствами. Совместное введение двух (или более) средств могут позволять вводить более низкие дозы каждого используемого средства, с уменьшением, таким образом, побочного эффекта,что может привести к повышению активности и поэтому, более высокого SVR, а также к уменьшению резистентности. Таким образом, в одном варианте осуществления мутасинтетический аналог санглиферина вводят совместно с одним или более терапевтическими средствами для лечения инфекции HCV, взятыми из стандарта лечения. Это может быть интерферон (например, pIFN и/или рибавирин). В альтернативном варианте осуществления санглифериновый макроцикл изобретения вводят совместно с одним или более другими противовирусными средствами, такими как STAT-C (средство направленного действия для лечения HCV) или DAA (противовирусные средства прямого действия), которые могут являться одним или несколькими из следующего: ненуклеозидные ингибиторы полимеразы(например, АВТ-333, АВТ-072, BMS 791325, IDX375, VCH-222, BI 207127, ANA598, VCH-916, GS 9190,PF-00868554 (филибувир) или VX-759), нуклеозидные или нуклеотидные ингибиторы полимеразы (например, 2'-С-метилцитидин, 2'-С-метиладенозин, R1479, R1479, PSI-6130, R7128, R1626, PSI 7977 илиNS4b, ингибиторы серин-С-пальмитоилтрансферазы, нитазоксанид или ингибиторы проникновения вируса (например, PRO 206). В альтернативном варианте осуществления санглифериновый макроцикл изобретения вводят совместно с одним или более другими противовирусными средствами (таким как высокоактивная антиретровирусная терапия (ВААРТ для лечения ВИЧ, которые могут являться одним или несколькими из следующего: нуклеозидные ингибиторы обратной транскриптазы (NRTI) (например, эмтрицитабин или тенофовир), ненуклеозидные ингибиторы обратной транскриптазы (NNRTI) (например, рилипивирин или эфавиренц), ингибиторы протеазы (PI) (например, ритонавир или лопинавир), ингибиторы слияния (например, маравирок или энфувиртид), ингибиторы CCR5 (например, аплавирок или викривирок), ингибиторы созревания (например, бевиримат), моноклональные антитела к CD4 (например, ибализумаб) и ингибиторы интегразы (например, элвитегравир). В альтернативном варианте осуществления санглифериновый макроцикл изобретения вводят совместно с одним или более другими противовирусными средствами для лечения HBV, которые могут являться одним или несколькими из следующего: интерфероны (например, интерферон- или пэгилированный интерферон-), аналоги нуклеозидов или нуклеотидов (например, ламивудин, энтекавир, адефовир дипивоксил или телбивудин), другие иммуномодуляторы (например, тимозин-, CYT107 или DV601) или HMG ингибиторы СоА редуктазы (например, симвастатин). Лекарственные формы предпочтительно могут быть представлены в виде единичной лекарственной формы и могут быть приготовлены любым из методов, известных в области фармации. Такие методы включают этап объединения действующего вещества (соединения изобретения) с носителем, который составляет один или большее количество дополнительных компонентов. В большинстве случаев лекарственные формы приготавливают путем однородного и тщательного смешивания действующего вещества с жидкими носителями или тонкоизмельченными твердыми носителями или с теми и другими с последующим, в случае необходимости, формованием продукта. Соединения изобретения обычно вводят перорально в форме фармацевтической композиции, вклю- 20023907 чающей действующее вещество, необязательно в форме нетоксичной соли присоединения органической или неорганической, кислоты или основания, соли присоединения, в фармацевтически приемлемой лекарственной форме. В зависимости от нарушения и пациента, подлежащего лечению, а также от пути введения композиции можно вводить в различных дозах. Например, соединения изобретения можно вводить перорально, буккально или подъязычно, в форме таблеток, капсул, суппозиториев, эликсиров, растворов или суспензий, которые могут содержать ароматизаторы или красители, для немедленного, замедленного или регулируемого высвобождения. Такие таблетки могут содержать вспомогательные вещества, такие как микрокристаллическую целлюлозу, лактозу, цитрат натрия, карбонат кальция, двухосновный фосфат кальция и глицин, разрыхлители, такие как крахмал (предпочтительно кукурузный, картофельный крахмал или крахмал тапиоки), натрий-крахмалгликолят, натрий-кроскармеллозу и некоторые сложные силикаты, а также связующие добавки для гранулирования, такие как поливинилпирролидон, гидроксипропилметилцеллюлозу (ГПМЦ),гидроксипропилцеллюлозу (ГПЦ), сахарозу, желатин и гуммиарабик. Дополнительно могут быть включены смазывающие вещества, такие как стеарат магния, стеариновая кислота, глицерилбегенат и тальк. Твердые композиции аналогичного типа также могут использоваться в качестве наполнителей в желатиновых капсулах. Предпочтительные вспомогательные вещества в этом отношении включают лактозу, крахмал, целлюлозу, молочный сахар или полиэтиленгликоли высокой молекулярной массы. В случае водных суспензий и/или эликсиров, соединения изобретения могут быть объединены с различными подсластителями или ароматизаторами, окрашивающими веществами или красителями, эмульгаторами и/или суспендирующими добавками и с разбавителями, такими как вода, этанол, пропиленгликоль и глицерин, а также их комбинациями. Таблетка может быть изготовлена путем прессования или формования, необязательно с одним или более дополнительными компонентами. Прессованные таблетки могут быть изготовлены путем прессования в подходящей машине действующего вещества в свободнотекучей форме, такой как порошок или гранулы, необязательно смешанного со связующим веществом (например, повидоном, желатином, гидроксипропилметилцеллюлозой), смазывающим веществом, инертным разбавителем, консервирующим веществом, разрыхлителем (например, натрий-крахмалгликолятом, сшитым повидоном, сшитой натрийкарбоксиметилцеллюлозой), поверхностно-активным или диспергирующим веществом. Формуемые таблетки могут быть изготовлены путем формования в подходящей машине смеси порошка соединения,увлажненного инертным жидким разбавителем. Таблетки необязательно могут быть покрыты оболочкой или на них могут быть нанесены риски и могут иметь такой состав, чтобы обеспечивать медленное или регулируемое высвобождение из них действующего вещества при использовании, например, гидроксипропилметилцеллюлозы в переменных пропорциях, обеспечивая требуемый профиль высвобождения. Лекарственные формы в соответствии с настоящим изобретением, подходящие для перорального введения, могут быть представлены в виде дискретных единиц, таких как капсулы, облатки или таблетки, каждая из которых содержит установленное количество действующего вещества; в виде порошка или гранул; в виде раствора или суспензии в водной жидкости или неводной жидкости или в виде жидкой эмульсии масло-в-воде или жидкой эмульсии вода-в-масле. Действующее вещество также может быть представлено в виде болюса, электуария или пасты. Следует понимать, что в дополнение к компонентам, конкретно указанным выше, лекарственные формы настоящего изобретения могут включать другие агенты, стандартные в данной области, относящиеся к типу рассматриваемой лекарственной формы, например, формы, подходящие для перорального введения, могут включать ароматизаторы. Предпочтительно такие добавки, как консервирующие и буферные вещества, могут быть растворены в среде. С целью повышения стабильности композиция может быть заморожена после заполнения флакона, а вода - удалена в вакууме. Сухой лиофилизированный порошок затем закрывают во флакон, и сопровождающий флакон воды для инъекции может поставляться для восстановления жидкости перед применением. Вводимая дозировка соединения изобретения будет изменяться в зависимости от конкретного соединения, заболевания, субъекта, природы и тяжести заболевания и физического состояния субъекта, а также выбранного пути введения. Соответствующая дозировка может быть с легкостью определена специалистом, квалифицированным в данной области. Композиции могут содержать от 0,1%, предпочтительно от 5-60%, более предпочтительно от 10-30 мас.%, соединения изобретения, в зависимости от способа введения. Специалисту в данной области будет очевидно, что оптимальное количество и интервал индивидуальных дозировок соединения изобретения будут определяться природой и степенью состояния, подвергаемого лечению, формой, путем и участком введения, а также возрастом и состоянием конкретного субъекта, подвергаемого лечению, и тем, что врач, в конечном счете, определит подходящие используемые дозировки. Такое введения доз может быть повторено настолько часто, насколько это необходимо. Если развиваются побочные эффекты, количество и/или частоту введения доз можно изменить или уменьшить, в соответствии с нормальной клинической практикой. Дополнительные аспекты изобретения включают применение соединения согласно изобретению для применения в качестве фармацевтического средства для лечения вирусных инфекций, таких как HCV или ВИЧ инфекция, для применения в качестве иммунодепрессанта или противовоспалительного средства; фармацевтическую композицию, включающую соединение согласно изобретению вместе с фармацевтически приемлемым разбавителем или носителем, для лечения вирусных инфекций, таких как HCV или ВИЧ инфекция, для применения в качестве иммунодепрессанта или противовоспалительного средства; способ лечения вирусных инфекций (в особенности РНК-вирусных инфекций), таких как HCV или ВИЧ инфекция, или применение в качестве иммунодепрессанта или противовоспалительного средства,включающий введение субъекту терапевтически эффективного количества соединения согласно изобретению. Общие методы Материалы и методы Бактериальные штаммы и условия роста. Продуцент санглиферина Streptomyces sp. A92-308110 (DSM номер 9954, полученный от DSMZ,Braunschweig, Germany), также называемый BIOT-4253 и BIOT-4370, или его производные, такие какBIOT-4585, поддерживали на овсяной среде с агаром, МАМ, ISP4 или ISP2 (см. ниже) при 28 С.BIOT-4585 (относительно методики конструирования, см. пример 1) выращивали на овсяном агаре при 28 С в течение 7-10 дней. Споры с поверхности агаровой чашки собирали в 20% мас./об. стерильный глицерин в дистиллированной воде и хранили в аликвотах по 0,5 мл при -80 С. Замороженный сток спор использовали для инокуляции посевной среды SGS или SM25-3. Инокулированную посевную среду инкубировали при встряхивании в пределах 200-300 об/мин с подбрасыванием на 5,0 или 2,5 см при 27 С в течение 24 ч. Ферментационную среду SGP-2 или ВТ 6 инокулировали 2,5-10% посевной культуры и инкубировали при встряхивании в пределах 200-300 об/мин с подбрасыванием на 5 или 2,5 см при 24 С в течение 4-5 дней. Затем культуру собирали для экстракции. Аналоги метатирозина. Метил-(2S)-2-амино-3-(6-гидрокси(2-пиридилпропаноат, метиловый эфир L-3-аминофенилаланина, метиловый эфир L-4-метил-метатирозина, метиловый эфир L-4-фтор-метатирозина и метиловый эфир L-4,5-дифтор-метатирозина были приобретены у Netchem (USA).(S)-метил-2-амино-3-(3-фтор-5-гидроксифенил)пропаноат был приобретен у NetChem (USA). (3 Бром-5-фторанизол (9-1) был приобретен у Accela ChemBio Co., Ltd., (Shanghai, China), a также может быть приобретен у Amfinecom Inc. (USA) или Apollo Scientific Ltd. (UK. К раствору 8-1 (3 г, 19,5 ммоль) в сухом ДХМ (150 мл) по каплям добавляли BBr3 (4M в ДХМ, 14,6 мл, 58,5 ммоль) при -70 С. После добавления реакционную смесь перемешивали при -20 С в течение 3 ч,осторожно добавляли воду со льдом и экстрагировали ДХМ. Органические слои промывали водой и насыщенным солевым раствором, сушили над Na2SO4, фильтровали и выпаривали. Остаток очищали с помощью флеш-хроматографии на силикагеле, получив требуемое соединение 8-2. К раствору 8-2 (0,9 г, 6,4 ммоль) в ацетоне (40 мл) добавляли K2CO3 (2,2 г, 16 ммоль) при комнат- 22023907 ной температуре. Реакционную смесь оставляли на ночь с перемешиванием при комнатной температуре. Добавляли воду и удаляли ацетон в вакууме, а затем экстрагировали EtOAc, органические слои промывали водой и насыщенным солевым раствором, сушили над Na2SO4, фильтровали и выпаривали. Остаток очищали с помощью флеш-хроматографии на силикагеле, получив требуемое соединение 8-3. Смесь 8-3 (1 г, 4,34 ммоль), гиппуровой кислоты (860 мг, 4,80 ммоль), NaOAc (400 мг) и Ас 2 О (2,2 мл) перемешивали при 80 С в течение 2 ч. Желтую реакционную смесь охлаждали и добавляли холодный EtOH (10 мл), смесь охлаждали в ледяной бане в течение 15 мин и затем вливали в 30 мл воды со льдом, охлаждали и собирали продукт при помощи фильтрации. Твердое вещество сушили в вакууме,получив 8-4. Раствор 8-4 (300 мг, 0,8 ммоль) и NaOAc (71 мг, 0,87 ммоль) в МеОН (50 мл) перемешивали при комнатной температуре в течение ночи. Растворитель удаляли на роторном испарителе и растворяли остаток в 50 мл EtOAc, раствор EtOAc два раза промывали водой и выпаривали, получив 8-5. Раствор 8-5 (360 мг, 0,89 ммоль) в МеОН (50 мл) гидрировали над 10% Pd/C (77 мг) при нормальном давлении в течение 20 ч. После удаления катализатора фильтрацией растворитель выпаривали с получением продукта 8-6. Раствор 8-6 (210 мг) в 3H HCl (10 мл) кипятили с обратным холодильником в течение 24 ч, раствор выпаривали досуха, а остаток очищали с помощью системы Combiflash с обращенными фазами, получив целевой продукт 8. К раствору 9-1 (20 г, 97,55 ммоль) в тетрагидрофуране (100 мл) по каплям добавляли н-бутиллитий(43 мл, 2,5 М, 107,3 ммоль) при -78 С. Смесь перемешивали в течение 30 мин и при указанной температуре добавляли N,N-диметилформамид (15,1 мл, 195,1 ммоль). Смесь перемешивали еще в течение 30 мин и убирали холодную баню. Через 1 ч реакцию останавливали насыщенным водным раствором хлорида аммония. Органический слой промывали водой и насыщенным раствором хлорида натрия, сушили(сульфат натрия), фильтровали и выпаривали. Остаток очищали с помощью хроматографии на силикагеле, получив 9-2. К раствору 9-2 (6 г, 38,9 ммоль) в сухом ДХМ (200 мл) по каплям добавляли BBr3 (4M и ДХМ, 30 мл, 116,8 ммоль) при -70 С. После добавления реакционную смесь перемешивали при -20 С в течение 3 ч, осторожно добавляли воду со льдом и экстрагировали ДХМ. Органические слои промывали водой и насыщенным солевым раствором, сушили над Na2SO4, фильтровали и выпаривали. Остаток очищали с помощью флеш-хроматографии на силикагеле, получив требуемое соединение 9-3. К раствору метил-2-(бензилоксикарбониламино)-2-(диметоксифосфорил)ацетата (4,64 г, 14 ммоль) в ДХМ (150 мл) при комнатной температуре добавляли DBU (4,26 г, 28 ммоль). Через 10 мин добавляли 9-3 (1,95 г, 14 ммоль) и оставляли полученную смесь на ночь с перемешиванием при комнатной температуре. Раствор разбавляли EtOAc (150 мл), разделяли и промывали органический слой 1 Н HCl, сушили над Na2SO4, фильтровали и выпаривали. Остаток очищали с помощью флеш-хроматографии на силикагеле, получив 9-4. Раствор 9-4 (1 г) в МеОН (20 мл) гидрировали в течение ночи над 200 мг 10% Pd/C при нормальном давлении. После удаления катализатора фильтрацией растворитель выпаривали с получением 10. К раствору 10 (300 мг, 1,4 ммоль) в EtOH (30 мл) добавляли водн. NaOH (2H, 4 мл), реакционную смесь перемешивали при комнатной температуре в течение 30 мин. Растворитель удаляли и остаток нейтрализовывали до рН 6 2 Н HCl, после чего образовавшиеся белые кристаллы собирали фильтрацией, получив целевое соединение 9.(3,5-Дифторбромбензол (9 а-1) был приобретен у Darui Fine Chemicals Co., Ltd., (Shanghai, China) и может быть также приобретен у Alfa Aesar или Sigma Aldrich). Получение 9 а-2. К раствору BnOH (1,61 мл, 15,54 ммоль) в ДМФА (30 мл) добавляли NaH (622 мг, 60% дисперсия в минеральном масле, 15,54 ммоль) при 0 С. Перемешивание продолжали при комнатной температуре в течение 0,5 ч с получением прозрачного раствора. 9 а-1 (1,79 мл, 15,54 ммоль) добавляли при такой скорости, чтобы поддерживать температуру ниже 40 С. Смесь перемешивали при комнатной температуре в течение ночи, получив желтый раствор. Реакцию останавливали водой и экстрагировали петролейным эфиром (35 мл 4). Объединенные органические слои выпаривали. И остаток очищали с помощью хроматографии на силикагеле, используя для элюирования петролейный эфир, с получением 9 а-2 (2,544 г) в виде бесцветного масла. Получение 9 а-3. В сухую трехгорлую колбу добавляли Mg (170,1 мг, 7,10 ммоль), безводный ТГФ (10 мл) и небольшое количество иода под азотом. Добавляли 1/3 9 а-2 (1,664 г, 5,9192 ммоль) в ТГФ (2 мл). Смесь нагревали до кипения с обратным холодильником. В это время желтая смесь постепенно приобретала яркожелтый цвет. Затем по каплям добавляли остальные 2/3 9 а-2 и продолжали кипятить реакционную смесь с обратным холодильником еще 0,5 ч. К вышеуказанной смеси медленно добавляли ДМФА (0,504 мл, 6,51 ммоль) при 0 С. Перемешивание продолжали в течение 0,5 ч при комнатной температуре. Добавляли HCl (2 М, 10 мл) и выпаривали ТГФ. Остаток экстрагировали этилацетатом (25 мл 3). И объединенные органические слои промывали насыщенным солевым раствором и выпаривали в вакууме. Остаток очищали с помощью хроматографии на силикагеле, элюируя в градиенте от петролейного эфира до петролейного эфира/этилацетата = 20/1,получив 9 а-3 (694 мг) в виде бесцветного масла. Получение 9 а-5. К раствору метил-2-(бензилоксикарбониламино)-2-(диметоксифосфорил)ацетата, 9 а-4 (993 мг, 3,00 ммоль) в ДХМ (30 мл) при комнатной температуре добавляли DBU (832 мкл, 5,57 ммоль). Через 10 мин добавляли 9 а-3 (694 мг, 3,01 ммоль) и перемешивали полученную смесь при комнатной температуре в течение 1 ч. Раствор промывали HCl (1 М, 10 мл) и объединенные органические слои сушили и выпаривали в вакууме. Остаток очищали с помощью флеш-хроматографии на силикагеле (элюция дихлорметан/этилацетат = 10/1), получив 9 а-5 (1,11 г). Получение 10. Раствор 9 а-5 (100 мг) в МеОН (50 мл) гидрировали над 20 мг 10% Pd/C при нормальном давлении в течение 2 ч. После удаления катализатора фильтрацией растворитель выпаривали, получив 10 (33 мг). Метил-2-амино-3-(2-фтор-5-гидроксифенил)пропаноат (11). К раствору соединения 11-1 (1,4 г, 9 ммоль) в 50 мл ДХМ по каплям добавляли BBr3 (4M в ДХМ,3,6 мл, 13,5 ммоль) при -78 С. После добавления реакционную смесь перемешивали при -20 С в течение 4 ч. Затем медленно добавляли лед/воду, слои разделяли, органические слои промывали водой и насыщенным солевым раствором, сушили над Na2SO4 и выпаривали досуха. Остаток использовали в следующей стадии без дополнительной очистки. К раствору метил-2-(бензилоксикарбониламино)-2-(диметоксифосфорил)ацетата (3 г, 9 ммоль) в 100 мл ДХМ добавляли DBU (2,8 г, 18 ммоль) при комнатной температуре, через 10 мин добавляли соединение 11-2 (неочищенное соединение из предыдущей стадии), перемешивали при комнатной температуре в течение 2 ч. Затем раствор разбавляли ДХМ (50 мл), промывали 1 Н HCl (20 мл), сушили надNa2SO4 и выпаривали досуха. Остаток очищали с помощью хроматографии на силикагеле (петролейный эфир/этилацетат = 5/1), получив 11-3. Смесь соединения 11-3 (500 мг, 1,5 ммоль) в МеОН (20 мл) гидрировали над 50 мг 10% Pd/C при нормальном давлении в течение ночи. После удаления катализатора фильтрацией растворитель выпаривали, получив неочищенный продукт, который очищали при помощи системы Combiflash с обращенными фазами, с получением 11 в виде твердого белого вещества. Метил-2-амино-3- (2-фтор-3-гидроксифенил)пропаноат (12) К раствору соединения 12-1 (1,4 г, 9 ммоль) в 50 мл ДХМ по каплям добавляли BBr3 (4M в ДХМ,3,6 мл, 13,5 ммоль) при -78 С. После добавления реакционную смесь перемешивали при 20 С в течение 4 ч. После медленного добавления льда/воды слои разделяли, органический слой промывали водой и насыщенным солевым раствором, сушили над Na2SO4 и выпаривали досуха. Остаток использовали в следующей стадии без дополнительной очистки. К раствору метил-2-(бензилоксикарбониламино)-2-(диметоксифосфорил)ацетата (3 г, 9 ммоль) в 100 мл ДХМ при комнатной температуре добавляли DBU (2,7 мл, 18 ммоль), через 10 мин добавляли соединение 12-2 (неочищенное соединение из предыдущей стадии), перемешивали при комнатной температуре в течение 2 ч. Затем раствор разбавляли ДХМ (100 мл), промывали 1 Н HCl (30 мл), сушили надNa2SO4 и выпаривали досуха. Остаток очищали с помощью хроматографии на силикагеле (петролейный эфир/этилацетат = 5/1), получив 12-3. Смесь соединения 12-3 (500 мг, 1,44 ммоль) в МеОН (10 мл) гидрировали над 100 мг 10% Pd/C при нормальном давлении в течение ночи. После удаления катализатора фильтрацией растворитель выпаривали, получив неочищенный продукт, который очищали при помощи системы Combiflash с обращенными фазами, с получением требуемого соединения 12 в виде твердого белого вещества. Метил-2-амино-3-(2,6-дифтор-3-гидроксифенил)пропаноат (13) К раствору 2,4-дифторфенола (2 г, 15,4 ммоль) в 50 мл ДМФА добавляли K2CO3 (3,2 г, 23,1 ммоль) и BnBr (2,2 мл, 18,5 ммоль) при 0 С. Реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Добавляли воду (100 мл) и ЕА (200 мл), органические слои промывали водой (50 мл) и насыщенным солевым раствором (50 мл), сушили над Na2SO4 и выпаривали досуха. Остаток очищали с помощью хроматографии на силикагеле (петролейный эфир/этилацетат = 10/1), получив неочищенное 13-1. К раствору соединения 13-1 (2 г, 9 ммоль) в 10 мл ТГФ по каплям добавляли H-BuLi (4 мл, 2,5 М) при -78 С и перемешивали в течение 30 мин. Добавляли ДМФА (1,3 г, 0,018 ммоль) и снова перемеши- 25023907 вали в течение 30 мин. Затем холодную баню убирали и перемешивали реакционную смесь при комнатной температуре в течение 1 ч перед добавлением воды. Смесь экстрагировали этилацетатом (20 мл 3),сушили над Na2SO4 и выпаривали досуха. Остаток очищали с помощью хроматографии на силикагеле(петролейный эфир/этилацетат = 10/1), получив 13-2 в виде твердого желтого вещества. К раствору метил-2-(бензилоксикарбониламино)-2-(диметоксифосфорил)ацетата (728 мг, 2,2 ммоль) в 20 мл ДХМ добавляли DBU (319 мг, 2,1 ммоль) при комнатной температуре. Через 10 мин добавляли соединение 13-2 (500 мг, 2 ммоль) и перемешивали при комнатной температуре в течение 2 ч. Затем раствор разбавляли ДХМ (50 мл), промывали 1 Н HCl (20 мл), сушили над Na2SO4 и выпаривали досуха. Остаток очищали с помощью хроматографии на силикагеле (петролейный эфир/этилацетат = 5/1), получив 13-3 в виде желтого масла. Соединение 13-3 (600 мг, 1,32 ммоль) в МеОН (20 мл) гидрировали над 60 мг 10% Pd/C при нормальном давлении в течение ночи. После удаления катализатора фильтрацией растворитель выпаривали,получив неочищенный продукт, который очищали при помощи системы Combiflash с обращенными фазами, с получением требуемого соединения 13 в виде твердого белого вещества. Составы сред. Воду, используемую для приготовления сред, подготавливали с использованием системы для очистки воды Millipore Elix Analytical Grade. Посевная среда SGS Примечания.пеногаситель использовали только в посевных ферментерах, но не в посевных колбах, конечный объем доводили с учетом посевного объема. Примечания.конечный объем доводили с учетом посевного объема, пеногаситель использовали только в посевных ферментерах, но не в посевных колбах. Среда SM25-3 (также называемая SM25). 20 г овсяной муки варили в 1 л воды на электроплитке (или в СВЧ-печи) в течение 20 мин. Готовую смесь фильтровали через миткаль/марлю и доводили до рН 7,2, а объем до 1 л. Добавляли 1 мл раствора микроэлементов ISP. Затем перед стерилизацией добавляли 18 г агара на 1 л. Агар МАМ. Продукционная среда ВТ 6. Общий метод ферментации. Криоконсервированные споры BIOT-4585 (методику конструирования см. в примере 1) размораживали при комнатной температуре. Вегетативные культуры (посевные культуры) приготавливали путем переноса 4,0 мл стока спор в 400 мл среды SM25 в 2 л колбе Эрленмейера с поропластовой пробкой. Культивирование вели в течение 48 ч при 27 С и 250 об/мин (с подбросом на 5,0 см). Из посевной культуры 25 мл переносили в 250 мл продукционной среды SGP2+5% HP20 в 2 л колбе Эрленмейера с поропластовой пробкой. После культивирования в течение 24 ч при 24 С и 250 об/мин (с подбросом на 2,5 см) в каждую продукционную колбу добавляли 2 мл 250 мМ раствора рацемического или 125 мМ раствора энантиомерно чистого нужного предшественника в 1 М соляной кислоте и 2 мл 250 мМ метанольного раствора DL-пиперазиновой кислоты, получив 1 мМ конечную концентрацию индивидуальных энантиомеров предшественников. Необязательно вместо 1 М соляной кислоты можно использовать ДМСО. DL-пиперазиновую кислоту необязательно можно исключить. Культивирование продолжали в течение еще четырех дней при 24 С и 250 об/мин (с подбросом на 2,5 см). Анализ сред культивирования с помощью ЖХ-УФ и ЖХ-УФ-МС. Добавляли среду культивирования (1 мл) и этилацетат (1 мл) и перемешивали в течение 15-30 мин с последующим центрифугированием в течение 10 мин, отбирали 0,4 мл органического слоя, выпаривали досуха и затем повторно растворяли в 0,20 мл ацетонитрила. Условия ВЭЖХ:
МПК / Метки
МПК: A61P 31/14, A61P 31/12, A61P 31/18, C07K 5/06, C07D 231/54
Метки: макроциклические, получения, способы, соединения
Код ссылки
<a href="https://eas.patents.su/30-23907-makrociklicheskie-soedineniya-i-sposoby-ih-polucheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Макроциклические соединения и способы их получения</a>
Предыдущий патент: Система и способ для технического обслуживания скважины
Следующий патент: Способ размещения виброизолирующих опор под рамой технологического агрегата
Случайный патент: Рекомбинантный ген m вируса гриппа b, кодирующий белок m1 с мутацией m86v












