Четырехциклические конденсированные соединения с гетероатомами, замещенные арилом, промежуточные соединения, способы получения, композиции и методы лечения
Формула / Реферат
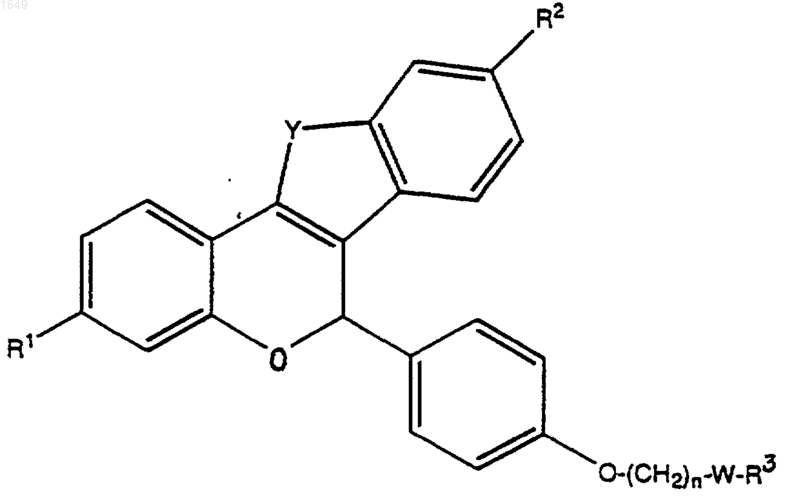
1. Соединение формулы I или II
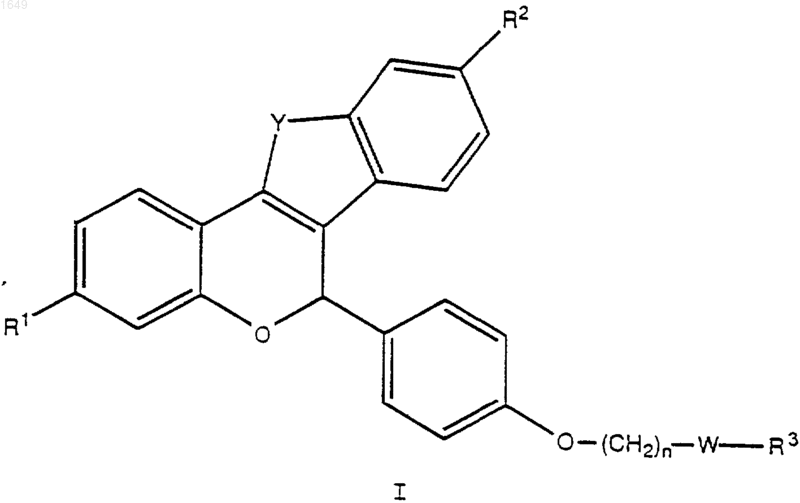
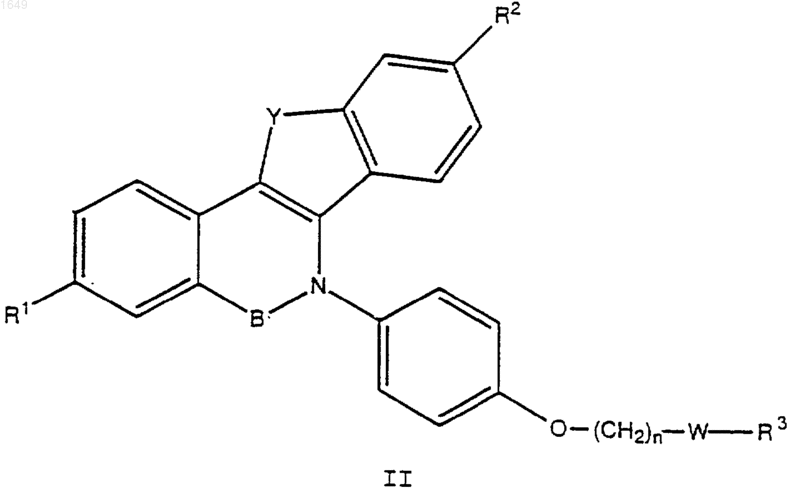
где Y обозначает -О-, -S-, -СН2-, -СН2СН2-, -СН=СН- или -NR4-;
В обозначает -СН2- или -СО-;
R1 и R2 обозначают каждый независимо -Н, -ОН, -O(C1-C4алкил), -ОСОС6Н5, -ОСО(С1-С6алкил), -ОSО2(С4-С6алкил), OSO2СF3, Сl или F;
n равно 1 или 2;
W обозначает -СН2- или >С=O;
R3 обозначает 1-пиперидинил, 2-оксо-1-пиперидинил, 1-пирролидинил, метил-1-пирролидинил, диметил-1-пирролидинил, 2-оксо-1-пирролидинил, 4-морфолино, диметиламино, диэтиламино или 1-гексаметиленимино; и
R4 обозначает C1-С3алкил, -COC6H5, -СО(С1-С6алкил), -С(O)ОС6Н5, -С(O)O(С1-С6алкил), SO2(С1-С6алкил), -SO2С6Н5 или -SO2СF3;
представляющее собой отдельный оптический изомер или смесь оптических изомеров;
или его фармацевтически приемлемая соль.
2. Соединение по п.1 формулы I, где Y представляет собой -S-.
3. Соединение по п.1 формулы II, где Y представляет собой -СН=СН-.
4. Соединение по любому из пп. с 1 по 3, где -О-(СН2)n-W-R3 представляет собой 2-(1-пиперидинил)этокси.
5. Соединение по п.1, которое выбирают из группы, включающей
3,9-дигидрокси-6-[4-[2-(1-пиперидинил)этокси]фенил]-6-Н-[1]бензотиено[3,2-с][1]бензопиран;
3,9-диметокси-6-[4-[2-(1-пиперидинил)этокси]фенил]-6-Н-[1]бензотиено[3,2-с][1]бензопиран;
3,9-бис(бензоилокси)-6-[4-[2-(1-пиперидинил)этокси]фенил]-6-Н-[1]бензотиено[3,2-с][1]бензопиран;
3,9-бис(пивалоилокси)-6-[4-[2-(1-пиперидинил)этокси]фенил]-6-Н-[1]бензотиено[3,2-с][1]бензопиран;
3,9-бис(1-бутилсульфонилокси)-6-[4-[2-(1-пиперидинил)-этокси]фенил]-6-Н-[1]бензотиено[3,2-с][1]бензопиран;
3,9-бис(трифторметансульфонилокси)-6-[4-[2-(1-пиперидинил)-этокси]фенил]-6-Н-[1]бензотиено[3,2-с][1]бензопиран;
6-[4-[2-(1-пиперидинил)этокси]фенил]-6-Н-[1]бензотиено[3,2-с][1]бензопиран;
3,9-дигидрокси-6-[4-[2-(1-пирролидинил)этокси]фенил]-6-Н-[1]бензотиено[3,2-с][1]бензопиран;
3,9-дигидрокси-6-[4-(2-диметиламиноэтокси)фенил]-6-Н-[1]бензотиено[3,2-с][1]бензопиран;
3,9-дигидрокси-6-[4-[2-(2-оксо-1-пирролидинил)этокси]фенил]-6-Н-[1]бензотиено[3,2-с][1]бензопиран;
3,9-дигидрокси-6-[4-[2-(1-пиперидинил)этокси]фенил]-6-Н-бензофуро[3,2-с][1]бензопиран;
2,8-диметокси-5-[4-[2-(1-пиперидинил)этокси]фенил]-11,12-дигидро-6Н-бензо[с]фенантрид-6-он;
2,8-диметокси-5-[4-[2-(1-пиперидинил)этокси]фенил]-6Н-бензо[с]фенантридин;
2,6-дигидрокси-5-[4-[2-(1-пиперидинил)этокси]фенил]-6Н-бензо[с]фенантридин и
2,8-дигидрокси-5-[4-[2-(1-пиперидинил)этокси]фенил]-5Н-бензо[b]нафто[2,1-d]пиран.
6. Способ получения соединения формулы
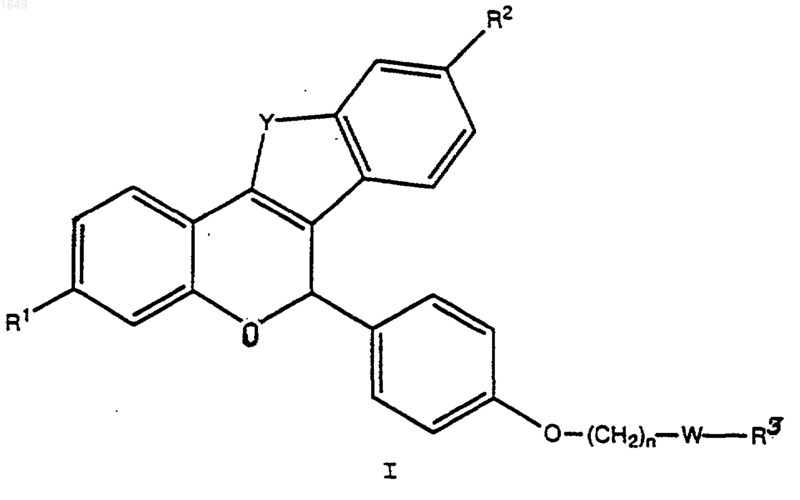
где Y обозначает -О-, -S-, -CH2-, -СН2СН2-, -СН=СН- или -NR4-;
В обозначает -СН2- или -СО-;
R1 и R2 обозначают каждый независимо -Н, -ОН, -O(С1-С4 алкил), -ОСОС6Н5, -ОСО(С1-С6алкил), -OSO2(С4-С6алкил), OSO2СF3, Сl или F;
n равно 1 или 2;
W обозначает -CH2- или >С=O;
R3 обозначает 1-пиперидинил, 2-оксо-1-пиперидинил, 1-пирролидинил, метил-1-пиррoлидинил, диметил-1-пирролидинил, 2-оксо-1-пирролидинил, 4-морфолино, диметиламино, диэтиламино или 1-гексаметиленимино; и
R4 обозначает С1-С3алкил, -СОС6Н5, -СО(С1-С6алкил), -С(O)ОС6Н5, -С(O)O(С1-С6алкил), -OSO2(С1-С6алкил), -SO2C6H5 или -SO2СF3;
представляющего собой отдельный оптический изомер или смесь оптических изомеров; или его фармацевтически приемлемой соли,
который включает следующие стадии:
1) взаимодействие соединения формулы
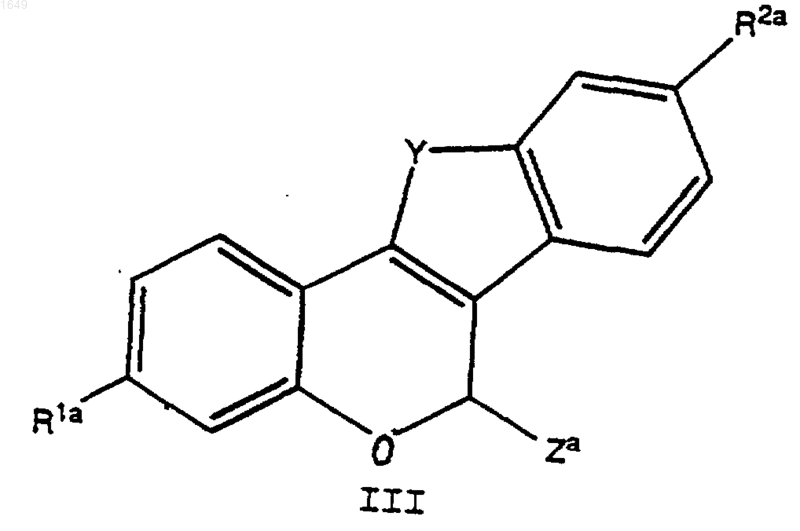
где R1a и R2a обозначают каждый независимо -Н, -O(С1-С4алкил), -Cl, -F или защищенный -ОН;
Y определено как указано выше; и
Za обозначает -ОН, -OC6H5 или -О(С1-С4алкил),
с реактивом Гриньяра формулы
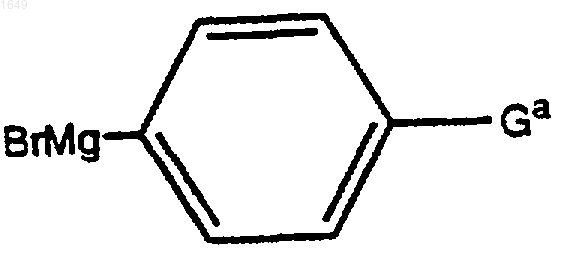
где Ga представляет собой -OSi(СН3)3, защищенную группу -ОН, с которой можно селективно удалить защиту в присутствии R1a и R2a, или -О-(СН2)n-W-R3, с получением соединения формулы
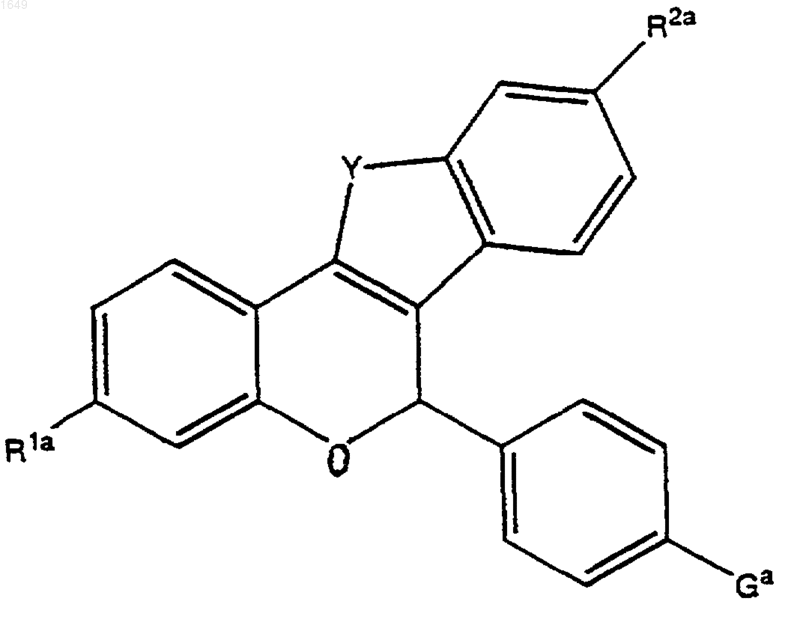
2) в случае, когда Ga представляет собой -OSi(СН3)3 или защищенную группу -ОН, как определено выше, (а) обработка продукта со стадии (1) с целью селективного удаления защиты с получением соединения формулы
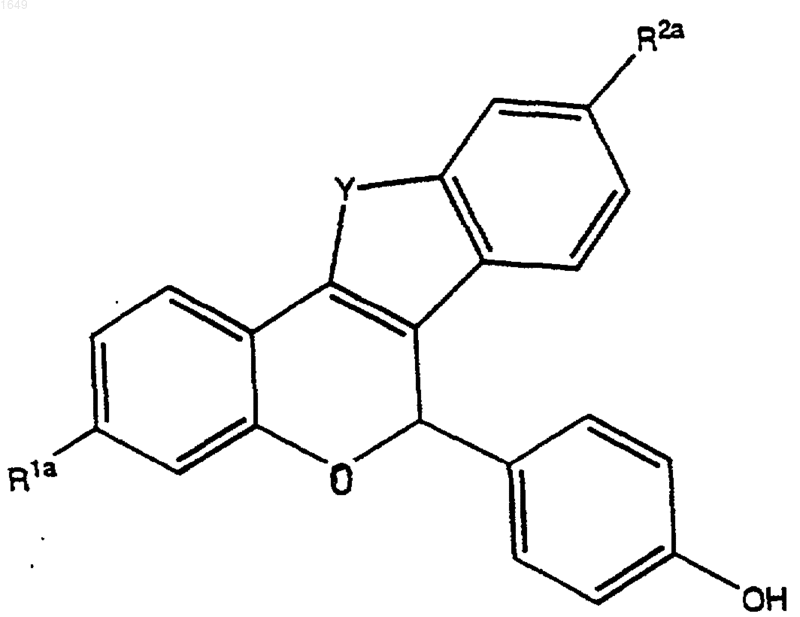
а затем (б) алкилирование этого соединения до соединения формулы
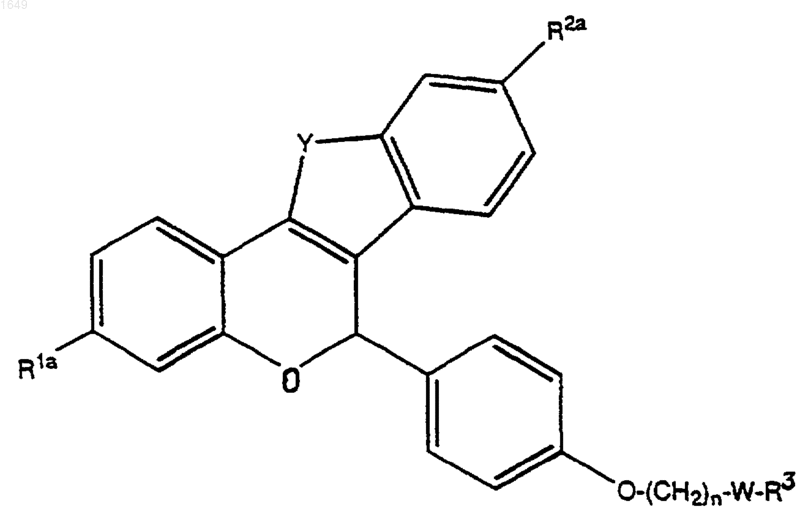
3) удаление защиты у любых защищенных -ОН групп в R1a или R2a в соединении со стадии 1 или стадии 2 с получением соединения формулы
4) при необходимости, взаимодействие продукта стадии 3 с фармацевтически приемлемой кислотой.
7. Соединение формулы
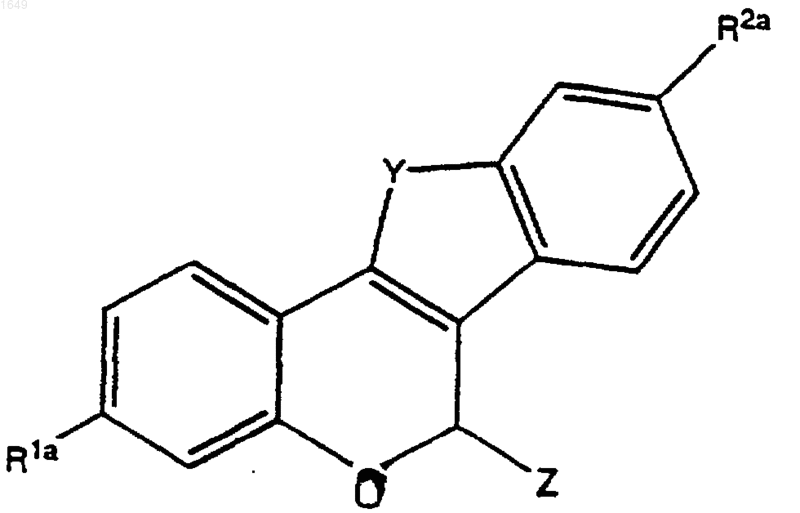
где Y обозначает -О-, -S-, -СН2-, -СН2СН2-, -СН=СН- или -NR4-;
R1a и R2a обозначают каждый независимо -Н, -O(С1-С4 алкил), -Cl, -F или защищенный -ОН; и
Z обозначает -ОН, -ОС6Н5, -О(С1-С4алкил) или 4-гидроксифенил;
представляющее собой отдельный оптический изомер или смесь оптических изомеров.
8. Соединение формулы
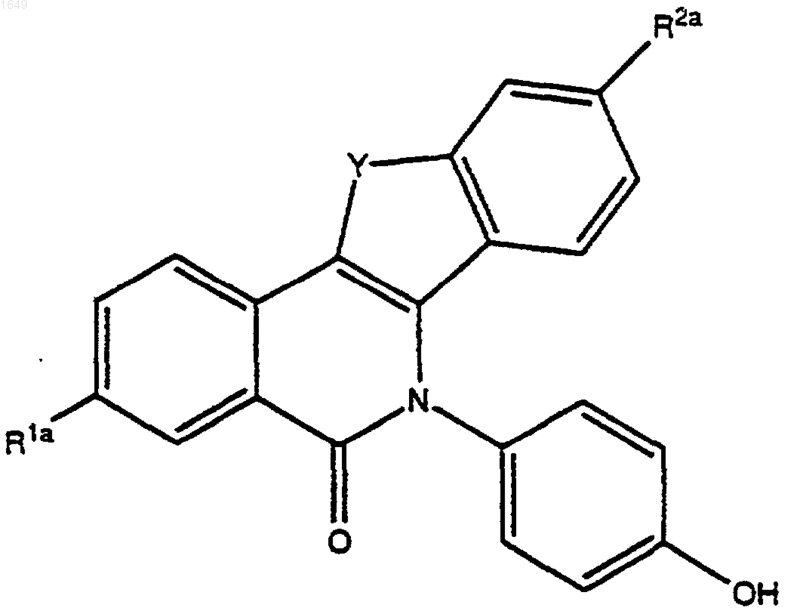
где Y обозначает -О-, -S-, -CH2-, -CH2CH2-, -СН=СН- или -NR4-;
R1a и R2a обозначают каждый независимо -Н, -O(С1-С4алкил), Cl, -F или защищенный -ОН.
9. Фармацевтическая композиция, включающая соединение по п.1 вместе с фармацевтически приемлемым носителем, растворителем или наполнителем.
10. Способ ингибирования потерь костной ткани или резорбции костей, включающий введение нуждающемуся в этом пациенту эффективного количества соединения по п.1.
11. Способ по п.10, причем потери костной ткани или резорбция костей связана с менопаузой или овариэктомией.
12. Способ снижения уровня холестерина в сыворотке крови, включающий введение нуждающемуся в этом пациенту эффективного количества соединения по п.1.
13. Соединение по п.1, имеющее следующую формулу
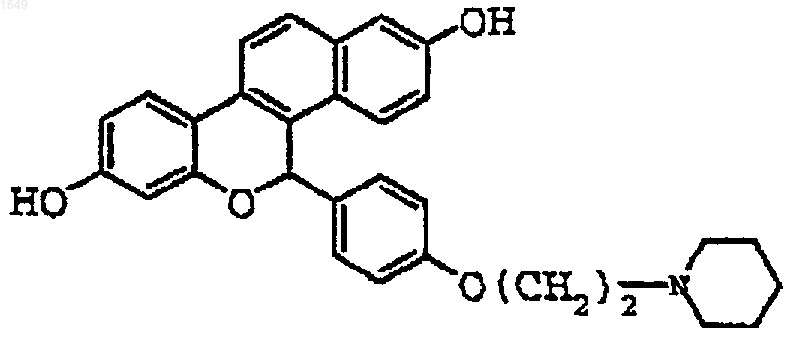
представляющее собой отдельный оптический изомер или смесь оптических изомеров;
или его фармацевтически приемлемая соль.
14. Соединение по п.1, которое представляхт собой гидрохлоридную соль.
15. Фармацевтическая композиция, включающая соединение по п.14 вместе с фармацевтически приемлемым носителем, растворителем или наполнителем.
16. Способ ингибирования потерь костной ткани или резорбции костей, включающий введение нуждающемуся в этом пациенту эффективного количества соединения по п.14.
17. Способ по п.16, причем потери костной ткани или резорбция костей связана с менопаузой или овариэктомией.
18. Способ снижения уровня холестерина в сыворотке крови, включающий введение нуждающемуся в этом пациенту эффективного количества соединения по п.14.
19. Способ ингибирования эстрогенозависимого рака, включающий введение нуждающемуся в этом пациенту эффективного количества соединения по п.1.
20. Способ по п.19, где рак представляет собой рак молочной железы.
21. Способ ингибирования эстрогенозависимого рака, включающий введение нуждающемуся в этом пациенту эффективного количества соединения по п.14.
22. Способ по п.21, где рак представляет собой рак молочной железы.
Текст
1 Настоящее изобретение относится к областям фармацевтической и органической химии и представляет новые пентациклические соединения, которые пригодны для лечения по различным медицинским показаниям, связанным с постменопаузным синдромом, фиброидным заболеванием матки, эндометриозом, пролиферацией клеток гладких мышц аорты. Данное изобретение, кроме того, относится к промежуточным соединениям и способам, применимым для получения фармацевтически активных соединений данного изобретения и фармацевтическим композициям."Синдром постменопаузы" - это термин,используемый для описания различных патологических состояний, которым часто подвержены женщины, вошедшие в период физиологических метаморфоз, известный как менопауза, или завершившие его. Хотя при использовании этого термина подразумеваются многие патологии,три главных эффекта постменопаузного синдрома являются источником наиболее долговременных медицинских проблем: остеопороз,сердечно-сосудистые эффекты, такие как гиперлипидемия, эстрогенозависимый рак, особенно рак молочных желез и рак матки. Остеопорозом называется группа заболеваний, которые имеют различную этиологию, но которые характеризуются общей потерей костной массы на единицу объема. Следствием этой потери костной массы и происходящих, в результате переломов является неспособность скелета обеспечивать адекватную структурную поддержку телу. Один из наиболее обычных типов остеопороза является остеопороз, связанный с менопаузой. Большинство женщин теряет от примерно 20% до примерно 60% костной массы в трабекулярной части кости в течение 36 лет после прекращения менструаций. Эта быстрая потеря в основном связана с усилением резорбции и образования костной ткани. Однако больше доминирует резорбтивный цикл, и результатом является общая потеря костной массы. Остеопороз является обычным и тяжелым заболеванием у женщин в постменопаузе. Установлено, что только в США этим заболеванием страдают 25 миллионов женщин. Результаты остеопороза пагубны для лица, им страдающего, а также служат причиной больших экономических потерь из-за его хронического характера и необходимости обширной и долговременной помощи (госпитализация и уход дома) в результате последствий заболевания. Это особенно верно для более пожилых пациентов. К тому же хотя, как обычно считают,остеопороз не является угрожающим жизни заболеванием, 20-30% смертности связано с переломами бедра у пожилых женщин. Большой процент этого уровня смертности может быть непосредственно связан с постменопаузным остеопорозом. 2 Наиболее уязвимой тканью в кости для эффектов постменопаузного остеопороза является трабекулярная костная ткань. Эту ткань часто называют губчатой или сетчатой костной тканью, и она, в частности, сконцентрирована вблизи концов костей (у суставов) и в позвонках позвоночного столба. Трабекулярная ткань характеризуется небольшими остеоидными структурами, которые связаны между собой, а также более твердой и плотной корковой тканью, которая образует наружную поверхность и центральное тело кости. Эта связанная между собой сеть трабекулы создает латеральную поддержку наружной корковой структуре и является определяющей для биомеханической прочности всей структуры. При постменопаузном остеопорозе в первую очередь происходит резорбция этой сетки и потеря трабекулы, которые приводят к недостаточности костной ткани и перелому кости. В свете потери трабекулы у женщин в постменопаузном периоде не удивительно, что большинство обычных переломов составляют те,которые связаны с костями с высокой зависимостью от трабекулярной поддержки, например,позвоночника, шейки несущих весовую нагрузку костей, таких как бедренная или кости предплечья. Несомненно, перелом бедра, перелом Коллиса и раздавливающие переломы позвоночника являются признаками постменопаузного остеопороза. В настоящее время единственным общепринятым методом лечения постменопаузного остеопороза является заместительная терапия эстрогенами. Хотя эта терапия обычно успешна,согласие пациента на эту терапию низко, в первую очередь из-за того, что лечение эстрогенами часто дает нежелательные побочные эффекты. В течение предменопаузного периода у большинства женщин заболеваемость сердечнососудистыми болезнями меньше, чем у одногодков мужчин. После менопаузы, однако, частота сердечно-сосудистых заболеваний у женщин медленно увеличивается, чтобы достичь частоты, наблюдаемой у мужчин. Эта потеря защиты связана с потерей эстрогена и, в частности, с потерей способности эстрогена регулировать уровни липидов в сыворотке крови. Природа способности эстрогена регулировать уровень липидов не вполне понятна, но современные данные показывают, что эстрогены могут повышать число рецепторов липидов низкой плотности (ЛНП) в печени с удалением избытка холестерина. К тому же эстрогены, повидимому, обладают некоторым действием на биосинтез холестерина и другими благоприятными воздействиями на состояние сердечнососудистой системы. В литературе были сообщения о том, что у женщин, получающих заместительную терапию эстрогенами происходил возврат уровней липидов в сыворотке к концентрациям предменопа 3 узного состояния. Таким образом, эстрогены, по видимому, являются обоснованным лечением для этого состояния. Однако побочные эффекты заместительной терапии эстрогенами неприемлемы для многих женщин, что таким образом,ограничивает применение этой терапии. Идеальной терапией для этого состояния было бы средство, которое регулировало бы уровень липидов, как и эстрогены, но которое было бы лишено побочных эффектов и отрицательного действия, связанных с терапией эстрогенами. Третьей главной патологией, связанной с постменопаузным синдромом, является эстрогенозависимый рак молочных желез, и в меньшей степени, эстрогенозависимый рак других органов, в частности матки. Хотя распространенность таких опухолевых заболеваний не ограничивается контингентом только женщин в постменопаузе, они преобладают у пожилых в постменопаузе. Современная терапия этих видов рака в большой степени основана на применении антиэстрогенных соединений, таких как,например, тамоксифен. Хотя такие смешанные агонисты-антагонисты обладают благоприятными эффектами при лечении этих видов рака,и эстрогенное побочное действие вполне допустимо в острых угрожающих жизни ситуациях,они не идеальны. Например, эти вещества могут производить стимулирующее действие на некоторые популяции раковых клеток в матке из-за их эстрогенных (агонистических) свойств и они могут, поэтому, быть неблаготворными в некоторых случаях. Лучшей терапией для лечения этих видов рака было бы вещество, которое является антиэстрогенным соединением, имеющим незначительные эстрогенные агонистические свойства на ткани репродуктивной системы, или не имеющие их. В ответ на явную потребность в новых фармацевтических веществах, которые способны облегчить симптомы, в том числе постменопаузного синдрома, данное изобретение представляет новые пентациклические соединения,их фармацевтические композиции и способы применения таких соединений для лечения постменопаузного синдрома и других эстрогенозависимых патологических состояний, таких как упоминаемые ниже. Фиброз матки (фиброидное заболевание матки, фибролейомиома) является старой и всегда существующей клинической проблемой,которая рассматривается под разными названиями, включающими фиброидное заболевание матки, гипертрофию матки, лиомиоматоз матки,гипертрофию миометрия, фиброз матки и фиброметрит. По существу фиброз матки является состоянием, когда существует несоответствующее расположение фиброидной ткани в стенке матки. Это состояние является причиной дисменореи и бесплодия у женщин. Точная причина этого состояния еще плохо понята, но имею 001649 4 щиеся данные наводят на мысль о том, что оно является несоответствующей реакцией фиброидной ткани на эстроген. Такое состояние было воспроизведено у кроликов путем ежедневного введения эстрогена в течение 3 месяцев. У морских свинок это состояние было воспроизведено путем ежедневного введения эстрогена в течение четырех месяцев. Кроме того, у крыс эстроген вызывает подобную же гипертрофию. Наиболее обычное лечение фиброза матки включает хирургическое вмешательство, как дорогостоящее, так и иногда являющееся источником осложнений, таких как образование абдоминальных спаек и инфекции. У некоторых пациентов хирургическое лечение является только временной лечебной мерой, и рост фиброзных узлов возобновляется. В этих случаях производится гистероэктомия, которая эффективно прекращает образование фиброзных узлов, но также и репродуктивную жизнь пациентки. К тому же можно вводить антагонисты рилизинг-гормона гонадотропина, хотя их применение ограничивается тем фактом, что они могут приводить к остеопорозу. Таким образом,существует потребность в новых способах лечения фиброза матки, и способы данного изобретения удовлетворяют эту потребность. Эндометриоз является состоянием с тяжелой дисменореей, которое сопровождается сильной болью, кровотечением в массы эндометрия или перитонеальную полость и часто приводит к бесплодию. Причиной симптомов этого состояния по-видимому является эктопический рост эндометрия, который несоответствующе реагирует на нормальную гормональную регуляцию и расположен в несоответствующих тканях. Из-за несоответствующего расположения для роста эндометрия эта ткань, повидимому, инициирует местные реакции, подобные воспалению, вызывающие инфильтрацию макрофагов и каскад явлений, приводящих к возникновению болевой реакции. Точная этиология этого заболевания не совсем понятна,и его лечение с помощью гормональной терапии противоречиво, плохо отработано и отличается многочисленными нежелательными и, возможно, опасными побочными эффектами. Один из методов лечения этого заболевания состоит в применении низкой дозы эстрогена для подавления роста эндометрия посредством отрицательного эффекта обратной связи на центральное выделение гонадотропина и последующую продукцию эстрогена в яичниках; однако, иногда необходимо использовать постоянное поступление эстрогена для борьбы с симптомами. Это применение эстрогена часто может приводить к нежелательным побочным эффектам и даже к риску возникновения рака эндометрия. Другой метод лечения состоит в непрерывном введении прогестинов, которые вызывают аменорею и, путем подавления продукции 5 эстрогенов яичниками, могут вызывать регрессию роста эндометрия. Использование хронической терапии прогестинами часто сопровождается неприятными побочными эффектами прогестинов на ЦНС и часто приводит к бесплодию из-за подавления функции яичников. Третий способ лечения состоит во введении слабых андрогенов, которые эффективны в борьбе с эндометриозом; однако они вызывают тяжелые маскулинизирующие эффекты. В нескольких случаях такое лечения эндометриоза также было связано с возникновением легкой степени потери костной ткани при продолжительной терапии. Поэтому желательны новые методы лечения эндометриоза. Пролиферация клеток гладких мышц аорты играет большую роль в таких заболеваниях,как атеросклероз и рестеноз. Сосудистый рестеноз после чрезкожной чрезпросветной коронарной ангиопластики (ЧЧКА), как было показано,является реакцией ткани, характеризующейся ранней и поздней стадиями. Ранняя фаза, происходящая в течение от часов до дней после ЧЧКА, связана с тромбозом при некотором сосудистом спазме, тогда как на поздней стадии,по-видимому, доминирует избыточная пролиферация и миграция клеток гладких мышц аорты. При этом заболевании повышенная подвижность клеток и колонизация такими мышечными клетками и макрофагами в значительной степени способствуют патогенезу этого заболевания. Избыточная пролиферация и миграция клеток сосудистых гладких мышц аорты может быть первичным механизмом в отношении реокклюзии коронарных артерий после ЧЧКА, атероэктомии, лазерной ангиопластики и операции пересадки артериального шунта. Смотрите "Intimal Proliferation of Smooth Muscle Cells as anCollege of Cardiology, 8: 369-375 (Aug. 1985). Сосудистый рестеноз остается главным долговременным осложнением после хирургического вмешательства на блокированных артериях путем чрезкожной чрезпросветной коронарной ангиопластики (ЧЧКА), атероэктомии,лазерной ангиопластики и операции пересадки артериального шунта. У примерно 35% пациентов, которые подверглись ЧЧКА, повторная окклюзия происходит в течение от трех до шести месяцев после операции. Современная стратегия лечения сосудистого повторного стеноза включает механическое вмешательство с помощью устройств, таких как стенты, или фармакологическую терапию, включающую гепарин,кумарин, аспирин, рыбий жир, антагонисты кальция, стероиды и простациклин. Эта стратегия не способна сдержать темп повторной окклюзии и неэффективна для лечения и предотвращения сосудистого повторного стеноза. См.Heart Journal, 122: 171-187 (July 1991). В патогенезе рестеноза избыточная клеточная пролиферация и миграция происходит в результате действия факторов роста, продуцируемых клеточными элементами крови и стенкой пораженного артериального сосуда, которые опосредуют пролиферацию клеток гладких мышц при повторном сосудистом стенозе. Вещества, которые подавляют пролиферацию и/или миграцию клеток гладких мышц аорты применимы для лечения и предотвращения рестеноза. Данное изобретение дает соединения для использования в качестве ингибиторов пролиферации клеток гладких мышц аорты и, таким образом, ингибиторы рестеноза. Трансформирующий фактор роста- (ТФР) является пептидным фактором роста, который относится к определенному семейству пептидов, часто называемых изоформами, означающими, что члены семейства или имеют гомологию аминокислот и/или обладают сходным физиологическим действием. ТФР-, особенно те, которые обозначаются как ТФР- 1, 2 и 3, в частности, связаны с процессами, происходящими при восстановлении тканей и заболеваниях, связанных с ненормальными процессами восстановления (см. Sporn and Roberts "TheSpringer Verlag, 1990. Средства, которые вызывают продукцию ТФР-, и, в частности, ТФР-3, применимы для стимуляции восстановления тканей и лечения заболеваний, при которых существует ненормальное восстановление ткани. Такое применение включает лечение ран, снижение образования рубцов (см. Ferguson, "Wound Healing, Scarring, ТФР- Antagonists, and Isoforms", Abst. NIH ТФР- Simposium, Bethesda MD, 3 May 1994), и язвенного воспаления слизистой оболочки, вызываемого химиотерапией и радиотерапией (см.Growth Factor-, Abst. NIH ТФР- Symposium,Bethesda MD, 3 May 1994), но не ограничивается этим. Данное изобретение представляет применение соединений в качестве промоторов процессов восстановления тканей и в качестве средств лечения заболеваний, при которых присутствует ненормальное восстановление тканей. Данное изобретение относится к соединениям формулы I-SО 2 СF3; или их фармацевтически приемлемым солям. Данное изобретение также представляет соединения формулы II 8 где R1a, R2a и Y имеют те же значения, что и выше. Данное изобретение, кроме того, относится к фармацевтическим композициям, содержащим соединения формулы I или формулы II, необязательно включающим эстроген или прогестин, и использованию таких соединений, отдельно или в сочетании с эстрогеном или прогестином, для облегчения симптомов постменопаузного синдрома, особенно остеопороза, патологических состояний, связанных с сердечно-сосудистой системой, и эстрогенозависимого рака. Так как он использован здесь, термин "эстроген" включает стероидные соединения, обладающие эстрогенной активностью, такие как, например,17b-эстрадиол, эстрон, конъюгированный эстроген (премарин), лошадиный эстроген, 17 аэтинилэстрадиол и тому подобное. Так как он использован здесь, термин "прогестин" включает соединения, обладающие гестагенной активностью, такие как, например, прогестерон, норэтилнодрел, нонгестрел, мегестролацетат, норэтиндрон и тому подобное. Соединения данного изобретения также применимы для подавления фиброидного заболевания матки и эндометриоза у женщин и пролиферации клеток гладких мышц, особенно рестеноза, у мужчин. Данное изобретение также представляет процесс для получения соединения формулы Iа В обозначает -СН 2- или -СОY, R1, R2, R3, n и W дано определение выше; или их фармацевтически приемлемые соли. Данное изобретение также представляет промежуточные соединения формул III и VI,которые применимы для получения фармакологически активных соединений данного изобретения, которые показаны ниже-Н, -O(C1-С 4 алкил), -Cl, -F или соответственно защищенный гидроксил;Z обозначает -ОН, -ОС 6 Н 5, -O(C1-С 4 алкил) или 4-гидроксифенил; Х и Y имеют те же значения, что и выше; где R1a, R2a обозначают каждый независимо -Н,-O(C1-С 4 алкил),-Сl, -F или соответственно защищенный гидроксил; Х и Y имеют те же определения, что и выше;G обозначает -ОН или -O(CH2)nWR3 где n,W и R3 имеют те же значения, что и выше; или их фармацевтически приемлемых солей, который включает а) реакцию соединения формулы IIIaR1a, R2a, X и Y имеют те же значения, что и выше;Za обозначает -ОН, -OC6H5, -O(C1-С 4 алкил) с реактивом Гриньяра формулы IVaG обозначает -OSi(СН 3)3, соответствующе защищенный гидроксил, у которого защита может быть селективно удалена в присутствии R1a,R2a, или -O(CH2)nWR3, где n, W и R3 имеют те же значения, что и выше;b) когда Ga обозначает -OSi(СН 3)3 или другую подходящую защищающую группу, необязательное удаление указанной защищающей группы и затем реакцию полученного -ОН с Q(CH2)n-W-R3,где Q обозначает бром, хлор или гидроксил; иc) по желанию, образование соли продукта реакции со стадии а) или b). В одном из аспектов данное изобретение включает соединения формулы IR1, R2 обозначают каждый независимо -Н,-ОН, -O(C1-С 4 алкил), -ОСОС 6 Н 5, -OCO(C1-С 6 алкил), -OSO2(C4-С 6 алкил), -ОSО 2 СF3, -Сl или F;R4 обозначает C1-С 3 алкил, -COC6H5,-CO(C1-С 6 алкил),-С(O)ОС 6 Н 5, -C(O)O(C1-С 6 алкил), -SO2(C1 С 6 алкил), -SO2C6H5 или -SО 2 СF3; или их фармацевтически приемлемые соли. Общие термины, использованные в описании соединений, представленных здесь, имеют свои обычные значения. Например, "C1-С 6 алкил" относится к прямым или разветвленным алифатическим цепям из 1-6 атомов углерода,включая метил, этил, пропил, изопропил, бутил,н-бутил, пентил, изопентил, гексил, изогексил и т. п. Исходным материалом для одного из путей получения соединений данного изобретения являются соединения формулы V, нижеR1a, R2a обозначают каждый независимо Н, -O(C1-С 4 алкил), -Сl, -F или соответственно защищенный гидроксил; Х и Y имеют те же значения, что и выше. Один из таких исходных материалов, соединения формулы VbX' обозначает -О-; получают по существу, как описано в Journal of Organic Chemistry, 40:3169 (1975). Предпочтительно, R1a и R2a являются метокси или соответственно защищенным гидроксилом, и X' является -О-. Обычно легко доступный тиоиндоксил формулы где R2a имеет те же значения, что и выше, подвергают взаимодействию с бензальдегидом формулы где Хb обозначает -ОН, -SH или -NH2, а R1a имеет те же значения, что и выше. Реакция обычно проводится в присутствии слабого основания,такого как триэтиламин, и протонного растворителя, такого как этанол, и протекает при комнатной температуре или более низкой. Продукт этой конденсации затем дегидрируют разными методами, известными специалистам, наиболее предпочтительно, с помощью реакции с 2,3 дихлор-5,6-дициано-1,4-бензохиноном (ДДХ) с получением соединения формулы V. Если это желательно, у соединений формулы V, в котором R1b, R2b обозначает метокси,может быть удалена защита с помощью реакции с трихлоридом алюминия и этантиолом, и они снова могут быть защищены альтернативной фенольной защищающей группой на этой стадии. Предпочтительны защищающие группы,которые удаляются в мягких условиях, такие как трет-бутилдиметилсилил. Альтернативные исходные материалы формулы VcR1c и R2c являются соответствующе защищенными гидроксилами; легко получаются с помощью стандартной защиты коммерчески доступного куместрола. Предпочтительны защищающие группы, которые удаляются в мягких условиях, такие как трет-бутилдиметилсилил. Исходные материалы формулы VdR1a, R2a имеют те же значения, что и выше;-СН=СН-, получают с помощью реакции фон Печмана, как описано в Organic Reactions, 7:1(1953). Обычно легко доступный тетралон или инданон формулы где R2a имеет те же значения, что и выше, a Yd обозначает -СН 2- или -СН 2-СН 2-, конденсируется с соответственно замещенным фенолом или тиофеналом: где R1a представляет собой -ОН, -Н, -O(C1-С 4 алкил) , -F, -Cl или соответственно защищенный гидроксил; и Хd обозначает -ОН или -SH,при действии конденсирующего вещества,такого как оксихлорид фосфора, пентоксид фосфора, серная кислота, хлорид алюминия и т.п. Предпочтительно R1a' представляет собой-CH2-CH2-, a R2a является метокси, и реакцию проводят в толуоле или бензоле при 80-110 С, с использованием оксихлорида фосфора в качестве конденсирующего вещества. Если продукт фон Печмана содержит фенольный заместитель, он может быть защищен на этой стадии, или альтернативно, если R2d является метокси, он может подвергаться последовательно дезалкилированию/повторной защите, как описано выше. Если это желательно, необязательная двойная связь может быть затем создана с помощью реакции с ДДХ или другим дегидрирующим веществом. Дополнительные исходные материалы формулы VeR1a, R2a и R4 имеют те же значения, что и выше; получают по существу, как описано в Heterocycles, 35:1425 (1993); United States patent5,073,553, опубликованном 17 декабря 1991; иIndian Journal of Chemistry, 24B: 556 (1989). Другие исходные материалы формулыR1a, R2a имеют те же значения, что и выше;Journal of the Chemical Society, Perkin Trans. I,1747 (1974). Если желательна двойная связь(Yf = -СН=СН-), она может быть получена способом, описанным выше при использовании ДДХ. Если было получено соединение формулыV, один из вариантов предусматривает восстановление избранного соединения формулы V до соединения формулы IIIbR1a, R2a, X и Y имеют те же значения, что и выше; путем реакции с соответствующим восстанавливающим веществом, таким как диизобутилалюминия гидрид, в растворителе, таком как толуол, CH2Cl2 или ТГФ. Обычно это восстановление проводится при температуре ниже 0 С, и предпочтительно, в интервале между-50 С и -100 С. Соединение формулы IIIb можно затем превратить, или in situ или на отдельной стадии, в соединение формулы IIIс, нижеR , R2a, X и Y имеют те же значения, что и выше; путем реакции со спиртом или феноломR6OH и, по желанию, кислотным соединением или дегидратирующим веществом, таким как сульфат магния. Предпочтительно проводить это превращение на отдельной стадии в CH2Cl2 или хлорбензоле, при температуре в интервале между комнатной температурой и температурой кипения. Предпочтительно, R1a, R2a являются соответственно защищенными гидроксилами, Х является -О-, Y представляет собой -O- или -S- иR6 является -С 6 Н 5. В качестве альтернативы соединение формулы V, в котором Х представляет собой -NH-,может быть ацилировано у азота и затем непосредственно превращено в соединение формулыIIIс путем реакции с NaBH4 или сходным восстанавливающим веществом в присутствии кислотного соединения, такого как НСl, и спиртового растворителя. При этом получении IIIc R1a и R2a, предпочтительно, являются метокси, Х является -N(СОС 6 Н 5)- или -N(СОС(СН 3)4)-, Y является -О-, а R6 предпочтительно, является-C2H5. На следующей стадии соединение формулы IIIb и IIIс подвергают взаимодействию с арильным реактивом Гриньяра формулы 1a где Ga обозначает -OSi(СН 3)3, соответственно защищенный гидроксил, у которого защита может быть селективно удалена в присутствии R1a и R2a или -(CH2)nWR3; где n, W и R3 имеют те же значения, что и выше; в растворителе, таком как толуол, ТГФ,диэтиловый эфир, CH2Cl2 или их смесь, при комнатной температуре или более низкой. По желанию осуществление реакции может облегчаться с помощью присутствия кислоты Льюиса, такой как трифторэтерат бора, тетрахлорид олова, тетрахлорид титана или тому подобное. Когда Ga в формуле IVa является-O(CH2)nWR3, эта реакция Гриньяра дает соединение формулы Ib-Н, -O(C1-С 4 алкил), -Cl, -F или соответственно защищенный гидроксил;X, Y, n, W и R3 имеют те же значения, что и выше, у которых по желанию может быть удалена защита, и которые могут быть превращены 14 в производные, как описано ниже с получением желаемого соединения формулы I. В качестве альтернативы, когда Ga в формуле IVa является -OSi(СН 3)3 или другим соответственно защищенным гидроксилом, защищающая группа удаляется на этой стадии в условиях, при которых R1a, R2a остаются интактными, с получением соединения формулы IсR1a, R2a, Х и Y имеют те же значения, что и выше. Такие условия зависят от природы защищающих групп и известны опытным специалистам [см., например, Green and Wuts, ProtectiveR1a и R2a представляют собой трет-бутилдиметилсилокси или метокси,a Ga является -OSi(СН 3)4, это может быть выполнено с помощью короткой экспозиции с суспензией карбоната калия в метаноле при комнатной температуре или более низкой в присутствии сорастворителя, такого как ТГФ или диэтиловый эфир. Соединение формулы Iс может быть превращено в соединение формулы Ib путем использования одного из путей синтеза, показанных на схеме I. В схеме I R1a, R2a, R3, W, X, Y иn обозначают то же самое, что и выше. Схема I Каждая стадия схемы I проводится с помощью процедур, хорошо известных специалистам. Например, соединение формулы Iс может подвергаться взаимодействию с соединением формулыR3-(СН 2)n-Q,3 где R , W и n имеют те же значения, что и выше,a Q является бромом или, предпочтительно, замещающим хлором, с получением соединений формулы Ib. Это алкилирование обычно достигается путем проведения реакции в присутствии избытка тонко измельченного карбоната калия и использования от эквивалента до легкого избытка реагента Q-(CH2)-R3. 15 Более предпочтительный метод включает реакцию соединения формулы Iс с соединением формулыR3-W-(CH2)n-Q,3 где R , W и n имеют те же значения, что и выше,в присутствии трифенилфосфина, диэтилазодикарбоксилата (ДЭАД) и соответствующего растворителя с получением соединения формулыIb. Этот процесс известен специалистам как связывание Митсунобу. Предпочтительно, 2-4 эквивалента 1-(2-гидроксиэтил)пирролидина реагируют с соединением формулы Iс в присутствии 2-5 эквивалентов каждого из трифенилфосфина и ДЭАД в инертном растворителе, таком как толуол при комнатной температуре. При этой температуре реакция занимает только от примерно 30 мин до примерно 3 ч, однако, изменение условий реакции будут влиять на количество времени, необходимого для того, чтобы реакция протекла до завершения. Конечно, протекание этой стадии реакции может контролироваться с помощью стандартных хроматографических методов. При еще одном пути синтеза соединение формулы Iс приводится во взаимодействие с избытком алкилирующего вещества формулыJ=W-(CH2)n-J',где J и J' каждый, являются одинаковыми или разными удаляемыми группами, в растворе щелочи. Соответствующие удаляемые группы включают, например, сульфонаты, такие как метансульфонат, 4-бромсульфонат, толуолсульфонат, этансульфонат, изопропансульфонат, 4 метоксибензолсульфонат, 4-нитробензолсульфонат, 2-хлорбензолсульфонат и тому подобное,галогены, такие как, бром, хлор, йод, и тому подобное и другие родственные группы. Предпочтительным алкилирующим веществом является 1,2-дибромэтан, и используется по меньшей мере 2 эквивалента, предпочтительно, более 2 эквивалентов, 1,2-дибромэтана на эквивалент субстрата. Предпочтительный щелочной раствор для этой реакции алкилирования содержит карбонат калия в инертном растворителе, таком как, например, метилэтилкетон (МЭК) или ДМФ. В этом растворе 4-гидроксигруппа бензоильной части соединения формулы IIId существует в виде феноксидного иона, который заменяет одну из удаляемых групп алкилирующего вещества. Реакция протекает лучше всего, когда щелочной раствор, содержащий реагенты доводят до кипения с обратным холодильником и дают реакции пройти до конца. Когда используется МЭК в качестве предпочтительного растворителя, время реакции составляет от примерно 6 часов до примерно 20 ч. Альтернативно, соединение формулы Id может быть получено путем реакции спирта формулыJ-W-(CH2)n-OH,где J выбирается из удаляемых групп, описанных выше, с соединением формулы Iс путем метода связывания Митсунобу. Предпочтительным спиртом является 2-бромэтанол. Продукт реакции с этой стадии, соединение формулы Id, затем приводят во взаимодействие с 1-пиперидином, 1-пирролидином, метил-1-пирролидином, диметил-1-пирролидином,4-морфолином, диметиламином, диэтиламином или 1-гексамстиленимином с помощью стандартных методик с образованием соединений формулы Ib. Предпочтительно, гидрохлоридную соль пиперидина подвергают взаимодействию с соединением формулы Ib в инертном растворителе, таком как безводный ДМФ, и нагревают до температуры в интервале от примерно 60 С до примерно 110 С. Когда смесь нагревают до предпочтительной температуры, равной примерно 90 С, реакция занимает только от примерно 30 мин до примерно 1 ч. Однако, изменения условий реакции будут влиять на количество времени, которое необходимо для протекания реакции до завершения. Само собой разумеется, ход реакции на этой стадии можно контролировать с помощью стандартных хроматографических методов. Дезалкилирование/удаление защиты защищенных на конце гидроксигрупп в соединениях формулы Iа может быть проведено, если желательно получить фармацевтически активные соединения формулы I путем процедур,известных специалисту. Предпочтительный способ для удаления защиты трет-бутилдиметилсилилэфиров, предпочтительного воплощения R1a и R2a, включает перемешивание их в соответствующем растворителе, таком как ТГФ,с растворимым источником фтора, таким как тетра-н-бутиламмония фторид, при комнатной температуре. Вышеприведенные процедуры дают новые фармакологически активные соединения формулы I, в которых R1, R2 каждый, представляют собой водород, гидрокси, C1-С 4 алкокси, хлор или фтор. Предпочтительными соединениями формулы Iа являются те, в которых R1 и R2, каждый, являются метокси, или R1 и R2, каждый,являются гидрокси, R3 является пиперидинилом или пирролидинилом, Х является -О-, Y является -S-, W является -СН 2-, а n равно 1. Эти предпочтительные соединения, а также другие соединения формулы Iа, могут использоваться в качестве фармацевтических средств или их можно далее видоизменять с получением других производных соединений формулы I, которые также применимы для осуществления на практике способов данного изобретения. Можно также применять альтернативный,"в одном сосуде", способ получения соединения формулы I или Iа из соединения формулы V. Этот путь включает: 17 1) Восстановление соединения формулы V с помощью гидрида диизобутилалюминия или похожего восстанавливающего вещества в ТГФ при температуре ниже -60 С. 2) Гашение избытка восстанавливающего вещества молярным эквивалентом протонного растворителя, такого как метанол или изопропанол. 3) Добавление арильного реактива Гриньяра формулы и нагревание до комнатной температуры. 4) Стандартную обработку экстрагированием реакционной смеси и концентрирование. 5) необязательную обработку ТГФ раствора остатка сильной кислотой, такой как НСl, в течение промежутка времени продолжительностью вплоть до 24 ч и последующую обработку основанием. В некоторых случаях способ "в одном сосуде" может дать продукты формулы Iа, у которых может быть удалена защита, как описано выше. Альтернативно, конечная обработка кислотой может вызывать сопутствующее удаление защиты и приводить непосредственно к получению соединений формулы I. Предпочтительные соединения формулы I от этой реакции являются такими же, как и предпочтительные соединения формулы I, описанные выше, и могут использоваться в качестве фармакологически активных веществ для способов, описанных здесь, или их можно превращать в производные с получением других новых соединений формулы I, которые также применимы для данных способов (ниже). В другом аспекте данное изобретение включает соединения формулы IIR1a, R2a и Y имеют те же значения, что и выше. Синтез предпочтительного воплощенияVI, VIa, в которых Y представляет собой СН 2 СН 2-, описан в схеме II. Схема II Так, легко доступный тетралон VIIa, в котором R2a имеет те же значения, что и выше,конденсируется с одним эквивалентом 4 аминофенола, предпочтительно в отсутствие растворителя, при температуре такой, что смесь плавится, обычно при 180 С, в атмосфере азота. Во время хода реакции можно дополнительно добавлять 4-аминофенол, чтобы возместить потерю при сублимации. Полученный имин формулы VIIIa отвердевает при охлаждении и может быть, по желанию, перекристаллизован. Защита гидроксильной группы в VIIIa в виде его силильного производного VIIIa' осуществляется в стандартных условиях, и имин превращается в энамид формулы IХа путем ацилирования ароилгалогенидом формулы где В обозначает -СН 2- или -СО-,Y, R1, R2, R3, n и W имеют те же значения,что и выше; или его фармацевтически приемлемые соли. Главным промежуточным соединением при получении соединений формулы II является соединение формулы VI где R1a и R2a имеют те же значения, что и выше,обычно в присутствии умеренного основания,такого как триэтиламин, и в инертном растворителе, таком как CH2Cl2 при температуре в интервале между комнатной и температурой кипения. Соединение формулы IХа затем фотолизируют в кварцевой иммерсионной ячейке с использованием ртутной лампы Hanovia в растворителе, таком как эфир или бензол, в течение срока от 4 часов до 1 недели с получением соединения формулы VIa'. Эта процедура по су 19 ществу такая же, как и описанная в Journal ofVIa' в стандартных условиях затем дает соединение формулы VIa. В отношении перечня соответствующих условий, см., например, Greene and Wuts, Protective Groups in Organic Synthesis, 2nd ed., p. 80,161 (1991). Предпочтительными соединениями формулы VI являются те, в которых R1a и R2a являются, каждый отдельно, -Н или метокси. Наиболее предпочтительным является соединение, в котором как R1a, так и R2a являются метокси. Соединение формулы VI превращается в соединение формулы IIb 20 температуре кипения с обратным холодильником, может быть выделено, непосредственно,желаемое соединение формулы IIс. У соединений формулы IIc может быть по желанию проведено дезалкилирование/удаление защиты с получением соединений формулы II. В предпочтительном случае, когда Y является -СН 2 СН 2-, т.е. соединения формулы IIаR1a, R2a, R3, n и W имеют те же значения,что и выше; может быть желательно проводить реакцию дегидрирования, получая таким образом соединение формулы IIdR1a, R2a, R3 , Y, n и W имеют те же значения, что и выше; с помощью методов, описанных выше, для превращения соединений формулы Iс в соединения формулы Ib. Например, предпочтительным методом является связывание Митсунобу соединения формулы VI с 1-(2-гидроксиэтил) пирролидином или 1-(2-гидроксиэтил) пиперидином. Когда получено соединение формулы IIb, у него, по желанию, может быть осуществлено удаление защиты/дезалкилирование с получением соединения формулы II или альтернативно, оно может быть восстановлено с получением соединения формулы IIcR1a, R2a, R3, Y, n и W имеют те же значения, что и выше. Один из методов проведения этого восстановления включает реакцию соединения формулы IIа с гидридом лития-алюминия в инертном растворителе, таком как ТГФ. Если реакция проводится при комнатной температуре, может быть выделен промежуточный продукт, который после дополнительного восстановления борогидридом натрия в уксусной кислоте превращается в соединение формулы IIс. Альтернативно, если реакция проводится приR1a, R2a, R3, n и W имеют те же значения,что и выше. Это дегидрирование может быть осуществлено с помощью разных методов, известных специалистам, наиболее предпочтительно, путем реакции с 2,3-дихлор-5,6 дициано-1,4-бензохиноном (ДДХ). Альтернативно, может быть желательно производить дегидрирование на более ранней стадии в процессе синтеза, у соединения формулы VIa' с получением соединения формулы Соединения формулы VIb можно затем превращать в соединения формулы IIе методами, аналогичными превращению VIa в IIа. У соединения формулы IId по желанию может быть произведено удаление защиты/дезалкилирование с получением соединения формулы II, или альтернативно, может быть восстановлено, как описано выше, с получением соединения формулы IIeR1a, R2a, R3, n и W имеют те же значения,что и выше. У соединения формулы IIе затем,необязательно, может быть произведено удаление защиты/дезалкилирование с получением соединения формулы II. В общем, соединения формулы IIа-е с их различными определенными заместителями,и/или продукты после удаления у них защитных групп, как описано выше, представлены как соединения формулы II данного изобретения. Например, когда R1a, R2a в соединении формулы IIе являются С 1-С 4-алкильными защищающими гидроксил группами, такие группы могут быть удалены путем стандартных методик дезалкилирования с получением особенно предпочтительного соединения формулы IIе. В наиболее предпочтительных примерах соединений формулы II R1 и R2 являются, каждый отдельно, -Н, -ОН или метокси, Y представляет-СН=СН-, В является -СН 2-, n равно 1, W представляет собой -СН 2-, а R3 представляет собой 1 пиперидинил или 1-пирролидинил. Альтернативный способ включает получение предпочтительных соединений формулы I или II путем замены R1, R2 гидроксильных групп в соединении формулы I или формулы II метокси. Эта трансформация производится с помощью хорошо известных процедур (см., например, Greene and Wuts, Protective Groups inOrganic Synthesis, 2nd ed., p. (1991. Особенно предпочтительный способ включает реакцию моно- или дифенольного соединения с избытком диазометана. Другие предпочтительные соединения формулы I или II получают путем замены вновь образованных гидроксильных групп R1, R2 соединения формулы I или формулы II заместителем формулы -O-СО-(C1-C6 алкил), или -O-SO2(С 4-С 6 алкил) с помощью хорошо известных процедур. См., например, патент США 4 358 593. Например, когда желательна -O-CO(C1C6 алкил)группа, дигидроксисоединение формулы I подвергают взаимодействию с таким веществом, как ацилхлорид, -бромид, -цианид или азид, или с соответствующим ангидридом или смешанным ангидридом. Реакции обычно проводятся в щелочном растворителе, таком как пиридин, лютидин, хинолин или изохинолин или в третичноаминном растворителе, таком как триэтиламин, трибутиламин, метилпиперидин и тому подобное. Реакция также может быть проведена в инертном растворителе, таком как 22 этилацетат, диметилформамид, диметилсульфоксид, диоксан, диметоксиэтан, ацетонитрил,ацетон, метилэтилкетон и тому подобное, к которому был добавлен по меньшей мере один эквивалент акцептора кислоты (за исключением того, что отмечено ниже), такой как третичный амин. Если желательно, можно использовать катализаторы ацилирования, такие как 4 диметиламинопиридин или 4-пирролидинопиридин. См., например, Haslam, et al., Tetrahedron, 36: 2409-2433 (1980). Реакции ацилирования, которые дают вышеупомянутые концевые группы R1, R2 соединений формулы I или формулы II, проводятся при умеренных температурах в интервале от примерно -25 С до примерно 100 С, часто в атмосфере инертного газа, такого как газообразный азот. Однако комнатной температуры обычно достаточно для того, чтобы протекала реакция. Такое ацилирование этих гидроксильных групп может быть также выполнено с помощью реакций, катализируемых кислотой, соответствующих карбоновых кислот в инертных органических растворителях или с помощью нагревания. Используются кислотные катализаторы,такие как серная кислота, полифосфорная кислота, метансульфоновая кислота и тому подобное. Вышеупомянутые группы R1, R2 соединений формулы I или формулы II могут быть также получены путем образования активного эфира соответствующей кислоты, такого как эфир,образуемый с помощью известных реагентов,таких как дициклогексилкарбодиимид, ацилимидазолы, нитрофенолы, пентахлорфенол, Nгидроксисукцинимид и 1-гидроксибензотриазол. См., например, Bull. Chem. Soc. Japan,38: 1979 (1965), и Chem. Ber., 788 и 2024 (1970). Каждая из вышеприведенных методик, которая дает заместители -O-СО(C1-C6 алкил),осуществляется в растворителях, которые обсуждались выше. Эти методики, при которых не продуцируются кислотные продукты в ходе реакции, разумеется, не требуют использования акцептора кислоты в реакционной смеси. Когда желательно соединение формулы I или формулы II, в котором группы R1, R2 соединений формулы I превращаются в группы формулы -O-SO2-(C4-C6 алкил) или -O-SO2-СF3, дигидроксисоединение формулы I подвергают взаимодействию с, например, сульфоновым ангидридом или производным соответствующей сульфоновой кислоты, такого как сульфонилхлорид, -бромид или сульфониламмонийная соль, как указывают King and Monoir, J. Am.Chem. Soc., 97: 2566-2567 (1975), или с реагентом, таким как N-фенилтрифторметансульфонимид, как указано у Hendrickson and Bergeron. Tetrahedron Letters, 4607 (1973). Дигидроксисоединение также может приводиться во взаимодействие с соответствующим сульфоно 23 вым ангидридом, смешанными сульфоновыми ангидридами или сульфонимидами. Такие реакции проводятся в условиях, таких, которые объяснены выше при обсуждении реакции с галогенидами кислот и тому подобным. В случае, когда R1, R2 соединений формулы I или формулы II были превращены в -ОSО 2-СF3, указанное производное может быть далее превращено в соединение формулы I или формулы II, в котором группы -О-SО 2-СF3 были заменены -Н. Таким образом, трифторметансульфонат восстанавливают в условиях,описанных в примере 1, ниже, или как указано уRitter, Synthesis, 735 (1933). Хотя в способах данного изобретения могут использоваться формы соединений формулыI и формулы II в виде свободного основания,иногда выгодно получать и использовать форму в виде фармацевтически приемлемой соли. Таким образом, соединения, используемые при способах этого изобретения, первоначально образуют фармацевтически приемлемые соли с присоединением кислоты с широким рядом органических и неорганических кислот, и включают физиологически приемлемые соли, которые часто используют в фармацевтической химии. Такие соли также являются частью этого изобретения. Типичные неорганические кислоты, используемые для образования таких солей,включают соляную кислоту, бромистоводородную кислоту, йодистоводородную кислоту,азотную кислоту, серную кислоту, фосфорную кислоту, фосфорноватую кислоту и тому подобное. Можно также использовать соли, получаемые из органических кислот, таких как алифатические моно- и дикарбоновые кислоты, фенилзамещенные алкановые кислоты, гидроксиалкановые кислоты и гидроксиалкандионовые кислоты, ароматические кислоты, алифатические и ароматические сульфоновые кислоты. Такие фармацевтически приемлемые соли, таким образом, включают ацетат, фенилацетат,трифторацетат, акрилат, аскорбат, бензоат,хлорбензоат, динитробензоат, гидроксибензоат,метоксибензоат, метилбензоат, о-ацетоксибензоат, нафталин-2-бензоат, бромид, изобутират,фенилбутират, b-гидроксибутират, бутин-1,4 диоат, гексин-1,4-диоат, капрат, каприлат, хлорид, циннамат, цитрат, формиат, фумарат, гликолят, гептаноат, гиппурат, лактат, малат, малеинат, гидроксималеинат, малонат, манделат,мезилат, никотинат, изоникотинат, нитрат, оксалат, фталат, терефталат, фосфат, моногидрофосфат, дигидрофосфат, метафосфат, пирофосфат, пропиолат, пропионат, фенилпропионат,салицилат, себакат, сукцинат, суберат, сульфат,бисульфат, пиросульфат, сульфит, бисульфит,сульфонат, бензолсульфонат, п-бромфенилсульфонат, хлорбензолсульфонат, этансульфонат, 2-гидроксиэтансульфонат, метансульфонат,нафталин-1-сульфонат, нафталин-2-сульфонат,п-толуолсульфонат, ксилолсульфонат, тартрат и 24 тому подобное. Предпочтительной солью является гидрохлорид на я соль. Фармацевтически приемлемые соли с присоединением кислоты обычно образуются путем реакции соединения формулы I или формулы II с эквимолярным количеством или избытком кислоты. Реагенты обычно соединяются в общем растворителе, таком как диэтиловый эфир или этилацетат. Соль обычно осаждается из раствора в течение от одного часа до десяти дней и может быть выделена путем фильтрования, или растворитель может быть отделен обычными способами. Фармацевтически приемлемые соли обычно улучшают свойства растворимости по сравнению с соединением, из которого они могут быть получены и таким образом они часто более удобны для получения жидких лекарственных форм и эмульсий. Следующие примеры представлены для дополнительной иллюстрации получения соединений данного изобретения. Они не предназначены для того, чтобы ограничить объем изобретения на основании любого из следующих примеров. Данные ЯМР для следующих примеров были получены на приборе для ЯМР GE 300 МГц, и в качестве растворителя использован безводный ацетон-d6, если не указано иначе. Препаративный пример 1 а. 6-Метокситианафтен-2-он.IN водный раствор НСl (200 мл) и полученную смесь нагревали до температуры кипения с обратным холодильником в течение 3 ч. Смесь охлаждали, слои разделяли и водный слой экстрагировали дихлорметаном (300 мл). Объединенные органические слои промывали водой(250 мл), сушили (MgSO4), фильтровали и концентрировали с получением неочищенного продукта, который перекристаллизовывали из 3 Аэтанола и сушили в вакууме при комнатной температуре с получением вещества, названного в заголовке (13,89 г, 77,0 ммоль, 80%): т.пл. 8082 С; ИК (KBr) 1713, 1605, 1485, 1287, 1015, 865,813 см-1; 1(20 г. 111 ммоль) в смеси этанола (100 мл) и метиленхлорида (50 мл) добавляли 4 метоксисалицилальдегид (17,5 г, 115 ммоль) с последующим добавлением триэтиламина (567 мг, 784 мл, 5,6 ммоль) при комнатной температуре. Через 30 мин начинало осаждаться твердое вещество и перемешивание продолжалось в течение ночи. Смесь затем разводили холодным гексаном (1 л) и фильтровали с получением 28,7 г (82%) продукта заголовка в виде не совсем белого твердого вещества, чистого по 1H-ЯМР анализу. Аналитический образец получали путем перекристаллизации из толуола в виде легких желтых кристаллов, т.пл. 157-165 рС: 1 Смесь продукта препаративного примера 2(4,5 г, 14,3 ммоль) и 2,3-дихлор-5,6-дициано-1,4 бензохинон (ДДХ) (3,4 г, 15 ммоль) в дихлорэтане (100 мл) недолго нагревали до 80 С, вызывая образование осадка. Смесь фильтровали горячей, промывая осадок метиленхлоридом, и маточную жидкость концентрировали в вакууме. Остаток растворяли в горячем метиленхлориде, фильтровали для удаления выпавшего в осадок гидрохинона и повторно концентрировали. Продукт перекристаллизовывали из толуола с получением 3,94 г (88%) продукта заголовка в виде белых игольчатых кристаллов, т.пл. 220221 С: 1 К механически перемешиваемой суспензии продукта препаративного примера 2 (12 г, 38,4 ммоль) в метиленхлориде (220 мл) добавляли этантиол (11,9 г, 13,4 шт, 192 ммоль) с последующим добавлением хлорида алюминия (38,4 г, 288 ммоль), частями. Реакционную смесь перемешивали при комнатной температуре в течение 5 часов, затем охлаждали до 0 С и затем осторожно гасили тетрагидрофураном (ТГФ)(250 мл) и затем насыщенным раствором бикарбоната натрия (250 мл). Смесь разбавляли ТГФ(1 л), слои разделяли и водный слой промывали ТГФ (200 мл). Объединенные органические слои сушили (сульфат натрия) и концентрировали с получением 11,1 г (102%) неочищенного дифенола в виде желтого твердого вещества,которое использовали без дополнительной очистки. Из неочищенного продукта готовили взвесь в метиленхлориде (220 мл) и обрабатывали триэтиламином (20,2 г, 28 мл, 200 ммоль) и трет-бутилдиметилсилилхлоридом (20,3 г, 134,4 ммоль). Смесь перемешивали при комнатной температуре в течение 5 часов, в течение чего она медленно становилась гомогенной. После разбавления гексаном (600 мл) смесь промывали насыщенным раствором соли (600 мл) и водный слой экстрагировали гексаном (300 мл). Объединенные органические слои сушили (сульфат натрия), концентрировали и остаток перекристаллизовывали из гексана с получением 18,0 г(91%) соединения заголовка в виде пушистого белого твердого вещества, т.пл. 142-144 С: 1 Раствор продукта препаративного примера 3 (2,0 г, 3,9 ммоль) в толуоле (200 мл) охлажда 27 ли до -92 С и по каплям добавляли 1,0 М толуольный раствор диизобутилалюминийгидрида(11,3 мл, 11,3 ммоль) со скоростью, при которой внутренняя температура сохранялась на уровне ниже -89 С. Смесь перемешивали в течение примерно 3 ч, причем температура постепенно повышалась до -77 С, затем гасили метанолом(5 мл) и 10% водным раствором лимонной кислоты (50 мл). После разбавления метиленхлоридом (200 мл) смесь промывали насыщенным раствором тартрата натрия (100 мл) и водный слой экстрагировали метиленхлоридом (2 х 200 мл). Объединенные органические слои промывали насыщенным раствором соли (300 мл) и промывной насыщенный раствор соли далее экстрагировали метиленхлоридом (100 мл). Органические слои сушили (сульфат натрия), концентрировали и остаток подвергали хроматографии (силикагель, 1-15% этилацетат/гексан) с получением 360 мг (18%) исходного материала,1,21 г (60%, 74% по выделенному исходному материалу) вещества заголовка в виде белого кристаллического вещества (аналитический образец перекристаллизовывали из гексана/этилацетата, т.пл.162-164 С): 1 в виде аморфного твердого вещества: 1 К раствору продукта препаративного примера 4 (4,52 г, 8,78 ммоль) и фенола (4,13 г, 43,9 ммоль) в метиленхлориде (100 мл) добавляли безводный сульфат магния (4,5 г) и полученную суспензию перемешивали в течение 4 ч при комнатной температуре. Смесь фильтровали и концентрировали, и остаток растворяли в хлорбензоле и повторно концентрировали в вакууме при примерно 70 С. Остаток затем растворяли в метиленхлориде (300 мл), промывали насыщенным раствором карбоната натрия (3 х 300 мл) и водой (2 х 300 мл), сушили (сульфат натрия) и концентрировали с получением 5,16 г (99%) вещества заголовка в виде аморфного твердого вещества, которое использовали без дополнительной очистки. 1 К раствору продукта препаративного примера 5 (4,0 г, 6,7 ммоль) в толуоле (100 мл) при 0C добавляли 0,5 М раствор 4-[2-(1-пиперидинил)этокси]фенилмагнийбромида в ТГФ (полученного из соответствующего бромбензола и магниевых стружек, при реакции, катализируемой йодом в ТГФ, 27 мл, 13,5 ммоль). Смеси давали нагреться до комнатной температуры и перемешивали в течение 1,5 ч. После гашения водой (300 мл) смесь экстрагировали этилацетатом (2 х 300 мл) и органический слой сушили 29 вещества заголовка в виде бесцветного смолообразного твердого вещества: 1 К раствору продукта препаративного примера 6 (3,85 г, 5,5 ммоль) в ТГФ (150 мл) добавляли 1,0 М раствор тетра-н-бутиламмонийфторида (ТБАФ) в ТГФ (27,4 мл, 27,4 ммоль). Раствор перемешивали при комнатной температуре в течение 2 ч, затем разбавляли этилацетатом (300 мл) и промывали насыщенным раствором хлорида аммония (300 мл). Водный слой промывали этилацетатом (150 мл) и объединенные органические слои промывали насыщенным раствором бикарбоната натрия(300 мл), сушили (сульфат натрия) и концентрировали. Остаток очищали с помощью хроматографии (силикагель, 1:1 гексан:этилацетат, 10% метанол, 0,1% гидроксид аммония) с получением 2,35 г, (90%) продукта заголовка в виде красной пены. Кристаллизация из метанола давала не совсем белый порошок, т.пл. 242-245 С. 1 Раствор продукта из примера 1 (300 мг,0,633 ммоль) в метаноле (75 мл) обрабатывали раствором диазометана в эфире/этаноле (примерно 16 ммоль) при комнатной температуре. Смесь перемешивали до тех пор, пока не прекращалось выделение газа, через смесь пропускали азот в течение 10 мин, чтобы удалить избыток диазометана и смесь концентрировали. Радиальная хроматография остатка (1:1 гексан:этилацетат, 2% метанол, в атмосфере аммиака) давала 118 мг (37%) вещества заголовка в виде белых кристаллов, т.пл. 134-36 С: 1 К раствору продукта из примера 1 (200 мг,0,42 ммоль) в метиленхлориде (25 мл) при комнатной температуре добавляли триэтиламин(0,18 мл, 1,27 ммоль) с последующим добавлением бензоилхлорида (0,15 мл, 1,27 ммоль) с помощью шприца в течение 10 мин. Реакционную смесь перемешивали в течение 16 ч и затем промывали насыщенным раствором бикарбоната натрия (25 мл) с последующим промыванием водой (25 мл). Органический слой сушили(сульфат натрия) и концентрировали и остаток очищали с помощью радиальной хроматографии (силикагель, 12:12:1 этилацетат:гексаны: метанол в атмосфере аммиака) с получением 200 мг (69%) вещества заголовка в виде желтовато-коричневого твердого вещества: В соответствии с процедурой из примера 2 продукт из примера 1 (200 мг, 0,42 ммоль) подвергали взаимодействию с триэтиламином (0,18 мл, 1,27 ммоль) и н-бутансульфонилхлоридом(0,17 мл, 1,27 ммоль) в метиленхлориде (25 мл) с получением 120 мг (40%) вещества заголовка в виде прозрачной коричневой смолы: 1 Н ЯМР (300 МГц, СDСl3) d 7,77 (с, 1H),7,38 (д, J=8,5 Гц, 1H), 7,29 (д, J=9,5 Гц, 2 Н), 7,11 К раствору продукта из примера 1 (500 мг,1,06 ммоль) в ТГФ (25 мл), содержащему диметилформамид (2 мл), при комнатной температуре добавляли триэтиламин (0,64 г, 0,69 мл, 6,36 ммоль) с последующим добавлением N-фенилтрифторметан-сульфонимида (0,83 г, 2,33 ммоль). Реакционную смесь перемешивали в течение 12 ч, нагревали до 60 С и добавляли дополнительно N-фенилтрифторметансульфонимид (0,30 г, 0,85 ммоль). Через 30 мин реакционную смесь охлаждали до комнатной температуры и концентрировали, и остаток очищали с помощью радиальной хроматографии (силикагель, 1:1 гексан:этилацетат, 1% метанол в атмосфере аммиака) с получением 780 мг (100%) вещества заголовка в виде белой пены: 1 Раствор продукта из примера 6 (780 мг,1,06 ммоль), ацетат палладия (II) (42 мг, 0,19 ммоль), 1,2-бис(дифенилфосфинпропан) (149 мг, 0,36 ммоль), муравьиную кислоту (0,6 мл) и триэтиламин (3,0 мл) в безводном диметилформамиде (40 мл) перемешивали при комнатной температуре в течение 4 дней. После концентрирования остаток подвергали хроматографии(силикагель, 1:1 гексан:этилацетат, 2-10% метанол, 0,1% гидроксид аммония). Содержащие продукт фракции концентрировали, разделяли между метиленхлоридом (100 мл) и насыщен 33 ным раствором бикарбоната натрия (100 мл), и водный слой экстрагировали метиленхлоридом(50 мл). Объединенные органические экстракты сушили (сульфат натрия), концентрировали и остаток очищали с помощью хроматографии(силикагель, 1:1 гексан:этилацетат, 2-10% метанол, 0,1% гидроксид аммония) с получением 267 мг (57%) вещества заголовка в виде масла,которое давало белое кристаллическое твердое вещество, т.пл. 107 С при растирании с эфиром/гексаном: 1 К раствору продукта препаративного примера 5 (3,0 г, 5,08 ммоль) в толуоле (150 мл) при 0 С добавляли 0,4 М раствор 4-(триметилсилилокси)фенилмагния бромида (полученного из соответствующего бромбензола и стружек магния, с катализатором - йодом, в ТГФ, 25,4 мл,10.16 ммоль) в ТГФ. Смеси давали нагреться до комнатной температуры и перемешивали в течение 1,5 ч. После разбавления эфиром (250 мл) смесь гасили насыщенным раствором хлорида аммония (250 мл) и органический слой сушили(сульфатом натрия) и концентрировали. Из остатка готовили взвесь в метаноле (100 мл) и добавляли эфир до тех пор, пока смесь не становилась гомогенной. Раствор охлаждали до 0 С и подвергали воздействию безводного карбоната калия (3 г) в течение 15 мин. После разбавления эфиром (250 мл) смесь фильтровали через броунмиллерит, промывали насыщенным раствором хлорида аммония и водный слой экстрагировали дополнительно эфиром (100 мл). Объединенные органические слои сушили (сульфат натрия), концентрировали и остаток очищали с помощью хроматографии (силикагель, 10:1 гексан:этилацетат). Перекристаллизация из гексана давала 2,6 г (87%) вещества заголовка в виде легкого розового твердого вещества, т.пл. 174175 С: Толуоловый раствор продукта препаративного примера 7 (400 мг, 0,68 ммоль), трифенилфосфин (708 мг, 1,1 ммоль) и 1-(2-гидроксиэтил)пирролидин (390 мг, 396 мл, 3,39 ммоль) подвергали воздействию диэтилазодикарбоксилата (ДЭАД) (470 мг, 425 мл, 2,7 ммоль) при комнатной температуре и перемешивали в течение 2 ч. Затем смесь разводили эфиром (100 мл),промывали насыщенным раствором хлорида аммония (100 мл) и водный слой промывали дополнительно эфиром (50 мл). Объединенные органические слои сушили (сульфат натрия),концентрировали и остаточный трифенилфосфина оксид осаждали из гексана. Маточный гексановый раствор концентрировали и остаток очищали с помощью хроматографии (силикагель, 1:1 гексан:этилацетат, 3-5% метанол, 0,1% гидроксид аммония) с получением 359 мг (77%) вещества заголовка в виде бесцветного масла: 1 Н ЯМР (300 МГц) d 7,45 (д, J=2,1 Гц, 1 Н),7,28 (д, J=8,6 Гц, 2 Н), 7,22 (м, 2 Н), 6,85 (д, 8,6 Гц, 2 Н), 6,83 (дд, J=8,6, 2,3 Гц, 1 Н), 6,68 (с, 1 Н),6,50 (дд, J=8,3, 2,2 Гц, 1 Н), 6,36 (д, 2,2 Гц, 1 Н),4,03 (т, J=6,0 Гц, 2 Н), 2,77 (т, J=6,0 Гц, 2 Н), 2,50 По способу, описанному в примере 1, продукт препаративного примера 8 (331 мг , 0,48 ммоль) подвергали взаимодействию с 1,0 М ТБАФ в ТГФ (2,4 ммоль) с получением после радиальной хроматографии (силикагель, 1:1 гексан:этилацетат, 30% метанол в атмосфере аммиака) 200 мг (91%) вещества заголовка в виде твердого белого вещества, т. пл. 237240 рС. 1 Н ЯМР (300 МГц, диметилформамид-d7) d 10,05 (шир, 2 Н), 7,45 (д, J=2,0 Гц, 1 Н), 7,30 (д,J=8,4 Гц, 2 Н), 7,23 (д, J=8,6 Гц, 1 Н), 7,19 (д,J=8,2 Гц, 1 Н), 6,91 (д, J=8,7 Гц, 2 Н), 6,86 (дд,J=8,9, 2,2 Гц, 1 Н), 6,74 (с, 1 Н), 6,51 (дд, J=8,2,2,1 Гц, 1 Н), 6,40 (д, J=2,1 Гц, 1 Н), 4,14 (т, J=5,6 Гц, 2 Н), 2,96 (т, J=5,5 Гц, 2 Н), 2,6-2,8 (м, 4 Н),1,6-1,8 (м, 4 Н); 13 С ЯМР (125 МГц, диметилформамид-d7) По методу, описанному в препаративном примере 8, продукт препаративного примера 7(450 мг, 0,76 ммоль), трифенилфосфин (799 мг,3,1 ммоль) и N,N-диметилэтаноламин (340 мг,383 мл, 3,81 ммоль) приводили во взаимодействие с диэтилазодикарбоксилатом (ДЭАД) (531 мг, 480 мл, 3,1 ммоль) в толуоле (30 мл). Хроматография (силикагель, 1:1 гексан:этилацетат, 3% метанол, 0,1% гидроксид аммония) давала 357 мг (71%) вещества заголовка в виде белой пены: 1 Н ЯМР (300 МГц) d 7,45 (д, J=2,1 Гц, 1 Н),7,27 (д, J=8,6 Гц, 2 Н), 7,24 (м, 2 Н), 6,83 (м, 3 Н),6,67 (с, 1 Н), 6,50 (дд, J=8,2, 2,2 Гц, 1 Н), 6,36 (д,2,2 Гц, 1 Н), 4,00 (т, J=5, 9 Гц, 2 Н), 2,60 (т, J=5,9 Гц, 2 Н), 2,20 (с, 6 Н), 0,98 (с, 9 Н), 0,95 (с, 9 Н),0,21 (с, 6 Н), 0,20 (с, 6 Н); По методу, описанному в примере 1, продукт препаративного примера 9 (328 мг, 0,50 ммоль) реагировал с 1,0 М ТБАФ в ТГФ (2,5 ммоль) с получением после радиальной хроматографии (силикагель, 1:1 гексан:этилацетат,30% метанол, в атмосфере аммиака) 212 мг(99%) вещества заголовка, которое кристаллизовалось из тетрахлористого углерода/ацетона в виде розового твердого вещества, т.пл. 130140 рС. 1 Н ЯМР (300 МГц) d 7,34 (д, J=2,1 Гц, 1 Н),7,25 (д, J=8,6 Гц, 2 Н), 7,15 (м, 2 Н), 6,9-7,0 (м,3 Н), 6,62 (с, 1 Н) , 6,45 (дд, J=8,3, 2,3 Гц, 1 Н),6,34 (д, J=2,2 Гц, 1 Н), 4,01 (т, J=5,8 Гц, 2 Н), 2,64 По методу, описанному в препаративном примере 8, продукт препаративного примера 7(450 мг, 0,76 ммоль), трифенилфосфин (799 мг,3,1 ммоль) и 1-(2-гидроксиэтил)-2-пирролидинон (492 мг, 431 мл, 3,81 ммоль) приводили во взаимодействие с диэтилазодикарбоксилатом С помощью процедуры, описанной в примере 1, продукт препаративного примера 10(331 мг, 0,47 ммоль) подвергали взаимодействию с 1,0 М ТБАФ в ТГФ (2,4 ммоль) с получением, после радиальной хроматографии (силикагель, 1:1 гексан:этилацетат, 20% метанол, в атмосфере аммиака) и перекристаллизации из ацетона, 161 мг (72%) соединения заголовка в виде красного твердого вещества, т.пл. 150160 рС: 1 Н ЯМР (300 МГц, метанол-d4) d 7,21 (м,3 Н), 7,11 (д, J=8,3 Гц, 1 Н), 7,02 (д, J=8,7 Гц, 1 Н),6,80 (д, J=8,6 Гц, 2 Н), 6,71 (дд, J=8,6, 2,2 Гц,1 Н), 6,51 (с, 1 Н), 6,37 (дд, J=8,2, 2,3 Гц, 1 Н), 6,25 С помощью процедуры, описанной в примере 1, продукт препаративного примера 11(458 мг, 0,66 ммоль) подвергали взаимодействию с 1,0 М ТБАФ в ТГФ (3,3 ммоль) с получением, после радиальной хроматографии (силикагель, 1:1 гексан:этилацетат, 10-20% метанол, в атмосфере аммиака) и кристаллизации из ацетона/эфира 296 мг (72%) соединения заголовка в виде твердого красного вещества, т.пл. 118123 рС. 1 Н ЯМР (300 МГц)7,35 (д, J=2,1 Гц, 1 Н),7,26 (д, J=8,6 Гц, 2 Н), 7,16 (д, J=8,1 Гц, 1 Н), 7,13 С помощью процедуры, описанной в примере 1, продукт препаративного примера 12(521 мг, 0,74 ммоль) приводили во взаимодействие с 1,0 М ТБАФ в ТГФ (3,7 ммоль) с получением, после радиальной хроматографии (силикагель, 1:1 гексан:этилацетат, 15% метанол, в атмосфере аммиака) и кристаллизации из ацетона/эфира 286 мг (81%) соединения заголовка в виде твердого красного вещества, т.пл. 147153 рС: 1(32 мл, 300 ммоль) при комнатной температуре. Через 1 ч начинало выпадать в осадок твердое вещество, и перемешивание продолжали в течение 3,5 ч. Затем смесь разбавляли холодным гексаном и фильтровали с получением 68,3 г(83%) продукта, названного в заголовке, в виде белого твердого порошкообразного вещества,чистого по анализу 1 Н-ЯМР: 1 Н ЯМР (300 МГц, СDСl3)7,45 (д, J=7,5 Гц, 1 Н), 7,33 (м, 2 Н), 7,17 (м, 1 Н), 7,07 (д, J=8,1 Гц, 1 Н), 6,77 (д, J=2,4 Гц, 1 Н), 6,69 (дд, J=2,4,8,5 Гц, 1 Н), 5,25 (д, J=7,4 Гц, 1 Н), 4,37 (д, J=7,3 Гц, 1 Н), 3,77 (с, 3 Н); 13 С ЯМР (75 МГц, СDСl3)166,4, 160,7,150,8, 141,4, 130,1, 129,0, 127,7, 127,0, 124,9,119,5, 117,2, 111,2, . 108,3, 55,5, 50,6, 49,6; ИК Смесь продукта препаративного примера 12 а (14,0 г, 49 ммоль) и 2,3-дихлор-5,6-дициано 1,4-бензохинона (ДДХ) (11,6 г, 51 ммоль) в дихлорэтане (350 мл) недолго нагревали до температуры кипения с обратным холодильником,вызывая образование осадка. Смесь фильтровали горячей, промывали осадок метиленхлоридом и маточную жидкость концентрировали в вакууме. Неочищенный продукт затем промывали несколько раз ацетоном и сушили в вакууме с получением 12,6 г (91%) продукта, названного в заголовке, в виде белого пушистого твердого вещества: 1 Н ЯМР (300 МГц, CDCI3)8,55 (д, J=8,9 Гц, 1 Н), 7,70 (дд, J=1,2, 8,0 Гц, 1 Н), 7,4-7,6 (м,2 Н), 7,33 (м, 2 Н), 7,13 (дд, J=2,3, 8,9 Гц, 1 Н),3,91 (с, 3 Н), ИК (СНСl3) 1722 см-1; МС (FD) m/e 282 (М+); К механически перемешиваемой суспензии продукта препаративного примера 12b (9,0 г, 32 ммоль) в метиленхлориде (235 мл) добавляли этантиол (5,9 мл, 80 ммоль) с последующим добавлением, частями, хлорида алюминия (15,8 г, 120 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч,затем охлаждали до 0 С и осторожно гасили тетрагидрофураном (ТГФ) с последующим добавлением насыщенного бикарбоната натрия. Смесь разбавляли ТГФ, слои разделяли и водный слой промывали несколько раз ТГФ. Объединенные органические слои сушили (сульфат натрия) и концентрировали с получением 7,4 г(86%) неочищенного фенола в виде не совсем белого, слегка розового твердого вещества, которое использовали без дополнительной очистки. Из неочищенного продукта готовили суспензию в метиленхлориде (200 мл) и подвергали ее взаимодействию с триэтиламином (19,1 мл,140 ммоль) и трет-бутилдиметилсилилхлоридом(10,4 г, 69 ммоль). Смесь перемешивали при комнатной температуре в течение ночи, во время чего она становилась гомогенной. После разбавления гексаном смесь промывали два раза насыщенным раствором соли. Органический слой сушили (сульфат натрия), концентрировали и остаток перекристаллизовывали из гексана с получением 9,8 г (80%) соединения заголовка в виде пушистого белого твердого вещества: 1 Раствор продукта препаративного примера 12 с (3,5 г, 9,1 ммоль) в толуоле (490 мл) охлаждали до -78 С и подвергали воздействию 1,0 М 41 толуольного раствора гидрида диизобутилалюминия (11,0 мл, 11 ммоль), добавляемого каплями со скоростью, при которой внутренняя температура сохраняется на уровне ниже -70 С. Смесь перемешивали в течение примерно 4 ч,затем гасили метанолом (14 мл), 10% водным раствором лимонной кислоты (140 мл) и водой(315 мл). Водный слой экстрагировали три раза метиленхлоридом (560 мл). Органические слои сушили (натрия сульфат), концентрировали и остаток подвергали хроматографии (силикагель,градиент от 2% этилацетата в гексане до 20% этилацетата в гексане) с получением 1,7 г (49%) соединения заголовка в виде белого кристаллического твердого вещества: 1 Н ЯМР (300 МГц)7,77 (д, J=8,6 Гц, 1 Н), 7,50 (д, J=2,1 Гц, 1 Н), 7,42 Продукт препаративного примера 12d (1,5 г, 3,9 ммоль) и фенол (2,7 г, 29 ммоль) растворяли в хлорбензоле (50 мл) и смесь перемешивали в течение 3,5 ч при температуре кипения с обратным холодильником. Смесь концентрировали и остаток растворяли в хлорбензоле и повторно концентрировали в вакууме при примерно 70 С. Остаток затем растворяли в диэтиловом эфире, промывали три раза насыщенным раствором карбоната натрия, водой и насыщенным раствором соли. Органический слой сушили (сульфат натрия) и концентрировали с получением 1,7 г (93%) соединения заголовка в виде пушистого твердого белого вещества, которое использовали без дополнительной очистки: спектр 1 Н ЯМР (300 МГц) был соответствующим структуре. Пример 10 с. 9-Гидрокси-6-[4-[2-(1-пиперидинил)этокси]фенил]-6-Н-[1]бензотиено[3,2-с] К раствору продукта препаративного примера 12 е (1,7 г, 3,6 ммоль) в толуоле (50 мл) при 0 С добавляли 0,2 М ТГФ раствор 4-[2-(1 001649 42 пиперидинил)этокси]фенилмагния бромида (полученного из соответствующего бромбензола и магниевых стружек с катализатором йодом в ТГФ, 45,3 мл, 9,1 ммоль). Смеси давали нагреться до комнатной температуры и перемешивали в течение 14 ч. После гашения водой смесь экстрагировали три раза метиленхлоридом и органический слой сушили (сульфат натрия) и концентрировали. Остаток очищали с помощью хроматографии (силикагель, гексан-4:1 гексан:этилацетат) с получением 2,6 г (126%) частично очищенного силилированного продукта. К раствору частично очищенного продукта(ТБАФ) (5,0 мл, 5,0 ммоль). Раствор перемешивали при комнатной температуре в течение 10 мин, затем разбавляли этилацетатом и промывали пять раз насыщенным раствором бикарбоната натрия и насыщенным раствором соли. Органические слои сушили (сульфат натрия) и концентрировали. Остаток очищали с помощью хроматографии (силикагель, 1:1 гексан: этилацетат, 0-10% метанол, 0,1% гидроксид аммония) с получением) 0,93 г (56%) соединения заголовка в виде белого пушистого твердого вещества: 1 Н ЯМР (300 МГц)6,7-7,4 (м, 12 Н), 4,02 К механически перемешиваемой суспензии 3-метокси-6-Н-[1]бензотиено[3,2-с][1]бензопиран-6-она (Journal of Organic Chemistry, 40:3169(1975 (1,0 г, 3,6 ммоль) в метиленхлориде (30 мл) добавляли частями этантиол (1,4 мл, 18,0 ммоль) с последующим добавлением хлорида алюминия (1,6 г, 12 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1,5 ч, затем охлаждали до 0 С и осторожно гасили тетрагидрофураном (ТГФ), а затем насыщенным раствором бикарбоната натрия. Смесь разбавляли ТГФ, слои разделяли и водный слой промывали несколько раз ТГФ. Объединенные органические слои сушили(сульфат натрия) и концентрировали с получе 43 нием неочищенного фенола, который использовали без дополнительной очистки. Из неочищенного продукта готовили суспензию в метиленхлориде (30 мл) и подвергали воздействию триэтиламина [2,5 мл, 18 ммоль) и трет-бутилдиметилсилилхлорида (1,3 г, 9,0 мл). Смесь перемешивали при комнатной температуре в течение ночи, в процессе чего она становилась гомогенной. После разбавления гексаном смесь промывали два раза насыщенным раствором соли. Органический слой сушили (сульфат натрия), концентрировали и остаток очищали с помощью хроматографии (силикагель, гексан 4:1 гексан:этилацетат) с получением 0,95 г(69%) соединения заголовка в виде пушистого белого твердого вещества: 1 Н ЯМР (300 МГц, ацетон-d6)8,57 (д,J=7,8 Гц, 1 Н), 8,10 (д, J=8,0 Гц, 1 Н), 7,81 (д,J=8,2 Гц, 1 Н), 7,5-7,7 (м, 2 Н), 6,99 (м,.2 Н), 1,03 Раствор продукта препаративного примера 12f (5,0 г, 13 ммоль) в толуоле (700 мл) охлаждали до -78 С и подвергали воздействию 1,0 М толуольного раствора гидрида диизобутил алюминия (15,7 мл, 15,7 ммоль), добавляемого по каплям с такой скоростью, чтобы внутренняя температура была ниже -70 С. Смесь перемешивали в течение примерно 4 часов, затем гасили метанолом (20 мл), 10% водным раствором лимонной кислоты (200 мл) и водой (450 мл). Водный слой экстрагировали три раза метиленхлоридом (800 мл). Органические слои сушили(сульфат натрия), концентрировали и остаток подвергали хроматографии (силикагель, градиент 2% этилацетата в гексане до 20% этилацетата в гексане) с получением 1,7 г (45%) соединения заголовка в виде белого пушистого твердого вещества: 1 Н ЯМР (300 МГц)7,96 (д, J=7,7 Гц, 1 Н),7,83 (д, J=6,7 Гц, 1 Н), 7,3-7,8 (м, 3 Н), 6,91 (м,1 Н), 6,62 (м, 2 Н), 1,00 (с, 9 Н), 0,26 (с, 6 Н); ИК Продукт препаративного примера 12g (0,09 г, 0,24 ммоль) и фенол (0,25 г, 2,6 ммоль) растворяли в хлорбензоле (10 мл) и смесь перемешивали в течение 3 ч при 100 С. Смесь концентрировали и остаток снова растворяли в хлорбензоле и повторно концентрировали в вакууме при примерно 70 С. Остаток затем растворяли в диэтиловом эфире, промывали пять раз насыщенным раствором карбоната натрия, водой и насыщенным раствором соли. Органический слой сушили (сульфат натрия) и концентрировали с получением 0,11 г (100%) соединения заголовка в виде пушистого белого твердого вещества, которое использовали без дополнительной очистки: 1 Н ЯМР спектр (300 МГц) соответствовал структуре. Пример 10d. 3-Гидрокси-6-[4-[2(1-пиперидинил)этокси]фенил]-6-Н-[1]бензотиено[3,2-с] К раствору продукта препаративного примера 12h (0,28 г, 0,61 ммоль) в толуоле (20 мл) при 0 С добавляли 0,2 М ТГФ раствор 4-[2-(1 пиперидинил)этокси]фенилмагния бромида (полученного из соответствующего бромбензола и магниевых стружек с катализатором йодом в ТГФ, 7,6 мл, 1,5 ммоль). Смеси давали нагреться до комнатной температуры и перемешивали в течение 1 часа. После гашения водой, смесь экстрагировали шесть раз метиленхлоридом и органический слой сушили (сульфат натрия) и концентрировали. Остаток очищали с помощью хроматографии (силикагель, 4:1-1:1 гексан:этилацетат) с получением 0,41 г (119%) частично очищенного силилированного продукта. К раствору частично очищенного продукта(ТБАФ) (0,67 мл, 0,67 ммоль). Раствор перемешивали при комнатной температуре в течение 10 мин, затем разбавляли этилацетатом и промывали три раза насыщенным раствором бикарбоната натрия и насыщенным раствором соли. Органические слои сушили (сульфат натрия) и концентрировали. Остаток растирали с метиленхлоридом с получением 0,23 г (82%) соединения заголовка в виде белого твердого порошкообразного вещества. Из твердого вещества готовили суспензию в метаноле и добавляли трифторуксусную кислоту по каплям до тех пор, 45 пока весь материал не переходил в раствор, нерастворенное вещество отфильтровывали и маточную жидкость концентрировали в вакууме с получением 0,28 г (80%) ТФУ соли в виде пушистого оранжевого твердого вещества: 1 Н ЯМР (300 МГц)7,95 (м, 1 Н), 7,38 (м,1 Н), 7,2-7,3 (м, 5 Н), 6,90 (д, J=8,6 Гц, 2 Н), 6,76 Смесь продукта препаративного примера 10 (7,0 г, 13,8 ммоль) и 2,3-дихлор-5,6-дициано 1,4-бензохинона (ДДХ) (3,3 г, 14,5 ммоль) в дихлорэтане (100 мл) нагревали до температуры кипения с обратным холодильником в течение ночи, вызывая образование осадка. Смесь фильтровали горячей, промывая осадок метиленхлоридом, и маточную жидкость концентрировали в вакууме. Остаток разделяли между гексаном:эфиром и водой и органический слой сушили (сульфат магния), концентрировали и перекристаллизовывали из гексана с получением 5,5 г (79%) продукта, названного в заголовке,в виде желто-коричневого твердого вещества,т.пл. 154-156 С. 1 Н ЯМР (300 МГц, СDСl3)9,69 (д, J=9,4 Гц), 8,80 (с, 2 Н), 8,01 (д, J=9,5 Гц), 7,34 (дд,J=9,3, 2,5 Гц, 1 Н), 7,28 (д, J=5,4 Гц, 1 Н), 6,90 (м,2 Н), 1,05 (с, 9 Н), 1,03 (с, 9 Н), 0,29 (с, 12 Н); ИК С помощью процедуры, описанной в препаративном примере 4, продукт препаративного примера 18 а (5,0 г, 9,9 ммоль) подвергали взаимодействию с 1,0 М диизобутилалюминия гидридом в толуоле (11,9 мл, 11,9 ммоль) с получением после перекристаллизации из гекса 001649 46 на:эфира, 4,14 г (82%) соединения заголовка в виде белого твердого вещества, т.пл. 188-190 С. 1 С помощью процедуры, описанной в препаративном примере 5, продукт препаративного примера 18b (3,5 г, 6,88 ммоль) приводили во взаимодействие с фенолом (3,2 г, 34,3 ммоль) с получением 3,82 г (95%) соединения заголовка в виде аморфного белого твердого вещества, которое использовали без дополнительной очистки: 1 С помощью процедуры, описанной в препаративном примере 6, продукт препаративного примера 18 с (3,5 г, 6,0 ммоль) подвергали взаимодействию с 0,2 М ТГФ раствором 4-[2-(1 пиперидинил)этокси] фенилмагнийбромида с получением после хроматографии (силикагель,3:2 гексан:этилацетат, 0,1% гидроксид аммония), 3,5 г (84%) соединения, названного в заголовке, в виде бесцветного смолообразного твердого вещества: 1 С помощью процедуры, описанной для примера 1, продукт препаративного примера 18d (3,4 г, 4,9 ммоль) подвергали взаимодействию с 1,0 М ТБАФ в ТГФ (24,4 ммоль) с получением после хроматографии (силикагель, 1:1 гексан:этилацетат, 10% метанол, 0,1% гидроксид аммония) и растирания с эфиром 2,2 г(96%) соединения, названного в заголовке, в виде белого твердого вещества, т.пл. 158-161 С. 1 Смесь продукта препаративного примера 22 (100 мг, 0,19 ммоль) и 2,3-дихлор-5,6 дициано-1,4-бензохинон (ДДХ) (47 мг, 0,21 ммоль) в дихлорэтане (10 мл) нагревали до ки 001649 48 пения с обратным холодильником в течение 2 ч,вызывая образование осадка. Смесь охлаждали до комнатной температуры, фильтровали и фильтрат разбавляли СН 2 Сl3 (70 мл), промывали 1N раствором гидроксида натрия (2 х 70 мл),сушили (Na2SO4) и концентрировали с получением 98 мг (98%) соединения, названного в заголовке, в виде белого твердого кристаллического вещества, т.пл. 211-213 С: 1 Продукт препаративного примера 22 а (6,8 г, 13,3 ммоль) растворяли в 1:1 ацетонитрил:метиленхлорид (200 мл) и подвергали взаимодействию с гидрофторид-пиридином (80 мл) в течение 1 ч. Смесь разбавляли насыщенным раствором соли (500 мл) и экстрагировали ТГФ(3 х 300 мл). Объединенные органические слои нейтрализовали насыщенным раствором бикарбоната натрия и получающийся водный слой промывали ТГФ (2 х 500 мл). Все водные слои затем объединяли и промывали ТГФ (500 мл), а объединенные органические слои сушили(сульфат натрия) и концентрировали, и твердый остаток промывали ацетоном с получением 5,27 г (100%) соединения, названного в заголовке, в виде не совсем белого порошка, т. пл. 310 рС. 1 С помощью процедуры, описанной для примера 14, продукт из примера 12 (310 мг, 0,61 ммоль) подвергался взаимодействию с этантиолом (189 мг, 3,1 ммоль) и хлоридом алюминия(611 мг, 4,6 ммоль) с получением после радиальной хроматографии (силикагель, 1:1 гексан:этилацетат, 10-20% метанол, в атмосфере аммиака) 237 мг (81%) соединения, названного в заголовке, в виде желтой пены, которая кристаллизовалась при растирании с эфиром, т.пл. 166-174 С. 1 Раствор продукта из примера 12 (350 мг,0,69 ммоль) в ТГФ (25 мл) подвергали взаимодействию с гидридом лития-алюминия (129 мг,3,4 ммоль), что вызывало умеренную экзотермию. Смеси давали вернуться к комнатной температуре и перемешивали в течение 2 ч, затем недолго нагревали с обратным холодильником,охлаждали и гасили этилацетатом (50 мл) и затем насыщенным раствором хлорида аммония(50 мл). Водный слой экстрагировали этилацетатом (2 х 50 мл) и объединенные органические слои сушили (сульфат натрия), концентрировали и очищали с помощью радиальной хроматографии (силикагель, 1:1 гексан:этилацетат, 5% метанол, в атмосфере аммиака) с получением 248 мг (64%) соединения заголовка в виде желтой пены: 1 Н ЯМР (300 МГц, СDСl3)7,28 (д, J=8,5 Гц, 1 Н), 7,05 (д, J=8,5 Гц, 1 Н), 6,79 (м, 3 Н), 6,72 По способу, описанному для примера 12,продукт препаративного примера 23 а (4,8 г, 12,1 ммоль), трифенилфосфин (6,3 г, 24,2 ммоль) и 1-(2-гидроксиэтил)пиперидин (3,9 г, 30,3 ммоль) подвергали взаимодействию с диэтилдиазодикарбоксилатом (ДЭАД) (4,2 г, 24,2 ммоль) с получением после хроматографии (силикагель, 1:1 гексан:этилацетат, 5-20% метанол, 0,1% гидроксид аммония) и перекристаллизации из этилацетата, 5,14 г (84%) соединения, названного в заголовке, в виде пушистого белого твердого вещества, т.пл. 176 С. 1 С помощью процедуры, описанной для примера 14, продукт из примера 12 а (500 мг,0,98 ммоль) подвергали взаимодействию с этантиолом (304 мг, 4,9 ммоль) и хлоридом алюминия (987 мг, 7,4 ммоль) с получением после хроматографии (силикагель, 1:1 гексан: этил 51 ацетат, 10-30% метанол, 0,1% гидроксид аммония) и кристаллизации из метанола 397 мг (84%) соединения заголовка в виде белого порошка. Аналитический образец перекристаллизовывали из метанола/СНСl3, т.пл. 227-232 рС. 1 Раствор продукта из примера 12 а (3,82 г,7,51 ммоль) в ТГФ (250 мл) обрабатывали гидридом лития-алюминия (1,43 г, 37,5 ммоль),причем происходило умеренное выделение тепла. После прекращения выделения тепла смесь нагревали до температуры кипения с обратным холодильником в течение ночи, охлаждали до комнатной температуры и осторожно гасили этилацетатом (200 мл), а затем 1N раствором гидроксида натрия (200 мл). Слои разделяли и водный слой экстрагировали этилацетатом (2 х 200 мл) и объединенные органические слои промывали насыщенным раствором соли (200 мл), сушили (сульфат натрия) и концентрировали. Остаток перекристаллизовывали из гексана:этилацетата с получением 3,24 г (87%) соединения заголовка в виде не совсем белого твердого вещества, т.пл. 136-137 С. 1 По способу, описанному в препаративном примере 8, продукт препаративного примера 7 По способу, описанному в препаративном примере 8, продукт препаративного примера 7 Из куместрола (10 г, 37.3 ммоль) готовили суспензию в метиленхлориде (600 мл), охлаждали до 0 С и подвергали ее взаимодействию с триэтиламином (24,9 г, 34,3 мл, 246 ммоль) и трет-бутилдиметилсилилхлоридом (24,7 г, 164 ммоль). Смесь нагревали до комнатной температуры и перемешивали в течение ночи, в процессе чего она медленно становилась гомогенной. После разбавления эфиром (800 мл) смесь промывали насыщенным раствором соли (800 мл) и водный слой экстрагировали эфиром (500 мл). Объединенные органические слои сушили(сульфат натрия), концентрировали и остаток перекристаллизовывали из гексана с получением 14,2 г (77%) соединения, названного в заголовке, в виде белого порошка, т.пл. 118-119 С: 1 По способу, описанному в препаративном примере 4, продукт препаративного примера 13(5,0 г, 10,0 ммоль) подвергали взаимодействию с 1,0 М толуольным раствором диизобутилалюминия гидрида (12,0 мл, 12,0 ммоль) в толуоле(450 мл). Перекристаллизация из гексана давала 1,26 г соединения заголовка в виде смеси с его альдегидным таутомером. Хроматография (силикагель, 2-15% этилацетат/гексан) маточной жидкости давала 1,37 г исходного материала 54 лизации, 580 мг соединения заголовка для общего выхода, равного 1,85 г (37%) таутомерной смеси: 1 По методу, описанному в препаративном примере 5, продукт препаративного примера 14(464 мг, 0,93 ммоль) подвергали взаимодействию с фенолом (1,05 г, 11,2 ммоль) в хлорбензоле (25 мл), содержащем безводный сульфат натрия (1,0 г) с получением 467 мг (87%) неочищенного соединения заголовка в виде нестабильной розовой пены, которое использовали без очистки. 1 Н ЯМР (300 МГц) d 7,1-7,7 (м, 8 Н), 6,6-6,9 По способу, описанному в препаративном примере 6, продукт препаративного примера 15(90%) соединения заголовка в виде бесцветного смолообразного твердого вещества: 1 По способу, описанному для примера 1,продукт препаративного примера 16 (520 мг,0,76 ммоль) подвергали взаимодействию с 1,0 М ТБАФ в ТГФ (4,5 ммоль) с получением после радиальной хроматографии (силикагель, 1:1,гексан:этилацетат, 10% метанол, в атмосфере аммиака) 292 мг (72%) соединения заголовка в виде ярко-красной пены которая кристаллизовалась из тетрахлористого углерода. 1 К раствору 1-карбометокси-6-метокси-2 тетралона (см. Colvin, Martin, and Shroot, Chemistry and Industry, 2130 (1966 (18,0 г, 76,8 ммоль) и резорцинола (8,9 г, 80,7 ммоль) при перемешивании при комнатной температуре в толуоле (450 мл) добавляли по каплям оксихлорид фосфора (12,0 г, 7,3 мл, 18,3 ммоль) и смесь нагревали до 80 С в течение 12 ч. После охлаждения до комнатной температуры смесь выливали в воду (500 мл) и фильтровали, промывая осадок эфиром. Слои фильтрата разделяли, вод 001649 56 ный слой экстрагировали этилацетатом (3 х 500 мл), а объединенные органические слои сушили(сульфат натрия) и концентрировали. Перекристаллизация остатка из метанола давала 16,0 г соединения заголовка в виде желтого твердого вещества, т.пл. 244-249 рС. 1 С помощью процедуры, описанной в препаративном примере 3, продукт препаративного примера 17 (4,17 г, 14,2 ммоль) приводили во взаимодействие с этантиолом (3,53 г, 3,95 мл,56,8 ммоль) и хлоридом алюминия (9,0 г, 67,5 ммоль) в метиленхлориде (100 мл). Неочищенный продукт далее приводили во взаимодействие с триэтиламином (8,6 г, 11,9 мл, 85,2 ммоль) и трет-бутилдиметилсилилхлоридом (8,6 г, 56,8 ммоль) в метиленхлориде (100 мл) с получением после перекристаллизации из гексана продукта, названного в заголовке, в качестве желтого твердого вещества, т.пл. 145-147 С. 1 57 После охлаждения до комнатной температуры твердую массу перекристаллизовывали из толуола/метанола: 1 Продукт препаративного примера 19 (36 г,134,7 ммоль) растворяли в 1:1 метиленхлориде:ТГФ (300 мл) и подвергали взаимодействию с триэтиламином (28,6 г, 39,4 мл, 283 ммоль) и трет-бутилдиметилсилилхлоридом (30,5 г, 202 ммоль). Смесь перемешивали в течение ночи и добавляли дополнительные порции триэтиламина (6,8 г, 9,4 мл, 67 ммоль) и третбутилдиметилсилилхлорида (10,2 г, 67 ммоль),чтобы довести реакцию до завершения. Через 5 ч смесь разбавляли эфиром (500 мл), фильтровали, концентрировали и остаток промывали гексаном/эфиром. Экстракты фильтровали, концентрировали и остаток очищали с помощью быстрой хроматографии (силикагель, 18:1-10:1 гексан:этилацетат) с получением 21,0 г (41%) соединения заголовка в виде легкой желтой пены: 1 Продукт препаративного примера 20 (10,2 г, 26,8 ммоль) растворяли в метиленхлориде(100 мл), охлаждали до 0 С и подвергали взаимодействию с триэтиламином (3,8 г, 5,2 мл, 37,5 ммоль), а затем с раствором 2,5-диметоксибензоилхлорида (6,72 г, 33,5 ммоль) в дихлорметане (25 мл). Смесь нагревали до температуры кипения с обратным холодильником в течение ночи, затем добавляли дополнительно триэтиламин (1,4 г, 1,9 мл, 13,4 ммоль) и хлорангидрид кислоты (2,7 г, 13,4 ммоль) и нагревание продолжали дополнительно в течение 12 ч. После концентрирования в вакууме остаток рас 001649 58 творяли в эфире (250 мл), промывали насыщенным раствором соли (250 мл), сушили (сульфат натрия) и концентрировали. Очистка остатка с помощью хроматографии (силикагель, 9:1-4:1 гексан:этилацетат) давала 10,3 г соединения заголовка в виде белой пены: 1 Н ЯМР (300 МГц, CDCl3) d 6,4-7,6 (шм,11 Н), 5,83 (шс, 1 Н), 3,4-3,8 (шм, 9 Н), 1,9-3,0 Раствор продукта препаративного примера 21 (2,73 г, 5 ммоль) в бензоле (250 мл) дегазировали путем 3 циклов замораживания/ откачивания/оттаивания и облучали с помощью внутренней ртутной лампы в 450 Вт в кварцевой иммерсионной ячейке в атмосфере азота. Через 22 ч смесь концентрировали и остаток очищали с помощью хроматографии (силикагель, 20:1 толуол: эфир) с получением 675 мг (26%) соединения заголовка в виде желтой пены. Аналитический образец получали с помощью кристаллизации из гексана/эфира в виде легких желтых кристаллов, т.пл. 194-95 С. 1 59 Продукт препаративного примера 22 (790 мг, 1,5 ммоль) растворяли в 3:2 ацетонитрил:метиленхлориде (50 мл) и подвергали взаимодействию с гидрофторидпиридином (10 мл) 2-мя порциями через 1-часовые интервалы. После дальнейшего перемешивания в течение 1 ч смесь разбавляли ТГФ (100 мл) и фильтровали,промывая метанолом и эфиром. Фильтраты разбавляли ТГФ (200 мл) и промывали насыщенным раствором соли (200 мл) и насыщенным раствором бикарбоната натрия (200 мл). Объединенные водные слои экстрагировали ТГФ (100 мл) и объединенные органические слои сушили (сульфат натрия) и концентрировали с получением 340 мг (57%)желтого порошка, т. пл. 250-275 рС, который использовали без очистки. 1 Н ЯМР (300 МГц, диметилформамид-d7) d 9,80 (шс, 1 Н), 7,91 (д, J=9,7 Гц, 1 н), 7,81 (д,J=1,9 Гц, 1 Н), 7,44 (дд, J=9,7, 1,9 Гц, 1 Н), 7,20 К раствору продукта препаративного примера 23 (340 мг, 0,85 ммоль), трифенилфосфина(296 мг, 268 мл, 1,7 ммоль) и смесь перемешивали при комнатной температуре в течение ночи. После концентрирования в вакууме хроматография (силикагель, 1:1 гексан:этилацетат, 520% метанол, 0,1% аммония гидроксид) давала 338 мг (66%) соединения заголовка в виде желтой пены: 1 Н ЯМР (300 МГц) d 7,82 (м, 2 Н), 7,35 (дд,J=9,7, 2,9 Гц, 1 Н), 7,23 (д, J=9,7 Гц, 2 Н), 6,91 (д,J=9,7 Гц, 2 Н), 6,82 (м, 1 Н), 6,70 (д, J=9,7 Гц, 1 Н),6,38 (дд, J=9,7, 1,9 Гц, 1 Н), 4,12 (т, J=5,8 Гц, 2 Н),3,90 (с, 3 Н), 3,70 (с, 3 Н), 2,86 (м, 6 Н), 2,65 (м,4 Н), 1,5-1,7 (м, 4 Н), 1,4-1,5 (м, 2 Н). Пример 13. 2,8-Диметокси-5-[4-[2-(1-пиперидинил)этокси]фенил]-6 Н-бензо[с]фенантридин. Раствор продукта из примера 12 (753 мг,1,47 ммоль) разбавляли дихлорэтаном (20 мл) и подвергали воздействию ДДХ (352 мг, 1,55 ммоль) и нагревали до 80 С. Через несколько 60 часов смесь охлаждали до комнатной температуры, разбавляли метиленхлоридом (100 мл),промывали насыщенным раствором карбоната натрия и органический слой сушили (сульфат натрия) и концентрировали. Остаток очищали с помощью хроматографии (силикагель, 1:1 гексан:этилацетат, 15% метанол) с получением 330 мг (44%) желтого твердого вещества. Полученное твердое вещество, указанное выше (309 мг, 0,61 ммоль) растворяли в ТГФ (25 мл) и подвергали взаимодействию с гидридом лития-алюминия (ЛАГ) (115 мг, 3,05 ммоль) при комнатной температуре. Через 10 мин избыток ЛАГ гасили этилацетатом (50 мл) и смесь промывали насыщенным раствором хлорида аммония (25 мл). Водный слой промывали этилацетатом (25 мл) и объединенные органические слои промывали насыщенным раствором соли(силикагель, 1:1 гексан:этилацетат, 5% метанол,в атмосфере аммиака). Продукт затем растворяли в ледяной уксусной кислоте (10 мл) и подвергали взаимодействию с борогидридом натрия (69 мг, 1,82 ммоль). Через 1 ч смесь гасили насыщенным раствором бикарбоната натрия и разделяли между метиленхлоридом и насыщенным раствором бикарбоната натрия. Органический слой сушили (сульфат натрия), концентрировали и остаток использовали без дополнительной очистки: 1 Н ЯМР (300 МГц) d 7,99 (д, J=8,6 Гц, 1 Н),7,82 (д, J=8,6 Гц, 1 Н), 7,74 (д, J=9,4 Гц, 1 Н), 7,71 Раствор продукта из примера 13 (195 мг,0,39 ммоль) в метиленхлориде (25 мл) подвергали взаимодействию с этантиолом (200 мг, 220 мл, 3,2 ммоль) и хлоридом алюминия (320 мг,2,4 ммоль). После перемешивания в течение 4 ч при комнатной температуре смесь тщательно гасили ТГФ (25 мл) и насыщенным раствором бикарбоната натрия (25 мл). Слои разделяли,водный слой экстрагировали ТГФ (25 мл) и объединенные органические слои сушили (сульфат натрия) и концентрировали. Остаток очищали с помощью радиальной хроматографии (силикагель, гексан:этилацетат 1:1, 10-20% метанол, в атмосфере аммиака) с получением 110 мг (60%) соединения заголовка в виде желто-коричневой
МПК / Метки
МПК: A61P 5/30, C07D 471/00, A61K 31/35
Метки: композиции, четырехциклические, замещенные, промежуточные, получения, методы, лечения, способы, гетероатомами, конденсированные, соединения, арилом
Код ссылки
<a href="https://eas.patents.su/30-1649-chetyrehciklicheskie-kondensirovannye-soedineniya-s-geteroatomami-zameshhennye-arilom-promezhutochnye-soedineniya-sposoby-polucheniya-kompozicii-i-metody-lecheniya.html" rel="bookmark" title="База патентов Евразийского Союза">Четырехциклические конденсированные соединения с гетероатомами, замещенные арилом, промежуточные соединения, способы получения, композиции и методы лечения</a>
Предыдущий патент: Высоковлажный материал для кормления птицы и других животных и способ его использования
Следующий патент: Усовершенствованный процесс гидроформилирования, катализируемый комплексом металл-лиганд
Случайный патент: Мебельная конструкция, такая как убирающаяся кровать с убирающимися ножками












