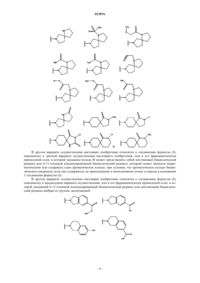
Бензодиоксановые ингибиторы продуцирования лейкотриена
Номер патента: 23876
Опубликовано: 29.07.2016
Авторы: Чжан Цин, Бёрке Майкл Дж., Абейуордейн Азита, Нетертон Маттью Рассел, Керрейн Томас Мартин Джр., Чжан Цян, Смит-Кинан Лейна Луиса, Падяна Анил Кумар, Тёрнер Майкл Роберт, Такахаши Хиденори
Формула / Реферат
1. Соединение формулы (I)
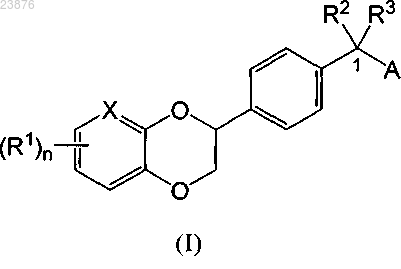
или его фармацевтически приемлемая соль, в которой
X обозначает N или СН;
n обозначает целое число, равное от 0 до 3;
R1 выбран из группы, включающей -Н или F;
R2 и R3 все независимо выбраны из группы, включающей -Н или СН3;
А обозначает группу формулы -NR4R5, в которой
R4 и R5 все независимо выбраны из группы, включающей -Н, -(С1-С6)алкил, -(С3-С6)циклоалкил, -(4-11-членный)гетероциклоалкил, -(С6-С10)арил и -(5-11-членный)гетероарил; где каждый из указанных выше -(С1-С6)алкилов, -(С3-С6)циклоалкилов, -(4-11-членных)гетероциклоалкилов, -(С6-С10)арилов и -(5-11-членных)гетероарилов указанных групп R4 и R5 необязательно независимо замещен 1-3 группами R6; где 2 группы R6, если они присоединены к одному и тому же атому углерода указанного -(С1-С6)алкила, могут связываться с образованием 3-6-членного кольца, необязательно содержащего от 1 до 3 гетероатомов и дополнительно необязательно замещенного 1-3 группами, выбранными из группы, включающей галоген, -ОН, (=O), -(С1-С6)алкил, -O(С1-С6)алкил, -С(O)ОН, -С(O)(С1-С6)алкил и -C(O)NH2;
или А обозначает (4-11-членное)N-гетероциклическое кольцо формулы В
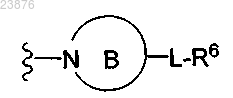
где указанное кольцо В может представлять собой неароматический 4-8-членный моноциклический радикал; мостиковый бициклический радикал; спироциклический радикал или 6-11-членный конденсированный бициклический радикал, который может являться неароматическим или содержать одно ароматическое кольцо, при условии, что ароматическое кольцо бициклического радикала, если оно содержится, не присоединено к метиленовому атому углерода в положении 1 соединения формулы (I);
где указанное кольцо В может дополнительно содержать от 1 до 3 дополнительных кольцевых гетероатомов, независимо выбранных из группы, включающей N, О и S;
где указанное кольцо В дополнительно может являться необязательно замещенным 1-3 группами, выбранными из группы, включающей галоген, -ОН, (=O), -С(O)ОН, -С(O)O-(С1-С6)алкил и -(С1-С6)алкил; и
где L отсутствует или обозначает мостик, выбранный из числа -(C1-С6)алкиленов;
каждый R6 независимо выбран из группы, включающей галоген, -OR7 , -CF3, -CN, -(С1-С6)алкил, -C(O)R7, -C(O)2R7, -C(O)N(R7)2, -N(R7)2, -NHC(O)R7, -NHC(O)N(R7)2, -S(O)2R7, -NH-S(O)2-R7, -(С3-С6)циклоалкил, -(4-11-членный)гетероциклоалкил, -(С6-С10)арил и -(5-11-членный)гетероарил; где каждый из указанных -(С1-С6)алкилов, -O(С1-С6)алкилов, -(С3-С6)циклоалкилов, -(4-11-членных)гетероциклоалкилов, -(С6-С10)арилов и -(5-11-членных)гетероарилов указанной группы R6 необязательно замещен, где это возможно, 1-3 группами, выбранными из группы, включающей галоген, -ОН, -CF3, -CN, (=O), -(С1-С6)алкил, -С(O)ОН, -С(O)O-(С1-С6)алкил, -NH2, -NH(C1-С6)алкил, -N((С1-С6)алкил)2, -S(O)2(С1-С6)алкил, -(С3-С6)циклоалкил, -(4-11-членный)гетероциклоалкил, -(С6-С10)арил и -(5-11-членный)гетероарил; и
каждый R7 независимо выбран из группы, включающей -Н, -(С1-С6)алкил, -(C1-С6)алкил, -(С1-С6)алкил-ОН, -(С1-С6)алкил-O-(С1-С6)алкил, -(С3-С6)циклоалкил, -(С3-С6)циклоалкил-ОН, -(4-11-членный)гетероциклоалкил, -(С6-С10)арил и -(5-11-членный)гетероарил.
2. Соединение по п.1 или его фармацевтически приемлемая соль, в которой группа А представляет собой группу формулы -NR4R5.
3. Соединение по п.1 или 2 или его фармацевтически приемлемая соль, в которой R4 обозначает -Н или -(С1-С6)алкил и R5 обозначает -(С1-С6)алкил; где каждый -(С1-С6)алкил указанных групп R4 и R5, если он содержится, необязательно независимо замещен 1-3 группами R6.
4. Соединение по п.1 или 3 или его фармацевтически приемлемая соль, в которой R4 обозначает -Н или -(С1-С6)алкил и R5 обозначает -(С1-С6)алкил; где указанный -(С1-С6)алкил указанной группы R5 замещен -(С3-С6)циклоалкилом, -(4-11-членным)гетероциклоалкилом, -(С6-С10)арилом или -(5-11-членным)гетероарилом; где каждый из указанных -(С3-С6)циклоалкилов, -(4-11-членных)гетероциклоалкилов, -(С6-С10)арилов и -(5-11-членных)гетероарилов необязательно замещен 1-3 группами, независимо выбранными из группы, включающей -(С1-С6)алкил, -CF3 и -C(O)OR8.
5. Соединение по п.1 или 2 или его фармацевтически приемлемая соль, в которой R4 обозначает -Н или -(С1-С6)алкил и R5 обозначает -(С1-С6)алкил; где указанный -(С1-С6)алкил указанной группы R5 независимо замещен 1-3 группами, выбранными из группы, включающей -(С1-С6)алкил, -O(С1-С6)алкил, -C(O)R8, -C(O)OR8, -S(O)2R8 и -NHC(O)R8.
6. Соединение по п.1 или 2 или его фармацевтически приемлемая соль, в которой R4 и R5 все независимо выбраны из группы, включающей -Н или -(C1-С6)алкил.
7. Соединение по п.1 или 2 или его фармацевтически приемлемая соль, в которой R4 обозначает -Н или -(С1-С6)алкил и R5 обозначает -(С3-С6)циклоалкил, -(4-11-членный)гетероциклоалкил, -(С6-С10)арил и -(5-11-членный)гетероарил; где каждая из указанных выше -(С3-С6)циклоалкильных, -(4-11-членных)гетероциклоалкильных, -(С6-С10)арильных и -(5-11-членных)гетероарильных групп указанной группы R5 необязательно независимо замещена 1-3 группами, выбранными из группы, включающей -(С1-С6)алкил, -O(С1-С6)алкил, -C(O)R8, -C(O)OR8, -S(O)2R8 и -NHC(O)R8.
8. Соединение по п.1 или его фармацевтически приемлемая соль, в которой группа А представляет собой (4-11-членное)N-гетероциклическое кольцо формулы В
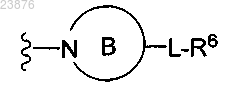
9. Соединение по п.1 или 8 или его фармацевтически приемлемая соль, в которой указанное кольцо В представляет собой 4-8-членный моноциклический радикал.
10. Соединение по п.9 или его фармацевтически приемлемая соль, в которой указанный 4-8-членный моноциклический радикал выбран из группы, включающей азетидин, тетрагидропиррол, пиперидин, гексаметиленимин, 1,2-диазетидин, пиразолидин, имидазолидин, пиперазин, гексагидродиазепин, изоксазолидин, оксазолидин, тетрагидро-2Н-1,3-оксазин, морфолин и гексагидро-1,4-оксазепин; где указанное моноциклическое кольцо дополнительно может являться необязательно замещенным 1-3 группами, выбранными из группы, включающей галоген, -ОН, (=O), -С(O)ОН, -С(O)O-(С1-С6)алкил и -(С1-С6)алкил.
11. Соединение по п.1 или 8 или его фармацевтически приемлемая соль, в которой указанное кольцо В представляет собой спироциклический гетероциклический радикал.
12. Соединение по п.1 или 8 или его фармацевтически приемлемая соль, в которой указанное кольцо В может представлять собой мостиковый бициклический радикал или 6-11-членный конденсированный бициклический радикал, который может являться неароматическим или содержать одно ароматическое кольцо, при условии, что ароматическое кольцо бициклического радикала, если оно содержится, не присоединено к метиленовому атому углерода в положении 1 соединения формулы (I).
13. Соединение по п.1 или 8 или его фармацевтически приемлемая соль, в которой L обозначает -СН2-.
14. Соединение по п.1 или 8 или его фармацевтически приемлемая соль, в которой L отсутствует.
15. Соединение по п.1 или 8 или его фармацевтически приемлемая соль, в которой указанное 4-8-членное гетероциклическое кольцо В выбрано из группы, включающей азетидинил, пирролидинил, пиперидинил и азепанил; где каждое из указанных выше азетидинильных, пирролидинильных, пиперидинильных и азепанильных колец необязательно замещено 1-3 группами, выбранными из группы, включающей галоген, -ОН, (=O), -С(O)ОН, С(O)O-(С1-С6)алкил и -(C1-С6)алкил; и где
L отсутствует или обозначает мостик, выбранный из числа -(С1-С6)алкиленов; и где
R6 выбран из группы, включающей галоген, -OR7 , -CF3, -CN, -(С1-С6)алкил, -C(O)R7, -С(О) 2R7, -C(O)N(R7)2, -N(R7)2, -NHC(O)R7, -NHC(O)N(R7)2, -S(O)2R7, -NH-S(O)2-R7, -(С3-С6)циклоалкил, -(4-11-членный)гетероциклоалкил, -(С6-С10)арил и -(5-11-членный)гетероарил; где каждый из указанных -(C1-С6)алкилов, -O(С1-С6)алкилов, -(С3-С6)циклоалкилов, -(4-11-членных)гетероциклоалкилов, -(С6-С10)арилов и -(5-11-членных)гетероарилов указанной группы R6 необязательно замещен, где это возможно, 1-3 группами, выбранными из группы, включающей галоген, -ОН, -CF3, -CN, (=O), -(С1-С6)алкил, -С(O)ОН, -С(O)O-(С1-С6)алкил, -NH2, -МН(С1-С6)алкил, -N((C1-С6)алкил)2, -S(O)2(С1-С6)алкил, -(С3-С6)циклоалкил, -(4-11-членный)гетероциклоалкил, -(С6-С10)арил и -(5-11-членный)гетероарил.
16. Соединение по любому из предыдущих пунктов или его фармацевтически приемлемая соль, в которой X обозначает N.
17. Соединение по любому из пп.1-15 или его фармацевтически приемлемая соль, в которой X обозначает СН.
18. Соединение, выбранное из группы, включающей
4-(1-{4-[(2S)-2,3-дигидро-1,4-бензодиоксин-2-ил]бензил}пиперидин-4-ил)бутановую кислоту;
4-(1-{4-[(3S)-2,3-дигидро[1,4]диоксино[2,3-b]пиридин-3-ил]бензил}пиперидин-4-ил)бензойную кислоту;
(3S)-3-{4-[(1s,4s)-7-азабицикло[2.2.1]гепт-7-илметил]фенил}-2,3-дигидро[1,4]диоксино[2,3-b]пиридин;
N-(1-{4-[(3S)-2,3-дигидро[1,4]диоксино[2,3-b]пиридин-3-ил]бензил}пиперидин-4-ил)метансульфонамид;
(3S)-3-[4-(азепан-1-илметил)фенил]-2,3-дигидро[1,4]диоксино[2,3-b]пиридин;
1-{4-[(2S)-2,3-дигидро-1,4-бензодиоксин-2-ил]бензил}-2-метилпиперидин;
7-{4-[(2S)-2,3-дигидро-1,4-бензодиоксин-2-ил]бензил}-1,7-диазаспиро[4.4]нонан-1-карбоксамид;
7-{4-[(3S)-2,3-дигидро[1,4]диоксино[2,3-b]пиридин-3-ил]бензил}-1,7-диазаспиро[4.4]нонан-2-он;
1-{4-[(2S)-2,3-дигидро-1,4-бензодиоксин-2-ил]бензил}пиперидин-4-карбоновую кислоту;
(1-{4-[(2S)-2,3-дигидро-1,4-бензодиоксин-2-ил]бензил}пиперидин-4-ил)(морфолин-4-ил)метанон;
8-{4-[(3S)-2,3-дигидро[1,4]диоксино[2,3-b]пиридин-3-ил]бензил}-1,3,8-триазаспиро[4.5]декан-2,4-дион;
(3S)-3-{4-[(3-метоксипиперидин-1-ил)метил]фенил}-2,3-дигидро[1,4]диоксино[2,3-b]пиридин;
N-(1-{4-[(2S)-2,3-дигидро-1,4-бензодиоксин-2-ил]бензил}пирролидин-3-ил)-N-метилацетамид;
1-{4-[(2S)-2,3-дигидро-1,4-бензодиоксин-2-ил]бензил}-4-(1,1-диоксидо-1,2-тиазолидин-2-ил)пиперидин;
(3R)-1-{4-[(3S)-2,3-дигидро[1,4]диоксино[2,3-b]пиридин-3-ил]бензил}пирролидин-3-ол;
N-(1-{4-[(3S)-2,3-дигидро[1,4]диоксино[2,3-b]пиридин-3-ил]бензил}пиперидин-4-ил)-2-гидроксиацетамид;
4-[(1-{4-[(3S)-2,3-дигидро[1,4]диоксино[2,3-b]пиридин-3-ил]бензил}пиперидин-4-ил)метил]бензойную кислоту;
(1-{4-[(3S)-2,3-дигидро[1,4]диоксино[2,3-b]пиридин-3-ил]бензил}пиперидин-4-ил)(морфолин-4-ил)метанон;
(3S)-3-[4-(морфолин-4-илметил)фенил]-2,3-дигидро[1,4]диоксино[2,3-b]пиридин;
8-{4-[(2S)-2,3-дигидро-1,4-бензодиоксин-2-ил]бензил}-2,8-диазаспиро[4.5]декан-1-он;
1-{4-[(3S)-2,3-дигидро[1,4]диоксино[2,3-b]пиридин-3-ил]бензил}пиперидин-4-карбонитрил;
1-{4-[(2S)-2,3-дигидро-1,4-бензодиоксин-2-ил]бензил}-N-метилпиперидин-4-карбоксамид;
8-{4-[(3S)-2,3-дигидро[1,4]диоксино[2,3-b]пиридин-3-ил]бензил}-2,8-диазаспиро[4.5] декан-1-он;
N-(1-{4-[(3S)-2,3-дигидро[1,4]диоксино[2,3-b]пиридин-3-ил]бензил}пиперидин-4-ил)-2-гидрокси-2-метилпропанамид;
N-(1-{4-[(3S)-2,3-дигидро[1,4]диоксино[2,3-b]пиридин-3-ил]бензил}пиперидин-4-ил)-1-гидроксициклопропанкарбоксамид;
N-{4-[(2S)-2,3-дигидро-1,4-бензодиоксин-2-ил]бензил}-N-этилциклопентанамин;
1-{4-[(3S)-2,3-дигидро[1,4]диоксино[2,3-b]пиридин-3-ил]бензил}-N-метилпиперидин-4-карбоксамид;
N-{4-[(3S)-2,3-дигидро[1,4]диоксино[2,3-b]пиридин-3-ил]бензил}-N-метилциклопентанамин;
1-[(1-{4-[(3S)-2,3-дигидро[1,4]диоксино[2,3-b]пиридин-3-ил]бензил}пиперидин-3-ил)метил]пирролидин-2-он;
1-{4-[(2S)-2,3-дигидро-1,4-бензодиоксин-2-ил]бензил}-2-метилпирролидин;
N-{4-[(3S)-2,3-дигидро[1,4]диоксино[2,3-b]пиридин-3-ил]бензил}-2-метил-1-(пирролидин-1-ил)пропан-2-амин;
N-циклогексил-N-{4-[(2S)-2,3-дигидро-1,4-бензодиоксин-2-ил]бензил}-N',N'-диметилэтан-1,2-диамин;
N-(1-{4-[(3S)-2,3-дигидро[1,4]диоксино[2,3-b]пиридин-3-ил]бензил}пиперидин-4-ил)ацетамид;
N-{4-[(3S)-2,3-дигидро[1,4]диоксино[2,3-b]пиридин-3-ил]бензил}-N-метил-2-(пиридин-2-ил)этанамин;
(3S)-3-[4-(пирролидин-1-илметил)фенил]-2,3-дигидро[1,4]диоксино[2,3-b]пиридин;
1-{4-[(3S)-2,3-дигидро[1,4]диоксино[2,3-b]пиридин-3-ил]бензил}пиперидин-3-карбоксамид;
1-{4-[(3S)-2,3-дигидро[1,4]диоксино[2,3-b]пиридин-3-ил]бензил}пиперидин-4-карбоксамид;
N-(1-{4-[(2S)-2,3-дигидро-1,4-бензодиоксин-2-ил]бензил}пирролидин-3-ил)ацетамид;
1-{4-[(3S)-2,3-дигидро[1,4]диоксино[2,3-b]пиридин-3-ил]бензил}-N-(2-гидроксиэтил)пиперидин-4-карбоксамид;
(3S)-3-[4-(1,4-оксазепан-4-илметил)фенил]-2,3-дигидро[1,4]диоксино[2,3-b]пиридин;
1-{4-[(2S)-2,3-дигидро-1,4-бензодиоксин-2-ил]бензил}-N-(2-гидроксиэтил)пиперидин-4-карбоксамид;
4-(1-{4-[(2S)-2,3-дигидро-1,4-бензодиоксин-2-ил]бензил}пиперидин-4-ил)бензойную кислоту;
1-(1-{4-[(2S)-2,3-дигидро-1,4-бензодиоксин-2-ил]бензил}пиперидин-4-ил)мочевину;
7-{4-[(2S)-2,3-дигидро-1,4-бензодиоксин-2-ил]бензил}-1,7-диазаспиро[4.4]нонан-2-он;
8-{4-[(3S)-2,3-дигидро[1,4]диоксино[2,3-b]пиридин-3-ил]бензил}-2-метил-2,8-диазаспиро[4.5]декан-1-он;
1-{4-[(3S)-2,3-дигидро[1,4]диоксино[2,3-b]пиридин-3-ил]бензил}пиперидин-4-ол;
N-(1-{4-[(2S)-2,3-дигидро-1,4-бензодиоксин-2-ил]бензил}пиперидин-4-ил)метансульфонамид;
3-(1-{4-[(3S)-2,3-дигидро[1,4]диоксино[2,3-b]пиридин-3-ил]бензил}пиперидин-4-ил)пропан-1-ол;
(3S)-3-{4-[(4-метилпиперидин-1-ил)метил]фенил}-2,3-дигидро[1,4]диоксино[2,3-b]пиридин;
N-{4-[(3S)-2,3-дигидро[1,4]диоксино[2,3-b]пиридин-3-ил]бензил}-N-этилэтанамин;
N-{4-[(3S)-2,3-дигидро[1,4]диоксино[2,3-b]пиридин-3-ил]бензил}-1-(метилсульфонил)пиперидин-4-амин;
(3S)-3-{4-[(4-фторпиперидин-1-ил)метил]фенил}-2,3-дигидро[1,4]диоксино[2,3-b]пиридин;
1-(4-{4-[(3S)-2,3-дигидро[1,4]диоксино[2,3-b]пиридин-3-ил]бензил}-1,4-диазепан-1-ил)этанон;
[(3R)-1-{4-[(2S)-2,3-дигидро-1,4-бензодиоксин-2-ил]бензил}пиперидин-3-ил]уксусную кислоту;
(1-{4-[(3S)-2,3-дигидро[1,4]диоксино[2,3-b]пиридин-3-ил]бензил}пиперидин-4-ил)метанол;
4-[(1-{4-[(2S)-2,3-дигидро-1,4-бензодиоксин-2-ил]бензил}пиперидин-4-ил)метил]бензойную кислоту;
(3S)-3-{4-[(4-метил-1,4-диазепан-1-ил)метил]фенил}-2,3-дигидро[1,4]диоксино[2,3-b]пиридин;
(3S)-3-{4-[(3-метоксипирролидин-1-ил)метил]фенил}-2,3-дигидро[1,4]диоксино[2,3-b]пиридин и
N-{4-[(2S)-2,3-дигидро-1,4-бензодиоксин-2-ил]бензил}-N,2-диметилпропан-2-амин; или
фармацевтически приемлемую соль каждого из приведенных выше соединений.
19. Соединение 4-{4-[(3S)-2,3-дигидро[1,4]диоксино[2,3-b]пиридин-3-ил]бензил}пиперазин-1-карбоксамид или его фармацевтически приемлемая соль.
20. Соединение 1-{4-[(2S)-2,3-дигидро-1,4-бензодиоксин-2-ил]бензил}пиперидин-4-карбоновая кислота или ее фармацевтически приемлемая соль.
21. Соединение [(3R)-1-{4-[(2S)-2,3-дигидро-1,4-бензодиоксин-2-ил]бензил}пиперидин-3-ил]уксусная кислота или ее фармацевтически приемлемая соль.
22. Фармацевтическая композиция, обладающая ингибирующей активностью в отношении лейкотриен-А4-гидролазы (LTA4H), содержащая соединение по любому из пп.1-21 или его фармацевтически приемлемую соль.
23. Способ лечения нарушений, опосредуемых лейкотриеном, включающий введение нуждающемуся в нем пациенту соединения по любому из пп.1-21 или его фармацевтически приемлемой соли в фармацевтически эффективном количестве.
24. Способ лечения сердечно-сосудистого заболевания, включающий введение нуждающемуся в нем пациенту соединения по любому из пп.1-21 или его фармацевтически приемлемой соли в фармацевтически эффективном количестве.
25. Способ по п.24, где сердечно-сосудистое заболевание выбрано из группы, включающей атеросклероз, инфаркт миокарда, удар, аневризму аорты, серповидноклеточный криз, ишемическое реперфузионное поражение, легочную артериальную гипертензию и сепсис.
26. Способ лечения атеросклероза, включающий введение нуждающемуся в нем пациенту соединения по любому из пп.1-21 или его фармацевтически приемлемой соли в фармацевтически эффективном количестве.
Текст
БЕНЗОДИОКСАНОВЫЕ ИНГИБИТОРЫ ПРОДУЦИРОВАНИЯ ЛЕЙКОТРИЕНА Описаны соединения формулы (I) в которой R1-R3, А, X и n являются такими, как определено в настоящем изобретении. Соединения формулы (I) применимы в качестве ингибиторов лейкотриен-А 4-гидролазы (LTA4H) и для лечения связанного с LTA4H нарушения. В изобретении также описаны фармацевтические композиции, содержащие соединения формулы (I), способы применения этих соединений для лечения различных заболеваний и нарушений и способы получения этих соединений.(71)(73) Заявитель и патентовладелец: БРИНГЕР ИНГЕЛЬХАЙМ ИНТЕРНАЦИОНАЛЬ ГМБХ (DE) Область техники, к которой относится изобретение Настоящее изобретение относится к бензодиоксанам, которые применимы в качестве ингибиторов лейкотриен-А 4-гидролазы (LTA4H) и поэтому применимы для лечения различных заболеваний и нарушений, которые опосредуются или поддерживаются активностью лейкотриенов, включая астму, аллергию и сердечно-сосудистые заболевания, включая атеросклероз, инфаркт миокарда и удар. Настоящее изобретение также относится к фармацевтическим композициям, содержащим эти соединения, способам применения этих соединений для лечения различных заболеваний и нарушений. Уровень техники Лейкотриены (LT) представляют собой окисленные липиды, которые продуцируются клетками нескольких типов, включая нейтрофилы, мастоциты, эозинофилы, базофилы, моноциты и макрофаги. Первая обязательная стадия внутриклеточного синтеза LT включает окисление арахидоновой кислоты 5 липоксигеназой (5-LO) с образованием лейкотрйена А 4 (LTA4), для этой стадии необходимо присутствие активирующего 5-липоксигеназу белка (FLAP). Лейкотриен-А 4-гидролаза (LTA4H) катализирует гидролиз LTA4, приводящий к образованию лейкотрина В 4 (LTB4). Посредством связывания рецепторов LTB4(BLT1, BLT2) LTB4 стимулирует множество провоспалительных ответов (хемотаксис лейкоцитов, высвобождение цитокинов и т.п.). Путь лейкотрйена участвует в заболеваниях, в которых воспаление является критически важным компонентом патологии; такие заболевания включают рак, астму, атеросклероз,колит, гломерулонефрит и боль (обзор приведен в публикации М. Peters-Golden and W.R. Henderson, Jr.,M.D., N. Engl. J. Med., 2007, 357, 1841-1854). Краткое изложение сущности изобретения Настоящее изобретение относится к новым соединениям, которые ингибируют лейкотриен-А 4 гидролазу (LTA4H), поэтому они применимы для лечения различных заболеваний и нарушений, которые опосредуются или поддерживаются активностью лейкотриенов, включая аллергические заболевания,заболевания легких, фиброзные, воспалительные и сердечно-сосудистые заболевания, и рак. В одном варианте осуществления настоящее изобретение относится к соединению формулы (I) или к его фармацевтически приемлемой соли, в которойR2 и R3 все независимо выбраны из группы, включающей -Н и СН 3; А обозначает группу формулы -NR4R5, в которойR4 и R5 все независимо выбраны из группы, включающей -Н, -(С 1-С 6)алкил, -(С 3-С 6)циклоалкил, -(411-членный)гетероциклоалкил, -(С 6-С 10)арил и -(5-11-членный)гетероарил; где каждый из указанных выше -(С 1-С 6)алкилов, -(С 3-С 6)циклоалкилов, -(4-11-членных)гетероциклоалкилов, -(С 6-С 10)арилов и -(511-членных)гетероарилов указанных групп R4 и R5 необязательно независимо замещен 1-3 группами R6; где 2 группы R6, если они присоединены к одному и тому же атому углерода указанного -(С 1-С 6)алкила,могут связываться с образованием 3-6-членного кольца, необязательно содержащего от 1 до 3 гетероатомов и дополнительно необязательно замещенного 1-3 группами, выбранными из группы, включающей галоген, -ОН, (=O), -(С 1-С 6)алкил, -O(C1-С 6)алкил, -С(O)ОН, -С(O)(С 1-С 6)алкил и -C(O)NH2; или А обозначает (4-11-членное)N-гетероциклическое кольцо формулы В где указанное кольцо В может представлять собой неароматический 4-8-членный моноциклический радикал; мостиковый бициклический радикал; спироциклический радикал или 6-11-членный конденсированный бициклический радикал, который может являться неароматическим или содержать одно ароматическое кольцо, при условии, что ароматическое кольцо бициклического радикала, если оно содержится, не присоединено к метиленовому атому углерода в положении 1 соединения формулы (I); где указанное кольцо В может дополнительно содержать от 1 до 3 дополнительных кольцевых гетероатомов, независимо выбранных из группы, включающей N, О и S; где указанное кольцо В дополнительно может являться необязательно замещенным 1-3 группами,выбранными из группы, включающей галоген, -ОН, (=O), -С(O)ОН, -С(O)O-(С 1-С 6)алкил и -(С 1-С 6)алкил; и где L отсутствует или обозначает мостик, выбранный из числа -(C1-С 6)алкиленов;-1 023876 каждый R6 независимо выбран из группы, включающей галоген, -OR7, -CF3, -CN, -(С 1-С 6)алкил,-C(O)R7, -С(О)2R7, -C(O)N(R7)2, -N(R7)2, -NHC(O)R7, -NHC(O)N(R7)2, -S(O)2R7, -NH-S(O)2-R7, -(С 3 С 6)циклоалкил, -(4-11-членный)гетероциклоалкил, -(С 6-С 10)арил и -(5-11-членный)гетероарил; где каждый из указанных -(С 1-С 6)алкилов, -O(С 1-С 6)алкилов, -(С 3-С 6)циклоалкилов, -(4-11-членных)гетероциклоалкилов, -(С 6-С 10)арилов и -(5-11-членных)гетероарилов указанной группы R6 необязательно замещен, где это возможно, 1-3 группами, выбранными из группы, включающей галоген, -ОН, -CF3, -CN,(=O), -(С 1-С 6)алкил, -С(O)ОН, -С(O)O-(С 1-С 6)алкил, -NH2, -NH(C1-С 6)алкил, -NС 1-С 6)алкил)2, -S(O)2(С 1 С 6)алкил, -(С 3-С 6)циклоалкил, -(4-11-членный)гетероциклоалкил, -(С 6-С 10)арил и -(5-11-членный)гетероарил; и каждый R7 независимо выбран из группы, включающей -Н, -(С 1-С 6)алкил, -(C1-С 6)алкил, -(С 1 С 6)алкил-ОН, -(С 1-С 6)алкил-O-(С 1-С 6)алкил, -(С 3-С 6)циклоалкил, -(С 3-С 6)циклоалкил-ОН, -(4-11 членный)гетероциклоалкил, -(С 6-С 10)арил и -(5-11-членный)гетероарил. Настоящее изобретение также относится к фармацевтическим композициям, содержащим соединения формулы (I), способам применения этих соединений для лечения различных заболеваний и нарушений. Подробное описание изобретения Определения. ДХЭ = дихлорэтан,ДХМ = дихлорметан,ДЭА = диэтиламин,DIBAL-H = диизобутилалюминийгидрид,ДИПЭА = диизопропилэтиламин,ДМА = диметилацетамид,ДМАП = 4-диметиламинопиридин,ДМЭ = диметиловый эфир,ДМФ = диметилформамид,ДМСО = диметилсульфоксид,Et2O = этиловый эфир,EtOAc = этилацетат,EtOH = этанол,ИПС = изопропиловый спирт,KHMDS = бис(триметилсилил)амид калия,MeCN = ацетонитрил,МеОН = метанол,TBTU = 2-(1 Н-бензотриазол-1-ил)-1,1,3,3-тетраметилуронийтетрафторборат,ТЭА = триэтиламин,ТФК = трифторуксусная кислота,ТГФ = тетрагидрофуран,TMSCF3 = (трифторметил)триметилсилан. Следует понимать, что термины "соединения формулы (I)" и "соединения, предлагаемые в настоящем изобретении," обладают одним и тем же значением, если не указано иное. В наиболее широком варианте осуществления ("первый вариант осуществления настоящего изобретения") настоящее изобретение относится к соединениям формулы (I), описанным выше, и к их фармацевтически приемлемым солям, описанным выше в разделе "Краткое изложение сущности изобретения". В другом варианте осуществления ("второй вариант осуществления настоящего изобретения") настоящее изобретение относится к соединению формулы (I), описанному в первом варианте осуществления настоящего изобретения, или к его фармацевтически приемлемой соли, в которой группа А представляет собой группу формулы -NR4R5. В другом варианте осуществления ("третий вариант осуществления настоящего изобретения") настоящее изобретение относится к соединению формулы (I), описанному в первом варианте осуществления настоящего изобретения, или к его фармацевтически приемлемой соли, в которой группа А представляет собой (4-11-членное)N-гетероциклическое кольцо формулы В В другом варианте осуществления настоящее изобретение относится к соединению формулы (I),описанному во втором варианте осуществления настоящего изобретения, или к его фармацевтически приемлемой соли, в которой R4 обозначает -Н или -(С 1-С 6)алкил, и R5 обозначает -(С 1-С 6)алкил; где каждый -(С 1-С 6)алкил указанных групп R4 и R5, если он содержится, необязательно независимо замещен 1-3 группами R6. В другом варианте осуществления настоящее изобретение относится к соединению формулы (I),описанному в предыдущем варианте осуществления, или к его фармацевтически приемлемой соли, в ко-2 023876 торой R4 обозначает -Н или -(С 1-С 6)алкил, и R5 обозначает -(С 1-С 6)алкил; где указанный -(С 1-С 6)алкил указанной группы R5 замещен -(С 3-С 6)циклоалкилом, -(4-11-членным)гетероциклоалкилом, -(С 6 С 10)арилом или -(5-11-членным)гетероарилом; где каждый из указанных -(С 3-С 6)циклоалкилов, -(4-11 членных)гетероциклоалкилов, -(С 6-С 10)арилов и -(5-11-членных)гетероарилов необязательно замещен 1-3 группами, независимо выбранными из группы, включающей -(С 1-С 6)алкил, -CF3 и -C(O)OR8. В другом варианте осуществления настоящее изобретение относится к соединению формулы (I),описанному во втором варианте осуществления настоящего изобретения, или к его фармацевтически приемлемой соли, в которой R4 обозначает -Н или -(С 1-С 6)алкил, и R5 обозначает -(С 1-С 6)алкил; где указанный -(С 1-С 6)алкил указанной группы R5 независимо замещен 1-3 группами, выбранными из группы,включающей -(С 1-С 6)алкил, -O(С 1-С 6)алкил, -C(O)R8, -C(O)OR8, -S(O)2R8 и -NHC(O)R8. В другом варианте осуществления настоящее изобретение относится к соединению формулы (I),описанному во втором варианте осуществления настоящего изобретения, или к его фармацевтически приемлемой соли, в которой R4 и R5 все независимо выбраны из группы, включающей -Н или -(C1 С 6)алкил. В другом варианте осуществления настоящее изобретение относится к соединению формулы (I),описанному во втором варианте осуществления настоящего изобретения, или к его фармацевтически приемлемой соли, в которой R4 обозначает -Н или -(С 1-С 6)алкил, и R5 обозначает -(С 3-С 6)циклоалкил, -(411-членный)гетероциклоалкил, -(С 6-С 10)арил и -(5-11-членный)гетероарил; где каждая из указанных выше -(С 3-С 6)циклоалкильных, -(4-11-членных)гетероциклоалкильных, -(С 6-С 10)арильных и -(5-11 членный)гетероарильных групп указанной группы R5 необязательно независимо замещена 1-3 группами,выбранными из группы, включающей -(С 1-С 6)алкил, -О(С 1-С 6)алкил, -C(O)R8, -C(O)OR8, -S(O)2R8 и-NHC(O)R8. В другом варианте осуществления настоящее изобретение относится к соединению формулы (I),описанному в третьем варианте осуществления настоящего изобретения, или к его фармацевтически приемлемой соли, в которой указанное кольцо В представляет собой 4-8-членный моноциклический радикал. В другом варианте осуществления настоящее изобретение относится к соединению формулы (I),описанному в предыдущем варианте осуществления, или к его фармацевтически приемлемой соли, в которой указанный 4-8-членный моноциклический радикал выбран из группы, включающей азетидин, тетрагидропиррол, пиперидин, гексаметиленимин, 1,2-диазетидин, пиразолидин, имидазолидин, пиперазин,гексагидродиазепин, изоксазолидин, оксазолидин, тетрагидро-2 Н-1,3-оксазин, морфолин и гексагидро 1,4-оксазепин; где указанное моноциклическое кольцо дополнительно может являться необязательно замещенным 1-3 группами, выбранными из группы, включающей галоген, -ОН, (=O), -С(O)ОН, -С(O)O(С 1-С 6)алкил и -(С 1-С 6)алкил. В другом варианте осуществления настоящее изобретение относится к соединению формулы (I),описанному в третьем варианте осуществления настоящего изобретения, или к его фармацевтически приемлемой соли, в которой указанное кольцо В представляет собой спироциклический гетероциклический радикал. В другом варианте осуществления настоящее изобретение относится к соединению формулы (I),описанному в предыдущем варианте осуществления, или к его фармацевтически приемлемой соли, в которой указанный спироциклический гетероциклический радикал выбран из группы, включающей В другом варианте осуществления настоящее изобретение относится к соединению формулы (I),описанному в третьем варианте осуществления настоящего изобретения, или к его фармацевтически приемлемой соли, в которой указанное кольцо В может представлять собой мостиковый бициклический радикал или 6-11-членный конденсированный бициклический радикал, который может являться неароматическим или содержать одно ароматическое кольцо, при условии, что ароматическое кольцо бициклического радикала, если оно содержится, не присоединено к метиленовому атому углерода в положении 1 соединения формулы (I). В другом варианте осуществления настоящее изобретение относится к соединению формулы (I),описанному в предыдущем варианте осуществления, или к его фармацевтически приемлемой соли, в которой указанный 6-11-членный конденсированный бициклический радикал или мостиковый бициклический радикал выбран из группы, включающей В другом варианте осуществления настоящее изобретение относится к соединению формулы (I),описанному в третьем варианте осуществления настоящего изобретения, или к его фармацевтически приемлемой соли, в которой L обозначает -СН 2-. В другом варианте осуществления настоящее изобретение относится к соединению формулы (I),описанному в третьем варианте осуществления настоящего изобретения, или к его фармацевтически приемлемой соли, в которой L отсутствует. В другом варианте осуществления настоящее изобретение относится к соединению формулы (I),описанному в третьем варианте осуществления настоящего изобретения, или к его фармацевтически приемлемой соли, в которой указанное 4-8-членное гетероциклическое кольцо В выбрано из группы,включающей азетидинил, пирролидинил, пиперидинил и азепанил; где каждое из указанных выше азетидинильных, пирролидинильных, пиперидинильных и азепанильных колец необязательно замещено 1-3 группами, выбранными из группы, включающей галоген, -ОН, (=O), -С(O)ОН, С(O)O-(С 1-С 6)алкил и-(С 1-С 6)алкил; и где L отсутствует или обозначает мостик, выбранный из числа -(С 1-С 6)алкиленов; и гдеR6 выбран из группы, включающей галоген, -OR7 , -CF3, -CN, -(С 1-С 6)алкил, -C(O)R7, -С(О) 2R7,-C(O)N(R7)2, -N(R7)2, -NHC(O)R7, -NHC(O)N(R7)2, -S(O)2R7, -NH-S(O)2-R7 , -(С 3-С 6)циклоалкил, -(4-11 членный)гетероциклоалкил, -(C6-С 10)арил и -(5-11-членный)гетероарил; где каждый из указанных -(С 1 С 6)алкилов, -O(С 1-С 6)алкилов, -(С 3-С 6)циклоалкилов, -(4-11-членных)гетероциклоалкилов, -(С 6 С 10)арилов и -(5-11-членных)гетероарилов указанной группы R6 необязательно замещен, где это возможно, 1-3 группами, выбранными из группы, включающей галоген, -ОН, -CF3, -CN, (=O), -(С 1-С 6)алкил,-С(O)ОН, -С(O)O-(С 1-С 6)алкил, -NH2, -NH(C1-C6)алкил, -NC1-С 6)алкил)2, -S(O)2(С 1-С 6)алкил, -(С 3 С 6)циклоалкил, -(4-11-членный)гетероциклоалкил, -(С 6-С 10)арил и -(5-11-членный)гетероарил. В другом варианте осуществления настоящее изобретение относится к соединению формулы (I),описанному в любом из указанных выше вариантов осуществления, или к его фармацевтически приемлемой соли, в которой X обозначает N. В другом варианте осуществления настоящее изобретение относится к соединению формулы (I),описанному в любом из указанных выше вариантов осуществления, за исключением предыдущего варианта осуществления, или к его фармацевтически приемлемой соли, в которой X обозначает СН. Ниже приведены типичные соединения, предлагаемые в настоящем изобретении, которые получены в соответствии с общими схемами синтеза, примерами и по методикам, известным в данной области техники. Таблица 1 Типичные соединения, предлагаемые в настоящем изобретении В одном варианте осуществления настоящее изобретение относится к любому из соединений, приведенных в табл. 1, и их фармацевтически приемлемым солям. В другом варианте осуществления настоящее изобретение относится к соединению, выбранному из группы, включающей 4-(1-4-[(2S)-2,3-дигидро-1,4-бензодиоксин-2-ил]бензилпиперидин-4-ил)бутановую кислоту; 4-(1-4-[(3S)-2,3-дигидро[1,4]диоксино[2,3-b]пиридин-3-ил]бензилпиперидин-4-ил)бензойную кислоту;N-4-[(2S)-2,3-дигидро-1,4-бензодиоксин-2-ил]бензил-N,2-диметилпропан-2-амин; или фармацевтически приемлемой соли каждого из приведенных выше соединений. В другом варианте осуществления настоящее изобретение относится к соединению, выбранному из группы, включающей:[(3R)-1-4-[(2S)-2,3-дигидро-1,4-бензодиоксин-2-ил]бензилпиперидин-3-ил]уксусную кислоту; 1-4-[(2S)-2,3-дигидро-1,4-бензодиоксин-2-ил]бензил-4-(1,1-диоксидо-1,2-тиазолидин-2-ил)пиперидин и 1-4-[(3S)-2,3-дигидро[1,4]диоксино[2,3-b]пиридин-3-ил]бензил-N-(2-гидроксиэтил)пиперидин-4 карбоксамид; или фармацевтически приемлемой соли каждого из приведенных выше соединений. В другом варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей одно или большее количество соединений формулы (I), определенных в любом из указанных выше вариантов осуществления, или их фармацевтически приемлемых солей и фармацевтически приемлемый носитель или разбавитель. Все термины при использовании в описании настоящего изобретения, если не указано иное, следует понимать в их обычных значениях, известных в данной области техники. Другие более конкретные определения приведены ниже. Термин "(С 1-С 6)алкил" означает разветвленные или не разветвленные алкильные группы, содержащие от 1 до 6 атомов углерода. Примеры -(C1-С 6)алкилов включают метил, этил, н-пропил, изопропил, нбутил, втор-бутил, изобутил, трет-бутил, н-пентан, изопентил, неопентил, н-гексан, изогексаны (например, 2-метилпентил, 3-метилпентил, 2,3-диметилбутил и 2,2-диметилбутил). Следует понимать, что любой атом углерода (С 1-С 6)алкильной группы может являться положением присоединения к другой группе или фрагменту, если это возможно с химической точки зрения. Термин "(С 3-С 6)циклоалкил" означает неароматический 3-6-членный моноциклический карбоциклический радикал. Примеры "(С 3-С 6)циклоалкилов" включают циклопропил, циклобутил, циклогексил,- 19023876 циклопентил и циклогексил. При использовании в настоящем изобретении термин "(С 6-С 10)арил" означает ароматические углеводородные кольца, содержащие от 6 до 10 кольцевых атомов углерода и включает моноциклические кольца и бициклические кольца, где по меньшей мере одно из колец является ароматическим. Неограничивающие примеры С 6-С 10-арилов включают фенил, инданил, инденил, бензоциклобутанил, дигидронафтил, тетрагидронафтил, нафтил, бензоциклогептанил и бензоциклогептенил. При использовании в настоящем изобретении термин "4-11-членный гетероцикл" включает стабильный неароматический 4-8-членный моноциклический гетероциклический радикал или стабильный неароматический 6-11-членный конденсированный бициклический, мостиковый бициклический или спироциклический гетероциклический радикал. 4-11-Членный гетероцикл состоит из атомов углерода и одного или большего количества гетероатомов, предпочтительно от 1 до 4 гетероатомов, выбранных из группы, включающей азот, кислород и серу. Гетероцикл может быть насыщенным или частично ненасыщенным. Неограничивающие примеры неароматических 4-8-членных моноциклических гетероциклических радикалов включают тетрагидрофуранил, азетидинил, пирролидинил, пиранил, тетрагидропиранил, диоксанил, тиоморфолинил, 1,1-диоксо-16, -тиоморфолинил, морфолинил, пиперидинил, пиперазинил и азепинил. Неограничивающие примеры неароматических 6-11-членных конденсированных бициклических радикалов включают октагидроиндолил, октагидробензофуранил и октагидробензотиофенил. Неограничивающие примеры неароматических 6-11-членных мостиковых бициклических радикалов включают 2-азабицикло[2.2.1]гептанил, 3-азабицикло[3.1.0]гексанил и 3-азабицикло[3.2.1]октанил. Неограничивающие примеры неароматических 6-11-членных спироциклических гетероциклических радикалов включают 7-азаспиро[3,3]гептанил, 7-спиро[3,4]октанил и 7-азаспиро[3,4]октанил. При использовании в настоящем изобретении термин "5-11-членный гетероарил" включает ароматические 5-6-членные моноциклические гетероарилы и ароматические 7-11-членные гетероарильные бициклические кольца, где по меньшей мере одно из колец является ароматическим, где гетероарильное кольцо содержит 1-4 гетероатома, такие как N, О и S. Неограничивающие примеры 5-6-членных моноциклических гетероарильных колец включают фуранил, оксазолил, изоксазолил, оксадиазолил, пиранил,тиазолил, пиразолил, пирролил, имидазолил, тетразолил, триазолил, тиенил, тиадиазолил, пиридинил,пиримидинил, пиридазинил, пиразинил, триазинил и пуринил. Неограничивающие примеры 7-11 членных бициклических гетероарильных колец включают бензимидазолил, 1,3-дигидробензимидазол-2 он, хинолинил, дигидро-2 Н-хинолинил, изохинолинил, хиназолинил, индазолил, тиено[2,3d]пиримидинил, индолил, изоиндолил, индазолил, бензотриазолил, бензофуранил, бензопиранил, бензодиоксолил, бензоксазолил, бензотиазолил, пирроло[2,3-b]пиридинил и имидазо[4,5-b]пиридинил. Следует понимать, что если гетероциклил или гетероарил содержит кольцевой атом S, то такой кольцевой атом S может содержаться в кольце в его двухвалентной, четырехвалентной или шестивалентной форме, т.е. в виде -S-, -S(O)- или -S(O)2-. Каждый арил или гетероарил, если не указано иное, включает его частично или полностью гидрированные производные. Например, хинолинил может включать декагидрохинолинил и тетрагидрохинолинил, нафтил может включать его гидрированные производные, такие как тетрагидронафтил. Другие частично или полностью гидрированные производные арильных и гетероарильных соединений, описанных в настоящем изобретении, должны быть очевидны для специалиста с общей подготовкой в данной области техники. Термин "гетероатом" при использовании в настоящем изобретении следует понимать, как означающий атомы, отличающиеся от атомов углерода, такие как О, N и S. Термин "галоген" означает фтор, хлор, бром или йод. Символ означает положение присоединения группы R к фрагменту. Во всех алкильных группах или углеродных цепях один или большее количество атомов углерода могут необязательно быть заменены гетероатомами О, S или N, следует понимать, что, если N не является замещенным, то он представляет собой NH, также следует понимать, что в разветвленной или неразветвленной углеродной цепи гетероатомы могут заменять концевые атомы углерода или внутренние атомы углерода. Такие группы могут быть замещены, как это описано выше в настоящем изобретении,группами, такими как оксогруппа, что приводит к таким определениям, но не ограничивается только ими, как алкоксикарбонил, ацил, амидая группа и тиооксогруппа. Для всех соединений, раскрытых выше в настоящей заявке, в случае, если название будет противоречить структуре, следует понимать, что соединение определяется структурой. Соединения по изобретению могут использоваться в фармацевтических препаратах, содержащих в качестве активного вещества одно или большее количество соединений, предлагаемых в настоящем изобретении, или их фармацевтически приемлемых производных, необязательно в комбинации с обычными инертными наполнителями и/или носителями. Соединения, предлагаемые в настоящем изобретении, также включают их изотопно-меченые формы. Изотопно-меченая форма активного агента комбинации, предлагаемой в настоящем изобретении,идентична указанному активному агенту, но отличается тем, что один или большее количество атомов указанного активного агента заменены на атом или атомы, обладающие атомной массой или массовым числом, отличающимися от атомной массы или массового числа указанного атома, который обычно обнаруживается в природе. Примеры изотопов, которые имеются в продаже и которые можно включить в активный агент комбинации, предлагаемой в настоящем изобретении, по хорошо известным методикам,включают изотопы водорода, углерода, азота, кислорода, фосфора, фтора и хлора, например 2 Н, 3 Н, 13 С,14 С, 15N, 18 О, 17 О, 31 Р, 32 Р, 35S, 18F и 36Cl соответственно. Активный агент комбинации, предлагаемой в настоящем изобретении, его пролекарство или фармацевтически приемлемая соль любого из них, которые содержат один или большее количество указанных выше изотопов и/или других изотопов других атомов,входят в объем настоящего изобретения. Настоящее изобретение включает применение любых из описанных выше соединений, содержащих один или большее количество асимметрических атомов углерода, которые могут представлять собой рацематы и рацемические смеси, отдельные энантиомеры, смеси диастереоизомеров и отдельные диастереоизомеры. Изомеры следует понимать, как означающие энантиомеры и диастереоизомеры. Все такие изомерные формы этих соединений явно включены в настоящее изобретение. Каждый стереогенный атом углерода может находиться в R- или S-конфигурации, а соединение может включать комбинацию конфигураций. Некоторые из соединений, предлагаемых в настоящем изобретении, могут существовать более чем в одной таутомерной форме. Настоящее изобретение включает способы, в которых применяются все такие таутомеры. Соединениями, предлагаемыми в настоящем изобретении, являются только такие, которые предполагаются "химически стабильными", что должно быть очевидно для специалистов в данной области техники. Например, соединение, которое содержит "свободную валентность", или "карбанион" не является соединением, соответствующим способам, раскрытым в настоящем изобретении. Настоящее изобретение включает фармацевтически приемлемые производные соединений формулы (I). "Фармацевтически приемлемое производное" означает любую фармацевтически приемлемую соль или сложный эфир или любое другое соединение, которое после введения пациенту способно образовать(прямо или косвенно) соединение, применимое в настоящем изобретении, или его фармакологически активный метаболит, или фармакологически активный остаток. Фармакологически активный метаболит следует понимать, как означающий любое соединение, предлагаемое в настоящем изобретении, способное к ферментативному или химическому метаболизму. Он включает, например, гидроксилированные или окисленные производные соединений, предлагаемых в настоящем изобретении. Фармацевтически приемлемые соли включают соли, полученные из фармацевтически приемлемых неорганических и органических кислот и оснований. Примеры подходящих кислот включают хлористоводородную, бромисто-водородную, серную, азотную, хлорную, фумаровую, малеиновую, фосфорную,гликолевую, молочную, салициловую, янтарную, толуол-п-сульфоновую, винную, уксусную, лимонную,метансульфоновую, муравьиную, бензойную, малоновую, нафталин-2-сульфоновую и бензолсульфоновую кислоты. Другие кислоты, такие как щавелевая кислота, которые сами по себе не являются фармацевтически приемлемыми, можно использовать при получении солей, использующихся в качестве промежуточных продуктов при получении соединений и их фармацевтически приемлемых солей присоединения с кислотами. Соли, полученные из подходящих оснований, включают соли щелочного металла(например, натрия), щелочно-земельного металла (например, магния), аммония и N-(С 1-С 4-алкил)4+. Кроме того, в объем настоящего изобретения входит применение пролекарств соединений, предлагаемых в настоящем изобретении. Пролекарства включают такие соединения, которые после простого химического превращения изменяются с образованием соединений, предлагаемых в настоящем изобретении. Простые химические превращения включают гидролиз, окисление и восстановление. Точнее, если пролекарство вводится пациенту, то пролекарство может превратиться в соединение, раскрытое выше в настоящем изобретении, и тем самым обеспечить необходимое фармакологическое воздействие. Общие методики синтеза Соединения, предлагаемые в настоящем изобретении, можно получить по общим методикам, примеры которых приведены ниже, и методикам, известным специалистам с общей подготовкой в данной области техники и описанным в химической литературе. На каждой из представленных ниже схем группы R1 -R3 и А являются такими, как определено выше для соединения формулы (I), если не указано иное. Оптимальные условия проведения реакций и длительность реакций могут меняться в зависимости от конкретных использующихся реагентов. Если не указано иное, то растворители, температуры, давления и другие условия проведения реакций могут быть легко выбраны специалистом с общей подготовкой в данной области техники. Конкретные методики приведены в разделе "Примеры синтеза". На приведенной ниже схеме 1 представлена общая методика синтеза соединений формулы (I), в которой X обозначает СН ("бензодиоксановые ингибиторы LTAH4"). Схема 1 Общая схема синтеза бензодиоксановых ингибиторов LTAH4 На приведенной ниже схеме 2 представлена общая методика синтеза соединений формулы (I), в которой X обозначает N ("8-азабензодиоксановые ингибиторы LTAH4"). Схема 2 Общая схема синтеза 8-азабензодиоксановых ингибиторов На схемах 1 и 2 использующиеся исходные вещества и реагенты имеются в продаже или специалисты в данной области техники могут легко их получить по методикам, описанным в химической литературе и в приведенном ниже разделе "Примеры синтеза". Приведенные ниже примеры являются иллюстративными и, как понятно специалисту в данной области техники, конкретные реагенты или условия можно менять в соответствии с тем, что необходимо для конкретных соединений, без проведения слишком большого объема исследований. Примеры синтеза Общие методики. Если не указано иное, то все реакции проводят при комнатной температуре (примерно 25 С), в инертной атмосфере (например, аргон, N2) и в безводной среде. Все соединения характеризуют с помощью по меньшей мере одной из следующих методик: 1 Н ЯМР (ядерный магнитный резонанс), ВЭЖХ(высокоэффективная жидкостная хроматография), ВЭЖХ-МС (высокоэффективная жидкостная хроматография-масс-спектрометрия) и определение температуры плавления. Обычно за протеканием реакции следят с помощью тонкослойной хроматографии (ТСХ) или ВЭЖХ-МС. Промежуточные продукты и конечные продукты очищают с помощью по меньшей мере одной из следующих методик: флэш-хроматография на силикагеле; перекристаллизация; хиральная ВЭЖХ с использованием колонки Chiralpak AD-H 20500 мм или колонки Chiralpak ODH 20500 мм и при элюировании в изократическом режиме смесью изопропанола и гептанов с добавлением 0,1% диэтиламина (ДЭА) при 7,5 мл/мин,с использованием колонки Chiralpak OD-H 20500 мм и при элюировании в изократическом режиме смесью изопропанола и гептанов при 7,5 мл/мин; хиральная ВЭЖХ с надкритической жидкостью (НКЖ) с использованием колонки RegisPack 3,025,0 см при элюировании в изократическом режиме смесью МеОН, изопропиламина (ИПС) и надкритического диоксида углерода при 125 бар и 80 мл/мин; и/или ВЭЖХ с обращенной фазой с использованием полупрепаративной колонки С 18 при элюировании в градиентном режиме смесью MeCN+0,1% ТФК/Н 2 О+0,1% ТФК или смесью MeCN+0,1% муравьиной кислоты/Н 2 О+0,1% муравьиной кислоты. Приведены данные МС для найденных [М+Н]+. Для бромсодержащих соединений приведены[М+Н]+ для одного или двух изотопов брома (т.е. 79Br и 81Br). Методики ЖХ/МС (жидкостная хроматография/масс-спектрометрия), использующиеся для характеризации и выделения соединений, предлагаемых в настоящем изобретении, описаны в приведенных ниже табл. 2 а и 2b. Синтез промежуточных продуктов Получение (S)-4-(2,3-дигидробензо[1,4]диоксин-2-ил)бензальдегида (А) При перемешивании к раствору пирокатехина (23,8 г, 216 ммоль) в ацетоне (300 мл) при комнатной температуре добавляют карбонат цезия (84,4 г, 259 ммоль) и 2-бром-1-(4-бромфенил)этанон (60 г, 216 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 1 ч, затем добавляют воду (200 мл). Осадок отфильтровывают и растирают с EtOAc (150 мл) и получают А-1 в виде твердого вещества. К раствору А-1 (50,0 г, 163 ммоль) в безводном ТГФ (375 мл) добавляют уксусный ангидрид (23,0 мл, 244 ммоль), ТЭА (34,0 мл, 244 ммоль) и ДМАП (199 мг, 1,63 ммоль). Реакционную смесь перемешивают при 40 С в течение 45 мин, охлаждают до комнатной температуры и разбавляют с помощью EtOAc(250 мл). Органический раствор промывают водой (2100 мл), 0,25 н. раствором HCl (100 мл), насыщенным раствором бикарбоната натрия (100 мл) и рассолом (100 мл) и сушат над Na2SO4. После удаления летучего растворителя остаток растирают с 5% раствором EtOAc в гептане (1500 мл). Твердое вещество отфильтровывают и сушат на воздухе и получают А-2. К дегазированному ДМФ (500 мл) добавляют А-2 (41,0 г, 117 ммоль), (1S,2S)-(+)-N-(4 толуолсульфонил)-1,2-дифенилэтилендиамин (756 мг, 2,10 ммоль) и димер пентаметилциклопентадиенилродий(III)дихлорида (CpRhCl2) (319 мг, 0,520 ммоль). Полученную смесь перемешивают при 0 С в течение 20 мин, продувая ее аргоном, и по каплям обрабатывают комплексом муравьиная кислота/триэтиламин (5:2, 31 мл, 72 ммоль). Реакционную смесь перемешивают в атмосфере аргона при 0 С в течение 2 ч, разбавляют с помощью EtOAc (600 мл) и промывают разбавленным вдвое насыщенным раствором бикарбоната натрия, насыщенным раствором бикарбоната натрия и рассолом. Органический слой сушат над Na2SO4 и концентрируют. Остаток очищают путем пропускания через слой силикагеля (400 мл) при элюировании смесью EtOAc/гептан (1:1,3 л) и получают А-3 в виде твердого вещества. К раствору А-3 (24,6 г, 69,0 ммоль) в МеОН (125 мл) добавляют раствор LiOHН 2 О (5,8 г, 137 ммоль) в воде (125 мл). Смесь перемешивают при 60 С в течение 30 мин, охлаждают до комнатной температуры и концентрируют. Остаток разбавляют водой и нейтрализуют 1 н. водным раствором HCl до обеспечения значения рН, равного 6. Полученную смесь экстрагируют с помощью EtOAc (3150 мл). Объединенные органические экстракты промывают насыщенным раствором бикарбонат натрия, рассо- 24023876 лом, сушат над Na2SO4, фильтруют и концентрируют и получают А-4 в виде масла. При 0 С к раствору трифенилфосфина (32,7 г, 125 ммоль) и диизопропилазодикарбоксилата (24,7 мл, 125 ммоль) в ТГФ (безводный, 400 мл) в течение 30 мин добавляют раствор А-4 (35 г, 113 ммоль) в ТГФ (безводный, 200 мл). Полученный раствор нагревают до комнатной температуры, перемешивают в течение 1 ч и концентрируют. Остаток энергично перемешивают в гептане (1,8 л) в течение 2 ч. Осадок отфильтровывают и промывают гептаном. Фильтрат концентрируют и очищают с помощью колоночной флэш-хроматографии на силикагеле (0-10% EtOAc в гептане) и получают А-5 в виде твердого вещества. К дегазированному аргоном раствору А-5 (30,7 г, 105 ммоль) в ДМФ (безводный, 400 мл) добавляют Zn(CN)2 (12,4 г, 105 ммоль), трис(дибензилиденацетон)дипалладий(0) (Pd2(dba)3) (2,9 г, 3,2 ммоль) и 1,1'-бис(дифенилфосфино)ферроцен (dppf) (3,5 г, 6,3 ммоль). Полученную смесь продувают аргоном и перемешивают при 80 С в течение ночи. Реакционную смесь охлаждают до комнатной температуры и фильтруют через слой диатомовой земли и промывают с помощью EtOAc. Фильтрат разбавляют водой(400 мл) и экстрагируют с помощью EtOAc (2400 мл). Объединенные органические экстракты промывают рассолом и перемешивают с активированным углем (80 г). Через 30 мин смесь фильтруют через слой диатомовой земли и концентрируют. Остаток растирают с 2% раствором EtOAc в гептане (1 л) и фильтруют и получают А-6 в виде твердого вещества. Раствор А-6 (11,1 г, 46,7 ммоль) в ТГФ (безводный, 400 мл) при 0 С по каплям обрабатывают с помощью DIBAL-H (25 мас.% в толуоле, 77,8 мл, 117 ммоль). Реакционную смесь перемешивают при 0 С в течение 30 мин, нагревают до комнатной температуры и перемешивают в течение 2 ч. Реакционную смесь охлаждают до 0 С и реакцию останавливают с помощью EtOAc (250 мл), затем с помощью насыщенного раствора тартрата калия-натрия (400 мл). Смесь разбавляют с помощью EtOAc (300 мл) и водой(300 мл) и перемешивают в течение 30 мин. Органический слой отделяют и промывают водой, 1 н. раствором HCl и рассолом и сушат над Na2SO4. После фильтрования через слой диатомовой земли фильтрат концентрируют и очищают с помощью колоночной флэш-хроматографии на силикагеле (0-30% EtOAc в гептане) и получают искомый продукт в виде твердого вещества. Получение -4-(2,3-дигидробензо[1,4]диоксин-2-ил)бензальдегида (В)(295 мг, 7,80 ммоль). Реакционную смесь перемешивают в течение 14 ч, реакцию останавливают 1 н. раствором HCl (10 мл) и смесь концентрируют для удаления EtOH. Твердый остаток отфильтровывают,промывают водой сушат в вакууме и получают В-1 в виде твердого вещества. Искомый продукт синтезируют из В-1 по методике, описанной для синтеза А из А-4. Получение (S)-4-(2,3-дигидро-[1,4]диоксино[2,3-b]пиридин-3-ил)бензальдегида (С) К раствору 2-хлор-3-гидроксипиридина (25,0 г, 193 ммоль) и 2,4'-дибромацетофенона (53,6 г, 193 ммоль) в ацетоне (400 мл) добавляют Cs2CO3 (75,4 г, 232 ммоль) и суспензию перемешивают при комнатной температуре в течение 1 ч. Реакционную смесь при перемешивании выливают в 1 л воды. Фильтрование смеси дает С-1 в виде твердого вещества. Раствор С-1 (30,0 г, 91,9 ммоль), димера CpRhCl2 (0,57 г, 0,92 ммоль) и N-1R,2R)-2-амино-1,2 дифенилэтил)-4-метилбензолсульфонамида (1,0 г, 2,8 ммоль) в безводном ДМФ (400 мл) охлаждают до 0 С и продувают аргоном в течение 20 мин, затем по каплям добавляют смесь муравьиная кислота:ТЭА(смесь состава 5:2; 28,2 мл). Реакционную смесь перемешивают при 0 С в течение 1 ч, продувая аргоном. Реакционную смесь медленно при энергичном перемешивании добавляют к 1,5 л воды. Фильтрование(61,5 мл, 0,5 М в толуоле) и полученный раствор перемешивают в течение 30 мин. Реакционную смесь охлаждают до комнатной температуры, реакцию останавливают водой, смесь концентрируют в вакууме и экстрагируют с помощью EtOAc. Объединенные органические вещества промывают рассолом, сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают с помощью колоночной флэшхроматографии (0-40% EtOAc в гептанах) и получают С-3 в виде твердого вещества. К дегазированному раствору С-3 (5,50 г, 18,8 ммоль) в безводном ДМФ (100 мл) добавляют Zn(CN)2(2,2 г, 18,8 ммоль) и dppf (1,0 г, 1,9 ммоль), затем добавляют Pd2(dba)3 (0,86 г, 0,90 ммоль) и реакционную смесь нагревают при 80 С в течение ночи. Затем реакционную смесь охлаждают до комнатной температуры и перемешивают в течение 48 ч. Смесь фильтруют через слой диатомовой земли и фильтрат при энергичном перемешивании медленно выливают в 1 л воды. Полученное твердое вещество выделяют фильтрованием и очищают с помощью флэш-хроматографии на силикагеле (0-40% EtOAc в гептанах) и получают С-4 в виде твердого вещества. Раствор С-4 (3,5 г, 14,7 ммоль) в 125 мл ТГФ охлаждают до 0 С в бане со льдом. Через капельную воронку в течение 15 мин по каплям добавляют раствор 25 мл 1,5 М раствора DIBAL-H (36,7 ммоль, 2,5 экв.) в толуоле. Реакционную смесь перемешивают при 0 С в течение 30 мин и затем ей дают нагреться до комнатной температуры. Реакционную смесь перемешивают при комнатной температуре в течение 2 ч. Реакционную смесь охлаждают до 0 С и реакцию осторожно останавливают с помощью EtOAc (всего 200 мл), затем с помощью 100 мл воды и 400 мл насыщенного водного раствора соли Рошеле и смесь перемешивают в течение 5 мин. Всю смесь переносят в делительную воронку и слои разделяют. Водный слой дважды экстрагируют порциями по 100 мл EtOAc и экстракты объединяют и промывают 0,5 н. раствором HCl (100 мл). В кислом слое обнаруживают небольшое количество продукта. Кислый слой охлаждают до 0 С, нейтрализуют насыщенным раствором NaHCO3 и дважды экстрагируют с помощьюEtOAc. Органические слои объединяют, промывают рассолом и сушат над безводным Na2SO4 и выпаривают. Полученный остаток очищают с помощью флэш-хроматографии при элюировании смесью 0-80%EtOAc/гептан и получают искомое соединение в виде твердого вещества. Получение -4-(2,3-дигидро-[1,4]диоксино[2,3-b]пиридин-3-ил)бензальдегида (D) Соединение D-1 синтезируют из С-1 по методике, описанной для синтеза В-1. Искомое соединение синтезируют из D-1 по методике, описанной для синтеза С из С-2. Получение 2,2,2-трифтор-1-пиперидин-4-илэтанола (Е) Раствор Е-1 (500 мг, 2,00 ммоль) и триметил(трифторметил)силана (TMSCF3) (863 мг, 6,00 ммоль) в сухом ДМФ (2 мл) охлаждают до -25 С и обрабатывают 1,3-бис(1-адамантил)имидазол-2-илиденом (3,4 мг, 0,010 ммоль). Смесь нагревают до комнатной температуры, перемешивают в течение 1 ч и обрабатывают 2 н. раствором HCl (2 мл). После завершения обработки смесь нейтрализуют с помощью NaOH (5M,0,7 мл), концентрируют и очищают с помощью ВЭЖХ с обращенной фазой (градиентный режим, 10-90%MeCN/H2O) и получают Е-2 (ЖХ/МС, методика 1; Rt = 0,88 мин; ЭР+ (электрораспыление в режиме положительных ионов) m/z [M+H]+ 318,2). Смесь Е-2 (524 мг, 1,65 ммоль) и 10% палладия на угле (200 мг) в МеОН (16 мл) перемешивают в атмосфере Н 2 при комнатной температуре в течение 15 ч. Смесь фильтруют через диатомовую землю и фильтрующий слой промывают с помощью МеОН. Фильтрат концентрируют и получают искомый продукт. Получение 1,1,1,3,3,3-гексафтор-2-пиперидин-4-илпропан-2-ола (F) Раствор бензилового моноэфира пиперидин-1,4-дикарбоновой кислоты (1,0 г, 3,80 ммоль), 2,3,4,5,6 пентафторфенола (0,77 г, 4,18 ммоль) и дициклогексилкарбодиимида (0,86 г, 4,18 ммоль) в диоксане (12 мл) перемешивают при комнатной температуре в течение 16 ч. Смесь фильтруют и концентрируют в вакууме. Остаток очищают с помощью флэш-хроматографии (EtOAc/гептан) и получают F-2. К раствору F-2 (200 мг, 0,47 ммоль) в ДМЭ (1,0 мл) при -50 С добавляют TMSCF3 (139 мг, 0,98 моль) и тетраметиламмонийфторид (43 мг, 0,47 ммоль). Полученной смеси дают нагреться до комнатной температуры и ее перемешивают в течение 16 ч. Смесь концентрируют в вакууме и остаток очищают с помощью ВЭЖХ с обращенной фазой (30-95%, MeCN/вода) и получают F-3. Смесь F-3 (670 мг, 1,74 ммоль) и 10% палладия на угле (210 мг) в МеОН (17 мл) перемешивают в атмосфере Н 2 при комнатной температуре в течение 15 ч. Смесь фильтруют через диатомовую землю и фильтрующий слой промывают с помощью МеОН. Фильтрат концентрируют и получают искомый продукт (F). Получение гидрохлорида метилового эфира 4-метилпиперидинкарбоновой кислоты (I-1) При перемешивании к раствору трет-бутилового моноэфира 4-метилпиперидин-1,4-дикарбоновой кислоты (1,00 г, 4,10 ммоль) в МеОН (2 мл) добавляют HCl (5 мл, 4 М раствор в диоксане). Через 18 ч смесь выпаривают досуха, остаток растворяют в МеОН (3 мл) и раствор при перемешивании обрабатывают с помощью Et2O (45 мл). Полученное твердое вещество отфильтровывают и сушат и получают искомое соединение. Приведенные ниже промежуточные продукты также получают по методике, описанной для синтеза I-1 Синтез соединений формулы I. Общие методики А-Е (методики восстановительного аминирования). Пример общей методики А. Получение 8-[(S)-4-(2,3-дигидро-[1,4]диоксино[2,3-b]пиридин-3 ил)бензил]-2,8-диазаспиро[4.5]декан-1-она (пример 125) ТЭА (0,12 мл, 0,83 ммоль) добавляют к смеси соединения С (100 мг, 0,42 ммоль) и 2,8 диазаспиро[4.5]декан-1-онгидрохлорида (158 мг, 0,83 ммоль) в 2 мл ДХМ. Добавляют одну каплю уксусной кислоты и смесь перемешивают в течение 10 мин, добавляют ацетоксиборогидрид натрия (132 мг,0,83 ммоль) и полученную смесь перемешивают в течение 24 ч. Растворитель выпаривают и неочищенную смесь растворяют в 2 мл смеси MeCN/Н 2 О (1:1). Смесь очищают на колонке для полупрепаративной ВЭЖХ с обращенной фазой С 18 при элюировании в градиентном режиме смесью 0-95% MeCN/H2O и получают искомый продукт. Пример общей методики В. Получение трет-бутилового эфира -4-[4-(2,3-дигидробензо К раствору соединения В (100 мг, 0,420 ммоль) и трет-бутилового эфира пиперазин-1-карбоновой кислоты (93 мг, 0,50 ммоль) в ДХЭ (4 мл) добавляют уксусную кислоту (50 мг, 0,83 ммоль). Смесь перемешивают при комнатной температуре в течение 10 мин, обрабатывают триацетоксиборогидридом натрия (141 мг, 0,67 ммоль) и перемешивают при комнатной температуре в течение 16 ч. Реакционную смесь разбавляют насыщенным водным раствором бикарбоната натрия (5 мл) и экстрагируют с помощьюEtOAc (5 мл 3). Объединенные органические слои промывают рассолом, сушат над Na2SO4, фильтруют и концентрируют. Остаток очищают на колонке для полупрепаративной ВЭЖХ с обращенной фазой С 18 при элюировании в градиентном режиме смесью 5-85% MeCN+0,1% ТФК/Н 2 О+0,1% ТФК). Объединенные фракции концентрируют и подщелачивают насыщенным водным раствором бикарбоната натрия (5 мл) и экстрагируют с помощью EtOAc (5 мл 3). Объединенные органические фазы промывают рассолом,сушат над Na2SO4, фильтруют и концентрируют и получают искомый продукт. Пример общей методики С. Получение метилового эфира 4-1-[(S)-4-(2,3-дигидробензо Раствор соединения А (100 мг, 0,42 ммоль), гидрохлорида метилового эфира 4-пиперидин-4 илметилбензойной кислоты (146 мг, 0,54 ммоль), цианоборогидрида натрия (52 мг, 0,83 ммоль) и ТЭА(0,08 мл, 0,54 ммоль) в ТГФ (5 мл) обрабатывают с помощью 2 капель уксусной кислоты и перемешивают при комнатной температуре в течение 16 ч. Смесь концентрируют и остаток очищают с помощью флэш-хроматографии при элюировании в градиентном режиме с использованием 0-10% МеОН в ДХМ и получают искомое соединение. Пример общей методики D. Получение метиламида 1-[4-(2,3-дигидробензо[1,4]диоксин-2 ил)бензил]пиперидин-4-карбоновой кислоты (пример 25) Раствор соединения В (40 мг, 0,17 ммоль) и метиламида пиперидин-4-карбоновой кислоты (47,2 мг,0,332 ммоль) обрабатывают уксусной кислотой (0,01 мл). После встряхивания в течение 1 ч добавляют раствор триацетоксиборогидрида натрия (70,6 мг, 0,33 ммоль) в ДМА (0,5 мл) и полученную смесь встряхивают в течение ночи. Смесь концентрируют, разбавляют с помощью ДМСО (0,8 мл), фильтруют и очищают на колонке для полупрепаративной ВЭЖХ С 18 при элюировании в градиентном режиме смесью 5-85% MeCN+0,1% ТФК/Н 2 О+0,1% ТФК и получают искомое соединение. Пример общей методики Е. Получение метилового эфира 4-[(S)-4-(2,3-дигидробензо[1,4]диоксин 2-ил)бензиламино]метилбензойной кислоты Раствор соединения А (310 мг), метил-4-(аминометил)бензоатгидрохлорида (338 мг), цианоборогидрида натрия (162 мг) и ДИПЭА (0,3 мл) в МеОН (5 мл) обрабатывают с помощью 2 капель уксусной кислоты и полученную смесь перемешивают при комнатной температуре в течение 16 ч. Смесь концентрируют и остаток очищают с помощью флэш-хроматографии при элюировании в градиентном режиме с использованием 0-10% МеОН в ДХМ и получают искомое соединение. В табл. 3 приведен перечень ключевых реагентов, использующихся для получения соединений примеров 1-191 в соответствии с общими методиками А, В, С, D, Е или F, как показано на приведенной ниже схеме реакции. Таблица 3 Примеры соединений, синтезированные по общим методикам А, В, С, D, Е или F
МПК / Метки
МПК: C07D 487/12, C07D 405/10, C07D 319/20, C07D 487/10
Метки: лейкотриена, бензодиоксановые, ингибиторы, продуцирования
Код ссылки
<a href="https://eas.patents.su/30-23876-benzodioksanovye-ingibitory-producirovaniya-lejjkotriena.html" rel="bookmark" title="База патентов Евразийского Союза">Бензодиоксановые ингибиторы продуцирования лейкотриена</a>
Предыдущий патент: Подбивка для шпалоподбивочного агрегата
Следующий патент: Макет головы для медицинской подготовки хирургов и способ
Случайный патент: Способ приготовления катализатора на основе молекулярного сита