Соединение, представляющее собой антагонист лейкотриена b4
Формула / Реферат
1. Соединение формулы (I)
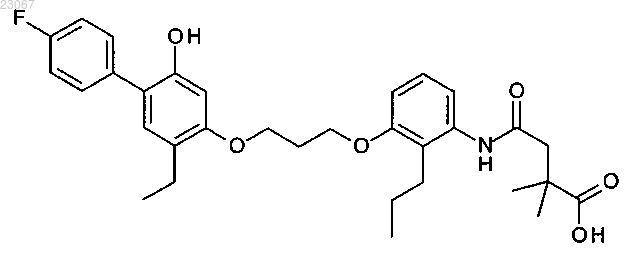
или его фармацевтически приемлемая соль.
2. Соединение по п.1, представляющее собой 4-[[3-[3-[2-этил-4-(4-фторфенил)-5-гидроксифенокси]пропокси]-2-пропилфенил]амино]-2,2-диметил-4-оксобутаноат натрия.
3. Фармацевтическая композиция, содержащая соединение по п.1 или 2 и фармацевтически приемлемый носитель.
Текст
СОЕДИНЕНИЕ, ПРЕДСТАВЛЯЮЩЕЕ СОБОЙ АНТАГОНИСТ ЛЕЙКОТРИЕНА B4 Согласно изобретению предложено соединение формулы (I) Стак Дуглас Ричард (US) Лыу Т.Н., Угрюмов В.М., Соболев А.Ю. (RU) или его фармацевтически приемлемая соль. Согласно изобретению также предложена фармацевтическая композиция, содержащая соединение формулы (I) или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. Согласно изобретению также предложены способы лечения аневризмы брюшной аорты или атеросклероза,включающие введение терапевтически эффективного количества соединения формулы (I),или его фармацевтически приемлемой соли, или фармацевтической композиции, содержащей фармацевтически приемлемый носитель и терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли.(71)(73) Заявитель и патентовладелец: ЭЛИ ЛИЛЛИ ЭНД КОМПАНИ (US) Лейкотриен В 4 (LTB4) представляет собой провоспалительный липидный медиатор семейства эйкозаноидов, который образуется в ходе нисходящих событий каскада ферментов 5-липоксигеназы и лейкотриен-A4-гидролазы. LTB4 активирует множество подклассов лейкоцитов, вызывая рекрутинг клеток,продукцию активных форм кислорода и индукцию экспрессии генов. LTB4 в основном передает сигнал через его высокоаффинный рецептор BLT1, связанный с G-белком, и в меньшей степени - через его низкоаффинный рецептор BLT2. Рецептор BLT1 экспрессируется на высоком уровне в специфических подклассах циркулирующих лейкоцитов периферической крови, а также на нелейкоцитарных клетках,включая эндотелиальные и гладкомышечные клетки. LTB4 вовлечен в сосудистую патологию при различных воспалительных состояниях, включая аневризму брюшной аорты (abdominal aortic aneurysm,AAA) и атеросклероз. Дегенеративное расстройство AAA характеризуется непрерывным прогрессированием воспаления стенки аорты, неконтролируемой локальной продукцией деструктивных протеаз, разрушением структурных белков и истощением медиальных гладкомышечных клеток медии. Ранняя или острая фаза начинается с привлечения воспалительных клеток. Повреждение происходит, когда локальный реактивный кислород, лейкотриены, хемокины и продукты разложения матрикса совместно активируют различные протеазные системы. Внеклеточный матрикс брюшной аорты также может быть ослаблен в результате избыточной деградации, что приводит к состоянию, называемому AAA. Участие накопления липидов в формировании атеросклеротической бляшки в интиме артерий точно установлено. Другим важным фактором в развитии атеросклероза является привлечение воспалительных клеток в область повреждения интимы. Бляшки, которые имеют высокое содержание как липидов,так и воспалительных клеток, легко поддаются разрывам и приводят к последующим событиям, включая инфаркт миокарда и ишемию головного мозга. В настоящее время AAA является десятой из основных причин смертности у людей старше 55 лет. Одобренного фармацевтического лечения, показанного для борьбы с AAA, не существует. Кроме того,несмотря на доступность способов фармацевтического лечения, направленных на борьбу с высоким уровнем холестерина и повышенным кровяным давлением, лечение атеросклероза остается нереализованной потребностью медицины. Более того, несмотря на перспективы применения антагонистов лейкотриена, таких как антагонисты, описанные согласно патенту США 5462954 и международной публикации WO 98/42346, ни один антагонист LTB4 не был одобрен для показания к применению при воспалении. Было показано, что соединения, представляющие собой антагонисты LTB4, также являются лигандами рецепторов, активируемых пролифераторами пероксисом (PPAR). Считается, что это ограничивает возможность их разработки в качестве противовоспалительных агентов. Антагонизм в отношенииLTB4 при отсутствии значительного связывания с PPAR удовлетворяет потребности медицины для лечения AAA, атеросклероза или обоих указанных заболеваний. Согласно настоящему изобретению предложено соединение формулы (I) или его фармацевтически приемлемая соль. Соединение формулы (I) имеет название 4-3-[3-[2 этил-4-(4-фторфенил)-5-гидроксифенокси]пропокси]-2-пропилфенил]амино]-2,2-диметил-4-оксобутановая кислота согласно функции создания названий по номенклатуре IUPAC программы Symyx Draw(версия 3,2.NET). Согласно второму аспекту настоящего изобретения предложена натриевая соль соединения формулы 1, которая представляет собой 4-3-[3-[2-этил-4-(4-фторфенил)-5-гидроксифенокси]пропокси]-2 пропилфенил]амино]-2,2-диметил-4-оксобутаноат натрия. Согласно третьему аспекту настоящего изобретения предложена фармацевтическая композиция,содержащая соединение формулы (I) или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель. Согласно четвертому аспекту настоящего изобретения предложена фармацевтическая композиция,содержащая 4-3-[3-[2-этил-4-(4-фторфенил)-5-гидроксифенокси]пропокси]-2-пропилфенил]амино]-2,2 диметил-4-оксобутаноат натрия и фармацевтически приемлемый носитель. Согласно пятому аспекту настоящего изобретения предложен способ лечения AAA, атеросклероза или обоих указанных заболеваний у нуждающегося в этом пациента, включающий введение указанному пациенту терапевтически эффективного количества соединения формулы (I), или его фармацевтически приемлемой соли, или фармацевтической композиции, содержащей фармацевтически приемлемый носитель и терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли. Согласно шестому аспекту настоящего изобретения предложен способ лечения AAA, атеросклероза или обоих указанных заболеваний у нуждающегося в этом пациента, включающий введение указанному пациенту терапевтически эффективного количества соединения 4-3-[3-[2-этил-4-(4-фторфенил)-5 гидроксифенокси]пропокси]-2-пропилфенил]амино]-2,2-диметил-4-оксобутаноата натрия или фармацевтической композиции, содержащей фармацевтически приемлемый носитель и терапевтически эффективное количество соединения 4-3-[3-[2-этил-4-(4-фторфенил)-5-гидроксифенокси]пропокси]-2 пропилфенил]амино]-2,2-диметил-4-оксобутаноата натрия. Согласно седьмому аспекту настоящего изобретения предложено соединение формулы (I) или его фармацевтически приемлемая соль для применения в терапии. Согласно восьмому аспекту настоящего изобретения предложено соединение, представляющее собой 4-3-[3-[2-этил-4-(4-фторфенил)-5-гидроксифенокси]пропокси]-2-пропилфенил]амино]-2,2-диметил 4-оксобутаноат натрия для применения в терапии. Согласно девятому аспекту настоящего изобретения предложено соединение формулы (I) или его фармацевтически приемлемая соль для применения для лечения AAA, атеросклероза или обоих указанных заболеваний. Согласно десятому аспекту настоящего изобретения предложено соединение 4-3-[3-[2-этил-4-(4 фторфенил)-5-гидроксифенокси]пропокси]-2-пропилфенил]амино]-2,2-диметил-4-оксобутаноат натрия для применения для лечения AAA, атеросклероза или обоих указанных заболеваний. Согласно одиннадцатому аспекту настоящего изобретения предложено применение соединения формулы (I) или его фармацевтически приемлемой соли для получения лекарственного средства для лечения AAA, атеросклероза или обоих указанных заболеваний. Согласно двенадцатому аспекту настоящего изобретения предложено применение соединения 4-3[3-[2-этил-4-(4-фторфенил)-5-гидроксифенокси]пропокси]-2-пропилфенил]амино]-2,2-диметил-4-оксобутаноата натрия для получения лекарственного средства для лечения AAA, атеросклероза или обоих указанных заболеваний. Согласно другому аспекту настоящего изобретения предложена фармацевтическая композиция, содержащая соединение формулы (I) или его фармацевтически приемлемую соль в комбинации с фармацевтически приемлемым носителем и, необязательно, один или более других терапевтических агентов. Согласно другому аспекту настоящего изобретения предложена фармацевтическая композиция, содержащая соединение 4-3-[3-[2-этил-4-(4-фторфенил)-5-гидроксифенокси]пропокси]-2-пропилфенил]амино]-2,2-диметил-4-оксобутаноат натрия в комбинации с фармацевтически приемлемым носителем и, необязательно, один или более других терапевтических агентов. Согласно другому аспекту настоящего изобретения предложено соединение формулы (I) или его фармацевтически приемлемая соль для применения для лечения AAA, или атеросклероза, или обоих указанных заболеваний. Согласно другому аспекту настоящего изобретения предложено соединение 4-3-[3-[2-этил-4-(4 фторфенил)-5-гидроксифенокси]пропокси]-2-пропилфенил]амино]-2,2-диметил-4-оксобутаноат натрия для применения для лечения AAA, или атеросклероза, или обоих указанных заболеваний. Согласно другому аспекту настоящего изобретения предложено применение соединения формулы(I) или его фармацевтически приемлемой соли для получения лекарственного средства для лечения AAA,или атеросклероза, или обоих указанных заболеваний. Согласно другому аспекту настоящего изобретения предложено применение соединения 4-3-[3-[2 этил-4-(4-фторфенил)-5-гидроксифенокси]пропокси]-2-пропилфенил]амино]-2,2-диметил-4-оксобутаноата натрия для получения лекарственного средства для лечения AAA, или атеросклероза, или обоих указанных заболеваний. В настоящей заявке выше и на всем протяжении описания изобретения следующие термины, если иное не указано, имеют следующие значения: Термин "аневризма брюшной аорты" (или "AAA") в настоящей заявке означает локальное расширение или вздутие брюшной аорты (считается, в целом, той части аорты, которая находится под диафрагмой) у млекопитающего, приводящее к тому, что размер, по меньшей мере, сегмента брюшной аорты превышает размер, который в противном случае считается нормальным состоянием и составляет 2 см. Брюшную аорту можно измерять и сравнивать в единицах любого измеряемого расстояния, включая, но не ограничиваясь указанными, внешний диаметр, диаметр просвета, периметр просвета и площадь просвета. Способы измерения и диагностики можно осуществлять с использованием ультразвука, компьютерной томографии или других методов визуализации. Например, человек страдает AAA, если внешний диаметр аорты составляет более 3 см. Если внешний диаметр аорты при этом составляет более 5 см, то стандартным лечением является немедленное восстановление хирургическим или эндоваскулярным путем (с помощью стента или трансплантата) для предотвращения разрыва и возможного летального исхода. Однако в случае, если указанное лечение недоступно или невозможно в связи с какой-либо причиной,например возрастом, то указанную популяцию людей можно также лечить с помощью настоящего изобретения. Термин "атеросклероз" в настоящей заявке относится к богатой липидами бляшке или повреждению в интиме артерий. Термин "нуждающийся в указанном лечении" в настоящей заявке относится к субъекту, который страдает состоянием или у которого диагностировано состояние (AAA или атеросклероз), требующее лечения. Термин "пациент" в настоящей заявке относится к млекопитающему, такому как собака, кошка,лошадь, корова, овца, свинья или человек. Термин "фармацевтически приемлемая соль" относится к солям соединений согласно настоящему изобретению. Примеры и способы их получения хорошо известны специалистам в данной области техники; см., например, Stahl et al., "Handbook of Pharmaceutical Salts: Properties, Selection and Use",VCHA/Wiley-VCH, 2002; S.M. Berge, et al., "Pharmaceutical Salts", Journal of Pharmaceutical Sciences, Vol. 66, No. 1, January 1977, p. 1-19. Конкретные фармацевтически приемлемые соли включают натриевые,калиевые, кальциевые и магниевые соли. Предпочтительная фармацевтически приемлемая соль согласно настоящему изобретению представляет собой натриевую соль. Термин "терапевтически эффективное количество" относится к количеству или дозе соединения формулы (I) или его фармацевтически приемлемой соли или композиции, содержащей соединение формулы (I) или его фармацевтически приемлемую соль, требуемой для достижения лечения. Предполагаемые дозы соединения формулы (I) или его фармацевтически приемлемой соли находятся в диапазоне от 60 до 1000 мг/пациент/сутки. Предполагается, что предпочтительные дозы находятся в диапазоне от 100 до 800 мг/пациент/сутки. Предполагается, что наиболее предпочтительные дозы находятся в диапазоне от 130 до 650 мг/пациент/сутки. Терапевтически эффективное количество может легко определить лечащий врач, например специалист в данной области техники, с учетом ряда факторов, известных специалисту в данной области техники, таких как, например, вес, рост, возраст, общее состояние здоровья пациента, тяжесть состояния, способ введения, режим дозирования и т.д. Несмотря на то что доза выражается в виде посуточной дозировки, режим дозирования можно адаптировать для достижения более оптимального терапевтического эффекта у пациента. Помимо ежедневного введения дозы может являться подходящим введение дозы два раза в день (BID) или три раза в день. Согласно настоящему изобретению режим дозирования BID считается предпочтительным. Термин "лечение" в настоящей заявке означает снижение скорости или прогрессирования заболевания. Он также может включать остановку заболевания. Термин также может включать не только остановку заболевания, но и снижение любого уже случившегося заболевания. Например, в контексте AAA термин "лечение" может означать снижение скорости распространения аневризмы брюшной аорты. Указанный термин также может включать остановку распространения аневризмы брюшной аорты. Кроме того, указанный термин может включать снижение любого распространения, которое уже произошло. В контексте атеросклероза термин "лечение" может означать замедление или остановку прогрессирования атеросклеротической бляшки. Указанный термин также может включать уменьшение существующей бляшки. Соединение согласно настоящему изобретению предпочтительно представлено в виде фармацевтической композиции и вводится различными способами. Предпочтительно такие композиции представляют собой композиции для перорального введения. Примеры и способы их получения хорошо известны специалистам в данной области техники; см., например, Remington: The Science and Practice of Pharmacy(A. Gennaro, et ah, eds. 19th ed., Mack Publishing Co., 1995). Соединение согласно настоящему изобретению и его фармацевтически приемлемые соли могут быть получены с помощью различных способов, известных в данной области техники, а также описанных в схемах, примерах и примерах получения ниже. Однако следующее далее описание никоим образом не ограничивает объем настоящего изобретения. Например, конкретные этапы синтеза для каждого из описанных способов можно комбинировать различным образом между собой или с этапами из других схем для получения соединений и фармацевтически приемлемых солей согласно настоящему изобретению. На схеме 2 показан альтернативный способ синтеза соединения согласно настоящему изобретению. Следующие примеры получения и примеры дополнительно иллюстрируют изобретение и предоставляют типичный способ синтеза соединения формулы (I), включая любые новые промежуточные соединения. Реагенты и исходные материалы легко доступны специалисту в данной области техники или могут быть получены с помощью способов, выбранных из стандартных методов органической и гетероциклической химии, методов, аналогичных способам синтеза известных структурно подобных соединений, а также способов, описанных в приведенных ниже примерах, включая любые новые способы. Примеры известных методик и способов включают методики и способы, описанные в тексте общих ссылок, таких как Comprehensive Organic Transformations, VCH Publishers Inc, 1989; Compendium of Organic Synthetic Methods, Volumes 1-10, 1974-2002, Wiley Interscience; Advanced Organic Chemistry, Reactions Mechanisms, and Structure, 5th Edition, Michael B. Smith and Jerry March, Wiley Interscience, 2001; Advanced Organic Chemistry, 4th Edition, Part B, Reactions and Synthesis, Francis A. Carey and Richard J.Sundberg, Kluwer Academic/Plenum Publishers, 2000, etc. и ссылки, цитируемые в настоящей заявке. Наименование следующих примеров получения и примеров в целом осуществляли по номенклатуреIUPAC с помощью программы Symyx Draw (версия 3,2.NET). Для точной идентификации примеров получения и соединений формулы (I) могут использоваться альтернативные названия, полученные с по-3 023067 мощью других способов наименования. В настоящей заявке следующие далее термины имеют указанные значения: "Bn" означает бензил; На схеме 1 показано образование промежуточного соединения 2-пропиланилина (6). На этапе 1 метил-3-гидрокси-2-пропилбензоат (2) алкилируют с помощью 1-бензилокси-5-(3 хлорпропокси)-4-этил-2-(4-фторфенил)бензола (1) (полученного в соответствии с источником Org. Process Res. Dev. (2009), 13: 268-275) с получением метилпропоксибензоата (3). Специалисту в данной области техники очевидно, что различные условия реакции могут оказывать эффект, например алкилирование. Например, реакцию можно проводить в инертном растворителе, таком как ДМСО, в присутствии N,Nдиметилпиридин-4-амина с использованием карбоната калия в качестве основания в течение от 2 до 4 дней при температуре примерно от 50 до 90C. Альтернативно, реакцию можно проводить в ДМФА в присутствии йодида калия с использованием неорганического основания, такого как карбонат калия или предпочтительно карбонат цезия. Реакцию осуществляют при температуре от 50 до 110C в течение от 8 до 24 ч. Другие основания, которые могут применяться, включают, например, гидрид натрия. На этапе 2 метилбензоат (3) гидролизуют до бензойной кислоты (не показано) с помощью KOH вN-метилпирролидоне при температуре от 90 до 140C. Затем на этапе 3 проводят обработку тионилхлоридом с получением ацилгалогенида и реакцию с гидроксидом аммония с получением бензамида (4). На этапе 4 бензамид (4) подвергают перегруппировке Гофмана с получением изоцианата, который в присутствии MeOH в качестве растворителя приводит к получению карбамата (5). Реакцию проводят в присутствии основания, такого как 1,8-диазабицикло[5,4,0]ундец-7-ен (DBU), и бромирующего агента,такого как N-бромсукцинимид, NBS. Используемый растворитель представляет собой MeOH, и реакция продолжается при температуре от -10 до 10C в течение от 12 до 30 ч. На этапе 5 карбамат (5) гидролизуют до 2-пропиланилина (6) с использованием твердого гидроксида калия в инертном растворителе, таком как N-метилпирролидон, при температуре от 90 до 140C в течение от 1 до 8 ч. Метил-3-гидрокси-2-пропилбензоат (2) получают из 2,3-диметоксибензойной кислоты. Бензойную кислоту превращают в трет-бутил-2,3-диметоксибензоат через ацилгалогенид. Обработка реактивом Гриньяра - хлоридом пропилмагния - приводит к замещению ортометоксигруппы с получением третбутил-3-метокси-2-пропилбензоата. В результате удаления защитной группы с помощью BBr3 получают 3-гидрокси-2-пропилбензойную кислоту, которую затем этерифицируют с получением метил-3 гидрокси-2-пропилбензоата (6). Альтернативный способ синтеза, начиная с 3-бензилоксибензальдегида,можно найти в литературе (Bioorg. Med. Chem. 1998, 6, 595-604). Схема 2 На схеме 2 показано получение промежуточного соединения 2-аллиланилина (10). На этапе 1 N-3(-аллилоксифенил)ацетамид (7) подвергают перегруппировке Кляйзена с получениемN-(2-аллил-3-гидроксифенил)ацетамида (8). Реакцию проводят в инертном растворителе с высокой температурой кипения, таком как диметиланилин, при температуре обратной конденсации растворителя в течение от 12 до 24 ч. На этапе 2 N-(2-аллил-3-гидроксифенил)ацетамид (8) алкилируют с помощью бензилокси-5-(3 хлорпропокси)-4-этил-2-(4-фторфенил)бензола (1) с получением феноксиацетамида (9) с использованием условий, описанных ранее для схемы 1, этапа 1. На этапе 3 феноксиацетамид (9) гидролизуют с получением 2-аллиланилина (10). Реакцию продолжают в смеси растворителей 6 н. HCl/этанол при температуре от 50C до температуры обратной конденсации растворителя в течение примерно от 1 до 12 ч.N-3(-Аллилоксифенил)ацетамид (7) получают путем алкилирования ацетамидофенола с помощью 3-йодпропена. Схема 3 На схеме 3 показан синтез соединения согласно изобретению (13). На этапе 1 анилин формулы (11) (Y=аллил или пропил) ацилируют 3,3-диметилтетрагидрофуран 2,5-дионом с получением амида (12). Реакцию проводят в инертном растворителе, таком как дихлорметан или ТГФ. Можно добавлять органическое основание, такое как N-метилморфолин или диизопропилэтиламин. Реакция продолжается при температуре от 10 до 40C в течение от 6 до 72 ч. На этапе 2 бензильную защитную группу соединения (12) удаляют путем гидрогенизации с получением соединения согласно изобретению (13). Реакция продолжается в атмосфере водорода в присутствии 5 или 10% палладиевого катализатора на углеродном носителе в растворителе или смеси растворителей,таких как ТГФ, EtOH/ТГФ, EtOH, MeOH или EtOAc/MeOH. Если Y=аллил, то аллильную группу восстанавливают до пропильной группы в условиях реакции. При желании продукт можно превратить в карбоксилат натрия с использованием водного раствора NaOH (1 экв.) и путем концентрирования в вакууме. Пример получения 1. трет-Бутил 2,3-диметоксибензоат К раствору 2,3-диметоксибензойной кислоты (132 г, 714 ммоль) и ДМФА (1,32 мл) в толуоле (528 мл), который поддерживали при температуре 40C, добавляли по каплям тионилхлорид (67,6 мл, 928 ммоль). После заверения добавления раствор перемешивали в течение 1 ч при температуре 40C. Смесь концентрировали в вакууме и осадок растворяли в дихлорметане (528 мл). Полученную смесь нагревали до температуры обратной конденсации и добавляли трет-бутиловый спирт (203,4 мл). Добавляли по каплям пиридин (86,6 мл) в течение 5 мин, затем добавляли N,N-диметилпиридин-4-амин (4,36 г, 35,7 ммоль) и полученную смесь перемешивали в течение 1 ч по мере охлаждения до температуры окружающей среды. Смесь разбавляли водой (200 мл) и закисляли (pH=2) с помощью 2 н. соляной кислоты. Фазы разделяли и органическую фазу промывали 0,5 н. соляной кислотой (230 мл). Органическую фазу промывали 15% раствором карбоната калия, водой и солевым раствором. Указанную органическую фазу концентрировали в вакууме с получением указанного в заголовке соединения (141,2 г, 83%) в виде твердого вещества белого цвета. ИЭР/МС m/z 165 [М-(С 4 Н 9 О)]+. Пример получения 2. трет-Бутил-3-метокси-2-пропилбензоат К охлажденному раствору (-34C) трет-бутил-2,3-диметоксибензоата (171 г, 718 ммоль) в ТГФ (855 мл) добавляли по каплям 2 М хлорид пропилмагния в эфире (448,5 мл, 897 ммоль) со скоростью, достаточной для поддержания внутренней температуры ниже -10C. Смесь перемешивали в течение 3,5 ч при поддержании температуры около -12C. К указанной смеси добавляли по каплям уксусную кислоту (51,4 мл) при поддержании температуры ниже -10C и затем полученную смесь разбавляли водой (340 мл). Фазы разделяли и водную фазу экстрагировали метил-трет-бутиловым эфиром (3100 мл). Объединен-5 023067 ные органические экстракты промывали солевым раствором и органическую фазу концентрировали в вакууме с получением указанного в заголовке соединения (190 г, количественный выход) в виде бесцветного масла, содержащего следовые количества ТГФ и метил-трет-бутилового эфира. 1H ЯМР (300 МГц, CDCl3)7,24-7,14 (m, 2 Н); 6,93 (dd, J=1,4, 8,0 Гц, 1 Н); 3,82 (s, 3H); 2,84-2,79 (m, 2H); 1,59 (m, 11H); 0,97 (t, J=7,4 Гц, 3H). Пример получения 3. 3-Гидрокси-2-пропилбензойная кислота К раствору трет-бутил-3-метокси-2-пропилбензоата (61,2 г, 244 ммоль) в толуоле (428 мл), охлажденному до -25C, добавляли по каплям трехбромистый бор (305,6 мл, 305,6 ммоль) при поддержании температуры ниже 0C. Перемешивали при -5C в течение 3 ч. Добавляли по каплям воду (100 мл), повышая температуру до 7C, и перемешивали в течение 30 мин. Смесь концентрировали в вакууме и затем полученное полутвердое вещество суспендировали в воде (200 мл). Перемешивали в течение 1 ч и суспензию фильтровали через стеклообразную фритту. Собранное твердое вещество промывали водой и твердое вещество сушили с получением указанного в заголовке соединения (43,1 г, 98%). 1H ЯМР (300 МГц, CDCl3)7,58 (d, J=8,0 Гц, 1 Н); 7,16 (t, J=8,0 Гц, 1H); 6,99 (d, J=7,7 Гц, 1H); 5,0 (bs, 2 H); 2,98 (t,J=7,7 Гц, 2H), 1,64 (m, 2H); 1,02 (t, J=7,4 Гц, 3H). Пример получения 4. Метил-3-гидрокси-2-пропилбензоат Раствор 3-гидрокси-2-пропилбензойной кислоты (59,79 г, 332 ммоль) в MeOH (598 мл) охлаждали до -10C и добавляли тионилхлорид (36,26 мл, 497,1 ммоль) с помощью шприцевой помпы в течение 35 мин. Смеси позволяли нагреваться до температуры окружающей среды при перемешивании в течение 35 ч. Смесь концентрировали в вакууме и осадок разбавляли метил-трет-бутиловым эфиром (360 мл). Полученную смесь концентрировали в вакууме до высыхания с получением указанного в заголовке соединения (64,4 г, 87%) в виде твердого вещества рыжеватого цвета. 1H ЯМР (300 МГц, CDCl3)7,38 (dd, J=8,0,0,8 Гц, 1 Н); 7,10 (t, J=8,0 Гц, 1 Н); 6,93 (dd, J=8,0,0,8 Гц, 1H); 5,1 (bs, 1 H); 3,89 (s, 3H); 2,98 (m, 2H), 1,61 К раствору метил-3-гидрокси-2-пропилбензоата (40,0 г, 206 ммоль) и 1-бензилокси-5-(3 хлорпропокси)-4-этил-2-(4-фторфенил)бензола (82,15 г, 206 ммоль), полученного в соответствии с литературным источником Org. Process Res. Dev. (2009), 13: 268-275, в диметилсульфоксиде (240 мл) добавляли последовательно карбонат калия (30,2 г, 219 ммоль) и N,N-диметилпиридин-4-амин (2,0 г, 16 ммоль). Суспензию перемешивали в течение 87 ч при 60C и затем указанной суспензии позволяли охлаждаться. Полученную смесь разбавляли водой (600 мл) и метил-трет-бутиловым эфиром (100 мл) и перемешивали в течение 15 мин. Фазы разделяли и водную фракцию промывали метил-трет-бутиловым эфиром (330 мл). Объединенные органические экстракты промывали водой и солевым раствором. Органическую фракцию концентрировали в вакууме с получением указанного в заголовке соединения(119 г, 181 ммоль) в N-метилпирролидоне (476 мл) добавляли гидроксид калия (21,2 г, 378 ммоль) и пе-6 023067 ремешивали в течение 25 мин при температуре 120C. Смеси позволяли охлаждаться и затем указанную смесь разбавляли водой (240 мл) и метил-трет-бутиловым эфиром (100 мл). Значение pH доводили до pH 2,5 с помощью 12 н. соляной кислоты. Фазы разделяли и водную фазу промывали метил-трет-бутиловым эфиром (335 мл). Объединенные органические экстракты дважды промывали водой и один раз солевым раствором. Органические экстракты концентрировали в вакууме. Полученный осадок перекристаллизовывали из ацетонитрила, фильтровали и сушили с получением (78 г, 67%) в виде твердого вещества белого цвета. 1H ЯМР (300 МГц, CDCl3)7,60-7,47 (m, 3H); 7,37-7,20 (m, 6H); 7,12-7,02 (m, 4H); 6,60 (s,1H); 5,00 (s, 2 Н); 4,20 (m, 4 Н); 3,00 (m, 2 Н); 2,61 (q, J=7,7 Гц, 2 Н); 2,33 (m, 2H); 1,59 (m, 2H); 1,18 (t, J=7,7 Гц, 3H); 0,98 (t, J=7,7 Гц, 3H). Пример получения 7. 3-[3-[5-Бензилокси-2-этил-4-(4-фторфенил)фенокси]пропокси]-2 пропилбензамид К раствору 3-[3-[5-бензилокси-2-этил-4-(4-фторфенил)фенокси]пропокси]-2-пропилбензойной кислоты (50,0 г, 92 ммоль) и ДМФА (2,5 мл, 32 ммоль) в ТГФ (250 мл) добавляли по каплям тионилхлорид(8,22 мл, 113 ммоль). Перемешивали в течение 1 ч и затем полученную реакционную смесь добавляли к раствору гидроксида аммония (102,5 мл, 1,52 моль) при 0-5C. Добавляли по каплям MeOH (250 мл) и воду (500 мл). Концентрировали в вакууме до примерно половины объема и полученную суспензию перемешивали в течение 30 мин при 0-5C. Суспензию фильтровали через стеклообразную фритту и полученное твердое вещество сушили в вакууме с получением указанного в заголовке соединения (50,3 г,количественный выход) в виде твердого вещества не совсем белого цвета. ИЭР/МС m/z 542 (M+1). Пример получения 8. Метил-N-[3-[3-[5-бензилокси-2-этил-4-(4-фторфенил)фенокси]пропокси]-2 пропилфенил]карбамат(62,0 г, 114 ммоль) в MeOH (620 мл) при ее механическом перемешивании последовательно добавляли 1,8-диазабицикло[5,4,0]ундец-7-ен (51,6 мл, 345 ммоль) и N-бромсукцинимид (34,6 г, 194 ммоль) в течение 1 мин, при этом температура повышалась от -4,1 до -3,2C. Реакционную смесь перемешивали при температуре от -5 до -10C в течение 22 ч. Добавляли по каплям раствор бисульфита натрия (25,1 г, 209 ммоль, в 25 мл воды) при перемешивании. Добавляли по каплям воду (620 мл) и перемешивали в течение 30 мин при 10C. Суспензию фильтровали через стеклообразную фритту, собранное твердое вещество промывали водой и сушили в вакууме с получением указанного в заголовке соединения (65,8 г, количественный выход) в виде порошка не совсем белого цвета. ИЭР/МС m/z 572 (M+1). Пример получения 9. Гидрохлорид 3-[3-[5-Бензилокси-2-этил-4-(4-фторфенил)фенокси]пропокси]2-пропиланилина К раствору метил-N-[3-[3-[5-бензилокси-2-этил-4-(4-фторфенил)фенокси]пропокси]-2-пропилфенил]карбамата (65,8 г, 115 ммоль) в N-метилпирролидоне (203 мл) добавляли гидроксид калия (12,97 г,231 ммоль) и перемешивали при 110-120C в течение 2 ч. Полученной смеси позволяли охлаждаться и затем выливали ее в смесь воды (450 мл) и метил-трет-бутилового эфира (180 мл). Смесь перемешивали в течение 20 мин и фазы разделяли. Водную фазу экстрагировали дополнительной порцией метил-третбутилового эфира (350 мл). Объединенные органические экстракты фильтровали через стеклообразную фритту и фильтрат промывали 15% солевым раствором. Указанный фильтрат концентрировали в вакууме и осадок растворяли в смеси этилацетата (300 мл) и метил-трет-бутилового эфира (300 мл). К указанному раствору добавляли по каплям 4 н. раствор соляной кислоты (43,1 мл) при перемешивании и охлаж-7 023067 дении полученной суспензии с помощью ледяной/соляной бани. Твердое вещество собирали посредством фильтрования через стеклообразную фритту, промывали холодным метил-трет-бутиловым эфиром и сушили в вакууме с получением указанного в заголовке соединения (57,8 г, 91%) в виде твердого вещества не совсем белого цвета. ИЭР/МС m/z 514 (M+1, свободное основание). Пример получения 10. 4-3-[3-[5-Бензилокси-2-этил-4-(4-фторфенил)фенокси]пропокси]-2 пропилфенил]амино]-2,2-диметил-4-оксобутановая кислота К суспензии гидрохлорида 3-[3-[5-бензилокси-2-этил-4-(4-фторфенил)фенокси]пропокси]-2 пропиланилина (90 г, 175 ммоль) в ТГФ (450 мл) добавляли диизопропилэтиламин (57 мл, 327 ммоль). К полученной смеси добавляли дигидро-3,3-диметил-2,5-фурандион (32,1 г, 251 ммоль) и перемешивали при 35C до тех пор, пока с помощью ЖХ/МС не показывали, что осталось 5% исходного материала. Смесь концентрировали в вакууме и добавляли метил-трет-бутиловый эфир (100 мл) и воду (75 мл). Значение pH доводили до pH 2-3 с помощью фосфорной кислоты и слои разделяли. Водный слой промывали дополнительной порцией метил-трет-бутилового эфира (250 мл). Объединенные органические экстракты промывали солевым раствором и концентрировали в вакууме. Неочищенный осадок растворяли в метил-трет-бутиловым эфире (180 мл) и добавляли гексан (450 мл) с получением суспензии и перемешивали в течение 30 мин. Суспензию собирали посредством фильтрования и сушили с получением указанного в заголовке соединения (92,5 г, 88%) в виде твердого вещества белого цвета. ИЭР/МС m/z 642 (M+1). Пример 1. 4-3-[3-[2-Этил-4-(4-фторфенил)-5-гидроксифенокси]пропокси]-2-пропилфенил]амино]2,2-диметил-4-оксобутановая кислота Суспензию 10% палладия на угле (50% влажность, содержание воды по массе) (13 г) и 4-3-[3-[5 бензилокси-2-этил-4-(4-фторфенил)фенокси]пропокси]-2-пропилфенил]амино]-2,2-диметил-4-оксобутановой кислоты (260 г, 405 ммоль) в ТГФ (1560 мл) гидрогенизировали при начальном давлении водорода 900 фунт/кв.дюйм. Продолжали гидрогенизацию в течение 20 ч без дополнительного добавления водорода. Гидрогенизировали в течение еще двух дней при поддержании давления водорода 200 фунт/кв.дюйм. Смесь фильтровали через диатомит и фильтрат концентрировали в вакууме с получением указанного в заголовке соединения (251 г, количественный выход) в виде твердого вещества (избыточная масса связана с присутствием ТГФ). ИЭР/МС m/z 552 (M+1). Пример 2. 4-3-[3-[2-Этил-4-(4-фторфенил)-5-гидроксифенокси]пропокси]-2-пропилфенил]амино]2,2-диметил-4-оксобутаноат натрия. К раствору 4-3-[3-[2-этил-4-(4-фторфенил)-5-гидроксифенокси]пропокси]-2-пропилфенил]амино]2,2-диметил-4-оксобутановой кислоты (223 г, 404 ммоль) в ТГФ (1115 мл) добавляли по каплям 1 н. гидроксид натрия (404 мл) и перемешивали при комнатной температуре в течение 15 мин. Объем уменьшали в вакууме и добавляли воду (1300 мл). Удаляли дополнительную порцию растворителя с помощью мембранного насоса во избежание нагрева раствора с получением конечного объема 1250 мл. Оставшийся раствор лиофилизировали отдельными порциями с получением указанного в заголовке соединения(230 г, 99%) в виде твердого вещества не совсем белого цвета. ИЭР/МС m/z 552 (M+1, свободное основание). Данные исследования на животных все более очевидно указывают на участие пути синтеза лейкотриена в хронических воспалительных заболеваниях, включая атеросклероз и AAA; см. Poeckel, et al. Cardiovascular Research (2010), 86: 243-253. Атеросклероз представляет собой состояние, при котором образуется атеросклеротическая бляшка или повреждение и встраивается в интиму артерий. Атеросклероз представляет собой хронический воспалительный ответ стенок артерий, который вызван главным образом накоплением лейкоцитов крови - макрофагов - и поддерживается липопротеинами низкой плотности в отсутствие надлежащего удаления жиров и холестерина из макрофагов функциональными липопротеинами высокой плотности. Артерия воспаляется. LTB4 играет проатерогенную роль в атеросклерозе в связи его способностью обеспечивать адгезию и хемотаксис лейкоцитов через эндотелий; см. Back, CurrentRosenfeld, Arterioscler. Thromb. Vasc. Biol. (2002) 22: 361-363. Холестериновые бляшки приводят к увеличению мышечных клеток и образованию ими плотного покрытия на поврежденном участке; см. Span-8 023067broek et al. PNAS, (2003), 100(3): 1238-1243. Стабильные атеросклеротические бляшки, которые имеют тенденцию протекать бессимптомно, богаты внеклеточным матриксом и гладкомышечными клетками. Нестабильные бляшки богаты макрофагами и пенистыми клетками, и внеклеточный матрикс, отделяющий участок повреждения от просвета артерии (фиброзное утолщение), как правило, является слабым и склонным к разрыву. Разрывы фиброзного утолщения приводят к попаданию в кровоток тромбогенного материала, такого как коллаген, и, в конце концов, вызывают образование тромба в просвете. Образовавшийся внутри просвета тромб может полностью закупоривать артерии или может открепляться, перемещаться в кровеносное русло и, в конце концов, закупоривать более маленькие нисходящие ветви артерий, вызывая тромбоэмболию (Ross, N.Engl. J. Med. (1999), 340(2): 115-126). Дегенеративное расстройство, AAA, характеризуется непрерывным прогрессированием 1) воспаления стенки аорты; 2) неконтролируемой локальной продукции деструктивных протеаз; 3) разрушения структурных белков и 4) истощения гладкомышечных клеток медии. Ранняя или острая фаза начинается с привлечения воспалительных клеток в медию и адвентицию. Интрамуральное повреждение происходит, когда локальный реактивный кислород, лейкотриены, хемокины и продукты деградации матрикса совместно активируют различные протеазные системы. Указанные патологические изменения в стенке аорты приводят к ослаблению ее сегмента, прогрессирующему расширению и спонтанному разрыву(Nanda et al. Recent Patents on Cardiovascular Drug Discovery (2009), 4: 150-159). Хроническое трансмуральное воспаление является одной из основных гистологических признаков установленной AAA. В указанный воспалительный ответ вовлечены мононуклеарные фагоциты, лимфоциты и плазматические клетки крови. Природа хронического воспалительного ответа при AAA, повидимому, отличается от природы воспалительного ответа при атеросклерозе. Воспалительный ответ приAAA обычно является трансмуральным по распределению, при этом плотные инфильтраты в основном сконцентрированы во внешней медии и адвентиции. При атеросклерозе инфильтрирующие воспалительные клетки в основном приурочены к поврежденной интиме, и такого концентрирования или сильного распространения указанных воспалительных клеток, как в случае AAA, по-видимому, не наблюдается. Несмотря на наличие общего компонента, представляющего собой хроническое воспаление, разрушение структурных белков во внешней стенке аорты, которое не наблюдается при атеросклерозе, по-видимому,отвечает за дегенерацию при аневризме (Thompson et al. Curr. Probl. Surg. (2002), 39(2): 110-230, 115, 137,142). Считается, что большинство опубликованных работ подтверждает участие каскада 5 липоксигеназы и LTB4 в патогенезе AAA, несмотря на наличие отрицающих это публикаций (см., например, Cao et al. Prostaglandinsother Lipid Mediators, (2007) 84: 34-42). Повышенный уровень LTB4,обусловленный нейтрофилами, играет ключевую роль в патогенезе AAA (Houard et al. FASEB J. (2009),23: 1376-1383; Ahluwalia, et al. J. Immunol. (2007), 179: 691-697; Kristo et al. Atherosclerosis, (2010), 210: 107-113). Следующие далее исследования in vitro и in vivo демонстрируют активность и эффективность соединения формулы (I) или его натриевой соли в лечении атеросклероза и AAA благодаря антагонизму в отношении LTB4. В целом, специалистами в данной области техники считается, что данные указанных анализов показывают клиническую терапевтическую активность у человека. Анализы, подтверждающие антагонистическую активность и эффективность в отношении сигналинга LTB4, можно проводить, по существу, как описано далее, или с помощью подобных анализов, предоставляющих сходные данные. Методики анализа in vitro. Связывание и активация BLT1 лейкотриеном LTB4 приводит к повышению внутриклеточного уровня инозитол-1,4,5-трифосфата, который вызывает высвобождение внутриклеточного кальция, а приток кальция опосредуется связыванием со специфическими субъединицами сигнального пути, сопряженными с G-белком, и передачей сигнала через указанные субъединицы (Gaudreau et al. Biochem. J.(1998), 335 (Pt 1): 15-18). Далее следуют два анализа in vitro, которые использовали для демонстрации антагонизма соединения согласно примеру 2 в отношении ранних событий сигнального каскада BLT1: анализ замещения лиганда [3H]-LTB4 с использованием препаратов мембран, полученных из стабильных клеточных линий, экспрессирующих BLT1 и BLT2, и анализ цельноклеточной мобилизации кальция. Анализ замещения лиганда LTB4.[3H]-LTB4 и известные антагонисты рецепторов BLT1 и BLT2 использовали для получения кривых замещения LTB4 и значений IC50 для соединений согласно настоящему изобретению. Для получения значений процентной эффективности ингибирование рецептора соединениями согласно настоящему изобретению определяли по отношению к референсным молекулам ингибиторов BLT1 и BLT2. Способы приготовления исследуемого соединения для анализа связывания с hBLT1. Для анализа связывания с hBLT1 исследуемые соединения разводили в ДМСО с получением 10 мМ исходного раствора. Указанный исходный раствор сначала разводили в отношении 1:10 в буфере А (50 мМ 4-(2-гидроксиэтил)пиперазин-1-этансульфоновая кислота (HEPES), pH 7,4, 10 мМ MgCl2, 10 мМ глицерина, 1% (мас./об.) БСА, 10 об.% ДМСО) с получением кривой разведений из 10 точек. Соединение в конечных концентрациях, варьирующих от 30 мкМ до 1,52 нМ, помещали в 96-луночный круглодонный планшет для проведения анализов in vitro. Способы приготовления исследуемого соединения для анализа связывания с hBLT2. Для анализа связывания с hBLT2 исследуемые соединения разводили в ДМСО с получением 10 мМ исходного раствора. Указанный исходный раствор сначала разводили в отношении 1:10 в буфере А (50 мМ HEPES, pH 7,4, 10 мМ MgCl2, 10 мМ NaCl, 10 об.% глицерина, 1% (мас./об.) БСА) с последующими серийными 3 Х разведениями в буфере В (50 мМ HEPES, pH 7,4, 10 мМ MgCl2, 10 мМ NaCl, 10 об.% глицерина, 1% БСА (мас./об.), 10 об.% ДМСО) с получением кривой разведений из 10 точек. Соединение в конечных концентрациях, варьирующих от 300 мкМ до 15,2 нМ, помещали в 96-луночный круглодонный планшет для проведения анализов in vitro. Способы получения стабильных клеточных линий BLT1/CHO-K1 и BLT2/CHO-K1. В целом, указанные клеточные линии получали с использованием коммерчески доступных материалов и с помощью методов, известных специалистам в данной области техники. Получение стабильной клеточной линии hBLT1/CHO-K1. ДНК рецептора BLT1 человека (NCBI (National Center for Biotechnology Information, Национальный центр биотехнологической информации США), референсная последовательность NM181657) синтезировали и клонировали в вектор экспрессии pcDNA3,1/гигро(+) (Invitrogen V87020). Конструкцию вектора экспрессии кДНК трансфицировали в клетки яичника китайского хомячка (СНО-K1) (Американская коллекция типовых культур (American Type Culture Collection, ATCC), CCL-61) с использованием липофектамина (Lipofectamin 2000, Invitrogen) в качестве реагента трансфекции. Через 24 ч после трансфекции клетки культивировали в селективной модифицированной Дульбекко среде Игла (DMEM), содержащей 200 мкг/мл гигромицина. Выделяли отдельные клоны и проводили скрининг на предмет экспрессии и функциональной активности BLT1 с помощью метода Вестерн-блоттинга и анализа высвобождения кальция с помощью планшетного ридера для флуорометрической визуализации (FLIPR). Получение стабильной клеточной линии hBLT2/CHO-K1. ДНК короткой формы рецептора человеческого BLT2 (NCBI, референсная последовательность базы данных GenBank AB029892, которая на 32 аминокислоты короче длинной формы BLT2 на N-конце,Wang et al. J. Biol. Chem. (2000), 275 (52): 40686-40694) синтезировали и клонировали в вектор экспрессии pcDNA3,1/Hygro(+) (Invitrogen V87020). Конструкцию вектора экспрессии кДНК трансфицировали в клетки CHO-K1 (АТСС CCL-61) с использованием липофектамина (Lipofectamin 2000, Invitrogen) в качестве реагента трансфекции. Через 48 ч после трансфекции клетки культивировали в селективной средеDMEM, содержащей 200 мкг/мл гигромицина. Выделяли отдельные клоны и проводили скрининг на предмет экспрессии и функциональной активности BLT2 с помощью Вестерн-блоттинга и анализа высвобождения кальция с помощью FLIPR. Получение мембраны, содержащей hBLT1. Трансфицированные hBLT1 клетки CHO-K1 суспендировали в буфере, содержащем 50 мМ HEPES,pH 7,4, 10 мМ MgCl2, 10 мМ NaCl, обрабатывали ультразвуком и концентрировали посредством дифференциального центрифугирования. Вкратце, после обработки ультразвуком гомогенаты центрифугировали при скорости 1000g в течение 10 мин. Супернатанты восстанавливали и центрифугировали снова при скорости 50000g в течение 60 мин. Осадок собирали, ресуспендировали в буфере, содержащем 50 мМ HEPES при pH 7,4, 10 мМ MgCl2, 10 мМ NaCl, 10% глицерин, и использовали в качестве мембраны,содержащей hBLT1. Получение мембраны, содержащей hBLT2. Трансфицированные hBLT2 клетки CHO-K1 суспендировали в буфере, содержащем 50 мМ HEPES,pH 7,4, 10 мМ MgCl2, 10 мМ NaCl, обрабатывали ультразвуком и концентрировали посредством дифференциального центрифугирования. Вкратце, после обработки ультразвуком гомогенаты центрифугировали при 1000g в течение 10 мин. Супернатанты восстанавливали и снова центрифугировали при скорости 50000g в течение 60 мин. Осадок собирали, ресуспендировали в буфере, содержащем 50 мМ HEPEShBLT2. Анализ связывания [3H]-LTB4 в содержащих hBLT1 мембранах. Аликвоты [3H]-LTB4 (30 мкл, 1,3 нМ, PerkinElmer NET-852) помещали в 96-луночный фильтрационный планшет для связывания Multiscreen, Millipore (кат. номер MAFBNOB10), который предварительно смачивали буфером А (50 мМ HEPES, pH 7,4, 10 мМ MgCl2, 10 мМ NaCl, 10% глицерин, 1% БСА). Исследуемое соединение в разведениях, приготовленного ранее диапазона для кривой зависимости эффекта от дозы (по 10 мкл), добавляли в 2-11 колонки планшета с конечными концентрациями соединения, варьирующими от 3 мкМ до 152 пкМ. Для контроля связывания в выбранные лунки добавляли аликвоты по 10 мкл 2-[3-[3-[(5-этил-4'-фтор-2-гидрокси[1,1'-бифенил]4-ил)окси]пропокси]-2 пропилфенокси]бензоата натрия (LY293111 Na, коммерчески доступный известный ингибитор hBLT1;hBLT1 (0,7 мкг) добавляли в соответствующие лунки титрационного микропланшета с достижением общего объема 100 мкл. Планшет помещали на перемешиватель для планшетов при низкой скорости перемешивания и инкубировали в течение 1 ч. После инкубации проводили аспирацию лунок планшета и затем промывали 200 мкл ледяного буфера С (50 мМ HEPES pH 7,4, 10 мМ MgCl2, 10 мМ NaCl) с последующими дополнительными промывками (2100 мкл) и проведением аспирации между указанными промывками. Планшет высушивали на воздухе и затем добавляли 100 мкл реагента Microscint 20(PerkinElmer). Содержимому планшета позволяли перемешиваться в течение 16 ч и затем планшет анализировали с помощью планшетного ридера Topcount (Packard Instrument Company) в течение 1 мин. Значения СРМ (число импульсов в 1 мин) наносили на график в зависимости от концентрации ингибитора и полученную кривую приводили в соответствие с 3-параметрической логистической моделью с фиксированным нижним пределом для получения значений IC50. Значения IC50 переводили в значения Ki путем деления на 2,7 (ранее рассчитанный коэффициент). 2,7 представляет собой константу, ранее определенную по ходу кривой насыщения соединения для [3H]-LTB4 и hBLT1 и путем определения KM с помощью формулы Ki=IC50/1+[субстрат]/KM и ее упрощения: Ki=IC50/2,7). При проведении исследования по существу в соответствии с описанным выше протоколом было показано, что абсолютная Ki для соединения согласно примеру 2 в указанных условиях составляла 5,5 нМ (относительная Ki составляла 10,4 нМ). Указанные данные свидетельствуют об активном антагонизме соединения согласно примеру 2 в отношении связывания LTB4 с его высокоаффинным рецептором. Анализ связывания [3H]-LTB4 в содержащих hBLT2 мембранах. Аликвоты [3H]-LTB4 (30 мкл 2,8 нМ, PerkinElmer NET-852) помещали в каждую лунку титрационного микропланшета Falcon 3072 (BD Biosciences). Исследуемое соединение в 10 концентрациях ранее приготовленного диапазона для кривой зависимости эффекта от дозы (по 10 мкл) добавляли во 2-11 колонки планшета с конечными концентрациями соединения, варьирующими от 30 мкМ до 1,5 нМ. Для контроля связывания в выбранные лунки добавляли аликвоты 1-(5-этил-2-гидрокси-4-(6-метил-6-1Hтетразол-5-ил)гептилокси)фенил)этанона (LY255283, коммерчески доступный известный ингибиторhBLT2) по 10 мкл 100 мкМ раствора, в конечной концентрации 10 мкМ (в качестве положительного контроля) или 10 мкл буфера В (50 мМ HEPES pH 7,4, 10 мМ MgCl2, 10 мМ NaCl, 10% глицерин, 1% БСА,10% ДМСО) (в качетве отрицательного контроля). Мембранный белок hBLT2 (7,5 мкг) добавляли в соответствующие лунки титрационного микропланшета с достижением общего объема 100 мкл. Планшеты помещали на перемешиватель для планшетов при низкой скорости перемешивания и инкубировали в течение 1 ч. После инкубации 90 мкл реакционной смеси из каждой лунки переносили в 96-луночный фильтрационный планшет для связывания Multiscreen, Millipore (каталожный номер MAFBNOB10), который предварительно смачивали буфером А (50 мМ HEPES pH 7,4, 10 мМ MgCl2, 10 мМ NaCl, 10% глицерин, 0,03% БСА). Проводили аспирацию планшета и затем промывали 3 раза 300 мкл ледяного буфера С (50 мМ HEPES pH 7,4, 10 мМ MgCl2, 10 мМ NaCl), при этом после каждого промывочного этапа проводили аспирацию. Планшет высушивали на воздухе и затем добавляли реагент Microscint 20(PerkinElmer, 100 мкл). Содержимому планшета позволяли перемешиваться в течение 16 ч и затем планшет анализировали на Topcount (Packard Instrument Company) в течение 1 мин. Значения СРМ (число импульсов в 1 мин) наносили на график в зависимости от концентрации ингибитора и кривую приводили в соответствие с 3-параметрической логистической моделью с фиксированным нижним пределом для получения значений IC50. При проведении исследования по существу в соответствии с описанным выше протоколом было показано, что абсолютная IC50 для соединения согласно примеру 2 в указанных условиях составляла 16,5 мкМ (относительная IC50 составляла 15,4 мкМ). Указанные данные свидетельствуют о статистически незначимом антагонизме соединения согласно примеру 2 в отношении связывания LTB4 с его низкоаффинным рецептором. Анализ высвобождения кальция с помощью FLIPR. Клетки яичника китайского хомячка (CHO-K1), стабильно экспрессирующие высокоаффинный(BLT1) рецептор LTB4, высевали в 96-луночный планшет (Corning) в концентрации 10000 клеток/лунку в ростовой среде, содержащей DMEM/F-12 (3:1) без фенолового красного (Invitrogen), 5% сыворотки эмбрионов коров (СЭК) (Hyclone), 20 мМ HEPES (Invitrogen), 200 мкг/мл гигромицина В (Invitrogen) и 40 мкг/мл L-пролина (Sigma). Планшет инкубировали в течение 22-24 ч при 37C и 5% CO2, затем ростовую среду замещали на среду для проведения исследования (50 мкл/лунку), содержащую среду RPMI-1640(среда Мемориального института парка Роузвелл, RPMI) без фенолового красного (Invitrogen), 20 мМHEPES (Invitrogen) и 0,2% (мас./об.) бычьего сывороточного альбумина (Sigma). Через 30-60 мин инкубирования при 37C и 5% CO2 в лунки добавляли 50 мкл разведенного реагента аналитического набораCalcium 3 для FLIPR (Molecular Devices), содержащего 5 мМ пробенецид (Sigma), и планшет инкубировали в течение дополнительных 1,25 ч при 37C, 5% CO2. Планшет помещали на прибор FLIPR (Molecular Devices) и добавляли 50 мкл 4 об.% ДМСО или соединения с последующим добавлением 50 мкл носитель или LTB4 через 6 мин. Конечная концентрация LTB4 составляла 8 нМ. Планшет анализировали при выдержке 0,5 с и мощности лазера 0,6 Вт. Было показано, что Kb (нМ) подавления LTB4-вызванной мобилизации кальция (активность и селективность) для соединения согласно примеру 2 составляла 0,98 (n=2 +/-1,64) и относительная IC50 (нМ) составляла 6,48 (n=2 +/-10,8). Кроме того, ниже приведено несколько дополнительных анализов, используемых для оценки нисходящих событий, вызванных связыванием LTB4 с BLT1, включая фосфорилирование регулируемых внеклеточными сигналами киназ 1 и 2 (ERK) в моноцитах (Lindsay et al. J. Leukoc. Biol. (1998), 64: 555562) и индукцию CD11b в нейтрофилах в соответствующих типах клеток крови мышей и человека, а также аффинности связывания LTB4 с рецепторами, активируемыми пролифераторами пероксисом(PPAR), относящимися к подсемейству ядерных рецепторов. Анализ фосфорилированной связанной с внеклеточными сигналами киназы (pERK) человека. Способность соединения согласно примеру 2 блокировать LTB4-вызванный сигналинг через BLT1 оценивали в пробах цельной крови, полученной от здоровых людей-доноров и от мышей линии 129SvEv,которые представляют собой модельную линию для доклинической оценки эффективности леченияAAA. Цельную кровь у людей-доноров собирали в вакуумные пробирки K2 на 10 мл, содержащие этилендиаминтетрауксуную кислоту (ЭДТА, BD Biosciences). Аликвоты цельной крови предварительно нагревали при 37C в течение 20 мин. Анализировали кривые зависимости эффекта от дозы исследуемых соединений, построенные из 10 точек, при конечной концентрации 20 нМ-10 мкМ. Готовили 10 точек 1/2 серийных разведений соединения в ДМСО при конечной анализируемой концентрации 1000. Соединение затем разводили до концентрации 10 в фосфатно-солевом буфере Дульбекко (DPBS) (концентрация ДМСО теперь составляла 1%). 10 мкл соединения в разведениях (при концентрации 10 в DPBS) или 1% ДМСО в DPBS добавляли в лунки 96-луночного планшета с глубокими лунками на 2,0 мл (Nunc) и помещали в термоблок при 37C. Сразу после этого добавляли 80 мкл цельной крови и инкубировали в течение 20 мин при 37C (на последние 10 мин инкубации добавляли 10 мкл античеловеческих CD14-FITC, BD Biosciences). Добавляли 11 мкл предварительно нагретого 10 LTB4 (Cayman Chemicals, конечная концентрация 10 нМ) и инкубировали при 37C в течение 1 мин. Реакцию останавливали с помощью 1.5 мл 1X раствора PhosflowLyse/Fix, BD Biosciences (предварительно нагретого до 37C). Планшет запечатывали, содержимое перемешивали на вортексе и инкубировали при 37C в течение 10 мин. Клетки промывали один раз 1,5 млDPBS (Hyclone), затем пермеабилизировали смесью 100 мкл 2% раствор Cytofix (BD Biosciences)/900 мкл холодного метанола в течение 30 мин на льду. Клетки промывали один раз 1 мл промывочного буфераSignaling) в разведении 1:100 (100 мкл) в течение 1 ч при комнатной температуре. Клетки промывали один раз промывочным буфером, затем инкубировали антикроличьими антителами IgG-PE (Invitrogen) в концентрации 2 мкг/мл (100 мкл) в течение 30 мин при комнатной температуре в темноте. Клетки снова промывали промывочным буфером, затем фиксировали в 400 мкл 1% раствора Cytofix (BD Biosciences). Клетки переносили в пробирки (1275 мм) и затем замораживали до момента проведения анализа. Образцы нагревали до комнатной температуры и анализировали на проточном питометре Beckman Coulter FC500. Человеческие моноциты выделяли по боковому светорассеянию и принципу селекции CD14-FITC-положительных клеток. Данные анализировали с помощью программыWinList (Verity Software House) для определения среднего и медианного значений интенсивности флуоресценции для pERK-PE из популяции моноцитов. Добавление соединения согласно примеру 2 в различных концентрациях к цельной крови человека приводило к блокировке LTB4-вызванного фосфорилирования ERK в моноцитах при IC50, составляющей 814 нМ, что свидетельствует об антагонизме соединения согласно примеру 2 в отношении нисходящих сигнальных событий. Анализ pERK y мышей. У мышей линии 129SvEv собирали цельную кровь в 50 мМ ЭДТА (Gibco). Для экспериментов in vitro анализировали кривые зависимости эффекта от дозы исследуемых соединений, построенные из 10 точек, при конечной концентрации 20 нМ-10 мкМ. Готовили 10 точек 1/2 серийных разведений соединения в ДМСО при конечной анализируемой концентрации 1000. Соединение затем разводили до концентрации 10 в DPBS (концентрация ДМСО теперь составляла 1%). В лунки 96-луночного планета с глубокими лунками добавляли по 10 мкл соединения в разведениях (при 10 разведении в DPBS) или 1% ДМСО в DPBS. Добавляли по 80 мкл цельной крови и инкубировали в течение 20 мин при комнатной температуре (на последние 10 мин инкубации добавляли 10 мкл антимышиных антител LY6G-FITC (BDPharmingen) и 10 мкл антимышиных антител CD11b-APC (BD Biosciences) в конечной концентрации 1 мкг/мл). Добавляли 11 мкл предварительно нагретого 10 LTB4 (конечная концентрация 20 нМ) и инкубировали при 37C в течение 2 мин. Реакцию останавливали с помощью 1,5 мл 1X раствора PhosflowLyse/Fix (BD Biosciences), предварительно нагретого до 37C. Планшет запечатывали, содержимое пере- 12023067 мешивали на вортексе и инкубировали при 37C в течение 10 мин. Клетки промывали один раз 1,5 млDPBS, затем пермеабилизировали с помощью 1 мл буфера BD Perm/Wash (BD Biosciences) в течение 10 мин при комнатной температуре. Клетки промывали один раз 1 мл буфера Perm/Wash, затем инкубировали с антителами pERK (Cell Signaling) в разведении 1:100 (100 мкл) в течение 1 ч при комнатной температуре. Клетки снова промывали буфером Perm/Wash, затем инкубировали с антикроличьими антителами IgG-PE (Invitrogen) в концентрации 2 мкг/мл (100 мкл) в течение 30 мин при комнатной температуре в темноте. Клетки снова промывали смесью буфера Perm/Wash и затем фиксировали в 400 мкл 1% раствора BD Cytofix. Мышиные моноциты выделяли по принципу селекции LY6G-FITCотрицательных/CD11b-АРС-положительных клеток. Соединение согласно примеру 2 блокировало вызванное LTB4 фосфорилирование ERK в моноцитах цельной крови мышей при IC50 243 нМ, что свидетельствует об антагонизме в отношении нисходящих сигнальных событий. Анализ CD11b. Воспаление представляет собой патофизиологический процесс, для которого возможна разработка биомаркеров. Например, простой анализ крови может использоваться вместо тканевой биопсии для наблюдения за активацией нейтрофилов. Активация нейтрофилов приводит к их миграции из крови к месту повреждения ткани и играет главную роль в процессе воспаления (Busse, Am. J. Respir. Crit Care Med.(1998), 157: S210-213). Нейтрофилы, как правило, отсутствуют в здоровых тканях. Анализ не основе биомаркера, специфичного к активации нейтрофилов в крови, является не требующим инвазивного вмешательства показателем воспалительного ответа в ткани. Повышенная экспрессия 2-интегринаCD11b/CD18 (Мас-1), гликопротеина на поверхности нейтрофилов является ранним событием в миграции нейтрофилов в область воспаления (Parkos, BioEssays (1997), 19: 865-873). Применение CD11b в качестве доклинического и клинического биомаркера антагонизма в отношении рецептора BLT1 основано на том, что LTB4 активно подавляет экспрессию CD11b на нейтрофилах (Turner et al. J. Clin. Invest.(1996), 97: 381-387), и было показано, что антагонисты рецептора LTB4 вызывают значительное снижение стимуляции CD11b лейкотриеном LTB4 (Allen et al. J. Pharmacol. Exp. Ther. (1996), 277: 341-349; Davis et al. J. Immunol. Methods (2000), 240: 125-132; Marder et al. Biochem. Pharmacol. (1995), 49: 16831690). Антикоагулированную с помощью ЭДТА кровь собирали у людей-доноров или мышей, как описано ранее. Для экспериментов in vitro анализировали кривые зависимости эффекта от дозы исследуемых соединений, построенные из 8 или 10 точек, при конечной концентрации, составляющей 78 нМ-10 мкМ или 20 нМ-10 мкМ соответственно. Готовили серийные разведения 1/2 соединения при 1000 конечной анализируемой концентрации в ДМСО. Затем соединение разводили до 10 в DPBS (концентрация ДМСО теперь составляла 1%). 10 мкл соединения в разведениях (при концентрации 10 в DPBS) или 1% ДМСО в DPBS добавляли в лунки 96-луночного планшета с глубокими лунками. Добавляли 90 мкл цельной крови и инкубировали в течение 20 мин при комнатной температуре. Добавляли 11 мкл 10LTB4 (конечная концентрация 25 нМ для мышей или 10 нМ для человека) и инкубировали при 37C в течение 30 мин. Реакцию останавливали посредством инкубирования планшета на льду в течение 5 мин. Клетки окрашивали 10 мкл антимышиных или античеловеческих антител CD11b-PE (BD Biosciences, в разведении 1:20 для мышей и без разведения для человека) и инкубировали на льду в течение 30 мин в темноте (для экспериментов на мышах на последние 10 мин инкубации добавляли 10 мкл антимышиных антител LY6G-FITC (BD Pharmingen) в разведении 1:25). Эритроциты крови (RBC) лизировали путем добавления 1,5 мл 1X раствора BD FACSlyse (BD Biosciences) и инкубирования в течение 10 мин при комнатной температуре в темноте. Клетки промывали один раз 1,5 мл DPBS и затем фиксировали в 400 мкл 1% раствора Cytofix. Мышиные нейтрофилы выделяли по принципу селекции LY6G-FITCположительных клеток и человеческие нейтрофилы выделяли на основе свойств светорассеяния. Данные анализировали с помощью программного обеспечения WinList (Verity Software House) для определения среднего и медианного значения интенсивности флуоресценции для CD11b-РЕ из популяции нейтрофилов. В указанной доклинической модели соединение согласно примеру 2 подавляло дозозависимым образом LTB4-вызванную экспрессию CD11b в нейтрофилах и соединение согласно примеру 2 блокировалоLTB4-вызванную экспрессию CD11b в нейтрофилах цельной крови мышей и человека. LTB4-вызванная экспрессия CD11b в нейтрофилах цельной крови человека блокировалась при IC50, составляющей 193 нМ. Подобным образом, соединение согласно примеру 2 вызывало подавление экспрессии CD11b в нейтрофилах цельной крови мышей при IC50, составляющей 1,45 мкМ. Анализ лиганд-активированного связывания активируемого пролифераторами пероксисом рецептора альфа, дельта и гамма (PPAR , , ). Было показано, что LTB4 и антагонисты рецептора BLT являются лигандами подсемейства ядерных рецепторов, активируемых пролифераторами пероксисом (PPAR). Считается, что это ограничивает возможность их применения (Devchand et al. J. Biol. Chem. (1999), 274: 23341-23348; Devchand et al. Nature Получение функционального лизата PPAR. В целом, указанные клеточные линии получали с использованием коммерчески доступных материалов и с помощью способов, известных специалистам в данной области техники. Синтезировали нуклеотидные последовательности, кодирующие полноразмерную ДНК рецептораNM002957,4), и встраивали в вектор pFastBacHTb (Invitrogen) в одной рамке считывания с N-концевойHIS-меткой из вектора. Конструировали рекомбинантную бакмиду (плазмиду челночного вектора бакуловируса) путем трансформирования клеток DH10Bac и выделения ДНК из белых колоний в соответствии с протоколом производителя бакуловирусной системы экспрессии Вас-to-Bac (Invitrogen; см. также Руководство пользователя Invitrogen, версию F, от 04 сентября 2010 г. и Инструкцию по эксплуатацииInvitrogen от 27 февраля 2002 г.). Клетки Sf9 трансфицировали в 6-луночных планшетах в концентрации 0,9106 клеток/лунку с использованием реагента CellFectin (Invitrogen). Вирус Р 0 собирали через 72 ч после трансфекции и использовали для инфицирования клеток насекомых Sf9 в суспензии в объеме 100 мкл вируса Р 0 на 50 мл клеток в концентрации 1,5106 клеток/мл. Вирус Р 1 собирали через 96 ч. Для продукции белка 1 л клеток Sf9 в концентрации 1,5106 клеток/мл инфицировали 5 мл вируса Р 1 и клетки собирали через 48 ч. Для получения клеточных лизата клеточные осадки из 1 л культуры ресуспендировали с 12,5 мл ледяного лизирующего буфера (20 мМ HEPES, pH7,8, 160 мМ KCl, 1 мМ MgCl2, 2 мМ дитиотреитол (DTT), 1% 3-[(3-хлорамидопропил)диметиламмонио]-1-пропансульфонат (CHAPS), 40% глицерин, 1 смесь ингибиторов протеаз Roche) для PPAR или лизирующего буфера В (10 мМ Tris-HCl,pH7,5, 500 мМ NaCl, 1 мМ EDTA, 1 мМ DTT, 50% глицерин, 1 смесь ингибиторов протеаз Roche) дляRXR, и затем гомогенизировали и обрабатывали ультразвуком на льду. После центрифугирования на роторе Beckman JA18 со скоростью 16500 об/мин в течение 45 мин при 4C супернатант аликвотировали и замораживали при -80C. Концентрацию белка определяли с помощь метода Бредфорда с использованием бычьего сывороточного альбумина (БСА) в качестве стандарта. Аффинность связывания соединений с рецепторами PPAR ,иоценивали с использованием технологии сцинтилляционного анализа сближения (SPA). Биотинилированный олигонуклеотид (DR2) 5'TAATGTAGGTAATAGTTCAATAGGTCAAAGGG3'(SEQ ID NO: 1) использовали для связывания рецепторов с покрытыми стрептавиином SPA-гранулами на основе силиката иттрия (Perkin Elmer). Рецепторы PPAR , ,и ретиноидный X рецептор (RXR)(эндогенно экспрессируемый в виде гетеродимеров) были представлены как лизаты из бакуловирусной системы экспрессии в Sf9 клетках. DR2 присоединяли к покрытым стрептавидином SPA-гранулам путем перемешивания в течение 30 мин при комнатной температуре в связывающем буфере, содержащем 10 мМ HEPES при pH 7,8, 80 мМ KCl, 0,5 мМ MgCl2, 1 мМ DTT, 0,5% CHAPS и 16,6 мкг бычьего сывороточного альбумина. Смесь центрифугировали при скорости 2000 об/мин в течение 3 мин для осаждения смеси гранула-олигонуклеотид. Супернатант удаляли и осадок гранула-олигонуклеотид ресуспенировали в том же связывающем буфере, как описано выше. Клеточные лизаты инкубировали в каждой лунке с одной из 11 концентраций соединения, варьирующих от 0,17 до 10,000 нМ, в присутствии меченного тритием(рацемическая смесь 2-[4-[2-(2,4 дифторфенил)карбамоил](гептил)амино]этил]фенокси]-2-метилбутановой кислоты) для альфа- и дельтарецепторов и меченной тритием (0,0373 мкКи) 2-метил-2-[4-[3-[пропил[(5-пиридин-2-илтиофен-2 ил)сульфонил]амино]пропил]фенокси]пропановой кислоты для гамма-рецептора, 110,3 мкг покрытых стрептовиином SPA-гранул, 0,126 нМ HD Oligo DR2 и 0,3 мкг PPAR с 0,5 мкг RXR, 0,5 мкг PPAR с 0,5 мкг RXR или 1,25 мкг PPAR с 3,03 мкг RXR в связывающем буфере, приведенном выше, содержащем также 14% глицерина и 5 мкг разрезанной ДНК из молок лососевых. Неспецифическое связывание определяли в присутствии 10000 нМ немеченого GW2331 (Kliewer, S.A. et al. Proc. Natl. Acad. Sci.USA (1997), 94: 4318-4323) для альфа-и дельта-рецепторов и 2-метил-2-[4-[3-[пропил[(5-пиридин-2 илтиофен-2-ил)сульфонил]амино]пропил]фенокси]пропановой кислоты (WO 2004/073606) для гаммарецептора. Реакцию связывания (100 мкл на лунку в 96-луночном планшете [Costar 3632]) проводили в течение 10 ч и оценивали как число распадов в 1 мин (dpm) на жидкостном сцинтилляционном счетчикеMicrobeta Luminometer, Wallac. Аффинность связывания рецептора (IC50) для соединений определяли путем приведения 11-точечной кривой зависимости эффекта от концентрации в соответствие с 4 параметрическим логистическим уравнением. Ki определяли на основе значения IC50 с использованием уравнения Ченга-Пруссофа и Kd определяли с помощью анализа насыщения соединения. Меченный тритием GW2331 может быть, в целом, получен в соответствии со способами, описанными в литературе для синтеза гем-диметильного аналога (WO 92/10468; Hawke, R.L. et al. J. Lipid Res. 1997, 35:1189-1203), с получением не меченного тритием материала. Тритирование можно осуществлять с использованием газообразного трития и катализатора Крэбтри (Heys, J.R. et a.l J. Labelled Cpd. Radiopharm. (1999), 42: 797-807), который помещает тритий в орто-положение дифторфенила. Альтернативно,тритий может быть помещен в гептильную часть молекулы с помощью катализируемого палладием вос- 14023067 становления гептенильного аналога газообразным тритием (в том же источнике, Kliewer, S.А.). Меченная тритием 2-метил-2-[4-[3-[пропил[(5-пиридин-2-илтиофен-2-ил)сульфонил]амино]пропил]фенокси]пропановая кислота может быть получена путем каталитического восстановления аллильного предшественника с помощью газообразного трития. Аллильный предшественник (2-[4-[3-[аллил 5-(2-пиридил)-2-тиенил]сульфонил]амино]пропил]фенокси]-2-метилпропановая кислота), в целом, может быть получен в соответствии со способами, описанными в международной публикации WO 2004/073606, начиная с этил-2-метил-2-[4-[3-(п-толилсульфонилокси)пропил]фенокси]пропаноата, в ходе реакции с аллиламином с последующим сульфонилированием 5-(2-пиридинил)-2-тиофенесульфонилхлоридом и гидролизом этилового эфира. Применение указанных двух радиолигандов можно найти в литературе (Burris et al. Molecular Pharmacology, 2004 67: 948-954, Xu et al. J. Med. Chem. 2004, 47: 2422-2425). При проведении исследования по существу в соответствии с описанным выше протоколом было показано, что Ki для соединения согласно примеру 2 в анализе связывания PPAR , , , составляла примерно 617 нМ (n=3),8830 нМ (n=4) и 1380 нМ (n=2) соответственно. Указанные данные демонстрируют, что соединение согласно примеру 2 только слабо взаимодействует с рецепторами PPAR. Считается,что активность свидетельствует о селективности и отсутствии ограничений для применения. Методики анализа in vivo. Животная модель эффективности лечения AAA, вызванной CaCl2. Непосредственное нанесение раствора хлорида кальция на аорту мыши приводит к расширению сосуда; см. Chiou et al. J. Surg. Res. (2001), 99: 371-376; Lomgo et al. J. Clin. Invest. (2002), 110: 625-632. Через две недели после обработки расширение сосуда становится статистически значимым по сравнению с исходным диаметром сосуда, с увеличением периметра просвета аорты вплоть до 75% через 4 недели. Кальциевые отложения располагаются главным образом внутри сети эластических волокон медии. Разрыв указанной структуры в результате образования комплекса кальций-эластическая ткань приводит к ослаблению стенки сосуда и вносит вклад в формирование аневризмы. Указанное повреждение также служит провоспалительным стимулом, привлекая нейтрофилы, лимфоциты, моноциты и тучные клетки. Животные. Мыши: самцов линии 129SvEv возрастом 7-недель приобретали в компании Taconic Farms, Германтаун, Нью-Йорк, США. Крысы: крыс линии Sprague-Dawley возрастом 7-8 недель приобретали в компании Harlan (Индианаполис, Индиана, США). Модель индукции аневризмы. Все действия производили в соответствии с руководствами по институциональному уходу за животными и их использованию компании Eli Lilly and Company. Период акклиматизации животных после их прибытия длился одну неделю. В течение указанного периода животные имели неограниченный доступ к стандартному корму для грызунов (Purina 2014) и водопроводной воде. После периода акклиматизации животным проводили анестезию с помощью изофлурана и осуществляли лапаротомию для стимулированной CaCl2 индукции аневризмы брюшной аорты (AAA). Брюшную аорту от уровня почечных артерий до бифуркации подвздошных артерий отделяли от нижней полой вены и окружающей соединительной ткани с использованием микрохирургической техники. После отделения брюшной аорты ее исследуемый участок (ROI) обворачивали стерильной хлопчатобумажной марлей, предварительно смоченной в 0,25 М растворе CaCl2. Для контрольных ложно стимулированных животных вместо CaCl2 использовали 0,9% солевой раствор. Через 7 мин марлю удаляли и повторно наносили вторую смоченную раствором CaCl2 марлю. Через 7 мин марлю убирали, аорту промывали 0,9% солевым раствором и закрывали брюшную полость. Животных возвращали в общее помещение в конце дня проведения хирургической операции. Введение соединения. Мышам вводили исследуемое соединение (пример 2) путем принудительного кормления в дозе объемом 10 мл/кг массы тела, крысам вводили исследуемое соединение (пример 2) путем принудительного кормления в дозе объемом 2,5 мл/кг массы тела. Соединение вводили BID (в первой и во второй половине дня); первую дозу вводили за день до операции (во второй половине дня) и вторую дозу вводили утром в день проведения операции. Животные не получали дозу во второй половине дня в день операции. Через день после проведения операции продолжали введение дозы BID в течение 28 дней. Измерение размеров аорты с помощью ультразвука. Через 28 дней после проведения операции животных анестезировали и проводили измерения с помощью ультразвука брюшной полости с использованием ультразвукового аппарата eSaote MyLab 30Gold (Biosound), снабженного датчиком 7,5 МГц. Из-за несимметричного развития AAA в доклинических CaCl2-моделях на грызунах измеряли внешний диаметр и диаметр просвета артерий (внутренний диаметр) во время пика систолы как по продольной оси, так и по оси поперечного сечения для определения наиболее расширенного участка в пределах исследуемой области (ROI). Проводили измерения внутреннего поперечного периметра просвета (мм) в этой точке для оценки эффективности и проводили ста- 15023067 тистический анализ с помощью программы JMP 7 (Кэри, Северная Каролина). Статистический анализ. Измерения периметра просвета выражали как средние значения SE (стандартная ошибка среднего). Для определения процентного подавления AAA для групп, получавших лечение лекарственным средством, измерения, полученные для группы ложно стимулированных животных, получавших носитель, принимали за 100% подавление развития AAA, а измерения, полученные для группы CaCl2 стимулированных животных, получавших носитель, принимали за 0% подавление развития AAA. Статистический анализ осуществляли с помощью программы JMP 7 (Кэри, Северная Каролина) и критерий Даннетта использовали для статистических сравнений между лечебными группами. Статистическую значимость принимали при Р 0,05. Диапазон показателя эффективности в модели CaCl2-вызванной аневризмы брюшной аорты определялся значением периметра просвета аорты у мышей, которых обрабатывали марлей, пропитанной солевым раствором, с последующим введением носителя в течение 4 недель, представляющим собой 100% эффективность ("Группа носителя с ложной стимуляцией"), и значением периметра просвета аорты у мышей, которых обрабатывали CaCl2-пропитанной марлей с последующим введением дозы носитель в течение 4 недель ("группа носителя"), представляющим собой 0% эффективность. При проведении исследования по существу в соответствии с описанным выше протоколом при использовании мышей линии 129SvEv и соединения согласно примеру 2 было показано статистически значимое уменьшение периметра просвета аорты (табл. 1) по сравнению с мышами, получающими лечение носитель, что свидетельствует о снижении AAA с помощью соединения согласно примеру 2 в данной животной модели. Таблица 1 Процентное (%) снижение AAA у мышей in vivo В подобной схеме эксперимента проводили оценку способности соединения согласно примеру 2 модулировать расширение аневризмы аорты после CaCl2-вызванного повреждения у крыс линии Sprague-Dawley. Наблюдалось статически значимое снижение периметра просвета аорты по сравнению с крысами, получающими носитель (табл. 2), что свидетельствует о снижении AAA с помощью соединения согласно примеру 2. Модель атеросклероза плечеголовной дуги (ВСА) на мышах LDLr KO. Соединение согласно примеру 2 исследовали на модели атеросклероза на мышах с нокаутом рецептора липопротеина низкой плотности (LDL) (LDLr KO). У мышей, не способных кодировать и синтезировать рецептор LDL (LDLr KO), наблюдается повышенный уровень холестерина в крови, особенно при их содержании на диете с высоким содержанием холестерина (Ishibashi et al. J. Clin. Invest. (1994), 93: 1885-1893). В больших артериях у мышей LDLr KO спонтанно развиваются атеросклеротические повреждения, которые повторяют главные особенности клеточного и липидного состава и состава внеклеточного матрикса повреждений у человека. Важным компонентом повреждений как у человека, так и у мыши является нагруженный липидами макрофаг, или "пенистая клетка", в артериальном субэндотелии. Этерифицированный холестерин, запасаемый макрофагами, является косвенным показателем развития повреждения. Анализ этерифицированного холестерина непосредственно из ткани артерии мыши (с помощью ЖХ/МС) обеспечивает быстрый показатель тяжести повреждения. Преимуществом модели LDLrKO, используемой в настоящем исследовании, является быстрое развитие зрелых атеросклеротических бляшек в плечеголовной артерии (ВСА). Основными конечными показателями исследования являлись содержание эфира холестерина в артерии и размеры повреждения, полученные путем измерения повреждений с помощью светового микроскопа на серийных поперечных срезах артерии. Самцов мышей линии LDLr KO (JAX 002207) возрастом 7 недель получали из лаборатории Джексона (Jackson Laboratory, Бар Харбор, Мэн). После прибытия мышей в испытательную лабораторию и в течение в общем 10 недель животных содержали отдельно друг от друга и обеспечивали неограниченным доступом к атерогенному корму TD,88137 (Teklad). В течение первых 6 недель мышей оставляли в клетках и не беспокоили. В течение последних 4 недель мыши получали исследуемое соединение два раза в день путем принудительного кормления. Данные оценок показаны в табл. 3, ниже. Данные по площади атеросклеротического повреждения ВСА у мышей линии LDLr KO показали дозозависимое снижение конечных показателей атеросклероза. Сравнения между лечебными группами проводили с помощью 1-стороннего анализа ANOVA и затем с помощью критерия Даннетта. В табл. 3 показано, что соединение согласно примеру 2 в концентрации 30 мг/кг при введении дозы два раза в день вызывало снижение содержания эфира холестерина (СЕ) в ВСА на 23% по сравнению с группой, получавшей носитель (р 0,04). Соединение согласно примеру 2 в концентрации 10 мг/кг при введении два раза в день, несмотря на меньший эффект по сравнению с концентрацией 30 мг/кг при введении два раза в день, вызывало снижение содержания СЕ на 18% по сравнению с группой, получавшей носитель (р 0,09). Тенденцию к значительному снижению атеросклероза ВСА, на которую указывают косвенные данные, подтверждали и уточняли с помощью непосредственного измерения повреждений ВСА. В табл. 3 показано значительное снижение площади повреждения, вызванное соединением согласно примеру 2 в концентрации 30 мг/кг при пероральном введении дозы два раза в день. Лечение с использованием указанной дозы приводило к уменьшению площади повреждения на 66% по сравнению с использованием только носителя (р 0,017). Уменьшение площади повреждения на 58 и 53%, вызванное соединением согласно примеру 2 в дозировке 10 мг/кг два раза в день и 3 мг/кг два раза в день соответственно иллюстрирует дозозависимый эффект, подобный эффекту на содержание эфира холестерина в ВСА. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение формулы (I) или его фармацевтически приемлемая соль. 2. Соединение по п.1,представляющее собой 4-3-[3-[2-этил-4-(4-фторфенил)-5 гидроксифенокси]пропокси]-2-пропилфенил]амино]-2,2-диметил-4-оксобутаноат натрия. 3. Фармацевтическая композиция, содержащая соединение по п.1 или 2 и фармацевтически приемлемый носитель.
МПК / Метки
МПК: A61K 31/167, A61P 19/02, C07C 233/25
Метки: собой, антагонист, соединение, лейкотриена, представляющее
Код ссылки
<a href="https://eas.patents.su/19-23067-soedinenie-predstavlyayushhee-sobojj-antagonist-lejjkotriena-b4.html" rel="bookmark" title="База патентов Евразийского Союза">Соединение, представляющее собой антагонист лейкотриена b4</a>












