Антагонисты лейкотриена для лечения эпителиальной плоскоклеточной карциномы ротовой полости
Номер патента: 2742
Опубликовано: 29.08.2002
Авторы: Флейш Джером Х., Джэксон Уилльям Т., Сойер Джэйсон С.
Формула / Реферат
1. Способ лечения эпителиальной плоскоклеточной карциномы у млекопитающего, который включает в себя введение млекопитающему в случае необходимости эффективного количества соединения формулы
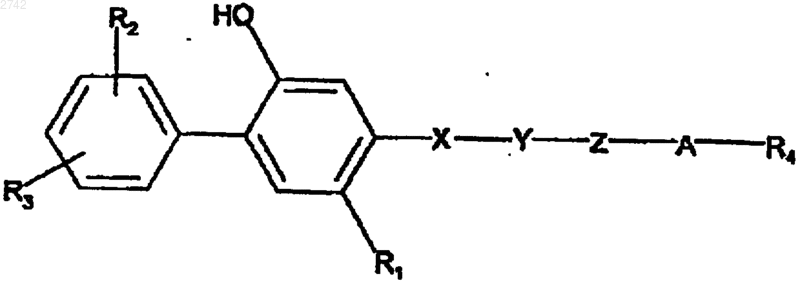
или его фармацевтически приемлемой соли присоединения оснований, в которой
R1 представляет собой С1-С5-алкил, С1-С4-алкокси, (C1-C4-алкил)тио, галоген или R2-замещенный фенил;
каждый R2 и R1 независимо представляет собой водород, галоген, гидрокси, С1-С4-алкил, С1-С4-алкокси;
Y и Х представляют собой -О- или -CH2-;
Z представляет собой СН2-СН2 или СН2СН2СН2СН2;
А представляет собой -О-, -СН2-, СН(R7-замещенный фенил)- или -С(СН3)2-;
R4 представляет собой

каждый R7 представляет собой водород, С1-С4-алкил,
R8 представляет собой водород или галоген;
и при условии, что, когда Х представляет собой -О-, Y не является -О-.
2. Способ по п.1, где соединение представляет собой 2-[2-пропил-3-[3-[2-этил-4-(4-фторфенил)-5-гидроксифенокси]пропокси]фенокси]бензойную кислоту или ее фармацевтическую приемлемую соль или сольват.
3. Способ по п.1, где соединение представляет собой 3-(2-(3-(2-этил-4-(4-фторфенил)-5-гидроксифенокси)пропокси-6-(4-карбоксифенокси)фенил)пропионовую кислоту или ее фармацевтическую приемлемую соль или сольват.
4. Способ по п.1, где соединение представляет собой 1-(4-карбоксиметокси)фенил-1-(1H-тетразол-5-ил)-6-(2-этил-4-(4-фторфенил)-5-гидроксифенокси)гексан или его фармацевтическую приемлемую соль или сольват.
5. Способ по п.1, где соединение представляет собой 3-[4-[7-карбокси-9-оксо-3-[3-[2-этил-4-(4-фторфенил)-5-гидроксифенокси]пропокси]-9Н-ксантен]]пропановую кислоту или ее фармацевтическую приемлемую соль или сольват.
6. Способ по п.1, где соединение представляет собой 5-[3-[2-(1-карбоксиэтил]-4-[3-[2-этил-4-(4-фторфенил)-5-гидроксифенокси]пропокси]фенил]-4-пентиновую кислоту или ее фармацевтическую приемлемую соль или сольват.
7. Способ по п.1-6, где млекопитающее является человеком.
Текст
1 Эпителиальная плоскоклеточная карцинома является наиболее часто встречающимся злокачественным новообразованием головы и шеи. Она составляет, по меньшей мере, 75% раковых заболеваний головы и шеи, и у этих больных с большой частотой выявляются иммунодефицит и симптомы воспаления. Несмотря на усовершенствование средств лечения за последние 40 лет, 5-летний срок выживания примерно 30% больных не изменился в течение этого же периода. Эпителиальную плоскоклеточную карциному ротовой полости связывают с чрезмерным курением сигарет и злоупотреблением алкоголем, как отдельно, так и в сочетании. Другие факторы, ассоциируемые с раком ротовой полости, включают в себя плохую гигиену полости рта и неправильную подгонку зубных протезов или сломанные зубы, которые вызывают хроническое воспаление слизистой оболочки. Производственные вредности включают в себя хронический контакт с пылью у столяров, плотников и токарей по дереву, что связывают с раком носоглотки, и контакт с никелевыми соединениями, который повышает риск возникновения рака придаточных пазух носа. С карциномой носоглотки связывают вирус Эпштейна-Барр (ВЭБ), этиологический агент инфекционного мононуклеоза. Подозревается участие и других вирусов, включая вирус простого герпеса (Неrреs simplex) типа 1 ротовой полости и эндогенные онкорнавирусы. Радиационное облучение, а также дефициты в диете также могут предрасполагать индивидуумов к раку головы и шеи. Примерно 90% рака ротовой полости с высоким риском возникновения обнаруживается только на некоторых участках: дно полости рта,вентролатеральная сторона языка и комплекс мягкого неба. Нужно принять во внимание и рак щек и губ преддверия рта у людей, которые используют бездымный табак. Рак головы и шеи встречается в четырех основных местах: полость рта, глотка, гортань и носовые и околоносовые пазухи. Эти локализации подразделяются на различные составляющие областей. Наиболее обычными местами локализации заболеваний являются полость рта и ротоглотка,что встречается немного реже, чем в 50% случаев, после чего идет гортань, что имеет место примерно в 30% случаев. На ранних стадиях бессимптомный рак ротовой полости наиболее часто имеет вид красноватых (эритропластических) повреждений. Плоскоклеточная эпителиальная карцинома, не диагностированная на ранних стадиях, позднее выглядит как глубокая язва с гладкими уплотненными приплюснутыми краями, сросшимися с более глубокими тканями. Для диагноза карциномы необходима биопсия. 2 Плоскоклеточная эпителиальная карцинома часто диагностируется на ранних стадиях в связи с местной симптоматикой, такой как боль,осиплость (охриплость) и затруднения при глотании. Однако во многих случаях диагноз отсрочивается, так как местные симптомы или боль от вовлеченных в процесс нервов не проявляются до тех пор, пока не разовьется большая первичная опухоль. В таких случаях первоначальным проявлением могут быть региональные узелковые метастазы. Удаленные метастазы редко появляются без локально проявившегося первичного заболевания или появления узлов. Рак головы и шеи может быть заболеванием всей слизистой верхней части дыхательного и пищеварительного трактов, часто имеют место дополнительные молчащие синхронные первичные поражения. Пациенты с такой клинической картиной предрасположены к дополнительным первичным раковым заболеваниям головы и шеи в более поздние сроки (частота встречаемости составляет примерно три - пять процентов в год). Хотя существует несколько маркеров рака головы и шеи, сообщается, что уровень ферритина точно отражает стадию и течение заболевания (ферритин является главным белком, аккумулирующим железо и обнаружен в небольших количествах в сыворотке). Однако повышенный уровень ферритина в сыворотке не является специфичным для рака головы и шеи; его уровень также повышается при раке другой локализации и при патологических состояниях без злокачественных новообразований. Уровень антител к ВЭБ при установленной и скрытой карциноме носоглотки может использоваться в качестве диагностического средства. Наиболее специфическими тестами являются определение титров IgA-антител к вирусному капсидному антигену (анти-VCA) и IgG-антител к раннему антигену (анти-ЕА), особенно для неидентифицированных типов носоглоточной карциномы (НГК, NPC). Рак головы и шеи делится на стадии по системе TNM Американского объединенного комитета по раковым заболеваниям. Классификация первичной опухоли (О, Т) меняется в зависимости от ее локализации, размера и степени инвазии в окружающие ткани и связывания с ними; только опухоли полости рта и ротоглотки классифицируются с применением подобных критериев. Когда поражение не может быть точно измерено, для определения стадии Т используется число затронутых местонахождений. Шейные лимфатические узлы (У, N) классифицируются по размеру, числу и расположению(гомолатеральное или билатеральное) пораженных узлов. Заболевание также классифицируется по наличию или отсутствию отдаленных метастазов (М). Общая стадия заболевания определяется по стадии TNM: заболевания стадии I и стадии II, которые считаются ограниченными 3 заболеваниями, точно определяются с помощью клинической оценки; заболевание стадии III,или локально далеко зашедшее заболевание,главным образом включает в себя большие первичные опухоли с региональным распространением узлов или без него (T3N0, T1-3N1); и заболевание IV стадии представляет собой массивные экстенсивно инвазивные первичные поражения с разнообразными типами поражения узлов (T1-4N0-1 или локально далеко зашедшее заболевание) или любую другую комбинацию TN с удаленными метастазами (M1 или метастатическое заболевание). Хотя хирургическое лечение и радиотерапия остаются основой лечения, химиотерапия играет все более важную роль в лечении этого заболевания. Химиотерапия используется для снижения метастазирования и рецидивов заболевания или в качестве первоначального лечения в сочетании с хирургическим вмешательством и радиотерапией при локально распространенном процессе. Так как эпителиальная плоскоклеточная карцинома головы и шеи является гетерогенным заболеванием, которое может возникать во многих местах, степень реакции на хирургическое вмешательство, облучение и химиотерапию варьирует в зависимости от места первичного заболевания. Таким образом, прогноз связан не только со стадией и с гистопаталогическими чертами, но также и с локализацией, а для пациентов, которые подвергаются химиотерапии, с предшествующим лечением. Стратегия лечения определяется стадией заболевания. На ранней стадии заболевания может быть применено или хирургическое лечение, или радиотерапия, так как они дают сходные результаты выживаемости. Выбор зависит от ожидаемых проявлений заболевания при лечении (например, потеря речи или функциональный изъян при хирургическом лечении, или сильная сухость во рту, или измененный вкус из-за радиотерапии), а также от необходимой срочности лечения. При более далеко зашедшем локальном заболевании хирургическое лечение и радиотерапия сочетаются, так как этот подход дает наилучшее подавление локального заболевания. Радиотерапия может применяться или перед операцией, или после операции. Профилактическая радиотерапия часто применяется для дренажа мест расположения в лимфатических узлах, которые имеют высокий риск микроскопических включений. Для пациентов с далеко зашедшим локальным заболеванием в план первоначального лечения включают химиотерапию, так как пятилетний период жизни без заболевания обычно является низким для таких пациентов (10-30%), когда используется обычная хирургическая операция, радиотерапия или оба метода. Существует повышенный интерес к тому,что методы лечения, такие как хирургический, 002742 4 радиотерапия и химиотерапия, могут неблагоприятно влиять на естественный иммунитет пациента, что возможно увеличивает шансы роста остаточных или метастатических опухолевых клеток. Это направляло внимание не только на раннее определение и лучшее лечение, но также на расширение исследований по возможной этиологии заболевания. Исследования в области аллергических реакций легкого дали подтверждение того, что производные арахидоновой кислоты, образуемые при действии липооксигеназ, связаны с различными болезненными состояниями. Некоторые из этих метаболитов арахидоновой кислоты были классифицированы как представители семейства эйкозатетраеновых кислот, называемых лейкотриенами. Три из этих веществ,как в настоящее время считается, являются главными компонентами того, что ранее называлось веществом медленной реакции анафилаксии (SRS-A), и были названы лейкотриенами С 4, D4 и Е 4 (LTC4, LTD4 и LTE4, соответственно). Другой метаболит арахидоновой кислоты,лейкотриен В 4 (LTB4), является провоспалительным липидом, который, как предполагается,участвует в патогенезе псориаза, артрита, хронических заболеваний легких, острого респираторного дистресс-синдрома, шока, астмы, воспалительных заболеваний кишечника и других воспалительных состояний, характеризующихся инфильтрацией и активацией нейтрофильных лейкоцитов и других провоспалительных клеток. Активированные таким образом нейтрофильные лейкоциты выделяют разрушающие ткани ферменты и реактивные химические вещества, вызывающие воспаление. АнтагонизмLTB4 должен поэтому давать новый терапевтический подход к лечению этих и других опосредуемых LTB4 патологических состояний. Из-за изнуряющего воздействия эпителиальной плоскоклеточной карциномы сохраняется потребность в эффективном ее лечении. Это изобретение представляет собой способ лечения или подавления эпителиальной плоскоклеточной карциномы полости рта, который включает в себя введение млекопитающему, в случае необходимости, эффективного количества соединения формулы IY представляет собой -О- или -СН 2-; или когда взяты вместе, -X-Y- представляет собой -СН=СН-или -CC-;Z представляет собой C1-С 10-алкилиденил с прямой или разветвленной цепью; А представляет собой связь, -О-, -S-,- СН=СН- или -CRaRb-,гдеRa и Rb, каждый независимо, представляют собой водород, C1-С 5-алкил или R7-замещенный фенил, или когда они взяты с атомом углерода,с которым связаны, они образуют С 4-С 8 циклоалкильное кольцо; где каждый R6 независимо представляет собой СООН, 5-тетразолил, -CON(R9)2, или CONHSO2R10; каждый R7 представляет собой водород,С 1-С 4-алкил, С 2-С 5-алкенил, С 2-С 5-алкинил, бензил, метокси, -W-R6, -T-G-R6, (C1-C4-алкил)-Т(С 1-С 4-алкилиденил)-О- или гидрокси;R8 представляет собой водород или галоген; каждый R9 независимо представляет собой водород, фенил или С 1-С 4-алкил или, когда он взят вместе с атомом азота, образует морфолино, пиперидино, пиперазино или пирролидиногруппу;R11 представляет собой R2, -W-R6 или -TG-R6; каждый W представляет собой связь или дивалентный гидрокарбиловый радикал с прямой или разветвленной цепью из одного - восьми атомов углерода; каждый G представляет собой дивалентный гидрокарбиловый радикал с прямой или разветвленной цепью из одного - восьми атомов углерода; 6 каждый Т представляет собой связь, -СН 2-,-О-, -NH-,-NHCO-, -С(=О)- или -S(O)q-; К представляет собой -С(=O)- или -Н(ОН)-; каждый q независимо представляет собой 0, 1 или 2; р равен 0 или 1; иt равно 0 или 1; при условии, что когда Х представляет собой -О- или -S-, то Y не является -О-; при условии, что когда А представляет собой -О- или -S-, то R4 не является R6; при условии, что когда А представляет собой -О- или -S-, a Z представляет собой связь, Y не является -О-; и при условии, что W не является связью,когда р равно 0; или его фармацевтически приемлемой соли или сольвата. Следующие определения относятся к различным терминам, использованным в этом описании. Термин C1-С 6-алкил относится к алифатическим радикалам из 1-6 атомов углерода с прямой или разветвленной цепью, таким как метил, этил, пропил, изопропил, н-бутил, вторичный бутил, трет-бутил, н-пентил, 2,2 диметилпропил, гексил и тому подобное. В это определение включаются термины C1-С 3 алкил, С 1-С 4-алкил и С 1-С 5-алкил. Термин С 2-С 5-алкенил относится к алифатическим радикалам из 2-5 атомов углерода с прямой или разветвленной цепью, содержащим одну двойную связь, таким как -СН=СН 2, -СН 2 СН=СН 2,СН 2 СН 2 СН=СН 2, -СН 2 С(СН 3)=СН 2, -СН 2 СН=С(СН 3)2 и тому подобное. Термин С 2 -С 5 -алкинил относится к алифатическим остаткам из 2-5 атомов углерода, содержащим одну тройную связь,таким как -ССН, -СН 2 -ССН, -СН 2 СН 2 ССН, -СН 2 СН(СН 3 )ССН, -СН 2 СССН 3 и тому подобному. Термин С 1-С 4-алкокси относится к метокси, этокси, пропокси, изопропокси, бутокси,вторичному бутокси и трет-бутокси. Термин галоген относится к фтору,хлору, брому и йоду. Термин C 1 -С 10 алкилиденил относится к дивалентным радикалам, производным от C 1 -С 10 -алкана, таким как -СН 2 -, -СН(СН 3), -С(СН 3 ) 2 -, -СН(С 2 Н 5)СН 2-, -СН 2 СН 2 СН 2 СН 2 СН 2-, -СН(СН 3) СН 2-СН 2 СН 2 СН 2-, -СН 2 СН 2 СН 2 СН 2 СН 2 СН 2-, (СН 2)10- и тому подобному. В это определение включаются и термины С 1-С 4-алкилиден и С 2-С 4-алкилиден. 7 Термин С 4=С 8-циклоалкил относится к циклоалкильному кольцу из четырех - восьми атомов углерода, такому как циклобутил, циклопентил, циклогексил,4,4-диметилциклогексил, циклогептил, циклооктил и тому подобное. Термин дивалентный гидрокарбиловый остаток из одного-восьми атомов углерода с прямой или разветвленной цепью относится к дивалентному радикалу, производному от алкана, алкена или алкина из одного-восьми атомов углерода с прямой или разветвленной цепью. В зависимости от разветвления и числа атомов углерода, как будет понятно специалистам в органической химии, такой заместитель может содержать одну, две или три двойные или тройные связи или их сочетание. Как таковой, этот термин может считаться алкилиденовой группой, которой дано определение выше, содержащей от 1 до 8 атомов углерода, необязательно содержащей одну - три двойные или тройные связи или сочетание этих двух, с ограничениями, которые указаны в предшествующем предложении. Это изобретение включает в себя фармацевтически приемлемые соли с присоединением основания соединений формулы I. Такие соли включают те, которые получены с неорганическими основаниями, такими как гидроксиды аммиака и щелочных и щелочно-земельных металлов, карбонаты, бикарбонаты и тому подобное, а также соли, полученные с основными органическими аминами, такими как алифатические и ароматические амины, алифатические диамины, гидроксиалкиламины и тому подобное. Такие основания, применимые для получения солей этого изобретения, таким образом,включают в себя гидроксид аммония, карбонат калия, бикарбонат натрия, гидроксид кальция,метиламин, диэтиламин, этилендиамин, циклогексиламин этаноламин и тому подобное. Особенно предпочтительны калиевые и натриевые виды солей. Это изобретение включает в себя как моносолевые формы, т.е. соединение формулы I с основанием в соотношении 1:1, как описано выше, так и дисолевые формы, в тех случаях,когда соединение формулы I имеет две кислотные группы. Кроме того, это изобретение включает в себя любые сольватные формы соединений формулы I или их солей, такие как этанольные сольваты, гидраты и тому подобное. Известно, что для соединений, имеющих функциональные группы разветвленного алкила, алкилиденила или гидрокарбила и для тех соединений, которые несут двойные или тройные связи, могут существовать различные стереоизомерные продукты. Это изобретение не ограничивается каким-либо конкретным изомером, но включает в себя все характерные изомеры и их смеси. Термин 5-тетразолил относит 002742(2 Н)-5-тетразолил. Наиболее предпочтительную группу соединений, применяемых в способах данного изобретения, представляют собой соединения формулы Iа и их фармацевтически приемлемые соли с добавлением основания. Особенно предпочтительными являются те соединения, где R2 представляет собой галоген, в частности, фтор. Предпочтительными R1-заместителями являются пропил, и особенно - этил. Предпочтительные Z-заместители включают в себя C2-C4-алкилиден, особенно предпочтительно-W-COOH, -T-G-COOH или соответствующие тетразольные производные. ПредпочтительнымW-фрагментом является таковой из связи или С 1-С 4-алкилидена с прямой цепью; предпочтительными G заместителями являются C1-C4 алкилидены с прямой цепью. Предпочтительно,чтобы R5 или R7 представляли собой С 1-С 4 алкил, особенно н-пропил. Особенно предпочтительными группами являются те, в которых А представляет собой -СН(R7 замещенный фенил)-, а R4 представляет собой-СООН или 5-тетразолил. Также предпочтительными являются те соединения, где А представляет собой -О-, a R4 является Предпочтительными аспектами этой субструктуры является также, когда R7 представляет собой С 1-С 4-алкил, особенно н-пропил, a R6 представляет собой -W-COOH. Особенно предпочтительными являются те соединения, в которых Т является -О- или -S-, a W представляет собой связь. Особенно предпочтительные соединения данного изобретения включают в себя 2-[2-пропил-3-[3-[2-этил-4-(4-фторфенил)5-гидроксифенокси]-пропоксибензойную кислоту; 3-(2-(3-(2-этил-4-(4-фторфенил)-5-гидроксифенокси)пропокси)-6-(4-карбоксифенокси)фенил)пропионовую кислоту; 1-(4-(карбоксиметокси)фенил)-1-(1 Нтетразол-5-ил)-6-(2-этил-4-(4-фторфенил)-5 гидроксифенокси)гексан; 3-[4-[7-карбокси-9-оксо-3-[3-[2-этил-4-(4 фторфенил)-5-гидроксифенокси]пропокси]-9Hксантенпропановую кислоту и 5-[3-[2-(1-карбокси)этил]-4-[3-[2-этил-4-(4 фторфенил)-5-гидроксифенокси]пропокси]фенил]-4-пентиновую кислоту или их фармацевтически приемлемые соли или сольваты. Антагонисты лейкотриена В 4 (LTB4), используемые в способах данного изобретения,могут быть синтезированы, по существу, так,как описано в патенте США 54622954, опубликованном 31 октября 1995, все содержание которого включено сюда в виде ссылки. Следующие примеры дополнительно иллюстрируют получение соединений, применяемых в этом изобретении. Примеры являются только иллюстративными и не предназначаются для ограничения объема изобретения. Температуры плавления определены в аппарате ТомасаХувера и неоткорректированы. Спектры ЯМР определены на спектрометре GE QE-300. Все химические сдвиги представлены в частях на миллионотносительно тетраметилсилана. Химические сдвиги ароматических протонов хинолиновых соединений в ДМСО-d6 зависят от концентрации. Для обозначения характеристики сигналов использованы следующие аббревиатуры: с = синглет, д = дуплет, т = триплет, кв = квартет, ш = широкий, м = мультиплет. Инфракрасные спектры определены на спектрометреNicolet DX FT-IR. Масс-спектральные данные определены на спектрометре СЕС-21-110 с использованием условий электронного удара (El),спектрометре MAT-731 с использованием условий свободной десорбции (FD) или на спектрометре VG ZAB-3F с использованием условий бомбардировки быстрыми атомами (FAB). Хроматографию на силикагеле выполняли с использованием градиентов этилацетата/гексана, если не указано иначе. Хроматографию с обращенной фазой выполняли на геле MCI CHP20P с использованием градиентов ацетонитрила/воды или метанола/воды, если не указано иначе. Тетрагидрофуран (ТГФ) подвергали дистилляции из натрийбензофенонкетила непосредственно перед использованием. Все реакции проводятся в атмосфере аргона при перемешивании, если не указано иначе. Там, где структуры были подтверждены с помощью спектрального анализа в инфракрасной области, протонно-ядерного магнитного резонанса или масс-спектрального анализа, соединения, соответственно, так и обозначены: ИК, ЯМР или МС. Пример 1. 3-[2-[3-[(5-Этил-2-гидрокси[1,1'бифенил]-4-ил)окси]пропокси]-1-дибензофуран]пропановой кислоты динатриевая соль. А. Получение 3,3-диэтокси-2,3-дигидро 1 Н-бензофуро-[3,2-f] [1]бензопирана. Раствор 2-гидроксидибензофурана (5,00 г,27,2 ммоль), триэтилортоакрилата (10,1 г, 54,3 ммоль) и пиваловой кислоты (1,39 г, 13,6 ммоль) в толуоле (100 мл) кипятили с обратным холодильником в течение 18 ч. Смесь охлаждали до комнатной температуры и промывали один раз водой и один раз насыщенным раствором бикарбоната натрия, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении с получением оранжевого масла. Это вещество разбавляли гексаном и хранили при -20 С в течение 18 ч. Полученные кристаллы собирали с помощью вакуумфильтрации с получением 5,67 г (67%) искомого промежуточного соединения, т.пл. 64 С; ЯМР(CDCl3) 7,96 (д, J=7,8 Гц, 1 Н), 7,57 (д, J=8,0 Гц,1 Н), 7,46 (т, J=8 Гц, 1 Н), 7,35 (м, 2 Н), 7,06 (д,J=8,8 Гц, 1 Н), 3,82 (кв, J=7,2 Гц, 2 Н), 3,73 (кв,J=6,8 Гц, 2 Н), 3,35 (т, J=6,9 Гц, 2 Н), 2,29 (т,J=7,0 Гц, 2 Н), 1,23 (т, J=7,1 Гц, 6 Н); MC-FD м/е 312 (р) ; ИК (СНСl3, см-1) 2982, 1494, 1476, 1451,1434, 1251, 1090, 1054, 975. Анализ для C19H20O4: Вычислено: С 73,06; Н 6,45; Найдено: С 72,81; Н 6,72. В. Получение сложного этилового эфира 3[1-(2-гидроксидибензофуран)]-пропановой кислоты. Смесь 3,3-диэтокси-2,3-дигидро-1 Н-бензофуро-[3,2-f] [1] бензопирана (3,50 г, 11,2 ммоль) и 10% водного раствора соляной кислоты (5 мл) в этилацетате (30 мл) перемешивали при комнатной температуре в течение 1 ч. Полученную смесь промывали один раз водой, сушили над сульфатом натрия, фильтровали и концентрировали в вакууме с получением желтоватокоричневого твердого вещества. Перекристаллизация из гексана/этилацетата давала 3,11 г(98%) искомого промежуточного соединения в виде не совсем белого кристаллического вещества: т.пл. 128-131 С; ЯМР (CDCl3) 7,88 (д,J=7,7 Гц, 1 Н), 7,59 (д, J=8,4 Гц, 1 Н), 7,47 (т,J=7,2 Гц, 1 Н), 7,37 (д, J=8,9 Гц, 1 Н), 7,36 (т,J=6,6 Гц, 1 Н), 7,13 (д, J=8,8 Гц, 1 Н), 7,13 (кв,J=8,8 Гц, 2 Н), 3,43 (т, J=5,8 Гц, 2 Н), 3,01 (т,J=7,7 Гц, 2 Н), 1,23 (т, J=7,2 Гц, 3 Н); MC-FD м/е 284 (100, р) 256(65), 238(17); ИК(КВr, см-1) 2985 11 Найдено: С 71,90; Н 5,43. С. Получение сложного этилового эфира 3[2-[3-5-этил-2-(фенилметокси)-[1,1'-бифенил]4-ил]окси]пропокси]-1-дибензофуран]пропановой кислоты. Сложный этиловый эфир 3-[1-(2 гидроксидибензофуран)]пропановой кислоты(625 мг, 2,20 моль) растворяли в диметилформамиде (10 мл) и осторожно приводили во взаимодействие при комнатной температуре с 95% гидридом натрия (58 мг, 2,4 ммоль). Когда выделение газа прекращалось, добавляли 2 бензилокси-1-фенил-5-этил-4-(3-хлор-1-пропилокси)бензол (836 мг, 2,20 ммоль), и полученную смесь перемешивали в течение 18 ч. Смесь разбавляли эфиром и промывали один раз водой. Органический слой сушили над сульфатом натрия, фильтровали и концентрировали в вакууме с получением темного масла. Хроматография на силикагеле (этилацетат/гексан) давала 200 мг (14%) искомого промежуточного соединения в виде бесцветного масла: ЯМР(СDСl3),8,11 (д, J=7,7 Гц, 1 Н), 7,57 (м, 3 Н), 7,48 (т, J=7,3 Гц, 1 Н), 7,20-7,44 (м, 10 Н), 7,17 (с, 2 Н), 7,08 (д,J=8,9 Гц, 1 Н), 6,67 (с, 1 Н), 5,05 (с, 2 Н), 4,29 (т,J=6,2 Гц, 2 Н), 4,26 (т, J=6,1 Гц, 2 Н), 4,15 (кв,J=7,2 Гц, 2 Н), 3,54 (т, J=8,5 Гц, 2 Н), 2,67 (м, 4 Н),2,37 (т, J=6,0 Гц, 2 Н), 1,21 (м, 6 Н).D. Получение динатриевой соли 3-[2-[3[(5-этил-2-гидрокси-[1,1'-бифенил]-4-ил)окси]пропокси]-1-дибензофуран]пропановой кислоты. К продутому азотом раствору сложного этилового эфира 3-[2-[3-5-этил-2-(фенилметокси)-[1,1'-бифенил]-4-ил]окси]пропокси]-1 дибензофуран]пропановой кислоты (200 мг,0,318 ммоль) в смеси метанола/тетрагидрофурана (40 мл) 1:1 добавляли 10% палладия на угле (25 мг). Полученную суспензию подвергали гидрогенизации при давлении 1 атм в течение 24 ч при комнатной температуре. Смесь фильтровали через невысокую подушку флоризила (Florisil), и фильтрат концентрировали в вакууме. Остаток растворяли в смеси метанола/тетрагидрофурана (20 мл) 1:1 и подвергали взаимодействию с 5N раствором гидроксида натрия (2 мл) при комнатной температуре в течение 24 ч. Полученную смесь экстрагировали один раз диэтиловым эфиром. Водный слой подкисляли 5N раствором соляной кислоты и дважды экстрагировали метиленхлоридом. Объединенные метиленхлоридные фракции концентрировали под пониженным давлением. Остаток растворяли, как минимум, в 1N растворе гидроксида натрия и очищали на смоле 2 Р-20 с получением 53 мг (30%) искомого продукта в виде пушистого белого твердого вещества. ЯМР 12 4 Н), 1,10 (т, J=7,6 Гц, 3 Н); MC-FAB м/е 555 (88,р + 1), 533 (62); ИК (СНСl3, см-1) 3384 (b), 2969, 1566, 1428,1257, 1181. Анализ для С 32 Н 28O6Nа 2: Вычислено: С 69,31; Н 5,09; Найдено: С 69,51; Н 5,39. Пример 2. Моногидрат динатриевой соли 7-карбокси-9-оксо-3-[3-(2-этил-5-гидрокси-4 фенилфенокси)пропокси]-9 Н-ксантен-4-пропановой кислоты. Смесь 2-бензилокси-1-фенил-5-этил-4-(3 хлор-1-пропилокси)бензола (749 мг, 1,97 ммоль), этил-7-карбоэтокси-3-гидрокси-9-оксо 9 Н-ксантен-4-пропаноата (729 мг, 1,97 ммоль),карбоната калия (1,36 г, 9,85 ммоль) и йодида калия (33 мг, 0,20 ммоль) кипятили с обратным холодильником в течение 24 ч. Добавляли диметилсульфоксид (2 мл) и нагревание продолжали в течение 24 ч. Реакционную смесь охлаждали до комнатной температуры, разбавляли этилацетатом и один раз промывали водой. Органический слой сушили над сульфатом натрия,фильтровали и концентрировали в вакууме с появлением желто-коричневого твердого вещества. Это вещество растворяли в этилацетате (30 мл) и полученный раствор продували азотом. К этому раствору добавляли 10% палладия на угле(120 мг) и полученную суспензию гидрогенизировали под давлением в 1 атм. Раствор фильтровали и концентрировали в вакууме с получением бесцветного масла. Это вещество растворяли в растворе метанола/тетрагидрофурана (30 мл) 1:1 и подвергали взаимодействию с 5N раствором гидроксида натрия (2 мл) при комнатной температуре в течение 18 ч. Полученный раствор экстрагировали один раз диэтиловым эфиром и водный слой подкисляли 5N раствором соляной кислоты. Полученный осадок собирали путем фильтрования с отсасыванием. Это вещество превращали в динатриевую соль и очищали, как описано выше для препарата из примера 1(D), с получением 390 мг (56%) искомого продукта в виде пушистого белого твердого вещества: ЯМР (ДМСО-d6) 12,65 (с, 1 Н, -ОН), 8,65 (с,1 Н), 8,28 (дд, J=8,5, 2,0 Гц, 1 Н), 8,01 (д, J=8,9 Гц, 1 Н), 7,50 (м, 3 Н), 7,29 (т, J=7,8 Гц, 2 Н), 7,17 А. Получение сложного метилового эфира 2-[2-пропил-3-[3-[2-этил-4-(4-фторфенил)-5(фенилметокси)фенокси]пропокси]фенокси]бензойной кислоты. Смесь 2-бензилокси-1-(4-фторфенил)-5 этил-4-(3-хлор-1-пропилокси)бензола (20,0 г,50,2 ммоль) и йодида натрия (75,3 г, 502 ммоль) в 2-бутаноне (200 мл) кипятили с обратным холодильником в течение 6 ч. Смесь разбавляли эфиром и один раз промывали водой. Органический слой сушили над сульфатом натрия,фильтровали и концентрировали в вакууме с получением бесцветного масла. Этот материал растворяли в диметилформамиде (100 мл) и подвергали взаимодействию со сложным метиловым эфиром 2-(3-гидрокси-2-пропилфенокси)бензойной кислоты (14,4 г, 50,2 ммоль) и карбонатом калия (20,8 г, 151 ммоль) при комнатной температуре в течение 24 ч. Эту смесь разбавляли водой и два раза экстрагировали эфиром. Водный слой отделяли и снова экстрагировали один раз этилацетатом. Объединенные органические слои сушили над сульфатом натрия, фильтровали и концентрировали в вакууме с получением желтого масла. Хроматография на силикагеле давала 25,4 г (78%) искомого промежуточного соединения в виде бледнозолотого масла: ЯМР(СDСl3) 7,91 (1, J=7,8 Гц,1 Н), 7,54 (д, J=8,6 Гц, 1H), 7,52 (т, J=8,5 Гц, 1 Н),7,25-7,43 (м, 6 Н), 7,03-7,38 (м, 5 Н), 6,84 (д, J=8,3 Гц, 1H), 6,71 (д, J=8,1 Гц, 1H), 6,63 (с, 1H), 6,47(д, J=8,1 Гц, 1H), 5,03 (с, 2 Н), 4,24 (т, J=5,7 Гц,2 Н), 4,21 (т, J=5, 8 Гц, 2 Н), 3,86 (с, 3 Н), 2,69 (т,J=7,8 Гц, 2 Н), 2,64 (т, J=7,7 Гц, 2 Н), 2,34 (квинтет, J=6,0 Гц, 2 Н), 1,60 (гекстет, J=5,0 Гц, 2 Н),1,22 (т, J=7,5 Гц, 3 Н), 0,94 (т, J=7,5 Гц, 3 Н); MCFD м/е 648 (р) ; ИК(СНСl3, см-1) 2960, 1740,1604, 1497, 1461, 1112. Анализ для C41H41O6F: Вычислено: С 75,91; Н 6,37; Найдено: С 76,15; Н 6,45. В. Получение сложного метилового эфира 2-[2-пропил-3-[3-[2-этил-4-(4-фторфенил)-5(гидрокси)фенокси]пропокси]фенокси]бензойной кислоты. 14 Сложный метиловый эфир 2-[2-пропил-3[3-[2-этил-4-(4-фторфенил)-5-(фенилметокси)фенокси]пропокси]фенокси]-бензойной кислоты (33,0 г, 50,9 ммоль) дебензилировали, как описано выше для препарата из примера 2, с получением 27,3 г (96%) промежуточного соединения, указанного в заголовке, в виде янтарного масла: ЯМР (CDCl3) 7,90 (дд, J=7,8, 1,7 Гц,1 Н), 7,42 (м, 3 Н), 7,05-7,23 (м, 4 Н), 6,99 (с, 1 Н),6,84 (д, J=8,1 Гц, 1 Н), 6,70 (д, J=8,1 Гц, 1 Н), 6,55(р) ; ИК(СНСl3, см-1) 2965, 1727, 1603, 1496,1458, 1306, 1112. Анализ для С 34 Н 35O6F: Вычислено: С 73,10; Н 6,31; Найдено: С 73,17; Н 6,42. С. Получение натриевой соли 2-[2-пропил 3-[3-[2-этил-4-(4-фторфенил)-5-гидроксифенокси]пропокси]фенокси]бензойной кислоты. Сложный метиловый эфир 2-[2-пропил-3-[3[2-этил-4-(4-фторфенил)-5-(гидрокси)фенокси]пропокси]фенокси]бензойной кислоты 921,5 г, 38,5 ммоль) гидролизировали, как описано выше для препарата из примера 2. Кислоту превращали в натриевую соль и очищали, как описано выше для препарата из примера 1(D), с получением 16,7 г (77%) искомого продукта в виде белого аморфного твердого вещества: ЯМР (ДМСО-d6) 10,50 (mc, 1H, -ОН), 7,51 (м, 3 Н), 7,20 (т, J=7,4 Гц, 1H), 7,13 (м, 2 Н), 7,00 (м, 2 Н), 6,95 (с, 1H),6,67 (дд, J=8,2 3,3 Гц, 2 Н), 6,62 (с, 1H), 6,26 (д,J=8,2 Гц, 1H), 4,14 (т, J=5,8 Гц, 2 Н), 4,02 (т,J=5,7 Гц, 2 Н), 2,60 (т, J=6,8 Гц, 2 Н), 2,47 (кв,J=7,3 Гц, 2 Н), 2,16 (т, J=5,9 Гц, 2 Н), 1,45 (гекстет, J=7,5 Гц, 2 Н), 1,07 (т, J=7,5 Гц, 3 Н), 0,81 (т,J=7,4 Гц, 3 Н); MC-FAB м/е 568 (38, р+1),567(100, р), 544(86), 527(77), 295(65), 253(45); ИК(КВr, см-1) 3407 (b), 2962, 1603, 1502, 1446,1395, 1239, 1112. Анализ для С 33 Н 32O6FNа: Вычислено: С 69,95; Н 5,69; F 3,35. Найдено: С 69,97; Н 5,99; F 3,52. В способах данного изобретения описывается использование лейкотриеновых антагонистов для лечения и предотвращения эпителиальной плоскоклеточной карциномы полости рта, которая характеризуется избыточным выделением лейкотриена B4. Термин избыточное выделение лейкотриена относится к количеству лейкотриена, достаточному для того, чтобы вызвать эпителиальную плоскоклеточную карциному полости рта. Количество лейкотриена, которое считается избыточным, будет зависеть от ряда факторов,включая количество лейкотриена, необходимое,чтобы вызвать заболевание, и вид причастного к этому млекопитающего. Как будет понятно опытному специалисту, успех лечения млекопи 15 тающего, подверженного заболеванию или страдающего эпителиальной плоскоклеточной карциномой, характеризующейся избыточным выделением лейкотриена, соединением формулы I будет определяться по ослаблению или предотвращению симптомов этого патологического состояния. Исследования Исследование 1. Эффективность соединений формулы I по подавлению связывания меченного тритиемLBN4 мембранами легких морских свинок определяли следующим образом. Исследование связывания радиолиганда [3H]LTB4 в легких морских свинок Мембраны[3H]-LTB4 (196-200 Кюри/ммоль) закупали в New England Nuclear (Boston, MA). Все другие материалы были закуплены у Sigma (St. Louis,МО). Инкубацию проб (555 мл) выполняли в полипропиленовых минипробирках в течение 45 мин при 30 С, и в них содержалось 25 мг белка мембран легкого морских свинок (Silbaugh et al.,European Journal of Pharmacology, 223 (1992) 5764) в буфере, содержащем 25 мМ MOPS, 10 мМ[3H]-LTB4 и несущий лиганд или носитель (0,1% ДМСО в 1 мМ карбонате натрия, конечная концентрация), соответственно. Реакцию связывания определяли путем добавления 1 мл промывного буфера с температурой льда (25 мМ ТрисHCl, рН 7,5) с последующим немедленным вакуум-фильтрованием через стекловолокнистые фильтры Ватман GF/C, используя сборникBrandel (Gaithersburg, MD) 48. Фильтры промывали три раза 1 мл промывного буфера. Оставшуюся радиоактивность определяли по подсчету в жидкостном сцинтилляторе при 50% эффективности счета с использованием смесиReady Protein Plus coctail (Beckman, Fullerton,Ca). Неустраняемое связывание определяли в присутствии 1 мМ LTB4; оно составляло обычно менее 10% общего связывания. Данные анализировали, используя линейный регрессионный анализ логарифмических кривых значений между 10 и 90% контрольного связывания для расчета IC50 и угловых факторов (коэффициентыpseudo-Hill). Значения IC50, полученные таким образом, корректировали по концентрации радиолиганда (Cheng and Prusoff, Biochem. Pharmacol., 22, 3099 (1973 для расчета значений Ki.pKi является средним - log Ki для n экспериментов. Соединения данного изобретения, испытанные в вышеприведенном исследовании, как было обнаружено, имеют pKi в интервале между 7 и 11. Способность соединения формулы I оказывать эффективное терапевтическое действие на экспериментальный рак ротовой полости может быть оценена путем испытания его воздействия на индукцию эпителиальной плоско 002742 16 клеточной карциномы в защечном кармане сирийских хомячков (Pollack et al., Br. J. Cancer 23,781-6, 1969). Исследование 2. Развитие опухоли вызывается путем окрашивания правых защечных карманов у сирийских хомячков (в возрасте 1,5- 2 месяцев) 0,5% раствором 9,10-диметил-1,2-бензантрацена(ДМБА) в тяжелом минеральном масле (USP) три раза в неделю в течение 15 недель. По завершении вышеуказанной процедуры животных забивали, выполняли аутопсию и исследовали оба защечных кармана на число и размер опухолей. Затем определяли природу поражений гистологически после фиксации ткани в 4% формалине и окрашивания гематоксилином и эозином. Ответную реакцию на определенную дозу получали путем разделения животных на 4 экспериментальные группы из 10 хомячков каждая. Группы представляли собой: животных, получавших носитель; и животных, которым вводили 10, 25 и 50 мг/кг/сутки соединения формулыI перорально. Эффективность лечения оценивали путем сравнения размера и числа эпителиальных плоскоклеточных карцином и числа атипичных папиллом в получавшей лечение группе с этим показателем в контрольной группе, получавшей носитель. Исследование 3. Клинические исследования: для оценки значения соединений формулы I при лечении эпителиальной плоскоклеточной карциномы ротовой полости могут быть также проведены клинические испытания у людей. План клинических испытаний, применение необходимых инструментов и интерпретация этих результатов хорошо известны клиницистам - специалистам в этой области. Например, для клинического изучения выбираются пять из пятидесяти пациентов. Пациенты страдают эпителиальной плоскоклеточной карциномой. При этом исследовании имеется контрольная группа, получающая плацебо, т.е. пациентов делят на две группы, одна из которых получает соединение формулы I в качестве активного вещества, а другая получает стандартное лечение для эпителиальной плоскоклеточной карциномы. Пациенты в испытуемой группе получают лекарственный препарат в интервале 30-1500 мг в сутки пероральным или парентеральным путем. Эту терапию им продолжают в течение 3-12 месяцев. Ведутся точные записи как симптомов, так и состояния ракового заболевания в обеих группах, и в конце исследования эти результаты сравниваются. Результаты сравнивают как у членов каждой группы, так и результаты для каждого пациента сравнивают со статусом, зарегистрированным для каждого пациента перед тем, как исследование началось. Терапевтическое и профилактическое лечение, представляемое этим изобретением, осуществляется на практике путем введения мле 17 копитающему, в случае необходимости, дозы соединения формулы I или его фармацевтически приемлемой соли или сольвата, то есть эффективной для подавления или лечения эпителиальной плоскоклеточной карциномы. Термин подавляет включает в себя в основном его общепринятое значение, которое включает в себя препятствие росту, предотвращение, сдерживание и замедление, остановку роста опухоли или регресс тяжести существующих в результате нее симптомов. Как таковой,данный способ включает в себя как медицинское терапевтическое, так и/или профилактическое применение, соответственно. Хотя возможно вводить соединение, используемое в способах этого изобретения, непосредственно без изготовления какой-либо лекарственной формы, эти соединения обычно вводят в виде фармацевтического препарата,содержащего фармацевтически приемлемый наполнитель, и, по меньшей мере, одно соединение данного изобретения. Соединения или лекарственные формы данного изобретения можно вводить (применять) пероральным или ректальным путем, местным нанесением, парентерально, например, путем инъекции и путем непрерывного или прерывистого внутриартериального вливания, в виде, например, таблеток,лепешек, подъязычных таблеток, пакетиков с порошком, капсул, эликсиров, гелей, суспензий,аэрозолей, мазей, например, содержащих от 0,01 до 90% по весу активного соединения в подходящей основе, мягких или твердых желатиновых капсулах, суппозиториях, инъекционных растворах и суспензиях в физиологически приемлемой среде, стерильных упакованных порошков, адсорбированных на материаленосителе, для изготовления инъекционных растворов. Такие лекарственные формы готовят способом, хорошо известным в области фармации, и содержат, по меньшей мере, одно активное соединение. См., например. Remington'sPharmaceutical Sciences, (16th ed. 1980). При изготовлении лекарственных форм,применяемых в данном изобретении, активный ингредиент обычно смешивается с наполнителем (основой), разбавляется наполнителем или заключается в таком носителе, который может быть в форме капсулы, пакетика, бумажного или другого контейнера. Когда основа служит разбавителем, он может быть твердым, полутвердым или жидким материалом, который играет роль средства доставки, носителя или среды для активного ингредиента. При изготовлении лекарственной формы может быть необходимо измельчить активное вещество для получения частиц соответствующего размера перед соединением с другими ингредиентами. Если активное вещество, по существу, нерастворимо,его обычно размалывают до размера частиц,менее, чем после сита 200. Если активное соединение в значительной степени растворимо в 18 воде, размер частиц обычно доводится путем размола до того, чтобы получить, по существу,равномерное распределение в лекарственной форме, например, примерно по ситу 40. Такие примеры соответствующих носителей, наполнителей и разбавителей включают в себя лактозу, декстрозу, сахарозу, сорбит, маннит, крахмал, камедь акации, фосфат кальция,альгинаты, трагакант, желатин, силикат кальция, микрокристаллическую целлюлозу, поливинилпирролидон, целлюлозу, трагакант, желатин, воду, сироп и метилцеллюлозу. Лекарственные формы могут дополнительно включать в себя повышающие скольжение вещества, такие как тальк, стеарат магния и минеральное масло; увлажняющие вещества; эмульгирующие и суспендирующие вещества, консервирующие вещества, такие как метил- и пропилгидроксибензоаты; подсластители; улучшающие вкус и запах вещества. Композиции этого изобретения могут быть изготовлены так, чтобы обеспечить быстрое, постоянное или отсроченное выделение активного ингредиента после введения пациенту путем применения процедур, известных специалистам. Соединения этого изобретения могут доставляться трансдермально, с использованием трансдермальных систем доставки и основ. Наиболее предпочтительно, соединение этого изобретения смешивается с усилителями проникновения, включая, но не ограничиваясь ими,пропиленгликоль, полиэтиленгликоль, монолаурат и азациклоалкан-2-оны, и включается в пластырь или похожую систему доставки. В трансдермальные лекарственные формы могут быть добавлены дополнительные вспомогательные вещества, включая гелеобразующие вещества, эмульгаторы и буферы, если желательно. Для местного применения соединение согласно изобретению теоретически можно смешивать с любым набором вспомогательных средств для получения вязко-жидкого или кремоподобного препарата. Для перорального введения соединение согласно изобретению теоретически можно смешивать с носителями и разбавителями и формовать в таблетки или заключать в желатиновые капсулы. В случае таблеток может быть включено повышающее скольжение вещество для предотвращения застревания порошкообразных ингредиентов в формах и прилипания к пуансонам таблетирующей машины. Для этой цели могут использоваться, например, стеараты алюминия,магния или кальция, тальк или минеральное масло. Предпочтительные фармацевтические формы данного изобретения включают в себя капсулы, таблетки и инъекционные растворы. Особенно предпочтительными являются капсулы и таблетки. 19 Терапевтическое и профилактическое лечение, представляемое по этому изобретению,осуществляется на практике путем введения млекопитающему, в случае необходимости, дозы соединения формулы I или его фармацевтически приемлемых соли или сольвата, которая эффективна для подавления или лечения эпителиальной плоскоклеточной карциномы. Для этой цели лекарственные формы преимущественно могут быть представлены в единичной дозированной форме, причем предпочтительно, чтобы каждая упаковка дозированной формы содержала примерно от 5 до 500 мг(примерно от 5 до 50 мг в случае парентерального или ингаляционного введения и примерно от 25 до 500 мг в случае перорального или ректального введения) соединения формулы I. Могут применяться дозировки примерно от 0,5 до 300 мг/кг в сутки, предпочтительно 0,5-20 мк/кг активного ингредиента, хотя будет, конечно,вполне понятно, что количество соединения или соединений формулы I, которое в действительности будет вводиться, будет определяться врачом в свете всех значимых обстоятельств,включая патологическое состояние, которое нужно лечить, выбор соединения, которое нужно вводить, и выбор пути введения, и поэтому вышеприведенный предпочтительный интервал дозировки не предназначен для ограничения объема данного изобретения каким-либо образом. Конкретная доза соединения, вводимого согласно изобретению для получения терапевтического или профилактического эффектов,будет, конечно, определяться конкретными обстоятельствами,сопутствующими случаю,включая, например, путь введения, возраст, вес и реакцию отдельного пациента, патологическое состояние, которое нужно лечить, и тяжесть симптоматики у пациента. В основном соединения согласно изобретению более желательно вводить в концентрациях, которые будут в основном давать эффективные результаты, не вызывая каких-либо серьезных побочных эффектов, и их можно вводить или в виде единственной дозы или, если желательно, доза может быть разделена на соответствующие субъединичные дозы, вводимые через соответствующие сроки в течение дня. Хотя все соединения, приведенные в качестве иллюстрации выше, подтверждены примерами активности по подавлению LTD4, также обнаружено, что соединения, несущие единственную кислотную группу (R6), обладают значительно большей биологической активностью при пероральном приеме млекопитающими, чем те соединения, которые несут две такие кислотные группы. Таким образом, предпочтительное осуществление, когда соединения формулы I вводятся млекопитающим перорально, включает в себя введение соединений, несущих одну функциональную кислотную группу. 20 В следующих примерах лекарственных форм в качестве активных соединений могут использоваться любые соединения этого изобретения. Эти примеры являются только иллюстративными и никак не предназначены для ограничения объема этого изобретения. Препарат 1. Твердые желатиновые капсулы получают,используя следующие ингредиенты: Количество(мг/капсулу) 3-(2-(3-(2-Этил-4-(4-фторфенил)-5 гидроксифенокси)пропокси)-6-(4 карбоксифенокси)фенил)пропановая кислота Крахмал Стеарат магния Вышеприведенные ингредиенты смешивают, и этой смесью в количестве по 460 мг заполняют твердые желатиновые капсулы. Препарат 2. Таблетки получают, используя нижеприведенные ингредиенты: Количество Компоненты смешивают и прессуют с формированием таблеток, каждая весом 665 мг. Препарат 3. Изготавливают раствор для аэрозоля, содержащий следующие компоненты: Вес.% 3-[4-[7-карбокси-9-оксо-3-[3-[2-этил-4(4-фторфенил)-5-гидркосифенокси]пропокси]-9 Н-ксантенпропановая кислота Этанол Пропеллент 11 (трихлорфторметан) Пропеллент 12 (дихлордифторметан) Пропеллент 114 (дихлортетрафторэтан) Активное соединение растворяют в этаноле и раствор добавляют в пропеллент 11, охлажденный до -30 С, и переносят в заполняющее устройство. Необходимое количество затем подается в контейнер, который дополнительно заполняется предварительно смешанными пропеллентами 12 и 114 методом холодного заполнения или методом заполнения под давлением. Контейнеры затем снабжаются клапанными устройствами. Препарат 4. Таблетки, каждая с содержанием 60 мг активного ингредиента, изготавливаются следующим образом: 2-[2-пропил-3-[3-[2-этил-5-гидрокси-4-(4 фторфенил)фенокси]пропокси]фенокси]-бен 60 мг зойной кислоты натриевая соль Крахмал 45 мг Микрокристаллическая целлюлоза 35 мг Поливинилпирролидон (в виде 10% раствора 4 мг в воде) Карбоксиметилнатрийкрахмал 4,5 мг Стеарат магния 0,5 мг Тальк 1 мг Всего 150 мг Активный ингредиент, крахмал и целлюлозу пропускают через сито 45 U.S. и тщательно перемешивают. Раствор поливинилпирролидона смешивают с полученными порошками, которые затем пропускают через сито 14U.S. Гранулы, полученные таким образом, сушат при 50-60 С и пропускают через сито 18U.S. К гранулам затем добавляют карбоксиметилкрахмал, стеарат магния и тальк, предварительно пропущенные через сито 60 U.S., что после перемешивания прессуют на таблеточной машине с получением таблеток, каждая весом 150 мг. Препарат 5. Капсулы, каждая с содержанием 80 мг лекарственного вещества, изготавливают следующим образом: 5-[3-[2-(1-карбокси)этил]-4-[3-[2-этил-4-(4 фторфенил)-5-гидроксифенокси]-пропокси]фенил]-4-пентиновая кислота Крахмал Микрокристаллическая целлюлоза Стеарат магния Всего Активный ингредиент, целлюлозу, крахмал и стеарат магния перемешивают, пропускают через сито 45 U.S. и этой смесью в количестве 200 мг заполняют твердые желатиновые капсулы. Препарат 6. Суппозитории, каждая с содержанием 225 мг активного ингредиента, изготавливаются следующим образом: 3-(2-(3-(2-этил-4-(4-фторфенил)-5-гидроксифенокси)пропокси)-6-(4-карбоксифенокси)фенил)пропановая кислота Глицериды ненасыщенных или насыщенных жирных кислот до Активный ингредиент пропускают через сито 60 U.S. и суспендируют в глицеридах жирных кислот, предварительно расплавленных с применением минимально необходимого нагревания. Смесь затем выливают в форму для суппозиториев с номинальным объемом 2 г и дают остыть. 22 Препарат 7. Суспензии, каждая из которых содержит 50 мг лекарственного вещества на 5 мл дозу,изготавливаются следующим образом: 2-[2-пропил-3-[3-[2-этил-4-(4 фторфенил)-5-гидроксифенокси]пропокси]фенокси]-бензойная кислота Натрийкарбоксиметилцеллюлоза Сахар Метилпарабен Пропилпарабен Вещество, улучшающее вкус и запах Подкрашивающее вещество Очищенная вода до Лекарственное вещество пропускают через сито 45 U.S. и перемешивают с карбоксиметилцеллюлозой, сахаром и частью воды до образования суспензии. Парабены, улучшающие вкус и запах вещества, и подкрашивающее вещество растворяют и разбавляют в небольшом количестве воды и добавляют при перемешивании. Затем добавляют достаточное количество воды, чтобы получить необходимый объем. Препарат 8. Лекарственную форму для внутривенного введения готовят следующим образом: 2-[2-пропил-3-[3-[2-этил-4-(4-фторфенил)5-гидроксифенокси]пропокси]фенокси]бензойная кислота Изотонический раствор хлорида натрия Раствор вышеназванных ингредиентов обычно пациенту вводят внутривенно со скоростью 1 мл в минуту. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ лечения эпителиальной плоскоклеточной карциномы у млекопитающего, который включает в себя введение млекопитающему в случае необходимости эффективного количества соединения формулы или его фармацевтически приемлемой соли присоединения оснований, в которойR1 представляет собой С 1-С 5-алкил, С 1-С 4 алкокси, (C1-C4-алкил)тио, галоген или R2 замещенный фенил; каждый R2 и R1 независимо представляет собой водород, галоген, гидрокси, С 1-С 4-алкил,С 1-С 4-алкокси;Z представляет собой СН 2-СН 2 или СН 2 СН 2 СН 2 СН 2; А представляет собой -О-, -СН 2-, СН(R7 замещенный фенил)- или -С(СН 3)2-; каждый R7 представляет собой водород, С 1-С 4 алкил,R8 представляет собой водород или галоген; и при условии, что, когда Х представляет собой -О-, Y не является -О-. 2. Способ по п.1, где соединение представляет собой 2-[2-пропил-3-[3-[2-этил-4-(4 фторфенил)-5-гидроксифенокси]пропокси]фенокси]бензойную кислоту или ее фармацевтическую приемлемую соль или сольват. 3. Способ по п.1, где соединение представляет собой 3-(2-(3-(2-этил-4-(4-фторфенил)-5 гидроксифенокси)пропокси-6-(4-карбоксифенокси)-фенил)пропионовую кислоту или ее фармацевтическую приемлемую соль или сольват. 24 4. Способ по п.1, где соединение представляет собой 1-(4-карбоксиметокси)фенил-1-(1Hтетразол-5-ил)-6-(2-этил-4-(4-фторфенил)-5 гидроксифенокси)гексан или его фармацевтическую приемлемую соль или сольват. 5. Способ по п.1, где соединение представляет собой 3-[4-[7-карбокси-9-оксо-3-[3-[2-этил 4-(4-фторфенил)-5-гидроксифенокси]пропокси]9 Н-ксантенпропановую кислоту или ее фармацевтическую приемлемую соль или сольват. 6. Способ по п.1, где соединение представляет собой 5-[3-[2-(1-карбоксиэтил]-4-[3-[2 этил-4-(4-фторфенил)-5-гидроксифенокси]пропокси]фенил]-4-пентиновую кислоту или ее фармацевтическую приемлемую соль или сольват. 7. Способ по п.1-6, где млекопитающее является человеком.
МПК / Метки
МПК: A61P 35/00, A61K 31/055
Метки: лейкотриена, лечения, полости, антагонисты, карциномы, ротовой, плоскоклеточной, эпителиальной
Код ссылки
<a href="https://eas.patents.su/13-2742-antagonisty-lejjkotriena-dlya-lecheniya-epitelialnojj-ploskokletochnojj-karcinomy-rotovojj-polosti.html" rel="bookmark" title="База патентов Евразийского Союза">Антагонисты лейкотриена для лечения эпителиальной плоскоклеточной карциномы ротовой полости</a>
Предыдущий патент: Жидкие производные бензизохинолина
Следующий патент: Полипептид белка-106 наружной мембраны moraxella catarrhalis, днк, его кодирующие, и их применение
Случайный патент: Фунгицидные смеси на основе триазолов












