Производные бензопирана, обладающие антагонистическим действием в отношении лейкотриена.
Номер патента: 1680
Опубликовано: 25.06.2001
Авторы: Паломер Бенет Альберт, Паскуаль Авельяна Хайме, Карганико Хермано, Маулеон Касельяс Давид, Гарсия Перес Мария Луиса
Формула / Реферат
1. Соединение формулы I
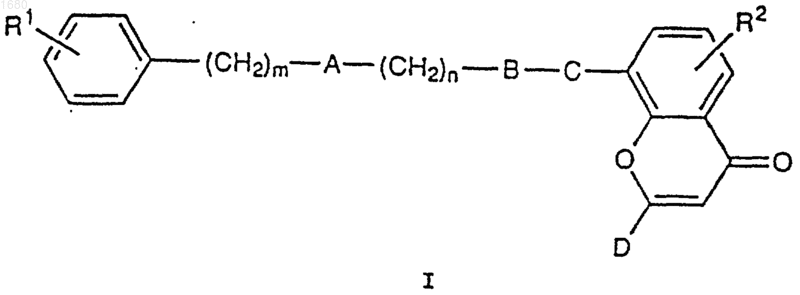
где А является атомом кислорода или серы или метиленовой группой;
В может быть
а) сконденсированным с бензолом гетероциклом
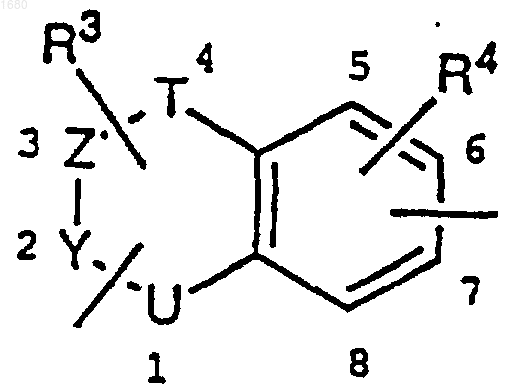
где U является атомом кислорода или серы или NR5 группой, где R5 является водородом или (С1-С4)алкилом, причем R5 группа является возможно замещенной заместителем, содержащим А, когда указанный заместитель связан с 1-м положением сконденсированного с бензолом гетероцикла;
Z и Y представляют собой два атома углерода, соединенных вместе простой или двойной связью;
Т является простой связью, метиленовой группой или карбонильной группой;
и где заместитель, содержащий А, связан с любым из возможных 1-, 2-, 3- или 4-ом положением сконденсированного с бензолом гетероцикла;
заместитель, содержащий С, связан с 6- или 7-м положением сконденсированного с бензолом гетероцикла;
б) фенильной группой
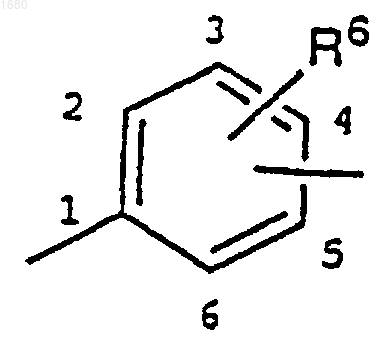
где заместитель, содержащий С, связан с фенильной группой в 3-, 4- или 5-м положении;
С является бирадикалом, который представляет собой
а) когда В является сконденсированным с бензолом гетероциклом, то группу -CONR7-, -CSNR7-, -SO2NR7-, -СН2O-, -СН=СН-, где R7 является водородом или метилом;
б) когда В является фенильной группой, то группу -SO2NR7-, -СН2O-, -СН=СН-, где R7 является водородом или метилом;
D является 5-тетразолилом или группой -COOR8, где R8 представляет собой водород, (С1-С4)алкильную или фенилалкильную группу из менее чем 10 атомов углерода;
R1, R2, R3, R4 и R6 являются независимо водородом, галогеном, (C1-C4) алкилом, -ОСН3 или -ОН;
m и n являются целыми числами от 0 до 4;
а также его сольваты и фармацевтически приемлемые соли и все возможные стереоизомеры или их смеси.
2. Соединение по п.1, где R1 и R2 являются водородом, фтором или хлором, и D является 5-тетразолилом или группой COOR8, где R8 является водородом, метилом, этилом или бензилом.
3. Соединение по любому из пп. 1 или 2, где В является сконденсированным с бензолом гетероциклом
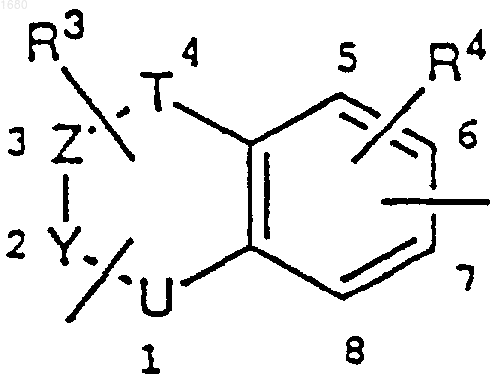
и С является -CONR7- или -СН=СН-.
4. Соединение по п.3, где R3 является водородом или метилом, и U является группой NR5, где R5 является водородом или метилом или может быть замещен заместителем, содержащим А.
5. Соединение по п.3, где R3 является водородом, R4 является водородом, фтором, хлором, метилом или метоксидом и U является кислородом.
6. Соединение по п.3, где заместитель, содержащий С, связан с 6-м положением центрального сконденсированного с бензолом гетероцикла.
7. Соединение по пп.4 и 6, где Т является простой связью или карбонильной группой, Y-Z является группой -СН=СН- и заместитель, содержащий А, связан с 1-м или 2-м положением центрального сконденсированного с бензолом гетероцикла.
8. Соединение по пп.5 и 6, где заместитель, содержащий А, связан со 2-м положением центрального сконденсированного с бензолом гетероцикла.
9. Соединение по любому из пп.3-8, где m и n являются целыми числами от 1 до 2.
10. Соединение по любому из пп.1 или 2, где В является замещенным фенилом
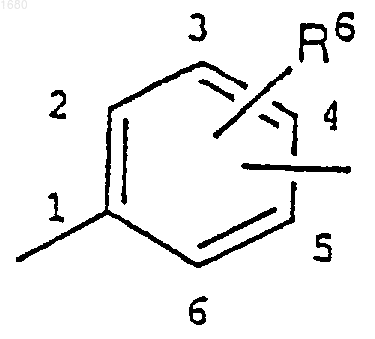
и С является -СН=СН-, -СН2O- или -SO2NR7-, где R7 является водородом или метилом.
11. Соединение по п.10, где заместители, содержащие А и С, связаны с фенильной группой в соответствующем пара положении.
12. Соединение по пп.10 и 11, где R6 является водородом, фтором, хлором, метилом или метоксидом, n равно 0, А является кислородом или серой и m равно от 3 до 5.
13. Соединение по п.1, выбранное из числа следующих
8-[2-(бензилоксиметил)хроман-6-карбоксамидо]-4-оксо-4Н-1-бензопиран-2-карбоновая кислота;
N-[4-оксо-2-(1Н-5-тетразолил)-4Н-1-бензопиран-8-ил]-2-(бензилоксиметил)хроман-6-карбоксамид;
8-[2-(3-фенилпропил)хроман-6-карбоксамидо]-4-оксо-4Н-1-бензопиран-2-карбоновая кислота;
N-[4-оксо-2-(1Н-5-тетразолил)-4Н-1-бензопиран-8-ил]-2-(3-фенилпропил)хроман-6-карбоксамид;
8-[2-(бензилоксиметил)бензофуран-5-карбоксамидо]-4-оксо-4Н-1-бензопиран-2-карбоновая кислота;
8-(2-бензилоксиметил-2,3-дигидробензофуран-5-карбоксамидо)-4-оксо-4Н-1-бензопиран-2-карбоновая кислота;
N-[4-оксо-2-(1Н-5-тетразолил)-4Н-1-бензопиран-8-ил]-2-бензилоксиметил-2.3-дигидробензофуран-5-карбоксамид;
8-[2-(3-фенилпропил)-2,3-дигидробензофуран-5-карбоксамидо]-4-оксо-4Н-1-бензопиран-2-карбоновая кислота;
N-[4-оксо-2-(1Н-5-тетразолил)-4Н-1-бензопиран-8-ил]-2-(3-фенилпропил)-2,3-дигидробензофуран-5-карбоксамид;
8-(2-бензилтиометил-2,3-дигидробензофуран-5-карбоксамидо)-4-оксо-4Н-1-бензопиран-2-карбоновая кислота;
8-[2-(4'-фторбензилоксиметил)-2,3-дигидробензофуран-5-карбоксамидо]-4-оксо-4Н-1-бензопиран-2-карбоновая кислота;
N-[4-оксо-2-(1Н-5-тетразолил)-4Н-1-бензопиран-8-ил]-2-(4'-фторбензилоксиметил)-2,3-дигидробензофуран-5-карбоксамид;
8-[7-хлор-2-(3-фенилпропил)-2,3-дигидробензофуран-5-карбоксамидо]-4-оксо-4Н-1-бензопиран-2-карбоновая кислота;
8-[2-(3-фенилпропил)-2,3-дигидробензофуран-5-карбоксамидо]-6-фтор-4-оксо-4Н-1-бензопиран-2-карбоновая кислота;
8-[4-хлор-2-(3-фенилпропил)-2,3-дигидробензофуран-5-карбоксамидо]-4-оксо-4H-1-бензопиран-2-карбоновая кислота;
8-[6-хлор-2-(3-фенилпропил)-2,3-дигидробензофуран-5-карбоксамидо]-4-оксо-4H-1-бензопиран-2-карбоновая кислота;
N-[4-oкco-2-(1H-5-тeтpaзoлил)-4H-1-бeнзoпиpaн-8-ил]-1-(4-фeнилбyтил)-3-метилиндол-5-карбоксамид;
8-[[4-(4-фенилбутокси)фенил]метилокси]-4-оксо-4Н-1-бензопиран-2-карбоновая кислота;
8-[[4-(4-фенилбутокси)фенил]сульфониламино]-4-оксо-4Н-1-бензопиран-2-карбоновая кислота;
8-[(Е)-2-[4-(4-фенилбутокси)фенил]этен-1-ил]-4-оксо-4Н-1-бензопиран-2-карбоновая кислота;
8-[(Е)-2-[4-(4-фенилбутокси)фенил]этен-1-ил]-4-оксо-2-(5-1Н-тетразолил)-4Н-1-бензопиран;
8-[(Е)-2-[4-[4-(4-фторфенил)бутокси]фенил]этен-1-ил]-4-оксо-4Н-1-бензопиран-2-карбоновая кислота;
8-[(Е)-2-[4-[4-(4-фторфенил)бутокси]фенил]этен-1-ил]-4-оксо-2-(5-1Н-тетразолил)-4Н-1-бензопиран;
8-[(Е)-2-[4-(4-фенилбутокси)-2-фторфенил]этен-1-ил]-4-оксо-4Н-1-бензопиран-2-карбоновая кислота;
8-[(Е)-2-[2-(4'-фторбензилоксиметил)-2,3-дигидробензофуран-5-ил]этен-1-ил]-4-оксо-4Н-1-бензопиран-2-карбоновая кислота;
8-[(Е)-2-[2-(4'-фторбензилоксиметил)-2,3-дигидробензофуран-5-ил]этен-1-ил]-4-оксо-2-(5-1 Н-тетразолил)-4Н-1-бензопиран;
8-[(Е)-2-[4-[4-(4-хлорфенил)бутокси]фенил]этен-1-ил]-4-оксо-2-(5-1Н-тетразолил)-4Н-1-бензопиран;
8-[(Е)-2-[4-[4-(4-метилфенил)бутокси]фенил]этен-1-ил]-4-оксо-2-(5-1Н-тетразолил)-4Н-1-бензопиран;
8-[(Е)-2-[4-[4-(4-метоксифенил)бутокси]фенил]этен-1-ил]-4-оксо-2-(5-1Н-тетразолил)-4Н-1-бензопиран;
8-[(Е)-2-[4-[4-[4-(изопропил)фенил]бутокси]фенил]-этен-1-ил]-4-оксо-2-(5-1Н-тетразолил)-4Н-1-бензопиран;
8-[(Е)-2-[4-[4-[4-(трет-бутил)фенил]бутокси]фенил]-этен-1-ил]-4-оксо-2-(5-1Н-тетразолил)-4Н-1-бензопиран;
8-[(Е)-2-[4-[4-(4-хлорфенил)пропилокси]фенил]этен-1-ил]-4-оксо-2-(5-1Н-тетразолил)-4Н-1-бензопиран;
8-[(Е)-2-[4-[4-(4-фторфенил)пропилокси]фенил]этен-1-ил]-4-оксо-2-(5-1Н-тетразолил)-4Н-1-бензопиран;
8-[(Е)-2-[4-[4-(4-метилфенил)пропилокси]фенил]этен-1-ил]-4-оксо-2-(5-1Н-тетразолил)-4Н-1-бензопиран;
8-[(Е)-2-[4-[4-(4-метоксифенил)пропилокси]фенил]этен-1-ил]-4-оксо-2-(5-1Н-тетразолил)-4Н-1-бензопиран;
8-[(Е)-2-[4-[4-[4-(изо-пропил)фенил]пропилокси]фенил]-этен-1-ил]-4-оксо-2-(5-1Н-тетразолил)-4Н-1-бензопиран;
8-[(Е)-2-[4-[4-[4-(трет-бутил)фенил]пропилокси]фенил]-этен-1-ил]-4-оксо-2-(5-1Н-тетразолил)-4Н-1-бензопиран.
14. Способ получения соединений общей формулы I по п.1 и их фармацевтически приемлемых солей, при котором когда в общей формуле I D является -COOR8, соединение общей формулы II
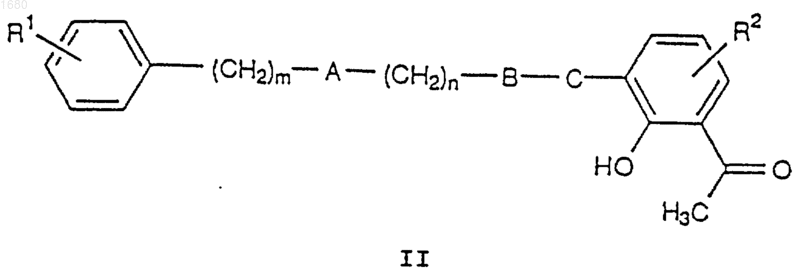
где R1, R2, А, В, С, m и n имеют вышеупомянутые значения, подвергают взаимодействию с имеющимся в продаже соединением III
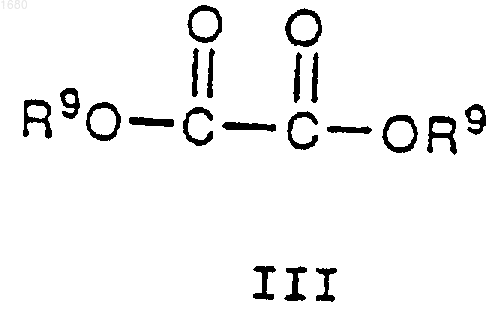
где R9 является остатком R8, исключая водород, в присутствии основания с получением соединения IV
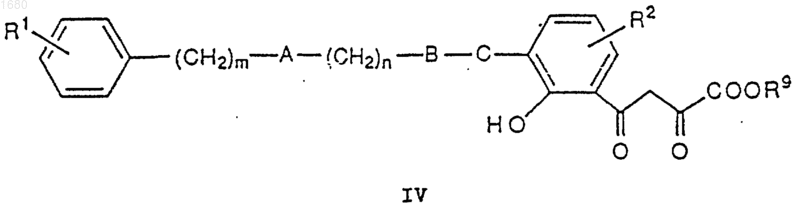
которое подвергают обработке кислотой с получением соединения V
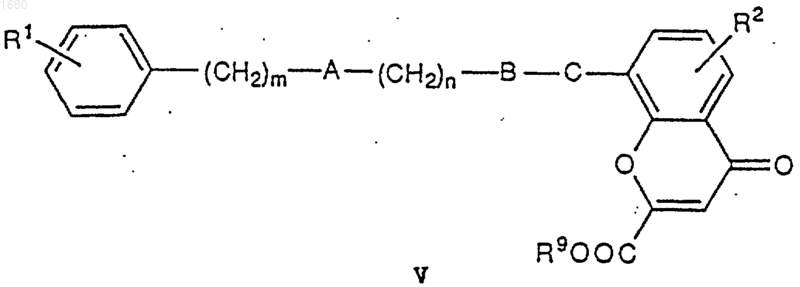
которое соответствует I, в котором D является COOR8 или, когда D является СООН в формуле I, превращают в I путем отщепления группы R9 посредством щелочного гидролиза;
и, если необходимо, соединение формулы I превращают в желаемую соль путем обработки основанием или подходящим ионообменником согласно обычным способам.
15. Способ получения соединений общей формулы I по п.1 и их фармацевтически приемлемых солей, при котором когда в общей формуле I D является 5-тетразолильной группой, соединение формулы VI
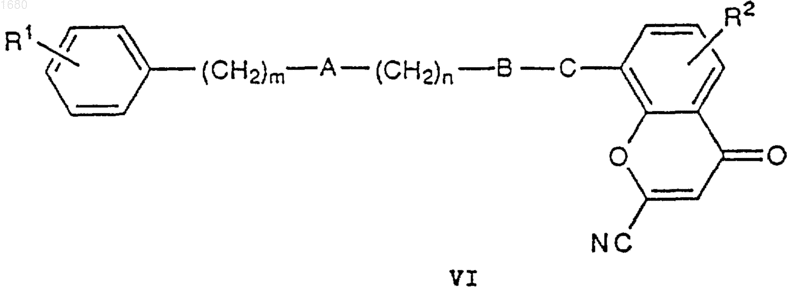
где R1, R2, А, В, С, m и n имеют вышеупомянутые значения, подвергают взаимодействию с азидом натрия с получением соединения VII
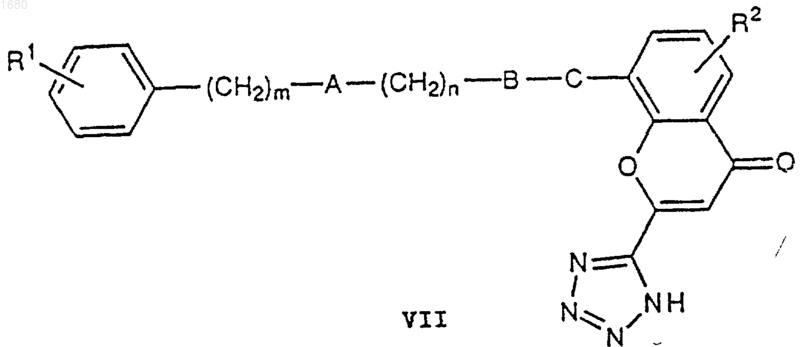
которое соответствует I, в котором D является 5-тетразолильной группой;
и, если необходимо, соединение формулы I превращают в желаемую соль путем обработки основанием или подходящим ионообменником согласно обычным способам.
16. Способ получения соединений общей формулы I по п.1 и их фармацевтически приемлемых солей, при котором когда в общей формуле I С является -CO-NR7-, соединение VIII
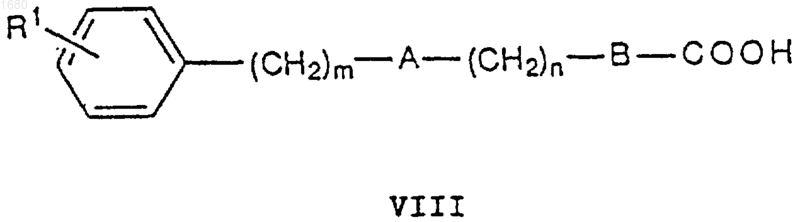
где R, А, В, С, m и n имеют вышеупомянутые значения, подвергают взаимодействию с соединением IX
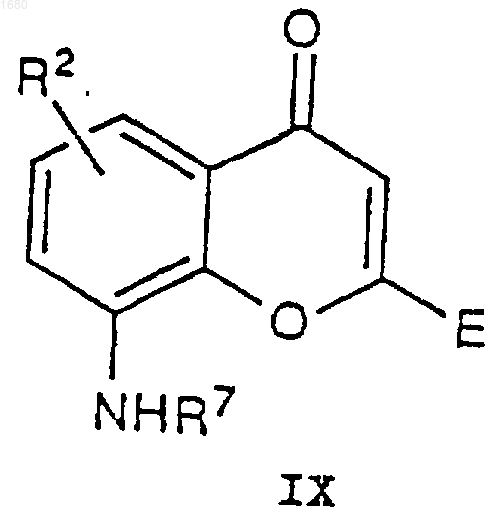
где R2 и R7 имеют вышеупомянутые значения, и Е может быть эквивалентен группе D в I или, когда D в формуле I является СООН, тогда Е содержит подходящую карбокси-защищающую группу, причем реакцию проводят, предварительно получая кислый хлорид соединения VIII согласно обычным способам, затем подвергают его взаимодействию с соединением IX в присутствии основания с получением таким образом соединения формулы X
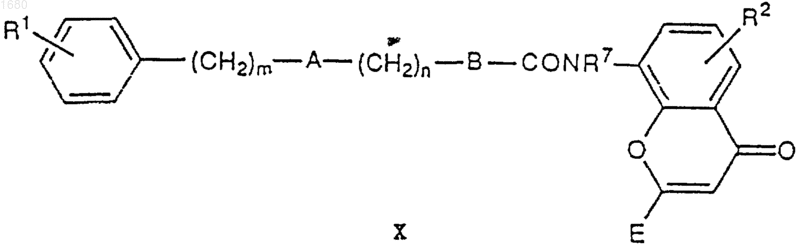
которое соответствует I, в котором С является -CON R7-, или превращают его в I, в котором С является -CONR7-, путем удаления любой СООН-защищающей группы, присутствующей в Е;
и, если необходимо, соединение формулы I превращают в желаемую соль путем обработки основанием или подходящим ионообменником согласно обычным способам.
17. Способ получения соединений общей формулы I по п.1 и их фармацевтически приемлемых солей, при котором
когда в общей формуле I С является -СН2O-, соединение формулы XI
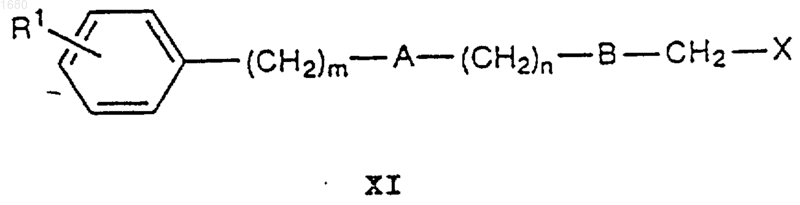
где R1, А, В, m и n имеют вышеупомянутые значения и Х является атомом хлора или брома или алкил- или арилсульфонатной группой, подвергают взаимодействию с соединением XII
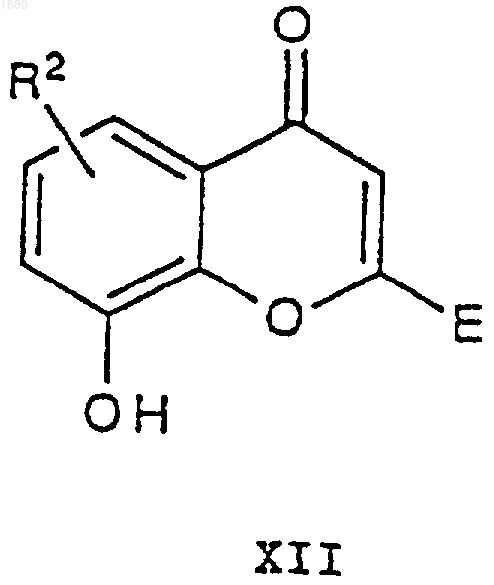
где R2 и Е имеют вышеупомянутые значения, в присутствии основания с получением соединения формулы XIII
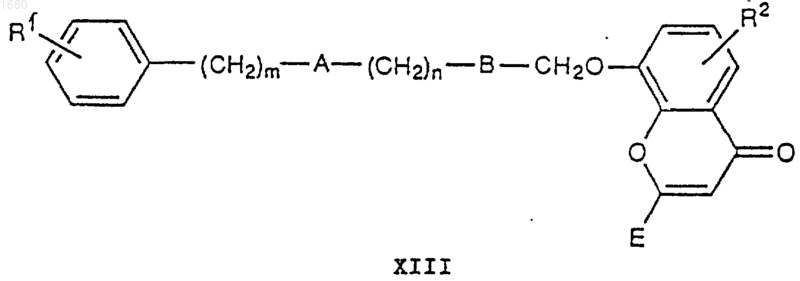
которое соответствует I, в котором С является -CH2O-, или превращают его в I, в котором С является -CH2O-, путем удалением любых СООН-защищающих групп, присутствующих в Е;
и, если необходимо, соединение формулы I превращают в желаемую соль путем обработки основанием или подходящим ионообменником согласно обычным способам.
18. Способ получения соединений общей формулы I по п.1 и их фармацевтически приемлемых солей, при котором, когда в формуле I С является -SO2NR7- и А является кислородом или серой, соединение XIV
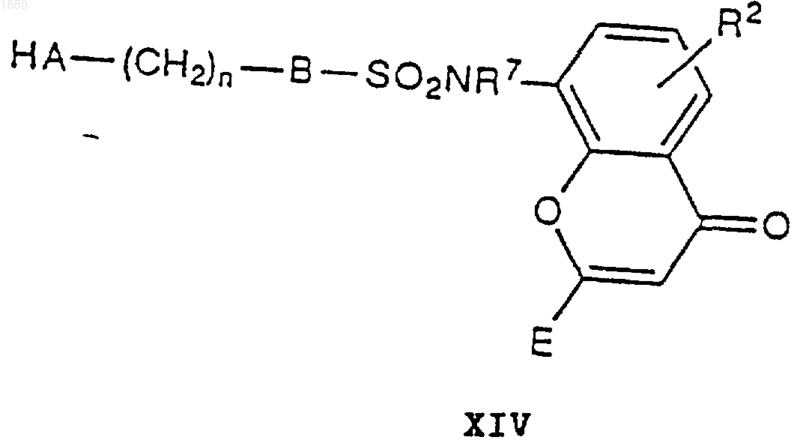
где R2, R7, В, Е и n имеют вышеупомянутые значения, и А является атомом кислорода или серы, подвергают взаимодействию с соединением XV
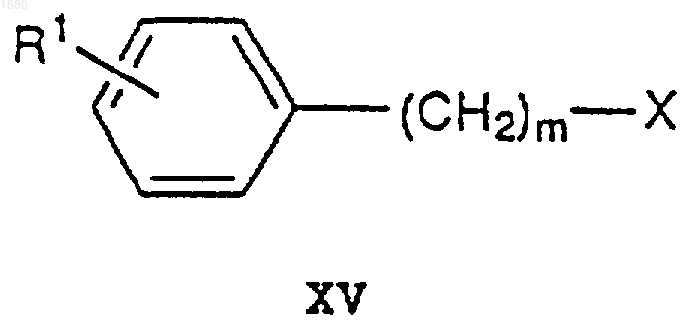
где R1, X и m имеют вышеупомянутые значения, в присутствии основания с получением соединения XVI
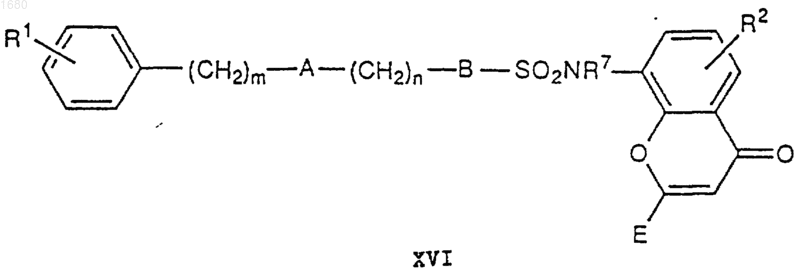
которое соответствует I, в котором С является -SO2NR7-, и А является кислородом или серой, или превращают его в I, в котором С является -SO2NR7-, и А является кислородом или серой, путем удаления любых СООН-защищающих групп, присутствующих в Е;
и, если необходимо, соединение формулы I превращают в желаемую соль путем обработки основанием или подходящим ионообменником согласно обычным способам.
19. Применение соединения по любому из пп.1-12 в приготовлении лекарственного средства для терапевтического лечения опосредованных лейкотриеном заболеваний.
20. Применение по п.19, отличающееся тем, что опосредованные лейкотриеном заболевания являются заболеваниями воспалительного или аллергического типа.
21. Применение по п.20, отличающееся тем, что воспалительными или аллергическими заболеваниями являются: бронхиальной астма, аллергический ринит, аллергический конъюнктивит, ревматоидный артрит, остеоартрит, тендинит, бурсит или псориаз.
22. Применение по п.19, отличающееся тем, что опосредованные лейкотриеном заболевания являются заболеваниями сердечно-сосудистого типа.
23. Применение по п.22, отличающееся тем, что заболеваниями сердечно-сосудистого типа являются: сердечная ишемия, инфаркт миокарда, коронарный спазм, сердечная анафилаксия, церебральный отек или эндотоксический шок.
Текст
1 Настоящее изобретение относится к новым производным бензопирана, их фармацевтически приемлемым солям и сольватам и фармацевтическим композициям, их содержащим, обладающим антагонистической активностью в отношении лейкотриена. Настоящее изобретение также относится к способу получения новых производных бензопирана, а также к их терапевтическому применению. Технологические предпосылки Хорошо известно, что большинство эйкозаноидов, простагландинов, лейкотриенов и родственных соединений происходят от жирной кислоты, имеющей 20 углеродов и 4 ненасыщенные связи, называемой арахидоновой кислотой (АК), которая существенно этерифицирует гидроксил во 2-м положении глицерина фосфолипидов, содержащихся в клеточных мембранах. АК высвобождается из содержащего ее фосфолипида под действием липазы, фосфолипазы A2 (PLA2) (CRC Handbook of Eicosanoids and Related Lipids, vol. II, Ed. A.L.Willis,CRS Press Inc., Florida (1989. Будучи высвобожденной, АК метаболизируется у млекопитающих главным образом двумя различными метаболическими путями или ферментными системами. При помощи циклооксигеназы из нее получаются простагландины и тромбоксаны, наиболее значимые из них - PGE2 и ТхА 2, которые непосредственно вовлечены в воспаление (Higgset al. Annals of Clinical Research, 16, 287 (1984. При помощи липоксигеназы из нее получаются лейкотриены, наиболее значимый из них -LTB4,и пептид-лейкотриены LTC4, LTD4 и LTE4. Все они также вовлечены в воспалительные реакции, проявляя хемотаксические активности,стимулируя секрецию лизосомных ферментов и играя важную роль в реакциях гиперчувствительности немедленного типа (Bailey and Casey,Ann. Rep. Med. Chem., 17, 203 (1982. Лейкотриен LTB4 является сильным хемотаксическим агентом, который способствует инфильтрации лейкоцитов и их последующей дегрануляции.(Salmon et al., Prog. Drug Res., 37,9 (1991. Было с очевидностью показано, что LTC4 и LTD4 оказывают сильное сужающее действие на бронхи человека (Dahlen et al., Nature, 288, 484 (1980,вызывая обструкцию дыхательных путей путем воспаления и выработки слизи (Marom et al.,Am. Rev. Resp. Dis., 126, 449 (1982, являясь таким образом вовлеченными в патогенез бронхиальной астмы, хронического бронхита, аллергического ринита и так далее. Пептидлейкотриены также приводят к экстравазации крови, вызываемой увеличением сосудистой проницаемости (Camp et al., Br. J. Pharmacol.,80, 497 (1883 и вовлечены в некоторые воспалительные заболевания, такие как атопическая экзема и псориаз. С другой стороны, наблюдали ряд эффектов, оказываемых пептид-лейкотриенами на сердечно-сосудистую систему человека; они главным образом вовлечены в патогенез 2 ишемической кардиопатии. Эта связь была подтверждена тем фактом, что коронарные артерии могут продуцировать эти медиаторы (Piomelli etLTD4, дали возможность предположить, что эти медиаторы могут способствовать другим сердечно-сосудистым нарушениям, таким как коронарный спазм, сердечная анафилаксия, церебральный отек и эндотоксический шок. Из вышесказанного следует, что регулирование биологической активности лейкотриенов с помощью соединений, которые ингибируют их высвобождение или антагонизируют их действие, представляет собой новый рациональный подход к предотвращению, элиминации или улучшению различных аллергических, анафилактических, воспалительных и тромботических состояний, в которые вовлечены такие медиаторы. В литературе были описаны некоторые соединения, которые могут рассматриваться как структурно родственные соединениям по настоящему изобретению и, кроме того, оказывающие ингибирующее действие на лейкотриены. Известны (Toda М. et al., ЕР 173, 516) N-[4 оксо-2-(1 Н-5-тетразолил)-4 Н-1-бензопиран-8 ил]-4-(4-фенилбутокси)бензамид и его производные как сильные антагонисты лейкотриенов. Все эти производные имеют в своей структуре амидную или тиоамидную группу в качестве моста между липофильной группировкой и углеродным циклом, содержащим кислотную группировку. Таким образом, соединения, описанные в настоящем изобретении, помимо других функциональных групп в качестве мостов между другими липофильными и полярными группировками, могут с таким же успехом иметь амиды, в любом случае такие производные не включены в общую формулу патентаToda et al. С другой стороны, производные по настоящему изобретению обладают преимуществом, заключающемся в очень высокой пероральной биологической доступности благодаря их метаболической и/или химической стабильности. С другой стороны, известны (Huang F.C. etal., US 4977162 и US 5082849) 4-оксо-7-3-(2 хинолинилметокси)фенил]метилокси]-2-(1 Н-5 тетразолил)-4 Н-1-бензопиран и его производные как сильные антагонисты лейкотриенов. Все названные соединения являются производными хинолина, содержащими простые эфиры,тиоэфиры, сульфоксиды, сульфоны, амиды, кетоны, винилены и амины в качестве мостов между гетероциклом хромана или его эквивалентом с кислотной функцией и хинолинсодержащей липофильной группировкой. Таким образом, такие соединения отличаются от соединений по настоящему изобретению тем, что содержат в их общей формуле хинолин, причем 3 этот гетероцикл никогда не присутствует в общей формуле и формуле изобретения настоящего изобретения. Однако получение соединений с высокой антагонистической активностью в отношении лейкотриенов и хорошей биодоступностью при пероральном введении все еще остается нерешенной до настоящего времени проблемой в ряду антагонистов. В настоящем изобретении предложены серии новых соединений, которые оказывают вышеупомянутое антагонистическое действие, показывают хорошую адсорбцию при пероральном введении и применимы в терапии. Описание изобретения В настоящем изобретении предложены новые производные бензопирана общей формулы I- А является атомом кислорода или серы или метиленовой группой;- U является атомом кислорода или серы или NR5 группой, где R5 является водородом или (С 1-С 4)алкилом, причем R5 группа является возможно замещенной заместителем, содержащим А, когда указанный заместитель связан с 1 м положением сконденсированного с бензолом гетероцикла;- Z и Y представляют собой два атома углерода, связанных вместе простой или двойной связью;- Т является простой связью, метиленовой группой или карбонильной группой; и где:- заместитель, содержащий А, связан с любым одним из возможных 1-, 2-, 3- или 4-го положений сконденсированного с бензолом гетероцикла; где заместитель, содержащий С, связан с фенильной группой по 3-, 4- или 5-му положению; 4 а) когда В является сконденсированным с бензолом гетероциклом, то -CONR7-, -CSNR7-,-SO2NR7-, -CH2O-, -СН=СН- группу, где R7 является водородом или метилом; б) когда В является фенильной группой, то-SO2NR7-, -СН 2O-, -СН=СН- группу, где R7 является водородом или метилом;- D является 5-тетразолилом или -COOR8 группой, где R8 представляет собой водород,(С 1-С 4)алкильную или фенилалкильную группу из менее чем 10 атомов углерода;-m и n являются целыми числами от 0 до 4. В настоящем изобретении также предложен способ получения новых производных бензопирана, а также их терапевтическое применение. Настоящее изобретение также относится к сольватам и фармацевтически приемлемым солям соединений формулы I и, в частности, к солям, представленным формулой Ia, где M+ является катионом щелочного металла(например Na+, К+), или он представляет собой половинное количество катиона щелочноземельного метала (например 1/2 Са 2+, 1/2 Мg2+), или катион, полученный из соли амина или аммония (например этаноламмония, диэтаноламмония, триэтаноламмония, трис(гидроксиметил)метиламмония). Соединения формулы I могут иметь в своей структуре один или более чем один асимметричный углерод. Настоящее изобретение включает в себя все возможные стереоизомеры, также как и их смеси. Предпочтительными соединениями являются те, в которых R1 и R2 являются водородом,фтором или хлором, и D является 5-тетразолилом или COOR8 группой, где R8 является водородом, метилом, этилом или бензилом. Предпочтительными соединениями также являются те, в которых В является сконденсированным с бензолом гетероциклом, а С является -CO-NR7- или -СН=СН- группой. Дополнительными предпочтительными соединениями являются соединения общей формулы I, в которых В является фенильной группой, и С является -СН=СН-, -CH2O- или-SO2NR7- группой. Наиболее предпочтительными являются соединения формулы I, где R3 является водородом или метилом, С является -CO-NR7- или-СН=СН- группой, m и n являются целыми чис 5 лами от 1 до 2, В является сконденсированным с бензолом гетероциклом, где Y-Z представляет собой два атома углерода, связанных двойной связью, Т является простой связью или карбонильной группой, и U является NR5 группой, гдеR5 является водородом или метилом или может быть замещен заместителем, содержащим А, и где заместитель, содержащий С, связан с 6-м положением сконденсированного с бензолом гетероцикла, и заместитель, содержащий А, связан с 1- или 2- положением сконденсированного с бензолом гетероцикла. Наиболее предпочтительными также являются соединения формулы I, где R3 является водородом, R4 является водородом, фтором,хлором, метилом или метоксидом, С является-CONR7- или -СН=СН- группой, m и n являются целыми числами от 1 до 2, В является сконденсированным с бензолом гетероциклом, где Y-Z представляет собой два атома углерода, связанных простой или двойной связью, Т является простой связью или метиленовой группой, и U является атомом кислорода, и где заместитель,содержащий С, связан с 6- положением сконденсированного с бензолом гетероцикла, и заместитель, содержащий А, связан со 2- положением сконденсированного с бензолом гетероцикла согласно вышеприведенной нумерации. Наиболее предпочтительными также являются соединения общей формулы I, где С является -СН=СН-, -CH2O- или -SO2NR7- группой,n является 0, m является целым числом от 3 до 5, и В представляет собой фенильную группу, в которой заместители, содержащие А и С, связаны с фенильной группой в соответственном относительном пара положении. Наиболее предпочтительными соединениями формулы I по настоящему изобретению являются следующие: 8-[2-(бензилоксиметил)хроман-6-карбоксамидо]-4-оксо-4 Н-1-бензопиран-2-карбоновая кислота 7 8-[(Е)-2-[4-[4-(4-метоксифенил)бутокси] фенил]этен-1-ил]-4-оксо-2-(5-1 Н-тетразолил)4 Н-1-бензопиран; 8-[(Е)-2-[4-[4-[4-(изо-пропил)фенил)бутокси]фенил]-этен-1-ил]-4-оксо-2-(5-1 Н-тетразолил)-4 Н-1-бензопиран; 8-[(Е)-2-[4-[4-[4-(трет-бутил)фенил)бутокси]фенил]-этен-1-ил]-4-оксо-2-(5-1 Н-тетразолил)-4 Н-1-бензопиран; 8-[(Е)-2-[4-[4-(4-хлорфенил)пропилокси] фенил]этен-1-ил]-4-оксо-2-(5-1 Н-тетразолил)4 Н-1-бензопиран; 8-[(Е)-2-[4-[4-(4-фторфенил)пропилокси] фенил]этен-1-ил]-4-оксо-2-(5-1 Н-тетразолил)4 Н-1-бензопиран; 8-[(Е)-2-[4-[4-(4-метилфенил)пропилокси] фенил]этен-1-ил]-4-оксо-2-(5-1 Н-тетразолил)4 Н-1-бензопиран; 8-[(Е)-2-[4-[4-(4-метоксифенил)пропилокси]фенил]этен-1-ил]-4-оксо-2-(5-1 Н-тетразолил)-4 Н-1-бензопиран; 8-[(Е)-2-[4-[4-[4-(изо-пропил)фенил]пропилокси]фенил]-этен-1-ил]-4-оксо-2-(5-1 Нтетразолил)-4 Н-1-бензопиран; 8-[(Е)-2-[4-[4-[4-(трет-бутил)фенил]пропилокси]фенил]-этен-1-ил]-4-оксо-2-(5-1 Нтетразолил)-4 Н-1-бензопиран; а также эфиры карбоновых кислот, описанные в примерах. Согласно настоящему изобретению, соединения общей формулы I получают посредством одного из следующих способов: а) когда в общей формуле I D является-COOR8, исходное соединение общей формулы 8 подвергают обработке концентрированной или разбавленной соляной кислотой в подходящем растворителе, таком как этанол, метанол, тетрагидрофуран или их смеси, при температуре,варьирующей от 25 С до температуры флегмообразования растворителя, в течение времени от 1 до 24 ч, с получением соединения V, которое соответствует I, где D является -COOR8 или, когда D является -СООН в формуле I, превращают в I, удаляя группу R9 щелочным гидролизом путем обработки подходящим основанием, таким как гидроксид лития, натрия или калия, в водном растворе в подходящем органическом растворителе, таком как метанол, этанол или тетрагидрофуран, при температуре, варьирующей между 0 С и температурой флегмообразования растворителя, в течение промежутка времени от 30 мин до 18 ч. б) когда в общей формуле I D является 5 тетразолильной группой, исходное соединение общей формулы VI где R1, R2, А, В, С, m и n имеют вышеупомянутые значения, подвергают взаимодействию с имеющимся в продаже соединением III, где R1, R2, А, В, С, m и n имеют вышеупомянутые значения, подвергают взаимодействию с азидом натрия в присутствии слабой кислоты,такой как хлорид аммония или гидрохлорид пиридиния, в подходящем растворителе, таком как N,N-диметилформамид, при температуре между 25 С и температурой флегмообразования растворителя, в течение промежутка времени от 1 до 24 часов, таким образом получая соединение VII, где R9 является остатком R8 с исключением водорода, в присутствии алкоксида металла, такого как метоксид или этоксид натрия, в подходящем органическом растворителе, таком как сопряженный спирт соответствующего основания,этиловый эфир, тетрагидрофуран или их смеси,при температуре, варьирующей от 50 до 85 С,в течение периода времени между 3 и 18 ч. Полученное в результате соединение IV которое соответствует I, где D является 5 тетразолильной группой. в) в другом способе получения соединения общей формулы I, где С является -CO-NR7-, исходное соединение VIII где R2 и R7 имеют вышеупомянутые значения, и Е может быть эквивалентно группе D в I или,когда D в формуле I является СООН, тогда Е содержит подходящую карбокси-защищающую группу, например метиловый, этиловый или бензиловый эфир. Реакцию между VIII и IX проводят, предварительно получая кислый хлорид или соединение VIII путем реакции взаимодействия с избытком оксалилхлорида при температуре, варьирующей между 50 и 80 С, в течение промежутка времени от 30 мин до 1,5 ч, и впоследствии подвергая его взаимодействию с соединением IX в присутствии основания, такого как триэтиламин, 4-диметиламинопиридин или пиридин, в подходящем апротонном растворителе, таком как хлороформ, метиленхлорид или N,N-диметилформамид, при температуре, варьирующей между 0 и 40 С, в течение промежутка времени от 3 до 24 ч. Полученное в результате соединение формулы X, 001680N,N-диметилформамид при температуре, варьирующей между 25 и 80 С, в течение периода времени от 5 до 48 ч. Полученное в результате соединение формулы XIII которое соответствует I, где С является -СН 2 О-,или превращается в I, где С является -СН 2O-,путем удаления любых СООН - защищающих групп, присутствующих в Е, так, когда Е является, например, метиловым или этиловым эфиром, она может быть удалена путем щелочного гидролиза, как описано выше для получения I,где D=COOH, начиная с V. д) В способе получения соединения общей формулы I, где С является -SO2NR7-, и А является кислородом или серой, исходное соединение XIV где R2, R7, В, Е и n имеют вышеупомянутые значения, и А является атомом кислорода или серы, подвергают взаимодействию с соединением XV которое соответствует I, где С является -CONR7,или превращается в I, где С является -CONR7-,путем удаления любых СООН защищающих групп, присутствующих в Е, так, когда Е является, например, метиловым или этиловым эфиром, она может быть удалена путем щелочного гидролиза, как описано выше для получения I,где D=COOH, начиная c V. г) В способе получения соединения общей формулы I, где С является -CH2O-, исходное соединение формулы XI, где R1, А, В, m и n имеют вышеупомянутые значения, и Х является атомом хлора или брома либо группой алкил- или арилсульфоната, подвергают взаимодействию с соединением XII, где R2 и Е имеют вышеупомянутые значения, в присутствии основания, такого как гидроксид,алкоксид или карбонат металла, в подходящем где R1, X и m имеют вышеупомянутые значения. Реакцию между XIV и XV проводят, предварительно получая соль XIV путем реакции взаимодействия с основанием, подходящим для pka спирта или тиола, таким как гидрид, алкоксид,гидроксид или карбонат металла, в подходящем растворителе, таком как N,N-диметилформамид или тетрагидрофуран, при температуре, варьирующей между 25 и 80 С, в течение промежутка времени от 2 до 18 ч. Полученное в результате соединение XVI-SO2NR7-, и А является кислородом или серой,или превращается в I, где С является -SO2NR7-,и А является кислородом или серой, путем удаления любых COOH - защищающих групп, присутствующих в Е, так, когда Е является, например, метиловым или этиловым эфиром, она может быть удалена путем щелочного гидролиза, 11 как описано для получения I, где D=COOH, начиная c V. е) Соединения общей формулы I, где С является -CSNR7-, получают, начиная с соединений формулы I, где А является -CONR7-, путем обработки реактивом Лавессона (Lawesson's) в условиях, описанных в литературе (Clausen К.Et al., Tetrahedron, 1981, 37, 3635). Когда желаемая специфическая соль общей формулы Ia, соединение I может быть обработано основанием или ионообменной смолой, подходящей для этой цели, согласно обычным химическим методам. Так например, I может быть обработано гидроксидом натрия или трис (гидроксиметил)метиламином в подходящем растворителе, таком как смеси водаметанол или этанол, в течение периода времени от 15 мин до 2 ч, при температуре, варьирующей между 25C и температурой флегмообразования растворителя. Исходное соединение формулы VI может быть получено, начиная с соединения формулыV, посредством способа, представленного на схеме 1. Схема 1 В этой последовательности соединение VI может быть получено путем дегидратации карбоксамида XVII, например, с помощью фосфористого оксихлорида, в растворителе, таком какN,N-диметилформамид, при температуре, варьирующей между 0 и 50 С, в течение промежутка времени от 3 до 24 ч (стадия 2). КарбоксамидXVII может быть получен путем аминолиза сложного эфира V, например, путем обработки газообразным аммиаком в подходящем растворителе, таком как метанол, этанол, тетрагидрофуран или их смесь, при температуре, варьирующей от -30 и 25 С, в течение промежутка времени от 15 мин до 24 ч (стадия 1). 12 Исходное соединение формулы IIa, то есть общей формулы II, где С является -CO-NR7,может быть получено, например, путем реакции взаимодействия соединения VIII с соединением где R2 и R7 имеют вышеупомянутые значения,следуя тому же способу, что описан для получения соединения X, начиная с VIII и IX. Исходное соединение формулы IIб, то есть общей формулы II, где С является -СН=СН-,может быть получено, например, с помощью способа, представленного на схеме 2. Схема 2 В этой последовательности исходное соединение XX может быть получено, например,посредством реакции Виттига (Wittig) между соединением XIX и имеющейся в продаже солью метилфосфония в присутствии подходящего основания, такого как бутиллитий, амид натрия или бис(триметилсилил)амид лития, в инертном растворителе, таком как тетрагидрофуран или этиловый эфир, при температуре,варьирующей между 0 и 25 С, и в течение промежутка времени от 45 мин до 36 ч (стадия 3). Соединение IIб может быть получено посредством реакции взаимодействия соединенияXX с соединением XXI в условиях, общих для реакции внедрения олефинов, катализируемой комплексами палладия (0) (реакция Хека(Heck. Затем реакцию между XX и XXI проводят в присутствии ацетата палладия (II) и триэтиламина в подходящем растворителе, таком как ацетонитрил, при температуре флегмообразования растворителя, в течение промежутка времени от 10 до 48 ч (стадия 4). Исходное соединение формулы VIIIa, то есть общей формулы VIII, где В является сконденсированным с бензолом гетероциклом где R3, R4, Y-Z и Т имеют вышеупомянутые значения, U является атомом кислорода или серы, и -СООН группа связана с бензольным кольцом в пара-положении к U атому, может быть получено, например, начиная с соединенияXXII, где R3, R4, Y-Z, Т и n имеют вышеупомянутые значения, и G является атомом водорода,хлора, брома или группой COOR9, где R9 представляет собой группы, определенные выше,согласно любому из способов синтеза, представленных на схеме 3. Схема 3XXV, в котором А = кислород, где R1, R3, R4, Т,Y-Z, G, m и n представляют собой группы и величины, определенные выше, и U является кислородом или серой, получают, например, подвергая соединение XXII действию основания,такого как гидрид натрия или гидрид калия, и затем подвергая его взаимодействию с соединением XXVI, имеющемся в продаже или легко получаемым через схожие химические способы,где R1 представляет собой группы, определенные выше, и М является, когда А является кислородом, атомом брома или хлора или алкилили арил-сульфонатной группой, в подходящем органическом растворителе, таком как бензол,N,N-диметилформамид или тетрагидрофуран,при температуре, варьирующей между 0 и 14 25 С, в течение промежутка времени от 3 до 24 ч (стадия 6). Соединение XXV, где А является серой,может быть получено, например, путем реакции взаимодействия соединения XXIII, где R3, R4, G и n имеют вышеупомянутые значения, и ТfO представляет собой трифторметансульфонатную группу, с соединением XXIV, где М является SH группой (тиол), имеющемся в продаже или легко получаемым через схожие химические способы, в присутствии основания, такого как гидроксид калия, метоксид натрия или этоксид натрия, в подходящем растворителе, таком как этанол, метанол, диметилсульфоксид илиN,N-диметилформамид, при температуре, варьирующей от 0 до 25 С, в течение промежутка времени от 4 до 24 ч (стадия 7). Соединение XXV, где А является метиленовой группой, получают посредством реакции взаимодействия соединения XXIII, где R3, R4, G и n имеют вышеупомянутые значения, с соединением XXIV, где М является МgВr группой, в присутствии каталитических количеств соли меди (I), в подходящем растворителе, таком как этиловый эфир или тетрагидрофуран, при температуре между 0 С и флегмообразованием растворителя, и в течение промежутка времени от 2 до 24 ч (стадия 7). Соединение XXIV с М = МgВr получают, начиная с имеющегося в продаже бромида и магния, согласно способам, разработанным для получения реагентов Гриньяра(Grignard). Соединение XXIII получают, начиная с соединения XXII, посредством его реакции с трифторметансульфоновым ангидридом в присутствии пиридина или триэтиламина в метиленхлориде, при температуре между -10 и 25 С,в течение промежутка времени от 4 до 24 ч(стадия 8), посредством щелочного гидролиза,как описано для получения I с D = СООН, начиная с V. Соединение VIIIa может быть получено,начиная с XXV, где G является водородом, путем его помещения в условия реакции Вильсмайера-Хаака (Vilsmeier-Haack) и затем окисления полученного в результате альдегида XXVI до соответствующей карбоновой кислоты с помощью, например, реагента Джонса (Jones). Соединение XXVI, таким образом, получают посредством реакции взаимодействия XXV с фосфористым оксихлоридом в N,N-диметилформамиде или N-метилформанилиде при температуре между 25 и 100 С, и в течение промежутка времени от 1 до 24 ч (стадия 9). ОбработкаXXVI триоксидом хрома в присутствии серной кислоты и воды в подходящем растворителе,таком как ацетон, при температуре между 0 и 25 С и в течение промежутка времени от 4 до 24 15 ч позволяет получить соединение VIIIa (стадия 10). Соединение VIIIa может быть получено,начиная с XXV, где G является хлором или бромом, путем замещения галогена нитрильной группой в условиях реакции Розенмунда-Брауна(Rosenmund-von Braun) и последующего гидролиза нитрильной группы до карбоновой кислоты. Таким образом, соединение XXVII получают путем реакции взаимодействия соединенияXXV, где G является атомом хлора или брома, с цианидом меди (I) в подходящем высококипящем растворителе, таком как N-метилпирролидинон, при температуре, варьирующей от 150 до 230 С, в течение промежутка времени от 2 до 18 ч (стадия 11). Иначе соединение XXVII, где А является кислородом, может быть получено путем проведения стадий 6 и 11 в обратном порядке. Наконец, соединение VIIIa может быть получено, начиная с XXVII, путем щелочного гидролиза в присутствии гидроксида натрия или калия в подходящем растворителе, таком как этанол, тетрагидрофуран или диоксан, при температуре между 25 и флегмообразованием растворителя, за период времени от 2 до 24 ч (стадия 12). Исходное соединение формулы VIIIб 16 где R3, R4, Т, Y-Z и n имеют вышеуказанные значения, U является кислородом или серой, и G является атомом хлора или брома, посредством одного из способов синтеза, описанных выше для получения XXV, начиная с XXII. Исходное соединение формулы VIIIв, то есть общей формулы VIII, где В является сконденсированным с бензолом гетероциклом, где U является атомом азота, N-замещенным заместителем, содержащим А, Т является простой связью, и Y-Z является СН=СН, R1, R3, R4,A, m и n имеют вышеупомянутые значения, и R3 является (С 1-С 4)алкилом в 3- положении гетероцикла, может быть получено, например, согласно последовательности синтеза, представленной на схеме 4. Схема 4 то есть общей формулы VIII, где В является сконденсированным с бензолом гетероциклом где R3, R4, Y-Z и Т имеют вышеупомянутые значения, U является атомом кислорода или серы, и -СООН группа связана с 7- положением сконденсированного с бензолом гетероцикла,может быть получено, начиная с соединения где G является атомом хлора или брома, согласно тому же способу синтеза, что и описанный для получения VIIIa, начиная с XXV, согласно стадиям (11) и (12). Соединение формулы XXVIII может быть получено, начиная с соединения XXIXXXXI может быть получено путем этерификации имеющегося в продаже соединения XXX согласно разработанным способам синтеза (стадия 13). Начиная с XXXI, соединение XXXII может быть получено (стадия 14) посредством формилирования в условиях, обычно описываемых для реакции Вилсмайера-Хаака (VilsmeierHaack). Соединение XXXIV может быть получено путем N-алкилирования соединения XXXII соединением XXXIII, имеющимся в продаже или легко получаемым посредством сходных химических превращений, где Q является хорошей уходящей группой, такой как атом хлора или брома или алкил- или арилсульфонатная группа,в присутствии подходящего основания, такого как трет-бутоксид калия, в подходящем растворителе, таком как N,N-диметилформамид, при температуре между 25 и 100 С, в течение промежутка времени от 2 до 24 ч (стадия 15). Соединение XXXV, где R3 является метилом, получают путем восстановления формильной группы соединения XXXIV (стадия 16). Указанное превращение может быть проведено,например, с цианоборгидридом натрия в при 17 сутствии иодида цинка в подходящем растворителе, при температуре между 25 и 90 С и в течение промежутка времени от 1 до 18 ч. Соединение XXV, где R3 является (С 1-С 4)алкильной группой, отличной от метильной группы, может быть получено в посредством реакции Виттига(Wittig) с подходящей солью фосфония с последующим восстановлением полученного олефина путем гидрогенолиза в атмосфере водорода в присутствии палладиевого катализатора и в подходящем растворителе (стадия 16). Соединение VIIIB может быть получено,начиная с XXXV (стадия 17), посредством щелочного гидролиза как описано для получения I с D=COOH, начиная с V. Исходное соединение формулы VIIIг, например, общей формулы VIII, где В является сконденсированным с фенолом гетероциклом где U является NR5 группой, Т является карбонильной группой, и Y-Z является СН=СН группой, R3 является водородом, R5 является (С 1-С 4) алкилом, и R1, R2, X, m и n представляют собой группы и значения, определенные выше, может быть получено, например, согласно последовательности синтеза, представленной на схеме 5. Схема 5 В этой последовательности синтеза соединение XXXVI может быть легко получено путем реакции взаимодействия имеющейся в продаже кислоты Мелдрума (Meldrum) с сульфидом углерода с последующим метилированием с помощью метилйодида согласно способам, описанным в литературе. Соединение XXXVIII получают путем реакции взаимодействия XXXVI с реагентом Гриньяра (Grignard) XXXVII, получаемого начиная с соответствующего бромида,следуя способам, разработанным для получения 18 органических соединений магния, согласно способу, описанному для получения XXV с А=СН 2,начиная с XXIII (стадия 18). Реакция взаимодействия XXXVIII с соединением XXXIX позволяет получить 4-хинолон XL (стадия 19). Соединение XLI получают путем N-алкилирования соединения XL в присутствии подходящего основания, такого как гидрид натрия или калия, в подходящем растворителе, таком какN,N-диметилформамид или бензол, при температуре между 0 и 100 С и в течение промежутка времени от 4 до 24 ч (стадия 20). Щелочной гидролиз соединения XLI согласно способам,описанным выше, например, в получение I, гдеD=COOH, начиная с V, позволяет получить соединение VIIIг (стадия 21). Исходное соединение формулы VIIIд то есть общей формулы VIII, где В является фенильной группой, замещенной в любом одном из своих свободных положений R6 группой, может быть получено, начиная с соединения XLII имеющегося в продаже или легко получаемого с помощью сходных химических способов, где R6 и n имеют вышеупомянутые значения, и К может представлять собой G или формильную группу (К=СНО), следуя одному из способов синтеза, используемых для получения VIIIa,начиная с XXII. В частности, когда n равно 0, соединение формулы VIIIд может быть получено, следуя двухстадийному способу. Первая стадия включает в себя реакцию взаимодействия соединенияXLII, где n=0 и k=COOR9, имеющегося в продаже или легко получаемого, начиная со схожих химических способов, с соединением XXIV, где М является -ОН, в общих условиях реакции Мицунобу (Mitsunobu); то есть путем реакции взаимодействия XLII (с n=0) с XXIV (с М=ОН) в присутствии диэтилазодикарбоксилата и трифенилфосфина в подходящем растворителе,таком как тетрагидрофуран, при комнатной температуре и в течение промежутка времени от 24 до 72 ч. С другой стороны, реакция Мицунобу может быть заменена реакцией Oалкилирования Вильямсона (Williamson), подвергая соединение XLII с n=0 и k=COOR9 действию основания, такого как гидроксид или карбонат металла, и впоследствии подвергая его реакции взаимодействия с соединением XXIV,где М является атомом хлора или брома или группой алкил- или арилсульфоната, в подхо 19 дящем органическом растворителе, таком какN,N-диметилформамид, при температуре между 0 и 100 С, в течение промежутка времени от 2 до 24 ч. На второй стадии соединение VIIIд получают путем гидролиза эфира, полученного на предыдущей стадии, следуя способу, описанному для получения I с D=COOH, начиная c V. Исходные соединения XI и XIX могут быть получены, например следуя способам синтеза, показанным на схеме 6. Схема 6XLIII может быть получено путем восстановления соединения VIII, например алюмогидридом лития или бораном в инертном растворителе,таком как этиловый эфир или тетрагидрофуран,при температуре, варьирующей от 25C до флегмообразования растворителя, в течение промежутка времени от 2 до 24 ч (стадия 22). Соединение XI, где Х является группой алкилили арилсульфоната, получают, начиная с соединения XLIII, путем реакции взаимодействия с хлоридом алкил- или арилсульфоната, например мезил- или тозилхлоридом, применяя пиридин в качестве растворителя, или в присутствии триэтиламина, в подходящем растворителе, таком как хлороформ или дихлорметан, при температуре между -20 и 25 С, в течение промежутка времени от 8 до 24 ч (стадия 23). Соединение XIX может быть получено путем окисления соединения XLIII, следуя химическим способам, широко описанным в литературе, например, путем реакции взаимодействия с хлорхроматом пиридиния или с диоксидом марганца в инертном растворителе, таком как дихлорметан,при комнатной температуре в течение промежутка времени от 2 до 24 ч (стадия 24). С другой стороны, соединение XIX, где А является кислородом, может быть получено путем реакции взаимодействия соединения XLII, в котором К=СНО (формил), с соединением XXIV, следуя одному из способов, описанных для полученияVIIIд, начиная с XLII и XXIV. Исходное соединение формулы XLVII, например общей формулы XIV, где Е является-COOR9, может быть получено, следуя способу синтеза, представленному на схеме 7.XLIV, где В и n имеют вышеобозначенные значения, А является атомом кислорода или серы, иR10 является подходящей гидрокси- или тиолзащищающей группой, например, когда В является фенильной группой и n=0, R10 может быть метильной группой, взаимодействует с соединением XVIII (стадия 25) в условиях, описанных для получения IIа, начиная с VIII и XVIII, с получением соединения XLV. Соединение XLVI может быть получено путем реакции взаимодействия соединения XLV с соединением III с последующей обработкой соляной кислотой согласно способу, описанному выше для получения V, начиная с II (стадия 26). Отщепление защитной группы R10 в XLVI (стадия 27) дает соединение XLVII. Когда В является фенильной группой, n=0, и R10 является метильной группой, упомянутое превращение осуществляют путем обработки трибромидом бора в таком растворителе, как дихлорметан или этиловый эфир, при температуре, варьирующей от -40 С до комнатной температуры, и в течение промежутка времени от 4 до 24 ч. Исходное соединение XLIV, если оно отсутствует в продаже, может быть получено, начиная с имеющихся в продаже соединений, посредством сходных химических способов. Например, хлорсульфонильная группа может быть получена путем замещения соответствующей соли диазония газообразным диоксидом серы согласно способам, описанным в литературе(Cornish E.J. et al., J. Pharm. Pharmac., 1966, 18,65). Соль диазония может быть получена, начиная с приготовления соответствующего ароматического амина, если он отсутствует в продаже, начиная с соответствующей карбоновой кислоты, посредством перегруппировки Куртиуса 21 то есть общей формулы XXII, в которой T=CH2,Y-Z=CH2CH2, U=кислород, G=водород и n=1,может быть получено, начиная с имеющегося в продаже 2-гидроксиацетофенона согласно способам синтеза, описанным в литературе. Таким образом, соединение XXIIa с гидроксиметильной группой во 2-положении дигидробензопиранового кольца может быть получено согласно известным (Augstein J. et al., J. Med. Chem.,1968, 11, 844; Urban F.J. et al., J. HeterocyclicXXIIa с гидроксиметильной группой в 3-м положении дигидробензопиранового кольца может быть получено, например, согласно известному (Okumura К. et al., Chem. Pharm. Bull.,1974, 22, 331) способу. Соединение XXIIa с гидроксиметильной группой в 4-м положении дигидробензопиранового кольца может быть получено, например, согласно известному (Solladie то есть общей формулы XXII, в которой Т=простая связь, Y-Z=CH2CH2, G=COOR9, U=0,n=1, с гидроксиметильной группой во 2-м положении дигидробензофуранового кольца, может быть получено, начиная с подходящего имеющегося в продаже эфира 4-гидроксибензойной кислоты, следуя способам, описанным в литературе (Eggler J.F. et al., US 4703052). Исходное соединение ХХIIв, то есть общей формулы XXII, в которой Т=простая связь,Y-Z=CH2CH2, G=Br или Cl, U=O, n=1, с гидроксиметильной группой в 3- положении дигидробензофуранового кольца, может быть получено посредством воздействия на соединение XLVIII подходящим гидридом металла, таким как боргидрид натрия, в растворителе, таком как метанол, этанол или тетрагидрофуран, в присутствии каталитического количества воды при температуре между 20 С и флегмообразованием растворителя, в течение промежутка времени от 3 до 24 ч (стадия 28). 22 то есть общей формулы XXII, в которой Т=простая связь, Y-Z=CH=CH, G=Br или Cl,U=O, n=1, может быть получено согласно способам, описанным в литературе, или путем сходных превращений продуктов, описанных в литературе. Таким образом, соединение XXIIг с гидроксиметильной группой во 2- положении бензофуранового кольца может быть получено,например, согласно известному (Dann О. Et al.,Liebigs Ann. Chem., 1982, 1836) способу. Соединение XXIIг с гидроксиметильной группой в 3 м положении бензофуранового кольца может быть получено согласно условиям, описанным на стадии 28, путем восстановления подходящего эфира бензофуран-3-карбоновой кислоты,получаемого в свою очередь согласно способам,описанным в литературе (Mustafa A., Chem.Heterocycl. Compd., Weissberger-Taylor Eds.,John Wiley and Sons, N.Y., 1974, vol. 29, 114117). Исходное соединение XXIX может быть получено согласно одному из способов, описанных выше для получения соединений XXII, начиная с имеющихся в продаже или легко доступных соединений, путем схожих способов синтеза. Исходное соединение IX, где R7 является водородом, может быть получено, например,согласно способу синтеза, представленному на схеме 8. Схема 8 Начиная с соединения XLIX, легко получаемого согласно способу синтеза, описанному в литературе (JP 03095144, 1991), где R2 представляет собой группы, определенные выше, иW может быть атомом брома или хлора, соединение L может быть получено путем реакции взаимодействия с соединением III (стадия 29) в условиях, описанных для получения V, начиная с II и III. Путем дегалогенирования соединенияL, например, муравьиной кислотой в присутствии каталитических количеств 10% палладияна-угле, в подходящем растворителе, таком какN,N-диметилформамид, при температуре между 100 С и температурой флегмообразования растворителя, в течение промежутка времени от 2 23 до 8 ч, может быть получено соединение LI(стадия 30). Восстановление нитрогруппы соединения LI, например путем гидрогенизации в присутствии каталитических количеств 5% палладия-на-угле, при комнатном давлении и температуре, в подходящем растворителе, таком как метанол, этанол или смеси метанола и хлороформа, в течение промежутка времени от 1 до 8 ч, приводит к соединению IX с E=COOR9(стадия 31). Превращение LI в соединение тетразола LIV включает в себя трехстадийный способ (32, 33 и 34), идентичный способу, описанному выше для получения VII, начиная с V. Соединение IX, где Е является 5-тетразолильной группой, может быть получено путем гидрогенизации соединения LIV в условиях, описанных выше для получения IX с D=COOR9, начиная сLI. Исходное соединение XVIII, где R7 является водородом, получают согласно способу, описанному в литературе (JP 03095144, 1991). Исходное соединение XXI может быть получено, начиная с соединения XVIII, где R7 является водородом, путем реакции взаимодействия сначала с нитритом натрия в смеси концентрированной серной кислоты и воды при температуре между -10 и 10 С, в течение промежутка времени от 20 мин до 2 ч, а затем путем обработки указанной реакционной смеси иодидом калия в присутствии порошка меди при 75 С в течение 2 ч. Соединения IX и XVIII, где R7 является метильной группой, могут быть получены, начиная с соответствующих соединений, где R7 является водородом, согласно схожим химическим способам моноалкилирования первичных аминов, описанным в литературе (JohnstoneR.A.W. et al. J. Chem. Soc. C, 1969, 2223). Исходное соединение XII может быть получено согласно способам, описанным в литературе (Huan F.C. et al., J. Med. Chem., 1991, 34,1704). Соединения по настоящему изобретению проявляют заметную антагонистическую активность по отношению к эффектам лейкотриенов и демонстрируют хорошую биодоступность при пероральном введении, и поэтому они обладают противовоспалительными и противоаллергическими свойствами, которые делают их полезными в лечение заболеваний, в которые вовлечены указанные медиаторы. Указанные соединения поэтому могут быть применимы в терапии человека для предотвращения и лечения аллергического ритинита, бронхиальной астмы,реакций гиперчувствительности, таких как аллергический конъюктивит, различных воспалительных состояний, таких как ревматоидный артрит, остеоартрит, тендинит, бурсит, псориаз и схожие воспаления. Соединение по настоящему изобретению также может быть применимо в лечении заболеваний сердечно-сосудистой системы, таких как 24 сердечная ишемия, инфаркт миокарда, коронарный спазм, сердечная анафилаксия, церебральный отек и эндотоксический шок. Для предполагаемых терапевтических применений соединения по изобретению приготавливают в подходящих фармацевтических композициях, применяя общепринятые способы и методы, как описано в Remington's Pharmaceutical Science Handbook, Mack Pub. Co., N.Y.U.S.A. Примеры указанных препаратов включают в себя капсулы, таблетки, сиропы и тому подобное, содержащие от 1 до 1000 мг активного начала в стандартной дозе. Примеры Следующие примеры иллюстрируют получение соединений по настоящему изобретению. Пример 1. 8-[2-(Бензилоксиметил)хроман 6-карбоксамидо]-4-оксо-4 Н-1-бензопиран-2 карбоновая кислота. 1 А. Этиловый эфир 4-оксо-4 Н-1-бензопиран-2-карбоновой кислоты. 2,68 М раствор этоксида натрия в этаноле(21,9 мл) медленно добавляют к раствору 2 гидроксиацетофенона (1,76 мл, 14,7 ммоль) и диэтилоксалата (3.98 мл, 29,4 ммоль) в смеси сухого этилового эфира (20 мл) и абсолютного этанола (20 мл). Смесь перемешивают при кипячении с обратным холодильником в течение 3 ч. Впоследствии ее разбавляют этиловым эфиром (40 мл), добавляют 1 М HCl (25 мл) и экстрагируют этиловым эфиром (3 х 40 мл). Объединенные эфирные фазы сушат и растворители удаляют путем выпаривания при пониженном давлении. Полученный остаток растворяют в абсолютном этаноле (60 мл) и добавляют 0,380 мл концентрированной соляной кислоты. Полученную смесь оставляют при перемешивании при 75 С на 1 ч. После прохождения этого промежутка времени 50 мл воды выливают на смесь, которую экстрагируют этилацетатом(3 х 50 мл). Органическую фазу последовательно промывают насыщенным раствором бикарбоната натрия и насыщенным раствором NaCl, сушат и растворители выпаривают при пониженном давлении, получая неочищенное соединение,которое очищают путем кристаллизации из этилового эфира, таким образом получая 2,660 г продукта, указанного в заголовке (83%-ный выход). 1 Н ЯМР (300 МГц, CDCl3)ppm: 1.41 (t,3 Н); 4.43 (q, 2H); 7.08 (s, 1H); 7.42 (t, 1H); 7.59(d, 1H); 7.71 (t, 1H); 8.16 (dd, 1H). 1 Б. Этиловый эфир 2-хроманкарбоновой кислоты. К раствору этилового эфира 4-оксо-4 Н-1 бензопиран-2-карбоновой кислоты (2,0 г, 9,17 ммоль) в метаноле (60 мл), хлороформе (25 мл) и ледяной уксусной кислоте (20 мл) добавляют 10% палладий-на-угле и смесь оставляют при перемешивании при комнатном давлении и температуре в течение 24 ч в атмосфере водорода. После этого катализатор отфильтровывают и 25 фильтрат выпаривают до сухости. Остаток повторно растворяют в этиловом эфире и последовательно промывают 5%-ным раствором бикарбоната натрия и насыщенным раствором хлорида натрия. Смесь сушат и растворитель выпаривают при пониженном давлении, получая 1,575 г продукта, указанного в заголовке (84%-ный выход). 1 Н ЯМР (300 МГц, CDCl3)ppm: 1.38 (t,3 Н); 2.01- 2.29 (sc, 2H); 2.78 (m, 2H); 4.21 (q,2H); 4.69 (dd, 1H); 6.82 (t, 1H); 6.90 (d, 1H); 7.01(d, 1H); 7.09 (t,1H). 1 В. 2-Хроманметанол. К раствору этилового эфира 2-хроманкарбоновой кислоты (1,575 г, 7,68 ммоль) в смеси тетрагидрофурана (75 мл) и воды (2 мл) маленькими порциями добавляют боргидрид натрия(0,686 г, 18,2 ммоль) и смесь оставляют перемешиваться при комнатной температуре в течение 48 ч. Впоследствии смесь охлаждают при-10 С и соединяют с ацетоном (47 мл), перемешивая при комнатной температуре в течение 0,5 ч. Затем добавляют воду (100 мл) и смесь экстрагируют дихлорметаном. Объединенные органические фазы сушат и растворитель удаляют путем выпаривания при пониженном давлении,таким образом получая 1,218 г продукта, указанного в заголовка (97%-ный выход). 1H ЯМР (300 МГц, CDCl3)ppm: 1.87 (m,qH); 1.94 (m, 1H); 2.18 (широкий s, 1H); 2.76 (m,1H); 2.90 (m, 1H); 3.76 (dd, 1H); 3.85(dd, 1H); 4.13 (m, 1H); 6.84 (sc, 2H); 7.07 (sc, 2H). 1 Г. 2-(Бензилоксиметил)хроман. К суспензии 60%-ной дисперсии гидрида натрия в минеральном масле (0,711 г, 17,8 ммоль, предварительно промытой сухим петролейным эфиром) в сухом N,N-диметилформамиде (30 мл) добавляют в инертной атмосфере 2-хлороманметанол (1,218 г, 7,43 моль), растворенный в N,N-диметилформамиде (15 мл) и смесь оставляют при перемешивании при комнатной температуре в течение 1 ч. После этого добавляют раствор бензилбромида (2,12 мл, 17,8 моль) в N,N-диметилформамиде (20 мл) и несколько кристаллов тетрабутиламмонийиодида,перемешивая при комнатной температуре в течение 18 ч. Впоследствии добавляют воду (10 мл) и растворитель выпаривают при пониженном давлении. Полученный остаток фракционируют в смеси воды (70 мл) и этилового эфира(70 мл), фазы разделяют и водную фазу экстрагируют этиловым эфиром (3 х 70 мл). Объединенные огранические фазы сушат и растворитель выпаривают при пониженном давлении,получая неочищенное соединение, которое очищают путем флэш-хроматографии через колонку с диоксидом кремния. Элюируя смесью петролейный эфир: этиловый эфир, 9:1, выделяют 1,569 г соединения, указанного в заголовкеH ЯМР (300 МГц, CDCl3)ppm: 1.85 (m,1H); 2.04 (m, 1H); 2.74 (m, 1H); 2.87 (m, 1H); 3.61 (dd, 1H); 3.71 (dd, 1H); 4.21 (m, 1H); 4.62 (s,2H); 6.79-6.85 (sc,2H); 7.00-7.10 (sc, 2H); 7.257.36 (sc, 5H) 1 Д. 2-(Бензилоксиметил)-6-хроманкарбальдегид. Фосфористый оксихлорид (0,863 мл, 9,26 моль) очень медленно и в инертной атмосфере добавляют к N-метилформанилиду (1,14 мл. 9,26 моль) и смесь оставляют при перемешивании при комнатной температуре в течение 30 мин. После этого добавляют 2-(бензилоксиметил)хроман (1,569 г, 6,18 моль), перемешивая при 65 С в течение 1,5 ч. Последовательно смесь разбавляют дихлорметаном (30 мл), соединяют с 15%-ным раствором ацетата натрия(20 мл), фазы разделяют и органическую фазу последовательно промывают 1 М раствором соляной кислоты и насыщенным раствором хлорида натрия. После высушивания и удаления растворителя путем выпаривания при пониженном давлении получают остаток, который очищают путем флэш-хроматографии через колонку с силикагелем. Элюируя смесью гексан:этилацетат, 10:1, выделяют 0,921 г продукта, указанного в заголовке (53%-ный выход). 1(Jones), состоящий из смеси триоксида хрома(0,326 г, 3,27 ммоль), воды (0,95 мл) и концентрированной серной кислоты (0,27 мл). Смесь оставляют при перемешивании при комнатной температуре в течение 18 ч. После этого добавляют смесь изопропилового спирта (10 мл) и воды (50 мл), экстрагируя этиловым эфиром(3 х 30 мл). Органическую фазу сушат и растворители выпаривают при пониженном давлении,получая остаток, который очищают путем хроматографии через колонку силикагеля. Элюируя смесью гексан:этилацетат 7:3, получают 0,580 г соединения, указанного в заголовке (60%-ный выход). 1H ЯМР (300 МГц, CDCl3)ppm: 1.87 (m,1H); 2.08 (m, 1H); 2.84 (m, 2H); 3.65 (dd, 1H); 3.72 (dd, 1H); 4.29 (m, 1H); 4.62 (s, 2H); 6.88 (d,1H); 7.32-7.40 (sc, 5H); 7.82 (sc, 2H). 1 Ж. 4-Бромфенилацетат. К раствору 4-бромфенола (25 г, 0,145 моль) в 100 мл хлороформа добавляют при 0 С триэтиламин (20,1 мл) и уксусный ангидрид(16,4 мл), перемешивая при комнатной температуре в течение 2 ч. После этого смесь промывают 0,2 М раствором HCl, сушат и растворитель 1 27 выпаривают при пониженном давлении, таким образом получая соединение, указанное в заголовке, в виде бесцветного масла (количественный выход). 1 З. 5-Бром-2-гидроксиацетофенон. Смесь 4-бромфенилацетата (31,3 г, 0,145 моль) и АlСl3 (47,3 г) греют при 120 С в течение 2 ч. Впоследствии смесь оставляют охлаждаться при температуре около 50 С и осторожно смешивают со смесью льда (70 г) и концентрированной соляной кислоты (15 мл). Полученную в результате смесь греют при 100 С, получая гомогенный раствор. После этого смесь охлаждают при комнатной температуре и экстрагируют этилацетатом (4 х 100 мл). Органическую фазу сушат и растворитель выпаривают при пониженном давлении, получая неочищенное соединение, которое очищают путем хроматографии через колонку с силикагелем, элюируя смесью гексан:хлороформ 9:1, таким образом выделяя 23,7 г соединения, указанного в заголовке (76%ный выход). 1 Н ЯМР (300 МГц, СDСl3)ppm: 2.56 (s,3 Н); 6.78 (d, 1H); 7.43 (dd, 1H); 7.72 (d, 1H); 12.10 (s, 1H). 1 И. 5-Бром-2-гидрокси-3-нитроацетофенон. К раствору 5-бром-2-гидроксиацетофенона(23,7 г, 0,110 моль) в четыреххлористом углероде (90 мл) добавляют концентрированную азотную кислоту (17,2 мл). Смесь оставляют при перемешивании при 75 С в течение 50 мин, затем оставляют ее охлаждаться при комнатной температуре. Осажденное твердое вещество выделяют путем фильтрации, промывая холодным четыреххлористым углеродом. После высушивания под вакуумом, получают 20,9 г соединения, указанного в заголовке, в виде светло-желтого твердого вещества (73%-ный выход). 1 Н ЯМР (300 МГц, CDCl3)ppm: 2.73 (s,3 Н); 8.14 (d, 1H); 8.31 (d, 1H); 12.92 (s, 1H). 1 К. 3-Амино-2-гидроксиацетофенон. Следуя способу, описанному в пункте Б,начиная с 5-бром-2-гидрокси-3-нитроацетофенона, растворенного в смеси метанол:дихлорметан 9:1, получают соединение, указанное в заголовке, в виде гидробромида (количественный выход). 1N-(3-Ацетил-2-гидроксифенил)-2(бензилоксиметил)хроман-6-карбоксамид. Суспензию 2-(бензилоксиметил)-6-хроманкарбоновой кислоты (0,700 г, 2,35 ммоль) в оксалилхлориде (5,98 мл) греют при 75 С в течение 35 мин. Избыток оксалилхлорида выпаривают в потоке азота и полученный остаток растворяют в минимальном количестве сухого метиленхлорида. Этот раствор добавляют при 0 С и в инертной атмосфере к раствору 3-амино-2 гидроксиацетофенона (0,550 г, 2,37 ммоль), пи 001680 28 ридина (7 мл) и сухого метиленхлорида (40 мл). Полученную в результате смесь оставляют при перемешивании при комнатной температуре в течение 18 ч, затем разбавляют метиленхлоридом (40 мл), последовательно промывают 1 МHCl и насыщенным раствором хлорида натрия,сушат и растворитель выпаривают при пониженном давлении. Получают неочищенное соединение, которое очищают путем хроматографии через колонку с силикагелем, элюируя смесями петролейный эфир:хлороформ увеличивающейся полярности. При 40%-ном содержании хлороформа элюируют 0,732 г соединения,указанного в заголовке (72%-ный выход). 1(sc, 2H); 8.09 (s, 1H); 8.80 (d, 1H); 13.01 (s, 1H). 1 М. Этиловый эфир 8-[2-(бензилоксиметил)хроман-6-карбоксамидо]-4-оксо-4H-1 бензопиран-2-карбоновой кислоты. Следуя способу, описанному в пункте А,начиная с N-(3-ацетил-2-гидроксифенил)-2(бензилоксиметил)хроман-6-карбоксамида и диэтилоксалата, получают соединение, указанное в заголовке, которое очищают путем теплой кристаллизации в этилацетате (66%-ный выход). 1H ЯМР (300 МГц, CDCl3)ppm: 1.47 (t,3 Н); 1.90 (m, 1H); 2.11 (m, 1H); 2.89 (m, 2H); 3.67 (dd, 1H); 3.75 (dd, 1H); 4.32 (m, 1H); 4.49 (q,2H); 4.65 (s, 2H);6.95(d, 1H); 7.15 (s, 1H); 7.307.40 (sc, 5H); 7.47 (t, 1H); 7.70 (dd, 1H); 7.78 (d,1H); 7.88 (dd, 1H); 8.74 (s, 1H); 8.93 (dd, 1H). 1H. 8-[2-(Бензилоксиметил)хроман-6-карбоксамидо]-4-оксо-4 Н-1-бензопиран-2-карбоновая кислота. К суспензии этилового эфира 8-[2(бензилоксиметил)хроман-6-карбоксамидо]-4 оксо-4 Н-1-бензопиран-2-карбоновой кислоты(0,240 г, 0,47 ммоль) в смеси метанола (15 мл) и тетрагидрофурана (15 мл) добавляют 0,510 мл 1 М раствора NaOH, перемешивая при комнатной температуре в течение 1,30 ч. После этого смесь выпаривают до сухости и полученный остаток суспендируют в воде, добавляя 0,2 М соляную кислоту до слабо кислого значения рН(рН=4-5). Твердое вещество восстанавливают путем фильтрации, промывают метанолом и сушат на пентоксиде фосфора под вакуумом,таким образом получая 0,221 г соединения, указанного в заголовке в виде белого твердого вещества, которое разлагается при температуре выше 283 С (97%-ный выход). 1(пункт А), начиная с 5-бром-2-гидрокси-3 нитроацетофенона и диэтилоксалата, получают соединение, указанное в заголовке, которое очищают путем кристаллизации из смесей тетрагидрофуран:этанол (77%-ный выход). 1 Н ЯМР (300 МГц, СDСl3)ppm: 1.45 (t,3H); 4.49 (q, 2H); 7.21 (s, 1H); 8.48 (d, 1H);8.58(d,1H). 2 Б. Этиловый эфир 8-нитро-4-оксо-4 Н-1 бензопиран-2-карбоновой кислоты. Смесь этилового эфира 6-бром-8-нитро-4 оксо-4 Н-1-бензопиран-2-карбоновой кислоты(5,0 г, 14,6 моль), 10% палладия-на-угле (0,541 г), муравьиной кислоты (7,90 мл) и N,Nдиметилформамида (42 мл) перемешивают при 145 С в течение 5,45 ч в инертной атмосфере. По истечении указанного времени смесь оставляют охладиться и катализатор удаляют путем фильтрации, промывая ее N,N-диметилформамидом. Полученный фильтрат выпаривают до сухости и полученный остаток очищают путем хроматографии через колонку с силикагелем. Элюцией смесью гексан:хлороформ, 85:15, выделяют 2,109 г соединения, указанного в заголовке (55%-ный выход). 1(dd, 1H); 8.49(dd,1H). 2 В. 8-Нитро-4-оксо-4 Н-1-бензопиран-2 карбоксамид. Газообразный аммиак барботируют в течение 30 мин в растворе этилового эфира 8 нитро-4-оксо-4 Н-бензопиран-2-карбоновой кислоты (2,109 г, 8,02 ммоль) в безводном этаноле(50 мл) и безводном тетрагидрофуране (50 мл). После этого смесь выпаривают до сухости и полученной твердый остаток суспендируют в концентрированной соляной кислоте (20 мл),перемешивая при комнатной температуре в течение 4 ч. Затем смесь разбавляют водой, твердое вещество выделяют путем фильтрации,многократно промывают водой и сушат под вакуумом на пентоксиде фосфора, получая 1,515 г продукта, указанного в заголовке (81 %-ный выход). 1H ЯМР (300 МГц, ДМСО)ppm: 7.01 (s,1H); 7.75 (t, 1H); 8.01 (широкий s, 1 Н); 8,37 (широкий s, 1H); 8,43 (dd, 1H); 8.61 (dd, 1H). 2 Г. 8-Нитро-4-оксо-4 Н-1-бензопиран-2 карбонитрил. Фосфористый оксихлорид (2,86 мл) очень медленно добавляют при 0 С к сухому N,Nдиметилформамиду (40 мл) и смесь оставляют при перемешивании при комнатной температуре в течение 35 мин. После этого добавляют рас 001680 30 твор 8-нитро-4-оксо-4 Н-1-бензопиран-2-карбоксамида (1,515 г, 6,47 ммоль) в N,N-диметилформамиде (10 мл) и смесь оставляют при перемешивании при комнатной температуре в течение 18 ч. По истечении этого времени реакционную смесь выливают на смесь лед-вода (100 мл) и экстрагируют этилацетатом (4 х 40 мл). После высушивания и удаления растворителей при пониженном давлении получают остаток,который очищают путем хроматографии через колонку с силикагелем. Элюцией смесью гексан:хлороформ 7:3, выделяют 1,094 г соединения, указанного в заголовке (78%-ный выход). 1 Н ЯМР (300 МГц, ДМСО)ppm: 7.01 (s,1H); 7.70 (t, 1H); 8,38 (dd, 1H); 8.56 (dd, 1H). 2 Д. 8-Нитро-4-оксо-2-(5-1 Н-тетразолил)4 Н-1-бензопиран. Смесь 8-нитро-4-оксо-4 Н-1-бензопиран-2 карбонитрила (1,094 г, 5,06 ммоль), азида натрия (1,638 г, 25,3 ммоль), хлорида аммония(1,349 г, 25,3 ммоль) и сухого N,Nдиметилформамида (50 мл) оставляют при перемешивании при 100 С в течение 1,25 ч. После этого смесь охлаждают при комнатной температуре и выливают на раствор 1 М соляной кислоты (50 мл), выделяя образованный осадок путем фильтрации. Полученное твердое вещество суспендируют в концентрированной соляной кислоте (12 мл), перемешивая при комнатной температуре в течение 2,5 ч. По истечении этого времени кислую смесь разбавляют водой (50 мл) и экстрагируют этилацетатом (4 х 30 мл). Органическую фазу сушат и растворитель выпаривают при пониженном давлении, таким образом получая 0,906 г продукта, указанного в заголовке (69%-ный выход). 1 Н ЯМР (300 МГц, ДМСО)ppm: 7.21 (s,1H); 7.73 (t, 1 Н); 8,41 (dd, 1H); 8.55 (dd, 1H). 2 Е. 8-Амино-4-оксо-2-(5-1 Н-тетразолил)4 Н-1-бензопиран. Следуя способу, описанному в примере 1(пункт Б), путем гидрогенизации в течение 4 ч 8-нитро-4-оксо-2-(5-1 Н-тетразолил)-4 Н-1 бензопирана (0,896 г, 3,46 ммоль) с 5% палладием-на-угле (91 мг) в смеси метанола (65 мл),хлороформа (20 мл) и концентрированной соляной кислоты (2 мл), получают соединение, указанное в заголовке, в виде его соответствующего гидрохлорида (количественный выход). 1 Н ЯМР (300 МГц, CD3OD)ppm: 7.25 (s,1H); 7.62 (t, 1H); 7,94 (d, 1H); 8.14 (d,1H). 2 Ж. N-[4-Оксо-2-(1 Н-5-тетразолил)-4 Н-1 бензопиран-8-ил]-2-(бензилоксиметил)хроман 6-карбоксамид. Следуя способу, описанному в примере 1(пункт Л), начиная с 2-(бензилоксиметил)-6 хроманкарбоновой кислоты и 8-амино-4-оксо-2(5-1 Н-тетразолил)-4 Н-1-бензопирана, получают соединение, указанное в заголовке, в виде белого твердого вещества с точкой плавления 214 31 216 С, которое очищают путем кристаллизации в метаноле (57%-ный выход). 1ppm: 1.82 (m, 1H); 2.12 (m, 1H); 2.85 (m, 2 Н); 3.62 (dd, 1H); 3.67 (dd, 1H); 4.23 (m, 1H); 4.58 (s,2H); 6.89 (d, 1H); 7.18 (s, 1H); 7.20-7.34 (sc, 5H); 7.44 (t, 1H); 7,72 (dd, 2H); 7.87 (dd, 1H); 8.59 (dd,1H); 8.80 (широкий s, 1H). Пример 3. 8-[2-(3-Фенилпропил)хроман-6 карбоксамидо]-4-оксо-4 Н-1-бензопиран-2-карбоновая кислота. 3 А. 2-Хроманметилтрифторметансульфонат. К смеси 2-хроманметанола (0,765 г, 4,67 ммоль) и пиридина (1,05 мл) в сухом дихлорметане (25 мл) при 0 С в инертной атмосфере добавляют ангидрид трифторметансульфоновой кислоты (1,10 мл, 6,53 ммоль) и смесь оставляют при перемешивании в течение 18 ч при 0 С,затем ее разбавляют дихлорметаном (20 мл),добавляют воду (25 мл) и водную фазу экстрагируют дихлорметаном (3 х 20 мл). Объединенные органические фазы последовательно промывают 1H HCl, 5%-ным NaHCO3 и насыщенным раствором NaCl. После высушивания и удаления растворителей, получают остаток, который очищают путем хроматографии через колонку с силикагелем, элюируя смесью гексан:этилацетат 9:1, таким образом получая 1,381 г соединения, указанного в заголовке (82%-ный выход). 1(m,1H); 4.64 (d, 2H); 6.86 (m, 2 Н); 7.07 (m, 2H). 3 Б. 2-(3-Фенилпропил)хроман. К суспензии магния (0,304 г, 12,6 ммоль) в сухом тетрагидрофуране (5 мл) с кристаллом иода добавляют капля за каплей и в инертной атмосфере раствор 2-бромэтилбензола (1,72 мл,12,6 ммоль) в сухом тетрагидрофуране (12 мл). Реакцию, начавшуюся в процессе добавления бромида, оставляют при комнатной температуре в течение 2,5 ч. После этого при 0 С последовательно добавляют раствор СuВr(СН 3)2S (163 мг,0,79 ммоль) в тетрагидрофуране (2 мл) и раствор 2-хроманметилтрифторметансульфоната(1,381 г, 4,67 ммоль) в тетрагидрофуране (5 мл) и смесь оставляют при перемешивании при 0 С в течение 2,5 ч. По истечении этого времени смесь медленно выливают на смесь дихлорметана (25 мл) и насыщенного водного раствора хлорида аммония (20 мл). Фазы разделяют и водную фазу экстрагируют дихлорметаном(4 х 25 мл). Объединенные органические экстракты сушат и растворитель выпаривают при пониженном давлении, получая неочищенное соединение, которое очищают путем хроматографии через колонку с силикагелем, элюируя смесью гексан:дихлорметан 9:1 с выделением 0,990 г продукта, указанного в заголовке (85%-ный выход).(пункт А), начиная с N-(3-ацетил-2-гидроксифенил)-2-(3-фенилпропил)хроман-6-карбоксамида и диэтилоксалата, получают соединение, указанное в заголовке, которое очищают путем хроматографии через колонку с силикагелем,элюируя хлороформом (47%-ный выход). 1 33 белого твердого вещества с точкой плавления 325-326 С (80%-ный выход). 1(пункт Л), начиная с 2-(3-фенилпропил)-6 хроманкарбоновой кислоты и 8-амино-4-оксо-2(5-1 Н-тетразолил)-4 Н-1-бензопирана, получают соединение, указанное в заголовке, в виде белого твердого вещества, которое разлагается при температурах выше 370 С, и которое очищают путем кристаллизации в метаноле (65%-ный выход). 1(4-Бром-2-формил)фенилоксиацетонитрил. К смеси 5-бромсалицилового альдегида (5 г, 24,8 ммоль), карбоната калия (3,78 г, 26,8 ммоль) и N,N-диметилформамида (70 мл) добавляют раствор хлорацетонитрила (1,87 г, 24,8 ммоль) в N,N-диметилформамиде (10 мл), затем каталитическое количество иодида калия. Полученную в результате смесь оставляют перемешиваться при 80 С в течение 1,5 ч, затем добавляют воду (50 мл) и экстрагируют этилацетатом(4 х 75 мл). Объединенные органические фазы сушат и растворители удаляют при пониженном давлении, получая 5,126 г соединения, указанного в заголовке (98%-ный выход). 1 Н ЯМР (300 МГц, CDCl3)ppm: 4.93 (s,2H); 7.01 (d, 1H); 7.73 (dd, 1H); 8.00 (d,1H). 5 Б. 5-Бром-2-бензофуранкарбоновая кислота. Смесь (4-бром-2-формил)фенилоксиацетонитрила (5,11 г, 21,3 ммоль), гидроксида калия(6,0 г) и абсолютного этанола (250 мл) кипятят с обратным холодильником в течение 24 ч, после чего разбавляют водой (75 мл) и подкисляют 1 М соляной кислотой. Летучие компоненты выпаривают при пониженном давлении и полученный в результате водный остаток экстрагируют этилацетатом (4 х 100 мл). Объединенные органические фазы сушат и растворитель выпаривают при пониженном давлении, получая соединение, указанное в заголовке, в виде желтого твердого вещества с точкой плавления 249252 С (98%-ный выход). 1 34 5 В. Этиловый эфир 5-бром-2-бензофуранкарбоновой кислоты. К раствору 5-бром-2-бензофуранкарбоновой кислоты (5,01 г, 20,8 ммоль) в абсолютном этаноле (150 мл) добавляют концентрированную серную кислоту (15 мл) и смесь кипятят с обратным холодильником при перемешивании в течение 2 ч. По истечении этого времени летучие компоненты выпаривают при пониженном давлении и полученный в результате остаток нейтрализуют насыщенным раствором бикарбоната натрия и экстрагируют этиловым эфиром (4 х 100 мл). Смесь сушат и растворитель выпаривают при пониженном давлении, получая 5,19 г соединения, указанного в заголовке, в виде белого твердого вещества с точкой плавления 58-60 С (93%-ный выход). 1H ЯМР (300 МГц, СDСl3)ppm: 1.34 (t,3H); 4.35 (q, 2 Н); 7.39 (m, 3H); 7.71 (d, 1H). 5 Г. (5-Бром-2-бензофуранил)метанол. К раствору этилового эфира 5-бром-2 бензофуранкарбоновой кислоты (2,20 г, 8,19 ммоль) в тетрагидрофуране (75 мл) добавляют боргидрид натрия (1,24 г) и несколько капель воды. Смесь кипятят с обратным холодильником при перемешивании в течение 18 ч и после этого добавляют несколько капель концентрированной НСl. Летучие компоненты выпаривают и полученный остаток разбавляют водой и экстрагируют этиловым эфиром (3 х 75 мл). После высушивания и выпаривания растворителя при пониженном давлении, получают неочищенное соединение, которое очищают путем хроматографии через колонку с силикагелем,элюируя смесью петролейный эфир:хлороформ,60:40. Выделяют 1,19 г соединения, указанного в заголовке, в виде белого твердого вещества с точкой плавления 101-103 С (64%-ный выход). 1(1,19 г, 5,24 ммоль), цианида меди (I) (0,470 г,5,25 ммоль) и N-метилпирролидинона (15 мл) оставляют при перемешивании при 200 С в течение 3,5 ч, затем выливают на раствор этилендиамина (6 г) в воде (80 мл) и экстрагируют этилацетатом (3 х 75 мл). Органическую фазу сушат и растворители выпаривают при пониженном давлении. Полученное в результате неочищенное соединение очищают путем хроматографии через колонку с силикагелем, элюируя смесями н-гексан:этилацетат увеличивающейся полярности, таким образом получая 0,671 г продукта, указанного в заголовке, в виде желтого твердого вещества с точкой плавления 113114 С (74%-ный выход). 1 35 5 Е. 2-(Бензилоксиметил)бензофуран-5 карбонитрил. Дисперсию гидрида калия (0,990 г, 5,04 ммоль) в 20%-ном минеральном масле промывают путем декантации безводным гексаном,затем повторно суспендируют в безводном бензоле (25 мл). Эту суспензию смешивают при 0 С и в инертной атмосфере с раствором 2(гидроксиметил)бензофуран-5-карбонитрила(0,671 мг, 3,89 ммоль) в бензоле (10 мл), перемешивая при комнатной температуре в течение 15 мин, затем с бензилбромидом (0,825 мл) и каталитическим количеством иодида тетрабутиламмония. Смесь оставляют при перемешивании при комнатной температуре в течение 4 ч,затем добавляют воду (50 мл) и экстрагируют этилацетатом (4 х 50 мл). Органическую фазу сушат и удаляют растворитель, получая неочищенное соединение, которое очищают путем хроматографии через колонку с силикагелем,элюируя смесями н-гексан:этилацетат увеличивающейся полярности, таким образом выделяя 1,087 г соединения, указанного в заголовке, в виде желтоватого масла (82%-ный выход). 1(s, 2H); 7.79 (s, 1H). 5 Ж. 2-(Бензилоксиметил)бензофуран-5 карбоновая кислота. К раствору 2-(бензилоксиметил)бензофуран-5-карбонитрила (1,087 г, 4,13 ммоль) в этаноле (150 мл) добавляют 35%-ный NaOH (55 мл) и кипятят с обратным холодильником при перемешивании в течение 3 ч. После этого смесь подкисляют 1 М HCl, летучие компоненты выпаривают и остаток экстрагируют этилацетатом (4 х 100 мл). Органическую фазу сушат и растворитель выпаривают при пониженном давлении, получая 1,165 г соединения, указанного в заголовке, в виде белого твердого вещества с точкой плавления 129-132 С (количественный выход). 1 Н ЯМР (300 МГц, CDCl3)ррm: 4.67 (s,4 Н); 6.81 (s, 1 Н); 7.40 (m, 5 Н); 7.56 (d, 1 Н); 8.12(пункт Л), начиная с 2-(бензилоксиметил) бензофуран-5-карбоновой кислоты и 3-амино-2 гидроксиацетофенона, получают соединение,указанное в заголовке, в виде желтоватого твердого вещества с точкой плавления 92-94 С, которое очищают путем хроматографии через колонку с силикагелем (98%-ный выход). 1(пункт А), начиная с N-(3-ацетил-2-гидроксифенил)-2-(бензилоксиметил)бензофуран-5 карбоксамида и диэтилоксалата, получают этиловый эфир 8-[2-(бензилоксиметил)бензофуран 5-карбоксамидо]-4-оксо-4 Н-1-бензопиран-2 карбоновой кислоты, который последовательно гидролизуют согласно способу, описанному в примере 1 (пункт Н), получая соединение, указанное в заголовке, в виде белого твердого вещества с точкой плавления 215-218 С (65%-ный общий выход). 1(m, 5H); 7.57 (t, 1H); 7.76 (d, 1H); 7.93 (d, 1H); 8.02 (d, 1H); 8.09 (d, 1H);8.38(d, 1H). Пример 6. 8-(2-Бензилоксиметил-2.3 дигидробензофуран-5-карбоксамидо)-4-оксо 4 Н-1-бензопиран-2-карбоновая кислота. 6 А. Этиловый эфир 4-аллилоксибензойной кислоты. К смеси этилового эфира 4 гидроксибензоата (10,0 г, 60,2 ммоль) и карбоната калия (8,32 г, 60,2 ммоль) в ацетоне (50 мл) добавляют аллилбромид (7,22 мл, 66,2 ммоль) и смесь кипятят с обратным холодильником в течение 18 ч. После этого карбонат калия отфильтровывают и растворитель выпаривают при пониженном давлении, таким образом получая 12,3 г неочищенного продукта, содержащего только соединение, указанное в заголовке (99%ный выход). 1(dd, 1H); 6.03 (m, 1H); 6.90 (d, 2H); 7.98 (d, 2H). 6 Б. Этиловый эфир 3-аллил-4-гидроксибензойной кислоты. Смесь этилового эфира 4-аллилоксибензойной кислоты (10,0 г, 48,5 ммоль) и N,Nдиметиланилина (20 мл) оставляют при перемешивании при 200 С в течение 48 ч, затем разбавляют этилацетатом (150 мл) и промывают 1 М HCl. После высушивания и выпаривания растворителя, получают неочищенное соединение, которое очищают путем хроматографии через колонку с силикагелем, элюируя смесью н-гексан:этилацетат, 95:5, таким образом выделяя 6,85 г соединения, указанного в заголовке(m,1H); 6.89(d,1H); 7.81 (dd, 1H); 7.83 (s, 1H). 6 В. Этиловый эфир 2-гидроксиметил-2,3 дигидробензофуран-5-карбоновой кислоты. К раствору этилового эфира 3-аллил-4 гидроксибензойной кислоты (6.74 г, 32,7 ммоль) в хлороформе (105 мл) добавляют метахлорпербензойную кислоту (11,40 г, 66,1 ммоль) 37 и смесь кипятят с обратным холодильником при перемешивании в течение 4 ч. После этого растворитель выпаривают, неочищенное соединение повторно растворяют в этилацетате и промывают раствором 1 М NaOH. После высушивания и удаления растворителя, получают неочищенное соединение, которое очищают путем хроматографии через колонку с силикагелем,элюируя смесью н-гексан:этилацетат, 90:10,выделяя 5,95 г соединения, указанного в заголовке (82%-ный выход). 1(пункт Г), начиная с этилового эфира 2 гидроксиметил-2,3-дигидробензофуран-5 карбоновой кислоты и бензилбромида, получают соединение, указанное в заголовке, которое очищают путем хроматографии через колонку с силикагелем,элюируя смесью нгексан:этилацетат, 95:5 (65%-ный выход). 1 Н ЯМР (300 МГц, CDCl3)ppm: 1.32 (t,3 Н); 2.93 (dd, 1H); 3.13 (dd, 1H); 3.55(dd,1H); 3.59(dd,1H); 4.27 (q, 2H); 4.51 (dd, 1H); 4.94 (m,1H); 6.75 (d, 1H); 7.19-7.27 (sc,5H); 7.78 (s,1H); 7.85(dd,1H). 6 Д. 2-Бензилоксиметил-2.3-дигидробензофуран-2-карбоновая кислота. К раствору этилового эфира 2 бензилоксиметил-2,3-дигидробензофуран-2 карбоновой кислоты (1,62 г, 5,47 ммоль) в метаноле (70 мл) добавляют раствор 1 М гидроксида лития (54,7 мл). Смесь кипятят с обратным холодильником при перемешивании в течение 3 ч,после чего нейтрализуют 1 М HCl и метанол выпаривают при пониженном давлении. Полученное неочищенное соединение суспендируют в воде (20 мл) и экстрагируют этилацетатом(4 х 25 мл). Органическую фазу сушат и растворитель выпаривают при пониженном давлении,получая 1,436 г соединения, указанного в заголовке, которое очищают путем кристаллизации в метаноле (97%-ный выход). 1 Н ЯМР (300 МГц, CDCl3)ppm: 3.02 (dd,1H); 3.26 (dd, 1H); 3.65 (dd, 1H); 3.68(dd,1H); 4.60(dd,2H); 5.05 (m, 1H); 6.82 (d, 1H); 7.22-7.33(пункт Л), начиная с 2-бензилоксиметил-2,3 дигидробензофуран-2-карбоновой кислоты и 3 амино-2-гидроксиацетофенона, получают соединение, указанное в заголовке, в виде желтоватого твердого вещества с точкой плавления 38 103-105 С, и очищают путем хроматографии через колонку с силикагелем (74%-ный выход). 1(пункт А), начиная с N-(3-ацетил-2-гидроксифенил)-2-бензилоксиметил-2,3-дигидробензофуран-5-карбоксамида и диэтилоксалата, получают соединение, указанное в заголовке, в виде желтого твердого вещества с точкой плавления 166-168 С, и очищают путем кристаллизации в этаноле (73%-ный выход). 1(пункт Н), начиная с этилового эфира 8-(2 бензилоксиметил-2,3-дигидробензофуран-5-кар боксамид)-4-оксо-4 Н-1-бензопиран-2-карбоновой кислоты, получают соединение, указанное в заголовке, в виде желтого твердого вещества с точкой плавления 184-188 С (60%-ный выход). 1ppm: 3.12 (dd, 1H); 3.36 (dd, 1H); 3.70 (dd, 1H); 3.73 (dd, 1H); 4.63 (s, 2H); 5.11 (m, 1H); 6.91 (d,1H); 7.10 (s, 1H); 7.30-7.38 (sc, 5 Н); 7.49 (t, 1H); 7.82 (d, 1 Н); 7.85 (s, 1H); 7.90 (dd, 1H); 8.73 (dd,1H). Пример 7. N-[4-Оксо-2-(1 Н-5-тетразолил)4 Н-1-бензопиран-8-ил]-2-бензилоксиметил-2,3 дигидробензофуран-5-карбоксамид. 7 А. N-[4-Оксо-2-карбамоил-4 Н-1-бензопиран-8-ил]-2-бензилоксиметил-2,3-дигидробензофуран-5-карбоксамид. В растворе этилового эфира 8-(2 бензилоксиметил-2,3-дигидробензофуран-5-карбоксамид)-4-оксо-4 Н-1-бензопиран-2-карбоксилата (528 мг, 1,06 ммоль) в метаноле (25 мл) и безводном тетрагидрофуране (25 мл), барботируют газообразный аммиак в течение 30 мин. После выпаривания до сухости, полученный в результате твердый -остаток растворяют в смеси тетрагидрофуран: метанол, 1:1 (15 мл) и добавляют концентрированную HCl (0,5 мл). Смесь кипятят с обратным холодильником при перемешивании в течение 1,5 ч, затем растворители выпаривают при пониженном давлении. Полученное в результате неочищенное соединение 39 суспендируют в воде и нерастворимое твердое вещество выделяют путем фильтрации, многократно промывают водой и сушат в вакууме на пентаоксиде фосфора, таким образом получая 527 мг соединения, указанного в заголовке (количественный выход). 1 Н ЯМР (300 МГц, ДМСО)ppm: 3.08 (dd,1H); 3.36 (dd, 1H); 3.70 (m, 2H); 4.57 (s, 2 Н); 5.12(пункт Г), начиная с N-[4-оксо-2-карбамоил-4 Н 1-бензопиран-8-ил]-2-бензилоксиметил-2,3 дигидробензофуран-5-карбоксамида, получают соединение, указанное в заголовке, которое очищают путем хроматографии через колонку с силикагелем, элюируя смесями петролейный эфир:хлороформ увеличивающейся полярностиN-[4-оксо-2-циано-4 Н-1-бензопиран-8-ил]-2-бензилоксиметил-2,3-дигидробензофуран-5-карбоксамида (300 мг, 0,66 ммоль),азида натрия (129 мг, 1,99 ммоль), хлорида аммония (107 мг, 1,99 ммоль) и сухого N,Nдиметилформамида (10 мл) оставляют при перемешивании при 100 С в течение 1,25 ч. После этого смесь, охлажденную при комнатной температуре, выливают на 1 М раствор соляной кислоты (10 мл), выделяя путем фильтрования образованный осадок, таким образом получая 111 мг соединения, указанного в заголовке, в виде белого твердого вещества с точкой плавления 200-202 С, которое очищают путем кристаллизации в смесях метанол:дихлорметан(пункт Б), начиная с этилового эфира 2 трифторметансульфонилоксиметил-2,3-дигидробензофуран-5-карбоновой кислоты и 2 бромэтилбензола, получают соединение, указанное в заголовке, которое очищают путем хроматографии через колонку с силикагелем,элюируя смесью н-гексан:этилацетат, 95:5(пункт А), начиная с N-(3-ацетил-2-гидроксифенил)-2-(3-фенилпропил)-2,3-дигидробензофуран-5-карбоксамида и диэтилоксалата, получают соединение, указанное в заголовке, которое очищают путем кристаллизации в горячем этаноле (67%-ный выход). 1 Н ЯМР (300 МГц, CDCl3)ppm: 1.45 (t,3H); 1.70-1.92 (m, 4H); 2.71 (t, 2H); 2.93(dd,1H); 3.38(dd,1H); 4.50 (q, 2H); 4.93 (m, 1H); 6.85 (d,1H); 7.16 (s, 1H); 7.18-7.32 (sc, 5H); 7.47 (t, 1H);(пункт Н), начиная с этилового эфира 8-[2-(3 фенилпропил)-2,3-дигидробензофуран-5-карбоксамидо]-4-оксо-4 Н-1-бензопиран-2-карбоновой кислоты, получают соединение, указанное в заголовке, в виде желтого твердого вещества с точкой плавления 184-185 С, которое очищают путем варки в метаноле (41 %-ный выход). 1(пункт Г), начиная с N-[4-оксо-2-карбамоил-4 Н 1-бензопиран-8-ил]-2-(3-фенилпропил)-2,3 дигидробензофуран-5-карбоксамида, получают соединение, указанное в заголовке, которое очищают путем хроматографии через колонку с силикагелем, элюируя смесями петролейный эфир:этилацетат увеличивающейся полярности 42 ватого твердого вещества с точкой плавления 234-235 С, которое очищают путем кристаллизации в смесях метанол:дихлорметан (61%-ный выход). 1 Н ЯМР (300 МГц, ДМСО)ppm: 1.651.85 (m, 4H); 2.66 (t, 2 Н); 2.92 (dd, 1H); 3.39 (dd,1 Н); 4.96 (m, 1H); 6.90 (d, 1H); 7.14 (s, 1H); 7.157.32 (sc, 5H); 7.56 (t,1H); 7.87 (dd, 1H); 7.90 (d,1H); 7.92 (s, 1H); 8.24(dd,1H); 9.98 (s, 1H). Пример 10. 8-(2-Бензилтиометил-2,3-дигидробензофуран-5-карбоксамидо)-4-оксо-4 Н-1 бензопиран-2-карбоновая кислота. 10 А. Этиловый эфир 2-бензилтиометил 2,3-дигидробензофуран-2-карбоксилат. К раствору бензилмеркаптана (0,992 мл,8,47 ммоль) в абсолютном этаноле (10 мл) в инертной атмосфере добавляют раствор гидроксида калия (0,712 г, 12,7 ммоль) в абсолютном этаноле (10 мл). Через 15 мин, при перемешивании при комнатной температуре, добавляют раствор этилового эфира трифторметансульфонилоксиметил-2,3-дигидробензофуран-5-карбоновой кислоты (3,00 г, 8,47 ммоль) в этаноле (15 мл). Полученную в результате смесь оставляют при перемешивании при комнатной температуре в течение 24 ч. После этого летучие компоненты выпаривают при пониженном давлении, полученный в результате остаток фракционируют в смеси воды (50 мл) и этилацетата (50 мл), и водную фазу экстрагируют этилацетатом (3 х 40 мл). Объединенные органические фазы сушат и растворитель выпаривают при пониженном давлении, получая 2,810 г соединения, указанного в заголовке, в виде темного масла (количественный выход). 1H ЯМР (300 МГц, CDCl3)ppm: 1.34 (t,3 Н); 2.68 (dd, 1H); 2.77 (dd, 1H); 2.98 (dd, 1H); 3.25 (dd, 1H); 3.78 (s, 2H); 4.31 (q, 2H); 4.92 (m,1H); 6.76 (d, 1H); 7.19-7.27 (sc, 5H); 7.82 (s, 1H); 7.86 (dd, 1H). 10 Б. 2-Бензилтиометил-2,3-дигидробензофуран-2-карбоновая кислота. К раствору этилового эфира 2-бензилтиометил-2,3-дигидробензофуран-2-карбоновой кислоты (2,70 г, 8,53 ммоль) в этаноле (100 мл) добавляют раствор 1 М гидроксида калия (42,6 мл). Смесь кипятят с обратным холодильником при перемешивании в течение 3 ч, после чего нейтрализуют 1 М HCl и этанол выпаривают при пониженном давлении. Полученное в результате неочищенное соединение суспендируют в воде(30 мл) и экстрагируют этилацетатом (4 х 30 мл). Органическую фазу сушат и растворитель выпаривают при пониженном давлении, получая 2,172 г соединения, указанного в заголовке, в виде коричневого твердого вещества с точкой плавления 125-127 С (85%-ный выход). 1 Н ЯМР (300 МГц, CDCl3)ррm: 2.70 (dd,1H); 2.81 (dd, 1H); 3.02 (dd, 1H); 3.32 (dd, 1H); 3.79 (s, 2 Н); 4.98 (m, 1H); 6.80 (d, 1H); 7.20-7.27(пункт Л), начиная с 2-бензилтиометил-2,3 дигидробензофуран-2-карбоновой кислоты и 3 амино-2-гидроксиацетофенона, получают соединение, указанное в заголовке, в виде желтого твердого вещества с точкой плавления 119121 С, которое очищают путем хроматографии через колонку с силикагелем, элюируя смесью н-гексан:этилацетат, 90:10 (86%-ный выход). 1 Н ЯМР (300 МГц, СDСl3)ppm: 2.61 (s,3 Н), 2.68 (dd, 1H); 2.80 (dd, 1H); 3.06 (dd, 1H); 3.34 (dd, 1H); 3.79 (s, 3 Н); 4.95 (m, 1H); 6.83 (d,1H); 6.93 (t, 1H); 7.21-7.35 (sc, 5H); 7.46 (d, 1H); 7.72 (d, 1H); 7.73 (s, 1H); 8.53 (s, 1H); 8.74 (d,1H). 10 Г. Этиловый эфир 8-(2-бензилтиометил 2,3-дигидробензофуран-5-карбоксамидо)-4 оксо-4 Н-1-бензопиран-2-карбоновой кислоты. Следуя способу, описанному в примере 1(пункт А), начиная с N-(3-ацетил-2-гидроксифенил)-2-бензилтиометил-2,3-дигидробензофуран-5-карбоксамида и диэтилоксалата, получают соединение, указанное в заголовке, в виде слегка желтоватого твердого вещества с точкой плавления 175-177 С, которое очищают путем хроматографии через колонку с силикагелем,элюируя хлороформом (81%-ный выход). 1 Н ЯМР (300 МГц, СDСl3)ppm: 1.47 (t,3 Н), 2.72 (dd, 1 Н); 2.34 (dd, 1H); 3.09 (dd, 1H); 3.38 (dd, 1H); 3.80 (s, 3 Н); 4.49 (q, 2H); 4.99 (m,1H); 6.85 (d, 1H); 7.12 (s, 1H); 7.21-7.35 (sc, 5H); 7.43 (t, 1H); 7.76 (d, 1H); 7.80 (s, 1H); 7.85 (d,1H); 8.70(s, 1H); 8.89 (d, 1H). 10 Д. 8-(2-Бензилтиометил-2,3-дигидробензофуран-5-карбоксамидо)-4-оксо-4 Н-1-бензопиран-2-карбоновая кислота. Следуя способу, описанному в примере 1(пункт Н), начиная с этилового эфира 8-(2 бензилтиометил-2,3-дигидробензофуран-5 карбоксамидо)-4-оксо-4 Н-1-бензопиран-2 карбоновой кислоты, получают соединение,указанное в заголовке, в виде желтого твердого вещества с точкой плавления 122-125 С (81%ный выход). 1 Н ЯМР (300 МГц, ДМСО)ppm: 2.80 (d,2H), 3.05 (dd, 1H); 3.20 (dd, 1H); 3.85 (s, 3 Н); 5.08 (m, 1H); 6.91 (s, 1H); 6.92 (d, 1H); 7.27 (m,1H); 7.34 (d, 4H); 7.54 (t,1H); 7.86 (d,1H); 7.88 (d,1H); 7.90 (s, 1H); 8.08(dd,1H); 10.04(s,1H). Пример 11. 8-[2-(4'-Фторбензилоксиметил)-2,3-дигидробензофуран-5-карбоксамидо]-4 оксо-4 Н-1-бензопиран-2-карбоновая кислота. 11 А. Этиловый эфир 2-(4'-фторбензилоксиметил)-2,3-дигидробензофуран-2-карбоновой кислоты. Следуя способу, описанному в примере 1 44 карбоновой кислоты и 4'-фторбензилбромида,получают соединение, указанное в заголовке,которое очищают путем хроматографии через колонку с силикагелем, элюируя смесью нгексан:этилацетат, 95:5 (68%-ный выход). 1(пункт Д), начиная с этилового эфира 2-(4'фторбензилоксиметил)-2,3-дигидробензофуран 2-карбоновой кислоты, получают соединение,указанное в заголовке, которое очищают путем кристаллизации в метаноле (94%-ный выход). 1 Н ЯМР (300 МГц, CDCl3)ppm: 3.01 (dd,1 Н); 3.27 (dd, 1H); 3.65 (m, 2H); 4.58 (dd, 2H); 5.05 (m, 1H); 6.81 (d, 1H); 7.00 (t, 2H); 7.27 (dd,2H); 7.86 (s, 1H); 7.92 (dd, 1H); 12.20 (широкий сигнал, 1H). 11 В. N-(3-Ацетил-2-гидроксифенил)-2-(4'фторбензилоксиметил)-2,3-дигидробензофуран 2-карбоксамид. Следуя способу, описанному в примере 1(пункт Л), начиная с 2-(4'-фторбензилоксиметил)-2,3-дигидробензофуран-2-карбоновой кислоты, получают соединение, указанное в заголовке, которое очищают путем хроматографии через колонку с силикагелем, элюируя смесью н-гексан:хлороформ, 1:1 (81%-ный выход). 1 Н ЯМР (300 МГц, CDCl3)ppm: 2.60 (s,3 Н); 3.05 (dd, 1H); 3.30 (dd, 1H); 3.65 (m, 2H); 4.58 (dd, 2H); 5.05 (m, 1H); 6.84 (d, 1H); 6.92 (t,1H); 7.01 (t, 2H); 7.27 (m, 2H); 7.43 (d, 1H); 7.71(пункт А), начиная с N-(3-ацетил-2-гидроксифенил)-2-(4'-фторбензилоксиметил)-2,3-дигидробензофуран-2-карбоксамида и диэтилоксалата, получают соединение, указанное в заголовке,которое очищают путем хроматографии через колонку с силикагелем, элюируя смесью нгексан:хлороформ, 1:2 (53%-ный выход). 1 Н ЯМР (300 МГц, СDСl3)ppm: 1.46 (t,3 Н); 3.10 (dd, 1H); 3.35 (dd, 1H); 3.70 (m, 2H); 4.49 (q, 2H); 4.58 (dd, 2H); 5.10 (m, 1H); 6.88 (d,1H); 7.01 (t, 2H); 7.13 (s, 1H); 7.30 (m, 2H); 7.44(пункт Н), начиная с этилового эфира 8-[2-(4'фторбензилоксиметил)-2,3-дигидробензофуран 5-карбоксамидо)-4-оксо-4 Н-1-бензопиран-2 карбоновой кислоты, получают соединение,указанное в заголовке, в виде желтого твердого вещества с точкой плавления 195-197 С, которое очищают путем кристаллизации в метаноле. 1 Н ЯМР (300 МГц, ДМСО)ppm: 3.10 (dd,1H); 3.37 (dd, 1H); 3.68 (d, 2H); 4.56 (s,2H); 5.12(m, 1H); 6.91 (d, 1H); 6.95 (s,1H); 7.17 (t, 2H); 7.38 (t, 2H); 7.54 (t, 1H); 7.88 (sc, 3H); 8.08 (dd,1H); 10.03 (s, 1H). Пример 12. N-[4-Оксо-2-(1 Н-5-тетразолил)-4 Н-1-бензопиран-8-ил]-2-(4'-фторбензилоксиметил)-2,3-дигидробензофуран-5-карбоксамид. 12 А. N-[4-Оксо-2-карбамоил-4 Н-1-бензопиран-8-ил]-2-(4'-фторбензилоксиметил)-2,3 дигидробензофуран-5-карбоксамид. К раствору этилового эфира 8-[2-(4'фторбензилоксиметил)-2,3-дигидробензофуран 5-карбоксамидо]-4-оксо-4 Н-1-бензопиран-2 карбоновой кислоты (1,219 г, 2,36 ммоль) в сухом тетрагидрофуране (100 мл) при -20 С добавляют насыщенный раствор аммиака в метаноле (12 мл, приблизительно 4 М раствор). Полученную в результате смесь оставляют при перемешивании при 0 С в течение 4 ч, затем растворители удаляют с получением 1,158 г соединения, указанного в заголовке (количественный выход). 1 Н ЯМР (300 МГц, ДМСО)ppm: 3.09 (dd,1H); 3.35 (dd, 1H); 3.67 (s, 2H); 4.56 (s,2H); 5.11(пункт Г), путем взаимодействия N-[4-оксо-2 карбамоил-4 Н-1-бензопиран-8-ил]-2-(4'-фторбензилоксиметил)-2,3-дигидробензофуран-5 карбоксамида с оксихлоридом фосфора в ДМФ в течение 0,5 ч при 0 С, получают соединение,указанное в заголовке, которое очищают путем хроматографии через колонку с силикагелем,элюируя смесью петролейный эфир:хлороформ,1:1 (77%-ный выход) 1 46 бензопиран-8-ил]-2-(4'-фторбензилоксиметил)2,3-дигидробензофуран-5-карбоксамида, получают соединение, указанное в заголовке, в виде белого твердого вещества с точкой плавления 229-232 С, которое очищают путем варки в этиловом эфире (77%-ный выход). 1(пункт Б), начиная с этилового эфира 4 аллилокси-3-хлорбензойной кислоты, получают соединение, указанное в заголовке, которое очищают путем перегонки при пониженном давлении (0,2 торр) (количественный выход). 1 Н ЯМР (300 МГц, CDCl3)ppm: 1.38 (t,3 Н); 3.45 (d, 2H); 4.35 (q, 2 Н); 5.09 (d, 1 Н); 5.14(пункт Б), начиная с этилового эфира 7-хлор-2 трифторметансульфонилоксиметил-2,3-дигидробензофуран-5-карбоновой кислоты и 2 бромэтилбензола, получают соединение, указанное в заголовке, которое очищают путем хроматографии через колонку силикагеля,элюируя смесью петролейный эфир:этилацетат,95:5 (58%-ный выход). 1 Н ЯМР (300 МГц, CDCl3)ppm: 1.36 (t,3 Н); 1.70-1.92 (m, 4H); 2.68 (t, 2H); 2.91 (dd,1H); 3.34(dd,1H); 4.32 (q, 2H); 4.95 (m, 1H); 7.15-7.30(пункт Л), начиная с 7-хлор-2-(3-фенилпропил)2,3-дигидробензофуран-5-карбоновой кислоты,получают соединение, указанное в заголовке,которое очищают путем хроматографии через колонку с силикагелем, элюируя смесью петролейный эфир:хлороформ, 1:1 (84%-ный выход). 1(пункт А), начиная с N-(3-ацетил-2-гидроксифенил)-7-хлор-2-(3-фенилпропил)-2,3-дигидробензофуран-5-карбоксамида, получают соединение, указанное в заголовке, которое очищают путем хроматографии через колонку с силикагелем,элюируя смесями петролейный(пункт Н), начиная с этилового эфира 8-[7-хлор 2-(3-фенилпропил)-2,3-дигидробензофуран-5 карбоксамидо]-4-оксо-4 Н-1-бензопиран-2 карбоновой кислоты, получают соединение,указанное в заголовке, в виде белого твердого вещества с точкой плавления 224-225 С, которое очищают путем хроматографии через колонку с силикагелем, элюируя смесью хлороформ:метанол, 98:2 (54%-ный выход). 1 Н ЯМР (300 МГц, CD3OD/CDCl3 смеси)(пункт Ж), начиная с 4-фторфенола, получают соединение, указанное в заголовке, в виде бесцветного масла (94%-ный выход). 1(пункт 3), начиная с 4-фторфенилацетата, получают соединение, указанное в заголовке, в виде белого твердого вещества с точкой плавления 55-58 С, которое очищают путем хроматографии через колонку с силикагелем, элюируя смесью петролейный эфир:хлороформ, 9:1 (78%ный выход). 1 Н ЯМР (300 МГц, CDCl3)ppm: 2.62 (s,3 Н); 6.95 (dd, 1H); 7.22 (dt, 1H); 7.40 (dd, 1H); 11.98(s, 1H). 14 В. 5-Фтор-2-гидрокси-3-нитроацетофенон. Следуя способу, описанному в примере 1(пункт И), начиная с 5-фтор-2-гидроксиацетофенона, получают соединение, указанное в заголовке, в виде желтого твердого вещества,которое очищают путем хроматографии через колонку с силикагелем, элюируя смесью петролейный эфир:хлороформ, 1:1 (52%-ный выход). 1(пункт Л), начиная с 2-(3-фенилпропил)-2,3 дигидробензофуран-5-карбоновой кислоты и 3 амино-5-фтор-2-гидроксиацетофенона, получают соединение, указанное в заголовке, которое очищают путем хроматографии через колонку с силикагелем, элюируя смесью петролейный эфир:хлороформ, 1:1 (79%-ный выход). 1(пункт А), начиная с N-(3-ацетил-5-фтор-2 гидроксифенил)-2-(3-фенилпропил)-2,3-дигидробензофуран-5-карбоксамида и диэтилоксалата, получают соединение, указанное в заголовке,которое очищают путем кристаллизации в этаноле (55%-ный выход). 1 Н ЯМР (300 МГц, CDCl3)ppm: 148 (t,3 Н); 1.70-1.92 (m, 4H); 2.79 (t, 2H); 2.90(dd,1H); 3.32(dd,1H); 4.48 (q, 2H); 4.90 (m, 1H); 6.80 (d,1H); 7.08 (s, 1H); 7.18-7.32 (sc, 5H); 7.42 (dd, 1H); 7.69 (dd, 1H); 7.77 (s, 1H); 8.70 (dd, 1H); 8.71(пункт Н), начиная с этилового эфира 8-[2-(3 фенилпропил)-2,3-дигидробензофуран-5-карбоксамидо]-6-фтор-4-оксо-4 Н-1-бензопиран-2 карбоновой кислоты, получают соединение,указанное в заголовке, в виде белого твердого вещества с точкой плавления 183-185 С, которое очищают путем хроматографии через колонку с силикагелем, элюируя смесью хлороформ:метанол, 95:5 (66%-ный выход). 1(пункт А), начиная с 2-хлор-4-гидроксибензонитрила, получают соединение, указанное в заголовке, в виде белого твердого вещества с точкой плавления 50-52 С (98%-ный выход). 1 Н ЯМР (300 МГц, CDCl3)ppm: 4.59 (m,2H); 5.35 (dd, 1H); 5.40 (dd, 1H); 6.00 (m, 1H); 6.88 (dd, 1H); 7.03 (d, 1H); 7.59 (d). 15 Б. 5-Аллил-2-хлор-4-гидроксибензонитрил и 3-аллил-2-хлор-4-гидроксибензонитрил. Следуя способу, описанному в примере 6(пункт Б), начиная с 4-аллилокси-2-хлорбензонитрила, получают смесь 5-аллил-2-хлор-4 гидроксибензонитрила и 3-аллил-2-хлор-4 гидроксибензонитрила. Два изомера разделяют путем хроматографии через колонку с силикагелем. Элюируя смесью петролейный эфир:этиловый эфир, 8:2, выделяют изомер 5 аллил-2-хлор-4-гидроксибензонитрил (39%-ный выход) и, элюируя смесью петролейный эфир:этиловый эфир, 6:4, выделяют изомер 3 аллил-2-хлор-4-гидроксибензонитрил (51 %-ный выход). 1(пункт Б), начиная с 4-хлор-2-трифторметансульфонилоксиметил-2,3-дигидробензофуран-5 карбонитрила и 2-бромэтилбензола, получают соединение, указанное в заголовке, которое очищают путем хроматографии через колонку с силикагелем, элюируя смесью петролейный эфир:этиловый эфир, 95:5 (68%-ный выход).(пункт А), начиная с N-(3-ацетил-2-гидроксифенил)-4-хлор-2-(3-фенилпропил)-2,3-дигидробензофуран-5-карбоксамида и диэтилоксалата,получают соединение, указанное в заголовке,которое очищают путем хроматографии через колонку с силикагелем, элюируя смесью петролейный эфир: хлороформ, 4:6 (61 %-ный выход). 1(пункт Н), начиная с этилового эфира 8-[4-хлор 2-(3-фенилпропил)-2,3-дигидробензофуран-5 карбоксамидо]-4-оксо-4 Н-1-бензопиран-2 карбоксилата, получают соединение, указанное в заголовке, в виде желтоватого твердого вещества, которое распадается при 265 С (81 %-ный выход). 1(пункт В), начиная с 5-аллил-2-хлор-4-гидроксибензонитрила, получают соединение, указанное в заголовке, которое очищают путем хроматографии через колонку с силикагелем, элюируя смесью петролейный эфир: хлороформ, 1:4(пункт Б), начиная с 6-хлор-2-трифторметансульфонилоксиметил-2,3-дигидробензофуран-5-карбонитрила и 2-бромэтилбензола, получают соединение, указанное в заголовке, которое очищают путем хроматографии через колонку с силикагелем, элюируя смесью петролейный эфир: этиловый эфир, 9:1 (20%-ный выход). 1(пункт Л), начиная с 6-хлор-2-(3-фенилпропил)2,3-дигидробензофуран-5-карбоновой кислоты и З-амино-2-гидроксиацетофенона, получают соединение, указанное в заголовке, которое очищают путем хроматографии через колонку с(пункт А), начиная с N-(3-ацетил-2-гидроксифенил)-6-хлор-2-(3-фенилпропил)-2,3-дигидробензофуран-5-карбоксамида и диэтилоксалата,получают соединение, указанное в заголовке,которое очищают путем хроматографии через колонку с силикагелем, элюируя смесью петролейный эфир:хлороформ, 4:6 (75%-ный выход). 1 Н ЯМР (300 МГц, CDCl3)ppm: 1.42 (t,3H); 1.70-1.92 (m, 4H); 2.68 (t, 2 Н); 2.85 (dd, 1H); 3.29 (dd, 1H); 4.45 (q, 2H); 4.92 (m, 1H); 6,81 (s,1H); 7.12 (s, 1H); 7.15-7.32 (sc, 5H); 7.43 (t, 1H); 7.85 (dd, 1H); 7.86 (s, 1H); 8.93 (d, 1H); 9.52 (s,1H). 16 Ж. 8-[6-Хлор-2-(3-фенилпропил)-2,3 дигидробензофуран-5-карбоксамидо]-4-оксо 4 Н-1-бензопиран-2-карбоновая кислота. Следуя способу, описанному в примере 1(пункт Н), начиная с этилового эфира 8-[6-хлор 2-(3-фенилпропил)-2,3-дигидробензофуран-5 карбоксамидо]-4-оксо-4 Н-1-бензопиран-2 карбоновой кислоты, получают соединение,указанное в заголовке, в виде желтоватого твердого вещества, которое распадается при 265 С(s, 1H); 10,00 (s, 1H); 12.46 (широкий s, 1H). 17 В. Метиловый эфир 1-(4-фенилбутил)-3 формилиндол-5-карбоновой кислоты. К раствору метилового эфира 3 формилиндол-5-карбоновой кислоты (2,234 г,11,0 ммоль) и трет-бутоксида калия (1,259 г,11,2 ммоль) в сухом N,N-диметилформамиде (50 мл) добавляют 1-бром-4-фенилбутан (2,385 г,11,2 ммоль) и оставляют при перемешивании при комнатной температуре в течение 18 ч. После этого растворитель выпаривают при пониженном давлении, полученный остаток фракционируют между насыщенным раствором NaCl(50 мл) и хлороформом (50 мл), и водную фазу экстрагируют хлороформом (3 х 50 мл). После высушивания и выпаривания растворителя при пониженном давлении, получают неочищенное соединение, которое очищают путем хроматографии через колонку с силикагелем, элюируя смесью н-гексан:этилацетат, 70:30, таким образом получая 2,847 г соединения, указанного в заголовке (87%-ный выход). 1(t,2H); 7.11 (d, 2H); 7.19 (m, 1H); 7.25 (d, 2H); 7,33 (d, 1H); 7.70(s, 1H); 8.01 (dd, 1H); 8.99 (s,1H); 9.98 (s, 1H). 17 Г. Метиловый эфир 1-(4-фенилбутил)-3 метилиндол-5-карбоновой кислоты. К раствору метилового эфира 1-(4 фенилбутил)-3-формилиндол-5-карбоновой кислоты (600 мг, 1,79 ммоль) в сухом дихлорметане (15 мл) последовательно добавляют иодид цинка (857 мг, 2.69 ммоль) и цианоборгидрид натрия (843 мг, 13,41 ммоль). Полученную смесь оставляют при перемешивании при 85 С в течение 1,5 ч. После этого смесь фильтруют через броунмиллерит, промывая твердое вещество дихлорметаном (200 мл). Растворитель выпаривают при пониженном давлении и полученное неочищенное соединение очищают путем хроматографии через колонку с силикагелем, элюируя смесью н-гексан:этилацетат, 98:2,таким образом выделяя 459 мг соединения, указанного в заголовке (80%-ный выход). 1(пункт Л), начиная с 1-(4-фенилбутил)-3 метилиндол-5-карбоновая кислоты и 8-амино-4 оксо-2-(5-1 Н-тетразолил)-4 Н-1-бензопирана,получают соединение, указанное в заголовке, в виде желтого твердого вещества с точкой плавления 186-187 С, которое очищают путем кристаллизации в метаноле (54%-ный выход). 1 Н ЯМР (300 МГц, СDСl3)ррm: 1.53(m,2 Н); 1.78 (m, 2H); 2.35 (s, 3 Н); 2.59 (t,2H); 4.21 (t, 2H); 7.13-7.18 (sc, 4H); 7.23-7.29 (sc,3 Н); 7.57 (m, 2H); 7,83(dd,1H); 8.87(dd,1H); 8.33(s, 1H); 8.38 (d, 1H); 10.05(s,1H). Пример 18. 8-4-(4-Фенилбутокси)фенил] метилокси]-4-оксо-4 Н-1-бензопиран-2-карбоновая кислота. 18 А. Метиловый эфир 4-(4-фенилбутокси) бензойной кислоты. К смеси метилового эфира 4 гидроксибензойной кислоты (3 г, 19,7 ммоль), 4 фенилбутанола (3,04 мл, 19,7 ммоль) и трифенилфосфина (7,74 г, 29,6 ммоль) в безводном тетрагидрофуране (110 мл) добавляют диэтил азодикарбоксилат (4.65 мл, 29,6 ммоль). Полученную в результате смесь оставляют при перемешивании при комнатной температуре в течение 36 ч, затем добавляют этиловый эфир (500 мл) и оставляют кристаллизоваться в течение 24 ч при 0 С. После этого твердое вещество отфильтровывают и фильтрат последовательно промывают 0,2 М соляной кислотой, 5%-ным бикарбонатом натрия и насыщенным раствором хлорида натрия. После высушивания и удаления растворителя при пониженном давлении, получают остаток, который очищают путем хроматографии через колонку с силикагелем, элюируя смесями петролейный эфир:хлороформ увеличивающейся полярности, таким образом выделяя 3,856 г соединения, указанного в заголовке(пункт Б), начиная с метилового эфира 4-(4 фенилбутокси)бензойной кислоты, получают соединение, указанное в заголовке, которое очищают путем варки в этиловом эфире (92%ный выход). 1 Н ЯМР (300 МГц, СD3OD)ppm: 1.81 (m,4 Н); 2.68 (t, 2H); 4.01 (t, 2H); 6.90 (d, 2H); 7,167.31 (sc, 5H); 7.97 (d, 2H). 18 В. 4-(4-Фенилбутокси)бензиловый спирт. К суспензии алюмогидрида лития (309 мг,7,62 ммоль) в безводном тетрагидрофуране (65 56 мл) добавляют в инертной атмосфере раствор 4(4-фенилбутокси)бензойной кислоты (1,03 г,3,81 ммоль) в 20 мл сухого этилового эфира. Смесь оставляют при перемешивании при комнатной температуре в течение 2 ч, после чего медленно добавляют насыщенный раствор NaCl в воде (80 мл), две фазы разделяют и водную фазу экстрагируют этилацетатом (3 х 50 мл). Органические экстракты сушат и растворитель выпаривают, получая неочищенное соединение,которое варят с этиловым эфиром. Экстракты после варки выпаривают при пониженном давлении, получая 556 мг соединения, указанного в заголовке (57%-ный выход). 1H ЯМР (300 МГц, CDCl3)ppm: 1.79 (m,4 Н); 2.65 (t, 2H); 3.92 (t, 2H); 4.54 (s,2H); 6.85 (d,2H); 7,13-7.28 (sc, 7H). 18 Г. 4-(4-Фенилбутокси)бензилхлорид. Раствор 4-(4-фенилбутокси)бензилового спирта (556 мг, 2,17 ммоль) в хлороформе (10 мл) смешивают с тионилхлоридом (0,288 мл) и оставляют при перемешивании при комнатной температуре в течение 24 ч, затем выпаривают до сухости при пониженном давлении, получая 595 мг соединения, указанного в заголовке (количественный выход). 1(100 мл) добавляют при 0 С 3 М раствор бромида метилмагния в этиловом эфире (35 мл) и оставляют при перемешивании при 0 С в течение 0,5 ч. Затем к реакционной смеси добавляют двухфазную смесь этилового эфира и насыщенного раствора хлорида аммония, экстрагируя водную фазу этиловым эфиром. Органические экстракты сушат и растворитель выпаривают при пониженном давлении, таким образом получая 10,06 г соединения, указанного в заголовке (92%-ный выход). 1H ЯМР (300 МГц, CDCl3)ppm: 1.45 (d,3 Н); 3.02 (широкий s, 1H); 3.83 (s, ЗН); 3.84 (s,3 Н); 5.12 (m, 1H); 6.81 (dd, 1H); 6.96-7.06 (sc,2H). 18 Е. 2',3'-Диметоксиацетофенон. К раствору дихромата калия (24,76 г), воды(12 мл) добавляют 2-(2,3-диметоксифенил)этан 2-ол (10,06 г, 55.3 ммоль) и оставляют при перемешивании при комнатной температуре в течение 15 мин. После этого смесь экстрагируют этиловым эфиром и последовательно промывают 5%-ным раствором карбоната калия (2 х 150 мл) и насыщенным раствором хлорида натрия(1 х 100 мл). Растворитель сушат и выпаривают при пониженном давлении, получая остаток,который очищают путем перегонки при высоком вакууме. При давлении 0,3 торр и темпера 57 туре 85 С отгоняется 6,47 г соединения, указанного в заголовке (65%-ный выход). 1(4,85 г, 26,9 ммоль) в дихлорметане (100 мл) добавляют при -70 С раствор 1 М трибромида бора в дихлорметане (68 мл). Смесь оставляют охлаждаться, продолжая перемешивать в течение 2,5 ч при комнатной температуре, затем добавляют метанол (70 мл), оставляют перемешиваться в течение 1 ч, после чего выпаривают до сухости. Остаток растворяют в этилацетате (250 мл), промывают 2%-ным NаНСО 3 (1 х 30 мл),сушат и растворитель выпаривают, получая неочищенное соединение, которое очищают путем кристаллизации в метаноле, таким образом получая 3,10 г соединения, указанного в заголовке,в виде желтого твердого вещества (76%-ный выход) 1 Н ЯМР (300 МГц, СDСl3)ppm: 2.61 (s,3 Н); 7.05-6.77 (t, 1H); 7.02 (dd, 1H); 7.36 (dd,1H). 183. Этиловый эфир 8-гидрокси-4-оксо 4 Н-1-бензопиран-2-карбоновой кислоты. Следуя способу, описанному в примере 1(dd, 1H). 18 И. Этиловый эфир 8-4-(4-фенилбутокси)фенил]метилокси]-4-оксо-4 Н-1 бензопиран-2-карбоновой кислоты. К раствору карбоната калия (330 мг. 2,39 ммоль) в сухом N,N-диметилформамиде (15 мл) добавляют этиловый эфир 8-гидрокси-4-оксо 4 Н-1-бензопиран-2-карбоновой кислоты (520 мг, 2,39 ммоль), перемешивая при комнатной температуре в течение 10 мин. После этого к реакционной смеси добавляют 4-(4-фенилбутокси)бензилхлорид (595 мг, 2,17 ммоль) и оставляют при перемешивании при 60 С в течение 18 ч, затем добавляют воду (25 мл), экстрагируют этиловым эфиром (3 х 50 мл), сушат и растворитель выпаривают при пониженном давлении,получая остаток, который очищают путем хроматографии через колонку с силикагелем,элюируя смесью петролейный эфир: хлороформ,7:3, выделяя 740 мг соединения, указанного в заголовке (66%-ный выход). 1 Н ЯМР (300 МГц, СDСl3)ppm: 1.40 (t,3H); 1.80 (m, 4H); 2.66 (t, 2H); 3.95 (t,2H); 4.41(пункт Н), начиная с этилового эфира 8-4-(4 фенилбутокси)фенил]метилокси]-4-оксо-4 Н-1 бензопиран-2-карбоновой кислоты, получают соединение, указанное в заголовке, в виде слегка желтоватого полутвердого вещества (78%ный выход). 1N-(3-Ацетил-2-гидроксифенил)-4 метоксибензолсульфонамид. К раствору 3'-амино-2'-гидроксиацетофенона гидробромида (1,282 г, 5,52 ммоль) в пиридине (25 мл) при 0 С добавляют 4 метоксибензолсульфонилхлорид (1,18 г, 5,71 ммоль), растворенный в минимальном количестве пиридина, и смесь оставляют при комнатной температуре на 18 ч. Затем ее выпаривают до сухости, снова растворяют в дихлорметане,промывают 1 М HCl, сушат и растворитель выпаривают при пониженном давлении, таким образом получая 1,479 г соединения, указанного в заголовке (81 %-ный выход). 1N-(3-ацетил-2 гидроксифенил)-4-метоксибензолсульфонамида и диэтилоксалата, получают соединение, указанное в заголовке, которое очищают путем хроматографии через колонку с силикагелем,элюируя смесью петролейный эфир: хлороформ 4:6 (90%-ный выход). 1(пункт Ж), начиная с этилового эфира 8-[(4 метоксифенил)сульфониламино]-4-оксо-4 Н-1 бензопиран-2-карбоновой кислоты, получают соединение, указанное в заголовке, которое очищают путем хроматографии через колонку с силикагелем, элюируя смесью петролейный эфир:хлороформ 25:75 (67%-ный выход). 1 Н ЯМР (300 МГц, CDCl3)ppm: 1.43 (t,3 Н); 4.47 (q, 2H); 6.80 (d, 2H); 6,99 (s, 1H); 7.24(s, 1H); 7.38 (t, 1H); 7.61 (d, 2H); 7.85 (d, 1H); 7.96 (d, 1H); 12.51 (s, 1H). 19 Г. 8-4-(4-фенилбутокси)фенил]сульфониламино]-4-оксо-4 Н-1-бензопиран-2-карбоновая кислота. К раствору этилового эфира 8-[(4 гидроксифенил)сульфониламино)]-4-оксо-4 Н-1 бензопиран-2-карбоновой кислоты (200 мг, 0,26 ммоль) в ДМФ (3 мл) добавляют 5,3 М раствор метоксида натрия в метаноле (0,194 мл, 1,04 ммоль), и смесь оставляют перемешиваться при 50 С в течение 2 ч, затем охлаждают при 0 С,добавляют 1-бром-4-фенилбутан (57 мг, 0,26 ммоль), перемешивают при 50 С 2 ч и при комнатной температуре 18 ч. Затем смесь выпаривают до сухости, фракционируют в смеси вода:этилацетат, 1:1, экстрагируют эилацетатом(3 х 25 мл), промывают 0,2 М НСl, сушат и выпаривают растворитель, получая неочищенное соединение, которое очищают путем хроматографии через колонку с силикагелем, элюируя смесями хлороформ:метанол с возрастающей полярностью, получая 70 мг соединения, указанного в заголовке (54%-ный выход). 1(10 мл) при 0 С последовательно добавляют концентрированную серную кислоту (0,70 мл) и нитрит натрия (0,783 г, 11,3 ммоль), растворенный в воде (1,5 мл), смесь оставляют перемешиваться при 0 С на 20 мин. Затем добавляют концентрированную серную кислоту (0,2 мл) и получившуюся смесь выливают на раствор иодида калия (2,2 г) в воде (2 мл), охлажденный до 0 С. Через несколько минут добавляют медный порошок (11 мг) и смесь оставляют на 2 ч при 75 С. По прошествии этого времени смеси дают остыть при комнатной температуре, а затем экстрагируют хлороформом (3 х 50 мл), органическую фазу промывают 5%-ным раствором тиосульфата натрия, сушат и растворитель выпаривают при пониженном давлении. Полученную смесь очищают путем колоночной хроматографии,элюируя смесью петролейный эфир:хлороформ, 6:4, получая 1,95 г соединения, указанного в заголовке (69%-ный выход). 1(sc, 5 Н); 7.78 (d, 2H); 9.83 (s, 1H). 20 В. 4-(4-Фенилбутокси)стирол. К раствору метилтрифенилфосфонийбромида (4,98 г, 13,9 ммоль) в безводном тетрагидрофуране (130 мл) при 0 С и в инертной атмосфере добавляют 1,6 М раствор бутиллития в гексане (8,69 мл) и смесь оставляют перемешиваться при 0 С на 2 ч. Затем добавляют раствор 4-(4-фенилбутокси)бензальдегида (2,5 г, 9,84 ммоль) в тетрагидрофуране (10 мл) и смесь оставляют перемешиваться при комнатной температуре на 36 ч, затем осторожно добавляют воду(20 мл) и экстрагируют этиловым эфиром (4 х 50 мл). Органические экстракты сушат и растворители выпаривают при пониженном давлении. Полученный неочищенный продукт очищают путем хроматографии через колонку с силикагелем, элюируя смесью петролейный эфир: этиловый эфир, 95:5, выделяя 4,20 г соединения,указанного в заголовке (62%-ный выход). 1(612 мг, 2,33 ммоль), триэтиламина (0,408 мл,3,01 ммоль), ацетата палладия (II) (14 мг, 0,06 ммоль) в ацетонитриле (15 мл) оставляют перемешиваться при 100 С на 24 ч. Затем к смеси добавляют воду (15 мл), экстрагируют этиловым эфиром (4 х 30 мл), сушат и растворители выпаривают при пониженном давлении. Полученный остаток очищают путем хроматографии через колонку с силикагелем, элюируя смесью петролейный эфир: этиловый эфир, 9:1, получая 633 г соединения, указанного в заголовке (70%ный выход). 1(пункт А), начиная с 3'-[(Е)-2-[4-(4-фенилбутокси)фенил]этен-1-ил]-2'-гидроксиацетофенона и диэтилоксалата, получают соединение,указанное в заголовке, которое очищают путем хроматографии через колонку с силикагелем,элюируя смесью петролейный эфир:хлороформ,6:4 (66%-ный выход).
МПК / Метки
МПК: C07D 311/58, A61K 31/352, A61P 9/00
Метки: отношении, действием, бензопирана, обладающие, антагонистическим, лейкотриена, производные
Код ссылки
<a href="https://eas.patents.su/30-1680-proizvodnye-benzopirana-obladayushhie-antagonisticheskim-dejjstviem-v-otnoshenii-lejjkotriena.html" rel="bookmark" title="База патентов Евразийского Союза">Производные бензопирана, обладающие антагонистическим действием в отношении лейкотриена.</a>
Предыдущий патент: Металлические соли циклогексеноноксимовых эфиров
Следующий патент: Способ лечения или предупреждения макулярного отека или возрастной макулярной дистрофии
Случайный патент: Способ получения симвастатина и его производных












