Гетероароматические производные фенилимидазола в качестве ингибиторов фермента pde10a
Номер патента: 23663
Опубликовано: 30.06.2016
Авторы: Ланггор Мортен, Пюшль Аск, Нильсен Якоб, Мариго Мауро, Килберн Джон Пол, Келер Ян
Формула / Реферат
1. Соединение, имеющее структуру I
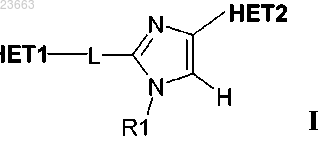
где HET1 обозначает гетероароматическую группу, выбранную из группы, состоящей из имидазо[1,2-а]пиримидина, [1,2,4]триазоло[1,5-а]пиридина, [1,2,4]триазоло[1,5-а]пиразина и [1,2,4]триазоло[1,5-а]пиримидина; и НЕТ1 необязательно может содержать вплоть до трех заместителей R2-R4, индивидуально выбранных из атома водорода, C1-C6-алкила, атома галогена, C1-C6-алкокси и C1-C6-гидроксиалкила;
НЕТ2 обозначает гетероароматическую группу, выбранную из группы, состоящей из тиофена, фурана, тиазола и пиридина, и НЕТ2 необязательно может содержать вплоть до трех заместителей R5, R6 и R7, индивидуально выбранных из атома водорода и C1-C6-алкила;
-L- обозначает мостиковую группу, выбранную из -СН2-СН2- и -СН=СН-;
R1 выбран из группы, состоящей из Н, C1-C6-алкила, тетрагидропиран-4-ил-метила и 2-морфолин-4-ил-этила,
и его таутомеры и фармацевтически приемлемые кислотно-аддитивные соли.
2. Соединение по п.1, где R1 обозначает атом водорода.
3. Соединение по п.1, где R1 отличен от атома водорода.
4. Соединение по любому из пп.1-3, где R2, R3, R4, R5 и R6 все обозначают атом водорода.
5. Соединение по любому из пп.1-3, где по меньшей мере один из R2, R3, R4 обозначает C1-C6-алкокси.
6. Соединение по п.5, где C1-C6-алкокси представляет собой метокси.
7. Соединение по любому из пп.1-3, где по меньшей мере один из R2, R3, R4 обозначает атом галогена.
8. Соединение по п.7, где атом галогена представляет собой атом хлора или фтора.
9. Соединение по любому из пп.1-3, где R2, R3 и R4 все обозначают атом водорода.
10. Соединение по любому из пп.1-3, где по меньшей мере один из R2, R3 и R4 обозначает C1-C6-алкил.
11. Соединение по п.10, где C1-C6-алкил представляет собой метил.
12. Соединение по п.7, где атом галогена представляет собой атом хлора или брома.
13. Соединение по п.1, выбранное из группы, которая включает
5,7-диметил-2-[2-(1-метил-4-тиофен-3-ил-1H-имидазол-2-ил)этил]имидазо[1,2-а]пиримидин;
5,7-диметил-2-[(Е)-2-(1-метил-4-пиридин-3-ил-1H-имидазол-2-ил)винил]имидазо[1,2-а]пиримидин;
5,7-диметил-2-[(Е)-2-(1-метил-4-тиофен-2-ил-1H-имидазол-2-ил)винил]имидазо[1,2-а]пиримидин;
2-[(Е)-2-(4-фуран-2-ил-1-метил-1H-имидазол-2-ил)винил]-5,7-диметилимидазо[1,2-а]пиримидин;
5,7-диметил-2-[(Е)-2-(1-метил-4-тиазол-5-ил-1H-имидазол-2-ил)винил]имидазо[1,2-а]пиримидин;
5,7-диметил-2-[(Е)-2-(1-метил-4-тиазол-4-ил-1H-имидазол-2-ил)винил]имидазо[1,2-а]пиримидин;
5,7-диметил-2-[(Е)-2-(1-метил-4-тиофен-3-ил-1H-имидазол-2-ил)винил]имидазо[1,2-а]пиримидин;
2-[(Е)-2-(4-фуран-3-ил-1-метил-1Н-имидазол-2-ил)винил]-5,7-диметилимидазо[1,2-а]пиримидин;
5,7-диметил-2-[2-(4-тиофен-2-ил-1H-имидазол-2-ил)этил]имидазо[1,2-а]пиримидин;
2-{2-[1-(2-фторэтил)-4-тиофен-2-ил-1H-имидазол-2-ил]этил}-5,7-диметил-имидазо[1,2-а]пиримидин;
5,7-диметил-2-{2-[1-(2-морфолин-4-илэтил)-4-тиофен-2-ил-1H-имидазол-2-ил]этил}имидазо[1,2-а]пиримидин;
5,7-диметил-2-[2-(1-метил-4-тиофен-2-ил-1H-имидазол-2-ил)этил]имидазо[1,2-а]пиримидин;
(S)-2-{2-[2-(5,7-диметилимидазо[1,2-а]пиримидин-2-ил)этил]-4-тиофен-2-илимидазол-1-ил}пропан-1-ол;
5,7-диметил-2-[2-(1-пропил-4-тиофен-2-ил-1H-имидазол-2-ил)этил]имидазо[1,2-а]пиримидин;
2-[2-(1-изопропил-4-тиофен-2-ил-1H-имидазол-2-ил)этил]-5,7-диметилимидазо[1,2-а]пиримидин;
5,7-диметил-2-{2-[1-(3-метилбутил)-4-тиофен-2-ил-1H-имидазол-2-ил]этил}имидазо[1,2-а]пиримидин;
2-[2-(1-изобутил-4-тиофен-2-ил-1Н-имидазол-2-ил)этил]-5,7-диметилимидазо[1,2-а]пиримидин;
5-метил-2-[2-(4-тиофен-2-ил-1Н-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиридин;
8-метил-2-[2-(4-тиофен-2-ил-1Н-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиридин;
(S)-2-{2-[2-(5-метил[1,2,4]триазоло[1,5-а]пиридин-2-ил)этил]-4-тиофен-2-илимидазол-1-ил}пропан-1-ол;
5-метил-2-{2-[4-(5-метилфуран-2-ил)-1H-имидазол-2-ил]этил}-[1,2,4]триазоло[1,5-а]пиридин;
5-метил-2-[2-(4-тиофен-3-ил-1H-имидазол-2-ил]этил}-[1,2,4]триазоло[1,5-а]пиридин;
5-метил-2-[2-(4-пиридин-3-ил-1H-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиридин;
5-метил-2-{2-[4-(4-метилтиофен-3-ил)-1H-имидазол-2-ил]этил}-[1,2,4]триазоло[1,5-а]пиридин;
8-метокси-2-[(Е)-2-(1-метил-4-тиофен-2-ил-1H-имидазол-2-ил)винил]-[1,2,4]триазоло[1,5-а]пиридин;
8-метокси-2-[(Е)-2-(1-метил-4-тиофен-3-ил-1H-имидазол-2-ил)винил]-[1,2,4]триазоло[1,5-а]пиридин;
8-метокси-2-[(Е)-2-(1-метил-4-тиазол-5-ил-1H-имидазол-2-ил)винил]-[1,2,4]триазоло[1,5-а]пиридин;
8-метокси-2-{(Е)-2-[1-метил-4-(5-метилфуран-2-ил)-1H-имидазол-2-ил]винил}-[1,2,4]триазоло[1,5-а]пиридин;
2-[(Е)-2-(4-фуран-3-ил-1-метил-1Н-имидазол-2-ил)винил]-8-метокси[1,2,4]триазоло[1,5-а]пиридин;
8-метокси-2-{(Е)-2-[1-метил-4-(4-метилтиофен-3-ил)-1H-имидазол-2-ил]винил}-[1,2,4]триазоло[1,5-а]пиридин;
8-метокси-5-метил-2-[(Е)-2-(1-метил-4-тиофен-2-ил-1Н-имидазол-2-ил)винил]-[1,2,4]триазоло[1,5-а]пиридин;
5,7-диметил-2-[2-(1-метил-4-тиофен-2-ил-1H-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиримидин;
8-метокси-2-[2-(1-метил-4-тиофен-2-ил-1H-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиридин;
8-метокси-2-[2-(1-метил-4-тиофен-3-ил-1H-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиридин;
8-метокси-2-[2-(1-метил-4-тиазол-5-ил-1H-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиридин;
8-метокси-2-{2-[1-метил-4-(5-метилфуран-2-ил)-1H-имидазол-2-ил]этил}-[1,2,4]триазоло[1,5-а]пиридин;
8-метокси-2-{2-[1-метил-4-(4-метилтиофен-3-ил)-1H-имидазол-2-ил]этил}-[1,2,4]триазоло[1,5-а]пиридин;
8-фтор-2-[(Е)-2-(1-метил-4-тиазол-5-ил-1H-имидазол-2-ил)винил]-[1,2,4]триазоло[1,5-а]пиридин;
(R)-1-хлор-3-{2-[2-(5-метил[1,2,4]триазоло[1,5-а]пиридин-2-ил)этил]-4-тиофен-2-илимидазол-1-ил}пропан-2-ол;
8-фтор-2-[(Е)-2-(1-метил-4-тиофен-2-ил-1H-имидазол-2-ил)винил]-[1,2,4]триазоло[1,5-а]пиридин;
8-фтор-2-{(Е)-2-[1-метил-4-(5-метилфуран-2-ил)-1H-имидазол-2-ил]винил}-[1,2,4]триазоло[1,5-а]пиридин;
8-метокси-5-метил-2-[2-(1-метил-4-тиофен-2-ил-1H-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиридин;
8-фтор-2-[2-(1-метил-4-тиофен-2-ил-1Н-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиридин;
8-фтор-2-{2-[1-метил-4-(5-метилфуран-2-ил)-1H-имидазол-2-ил]этил}-[1,2,4]триазоло[1,5-а]пиридин;
8-метил-2-[2-(4-пиридин-3-ил-1H-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиридин;
5,7-диметил-2-[2-(1-метил-4-пиридин-3-ил-1H-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиримидин;
8-метокси-2-[2-(4-тиазол-5-ил-1Н-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиридин;
8-метокси-2-[2-(4-пиридин-3-ил-1H-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиридин;
8-метокси-2-[2-(4-тиофен-2-ил-1H-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиридин;
8-метокси-2-{2-[4-(5-метилфуран-2-ил)-1H-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиридин;
5-метил-2-[2-(1-метил-4-тиофен-2-ил-1H-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиридин;
8-метил-2-[2-(1-метил-4-тиофен-2-ил-1H-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиридин;
5-метил-2-[2-(1-пропил-4-пиридин-3-ил-1H-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиридин;
5-метил-2-[2-(1-метил-4-пиридин-3-ил-1H-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиридин;
8-метил-2-[2-(1-метил-4-пиридин-3-ил-1H-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиридин;
8-метил-2-[2-(1-метил-4-тиазол-5-ил-1H-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиридин;
5-метил-2-[2-(1-метил-4-тиазол-5-ил-1H-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиридин;
8-метокси-5-метил-2-[2-(1-метил-4-тиазол-5-ил-1H-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиридин;
8-метокси-5-метил-2-[2-(1-метил-4-пиридин-3-ил-1H-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиридин;
8-метокси-5-метил-2-[2-(4-тиофен-2-ил-1H-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиридин;
5,8-диметил-2-[2-(1-метил-4-тиофен-2-ил-1H-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиридин;
8-метокси-5-метил-2-[2-(1-пропил-4-тиофен-2-ил-1H-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиридин;
8-метокси-5-метил-2-{2-[1-(2-морфолин-4-илэтил)-4-тиофен-2-ил-1H-имидазол-2-ил]этил}-[1,2,4]триазоло[1,5-а]пиридин;
8-метокси-5-метил-2-[2-(1-метил-4-тиофен-3-ил-1H-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиридин;
2-[2-(4-фуран-3-ил-1-метил-1H-имидазол-2-ил)этил]-8-метокси-5-метил[1,2,4]триазоло[1,5-а]пиридин;
5,8-диметил-2-{2-[1-метил-4-(5-метилфуран-2-ил)-1H-имидазол-2-ил]этил}-[1,2,4]триазоло[1,5-а]пиразин;
5,8-диметил-2-[2-(1-метил-4-тиофен-2-ил-1H-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиразин;
5,8-диметил-2-[2-(1-метил-4-тиазол-2-ил-1H-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиридин;
5,8-диметил-2-[2-(1-метил-4-тиазол-2-ил-1Н-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиразин;
8-метокси-5-метил-2-[2-(1-метил-4-(4-метил)тиофен-3-ил-1H-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиридин;
5,8-диметил-2-[2-(1-метил-4-тиазол-2-ил-1Н-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-с]пиримидин;
5,8-диметил-2-[2-(1-метил-4-пиридин-3-ил-1H-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиридин;
5,8-диметил-2-[2-(1-метил-4-пиридин-3-ил-1H-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиразин;
5,8-диметил-2-{2-[1-метил-4-(5-метилфуран-2-ил)-1H-имидазол-2-ил]этил}-[1,2,4]триазоло[1,5-а]пиридин;
5,7-диметил-2-{2-[1-метил-4-(5-метилфуран-2-ил)-1H-имидазол-2-ил]этил}-[1,2,4]триазоло[1,5-а]пиримидин;
2-[2-(4-фуран-3-ил-1-метил-1H-имидазол-2-ил)этил]-5,8-диметил[1,2,4]триазоло[1,5-а]пиразин;
8-метокси-5-метил-2-{2-[1-метил-4-(5-метилфуран-2-ил)-1H-имидазол-2-ил]этил}-[1,2,4]триазоло[1,5-а]пиридин;
5,8-диметил-2-[2-(1-метил-4-тиазол-5-ил-1Н-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиразин;
5,7-диметил-2-[(Е)-2-(1-метил-4-пиразин-2-ил-1H-имидазол-2-ил)винил]имидазо[1,2-а]пиримидин;
5,7-диметил-2-[(Е)-2-(1-метил-4-пиридин-2-ил-1H-имидазол-2-ил)винил]имидазо[1,2-а]пиримидин;
5,7-диметил-2-{(Е)-2-[1-метил-4-(2-метил-2Н-пиразол-3-ил)-1H-имидазол-2-ил]винил}имидазо[1,2-а]пиримидин;
5,7-диметил-2-[(Е)-2-(1-метил-4-пиримидин-5-ил-1H-имидазол-2-ил)винил]имидазо[1,2-а]пиримидин;
5,7-диметил-2-{(Е)-2-[1-метил-4-(1-метил-1Н-пиразол-4-ил)-1H-имидазол-2-ил]винил}имидазо[1,2-а]пиримидин
и их фармацевтически приемлемые кислотно-аддитивные соли.
14. Применение соединения по любому из пп.1-13 в качестве лекарственного средства для лечения нейродегенеративного или психического расстройства, где нейродегенеративное расстройство выбрано из группы, которая включает болезнь Альцгеймера, мультиинфарктную деменцию, алкогольную деменцию или другую, связанную с лекарственными средствами деменцию, деменцию, связанную с внутричерепными опухолями или мозговой травмой, деменцию, связанную с болезнью Хантингтона или болезнью Паркинсона, СПИД-ассоциированную деменцию; делириозный синдром; амнестическое расстройство; посттравматическое стрессовое расстройство; задержку психического развития; расстройство развития навыков обучения; расстройство, связанное с дефицитом внимания/гиперактивностью; возрастное снижение познавательных способностей; а психическое расстройство выбрано из группы, которая включает шизофрению; шизофрениформное расстройство; шизоаффективное расстройство; бредовое расстройство; вызванное химическими соединениями психотическое расстройство; изменение личности параноидального типа и изменение личности шизоидного типа.
15. Применение соединения по любому из пп.1-13 для лечения привыкания к чрезмерному употреблению лекарственных препаратов у млекопитающего, включая человека.
16. Фармацевтическая композиция, имеющая PDE10A ингибирующую активность, содержащая терапевтически эффективное количество соединения по любому из пп.1-13 и один или несколько фармацевтически приемлемых носителей, разбавителей или наполнителей.
Текст
ГЕТЕРОАРОМАТИЧЕСКИЕ ПРОИЗВОДНЫЕ ФЕНИЛИМИДАЗОЛА В КАЧЕСТВЕ ИНГИБИТОРОВ ФЕРМЕНТА PDE10A Изобретение касается соединений формулы I где значения R1, HET1, НЕТ 2, L указаны в формуле изобретения, которые являются ингибиторами фермента PDE10A. В изобретении предлагается фармацевтическая композиция, имеющаяPDE10A ингибирующую активность, содержащая терапевтически эффективное количество соединения по настоящему изобретению и фармацевтически приемлемый носитель. Кроме того,в настоящем изобретении предлагается применение соединения формулы I для лечения пациента,страдающего от нейродегенеративного расстройства, от привыкания к чрезмерному употреблению лекарственных средств или от психического расстройства. Область техники, к которой относится изобретение В настоящем изобретении предлагаются гетероароматические соединения, которые являются ингибиторами фермента PDE10A и, таким образом, пригодны для лечения нейродегенеративных и психических расстройств. В настоящем изобретении предлагаются также фармацевтические композиции, содержащие соединения по настоящему изобретению, и способы лечения расстройств с применением соединений по настоящему изобретению. Предпосылки к созданию изобретения По тексту настоящего описания даются ссылки на различные публикации во всей их полноте. Описание указанных публикаций включено в настоящее изобретение с целью более полного освещения существующего уровня техники в той области, к которой относится настоящее изобретение. Циклические нуклеотиды циклический аденозинмонофосфат (сАМР) и циклический гуанозинмонофосфат (cGMP) выполняют функции внутриклеточных вторичных сигнализаторов, регулирующих широкий спектр процессов в нейронах. Внутриклеточные cAMP и cGMP генерируются аденилциклазами и гуанилциклазами и разлагаются циклическими нуклеотидфосфодиэстеразами (PDE). Внутриклеточные уровни cAMP и cGMP регулируются путем передачи сигнала внутри клетки, и стимуляция/репрессия аденилциклаз и гуанилциклаз в ответ на активацию под действием GPCR представляет собой хорошо изученный путь регулирования концентрации циклических нуклеотидов (Antoni, F.A. Front. Neuroendocrinol. 2000, 21, 103-132). В свою очередь, концентрации сАМР и cGMP регулируют активность сАМР- иcGMP-зависимых киназ, а также других белков с циклическими нуклеотидными ответными элементами,которые за счет последующего фосфорилирования белков и других процессов регулируют ключевые функции нейронов, такие как передача возбуждения по синапсам, дифференциация и выживание нейронов. Существует 21 ген фосфодиэстераз, которые можно разделить на 11 семейств генов. Существует десять семейств аденилилциклаз, два семейства гуанилилциклаз и одиннадцать семейств фосфодиэстераз. PDE представляют собой класс внутриклеточных ферментов, которые регулируют уровни сАМР иcGMP посредством гидролиза циклических нуклеотидов в их соответствующие нуклеотидмонофосфаты. Некоторые PDE разлагают сАМР, некоторые разлагают cGMP, а некоторые разлагают оба указанных типа. Большинство PDE обладает способностью к обширной экспрессии и играет свою роль во многих тканях, в то время как некоторые в большей степени являются тканеспецифичными. Фосфодиэстераза 10 А (PDE10A) представляет собой обладающую "двойной" специфичностью фосфодиэстеразы, которая может превращать как сАМР в AMP, так и cGMP в GMP (Loughney, K. et al.,Gene 1999, 234, 109-117; Fujishige, K. et al., Eur. J. Biochem. 1999, 266, 1118-1127 и Soderling, S. et al.,Proc. Natl. Acad. Sci. 1999, 96, 7071-7076). PDE10A, в первую очередь, экспрессируется в нейронах в полосатом теле, прилежащем ядре и в обонятельных узелках (Kotera, J. et al., Biochem. Biophys. Res. Comm. 1999, 261, 551-557 и Seeger, T.F. et al., Brain Research, 2003, 985, 113-126).PDE10A мыши является первым идентифицированным членом семейства PDE10 фосфодиэстераз(Fujishige, K. et al., J. Biol. Chem. 1999, 274, 18438-18445 и Loughney, K. et al., Gene 1999, 234, 109-117), и идентифицированы N-концевые сплайс-варианты как генов мыши, так и генов человека (Kotera, J. et al.,Biochem. Biophys. Res. Comm. 1999, 261, 551-557 и Fujishige, K. et al., Eur. J. Biochem. 1999, 266, 11181127). При этом последовательности у этих видов в большой степени гомологичны. По сравнению с другими семействами PDE, распространение PDE10A однозначно ограничено млекопитающими. мРНК дляPDE10 в значительной степени экспрессируется в яичках и мозге (Fujishige, K. et al., Eur. J. Biochem. 1999, 266, 1118-1127; Soderling, S. et al., Proc. Natl. Acad. Sci. 1999, 96, 7071-7076 и Loughney, K. et al.,Gene 1999, 234, 109-117). Указанные исследования показывают, что в мозге PDE10 в наибольшей степени экспрессируется в полосатом теле (хвостатое ядро и путамен), прилежащем ядре и обонятельных узелках. Совсем недавно был проведен анализ уровня экспрессии мРНК PDE10A (Seeger, T.F. et al., Abst.PDE10A с высокими уровнями экспрессируется в средних шипиковых нейронах (MSN) хвостатого ядра, прилежащем ядре и соответствующих нейронах обонятельных узелков. Они составляют сердцевину системы базальных ядер. MSN играют ключевую роль в кортиково-базально-таламокортикальной петле, интегрируя конвергентный кортикальный/таламический каскад реакций на входе и посылая указанную интегрированную информацию обратно в кору головного мозга. MSN экспрессируют два функциональных класса нейронов: класс D1, который экспрессирует D1-рецепторы дофамина, и класс D2, который экспрессирует D2-рецепторы дофамина. Класс D1 нейронов является частью "прямого" стриатального каскада реакций на выходе, который выполняет обширные функции, обеспечивающие поведенческие ответные реакции. Класс D2 нейронов является частью "непрямого" стриатального каскада реакций на выходе, функции которого заключаются в подавлении поведенческих ответных реакций, конкурирующих с поведенческими реакциями, которые обеспечивают "прямой" стриатальный каскад реакций. Указанные конкурирующие каскады реакций действуют как тормоз и акселератор в автомобиле. В упрощенном виде скудность движений при болезни Паркинсона является результатом избыточной активности "непрямого" каскада реакций, в то время как избыточная подвижность в таких расстройствах, как болезнь Хантингтона, отражает избыточную активность прямого каскада реакций. Регулирование посредством PDE10A передачи сигнала сАМР и/или cGMP в дендритном компартменте указанных нейронов может принимать участие в обработке и передаче кортико/таламического входного сигнала в MSN. Кроме того, PDE10A могут вовлекаться в регулирование высвобождения GABA в черной субстанции и бледном шаре (Seeger, T.F. et al., Brain Research, 2003, 985, 113-126). Применение антагонизма D2 рецептора дофамина при лечении шизофрении хорошо изучено. Начина с 1950-х годов подавление D2 рецепторов дофамина является оплотом лечения психоза, и все эффективные антипсихотические лекарственные средства являются антагонистами D2 рецепторов. ВоздействиеD2, вероятно, опосредуется, в первую очередь, нейронами в полосатом теле, прилежащем ядре и обонятельных узелках, поскольку указанные области получают наиболее плотные дофаминергические проекции и обладают наиболее сильной экспрессией D2 рецепторов (Konradi, С. and Heckers, S., Society of Biological Psychiatry, 2001, 50, 729-742). Агонизм D2-рецепторов дофамина приводит к снижению уровней сАМР в клетках, в которых он экспрессируется путем ингибирования аденилатциклазы, и он представляет собой компонент D2 передачи сигнала (Stoof, J.C.; Kebabian J.W., Nature 1981, 294, 366-368 и Neve,K.A. et al., Journal of Receptors and Signal Transduction 2004, 24, 165-205). Напротив, антагонизм D2 рецептора дофамина эффективно повышает уровни сАМР, и указанный эффект можно имитировать путем ингибирования фосфодиэстераз, разлагающих сАМР. Большинство 21 генов фосфодиэстераз широко экспрессируется; таким образом, ингибирование может приводить к побочным эффектам. Поскольку в данном контексте PDE10A имеет требуемый профиль экспрессии с высокой и относительно специфической экспрессией в нейронах в полосатом теле,прилежащем ядре и обонятельных узелках, то ингибирование PDE10A, вероятно, будет вызывать эффект, аналогичный антагонизму D2 рецепторов, и, таким образом, оказывать антипсихотическое действие. Несмотря на то что, как ожидается, ингибирование PDE10A частично имитирует антагонизм D2 рецепторов, можно ожидать, что оно имеет другой профиль. D2 рецепторы имеют компоненты передачи сигнала помимо сАМР (Neve, K.A. et al., Journal of Receptors and Signal Transduction 2004, 24, 165-205), а потому взаимодействие с сАМР посредством ингибирования PDE10A, скорее, может снижать, а не прямо противодействовать передаче дофаминовых сигналов посредством D2 рецепторов. Указанное обстоятельство может снизить риск экстрапирамидальных побочных эффектов, которые наблюдаются при сильном D2 антагонизме. Наоборот, ингибирование PDE10A может вызвать некоторые эффекты, которые не наблюдаются при антагонизме D2 рецепторов. PDE10A также экспрессируется в стриатальных нейронах, экспрессирующих D1 рецепторы (Seeger, Т.F. et al., Brain Research, 2003, 985, 113-126). Поскольку агонизм D1 рецепторов приводит к активизации аденилатциклазы и вследствие этого к повышению уровней сАМР, то ингибирование PDE10A, вероятно, оказывает также воздействие, которое имитирует агонизм D1 рецепторов. Наконец, ингибирование PDE10A не только повышает уровни сАМР в клетках,но и повышает, как можно было бы также ожидать, уровни cGMP, поскольку PDE10A представляет собой фосфодиэстеразу, обладающую "двойной" специфичностью. cGMP активирует ряд белков-мишеней в клетках, таких как сАМР, а также взаимодействует с каскадами реакций передачи сигнала сАМР. Таким образом, ингибирование PDE10A, вероятно, частично имитирует антагонизм D2 рецепторов и тем самым оказывает антипсихотическое действие, однако его профиль может отличаться от профиля, который наблюдается при использовании классических антагонистов D2 рецепторов. Показано, что ингибитор PDE10A папаверин активен в нескольких антипсихотических моделях. Папаверин усиливает у крыс каталептическое действие галоперидола, антагониста D2 рецептора, но сам по себе не вызывает каталепсии (WO 03/093499). Папаверин снижает индуцированную действием РСР гиперактивность у крыс, в то время как снижение гиперактивности, вызываемой действием амфетамина,незначительно (WO 03/093499). Указанные модели свидетельствуют о том, что ингибирование PDE10A имеет классический антипсихотический потенциал, который можно было бы ожидать, исходя из теоретических соображений. В WO 03/093499 раскрывается также применение селективных ингибиторовPDE10 для лечения связанных неврологических и психических расстройств. Кроме того, ингибированиеPDE10A приводит к обращению вызываемой действием РСР субхронической недостаточности регулирования внимания у крыс (Rodefer et al., Eur. J. Neurosci. 2005, 4, 1070-1076). Указанная модель свидетельствует о том, что ингибирование PDE10A может облегчить когнитивные расстройства, связанные с шизофренией. Распределение PDE10A в тканях указывает на то, что ингибиторы PDE10A могут применяться для повышения уровней сАМР и/или cGMP в клетках, которые экспрессируют фермент PDE10, в особенности, в нейронах, которые составляют базальные ядра, а потому ингибиторы PDE10A по настоящему изобретению могли бы быть пригодны при лечении множества связанных психоневрологических состояний,включающих базальные ядра, таких как неврологические и психические расстройства, шизофрения, биполярное аффективное расстройство, навязчиво-компульсивное расстройство и т.п., и могут обладать тем преимуществом, что они не имеют нежелательных побочных эффектов, которые связаны с имеющимися на рынке лекарственными препаратами. Кроме того, последние публикации (WO 2005/120514, WO 2005/012485, Cantin et al., BioorganicMedicinal Chemistry Letters 17 (2007) 2869-2873) свидетельствуют о том, что ингибиторы PDE10A могут быть пригодны при лечении ожирения и инсулиннезависимого диабета. Что касается ингибиторов PDE10A, то в ЕР 1250923 раскрывается применение селективных PDE10 в целом и папаверина, в частности, для лечения некоторых неврологических и психических расстройств. В WO 05/113517 раскрываются стереоспецифические бензодиазепиновые соединения в качестве ингибиторов фосфодиэстеразы, особенно 2-го и 4-го типов, и предотвращение и лечение патологий,включающих центральное и/или периферическое расстройство. В WO 02/88096 раскрываются производные соединения бензодиазепина и их применение в области терапии в качестве ингибиторов фосфодиэстеразы, особенно 4-го типа. В WO 04/41258 раскрываются производные бензодиазепинона и их применение в области терапии в качестве ингибиторов фосфодиэстеразы, особенно 2-типа. Пирролодигидроизохинолины и их варианты в качестве ингибиторов PDE10 раскрываются в WO 05/03129 и WO 05/02579. Пиперидинилзамещенные хиназолины и изохинолины, которые являются ингибиторами PDE10, раскрыты в WO 05/82883. В WO 06/11040 раскрываются замещенные хиназолиновые и изохинолиновые соединения, которые применяют в качестве ингибиторов PDE10. В US 2005/0182079 раскрываются замещенные тетрагидроизохинолинильные производные хиназолина и изохинолина, которые служат в качестве эффективных ингибиторов фосфодиэстеразы (PDE). В частности, US 2005/0182079 касается указанных соединений, которые являются селективными ингибиторами PDE10. Аналогично, в US 2006/0019975 раскрываются пиперидиновые производные хиназолина и изохинолина,которые служат в качестве эффективных ингибиторов фосфодиэстеразы (PDE). US 2006/0019975 касается также соединений, которые являются селективными ингибиторами PDE10. В WO 06/028957 раскрываются производные соединения циннолина в качестве ингибиторов фосфодиэстеразы типа 10 для лечения психических и неврологических синдромов. Однако указанные раскрытые сведения не относятся к соединениям по настоящему изобретению,которые не связаны структурно с какими-либо известными ингибиторами PDE (Kehler, J. et al., ExpertOpin. Ther. Patents 2007, 17, 147-158 и Kehler, J. et al., Expert Opin. Ther. Patents 2009, 19, 1715-1725) и которые, как обнаружили авторы настоящего изобретения, являются высокоэффективными и селективными ингибиторами фермента PDE10A. Соединения по настоящему изобретению могут оказаться альтернативой имеющимся в настоящее время лекарственным средствам для лечения нейродегенеративных и/или психических расстройств, которые не эффективны для всех пациентов. Следовательно, сохраняется потребность в альтернативных способах лечения. Сущность изобретения Целью настоящего изобретения являются соединения, которые представляют собой селективные ингибиторы фермента PDE10A. Еще одной целью настоящего изобретения являются соединения, которые проявляют подобную активность и которые обладают лучшей растворимостью, устойчивостью при обмене и/или биодоступностью по сравнению с известными соединениями. Другой целью настоящего изобретения является эффективное лечение, в частности длительное лечение пациентов-людей, не вызывающее побочных эффектов, как правило, связанных с применяемыми в настоящее время терапевтическими способами лечения неврологических и психических расстройств. Другие цели настоящего изобретения станут очевидны при прочтении данного описания. Таким образом, один аспект настоящего изобретения касается соединений формулы I[1,2,4]триазоло[1,5-а]пиримидина; и НЕТ 1 необязательно может содержать вплоть до трех заместителейR2, R3 и R4, индивидуально выбранных из Н; C1-C6-алкила, такого как Me; атома галогена, такого как атом хлора или брома; C1-C6-алкокси и C1-C6-гидроксиалкила; НЕТ 2 обозначает гетероароматическую группу, выбранную из группы, состоящей из тиофена, фурана, тиазола и пиридина, и НЕТ 2 необязательно может содержать вплоть до трех заместителей R5, R6 иR7, индивидуально выбранных из Н; C1-C6-алкила, такого как Me;R1 выбран из Н, C1-C6-алкила, тетрагидропиран-4-илметила и 2-морфолин-4-илэтила; и их таутомеров и фармацевтически приемлемых кислотно-аддитивных солей, а также их полиморфных форм. В отдельных вариантах осуществления настоящего изобретения соединение формулы I выбрано из конкретных соединений, раскрытых в экспериментальной части данного описания. В настоящем изобретении предлагается соединение формулы I или его фармацевтически приемлемая кислотно-аддитивная соль для применения в качестве лекарственного средства. В соответствии с другим аспектом в настоящем изобретении предлагается фармацевтическая композиция, содержащая терапевтически эффективное количество соединения формулы I и фармацевтически приемлемый носитель, разбавитель или инертный наполнитель. В настоящем изобретении предлагается также использование соединения формулы I или его фармацевтически приемлемой кислотно-аддитивной соли с целью приготовления лекарственного средства для лечения нейродегенеративного или психического расстройства. Кроме того, в соответствии с другим аспектом в настоящем изобретении предлагается применение соединения формулы I для лечения пациента, страдающего от нейродегенеративного расстройства, которое включает назначение пациенту терапевтически эффективного количества соединения формулы I. В соответствии с еще одним аспектом в настоящем изобретении предлагается применение соединения формулы I для лечения пациента, страдающего от психического расстройства, которое включает назначение пациенту терапевтически эффективного количества соединения формулы I. В другом варианте осуществления настоящего изобретения предлагается применение соединения формулы I для лечения пациента, страдающего от привыкания к чрезмерному употреблению наркотиков, такого как алкогольная зависимость, зависимость от амфетамина, кокаина или опиатов. Подробное описание изобретения Определение заместителей. По тексту описания настоящего изобретения термины "галогено" и "галоген" используются взаимозаменяемо и относятся к атому фтора, хлора, брома или йода. Термин "C1-C6-алкил" относится к насыщенному углеводороду с прямой или разветвленной цепью,имеющему от одного до шести атомов углерода включительно. Примеры подобных групп включают,однако этим не ограничиваясь, метил, этил, 1-пропил, 2-пропил, 1-бутил, 2-бутил, 2-метил-2-пропил, 2 метил-1-бутил и н-гексил. Выражение "C1-C6-гидроксиалкил" относится к C1-C6-алкильной группе, определение которой приведено выше, замещенной одной гидроксильной группой. Термин "галоген(C1C6)алкил" относится к C1-C6-алкильной группе, определение которой приведено выше, содержащей в качестве заместителей вплоть до трех атомов галогена, такой как трифторметил. Выражение "C1-C6-алкокси" относится к алкоксигруппе с прямой или разветвленной цепью, содержащей от одного до шести атомов углерода включительно, свободная валентность которой находится у атома кислорода. Примеры подобных групп включают, однако этим не ограничиваясь, метокси, этокси,н-бутокси, 2-метилпентокси и н-гексилокси. Термин "C3-C8-циклоалкил" обычно относится к циклопропилу, циклобутилу, циклопентилу, циклогексилу, циклогептилу или циклооктилу. Выражение "C1-C6-алкил(C3-C8)циклоалкил" относится к C3C8-циклоалкилу, определение которого дано выше, замещенного C1-C6-алкилом с прямой или разветвленной цепью. Примеры подобных групп включают, однако этим не ограничиваясь, циклопропилметил. Термин "гетероциклоалкил" относится к от 4- до 8-членных циклам, содержащим атомы углерода и вплоть до трех атомов N, О или S, при условии, что от четырех до восьмичленных циклы не содержат соседних атомов О или соседних атомов S. Открытая валентность находится либо у гетероатома, либо у атома углерода. Примеры подобных групп включают, однако этим не ограничиваясь, азетидинил, оксэтанил, пиперазинил, морфолинил, тиоморфолинил и [1,4]диазепанил. Термин "гидроксигетероциклоалкил" относится к гетероциклоалкилу, определение которого дано выше, замещенному одной гидроксильной группой. Термин "C1-C6-алкил-гетероциклоалкил" относится к гетероциклоалкилу, определение которого дано выше, замещенному C1-C6-алкильной группой. Примеры подобных групп включают, однако этим не ограничиваясь, тетрагидропиран-4-илметил и 2-морфолин-4-илэтил. Термин "арил" относится к фенильному циклу, необязательно замещенному атомом галогена, C1C6-алкилом, C1-C6-алкокси или галоген(C1-C6)алкилом, определение которых приведено выше. Примеры подобных групп включают, однако этим не ограничиваясь, фенил и 4-хлорфенил. Термин"C1-C6-арилалкил" относится к арилу, определение которого приведено выше, замещенномуC1-C6-алкилом с прямой или разветвленной цепью. Примеры подобных групп включают, однако этим не ограничиваясь, бензил и 4-хлорбензил. Кроме того, в настоящем изобретении предлагаются также конкретные варианты осуществления настоящего изобретения, которые описаны ниже. В одном варианте осуществления настоящего изобретения НЕТ 1 представляет собой гетероароматическую группу, содержащую 2 атома азота. В другом варианте осуществления настоящего изобретения НЕТ 1 представляет собой гетероароматическую группу, содержащую 3 атома азота. Наконец, в еще одном варианте осуществления настоящего изобретения НЕТ 1 представляет собой гетероароматическую группу, содержащую 4 атома азота. Предпочтительно НЕТ 1 выбран из следующих гетероароматических групп: В еще одном варианте осуществления настоящего изобретения гетероароматическая группа НЕТ 1 замещена одним заместителем R2, выбранным из Н; C1-C6-алкила, такого как метил; атома галогена, та-4 023663 кого как атом хлора или брома; C1-C6-гидроксиалкила, такого как СН 2 СН 2 ОН; C1-C6-алкокси, такого как метокси. В другом варианте осуществления настоящего изобретения группа НЕТ 1 замещена двумя заместителями R2 и R3, индивидуально выбранными из Н; C1-C6-алкила, такого как метил; атома галогена,такого как атом хлора или брома; C1-C6-гидроксиалкила, такого как СН 2 СН 2 ОН. В еще одном варианте осуществления настоящего изобретения группа НЕТ 1 замещена тремя заместителями R2, R3 и R4, индивидуально выбранными из Н; C1-C6-алкила, такого как метил; атома галогена, такого как атом хлора или брома; C1-C6-гидроксиалкила, такого как СН 2 СН 2 ОН. В конкретном варианте осуществления настоящего изобретения R2, R3 и R4 все обозначают атом водорода. В другом варианте осуществления настоящего изобретения по крайней мере один из R2, R3 иR4 обозначает C1-C6-алкил, такой как метил. В еще одном варианте осуществления настоящего изобретения по крайней мере один из R2, R3 и R4 обозначает атом галогена, такой как атом хлора или брома. Конкретные варианты соединения, для которого используют радикал НЕТ 1, приведены ниже. В конкретном варианте осуществления настоящего изобретения НЕТ 1 обозначает имидазо[1,2 а]пиримидин. Во втором конкретном варианте осуществления настоящего изобретения НЕТ 1 обозначает[1,2,4]триазоло[1,5-а]пиридин. В третьем конкретном варианте осуществления настоящего изобретения НЕТ 1 обозначает [1,2,4]триазоло[1,5-а]пиримидин. В четвертом конкретном варианте осуществления настоящего изобретения НЕТ 1 обозначает [1,2,4]триазоло[1,5-а]пиразин. В другом конкретном варианте осуществления настоящего изобретения НЕТ 1 обозначает[1,2,4]триазоло[1,5-а]пиримидин. В другом конкретном варианте осуществления настоящего изобретения НЕТ 1 обозначает 1-метил-1 Н-бензоимидазол. В другом конкретном варианте осуществления настоящего изобретения НЕТ 1 обозначает 1-фенил-1 Н-бензоимидазол. В другом конкретном варианте осуществления настоящего изобретения НЕТ 1 обозначает 2-(6-хлорбензоимидазол-1-ил)этанол. В другом конкретном варианте осуществления настоящего изобретения НЕТ 1 обозначает 5,7-диметил[1,2,4]триазоло[1,5 а]пиридин. В другом конкретном варианте осуществления настоящего изобретения НЕТ 1 обозначает 5,7 диметилимидазо[1,2-а]пиридин. В другом конкретном варианте осуществления настоящего изобретения НЕТ 1 обозначает 5-хлоримидазо[1,2-а]пиридин. В другом конкретном варианте осуществления настоящего изобретения НЕТ 1 обозначает 5-метилимидазо[1,2-а]пиридин. В другом конкретном варианте осуществления настоящего изобретения НЕТ 1 обозначает 5-трифторметилимидазо[1,2-а]пиридин. В другом конкретном варианте осуществления настоящего изобретения НЕТ 1 обозначает 6-бром-5,7 диметил[1,2,4]триазоло[1,5-а]пиридин. В другом конкретном варианте осуществления настоящего изобретения НЕТ 1 обозначает 6-бром-7-метил[1,2,4]триазоло[1,5-а]пиридин. В другом конкретном варианте осуществления настоящего изобретения НЕТ 1 обозначает 6-хлор-8-метил[1,2,4]триазоло[1,5-а]пиридин. В другом конкретном варианте осуществления настоящего изобретения НЕТ 1 обозначает 6 хлоримидазо[1,2-а]пиридин. В другом конкретном варианте осуществления настоящего изобретения НЕТ 1 обозначает 7-метил[1,2,4]триазоло[1,5-а]пиридин. В другом конкретном варианте осуществления настоящего изобретения НЕТ 1 обозначает 8-метилимидазо[1,2-а]пиридин. В другом конкретном варианте осуществления настоящего изобретения НЕТ 1 обозначает 5,7-диметил[1,2,4]триазоло[1,5 а]пиримидин. Как правило, НЕТ 1 обозначает 5,7-диметилимидазо[1,2-а]пиримидин или [1,2,4]триазоло[1,5 с]пиримидин, или [1,2,4]триазоло[1,5-а]пиразин. В одном варианте осуществления настоящего изобретения НЕТ 2 представляет собой гетероароматическую группу, содержащую 1 атом азота. В одном варианте осуществления настоящего изобретения НЕТ 2 представляет собой гетероароматическую группу, содержащую 1 атом кислорода. В одном варианте осуществления настоящего изобретения НЕТ 2 представляет собой гетероароматическую группу, содержащую 1 атом серы. В одном варианте осуществления настоящего изобретения НЕТ 2 представляет собой гетероароматическую группу, содержащую 1 атом азота и один атом серы. Предпочтительно группа НЕТ 2 выбрана из следующих гетероароматических групп: В еще одном варианте осуществления настоящего изобретения гетероароматическая группа НЕТ 2 замещена одним заместителем R5, выбранным из Н; C1-C6-алкила, такого как метил. В другом варианте осуществления настоящего изобретения группа НЕТ 2 замещена двумя заместителями R5 и R6, индивидуально выбранными из Н; C1-C6-алкила, такого как метил. В еще одном варианте осуществления настоящего изобретения группа НЕТ 2 замещена тремя заместителями R5, R6 и R7, индивидуально выбранными из Н; C1-C6-алкила, такого как метил. В конкретном варианте осуществления настоящего изобретения R5, R6 и R7 все обозначают атом водорода. В другом варианте осуществления настоящего изобретения по крайней мере один из R5, R6 иR7 обозначает C1-C6-алкил, такой как метил. В другом варианте осуществления настоящего изобретения -L- принимает значение -СН 2-СН 2-. Наконец, в еще одном варианте осуществления настоящего изобретения -L- принимает значение Следует понимать, что различные аспекты, варианты осуществления, варианты воплощения и особенности настоящего изобретения могут быть заявлены по отдельности или же в любой комбинации, как показывают следующие примеры, не ограничивающие настоящее изобретение. В отдельных вариантах осуществления настоящего изобретения соединение формулы I выбрано из следующих конкретных соединений, в форме свободного основания, одного или нескольких его таутомеров и его фармацевтически приемлемой кислотно-аддитивной соли. Каждое из соединений составляет отдельный вариант осуществления настоящего изобретения: Фармацевтически приемлемые соли. Настоящее изобретение охватывает также соли соединений, как правило, фармацевтически приемлемые соли. Подобные соли включают фармацевтически приемлемые кислотно-аддитивные соли. Кислотно-аддитивные соли включают соли неорганических кислот, а также соли органических кислот. Отдельные примеры подходящих неорганических кислот включают хлористо-водородную, бромисто-водородную, иодисто-водородную, фосфорную, серную, сульфаминовую, азотную кислоты и т.п. Отдельные примеры подходящих органических кислот включают муравьиную, уксусную, трихлоруксусную, трифторуксусную, пропионовую, бензойную, коричную, лимонную, фумаровую, гликолевую, итаконовую, молочную, метансульфоновую, малеиновую, яблочную, малоновую, миндальную, щавелевую,пикриновую, пировиноградную, салициловую, янтарную, метансульфоновую, этансульфоновую, винную, аскорбиновую, памовую, бисметиленсалициловую, этандисульфоновую, глюконовую, цитраконовую, аспарагиновую, стеариновую, пальмитиновую, этилендиаминтетрауксусную, гликолевую, паминобензойную, глутаминовую, бензолсульфоновую, п-толуолсульфоновую кислоты, уксусные кислоты теофиллина, а также 8-галотеофиллины, например, 8-бромтеофиллин и т.п. Дальнейшие примеры фармацевтически приемлемых аддитивных солей неорганических или органических кислот включают фармацевтически приемлемые соли, приведенные в публикации Berge, S.M. et al., J. Pharm. Sci. 1977, 66,2, содержание которой включено в данное описание посредством ссылки. Кроме того, соединения по настоящему изобретению могут существовать в несольватированных, а также в сольватированных формах с фармацевтически приемлемыми растворителями, такими как вода,этанол и т.п. В общем случае в данном описании сольватированные формы считаются эквивалентными несольватированными формами. Терапевтически эффективное количество. В данном описании термин "терапевтически эффективное количество" соединения означает количество, достаточное для того, чтобы излечить, облегчить или частично остановить клинические проявления данной болезни и ее осложнений при терапевтическом вмешательстве, включающем введение указанного соединения. Количество, адекватное для достижения указанного воздействия, определяют как"терапевтически эффективное количество". Эффективные количества для каждой цели будут зависеть от серьезности заболевания или поражения, а также от массы и общего состояния пациента. Следует понимать, что величину соответствующей дозировки можно установить с помощью обычных экспериментов,путем создания матрицы значений и путем проверки различных точек в указанной матрице, что вполне по силам сделать квалифицированному врачу. В данном описании термин "лечение" означает ведение пациента и уход за пациентом с целью борьбы с состоянием, таким как заболевание или расстройство. Предполагается, что указанный термин включает полный спектр методов лечения того состояния, от которого страдает пациент, таких как назначение активного соединения, с целью облегчить симптомы или осложнения, задержать прогрессирование заболевания, расстройства или состояния, с целью облегчить или ослабить симптомы и осложнения, и/или излечить или устранить заболевание, расстройство или состояние, а также предотвратить состояние, при этом под предотвращением следует понимать ведение пациента и уход за пациентом с целью борьбы с заболеванием, состоянием или расстройством, и оно включает назначение активных соединений, чтобы предотвратить возникновение симптомов или осложнений. Тем не менее, профилактическое (превентивное) лечение и терапевтическое (излечивающее) воздействие являются двумя отдельными аспектами настоящего изобретения. Пациентом, лечение которого проводят, предпочтительно,является млекопитающее, в частности, человек. Фармацевтические композиции. Кроме того, в настоящем изобретении предлагается фармацевтическая композиция, содержащая терапевтически эффективное количество соединения формулы I и терапевтически приемлемый носитель или разбавитель. В настоящем изобретении предлагается также фармацевтическая композиция, содержащая терапевтически эффективное количество одного из конкретных соединений, раскрытых в экспериментальной части настоящего описания, и терапевтически приемлемый носитель или разбавитель. Соединения по настоящему изобретению могут назначаться отдельно или в комбинации с фармацевтически приемлемыми носителями, разбавителями или инертными наполнителями как в виде однократных, так многократных доз. Фармацевтические композиции по настоящему изобретению могут быть приготовлены вместе с фармацевтически приемлемыми носителями или разбавителями, а также любыми другими известными вспомогательными лекарственными средствами и наполнителями в соответствии с обычными методами, такими как методы, раскрытые в Remington: The Science and Practice of Pharmacy,19th Edition, Gennaro, Ed., Mack Publishing Co., Easton, PA, 1995. Фармацевтические композиции могут быть специально составлены для введения любым подходящим способом, таким как пероральный, ректальный, интраназальный, легочный, местный (включая трансбуккальный и сублингвальный), трансдермальный, интрацистернальный, внутрибрюшинный, вагинальный и парентеральный (включая подкожный, внутримышечный, внутриоболочечный, внутривенный и внутрикожный) пути введения. Следует понимать, что путь введения будет зависеть от общего состояния и возраста пациента, лечение которого проводят, типа состояния, лечение которого проводят, и от активного ингредиента. Фармацевтические композиции для перорального введения включают твердые лекарственные формы, такие как капсулы, таблетки, драже, пилюли, пастилки, порошки и гранулы. Если необходимо, композиции могут быть приготовлены с покрытиями, такими как энтеросолюбильные оболочки, или они могут быть приготовлены таким образом, чтобы обеспечить контролируемое высвобождение активного ингредиента путем замедленного или пролонгированного высвобождения в соответствии с методами,хорошо известными из области техники. Жидкие лекарственные формы для перорального приема включают растворы, эмульсии, суспензии, сиропы и эликсиры. Фармацевтические композиции для парентерального введения включают стерильные водные и неводные растворы для инъекций, дисперсии, суспензии или эмульсии, а также стерильные порошки, которые перед использованием должны быть восстановлены в стерильных растворах для инъекций или дисперсиях. Другие подходящие для назначения формы включают, однако этим не ограничиваясь, суппозитории, спреи, мази, кремы, гели, лекарственные формы для ингаляции, кожные пластыри и имплантаты. Типичные пероральные дозы составляют от приблизительно 0,001 до приблизительно 100 мг на 1 кг массы тела в сутки. Типичные пероральные дозы составляют от приблизительно 0,01 до приблизительно 50 мг на 1 кг массы тела в сутки. Кроме того, типичные пероральные дозы составляют от приблизительно 0,05 до приблизительно 10 мг на 1 кг массы тела в сутки. Пероральные дозы обычно назначают в виде одной или нескольких доз, как правило, от одной до трех доз в сутки. Точная доза будет зависеть от частоты и способа введения, пола, возраста, массы и общего состояния пациента, лечение которого проводят, типа и тяжести состояния, лечение которого проводят, любых сопутствующих заболеваний, лечение которых проводят, и других факторов, очевидных для специалистов. Составы могут быть также приготовлены в виде стандартной лекарственной формы с помощью методов, известных специалистам. С целью пояснения типичная стандартная лекарственная форма для перорального введения может составлять от приблизительно 0,01 до приблизительно 1000 мг, от приблизительно 0,05 до приблизительно 500 мг или от приблизительно 0,5 до приблизительно 200 мг. Для парентеральных путей введения, таких как внутривенный, внутриоболочечный, внутримышечный и подобные пути, типичные дозы составляют порядка половины от той дозы, которую применяют для перорального введения. В настоящем изобретении предлагается также способ приготовления фармацевтической композиции, включающий смешивание терапевтически эффективного количества соединения формулы I и, по крайней мере, одного фармацевтически приемлемого носителя или разбавителя. В одном варианте осуществления настоящего изобретения соединение, которое используют в вышеуказанном способе, является одним из конкретных соединений, раскрытых в экспериментальной части данного описания. Соединения по настоящему изобретению в общем случае используют в виде свободного соединения или в виде его фармацевтически приемлемой соли. Одним примером является кислотно-аддитивная соль соединения, обладающего свойством свободного основания. В том случае, когда соединение формулы I включает свободное основание, подобные соли получают обычным образом, обрабатывая раствор или суспензию свободного основания формулы I молярным эквивалентом фармацевтически приемлемой кислоты. Отдельные примеры подходящих органических и неорганических кислот приведены выше. Для парентерального введения могут использоваться растворы соединений формулы I в стерильном водном растворе, водном растворе пропиленгликоля, водном растворе витамина Е или в кунжутном или арахисовом масле. Подобные водные растворы, в случае необходимости, должны быть соответствующим образом забуферены, а жидкий разбавитель вначале делают изотоническим с помощью достаточного количества физиологического раствора или глюкозы. Водные растворы наиболее пригодны для внутривенного, внутримышечного, подкожного и внутрибрюшинного введения. Соединение формулы I легко можно включить в известные стерильные среды на водной основе, используя стандартные методики,известные специалистам. Подходящие фармацевтические носители включают инертные твердые разбавители или наполнители, стерильные водные растворы и различные органические растворители. Примеры твердых носителей включают лактозу, магнезию, сахарозу, циклодекстрин, тальк, желатин, агар-агар, пектин, аравийскую камедь, стеарат магния, стеариновую кислоту и простые низшие алкильные эфиры целлюлозы. Примеры жидких носителей включают, однако этим не ограничиваясь, сироп, арахисовое масло, оливковое масло,фосфолипиды, жирные кислоты, кислые жирные амины, полиэтиленоксид и воду. Аналогично, носитель или разбавитель может включать любое вещество для пролонгированного высвобождения, известное из области техники, такое как глицерил моностеарат или глицерил дистеарат, как отдельно, так и в смеси с воском. Фармацевтические композиции, которые получают, объединяя соединения формулы I и фармацевтически приемлемый носитель, затем легко вводят в виде различных лекарственных форм, пригодных для указанных путей введения. Составы удобно готовить в виде стандартных лекарственных форм, используя методы, известные из области фармации. Составы по настоящему изобретению, пригодные для перорального приема, могут быть представлены в виде дискретных единиц, таких как капсулы или таблетки, каждая из которых содержит определенное количество активного ингредиента и необязательно соответствующий инертный наполнитель. Кроме того, доступные для перорального приема составы могут быть приготовлены в форме порошка или гранул, раствора или суспензии в водной или неводной жидкостиили в виде эмульсии типа масло в воде или вода в масле. Если для перорального приема используют твердый носитель, то препарат можно таблетировать,помещая его в виде порошка или гранул в твердую желатиновую капсулу, или же приготовить его в форме лепешки или пастилки. Количество твердого носителя меняется в широких пределах в диапазоне приблизительно от 25 мг до приблизительно до 1 г на одну лекарственную форму. Если используют жидкий носитель, то препарат может быть приготовлен в форме сиропа, эмульсии, мягкой желатиновой капсулы или стерильной жидкости для инъекций, такой как водная или неводная жидкая суспензия или раствор. Фармацевтические композиции по настоящему изобретению могут быть приготовлены обычными способами, известными из области техники. Например, таблетки можно изготовить, смешивая активный ингредиент с обычными вспомогательными лекарственными средствами и/или разбавителями, а затем спрессовывая полученную смесь в обычной машине для приготовления таблеток. Примеры вспомогательных лекарственных средств и/или разбавителей включают: кукурузный крахмал, картофельный крахмал, тальк, стеарат магния, желатин, лактозу, каучуки и т.п. Могут применяться любые другие вспомогательные лекарственные средства или добавки, обычно используемые для подобных целей, такие как красители, ароматизаторы, консерванты и т.п., при условии, что они совместимы с активными ингредиентами. Лечение заболеваний. Как указано выше, соединения формулы I являются ингибиторами фермента PDE10A и в этом качестве они пригодны для лечения заболеваний, вызванных неврологическими и психическими расстройствами. Таким образом, в настоящем изобретении предлагается соединение формулы I или его фармацевтически приемлемая кислотно-аддитивная соль, а также фармацевтическая композиция, содержащая подобное соединение, для использования при лечении нейродегенеративного расстройства, психического расстройства или привыкания к чрезмерному употреблению лекарственных средств у млекопитающих,включая людей; при этом нейродегенеративное расстройство выбрано из группы, которая включает болезнь Альцгеймера, мультиинфарктную деменцию, алкогольную деменцию или другую, связанную с лекарственными средствами деменцию, деменцию, связанную с внутричерепными опухолями или мозговой травмой, деменцию, связанную с болезнью Хантингтона или болезнью Паркинсона, СПИДассоциированную деменцию; делириозный синдром; амнестическое расстройство; посттравматическое стрессовое расстройство; задержку психического развития; расстройство развития навыков обучения,например, расстройство чтения, расстройство математических навыков или нарушение способности излагать свои мысли в письменной форме; расстройство, связанное с дефицитом внимания/гиперактивностью; и возрастное снижение познавательных способностей; и где психическое расстройство выбрано из группы, которая включает шизофрению, например параноидального, дезорганизованного, кататонического, недифференцированного или остаточного типа; шизофрениформное расстройство; шизоаффективное расстройство, например бредового типа или депрессивного типа; бредовое расстройство; вызванное химическими соединениями психотическое расстройство, например психоз, вызванный алкоголем, амфетамином, марихуаной, кокаином, галлюциногенами, летучими препаратами,опиоидами или фенциклидином; изменение личности параноидального типа; и изменение личности шизоидного типа; и где привыкание к чрезмерному употреблению лекарственных средств представляет собой привыкание к алкоголю, амфетамину, кокаину или опиату. Соединение формулы I или их фармацевтически приемлемые соли могут использоваться в комбинации с одним или несколькими другими лекарственными средствами при лечении заболеваний или состояний, для которых пригодны соединения по настоящему изобретению, где совместная комбинация лекарственных средств более безопасна или более эффективна, чем любого отдельного лекарственного средства. Кроме того, соединения по настоящему изобретению могут использоваться в комбинации с одним или несколькими другими лекарственными средствами, которые излечивают, предотвращают,регулируют, снижают интенсивность симптомов заболевания или уменьшают риск побочных эффектов или токсичность соединений по настоящему изобретению. Подобные другие препараты могут вводиться обычными путями и в обычном используемом количестве одновременно или последовательно с соединениями по настоящему изобретению. Таким образом, фармацевтические композиции по настоящему изобретению включают такие фармацевтические композиции, которые в дополнение к соединениям по настоящему изобретению содержат один или несколько других активных ингредиентов. Указанные комбинации могут назначаться как часть стандартной лекарственной формы комбинированного препарата или в виде набора химических реагентов или как часть методики лечения, где один или несколько дополнительных препаратов назначают в виде отдельных лекарственных форм как часть методики лечения. В настоящем изобретении предлагается способ лечения млекопитающего, включая человека, страдающего от нейродегенеративного расстройства, выбранного из расстройства познавательных способностей или нарушения движений, при этом указанный способ включает назначение пациенту терапевтически эффективного количества соединения формулы I. В настоящем изобретении предлагается также способ лечения нейродегенеративного расстройства или состояния у млекопитающего, включая человека, при этом указанный способ включает назначение указанному млекопитающему количество соединения формулы I, эффективного для ингибированияPDE10. В настоящем изобретении предлагается также способ лечения пациента, страдающего от психического расстройства, при этом указанный способ включает назначение пациенту терапевтически эффективного количества соединения формулы I. Примеры психических расстройств, которые можно лечить согласно настоящему изобретению, включают, однако этим не ограничиваясь, шизофрению, например параноидального, дезорганизованного, кататонического, недифференцированного или остаточного типа; шизофрениформное расстройство; шизоаффективное расстройство, например бредового типа или депрессивного типа; бредовое расстройство; вызванное химическими соединениями психотическое расстройство, например психоз, вызванный алкоголем, амфетамином, марихуаной, кокаином, галлюциногенами, летучими препаратами, опиоидами или фенциклидином; изменение личности параноидального типа; изменение личности шизоидного типа; и тревожное расстройство, выбранное из панического рас- 12023663 стройства; агарофобию; специфическую фобию; социофобию; навязчиво-компульсивное расстройство; посттравматическое стрессовое расстройство; острое стрессовое расстройство; и общее тревожное расстройство. Было установлено, что соединения формулы I или их фармацевтически приемлемые соли можно успешно применять в комбинации по крайней мере с одним нейролептическим средством (которое может быть типичным или нетипичным нейролептическим средством) и тем самым обеспечить лучшее лечение психических расстройств, таких как шизофрения. Комбинации, использование и способы лечения по настоящему изобретению также могут предоставить преимущества при лечении пациентов, которые не в состоянии реагировать адекватно или у которых проявляется стойкость к другим известным способам лечения. Таким образом, в настоящем изобретении предлагается способ лечения млекопитающего, страдающего от психического расстройства, такого как шизофрения, при этом указанный способ включает назначение млекопитающему терапевтически эффективного количества соединения формулы I как отдельно, так и в виде комбинированной терапии, по крайней мере, с одним нейролептическим средством. Термин "нейролептическое средство" в данном описании относится к лекарственным средствам,которые оказывают воздействие на познавательную способность или поведение, или антипсихотическим препаратам, которые уменьшают спутанность сознания, бред, галлюцинации и психомоторное возбуждение у больных с психозом. Кроме того, основные транквилизаторы и антипсихотические средства включают, однако этим не ограничиваясь: типичные антипсихотические препараты, включая фенотиазины, которые далее подразделяются на алифатические углеводороды, пиперидины и пиперазины, тиоксантены (например, цисокординол), бутирофеноны (например, галоперидол), дибензоксазепины (например, локсапин), дигидроиндолоны (например, молиндон), дифенилбутилпиперидины (например, пимозид) и нетипичные антипсихотические препараты, включая бензизоксазолы (например, рисперидон), сертиндол, оланзапин, кветиапин, осанетант и зипразидон. Наиболее предпочтительными нейролептическими средствами для применения в настоящем изобретении являются сертиндол, оланзапин, рисперидон, кветиапин, арипипразол, галоперидол, клозапин,зипразидон и осанетант. Кроме того, в настоящем изобретении предлагается способ лечения пациента, страдающего от когнитивного расстройства, при этом указанный способ включает назначение пациенту терапевтически эффективного количества соединения формулы I. Примеры когнитивных расстройств, которые можно лечить согласно настоящему изобретению, включают, однако этим не ограничиваясь, болезнь Альцгеймера, мультиинфарктную деменцию, алкогольную деменцию или другую, связанную с лекарственными средствами деменцию, деменцию, связанную с внутричерепными опухолями или мозговой травмой, деменцию, связанную с болезнью Хантингтона или болезнью Паркинсона или СПИД-ассоциированную деменцию; делириозный синдром; амнестическое расстройство; посттравматическое стрессовое расстройство; задержку психического развития; расстройство развития навыков обучения, например, расстройство чтения, расстройство математических навыков или нарушение способности излагать свои мысли в письменной форме; расстройство, связанное с дефицитом внимания/гиперактивностью; и возрастное снижение познавательных способностей. В настоящем изобретении предлагается также способ лечения нарушения движений, при этом указанный способ включает назначение пациенту терапевтически эффективного количества соединения формулы I. Примеры нарушений движений, которые можно лечить согласно настоящему изобретению,включают, однако этим не ограничиваясь, болезнь Хантингтона и дискинезию, связанную с терапией с использованием агониста дофамина. Кроме того, в настоящем изобретении предлагается способ лечения нарушения движений, выбранного из болезни Паркинсона и синдрома беспокойных ног, который включает назначение пациенту терапевтически эффективного количества соединения формулы I. В настоящем изобретении предлагается также способ лечения расстройства настроения, при этом указанный способ включает назначение пациенту терапевтически эффективного количества соединения формулы I. Примеры расстройства настроения и приступов смены настроений, которые можно лечить согласно настоящему изобретению, включают, однако этим не ограничиваясь, главный депрессивный эпизод мягкого, умеренного или тяжелого типа, маниакальный или смешанный приступ смены настроения, гипоманиакальный приступ смены настроения, депрессивный приступ с типичными особенностями; приступ депрессии с меланхолическими особенностями; приступ депрессии с кататоническими особенностями; смена настроения после родов; постинсультная депрессия; большое депрессивное расстройство; дистимическое расстройство; малое депрессивное расстройство; предменструальное дисфорическое расстройство; постпсихотическая депрессия при шизофрении; большое депрессивное расстройство на фоне психоза, такое как бредовое расстройство или шизофрения; биполярное расстройство, например,биполярное расстройство I, биполярное расстройство II, и циклотимическое расстройство личности. Подразумевается, что смена настроения является психическим расстройством. В настоящем изобретении предлагается также способ лечения привыкания к чрезмерному употреблению лекарственных препаратов у млекопитающего, включая человека, например, лечения привыкания к чрезмерному употреблению алкоголя, амфетамина, кокаина или опиатов, при этом указанный способ включает назначение указанному млекопитающему количества соединения формулы I, эффективного для лечения чрезмерного употребления лекарственных препаратов. В настоящем изобретении предлагается также способ лечения привыкания млекопитающего, включая человека, к чрезмерному употреблению лекарственных препаратов, например, привыкания к алкоголю, амфетамину, кокаину или опиатам, при этом указанный способ включает назначение указанному млекопитающему количества соединения формулы I, эффективного для ингибирования PDE10. Термин "привыкание к чрезмерному употреблению лекарственных препаратов" в данном описании означает аномальное желание лекарственного средства и в общем случае характеризуется мотивационными расстройствами, такими как непреодолимое влечение принять желаемое лекарственное средство и приступы интенсивной тяги к лекарственному средству. Привыкание к чрезмерному употреблению лекарственных препаратов в широком смысле считают патологическим состоянием. Расстройство, связанное с пристрастием к лекарственным препаратам, прогрессирует от использования лекарственного средства в остром случае до развития наркотической "ломки", характеризуется восприимчивостью к обострению заболевания и сниженной, замедленной способностью отвечать на естественные мотивационные раздражители. Например, The Diagnostic and StatisticalManual of Mental Disorders, Fourth Edition (DSM-IV) классифицирует три стадии развития зависимости: озабоченность/ожидание, пьянство/интоксикация и синдром отмены/негативное воздействие. Указанные стадии везде характеризуются, соответственно, постоянным страстным желанием и озабоченностью получить препарат; использованием большего количества препарата, чем необходимо для того, чтобы испытать эффекты интоксикации; и страданием от привыкания, абстиненции и сниженной мотивации для введения нормальной жизнедеятельности. Кроме того, в настоящем изобретении предлагается способ лечения расстройства, включающего в качестве симптома недостаток внимания и/или познавательной способности у млекопитающего, включая человека, при этом указанный способ включает назначение указанному млекопитающему количество соединения формулы I, эффективного для лечения указанного расстройства. Другими расстройствами, которые можно лечить согласно настоящему изобретению, являются навязчиво-компульсивное расстройство, синдром Туретта и другие тикозные расстройства. В данном описании и если не указано иное, "нейродегенеративное расстройство или состояние" относится к расстройству или состоянию, которое вызывается дисфункцией и/или смертью нейронов центральной нервной системы. Лечению указанных расстройств и состояний может способствовать назначение средства, которое предотвращает дисфункцию или смерть нейронов в случае риска развития указанных расстройств или состояний и/или усиливает функцию поврежденных или здоровых нейронов таким образом, чтобы компенсировать потерю функции, вызванную дисфункцией или смертью нейронов, находящихся в группе риска. Термин "нейротрофическое средство", которое используют в данном описании, относится к веществу или средству, которое обладает некоторыми из указанных свойств или всеми указанными свойствами. Примеры нейродегенеративных расстройств и состояний, которые можно лечить согласно настоящему изобретению, включают, однако этим не ограничиваясь, болезнь Паркинсона; болезнь Хантингтона; деменцию, например, болезнь Альцгеймера, мультиинфарктную деменцию,СПИД-ассоциированную деменцию и фронто-темпоральную деменцию; нейродегенерацию, связанную с мозговой травмой; нейродегенерацию, связанную с инсультом, нейродегенерацию, связанную с церебральным инфарктом; нейродегенерацию, вызванную гипогликемией; нейродегенерацию, связанную с приступом эпилепсии; нейродегенерацию, связанную с нейротоксиновым отравлением; и множественную системную атрофию. В одном варианте осуществления настоящего изобретения нейродегенеративное расстройство или состояние включает нейродегенерацию стриатальных средних шипиковых нейронов у млекопитающего,включая человека. В другом варианте осуществления настоящего изобретения нейродегенеративным расстройством или состоянием является болезнь Хантингтона. В другом варианте осуществления настоящего изобретения предлагается способ лечения пациента с целью снизить содержание жира и массу тела, или способ лечения инсулиннезависимого сахарного диабета (NIDDM), метаболического синдрома или нарушения толерантности к глюкозе, который включает назначение нуждающемуся в этом пациенту терапевтически эффективного количества соединения формулы I. В предпочтительных вариантах осуществления настоящего изобретения пациентом является человек, пациент имеет избыточный вес или страдает от ожирения, а антагонист назначают перорально. В другом предпочтительном варианте осуществления настоящего изобретения способ включает также назначение пациенту второго терапевтического средства, предпочтительно, средства против ожирения,например, римонабанта, орлистата, сибутрамина, бромокриптина, эфедрина, лептина, псевдоэфедрина или пептида YY3-36, или их аналогов. Термин "метаболический синдром" в данном описании относится к совокупности состояний, которые приводят людей в группу с высоком риском развития заболевания коронарных артерий. Указанные условия включают диабет 2 типа, ожирение, высокое кровяное давление и плохой липидный профиль с повышенным уровнем LDL ("плохого") холестерина, низким уровнем HDL ("хорошего") холестерина и повышенным содержанием триглицеридов. Все указанные условия связаны с высокими уровнями инсулина в крови. Фундаментальным нарушением при метаболическом синдроме является инсулинрезистентность как в жировой ткани, так и в мышцах. Все ссылки, включая публикации, заявки на патенты и патенты, цитируемые в данном описании,включены в настоящую заявку посредством ссылки во всей их полноте и в той степени, как если бы каждая ссылка была указана индивидуально и специально для включения в настоящее изобретение посредством ссылки и была сформулирована во всей ее полноте (в максимальной степени, разрешенной законодательством). Заголовки и подзаголовки используются здесь лишь для удобства, и их не следует рассматривать как каким-либо образом ограничивающие настоящее изобретение. Использование любого и всех примеров или примерных формулировок (включая "например", "в частности" и "таким образом") в настоящем описании предназначается лишь для лучшего освещения настоящего изобретения и не предполагает ограничения объема настоящего изобретения, если не указано иное. Цитирование и включение патентных документов в данное описание приведено лишь для удобства и не отражает какую-либо проверку технической пригодности, патентоспособности и/или возможности осуществления подобных патентных документов. Настоящее изобретение включает все модификации и эквиваленты объекта изобретения, указанного в приведенной формуле изобретения, в соответствии с действующим законодательством. Экспериментальная часть Получение соединений по настоящему изобретению. Соединения общей формулы I по настоящему изобретению могут быть получены, как описано на следующих схемах реакций. Если не указано иное, на реакционных схемах и приведенных обсуждениях НЕТ 1, НЕТ 2, R1-R7, -L-, Z и Y имеют значения, указанные выше. Соединения общей формулы I, где -L- принимает значение -S-СН 2-, могут быть получены по реакции конденсации нуклеофила формулы V или Va с электрофилом формулы VI, где X обозначает уходящую группу, в частности Cl, Br, I, метансульфонил, 4-толуолсульфонил, как показано на схеме 1. В реакции между Va и VI алкилирование атома серы в Va с помощью VI и закрытие цикла и образование триазольного цикла протекают в одних и тех же условиях в одном реакционном сосуде. Схема 1 Указанную реакцию, как правило, проводят в растворителе, таком как 1-пропанол, толуол, ДМФА или ацетонитрил, необязательно в присутствии карбонатного основания, такого как карбонат калия, или третичного аминового основания, такого как триэтиламин или диизопропилэтиламин (DIPEA), при температуре в диапазоне от приблизительно 0 до приблизительно 200 С, необязательно под давлением в закрытом сосуде. Другие подходящие растворители включают бензол, хлороформ, диоксан, этилацетат,2-пропанол и ксилол. В качестве альтернативы, могут использоваться смеси растворителей, такие как толуол/2-пропанол. Соединения формулы V либо коммерчески доступны, либо могут быть получены, как описано в литературе, см., например, Brown et al., Aust. J. Chem. 1978, 31, 397-404; Yutilov et al., Khim. Geter. Soedin. 1988, 799-804; Wilde et al., Bioorg. Med. Chem. Lett. 1995, 5, 167-172; Kidwai et al., J. Korean Chem. Soc. 2005, 49, 288-291. Соединения формулы Va могут быть получены, как описано в WO 96/01826, из соответствующих 1,2-диаминпиридинов по реакции с тиокарбонилдиимидазолом в подходящем растворителе, таком как хлороформ, при подходящей температуре, такой как комнатная температура или 40 С. Необходимые 1,2-диаминпиридины легко получаются из соответствующих коммерчески доступных 2 аминопиридинов по реакции с подходящим реагентом(мезитилсульфонил)гидроксиламин, в подходящем растворителе, таком как хлороформ, при подходящей температуре, такой как 0 С, или комнатной температуре, см. WO 96/01826. 2-Галогенметил-4-(гетарил)-1 Н-имидазолы формулы VI могут быть получены галогенированием соответствующих 2-гидроксиметил-4-(гетарил)-1 Н-имидазолов с помощью подходящего реагента, в частности, тионилхлорида, трихлорида фосфора или трибромида фосфора, необязательно с использованием подходящего растворителя, такого как дихлорметан, по хорошо известным квалифицированным химикам способам. Необходимые 2-гидроксиметил-4-(гетарил)-1 Н-имидазолы могут быть получены известными из области техники способами (см., например, Magdolen, P; Vasella, A., Helv. Chim. Acta 2005,88, 2454-2469; Song, Z. et al., J. Org. Chem. 1999, 64, 1859-1867). Соединения формулы I, где -L- принимает значение -CH2-S-, могут быть получены по реакции конденсации нуклеофила формулы XII с электрофилом формулы XIII, как показано на схеме 2. Схема 2 Указанную реакцию, как правило, проводят в растворителе, таком как 1-пропанол, толуол, ДМФА или ацетонитрил, необязательно в присутствии карбонатного основания, такого как карбонат калия, или третичного аминового основания, такого как триэтиламин или диизопропилэтиламин (DIPEA), при температуре в диапазоне от приблизительно 0 до приблизительно 200 С, необязательно под давлением в закрытом сосуде. Другие подходящие растворители включают бензол, хлороформ, диоксан, этилацетат,2-пропанол и ксилол. В качестве альтернативы могут использоваться смеси растворителей, такие как толуол/2-пропанол. Некоторые электрофилы формулы VIII коммерчески доступны, а многие другие известны из области техники, см., например, JP 59176277. Электрофил VIII, где X обозначает уходящую группу, например,Cl, Br, I, метансульфонил, 4-толуолсульфонил, можно также получить превращением первичной спиртовой группы в соединении формулы VII в указанную уходящую группу, используя способы, известные квалифицированным химикам. Указанные способы можно, например, выбрать из взаимодействия соединений формулы VII с тионилхлоридом, трихлоридом фосфора, трибромидом фосфора, метансульфонилхлоридом или 4-толуолсульфонилхлоридом необязательно в присутствии подходящего растворителя,такого как дихлорметан или 1,2-дихлорэтан, и необязательно в присутствии основания, такого как триэтиламин, диизопропилэтиламин или пиридин. В качестве альтернативы электрофилы формулы VIII могут быть получены по реакции коммерчески доступных ароматических аминов формулы IX с 1,3 дигалогенацетонами формулы XI, например, с 1,3-дихлорацетоном, в подходящем растворителе, таком как 1,2-диметоксиэтан или этанол, при соответствующей температуре, такой как комнатная температура,или при кипячении с обратным холодильником. Некоторые электрофилы формулы VII коммерчески доступны, а многие другие известны из области техники, см., например, Tsuchiya, Т.; Sashida, H., J. Chem.Soc., Chem. Commun. 1980, 1109-1110; Tsuchiya, Т.; Sashida, H.; Konoshita, A., Chem. Pharm. Bull. 1983,31, 4568-4572. В качестве альтернативы спирты формулы VII можно получить взаимодействием коммерчески доступных ароматических аминов формулы IX с подходящим реагентом N-аминирования, таким как O-(мезитилсульфонил)гидроксиламин, в подходящем растворителе, таком как хлороформ, при соответствующей температуре,такой как 0 С или комнатной температуре,см.WO 96/01826, с образованием соединений формулы X. Указанные соединения формулы X можно преобразовать в соединения формулы VII по реакции с метилгликолятом с последующим восстановлением сложного метилового эфира в требуемый спирт, используя подходящий восстановитель, такой как алюмогидрид лития, в подходящем растворителе, таком как диэтиловый эфир или тетрагидрофуран, по известным специалистам способам. Соединения формулы XII либо коммерчески доступны, либо могут быть получены, как описано в литературе, см., в частности, Kjellin, G; Sandstrm, J. Acta Chem. Scand. 1969, 23, 2879-2887; Laufer, S. A. Соединения формулы I, где R1 отличен от атома водорода, можно получить алкилированием соединения формулы I, где R1 обозначает атом водорода, алкилгалогенидом формулы XIII, как показано на схеме 3. Схема 3 Указанную реакцию, как правило, проводят в подходящем растворителе, таком как диметилформамид, диметилацетамид или ацетонитрил, в присутствии подходящего основания, такого как карбонатное основание, в частности, карбонат калия, или третичное аминовое основание, в частности, триэтиламин или диизопропилэтиламин (DIPEA), при температуре в диапазоне от приблизительно 0 до приблизительно 100 С. Соединения формулы I, где -L- принимает значение -СН=СН- или -СН 2-СН 2-, можно получить, используя последовательность операций, приведенную на схеме 4. Схема 4 В частности, соединения формулы I, где -L- принимает значение -СН 2-СН 2-, можно получить, восстанавливая алкен формулы I, где -L- принимает значение -СН=СН-, гидрированием с использованием катализатора на основе переходного металла, такого как металлический палладий, вместе с источником водорода, таким как газообразный водород, бикарбонат аммония или циклогексадиен. Указанные алкены формулы I, где -L- принимает значение -СН=СН-, могут быть получены по реакции Виттига между солью фосфония формулы XIV и альдегидом формулы XV в подходящем растворителе, таком как тетрагидрофуран, в присутствии подходящего основания, такого как 1,8-диазабицикло[5.4.0]ундец-7-ен. Соль фосфония формулы XIV легко получают по реакции соединений формулы VIII (см. выше схему 2) с трифенилфосфином с использованием методик, известных квалифицированным химикам. Альдегиды формулы XV легко получают окислением спиртов формулы VII (см. выше схему 2) с использованием методов, известных квалифицированным химикам, например, по реакции спиртов формулы VII с соответствующим окислителем, таким как периодинан Десса-Мартина, в подходящем растворителе, таком как дихлорметан или 1,2-дихлорэтан. Соединения формулы I, где -L- принимает значение -СН=СН- или -СН 2-СН 2-, можно также получить, используя последовательность операций, приведенную на схеме 5. В частности, соединения формулы XVI могут быть получены по реакции Виттига между солью фосфония формулы XIV и альдегидом формулы XV в подходящем растворителе, таком как тетрагидрофуран, и в присутствии подходящего основания, такого как 1,8-диазабицикло[5.4.0]ундец-7-ен. Соль фосфония формулы XIV легко получают по реакции соединений формулы VIII (см. выше схему 2) с трифенилфосфином с использованием методов, известных квалифицированным химикам. Альдегиды формулы XV легко получают бромированием коммерчески доступных 1-замещенных 1 Н-имидазол-2 карбальдегидов и разделением двух образовавшихся региоизомеров известными квалифицированным химикам способами, например, по реакции коммерчески доступных 1-замещенных 1 Н-имидазол-2 карбальдегидов с N-бромсукцинимидом в подходящем растворителе, таком как диметилформамид. Соединения формулы I, где -L- принимает значение -СН=СН-, можно получить по реакции соединений формулы XVI с гетероароматическим реагентом олова формулы XVIII (где х может означать, однако этим не ограничиваясь, SnBu3) с использованием методов конденсации, известных квалифицированным химикам, в частности, с использованием подходящего катализатора, такого как Pd(PPh3)4 в подходящем растворителе, таком как тетрагидрофуран. Соединения формулы I, где -L- принимает значение -СН=СН-,можно также получить по реакции соединений формулы XVI с гетероароматическими бороновыми кислотами формулы XVIII (где х может означать, однако этим не ограничиваясь, B(ОН)2) с использованием методов конденсации, известных квалифицированным химикам, в частности, с использованием подходящего катализатора, такого как Pd(PPh3)4 подходящего основания, такого как трет-бутоксид натрия, в подходящем растворителе, таком как толуол. Соединения формулы I, где -L- принимает значение -СН 2 СН 2-, могут быть получены восстановлением алкена формулы I, где -L- принимает значение -СН=СН-,путем гидрирования с использованием катализатора на основе переходного металла, такого как металлический палладий, вместе с источником водорода, таким как газообразный водород, бикарбонат аммония или циклогексадиен. Раскрываемое в данном описании изобретение далее поясняется следующими примерами, которые не ограничивают настоящее изобретение. Общие методы Аналитические ЖХМС данные получают с использованием следующих методов. Метод А. Используют прибор РЕ Sciex API 150EX, работающий в режиме фотоионизации при атмосферном давлении, и ЖХ систему Shimadzu LC-8A/SLC-10A. Колонка: 4,630 мм Waters Symmetry C18 с размером частиц 3,5 мкм; температура колонки: 60 С; система растворителей: А = вода/трифторуксусная кислота (100:0,05) и В = вода/ацетонитрил/трифторуксусная кислота (5:95:0,035); метод: элюирование в линейном градиенте с отношением А:В = 90:10 до 0:100 в течение 2,4 мин со скоростью подачи 3,3 мл/мин. Метод В. Используют прибор РЕ Sciex API 300, работающий в режиме фотоионизации при атмосферном давлении, и ВЭЖХ систему Waters. Колонка: Acquity UPLC ВЕН C18 1,7 мкм, 2,150 мм (Waters); температура колонки: 60 С; система растворителей: А = вода/трифторуксусная кислота (100:0,05) и В = вода/ацетонитрил/трифторуксусная кислота (5:95:0,035); метод: элюирование в линейном градиенте с отношением А:В = 90:10 до 0:100 в течение 1,0 мин со скоростью подачи 1,2 мл/мин. Метод C. Используют прибор РЕ Sciex API 150EX, работающий в режиме фотоионизации при атмосферном давлении, и ЖХ систему Shimadzu LC-8A/SLC-10A. Колонка: 4,630 мм Waters Symmetry C18 с размером частиц 3,5 мкм; температура колонки: 60 С; система растворителей: А = вода/трифторуксусная кислота (99,95:0,05) и В = метанол/трифторуксусная кислота (99,965:0,035); метод: элюирование в линейном градиенте с отношением А:В = 83:17 до 0:100 в течение 2,4 мин со скоростью подачи 3,0 мл/мин. Препаративную ЖХМС очистку проводят на приборе РЕ Sciex API 150EX в режиме химической ионизации при атмосферном давлении. Колонка: 5020 мм YMC ODS-A с размером частиц 5 мкм; метод: элюирование в линейном градиенте с отношением А:В = 80:20 до 0:100 в течение 7 мин со скоростью подачи 22,7 мл/мин. Сбор фракций проводят методом МС детектирования в разделенных потоках. Спектры 1 Н ЯМР регистрируют на частоте 500,13 МГц на приборе Bruker Avance AV500 или на частоте 250,13 Мгц на приборе Bruker Avance DPX250. В качестве внутреннего стандарта используют ТМС. Химические сдвиги выражают в м.д. Для обозначения мультиплетности ЯМР сигналов используют следующие сокращения: с = синглет, д = дублет, т = триплет, кв = квартет, кви = квинтет, г = гептет, дд = дублет дублетов, дт = дублет триплетов, дкв = дублет квартетов, тт = триплет триплетов, м = мультиплет,шир. с = уширенный синглет и шир. = широкий сигнал. Сокращения приведены в соответствии с ACS Style Guide: "The ACS Styleguide - A manual for authors and editors" Janet S. Dodd, Ed. 1997, ISBN: 0841234620. Поучение промежуточных соединений 4-Бром-1-метил-1 Н-имидазол-2-карбальдегид Раствор 1-метил-1 Н-имидазол-2-карбальдегида (10 г, 90 ммоль) в освобожденном от кислорода ДМФА (300 мл) обрабатывают N-бромсукцинимидом (17,8 г, 100 ммоль) и полученный раствор перемешивают при комнатной температуре в течение 6 дней. Добавляют воду (750 мл) и полученную смесь экстрагируют с помощью EtOAc (4200 мл), экстракты объединяют и сушат над Na2SO4, фильтруют, а летучие вещества удаляют в вакууме. Остаток очищают колоночной хроматографией на силикагеле (нrenTaH/EtOAc = 4/l) и получают указанное в названии соединение (7,33 г, 40%) в виде твердого вещества белого цвета. ЖХМС: m/z = 191,2 (МН+), tR = 0,48 мин, метод А. Спектр 1H ЯМР (600 МГц, ДМСО-d6):9,62 (с, 1 Н), 7,80 (с, 1 Н), 3,92 (с, 3 Н). 4-Фуран-3-ил-1-метил-1 Н-имидазол-2-карбальдегид В стеклянный сосуд помещают 4-бром-1-метил-1 Н-имидазол-2-карбальдегид (567 мг, 3,0 ммоль),фуран-3-бороновую кислоту (504 мг, 4,5 ммоль), 1,2-диметоксиэтан (12 мл) и 1 М раствор карбоната натрия (4,5 мл). Из образовавшейся суспензии удаляют кислород, барботируя через нее аргон, а затем добавляют тетракис-(трифенилфосфин)палладий(0) (78 мг, 0,0675 ммоль), сосуд герметизируют, нагревают до 120 С и перемешивают суспензию при указанной температуре в течение 5 ч, а затем при 110 С - в течение 12 ч. К охлажденной смеси добавляют ТГФ (45 мл), а затем насыщенный раствор соли (15 мл). Органический слой отделяют, а водный слой экстрагируют с помощью EtOAc (250 мл). Экстракты объединяют, сушат над Na2SO4, фильтруют и летучие вещества удаляют в вакууме. Остаток очищают колоночной хроматографией на силикагеле (элюируют в градиенте от н-гептан/EtOAc = 3/1 до нгептан/EtOAc = 1/1) и получают указанное в названии соединение (326 мг, 62%) в виде твердого вещества желтого цвета. Спектр 1H ЯМР (500 МГц, CDCl3):9,82 (с, 1 Н), 7,88 (с, 1 Н), 7,49 (с, 1 Н), 7,19 (с, 1 Н), 6,69 (с, 1 Н),4,05 (с, 3 Н). Аналогичным образом получают следующее промежуточное соединение. 1-Метил-4-тиофен-3-ил-1H-имидазол-2-карбальдегид. Выход 79%. 1 В стеклянный сосуд помещают 4-бром-1-метил-1 Н-имидазол-2-карбальдегид (1420 мг, 7,5 ммоль),трибутил-(2-тиенил)станнан (3,50 г, 9,38 ммоль), ДМФА (15 мл) и из образовавшейся суспензии удаляют кислород, барботируя через нее аргон, а затем добавляют тетракис-(трифенилфосфин)палладий(0) (216 мг, 0,1875 ммоль), сосуд герметизируют, нагревают в микроволновом реакторе до 160 С течение 30 мин. Летучие вещества отгоняют в вакууме, добавляют EtOAc (50 мл), а затем добавляют насыщенный водный раствор бикарбоната натрия (25 мл). Экстракты объединяют, сушат над Na2SO4, фильтруют и летучие вещества удаляют в вакууме. Остаток очищают колоночной хроматографией на силикагеле (элюируют в градиенте от н-гептан/EtOAc = 4/1 до EtOAc (100%) и получают указанное в названии соединение(730 мг, 51%) в виде твердого вещества желтого цвета. Спектр 1H ЯМР (500 МГц, CDCl3):9,72 (с, 1 Н), 7,99 (с, 1 Н), 7,49-7,47 (м, 1 Н), 7,40-7,38 (м, 1 Н),7,12-7,08 (м, 1 Н), 3,95 (с, 3 Н). Аналогичным образом получают следующие промежуточные соединения. 1-Метил-4-тиазол-5-ил-1H-имидазол-2-карбальдегид. Выход 50%. Спектр 1H ЯМР (500 МГц, ДМСО-d6):9,75 (с, 1 Н), 9,05 (с, 1 Н), 8,21 (с, 1 Н), 8,08 (с, 1 Н), 3,98 Раствор 2-амино-4,6-диметилпиримидина (2,46 г, 20,0 ммоль) и 1,3-дихлор-2-пропанона (2,67 г, 21,0 ммоль) в 1,2-диметоксиэтане (20 мл) перемешивают при 45 С в течение ночи. Образуется осадок, его выделяют фильтрованием, а затем кипятят с обратным холодильником в этаноле (15 мл) в течение 2 ч. После охлаждения до комнатной температуры продукт осаждается в виде белых игл, которые собирают фильтрованием и сушат в вакууме, получая очищенное соединение в виде гидрохлоридной соли (883 мг,19%). 1H ЯМР (500 МГц, ДМСО-d6):7,84 (с, 1 Н), 6,88 (с, 1 Н), 4,84 (с, 2 Н), 2,60 (с, 3 Н), 2,49 (с, 3 Н). Следующие промежуточные соединения получают аналогичным образом, однако на первой стадии реакцию проводят при температуре 90 С. 2-Хлорметилимидазо[1,2-а]пиримидина гидрохлорид. Выход 62%. ЖХМС: m/z = 168,2 (МН+), tR = 0,13 мин, метод А. К раствору 4,6-диметилпиримидин-2-иламина (25 г, 200 ммоль) в 400 мл CH2Cl2 по каплям добавляют раствор гидроксиламин-2,4,6-триметилбензолсульфоната (105 г, 488 ммоль) в 300 мл CH2Cl2 при 0 С, и полученную смесь перемешивают при 0 С в течение 1 ч, а затем фильтруют. Выделенное твердое вещество промывают с помощью CH2Cl2 (100 мл) и получают 2,4,6-триметилбензолсульфонат 1-амино 4,6-диметил-1 Н-пиримидин-2-илиденаммония (40 г, выход: 62%). Смесь 2,4,6-триметилбензолсульфоната 1-амино-4,6-диметил-1 Н-пиримидин-2-илиденаммония(40 г, 0,1 моль) и NaOH (10 г, 0,2 моль) в 500 мл EtOH перемешивают при 5060 С в течение 1 ч. После добавления сложного метилового эфира хлоруксусной кислоты (16,6 г, 0,15 моль) полученную смесь перемешивают при кипячении с обратным холодильником в течение 4 ч. Концентрируют при уменьшенном давлении, остаток разбавляют водой (1000 мл) и экстрагируют с помощью CH2Cl2 (300 мл 3). Органические слои объединяют и промывают насыщенным раствором соли (200 мл), сушат над Na2SO4,фильтруют и концентрируют в вакууме. Остаток очищают колоночной хроматографией на силикагелеH ЯМР (300 МГц, ДМСО-d6):8,55 (с, 1 Н), 6,25 (с, 2 Н), 4,05 (с, 3 Н), 3,95 (с, 3 Н). ЖХМС: m/z = 196,9 (МН+), tR = (минуты, метод А) = 0,52. Аналогичным образом получают следующие промежуточные соединения. 7-Хлор-2-хлорметил-5,8-диметил[1,2,4]триазоло[1,5-с]пиримидин из 6-хлор-2,5 диметилпиримидин-4-иламина, который получают, как описано в Henze et al., J. Org. Chem. 1952, 17,1320-1327. Выход 3,2% ЖХМС: m/z = 231,5 (МН+), tR = 1,13 мин, метод С. 2-Хлорметил-5,8-диметил[1,2,4]триазоло[1,5-а]пиразин из 2-амино-3,6-диметилпиразина. Выход 60%. Спектр 1H ЯМР (500 МГц, CDCl3):7,91 (с,1 Н), 4,87 (с, 2 Н), 2,91 (с, 3 Н), 2,74 (с, 3 Н). ЖХМС: m/z = 196,9 (МН+), tR = 0,64 мин, метод А. 2-Хлорметил-5,8-диметил[1,2,4]триазоло[1,5-а]пиридин из 6-хлор-5-этил-2-метилпиримидин-4 иламина. Выход 21% ЖХМС: m/z = 245,0 (МН+), tR = 0,72 мин, метод А. 2-Хлорметил-8-метокси-5-метил[1,2,4]триазоло[1,5-а]пиридин из 3-метокси-6-метилпиридин-2 иламина. Выход 64%. Спектр 1H ЯМР (500 МГц, ДМСО-d6):7,11-7,08 (д, 1 Н), 7,01-6,98 (д, 1 Н), 4,93 (с, 2 Н), 3,98 (с, 3 Н),2,61 (с, 3 Н). 2-Хлорметилимидазо[1,2-а]пиридин Используют методику, приведенную в Vanelle et al. Tetrahedron 1991, 47, 5173-5184. К раствору 1,3 дихлор-2-пропанона (2,69 г, 21,2 ммоль) в 1,2-диметоксиэтане (5 мл) добавляют 2-аминопиридин и полученную смесь перемешивают при комнатной температуре в течение 2 ч. За это время образуется толстый слой осадка, который собирают фильтрованием. Осадок кипятят с обратным холодильником в абсолютном этаноле в течение 2 ч, после чего летучие вещества отгоняют выпариванием. Остаток растворяют в воде (30 мл) и добавляют твердый NaHCO3, чтобы нейтрализовать смесь. Образуется белый осадок, его собирают фильтрованием, промывают водой и сушат в вакууме, получая указанное в названии очищен- 21023663 ное соединения в виде кремообразного твердого вещества белого цвета (1,43 г, 42%). Спектр 1H ЯМР (500 MHz, CDCl3):8,08 (д, J = 6,7 Гц, 1 Н), 7,62 (с, 1 Н), 7,58 (д, J = 9,0 Гц, 1 Н),7,17-7,22 (м, 1 Н), 6,80 (т, J = 6,8 Гц, 1 Н), 4,78 (с, 2 Н). Аналогичным образом получают следующее промежуточное соединение. 2-Хлорметил-8-метилимидазо[1,2-а]пиридин. Выход 53%. Спектр 1H ЯМР (500 MHz, CDCl3):7,95 (д, J = 6,9 Гц, 1 Н), 7,61 (с, 1 Н), 6,97 (дт, J = 7,0 Гц, 1,1 Гц,1 Н), 6,70 (т, J = 6,8 Гц, 1 Н), 4,80 (с, 2 Н), 2,60 (с, 3 Н). 2-Хлорметил-5,7-диметил[1,2,4]триазоло[1,5-а]пиридин К раствору 0,79 г гидроксида натрия в этаноле (20 мл) добавляют 2-имино-4,6-диметил-2 Нпиридин-1-иламин (1,7 г, 0,012 моль; получен при ВЭЖХ очистке промежуточного соединения 10). Перемешивают при температуре 50-60 С в течение 1 ч, добавляют метилгликолят (1,4 г, 0,016 моль) и полученную смесь перемешивают при кипячении с обратным холодильником в течение 6 ч. Растворитель удаляют при пониженном давлении, остаток очищают колоночной хроматографией на силикагеле (этилацетат) и получают (5,7-диметил [1,2,4]триазоло[1,5-а]пиридин-2-ил)метанол (0,2 г, 10%). Спектр 1H ЯМР (300 МГг, ДМСО-d6):7,39 (с, 1 Н), 6,87 (с, 1 Н), 5,38 (т, J = 6,3 Гц, 1 Н), 4,59 (д, J = 6,3 Гц, 2 Н), 2,64 (с, 3 Н), 2,38 (с, 3 Н). Смесь указанного соединения (31 мг, 0,175 ммоль) и SOCl2 (10 мл) в сухом CH2Cl2 (10 мл) перемешивают при комнатной температуре в течение 2 ч. Растворитель и избыток SOCl2 упаривают в вакууме и получают указанное в названии соединение в виде сырого продукта, который используют для получения конечных соединений без очистки или исследования свойств. Следующие соединения известны из области техники. 2-Хлорметил-1-фенил-1 Н-бензоимидазол (JP 59176277). 1-Метил-1,3-дигидробензоимидазол-2-тион (Wilde et al., Bioorg. Med. Chem. Lett. 1995, 5, 167-172). 1-Фенил-1,3-дигидробензоимидазол-2-тион (Kidwai et al., J. Korean Chem. Soc. 2005, 49, 288-291).[1,2,4]Триазоло[1,5-a]пиримидин-2-тион (Brown et al., Aust. J. Chem. 1978, 31, 397-404). 1,3-Дигидроимидазо[4,5-b]пиридин-2-тион (Yutilov et al., Khim. Geter. Soedin. 1988, 799-804). Пиразоло[1,5-a]пиридин-2-илметанол (Tsuchiya, Т.; Sashida, H., J. Chem. Soc, Chem. Commun. 1980,1109-1110; Tsuchiya, Т.; Sashida, H; Konoshita, A., Chem. Pharm. Bull. 1983, 31, 4568-4572). Получение соединений по настоящему изобретению Пример 1. транс-5,8-Диметил-2-[(Е)-2-(1-метил-4-бром-1 Н-имидазол-2-ил)винил]-[1,2,4]триазоло[1,5 а]пиразин Раствор 2-хлорметил-5,8-диметил[1,2,4]триазоло[1,5-а]пиразина (1,351 г, 6,87 ммоль) и трифенилфосфина (1,80 г, 6,87 ммоль) в ацетонитриле (150 мл) кипятят с обратным холодильником в течение 12 ч. Растворители удаляют в вакууме, а остаток суспендируют в эфире, фильтруют и сушат, получая на выходе хлорид (5,8-диметил[1,2,4]триазоло[1,5-а]пиразин-2-илметил)трифенилфосфония в виде беловатого твердого вещества (2,412 г, 74,9%). ЖХМС: m/z = 423,2 ([M-Cl]+), tR = 0,86 мин, метод А. Раствор 4-бром-1-метил-1 Н-имидазол-2-карбальдегида (930 мг, 4,92 ммоль) в сухом ТГФ добавляют в атмосфере аргона к хлориду(736 мкл, 4,92 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение 12 ч. Добавляют воду (50 мл), а затем EtOAc (50 мл). Выпавшие в осадок твердые вещества отфильтровывают,промывают небольшим количеством EtOAc и сушат при 40 С в течение 12 ч, получая указанное в названии соединение (1,36 г, 83%) в виде беловатого твердого вещества. ЖХМС: m/z = 333,1 (МН+), tR = 1,18 мин, метод С. Аналогичным образом получают следующие соединения. 5,7-Диметил-2-[(Е)-2-(1-метил-4-тиофен-3-ил-1 Н-имидазол-2-ил) винил]имидазо[1,2-а]пиримидин из хлорида (5,7-диметилимидазо[1,2-а]пиримидин-2-илметил)трифенилфосфония и 1-метил-4-тиофен-3- 22023663 В стеклянный сосуд помещают 2-[2-(4-бром-1-метил-1 Н-имидазол-2-ил)винил]-5,7 диметилимидазо[1,2-а]пиримидин (150 мг, 0,45 ммоль), трибутил(2-тиенил)станнан (226 мкл, 0,67 ммоль), ДМФА (4 мл) и из полученной суспензии удаляют кислород, барботируя аргон, а затем добавляют тетракис-(трифенилфосфин)палладий(0) (26 мг, 0,05 ммоль), сосуд герметизируют и нагревают в реакторе с ВЧ нагревом до 160 С в течение 30 мин. Добавляют ТГФ (15 мл), а затем - насыщенный водный раствор бикарбоната натрия (25 мл). Органический слой отделяют, а водный слой экстрагируют с помощью ТГФ (15 мл). Экстракты объединяют и сушат над Na2SO4, фильтруют и летучие вещества удаляют в вакууме. Остаток очищают колоночной хроматографией на силикагеле (EtOAc:Et3N, 95:5) и получают указанное в названии соединение (60 мг, 40%) в виде твердого вещества светло-коричневого цвета. Спектр 1H ЯМР (500 MHz, CDCl3):8,10 (с, 1 Н), 7,58 (с, 1 Н), 7,49-7,41 (м, 1 Н), 7,39-7,31 (м, 2 Н),7,29-7,25 (м, 1 Н), 7,18-7,12 (м, 1 Н), 6,83 (с, 1 Н), 3,79 (с, 3 Н), 2,60 (с, 3 Н), 2,49 (с, 3 Н). ЖХМС (МН+): m/z = 336,4, tR (мин, метод А) = 0,51. Аналогичным образом получают следующие соединения. 5,7-Диметил-2-[(Е)-2-(1-метил-4-пиразин-2-ил-1 Н-имидазол-2-ил)винил]имидазо[1,2-а]пиримидин из 2-[2-(4-бром-1-метил-1 Н-имидазол-2-ил)винил]-5,7-диметилимидазо[1,2-а]пиримидина и 2(трибутилстаннил)пиразина. Выход 8,4%, ЖХМС (МН+): m/z = 332,0, tR (мин, метод В) = 0,30. 5,7-Диметил-2-[(Е)-2-(1-метил-4-пиридин-3-ил-1 Н-имидазол-2-ил)винил]имидазо[1,2-а]пиримидин из 2-[2-(4-бром-1-метил-1 Н-имидазол-2-ил)винил]-5,7-диметилимидазо[1,2-а]пиримидина и трибутил-(3 пиридинил)станнана. Выход 8,4%, ЖХМС (МН+): m/z = 331,2, tR (мин, метод В) = 0,26. 5,7-Диметил-2-[(Е)-2-(1-метил-4-пиридин-2-ил-1 Н-имидазол-2-ил)винил]имидазо[1,2-а]пиримидин из 2-[2-(4-бром-1-метил-1 Н-имидазол-2-ил)винил]-5,7-диметилимидазо[1,2-а]пиримидина и 2 трибутилстаннилпиридина. Выход 8,4%, ЖХМС (МН+): m/z = 331,2, tR (мин, метод В) = 0,28. 5,7-Диметил-2-[(Е)-2-(1-метил-4-пиридин-4-ил-1 Н-имидазол-2-ил)винил]имидазо[1,2-а]пиримидин из 2-[2-(4-бром-1-метил-1 Н-имидазол-2-ил)винил]-5,7-диметилимидазо[1,2-а]пиримидина и 4 трибутилстаннилпиридина. Выход 8,4%, ЖХМС (МН+): m/z = 331,2, tR (мин, метод В) = 0,28. 2-[(Е)-2-(4-Фуран-2-ил-1-метил-1 Н-имидазол-2-ил)винил]-5,7-диметилимидазо[1,2-а]пиримидин из В стеклянный сосуд помещают 2-[(Е)-2-(4-бром-1-метил-1 Н-имидазол-2-ил)винил]-8 метокси[1,2,4]триазоло[1,5-а]пиридин (67 мг, 0,20 ммоль), 4-метил-З-(4,4,5,5-тетраметил-1,3,2 диоксаборолан-2-ил)тиофен (67 мг, 0,30 ммоль), 1,2-диметоксиэтан (0,8 мл), 1 М раствор карбоната натрия в воде (0,3 мл) и из полученной суспензии удаляют кислород, барботируя через нее аргон, а затем добавляют тетракис-(трифенилфосфин)палладий(0) (5,2 мг, 0,0045 ммоль), сосуд герметизируют и нагревают в реакторе с ВЧ нагревом до температуры 110 С в течение 12 ч. Добавляют EtOAc (3 мл), а затем насыщенный раствор соли (2 мл). Органический слой отделяют и летучие вещества удаляют в вакууме. Остаток очищают препаративной ЖХМС хроматографией и получают указанное в названии соединение(7 мг, 10%). Спектр 1H ЯМР (500 МГц, ДМСО-d6):8,51-8,49 (м, 1 Н), 7,72-7,69 (м, 1 Н), 7,68-7,62 (м, 1 Н), 7,587,52 (м, 1 Н), 7,49-7,45 (м, 1 Н), 7,23-7,20 (м, 1 Н), 7,11-7,08 (м, 2 Н), 4,01 (с, 3 Н), 3,85 (с, 3 Н), 2,49 (с, 3 Н). ЖХМС (МН+): m/z = 352,1. tR (мин, метод В) = 0,46. Аналогичным образом получают следующие промежуточные соединения. 2-[(Е)-2-(4-Фуран-3-ил-1-метил-1 Н-имидазол-2-ил)винил]-5,7-диметилимидазо[1,2-а]пиримидин из 2-[2-(4-бром-1-метил-1 Н-имидазол-2-ил)винил]-5,7-диметилимидазо[1,2-а]пиримидин,фуран-3 бороновой кислоты и дихлорметанового комплекса В стеклянный сосуд помещают 2-[2-(4-бром-1-метил-1 Н-имидазол-2-ил)этил]-8-метокси-5 метил[1,2,4]триазоло[1,5-а]пиридин (70 мг, 0,20 ммоль), 4-фуран-3-бороновую кислоту (33,6 мг, 0,30 ммоль), 1,2-диметоксиэтан (0,8 мл), 1 М раствор карбоната натрия в воде (0,3 мл) и из полученной суспензии удаляют кислород, барботируя через нее аргон, а затем добавляют тетракис(трифенилфосфин)палладий(0) (5,2 мг, 0,0045 ммоль), сосуд герметизируют и нагревают до температуры 110 С в течение 12 ч. Добавляют EtOAc (3 мл), а затем - насыщенный раствор соли (2 мл). Органический слой отделяют, и летучие вещества удаляют в вакууме. Остаток очищают колоночной хроматографией на силикагеле (в градиенте от 100% EtOAc до EtOAc:MeOH, 7:3) и получают указанное в названии соединение (10 мг, 10%). ЖХМС (МН+): m/z = 338,1. tR (мин, метод В) = 0,41. Аналогичным образом получают следующее соединение. 8-Метокси-5-метил-2-2-[1-метил-4-(4-метилтиофен-3-ил)-1 Н-имидазол-2-ил]этил[1,2,4]триазоло[1,5-а]пиридин из 2-[2-(4-бром-1-метил-1 Н-имидазол-2-ил)этил]-8-метокси-5 метил[1,2,4]триазоло[1,5-а]пиридина и 4-метил-3-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)тиофена. Выход 70%, ЖХМС (МН+): m/z = 368,3. tR (мин, метод В) = 0,80. Пример 5. 5-Метил-2-2-[4-(5-метилфуран-2-ил)-1 Н-имидазол-2-ил]этил-[1,2,4]триазоло[1,5-а]пиридин К раствору 5-метил-2-(Е)-2-[4-(5-метилфуран-2-ил)-1 Н-имидазол-2-ил]винил-[1,2,4]триазоло[1,5 а]пиридина (20 мг, 0,07 ммоль) в метаноле (20 мл) добавляют 10%-ный палладий на угле (20 мг). Реакционную смесь встряхивают в течение ночи при давлении 3 бар водорода. После фильтрации и отгонки летучих веществ получают указанное в названии соединение (6 мг, 30%). ЖХМС: m/z = 308,3 (МН+), tR = 0,41 мин, метод А. Аналогичным образом получают следующие соединения. 5,7-Диметил-2-[2-(1-метил-4-тиофен-3-ил-1 Н-имидазол-2-ил)этил]имидазо[1,2-а]пиримидин, очищают методом препаративной ЖХМС. Выход 32%, ЖХМС (МН+): m/z = 338,7. tR (мин, метод А) = 0,35. 5-Метил-2-[2-(4-тиофен-3-ил-1 Н-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиридин, очищают колоночной хроматографией на силикагеле (в градиенте от 100% EtOAc до EtOAc:MeOH, 7:3). Выход 6%, ЖХМС (МН+): m/z = 310,2. tR (мин, метод В) = 0,39. 8-Метокси-2-[2-(1-метил-4-тиофен-2-ил-1 Н-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиридин,очищают колоночной хроматографией на силикагеле (в градиенте от 100% EtOAc до EtOAc:MeOH, 7:3). Выход 26%, ЖХМС (МН+): m/z = 339,9. tR (мин, метод В) = 0,40. 8-Метокси-2-[2-(1-метил-4-тиофен-3-ил-1 Н-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиридин,очищают колоночной хроматографией на силикагеле (в градиенте от 100% EtOAc до EtOAc:MeOH, 7:3). Выход 8,5%, ЖХМС (МН+): m/z = 339,9. tR (мин, метод В) = 0,41. 8-Метокси-2-[2-(1-метил-4-тиазол-5-ил-1 Н-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиридин,очищают колоночной хроматографией на силикагеле (в градиенте от 100% EtOAc до EtOAc:MeOH, 7:3). Выход 36%, ЖХМС (МН+): m/z = 340,9. tR (мин, метод В) = 0,31. 8-Метокси-2-2-[1-метил-4-(5-метилфуран-2-ил)-1 Н-имидазол-2-ил]этил-[1,2,4]триазоло[1,5 а]пиридин, очищают колоночной хроматографией на силикагеле (в градиенте от 100% EtOAc доEtOAc:MeOH, 7:3). Выход 40%, ЖХМС (МН+): m/z = 338,1. tR (мин, метод В) = 0,42. 8-Метокси-2-2-[1-метил-4-(4-метилтиофен-3-ил)-1 Н-имидазол-2-ил]этил-[1,2,4]триазоло[1,5 а]пиридин, очищают колоночной хроматографией на силикагеле (в градиенте от 100% EtOAc доEtOAc:MeOH, 7:3). Выход 8,5%, ЖХМС (МН+): m/z = 354,2. tR (мин, метод В) = 0,45. 8-Метокси-5-метил-2-[2-(4-тиофен-2-ил-1 Н-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиридин,очищают колоночной хроматографией на силикагеле (в градиенте от 100% EtOAc до EtOAc:MeOH, 7:3). Выход 29%, ЖХМС (МН+): m/z = 340,3. tR (мин, метод С) = 0,77. 8-Метил-2-[2-(4-тиофен-2-ил-1 Н-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиридин, очищают колоночной хроматографией на силикагеле (в градиенте от 100% EtOAc до EtOAc:MeOH:Et3N, 90:5:5). Выход 58%, ЖХМС (МН+): m/z = 310,5. tR (мин, метод А) = 0,57. 8-Метокси-5-метил-2-[2-(1-метил-4-тиофен-2-ил-1 Н-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5 а]пиридин, очищают методом препаративной ЖХМС. Выход 18%, ЖХМС (МН+): m/z = 354,5. tR (мин, метод А) = 0,66. 8-Фтор-2-[2-(1-метил-4-тиофен-2-ил-1 Н-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиридин,очищают методом препаративной ЖХМС. Выход 3,1%, ЖХМС (МН+): m/z = 328,4. tR (мин, метод А) = 0,54. 8-Фтор-2-2-[1-метил-4-(5-метилфуран-2-ил)-1 Н-имидазол-2-ил]этил-[1,2,4]триазоло[1,5 а]пиридин, очищают методом препаративной ЖХМС. Выход 4,9%, ЖХМС (МН+): m/z = 326,3. tR (мин, метод А) = 0,60. 8-Метил-2-[2-(4-пиридин-3-ил-1 Н-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиридин,очищают колоночной хроматографией на силикагеле (в градиенте от 100% EtOAc до EtOAc:MeOH, 7:3). Выход 38%, ЖХМС (МН+): m/z = 305,3. tR (мин, метод А) = 0,32. 5-Метил-2-[2-(1-метил-4-тиофен-2-ил-1 Н-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиридин, очищают колоночной хроматографией на силикагеле (100% EtOAc). Выход 46%, ЖХМС (МН+): m/z = 324,4. tR (мин, метод А) = 0,57. 8-Метил-2-[2-(1-метил-4-тиофен-2-ил-1 Н-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиридин, очищают колоночной хроматографией на силикагеле (100% EtOAc). Выход 38%, ЖХМС (МН+): m/z = 324,3. tR (мин, метод А) = 0,57. 5,8-Диметил-2-[2-(1-метил-4-тиазол-4-ил-1 Н-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиразин,ЖХМС: m/z = 340,1 (МН+), tR = 1,29 мин (метод С). 5,8-Диметил-2-[2-(1-метил-4-тиазол-4-ил-1 Н-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиридин,ЖХМС: m/z = 339,1 (МН+), tR = 0,40 мин (метод С). 5,8-Диметил-2-[2-(1-метил-4-пиримидин-5-ил-1 Н-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5 а]пиразин,ЖХМС: m/z = 335,1 (МН+), tR = 0,44 мин (метод С). 5,8-Диметил-2-[2-(1-метил-4-пиразин-2-ил-1 Н-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиразин,ЖХМС: m/z = 335,2 (МН+), tR = 0,52 мин (метод С). 5,8-Диметил-2-[2-(1-метил-4-пиридин-4-ил-1 Н-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиразин,ЖХМС: m/z = 334,2 (МН+), tR = 0,55 мин (метод С). Пример 6. 5,7-Диметил-2-[2-(1-метил-4-тиофен-2-ил-1 Н-имидазол-2-ил)этил]имидазо[1,2-а]пиримидин Раствор 5,7-диметил-2-[(Е)-2-(1-метил-4-тиофен-2-ил-1 Н-имидазол-2-ил)винил]имидазо[1,2 а]пиримидина (40 мг, 0,083 ммоль) в метаноле (2 мл) пропускают в реакторе гидрирования проточного типа H-Cube (ThalesNano) со скоростью подачи 1 мл/мин через небольшой картридж 10% Pd/C(THS01111) при температуре внутри реактора 40 С и давлении водорода 30 бар. После отгонки летучих веществ получают указанное в названии соединение (11,6 мг, 41%). ЖХМС: m/z = 338,6 (МН+), tR = 0,69 мин, метод А. Аналогичным образом получают следующие соединения. 5,7-Диметил-2-[2-(1-метил-4-тиофен-3-ил-1 Н-имидазол-2-ил)этил]имидазо[1,2-а]пиримидин (условия в реакторе H-Cube: 1 мл/мин, 25 С, давление водорода 1 бар). Выход 1,3%, ЖХМС (МН+): m/z = 338,7. tR (мин, метод А) = 0,33. 5,7-Диметил-2-2-[4-тиофен-2-ил-1-(2-триметилсиланилэтоксиметил)-1 Н-имидазол-2 ил]этилимидазо[1,2-а]пиримидин (условия в реакторе H-Cube: 1 мл/мин, 40 С, давление водорода 30 бар). Выход 56%, ЖХМС (МН+): m/z = 452,2. tR (мин, метод В) = 0,67. 5-Метил-2-[2-(1-пропил-4-пиридин-3-ил-1 Н-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиридин(условия в реакторе Н-Cube: 1 мл/мин, 30 С, давление водорода 30 бар). Выход 85%, ЖХМС (МН+): m/z = 347,1. tR (мин, метод А) = 0,51. 5-Метил-2-[2-(1-метил-4-пиридин-3-ил-1 Н-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиридин (условия в реакторе Н-Cube: 1 мл/мин, 30 С, давление водорода 30 бар), очищают колоночной хроматографией на силикагеле (100% EtOAc). Выход 44%, ЖХМС (МН+): m/z = 318,9. tR (мин, метод В) = 0,29. 8-Метил-2-[2-(1-метил-4-пиридин-3-ил-1 Н-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиридин (условия в реакторе Н-Cube: 1 мл/мин, 30 С, давление водорода 30 бар), очищают колоночной хроматографией на силикагеле (100% EtOAc). Выход 48%, ЖХМС (МН+): m/z = 319,2. tR (мин, метод В) = 0,35. 8-Метил-2-[2-(1-метил-4-тиазол-5-ил-1 Н-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиридин (условия в реакторе Н-Cube: 1 мл/мин, 30 С, давление водорода 30 бар), очищают колоночной хроматографией на силикагеле (элюируют в градиенте от 100% EtOAc до EtOAc:MeOH:Et3N, 90:5:5). Выход 51%, ЖХМС (МН+): m/z = 325,5. tR (мин, метод А) = 0,41. 5-Метил-2-[2-(1-метил-4-тиазол-5-ил-1 Н-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиридин (условия в реакторе Н-Cube: 1 мл/мин, 30 С, давление водорода 30 бар), очищают колоночной хроматогра- 27023663 фией на силикагеле (элюируют в градиенте от 100% EtOAc до EtOAc:MeOH:Et3N, 90:5:5). Выход 59%, ЖХМС (МН+): m/z = 325,1. tR (мин, метод А) = 0,40. 8-Метокси-5-метил-2-[2-(1-метил-4-тиазол-5-ил-1 Н-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5 а]пиридин (условия в реакторе Н-Cube: 1 мл/мин, 30 С, давление водорода 30 бар). Выход 21%, ЖХМС (МН+): m/z = 355,4. tR (мин, метод С) = 0,53. 8-Метокси-5-метил-2-[2-(1-метил-4-пиридин-3-ил-1 Н-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5 а]пиридин (условия в реакторе H-Cube: 1 мл/мин, 30 С, давление водорода 30 бар), очищают колоночной хроматографией на силикагеле (элюируют в градиенте от 100% EtOAc до EtOAc:MeOH:Et3N, 90:5:5). Выход 32%, ЖХМС (МН+): m/z = 349,1. tR (мин, метод С) = 0,48. 8-Метокси-5-метил-2-[2-(1-метил-4-тиофен-3-ил-1 Н-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5 а]пиридин (условия в реакторе Н-Cube: 1 мл/мин, 30 С, давление водорода 30 бар), очищают колоночной хроматографией на силикагеле (элюируют в градиенте от 100% EtOAc до EtOAc:MeOH:Et3N, 90:5:5). Выход 14%, ЖХМС (МН+): m/z = 354,5. tR (мин, метод С) = 0,75. 5,7-Диметил-2-[2-(1-метил-4-тиофен-2-ил-1 Н-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиримидин(условия в реакторе Н-Cube: 1 мл/мин, 25 С, давление водорода 1 бар). Выход 35%, ЖХМС (МН+): m/z = 339,5. tR (мин, метод С) = 0,55. 5,7-Диметил-2-[2-(1-метил-4-пиридин-3-ил-1 Н-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5 а]пиримидин (условия в реакторе Н-Cube: 1 мл/мин, 30 С, давление водорода 30 бар). Выход 55%, ЖХМС (МН+): m/z = 334,4. tR (мин, метод В) = 0,38. 5,8-Диметил-2-2-[1-метил-4-(5-метилфуран-2-ил)-1 Н-имидазол-2-ил]этил-[1,2,4]триазоло[1,5 а]пиразин (условия в реакторе H-Cube: 2 мл/мин, 25 С, давление водорода 1 бар). Выход 12%, ЖХМС (МН+): m/z = 337,6. tR (мин, метод С) = 0,67. 5,8-Диметил-2-[2-(1-метил-4-тиазол-2-ил-1 Н-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-с]пиримидин из 7-хлор-5,8-диметил-2-[2-(1-метил-4-тиазол-2-ил-1 Н-имидазол-2-ил)винил]-[1,2,4]триазоло[1,5 с]пиримидина (условия в реакторе H-Cube: 1 мл/мин, 25 С, давление водорода 1 бар), очищают методом препаративной ЖХМС. Выход 2,6%, ЖХМС (МН+): m/z = 340,4. tR (мин, метод С) = 0,55. 5,8-Диметил-2-2-[1-метил-4-(5-метилфуран-2-ил)-1 Н-имидазол-2-ил]этил-[1,2,4]триазоло[1,5 а]пиридин (условия в реакторе H-Cube: 2 мл/мин, 20 С, давление водорода 1 бар), очищают колоночной хроматографией на силикагеле (элюируют в градиенте от EtOAc:гептан, 1:1 до EtOAc 100%). Выход 11,2%, ЖХМС (МН+): m/z = 336,5. tR (мин, метод С) = 0,82. 5,7-Диметил-2-2-[1-метил-4-(5-метилфуран-2-ил)-1 Н-имидазол-2-ил]этил-[1,2,4]триазоло[1,5 а]пиримидин (условия в реакторе H-Cube: 2 мл/мин, 25 С, давление водорода 1 бар), очищают методом препаративной ЖХМС. Выход 55%, ЖХМС (МН+): m/z = 337,6. tR (мин, метод С) = 0,61. 8-Метокси-5-метил-2-2-[1-метил-4-(5-метилфуран-2-ил)-1 Н-имидазол-2-ил]этил[1,2,4]триазоло[1,5-а]пиридин (условия в реакторе H-Cube: 1,5 мл/мин, 20 С, давление водорода 1 бар),очищают колоночной хроматографией на силикагеле (элюируют в градиенте EtOAc 100% до(условия в реакторе Н-Cube: 1 мл/мин, 20 С, давление водорода 1 бар), очищают колоночной хроматографией на силикагеле (элюируют в градиенте от EtOAc 100% до EtOAc:MeOH 95:5). Выход 30%, ЖХМС (МН+): m/z = 338,7. tR (мин, метод С) = 0,79. 5,8-Диметил-2-[2-(1-метил-4-тиофен-2-ил-1 Н-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиразин К раствору 2-[(Е)-2-(4-фуран-3-ил-1-метил-1 Н-имидазол-2-ил)винил]-5,8 диметил[1,2,4]триазоло[1,5-а]пиразина (170 мг, 0,53 ммоль) в ДМФА (13 мл) добавляют птолуолсульфонилгидразид (300 мг, 1,6 ммоль). Реакционную смесь перемешивают в течение 8 ч при 120 С. Летучие вещества удаляют в вакууме, а остаток растворяют в EtOAc (50 мл), промывают насыщенным раствором бикарбоната натрия, насыщенным раствором соли и сушат (MgSO4). После фильтрования, отгонки летучих веществ и очистки колоночной хроматографией на силикагеле (EtOAc 100%) получают указанное в названии соединение (126 мг, 74%). ЖХМС: m/z = 323,3 (МН+), tR = 0,48 мин, метод С. Пример 8. 5-Метил-2-[2-(4-тиофен-2-ил-1 Н-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиридин К раствору 5-метил-2-(Е)-2-[4-(4-метилтиофен-3-ил)-1-(2-триметилсиланилэтоксиметил)-1 Нимидазол-2-ил]винил-[1,2,4]триазоло[1,5-а]пиридина (130 мг, 0,29 ммоль) в 1,2-дихлорэтане (2 мл) добавляют трифторуксусную кислоту (5 мл). Реакционную смесь встряхивают в атмосфере аргона в течение 96 ч. Летучие вещества удаляют в вакууме, а остаток растворяют в метаноле (15 мл), а затем добавляют 10%-ный палладий на угле (60 мг). Реакционную смесь оставляют на ночь встряхиваться в атмосфере водорода под давлением 3 бар. После фильтрации, отгонки летучих веществ и очистки колоночной хроматографией на силикагеле (элюируют в градиенте от 100% EtOAc до EtOAc:МеОН, 7:3) получают указанное в названии соединение (27 мг, 29%). ЖХМС: m/z = 324,1 (МН+), tR = 0,44 мин, метод В. Аналогичным образом получают следующие соединения. 5-Метил-2-[2-(4-пиридин-3-ил-1 Н-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиридин. Выход 40%, ЖХМС (МН+): m/z = 305,2. tR (мин, метод В) = 0,26. 5-Метил-2-[2-(4-тиофен-2-ил-1 Н-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиридин, восстановление промежуточного алкена проводят, как указано в примере 5 (условия в реакторе H-Cube: 1 мл/мин,30 С, давление водорода 30 бар). Выход 65%, ЖХМС (МН+): m/z = 310,3. tR (мин, метод В) = 0,44. 2-[2-(8-Метокси-[1,2,4]триазоло[1,5-а]пиридин-2-ил)этил]-4-тиофен-2-ил-1 Н-имидазол,очищают колоночной хроматографией на силикагеле (элюируют в градиенте от 100% EtOAc до EtOAc:MeOH, 7:3). Выход 15%, ЖХМС (МН+): m/z = 326,3. tR (мин, метод В) = 0,39. 8-Метокси-2-2-[4-(5-метилфуран-2-ил)-1 Н-имидазол-2-ил]этил-[1,2,4]триазоло[1,5-а]пиридин,очищают колоночной хроматографией на силикагеле (элюируют в градиенте от 100% EtOAc доEtOAc:MeOH, 7:3). Выход 18%, ЖХМС (МН+): m/z = 324,1. tR (мин, метод В) = 0,41. 2-[2-(8-Метокси-[1,2,4]триазоло[1,5-а]пиридин-2-ил)этил]-4-тиазол-5-ил-1 Н-имидазол,очищают колоночной хроматографией на силикагеле (элюируют в градиенте от 100% EtOAc до EtOAc:МеОН, 7:3). Выход 52%, ЖХМС (МН+): m/z = 327,3. tR (мин, метод В) = 0,30. 8-Метокси-2-[2-(4-пиридин-3-ил-1 Н-имидазол-2-ил)этил]-[1,2,4]триазоло[1,5-а]пиридин, очищают колоночной хроматографией на силикагеле (элюируют в градиенте от 100% EtOAc до EtOAc:MeOH, 7:3). Выход 22%, ЖХМС (МН+): m/z = 321,3. tR (мин, метод В) = 0,27.
МПК / Метки
МПК: C07D 487/04, A61P 25/00, A61K 31/519, C07D 471/04
Метки: ингибиторов, фермента, фенилимидазола, производные, гетероароматические, pde10a, качестве
Код ссылки
<a href="https://eas.patents.su/30-23663-geteroaromaticheskie-proizvodnye-fenilimidazola-v-kachestve-ingibitorov-fermenta-pde10a.html" rel="bookmark" title="База патентов Евразийского Союза">Гетероароматические производные фенилимидазола в качестве ингибиторов фермента pde10a</a>
Предыдущий патент: Вакцины против гриппа со сниженным количеством сквалена
Следующий патент: Левитирующий диск
Случайный патент: Способ коррекции психосоматических дисфункций












