Производные 2-арилимидазола в качестве ингибиторов фермента pde10a
Номер патента: 21415
Опубликовано: 30.06.2015
Авторы: Ланггор Мортен, Пюшль Аск, Нильсен Якоб, Килберн Джон Пол, Келер Ян, Мариго Мауро
Формула / Реферат
1. Соединение, имеющее структуру I
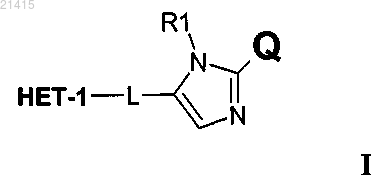
где НЕТ-1 представляет собой гетероароматическую группу, выбранную из группы, включающей [1,2,4]триазоло[1,5-а]пиридин и [1,2,4]триазоло[1,5-а]пиразин, и где НЕТ-1 необязательно может быть замещен 1-3 заместителями R7, R8 и R9, индивидуально выбираемыми из водорода, C1-C6-алкила и метокси; символ * обозначает место присоединения;
Q выбран из группы, включающей фенил, тиазол, тиофен и фуран, необязательно замещенный метилом или фтором;
-L- представляет собой -СН2-СН2-;
R1 выбирают из Н и C1-C6-алкила;
и его таутомеры и фармацевтически приемлемые соли при условии, что соединение не является 2-(5-фенил-1Н-имидазол-2-илметилсульфанил)-1Н-бензоимидазолом или 2-(5-фенил-1Н-имидазол-2-илсульфанилметил)-1Н-бензоимидазолом.
2. Соединение по п.1, где НЕТ-1 представляет собой [1,2,4]триазоло[1,5-а]пиридиновую группу.
3. Соединение по п.1, где НЕТ-1 представляет собой [1,2,4]триазоло[1,5-а]пиразиновую группу.
4. Соединение по п.1 или 2, где все R7, R8 и R9 представляют собой водород.
5. Соединение по п.1 или 2, где по меньшей мере один из R7, R8 и R9 является метилом.
6. Соединение по п.1, где соединение выбирают из группы, состоящей из
5,8-диметил-2-[2-(2-фенил-1Н-имидазол-4-ил)этил]-[1,2,4]триазоло[1,5-а]пиразина;
5,8-диметил-2-[2-(1-метил-2-фенил-1Н-имидазол-4-ил)этил]-[1,2,4]триазоло[1,5-а]пиразина;
8-этил-5-метил-2-[2-(1-метил-2-фенил-1Н-имидазол-4-ил)этил]-[1,2,4]триазоло[1,5-а]пиридина;
5,8-диметил-2-[2-(1-метил-2-тиофен-2-ил-1Н-имидазол-4-ил)этил]-[1,2,4]триазоло[1,5-а]пиразина;
5,8-диметил-2-[2-(1-метил-2-тиазол-2-ил-1Н-имидазол-4-ил)этил]-[1,2,4]триазоло[1,5-а]пиразина;
8-метокси-5-метил-2-[2-(2-фенил-1Н-имидазол-4-ил)этил]-[1,2,4]триазоло[1,5-а]пиридина;
8-метокси-5-метил-2-[2-(1-метил-2-тиофен-2-ил-1Н-имидазол-4-ил)этил]-[1,2,4]триазоло[1,5-а]пиридина;
8-метокси-5-метил-2-[2-(1-метил-2-фенил-1Н-имидазол-4-ил)этил]-[1,2,4]триазоло[1,5-а]пиридина,
и его фармацевтически приемлемые соли.
Текст
Изобретение относится к соединениям, которые являются ингибиторами фермента PDE10A. В изобретении предлагают фармацевтическую композицию, содержащую терапевтически эффективное количество соединения по изобретению и фармацевтически приемлемый носитель. В настоящем изобретении также предусматривают способы получения соединения формулы (I). В настоящем изобретении дополнительно предлагают способ лечения пациента, страдающего нейродегенеративным расстройством, включающий введение пациенту терапевтически эффективного количества соединения формулы (I). В настоящем изобретении также предложен способ лечения пациента, страдающего наркоманией, включающий введение пациенту терапевтически эффективного количества соединения формулы (I). В настоящем изобретении также предложен способ лечения пациента, страдающего психиатрическим расстройством, включающий введение пациенту терапевтически эффективного количества соединения формулы (I). Область техники, к которой относится изобретение В настоящем изобретении представляют гетероароматические соединения, которые являются ингибиторами фермента PDE10A, и в этом качестве пригодны для лечения нейродегенеративных и психиатрических расстройств. Главным образом, в изобретении предоставляют соединения, которые являются высокоселективными по отношению к PDE10 по сравнению с другими подтипами PDE. В настоящем изобретении также предусматривают фармацевтические композиции, содержащие соединения по изобретению, и способы лечения расстройств, используя соединения по изобретению. Предпосылки создания изобретения В описании данного изобретения вводятся ссылки на различные публикации во всей их полноте. Описания этих публикаций настоящим включаются путем ссылки в данное изобретение для более полного описания состояния области техники, к которой относится данное изобретение. Циклические нуклеотиды - циклический аденозинмонофосфат (цАМФ) (сАМР) и циклический гуанозинмонофосфат (цГМФ) (cGMP) - функционируют как внутриклеточные вторичные мессенджеры,регулируя большое количество процессов в нейронах. Внутриклеточные сАМР и cGMP генерируются аденил- и гуанилциклазами и подвергаются деградации под действием фосфодиэстераз (PDE) циклических нуклеотидов. Внутриклеточные уровни сАМР и cGMP контролируются внутриклеточной передачей сигнала; и стимуляция/подавление аденил- и гуанилциклаз в ответ на активацию GPCR (рецепторов, сопряженных с белками), является четко охарактеризованным путем регуляции концентраций циклических нуклеотидов (Antoni, F.A. Front. Neuroendocrinol. 2000, 21, 103-132). Уровни сАМР и cGMP, в свою очередь, контролируют активность сАМР- и cGMP-зависимых киназ так же, как и других белков с элементами ответа циклических нуклеотидов, которые через последующее фосфорилирование белков и другие процессы регулируют ключевые нейрональные функции, такие как синаптическая передача, нейрональная дифференцировка и выживание. Существует 21 ген фосфодиэстераз, которые могут быть разделены на 11 семейств генов. Существует десять семейств аденилилциклаз, два семейства гуанилилциклаз и одиннадцать семейств фосфодиэстераз. PDE представляют собой класс внутриклеточных ферментов, которые регулируют уровни сАМР и cGMP посредством гидролиза циклических нуклеотидов, превращая их в соответствующие нуклеотидмонофосфаты. Некоторые PDE подвергают деградации сАМР, некоторые - cGMP и некоторые -обеих. Большинство PDE имеет широко распространенную экспрессию и имеет свои роли во многих тканях,тогда как некоторые являются более тканеспецифичными. Фосфодиэстераза 10 А (PDE10A) представляет собой фосфодиэстеразу двойной специфичности, которая способна преобразовывать как сАМР в AMP, так и cGMP в GMP (Loughney, K. et al. Gene 1999,234, 109-117; Fujishige, K. et al. Eur. J. Biochem. 1999, 266, 1118-1127 and Soderling, S. et al. Proc. Natl.Acad. Sci. 1999, 96, 7071-7076). PDE10A экспрессируется, главным образом, в нейронах в полосатом теле, прилегающем ядре и обонятельном бугорке (Kotera, J. et al. Biochem. Biophys. Res. Comm. 1999, 261,551-557; Seeger, T.F. et al. Brain Research, 2003, 985, 113-126). Мышиная PDE10A представляет собой первый индентифицированный член PDE10 семейства фосфодиэстераз (Fujishige, K. et al. J. Biol. Chem. 1999, 274, 18438-18445, и Loughney, K. et al. Gene 1999, 234,109-117). Были идентифицированы варианты N-концевого сплайсинга и крысиных, и человеческих генов(Kotera, J. et al. Biochem. Biophys. Res. Comm. 1999, 261, 551-557, и Fujishige, K. et al. Eur. J. Biochem. 1999, 266, 1118-1127). Существует высокая степень межвидовой гомологичности. По сравнению с другими семействами PDE, единственно PDE10A локализована у млекопитающих. мРНК PDE10 высоко экспрессируется в мужской половой железе и мозге (Fujishige, K. et al. Eur J. Biochem. 1999, 266, 11181127; Soderling, S. et al. Proc. Natl. Acad. Sci. 1999, 96, 7071-7076, и Loughney, K. et al. Gene 1999, 234,109117). Эти исследования показывают, что внутри мозга экспрессия PDE10 является наиболее высокой в стриатуме (хвостатом ядре и скорлупе), прилегающем ядре и обонятельном бугорке. Недавно было проведено исследование образца экспрессии в мозгу грызуна мРНК PDE10A (Seeger, T.F. et al. Abst. Soc.Neurosci. 2000, 26, 345.10) и белка PDE10A (Menniti, F.S. et al. William Harvey-Research Conference "Phosphodiesterase in Health and Disease", Porto, Portugal, Dec. 5-7, 2001). Высокий уровень PDE10A экспрессируется в шиповидных нейронах среднего размера (MSN) хвостатого ядра, прилегающего ядра и соответствующих нейронах обонятельного бугорка. Они составляют центр системы базальных ганглиев. MSN играет ключевую роль в корково-базально-ганглионарном таламокортикальном цикле (или петле), интегрируя в одно целое информацию, сходящуюся на таламокортикальном входе, и отправляя эту интегрированную информацию обратно в кору головного мозга.MSN экспрессирует два функциональных класса нейронов: D1 класс, экспрессирующий D1 дофаминовые рецепторы, и D2 класс, экспрессирующий D2 дофаминовые рецепторы. D1 класс нейронов является частью "прямого" стриарного пути выхода, который, в общих чертах, функционирует для облегчения психологической поведенческой ответной реакции. D2 класс нейронов является частью "непрямого" пути выхода, который функционирует для подавления поведенческой ответной реакции, которая конкурирует с теми ответными реакциями, которым способствует "прямой" путь. Эти конкурирующие пути действуют аналогично тормозному устройству и акселератору в автомобиле. При простейшем подходе недостаток движения при болезни Паркинсона является результатом переизбытка активности "непрямого" пути,-1 021415 тогда как избыточность движения при таком расстройстве, как болезнь Гентингтона, указывает на гиперактивность прямого пути. PDE10A регуляция сАМР и/или cGMP сигналинга в дендритической зоне этих нейронов может быть включена в фильтрацию информации таламо-кортикального входа в MSN. Более того, PDE10A может быть включена в регуляцию высвобождения GABA (гамма-аминомасляной кислоты (ГАМК в черной субстанции и бледном шаре (Seeger, T.F. et al. Brain Research, 2003, 985, 113126). Антагонизм дофаминового D2 рецептора надежно установлен при лечении шизофрении. С 1950-х гг. антагонизм дофаминового D2 рецептора служил основой лечения психозов, и все эффективные антипсихотические лекарственные средства являются антагонистами D2 рецепторов. Воздействия D2, вероятно, опосредованы, главным образом, нейронами стриатума, прилегающего ядра и обонятельного бугорка,так как эти области получают наиболее плотные дофаминергические проекции и имеют наиболее сильную экспрессию D2 рецепторов (Konradi, С. and Heckers, S. Society of Biological Psychiatry, 2001, 50, 729742). Агонизм дофаминового D2 рецептора ведет к уменьшению сАМР уровней в клетках, где он экспрессируется, вследствие ингибирования аденилатциклазы, и это является компонентом D2 сигналингаTransduction 2004, 24, 165-205). Напротив, антагонизм D2 рецептора эффективно увеличивает сАМР уровни, и этот эффект можно было бы имитировать посредством ингибирования фосфодиэстераз, подвергающих деградации сАМР. Из 21 гена фосфодиэстераз большая часть широко экспрессируется, поэтому ингибирование, вероятно, имеет побочные эффекты. В этой связи, так как PDE10A имеет требуемый профиль экспрессии с высокой и относительно специфической экспрессией в нейронах стриатума прилегающего ядра и обонятельного бугорка, то, по-видимому, ингибирование PDE10A производит эффект, аналогичный эффекту антагонизма D2 рецептора, вследствие чего обладает антипсихотическим воздействием. Хотя полагают, что ингибирование PDE10A частично имитирует антагонизм D2 рецептора, можно было бы предположить, что оно имеет отличающийся профиль. Рецептор D2 имеет компоненты сигналинга, кроме сАМР (Neve, K.A. et al. Journal of Receptors and Signal Transduction 2004, 24, 165-205). По этой причине вмешательство cAMP при помощи ингибирования PDE10A может негативно корректировать, а не является прямым антагонистом дофаминового сигналинга через D2 рецепторы. Это может снизить риск экстрапирамидных побочных эффектов, которые наблюдают при сильном D2 антагонизме. Напротив, ингибирование PDE10A может оказывать некоторые воздействия, не наблюдаемые при антагонизме D2 рецептора. PDE10A экспрессируется также в стриарных нейронах, экспрессирующих D1 рецепторы (Seeger, T.F. et al. Brain Research, 2003, 985, 113-126). Так как агонизм D1 рецептора ведет к стимулированию аденилатциклазы, что приводит к увеличению уровней сАМР, то ингибирование PDE10A,также, вероятно, производит эффект, который имитирует агонизм D1 рецептора. В заключение, ингибирование PDE10A будет не только увеличивать уровни сАМР в клетках, но, предположительно, увеличивать также cGMP уровни, так как PDE10A представляет собой фосфодиэстеразу двойственной специфичности. cGMP активирует некоторые белки-мишени в таких клетках, как сАМР и также взаимодействует с путями сАМР - сигналинга. В заключение, ингибирование PDE10A, вероятно, частично имитирует антагонизм D2 рецептора и поэтому обладает антипсихотическим эффектом, но с профилем, возможно,отличающимся от профиля, наблюдаемого с классическими антагонистами D2 рецептора. Показано, что папаверин, являющийся ингибитором PDE10A, является активным в некоторых антипсихотических моделях. Папаверин потенцировал у крыс каталепсический эффект антагониста D2 рецептора, галоперидола, но не вызывал каталепсию сам по себе (WO 03/093499). Папаверин снижал гиперактивность, индуцированную РСР, у крыс, тогда как снижение гиперактивности, индуцированной амфетамином, было незначительным (WO 03/093499). Предполагают, что ингибирование PDE10A обладает классическим антипсихотическим потенциалом для этих моделей, что можно было бы предсказать, исходя из теоретических соображений. В патенте WO 03/093499 дополнительно описывают использование селективных ингибиторов PDE10 для лечения ассоциированных неврологических и психиатрических расстройств. Более того, ингибирование PDE10A возвращает в прежнее состояние подострый индуцированный РСР (фенциклидином) дефицит регуляции переключения внимания у крыс (Rodefer et al. Eur. J.Neurosci. 2005, 4, 1070-1076). Предполагают, что для этой модели ингибирование PDE10A могло бы смягчить когнитивную недостаточность, обусловленную шизофренией. Распределение PDE10A в тканях указывает на то, что ингибиторы PDE10A могут быть использованы для повышения уровней сАМР и/или cGMP внутри клеток, которые экспрессируют фермент PDE10,особенно нейроны, которые включают базальные ганглии. Поэтому ингибиторы PDE10A по настоящему изобретению могли бы оказаться пригодными для лечения множества ассоциированных нейропсихиатрических расстройств, включающих базальные ганглии, таких как неврологические и психиатрические расстройства, шизофрения, биполярное расстройство, обессивно-компульсивное расстройство и т.п. Они могут обладать таким преимуществом, как отсутствие нежелательных побочных эффектов вследствие применения доступных современных видов терапии. Более того, в недавних публикациях (WO 2005/120514, WO 2005012485, Cantin et al., Bioorganic пригодными для лечения тучности и инсулинорезистентного сахарного диабета. Что касается ингибиторов PDE10A, то в патенте ЕР 1250923 в общем описывают использование селективных ингибиторов PDE10 и папаверина, в частности, для лечения некоторых неврологических и психиатрических расстройств. В патенте WO 05/113517 описывают стереоспецифические соединения бензодиазепина, как ингибиторы фосфодиэстеразы, в основном типов 2 и 4, а также предотвращение и лечение патологий, включающих центральное и/или периферическое расстройство. В WO 02/88096 описывают производные бензодиазепина как ингибиторы фосфодиэстеразы, в особенности типа 4, и их использование в сфере терапии. В WO 04/41258 описывают производные бензодиазепинона и их использование в сфере терапии в качестве ингибиторов фосфодиэстеразы, особенно типа 2. Пирролодигидроизохинолины и их варианты описаны как ингибиторы PDE10 в патентах WO 05/03129 и WO 05/02579. Пиперидинилзамещенные хиназолины и изохинолины, которые служат как ингибиторы PDE10, описаны в WO 05/82883. В WO 06/11040 описаны соединения замещенного хиназолина и изохинолина, которые служат как ингибиторы PDE10. В US 20050182079 описывают замещенные тетрагидроизохинолинилпроизводные хиназолина и изохинолина, которые служат эффективными ингибиторами фосфодиэстеразы (PDE). В частности, патент US 20050182079 относится к указанным соединениям, которые являются селективными ингибиторами PDE10. Аналогично, в US 20060019975 описывают пиперидиновые производные хиназолина и изохинолина, которые служат эффективными ингибиторами фосфодиэстеразы (PDE). Патент US 20060019975 также относится к соединениям, которые являются селективными ингибиторами PDE10. В патенте WO 06/028957 описывают производные циннолина как ингибиторы фосфодиэстеразы типа 10 для лечения психиатрического и неврологического синдромов. Однако эти сообщения не имеют отношения к соединениям по настоящему изобретению и структурно не являются родственными любому из известных PDE10 ингибиторов (Kehler, J. et al. Expert Opin.Then Patents 2007, 17, 147-158, и Kehler, J. et al. Expert Opin. Ther. Patents 2009, 19, 1715-1725). И, как было обнаружено авторами настоящего изобретения, которые являются чрезвычайно активными и селективными ингибиторами фермента PDE10A. Соединения по изобретению могут быть предложены как альтернатива современным методам, доступным на медицинском рынке, которые не являются эффективными для всех пациентов, нуждающихся в лечении нейродегенеративных и/или психиатрических расстройств. Следовательно, остается потребность в альтернативных способах лечения. Сущность изобретения Целью настоящего изобретения является получение соединений, которые являются селективными ингибиторами фермента PDE10A. Дополнительной целью настоящего изобретения является получение соединений, которые обладают такой активностью и которые обладают улучшенной растворимостью, метаболической стабильностью и/или биодоступностью по сравнению с соединениями известного уровня техники. Еще одной целью изобретения является обеспечение эффективным лечением, в частности, длительным лечением человека (больного), не вызывая при этом побочных эффектов, обычно сопутствующих современному лечению неврологических и психиатрический расстройств. Другие цели изобретения будут очевидны при прочтении настоящего описания изобретения. Соответственно, один аспект настоящего изобретения относится к соединениям формулы I где НЕТ-1 представляет собой гетероароматическую группу формулы II, содержащую от 2 до 4 атомов азота где Y может представлять собой N или СН; Z может быть атомом N или С, и где НЕТ-1 необязательно может быть замещен несколькими заместителями, R7, R8 и R9 в количестве от одного до трех,индивидуально выбираемыми из Н; C1-C6-алкила, такого как Me; галогена, такого как хлор и бром; циано; галоген (C1-C6)алкила, такого как трифторметил; арила, такого как фенил; алкокси, такого как метокси, диметокси, этокси, метоксиэтокси и этоксиметокси; и C1-C6-гидроксиалкила, такого как СН 2 СН 2 ОН; символопределяет место присоединения;R1 выбирают из Н; C1-C6-алкила, такого как метил, этил, 1-пропил, 2-пропил, изобутил; C1-C6 алкил(C3-C8)циклоалкила, такого как циклопропилметил; C1-C6-гидроксиалкила, такого как гидроксиэтил; CH2CN; CH2C(O)NH2; C1-C6-арилалкила, такого как бензил и 4-хлорбензил; и C1-C6-3 021415Q представляет собой фенил, необязательно замещенный 1, 2 или тремя заместителями, или Q представляет собой моноциклическую 5-членную или 6-членную гетероароматическую группу, содержащую 1 или 2 гетероатома; предпочтительно, когда Q выбирают из структур нижеследующих формул,где символ обозначает место присоединения: где R2-R6, каждый независимо, выбирают из Н; C1-C6-алкокси, такого как метокси; и галогена, такого как хлор или фтор; их таутомерам и фармацевтически приемлемым солям и их полиморфным формам. В отдельных вариантах осуществления изобретения соединение формулы I выбирают из конкретных соединений, описанных здесь в экспериментальной части. В изобретении дополнительно предлагают соединение формулы I или его фармацевтически приемлемую соль для применения в качестве лекарственного средства. Еще один аспект настоящего изобретения представляет фармацевтическую композицию, содержащую терапевтически эффективное количество соединения формулы I и фармацевтически приемлемый носитель, разбавитель или эксципиент. В изобретении дополнительно предлагают применение соединения формулы I или его фармацевтически приемлемой соли для получения лекарственного средства для лечения нейродегенеративных или психиатрических расстройств. Более того, по еще одному аспекту в настоящем изобретении предлагают способ лечения субъекта,страдающего нейродегенеративным расстройством, включающий введение субъекту терапевтически эффективного количества соединения формулы I. Согласно еще одному аспекту в настоящем изобретении предлагают способ лечения субъекта, страдающего психиатрическим расстройством, который включает введение субъекту терапевтически эффективного количества соединения формулы I. В еще одном варианте осуществления изобретения предлагают способ лечения субъекта, страдающего от лекарственной аддикции, такой как алкогольная, амфетаминовая, кокаиновая или опиатная аддикция. Подробное описание изобретения Описание заместителей. Применяемые в контексте настоящего изобретения термины "гало" и "галоген" используют как взаимозаменяемые, и они относятся к фтору, хлору, брому или йоду. Термин "C1-C6-алкил" обозначает насыщенный углеводород с прямой или разветвленной цепью,имеющий от одного до шести атомов углерода включительно. Примеры таких групп включают, кроме прочих, метил, этил, 1-пропил, 2-пропил, 1-бутил, 2-бутил, 2-метил-2-пропил, 2-метил-1-бутил и нгексил. Выражение "C1-C6-гидроксиалкил" относится к C1-C6-алкильной группе, определенной выше,которая замещена одной гидроксигруппой. Термин "галоген(C1-C6)алкил" обозначает C1-C6-алкильную группу, определенную выше, которая замещена 1-3 атомами галогена, такую как трифторметил. Выражение "C1-C6-алкокси" обозначает насыщенную алкоксигруппу с прямой или разветвленной цепью, имеющую от одного до шести атомов углерода, включительно, со свободной валентностью на кислороде. Примеры таких групп включают, кроме прочих, метокси, этокси, н-бутокси, 2-метилпентокси и н-гексилокси. Термин "C3-C8-циклоалкил" обычно относится к циклопропилу, циклобутилу, циклопентилу, циклогексилу, циклогептилу или циклооктилу. Выражение "C1-C6-алкил(C3-C8)циклоалкил" обозначает C3C8-циклоалкил, определенный выше, который замещен C1-C6-алкилом с прямой или разветвленной цепью. Примеры таких групп включают, кроме прочих, циклопропилметил. Термин "гетероциклоалкил" обозначает четырех-восьмичленный цикл, содержащий атомы углерода и до трех атомов N, О или S, при условии, что четырех-восьмичленный цикл не содержит соседних атомов О или соседних атомов S. Свободная валентность находится или на гетероатоме, или на атоме углерода. Примеры таких групп включают, кроме прочих, азетидинил, оксетанил, пиперазинил, морфолинил,тиоморфолинил и [1,4]диазепанил. Термин "гидроксигетероциклоалкил" обозначает гетероциклоалкил,-4 021415 определенный выше, который замещен одной гидроксигруппой. Термин "C1-C6-алкилгетероциклоалкил" относится к гетероциклоалкилу, определенному выше, замещенному C1-C6-алкильной группой. Примеры таких групп включают, кроме прочих, тетрагидропиран-4-илметил 2-морфолин-4-илэтил. Термин "арил" обозначает фенильный цикл, необязательно замещенный галогеном, C1-C6-алкилом,C1-C6-алкокси или галоген(C1-C6)алкилом, определенными выше. Примеры таких групп включают, кроме прочих, фенил и 4-хлорфенил. Термин "C1-C6-арилалкил" обозначают арил, определенный выше, который замещен C1-C6-алкилом с прямой или разветвленной цепью. Примеры таких групп включают, кроме прочих, бензил и 4 хлорбензил. В дополнение, в настоящем изобретении дополнительно представляют некоторые варианты осуществления изобретения, которые описаны ниже. В одном варианте осуществления изобретения НЕТ-1 представляет собой гетероароматическую группу формулы II, содержащую 2 атома азота. В еще одном варианте осуществления изобретения НЕТ 1 представляет собой гетероароматическую группу формулы II, содержащую 3 атома азота. И в еще одном варианте осуществления изобретения НЕТ-1 представляет собой гетероароматический группу формулы II, содержащую 4 атома азота. НЕТ-1 предпочтительно выбирают из нижеследующих гетероароматических групп, в которых символ обозначает место присоединения: В дополнительном варианте осуществления изобретения один или несколько из атомов водорода соединения формулы I были замещены дейтерием. В частности, водород был замещен дейтерием, когдаR7-R9 представляют собой метил или метокси. В отдельных вариантах осуществления изобретения соединение формулы I выбирают из нижеследующих конкретных соединений, в форме свободного основания, одного или нескольких его таутомеров,или в виде его фармацевтически приемлемой соли. В таблице перечислены соединения по изобретению и соответствующие величины IC50, определенные как описано в разделе "Исследование PDE10A ингибирования". Каждое из соединений составляет отдельный вариант осуществления настоящего изобретения. Следует понимать, что различные аспекты изобретения, варианты осуществления изобретения, варианты внедрения и свойства изобретения, упомянутые здесь, могут быть заявлены по отдельности или в любой комбинации, как проиллюстрируют нижеследующие примеры, не вводящие каких-либо ограничений. Соединения по изобретению и величины IC50 В конкретном варианте осуществления изобретения соединения по настоящему изобретению имеют величину IC50 менее чем 50 нМ, такую как 0,2-20 нМ, в частности 0,2-10 нМ, такую как 0,2-5 нМ или 0,2-1 нМ. Фармацевтически приемлемые соли. Настоящее изобретение также включает соли соединений, обычно фармацевтически приемлемые соли. Такие соли включают фармацевтически приемлемые кислотно-аддитивные соли. Кислотноаддитивные соли включают соли как неорганических кислот, так и органических кислот. Характерные примеры пригодных неорганических кислот включают хлористо-водородную, бромисто-водородную, йодисто-водородную, фосфорную, серную, сульфаминовую, азотную кислоты и т.п. Характерные примеры пригодных органических кислот включают муравьиную, уксусную, трихлоруксусную, трифторуксусную, пропионовую, бензойную, коричную, лимонную, фумаровую, гликолевую,итаконовую, молочную, метансульфоновую, малеиновую, яблочную, малоновую, миндальную, щавелевую, пикриновую, пировиноградную, салициловую, сукциновую, метансульфоновую, этансульфоновую,винную, аскорбиновую, памовую, бисметиленсалициловую, этандисульфоновую, глюконовую, цитраконовую, аспарагиновую, стеариновую, пальмитиновую, ЭДТА (EDTA), гликолевую, п-аминобензойную,глютаминовую, бензолсульфоновую, п-толуолсульфокислоты, теофиллинуксусную кислоты, а также 8 галогентеофиллины, например 8-бромтеофиллин, и т.п. Дополнительные примеры фармацевтически приемлемых неорганических или органических кислотно-аддитивных солей включают фармацевтически приемлемые соли, перечисленные в Berge, S.M. et al., J. Pharm. Sci. 1977, 66, 2, содержание которого включено здесь путем ссылки. Более того, соединения по настоящему изобретению могут находиться в несольватированных, а также в сольватированных формах с фармацевтически приемлемыми растворителями, такими как вода,этанол и т.п. Вообще, для целей настоящего изобретения сольватированные формы рассматривают как эквивалентные несольватированным формам. Фармацевтические композиции. В настоящем изобретении, кроме того, предлагают фармацевтическую композицию, содержащую терапевтически эффективное количество соединения формулы I и фармацевтически приемлемый носитель или разбавитель. В настоящем изобретении предусматривают также фармацевтическую композицию, содержащую терапевтически эффективное количество одного из конкретных соединений, описанных здесь в "Экспериментальном разделе", и фармацевтически приемлемый носитель или разбавитель. Соединения по изобретению могут быть введены отдельно сами по себе или в комбинации с фармацевтически приемлемых носителями, разбавителями или эксципиентами, или в единичной дозе, или в множественных дозах. Фармацевтические композиции по изобретению могут быть составлены с использованием фармацевтически приемлемых носителей или разбавителей, а также любых других известных вспомогательных средств и эксципиентов, в соответствии с общепринятыми методами, такими как методы, описанные в Remington: The Science and Practice of Pharmacy, 19th Edition, Gennaro, Ed., Mack Publishing Co., Easton, PA, 1995. Фармацевтические композиции могут быть специально составлены для введения посредством любого подходящего пути введения, такого как оральный, ректальный, назальный, пульмональный, местный (включая буккальный и сублингвальный), трансдермальный, интрацистернальный, внутрибрюшинный, вагинальный и парентеральный (включая подкожный, внутримышечный, интратекальный, внутривенный и интрадермальный) пути. Будет понятно, что пути введения будут зависеть от общего состояния и возраста больного, подлежащего лечению, природы состояния, подвергаемого лечению, и активного компонента. Фармацевтические композиции для орального введения включают твердые дозированные формы,такие как капсулы, таблетки, драже, пилюли, пастилки, порошки и гранулы. Там, где необходимо, композиции могут быть получены в оболочках, таких как энтеросолюбильные покрытия, или же они могут быть разработаны таким образом, чтобы обеспечить контролируемое высвобождение активного ингредиента, такое как замедленное или пролонгированное высвобождение, в соответствии со способами, хорошо известными в данной области техники. Жидкие дозированные формы для орального введения включают растворы, эмульсии, суспензии, сиропы и эликсиры. Фармацевтические композиции для парентерального введения включают стерильные водные и неводные инъецируемые растворы, дисперсии,суспензии или эмульсии, а также стерильные порошки для восстановления перед использованием в стерильные инъецируемые растворы или дисперсии. Другие формы, пригодные для введения, включают,кроме прочих, суппозитории, аэрозоли, мази, кремы, гели, средства для ингаляции, дермальные пластыри и импланты. Обычные оральные дозировки находятся в диапазоне от приблизительно 0,001 до приблизительно 100 мг/кг массы тела в день. Обычные оральные дозировки также попадают в диапазон от приблизительно 0,01 до приблизительно 50 мг/кг массы тела в день. Обычные оральные дозировки дополнительно попадают в интервал от приблизительно 0,05 до приблизительно 10 мг/кг массы тела в день. Оральные дозировки обычно вводят в одной или в нескольких дозах, обычно, от одной до трех доз в день. Точная доза будет зависеть от частоты и способа введения, пола, возраста, массы тела и общего состояния больного, подлежащего лечению, природы и тяжести состояния, подвергаемого лечению, и любых сопутствующих заболеваний, требующих лечения, а также других факторов, очевидных специалистам в данной области техники. Препараты также могут быть представлены в единичной дозированной форме с помощью способов,известных специалистам в данной области техники. В целях иллюстрации: единичная дозированная форма, предназначенная для орального введения, может содержать от приблизительно 0,01 до приблизительно 1000 мг, от приблизительно 0,05 до приблизительно 500 мг или от приблизительно 0,5 до приблизительно 200 мг. Для парентеральных путей введения, таких как внутривенный, интратекальный, внутримышечный пути введения и подобные пути введения, обычные дозы по порядку величины составляют половину дозы, применяемой при оральном введении. В настоящем изобретении также предлагают способ получения фармацевтической композиции,включающий смешение терапевтически эффективного количества соединения формулы I и по меньшей мере одного фармацевтически приемлемого носителя или разбавителя. В одном варианте осуществления настоящего изобретения соединение, используемое в указанном выше способе, является одним из конкретных соединений, описанных здесь в "Экспериментальном разделе". Соединения по изобретению обычно используют в виде свободного химического вещества или в виде его фармацевтически приемлемой соли. Один пример представляет собой кислотно-аддитивную соль соединения, имеющую полезность свободного основания. Когда соединение формулы I содержит свободное основание, такие соли получают общепринятым способом, обрабатывая раствор или суспензию свободного основания формулы I молярным эквивалентом фармацевтически приемлемой кислоты. Характерные примеры пригодных органических и неорганических кислот описаны выше. Для парентерального введения могут быть использованы растворы соединения формулы I в стерильном водном растворе, водном пропиленгликоле, водном витамине Е или в кунжутном или арахисо-8 021415 вом масле. В такие водные растворы следует, при необходимости, добавлять соответствующий буфер, и жидкий разбавитель, сначала доведенный до изотонического состояния добавлением достаточного количества физиологического раствора или глюкозы. Водные растворы особенно пригодны для внутривенного, внутримышечного, подкожного и внутрибрюшинного введений. Соединения формулы I могут быть легко включены в состав известных стерильных водных сред, используя стандартные методики, известные специалистам в данной области техники. Пригодные фармацевтические носители включают инертные твердые разбавители или наполнители, стерильные водные растворы и различные органические растворители. Примеры твердых носителей включают лактозу, фарфоровую глину, сахарозу, циклодекстрин, тальк, желатин, агар, пектин, гуммиарабик, стеарат магния, стеариновую кислоту и низшие алкиловые простые эфиры целлюлозы. Примеры жидких носителей включают, кроме прочих, очищенную патоку, арахисовое масло, оливковое масло,фосфолипиды, жирные кислоты, амины жирных кислот, полиоксиэтилен и воду. Аналогично, носитель или разбавитель может содержать любое вещество с пролонгированным высвобождением, известное в данной области техники, такое как глицерилмоностеарат или глицерилдистеарат, отдельно само по себе или смешанное с воском. Фармацевтические композиции, образованные путем объединения соединений формулы I и фармацевтически приемлемого носителя, затем легко вводят в виде разных дозированных форм, применимых для описанных путей введения. Препараты могут быть легко получены в единичной дозированной форме способами, известными в данной области фармации. Препараты по настоящему изобретению, пригодные для орального введения, могут быть представлены в виде таких дискретных единиц, как капсулы или таблетки, при этом каждая содержит заранее определенное количество активного ингредиента и, необязательно, подходящий эксципиент. Более того,препараты, пригодные для орального введения, могут находиться в виде порошка или гранул, раствора или суспензии в водной или неводной жидкости, или жидкой эмульсии масла в воде или воды в масле. Если для орального введения используют твердый носитель, то препарат может быть таблетирован,помещен в виде порошка или пилюли в твердую желатиновую капсулу или он может находиться в форме пастилки или леденца. Количество твердого носителя будет колебаться в широких пределах, но будет находиться в диапазоне от приблизительно 25 мг до приблизительно 1 г на единицу дозы. Если используют жидкий носитель, препарат может находиться в виде сиропа, эмульсии, мягкой желатиновой капсулы или стерильной инъецируемой жидкости, такой как водная или неводная жидкая суспензия или раствор. Фармацевтические композиции по изобретению могут быть получены способами, общепринятыми в данной области техники. Например, таблетки могут быть получены путем смешения активного ингредиента с обычными вспомогательными средствами и/или разбавителями; затем, чтобы получить таблетки, смесь прессуют в обычной машине для таблетирования. Примеры вспомогательных средств или разбавителей включают: кукурузный крахмал, картофельный крахмал, тальк, стеарат магния, желатин, лактозу, смолы и т.п. Могут быть использованы любые другие вспомогательные средства или добавки,обычно используемые для этих целей, такие как красители, корригенты, консерванты и т.д., при условии,что они совместимы с активными ингредиентами. Терапевтически эффективное количество. В настоящем контексте термин "терапевтически эффективное количество" соединения обозначает количество соединения, которое является достаточным для лечения, облегчения или частичной приостановки клинических проявлений данного заболевания и его осложнений, возникающих при терапевтическом воздействии, включающем введение указанного соединения. Количество, адекватное достижению указанного, определяют как "терапевтически эффективное количество". Количества, эффективные для каждого случая лечения, будут зависеть от тяжести заболевания или повреждения, а также массы тела и общего состояния пациента. Следует понимать, что установление адекватной дозы может быть достигнуто, посредством стандартного экспериментирования, составляя таблицу значений, и проводя тестирование по разным точкам этой таблицы. Все это вполне соответствует обычным профессиональным навыкам опытного врача. В данном контексте термины "лечение" и "лечить" означают оказание помощи и лечения пациенту с целью борьбы с таким состоянием, как заболевание или расстройство. Термин предназначен для включения полного спектра вариантов лечения данного состояния, которым страдает пациент, таких как введение активного соединения для ослабления симптомов или осложнений, чтобы задержать развитие болезни, расстройства или состояния, ослабить или облегчить симптомы и осложнения, и/или чтобы излечить или устранить само заболевание, расстройство или состояние, а также предупредить состояние, при котором "предупреждение" следует понимать как оказание помощи и лечения пациенту с целью борьбы с заболеванием, состоянием или расстройством и включает введение активного соединения для предотвращения возникновения симптомов или осложнений. Однако профилактические (превентивные) и терапевтические (целебные) виды лечения представляют собой два отдельных аспекта данного изобретения. Пациент, подлежащий лечению, предпочтительно представляет собой млекопитающее, в частности человека. Лечение расстройств. Как указано выше, соединения формулы I представляют собой ингибиторы фермента PDE10A и как таковые являются пригодными для лечения ассоциированных неврологических и психиатрических расстройств. В изобретении, таким образом, предлагают соединение формулы I или его фармацевтически приемлемую кислотно-аддитивную соль, а также фармацевтическую композицию, содержащую такое соединение, которые предназначаются для применения при лечении нейродегенеративного расстройства, психиатрического расстройства или лекарственной аддикции у млекопитающих, включая людей; где нейродегенеративное расстройство выбирают из группы, состоящей из болезни Альцгеймера, мультиинфарктной деменции, алкогольной деменции или деменции, связанной с другими лекарственными (наркотическими) средствами, деменции, обусловленной внутричерепными опухолями или черепно-мозговой травмой, деменции, связанной с болезнью Гентингтона или болезнью Паркинсона, или деменции, связанной со СПИДом (AIDS); делириозного синдрома; амнестического расстройства; посттравматического стрессового расстройства; олигофрении; нарушения учебных навыков, например, нарушения чтения, нарушения усвоения математических навыков или нарушения навыков письма; синдрома дефицита внимания и гиперактивности и старческого снижения когнитивных функций, где психиатрическое расстройство выбирают из группы, состоящей из шизофрении, например, параноидального, дезорганизованного, кататонического, недифференцированного или остаточного типов; шизофреноформного расстройства; шизоаффективного расстройства, например, бредового типа или депрессивного типа; бредового расстройства; психотического расстройства, вызванного психоактивными веществами, например, психоза, индуцированного спиртом, амфетамином, марихуаной, кокаином, галлюциногенами, средствами для ингаляции,синтетическими наркотическими препаратами, или фенциклидином; изменения личности по параноидальному типу; и изменения личности по шизоидному типу; и где лекарственная аддикция представляет собой алкогольную, амфетаминовую, кокаиновую или опиатную аддикцию. Соединения формулы I или их фармацевтически приемлемые соли могут быть использованы в комбинации с одним или несколькими другими лекарственными средствами. Это возможно при лечении таких болезней или состояний, для которых лечение соединениями по настоящему изобретению будет эффективным, когда совместная комбинация лекарственных средств является более безопасной или более эффективной, чем любое из двух лекарственных средств, примененных отдельно. В дополнение, соединения по настоящему изобретению могут быть использованы в комбинации с одним или несколькими другими лекарственными средствами, которые лечат, предотвращают, регулируют, улучшают или снижают риск побочных эффектов или же токсичность соединения по настоящему изобретению. Такие дополнительные лекарственные средства могут быть введены обычно используемыми путями и в обычно используемых количествах и, следовательно, одновременно или последовательно с соединениями по настоящему изобретению. Соответственно, фармацевтические композиции по настоящему изобретению включают такие соединения, которые содержат один или несколько других активных ингредиентов, в дополнение к соединениям по настоящему изобретению. Комбинации можно вводить как часть комбинированного продукта в единичной дозированной форме; или вводить как набор, или вводить, согласно схеме лечения, указанной в лечебном протоколе, по которой одно или несколько дополнительных лекарственных средств вводят в виде отдельных доз. В настоящем изобретении предлагают способ лечения млекопитающих, включая человека, страдающих нейродегенеративным расстройством, выбираемым из расстройства когнитивной способности или расстройства движения. Этот способ включает введение пациенту терапевтически эффективного количества соединения формулы I. В настоящем изобретении дополнительно предлагают способ лечения нейродегенеративного расстройства или состояния у млекопитающих, включая человека. Этот способ включает введение указанному млекопитающему эффективного для ингибирования PDE10 количества соединения формулы I. В настоящем изобретении также предлагают способ лечения пациента, страдающего психиатрическим расстройством. Этот способ включает введение пациенту терапевтически эффективного количества соединения формулы I. Примеры психиатрических расстройств, которые можно подвергать лечению по настоящему изобретению, включают, кроме прочих, шизофрению, например параноидального, дезорганизованного, кататонического, недифференцированного или остаточного типов; шизофреноформное расстройство; шизоаффективное расстройство, например бредового типа или депрессивного типа; бредовое расстройство; психотическое расстройство, вызванное психоактивными веществами, например психоз, индуцируемый спиртом, амфетамином, марихуаной, кокаином, галлюциногенами, средствами для ингаляции, синтетическими наркотическими препаратами или фенциклидином; изменение личности параноидального типа и изменение личности шизоидного типа; и тревожное расстройство, которое выбирают из панического расстройства, агорафобии, специфической фобии, социофобии, обсессивнокомпульсивного расстройства, посттравматического стрессового расстройства, острого стрессового расстройства, генерализованного тревожного расстройства. Было обнаружено, что соединения формулы I или их фармацевтически приемлемые соли преимущественно могут быть введены в комбинации по меньшей мере с одним нейролептическим средством(которое может быть типичным или атипичным антипсихотическим средством), чтобы обеспечить улучшенный вариант лечения психиатрических расстройств, таких как шизофрения. Комбинации, применения и способы лечения по изобретению могут также обеспечить преимущества при лечении пациентов, которые не способны проявлять адекватную ответную реакции на лечение или которые демонстрируют резистентность к другим известным вариантам лечения. Таким образом, в настоящем изобретении предлагают способ лечения млекопитающего, страдающего таким психиатрическим расстройством, как шизофрения. Этот способ включает введение млекопитающему терапевтически эффективного количества соединения формулы I, или отдельно, или в виде комбинированной терапии совместно по меньшей мере с одним нейролептическим средством. Термин "нейролептическое средство", используемый здесь, обозначает лекарственные средства, которые воздействуют на когнитивную способность; и поведение лекарственных средств, содержащих антипсихотическое средство, которые уменьшают спутанность сознания, бред, галлюцинации и психомоторное возбуждение у пациентов, страдающих психозами. Нейролептические средства, известные также как основные транквилизаторы и антипсихотические лекарственные средства, включают, кроме прочих,типичные антипсихотические лекарственные средства, включающие фенотиазины, дополнительно разделяемые на алифатические соединения, пиперидины и пиперазины, тиоксантены (например, цисординол), бутирофеноны (например, галоперидол), дибензоксазепины (например, локсапин), дигидроиндолоны (например, молиндон), дифенилбутилпиперидины (например, пимозид), и атипичные антипсихотические лекарственные средства, включая бнзиоксазолы (например, рисперидон), сертиндол, оланзапин,кветиапин, осанетант и зипрасидон. В частности, предпочтительными нейролептическими средствами для применения по изобретению представляют собой сертиндол, оланзапин, рисперидон, кветиапин, арипипразол, галоперидол, клозапин,зипрасидон и осанетант. В настоящем изобретении дополнительно представляют способ лечения пациента, страдающего когнитивным расстройством. Этот способ включает введение пациенту терапевтически эффективного количества соединения формулы I. Примеры когнитивных расстройств, которые могут подлежать лечению по настоящему изобретению, включают, кроме прочих, болезнь Альцгеймера, мультиинфарктную деменцию, алкогольную деменцию или деменцию, связанную с другими лекарственными (наркотическими) средствами, деменцию, обусловленную внутричерепными опухолями или черепно-мозговой травмой, деменцию, связанную с болезнью Гентингтона или болезнью Паркинсона, или деменцию, связанную со СПИДом; делириозный синдром; амнестическое расстройство; посттравматическое стрессовое расстройство; олигофрению; нарушение учебных навыков, например, нарушение навыков чтения, нарушение усвоения математических навыков или нарушение навыков письма; синдром дефицита внимания и гиперактивность и старческое снижение когнитивных функций. В настоящем изобретении также предлагают способ лечения нарушения движений. Этот способ включает введение пациенту терапевтически эффективного количества соединения формулы I. Примеры нарушения движений, которые могут подлежать лечению по настоящему изобретению, включают, кроме прочих, болезнь Гентингтона и дискинезию, обусловленному терапией агонистом дофамина. В этом изобретении дополнительно предусмотрен способ лечения нарушения движений, выбираемых из болезни Паркинсона и синдрома усталых ног, который включает введение пациенту терапевтически эффективного количества соединения формулы I. В настоящем изобретении также предлагают способ лечения расстройства настроения. Этот способ включает введение пациенту терапевтически эффективного количества соединения формулы I. Примеры расстройств настроения и приступов депрессии, которые можно подвергать лечению по настоящему изобретению, включают, кроме прочих, большой депрессивный эпизод, легкого, умеренного или тяжелого типа, эпизод маниакальной депрессии или состояний смешанной депрессии, эпизод гипоманиакального настроения; депрессивный эпизод с типичными проявлениями; депрессивный эпизод с симптомами меланхолии; депрессивный эпизод с кататоническими проявлениями; приступ послеродовой депрессии; постинсультную депрессию; депрессивный эпизод тяжелой степени; дистимическое расстройство; слабое депрессивное расстройство; пременструальное дисфорическое расстройство; постпсихотическое депрессивное расстройство при шизофрении; депрессивный эпизод тяжелой степени, наложившийся на такое психотическое расстройство, как бредовое расстройство или шизофрения; биполярное расстройство, например биполярное расстройство-I, биполярное расстройство-II, и циклотимическое расстройство. Понятно, что расстройство настроения представляет собой психиатрическое расстройство. В настоящем изобретении дополнительно представляют способ лечения лекарственной аддикции,например, алкогольной, амфетаминовой, кокаиновой или опиатной аддикции, у млекопитающего, включая человека. Этот способ включает введение указанному млекопитающему эффективного количества соединения формулы I для лечения лекарственной аддикции. В этом изобретении также предлагают способ лечения лекарственной аддикции, например алкогольной, амфетаминовой, кокаиновой или опиатной аддикции, у млекопитающего, включая человека. Этот способ включает введение указанному млекопитающему количество соединение формулы I, эффективное для ингибирования PDE10. Термин "лекарственная аддикция", используемый здесь, означает патологическую потребность в лекарственном средстве, обычно характеризуемую мотивационным возбуждением, а именно принуждением к получению желаемого лекарственного средства и эпизодами интенсивного добывания лекарственного средства. Лекарственная аддикция представляет собой широко обсуждаемое патологическое состояние. Аддикция включает прогрессирование в использовании неотложного лекарственного средства до развития поведения, обусловленного поиском лекарственного средства, уязвимостью по отношению к рецидиву, и сниженную, замедленную способность ответа на естественно поощрительные стимулы. Например, в руководстве "The Diagnostic and Statistical Manual of Mental Disorders, Fourth Edition (DSM-IV)" классифицировали три стадии аддикции: поглощенность/предвкушение, празднество/интоксикация и прекращение приема/негативная эмоциональная реакция. Эти стадии везде характеризуются, соответственно, постоянными поглощенностью и стремлением к получению вещества; использованием большего количества вещества, чем это необходимо, чтобы ощутить эффект одурманивания; и испытанием привыкания,симптомов при воздержании и уменьшенную мотивацию для активности в нормальной жизни. В настоящем изобретении дополнительно предлагают способ лечения расстройства, включающего симптом дефицита внимания и/или когнитивной способности у млекопитающего, включая человека. Этот способ включает введение указанному млекопитающему эффективного количества соединения формулы I для лечения указанного расстройства. Другие расстройства, которые можно лечить по настоящему изобретению, представляют собой обсессивно-компульсивные расстройства, синдром Жиль де ля Туретта и другие тиковые расстройства. Используемый здесь термин "нейродегенеративное расстройство или состояние" обозначает, пока не оговорено иначе, расстройство или состояние, которое вызвано дисфункцией и/или гибелью нейронов центральной нервной системы. Лечение этих расстройств и состояний можно облегчить введением агента, который препятствует дисфункции или гибели нейронов повышенного риска при таких расстройствах или состояниях, и/или улучшает функционирование поврежденных и здоровых нейронов таким образом,чтобы они компенсировали потерю функций, вызванную дисфункцией или гибелью нейронов риска. Термин "нейротрофический агент" используемый здесь, обозначает вещество или агента, который обладает некоторыми или всеми из этих свойств. Примеры нейродегенеративных расстройств или состояний, которые можно лечить по настоящему изобретению, включают, кроме прочих, болезнь Паркинсона; болезнь Гентингтона; деменцию, например болезнь Альцгеймера, мультиинфарктную деменцию, СПИД-ассоциированную деменцию, и фронтотемпоральную деменцю; нейродегенерацию, обусловленную черепно-мозговой травмой; нейродегенерацию, связанную с ударом, нейродегенерацию, обусловленную инсультом; нейродегенерацию, индуцированную гипогликемией; нейродегенерацию, связанную с эпилептическим приступом; нейродегенерацию,связанную с нейротоксиновой интоксикацией; и мультисистемную атрофию. В одном варианте осуществления настоящего изобретения нейродегенеративное расстройство или состояние включает нейродегенерацию стриарных шиповидных нейронов среднего размера у млекопитающего, включая человека. В дальнейшем варианте осуществления настоящего изобретения нейродегенеративное расстройство или состояние представляет собой болезнь Гентингтона. В еще одном варианте осуществления изобретения предлагают способ лечения пациента для снижения тучности тела или массы тела, или лечения инсулин-независимого сахарного диабета (NIDDM),метаболического синдрома или толерантность глюкозы, включающий введение терапевтически эффективного количество соединения формулы I пациенту, которому это необходимо. В предпочтительных вариантах осуществления изобретения пациент представляет собой человека; пациент имеет избыточную массу или страдает ожирением, и ему антагонист вводят орально. В еще одном предпочтительном варианте осуществления изобретения способ дополнительно включает введение пациенту второго терапевтического агента, предпочтительно, агента антитучности, например, римонабанта, орлистата, сибутрамина,бромокриптина, эфедрина, лептина, псевдоэфедрина или пептида YY3-36, или их аналогов. Термин "метаболический синдром", используемый здесь, обозначает совокупность состояний,вследствие которых людей, ввиду заболевания коронарной артерии, относят к высокой зоне риска. Эти состояния включают сахарный диабет 2-го типа, тучность, высокое кровяное давление и плохой липидный профиль с повышенным уровнем LDL ("плохого") холестерина, низким уровнем HDL ("хорошего") холестерина и повышенными уровнями триглицеридов. Все эти состояния связаны с высокими уровнями инсулина в крови. Основным нарушением при метаболическом синдроме является инсулинорезистентность как в жировой, так и в мышечной ткани. Все ссылки, включая публикации, заявки на патент и цитируемые здесь патенты, тем самым включены здесь во всей полноте в виде ссылки. Эти ссылки включены в такой же степени, как если бы каждая ссылка была индивидуально и конкретно изложена здесь и указана как "включенная здесь во всей полноте в виде ссылки" (в максимальной степени, допускаемой законом). Заголовки и подзаголовки использованы здесь только для удобства и их не следует рассматривать каким-либо образом ограничивающими изобретение. Использование любого из примеров и всех примеров или иллюстративных оборотов (включающих обороты "например", "как таковой") в настоящем описании изобретения предназначены только для лучшего освещения изобретения и не ограничивают рамки изобретения, если не указано противоположное. Цитирование и включение патентных документов здесь выполнено только в целях удобства, а не отражает представления об обоснованности, патентоспособности и/или обеспеченности правовой санкцией таких патентных документов. Настоящее изобретение включает все модификации и эквиваленты существа изобретения, излагаемого в прилагаемой к описанию формуле изобретения, что соответствует допускаемой правовой норме. Раскрытое здесь изобретение иллюстрируют далее с помощью нижеследующих примеров, не вносящих дополнительных ограничений. Экспериментальный раздел Основные способы. Аналитические данные ЖХ/МС получали, используя один из нижеследующих способов. Способ А. Использовали прибор РЕ Sciex API 150EX, оснащенный фотоионизацией при атмосферном давлении и системой ЖХ Shimadzu LC-8A/SLC-10A. Колонка размером 4,630 мм фирмы Waters с сорбентомSymmetry C18 с размером частиц 3,5 мкм; температура колонки: 60 С; система растворителя: А представляет собой смесь вода/трифторуксусная кислота (100:0,05), и В представляет собой смесь вода/ацетонитрил/трифторуксусная кислота (5:95:0,035); способ: линейное градиентное элюирование составом А:В, при соотношениях А:В в течение 2,4 мин от 90:10 до 0:100 и при скорости потока 3,3 мл/мин. Способ В. Использовали прибор РЕ Sciex API 300, оснащенный фотоионизацией при атмосферном давлении,системы UPLC фирмы Waters. Колонка (Acquity UPLC ВЕН) размером 2,150 мм (фирма Waters); с наполнителем C18 с размером частиц 1,7 мкм; температура колонки: 60C; система растворителей: А представляет собой смесь вода/трифторуксусная кислота (100:0,05), и В представляет собой смесь вода/ацетонитрил/трифторуксусная кислота (5:95:0,035); способ: линейное градиентное элюирование составом А:В при соотношениях А: В в течение 1,0 мин от 90:10 до 0:100 и при скорости потока 1,2 мл/мин. Способ С. Использовали прибор РЕ Sciex API 150EX, оснащенный фотоионизацией при атмосферном давлении и системой ЖХ Shimadzu LC-8A/SLC-10A. Колонка размером 4,630 мм фирмы Waters с сорбентомSymmetry C18 с размером частиц 3,5 мкм; температура колонки: 60C; система растворителей: А представляет собой смесь вода/трифторуксусная кислота (99,95:0,05), и В представляет собой смесь метанол/трифторуксусная кислота (99,965:0,035); способ: линейное градиентное элюирование составом А:В при соотношениях А:В в течение 2,4 мин от 83:17 до 0:100 при скорости потока 3,0 мл/мин. Препаративную ЖХ/МС-очистку осуществляли на РЕ Sciex API 150 ЕХ приборе с химической ионизацией при атмосферном давлении. Колонка фирмы YMC ODS-A размером 5020 мм с размером частиц 5 мкм; способ: линейное градиентное элюирование составом А:В при соотношениях А:В в течение 7 мин от 80:20 до 0:100 и при скорости потока 22,7 мл/мин. Сбор фракций осуществляли при МС детектировании расщепленного потока. Спектры 1 Н-ЯМР регистрировали на спектрометре Bruker Avance AV500 с частотой 500,13 МГц или на спектрометре Bruker Avance DPX250 с частотой 250,13 МГц. В качестве внутреннего эталона сравнения использовали TMS (тетраметилсилан). Величины химических сдвигов выражают в м.д. Нижеследующие сокращения используют для обозначения мультиплетности ЯМР сигналов: с = синглет, д = дублет, т = триплет, к = квартет, кви = киинтет, г = гептет, дд = двойной дублет, дт = двойной триплет,дк = двойной квартет, тт = триплет триплетов, м = мультиплет, ш.с. = широкий синглет и ш = широкий сигнал. Аббревиатура соответствует сокращениям, приведенным в ACS - руководстве по стилю аббревиатуры: "The ACS Styleguide - А manual for authors and editors", Janet S. Dodd, Ed. 1997, ISBN: 0841234620. Основные соединения. п-Толуолсульфонилгидразид (98%) был получен от фирмы Avocado. 2-Фенил-1 Н-имидазол-4-карбальдегид был получен от фирмы ASDI. Получение соединений по изобретению Соединения общей формулы I по изобретению могут быть получены, как показано на нижеследующих реакционных схемах. Пока не указано иначе, в данных реакционных схемах и последующей дискуссии символы НЕТ-1, R1-R9, -L-, Z и Y являются такими же, как определено выше. Соединения формулы I, где -L- представляет собой -S-CH2-, могут быть получены сочетанием нуклеофила формулы V или Va с электрофилом формулы VI, где X представляет собой уходящую группу,например Cl, Br, I, метансульфонил, 4-толуолсульфонил, как показано на схеме 1. При реакции между Va и VI, алкилирование атома серы соединения Va соединением VI и замыкание цикла с образованием конденсированного бициклического триазольного цикла, протекают в одинаковых реакционных условиях, в процессе, протекающем в одном сосуде. Схема 1 Эту реакцию обычно осуществляют в таком растворителе, как 1-пропанол, толуол, ДМФА (ДМФА) или ацетонитрил, необязательно в присутствии основания в виде карбоната, такого как карбонат калия,или основания третичного амина, такого как триэтиламин или диизопропилэтиламин (DIPEA), при температуре в интервале от приблизительно 0 до приблизительно 200C, необязательно под давлением в закрытом сосуде. Другие пригодные растворители включают бензол, хлороформ, диоксан, этилацетат, 2 пропанол и ксилол. Альтернативно, можно использовать смеси растворителей, таких как смесь толуол/2 пропанол. Соединения формулы V являются или коммерчески доступными, или могут быть получены, как описано в литературе, см., например, Brown et al. Aust. J. Chem. 1978, 31, 397-404; Yutilov et al. Khim.Chem. Soc. 2005, 49, 288-291. Соединения формулы Va могут быть получены, как описано в WO 96/01826, из соответствующих 1,2-диаминопиридинов взаимодействием с тиокарбонилдиимидазолом в подходящем растворителе, таком как хлороформ, при подходящей температуре, такой как комнатная температура или 40C. Требуемые 1,2-диаминопиридины легко получают из соответствующих коммерчески доступных 2-аминопиридинов путем взаимодействия с соответствующим реагентом Nаминирования, таким как О-(мезитилсульфонил)гидроксиламин, в пригодном растворителе, таком как хлороформ, при подходящей температуре, такой как 0C или комнатная температура, см. WO 96/01826. 2-Галогенметил-4-(арил)-1 Н-триазолы формулы VI могут быть получены галогенированием соответствующих (2-арил-1 Н-имидазол-4-ил)метанолов или (2-гетероарил-1 Н-имидазол-4-ил)метанолов, используя пригодный реагент, например тионилхлорид, трихлорид фосфора или трибромид фосфора, необязательно используя пригодный растворитель, такой как дихлорметан, используя способы, хорошо известный химикам-профессионалам в данной области техники. Требуемые (2-арил-1 Н-имидазол-4 ил)метанолы могут быть получены способами, известными в данной области техники (см., например,Journal of Medicinal Chemistry 1986, 29(2), 261-267; WO-2005014588A1). Требуемые (2-арил-1 Нимидазол-4-ил)метанолы или (2-гетероарил-1 Н-имидазол-4-ил)метанолы также легко получить восстановлением альдегидов XV (см. схему 4, приведенную ниже) способами, известными химикампрофессионалам в данной области техники, например, взаимодействием альдегидов формулы XV с пригодным восстановителем, таким как борогидрид натрия, в пригодном растворителе, таком как ТГФ(THF) или метанол. Соединения формулы I, где -L- представляет -CH2-S-, могут быть получены сочетанием нуклеофила формулы XII с электрофилом формулы VIII, как показано на схеме 2. Эту реакция обычно проводят в растворителе, таком как 1-пропанол, толуол, ДМФА или ацетонитрил, необязательно в присутствии основания в виде карбоната, такого как карбонат калия, или основания третичного амина, такого как триэтиламин или диизопропилэтиламин (DIPEA), при температуре, находящейся в интервале от приблизительно 0C до приблизительно 200C, необязательно под давлением в закрытом сосуде. Другие пригодные растворители включают бензол, хлороформ, диоксан, этилацетат, 2 пропанол и ксилол. Альтернативно, могут быть использованы смеси растворителей, такие как смесь толуол/2-пропанол. Некоторые электрофилы формулы VIII коммерчески доступны, а многие другие известны в данной области техники, см., например, JP 59176277. Электрофил VIII, где X представляет собой уходящую группу, например Cl, Br, I, метансульфонил, 4-толуолсульфонил, также могут быть получены превращением первичного спирта соединений формулы VII в указанную уходящую группу с помощью способов,известных химикам-профессионалам в данной области техники. Указанные способы могут, например,быть выбраны из взаимодействия соединений формулы VII с тионилхлоридом, трихлоридом фосфора,трибромидом фосфора, метансульфонилхлоридом или 4-толуолсульфонилхлоридом, необязательно в присутствии пригодного растворителя, такого как дихлорметан или 1,2-дихлорэтан, и необязательно в присутствии основания, такого как триэтиламин, диизопропилэтиламин или пиридин. Альтернативно,электрофилы формулы VIII могут быть получены взаимодействием коммерчески доступных ароматических аминов формулы IX с 1,3-дигалогенацетонами формулы XI, например, 1,3-дихлорацетоном, в пригодном растворителе, таком как 1,2-диметоксиэтан или этанол, при подходящей температуре, такой как комнатная температура или температура флегмы. Некоторые электрофилы формулы VII являются коммерчески доступными, а многие другие известны в данной области техники, см., например, Tsuchiya, Т.;Pharm. Bull. 1983, 31, 4568-4572. Альтернативно, спирты формулы VII могут быть получены взаимодействием коммерчески доступных ароматических аминов формулы IX с пригодным реагентом Nаминирования, таким как О-(мезитилсульфонил)гидроксиламин, в пригодном растворителе, таком как хлороформ, при соответствующей температуре, такой как 0C или комнатная температура, см. WO 96/01826, чтобы на выходе получить соединения формулы X. Указанные соединения формулы X могут быть преобразованы в соединения формулы VII путем взаимодействия с метилгликолятом с последующим восстановлением метилового сложного эфира до требуемого спирта, используя пригодный восстановитель, такой как алюмогидрид лития, в пригодном растворителе, таком как диэтиловый эфир или тетрагидрофуран, используя способы, известные профессиональным химикам, работающим в данной области техники. Соединения формулы XII могут быть получены, как описано в литературе, см., например, Zoete,Vincent et al. Journal of the Chemical Society, Perkin Transactions 1: Organic and Bio-Organic Chemistry 1997,(20), 2983-2988. Соединения формулы I, где R1 не является водородом, могут быть получены алкилированием соединений формулы I, где R1 представляет собой водород, алкилгалогенидом формулы XIII, как показано на схеме 3. Схема 3 Эту реакцию обычно проводят в пригодном растворителе, таком как диметилформамид, диметилацетамид или ацетонитрил, в присутствии пригодного основания, такого как основание в виде карбоната,например, карбонат калия, или основание третичного амина, такого как триэтиламин или диизопропилэтиламин (DIPEA), при температуре в интервале от приблизительно 0 до приблизительно 100C. Соединения формулы I, где -L- представляет собой -СН=СН-или -СН 2-СН 2-, могут быть получены через последовательность реакций, показанных на схеме 4. Схема 4 В частности, соединения формулы I, где -L- является группой -СН 2-СН 2-, могут быть получены восстановлением алкена формулы I, в котором -L- является группой -СН=СН-, путем гидрогенизации, используя в качестве катализатора переходный металл, такой как металлический палладий, вместе с источником водорода, таким как газообразный водород, гидрокарбонат аммония или циклогексадиен. Указанные алкены формулы I, где -L- представляет собой группу -СН=СН-, могут быть получены по реакции Виттига между солью фосфония формулы XIV и альдегидом формулы XV в пригодном растворителе,таком как тетрагидрофуран, в присутствии пригодного основания, такого как 1,8 диазабицикло[5.4.0]ундец-7-ен. Фосфониевую соль формулы XIV легко получают путем взаимодействия соединений формулы VIII (см. схему 2, приведенную выше) с трифенилфосфином способами, известными химикам, являющимся профессионалами в данной области техники. Альдегиды формулы XV легко получают окислением спиртов формулы VII (см. схему 2, приведенную выше) способами, известными химикам, являющимися профессионалами в данной области техники, например, взаимодействием спиртов формулы VII с пригодным окислителем, таким как периодинан Десс-Мартина, в пригодном растворителе, таком как дихлорметан или 1,2-дихлорэтан. Или альдегиды формулы XV легко получают способами, описанными в литературе, см., например, Dhainaut, A. et al. Journal of Medicinal Chemistry, 2000, 43,2165-2175. Далее изобретение, описанное здесь, иллюстрируют нижеследующие примеры, которые не вносят в него дополнительных ограничений. Получение промежуточных соединений. Пример 1. 2-Тиофен-2-ил-1 Н-имидазол-4-карбальдегид При комнатной температуре (rt) добавляли 1,3-дигидрокси-2-пропанон (11,08 г, 123,0 ммоль) к перемешиваемому раствору 2-тиофенкарбоксамидина гидрохлорида в 12,4 М растворе аммиака в воде (200 мл). Раствор нагревали в течение 1 ч при температуре образования флегмы. Раствор охлаждали до комнатной температуры (rt) и экстрагировали EtOAc (2300 мл) и ТГФ (300 мл). Объединенные органические фазы промывали насыщенным солевым раствором (150 мл), сушили(Na2SO4) и упаривали в вакууме, чтобы получить 6,4 г неочищенного спирта, который очищали хроматографией на силикагеле (элюент: 10% МеОН в EtOAc). Выход: 2,00 г спирта, (2-тиофен-2-ил-1 Н-имидазол-4-ил)метанола. ТСХ: Rf приблизительно 0,1 в EtOAc. Периодинан Десс-Мартина (4,71 г, 11,1 ммоль) добавляли к перемешиваемой суспензии (2-тиофен 2-ил-1 Н-имидазол-4-ил)метанола (2,00 г, 11,1 ммоль), растворенного в метиленхлориде (111 мл) при комнатной температуре в атмосфере Ar. Смесь темнела, и ее перемешивали при комнатной температуре в течение ночи. Добавляли еще дихлорметан (ДХМ) (100 мл) и насыщенный раствор NaHCO3 (100 мл) и фазы разделяли после фильтрования для удаления некоторых твердых частиц. Органический слой наносили на силикагель и очищали хроматографией на силикагеле (элюент: 0-100% EtOAc в н-гептане). Выход: 0,57 г соединения, указанного в названии, в виде красного твердого вещества. ЖХ/МС: m/z=178,6 (MH+), tR=0,31 мин, способ С. Использовали модификацию способа, описанного в Baldwin et al. J. Med. Chem. 1975, 895 (стадию алкилирования осуществляли до восстановления с помощью DIBAL-H). При комнатной температуре добавляли 1,1-дибромтрифторацетон (26,24 г, 97,22 ммоль) к перемешиваемому раствору ацетата натрия (16,0 г, 194 ммоль) в воде (90 мл). Раствор кипятили с обратным холодильником в течение 30 мин и затем охлаждали до комнатной температуры. Охлажденный раствор добавляли к перемешиваемому раствору 2-формилтиазола (10,00 г, 88,39 ммоль) в метаноле (400 мл) и 12,4 М раствору аммиака в воде (100 мл). Раствор перемешивали, сохраняя комнатную температуру. Раствор упаривали, используя лабораторный роторный испаритель "Rotovap", до 190 мл, и добавляли воду(100 мл). Раствор выдерживали при 4C в течение 30 мин и получающееся оранжевое твердое вещество отфильтровывали. Оранжевое твердое вещество аккуратно нагревали в воде (приблизительно 100 мл) в течение 5 мин (не доводя до полного растворения). Цвет менялся до светло-коричневого. Твердое вещество отфильтровывали и сушили в вакууме, получая 6,50 г промежуточного 2-(4-трифторметил-1 Нимидазол-2-ил)тиазола. 1 Н-ЯМР (ДМСО-d6) аналогичен опубликованному спектру ЯМР (J. Med Chem(2000), 2165). 2-(4-Трифторметил-1 Н-имидазол-2-ил)тиазол (6,25 г, 28,5 ммоль) растворяли в метаноле (300 мл) и добавляли 12,4 М раствора аммиака в воде (40 мл) и воду (180 мл). Раствор нагревали при 60C в течение ночи. Добавляли еще 12 М раствора аммиака в воде (40 мл) и раствор нагревали при 70C в течение 5 ч. Реакционную смесь упаривали в лабораторном роторном испарителе "Rotovap" до меньшего объема. Выпадал желтый твердый осадок. Хранили при 4C в течение 2 ч. Желтый порошок отфильтровывали и сушили в вакууме. Выход 2-тиазол-2-ил-1 Н-имидазол-4-карбонитрила составлял 5,54 г неочищенного вещества. Метилиодид (4,06 г, 28,6 ммоль), растворенный в ДМФА (DMF) (8 мл), по каплям добавляли к перемешиваемому раствору 2-тиазол-2-ил-1 Н-имидазол-4-карбонитрила (5,31 г, 30,1 ммоль) и карбоната калия (4,58 г, 33,1 ммоль), растворенных в N,N-диметилформамиде (50 мл). Смесь перемешивали при 60C в течение 1 ч в атмосфере Ar. Большую часть ДМФА удаляли в вакууме и остаток распределяли между EtOAc (150 мл) и насыщенным солевым раствором (50 мл). Органическую фазу промывали добавочным количеством насыщенного солевого раствора и сушили (MgSO4). Раствор упаривали, используя лабораторный роторный испаритель "Rotovap", и неочищенный продукт очищали хроматографией на силикагеле (элюент: 20-50% EtOAc в н-гептане). Выход: 0,982 г желтого твердого вещества, 1-метил-2-тиазол-2-ил-1 Н-имидазол-4-карбонитрила. 1H-ЯМР (ДМСО-d6):8,35 (с, 1 Н), 8,03 (д, 1 Н), 7,92 (д, 1 Н), 4,10 (с, 3H). Добавляли 1,00 М раствор диизобутилалюминийгидрида в толуоле (7,73 мл) к перемешиваемому раствору 1-метил-2-тиазол-2-ил-1 Н-имидазол-4-карбонитрила (0,980 г, 5,15 ммоль), растворенного в сухом тетрагидрофуране (10 мл) при -78C в атмосфере Ar. Температуру медленно (в течение приблизительно 1 ч) поднимали до -40C. Охлаждающую баню удаляли и смесь гасили, добавляя МеОН (2,6 мл). Смесь упаривали на лабораторном роторном испарителе "Rotovap", и неочищенный продукт хроматографировали, используя силикагель (элюент: 0-30% МеОН в EtOAc), чтобы получить 0,321 г загрязненного примесями вещества. Вещество повторно очищали хроматографией на силикагеле (используяEtOAc в качестве элюента). Выход: 140 мг соединения, указанного в названии, в виде желтого твердого вещества. 1 Использовали способ, приведенный в Baldwin et al. J. Med. Chem. 1975, 895. Аналогично получают нижеследующие промежуточные соединения: 2-фуран-2-ил-1 Н-имидазол-4-карбальдегид При комнатной температуре метилйодид (477 мг, 3,36 ммоль), растворенный в ДМФА (0,5 мл), по каплям добавляли к перемешиваемому раствору 2-тиофен-2-ил-1 Н-имидазол-4-карбальдегида (0,57 г, 3,2 ммоль) и карбоната калия (0,48 6 г, 3,52 ммоль) в сухом N,N-диметилформамиде (6 мл). Раствор перемешивали при 70C в течение 3 ч. Большую часть ДМФА выпаривали и остаток распределяли междуEtOAc (50 мл) и насыщенным солевым раствором (25 мл). Фазы разделяли, органическую фазу сушили(Na2SO4) и растворитель выпаривали. Неочищенный продукт очищали хроматографией на силикагеле(элюент: 50-100% EtOAc в н-гептане). Выход: 211 мг соединения, указанного в названии, в виде масла. 1 Н-ЯМР (ДМСО-d6):9,71 (с, 1 Н), 7, 80 (с, 1 Н) 7,54 (м, 2 Н), 7,17 (м, 1 Н), 4,14 (с, 3H). ЖХ/МС: m/z=192,9 (MH+), tR=0,34 мин, способ С; (211 мг быстро вымывающегося изомера (3 метил-2-тиофен-2-ил-3H-имидазол-4-карбальдегида) отделяли и отбрасывали). Пример 5. 2-Хлорметил-5,7-диметил[1,2,4]триазоло[1,5-а]пиримидин К раствору 4,6-диметилпиримидин-2-иламина (25 г, 200 ммоль) в 400 мл CH2Cl2 при 0C по каплям добавляли раствор гидроксиламин-2,4,6-триметилбензолсульфоната (105 г, 488 ммоль) в 300 мл CH2Cl2,и смесь перемешивали при 0C в течение 1 ч и фильтровали. Собранное твердое вещество промывалиCH2Cl2 (100 мл), чтобы получить 1-амино-4,6-диметил-1 Н-пиримидин-2-илиденаммоний 2,4,6 триметилбензолсульфонат (40 г, выход 62%). Смесь 1-амино-4,6-диметил-1 Н-пиримидин-2-илиденаммоний 2,4,6-триметилбензолсульфоната (40 г, 0,1 моль) и NaOH (10 г, 0,2 моль) в 500 мл EtOH перемешивали при 50-60C в течение 1 ч. После добавления метилового эфира хлоруксусной кислоты (16,6 г, 0,15 моль) полученную смесь перемешивали при температуре образования флегмы в течение 4 ч. После концентрирования при пониженном давлении остаток разбавляли водой (1000 мл) и экстрагировали CH2Cl2 (300 мл 3). Объединенные органические слои промывали насыщенным солевым раствором (200 мл), сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали колоночной хроматографией на силикагеле (смесью петролейный эфир/EtOAc=2/1), получая 2 г 2-хлорметил-5,7-диметил[1,2,4]триазоло[1,5-а]пиримидина с выходом 9%. 1H-ЯМР (300 МГц, ДМСО-d6):8,55 (с, 1 Н), 6,25 (с, 2 Н), 4,05 (с, 3H), 3,95 (с, 3H). ЖХ/МС (МН+): m/z=196,9, tR=0,52 мин, способ А. Нижеследующие промежуточные соединения получали аналогичным образом. 7-Хлор-2-хлорметил-5,8-диметил[1,2,4]триазоло[1,5-с]пиримидин из 6-хлор-2,5 диметилпиримидин-4-иламина, полученного, как описано в Henze et al. J. Org. Chem 1952, 77, 1320-1327. Выход 3,2%; ЖХ/МС: m/z=231,5 (MH+), tR=1,13 мин, способ С. 2-Хлорметил-5,8-диметил[1,2,4]триазоло[1,5-а]пиразин - из 2-амино-3,6-диметилпиразина. Выход 60%, 1 Н-ЯМР (500 МГц, CDCl3):7,91 (с, 1 Н), 4,87 (с, 2 Н), 2,91 (с, 3H), 2,74 (с, 3H). ЖХ/МС: m/z=196,9m/z=197,8 (MH+), tR=0,40 мин, способ В. 2-Хлорметил-8-этил-5-метил[1,2,4]триазоло[1,5-а]пиридин - из 2-амино-3-этил-6-метилпиридина; ЖХ/МС: m/z=209,8 (MH+), tR=0, 60 мин, способ В. Нижеследующие соединения являются известными в данной области техники: 2-хлорметил-1-фенил-1 Н-бензоимидазол (JP 59176277); 1-метил-1,3-дигидробензоимидазол-2-тион (Wilde et al. Bioorg. Med. Chem. Lett. 1995, 5, 167-172); 1-фенил-1,3-дигидробензоимидазол-2-тион (Kidwai et al. J. Korean Chem. Soc. 2005, 49, 288-291); Раствор 2-хлорметил-5,8-диметил[1,2,4]триазоло[1,5-а]пиразина (1,351 г, 6,87 ммоль) и трифенилфосфина (1,80 г, 6,87 ммоль) в ацетонитриле (150 мл) нагревали в течение 12 ч при температуре образования флегмы. Растворители удаляли в вакууме и остаток суспендировали в простом эфире, фильтровали и сушили, получая (5,8-диметил[1,2,4]триазоло[1,5-а]пиразин-2-илметил)трифенилфосфонийхлорид в виде не совсем белого твердого вещества (2,412 г, 74,9%). ЖХ/МС: m/z=423,2 ([M-CI]+), tR=0,86 мин, способ А. Нижеследующие промежуточные соединения получали аналогичным образом:(8-этил-5-метил[1,2,4]триазоло[1,5-а]пиридин-2-илметил)трифенилфосфонийхлорид из 2 хлорметил-8-этил-5-метил[1,2,4]триазоло[1,5-а]пиридина; ЖХ/МС: m/z=423,9 (MH+), tR=0,55 мин, способ В. Получение соединений по изобретению. Пример 7. 5,8-Диметил-2-[2-(2-фенил-1 Н-имидазол-4-ил)этил]-[1,2,4]триазоло[1,5-а]пиразин(5,8-диметил[1,2,4]триазоло[1,5-а]пиразин-2 илметил)трифенилфосфонийхлорида (0,27 г, 0,58 ммоль) и 2-фенил-1 Н-имидазол-4-карбальдегида (0,100 г, 0,581 ммоль) в сухом ТГФ (8 мл) добавляли 1,8-диазабицикло[5.4.0]ундец-7-ен (0,087 мл, 0,58 ммоль) и смесь перемешивали при комнатной температуре в атмосфере аргона в течение ночи. Некоторое количество твердого вещества отфильтровывали и растворитель удаляли в вакууме. Остатки растворяли в ДХМ и очищали хроматографией на силикагеле (элюент: 0-100% EtOAc в н-гептане). Выход: 97 мг промежуточного соединения в виде масла, представляющего собой смесь цис/транс-изомеров (53%). Это вещество (0,090 г, 0,28 ммоль) растворяли в ДМФА (8 мл) и добавляли птолуолсульфонилгидразид (0,16 г, 0,85 ммоль). Реакционную смесь перемешивали при 120C в течение 8 ч в атмосфере Ar. Раствор оставляли для достижения комнатной температуры и перемешивали на протяжении ночи. Добавляли еще п-толуолсульфонилгидразида (0,08 г) и в течение 6 ч реакционная смесь находилась при 120C в атмосфере Ar. ДМФА упаривали, и остаток растворяли в EtOAc (20 мл) и экстрагировали насыщенным раствором NaHCO3 (220 мл). Органическую фазу промывали насыщенным солевым раствором, сушили (MgSO4) и упаривали, используя лабораторный роторный испаритель "Rotovap". Неочищенный продукт очищали хроматографией на силикагеле (элюент: 0-100% EtOAc в н-гептане). Выход: 40 мг (40%) продукта в виде не совсем белого твердого вещества. ЖХ/МС: m/z=319,2 (МН+), tR=0, 63 мин, способ Е. 1 Н-ЯМР (600 МГц, CDCl3):7,90 (м, 3H), 7,43 (м, 2 Н), 7,35 (м, 1 Н), 6,96 (с, 1 Н), 3,40 (м, 2 Н), 3,22(м, 2 Н) 2,98 (с, 3H), 2,75 (с, 3H). Нижеследующие соединения получали аналогичным образом: 5,8-диметил-2-[2-(1-метил-2-фенил-1 Н-имидазол-4-ил)этил]-[1,2,4]триазоло[1,5-а]пиразин(0,109 мл, 0,72 ммоль); и смесь перемешивали при комнатной температуре в атмосфере аргона в течение 2 ч. Растворитель удаляли в вакууме. Остатки растворяли в ДХМ и очищали хроматографией на силикагеле (элюент: 0-10% МеОН в EtOAc). Выход: 102 мг (42%) смеси цис/транс промежуточных соединений в виде белого твердого вещества. Это вещество (102 мг, 0,30 ммоль) растворяли в ДХМ (5 мл) и МеОН (5 мл) и добавляли 10% Pd/C(35 мг), и в аппарате parr -shaker в течение ночи при давлении 1,8 бар осуществляли реакцию гидрирования. Катализатор отфильтровывали, и растворитель удаляли в вакууме. Неочищенный продукт очищали хроматографией на силикагеле (элюент: 0-10% МеОН в EtOAc). Выход: 80 мг (78%) продукта, указанного в названии, в виде не совсем белого твердого вещества. ЖХ/МС: m/z=339,9 (MH+), tR=0,35 мин, способ С. 1(м, 2 Н), 3,04 (м, 2 Н), 2,75 (с, 3H), 2,65 (с, 3H). Нижеследующие соединения получали аналогичным образом: 8-метокси-5-метил-2-[2-(2-фенил-1 Н-имидазол-4-ил)этил]-[1,2,4]триазоло[1,5-а]пиридин; ЖХ/МС: Метилйодид (0,035 мл, 0,57 ммоль) добавляли к перемешиваемой суспензии 8-метокси-5-метил-2[2-(2-фенил-1 Н-имидазол-4-ил)этил]-[1,2,4]триазоло[1,5-а]пиридина (145 мг, 0,435 ммоль) и Cs2CO3 (360 мг, 1,1 ммоль) в 2-бутаноне (10 мл). Смесь нагревали при 50C в течение 7 ч в атмосфере аргона. Смесь охлаждали до комнатной температуры и растворитель выпаривали. Неочищенный продукт растворяли в ДХМ и очищали хроматографией на силикагеле (элюент: 0-100% EtOAc в н-гептане, затем замененный на 0-5% МеОН в EtOAc). Выход: 31 мг (20%) соединения, указанного в названии, в виде не совсем белого твердого вещества. ЖХ/МС: m/z=348,2 (МН+), tR=0,70 мин, способ Е. Фармакологическое тестирование. Фермент PDE10A. Для использования в опытах по тестированию PDE активный фермент PDE10A получают рядом способов (Loughney, K. et al. Gene 1999, 234, 109-117; Fujishige, K. et al. Eur J. Biochem. 1999, 266, 11181127 and Soderling, S. et al. Proc. Natl. Acad. Sci. 1999, 96, 7071-7076). PDE10A может экспрессироваться как непроцессированные белки, так и как процессированные белки до тех пор, пока они экспрессируют каталитический домен. PDE10A может быть получена в клетках разных типов, например, в клетках насекомых или E.coli. Нижеследующий пример представляет собой способ получения каталитически активного PDE10A. Каталитический домен человеческого фермента PDE10A (аминокислоты 440-779 из последовательности с инвентарным номером NP 006652) амплифицируют из полного набора РНК всего головного мозга посредством стандартного метода RT-PCR (ОТ-ПЦР) и клонируют в сайты BamHI иXhol вектора рЕТ 28 а (Novagen). Экспрессию в coli осуществляли согласно стандартным протоколам. Вкратце, экспрессионные плазмиды трансформировали в BL21(DE3) штамм Е. coli, и 50 мл культур, в которые были инокулированы клетки, оставляли для выращивания до OD600 0,4-0,6 перед экспрессией белка, индуцированной 0,5 мМ IPTG. После индукции клетки инкубируют при комнатной температуре в течение ночи. Затем клетки собирают центрифугированием. Клетки, экспрессирующие PDE10A, суспендируют повторно в 12 мл состава: 50 мМ TRIS-HCl (рН 8,0), 1 мМ MgCl2 и ингибиторы протеазы. Клетки лизируют, обрабатывая ультразвуком и, после лизирования всех клеток, добавляют Triton X100, согласно протоколам Novagen. PDE10A частично очищают, используя Q сефарозу. Наиболее активные фракции объединяли. Результат исследования ингибирования PDE10A. Исследование PDE10A можно осуществлять, например, следующим образом. Тест осуществляют в 60 мкл образцов, содержащих фиксированное количество соответствующего фермента PDE (достаточное для преобразования 20-25% циклического нуклеотидного субстрата), буфер (50 мМ HEPES 7,6; 10 мМMgCl2; 0,02% Tween 20), 0,1 мг/мл BSA, 225 пКи (pCi) 3 Н-меченного циклического нуклеотидного субстрата, cAMP, меченный тритием (до конечной концентрации трития, составляющей 5 нМ), и варьируемое количество ингибиторов. Реакции инициировали добавлением циклического нуклеотидного субстрата. И реакции оставляли протекать в течение 1 ч при комнатной температуре, перед тем как остановить реакции посредством смешения с SPA микрошариками, объемом 15 мкл, из состава, содержащего силикат иттрия (8 мг/мл), (Amersham). Допустимо оставлять шарики в темноте на один час, перед тем как внести планшеты в счетчик Wallac 1450 Microbeta для выполнения расчетов. Измеряемый сигнал может быть преобразован в активность относительно неингибируемого контроля (100%), и величины IC50 можно рассчитать, используя программу EXCEL с расширением Xlfit. Гиперактивность, индуцируемая фенциклидином (РСР). Использовали мышиных самцов (NMRI, Charles River) массой 20-25 г. В каждой группе использовали восемь мышей, получающих тестируемое соединение (5 мг/кг) и РСР (2,3 мг/кг), включая параллельные контрольные группы, получающие носитель тестируемого соединения и РСР или только инъекции носителя. Объем инъекции составляет 10 мл/кг. Эксперимент осуществляют в условиях нормального освещения и удобного вольера. Тестируемое вещество инъецировали через рот за 60 мин до инъекции РСР, которую вводили подкожно. Сразу после инъекции РСР мышей индивидуально помещали в специально сконструированную клетку для тестирования (размером 2032 см). Активность измеряли с помощью источников инфракрасного излучения (58) и фотоэлементов, расположенных на расстоянии 4 см друг от друга. Световые пучки пересекали клетку на высоте 1,8 см от дна клетки. Для регистрирования счета подвижности требуется временное прерывание соседних лучей света, чтобы таким образом избежать отсчетов, вызываемых стационарными движениями мышей. Подвижность регистрируют с 5-минутными интервалами на протяжении 1 ч. Воздействие лекарственного средства рассчитывают по суммарным отсчетам, выполняемым в течение 1 ч поведенческого тестирования, следующим образом. Усредненную подвижность, индуцируемую лечением одним носителем в отсутствие РСР, используют как базовую линию. 100% эффект действия РСР соответственно вычисляют как суммарные отсчеты подвижности за вычетом базовой линии. Ответную реакцию в группах, в которых мышам вводят тестируемое соединение, определяют, соответственно, как суммарные отсчеты подвижности за вычетом базовой линии, выраженные в процентах от аналогичного результата, зарегистрированного для параллельной контрольной РСР группы. Процент ответных реакций преобразуют в процент ингибирования. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединение, имеющее структуру I где НЕТ-1 представляет собой гетероароматическую группу, выбранную из группы, включающей[1,2,4]триазоло[1,5-а]пиридин и [1,2,4]триазоло[1,5-а]пиразин, и где НЕТ-1 необязательно может быть замещен 1-3 заместителями R7, R8 и R9, индивидуально выбираемыми из водорода, C1-C6-алкила и метокси; символобозначает место присоединения;Q выбран из группы, включающей фенил, тиазол, тиофен и фуран, необязательно замещенный метилом или фтором;R1 выбирают из Н и C1-C6-алкила; и его таутомеры и фармацевтически приемлемые соли при условии, что соединение не является 2(5-фенил-1 Н-имидазол-2-илметилсульфанил)-1 Н-бензоимидазолом или 2-(5-фенил-1 Н-имидазол-2 илсульфанилметил)-1 Н-бензоимидазолом. 2. Соединение по п.1, где НЕТ-1 представляет собой [1,2,4]триазоло[1,5-а]пиридиновую группу. 3. Соединение по п.1, где НЕТ-1 представляет собой [1,2,4]триазоло[1,5-а]пиразиновую группу. 4. Соединение по п.1 или 2, где все R7, R8 и R9 представляют собой водород. 5. Соединение по п.1 или 2, где по меньшей мере один из R7, R8 и R9 является метилом. 6. Соединение по п.1, где соединение выбирают из группы, состоящей из 5,8-диметил-2-[2-(2-фенил-1 Н-имидазол-4-ил)этил]-[1,2,4]триазоло[1,5-а]пиразина; 5,8-диметил-2-[2-(1-метил-2-фенил-1 Н-имидазол-4-ил)этил]-[1,2,4]триазоло[1,5-а]пиразина; 8-этил-5-метил-2-[2-(1-метил-2-фенил-1 Н-имидазол-4-ил)этил]-[1,2,4]триазоло[1,5-а]пиридина; 5,8-диметил-2-[2-(1-метил-2-тиофен-2-ил-1 Н-имидазол-4-ил)этил]-[1,2,4]триазоло[1,5-а]пиразина; 5,8-диметил-2-[2-(1-метил-2-тиазол-2-ил-1 Н-имидазол-4-ил)этил]-[1,2,4]триазоло[1,5-а]пиразина; 8-метокси-5-метил-2-[2-(2-фенил-1 Н-имидазол-4-ил)этил]-[1,2,4]триазоло[1,5-а]пиридина; 8-метокси-5-метил-2-[2-(1-метил-2-тиофен-2-ил-1 Н-имидазол-4-ил)этил]-[1,2,4]триазоло[1,5 а]пиридина; 8-метокси-5-метил-2-[2-(1-метил-2-фенил-1 Н-имидазол-4-ил)этил]-[1,2,4]триазоло[1,5-а]пиридина,и его фармацевтически приемлемые соли.
МПК / Метки
МПК: C07D 487/04, C07D 471/04, A61K 31/519, A61P 25/00
Метки: ингибиторов, 2-арилимидазола, pde10a, качестве, производные, фермента
Код ссылки
<a href="https://eas.patents.su/26-21415-proizvodnye-2-arilimidazola-v-kachestve-ingibitorov-fermenta-pde10a.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 2-арилимидазола в качестве ингибиторов фермента pde10a</a>
Предыдущий патент: Способ удаления и конденсации паров
Следующий патент: Вибрационная машина для изготовления прессованных изделий путем уплотнения
Случайный патент: Производные 3-азабицикло(3.1.0)гексана, обладающие сродством к опиодному рецептору












