Замещенные производные индазола, активные в качестве ингибиторов киназы
Номер патента: 23579
Опубликовано: 30.06.2016
Авторы: Донати Даниеле, Ломбарди Борджиа Андреа, Чиомеи Марина, Нези Марчелла
Формула / Реферат
1. Соединение формулы (I)
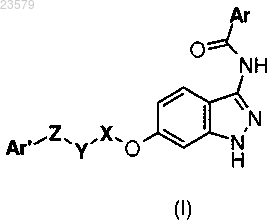
где Ar представляет собой группу, выбранную из
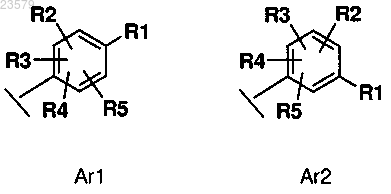
где R1 выбран из группы A, NR6R7, OR8 и 4-6-членного гетероциклила, где один или несколько атомов углерода замещены на N или О, необязательно замещенного C1-C6 алкилом, OR13, NR11R12, COR10, 5-членным гетероциклилом, где один или несколько атомов углерода замещены на N;
R2, R3, R4 и R5 независимо выбраны из водорода, галогена и 6-членного гетероциклила, где один или несколько атомов углерода замещены на N, необязательно замещенного C1-C6 алкилом;
где А представляет собой неразветвленный или разветвленный C1-C6 алкил, замещенный группой NR11R12;
R6 представляет собой водород или неразветвленный или разветвленный C1-C6 алкил, необязательно замещенный NR11R12, или 6-членный гетероциклил, где один или несколько атомов углерода замещены на N или О, необязательно замещенный C1-C6 алкилом;
R7 представляет собой водород, замещенный неразветвленный или разветвленный C1-C6 алкил или 6-членный гетероциклил, где один или несколько атомов углерода замещены на N или О, необязательно замещенный C1-C6 алкилом или OR13, или
R6 и R7, взятые вместе с атомом азота, с которым они связаны, могут образовывать 4-6-членную гетероциклильную группу, где один или несколько атомов углерода замещены на N, необязательно замещенную C1-C6 алкилом, OR13, NR11R12, COR10 или 5-членным гетероциклилом, где один или несколько атомов углерода замещены на N;
R8 представляет собой 6-членный гетероциклил, где один или несколько атомов углерода замещены на N, необязательно замещенный C1-C6 алкилом;
R10 представляет собой OR13;
R11 и R12 независимо представляют собой водород или неразветвленный или разветвленный C1-C6 алкил;
R13 представляет собой водород, неразветвленный или разветвленный C1-C6 алкил или 6-членный арил;
X представляет собой связь или группу, выбранную из неразветвленного или разветвленного C1-C6 алкила, 6-членного гетероциклила, где один или несколько атомов углерода замещены на N, и фенила, необязательно замещенного галогеном, фенилом, OR13 или C1-C6 алкилом, замещенным фенилом;
Y представляет собой связь, кислород или группу, выбранную из неразветвленного или разветвленного C1-C6 алкила, неразветвленного или разветвленного C2-C6 алкенила, неразветвленного или разветвленного C2-C6 алкинила и 5-членного гетероциклила, где один или несколько атомов углерода замещены на N, необязательно замещенного фенилом или C1-C6 алкилом, необязательно замещенным фенилом;
Z представляет собой связь, кислород или неразветвленный или разветвленный C1-C6 алкил, необязательно замещенный пиридинилом или фенилом, необязательно замещенным галогеном, OR13 или C1-C6 алкилом, замещенным галогеном;
Ar' представляет собой фенил или пиридинил, необязательно замещенный галогеном, OR13 или C1-C6 алкилом, замещенным галогеном;
или его фармацевтически приемлемая соль.
2. Соединение формулы (I) или его фармацевтически приемлемая соль по п.1, которое выбирают из группы, состоящей из:
N-(6-бензилокси-1Н-индазол-3-ил)-4-(4-метилпиперазин-1-ил)бензамида,
4-(4-метилпиперазин-1-ил)-N-(6-фенокси-1Н-индазол-3-ил)бензамида,
N-[6-(3-фторфенокси)-1Н-индазол-3-ил]-4-(4-метилпиперазин-1-ил)бензамида,
N-[6-(4-бензилоксифенокси)-1Н-индазол-3-ил]-4-(4-метилпиперазин-1-ил)бензамида,
4-(4-метилпиперазин-1-ил)-N-[6-(3-феноксибензилокси)-1Н-индазол-3-ил]бензамида,
N-[6-(1-бензилпиперидин-4-илокси)-1Н-индазол-3-ил]-4- (4-метилпиперазин-1-ил)бензамида,
4-(4-метилпиперазин-1-ил)-N-[6-(3-фенилпроп-2-инилокси)-1Н-индазол-3-ил]бензамида,
4-(4-метилпиперазин-1-ил)-N-[6-(4-феноксифенокси)-1Н-индазол-3-ил]бензамида,
N-[6-(3-бензилоксифенокси)-1Н-индазол-3-ил]-4-(4-метилпиперазин-1-ил)бензамида,
4-(4-метилпиперазин-1-ил)-N-[6-(2-феноксиэтокси)-1Н-индазол-3-ил]бензамида,
N-[6-(2-бензилоксиэтокси)-1Н-индазол-3-ил]-4-(4-метилпиперазин-1-ил)бензамида,
N-[6-(1-бензилпиперидин-3-илокси)-1Н-индазол-3-ил]-4-(4-метилпиперазин-1-ил)бензамида,
N-[6-(1-бензилпирролидин-2-илметокси)-1Н-индазол-3-ил]-4-(4-метилпиперазин-1-ил)бензамида,
N-[6-(2-бензилоксиэтокси)-1H-индазол-3-ил]-4-(4-метил-4-оксипиперазин-1-ил)бензамида,
N-[6-(2-бензилоксиэтокси)-1Н-индазол-3-ил]-4-(4-диметиламинопиперидин-1-ил)бензамида,
N-[6-(2-бензилоксиэтокси)-1Н-индазол-3-ил]-4-[(2-диметиламиноэтил)метиламино]бензамида,
N-[6-(2-бензилоксиэтокси)-1Н-индазол-3-ил]-4-[(3-диметиламинопропил)метиламино]бензамида,
трет-бутилового эфира 4-{4-[6-(2-бензилоксиэтокси)-1Н-индазол-3-илкарбамоил]фенил}пиперазин-1-карбоновой кислоты,
N-[6-(2-бензилоксиэтокси)-1Н-индазол-3-ил]-4-(1-метилпиперидин-4-иламино)бензамида,
N-[6-(2-бензилоксиэтокси)-1Н-индазол-3-ил]-4-пиперазин-1-илбензамида,
N-[6-(2-бензилоксиэтокси)-1Н-индазол-3-ил]-4-диметиламинометилбензамида,
N-[6-(2-бензилоксиэтокси)-1Н-индазол-3-ил]-4-(1-метилпиперидин-4-илокси)бензамида,
N-[6-(2-бензилоксиэтокси)-1Н-индазол-3-ил]-4-[метил(1-метилпиперидин-4-ил)амино]бензамида,
N-[6-(2-бензилоксиэтокси)-1Н-индазол-3-ил]-4-морфолин-4-илбензамида,
N-[6-(2-бензилоксиэтокси)-1Н-индазол-3-ил]-4-(2-морфолин-4-илэтиламино)бензамида,
N-[6-(2-бензилоксиэтокси)-1Н-индазол-3-ил]-4-(тетрагидропиран-4-иламино)бензамида,
N-[6-(2-бензилоксиэтокси)-1Н-индазол-3-ил]-4-[(1-метилпиперидин-4-илметил)амино]бензамида,
N-[6-(2-бензилоксиэтокси)-1Н-индазол-3-ил]-4-(3-пирролидин-1-илазетидин-1-ил)бензамида,
N-[6-(2-бензилоксиэтокси)-1Н-индазол-3-ил]-3-(4-метилпиперазин-1-ил)бензамида,
N-{6-[2-(2-фторбензилокси)этокси]-1Н-индазол-3-ил}-4-(4-метилпиперазин-1-ил)бензамида,
N-{6-[2-(3-фторбензилокси)этокси]-1Н-индазол-3-ил}-4-(4-метилпиперазин-1-ил)бензамида,
N-{6-[2-(4-фторбензилокси)этокси]-1Н-индазол-3-ил}-4-(4-метилпиперазин-1-ил)бензамида,
4-(4-метилпиперазин-1-ил)-N-{6-[2-(4-трифторметилбензилокси)этокси]-1Н-индазол-3-ил}бензамида,
4-(4-метилпиперазин-1-ил)-N-{6-[2-(3-трифторметилбензилокси)этокси]-1Н-индазол-3-ил}бензамида,
4-(4-метилпиперазин-1-ил)-N-{6-[2-(пиридин-4-илметокси)этокси]-1Н-индазол-3-ил}бензамида,
4-(4-метилпиперазин-1-ил)-N-{6-[2-(пиридин-3-илметокси)этокси]-1Н-индазол-3-ил}бензамида,
4-(4-метилпиперазин-1-ил)-N-{6-[2-(пиридин-2-илметокси)этокси]-lH-индазол-3-ил}бензамида,
N-[6-(2-бензилоксиэтокси)-1Н-индазол-3-ил]-2-фтор-4-(4-метилпиперазин-1-ил)бензамида,
4-(4-метилпиперазин-1-ил)-N-[6-((Е)-3-фенилаллилокси)-1Н-индазол-3-ил]бензамида,
N-{6-[2-(4-метоксибензилокси)этокси]-1Н-индазол-3-ил}-4-(4-метилпиперазин-1-ил)бензамида,
N-[6-(2-бензилоксиэтокси)-1Н-индазол-3-ил]-4-[метил-(1-метил-1-оксипиперидин-4-ил)амино]бензамида,
4-(4-метил-4-оксипиперазин-1-ил)-N-{6-[2-(4-трифторметилбензилокси)этокси]-1Н-индазол-3-ил}бензамида и
N-[6-(2-бензилоксиэтокси)-1Н-индазол-3-ил]-2,4-бис-(4-метилпиперазин-1-ил)бензамида.
3. Способ получения соединения формулы (I) по п.1 или его фармацевтически приемлемой соли, отличающийся тем, что указанный способ включает следующую стадию:
L) ацилирование соединения формулы (XVI)
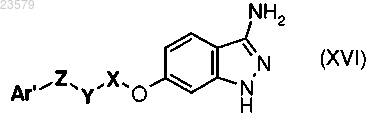
где Ar', X, Y и Z имеют значения, указанные в п.1, соединением формулы (V)
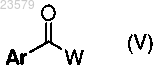
где Ar имеет значения, указанные в п.1, и W представляет собой гидрокси, галоген или подходящую уходящую группу; для получения соединения формулы (I), как определено выше;
необязательное разделение полученного соединения формулы (I) на отдельные изомеры.
4. Способ по п.3, отличающийся тем, что соединение формулы (XVI) по п.3 получают, используя следующие стадии:
J) сочетание соединения формулы (XIV)

альтернативно с
Ja) соединением формулы (VIII)
где Ar', Z и Y имеют значения, указанные в п.1, и X представляет собой группу, выбранную из разветвленного или неразветвленного C1-C6 алкила и 6-членного гетероциклила, где один или несколько атомов углерода замещены на N, необязательно замещенного галогеном, фенилом, OR13 или C1-C6 алкилом, замещенным фенилом;
или
Jb) соединением формулы (IX)
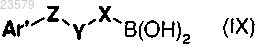
где Ar', Z и Y имеют значения, указанные в п.1, и X представляет собой фенил, необязательно замещенный галогеном, фенилом, OR13 или C1-C6 алкилом, замещенным фенилом, или где Ar' имеет значения, указанные в п.1, и X, Y и Z представляют собой связь;
или
Jc) соединением формулы (X)
где Ar', Z и Y имеют значения, указанные в п.1, X представляет собой группу, выбранную из неразветвленного или разветвленного C1-C6 алкила и 6-членного гетероциклила, где один или несколько атомов углерода замещены на N, необязательно замещенного галогеном, фенилом, OR13 или C1-C6 алкилом, замещенным фенилом, и L представляет собой подходящую уходящую группу, такую как галоген, метансульфонилокси, трифторметансульфонилокси или п-толуолсульфонилокси;
K) превращение полученного соединения формулы (XV)
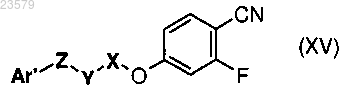
где Ar1, X, Y и Z имеют значения, указанные в п.1; для получения соединения формулы (XVI) по п.3.
5. In vitro способ ингибирования активности FLT3 или KIT протеинкиназ, который включает приведение в контакт указанного белка с эффективным количеством соединения формулы (I) по п.1.
6. Фармацевтическая композиция, включающая терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли по п.1 и по меньшей мере один фармацевтически приемлемый эксципиент, носитель и/или разбавитель.
7. Фармацевтическая композиция по п.6, которая дополнительно включает один или более из химиотерапевтических агентов.
8. Применение соединения формулы (I) или его фармацевтически приемлемой соли по п.1 при производстве лекарственного средства с противораковой активностью.
Текст
Изобретение относится к замещенным соединениям индазола, которые модулируют активность протеинкиназ и поэтому их можно использовать при лечении заболеваний, вызванных разрегулированием активности протеинкиназ, сходной с раковой. В настоящем изобретении также предложены способы получения указанных соединений, включающих указанные соединения фармацевтических композиций, и способы лечения заболеваний с использованием таких указанных соединений или содержащих их фармацевтических композиций.(71)(73) Заявитель и патентовладелец: НЕРВИАНО МЕДИКАЛ САЙЕНСИЗ С.Р.Л. (IT) Настоящее изобретение относится к определенным замещенным соединениям индазола, которые модулируют активность протеинкиназ. Поэтому соединения настоящего изобретения пригодны для лечения заболеваний, вызванных нарушенным регулированием активности протеинкиназ. В настоящем изобретении также предложены способы получения указанных соединений, фармацевтических композиций, включающих указанные соединения, и способы лечения заболеваний с использованием фармацевтических композиций, включающих указанные соединения. Недостаточное функционирование протеинкиназ (PK) является отличительным признаком многочисленных заболеваний. Значительная доля онкогенов и протоонкогенов, участвующих в раковых заболеваниях человека,кодируется PK. Повышенные активности PK также сопутствуют многим незлокачественным заболеваниям, таким как доброкачественная гиперплазия простаты, семейный аденоматоз, полипоз, нейрофиброматоз, псориаз, пролиферация гладких клеток сосудов, связанная с атеросклерозом, легочный фиброз, артрит, гломерулонефрит и послеоперационный стеноз и рестеноз.PK могут также играть важную роль в патогенезе и развитии нейродегенеративных нарушений. Относительно общих ссылок на недостаточное функционирование или разрегулирование PK см.,например, Current Opinion in Chemical Biology (1999) 3, 459-465; Cell (2000) 100, 113-127; Nature Rev.Drug Discov. (2002) 1, 309-315; и Carcinogenesis (2008) 29, 1087-191. Подмножество PK представляет собой группу мембранных рецепторов с внутренней протеинтирозин киназной активностью (RPTK). После связывания с факторами роста RPTK активируются и самофосфорилируются и фосфорилируют серию субстратов в цитоплазме. За счет указанного механизма они могут преобразовывать систему внутриклеточных сигналов для пролиферации, дифференцирования или других биологических изменений. Структурные аномалии, сверхэкспрессия и активация RTPK часто наблюдаются в человеческих опухолях, что предполагает, что конститутивное инициирование сигнальной трансдукции, приводящее к клеточной пролиферации, может вызвать злокачественные превращения.FMS-подобные тирозинкиназы 3(FLT3) и KIT обе являются членами семейства PDGFR класса III рецепторов тирозинкиназ, характеризующихся внеклеточным доменом с 5 иммуноглобулино-подобными петлями, трансмембранным участком и цитоплазмическим доменом, содержащим не только домен киназы (разделенный на два участка), но также автоингибиторный околомембранный (JM) домен, который стыкуется с доменом киназы для стабилизации каталитически неактивной конформации. Обычно FLT3 играют решающую роль в нормальном гематопоэзе и их экспрессирование ограничено CD34+ гематопоэтическими стволовыми клетками/клетками-предшественниками, клетками мозга, плаценты и гонад. Активация FLT3 за счет FLT3-лиганда промотирует нормальный рост ранних клеток-предшественников. Было обнаружено, что при острой лейкемии мутации FLT3 гена являются наиболее общими приобретенными генетическими нарушениями. Мутации FLT3 можно обнаружить у 30% пациентов с острой миелоидной лейкемией (AML) (Nakao M, et al. Leukemia. 1996 Dec; 10(12): 1911-8), и также у 5-10% пациентов с миелодиспластическим синдромом (Horiike S, et al. Leukemia. 1997 Sep; 11(9): 1442-6). Существует два часто встречающихся типа генетических мутаций соматических FLT3: внутренние тандемные дупликации (ITD) в JM домене и точечные мутации в петле активации домена тирозинкиназы (TKD).ITD мутации представляют собой любые удлинения или укорочения JM домена FLT3, вызванные добавлениями или делециями аминокислот, что приводит к конститутивной активации FLT3. ПрисутствиеFLT3/ITD мутаций связано с плохими клиническими результатами как в педиатрии, так и у взрослых пациентов с AML. Точечные мутации в петле активации домена киназы (FLT3/TKD) включают аспарагиновую кислоту, D835 остаток, что приводит к активированной конфигурации и трансформации миелоидных клеток. D835 мутации представляют собой бессмысленные мутации, приводящие к замещению аспарагиновой кислоты на тирозин, гистидин, валин, глутаминовую кислоту или аспарагин по аминокислоте 835 у FLT3. Наличие таких мутаций, как сообщается, присутствует у 7% пациентов с AML. TKD мутации, в отличие от ITD мутаций, как было показано, не имеют какого-либо прогностического значения для AML пациентов. Оба типа FLT3 мутаций вызывают лиганднезависимую активацию рецептора и активацию расположенных в прямом направлении сигнальных путей. Мутантные FLT3 обеспечивают преимущество выживания для лейкемических клеток, так как они вызывают активацию трех основных внутриклеточных сигнальных путей: PI3K/AKT; RAS/RAF/MAPK и JAK/STAT (Masson K, Ronnstrand L.Cell Signal. 2009 Dec; 21(12): 1717-26). В заключение, нарушение передачи сигналов FLT3 по-видимому представляет собой специфический и эффективный путь для блокирования пролиферации опухолевых клеток при AML и возможно при других показаниях.KIT обычно активируются фактором стволовых клеток. Передача сигналов за счет KIT играет важную роль в эритропоэзе, лимфопоэзе, в развитии и функциях тучных клеток, мегакариопоэзе, гаметогенезе и меланогенезе. Гематопоэтические стволовые клетки, мультипотентные предшественники и общие миелоидные предшественники, но также ранние предшественники Т клеточной линии и тимоциты экспрессируют высокие уровни KIT. Кроме того, тучные клетки, меланоциты в коже и интерстициальные клетки Кахаля в пищеварительном тракте экспрессируют KIT (Pittoni P. et al. Oncogene 2011 Feb 17; 30(7): 757-69). Сверхэкспрессирование или мутации KIT могут привести к раку. Мутации указанного гена часто связаны с гастроинтестинальными стромальными опухолями (GIST) (Antonescu CR. J Pathol. 2011; 223(2): 251-6). Около 65-85% GIST имеют KIT мутации, разделенные на две категории: мутации рецепторных регуляторных доменов (внеклеточных и околомембранных) и мутации в ферментативных доменах. В диагнозе наиболее частые мутации, делеции и точечные мутации повреждают JM домен. Мутации внеклеточного домена представляют собой вторые по количеству общие мутации, после которых следуют мутации тирозинкиназного домена. Мутации KIT были также идентифицированы в меланоме(Curtin JA, JCO, 2006, 24 (26): 4340-4346), при острой миелоидной лейкемии (Malaise M., Steinbach D.,Corbacioglu S., Curr Hematol Malig Rep. 2009, 4(2): 77-82), и для первичной аденокистозной карциномы слюнных желез (Vila L., Liu H., Al-Quran S.Z., Coco D.P., Dong H.J., Liu C., Mod Pathol. 2009; 22(10): 1296-302). Сверхэкспрессирование сообщалось также для карциномы тимуса (Strbel P., Hohenberger P.,Marx A., J Thorac Oncol. 2010; 5 (10 Suppl 4): S286-90), глиомы (Morris P.G., Abrey L.E.Target Oncol. 2010; 5(3): 193-200), семиномы яичек (Nikolaou M. et al. Anticancer Res. 2007; 27(3B): 1685-8) и мелкоклеточного рака легких (SCLC) (Micke P., et al. Clin Cancer Res. 2003; 9(1): 188-94). Дополнительные нарушения связаны с активацией KIT, таких как при мастоцитозе (Lim K.H., Pardanani A., Tefferi A. Acta Haematol. 2008; 119(4):194-8) или "пегой коже" (Murakami T., et al. J Dermatol Sci. 2004 Jun; 35(1):29-33). На основании собранных данных можно предположить, что активация KIT киназы является провоцирующим фактором для важной группы злокачественных образований, как гематологических, так и твердых раковых заболеваний, что предполагает, что указанная активация может представлять собой удобную терапевтическую мишень для лечения указанных патологий. Некоторые производные индазола, которые можно использовать для лечения различных заболеваний, таких как раковые заболевания, нейродегенерация и атеросклероз, были раскрыты в WO 2003028720, WO 2005085206, WO 2008003396 и WO 201069966 от имени соответственно Pharmacia Italiaspa, Hoffmann La Roche AG, Merck GMBH и Nerviano Medical Sciences. Несмотря на указанные разработки все еще остается необходимость в более эффективных агентах. Авторы настоящего изобретения обнаружили, что ряд индазолов являются потенциальными ингибиторами протеинкиназ, и поэтому их можно использовать в противораковой терапии. Соответственно первой целью настоящего изобретения является получение соединений замещенного индазола, представленных формулой (I) где R1 представляет собой A, NR6R7, OR8, SOnR9, COR10, нитро, циано или необязательно замещенную группу, выбранную из С 3-С 6 циклоалкила, гетероциклила и гетероарила;R2, R3, R4 и R5 независимо представляют собой водород, галоген, нитро, циано, SOnR9, COR10,NR11R12, OR13 или необязательно замещенную группу, выбранную из неразветвленного или разветвленного C1-C6 алкила, неразветвленного или разветвленного C2-C6 алкенила, неразветвленного или разветвленного C2-C6 алкинила, C3-C6 циклоалкила и гетероциклила, где А представляет собой неразветвленный или разветвленный C1-C6 алкил, замещенный группой, выбранной из необязательно замещенного гетероциклила, необязательно замещенного гетероарила, SOnR9,COR10, NR11R12 и OR13;R6 представляет собой водород или необязательно замещенную группу, выбранную из неразветвленного или разветвленного C1-C6 алкила, неразветвленного или разветвленного C2-C6 алкенила, неразветвленного или разветвленного C2-C6 алкинила, С 3-С 6 циклоалкила, гетероциклила, арила и гетероарила;R7 представляет собой водород, SOnR9, COR10, замещенный неразветвленный или разветвленныйC1-C6 алкил или необязательно замещенную группу, выбранную из неразветвленного или разветвленного С 2-C6 алкенила, неразветвленного или разветвленного C2-C6 алкинила, C3-C6 циклоалкила, гетероциклила, арила и гетероарила илиR6 и R7, взятые вместе с атомом азота, с которым они связаны, могут образовывать необязательно замещенную гетероциклильную группу;R8 представляет собой водород, A, COR10 или необязательно замещенную группу, выбранную из неразветвленного или разветвленного С 2-C6 алкенила, неразветвленного или разветвленного C2-C6 алкинила, C3-C6 циклоалкила, гетероциклила, арила и гетероарила, где А имеет указанные выше значения;R9 представляет собой NR11R12 или необязательно замещенную группу, выбранную из неразветв-2 023579 ленного или разветвленного C1-C6 алкила, неразветвленного или разветвленного С 2-С 6 алкенила, неразветвленного или разветвленного C2-C6 алкинила, C3-C6 циклоалкила, гетероциклила, арила и гетероарила;R10 представляет собой водород, NR11R12, OR13 или необязательно замещенную группу, выбранную из неразветвленного или разветвленного C1-C6 алкила, неразветвленного или разветвленного С 2-С 6 алкенила, неразветвленного или разветвленного С 2-С 6 алкинила, C3-C6 циклоалкила, гетероциклила, арила и гетероарила;R11 и R12 независимо представляют собой водород, SOnR9, COR10 или необязательно замещенную группу, выбранную из неразветвленного или разветвленного C1-C6 алкила, неразветвленного или разветвленного С 2-C6 алкенила, неразветвленного или разветвленного С 2-С 6 алкинила, C3-C6 циклоалкила,гетероциклила, арила и гетероарила, где R9 и R10 имеют указанные выше значения, илиR11 и R12, взятые вместе с атомом азота, с которым они связаны, могут образовывать необязательно замещенную гетероциклильную группу;R13 представляет собой водород, COR10 или необязательно замещенную группу, выбранную из неразветвленного или разветвленного C1-C6 алкила, неразветвленного или разветвленного C2-C6 алкенила,неразветвленного или разветвленного C2-C6 алкинила, C3-C6 циклоалкила, гетероциклила, арила и гетероарила, где R10 имеет указанные выше значения;X представляет собой связь или необязательно замещенную группу, выбранную из неразветвленного или разветвленного C1-C6 алкила, гетероциклила и арила;Y представляет собой связь, кислород или необязательно замещенную группу, выбранную из неразветвленного или разветвленного C1-C6 алкила, неразветвленного или разветвленного C2-C6 алкенила, неразветвленного или разветвленного C2-C6 алкинила, гетероциклила и арила;Z представляет собой связь, кислород или необязательно замещенный неразветвленный или разветвленный C1-C6 алкил;Ar' представляет собой необязательно замещенный арил или необязательно замещенный гетероарил; или его фармацевтически приемлемой соли. В настоящем изобретении также предложены способы получения замещенных производных индазола формулы (I), полученных способом, состоящим из стандартных синтетических превращений, и изомеров, таутомеров, гидратов, сольватов, комплексов, метаболитов, пролекарств, носителей, N-оксидов. В настоящем изобретении также предложен способ лечения заболеваний, вызванных и/или связанных с разрегулированием активности протеинкиназ, в частности ABL, ACK1, AKT1, ALK, AUR1, AUR2,BRK, BUB1, CDC7/DBF4, CDK2/CYCA, CHK1, CK2, EEF2K, EGFR1, EphA2, EphB4, ERK2, FAK,FGFR1, FLT3, GSK3beta, Haspin, IGFR1, IKK2, IR, JAK1, JAK2, JAK3, KIT, LCK, LYN, MAPKAPK2,MELK, MET, MNK2, MPS1, MST4, NEK6, NIM1, P38alpha, PAK4, PDGFR, PDK1, PERK, PIM1, PIM2,PKAalpha, PKCbeta, PLK1, RET, ROS1, SULU1, Syk, TLK2, TRKA, TYK, VEGFR2, VEGFR3 или ZAP70 активности, более конкретно FLT3, PDGFR, VEGFR3, TRKA или KIT активности, и еще более конкретноFLT3 или KIT активности, который включает введение нуждающемуся в этом млекопиающему эффективного количества соединения замещенного индазола, представленного формулой (I), как определено выше. Предпочтительный способ настоящего изобретения состоит в лечении заболевания, вызванного и/или связанного с разрегулированием активности протеинкиназы, выбранного из группы, состоящей из рака, нарушений клеточной пролиферации и заболеваний и нарушений, связанных с иммунными клетками. Другой предпочтительный способ настоящего изобретения состоит в лечении специфических типов рака, выбранных из группы, состоящей из, но ими не ограничивается, карцином, таких как карцинома мочевого пузыря, груди, ободочной кишки, почек, печени, легких (включая мелкоклеточный рак легких),слюнных желез, эзофагуса, желчного пузыря, яичников, поджелудочной железы, желудка, шейки матки,щитовидной железы, тимуса, простаты и кожи, включая карциному сквамозных клеток; гематопоэтических опухолей лимфоидной линии, включая лейкемию, острую лимфоцитарную лейкемию, острую лимфобластную лейкемию, В-клеточную лимфому, Т-клеточную лимфому, лимфому Ходжкина, лимфому не-Ходжкина, волосистоклеточную лимфому и лимфому Буркитта; гематопоэтических опухолей миелоидного ростка, включая острую и хроническую миелогенные лейкемии, миелодиспластический синдром и промиелоцитарную лейкемию; опухолей мезенхимального происхождения, включая гастроинтестинальную стромальную опухоль, фибросаркому и рабдомиосаркому; опухолей центральной и периферической нервной системы, включая астроцитомную нейробластому, глиому и шванномы; других опухолей, включая мастоцитоз, меланому, семиному, тератокарциному, остеосаркому, пигментную ксеродерму, кератоксантому, фолликулярный рак щитовидной железы, саркому Капоши и мезотелиому и другие. Другой предпочтительный способ настоящего изобретения состоит в лечении специфических нарушений клеточной пролиферации, таких как, например, доброкачественная гиперплазия простаты, семейный аденоматоз толстой кишки, нейрофиброматоз, псориаз, пролиферация гладких клеток сосудов,связанная с атеросклерозом, легочным фиброзом, артритом, гломерулонефритом и постхирургическим стенозом и рестенозом. Другой предпочтительный способ настоящего изобретения состоит в лечении связанных с иммунными клетками заболеваний и нарушений, таких как воспалительные и аутоиммунные заболевания, например рассеянный склероз, системная красная волчанка, воспалительные заболевания кишечника (IBD),болезнь Крона, синдром раздраженного кишечника, панкреатит, язвенный колит, дивертикулез, миастениа гравис, васкулит, псориаз, склеродермы, астма, аллергия, системный склероз, витилиго, артрит, такой как остеоартрит, ювенильный ревматоидный артрит, алкилирующий спондилит. Другой предпочтительный способ настоящего изобретения состоит в лечении FLT3 мутированного рака, такого как острая миелоидная лейкемия или миелодиспластический синдром. Другой предпочтительный способ настоящего изобретения состоит в лечении KIT мутированных раков, таких как гастроинтестинальные стромальные опухоли, меланома, острая миелоидная лейкемия,первичная аденокистозная карцинома слюнных желез, карцинома тимуса, глиома, семинома яичек, мелкоклеточный рак легких, мастоцитоз или "пегая кожа". Кроме того, в настоящем изобретении также предложен способ ингибирования опухолевого ангиогенеза и метастазирования. В следующем предпочтительном варианте указанный способ настоящего изобретения включает далее проведение для нуждающегося в этом млекопитающего курса радиационной терапии или химиотерапии в комбинации с использованием по меньшей мере одного цитостатического или цитотоксического агента. Кроме того, в настоящем изобретении предложен in vitro способ ингибирования активности FLT3 или KIT протеинкиназ, который включает осуществление контактирования указанного белка с эффективным количеством соединения формулы (I). В настоящем изобретении также предложены фармацевтическая композиция, включающая терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли и по меньшей мере одного фармацевтически приемлемого эксципиента, носителя и/или разбавителя. В настоящем изобретении далее предложена фармацевтическая композиция, включающая соединение формулы (I) в комбинации с одним или более из химиотерапевтических, например цитостатических или цитотоксических, агентов, агентов типа антибиотиков, алкилирующих агентов, противометаболических агентов, гормональных агентов, иммунологических агентов, агентов типа интерферона, ингибиторов циклооксигеназы (например, ингибиторов СОХ-2), ингибиторов матриксметаллопротеаз, ингибиторов теломераз, ингибиторов тирозинкиназ, агентов ингибиторов факторов роста, анти-HER агентов, анти-EGFR агентов, агентов анти-ангиогенеза (например, ингибиторов ангиогенеза), ингибиторов фарнезилтрансферазы, ингибиторов пути ras-raf трансдукции сигналов, ингибиторов клеточного цикла, другихcdks ингибиторов, агентов связывания тубулина, ингибиторов топоизомеразы I, ингибиторов топоизомеразы II и т.п. Кроме того, в настоящем изобретении предложен продукт, включающий соединение формулы (I) или его фармацевтически приемлемую соль, как определено выше, и один или более из химиотерапевтических агентов в виде объединенного лекарственного препарата для одновременного, раздельного или последовательного использования в противораковой терапии. В еще одном аспекте настоящего изобретения предложено соединение формулы (I) или его фармацевтически приемлемая соль, как определено выше, для использования в качестве лекарственного средства. Кроме того, в настоящем изобретении предложено соединение формулы (I) или его фармацевтически приемлемая соль, как определено выше, для использования в способе лечения рака. И наконец, в настоящем изобретении предложено использование соединения формулы (I) или его фармацевтически приемлемой соли, как определено выше, при производстве лекарственного средства с противоопухолевой активностью. Соединения формулы (I) могут иметь один или более из асимметрических центров, и поэтому могут существовать в виде индивидуальных оптических изомеров или рацемических смесей. Соответственно все возможные изомеры и их смеси соединений формулы (I) включены в объем настоящего изобретения. В тех случаях, когда соединения формулы (I) содержат ненасыщенные углерод-углеродные двойные связи, как цис (Z), так и транс (Е) изомеры включены в объем настоящего изобретения. Производные соединений формулы (I), образовавшиеся в результате метаболизма в организме млекопитающих, и фармацевтически приемлемые биопредшественники (другими словами характеризуемые как пролекарства) соединений формулы (I) также включены в объем настоящего изобретения. В дополнение к вышеизложенному, как хорошо известно специалистам в данной области, незамещенный азот пиразольного кольца соединения формулы (I) быстро образует равновесную смесь таутомеров, как изображено далее где Ar, Ar', X, Y и Z имеют указанные выше значения. Соответственно в настоящем изобретении, если только один таутомер указан для соединения формулы (I), другой таутомер (Ia) также включен в объем настоящего изобретения, если специально не указано иначе. Кроме того, легко получаемые из соединений формулы (I), как определено выше, гидраты, сольваты, комплексы и N-оксиды также включены в объем настоящего изобретения.N-оксиды представляют собой соединения формулы (I), в которых азот и кислород связаны координационной связью. Использованные в описании общие термины, если не указано иначе, имеют указанные далее значения. Термин "неразветвленный или разветвленный C1-C6 алкил" относится к насыщенному алифатическому углеводородному радикалу, включая группы разветвленных или неразветвленных цепочек, содержащих от 1 до 6 атомов углерода, например метил, этил, пропил, 2-пропил, н-бутил, изо-бутил, третбутил, пентил и т.п. Алкильные группы могут быть замещенными или незамещенными; если не указано иначе, групп заместителей предпочтительно бывает одна-три, которые независимо выбирают из группы,состоящей из галогена, циано, нитро, SOnR9, COR10, NR11R12, OR13, R11R12N-(C1-C6)-алкила, R13 О(C1-C6)-алкила и необязательно далее замещенной группы, выбранной из C2-C6 алкенила, C2-C6 алкинила,С 3-C6 циклоалкила, гетероциклила, арила и гетероарила, где R9, R10, R11, R12, R13 и n имеют указанные выше значения. Термин "C3-C6 циклоалкил" относится к 3-6-членному полностью углеродному моноциклическому кольцу, которое может содержать одну или более из двойных связей, но не должно содержать полностью сопряженной -электронной системы. Примерами циклоалкильных групп, без ограничений, являются циклопропил, циклобутил, циклопентил, циклопентенил, циклогексил, циклогексенил и циклогексадиенил. Циклоалкильные группы могут быть замещенными или незамещенными; если не указано иначе,могут содержать предпочтительно от одной до трех групп заместителей, независимо выбранных из группы, состоящей из галогена, циано, нитро, SOnR9, COR10, NR11R12, OR13, R11R12N-(C1-C6)-алкила,R13 О-(C1-C6)-алкила и необязательно дополнительно замещенных неразветвленным или разветвленнымC1-C6 алкилом, C2-C6 алкенилом, С 2-С 6 алкинилом, гетероциклилом, арилом и гетероарилом, где R9, R10,R11, R12, R13 и n имеют указанные выше значения. Термин "гетероциклил" относится к 3-7-членному, насыщенному или частично ненасыщенному карбоциклическому кольцу, в котором один или более из атомов углерода замещен гетероатомами, такими как азот, кислород и сера. Нелимитирующими примерами гетероциклильных групп являются, например, оксиранил, азиридинил, оксетанил, азетидинил, тетрагидрофуранил, дигидрофуранил, тетрагидротиофенил, дигидротиофенил, пирролидинил, дигидропирролил, пиранил, дигидропиранил, тетрагидропиранил, тетрагидротиопиранил, пиперидинил, пиразолинил, изоксазолидинил, изоксазолинил, тиазолидинил, тиазолинил, изотиазолинил, диоксанил, пиперазинил, морфолинил, тиоморфолинил, экзаметилениминил, гомопиперазинил и т.п. Гетероциклильные группы могут быть замещенными или незамещенными; если не указано иначе, групп заместителей бывает предпочтительно от одной до трех, независимо выбранных из группы, состоящей из галогена, циано, нитро, SOnR9, COR10, NR11R12, OR13,R11R12N-(C1-C6)-алкила, R13O-(C1-C6)-алкила, и необязательно дополнительно замещенных неразветвленным или разветвленным C1-C6 алкилом, C2-С 6 алкенилом, C2-C6 алкинилом, C3-C6 циклоалкилом, гетероциклилом, арилом и гетероарилом, где R9, R10, R11, R12, R13 и n имеют указанные выше значения. Термин "арил" относится к моно-, би- или поликарбоциклическим углеводородам, содержащим от 1 до 4 кольцевых систем, необязательно дополнительно конденсированных или связанных друг с другом простыми связями, где по меньшей мере одно из карбоциклических колец является "ароматическим", где термин "ароматическое" относится к полностью сопряженной -электронной связанной системе. Нелимитирующими примерами таких арильных групп являются фенил, - или -нафтил или бифенильные группы. Термин "гетероарил" относится к ароматическим гетероциклическим кольцам, обычно 5-7-членным гетероциклам, содержащим от 1 до 3 гетероатомов, выбранных из N, О и S; причем гетероарильное кольцо может быть необязательно дополнительно конденсировано или связано с ароматическими или неароматическими карбоциклическими и гетероциклическими кольцами. Нелимитирующими примерами таких гетероарильных групп являются, например, пиридил, пиразинил, пиримидинил, пиридазинил, индолил, имидазолил, тиазолил, изотиазолил, пирролил, фенилпирролил, фурил, фенилфурил, оксазолил,изоксазолил, пиразолил, тиенил, бензотиенил, изоиндолинил, бензоимидазолил, хинолинил, изохинолинил, 1,2,3-триазолил, 1-фенил-1,2,3-триазолил, 2,3-дигидроиндолил, 2,3-дигидробензофуранил, 2,3 дигидробензотиофенил; бензопиранил, 2,3-дигидробензоксазинил, 2, 3-дигидрохиноксалинил и т.п. Арильные и гетероарильные группы могут быть замещенными или незамещенными; если не указано иначе, группы заместителей могут быть предпочтительно в количестве от одной до трех, независимо выбранными из группы, состоящей из галогена, циано, нитро, SOnR9, COR10, NR11R12, OR13,R11R12N-(C1-C6)-алкила, R13O-(C1-C6)-алкила и необязательно дополнительно замещенными неразветвленным или разветвленным C1-C6 алкилом, C2-C6 алкенилом, C2-C6 алкинилом, C3-C6 циклоалкилом, гетероциклилом, арилом и гетероарилом, где R9, R10, R11, R12, R13 и n имеют указанные выше значения. Термин "галоген" обозначает фтор, хлор, бром или йод. Термин "C2-C6 алкенил" обозначает алифатическую C2-C6 углеводородную цепочку, содержащую по меньшей мере одну углерод-углеродную двойную связь, которая может быть неразветвленной или разветвленной. Представительные примеры включают, но ими не ограничиваются, этенил, 1-пропенил,2-пропенил, 1- или 2-бутенил и т.п. Термин "C2-C6 алкинил" обозначает алифатическую C2-C6 углеводородную цепочку, содержащую по меньшей мере одну углерод-углеродную тройную связь, которая может быть неразветвленной или разветвленной. Представительные примеры включают, но ими не ограничиваются, этинил, 1-пропинил,2-пропинил, 1- или 2-бутинил и т.п. Указанные алкенильные и алкинильные группы могут быть замещенными или незамещенными; если не указано иначе, группы заместителей могут быть предпочтительно в количестве от одной до трех,независимо выбранные из группы, состоящей из галогена, циано, нитро, SOnR9, COR10, NR11R12, OR13,R11 R12N-(C1-C6)-алкила, R13O-(C1-C6)-алкила и необязательно дополнительно замещенные неразветвленным или разветвленным C1-C6 алкилом, C3-C6 циклоалкилом, гетероциклилом, арилом и гетероарилом, где R9, R10, R11, R12, R13 и n имеют указанные выше значения. Термин "нитро" обозначает -NO2 группу. Термин "циано" обозначает -CN остаток. Термин "фармацевтически приемлемая соль" соединения формулы (I) относится к тем солям, которые сохраняют биологическую эффективность и характеристики исходного соединения. Такие соли включают соли присоединения кислот с неорганическими кислотами, такими как хлористо-водородная,бромисто-водородная, азотная, фосфорная, серная, перхлорная кислоты и т.п., или с органическими кислотами, такими как уксусная, трифторуксусная, пропионовая, гликолевая, молочная, (D) или (L) яблочная, малеиновая, фумаровая, метансульфоновая, этансульфоновая, бензойная, п-толуолсульфоновая, салициловая, коричная, миндальная, винная, лимонная, янтарная, малоновая кислота и т.п.; соли, образованные, если кислотный протон, присутствующий в соединении формулы (I), или замещен ионом металла, например ионом щелочного металла, такого как натрий или калий, или ионом щелочно-земельного металла, такого как кальций или магний, или координирует с органическим основанием, таким как этаноламин, диэтаноламин, триэтаноламин, трометамин, N-метилглюкамин и т.п. Предпочтительным классом соединений формулы (I) являются соединения, в которых R1 представляет собой A, NR6R7, OR8 или необязательно замещенный гетероциклил, где A, R6, R7 и R8 имеют указанные выше значения. Более предпочтительным классом соединений формулы (I) являются соединения, в которых Ar представляет собой Ar1 или Ar2; и R2, R3, R4, R5 каждый независимо представляет собой водород, галоген, NR11R12 или OR13, где R11, R12 и R13 имеют указанные выше значения. Конкретные соединения (соед.) настоящего изобретения или их соли перечислены далее: 1. N-(6-Бензилокси-1 Н-индазол-3-ил)-4-(4-метилпиперазин-1-ил)бензамид. 2. 4-(4-Метилпиперазин-1-ил)-N-(6-фенокси-1 Н-индазол-3-ил)бензамид. 3. N-[6-(3-Фторфенокси)-1 Н-индазол-3-ил]-4-(4-метилпиперазин-1-ил)бензамид. 4. N-[6-(4-Бензилоксифенокси)-1 Н-индазол-3-ил]-4-(4-метилпиперазин-1-ил)бензамид. 5. 4-(4-Метилпиперазин-1-ил)-N-[6-(3-феноксибензилокси)-1 Н-индазол-3-ил]бензамид. 6. N-[6-(1-Бензилпиперидин-4-илокси)-1 Н-индазол-3-ил]-4-(4-метилпиперазин-1-ил)бензамид. 7. 4-(4-Метилпиперазин-1-ил)-N-[6-(3-фенилпроп-2-инилокси)-1 Н-индазол-3-ил]бензамид. 8. 4-(4-Метилпиперазин-1-ил)-N-[6-(4-феноксифенокси)-1 Н-индазол-3-ил]бензамид. 9. N-[6-(3-Бензилоксифенокси)-1 Н-индазол-3-ил]-4-(4-метилпиперазин-1-ил)бензамид. 10. 4-(4-Метилпиперазин-1-ил)-N-[6-(2-феноксиэтокси)-1 Н-индазол-3-ил]бензамид. 11. N-[6-(2-Бензилоксиэтокси)-1 Н-индазол-3-ил]-4-(4-метилпиперазин-1-ил)бензамид. 12. N-[6-(1-Бензилпиперидин-3-илокси)-1 Н-индазол-3-ил]-4-(4-метилпиперазин-1-ил)бензамид. 13. N-[6-(1-Бензилпирролидин-2-илметокси)-1 Н-индазол-3-ил]-4-(4-метилпиперазин-1-ил)бензамид. 14. N-[6-(2-Бензилоксиэтокси)-1 Н-индазол-3-ил]-4-(4-метил-4-оксипиперазин-1-ил)бензамид. 15. N-[6-(2-Бензилоксиэтокси)-1 Н-индазол-3-ил]-4-(4-диметиламинопиперидин-1-ил)бензамид. 16. N-[6-(2-Бензилоксиэтокси)-1 Н-индазол-3-ил]-4-[(2-диметиламиноэтил)метиламино]бензамид. 17. N-[6-(2-Бензилоксиэтокси)-1 Н-индазол-3-ил]-4-[(3-диметиламинопропил)метиламино]бензамид. 18. трет-Бутиловый эфир 4-4-[6-(2-бензилоксиэтокси)-1 Н-индазол-3-илкарбамоил]фенилпиперазин-1-карбоновой кислоты. 19. N-[6-(2-Бензилоксиэтокси)-1 Н-индазол-3-ил]-4-(1-метилпиперидин-4-иламино)бензамид. 20. N-[6-(2-Бензилоксиэтокси)-1 Н-индазол-3-ил]-4-пиперазин-1-илбензамид.N-[6-(2-Бензилоксиэтокси)-1 Н-индазол-3-ил]-4-[метил-(1-метилпиперидин-4-ил)амино]бензамид. 24. N-[6-(2-Бензилоксиэтокси)-1 Н-индазол-3-ил]-4-морфолин-4-илбензамид. 25. N-[6-(2-Бензилоксиэтокси)-1 Н-индазол-3-ил]-4-(2-морфолин-4-илэтиламино)бензамид. 26. N-[6-(2-Бензилоксиэтокси)-1 Н-индазол-3-ил]-4-(тетрагидропиран-4-иламино)бензамид. 27. N-[6-(2-Бензилоксиэтокси)-1 Н-индазол-3-ил]-4-[(1-метилпиперидин-4-илметил)амино]бензамид. 28. N-[6-(2-Бензилоксиэтокси)-1 Н-индазол-3-ил]-4-(3-пирролидин-1-илазетидин-1-ил)бензамид. 29. N-[6-(2-Бензилоксиэтокси)-1 Н-индазол-3-ил]-3-(4-метилпиперазин-1-ил)бензамид. 30. N-6-[2-(2-Фторбензилокси)этокси]-1 Н-индазол-3-ил-4-(4-метилпиперазин-1-ил)бензамид. 31. N-6-[2-(3-Фторбензилокси)этокси]-1 Н-индазол-3-ил-4-(4-метилпиперазин-1-ил)бензамид. 32. N-6-[2-(4-Фторбензилокси)этокси]-1 Н-индазол-3-ил-4-(4-метилпиперазин-1-ил)бензамид. 33. 4-(4-Метилпиперазин-1-ил)-N-6-[2-(4-трифторметилбензилокси)этокси]-1 Н-индазол-3-илбензамид. 34. 4-(4-Метилпиперазин-1-ил)-N-6-[2-(3-трифторметилбензилокси)этокси]-1 Н-индазол-3-илбензамид. 35. 4-(4-Метилпиперазин-1-ил)-N-6-[2-(пиридин-4-илметокси)этокси]-1 Н-индазол-3-илбензамид. 36. 4-(4-этилпиперазин-1-ил)-N-6-[2-(пиридин-3-илметокси)этокси]-1 Н-индазол-3-илбензамид. 37. 4-(4-Метилпиперазин-1-ил)-N-6-[2-(пиридин-2-илметокси)этокси]-1 Н-индазол-3-илбензамид. 38. N-[6-(2-Бензилоксиэтокси)-1 Н-индазол-3-ил]-2-фтор-4-(4-метилпиперазин-1-ил)бензамид. 39. 4-(4-Метилпиперазин-1-ил)-N-[6-Е)-3-фенил-аллилокси)-1 Н-индазол-3-ил]бензамид. 40. N-6-[2-(4-Метоксибензилокси)этокси]-1 Н-индазол-3-ил-4-(4-метилпиперазин-1-ил)бензамид. 41. N-[6-(2-Бензилоксиэтокси)-1 Н-индазол-3-ил]-4-[метил(1-метил-1-оксипиперидин-4-ил)амино] бензамид. 42. 4-(4-Метил-4-оксипиперазин-1-ил)-N-6-[2-(4-трифторметилбензилокси)этокси]-1 Н-индазол-3 илбензамид. 43. N-[6-(2-Бензилоксиэтокси)-1 Н-индазол-3-ил]-2,4-бис(4-метилпиперазин-1-ил)бензамид. В настоящем изобретении также предложен способ получения соединений формулы (I), как определено выше, используя направления реакций и схемы синтеза, раскрытые далее, используя доступные специалистам методики и легко доступные исходные материалы. Получение некоторых вариантов настоящего изобретения раскрыто в приводимых далее примерах, но специалисты в данной области могут легко понять, что раскрытые примеры получений можно легко адаптировать для получения других вариантов настоящего изобретения. Например, синтез не приведенных в примерах соединений настоящего изобретения можно осуществить используя модификации, которые очевидны специалистам в данной области, например соответствующим образом защищая мешающие группы, заменяя на другие подходящие реагенты, известные специалистам, или осуществляя рутинные модификации условий реакций. Альтернативно, другие реакции, упомянутые в описании или хорошо известные специалистам в данной области, можно рассматривать как приспособляемые для получения других соединений настоящего изобретения. Приводимые далее схемы 1 и 2 демонстрируют способы получения соединений формулы (I). Схема 1 где Ar имеет значения, указанные для формулы (I); W представляет собой гидрокси, галоген или подходящую уходящую группу; X, Y, Z и Ar' имеют указанные ранее значения для соединения формулы(I); и L представляет собой подходящую уходящую группу, такую как галоген, метансульфонилокси,трифторметансульфонилокси или п-толуолсульфонилокси. Схема 2 где Ar имеет значения, указанные для формулы (I); W представляет собой гидрокси, галоген или подходящую уходящую группу; X, Y, Z и Ar' имеют указанные ранее значения для соединения формулы(I); и L представляет собой подходящую уходящую группу, такую как галоген, метансульфонилокси,трифторметансульфонилокси или п-толуолсульфонилокси. Специалистам в данной области должно быть понятно, что любые преобразования, осуществляемые в соответствии с указанными способами, могут потребовать стандартных модификаций, таких как,например, защита мешающих групп, изменение на другие подходящие известные специалистам реагенты или осуществление рутинных модификаций условий реакций. Соответственно способ настоящего изобретения включает следующие стадии: А) введение трет-бутоксикарбонильной группы в соединение формулы (II) В) отщепление фталимидогруппы у полученного соединения формулы (III) С) ацилирование полученного соединения формулы (IV) в результате реакции с соединением формулы (V) где Ar имеет значения, указанные для формулы (I) и W представляет собой гидрокси, галоген или подходящую уходящую группу;D) селективное отщепление трет-бутилдиметилсилилового эфира у полученного соединения формулы (VI) где Ar имеет значения, указанные для формулы (I); Е) сочетание полученного соединения формулы (VII) где Ar имеет значения, указанные для формулы (I), альтернативно с Еа) соединением формулы (VIII) где Ar', Z и Y имеют указанные ранее значения для формулы (I) и X представляет собой необязательно замещенную группу, выбранную из неразветвленного или разветвленного C1-C6 алкила и гетероциклила; илиEb) соединением формулы (IX) где Ar', Z и Y имеют указанные ранее значения для соединения формулы (I) и X представляет собой необязательно замещенный арил, или где Ar' имеет значения, указанные для формулы (I) и X, Y и Z представляют собой связь; илиEc) соединением формулы (X) где Ar', Z и Y имеют указанные ранее значения для соединения формулы (I), X представляет собой необязательно замещенную группу, выбранную из неразветвленного или разветвленного C1-C6 алкила или гетероциклила, и L представляет собой подходящую уходящую группу, такую как галоген, метансульфонилокси, трифторметансульфонилокси или п-толуолсульфонилокси;F) отщепление трет-бутоксикарбонильной группы у полученного соединения формулы (XI), полученного на стадии Еа), Eb) или Ec) где Ar, Ar', X, Y и Z имеют указанные ранее значения для соединения формулы (I), для получения соединения формулы (I), как определено выше; необязательное разделение полученного соединения формулы (I) на отдельные изомеры; необязательное превращение полученного соединения формулы (I) в другое соединение формулы (I) и/или в его фармацевтически приемлемую соль, при желании. Альтернативно, промежуточное соединение формулы (XI), где Ar, Ar', Y и Z имеют указанные ранее значения для соединения формулы (I) и X представляет собой необязательно замещенную группу,выбранную из неразветвленного или разветвленного C1-C6 алкила и гетероциклила, можно получить способом, включающим следующие стадии:G) селективное отщепление трет-бутилдиметилсилилового эфира у соединения формулы (IV), как определено выше; Н) сочетание полученного соединения формулы (XII)I) ацилирование полученного соединения формулы (XIII) где Ar, Ar', Y и Z имеют значения, указанные для соединения формулы (I), и X представляет собой необязательно замещенную группу, выбранную из неразветвленного или разветвленного C1-C6 алкила и гетероциклила, с соединением формулы (V), как определено выше, для получения соединения формулы(XI), где Ar, Ar', Y и Z имеют значения, указанные для соединения формулы (I), и X представляет собой необязательно замещенную группу, выбранную из неразветвленного или разветвленного C1-C6 алкила и гетероциклила. Следующей целью настоящего изобретения является способ получения соединения формулы (I),как определено выше, включающий следующие стадии:J) сочетание соединения формулы (XIV) альтернативно сK) превращение полученного соединения формулы (XV) где Ar', X, Y и Z имеют значения, указанные для соединения формулы (I);L) ацилирование полученного соединения формулы (XVI) где Ar', X, Y и Z имеют значения, указанные для соединения формулы (I), соединением формулы(V), как определено выше, для получения соединения формулы (I), как определено выше; необязательное разделение полученного соединения формулы (I) на отдельные изомеры; необязательное превращение полученного соединения формулы (I) в другое соединение формулы (I) и/или в его фармацевтически приемлемую соль, при желании. Следующей целью настоящего изобретения является способ получения соединения формулы (I),где R1 представляет собой NR6R7, где R6 имеет указанные выше значения и R7 представляет собой водород, замещенный неразветвленный или разветвленный C1-C6 алкил или необязательно замещенную группу, выбранную из неразветвленного или разветвленного C2-C6 алкенила, неразветвленного или разветвленного C2-C6 алкинила, C3-C6 циклоалкила, гетероциклила, арила и гетероарила, и где Ar, Ar', X, Y иZ имеют указанные выше значения, включающий следующие стадии: М) ацилирование соединения формулы (XVI), как определено выше, соединением формулы (XVII) где R2, R3, R4 и R5 имеют значения, указанные для соединения формулы (I), и W и L имеют указанные выше значения;N) сочетание полученного соединения формулы (XVIII) где Ar', X, Y, Z, R2, R3, R4 и R5 имеют значения, указанные для соединения формулы (I), и L имеет указанные выше значения, с соединением формулы (XIX) где R6 имеет значения, указанные для формулы (I), и R7 представляет собой водород, замещенный неразветвленный или разветвленный C1-C6 алкил или необязательно замещенную группу, выбранную из неразветвленного или разветвленного С 2-С 6 алкенила, неразветвленного или разветвленного C2-C6 алкинила, С 3-C6 циклоалкила, гетероциклила, арила и гетероарила, для получения соединения формулы (I),где R1 представляет собой NR6R7, где R6 имеет значения, указанные для формулы (I), и R7 представляет собой водород, замещенный неразветвленный или разветвленный C1-C6 алкил или необязательно замещенную группу, выбранную из неразветвленного или разветвленного С 2-C6 алкенила, неразветвленного или разветвленного С 2-C6 алкинила, C3-C6 циклоалкила, гетероциклила, арила и гетероарила, и Ar, Ar', X,Y и Z имеют значения, указанные для соединения формулы (I); необязательно разделение полученного соединения формулы (I) на отдельные изомеры; необязательно превращение полученного соединения формулы (I) в другое соединение формулы (I) и/или в его фармацевтически приемлемую соль, при желании. Как было указано выше, соединения формулы (I), которые получают в соответствии с целевым способом настоящего изобретения, можно удобно превращать в другие соединения формулы (I), используя хорошо известные условия синтеза, причем далее приводятся примеры возможных превращений: 1) восстановление соединения формулы (I), где один из заместителей R1, R2, R3, R4 или R5 представляет собой NO2, до получения соответствующего соединения формулы (I), где таким заместителем является NH2; 2) ацилирование соединения формулы (I), где один из заместителей R1, R2, R3, R4 или R5 представляет собой NH2, путем осуществления взаимодействия с ацилирующим агентом формулы (XX) или где R9, R10 и W имеют указанные выше значения, до получения соответствующего соединения формулы (I), где такой заместитель представляет собой NHSO2R9 или NHCOR10 остаток, где R9 и R10 имеют указанные выше значения; 3) осуществление взаимодействия соединения формулы (I), где заместитель R1 представляет собойNH2, с подходящим альдегидом или кетоном в присутствии восстанавливающего агента до получения соответствующего соединения формулы (I), где такой заместитель представляет собой NR6R7 группу,где R7 представляет собой водород и R6 имеет значения, указанные для формулы (I), за исключением водорода; 4) осуществление взаимодействия соединения формулы (I), где один из заместителей R2, R3, R4 или R5 представляет собой NH2, с подходящим альдегидом или кетоном в присутствии восстанавливающего агента до получения соответствующего соединения формулы (I), где такой заместитель представляет собой NR11R12 группу, в которой один из R11 или R12 представляет собой водород и другой имеет значения, указанные для формулы (I), за исключением водорода, SOnR9 или COR10; 5) гидролиз соединения формулы (I), где один из заместителей R1, R2, R3, R4 или R5 представляет собой COOR13 остаток, где R13 представляет собой неразветвленный или разветвленный C1-C6 алкил, в условиях кислотного или щелочного катализа, до получения соответствующего соединение формулы (I),где такой заместитель представляет собой СООН группу, причем в этом случае R13 представляет собой водород; 6) амидирование соединения формулы (I), в котором один из заместителей R1, R2, R3, R4 или R5 представляет собой СООН остаток, амином формулы (XXII) где R11 и R12 имеют значения, указанные для соединения формулы (I), за исключением SOnR9 илиCOR10, до получения соответствующего соединения формулы (I), где такой заместитель представляет собой CONR11R12 остаток, где R11 и R12 имеют значения, указанные для соединения формулы (I), за исключением SOnR9 или COR10; 7) окисление соединения формулы (I), где R1 представляет собой 4-метилпиперазин-1-ил, до получения соответствующего соединения формулы (I), где такой заместитель представляет собой 4-метил-4 оксипиперазин-1-ил; 8) отщепление трет-бутоксикарбонильной группы у соединения формулы (I), где R1 представляет собой 4-трет-бутоксикарбонилпиперазин-1-ил, до получения соответствующего соединения формулы (I),где такой заместитель представляет собой пиперазин-1-ил. В соответствии со стадией А) указанное превращение соединения формулы (II) в соединение формулы (III) можно осуществить различными способами и в различных условиях экспериментов, которые хорошо известны специалистам в данной области для введения трет-бутоксикарбонильной группы, например, используя ди-трет-бутилдикарбонат. Предпочтительно вести указанную реакцию в подходящем растворителе, таком как, например, тетрагидрофуран, дихлорметан, толуол, 1,4-диоксан, и в присутствии акцептора протонов, такого как, например, пиридин, триэтиламин, N,N-диизопропилэтиламин, при температуре в интервале от комнатной температуры до температуры кипения с обратным холодильником в течение промежутка времени от около 30 мин до около 96 ч. В соответствии со стадией В) указанное отщепление фталимидогруппы у соединения формулы (III) до получения соединения формулы (IV) можно осуществить различными способами и в различных условиях экспериментов, которые хорошо известны специалистам в данной области, например используя гидразин. Предпочтительно вести указанную реакцию в подходящем растворителе, таком как, например,тетрагидрофуран, дихлорметан, толуол, 1,4-диоксан, при температуре в интервале от комнатной температуры до температуры кипения с обратным холодильником в течение промежутка времени от около 30 мин до около 96 ч. В соответствии со стадией С) соединение формулы (VI) можно получить, осуществляя взаимодействие соединения формулы (IV) с соединением формулы (V) различными способами и в различных условиях экспериментов, которые хорошо известны специалистам в данной области для реакций ацилирования. Предпочтительно соединение формулы (V), где W представляет собой гидрокси, превращают в его соответствующий хлористый ацил, где W представляет собой хлор, в присутствии тионилхлорида или оксалилхлорида, в подходящем растворителе, таком как толуол, дихлорметан, хлороформ, диэтиловый эфир, тетрагидрофуран, 1,4-диоксан или их смеси, при температуре в интервале от около -10 С до температуры кипения с обратным холодильником и в течение промежутка времени, меняющегося от около 1 ч до около 96 ч. Хлористый ацил выделяют путем выпаривания растворителя и дополнитнлно подвергают взаимодействию с соединением (IV) в присутствии основания, такого как пиридин, триэтиламин илиN,N-диизопропилэтиламин, при температуре в интервале от около -40 С до температуры кипения с обратным холодильником в течение промежутка времени, изменяющегося от около 1 ч до около 96 ч. Можно также добавить подходящий растворитель, такой как толуол, дихлорметан, хлороформ, диэтиловый эфир, тетрагидрофуран, 1,4-диоксан. Альтернативно, соединение формулы (IV) подвергают взаимодействию с соединением формулы (V), где W представляет собой гидрокси, в присутствии активирующего агента, такого как гидроксибензотриазол, дициклогексилкарбодиимид, диизопропилкарбодиимид,- 11023579 соль хлористо-водородной кислоты 1-этил-3-(3'-диметиламино)карбодиимида, О-(бензотриазол-1-ил)N,N,N',N'-тетраметилуронийтетрафторборат. Предпочтительно вести указанную реакцию в подходящем растворителе, таком как, например, тетрагидрофуран, дихлорметан, толуол, 1,4-диоксан, N,Nдиметилформамид, N,N-диметилацетамид, и в присутствии акцептора протонов, такого как, например,пиридин, триэтиламин, N,N-диизопропилэтиламин, при температуре в интервале от комнатной температуры до температуры кипения с обратным холодильником в течение промежутка времени от около 30 мин до около 96 ч. В соответствии со стадией D) селективное отщепление трет-бутилдиметилсилилового эфира у соединения формулы (VI) до получения соединения формулы (VII) можно осуществить различными способами в соответствии с обычными способами, хорошо известными из литературы. Предпочтительно указанное превращение осуществлять в присутствии тетрабутиламмонийфторида в подходящем растворителе, таком как, например, тетрагидрофуран, дихлорметан, толуол, 1,4-диоксан, при температуре в интервале от -10 С до температуры кипения с обратным холодильником в течение промежутка времени от около 30 мин до около 96 ч. В соответствии со стадией Еа) реакцию сочетания соединения формулы (VII) со спиртом формулы(VIII) до получения соединения формулы (XI) можно осуществить различными способами и в различных условиях экспериментов, которые хорошо известны специалистам в данной области для синтеза ариловых эфиров в условиях, аналогичных условиям реакции Мицунобу. Предпочтительно осуществлять указанное превращение в присутствии азодикарбоксилата, такого как,например,диэтилазодикарбоксилат,диизопропилазодикарбоксилат или ди-третбутилазодикарбоксилат, и фосфина, такого как, например, трифенилфосфин или трифенилфосфин, связанный с полимером, в подходящем растворителе, таком как, например, тетрагидрофуран, дихлорметан,1,4-диоксан, толуол, ацетонитрил, при температуре в интервале от -20 С до температуры кипения с обратным холодильником в течение промежутка времени от около 30 мин до около 96 ч. В соответствии со стадией Eb) реакцию сочетания соединения формулы (VII) с бороновой кислотой формулы (IX) до получения соединения формулы (XI) можно осуществить различными способами и в различных условиях экспериментов, которые хорошо известны специалистам в данной области, для синтеза ди-ариловых простых эфиров. Предпочтительно осуществлять указанные превращения в присутствии диацетата меди, 4 молекулярных сит или силикагеля, в подходящем растворителе, таком как, например, тетрагидрофуран, дихлорметан, 1,4-диоксан, и в присутствии акцептора протонов, такого как,например, пиридин, триэтиламин, N,N-диизопропилэтиламин, при температуре в интервале от -10 С до температуры кипения с обратным холодильником в течение промежутка времени от около 30 мин до около 96 ч. В соответствии со стадией Ec) реакцию сочетания соединения формулы (VII) с соединением формулы (X) до получения соединения формулы (XI) можно осуществить различными способами и в различных условиях экспериментов, которые хорошо известны специалистам в данной области, для алкилирования фенолов. Предпочтительно соединение формулы (VII) обрабатывают хлоридом, бромидом, иодидом, мезилатом или трифлатом формулы (X), причем в этом случае L представляет собой хлор, бром,йод, метансульфонилокси или трифторметансульфонилокси, соответственно в присутствии акцептора протонов, такого как, например, триэтиламин, N,N-диизопропилэтиламин, карбонат натрия, калия или цезия, в подходящем растворителе, таком как, например, тетрагидрофуран, 1,4-диоксан, N,Nдиметилформамид, N,N-диметилацетамид, диметоксиэтан, при температуре в интервале от -10 С до температуры кипения с обратным холодильником в течение промежутка времени от около 30 мин до около 96 ч. В соответствии со стадией F) указанное превращение соединения формулы (XI) в соединение формулы (I) можно осуществить различными способами в соответствии с обычными способами, хорошо известными из литературы, для указанного отщепление трет-бутоксикарбонильной группы. Например,указанную реакцию можно вести в кислотных условиях, например, в присутствии неорганической или органической кислоты, такой как хлористо-водородная, трифторуксусная или метансульфоновая кислота, в подходящем растворителе, таком как дихлорметан, 1,4-диоксан, низший спирт, такой как метанол или этанол, вода или их смеси, при температуре в интервале от комнатной температуры до температуры кипения с обратным холодильником и в течение промежутка времени от около 30 мин до около 96 ч. В соответствии со стадией G) указанное превращение соединения формулы (IV) в соединение формулы (XII) можно осуществить способом, аналогичным способу, раскрытому выше как способ D). В соответствии со стадией На) реакцию сочетания соединения формулы (XII) и спирта формулы(VIII) можно осуществить способом, аналогичным способу, раскрытому выше как способ Еа). В соответствии со стадией Hb) реакцию сочетания соединения формулы (XII) и соединения формулы (X) можно осуществить способом, аналогичным способу, раскрытому выше как способ Ec). В соответствии со стадией I) указанное ацилирование соединения формулы (XIII) соединением формулы (V) можно осуществить способом, аналогичным способу, раскрытому выше как способ С). В соответствии со стадией Ja) реакцию сочетания соединения формулы (XIV) и спирта формулы(VIII) можно осуществить способом, аналогичным способу, раскрытому выше как способ Еа). В соответствии со стадией Jb) реакцию сочетания соединения формулы (XIV) и бороновой кислоты формулы (IX) можно осуществить способом, аналогичным способу, раскрытому выше как способ Eb). В соответствии со стадией Jc) реакцию сочетания соединения формулы (XIV) и соединения формулы (X) можно осуществить способом, аналогичным способу, раскрытому выше как способ Ec). В соответствии со стадией K) соединение формулы (XV) можно превратить в соединение формулы(XVI) различными способами и в различных условиях экспериментов. Предпочтительно вести указанную реакцию в присутствии гидразина или моногидрата гидразина в подходящем растворителе, таком как, например, толуол, тетрагидрофуран, 1,4-диоксан, диметилсульфоксид, ацетонитрил, метанол, этанол или н-бутанол, при температуре в интервале от 0 С до температуры кипения с обратным холодильником в течение промежутка времени, варьирующегося от около 30 мин до около 96 ч. В соответствии со стадией L) указанное ацилирование соединения формулы (XVI) соединением формулы (V) можно осуществить способом, аналогичным способу, раскрытому выше как способ С). В соответствии со стадией М) указанное ацилирование соединения формулы (XVI) соединением формулы (XVII) можно осуществить способом, аналогичным способу, раскрытому выше как способ С). В соответствии со стадией N) реакцию сочетания соединения формулы (XVIII) с амином формулы(XIX) можно осуществить различными способами в соответствии с обычными способами, хорошо известными из литературы для аминирования Бухвальд-Хартвига. Предпочтительно соединение формулы(XVIII), где L представляет собой хлор, бром, йод или трифторметансульфонилокси, подвергают взаимодействию с соединением формулы (XIX) в подходящем растворителе, таком как, например, тетрагидрофуран, 1,4-диоксан, N,N-диметилформамид, N,N-диметилацетамид, диметоксиэтан, ацетонитнрил, толуол, в присутствии каталитических количеств производных палладия, таких как, например,трис(дибензилиденацетон)дипалладий(0), диацетат палладия, и фосфинового лиганда, такого как, например, 2,2'-бис(дифенилфосфино)-1,1'-бинафтил, 4, 5-бис(дифенилфосфино)-9,9-диметилксантен, 2 дициклогексилфосфино-2',4',6'-триизопропилбифенил, 2-дициклогексилфосфино-2'-(N,N-диметиламино)бифенил, в присутствии основания, такого как, например, бис(триметилсилил)амид натрия или лития,трет-бутоксид натрия или калия, карбонат натрия, калия или цезия, при температуре в интервале от 0 С до температуры кипения с обратным холодильником в течение промежутка времени, варьирующегося от около 15 мин до около 96 ч. В соответствии со способом превращения 1) восстановление соединения формулы (I), где один из заместителей R1, R2, R3, R4 или R5 представляет собой нитро, для получения соединения формулы (I),где такой заместитель представляет собой амино, можно осуществить различными способами в соответствии с обычными способами, хорошо известными из литературы. Предпочтительно осуществлять указанное превращение в подходящем растворителе, таком как, например, метанол, этанол, вода, тетрагидрофуран, 1,4-диоксан, N,N-диметилформамид, уксусная кислота или их смеси, в присутствии подходящего восстанавливающего агента, такого как, например, водород, и катализатора гидрирования, или путем обработки циклогексеном, или циклогексадиеном, или муравьиной кислотой, или аммонийформиатом и катализатором гидрирования, или металлом, таким как железо или цинк, в присутствии неорганической кислоты, такой как хлористо-водородная кислота, или путем обработки хлоридом олова (II) или гидросульфитом натрия в присутствии тетрабутиламмонийхлорида, при температуре в интервале от 0 С до температуры кипения с обратным холодильником в течение промежутка времени, варьирующегося от около 1 ч до около 96 ч. Катализатор гидрирования обычно представляет собой металл, чаще всего палладий, который можно использовать, как он есть, или нанесенным на уголь. В соответствии со способом превращения 2) указанное ацилирование соединения формулы (I), где один из заместителей R1, R2, R3, R4 или R5 представляет собой NH2, в реакции с агентом ацилирования формулы (XX) или (XXI), для получения соединения формулы (I), где такой заместитель представляет собой NHSO2R9 или NHCOR10 остаток, можно осуществить различными способами в соответствии с обычными способами, хорошо известными из литературы. Предпочтительно осуществлять указанное превращение способом, аналогичным способу, раскрытому выше как способ С). В соответствии со способом превращения 3) реакцию соединения формулы (I), где заместитель R1 представляет собой NH2, с подходящим альдегидом или кетоном для получения соединения формулы (I),где такой заместитель представляет собой NR6R7 группу, можно вести различными способами в соответствии с обычными способами осуществления восстановительного алкилирования. Предпочтительно вести указанную реакцию в подходящем растворителе, таком как, например, метанол, N,Nдиметилформамид, дихлорметан, тетрагидрофуран или их смеси, в присутствии подходящего восстанавливающего агента, такого как, например, боргидрид натрия, боргидрид тетраалкиламмония, цианоборгидрид натрия, натрийтриацетоксиборгидрид, тетраметиламмонийтриацетоксиборгидрид, и в присутствии кислотного катализатора, такого как, например, уксусная кислота или трифторуксусная кислота, при температуре в интервале от около 0 С до температуры кипения с обратным холодильником в течение промежутка времени, варьирующегося от около 1 ч до около 96 ч. В соответствии со способом превращения 4) реакцию соединения формулы (I), где один из заместителей R2, R3, R4 или R5 представляет собой NH2, с подходящим альдегидом или кетоном в присутствии восстанавливающего агента, для получения соединения формулы (I), где такой заместитель представляет собой NR11R12 группу, можно вести различными способами в соответствии с обычными способами осуществления восстановительного алкилирования. Предпочтительно указанное превращение осуществлять способом, аналогичным способу раскрытому выше как способ 3). В соответствии со способом превращения 5) гидролиз соединения формулы (I), где один из заместителей R1, R2, R3, R4 или R5 представляет собой COOR13 остаток, где R13 представляет собой неразветвленный или разветвленный C1-C6 алкил, для получения соответствующей карбоновой кислоты можно вести различными способами в соответствии со способами, хорошо известными специалистам в данной области для гидролиза сложноэфирных групп. Предпочтительно такой гидролиз осуществлять в присутствии неорганического основания, такого как, например, гидроксид лития, натрия или калия, или в присутствии неорганической или органической кислоты, такой как, например, хлористо-водородная кислота, трифторуксусная кислота, в подходящем растворителе, таком как, например, метанол, этанол,тетрагидрофуран, 1,4-диоксан, вода или их смеси, при температуре в интервале от около 0 С до температуры кипения с обратным холодильником в течение промежутка времени, варьирующегося от около 1 ч до около 96 ч. В соответствии со способом превращения 6) амидирование соединения формулы (I), где один из заместителей R1, R2, R3, R4 или R5 представляет собой СООН остаток, амином формулы (XXII), можно осуществить различными способами в соответствии с обычными способами синтеза карбоксамидов. Предпочтительно указанное превращение осуществлять в присутствии активирующего агента, такого как гидроксибензотриазол, дициклогексилкарбодиимид, диизопропилкарбодиимид, соль хлористоводородной кислоты 1-этил-3-(3'-диметиламино)карбодиимида, О-(бензотриазол-1-ил)-N,N,N',N'тетраметилуронийтетрафторборат, в подходящем растворителе, таком как, например, тетрагидрофуран,дихлорметан, толуол, 1,4-диоксан, N,N-диметилформамид, N,N-диметилацетамид, и в присутствии акцептора протонов, такого как, например, пиридин, триэтиламин, N,N-диизопропилэтиламин, при температуре в интервале от комнатной температуры до температуры кипения с обратным холодильником в течение промежутка времени от около 30 мин до около 96 ч. В соответствии со способом превращения 7) окисление соединения формулы (I), где R1 представляет собой 4-метилпиперазин-1-ил, для получения соединения формулы (I), где такой заместитель представляет собой 4-метил-4-оксипиперазин-1-ил, можно осуществлять различными способами в соответствии с обычными способами N-окисления третичных аминов. Предпочтительно осуществлять указанное превращение в присутствии окисляющего агента, такого как, например, 3-хлорпербензойная кислота, перекись водорода, диметилдиоксиран, в подходящем растворителе, таком как, например, дихлорметан, метанол, этанол, вода, ацетон или их смеси, при температуре в интервале от -10 С до температуры кипения с обратным холодильником в течение промежутка времени от около 30 мин до около 96 ч. В соответствии со способом превращения 8) указанное отщепление трет-бутоксикарбонильной группы у соединения формулы (I), где R1 представляет собой 4-трет-бутоксикарбонилпипразин-1-ил, для получения соединения формулы (I), где такой заместитель представляет собой пиперазин-1-ил, можно осуществить способом, аналогичным способу, раскрытому выше как способ F). Специалистам в данной области должно быть понятно, что если соединения формул (V), (XVII),(XX) или (XXI) содержат функциональные группы, которые могут мешать реакции ацилирования, такие группы необходимо защитить до осуществления указанной реакции. В частности, если соединения формул (V), (XVII), (XX) или (XXI) замещены остатками общей формулы NR6R7, NR11R12, OR8 или OR13,где R8 или R13, или по меньшей мере один из R6 и R7, или по меньшей мере один из R11 и R12 представляет собой водород, такие группы можно защитить, как известно специалистам. Специалистам известно также, что такие защитные группы можно удалить сразу после окончания реакции или на более поздней стадии процесса синтеза. Удаление защитных групп у соединения формулы (I), где один из заместителей представляет собой защищенную аминогруппу, можно осуществить различными способами в соответствии с обычными способами удаления защитных групп у аминогруппы. В зависимости от аминозащитных групп указанную реакцию можно осуществлять различными способами. В одном аспекте такую реакцию можно осуществить путем обработки неорганической кислотой, такой как хлористо-водородная, серная или перхлоркислота, или органической кислотой, такой как трифторуксусная или метансульфоновая кислота, в подходящем растворителе, таком как вода, метанол, этанол, 1,4-диоксан, тетрагидрофуран, диэтиловый эфир, диизопропиловый эфир, ацетонитнрил, N,N-диметилформамид, дихлорметан или их смеси, при температуре в интервале от -20 до 80 С и в течение промежутка времени в интервале от 30 мин до 48 ч. В другом аспекте указанную реакцию можно осуществить путем обработки неорганическим основанием,такими как гидроксид лития, или натрия, или калия, или карбонатом натрия, или калия, или цезия, или органическим основанием, таким как тризтиламин или N,N-диизопропилэтиламин, или безводным гидразином или гидразингидратом в подходящем растворителе, таком как вода, метанол, этанол, 1,4 диоксан, тетрагидрофуран, диэтиловый эфир, диизопропиловый эфир, ацетонитрил, N,Nдиметилформамид, дихлорметан или их смеси, при температуре в интервале от -20 до 80 С и в течение промежутка времени в интервале от 30 мин до 72 ч. Специалистам в данной области известно, что превращение одной химической функции в другую может потребовать, чтобы один или более из реакционных центров соединения, содержащего указанную функцию, был защищен, для того чтобы избежать нежелательных побочных реакций. Защиту указанных реакционных центров и последующее удаление защитных групп в конце синтетических превращений можно осуществить, следуя стандартным процедурам, раскрытым например, у: Green, Theodora W. and(NY), 1999. В тех случаях, когда соединение формулы (I) содержит один или более из асимметрических центров, указанное соединение можно разделить на отдельные изомеры, используя известные специалистам в данной области процедуры. Такие процедуры включают стандартные хроматографические методики,включая хроматографию с использованием хиральной неподвижной фазы, или кристаллизацию. Общие способы разделения соединений, содержащих один или более из асимметрических центров, изложены,например, у Jacques, Jean; Collet, Andre; Wilen, Samuel H., Enantiomers, Racemates and Resolutions, JohnWileySons Inc., New York (NY), 1981. Соединение формулы (I) можно также превратить в фармацевтически приемлемую соль в соответствии со стандартными процедурами, которые хорошо известны специалистам в данной области. Альтернативно, соединение формулы (I), которое получено в виде соли, можно превратить в свободное основание или свободную кислоту, используя стандартные процедуры, хорошо известные специалистам в данной области. В соответствии с любым из вариантов указанного способа получения соединений формулы (I), исходные материалы и любые другие реагенты, т.е. соединения формул (II), (V), (VIII), (IX),(X), (XIV), (XVII), (XIX), (XX), (XXI) и (XXII), являются или коммерчески доступными, известными или их легко получить хорошо известными способами, раскрытыми, например, в B.M.Trost and I. Fleming,Comprehensive Organic Synthesis, 1991, Pergamon Press; A.R. Katritzky, O. Meth-Cohn and C.W. Rees, Comprehensive Organic Functional Group Transformations, 1995, Elsevier Pergamon; A.R. Katritzky и R.J.K. Taylor, Comprehensive Organic Functional Group Transformations II, 2005, Elsevier Pergamon. В частности, соединение формулы (II) можно получить, как раскрыто в WO 2003028720, и соединение формулы (XIV) является коммерчески доступным. Соединения настоящего изобретения можно вводить или в виде отдельных агентов, или, альтернативно, в комбинации с известной противораковой терапией, такой как режим радиационной терапии или химиотерапии в комбинации с цитостатическими или цитотоксическими агентами, агентами типа антибиотиков, алкилирующими агентами, антиметаболитными агентами, гормональными агентами, иммунологическими агентами, агентами интерферонового типа, ингибиторами циклооксигеназы (например, ингибиторами СОХ-2), ингибиторами матриксметаллопротеазы, ингибиторами теломеразы, ингибиторами тирозинкиназы, агентами, подавляющими рецептор фактора роста, анти-HER агентами, анти-EGFR агентами, агентами антиангиогенеза (например, ингибиторами ангиогенеза), ингибиторами фарнезилтрансферазы, ингибиторами ras-raf сигнального пути трансдукции, ингибиторами клеточного цикла, ингибиторами других cdks, агентами связывания тубулина, ингибиторами топоизомеразы I, ингибиторами топоизомеразы II и т.п. Будучи приготовлены в фиксированных дозах, продукты таких комбинаций используют соединения настоящего изобретения в интервале доз, раскрытом далее, и другие фармацевтически активные агенты в предписываемом дозовом интервале. Соединения формулы (I) можно использовать последовательно с известными противораковыми агентами, если комбинированной лекарственной формы оказывается недостаточно. Соединения формулы (I) настоящего изобретения, пригодные для введения млекопитающим, например человеку, можно вводить обычными способами, и уровень доз зависит от возраста, массы, состояния пациента и от способа введения. Например, подходящая доза, адаптированная для перорального введения соединения формулы (I),может быть в интервале от около 10 до около 1000 мг на дозу, от 1 до 5 раз ежедневно. Соединения настоящего изобретения можно вводить в различных дозовых формах, например перорально в форме таблеток, капсул, таблеток, покрытых сахаром или пленкой, жидких растворов или суспензий; ректально в форме суппозиториев; парентерально, например внутримышечными, или внутривенными и/или интратекальными, и/или интраспинальными инъекциями или вливаниями. Настоящее изобретение также включает фармацевтические композиции, включающие соединение формулы (I) или его фармацевтически приемлемую соль в ассоциации с фармацевтически приемлемым эксципиентом, который может быть носителем или разбавителем. Фармацевтические композиции, содержащие соединения настоящего изобретения, обычно получают обычными способами и вводят в подходящей фармацевтической форме. Например, твердые формы для перорального введения могут содержать вместе с активным соединением разбавители, например лактозу, декстрозу, сахарозу, сукрозу, целлюлозу, кукурузный крахмал или картофельный крахмал; смазывающие агенты, например двуокись кремния, тальк, стеариновую кислоту, стеарат магния или кальция, и/или полиэтиленгликоли; связывающие агенты, например крахмалы, гуммиарабик, желатинметил- 15023579 целлюлозу, карбоксиметилцеллюлозу или поливинилпирролидон; разрыхляющие агенты, например крахмал, альгиновую кислоту, альгинаты или натрийкрахмалгликолят; шипучие смеси; красящие вещества; подсластители; увлажняющие агенты, такие как лецитин, полисорбаты, лаурилсульфаты; и обычно нетоксичные и фармакологически неактивные вещества, используемые в фармацевтических композициях. Указанные фармацевтические лекарственные препараты можно изготавливать известными способами, например путем смешивания, гранулирования, таблетирования, нанесения сахарного покрытия или нанесения пленочного покрытия. Жидкие дисперсии для перорального введения могут быть, например, сиропами, эмульсиями и суспензиями. Например, сиропы могут содержать в качестве носителя сахарозу или сахарозу с глицерином и/или маннит и сорбит. Суспензии и эмульсии могут содержать, например, носители, природные смолы, агар, альгинат натрия, пектин, метилцеллюлозу, карбоксиметилцеллюлозу или поливиниловый спирт. Суспензии или растворы для внутримышечных инъекций могут содержать вместе с активным соединением фармацевтически приемлемый носитель, например стерильную воду, оливковое масло, этилолеат, гликоли, например пропиленгликоль, и, при желании, подходящее количество гидрохлорида лидокаина. Растворы для внутривенных инъекций или вливаний могут содержать в качестве носителя стерильную воду или предпочтительно они могут быть в виде стерильных, водных, изотонических, солевых растворов, или они могут содержать в качестве носителя пропиленгликоль. Суппозитории могут содержать вместе с активным соединением фармацевтически приемлемый носитель, например масло какао, полиэтиленгликоль, поверхностно-активные эфиры полиоксиэтиленсорбитана и жирных кислот или лецитин. Для лучшей иллюстрации настоящего изобретения далее приводятся следующие примеры, но без каких-либо ограничений относительно них. Экспериментальный раздел Для ссылки на любые конкретные соединения формулы (I) настоящего изобретения необязательно в форме фармацевтически приемлемых солей смотри экспериментальный раздел и формулу изобретения. Что касается представленных далее примеров, то соединения настоящего изобретения синтезированы с использованием раскрытых в описании способов или других способов, которые хорошо известны специалистам в данной области. В представленных далее примерах использованные короткие формы и сокращения имеют следующие значения. Сокращения С целью лучшей иллюстрации настоящего изобретения приводятся следующие примеры, которые не являются ограничительными. Что касается использованных в описании символов и условных сокращений в процессах, схемах и примерах, то они соответствуют тем, которые приняты в современной научной литературе, например, вJournal of the American Chemical Society или в Journal of Biological Chemistry. Если не указано иначе, все материалы получают от коммерческих поставщиков, высокой степени чистоты и их используют без дополнительной очистки. Безводные растворители, такие как ДМФ, ТГФ,DCM и толуол, получают от Aldrich Chemical Company. Все реакции, в которых используют соединения,чувствительные к воздушной среде или влаге, осуществляют в атмосфере азота или аргона. Общие способы очистки и аналитические методы. Тонкослойную хроматографию (ТСХ) осуществляют на пластинах, предварительно покрытых силикагелем Merck 60 F254. Колоночную хроматографию используют или при среднем давлении на силикагеле (силикагель Merck 40-63 мкм), или используют флеш-систему очистки Biotage SP1 Flash Purification System с предварительно набитыми силикагельными картриджами (Biotage или Varian). 1H-NMR спектры записывают в ДМСО-d6 или CDCl3 при постоянной температуре 28 С на спектрометре Varian INOVA 400 с рабочей частотой 400,50 МГц, снабженном 5 мм z-осевым зондом с косвенным детектированием PFG Indirect Detection Probe (1H15N-31P) и на спектрометре Varian Inova 500 с рабочей частотой 499,75 МГц. Сигнал остаточного растворителя используют в качестве стандарта(=2,50 или 7,27 ч/млн). Химические сдвигивыражают в частях на миллион (ч/млн) и константы взаимодействия (J) выражают в Гц. Для характеристики мультиплетности используют следующие сокращения: с - синглет; шир. с - широкий сигнал; д - дублет; т - триплет; м - мультиплет; дд - дублет дублетов. Масс-спектры с электрораспылением (ESI) получают, используя сверхчувствительную массспектрометрическую ионную ловушку (Finnigan LCQ ion trap). Если не указано иначе, все конечные соединения были гомогенными (со степенью чистоты не менее чем 95%) по данным высокоэффективной жидкостной хроматографии (ВЭЖХ). ВЭЖХ-УФ-МС анализы, которые используют для оценки степени чистоты соединений, осуществляют, объединяя МС прибор с ионной ловушкой с ВЭЖХ системойSSP4000 (Thermo Separation Products), снабженной автосэмплером LC Pal (CTC Analytics) и UV6000LP диодно-матричным детектором (УФ детектирование на длинах волн 215-400 нм). Инструментальный контроль, накопление и обработку данных осуществляют, используя программное обеспечение Xcalibur 1.2 (Finnigan). ВЭЖХ осуществляют при комнатной температуре и скорости потока 1 мл/мин, используя колонку Waters X Terra RP 18 (4,650 мм; 3,5 мкм). В качестве подвижной фазы А используют буфер ацетат аммония 5 мМ (рН 5,5 с уксусной кислотой): ацетонитрил 90:10, и подвижная фаза В представляет собой буфер ацетат аммония 5 мМ (рН 5,5 с уксусной кислотой): ацетонитрил 10:90 с градиентом от 0 до 100% В за 7 мин, затем выдерживают 100% В в течение 2 мин перед приведением в состояние равновесия.ESI (+) масс-спектры высокого разрешения (HRMS) получают на приборе Waters Q-Tof Ultima, который напрямую соединен с микроВЭЖХ 1100 Agilent, как раскрыто ранее (Colombo, M.; Riccardi-Sirtori,F.; Rizzo, V.; A fully automated method for accurate mass determination using high-performance liquid chromatography with a quadrupole/orthogonal acceleration time-of-flight mass spectrometer. Rapid Commun. MassSpectrom. 2004, 18, 511-517). Пример получения 1. трет-Бутиловый эфир 6-(трет-бутилдиметилсиланилокси)-3-(1,3-диоксо-1,3 дигидроизоиндол-2-ил)индазол-1-карбоновой кислоты (III) Схема 1, стадия А). Раствор 2-[6-(трет-бутилдиметилсиланилокси)-1 Н-индазол-3-ил]изоиндол-1,3-диона (786 мг, 2 ммоль) в сухом ТГФ (10 мл) и DIPEA (1,4 мл, 8 ммоль), в атмосфере аргона обрабатывают ди-третбутилдикарбонатом (495 мг, 2,2 ммоль) и перемешивают при комнатной температуре в течение ночи. Растворитель выпаривают при пониженном давлении, и полученный сырой остаток очищают, используя флеш-хроматографию на силикагеле, элюируя смесью гексан/EtOAc 7:3, получая 884 мг (выход: 89%) указанного в заголовке соединения в виде твердого вещества белого цвета. 1 Н-ЯМР (400 МГц),(ч./млн, DMSO-d6): 8,09-8,04 (м, 2 Н), 8,02-7,96 (м, 2 Н), 7,77 (д, J=8,29 Гц, 1 Н),7,55 (д, J=1,95 Гц, 1 Н), 7,00 (дд, J=2,07, 8,78 Гц, 1 Н), 1,69 (с, 9 Н), 1,01 (с, 9 Н), 0,28 (с, 6 Н) карбоновой кислоты (IV). Схема 1, стадия В). Раствор трет-бутилового эфира 6-(трет-бутилдиметилсиланилокси)-3-(1,3-диоксо-1,3 дигидроизоиндол-2-ил)индазол-1-карбоновой кислоты (1,17 г, 2,37 ммоль) в сухом ТГФ (20 мл), в атмосфере аргона обрабатывают 3,56 мл 1 М гидразина в ТГФ (3,56 ммоль). Полученную смесь перемешивают при кипении с обратным холодильником в течение 1 ч, затем добавляют еще 1 М гидразина в ТГФ (8 мл). После перемешивания в течение дополнительно 2 ч при кипении с обратным холодильником полученную реакционную смесь охлаждают до комнатной температуры, и выпавший твердый осадок фильтруют и промывают ТГФ. Полученный фильтрат выпаривают досуха, и полученный остаток очищают,используя флеш-хроматографию на силикагеле, элюируя смесью DCM/ацетон 7:3, получая 785 мг (выход: 91%) указанного в заголовке соединения в виде желтоватого твердого вещества. 1 Н-ЯМР (400 МГц),(ч./млн, DMSO-d6): 7,71 (д, J=8,90 Гц, 1 Н), 7,37 (шир.с, 1 Н), 6,81 (дд, J=2,07,8,54 Гц, 1 Н), 6,21 (шир.с, 2 Н), 1,59 (с, 9 Н), 0,99 (с, 9 Н), 0,23 (с, 6 Н)ESI (+) MS m/z 364 (МН+) Пример получения 3. трет-Бутиловый эфир 6-(трет-бутилдиметилсиланилокси)-3-[4-(4-метилпиперазин-1-ил)бензоиламино]индазол-1-карбоновой кислоты. Схема 1, стадия С). К суспензии 4-(4-метилпиперазин-1-ил)бензойной кислоты (1,64 г, 7,48 ммоль) в сухом ТГФ (50 мл), в атмосфере аргона при комнатной температуре добавляют тионилхлорид (1,37 мл, 18,9 ммоль) и 3 капли сухого ДМФ. Полученную реакционную смесь нагревают до 50 С и перемешивают в течение 5 ч,затем летучие вещества удаляют при пониженном давлении. Полученный остаток помещают в сухой толуол (50 мл), снова выпаривают, и полученный твердый остаток сушат в высоком вакууме. Полученный сырой гидрохлорид 4-(4-метилпиперазин-1-ил)бензоилхлорида суспендируют в 20 мл сухого ТГФ и обрабатывают при комнатной температуре в атмосфере аргона, добавляя по каплям раствор третбутилового эфира 3-амино-6-(трет-бутилдиметилсиланилокси)индазол-1-карбоновой кислоты (1,81 г,4,98 ммоль) в 20 мл сухого ТГФ и 2,56 мл DIPEA (14,96 ммоль). Полученную реакционную смесь нагревают до 50 С и перемешивают в течение 22 ч. Летучие вещества удаляют при пониженном давлении,полученный остаток разбавляют DCM (100 мл) и промывают насыщенным раствором NaHCO3 (75 мл). Органический слой выделяют, сушат над сульфатом натрия и выпаривают досуха. Полученный сырой остаток очищают, используя флеш-хроматографию на силикагеле, элюируя смесью DCM/MeOH/30%ESI (+) MS m/z 566 (МН+) Пример получения 4. трет-Бутиловый эфир 6-гидрокси-3-[4-(4-метилпиперазин-1-ил)бензоиламино]индазол-1-карбоновой кислоты. Схема 1, стадия D). Раствор трет-бутилового эфира 6-(трет-бутилдиметилсиланилокси)-3-[4-(4-метилпиперазин-1 ил)бензоиламино]индазол-1-карбоновой кислоты 1,88 г (3,33 ммоль) в сухом ТГФ (20 мл) обрабатывают 1 М TBAF в ТГФ (4 мл, 4 ммоль) и перемешивают при комнатной температуре в течение 30 мин. Затем добавляют воду (20 мл), и полученную смесь экстрагируют EtOAc (100 мл). Выделенный органический слой сушат над сульфатом натрия и выпаривают досуха. Полученный остаток очищают, используя флеш-хроматографию на силикагеле, элюируя смесью DCM/MeOH/30% NH3 92:8:0,8 получая после тщательного растирания с Et2O 1,5 г (выход: 100%) указанного в заголовке соединения. 1 Н-ЯМР (400 МГц),(ч./млн, DMSO-d6): 10,86 (с, 1 Н), 10,16 (с, 1 Н), 8,02-7,94 (м, 2 Н), 7,65 (д,J=8,78 Гц, 1 Н), 7,48 (д, J=1,95 Гц, 1 Н), 7,05-7,00 (м, 2 Н), 6,82 (дд, J=2,07, 8,78 Гц, 1 Н), 3,34-3,32 (м, 4 Н),2,55-2,45 (м, 4 Н), 2,27 (с, 3H), 1,65 (с, 9 Н)ESI (+) MS m/z 452 (МН+) Пример получения 5. трет-Бутиловый эфир 3-[4-(4-метилпиперазин-1-ил)бензоиламино]-6-(3 феноксибензилокси)индазол-1-карбоновой кислоты. Схема 1, стадия Еа). Раствор трифенилфосфина (209 мг, 0,798 ммоль) и диизопропилазодикарбоксилата (0,152 мл, 0,732 ммоль) в сухом DCM (2 мл) перемешивают в атмосфере аргона при 4 С в течение 15 мин. Затем полученную смесь добавляют к перемешиваемому раствору трет-бутилового эфира 6-гидрокси-3-[4-(4 метилпиперазин-1-ил)бензоиламино]индазол-1-карбоновой кислоты (100 мг, 0,222 ммоль) и (3 феноксифенил)метанола (149 мг, 0,732 ммоль) в 2 мл сухого DCM при комнатной температуре в атмосфере аргона. После перемешивания при комнатной температуре в течение ночи полученную реакционную смесь адсорбируют на силикагеле, сушат, вводят в хроматографическую колонку с силикагелем и элюируют смесью DCM/MeOH/30% NH3 95:5:0,5, получая 87 мг (выход: 62%) указанного в заголовке соединения.ESI (+) MS m/z 625 (МН+) Пример получения 6. трет-Бутиловый эфир 3-[4-(4-метилпиперазин-1-ил)бензоиламино]-6 феноксииндазол-1-карбоновой кислоты. Схема 1, стадия Eb). Смесь трет-бутилового эфира 6-гидрокси-3-[4-(4-метилпиперазин-1-ил)бензоиламино]индазол-1 карбоновой кислоты (110 мг, 0,244 ммоль), фенилбороновой кислоты (92 мг, 0,732 ммоль), диацетата меди (45 мг, 0,244 ммоль) и 4 молекулярные сита (200 мг) в 5 мл DCM обрабатывают TEA (0,339 мл,2,44 ммоль). После перемешивания при комнатной температуре в течение 2 дней растворитель удаляют при пониженном давлении, полученный остаток обрабатывают смесью DCM/MeOH/30% NH3 95:5:0,5,фильтруют, и полученный фильтрат загружают в хроматографическую колонку с силикагелем и элюируют смесью DCM/MeOH/30% NH3 95:5:0,5, получая 88 мг (выход: 68%) указанного в заголовке соединения.ESI (+) MS m/z 634 (МН+) Пример получения 7 трет-Бутиловый эфир 3-амино-6-гидроксииндазол-1-карбоновой кислоты (XII) Схема 1, стадия G). Раствор трет-бутилового эфира 3-амино-6-(трет-бутилдиметилсиланилокси)индазол-1-карбоновой кислоты 672 мг (1,85 ммоль) в сухом ТГФ (10 мл) обрабатывают 1 М TBAF в ТГФ (1,85 мл, 1,85 ммоль) и перемешивают при комнатной температуре в течение 30 мин. Затем добавляют воду (20 мл), и полученную смесь экстрагируют EtOAc (350 мл). Выделенные органические слои объединяют, сушат над сульфатом натрия и выпаривают досуха. Полученный остаток очищают, используя флеш-хроматографию на силикагеле, элюируя смесью DCM/EtOAc 6:4, получая 429 мг (выход: 93%) указанного в заголовке соединения. 1K2CO3 (152 мг, 1,1 ммоль) и бензил 2-бромэтилового эфира (0,179 мл, 1,1 ммоль) в сухом ДМФ (5 мл) перемешивают при 50 С в течение 12 ч. Добавляют еще бензил 2-бромэтиловый эфир (30 мкл) и полученную смесь перемешивают при 50 С в течение дополнительно 4 ч. Полученную реакционную смесь выливают в воду (50 мл) и экстрагируют EtOAc (50 мл). Органический слой сушат над сульфатом натрия и выпаривают досуха. Полученный сырой остаток очищают, используя флеш-хроматографию на силикагеле, элюируя смесью DCM/EtOAc 7:3, получая 274 мг (выход: 72%) указанного в заголовке соединения. 1 Н-ЯМР (400 МГц),(ч./млн, DMSO-d6): 7,71 (д, J=8,66 Гц, 1 Н), 7,48 (шир.с, 1 Н), 7,38-7,27 (м, 5 Н),6,91 (дд, J=2,19, 8,66 Гц, 1 Н), 6,19 (шир.с, 2 Н), 4,59 (с, 2 Н), 4,25-4,20 (м, 2 Н), 3,85-3,80 (м, 2 Н), 1,58 (с,9 Н)ESI (+) MS m/z 384 (МН+) Пример получения 9. трет-Бутиловый эфир 6-(2-бензилоксиэтокси)-3-[4-(4-метилпиперазин-1 ил)бензоиламино]индазол-1-карбоновой кислоты. Схема 1, стадия I). Смесь гидрохлорида 4-(4-метилпиперазин-1-ил)бензоилхлорида, полученного из 248 мг (1,13 ммоль) 4-(4-метилпиперазин-1-ил)бензойной кислоты способом, раскрытым выше в примере получения 3, и DIPEA (0,386 мл, 2,25 ммоль) в сухом ТГФ (10 мл) обрабатывают по каплям при комнатной температуре в атмосфере аргона раствором трет-бутилового эфира 3-амино-6-(2-бензилокси-этокси)индазол-1 карбоновой кислоты (143 мг, 0,374 ммоль) в 10 мл сухого ТГФ. Полученную реакционную смесь нагревают вплоть до 50 С и перемешивают в течение 12 ч. Летучие вещества удаляют при пониженном давлении, полученный остаток помещают в DCM (100 мл) и промывают насыщенным раствором NaHCO3 (75 мл). Органический слой выделяют, сушат над сульфатом натрия и выпаривают досуха, и полученный сырой остаток очищают, используя флеш-хроматографию на силикагеле, элюируя смесью DCM/MeOH 98:2, затем 90:10, получая 124 мг (выход: 57%) указанного в заголовке соединения в виде твердого вещества белого цвета. 1 Раствор трет-бутилового эфира 3-[4-(4-метилпиперазин-1-ил)бензоиламино]-6-(3 феноксибензилокси)индазол-1-карбоновой кислоты (87 мг, 0,137 ммоль) в смеси DCM/TFA 8:2 (5 мл) перемешивают при комнатной температуре в течение 2 ч. Летучие вещества удаляют при пониженном давлении, и полученный остаток очищают, используя флеш-хроматографию на силикагеле, элюируя смесью DCM/MeOH/30% NH3 90:10:1, получая 71 мг (выход: 97%) указанного в заголовке соединения в виде твердого вещества белого цвета. 1ESI (+) HRMS рассчитано для C28N5O3H31+H+ 486,2500; найдено 486,2502. Пример получения 10. 4-(2-Бензилоксиэтокси)-2-фтор-бензонитрил. Схема 2, стадия Jc). Смесь 2-фтор-4-гидроксибензонитрил (4,57 г, 33,3 ммоль), K2CO3 (13,8 г, 99,9 ммоль) и бензил 2 бромэтилового эфира (5,79 мл, 36,6 ммоль) в сухом ДМФ (15 мл) перемешивают при 70 С в течение 6 ч. Полученную реакционную смесь охлаждают до комнатной температуры, выливают в 300 мл воды и экстрагируют EtOAc (2100 мл). Органические слои объединяют, сушат над сульфатом натрия и выпаривают досуха. Полученный сырой остаток очищают, используя флеш-хроматографию (Biotage SP1 FlashPurification System) с картриджем с силикагелем (Biotage SNAP 100 г), осуществляя градиентное элюирование от гексан/EtOAc 100:0 до 60:40 более 20 CV, получая 8,79 г (выход: 97%) указанного в заголовке соединения в виде бесцветного масла. 1(4,72 мл, 97,2 ммоль) в н-бутаноле (15 мл) перемешивают при 120 С в течение 8 ч. Полученную реакционную смесь охлаждают до комнатной температуры, обрабатывают 250 мл воды и перемешивают в течение 30 мин. Выпавший твердый осадок отфильтровывают, промывают водой и сушат в термостате при 50 С в высоком вакууме, получая 9,0 г указанного в заголовке соединения в виде кристаллов белого цвета (выход: 98%). 1 Перемешиваемую суспензию гидрохлорида 4-(4-метилпиперазин-1-ил)бензоилхлорида, полученную из 4,55 г (20,7 ммоль) 4-(4-метилпиперазин-1-ил)бензойной кислоты способом, раскрытым выше в примере получения 3, в сухом пиридине (50 мл) обрабатывают по каплям при 0 С в атмосфере аргона раствором 6-(2-бензилоксиэтокси)-1 Н-индазол-3-иламина (5,31 г, 18,8 ммоль) в 80 мл сухого пиридина. Полученную реакционную смесь оставляют нагреваться до комнатной температуры при перемешивании в течение ночи, затем концентрируют до 30 мл в роторном испарителе, выливают в 500 мл насыщенного раствора NaHCO3 и экстрагируют 300+100 мл DCM. Полученные органические слои объединяют, сушат над сульфатом натрия и выпаривают досуха. Полученный сырой остаток обрабатывают 200 мл EtOAc и перемешивают при кипении с обратным холодильником в течение 2 ч. После охлаждения до комнатной температуры твердое вещество отфильтровывают, промывают EtOAc и сушат в термостате при 50 С в высоком вакууме, получая 5,23 г (выход: 57%) указанного в заголовке соединения в виде твердого вещества белого цвета. 1ESI (+) HRMS рассчитано для C28H29N5O2+H+ 468,2394; найдено 468,2394. Пример получения 12. N-[6-(2-Бензилоксиэтокси)-1 Н-индазол-3-ил]-4-бромбензамид. Схема 2, стадия М). К перемешиваемому раствору 6-(2-бензилоксиэтокси)-1 Н-индазол-3-иламина (3,0 г, 10,6 ммоль) в 30 мл сухого пиридина при 0 С в атмосфере аргона добавляют порциями 4-бромбензоилхлорид (2,32 г,10,6 ммоль). Полученную реакционную смесь оставляют нагреваться до комнатной температуры при перемешивании в течение ночи, затем выпаривают досуха. Полученный остаток обрабатывают 50 мл МеОН и 25 мл 2 н. NaOH и перемешивают при комнатной температуре в течение 1 ч. Полученную смесь концентрируют до приблизительно 10 мл в роторном испарителе, разбавляют 200 мл воды, перемешивают в течение 15 мин при комнатной температуре, и находящееся в суспензии твердое вещество отфильтровывают и промывают водой. После сушки в вакууме сырое твердое вещество очищают с помощью флеш-хроматографии (Biotage SP1 Flash Purification system), используя картридж с силикагелем (BiotageSNAP 100 г), используя DCM в качестве элюента А и смесь DCM/MeOH 9:1 в качестве элюента В. Осуществляют градиентное элюирование от А/В 100:0 до 70:30 более 25 CV, получая твердое вещество розового цвета, которое тщательно растирают с EtOAc (50 мл), фильтруют, промывают EtOAc и сушат,получая 3,01 г (выход: 61%) указанного в заголовке соединения в виде беловатого твердого вещества. 1ESI (+) MS m/z 467 (МН+) Пример получения 13. 2-(4-Трифторметилбензилокси)этанол. В атмосфере аргона при комнатной температуре гидрид натрия (60% дисперсию в минеральном масле, 1,92 г, 48 ммоль) перемешивают с н-гексаном (приблизительно 10 мл). Раствор гексан/минеральное масло сливают и удаляют, а оставшийся гидрид натрия обрабатывают 20 мл сухого ТГФ. Затем этиленгликоль (17,8 мл, 320 ммоль) медленно добавляют по каплям при комнатной температуре (осторожно: выделяется водород) и полученную смесь перемешивают при комнатной температуре в течение 1,5 ч. После нагревания до температуры кипения с обратным холодильником (80 С, масляная баня) добавляют раствор 1-бромметил-4-трифторметилбензола (7,6 г, 32 ммоль) в 20 мл сухого ТГФ, и полученную реакционную смесь перемешивают при кипении с обратным холодильником в течение 2,5 ч. После охлаждения до комнатной температуры добавляют 100 мл насыщенного раствора аммонийхлорида. Органический слой выделяют, промывают 50 мл воды, сушат над сульфатом натрия и выпаривают досуха. Полученный сырой остаток очищают, используя флеш-хроматографию (система Biotage SP1Flash Purification System), используя картридж с силикагелем (Varian SF40-120 г) используя н-гексан в качестве элюента А и EtOAc в качестве элюента В. Осуществляют градиентное элюирование от А/В 75:25 до 70:30 более 2 CV, затем от 70:30 до 0:100 более 2 CV, затем 100% В, получая 5,9 г (выход: 84%) указанного в заголовке соединения в виде масла желтого цвета (выход: 93%). 1(2,36 мл, 13,5 ммоль) при 0 С в атмосфере аргона добавляют метансульфонилхлорид (421 мкл, 5,4 ммоль). Полученную реакционную смесь перемешивают при 0 С в течение 10 мин, затем баню со льдом удаляют и перемешивание продолжают в течение 2 ч при комнатной температуре. Полученную смесь затем разбавляют 70 мл DCM и промывают 50 мл насыщенного раствора NaHCO3, 100 мл воды, 100 мл 2 н. HCl и 100 мл воды, сушат над сульфатом натрия и выпаривают досуха, получая 1,35 г (выход: количественный) 2-(4-трифторметилбензилокси)этилового эфира метансульфоновой кислоты в виде масла коричневого цвета, которое используют, как оно есть на следующей стадии без дополнительной очистки. 1 Н-ЯМР (400 МГц),(ч./млн, DMSO-d6): 7,73 (д, J=8,06 Гц, 2 Н), 7,57 (д, J=7,88 Гц, 2 Н), 4,64 (с, 2 Н),4,35-4,42 (м, 2 Н), 3,71-3,78 (м, 2 Н), 3,18 (с, 3H)ESI (+) HRMS рассчитано для C11H13F3O4S+Na+ 321,0379; найдено 321,0380. Используя аналогичный способ, получают следующие соединения: 2-(4-фторбензилокси)этиловый эфир метансульфоновой кислоты 1 Н-ЯМР (400 МГц),(ч./млн, DMSO-d6): 7,30-7,44 (м, 2 Н), 7,12-7,23 (м, 2 Н), 4,51 (с, 2 Н), 4,29-4,38ESI (+) HRMS рассчитано для C11H13F3O4S+Na+ 271,0411; найдено 271,0412,2-(3-трифторметилбензилокси)этиловый эфир метансульфоновой кислоты 1ESI (+) MS m/z 299 (МН+) 2-(2-фторбензилокси)этиловый эфир метансульфоновой кислоты 1ESI (+) HRMS рассчитано для C11H13F3O4S+Na+ 271,0411; найдено 271,0411,2-(4-метоксибензилокси)этиловый эфир метансульфоновой кислоты 1ESI (+) HRMS рассчитано для C11H16O5S+Na+ 283,0610; найдено 283,0614,2-(пиридин-4-илметокси)этиловый эфир метансульфоновой кислоты 1 Н-ЯМР (400 МГц),(ч./млн, DMSO-d6): 8,51-8,57 (м, 2 Н), 7,34 (д, J=5,86 Гц, 2 Н), 4,60 (с, 2 Н), 4,364,41 (м, 2 Н), 3,72-3,78 (м, 2 Н), 3,19 (с, 3H)
МПК / Метки
МПК: A61K 31/416, C07D 403/12, C07D 231/56, C07D 403/14, C07D 401/14, A61P 35/00
Метки: производные, индазола, киназы, замещенные, ингибиторов, качестве, активные
Код ссылки
<a href="https://eas.patents.su/30-23579-zameshhennye-proizvodnye-indazola-aktivnye-v-kachestve-ingibitorov-kinazy.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные производные индазола, активные в качестве ингибиторов киназы</a>












