Замещенные производные индазола, активные как ингибиторы киназы
Номер патента: 18503
Опубликовано: 30.08.2013
Авторы: Ломбарди Борджиа Андреа, Меникинкери Мария, Панцери Акилле, Перроне Этторе, Маркионни Кьяра, Нези Марчелла, Ванотти Эрмес, Орсини Паоло
Формула / Реферат
1. Соединение формулы (I)
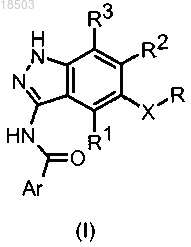
в которой X обозначает -CH2-, -CH(OH)-, -CH(OR')- или -C(R'R")-, причем R' обозначает C1-C6-алкил и R" обозначает водород;
Ar обозначает фенил, пиразолил или пиридил, в случае необходимости замещенный одним или более заместителями, независимо выбранными из галогена, нитро, COR4, NR5R6, OR7, NHSO2R10, прямого или разветвленного C1-C6-алкила, в случае необходимости замещенного гетероциклилом, который, в свою очередь, может быть замещен прямым или разветвленным C1-C6-алкилом или гетероциклилалкилом, или гетероциклила, в случае необходимости замещенного прямым или разветвленным C1-C6-алкилом, который, в свою очередь, может быть замещен гетероциклилом или C1-C6-алкоксикарбонилом, или C1-C6-диалкиламино;
R4 обозначает NR5R6 или гетероциклил, в случае необходимости замещенный прямым или разветвленным C1-C6-алкилом, гетероциклилалкилом, гетероциклилом или C1-C6-диалкиламино;
R5 и R6 независимо обозначают водород; R8R9N-C2-C6-алкил; R8O-C2-C6-алкил; прямой или разветвленный C1-C6-алкил, в случае необходимости дополнительно замещенный C1-C6-алкокси, C1-C6-диалкиламино, галогеном, фенилом, гидрокси или гетероциклилом, который, в свою очередь, может быть замещен алкилом; С3-С6-циклоалкил, в случае необходимости замещенный гидрокси- или трифтор-C1-C6-алкалкилом; гетероциклил, в случае необходимости замещенный C1-C6-алкилом, который, в свою очередь, может быть замещен галогеном или гетероциклилом, C1-C6-алкоксикарбонилом, C1-C6-диалкиламино, гетероциклилом; или фенил; или
R5 и R6 вместе с атомом азота, к которому они присоединены, могут образовывать гетероциклил, в случае необходимости замещенный прямым или разветвленным C1-C6-алкилом, который, в свою очередь, может быть замещен гетероциклилом или C1-C6-алкоксикарбонилом, C1-C6-диалкиламино или гетероциклилом;
R7 обозначает прямой или разветвленный C1-C6-алкил, в случае необходимости замещенный C1-C6-диалкиламино или гетероциклилом, в свою очередь, замещенным C1-C6-алкилом;
R8 и R9 независимо обозначают в случае необходимости дополнительно замещенный прямой или разветвленный C1-C6-алкил;
R10 обозначает в случае необходимости дополнительно замещенный прямой или разветвленный C1-C6-алкил;
R обозначает фенил или пиридил, в случае необходимости замещенный галогеном или прямым или разветвленным C1-C6-алкилом;
R1, R2 и R3 обозначают водород;
причем термин "гетероциклил" относится к 5-7-членному насыщенному или частично ненасыщенному карбоциклическому кольцу, в котором один или два атома углерода заменены гетероатомами, такими как азот или кислород, и термин "С3-С6-циклоалкил" относится к 3-6-членному полностью углеродному моноциклическому кольцу, которое может содержать одну или более двойных связей, но не имеет полностью конъюгированной p-электронной системы,
или его изомеры, таутомеры или фармацевтически приемлемая соль.
2. Соединение формулы (I) по п.1, в которой X обозначает -CH2-, -CH(OH)-, -CH(OR')- или -C(R'R")-, причем R' обозначает C1-C3-алкил.
3. Соединение формулы (I) по п.1 или 2, в которой X обозначает -CH2-, -CH(OH)-, -CH(OR')- или -C(R'R")-, где R' обозначает метил.
4. Соединение формулы (I) по пп.1-3, в которой Ar обозначает группу формулы
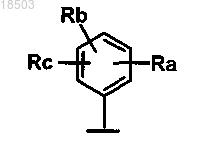
где Ra, Rb и Rc независимо обозначают водород, галоген, нитро, COR4, NR5R6, OR7, NHSO2R10, прямой или разветвленный C1-C6-алкил, в случае необходимости дополнительно замещенный гетероциклилом, который, в свою очередь, может быть замещен прямым или разветвленным C1-C6-алкилом или гетероциклилалкилом, или гетероциклилом, в случае необходимости замещенным прямым или разветвленным C1-C6-алкилом, который, в свою очередь, может быть замещен гетероциклилом или C1-C6-алкоксикарбонилом, или C1-C6-диалкиламино;
причем R4, R5, R6, R7, R8, R9 и R10 имеют значения, определенные в п.1; и
R обозначает фенил, в случае необходимости замещенный галогеном или прямым или разветвленным C1-C6-алкилом.
5. Соединение формулы (I) по пп.1-4, в которой Ar обозначает группу формулы
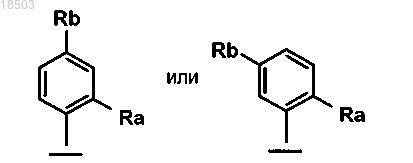
где Ra обозначает водород, галоген, нитро или NR5R6 и
Rb обозначает водород, нитро, NR5R6 или OR7,
причем R5, R6 и R7 имеют значения, определенные в п.1.
6. Соединение формулы (I) или его фармацевтически приемлемая соль по пп.1-5, выбранное из группы, состоящей из следующих соединений:
N-(5-бензил-1H-индазол-3-ил)-4-(4-метилпиперазин-1-ил)бензамид;
N-[5-(3-фторбензил)-1H-индазол-3-ил]-4-(4-метилпиперазин-1-ил)бензамид;
N-[5-(2,5-дифторбензил)-1H-индазол-3-ил]-4-(4-метилпиперазин-1-ил)бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-4-(4-метилпиперазин-1-ил)бензамид;
N-[5-(3-фторбензил)-1H-индазол-3-ил]-4-(4-метилпиперазин-1-ил)-2-нитробензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-4-(4-метилпиперазин-1-ил)-2-нитробензамид;
2-амино-N-[5-(3-фторбензил)-1H-индазол-3-ил]-4-(4-метилпиперазин-1-ил)бензамид;
2-амино-N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-4-(4-метилпиперазин-1-ил)бензамид;
N-[5-(3-фторбензил)-1H-индазол-3-ил]-4-(4-метилпиперазин-1-ил)-2-(тетрагидропиран-4-иламино)бензамид;
N-[5-(2,5-дифторбензил)-1H-индазол-3-ил]-4-(4-метилпиперазин-1-ил)-2-(тетрагидропиран-4-иламино)бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-4-(4-метилпиперазин-1-ил)-2-(тетрагидропиран-4-иламино)бензамид;
N-[5-(3-фторбензил)-1H-индазол-3-ил]-4-(4-метилпиперазин-1-ил)-2-(1-метилпиперидин-4-иламино)бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-4-(4-метилпиперазин-1-ил)-2-(1-метилпиперидин-4-иламино)бензамид;
N-[5-(3-фторбензил)-1H-индазол-3-ил]-2-(2-метокси-1-метоксиметилэтиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-[5-(2,5-дифторбензил)-1H-индазол-3-ил]-2-(2-метокси-1-метоксиметилэтиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-2-(2-метокси-1-метоксиметилэтиламино)-4-(4-метилпиперазин-1-ил)бензамид;
2-циклогексиламино-N-[5-(3-фторбензил)-1H-индазол-3-ил]-4-(4-метилпиперазин-1-ил)бензамид;
2-циклогексиламино-N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-4-(4-метилпиперазин-1-ил)бензамид;
N-[5-(3-фторбензил)-1H-индазол-3-ил]-2-(4-гидроксициклогексиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-2-(4-гидроксициклогексиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-[5-(3-фторбензил)-1H-индазол-3-ил]-2-изобутиламино-4-(4-метилпиперазин-1-ил)бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-2-изобутиламино-4-(4-метилпиперазин-1-ил)бензамид;
2-бензиламино-N-[5-(3-фторбензил)-1H-индазол-3-ил]-4-(4-метилпиперазин-1-ил)бензамид;
2-бензиламино-N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-4-(4-метилпиперазин-1-ил)бензамид;
N-[5-(3-фторбензил)-1H-индазол-3-ил]-2-(2-метоксиэтиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-2-(2-метоксиэтиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-[5-(3-фторбензил)-1H-индазол-3-ил]-2-(2-метокси-1-метилэтиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-2-(2-метокси-1-метилэтиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-[5-(3-фторбензил)-1H-индазол-3-ил]-2-((S)-2-метокси-1-метилэтиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-2-((S)-2-метокси-1-метилэтиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-[5-(3-фторбензил)-1H-индазол-3-ил]-2-((R)-2-метокси-1-метилэтиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-2-((R)-2-метокси-1-метилэтиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-[5-(3-фторбензил)-1H-индазол-3-ил]-2-(2-метокси-1,1-диметилэтиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-2-(2-метокси-1,1-диметилэтиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-[5-(3-фторбензил)-1H-индазол-3-ил]-2-(3-метоксипропиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-2-(3-метоксипропиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-[5-(3-фторбензил)-1H-индазол-3-ил]-2-(2-фторэтиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-2-(2-фторэтиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-[5-(3-фторбензил)-1H-индазол-3-ил]-2-(3-фторпропиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-2-(3-фторпропиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-[5-(3-фторбензил)-1H-индазол-3-ил]-4-(4-метилпиперазин-1-ил)-2-фениламинобензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-4-(4-метилпиперазин-1-ил)-2-фениламинобензамид;
N-[5-(3-фторбензил)-1H-индазол-3-ил]-2-метансульфониламино-4-(4-метилпиперазин-1-ил)бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-2-метансульфониламино-4-(4-метилпиперазин-1-ил)бензамид;
2-фтор-N-[5-(3-фторбензил)-1H-индазол-3-ил]-5-(тетрагидропиран-4-иламино)бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-2-фтор-5-(тетрагидропиран-4-иламино)бензамид;
2-фтор-N-[5-(3-фторбензил)-1H-индазол-3-ил]-5-(2-метоксиэтиламино)бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-2-фтор-5-(2-метоксиэтиламино)бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-4-[(3-диметиламинопропил)метиламино]-2-(тетрагидропиран-4-иламино)бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-4-[(3-диметиламинопропил)метиламино]-2-(2-метокси-1-метоксиметилэтиламино)бензамид;
2-амино-N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-4-[(3-диметиламинопропил)метиламино]бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-4-[(3-диметиламинопропил)метиламино]бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-4-[(3-диметиламинопропил)метиламино]-2-нитробензамид;
N-{5-[(3,5-дифторфенил)гидроксиметил]-1H-индазол-3-ил}-4-(4-метилпиперазин-1-ил)-2-(тетрагидропиран-4-иламино)бензамид;
N-{5-[(3,5-дифторфенил)гидроксиметил]-1H-индазол-3-ил}-2-(2-метокси-1-метоксиметилэтиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-{5-[(3,5-дифторфенил)гидроксиметил]-1H-индазол-3-ил}-4-(4-метилпиперазин-1-ил)бензамид;
N-{5-[(3,5-дифторфенил)гидроксиметил]-1H-индазол-3-ил}-2-(2-метоксиэтиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-{5-[(3,5-дифторфенил)гидроксиметил]-1H-индазол-3-ил}-2-(3-метоксипропиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-{5-[(3,5-дифторфенил)гидроксиметил]-1H-индазол-3-ил}-2-(2-метокси-1,1-диметилэтиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-{5-[(3,5-дифторфенил)гидроксиметил]-1H-индазол-3-ил}-2-(2-фторэтиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-{5-[(3,5-дифторфенил)метоксиметил]-1H-индазол-3-ил}-4-(4-метилпиперазин-1-ил)-2-(тетрагидропиран-4-иламино)бензамид;
N-{5-[(3,5-дифторфенил)метоксиметил]-1H-индазол-3-ил}-2-(2-метокси-1-метоксиметилэтиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-{5-[(3,5-дифторфенил)метоксиметил]-1H-индазол-3-ил}-4-(4-метилпиперазин-1-ил)бензамид;
N-{5-[(3,5-дифторфенил)метоксиметил]-1H-индазол-3-ил}-2-(2-метоксиэтиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-{5-[(3,5-дифторфенил)метоксиметил]-1H-индазол-3-ил}-2-(3-метоксипропиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-{5-[(3,5-дифторфенил)метоксиметил]-1H-индазол-3-ил}-2-(2-метокси-1,1-диметилэтиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-{5-[(3,5-дифторфенил)метоксиметил]-1H-индазол-3-ил}-2-(2-фторэтиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-{5-[1-(3,5-дифторфенил)этил]-1H-индазол-3-ил}-4-(4-метилпиперазин-1-ил)-2-(тетрагидропиран-4-иламино)бензамид;
N-{5-[1-(3,5-дифторфенил)этил]-1H-индазол-3-ил}-2-(2-метокси-1-метоксиметилэтиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-{5-[(3,5-дифторфенил)этил]-1H-индазол-3-ил}-4-(4-метилпиперазин-1-ил)бензамид;
N-{5-[(3,5-дифторфенил)этил]-1H-индазол-3-ил}-2-(2-метоксиэтиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-{5-[(3,5-дифторфенил)этил]-1H-индазол-3-ил}-2-(3-метоксипропиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-{5-[(3,5-дифторфенил)этил]-1H-индазол-3-ил}-2-(2-метокси-1,1-диметилэтиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-{5-[(3,5-дифторфенил)этил]-1H-индазол-3-ил}-2-(2-фторэтиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-{5-[1-(3,5-дифторфенил)-1-метилэтил]-1H-индазол-3-ил}-4-(4-метилпиперазин-1-ил)-2-(тетрагидропиран-4-иламино)бензамид;
N-{5-[1-(3,5-дифторфенил)-1-метилэтил]-1H-индазол-3-ил}-2-(2-метокси-1-метоксиметилэтиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-{5-[1-(3,5-дифторфенил)-1-метилэтил]-1H-индазол-3-ил}-4-(4-метилпиперазин-1-ил)бензамид;
N-{5-[1-(3,5-дифторфенил)-1-метилэтил]-1H-индазол-3-ил}-2-(2-метоксиэтиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-{5-[1-(3,5-дифторфенил)-1-метилэтил]-1H-индазол-3-ил}-2-(3-метоксипропиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-{5-[1-(3,5-дифторфенил)-1-метилэтил]-1H-индазол-3-ил}-2-(2-метокси-1,1-диметилэтиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-{5-[1-(3,5-дифторфенил)-1-метилэтил]-1H-индазол-3-ил}-2-(2-фторэтиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-4-(4-метил-1,4-диазепан-1-ил)-2-(тетрагидро-2H-пиран-4-иламино)бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-4-[(2-диметиламиноэтил)метиламино]-2-(тетрагидропиран-4-иламино)бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-4-[4-(диметиламино)пиперидин-1-ил]-2-(тетрагидро-2H-пиран-4-иламино)бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-4-[(2S)-2-(пирролидин-1-илметил)пирролидин-1-ил]-2-(тетрагидро-2H-пиран-4-иламино)бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-3-(4-метилпиперазин-1-ил)бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-4-{[(2S)-1-метилпирролидин-2-ил]метокси}-2-(тетрагидро-2H-пиран-4-иламино)бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-4-[(1-метилпиперидин-4-ил)окси]-2-(тетрагидро-2H-пиран-4-иламино)бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-4-[2-(диметиламино)этокси]-2-(тетрагидро-2H-пиран-4-иламино)бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-4-{[(3S)-1-метилпирролидин-3-ил]окси}-2-(тетрагидро-2H-пиран-4-иламино)бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-4-(пиперазин-1-ил)-2-(тетрагидро-2H-пиран-4-иламино)бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-4-(4-метилпиперазин-1-ил)-2-{[цис-4-(трифторметил)циклогексил]амино}бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-4-(4-метилпиперазин-1-ил)-2-{[транс-4-(трифторметил)циклогексил]амино}бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-2-фтор-4-(4-метилпиперазин-1-ил)бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-1-(пиперидин-4-ил)-1H-пиразол-4-карбоксамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-2-[(цис-4-гидроксициклогексил)амино]-4-(4-метилпиперазин-1-ил)бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-2-[(транс-4-гидроксициклогексил)амино]-4-(4-метилпиперазин-1-ил)бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-2-[(2-гидроксиэтил)амино]-4-(4-метилпиперазин-1-ил)бензамид;
2-[(азетидин-3-илметил)амино]-N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-4-(4-метилпиперазин-1-ил)бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-2-{[(1-метилазетидин-3-ил)метил]амино}-4-(4-метилпиперазин-1-ил)бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-4-[(1-метилпиперидин-4-ил)амино]-2-[тетрагидро-2H-пиран-4-иламино]бензамид;
4-[(азетидин-3-илметил)амино]-N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-2-(тетрагидро-2H-пиран-4-иламино)бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-2-[(1-метилпиперидин-4-ил)амино]бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-2-[(1-метилпиперидин-4-ил)амино]-4-(морфолин-4-ил)бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-2-метокси-4-(4-метилпиперазин-1-ил)бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-5-(4-метилпиперазин-1-ил)-3-(тетрагидро-2H-пиран-4-иламино)пиридин-2-карбоксамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-6-(4-метилпиперазин-1-ил)-2-(тетрагидро-2H-пиран-4-иламино)пиридин-3-карбоксамид;
1-[4-{[5-(3,5-дифторбензил)-1H-индазол-3-ил]карбамоил}-3-(тетрагидро-2H-пиран-4-иламино)бензил]пиперидин;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-4-{[(2-метоксиэтил)-(метил)амино]метил}-2-(тетрагидро-2H-пиран-4-иламино)бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-4-(пирролидин-1-илметил)-2-(тетрагидро-2H-пиран-4-иламино)бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-4-(морфолин-4-илметил)-2-(тетрагидро-2H-пиран-4-иламино)бензамид;
4-(азетидин-1-илметил)-N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-2-(тетрагидро-2H-пиран-4-иламино)бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-2-фтор-5-(4-метилпиперазин-1-илметил)бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-2-фтор-5-{[(2S)-2-(пирролидин-1-илметил)пирролидин-1-ил]метил}бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-2-фтор-5-(морфолин-4-илметил)бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-2-фтор-5-((S)-2-пирролидин-1-илметилпирролидине-1-карбонил)бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-4-{[(2R)-2-(пирролидин-1-илметил)пирролидин-1-ил]карбонил}бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-4-{[(2S)-2-(пирролидин-1-илметил)пирролидин-1-ил]карбонил}бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-4-{[4-(пирролидин-1-ил)пиперидин-1-ил]карбонил}бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-4-{[(2S)-2-(пирролидин-1-илметил)пирролидин-1-ил]карбонил}-2-(тетрагидро-2H-пиран-4-иламино)бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-4-{[(2R)-2-(пирролидин-1-илметил)пирролидин-1-ил]карбонил}-2-(тетрагидро-2H-пиран-4-иламино)бензамид;
N1-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-N4-[2-(диметиламино)этил]-N4-метил-2-(тетрагидро-2H-пиран-4-иламино)бензол-1,4-дикарбоксамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-4-{[4-(пропан-2-ил)пиперазин-1-ил]карбонил}-2-(тетрагидро-2H-пиран-4-иламино)бензамид;
N1-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-N4-[2-(диметиламино)этил]-2-(тетрагидро-2H-пиран-4-иламино)бензол-1,4-дикарбоксамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-4-[(4-метилпиперазин-1-ил)карбонил]-2-(тетрагидро-2H-пиран-4-иламино)бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-4-{[4-(диметиламино)пиперидин-1-ил]карбонил}-2-(тетрагидро-2H-пиран-4-иламино)бензамид;
N1-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-N4-(1-метилпиперидин-4-ил)-2-(тетрагидро-2H-пиран-4-иламино)бензол-1,4-дикарбоксамид;
N-[5-(2-метил-5-фторбензил)-1H-индазол-3-ил]-4-(4-метилпиперазин-1-ил)-2-(тетрагидропиран-4-иламино)бензамид;
4-(4-метилпиперазин-1-ил)-N-[5-(пиридин-3-илметил)-1H-индазол-3-ил]-2-(тетрагидро-2H-пиран-4-иламино)бензамид;
N-[5-бензил-1H-индазол-3-ил]-4-(4-метилпиперазин-1-ил)-2-(тетрагидропиран-4-иламино)бензамид;
4-{[2-{[5-(3,5-дифторбензил)-1H-индазол-3-ил]карбамоил}-5-(4-метилпиперазин-1-ил)фенил]амино}пиперидин-1-этилкарбоксилат;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-4-(4-метилпиперазин-1-ил)-2-(пиперидин-4-иламино)бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-2-((S)-2-метокси-1-метилэтиламино)-4-(4-метилпиперазин-1-ил)бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-4-[(2R)-2-(пирролидин-1-илметил)пирролидин-1-ил]-2-(тетрагидро-2H-пиран-4-иламино)бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-4-{[(2R)-1-метилпирролидин-2-ил]метокси}-2-(тетрагидро-2H-пиран-4-иламино)бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-4-{[(3R)-1-метилпирролидин-3-ил]окси}-2-(тетрагидро-2H-пиран-4-иламино)бензамид;
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-2-фтор-5-{[(2R)-2-(пирролидин-1-илметил)пирролидин-1-ил]метил}бензамид и
N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-2-фтор-5-((R)-2-пирролидин-1-илметилпирролидин-1-карбонил)бензамид.
7. Соединение формулы (I) или его фармацевтически приемлемая соль по пп.1-6, представляющее собой N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-4-(4-метилпиперазин-1-ил)-2-(тетрагидропиран-4-иламино)бензамид.
8. Способ получения соединения формулы (I) по п.1, отличающийся тем, что способ включает:
i) восстановление карбонильного соединения формулы (II)
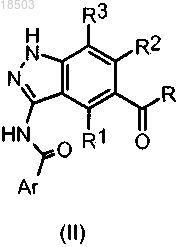
в которой Ar, R, R1, R2 и R3 имеют значения, определенные в п.1,
с получением соединения формулы (IA), (IB) или (IC):
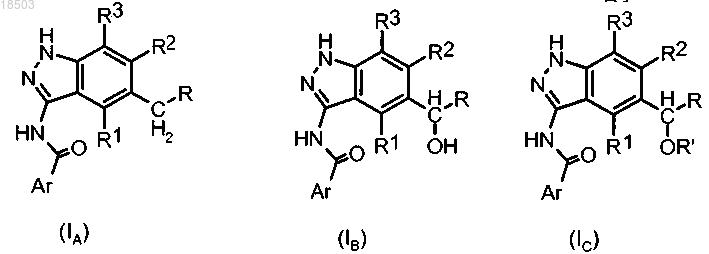
где Ar, R, R1, R2, R3 и R' имеют значения, определенные в п.1.
9. Способ получения соединения формулы (I) по п.1, отличающийся тем, что способ включает:
i') введение в реакцию соединения формулы (IIIA), (IIIB), (IIIC) или (IIID):
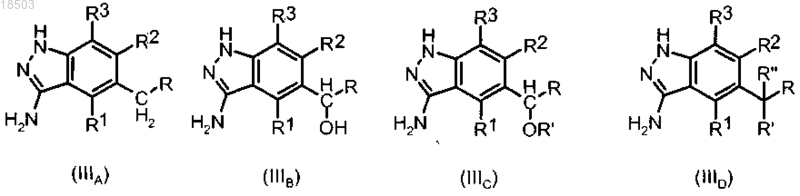
где R, R1, R2, R3, R' и R" имеют значения, определенные в п.1,
с соединением формулы (IV)
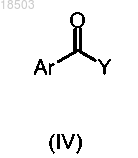
в которой Ar имеет значения, определенные в п.1; и
Y обозначает гидрокси или подходящую удаляемую группу, такую как галоген,
с получением соединения формулы (I) по п.1.
10. Способ получения соединения формулы (I) по п.1, отличающийся тем, что способ включает:
i") удаление защитной группы из соединения формулы (XXIIA), (XXIIC) или (XXIID):

где Ar, R, R1, R2, R3, R' и R" имеют значения, определенные в п.1; и
PG обозначает подходящую защитную группу, такую как бензил, п-метоксибензил, о,п-диметоксибензил или трифенилметил,
с получением соединения формулы (IA), (IC) или (ID):
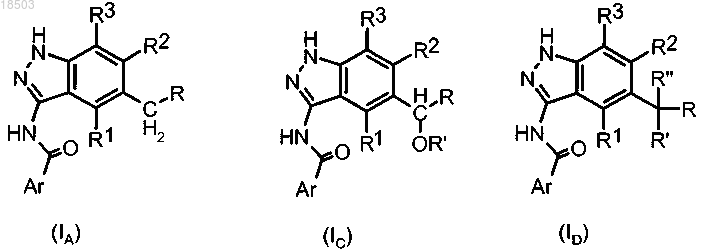
где Ar, R, R1, R2, R3, R' и R" имеют значения, определенные в п.1,
в случае необходимости разделение полученного соединения на отдельные изомеры, превращение соединения формулы (I) в другое соединение формулы (I) и/или в фармацевтически приемлемую соль, если желательно.
11. Способ получения соединения формулы (IA) по п.8, отличающийся тем, что соединение формулы (IIIA) по п.9 получают согласно следующим стадиям:
j) восстановление соединения формулы (XI)
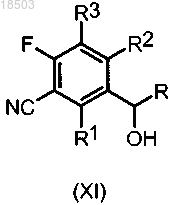
в которой R, R1, R2 и R3 имеют значения, определенные в п.1,
в присутствии подходящего реактива, такого как, например, NaI и Me3SiCl, с получением соединения формулы (XIV)
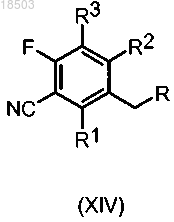
в которой R, R1, R2 и R3 имеют значения, определенные выше.
12. Способ получения соединения формулы (IA) по п.8, отличающийся тем, что соединение формулы (IIIA) по п.9 получают согласно следующим стадиям:
k) введение соединения бороновой кислоты формулы (XV)
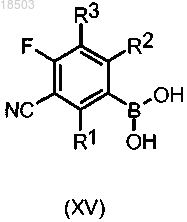
в которой R1, R2 и R3 имеют значения, определенные выше,
в реакцию с соединением формулы (XVI)
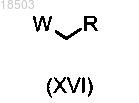
в которой R имеет значения, определенные в п.1; и
W обозначает атом галогена, такой как бром или йод, или подходящую удаляемую группу, такую как сульфонаты, такие как метансульфонат или трифторметансульфонат, или фосфаты в присутствии подходящего катализатора, такого как катализатор на основе палладия,
с получением соединения формулы (XIV), как определено выше;
l) введение полученного соединения формулы (XIV) в реакцию с гидратом гидразина с получением соединения формулы (IIIA) по п.9.
13. Способ получения соединения формулы (IA), (IC) или (ID) по п.10, отличающийся тем, что соединение формулы (XXIIA), (XXIIC) или (XXIID) по п.10 получают согласно следующим стадиям:
r) защита соединения формулы (IIIA), (IIIC) или (IIID) по п.9 с получением соединения формулы (XXIVA), (XXIVC) или (XXIVD):
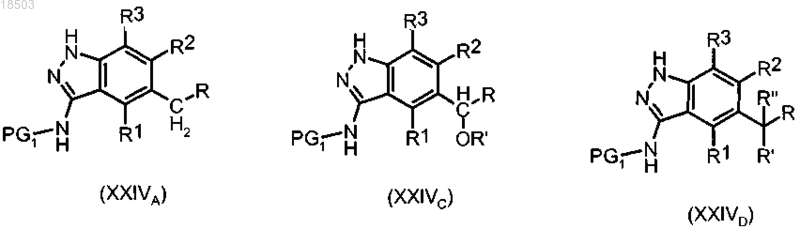
где R, R1, R2, R3, R' и R" имеют значения, определенные в п.1; и
PG1 обозначает подходящую защитную группу, такую как трифторацетил;
s) защита полученного соединения формулы (XXIVA), (XXIVC) или (XXIVD) с получением соединения формулы (XXVA), (XXVC) или (XXVD):
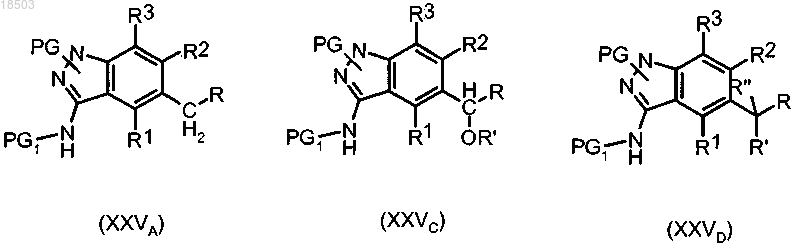
где R, R1, R2, R3, R', R" и PG1 имеют значения, определенные выше; и
PG имеет значения, определенные в п.10;
t) удаление защитной группы PG1 из полученного соединения формулы (XXVA), (XXVC) или (XXVD) с получением соединения формулы (XXVIA), (XXVIC) или (XXVID):
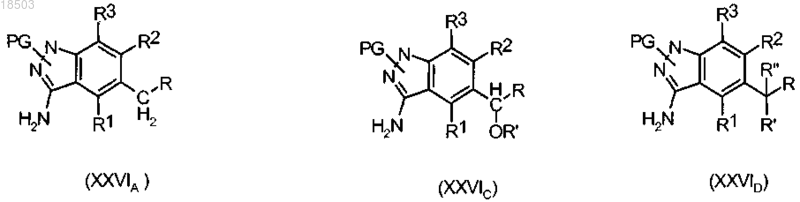
где R, R1, R2, R3, R', R" и PG имеют значения, определенные выше;
u) введение в реакцию полученного соединения формулы (XXVIA), (XXVIC) или (XXVID) с соединением формулы (IV) по п.9 с получением соединения формулы (XXIIA), (XXIIC) или (XXIID), как определено выше.
14. Способ получения соединения формулы (I) по п.8, отличающийся тем, что возможное превращение соединения формулы (I) в другое соединение формулы (I) осуществляют одной или более следующих реакций:
1) восстановление соединения формулы (I), в которой Ar обозначает замещенный фенил, пиразолил или пиридил и один из заместителей представляет собой NO2, с получением соединения формулы (I), в которой такой заместитель представляет собой NH2;
2) ацилирование соединения формулы (I), в которой Ar обозначает замещенный фенил, пиразолил или пиридил и один из заместителей представляет собой NH2, реакцией с соединением формулы (XXVII) или (XXVIII):
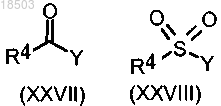
где R4 имеет значения, определенные в п.9, и Y имеет значения, определенные в п.8,
с последующим селективным удалением защитной группы от ацильной группы на пиразольном кольце с получением соединения формулы (I), в которой такой заместитель представляет собой остаток NHSO2R4, причем R4 имеет значения, определенные в п.1;
3) введение соединения формулы (I), в которой Ar обозначает замещенный фенил, пиразолил или пиридил и один из заместителей представляет собой NH2, в реакцию с подходящим альдегидом или кетоном в присутствии восстановителя с получением соединения формулы (I), в которой такой заместитель представляет собой группу NR5R6, причем один из R5 или R6 обозначает водород, а другой обозначает в случае необходимости дополнительно замещенный прямой или разветвленный C1-C6-алкил, С3-С6-циклоалкил, гетероциклил, фенил, R8R9N-C2-C6-алкил, R8O-C2-С6-алкил, причем R8 и R9 имеют значения, определенные в п.1.
15. Способ лечения заболевания, вызванного и/или связанного с разрегулированной активностью протеинкиназы, который включает введение млекопитающему эффективного количества соединения формулы (I) по п.1.
16. Фармацевтическая композиция, включающая терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемой соли, по п.1 и по меньшей мере один фармацевтически приемлемый эксципиент, носитель и/или разбавитель.
17. Соединение формулы (I)
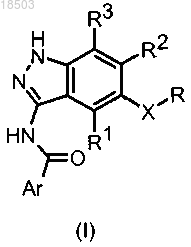
в которой X обозначает -CH2-, -CH(OH)-, -CH(OR')- или -C(R'R")-, причем R' обозначает C1-C6-алкил и R" обозначает водород;
Ar обозначает фенил, пиразолил или пиридил, в случае необходимости замещенный одним или более заместителями, независимо выбранными из галогена, нитро, COR4, NR5R6, OR7, NHSO2R10, прямого или разветвленного C1-C6-алкила, в случае необходимости замещенного гетероциклилом, который, в свою очередь, может быть замещен прямым или разветвленным C1-C6-алкилом или гетероциклилалкилом, или гетероциклила, в случае необходимости замещенного прямым или разветвленным C1-C6-алкилом, который, в свою очередь, может быть замещен гетероциклилом или C1-C6-алкоксикарбонилом, или C1-C6-диалкиламино;
R4 обозначает NR5R6 или гетероциклил, в случае необходимости замещенный прямым или разветвленным C1-C6-алкилом, гетероциклилалкилом, гетероциклилом или C1-C6-диалкиламино;
R5 и R6 независимо обозначают водород; R8R9N-C2-C6-алкил; R8O-C2-C6-алкил; прямой или разветвленный C1-C6-алкил, в случае необходимости дополнительно замещенный C1-C6-алкокси, C1-C6-диалкиламино, галогеном, фенилом, гидрокси или гетероциклилом, который, в свою очередь, может быть замещен алкилом; С3-С6-циклоалкил, в случае необходимости замещенный гидрокси- или трифтор-C1-C6-алкалкилом, гетероциклил, в случае необходимости замещенный C1-C6-алкилом, который, в свою очередь, может быть замещен галогеном или гетероциклилом, C1-C6-алкоксикарбонилом, C1-C6-диалкиламино, гетероциклилом; или фенил; или
R5 и R6 вместе с атомом азота, к которому они присоединены, могут образовывать гетероциклил, в случае необходимости замещенный прямым или разветвленным C1-C6-алкилом, который, в свою очередь, может быть замещен гетероциклилом или C1-C6-алкоксикарбонилом, C1-C6-диалкиламино или гетероциклилом;
R7 обозначает прямой или разветвленный C1-C6-алкил, в случае необходимости замещенный C1-C6-диалкиламино или гетероциклилом, в свою очередь замещенным C1-C6-алкилом;
R8 и R9 независимо обозначают в случае необходимости дополнительно замещенный прямой или разветвленный C1-C6-алкил;
R10 обозначает в случае необходимости дополнительно замещенный прямой или разветвленный C1-C6-алкил;
R обозначает фенил или пиридил, в случае необходимости замещенный галогеном или прямым или разветвленным C1-C6-алкилом;
R1, R2 и R3 обозначают водород;
причем термин "гетероциклил" относится к 5-7-членному насыщенному или частично ненасыщенному карбоциклическому кольцу, в котором один или два атома углерода заменены гетероатомами, такими как азот или кислород, и термин "С3-С6-циклоалкил" относится к 3-6-членному полностью углеродному моноциклическому кольцу, которое может содержать одну или более двойных связей, но не имеет полностью конъюгированной p-электронной системы,
или его изомеры, таутомеры или фармацевтически приемлемая соль для применения в качестве лекарственного средства.
18. Промежуточное соединение формулы (XXIIA), (XXIIC) или (XXIID):

где Ar, R, R1, R2, R3, R' и R" имеют значения, определенные в п.1; и
PG имеет значения, определенные в п.10.
19. Соединение формулы (XXVII)
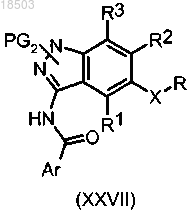
в которой Ar, R, R1, R2 и R3 имеют значения, определенные в п.1; и
PG2 обозначает этоксикарбонил или 2-метоксиэтилкарбонил.
20. Способ получения соединения формулы (XXVII) по п.19, отличающийся тем, что способ включает:
v) защиту соединения формулы (I) по п.1 с получением соединения формулы (XXVII)

в которой Ar, R, R1, R2 и R3 имеют значения, определенные в п.1; и
PG2 имеет значения, определенные в п.19.
Текст
ЗАМЕЩЕННЫЕ ПРОИЗВОДНЫЕ ИНДАЗОЛА, АКТИВНЫЕ КАК ИНГИБИТОРЫ КИНАЗЫ Раскрыты замещенные производные индазола формулы (I) и их фармацевтически приемлемые соли, как определено в описании, способ их получения и содержащие их фармацевтические композиции; соединения по изобретению могут быть использованы в терапии в лечении заболеваний, связанных с разрегулированной активностью протеинкиназы, таких как рак.(71)(73) Заявитель и патентовладелец: НЕРВИАНО МЕДИКАЛ САЙЕНСИЗ С.Р.Л. (IT) Уровень техники Настоящее изобретение относится к некоторым замещенным соединениям индазола, которые модулируют активность протеинкиназ. В связи с этим соединения согласно настоящему изобретению могут быть использованы в лечении заболеваний, вызванных разрегулированной активностью протеинкиназы. Настоящее изобретение также относится к способам получения этих соединений, к фармацевтическим композициям, включающим эти соединения, и к способам лечения заболеваний с использованием фармацевтических композиций, включающих эти соединения. Неправильное функционирование протеинкиназ (PK) является признаком многочисленных заболеваний. Множество онкогенов и протоонкогенов, участвующих в развитии рака у человека, кодирует PK. Увеличенные активности PK также участвуют во многих доброкачественных заболеваниях, таких как доброкачественная гиперплазия предстательной железы, семейный аденоматоз, полипоз, нейрофиброматоз, псориаз, пролиферация гладкомышечных клеток сосудов, связанная с атеросклерозом, легочный фиброз, артрит, гломерулонефрит и постоперационный стеноз и рестеноз.PK также участвуют в механизме воспалительных состояний и в размножении вирусов и паразитов.PK могут также играть главную роль в патогенезе и развитии нейродегенеративных нарушений. В качестве общей ссылки в отношении неправильного функционирования или нарушений регуляции PK см., например, Current Opinion in Chemical Biology. 1999, 3, 459-465. Подгруппу PK составляет группа мембранных рецепторов со свойственной активностью протеинтирозинкиназы (RPTK). После связывания факторов роста RPTK становятся активированными и фосфорилируют себя и ряд субстратов в цитоплазме. Через этот механизм они могут осуществлять внутриклеточную трансдукцию сигналов для пролиферации, дифференцировки или других биологических изменений. Структурные аномалии, суперэкспрессию и активацию RTPK часто наблюдают при опухолях человека, что позволяет предположить, что конститутивная инициация трансдукции сигнала, приводящей к пролиферации клеток, может привести к злокачественной трансформации. Киназа анапластической лимфомы (ALK) является рецептором тирозинкиназы, принадлежащим к подсемейству инсулинового рецептора RTK: ген ALK расположен на хромосоме 2 и экспрессируется главным образом в нейрональных клетках, особенно в ходе развития. Ген ALK участвует в сбалансированной транслокации хромосом с геном нуклеофосмина (NPM) на хромосоме 5 в большой подгруппе анапластических крупноклеточных лимфом (ALCL). В ALK+ALCL, в результате транслокации, убиквитарный промотор NPM вызывает эктопическую экспрессию слитого белка, в которой группа NPM димеризуется, а домен ALK киназы подвергается аутофосфорилированию и становится конститутивно активным. Множество данных из литературы демонстрируют, что слитый белок NPM-ALK имеет высокий онкогенный потенциал и его эктопическая экспрессия ответственна за клеточную трансформацию. Кроме того, конститутивная экспрессия человеческого NPM-ALK в Т-лимфоцитах мыши является достаточной для развития лимфоидной неоплазии у трансгенных животных с коротким периодом латентности.ALCL представляет собой определенное заболевание, характеризующееся поверхностной экспрессией антигена CD30 (Ki-1), и составляет 2% неходжкинских лимфом у взрослых и 13% в педиатрии, преимущественно поражая молодых пациентов мужского пола. ALK+ALCL составляет 70% от всех ALCL и является агрессивным заболеванием с системными симптомами и частыми внеузловыми поражениями(костный мозг, кожа, кость, мягкие ткани). Было обнаружено, что приблизительно 15-20% ALK-экспрессирующих ALCL несут другую хромосомную транслокацию, включающую эндоплазматическую часть ALK, с различными N-концевыми группами, которые все приводят к конститутивной активации домена ALK киназы. Кроме того, было обнаружено, что линии клеток, происходящие от солидных опухолей эктодермального происхождения, таких как меланомы, рак молочной железы, а также нейробластомы, глиобластомы, саркомы Юинга, ретинобластомы, экспрессируют рецептор ALK. В заключение, противодействие сигнальному пути ALK, вероятно, представляет собой особый и эффективный способ блокировать пролиферацию опухолевых клеток при ALCL и возможно при других показаниях. Рецептор инсулиноподобного фактора роста 1 (IGF-1R, IGF1R) также является членом подсемейства инсулиновых рецепторов RTK. Существуют несколько линий данных, позволяющих предположить, что передача сигналов IGF-1R может способствовать онкогенезу и что противодействие функции IGF-1R представляет собой действенный терапевтический выбор при лечении рака. В отношении краткого обзора IGF и передачи сигналовIGF-1R, физиологической функции и подробного описания данных, подтверждающих участие этой системы в развитии рака у человека, которые кратко представлены выше, а также в отношении других патологий читатель может обратиться к множеству обзоров по этой теме и к ссылкам, содержащимся в них,например, Baserga R. et al., Biochim. Biophys. Acta., vol. 1332, p. F105-F126, 1997; Khandwala H.M. et al.,Endocr. Rev., vol. 21, p. 215-44, 2000; Le Roith D. et al., Endocr. Rev., vol. 22, p. 53-74, 2001; Valentinis B. et Сущность изобретения Производные 3-амино и 3-ацидамино индазола для лечения нейродегенеративных заболеваний, цереброваскулярных нарушений, ожирения, сердечно-сосудистых заболеваний и рака раскрыты вWO 2006/003276, WO 2004/022544 и WO 2003/078403 на имя Aventis Pharma SA. Производные индазолиламида для лечения диабета, нейродегенеративных состояний, таких как болезнь Альцгеймера и болезнь Паркинсона, раскрыты в WO 2003/051847 на имя SmithKline BeechamP.L.C. Производные индазола для лечения опухолевого заболевания, вирусного заболевания, иммуносупрессии при трансплантации, муковисцидоза и заболеваний, связанных с ангиогенезом, раскрыты вWO 2008/003396 на имя Merck GMBH. Несмотря на эти открытия, все еще существует потребность в более эффективных действующих началах для лечения таких заболеваний. Авторы изобретения в настоящее время обнаружили, что ряд индазолов представляют собой мощные ингибиторы протеинкиназы и, таким образом, могут быть использованы в противораковой терапии. Соответственно, первый объект настоящего изобретения относится к замещенному соединению индазола, представленному формулой (I) в которой X обозначает -CH2-, -CH(OH)- -CH(OR')- или -C(R'R")-, причем R' обозначает в случае необходимости дополнительно замещенный прямой или разветвленный C1-C6-алкил и R" обозначает водород или в случае необходимости дополнительно замещенный прямой или разветвленный C1-C6-алкил;Ar обозначает арил или гетероарил, в случае необходимости замещенный одним или более заместителями, независимо выбранными из галогена, C2-C6-алкенила, C2-C6-алкинила, циано, нитро, NHCOR4,COR4, NR5R6, NR5COR4, OR7, SR7, SOR10, SO2R10, NHSOR10, NHSO2R10, R8R9N-C1-C6-алкила, R8O-C1-C6 алкила, в случае необходимости дополнительно замещенного прямого или разветвленного C1-C6-алкила,C3-C6-циклоалкила, гетероциклила, арила и гетероарила, причемR4 обозначает водород, C2-C6-алкенил, C2-C6-алкинил, NR5R6, OR7, SR7, R8R9N-C1-C6-алкил, R8O-C1C6-алкил, в случае необходимости дополнительно замещенный прямой или разветвленный C1-C6-алкил,C3-C6-циклоалкил, гетероциклил, арил или гетероарил;R5 и R6 независимо обозначают водород, C2-C6-алкенил, C2-C6-алкинил, R8R9N-C2-C6-алкил, R8O-C2C6-алкил, в случае необходимости дополнительно замещенный прямой или разветвленный C1-C6-алкил,C3-C6-циклоалкил, гетероциклил, арил или гетероарил илиR5 и R6 вместе с атомом азота, к которому они присоединены, могут образовывать в случае необходимости замещенный гетероциклил;R O-C2-C6-алкил, в случае необходимости дополнительно замещенный прямой или разветвленныйR8 и R9 независимо обозначают водород, C2-C6-алкенил, С 2-С 6-алкинил, COR4, в случае необходимости дополнительно замещенный прямой или разветвленный C1-C6-алкил, C3-C6-циклоалкил, гетероциклил, арил или гетероарил илиR8 и R9 вместе с атомом азота, к которому они присоединены, могут образовывать в случае необходимости замещенный гетероциклил, причем R4 имеет значения, определенные выше;R10 обозначает водород, C2-C6-алкенил, C2-C6-алкинил, NR5R6, OR7, R8R9N-C1-C6-алкил, R8O-C1-C6 алкил, в случае необходимости дополнительно замещенный прямой или разветвленный C1-C6-алкил,C3-C6-циклоалкил, гетероциклил, арил или гетероарил, причем R5, R6, R7, R8 и R9 имеют значения, определенные выше;R обозначает в случае необходимости замещенный прямой или разветвленный C1-C6-алкил,C3-C6-циклоалкил, гетероциклил, арил или гетероарил;R1, R2 и R3 независимо обозначают водород, галоген, нитро, в случае необходимости замещенный прямой или разветвленный C1-C6-алкил, NR5R6 или OR7, причем R5, R6 и R7 имеют значения, определенные выше; или к его изомерам, таутомерам, пролекарствам или фармацевтически приемлемой соли. Настоящее изобретение также относится к способам синтеза замещенных индазольных производных формулы (I), получаемых способом, состоящим из стандартных синтетических превращений. Настоящее изобретение также относится к способу лечения заболеваний, вызванных и/или связанных с разрегулированной активностью протеинкиназы, в частности семейства PLK, протеинкиназы C в различных изоформах, Met, PAK-4, PAK-5, ZC-1, STLK-2, DDR-2, Aurora-1, Aurora-2, Bub-1, Chk1, Chk2,HER2, raf1, MEK1, MAPK, EGF-R, PDGF-R, FGF-R, FLT3, JAK2, IGF-R, ALK, PI3K, weel киназы, Src,Ab1, Akt, MAPK, ILK, MK-2, IKK-2, Cdc7, Nek, семейства киназы Cdk/циклин, более предпочтительно активностью Aurora-2, IGF-IR и ALK и еще более предпочтительно активностью ALK, который включает введение млекопитающему эффективного количества замещенного соединения индазола, представленного формулой (I), как определено выше. Предпочтительный способ согласно настоящему изобретению представляет собой способ лечения заболевания, вызванного и/или связанного с разрегулированной активностью протеинкиназы, выбранного из группы, состоящей из рака и пролиферативных нарушений. Другой предпочтительный способ согласно настоящему изобретению представляет собой способ лечения определенных типов рака, включая карциному, плоскоклеточный рак, гематопоэтические опухоли миелоидного или лимфоидного происхождения, опухоли мезенхимального происхождения, опухоли центральной и периферической нервной системы, меланому, семиному, тератокарциному, остеосаркому, пигментную ксеродерму, кератокантомы, фолликулярный рак щитовидной железы и саркому Капоши. Другой предпочтительный способ согласно настоящему изобретению представляет собой способ лечения определенных типов рака, такого как, но не ограничиваясь ими, рак молочной железы, рак легкого, рак ободочной и прямой кишки, рак предстательной железы, рак яичника, рак эндометрия, рак желудка, светлоклеточный рак почки, увеальная меланома, множественная миелома, рабдомиосаркома,саркома Юинга, саркома Капоши и медуллобластома. Другой предпочтительный способ согласно настоящему изобретению представляет собой способ лечения ALK+ анапластических крупноклеточных лимфом (ALCL) и возможно других показаний, в которых может играть роль активность ALK, таких как нейробластома, рабдомиосаркома, глиобластома,воспалительная миофибробластическая опухоль и некоторые меланомы, виды рака молочной железы,саркомы Юинга, ретинобластомы и виды немелкоклеточного рака легкого (NSCLC). Другой предпочтительный способ согласно настоящему изобретению представляет собой способ лечения пролиферативных нарушений, таких как, но не ограничиваясь ими, доброкачественная гиперплазия предстательной железы, семейный аденоматоз, полипоз, нейрофиброматоз, псориаз, атеросклероз, и состояний, в которых участвует пролиферация гладкомышечных клеток сосудов или образование неоинтимы, таких как рестеноз после пластической операции на сосудах или хирургии, легочный фиброз, артрит, гломерулонефрит, ретинопатия, включая диабетические и ретинопатии новорожденных, и возрастная дегенерация желтого пятна, заболевание сосудистого трансплантата, такое как после трансплантации сосуда или органа, акромегалия и нарушения, вторичные по отношению к акромегалии, а также другие гипертрофические состояния, в которых участвует передача сигналов IGF/IGF-1R, такие как фиброзное заболевание легкого, патологии, связанные с хроническим или острым окислительным стрессом, или индуцированное гипероксией повреждение ткани, и метаболические нарушения, в которых участвуют повышенные уровни IGF или активность IGF-1R, такие как ожирение. Кроме того, способ согласно настоящему изобретению также обеспечивает ингибирование ангиогенеза и метастазирования опухоли. В другом предпочтительном варианте осуществления способ согласно настоящему изобретению дополнительно включает применение к млекопитающему лучевой терапии или химиотерапии в комбинации по меньшей мере с одним цитостатическим или цитотоксическим средством. Кроме того, изобретение относится к способу ингибирования активности белка ALK, который включает контактирование указанного белка с эффективным количеством соединения формулы (I). Настоящее изобретение также относится к фармацевтической композиции, включающей одно или более соединений формулы (I)или его фармацевтически приемлемую соль и фармацевтически приемлемый эксципиент, носитель или разбавитель. Настоящее изобретение также относится к фармацевтической композиции, включающей соединение формулы (I) в комбинации с одним или более химиотерапевтическими средствами или лучевой терапией. Такие средства могут включать, но не ограничены ими, антигормональные средства, такие как антиэстрогены, антиандрогены и ингибиторы ароматазы, ингибиторы топоизомеразы I, ингибиторы топоизомеразы II, агенты, нацеливающие микротрубочки, средства на основе платины, алкилирующие агенты, ДНК-повреждающие или встраивающие агенты, противоопухолевые антиметаболиты, другие ингибиторы киназы, другие антиангиогенные средства, ингибиторы кинезинов, терапевтические моноклональные антитела, ингибиторы mTOR, ингибиторы гистон деацетилазы, ингибиторы фарнезилтрансферазы и ингибиторы ответа на гипоксию. Дополнительно, изобретение относится к продукту или набору, включающему соединение формулы (I) или его фармацевтически приемлемую соль, как определено выше, или содержащие его фармацевтические композиции и одно или более химиотерапевтических средств, в качестве комбинированного препарата для одновременного, раздельного или последовательного применения в противораковой тера-3 018503 пии. В еще одном аспекте изобретение относится к соединению формулы (I) или его фармацевтически приемлемой соли, как определено выше, для применения в качестве лекарственного средства. Кроме того, изобретение относится к применению соединения формулы (I) или его фармацевтически приемлемой соли, как определено выше, для получения лекарственного средства с противоопухолевой активностью. Наконец, изобретение относится к соединению формулы (I) или к его фармацевтически приемлемой соли, как определено выше, для применения в способе лечения рака. Подробное описание изобретения Соединения формулы (I) могут иметь один или более асимметрических центров и могут поэтому существовать как индивидуальные оптические изомеры или рацемические смеси. Соответственно, все возможные изомеры и смеси соединений формулы (I) находятся в рамках настоящего изобретения. Производные соединений формулы (I), получаемые в результате метаболизма в организме млекопитающего, и фармацевтически приемлемые биопредшественники (иначе называемые пролекарствами) соединений формулы (I) также находятся в рамках настоящего изобретения. В дополнение к вышеуказанному, как известно специалисту, незамещенный азот на пиразольном кольце соединений формулы (I) быстро уравновешивается в растворе, образуя смесь таутомеров, как изображено ниже: где X, Ar, R, R1, R2 и R3 имеют значения, определенные выше. Соответственно, в настоящем изобретении, если для соединений формулы (I) обозначен только один таутомер, другой таутомер (IA) также находится в рамках настоящего изобретения, если специально не указано иное. Используемые здесь общие термины, если не указано иное, имеют значения, приведенные ниже. Термин "прямой или разветвленный C1-C6-алкил" относится к насыщенному алифатическому углеводородному радикалу, включая группы с прямой цепью и разветвленной цепью, содержащие от 1 до 6 атомов углерода, например метил, этил, пропил, 2-пропил, н-бутил, изобутил, трет-бутил, пентил и т.п. Алкильная группа может быть замещена или незамещена. Когда она замещена, группы заместителей предпочтительно насчитывают от одной до трех, независимо выбранных из группы, состоящей из галогена, C2-C6-алкенила, C2-C6-алкинила, циано, нитро, NHCOR4, COR4, NR5R6, NR5COR4, OR7, SR7, SOR10,SO2R10, NHSOR10, NHSO2R10, R8R9N-C1-C6-алкила, R8O-C1-C6-алкила, в случае необходимости дополнительно замещенного C3-C6-циклоалкила, гетероциклила и арила, причем R4, R5, R6, R7, R8, R9 и R10 имеют значения, определенные выше. Термин "C3-C6-циклоалкил" относится к 3-6-членному полностью углеродному моноциклическому кольцу, которое может содержать одну или более двойных связей, но не имеет полностью конъюгированной -электронной системы. Примерами циклоалкильных групп, без ограничения, являются циклопропил, циклобутил, циклопентил, циклопентенил, циклогексил, циклогексенил и циклогексадиенил. Циклоалкильная группа может быть замещена или незамещена. Когда она замещена, группы заместителей насчитывают предпочтительно один или два заместителя, независимо выбранных из группы, состоящей из галогена, C2-C6-алкенила, C2-C6-алкинила, циано, нитро, NHCOR4, COR4, NR5R6, NR5COR4,OR7, SR7, SOR10, SO2R10, NHSOR10, NHSO2R10, R8R9N-C1-C6-алкила, R8O-C1-C6-алкила, в случае необходимости дополнительно замещенного прямого или разветвленного C1-C6-алкила, C3-C6-циклоалкила, гетероциклила и арила, причем R4, R5, R6, R7, R8, R9 и R10 имеют значения, определенные выше. Термин "гетероциклил" относится к 3-7-членному, насыщенному или частично ненасыщенному карбоциклическому кольцу, где один или более атомов углерода заменены гетероатомами, такими как азот, кислород и сера. Неограничивающими примерами гетероциклильных групп являются, например,оксиранил, азиридинил, оксетанил, азетидинил, тетрагидрофуранил, дигидрофуранил, тетрагидротиофенил, дигидротиофенил, пирролидинил, дигидропирролил, пиранил, дигидропиранил, тетрагидропиранил,тетрагидротиопиранил, пиперидинил, пиразолинил, изоксазолидинил, изоксазолинил, тиазолидинил,тиазолинил, изотиазолинил, диоксанил, пиперазинил, морфолинил, тиоморфолинил, экзаметилениминил,гомопиперазинил и т.п. Гетероциклильная группа может быть замещена или незамещена. Если она замещена, группы заместителей насчитывают предпочтительно один или два заместителя, независимо выбранных из группы, состоящей из галогена, C2-C6-алкенила, C2-C6-алкинила, циано, нитро, NHCOR4,COR4, NR5R6, NR5COR4, OR7, SR7, SOR10, SO2R10, NHSOR10, NHSO2R10, R8R9N-C1-C6-алкила, R8O-C1-C6 алкила, в случае необходимости дополнительно замещенного прямого или разветвленного C1-C6-алкила,C3-C6-циклоалкила, гетероциклила и арила, причем R4, R5, R6, R7, R8, R9 и R10 имеют значения, опреде-4 018503 ленные выше. Термин "арил" относится к моно-, би- или поликарбоциклическому углеводороду, включающему от 1 до 4 кольцевых систем, в случае необходимости дополнительно конденсированных или связанных друг с другом простыми связями, в котором по меньшей мере одно из карбоциклических колец является "ароматическим", причем термин "ароматический" относится к системе полностью сопряженных-электронных связей. Неограничивающими примерами таких арильных групп являются фенил, - или-нафтил или бифенил. Термин "гетероарил" относится к ароматическим гетероциклическим кольцам, обычно 5-7-членным гетероциклам, имеющим от 1 до 3 гетероатомов, выбранных из N, О или S; гетероарильное кольцо может быть в случае необходимости дополнительно конденсировано или связано с ароматическими и неароматическими карбоциклическими и гетероциклическими кольцами. Неограничивающими примерами таких гетероарильных групп являются, например, пиридил, пиразинил, пиримидинил, пиридазинил, индолил,имидазолил, тиазолил, изотиазолил, пирролил, фенилпирролил, фурил, фенилфурил, оксазолил, изоксазолил, пиразолил, тиенил, бензотиенил, изоиндолинил, бензоимидазолил, хинолинил, изохинолинил,1,2,3-триазолил,1-фенил-1,2,3-триазолил,2,3-дигидроиндолил,2,3-дигидробензофуранил,2,3-дигидробензотиофенил; бензопиранил, 2,3-дигидробензоксазинил, 2,3-дигидрохиноксалинил и т.п. Арильные и гетероарильные группы могут быть замещены одним или более, предпочтительно одним, двумя или тремя заместителями, независимо выбранными из галогена, C2-C6-алкенила,C2-C6-алкинила, циано, нитро, NHCOR4, COR4, NR5R6, NR5COR4, OR7, SR7, SOR10, SO2R10, NHSOR10,NHSO2R10, R8R9N-C1-C6-алкила, R8O-C1-C6-алкила, в случае необходимости дополнительно замещенного прямого или разветвленного C1-C6-алкила, C3-C6-циклоалкила, гетероциклила и арила, причем R4, R5, R6,R7, R8, R9 и R10 имеют значения, определенные выше. Термин "галоген" обозначает фтор, хлор, бром или йод. Термин "C2-C6-алкенил" обозначает алифатическую C2-C6-углеводородную цепь, которая содержит по меньшей мере одну углерод-углеродную двойную связь и которая может быть прямой или разветвленной. Репрезентативные примеры включают, но не ограничены ими, этенил, 1-пропенил, 2-пропенил,1- или 2-бутенил и т.п. Термин "C2-C6-алкинил" обозначает алифатическую C2-C6-углеводородную цепь, которая содержит по меньшей мере одну углерод-углеродную двойную связь и которая может быть прямой или разветвленной. Репрезентативные примеры включают, но не ограничены ими, этинил, 1-пропинил, 2-пропинил,1- или 2-бутинил и т.п. Термин "циано" обозначает остаток -CN. Термин "нитро" обозначает группу -NO2. Термин "фармацевтически приемлемая соль" соединений формулы (I) относится к солям, которые сохраняют биологическую эффективность и свойства родительского соединения. Такие соли включают соли присоединения с неорганическими кислотами, такими как хлористо-водородная, бромистоводородная, азотная, фосфорная, серная, хлорная кислоты и т.п., или с органическими кислотами, такими как уксусная, трифторуксусная, пропионовая, гликолевая, молочная, (D)- или (L)-яблочная, малеиновая,метансульфоновая, этансульфоновая, бензойная, п-толуолсульфоновая, салициловая, коричная, миндальная, винная, лимонная, янтарная, малоновая кислоты и т.п.; соли, образующиеся, когда кислотный протон, присутствующий в соединении формулы (I), заменяют ионом металла, например ионом щелочного металла, такого как натрий или калий, или ионом щелочно-земельного металла, такого как кальций или магний, или он координирует с органическим основанием, таким как этаноламин, диэтаноламин, триэтаноламин, трометамин, N-метилглюкамин и т.п. Соединения формулы (I), в которой X обозначает -CH2-, представлены общей формулой (IA) Соединения формулы (I), в которой X обозначает -CH(OH)-, представлены общей формулой (IB) Соединения формулы (I), в которой X обозначает -CH(OR')-, представлены общей формулой (IC) Соединения формулы (I), в которой X обозначает -C(R'R")-, представлены общей формулой (ID) Предпочтительным классом соединений формулы (I) являются соединения, в которыхX обозначает -CH2-, -CH(OH)-, -CH(OR')- или -C(R'R")-, где R' обозначает C1-C3-алкил и R" обозначает водород или C1-C3-алкил;R обозначает в случае необходимости замещенный C3-C6-циклоалкил, гетероциклил, арил или гетероарил иR1, R2 и R3 независимо обозначают водород, галоген или гидрокси. Другим предпочтительным классом соединений формулы (I) являются соединения, в которыхX обозначает -CH2-, -CH(OH)-, -CH(OR')- или -C(R'R")-, где R' обозначает метил и R" обозначает водород или метил иR1, R2 и R3 обозначают водород. Другим предпочтительным классом соединений формулы (I) являются соединения, в которых R обозначает в случае необходимости замещенный арил или гетероарил. Более предпочтительным классом соединений формулы (I) являются соединения, в которых в которой Ra, Rb и Rc независимо обозначают водород, галоген, C2-C6-алкенил, C2-C6-алкинил, циано, нитро, NHCOR4, COR4, NR5R6, NR5COR4, OR7, SR7, SOR10, SO2R10, NHSOR10, NHSO2R10, R8R9N-C1C6-алкил, R8O-C1-C6-алкил, в случае необходимости дополнительно замещенный прямой или разветвленный C1-C6-алкил, C3-C6-циклоалкил, гетероциклил, арил или гетероарил, причем R4, R5, R6, R7, R8, R9 и R10 имеют значения, определенные выше; иR обозначает в случае необходимости замещенный арил. Другим более предпочтительным классом соединений формулы (I) являются соединения, в которых в которой Ra и Rb имеют значения, определенные выше. Наиболее предпочтительным классом соединений формулы (I) являются соединения, в которых Ar обозначает группу формулы-6 018503 в которой Ra обозначает водород, галоген, нитро, NHCOR4 или NR5R6 и Rb обозначает водород,нитро, NR5R6, OR7 или R8R9N-C1-C6-алкил, причем R4, R5, R6, R7, R8 и R9 имеют значения, определенные выше. Конкретные соединения по изобретения указаны ниже: 1) N-(5-бензил-1H-индазол-3-ил)-4-(4-метилпиперазин-1-ил)бензамид; 2) N-[5-(3-фторбензил)-1H-индазол-3-ил]-4-(4-метилпиперазин-1-ил)бензамид; 3) N-[5-(2,5-дифторбензил)-1H-индазол-3-ил]-4-(4-метилпиперазин-1-ил)бензамид; 4) N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-4-(4-метилпиперазин-1-ил)бензамид; 5) N-[5-(3-фторбензил)-1H-индазол-3-ил]-4-(4-метилпиперазин-1-ил)-2-нитробензамид; 6) N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-4-(4-метилпиперазин-1-ил)-2-нитробензамид; 7) 2-амино-N-[5-(3-фторбензил)-1H-индазол-3-ил]-4-(4-метилпиперазин-1-ил)бензамид; 8) 2-амино-N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-4-(4-метилпиперазин-1-ил)бензамид; 9)N-[5-(3,5-дифторбензил)-1H-индазол-3-ил]-2-фтор-5-[(R)-2-пирролидин-1 илметилпирролидин-1-карбонил)бензамид). Предпочтительным конкретным соединением по изобретению является N-[5-(3,5-дифторбензил)1H-индазол-3-ил]-4-(4-метилпиперазин-1-ил)-2-(тетрагидропиран-4-иламино)бензамид. Настоящее изобретение также относится к способу получения соединения формулы (I) как определено выше, отличающемуся тем, что способ включает:i) восстановление карбонильного соединения формулы (II) в которой Ar, R, R1, R2 и R3 имеют значения, определенные выше,с получением соединения формулы (IA), (IB) или (IC):i') введение в реакцию соединения формулы (IIIA), (IIIB), (IIIC) или (IIID):Y обозначает гидрокси или подходящую удаляемую группу, такую как галоген,- 11018503 с получением соединения формулы (I), как определено выше; илиi") удаление защитной группы от соединения формулы (XXIIA), (XXIIC) или (XXIID):PG обозначает подходящую защитную группу, такую как бензил,о,п-диметоксибензил или трифенилметил,с получением соединения формулы (IA), (IC) или (ID): п-метоксибензил, в которых Ar, R, R1, R2, R3, R' и R" имеют значения, определенные выше,в случае необходимости разделение полученного соединения на отдельные изомеры, превращение соединения формулы (I) в другое соединение формулы (I) и/или в фармацевтически приемлемую соль, если это желательно. Настоящее изобретение также относится к способу получения соединения формулы (IA), (IB) или(IC), как определено выше, отличающемуся тем, что соединение формулы (II), как определено выше, получают согласно следующим стадиям: а) введение соединения формулы (XII) в которой R1, R2 и R3 имеют значения, определенные выше,в реакцию с металлоорганическим соединением формулы RMgZ (XIII), а именно, реактивом Гриньяра, в котором R имеет значения, определенные выше, и Z обозначает галоген, с получением соединения формулы (XI)b) окисление полученного соединения формулы (XI) с получением соединения формулы (X) в которой R, R1, R2 и R3 имеют значения, определенные выше; с) введение полученного соединения формулы (X) в реакцию с гидратом гидразина с получением соединения формулы (IX)d) защита полученного соединения формулы (IX) с получением соединения формулы (VIII)PG1 обозначает подходящую защитную группу, такую как трифторацетил; е) защита полученного соединения формулы (VIII) с получением соединения формулы (VII)f) удаление защитной группы PG1 из полученного соединения формулы (VII) с получением соединение формулы (VI)g) введение полученного соединения формулы (VI) в реакцию с соединением формулы (IV), как определено выше, с получением соединения формулы (V)h) удаление защитной группы из полученного соединения формулы (V) с получением соединения формулы (II), как определено выше. Настоящее изобретение также относится способу получения соединения формулы (IA), как определено выше, отличающемуся тем, что соединение формулы (IIIA), как определено выше, получают согласно следующим стадиям:j) восстановление соединения формулы (XI), как определено выше, в присутствии подходящего реактива, такого как, например, NaI и Me3SiCl, с получением соединения формулы (XIV)k) введение соединения бороновой кислоты формулы (XV)W обозначает атом галогена, такой как бром или йод, или подходящую удаляемую группу, такую как сульфонаты, такие как метансульфонат или трифторметансульфонат, или фосфаты в присутствии подходящего катализатора, такого как катализатор на основе палладия,с получением соединения формулы (XIV), как определено выше;l) введение полученного соединения формулы (XIV) в реакцию с гидратом гидразина с получением соединения формулы (IIIA), как определено выше. Настоящее изобретение также относится к способу получения соединения формулы (IB), как определено выше, отличающемуся тем, что соединение формулы (IIIB), как определено выше, получают согласно следующим стадиям:l') введение соединения формулы (XI), как определено выше, в реакцию с гидратом гидразина с получением соединения формулы (IIIB), как определено выше. Настоящее изобретение также относится к способу получения соединения формулы (IC), как определено выше, отличающемуся тем, что соединение формулы (IIIC), как определено выше, получают согласно следующим стадиям:m) введение соединения формулы (XI), как определено выше, в реакцию с электрофильным алкилирующим агентом формулы (XVIII)W обозначает атом галогена, такой как хлор, бром или йод, или подходящую удаляемую группу,такую как сульфонаты, такие как метансульфонат или трифторметансульфонат,с получением соединения формулы (XVII)l") введение полученного соединения формулы (XVII) в реакцию с гидратом гидразина с получением соединения формулы (IIIC), как определено выше. Настоящее изобретение также относится к способу получения соединения формулы (ID), как определено выше, отличающемуся тем, что соединение формулы (IIID1), в котором R" обозначает водород,имеет формулу в которой R, R1, R2, R3 и R' имеют значения, определенные выше, получают согласно следующим стадиям:n) введение соединение формулы (XIV), определенной выше, в реакцию с соединением формулыl) введение полученного соединения формулы (XIXD1) в которой R, R1, R2, R3 и R' имеют значения, определенные выше,в реакцию с гидратом гидразина с получением соединения формулы (IIID1), как определено выше; илиo) введение соединения формулы (XXI)p) восстановление полученного соединения формулы (XX) с получением соединения формулы(XIXD1), как определено выше. Настоящее изобретение также относится к способу получения соединения формулы (ID), как определено выше, отличающемуся тем, что соединение формулы (IIID2), в котором R" имеет значения, определенные выше, но не является водородом, имеющее формулуq) введение соединения формулы (XIXD1), как определено выше, в реакцию с электрофильным алкилирующим агентом формулы (XXIII) в которой R" и W' имеют значения, определенные выше,с получением соединения формулы (XIXD2)R" имеет значения, определенные выше, но не является водородом;lIV) введение полученного соединения формулы (XIXD2) в реакцию с гидратом гидразина с получением соединения формулы (IIID2), как определено выше. Настоящее изобретение также относится к способу получения соединения формулы (IA), (IC) или(ID), как определено выше, отличающемуся тем, что соединение формулы (XXIIA), (XXIIC) или (XXIID),как определено выше, получают согласно следующим стадиям:r) защита соединения формулы (IIIA), (IIIC) или (IIID), как определено выше, с получением соединения формулы (XXIVA), (XXIVC) или (XXIVD):s) защита полученного соединения формулы (XXIVA), (XXIVC) или (XXIVD) с получением соединения формулы (XXVA), (XXVC) или (XXVD):t) удаление защитной группы PG1 из полученного соединения формулы (XXVA), (XXVC) или(XXVD) с получением соединения формулы (XXVIA), (XXVIC) или (XXVID):u) введение полученного соединения формулы (XXVIA), (XXVIC) или (XXVID) в реакцию с соединением формулы (IV), как определено выше, с получением соединения формулы (XXIIA), (XXIIC) или(XXIID), как определено выше. Должно быть отмечено, что соединение формулы (V), как определено выше, может быть в любой из его изомерных форм а или b или в виде смеси обеих форм: Аналогично, соединение формулы (XXIIA), (XXIIC), (XXIID), (XXVA), (XXVC), (XXVD), (XXVIA),(XXVIC) и (XXVID), как определено выше, может быть в любой из его изомерных форм а или b. Соединение формулы (II), (V), (XXIIA), (XXIIC) и (XXIID) может быть преобразовано в другое соединение формулы (II), (V), (XXIIA), (XXIIC) и (XXIID), причем указанное превращение выполняют путем одной или более из следующих реакций: 1) восстановление соединения формулы (II), (V), (XXIIA), (XXIIC) и (XXIID), в которой Ar обозначает замещенный арил и один из заместителей представляет собой NO2, с получением соединения формулы(II), (V), (XXIIA), (XXIIC) и (XXIID), в которой такой заместитель представляет собой NH2; 2) ацилирование соединения формулы (II), (V), (XXIIA), (XXIIC) и (XXIID), в которой Ar обозначает замещенный арил и один из заместителей представляет собой NH2, реакцией с ацилирующим агентом формулы (XXVII) или (XXVIII): в которых R4 и Y имеют значения, определенные выше,с получением соединения формулы (II), (V), (XXIIA), (XXIIC) и (XXIID), в которой такой заместитель представляет собой остаток NHCOR4 или NHSO2R4, причем R4 имеет значения, определенные выше; 3) введение соединения формулы (II), (V), (XXIIA), (XXIIC) и (XXIID), в которой Ar обозначает замещенный арил и один из заместителей представляет собой NH2, в реакцию с подходящим альдегидом или кетоном в присутствии восстановителя, с получением соединения формулы (II), (V), (XXIIA), (XXIIC) и (XXIID), в которой такой заместитель представляет собой группу NR5R6, в которой один из R5 или R6 обозначает водород, а другой обозначает в случае необходимости дополнительно замещенный прямой или разветвленный C1-C6-алкил, C3-C6-циклоалкил, гетероциклил, арил, R8R9N-C2-C6-алкил, R8O-C2-C6 алкил, причем R8 и R9 имеют значения, определенные выше. Соединение формулы (I) может быть преобразовано в другое соединение формулы (I), причем указанное превращение выполняют путем одной или более из следующих реакций: 4) восстановление соединения формулы (I), в которой Ar обозначает замещенный арил и один из заместителей представляет собой NO2, с получением соединения формулы (I), в которой такой заместитель представляет собой NH2; 5) ацилирование соединения формулы (I), в которой Ar обозначает замещенный арил и один из заместителей представляет собой NH2, реакцией с соединением формулы (XXVII) или (XXVIII), как определено выше, с последующим селективным удалением защитной группы для ацильной группы на пиразольном кольце с получением соединения формулы (I), в которой такой заместитель представляет собой остаток NHCOR4 или NHSO2R4, в котором R4 имеет значения, определенные выше; 6) введение соединения формулы (I), в которой Ar обозначает замещенный арил и один из заместителей представляет собой NH2, в реакцию с подходящим альдегидом или кетоном в присутствии восстановителя, с получением соединения формулы (I), в которой такой заместитель представляет собой группу NR5R6, в которой один из R5 или R6 имеет значения, определенные, как в случае превращения 3). Синтез соединения формулы (I) согласно способу синтеза, описанному выше, может осуществляться постадийно, причем каждое промежуточное соединение выделяют и очищают стандартными методами очистки, такими как, например, хроматография на колонках, перед выполнением последующей реак- 16018503 ции. Альтернативно, две или более стадии последовательного синтеза могут быть выполнены в так называемой процедуре "с одним резервуаром", как известно из уровня техники, причем только соединение,получаемое в результате двух или более стадий, выделяют и очищают. Схемы 1-4 ниже демонстрируют получение соединения формулы (I), в которой X, Ar, R, R1, R2 и R3 имеют вышеуказанные значения. Схема 1 Согласно стадии i) соединение формулы (IA), (IB) или (IC) может быть получено восстановлением соединения формулы (II) различными путями и в различных экспериментальных условиях, известных в данной области. Предпочтительно это восстановление проводят в присутствии боргидрида натрия, цианоборгидрида натрия, боргидрид натрия/трифторуксусная кислота, цинк/соляная кислота, хлорид олова/уксусная кислота, в подходящем растворителе, таком как толуол, дихлорметан, хлороформ, простой диэтиловый эфир, тетрагидрофуран, 1,4-диоксан, метанол, этанол, изопропанол, уксусная кислота, при температуре в пределах от приблизительно -10C до температуры кипения растворителя и в течение времени, варьирующего от приблизительно 1 до приблизительно 96 ч. Согласно экспериментальным условиям соединение формулы (IA), (IB) или (IC) может быть выделено как основной продукт. Согласно стадии i') соединение формулы (IA), (IB), (IC) или (ID) может быть получено введением соединения формулы (IIIA), (IIIB), (IIIC) или (IIID) в реакцию с соединением формулы (IV) различными путями и в различных экспериментальных условиях, которые широко известны в данной области применительно к реакциям конденсации. Предпочтительно соединение формулы (IV), в которой Y обозначает гидрокси, превращают в его соответствующий ацилхлорид, в котором Y обозначает хлор, в присутствии тионилхлорида или оксалилхлорида, в подходящем растворителе, таком как толуол, дихлорметан, хлороформ, простой диэтиловый эфир, тетрагидрофуран, 1,4-диоксан, при температуре в пределах от приблизительно -10C до температуры кипения растворителя и в течение времени, варьирующего от приблизительно 1 до приблизительно 96 ч. Ацилхлорид выделяют выпариванием растворителя и далее вводят в реакцию с (IIIA), (IIIB), (IIIC) или (IIID) в присутствии основания, такого как пиридин, триэтиламин или N-этилдиизопропиламин, в подходящем растворителе, таком как толуол, дихлорметан, хлороформ,простой диэтиловый эфир, тетрагидрофуран, 1,4-диоксан, при температуре в пределах от приблизительно -40C до температуры кипения растворителя и в течение времени, варьирующего от приблизительно 1 до приблизительно 96 ч. Альтернативно, соединение формулы (IV) вводят в реакцию с соединением формулы (IIIA), (IIIB), (IIIC) или (IIID) в присутствии активатора, такого как гидроксибензотриазол, дициклогексил карбодиимид, диизопропил карбодиимид, 1-этил-3-(3'-диметиламино)карбодиимид гидрохлорид. Предпочтительно эту реакцию проводят в подходящем растворителе, таком как, например, тетрагидрофуран, дихлорметан, толуол, 1,4-диоксан, и в присутствии акцептора протонов, такого как, например, пиридин, триэтиламин, N,N-диизопропилэтиламин, при температуре в пределах от температуры окружающей среды до температуры кипения растворителя и в течение времени, варьирующего от приблизительно 30 мин до приблизительно 96 ч. Согласно стадии i) соединение формулы (IA), (IC) или (ID) может быть получено удалением защитной группы из соединения формулы (XXIIA), (XXIIC) или (XXIID) различными путями и в различных экспериментальных условиях, которые широко известны в данной области. Предпочтительно в случае остатка ацила эту реакцию проводят в основных условиях, например в присутствии гидроксида натрия,гидроксида калия, гидроксида лития или гидроксида бария, или третичного амина, такого как триэтиламин или диизопропилэтиламин, или гидразина, и в подходящем растворителе, таком как метанол, этанол, тетрагидрофуран, N,N-диметилформамид, вода и их смеси. Как правило, реакцию проводят при температуре в пределах от температуры окружающей среды до температуры кипения растворителя и в течение времени, варьирующего от приблизительно 30 мин до приблизительно 96 ч. В случае, если PG обозначает подходящую защитную группу, такую как бензил, п-метоксибензил, о,п-диметоксибензил или трифенилметил, превращение может быть осуществлено в условиях, аналогичных описанным на стадии h). Согласно стадии а) превращение соединения формулы (XII) в соединение формулы (XI) может быть осуществлено различными путями и в различных экспериментальных условиях согласно обычным способам, которые широко известны в литературе при использовании реактивов Гриньяра формулы(XIII). Предпочтительно реакцию соединения формулы (XII) с металлорганическими реактивами проводят в подходящем растворителе, таком как, например, тетрагидрофуран, 1,4-диоксан и простой диэтиловый эфир, при температуре в пределах от -78C до температуры окружающей среды и в течение времени,варьирующего от приблизительно 30 мин до приблизительно 96 ч. Согласно стадии b) окисление соединения формулы (XI) до соединения формулы (X) может быть выполнено различными путями, согласно обычным способам для окисления спиртов до кетонов. Предпочтительно эту реакцию проводят в подходящем растворителе, таком как, например, метанол, этанол,трет-бутанол, вода, тетрагидрофуран, 1,4-диоксан, толуол, уксусная кислота, трифторуксусная кислота,дихлорметан, дихлорэтан, ацетонитрил, диметилсульфоксид или их смеси, в присутствии подходящего окислителя, такого как, например, 3-хлорпербензойная кислота, пероксид водорода, перйодинан ДессаМартина, оксон, перманганат калия, перйодат натрия, йодная кислота и каталитический оксид хрома(VI), тетрапропиламмоний перрутенат, хлорид рутения. Как правило, реакцию проводят при температуре в пределах от -78C до температуры кипения растворителя и в течение времени, варьирующего от приблизительно 30 мин до приблизительно 96 ч. Согласно стадии с) превращение соединения формулы (X) в соединение формулы (IX) может быть осуществлено различными путями и в различных экспериментальных условиях, которые широко известны в области получения 3-аминоиндазолов. Предпочтительно реакцию соединения формулы (X) с гидразином проводят в подходящем растворителе, таком как, например, толуол, тетрагидрофуран,1,4-диоксан, диметилсульфоксид, ацетонитрил, метанол, этанол или н-бутанол при температуре в пределах от 0C до температуры кипения растворителя и в течение времени, варьирующего от 1 до приблизительно 96 ч. Добавление кислоты, такой как, предпочтительно соляная кислота или уксусная кислота,может потребоваться, чтобы катализировать реакцию. Согласно стадии d) соединение формулы (IX) может быть преобразовано в соединение формулы(VIII) различными путями и в различных экспериментальных условиях, которые широко известны в области защиты первичной аминогруппы. Предпочтительно реакцию проводят путем обработки избытком трифторуксусного ангидрида или хлорангидрида трифторуксусной кислоты в подходящем растворителе,таком как ацетонитрил, тетрагидрофуран, толуол, дихлорметан. Как правило, реакцию проводят при температуре от 0 до приблизительно 110C и в течение времени, варьирующего от приблизительно 30 мин до приблизительно 96 ч. Обработка реакционной смеси протонным растворителем, таким как,например, вода, метанол, этанол, или их смесями или водным раствором гидрокарбоната натрия приводит к селективному гидролизу трифторацетильной группы на индазольном кольце. В случае получения фталимидного производного реакцию проводят путем обработки фталевым ангидридом в основных условиях, например в присутствии 1,8-диазабицикло[5.4.0]ундец-7-ена, N,N-диметиламинопиридина, пиридина, триэтиламина, и в подходящем растворителе, таком как ацетонитрил, тетрагидрофуран,N,N-диметилформамид, толуол, дихлорметан, вода и их смеси. Как правило, реакцию проводят при температуре в пределах от температуры окружающей среды до приблизительно 110C и в течение времени,варьирующего от приблизительно 30 мин до приблизительно 96 ч. Согласно стадии е) реакция соединения формулы (VIII) с получением соединения формулы (VII) может быть осуществлена различными путями и в различных экспериментальных условиях. Предпочтительно, когда PG обозначает трифенилметильную группу, реакцию проводят путем обработки трифенилхлорметаном в подходящем растворителе, таком как, например, тетрагидрофуран, дихлорметан, толуол,1,4-диоксан,и в присутствии акцептора протонов,такого как предпочтительно 1,8-диазабицикло[5.4.0]ундец-7-ен, триэтиламин, N,N-диизопропилэтиламин, пиридин, при температуре в пределах от температуры окружающей среды до температуры кипения растворителя и в течение времени, варьирующего от приблизительно 30 мин до приблизительно 96 ч. Согласно стадии f) соединение формулы (VII) может быть преобразовано в соединение формулы(VI) удалением подходящей защитной группы, такой как трифторацетильная группа, согласно обычным способам. Предпочтительно реакцию проводят путем обработки органическим или неорганическим основанием,таким как карбонат калия,гидроксид натрия,аммиак,триэтиламин,N,N-диизопропилэтиламин, в подходящем растворителе, таком как, например, тетрагидрофуран, дихлорметан, толуол, 1,4-диоксан, метанол, этанол, вода или их смеси, при температуре в пределах от температуры окружающей среды до температуры кипения растворителя и в течение времени, варьирующего от приблизительно 30 мин до приблизительно 96 ч. Согласно стадии g) соединение формулы (VI) может быть преобразовано в соединение формулы(V) различными путями и в различных экспериментальных условиях, которые широко известны в области реакций конденсации. Предпочтительно превращение осуществляют путем, аналогичным описанному для стадии i'). Согласно стадии h) соединение формулы (V) может быть преобразовано в соединение формулы (II) удалением защитной группы для атома азота эндоциклического индазола согласно обычным способам,позволяющим осуществить селективный гидролиз бензильной,4-метоксибензильной,2,4-диметоксибензильной и трифенилметильной защитных групп. Предпочтительно эту реакцию проводят в кислых условиях, предпочтительно в присутствии неорганической или органической кислоты, такой как хлористо-водородная, трифторуксусная или метансульфоновая кислоты, в подходящем растворителе, таком как дихлорметан, 1,4-диоксан, низший спирт, такой как метанол или этанол, при температуре в пределах от температуры окружающей среды до приблизительно 80C и в течение времени, варьирующего от приблизительно 1 ч до приблизительно 48 ч. В альтернативном варианте, эти реакции проводят в восстановительных условиях, например в присутствии водорода и гидрирующего катализатора в подходящем растворителе, таком как этанол, метанол, этилацетат или их смесь. Катализатор обычно представляет собой металл, чаще всего такой, как производное палладия, например гидроксид палладия или палладиевая чернь. Согласно стадии j) восстановление соединения формулы (XI) до соединения формулы (XIV) может быть выполнено различными путями, согласно обычным способам восстановления спиртов до алкана. Предпочтительно эту реакцию проводят в подходящем растворителе, таком как, например, метанол, этанол, тетрагидрофуран, 1,4-диоксан, уксусная кислота, дихлорметан, ацетонитрил или их смеси, в присутствии подходящей восстанавливающей системы, такой как, например, триметилсилил хлорид/йодид натрия, дихлордиметилсилан/йодид натрия, триэтилсилан/трифторуксусный ангидрид, боргидрид натрия/трифторуксусная кислота. Как правило, реакцию проводят при температуре в пределах от -10C до температуры кипения растворителя и в течение времени, варьирующего от приблизительно 30 мин до приблизительно 96 ч. Согласно стадии k) превращение соединения формулы (XV) в соединение формулы (XIV) в присутствии соединения формулы (XVI) может быть осуществлено различными путями согласно обычным способам сочетания производных бора, а именно Suzuki-подобными реакциями. Предпочтительно эту реакцию проводят в подходящем растворителе, таком как, например, этанол, вода, тетрагидрофуран, диоксан,ацетон, N,N-диметилформамид, диметоксиэтан, толуол, ксилол или их смеси, в присутствии подходяще- 20018503 го основания, такого как, например, триэтиламин, диизопропилэтиламин, карбоната натрия, калия или цезия, фосфат калия, гидроксид натрия или фторид цезия, при температуре в пределах от -20C до температуры кипения растворителя и в течение времени, варьирующего от 1 до приблизительно 96 ч. Катализатором обычно является металл, чаще всего такой как производное палладия, например хлорид палладия или ацетат палладия, в присутствии подходящего лиганда, такого как, например, трифенилфосфин. Согласно стадии l) превращение соединения формулы (XIV) в соединение формулы (IIIA) может быть осуществлено различными путями и в различных экспериментальных условиях. Предпочтительно его осуществляют путем, аналогичным описанному для стадии с). Согласно стадии l') превращение соединения формулы (XI) в соединение формулы (IIIB) может быть осуществлено различными путями и в различных экспериментальных условиях. Предпочтительно его осуществляют путем, аналогичным описанному для стадии с). Согласно стадии m) превращение соединения формулы (XI) в соединение формулы (XVII) в присутствии соединения формулы (XVIII) может быть осуществлено различными путями согласно обычным способам осуществления реакций О-алкилирования. Предпочтительно эту реакцию проводят в подходящем растворителе, таком как, например, тетрагидрофуран, диоксан, N,N-диметилформамид, диметоксиэтан, в присутствии подходящего основания, такого как, например, триэтиламин, диизопропилэтиламин,карбонат натрия, калия или цезия, гидрид натрия, при температуре в пределах от -78C до температуры кипения растворителя и в течение времени, варьирующего от 1 до приблизительно 96 ч. Алкилирующим агентом обычно является галоген или производное сульфонатов; чаще всего удаляемая группа представляет собой йод, бром, трифлат или мезилат. Согласно стадии l) превращение соединения формулы (XVII) в соединение формулы (IIIC) может бытьосуществлено различными путями и в различных экспериментальных условиях. Предпочтительно его осуществляют путем, аналогичным описанному для стадии с). Согласно стадии n) превращение соединения формулы (XIV) в соединение формулы (XIXD1) в присутствии соединения формулы (XVIII) может быть осуществлено различными путями согласно обычным способам осуществления реакций С-алкилирования. Предпочтительно его осуществляют путем, аналогичным описанному для стадии m). Согласно стадии l) превращение соединения формулы (XIXD1) в соединение формулы (IIID1) может быть осуществлено различными путями и в различных экспериментальных условиях. Предпочтительно, его осуществляют путем, аналогичным описанному для стадии с). Согласно стадии o) превращение соединения формулы (XXI) в соединение формулы (XX) в присутствии соединения формулы (XIII) может быть осуществлено различными путями и в различных экспериментальных условиях. Предпочтительно его осуществляют путем, аналогичным описанному для стадии а). Согласно стадии р) превращение соединения формулы (XX) в соединение формулы (XIXD1) может быть осуществлено различными путями и в различных экспериментальных условиях. Предпочтительно его осуществляют путем, аналогичным описанному для стадии j). Согласно стадии q) превращение соединения формулы (XIXD1) в соединение формулы (XIXD2) в присутствии соединения формулы (XXIII) может быть осуществлено различными путями и в различных экспериментальных условиях. Предпочтительно его осуществляют путем, аналогичным описанному для стадии m). Согласно стадии LIV) превращение соединения формулы (XIXD2) в соединение формулы (IIID2) может быть осуществлено различными путями и в различных экспериментальных условиях. Предпочтительно его осуществляют путем, аналогичным описанному для стадии с). Согласно стадии r) соединение формулы (IIIA), (IIIC) или (IIID) может быть преобразовано в соединение формулы (XXIVA), (XXIVC) или (XXIVD) различными путями и в различных экспериментальных условиях, которые широко известны в области защиты первичной аминогруппы. Предпочтительно это превращение осуществляют путем, аналогичным описанному для стадии d). Согласно стадии s) реакция соединения формулы (XXIVA), (XXIVC) или (XXIVD), чтобы получить соединение формулы (XXVA), (XXVC) или (XXVD), может быть осуществлена различными путями и в различных экспериментальных условиях. Предпочтительно ее осуществляют путем, аналогичным описанному для стадии е). Согласно стадии t) соединение формулы (XXVA), (XXVC) или (XXVD) может быть преобразовано в соединение формулы (XXVIA), (XXVIC) или (XXVID) удалением подходящей защитной группы, такой как трифторацетильная группа, согласно обычным способам. Предпочтительно это превращение осуществляют путем, аналогичным описанному для стадии f). Согласно стадии u) соединение формулы (XXVIA), (XXVIC) или (XXVID) может быть преобразовано в соединение формулы (XXIIA), (XXIIC) или (XXIID) различными путями и в различных экспериментальных условиях, которые широко известны в области реакций конденсации. Предпочтительно это превращение осуществляют путем, аналогичным описанному для стадии i'). Согласно преобразованию, описанному в l), восстановление соединения формулы (II), (V), (XXIIA),(XXIIC) или (XXIID), в которой Ar обозначает замещенный арил и один из заместителей представляет собой нитро, до соединения формулы (II), (V), (XXIIA), (XXIIC) или (XXIID), в которой такой заместитель представляет собой амино, может быть осуществлено различными путями согласно обычным способам,известным в литературе. Предпочтительно это превращение осуществляют в подходящем растворителе,таком как, например, метанол, этанол, вода, тетрагидрофуран, 1,4-диоксан, N,N-диметилформамид, уксусная кислота или их смесь, в присутствии подходящего восстановителя, такого как, например, водород, и гидрирующего катализатора, или обработкой циклогексеном или циклогексадиеном, или муравьиной кислотой или формиатом аммония и гидрирующим катализатором, или металлом, таким как железо или цинк, в присутствии неорганической кислоты, такой как соляная кислота, или обработкой хлоридом олова (II), при температуре в пределах от 0C до температуры кипения растворителя и в течение времени, варьирующего от 1 до приблизительно 96 ч. Гидрирующим катализатором обычно является металл,чаще всего палладий, который может использоваться в чистом виде или на угле в качестве носителя. Согласно преобразованию, описанному в 2), ацилирование соединения формулы (II), (V), (XXIIA),(XXIIC) или (XXIID), в которой Ar обозначает замещенный арил и один из заместителей представляет собой амино, реакцией с ацетилирующим реагентом формулы (XXVII) или (XXVIII), с получением соединения формулы (II), (V), (XXIIA), (XXIIC) или (XXIID), в которой такой заместитель представляет собой остаток NHCOR4 или NHSO2R4, может быть осуществлено различными путями согласно обычным способам, известным в литературе. Предпочтительно это превращение осуществляют путем, аналогичным описанному для стадии i'). Согласно преобразованию, описанному в 3), восстановительное аминирование соединения формулы (II), (V), (XXIIA), (XXIIC) или (XXIID), в которой Ar обозначает замещенный арил и один из заместителей представляет собой амино, реакцией с подходящим альдегидом или кетоном может быть осуществлено различными путями согласно обычным способам гидроалкилирования. Предпочтительно эту реакцию проводят в подходящем растворителе, таком как, например, метанол, N,N-диметилформамид, дихлорметан, тетрагидрофуран или их смеси, в присутствии подходящего восстановителя, такого как, например, боргидрид натрия, тетраалкиламмоний боргидрид, цианоборгидрид натрия, триацетоксиборгидрид натрия, тетраметиламмоний триацетоксиборгидрид, и в присутствии кислотного катализатора, такого как, например, уксусная кислота или трифторуксусная кислота, при температуре в пределах от приблизительно 0C до температуры кипения растворителя и в течение времени, варьирующего от 1 до приблизительно 96 ч. Согласно преобразованию, описанному в 4), восстановление соединения формулы (I), в которой Ar обозначает замещенный арил и один из заместителей представляет собой нитро, до соединения формулы(I), в которой такой заместитель представляет собой амино, может быть осуществлено различными путями согласно обычным способам, известным в литературе. Предпочтительно это превращение осуществляют путем, аналогичным описанному для преобразования 1). Согласно преобразованию, описанному в 5), ацилирование соединения формулы (I), в которой Ar обозначает замещенный арил и один из заместителей представляет собой амино, реакцией с ацетилирующим реагентом формулы (XXVII) или (XXVIII), с получением соединения формулы (I), в которой такой заместитель представляет собой остаток NHCOR4 или NHSO2R4, может быть осуществлено различными путями согласно обычным способам, известным в литературе. Предпочтительно это превращение осуществляют путем, аналогичным описанному для преобразования 2). Согласно преобразованию, описанному в 6), восстановительное аминирование соединения формулы (I), в которой Ar обозначает замещенный арил и один из заместителей представляет собой амино, реакцией с подходящим альдегидом или кетоном может быть осуществлено различными путями согласно обычным способам гидроалкилирования. Предпочтительно эту реакцию проводят в условиях, аналогичных описанным для преобразования 3). Специалисту известно, что, когда соединение формулы (IV) или формулы (XXVII) несет функциональные группы, которые могут препятствовать реакции ацилирования, такие группы должны быть защищены перед выполнением реакции. В частности, когда соединение формулы (IV) или формулы(XXVII) замещено остатками общей формулы NR5R6, OR7, SR7, R8R9N-C1-C6-алкил или R8O-C1-C6-алкил,в которых R7, или по меньшей мере один из R5 и R6, или по меньшей мере один из R8 и R9 обозначает водород, такие группы могут быть защищены, как известно в данной области. Специалисту также известно, что такая защитная группа может быть удалена только после реакции или на более поздней стадии способа синтеза. Удаление защитной группы из соединения формулы (I), (XXIIA), (XXIIC) или (XXIID), в которой Ar обозначает замещенный арил и один из заместителей представляет собой защищенную аминогруппу,может быть осуществлено различными путями согласно обычным способам удаления защитных групп для аминогрупп. В зависимости от защитной группы для аминогруппы, эта реакция может проводиться по-разному. В одном аспекте такая реакция может быть осуществлена путем обработки неорганической кислотой, такой как хлористо-водородная, серная или хлорная кислота, или органической кислотой, такой как трифторуксусная или метансульфоновая кислота, в подходящем растворителе, таком как вода,метанол, этанол, 1,4-диоксан, тетрагидрофуран, простой диэтиловый эфир, простой диизопропиловый эфир, ацетонитрил, N,N-диметилформамид, дихлорметан или в их смесях, при температуре от -10 до 80C и в течение времени в пределах от 30 мин до 48 ч. В другом аспекте такая реакция может быть осуществлена путем обработки неорганическим основанием, таким как гидроксид лития, или натрия, или калия либо карбонат натрия, или калия, или цезия, или органическим основанием, таким как триэтиламин или N,N-диизопропилэтиламин, или безводным гидразином или гидратом гидразина в подходящем растворителе, таком как вода, метанол, этанол, 1,4-диоксан, тетрагидрофуран, простой диэтиловый эфир, простой диизопропиловый эфир, ацетонитрил, N,N-диметилформамид, дихлорметан или их смеси, при температуре в пределах от -10 до 80C и в течение времени в пределах от 30 мин до 72 ч. Замещенные производные индазола можно получить, используя стандартные процедуры органического синтеза, как описано, например, в Smith, Michael - March's Advanced Organic Chemistry: reactions(NY), 2001. Специалисту известно, что превращение химической функции в другую может потребоваться, чтобы один или более реакционных центров в соединении, содержащем эту функцию, были защищены, чтобы избежать нежелательных побочных реакций. Защита таких реакционных центров и последующее удаление защитных групп в конце синтетических превращений могут быть осуществлены путем стандартных процедур, описанных, например, в Green, Theodora W. and Wuts, Peter G.M. - ProtectiveGroups in Organic Synthesis, Third Edition, John WileySons Inc., New York (NY), 1999. В случаях, если соединение формулы (I) содержит один или более центров асимметрии, указанное соединение может быть разделено на отдельные изомеры в соответствии с процедурами, известными специалисту. Такие процедуры включают стандартные хроматографические методы, включая хроматографию с использованием хиральной стационарной фазы, или кристаллизацию. Общие способы разделения соединений, содержащих один или более центров асимметрии, описаны, например, в Jacques, Jean;York (NY), 1981. Соединение формулы (I) может также быть преобразовано в фармацевтически приемлемую соль согласно стандартным процедурам, которые известны специалисту. Альтернативно, соединение формулы (I), которое получено в форме соли, может быть преобразовано в свободное основание или свободную кислоту согласно стандартным процедурам, которые известны специалисту. Исходные материалы способа согласно настоящему изобретению, т.е. соединения формулы (XII),(XIII), (XV), (XVI), (XVIII), (XXIII) и (XXI), либо являются коммерчески доступными, либо могут быть получены при использовании известных способов. Например, соединения формулы (XIII) могут быть легко получены согласно обычным процедурам,которые широко известны в области получения реактивов Гриньяра, как показано на следующей схеме: Например, соединения формулы (XV) могут быть легко получены из соответствующих производных галогена, как показано на следующей схеме (см., например, Wang, X.-J. et al.; Org. Lett. 2006, 8(2),305-307): Например, соединения формулы (XVI) могут быть легко получены с использованием соответствующих спиртовых производных согласно обычным способам синтеза. Например, соединения формулы (XXI) могут быть легко получены окислением соответствующих спиртовых производных согласно обычным способам синтеза. Другой объект настоящего изобретения относится к промежуточному соединению формулы (IIIA'),(IIIB'), (IIIC') или (IIID'): в которых R обозначает в случае необходимости замещенный C3-C6-циклоалкил, арил или гетероарил иR1, R2, R3, R' и R" имеют значения, определенные выше,при условии, что следующие соединения исключены: 6-(3-амино-1H-индазол-5-илметил)-3-изопропил-1-(2,4,6-трихлорфенил)-1,7-дигидропиразоло[3,4d]пиримидин-4-он и 1-[(3-амино-1H-индазол-5-ил)метил]-3-(1-[2-(диметиламино)этил]-1H-бензимидазол-2-илметил)1,3-дигидро-2H-бензимидазол-2-он. Другой объект настоящего изобретения относится к промежуточному соединению формулы (XIIA),(XXIIC) или (XXIID): в которых Ar, R, R1, R2, R3, R', R" и PG имеют значения, определенные выше. Другой объект настоящего изобретения относится к соединению формулы (XXVII)PG2 обозначает этоксикарбонил или 2-метоксиэтилкарбонил. Настоящее изобретение также относится к способу получения соединения формулы (XXVII), как определено выше, отличающемуся тем, что способ включает:v) защиту соединения формулы (I), как определено выше, с получением соединения формулы в которой R, R1, R2, R3 и PG2 имеют значения, определенные выше. Согласно стадии v) защита соединения формулы (I) с получением соединения формулы (XXVII) может быть осуществлена различными путями и в различных экспериментальных условиях. Предпочтительно эту реакцию осуществляют путем обработки основанием, таким как диизопропиламид лития,гидрид натрия или бис-(триметилсилил)амид лития, натрия или калия, в подходящем растворителе, таком как, например, толуол, тетрагидрофуран, 1,4-диоксан, простой диэтиловый эфир,N,N-диметилформамид, диметоксиэтан, при температуре в пределах от -78C до температуры окружающей среды и в течение времени, варьирующего от приблизительно 10 мин до приблизительно 96 ч. Электрофилом обычно является хлорформиатное производное, такое как, например, этил хлорформиат или 2-метоксиэтил хлорформиат. Фармакология. Сокращения и аббревиатуры, используемые в описании, имеют следующие значение: Тесты. Соединения согласно настоящему изобретению были проверены в биохимических тестах, как описано ниже. Получение цитоплазматического домена ALK для использования в биохимическом тесте. Клонирование и экспрессия. Цитоплазматический домен ALK, соответствующий остаткам 1060-1620 (номера аминокислотных остатков относятся к номеру доступа Genbank NP 004295,2), амплифицировали с помощью ПЦР, исходя из библиотеки кДНК яичка человека. Амплификацию осуществляли, используя прямой олигонуклеотид: 5'GGGGACAAGTTTGTACAAAAAAGCAGGCTTACTGGAAGTTCTGTTCCAGGGGCCCCGCCGGAAGCACCAGGAGCTG-3' и обратный олигонуклеотид: 5'GGGGACCACTTTGTACAAGAAAGCTGGGTTTCAGGGCCCAGGCTGGTTCATGCTATT-3'. Для целей клонирования олигонуклеотиды включали сайты attB, чтобы получитьattB-фланкированный продукт ПЦР, подходящий для клонирования с использованием технологииGateway (Invitrogen). Кроме того, в целях очистки прямой праймер включал сайт расщепленияPreScission (Amersham Biosciences). Полученный продукт ПЦР клонировали в Gatewayмодифицированном бакуловирусном векторе экспрессии pVLl393 (Invitrogen). В целях экспрессии и очистки к цитоплазматическому домену ALK на N-конце добавляли метку GST. Клонирование осуществляли согласно протоколам, описанным в руководстве Gateway (Invitrogen). Бакуловирус получали путем котрансфекции клеток насекомого Sf9 вектором экспрессии и вирусной ДНК, используя набор для трансфекции BaculoGold (Pharmingen). Вирусный супернатант собирали через 5 дней и подвергали 3 циклам амплификации, чтобы увеличить вирусный титр. Рекомбинантный белок получали, инфицируя клетки насекомого Sf21 в плотности 1106 клеток/мл вирусным супернатантом в количестве 30 мл на миллиард клеток при взбалтывании при 21C. После 48 ч инфекции клетки собирали, осаждали центрифугированием и замораживали при -80C. Очистка белка. Клетки повторно суспендировали в лизирующем буфере (Tris-HCl 50 мМ pH 8, NaCl 150 мМ,CHAPS 0,2%, DTT 20 мМ, глицерин 20%, "полный" коктейль ингибитора протеазы (Roche Diagnostics),Na3VO4 1 мМ и лизировали путем жидкой экструзии с гомогенизатором Gaulin (Niro Soavi, Италия). Лизат очищали центрифугированием при 20000g а течение 30 мин и загружали на колонку GlutathioneSepharose 4B (Amersham Biosciences). После экстенсивной промывки рекомбинантный белок элюировали с использованием 10 мМ глутатиона в 100 мМ Tris-HCl pH 8, 10% глицерина. Аффинно очищенный GST-ALK загружали на колонку Heparin Sepharose FF (AmershamBiosciences) и элюировали с использованием 50 мМ NaCl, 25 мМ Tris, pH 7,5, 2 мМ DTT, 20% глицерина. Элюируемые фракции объединяли и диализировали против 150 мМ NaCl, 50 мМ Tris-HCl, pH 7,4,2 мМ DTT, 20% глицерина. Очищенный белок сохраняли при -80C до его использования в биохимическом тесте. Биохимический тест ингибиторов активности ALK киназы. Фермент ALK нуждается в предварительной активации для линеаризации кинетики реакции.i. Киназный буфер (КБ) для ALK. Киназный буфер был составлен из 50 мМ HEPES pH 7,5, содержащего 1 мМ MnCl2, 5 мМ MgCl2,1 мМ DTT, 3 мкМ Na3VO4 и 0,2 мг/мл BSA. 3X КБ представляет собой буфер того же состава, как и КБ,но с трехкратной концентрацией каждого компонента.ii. Условия теста. Киназный тест проводили с конечной концентрацией фермента 20 нМ, в присутствии 8 мкМ АТФ,1 нМ 33 РАТФ и 2 мкМ МБР. МРВ был приобретен у Sigma-Aldrich, St. Louie, МО, США. Клеточные тесты ингибиторов активности ALK киназы. Анализ с использованием вестерн-блоттинга фосфорилирования ALK и STAT3 на линях клеток анапластической крупноклеточной лимфомы Karpas-299, SR-786 и SUP-M2. Клетки Karpas-299, SR-786 и SUP-M2 (DSMZ, Braunschwiegh, Германия) высевали в планшеты для культуры тканей с 6 лунками в количестве 5105 клеток/мл в среде RPMI-1640 + 2 мМ глутамина + 1015% FCS (EuroClone, Италия) и инкубировали в течение ночи при 37C, 5% CO2, 100%-ная относительная влажность. После этой инкубации клетки обрабатывали желательными концентрациями соединения в течение 2 ч при 37C. Клетки собирали центрифугированием при 248g в течение 5 мин, промывали холодным РВС, центрифугировали снова при 248g в течение 5 мин и затем лизировали в 100 мМ TrisHCl pH 7,4, 2% SDC, 1 мМ Na3VO4, коктейль ингибитора протеазы [Sigma-Aldrich продукт Р 8340], коктейль ингибитора фосфатазы [Sigma-Aldrich продукты Р 2850 + Р 5726]). После короткой обработки ультразвуком клеточные лизаты очищали центрифугированием в 10,000g в течение 20 мин при температуре окружающей среды и 20 мкг/дорожка очищенного белка лизата разгоняли на гелях NuPAGE (гелиNuPAGE 4-12% 10-lane Bis-Tris, Invitrogen) с буфером МОРС, затем переносили на фильтры из нитроцеллюлозы Hybond-ECL (Amersham Biosciences, Little Chalfont, Buckinghamshire, Великобритания) с MiniPROTEAN II (Bio-Rad Laboratoriec, Herculec, CA, США). Фильтры, несущие перенесенный белок, инкубировали в течение 1 ч в блокирующем буфере (TBS + 5%-ное обезжиренное сухое молоко [1706404TBS + 5% BSA + 0,1% Tween 20 при 4C, содержащей 1/500 антитела антифосфо-ALK Tyr 1604 (продукт 3341 Cell Signaling Technology, Beverly, MA, США) для детекции фосфорилированного ALK или 1/500 антитела анти-ALK мыши (продукт 35-4300, Zymed Laboratories, South San Francisco, CA, США) для детекции полного ALK, или 1/500 антитела антифосфо-STAT3 Tyr 705 мыши (продукт 612357, BDTransduction Laboratories, Канада) для детекции фосфорилированного STAT3, или 1/1000 антитела антиSTAT3 мыши (продукт 610190 BD Transduction Laboratories, Канада) для детекции полного STAT3. Во всех случаях фильтры затем промывали в течение 20 мин с несколькими заменами смесью TBS+ 0,1% Tween 20 и инкубировали в течение 1 ч в смеси TBS + 5%-ное обезжиренное сухое молоко + 0,1%Tween 20, содержащей 1/10000 разведение конъюгированного с пероксидазой хрена IgG против кролика или мыши (Amersham, продукт NA934), затем снова промывали и проявляли с использованием системы хемилюминесценции ECL (Amersham) согласно рекомендациям изготовителя. Если не указано иное, используемые реактивы были получены от Sigma-Aldrich, St. Louie, МО, США. Тест на пролиферацию клеток in vitro для ингибиторов активности ALK киназы. Человеческие линии клеток ALCL Karpas-299, SR-786 и SUP-M2 высевали в 96-луночные планшеты (PerkinElmer, Wellesley, MA, США) в количестве 1105 клеток/мл в среде RPMI-1640 + 2 мМ глутамина + 10-15% FCS (EuroClone, Италия), (100 мкл/лунка) и поддерживали при 37C, 5% CO2, 100%-ная относительная влажность. На следующий день планшеты обрабатывали, в двойном экземпляре, соответствующими разведениями соединений, полученными исходя из 10 мМ сток-раствора в ДМСО (конечная концентрация ДМСО: 0,1%). В каждый планшет входило восемь лунок с необработанным контролем. После 72 ч обработки к каждой лунке добавляли 50 мкл CellTiter-Glo Assay (Promega, Madison, WI,США) и после перемешивания сигнал люминесценции измеряли, используя Envision Detector(PerkinElmer Wellesley, MA, США). Значения IC50 вычисляли с помощью LSW/Data Analysis, используя построение сигмовидной кривой Microsoft Excel. Получение IGF-1R для использования в биохимическом тесте. Клонирование и экспрессия. кДНК человека использовали как матрицу для амплификации полимеразной цепной реакцией(ПЦР) предсказанной цитоплазматической части IGF-1R (аминокислотные остатки 960-1367 белкапредшественника; см. NCBI Entrez Protein Accession Р 08069), который включает полный киназный домен. ПЦР проводили,используя последовательность прямого праймера 5'-CTCGGATCCAGAAAGAGAAATAACAGCAGGCTG-3' и последовательность обратного праймера 5'-CTCGGATCCTCAGCAGGTCGAAGACTGGGGCAGCGG-3'. Для облегчения последовательных стадий клонирования оба праймера включают последовательность эндонуклеазных сайтов рестрикцииBamHI. Этот продукт ПЦР клонировали в рамке, используя липкие концы BamHI, в вектор переноса для бакуловирусной системы экспрессии, pVL1392 (Pharmingen), предварительно модифицированной вставкой в множественный сайт клонирования pVL1392 трансферазы с глютаминил-цистеинил-глицина кодирования последовательностей, кодирующих слитый белок Глутатион S-трансферазы (GST), сайта расщепления протеазой PreScission и частичной кассеты MCC, полученной из плазмиды pGex-6P (AmershamBioSciences). Вставка продукта ПЦР IGF-1R, описанного выше, в полученный из pGex-6P сайт BamHI модифицированного вектора pVL1392 приводит к открытой рамке считывания, соответствующей белкуpGEX-6P GST и пептиду PreScission, слитому с человеческим цитоплазматическим доменом IGF-1R. Чтобы получить слитый белок, клетки насекомого Sf21 (Invitrogen) котрансфицировали с 2 мкг очищенной плазмиды и 1 мкг вирусной ДНК (Набор для трансфекции BaculoGold, Pharmingen), как описано в руководстве Baculovirus Instruction (Pharmingen). Первую амплификацию вируса проводили, используя 600 мкл котрансфицированного вируса на 6106 Sf21 в культуре монослоя, в 12 мл среды (средаTNM-FH Grace, Pharmingen). Через 3 дня среду собирали, центрифугировали и переносили в стерильную пробирку. Вторую амплификацию проводили тем же самым способом, используя 2 мл на 3107 клеток,разбавленных в 40 мл среды. Для третьей амплификации вируса использовали 1 мл супернатанта от второго цикла на 3107 клеток, разбавленных в 40 мл среды. Экспрессию белка осуществляли в клетках насекомого Н 5, инфицированных 14 мл вируса/1109 клеток насекомого (MOI=1,5) в течение 65 ч при взбалтывании при 27C. Клетки собирали центрифугированием при 1200g в течение 10 мин. Очистка белка. Клетки повторно суспендировали в буферизованном фосфатом физиологическом растворе (PBS),20 мМ дитиотреитола (DTT), 0,2% CHAPS, 20% глицерина, 1 мМ OVA, "полный" коктейль ингибитора протеазы (1 таблетка/50 мл буфера; Roche Diagnostics, Милан, Италия) и лизировали путем жидкой экструзии с гомогенизатором Gaulin (Niro Soavi, Италия). Лизат центрифугировали при 14000g в течение 45 мин и супернатант загружали на колонку, содержащую 10 мл Glutathione Sepharose (AmershamBiosciences). Колонку сначала промывали буфером PBS в количестве 5 объемов колонки, затем 100 мМTris pH 8,0, 20% глицерина в количестве 5 объемов колонки и, наконец, элюировали 10 мМ глутатиона в 100 мМ Tris pH 8,0, 20% глицерина. Фракции по 10 мл собирали и богатые белком фракции объединяли. Как правило, от 1109 клеток рекуперировали 20 мг слитого белка, и его чистота обычно составляла 85%, по оценке SDS-PAGE, сопровождаемой окрашиванием Кумасси. Очищенный белок сохраняли при-80C до его использования в биохимических тестах. Биохимический тест ингибиторов киназной активности IGF-1R. Ингибирующая активность предполагаемых ингибиторов киназы и потенциал выбранных соединений определяли, используя тест перефосфорилирования. Специфический субстрат инкубировали с киназой в подходящих буферных условиях в присутствии АТФ, отслеживаемом с помощью 33 РАТФ (гамма-фосфат-меченый, Redivue Code Number AH9968,1000-3000 Ci/ммоль, Amersham Biosciences Piscataway, NJ, США), оптимальных кофакторов и тестируемого соединения. В конце реакции фосфорилирования более 98% холодного и радиоактивного АТФ было захвачено избытком ионообменной смолы Dowex. Смоле давали осесть на дне реакционных лунок под действием силы тяжести. Супернатант, содержащий пептидный субстрат, затем извлекали и переносили на счетный планшет и радиоактивность (соответствующую фосфату, включенному в пептид) оценивалиi. Получение смолы Dowex. 500 г влажной смолы (SIGMA, полученная обычным образом смола DOWEX 18 200-400 меш,2,5 кг) взвешивали и разбавляли до объема 2 л в 150 мМ формиата натрия, pH 3,00. Смоле давали осесть в течение нескольких часов и затем супернатант отбрасывали. Эту процедуру промывки повторяли три раза за два дня. Наконец, смоле давали осесть, супернатант отбрасывали и добавляли два объема (относительно объема смолы) буфера, представляющего собой 150 мМ формиата натрия. Конечный pH составлял приблизительно 3,0. Промытую смолу сохраняли при 4C перед использованием, и она была стабильна в течение более 1 недели.ii. Киназный буфер (КБ). Киназный буфер был составлен из 50 мМ HEPES pH 7,9, содержащего 3 мМ MnCl2, 1 мМ DTT,3 мкМ Na3VO4 и 0,2 мг/мл BSA. 3X КБ представляет собой буфер того же состава, как и КБ, но с трехкратной концентрацией каждого компонента.iii. Предварительная активация фермента и получение 3X ферментной смеси. До начала теста ингибирования киназы IGF-1R предварительно фосфорилировали, чтобы линеаризовать кинетику реакции. Для этого желательное полное количество фермента получали в концентрации фермента 360 нМ в КБ, содержащем 100 мкМ АТФ, и этот препарат инкубировали в течение 30 мин при 28C. 3X ферментную смесь получали, разбавляя этот предварительно активированный фермент в 20 раз в 3X КБ.iv. Условия теста. Киназный тест проводили с конечной концентрацией фермента 6 нМ, в присутствии 6 мкМ АТФ,1 нМ 33 РАТФ и 10 мкМ субстрата, биотинилированного на С-конце пептида следующей последовательности: KKKSPGEYVNIEFGGGGGK-биотин. Пептид получали партиями с 95%-ной чистотой пептида от American Peptide Company, Inc (Саннивейл, Калифорния, США). Автоматизированный тест Dowex. Тестовые реакции проводили в полном конечном объеме 21 мкл, состоящем из:a) 7 мкл/лунка 3X ферментной смеси (18 нМ предварительно активированного фермента в 3X киназном буфере);b) 7 мкл/лунка 3X субстрат/смесь АТФ (30 мкМ субстрата, 18 мкМ АТФ, 3 нМ 33 РАТФ в двойной дистиллированной воде (ddH2O);c) 7 мкл/лунка 3X тестируемых соединений, разбавленных в ddH2O-3% ДМСО. Разбавление соединения и схема проведения теста описаны ниже.i. Разбавление соединений. 10 мМ сток-растворов тестируемых соединений в 100%-ном ДМСО распределяли в 96-луночные планшеты для микротитрования формата 128. Для исследований % ингибирования получали разведения в 1 мМ, 100 мкМ и 10 мкМ в 100%-ном ДМСО, затем разбавляли до 3X конечной концентрации (30, 3 и 0,3 мкМ) в ddH2O, 3% ДМСО. Multimek 96 (Beckman Coulter, Inc. 4300 N. Harbor Boulevard, P.O. Box 3100 Fullerton, CA 92834-3100 США) использовали для отмеривания пипеткой соединения в тестовые планшеты. Для определения IC50 стартовые растворы 30 мкМ соединения в 3% ДМСО получали из стокрастворов 1 мМ/100% ДМСО. Эти 30 мкМ стартовые растворы использовали для получения дальнейших 9 серий 1/3 разведений в ddH2O, 3% ДМСО, чтобы получить 10-точечную кривую разведения в 3 Х конечной тестовой концентрации. Серийное разведение проводили в планшетах с 96 лунками, используя систему 2000 Biomek (Beckman Coulter). Получали кривые разведения 7 соединений/планшет, и каждый планшет также включал 10-точечную кривую разведения Staurosporine, а также нескольких отрицательных и положительных контрольных лунок.ii. Схема проведения теста. 7 мкл каждого разведения тестового соединения (или контроля) в ddH2O, 3% ДМСО, вводили пипеткой в каждую лунку 384-луночного тестового планшета с V-образным дном, который затем помещали на автоматизированную станцию PlateTrak 12 (Perkin Elmer, 45 William Street Wellesley, MA 02481-4078,США), оборудованную одним пипеточным блоком с 384 наконечниками, для начала теста, плюс один блок с 96 наконечниками для распределения смолы, с резервуарами, содержащими достаточное количество 3X ферментной смеси и 3X смеси АТФ (3X), для завершения теста. В начале теста система работы с жидкостью аспирирует 7 мкл смеси АТФ, вводит воздушный зазор в наконечниках (5 мкл) и затем аспирирует 7 мкл 3X ферментной смеси. Чтобы начать реакцию, содержимое наконечников распределяли в тестовую лунку, уже содержащую 7 мкл тестируемых соединений(в 3X желаемой конечной концентрации), с последующими 3 циклами смешивания, чтобы восстановить желаемую конечную концентрацию для всех компонентов реакции. Планшеты инкубировалии в течение 60 мин при температуре окружающей среды и затем реакцию останавливали, вводя пипеткой 70 мкл суспензии смолы Dowex в реакционную смесь, с последующими тремя циклами смешивания. После остановки реакции планшетам давали отдохнуть в течение 1 ч, чтобы максимизировать захват АТФ. В этот момент времени 20 мкл супернатанта перемещали из каждой лунки в лунки планшета 384-Optiplates (Perkin Elmer), содержащего 70 мкл/лунку Microscint 40 (Perkin Elmer); после 5 мин орбитального взбалтывания планшеты считывали на счетчике радиоактивности Perkin-Elmeriii. Анализ данных. Данные анализировали, используя адаптированную версию "Assay Explorer" (Elsevier MDL, Сан Леандро, Калифорния 94577). Для концентраций отдельного соединения ингибирующую активность обычно выражали как % ингибирования, полученного в присутствии соединения, по сравнению с полной активностью полученного фермента, когда ингибитор отсутствовал. Соединения, показывающие желаемое ингибирование, затем анализировали, чтобы изучить ингибиторующий потенциал через вычисление IC50. В этом случае данные ингибирования, полученные с использованием серийных разведений ингибитора, выстраивали с помощью нелинейной регрессии, используя следующее уравнение:v обозначает наблюдаемую скорость реакции;[I] обозначает концентрацию ингибитора. Клеточные тесты ингибиторов активности киназы IGF-1R. Анализ методом вестерн-блоттинга фосфорилирования рецептора после стимуляции IGF-1 в человеческих клетках рака молочной железы MCF-7. Клетки MCF-7 (ATCC HTB-22) высевали в планшеты для культуры тканей с 12 лунками в количестве 2105 клеток/лунка в среде Е-МЕМ (MEM + BSS Эрла + 2 мМ глутамина + 0,1 мМ несущественных аминокислот) + 10% FCS и инкубировали в течение ночи при 37C, 5% CO2, 100%-ная относительная влажность. Затем среду Е-МЕМ + 10%-ный FCS заменяли Е-МЕМ + 0,1% BSA и клетки инкубировали в течение ночи. После этой инкубации лунку обрабатывали желаемыми концентрациями соединения в течение 1 ч при 37C и затем стимулировали 10 нМ рекомбинантного человеческого IGF-1 (Invitrogen,Carlsbad, CA, США) в течение 10 мин при 37C. Клетки затем промывали PBS и лизировали в 100 мкл/лунка буфера для лизиса клеток (M-PER Реагент для экстракции белка млекопитающих [продукт 78501, Pierce, Rockford, IL, США] + 10 мМ EDTA + коктейль ингибитора протеазы [Sigma-Aldrich продукт Р 8340] + коктейль ингибитора фосфатазы [Sigma-Aldrich продукты Р 2850 + Р 5726]). Лизаты клеток очищали центрифугированием при 10000g в течение 5 мин и 10 мкг/дорожка очищенного белка лизата разгоняли на гелях NuPAGE (NuPAGE 4-12% 10-lane Bis-Tris gels, Invitrogen) с буфером МОРС,затем переносили на фильтры из нитроцеллюлозы Hybond-ECL (Amersham Biosciences, Little Chalfont,Buckinghamshire, Великобритания) с использованием камеры Mini PROTEAN II (Bio-Rad Laboratories,Hercules, CA, США). Фильтры, несущие перемещенный белок, инкубировали в течение 1 ч в блокирую- 28018503 щем буфере (TBS + 5% BSA + 0,15% Tween 20) и зондировали в течение 2 ч в том же самом буфере, содержащем 1/1000 антитела антифосфо-IGF-1R Tyr1131/InsR Tyr 1146 кролика (продукт 3021, Cell Signaling Technology, Beverly, MA, США) для детекции фосфорилированного IGF-1R, или разведение 1/1000 антитела IGF-Ir (Н-60) кролика (продукт sc-9038, Santa Cruz Biotechnology, Inc., Santa Cruz, CA, США) для детекции общего количествацепи IGF-1R. В любом случае фильтры затем промывали в течение 30 мин с несколькими заменами TBS + 0,15% Tween 20 и инкубировали в течение 1 ч в промывочном буфере, содержащем разведение 1/5000 конъюгированного с пероксидазой хрена IgG анти-кролик(Amersham, продукт NA934), затем снова промывали и проявляли с использованием системы хемилюминесценции ECL (Amersham) согласно рекомендациям изготовителя. Если не указано иное, используемые реактивы были получены от Sigma-Aldrich, St. Louis, МО, США. Индуцированное фактором роста фосфорилирование рибосомального белка S6 в первичных человеческих фибробластах. Фосфорилирование рибосомального белка s6 в ответ на стимуляцию фактором роста нормальных человеческих фибробластов кожи (NHDF) использовали, чтобы оценить потенциал соединения в ингибировании индуцированной IGF-1 трансдукции сигналов в клетках и селективность по отношению к стимулам EGF и PDGF. Клетки NHDF получали от PromoCell (Heidelberg, Германия), поддерживали при 31C в увлажненной атмосфере с 5% CO2 в полной среде для выращивания фибробластов (PromoCell). Для теста NHDF высевали в планшеты для культуры тканей с 384 лунками (черные планшеты с плоским прозрачным дном; Matrix Technologies Inc, Hudson, NH, США) в плотности 5000 клеток/лунка в бессывороточной среде, содержащей 0,1% бычьего сывороточного альбумина (BSA), и инкубировали в течение 5 дней. Собранные клетки обрабатывали в течение 1 ч желаемыми дозами соединений и затем стимулировали в течение еще 2 ч 10 нМ IGF-1 (Invitrogen Corp., CA, США), 10 нМ EGF (Gibco BRL, США) или 1 нМ PDGF-B/B (Roche Diagnostics GmbH, Германия). Клетки затем фиксировали в PBS/3,7% параформальдегида в течение 20 мин при температуре окружающей среды, промывали Х 2 PBS и усиливали проницаемости путем обработки PBS/0,3% Triton X-100 в течение 15 мин. Лунку затем насыщали PBS/1% обезжиренного сухого молока (Bio-Rad Laboratories, Hercules, CA, США) в течение 1 ч и затем зондировали в течение 1 ч при 37C с использованием антитела антифосфо-s6 (Ser 235/236) (Cell SignalingTechnology, Beverly, MA, США, кат. 2211) в разведении 1/200 в PBS/1% молока/0,3% Tween 20. Лунку затем промывали дважды PBS и инкубировали в течение 1 ч при 37C с PBS/1% молока/0,3%Tween 20 + 1 мкг/мл DAPI (4,6-диамидино-2-фенилиндол) + 1/500 Cy5-конъюгированного вторичного козьего антитела анти-кролик (Amersham Biosciences, Little Chalfont, Buckinghamshire, Великобритания). Лунку затем промывали Х 2 РВС и 40 мкл PBS оставляли в каждой лунке для анализа иммунофлюоресценции. Картину флюоресценции в каналах DAPI и Cy5 автоматически записывали, сохраняли и анализировали с использованием прибора Cellomics ArrayScan IV (Cellomics, Pittsburgh, США); CellomicsCytotoxicity Algorithm использовали для количественного определения цитоплазматической флюоресценции, связанной с фосфо-s6.(параметр сигнала Cy5: "Mean Lyso Mass-pH") для каждой клетки в 10 областях/лунка, и в конечном счете выражали как среднее значение популяции. Если не указано иное,реактивы были получены от Sigma-Aldrich, St. Louis, МО, США. Биохимический тест для ингибиторов активности киназы Aurora-2. Тест ингибирования киназы in vitro проводили таким же образом, как описано для IGF-1R. В отличие от IGF-1R, фермент Aurora-2 не нуждается в предварительной активации.i. Киназный буфер (КБ) для Aurora-2. Киназный буфер был составлен из 50 мМ Hepes, pH 7,0, 10 мМ MnCl2, 1 мМ DTT, 3 мкМ Na3VO4 и 0,2 мг/мл BSA.ii. Условия проведения теста для Aurora-2 (конечные концентрации). Киназный тест проводили с концентрацией фермента 2,5 нМ, 10 мкМ АТФ, 1 нМ 33 РАТФ и 8 мкМ субстратов, состоящих из 4 повторов LRRWSLG. Клеточные тесты для ингибиторов активности киназы Aurora-2. Тест пролиферации клеток in vitro для ингибиторов активности киназы Aurora-2. Линию клеток рака толстой кишки человека НСТ-116 высевали в количестве 5000 клеток/см 2 в 24-луночные планшеты (Costar), используя среду F12 (Gibco), дополненную 10% FCS (EuroClone, Италия), 2 мМ L-глутамина и 1% пенициллин/стрептомицин и поддерживали при 37C, 5% CO2 и 96%-ной относительной влажности. На следующий день планшеты обрабатывали в двойном экземпляре 5 мл соответствующего разведения соединений, исходя из 10 мМ стока. Две необработанные контрольные лунки были включены в каждый планшет. После 72 ч обработки среду удаляли и клетки отщепляли от каждой лунки с использованием 0,5 мл 0,05% (вес./об.) Трипсина, 0,02% (вес./об.) EDTA (Gibco). Образцы разбавляли 9,5 мл Isoton (Coulter) и подсчитывали с использованием счетчика клеток Multisizer 3
МПК / Метки
МПК: A61P 35/00, C07D 231/56, A61K 31/33
Метки: киназы, производные, активные, замещенные, ингибиторы, индазола
Код ссылки
<a href="https://eas.patents.su/30-18503-zameshhennye-proizvodnye-indazola-aktivnye-kak-ingibitory-kinazy.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные производные индазола, активные как ингибиторы киназы</a>
Предыдущий патент: Новые гетероциклические карбоксамиды и фармацевтические композиции, содержащие их
Следующий патент: Способ получения содержащего клетчатку пектинового продукта и пектиновые продукты, полученные данным способом
Случайный патент: Способ лечения атеросклероза, дислипидемий и связанных с ними состояний и фармацевтические композиции












