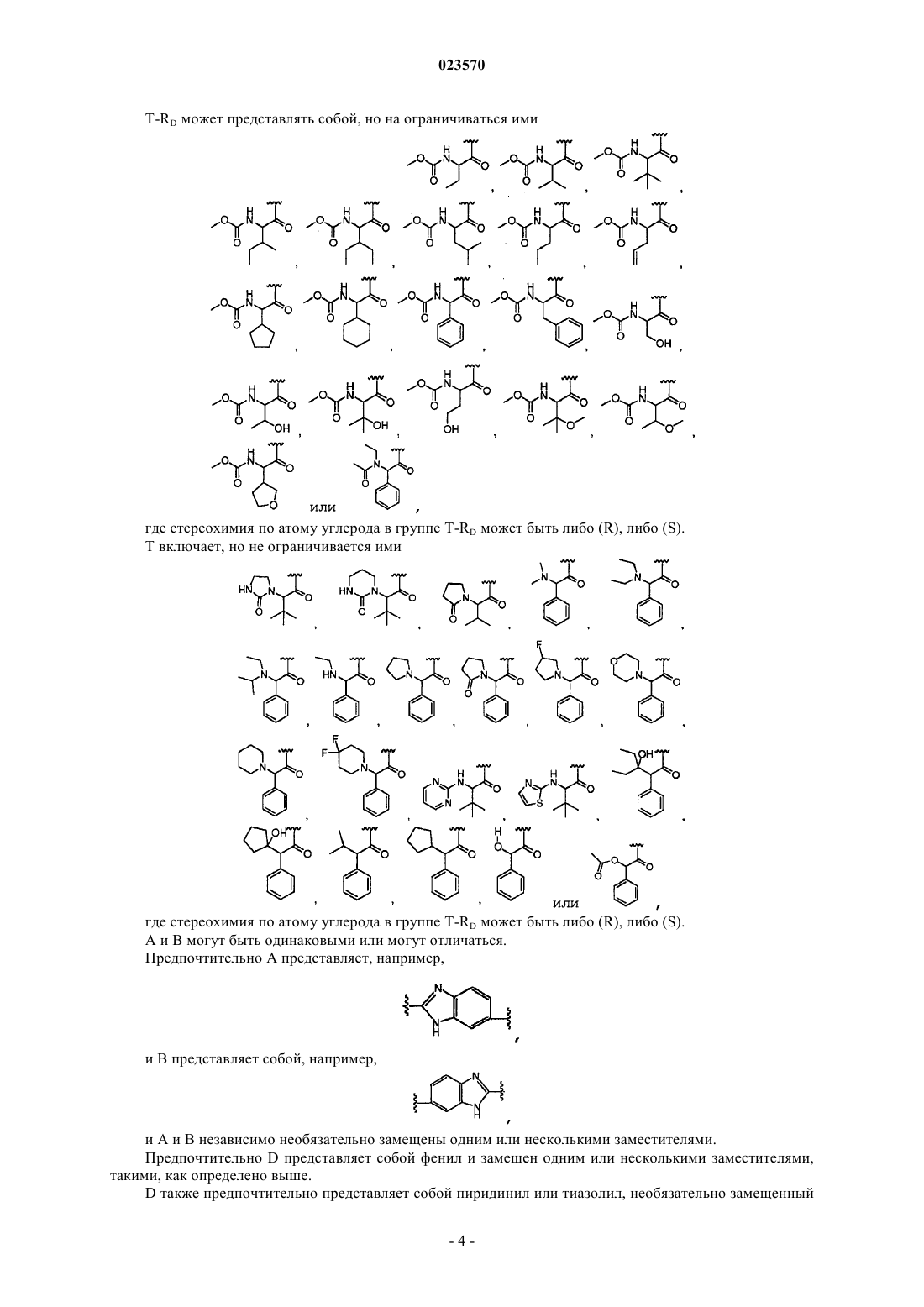
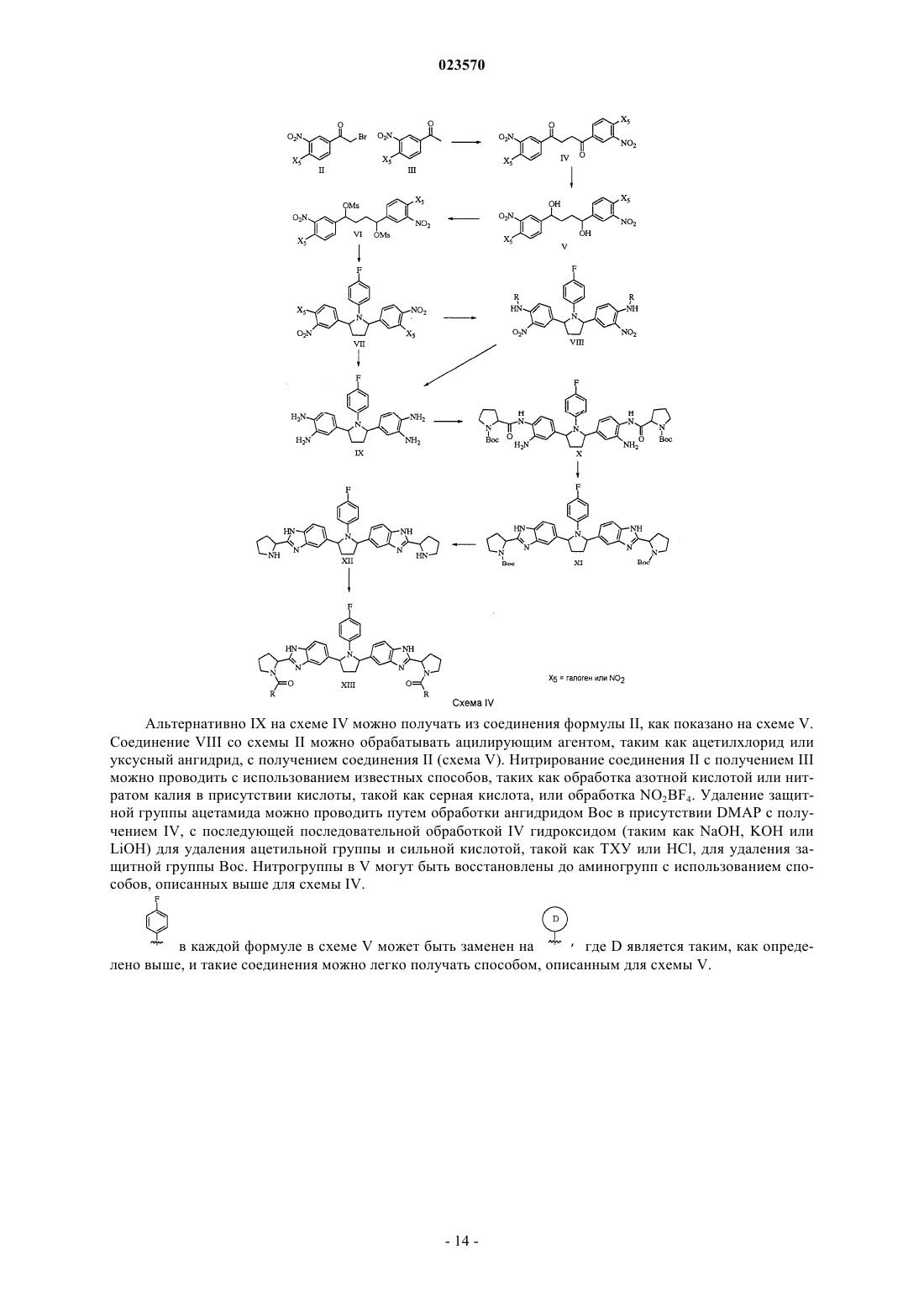
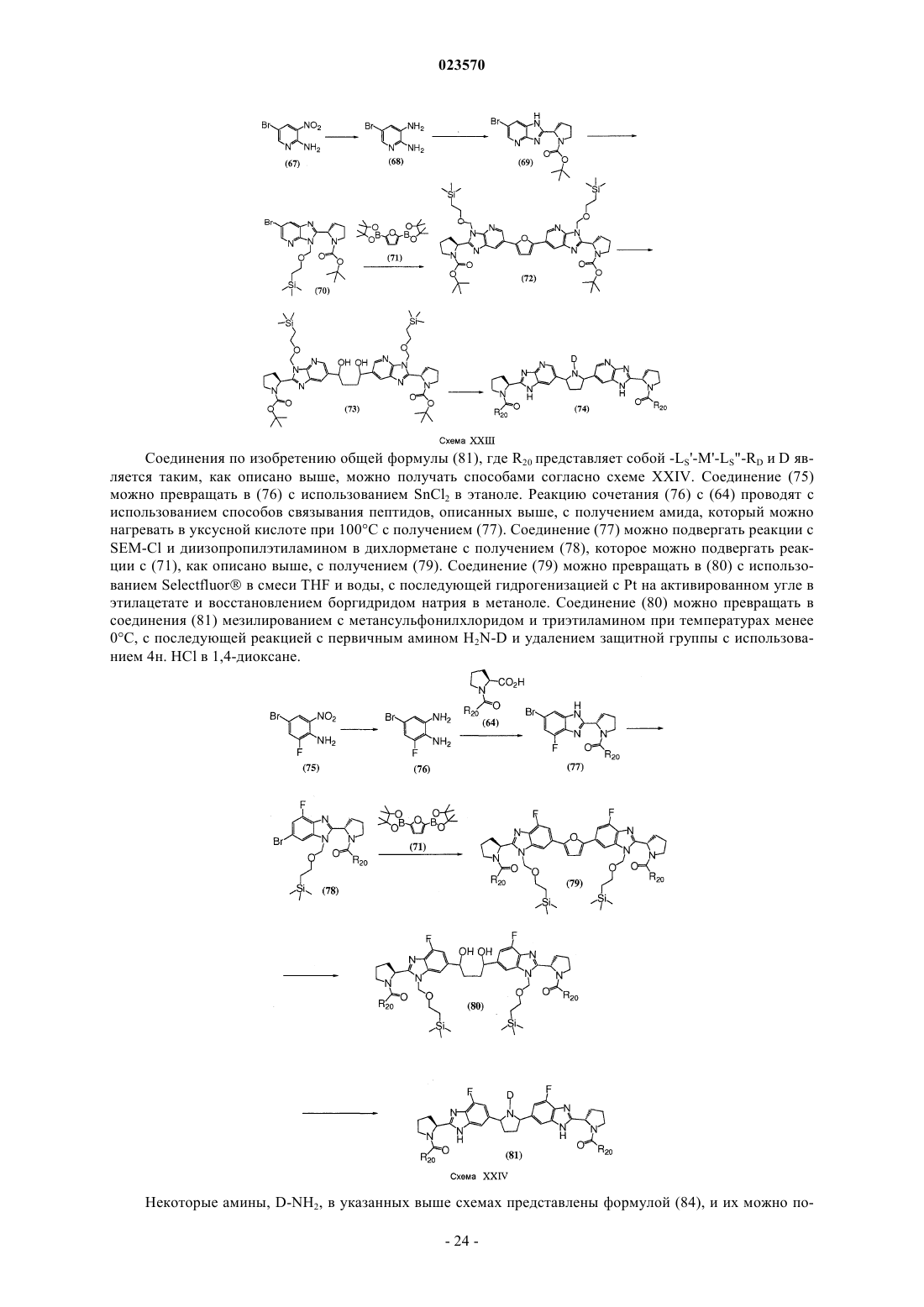
Противовирусные соединения
Номер патента: 23570
Опубликовано: 30.06.2016
Авторы: Нельсон Лисса Т., Крюгер Аллан К., Пател Сачин В., Каспи Дэниел Д., Ли Вэнькэ, Рокуэй Тодд В., Тьюфано Майкл Д., Лю Дачунь, Калифано Джин К., Бетебеннер Дэвид А., Пратт Джон К., Кати Уоррен М., Джинкерсон Тамми К., Рандолф Джон Т., Саррис Кэти, Флентге Чарльз А., Хатчинсон Дуглас К., Воллер Кевин Р., Вагнер Рольф, Маринг Кларенс Дж., Дегой Дэвид А., Кедди Райан Дж., Доннер Памела Л., Гао Йи, Матуленко Марк А., Беллиззи Мэри Э., Хатчинс Чарльз У., Моттер Кристофер Э., Уэгоу Сэйбл Х.
Формула / Реферат
1. Соединение или его фармацевтически приемлемая соль, где указанное соединение имеет формулу IB
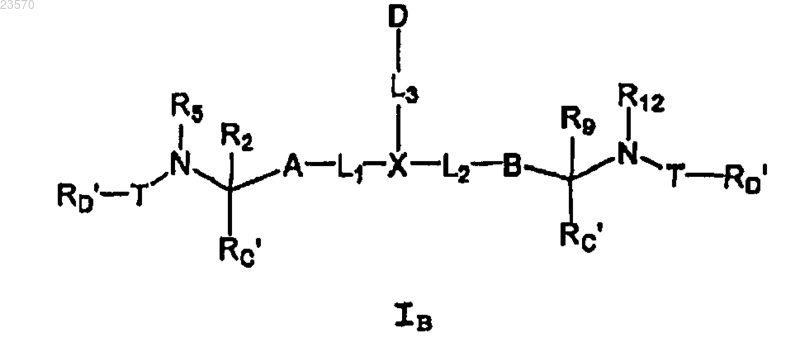
где X представляет пирролидин, необязательно замещенный одним или двумя заместителями, выбранными из С1-С6алкокси или С1-С6алкоксиС1-С6алкила;
А представляет собой
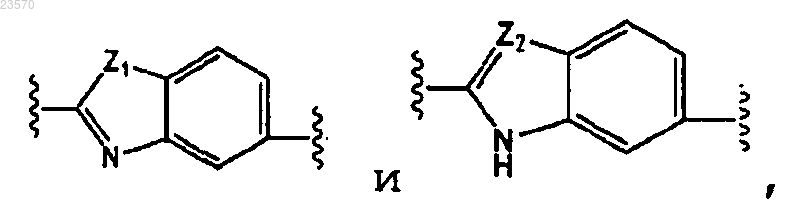
В представляет собой
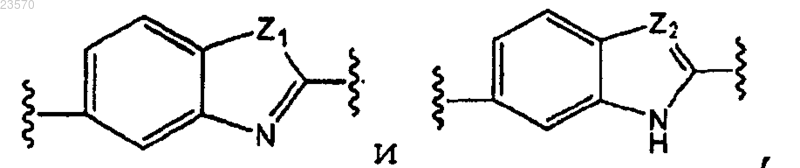
где каждый А и В необязательно замещены карбоксиC1-С6алкилом или галогеном;
Z1 представляет собой NH;
Z2 представляет собой N;
D представляет собой
фенил, необязательно замещенный одним-тремя заместителями, выбранными из группы, состоящей из С1-С6алкила, С1-С6алкокси, гидрокси, галогена, галогенС1-С6алкокси, галогенС1-С6алкилС1-С6алкила, нитрильной группы, С1-С6алкилнитрильной группы, гидроксиС1-С6алкила, тетрагидропиран-4-ила, С1-С6алкоксиС1-С6алкила, С1-С6алкокси(С1-С6алкокси)С1-С6алкила, аминоС1-С6алкила, нитроС1-С6алкила, С1-С6алкилациламида, адамантила, 3-6-членного циклоалкила, 3-12-членного гетероциклила, содержащего один или два гетероатома в кольце, выбранных из N, О или S, необязательно замещенных галогеном;
пиридин, замещенный С1-С6алкокси, С1-С6алкилом, аминоC1-С6алкилом, сульфоамидной группой, ацетамидом, 3-6-членным гетероциклом, содержащим один или два гетероатома, выбранных из N и О;
тиазол, необязательно конденсированный с 6-членным карбоциклом и замещенный фенилом, который необязательно замещен галогеном;
6-членный циклоалкил, замещенный фенилом;
фенил, конденсированный с 5-членным гетероциклом, содержащим два атома О в кольце, который замещен одним или двумя атомами галогена;
бензотиазол;
L1, L2 и L3 представляют собой связь;
-T-RD', в каждом случае его присутствия, независимо выбран из -C(O)-LY", замещенного одним или двумя заместителями, выбранными из фенила, С3-C8циклоалкила, гидроксила, C1-С6алкила, галогена; -С(О)-LY'-N (RB)C(O)-LS"-RD' или -С(О)-LY'-N(RB)С(O)O-LS''-RD', где LY' представляет собой С1-С6алкилен и необязательно замещен одним RL;
RC', в каждом случае его присутствия, представляет собой водород;
RD' представляет собой водород;
R2 и R5, взятые вместе с атомами, к которым они присоединены, образуют пирролидин, необязательно замещенный гидрокси, С1-С6алкокси;
R9 и R12, взятые вместе с атомами, к которым они присоединены, образуют пирролидин, необязательно замещенный гидрокси, С1-С6алкокси;
RB, в каждом случае его присутствия, выбран из водорода;
LS" представляет собой С1-С6алкилен и
RL представляет собой галоген, -O-С1-С6алкил, -C(O)-C1-С6алкил.
2. Соединение формулы IB по п.1, где X представляет собой пирролидин, необязательно замещенный С1-С6алкокси, где N непосредственно связан с -L3-D.
3. Соединение по п.1, где соединение представляет собой метил {(2S)-1-[(2S)-2-{5-[(2R,5R)-1-[3-фтор-4-(пиперидин-1-ил)фенил]-5-{2-[(2S)-1-{(2S)-2-[(метоксикарбонил)амино]-3-метилбутаноил}пирролидин-2-ил]-1Н-бензимидазол-5-ил}пирролидин-2-ил]-1Н-бензимидазол-2-ил}пирролидин-1-ил]-3-метил-1-оксобутан-2-ил}карбамат, или его фармацевтически приемлемая соль.
4. Фармацевтическая композиция, содержащая соединение по п.1 или его фармацевтически приемлемую соль.
Текст
Описаны соединения формулы (Ib) эффективные для ингибирования репликации вируса гепатита С ("HCV"). Это изобретение относится к способам получения таких соединений и к фармацевтическим композициям,содержащим такие соединения. По настоящей заявке испрашивается приоритет по предварительной заявке США с серийным 61/186291, поданной 11 июня 2009 г., условной заявке США с серийным 61/242836, поданной 16 сентября 2009 г., и условной заявке США с серийным 61/243596, поданной 18 сентября 2009 г., содержание которых включено в настоящий документ в качестве ссылки в полном объеме. Область техники Настоящее изобретение относится к соединениям, эффективным для ингибирования репликации вируса гепатита С ("HCV"). Также настоящее изобретение относится к композициям, содержащим эти соединения, и к способам применения этих соединений для лечения инфекции HCV. Уровень техникиHCV представляет собой РНК-вирус, относящийся к роду Hepacivirus семейства Flaviviridae. Оболочечный вирион HCV содержит геном в виде положительной цепи РНК, кодирующий все известные вирус-специфические белки в одной непрерывной открытой рамке считывания. Открытая рамка считывания содержит приблизительно 9500 нуклеотидов и кодирует один крупный полибелок приблизительно из 3000 аминокислот. Полибелок содержит коровый белок, белки оболочки E1 и Е 2, связанный с мембраной белок р 7 и неструктурные белки NS2, NS3, NS4A, NS4B, NS5A и NS5B. Инфекция HCV ассоциирована с прогрессирующей патологией печени, включая цирроз и печеночно-клеточную карциному. Хронический гепатит С можно лечить пегинтерфероном-альфа в комбинации с рибавирином. Остаются существенные ограничения с точки зрения эффективности и переносимости, поскольку многие потребители страдают от побочных эффектов, и устранение вируса из организма часто является недостаточным. Таким образом, существует необходимость в новых лекарственных средствах для лечения инфекцииHCV. Сущность изобретения Настоящее изобретение относится к соединениям формул I, IA, IB, IC и ID и к их фармацевтически приемлемым солям. Эти соединения и соли могут ингибировать репликацию HCV, и, таким образом, они пригодны для лечения инфекции HCV. Настоящее изобретение также относится к композициям, содержащим соединения или соли по настоящему изобретению. Композиции также могут включать дополнительные лекарственные средства, такие как ингибиторы хеликазы HCV, ингибиторы полимеразы HCV,ингибиторы протеазы HCV, ингибиторы NS5A HCV, ингибиторы CD81, ингибиторы циклофилина или ингибиторы участка внутренней посадки рибосомы (IRES). Кроме того, настоящее изобретение относится к способам применения соединений или солей по настоящему изобретению для ингибирования репликации HCV. Способы включают контактирование клеток, инфицированных вирусом HCV, с соединением или солью по настоящему изобретению, тем самым ингибируя репликацию вируса HCV в клетках. Кроме того, настоящее изобретение относится к способам применения соединений или солей по настоящему изобретению или содержащих их композиций для лечения инфекции HCV. Способы включают введение соединения или соли по настоящему изобретению или содержащей их фармацевтической композиции пациенту, нуждающемуся в этом, тем самым снижая уровень вируса HCV в крови или ткани пациента. Также настоящее изобретение относится к применению соединений или солей по настоящему изобретению для изготовления лекарственных средств для лечения инфекции HCV. Более того, настоящее изобретение относится к способам получения соединений или солей по изобретению. Другие признаки, задачи и преимущества настоящего изобретения представлены в подробном описании, которое следует далее. Однако следует понимать, что подробное описание, хотя и указывает на предпочтительные варианты осуществления изобретения, приведено только в качестве иллюстрации, а не для ограничения. Различные изменения и модификации в объеме изобретения станут понятными специалистам в данной области из подробного описания. Подробное описание Настоящее изобретение относится к соединениям формулы IB и к их фармацевтически приемлемым солям где X представляет пирролидин, необязательно замещенный одним или двумя заместителями, выбранными из C1-С 6 алкокси или C1-С 6 алкоксиС 1-С 6 алкила; А представляет собой где каждый А и В необязательно замещены карбокси C1-С 6 алкилом или галогеном;D представляет собой фенил, необязательно замещенный одним тремя заместителями, выбранными из группы, состоящей из С 1-С 6 алкила, С 1-С 6 алкокси, гидрокси, галогена, галоген С 1-С 6 алкокси, галоген С 1-С 6 алкилС 1-С 6 алкила, нитрильной группы, С 1-С 6 алкилнитрильной группы, гидроксиС 1-С 6 алкила, тетрагидропиран-4-ила, С 1-С 6 алкоксиС 1-С 6 алкила, С 1-С 6 алкокси(С 1-С 6 алкокси)С 1-С 6 алкила, аминоС 1-С 6 алкила, нитроС 1-С 6 алкила, С 1-С 6 алкилациламида, адамантила, 3-6-членного циклоалкила, 3-12-членного гетероциклила, содержащего один или два гетероатома в кольце, выбранных из N, О или S, необязательно замещенных галогеном; пиридин, замещенный С 1-С 6 алкокси, С 1-С 6 алкилом, аминоС 1-С 6 алкилом, сульфоамидной группы,ацетамид, 3-6-членным гетероциклом, содержащим один или двагетероатома, выбранных из N и О; тиазол, необязательно конденсированный с 6-членным карбоциклом и замещенный фенилом, который необязательно замещен галогеном; 6-членный циклоалкил, замещенный фенилом; фенил, конденсированный с 5-членным гетероциклом, содержащим два атома О в кольце, который замещен одним или двумя атомами галогена; бензотиазол;-T-RD' в каждом случае его присутствия независимо выбран из -C(O)-LY", замещенного одним или двумя заместителями, выбранными из фенила, С 3-C8 циклоалкила, гидроксила, С 1-С 6 алкила, галогена;-С(О)-LY'-N(RB)C(O)-LS-RD'- или -С(О)-LY'-N(RB)С(О)O-LS-RD', где LY' представляет собой С 1-С 6 алкилен и необязательно замещен одним RL;RC' в каждом случае его присутствия представляет собой водород;RB в каждом случае его присутствия выбран из водорода; где каждый А и В независимо необязательно замещен одним или несколькими карбоксиС 1 С 6 алкилом или галогеном. Наиболее предпочтительно D представляет собой где RM является таким, как определено выше, и каждый RN независимо выбран из RD и предпочтительно представляет собой водород. Один или несколько RN также предпочтительно могут представлять собой галоген, такой как F.D также предпочтительно представляет собой пиридинил или тиазолил, необязательно замещенный одним или несколькими заместителями. Неограничивающие примеры предпочтительного X включают следующие пирролидиновые кольца,каждое из которых необязательно замещено одним или двумя заместителями, выбранными из C1 С 6 алкокси или С 1-С 6 алкоксиС 1-С 6 алкила: Как показано, относительная стереохимия во 2 и 5 положениях указанного выше пирролидинового кольца может быть либо цис-, либо транс-. Стереохимия необязательных заместителей в 3 или 4 положениях пирролидина может варьировать относительно любого заместителя в любом другом положении на кольце пирролидина. В зависимости от конкретных заместителей, связанных с пирролидином, стереохимия в любом атоме углерода может представлять собой либо (R) или (S). Т и RD являются такими, как определено в настоящем документе. Т, например, может представлять собой -LS-M-LS'-M'-LS"-, где LS представляет собой связь; M представляет собой С(О); LS' представляет собой С 1-С 6 алкилен, такой как, но не ограничиваясь ими, где LS' необязательно замещен одним RL; RL представляет собой заместитель, такой как, но не ограничиваясь ими, фенил или метокси; М' представляет собой -NHC(O)- или -NMeC(O)-; и LS" представляет собой связь. Стереохимия по любым атомам углерода в группе LS' может быть либо (R), либо (S). T-RD включает, но не ограничивается имиT-RD также может включать некоторые стереохимические конфигурации; таким образом, T-RD включает, но не ограничивается имиT-RD может представлять собой, но на ограничиваться ими где стереохимия по атому углерода в группе T-RD может быть либо (R), либо (S). Т включает, но не ограничивается ими где стереохимия по атому углерода в группе T-RD может быть либо (R), либо (S). А и В могут быть одинаковыми или могут отличаться. Предпочтительно А представляет, например, и В представляет собой, например, и А и В независимо необязательно замещены одним или несколькими заместителями. Предпочтительно D представляет собой фенил и замещен одним или несколькими заместителями,такими, как определено выше.D также предпочтительно представляет собой пиридинил или тиазолил, необязательно замещенный одним или несколькими заместителями. Наиболее предпочтительно D представляет собой и необязательно замещен одним или несколькими заместителями. Предпочтительно -T-RD' в каждом случае его присутствия независимо выбран из -С(О)-LY'N(RB)С(О)-LS"-RD' или -C(O)-LY'-N (RB)С(O)O-LS"-RD'. Наиболее предпочтительно -T-RD' в каждом случае его присутствия независимо выбран из -С(О)-LY'-N(RB)С(О)-RD' или -С(О)-LY'-N(RB)С(O)O-RD', где каждый LY' предпочтительно независимо представляет собой С 1-С 6 алкилен (например, -СН 2-) и необязательно замещен одним или несколькими заместителями, выбранными из RL. Соединения по настоящему изобретению можно применять в форме солей. В зависимости от конкретного соединения, соль соединения может быть преимущественной вследствие одного или нескольких физических свойств солей, таких как повышенная фармацевтическая стабильность в определенных условиях или желаемая растворимость в воде или масле. В некоторых случаях соль соединения может быть пригодна для выделения или очистки соединения. Когда соль предназначена для введения пациенту, соль предпочтительно является фармацевтически приемлемой. Фармацевтически приемлемые соли включают, но не ограничиваются ими, кислотно-аддитивные соли, основно-аддитивные соли и соли щелочных металлов. Фармацевтически приемлемые кислотно-аддитивные соли можно получать из неорганических или органических кислот. Примеры пригодных неорганических кислот включают, но не ограничиваются ими, хлористо-водородную, бромисто-водородную, йодисто-водородную, азотную, угольную, серную и фосфорную кислоты. Примеры пригодных органических кислот включают, но не ограничиваются ими,классы алифатических, циклоалифатических, ароматических, аралифатических, гетероциклильных, карбоновых и сульфоновых органических кислот. Конкретные примеры пригодных органических кислот включают ацетат, трифторацетат, формиат, пропионат, сукцинат, гликолят, глюконат, диглюконат, лактат, малат, виннокаменную кислоту, цитрат, аскорбат, глюкуронат, малеат, фумарат, пируват, аспартат,глутамат, бензоат, антраниловую кислоту, мезилат, стеарат, салицилат, п-гидроксибензоат, фенилацетат,манделат, эмбонат (памоат), метансульфонат, этансульфонат, бензолсульфонат, пантотенат, толуолсульфонат, 2-гидроксиэтансульфонат, сульфанилат, циклогексиламиносульфонат, альгеновую кислоту, bгидроксимасляную кислоту, галактарат, галактоуронат, адипат, альгинат, бисульфат, бутират, камфорат,камфорсульфонат, циклопентанпропионат, додецилсульфат, гликогептаноат, глицерофосфат, гемисульфат, гептаноат, гексаноат, никотинат, 2-нафталсульфонат, оксалат, пальмоат, пектинат, персульфат, 3 фенилпропионат, пикрат, пивалат, тиоцианат, тозилат и ундеканоат. Фармацевтически приемлемые основно-аддитивные соли включают, но не ограничиваются ими,соли металлов и органические соли. Неограничивающие примеры пригодных солей металлов включают соли щелочных металлов (группы Ia), соли щелочно-земельных металлов (группы IIa) и другие фармацевтически приемлемые соли металлов. Такие соли могут быть получены, но не ограничиваясь этим, из алюминия, кальция, лития, магния, калия, натрия или цинка. Неограничивающие примеры пригодных органических солей можно получать из третичных аминов и четвертичных аминов, таких как трометамин, диэтиламин, N,N'-дибензилэтилендиамин, хлорпрокаин, холин, диэтаноламин, этилендиамин, меглумин (N-метилглюкамин) и прокаин. Основные азотсодержащие группы можно кватернизировать такими веществами, как алкилгалогениды (например, метил-, этил-, пропил-, бутил-, децил-, лаурил-, миристил- и стеарилхлориды/бромиды/йодиды), диалкилсульфаты (например, диметил-, диэтил-, дибутил и диамилсульфаты), аралкилгалогениды (например, бензил- и фенэтилбромиды) и другие. Соединения или соли по настоящему изобретению могут существовать в форме сольватов, таких как с водой (т.е. гидраты) или с органическими растворителями (например, с метанолом, этанолом или ацетонитрилом с образованием, соответственно, метанолата, этанолата или ацетонитрилата). Соединения или соли по настоящему изобретению также можно использовать в форме пролекарств. Соединения по изобретению могут содержать асимметрично замещенные атомы углерода, известные в качестве хиральных центров. Эти соединения могут существовать, но не ограничиваясь этим, в качестве единичных стереоизомеров (например, единичного энантиомера или единичного диастереомера), смесей стереоизомеров (например, смесь энантиомеров или диастереомеров) или рацемических смесей. Подразумевают, что соединения, представленные в настоящем документе в качестве единичных стереоизомеров, относятся к соединениям, которые присутствуют в форме, которая, по существу, не содержит других стереоизомеров (например, по существу, не содержит других энантиомеров или диастереомеров). Под "по существу, не содержит" подразумевают, что по меньшей мере 80% соединения в композиции представляет собой указанный стереоизомер; предпочтительно по меньшей мере 90% соединения в композиции представляет собой указанный стереоизомер и более предпочтительно по меньшей мере 95, 96, 97, 98 или 99% соединения в композиции представляет собой указанный стереоизомер. Когда стереохимия хирального атома углерода не указана в химической структуре соединения, подразумевают,что химическая структура охватывает соединения, содержащие любой стереоизомер хирального центра. Индивидуальные стереоизомеры соединений по изобретению можно получать с использованием множества способов, известных в данной области. Эти способы включают, но не ограничиваются ими,стереоспецифический синтез, хроматографическое разделение диастереомеров, хроматографическое разделение энантиомеров, преобразование энантиомеров в энантиомерной смеси в диастереомеры с последующим хроматографическим разделением диастереомеров и регенерацией отдельных энантиомеров и ферментативным разделением. Стереоспецифический синтез, как правило, вовлекает применение соответствующих оптически чистых (энантиомерно чистых) или по существу оптически чистых материалов и реакций синтеза, которые не вызывают рацемизации или инверсии стереохимии хиральных центров. Смеси стереоизомеров соединений, включая рацемические смеси, образовавшиеся в реакции синтеза, можно разделять, например,способами хроматографии, как понятно специалистам в данной области. Хроматографическое разделение энантиомеров можно проводить с использованием хиральных хроматографических смол, многие из которых являются коммерчески доступными. В неограничивающем примере рацемат помещают в раствор и загружают в колонку, содержащую хиральную стационарную фазу. Затем энантиомеры можно разделять способом ВЭЖХ. Разделение энантиомеров также можно проводить путем преобразования энантиомеров в смеси в диастереомеры путем реакции с хиральными вспомогательными реагентами. Полученные диастереомеры можно разделять колоночной хроматографией или кристаллизацией/перекристаллизацией. Этот способ пригоден, когда соединения, подлежащие разделению, содержат карбоксильную, амино или гидроксильную группы, которые образуют соль или ковалентную связь с хиральным вспомогательным реагентом. Неограничивающие примеры пригодных хиральных вспомогательных реагентов включают хирально чистые аминокислоты, органические карбоновые кислоты или органосульфоновые кислоты. После разделения диастереомеров хроматографией отдельные энантиомеры можно получать повторно. Часто хиральный вспомогательный реагент можно извлекать и использовать снова. Для разделения производных энантиомеров в энантиомерной смеси могут быть пригодны ферменты, такие как эстеразы, фосфатазы или липазы. Например, сложноэфирное производное карбоксильной группы в соединениях, подлежащих разделению, можно обрабатывать ферментом, который селективно гидролизует один из энантиомеров в смеси. Затем полученную энантиомерно чистую кислоту можно отделять от негидролизованного сложного эфира. Альтернативно соли энантиомеров в смеси можно получать с использованием любого пригодного способа, известного в данной области, включая обработку карбоновой кислоты пригодным оптически чистым основанием, таким как алкалоиды или фенэтиламин, с последующим осаждением или кристаллизацией/перекристаллизацией энантиомерно чистых солей. Способы, пригодные для разрешения/разделения смесей стереоизомеров, включая рацемические смеси, могут быть найдены в ENANTIOMERS, RACEMATES, AND RESOLUTIONS (Jacques et al., 1981, John Wiley and Sons, New York, NY). Соединение по этому изобретению может обладать одной или несколькими ненасыщенными углерод-углеродными двойными связями. Подразумевают, что в объем указанного соединения, если нет иных указаний, входят все изомеры по двойной связи, такие как цис-(Z)- и транс-(Е)-изомеры и их смеси. Кроме того, когда соединение существует в различных таутомерных формах, указанное соединение не ограничивается каким-либо конкретным таутомером, а скорее предполагается, что оно охватывает все таутомерные формы. Определенные соединения по изобретению могут существовать в различных стабильных конформационных формах, которые могут быть разделены. Торсионная асимметрия вследствие ограниченного вращения вокруг асимметричной одинарной связи, например, вследствие пространственного препятствия или напряжения кольца, может позволить разделение различных конформеров. Изобретение относится к каждому конформационному изомеру этих соединений и их смесей. Определенные соединения по изобретению также могут существовать в цвиттерионной форме, и изобретение охватывает каждую цвиттерионную форму этих соединений и их смесей. Соединения по настоящему изобретению, главным образом, описаны в настоящем документе с использованием стандартной номенклатуры. Для приведенного соединения, имеющего асимметричный центр(ы), следует понимать, что настоящее изобретение охватывает все стереоизомеры соединения и их смеси, если нет иных указаний. Неограничивающие примеры стереоизомеров включают энантиомеры,диастереомеры и цис-транс-изомеры. Когда приведенное соединение существует в различных таутомерных формах, подразумевают, что соединение охватывает все таутомерные формы. Определенные соединения описаны в настоящем документе с использованием общих формул, которые включают переменные(например, А, В, D, X, L1, L2, L3, Y, Z, T, RA или RB). Если нет иных указаний, каждая переменная в такой формуле определена независимо от любой другой переменной, и любая переменная, которая встречается в формуле более одного раза, определяется независимо в каждом случае. Если группы описаны, как "независимо" выбранные из группы, каждую группу выбирают независимо от другой группы. Таким обра-6 023570 зом, каждая группа может быть идентична другой группе или группам, или она может отличаться от нее."С 1-С 6 алкил" относится к алкильному заместителю, содержащему от 1 до 6 атомов углерода. Иллюстрируя далее С 3-С 6 циклоалкил означает насыщенное углеводородное кольцо, содержащее от 3 до 6 атомов углерода в кольце. Приставка, присоединенная к многокомпонентному заместителю, относится только к первому компоненту, который непосредственно следует за приставкой. Если нет иных указаний,когда связывающий элемент связывает два других элемента в представленной химической структуре,крайний слева из описанных компонентов связывающего элемента связан с левым элементом на представленной структуре, и самый правый из описанных компонентов связывающего элемента связан с правым элементом в представленной структуре. Для иллюстрации, если химическая структура представляет собой -LS-M-LS'- и M представляет собой -N(RB)S(O)-, тогда химическая структура представляет собой-LS-N(RB)S(O)-LS'-. Если связывающий элемент на представленной структуре представляет собой связь, тогда элемент,находящийся слева относительно связывающего элемента, присоединен непосредственно к элементу,находящемуся справа от связывающего элемента через ковалентную связь. Например, если химическая структура изображена как -LS-M-LS'- и M выбран в качестве связи, тогда химическая структура представляет собой -LS-LS'-. Если два или более соседних связывающих элемента на представленной структуре представляют собой связь, тогда элемент, находящийся слева от этих связывающих элементов, связан непосредственно с элементом, находящимся справа от этих связующих элементов, через ковалентную связь. Например, если химическая структура изображена как -LS-M-LS'-M'-LS"- и в качестве М и LS' выбрана связь, тогда химическая структура представляет собой -LS-M'-LS"-. Аналогично, если химическая структура представлена в качестве -LSM-LS'-M' -LS"- и M, LS' и M' представляют собой связь, тогда химическая структура представляет собой -LS-LS"-. Когда для описания группы используют химическую формулу, черта(ы) указывает на часть группы,которая имеет свободную валентность(и). Если группа описана как являющаяся "необязательно замещенной", группа может быть либо замещенной, либо незамещенной. Если группа описана, как являющаяся необязательно замещенной вплоть до конкретного количества неводородных радикалов, то группа может быть либо незамещенной, либо замещенной вплоть до этого конкретного количества неводородных радикалов или вплоть до максимального количества поддающихся замещению положений на группе, в зависимости от того, что является меньшим. Таким образом, например, если группа описана как гетероцикл, необязательно замещенный посредством вплоть до трех неводородных радикалов, тогда любой гетероцикл с менее чем тремя поддающимися замещению положениями является необязательно замещенным вплоть до только того количества неводородных радикалов, сколько гетероцикл имеет поддающихся замещению положений. Для иллюстрации, тетразолил (который имеет только одно поддающееся замещению положение) будет необязательно замещен посредством вплоть до одного неводородного радикала. Для дальнейшей иллюстрации, если азот аминогруппы описан как являющийся необязательно замещенным посредством вплоть до двух неводородных радикалов, тогда первичный азот аминогруппы будет необязательно замещен посредством вплоть до двух неводородных радикалов, в то время как вторичный азот аминогруппы будет необязательно замещен посредством вплоть до только одного неводородного радикала. Термин "алкенил" означает прямую или разветвленную углеводородную цепь, содержащую одну или несколько двойных связей. Каждая углерод-углеродная двойная связь может иметь либо цис-, либо транс-геометрию в алкенильной группе относительно групп, замещенных по углеродам двойной связи. Неограничивающие примеры алкенильных групп включают этенил (винил), 2-пропенил, 3-пропенил, 1,4 пентадиенил, 1,4-бутадиенил, 1-бутенил, 2-бутенил и 3-бутенил. Термин "алкенилен" относится к двухвалентной ненасыщенной углеводородной цепи, которая может быть линейной или разветвленной и которая имеет по меньшей мере одну углерод-углеродную двойную связь. Неограничивающие примеры алкениленовых групп включают -С(Н)=С(Н)-, -С(Н)=С(Н)СН 2-, -С(Н)=С(Н)-СН 2-СН 2-, -СН 2-С(Н)=С(Н)-СН 2-, -С(Н)=С(Н)-СН(СН 3)- и -СН 2-С(Н)=С(Н)СН(СН 2 СН 3)-. Термин "алкил" означает прямую или разветвленную насыщенную углеводородную цепь. Неограничивающие примеры алкильных групп включают метил, этил, н-пропил, изопропил, н-бутил, изобутил,втор-бутил, трет-бутил, пентил, изоамил и гексил. Термин "алкилен" означает двухвалентную насыщенную углеводородную цепь, которая может быть линейной или разветвленной. Типичные примеры алкилена включают, но не ограничиваются ими,-СН 2-, -СН 2 СН 2-, -СН 2 СН 2 СН 2-, -СН 2 СН 2 СН 2 СН 2- и -СН 2 СН(СН 3)СН 2-. Термин "алкинил" означает прямую или разветвленную углеводородную цепь, содержащую одну или несколько тройных связей. Неограничивающие примеры алкинила включают этинил, 1-пропинил, 2 пропинил, 3-пропинил, децинил, 1-бутинил, 2-бутинил и 3-бутинил. Термин "алкинилен" относится к двухвалентной ненасыщенной углеводородной группе, которая может быть линейной или разветвленной и которая имеет по меньшей мере одну углерод-углеродную тройную связь. Типичные алкиниленовые группы включают, в качестве примера, -СС-, -CC-CH2-,-7 023570-СС-СН 2-СН 2-,CH2-CC-CH2-, -СС-СН(СН 3)- и -СН 2-СС-СН (СН 2 СН 2)-. Термин "карбоцикл", или "карбоциклический", или "карбоциклил" относится к насыщенной (например, "циклоалкильной"), частично насыщенной (например, "циклоалкенильной" или "циклоалкинильной") или полностью ненасыщенной (например, "арильной") кольцевой системе, содержащей ноль гетероатомов в атомах кольца. "Кольцевые атомы" или "члены кольца" представляют собой атомы, связанные с образованием кольца или колец. Карбоциклил может представлять собой, но не ограничиваясь ими, одинарное кольцо, два конденсированных кольца, или кольца с мостиком или спиро-кольца. Замещенный карбоциклил может иметь либо цис-, либо транс-геометрию. Типичные примеры карбоциклильных групп включают, но не ограничиваются ими, циклопропил, циклобутил, циклопентил, циклогексил,циклогептил, циклооктил, циклопентенил, циклопентадиенил, циклогексадиенил, адамантил, декагидронафталенил, октагидроинденил, циклогексенил, фенил, нафтил, инданил, 1,2,3,4-тетрагидронафтил, инденил, изоинденил, декалинил и норпинанил. Карбоциклильная группа может быть связана с основной молекулярной группой через любой поддающийся замещению углеродный атом кольца. Когда карбоциклильная группа представляет собой двухвалентную группу, связывающую два элемента на представленной химической структуре (таких как А в формуле I), карбоциклильная группа может быть связана с двумя другими элементами через любые два поддающихся замещению атома кольца. Аналогично, когда карбоциклильная группа представляет собой трехваленную группу, связывающую три других элемента на представленной химической структуре (такие как X в формуле I), карбоциклильная группа может быть связана с тремя другими элементами через любые три поддающихся замещению атома кольца соответственно. Термин "карбоциклилалкил" относится к карбоциклильной группе, присоединенной к основной молекулярной группе через алкиленовую группу. Например, С 3-С 6 карбоциклилС 1-С 6 алкил относится к С 3 С 6 карбоциклильной группе, присоединенной к основной молекулярной группе через С 1-С 6 алкилен. Термин "циклоалкенил" относится к неароматической, частично ненасыщенной карбоциклильной группе, имеющей ноль гетероатомных членов в кольце. Типичные примеры циклоалкенильных групп включают, но не ограничиваются ими, циклобутенил, циклопентенил, циклогексенил и октагидронафталенил. Термин "циклоалкил" относится к насыщенной карбоциклильной группе, содержащей ноль гетероатомных членов кольца. Неограничивающие примеры циклоалкилов включают циклопропил, циклобутил, циклопентил,циклогексил, циклогептил, циклооктил, декалинил и норпиналил. Приставка "галоген" указывает на то, что заместитель, к которому присоединена эта приставка, замещен одним или несколькими независимо выбранными радикалами галогена. Например, "C1 С 6 галогеналкил" означает С 1-С 6 алкильный заместитель, где один или несколько атомов водорода заменены независимо выбранными радикалами галогенов. Неограничивающие примеры C1-С 6 галогеналкила включают хлорметил, 1-бромэтил, фторметил, дифторметил, трифторметил и 1,1,1-трифторэтил. Должно быть понятно, что если заместитель замещен более чем одним радикалом галогена, эти радикалы галогенов могут быть идентичными или могут отличаться (если нет иных указаний). Термин "гетероцикл", или "гетероцикло", или "гетероциклил" относится к насыщенной (например,"гетероциклоалкильной"), частично ненасыщенной (например, "гетероциклоалкенильной" или "гетероциклоалкинильной") или полностью ненасыщенной (например, "гетероарильной") кольцевой системе,где по меньшей мере один из атомов кольца представляет собой гетероатом (т.е. азот, кислород или серу), а остальные атомы кольца независимо выбраны из группы, состоящей из углерода, азота, кислорода и серы. Гетероцикл может представлять собой, но неограничиваясь ими, одинарное кольцо, два конденсированных кольца, или кольца с мостиком или спиро-кольца. Гетероциклильная группа может быть связана с основной группой через любой поддающийся замещению атом(ы) углерода или азота в группе. Когда гетероциклильная группа является двухвалентной группой, которая связывает другие два элемента на представленной химической структуре (такие как А в формуле I), гетероциклильная группа может быть присоединена к двум другим элементам через любые два поддающихся замещению атома кольца. Аналогично, когда гетероциклильная группа представляет собой трехвалентную группу, которая связывает три других элемента на представленной химической структуре (такие как X в формуле I), гетероциклическая группа может быть присоединена к трем другим элементам через любые три поддающихся замещению атома кольца соответственно. Гетероциклил может представлять собой, но не ограничиваясь ими, моноцикл, который содержит одно кольцо. Неограничивающие примеры моноциклов включают фуранил, дигидрофуранил, тетрагидрофуранил, пирролил, изопирролил, пирролинил, пирролидинил, имидазолил, изоимидазолил, имидазолинил, имидазолидинил, пиразолил, пиразолинил, пиразолидинил, триазолил, тетразолил, дитиолил, оксатиолил, оксазолил, изоксазолил, тиазолил, изотиазолил, тиазолинил, изотиазолинил, тиазолидинил,изотиазолидинил, тиодиазолил, оксатиазолил, оксадиазолил (включая 1,2,3-оксадиазолил, 1,2,4 оксадиазолил(также известный как "азоксимил"), 1,2,5-оксадиазолил (также известный как "фуразанил") и 1,3,4-оксадиазолил), оксатриазолил (включая 1,2,3,4-оксатриазолил и 1,2,3,5-оксатриазолил), диоксазолил (включая 1,2,3-диоксазолил, 1,2,4-диоксазолил, 1,3,2-диоксазолил и 1,3,4-диоксазолил), оксатиола-8 023570(включая 1,2,5-оксатиазинил или 1,2,6-оксатиазинил), оксадиазинил (включая 1,4,2-оксадиазинил и 1,3,5,2-оксадиазинил), морфолинил, азепинил, оксепинил, тиепинил, тиоморфолинил и диазепинил. Гетероциклил также может представлять собой, но не ограничиваясь ими, бицикл, содержащий два конденсированных кольца, например, такой как нафтиридинил (включая [1,8]нафтиридинил и[1,6]нафтиридинил), тиазолпиримидинил, тиенопиримидинил, пиримидопиримидинил, пиридопиримидинил, пиразолопиримидинил, индолизинил, пириндинил, пиранопирролил, 4 Н-хинолизинил, пуринил,пиридопиридинил (включая пиридо[3,4-b]пиридинил., пиридо[3,2-b]пиридинил и пиридо[4,3b]пиридинил), пиридопиримидин и птеридинил. Другие неограничивающие примеры гетероциклов с конденсированными кольцами включают бензоконденсированные гетероциклилы, такие как индолил,изоиндолил, индоленинил (также известный как "псевдоиндолил"), изоиндазолил (также известный, как"бензпиразолил" или индазолил), бензазинил (включая хинолинил (также известный как "1-бензазинил") и изохинолинил (также известный как "2-бензазинил", бензимидазолил, фталазинил, хиноксалинил,бензодиазинил (включая циннолинил (также известный как "1,2-бензодиазинил") и хиназолинил (также известный как "1,3-бензодиазинил", бензопиранил (включая "хроменил" и "изохроменил"), бензотиопиранил (также известный как "тиохроменил"), бензоксазолил, индоксазинил (также известный как "бензизоксазолил"), антранилил, бензодиоксолил, бензодиоксанил, бензоксадиазолил, бензофуранил (также известный как "кумаронил"), изобензофуранил, бензотиенил (также известный как "бензотиофенил","тионафтенил" и "бензотиофуранил"), изобензотиенил (также известный как "изобензотиофенил", "изотионафтенил" и "изобензотиофуранил"), бензотиазолил, 4,5,6,7-тетрагидробензо[d]тиазолил, бензотиадиазолил, бензимидазолил, бензотриазолил, бензоксазинил (включая 1,3,2-бензоксазинил, 1,4,2 бензоксазинил, 2,3,1-бензоксазинил и 3,1,4-бензоксазинил), бензизоксазинил (включая 1,2 бензизоксазинил и 1,4-бензизоксазинил) и тетрагидроизохинолинил. Гетероциклил также может представлять собой, но не ограничиваясь ими, спиро-колыдевую систему, например, такую как 1,4-диокса-8-азаспиро[4,5]деканил. Гетероциклил может содержать один или несколько атомов серы в качестве членов кольца; и в некоторых случаях атом(ы) серы окислен до SO или SO2. Гетероатом(ы) азота в гетероциклиле может быть или может не быть кватернизованным, он может быть окислен до N-оксида или может быть не окислен. Кроме того, гетероатом(ы) азота могут быть или могут не быть N-защищенными. в химической формуле относится к одинарной или двойной связи. Термин "фармацевтически приемлемый" используют в качестве прилагательного для обозначения того, что существительное, к которому оно относится, пригодно для применения в качестве фармацевтического продукта или в качестве части фармацевтического продукта. Термин "терапевтически эффективное количество" относится к общему количеству каждого активного вещества, которое является достаточным, чтобы показать существенную пользу у пациента, например снижение вирусной нагрузки. Термин "пролекарство" относится к производным соединений по изобретению, которые имеют химически или метаболически отщепляемые группы и становятся путем сольволиза или в физиологических условиях соединениями по изобретению, которые являются фармацевтически активными in vivo. Пролекарство соединения может быть получено общепринятым способом путем реакции с функциональной группой соединения (такой как амино-, гидрокси- или карбоксигруппа). Пролекарства часто обеспечивают преимущества растворимости, совместимости с тканями или замедленного высвобождения у млекопитающих (см., Bungard, H., DESIGN OF PRODRUGS, pp. 7-9, 21-24, Elsevier, Amsterdam 1985). Пролекарства включают кислотные производные, хорошо известные практикующим специалистам в данной области, например, такие как сложные эфиры, полученные реакцией исходного кислотного соединения с пригодным спиртом, или амиды, полученные реакцией исходного кислотного соединения с подходящим амином. Примеры пролекарств включают, но не ограничиваются ими, ацетат, формиат, бензоат или другие ацетилированные производные функциональных групп спиртов или аминов в соединениях по изобретению. Термин "сольват" относится к физической ассоциации соединения по изобретению с одной или несколькими молекулами растворителя как органического, так и неорганического. Эта физическая ассоциация часто включает образование водородных связей. В определенных примерах сольват способен к выделению, например, когда одна или несколько молекул растворителя включены в кристаллическую решетку кристаллического твердого вещества. "Сольват" охватывает как находящиеся в фазе раствора,так и выделяемые сольваты. Иллюстративные сольваты включают, но не ограничиваются ими, гидраты,этанолаты и метанолаты. Термин "N-защитная группа" или "N-защищенный" относится к группам, способным защищать аминогруппу от нежелательных реакций. Часто используемые N-защитные группы описаны в Greene andWuts, PROTECTING GROUPS IN CHEMICAL SYNTHESYS (3rd ed., John WileySons, NY (1999). Неограничивающие примеры N-защитных групп включают ацильные группы, такие как формил, ацетил, пропионил, пивалоил, трет-бутилацетил, 2-хлорацетил, 2-бромацетил, трифторацетил, трихлорацетил, фталил, о-нитрофеноксиацетил, бензоил, 4-хлорбензоил, 4-бромбензоил или 4-нитробензоил; сульфонильные группы, такие как бензолсульфонил или п-толуолсульфонил; сульфенильные группы, такие как фенилсульфенил (фенил-S-) или трифенилметилсульфенил (тритил-S-); сульфинильные группы, такие как п-метилфенилсульфинил (п-метилфенил-S(О)-) или трет-бутилсульфинил (t-Bu-S(О)-); образующие карбамат группы, такие как бензилоксикарбонил, п-хлорбензилоксикарбонил, п-метоксибензилоксикарбонил, п-нитробензилоксикарбонил, 2-нитробензилоксикарбонил, п-бромбензилоксикарбонил, 3,4 диметоксибензилоксикарбонил, 3,5-диметоксибензилоксикарбонил, 2,4-диметоксибензилоксикарбонил,4-метоксибензилоксикарбонил, 2-нитро-4,5-диметоксибензилоксикарбонил, 3,4,5-триметоксибензилоксикарбонил, 1-(п-бифенилил)-1-метилэтоксикарбонил, диметил-3,5-диметоксибензилоксикарбонил,бензгидрилоксикарбонил, трет-бутилоксикарбонил, диизопропилметоксикарбонил, изопропилоксикарбонил, этоксикарбонил, метоксикарбонил, аллилоксикарбонил, 2,2,2-трихлорэтоксикарбонил, феноксикарбонил, 4-нитрофеноксикарбонил, циклопентилоксикарбонил, адамантилоксикарбонил, циклогексилоксикарбонил или фенилтиокарбонил; алкильные группы, такие как бензил, п-метоксибензил, трифенилметил или бензилоксиметил; п-метоксифенил; и силильные группы, такие как триметилсилил. Предпочтительные N-защитные группы включают формил, ацетил, бензоил, пивалоил, трет-бутилацетил, фенилсульфонил, бензил, трет-бутилоксикарбонил (Boc) и бензилоксикарбонил (Cbz). Соединения по настоящему изобретению можно получать с использованием множества способов. В качестве неограничивающего примера соединения по настоящему изобретению можно получать согласно схеме I, начиная с соединений формулы II (например, n=0-8), формулы V (Х 4 может представлять собой, например, О или NRA, где RA является таким, как описано в настоящем документе выше, и предпочтительно представляет собой H или RE, как определено выше, как, например, С 1-С 6 алкил, 3-12-членный карбоцикл или гетероцикл, -C(O)RS, -C(O)ORS, -С(O)N(RSRS') , SO2N(RSRS'), -S(O)2ORS, -S(O)ORS,-S(О)N(RSRS'), или пригодную защитную группу, такую как Boc или Fmoc), или формулы VIII (Е может представлять собой, например, 3-7-членный карбоцикл или гетероцикл и необязательно замещен одним или несколькими RA), где А, В, D, Y, Z и RA являются такими, как описано выше. 1,4-дикетоны II, V иVIII можно восстанавливать до 1,4-диолов с использованием способов, описанных ниже, и полученные рацемические энантиомерно обогащенные или мезо-1,4-диолы можно превращать в димезилаты III, VI или IX или альтернативно в дитрифлаты, дитозилаты или дигалогениды способами, описанными ниже. Димезилаты III, VI и IX, дитрифлаты, дитозилаты или дигалогениды можно подвергать реакции с амином, включая, но не ограничиваясь ими, анилин, 3,5-дифторанилин, 3,4-дифторанилин, 4-фторанилин, 3 фторанилин, 4-трифторметиланилин, 4-хлоранилин, гетероариламины, алкиламины, циклоалкиламины,замещенные бензиламины или аллиламин, в условиях, описанных ниже, с получением соединений по изобретению. L1 и L2 можно легко вносить в формулы II, V и VIII, как будет понятно специалистам в данной области ввиду настоящего изобретения. Аналогично, вместо D-NH2 можно использовать D-L3NH2, как понятно специалистам в данной области. В качестве другого неограничивающего примера соединения по настоящему изобретению можно получать, начиная с соединений формулы II и формулы III, как показано на схеме II. 1,4-Дикетоны, как например, формулы IV, можно получать с использованием известных способов (см. Nevar, et al., Synthesis: 1259-1262 (2000, таких как реакция -бромкетонов, таких как соединение формулы II, с метилкето- 10023570 нами, такими как соединение формулы III, в присутствии пригодной кислоты Льюиса, такой как ZnCl2 или Ti(OiPr)4. 1,4-Дикетоны IV можно восстанавливать до 1,4-диолов, таких как V, под действиемNaBH4, LiAlH4 или DIBAL. Альтернативно по аналогии с описанными способами можно проводить энантиоселективное восстановление 1,4-дикетонов, таких как соединение формулы IV (см. Chong, et al.,Tetrahedron: Asymmetry 6:409-418 (1995), Li, et al., Tetrahedron 63:8046-8053 (2007), Aldous, et al., Tetrahedron: Asymmetry 11:2455-2462 (2000), Masui, et al., Synlett: 273-274 (1997), Jing, et al., Adv. Synth. Catal. 347:1193-1197 (2005), Sato, et al., Synthesis: 1434-1438 (2004, такое как восстановление посредством (-) или (+)-диизопинокамфеилхлорборана (DIP-хлорид), боргидридом и оксазаборолидиновым катализатором, или путем асимметричной гидрогенизации в присутствии пригодного катализатора на основе рутения(II), такого как [RuCl2(R)-BINAP(R,R)-DPEN] (BINAP=2,2'-бис(диарилфосфино)-1,1'-бинафтил;DPEN=1,2-дифенилэтилендиамин). Полученные рацемические энантиомерно обогащенные или мезо-1,4 диолы V можно подвергать реакции с метансульфонилхлоридом с получением димезилата формулы VI. Альтернативно соединение формулы V можно превращать в дитрифлат или дитозилат под действием птолуолсульфонилхлорида или трифторметансульфонового ангидрида, или в дигалогенид, такой как дибромид или дихлорид, под действием PPh3 в присутствии CCl4 или CBr4, или под действием SOCl2, POCl3 или PBr3. Димезилат, дитрифлат, дитозилат или дигалогенид может реагировать с амином, таким как 4 фторанилин (как для иллюстрации показано на схеме II), с сорастворителем, таким как DMF, или без него, при температуре от комнатной температуры до 100 С, с получением пирролидинов, таких как соединение формулы VII. В дополнение к 4-фторанилину с димезилатом формулы VI можно подвергать реакции альтернативные амины, включая, но не ограничиваясь ими, анилин, 3,5-дифторанилин, 3,4 дифторанилин, 3-фторанилин, 4-трифторметиланилин, 4-хлоранилин, гетероариламины, алкиламины,циклоалкиламины, замещенные бензиламины или аллиламин. Динитросоединение формулы VII можно восстанавливать до диаминосоединения формулы VIII с использованием Fe в присутствии NH4Cl, HCl или уксусной кислоты или путем обработки гидридным восстановителем, таким как боргидрид натрия (с добавлением соли переходного металла, такой какBlCl3, SbCl3, NiCl2, Cu2Cl2 или CoCl2, или без нее), в растворителе, таком как этанол или THF. Альтернативно соединение формулы VII можно восстанавливать до продукта формулы VIII посредством гидрогенизации в присутствии пригодного катализатора, такого как палладиевый или платиновый катализатор или никель Ренея. Диамин формулы VIII можно подвергать реакции с пригодным образом защищенной пролиновой кислотой (показан Boc, хотя вместо него могут быть Cbz, Troc или Fmoc) в присутствии реагента для присоединения пептида, такого как EDAC/HOBT, РуВОР, HATU или DEBPT, в растворителе,таком как THF, DMF, дихлорметан или DMSO, с добавлением аминового основания, такого как основание Хунига, пиридин, 2,6-лутидин или триэтиламин, или без него, с получением соединения формулыIX. Удаление защитных групп Boc с получением X можно проводить путем обработки кислотой, такой как ТХУ, HCl или муравьиная кислота. Соединения по настоящему изобретению можно получать путем присоединения к соединению формулы X выбранной кислоты с использованием стандартных реагентов для связывания пептидов и условий, описанных выше. Альтернативно диамин VIII можно подвергать реакции с N-замещеннным пролином в присутствии реагента для связывания пептидов, такого какDMSO, с добавлением аминового основания, такого как основание Хунига, пиридин, 2,6-лутидин или триэтиламин, или без него, прямо получая соединения по настоящему изобретению (формулы XI). в каждой формуле на схеме II может быть заменен на где D является таким, как определено выше, и такие соединения можно легко получать способом, описанным на схеме II (включая получение соединения XI непосредственно из соединения VIII). В качестве другого неограничивающего примера соединения по настоящему изобретению можно получать, начиная с соединений формулы II и формулы III, как показано на схеме III, где А, В, D, Y и Z являются такими, как описано выше, с использованием условий, сходных с условиями, описанными выше для получения IV на схеме II. Аналогично, полученный 1,4-дикетон IV можно восстанавливать до 1,4-диолов V с использованием способов, описанных выше для схемы II. Полученные рацемические энантиомерно обогащенные или мезо-1,4-диолы V можно превращать в димезилат VI или альтернативно в дитрифлат, дитозилат или дигалогенид способами, описанными выше. Димезилат VI, дитрифлат, дитозилат или дигалогенид можно подвергать реакции с амином, включая, но не ограничиваясь ими, анилин,3,5-дифторанилин, 3,4-дифторанилин, 4-фторанилин, 3-фторанилин, 4-трифторметиланилин, 4 хлоранилин, гетероариламины, алкиламины, циклоалкиламины, замещенные бензиламины или аллиламин, в условиях, описанных выше, с получением соединений по изобретению. Альтернативно соединения, такие как VIII, где R представляет собой группу, такую как аллил, 4-метоксибензил или 2,4 диметоксибензил, можно обрабатывать реагентами, пригодными для удаления группы R (родиевый катализатор, такой как Rh(Ph3P)3Cl для R=аллил; обработка кислотой, такой как TXY или HCl, для R=4 метоксибензил или 2,4-диметоксибензил; гидрогенолиз Pd-катализатором для R=замещенный бензил) с получением соединений, таких как IX. Амин IX можно подвергать реакции с арилгалогенидом или трифлатом, таким как X (для иллюстрации показан йодид), с использованием реакции Бухвальда-Хартвига в присутствии палладиевого катализатора (такого как Pd(OAc)2 или Pd2(dba)3) и фосфинового лиганда (такого как трифенилфосфин или XantPhos) и основания (такого как бис(триметилсилил)амид натрия, третбутоксид калия или K3PO4) с получением соединений по настоящему изобретению. Альтернативно соединения по настоящему изобретению можно получать путем реакции IX с альдегидом или кетоном путем восстановительного аминирования в присутствии гидридного восстановителя, такого как борогидрид натрия или цианоборгидрид натрия (с добавлением кислоты, такой как уксусная кислота, или без нее), в растворителе, таком как этанол, толуол, THF или дихлорметан. Альтернативно можно проводить восстановительное аминирование с использованием гидрогенизации в присутствии пригодного катализатора,такого как палладиевый или платиновый катализатор или никель Ренея. Альтернативно амин IX можно подвергать реакции с электрофильными реагентами, такими как алкилгалогениды, или с арильными злектрофилами (пригодными являются электронодефицитные арил- и гетероарилгалогениды и трифлаты) путем реакций нуклеофильного ароматического замещения с получением соединений по настоящему изобретению. В качестве следующего неограничивающего примера соединения по настоящему изобретению можно получать, начиная с соединений формулы II и формулы III, как показано на схеме IV, где Х 5 в формуле II и формуле III представляет собой галоген (например, Cl, Br или F) или нитрогруппу. 1,4 Дикетоны, такие как IV, можно получать с использованием известных способов, описанных выше для получения IV для схемы II. 1,4-Дикетоны IV можно восстанавливать до 1,4-диолов, таких как V, под действием NaBH4, LiAlH4 или DIBAL. Альтернативно можно проводить энантиоселективное восстановление 1,4-дикетона, такого как IV, способами, описанными выше для получения V для схемы II. Полученные рацемические энантиомерно обогащенные или мезо-1,4-диолы V можно подвергать реакции с метансульфонилхлоридом с получением димезилата VI. Альтернативно V можно превращать в дитрифлат или дитозилат способами, описанными выше для схемы II. Димезилат, дитрифлат, дитозилат или дигалогенид можно подвергать реакции с амином, включая, но не ограничиваясь ими, анилин, 3,5-дифторанилин,3,4-дифторанилин, 4-фторанилин, 3-фторанилин, 4-трифторметиланилин, 4-хлоранилин, гетероариламины, алкиламины, циклоалкиламины, замещенные бензиламины или аллиламин, с получением VII. Когда Х 5 в формуле VII представляет собой нитро, нитрогруппы можно восстанавливать до тетрааминопродукта IX с использованием Fe в присутствии NH4Cl, HCl или уксусной кислоты или с помощью гидридного восстановителя, такого как борогидрид натрия (с добавлением соли переходного металла, такой какBiCl3, SbCl3, NiCl2, Cu2Cl2 или CoCl2, или без него), в растворителе, таком как этанол или THF. Альтернативно VII (Х 5=нитро) можно восстанавливать до продукта IX путем гидрогенизации в присутствии пригодного катализатора, такого как палладиевый или платиновый катализатор или никель Ренея. Альтернативно соединения VII, где Х 5=галоген, можно подвергать реакции с аммиаком (R=H) или аминсодержащей пригодной защитной группой (R=замещенный бензил, такой как 4-метоксибензил или 2,4 диметоксибензил или R=аллил). Полученные продукты VIII можно обрабатывать реагентом, пригодным для удаления защитной группы R (родиевый катализатор, такой как Rh(Ph3P)3Cl для R=аллил; обработка кислотой, такой как ТХУ или HCl для R=4-метоксибензил или 2,4-диметоксибензил; гидрогенолиз с Pdкатализатором для R=замещенный бензил), с получением продукта IX. Соединение формулы IX можно подвергать реакции с пригодным образом защищенной пролиновой кислотой (показан Boc, хотя он может быть заменен Cbz, Troc или Fmoc) в присутствии реагента для связывания пептидов, такого какEDAC/HOBT, РуВОР, HATU или DEBPT, в растворителе, таком как THF, DMF, дихлорметан или DMSO,с добавлением аминового основания, такого как основание Хунига, пиридин, 2,6-лутидин или триэтиламин, или без него, с получением X в качестве смеси амидных продуктов. Превращение в соединение бензимидазола XI можно проводить путем нагревания X в уксусной кислоте (50-100 С). Альтернативно XI можно получать путем реакции IX с альдегидом, с последующей обработкой окислителем, таким какCu(OAc)2 или MnO2 (см. Penning, et al., Bioorg. Med. Chem. 16:6965-6975 (2008. После удаления защитных групп Boc из XI (проводимого с помощью кислоты, такой как ТХУ, HCl или муравьиная кислота),соединения по настоящему изобретению можно получать путем связывания полученного, диамина XII с выбранной кислотой с использованием стандартных реагентов для связывания пептидов и условий, описанных выше для схемы II. в каждой формуле схемы IV может быть заменен на где D является таким, как определено выше, и такие соединения можно легко получать способом, описанным в схеме IV. Альтернативно IX на схеме IV можно получать из соединения формулы II, как показано на схеме V. Соединение VIII со схемы II можно обрабатывать ацилирующим агентом, таким как ацетилхлорид или уксусный ангидрид, с получением соединения II (схема V). Нитрирование соединения II с получением III можно проводить с использованием известных способов, таких как обработка азотной кислотой или нитратом калия в присутствии кислоты, такой как серная кислота, или обработка NO2BF4. Удаление защитной группы ацетамида можно проводить путем обработки ангидридом Boc в присутствии DMAP с получением IV, с последующей последовательной обработкой IV гидроксидом (таким как NaOH, KOH илиLiOH) для удаления ацетильной группы и сильной кислотой, такой как ТХУ или HCl, для удаления защитной группы Boc. Нитрогруппы в V могут быть восстановлены до аминогрупп с использованием способов, описанных выше для схемы IV. в каждой формуле в схеме V может быть заменен на где D является таким, как определено выше, и такие соединения можно легко получать способом, описанным для схемы V. В другом неограничивающем примере соединения по настоящему изобретению можно получать,начиная с соединений формулы II, как показано на схеме VI, где А, В, D, Y и Z являются такими, как описано выше. Соединение 1,4-дикетона формулы II (полученное, как описано на схеме III), можно подвергать реакции с амином, включая, но не ограничиваясь ими, анилин, 3,5-дифторанилин, 3,4 дифторанилин, 4-фторанилин, 3-фторанилин, 4-трифторметиланилин, 4-хлоранилин, гетероариламины,алкиламины, циклоалкиламины, замещенные бензиламины или аллиламин, в условиях, катализируемых кислотой, такой как уксусная кислота, ТХУ, муравьиная кислота или HCl, с получением соединений по изобретению. В качестве следующего неограничивающего примера соединения по настоящему изобретению можно получать из соединения формулы II, как показано на схеме VII. Соединение формулы II, где RX представляет собой галоген, такой как бром, хлор или йод, или трифлат или нонафлат, можно превращать в бороновую кислоту или сложный эфир, такой как соединение формулы III, где R представляет собой водород, метил, этил или циклический пинаколовый сложный эфир. Например, соединение формулы II можно превращать в соединение III путем обработки пинаколбораном в присутствии катализатора, например, такого как трис(дибензилиденацетон)палладий(0), и лиганда, например, такого как тритрет-бутилфосфин, в растворителях, например, таких как тетрагидрофуран, диоксан или толуол, при температурах в диапазоне от температуры окружающей среды до приблизительно 130 С. Альтернативно соединение II можно подвергать реакции с бис(пинаколато)дибором в присутствии катализатора, например, такого как Combiphos-Pd6 (CombiPhos Catalysts, Inc. (NJ, USA), аддукт дихлор[1,1'бис(дифенилфосфино)ферроцен]палладия(II) с дихлорметаном, или ацетат палладия в присутствии лиганда, например, такого как 2-дициклогексилфосфино-2',4',6'-триизопропилбифенил (XPhos), и основания, например, такого как ацетат калия, в растворителях, например, таких как толуол, диоксан, тетрагидрофуран, диметилформамид или диметилсульфоксид, при температурах от приблизительно 60 до приблизительно 130 С с получением соединения III. Альтернативно соединение формулы II можно подвергать реакции с литийорганическим реагентом, таким как н-BuLi, втор-BuLi или трет-BuLi, с последующей реакцией с триметилборатом или триэтилборатом, с получением соединения формулы III. Соединение формулы III на схеме VII можно присоединять к соединению формулы IV, где RY представляет собой галоген, такой как бром, хлор или йод, в условиях реакции Сузуки с получением соединения формулы V. Такие условия включают, например, применение палладиевого катализатора, например, такого как три(дибензилиденацетон)палладий(0), ацетат палладия, хлорид бис(трифенилфосфин)палладия(II), тетракис(трифенилфосфин)палладий или аддукт дихлор[1,1'-бис(дифенилфосфино)ферроцен]палладия(II) с дихлорметаном; основания, например, такого как карбонат калия, фосфат калия, трет-бутоксид калия, карбонат натрия, карбонат цезия или фторид цезия; и растворителя, например, такого как толуол, этанол, вода или тетрагидрофуран, или их смеси, нагретые до диапазона температур от приблизительно 40 до приблизительно 130 С. Удаление защитных групп Boc из V можно проводить посредством обработки кислотой, такой как ТХУ, HCl или муравьиная кислота. Соединения по настоящему изобретению, такие как VI, можно полу- 15023570 чать путем присоединения к полученным аминосоединениям выбранной кислоты с использованием стандартных реагентов для связывания пептидов, таких как EDAC/HOBT, РуВОР, HATU или DEBPT, в растворителе, таком как THF, DMF, дихлорметан или DMSO, с добавлением аминового основания, такого как основание Хунига, пиридин, 2,6-лутидин или триэтиламин, или без него. Каждый RZ независимо представляет собой -LY'-M'-RD (например, -LY-N(RB")С(О)-LS-RE), и D, L3, R1, R2, R5, LY, RB", LS, RE, LY',M' и RD являются такими, как определено выше. В качестве другого неограничивающего примера соединения по настоящему изобретению можно получать по схеме VIII, начиная с соединения формулы II, сначала расщепляя диол путем окислительного расщепления с последующим гидролизом ацетонида кислотой. Затем это диальдегидное промежуточное соединение обрабатывают арилборонатом или арилбороновой кислотой (соединение IV, где А и Y являются такими, как описано выше, или соединение VII) и анилином III (где W представляет собой RM или J, и RM и J являются такими, как определено выше), что приводит к образованию соединений формулы V или формулы VIII соответственно. Соединение формулы V можно преобразовывать в производное путем депротонирования гидроксильных групп сильным основанием, таким как гидрид натрия, бутиллитий или гидрид калия, с последующим алкилированием RS-галогеном. Альтернативно соединение формулы VIII можно депротонировать сильным основанием (например, гидридом натрия), а также алкилировать RS-галогеном, с последующим гидролизом кислотой фенолзащитных групп. Сульфонилирование фенолов нонафторбутилсульфонилфторидом в присутствии нейтрализующего вещества, такого как карбонат калия, в полярном апротонном растворителе, таком как DMF, с последующим нагреванием дает соединение формулы IX. Боронат формулы X получают нагреванием соединения формулы IX с бис(пинаколато)дибором в присутствии X-phos и палладиевого катализатора, такого как Pd2(dba)3 и основания, такого как ацетат калия, в органическом растворителе, таком как диоксан. Соединение формулы X далее преобразовывают в производное до конечного продукта путем нагревания с пригодным образом замещенным гетероарилгалогенидом в присутствии палладиевого катализатора, такого какPdCl2(dppf), в присутствии основания, такого как карбонат натрия, в смеси толуола и этанола. RS является таким, как определено выше. в каждой формуле на схеме VIII может быть заменен на где D является таким, как определено выше, и такие соединения можно легко получать способом, описанным на схеме VIII. В качестве другого неограничивающего примера соединения по настоящему изобретению можно получать согласно схеме IX, начиная с соединений формулы II и формулы III. Карбоновую кислоту формулы III активируют для присоединения с использованием реагентов, таких как изобутилхлорформиат,DCC, EDAC или HATU, в присутствии органического основания, такого как диизопропилэтиламин. После активации к реакционной смеси добавляют дианилин формулы II, выделяя промежуточный амид,который нагревают в уксусной кислоте, предпочтительно при 60 С, с получением соединения формулыIV. Бензимидазол формулы IV обрабатывают SEM-Cl в присутствии основания в апротонном растворителе, таком как THF, с получением двух защищенных бензимидазольных региоизомеров V. Боронатные сложные эфиры VI получают нагреванием соединения формулы V с бис(пинаколато)дибором в присутствии палладиевого катализатора, такого как PdCl2(dppf), X-Phos, и основания, такого как ацетат калия, в органическом растворителе, таком как диоксан. Нагревание дает оба бензимидазольных региоизомераVI. Диол VII отщепляют окислительным отщеплением с последующим кислотным гидролизом ацетонида. Затем это диальдегидное промежуточное соединение обрабатывают арилборонатом VI и анилиномVIII (где W представляет собой RM или J, и RM и J являются такими, как определено выше), что приводит к образованию 3 бензимидазольных региоизомеров формулы IX. Соединение формулы X получают депротонированием гидроксильных групп сильным основанием, таким как гидрид натрия, бутиллитий или гидрид калия, с последующим алкилированием Rs-галогеном, с последующим кислотным гидролизом пирродилин- и бензимидазолзащитных групп, предпочтительно путем обработки минеральной кислотой,такой как хлористоводородная кислота, в спиртовом растворителе, таком как метанол. Карбоновую кислоту R2-COOH активируют для присоединения с использованием таких реагентов, как изобутилхлорформиат, DCC, EDAC или HATU, в присутствии органического основания, такого диизопропилэтиламин. После активации к реакционной смеси добавляют соединение формулы X, выделяя соединение формулы XI. на каждой формуле в схеме IX может быть заменена на где D является таким, как определено выше, и такие соединения можно легко получать способом, описанным в схеме IX. Соединения по изобретению общей формулы (8), где R20 представляет собой -LS'-M' -LS"-RD и D является таким, как описано выше, можно получать способам согласно схеме X. Бромалкилкетон (1) можно подвергать реакции с арилалкилкетоном (2) с использованием условий, обуславливаемых кислотой Льюиса, описанных выше на схеме II, с получением диарилдикетона (3). Дикетон (3) можно превращать в бисборонат (4) реакцией с бис(пинаколато)дибором в присутствии основания, такого как ацетат калия,катализатора, такого как PdCl2(dppf)-CH2Cl2, в растворителе, таком как DMSO, диметоксиэтан или диоксан, с нагреванием до температуры между 60-100 С. Бисборонат (4) можно превращать в промежуточное соединение (5) реакцией Сузуки с использованием аналогичным образом условий Сузуки, описанных в схеме VII. Промежуточное соединение (5) можно превращать в (6) путем реакции с амином D-NH2 в условиях, аналогичных условиям, описанным на схеме VI. Например, реакция (5) с D-NH2 в присутствии кислоты, такой как, но не ограничиваясь ими, ТХУ, в растворителе, таком как, но не ограничиваясь им,толуол, и с нагреванием вплоть до 110 С может, обеспечить промежуточные соединения общей структуры (6). Соединения (6) можно превращать в соединения общей формулы (7) а затем (8) с использованием способов, аналогичных способам, описанным на схеме VII. Промежуточные соединения (6) также можно получать с использованием способа, представленного на схеме XI. Промежуточное соединение (3) можно подвергать реакции с амином D-NH2 с использованием условий, аналогичных условиям, описанным на схемах VI и X, с получением промежуточных соединений(9), которые можно превращать в (10) с использованием условий, аналогичных условиям, описанным на схеме X; и (10), в свою очередь, можно превращать в соединения (6) с использованием условий реакции Сузуки, описанных на схеме VII. Соединения по изобретению общей формулы (15), где R20 представляет собой -LS'-M'-LS"-RD и D является таким, как описано выше, можно получать способами согласно схеме XII. Соединения (11) можно получать способами превращения (3) в (9) с использованием основных условий, как описано на схеме VI, например, путем реакции подходящего нитрофенилдикетона с аминомD-NH2 при нагревании в уксусной кислоте до температуры приблизительно 70 С. Соединения (11) можно превращать в (12) с использованием восстанавливающих условий, описанных на схеме II. Соединения(12) можно последовательно превращать в соединения общей формулы (13), (14) и (15) с использованием способов, аналогичных способам, описанным выше на схеме II. Соединения общей формулы (19), где D является таким, как описано выше, можно получать способами согласно схеме XIII. Соединения общей формулы (16) можно превращать в соединения общей формулы (17) с использованием реакции Бухвальда с трет-бутил-2-карбамоилпирролидин-1 карбоксилатом. Эту реакцию Бухвальда можно проводить в присутствии основания (например, карбоната цезия), палладиевого катализатора (например, трис(дибензилиденацетон)дипалладия(0, фосфинового лиганда (например, 4,5-бис(дифенилфосфино)-9,9-диметилксантена) в растворителе, таком как диоксан,при нагревании приблизительно до 80-120 С. Промежуточное соединение (17) можно восстанавливать до (18) и замыкать в кольцо с получением (19) с использованием условий, аналогичных условиям, описанным, главным образом, на схеме IV. Соединения (19) можно далее подвергать реакции, как проиллюстрировано на схеме IV, с получением соединений по изобретению. Соединения по изобретению общей формулы (23), где D является таким, как описано выше, можно получать способами согласно схеме XIV. Соединения (16) можно подвергать реакции с соединением (20) с использованием реакции Бухвальда, как описано, главным образом, на схеме XIII, с получением соединений (21). Соединения (21) можно восстанавливать до соединений (22) и замыкать в цикл с получением Соединения по изобретению общей формулы (29), где R20 представляет собой -LS'-M'-LS"-RD и D является таким, как описано выше, можно получать способами согласно схеме XV. Соединения формулы (24) можно превращать в соединения формулы (25) (реакция Соногашира) посредством реакции с триметилсилилацетиленом, палладиевым катализатором (например, хлоридом бис(трифенилфосфин)палладия(II, медным катализатором (например, йодидом меди(I и основанием(например, триэтиламином), где аминовое основание также можно использовать в качестве растворителя. Соединения (25) можно десилилировать до соединений (26) реакцией с источником фторида (например, фторидом тетрабутиламмония) в растворителе, таком как THF. Соединения (26) можно превращать в соединения (27) путем образования дианиона (26) с н-бутиллитием и последующей реакцией с амидом Вайнреба (например, N-(трет-бутоксикарбонил)-L-пролин-N'-метокси-N'-метиламидом). Эту реакцию можно проводить в подходящем растворителе, таком как THF или диметоксиэтан. Соединения (27) можно превращать в соединения (28) путем реакции с гидразином в растворителе, таком как этанол. Соединения (28) можно превращать в соединения (29) с использованием способов, описанных, главным образом, на представленных выше схемах. Соединения по изобретению общей формулы (34), где R20 представляет собой -LS'-M' -LS"-RD и D является таким, как описано выше, можно получать способами согласно схеме XVI. Соединения (24) можно превращать в соединения (30) реакцией (24) с СО (газ) под давлением (приблизительно 60 фунт/кв.дюйм (414 кПа в присутствии палладиевого катализатора (например, PdCl2(dppf в метаноле в качестве растворителя и при нагревании до приблизительно 100 С. Соединения (30) можно превращать в соединения (31) путем реакции с гидразином в растворителе, таком как метанол, при нагревании до приблизительно 60-80 С. Соединения (31) можно превращать в соединения (32) путем реакции с N-Boc-2 цианопирролидином в присутствии основания (например, карбоната калия) в растворителе, таком как бутанол, и при нагревании до приблизительно 150 С при облучении в микроволновом реакторе. Из соединений (32) можно удалять защитную группу с получением соединений (33) и их можно ацилировать до (34) с использованием условий, аналогичных условиям, описанным, главным образом, на представленных выше схемах. Соединения по изобретению общей формулы (38), где R20 представляет собой -LS'-M'-LS"-RD и D является таким, как описано выше, можно получать способами согласно схеме XVII. Соединения формулы(24) можно превращать в соединения (35) реакцией с CuCN в растворителе, таком как DMF, и при нагревании приблизительно до 160 С при микроволновом облучении. Соединения (35) можно превращать в соединения (36) реакцией с HCl (газ) в безводном метаноле при 0 С при нагревании до комнатной температуры. Соединения (36) можно превращать в соединения (37) реакцией с NH3 (газ) в безводном метаноле при 0 С при нагревании до комнатной температуры. Соединения (37) можно превращать в соединения (38) реакцией с (41) в THF в присутствии основания (например, карбоната калия). Соединения формулы (41), где R20 представляет собой -LS'-M'-LS"-RD, можно получать с использованием способов согласно схеме XVIII. Соединения (39) можно превращать в соединения (40) путем последовательной реакции (39) с изобутилхлорформиатом в THF при 0 С, а затем с диазометаном. Соединения (40) можно превращать в соединения (41) реакцией с HBr в уксусной кислоте. Соединения по изобретению общей формулы (48), где R20 представляет собой -LS'-M'-LS"-RD и D является таким, как описано выше, можно получать способами согласно схеме XIX. Соединение (42) можно подвергать реакции с соединением (43) с использованием условий, аналогичных условиям, обуславливаемым кислотой Льюиса, которые описаны выше на схеме II, с получением соединения (44). Соединение (44) можно последовательно превращать в диол (45), мезилат (46) и циклическое промежуточное соединение (47) с использованием условий, аналогичных условиям со схемы II. Соединения (47) можно превращать в соединения (48) реакцией (20) в условиях Бухвальда, таких как условия, указанные на схеме XIV и описанные на схеме XIII. Соединения по изобретению общей формулы (55), где R20 представляет собой -LS'-M'-LS"-RD и D является таким, как описано выше, можно получать способами согласно схеме XX. Диэтилмезо-2,5 дибромадипат (49) можно подвергать реакции с амином D-NH2 в растворителе, таком как THF, диоксан или диметоксиэтан, при нагревании 50-100 С с получением соединений (50). Соединения (50) можно превращать в (51) щелочным гидролизом с основанием (например, NaOH, KOH) в спирте (например,метаноле, этаноле) и водной смесью растворителя. Соединения (51) можно превращать в (52) сначала реакцией с оксалилхлоридом, а затем обработкой промежуточного кислотного хлорида диазометаном при 0 С. Соединения (52) можно превращать в (53) реакцией с водным раствором HBr. Соединения (53) можно превращать в соединения (54) реакцией с тиомочевиной в этаноле или подобном растворителе. Соединения (54) можно превращать в соединения (55) с использованием, аналогичным образом, условий,описанных выше на схеме II. Соединения по изобретению общей формулы (60), где R20 представляет собой -LS'-M'-LS"-RD и D является таким, как описано выше, можно получать способами согласно схеме XXI. Соединение (56) можно подвергать реакции с соединением (57) в пиридине при нагревании до приблизительно 135 С с получением соединения (58). Соединение (58) можно превращать в соединения (59) реакцией амина DNH2 с POCl3 с последующим добавлением (58) и нагреванием до приблизительно 200 С в 1,2 дихлорбензоле. Соединения (59) можно превращать в соединения (60) с использованием условий, аналогичных условиям, описанным выше на схеме VII. Соединения по изобретению общей формулы (66), где R20 представляет собой -LS'-M'-LS"-RD и D является таким, как описано выше, можно получать способами согласно схеме XXII. Соединения общей формулы (61) можно подвергать реакции с бортрибромидом в дихлорметане при 0 С с получением соединений (62), которые можно подвергать условиям гидрогенизации с использованием оксида платины(II) с получением соединений (63). Реакцию сочетания между соединениями (63) и производными пролина (64) можно проводить с использованием стандартных условий, описанных выше, с получением соединений (65), которые можно превращать в (66) под действием диэтилазодикарбоксилата и трифенилфосфина в THF. Соединения по изобретению общей формулы (74), где R20 представляет собой -LS'-M'-LS"-RD и D является таким, как описано выше, можно получать способами согласно схеме XXIII. Соединение (67) можно превращать в (68) восстановлением нитрогруппы с использованием хлорида олова(II) в этаноле. Соединение (69) можно получать из (68) путем связывания с пептидом с Вос-пролином, с последующим нагреванием полученного амида в уксусной кислоте при 80 С. Соединение (69) можно подвергать реакции с SEM-Cl и диизопропилэтиламином в дихлорметане с получением (70), к которому можно присоединять (71) с использованием палладиевого катализатора, такого как PXPd, с использованием основания,такого как фторид цезия, в растворителе, таком как N,N-диметилформамид, при 100 С с получением(72). Соединение (72) можно превращать в (73) реакцией с Selectfluor в смеси THF и воды, с последующей гидрогенизацией с использованием 3% Pt на активированном угле в этилацетате, а затем восстановлением с использованием боргидрида натрия в метаноле. Соединение (73) можно подвергать реакции с метансульфонилхлоридом и триэтиламином в дихлорметане при -10 С, с последующим добавлением амина (H2N-D) с получением промежуточного соединения, которое можно превращать в (74) удалением защитной группы с использованием 4 н. HCl в 1,4-диоксане, с последующим связыванием с R20CO2H с использованием способов связывания пептидов, описанных выше. Соединения по изобретению общей формулы (81), где R20 представляет собой -LS'-M'-LS"-RD и D является таким, как описано выше, можно получать способами согласно схеме XXIV. Соединение (75) можно превращать в (76) с использованием SnCl2 в этаноле. Реакцию сочетания (76) с (64) проводят с использованием способов связывания пептидов, описанных выше, с получением амида, который можно нагревать в уксусной кислоте при 100 С с получением (77). Соединение (77) можно подвергать реакции сSEM-Cl и диизопропилэтиламином в дихлорметане с получением (78), которое можно подвергать реакции с (71), как описано выше, с получением (79). Соединение (79) можно превращать в (80) с использованием Selectfluor в смеси THF и воды, с последующей гидрогенизацией с Pt на активированном угле в этилацетате и восстановлением боргидридом натрия в метаноле. Соединение (80) можно превращать в соединения (81) мезилированием с метансульфонилхлоридом и триэтиламином при температурах менее 0 С, с последующей реакцией с первичным амином H2N-D и удалением защитной группы с использованием 4 н. HCl в 1,4-диоксане. Некоторые амины, D-NH2, в указанных выше схемах представлены формулой (84), и их можно по- 24023570 лучать общим способом, представленным на схеме XXV, где RN является таким, как определено выше(например, галогеном, алкилом, галогеналкилом), и RM представляет собой -N(RSRS') (например, -NEt2),гетероциклил (например, пирролидин-1-ил, пиперидин-1-ил и т.д.) или -ORS (например, -О-трет-бутил,-О-изопропил, и т.д.). Фторнитробензолы (82) можно подвергать реакции с соответствующим амином в присутствии двухосновного фосфата калия в растворителе, таком как DMSO, необязательно при нагревании, с получением промежуточных соединений (83), где RM представляет собой -N(RSRS') (например,-NEt2) или гетероциклил (например, пирролидин-1-ил, пиперидин-1-ил и т.д.). Фторнитробензолы (82) также можно подвергать реакции с алкоксидами щелочных металлов (например, трет-бутоксидом калия) с получением промежуточных соединений (83), где RM представляет собой -ORS (например, -О-трет-бутил, -О-изопропил и т.д.). Промежуточные соединения (83) можно превращать в (84) с использованием хорошо известных условий нитровосстановления. Например, (83) можно превращать в (84) каталитической гидрогенизацией с использованием палладия на активированном угле. Альтернативно (83) можно превращать в (84) реакцией с хлоридом железа/аммония вTHF/метаноле/воде в качестве растворителя. Другие условия для проведения нитровосстановления включают условия, описанные на указанных выше схемах, и условия, общеизвестные специалистам в данной области. На указанных выше схемах показаны соединения, где ароматическое кольцо (например, фенил) замещено группами с конкретной региохимией (например, пара-). На указанных выше схемах исходный материал или промежуточное соединение с пара-замещением дает конечный продукт с паразамещением. Специалисту в данной области понятно, что замена на указанных выше схемах исходного материала или промежуточного соединения исходным материалом или. промежуточным соединением с отличающейся региохимией (например, мета-) даст конечный продукт с отличающееся региохимией. Например, замена пара-замещенного исходного материала или промежуточного соединения на указанных выше схемах мета-замещенным исходным материалом или промежуточным соединением приведет к мета-замещенному продукту. Если группа, описанная в настоящем документе (например, -NH2 или -ОН), не совместима со способами синтеза, группу можно защищать подходящей защитной группой, которая является стабильной в условиях реакции, используемых в способах. Защитную группу можно удалять в пригодной точке последовательности реакций с получением желаемого промежуточного соединения или конечного соединения. Пригодные защитные группы и способы внесения защитных групп и удаления защитных групп хорошо известны в данной области, и их примеры могут быть найдены в Greene and Wuts, выше. Оптимальные условия реакции и время реакции для каждой конкретной стадии могут варьировать в зависимости от конкретных используемых реагентов и заместителей, присутствующих в используемых реактантах. Растворители, температуры и другие условия реакции может легко выбирать специалист в данной области на основе настоящего изобретения. Другие соединения по изобретению можно получать сходным образом согласно описанным выше схемам, а также способам, описанным в представленных ниже примерах, как понятно специалистам в данной области. Следует понимать, что описанные выше варианты осуществления и схемы и представленные ниже примеры приведены в качестве иллюстрации, а не для ограничения. Различные изменения и модификации в объеме настоящего изобретения станут очевидными специалистам в данной области из настоящего описания. Соединения в примерах ниже были названы с использованием либо ChemDraw версии 9.0, либоACD версии 12 (ACD v12). Конечные соединения примеров 1-50 были названы с использованием ChemDraw, если нет иных указаний на то, что они были названы с использованием ACD v12. Конечные соединения после примера 50 были названы с использованием ACD v12. Промежуточные соединения были названы с использованием ChemDraw, если нет иных указаний на то, что они были названы с использованием ACD v12. Определенные соединения в примерах ниже очищали с использованием ВЭЖХ с обращенной фазой. Очистку проводили с использованием обращенно-фазовой колонки либо С 18, либо С 8. Соединения элюировали с использованием градиента приблизительно 10-100% ацетонитрила в 0,1% водном растворе ТХУ; приблизительно 60-100% метанола в 10 мМ водном растворе ацетата аммония; или приблизительно 10-95% метанола в 10 мМ водном растворе ацетата аммония. Для очистки, проводимой с помощью ТХУ, продукт, полученный таким образом, может быть в форме соли ТХУ. Соединения могут быть охарактеризованы как соль ТХУ или как свободное основание после нейтрализации, экстракции и выделения. Определенные соединения в примерах ниже очищали с использованием нормально-фазовой хроматографии на силикагеле, включая традиционную флэш-хроматографию или автоматизированную систему очистки (например, Isco Combi-Flash, Analogix Intelliflash) с использованием предварительно упакованных колонок с силикагелем (силикагель 55 или 35 мкм, колонки Isco gold). Типичные растворители для хроматографии с силикагелем включают этилацетат в гексане, диэтиловый эфир в гексане, THF в гексане, этилацетат в метиленхлориде, метанол в метиленхлориде, метанол в метиленхлориде с NH4OH, ацетон в гексане и метиленхлорид в гексане. Пример 1. Диметил-(2S,2'S)-1,1'-2S,2'S)-2,2'-(4,4'-2S,5S)-1-(4-фторфенил)пирролидин-2,5 диил)бис(4,1-фениленбис(азандиил)бис(оксометилен)бис(пирролидин-2,1-диилбис(3,3-диметил-1 оксобутан-2,1-диил)дикарбамат и диметил-(2S,2'S)-1,1'-2S,2'S)-2,2'-(4,4'-2R,5R)-1-(4-фторфенил)пирролидин-2,5-диил)бис(4,1-фениленбис(азандиил)бис(оксометилен)бис(пирролидин-2,1-диилбис(3,3 диметил-1-оксобутан-2,1-диил)дикарбамат Пример 1 А. 1,4-бис(4-Нитрофенил)бутан-1,4-дион. Безводный хлорид цинка(II) (2,73 г, 20,00 ммоль) перемешивали в сухом бензоле (15 мл) при одновременном добавлении диэтиламина (1,558 мл, 15,00 ммоль) и трет-бутанола (1,435 мл, 15,00 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 90 мин с получением мутного раствора. К этой смеси добавляли 2-бром-1-(4-нитрофенил)этанон (2,44 г, 10,00 ммоль) и 1-(4 нитрофенил)этанон (2,477 г, 15,00 ммоль) и полученную смесь перемешивали при комнатной температуре в течение ночи. Смесь выливали в воду (50 мл) и экстрагировали этилацетатом (350 мл). Объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали. Полученный осадок растирали с дихлорметаном с получением оранжевого твердого вещества, которое собирали фильтрацией и сушили с получением указанного в заголовке соединения (2,0 г, выход 61%). Пример 1 В. 1,4-бис(4-Нитрофенил)бутан-1,4-диол. К раствору продукта примера 1 А (1,0 г, 3,05 ммоль) в безводном THF (30 мл) при 0 С добавляли боргидрид натрия (0,357 г, 9,44 ммоль). Полученную смесь перемешивали при 50 С в течение ночи. Охлажденную смесь выливали в воду, экстрагировали этилацетатом, сушили над Na2SO4, фильтровали и концентрировали в вакууме. Полученное твердое вещество растирали с дихлорметаном с получением желтовато-коричневого твердого вещества, которое собирали фильтрацией и сушили с получением указанного в заголовке соединения (0,82 г, выход 81%). Пример 1 С. 1,4-бис(4-Нитрофенил)бутан-1,4-диилдиметансульфонат. К раствору продукта примера 1 В (0,80 г, 2,407 ммоль) в сухом CH2Cl2 (25 мл) при 0 С добавляли триэтиламин (1,007 мл, 7,22 ммоль) с последующим капельным добавлением метансульфонилхлорида(0,469 мл, 6,02 ммоль). Полученную смесь перемешивали при 0 С в течение 30 мин, и в течение этого времени исходный материал медленно переходил в раствор. После дополнительного перемешивания в течение 1 ч при 0 С начинал образовываться осадок. Добавляли насыщенный водный NH4Cl (4 мл) и перемешивание продолжали при комнатной температуре в течение 20 мин. Смесь промывали водой (210 мл) и органический слой обрабатывали гексаном (10 мл) с получением оранжевого твердого вещества,которое собирали фильтрацией с получением указанного в заголовке соединения (0,75 г, выход 64%). Пример 1D. 1-(4-Фторфенил)-2,5-бис(4-нитрофенил)пирролидин. Продукт примера 1 С (0,6 г, 1,228 ммоль) и 4-фторанилин (2,0 мл, 20,82 ммоль) объединяли и перемешивали при 50 С в течение ночи. Полученную смесь распределяли между 0,2 н. HCl (50 мл) и этилацетатом (350 мл) и объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали хроматографией на силикагеле с использованием градиента растворителей, состоящего из 0-40% этилацетата в гексане, с получением указанного в заголовке соединения в качестве цис- и транс-изомеров (0,5 г, выход 100%). Пример 1E. 4,4'-(1-(4-Фторфенил)пирролидин-2,5-диил)дианилин. К раствору продукта примера 1D (0,501 г, 1,23 ммоль) в этаноле (5 мл) и THF (5,00 мл) добавляли железный порошок (0,412 г, 7,38 ммоль) и раствор хлорида аммония (0,197 г, 3,69 ммоль) в воде (1,0 мл). Полученную смесь перемешивали при 80 С в течение 45 мин. Смесь охлаждали, фильтровали через целит, промывали этанолом и концентрировали в вакууме. Неочищенный продукт очищали хроматографи- 26023570 ей на силикагеле с использованием градиента растворителей, состоящего из 0-100% этилацетата в гексане, с получением указанного в заголовке соединения в качестве цис- и транс-изомеров (0,135 г, 32%). Пример 1F. (2S,2'S)-трет-Бутил-2,2'-(4,4'-(1-(4-фторфенил)пирролидин-2,5-диил)бис(4,1-фенилен бис(азандиил)бис(оксометилен)дипирролидин-1-карбоксилат. К смеси продукта примера 1E (0,13 г, 0,374 ммоль), (S)-l-(трет-бутоксикарбонил)пирролидин-2 карбоновой кислоты (0,201 г, 0,935 ммоль) и HATU (0,356 г, 0,935 ммоль) в DMSO (3 мл) добавляли основание Хунига (0,196 мл, 1,123 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 90 мин. Смесь выливали в воду и экстрагировали этилацетатом. Органический экстракт сушили над Na2SO4, фильтровали и концентрировали в вакууме с получением неочищенного продукта, который очищали колоночной хроматографией на силикагеле, элюируя градиентом растворителей, состоящим из 5-100% этилацетата в гексане, с получением указанного в заголовке соединения (0,28 г, 100%). Пример 1G. (2S,2'S)-N,N'-(4,4'-(1-(4-Фторфенил)пирролидин-2,5-диил)бис(4,1-фенилендипирролидин-2-карбоксамид. К продукту примера 1F (0,28 г, 0,377 ммоль) в CH2Cl2 (2,0 мл) добавляли ТХУ (2,0 мл). Реакционную смесь перемешивали при комнатной температуре в течение 45 мин и концентрировали в вакууме. Осадок распределяли между 3:1 CH2Cl2:2-PrOH и насыщенным водным раствором NaHCO3. Органический слой сушили над Na2SO4, фильтровали и концентрировали с получением указанного в заголовке соединения (0,195 г, выход 95%). Пример 1H. Диметил-(2S,2'S)-1,1'-2S,2'S)-2,2'-(4,4'-2S,5S)-1-(4-фторфенил)пирролидин-2,5 диил)бис(4,1-фениленбис(азандиил)бис(оксометилен)бис(пирролидин-2,1-диилбис(3,3-диметил-1 оксобутан-2,1-диил)дикарбамат и диметил-(2S,2'S)-1,1'-2S,2'S)-2,2'-(4,4'-2R,5R)-1-(4-фторфенил)пирролидин-2,5-диил)бис(4,1-фениленбис(азандиил)бис(оксометилен)бис(пирролидин-2,1-диилбис(3,3 диметил-1-оксобутан-2,1-диил)дикарбамат. К смеси продукта примера 1G (0,03 г, 0,055 ммоль), (S)-2-(метоксикарбониламино)-3,3 диметилбутановой кислоты (0,0262 г, 0,138 ммоль) и HATU (0,0526 г, 0,138 ммоль) в DMSO (0,5 мл) добавляли основание Хунига (0,029 мл, 0,166 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 90 мин. Смесь выливали в воду (2 мл) и экстрагировали этилацетатом (22 мл) и объединенные органические слои концентрировали и подвергали очистке посредством ВЭЖХ на полупрепаративной обращенно-фазовой колонке С 18 с использованием градиента из 10-100% ацетонитрила в 0,1% водной ТХУ. Транс-замещенный изомер пирролидина был первым элюируемым из 2 стереоизомеров, давая указанное в заголовке соединение в качестве смеси диастереомеров 1:1 (0,014 г, выход 29%). 1H ЯМР (Соль ТХУ) (400 МГц, DMSO-D6)м.д. 0,93-1,01 (м, J=4,99 Гц, 18 Н), 1,62-1,68 (м, 2 Н),1,81-1,93 (м, 6 Н), 1,94-2,04 (м, 2 Н), 2,09-2,20 (м, 2 Н), 3,54 (с, 6 Н), 3,59-3,69 (м, 2 Н), 3,73-3,81 (м, 2 Н),4,18-4,24 (м, 2 Н), 4,43 (дд, J=7,81, 5,42 Гц, 2 Н), 5,16 (д, 2 Н), 6,20 (дд, J=9,05, 4,39 Гц, 2 Н), 6,78 (т, J=8,89 Гц, 2 Н), 7,09 (д, J=8,89 Гц, 2 Н), 7,12 (д, 4 Н), 7,50 (д, J=8,02 Гц, 4 Н), 9,99 (с, 2 Н . Указанное в заголовке соединение продемонстрировало значение ЕС 50 менее чем приблизительно 0,1 нМ в анализах с репликоном HCV 1b-Con1 в присутствии 5% FBS. Анализ с репликоном 1b-Con1 описан ниже. Пример 2. Диметил-(2S,2'S)-1,1'-2S,2'S)-2,2'-(4,4'-2S,5R)-1-(4-фторфенил)пирролидин-2,5 диил)бис(4,1-фениленбис(азандиил)бис(оксометилен)бис(пирролидин-2,1-диилбис(3,3-диметил-1 оксобутан-2,1-диил)дикарбамат К смеси продукта примера 1G (0,03 г, 0,055 ммоль), (S)-2-(метоксикарбониламино)-3,3 диметилбутановой кислоты (0,0262 г, 0,138 ммоль) и HATU (0,0526 г, 0,138 ммоль) в DMSO (0,5 мл) добавляли основание Хунига (0,029 мл, 0,166 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 90 мин. Смесь выливали в воду (2 мл) и экстрагировали этилацетатом (22 мл) и объединенные органические слои концентрировали и подвергали очистке посредством ВЭЖХ на полупрепаративной обращенно-фазовой колонке С 18 с использованием градиента из 10-100% ацетонитрила в 0,1% водной ТХУ. цис-Замещенный изомер пирролидина был вторым из элюируемых 2 стереоизомеров,давая указанное в заголовке соединение (0,018 г, выход 37%). 1 Н ЯМР (Соль ТХУ) (400 МГц, DMSO-D6)м.д. 0,93-1,01 (м, J=3,04 Гц, 18 Н), 1,75-1,94 (м, 6 Н),1,94-2,05 (м, 2 Н), 2,11-2,22 (м, 2 Н), 2,31-2,35 (м, 1 Н), 3,54 (с, 6 Н) , 3,61-3,70 (м, 2 Н), 3,74-3,83 (м, 2 Н),4,22 (д, J=8,78 Гц, 2 Н), 4,46 (дд, J=8,02, 5,42 Гц, 2 Н), 4,65 (т, 2 Н), 6,34 (дд, 2 Н), 6,86 (т, J=8,89 Гц, 2 Н),7,08 (д, 2 Н), 7,43 (д, J=7,81 Гц, 4 Н), 7,60 (д, J=8,57 Гц, 4 Н), 10,05 (с, 2 Н). Указанное в заголовке соединение продемонстрировало значение ЕС 50 менее чем приблизительно 0,1 нМ в анализах с репликоном HCV 1b-Con1 в присутствии 5% FBS. Продукт примера 1 Н очищали хиральной хроматографией на полупрепаративной колонке ChiralpakAD-H, элюируя смесью 1:1 гексан:(2:1 IPA:EtOH). Указанное в заголовке соединение было первым элюируемым из 2 стереоизомеров. 1 Н ЯМР (400 МГц, DMSO-D6)м.д. 0,97 (с, 18 Н), 1,61-1,67 (м, J=5,64 Гц, 2 Н), 1,79-1,92 (м, 6 Н),1,93-2,04 (м, J=5,86 Гц, 2 Н), 2,07-2,20 (м, J=6,51 Гц, 2 Н), 3,54 (с, 6 Н), 3,59-3,69 (м, 2 Н), 3,71-3,83 (м, 2 Н),4,21 (д, J=8,89 Гц, 2 Н), 4,43 (дд, J=7,97, 5,37 Гц, 2 Н), 5,15 (д, J=6,51 Гц, 2 Н) , 6,20 (дд, 2 Н), 6,78 (т, J=8,95 Гц, 2 Н), 7,13 (д, J=8,57 Гц, 4 Н), 7,50 (д, J=8,57 Гц, 4 Н), 9,99 (с, 2 Н). Указанное в заголовке соединение продемонстрировало значение ЕС 50 менее чем приблизительно 0,1 нМ в анализах с репликоном HCV 1bCon1 в присутствии 5% FBS. Пример 4. Диметил-(2S,2'S)-1,1'-2S,2'S)-2,2'-(4,4'-2R,5R)-1-(4-фторфенил)пирролидин-2,5 диил)бис(4,1-фениленбис(азандиил)бис(оксометилен)бис(пирролидин-2,1-диилбис(3,3-диметил-1 оксобутан-2,1-диил)дикарбамат Продукт примера 1 Н разделяли хиральной хроматографией на полупрепаративной колонкеChiralpak AD-H, элюируя смесью 1:1 гексан:(2:1 IPA:EtOH). Указанное в заголовке соединение было вторым из 2 элюируемых стереоизомеров. 1 Н ЯМР (400 МГц, DMSO-D6)м.д. 0,96 (с, 18 Н), 1,64 (д, J=5,53 Гц, 2 Н), 1,78-1,93 (м, 6 Н), 1,942,06 (м, 2 Н), 2,09-2,21 (м, 2 Н), 3,54 (с, 6 Н), 3,59-3,69 (м, 2 Н), 3,72-3,83 (м, 2 Н), 4,20 (д, J=8,89 Гц, 2 Н),4,43 (дд, J=7,92, 5,42 Гц, 2 Н), 5,16 (д, J=6,29 Гц, 2 Н), 6,20 (дд, J=9,16, 4,39 Гц, 2 Н), 6,77 (т, J=8,95 Гц, 2 Н),7,12 (д, J=8,57 Гц, 4 Н), 7,50 (д, J=8,57 Гц, 4 Н), 9,99 (с, 2 Н). Указанное в заголовке соединение продемонстрировало значение ЕС 50 менее чем приблизительно 0,1 нМ в анализах с репликоном HCV 1b-Con1 в присутствии 5% FBS. Пример 5. Диметил-(2S,2'S)-1,1'-2S,2'S)-2,2'-(4,4'-2S,5S)-l-(4-фторфенил)пирролидин-2,5 диил)бис(4,1-фениленбис(азандиил)бис(оксометилен)бис(пирролидин-2,1-диилбис(1-оксобутан-2,1 диил)дикарбамат и диметил-(2S,2'S)-1,1'-2S,2'S)-2,2'-(4,4'-2R,5R)-1-(4-фторфенил)пирролидин-2,5 диил)бис(4,1-фениленбис(азандиил)бис(оксометилен)бис(пирролидин-2,1-диилбис(1-оксобутан-2,1 диил)дикарбамат Пример 5 А. 4,4'-2S,5S)-1-(4-фторфенил)пирролидин-2,5-диил)дианилин и 4,4'-2R,5R)-1-(4 фторфенил)пирролидин-2,5-диил)дианилин. Продукт примера 1E очищали колоночной хроматографией на силикагеле, элюируя градиентом растворителей из 0-100% этилацетата в гексане. Указанное в заголовке соединение элюировали в качестве первого из 2 стереоизомеров и его получали в качестве рацемической смеси транс-диастереомеров. 1 Н ЯМР (400 МГц, DMSO-D6)м.д. 1,57 (д, J=5,64 Гц, 2 Н), 2,36-2,42 (м, 2 Н), 4,86-4,91 (м, 4 Н), 4,96 фениленбис(азандиил)бис(оксометилен)дипирролидин-1-карбоксилат и (2S,2'S)-трет-бутил-2,2'-(4,4'2R,5R)-1-(4-фторфенил)пирролидин-2,5-диил)бис(4,1-фениленбис(азандиил)бис(оксометилен)дипирролидин-1-карбоксилат. Продукт примера 5 А (50 мг, 0,144 ммоль) подвергали условиям, описанным в примере 1F, с получением указанного в заголовке соединения в качестве смеси 1:1 диастереомеров (105 мг, 98%): 1 Н ЯМР (400 МГц, DMSO-D6)м.д. 1,34 (д, 18 Н), 1,66 (д, J=5,10 Гц, 2 Н), 1,74-1,89 (м, 6 Н), 2,072,23 (м, 2 Н), 4,15-4,25 (м, 2 Н), 5,18 (д, J=3,47 Гц, 2 Н), 6,18-6,25 (м, 2 Н), 6,78 (т, J=8,95 Гц, 2 Н), 7,14 (д,J=8,24 Гц, 4 Н), 7,51 (т, J=8,29 Гц, 4 Н), 9,92 (д, 2 Н). Пример 5 С. (2S,2'S)-N,N'-(4,4'-2S,5S)-1-(4-фторфенил)пирролидин-2,5-диил)бис(4,1-фенилендипирролидин-2-карбоксамид и (2S,2'S)-N,N'-(4,4'-2R,5R)-1-(4-фторфенил)пирролидин-2,5-диил)бис(4,1 фенилендипирролидин-2-карбоксамид. Продукт примера 5 В подвергали условиям, описанным в примере 1G, с получением указанного в заголовке соединения в качестве смеси 1:1 диастереомеров. Пример 5D. Диметил-(2S,2'S)-1,1'-2S,2'S)-2,2'-(4,4'-2S,5S)-1-(4-фторфенил)пирролидин-2,5 диил)бис(4,1-фениленбис(азандиил)бис(оксометилен)бис(пирролидин-2,1-диилбис(1-оксобутан-2,1 диил)дикарбамат и диметил-(2S,2'S)-1,1'-2S,2'S)-2,2'-(4,4'-2R,5R)-1-(4-фторфенил)пирролидин-2,5 диил)бис (4,1-фениленбис(азандиил)бис(оксометилен)бис(пирролидин-2,1-диилбис(1-оксобутан-2,1 диил)дикарбамат. К смеси продукта примера 5 С (0,102 г, 0,188 ммоль), (S)-2-(метоксикарбониламино)бутановой кислоты (0,064 г, 0,395 ммоль) и HATU (0,150 г, 0,395 ммоль) в DMS0 (2 мл) добавляли основание Хунига(0,099 мл, 0,565 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 45 мин. Реакционную смесь распределяли между водой и этилацетатом и органический слой сушили надNa2SO4, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали колоночной хроматографией на силикагеле с использованием градиента растворителей из 0-4% МеОН в дихлорметане с получением указанного в заголовке соединения в качестве смеси 1:1 стереоизомеров (0,158 г, выход 94%): 1 Н ЯМР (400 МГц, DMSO-D6)м.д. 0,86-0,96 (м, 6 Н), 1,53 (д, J=4,34 Гц, 2 Н), 1,59-1,73 (м, 2 Н),1,80-1,96 (м, J=6,29 Гц, 4 Н), 1,96-2,06 (м, 2 Н), 2,08-2,20 (м, 2 Н), 3,52 (с, 6 Н), 3,67-3,79 (м, 2 Н), 4,12-4,23(м, 2 Н), 4,42 (дд, J=8,13, 4,66 Гц, 2 Н), 5,16 (д, J=6,40 Гц, 2 Н), 6,20 (дд, J=9,22, 4,45 Гц, 2 Н), 6,77 (т, J=8,89 Гц, 2 Н), 7,12 (д, J=7,59 Гц, 4 Н), 7,30 (дд, J=7,59, 3,25 Гц, 2 Н), 7,50 (д, J=8,24 Гц, 4 Н), 8,16 (с, 2 Н), 9,95 (с,2 Н). Указанное в заголовке соединение продемонстрировало значение ЕС 50 от приблизительно 0,1 до приблизительно 1 нМ в анализах с репликоном HCV 1b-Con1 в присутствии 5% FBS. Пример 6. Диметил-(2S,2'S)-1,1'-2S,2'S)-2,2'-(4,4'-2S,5S)-1-(4-фторфенил)пирролидин-2,5 диил)бис(4,1-фениленбис(азандиил)бис(оксометилен)бис(пирролидин-2,1-диилбис(3-гидрокси-3 метил-1-оксобутан-2,1-диил)дикарбамат и диметил-(2S,2'S)-1,1'-2S,2'S)-2,2'-(4,4'-2R,5R)-1-(4 фторфенил)пирролидин-2,5-диил)бис(4,1-фениленбис(азандиил)бис(оксометилен)бис(пирролидин-2,1 диилбис(3-гидрокси-3-метил-1-оксобутан-2,1-диил)дикарбамат К смеси продукта примера 5 С (0,1 г, 0,185 ммоль), (S)-3-гидрокси-2-(метоксикарбониламино)-3 метилбутановой кислоты(0,074 г, 0,388 ммоль) и HATU (0,147 г, 0,388 ммоль) в DMSO (2 мл) добавляли основание Хунига (0,097 мл, 0,554 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 45 мин. Реакционную смесь распределяли между водой и этилацетатом и органический слой сушили над Na2SO4, фильтровали и концентрировали в вакууме. Неочищенный продукт очищали колоночной хроматографией на силикагеле с использованием градиента растворителей из 0-4% МеОН в дихлорметане с получением указанного в заголовке соединения в качестве смеси 1:1 стереоизомеров(0,162 г, выход 97%): 1 Н ЯМР (400 МГц, DMSO-D)м.д. 1,15 (д, J=10,19 Гц, 12 Н), 1,64 (д, J=5,64 Гц, 2 Н), 1,87-1,98 (м,6 Н), 2,09-2,22 (м, 2 Н), 3,55 (с, 6 Н), 3,58-3,66(м, 2 Н), 3,66-3,74 (м, 2 Н), 3,83-3,92 (м, 2 Н), 4,37 (с, 2 Н), 4,444,50 (м, 2 Н), 5,07 (с, 2 Н), 5,11 (с, 2 Н), 5,17 (д, J=6,18 Гц, 2 Н), 6,15-6,28 (м, 2 Н), 6,78 (т, J=8,89 Гц, 2 Н),7,13 (д, J=8,13 Гц, 4 Н), 7,51 (д, J=7,81 Гц, 4 Н), 8,11-8,23 (м, 2 Н), 9,67 (д, J=9,11 Гц, 2 Н). Указанное в заголовке соединение продемонстрировало значение ЕС 50 менее чем приблизительно 0,1 нМ в анализах с
МПК / Метки
МПК: C07D 417/14, A61K 31/4184, A61K 31/4025, A61K 31/4439, A61K 31/4178, C07D 401/14, A61P 31/14, A61K 31/4196, C07D 403/14
Метки: противовирусные, соединения
Код ссылки
<a href="https://eas.patents.su/30-23570-protivovirusnye-soedineniya.html" rel="bookmark" title="База патентов Евразийского Союза">Противовирусные соединения</a>
Предыдущий патент: Частицы перекрестно-связанного эпоксидного винилового эфира и способы их изготовления и использования
Следующий патент: Стриголактамовые производные и их применение в качестве регуляторов роста растений
Случайный патент: Способ алкилирования ароматических углеводородов с реакционной дистилляцией