Стриголактамовые производные и их применение в качестве регуляторов роста растений
Номер патента: 23571
Опубликовано: 30.06.2016
Авторы: Лашья Матильда Дениза, Вольф Ханно Кристиан, Де Месмакер Ален, Жунг Пьер Жозеф Марсель
Формула / Реферат
1. Соединение формулы (I)
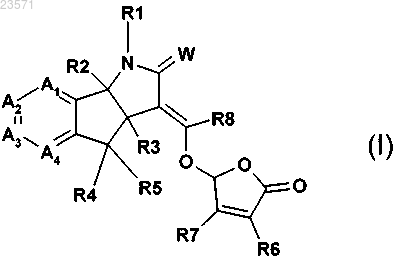
где W представляет собой О или S;
R2 и R3 независимо представляют собой водород или С1-С3алкил;
R4 и R5 независимо представляют собой водород, галоген, нитро, циано, С1-С3алкил, C1-С3галогеналкил, С1-С3алкокси, гидроксил, -OC(O)R9, амин, N-C1-С3алкиламин или N,N-ди-С1-С3алкиламин;
R9 представляет собой водород, С1-С6алкил, С1-С6алкокси или С1-С6галогеналкил;
R6 и R7 независимо представляют собой водород, С1-С3алкил, гидроксил или С1-С3алкокси;
R8 представляет собой водород, нитро, циано, С1-С6алкил или С1-С6галогеналкил;
R1 представляет собой водород, С1-С6алкокси, гидроксил, амин, N-C1-С6алкиламин, N,N-ди-С1-С6алкиламин, С1-С6алкил, замещенный или не замещенный одним-пятью R10, С1-С8алкилкарбонил, С1-С8алкоксикарбонил, арил, арил, замещенный одним-пятью R10, гетероарил, гетероарил, замещенный одним-пятью R10, гетероциклил, гетероциклил, замещенный одним-пятью R10, бензил или бензил, замещенный одним-пятью R10;
R10 представляет собой водород, циано, нитро, галоген, С1-С6алкил, С1-С6алкокси, С1-С6галогеналкил, С2-С6алкенил или С2-С6алкинил;
каждый А1 А2, А3 и А4 независимо представляет собой С-Х или азот, где каждый X может быть одинаковым или различным, и при условии, что не более двух из А1 А2, А3 и А4 представляют собой азот; и
X представляет собой водород, галоген, циано, С1-С3гидроксиалкил, -OC(O)R9, С1-С6алкокси, С1-С6алкил или С1-С6галогеналкил, нитро, амин, N-C1-С6алкиламин, N,N-ди-С1-С6алкиламин или NHC(O)R9;
или его соли.
2. Соединение по п.1, где W представляет собой О.
3. Соединение по п.2, где
R2 и R3 независимо представляют собой водород, метил или этил;
R4 и R5 независимо представляют собой водород, гидроксил, метил или этил;
R6, R7 и R8 независимо представляют собой водород, метил или этил;
R1 представляет собой водород, С1-С6алкокси, С1-С6алкил, замещенный или не замещенный одним-пятью R10, С1-С8алкилкарбонил, С1-С8алкоксикарбонил, арил, арил, замещенный одним-пятью R10, гетероарил, гетероарил, замещенный одним-пятью R10, гетероциклил, гетероциклил, замещенный одним-пятью R10, бензил или бензил, замещенный одним-пятью R10;
R10 независимо представляет собой водород, циано, нитро, галоген, С1-С6алкил, С1-С6алкокси или С1-С6галогеналкил;
каждый А1 А2, А3 и А4 независимо представляет собой С-Х; и
X представляет собой водород, гидроксил, галоген, циано, метил, этил, н-пропил, гидроксиметил, трифторметил или метокси.
4. Композиция для регуляции роста растений или стимуляции прорастания семян, содержащая соединение по любому из предыдущих пунктов и сельскохозяйственно приемлемое вспомогательное средство.
5. Способ регуляции роста растений, заключающийся в нанесении на местоположение растения эффективного количества композиции по п.4.
6. Способ стимуляции прорастания семян, предусматривающий нанесение на семена или на местоположение семян эффективного количества композиции по п.4.
7. Способ борьбы с сорными растениями, предусматривающий нанесение на местоположение семян сорного растения эффективного количества композиции по п.4, обеспечивающего прорастание семян, а затем нанесение на местоположение послевсходового гербицида.
8. Способ получения соединения формулы (I)
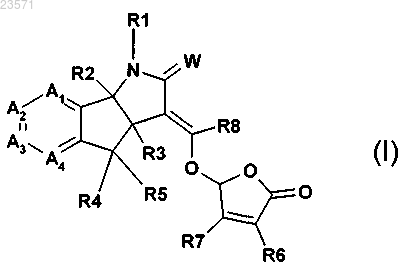
предусматривающий этапы:
а) обработки соединения формулы (VI)
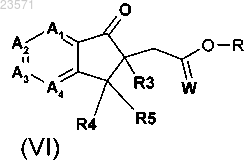
аминным производным с последующим восстановлением с получением соединения формулы (III);
b) обработки соединения формулы (III)
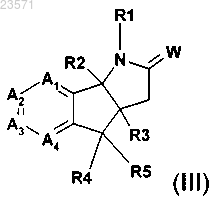
производным сложного эфира муравьиной кислоты в основных условиях с образованием соединения формулы (II) и
с) обработки соединения формулы (II)
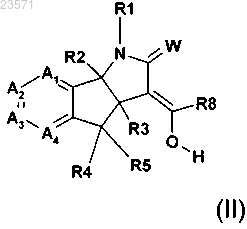
5Н-фураноновым производным
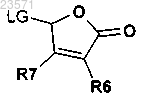
в основных условиях; где W представляет собой О или S; R2 и R3 независимо представляют собой водород или C1-С3алкил; R4 и R5 независимо представляют собой водород, галоген, нитро, циано, C1-С3алкил, С1-С3галогеналкил, C1-С3алкокси, гидроксил, -OC(O)R9, амин, N-C1-С3алкиламин или N,N-ди-С1-С3алкиламин; R9 представляет собой водород, С1-С6алкил, С1-С6алкокси или С1-С6галогеналкил; R6 и R7 независимо представляют собой водород, C1-С3алкил, гидроксил или C1-С3алкокси; R8 представляет собой водород, нитро, циано, С1-С6алкил или С1-С6галогеналкил; R1 представляет собой водород, С1-С6алкокси, гидроксил, амин, N-C1-С6алкиламин, N,N-ди-C1-С6алкиламин, С1-С6алкил, замещенный или незамещенный одним-пятью R10, С1-С8алкилкарбонил, С1-С8алкоксикарбонил, арил, арил, замещенный одним-пятью R10, гетероарил, гетероарил, замещенный одним-пятью R10, гетероциклил, гетероциклил, замещенный одним-пятью R10, бензил или бензил, замещенный одним-пятью R10; R10 представляет собой водород, циано, нитро, галоген, С1-С6алкил, С1-С6алкокси, С1-С6галогеналкил, С2-С6алкенил или С2-С6алкинил; каждый А1 А2, А3 и А4 независимо представляет собой С-Х или азот, где каждый X может быть одинаковым или различным, и при условии, что не более двух из А1 А2, А3 и А4 представляют собой азот; и X представляет собой водород, галоген, циано, С1-С3гидроксиалкил, -OC(O)R9, С1-С6алкокси, С1-С6алкил или С1-С6галогеналкил, нитро, амин, N-C1-С6алкиламин, N,N-ди-С1-С6алкиламин или NHC(O)R9.
9. Соединение формулы (II)
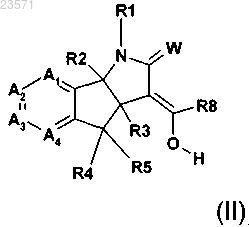
где W представляет собой О или S;
R2 и R3 независимо представляют собой водород или С1-С3алкил;
R4 и R5 независимо представляют собой водород, галоген, нитро, циано, С1-С3алкил, С1-С3галогеналкил, С1-С3алкокси, гидроксил, -OC(O)R9, амин, N-C1-С3алкиламин или N,N-ди-С1-С3алкиламин;
R9 представляет собой водород, С1-С6алкил, С1-С6алкокси или С1-С6галогеналкил;
R8 представляет собой водород, нитро, циано, С1-С6алкил или С1-С6галогеналкил;
R1 представляет собой водород, С1-С6алкокси, гидроксил, амин, N-C1-С6алкиламин, N,N-ди-С1-С6алкиламин, С1-С6алкил, замещенный или не замещенный одним-пятью R10, С1-С8алкилкарбонил, С1-С8алкоксикарбонил, арил, арил, замещенный одним-пятью R10, гетероарил, гетероарил, замещенный одним-пятью R10, гетероциклил, гетероциклил замещенный одним-пятью R10, бензил или бензил, замещенный одним-пятью R10;
R10 представляет собой водород, циано, нитро, галоген, С1-С6алкил, С1-С6алкокси, С1-С6галогеналкил, С2-С6алкенил или С2-С6алкинил;
каждый А1 А2, А3 и А4 независимо представляют собой С-Х или азот, где каждый X может быть одинаковым или различным, и при условии, что не более двух из А1 А2, А3 и А4 представляют собой азот; и
X представляет собой водород, галоген, циано, C1-С3гидроксиалкил, -OC(O)R9, С1-С6алкокси, С1-С6алкил или С1-С6галогеналкил, нитро, амин, N-C1-С6алкиламин, N,N-ди-С1-С6алкиламин или NHC(O)R9;
или его соли.
10. Применение соединения формулы (I) в качестве регулятора роста растений или стимулятора прорастания семян.
Текст
СТРИГОЛАКТАМОВЫЕ ПРОИЗВОДНЫЕ И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ РЕГУЛЯТОРОВ РОСТА РАСТЕНИЙ Изобретение относится к новым стриголактамным производным формулы (I), к способам и промежуточным соединениям для их получения, к композициям для регуляции роста растений,содержащим их, и к способам их применения для контроля роста растений и/или обеспечения прорастания семян. Лашья Матильда Дениза, ДеМесмакер Ален, Вольф Ханно Кристиан, Жунг Пьер Жозеф Марсель Изобретение относится к новым стриголактамовым производным, к способам и промежуточным соединениям для их получения, к регулирующим рост растения композициям, содержащим их, а также к способам их применения для контроля роста растений и/или обеспечения прорастания семян. Стриголактоновые производные являются фитогормонами со свойствами регулирование роста растений и прорастания семян; они описаны, например, в WO 2009/138655, WO 2010/125065, WO 05/077177,WO 06/098626 и в Annual Review of Phytopathology (2010), 48 p.93-117. Известно, что стриголактоновые производные, подобно синтетическому аналогу GR24, действуют на прорастание паразитических сорных растений, таких как виды Orobanche. Из уровня техники хорошо известно, что тестирование на прорастание семян Orobanche является тестом, применимым для идентификации стриголактоновых аналогов (см.,например, Plant and Cell Physiology (2010), 51(7) p.1095; и OrganicBiomolecular Chemistry (2009), 7(17),p.3413). Было обнаружено, что определенные стриголактамовые производные обладают свойствами аналогичными стриголактону. В соответствии с настоящим изобретением представлено соединение формулы (I)R2 и R3 независимо представляют собой водород или С 1-С 3 алкил;R4 и R5 независимо представляют собой водород, галоген, нитро, циано, С 1-С 3 алкил, С 1 С 3 галогеналкил, С 1-С 3 алкокси, гидроксил, -OC(O)R9, амин, N-Cl-С 3 алкиламин или N,N-ди-С 1 С 3 алкиламин;R6 и R7 независимо представляют собой водород, С 1-С 3 алкил, гидроксил или С 1-С 3 алкокси;R10 представляет собой водород, циано, нитро, галоген, С 1-С 6 алкил, С 1-С 6 алкокси, С 1 С 6 галогеналкил, С 2-С 6 алкенил, или С 2-С 6 алкинил; каждый из А 1 А 2, А 3 и А 4 независимо представляет собой С-Х или азот, где каждый X может быть одинаковым или различным, и при условии, что не более двух из A1, A2, A3 и А 4 представляют собой азот; а X представляет собой водород, галоген, циано, гидроксил, -OC(O)R9, С 1-С 6 алкокси, С 1-С 6 алкил,С 1-С 6 галогеналкил, С 1-С 3 гидроксиалкил, нитро, амин, N-C1-С 6 алкиламин, N,N-ди-С 1-С 6 алкиламин или NHC(O)R9. Соединения формулы (I) могут существовать в виде различных геометрических или оптических изомеров (диастереоизомеров и энантиомеров) или таутомерных форм. Настоящее изобретение охватывает все такие изомеры и таутомеры и их смеси во всех пропорциях, а также изотопные формы, такие как дейтерированные соединения. Настоящее изобретение также охватывает все соли соединений формулы(I). Каждый алкильный фрагмент либо отдельно, либо как часть более крупной группы (такой как алкокси, алкоксикарбонил, алкилкарбонил, алкиламинокарбонил, диалкиламинокарбонил) характеризуется прямой или разветвленной цепью и представляет собой, например, метил, этил, н-пропил, н-бутил, нпентил, н-гексил, изо-пропил, н-бутил, втор-бутил, изо-бутил, трет-бутил или нео-пентил. Алкильными группами предпочтительно являются С 1-С 6 алкильные группы, более предпочтительно С 1-С 4 и наиболее предпочтительно С 1-С 3 алкильные группы. Галогеном является фтор, хлор, бром или йод. Галогеналкильными группами (либо отдельно, либо как часть более крупной группы, такой как галогеналкокси или галогеналкилтио) являются алкильные группы, которые замещены одной или несколькими одинаковыми или различными атомами галогена и представляют собой, например, -CF3, -CF2Cl,-CH2CF3 или -CH2CHF2. Гидроксиалкильными группами являются алкильные группы, которые замещены одной или несколькими гидроксильными группами и представляют собой, например, -СН 2 ОН, -СН 2 СН 2 ОН или-СН(ОН)СН 3. В контексте настоящего изобретения термин "арил" относится к кольцевой системе, которая может быть моно-, би- или трициклической. Примеры таких колец включают фенил, нафталенил, антраценил,инденил или фенантренил. Предпочтительной арильной группой является фенил. Если не указано иное, алкенил и алкинил, сами по себе или как часть другого заместителя, могут быть с прямой или разветвленной цепью и предпочтительно могут содержать 2-6 атомов углерода, предпочтительно 2-4, более предпочтительно 2-3, и в случае необходимости, может быть либо в (E)-, либо в(Z)-конфигурации. Примеры включают винил, аллил и пропаргил. Термин "гетероарил" относится к ароматической кольцевой системе, содержащей по меньшей мере один гетероатом и содержащей либо отдельное кольцо, либо два или более слитых колец. Предпочтительно отдельные кольца будут содержать до трех, а бициклические системы до четырех гетероатомов,которые предпочтительно будут выбраны из азота, кислорода и серы. Примеры таких групп включают пиридил, пиридазинил, пиримидинил, пиразинил, фуранил, тиофенил, оксазолил, изоксазолил, оксадиазолил, тиазолил, изотиазолил, тиадиазолил, пирролил, пиразолил, имидазолил, триазолил и тетразолил. Предпочтительной гетероарильной группой является пиридин. Термин "гетероциклил" определяется как включающий гетероарил и в дополнение его ненасыщенные или частично ненасыщенные аналоги, такие как 4,5,6,7-тетрагидробензотиофенил, 9 Н-фторенил, 3,4 дигидро-2 Н-бензо-1,4-диоксепинил, 2,3-дигидробензофуранил, пиперидинил, 1,3-диоксоланил, 1,3-диоксанил, 4,5-дигидроизоксазолил, тетрагидрофуранил и морфолинил. Предпочтительные значения W, R2, R3, R4, R5, R9, R8, R1, R10, А 1 А 2, А 3, А 4 и X, в любой комбинации, изложены ниже.W предпочтительно представляет собой кислород.R2 предпочтительно представляет собой водород, метил или этил; наиболее предпочтительно R2 представляет собой водород.R3 предпочтительно представляет собой водород, метил или этил; наиболее предпочтительно R3 представляет собой водород.R4 предпочтительно представляет собой водород, гидроксил, метил или этил; наиболее предпочтительно R4 представляет собой водород или гидроксил.R5 предпочтительно представляет собой водород, гидроксил, метил или этил; наиболее предпочтительно R5 представляет собой водород или гидроксил.R6 предпочтительно представляет собой водород, метил или этил; наиболее предпочтительно R6 представляет собой метил.R7 предпочтительно представляет собой водород, метил или этил; наиболее предпочтительно R7 представляет собой водород.R8 предпочтительно представляет собой водород, метил или этил; наиболее предпочтительно R8 представляет собой водород.R1 предпочтительно представляет собой водород, С 1-С 6 алкокси, С 1-С 6 алкил, замещенный или незамещенный одним-пятью R10, С 1-С 8 алкилкарбонил, С 1-С 8 алкоксикарбонил, арил, арил, замещенный одним-пятью R10, гетероарил, гетероарил, замещенный одним-пятью R10, гетероциклил, гетероциклил,замещенный одним-пятью R10, бензил или бензил, замещенный одним-пятью R10; более предпочтительно R1 представляет собой водород, С 1-С 6 алкокси, С 1-С 6 алкил, замещенный или незамещенный одним-пятью R10, С 1-С 8 алкилкарбонил, С 1-С 8 алкоксикарбонил, бензил или бензил, замещенный однимпятью R10; наиболее предпочтительно R1 представляет собой водород, метил, этил, фенил, бензил, ацетат, или метоксикарбонил.R10 независимо представляет собой водород, циано, нитро, галоген, С 1-С 6 алкил, С 1-С 6 алкокси,С 1-С 6 галогеналкил; наиболее предпочтительно R10 представляет собой водород, циано, нитро, хлорид,бромид, фтор, метил, метокси и трифторметил. Предпочтительно A1 представляет собой С-Х. Предпочтительно А 2 представляет собой С-Х. Предпочтительно А 3 представляет собой С-Х. Предпочтительно А 4 представляет собой С-Х. Предпочтительно, X представляет собой водород, гидроксил, галоген, циано, метил, этил, н-пропил,гидроксиметил, трифторметил или метокси. Более предпочтительно, X представляет собой водород, гидроксил, метил, трифторметил или метокси. Еще более предпочтительно, X представляет собой водород,метил, гидроксил или метокси. Наиболее предпочтительно, X представляет собой водород, метил, гидроксил или метокси. В предпочтительном варианте осуществления обеспечено соединение формулы (1), гдеR2 и R3 независимо представляют собой водород, метил или этил; R4 и R5 независимо представляют собой водород, гидроксил, метил или этил; R6, R7 и R8 независимо представляют собой водород, метил или этил; R1 представляет собой водород, С 1-С 6 алкокси, С 1-С 6 алкил, замещенный или незамещенный одним-пятью R10, С 1-С 8 алкилкарбонил, С 1-С 8 алкоксикарбонил, арил, арил, замещенный одним пятью R10, гетероарил, гетероарил, замещенный одним-пятью R10, гетероциклил, гетероциклил, замещенный одним-пятью R10, бензил или бензил, замещенный одним-пятью R10;R10 независимо представляет собой водород, циано, нитро, галоген, С 1-С 6 алкил, С 1-С 6 алкокси или С 1-С 6 галогеналкил; каждый А 1 А 2, А 3 и А 4 независимо представляет собой С-Х; и X представляет собой водород, гидроксил, галоген, циано, метил, этил, н-пропил, гидроксиметил, трифторметил или метокси. В предпочтительном варианте осуществления обеспечено соединение формулы (II)R2 и R3 независимо представляют собой водород или С 1-С 3 алкил;R4 и R5 независимо представляют собой водород, галоген, нитро, циано, С 1-С 3 алкил, С 1 С 3 галогеналкил, С 1-С 3 алкокси, гидроксил, -OC(O)R9, амин, N-C1-С 3 алкиламин или N,N-ди-С 1 С 3 алкиламин;R10 представляет собой водород, циано, нитро, галоген, С 1-С 6 алкил, С 1-С 6 алкокси, С 1 С 6 галогеналкил, С 2-С 6 алкенил или С 2-С 6 алкинил; каждый A1, A2, A3 и А 4 независимо представляет собой С-Х или азот, где каждый X может быть одинаковым или различным, и при условии, что не более двух из A1, A2, A3 и А 4 представляют собой азот; а X представляет собой водород, галоген, циано, гидроксил, -OC(O)R9, С 1-С 6 алкокси, С 1-С 6 алкил,С 1-С 6 галогеналкил, С 1-С 3 гидроксиалкил, нитро, амин, N-C1-С 6 алкиламин, N,N-ди-С 1-С 6 алкиламин или NHC(O)R9; или его соли. Предпочтения для А 1, А 2, А 3, А 4, R1, R2, R3, R4, R5, R8 и W являются такими же, как и предпочтения, изложенные для соответствующих заместителей соединений формулы (I). Соединение формулы (II) являются промежуточными соединениями в синтезе соединения формулы (I). Табл. 1 и 2 ниже представляют примеры соединений настоящего изобретения. Таблица 1 Соединения формулы (I) в соответствии с настоящим изобретением могут быть использованы как регуляторы роста растений или стимуляторы прорастания семян сами по себе, но, как правило, их составляют в композиции для регулирования роста растений или стимулирования прорастания семян с использованием вспомогательных средств для составления, таких как носители, растворители и поверхностно-активные вещества (SFA). Таким образом, настоящее изобретение, кроме того, относится к композиции для регуляции роста растений, содержащей регулирующее рост растений соединение формулы (I) и сельскохозяйственно приемлемое вспомогательное средство для составления. Настоящее изобретение,-4 023571 кроме того, относится к композиции для регуляции роста растений, содержащей в основном регулирующее рост растений соединение формулы (I) и сельскохозяйственно приемлемое вспомогательное средство для составления. Настоящее изобретение, кроме того, относится к композиции для регуляции роста растений, содержащей регулирующее рост растений соединение формулы (I) и сельскохозяйственно приемлемое вспомогательное средство для составления. Настоящее изобретение, кроме того, относится к композиции для стимуляции прорастания семян, содержащей стимулирующее прорастание семян соединение формулы (I) и сельскохозяйственно приемлемое вспомогательное средство для составления. Настоящее изобретение, кроме того, относится к композиции для стимулирования прорастания семян, содержащей в основном стимулирующее прорастание семян соединение формулы (I) и сельскохозяйственно приемлемое вспомогательное средство для составления. Настоящее изобретение, кроме того, относится к композиции для стимулирования прорастания семян, содержащей стимулирующее прорастание семян соединение формулы (I) и сельскохозяйственно приемлемое вспомогательное средство для составления. Композиция может иметь форму концентратов, которые растворяются перед применением, хотя также могут быть получены готовые к применению композиции. Конечное разбавление, как правило,осуществляется водой, но вместо воды или в добавок к воде может быть выполнено, например, с жидкими удобрениями, микроэлементами, биологическими организмами, маслом или растворителями. Композиции, как правило, содержат от 0,1 до 99 вес.%, особенно от 0,1 до 95 вес.%, соединений формулы I и от 1 до 99,9 вес.% вспомогательного средства для составления, которое предпочтительно включает от 0 до 25 вес.% поверхностно-активного вещества. Композиции могут быть выбраны из ряда типов составов, многие из которых известны из Manual onDevelopment and Use of FAO Specifications for Plant Protection Products, 5th Edition, 1999. Они включают распыляемые порошки (DP), растворимые порошки (SP), растворимые в воде гранулы (SG), диспергируемые в воде гранулы (WG), увлажняемые порошки (WP), гранулы (GR) (высвобождаемые медленно или быстро), растворимые концентраты (SL), смешиваемые с маслом жидкости (OL), жидкости сверхнизкого объема (UL), эмульгируемые концентраты (ЕС), диспергируемые концентраты (DC), эмульсии(и масло-в-воде (EW), и вода-в-масле (ЕО, микроэмульсии (ME), суспензионные концентраты (SC),аэрозоли, капсульные суспензии (CS) и составы для обработки семян. Выбор типа состава в любом случае будет зависеть от конкретной предусматриваемой цели и от физических, химических и биологическими свойств соединения формулы (I). Распыляемые порошки (DP) могут быть получены смешиванием соединения формулы (I) с одним или несколькими твердыми разбавителями (например, природные глины, каолин, пирофиллит, бентонит,глинозем, монтмориллонит, кизельгур, мел, диатомовые земли, фосфаты кальция, карбонаты кальция и магния, сера, известь, тонкодисперсные материалы, тальк и другие органические и неорганические твердые носители) и механическим измельчением смеси до мелкого порошка. Растворимые порошки (SP) могут быть получены смешиванием соединения формулы (I) с одной или несколькими растворимыми в воде неорганическими солями (такими как бикарбонат натрия, карбонат натрия или сульфат магния) или с одним или несколькими растворимыми в воде органическими твердыми веществами (такими как полисахарид) и необязательно с одним или несколькими увлажняющими средствами, с одним или несколькими диспергирующими средствами или со смесью указанных средств для улучшенной диспергируемости/растворимости в воде. Затем смесь измельчается до мелкого порошка. Подобные композиции также могут быть гранулированы с образованием растворимых в воде гранул (SG). Увлажняемые порошки (WP) могут быть получены смешиванием соединения формулы (I) с одним или несколькими твердыми разбавителями или носителями, с одним или несколькими увлажняющими средствами и, предпочтительно, с одним или несколькими диспергирующими средствами и необязательно с одним или несколькими суспендирующими средствами для облегчения дисперсии в жидкостях. Затем смесь измельчается до мелкого порошка. Подобные композиции также могут быть гранулированы с образованием диспергируемых в воде гранул (WG). Гранулы (GR) могут быть получены либо гранулированием смеси соединения формулы (I) и одного или нескольких порошковых твердых разбавителей или носителей, либо путем абсорбирования соединения формулы (I) (или его раствора, в приемлемом средстве) в пористый гранулярный материал предварительно полученных пустых гранул (такой как пемза, аттапульгитовые глины, фуллерова земля, кизельгур, диатомовые земли или измельченные кукурузные початки), либо адсорбированием соединения формулы (I) (или его раствора, в приемлемом средстве) на материал твердого ядра (такой как пески, силикаты, минеральные карбонаты, сульфаты или фосфаты) и сушкой при необходимости. Средства, которые традиционно используются для абсорбции или адсорбции включают растворители (такие как алифатические и ароматические нефтяные растворители, спирты, эфиры, кетоны и сложные эфиры) и прилипатели(такие как поливинилацетаты, поливиниловые спирты, декстрины, сахара и растительные масла). Одна или несколько других добавок также могут быть включены в гранулы (например, эмульгирующее средство, увлажняющее средство или диспергирующее средство). Диспергируемые концентраты (DC) могут быть получены растворением соединения формулы (I) в воде или в органическом растворителе, таком как кетон, спирт или гликолевый эфир. Эти растворы мо-5 023571 гут содержать поверхностно-активное средство (например, для улучшения растворимости в воде или предупреждения кристаллизации в резервуаре опрыскивателя). Эмульгируемые концентраты (ЕС) или эмульсии масло-в-воде (EW) могут быть получены растворением соединения формулы (I) в органическом растворителе (необязательно содержащем одно или несколько увлажняющих средств, одно или несколько эмульгирующих средств или смесь указанных средств). Приемлемые органические растворители для применения в ЕС включают ароматические углеводороды (такие как алкилбензолы или алкилнафталины, представленные SOLVESSO 100, SOLVESSO 150 и SOLVESSO 200; SOLVESSO является зарегистрированным товарным знаком), кетоны (такие как циклогексанон или метилциклогексанон) и спирты (такие как бензиловый спирт, фурфуриловый спирт или бутанол), N-алкилпирролидоны (такие как N-метилпирролидон или N-октилпирролидон), диметиламиды жирных кислот (такие как диметиламид C8-С 10 жирной кислоты) и хлорированные углеводороды. Продукт ЕС может самопроизвольно эмульгироваться при добавлении в воду с получением эмульсии,достаточно стабильной для обеспечения нанесения распылением с помощью соответствующего оборудования. Получение EW предусматривает получение соединения формулы (I) либо в виде жидкости (если оно не является жидким при комнатной температуре, его можно расплавить при приемлемой температуре, как правило, ниже 70 С), либо в растворе (путем растворения его в соответствующем растворителе), а затем эмульгирование полученной в результате жидкости или раствора в воде, содержащей одно или несколько SFA, при высоком усилии сдвига с получением эмульсии. Приемлемые растворители для применения в EW включают растительные масла, хлорированные углеводороды (такие как хлорбензолы), ароматические растворители (такие как алкилбензолы или алкилнафталины) и другие соответствующие органические растворители, которые характеризуются низкой растворимостью в воде. Микроэмульсии (ME) могут быть получены смешиванием воды со смесью одного или нескольких растворителей с одним или несколькими SFA с самопроизвольным получением термодинамически стабильного изотропного жидкого состава. Соединение формулы (I) первоначально находится либо в воде,либо в смеси растворителя и SFA. Приемлемые растворители для применения в ME включают описанные выше для применения в ЕС или в EW. ME может быть системой либо масло-в-воде, либо вода-вмасле (присутствие которой может быть определено измерениями проводимости) и может быть приемлемой для смешивания растворимых в воде и растворимых в масле пестицидов в одном и том же составе. ME является приемлемой для разбавления в воде, либо остается в виде микроэмульсии, либо образует традиционную эмульсию маслов-воде. Суспензионные концентраты (SC) могут включать водные или неводные суспензии тонко измельченных нерастворимых твердых частиц соединения формулы (I). SC могут быть получены с помощью шаровой или бисерной мельницы твердого соединения формулы (I) в приемлемой среде, необязательно с одним или несколькими диспергирующими средствами с получением суспензии мелких частиц соединения. Одно или несколько увлажняющих средств могут быть включены в композицию, и суспендирующее средство может быть включено для снижения скорости оседания частиц. В качестве альтернативы, соединение формулы (I) может быть помолото сухим и добавлено в воду, содержащую описанные выше средства, с получением желаемого конечного продукта. Аэрозольные составы включают соединения формулы (I) и приемлемый пропеллент (например, нбутан). Соединение формулы (I) также может быть растворено или диспергировано в приемлемой среде(например, в воде или в смешиваемой с водой жидкости, такой как н-пропанол) с получением композиций для применения в ненагнетательных, приводимых в действие вручную насосах для опрыскивания. Капсульные суспензии (CS) могут быть получены способом, подобным получению составов EW, но с дополнительным этапом полимеризации, так, что получается водная дисперсия масляных капель, в которой каждая масляная капля инкапсулируется в полимерную оболочку и содержит соединение формулы(I) и необязательно носитель или его разбавитель. Полимерная оболочка может быть получена либо реакцией межфазной поликонденсации, либо процедурой коацервации. Композиции могут обеспечивать регулированное высвобождение соединения формулы (I), и их можно использовать для обработки семян. Соединение формулы (I) также может быть составлено в биоразлагаемой полимерной матрице с обеспечением медленного, регулируемого высвобождения соединения. Композиция может включать одну или несколько добавок для улучшения биологических характеристик композиции, например, путем улучшения увлажнения, удержания или распределения на поверхностях; устойчивости к дождю на обработанных поверхностях; или поглощения или подвижности соединения формулы (I). Такие добавки включают поверхностно-активные средства (SFA), добавки для распыления на основе масел, например, определенных минеральных масел или природных растительных масел (таких как соевое и рапсовое масло), и смеси их с другими биоусиливающими вспомогательными средствами (ингредиентами, которые могут способствовать действию или модифицировать действие соединения формулы (I. Увлажняющими средствами, диспергирующими средствами и эмульгирующими средствами могут быть SFA катионного, анионного, амфотерного или неионного типа. Приемлемые SFA катионного типа включают соединения четвертичного аммония (например, бромид цетилтриметиламмония), имидазолины и аминные соли. Приемлемые анионные SFA включают соли щелочных металлов и жирных кислот, соли алифатических сложных моноэфиров серной кислоты (например, лаурилсульфат натрия), соли сульфонированных ароматических соединений (например, додецилбензолсульфонат натрия, додецилбензолсульфонат кальция, бутилнафталинсульфонат и смеси натрия ди-изопропил- и три-изопропил-нафталинсульфонатов),эфир сульфаты, спиртовые эфир сульфаты (например, лаурет-3-сульфат натрия), эфир карбоксилаты (например, лаурет-3-карбоксилат натрия), сложные эфиры фосфатов (продукты реакции между одним или несколькими жирными спиртами и фосфорной кислотой (преимущественно сложные моноэфиры) или пентоксид фосфора (преимущественно сложные диэфиры), например, реакции между лауриловым спиртом и тетрафосфорной кислотой; дополнительно эти продукты могут быть этоксилированы), сульфосукцинаматы, парафин- или олефинсульфонаты, таураты и лигносульфонаты. Приемлемые SFA амфотерного типа включают бетаины, пропионаты и глицинаты. Приемлемые SFA неионного типа включают продукты конденсации алкиленоксидов, таких как этиленоксид, пропиленоксид, бутиленоксид или их смеси, с жирными спиртами (такими как олеиловый спирт или цетиловый спирт) или с алкилфенолами (такими как окстилфенол, нонилфенол или окстилкрезол); частичными сложными эфирами, происходящими из длинноцепочечных жирных кислот или ангидриды гекситов; продукты конденсации указанных частичных сложных эфиров с этиленоксидом; блокполимеры (содержащие этиленоксид и пропиленоксид); алканоламиды; простые сложные эфиры (например, сложные эфиры жирных кислот и полиэтиленгликоля); аминоксиды (например, лаурилдиметиламиноксид) и лецитины. Приемлемые суспензионные средства включают гидрофильные коллоиды (такие как полисахариды,поливинилпирролидон или карбоксиметилцеллюлоза натрия) и разбухающие глины (такие как бентонит или аттапульгит). Настоящее изобретение, кроме того, относится к способу регулирования роста растений на местоположении, предусматривающему нанесение на местоположение регулирующее рост растений количество композиции в соответствии с настоящим изобретением. Настоящее изобретение также относится к способу обеспечения прорастания семян, предусматривающему нанесение на семена или на местоположение, содержащее семена, стимулирующее прорастание семян количество композиции в соответствии с настоящим изобретением. Нанесение обычно осуществляется путем распыления композиции, как правило, с помощью монтируемого на тракторе распылителя для больших площадей, а также могут использоваться другие способы,такие как опудривание (для порошков), капельное орошение или дождевание. В качестве альтернативы,композиция может быть внесена в борозду или непосредственно на семя до или во время высевания. Соединение формулы (I) или композиция по настоящему изобретению может быть нанесена на растение, часть растения, орган растения, материал для размножения растений или окружающую их зону. В одном варианте осуществления настоящее изобретение относится к способу обработки материала для размножения растений, предусматривающему нанесение на материал для размножения растений композиции по настоящему изобретению в количестве, эффективном для обеспечения прорастания и/или регулирования роста растений. Настоящее изобретение также относится к материалу для размножения растений, обработанному соединением формулы (I) или композицией по настоящему изобретению. Предпочтительно, материалом для размножения растений является семя. Термин "материал для размножения растений" означает все генеративные части растения, такие как семена, которые могут быть использованы для размножения последнего, и вегетативные растительные материалы, такие как черенки и клубни. В частности, могут быть упомянуты семена, корни, плоды,клубни, луковицы и корневища. Способы нанесения активных ингредиентов на материал для размножения растений, особенно на семена, известны в уровне техники и включают способы нанесения на материал для размножения путем протравливания, покрытия, дражирования и смачивания. Обработка может быть применена к семени в любое время от сбора семени до высевания семени или во время процесса высевания. Семя также может быть подвергнуто первичной обработке либо до, либо после обработки. Соединение формулы (I) необязательно может быть нанесено в комбинации с покрытием или технологией контролированного высвобождения так, что соединение высвобождается с течением времени. Композиция по настоящему изобретению может быть нанесена как довсходовая или послевсходовая. Соответственно, если композиция используется для регулирования роста культурных растений, она может быть нанесена до или после появления всходов, но предпочтительно после появления всходов сельскохозяйственной культуры. Если композиция используется для обеспечения прорастания семян,она может быть нанесена как довсходовая. Нормы нанесения соединений формулы I могут варьировать в широких пределах и зависеть от природы почвы, способа нанесения (до или после появления всходов; протравливание семян; внесение в борозду для семян; беспахотное внесение и т.п.), культурного растения, преобладающих климатических условий и других факторов, регулируемых способом нанесения, временем нанесения и целевой сельско-7 023571 хозяйственной культурой. Для лиственного нанесения или дождевания соединения формулы I в соответствии с настоящим изобретением, как правило, наносятся при норме от 1 до 2000 г/га, особенно от 5 до 1000 г/га. Для обработки семян норма нанесения, как правило, составляет от 0,0005 до 150 г на 100 кг семени. Растения, для которых может быть использована композиция в соответствии с настоящим изобретением, включают сельскохозяйственные культуры, такие как зерновые (например, пшеница, ячмень,рожь, овес); свекла (например, сахарная свекла или кормовая свекла); плодовые (например, семечковые,косточковые или ягодные, такие как яблони, груши, сливы, персики, миндаль, вишни, клубника, малина или ежевика); бобовые растения (например, бобы, чечевица, горох или соя); масличные растения (например, рапс, горчица, мак, оливы, подсолнечник, кокосовая пальма, клещевина, бобы какао или арахис); огурцовые растения (например, кабачки, огурцы или дыни); волокнистые растения (например, хлопчатник, лен, конопля или джут); цитрусовые (например, апельсины, лимоны, грейпфрут или мандарины); овощные культуры (например, шпинат, латук, спаржа, капусте, морковь, лук, томаты, картофель, тыквенные или паприка); лавровые (например, авокадо, коричное дерево или камфарное дерево); маис; рис; табак; орехи; кофе; сахарный тростник; чай; виноград; хмель; дуриан; банан; каучуконосные растения; газонные или декоративные (например, цветы, кустарники, широколиственные деревья или вечнозеленые, такие как хвойные). Это перечень не подразумевает какое-либо ограничение. Настоящее изобретение также может быть использовано для регуляции роста или для обеспечения прорастания семян растений, не являющихся сельскохозяйственными культурами, например, для облегчения борьбы с сорными растениями путем синхронизации прорастания. Следует понимать, что сельскохозяйственные культуры также включают такие сельскохозяйственные культуры, которые модифицированы традиционными способами селекции или генетически модифицированы. Например, настоящее изобретение может быть использовано в отношении сельскохозяйственных культур, которым придана выносливость к гербицидам или классам гербицидов (например, ALS, GS-, EPSPS-, РРО-, АССаза- и HPPD-ингибиторы). Примером сельскохозяйственной культуры, которой придана выносливость к имидазолинонам, например, к имазамоксу, традиционными способами селекции, является яровой рапс Clearfield (канола). Примеры сельскохозяйственных культур, которым придана выносливость к гербицидам способами генетической модификации, включают, например, устойчивые к глифосату и глифозинату сорта маиса, коммерчески доступные под торговой маркойRoundupReady и LibertyLink. Способы придания сельскохозяйственным растениям выносливости кHPPD-ингибиторам известны, например, из WO 0246387; например, сельскохозяйственное растение является трансгенным в отношении полинуклеотида, содержащего последовательность ДНК, которая кодирует устойчивый к HPPD-ингибитору фермент HPPD, полученный из бактерии, более конкретно, изPseudomonas fluorescens или Shewanella colwelliana, или из растения, более конкретно, полученный из однодольного растения, или еще более конкретно, из видов ячменя, маиса, пшеницы, риса, Brachiaria,Chenchrus, Lolium, Festuca, Setaria, Eleusine, Sorghum или Avena. Сельскохозяйственные культуры также следует считать такими, которым придана устойчивость к вредным насекомым способами генной инженерии, например, Bt-маис (устойчивый к кукурузному мотыльку), Bt-хлопчатник (устойчивый к хлопковому долгоносику), а также Bt-картофель (устойчивый к колорадскому жуку). Примерами Bt-маиса являются гибриды маиса Bt 176 NK (Syngenta Seeds). Btтоксин представляет собой белок, который образуется в природе почвенной бактерией Bacillus thuringiensis. Примеры токсинов или трансгенных растений, способных синтезировать такие токсины описаны в ЕР-А-451878, ЕР-А-374753, WO 93/07278, WO 95/34656, WO 03/052073 и ЕР-А-427529. Примерами трансгенных растений, содержащих один или несколько генов, которые кодируют устойчивость к инсектицидам и экспрессируют один или несколько токсинов, являются KnockOut (маис), Yield Gard (маис), NuCOTIN33B (хлопчатник), Bollgard (хлопчатник), NewLeaf (картофель), NatureGard и Protexcta. Растительные культуры или их семенной материал могут быть в одно и то же время устойчивы к гербицидам и устойчивы к поединию насекомыми ("stacked" трансгенные события). Например, семя может обладать способностью экспрессии инсектицидного белка Cry3 и в то же время, являясь устойчивым к глифосату. Следует понимать, что сельскохозяйственные культуры также включают такие, что получены традиционными способами селекции или генной инженерии и содержат так называемые производственные признаки (например улучшенную устойчивость при хранении, более высокую питательную ценность и улучшенный вкус). Соединения по настоящему изобретению могут быть получены следующими способами. Схема 1. Вариант Аi) Соединения формулы (XIV), где R представляет собой С 1-С 6 алкил, может быть получено обра-8 023571 боткой соединений формулы (XIII), где X представляет собой Br или I, a R представляет собой С 1 С 6 алкил, аллильным производным формулы ZC(R4R5)C(R3)CH2, где Z представляет собой производные бора или олова, в присутствии приемлемой системы катализатор/лиганд, часто комплекса палладия(О). Соединение формулы (XIII), где X представляет собой Вг или I, и R представляет собой С 1-С 6 алкил,является известным соединением или может быть получено способами, известными специалисту в данной области.ii) Соединения формулы (XV) могут быть получены обработкой соединений формулы (XIV), где R представляет собой С 1-С 6 алкил, с помощью гидролиза сложноэфирной группы с основанием, таким как гидроксид натрия или гидроксид лития. Схема 1. Вариант Вi) Соединения формулы (XII), где X представляет собой Br или I, может быть получено обработкой соединений формулы (XIII), где R представляет собой Н, С 1-С 6 алкокси, С 1, F или Br, амином формулыHNR'2, где R' не является хиральным, таким как изопропил, или R'2 является хиральным, таким как (R,R)2,5-диметилпирролидин. Если R представляет собой Н, такие реакции могут быть осуществлены в присутствии связывающего реагента, такого как DCC (N,N'-дициклогексилкарбодиимид), EDC (1-этил-3-[3 диметиламинопропил]карбодиимида гидрохлорид) или ВОР-С 1 (бис(2-оксо-3-оксазолидинил)фосфоновый хлорид), в присутствии основания, такого как пиридин, триэтиламин, 4-(диметиламино)пиридин или диизопропилэтиламин, и необязательно в присутствии нуклеофильного катализатора, такого как гидроксибензотриазол или 1-гидрокси-7-азабензотриазол. Если R представляет собой С 1, такие реакции могут быть осуществлены в основных условиях, например, в присутствии пиридина, триэтиламина, 4(диметиламино)пиридина или диизопропилэтиламина и необязательно в присутствии нуклеофильного катализатора. В качестве альтернативы, реакция может быть проведена в двухфазной системе, содержащей органический растворитель, предпочтительно этилацетат, и в водном растворителе, предпочтительно в растворе бикарбоната натрия. Если R представляет собой С 1-С 6 алкокси, сложный эфир может быть непосредственно превращен в амид путем нагревания сложного эфира и амина вместе термическим способом. Соединения формулы (XIII) и амины формулы R'2NH либо являются известными соединениями,либо могут быть получены способами, известными специалисту в данной области.ii) Соединения формулы (XI), где R' не является хиральным, таким как изопропил, или R'2 является хиральным, таким как (R,R)-2,5-диметилпирролидин, могут быть получены обработкой соединений формулы (XII), где X представляет собой Br или I, аллильным производным формулы ZC(R4R5)C(R3)CH2, где Z представляет собой бор или производные олова, в присутствии приемлемой системы катализатор/лиганд, часто комплекса палладия(О).iii) В качестве альтернативы, соединения формулы (XI) могут быть получены из соединения формулы (XIV), где R представляет собой Н (соединение формулы (XV, С 1-С 6 алкокси, Cl, F или Br, как описано в i). Схема 2. Вариант А Соединения формулы (X) могут быть получены обработкой соединений формулы (XV) реагентом,применяемым для синтеза ацилхлорида, таким как (1-хлор-2-метилпропенил)диметиламин, с последующей реакцией с основанием, таким как триэтиламин Образование ацилхлорида очень хорошо известно специалисту в данной области и может быть выполнено со многими другими реагентами, такими как тионилхлорид, оксалоилхлорид или трихлорид фосфора. Вторая реакция известна специалисту в данной области как обработка путем внутримолекулярного кетенового циклоприсоединения. Схема 2. Вариант В Соединения формулы (X) может быть получены обработкой соединений формулы (XI) дегидратирующим средством, таким как трифторметансульфоновый ангидрид, в присутствии основания, такого как коллидин, с получением кетенового промежуточного соединения иминия путем внутримолекулярного циклоприсоединения с последующим гидролизом с водой. Применение соединений формулы (XI), гдеR'2 является хиральным, дает хиральные соединения формулы (X), (IX), (VIII), (VII), (VI), (IV), (III), (II),(I). Схема 3 Соединения формулы (IX) могут быть получены обработкой соединений формулы (X) пероксидным производным, таким как пероксид водорода. Эта реакция очень хорошо известна специалистам в данной области под названием окисление Байера-Виллигера для превращения карбонильных соединений в лактоны или сложные эфиры. Схема 4i) Соединения формулы (VII), где W представляет собой кислород, могут быть получены из соединений формулы (IX) через соединение формулы (VIII), где R2 представляет собой водород, и W представляет собой кислород, с помощью гидролиза до кислот с обработкой гидроксидом щелочного металла, таким как гидроксид натрия, в растворителе, таком как вода, в последующим окислением in situ путем обработки оксидантом, таким как хлорид рутения в присутствии метапериодата натрия. Соединения формулы (IX), такие как 2-индануксусная кислота, 1-гидроксилактон, коммерчески доступны или получают, как описано выше в 4).ii) Соединения формулы (VI), где R представляет собой С 1-С 6 алкил, и W представляет собой кислород, могут быть получены из соединений формулы (VII) путем образования сложного эфира с помощью обработки спиртом в присутствии кислоты, например, серная кислота в метаноле или этаноле. В качестве альтернативы, соединения формулы (VI) могут быть получены из коммерческого исходного материала, такого как инданоновые производные, как описано в литературе (см. например Bioorganici) Соединения формулы (III) могут быть получены из соединения формулы (VI), где R не является водородом, например, R представляет собой метил или этил, путем восстановительного аминирования реакцией замещенного амина, такого как метиламин, и восстанавливающего средства, такого как цианоборгидрид натрия, с последующей in situ внутримолекулярной циклизацией.ii) В качестве альтернативы, соединения формулы (IIIa) могут быть получены из соединения формулы (VI), где R представляет собой Н, путем восстановительного аминирования реакцией амина, такого как ацетат аммония, и восстанавливающего средства, такого как цианоборгидрид натрия, с последующейiii) В качестве альтернативы, соединения формулы (IIIa) могут быть получены из соединения формулы (VI) путем образования оксима с использованием соли гидроксиламина и основания, такого как ацетат натрия или пиридин, с последующим восстановлением промежуточного оксима с использованием гидрогенирования с помощью Н 2 и катализатора, такого как Pd/C или ренеевского никелевого катализатора, или другими известными способами, такими как цинк в уксусной кислоте. Соединения формулы (III), где R1 не является водородом, могут быть получены из соединения формулы (IIIa) (где R1 является Н) путем алкилирования реакцией амида с алкилирующим средством,- 10023571 таким как алкилгалид, в присутствии основания, такого как гидрид натрия. Соединения формулы (III), где R1 представляет собой ароматическую или гетероароматическую группу, могут быть получены из соединения формулы (IIIa) (где R1 представляет собой Н) путем реакции амида с ароматическим или гетероароматическим соединением формулы ArX, X является галогеном,в присутствии основания, такого как фосфат калия, и с приемлемым катализатором, часто солью меди (I) и лигандом, таким как диметилэтан-1,2-диамин Соединения формулы (III), где R1 представляет собой карбонильное производное, могут быть получены путем ацилирования соединения формулы (IIIa) с соединением формулы (V), где R представляет собой ОН, в присутствии связывающего реагента, такого как DCC (N,N'-дициклогексилкарбодиимид),EDC (1-этил-3-[3-диметиламинопропил]карбодиимида гидрохлорид) или ВОР-С 1 (бис(2-оксо-3-оксазолидинил)фосфоновый хлорид), в присутствии основания, такого как пиридин, триэтиламин, 4(диметиламино)пиридин или дизопропилэтиламин, и необязательно в присутствии нуклеофильного катализатора, такого как гидроксибензотриазол. Необязательно, если R представляет собой С 1 или ОС(О)С 1-С 6 алкокси, реакция ацилирования может быть осуществлена в основных условиях (например в присутствии пиридина, триэтиламина, 4-(диметиламино)пиридина или диизопропилэтиламина) необязательно в присутствии нуклеофильного катализатора. В качестве альтернативы, реакция может быть проведена в двухфазной системе, содержащей органический растворитель, предпочтительно этилацетат, и водный растворитель, предпочтительно раствор бикарбоната натрия. Необязательно, если R представляет собой C1-С 6 алкокси, амид может быть получен путем нагревания сложного эфира (V) и амида (IIIa) вместе. R' может быть алкилом или алкоксигруппой. Кроме того, соединения формулы (III) могут быть получены в рацемической форме, как описано в Journal of Pharmaceutical Sciences 1973 Vol. 62, No. 8, p 1363, Journal of Organic Chemistry (1994), 59(2), 284, Russian Journal of Organic Chemistry, Vol. 41, No. 3,2005, pp. 361 или в WO84/00962. Соединения формулы (III), где A1, A2, A3 и А 4 независимо представляют собой C-CN, могут быть получены из соединений формулы (III), где A1, A2, A3 и А 4 независимо представляют собой С-Х (X является галогеном), с использованием палладиевого катализатора, такого как палладия трифенилфосфин тетракис, и цианидной соли, такой как цианид цинка. Соединения формулы (III), где A1, A2, A3 и А 4 независимо представляют собой C-NO2, могут быть получены из соединений формулы (III), где A1, A2, A3 и А 4 независимо представляют собой С-Н, путем нитрирования с использованием, например, азотной кислоты, в присутствии серной кислоты. Соединения формулы (III), где A1, A2, A3 и А 4 независимо представляют собой С-аллил или замещенный С-аллил, могут быть получены реакцией соединений формулы (III), где A1, A2, A3 и А 4 независимо представляют собой С-Х (X является уходящей группы, такой как галоген), с производным аллилбора или аллилолова в присутствии приемлемой системы катализатор/лиганд, часто комплекса палладия(0). Эти реакции известны специалистам в данной области как присоединение Стилла и присоединение Сузуки, соответственно, см. например Strategic Applications of Named Reactions in Organic Synthesis Kurti,Laszlo; Czako, Barbara; Editors. USA. (2005), Publisher: Elsevier Academic Press, Burlington, Mass. Page 448(присоединение Сузуки) и р 438 (присоединение Стилла) и цитированные ссылки. Соединения формулы (III), где A1, A2, A3 и А 4 описаны для соединения формулы (I), могут быть получены гидрогенизированием соединения формулы (III), где A1, A2, A3 и А 4 независимо представляют собой С-аллильное производное, с использованием стандартного катализатора гидрогенизации, такого как палладий на угле. Соединения формулы (III), где R4 или R5 не является водородом, могут быть получены из соединения формулы (IIIa) (где R4 и R5 представляют собой Н), путем бензильного окисления с использованием оксиданта, такого как перманганат калия или оксид хрома, с получением кетона (R4=R5=O). Соединение(III), где R4=OH, и R5=H, может быть получено из соответствующего кетона путем восстановления кетона с восстанавливающим средством, таким как боргидрид натрия. В качестве альтернативы, соединение формулы (III), где R4=OAc, и R5=H, может быть получено непосредственным окислением с (диацетоксийод)бензолом в присутствии п-толуолсульфонамида и йода. Соединение (III), где R4=F, и R5=H,может быть получено из соединения (III), где R4=OH, и R5=H, реакцией с фторирующим средством, таким как диэтиламиносеры трифторид или Deoxo-Fluor. Схема 6 Соединения формулы (II) могут быть получены из соединения формулы (III) путем реакции с производным сложного эфира муравьиной кислоты, таким как метилформиат, в присутствии основания, такого как диизопропиламид лития или трет-бутилат калия. В качестве альтернативы, соединения формулы(II) могут быть получены из соединения формулы (IV) путем гидролиза с кислотой, такой как хлороводород. Соединения формулы (IV) могут быть получены из соединений формулы (III) путем реакции с реагентом Бредерека (т-бутоксибис(диметиламино)метан), где R представляет собой метил или аналог. Соединения формулы (II), где A1, A2, A3 и А 4 описаны для соединения формулы (I), могут быть получены гидрогенизацией соединения формулы (II), где A1, A2, A3 и А 4 независимо представляют собой Саллильное производное, с использованием стандартного катализатора гидрогенизации, такого как палладий на угле. Соединения формулы (II), где R1 представляет собой карбонил, могут быть получены из соединения формулы (II), где R1 представляет собой Н, ацилированием с последующим селективным гидролизом диацилированного продукта. Ацилирование может быть выполнено реакцией соединения (II) с соединением формулы R1X, где X представляет собой галоген или ОН, или (R1)2O в основных условиях(например, в присутствии пиридина, триэтиламина, 4-(диметиламино)пиридина или диизопропилэтиламина), необязательно в присутствии нуклеофильного катализатора, такого как 4-(диметиламино) пиридин. Гидролиз может быть выполнен в спиртовом растворителе в присутствии основания, такого как карбонат калия. Соединения формулы (IIb) могут быть получены из соединения формулы (IIa), где R представляет собой алкильную группу, такую как трет-бутил, путем обработки кислотой, такой как трифторуксусная кислота или НС 1. Схема 7 Соединения формулы (I) могут быть получены из соединений формулы (II) путем нуклеофильного замещения 5 Н-фуранонового производного, содержащего замещаемую группу (LG), и LG является замещаемой группой, такой как бромид, в положении 5 в присутствии основания, такого как, например,трет-бутилат калия или основание Хунига. В качестве альтернативы, соединения формулы (I), где R1 представляет собой алкильные производные или бензильные производные, могут быть получены из соединения формулы (Ia), где R1 представляет собой Н, путем алкилирования реакцией амина с алкилирующим средством, таким как алкилгалогенид, бензилгалогенид, необязательно в присутствии основания, такого как гидрид натрия. В качестве альтернативы соединения формулы (I), где карбонильное производное, может быть получено из соединения формулы (Ia), где R1 представляет собой Н, путем ацилирования соединением формулы (V), где R представляет собой ОН, в присутствии связывающего реагента, такого как DCC(N,N'-дициклогексилкарбодиимид), EDC (1-этил-3-[3-диметиламинопропил]карбодиимида гидрохлорид) или ВОР-С 1 (бис(2-оксо-3-оксазолидинил)фосфоновый хлорид), в присутствии основания, такого как пиридин, триэтиламин, 4-(диметиламино)пиридин или диизопропилэтиламин, и необязательно в присутствии нуклеофильного катализатора, такого как гидроксибензотриазол. Необязательно, если R представляет собой С 1 или ОС(О)С 1-С 6 алкокси, реакция ацилирования может быть выполнена в основных условиях (например, в присутствии пиридина, триэтиламина, 4-(диметиламино)пиридина или диизопропилэтиламина), необязательно в присутствии нуклеофильного катализатора. В качестве альтернативы, реакция может быть проведена в двухфазной системе, содержащей органический растворитель, предпочтительно этилацетат, и водный растворитель, предпочтительно раствор бикарбоната натрия. Необязательно, если R представляет собой C1-С 6 алкокси, амид может быть получен нагреванием сложного эфира (V) и амида (Ia) вместе. R' может быть алкилом или алкоксигруппой. Соединения формулы (I), где W представляет собой серу, может быть получен из соединения формулы (I), где W представляет собой кислород, путем нагревания с передающим тиогруппу реагентом,таким как реагент Лавессона или пентасульфида фосфора. Примеры Для анализа соединений применяли следующие способы HPLC-MS. Способ А. Спектр регистрировали на масс-спектрометре ZQ (Waters Corp. Milford, MA, USA), оснащенном источником электрораспыления (ESI; температура источника 100 С; температура десольватации 250 С; напряжение на конусе 30 В; поток газа на конусе 50 л/ч поток газа десольватации 400 л/ч,диапазон масс: 100-900 Да) и Agilent 1100 LC (колонка: Gemini С 18, размер частиц 3 мкм, 110 Ангстрем,303 мм (Phenomenex, Torrance, CA, USA); температура колонки: 60 С; скорость потока 1,7 мл/мин; элюент А: Н 2 О/НСООН 100:0,05; элюент В: MeCN/MeOH/HCO2H 80:20:0,04; градиент: 0 мин 5% В; 2 - 2,8 мин 100% В; 2,9-3 мин 5% В; УФ-детектирование: 200-500 нм, разрешение 2 нм. Поток делили после колонки перед анализом MS. Способ В. Спектр регистрировали на масс-спектрометре ZMD (Micromass, Manchester UK), оснащенном источником электрораспыления (ESI; температура источника 80 С; температура десольватации 200 С; напряжение на конусе 30 В; поток газа десольватации 600 л/час, диапазон масс: 100-900 Да), иAgilent 1100 LC (колонка: Gemini С 18, размер частиц 3 мкм, 110 Ангстрем, 303 мм (Phenomenex, Torrance, CA, USA); температура колонки: 60 С; скорость потока 1,7 мл/мин; элюент А: Н 2 О/НСО 2 Н 100:0,05; элюент В: MeCN/MeOH/HCO2H 80:20:0,04; градиент: 0 мин 5% В; 2 - 2,8 мин 100% В; 2,9-3 мин 5% В; УФ-детектирование: 200-500 нм, разрешение 2 нм. Поток делили после колонки перед анализомMS. Способ С. Спектр регистрировали на масс-спектрометре API2000/Q-TRAP (Applied Biosystems), оснащенном источником электрораспыления (ESI; температура источника 200 С; капилляр 5,5 кВ, (потенциал декластеризации 50 В), (фокусирующий потенциал 400 В, входной потенциал 10 В), ("газовая завеса" 30 фунтов на квадратный дюйм, GS1 40 фунтов на квадратный дюйм, GS2 50 фунтов на квадратный дюйм), диапазон масс: 100-800 Да) и Shimadzu SIL HTC/UFLC (колонка: см. табл. Н); температура колонки: 25 С; скорость потока 1,2 мл/мин; элюент А: 10 мМ NH4OAc в Н 2 О; элюент В: MeCN; градиент: 0,01 мин 10% В; 1,5 мин 30% В; 3-4 мин 90% В; 5 мин 10% В; УФ-детектирование: 220 и 260 нм. Поток делили после колонки перед анализом MS. Способ D. Спектр регистрировали на масс-спектрометре Agilent G195 6 А, оснащенном источником электрораспыления (ESI; температура источника 100 С; температура десольватации 350 С; капилляр 4 кВ; поток газа десольватации 10 л/ч, диапазон масс: 100-1000 Да), и Agilent 1100 LC (колонка: DiscoveryHS-C18, размер частиц 3 мкм, 110 Ангстрем, 504,6 мм, Supelco 569250-U); температура колонки: нет данных; скорость потока 2,20 мл/мин; элюент A: MeCN/TFA 100:0,05; элюент В: Н 2 О/TFA 100:0,05; градиент: 0 мин 10% А, 5 мин 90% А, 6 мин 99% А; УФ-детектирование: 190 - 400 нм, разрешение 2 нм. Способ Е. Спектр регистрировали на масс-спектрометре SQD (Waters Corp. Milford, MA, USA), оснащенном источником электрораспыления (ESI; температура источника 150 С; температура десольватации 250 С; напряжение на конусе 45 В; поток газа десольватации 650 л/час, диапазон масс: 100-900 Да),и Agilent UP LC (колонка: Gemini С 18, 3 мкм, 302 мм (Phenomenex, Torrance, CA, USA); LC (колонка:MeCN/HCOOH 100:0,05; градиент: 0 мин 0% В; 0-1,2 мин 100% В; 1,2-1,50 мин 100% В; УФдетектирование: 210-500 нм, разрешение 2 нм. Поток делили после колонки перед анализом MS. Во всем этом разделе используются следующие аббревиатуры: s = синглет; bs = широкий синглет; d К раствору 2-йодфенилуксусной кислоты (11,0 г, 42,0 ммоль, коммерчески доступной) в дихлорметане (85 мл) добавляли оксалилхлорид (7,11 мл, 84 ммоль), а затем 2 капли диметилформамида. Раствор перемешивали при комнатной температуре в течение 2 ч и растворители удаляли in vacuo. Остаток поглощался дихлорметаном (100 мл) и охлаждался при 0 С. Затем добавляли диизопропиламин (17,6 мл,126 ммоль) и раствор нагревали до комнатной температуры. Растворители удаляли in vacuum. Остаток делили между этилацетатом и водой и экстрагировали этилацетатом. Объединенные органические слои промывали хлороводородом (1 N), солевым раствором, сушили и концентрировали с получением 14,3 г К дегазированному раствору (N,N)-диизопропил-2-йодфенилацетамида (этап 1, 0,235 г, 0,681 ммоль) в толуоле (17 мл) добавляли тетракис(трифенилфосфин)палладий (84 мг, 0,072 ммоль). Полученный в результате раствор нагревали до 110 С в течение 20 ч, а затем охлаждали. Растворители удаляли invacuo, желтое масло разделяли между ацетонитрилом (30 мл) и гексаном (30 мл) и ацетонитрильный слой промывали гексаном (230 мл). Ацетонитрил удаляли in vacuo и остаток очищали флэшхроматографией с элюированием циклогексаном и этилацетатом (9/1-4/1) с получением (N,N)диизопропил-2-аллилфенилацетамида (бесцветное масло, 250 мг, 67%). C17H25NO; MW: 259,39; LCMS(способ A) RT 1,97 мин; ES: 260 (100%, MH+); IR 2965, 1634, 1466,1439, 1369, 1335 см-1; 1H NMR (400 МГц, CDCl3)7,09 - 7,23 (4 H, m), 5,95 (1 H, m), 5,07 (1 H, dd), 4,99 (1 H, dd), 3,85 (1 H, m), 3,66 (2 H, s),3,38 - 3,50 (1 H, m), 3,36 (2 H, d), 1,45 (7 H, d), 1,08 (6 H, d) ppm. Альтернатива этапу 2. К дегазированному раствору (N,N-диизопропил-2-йодфенилацетамида (этап 1,0,50 г, 1,44 ммоль) в тетрагидрофуране (10 мл) добавляли тетракис(трифенилфосфин)палладий (39 мг, 0,034 ммоль), фторид цезия (0,207 мг, 1,40 ммоль) и пинакол аллилборонат (0,229 мг, 1,361 ммоль). Полученный в результате раствор нагревали до кипения в течение 4 ч и добавляли воду (20 мл). Водный слой экстрагировали диэтиловым эфиром и объединенные органические слои промывали солевым раствором, сушили и концентрировали. Остаток очищали флэш-хроматографией с элюированием циклогексаном и этилацетатом (9/14/1) с получением (N,N)-диизопропил-2-аллилфенилацетамида (бесцветное масло, 135 мг, 76%). Аналитические данные были идентичны предшествующей процедуре присоединения. Пример I2. 2-(2-Аллил-фенил)-1-2R,5R)-2,5-диметил-пирролидин-1-ил)этанон. Этап 1. Метил-2-аллилфенилацетат К раствору метил-2-йодфенилацетата (1,00 г, 3,62 ммоль, полученному из соответствующей кислоты согласно литературному источнику Tetrahedron 63, 2007, 9979) в толуоле (45 мл) добавляли тетракис(трифенилфосфин)палладий (209 мг, 0,181 ммоль) и аллилтрибутилстаннан (1,35 мл, 4,34 ммоль). Полученный в результате раствор нагревали до 110 С в течение 20 ч, а затем охлаждали. Растворители удаляли in vacuo. Желтое масло разделяли между ацетонитрилом (30 мл) и гексаном (30 мл) и ацетонитрильный слой промывали гексаном (230 мл). Ацетонитрил удаляли in vacuo и остаток очищали флэшхроматографией с элюированием циклогексаном и этилацетатом (15/1) с получением метил-2 аллилфенилацетата (бесцветное масло, 446 мг, 65%). C12H14O2; MW: 190,24; LCMS (способ A) RT 1,74 мин; ES: 191 (100%, МН+); IR 2951, 1734 см-1; 1H NMR (400 МГц, CDC13)7,14 - 7,41 (4 Н, m), 5,99 (1 Н,m), 5,12 (1 Н, m), 5,03 (1 Н, m), 3,73 (3 Н, s), 3,72 (2 Н, s), 3,47 (2 Н, dt) ppm. Этап 2. 2-Аллилфенилуксусная кислота К раствору метил-2-аллилфенилацетата (этап 1, 0,400 мг, 2,10 ммоль) в тетрагидрофуране (10 мл) добавляли гидроксид лития (0,097 г, 2,31 ммоль) в воде (10 мл). Раствор перемешивали при комнатной температуре в течение 3 ч и концентрировали in vacuo. Добавляли воду (40 мл) и доводили рН до 1. Раствор экстрагировали дихлорметаном и объединенные органические слои сушили и концентрировали с получением 2-аллилфенилуксусной кислоты (желтое масло, 363 мг, 98%); С 11 Н 12 О 2; MW: 176,22; ES-175; бавляли 3-[3-(диметиламино)пропил]-1-этилкарбодиимида гидрохлорид (EDCI, 0,075 ммоль, 0,397 ммоль), 1-гидрокси-7-азабензотриазол (HOAt, 0,054 мг, 0,397 ммоль), (2R,5R)-диметилпирролидин (0,034 мл, 0,298 ммоль), а затем триэтиламин (0,118 мл, 0,851 ммоль). Раствор перемешивали в течение 18 ч и добавляли воду (20 мл). Водный слой экстрагировали диэтиловым эфиром, и объединенные органические слои промывали солевым раствором, сушили и концентрировали. Остаток очищали флэшхроматографией с элюированием циклогексаном и этилацетатом (9/1-4/1) с получением 2-(2-аллилфенил)-1-2R,5R)-2,5-диметил-пирролидин-1-ил)-этанона (бесцветное масло, 73 мг, 99%). C17H23NO; К раствору (N,N)-диизопропил-2-аллилфенилацетамида (пример I1, 0,100 г, 0,386 ммоль) в дихлорметане (10 мл) добавляли коллидин (0,061 мл, 0,463 ммоль), а затем трифторметансульфоновый ангидрид (0,072 мл, 0,424 ммоль). Раствор перемешивали при комнатной температуре в течение 24 ч. Растворители удаляли in vacuo, остаток поглощался тетрахлоридом углерода (4 мл) и водой (4 мл), а двухфазная смесь перемешивали при 70 С в течение 6 ч. Водный слой экстрагировали дихлорметаном и объединенные органические слои сушили и концентрировали. Остаток очищали флэш-хроматографией с элюированием циклогексаном и этилацетатом (20/1) с получением 1,2 а,7,7 а-тетрагидро-2 Н-циклобут[а]инден 2-она (бесцветное масло, 48 мг, 74%); MW: 158,22; LCMS (способ A) RT 1,51 мин; ES: 159 (20%, МН+),143 (100%); IR: 2921 1777 см-1; 1H NMR (400 МГц, CDC13)7,29 - 7,36 (2 H, m), 7,23 - 7,29 (2 Н, m), 4,65(25 мл) при 0 С добавляли 1-хлор-N,N,2-триметил-1-пропениламин (0,078 мл, 0,593 ммоль). Раствор перемешивали в течение 1 часа, а затем нагревали до кипячения. Затем раствор триэтиламина (0,082 мл,0,593 ммоль) в дихлорметане (4 мл) медленно за два часа добавляли к раствору соляной кислоты при нагревании и до кипячения. Реакционную смесь перемешивали еще 2 ч, а затем охлаждали. Растворители удаляли in vacuo и остаток очищали флэш-хроматографией с элюированием циклогексаном и этилацетатом (20/1) с получением 1,2 а,7,7 а-тетрагидро-2 Н-циклобут[а]инден-2-она (бесцветное масло, 56 мг, 66%). Аналитические данные были идентичны продукту, полученному способом А. Пример I5. Производное тетрагидроиндено[1,2-b]фуран-2-она. Пример 1. рац-Тетрагидроиндено[1,2-b]фуран-2-он Раствор 1,2 а,7,7 а-тетрагидро-2 Н-циклобут[а]инден-2-она (пример 14, 0,377 мг, 2,383 ммоль) в уксусной кислоте (5 мл) и воде (0,5 мл) охлаждали при 0 С и добавляли пероксид водорода (30% в воде,0,810 мл, 7,14 ммоль). Раствор перемешивали в течение 3 ч при 0 С и реакционную смесь выливали в насыщенный раствор гидрокарбоната натрия. Раствор экстрагировали этилацетатом и объединенные органические слои промывали солевым раствором, сушили и концентрировали. Остаток очищали флэшхроматографией с элюированием циклогексаном и этилацетатом (4/1) с получением рац-тетрагидроиндено[1,2-b]фуран-2-она (бесцветное масло, 383 мг, 92%), которое затвердевало при охлаждении (данные совпадают с литературными данными, CAS 4471-33-4). C11H10O2; MW: 174,20; LCMS (способ A) RT 1,32 мин; ES: 175 (60%, MH+), 129 (100%); IR: 1769 см-1; 1H NMR (400 МГц, CDC13)7,50 (1 Н, d), 7,25 7,39 (4 Н, m), 5,91 (1 Н, d), 3,28 - 3,45 (2 Н, m), 2,86 - 2,97 (2 Н, m), 2,41 (1 Н, dd) ppm. Пример 2. 3 а(R),8b(S)-Тетрагидроиндено[1,2-b]фуран-2-он. Хиральный лактон получали из 2-(2-аллил-фенил)-1-2R,5R)-2,5-диметил-пирролидин-1-ил)- 15023571 этанона (пример I3) с применением способа А (пример I4) для образования циклобутанона и окисления Байера-Виллигера, как описано выше. Энантиомерный избыток определяли анализом хиральной HPLC с использованием колонки CHIRALPAK IC (целлюлоза трис(3,5-дихлорофенилкарбамат), фиксированная на 5 мкм силикагеля, 0,4625 см, DAD длина волны (нм): 270); градиент растворителя: гептан/2 пропанол/0,1% DEA 97/03/0,1; скорость потока 1 мл/мин; время удержания энантиомера 1: 32 мин (96%),энантиомера 2: 38 мин (4%); ее=92%; [D]D= -107(литературный источник: J. Agric. FoodChem. 1997,2278-2283). Пример I6. Производные метилового сложного эфира (1-оксо-индан-2-ил)-уксусной кислоты. Пример I6(а). Метиловый сложный эфир (1-оксо-индан-2-ил)-уксусной кислоты (H1). Этап 1. (1-оксоиндан-2-ил)уксусная кислота К суспензии тетрагидроиндено[1,2-b]фуран-2-она (пример I5 или коммерчески доступного, 0,200 г,1,15 ммоль) в воде (20 мл) добавляли гидроксид натрия (0,051 г, 1,26 ммоль) и раствор нагревали до 100 С в течение одного часа. Раствор охлаждали до комнатной температуры, и по каплям добавляли гидрат хлорида рутения(III) (0,048 г, 0,230 ммоль) с последующим перйодатом натрия (0,368 мг, 1,72 ммоль) в воде (5 мл). Раствор перемешивали при комнатной температуре в течение 1 ч и добавляли изопропанол(0,2 мл). рН окисляли до 1 с применением 2 М НС 1 и реакцию фильтровали. Фильтрат экстрагировали дихлорметаном (330 мл) и объединенные органические слои промывали водой (30 мл), высушивали и концентрировали с получением (1-оксо-индан-2-ил)-уксусной кислоты (бледно-желтое твердое вещество, 170 мг, 78%). С 11 Н 10 О 3; MW: 190,2. LCMS (способ A) RT 1,16 мин; ES-189 (35%, МН+), 175 (70%), 145- 3,51 (1 Н, m), 2,83 - 3,02 (3 Н, m), 2,70 (1 Н, m) ppm. Этап 2. Метиловый сложный эфир (1-оксо-индан-2-ил)-уксусной кислоты (H1) К раствору (1-оксо-индан-2-ил)уксусной кислоты (Этап 1, 2,00 г) в метаноле (10 мл) при 0 С добавляли серную кислоту (2 мл). Раствор перемешивали в течение 2 ч и затем разбавляли водой (50 мл) и экстрагировали этилацетатом. Объединенные органические слои промывали насыщенным гидрокарбонатом натрия, высушивали и концентрировали с получением метилового сложного эфира (1-оксо-индан-2-ил)уксусной кислоты (бледно-желтое масло, 2,15 г, согласно количественному анализу). C12H12O3; MW: 204,23; LCMS (способ A) RT 1,40 мин; ES 227 (25%, MNa+), 205 (25%, МН+), 173 (100%); IR: 2952, 1734,1710, 1608,1436 см-1; 1H NMR (400 МГц, CDC13) 7,78 (1 Н, d), 7,61 (1 Н, t), 7,47 (1 Н, d), 7,39 (1 Н, t), 3,70(3 Н, s), 3,47 (1 Н, dd), 2,95 - 3,08 (2 H, m), 2,89 (1 Н, dd), 2,63 (1 Н, dt) ppm. Соединение применяли без дальнейшей очистки на следующем этапе Пример I6(b). Метил 2-(5-фтор-1-оксо-индан-2-ил)ацетат (Н 2). Соединения в данном примере синтезировали известным способом, описанным в Journal of Agricultural and Food Chemistry (1997), 45(6), 2278-2283 и Journal of Agricultural and Food Chemistry (1992), 40(7),1230-5. Этап 1. 5-Фтор-1-оксо-индан-2-карбоксилат"для HPLC" (дважды). Добавляли сухой бензол (4,2 мл) и диэтилкарбонат (1,57 г, 1,6 мл, 13,3 ммоль) и полученный в результате раствор нагревали в колбе с обратным холодильником в течение одного часа(реакционная смесь стала зеленой). К раствору, который кипятили в колбе с обратным холодильником,медленно в течение 45 мин добавляли 5-фтор-индан-1-он (1,0 г, 6,66 ммоль) в бензоле (2,7 мл). Полученную в результате реакционную смесь кипятили в колбе с обратным холодильником в течение дополнительного одного часа. После окончания реакции добавляли уксусная кислоту/воду (50/50, приблизительно 20 мл) до тех пор, пока все твердое вещество не растворилось (рН-5). Водный слой экстрагировали три раза бензолом. Объединенную органическую часть промывали водой, насыщенным солевым раствором, высушивали над сульфат натрия и выпаривали до сухости. Неочищенный продукт очищали колоночной хроматографией с использованием этил ацетата / гексана (5%) с выходом необходимого продукта Смесь этил 5-фтор-1-оксо-индан-2-карбоксилата (1,4 г, 6,3 ммоль), гидрида натрия (278 мг, 6,9 ммоль, 60 % в минеральном масле) и DMF (сухой, 2,5 мл) нагревали до 65 С в течение одного часа. Добавляли раствор сложного бромэтилового эфира (1,15 г, 0,8 мл, 6,9 ммоль) в сухом DMF (4,0 мл) при такой же температуре и нагревание продолжили в течение дополнительных 3 часов. После окончания реакции реакционную массу выпаривали до сухости, добавляли 5 мл воды и суспензию экстрагировали этилацетатом (25 мл 3). Объединенный органический слой промывали солевым раствором, высушивали над сульфатом натрия, выпаривали и подвергали колоночной хроматографии с применением этил ацетата/гексана (15%) с выходом необходимого продукта (1,3 г, 72%). Этап 3. (5-Фтор-1-оксо-индан-2-ил)-уксусная кислота Этил 2-(2-этокси-2-оксо-этил)-5-фтор-1-оксо-индан-2-карбоксилат (500 мг, 1,6 ммоль) суспендировали в 1,4 мл смеси 6N НС 1: уксусной кислоты (1:1) и нагревали до кипения в течение 3 ч. Реакцию контролировали с помощью TLC. Реакционную массу выпаривали до сухости, добавляли 10 мл вода и экстрагировали этилацетатом (40 мл 3). Органический слой промывали насыщенным солевым раствором,высушивали над сульфатом натрия. Неочищенный продукт промывали гексаном с получением необходимого продукта (280 мг, 82 %). Этап 4. Метил-2-(5-фтор-1-оксо-индан-2-ил)ацетат Н 2(5-фтор-1-оксо-индан-2-ил)-уксусную кислоту (280 мг, 1,3 ммоль) брали в 10 мл метанола (квалификации "для HPLC"), охлаждали до 0 С, и по каплям в раствор добавляли 0,5 мл концентрированной серной кислоты, и нагревали до кипения в течение 5 ч. Реакцию контролировали с помощью TLC. После окончания реакционную массу выпаривали, добавляли 10 мл воды и экстрагировали этилацетатом (25 мл 3). Этилацетатовую часть промывали насыщенным водным бикарбонатом натрия, солевым раствором,высушивали (сульфат натрия) и концентрировали при пониженном давлении. Неочищенный продукт очищали колоночной хроматографией с применением ацетона / гексана (8 %) с выходом необходимого продукта Н 2 (230 мг, 77 %). Настоящий способ применяли для получения соединение с Н 2 по Н 8 (табл. Н). Пример I6(с). Метиловый сложный эфир (1-оксо-4-бром-индан-2-ил)уксусной кислоты Н 9 К раствору 4-броминданона (15,8 г, 75 ммоль) при -78 С добавляли LiHMDS (1MB THF, 90 мл). Слегка коричневому раствору позволяли нагреться до 0 С, и опять охлаждали до -75 С и добавляли по каплям этил-2-бромацетат (9,1 мл, 82 ммоль). Смеси позволяли нагреться на протяжении ночи (с -75 С до -20 С в течение 12 ч). Смесь гасили насыщенным хлоридом аммония и экстрагировали этилацетатом. Флеш-хроматография дает 19,5 г титульного соединения в смеси с начальным инданон-этил-2-[4-бром-2(2-этокси-2-оксо-этил)-1-оксо-индан-2-ил]ацетатом Н 9 и который применяли без дальнейшей очистки на следующем этапе (чистота, 60 % необходимого продукта). Настоящий способ применяли для получения соединений Н 9 и Н 10 (табл. Н). Пример I7. 3,3 а,4,8b-Тетрагидро-1 Н-индено[1,2-b]пиррол-2-он. Пример I7(а). 3,3 а,4,8b-Тетрагидро-1H-индено[1,2-b]пиррол-2-он G1 Способ А. Раствор ацетата аммония (3,77 г, 48,9 ммоль) одновременно выпаривали в безводном метаноле. Затем метиловый сложный эфир (1-оксо-индан-2-ил)-уксусной кислоты H1 (1,00 г, 4,89 ммоль) в метаноле (40 мл) добавляли с последующими молекулярными ситами (4,9 г). Раствор перемешивали в течение 30 мин и добавляли цианоборгидрид натрия (0,92 г, 14,9 ммоль). Суспензию кипятили в колбе с обратным холодильником в течение 40 ч. Раствор фильтровали через целит. Добавляли насыщенный раствор гидрокарбоната натрия и раствор экстрагировали этилацетатом (350 мл). Объединенные органические слои промывали хлороводородом (1N), солевым раствором, высушивали и концентрировали. К раствору метилового сложного эфира 1-оксо-индан-2-ил-уксусной кислоты H1 (8,55 г, 41,89 ммоль) в метаноле (100 мл) добавляли ацетат натрия (5,15 г, 62,8 ммоль) и гидрохлорид гидроксиламина(4,36 г, 62,8 ммоль). Раствор нагревали до 65 С в течение 12 ч, разбавляли водой, экстрагировали этилацетатом, промывали солевым раствором, высушивали и концентрировали с получением соответствующего оксима (8,00 г, 87%). Остаток поглощался уксусной кислотой (70 мл) и нагревался до 60 С. Затем,цинковую пыль (23,8 г, 364 ммоль) добавляли порциями, поддерживая температуру ниже 80 С. Раствор перемешивали в течение 30 мин при 60 С и затем фильтровали. Воду добавляли к фильтрату, и раствор нейтрализовали твердым карбонатом калия пока рН не достигло 7. Раствор экстрагировали дихлорметаном, промывали водной НСl (1N), высушивали и концентрировали с получением лактама G1 (3,9 г, 61%) в виде белого твердого вещества. Данные тождественны способу А. Настоящий способ применяли для получения соединений с Gl no G10 (таблица G). Пример I7(b). 7-Нитро-3,3a,4,8b-тетрагидро-1 Н-индено[1,2-b]пиррол-2-он Серную кислоту (72 мл) добавляли к охлажденной смеси азотной кислоты (63,5 ммоль, 4,4 мл) и воды (11,3 мл), и смесь добавляли по каплям к холодной (2 - 8 С) суспензии 3,3 а,4,8b-тетрагидро-1 Ниндено[1,2-b]пиррол-2-она (10 г, 57,7 ммоль) в нитрометане (100 мл). Смесь перемешивали 1,5 ч при 28 С после завершения добавления, и выливали в смесь льда и воды (1 л). Белую суспензию перемешивали в течение одного часа, фильтровали и промывали водой. Белое твердое вещество суспендировали в 1 л этилацетата, высушивали и концентрировали под вакуумом. Получали 7-нитро-3,3 а,4,8b-тетрагидро 1 Н-индено[1,2-b]пиррол-2-он (9,2 г, 73%). 1 Н NMR (400 МГц, CD3OD)8,16-8,08 (2 Н, m), 7,39 (1 Н, d),6,89 (1 Н, brs), 5,09 (1 Н, d), 3,49 - 3,37 (2 Н, m), 2,93 (1 Н, d), 2,78 (1 Н, dd), 2,26 (1 Н, dd) ppm. Пример I8. Производные 2-оксо-3,3 а,4,8b-тетрагидро-2 Н-индено[1,2-b] пиррола. Пример I8(а). 2-Оксо-3,3 а,4,8b-тетрагидро-2 Н-индено[1,2-b]пиррол-1-карбоновой кислоты третбутиловый сложный эфир F1 К суспензии 3,3 а,4,8b-тетрагидро-1 Н-индено[1,2-b]пиррол-2-она G1 (0,100 г, 0,578 ммоль) в безводном ацетонитриле (10 мл) добавляли диметиламинопиридин (0,007 мг, 0,057 ммоль), триэтиламин (0,161 мл, 1,15 ммоль) и ди-t-бутил бикарбонат (245 ммоль, 1,15 ммоль в 1 мл дихлорметана). Раствор перемешивали при комнатной температуре в течение 6 ч. Раствор разбавляли этилацетатом и промывали хлороводородом (1 М) и солевым раствором. Объединенные органические слои высушивали и концентрировали. Остаток очищали флеш-хроматографией с элюированием этилацетатом и циклогексаном (7/3) с получением масла с большим содержанием смолистых веществ F1 (160 мг, согласно количественному анализу). C16H19NO3; MW: 273,33; LCMS (способ В) RT 1,74 мин; ES: 296 (MNa+), 174 (МН+-Вос), 129; IR: 2978, 1782, 1747, 1709 см-1; 1H NMR (400 МГц, CDC13)7,57 (1 Н, d), 7,19 - 7,34 (3 Н, m), 5,62 (1 Н, d),3,08 - 3,26 (2 Н, m), 2,84 (1 Н, d), 2,78 (1 Н, dd), 2,29 (1 Н, dd), l,63 (9H,s) ppm. Настоящий способ применяли для получения соединений с F1 no F10 (табл. F). Пример I8(b). трет-Бутил-5-циано-2-оксо-3,3 а,4,8b-тетрагидроиндено[1,2-b]пиррол-1-карбоксилат(1,5 г, 4,25 ммоль) в DMF (30 мл) добавляли Pd(PPh3)4 (751 мг, 0,63 ммоль) и Zn(CN)2 (1,00 г, 8,51 ммоль). Раствор перемешивали при 100 С в течение 16 ч. После охлаждения добавляли воду и раствор экстрагировали этилацетатом. Органический слой промывали солевым раствором три раза, высушивали и концентрировали. Неочищенное сырье растворяли в 50 мл ацетонитрила в который добавляли Вос 2 О(5,5 г, 25,2 ммоль), NEt3 (6 мл) и DMAP (520 мг, 4,26 ммоль). Полученную в результате смесь перемешивали в течение 16 ч. Темно-коричневый раствор концентрировали под вакуумом, и остаток растворяли в этилацетате. Органический слой промывали дважды НС 1 (1N), солевой раствор, высушивали и концентрировали под вакуумом. Остаток очищали флеш-хроматографией с элюированием этилацетатом и циклогексаном (с 10/90 до 30/70 в течение 30 мин) с получением 880 мг необходимого соединения F11 в виде бежевой смолы (69%). LCMS (способ Е): 0,87 мин; ES+: 619 [2M+Na]. Настоящий способ применяли для получения соединений F12 из F10 и F11 из F9 (табл. F). Пример I8(с). трет-Бутил-8-аллил-2-оксо-3,3 а,4,8b-тетрагидроиндено[1,2-b]пиррол-1-карбоксилат Раствор трет-бутил-8-бром-2-оксо-3,3 а,4,8b-тетрагидроиндено[1,2-b]пиррол-1-карбоксилата (пример F10, 700 мг), Pd(PPh3)4 (280 мг, 0,12 эквивалента), аллилтрибутилстаннат (1,65 г, 2,5 эквивалента) в толуол (17 мл) дегазировали и перемешивали при кипячении с обратным холодильником на протяжении ночи. Растворитель удаляли под вакуумом. Остаток поглощался ацетонитрилом (40 мл) и промывался дважды n-гексаном. Ацетонитрил удаляли под вакуумом и остаток очищали флеш-хроматографией с элюированием этилацетатом и циклогексаном (с 1% до 25%) с получением 350 мг необходимых продуктов (смесь аллила и изомера) F14: LCMS (способ Е), RT: 1,06 мин, [ES+ [377, M+CH3CN+Na]. Настоящий способ применяли для получения соединений F13 из F9 и F14 из F10 (табл. F). Пример I8(d). трет-Бутил-8-пропил-2-оксо-3,3 а,4,8b-тетрагидроиндено[1,2-b] пиррол-1-карбоксилат Колбу, промытую аргоном, наполняли 2-оксо-3,3 а,4,8b-тетрагидро-2 Н-4-аллил-индено[1,2-b] пиррол-1-карбоновой кислоты трет-бутиловым сложным эфиром F14 и изомером (200 мг, 0,63 ммоль), этилацетатом (4 мл) и Pd/C (10%, 30 мг). Черную суспензию перемешивали в атмосфере Н 2 при комнатной температуре в течение 72 ч. Суспензию затем фильтровали на целитовой подушке, и фильтрат концентрировали под вакуумом, очищенный флеш-хроматографией с градиентом этилацетатом в циклогексане от 1% до 10%, с получением необходимого соединения F15 в виде бесцветного масла (120 мг, 60%). К раствору тетрагидро-1 Н-индено[1,2-b]пиррол-2-она (1,00 г, 5,77 ммоль) в воде (3 мл) добавляли оксид меди (I) (167 мг), р-хлорйодбензол (1,38 г, 5,77 ммоль), тетрабутиламмония бромид (0,372 г, 1,15 ммоль) и фосфат калия (2,45 г, 11,5 ммоль). Суспензию энергично перемешивали при 130 С на протяжении ночи. Смесь охлаждали и разбавляли дихлорметаном. Твердое вещество отфильтровывали и органический слой высушивали и концентрировали. Остаток очищали флеш-хроматографией с градиентом этилацетата в циклогексане от 1% до 60%, с получением необходимого продукта F16 (600 мг, 39%). LCMS(способ А) 1,72 мин; ES+: 284 (М+Н+). Настоящий способ применяли для получения соединения F16-F19. Пример I8(f). 6-(2-Оксо-3,3 а,4,8b-тетрагидроиндено[1,2-b]пиррол-1-ил)пиридин-3-карбонитрил F20 К суспензии 3,3 а,4,8b-тетрагидро-1 Н-индено[1,2-b]пиррол-2-она (1 г, 5,77 ммоль) в толуоле (15 мл) добавляли гидрид натрия (0,254 г, 6,35 ммоль) при 0 С. Порцию нагревали до комнатной температуры и добавляли 2-хлор-5-цианопиридин (0,824 г, 5,77 ммоль). Порцию перемешивали при 95 С в течение 2 ч. После охлаждения порцию добавляли к ледяной воде и экстрагировали этилацетатом (2). Объединенные органические фазы концентрировали и остаток очищали колоночной хроматографией (гексан / этилацетат 7/3) с получением 6-(2-оксо-3,3 а,4,8b-тетрагидроиндено[1,2-b]пиррол-1-ил)пиридин-3- 19023571 карбонитрила F20 (1,00 г, 63%). LCMS (способ А) 1,68 мин; ES+: 276 (М+Н+). Пример I8(g). 3aR,8bS)-1-тиазол-2-ил-3,3 а,4,8b-тетрагидроиндено[1,2-b]пиррол-2-он F21 К раствору (3aR,8bS)-3,3 а,4,8b-тетрагидро-1 Н-индено[1,2-b]пиррол-2-она (0,500 г, 2,89 ммоль) в диоксане (6 мл) добавляли фосфат калия (1,26 г, 5,77 ммоль), йодид меди (0,055 г, 0,289 ммоль), 2 бромтоазол (0,473 г, 2,89 ммоль) и N,N-диметилэтан-1,2-диамин (0,0254 г, 0,288 ммоль). Желтый раствор нагревали до кипения на протяжении ночи. Суспензию затем разбавляли этилацетатом и фильтровали. Растворители удаляли под вакуумом и остаток очищали флеш-хроматографией с элюированием циклогексаном и этилацетатом (0-50%) с получением титульного соединения в виде бесцветного масла,3aR,8bS)-1-тиазол-2-ил-3,3 а,4,8b-тетрагидроиндено[1,2-b]пиррол-2-она F21 (0,390 г, 1,52 ммоль, 52,7% выход). LCMS (способ А) 1,66 мин; ES+: 257 (М+Н+). Пример I8(h). (3aR,8bS)-1-Аллил-3,3 а,4,8b-тетрагидроиндено[1,2-b]пиррол-2-он F22DMF (10 мл) добавляли при 0 С гидрид натрия (60% в минеральном масле, 0,254 г, 6,35 ммоль). Раствор перемешивали в течение 1 ч при 0 С и добавляли аллил бромид (1,41 г, 2 эквивалента, 1,01 мл, 11,5 ммоль). Раствор перемешивали в течение 18 ч при комнатной температуре и добавляли воду. Смесь экстрагировали этилацетатом и промывали водой и солевым раствором. Растворители удаляли под вакуумом и остаток очищали флеш-хроматографией с элюированием циклогексаном и этилацетатом (50:50), с получением (3aR,8bS)-l-аллил-3,3a,4,8b-тетрагидроиндено[1,2-b]пиррол-2-она F22 (0,910 г, 0,910 г, 4,27 ммоль, выход 73,9%) в виде бесцветного масла. LCMS (способ А) 1,51 мин; ES+: 214 (М+Н+). Соединения с F23 по F25 получали согласно настоящему способу с использованием 4-фторбензилхлорида, 2 бромацетонитрила, этилхлорформиата в качестве алкилирующего реагента. Пример I8(i). трет-Бутил (3aR,8bS)-2,4-диоксо-3 а,8b-дигидро-3 Н-индено[1,2-b]пиррол-1-карбоксилат F26 К раствору 2-оксо-3,3 а,4,8b-тетрагидро-2 Н-индено[1,2-b]пиррол-1-карбоновой кислоты третбутилового сложного эфира F1 (5,00 г, 18,2 ммоль) в ацетоне (90 мл) и воде (20 мл) добавляли KMnO4(14,7 г, 93 ммоль). Раствор перемешивали в течение 48 ч при комнатной температуре и фильтровали. Раствор концентрировали до половины объема и добавляли раствор тиосульфата натрия (2%, 50 мл). Раствор экстрагировали этилацетатом, промывали солевым раствором, высушивали и концентрировали. Остаток очищали флеш-хроматографией с элюированием циклогексаном и этилацетатом (7/3) с получением необходимого продукта F26 (1,6 г, 30%). LCMS (способ Е): 0,81 мин; ES+: 597 (2M+Na+). Пример I8(j). трет-бутил-(3aR,4R,8bS)-4-гидрокси-2-оксо-3,3 а,4,8b-тетрагидроиндено[1,2-b]пиррол 1-карбоксилат F27F 26 (1,60 г, 5,56 ммоль) в этаноле (20 мл) и THF (20 мл) добавляли при 0 С NaBH4 (0,316 г, 8,15 ммоль). Раствор перемешивали в течение 2 ч при 0 С. 1 М НСl осторожно добавляли и раствор концентрировали под вакуумом. Остаток разделяли между этилацетатом и водой и экстрагировали этилацетатом. Объединенные органические слои промывали солевым раствором, высушивали и концентрировали. Остаток очищали флеш-хроматографией (2/1 циклогексана/этилацетата) с получением трет-бутил-(3aR,4R,8bS)-4 гидрокси-2-оксо-3,3 а,4,8b-тетрагидроиндено[1,2-b]пиррол-1-карбоксилата F27 (800 мг, 50%). LCMS К раствору трет-бутил-(3aR,4R,8bS)-4-гидрокси-2-оксо-3,3 а,4,8b-тетрагидроиндено[1,2-b]пиррол-1 карбоксилата (0,200 г, 0,691 ммоль) в дихлорметане (1 эквивалент, 3 мл, 0,69 ммоль) добавляли при 0 С трифторид диэтиламиносеры (0,913 мл, 6,91 ммоль). Раствор перемешивали при 0 С в течение 30 мин Реакционную смесь осторожно гасили насыщенным NaHCO3 и экстрагировали дихлорметаном. Органический слой высушивали и концентрировали. Остаток очищали флеш-хроматографией (0-80% этилацетата в циклогексане) с получением необходимого продукта, F28 (0,150 г, 74%). LCMS (способ А): 1,65 мин; ES+: 605 (2M+Na+). Пример I8(1). трет-Бутил-4-ацетокси-2-оксо-3,3 а,4,8b-тетрагидроиндено[1,2-b]пиррол-1-карбоксилат F29 К раствору трет-бутил-2-оксо-3,3 а,4,8b-тетрагидроиндено[1,2-b]пиррол-1-карбоксилата (1,28 г, 4,68 ммоль) в дихлорметане (9 мл) добавляли р-толуолсульфонамид (0,164 г, 0,937 ммоль), (диацетоксииодо)бензол (3,85 г, 11,7 ммоль) и йод (0,238 г, 0,937 ммоль). Раствор нагревали при 60 С в аргоне в течение 2 ч. Раствор охлаждали до комнатной температуры и добавляли насыщенный сульфат натрия (2 мл). Добавляли воду и раствор экстрагировали дихлорметаном (350 мл), высушивали и концентрировали. Остаток очищали флеш-хроматографией (от 10 до 90% этилацетата в циклогексане) с получением трет-бутил-4-ацетокси-2-оксо-3,3 а,4,8b-тетрагидроиндено[1,2b]пиррол-1-карбоксилата F29 (0,900 г, 58%) в виде смеси диастереоизомеров (2:1 в ползу "транс"). Изомеры могли не разделять. LCMS (способ Е): 0,90 мин; ES+: 685 (2M+Na+). Пример I9. Синтез 3-[1-диметиламино-мет-(Z)-илиден]-2-оксо-3,3 а,4,8b-тетрагидро-2 Н-индено[1,2b]пиррол-1-карбоновой кислоты трет-бутилового сложного эфира E1 Раствор 2-оксо-3,3 а,4,8b-тетрагидро-2 Н-индено[1,2-b]пиррол-1-карбоновой кислоты трет-бутилового сложного эфира F1 (160 мг, 0,586 ммоль) в трет-бутоксибис(диметиламино)метан нагревали при 75 С в течение 4 ч. Раствор разбавляли этилацетатом и промывали водой, солевым раствором, высушивали и концентрировали с получением 3-[1-диметиламино-мет-(Z)-илиден]-2-оксо-3,3 а,4,8b-тетрагидро 2 Н-индено[1,2-b]пиррол-1-карбоновой кислоты трет-бутилового сложного эфира, Е 1 (бесцветное твердое вещество, 190 мг, 98%). C19H24N2O3; MW: 328,41; LCMS (способ A) RT 1,78 мин; ES: 329 (МН+), 273; 1 Н(6 Н, s), 3,06 (1 Н, dd), 1,60(9 Н, s)ppm. Настоящий способ применяли для получения соединений с Е 1 по Е 15 (табл. Е). Пример I10. Синтез производных 3-[1-гидрокси-мет-(Z)-илиден]-2-оксо-3,3 а,4,8b-тетрагидро-2 Ниндено[1,2-b] пиррола. Пример I10(а). 3-[1-Гидрокси-мет-(Z)-илиден]-2-оксо-3,3 а,4,8b-тетрагидро-2 Н-индено[1,2-b]пиррол 1-карбоновой кислоты трет-бутиловый сложный эфир D1(2 мл) добавляли хлороводород (1 М, 0,87 мл). Раствор перемешивали при комнатной температуре в течение 3 ч. Раствор разбавляли этилацетатом и промывали водой, солевым раствором, высушивали и концентрировали. Остаток растирали в порошок с этилацетатом с получением 3-[1-гидрокси-мет-(Z)илиден]-2-оксо-3,3 а,4,8b-тетрагидро-2 Н-индено[1,2-b]пиррол-1-карбоновой кислоты трет-бутилового сложного эфира D1 (белый порошок, 140 мг, 80%). C17H19NO4; MW: 301,35; LCMS (способ A) RT 1,72 мин; ES: 302 (МН+), 246; 1H NMR (400 МГц, DMSO-d6)11,04 (1 Н, s), 7,54 (1 Н, d), 7,42 (1 Н, d), 7,13 7,31 (3 Н, m), 5,59 (1 Н, d), 3,70 (1 Н, m), 3,22 (1 Н, dd), 3,15 (1 Н, dd), 1,53 (10 Н, s) ppm. Настоящий спо- 21023571 соб применяли для получения соединений c D1 по D10 и D25 (табл. D). Пример I10(b). Синтез трет-бутил-(3Z)-5-пропил-3-(диметиламинометилен)-2-оксо-4,8b-дигидро 3 аН-индено[1,2-b]пиррол-1-карбоксилата D11 Колбу, промытую аргоном, наполнили трет-бутил-(3Z)-5-аллил-3-(диметиламинометилен)-2-оксо 4,8b-дигидро-3 аН-индено[1,2-b]пиррол-1-карбоксилатом D10 (98 мг, 0,29 ммоль), и Pd/C (10%, 40 мг), и этилацетатом (6 мл). Черную суспензию перемешивали в атмосфере Н 2 при комнатной температуре в течение 24 ч. Суспензию фильтровали на целитовой подушке, и желтый фильтрат концентрировали под вакуумом с получением титульного соединения D11 в виде коричневой смолы (47 мг, 47%). LCMS (Способ Е): RT : 1,06 мин; ES- 342 [М-Н]. Пример I10(с). Синтез этил-(3 Е)-3-(гидроксиметилен)-2-оксо-4,8b-дигидро-3 аН-индено[1,2-b] пиррол-1-карбоксилата D12 Этил 2-оксо-3,3 а,4,8b-тетрагидроиндено[1,2-b]пиррол-1-карбоксилат (200 мг, 0,81 ммоль) растворяли в тетрагидрофуране (8 мл), охлаждали до -78 С. Затем добавляли бис(триметилсилил)амид лития (1 моль/л в THF, 1,22 мл, 1,22 ммоль). После 1 ч при -78 С добавляли этилформиат (0,198 мл, 2,446 ммоль). Смесь перемешивали в течение еще 30 мин и затем позволяли нагреться до комнатной температуры. Еще после 30 мин добавляли воду. Смесь экстрагировали диэтиловым эфиром, рН водного слоя доводили до 1 и раствор экстрагировали EtOAc (220 мл), высушивали (Na2SO4) и концентрировали с получением бесцветного масла этил-(3 Е)-3-(гидроксиметилен)-2-оксо-4,8b-дигидро-3 аН-индено[1,2-b]пиррол-1 карбоксилата В 12 (120 мг, 54%), которое использовали без дальнейшей очистки на следующем этапе.LCMS (Способ А): RT : 1,53 мин; ES- 272 [М-Н]. Следующие соединения получали согласно настоящему способу D12-D21, D23 и D24. Пример D22. Синтез (3 Е)-1-ацетил-3-(гидроксиметилен)-4,8b-дигидро-3 аН-индено[1,2-b]пиррол-2 она D22 К раствору (3 Е)-3-(гидроксиметилен)-1,3 а,4,8b-тетрагидроиндено[ 1,2-b]пиррол-2-она (100 мг, 0,497 ммоль) в дихлорметан (5 мл, 0,497 ммоль) добавляли N,N-диметилпиридин-2-амин (6 мг, 0,05 ммоль),N,N-диэтилэтанамин (0,20 мл, 1,49 ммоль), ангидрид уксусной кислоты (0,152 г, 1,49 ммоль). Раствор перемешивали в течение 24 ч при комнатной температуре. Смесь разбавляли дихлорметаном и промывали 1N HCl. Органический слой высушивали и концентрировали, и остаток очищали флешхроматографией (0-100% EtOAc в СуН) с получением [(Е)-(1-ацетил-2-оксо-4,8b-дигидро-3 аН-индено[1,2-b]пиррол-3-илиден)метил]-ацетата (45 мг, 31%) (LCMS (Способ A): RT : 1,69 мин; ES+ 286 (М+Н+). К раствору предыдущего сырья (40 мг, 0,14 ммоль) в метанол (1 мл) добавляли карбонат калия (0,019g,0,14 ммоль). Раствор перемешивали в течение 30 мин и добавляли 1N HCl (2 капли). Добавляли воду (20 мл), и раствор экстрагировали с EtOAc (220 мл), высушивали и концентрировали с получением белого твердого вещества (35 мг, количественно оцениваемого), которое использовали без дальнейшей очистки на следующем этапе. LCMS (Способ А): RT : 1,53 мин; ES- 272 [М-Н]. Пример I11. Синтез 3-[1-Гидрокси-мет-(Z)-илиден]-3,3 а,4,8b-тетрагидро-1 Н-индено[1,2-b]пиррол-2 он (С 1). Способ А К раствору 3-[1-гидрокси-мет-(Z)-илиден]-2-оксо-3,3 а,4,8b-тетрагидро-2 Н-индено[1,2-b]пиррол-1 карбоновой кислоты трет-бутилового сложного эфира D1 (0,400 г, 1,32 ммоль) в дихлорметане (20 мл) добавляли трифторуксусную кислоту (2 мл) при 0 С. Раствор перемешивали в течение 1 ч. Добавляли насыщенный раствор гидрокарбоната натрия и водный слой экстрагировали дихлорметаном. Объединенные органические слои промывали насыщенным раствором гидрокарбоната натрия, высушивали и концентрировали in vacuo с получением 3-[1-гидрокси-мет-(Z)-илиден]-3,3 а,4,8b-тетрагидро-1 Н-инденоH NMR (400 МГц, DMSO-d6)10,00 (1 Н, s), 7,16-7,38 (4 Н, m), 7,13 (1 Н, d), 4,94 (1 Н, d), 3,68-3,82 (1 Н,m), 3,31 (2 Н, dd), 3,01 (1 Н, dd) ppm. Настоящий способ использовали для получения соединений с С 1 по С 10 (табл. С). Способ В К раствору 3-[1-диметиламино-мет-(Z)-илиден]-2-оксо-3,3 а,4,8b-тетрагидро-2 Н-индено[1,2-b] пиррол-1-карбоновой кислоты трет-бутилового сложного эфира D1 (1,68 г, 4,63 ммоль) в диоксане (50 мл) добавляли НСl (37%, 8,37 мл). Раствор перемешивали на протяжении ночи при комнатной температуре и затем разбавляли водой, экстрагировали этилацетатом, промывали солевым раствором, высушивали и концентрировали с получением 3-[1-гидрокси-мет-(Z)-илиден]-3,3 а,4,8b-тетрагидро-1 Н-индено[1,2-b] пиррол-2-он С 1 такое же, как в способе А (0,85 г, 78%). Настоящий способ используют для получения: С 1, с С 11 по С 14 (табл. С). Пример Р 1 и Р 2. Синтез диастереоизомера of (3aR,8bS,5'R)-3-[1-(4-метил-5-оксо-2,5-дигидрофуран-2-илокси)-мет-(Е)-илиден]-3,3 а,4,8b-тетрагидро-1 Н-индено[1,2-b]пиррол-2-она (Р 1) и диастереоизомера(0,130 г, 0,646 ммоль) в диметилформамиде (5 мл), охлажденному при 0 С, добавляли калийный трет бутоксид (0,086 г, 0,711 ммоль). Раствор перемешивали в течение 10 мин и добавляли раствор бром бутенолида (0,137 мг, 0,775 ммоль, полученный согласно Johnsonall, J.C.S. Perkin I, 1981, 1734-1743) в тетрагидрофуране (1 мл). Раствор перемешивали при 0 С в течение 3 ч. Раствор разделяли между этилацетатом и водой, и водный слой экстрагировали этилацетатом. Объединенный органический слой промывали солевым раствором и концентрировали. Остаток очищали флеш-хроматографией с элюированием циклогексаном и этилацетатом (1/4). Получали два диастереоизомера: диастереоизомер (3aR,8bS,5'R)-3-[1-(4-метил-5-оксо-2,5-дигидро-фуран-2-илокси)-мет-(Е)-илиден]-3,3 а,4,8b-тетрагидро-1 Н-индено[1,2-b]пиррол-2-она Р 1 (менее полярный, 50 мг, 26%); C17H15NO4;MW: 297,31; mp 213C; LCMS (способ А) RT 1,51 мин; ES: 339 (MHMeCN), 298 (MH+); 1H NMR (400 МГц, CDC13)7,11 -7,38 (5 H, m), 6,96 (1 H, s), 6,73 (1 H, br. s.), 6,15 (1 H, s), 5,12 (1 H, d), 3,91 (1 H, tt),3,44 (1 H, dd), 3,08 (1 H, dd), 2,02 (3 H, s) ppm. Соединения с A2 по А 27 и с В 2 по В 27 получали согласно такому же способу. А 2-А 27 являются менее полярными диастереоизомерами (смотри табл. А); В 2-27 являются более полярными диастереоизомерами (смотри табл. В). Пример А 27. Синтез (3 Е)-1-[(4-фторфенил)метил]-3-[(4-метил-5-оксо-2 Н-фуран-2-ил)оксиметилен]4,8b-дигидро-3 аН-индено[1,2-b]пиррол-2-она А 27 и (3 Е)-1-[(4-фторфенил)метил]-3-[(4-метил-5-оксо-2 Нфуран-2-ил)оксиметилен]-4,8b-дигидро-3 аН-индено[1,2-b]пиррол-2-она В 27 К раствору (3 Е)-1-[(4-фторфенил)метил]-3-(гидроксиметилен)-4,8b-дигидро-3 аН-индено[1,2-b] пиррол-2-она (60 мг, 0,1940 ммоль) в дихлорметане (10 мл) добавляли 2-бром-4-метил-2 Н-фуран-5-он (51 мг,0,291 ммоль) и основание Хунинга (0,064 мл, 0,39 ммоль). Раствор перемешивали на протяжение ночи при комнатной температуре и растворитель удаляли в вакууме. Остаток очищали флеш-хроматографией с элюированием циклогексаном и этилацетатом (1:4) с получением необходимого продукта в качестве смеси диастереоизомеров (3 Е)-1-[(4-фторфенил)метил]-3-[(4-метил-5-оксо-2 Н-фуран-2-ил)оксиметилен]4,8b-дигидро-3 аН-индено [1,2-b] пиррол-2-она А 27 и В 27 (30 мг, 38%). LCMS (способ A) RT 1,85 мин;ES: 406 (М+Н+). Соединения А 28, В 28, А 29 и В 29 получали согласно настоящему способу (табл. А и В). Пример Р 3. Синтез 1-метил-(3aR,8bS,5'R)-3-[1-(4-метил-5-оксо-2,5-дигидро-фуран-2-илокси)мет-(Е)-илиден]-3,3 а,4,8b-тетрагидро-1 Н-индено[1,2-b]пиррол-2-она К раствору диастереоизомера (3aR,8bS, 5'R)-3-[1-(4-метил-5-оксо-2,5-дигидро-фуран-2-илокси)мет-(Е)-илиден]-3,3 а,4,8b-тетрагидро-1 Н-индено[1,2-b]пиррол-2-она Р 1 (23 мг, 0,077 ммоль) в диметилформамиде (1 мл) добавляли гидрид натрия (3,5 мг, 0,077 ммоль) с последующим метилйодом (1 капля). Раствор перемешивали при 0 С в течение 2 ч и затем 24 ч при комнатной температуре. Раствор разделяли между этилацетатом и водой, и водный слой экстрагировали этилацетатом. Объединенный органический слой промывали солевым раствором и концентрировали. Остаток очищали флеш-хроматографией с элюированием циклогексаном-этилацетатом (1/4). Остаток растирали в порошок в пентане с получением диастереоизомера 1-метил-(3aR,8bS,5'R)-3-[1-(4-метил-5-оксо-2,5-дигидро-фуран-2-илокси)-мет-(Е)илиден]-3,3 а,4,8b-тетрагидро-1 Н-индено[1,2-b]пиррол-2-она Р 3 (белое твердое вещество, 12 мг, 49%). Биологические примеры Воздействие соединений формулы (I) на прорастание семян Orobanche cumana Wallr. оценивали на фильтровальной бумаге из стекловолокна (GFFP) в чашках Петри. Семена предварительно кондиционировали при влажности и приемлемой температуре, чтобы сделать восприимчивыми к конкретным химическим стимуляторам прорастания. Тестовые соединения растворяли в DMSO (10 000 мг л-1) и хранили при комнатной температуре в эксикаторах с дессикантами. Исходные растворы растворяли деионизированной водой для соответствующей конечной тестовой концентрации. Семена О. cumana расы 'F' собирали с полей подсолнечника в Мансанилье (Seville, Spain) в 2006(партия семян IN146) и 2008 (партия семян IN153) и хранили при комнатной температуре. Для того, чтобы отделить семена от тяжелых органических остатков, применяли модифицированный способ плавучести в растворе сахарозы, который описан HartmanTanimonure (Plant Disease (1991), 75, p.494). Семенами заполняли делительную воронку и перемешивали их в воде. Если семена всплывали на поверхность, от водной фракции, содержащей тяжелые остатки, избавлялись. Семена повторно суспендировали в 2,5 М растворе сахарозы (относительная плотность 1,20) и тяжелым остаткам позволяли осесть в течение 60 мин. После удаления остатков, семена дезинфицировали в 1% растворе гипохлорита натрия и 0,025% (объем/объем) Tween 20 в течение 2 мин. Семена сцеживали на двойной слой марли, прополаскивали стерильной деионизированной водой и повторно суспендировали в стерильной деионизированной воде. Два мл суспензии семян, содержащей приблизительно 150-400 семян равномерно наносили на двойной слой стерильного диска фильтровальной бумаги из стекловолокна ( 9 мм) в чашках Петри ( 9 см). После смачивания дисков 3 мл стерильной деионизированной воды, чашки Петри запечатывали парафильмом. Семена инкубировали в течение 10 дней при 20 С в темноте для кондиционирования семян. Верхний диск с кондиционированными семенами быстро высушивали, переносили в чашку Петри,покрытую сухим диском GFFP, и смачивали 6 мл соответствующего тестового раствора. Соединения формулы (I) тестировали при концентрациях 0,001, 0,01 и 0,1 мг л-1. Аналог стриголактона GR24 (коммерчески доступный в качестве смеси изомеров) включали в качестве положительного контроля и 0,001% DMSO в качестве отрицательного контроля. Все обработки тестировали в пяти повторностях. Семена повторно инкубировали при 20 С в темноте и исследовали на прорастание 10 дней спустя. Первичные корешки пророщенных семян окрашивали в течение 5 мин синим чернилом (MIGROS, Switzerland) в 5% уксусной кислоте согласно Long et al. (Seed Science Research (2008), 18, p.125). После окрашивания семена сканировали с использованием планшетного сканера с оптическим разрешением 1200 точек на дюйм (PULSTEK, OpticPro ST28) или фотографировали с использованием штатива кинокамеры с установленной цифровой SLR камерой (Canon EOS 5D). Прорастание 100 семян на повторность оценивали по цифровым изображениям. Семена считали пророщенными, если первичный корешок выступал из семенной оболочки. Для анализа вариантности (способ GLM) и множественных сравнений средних по ус- 28023571 ловиям испытаний (t-тест Сидака) исходя из данных процента прорастания, трансформированных по арксинусу использовали пакет программ для статистической обработки данных SAS версия 9.1. Результаты тестов на прорастание семян Orobanche показаны в табл. 3-8. Результаты показывают, что все протестированные соединения, показали прорастание, включая воздействие по сравнению с необработанным контролем. Таблица 3. Воздействие соединений формулы (I) на прорастание предварительно кондиционированных семян Orobanche cumana партии семян IN146 расы F Среднее; N = 5100 семян; показаны повторно преобразованные данные; Средние с одинаковой буквой значимо не различаются, Р 0,05. Таблица 4. Прорастание (%) предварительно кондиционированных семян Orobanche cumana партииIN146 расы F, обработанных соединениями формулы (I) при различных концентрациях 1/1 смесь диастереоизомеров с соответствующим соединением В; Среднее; N = 5100 семян; показаны повторно преобразованные данные; Средние с одинаковой буквой значимо не различаются, Р 0,05; Средние с буквой 'е' значимо не отличаются от водного контроля (0,001% DMSO), показывающего прорастание 0%. Таблица 5. Прорастание (%) предварительно кондиционированных семян Orobanche ситапа партии IN146 расы F, обработанных соединениями формулы (I) при различных концентрациях 1/1 смесь диастереоизомеров с соответствующим соединением В;Среднее; N = 5100 семян; показаны повторно преобразованные данные; Средние с одинаковой буквой значимо не различаются, Р 0,05; Средние с буквой 'е' значимо не отличаются от водного контроля (0,001% DMSO), показывающего прорастание 0%. Таблица 6. Прорастание (%) предварительно кондиционированных семян Orobanche ситапа партии IN146 расы F, обработанных соединениями формулы (I) при различных концентрациях Среднее; N = 5100 семян; показаны повторно преобразованные данные; Средние с одинаковой буквой значимо не различаются, Р 0,05; Средние с буквой 'е' значимо не отличаются от водного контроля (0,001% DMSO), показывающего прорастание 0%.
МПК / Метки
МПК: A01N 43/38, C07D 417/14, C07D 209/70, C07D 405/14, A01P 21/00, C07D 401/04, C07D 405/12, C07D 417/04
Метки: качестве, роста, стриголактамовые, регуляторов, растений, производные, применение
Код ссылки
<a href="https://eas.patents.su/30-23571-strigolaktamovye-proizvodnye-i-ih-primenenie-v-kachestve-regulyatorov-rosta-rastenijj.html" rel="bookmark" title="База патентов Евразийского Союза">Стриголактамовые производные и их применение в качестве регуляторов роста растений</a>
Предыдущий патент: Противовирусные соединения
Следующий патент: Механизированная стоянка
Случайный патент: Способ получения водорода и устройство












