Производные гетероциклических аминов
Формула / Реферат
1. Соединения формулы

где R1 представляет собой водород, C1-7алкил, галоген, C1-7алкил, замещенный галогеном, C1-7алкокси, C1-7алкокси, замещенный галогеном, циано, нитро, C3-6-циклоалкил, -CH2-C3-6-циклоалкил, -O-CH2-C3-6-циклоалкил, -O-(CH2)2-O-C1-7алкил, S(O)2CH3, SF5, -C(O)NH-C1-7алкил, фенил, -O-пиримидинил, возможно замещенный C1-7алкокси, замещенным галогеном, или представляет собой бензил, оксетанил или фуранил;
m представляет собой 1 или 2;
Ar представляет собой арил или гетероарил, выбранный из группы, состоящей из фенила, нафтила, пиримидинила, пиридинила, бензотиазолила, хинолинила, хиназолинила, бензо[d][1.3]диоксолила, 5,6,7,8-тетрагидрохиназолинила, пиразолила, пиразинила, пиридазинила или 1,3,4-оксадиазолила;
Y представляет собой связь, -CH2-, -CH2CH2-, -CH(CF3)- или -CH(CH3)-;
R2 представляет собой водород или C1-7алкил;
A представляет собой CR или N;
R представляет собой водород, циано, галоген или C1-7алкил;
R' представляет собой водород или галоген; при условии, что когда R' представляет собой галоген, тогда A представляет собой CH;
B представляет собой CH или N;
n представляет собой 0, 1 или 2;
X представляет собой связь, -CH2- или -O-;
или их фармацевтические активные кислотно-аддитивные соли за исключением следующих соединений:
(2,6-дихлорбензил)-(4-морфолин-2-ил-фенил)амин,
N-(4-((2S)-морфолин-2-ил)фенил)пиридин-2-амин,
N-метил-N-(4-((2S)-морфолин-2-ил)фенил)пиридин-2-амин и
(2,6-дихлорфенил)-(4-морфолин-2-ил-фенил)амин.
2. Соединения формулы IA по п.1
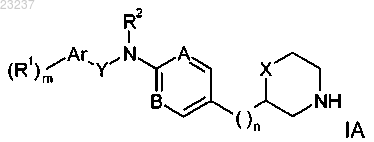
где R1 представляет собой водород, C1-7алкил, галоген, C1-7алкил, замещенный галогеном, C1-7алкокси, C1-7алкокси, замещенный галогеном, циано, нитро, C3-6-циклоалкил, S(O)2CH3 или фенил;
m представляет собой 1 или 2;
Ar представляет собой арил или гетероарил, выбранный из группы, состоящей из фенила, нафтила, пиримидинила, пиридинила, бензотиазолила, хинолинила, хиназолинила, бензо[d][1.3]диоксолила, 5,6,7,8-тетрагидрохиназолинила, пиразолила или 1,3,4-оксадиазолила;
Y представляет собой связь, -CH2-, -CH2CH2-, -CH(CF3)- или -CH(CH3)-;
R2 представляет собой водород или C1-7алкил;
A представляет собой CR или N;
R представляет собой водород, циано, галоген или C1-7алкил;
B представляет собой CH или N;
n представляет собой 0, 1 или 2;
X представляет собой связь, -CH2- или -O-;
или их фармацевтические активные кислотно-аддитивные соли, за исключением следующих соединений:
(2,6-дихлорбензил)-(4-морфолин-2-ил-фенил)амин,
N-(4-((2S)-морфолин-2-ил)фенил)пиридин-2-амин,
N-метил-N-(4-((2S)-морфолин-2-ил)фенил)пиридин-2-амин и
(2,6-дихлорфенил)-(4-морфолин-2-ил-фенил)амин.
3. Соединения формулы I по п.1, где А представляет собой CR и B представляет собой CH, за исключением следующих соединений:
(2,6-дихлорбензил)-(4-морфолин-2-ил-фенил)амин,
N-(4-((2S)-морфолин-2-ил)фенил)пиридин-2-амин,
N-метил-N-(4-((2S)-морфолин-2-ил)фенил)пиридин-2-амин и
(2,6-дихлорфенил)-(4-морфолин-2-ил-фенил)амин.
4. Соединения формулы I по п.3, где Y представляет собой связь и Ar представляет собой фенил или нафтил, за исключением (2,6-дихлорфенил)-(4-морфолин-2-ил-фенил)амина.
5. Соединения формулы I по п.4, где соединения представляют собой
(RS)-(4-хлорфенил)-(4-морфолин-2-ил-фенил)амин,
((S)-4-морфолин-2-ил-фенил)нафталин-2-ил-амин,
(S)-4-хлор-2-фтор-N-(4-(морфолин-2-ил)фенил)анилин,
(4-хлорфенил)метил-((S)-4-морфолин-2-ил-фенил)амин,
(RS)-(4-хлорфенил)-(2-метил-4-морфолин-2-ил-фенил)амин,
[5-(3,4-диметоксифенил)пиримидин-2-ил]-((S)-4-морфолин-2-ил-фенил)амин или
[5-(3,4-диметоксифенил)пиримидин-2-ил]-((R)-4-морфолин-2-ил-фенил)амин.
6. Соединения формулы I по п.3, где Y представляет собой связь и Ar представляет собой пиридинил, пиримидинил, пиразолил, бензотиазолил, хинолинил, хиназолинил, бензо[d][1.3]диоксолил, 5,6,7,8-тетрагидрохиназолинил, пиразинил, пиридазинил или 1,3,4-оксадиазолил, за исключением
N-(4-((2S)-морфолин-2-ил)фенил)пиридин-2-амина и
N-метил-N-(4-((2S)-морфолин-2-ил)фенил)пиридин-2-амина.
7. Соединения формулы I по п.6, где соединения представляют собой
(RS)-(4,6-диметилпиримидин-2-ил)-(4-пирролидин-3-ил-фенил)амина гидрохлорид,
(RS)-(5-хлорпиридин-2-ил)-(4-морфолин-2-ил-фенил)амин,
(RS)-(5-хлорпиримидин-2-ил)-(4-морфолин-2-ил-фенил)амин,
(RS)-(5-бромпиримидин-2-ил)-(4-морфолин-2-ил-фенил)амин,
(S)-5-бром-N-(4-(морфолин-2-ил)фенил)пиридин-2-амин,
(S)-N-(4-(морфолин-2-ил)фенил)-5-(трифторметил)пиридин-2-амин,
(5-метоксипиримидин-2-ил)-((S)-4-морфолин-2-ил-фенил)амин,
(5-фторпиримидин-2-ил)-((S)-4-морфолин-2-ил-фенил)амин,
(5-этилпиримидин-2-ил)-((S)-4-морфолин-2-ил-фенил)амин,
2-((S)-4-морфолин-2-ил-фениламино)пиримидин-5-карбонитрил,
(5-циклопропилпиримидин-2-ил)-((S)-4-морфолин-2-ил-фенил)амин,
(5-метилпиримидин-2-ил)-((S)-4-морфолин-2-ил-фенил)амин,
((S)-4-морфолин-2-ил-фенил)-(5-трифторметилпиримидин-2-ил)амин,
((S)-4-морфолин-2-ил-фенил)-(5-пропилпиримидин-2-ил)амин,
[5-фтор-4-(2,2,2-трифторэтокси)пиримидин-2-ил]-((R)-4-морфолин-2-ил-фенил)амин,
(4-циклопропилпиримидин-2-ил)-((R)-4-морфолин-2-ил-фенил)амин,
(4-циклопропил-5-фторпиримидин-2-ил)-((R)-4-морфолин-2-ил-фенил)амин,
(4-пентафторсульфанилфенил)-((R)-4-морфолин-2-ил-фенил)амин,
(R)-5-циклопропил-N-(3-фтор-4-(морфолин-2-ил)фенил)пиримидин-2-амин,
((S)-3-хлор-4-морфолин-2-ил-фенил)-(5-циклопропилпиримидин-2-ил)амин,
((R)-3-хлор-4-морфолин-2-ил-фенил)-(5-циклопропилпиримидин-2-ил)амин,
(S)-5-циклопропил-N-(3-фтор-4-(морфолин-2-ил)фенил)пиримидин-2-амин,
(R)-N-(3-фтор-4-(морфолин-2-ил)фенил)-5-(трифторметил)пиримидин-2-амин,
(S)-N-(3-фтор-4-(морфолин-2-ил)фенил)-5-(трифторметил)пиримидин-2-амин,
(R)-N-(4-(морфолин-2-ил)фенил)-6-(трифторметил)пиримидин-4-амин,
(R)-6-хлор-N-(4-(морфолин-2-ил)фенил)пиримидин-4-амин,
(R)-N-(4-(морфолин-2-ил)фенил)-2-(трифторметил)пиримидин-4-амин,
(R)-N-(4-(морфолин-2-ил)фенил)-5-(трифторметил)пиразин-2-амин,
((R)-3-хлор-4-морфолин-2-ил-фенил)-(5-хлорпиримидин-2-ил)амин,
((R)-3-хлор-4-морфолин-2-ил-фенил)-[5-(2,2,2-трифторэтокси)пиримидин-2-ил]амин,
((R)-3-хлор-4-морфолин-2-ил-фенил)-(5-трифторметилпиримидин-2-ил)амин,
(R)-5-хлор-N-(4-(морфолин-2-ил)фенил)пиразин-2-амин,
(R)-6-хлор-N-(4-(морфолин-2-ил)фенил)пиразин-2-амин,
(R)-N-(3-фтор-4-(морфолин-2-ил)фенил)-5-(2,2,2-трифторэтокси)пиримидин-2-амин,
(R)-N-(3-фтор-4-(морфолин-2-ил)фенил)-4-(2,2,2-трифторэтокси)пиримидин-2-амин,
(R)-5-фтор-N-(3-фтор-4-(морфолин-2-ил)фенил)-4-(2,2,2-трифторэтокси)пиримидин-2-амин,
(R)-5-хлор-N-(3-фтор-4-(морфолин-2-ил)фенил)пиримидин-2-амин или
((R)-3-хлор-4-морфолин-2-ил-фенил)-[4-(2,2,2-трифторэтокси)пиримидин-2-ил]амин.
8. Соединения формулы I по п.3, где Y представляет собой -CH2-, -CH2CH2-, -CH(CF3)- или -CH(CH3)- и Ar представляет собой фенил или нафтил, за исключением (2,6-дихлорбензил)-(4-морфолин-2-ил-фенил)амина.
9. Соединения формулы I по п.8, где соединения представляют собой
[(RS)-1-(4-хлорфенил)-2,2,2-трифторэтил]-[(RS)-4-(2-пирролидин-3-ил-этил)фенил]амин,
(RS)-[1-(4-хлорфенил)-2,2,2-трифторэтил]-[(RS)-4-(2-пиперидин-3-ил-этил)фенил]амин,
(RS)-(4-хлорбензил)-(4-морфолин-2-ил-фенил)амин,
((S)-4-морфолин-2-ил-фенил)фенэтиламин,
(4-метоксибензил)-((S)-4-морфолин-2-ил-фенил)амин,
(4-метилбензил)-((S)-4-морфолин-2-ил-фенил)амин,
4-[((S)-4-морфолин-2-ил-фениламино)метил]бензонитрил,
((S)-4-морфолин-2-ил-фенил)-(4-трифторметилбензил)амин,
((S)-4-морфолин-2-ил-фенил)-(4-трифторметоксибензил)амин,
(3,4-дихлорбензил)-((S)-4-морфолин-2-ил-фенил)амин,
(4-фторбензил)-((S)-4-морфолин-2-ил-фенил)амин,
[2-(4-хлорфенил)этил]-((S)-4-морфолин-2-ил-фенил)амин,
(4-хлор-2-фторбензил)-((S)-4-морфолин-2-ил-фенил)амин,
(4-этилбензил)-((S)-4-морфолин-2-ил-фенил)амин,
(4-бромбензил)-((S)-4-морфолин-2-ил-фенил)амин или
[(RS)-1-(4-хлорфенил)этил]-((S)-4-морфолин-2-ил-фенил)амин.
10. Соединения формулы I по п.3, где Y представляет собой -CH2-, -CH2CH2-, -CH(CF3)- или -CH(CH3)- и Ar представляет собой фурил, пиридинил, пиримидинил, пиразолил, бензотиазолил, хинолинил, хиназолинил, бензо[d][1.3]диоксолил, 5,6,7,8-тетрагидрохиназолинил или 1,3,4-оксадиазолил.
11. Соединения формулы I по п.10, где соединения представляют собой
[(RS)-1-(5-бромпиридин-2-ил)-2,2,2-трифторэтил]-((RS)-4-пирролидин-3-ил-фенил)амин,
(5-бромпиридин-2-ил-метил)-((S)-4-морфолин-2-ил-фенил)амин,
(6-метоксипиридин-2-ил-метил)-((S)-4-морфолин-2-ил-фенил)амин,
(S)-N-((6-хлорпиридин-3-ил)метил)-4-(морфолин-2-ил)анилин,
(S)-4-(морфолин-2-ил)-N-((6-(трифторметил)пиридин-3-ил)метил)анилин,
(5-фторпиридин-2-ил-метил)-((S)-4-морфолин-2-ил-фенил)амин или
(S)-N-((2-хлорхинолин-3-ил)метил)-4-(морфолин-2-ил)анилин.
12. Соединение формулы I по п.1, где A представляет собой N, B представляет собой CH, Y представляет собой связь и Ar представляет собой пиридинил, пиримидинил.
13. Соединения формулы I по п.12, где соединения представляют собой
(RS)-5-хлор-N-(5-(морфолин-2-ил)пиридин-2-ил)пиридин-2-амин,
(RS)-5-бром-N-(5-(морфолин-2-ил)пиридин-2-ил)пиридин-2-амин,
(RS)-5-циклопропил-N-(5-(морфолин-2-ил)пиридин-2-ил)пиримидин-2-амин,
(R)-5-бром-N-(5-(морфолин-2-ил)пиридин-2-ил)пиридин-2-амин или
(S)-5-бром-N-(5-(морфолин-2-ил)пиридин-2-ил)пиридин-2-амин.
14. Соединение формулы I по п.1, где А представляет собой CR, B представляет собой N, Y представляет собой связь и Ar представляет собой пиридинил.
15. Соединение формулы I по п.14, где соединение представляет собой (RS)-N-(5-бромпиридин-2-ил)-3-метил-5-(морфолин-2-ил)пиридин-2-амин.
16. Соединение, которое представляет собой
[5-(3,4-диметоксифенил)пиримидин-2-ил]-((S)-4-морфолин-2-ил-фенил)амин или
[5-(3,4-диметоксифенил)пиримидин-2-ил]-((R)-4-морфолин-2-ил-фенил)амин.
17. Способ получения соединения формулы I по любому из пп.1-15, согласно которому
а) отщепляют N-защитную группу от соединений формулы
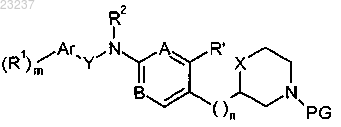
до соединения формулы
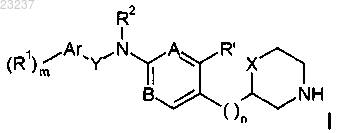
PG представляет собой N-защитную группу, выбранную из -C(O)О-трет-бутила.
18. Фармацевтическая композиция для связывания с рецепторами, ассоциированными со следовыми аминами 1 (TAAR1), включающая соединение по любому из пп.1-16 и фармацевтически приемлемый носитель и/или адъювант.
19. Фармацевтическая композиция, включающая соединение по любому из пп.1-16 и фармацевтически приемлемый носитель и/или адъювант, для лечения депрессии, тревожных расстройств, биполярного расстройства, синдрома дефицита внимания с гиперактивностью (СДВГ), расстройств, обусловленных стрессом, психотических расстройств, шизофрении, неврологических заболеваний, болезни Паркинсона, нейродегенеративных расстройств, болезни Альцгеймера, эпилепсии, мигрени, гипертонии, наркотической зависимости, метаболических расстройств, расстройств приема пищи, диабета, диабетических осложнений, ожирения, дислипидемии, расстройств расхода и поглощения энергии, расстройств и нарушения гомеостаза температуры тела, расстройств сна и циркадного ритма и сердечно-сосудистых расстройств.
20. Применение соединения по любому из пп.1-16 в качестве терапевтически активных веществ, обладающих сродством к TAAR1.
21. Применение соединения по любому из пп.1-16 в качестве терапевтически активных веществ в лечении депрессии, тревожных расстройств, биполярного расстройства, синдрома дефицита внимания с гиперактивностью (СДВГ), расстройств, обусловленных стрессом, психотических расстройств, шизофрении, неврологических заболеваний, болезни Паркинсона, нейродегенеративных расстройств, болезни Альцгеймера, эпилепсии, мигрени, наркотической зависимости, метаболических расстройств, расстройств приема пищи, диабета, диабетических осложнений, ожирения, дислипидемии, расстройств расхода и поглощения энергии, расстройств и нарушения гомеостаза температуры тела, расстройств сна и циркадного ритма и сердечно-сосудистых расстройств.
22. Применение соединения по любому из пп.1-16 в качестве терапевтически активных веществ в лечении заболеваний ЦНС, выбранных из депрессии, тревожных расстройств, биполярного расстройства, синдрома дефицита внимания с гиперактивностью (СДВГ), расстройств, обусловленных стрессом, психотических расстройств, шизофрении, неврологических заболеваний, болезни Паркинсона, нейродегенеративных расстройств, болезни Альцгеймера, эпилепсии, наркотической зависимости или мигрени.
23. Применение соединения по любому из пп.1-16 в качестве терапевтически активных веществ в лечении метаболических расстройств, выбранных из расстройств приема пищи, диабета, диабетических осложнений или ожирения.
24. Применение соединения по любому из пп.1-16 для изготовления лекарств для терапевтического и/или профилактического лечения депрессии, тревожных расстройств, биполярного расстройства, синдрома дефицита внимания с гиперактивностью (СДВГ), расстройств, обусловленных стрессом, психотических расстройств, шизофрении, неврологических заболеваний, болезни Паркинсона, нейродегенеративных расстройств, болезни Альцгеймера, эпилепсии, мигрени, наркотической зависимости, метаболических расстройств, расстройств приема пищи, диабета, диабетических осложнений, ожирения, дислипидемии, расстройств расхода и поглощения энергии, расстройств и нарушения гомеостаза температуры тела, расстройств сна и циркадного ритма и сердечно-сосудистых расстройств.
Текст
Настоящее изобретение относится к соединениям формулы (I) где R1 представляет собой водород, C1-7 алкил, галоген, C1-7 алкил, замещенный галогеном, C1-7 алкокси,C1-7 алкокси, замещенный галогеном, циано, нитро, C3-6-циклоалкил, -CH2-C3-6-циклоалкил, -O-CH2-C3-6 циклоалкил, -O-(CH2)2-O-C1-7 алкил, S(O)2CH3, SF5, -C(O)NH-C1-7 алкил, фенил, -O-пиримидинил, возможно замещенный C1-7 алкокси, замещенным галогеном, или представляет собой бензил, оксетанил или фуранил;m представляет собой 1 или 2; Ar представляет собой арил или гетероарил, выбранный из группы,состоящей из фенила, нафтила, пиримидинила, пиридинила, бензотиазолила, хинолинила, хиназолинила,бензо[d][1.3]диоксолила, 5,6,7,8-тетрагидрохиназолинила, пиразолила, пиразинила, пиридазинила или 1,3,4 оксадиазолила; Y представляет собой связь, -CH2-, -CH2CH2-, -CH(CF3)- или -CH(CH3)-; R2 представляет собой водород или C1-7 алкил; A представляет собой CR или N и R представляет собой водород, циано, галоген или C1-7 алкил; R' представляет собой водород или галоген; при условии, что когда R' представляет собой галоген, тогда А представляет собой CH; B представляет собой CH или N; n представляет собой 0, 1 или 2; X представляет собой связь, -CH2- или -O-; или к их фармацевтическим активным кислотно-аддитивным солям за исключением следующих соединений: (2,6-дихлорбензил)-(4-морфолин-2-ил-фенил)амин, N(4-2S)-морфолин-2-ил)фенил)пиридин-2-амин, N-метил-N-(4-2S)-морфолин-2-ил)фенил)пиридин-2-амин и (2,6-дихлорфенил)-(4-морфолин-2-ил-фенил)амин. Установлено, что соединения формулы I обладают хорошим сродством к рецепторам, ассоциированным со следовыми аминами (TAARs), особенно к TAAR1. Соединения могут быть использованы для лечения депрессии, тревожных расстройств, биполярного расстройства, синдрома дефицита внимания с гиперактивностью (СДВГ), расстройств, обусловленных стрессом, психотических расстройств, таких как шизофрения, неврологических заболеваний, таких как болезнь Паркинсона, нейродегенеративных расстройств, таких как болезнь Альцгеймера, эпилепсии, мигрени,гипертонии, наркотической зависимости и метаболических расстройств, таких как расстройства приема пищи,диабет, диабетические осложнения, ожирение, дислипидемия, расстройства расхода и поглощения энергии,расстройства и нарушение гомеостаза температуры тела, расстройств сна и циркадного ритма и сердечнососудистых расстройств. 023237 Настоящее изобретение относится к соединениям формулы где R1 представляет собой водород, низший алкил, галоген, низший алкил, замещенный галогеном, низший алкокси, низший алкокси, замещенный галогеном, циано, нитро, C3-6-циклоалкил, -CH2-C3-6 циклоалкил, -O-CH2-C3-6-циклоалкил, -O-(CH2)2-O-низший алкил, S(O)2CH3, SF5, -C(O)NH-низший алкил,фенил, -O-пиримидинил, возможно замещенный низшим алкокси, замещенным галогеном, или представляет собой бензил, оксетанил или фуранил;Ar представляет собой арил или гетероарил, выбранный из группы, состоящей из фенила, нафтила,пиримидинила, пиридинила, бензотиазолила, хинолинила, хиназолинила, бензо[d][1,3]диоксолила,5,6,7,8-тетрагидрохиназолинила, пиразолила, пиразинила, пиридазинила или 1,3,4-оксадиазолила;R2 представляет собой водород или низший алкил; А представляет собой CR или N; R представляет собой водород, циано, галоген или низший алкил;R' представляет собой водород или галоген; при условии, что когда R' представляет собой галоген,тогда А представляет собой CH; В представляет собой CH или N;X представляет собой связь, -CH2- или -O-; или к их фармацевтическим активным кислотно-аддитивным солям. Изобретение включает все рацемические смеси, все соответствующие энантиомеры и/или оптические изомеры. Кроме того, настоящее изобретение также охватывает все таутомерные формы соединений формулы I. Установлено, что соединения формулы I обладают хорошим сродством к рецепторам, ассоциированным со следовыми аминами (TAARs от trace amine associated receptors), особенно к TAAR1. Соединения могут быть использованы для лечения депрессии, тревожных расстройств, биполярного расстройства, синдрома дефицита внимания с гиперактивностью (СДВГ), расстройств, обусловленных стрессом, психотических расстройств, таких как шизофрения, неврологических заболеваний, таких как болезнь Паркинсона, нейродегенеративных расстройств, таких как болезнь Альцгеймера, эпилепсии,мигрени, гипертонии, наркотической зависимости и метаболических расстройств, таких как расстройства приема пищи, диабет, диабетические осложнения, ожирение, дислипидемия, расстройства расхода и поглощения энергии, расстройства и нарушение гомеостаза температуры тела, расстройств сна и циркадного ритма и сердечно-сосудистых расстройств. Некоторые из физиологических эффектов (т.е. сердечно-сосудистые эффекты, гипотония, индукция седативного эффекта), о которых сообщалось в отношении соединений, которые могут быть связаны с адренергическими рецепторами (WO 02/076950, WO 97/12874 или EP 0717037), могут рассматриваться как нежелательные подобные эффекты в случае лекарств, нацеленных на лечение заболеваний центральной нервной системы, как описано выше. Следовательно, желательно получить лекарства, обладающие селективностью к рецептору TAAR1 по сравнению с адренергическими рецепторами. Объекты настоящего изобретения демонстрируют избирательность к рецептору TAAR1 относительно адренергических рецепторов, в частности хорошую селективность по сравнению с адренергическими рецепторами 1 и 2 человека и крысы. Классические биогенные амины (серотонин, норэпинефрин, эпинефрин, дофамин, гистамин) выполняют важные функции в качестве нейромедиаторов в центральной и периферической нервной системе [1]. Их синтез и хранение, а также их разрушение и повторное поглощение после высвобождения строго регламентированы. Известно, что дисбаланс в уровнях биогенных аминов ответственен за измененную функцию головного мозга при многих патологических состояниях [2-5]. Второй класс эндогенных аминных соединений, так называемых следовых аминов (TAs от trace amines), значительно совпадает с классическими биогенными аминами в отношении стуктуры, метаболизма и подклеточной локализации. TAs включают п-тирамин, -фенилэтиламин, триптамин и октопамин, и они присутствуют в нервной системе млекопитающих, как правило, на более низких уровнях, чем классические биогенные амины [6]. Их дисрегуляция связана с разными психиатрическими заболеваниями, подобными шизофрении и депрессии [7], и другими состояниями, подобными синдрому дефицита внимания с гиперактивностью,мигрени, болезни Паркинсона, наркотической зависимости и расстройств приема пищи [8, 9]. В течение длительного времени ТА-специфические рецепторы только предполагались, исходя из анатомически дискретных сайтов связывания с высоким сродстом к ТА в ЦНС людей и других млекопитающих [10, 11]. Таким образом, считалось, что фармакологические эффекты TAs опосредованы широко-1 023237 известным механизмом классических биогенных аминов, либо инициированием их высвобождения, либо ингибированием их обратного захвата, либо "кросс-взаимодействием" с их системами рецепторов [9, 12,13]. Данная точка зрения претерпела значительные изменения, связанные с определением нескольких членов нового семейства GPCRs, рецепторов, ассоциированных со следовыми аминами (TAARs) [7, 14]. Сущестсвует 9 генов TAAR у человека (включая 3 псевдогена) и 16 генов у мыши (включая 1 псевдоген). Гены TAAR не содержат интронов (за одним исключением TAAR2 содержит 1 интрон) и располагаются рядом друг с другом на одном и том же хромосомном участке. Сравнение филогенетической взаимосвязи генов рецепторов в соответствии с глубоким сходством с фармакофором GPCR и фармакологические данные указывают на то, что эти рецепторы образуют три отчетливых подсемейства [7, 14]. TAAR1 входит в первый подкласс четырех генов (TAAR1-4), высококонсервативных среди человека и грызунов.TAs активируют TAAR1 посредством Gas. Показано, что дисрегуляция TAs влияет на этиологию разных заболеваний, подобных депрессии, психозу, синдрому дефицита внимания с гиперактивностью, наркотической зависимости, болезни Паркинсона, мигрени, расстройствам приема пищи, метаболическим расстройствам и, следовательно, лиганды TAAR1 обладают высоким потенциалом в лечении этих заболеваний. Следовательно, существует большой интерес к увеличению знаний о рецепторах, ассоциированных со следовыми аминами. Используемые ссылки-2 023237 Предметами настоящего изобретения являются новые соединения формулы I и их фармацевтически приемлемые соли, их применение для изготовления лекарств для лечения заболеваний, связанных с биологической функцией рецепторов, ассоциированных со следовыми аминами, их изготовление и лекарства на основе соединения согласно изобретению при регулировании или предотвращении заболеваний,таких как депрессия, тревожные расстройства, биполярное расстройство, синдром дефицита внимания с гиперактивностью, расстройства, обусловленные стрессом, психотические расстройства, такие как шизофрения, неврологические заболевания, такие как болезнь Паркинсона, нейродегенеративные расстройства, такие как болезнь Альцгеймера, эпилепсия, мигрень, наркотическая зависимость и метаболические расстройства, такие как расстройства приема пищи, диабет, диабетические осложнения, ожирение, дислипидемия, расстройства расхода и поглощения энергии, расстройства и нарушение гомеостаза температуры тела, расстройства сна и циркадного ритма и сердечно-сосудистые расстройства. Предпочтительными показаниями применения соединений по настоящему изобретению являются депрессия, психоз, болезнь Паркинсона, диабет, тревога и синдром дефицита внимания с гиперактивностью (СДВГ). Как используется здесь, термин "низший алкил" обозначает насыщенную неразветвленную или разветвленную группу, содержащую от 1 до 7 атомов углерода, например метил, этил, пропил, изопропил,н-бутил, изобутил, 2-бутил, трет-бутил и подобные. Предпочтительными алкильными группами являются группы с 1-4 атомами углерода. Как используется здесь, термин "низший алкокси" обозначает группу, где алкильный остаток является таким, как определено выше, и который присоединен через атом кислорода. Как используется здесь, термин "низший алкил, замещенный галогеном" обозначает алкильную группу, как определено выше, где по меньшей мере один атом водород замещен галогеном, напримерCF3, CHF2, CH2F, CH2CF3, CH2CH2CF3, CH2CF2CF3 и подобные. Как используется здесь, термин "низший алкокси, замещенный галогеном" обозначает группу, где алкильный остаток является таким, как определено выше, и который присоединен через атом кислорода,и где по меньшей мере один атом водорода замещен галогеном. Термин "галоген" обозначает хлор, йод, фтор и бром. Термин "циклоалкил" представляет собой алкиленовое кольцо, содержащее от 3 до 6 кольцевых атомов углерода. Термин "арил" относится к ароматическому углеродному кольцу, такому как фенильное или нафтильное кольцо, предпочтительно фенильное кольцо. Термин "гетероарил" относится к ароматическому 5-6-членному моноциклическому кольцу или 910-членному бициклическому кольцу, которое может включать 1, 2 или 3 гетероатома, выбранных из азота, кислорода и/или серы, такому как пиримидинил, пиридинил, бензотиазолил, хинолинил, хиназолинил, бензо[d][1.3]диоксолил, 5,6,7,8-тетрагидрохиназолинил, пиразолил, пиразинил, пиридазинил или 1,3,4-оксадиазолил. Термин "фармацевтически приемлемые кислотно-аддитивные соли" охватывает соли с неорганическими и органическими кислотами, такими как соляная кислота, азотная кислота, серная кислота, фосфорная кислота, лимонная кислота, муравьиная кислота, фумаровая кислота, малеиновая кислота, уксусная кислота, янтарная кислота, винная кислота, метансульфоновая кислота, п-толуолсульфоновая кислота и подобные. Одним воплощением настоящего изобретения являются соединения формулыAr представляет собой арил или гетероарил, выбранный из группы, состоящей из фенила, нафтила,пиримидинила, пиридинила, бензотиазолила, хинолинила, хиназолинила, бензо[d][1.3]диоксолила,5,6,7,8-тетрагидрохиназолинила, пиразолила или 1,3,4-оксадиазолила;R2 представляет собой водород или низший алкил;A представляет собой CR или N и R представляет собой водород, циано, галоген или низший алкил;X представляет собой связь, -CH2- или -O-; или их фармацевтические активные кислотно-аддитивные соли. Одним дополнительным воплощением изобретения являются соединения формулы I, где A пред-3 023237 ставляет собой CR и B представляет собой CH. Воплощением данной группы являются соединения формулы I, где Y представляет собой связь и Ar представляет собой фенил или нафтил, например следующие соединения: Воплощением данной группы, кроме того, являются соединения формулы I, где Y представляет собой связь и Ar представляет собой пиридинил, пиримидинил, пиразолил, бензотиазолил, хинолинил, хиназолинил, бензо[d][1.3]диоксолил, 5,6,7,8-тетрагидрохиназолинил, пиразинил, пиридазинил или 1,3,4 оксадиазолил, например следующие соединения: Воплощением данной группы являются соединения формулы I, где Y представляет собой -CH2-,-CH2CH2-, -CH(CF3)- или -CH(CH3)- и Ar представляет собой фенил или нафтил, например следующие соединения: Дополнительным воплощением данной группы являются, кроме того, соединения формулы I, где Y представляет собой -CH2-, -CH2CH2-, -CH(CF3)- или -CH(CH3)- и Ar представляет собой фурил, пиридинил, пиримидинил, пиразолил, бензотиазолил, хинолинил, хиназолинил, бензо[d][1.3]диоксолил, 5,6,7,8 тетрагидрохиназолинил или 1,3,4-оксадиазолил, например следующие соединения: Одним дополнительным воплощением изобретения являются соединения формулы I, где А представляет собой N, B представляет собой CH, Y представляет собой связь и Ar представляет собой пиридинил, пиримидинил, например следующие соединения: Одним дополнительным воплощением изобретения являются соединения формулы I, где А представляет собой CR, B представляет собой N, Y представляет собой связь и Ar представляет собой пиридинил, например следующее соединение (RS)-N-(5-бромпиридин-2-ил)-3-метил-5-(морфолин-2 ил)пиридин-2-амин. Настоящие соединения формулы I и их фармацевтически приемлемые соли могут быть получены известными в данной области техники способами, например в ходе описанных ниже процессов, согласно которым а) отщепляют N-защитную группу от соединений формулыPG представляет собой N-защитную группу, выбранную из -C(O)О-трет-бутила, и при желании переводят полученные соединения в фармацевтически приемлемые кислотноаддитивные соли. Получение соединений формулы I по настоящему изобретению может быть выполнено с помощью последовательных или сходящихся синтетических подходов. Синтезы соединений по изобретению показаны на следующих схемах 1-11 и в описании 211 конкретных примеров. Знания, необходимые для проведения реакций и очистки полученных в результате продуктов, известны квалифицированным специалистам в данной области техники. Заместители и индексы, используемые в следующем описании способов, имеют приведенные выше значения, если не указано иное. Более подробно соединения формулы I можно получить способами, приведенными ниже, способами, приведенными в примерах, или аналогичными способами. Соответствующие реакционные условия для отдельных стадий реакций известны квалифицированному специалисту в данной области техники. Последовательность реакций не ограничивается изображенной на схемах 1-11, однако в зависимости от исходных веществ и их соответствующей реакционной способности последовательность стадий реакций может быть свободно изменена. Исходные вещества либо имеются в продаже, либо могут быть получены способами, аналогичными способам, приведенным ниже, либо способами, описанными в ссылках, приведенных в описании или в примерах, либо способами, известными в данной области техники. Общая методика Схема 1 Заместители являются такими, как описано выше, и Y представляет собой -CH(CF3)-. Стадия A. Добавление трифторметильной группы к ароматическому альдегиду 2 может быть выполнено путем обработки (трифторметил)триметилсиланом в присутствии источника ионов фторида,такого как тетрабутиламмония фторид. Предпочтительными условиями являются применение ТГФ в качестве растворителя при 0C в течение 30 мин и затем при комнатной температуре в течение 2 ч. Стадия B. Превращение спирта 3 в соответствующий трифлат 4 может быть выполнено путем депротонирования с основанием, таким как NaH, KOtBu, n-BuLi, LiHMDS, NaHMDS, KHMDS или LDA, в непротонных органических растворителях, таких как ТГФ, диоксан, 1,2-диметоксиэтан, ДМФА, бензол,толуол или их смеси, при температурах от -78 до 80C в течение 15 мин - 2 ч с последующей обработкой трифторметансульфонилхлоридом. Предпочтительными условиями являются депротонирование при комнатной температуре в течение 30 мин с использованием гидрида натрия в качестве основания и диэтилового эфира в качестве растворителя с последующей обработкой трифторметансульфонилхлоридом при комнатной температуре в течение 15 мин. Стадия C. Образование связи C-N может быть выполнено путем обработки трифлата 4 ариламином 5 в присутствии основания, такого как NaH, KOtBu, n-BuLi, LiHMDS, NaHMDS, KHMDS или LDA, в непротонных органических растворителях, таких как ТГФ, диоксан, 1,2-диметоксиэтан, ДМФА, бензол,толуол или их смеси, при температурах от -78 до 80C в течение 15 мин - 24 ч. Примеры подходящих аминов 5 включают N-защищенные производные пирролидина, такие как 5-a[CAS 908334-28-1] или 5-d [пример 3(b)], производные пиперидина, такие как 5-b [CAS 875798-79-1] или 5-е [пример 4], или производные морфолина, такие как 5-c [CAS 1002726-96-6]. Предпочтительными условиями являются депротонирование амина 5 при комнатной температуре в течение 15 мин с использованием гидрида натрия в качестве основания и ТГФ в качестве растворителя с последующей обработкой трифлатом 4 при комнатной температуре в течение ночи. Стадия D. Удаление N-защитной группы ВОС может быть выполнено с неорганическими кислотами, такими как HCl, H2SO4 или Н 3 РО 4, или органическими кислотами, такими как CF3COOH,CHCl2COOH, НОАс или п-толуолсульфоновая кислота, в растворителях, таких как CH2Cl2, CHCl3, ТГФ,MeOH, EtOH или H2O, при от 0 до 80C. Предпочтительными условиями являются CF3COOH в водном ацетонитриле при 80C в течение 2 ч или 4 н. HCl в диоксане и ТГФ при 60C в течение 4 ч. Заместители являются такими, как описано выше, и Y представляет собой связь. Стадия A. Образование связи C-N может быть выполнено путем обработки арилгалида 7 или гетероарилгалида 7 ариламином 5 в присутствии палладиевого или медного катализатора, лиганда и основания в растворителях, таких как диоксан, ДМЭ, ТГФ, толуол, ДМФА и ДМСО, при повышенных температурах, например используя катализируемую палладием реакцию Бухвальда-Хартвига. Примеры подходящих аминов 5 включают N-защищенные производные пирролидина, такие как 5-a[CAS 908334-28-1], производные пиперидина, такие как 5-b [CAS 875798-79-1], или производные морфолина, такие как 5-c [CAS 1002726-96-6]. Предпочтительными условиями являются каталитический комплекс трис(дибензилиденацетон)дипалладия хлороформа, каталитический 9,9-диметил-4,5-бис(дифенилфосфино)ксантен (ксантфос) и карбонат цезия в диоксане в закрытой пробирке, нагретой при 100C в течение ночи, согласно модификации процедуры от van Leeuwen с сотрудниками (Tempahedron. Lett. 1999, 40, 3789-3790). В случае, если арилгалид 7 или гетероарилгалид 7 активируют, подвергая нуклеофильному замещению вследствие присутствия электроноакцепторных заместителей, предпочтительно в присутствии трифторметильной группы, то объединение с ариламином 5 может быть выполнено в ходе реакции этих соединений в присутствии основания, такого как диизопропилэтиламин, триэтиламин, карбонат калия или гидрид натрия, в растворителе, таком как изопропанол, диоксан, диметилацетамид или диметилформамид, при температуре между 50 и 140C в течение от 1 до 24 ч. Предпочтительными условиями являются нагревание смеси 5 и 7 с диизопропилэтиламином в изопропаноле или диметилацетамиде при 80C в течение 18 ч. Стадия B. Удаление N-защитной группы ВОС может быть выполнено с неорганическими кислотами, такими как HCl, H2SO4 или Н 3 РО 4, или органическими кислотами, такими как CF3COOH,CHCl2COOH, НОАс или п-толуолсульфоновая кислота, в растворителях, таких как CH2Cl2, CHCl3, ТГФ,MeOH, EtOH или H2O, при от 0 до 80C. Предпочтительными условиями являются CF3COOH в водном ацетонитриле при 80C в течение 2 ч или 4 н. HCl в диоксане и ТГФ при 60C в течение 16 ч. Заместители являются такими, как описано выше, и Y представляет собой -CH2- или -CH2CH2-. Стадия A. Образование связи C-N может быть выполнено в ходе реакции восстановительного аминирования, включая обработку альдегида 9 ариламином 5 в присутствии восстановителя, такого какNaBH4, LiBH4, NaBH(OAc)3 или Na(CN)BH3, в растворителе, таком как MeOH, EtOH, дихлорметан, 1,2 дихлорэтан, ТГФ, диоксан или их смеси, в присутствии активированной протонсодержащей кислоты,такой как HCl или карбоновая кислота, или активированной кислоты Льюиса, такой как ZnCl2 илиTi(OiPr)4, при температуре от -10 до 60C в течение 1-40 ч. Примеры подходящих аминов 5 включают N-защищенные производные пирролидина, такие как 5-a[CAS 908334-28-1], производные пиперидина, такие как 5-b [CAS 875798-79-1], или производные морфолина, такие как 5-c [CAS 1002726-96-6]. Предпочтительными условиями являются триацетоксиборгидрид натрия в уксусной кислоте и ТГФ при 60C в течение 3 ч. Стадия B. Удаление N-защитной группы ВОС может быть выполнено с неорганическими кислотами, такими как HCl, H2SO4 или Н 3 РО 4, или органическими кислотами, такими как CF3COOH,CHCl2COOH, НОАс или п-толуолсульфоновая кислота, в растворителях, таких как CH2Cl2, CHCl3, ТГФ,MeOH, EtOH или H2O, при от 0 до 80C. Предпочтительными условиями являются CF3COOH в водном ацетонитриле при 80C в течение 2 ч или 4 н. HCl в диоксане и ТГФ при 60C в течение 16 ч. Схема 4- 13023237 Стадия A. Образование связи C-N может быть выполнено путем обработки амина 11 арилгалидом 12 в присутствии палладиевого или медного катализатора, лиганда и основания в растворителях, таких как диоксан, ДМЭ, ТГФ, толуол, ДМФА и ДМСО, при повышенных температурах, например используя катализируемую палладием реакцию Бухвальда-Хартвига. Примеры подходящих арилгалидов 12 включают N-защищенные производные пирролидина, такие как 12-a [CAS 328546-99-2], производные пиперидина, такие как 12-b [CAS 769944-73-2], или производные морфолина, такие как 12-c [CAS 1131220-82-0]. Предпочтительными условиями являются каталитический трис(дибензилиденацетон)дипалладий(0), каталитический 2-ди-трет-бутилфосфино-2',4',6'-триизопропилбифенил и трет-бутилат натрия в диоксане в закрытой пробирке, нагретой при 120C в течение ночи. Стадия B. Удаление N-защитной группы ВОС может быть выполнено с неорганическими кислотами, такими как HCl, H2SO4 или Н 3 РО 4, или органическими кислотами, такими как CF3COOH,CHCl2COOH, НОАс или п-толуолсульфоновая кислота, в растворителях, таких как CH2Cl2, CHCl3, ТГФ,MeOH, EtOH или H2O, при от 0 до 80C. Предпочтительными условиями являются CF3COOH в водном ацетонитриле при 80C в течение 2 ч или 4 н. HCl в диоксане и ТГФ при 60C в течение 16 ч. Схема 5 Заместители являются такими, как описано выше, и X представляет собой O, Y представляет собой связь, А представляет собой С-низший алкил, B представляет собой CH, R' представляет собой водород иn представляет собой 0. Стадия A. -Галокетоны 15 могут быть получены в ходе реакции гомологизации ацилгалида 14[например гал' = хлор и алкил = метил, CAS 35675-46-8], включая последовательную обработку сначала(триметилсилил)диазометаном и затем обработку концентрированной бромисто-водородной кислотой или хлористо-водородной кислотой. Реакцию проводят, используя смесь ацетонитрила, ТГФ и гексана в качестве растворителя при температурах между 0C и комнатной температурой. Предпочтительными условиями являются смешивание реагентов при 0-5C с последующим взаимодействием в течение 1 ч при комнатной температуре для первой стадии, и смешивание реагентов при 0-5C с последующим взаимодействием в течение 30 мин при комнатной температуре для второй стадии. Стадия B. Образование эпоксида можно выполнить в ходе постадийного способа, включающего восстановление -галокетонов 15 в ходе обработки восстановителем, таким как NaBH4 или LiBH4, в растворителе, таком как MeOH, EtOH, ТГФ, диоксан, с последующей циклизацией будущего -галоспирта в- 14023237 ходе обработки основанием, таким как метилат натрия, этилат натрия, трет-бутилат калия или карбонат цезия, в том же растворителе. Предпочтительными условиями являются NaBH4 в этаноле при 5C до комнатной температуры в течение 1 ч с последующей обработкой метилатом натрия при комнатной температуре в течение 16 ч. Стадия C. Нуклеофильное раскрытие кольца может быть выполнено обработкой эпоксида 16 2 аминоэтанолом возможно в присутствии органического основания, такого как триэтиламин, N,Nдиизопропилэтиламин или N-метилморфолин, в непротонном полярном органическом растворителе, таком как эфир, ТГФ, диоксан или ТБМЭ. Предпочтительными условиями являются использование избытка 2-аминоэтанола в качестве основания в ТГФ при комнатной температуре в течение 16 ч. Стадия D. Избирательная защита аминогруппы аминоспирта 17 может быть выполнена при обработке ди-трет-бутилкарбонатом возможно в присутствии органического основания, такого как триэтиламин, N,N-диизопропилэтиламин или N-метилморфолин, в галогензамещенных растворителях, таких как дихлорметан или 1,2-дихлорэтан, или эфирных растворителях, таких как диэтиловый эфир, диоксан,ТГФ или ТБМЭ. Предпочтительными условиями являются ТГФ в отсутствии основания при комнатной температуре в течение 16 ч. Стадия E. Циклизацию можно выполнить в ходе постадийного процесса, включающего образование сульфоната при обработке диола 18 одним эквивалентом метансульфонилхлорида в присутствии органического основания, такого как триэтиламин, N,N-диизопропилэтиламин или N-метилморфолин, в эфирных растворителях, таких как диэтиловый эфир, диоксан, ТГФ или ТБМЭ, с последующей циклизацией при обработке ненуклеофильным основанием, таким как трет-бутилат калия или 2-метил-2-бутилат калия, в эфирных растворителях, таких как диэтиловый эфир, диоксан, ТГФ или ТБМЭ. Предпочтительными условиями для первой стадии являются триэтиламин в ТГФ, смешанном с реагентами при 0-5C, и затем взаимодействие в течение 1 ч при комнатной температуре, затем удаление побочного продукта гидрохлорида триэтиламина в ходе фильтрации. Предпочтительными условиями для второй стадии являются 2-метил-2-бутилат калия в ТГФ, смешанном с реагентами при 0-5C, и затем взаимодействие в течение 30 мин при комнатной температуре. Стадия F. Восстановление нитрогруппы 19 можно выполнить при гидрировании водородом при нормальном или повышенном давлении или в ходе трансферного гидрирования, используя формиат аммония или циклогексадиен в качестве источника водорода, с катализатором, таким как PtO2, Pd-C или никель Ренея, в растворителях, таких как MeOH, EtOH, H2O, диоксан, ТГФ, HOAc, EtOAc CH2Cl2, CHCl3,ДМФА, или их смеси. Предпочтительными условиями являются формиат аммония в присутствии палладия на угле вMeOH при 60C в течение 1 ч. Стадия G. Образование связи C-N может быть выполнено путем обработки арилгалида 7 ариламином 20 в присутствии палладиевого или медного катализатора, лиганда и основания в растворителях,таких как диоксан, ДМЭ, ТГФ, толуол, ДМФА и ДМСО, при повышенных температурах, например используя катализируемую палладием реакцию Бухвальда-Хартвига. Предпочтительными условиями являются каталитический комплекс трис(дибензилиденацетон)дипалладия хлороформа, каталитический 9,9-диметил-4,5-бис(дифенилфосфино)ксантен (ксантфос) и карбонат цезия в диоксане в закрытой пробирке, нагретой при 80C в течение 1 ч, согласно модификации процедуры по van Leeuwen с сотрудниками (Tempahedron. Lett. 1999, 40, 3789-3790). Стадия H. Удаление N-защитной группы ВОС может быть выполнено с неорганическими кислотами, такими как HCl, H2SO4 или Н 3 РО 4, или органическими кислотами, такими как CF3COOH,CHCl2COOH, HOAc или п-толуолсульфоновая кислота, в растворителях, таких как CH2Cl2, CHCl3, ТГФ,MeOH, EtOH или H2O, при от 0 до 80C. Предпочтительными условиями являются CF3COOH в водном ацетонитриле при 80C в течение 2 ч или 4 н. HCl в диоксане и ТГФ при 60C в течение 16 ч. Заместители являются такими, как описано выше, и X представляет собой O, Y представляет собой связь, А представляет собой N, B представляет собой CH, R' представляет собой водород и n представляет собой 0. Стадия A. -Галокетоны 23 могут быть получены в ходе реакции гомологизации ацилхлорида 22[CAS 58757-38-3], включая последовательную обработку сначала (триметилсилил)диазометаном и затем обработку концентрированной бромисто-водородной кислотой или хлористо-водородной кислотой. Реакцию проводят, используя смесь ацетонитрила, ТГФ и гексана в качестве растворителя при температурах между 0C и комнатной температурой. Предпочтительными условиями являются смешивание реагентов при 0-5C с последующим взаимодействием в течение 1 ч при комнатной температуре для первой стадии и смешивание реагентов при 0-5C с последующим взаимодействием в течение 30 мин при комнатной температуре для второй стадии. Стадия B. Образование эпоксида можно выполнить в ходе постадийного способа, включающего восстановление -галокетонов 23 в ходе обработки восстановителем, таким как NaBH4 или LiBH4, в растворителе, таком как MeOH, EtOH, ТГФ, диоксан, с последующей циклизацией будущего -галоспирта в ходе обработки основанием, таким как метилат натрия, этилат натрия, трет-бутилат калия или карбонат цезия, в том же растворителе. Предпочтительными условиями являются NaBH4 в этаноле при 5C до комнатной температуры в течение 1 ч с последующей обработкой метилатом натрия при комнатной температуре в течение 16 ч. Стадия C. Нуклеофильное раскрытие кольца может быть выполнено обработкой эпоксида 24 2 аминоэтанолом возможно в присутствии органического основания, такого как триэтиламин, N,Nдиизопропилэтиламин или N-метилморфолин, в непротонном полярном органическом растворителе, таком как эфир, ТГФ, диоксан или ТБМЭ. Предпочтительными условиями являются использование избытка 2-аминоэтанола в качестве основания в ТГФ при комнатной температуре в течение 16 ч. Стадия D. Избирательная защита аминогруппы аминоспирта 25 может быть выполнена при обра- 16023237 ботке ди-трет-бутилкарбонатом возможно в присутствии органического основания, такого как триэтиламин, N,N-диизопропилэтиламин или N-метилморфолин, в галогензамещенных растворителях, таких как дихлорметан или 1,2-дихлорэтан, или эфирных растворителях, таких как диэтиловый эфир, диоксан,ТГФ или ТБМЭ. Предпочтительными условиями являются ТГФ в отсутствии основания при комнатной температуре в течение 16 ч. Стадия E. Циклизацию можно выполнить в ходе постадийного процесса, включающего образование сульфоната при обработке диола 26 одним эквивалентом метансульфонилхлорида в присутствии органического основания, такого как триэтиламин, N,N-диизопропилэтиламин или N-метилморфолин, в эфирных растворителях, таких как диэтиловый эфир, диоксан, ТГФ или ТБМЭ, с последующей циклизацией при обработке ненуклеофильным основанием, таким как трет-бутилат калия или 2-метил-2-бутилат калия, в эфирных растворителях, таких как диэтиловый эфир, диоксан, ТГФ или ТБМЭ. Предпочтительными условиями для первой стадии являются триэтиламин в ТГФ, смешанном с реагентами при 0-5C, и затем взаимодействие в течение 2,5 ч при комнатной температуре, затем удаление побочного продукта гидрохлорида триэтиламина в ходе фильтрации. Предпочтительными условиями для второй стадии являются 2-метил-2-бутилат калия в ТГФ, смешанном с реагентами при 0-5C, и затем взаимодействие в течение 15 мин при комнатной температуре. Стадия F. Образование связи C-N может быть выполнено путем обработки 27 бензофенонимином в присутствии палладиевого или медного катализатора, лиганда и основания в растворителях, таких как диоксан, ДМЭ, ТГФ, толуол, ДМФА и ДМСО, при повышенных температурах, например используя катализируемую палладием реакцию Бухвальда-Хартвига. Предпочтительными условиями являются каталитический трис(дибензилиденацетон)дипалладий(0), каталитический (R)-(+)-2,2'-бис(дифенилфосфино)-1,1'-бинафтил и трет-бутилат натрия в диоксане при 100C в течение 16 ч. Стадия G. Удаление азот-защитной группы 28 можно выполнить при гидрировании водородом при нормальном или повышенном давлении или в ходе трансферного гидрирования, используя формиат аммония или циклогексадиен в качестве источника водорода, с катализатором, таким как PtO2, Pd-C или никель Ренея, в растворителях, таких как MeOH, EtOH, H2O, диоксан, ТГФ, HOAc, EtOAc, CH2Cl2,CHCl3, ДМФА или их смеси. Предпочтительными условиями являются формиат аммония в присутствии палладия на угле вMeOH при 60C в течение 1 ч. Стадия H. Образование связи C-N может быть выполнено путем обработки арилгалида 7 ариламином 29 в присутствии палладиевого или медного катализатора, лиганда и основания в растворителях,таких как диоксан, ДМЭ, ТГФ, толуол, ДМФА и ДМСО, при повышенных температурах, например используя катализируемую палладием реакцию Бухвальда-Хартвига. Предпочтительными условиями являются каталитический комплекс трис(дибензилиденацетон)дипалладия хлороформа, каталитический 9,9-диметил-4,5-бис(дифенилфосфино)ксантен (ксантфос) и карбонат цезия в диоксане в закрытой пробирке, нагретой при 100C в течение 16 ч, согласно модификации процедуры по van Leeuwen с сотрудниками (Tempahedron. Lett. 1999, 40, 3789-3790). Стадия I. Удаление N-защитной группы ВОС может быть выполнено с неорганическими кислотами,такими как HCl, H2SO4 или Н 3 РО 4, или органическими кислотами, такими как CF3COOH, CHCl2COOH,HOAc или п-толуолсульфоновая кислота, в растворителях, таких как CH2Cl2, CHCl3, ТГФ, MeOH, EtOH или H2O, при от 0 до 80C. Предпочтительными условиями являются CF3COOH в водном ацетонитриле при 80C в течение 2 ч или 4 н. HCl в диоксане и ТГФ при 60C в течение 16 ч. Заместители являются такими, как описано выше, и X представляет собой O, Y представляет собой связь, A представляет собой C-алкил, B представляет собой N, R' представляет собой водород и n представляет собой 0. Стадия A. Образование эпоксида может быть выполнено в ходе реакции Кори-Чайковского альдегидов 31 [например алкил = метил, CAS 885167-81-7] при обработке иодидом триметилсульфония в присутствии основания, такого как гидрид натрия, в непротонном полярном органическом растворителе,таком как ДМСО или ДМФА. Предпочтительными условиями являются гидрид натрия в ДМСО при 0C в течение 30 мин и затем при комнатной температуре в течение 16 ч. Стадия B. Нуклеофильное раскрытие кольца может быть выполнено обработкой эпоксида 32 2 аминоэтанолом возможно в присутствии органического основания, такого как триэтиламин, N,Nдиизопропилэтиламин или N-метилморфолин, в непротонном полярном органическом растворителе, таком как эфир, ТГФ, диоксан или ТБМЭ. Предпочтительными условиями являются использование избытка 2-аминоэтанола в качестве основания в ТГФ при комнатной температуре в течение 16 ч. Стадия C. Избирательная защита аминогруппы аминоспирта 33 может быть выполнена при обработке ди-трет-бутилкарбонатом возможно в присутствии органического основания, такого как триэтиламин, N,N-диизопропилэтиламин или N-метилморфолин, в галогензамещенных растворителях, таких как дихлорметан или 1,2-дихлорэтан, или эфирных растворителях, таких как диэтиловый эфир, диоксан,ТГФ или ТБМЭ. Предпочтительными условиями являются ТГФ в отсутствии основания при комнатной температуре в течение 7 ч. Стадия D. Циклизацию можно выполнить в ходе постадийного процесса, включающего образование сульфоната при обработке диола 34 одним эквивалентом метансульфонилхлорида в присутствии органического основания, такого как триэтиламин, N,N-диизопропилэтиламин или N-метилморфолин, в эфирных растворителях, таких как диэтиловый эфир, диоксан, ТГФ или ТБМЭ, с последующей циклизацией при обработке ненуклеофильным основанием, таким как трет-бутилат калия или 2-метил-2-бутилат калия, в эфирных растворителях, таких как диэтиловый эфир, диоксан, ТГФ или ТБМЭ. Предпочтительными условиями для первой стадии являются триэтиламин в ТГФ, смешанном с реагентами при 0-5C, и затем взаимодействие в течение 15 мин при комнатной температуре, затем удале- 18023237 ние побочного продукта гидрохлорида триэтиламина в ходе фильтрации. Предпочтительными условиями для второй стадии являются 2-метил-2-бутилат калия в ТГФ, смешанном с реагентами при 0-5C и затем взаимодействие в течение 10 мин при комнатной температуре. Стадия E. Образование связи C-N может быть выполнено путем обработки 35 бензофенонимином в присутствии палладиевого или медного катализатора, лиганда и основания в растворителях, таких как диоксан, ДМЭ, ТГФ, толуол, ДМФА и ДМСО, при повышенных температурах, например используя катализируемую палладием реакцию Бухвальда-Хартвига. Предпочтительными условиями являются каталитический трис(дибензилиденацетон)дипалладий(0), каталитический (R)-(+)-2,2'-бис(дифенилфосфино)-1,1'-бинафтил и трет-бутилат натрия в диоксане при 100C в течение 16 ч. Стадия F. Удаление азот-защитной группы 36 можно выполнить при гидрировании водородом при нормальном или повышенном давлении или в ходе трансферного гидрирования, используя формиат аммония или циклогексадиен в качестве источника водорода, с катализатором, таким как PtO2, Pd-C или никель Ренея, в растворителях, таких как MeOH, EtOH, H2O, диоксан, ТГФ, HOAc, EtOAc, CH2Cl2,CHCl3, ДМФА или их смеси. Предпочтительными условиями являются формиат аммония в присутствии палладия на угле вMeOH при 80C в течение 2 ч. Стадия G. Образование связи C-N может быть выполнено путем обработки арилгалида 7 ариламином 37 в присутствии палладиевого или медного катализатора, лиганда и основания в растворителях,таких как диоксан, ДМЭ, ТГФ, толуол, ДМФА и ДМСО, при повышенных температурах, например используя катализируемую палладием реакцию Бухвальда-Хартвига. Предпочтительными условиями являются каталитический комплекс трис(дибензилиденацетон)дипалладия хлороформа, каталитический 9,9-диметил-4,5-бис(дифенилфосфино)ксантен (ксантфос) и карбонат цезия в диоксане в закрытой пробирке, нагретой при 100C в течение 16 ч, согласно модификации процедуры по van Leeuwen с сотрудниками (Tempahedron. Lett. 1999, 40, 3789-3790). Стадия H. Удаление N-защитной группы ВОС может быть выполнено с неорганическими кислотами, такими как HCl, H2SO4 или Н 3 РО 4, или органическими кислотами, такими как CF3COOH,CHCl2COOH, HOAc или п-толуолсульфоновая кислота, в растворителях, таких как CH2Cl2, CHCl3, ТГФ,MeOH, EtOH или H2O, при от 0 до 80C. Предпочтительными условиями являются CF3COOH в водном ацетонитриле при 80C в течение 3 ч или 4 н. HCl в диоксане и ТГФ при 60C в течение 16 ч. Схема 8- 19023237 связь, А представляет собой C-F, B представляет собой CH, R' представляет собой водород и n представляет собой 0. Стадия A. -Галокетоны 40 могут быть получены в ходе реакции гомологизации ацилхлорида 39[CAS 695188-21-7], включая последовательную обработку сначала (триметилсилил)диазометаном и затем обработку концентрированной бромисто-водородной кислотой или хлористо-водородной кислотой. Реакцию проводят, используя смесь ацетонитрила, ТГФ и гексана в качестве растворителя при температурах между 0C и комнатной температурой. Предпочтительными условиями являются смешивание реагентов при 0-5C с последующим взаимодействием в течение 30 мин при комнатной температуре для первой стадии и смешивание реагентов при 0-5C с последующим взаимодействием в течение 1 ч при комнатной температуре для второй стадии. Стадия B. Образование эпоксида можно выполнить в ходе постадийного способа, включающего восстановление -галокетонов 40 в ходе обработки восстановителем, таким как NaBH4 или LiBH4, в растворителе, таком как MeOH, EtOH, ТГФ, диоксан, с последующей циклизацией будущего -галоспирта в ходе обработки основанием, таким как метилат натрия, этилат натрия, трет-бутилат калия или карбонат цезия, в том же растворителе. Предпочтительными условиями являются NaBH4 в этаноле при 5C до комнатной температуры в течение 1 ч с последующей обработкой метилатом натрия при комнатной температуре в течение 16 ч и затем при 40C в течение 1 ч. Стадия C. Нуклеофильное раскрытие кольца может быть выполнено обработкой эпоксида 41 2 аминоэтанолом возможно в присутствии органического основания, такого как триэтиламин, N,Nдиизопропилэтиламин или N-метилморфолин, в непротонном полярном органическом растворителе, таком как эфир, ТГФ, диоксан или ТБМЭ. Предпочтительными условиями являются использование избытка 2-аминоэтанола в качестве основания в ТГФ при комнатной температуре в течение 16 ч. Стадия D. Избирательная защита аминогруппы аминоспирта 42 может быть выполнена при обработке ди-трет-бутилкарбонатом возможно в присутствии органического основания, такого как триэтиламин, N,N-диизопропилэтиламин или N-метилморфолин, в галогензамещенных растворителях, таких как дихлорметан или 1,2-дихлорэтан, или эфирных растворителях, таких как диэтиловый эфир, диоксан,ТГФ или ТБМЭ. Предпочтительными условиями являются дихлорметан в отсутствии основания при комнатной температуре в течение 16 ч. Стадия E. Циклизацию можно выполнить в ходе постадийного процесса, включающего образование сульфоната при обработке диола 43 1 экв. метансульфонилхлорида в присутствии органического основания, такого как триэтиламин, N,N-диизопропилэтиламин или N-метилморфолин, в эфирных растворителях, таких как диэтиловый эфир, диоксан, ТГФ или ТБМЭ, с последующей циклизацией при обработке ненуклеофильным основанием, таким как трет-бутилат калия или 2-метил-2-бутилат калия, в эфирных растворителях, таких как диэтиловый эфир, диоксан, ТГФ или ТБМЭ. Предпочтительными условиями для первой стадии являются триэтиламин в ТГФ, смешанном с реагентами при 0-5C и затем взаимодействие в течение 30 мин при комнатной температуре, затем удаление побочного продукта гидрохлорида триэтиламина в ходе фильтрации. Предпочтительными условиями для второй стадии являются 2-метил-2-бутилат калия в ТГФ, смешанном с реагентами при 0-5C, и затем взаимодействие в течение 1 ч при комнатной температуре. Стадия F. Образование связи C-N может быть выполнено путем обработки 44 бензофенонимином в присутствии палладиевого или медного катализатора, лиганда и основания в растворителях, таких как диоксан, ДМЭ, ТГФ, толуол, ДМФА и ДМСО, при повышенных температурах, например используя катализируемую палладием реакцию Бухвальда-Хартвига. Предпочтительными условиями являются каталитический трис(дибензилиденацетон)дипалладий(0), каталитический (R)-(+)-2,2'-бис(дифенилфосфино)-1,1'-бинафтил и трет-бутилат натрия в диоксане при 100C в течение 1 ч. Стадия G. Удаление азот-защитной группы 45 можно выполнить при гидрировании водородом при нормальном или повышенном давлении или в ходе трансферного гидрирования, используя формиат аммония или циклогексадиен в качестве источника водорода, с катализатором, таким как PtO2, Pd-C или никель Ренея, в растворителях, таких как MeOH, EtOH, H2O, диоксан, ТГФ, HOAc, EtOAc, CH2Cl2,CHCl3, ДМФА или их смеси. Предпочтительными условиями являются формиат аммония в присутствии палладия на угле вMeOH при 60C в течение 1 ч. Стадия H. Образование связи C-N может быть выполнено путем обработки арилгалида 7 ариламином 46 в присутствии палладиевого или медного катализатора, лиганда и основания в растворителях,таких как диоксан, ДМЭ, ТГФ, толуол, ДМФА и ДМСО, при повышенных температурах, например используя катализируемую палладием реакцию Бухвальда-Хартвига. Предпочтительными условиями являются каталитический комплекс трис(дибензилиденацетон)ди- 20023237 палладия хлороформа, каталитический 9,9-диметил-4,5-бис(дифенилфосфино)ксантен (ксантфос) и карбонат цезия в диоксане в закрытой пробирке, нагретой при 120C в течение 2 ч, согласно модификации процедуры по van Leeuwen с сотрудниками (Tempahedron. Lett. 1999, 40, 3789-3790). Стадия H'. Образование C-N связи, что дает би-ариламин 47, альтернативно может быть выполнено непосредственно из арилбромида 44 при обработке арилбромида 44 ариламином 11' в присутствии палладиевого или медного катализатора, лиганда и основания в растворителях, таких как диоксан, ДМЭ,ТГФ, толуол, ДМФА и ДМСО, при повышенных температурах, например используя катализируемую палладием реакцию Бухвальда-Хартвига. Предпочтительными условиями являются каталитический трис(дибензилиденацетон)дипалладий(0), каталитический 2-ди-трет-бутилфосфино-2',4',6'-триизопропилбифенил и трет-бутилат натрия в диоксане при 120C в течение 16 ч. Стадия I. Удаление N-защитной группы ВОС может быть выполнено с неорганическими кислотами,такими как HCl, H2SO4 или Н 3 РО 4, или органическими кислотами, такими как CF3COOH, CHCl2COOH,HOAc или п-толуолсульфоновая кислота, в растворителях, таких как CH2Cl2, CHCl3, ТГФ, MeOH, EtOH или H2O, при от 0 до 80C. Предпочтительными условиями являются CF3COOH в водном ацетонитриле при 80C в течение 3 ч или 4 н. HCl в диоксане и ТГФ при 60C в течение 16 ч. Схема 9 Заместители являются такими, как описано выше, и X представляет собой O, Y представляет собой связь, А представляет собой C-Cl, B представляет собой CH, R' представляет собой водород и n представляет собой 0. Стадия A. -Галокетоны 49 могут быть получены в ходе реакции гомологизации ацилхлорида 48[CAS 21900-32-3], включая последовательную обработку сначала (триметилсилил)диазометаном и затем обработку концентрированной бромисто-водородной кислотой или хлористо-водородной кислотой. Реакцию проводят, используя смесь ацетонитрила, ТГФ и гексана в качестве растворителя при температурах между 0C и комнатной температурой. Предпочтительными условиями являются смешивание реагентов при 0-5C с последующим взаимодействием в течение 30 мин при комнатной температуре для первой стадии и смешивание реагентов при 0-5C с последующим взаимодействием в течение 30 мин при комнатной температуре для второй стадии.- 21023237 Стадия B. Образование эпоксида можно выполнить в ходе постадийного способа, включающего восстановление -галокетонов 49 в ходе обработки восстановителем, таким как NaBH4 или LiBH4, в растворителе, таком как MeOH, EtOH, ТГФ, диоксан, с последующей циклизацией будущего -галоспирта в ходе обработки основанием, таким как метилат натрия, этилат натрия, трет-бутилат калия или карбонат цезия, в том же растворителе. Предпочтительными условиями являются NaBH4 в этаноле при 5C до комнатной температуры в течение 90 мин с последующей обработкой метилатом натрия при 50C в течение 4 ч. Стадия C. Нуклеофильное раскрытие кольца может быть выполнено обработкой эпоксида 50 2 аминоэтанолом возможно в присутствии органического основания, такого как триэтиламин, N,Nдиизопропилэтиламин или N-метилморфолин, в непротонном полярном органическом растворителе, таком как эфир, ТГФ, диоксан или ТБМЭ. Предпочтительными условиями являются использование избытка 2-аминоэтанола в качестве основания в ТГФ при комнатной температуре в течение 7 ч. Стадия D. Избирательная защита аминогруппы аминоспирта 51 может быть выполнена при обработке ди-трет-бутилкарбонатом возможно в присутствии органического основания, такого как триэтиламин, N,N-диизопропилэтиламин или N-метилморфолин, в галогензамещенных растворителях, таких как дихлорметан или 1,2-дихлорэтан, или эфирных растворителях, таких как диэтиловый эфир, диоксан,ТГФ или ТБМЭ. Предпочтительными условиями являются дихлорметан в отсутствии основания при комнатной температуре в течение 16 ч. Стадия E. Циклизацию можно выполнить в ходе постадийного процесса, включающего образование сульфоната при обработке диола 52 одним эквивалентом метансульфонилхлорида в присутствии органического основания, такого как триэтиламин, N,N-диизопропилэтиламин или N-метилморфолин, в эфирных растворителях, таких как диэтиловый эфир, диоксан, ТГФ или ТБМЭ, с последующей циклизацией при обработке ненуклеофильным основанием, таким как трет-бутилат калия или 2-метил-2-бутилат калия, в эфирных растворителях, таких как диэтиловый эфир, диоксан, ТГФ или ТБМЭ. Предпочтительными условиями для первой стадии являются триэтиламин в ТГФ, смешанном с реагентами при 0-5C, и затем взаимодействие в течение 1 ч при комнатной температуре, затем удаление побочного продукта гидрохлорида триэтиламина в ходе фильтрации. Предпочтительными условиями для второй стадии являются 2-метил-2-бутилат калия в ТГФ, смешанном с реагентами при 0-5C, и затем взаимодействие в течение 30 мин при комнатной температуре. Стадия F. Образование связи C-N может быть выполнено путем обработки 53 бензофенонимином в присутствии палладиевого или медного катализатора, лиганда и основания в растворителях, таких как диоксан, ДМЭ, ТГФ, толуол, ДМФА и ДМСО, при повышенных температурах, например используя катализируемую палладием реакцию Бухвальда-Хартвига. Предпочтительными условиями являются каталитический трис(дибензилиденацетон)дипалладий(0), каталитический (R)-(+)-2,2'-бис(дифенилфосфино)-1,1'-бинафтил и трет-бутилат натрия в диоксане при 90C в течение 16 ч. Стадия G. Удаление азот-защитной группы 54 можно выполнить при обработке гидрохлоридом гидроксиламина в присутствии основания, такого как ацетат натрия или метилат натрия, в растворителях, таких как MeOH, EtOH, H2O, диоксан, ТГФ, HOAc, EtOAc, CH2Cl2, CHCl3, ДМФА или их смеси. Предпочтительными условиями являются гидрохлорид гидроксиламина в присутствии ацетата натрия в MeOH при 60C в течение 1 ч. Стадия H. Образование связи C-N может быть выполнено путем обработки арилгалида 7 ариламином 55 в присутствии палладиевого или медного катализатора, лиганда и основания в растворителях,таких как диоксан, ДМЭ, ТГФ, толуол, ДМФА и ДМСО, при повышенных температурах, например используя катализируемую палладием реакцию Бухвальда-Хартвига. Предпочтительными условиями являются каталитический комплекс трис(дибензилиденацетон)дипалладия хлороформа, каталитический 9,9-диметил-4,5-бис(дифенилфосфино)ксантен (ксантфос) и карбонат цезия в диоксане в закрытой пробирке, нагретой при 120C в течение 16 ч, согласно модификации процедуры по van Leeuwen с сотрудниками (Tempahedron. Lett. 1999, 40, 3789-3790). Стадия Н'. Образование C-N связи, что дает би-ариламин 56, альтернативно может быть выполнено непосредственно из арилбромида 53 при обработке арилбромида 53 ариламином 11' в присутствии палладиевого или медного катализатора, лиганда и основания в растворителях, таких как диоксан, ДМЭ,ТГФ, толуол, ДМФА и ДМСО, при повышенных температурах, например используя катализируемую палладием реакцию Бухвальда-Хартвига. Предпочтительными условиями являются каталитический трис(дибензилиденацетон)дипалладий(0), каталитический 2-ди-трет-бутилфосфино-2',4',6'-триизопропилбифенил и трет-бутилат натрия в диоксане при 120C в течение 16 ч. Стадия I. Удаление N-защитной группы ВОС может быть выполнено с неорганическими кислотами,такими как HCl, H2SO4 или Н 3 РО 4, или органическими кислотами, такими как CF3COOH, CHCl2COOH,- 22023237HOAc или п-толуолсульфоновая кислота, в растворителях, таких как CH2Cl2, CHCl3, ТГФ, MeOH, EtOH или H2O, при от 0 до 80C. Предпочтительными условиями являются CF3COOH в водном ацетонитриле при 80C в течение 3 ч или 4 н. HCl в диоксане и ТГФ при 60C в течение 16 ч. Схема 10 Заместители являются такими, как описано выше, и X представляет собой O, Y представляет собой связь, А представляет собой CH, R' представляет собой F, B представляет собой CH и n представляет собой 0. Стадия A. -Галокетоны 58 могут быть получены в ходе реакции гомологизации ацилхлорида 57[CAS 151982-51-3], включая последовательную обработку сначала (триметилсилил)диазометаном и затем обработку концентрированной бромисто-водородной кислотой или хлористо-водородной кислотой. Реакцию проводят, используя смесь ацетонитрила, ТГФ и гексана в качестве растворителя при температурах между 0C и комнатной температурой. Предпочтительными условиями являются смешивание реагентов при 0-5C с последующим взаимодействием в течение 30 мин при комнатной температуре для первой стадии и смешивание реагентов при 0-5C с последующим взаимодействием в течение 1 ч при комнатной температуре для второй стадии. Стадия B. Образование эпоксида можно выполнить в ходе постадийного способа, включающего восстановление -галокетонов 58 в ходе обработки восстановителем, таким как NaBH4 или LiBH4, в растворителе, таком как MeOH, EtOH, ТГФ, диоксан, с последующей циклизацией будущего -галоспирта в ходе обработки основанием, таким как метилат натрия, этилат натрия, трет-бутилат калия или карбонат цезия, в том же растворителе. Предпочтительными условиями являются NaBH4 в этаноле при 5C до комнатной температуры в течение 1 ч с последующей обработкой метилатом натрия при комнатной температуре в течение 16 ч. Стадия C. Нуклеофильное раскрытие кольца может быть выполнено обработкой эпоксида 59 2 аминоэтанолом возможно в присутствии органического основания, такого как триэтиламин, N,Nдиизопропилэтиламин или N-метилморфолин, в непротонном полярном органическом растворителе, таком как эфир, ТГФ, диоксан или ТБМЭ. Предпочтительными условиями являются использование избытка 2-аминоэтанола в качестве основания в ТГФ при комнатной температуре в течение 16 ч. Стадия D. Избирательная защита аминогруппы аминоспирта 60 может быть выполнена при обра- 23023237 ботке ди-трет-бутилкарбонатом возможно в присутствии органического основания, такого как триэтиламин, N,N-диизопропилэтиламин или N-метилморфолин, в галогензамещенных растворителях, таких как дихлорметан или 1,2-дихлорэтан, или эфирных растворителях, таких как диэтиловый эфир, диоксан,ТГФ или ТБМЭ. Предпочтительными условиями являются дихлорметан в отсутствие основания при комнатной температуре в течение 16 ч. Стадия E. Циклизацию можно выполнить в ходе постадийного процесса, включающего образование сульфоната при обработке диола 61 1 экв. метансульфонилхлорида в присутствии органического основания, такого как триэтиламин, N,N-диизопропилэтиламин или N-метилморфолин, в эфирных растворителях, таких как диэтиловый эфир, диоксан, ТГФ или ТБМЭ, с последующей циклизацией при обработке ненуклеофильным основанием, таким как трет-бутилат калия или 2-метил-2-бутилат калия, в эфирных растворителях, таких как диэтиловый эфир, диоксан, ТГФ или ТБМЭ. Предпочтительными условиями для первой стадии являются триэтиламин в ТГФ, смешанном с реагентами при 0-5C, и затем взаимодействие в течение 1 ч при комнатной температуре, затем удаление побочного продукта гидрохлорида триэтиламина в ходе фильтрации. Предпочтительными условиями для второй стадии являются 2-метил-2-бутилат калия в ТГФ, смешанном с реагентами при 0-5C, и затем взаимодействие в течение 20 мин при комнатной температуре. Стадия F. Образование связи C-N может быть выполнено путем обработки 62 бензофенонимином в присутствии палладиевого или медного катализатора, лиганда и основания в растворителях, таких как диоксан, ДМЭ, ТГФ, толуол, ДМФА и ДМСО, при повышенных температурах, например используя катализируемую палладием реакцию Бухвальда-Хартвига. Предпочтительными условиями являются каталитический трис(дибензилиденацетон)дипалладий(0), каталитический (R)-(+)-2,2'-бис(дифенилфосфино)-1,1'-бинафтил и трет-бутилат натрия в диоксане при 90C в течение 90 мин. Стадия G. Удаление азот-защитной группы 63 можно выполнить при обработке гидрохлоридом гидроксиламина в присутствии основания, такого как ацетат натрия или метилат натрия, в растворителях, таких как MeOH, EtOH, H2O, диоксан, ТГФ, HOAc, EtOAc, CH2Cl2, CHCl3, ДМФА или их смеси. Предпочтительными условиями являются гидрохлорид гидроксиламина в присутствии ацетата натрия в MeOH при 50C в течение 16 ч. Стадия H. Образование связи C-N может быть выполнено путем обработки арилгалида 7 ариламином 64 в присутствии палладиевого или медного катализатора, лиганда и основания в растворителях,таких как диоксан, ДМЭ, ТГФ, толуол, ДМФА и ДМСО, при повышенных температурах, например используя катализируемую палладием реакцию Бухвальда-Хартвига. Предпочтительными условиями являются каталитический комплекс трис(дибензилиденацетон)дипалладия хлороформа, каталитический 9,9-диметил-4,5-бис(дифенилфосфино)ксантен (ксантфос) и карбонат цезия в диоксане в закрытой пробирке, нагретой при 120C в течение 3 ч, согласно модификации процедуры по van Leeuwen с сотрудниками (Tempahedron. Lett. 1999, 40, 3789-3790). Стадия Н'. Образование C-N связи, что дает би-ариламин 56, альтернативно может быть выполнено непосредственно из арилбромида 53 при обработке арилбромида 53 ариламином 11' в присутствии палладиевого или медного катализатора, лиганда и основания в растворителях, таких как диоксан, ДМЭ,ТГФ, толуол, ДМФА и ДМСО, при повышенных температурах, например используя катализируемую палладием реакцию Бухвальда-Хартвига. Предпочтительными условиями являются каталитический трис(дибензилиденацетон)дипалладий(0), каталитический 2-ди-трет-бутилфосфино-2',4',6'-триизопропилбифенил и трет-бутилат натрия в диоксане при 100C в течение 2 ч. Стадия I. Удаление N-защитной группы ВОС может быть выполнено с неорганическими кислотами,такими как HCl, H2SO4 или Н 3 РО 4, или органическими кислотами, такими как CF3COOH, CHCl2COOH,HOAc или п-толуолсульфоновая кислота, в растворителях, таких как CH2Cl2, CHCl3, ТГФ, MeOH, EtOH или H2O, при от 0 до 80C. Предпочтительными условиями являются CF3COOH в водном ацетонитриле при 80C в течение 16 ч или 4 н. HCl в диоксане и ТГФ при 60C в течение 16 ч. Заместители являются такими, как описано выше, и X представляет собой O, Y представляет собой связь, A представляет собой CH, R' представляет собой Cl, B представляет собой CH и n представляет собой 0. Стадия A. -Галокетоны 67 могут быть получены в ходе реакции гомологизации ацилхлорида 66[CAS 21900-55-0], включая последовательную обработку сначала (триметилсилил)диазометаном и затем обработку концентрированной бромисто-водородной кислотой или хлористо-водородной кислотой. Реакцию проводят, используя смесь ацетонитрила, ТГФ и гексана в качестве растворителя при температурах между 0C и комнатной температурой. Предпочтительными условиями являются смешивание реагентов при 0-5C с последующим взаимодействием в течение 30 мин при комнатной температуре для первой стадии и смешивание реагентов при 0-5C с последующим взаимодействием в течение 30 мин при комнатной температуре для второй стадии. Стадия B. Образование эпоксида можно выполнить в ходе постадийного способа, включающего восстановление -галокетонов 67 в ходе обработки восстановителем, таким как NaBH4 или LiBH4, в растворителе, таком как MeOH, EtOH, ТГФ, диоксан, с последующей циклизацией будущего -галоспирта в ходе обработки основанием, таким как метилат натрия, этилат натрия, трет-бутилат калия или карбонат цезия, в том же растворителе. Предпочтительными условиями являются NaBH4 в этаноле при 5C до комнатной температуры в течение 90 мин с последующей обработкой метилатом натрия при 50C в течение 4 ч. Стадия C. Нуклеофильное раскрытие кольца может быть выполнено обработкой эпоксида 68 2 аминоэтанолом возможно в присутствии органического основания, такого как триэтиламин, N,Nдиизопропилэтиламин или N-метилморфолин, в непротонном полярном органическом растворителе, таком как эфир, ТГФ, диоксан или ТБМЭ. Предпочтительными условиями являются использование избытка 2-аминоэтанола в качестве основания в ТГФ при комнатной температуре в течение 7 ч. Стадия D. Избирательная защита аминогруппы аминоспирта 69 может быть выполнена при обработке ди-трет-бутилкарбонатом возможно в присутствии органического основания, такого как триэтиламин, N,N-диизопропилэтиламин или N-метилморфолин, в галогензамещенных растворителях, таких как дихлорметан или 1,2-дихлорэтан, или эфирных растворителях, таких как диэтиловый эфир, диоксан,- 25023237 ТГФ или ТБМЭ. Предпочтительными условиями являются дихлорметан в отсутствие основания при комнатной температуре в течение 16 ч. Стадия E. Циклизацию можно выполнить в ходе постадийного процесса, включающего образование сульфоната при обработке диола 70 1 экв. метансульфонилхлорида в присутствии органического основания, такого как триэтиламин, N,N-диизопропилэтиламин или N-метилморфолин, в эфирных растворителях, таких как диэтиловый эфир, диоксан, ТГФ или ТБМЭ, с последующей циклизацией при обработке ненуклеофильным основанием, таким как трет-бутилат калия или 2-метил-2-бутилат калия, в эфирных растворителях, таких как диэтиловый эфир, диоксан, ТГФ или ТБМЭ. Предпочтительными условиями для первой стадии являются триэтиламин в ТГФ, смешанном с реагентами при 0-5C, и затем взаимодействие в течение 1 ч при комнатной температуре, затем удаление побочного продукта гидрохлорида триэтиламина в ходе фильтрации. Предпочтительными условиями для второй стадии являются 2-метил-2-бутилат калия в ТГФ, смешанном с реагентами при 0-5C, и затем взаимодействие в течение 30 мин при комнатной температуре. Стадия F. Образование связи C-N может быть выполнено путем обработки 71 бензофенонимином в присутствии палладиевого или медного катализатора, лиганда и основания в растворителях, таких как диоксан, ДМЭ, ТГФ, толуол, ДМФА и ДМСО, при повышенных температурах, например используя катализируемую палладием реакцию Бухвальда-Хартвига. Предпочтительными условиями являются каталитический трис(дибензилиденацетон)дипалладий(0), каталитический (R)-(+)-2,2'-бис(дифенилфосфино)-1,1'-бинафтил и трет-бутилат натрия в диоксане при 90C в течение 16 ч. Стадия G. Удаление азот-защитной группы 72 можно выполнить при обработке гидрохлоридом гидроксиламина в присутствии основания, такого как ацетат натрия или метилат натрия, в растворителях, таких как MeOH, EtOH, H2O, диоксан, ТГФ, HOAc, EtOAc, CH2Cl2, CHCl3, ДМФА или их смеси. Предпочтительными условиями являются гидрохлорид гидроксиламина в присутствии ацетата натрия в MeOH при 60C в течение 1 ч. Стадия H. Образование связи C-N может быть выполнено путем обработки арилгалида 7 ариламином 73 в присутствии палладиевого или медного катализатора, лиганда и основания в растворителях,таких как диоксан, ДМЭ, ТГФ, толуол, ДМФА и ДМСО, при повышенных температурах, например используя катализируемую палладием реакцию Бухвальда-Хартвига. Предпочтительными условиями являются каталитический комплекс трис(дибензилиденацетон)дипалладия хлороформа, каталитический 9,9-диметил-4,5-бис(дифенилфосфино)ксантен (ксантфос) и карбонат цезия в диоксане в закрытой пробирке, нагретой при 120C в течение 16 ч, согласно модификации процедуры по van Leeuwen с сотрудниками (Tempahedron. Lett. 1999, 40, 3789-3790). Стадия Н'. Образование C-N связи, что дает би-ариламин 74, альтернативно может быть выполнено непосредственно из арилбромида 71 при обработке арилбромида 71 ариламином 11' в присутствии палладиевого или медного катализатора, лиганда и основания в растворителях, таких как диоксан, ДМЭ,ТГФ, толуол, ДМФА и ДМСО, при повышенных температурах, например используя катализируемую палладием реакцию Бухвальда-Хартвига. Предпочтительными условиями являются каталитический трис(дибензилиденацетон)дипалладий(0), каталитический 2-ди-трет-бутилфосфино-2',4',6'-триизопропилбифенил и трет-бутилат натрия в диоксане при 100C в течение 2 ч. Стадия I. Удаление N-защитной группы ВОС может быть выполнено с неорганическими кислотами,такими как HCl, H2SO4 или Н 3 РО 4, или органическими кислотами, такими как CF3COOH, CHCl2COOH,HOAc или п-толуолсульфоновая кислота, в растворителях, таких как CH2Cl2, CHCl3, ТГФ, MeOH, EtOH или H2O, при от 0 до 80C. Предпочтительными условиями являются CF3COOH в водном ацетонитриле при 80C в течение 3 ч или 4 н. HCl в диоксане и ТГФ при 60C в течение 16 ч. Выделение и очистка соединений Выделение и очистку соединений и промежуточных соединений, описанных здесь, можно выполнить, при необходимости, в ходе любой подходящей процедуры разделения или очистки, такой как, например, фильтрация, экстракция, кристаллизация, колоночная хроматография, тонкослойная хроматография, хроматография в толстом слое, препаративная жидкостная хроматография при низком или высоком давлении или комбинации этих процедур. Конкретные иллюстрации подходящих процессов разделения и выделения могут быть выполнены в соответствии с получениями и примерами ниже. Однако,конечно, также можно использовать другие эквивалетные процедуры разделения или выделения. Рацемические смеси хиральных соединений формулы I могут быть разделены с использованием хиральной ВЭЖХ. Соли соединений формулы I Соединения формулы I являются основными и могут быть преобразованы в соответствующие кислотно-аддитивные соли. Превращение выполняют при обработке, по меньшей мере, стехиометрическим количеством подходящей кислоты, такой как хлористо-водородная кислота, бромисто-водородная кисло- 26023237 та, серная кислота, азотная кислота, фосфорная кислота и подобные, и органических кислот, таких как уксусная кислота, пропионовая кислота, гликолевая кислота, пировиноградная кислота, щавелевая кислота, яблочная кислота, малоновая кислота, янтарная кислота, малеиновая кислота, фумаровая кислота,винная кислота, лионная кислота, бензойная кислота, коричная кислота, миндальная кислота, метансульфоновая кислота, этансульфоновая кислота, п-толуолсульфоновая кислота, салициловая кислота и подобные. Обычно свободное основание растворяют в инертном органическом растворителе, таком как диэтиловый эфир, этилацетат, хлороформ, этанол или метанол и подобные, и добавляют кислоту в этом же растворителе. Температуру поддерживают между 0 и 50C. Полученная в результате соль осаждается самопроизвольно или может быть выделена из раствора с менее полярным растворителем. Кислотно-аддитивные соли основных соединений формулы I могут быть преобразованы в соответствующие свободные основания при обработке, по меньшей мере, стехиометрическим эквивалентом подходящего основания, такого как гидроксид натрия или калия, карбонат калия, гидрокарбонат натрия,аммиак и подобные. Пример 1. (RS)-(4,6-Диметилпиримидин-2-ил)-(4-пирролидин-3-ил-фенил)амина гидрохлорид Указанное в заголовке соединение получали по аналогии с примером 5, используя трет-бутиловый эфир (RS)-3-(4-аминофенил)пирролидин-1-карбоновой кислоты (CAS 908334-28-1) вместо третбутилового эфира (RS)-2-(4-аминофенил)морфолин-4-карбоновой кислоты и 2-хлор-4,6-диметилпиримидин (CAS 4472-44-0) вместо 2,5-дихлорпиридина на стадии (а). Светло-коричневое твердое вещество. МС (ИСП): 271,3 ([37ClM+H]+), 269,4 ([35ClM+H]+). Пример 2. [(RS)-1-(5-Бромпиридин-2-ил)-2,2,2-трифторэтил]-RS)-4-пирролидин-3-ил-фенил)амин а) (RS)-1-(5-Бромпиридин-2-ил)-2,2,2-трифторэтанол. К охлажденному перемешиваемому раствору 5-бромпиридин-2-карбальдегида (3,72 г, CAS 3118190-5) и (трифторметил)триметилсилана (3,56 мл) в ТГФ (30 мл) при 0C добавляли по каплям раствор тетрабутиламмония фторида (1,0 мл, 1 М раствор в ТГФ). Реакционную смесь перемешивали при 0C в течение 30 мин и затем при комнатной температуре в течение 2 ч. Смесь потом разбавляли 1 н. водн. HCl(20 мл) и продолжали перемешивать в течение дополнительных 2 ч. Смесь разбавляли водой и экстрагировали дважды этилацетатом. Объединенные органические фазы сушили над сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии (SiO2; градиент: гептан/EtOAc), что давало (RS)-1-(5-бромпиридин-2-ил)-2,2,2-трифторэтанол в виде светло-желтого твердого вещества (3,35 г, 65%). МС (ИСП): 258,0 ([81BrM+H]+), 256,1 ([79BrM+H]+).b) (RS)-1-(5-Бромпиридин-2-ил)-2,2,2-трифторэтиловый эфир трифторметансульфоновой кислоты. К перемешиваемой суспензии гидрида натрия (765 мг, 60% дисперсия в минеральном масле) в безводном диэтиловом эфире (20 мл) в атмосфере аргона при 0C добавляли по каплям раствор (RS)-1-(5 бромпиридин-2-ил)-2,2,2-трифторэтанола (3,06 г) в диэтиловом эфире (10 мл) и полученную в результате смесь перемешивали при комнатной температуре в течение 30 мин. Трифторметансульфонилхлорид (1,4 мл) добавляли и продолжали перемешивать в течение дополнительных 15 мин при комнатной температуре. Реакционную смесь гасили, добавляя 10% водн. раствор гидрокарбоната натрия и смесь экстрагировали диэтиловым эфиром. Фазы разделяли и органическую фазу промывали насыщенным солевым раствором. Органическую фазу отделяли, сушили над сульфатом натрия и концентрировали в вакууме. Остаток очищали в ходе дистилляции с помощью Kugelrohr (температура печи 60C, 0,3 мбар), что давало (RS)-1-(5-бромпиридин-2-ил)-2,2,2-трифторэтиловый эфир трифторметансульфоновой кислоты (3,6 г,78%) в виде белого твердого вещества. МС (ЭИ): 389 ([81BrМ]+), 387 ([79BrМ]+), 320 ([81BrM-CF3]+),318 ([79BrM-CF3]+), 256 ([81BrM-CF3-SO2]+), 254 ([79BrM-CF3-SO2]+), 240 ([81BrM-OSO2CF3]+), 238([79BrM-OSO2CF3]+). с) трет-Бутиловый эфир (RS)-3-(4-[(RS)-1-(5-бромпиридин-2-ил)-2,2,2-трифторэтиламино]фенил) пирролидин-1-карбоновой кислоты. К перемешиваемому раствору трет-бутилового эфира (RS)-3-(4-аминофенил)пирролидин-1 карбоновой кислоты (50 мг, CAS 908334-28-1) в безводном ТГФ (0,1 мл) в атмосфере аргона добавляли гидрид натрия (14 мг, 60% дисперсия в минеральном масле) и продолжали перемешивать в течение 15 мин. Затем 1-(5-бромпиридин-2-ил)-2,2,2-трифторэтиловый эфир трифторметансульфоновой кислоты (74 мг) добавляли и смесь перемешивали в течение ночи при комнатной температуре. Реакционную смесь- 27023237 разбавляли этилацетатом и промывали последовательно водой и насыщенным солевым раствором. Органическую фазу отделяли, сушили над сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью колоночной флэш-хроматографии (силикагель; градиент: гептан/EtOAc), что давало третбутиловый эфир (RS)-3-4-[(RS)-1-(5-бромпиридин-2-ил)-2,2,2-трифторэтиламино]фенилпирролидин-1 карбоновой кислоты (34 мг, 36%) в виде желтого масла. МС (ИСП): 501,9 ([81BrM+H]+), 500,2d) [(RS)-1-(5-Бромпиридин-2-ил)-2,2,2-трифторэтил]-RS)-4-пирролидин-3-ил-фенил)амин. К перемешиваемому раствору трет-бутилового эфира (RS)-3-4-[(RS)-1-(5-бромпиридин-2-ил)2,2,2-трифторэтиламино]фенилпирролидин-1-карбоновой кислоты (27 мг) в ТГФ (1 мл) добавляли по каплям раствор хлороводорода в диоксане (0,20 мл, 4 М раствор) и смесь нагревали при 60C в течение 4 ч. Потом смесь охлаждали до комнатной температуры, разбавляли этилацетатом/ТГФ (1:1) и промывали последовательно 2 н. водн. раствором гидроксида натрия и насыщенным солевым раствором. Органических фазу отделяли, сушили над сульфатом натрия и концентрировали в вакууме. Остаток очищали с помощью колоночной флэш-хроматографии (силикагель; градиент: гептан/дихлорметан/метанол), что давало [(RS)-1-(5-бромпиридин-2-ил)-2,2,2-трифторэтил]-RS)-4-пирролидин-3-ил-фенил)амин (12 мг,56%) в виде желтого аморфного твердого вещества. МС (ИСП): 402,1 ([81BrM+H]+), 400,1-78C добавляли по каплям раствор н-бутиллития (14,9 мл, 1,6 М в гексане) и реакционную смесь потом нагревали до 0C в течение 15 мин. После повторного охлаждения до -78C добавляли по каплям раствор диэтил-(4-нитробензил)фосфоната (5,00 г, CAS 2609-49-6) в тетрагидрофуране (10 мл). Смесь перемешивали при -78C в течение 60 мин и затем добавляли по каплям раствор трет-бутилового эфира (RS)-3 формилпирролидин-1-карбоновой кислоты (4,01 г, CAS 59379-02-1) в тетрагидрофуране (10 мл) в течение 30 мин. Потом смесь нагревали до комнатной температуры и продолжали перемешивать при комнатной температуре в течение 18 ч. Затем смесь разбавляли этилацетатом и подкисляли до рН 6, добавляя водную соляную кислоту (1 н.). Смесь промывали последовательно водой и насыщенным солевым раствором, сушили над Na2SO4 и концентрировали в вакууме. Остаток очищали с помощью колоночной флэш-хроматографии (силикагель, градиент: гептан/EtOAc), что давало трет-бутиловый эфир (RS)-3[(Е)-2-(4-нитрофенил)винил]пирролидин-1-карбоновой кислоты (3,39 г, 58%) в виде желтого масла.b) трет-Бутиловый эфир (RS)-3-[2-(4-аминофенил)этил]пирролидин-1-карбоновой кислоты. К раствору трет-бутилового эфира (RS)-3-формилпирролидин-1-карбоновой кислоты (3,39 г) в метаноле (250 мл) добавляли палладий на угле (10%, 340 мг). Смесь энергично перемешивали в атмосфере водорода в течение 7 ч. Катализатор отфильтровывали и фильтрат выпаривали. Неочищенный продукт очищали с помощью колоночной флэш-хроматографии (силикагель; градиент: гептан/EtOAc), что давало трет-бутиловый эфир (RS)-3-[2-(4-аминофенил)этил]пирролидин-1-карбоновой кислоты (2,44 г, 79%) в виде желтого масла. МС (ИСП): 291,2 ([M+H]+).c) трет-Бутиловый эфир (RS)-3-(2-4-[(RS)-1-(4-хлорфенил)-2,2,2-трифторэтиламино]фенил)этил) пирролидин-1-карбоновой кислоты. Указанное в заголовке соединение получали по аналогии со стадией (с) примера 2, используя третбутиловый эфир (RS)-3-[2-(4-аминофенил)этил]пирролидин-1-карбоновой кислоты вместо третбутилового эфира (RS)-3-(4-аминофенил)пирролидин-1-карбоновой кислоты и (RS)-1-(4-хлорфенил)2,2,2-трифторэтиловый эфир трифторметансульфоновой кислоты (CAS 1202576-95-1) вместо (RS)-1-(5 бромпиридин-2-ил)-2,2,2-трифторэтилового эфира трифторметансульфоновой кислоты. Желтое масло. МС (ИСП): 429,2 ([37ClM+H-C4H8]+), 427,1 ([35ClM+H-С 4 Н 8]+).d) [RS)-1-(4-Хлорфенил)-2.2.2-трифторэтил]-[(RS)-4-(2-пирролидин-3-ил-этил)фенил]амин. Указанное в заголовке соединение получали по аналогии со стадией (d) примера 2, используя третбутиловый эфир (RS)-3-(2-4-[(RS)-1-(4-хлорфенил)-2,2,2-трифторэтиламино]фенилэтил)пирролидин-1 карбоновой кислоты вместо трет-бутилового эфира (RS)-3-4-[(RS)-1-(5-бромпиридин-2-ил)-2,2,2 трифторэтиламино]фенилпирролидин-1-карбоновой кислоты. Твердое вещество белого оттенка. МС Указанное в заголовке соединение получали по аналогии с примером 3, используя трет-бутиловый эфир (RS)-3-формилпиперидин-1-карбоновой кислоты (CAS 118156-93-7) вместо трет-бутилового эфира(RS)-3-формилпирролидин-1-карбоновой кислоты на стадии (а). Бесцветное аморфное твердое вещество. МС (ИСП): 399,1 ([37ClM+H]+), 397,1 ([35ClM+H]+). Пример 5. (RS)-(5-Хлорпиридин-2-ил)-(4-морфолин-2-ил-фенил)амин(2 мл), что давало желтую суспензию. Смесь дегазировали, барботируя аргоном смесь в течение нескольких минут. Потом добавляли ксантфос (7,48 мг) и комплекс трис(дибензилиденацетон)дипалладия хлороформа (6,69 мг). Реакционную смесь затем закрывали и перемешивали при 100C в течение ночи. Неочищенную реакционную смесь охлаждали до комнатной температуры и фильтровали. Фильтрат концентрировали в вакууме и остаток очищали с помощью колоночной флэш-хроматографии (силикагель; градиент: 0% до 70% EtOAc в гексанах), что давало трет-бутиловый эфир (RS)-2-[4-(5-хлорпиридин-2 иламино)фенил]морфолин-4-карбоновой кислоты (52 мг, 62%) в виде желтого аморфного твердого вещества. МС (ИСП): 392,0 ([37ClM+H]+), 390,1 ([35ClM+H]+), 336,4 ([37ClM+H-C4H8]+), 334,3b) (RS)-(5-Хлорпиридин-2-ил)-4-морфолин-2-ил-фенил)амин. К перемешиваемому раствору трет-бутилового эфира (RS)-2-[4-(5-хлорпиридин-2-иламино)фенил] морфолин-4-карбоновой кислоты (50 мг) в ТГФ (2 мл) добавляли по каплям раствор хлороводорода в диоксане (0,26 мл, 4 М раствор) и смесь нагревали при 60C в течение ночи. Затем смесь охлаждали до комнатной температуры и выливали в 1 М водн. раствор гидроксида натрия. Смесь экстрагировали дважды этилацетатом и объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии (Isolute Flash-NH2 от Separtis; градиент: гептан/этилацетат/метанол), что давало (RS)-(5-хлорпиридин-2-ил)-(4-морфолин-2-ил-фенил) амин (19 мг, 51%) в виде белого твердого вещества. МС (ИСП): 292,1 ([37ClM+H]+), 290,1 Указанное в заголовке соединение получали по аналогии с примером 5, используя 2,5 дихлорпиримидин (CAS 22536-67-0) вместо 2,5-дихлорпиридина на стадии (а). Желтое твердое вещество. МС (ИСП): 293,1 ([37ClM+H]+), 291,1 ([35ClM+H]+). Пример 7. (RS)-(5-Бромпиримидин-2-ил)-(4-морфолин-2-ил-фенил)амин Указанное в заголовке соединение получали по аналогии с примером 5, используя 2,5 дибромпиримидин (CAS 32779-37-6) вместо 2,5-дихлорпиридина на стадии (а). Желтое твердое вещество. МС (ИСП): 337,1 ([81BrM+H]+), 335,1 ([79BrM+H]+).
МПК / Метки
МПК: C07D 403/12, C07D 413/12, C07D 417/12, C07D 211/26, C07D 265/30, C07D 413/14, C07D 207/09, C07D 401/12
Метки: гетероциклических, аминов, производные
Код ссылки
<a href="https://eas.patents.su/30-23237-proizvodnye-geterociklicheskih-aminov.html" rel="bookmark" title="База патентов Евразийского Союза">Производные гетероциклических аминов</a>
Предыдущий патент: Опорный поручень для лиц с ограниченными возможностями для использования в санузлах
Следующий патент: Замещенные производные индола для лечения иммунологических расстройств
Случайный патент: Кристаллическая форма соединения (3s,3s') 4,4'-дисульфандиилбис(3-аминобутан-1-сульфокислоты) с l-лизином












