Способ получения гетероциклических производных
Формула / Реферат
1. Способ получения производных триазола формулы (I)
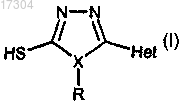
в которой
X - азот;
Het означает арил или гетероарил (где арил обозначает ароматическую карбоциклическую функциональную группу, такую как фенил, бифенил или нафтил, а гетероарил означает моно- или бициклическое ароматическое гетероциклическое кольцо из от 5 до 10 членов и имеющее по крайней мере один гетероатом, выбранный из азота, кислорода и серы), каждый из которых может быть замещен от 1 до 4 групп J, выбранных из галогена, C1-C6алкила, С1-С6алкокси, галоген С1-С6алкила, С2-С6алкенила, С2-С6 алкинила, галоген С1-С6алкокси, -C(O)R1, нитро, гидрокси, NR2R3, циано;
R1 представляет собой С1-С4алкил или -OR3;
R2 представляет собой водород или С1-С6алкил;
R3 представляет собой водород или С1-С6алкил;
R представляет собой Н, С1-С6алкил, арил, бензил, каждый из которых может быть замещен от 1 до 4 групп J;
в соответствии со следующей схемой:
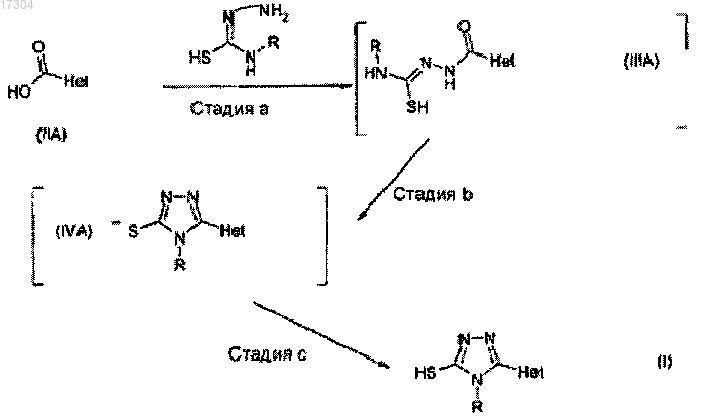
в которой
стадия а представляет реакцию в основных условиях соединений (IIA) с производными тиосемикарбазида;
стадия b представляет обработку неорганическим основанием и н-пропан фосфоновым циклическим ангидридом до достижения основного значения рН;
стадия с представляет окончательное доведение рН до 4-8 неорганическими кислотами, с получением соединения формулы (I).
2. Способ по п.1, в котором в производном триазола формулы (I) замещенный Het означает 4-метил-1,3-оксазол-5-ил, a R1 представляет собой метил.
3. Способ по п.1, в котором в производном триазола формулы (I) замещенный Het означает 2,4-диметил-1,3-тиазол-5-ил, a R1 представляет собой метил.
4. Способ по п.1, в котором в производном триазола формулы (I) замещенный Het означает 2-метил-3-пиридинил, a R1 представляет собой метил.
5. Способ по п.1, в котором в производном триазола формулы (I) незамещенный Het означает 4-пиридазинил, a R1 представляет собой метил.
6. Способ по п.1, в котором в производном триазола формулы (I) замещенный Het означает 2,4-диметил-1,3-оксазол-5-ил, a R1 представляет собой метил.
Текст
СПОСОБ ПОЛУЧЕНИЯ ГЕТЕРОЦИКЛИЧЕСКИХ ПРОИЗВОДНЫХ Настоящее изобретение относится к новому способу для получения ключевых промежуточных соединений в синтезе различных соединений, среди которых соединения, которые являются сильными и специфическими антагонистами D3 рецепторов. Соединение формулы (I), в которойX - азот; Het означает арил или гетероарил (где арил обозначает ароматическую карбоциклическую функциональную группу, такую как фенил, бифенил или нафтил, а гетероарил означает моноили бициклическое ароматическое гетероциклическое кольцо из от 5 до 10 членов, имеющее по крайней мере один гетероатом, выбранный из азота, кислорода и серы), каждый из которых может быть замещен от 1 до 4 групп J, выбранных из галогена, С 1-С 6 алкила, С 1-С 6 алкокси, галоген C1 С 6 алкила, С 2-С 6 алкенила, С 2-С 6 алкинила, галоген С 1-С 6 алкокси, -C(O)R1, нитро, гидрокси, -NR2R3,циано; R1 представляет собой С 1-С 4 алкил, -OR3; R2 представляет собой водород или С 1-С 6 алкил;R3 представляет собой водород или С 1-С 6 алкил; R представляет собой Н, C1-С 6 алкил, арил, бензил; каждый из которых может быть замещен от 1 до 4 групп J, получают в соответствии со следующей схемой: в которой стадия а представляет реакцию в основных условиях соединений (IIA) с производными тиосемикарбазида; стадия b представляет обработку неорганическим основанием и н-пропан фосфоновым циклическим ангидридом до достижения основного значения рН; стадия с представляет окончательное доведение рН до 4-8 неорганическими кислотами с получением соединения формулы (I).(71)(73) Заявитель и патентовладелец: ГЛЭКСО ГРУП ЛИМИТЕД (GB) 017304 Настоящее изобретение относится к новому способу для получения ключевых промежуточных соединений в синтезе различных соединений, среди которых соединения, которые являются сильными и специфическими антагонистами D3 рецепторов. Настоящее изобретение относится к новому способу получения тиазола или производных тиазола формулы (I)X может быть азотом или серой;Het означает арил или гетероарил, каждый из которых может быть замещен от 1 до 4 групп J, выбранных из галогена, C1-C6 алкила, С 1-С 6 алкокси, галоген С 1-С 6 алкила, C2-С 6 алкенила, С 2-С 6 алкинила,галоген С 1-С 6 алкокси, -C(O)R1, нитро, гидрокси, NR2R3, циано или группы Z;R2 представляет собой водород или С 1-С 6 алкил;R3 представляет собой водород или С 1-С 6 алкил;R представляет собой Н, С 1-С 6 алкил, арил, бензил, каждый из которых может быть замещен от 1 до 4 групп J; в соответствии со следующей схемой: в которой стадия а представляет реакцию в основных условиях соединений (IIA) с производными тиосемикарбазида; стадия b представляет обработку неорганическим основанием и н-пропан фосфоновым циклическим ангидридом до достижения основного значения рН; стадия с представляет окончательное доведение рН до 4-8 неорганическими кислотами, с получением соединения формулы (I). Термин С 1-С 6 алкил, использованный в контексте данного документа в качестве группы или части группы, относится к линейной или разветвленной алкильной группе, содержащей от 1 до 6 атомов углерода; примеры подобных групп включают метил, этил, пропил, изопропил, н-бутил, изобутил, третбутил, пентил или гексил. Термин галоген относится к атому фтора, хлора, брома или йода. Термин галоген С 1-С 6 алкил подразумевает алкильную группу, имеющую один или более атомов углерода, причем по крайней мере один атом водорода замещен на галоген, например, как трифторметильная группа и тому подобное. Термин С 1-С 6 тиоалкил может быть представлен тиоалкильной группой с линейной или разветвленной цепью, например тиометил, тиоэтил, тиопропил, тиоизопропил, тиобутил, тио-втор-бутил, тиотрет-бутил и тому подобное. Термин С 2-С 6 алкенил обозначает углеводородные радикалы с прямолинейной или разветвленной цепью, содержащие одну или более двойную связь и имеющие от 2 до 6 атомов углерода, такие как, например, этенил, 2-пропенил, 3-бутенил, 2-бутенил, 2-пентенил, 3-пентенил, 3-метил-2-бутенил или 3 гексенил и тому подобное. Термин С 1-С 6 алкоксигруппа может быть представлен алкоксигруппой с линейной разветвленной цепью, например метокси, этокси, пропокси, проп-2-окси, бутокси, бут-2-окси или метилпроп-2-окси и тому подобное. Термин галоген С 1-С 6 алкоксигруппа может быть представлен С 1-С 6 алкоксигруппой, как определено ранее, замещенной по крайней мере одним галогеном, предпочтительно фтором, такой как OCHF2-1 017304 или OCF3. Термин С 2-С 6 алкинил обозначает углеводородные радикалы с прямолинейной или разветвленной цепью, содержащие одну или более тройную связь и имеющие от 2 до 6 атомов углерода, включая ацетиленил, пропинил, 1-бутинил, 1-пентинил, 3-метил-1-бутинил и тому подобное. Термин арил обозначает ароматическую карбоциклическую функциональную группу, такую как фенил, бифенил или нафтил. Термин гетероарил означает ароматическое гетероциклическое кольцо из от 5 до 10 членов и,имеющее по крайней мере один гетероатом, выбранный из азота, кислорода и серы, и, содержащее по крайней мере 1 атом углерода, включая как моно-, так и бициклические кольцевые системы. Типичные представители гетероарилов включают (но не ограничиваются) фурил, бензофуранил,тиофенил, бензотиофенил, пирролил, индолил, изоиндолил, азаиндолил, пиридил, хинолинил, изохинолинил, оксазолил, изооксазолил, бензоксазолил, пиразолил, имидазолил, бензимидазолил, тиазолил, бензотиазолил, изотиазолил, пиридазинил, пиримидинил, пиразинил, триазинил, циннолинил, фталазинил,триазолил, тетразолил, хиназолинил и бензодиоксолил. Термин 5-6-членный гетероцикл подразумевает в соответствии с вышеупомянутым определением 5-6-моноциклическое гетероциклическое кольцо, которое является насыщенным, ненасыщенным или ароматическим и которое содержит от 1 до 4 гетероатомов, независимо выбранных из азота, кислорода и серы, и причем гетероатомы азота и серы могут быть необязательно окисленными, а гетероатом азота может быть необязательно кватернизован. Гетероциклы включают гетероарилы, как определено выше. Гетероцикл может быть присоединен через любой гетероатом или атом углерода. Таким образом, понятие включает (но не ограничивается) морфолинил, пиридинил, пиразинил, пиразолил, тиазолил, триазолил, имидазолил, оксадиазолил, оксазолил, изоксазолил, пирролидинонил, пирролидинил, пиперидинил,гидантоинил, валеролактамил, оксиранил, окситанил, тетрагидрофуранил, тетрагидропиранил, тетрагидропиридинил, тетрагидропиримидинил, тетрагидротиофенил, тетрагидротиопиранил и тому подобное. Соединения формулы (I) могут быть применимы, (не ограничиваясь этим) для получения антагонистов D3 формулы (IA), как раскрыто в WO 2005080382G выбирается из группы, состоящей из фенила, пиридила, бензотиазолила, индазолила,р представляет собой целое число от 0 до 5;R1 независимо выбирается из группы, состоящей из галогена, гидрокси, циано, C1-4 алкил, галогенС 1 алкил, C1-4 алкокси, галогенС 1-4 алкокси, C1-4 алканоил; или соответствует группе R5; 4R2 представляет собой водород или C1-4 алкил;R4 представляет собой водород или фенильную группу, гетероциклильную группу, 5- или 6 членную гетероароматическую группу или 8-11-членную бициклическую группу, любая из которых необязательно замещена 1, 2, 3 или 4 заместителями, выбранными из группы, состоящей из галогена, циано, C1-4 алкила, галогенС 1-4 алкила, C1-4 алкокси, C1-4 алканоила;R5 представляет собой функциональную группу, выбранную из группы, состоящей из изоксазолила,-СН 2-N-пирролила,1,1-диоксидо-2-изотиазолидинила,тиенила,тиазолила,пиридила,2 пирролидинонила, причем подобная группа является необязательно замещенной одним или двумя заместителями, выбранными из галогена, циано, C1-4 алкила, галогенС 1-4 алкила, C1-4 алкокси, C1-4 алканоила; и если R1 представляет собой хлор, а р представляет собой 1, то такой R1 не присутствует в ортоположении по отношению к соединяющей связи с остальной частью молекулы; а если R1 соответствуетR5, то р представляет собой 1. Соединения формулы (I) в качестве промежуточных соединений для получения других соединений,могут быть обычно функционализированы, как раскрыто в WO 2005080382. Пример представлен в настоящей экспериментальной главе. В получении соединений формулы (I), описанном в WO 2005080382, применялся 1 гидроксибензотриазол (ГОБт) совместно с 1,3-дициклогексилкарбодиимидом (ДЦК). Недостатки данных реагентов на промышленном уровне можно суммировать следующим образом: ГОБт и его побочные продукты имеют взрывоопасную природу, а ДЦК и его побочный продукт всегда трудно удалить полностью. Технологический процесс решает вышеупомянутые проблемы посредством применения н-пропан фосфонового циклического ангидрида, Т 3 Р, в качестве конденсирующего агента. Т 3 Р был впервые применен в пептидном синтезе в 1980 Н. Wissmann (Angew. Chem., 1980, 92, 129) и уверенно приобретает все большее значение в органическом синтезе, так как является менее токсичным и более безопасным по сравнению с другими общепринятыми конденсирующими агентами, такими как ДЦК. Реагент не дает никакого не растворимого в воде побочного продукта. Т 3 Р применяется в качестве 50% раствора в этилацетате в способе настоящего изобретения и не нуждается в выделении промежуточного соединения гидразин-карботиамида. Аналогично, Т 3 Р доступен в качестве 50% раствора в ДМФА (диметилформамид) и может применяться в процессе настоящего изобретения. Исходное вещество, гетероциклическая карбоновая кислота, обычно является коммерчески доступной или веществом, которое можно получить в соответствии с известными в литературе способами,обычно в количестве 1 эквивалент можно растворить в подходящем растворителе (например, диметилформамид; этилацетат; ацетонитрил и тетрагидрофуран и другой полярный апротонный растворитель) и обработать небольшим избытком производных 3-тиосемикарбазида (1,10 экв.), таких как 4 метилпроизводное. Затем при комнатной температуре добавляют органическое основание (например,триэтиламин, диизопропилэтиламин и возможно другие алифатические или ароматические амины). Затем можно добавить н-пропан фосфоновый циклический ангидрид (50% мас./мас. в этилацетате) при температуре от 0 до 40 по каплям. В случае если добавление осуществляется при около 0 С, то затем температура поддерживается ниже 15 С в течение 20-60 мин. Результирующую смесь далее перемешивают при 20 С в течение 2-16 ч. Смесь затем разбавляют водным раствором подходящего неорганического основания, пока не будет достигнут основный показатель рН. Подходящее основание можно выбрать из карбоната калия, карбоната натрия, гидроксида натрия, гидроксида калия. Результирующей двухфазной смеси (когда наблюдается) затем позволяют разделиться и верхний органический слой удаляют. Водный слой затем нагревают до 50-90 С (внутренняя температура) в течение от получаса до нескольких часов до завершения реакции. После охлаждения до 20 С затем медленно добавляют подходящую минеральную кислоту (например, HCl 37%) для регулирования рН при необходимости (от 4 до 8). Затем суспензию обычно перемешивают в течение 2-16 ч, отфильтровывают твердое вещество,промывают чистой водой и сушат в вакуумной печи при 40-60 С до сухого вещества. Конечный продукт выделяют из водной смеси, не имеющей примесей фосфористых производных. Примеры В примерах, если не указано особо: Все температуры выражаются в С. Инфракрасные спектры измеряли на ИК-Фурье спектрометре. Соединения исследовали посредством непосредственного введения образца, растворенного в ацетонитриле, в масс-спектрах, снимаемых по механизму положительной ионизации злектроспрей (ES+). Спектры протонного магнитного резонанса (1 Н-ЯМР) записывали при 400 МГц, химические сдвиги приводятся в(q) или мультиплетов (m). Колоночную хроматографию проводили на силикагеле (Merck AG Darmstaadt,Germany). В тексте применяются следующие аббревиатуры: Т 3 Р=н-пропан фосфоновый циклический ангидрид, EtOAc=этилацетат, DIPEA=N,N-диизопропилэтиламин. Пример 1. Получение 4-метил-5-(4-метил-1,3-оксазол-5-ил)-2,4-дигидро-3H-1,2,4-триазол-3-тиона 4-Метил-1,3-оксазол-5-карбоновую кислоту (коммерчески доступна) (12,9 г, 101,5 ммоль) растворили в ДМФА (60 мл) и обработали 4-метил-3-тиосемикарбазидом (11,61 г, 1,10 эквив.). Затем добавили DIPEA (31,0 мл, 1,75 эквив.) при 20 С. При охлаждении на ледяной бане добавляли по каплям Т 3 Р 50% мас./мас. в EtOAc (90 мл), поддерживая температуру ниже 15 С в течение 20 мин. Затем результирующую смесь перемешивали при 20 С в течение 6 ч. Смесь разбавляли NaOH 4M (120,0 мл). Результирующей двухфазной смеси позволили разделиться и верхний органический слой удаляли. Водный слой (рН=8) довели до рН=11 дополнительным NaOH 4M(60 мл), а затем нагрели до 70 С (внутренняя температура) в течение 30 мин. После охлаждения в течение ночи медленно добавляли HCl 37%, пока не был достигнут показатель рН=5. Суспензию перемешивали в течение 8 ч, затем твердое вещество отфильтровали и промыли водой(60 мл), и сушили его в вакуумной печи при 40 С в течение ночи. Выход: 10,48 г, 53,4 ммоль, 53% от теор. 2,4-Диметил-1,3-оксазол-5-карбоновую кислоту (коммерчески доступна) (5 г, 31,8 ммоль) и 4 метил-3-тиосемикарбазид (3,68 г, 1,10 эквив.) растворили в ДМФА (15 мл). Затем добавляли DIPEA (10,0 мл, 1,80 эквив.) при 20 С. При охлаждении на ледяной бане добавляли по каплям Т 3 Р 50% мас./мас. вEtOAc (35 мл, 1,50 эквив.), поддерживая температуру ниже 10 С. Затем результирующую смесь перемешивали при 20 С в течение 2 ч. Смесь разбавляли водой (20 мл), затем добавляли NaOH 4M (20,0 мл). Органическую фазу удаляли,а водную фазу нагревали до 70 С (внутренняя температура) в течение 90 мин. После охлаждения до 50 С медленно добавляли HCl 37%, пока не был достигнут показатель рН=6,5. Суспензию охлаждали до 5 С, а твердое вещество отфильтровали и промыли водой, и затем сушили его в вакуумной печи при 40 С в течение ночи. Выход: 5,45 г, 24,4 ммоль, 77% теорет. 1 Н ЯМР (ДМСО-d6, 600 МГц,ppm) 14,02 (шир.с, 1 Н), 3,39 (с, 3H), 2,69 (с, 3H), 2,34 (с, 3H) МН+=227 Пример 3. Получение 4-метил-5-(2-метил-3-пириддинил)-2,4-дигидро-3H-1,2,4-триазол-3-тиона 2-Метилникотиновую кислоту (коммерчески доступна) (5 г, 36,5 ммоль) и 4-метил-3 тиосемикарбазид (4,22 г, 1,10 эквив.) растворили в EtOAc (15 мл). Затем добавляли DIPEA (14,5 мл, 2,28 эквив.) при 20 С. При охлаждении на ледяной бане добавляли по каплям Т 3 Р 50% мас./мас. в EtOAc(32,5 мл, 1,50 эквив.), поддерживая температуру ниже 15 С. Затем результирующую смесь перемешивали при 20 С в течение 90 мин. Смесь разбавляли водой (10 мл), затем добавляли NaOH 4M (18,5 мл). Органический слой удаляли,а оставшийся водный слой нагревали до 70 С (внутренняя температура) в течение 2 ч 45 мин. После охлаждения до температуры окружающей среды получили суспензию, которая имела рН от около 7,5 до 8,0.HCl 37% медленно добавляли, пока не был достигнут показатель рН=5. Твердое вещество отфильтровали, а затем сушили его в вакуумной печи при 40 С в течение ночи. Выход: 7,04 г, 34,1 ммоль, 93% теоретич. 1 Н ЯМР (ДМСО-d6, 600 МГц,ppm): 14,01 (шир.с, 1 Н), 8,66 (дд, 1 Н), 7,96 (дд, 1 Н), 7,42 (дд, 1 Н),3,29 (с, 3H), 2,42 (с, 3H) МН+=207 Пример 4. Получение 4-метил-5-(4-пиридазинил)-2,4-дигидро-3H-1,2,4-триазол-3-тиона 4-Пиридазинкарбоновую кислоту (коммерчески доступна) (5 г, 40,3 ммоль) и 4-метил-3 тиосемикарбазид (4,66 г, 1,10 эквив.) растворили в ДМФА (15 мл). Затем добавляли DIPEA (12,5 мл, 1,78 эквив.) при 20 С. При охлаждении на ледяной бане добавляли по каплям Т 3 Р 50% мас./мас. в EtOAc (36 мл, 1,50 эквив.), поддерживая температуру ниже 20 С. Затем результирующую смесь перемешивали при 20 С в течение 30 мин. Смесь разбавляли водой (20 мл), затем добавляли NaOH 4 М (20,0 мл). Органический слой удаляли,а оставшуюся водную фазу нагревали до 70 С (внутренняя температура) в течение 5 ч. После охлаждения до температуры окружающей среды получили суспензию, которая имела рН от около 7,5 до 8,0. HCl 37% медленно добавляли, пока не был достигнут показатель рН=5. Твердое вещество отфильтровали и промыли водой (3 раза по 20 мл), а затем сушили его в вакуумной печи при 40 С в течение ночи. Выход: 6,37 г, 33,0 ммоль, 82% теоретич. 1 Н ЯМР (ДМСО-d6, 600 МГц,ppm): 14,29 (шир.с, 1 Н), 9,58 (д, 1 Н), 9,47 (д, 1 Н), 8,09 (д, 1 Н), 3,64 4-Метил-3-тиосемикарбазид (4,5 г, 42,8 ммоль) растворили в ДМФА (12,5 мл, 2,5 об) при перемешивании. Добавляли коммерчески доступную 2,4-диметил-1,3-оксазол-5-карбоновую кислоту (5 г, 35,4 ммоль) и DIPEA (15,5 мл, 89 ммоль). Смесь охлаждали до 5 С на бане лед-вода и добавляли по каплям раствор Т 3 Р 50% мас./мас. в этилацетате (45,5 мл, 76,4 ммоль) в течение 15 мин, поддерживая температуру ниже 10 С. После добавления смеси дали нагреться до температуры окружающей среды и перемешивали в течение 2 чв в атмосфере азота. Смесь разбавляли 22,5 мл воды и 22,5 мл раствора NaOH 32% мас./мас. при перемешивании (конечный рН=12). После разделения верхний органический слой удаляли,тогда как водную фазу нагревали до 70 С (65 С внутренняя). рН смеси проверяли с течением времени и рН доводили до 12 при необходимости. Нагревание поддерживали в течение всего 3 ч. После охлаждения до температуры окружающей среды добавили 2,5 мл раствора HCl 37% мас./мас., пока показатель рН не стал 8. Твердое вещество начало осаждаться и суспензию перемешивали в течение ночи. Смесь отфильтровали, слой осадка промыли 22,5 мл воды и собранное твердое вещество сушили в вакуумной печи при 40 С в течение 5 ч. Выход: 4,28 г, 57% от теоретического. 1 Н-ЯМР 600 МГц, ДМСО-d6: 2,26 (3H, с), 2,48 (3H, с), 3,59 (3H, с), 14,07 (1 Н, шир.с). МН+ [211] Пример 6. Получение производного 4-метил-5-(4-пиридазинил)-2,4-дигидро-3H-1,2,4-триазол-3 тиона: 4-5-[(3-хлорпропил)тио]-4-метил-4 Н-1,2,4-триазол-3-илпиридазинаK2CO3 325 меш (1,2 эквив., 4,3 г) суспендировали в смеси с ацетоном (17,5 мл) и метанолом (7,5 мл). Суспензию нагревали до 40 С и добавляли одновременно 1-бром-3-хлорпропан (1,1 эквив., 2,8 мл). Суспензию перемешивали при 40 С в течение 3 ч, а затем охладили до температуры окружающей среды. Добавили этилацетат (25 мл) и смесь перегоняли до приблизительно 20 мл. Смесь разбавляли этилацетатом (20 мл) и промывали ее водой (15 мл каждое промывание). Раствор сушили над Na2SO4, фильтровали и перегоняли вплоть до приблизительно 20 мл. Результирующий раствор охладили до температуры окружающей среды при перемешивании в течение 30 мин и перемешивали его еще дополнительные 30 мин. За это время часть продукта выпадет из раствора. В течение 30 мин по каплям добавляли гептан (40 мл) и результирующую суспензию перемешивали в течение по крайней мере 6 ч. Суспензию отфильтровали и слой осадка промыли смесью EtOAc/гептан 1/2 (15 мл). Главное соединение 4-5-[(3-хлорпропил)тио]-4 метил-4 Н-1,2,4-триазол-3-илпиридазин, сушили в печи при 40 С, пока не была достигнута постоянная масса. Выход: 61% теоретич., 4,27 гMS [MH]+ 270 ЯМР (ДМСО-d6, 600 МГц,ppm) 9,61 (дд, 1 Н), 9,43 (дд, 1 Н), 8,07 (дд, 1 Н), 3,78 (т, 2 Н), 3,73 (с, 3H),3,31 (т, 2 Н), 2,17 (м, 2 Н) Все публикации, включая, но, не ограничиваясь ими, патенты и патентные заявки, приведенные в данном описании изобретения, включены в контекст данного документа путем ссылки, как если бы было определено, что каждая отдельная публикация конкретно и в отдельности включена путем ссылки в контекст данного документа, как полностью изложенная. Следует понимать, что настоящее изобретение охватывает все комбинации конкретных и предпочтительных групп, описанных выше в контексте данного документа. Заявку, часть которой образуют данное описание и формула изобретения, можно применять в качестве основания приоритета в отношении любой последующей заявки. Формула изобретения подобной последующей заявки может быть направлена на любую характеристику или комбинацию характеристик,описанных в контексте данного документа. Они могут принимать форму продукта, композиции, способа или применения и могут включать в качестве примера и без ограничения следующую формулу изобретения. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Способ получения производных триазола формулы (I)Het означает арил или гетероарил (где арил обозначает ароматическую карбоциклическую функциональную группу, такую как фенил, бифенил или нафтил, а гетероарил означает моно- или бициклическое ароматическое гетероциклическое кольцо из от 5 до 10 членов и имеющее по крайней мере один гетероатом, выбранный из азота, кислорода и серы), каждый из которых может быть замещен от 1 до 4 групп J, выбранных из галогена, C1-C6 алкила, С 1-С 6 алкокси, галоген С 1-С 6 алкила, С 2-С 6 алкенила, С 2-С 6 алкинила, галоген С 1-С 6 алкокси, -C(O)R1, нитро, гидрокси, NR2R3, циано;R2 представляет собой водород или С 1-С 6 алкил;R3 представляет собой водород или С 1-С 6 алкил;R представляет собой Н, С 1-С 6 алкил, арил, бензил, каждый из которых может быть замещен от 1 до 4 групп J; в соответствии со следующей схемой: в которой стадия а представляет реакцию в основных условиях соединений (IIA) с производными тиосемикарбазида; стадия b представляет обработку неорганическим основанием и н-пропан фосфоновым циклическим ангидридом до достижения основного значения рН; стадия с представляет окончательное доведение рН до 4-8 неорганическими кислотами, с получением соединения формулы (I). 2. Способ по п.1, в котором в производном триазола формулы (I) замещенный Het означает 4-метил 1,3-оксазол-5-ил, a R1 представляет собой метил. 3. Способ по п.1, в котором в производном триазола формулы (I) замещенный Het означает 2,4 диметил-1,3-тиазол-5-ил, a R1 представляет собой метил. 4. Способ по п.1, в котором в производном триазола формулы (I) замещенный Het означает 2-метил 3-пиридинил, a R1 представляет собой метил. 5. Способ по п.1, в котором в производном триазола формулы (I) незамещенный Het означает 4 пиридазинил, a R1 представляет собой метил. 6. Способ по п.1, в котором в производном триазола формулы (I) замещенный Het означает 2,4 диметил-1,3-оксазол-5-ил, a R1 представляет собой метил.
МПК / Метки
МПК: C07D 413/04, C07D 403/04, C07D 417/04, C07D 401/04
Метки: гетероциклических, производных, способ, получения
Код ссылки
<a href="https://eas.patents.su/7-17304-sposob-polucheniya-geterociklicheskih-proizvodnyh.html" rel="bookmark" title="База патентов Евразийского Союза">Способ получения гетероциклических производных</a>
Предыдущий патент: Модифицированные гуманизированные антитела против интерлейкина-18 и их применение
Следующий патент: Новые аспарагиназы и их применение
Случайный патент: Узел соединения крышки и шпинделя запорного клапана











