Спирогетероциклические соединения и их применение в качестве антагонистов mglu5
Номер патента: 23020
Опубликовано: 29.04.2016
Авторы: Грацьяни Давид, Карамфилова Катя Димитрова, Мотта Джанни, Де Тома Карло, Леонарди Амедео, Рива Карло, Гварнери Лучано
Формула / Реферат
1. Соединение, имеющее общую формулу I
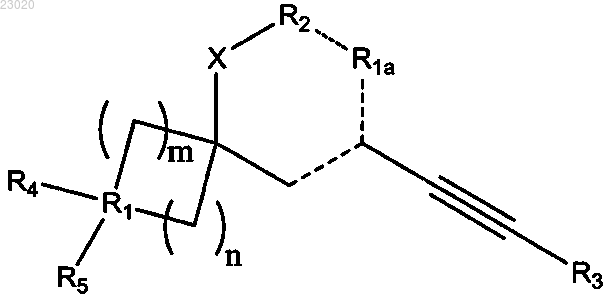
в которой X означает атом кислорода;
R1 означает атом углерода, азота, кислорода или серы;
R1a означает СН, СН2, N или NH;
R2 означает валентную связь или группу СН или СН2;
R3 означает необязательно замещенную С1-С6 алкильную группу, необязательно замещенную моно-, би- или трициклическую С1-С13 гетероциклильную группу, содержащую от 1 до 5 гетероатомов, выбранных из N, О и S, или необязательно замещенную моно-, би- или трициклическую С6-С14 арильную группу;
когда R1 означает атом углерода
R4 означает атом водорода, атом галогена, необязательно замещенную моно- или бициклическую C1-C9 гетероциклильную группу, содержащую от 1 до 3 гетероатомов, выбранных из N, О и S, или необязательно замещенную моно-, би-или трициклическую C6-C14 арильную группу;
R5 означает атом водорода или галогена, цианогруппу или необязательно замещенные гидрокси, меркапто, амино, карбамоил, C1-C6 алкильную или C1-C6 алкоксильную группу или группу формулы -C(=O)-R6, в которой R6 означает необязательно замещенную C1-C6 алкильную или C1-C6 алкоксильную группу, необязательно замещенную моно- или бициклическую C1-C9 гетероциклильную группу, содержащую от 1 до 3 гетероатомов, выбранных из N, О и S, или необязательно замещенную моно- би- или трициклическую C6-C14 арильную группу; или
R4 и R5 вместе означают оксогруппу или необязательно замещенную метиленовую или гидроксиимино группу; или
R4 и R5 вместе с R1 означают необязательно замещенное ненасыщенное 4-6-членное кольцо, содержащее от 0 до 3 гетероатомов, выбранных из N, О и S;
когда R1 означает атом кислорода
R4 и R5 отсутствуют;
когда R1 означает атом азота
один из R4 и R5 отсутствует и другой является таким, как определено в описании выше;
когда R1 означает атом серы
каждый из R4 и R5 независимо отсутствует или означает оксогруппу;
m равно 1, 2 или 3;
n равно 1 или 2;
когда n равно 2 или m равно 2 или 3, кольцо, содержащее R1, может быть сочленено с необязательно замещенным бензольным кольцом; и каждый ---- означает одинарную или двойную связь при условии, что одна двойная связь отходит от атома углерода, с которым связан R3-CºC-, и что ни один атом углерода кольца не имеет две двойные связи;
где заместители независимо выбраны из атомов галогена и C1-C6 алкильной, C1-C6 алкоксильной, гидроксильной, меркапто, нитро, циано, оксо, гало(C1-C6)алкильной, гало(C1-C6)алкоксильной, C1-C6 алкилтио, C1-C6 алкилсульфонильной, C1-C6 алкилкарбонильной, сульфамоильной, C1-C6 алкилсульфамоильной, ди(C1-C6)алкилсульфамоильной, (C1-C6)алкоксикарбонильной и (C1-C6)алкилкарбонил(C1-C6)алкильной групп и из групп формул -NR*R*, -C(=O)NR*R*, -А, -О-А, -С(=О)А,
-(CH2)q-A, -NR**-A, -C(=O)NR**-A, -NR**C(=O)A и -О-С(=О)А, в которых каждый R* независимо означает атом водорода или C1-C6 алкильную, C1-C6 алкилкарбонильную, фенильную или бензильную группу, R** означает атом водорода или C1-C6 алкильную группу, q равно целому числу от 1 до 6, и А означает фенильную группу или C1-C8 гетероциклильную группу, содержащую от 1 до 3 гетероатомов, выбранных из N, О и S; при этом каждая группа А необязательно замещена 1-3 группами, независимо выбранными из гало, гидрокси, циано, нитро и C1-C6 алкильных групп; и его гидраты, энантиомеры, диастереомеры и фармацевтически приемлемые соли.
2. Соединение по п.1, в котором X означает атом кислорода, R1a означает атом азота, R2 означает связь, и двойная связь отходит от R1a к атому углерода, с которым связан R3-CºC-.
3. Соединение по п.1, в котором X означает атом кислорода, R1a означает СН группу с двойной связью, отходящей от R1a к атому углерода, с которым связан R3-СºС-, или СН2 группу с одинарной связью, отходящей от R1a к атому углерода, с которым связан R3-CºC-, и R2 означает СН2 группу.
4. Соединение по любому из пп.1-3, в котором R3 означает алкильную группу, необязательно замещенную C3-C5 гетеромоноциклическую группу, содержащую от 1 до 3 гетероатомов, выбранных из N, О и S, или необязательно замещенную фенильную группу.
5. Соединение по любому из пп.1-3, в котором R3 означает метильную, изопропильную, бутильную, фенильную, 3-(t.бутил)фенильную, 2-хлорфенильную, 3-хлорфенильную, 3-хлор-5-фторфенильную, 2-цианофенильную, 3-цианофенильную, 3-этоксифенильную, 3-этилфенильную, 2-фторфенильную, 3-фторфенильную, 4-фторфенильную, 3-гидроксифенильную, 3-изопропилфенильную, 3-метоксифенильную, 2-метилфенильную, 3-метилфенильную, 3-(3-метил-[1,2,4]-оксадиазол-5-ил)фенильную, 3-нитрофенильную, 3-трифторметоксифенильную, 3-трифторметилфенильную, 2-пиридильную, 4-хлор-2-пиридильную, 5-хлор-2-пиридильную, 5-фтор-2-пиридильную, 6-фтор-2-пиридильную, 4-метил-2-пиридильную, 6-метокси-3-пиридильную, 6-метил-2-пиридильную, 4-трифторметил-2-пиридильную, 3-пиридильную, 6-фтор-3-пиридильную, 2-фурильную, 2-тиенильную, 3-тиенильную, 2-пиразинильную, 2-метил-1,3-тиазол-4-ильную или 2-фуроильную группы.
6. Соединение по любому из пп.1-5, в котором R1 означает атом углерода, R4 означает атом водорода, атом галогена, необязательно замещенную моноциклическую C3-C5 гетероциклильную группу, содержащую от 1 до 3 гетероатомов, выбранных из N, О и S, или необязательно замещенную фенильную группу; и R5 означает атом водорода или галогена, цианогруппу, или необязательно замещенные гидрокси, меркапто, амино, карбамоил, C1-C6 алкил или C1-C6 алкоксигруппы, или группу формулы -C(=O)-R6, в которой R6 означает необязательно замещенную C1-C6 алкильную группу, необязательно замещенную моноциклическую C3-C5 гетероциклильную группу, содержащую от 1 до 3 гетероатомов, выбранных из N, О и S, или необязательно замещенную фенильную группу.
7. Соединение по любому из пп.1-5, в котором R1 означает атом углерода, R4 означает атом водорода или фтора или 2-пиридильную группу и R5 означает атом водорода, или фтора, или циано, гидроксильную или этоксикарбонильную группы.
8. Соединение по любому из пп.1-5, в котором R1 означает атом углерода и R4 и R5 вместе означают оксо, метиленовую, дифторметиленовую, 2-пиридилметиленовую, триметиленовую, тетраметиленовую, этилендиокси, пропилендиокси, оксиэтильную, оксипропильную, метиленоксиметиленовую, гидроксиимино, метоксиимино или 1-карбокси-3-гидроксипропоксиимино группу.
9. Соединение по любому из пп.1-5, в котором R1 означает атом углерода и R4 и R5 вместе с R1 означают группу формулы -(Yp)-, в которой р равно целому числу от 3 до 5, и каждый Y независимо означает атом кислорода или необязательно замещенную метиленовую группу при условии, что две смежные Y части не означают атомы кислорода.
10. Соединение по п.9, в котором R4 и R5 вместе означают группу формулы -О-СН2СН2-О-, -О-СН2СН2СН2-О-,
-О-СН2СН2-, -О-СН2СН2СН2-, -СН2-О-СН2-, -СН2СН2СН2-, -СН2СН2СН2СН2-, -СН2СН2СН2СН2СН2- или
-CH2CH2CF2CH2CH2-.
11. Соединение по любому из пп.1-5, в котором R1 означает атом азота; R4 означает необязательно замещенную С3-С5 гетеромоноциклическую группу, содержащую от 1 до 3 гетероатомов, выбранных из N, О и S; и R5 отсутствует.
12. Соединение по любому из пп.1-5, в котором R1 означает атом азота; R4 означает 3-циано-2-пиразинильную, 3-нитро-2-пиридильную или 3-нитро-6-метил-2-пиридильную группу и R5 отсутствует.
13. Соединение по любому из пп.1-5, в котором R1 означает атом азота; R4 отсутствует и R5 означает алкоксикарбонильную, необязательно замещенную арилкарбонильную, необязательно замещенную гетероциклилкарбонильную, карбамоильную, диалкилкарбамоильную, N-алкокси-N-алкилкарбамоильную или необязательно замещенную гетероциклилкарбамоильную группу.
14. Соединение по любому из пп.1-5, в котором R1 означает атом азота; R4 отсутствует и R5 означает этоксикарбонильную, 3-хлорбензоильную, 2-фуроильную, 2-оксо-1-имидазолидинилкарбонильную, 3-метилсульфонил-2-оксо-1-имидазолидинилкарбонильную, 4-метил-1-пиперазинилкарбонильную, пиперидинокарбонильную, 1-пирролидинилкарбонильную, карбамоильную, диметилкарбамоильную, диэтилкарбамоильную, N-метокси-N-метилкарбамоильную, N-этил-N-изопропилкарбамоильную или 4-пиридилкарбамоильную группы.
15. Соединение по п.1, выбранное из группы, включающей
3-фенилэтинил-8-(6-метил-3-нитро-2-пиридил)-1-окса-2,8-диазаспиро[4.5]дек-2-ен,
3-фенилэтинил-8-(3-нитро-2-пиридил)-1-окса-2,8-диазаспиро[4.5]дек-2-ен,
3-[(6-метил-2-пиридил)этинил]-8-(6-метил-3-нитро-2-пиридил)-1-окса-2,8-диазаспиро[4.5]дек-2-ен,
3-(2-тиенилэтинил)-8-(6-метил-3-нитро-2-пиридил)-1-окса-2,8-диазаспиро[4.5]дек-2-ен,
3-(2-пиридилэтинил)-8-(6-метил-3-нитро-2-пиридил)-1-окса-2,8-диазаспиро[4.5]дек-2-ен,
3-(2-фторфенилэтинил)-8-(6-метил-3-нитро-2-пиридил)-1-окса-2,8-диазаспиро[4.5]дек-2-ен,
3-(3-фторфенилэтинил)-8-(6-метил-3-нитро-2-пиридил)-1-окса-2,8-диазаспиро[4.5]дек-2-ен,
3-(4-фторфенилэтинил)-8-(6-метил-3-нитро-2-пиридил)-1-окса-2,8-диазаспиро[4.5]дек-2-ен,
3-(2-фурилэтинил)-8-(6-метил-3-нитро-2-пиридил)-1-окса-2,8-диазаспиро[4.5]дек-2-ен,
3-[(2-метил-1,3-тиазол-4-ил)этинил]-8-(6-метил-3-нитро-2-пиридил)-1-окса-2,8-диазаспиро[4.5]дек-2-ен,
3-(проп-1-инил)-8-(6-метил-3-нитро-2-пиридил)-1-окса-2,8-диазаспиро[4.5]дек-2-ен,
3-(3-хлорфенилэтинил)-8-(6-метил-3-нитро-2-пиридил)-1-окса-2,8-диазаспиро[4.5]дек-2-ен,
3-(3-метилфенилэтинил)-8-(6-метил-3-нитро-2-пиридил)-1-окса-2,8-диазаспиро[4.5]дек-2-ен,
3-(3-метоксифенилэтинил)-8-(6-метил-3-нитро-2-пиридил)-1-окса-2,8-диазаспиро[4.5]дек-2-ен,
3-(3-цианофенилэтинил)-8-(6-метил-3-нитро-2-пиридил)-1-окса-2,8-диазаспиро[4.5]дек-2-ен,
3-(3-тиенилэтинил)-8-(6-метил-3-нитро-2-пиридил)-1-окса-2,8-диазаспиро[4.5]дек-2-ен,
3-(3-пиридилэтинил)-8-(6-метил-3-нитро-2-пиридил)-1-окса-2,8-диазаспиро[4.5]дек-2-ен,
3-{3-(3-метил-[1,2,4]оксадиазол-5-ил)фенилэтинил}-8-(6-метил-3-нитро-2-пиридил)-1-окса-2,8-диазаспиро[4.5]дек-2-ен,
3-(3-метилбут-1-инил)-8-(6-метил-3-нитро-2-пиридил)-1-окса-2,8-диазаспиро[4.5]дек-2-ен,
3-(гекс-1-инил)-8-(6-метил-3-нитро-2-пиридил)-1-окса-2,8-диазаспиро[4.5]дек-2-ен,
3-(2-цианофенилэтинил)-8-(6-метил-3-нитро-2-пиридил)-1-окса-2,8-диазаспиро[4.5]дек-2-ен,
3-(3-хлорфенилэтинил)-8-(3-циано-2-пиразинил)-1-окса-2,8-диазаспиро[4.5]дек-2-ен,
3-(2-метилфенилэтинил)-8-(6-метил-3-нитро-2-пиридил)-1-окса-2,8-диазаспиро[4.5]дек-2-ен,
3-(2-хлорфенилэтинил)-8-(6-метил-3-нитро-2-пиридил)-1-окса-2,8-диазаспиро[4.5]дек-2-ен,
3-(2-пиразинилэтинил)-8-(6-метил-3-нитро-2-пиридил)-1-окса-2,8-диазаспиро[4.5]дек-2-ен,
3-фенилэтинил-8-(6-метил-3-нитро-2-пиридил)-1-окса-8-азаспиро[4.5]дек-3-ен,
3-(3-хлорфенилэтинил)-7-(6-метил-3-нитро-2-пиридил)-1-окса-2,7-диазаспиро[4.4]нон-2-ен,
3-(3-хлорфенилэтинил)-7-(6-метил-3-нитро-2-пиридил)-1-окса-2,7-диазаспиро[4.3]окт-2-ен,
4-фенилэтинил-9-(6-метил-3-нитро-2-пиридил)-1-окса-9-азаспиро[5.5]ундек-4-ен,
4-фенилэтинил-9-(6-метил-3-нитро-2-пиридил)-1-окса-9-азаспиро[5.5]ундек-3-ен,
3-(3-хлорфенилэтинил)-1,9,12-триокса-2-азадиспиро[4.2.4.2]тетрадек-2-ен,
3-(3-хлорфенилэтинил)-8-оксо-1-окса-2-азаспиро[4.5]дек-2-ен,
3-(3-хлорфенилэтинил)-8-метилен-1-окса-2-азаспиро[4.5]дек-2-ен,
3-(3-хлорфенилэтинил)-8-метоксиимино-1-окса-2-азаспиро[4.5]дек-2-ен,
3-[(6-метил-2-пиридил)этинил]-7-(6-метил-3-нитро-2-пиридил)-1-окса-2,7-диазаспиро[4.4]нон-2-ен,
3-фенилэтинил-7-(6-метил-3-нитро-2-пиридил)-1-окса-2,7-диазаспиро[4.4]нон-2-ен,
3-(3-фторфенилэтинил)-7-(6-метил-3-нитро-2-пиридил)-1-окса-2,7-диазаспиро[4.4]нон-2-ен,
3-фенилэтинил-7-(6-метил-3-нитро-2-пиридил)-1-окса-2,7-диазаспиро[4.3]окт-2-ен,
3-(3-гидроксифенилэтинил)-7-(6-метил-3-нитро-2-пиридил)-1-окса-2,7-диазаспиро[4.4]нон-2-ен,
3-(3-фторфенилэтинил)-7-(6-метил-3-нитро-2-пиридил)-1-окса-2,7-диазаспиро[4.3]окт-2-ен,
3-(3-хлорфенилэтинил)-8-(2-пиридилметилен)-1-окса-2-азаспиро[4.5]дек-2-ен,
3-фенилэтинил-1,9,12-триокса-2-азадиспиро[4.2.4.2]тетрадек-2-ен,
3-фенилэтинил-8-оксо-1-окса-2-азаспиро[4.5]дек-2-ен,
3-[(6-метил-2-пиридил)этинил]-8-циано-8-(2-пиридил)-1-окса-2-азаспиро[4.5]дек-2-ен,
3-[(5-фтор-2-пиридил)этинил]-1,9,12-триокса-2-азадиспиро[4.2.4.2]тетрадек-2-ен,
3-[(6-метил-2-пиридил)этинил]-1,9,12-триокса-2-азадиспиро[4.2.4.2]тетрадек-2-ен,
3-[(6-фтор-2-пиридил)этинил]-1,9,12-триокса-2-азадиспиро[4.2.4.2]тетрадек-2-ен,
3-[(6-фтор-3-пиридил)этинил]-1,9,12-триокса-2-азадиспиро[4.2.4.2]тетрадек-2-ен,
3-(3-нитрофенилэтинил)-1,9,12-триокса-2-азадиспиро[4.2.4.2]тетрадек-2-ен,
3-[(2-метил-1,3-тиазол-4-ил)этинил]-1,9,12-триокса-2-азадиспиро[4.2.4.2]тетрадек-2-ен,
3-(3-метоксифенилэтинил)-1,9,12-триокса-2-азадиспиро[4.2.4.2]тетрадек-2-ен,
3-(3-хлор-5-фторфенилэтинил)-1,9,12-триокса-2-азадиспиро[4.2.4.2]тетрадек-2-ен,
3-(3-метилфенилэтинил)-1,9,12-триокса-2-азадиспиро[4.2.4.2]тетрадек-2-ен,
3-(3-этоксифенилэтинил)-1,9,12-триокса-2-азадиспиро[4.2.4.2]тетрадек-2-ен,
3-(3-трифторметоксифенилэтинил)-1,9,12-триокса-2-азадиспиро[4.2.4.2]тетрадек-2-ен,
3-(3-t.бутилфенилэтинил)-1,9,12-триокса-2-азадиспиро[4.2.4.2]тетрадек-2-ен,
3-(3-цианофенилэтинил)-1,9,12-триокса-2-азадиспиро[4.2.4.2]тетрадек-2-ен,
3-(3-фторфенилэтинил)-1,9,12-триокса-2-азадиспиро[4.2.4.2]тетрадек-2-ен,
3-(3-этилфенилэтинил)-1,9,12-триокса-2-азадиспиро[4.2.4.2]тетрадек-2-ен,
3-(3-изопропилфенилэтинил)-1,9,12-триокса-2-азадиспиро[4.2.4.2]тетрадек-2-ен,
3-[(4-хлор-2-пиридил)этинил]-1,9,12-триокса-2-азадиспиро[4.2.4.2]тетрадек-2-ен,
3-[(4-метил-2-пиридил)этинил]-1,9,12-триокса-2-азадиспиро[4.2.4.2]тетрадек-2-ен,
3-(3-трифторметилфенилэтинил)-1,9,12-триокса-2-азадиспиро[4.2.4.2]тетрадек-2-ен,
3-[(4-трифторметил-2-пиридил)этинил]-1,9,12-триокса-2-азадиспиро[4.2.4.2]тетрадек-2-ен,
3-[(5-хлор-3-пиридил)этинил]-1,9,12-триокса-2-азадиспиро[4.2.4.2]тетрадек-2-ен,
3-фенилэтинил-8-(1-карбокси-3-гидроксипропоксиимино)-1-окса-2-азаспиро[4.5]дек-2-ен,
3-(3-хлорфенилэтинил)-1,8-диокса-2-азаспиро[4.5]дек-2-ен,
3-[(6-метил-2-пиридил)этинил]-1,8-диокса-2-азаспиро[4.5]дек-2-ен,
3-[(4-хлор-2-пиридил)этинил]-1,8-диокса-2-азаспиро[4.5]дек-2-ен,
3-(3-хлорфенилэтинил)-1-окса-8-тиа-2-азаспиро[4.5]дек-2-ен 8,8-диоксид,
3-(3-хлорфенилэтинил)-1,7-диокса-2-азаспиро[4.5]дек-2-ен,
3-(3-хлорфенилэтинил)-1,9-диокса-2-азадиспиро[4.2.4.2]тетрадек-2-ен,
3-(3-метилфенилэтинил)-1,9-диокса-2-азадиспиро[4.2.4.2]тетрадек-2-ен,
3-(3-гидроксифенилэтинил)-7-(6-метил-3-нитро-2-пиридил)-1-окса-2,7-диазаспиро[4.3]окт-2-ен,
3-(3-цианофенилэтинил)-7-(6-метил-3-нитро-2-пиридил)-1-окса-2,7-диазаспиро[4.3]окт-2-ен,
3'-(3-хлорфенилэтинил)-2,3-дигидро-3-гидрокси-4'Н-спиро[инден-1,5'-изоксазол],
3'-(3-хлорфенилэтинил)-2,3-дигидро-3-оксо-4'Н-спиро[инден-1,5'-изоксазол],
3'-(3-хлорфенилэтинил)-2,3-дигидро-3-метоксиимино-4'Н-спиро[инден-1,5'-изоксазол],
3-(3-хлорфенилэтинил)-1,9-диокса-2-азадиспиро[4.2.3.2]тридек-2-ен,
3-(3-хлорфенилэтинил)-1,9,13-триокса-2-азадиспиро[4.2.5.2]пентадек-2-ен,
3'-[(6-метил-2-пиридил)этинил]-2,3-дигидро-3-гидрокси-4'Н-спиро[инден-1,5'-изоксазол],
3-(3-хлорфенилэтинил)-1-окса-2-азадиспиро[4.2.4.2]тетрадек-2-ен,
3-(3-хлорфенилэтинил)-8,8-дифтор-1-окса-2-азаспиро[4.5]дек-2-ен,
3-(3-метилфенилэтинил)-1-окса-2-азадиспиро[4.2.4.2]тетрадек-2-ен,
3-[(6-метокси-3-пиридил)этинил]-1,9,12-триокса-2-азадиспиро[4.2.4.2]тетрадек-2-ен,
3'-[(6-метил-2-пиридил)этинил]-2,3-дигидро-3-оксо-4'Н-спиро[инден-1,5'-изоксазол],
3'-[(6-метил-2-пиридил)этинил]-2,3-дигидро-3-метоксиимино-4'Н-спиро[инден-1,5'-изоксазол],
3-(3-хлорфенилэтинил)-7-диметилкарбамоил-1-окса-2,7-диазаспиро[4.4]нон-2-ен,
3-(3-хлорфенилэтинил)-7-карбамоил-1-окса-2,7-диазаспиро[4.4]нон-2-ен,
3-(3-хлорфенилэтинил)-1-окса-2-аза-диспиро[4.1.3.1 ]ундек-2-ен,
3-(3-метилфенилэтинил)-1,9,13-триокса-2-азадиспиро[4.2.5.2]пентадек-2-ен,
3-(3-хлорфенилэтинил)-1-окса-2-азаспиро[4.3]окт-2-ен,
3-(3-хлорфенилэтинил)-1,10-диокса-2-азадиспиро[4.2.3.2]тридек-2-ен,
3-[(4-хлор-2-пиридил)этинил]-8,8-дифтор-1-окса-2-азаспиро[4.5]дек-2-ен,
3-[(4-хлор-2-пиридил)этинил]-8-этоксикарбонил-1-окса-2-азаспиро[4.5]дек-2-ен,
3'-(3-хлорфенилэтинил)-1Н,4'Н-спиро[изохроман-4,5'-изоксазол],
3-(3-хлорфенилэтинил)-7-(4-метил-1-пиперазинилкарбонил)-1-окса-2,7-диазаспиро[4.4]нон-2-ен,
3-(3-хлорфенилэтинил)-7-(2-оксо-1-имидазолидинилкарбонил)-1-окса-2,7-
диазаспиро[4.4]нон-2-ен,
3-(3-хлорфенилэтинил)-7-(1-пирролидинилкарбонил)-1-окса-2,7-диазаспиро[4.4]нон-2-ен,
3-(3-хлорфенилэтинил)-7-пиперидинокарбонил-1-окса-2,7-диазаспиро[4.4]нон-2-ен,
3-(3-хлорфенилэтинил)-7-(3-метилсульфонил-2-оксо-1-имидазолидинилкарбонил)-1-окса-2,7-диазаспиро[4.4]нон-2-ен,
3-(3-хлорфенилэтинил)-7-(N-этил-N-изопропилкарбамоил)-1-окса-2,7-диазаспиро[4.4]нон-2-ен,
3-(3-хлорфенилэтинил)-7-(N-метокси-N-метилкарбамоил)-1-окса-2,7-диазаспиро[4.4]нон-2-ен,
3-(3-хлорфенилэтинил)-7-(4-пиридилкарбамоил)-1-окса-2,7-диазаспиро[4.4]нон-2-ен,
3-(3-хлорфенилэтинил)-7-этоксикарбонил-1-окса-2,7-диазаспиро[4.4]нон-2-ен,
3-[(6-метил-2-пиридил)этинил]-8,8-дифтор-1-окса-2-азаспиро[4.5]дек-2-ен,
3-(3-хлорфенилэтинил)-1,7-диокса-2-азаспиро[4.3]окт-2-ен,
3-(3-хлорфенилэтинил)-1-окса-3-азаспиро[4.5]дек-2-ен,
3-(3-хлорфенилэтинил)-8-дифторметилен-1-окса-2-азаспиро[4.5]дек-2-ен,
3-(3-хлорфенилэтинил)-8-карбамоил-1-окса-2-азаспиро[4.5]дек-2-ен,
3-(3-хлорфенилэтинил)-8-(2-фуроил)-1-окса-2,8-диазаспиро[4.5]дек-2-ен,
3-(3-хлорфенилэтинил)-8-(N-метокси-N-метил-карбамоил)-1-окса-2,8-диазаспиро[4.5]дек-2-ен,
3-(3-хлорфенилэтинил)-8-диэтилкарбамоил-1-окса-2,8-диазаспиро[4.5]дек-2-ен,
3-(3-хлорфенилэтинил)-8-(3-хлорбензоил)-1-окса-2,8-диазаспиро[4.5]дек-2-ен,
3-(3-хлорфенилэтинил)-8-этоксикарбонил-1-окса-2,8-диазаспиро[4.5]дек-2-ен,
3-(3-хлорфенилэтинил)-8-(1-пирролидинилкарбонил)-1-окса-2,8-диазаспиро[4.5]дек-2-ен,
3-(3-хлорфенилэтинил)-8-диметилкарбамоил-1-окса-2,8-диазаспиро[4.5]дек-2-ен,
3-(3-хлорфенилэтинил)-8-(t.бутоксикарбонил)-6-метокси-1-окса-2,8-диазаспиро[4.4]нон-2-ен или
3-(3-хлорфенилэтинил)-8-этоксикарбонил-6-метокси-1-окса-2,8-диазаспиро[4.4]нон-2-ен,
или их фармацевтически приемлемые соли.
16. Фармацевтическая композиция для лечения заболеваний или нарушений нижних мочевыводящих путей, мигрени; гастроэзофагеальной рефлюксной болезни, тревожных расстройств, передозировки, аддиктивных расстройств и абстинентных расстройств, нейропатической боли и синдрома умственной отсталости с ломкой хромосомой X, включающая соединение по любому из пп.1-14 или его гидрат, энантиомер, диастереомер или фармацевтически приемлемые соли в смеси с фармацевтически приемлемым носителем.
Текст
Изобретение предусматривает создание соединений, имеющих общую формулу IR1a означает СН, СН 2, N или NH; R2 означает валентную связь или группу СН или СН 2; m равно 1, 2 или 3; n равно 1 или 2; когда n равно 2 или m равно 2 или 3, кольцо, содержащееR1, может быть сочленено с необязательно замещенным бензольным кольцом; и каждый означает одинарную или двойную связь при условии, что одна двойная связь отходит от атома углерода, с которым связан R3-СС-, и что ни один атом углерода кольца не имеет две двойных связи; и R3, R4 и R5 означают широкий диапазон заместителей. Настоящее изобретение дополнительно предусматривает создание фармацевтической композиции для лечения заболеваний или нарушений нижних мочевыводящих путей, мигрени; гастроэзофагеальной рефлюксной болезни, тревожных расстройств, передозировки, аддиктивных расстройств и абстинентных расстройств, нейропатической боли; синдрома умственной отсталости с ломкой хромосомойX, включающей соединение формулы I или его гидрат, энантиомер, диастереомер или их фармацевтически приемлемые соли в смеси с фармацевтически приемлемым носителем. Область техники, к которой относится изобретение Изобретение относится к новым спирогетероциклическим соединениям, обладающим избирательным сродством к метаботропным глутаматным рецепторам 5-го подтипа (mGlu5), к фармацевтическим композициям, включающим такие соединения, и к способам лечения с их использованием. Предпосылки создания изобретения Заболевания нижних мочевыводящих путей включают ряд синдромов, негативно влияющих на нормальное мочеиспускание. К заболеваниям нижних мочевыводящих путей может привести сочетание патологических и(или) возрастных изменений мочеполовой системы, или иная этиология, например,неврологические расстройства. Лица, имеющие заболевания нижних мочевыводящих путей, страдают от ухудшения качества жизни, в том числе от состояния нарушенного душевного равновесия, низкого самовосприятия и общего снижения эмоционального равновесия, социальной функции и общего состояния здоровья. Более того, заболевания нижних мочевыводящих путей могут быть связаны с другими физическими заболеваниями, в том числе с целлюлитом, пролежневой язвой, инфекциями мочевыводящих путей, падениями с переломами костей, депривацией сна, социальной самоизоляцией, депрессией и половой дисфункцией. Со стороны лиц, оказывающих медицинскую помощь, а именно, как членов семьи, так и медиков, в отношении людей пожилого возраста с заболеваниями нижних мочевыводящих путей, требуется проявление большей заботы, что может послужить фактором при принятии решений о помещении их в медицинские учреждения. По оценкам Национального института здравоохранения США около 35 миллионов американских граждан страдают заболеваниями нижних мочевыводящих путей. Заболевания нижних мочевыводящих путей наиболее часто встречаются у женщин, чем у мужчин (2:1) в возрасте до 80 лет, а по достижению указанного возраста мужчины и женщины в равной степени подвержены этому заболеванию. Частотность заболеваний нижних мочевыводящих путей увеличивается с возрастом. К 65 годам заболевания нижних мочевыводящих путей поражают от 15 до 30% всех лиц и приблизительно 50% хронических больных. Для лечения заболеваний нижних мочевыводящих путей применялись лечебные препараты, характеризующиеся различными механизмами действия. Указанные препараты включают препараты, непосредственно воздействующие на нижние мочевыводящие пути, например, антимускариновые средства и альфа-1 антагонисты, а также препараты, действующие через центральную нервную систему, например,ингибиторы обратного захвата серотонина и (или) норадреналина. По информации Института здравоохранения США, несмотря на достигнутый определенный прогресс в области диагностики, управления ходом и лечения заболеваний нижних мочевыводящих путей, указанные заболевания нередко остаются трудноизлечимыми. Таким образом, до сих пор существует необходимость в усовершенствованных лекарственных препаратах, рецептурах и терапевтических методах для лечения заболеваний нижних мочевыводящих путей. Глутаминовая кислота - возбуждающая аминокислота - присутствует при синапсисе по всей центральной нервной системе, и, как известно, воздействует по меньшей мере на два типа рецепторов: ионотропные и метаботропные глутаматные рецепторы. Основная функция ионотропных глутаматных рецепторов заключается в том, что их активация формирует лигандуправляемые ионные каналы и, тем самым непосредственно опосредует передачу электрических сигналов нервных клеток, вызывая быстрые и относительно значительные сдвиги проводимости в постсинаптических мембранах. Метаботропные глутаматные рецепторы (mGluRs) косвенно регулируют передачу электрических сигналов, оказывая влияние на межклеточные метаболические процессы с помощью G-протеинов. Сдвиги в постсинаптической клетке, опосредованные метаботропными глутаматными рецепторами, в последующем относительно замедляются со временем и не связаны с быстрыми и значительными сдвигами в проводимости нейрональных мембран. Было приведено описание трех подтипов ионотропных глутаматных рецепторов, т.е., NMDAрецепторов, АМРА-рецепторов и каинатных рецепторов. Было клонировано восемь подтипов метаботропных глутаматных рецепторов. Подтипы классифицируются на три группы на основе сходств последовательностей и фармакологических и биохимических свойств (Spooren et al., Trends Pharmacol. Sci. 22: 331-337, 2001): рецепторы mGlu группы I (mGlui иmGlu5), рецепторы mGlu группы II (mGlu2 и mGlu3) и рецепторы mGlu группы III (mGlu4, mGlu6, mGlu7 и mGlu8). Известно, что метаботропный глутаматный рецептор 5-го подтипа группы I (либо человеческий,либо крысиный) включает по меньшей мере два подтипа - "а" и "b". Подтип "b" длиннее, чем подтип "а" из-за альтернативного сплайсинга удлинения 32 аминокислот в С-терминальном (внутриклеточном) домене, 50 аминокислотных остатков в нижней части начала домена. Длина человеческого рецептораmGlu5b составляет 1212 аминокислот, в то время как в форме "а" отсутствуют аминокислоты с 877 по 908 ( 828 является первой аминокислотой внутриклеточного домена). Длина крысиного рецептора( 827 является первой аминокислотой внутриклеточного домена). (Hermans and Challis, Biochem. J. 359: 465-484, 2001). Рецепторы mGlu, принадлежащие семейству 3-х рецепторов, сопряжнных с G-белком (GPCR), характеризуются двумя отличающимися топологическими доменами: большой внеклеточный Nтерминальный домен, содержащий модуль венериной мухоловки, ответственный за связывание агониста,и 7-ТМ домен плюс внутриклеточный С-терминальный домен, участвующий в активации рецептора и в связывании G-белка. Было продемонстрировано, что 7-ТМ домен рецепторов mGlu группы I образует связывающий"карман" в соотношении положительных и отрицательных аллостерических модуляторов; отрицательные аллостерические модуляторы были определены благодаря применению технологий скрининга с высокой пропускной способностью, и они действуют в качестве неконкурирующих антагонистов, не оказывая при этом воздействия на связывание агониста. Наиболее интересным свойством указанных молекул, кроме их высокой активности, является исключительная селективность в соотношении подтипа. Область связывания 7-ТМ расположена в "кармане", окаймленном TM-III, ТМ-V, TM-VI и TM-VII; указанный сайт соответствует ретинальному связывающему "карману" в родопсине. Аллостерические модуляторы метаботропного глутаматного рецептора 5-го подтипа представляют собой замечательное достижение, позволяющее продемонстрировать возможности разработки новых научно-исследовательских инструментов и терапевтических средств, регулирующих активность специфических подтипов mGluR. Соединения настоящего изобретения включают приведенные в настоящем описании соединения,применяемые в качестве антагонистов метаботропного глутаматного рецептора 5-го подтипа, которые во многих случаях фактически являются отрицательными аллостерическими модуляторами, воздействующими на область связывания 7-ТМ. В заявке на патент WO 00/63166 раскрываются производные трициклической карбаминовой кислоты, применяемые для лечения различных заболеваний, в том числе недержания мочи. Раскрываемые производные являются агонистами или антагонистами рецепторов mGlu группы I, обладающих специфичностью в соотношении к рецептору mGlui. В заявке на патент WO 01/32632 раскрываются производные пиримидина, применяемые для лечения различных заболеваний, в том числе недержания мочи. Производные раскрываются как селективные антагонисты рецептора mGlui, обладающего по меньшей мере 10-кратной селективностью в соотношении рецептора mGlui по сравнению с рецепторомmGlu 5. В заявке на патент WO 01/27070 раскрываются новые бис-арилацетамиды, применяемые для лечения недержание мочи, помимо других состояний. Раскрываются молекулы, являющиеся агонистами или антагонистами, обладающими селективностью в соотношении рецептора mGlul. В патенте США 6,369,222 раскрываются производные гетероциклоазепенил пиримидина, применяемые для лечения недержание мочи, помимо других состояний. Производные раскрываются как антагонисты рецептора mGlul Таким образом, в вышеуказанных областях применения и в патенте раскрываются антагонисты рецептора mGlul для их применения при лечении недержания мочи. Тем не менее, ни в одной из ссылок не дается экспериментального подтверждения лечения недержания мочи либо у человека, либо в животной модели заболевания нижних мочевыводящих путей. Нами было проведено тестирование активности селективных антагонистов mGlul и mGlu5 в крысиных моделях, применяемых для обнаружения воздействия на нижние мочевыводящие пути. Высокая эффективность была обнаружена для антагонистов, селективных в отношении к метаботропному глутаматному рецептору 5-го подтипа, в то время как коммерчески доступные на рынке антагонисты, селективные в отношении метаботропному глутаматному рецептору 1-го подтипа не проявили такого воздействия. Антагонист, селективный в соотношении рецепторов mGluR группы II также не проявил указанного воздействия в крысиной модели. Учитывая указанные результаты селективные антагонисты метаботропного глутаматного рецептора 5-го подтипа могут явиться эффективным средством для лечения заболеваний нижних мочевыводящих путей. В данной области техники существует необходимость в разработке новых соединений и композиций для лечения заболеваний нижних мочевыводящих путей и ослабления симптомов, связанных с такими заболеваниями. Изобретатели настоящего изобретения решили эту проблему путем разработки новых гетероциклических соединений, являющихся селективными модуляторами метаботропного глутаматного рецептора 5-го подтипа, в том числе селективными антагонистами метаботропного глутаматного рецептора 5-го подтипа. Соединения в соответствии с настоящим изобретением обеспечивают эффективное ингибирование рефлекса мочеиспускания благодаря новому механизму действия. Настоящее изобретение предусматривает создание соединения, имеющего общую формулу IR2 означает валентную связь или группу СН или СН 2;R3 означает необязательно замещенную C1-C6 алкильную группу, необязательно замещенную моно-, биили трициклическую С 1-С 13 гетероциклильную группу, содержащую от 1 до 5 гетероатомов, выбранных из N, О и S, или необязательно замещенную моно-, би- или трициклическую C6-C14 арильную группу; когда R1 означает атом углерода,R4 означает атом водорода, атом галогена, необязательно замещенную моно- или бициклическуюC1-С 9 гетероциклильную группу, содержащую от 1 до 3 гетероатомов, выбранных из N, О и S, или необязательно замещенную моно-, би-или трициклическую C6-C14 арильную группу;R5 означает атом водорода или галогена, цианогруппу, или необязательно замещенные гидрокси,меркапто, амино, карбамоил, C1-С 6 алкильную или C1-С 6 алкоксильную группу или группу формулы-C(=O)-R6, в которой R6 означает необязательно замещенную C1-С 6 алкильную или C1-С 6 алкоксильную группу, необязательно замещенную моно- или бициклическую C1-С 9 гетероциклильную группу, содержащую от 1 до 3 гетероатомов, выбранных из N, О и S, или необязательно замещенную моно-, би- или трициклическую С 6-С 14 арильную группу; илиR4 и R5 вместе означают оксогруппу или необязательно замещенную метиленовую или гидроксиимино группу; илиR4 и R5 вместе с R1 означают необязательно замещенное ненасыщенное 4-6-членное кольцо, содержащее от 0 до 3 гетероатомов, выбранных из N, О и S; когда R1 означает атом кислорода,R4 и R5 отсутствуют; когда R1 означает атом азота,один из R4 и R5 отсутствует и другой является таким, как определено в описании выше; когда R1 означает атом серы,каждый из R4 и R5 независимо отсутствует или означает оксогруппу;n равно 1 или 2; когда n равно 2 или m равно 2 или 3, кольцо, содержащее R1, может быть сочленено с необязательно замещенным бензольным кольцом; и каждыйозначает одинарную или двойную связь, при условии, что одна двойная связь отходит от атома углерода, с которым связан R3-CC-, и что ни один атом углерода кольца не имеет две двойных связи; и сольваты, гидраты, энантиомеры, диастереомеры, N-оксиды и фармацевтически приемлемые соли таких соединений. Необязательные заместители независимо выбраны из атомов галогена и C1-C6 алкильной, C1-C6 алкоксильной, гидроксильной, меркапто, нитро, циано, оксо, гало(C1-C6)алкильной, гало(C1-C6) алкоксильной, C1-C6 алкилтио, C1-C6 алкилсульфонильной, C1-C6 алкилкарбонильной, сульфамоильной, C1-C6 алкилсульфамоильной, ди(C1-C6)алкилсульфамоильной, (C1-C6)алкоксикарбонильной и (C1-C6) алкилкарбонил(C1-C6)алкильной групп и из групп формул -NRR, -C(=O)NRR, -А, -О-А, -С(=О)А, -(CH2)q-A,-NR-A, -C(=O)NR-A, -N RC(=O)A и -О-С(=О)А, в которых каждый R независимо означает атом водорода или C1-C6 алкильную, C1-C6 алкилкарбонильную, фенильную или бензильную группу, R означает атом водорода или C1-C6 алкильную группу, q равно целому числу от 1 до 6 и А означает фенильную группу или C1-C8 гетероциклильную группу, содержащую от 1 до 3 гетероатомов, выбранных из N,О и S; при этом каждая группа А необязательно замещена 1-3 группами, независимо выбранными из гало, гидрокси, циано, нитро и C1-C6 алкильных групп; и гидраты, энантиомеры, диастереомеры и фармацевтически приемлемые соли таких соединений. Наиболее предпочтительными соединениями в соответствии с настоящим изобретением являются соединения, в которых X означает атом кислорода, R1a означает атом азота, R2 означает связь, и двойная связь отходит от R1a к атому углерода, с которым связан R3-CC-. Тем не менее, также являются предпочтительными соединения в соответствии с настоящим изобретением, в которых X означает атом кислорода, R1a означает СН группу с двойной связью, отходящей от R1a к атому углерода, с которым связанR3 предпочтительно означает алкильную группу, необязательно замещенную С 3-С 5 гетеромоноцик-3 023020 лическую группу, содержащую от 1 до 3 гетероатомов, выбранных из N, О и S, необязательно замещенную фенильную группу. Более предпочтительно R3 означает метильную, изопропильную, бутильную,фенильную, 3-(t.бутил)-фенильную, 2-хлорфенильную, 3-хлорфенильную, 3-хлор-5-фторфенильную, 2 цианофенильную, 3-цианофенильную, 3-этоксифенильную, 3-этилфенильную, 2-фторфенильную, 3 фторфенильную, 4-фторфенильную, 3-гидроксифенильную, 3-изопропилфенильную, 3-метоксифенильную, 2-метилфенильную, 3-метилфенильную, 3-(3-метил-[1,2,4]-оксадиазол-5-ил)-фенильную, 3 нитрофенильную, 3-трифторметоксифенильную, 3-трифторметилфенильную, 2-пиридильную, 4-хлор-2 пиридильную, 5-хлор-2-пиридильную, 5-фтор-2-пиридильную, 6-фтор-2-пиридильную, 4-метил-2 пиридильную, 6-метокси-3-пиридильную, 6-метил-2-пиридильную, 4-трифторметил-2-пиридильную, 3 пиридильную, 6-фтор-3-пиридильную, 2-фурильную, 2-тиенильную, 3-тиенильную, 2-пиразинильную, 2 метил-1,3-тиазол-4-ильную или 2-фуроильную группы. Когда R1 означает атом углерода, R4 предпочтительно означает атом водорода, атом галогена, необязательно замещенную моноциклическую С 3-С 5 гетероциклильную группу, содержащую от 1 до 3 гетероатомов, выбранных из N, О и S, или необязательно замещенную фенильную группу; и R5 предпочтительно означает атом водорода или галогена, цианогруппу или необязательно замещенные гидроксильную, меркапто, амино, карбамоильную, C1-C6 алкильную или C1-C6 алкоксильную группу или группу формулы -C(=O)-R6, в которой R6 означает необязательно замещенную C1-C6 алкильную группу, необязательно замещенную моноциклическую С 3-С 5 гетероциклильную группу, содержащую от 1 до 3 гетероатомов, выбранных из N, О и S или необязательно замещенную фенильную группу. Когда R1 означает атом углерода, R4 более предпочтительно означает атом водорода или фтора или 2-пиридильную группу, и R5 более предпочтительно означает атом водорода или фтора или циано, гидроксильную или этоксикарбонильную группу. Кроме того, когда R1 означает атом углерода, R4 и R5 вместе предпочтительно означают оксо, метиленовую, дифторметиленовую, 2-пиридилметиленовую, триметиленовую, тетраметиленовую, этилендиокси, пропилендиокси, оксиэтильную, оксипропильную, метиленоксиметиленовую, гидроксиимино, метоксиимино или 1-карбокси-3-гидроксипропоксиимино группу. Кроме того, когда R1 означает атом углерода, R4 и R5 вместе предпочтительно означают группу формулы -(Yp)-, в которой р равно целому числу от 3 до 5, и каждый Y независимо означает атом кислорода или необязательно замещенную метиленовую группу, при условии, что две смежные Y части не означают атомы кислорода. Например, -(Yp)- может являться -О-(СН 2)2-О-, -О-(СН 2)3-О-, -С-(СН 2)2-, -О(СН 2)3-, -СН 2-О-СН 2-, -(СН 2)3-, -(СН 2)4-, -(СН 2)5- или -CH2CH2CF2CH2CH2-.[029] Когда R1 означает атом азота, R4 предпочтительно означает необязательно замещенную С 3-С 5 гетеромоноциклическую группу, содержащую от 1 до 3 гетероатомов, выбранных из N, О и S, при этомR5 отсутствует. Кроме того, R5 предпочтительно означает алкоксикарбонильную, необязательно замещенную арилкарбонильную, необязательно замещенную гетероциклилкарбонильную, карбамоильную,диалкилкарбамоильную, N-алкокси-N-алкилкарбамоильную или необязательно замещенную гетероциклилкарбамоильную группу, при этом R4 отсутствует. Когда R1 означает атом азота, R4 более предпочтительно означает 3-циано-2-пиразинильную, 3 нитро-2-пиридильную или 3-нитро-6-метил-2-пиридильную группу, при этом R5 отсутствует. Кроме того, R5 более предпочтительно означает этоксикарбонильную, 3-хлорбензоильную, 2-фуроильную, 2-оксо 1-имидазолидинилкарбонильную, 3-метилсульфонил-2-оксо-1-имидазолидинилкарбонильную, 4-метил 1-пиперазинилкарбонильную, пиперидинокарбонильную, 1-пирролидинилкарбонильную, карбамоильную, диметилкарбамоильную, диэтилкарбамоильную, N-метокси-N-метилкарбамоильную, N-этил-Nизопропилкарбамоильную или 4-пиридилкарбамоильную группы, при этом R4 отсутствует. Определения Кроме случаев, когда указано иное, следующие определения применимы в соотношении всего описания настоящего изобретения и формулы изобретения. Указанные определения применимы независимо от того, используется ли термин сам по себе или в сочетании с другими терминами. Например, определение "алкил" относится не только к алкилу как к таковому, но также к алкильным частям алкокси, алкиламино, алкилтио, алкилкарбонил и т.д. Кроме того, все диапазоны, описанные в соотношении химической группы, например, диапазоны "от 1 до 20 атомов углерода" и "C1-C6 алкил" включают все сочетания и подсочетания диапазонов и конкретное количество содержащихся в них атомов углерода."Алкил" означает алифатическую углеводородную группу с неразветвленной или разветвленной цепью, содержащую от 1 до 20 атомов углерода в цепи. Предпочтительные алкильные группы имеют от 1 до 12 атомов углерода в цепи. Более предпочтительно алкильные группы имеют от 1 до 6 атомов углерода в цепи. "Низший алкил" означает алкильную группу, имеющую приблизительно от 1 до приблизительно 6 атомов углерода в цепи, которая может быть неразветвленной или разветвленной. Примеры приемлемых алкильных групп включают метил, этил, n-пропил, изопропил, сек-бутил, n-бутил и t-бутил."Алкенил" означает алифатическую углеводородную группу с неразветвленной или разветвленной цепью, имеющую по меньшей мере одну углерод-углерод двойную связь и имеющую от 2 до 15 атомов углерода в цепи. Предпочтительные алкенильные группы имеют от 2 до 12 атомов углерода в цепи. Более предпочтительные алкенильные группы имеют от 2 до 6 атомов углерода в цепи. "Низший алкенил" означает алкенильную группу, имеющую от 2 до приблизительно 6 атомов углерода в цепи,которая может быть неразветвленной или разветвленной. Примеры приемлемых алкенильных групп включают этенил, пропенил, изопропенил, n-бутенил, 1-гексенил и 3-метилбут-2-энил."Алкинил" означает алифатическую углеводородную группу с неразветвленной или разветвленной цепью имеющую по меньшей мере одну углерод-углерод тройную связь и имеющую от 2 до 15 атомов углерода в цепи. Предпочтительные алкинильные группы имеют от 2 до 12 атомов углерода в цепи. Более предпочтительные алкинильные группы имеют от 2 до 6 атом углерода в цепи. "Низший алкинил" означает алкинильную группу, имеющую от 2 до приблизительно 6 атом углерода в цепи, которая может быть неразветвленной или разветвленной. Примеры приемлемых алкинильных групп включают этинил,пропинил и 2-бутинил."Моно-, би- или трициклический арил" означает систему ароматического моноциклического, бициклического или трициклического кольца, включающую от 6 до 14 атомов углерода. Би- и трициклические арильные группы спаяны в 2 или 4-х точках или соединены в одной точке с помощью связи или гетероатомного линкера (O,S, NH, или N(C1-C6 алкил) (например, бифенил, 1-фенилнаптил). Арильная группа может быть необязательно замещена на кольце одним или несколькими заместителями, предпочтительно от 1 до 6 заместителей, которые могут одинаковыми или различными. Примеры приемлемых арильных групп включают фенил и нафтил."Моно-, би-, или трициклический гетероцикл" означает систему ароматического или неароматического насыщенного моно-, би или трициклического кольца, имеющую от 2 до 14 атомов углерода кольца и содержащую от 1 до 5 атомов кольца, выбранных из N, О и S, по отдельности или в сочетании. Би- и трициклические гетероциклильные группы спаены в 2 или 4-х точках или соединены в одной точке с помощью связи или гетероатомного линкера (O, S, NH или N(C1-C6 алкил). "Моно-, би или трициклический гетероцикл" может быть необязательно замещен на кольце путем замены имеющегося водорода на кольце одним или несколькими заместителями, которые могут быть одинаковыми или различными. В системе кольца отсутствуют смежные атомы кислорода или серы. Атом азота или серы гетероцикла может быть необязательно оксидирован до соответствующего N-оксида, S-оксида или S-диоксида. Примеры приемлемых гетероциклов включают фуранил, имидазолил, изоксазолил, оксадиазолил, оксазолил,пирролил, пиридил, пиримидил, пиридазинил, тиазолил, триазолил, тетразолил, тиенил, карбазолил, бензимидазолил, бензотиенил, бензофуранил, индолил, хинолинил, бензотриазолил, бензотиазолил, бензооксазолил, бензимидазолил, изохинолинил, изоиндолил, акридинил и бензоизоксазолил, азиридинил,пиперидинил, пирролидинил, пиперазинил, тетрагидропиранил тетрагидрофуранил, тетрагидротиофенил, морфолинил и тиоморфолинил. Гетероциклы с ароматическими характеристиками могут называться гетероарилы или гетероароматические соединения. Примеры приемлемых гетероароматических соединений включают фуранил, имидазолил, изоксазолил, оксадиазолил, оксазолил, пирролил, пиридил, пиримидил, пиридазинил, тиазолил,триазолил, тетразолил, тиенил, карбазолил, бензимидазолил, бензотиенил, бензофуранил, индолил, хинолинил, бензотриазолил, бензотиазолил, бензооксазолил, бензимидазолил, изохинолинил, изоиндолил,акридинил, бензоизоксазолил, тетрагидрохинолинил, тетрагидроизохинолинил, 3-фенилпиридин, 3 циклогексилпиридин, 3-(пиридин-3-ил)морфолин, 3-фенилизоксазол и 2-(пиперидин-1-ил)пиримидин."Моно или бициклический циклоалкил" означает систему моноциклического или бициклического углеродного кольца, имеющую от 3 до 14 атомов углерода, предпочтительно от 3 до 6 атомов углерода. Циклоалкил может быть необязательно замещен на кольце путем замены имеющегося водорода на кольце одним или несколькими заместителями, которые могут быть одинаковыми или различными. Примеры приемлемых моноциклических циклоалкилов включают циклопропил, циклопентил, циклогексил и циклогептил. Примеры приемлемых мультициклических циклоалкилов включают 1-декалинил, норборнил и адамантил."Циклоалкенил" имеет значение, соответствующее значению циклоалкила, но с одной или двумя двойными связями внутри кольца (например, циклогексенил, циклогексадиен)."Галоген", или Тал" означает фтор, хлор, бром или иод. Предпочтительными являются фтор, хлор или бром, и более предпочтительными являются фтор и хлор. Термин "ацил", используемый либо по отдельности, либо в таком термине, как "ациламино", означает радикал, представленный остатком после удаления гидроксила из органической кислоты. Термин"ациламино" относится к аминорадикалу, замещенному ацильной группой. Примером радикала "ациламино" является CH3C(=O)-NH-, где амин может быть далее замещен алкилом, арилом или аралкилом. Стереохимия соединений в соответствии с настоящим изобретением Соединения формулы I могут иметь один или несколько хиральных центров, и в зависимости от характера отдельных заместителей они также могут иметь геометрические изомеры. Изомеры, отличающиеся по расположению своих атомов в пространстве, называются "стереоизомерами". Стереоизомеры,не являющиеся зеркальными изображениями друг друга, называются "диастереомерами", а стереоизомеры, являющиеся неналагающимися зеркальными изображениями друг друга, называются "энантиомерами". Когда соединение имеет хиральный центр, возможна пара энантиомеров. Энантиомер может быть охарактеризован абсолютной конфигурацией своего несимметричного центра и описан правилами по-5 023020 следовательности R-и S-, предложенными Каном и Прелогом, или в зависимости от того, каким образом молекула вращает плоскость поляризованного света, и в зависимости от того, обозначена ли она как право- или левовращающий (т.е. как (+) или (-)-изомер, соответственно). Хиральное соединение может существовать либо в форме отдельного энантиомера, либо в виде смеси энанатиомеров. Смесь, содержащая равные пропорции энантиомеров, называется "рацемической смесью". Смесь, содержащая неравные части энантиомеров, описана как смесь, имеющая "энантиомерный избыток" (ее) либо соединения R, либоS. Избыток одного энантиомера в смеси зачастую описывается со значением % энантиомерного избытка(% ее), определяемым по нижеприведенной формуле:% ее = (R) - (S) / (R) + (S). Соотношение энантиомеров также может быть определено на основе "оптической чистоты", при этом степень, с которой смесь энантиомеров вращает плоскость поляризованного света, сравнивают с отдельными оптически чистыми R и S соединениями. Оптическая чистота может быть определена по нижеприведенной формуле: Оптическая чистота = энант.major/ (энант.major + энант.minor). Настоящее изобретение охватывает все отдельные изомеры соединений формулы I. Описание или название конкретного соединения в описании изобретения или формуле изобретения включает как отдельные энантиомеры, так и их рацемические и иные смеси. Способы определения стереохимии и разделения стереоизомеров хорошо известны в данной области техники. Для многих областей применения предпочтительным является проведение стереоселективного синтеза и (или) проведение соответствующих этапов очистки продукта реакции с целью получения практически оптических чистых материалов. Приемлемые технологии стереоселективного синтеза для получения оптически чистых материалов хорошо известны в данной области техники, а также технологии очистки рацемических смесей для получения оптически чистых фракций. Специалистам в данной области техники должно быть очевидно, что соединения в соответствии с настоящим изобретением могут существовать в полиморфных формах, в которых соединение способно кристаллизоваться в различные формы. Приемлемых способы определения и разделения полиморфизмов хорошо известны в данной области техники. Диастереомеры отличаются как в плане физических свойств, так и в плане химической реактивности. Смесь диастереомеров может быть разделена на энантиомерные пары исходя из растворимости,фракционной кристаллизации или хроматографических свойств, например, тонкопленочная хроматография, колоночная хроматография или ВЭЖХ. Для очистки сложных смесей диастереомеров и превращения их в энантиомеры обычно требуется проведение двух этапов. На первом этапе смесь диастереомеров разделяют на энантиомерные пары в соответствии с вышеприведенным описанием. На втором этапе энантиомерные пары дополнительно очищают получают композиции, обогащенные тем или иным энантиомером или, более предпочтительно,разделяют на композиции, включающие чистые энантиомеры. Разделение энантиомеров обычно происходит в процессе реакции или молекулярного взаимодействия с хиральным агентом, например, растворителем или колоночной матрицей, разделение может быть достигнуто, например, путем преобразования смеси энантиомеров, например, рацемической смеси в смесь диастереомеров за счет протекания реакции с чистым энантиомером второго агента, т.е. разделяющего агента. Далее два полученных диастереомерных продукта могут быть разделены. Затем разделенные диастереомеры снова преобразуют в чистые энантиомеры за счт обратной начальной химической трансформации. Разделение энантиомеров также может быть достигнуто за счет различий из нековалентного связывания с хиральным веществом, например, методом хроматографии на гомохиральных адсорбантах. Нековалентное связывание между энантиомерами и хроматографическими адсорбантами обеспечивает создание диастереомерных комплексов, ведущих к дифференциальному разделению на мобильное и связанное состояние в хроматографической системе. Таким образом, два энантиомера перемещаются через хроматографическую систему, например, колонку с различными скоростями, в результате чего обеспечивается их разделение. Хиральные разделительные колонки хорошо известны в данной области техники и являются коммерчески доступными на рынке (например, поставляемые компанией "MetaChem Technologies Inc.", отделением компании "ANSYS Technologies, Inc.", Lake Forest, CA). Энантиомеры можно проанализировать и очистить, например, с использованием хиральных неподвижных фаз (CSPs) для ВЭЖХ. Хиральные колонки ВЭЖХ обычно содержат одну форму энантиомерного соединения, иммобилизированного на поверхности наполнителя, содержащего силикагель.D-фенилглицин и L-лейцин являются примерами хиральных неподвижных фаз I типа, и в них используются сочетания - взаимодействий, гидрогенных связей, диполь-дипольных взаимодействий и стерических взаимодействий для достижения хирального распознавания. Для проведения разделения на колонке I типа энантиомеры аналита должны содержать функциональную группу, дополняющую функциональную группу хиральной неподвижной фазы, для обеспечения существенных взаимодействий с хиральной неподвижной фазой. Образец предпочтительно должен содержать одну из следующих функ-6 023020 циональных групп: -кислоту или -основание, донор и (или) акцептор водородной связи или амидный диполь. Дериватизацию используют в некоторых случаях для добавления интерактивных сайтов тем соединениям, у которых они отсутствуют. Наиболее общеизвестные производные предусматривают формирование амидов из аминов и карбоновых кислот.MetaChiral ODM является примером хиральной неподвижной фазы II типа. Первичные механизмы для формирования комплексов раствор-хиральной неподвижной фазы основаны на аттрактивных взаимодействиях, однако важную роль также играют комплексы включения. Водородное связывание,взаимодействия и дипольный стэкинг являются важными факторами для хирального разделения наMetaChiral ODM. Дериватизация может быть необходимой в том случае, когда молекула раствора не содержит группы, необходимые для взаимодействий растор-колонка. Дериватизация обычно с бензиламидами может быть необходима для ряда сильно полярных молекул, таких как амины и карбоновые кислоты, которые в противоположном случае активно взаимодействовали бы с неподвижной фазой за счет неспецифических стереовзаимодействий. Соединения формулы I могут быть разделены на диастереомерные пары например путем разделения методом колоночной хроматографии тонкопленочной хроматографии на силикагеле. Указанные диастереомерные пары называют в настоящем описании диастереомером с коэффициентом удерживания в верхней части колонки ТПХ; и диастереомером с коэффициентом удерживания в нижней части колонки ТПХ. Диастереомеры могут быть далее обогащены для конкретного энантиомера или разделены на единичный энантиомер с использованием способов, хорошо известных в данной области техники, в частности, способов, приведенных в описании настоящего изобретения. Относительная конфигурация диастереомерных пар может быть выведена на основе применения теоретических моделей или правил (например, правило Крама, модель Фелкин-Ана) или за счет использования более надежных трехмерных моделей, созданных с помощью программ вычислительной химии. Во многих случаях указанные методы позволяют предсказать, какой диастереомер является энергетически предпочитаемым продуктом химического превращения. В качестве альтернативы относительная конфигурация диастереомерных пар может быть косвенно определена путем обнаружения абсолютных конфигураций единичного энантиомера в одной (или обеих) диастереомерной(-ых) паре(-ах). Абсолютная конфигурация стереоцентров может быть определена с помощью метода, хорошо известного специалистам в данной области техники (например, рентгеновская дифракция и циркулярный дихроизм). Определение абсолютной конфигурации может оказаться эффективным также для подтверждения предсказуемости теоретических моделей и может оказаться полезным для распространения использования указанных моделей на аналогичные молекулы, полученные путем проведения реакций с аналогичными механизмами (например, восстановление кетонов и восстановительное аминирование кетонов гидридами). Настоящее изобретение также охватывает стереоизомеры типа Z-E и их смеси ввиду того, что R2-R3 заместители двойной связи не напрямую связаны с кольцом. Дополнительные стереоизомеры Z-E встречаются в том случае, когда m не равно 1, и m и n различаются. Применимы правила приоритета КанаИнгольда-Прелога для определения того, являются ли стереоизомеры Z или Е типом ввиду относительного положения в плоскости двойной связи заместителей, соединенных двойной связью. Стереоизомеры обозначены как Z (zusammen = вместе), 2, если высокоприоритетные группы находятся на одной и той же стороне основной плоскости, проходящей через связь С=С. Другой стереоизомер обозначен как Е(entgegen = противоположный). Смесь стереоизомеров типа E-Z может быть разделена (и (или) охарактеризована) по их компонентам с использованием классических методов очистки, основанных на различных химико-физических свойствах указанных соединений. Указанные методы включают фракционную кристаллизацию, хроматографию низкого, среднего и высокого давления, фракционную очистку и иные методы, хорошо известные специалистам в данной области техники. Производные соединений в соответствии с настоящим изобретением Настоящее изобретение также охватывает соли, сольваты, гидраты, N-оксиды, пролекарства и активные метаболиты соединений формулы I. Термин "соли" может включать кислотно-аддитивные соли или аддитивные соли свободных оснований. В целях выделения или очистки можно использовать фармацевтически неприемлемые соли. Тем не менее, исключительно фармацевтически приемлемые, нетоксичные соли используют в терапевтических целях, и, таким образом, они являются предпочтительными. Примеры кислот, которые могут быть использованы для получения фармацевтически приемлемых кислотно-аддитивных солей включают соли,полученные из нетоксичных неорганических кислот, таких как азотная, фосфорная, серная или бромисто-водородная, йодисто-водородная, фтористо-водородная, фосфористая кислоты, а также соли, полученные из нетоксичных органических кислот, таких как алифатические моно- и дикарбоновые кислоты,фенилзамещенные карбоновые кислоты, гидроксил карбоновые кислоты, алкандикислоты, ароматические кислоты, алифатические и ароматические сульфокислоты, и уксусная, малеиновая, янтарная или лимонная кислоты. Примеры таких солей включают нападизилат, безилат, сульфат, пиросульфат, би-7 023020 сульфат, сульфит, бисульфит, нитрат, фосфат, моногидрогенфосфат, дигидрогенфосфат, метафосфат,пирофосфат, хлорид, бромид, иодид, ацетат, трифторацетат, пропионат, каприлат, изобутират, оксалат,моланат, сукцинат, суберат, себакат, фумарат, малеат, манделат, бензоат, хлорбензоат, метилбензоат,динитробензоат, фталат, бензолсульфонат, толуолсульфонат, фенилацетат, цитрат, лактат, малеат, тартрат, метансульфонат и аналогичные соли. Также предусматриваются соли аминокислот, такие как аргинати аналогичные соли и глюконат, галактуронат (см., например, Berge, et al. "Pharmaceutical Salts," J.Pharma. Sci. 1977;66:1). Фраза "фармацевтически приемлемые", используемая в соотношении композиций в соответствии с настоящим изобретением, относится к молекулярным субстанциям и иным ингредиентам таких композиций, являющимися физиологически переносимыми и обычно не вызывающими нежелательные реакции при введении млекопитающему (например, человеку). Термин "фармацевтически приемлемые" в соответствии со значением, используемым в настоящем контексте, предпочтительно означает композиции, одобренные контрольным органом федерального правительства или правительства штата или занесенные в перечень Фармакопеи США или в иные общепризнанные фармакопеи, для использования млекопитающими и, в частности, человеком. Обычно фармацевтически приемлемая соль соединения формулы I может быть быстро получена путем использования требуемой кислоты или основания в зависимости от конкретного случая. Соль может быть осаждена из раствора и собрана путем фильтрования, либо может быть получена путем выпаривания растворителя. Например, водный раствор кислоты, такой как хлористо-водородная кислота, может быть добавлен к водной суспензии соединения формулы I, и полученную смесь выпаривают до сухого состояния (лиофилизируют) для получения кислотно-аддитивной соли в виде твердого вещества. Кроме того, соединение формулы I может быть растворено в приемлемом растворителе, например, в спирте, таком как изопропанол, и кислота может быть добавлена в тот же растворитель или в иной приемлемый растворитель. Далее, полученная кислотно-аддитивная соль может быть непосредственно осаждена, либо путем добавления менее полярного растворителя, такого как диизопропиловый простой эфир или гексан, и отделена путем фильтрования. Кислотно-аддитивные соли соединений формулы I могут быть получены путем вступления в реакцию свободноосновной формы с достаточным количеством требуемой кислоты для получения соли известным способом. Свободноосновная форма может быть регенерирована путем вступления в реакцию солевой формы с основанием и выделения свободного основания известным способом. Свободноосновные формы несколько отличаются от своих соответствующих солевых форм в плане определенных физических свойств, таких как растворимость в полярных растворителях, однако во всех других случаях соли эквивалентны своему соответствующему свободному основанию в целях настоящего изобретения. Также включены как полные, так и неполные соли, то есть соли с 1, 2 или 3, предпочтительно 2, эквивалентами основания на моль кислоты формулы I или соли с 1, 2 или 3 эквивалентами, предпочтительно 1 эквивалентом кислоты на моль основания формулы I. Фармацевтически приемлемые соли присоединения оснований образуются с металлами или аминами, такими как щелочи и земельно-щелочные металлы или органические амины. Примеры металлов, используемых в качестве катионов включают натрия, калий, магния, кальций и аналогичные металлы. Примеры приемлемых аминов включают N,N'-дибензилэтилендиамин, хлорпрокаин, холин, диэтаноламин, дициклогексиламин, этилендиамин, N-метилглюкамин и прокаин. Соли присоединения оснований указанного кислотного соединения получают путем вступления в реакцию свободнокислотной формы с достаточным количеством требуемого основания для получения соли известным способом. Свободнокислотная форма может быть регенерирована путем вступления в реакцию солевой формы с кислотой и путем выделения свободной кислоты. Соединения в соответствии с настоящим изобретение могут иметь как щелочной, так и кислотный центр, и, таким образом, могут находится в виде цвиттерионов или внутренних солей. Обычно фармацевтически приемлемая соль соединения формулы I может быть быстро получена путем использования требуемой кислоты или основания в зависимости от конкретного случая. Соль может быть осаждена из раствора и собрана путем фильтрования, либо может быть получена путем выпаривания растворителя. Например, водный раствор кислоты, такой как хлористо-водородная кислота, может быть добавлен к водной суспензии соединения формулы I, и полученную смесь выпаривают до сухого состояния (лиофилизируют) для получения кислотно-аддитивной соли в виде твердого вещества. Кроме того, соединение формулы I может быть растворено в приемлемом растворителе, например, в спирте, таком как изопропанол, и кислота может быть добавлена в тот же растворитель или в иной приемлемый растворитель. Далее, полученная кислотно-аддитивная соль может быть непосредственно осаждена, либо путем добавления менее полярного растворителя, такого как диизопропиловый простой эфир или гексан, и отделена путем фильтрования. Специалистам в данной области техники должно быть очевидно, что многие органические соединения могут образовывать комплексы с растворителями, в которых они вступают в реакцию или из которых они осаждаются или кристаллизуются. Указанные комплексы известны как "сольваты". Например,комплекс с водой известен как "гидрат". Сольваты соединения в соответствии с настоящим изобретением не выходят за объем настоящего изобретения. Соли соединения формулы I могут образовывать сольваты(например, гидраты), и изобретение также предусматривает включение всех таких сольватов. Значение слова "сольваты" хорошо известно специалистам в данной области техники как соединение, образованное путем взаимодействия растворителя и раствора (т.е. путем растворения). Технологии получения сольватов хорошо отработаны в данной области техники (см, например, Brittain. Polymorphism in Pharmaceutical solids. Marcel Decker, New York, 1999.). Настоящее изобретение также охватывает N-оксиды соединений формулы I. Термин "N-оксид" означает, что в соотношении гетероциклов, содержащих незамещенный sp2N атом, N атом может иметь ковалентно связанный О атом, т.е., -NO. Примеры таких N-оксид замещенных гетероциклов включают пиридил N-оксиды, пиримидил N-оксиды, пиразинил N-оксиды и пиразолил N-оксиды. Настоящее изобретение также охватывает пролекарства соединений формулы I, т.е., соединения,высвобождающие активное исходное лекарственное средство в соответствии с формулой I in vivo при введении млекопитающему. Пролекарство является фармакологически активным или в основном неактивным соединением, преобразованным в фармакологически активный агент за счет метаболического превращения. Пролекарства соединения формулы I получают путем модифицирования функциональных групп, присутствующих в соединении формулы I таким образом, чтобы обеспечивалось расщепление модификаций in vivo для высвобождения исходного соединения. In vivo пролекарство легко подвергается химическим изменениям в физиологических условиях (например, на них воздействует (-ют) естественный (-ые) фермент (-ы, в результате чего происходит высвобождение фармакологически активного агента. Пролекарства включают соединения формулы I, в которых гидрокси, амино или карбоксигруппа соединения формулы I связана с любой группой, которая может быть расщеплена in vivo для регенерирования свободной гидроксильной, амино или карбоксигруппы соответственно. Примеры пролекарств включают сложные эфиры (например, производные ацетата, формиата и бензоата) соединений формулыI или любое иное производное, которое при приведении его к физиологическому рН или за счет воздействия ферментов преобразуется в активное исходное лекарственное средство. Известные технологии для выбора и получения приемлемых производных пролекарства описаны в данной области техники (см.,например, Bundgaard. Design of Prodrugs. Elsevier, 1985). Пролекарства могут быть введены аналогичным образом, как и активный ингредиент, в который они преобразуются, или могут быть доставлены в резервуарной форме, например, в виде трансдермального пластыря или в виде иного резервуара, который предназначен для обеспечения (за счет подачи фермента или иного соответствующего реагента) медленного преобразования пролекарства в активный ингредиент с течением времени и доставки активного ингредиента в организм пациента. Настоящее изобретение также охватывает метаболиты. "Метаболит" соединения, раскрываемого в настоящем описании изобретения, является производным соединения, образующегося при метаболизации соединения. Термин "активный метаболит" относится к биологически активному производному соединения, образующегося при метаболизации соединения. Термин "метаболизированный" относится к сумме процессов, с помощью которых конкретное вещество подвергается изменению в живом организме. Короче говоря, все соединения, присутствующие в организме, подвергаются воздействию вырабатываемых организмом ферментов для получения энергии и (или) их удаления из организма. Конкретные ферменты вызывают конкретные структурные изменения соединения. Например, цитохром Р 450 катализирует различные окислительные и восстановительные реакции, в то время как уридин дифосфат глюкуронилтрансферазы катализируют перенос активированной молекулы глюкуроновой кислоты в ароматические спирты, алифатические спирты, карбоновые кислоты, амины и свободные сульфидрильные группы. Дополнительная информация о метаболизме содержится в публикации The Pharmacological Basis ofTherapeutics , 9th Edition, McGraw-Hill (1996), стр. 11-17. Метаболиты соединений, раскрытых в описании настоящего изобретения, могут быть определены либо путем введения соединений в организм-хозяин и проведения анализа образцов ткани, взятых из организма-хозяина, либо путем инкубирования соединений с гепатическими клетками in vitro и проведения анализа полученных соединений. Оба способа хорошо известны в данной области техники. Применение соединений в соответствии с настоящим изобретением для лечения заболеваний нижних мочевыводящих путей фаза наполнения в цикле мочеиспускания Номенклатура симптомов и патологий нижних мочевыводящих путей, используемых в описании настоящего изобретения, изложена в Abrams et al., Neurol. and Urodyn. 21:167-178 (2002) и Andersson etal., Pharmacol. Rev. 56:581-631 (2004). Дисфункции мочеиспускания могут быть приблизительно классифицированы как расстройства фазы наполнения в цикле мочеиспускания или опорожнения мочевого пузыря. Симптомы наполнения в цикле мочеиспускания проявляются во время фазы наполнения мочевого пузыря в цикле мочеиспускания и включают учащенное мочеиспускание в течение дня или ночную полиурию (в течение ночи человек просыпается несколько раз для мочеиспускания), императивные позывы к мочеиспусканию (внезапное, непреодолимое желание помочиться, от которого трудно воздержаться) и недержание мочи (любое непроизвольное истечение мочи). Недержание мочи далее может быть охарактеризовано в соответствии с симптомами. Стрессовое недержание мочи является непроизвольным истечением мочи при усилии или напряжении, либо при чихании или кашле. Неотложное недержание мочи представляет собой непроизвольное истечение мочи, сопровождаемое императивными позывами к мочеиспусканию или непосредственно предшествующее позывам. Смешанное недержание мочи представляет собой непроизвольное истечение мочи, связанное с императивными позывами к мочеиспусканию, а также с напряжением, усилием, чиханием или кашлем. Недержание мочи вследствие переполнения мочевого пузыря представляет собой непроизвольное истечение мочи, имеющее место после превышения емкости мочевого пузыря,например, при задержке опорожнения. Энурез также относится к любому непроизвольному истечению мочи. Ночной энурез представляет собой истечение мочи, происходящее во время сна. Симптомы нарушения мочеиспускания включают медленное мочеиспускание, расщепление или разбрызгивание струи мочи, прерывистую струю (прерывистость, т.е. приостановление и возобновление струи мочи во время мочеиспускания), затрудннное начало мочеиспускания (трудность в начале мочеиспускания в результате задержки наступления опорожнения мочевого пузыря после того как человек готов помочиться), напряжение при мочеиспускании и мочеиспускание после прекращения мочеиспускания (пролонгированная завершающая часть мочеиспускания, когда произошло замедление струи до тонкой струйки/мочеиспускания по каплям). Заболевания нижних мочевыводящих путей могут быть дополнительно категоризированы по группе симптомов (т.е., синдрому) или по этиологии. Лица, страдающие от синдрома гиперактивного мочевого пузыря (ОАВ), например, обычно страдающие от симптомов императивных позывов к мочеиспусканию, неотложному недержания мочи, учащенному мочеиспусканию в течение дня или ночной полиурии. Гиперактивный мочевой пузырь возникает в результате повышенной активности мышцы детрузора, называемой нестабильностью мышцы детрузора. Нестабильность мышцы детрузора может возникнуть ввиду неневрологических расстройств, таких как камни в мочевом пузыре, мышечная дистрофия, инфекция мочевыводящих путей или побочные эффекты лекарственных препаратов, либо нестабильность мышцы детрузора может носить идиопатический характер. Нейрогенный гиперактивный мочевой пузырь (или нейрогенный мочевой пузырь) является типом гиперактивного мочевого пузыря, при этом заболевание возникает в результате повышенной активности мышцы детрузора, называемой гиперрефлексией детрузора, возникающей на фоне известных неврологических расстройств. Пациенты с неврологическими расстройствами, такими как нарушение мозгового кровообращения, болезнь Паркинсона, диабет, рассеянный склероз, периферическая нейропатия или поражения спинного мозга, нередко страдают от нейрогенного гиперактивного мочевого пузыря. Цистит (включая интерстициальный цистит) является заболеванием нижних мочевыводящих путей неизвестной этиологии, который в основном поражает женщин молодого и среднего возраста, хотя этому заболевания также могут быть подвержены мужчины и дети. Симптомы интерстициального цистита могут включать симптомы, связанные с мочеиспусканием, учащенное мочеиспускание в течение дня, императивные позывы к мочеиспусканию, ночная полиурия или боли в области лобка или таза, связанные с мочеиспусканием и ослабевающие при опорожнении мочевого пузыря. Многие пациенты с интерстициальным циститом испытывают головные боли, а также имеют проблемы с желудочно-кишечным трактом и кожным покровом. В некоторых случаях интерстициальный цистит может также быть связан с язвами и рубцами мочевого пузыря. Простатит и простатодиния являются другими заболеваниями нижних мочевыводящих путей, которые, по некоторым оценкам, поражают приблизительно 2-9% взрослого мужского населения. Простатит является воспалением простаты и включает бактериальный простатит (острый и хронический) и небактериальный простатит. Острый и хронический бактериальный простатиты характеризуются воспалением простаты и бактериальной инфекцией предстательной железы, при этом первый и последний обычно связаны с симптомами боли, учащенного мочеиспускания в течение дня и (или) императивными позывами к мочеиспусканию. Хронический бактериальный простатит отличается от острого бактериального простатита рецидивным характером заболевания. Хронический небактериальный простатит характеризуется воспалением простаты, имеющим неизвестную этиологию и сопровождающимся наличием избыточного количества воспалительных клеток в секретах простаты, в данном случае несвязанных с бактериальной инфекцией предстательной железы, и обычно сопровождающийся симптомами боли, учащенным мочеиспусканием в течение дня и (или) императивными позывами к мочеиспусканию. Простадения является заболеванием с симптомами, схожими с симптомами простатита при отсутствии воспаления простаты, бактериальной инфекции простаты и повышенных уровней воспалительных клеток в секретах простаты. Простадения может сопровождаться симптомами боли, учащенным мочеиспусканием в течение дня и (или) императивными позывами к мочеиспусканию. Доброкачественная гиперплазия предстательной железы представляет собой незлокачественное увеличение простаты, широко распространенное среди мужчин старше 40 лет. Доброкачественная гиперплазия предстательной железы предположительно обусловлена чрезмерным клеточным ростом как гландулярных элементов, так и стромальных элементов простаты. Симптомы доброкачественной гиперплазии предстательной железы могут включать учащенное мочеиспускание, императивные позывы к мочеиспусканию, неотложное недержание мочи, ночную полиурия и симптомы нарушения мочеиспускания, включая медленное мочеиспускание, расщепление и разбрызгивание струи мочи, прерывистость,- 10023020 затрудннное начало мочеиспускания, напряжение при мочеиспускании и мочеиспускание после прекращения мочеиспускания. Соединения в соответствии с настоящим изобретением быть эффективными для лечения вышеуказанных заболеваний или расстройств нижних мочевыводящих путей, в частности, нейромышечных дисфункций нижних мочевыводящих путей, в том числе императивных позывов к мочеиспусканию, гиперактивного мочевого пузыря, учащенное мочеиспускание, пониженная эластичность стенки мочевого пузыря (пониженная емкость мочевого пузыря), цистит, интерстициальный цистит, недержание мочи,истечение мочи, энурез, затруднение или боль при мочеиспускании, затрудннное начало мочеиспускания и затруднения опорожнения мочевого пузыря. Под лечением понимается лечение любого одного или нескольких выше описанных состояний, симптомов и (или) синдромов. При лечении нейромышечных дисфункций нижних мочевыводящих путей, соединения в соответствии с настоящим изобретением могут быть введены отдельно или в сочетании с другим лекарственным средством. Такие иные лекарственные препараты могут представлять собой антимускариновые лекарственные средства, такие как оксибутинин, толтеродин, дирифенацин, солифенацин, троспиум, имидафенацин, фезотеродин или темиверин; 1-адренэргический антагонист, такой как празозин, доксазозин,теразозин, алфузозин, силодозин или тамсулозин; ингибиторы обратного захвата (повторного поглощения) серотонина и (или) норадреналина, такие как дулоксетин, милнаципран, амоксапин, венлафаксин,десвенлафаксин, сибутрамин, тезофенсин или десметилсибутрамин; или селективные или неселективные ЦОГ ингибиторы, такие как ибупрофен, напроксен, беноксапрофен, флурбипрофен, фенопрофен, кетопрофен, индопрофен, пирпрофен, карпрофен, тиоксапрофен, супрофен, тиапрофеновая кислота, флупрофен, индометацин, сулиндак, тометин, зомепирак, диклофенак, фенклофенак, ибуфенак, ацетилсалициловая кислота, пироксикам, теноксикам, набуметон, кеторолак, азапропазон, мефенамовая кислота, толфенамовая кислота, дифлунизал, ацеметацин, фентиазак, клиданак, меклофенамовая кислота, флуфенамовая кислота, нифлумовая кислота, флуфенизал, судоксикам, этодолак, салициловая кислота, бенорилат, изоксикам, 4-(нитроокси)бутил эфир 2-фторметил-[1,1'-бифенил]-4-уксусной кислоты, мелоксикам, парекоксиб или нимесулид. Другие области применения соединений в соответствии с настоящим изобретением Соединения в соответствии с настоящим изобретением также могут быть эффективными для лечения заболеваний или нарушений нижних мочевыводящих путей, мигрени; для лечения гастроэзофагеальной рефлксной болезни; для лечения тревожных расстройств; для лечения передозировки, аддиктивных расстройств и абстинентных расстройств; для лечения нейропатической боли; и для лечения синдрома умственной отсталости, сцепленный с ломкой хромосомой X. Фармацевтические композиции, включающие соединение формулы I В то время как существует возможность введения соединения I в виде готового к употреблению вещества предпочтительно было бы включить активный ингредиент в фармацевтическую рецептуру,например, в которой агент находится в смеси с фармацевтически приемлемым носителем, выбранным в зависимости от пути введения и стандартной фармацевтической практики. Таким образом, настоящее изобретение дополнительно предусматривает создание фармацевтической композиции, включающей соединение формулы I или его гидрат, энантиомер, диастереомер или их фармацевтически приемлемые соли в смеси с фармацевтически приемлемым носителем. Термин "носитель" относится к разбавителю, вспомогательному веществу и (или) основе, с которыми обеспечивается введение активного соединения. Соединение формулы I может быть использовано в сочетании с другими видами терапии и(или) активными агентами. Таким образом, в соответствии с дополнительным аспектом настоящее изобретение предусматривает создание фармацевтической композиции, включающей соединение формулы I или сольват, гидрат, энантиомер, диастереомер, N-оксид или их фармацевтически приемлемые соли, второй активный агент и фармацевтически приемлемый носитель. Кроме носителя, фармацевтические композиции могут включать любое приемлемое связующее вещество, лубрикант, суспендирующее вещество, покровное вещество и(или) солюбилизирующий компонент. Консерванты, стабилизаторы, красители и ароматизаторы также могут быть включены в фармацевтическую композицию. Кроме того, могут быть использованы антиоксиданты и суспендирующие вещества. Соединения в соответствии с настоящим изобретением могут быть измельчены с использованием известных технологий измельчения, таких как мокрое измельчение для получения размера частиц, приемлемого для формирования таблеток и для других типов лекарственных форм. Мелкодисперсные (в форме наночастиц) препараты соединений в соответствии с настоящим изобретением могут быть получены с помощью технологий, известных в данной области техники, например, см. заявку на патент WO 02/00196. Пути введения и стандартные лекарственные формы Пути введения включают пероральный (например, в виде таблеток, капсул или в виде проглатываемого раствора), топический, мукозальный (например, в виде назального спрей или аэрозоли для ингаляции), назальный, парентеральный (например, в виде лекарственной формы для инъекций), гастроинтестинальный, интраспинальный, интраперитонеальный, внутримышечный, внутривенный, внутриматочный, интраокулярный, интрадермальный, интракраниальный, интратрахеальный, интравагинальный, интрацеребровентрикулярный, интрацеребральный, подкожный, офтальмический (включая интравитреальный или интракамералыный), трансдермальный, ректальный, буккальный, эпидуральный и сублингвальный пути. Композиции в соответствии с настоящим изобретением могут быть, в частности, выполнены в виде лекарственной формы для любого из указанных путей введения. В предпочтительных примерах осуществления настоящего изобретения фармацевтические композиции в соответствии с настоящим изобретением выполнены в виде лекарственной формы, приемлемой для пероральной доставки. К композициям и рецептурам могут предъявляться различные требования в зависимости от различных систем доставки. Очевидно, что нет необходимости введения всех соединений одним и тем же путем. Аналогичным образом, если композиция включает несколько активных компонентов, то указанные компоненты могут быть введены различными путями. Например, фармацевтическая композиция в соответствии с настоящим изобретением может быть выполнена в лекарственной форме, доставка которой обеспечивается с помощью мини насоса или мукозальным путем, например, в виде назального спрея или аэрозоли для ингаляции или проглатываемого раствора, или парентеральным путем, при котором композиция выполнена в виде инъецируемой лекарственной формы для доставки, например, внутривенным,внутримышечным или подкожным путем. Кроме того, могут быть разработаны лекарственные формы для их доставки несколькими путями. В тех случаях, когда агент доставляется мукозально через гастроинтестинальную слизистую оболочку, агент должен обладать способностью сохранять стабильность при его прохождении через гастроинтестинальный тракт; например, он должен быть резистентным к протеолитическому распаду, стабильным при кислотном рН и стойким к детергентному воздействию желчи. Например, на соединение формулы I может быть нанесено энтеросолюбильное покрытие таблетки. Материал энтеросолюбильного покрытия таблетки может быть диспергирован или растворен либо в воде, либо в приемлемом органическом растворителе. В качестве полимеров энтеросолюбильного покрытия таблетки могут быть использованы один или несколько по отдельности или в сочетании нижеприведенные полимеры: например, растворы или дисперсии сополимера метакриловой кислоты, ацетатфталатцеллюлоза, ацетатбутиратцеллюлоза, гидроксипропил метилцеллюлоза фталат, ацетатсукцинат гидроксипропилметилцеллюлоза,поливинилацетатфталат, ацетаттримеллитатцеллюлоза, карбоксиметилэтилцеллюлоза, шеллак или иной(-ые) приемлемый(-е) полимер(-ы) энтеросолюбильного покрытия таблетки. По экологическим причинам нанесение покрытия в водном растворе может быть предпочтительным. При использовании технологий нанесения покрытий в водном растворе сополимеры метакриловой кислоты являются наиболее предпочтительными. Когда это целесообразно, фармацевтические композиции могут быть введены путем ингаляции, в виде суппозиториев или пессариев, топически в виде лосьона, раствора, крема, мази или присыпки, с использованием трансдермальных пластырей, перорально в виде таблеток, содержащих вспомогательные вещества, такие как крахмал или лактоза, или в виде капсул или овулей по отдельности или в смеси со вспомогательными веществами, либо в виде эликсиров, растворов или суспензий, содержащих ароматизирующие и красящие вещества, либо они могут быть инъецированы парентерально, например, внутривенно, внутримышечно или подкожно. Для буккального или сублингвального введения композиции могут быть введены в виде таблеток или таблеток для рассасывания, которые могут быть изготовлены известным способом. При необходимости введения композиции в соответствии с настоящим изобретением парентерально такое введение включает введение лекарственного вещества внутривенно, внутриартериально, интраперитонеально, интратекально, интравентрикулярно, интрауретально, интрастернально, интракраниально, внутримышечно или подкожно и (или) с использованием способов инфузии. Фармацевтические композиции в соответствии с настоящим изобретением могут быть введены парентерально, например, путем инфузии или инъецирования. Фармацевтические композиции, приемлемые для инъецирования или инфузии, могут быть в виде стерильного водного раствора, дисперсии или стерильного порошка, содержащего активный ингредиент, отрегулированный, при необходимости, такого стерильного раствора или дисперсии, приемлемых для инфузии или инъецирования. Указанный препарат может быть выборочно инкапсулирован в липосомы. Во всех случаях конечный препарат должен быть стерильным, жидким и устойчивым в условиях производства и хранения. В целях повышения стабильности свойств при хранении такие препараты могут содержать консерванты для предотвращения роста микроорганизмов. Предотвращение воздействия микроорганизмов может быть достигнуто путем добавления антибактериальных и противогрибковых веществ, например, парабена, хлорбутанола или аскорбиновой кислоты. Во многих случаях рекомендованы изотонические вещества, например, сахар,буферные растворы и хлорид натрия для обеспечения осмотического давления, аналогичного осмотиче- 12023020 скому давлению биологических жидкостей, в частности крови. Пролонгированное поглощение таких инъецируемых смесей может быть достигнуто путем введения веществ, замедляющих поглощение, такие как моностеарат алюминия или желатин. Дисперсии могут быть приготовлены в жидком носителе или промежуточном веществе, таком как глицерин, жидкие полиэтиленгликоли, триацетиновые масла и их смеси. Жидкий носитель или промежуточное вещество могут представлять собой растворитель или жидкую диспергирующую среду, содержащую, например, воду, этанол, полиол (например, глицерин, пропиленгликоль или аналогичные вещества), растительные масла, нетоксичные сложные эфиры глицерина и их приемлемые смеси. Приемлемая текучесть может поддерживаться за счет образования липосом, введения приемлемого размера частиц в случае дисперсий или путем добавления поверхностно-активных веществ. Для парентерального введения соединение может быть наиболее эффективно использовано в виде стерильного водного раствора, который может содержать другие вещества, например, достаточное количество солей или глюкоза для приготовления раствора, являющегося изотоничным плазме крови. Водные растворы должны быть должным образом буферированы (предпочтительно до значения рН от 3 до 9),при необходимости. Приготовление приемлемых парентеральных рецептур в стерильных условиях легко осуществимо с использованием стандартных фармацевтических способов, хорошо известных специалистам в данной области техники. Стерильные инъецируемые растворы могут быть приготовлены путем смешивания соединения формулы I с соответствующим растворителем и одним или несколькими вышеуказанными носителями с последующим стерильным фильтрованием. В случае со стерильными порошками, приемлемыми для использования при приготовлении стерильных инъецируемых растворов предпочтительные способы приготовления включают сушку под вакуумом и лиофилизацию, которые обеспечивают получение порошковых смесей антагонистов рецепторов альдостерона и требуемых вспомогательных веществ для последующего приготовления стерильных растворов. Соединения в соответствии с настоящим изобретением могут быть выполнены в лекарственной форме для использования в медицине человека или в ветеринарии для введения инъекций (например,инъецирование или инфузия внутривенных болюсов, либо введение внутримышечно, подкожно или интратекально) и могут быть представлены в стандартной лекарственной форме в ампулах или в другой упаковке лекарственных средств для однократного прима, или в упаковке лекарственных средств для многократного прима с добавлением консервантов при необходимости. Композиции для инъецирования могут быть в виде суспензий, растворов или эмульсий на масляной или водной основе, и могут содержать такие рецептурные вещества, как суспендирующие, стабилизирующие, солюбилизирующие и (или) диспергирующие вещества. Кроме того, активный ингредиент может быть в форме стерильного порошка для перевода сухой лекарственной формы в жидкую с использованием приемлемой основы, например,стерильной, апирогенной воды до применения. Соединения в соответствии с настоящим изобретением могут быть введены (например, перорально или топически) в виде таблеток, капсул, суппозиториев, эликсиров, растворов или суспензий, которые могут содержать ароматизирующие и красящие вещества, для немедленного, отсроченного, замедленного, длительного, прерывистого или контролируемого высвобождения. Соединения в соответствии с настоящим изобретением также могут быть представлены для использования в медицине человека или в ветеринарии в форме, приемлемой для перорального или буккального введения, например, в виде растворов, гелей, сиропов, жидкостей для полоскания рта или суспензий или сухих порошков для разведения водой или другой приемлемой основой до применения, выборочно с ароматизирующими или подкрашивающими веществами. Также могут использоваться твердые композиции, такие как таблетки, капсулы, таблетки для рассасывания, пастилки, пилюли, шарики, порошки, пасты, гранулы или готовые смеси. Твердые и жидкие композиции для перорального введения могут быть приготовлены с использованием способов, хорошо известных в данной области техники. Такие композиции также могут содержать один или несколько фармацевтически приемлемых носителей и вспомогательных веществ, которые могут находиться в твердой или жидкой форме. Таблетки могут содержать вспомогательное вещества, такие как микрокристаллическая целлюлоза,лактоза, цитрат натрия, карбонат кальция, двухосновный фосфат кальция и глицин, разрыхлители, такие как крахмал (предпочтительно кукурузный, картофельный или тапиоковый крахмал), гликолят крахмал натрия, кроскармеллозу натрия и некоторые сложные силикаты и гранулирующие связующее вещества,такие как поливинилпирролидон, гидроксипропилметилцеллюлоза (НРМС), гидроксипропилцеллюлоза(НРС), сахароза, желатин и камедь. Дополнительно могут быть включены смазывающие вещества, такие как стеарат магния, стеариновая кислота, глицерил бегенат и тальк. Композиции могут быть введены перорально в виде таблеток, микрочастиц, минитаблеток, капсул,саше и пероральных растворов или суспензий, быстрого или контролируемого высвобождения или порошков для их приготовления. Дополнительно к новым твердым формам пантопразола в соответствии с настоящим изобретением, применяемого в качестве активного вещества, пероральные препараты могут выборочно включать различные стандартные фармацевтические носители и вспомогательные вещества,- 13023020 такие как связующие вещества, наполнители, буферы, лубриканты, глиданты, красители, разрыхлители,ароматизаторы, подсластители, поверхностно-активные вещества, разделительные составы при изготовлении таблеток, антиадгезивные вещества и покрытия. Некоторые вспомогательное вещества могут выполнять несколько функций в композициях, например, действовать в качестве связующих веществ и разрыхлителей. Примеры фармацевтически приемлемых разрыхлителей для пероральных композиций включают крахмал, прежелатинизированный крахмал, гликолят крахмала натрия, карбоксиметилцеллюлозу натрия,кроскармеллозу натрия, микрокристаллическую целлюлозу, алгинаты, смолы, поверхностно-активные вещества, шипучие композиции, водные алюмосиликаты и сшитый поливинилпирролидон. Примеры фармацевтически приемлемых связующих веществ для пероральных композиций включают камедь; производные целлюлозы, такие как метилцеллюлоза, карбоксиметилцеллюлоза, гидроксипропилметилцеллюлоза, гидроксипропилцеллюлоза или гидроксиэтилцеллюлоза; желатин, глюкозу, декстрозу, ксилитол, полиметакрилаты, поливинилпирролидон, сорбидол, крахмал, прежелатинизированный крахмал, трагакант, ксантановую смолу, алгинаты, алюмосиликат магния, полиэтиленгликоль или бентонит. Примеры фармацевтически приемлемых наполнителей для пероральных композиций включают лактозу, ангидролактозу, моногидрат лактозы, сахарозу, декстрозу, маннитол, сорбитол, крахмал, целлюлозу (в частности, микрокристаллическую целлюлозу), дигидро- или ангидрофосфат кальция, карбонат кальция и сульфат кальция. Примеры фармацевтически приемлемых лубрикантов, используемых в композиции в соответствии с настоящим изобретением, включают стеарат магния, тальк, полиэтиленгликоль, полимеры этиленоксида, лаурилсульфат натрия, лаурилсульфат магния, олеат натрия, стеарилфумарат натрия и коллоидальную двуокись кремния. Примеры применяемых фармацевтически приемлемых ароматизаторов для пероральных композиций включают синтетические ароматизаторы и натуральные ароматические масла, такие как экстракты масел, цветов и фруктов (например, бананов, яблок, вишни обыкновенной и персика) и их сочетаний, а также аналогичные ароматизаторы. Их использование зависит от многих факторов, наиболее важным из которых является органолептическая приемлемость для лиц, которые будут принимать фармацевтические композиции. Примеры применяемых фармацевтически приемлемых красителей для пероральных композиций включают синтетические и натуральные красители, такие как двуокись титана, бета-каротин и экстракты из кожуры грейпфрута. Примеры применяемых фармацевтически приемлемых покрытий для пероральных композиций, используемых обычно для облегчения проглатывания, модифицирования свойств высвобождения, улучшения внешнего вида и (или) маскирование вкуса композиций, включают гидроксипропилметилцеллюлозу,гидроксипропилцеллюлозу и сополимеры акрилата/метакрилата. Примеры применяемых фармацевтически приемлемых подсластителей для пероральных композиций включают аспартам, сахарин, сахарин натрия, цикламат натрия, ксилитол, маннитол, сорбитол, лактозу и сахарозу. Примеры фармацевтически приемлемых буферов включают лимонную кислоту, цитрат натрия, бикарбонат натрия, двухосновный фосфат натрия, оксид магния, карбонат кальция и гидроксид магния. Примеры фармацевтически приемлемых поверхностно-активных веществ включают лаурилсульфат натрия и полисорбаты. Твердые композиции аналогичного типа могут также быть использованы в качестве наполнителей в желатиновых капсулах. В этом отношении предпочтительные вспомогательные вещества включают лактозу, крахмал, целлюлозу, молочный сахар или высокомолекулярные полиэтиленгликоли. В соотношении водных суспензий и (или) эликсиров агент может сочетаться с различными подсластителями или ароматизаторами, подкрашивающими веществами или красителями, с эмульгирующими и (или) суспендирующими веществами и с разбавителями, такими как вода, этанол, пропиленгликоль и глицерин, и с их сочетаниями. Соединения в соответствии с настоящим изобретением могут также, например, быть приготовлены в форме суппозиториев, например, содержащих известные основы суппозиториев для применения в медицине человека или в ветеринарии, либо в виде пессариев, например, содержащих известные основы пессариев. Соединения в соответствии с настоящим изобретением могут быть выполнены в лекарственной форме для обеспечения топического введения для использования в медицине человека и ветеринарии в виде мазей, кремов, гелей, гидрогелей, лосьонов, растворов, шампуней, порошков (в том числе спреев или присыпок), пессариев, тампонов, спреев, примочек, аэрозолей, капель (например, глазных, ушных или носовых капель) или пуронов. Для топического нанесения на кожу вещество в соответствии с настоящим изобретением может быть выполнено в лекарственной форме в виде приемлемой мази, содержащей активное соединение,суспендированное или растворенное, например, в смеси с одним или несколькими из нижеприведенных веществ: минеральное масло, жидкий вазелин, белый вазелин, пропиленгликоль, соединение полиоксиэтилен-полиоксипропилен, эмульгирующий воск, моностеарат сорбитана, полиэтиленгликоль, жидкий парафин, полисорбат 60, воск цетиловых эфиров, цетеариловый спирт, 2-октилдодеканол, бензиловый спирт и вода. Такие композиции также могут содержать другие фармацевтически приемлемые вспомогательные вещества, такие как полимеры, масла, жидкие носители, поверхностно-активные вещества, буферы, консерванты, стабилизаторы, антиоксиданты, увлажнители, смягчители, красители и ароматизаторы. Примеры фармацевтически приемлемых полимеров, пригодных для таких топических композиций,включают акриловые полимеры; производные целлюлозы, такие как карбоксиметилцеллюлоза натрия,метилцеллюлоза или гидроксипропилцеллюлоза; и природные полимеры, такие как алгинаты, трагакант,пектин, ксантан и цитозан . Примеры фармацевтически приемлемых масел включают минеральные масла, кремнийорганические масла, жирные кислоты, спирты и гликоли. Примеры фармацевтически приемлемых жидких носителей включают воду, спирты или гликоли,такие как этанол, изопропанол, пропиленгликоль, гексиленгликоль, глицерин и полиэтиленгликоль или их смеси, в которых растворены или диспергированы псевдополиморфы, выборочно с добавлением нетоксичных анионных, катионных или неионных поверхностно-активных веществ и неорганических или органических буферных составов. Примеры фармацевтически приемлемых консервантов включают бензоат натрия, аскорбиновую кислоту, сложные эфиры р-гидроксибензойной кислоты и различные антибактериальные и противогрибковые вещества, такие как растворители, например этанол, пропиленгликоль, бензиловый спирт, хлорбутанол, четвертичные аммониевые соли и парабены (такие как метилпарабен, этилпарабен и пропилпарабен). Примеры фармацевтически приемлемых стабилизаторов и антиоксидантов включают этилендиаминтетриуксусную кислоту (EDTA), тиомочевину, токоферол и бутилгидроксианизол. Примеры фармацевтически приемлемых увлажнителей включают глицерин, сорбитол, мочевину и полиэтиленгликоль. Примеры фармацевтически приемлемых смягчителей включают минеральные масла, изопропилмиристат и изопропилпалмилат. Соединения также может быть введено дермально или трансдермально, например, с использованием трансдермальных пластырей. Для офтальмического применения соединения могут быть выполнены в виде микронизированных суспензий в изотоническом, рН-отрегулированном, стерильном физиологическом растворе, или, предпочтительно, в виде растворов в изотоническом, рН-отрегулированном, стерильном физиологическом растворе, выборочно в сочетании с таким консервантом, как бензилалконий хлорид. Как указывалось, соединения в соответствии с настоящим изобретением могут быть введены интраназально или путем ингаляции, и они приемлемым образом доставляются с помощью ингалятора сухого порошка или в виде аэрозольного спрея из аэрозольного баллончика, насоса, пульверизатора или небулайзера с использованием приемлемого газа-вытеснителя, например, дихлордифторметана, трихлорфторметана, дихлортетрафторэтана, гидрофторалкана, такого как 1,1,1,2-тетрафторэтан (HFA 134AT) или 1,1,1,2,3,3,3-гептафторпропан (HFA 227EA), двуокиси углерода или иного приемлемого газа. В случае с распыляемыми под давлением аэрозолями единица дозирования может быть определена с помощью клапана, установленного на устройстве, для подачи дозированного количества лекарственного средства. Аэрозольный баллончик, насос, пульверизатор или небулайзер могут содержать раствор или суспензию активного соединения, например, смесь этанола и газа-вытеснителя в качестве растворителя,которая может дополнительно содержать лубрикант, например, сорбитан триолеат. Капсулы и картриджи (выполненные, например, из желатина) для использования в ингаляторах или инсуффляторах, могут быть выполнены в лекарственной форме, содержащей порошковую смесь соединения и приемлемой порошковой основы, такой как лактоза или крахмал. Для топического введение путем ингаляции соединения в соответствии с настоящим изобретением могут доставляться для использования в медицине человека или ветеринарии с помощью небулайзера. Фармацевтические композиции в соответствии с настоящим изобретением могут содержать от 0,01 до 99% весовых долей активного материала. Для топического введения, например, композиция обычно должна содержать 0,01-10%, более предпочтительно 0,01-1% активного материала. Активные вещества также могут быть введены в виде липосомальных систем доставки, таких как малые моноламеллярные везикулы, большие моноламеллярные везикулы и мультиламеллярные везикулы. Липосомы могут быть образованы из широкого разнообразия фосфолипидов, таких как холестерин,стеариламин или фосфатидилхолины. Фармацевтическая композиция или стандартная лекарственная форма в соответствии с настоящим изобретением может быть введена в соответствии с режимом введения и дозирования лекарственного средства, определенным путем проведения контрольного тестирования в свете вышеприведенных рекомендаций для достижения оптимальной активности при минимальной токсичности или минимальных побочных эффектах для конкретного пациента. Тем не менее, такая "точная настройка" терапевтического режима является стандартной в свете приведенных в настоящем описании рекомендаций. Доза активных веществ в соответствии с настоящим изобретением может изменяться в зависимости от разнообразных факторов, таких как условия основного заболевания, состояние пациента, вес, пол и возраст, а также от способа введения. Эффективное количество для лечения может быть легко определено с помощью эмпирических способов, известных специалистам в данной области техники, например,путем создания матрицы доз и частоты введения и путем сравнения групп экспериментальных единиц или субъектов в каждой точке матрицы. Точное количество, вводимое пациенту, изменяется в зависимости от состояния и тяжести заболевания и физического состояния пациента. Измеряемое уменьшение интенсивности любого симптома или параметра заболевания может быть определен специалистами в данной области техники, или врач может получить эту информацию от пациента. Очевидно, что любое клинически или статистически значимое ослабление или уменьшение интенсивности любого симптома или параметра заболевания мочевыводящих путей не выходит за объем настоящего изобретения. Клинически значимое ослабление или уменьшение интенсивности заболевания означает воспринимаемое ослабление или уменьшение интенсивности симптомов заболевания пациентом и (или) врачом. Например, один пациент может одновременно страдать от ряда симптомов затруднения или боли при мочеиспускании таких, как, например, императивные позывы к мочеиспусканию и учащенное мочеиспускание или оба симптома, и указанные симптомы могут быть ослаблены с использованием способов в соответствии с настоящим изобретением. В случае недержания мочи любое уменьшение частоты или объема нежелательного мочеиспускания рассматривается как благотворное воздействие настоящего способа лечения. Количество вводимого вещества может находиться в пределах от приблизительно 0,01 до приблизительно 25 мг/кг/сутки, предпочтительно от приблизительно 0,1 до приблизительно 10 мг/кг/сутки и наиболее предпочтительно от 0,2 до приблизительно 5 мг/кг/сутки. Очевидно, что фармацевтические рецептуры в соответствии с настоящим изобретением не должны в обязательном порядке содержать все количество вещества, являющегося эффективным для лечения заболевания, т.к. такое эффективное количество может быть достигнуто путем введения нескольких доз таких фармацевтических рецептур. В предпочтительном примере осуществления настоящего изобретения соединения формулы I выполнены в виде капсул или таблеток, предпочтительно содержащих 10-200 мг соединений в соответствии с настоящим изобретением, их предпочтительно вводят пациенту при суммарной суточной дозе 10300 мг, предпочтительно 20-150 мг и наиболее предпочтительно приблизительно 50 мг для лечения недержания мочи и других дисфункций. Фармацевтическая композиция для парентерального введения содержит от приблизительно 0,01% до приблизительно 100% по весу активных веществ в соответствии с настоящим изобретением, исходя из 100 вес.% от общего веса фармацевтической композиции. В целом, трансдермальные лекарственные формы могут содержать от приблизительно 0,01% до приблизительно 100% по весу активных веществ по сравнению со 100% общего веса лекарственной формы. Фармацевтическая композиция или стандартная лекарственная форма может быть введена в виде однократной суточной дозы, либо общая суточная доза может быть введена в разделенных дозах. Кроме того, может быть желательным совместное введение или последовательное введение другого соединения для лечения заболевания. С этой целью комбинированные активные компоненты выполняют в виде простой единицы дозирования. Для проведения комбинированного лечения, при котором соединения представлены в виде отдельных лекарственных форм, соединения могут быть введены одновременно, либо каждое соединение может быть введено с разнесением во времени. Например, соединение в соответствии с настоящим изобретением может быть введено утром, а антимускариновое соединение может быть введено вечером, или наоборот. Дополнительные соединения также могут быть введены через определенные интервалы. Порядок введения будет зависеть от различных факторов, таких как возраст, вес, пол, состояние здоровья пациента, тяжесть и этиология заболеваний, подлежащих лечению, путь введения, функционирование почек и печени пациента, история болезни пациента и чувствительность пациента к препарату. Может быть проведена тщательная настройка определения порядка введения соединения, и такая точная настройка является стандартной в свете данных в настоящем описании рекомендаций. Синтез соединений в соответствии с настоящим изобретением Соединения формулы I и их энантиомеры, диастереомеры, N-оксиды и фармацевтически приемлемые соли могут быть получены с помощью общепринятых способов, изложенных ниже в настоящем описании, при этом указанные способы образуют дополнительный аспект в соответствии с настоящим изобретением. Специалистам в данной области техники должно быть очевидно, что желательным может явиться использование защищенных производных промежуточных веществ, используемых при приготовлении соединений формулы I. Создание защиты и снятие защиты функциональных групп может быть осуществлено с помощью способов, известных в данной области техники (см., например, Green and Wuts Protec- 16023020tive Groups in Organic Synthesis. John Wiley и Sons, New York, 1999). Гидрокси или аминогруппы могут быть защищены любой защитной гидрокси или аминогруппой. Защитные аминогруппы могут быть удалены с использованием известных технологий. Например, ацильные группы, такие как алканоильные,алкоксикарбонильные и ароильные группы, могут быть удалены путем сольволиза, например, путем гидролиза в кислых или щелочных условиях. Арилметоксикарбонильные группы (например, бензилоксикарбонилыные) могут быть расщеплены путем гидрогенолиза в присутствии катализатора, такого как палладий-на-угле. Процесс синтеза целевых соединений завершается удалением любых защитных групп, которые могут присутствовать в предпоследних промежуточных веществах, с использованием стандартных способов, хорошо известных специалистам в данной области техники. Далее незащищенные конечные продукты очищают, при необходимости, с использованием стандартных методов, таких как хроматография на силикагеле, ВЭЖХ на силикагеле и аналогичных методов, и (или) путем рекристаллизации. Соединения в соответствии с настоящим изобретением обычно получают в соответствии со следующей схемой. Схема 1 В схеме 1 "Ak" означает низшую алкильную группу, а остальные переменные определяются для общей формулы I или внутри самой схемы. Циклические кетоны 1 коммерчески доступны на рынке, либо их легко получить с помощью стандартных способов, известных специалистам в данной области техники, например, из пиперидона (R1 = N) с карбонильной группой, которая может или не может быть заранее защищена (такой как кетальная группа, например 1,3-диоксолан) простым нуклеофильным замещением активированных галоарилов,галоалкилов или галогетероарилов, что может быть проведено в соответствующем растворителе (таком как n-бутанол, DMF, N-метилпирролидон или N,N-диметилацетамид) при температуре в диапазоне от комнатной температуры до температуры флегмы выбранных растворителей в присутствии основания,такого как триэтиламин или 4,4-диметиламинопиридин. Реакция может быть также проведена при микроволновом излучении в микроволновом аппарате для сокращения времени реакции. Альтернативным общеизвестным способом получения пиперидонов из инактивированных галоарилов или галогетероарилов (или трифлатов) является способ аминирования Бухвальда-Хартвига с использованием палладия в качестве катализатора или проведение катализированного аминирования с использованием других металлов. Могут быть использованы хорошо известные способы восстановительного аминирования в тех случаях, когда R4(R5)1 означает алкил. Циклические кетоны 1 вступают в реакцию с илидами, например,полученными путем добавления основания (например, LiHMDS или трет-бутоксида калия в апротонном растворителе, таком как ТГФ или диэтиловый эфир), например, к метилтрифенилфосфоний бромиду, для получения производных экзометилена 2. Производные метилена 2, в свою очередь, циклизированы с использованием методологии 1,3-диполярного циклоприсоединения до производных алкинила 3 (Hao-WeiShih et. al., TeTpahedron letters 49 (2008) 1008-1011, WO 20006/122770). С этой целью оксимы триалкилсилилпропиональдегидов превращают in situ (либо путем выделения промежуточного вещества) в соответствующие хлоро- или бромооксимы (например, путем использования N-бромсукцинимида, или Nхлорсукцинимида или гипохлорита или гипобромита натрия, или t.бутилгипохлорита в соответствующем растворителе, таком как дихлорметан или ДМФ с добавлением воды или без добавления воды), которые выделяют или непосредственно трансформируют в реакционном сосуде в соответствующие нитрилоксиды, с помощью слабого основания, такого как Na2CO3,триэтиламин или этилмагнийбромид. Нитрилоксиды достаточно легко вступают в реакцию с соединениями 2 в простейшем растворителе, таком как дихлорметан или ДМФ обычно при температуре от -78 С до 0 вплоть до комнатной температуры или при нагреве до дефлегмирования выбранного растворителя, позволяя получить соединения 3. Далее силильную защитную группу 3 удаляют путем обработки тетрабутиламмоний фторидом в ТГФ при температуре в диапазоне от температуры внешней среды до дефлегмирования или путем гид- 17023020 ролиза с основанием (K2CO3 или KOH в МеОН) или с помощью иного приемлемого способа, выбранного из способов, о которых сообщалось в Greene-Wuts (Greene's Protective Groups in Organic Synthesis, 3rdEdition, Peter G. M. Wuts, Theodoura W. Greene 1999, Wiley Interscience page 654-659), и которые хорошо известны специалистам в данной области техники. Далее полученные ацетиленовые соединения преобразуют в соединения 4 путем проведения реакции между ними и R3-LG с последующим проведением реакции Соногаширы (Science of Synthesis, H. Heaney and S. Christie, October 2003, Vol. 3, Page 402 и далее). В указанной реакции используют иодид меди и палладиевый комплекс, выбранный из (Ph3P)2PdCl2,(Ph3P)2Pd(OAc)2, (Ph3P)4Pd (который также может быть получен in situ, например, из трифенилфосфина иPd(OAc)2), и из всех других палладиевых комплексов, приведенных в литературе и используемых в такого рода реакции в присутствии такого основания, как TEA, DEA, DIPEA, ТМА, бутиламин и пиперидин. Растворители выбраны из THF, DME, DMF, DMA, этилацетата, DMSO, толуола и иных приемлемых растворителей для целей реакции; либо может быть использовано то же самое основание в избыточном количестве в качестве реакционного растворителя. При проведении реакции в DMF или DME выделение соединения 4 можно избежать путем добавления тетрабутиламмоний фторида или тетрабутиламмоний хлорида непосредственно в реакционную среду, содержащую соединения 3, до того, как произойдет связывание (Sorensen, U.S., Pombo-Villar, E. TeTpahedron 2005, 61, 2697-2703). Вводят R3 заместители с использованием арильных или гетероарильных галидов (предпочтительно в порядке уменьшения - иодид,бромид, хлорид), арильных или гетероарильных трифлатов, алкильных галогенидов или ацильных хлоридов, ароильных хлоридов и гетероарильных хлоридов. Трифлаты синтезируют с использованием способа, исключительно хорошо известного специалистам в данной области техники, например, из фенолов или гидроксиарилов (гетероарилов) с использованием трифторметансульфонового ангидрида в хлорированном растворителе или с использованием N-фенилтрифлимида в толуоле или хлорированного растворителя в присутствии основания (например, TEA) или без него. Оба процесса могут быть ускорены при воздействии микроволн при проведении реакции в микроволновой печи. Другими приемлемыми замещаемым группами LG для R3-LG являются нонафлаты, тозилаты и трифторбораты калия. Когда R3 означает Ak, альтернативной реакцией связывания по Соногашира является реакция соединения 4 с основанием лития (например, бутил литий или LHDMS) в соответствующем растворителе, например, для получения производного литий алкинила, которое, в свою очередь, вступает в реакцию с электрофилом, например, с бутил иодидом или аналогичным электрофилом в том же самом растворителе или в альтернативном апротонном растворителе, таком как толуол, при температуре в диапазоне от -20 С до температуры дефлегмирования выбранного растворителя. Если получены соединения 4, в которых Q является защитной группой, необходимо снятие с них защиты и N-арилирование/алкилирование или иные виды этапов дериватизации для получения соединения I. Соединения 4 могут быть получены путем непосредственного вступления в реакцию соединений 2 с соответствующими дериватизированными пропиолальдегидными оксимами, в которых R3 группа заменяет триалкилсилильную группу. В схеме 2, "Ak" означает низшую алкильную группу, и остальные переменные имеют такие значения, которые определены для общей формулы I или внутри самой схемы. Схема 2 представляет собой альтернативную реакцию для получения соединений I, в которых R3 означает Ak. Как указывалось выше, при проведении реакции с дибромформальдоксимом для получения соединений 3 можно синтезировать соединения 5. Бромоксазолин 5 может быть далее алкинилирован с использованием алкинов, соответствующего основания, такого как карбонат натрия, при проведении сокатализа Cu/Cul в соответствии с детальным описанием, приведенным в экспериментальной части. ЕслиQ является защитной группой в полученных соединениях 6, необходимо провести дальнейшее снятие защиты с них и N-арилирование/алкилирование или иные виды этапов дериватизации для получения соединения I. Соединения 6 могут быть получены путем непосредственного вступления в реакцию соединения 2 с соответствующими алкилпропиональдегидными оксимами. Другие спирогетероциклические промежуточные вещества, отличающиеся от спирооксазолинов,могут быть синтезированы с помощью способов, приведенных в литературе и описанных в экспериментальной части в качестве ссылок. Синтез других соединений, не приведенных на данный момент в общем описании выше, в полной мере задокументирован в экспериментальной части нижеприведенного описания настоящего изобретения. Свободные основания формулы I, их диастереомеры или энантиомеры могут быть преобразованы в соответствующие фармацевтически приемлемые соли при стандартных условиях, хорошо известных в данной области техники. Например, свободное основание растворяют в приемлемом органическом растворителе, таком как метанол, обрабатывают, например, одним эквивалентом малеиновой или оксалиновой кислоты, одним или двумя эквивалентами хлористоводородной кислоты или метансульфокислоты, и далее концентрируют под вакуумом для получения соответствующей фармацевтически приемлемой соли. Далее остаток может бытля или смеси органических растворителей, таких как метанол/диь очищен путем рекристаллизации от приемлемого органического растворитеэтилэфир.N-оксиды соединений формулы I могут быть синтезированы путем простых реакций окисления, хорошо известных специалистам в данной области техники. Примеры Нижеприведенные примеры иллюстрируют синтез соединений формулы I в соответствии с вышеприведенным общим описанием. Указанные примеры являются иллюстративными и не ограничивают объема настоящего изобретения. Реагенты и исходные материалы доступны специалистам в данной области техники. Пример 1. 3-Фенилэтинил-8-(6-метил-3-нитро-2-пиридил)-1-окса-2,8-диазаспиро[4.51 дек-2-ен. 3-Фенилпроп-2-иналоксим (соединение 1 а). Смесь фенилпропаргилальдегида (859 мг, 6,6 ммоль), гидроксиламин гидрохлорида (4,59 г, 66 ммоль), этилового спирта (48 мл) и воды (12 мл) перемешивали при комнатной температуре в течение 24 ч. Реакционную смесь разбавляли Н 2 О, экстрагировали Et2O - этилацетатом, промывали рассолом и выпаривали до сухого состояния под вакуумом и получали 0,96 г указанного в заголовке соединения(син:анти 1:1) в виде пастообразного твердого вещества коричневатого цвета. MS: [М+Н]+= 146.11. 3-Фенилэтинил-8-(t.бутоксикаобонил)-1-окса-2,8-диазаспиоо[4.5]дек-2-ен (соединение 1b). К раствору соединения 1 а (0,35 г, 2,41 ммоль) в 3 мл ДМФ, перемешиваемому при комнатной температуре, добавляли N-хлорсукцинимид (0,386 г, 2,89 ммоль), и раствор окрашивался в оранжевый цвет. После перемешивания в течение 2 ч раствор приобретал желтый цвет и после дополнительного перемешивания в течение 2 ч его охлаждали до 0 С и добавляли раствор 1-(t.бутоксикарбонил)-4-метиленпиперидин (143 мг, 0,73 ммоль) в 0,5 мл ДМФ, затем добавляли раствор TEA в 0,5 мл ДМФ. Ледяную баню удаляли, и реакционную смесь перемешивали при комнатной температуре в течение 2 дней. Затем реакционную смесь разбавляли холодной водой и экстрагировали этилацетатом. Экстракты промывали рассолом, высушивали над Na2SO4 и выпаривали до сухого состояния под вакуумом. Неочищенный продукт очищали методом флэш-хроматографии в автоматизированном режиме (SP1TM - Biotage; элюируя градиентом петролейного эфира - этилацетата в соотношении от 95 : 5 до 7 : 3) и получали 210 мг указанного в заголовке продукта. Выход: 85,5%. MS: [М+Н]+ = 341.16. 3-Фенилэтинил-1-окса-2,8-диазаспиро[4.5]дек-2-ен (соединение 1 с). К раствору соединения 1b (200 мг, 0,59 ммоль) в CH2Cl2 (12 мл), перемешиваемому при 0 С, добавляли трифторуксусную кислоту (452 мкл, 5,87 ммоль) и реакционную смесь перемешивали при 25 С в течение 24 ч до тех пор, пока с помощью метода жидкостной хроматографии/масс-спектрометрии не наблюдалась полная конверсия реагента. Добавляли воду, а затем 3N водный раствор NaOH для получения щелочного рН. Органический слой отделяли, экстрагировали в водном слое с помощью CH2Cl2, промывали рассолом, высушивали комбинированные органические слои над Na2SO4 и получали указанное в заголовке соединение в виде твердого вещества бежевого цвета, которое использовали на следующем этапе без дальнейшей очистки. MS: [M+H]+= 241.29. 3-Фенилэтинил-8-(6-метил-3-нитро-2-пиоидил)-1-окса-2,8-диазаспиро[4.5]дек-2-ен. Раствор соединения 1 с (50 мг, 0,21 ммоль), 2-хлор-6-метил-3-нитропиридин (39,5 мг, 0,23 ммоль) и триэтиламина (31,9 мкл, 0,23 ммоль) в 14,14-диметилацетамиде (1,14 мл) перемешивали при комнатной температуре в течение 24 ч и вливали в воду. Водный слой экстрагировали этилацетатом. Комбинированные экстракты промывали водой, высушивали над Na2SO4 и выпаривали до сухого состояния под вакуумом. Неочищенный продукт очищали методом флэш-хроматографии в автоматизированном режиме(SP1TM - Biotage), элюируя смесью петролейного эфира - Ме 2 СО в соотношении 95 : 5. Дальнейшая очистка с использованием CH2Cl2 в качестве элюента позволяла получить 47,7 мг указанного в заголовке соединения (67,7 %) в виде твердого вещества желтого цвета. MS: [M+H]+ = 377.22. 1n-Бутиллитий в гексане (2,5 М, 4,93 мл, 12,3 ммоль) добавляли по каплям в течение 10 мин в суспензию 98% метилтрифенилфосфоний бромида (4,65 г, 12,8 ммоль) в 40 мл ТГФ, перемешиваемого при 70 С. Спустя 0,5 ч, добавляли раствор 1-(3-нитро-2-пиридил)-4-оксопиперидина (2 г, 8,5 ммоль) в 16 мл ТГФ и реакционную смесь выдерживали до тех пор, пока она не нагревалась до комнатной температуры. После выдерживания в течение ночи смесь быстро охлаждали водным насыщенным раствором NH4Cl,экстрагировали этилацетатом, высушивали над Na2SO4 и выпаривали до сухого состояния под вакуумом. Неочищенный продукт очищали методом флэш-хроматографии в автоматизированном режиме (SP1TM-Biotage), элюируя градиентом петролейного эфира - этилацетата в соотношении от 1:0 до 9:1 и получали 1,23 г указанного в заголовке соединения в виде твердого вещества желтого цвета. MS: [М+Н]+ = 220.18. 3-Фенилэтинил-8-(3-нитро-2-пиридил)-1-окса-2,8-диазаспиро[4.5]дек-2-ен. Указанный в заголовке продукт был получен в соответствии с описанием для получения соединения 1b, но при этом использовали соединение 2 а вместо 1-t.бутоксикарбонил)-4-метиленпиперидина. После обычной процедуры выделения продукта реакции смесь очищали смесь очищали методом флэшхроматографии в автоматизированном режиме (SP1TM - Biotage), элюируя градиентом петролейного эфира - этилацетата в соотношении от 95 : 5 до 7 : 3, и получали 25 мг указанного в заголовке соединения. Выход: MS: [M+H]+ = 363.54. 1[4.5]дек-2-ен. 6-Метил-2-(4-метилен-1-пиперидил)-3-нитропиридин (соединение 3 а). Указанный в заголовке продукт синтезировали с использованием способа, описанного для получения соединения 2 а, но заменив при этом при этом 1-(3-нитро-2-пиридил)-4-оксо-пиперидин 1-(6-метил-3 нитро-2-пиридил)-4-оксопиперидином. Выход: 62%. MS: [М+Н]+ = 233.12.Letters, Volume 7, Issue 10, 2005, Pages 2011-2014] в 11,9 мл ДМФ, перемешиваемому при комнатной температуре, добавляли N-хлорсукцинимид (1,99 г, 14,8 ммоль). После перемешивания в течение 4 ч раствор вливали в воду и экстрагировали Et2O. После обычной процедуры выделения продукта реакции остаток (2,09 г) использовали как таковой на следующем этапе. 3-(Триметилсилилэтинил)-8-(6-метил-3-нитро-2-пиридил)-1-окса-2,8-диазаспиро[4.5]дек-2-ен (соединение 3 с). Раствор TEA (0,554 мл, 3,85 ммоль) в 9,4 мл дихлорметана добавляли по каплям в раствор соединения 3b (1,67 г, 2,57 ммоль) и соединения 3 а (600 мг, 2,57 ммоль) в 42 мл дихлорметана, перемешиваемых при 0 С. Затем реакционную смесь перемешивали при комнатной температуре в течение 24 ч и разбавляли холодной водой. Органический слой промывали рассолом, высушивали над Na2SO4 и выпаривали до сухого состояния под вакуумом. Неочищенный продукт очищали методом флэш-хроматографии в автоматизированном режиме (SP1TM - Biotage; градиент CH2Cl2 - петролейный эфир - этилацетат в соотношении от 5 : 5 до 10 : 0) и получали 641 мг указанного в заголовке продукта. Выход: 67%. MS: [M+H]+ = 273.43. 3-[(6-Метил-2-пиридил)этинил]-8-(6-метил-3-нитро-2-пиридил)-1-окса-2.8-диазаспиро[4.5]дек-2-ен. Суспензию соединения 3 с (58 мг, 0,16 ммоль), ацетаттригидрат натрия (42,5 мг, 0,31 ммоль), 2 бром-6-метилпиридина (26,8 мг, 0,16 ммоль), тетрабутиламмоний фторида (40,8 мг, 0,156 ммоль) и тетракис(трифенилфосфин)палладия(0) (15,8 мг, 0,014 ммоль) в 2,05 мл ДМФ, промытую струей водорода,нагревали в микроволновой печи (Biotage) при 120 С в течение 10 мин. Разбавляли этилацетатом, промывали Н 2 О и высушивали над Na2SO4, затем выпаривали и очищали остаток с использованием автоматизированной системы флэш-жидкостной хроматографии (HorizonTM - Biotage) (элюируя градиентом петролейного эфира - этилацетата в соотношении от 9 : 1 до 6 : 4) и получали 17,4 мг (28,5%) указанного в заголовке соединения в виде масла желтого цвета. MS: [M+H]+ = 392.33. 1(d, J=8 Hz, 1H), 7.22-7.26 (m, 1H), 7.42-7.46 (m, 1H), 7.65-7.61 (m,1 Н), 8.10 (d, J=8 Hz, 1H). Пример 4. 3-(2-Тиенилэтинил)-8-(6-метил-3-нитро-2-пиридил)-1-окса-2,8-диазаспиро[4.5]дек-2-ен. Указанный в заголовке продукт получали, следуя процедуре, описанной выше для получения соединения примера 3, но при этом использовали 2-бромтиофен вместо 2-бром-6-метилпиридина. Очищали остаток с использованием автоматизированной системы флэш-жидкостной хроматографии (HorizonTM- Biotage) (элюируя градиентом петролейного эфира - этилацетата в соотношении от 9 : 1 до 6 : 4). Выход: 26,7%. MS: [M+H]+ = 383.52. Пример 5. 3-(2-Пиридилэтинил)-8-(6-метил-3-нитро-2-пиридил)-1-окса-2,8-диазаспиро[4.5]дек-2-ен. Указанный в заголовке продукт получали, следуя процедуре, описанной выше для получения соединения примера 3, но при этом использовали 2-йодпиридин вместо 2-бром-6-метилпиридина. Остаток очищали с использованием автоматизированной системы флэш-жидкостной хроматографии (HorizonTM - Biotage) (элюируя градиентом петролейного эфира - этилацетата в соотношении от 9 : 1 до 4:6). Выход: 49,6%. MS: [M+H]+ = 378.46. 1H-NMR: (COCl3 ,): 1.90-2.09 (m, 4H), 2.49 (s, 3 Н), 3.03 (s, 2H), 3.51-3.67 (m, 4H), 6.63 (d,J=8Hz,1H), 7.36-7.41 (m, 1H), 7.59-7.63 (m, 1H), 7.76-7.82 (m, 1H), 8.11 (d, J=8Hz, 1H), 8.66-8.69 (m, 1H). Пример 6. 3-(2-Фторфенилэтинил)-8-(6-метил-3-нитро-2-пиридил)-1-окса-2,8-диазаспиро[4.5]дек-2 ен. Указанный в заголовке продукт получали, следуя процедуре, описанной выше для получения соединения примера 3, но при этом использовали 2-фторйодбензол вместо 2-бром-6-метилпиридина. Остаток очищали с использованием автоматизированной системы флэш-жидкостной хроматографии(HorizonTM - Biotage) (элюируя градиентом петролейного эфира - этилацетата в соотношении от 95 : 5 до 7 : 3). Выход: 42,6%. MS: [M+H]+ = 395.27. 1H-NMR: (CDCl3, ): 1.90-2.11 (m, 4 Н), 2.50 (s, 3 Н), 3.02 (s, 2 Н), 3.50-3.70 (m, 4 Н), 6.63 (d, J=8 Hz,1 Н), 7.09-7.21 (m, 2 Н), 7.36-7.45 (m, 1 Н), 7.49-7.57 (m,1 Н), 8.11 (d, J=8 Hz, 1 Н). Пример 7. 3-(3-Фторфенилэтинил)-8-(6-метил-3-нитро-2-пиридил)-1-окса-2,8-диазаспиро[4.5]дек-2 ен. Указанный в заголовке продукт получали, следуя процедуре, описанной выше для получения соединения примера 3, но при этом использовали 3-фторйодбензол вместо 2-бром-6-метилпиридина. Выход: 42,4%. MS: [M+H]+ = 395.41. 1H-NMR: (CDCl3, ): 1.90-2.11 (m, 4 Н), 2.50 (s, 3 Н), 2.99 (s, 2 Н), 3.50-3.70 (m, 4 Н), 6.63 (d J=8 Hz,1 Н), 7.09-7.17 (m, 1 Н), 7.20-7.27 (m, 1 Н), 7.30-7.39 (m, 2 Н), 8.11 (d, 8 Hz, 1H). Пример 8. 3-(4-Фторфенилэтинил)-8-(6-метил-3-нитро-2-пиридил)-1-окса-2,8-диазаспиро[4.5]дек-2 ен. Указанный в заголовке продукт получали, следуя процедуре, описанной выше для получения соединения примера 3, но при этом использовали 4-фторйодбензол вместо 2-бром-6-метилпиридин. Выход: 37,7%. MS: [M+H]+ = 395.27. 1H-NMR: (CDCl3, ): 1.90-2.10 (m, 4 Н), 2.50 (s, 3 Н), 2.99 (s, 2 Н), 3.50-3.70 (m, 4 Н), 6.63 (d J=8 Hz,1 Н), 7.04-7.13 (m, 2 Н), 7.50-7.57 (m, 2 Н), 8.11 (d, J=8 Hz, 1H). Пример 9. 3-(2-Фурилэтинил)-8-(6-метил-3-нитро-2-пиридил)-1-окса-2,8-диазаспиро[4.5]дек-2-ен. Указанный в заголовке продукт получали, следуя процедуре, описанной выше для получения соединения примера 3, но при этом использовали 2-бромфуран вместо 2-бром-6-метилпиридина. Остаток очищали с использованием автоматизированной системы флэш-жидкостной хроматографии (HorizonTM - Biotage) (элюируя градиентом петролейного эфира - этилацетата в соотношении от 95 : 5 до 6 : 4). Выход: 12,6%. MS: [M+H]+ = 367.33. Пример 10. 3-[(2-Метил-1,3-тиазол-4-ил)этинил]-8-(6-метил-3-нитро-2-пиридил)-1-окса-2,8-диазаспиро[4.5]дек-2-ен. Указанный в заголовке продукт получали, следуя процедуре, описанной выше для получения соединения примера 3, но при этом использовали 4-бром-2-метилтиазол вместо 2-бром-6-метилпиридина. Остаток очищали с использованием автоматизированной системы флэш-жидкостной хроматографии(HorizonTM -Biotage) (элюируя градиентом петролейного эфира - этилацетата в соотношении от 9 : 1 до 5:5). Выход: 17,6%. MS: [M+H]+ = 398.35. Пример 11. 3-(Проп-1-инил)-8-(6-метил-3-нитро-2-пиридил)-1-окса-2,8-диазаспиро[4.5]дек-2-ен. 3-Этинил-8-(6-метил-3-нитро-2-пиоидил)-1-окса-2,8-диазаспиро[4.5]дек-2-ен (соединение 11 а). К раствору соединения 3 с (360 мг, 0,96 ммоль) в 9 мл ТГФ добавляли тетрабутиламмоний фторид гидрат (269 мг, 0,963 ммоль), и реакционную смесь перемешивали при комнатной температуре в течение 4 ч. После выдерживания в течение ночи, быстро охлаждали водой, экстрагировали этилацетатом и выпаривали до сухого состояния, неочищенный продукт очищали с использованием автоматизированной системы флэш-жидкостной хроматографии (HorizonTM -Biotage) (элюируя градиентом петролейного эфира - этилацетата в соотношении от 95 : 5 до 7 : 3), и получали соединение 11 а (0,231 г, 80%). MS:[М+Н]+ = 301.36. 3-(Проп-1-инил)-8-(6-метил-3-нитро-2-пиридил)-1-окса-2,8-диазаспиро[4.5]дек-2-ен. В раствор соединения 11 а (25 мг, 0,83 ммоль) в ТГФ (1,26 мл) при постоянном перемешивании при-78 С добавляли по каплям бутиллитий в гексане (2,5 М, 0,04 мл, 0,1 ммоль). Спустя 30 мин добавляли метилйодид (6,22 мкл, 0,1 ммоль). Ледяную баню удаляли и раствор оранжевого цвета выдерживали до нагревания до комнатной температуры. После выдерживания в течение ночи раствор быстро охлаждали насыщенным водным раствором NH4Cl, экстрагировали этилацетатом, промывали Н 2 О, высушивали надNa2SO4 и выпаривали до сухого состояния под вакуумом. Неочищенный продукт очищали с использованием автоматизированной системы флэш-жидкостной хроматографии (HorizonTM - Biotage) (элюируя градиентом петролейного эфира - этилацетата в соотношении от 95 : 5 до 6 : 4) и получали 6 мг указан- 21023020 ного в заголовке соединения. Выход: 22,9%. MS: [М+Н]+ = 315.32. Пример 12. 3-(3-Хлорфенилэтинил)-8-(6-метил-3-нитро-2-пиридил)-1-окса-2,8-диазаспиро[4.5]дек 2-ен. Указанный в заголовке продукт получали, следуя процедуре, описанной выше для получения соединения примера 3, но при этом использовали 3-хлорйодбензол вместо 2-бром-6-метилпиридина. Остаток очищали с использованием автоматизированной системы флэш-жидкостной хроматографии(HorizonTM - Biotage) (элюируя градиентом петролейного эфира - этилацетата в соотношении от 9 : 1 до 7 : 3). Выход: 55%. MS: [М+Н]+ = 411.16. 1H-NMR: (CDCl3, ): 1.90-2.11 (m, 4 Н), 2.50 (s, 3 Н), 2.99 (s, 2 Н), 3.50-3.70 (m, 4 Н), 6.64 (d, J=8 Hz,1 Н), 7.29-7.35 (m, 1 Н), 7.39-7.45 (m, 2 Н), 7.53 (m, 1 Н), 8.11 (d, 8 Hz, 1H). Пример 13. 3-(3-Метилфенилэтинил)-8-(6-метил-3-нитро-2-пиридил)-1-окса-2,8-диазаспиро[4.5]дек 2-ен. Указанный в заголовке продукт получали, следуя процедуре, описанной выше для получения соединения примера 3, но при этом использовали 3-йодтолуол вместо 2-бром-6-метилпиридина. Получали твердое вещество желтого цвета. Выход: 59,6%. MS: [М+Н]+ = 391.42. 1(d, J=8 Hz, 1 Н), 7.20-7.27 (m, 2 Н), 7.29-7.38 (m, 2 Н), 8.12 (d, J=8 Hz, 1H). Пример 14. 3-(3-Метоксифенилэтинил)-8-(6-метил-3-нитро-2-пиридил)-1-окса-2,8-диазаспиро[4.5] дек-2-ен. Указанный в заголовке продукт получали, следуя процедуре, описанной выше для получения соединения примера 3, но при этом использовали 3-метоксийодбензол вместо 2-бром-6-метилпиридина. Получали твердое вещество желтого цвета. Выход: 41%. MS: [M+H]+ = 407.27. 1(d, J=8 Hz, 1H), 6.95-7.00 (m, 1H), 7.06-7.08 (m, 1H), 7.12-7.16 (m, 1H), 7.26-7.32(m, 1H), 8.11 (d, J=8 Hz,1H). Пример 15. 3-(3-Цианосренилэтинил)-8-(6-метил-3-нитро-2-пиридил)-1-окса-2,8-диазаспиро[4.5] дек-2-ен. Указанный в заголовке продукт получали, следуя процедуре, описанной выше для получения соединения примера 3, но при этом использовали 3-йодбензонитрил вместо 2-бром-6-метилпиридина. Остаток очищали с использованием автоматизированной системы флэш-жидкостной хроматографии (HorizonTM - Biotage) ( элюируя градиентом петролейного эфира - этилацетата в соотношении от 95 : 5 до 5 : 5). Выход: 66,5%. MS: [M+H]+ = 402.23. 1H-NMR: (CDCl3, ): 1.90-2.09 (m, 4H), 2.49 (s, 3 Н), 3.00(s, 2H), 3.50-3.70 (m, 4H), 6.64 (d, J=8 Hz,1H), 7.49-7.55 (m, 1H), 7.67-7.71 (m, 1H), 7.74-7.78 (m, 1H), 7.81-7.83 (s, 1H), 8.11 (d, J=8 Hz, 1H). Пример 16. 3-(3-Тиенилэтинил)-8-(6-метил-3-нитро-2-пиридил)-1-окса-2.8-диазаспиро[4.5]дек-2-ен. Указанный в заголовке продукт получали, следуя процедуре, описанной выше для получения соединения примера 3, но при этом использовали 3-бромтиофен вместо 2-бром-6-метилпиридина. Остаток очищали с использованием автоматизированной системы флэш-жидкостной хроматографии (Horizon Biotage) (элюируя градиентом петролейного эфира - этилацетата в соотношении от 7 : 3 до 3 : 7). Получали твердое вещество желтого цвета. Выход: 66,5%. MS: [M+H]+ = 383.22. 1H-NMR: (CDCl3, ): 1.90-2.01 (m, 4H), 2.49 (s, 3 Н), 2.98 (s, 2H), 3.50-3.70 (m, 4H), 6.62 (d, J=8 Hz,1H), 7.19-7.22 (m, 1H), 7.32-7.35 (m, 1H), 7.62-7.63 (m, 1H), 8.11 (d, J=8 Hz, 1H). Пример 17. 3-(3-Пиридилэтинил)-8-(6-метил-3-нитро-2-пиридил)-1-окса-2,8-диазаспиро[4.5]дек-2 ен. Указанный в заголовке продукт получали, следуя процедуре, описанной выше для получения соединения примера 3, но при этом использовали 3-йодпиридин вместо 2-бром-6-метилпиридина. После обычной процедуры выделения продукта реакции неочищенный продукт очищали методом флэшхроматографии в автоматизированном режиме (SP1TM - Biotage; элюируя градиентом петролейного эфира - этилацетата в соотношении от 7 : 3 до 3 : 7) и получали указанный в заголовке продукт в виде твердого вещества желтого цвета. Выход: 66,7%. MS: [M+H]+ = 378.27 1H-NMR: (CDCl3, ): 1.90-2.09 (m,4 Н), 2.49 (s, 3 Н), 3.01 (s, 2 Н), 3.50-3.70 (m, 4 Н), 6.63 (d, J=8 Hz, 1 Н), 7.33-7.38 (m, 1 Н), 7.83-7.87 (m, 1 Н),8.11 (d, J=8 Hz, 1H), 8.63-8.65 (m, 1 Н), 8.78-7.80 (s, 1H). Пример 18. 3-(3-(3-Метил-[1,2,4]оксадиазол-5-ил)фенилэтинил)-8-(6-метил-3-нитро-2-пиридил)-1 окса-2,8-диазаспиро[4.5]дек-2-ен. Указанный в заголовке продукт получали, следуя процедуре, описанной выше для получения соединения примера 3, но при этом использовали 5-(3-бром-фенил)-3-метил-[1,2,4]оксадиазол вместо 2 бром-6-метилпиридина. После обычной процедуры выделения продукта реакции неочищенный продукт очищали методом флэш-хроматографии в автоматизированном режиме (SP1TM - Biotage; элюируя градиентом петролейного эфира - этилацетата в соотношении от 95 : 5 до 6 : 4) и получали указанный в заголовке продукт в виде твердого вещества желтого цвета. Выход: 33,8%. MS: [М+Н]+ = 459.11 1H-NMR: 7.59 (m, 1H), 7.72-7.76 (m, 1H), 8.10-8.17 (m, 2H), 8.29-8.31 (m, 1H). Пример 19. 3-(3-Метилбут-1-инил)-8-(6-метил-3-нитро-2-пиридил)-1-окса-2.8-диаза-спиро[4.5]дек 2-ен. 3-Боом-8-(6-метил-3-нитоо-2-пиридил)-1-окса-2,8-диазаспиоо[4.5]дек-2-ен (соединение 19 а). Суспензию 6-метил-2-(4-метилен-1-пиперидил)-3-нитропиридина (соединение 3 а, 350 мг, 1,5 ммоль), карбоната натрия (1,26 г, 15 ммоль) и дибромформальдоксима (608 мг, 3 ммоль) в 25 мл этилацетата перемешивали при комнатной температуре в течение 2 дней. После этого реакционную смесь промывали водой, высушивали над сульфатом натрия и выпаривали до сухого состояния под вакуумом. Неочищенный продукт очищали методом флэш-хроматографии в автоматизированном режиме (SP1TM Biotage; элюируя градиентом петролейного эфира - этилацетата в соотношении от 9 : 1 до 6 : 4) и получали 377 мг указанного в заголовке продукта. Выход: 70,8%. MS: [M+H]+ = 356.41. 3-(3-Метилбут-1-инил)-8-(6-метил-3-нитоо-2-пиридил)-1-окса-2,8-диаза-спиро[4.5]дек-2-ен. Смесь соединения 19 а (50 мг, 0,141 ммоль), 3-метил-1-бутина (48 мг, 0,705 ммоль), карбоната натрия (74,6 мг, 0,704 ммоль) и Cu (44,8 мг, 0,705 ммоль) нагревали в герметичном сосуде при 120 С в течение 32 ч, добавляя через каждые 8 ч дополнительное равное количество 3-метил-1-бутина, карбоната натрия и Cu. После этого смесь охлаждали, добавляли в нее CH2Cl2, фильтровали на целите и выпаривали до сухого состояния под вакуумом. Остаток очищали методом флэш-хроматографии в автоматизированном режиме (SP1TM - Biotage; элюируя градиентом петролейного эфира - этилацетата в соотношении от 95 : 5 до 75 : 25 и далее изократическим элюированием смеси петролейного эфира - этилацетата в соотношении 9 : 1) и получали 16 мг указанного в заголовке продукта. Выход: 33,1%. MS: [M+H]+ = 343.20. 1H-NMR: (CDCl3, ): 1.26 (d, 6H, J=8 Hz), 1.86-2.05 (m, 4H), 2.49 (s, 3H), 2.73-2.81 (m, 1 Н), 2.86 (s,2H), 3.48-3.65 (m, 4H), 6.62 (d, J=8 Hz, 1H), 8.10 (d, J=8 Hz, 1H). Пример 20. 3-(Гекс-1-инил)-8-(6-метил-3-нитро-2-пиридил)-1-окса-2,8-диазаспиро[4.5]дек-2-ен. Указанный в заголовке продукт синтезировали с использованием способа, описанного для получения соединения примера 19, но заменив при этом 3-метил-1-бутин-гекс-1-ином. Остаток очищали методом флэш-хроматографии в автоматизированном режиме (SP1TM - Biotage; элюируя градиентом петролейного эфира - этилацетата в соотношении от 95 : 5 до 85 : 15) и получали 7,8 мг указанного в заголовке продукта. Выход: 27,9 %. MS: [M+H]+ = 357.27. 1H-NMR: (CDCl3, ): 0.95-0.99 (m, 3H), 1.26-1.65 (m, 4H), 1.86-2.03 (m, 4H), 2.38-2.45 (m, 2H), 2.48 (s,3H), 2.86 (s, 2H), 3.48-3.65 (m, 4H), 6.61 (d, J=8 Hz, 1H), 8.10 (d, 8 Hz, 1H). Пример 21. 3-(2-Цианофенилэтинил)-8-(6-метил-3-нитро-2-пиридил)-1-окса-2,8-диазаспиро[4.5]дек 2-ен. Указанный в заголовке продукт получали, следуя процедуре, описанной выше для получения соединения примера 3, но при этом использовали 2-бромбензонитрил вместо 2-бром-6-метилпиридина. После обычной процедуры выделения продукта реакции неочищенный продукт очищали методом флэшхроматографии в автоматизированном режиме (SP1TM - Biotage; элюируя градиентом петролейного эфира - этилацетата в соотношении от 9 : 1 до 4 : 6) и получали указанный в заголовке продукт в виде масла желтого цвета. Выход: 74,8%. MS: [M+H]+ = 402.08. 1H-NMR: (CDCl3, ): 1.90-2.11 (m, 4H), 2.49 (s, 3 Н), 3.06 (s, 2H), 3.50-3.70 (m, 4H), 6.63 (d, J=8 Hz,1H), 7.48-7.54 (m, 1H), 7.60-7.74 (m, 3 Н), 8.11 (d, J=8 Hz, 1H). Пример 22. 3-(3-Хлорфенилэтинил)-8-(3-ииано-2-пиразинил)1-окса-2,8-диазаспиро[4.5]дек-2-ен. 3-Триметилсилилэтинил-8-(t.бутоксикаобонил)-1-окса-2,8-диазаспиро[4.5]дек-2-ен (соединение 22 а). Указанное в заголовке соединение синтезировали в соответствии со способом, описанном для получения соединения 3 с, но при этом использовали 1-(1 бутоксикарбонил)-4-метиленпиперидин вместо соединения 3 а. После обычной процедуры выделения продукта реакции, неочищенный продукт очищали методом флэш-хроматографии в автоматизированном режиме (SP1TM - Biotage; элюируя градиентом петролейного эфира - этилацетата в соотношении от 95 : 5 до 6 : 4) и получали указанный в заголовке продукт в виде твердого вещества белого цвета. Выход: 43,3%. MS: [М+Н]+ = 337.13. 3-(3-Хлорфенилэтинил)-8-(t.бутоксикаобонил)-1-окса-2,8-диазаспиро[4.5]дек-2-ен(соединение 22b). Указанное в заголовке соединение синтезировали в соответствии со способом, описанном для получения соединения примера 3, замещая 2-бром-6-метилпиридин 1-хлор-3-йодбензолом и соединение 3 с соединением 22 а. После обычной процедуры выделения продукта реакции неочищенный продукт очищали методом флэш-хроматографии в автоматизированном режиме (SP1TM - Biotage; элюируя градиентом петролейного эфира - этилацетата в соотношении от 95 : 5 до 6 : 4) и получали указанный в заголовке продукт в виде твердого вещества белого цвета. Выход: 76,9%. MS: [М+Н]+ = 375.14. 3-(3-Хлорфенилэтинил)-1-окса-2,8-диазаспиро[4.5]дек-2-ен (соединение 22 с). Указанное в заголовке соединение синтезировали в соответствии со способом, описанном для получения соединения 1c, замещая соединение 1b соединением 22 с. Неочищенный остаток использовали без дальнейшей очистки в следующей реакции. Выход: 90,4%. MS: [М+Н]+ = 275,12. 3-(3-Хлорфенилэтинил)-8-(3-ииано-2-пиразинил)-1-окса-2,8-диазаспиоо[4.5]дек-2-ен. Указанное в заголовке соединение получали с использованием способа, описанного для получения соединения примера 1, но заменив при этом соединение 1 с соединением 22d и 2-хлор-6-метил-3 нитропиридин 2-хлор-3-цианопиразином. Получали густое масло коричневатого цвета. Выход: 83,3%. MS: [М+Н]+ = 378.14. 1H-NMR: (CDCl3, ): 1.90-2.00 (m, 2 Н), 2.10-2.15 (m, 2 Н), 2.99 (s, 2H), 3.65-3.78 (m, 2 Н), 4.20-4.27 (m,2 Н), 7.29-7.35 (m, 1 Н), 7.39-7.45 (m, 2 Н), 7.54 (s, 1H), 8.05 (s, 1H), 8.28 (s, 1H). Пример 23. 3-(2-Метилфенилэтинил)-8-(6-метил-3-нитро-2-пиридил)окса-2,8-диазаспиро[4.5]дек-2 ен. Указанное в заголовке соединение получали, следуя процедуре, описанной для получения соединения примера 3, но заменив при этом 2-бром-6-метилпиридин 2-бромтолуолом. После обычной процедуры выделения продукта реакции неочищенный продукт очищали методом флэш-хроматографии в автоматизированном режиме (SP1TM - Biotage; элюируя градиентом петролейного эфира - этилацетата в соотношении от 95 : 5 до 8 : 2) и получали указанный в заголовке продукт в виде твердого вещества желтого цвета. Выход: 29,6%. MS: [М+Н]+ = 391,09. 1J=8Hz, 1 Н), 7.18-7.34 (m, 3 Н), 7.48-7.52 (m, 1 Н), 8.11 (d, J=8 Hz, 1H). Пример 24. 3-(2-Хлорфенилэтинил)-8-(6-метил-3-нитро-2-пиридил)-1-окса-2,8-диазаспиро[4.5]дек 2-ен. Указанный в заголовке продукт получали, следуя процедуре, описанной выше для получения соединения примера 3, но при этом использовали 1-хлор-2-йодбензол вместо 2-бром-6-метилпиридина. После обычной процедуры выделения продукта реакции неочищенный продукт очищали методом флэшхроматографии в автоматизированном режиме (SP1TM - Biotage; элюируя градиентом петролейного эфира - этилацетата в соотношении от 95 : 5 до 7 : 3) и получали указанный в заголовке продукт в виде масла желтого цвета. Выход: 57,2%. MS: [М+Н]+ = 410,97. 1H-NMR: (CDCl3, ): 1.90-2.11 (m, 4H), 2.49 (s, 3 Н), 3.03 (s, 2H), 3.50-3.70 (m, 4H), 6.63 (d J=8 Hz,1H), 7.26-7.38 (m, 2H), 7.44-7.48 (m, 1 Н), 7.56-7.60 (m,1H), 8.11 (d, J=8 Hz, 1H). Пример 25. 3-(2-Пиразинилэтинил)-8-(6-метил-3-нитро-2-пиридил)-1-окса-2,8-диазаспиро[4.5]дек 2-ен. Указанное в заголовке соединение получали, следуя процедуре, описанной выше для получения соединения примера 3, но заменив при этом 2-бром-6-метилпиридин 2-йодпиразином. После обычной процедуры выделения продукта реакции неочищенный продукт очищали методом флэш-хроматографии в автоматизированном режиме (SP1TM - Biotage; элюируя градиентом петролейного эфира - этилацетата в соотношении от 8 : 2 до 3 : 7) и получали указанный в заголовке продукт в виде твердого вещества желтого цвета. Выход: 28,1%. MS: [M+H]+ = 379,22. 1H-NMR: (CDCl3, ): 1.93-2.11 (m, 4H), 2.51 (s, 3H), 3.03 (s, 2H), 3.51-3.71 (m, 4H), 6.64 (d J=8 Hz,1H), 8.12 (d, J=8 Hz, 1H), 8.60 (dd, J=16 Hz, 4 Hz, 2H), 8.80 (s, 1H). Пример 26. 3-Фенилэтинил-8-(6-метил-3-нитро-2-пиридил)-1-окса-8-азаспиро[4.5]дек-3-ен. 3-Гидрокси-3-фенилэтинил-8-этоксикаобонил-1-окса-8-азаспиро[4.51 декане (соединение 26 а). К раствору 82 мг (0,362 ммоль) этил 3-оксо-1-окса-8-азаспиро[4.5]декане-8-карбоксилата [Edwin S. С. Wu et al., J. Med.Chem., 1995, 38 (9), pp 1558-1570] в ТГФ (4 мл) добавляли по каплям 1 М раствор фенилэтинилмагний бромида в ТГФ (0,724 мл, 0,724 ммоль), перемешивания при комнатной температуре в атмосфере обезвоженного азота. Реакционную смесь перемешивали при комнатной температуре в течение 4 ч, далее при 60 С в течение 6 ч, затем реакционную смесь быстро охлаждали насыщенным водным раствором аммоний хлорида и экстрагировали этилацетатом. Комбинированные органические слои промывали рассолом, высушивали над сульфатом натрия и выпаривали до сухого состояния под вакуумом. Неочищенный продукт очищали методом флэш-хроматографии в автоматизированном режиме (SP1TM- Biotage; элюируя градиентом петролейного эфира - этилацетата в соотношении от 75 : 25 до 4 : 6) и получали указанный в заголовке продукт в виде твердого вещества желтого цвета. Выход: 87,2%. MS:[M+H]+ = 330,33. 3-Фенилэтинил-8-этоксикаобонил-1-окса-8-азаспиро[4.5]дек-3-ен (соединение 26b). К раствору соединения 26 а (93 мг, 0,282 ммоль), перемешиваемому в пиридине (4 мл) при 0 С, добавляли тионилхлорид (0,103 мл, 1,141 ммоль) и реакционную смесь перемешивали при 0 С до комнатной температуры в течение 2 ч. После этого смесь вливали в воду, подкисляли 1 М HCl и экстрагировали хлороформом. Органические слои комбинировали, промывали рассолом, высушивали над сульфатом натрия, выпаривали до сухого состояния и получали неочищенный продукт, который очищали методом флэш-хроматографии в автоматизированном режиме (SP1TM - Biotage; элюируя градиентом петролейного эфира - этилацетата в соотношении от 92 : 8 до 75 : 25) и получали 18 мг указанного в заголовке соединения. MS: [М+Н]+ = 312,34. 3-Фенилэтинил-1-окса-8-азаспиро[4.5]дек-3-ен (соединение 26 с). Смесь соединения 26b (25 мг, 0,803 ммоль), KOH (80 мг, 1,43 ммоль), воды (2 мл) и МеОН (4 мл) перемешивали при дефлегмировании в течение 2 ч. Затем смесь экстрагировали этилацетатом. Органи- 24023020 ческий слой промывали рассолом, высушивали над сульфатом натрия и выпаривали до сухого состояния под вакуумом. Неочищенный остаток (19,2 мг) использовали без какой-либо очистки на следующем этапе. MS: [М+Н]+ = 240,10. 3-Фенилэтинил-8-(6-метил-3-нитро-2-пиридил)-1-окса-8-азаспиро[4.5]дек-3-ен. Указанное в заголовке соединение получали с использованием способа, описанного для получения соединения примера 1, но заменив при этом соединение 1 с соединением 26 с. Неочищенный продукт очищали методом флэш-хроматографии в автоматизированном режиме (SP1TM - Biotage; элюируя градиентом петролейного эфира - этилацетата в соотношении от 98 : 2 до 9 : 1) и получали 8 мг указанного в заголовке соединения. Выход: 51%. MS: [М+Н]+ = 376,14. 1H-NMR: (CDCI3, ): 1.75-1.87 (m, 2 Н), 1.87-1.98 (m, 2 Н), 2.48 (s, 3 Н), 3.49 (ddd, J=13.39, 10.70,3.06 Hz, 2 H), 3.68 (dt, J=13.45, 4.16 Hz, 2 H), 4.76 (d, J=2.20 Hz, 2 H), 6.13 (t, J=2.20 Hz, 1 H), 6.58 (d,J=8.31 Hz, 1 H), 7.32-7.40 (m, 3 H), 7.43-7.50 (m, 2 H), 8.08 (d, J=8.07 Hz, 1 H). Пример 27. 3-(3-Хлорсренилэтинил)-7-(6-метил-3-нитро-2-пиридил)-1-окса-2,7-диазаспиро[4.4]нон 2-ен. 1-(t.бутоксикарбонил)-3-метилен-пирролидин (соединение 27 а). Указанное в заголовке соединение синтезировали с использованием способа, описанного выше, для получения соединения 2 а, но при этом использовали 1-(t.бутоксикарбонил)-3-пирролидинон вместо 1-(3 нитро-2-пиридил)-4-оксопиперидина. После обычной процедуры выделения продукта реакции неочищенный продукт очищали методом флэш-хроматографии в автоматизированном режиме (HorizonTM Biotage), элюируя градиентом петролейного эфира - этилацетата в соотношении от 95 : 5 до 7 : 3), и получали указанное в заголовке соединение в виде масла коричневатого цвета. Выход: 75,8%. MS: [M+H]+(соединение 27b). Указанное в заголовке соединение синтезировали с использованием способа, описанного выше, для получения соединения 3 с, но при этом использовали соединение 27 а вместо соединения 3 а. После обычной процедуры выделения продукта реакции неочищенный продукт очищали методом флэшхроматографии в автоматизированном режиме (HorizonTM - Biotage), элюируя градиентом петролейного эфира - этилацетата в соотношении от 95 : 5 до 75 : 25, и получали указанное в заголовке соединение. Выход: 82,9%. MS: [M+H]+ = 323,45. 3-(3-Хлорфенилэтинил)-7-(t.бутоксикарбонил)-1-окса-2,7-диазаспиро[4.4]нон-2-ен(соединение 27 с). Указанное в заголовке соединение получали, следуя процедуре, описанной для получения соединения примера 3, но при этом использовали 1-хлор-3-йодбензол вместо 2-бром-6-метилпиридина. После обычной процедуры выделения продукта реакции неочищенный продукт очищали методом флэшхроматографии в автоматизированном режиме (SP1TM - Biotage; элюируя градиентом петролейного эфира - этилацетата в соотношении от 95 : 5 до 6 : 4) и получали указанный в заголовке продукт в виде масла желтого цвета. Выход: 14%. MS: [М+Н]+ = 361,13. 3-(3-Хлорфенилэтинил)-1-окса-2,7-диазаспиро[4.4]нон-2-ен (соединение 27d). Указанное в заголовке соединение синтезировали с использованием способа, описанного выше, для получения соединения 1 с, но замещая соединение 1b соединением 27 с. неочищенный остаток использовали без дальнейшей очистки в следующей реакции. MS: [M+H]+ = 261,11. 3-(3-Хлорфенилэтинил)-7-(6-метил-3-нитро-2-пиридил)-1-окса-2,7-диазаспиро[4.4]нон-2-ен. Указанное в заголовке соединение получали с использованием способа, описанного для получения соединения примера 1, замещая соединение 1 с соединением 27d. Неочищенный продукт очищали методом флэш-хроматографии в автоматизированном режиме (SP1TM - Biotage; элюируя градиентом петролейного эфира - ацетона в соотношении от 95 : 5 к 9 : 1), и получали указанное в заголовке соединение в виде густого масла желтого цвета. Выход: 68,5%. 1H-NMR: (CDCl3, ): 2.13-2.25 (m, 1 Н), 2.46 (dd, J=12.84, 6.48 Hz, 1 Н), 2.52 (s, 3 Н), 3.17-3.34 (m, 2 Н),3.42 (d, J=12.47 Hz, 1 Н), 3.69 (t, J=9.78 Hz, 1H,) 3.82 (d, J=12.47 Hz, 1H), 3.98 (td, J=10.94, 6.97 Hz, 1H),6.61 (d, J=8.07 Hz, 1H), 7.30-7.36 (m, 1H,) 7.37-7.45 (m, 2 H), 7.53 (s, 1H), 8.07 (d, J=8.31 Hz, 1H). Пример 28. 3-(3-Хлорфенилэтинил)-7-(6-метил-3-нитро-2-пиридил)-1-окса-2,7-диазаспиро[4.3]окт 2-ен. 1-(t.бутоксикарбонил)-3-метиленазетидин (соединение 28 а). К суспензии метилтрифенилфосфоний бромида (1,56 г, 4,37 ммоль) в 30 мл Et2O, перемешиваемого при 0 С, добавляли трет-бутилат калия (0,459 г, 4,09 ммоль). Спустя 0,5 ч ледяную ванну удаляли, и смесь перемешивали в течение 1 ч при комнатной температуре. После этого смесь охлаждали в водяной ванне со льдом и добавляли 1-(t.бутоксикарбонил)-3-азетидинон (500 мг, 2,92 ммоль). Ледяную баню удаляли. После выдерживания в течение ночи реакционную смесь быстро охлаждали насыщенным раствором NH4Cl в воде, экстрагировали Et2O, высушивали над Na2SO4, выпаривали до сухого состояния под вакуумом. Остаточный неочищенный продукт очищали методом флэш-хроматографии в автомати- 25023020 зированном режиме (SP1TM - Biotage; элюируя градиентом петролейного эфира - ацетона в соотношении от 10 : 0 до 7 : 3) и получали указанное в заголовке соединение (426 мг) в виде густого бесцветного масла. Выход: 86,2%. MS: [M+H]+ = 170,45. 3-Триметилсилилэтинил-7-(t.бутоксикарбонил)-1-окса-2,7-диазаспиро[4.3]окт-2-ен(соединение 28b). Указанное в заголовке соединение синтезировали с использованием способа, описанного выше, для получения соединения 3 с, но при этом использовали соединение 28 а вместо соединения 3 а. После обычной процедуры выделения продукта реакции неочищенный продукт очищали методом флэшхроматографии в автоматизированном режиме (HorizonTM - Biotage), элюируя градиентом петролейного эфира - этилацетата в соотношении от 95 : 5 до 6 : 4, и получали указанное в заголовке соединение. Выход: 62%. MS: [М+Н]+ = 309,16. 3-(3-Хлорфенилэтинил)-7-(t.бутоксикарбонил)-1-окса-2,7-диазаспиро[4.3]окт-2-ен (соединение 28 с). Указанное в заголовке соединение получали, следуя процедуре, описанной для получения соединения примера 3, но при этом использовали 1-хлор-3-йодбензол вместо 2-бром-6-метилпиридина. После обычной процедуры выделения продукта реакции неочищенный продукт очищали методом флэшхроматографии в автоматизированном режиме (SP1TM - Biotage; элюируя градиентом петролейного эфира - этилацетата в соотношении от 8 : 2 до 65 : 35), и получали указанный в заголовке продукт в виде масла желтого цвета. Выход: 24,3%. MS: [M+H]+ = 347,09. 3-(3-Хлорфенилэтинил)-1-окса-2,7-диазаспиро[4.3]окт-2-ен (соединение 28d). Указанное в заголовке соединение синтезировали с использованием способа, описанного выше, для получения соединения 1 с, но заменив при этом соединение 1b соединением 28 с. Неочищенный остаток использовали без дальнейшей очистки на этапе следующей реакции. MS: [M+H]+ = 247,13. 3-(3-Хлорфенилэтинил)-7-(6-метил-3-нитро-2-пиридил)-1-окса-2,7-диазаспиро[4.3]окт-2-ен. Указанное в заголовке соединение получали с использованием способа, описанного для получения соединения примера 1, но заменив при этом соединение 1 с соединением 28d. Неочищенный продукт очищали методом флэш-хроматографии в автоматизированном режиме (SP1TM - Biotage; Петролейный эфир - дихлорметан в соотношении 1 : 9) и получали указанное в заголовке соединение в виде густого масла желтого цвета. Выход: 68,5%. MS: [M+H]+ = 383,08. 1(d, J=8.31 Hz, 1H), 7.33 (t, J=8.10 Hz, 1H), 7.42 (t, J=8.07 Hz, 2H),7.54 (s, 1H), 8.17 (d, J=8.31 Hz, 1H). Примеры 29 и 30. 4-Фенилэтинил-9-(6-метил-3-нитро-2-пиридил)-1-окса-9-азаспиро[5.5] ундек-4-ен и 4-фенилэтинил-9-(6-метил-3-нитро-2-пиридил)-1-окса-9-азаспиро[5,5]ундек-3-ен. 4-метилен-9-(t.бутоксикарбонил)-1-окса-9-азаспиро[5.5]ундекан (соединение 29 а). К раствору 1-Вос-пиперидона (2,39 г, 12 ммоль) и этокситриметилсилана (3,75 мл, 24 ммоль) в 80 мл CCl4 при перемешивании при 0 С добавляли триметилсилил трифторметилсульфонат (217 мкл, 1,2 ммоль) и триметил-(2-метилен-4-триметилсилилоксибутил)силан (Е. I. Marko et al., Journal of OrganicChemistry, 1992, 57, 2211-2213), растворенные в 23 мл CCl4. После перемешивания при 0-5 С в течение 6 ч и выдерживании в течение ночи при 0 С реакционную смесь промывали водой, высушивали надNa2SO4, фильтровали, и растворитель выпаривали до сухого состояния под вакуумом. Остаток в виде 6,5 г бесцветного масла очищали методом флэш-хроматографии в автоматизированном режиме (SP1TM Biotage; элюируя градиентом петролейного эфира - этилацетата в соотношении от 99:1 до 85:15) и получали 3,2 г указанного в заголовке соединения в виде бесцветного масла. Выход: 100%. MS: [M+H]+ = 268,62. 4-Оксо-9-(t.бутоксикаобонил)-1-окса-9-азаспиро[5.5]ундекан (соединение 29b). К раствору соединения 29 а (1,6 г, 5.99 ммоль) в смеси диоксан - вода (32,9 мл и 11 мл соответственно) при перемешивании при комнатной температуре добавляли 4% раствор осмия тетраоксида в воде(0,762 мкл, 0,125 ммоль). Спустя 2 ч, добавляли порциями измельченный метапериодат натрия (2,56 г, 12 ммоль) и получали суспензию, которая меняла свой цвет от коричневатого до светло-серого. Спустя 4 ч добавляли Н 2 О, экстрагировали этилацетатом, промывали Н 2 О, высушивали над Na2SO4 и выпаривали растворитель до сухого состояния. Остаток в виде полутвердого вещества коричневато-желтого цвета очищали методом флэш-хроматографии в автоматизированном режиме (SP1TM - Biotage; петролейный эфир - этилацетат в соотношении 7 : 3) и получали 0,96 г указанного в заголовке соединения в виде твердого вещества серого цвета. Выход: 59,5%. MS: [M+H]+ = 270,33. 4-Гидрокси-4-фенилэтинил-9-(t.бутоксикарбонил)-1-окса-9-азаспиро[5.5]ундекан (соединение 29 с). Указанное в заголовке соединение получали с использованием способа, описанного для получения соединения 26 а, замещая этил 3-оксо-1-окса-8-азаспиро[4,5]декан-8-карбоксилат соединением 29b. После обычной процедуры выделения продукта реакции маслянистый остаток очищали методом флэшхроматографии в автоматизированном режиме (SP1TM - Biotage; элюируя градиентом петролейного эфира - этилацетата в соотношении от 9 : 1 до 6:4) и получали 0,.96 г указанного в заголовке соединения в виде твердого вещества серого цвета. Выход: 57,3%. MS: [M+H]+ = 372,14. 4-Фенилэтинил-1-окса-9-азаспиро[5.5]ундек-3-ен и 4-фенилэтинил-1-окса-9-азаспиро[5.5]ундек-4- 26023020 ен (соединения 29d). Указанные в заголовке соединения получали с использованием способа, описанного для получения соединения 26 с, замещая соединение 26b соединением 29 с. После обычной процедуры выделения продукта реакции остаточное масло очищали методом флэш-хроматографии в автоматизированном режиме(SP1TM - Biotage; элюируя градиентом петролейного эфира - этилацетата в соотношении от 9: 1 до 8:2), и получали 0,49 г (33.6%) указанных в заголовке соединений в виде масла коричневатого цвета, используемого на следующем этапе без отделения. MS: [М+Н]+ = 254,17. 4-Фенилэтинил-9-(6-метил-3-нитро-2-пиридил)-1-окса-9-азаспиро[5.5]ундек-4-ен и 4-фенилэтинил 9-(6-метил-3-нитро-2-пиридил)-1-окса-9-азаспиро[5.5]ундек-3-ен. Указанные в заголовке соединения получали с использованием способа, описанного для получения соединения примера 1, но заменив при этом соединение 1 с соединением 29d Неочищенный продукт очищали методом флэш-хроматографии в автоматизированном режиме (SP1TM - Biotage; элюируя градиентом петролейного эфира - CH2Cl2 в соотношении 4 : 6 к 3 : 7) и получали 5 мг соединения примера 29 и 1 мг соединения примера 30. Пример 29. MS: [M+H]+ = 390,29. 1H-NMR: (CDCl3, ): 1.69-1.79 (m, 2H), 1.95 (d, J=13.20 Hz, 2H), 2.26 (d, J=1.96 Hz, 2H), 2.48 (s, 3H),3.36-3.50 (m, 2H), 3.58-3.70 (m, 2H), 4.30 (d, J=2.69 Hz, 2H), 6.20 (br. s., 1H), 6.58 (d, J=8.31 Hz, 1H), 7.317.41 (m, 3H), 7.45 (dd, J=6.60, 2.93 Hz, 2H), 8.08 (d, J=8.31 Hz, 1H). Пример 31. 3-(3-Хлорфенилэтинил)-1,9,12-триокса-2-азадиспиро[4.2.4,2]тетрадек-2-ен. 8-Метилен-1,4-диоксаспиро[4.51 декан (соединение 31 а). Указанное в заголовке соединение получали с использованием способа, описанного для получения соединения 2 а, но при этом использовали литий-бис-триметилсилиламид вместо бутиллития и проводили реакцию при -20 С. В качестве исходного материала 1,4-диоксаспиро[4.5]декан-8-он заменял 1-(3 нитро-2-пиридил)-4-оксопиперидин. После обычной процедуры выделения продукта реакции остаток очищали методом флэш-хроматографии в автоматизированном режиме (HorizonTM - Biotage; Петролейный эфир - этилацетат в соотношении 95 : 5) и получали указанное в заголовке соединение в виде жидкого бесцветного масла. Выход: 99,3%. MS: [М+Н]+= 155,13. 3-Триметилсилилэтинил-1,9,2-триокса-2-азадиспиро[4.2.4.2]тетоадек-2-ен (соединение 31b). Указанное в заголовке соединение синтезировали, используя способ, описанный для получения соединения 3 с, но при этом использовали соединение 31 а вместо соединения 3 а. После обычной процедуры выделения продукта реакции остаток очищали методом флэш-хроматографии в автоматизированном режиме (HorizonTM - Biotage; градиентное элюирование петролейным эфиром-этилацетатом в соотношении от 98 : 2 до 9 : 1) и получали указанное в заголовке соединение. 3-(3-Хлорфенилэтинил)-1,9,2-триокса-2-азадиспиро[4.2.4.2]тетрадек-2-ен. Указанное в заголовке соединение получали с использованием способа, описанного для получения соединения примера 3, но заменив при этом 2-бром-6-метилпиридин 1-хлор-3-йодбензолом. После обычной процедуры выделения продукта реакции, остаток очищали методом флэш-хроматографии в автоматизированном режиме (HorizonTM - Biotage; петролейный эфир - этилацетат в соотношении 85 : 15) и получали указанное в заголовке соединение в виде твердого вещества серого цвета. Выход: 80,1%. Альтернативная процедура. 1-Хлор-3-(3,3-диэтоксипроп-1-инил)бензол (соединение 31 с). Смесь 1-хлор-3-йодбензола (4 г, 16,8 ммоль), пропаргилальдегида диэтилацеталя (2,66 мл, 18,5 ммоль), бис(трифенилфосфин)палладий(II)дихлорида (295 мг, 0,42 ммоль), йодида меди (160 мг, 0,84 ммоль) и триэтиламина (60 мл) перемешивали при комнатной температуре в течение 3 ч. Спустя 4 ч, реакционную смесь быстро охлаждали Н 2 О и экстрагировали этилацетатом. Экстракты промывали рассолом, высушивали над Na2SO4 и выпаривали до сухого состояния под вакуумом. Остаток очищали методом флэш-хроматографии в автоматизированном режиме (HorizonTM - Biotage; петролейный эфир этилацетат в соотношении 97 : 3) и получали 4 г указанного в заголовке соединения в виде жидкого масла желтоватого цвета. Выход: 100%. MS: [M+H]+ = 239,32. 3-(3-Хлорфенил)проп-2-инал (соединение 31d). 38,8 мл воды и 7,7 мл трифторуксусной кислоты добавляли к раствору соединения 31 с (4 г, 16,7 ммоль) в CH2Cl2. Спустя 4 ч при постоянном перемешивании дополнительно добавляли 4 экв. трифторуксусной кислоты. Спустя 24 ч превращение завершалось, 2 слоя разделяли, органический слой промывали водой, высушивали над Na2SO4, выпаривали до сухого состояния под вакуумом и получали указанное в заголовке соединение в виде масла желто-коричневатого цвета, используемое на следующем этапе без дальнейшей очистки. MS: [М+Н]+ = 165,35. 3-(3-Хлорфенил)проп-2-иналоксим(соединение 31 е). Указанное в заголовке соединение получали с использованием способа, описанного для получения соединения 1 а, используя при этом соединение 31d вместо фенилпропаргилальдегида. Остаток слабокоричневого цвета использовали на следующем этапе без дальнейшей очистки. Выход: 96,4%. MS:[М+Н]+= 180,16. 3-(3-Хлорфенил)-N-гидрокси-проп-2-инимидоил хлорид (соединение 31 f). Указанное в заголовке соединение получали с использованием способа, описанного для получения соединения 3b, при этом использовали соединение 31 е вместо 3-триметилсилилпроп-2-инал оксима. Остаток слабо-коричневого цвета использовали на следующем этапе без дальнейшей очистки. Выход: 96,4%. 3-(3-Хлорфенилэтинил)-1.9,12-триокса-2-азадиспиро[4.2.4.2]тетрадек-2-ен. Указанное в заголовке соединение получали в соответствии с процедурой, описанной для получения соединения 3 с, используя соединение 31f вместо соединения 3b и соединение 31 а вместо соединения 3 а. После обычной процедуры выделения продукта реакции остаток очищали методом флэшхроматографии в автоматизированном режиме (HorizonTM - Biotage; элюируя градиентом петролейного эфира - ацетона в соотношении от 95 : 5 до 9 : 1) и получали указанное в заголовке соединение в виде твердого вещества серого цвета. Выход: 64,8%. MS: [М+Н]+ = 332.14. 1H-NMR: (CDCl3, ): 1.63-1.74 (m, 2 Н), 1.88 (dd, J=13.94, 2.45 Hz, 2 Н), 1.96-2.10 (m, 4 Н), 2.92 (s, 2 Н),3.92-4.05 (m, 4 Н), 7.32 (d, J=7.58 Hz, 1 Н), 7.35-7.44 (m, 2 Н), 7.52 (s, 1 Н). Пример 32. 3-(3-Хлорфенилэтинил)-8-оксо-1-окса-2-азаспиро[4.5]дек-2-ен. Раствор соединения примера 31 (0,76 г, 2,3 ммоль) в 5 мл трифторуксусной кислоты разбавляли водой (0,21 мл) и перемешивали при 0-4 С в течение 4 ч, подщелачивали 3N NaOH, экстрагировали этилацетатом, промывали водой, высушивали над Na2SO4, выпаривали до сухого состояния под вакуумом и получали указанное в заголовке соединение в виде масла желто-коричневатого цвета. Остаток очищали методом флэш-хроматографии в автоматизированном режиме (HorizonTM - Biotage; петролейный эфир- этилацетат в соотношении 8 : 2) и получали указанное в заголовке соединение в виде твердого вещества серого цвета. Выход: 53,8%. MS: [М+Н]+ = 288,14. 1H-NMR: (CDCl3, ): 1.99-2.10 (m, 2 Н), 2.28-2.44 (m, 4 Н), 2.78-2.90 (m, 2 Н), 3.03 (s, 2 Н), 7.33 (t,J=7.60 Hz, 1H), 7.38-7.46 (m, 2H), 7.53 (s, 1H). Пример 33. 3-(3-Хлорфенилэтинил)-8-метилен-1-окса-2-азаспиро[4.5]дек-2-ен. Указанное в заголовке соединение синтезировали, используя методологию, аналогичную методологии, описанной для получения соединения 31 а, однако начиная с соединения примера 32 вместо 1,4 диоксаспиро[4.5]декан-8-она. После обычной процедуры выделения продукта реакции остаток очищали методом флэш-хроматографии в автоматизированном режиме (HorizonTM - Biotage; элюируя градиентом петролейного эфира - ацетон этилацетата в соотношении от 95 : 5 до 9 : 1) и получали указанное в заголовке соединение в виде твердого вещества серого цвета. Выход: 67,3%. MS: [М+Н]+ = 286.14. 1H-NMR: (CDCl3, ): 1.64-1.78 (m, 2 Н) 1.93-2.06 (m, 2 Н), 2.16-2.25 (m, 2 Н), 2.50 (ddd, J=13.75, 9.60,4.52 Hz, 2 H), 2.93 (s, 2 H), 4.74 (s, 2 H), 7.29-7.34 (m, 1 H), 7.35-7.43 (m, 2 H), 7.47-7.57 (m, 1 H). Пример 34. 3-(3-Хлорфенилэтинил)-8-метоксиимино-1-окса-2-азаспиро[4,5]дек-2-ен. Смесь соединения примера 31 (80 мг, 0,28 ммоль), О-метил гидроксиламин гидрохлорида (30,2 г,0,361 ммоль), МеОН (12 мл) и триэтиламина (58 мкл, 0,42 ммоль) перемешивали при комнатной температуре в течение 12 ч. Реакционную смесь разбавляли Н 2 О, экстрагировали этилацетатом, промывали рассолом, высушивали над сульфатом натрия и выпаривали до сухого состояния под вакуумом. Остаток очищали методом флэш-хроматографии в автоматизированном режиме (HorizonTM - Biotage; градиентное элюирование петролейным эфиром-этилацетатом в соотношении от 9 : 1 до 8 : 2) и получали 56 мг указанного в заголовке соединения в виде масла желтого цвета. Выход: 63,6%. MS: [М+Н]+ = 317,18. 1[4.4]нон-2-ен. 3-[(6-Метил-2-пиридил)этинил]-7-(t.бутоксикарбонил)-1-окса-2,7-диазаспиоо[4.4]нон-2-ен (соединение 35 а). Указанное в заголовке соединение получали, следуя процедуре, описанной для получения соединения примера 3, но заменив при этом соединение 3 с соединением 27b. После обычной процедуры выделения продукта реакции неочищенный продукт очищали методом флэш-хроматографии в автоматизированном режиме (SP1TM - Biotage; элюируя градиентом петролейного эфира - этилацетата в соотношении от 75 : 25 до 40 : 60) и получали указанный в заголовке продукт в виде бесцветного масла. Выход: 66,2%. MS: [M+H]+ = 342,51. 3-[(6-Метил-2-пиридил)этинил]-1-окса-2,7-диазаспиоо[4.4]нон-2-ен (соединение 35b). Указанное в заголовке соединение синтезировали с использованием способа, описанного выше, для получения соединения 1 с, но замещая соединение 1b соединением 35 а и проводя реакцию в хлороформе. Неочищенный продукт в виде масляного остатка коричневатого цвета использовали без дальнейшей очистки на следующем этапе. Выход: 94,5%. MS: [M+H]+ = 242.33. 3-[(6-Метил-2-пиридил)этинил]-7-(6-метил-3-нитро-2-пиоидил)-1-окса-2,7-диазаспиоо[4.4]нон-2-ен. Указанное в заголовке соединение получали с использованием способа, описанного для получения соединения примера 1, но заменив при этом соединение 1 с соединением 35b. Неочищенный продукт очищали методом хроматографии с обращенной фазой в автоматизированном режиме (SP1TM - Biotage; градиент MeCN - Н 2 О в соотношении от 4 : 6 до 7 : 3), и получали указанное в заголовке соединение в виде твердого вещества желтого цвета. Выход: 41,5%. MS: [M+H]+ = 378,62. 1H-NMR: (CDCl3,): 2.17 (d, 1 Н), 2.43 (dd, 1 Н), 2.49 (s, 3 Н), 2.63 (s, 3 Н), 3.21-3.35 (m, 2 Н), 3.42 (d,1H), 3.63 (t, 1 Н), 3.79 (d, 1H), 3.97 (m, 1H), 6.59 (d, 1H), 7.22 (d, 1H), 7.41 (d, 1H), 7.65 (t, 1H), 8.05 (d, 1H). Пример 36. 3-Фенилэтинил-7-(6-метил-3-нитро-2-пиридил)-1-окса-2.7-диазаспиро[4.4]нон-2-ен. 3-Фенилэтинил-7-(t.бутоксикаобонил)-1-окса-2,7-диазаспиро[4.4]нон-2-ен (соединение 36 а). Указанное в заголовке соединение получали, следуя процедуре, описанной для получения соединения примера 3, но заменив при этом соединение 3 с соединением 27B и 2-бром-6-метилпиридин йодбензолом. После обычной процедуры выделения продукта реакции неочищенный продукт очищали методом флэш-хроматографии в автоматизированном режиме (SP1TM - Biotage; элюируя градиентом петролейного эфира - этилацетата в соотношении от 95 : 5 до 60 : 40), и получали указанный в заголовке продукт в виде бесцветного масла. Выход: 40,9%. MS: [M+H]+ = 327,35. 3-Фенилэтинил-1-окса-2,7-диазаспиро[4.4]нон-2-ен (соединение 36B). Указанное в заголовке соединение синтезировали с использованием способа, описанного выше, для получения соединения 1 с, замещая соединение 1B соединением 36 а и проводя реакцию в хлороформе. Неочищенный маслянистый остаток коричневатого цвета использовали без дальнейшей очистки на следующем этапе реакции. Выход: 91,3%. MS: [M+H]+ = 227,33. 3-Фенилэтинил-7-(6-метил-3-нитро-2-пиридил)-1-окса-2,7-диазаспирр[4.4]нон-2-ен. Указанное в заголовке соединение получали с использованием способа, описанного для получения соединения примера 1, но заменив при этом соединение 1 с соединением 36b. Неочищенный продукт очищали методом хроматографии в автоматизированном режиме (SP1TM - Biotage; элюируя градиентом петролейного эфира - этилацетата в соотношении от 95 : 5 до 70 : 30), и получали указанное в заголовке соединение в виде твердого вещества желтого цвета. Выход: 26,3%. MS: [M+H]+ = 363,44. 1H-NMR: (CDCl3, ): 2.12-2.23 (m, 1 Н), 2.39-2.53 (m, 1 Н), 2.49 (s, 3 Н), 3.18-3.32 (m, 2 Н), 3.40 (d, 1 Н),3.65 (dd, 1 Н), 3.78 (d, 1 Н), 3.96 (m, 1 Н), 6.59 (d, 1 Н), 7.34-7.46 (m, 3 Н), 7.54 (dd, 2 Н), 8.05 (d, 1 Н). Пример 37. 3-(3-Фторфенилэтинил)-7-(6-метил-3-нитро-2-пиридил)-1-окса-2,7-диазаспиро[4.4]нон 2-ен. 3-(3-Фторфенилэтинил)-7-(t.бутоксикарбонил)-1-окса-2,7-диазаспиро[4.4]нон-2-ен (соединение 37 а). Указанное в заголовке соединение получали, следуя процедуре, описанной для получения соединения примера 3, но заменив при этом соединение 27b соединением 3 с и 2-бром-6-метилпиридин 1-фтор-3 йодбензолом. После обычной процедуры выделения продукта реакции неочищенный продукт очищали методом флэш-хроматографии в автоматизированном режиме (SP1TM - Biotage; элюируя градиентом петролейного эфира - этилацетата в соотношении от 95 : 5 до 60 : 40), и получали указанный в заголовке продукт в виде бесцветного масла. Выход: 46,9%. MS: [M+H]+ = 345,40. 3-(3-Фторфенилэтинил)-1-окса-2,7-диазаспиро[4.4]нон-2-ен (соединение 37b). Указанное в заголовке соединение синтезировали с использованием способа, описанного выше, для получения соединения 1 с, но заменив при этом соединение 1b соединением 37 а и проводя реакцию в хлороформе. Неочищенный маслянистый остаток коричневатого цвета использовали без дальнейшей очистки на следующем этапе реакции. Выход: 91,8%. MS: [M+H]+ = 245.36. 3-(3-Фторфенилэтинил)-7-(6-метил-3-нитро-2-пиридил)-1-окса-2,7-диазаспиоо[4.4]нон-2-ен. Указанное в заголовке соединение получали с использованием способа, описанного для получения соединения примера 1, но заменив при этом соединение 1 с соединением 37b. Неочищенный продукт очищали методом хроматографии с обращенной фазой в автоматизированном режиме (SP1TM Biotage; градиент MeCN - буфер карбоната аммония в соотношении от 4: 6 до 7 : 3), и получали указанное в заголовке соединение в виде твердого вещества желтого цвета. Выход: 74,9%. MS: [M+H]+ = 381,54. 1H-NMR: (CDCl3, ): 2.13-2.25 (m, 1 Н), 2.45 (dd, 1 Н), 2.52 (s, 3 Н), 3.18-3.33 (m, 2 Н), 3.41 (d, 1 Н),3.64-3.73 (m, 1 Н), 3.81 (d, 1H), 3.98 (t, 1H), 6.61 (d, 1H), 7.10-7.17 (m, 1H) 7.21-7.27 (m, 1 Н), 7.30-7.40 (m,2 Н), 8.07 (d, 1H). Пример 38. 3-Фенилэтинил-7-(6-метил-3-нитро-2-пиридил)-1-окса-2,7-диазаспиро[4.3]окт-2-ен. 3-Фенилэтинил-7-(t.бутоксикаобонил)-1-окса-2,7-диазаспиро[4.3]окт-2-ен (соединение 38 а). Указанное в заголовке соединение получали, следуя процедуре, описанной для получения соединения примера 3, но заменив при этом соединение 3 с соединением 28b и 2-бром-6-метилпиридин 1 йодбензолом. После обычной процедуры выделения продукта реакции неочищенный продукт очищали методом флэш-хроматографии в автоматизированном режиме (SP1TM - Biotage; элюируя градиентом
МПК / Метки
МПК: C07D 491/10, A61P 13/02, A61K 31/438, C07D 498/10
Метки: mglu5, соединения, антагонистов, качестве, спирогетероциклические, применение
Код ссылки
<a href="https://eas.patents.su/30-23020-spirogeterociklicheskie-soedineniya-i-ih-primenenie-v-kachestve-antagonistov-mglu5.html" rel="bookmark" title="База патентов Евразийского Союза">Спирогетероциклические соединения и их применение в качестве антагонистов mglu5</a>












