Имидазотиадиазолы для применения в качестве ингибиторов киназ
Номер патента: 22753
Опубликовано: 29.02.2016
Авторы: Пастор-Фернандес Хоакин, Курс Гидо, Мартинес Гонсалес Соня
Формула / Реферат
1. Соединение формулы I
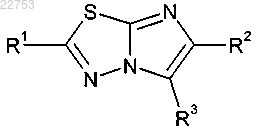
где R1 представляет собой:
(i) арил, замещенный одним или более заместителями, выбранными из А1; или
(ii) гетероарил, необязательно, замещенный одним или более заместителями, выбранными из А2;
R2 представляет собой водород или C1-3алкил, необязательно, замещенный одним или более атомами фтора;
R3 представляет собой арил или гетероарил, каждый из которых является, необязательно, замещенным одним или более заместителями, выбранными из А3 и А4 соответственно;
каждый А1, А2, А3 и А4, независимо, представляет собой:
(i) Q1;
(ii) C1-6алкил, замещенный одним или более заместителями, выбранными из Q2;
каждый Q1 и Q2, независимо, представляет собой
галоген, -CN, -NO2, -N(R10a)R11a, -OR10a, -C(=Y)-R10a, -C(=Y)-OR10a, -C(=Y)N(R10a)R11a, -N(R12a)C(=Y)R11a, -N(R12a)C(=Y)OR11a, -NR12aS(O)2R10a, -S(O)2N(R10a)R11a, -S(O)2R10a, -SR10a, -S(O)R10a или С1-12алкил, необязательно, замещенный одним или более заместителями, выбранными из =O и Е1;
каждый R10a, R11a и R12a, независимо, представляет собой водород или С1-12алкил, необязательно, замещенный одним или более заместителями, выбранными из =O и Е3;
или любые соответствующие два из R10a, R11a и R12a могут быть связаны вместе с образованием 4-8-членного кольца, необязательно, содержащего один или два дополнительных гетероатома, выбранных из кислорода, азота и серы, необязательно, содержащего одну или более двойных связей, и являющегося, необязательно, замещенным одним или более заместителями, выбранными из =O и Е5;
каждый Е1, Е3 и Е5, независимо, представляет собой:
(i) Q4 или
(ii) C1-6алкил, необязательно, замещенный одним или более заместителями, выбранными из =O и Q5;
каждый Q4 и Q5, независимо, представляет собой
галоген, -CN, -NO2, -N(R20)R21, -OR20, -C(=Y)-R20, -C(=Y)-OR20, -C(=Y)N(R20)R21, -N(R22)C(=Y)R21, -N(R22)C(=Y)OR21, -NR22S(O)2R20, -S(O)2N(R20)R21, -S(O)2R20, -SR20, -S(O)R20 или C1-6алкил, необязательно, замещенный одним или более заместителями, выбранными из фтора;
Y представляет собой =O;
каждый R20, R21 и R22, независимо, представляет собой водород или C1-3алкил, необязательно, замещенный одним или более заместителями, выбранными из J3 и =O;
или любые соответствующие два из R20, R21 и R22 могут быть связаны вместе с образованием 4-8-членного кольца, необязательно, содержащего дополнительный один или два гетероатома, выбранных из кислорода, азота и серы, необязательно, содержащего одну или более двойных связей, и являющегося, необязательно, замещенным одним или более заместителями, выбранными из J5 и =O;
каждый J3 и J5, независимо, представляет собой:
(i) Q7 или
(ii) C1-6алкил, необязательно, замещенный одним или более заместителями, выбранными из =O и Q8;
каждый Q7 и Q8, независимо, представляет собой
галоген, -N(R50)R51, -OR50 или С1-3алкил, необязательно, замещенный одним или более атомами фтора;
каждый R50 и R51, независимо, представляет собой водород или C1-6алкил, необязательно, замещенный одним или более заместителями, выбранными из фтора;
где арил означает моноциклические, бициклические или трициклические группы, которые имеют от 6 до 10 атомов углерода в кольце и в которых по меньшей мере одно кольцо является ароматическим;
гетероарил означает 5-10-членные ароматические моноциклические, бициклические или трициклические группы, содержащие один или более гетероатом(ов), например от одного до четырех гетероатомов, выбранных из N, О и S;
или фармацевтически приемлемый эфир, амид, сольват или их соль,
при условии, что если R2 представляет собой Н, тогда:
(I) если R1 представляет собой 4-хлорфенил, тогда R3 не представляют собой незамещенный фенил или 4-хлорфенил;
(II) если R1 представляет собой 4-метоксифенил, тогда R3 не представляют собой 4-хлорфенил или незамещенный фенил.
2. Соединение по п.1, где R1 представляет собой фенил, замещенный одним или более заместителями, выбранными из А1; и/или R1 представляет собой гетероарил, необязательно, замещенный одним или более заместителями, выбранными из А2.
3. Соединение по п.1 или 2, где ароматические группы, определенные при помощи R1 и/или R3, являются замещенными.
4. Соединение по любому из предшествующих пунктов, где R1 и/или R3 является замещенным одним или двумя заместителями, расположенными в пара- и/или мета-положении.
5. Соединение по любому из предшествующих пунктов, где А1, А2, А3 и А4, независимо, представляют собой Q1 или могут, альтернативно, представлять собой C1-6алкил, замещенный одним или более заместителями Q2 (и предпочтительно А1, А2, А3 и А4, независимо, представляют собой Q1); каждый Q1 и Q2, независимо, представляет собой -SR10a, -S(O)R10a, -NR12aS(O)2R10a, -C(=Y)-N(R10a)R11a, -S(O)2N(R10a)R11a, -N(R12a)C(=Y)R11a, галоген, -CN, -OR10a, -N(R10a)R11a, -C(=Y)OR10a, -S(O)2R10a или C1-6алкил, необязательно, замещенный одним или более атомами фтора (и предпочтительно Q1 представляет собой галоген (например, фтор), -CN, -OR10a, -N(R10a)R11a, -C(=Y)OR10a или -S(O)2R10a); Q2 представляет собой галоген, -NR12aS(O)2R10a, -C(=Y)OR10a или C1-6алкил, необязательно, замещенный одним или более атомами фтора; каждый R10a, R11a и R12a, независимо, представляет собой водород или С1-3алкил, необязательно, замещенный одним или более заместителями, выбранными из Е3 (предпочтительно каждый R10a, R11a и R12a, независимо, представляет собой водород или C1-3алкил, необязательно, замещенный одним или более заместителями, выбранными из Е3); или R10a и R11a могут быть связаны вместе с образованием 5- или предпочтительно 6-членного кольца, необязательно, содержащего один дополнительный гетероатом (причем кольца могут быть замещенными одним или более Е5 заместителями); R12a представляет собой С1-3алкил или водород; каждый Е1, Е3 и Е5, независимо, представляет собой C1-6алкил, необязательно, замещенный одним или более заместителями, выбранными из =O и Q5 (предпочтительно Е1, Е3 и Е5, независимо, представляют собой Q4); каждый Q4 и Q5, независимо, представляет собой галоген, -C(=Y)-OR20, -N(R20)R21, -C(=Y)N(R20)R21 или -N(R22)C(=Y)OR21 (предпочтительно Q4 представляет собой -N(R20)R21, -C(=Y)N(R20)R21 или -N(R22)C(=Y)OR21); каждый Y, независимо, представляет собой =O; R20 и R21, независимо, представляют собой водород или C1-3алкил; или R20 и R21, если присоединены к одному и тому же атому азота, то связаны вместе с образованием 5- или 6-членного кольца, необязательно, содержащего один дополнительный гетероатом; и/или R22 представляет собой водород.
6. Соединение по п.1, выбранное из числа следующих:
2-(3,4-диметоксифенил)-5-(3-фтор-4-метансульфонилфенил)-6-метилимидазо[2,1-b][1,3,4]тиадиазол,
5-[2-(3,4-диметоксифенил)-6-метилимидазо[2,1-b][1,3,4]тиадиазол-5-ил]пиридин-2-карбонитрил,
5-[2-(3,4-диметоксифенил)-6-метилимидазо[2,1-b][1,3,4]тиадиазол-5-ил]-3-трифторметилпиридин-2-иламин,
2-(3,4-диметоксифенил)-6-метил-5-пиридин-3-ил-имидазо[2,1-b][1,3,4]тиадиазол,
2-(3,4-диметоксифенил)-5-(6-метоксипиридин-3-ил)-6-метилимидазо[2,1-b][1,3,4]тиадиазол,
2,5-бис-(3,4-диметоксифенил)-6-метилимидазо[2,1-b][1,3,4]тиадиазол,
5-[2-(3,4-диметоксифенил)-6-метилимидазо[2,1-b][1,3,4]тиадиазол-5-ил]пиримидин-2-иламин,
5-[2-(3,4-диметоксифенил)-6-метилимидазо[2,1-b][1,3,4]тиадиазол-5-ил]пиридин-2-ол,
трет-бутил-2-(4-(5-(6-амино-5-(трифторметил)пиридин-3-ил)-6-метилимидазо-[2,1-b][1,3,4]тиадиазол-2-ил)-2-метоксифенокси)этилкарбамат,
2-(4-(5-(6-амино-5-(трифторметил)пиридин-3-ил)-6-метилимидазо[2,1-b][1,3,4]тиадиазол-2-ил)-2-метоксифенокси)-N,N-диметилацетамид,
5-(2-(4-(2-морфолиноэтокси)-3-метоксифенил)-6-метилимидазо[2,1-b][1,3,4]тиадиазол-5-ил)-3-(трифторметил)пиридин-2-амин,
2,5-бис-(3,4-диметоксифенил)имидазо[2,1-b][1,3,4]тиадиазол,
5-[2-(3,4-диметоксифенил)имидазо[2,1-b][1,3,4]тиадиазол-5-ил]пиридин-2-карбонитрил,
2-амино-5-[2-(3,4-диметоксифенил)имидазо[2,1-b][1,3,4]тиадиазол-5-ил]никотинонитрил,
трет-бутиловый эфир 4-{5-[2-(3,4-диметоксифенил)имидазо[2,1-b][1,3,4]тиадиазол-5-ил]пиримидин-2-ил}пиперазин-1-карбоновой кислоты,
2-(3,4-диметоксифенил)-5-(2-пиперазин-1-ил-пиримидин-5-ил)имидазо[2,1-b][1,3,4]тиадиазол,
2-(3,4-диметоксифенил)-5-[2-(4-метилпиперазин-1-ил)пиримидин-5-ил]имидазо[2,1-b][1,3,4]тиадиазол,
2-(3,4-диметоксифенил)-5-(6-пиперазин-1-ил-5-трифторметилпиридин-3-ил)имидазо[2,1-b][1,3,4]тиадиазол,
2-(3,4-диметоксифенил)-5-[6-(4-метилпиперазин-1-ил)-5-трифторметилпиридин-3-ил]имидазо[2,1-b][1,3,4]тиадиазол,
2-(3,4-диметоксифенил)-5-(2-метилсульфанилпиримидин-5-ил)имидазо[2,1-b][1,3,4]тиадиазол,
2-(3,4-диметоксифенил)-5-(2-метансульфинилпиримидин-5-ил)имидазо[2,1-b][1,3,4]тиадиазол,
N'-{5-[2-(3,4-диметоксифенил)имидазо[2,1-b][1,3,4]тиадиазол-5-ил]пиримидин-2-ил}-N,N-диметилэтан-1,2-диамин,
2-(3,4-диметоксифенил)-5-(5-метоксипиридин-3-ил)имидазо[2,1-b][1,3,4]тиадиазол,
5-[2-(3-метоксифенил)имидазо[2,1-b][1,3,4]тиадиазол-5-ил]-3-трифторметилпиридин-2-иламин,
3-[5-(6-амино-5-трифторметилпиридин-3-ил)имидазо[2,1-b][1,3,4]тиадиазол-2-ил]бензонитрил,
5-[2-(4-метоксифенил)имидазо[2,1-b][1,3,4]тиадиазол-5-ил]-3-трифторметилпиридин-2-иламин,
N-{3-[5-(6-амино-5-трифторметилпиридин-3-ил)имидазо[2,1-b][1,3,4]тиадиазол-2-ил]фенил}метансульфонамид,
5-(2-пиридин-3-ил-имидазо[2,1-b][1,3,4]тиадиазол-5-ил)-3-трифторметилпиридин-2-иламин,
4-[5-(6-амино-5-трифторметилпиридин-3-ил)имидазо[2,1-b][1,3,4]тиадиазол-2-ил]бензонитрил,
N-{3-[5-(6-амино-5-трифторметилпиридин-3-ил)имидазо[2,1-b][1,3,4]тиадиазол-2-ил]бензил}метансульфонамид,
3-[5-(6-амино-5-трифторметилпиридин-3-ил)имидазо[2,1-b][1,3,4]тиадиазол-2-ил]бензамид,
5-[2-(1-этил-1H-пиразол-4-ил)имидазо[2,1-b][1,3,4]тиадиазол-5-ил]-3-трифторметилпиридин-2-иламин,
5-[2-(4-метилпиридин-3-ил)имидазо[2,1-b][1,3,4]тиадиазол-5-ил]-3-трифторметилпиридин-2-иламин,
5-[2-(1Н-индол-5-ил)имидазо[2,1-b][1,3,4]тиадиазол-5-ил]-3-трифторметилпиридин-2-иламин,
5-[2-(3-метансульфонилфенил)имидазо[2,1-b][1,3,4]тиадиазол-5-ил]-3-трифторметилпиридин-2-иламин,
5-[2-(3-диметиламинофенил)имидазо[2,1-b][1,3,4]тиадиазол-5-ил]-3-трифторметилпиридин-2-иламин,
5-[2-(6-метилпиридин-3-ил)имидазо[2,1-b][1,3,4]тиадиазол-5-ил]-3-трифторметилпиридин-2-иламин,
5-{2-[4-(морфолин-4-сульфонил)фенил]имидазо[2,1-b][1,3,4]тиадиазол-5-ил}-3-трифторметилпиридин-2-иламин,
5-{2-[3-(морфолин-4-сульфонил)фенил]имидазо[2,1-b][1,3,4]тиадиазол-5-ил}-3-трифторметилпиридин-2-иламин,
N-{3-[5-(6-амино-5-трифторметилпиридин-3-ил)имидазо[2,1-b][1,3,4]тиадиазол-2-ил]фенил}ацетамид,
5-[2-(5-метоксипиридин-3-ил)имидазо[2,1-b][1,3,4]тиадиазол-5-ил]-3-трифторметилпиридин-2-иламин,
5-[5-(4-метансульфонилфенил)имидазо[2,1-b][1,3,4]тиадиазол-2-ил]-3-трифторметилпиридин-2-иламин,
5-[5-(6-фторпиридин-3-ил)имидазо[2,1-b][1,3,4]тиадиазол-2-ил]-3-трифторметилпиридин-2-иламин,
метиловый эфир 4-[2-(6-амино-5-трифторметилпиридин-3-ил)имидазо[2,1-b][1,3,4]тиадиазол-5-ил]-2-метоксибензойной кислоты
или их фармацевтически приемлемые эфиры, амиды, сольваты или соли.
7. Соединение, выбранное из числа следующих:
5-{2-[3-метокси-4-(пиперидин-4-илокси)фенил]имидазо[2,1-b][1,3,4]тиадиазол-5-ил}-3-трифторметилпиридин-2-иламин,
2-[3-метокси-4-(пиперидин-4-илокси)фенил]-5-(6-метоксипиридин-3-ил)имидазо[2,1-b][1,3,4]тиадиазол,
трет-бутиловый эфир 4-{4-[5-(2-аминопиримидин-5-ил)имидазо[2,1-b][1,3,4]тиадиазол-2-ил]-2-метоксифенокси}пиперидин-1-карбоновой кислоты,
5-{2-[3-метокси-4-(пиперидин-4-илокси)фенил]имидазо[2,1-b][1,3,4]тиадиазол-5-ил}пиримидин-2-иламин,
5-[2-(1'-(трет-бутоксикарбонил)-2-оксо-1,2-дигидроспиро[индол-3,4'-пиперидин]-5-ил)имидазо[2,1-b][1,3,4]тиадиазол-5-ил]-3-трифторметилпиридин-2-иламин,
5-[2-(2-оксо-1,2-дигидроспиро[индол-3,4'-пиперидин]-5-ил)имидазо[2,1-b][1,3,4]тиадиазол-5-ил]-3-трифторметилпиридин-2-иламин,
2,4-дифтор-N-[2-метокси-5-(5-пиридазин-4-ил-имидазо[2,1-b][1,3,4]тиадиазол-2-ил)пиридин-3-ил]бензолсульфонамид
или их фармацевтически приемлемые эфиры, амиды, сольваты или соли.
8. Применение соединения формулы I по любому из пп.1-5 или фармацевтически приемлемого эфира, амида, сольвата или их соли в качестве фармацевтического средства при лечении заболевания, при котором требуется и/или является желательным ингибирование PI3-K.
9. Фармацевтическая композиция для ингибирования PI3-киназы, включающая соединение формулы I, по любому из пп.1-5, или фармацевтически приемлемый эфир, амид, сольват или их соль, в смеси с фармацевтически приемлемым адъювантом, разбавителем или носителем.
10. Применение соединения формулы I по любому из пп.1-5, но без ограничений, или фармацевтически приемлемого эфира, амида, сольвата или их соли, для изготовления лекарственного средства для лечения рака.
11. Способ лечения рака, который включает введение терапевтически эффективного количества соединения формулы I по любому из пп.1-5, но без ограничений, или фармацевтически приемлемого эфира, амида, сольвата или их соли, пациенту, страдающему от такого состояния или чувствительному к такому состоянию.
12. Способ получения соединения формулы I по п.1, который включает
взаимодействие соответствующего соединения формулы II
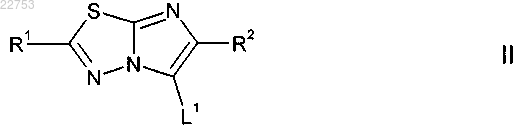
где L1 представляет собой подходящую уходящую группу; R1 и R2 определены в п.1,
с соединением формулы III
где L2 представляет собой подходящую группу; R3 является таким, как определено в п.1.
13. Способ получения соединения формулы I по п.1, который включает
взаимодействие соединения формулы IV
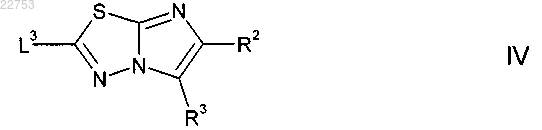
где L3 представляет собой подходящую уходящую группу; R2 и R3 определены в п.1,
с соединением формулы V
где L4 представляет собой подходящую уходящую группу.
14. Способ получения соединения формулы I по п.1, который включает для соединений формулы I, в которых присутствуют заместители Q1-Q6, в которых такие группы представляют собой -OR10a или -OR20, где это уместно, в которых R10a и R20 не представляют собой водород, взаимодействие соответствующего соединения формулы I, в котором присутствуют Q1-Q6, которые представляют собой -OR10a и -OR20 (где это уместно), в которых R10a и R20 представляют собой водород, с соединением формулы VI
где L5 представляет собой подходящую уходящую группу; Rx представляет собой R10a или R20 (где это уместно), при условии, что они не являются водородом.
15. Способ получения фармацевтической композиции по п.9, который включает взаимодействие соединения формулы I по любому из пп.1-5 или фармацевтически приемлемого эфира, амида, сольвата или их соли с фармацевтически приемлемым адъювантом, разбавителем или носителем.
Текст
ИМИДАЗОТИАДИАЗОЛЫ ДЛЯ ПРИМЕНЕНИЯ В КАЧЕСТВЕ ИНГИБИТОРОВ КИНАЗ Предложены соединения формулы I где R1, R2 и R3 имеют значения, данные в описании, и фармацевтически приемлемые эфиры,амиды, сольваты или их соли, которые являются пригодными для лечения заболеваний, при которых требуется и/или является желательным ингибирование протеинкиназ и липидных киназ (например,PI3-K, в частности класса I PI3K), и, в частности, для лечения рака.(71)(73) Заявитель и патентовладелец: ФУНДАСЬОН СЕНТРО НАСИОНАЛЬ ДЕ ИНВЕСТИГАСЬОНЕС ОНКОЛОХИКАС КАРЛОС III (ES) Область техники, к которой относится изобретение Изобретение относится к новым фармацевтически пригодным соединениям, которые находят применение в качестве ингибиторов протеинкиназ и липидных киназ (таких как ингибиторы семейства фосфоинозитид-3'ОН-киназ (PI3-киназ), в частности, подтипа класса I). Соединения являются потенциально применимыми в лечении болезней, таких как рак. Изобретение также относится к применению таких соединений в качестве медикаментов, к фармацевтическим композициям, содержащим их, и к синтетическим способам их получения. Предшествующий уровень техники Нарушение функционирования протеинкиназ (PKs) является отличительным признаком множества болезней. Большая часть онкогенов и протоонкогенов, включенных в разновидности рака человека, кодируют PKs. Повышенная активность PKs также связана со многими незлокачественными болезнями,такими как доброкачественная гиперплазия простаты, наследственный аденоматоз, полипоз, нейрофиброматоз, псориаз, пролиферация сосудистых клеток гладкой мускулатуры, связанная с атеросклерозом,легочный фиброз, артрит, гломерулонефрит и послеоперационный стеноз и рестеноз. PKs также вовлечены в воспалительные состояния и в размножение вирусов и паразитов. PKs могут также играть главную роль в патогенезе и развитии нейродегенеративных нарушений. В качестве общего обзора по нарушению функционирования или дисрегуляции PKs см., например,Current Opinion in Chemical Biology 1999, 3, 459-465. Фосфатилидинозит-3-киназы (PI3Ks) представляют собой семейство липидных и серин/треониновых киназ, которые катализируют фосфорилирование мембранного липида фосфатилидинозита (PI) по 3'-ОН инозитольного кольца с образованием фосфоинозитол-3-фосфата (PIP), фосфоинозитол-3,4-дифосфата (PIP2) и фосфоинозитол-3,4,5-трифосфата (PIP3), которые служат в качестве сайтов рекрутмента для различных внутриклеточных сигнальных белков, которые, в свою очередь, образуют сигнальные комплексы для передачи внешнеклеточных сигналов на цитоплазматическую поверхность плазматической мембраны. Эти 3'-фосфоинозитидные подтипы функционируют в качестве вторичных мессенджеров на внутриклеточных путях сигнальной трансдукции (см., например, Trends Biochem. Sci 22 87, 267-72 (1997) by Vanhaesebroeck et al.; Chem. Rev. 101 (8), 2365-80 (2001) by Leslie et al. (2001); Annu.et al.). Многочисленные изоформы PI3K, распределенные по категориям по их каталитическим субъединицам, их регуляции соответствующими регуляторными субъединицами, паттернам экспрессии и специфическим сигнальным функциям (p110, , , ) осуществляют эту ферментативную реакцию (Exp.Cell. Res. 25 (1). 239-54 (1999), Vanhaesebroeck и Katso et al., 2001, выше). Близкородственные изоформы p110 иявляются повсеместно эспрессированными, в то время какиявляются более специфично эспрессированными в клетках кроветворной системы, клетках гладкой мускулатуры, миоцитах и эндотелиальных клетках (см., например, Vanhaesebroeck et al., Trends Biochem.Sci. 22 (7), 267-72 (1997. Их экспрессия, необязательно, также регулируется при помощи индукции, в зависимости от типа клетки, ткани и раздражителя, также контекста болезни. Индуцибельность экспрессии белка включает синтез белка, а также стабилизацию белка, которая частично регулируется при помощи ассоциирования с регуляторными субъединицами. Восемь киназ PI3Ks млекопитающих были идентифицированы к настоящему времени, включая четыре PI3Ks класса I. Класс Ia включает PI3K, PI3K и PI3K. Все ферменты класса Ia представляют собой гетеродимерные комплексы, содержащие каталитическую субъединицу (р 110, р 110 или р 110),связанную с SH2-доменом, содержащим адаптерную субъединицу р 85. Киназы PI3Ks класса Ia активируются посредством тирозинкиназного сигнализирования и включаются в пролиферацию и выживание клеток. PI3K и PI3K вовлечены в онкогенез в множестве видов рака человека. Поэтому фармакологические ингибиторы PI3K и PI3K являются пригодными для лечения различных типов рака.PI3K, единственный член класса Ib PI3Ks, состоит из каталитической субъединицы р 110, которая ассоциирована с регуляторной субъединицей p110. PI3K регулируется рецепторами, связанными с Gбелками (GPCRs) посредством ассоциирования с -субъединицами гетеротримерных G-белков. PI3K эспрессируется первоначально в кроветворных клетках и кардиомиоцитах и включается в воспаление и в функционирование тучных клеток. Таким образом, фармакологические ингибиторы PI3K являются пригодными для лечения множества воспалительных заболеваний, аллергии и сердечно-сосудистых заболеваний. Эти наблюдения показывают, что дерегуляция фосфоинозитол-3-киназы, а также предыдущих и последующих по ходу компонентов этого сигнального пути является одной из наиболее обыкновенных дерегуляций, связанных с раком человека и пролиферативными заболеваниями (см., например, Parsons etal., Nature 436:792 (2005); Hennessey et al., Nature Rev. Drug Discovery 4: 988-1004 (2005. Перечисление или обсуждение очевидно ранее опубликованного документа в этом описании не следует обязательно считать признанием того, что этот документ является частью существующего уровня техники или содержит общеизвестные сведения. Международная патентная заявка WO 2007/064797 раскрывает различные соединения, которые могут быть пригодными для лечения рака. Однако в этом документе нет упоминания об имидазотиадиазолах. Патентные заявки США US 2007/0049591 и US 2007/0093490 и международная патентная заявкаWO 2004/058769 - все раскрывают различные соединения, которые могут быть пригодными в качестве ингибиторов киназы. Кроме того, международная патентная заявка WO 2007/0136736 раскрывает различные соединения, которые могут быть пригодными в качестве Lck-ингибиторов. Однако все эти документы только упоминают соединения, в которых циклическое ядро представляет собой 6,5-циклическую систему. Международная патентная заявка WO 2004/111060 раскрывает различные имидазотиадиазолы, которые могут быть пригодными для лечения нейродегенеративных болезней и рака. Однако этот документ, прежде всего, относится к 6-ариламещенным имидазо[2,1-b]-1,3,4-тиадиазолам, замещенным во 2 м положении тиа-мостиковой группой (или ее окисленным производным). Кроме того, международная патентная заявка WO 03/051890 также раскрывает различные имидазотиадиазолы, которые могут быть пригодными для лечения нейродегенеративных болезней и рака. Однако этот документ, прежде всего,относится к 6-ариламещенным имидазо[2,1-b]-1,3,4-тиадиазолам, замещенным в положении 2 сульфамидной группой. Статья в журнале: Terzioglu et al., European Journal of Medicinal Chemistry (2003), 38(7-8), 781-786 раскрывает различные соединения, которые могут быть пригодными для лечения рака. Однако этот документ раскрывает только соединения, которые содержат карбогидразидный фрагмент. Статья итальянских авторов Andreani et al., в журнале Arzneimittel-Forschung (2000), 50(6), 550-553 раскрывает различные соединения, включая отдельные имидазотиадиазолы. Однако в этой журнальной статье нет упоминания о том, что соединения, раскрытые в ней, могут быть пригодными в качестве ингибиторов протеинкиназ. Международная патентная заявка WO 97/11075 раскрывает различные имидазотиадиазольные соединения в качестве гербицидов. Однако там нет раскрытия того факта, что такие соединения могут быть пригодными в качестве лекарственных препаратов, например, в лечении рака. Европейская патентная заявка ЕР 662477 и статья Joshi et al. в журнале Journal of Indian ChemicalSociety (1979), 56(7), 716-17, обе, раскрывают различные гетероциклические соединения, включая отдельные имидазолотиазольные соединения, которые могут быть активными в качестве фунгицидов. Однако ни в одном из этих документов нет раскрытия того, что соединения раскрытые в них, могут быть пригодными в качестве ингибиторов протеинкиназ. Итальянская журнальная статья Abignente et al. в Farmaco, Edizione Scientifica (1985), 40(3), 190-9 и Европейская патентная заявка ЕР 41215 - обе раскрывают различные имидазотиадиазолы, которые могли быть протестированы на медицинские свойства в целях исследования. Различные имидазотиадиазолы также были раскрыты в Journal of Indian Chemical Society (1982),59(10), 1170-3 в качестве потенциальных фунгицидов и/или бактерицидов. Международная патентная заявка WO 2009/040552 раскрывает различные имидазотиазольные соединения для применения в качестве ингибиторов киназ. Однако этот документ не относится преимущественно к имидазотиадиазолам, непосредственно замещенным ароматической группой в положениях 2 и 5. Сущность изобретения Согласно изобретению предложено соединение формулы I(i) арил, замещенный одним или более заместителями, выбранными из А 1;(ii) гетероарил, необязательно, замещенный одним или более заместителями, выбранными из А 2;R2 представляет собой водород или C1-3 алкил, необязательно, замещенный одним или более атомами фтора;R3 представляет собой арил или гетероарил, каждый из которых является, необязательно, замещенным одним или более заместителями, выбранными из А 3 и А 4 соответственно; каждый из А 1, А 2, А 3 и А 4, независимо, представляет собой в каждом случае при использовании в данном контексте:(ii) C1-6 алкил, замещенный одним или более заместителями, выбранными из Q2; каждый Q1 и Q2, независимо, представляет собой в каждом случае при использовании в данном контексте: галоген, -CN, -NO2, -N(R10a)R11a, -OR10a, -C(=Y)-R10a, -C(=Y)-OR10a, -C(=Y)N(R10a)R11a,12a-2 022753 С 1-12 алкил (необязательно, замещенный одним или более заместителями, выбранными из =O и Е 1); каждый R10a, R11a и R12a, независимо, представляет собой, в каждом случае при использовании в данном контексте, водород или С 1-12 алкил (необязательно замещенный одним или более заместителями,выбранными из =O и Е 3); или любые соответствующие два R10a, R11a и R12a могут (например, при присоединении к одному и тому же атому, соседним атомам (т.е. 1,2-расположение) или к атомам, которые отстоят друг от друга на два атома, т.е. 1,3-расположение) быть соединены связью с образованием (например, с учетом имеющегося атома азота, к которому они могут быть присоединены) 4-8-членного кольца, необязательно, содержащего один или два дополнительных гетероатома (например, в дополнение к тем, которые могут заранее присутствовать, например, (а) гетероатому(ам), выбранным из кислорода, азота и серы), необязательно,содержащего одну или более двойных связей, и, необязательно, замещенного одним или более заместителями, выбранными из =O и Е 5; каждый Е 1, Е 3 и Е 5, независимо, представляет собой, в каждом случае при использовании в данном контексте:(ii) C1-6 алкил, необязательно, замещенный одним или более заместителями, выбранными из =O иQ5; каждый Q4 и Q5, независимо, представляет собой, в каждом случае при использовании в данном контексте: галоген, -CN, -NO2, -N(R20)R21, -OR20, -C(=Y)-R20, -C(=Y)-OR20, -C(=Y)N(R20)R21, -N(R22)C(=Y)R21,22-N(R )C(=Y)OR21, -NR22S(O)2R20, -S(O)2N(R20)R21, -S(O)2R20, -SR20, -S(O)R20 или C1-6 алкил (необязательно, замещенный одним или более заместителями, выбранными из фтора);Y представляет собой =O; каждый R20, R21 и R22, независимо, представляет собой, в каждом случае при использовании в данном контексте, водород или С 1-3 алкил (необязательно, замещенный одним или более заместителями, выбранными из J3 и =O); или любые соответствующие два R20, R21 и R22 могут (например, при присоединении к одному и тому же атому, соседним атомам (т.е. 1,2-расположение) или к атомам, которые отстоят друг от друга на два атома, т.е. 1,3-расположение) быть соединены связью с образованием (например, с учетом имеющегося атома азота, к которому они могут быть присоединены) 4-8-членного кольца, необязательно, содержащего дополнительный один или два гетероатома (например, в дополнение к тем, которые могут заранее присутствовать, например, (а) гетероатому(ам), выбранным из кислорода, азота и серы), необязательно,содержащего одну или более двойных связей, и, необязательно, замещенного одним или более заместителями, выбранными из J5 и =O; каждый J3 и J5, независимо, представляет собой, в каждом случае при использовании в данном контексте:(ii) C1-6 алкил, необязательно, замещенный одним или более заместителями, выбранными из =O иQ8; каждый Q7 и Q8, независимо, представляет собой, в каждом случае при использовании в данном контексте: более предпочтительно галоген, -N(R50)R51, -OR50 или С 1-3 алкил, необязательно, замещенный одним или более атомами фтора; каждый R50 и R51, независимо, представляет собой, в каждом случае при использовании в данном контексте, водород или C1-6 алкил, необязательно, замещенный одним или более заместителями, выбранными из фтора; или фармацевтически приемлемый эфир, амид, сольват или их соль,при условии, что если R2 представляет собой Н, тогда:(I) если R1 представляет собой 4-хлорфенил, тогда R3 не представляет собой незамещенный фенил или 4-хлорфенил;(II) если R1 представляет собой 4-метоксифенил, тогда R3 не представляет собой 4-хлорфенил или незамещенный фенил,причем соединения, эфиры, амиды, сольваты и соли здесь и далее именуются как "соединения по изобретению". Фармацевтически приемлемые соли включают соли присоединения кислоты и соли присоединения основания. Такие соли могут быть образованы с помощью обычных способов, например, при реакции свободной кислотной или свободной основной формы соединения формулы I с одним или более эквивалентами соответствующей кислоты или основания, необязательно, в растворителе, или в среде, в которой соль является нерастворимой, с последующим удалением указанного растворителя или указанной среды с использованием стандартных методик (например, в вакууме, при помощи лиофильной сушки или путем фильтрации). Соли могут также быть получены путем обмена противоиона соединений по изобретению в форме соли на другой противоион, например, с использованием подходящей ионообменной смо-3 022753 лы. В "фармацевтически приемлемые эфир, амид, сольват или их соль" авторы включают соли, такие как соли эфира или амида, и сольваты, такие как сольваты эфира, амида или соли. Например, фармацевтически приемлемые эфиры и амиды, такие как те, что определены здесь, могут упоминаться так же, как фармацевтически приемлемые сольваты или соли. Фармацевтически приемлемые эфиры и амиды соединений по изобретению также включены в объем изобретения. Фармацевтически приемлемые эфиры и амиды соединений формулы I могут иметь соответствующую группу, например, кислотную группу, превращенную в соответствующей эфир или амид. Например, фармацевтически приемлемые эфиры (карбоновых кислот), которые могут быть упомянуты, включают, необязательно, замещенные C1-6 алкиловые, С 5-10 ариловые и/или C5-10 арил-C1-6 алкиловые эфиры. Фармацевтически приемлемые амиды (карбоновых кислот), которые могут быть упомянуты,включают амиды формулы -C(O)N(Rz1)Rz2, в которой Rz1 и Rz2, независимо, представляют собой, необязательно, замещенный C1-6 алкил, С 5-10 арил, или С 5-10 арил-C1-6 алкилен. Предпочтительно C1-6 алкильные группы, которые могут быть упомянуты в контексте таких фармацевтически приемлемых эфиров и амидов, являются нециклическими, например линейными и/или разветвленными. Предпочтительно отдельные эфиры и амиды соединений по изобретению, которые могут быть упомянуты, включают эфиры и амиды соединений по изобретению. Следующие соединения по изобретению, которые могут быть упомянуты, включают карбаматные,карбоксамидные или уреидные производные, например, такие производные существующих аминофункциональных групп. Для целей этого изобретения поэтому пролекарства соединений по изобретению также включены в объем изобретения. Термин "пролекарство" соответствующего соединения по изобретению включает любое соединение, которое, после перорального или парентерального введения, метаболизируется in vivo с образованием этого соединения в экспериментально детектируемом количестве и в течение заданного времени (например, в течение интервала дозирования между 6 и 24 ч (т.е. от одного до четырех раз в сутки. Во избежание сомнения термин "парентеральное" введение включает все формы введения, иные, чем пероральное введение. Пролекарства соединений по изобретению могут быть получены при помощи модификации функциональных групп, присутствующих в соединении, таким образом, что продукты модификации расщепляются in vivo, когда такое пролекарство вводят млекопитающему субъекту. Модификации обычно осуществляют при помощи синтеза материнского соединения с пролекарственным заместителем. Пролекарства включают соединения по изобретению, где гидроксильная, амино, сульфгидрильная, карбоксильная или карбонильная группа в соединении по изобретению связана с любой группой, которая может быть отщеплена in vivo с регенерацией свободной гидроксильной, амино, сульфгидрильной, карбоксильной или карбонильной группы соответственно. Примеры пролекарств включают (но не ограничиваются ими) эфиры и карбаматы гидроксифункциональных групп, эфирные группы карбоксильных функциональных групп, N-ацильные производные иN-основания Манниха. Общую информацию по пролекарствам можно найти, например, в Bundegaard, H."Design Prodrugs", p. 1-92, Elesevier, New York-Oxford (1985). Соединения по изобретению могут содержать двойные связи и могут, таким образом, существовать в виде геометрических изомеров Е (entgegeri) и Z (zusammen) вокруг каждой отдельной двойной связи. Изомеры положения могут также быть охвачены соединениями по изобретению. Все такие изомеры (например, если соединение по изобретению включает двойную связь или конденсированное кольцо, то cisи трансформы охвачены) и их смеси включены в объем изобретения (например, отдельные изомеры положения и смеси изомеров положения могут быть включены в объем изобретения). Соединения по изобретению могут также проявлять таутомерию. Все таутомерные формы (или таутомеры) и их смеси включены в объем изобретения. Термин "таутомер" или "таутомерная форма" относится к структурным изомерам различных энергий, которые взаимопревращаются, преодолевая низкий энергетический барьер. Например, протонные таутомеры (также известные как прототропные таутомеры) включают взаимопревращения посредством миграции протона, такой как кето-енольная и иминенаминная изомеризация. Валентные таутомеры включают взаимопревращения при помощи реорганизации каких-либо связывающих электронов. Соединения по изобретению могут также содержать один или более асимметричных атомов углерода и могут, поэтому, проявлять оптическую и/или диастереомерию. Диастереомеры могут быть разделены с использованием обычных методик, например, хроматографии или фракционной кристаллизации. Различные стереоизомеры могут быть выделены при помощи разделения рацемической или иной смеси соединений с использованием обычных методик, например, фракционной кристаллизации или ВЭЖХ. Альтернативно, желаемые оптические изомеры могут быть получены с помощью реакции соответствующих оптически активных исходных материалов в условиях, которые не вызовут рацемизацию или эпимеризацию (т.е. способ "хирального пула"), при помощи реакции соответствующего исходного материала с хиральным вспомогательным элементом, который может впоследствии быть удален на подходя-4 022753 щей стадии, с помощью дериватизации (т.е. разрешения, включая динамическое разрешение), например,гомохиральной кислотой с последующим разделением диастереомерных производных обычными способами, такими как хроматография, или с помощью реакции с соответствующим хиральным реагентом или хиральным катализатором, все при условиях, известных квалифицированному лицу. Все стереоизомеры (включая (но не ограничиваясь ими) диастереомеры, энантиомеры и атропоизомеры) и их смеси (например, рацемические смеси) включены в объем изобретения. Если в структурах, показанных здесь, стереохимия любого конкретного хирального атома не указана, тогда все стереоизомеры имеются в виду и включены в качестве соединений по изобретению. Если стереохимия указана с помощью клина или пунктирной линии, представляющих конкретную конфигурацию, тогда этот стереоизомер является установленным и определенным. Соединения настоящего изобретения могут существовать в несольватированной, а также сольватированной формах с фармацевтически приемлемыми растворителями, такими как вода, этанол и т.п., и подразумевается, что изобретение охватывает обе формы: сольватированную и несольватированную. Настоящее изобретение также охватывает изотопно-меченые соединения настоящего изобретения,которые являются идентичными перечисленным здесь, за исключением того факта, что один или более атомов замещены атомом, имеющим атомную массу или массовое число, отличное от атомной массы или массового числа, обычно встречающихся в природе (или наиболее широко распространенного в природе). Все изотопы любого конкретного атома или элемента, указанного здесь, предусмотрены в объеме соединений по изобретению. Примеры изотопов, которые могут входить в состав соединения по изобретению, включают изотопы водорода, углерода, азота, кислорода, фосфора, серы, фтора, хлора и йода,такие как 2 Н, 3 Н, 11 С, 13 С, 14 С, 13N, 15O, 17O, 18O, 32P, 33P, 35S, 18F, 36Cl, 123I и 125I. Отдельные изотопномеченые соединения настоящего изобретения (например, меченые Н и 14 С) являются пригодными в соединении и для анализа распределения субстрата в ткани. Изотопы трития (3 Н) и углерода-14 (14 С) являются пригодными из-за простоты их получения и детектируемости. Кроме того, замещение более тяжелыми изотопами, такими как дейтерий (т.е. 2 Н) может предоставить отдельные терапевтические преимущества, проистекающие из их более высокой метаболической стабильности (например, увеличение периода полувыведения in vivo или снижение дозировочных требований) и, следовательно, могут быть предпочтительными в некоторых обстоятельствах. Изотопы, испускающие позитроны, такие как 15 О, 13N,11 С и F, являются пригодными для исследований методом позитронно-эмиссионной томографии (ПЭТ) при изучении местонахождения рецептора субстрата. Изотопно-меченые соединения настоящего изобретения обычно могут быть получены с помощью ниже следующих процедур, аналогичных тем, которые раскрыты в схеме 1 и/или в примерах здесь ниже, при помощи замещения изотопно-меченым реагентом не-изотопно-меченого реагента. Если не заявлено иное, термины C1-q-алкильная и C1-q-алкиленовая группы (где q составляет верхнюю границу диапазона), определенные здесь, могут быть линейными или, когда имеется достаточное число атомов углерода, разветвленными, насыщенными или ненасыщенными (таким образом, образующими, например, алкенильную или алкинильную группу). С 3-q-циклоалкильные группы (где q является верхней границей диапазона) которые могут быть упомянуты, могут представлять собой моноциклические или бициклические алкильные группы, причем циклоалкильные группы могут, кроме того, быть мостиковыми (с образованием, например, конденсированных циклических систем, таких, как три конденсированные циклоалкильные группы). Такие циклоалкильные группы могут быть насыщенными или ненасыщенными, содержащими одну или более двойных или тройных связей (образующими например, циклоалкенильную или циклоалкинильную группу). Заместители могут быть присоединены к любому месту циклоалкильной группы. Кроме того, там, где имеется достаточное число (т.е. минимум четыре) такие циклоалкильные группы могут также быть частично циклическими. Во избежание сомнения, возможные заместители могут также быть иными циклическими группами, которые могут быть присоединены посредством одного углеродного атома, общего для обоих колец, с образованием спироцикла. Термин "галоген", при использовании в данном контексте, включает фтор, хлор, бром и йод. Гетероциклоалкильные группы, которые могут быть упомянуты, включают неароматические моноциклические и бициклические гетероциклоалкильные группы, в которых по меньшей мере один (например, от одного до четырех) из атомов в циклической системе является иным, чем углерод (т.е. гетероатомом) и в которых общее число атомов в циклической системе составляет между пятью и десятью. Такие гетероциклоалкильные группы могут также быть мостиковыми. Кроме того, такие гетероциклоалкильные группы могут быть насыщенными или ненасыщенными, содержащим одну или более двойных и/или тройных связей, образующими, например, С 2-q-гетероциклоалкенильную (где q является верхней границей диапазона) или C7-q-гетероциклоалкинильную группу. С 2-q-гетероциклоалкильные группы, которые могут быть упомянуты, включают 7-азабицикло[2,2,1]гептанил, 6-азабицикло[3,1,1]гептанил, 6 азабицикло[3,2,1]октанил, 8-азабицикло[3,2,1]октанил, азиридинил, азетидинил, дигидропиранил, дигидропиридил, дигидропирролил (включая 2,5-дигидропирролил), диоксоланил (включая 1,3-диоксоланил),диоксанил (включая 1,3-диоксанил и 1,4-диоксанил), дитианил (включая 1,4-дитианил), дитиоланил 6-оксабицикло[3,2,1]октанил, оксетанил, оксиранил, пиперазинил, пиперидинил, пиранил, пиразолидинил, пирролидинонил, пирролидинил, пирролинил, хинуклидинил, сульфоланил, 3-сульфоленил, тетрагидропиранил, тетрагидрофуранил, тетрагидропиридил (такой как 1,2,3,4-тетрагидропиридил и 1,2,3,6 тетрагидропиридил), тиетанил, тииранил, тиоланил, тиоморфолинил, тритианил (включая 1,3,5 тритианил), тропанил и т.п. Заместители в гетероциклоалкильных группах могут, когда это уместно, находиться при любом атоме в циклической системе, включая гетероатом. Местом присоединения гетероциклоалкильных групп может быть любой атом в циклической системе, включая (где это уместно) гетероатом (такой как атом азота), или атом любого конденсированного карбоциклического кольца, которое может присутствовать в качестве части циклической системы. Гетероциклоалкильные группы могут также находиться в N-или S- окисленной форме (т.е. эти гетероатомы могут быть замещенными одним или двумя заместителями =O, где это уместно). Как указано здесь, другие атомы углерода гетероциклоалкильных групп, упомянутых здесь, могут также быть замещенными одним или более =O заместителями. Во избежание сомнения, необязательными заместителями могут также быть другие циклические группы, которые могут быть присоединены посредством одного атома углерода, общего для обоих колец(с образованием тем самым спироцикла). Во избежание сомнения, термин "бициклические" (например, при использовании в контексте гетероциклоалкильных групп) относится к группам, в которых второе кольцо бициклической системы образовано с участием двух соседних атомов первого кольца. Термин "мостиковые" (например, при использовании в контексте циклоалкильных или гетероциклоалкильных групп) относится к моноциклическим или бициклическим группам, в которых два несоседних атома связаны либо алкиленовой, либо гетероалкиленовой цепью (где это уместно). Арильные группы, которые могут быть упомянуты, включают С 6-10 арильные группы. Такие группы могут быть моноциклическими, бициклическими или трициклическими и иметь от 6 до 10 атомов углерода в кольце, при этом по меньшей мере одно кольцо является ароматическим. С 6-10 арильные группы включают фенил, нафтил и т.п., такой как 1,2,3,4-тетрагидронафтил. Местом присоединения арильных групп может быть любой атом циклической системы. Однако когда арильные группы являются бициклическими или трициклическими, они связаны с остальной частью молекулы через ароматическое кольцо. Во избежание сомнения, необязательные заместители включают те, которые определены здесь, и также включают заместители =O, которые могут быть присоединены к любым неароматическим кольцам полициклической (например, бициклической) арильной группы (однако, в воплощение заместители =O не включены). Во избежание сомнения, необязательными заместителями могут также быть другие циклические группы, которые, будучи присоединены к неароматическому кольцу арильной группы, могут быть присоединены посредством одного атома углерода, общего для обоих колец (с образованием, тем самым,спироцикла). Если не оговорено иное, термин "гетероарил" при использовании в данном контексте относится к ароматической группе, содержащей один или более гетероатом(ов) (например, от одного до четырех гетероатомов), предпочтительно выбранных из N, О и S. Гетероарильные группы включают те, которые имеют от 5 до 10 членов и могут быть моноциклическими, бициклическими или трициклическими, при условии, что по меньшей мере одно из колец является ароматическим (с образованием, тем самым, например, моно-, би- или трициклической гетероароматической группы). Однако когда гетероарильные группы являются бициклическими или трициклическими, они связаны с остальной частью молекулы через ароматическое кольцо. Гетероарильные группы, которые могут быть упомянуты, включают акридинил, бензимидазолил, бензодиоксанил, бензодиоксепинил, бензодиоксолил (включая 1,3 бензодиоксолил), бензофуранил, бензофуразанил, бензотиадиазолил (включая 2,1,3-бензотиадиазолил),бензотиазолил, бензоксадиазолил (включая 2,1,3-бензоксадиазолил), бензоксазинил (включая 3,4 дигидро-2H-1,4-бензоксазинил), бензоксазолил, бензоморфолинил, бензоселенадиазолил (включая 2,1,3 бензоселенадиазолил), бензотиенил, карбазолил, хроманил, циннолинил, фуранил, имидазолил, имидазо[1,2-а]пиридил, индазолил, индолинил, индолил, изобензофуранил, изохроманил, изоиндолинил, изоиндолил, изохинолинил, изотиазолил, изотиохроманил, изоксазолил, нафтиридинил (включая 1,6 нафтиридинил или предпочтительно 1,5-нафтиридинил и 1,8-нафтиридинил), оксадиазолил (включая 1,2,3-оксадиазолил, 1,2,4-оксадиазолил и 1,3,4-оксадиазолил), оксазолил, феназинил, фенотиазинил, фталазинил, птеридинил, пуринил, пиранил, пиразинил, пиразолил, пиридазинил, пиридил, пиримидинил,пирролил, хиназолинил, хинолинил, хинолизинил, хиноксалинил, тетрагидроизохинолинил (включая 1,2,3,4-тетрагидроизохинолинил и 5,6,7,8-тетрагидроизохинолинил), тетрагидрохинолинил (включая 1,2,3,4-тетрагидрохинолинил и 5,6,7,8-тетрагидрохинолинил), тетразолил, тиадиазолил (включая 1,2,3 тиадиазолил, 1,2,4-тиадиазолил и 1,3,4-тиадиазолил), тиазолил, тиохроманил, тиофенетил, тиенил, триазолил (включая 1,2,3-триазолил, 1,2,4-триазолил и 1,3,4-триазолил) и т.п. Заместители в гетероциклоалкильных группах могут, когда это уместно, находиться при любом атоме в циклической системе, включая гетероатом. Во избежание сомнения, необязательные заместители включают те, что определены здесь, и также включают заместители =O, которые могут быть присоединены к любым неароматическим кольцам полициклической (например, бициклической) гетороарильной группы (однако, в воплощение заместители =O не включены). Во избежание сомнения, необязательными заместителями могут также быть другие циклические группы, которые могут быть присоединены к неароматическому кольцу гетероарильной группы посредством одного атома углерода, общего для обоих колец (с образованием, тем самым, спироцикла). Местом присоединения гетероарильной группы может быть любой атом в циклической системе, включая (где это уместно) гетероатом (такой как атом азота), или атом любого конденсированного карбоциклического кольца, которое может присутствовать в качестве части циклической системы. Гетероарильные группы могут также находиться в N- или S- окисленной форме. Можно специально оговорить, что гетероарильная группа является моноциклической или бициклической. В том случае, когда указано, что гетероарил является бициклическим, тогда он может состоять из пяти-, шести- или семичленного моноциклического кольца (например, моноциклического гетероарильного кольца), конденсированного с другим пяти-, шести- или семичленным кольцом (например, моноциклическим арильным или гетероарильным кольцом). Гетероатомы, которые могут быть упомянуты, включают фосфор, кремний, бор и предпочтительно кислород, азот и серу. Во избежание сомнения, в тех случаях, когда два или более заместителя в соединении по изобретению могут быть идентичными, фактическая природа соответствующих заместителей не являются никоим образом взаимозависимой. Например, в ситуации, в которой присутствует более чем один заместитель А 1, эти заместители А 1 могут быть одинаковыми или различными. Кроме того, в том случае, если присутствуют два заместителя А 1, один из которых представляет собой -OR10a, другой представляет собой -C(O)-R10a, эти группы R10a следует рассматривать как взаимозависимые. Во избежание сомнения, в случае, когда циклические заместители (например, циклоалкильные или гетероциклоалкильные группы) присутствуют в группах (таких как алкильные группы), тогда эти циклические заместители могут быть присоединены к одному углеродному атому, с образованием, например,спироциклической группы. Все индивидуальные признаки (например, предпочтительные признаки), упомянутые здесь, могут быть взяты по отдельности или в сочетании с любым другим признаком (включая предпочтительный признак), упомянутым здесь (следовательно, предпочтительные признаки могут быть взяты совместно с другими предпочтительными признаками, или, независимо от них). Квалифицированный специалист примет во внимание, что соединения по изобретению, которые являются объектом этого изобретения, включают те, которые являются стабильными. Т.е. соединения по изобретению включают те, которые являются достаточно устойчивыми для того, чтобы выдержать выделение из, например, реакционной смеси с пригодной степенью чистоты. Во избежание сомнения, если термин, такой как "от R10a до R12a", применяется здесь, квалифицированный специалист будет понимать, что это означает R10a, R11a и R12a включительно. Подобным образом,квалифицированный специалист будет понимать, что термин, такой как "от А 1 до А 4" при использовании здесь, означает А 1, А 2, А 3 и А 4 включительно. В воплощении изобретения предложены соединения по изобретению, которые определены здесь выше, но в которых R2 представляет собой водород. В другом воплощении изобретения предложены соединения по изобретению, которые определены здесь выше, но в которых R2 представляет собойC1-3 алкил (например, метил), необязательно, замещенный одним или более атомами фтора (например,особенно в тех случаях, когда R2 представляет собой незамещенный метил). Соединения по изобретению, которые могут быть упомянуты, включают те, в которых, например, в частности, для воплощении, в котором R2 представляет собой водород: если R1 представляет собой замещенный арил, то это предпочтительно фенил, замещенный одним или более заместителями, выбранными из А 1; и/илиR1 представляет собой гетероарил, необязательно, замещенный одним или более заместителями,выбранными из А 2;R3 представляет собой незамещенный арил (например, фенил); и/или если R3 представляет собой гетероарильную группу, тогда он предпочтительно представляет собой:(i) моноциклическую 5-членную гетероарильную группу, необязательно, замещенную одним или более заместителями, выбранными из А 4;(ii) моноциклическую 6-членную гетероарильную группу, в которой гетероатом выбран из кислорода и серы, причем эта группа является, необязательно, замещенной одним или более заместителями,выбранными из А 4;(iii) моноциклическую 6-членную гетероарильную группу, в которой присутствуют два или более атомов азота, причем группа является, необязательно, замещенной одним или более заместителями, выбранными из А 4;(iv) бициклическую гетероарильную группу (например, 8-, 9- или 10-членное кольцо), в которой местом присоединения к имеющемуся бициклу формулы I является кольцо, содержащее гетероатом,причем это бициклическое кольцо является, необязательно, замещенным одним или более заместителями, выбранными из А 4;(v) бициклическую гетероарильную группу, замещенную одним или более заместителями, выбранными из А 4. Кроме того, соединения по изобретению, которые могут быть упомянуты, включают те, в которых каждая из ароматических групп, представленных R1 и R3, является замещенной заместителем, определенным здесь. Предпочтительные соединения по изобретению, которые могут быть упомянуты, включают те, в которых местом присоединения гетероарильных групп, которые могут представлять собой R1 и R3, является гетероциклическое кольцо (например, гетероароматическое кольцо) этой гетероарильной группы (например, если гетероарильное кольцо является бициклическим, в котором имеется бензольное кольцо,конденсированное с гетероциклическим кольцом, тогда местом присоединения является скорее гетероциклическое кольцо, чем бензольное кольцо, например, индолильная группа, предпочтительно связанная по положению 2 или 3); если любые соответствующие два R10a, R11a и R12a и/или R20, R21 и R22 связаны вместе, тогда они могут быть связаны в том случае, когда эти заместители присоединены к одному и тому же атому (т.е. атому азота, к которому они обязательно присоединены); если любой из R1 и R3 представляют собой гетероарильную группу, тогда он может быть:(i) моноциклическим 5- или 6-членным кольцом, содержащим от одного до четырех гетероатомов(например, от одного до трех, предпочтительно один или два), в котором гетероатомы предпочтительно выбраны из кислорода, серы и, особенно, азота, которое является, необязательно, замещенным, как определено здесь;(ii) бициклической 8-, 9- или 10-членной гетероарильной группой, содержащей от одного до четырех гетероатомов (например, от одного до трех, предпочтительно один или два), в которой бицикл состоит из 5- или 6-членного кольца, конденсированного с другим 5- или 6-членным кольцом. Предпочтительно она состоит из бензольного кольца, конденсированного с моноциклической гетероарильной группой, которая определена здесь (например, 5- или 6-членного кольца, которое определено выше). Предпочтительные соединения по изобретению включают те, в которых ароматические группы, определенные как R1 и/или R3, являются замещенным (или по меньшей мере одна из этих групп является замещенной). Предпочтительно, если такие группы являются замещенными, они являются замещенными одним или двумя заместителями, которые определены здесь. Предпочтительно, чтобы такие заместители находились в пара- и/или мета-положении по отношению к месту присоединения к имеющемуся (имидазотиазольному) бициклу соединения формулы I (например, когда R1 и/или R3 представляет собой фенил,тогда предпочтительно, чтобы эти заместители находились в положениях 3 и/или 4; когда R1 и/или R3 представляет собой замещенный 3-пиридил, тогда предпочтительно, чтобы эти заместители являлись замещенными в положениях 5 и/или 6; когда R1 и/или R3 представляет собой замещенный 5 пиримидинил, тогда заместитель предпочтительно находится в положении 2). Предпочтительно имеется по меньшей мере один заместитель, присутствующий в группе R1 и/или R3 (более конкретно, имеется по меньшей мере один заместитель, на обе группы), который находится в мета- или предпочтительно параположении. Более предпочтительные соединения по изобретению включают те, в которых А 1, A2, A3 и А 4, независимо, представляют собой, в каждом случае при использовании в данном контексте, Q1 или C1-6 алкил(например, С 1-3 алкил), замещенный одним или более заместителями, выбранными из Q2; каждый Q1 и Q2, независимо, представляет собой, в каждом случае при использовании в данном контексте, галоген, -CN, -NO2, -N(R10a)R11a, -OR10a; -C(=Y)-R10a, -C(=Y)-OR10a, -C(=Y)N(R10a)R11a,-N(R12a)C(=Y)R11a, -N(R12a)C(=Y)OR11a, -NR12aS(O)2R10a, -S(O)2N(R10a)R11a, -S(O)2R10a, -SR10a, -S(O)R10a или С 1-12 (например, C1-6) алкил (необязательно, замещенный одним или более заместителями, выбранными из =O и предпочтительно Е 1); каждый R10a, R11a и R12a, независимо, представляют собой, в каждом случае при использовании в данном контексте, водород или C1-12 алкил, необязательно, замещенный одним или более заместителями,выбранными из =O и предпочтительно Е 3; или любые соответствующие два R10a, R11a и R12a (например, R10a и R11a) могут быть связаны вместе с образованием (например, при присоединении к одному и тому же атому азота, наряду с имеющимся атомом азота, к которому они присоединены) 4-8-членного кольца, необязательно, содержащего одну или более двойных связей (например, одну или две), при этом кольцо может содержать, кроме того, два или предпочтительно один дополнительный гетероатом (предпочтительно выбранный из азота и, особенно,кислорода), при этом кольцо представляет собой, необязательно, замещенное одним или более заместителями, выбранными из Е 5 и =O; Е 1, Е 3 и Е 5 (например, Е 1, Е 2 и Е 3), независимо, представляют собой, в каждом случае при использовании в данном контексте, Q4 или C1-6 (например, C1-3) алкил, необязательно, замещенный одним или более заместителями, выбранными из =O и предпочтительно Q5 (наиболее предпочтительно такие группы Е 1, Е 3 и Е 5 представляют собой Q4); каждый Q4 и Q5 (например, Q4), независимо, представляет собой, в каждом случае при использовании в данном контексте, галоген, -CN, -NO2, -N(R20)R21, -OR20, -C(=Y)-R20, -C(=Y)-OR20, -C(=Y)N(R20)R21,-N(R22)C(=Y)R21, -N(R22)C(=Y)OR21, -NR22S(O)2R20, -S(O)2N(R20)R21, -S(O)2R20, -SR20, -S(O)R20 илиC1-6 алкил, необязательно, замещенный одним или более заместителями, выбранными из фтора;Y представляет собой, в каждом случае при использовании в данном контексте, =O; каждый R20, R21 и R22, независимо, представляют собой, в каждом случае при использовании в данном контексте, водород или С 1-3 алкил, необязательно, замещенный одним или более заместителями, выбранными из J3 и =O; или любые два R20, R21 и R22 (например, R20 и R21) могут быть связаны вместе с образованием (например, при присоединении к одному и тому же атому азота, наряду с имеющимся атомом азота, к которому они присоединены) 4-8-членного кольца, необязательно, содержащего одну или более двойных связей(например, одну или две), при этом кольцо может содержать, кроме того, два или предпочтительно один дополнительный гетероатом (предпочтительно выбранный из азота и, особенно, кислорода), при этом кольцо является, необязательно, замещенным одним или более заместителями, выбранными из J5 и =O; каждый J3 и J5, независимо, представляет собой, в каждом случае при использовании в данном контексте: (i) Q7; или (ii) C1-6 алкил (например, С 1-3 алкил), необязательно, замещенный одним или более заместителями, выбранными из =О и Q8 (более предпочтительно каждый J3 и J5, независимо, представляет собой Q7); каждый Q7 и Q8 (например, Q7), независимо, представляет собой -N(R50)R51, -OR50 или предпочтительно галоген (например, фтор) или C1-3 алкил (например, метил), необязательно, замещенный одним или более атомами фтора; каждый заместитель R50 и R51, независимо, представляет собой, в каждом случае при использовании в данном контексте, водород или C1-6 алкил (например, С 1-3 алкил), необязательно, замещенный одним или более заместителями, выбранными из фтора;R60, R61 и R62, независимо, представляют собой метил или водород. Предпочтительные арильные и гетероарильные группы, которые R1 и R3 могут, независимо, представлять собой, включают, необязательно, замещенный фенил, нафтил, пирролил, фуранил, тиенил, имидазолил, оксазолил, изоксазолил, тиазолил, пиразолил, пиридил, индазолил, индолил, индолинил, изоиндолинил, хинолинил, изохинолинил, хинолизинил, бензоксазолил, бензофуранил, изобензофуранил, хроманил, бензотиенил, пиридазинил, пиримидинил, пиразинил, индазолил, бензимидазолил, хиназолинил,хиноксалинил, 1,3-бензодиоксолил, тетразолил, бензотиазолил, и/или бензодиоксанил. Особенно предпочтительные группы, которые R1 и R3 могут, независимо, представлять собой, включают, необязательно, замещенный фенил, пиридил (например, 3-пиридил) и пиримидинил (например, 5-пиримидинил). Предпочтительные заместители в арильной или гетероарильной группах, которые R1 и R3 могут представлять собой, включают (где это уместно):=O (например, в случае циклоалкильной или предпочтительно гетероциклоалкильной групп);C1-4 алкил, причем алкильная группа может быть циклической, частично циклической, ненасыщенной или предпочтительно линейной или разветвленной (например, C1-4 алкил, такой как этил, N-пропил,изопропил, трет-бутил или предпочтительно N-бутил или метил), все из которых являются, необязательно, замещенными одним или более заместителями, выбранными из -ORz1, -N(Rz4)Rz5 (с образованием,например, групп -СН 2-СН 2-ОН или -CH2-CH2-N(CH3)2) и предпочтительно галогена (например, фтора; с образованием, например, фторметила, дифторметила или предпочтительно трифторметила); арил (например, фенил), где это уместно (например, когда заместитель в алкильной группе, с образованием, например, бензильной группы);-N(Rz9)Rz10; где Rz1-Rz10, независимо, представляют собой, в каждом случае при использовании в данном контексте, Н или C1-4 алкил (например, этил, N-пропил, трет-бутил или предпочтительно N-бутил, метил или изопропил), необязательно, замещенный одним или более заместителями, выбранными из галогена (например, фтора), -N(Rz11)C(O)ORz12 и -C(O)N(Rz13)Rz14, в которых Rz11-Rz14, независимо, представляют собой Н или С 1-4 алкил (например, метил или трет-бутил), или Rz13 и Rz14 связаны вместе с образованием 5 или 6-членного кольца (необязательно, содержащего еще один гетероатом с образованием, например,морфолинильной группы). Предпочтительные соединения по изобретению включают те, в которыхR1 представляет собой арил (например, фенил), замещенный одним или более заместителями, выбранными из А 1, или гетероарил (например, пиридил, такой как 3-пиридил), необязательно, замещенный одним или более заместителями, выбранными из А 2; если R1 представляет собой, необязательно, замещенный гетероарил, тогда он, предпочтительно представляет собой, необязательно, замещенную моноциклическую гетероарильную группу (например,5- или предпочтительно 6-членную моноциклическую гетероарильную группу), предпочтительно содержащую два или предпочтительно один гетероатом(ы) (предпочтительно выбранные из кислорода, серы или, в особенности, азота);R2 представляет собой водород или метил;R3 представляет собой арил (например, фенил), необязательно, замещенный одним или более заместителями, выбранными из А 3, или гетероарил (например, пиридил, такой как 3-пиридил, и пиримидинил,такой как 5-пиримидинил), необязательно, замещенный одним или более заместителями, выбранными из А 4; когда R3 представляет собой, необязательно, замещенный гетероарил, тогда он предпочтительно представляет собой, необязательно, замещенную моноциклическую гетероарильную группу (например,5- или предпочтительно 6-членную моноциклическую гетероарильную группу), предпочтительно содержащую один или два гетероатома (предпочтительно выбранные из кислорода, серы или, в особенности,азота); оба R1 и R3 предпочтительно представляют собой замещенные ароматические (арильные или гетероарильные) группы, которые определены здесь; когда R2 представляет собой водород, тогда предпочтительно R1 представляет собой, необязательно, замещенный гетероарил, который определен здесь; А 1, А 2, А 3 и А 4, независимо, представляют собой Q1; каждый Q1 и Q2 (например, Q1), независимо, представляет собой галоген (например, фтор), -CN,10a-OR , -N(R10a)R11a, -C(=Y)OR10a или -S(O)2R10a; каждый R10a, R11a и R12a (например, R10a), независимо, представляет собой водород или C1-3 алкил(например, метил или этил), необязательно, замещенный одним или более заместителями, выбранными из Е 3; каждый Е 1, Е 3 и Е 5 (например, Е 3), независимо, представляют собой Q4; каждый Q4 и Q5 (например, Q4), независимо, представляет собой -N(R20)R21, -C(=Y)N(R20)R21 или 22R20, R21 и R22 (например, R20 и R21), независимо, представляют собой водород или предпочтительно С 1-3 алкил (например, метил); илиR20 и R21, будучи присоединены к одному и тому же атому азота, связаны вместе с образованием 5 или 6-членного кольца, необязательно, содержащего, еще один гетероатом (например, азот или предпочтительно кислород) с образованием, например, морфолинильной группы;R22 представляет собой водород. Предпочтительные соединения по изобретению включают те, в которыхR1 представляет собой арил (например, фенил), замещенный одним или более заместителями, выбранными из А 1, или гетероарил (например, 5-членную гетероарильную группу, такую как пиразолил(например, 4-пиразолил, 9- или 10-членные конденсированные бициклические кольца, такие как индолил (например, 5-индолил или 2-оксо-1,2-дигидроиндолил), или предпочтительно 6-членную гетероарильную группу, например пиридил, такой как 3-пиридил), необязательно, замещенный одним или более заместителями, выбранными из А 2; когда R1 представляет собой бициклический гетероарил, тогда он связан с имеющимся имидазотиадиазольным ядром соединения по изобретению (см. формулу I выше) через ароматическое кольцо (например, бензольное кольцо);R2 представляет собой водород или метил (предпочтительно водород);R3 представляет собой арил (например, фенил), необязательно, замещенный одним или более заместителями, выбранными из А 3, или гетероарил (например, пиридазинил или предпочтительно пиридил,такой как 3-пиридил, и пиримидинил, такой как 5-пиримидинил), необязательно, замещенный одним или более заместителями, выбранными из А 4; когда R3 представляет собой, необязательно, замещенный гетероарил, тогда он предпочтительно представляет собой, необязательно, замещенную моноциклическую гетероарильную группу (например,5- или предпочтительно 6-членную моноциклическую гетероарильную группу), предпочтительно содержащую один или два гетероатома (предпочтительно выбранных из кислорода, серы или, в особенности,азота); обе R1 и R3 предпочтительно представляют собой замещенные ароматические (арильные или гетероарильные) группы, которые определены здесь; когда R2 представляет собой водород, тогда предпочтительно, чтобы R1 представлял собой, необязательно, замещенный гетероарил, который определен здесь; А 1, А 2, А 3 и А 4, независимо, представляют собой Q1 или (например, А 1, А 2 или А 4) могут альтернативно представлять собой C1-6 алкил (например, С 1-3 алкил) (например, метил или этил), который является,необязательно, замещенным одним или более заместителями Q2; каждый Q1 и Q2 (например, Q1), независимо, представляет собой C1-6 алкил (например, C1-3 алкил)(необязательно, замещенный одним или более атомами фтора), -SR10a, -S(O)R10a, -NR12aS(O)2R10a, -C(=Y)N(R10a)R11a, -S(O)2N(R10a)R11a, -N(R12a)C(=Y)R11a или более предпочтительно галоген (например, хлор или предпочтительно фтор), -CN, -OR10a, -N(R10a)R11a, -C(=Y)OR10a или -S(O)2R10a;Q2 представляет собой галоген (например, фтор) или -NR12aS(O)2R10a (например, когда в алкильной группе) или C1-6 алкил (например, С 1-3 алкил) (например, метил; причем алкильная группа является, необязательно, замещенной одним или более атомами фтора) или -C(=Y)OR10a (например, когда на гетероатоме гетероциклоалкильной группы); каждый R10a, R11a и R12a (например, R10a), независимо, представляет собой водород, С 1-3 алкил (например, метил или этил), необязательно, замещенный одним или более заместителями, выбранными из Е 3 (предпочтительно каждый R10a, R11a и R12a, независимо, представляют собой водород или C1-3 алкил,необязательно, замещенный одним или более заместителями, выбранными из Е 3; в которых Е 3 может представлять собой фтор или другой заместитель, который определен здесь, такой как -N(R20)R21); илиR10a и R11a (например, в случае -S(O)2N(R10a)R11a) могут быть связаны вместе с образованием 5- или предпочтительно 6-членного кольца, необязательно, содержащего еще один гетероатом (например, азот или предпочтительно кислород), с образованием, например, морфолинильной группы (причем кольцо может быть замещенным одним или более, заместителями Е (но, например, в случае кольца, образованного связыванием группы -S(O)2N(R10a)R11a, является предпочтительно незамещенным);R12a представляет собой C1-3 алкил или предпочтительно водород; каждый Е 1, Е 3 и Е 5 (например, Е 3), независимо, представляют собой C1-6 алкил (например, C1-3 алкил),необязательно, замещенный одним или более заместителями, выбранными из =O и предпочтительно Q5,или Е 1, Е 3 и Е 5 (например, Е 3), независимо, (и более предпочтительно) представляют собой Q4; каждый Q4 и Q5 (например, Q4), независимо, представляют собой галоген (например, фтор), -C(=Y)20OR или более предпочтительно -N(R20)R21, -C(=Y)N(R20)R21 или -N(R22)C(=Y)OR21;R20, R21 и R22 (например, R20 и R21), независимо, представляют собой водород или предпочтительноR20 и R21, будучи присоединены к одному и тому же атому азота, связаны вместе с образованием 5 или 6-членного кольца, необязательно, содержащего, дополнительный гетероатом (например, азот, или предпочтительно кислород) с образованием, например, морфолинильной группы;R22 представляет собой водород. Предпочтительные соединения по изобретению, которые могут быть упомянуты, включают те, в которыхR1 представляет собой арил или предпочтительно гетероарил (например, 3-пиридил) замещенный(например, в мета-положении по отношению к месту присоединения к имидазотиадиазолу, т.е. в случае 3-пиридила, в положении 5) группой -NR12aS(O)2R10a, и необязательно, замещенный дополнительно одним или более (например, от одного до трех, если R1 представляет собой пиридил) заместителями, выбранными из А 1 или А 2 (где это уместно);R12a представляет собой С 1-3 алкил или предпочтительно водород; если R1 представляет собой пиридил (например, 3-пиридил), замещенный в положении 5 группой 12aQ1 представляет собой -OR10a (в котором R10a представляет собой, предпочтительно C1-3 алкил, необязательно, замещенный одним или более атомами фтора; предпочтительно R10a в этом случае представляет собой незамещенный метил);Q4 представляет собой галоген (особенно фтор);R2 представляет собой водород или C1-3 алкил (например, метил) (предпочтительно водород);R3 представляет собой 6-членную моноциклическую гетероарильную группу (в которой имеется один или два гетероатома, предпочтительно выбранных из азота; с образованием, например, пиридазинильной (например, 4-пиридазинильной) группы; предпочтительно незамещенной), которая может быть замещенной одним или более А 4 заместителями, но которая является предпочтительно незамещенной. Особенно предпочтительные соединения по изобретению включают соединения из примеров, описанных здесь ниже. Соединения по изобретению могут быть получены в соответствии с методиками, которые являются хорошо известными лицам, квалифицированным в данной области, например, такими, которые описаны здесь ниже. Согласно следующему объекту изобретения предложен способ получения соединения формулы I,который включает:(i) взаимодействие соответствующего соединения формулы II где L1 представляет собой подходящую уходящую группу, такую как йод, бром, хлор или сульфонатную группу (например, -OS(O)2CF3, -OS(O)2CH3 или -OS(O)2PhMe) (наиболее предпочтительно L представляет собой йод); R1 и R2 являются такими, которые определены здесь выше,с соединением формулы III где L2 представляет собой подходящую группу, такую как -В(ОН)2, -B(ORwx)2 или -Sn(Rwx)3, в которой каждый Rwx, независимо, представляет собой C1-6 алкильную группу, или, в случае -B(ORwx)2, соответствующие группы Rwx могут быть связаны вместе с образованием 4-6-членной циклической группы(такой как группа 4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил); R3 является таким, как определено здесь выше (наиболее предпочтительно L2 представляет собой -B(ORwx)2); эта реакция может быть осуществлена, например, в присутствии подходящей каталитической системы, например, металла или его соли или комплекса, такого как CuI, Pd/C, PdCl2, Pd(OAc)2,Pd(Ph3P)2Cl2, Pd(Ph3P)4 (т.е. тетракис-(трифенилфосфин)палладий), Pd2(dba)3 или NiCl2 и лиганда, такого как трет-Bu3P, (С 6 Н 11)3P, Ph3P, AsPh3, P(o-Tol)3, 1,2-бис-(дифенилфосфино)этан, 2,2'-бис-(ди-третбутилфосфин)-1,1'-бифенил,2,2'-бис-(дифенилфосфино)-1,1'-би-нафтил,1,1'-бис(дифенилфосфиноферроцен), 1,3-бис-(дифенилфосфино)пропан, ксантфос, или их смеси, вместе с подходящим основанием, таким как Na2CO3, K3PO4, Cs2CO3, NaOH, KOH, K2CO3, CsF, Et3N, (i-Pr)2NEt, третBuONa или трет-BuOK (или их смесями) в подходящем растворителе, таком как диоксан, толуол, этанол,диметилформамид, диметиловый эфир этиленгликоля, вода, диметилсульфоксид, ацетонитрил, диметилацетамид, N-метилпирролидинон, тетрагидрофуран, диметоксиэтан (диметиловый эфир) или их смесях(предпочтительно применяют полярный апротонный растворитель, например диоксан или диметиловый эфир). Реакцию можно также проводить, например, при комнатной температуре или выше (например,при высокой температуре, такой как температура дефлегмации системы растворителей). Реакцию можно также проводить в условия микроволнового облучения реакционной смеси, например, при повышенной температуре (например, выше 100 С, такой как около 135-140 С). Альтернативные группы L2, которые могут быть упомянуты, включают группы, содержащие щелочные металлы (например, литий) и группы,содержащие галоген, которые могут быть превращены в галогенид магния (т.е. реактив Гриньяра), в котором магний может претерпевать реакцию "транс-металлирования", тем самым обмениваясь, например,на цинк;(ii) взаимодействие соединения формулы IV где L3 представляет собой подходящую уходящую группу, такую как группа, определенная здесь ранее применительно к L1 (например, йод); R2 и R3 являются такими, как определено здесь выше,с соединением формулы V где L4 представляет собой подходящую уходящую группу, такую как группа, определенная здесь ранее применительно к L2 (например, бороновую кислоту); R1 является таким, как определено здесь выше, например, в условиях реакции, таких как условия, описанные здесь ранее применительно к стадии (i) способа; альтернативно, стадии (i) и (ii) могут быть осуществлены в одном реакторе, т.е. фрагменты L1 и L3 могут быть замещены на R3 и R1 в одном реакторе;(iii) для соединений формулы I, в которых присутствуют заместители Q1-Q6 (т.е. присутствуют заместители Q1, Q2, Q3, Q4, Q5 и/или Q6), в которых такие группы представляют собой -OR10a или -OR20, в соответствующих случаях, в которых R10a и R20 не представляют собой водород (а наиболее предпочтительно представляют собой, необязательно, замещенный алкил, такой, как определено здесь, например,С 1-12 алкил или C1-6 алкил, необязательно, замещенный так, как определено здесь), взаимодействие соответствующего соединения формулы I, в котором присутствуют Q1-Q6, которые представляет собой -OR10a и -OR20 (в соответствующих случаях), в которых R10a и R20 представляют собой водород, с соединением формулы VI где L5 представляет собой подходящую уходящую группу, такую как группа, определенная здесь ранее при определении L (например, хлор или предпочтительно бром); Rx представляет собой R10a илиR20 (в соответствующих случаях), при условии, что они не представляют собой водород (а предпочтительно представляют собой С 1-12 алкил или C1-6 алкил, необязательно, замещенный так, как определено здесь), в условиях реакции известных квалифицированным специалистам в данной области; реакция может быть осуществлена при температуре около комнатной или выше (например, до 40180 С), необязательно, в присутствии подходящего основания (например, гидрида натрия, бикарбоната натрия, карбоната калия, пирролидинопиридина, пиридина, триэтиламина, трибутиламина, триметиламина,диметиламинопиридина,диизопропиламина,диизопропилэтиламина,1,8 диазабицикло[5,4,0]ундец-7-ена, гидроксида натрия, N-этилдиизопропиламина, N-(метилполистирол)-4(метиламино)пиридина, бис-(триметилсилил)амида калия, бис-(триметилсилил)амида натрия, третбутоксида калия, диизопропиламида лития, 2,2,6,6-тетраметилпиперидина лития или их смесей) и соответствующего растворителя (например, тетрагидрофурана, пиридина, толуола, дихлорметана, хлороформа, ацетонитрила, диметилформамида, трифторметилбензола, диоксана, триэтиламина, воды или их смесей). Соединения формулы II, в которых L1 представляет собой галоген, могут быть получены с помощью взаимодействия соединения формулы VII где R1 и R2 являются теми, которые определены здесь выше, с источником галогенид-ионов, например электрофил, который предоставляет источник иодид-ионов, включает йод, дииодэтан, дииодтетрахлороэтан или предпочтительно N-иодсукцинимид, источник бромид-ионов включает Nбромсукцинимид и бром, источник хлорид-ионов включает N-хлорсукцинимид, хлор и монохлорид йода. Другие соединения формулы II могут также быть получены в стандартных условиях, например таких, как условия, описанные здесь. Например, для синтеза соединений формулы II, в которых L1 представляет собой сульфонатную группу, взаимодействие соединения, соответствующего соединению формулы II, но в котором L представляет собой -ОН, с соответствующим сульфонилгалогенидом в стандартных условиях реакции, таких как в присутствии основания (например, такого как описанные здесь ранее применительно к получению соединений формулы I (стадия (iii) способа. Соединения формулы VII (например, те, в которых R2 представляет собой водород или метил) могут быть получены путем взаимодействия соединения формулы VII где R1 является таким, как определено здесь выше,с соединением формулы IX где R2a представляет собой водород или С 1-3 алкил, необязательно, замещенный одним или более атомами галогена (например, фтором) (наиболее предпочтительно R2a представляет собой водород или метил),в стандартных условиях, известных квалифицированным специалистам в данной области. Например, соединение формулы IX может уже присутствовать в воде, и, следовательно, реакция может быть осуществлена в присутствии воды в качестве растворителя, необязательно, в присутствии дополнительного растворителя, такого как спирт (например, N-бутанол), например, при комнатной температуре или предпочтительно повышенной температуре, такой как температура дефлегмации. Соединения формулы VIII могут быть получены с помощью взаимодействия соответствующего соединения формулы X где L1 является таким, как определено здесь выше,с соединением формулы V, которое определено здесь выше, например, в условиях реакции, таких,как описанные здесь ранее применительно к получению соединений формулы I (стадия (ii) способа). Соединения формулы X, в которых L представляет собой галоген, могут быть получены путем взаимодействия соответствующего соединения формулы XI с источником галогенид-ионов (например, в случае бромид-ионов, брома), таким как описанные здесь ранее, применительно к получению соединений формулы II, например, в присутствии подходящего растворителя, такого как спирт (например, метанол) необязательно, в присутствии подходящего основания, такого как слабое неорганическое основание, например, бикарбонат натрия. Соединения формулы III, V, VI, IX и XI (а также некоторые другие промежуточные соединения) являются либо коммерчески доступными, являются известными в литературе, либо могут быть получены или по аналогии со способами, описанными здесь, или с помощью обычных синтетических процедур, в соответствии со стандартными методиками, из доступных исходных материалов с использованием соответствующих реагентов и условий реакции. Кроме того, квалифицированный специалист примет во внимание, "что если описаны реакции введения фрагмента "-R1" в соединения формулы I, аналогичные реакции могут быть осуществлены для введения фрагмента"-R3" (или "-R2") в соединения формулы I и наоборот. Кроме того, способы получения соединений формулы I могут быть описаны в литературе, например Другие специфические стадии превращений (включая те, которые могут быть использованы для образования соединений формулы I), которые могут быть упомянуты, включают: использованием соответствующих условий восстановления (например, -С(О)ОН (или ее эфир), может быть превращена в группу -С(О)Н или -CH2-OH, с использованием DIBAL (диизобутилалюминийгидрида) и LiAlH4, соответственно (или аналогичных хемоселективных восстановителей;(ii) восстановление альдегидной группы (-С(О)Н) в спиртовую группу (-СН 2 ОН) с использованием соответствующих восстановительных условий, таких как те, что упомянуты в пункте (i) выше;(iii) окисление, например, фрагмента, содержащего спиртовую группу (например, -СН 2 ОН) в альдегид (например, -С(О)Н) или -S-группы в -S(O)- или -S(O)2-группу (или обратная реакция восстановления), например, в присутствии подходящего окислителя, например, MnO2 или mcpba (метахлорпероксибензойной кислоты) или подобных;(iv) восстановительное аминирование альдегида и амина, в соответствующих условиях реакции, например, в "однореакторной" процедуре в присутствии соответствующего восстановителя, такого, как хемоселективный восстановитель, такой как цианоборогидрид натрия или предпочтительно триацетоксиборогидрид натрия, или подобный. Альтернативно, такие реакции могут быть осуществлены в две стадии, например, стадия конденсации (в присутствии, например, дегидратирующего агента, такого, как триметилортоформиат или MgSO4, или молекулярные сита и т.д.) с последующей стадией восстановления (например, с помощью реакции в присутствии восстановителя, такого, как хемоселективный восстановитель, упомянутый выше, или NaBH4, AlH4 или подобный), например превращение -NH2 в -N(Н)изопропил при помощи конденсации в присутствии ацетона (Н 3 С-С(О)-СН 3) с последующим восстановлением в присутствии восстановителя, такого, как цианоборогидрид натрия (т.е., в целом, восстановительное аминирование);(v) образование амида или сульфонамида, например, с помощью реакции сульфонилхлорида с амином или при помощи реакции амидосочетания, т.е. образования амида из карбоновой кислоты (или ее эфира); например, -С(О)ОН (или ее эфир) могут быть превращены в группу -C(O)N(R10a)R11a (в которойR10a и R11a являются такими, которые определены здесь выше, и могут быть связаны вместе, например,как определено выше), и такая реакция может (например, для -СООН) быть осуществлена в присутствии подходящего агента сочетания (например, 1,1'-карбонилдиимидазола, N,N-дициклогексилкарбодиимида или подобных) или, в случае эфира, (например, -С(О)ОСН 3 или -С(О)ОСН 2 СН 3) может быть осуществлена в присутствии, например, триметилалюминия, или, альтернативно, группа -С(О)ОН может сначала быть активирована до соответствующего ацилгалогенида (например -C(O)Cl, при помощи обработки оксалилхлоридом, тионилхлоридом, пентахлоридом фосфора, оксихлоридом фосфора или подобными),и, во всех случаях, соответствующее соединение реагирует с соединением формулы HN(R10a)R11a (в которой R10a и R11a являются такими, как определено здесь выше), в стандартных условиях, известных квалифицированным специалистам в данной области, (например, необязательно, в присутствии подходящего растворителя, подходящего основания и/или в инертной атмосфере);(vi) превращение первичной амидной группы в нитрильную функциональную группу, например, в условиях реакции дегидратации, например, в присутствии POCl3, или подобных;(vii) реакции нуклеофильного замещения (например, ароматическое нуклеофильное замещение),где любой нуклеофил замещает уходящую группу, например, амин может заместить уходящую группу S(О)СН 3;(viii) превращение метоксигруппы в гидроксигруппу, при помощи реакции в присутствии соответствующего реагента, такого как комплекс фторид бора-диметилсульфид или BBr3 (например, в присутствии подходящего растворителя, такого как дихлорметан);(ix) реакции алкилирования, ацилирования или сульфонилирования, которые могут быть осуществлены в присутствии основания и растворителя (таких как описанные здесь ранее);(х) специфические стадии снятия защиты, такие как снятие защитной группы N-Вос (N-третбутоксикарбонил-) с помощью реакции в присутствии кислоты, или снятие защиты с гидрокси-группы,защищенной в виде силильного эфира (например, трет-бутил-диметилсилильной защитной группой) может быть осуществлено с помощью реакции с источником фторид-ионов, например, при применении реагента фторида тетрабутиламмония (TBAF). Заместители R1, R2 и R3 (или заместители в них, например, определенные как А 1, А 2, А 3, А 4, или Q1,2Q , Q3, Q4, Q5, Q6, Q7, Q8 и/или Q9) в конечных соединениях по изобретению или соответствующих интермедиатах могут быть модифицированы один или более раз, после или во время процессов, описанных выше, с помощью способов, которые хорошо известны квалифицированным специалистам в данной области. Примеры таких способов включают замещение, восстановление, окисление, алкилирование, ацилирование, гидролиз, образование сложных эфиров, образование простых эфиров, галогенирование или нитрование. Такие реакции могут приводить к образованию симметричного или асимметричного конечного соединения по изобретению или интермедиата. Предшествующие группы могут быть заменены на другую такую группу или на группы, определенные в формуле I, в любое время в ходе последовательности реакций. Например, в тех случаях, когда присутствует -CO2H, квалифицированный специалист примет во внимание, что на любой стадии во время синтеза (например, на конечной стадии), соответствующая эфирная группа может быть гидролизована с образованием функциональной группы карбоновой кислоты. Соединения по изобретению, имеющие карбоксиэфирную функциональную группу, могут быть превращены во множество производных, согласно хорошо известным в данной области техники способам превращения карбоксиэфирной группы в карбоксамиды, N-замещенные карбоксамиды, N,Nдизамещенные карбоксамиды, карбоновые кислоты и т.п. Условия проведения реакций широко известны в данной области техники и могут включать, например, превращение карбоксиэфирной группы в карбоксамидную группу, реакцию с аммиаком или гидроксидом аммония в присутствии подходящего растворителя, такого как низший спирт, диметилформамид или их смесь; предпочтительно реакцию проводят с гидроксидом аммония в смеси метанол/диметилформамид, при температуре в диапазоне от около 50 С до около 100 С. Аналогичные условия проведения реакций применяют при получении N-замещенных или N,N-дизамещенных карбоксамидов, где подходящий первичный или вторичный амин используют вместо аммиака или гидроксида аммония. Подобным образом, карбоксиэфирные группы могут быть превращены в производные карбоновой кислоты с помощью основных или кислотных условий гидролиза, широко известных в данной области техники. Кроме того, аминопроизводные соединений по изобретению могут легко быть превращены в соответствующие карбаматные, карбоксамидные или уреидные производные. Соединения по изобретению могут быть выделены из их реакционных смесей с использованием обычных методик (например, перекристаллизации). Квалифицированные специалисты в данной области техники, примут во внимание, что, в способах,описанных выше и здесь далее, функциональные группы промежуточных соединений могут нуждаться в защите с помощью защитных групп. Защита и снятие защиты функциональных групп может иметь место до или после реакции в вышеупомянутых схемах. Защитные группы могут быть удалены, в соответствии с методиками, которые хорошо известны специалистам, квалифицированным в данной области, и которые описаны здесь ниже. Например, защищенные соединения/интермедиаты, описанные здесь, могут быть химически превращены в незащищенные соединения с использованием стандартных методик снятия защиты. Тип химических процессов, имеющих место, будет диктовать необходимость и тип защитной группы, а также последовательность осуществления синтеза. Применение защитных групп исчерпывающе описано в "Protective Groups in Organic Synthesis", 3rdedition, T.W. GreeneP.G.M. Wutz. Wiley-Interscience (1999). Медицинские и фармацевтические применения Соединения по изобретению показаны в качестве фармацевтических препаратов. Согласно следующему объекту изобретения предложено соединение по изобретению для применения в качестве фармацевтического препарата. Во избежание сомнения, хотя соединения по изобретению могут обладать фармакологической активностью, сами по себе, могут существовать или быть получены отдельные фармацевтически приемлемые (например, "защищенные) производные соединений по изобретению, которые могут не обладать такой активностью, но могут быть введены парентерально или перорально, и после этого метаболизироваться в организме с образованием соединений по изобретению. Поэтому такие соединения (которые могут обладать некоторой фармакологической активностью при условии, что такая активность является значительно более низкой, чем у "активных" соединений, в которые они метаболизируются) могут быть описаны в качестве "пролекарств" соединений по изобретению."Пролекарство соединений по изобретению", как определено здесь выше, включает соединения, которые образуют соединение по изобретению, в экспериментально детектируемом количестве в течение заданного времени (например, около 1 ч) после перорального или парентерального введения. Все пролекарства соединений по изобретению включены в объем изобретения. Более того, отдельные соединения по изобретению, сами по себе, могут обладать минимальной фармакологической активностью или не иметь ее, но могут быть введены парентерально или перорально,и после этого быть метаболизированы в организме с образованием соединений по изобретению, которые обладают фармакологической активностью, сами по себе. Такие соединения (которые также включают соединения, которые могут обладать некоторой фармакологической активностью, но активность которых является значительно более низкой, чем у "активных" соединений по изобретению, в которые они метаболизируется), могут также быть описаны в качестве "пролекарств". Таким образом, соединения по изобретению являются пригодными, потому что они обладают фармакологической активностью и/или метаболизируется в организме после перорального или парентерального введения с образованием соединений, которые обладают фармакологической активностью. Соединения по изобретению могут ингибировать протеинкиназы или липидные киназы, такие как киназа PI3 (особенно, класса I PI3K), например, как можно показать с помощью испытаний, описанных ниже (например, испытание ингибирования PI3K, описанное ниже) и/или в испытаниях, известных квалифицированному специалисту. Таким образом, соединения по изобретению могут быть пригодны для лечения таких нарушений у индивидуума, при которых ингибирование таких протеинкиназ или липидных киназ (например, PI3K, в частности, класса IPI3K) является желательным и/или требуется. Термин "ингибировать" может относиться к любому поддающемуся измерению снижению и/или препятствованию каталитической активности киназ (например, PI3K, в частности, класса I PI3K). Снижение и/или препятствование активности киназ может быть измерено при помощи сравнения активности киназы в образце, содержащем соединение по изобретению, и эквивалентном образце киназы (например,PI3K, в частности, класса I PI3K) в отсутствие соединений по изобретению, что будет очевидно специалистам, квалифицированным в данной области. Поддающееся измерению изменение может быть объективным (например, поддающимся измерению при помощи какого-либо испытания или маркера, например, анализа или испытания in vitro или in vivo, такого как описанные здесь ниже, или, иначе, другого подходящего анализа или испытания, известного лицам, квалифицированным в данной области) или субъективным (например, у субъекта имеются симптомы, или он ощущает эффект). Можно обнаружить, что соединения по изобретению проявляют 50% ингибирование протеинкиназ и липидных киназ (например, PI3K, таких как класс I PI3K) при концентрации 100 мкмоль или ниже (например, при концентрации ниже 50 мкмоль, или даже ниже 10 мкмоль, такой как ниже 1 мкмоль), в анализе (или другом испытании), например, таком, какое описано здесь ниже, или, иначе, другом подходящем анализе или испытании, известном квалифицированному специалисту. Таким образом, ожидается, что соединения по изобретению являются пригодными для лечения нарушения, в котором, как известно, играет роль протеинкиназа или липидная киназа (например, PI3K, такая как класса I PI3K) и которые характеризуются или связаны с общей повышенной активностью этой киназы (обусловленной, например, увеличением количества киназы или увеличением каталитической активности киназы). Следовательно, ожидается, что соединения по изобретению являются пригодными для лечения болезни/нарушения, возникающего из-за ненормального роста, функционирования или поведения клеток, связанного с протеинкиназами и липидными киназами (например, PI3K, такими как класса I PI3K). Такие состояния/нарушения включают рак, иммунные нарушения, сердечно-сосудистые заболевания, вирусные инфекции (или вирусные заболевания), воспаление, нарушение метаболической/эндокринной функции и неврологические нарушения. Нарушения/состояния, для лечения которых могут быть пригодны соединения по изобретению,следовательно, включают рак (такой как лимфомы, солидные опухоли или рак такой, как описано здесь ниже), непроходимость дыхательных путей, аллергические заболевания, воспалительные заболевания(такие, как астма, аллергия и Болезнь Крона), иммуноподавление (такое как отторжение трансплантата и аутоиммунные заболевания), нарушения, обычно связанные с трансплантацией органов, СПИДассоциированные заболевания и другие сопутствующие заболевания. Другие сопутствующие заболевания, которые могут быть упомянуты (в частности, обусловленные ключевой ролью киназы в регуляции клеточной пролиферации), включают другие клеточные пролиферативные нарушения и/или незлокачественные заболевания, такие, как доброкачественная гиперплазия простаты, наследственный аденоматоз,полипоз, нейрофиброматоз, псориаз, поражение кости, атеросклероз, пролиферация сосудистых клеток гладкой мускулатуры, связанная с атеросклерозом, легочный фиброз, артрит, гломерулонефрит и послеоперационный стеноз и рестеноз. Другие болезненные состояния, которые могут быть упомянуты, включают сердечно-сосудистое заболевание, инсульт, диабет, гепатомегалию, болезнь Альцгеймера, муковисцидоз, гормон-зависимые заболевания, иммунодефицитные нарушения, деструктивное поражение кости, инфекционные заболевания, состояния, связанные с клеточной смертью, тромбининдуцированную агрегацию тромбоцитов, хроническую миелогенную лейкемию, болезнь печени, патологические иммунные состояния, включающие активацию Т-клеток и нарушения центральной нервной системы (CNS). Как указано выше, соединения по изобретению могут быть пригодны для лечения рака. Более конкретно, соединения по изобретению могут, поэтому, быть пригодными для лечения множества видов рака, включая, но не ограничиваясь, карциному, такую как рак мочевого пузыря, груди, ободочной кишки, почек, печени, легких (включая немелкоклеточный рак и мелкоклеточный рак легких), пищевода,желчного пузыря, яичников, поджелудочной железы, желудка, шейки матки, щитовидной железы, простаты, кожи, плоскоклеточную карциному, рак семенников, мочеполового тракта, гортани, глиобластому, нейробластому, кератоакантому, эпидермоидную карциному, крупноклеточную карциному, немелкоклеточную карциному легких, мелкоклеточную карциному легких, аденокарциному легких, рак кости,аденому, аденокарциному, фолликулярную карциному, недифференцированную карциному, папиллярную карциному, семиному, меланому, саркому, карциному мочевого пузыря, карциному печени и желчных протоков, карциному почек, миелоидные нарушения, лимфоидные нарушения, рак ворсистых клеток, полости рта и глотки (ротовой части), губ, языка, рта, глотки, тонкого кишечника, ободочной и прямой кишки, толстого кишечника, прямой кишки, мозга и центральной нервной системы, Ходжкина и лейкемии; гематобластоз лимфоидного происхождения, включая лейкемию, острую лимфоцитарную лейкемию, острую лимфобластную лейкемию, В-клеточную лимфому, Т-клеточную лимфому, лимфому Ходжкина, лимфому нон-Ходжкина, лимфому ворсистых клеток и лимфому Беркетта; гематобластоз миелоидного происхождения, включая острую и хроническую миелогенную лейкемии, миелодиспластический синдром и промиелоцитарную лейкемию; опухоли мезенхимального происхождения, включая фибросаркому и рабдомиосаркому; опухоли центральной и периферической нервной системы, включая астроцитому, нейробластому, глиому и шванному; и другие опухоли, включая меланому, семиному, тератокарциному, остеосаркому, пигментарную ксеродерму, кератоксантому, фолликулярный рак щитовидной железы и саркому Капоши. Кроме того, протеинкиназы или липидные киназы (например, PI3K, такие как класса I PI3K) могут также быть вовлечены в размножение вирусов и паразитов. Они могут также играть главную роль в патогенезе и развитии нейродегенеративных нарушений. Следовательно, соединения по изобретению могут также быть пригодными для лечения вирусных состояний, паразитарных состояний, также нейродегенеративных нарушений. Соединения по изобретению показаны и для терапевтического и/или для профилактического лечения вышеупомянутых состояний. Согласно следующему объекту настоящего изобретения, предложен способ лечения заболевания(например, рака или другого заболевания, которое упомянуто здесь), который связан с тем, что требуется и/или является желательным ингибирование протеинкиназ и липидных киназ (например, PI3K, таких как класса I PI3K) (например, способ лечения заболевания/нарушения, возникающего из-за ненормального роста, функционирования или поведения клеток, связанного с протеинкиназами или липидными киназами, например, PI3K, такими как класса I PI3K), который содержит введение терапевтически эффективного количества соединения по изобретению, которое определено здесь выше, но не ограничено этим, пациенту, страдающему от, или чувствительному к, такому состоянию."Пациенты" включают млекопитающих (включая человека) пациентов. Следовательно, способ лечения, обсужденный выше, может включать лечение организма человека или животного. Термин "эффективное количество" относится к количеству соединения, которое оказывает терапевтический эффект на пациента, подвергающегося лечению. Эффект может быть объективным (например,поддающимся измерению при помощи некоторого испытания или маркера) или субъективным (например, у субъекта имеются симптомы, или он или ощущает эффект). Соединения по изобретению могут быть введены перорально, внутривенно, подкожно, буккально,ректально, дермально, назально, трахеально, бронхиально, сублингвально, с помощью любого другого парентерального пути или посредством ингаляции, в фармацевтически приемлемой дозированной форме. Соединения по изобретению могут быть введены отдельно, но предпочтительно их вводят при помощи известных фармацевтических композиций, включая таблетки, капсулы или эликсиры для перорального введения, суппозитории для ректального введения, стерильные растворы или суспензии для парентерального или внутримышечного введения и т.п. Тип фармацевтической композиции может быть выбран с учетом предполагаемого пути введения и стандартной фармацевтической практики. Такие фармацевтически приемлемые носители могут быть химически инертными по отношению к активному соединению и не могут иметь вредных побочных эффектов или токсичности в условиях применения. Такие композиции могут быть получены в соответствии со стандартной и/или общепринятой фармацевтической практикой. Иными словами, получение подходящих композиций может быть осуществлено квалифицированным специалистом неизобретательским путем, с использованием рутинных методик и/или в соответствии со стандартной и/или общепринятой фармацевтической практикой. Таким образом, согласно следующему объекту изобретения предложена фармацевтическая композиция, включающая соединение по изобретению, которое определено здесь выше, в смеси с фармацевтически приемлемым адъювантом, разбавителем и/или носителем. В зависимости от, например, эффективности и физических характеристик соединения по изобретению (т.е. активного ингредиента), фармацевтические композиции, которые могут быть упомянуты,включают те, в которых активный ингредиент присутствует в количестве по меньшей мере 1% (или по меньшей мере 10%, по меньшей мере 30% или по меньшей мере 50%) по массе. Т.е. отношение активного ингредиента к другим компонентам (т.е. добавке адъюванта, разбавителя и носителя) фармацевтической композиции составляет по меньшей мере 1:99 (или по меньшей мере 10:90, по меньшей мере 30:70 или по меньшей мере 50:50) по массе. Количество соединения по изобретению в готовой форме будет зависеть от тяжести состояния, и от пациента, подвергающегося лечению, а также от соединения(й), которые использованы, но может быть определено неизобретательским путем квалифицированным специалистом. Изобретение, кроме того, предлагает способ получения фармацевтической композиции, которая определена здесь выше, который включает приведение в ассоциацию соединения по изобретению, которое определено здесь выше, или фармацевтически приемлемого эфира, амида, сольвата или их соли с фармацевтически приемлемым адъювантом, разбавителем или носителем. Соединения по изобретению можно также комбинировать с другими терапевтическими агентами,которые являются ингибиторами протеинкиназ (например, PI3K, таких как класса I PI3K) и/или пригодными для лечения рака и/или пролиферативного заболевания. Соединения по изобретению можно также сочетать с другими видами терапии. Согласно следующему объекту изобретения предложен комбинированный продукт, содержащий:(A) соединение по изобретению, которое определено здесь выше, но без ограничений; и(B) другой терапевтический агент, который является пригодным для лечения рака и/или пролифера- 18022753 тивного заболевания,где каждый из компонентов (А) и (В) находится в смеси с фармацевтически приемлемым адъювантом, разбавителем или носителем. Такие комбинированные продукты обеспечивают введение соединений по изобретению совместно с другими терапевтическими агентами, и могут, таким образом, быть представлены либо в виде отдельных композиций, где по меньшей мере одна из этих композиций содержит соединение по изобретению, и по меньшей мере одна содержит другой терапевтический агент, или могут быть представлены (т.е. составлены) в виде комбинированного препарата (т.е. представлены в виде единой композиции, включающей соединение по изобретению и другой терапевтический агент). Таким образом, далее, предложены:(1) фармацевтическая композиция, включающая соединение по изобретению, которое определено здесь выше, но без ограничений, другой терапевтический агент, который является пригодным для лечения рака и/или пролиферативного заболевания, и фармацевтически приемлемый адъювант, разбавитель или носитель; и(a) фармацевтическую композицию, включающую соединение по изобретению, которое определено здесь выше, но без ограничений, в смеси с фармацевтически приемлемым адъювантом, разбавителем или носителем; и(b) фармацевтическую композицию, включающую другой терапевтический агент, который является пригодным для лечения рака и/или пролиферативного заболевания в смеси с фармацевтически приемлемым адъювантом, разбавителем или носителем,причем компоненты (а) и (b), каждый, предложены в форме, которая является подходящей для введения совместно одного с другим. Изобретение, кроме того, предлагает способ получения комбинированного продукта, который определен здесь выше, который включает приведение в ассоциацию соединения по изобретению, которое определено здесь выше, но без ограничений, или фармацевтически приемлемого эфира, амида, сольвата или их соли с другим терапевтическим агентом, который является пригодным для лечения рака и/или пролиферативного заболевания, и по меньшей мере одним фармацевтически приемлемым адъювантом,разбавителем или носителем. Под "приведением в ассоциацию" авторы подразумеваем, что конкретные два компонента приводят в состояние, подходящее для введения совместно одного с другим. Таким образом, в отношении способа получения набора частей, который определен здесь выше, при помощи "приведения в ассоциацию" двух компонентов одного с другим, авторы указывают, что два компонента набора частей могут быть:(i) предложены в виде отдельных композиций (т.е., независимо, один от другого), которые впоследствии объединяют вместе для применения совместно одного с другим в комбинированной терапии; или(ii) расфасованы и представлены вместе в виде отдельных компонентов "комбинированной упаковки" для применения совместно одного с другим в комбинированной терапии. В зависимости от нарушения и от пациента, подлежащего лечению, а также пути введения, соединения по изобретению могут быть введены в различных терапевтически эффективных дозах пациенту,нуждающемуся в них. Однако доза, вводимая млекопитающему, в частности, человеку, в контексте настоящего изобретения должна быть достаточной для того, чтобы вызвать терапевтический ответ у млекопитающего в приемлемых временных рамках. Специалист, квалифицированный в данной области техники, признает, что на выбор точной дозы и композиции и наиболее соответствующей схемы приема будут также влиять, среди прочего, фармакологические свойства композиции, природа и тяжесть состояния субъекта, подвергающегося лечению, и физическое состояние и ясность ума реципиента, также эффективность конкретного соединения, возраст, состояние, масса тела, пол и реакция пациента, подлежащего лечению, и стадия/тяжесть заболевания. Введение может быть непрерывным или периодическим (например, с помощью болюсной инъекции). Дозировка может также определяться расписанием и частотой введения. В случае перорального или парентерального введения дозировку можно варьировать от около 0,01 мг до около 1000 мг соединения по изобретению в сутки. Так или иначе, практикующий врач, или другой квалифицированный специалист, будет способен определить обычным путем реальную дозировку, которая будет наиболее подходящей для отдельного пациента. Вышеупомянутые дозировки являются примерными для среднего случая; могут, конечно,иметь место отдельные случаи, где имеют преимущество более высокие или более низкие пределы дозировки, и таковые находятся в объеме этого изобретения. Соединения по изобретению могут иметь преимущество, состоящее в том, что они являются эффективными ингибиторами протеинкиназ (например, PI3K, таких как класса I PI3K). Соединения по изобретению могут также иметь преимущество, состоящее в том, что они могут быть более эффективными, быть менее токсичными, быть более длительно действующими, быть более сильнодействующими, давать меньше побочных эффектов, более легко адсорбироваться и/или иметь лучший фармакокинетический профиль (например, более высокую пероральную биодоступность и/или более низкий клиренс), и/или иметь другие полезные фармакологические, физические, или химические свойства лучше, чем соединения, известные в современном уровне техники, либо для применения по вышеуказанным показаниям, либо иначе. Осуществление изобретения Примеры/биологические испытания. Анализ активности PI3K. Активность киназ измеряли с использованием коммерчески доступного набора для анализа ADPHunter Plus от DiscoveRx (33-016), при помощи которого осуществляют гомогенный анализ для измерения накопления аденозиндифосфата (ADP), универсального продукта активности киназ. Фермент PI3K(р 110/р 85) покупали в Carna Biosciences (07CBS-0402A). Анализ осуществляли согласно рекомендациям изготовителя с небольшими модификациями: В основном, киназный буфер заменяли на 50 ммоль(3-[(3 холанидопропил)диметиламмоний]-1-пропансульфонат), 2 ммоль ТСЕР (трихлорэтилфосфат) и 0,01 мг/мл BGG (бычий гамма-глобулин). PI3K анализировали при помощи титрования для определения оптимальной концентрации белка для анализа ингибирования. Для расчета IC50 ЕТР-соединений, серийные разведения (1:5) соединений прибавляли к ферменту при фиксированной концентрации (2,5 мкг/мл). Фермент преинкубировали с ингибитором и 30 мкмоль субстрата PIP2 (P9763, Sigma) в течение 5 мин,затем прибавляли АТР (аденозинтрифосфат) до конечной концентрации 50 мкмоль. Реакцию проводили в течение 1 часа при 25 С. Реагенты А и В последовательно прибавляли в лунки, и планшеты инкубировали в течение 30 мин при 37 С. Показания флуоресценции снимали на приборе Victor (Perkin Elmer) с рекомендованными установочными параметрами (544 и 580 нм для длин волн возбуждения и эмиссии,соответственно). Значения были нормализованы относительно контрольной активности, заложенной для каждого фермента (т.е. 100% активности киназ PI3, без соединения). С использованием программы Graphad был построен график зависимости этих значений от концентрации ингибитора, соответствующий сигмоидной кривой зависимости доза-ответ. Примеры Вышеуказанные названия соединений генерированы при помощи MDL ISIS/DRAW 2,5 SP 2, Autonom 2000. Следующие примеры иллюстрируют изобретение. Общие экспериментальные условия. 5-(4,4,5,5-Тетраметил-[1,3,2]диоксаборолан-2-ил)-3-трифторметилпиридин-2-иламин синтезировали согласно процедуре, описанной в WO 2008/138834. ВЭЖХ-МС анализы проводили на Agilent 1100 Series с использованием ESI+ (или API 2000) для ионизации и различные марки колонок RP-C18 для разделения. Анализ конечных соединений осуществляли с использованием колонки Gemini NX C18 (1002,0 ммоль, 5 мкм) при скорости потока 0,8 мл/мин и градиенте 5-100% В за 8 мин (В= ACN(ацетонитрил) + 0,1% муравьиная кислота; А= Н 2 О+0,1% муравьиная кислота) или как указано. Рассчитанная молекулярная масса является усредненной по изотопам, "найденная масса" относится к наиболее распространенному изотопу, детектируемому при помощиLC-MC. Спектры 1 Н NMR детектировали на спектрометре Bruker Avance II 300 (300 МГц) и внутренне соотносили с остаточными пиками растворителя. Спектральные данные для 1H NMR приведены в обычной форме: химический сдвиг (, м.д.), мультиплетность (s=синглет, d=дублет, t=триплет, q=квадруплет,hp=гептет, m=мультиплет, br=широкий сигнал), константа расщепления (Гц), количество атомов Н. Сокращения. Здесь далее термин "DCM" означает дихлорметан, "CHCl3" означает хлороформ,"МеОН" означает метанол, "EtOH" означает этанол, "EtOAc" означает этилацетат, "ТГФ" означает тетрагидрофуран, "ACN" означает ацетонитрил, "ДМФА" означает диметилформамид, "диметиловый эфир" означает диметоксиэтан, "ДМСО" означает диметилсульфоксид, "Et2O" означает диэтиловый эфир, "Hex" означает гексан, "EtOAc" означает этилацетат, "ВА/ВЕ" означает бороновую кислоту/эфир,"Pd(Ph3P)2Cl2" означает дихлор-бис-(трифенилфосфин)палладий(II), "Pd(dppf)Cl2.DCM" означает 1,1'дихлорид бис-(дифенилфосфино)ферроценпалладий(II), дихлорметановый комплекс, "NIS" означает Nиодсукцинимид, "Na2SO4" означает сульфат натрия, "MgSO4 означает сульфат магния, "K2CO3" означает карбонат калия, Na2CO3 означает карбонат натрия, "NaHCO3" означает бикарбонат натрия, "насыщ." означает насыщенный, "водн." означает водный, "ВЭЖХ" высокоэффективная жидкостная хроматография, "tR" означает время удерживания, "МС" означает масс-спектрометрия, "ТСХ" означает тонкослойная хроматография, "Rf" означает коэффициент удерживания, "г" означает грамм(ы), "ммоль" означает миллимоль(и), "экв." означает эквивалент(ы), "мл" означает миллилитр(ы), "мин" означает минута(ы),"ч" означает час(ы), "RT" означает комнатная температура. Интермедиат А. 2-Бром-6-метилимидазо[2,1-b][1,3,4]тиадиазол. 5-Бром-1,3,4-тиадиазол-2-амин (1 г, 5,55 ммоль, 1 экв.) и хлорацетон (1,327 мл, 16,665 ммоль, 3 экв.) в воде (24 мл) перемешивали при температуре дефлегмации в течение ночи. Прибавляли дополнительно хлорацетон (1,106 мл, 13,887 ммоль, 2,5 экв.) и продолжали нагревание на протяжении двух выходных дней. Реакционную смесь охлаждали до RT, выливали в NaHCO3 (насыщ. раствор, 43 мл) и экстрагировали DCM. Органические экстракты сушили (MgSO4), фильтровали и концентрировали с образованием темно-коричневого остатка, который очищали при помощи флэш-хроматографии (SiO2, DCM) с образованием желаемого продукта (белое твердое вещество, 0,613 г, 50%). ВЭЖХ-МС (10-95% В за 4 мин при 0,5 мл + 2 мин 100% В, поток 0,7 мл/мин): tR=4,81 мин, [М+Н]+ m/z 217,9. 1(Na2SO4) и концентрировали. Продукт (желтое твердое вещество, 0,720 г) очищали с помощью автоматизированной флэш-хроматографии (SiO2, DCM/0-40% MeOH) с образованием желаемого продукта (желтое твердое вещество, 0,347 г, 50%). ВЭЖХ-МС (10-95% В за 4 мин при 0,5 мл + 2 мин 100% В, поток 0,8 мл/мин, 50 С): tR=3,77 мин, [М+Н]+ m/z 276,1. Интермедиат С. 2-(3,4-Диметоксифенил)-5-иод-6-метилимидазо[2,1-b][1,3,4]тиадиазол. 2-(3,4-Диметоксифенил)-6-метилимидазо[2,1-b][1,3,4]тиадиазол (0,346 г, 1,257 ммоль) растворяли вDCM (4,2 мл) и прибавляли NIS (0,283 мг, 1,257 ммоль). Реакционную смесь перемешивали при RT в течение ночи, гасили насыщ. водн. тиосульфатом и экстрагировали DCM. Органические слои объединяли и промывали насыщ. водн. NH4Cl, сушили (MgSO4), фильтровали и концентрировали. Продукт суспендировали в Et2O, твердое вещество отфильтровывали, промывали Et2O и сушили в вакууме с образованием желаемого продукта (коричневое твердое вещество (0,295 г, 58%. ТСХ (циклогексан/EtOAc 1:1)(0,047 г, 0,217 ммоль, 2,5 экв.), Pd(Ph3P)2Cl2 (0,006 г, 0,0087 ммоль, 0,1 экв.), карбонат калия (0,06 г, 0,435 ммоль, 5 экв.) и воду (0,8 мл). Реакционную смесь подвергали микроволновому облучению (120 С, 35 мин, 200 Вт), охлаждали до RT и концентрировали. Продукт очищали с помощью хроматографии на силикагеле (0-0,5% МеОН в DCM). Фракции продукта давали маслянистый продукт, который затем очищали ресуспендированием в Et2O с образованием бледно-желтого твердого вещества (0,02 г) и с помощью препаративной ВЭЖХ с образованием чистого продукта (0,010 г, 25%). ВЭЖХ-МС: (50-100% В за 8 мин,0,6 мл/мин): tR=2,41 мин, [М+Н]+ m/z 448,1. 1(MgSO4), фильтровали и концентрировали, продукт очищали при помощи хроматографии на силикагеле(0-100% DCM в гексане, затем 0-3% МеОН в DCM). Фракции продукта концентрировали с образованием твердого вещества, которое затем очищали препаративной ВЭЖХ с образованием чистого продукта Пример 3. 5-[2-(3,4-Диметоксифенил)-6-метилимидазо[2,1-b][1,3,4]тиадиазол-5-ил]-3-трифторметилпиридин 2-иламин. Смесь 2-(3,4-диметоксифенил)-5-иод-6-метилимидазо[2,1-b][1,3,4]тиадиазола (0,125 г, 0,312 ммоль,1 экв.), 5-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-3-трифторметилпиридин-2-иламина (0,119 г,0,414 ммоль, 1,33 экв.), Pd(dppf)Cl2.DCM (0,008 г, 0,009 ммоль, 0,03 экв.) и карбоната цезия (0,305 г,0,935 ммоль, 3 экв.) в диметиловом эфире (4 мл) и воде (0,1 мл) нагревали в микроволновой печи (45 мин, 130 С), охлаждали до RT, разбавляли водой, экстрагировали EtOAc и промывали соляным раствором. Органические слои сушили (MgSO4), фильтровали и концентрировали, продукт очищали при помощи хроматографии на силикагеле (0-100% EtOAc в гексане). Фракции продукта концентрировали и ресуспендировали в Et2O, твердое вещество отфильтровывали и сушили с образованием желаемого продукта (твердое вещество, 0,070 г, 52%). ВЭЖХ-МС: (50-100% В за 8 мин, 0,8 мл/мин): tR=1,11 мин,[М+Н]+ m/z 436,0. 1H NMR (300 МГц, CDCl3) /м.д. 8,62 (d, J=1,6, 1H), 8,22 (d, J=1,6, 0H), 7,44 (d, J=2,2, 1H), 7,39 (dd,J=8,2, 2,2, 1H), 6,96 (d, J=8,5, 1H), 5,11 (s, 1H), 3,99 (s, 3H), 3,97 (s, 3H), 2,53 (s, 1H). Пример 4. 2-(3,4-Диметоксифенил)-6-метил-5-пиридин-3-ил-имидазо[2,1-b][1,3,4]тиадиазол. Смесь 2-(3,4-диметоксифенил)-5-иод-6-метилимидазо[2,1-b][1,3,4]тиадиазола (0,070 г, 0,174 ммоль), пиридин-3-бороновой кислоты (0,026 г, 0,209 ммоль), Pd(dppf)Cl2.DCM (0,014 г, 0,017 ммоль) и карбоната калия (0,5 мл, насыщ.водн.) в диметиловом эфире (1,7 мл) нагревали в микроволновой печи при 150 С в течение 2 ч. Так как превращение было неполным, дополнительно прибавляли 1,2 экв. пиридин-3-бороновой кислоты и 0,1 экв. Pd(dppf)Cl2.DCM, и смесь подвергали дополнительно 7-часовому микроволновому облучению при 150 С. Реакционную смесь охлаждали, разбавляли DCM, промывали водой, сушили (Na2SO4) и концентрировали. Было получено желтое твердое вещество (0,055 г), которое очищали с помощью хроматографии на силикагеле (циклогексан/0-60% EtOAc) с образованием желаемого продукта (белое твердое вещество, 0,042 г, 39%). ВЭЖХ-МС: (5-100% В за 8 мин, 0,8 мл/мин, 50 С):H NMR (300 МГц, CDCl3) /м.д. 9,00 (d, J=2,2, 1 Н), 8,53 (dd, J=4,8, 1,6, 1 Н), 8,00 (dd, J=8,0, 1,8, 1 Н),7,48-7,29 (m, 3 Н), 6,88 (d, J=9,0, 1H), 3,90 (d, J=5,0, 7H), 2,50 (s, 3H). Пример 5. 2-(3,4-Диметоксифенил)-5-(6-метоксипиридин-3-ил)-6-метилимидазо[2,1-b][1,3,4]тиадиазол. Смесь 2-(3,4-диметоксифенил)-5-иод-6-метилимидазо[2,1-b][1,3,4]тиадиазола (0,10 г, 0,249 ммоль),2-метокси-5-пиридинбороновой кислоты (0,046 г, 0,299 ммоль), Pd(dppf)Cl2.DCM (0,021 г. 0,025 ммоль) и карбоната калия (0,7 мл, насыщ.водн.) в диметиловом эфире (2,5 мл) нагревали в запаянной ампуле при 130 С в течение 5 ч. Реакционную смесь охлаждали, разбавляли DCM, промывали водой, сушили(Na2SO4) и концентрировали. Получали желтое твердое вещество (0,120 г), которое очищали при помощи хроматографии на силикагеле (DCM/0-40% MeOH) с образованием коричневого твердого вещества(0,080 г). Повторное хроматографирование (SiO2, циклогексан/0-60% EtOAc) давало чистый продукт (белое твердое вещество, 0,056 г, 59%). ТСХ (SiO2, циклогексан/EtOAc 1:2) Rf= 0,19; ВЭЖХ-МС: (5-100% В за 8 мин, 0,8 мл/мин, 50 С): tR=5,58 мин, [М+Н]+ m/z 383,1. 1(dt, J=17,3, 8,7, 2H), 4,01-3,80 (m, 9H), 2,52-2,31 (m, 3H). Пример 6. 2,5-бис-(3,4-Диметоксифенил)-6-метилимидазо[2,1-b][1,3,4]тиадиазол. Смесь 2-(3,4-диметоксифенил)-5-иод-6-метилимидазо[2,1-b][1,3,4]тиадиазола (0,070 г, 0,174 ммоль), 3,4-диметоксифенилбороновой кислоты (0,038 г, 0,209 ммоль), Pd(dppf)Cl2.DCM (0,014 г. 0,017 ммоль) и карбоната калия (0,5 мл, насыщ.водн.) в диметиловом эфире (1,7 мл) нагревали в микроволновой печи при 150 С в течение 2 ч. Реакционную смесь охлаждали, разбавляли DCM, промывали водой,сушили (Na2SO4) и концентрировали. Было получено желтое твердое вещество (0,054 г), которое очищали при помощи хроматографии на силикагеле (циклогексан/0-60% EtOAc) с образованием желаемого продукта (белое твердое вещество, 0,030 г, 42%). ТСХ (SiO2, циклогексан/EtOAc 1:2) Rf= 0,20; ВЭЖХМС: (5-100% В за 8 мин, 0,8 мл/мин, 50 С): tR=5,47 мин, [М+Н]+ m/z 412,1. 1(0,3 мл) и диоксане (2,2 мл) подвергали микроволновому облучению (120 С, 35 мин, 200 Вт). Растворители отгоняли и полученный продукт очищали при помощи хроматографии на силикагеле (0-3% MeOH вDCM) и препаративной ВЭЖХ (RP-C18, ACN/вода) с образованием желаемого продукта (0,012 г). ВЭЖХ-МС: (5-100% В за 8 мин, 0,8 мл/мин, 50 С): tR=4,08 мин, [М+Н]+ m/z 369,1. Пример 8. 5-[2-(3,4-Диметоксифенил)-6-метилимидазо[2,1-b][1,3,4]тиадиазол-5-ил]пиридин-2-ол. Раствор 2-(3,4-диметоксифенил)-5-(6-метоксипиридин-3-ил)-6-метилимидазо[2,1b][1,3,4]тиадиазола (0,028 г, 0,073 ммоль, 1 экв.) в 25% HCl (0,75 мл) подвергали микроволновому облучению (95 С, 2 ч, 200 Вт). Реакционную смесь охлаждали до RT, нейтрализовали NaHCO3 (насыщ. раствор) и экстрагировали EtOAc, затем CH2Cl2/МеОН (9:1). Органическую фазу сушили (MgSO4), фильтровали и концентрировали. Сырой продукт (0,007 г) очищали при помощи препаративной ВЭЖХ (RP-C18,ACN/вода) с образованием желаемого продукта (желтоватое твердое вещество, 0,005 г, 19 %). ВЭЖХМС: (5-100% В за 8 мин, 0,8 мл/мин, 50 С): tR=3,94 мин, [М+Н]+ m/z 369,1. 1(30 мл) прибавляли 2-метокси-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)фенол (1,76 г, 7,02 ммоль,1 экв.), затем 2 М водн. Na2CO3 (15 мл, 30 ммоль, 4,3 экв.). Суспензию дегазировали (N2, 15 мин) и подсоединяли к баллону с аргоном. Быстро прибавляли Pd(Ph3P)2Cl2 (1,23 г, 1,75 ммоль, 0,25 экв.), и реакционную колбу помещали в предварительно нагретую баню (115 С). После перемешивания при температуре дефлегмации в течение 2 ч реакционную смесь охлаждали до RT и концентрировали. Осадок извлекали в воде и экстрагировали DCM; органическую фазу промывали водой, сушили и концентрировали с образованием 2-метокси-4-(6-метилимидазо[2,1-b][1,3,4]тиадиазол-2-ил)фенола в виде сырого продукта(коричневое твердое вещество, 3 г), который использовали на следующей стадии без дополнительной очистки. ВЭЖХ-МС (10-95% В за 4 мин + 2 мин 100% В, поток 0,5 мл/мин, 50 С): tR=3,27 мин, [М+Н]+m/z 262,0. Интермедиат Е. 4-(5-Иод-6-метилимидазо[2,1-b][1,3,4]тиадиазол-2-ил)-2-метоксифенол. Сырой материал из предыдущей стадии растворяли в сухом ДМФА (25 мл), и прибавляли NIS (1,7 г, 7,7 ммоль, 1,1 экв.). Реакционную смесь перемешивали при RT в течение 15 ч, затем концентрировали. Продукт был поделен между DCM и водой содержащей немного водн. тиосульфата натрия. Органическую фазу отделяли, сушили (MgSO4) и концентрировали с образованием черного масла, которое ресуспендировали с Et2O. Твердое вещество отфильтровывали и сушили в вакууме с образованием желаемого продукта в виде светло-коричневого твердого вещества (0,73 г). ВЭЖХ-МС (10-95% В за 4 мин + 2 мин 100% В, поток 0,5 мл/мин, 50 С): tR=3,99 мин (степень чистоты 50%), [М+Н]+m/z 387,9. Интермедиат F. 4-(5-(6-Амино-5-(трифторметил)пиридин-3-ил)-6-метилимидазо[2,1-b][1,3,4]тиадиазол-2-ил)-2 метоксифенол. Смесь 6-(3,4-диметоксифенил)-3-иод-2-метилимидазо[1,2-b]пиридазина (сырого материала с предыдущей стадии, 0,72 г, 1,8 ммоль, 1,0 экв.), 5-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)-3 трифторметилпиридин-2-иламина (0,70 г, 2,42 ммоль, 1,3 экв.), Pd(dppf)Cl2.DCM (0,31 г, 0,37 ммоль, 0,20 экв.) и Cs2CO3 (1,80 г, 5,59 ммоль, 3,0 экв.) в диметиловом эфире (20 мл) и воде (4 мл) дегазировали (Ar),держали под Ar и нагревали в двугорлой круглодонной колбе, снабженной обратным холодильником (3 ч, 115 С). Как только превращение было завершено, реакционную смесь охлаждали до RT и доводили рН до 7 прибавлением насыщенного водного раствора NH4Cl. Растворители отгоняли, и остаток переносили в воду и экстрагировали DCM (3 раза). Объединенные органические слои сушили (MgSO4), фильтровали и концентрировали в вакууме. Сырой продукт (0,9 г) адсорбировали на силикагеле и очищали при помощи колоночной хроматографии (SiO2, DCM/MeOH) с образованием желаемого продукта (коричневое твердое вещество, 0,143 г, 0,34 ммоль, 5% выход, 3 стадии). Небольшое количество затем очищали при помощи препаративной ВЭЖХ (RP-C18, ACN/вода) и ресуспендирования в Et2O. ВЭЖХ-МС: (10-95% В за 4 мин, 0,5 мл/мин + 2 мин 100% В, 0,8 мл/мин): tR=3,99 мин, [М+Н]+ m/z 422,1. 1H NMR (300 МГц, MeOD) /м.д. 8,42 (s, 1H), 8,09 (s, 1H), 7,73-7,65 (m, 1H), 7,51-7,39 (m, 2H), 4,073,93 (m, 4H), 2,40-2,25 (m, 3H). Пример 9. трет-Бутил-2-(4-(5-(6-амино-5-(трифторметил)пиридин-3-ил)-6-метилимидазо-[2,1b][1,3,4]тиадиазол-2-ил)-2-метоксифенокси)этилкарбамат. К раствору 4-(5-(6-амино-5-(трифторметил)пиридин-3-ил)-6-метилимидазо[2,1-b][1,3,4]тиадиазол-2 ил)-2-метоксифенола (0,030 г, 0,07 ммоль, 1 экв.) в сухом ДМФА (0,8 мл), прибавляли трет-бутил 2 бромэтилкарбамат (0,020 г, 0,09 ммоль, 1,25 экв.) и K2CO3 (0,01 г, 0,09 ммоль, 1,25 экв.). Смесь перемешивали при 105 С в течение 2 ч и охлаждали до RT. Растворитель отгоняли и сухой остаток экстрагиро- 23022753 вали DCM, промывали водой (21 мл), сушили (MgSO4), фильтровали и концентрировали до сухости. Очистка при помощи препаративной ВЭЖХ (RP-C18, ACN/вода) давала желаемый продукт (0,006 г,15%). ВЭЖХ-МС: (50-100% В за 8 мин, 0,8 мл/мин): tR=1,75 мин, [М+Н]+ m/z 565. 1(m, 8H), 1,98 (s, 3H). Пример 10. 2-(4-(5-(6-Амино-5-(трифторметил)пиридин-3-ил)-6-метилимидазо[2,1-b][1,3,4]тиадиазол-2-ил)-2 метоксифенокси)-N,N-диметилацетамид. К раствору 4-(5-(6-амино-5-(трифторметил)пиридин-3-ил)-6-метилимидазо[2,1-6][1,3,4]тиадиазол-2 ил)-2-метоксифенола (0,042 г, 0,1 ммоль, 1 экв.) в сухом ДМФА (1 мл) прибавляли 2-хлор-N,Nдиметилацетамид (0,016 г, 0,13 ммоль, 1,25 экв.) и K2CO3 (0,018 г, 0,13 ммоль, 1,25 экв.). Смесь перемешивали при 105 С в течение 1 ч и охлаждали до RT. Растворитель отгоняли, и сухой остаток экстрагировали DCM, промывали водой (21 мл), сушили (Mg SO4), фильтровали и концентрировали до сухости. Очистка при помощи препаративной ВЭЖХ (RP-C18, ACN/вода) и ресуспендирования в Et2O давала желаемый продукт. ВЭЖХ-МС: (5-100% В за 8 мин, 0,8 мл/мин): tR=4,68 мин, [М+Н]+ m/z 507,1. 1(0,018 г, 0,13 ммоль, 1,25 экв.). Смесь перемешивали при 105 С в течение 1 ч и охлаждали до RT. Растворитель отгоняли, и сухой остаток экстрагировали DCM, промывали водой (21 мл), сушили (MgSO4),фильтровали и концентрировали до сухости. Очистка при помощи обращеннофазной хроматографии(RP-C18, ACN/вода) с использованием заранее заполненного картриджа, затем, препаративной ВЭЖХ давала желаемый продукт. ВЭЖХ-МС: (5-100% В за 8 мин, 0,6 мл/мин): tR=3,3 мин, [М+Н]+ m/z 534,1. 1H NMR (300 МГц, CDCl3) /м.д. 8,44 (d, J=1,7, 1 Н), 7,98 (d, J=1,8, 1H), 7,49 (d, J=0,8, 1H), 7,41 (d,J=2,0, 1H), 7,31 (d, J=2,1, 1H), 5,07 (s, 2H), 4,01-3,89 (m, 6H), 3,69-3,59 (m, 4H), 3,47 (s, 3H), 2,62-2,51 (m,3H), 2,38 (dd, J=9,0, 2,7, 7H). Интермедиат G. 2-Бромимидазо[2,1-b][1,3,4]тиадиазол. К суспензии 5-бром-1,3,4-тиадиазол-2-амина (60 г, 0,33 моль) в Н 2 О (1,5 л) прибавляли раствор хлорацетальдегида (50 мас.% в воде, 64,5 мл, 0,50 моль), и смесь перемешивали при температуре дефлегмации в течение 5 ч. Прибавляли вторую порцию хлорацетальдегида (20,6 мл, 0,5 экв.) и перемешивание продолжали в течение ночи. Исходный материал расходовался полностью и реакционную смесь охлаждали до RT. Твердое вещество удаляли фильтрованием и промывали водой. Маточный раствор нейтрализовали насыщ. водн. раствор NaHCO3 и экстрагировали DCM (21L). Органические слои промывали соляным раствором (2600 мл), сушили и упаривали в вакууме. Полученный коричневый продукт ресуспендировали со смесью МеОН и МТВЕ (1:1, 70 мл) для получения желаемого продукта в виде бледно-желтого твердого вещества. Маточные растворы очищали при помощи хроматографии (SiO2,DCM) для получения дополнительного количества продукта. Суммарный выход: 9,4 г (14%). МС (ESI+):NIS (3,83 г, 16,2 ммоль, 1,1 экв.) прибавляли в раствор 2-бромимидазо[2,1-b][1,3,4]тиадиазола (3,0 г,14,7 ммоль, 1 экв.) в сухом ДМФА (50 мл). Смесь перемешивали при RT в течение 4 ч, затем выливали в водн. Na2S2O3 (10%) и разбавляли EtOAc. Органическую фазу промывали водой, сушили и концентрировали с образованием желаемого продукта (светло-коричневое твердое вещество; 4,34 г, выход 89%). 1(1,26 г, 4,8 ммоль, 1,5 экв.) в безводном ТГФ (8 мл) прибавляли диизопропидазодикарбонилат (0,94 мл,4,8 ммоль, 1,5 экв.) по каплям при 0 С. Раствор перемешивали при RT в течение 45 ч. Растворитель уда- 24022753 ляли, и полученный светло-оранжевый маслянистый остаток обрабатывали 20% смесьюAcOEt/циклогексан с образованием белых кристаллов (PPh3O), которые отфильтровывали и промывали той же смесью. Фильтрат упаривали с образованием маслянистого остатка, который обрабатывали циклогексаном и несколькими каплями AcOEt с образованием белого осадка, который удаляли при помощи фильтрования, и маслянистого осадка, который отвердевал при стоянии. Сырой продукт (1,93 g, содержащий некоторое количество циклогексана) использовали, как таковой, в последующей стадии. Остаток очищали при помощи колоночной хроматографии (колонка Isolute Flash Si II, 25 г силикагеля, 0-8% AcOEt в циклогексане) с образованием чистого желаемого продукта (0,991 г). ВЭЖХ-МС (10-95% В за 4 мин при 0,5 мл + 2 мин 100% В, поток 0,8 мл/мин, 50 С): tR=5,10 мин, [M+H]+m/z 334,3. Интермедиат J. трет-Бутиловый эфир 4-[4-(5-иод-имидазо[2,1-b][1,3,4]тиадиазол-2-ил)-2-метоксифенокси]пиперидин-1-карбоновой кислоты. К суспензии 2-бром-5-иодимидазо[2,1-b][1,3,4]тиадиазола (0,262 г, 0,794 ммоль, 1 экв.) в 1,4 диоксане(13 мл) прибавляли трет-бутиловый эфир 4-[2-метокси-4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)фенокси]пиперидин-1-карбоновой кислоты (0,413 г, 0,953 ммоль, 1,2 экв.),Cs2CO3 (0,517 г, 1,588 ммоль, 2 экв.), дихлор-бис-(трифенилфосфин)палладия(II) (0,056 г, 0,079 ммоль,0,1 экв.) и воду (6 мл). Полученную смесь нагревали при 115 С в течение ночи. Растворители удаляли и сырой продукт очищали на колонке Isolute Флеш Si II (25 г силикагеля, 10-21% EtOAc в циклогексане) с образованием желаемого продукта (0,21 г). ВЭЖХ-МС (10-95% В за 4 мин при 0,5 мл + 2 мин 100% В,поток 0,8 мл/мин, 50 С): tR=4,98 мин, [М+Н]+ m/z 557,1. Интермедиат K. трет-Бутиловый эфир 4-4-[5-(6-амино-5-трифторметилпиридин-3-ил)имидазо[2,1b][1,3,4]тиадиазол-2-ил]-2-метоксифеноксипиперидин-1-карбоновой кислоты. Смесь трет-бутилового эфира 4-[4-(5-иод-имидазо[2,1-b][1,3,4]тиадиазол-2-ил)-2-метоксифенокси]пиперидин-1-карбоновой кислоты (94 мг, 0,169 ммоль, 1 экв.), 5-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)-3-трифторметилпиридин-2-иламина (73 мг, 0,253 ммоль, 1,5 экв.), 1,4 диоксана (5 мл), K2CO3 (70 мг, 0,507 ммоль, 3 экв.), Н 2 О (2 мл) и Pd(PPh3)2Cl2 (12 мг, 0,0169 ммоль, 0,1 экв.) нагревали при микроволновом облучении (120 С, 30 мин). Растворители удаляли, и остаток разделяли между Н 2 О и EtOAc. Органический слой сушили, фильтровали и упаривали. Остаток очищали на колонке Isolute Флеш Si II (10-25% EtOAc в циклогексане и 20% МеОН в DCM) и при помощи препаративной ВЭЖХ с образованием желаемого продукта (7 мг) в виде желтого твердого вещества. Водную фазу, кроме того, экстрагировали MeOH/DCM 1:9, органические слои сушили, фильтровали и упаривали. Остаток ресуспендировали с МеОН/ДМСО, фильтровали и промывали CH3CN с образованием желаемого продукта (18 мг, в целом выход: 25%). ВЭЖХ-МС (5-100% В за 8 мин при 0,8 мл): tR=2,95 мин,[М+Н]+ m/z 591,2. 1(m, 2 Н), 1,41 (s, 9H). Пример 12. 5-2-[3-Метокси-4-(пиперидин-4-илокси)фенил]имидазо[2,1-b][1,3,4]тиадиазол-5-ил-3 трифторметилпиридин-2-иламин. трет-Бутиловый эфир 4-4-[5-(6-амино-5-трифторметилпиридин-3-ил)имидазо[2,1b][1,3,4]тиадиазол-2-ил]-2-метоксифеноксипиперидин-1-карбоновой кислоты (23 мг; 0,039 ммоль; 1 экв.) суспендировали в безводном DCM (3 мл) и прибавляли 4 М HCl в 1,4-диоксане (0,097 мл, 0,39 ммоль, 10 экв.). Реакционную смесь перемешивали при RT в течение ночи. Растворители удаляли и остаток упаривали совместно с DCM ( 3). Остаток ресуспендировали в CH3CN и фильтровали с образованием желаемого продукта в виде солянокислой соли (19 мг, 92%). ВЭЖХ-МС (5-100% В за 8 мин при 0,8 мл): tR=3,25 мин, [М+Н]+ m/z 491,2. 1(39 мг, 0,253 ммоль, 1,5 экв.), EtOH (5 мл), Et3N (0,070 мл, 0,507 ммоль, 3 экв.) и Pd(PPh3)2Cl2 (12 мг,0,0169 ммоль, 0,1 экв.) нагревали при микроволновом облучении (120 С, 30 мин). Растворители удаляли при пониженном давлении, и остаток обрабатывали Et2O. Фильтрат упаривали, и остаток очищали при помощи ВЭЖХ с образованием желаемого продукта (12 мг; 13%) в виде бесцветного масла. ВЭЖХ-МСDCM (1 мл) и прибавляли 4 М HCl (0,051 мл, 0,204 ммоль, 10 экв.). Реакционную смесь перемешивали при RT в течение 2 ч. Избыток кислоты упаривали совместно с DCM (3) с образованием желаемого продукта (9 мг, 100%) в виде белого твердого вещества. ВЭЖХ-МС (5-100% В за 8 мин при 0,8 мл):(m, 1H), 4,10 (s, 3H), 3,94 (s, 3H), 3,45 (m, 2H), 3,21 (m, 2H), 2,17 (m, 4H). Пример 14. трет-Бутиловый эфир 4-4-[5-(2-аминопиримидин-5-ил)имидазо[2,1-b][1,3,4]тиадиазол-2-ил]-2 метоксифеноксипиперидин-1-карбоновой кислоты. Смесь трет-бутилового эфира 4-[4-(5-иод-имидазо[2,1-b][1,3,4]тиадиазол-2-ил)-2-метоксифенокси]пиперидин-1-карбоновой кислоты (82 мг, 0,147 ммоль, 1 экв.), пинаколового эфира 2-аминопиримидин 5-бороновой кислоты (48 мг, 0,22 ммоль, 1,5 экв.), 1,4-диоксана (4 мл), K2CO3 (61 мг, 0,441 ммоль, 3 экв.), Н 2 О (1,6 мл) и Pd(PPh3)2Cl2 (10 мг, 0,0147 ммоль, 0,1 экв.) нагревали при микроволновом облучении(120 С, 30 мин). Растворители удаляли и остаток очищали на колонке Isolute Флеш Si II (0-3% МеОН вDCM). Полученный продукт ресуспендировали с EtOAc и фильтровали. Фильтрат упаривали и остаток ресуспендировали с ацетоном. Фильтрат упаривали. Остаток очищали при помощи колоночной хроматографии (EtOAc) с образованием желаемого продукта (11 мг, 14%). ВЭЖХ-МС (5-100% В за 8 мин при 0,8 мл): tR=5,90 мин, [М+Н]+ m/z 524,2. 1DCM (1 мл), и прибавляли 4 М HCl в 1,4-диоксане (0,042 мл, 0,17 ммоль, 10 экв.). Реакционную смесь перемешивали при RT в течение ночи. Растворитель отгоняли и остаток упаривали с DCM (3). Остаток ресуспендировали в CH3CN и фильтровали. Полученное маслянистое твердое вещество растворяли в МеОН и упаривали с образованием желаемого продукта в виде солянокислой соли (6 мг, 77%). ВЭЖХМС (5-100% В за 8 мин при 0,8 мл): tR=3,29 мин, [М+Н]+ m/z 424,1. 1(0,5 г,2,5 ммоль,1 экв.),3,4 диметоксифенилбороновой кислоты (0,683 г, 3,7 ммоль, 1,5 экв.), диоксана (12,5 мл) и Na2CO3 (2 М водн. раствор, 3,8 мл) дегазировали в течение 20 мин при комнатной температуре. Прибавляли Pd(Ph3P)2Cl2, и реакцию нагревали при 110 С в течение 2 ч в атмосфере аргона. Реакционную смесь разбавляли EtOAc и промывали водой. Объединенные органические слои сушили (Na2SO4), фильтровали и концентрировали,и остаток очищали при помощи колоночной хроматографии (SiO2, циклогексан/20-100% этилацетат). Продукт затем очищали при помощи ресуспендирования с Et2O, отфильтровывали и сушили с образованием желаемого продукта (0,080 г). 1H NMR (300 МГц, ДМСО) /м.д. 8,18 (d, J=1,4, 1 Н), 7,47 (m, 2 Н), 7,33 (d, J=1,4, 1 Н), 7,15 (d, J=8,3,1H), 3,86 (s. 3 Н), 3,75 (s, 3 Н). Фильтрат концентрировали, снова растворяли в DCM и очищали при помощи флеш-хроматографии(SiO2, DCM/1% МеОН) для получения желаемого продукта (0,65 г, содержащего некоторое количествоPh3PO) который использовали, как таковой, на следующей стадии. Интермедиат N. 2-(3,4-Диметоксифенил)-5-иод-имидазо[2,1-b][1,3,4]тиадиазол. 2-(3,4-Диметоксифенил)имидазо[2,1-b][1,3,4]тиадиазол (из предыдущей стадии, 0,65 г, 2,50 ммоль,1 экв.) растворяли в ДМФА (9 мл) и прибавляли NIS (0,41 г, 1,75 ммоль, 0,7 экв.). Смесь перемешивали при RT в атмосфере аргона. Через 2 ч анализ ВЭЖХ-МС показал неполное превращение; прибавляли 0,1 г NIS, реакционную смесь перемешивали при RT в течение ночи. Прибавляли еще 0,08 г NIS; и еще через 2 ч перемешивания при RT реакционную смесь выливали в 20 мл водн. тиосульфата натрия (10%) и экстрагировали EtOAc. Объединенные органические слои промывали водой, сушили (Na2SO4) и концентрировали, остаток (0,888 г) очищали при помощи колоночной хроматографии (SiO2, циклогексан/20-100%EtOAc) для получения желаемого продукта (белое твердое вещество, 0,336 г, 36% выход, 2 стадии). ВЭЖХ-МС: (10-95% В за 4 мин, 0,5 мл/мин + 2 мин 100% В, 0,7 мл/мин): tR=4,42 мин, [М+Н]+ m/z 387,9. 1H NMR (300 МГц, ДМСО) /м.д. 7,50 (dd, J=2,2, 8,4, 1H), 7,42 (d, J=2,1, 1H), 7,37 (s, 1 Н), 7,16 (d,J=8,5,1H), 3,89 (s, 3 Н), 3,86 (s, 3 Н). Пример 16. 2,5-бис-(3,4-Диметоксифенил)имидазо[2,1-b][1,3,4]тиадиазол. Смесь 2-(3,4-диметоксифенил)-5-иод-имидазо[2,1-b][1,3,4]тиадиазола (0,10 г, 0,3 ммоль, 1 экв.), диоксана (5 мл), 3,4-диметоксифенилбороновой кислоты (0,12 г, 0,6 ммоль, 2,5 экв.), Pd(Ph3P)2Cl2 (0,018 г,0,1 экв.), K2CO3 (0,178 г, 1,3 ммоль, 5 экв.) и воды (2 мл) нагревали в микроволновой печи (120 С, 30 мин). Реакционную смесь концентрировали и остаток очищали при помощи колоночной хроматографии(SiO2, циклогексан/5-100% EtOAc). Полученный продукт ресуспендировали в МеОН/Et2O с образованием желаемого продукта (желтое твердое вещество, 0,026 г, 26%). ВЭЖХ-МС: (5-100% В в 10 мин, 0,6 мл/мин, 50 С): tR = 7,24 мин, [М+Н]+ m/z 398,1. 1(m, 2H), 7,17 (d, J=8,2, 1H), 7,09 (d, J=8,5, 1H), 3,88 (s, 6H), 3,86 (s, 3H), 3,81 (s, 3H). Пример 17. 5-[2-(3,4-Диметоксифенил)имидазо[2,1-b][1,3,4]тиадиазол-5-ил]пиридин-2-карбонитрил. Смесь 2-(3,4-диметоксифенил)-5-иод-имидазо[2,1-b][1,3,4]тиадиазола (0,10 г, 0,3 ммоль. 1 экв.), диоксана (5 мл), пинаколового эфира 2-цианопиридин-5-бороновой кислоты (0,155 г, 0,64 ммоль, 2,5 экв.),Pd(Ph3P)2Cl2 (0,018 г, 0,1 экв.), карбоната калия (0,178 г, 1,3 ммоль, 5 экв.) и воды (2 мл) нагревали в микроволновой печи (120 С, 30 мин) и оставляли охлаждаться до RT. Образовавшийся осадок отфильтровывали (0,048 г) и промывали смесью Et2O с небольшим количеством МеОН для получения желаемого продукта (белое твердое вещество, 0,029 г, 31%). ВЭЖХ-МС: (5-100% В за 8 мин, 0,8 мл/мин, 50 С): tR=5,37 мин, [М+Н]+ m/z 364,1. 1H NMR (300 МГц, ДМСО)9,47-9,39 (m, 1H), 8,68 (dd, J=8,3, 2,3, 1H), 8,23-8,10 (m, 2H), 7,60 (dd,J=8,3, 2,3, 1H), 7,51 (d, J=2,1, 1H), 7,17 (d, J=8,5, 1H), 3,91 (s, 3H), 3,87 (s, 3H); Пример 18. 2-Амино-5-[2-(3,4-диметоксифенил)имидазо[2,1-b][1,3,4]тиадиазол-5-ил]никотинонитрил. Смесь 2-(3,4-диметоксифенил)-5-иод-имидазо[2,1-b][1,3,4]тиадиазола (0,1 г, 0,258 ммоль, 1 экв.), 2 амино-5-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)никотинонитрила (0,11 г, 0,449 ммоль, 1,74 экв.),PdCl2(Ph3P)2 (36 мг, 0,052 ммоль, 0,2 экв.) и Na2CO3 (2 М водный раствор, 0,5 мл) в диоксане нагревали при 110 С в течение 2,5 ч. Реакцию охлаждали до RT, и растворители удаляли при пониженном давлении. Остаток обрабатывали водой, обрабатывали ультразвуком, затем фильтровали. Твердое вещество промывали водой, Et2O, Et2O/MeOH (9:1) и сушили. Остаток очищали на силикагеле (isolute flash-Si II,DCM/MeOH 5-10% МеОН; и Biotage, MeOH/DCM, 0-10%) с образованием желаемого продукта (21 мг,22%). ВЭЖХ-МС: (5-100% В за 8 мин, 0,8 мл/мин, 50 С): tR=4,68 мин, [М+Н]+ m/z 379,1. 1H NMR (300 МГц, ДМСО)8,91 (d, J=2,4 Гц, 1H), 8,45 (d, J=2,4 Гц, 1H), 7,72 (s, 2H), 7,56 (dd,J=8,4, 2,1 Гц, 1H), 7,48 (d, J=2,1 Гц, 1H), 7,17 (m, 3 Н), 3,89 (s, 3 Н), 3,86 (s, 3 Н). Пример 19. трет-Бутиловый эфир 4-5-[2-(3,4-диметоксифенил)имидазо[2,1-b][1,3,4]тиадиазол-5 ил]пиримидин-2-илпиперазин-1-карбоновой кислоты. Смесь 2-(3,4-диметоксифенил)-5-иод-имидазо[2,1-b][1,3,4]тиадиазола (0,3 г, 0,775 ммоль, 1 экв.),PdCl2(Ph3P)2 (0,11 г, 0,155 ммоль, 0,2 экв.), пинаколового эфира 2-(4-трет-бутоксикарбонил-пиперазин-1 ил)пиримидин-5-бороновой кислоты (0,454 г, 1,16 ммоль, 1,5 экв.) и Na2CO3 (2 М водный раствор, 1,5 мл) в диоксане (4,5 мл) нагревали при 110 С в течение 2,5 ч. Реакцию охлаждали до RT, и растворители удаляли при пониженном давлении. Остаток обрабатывали водой, обрабатывали ультразвуком и фильтровали. Твердое вещество промывали водой, Et2O и сушили с образованием желаемого продукта (416 мг,100%). ВЭЖХ-МС: (5-100% В за 8 мин, 0,8 мл/мин, 50 С): tR=6,48 мин, [М+Н]+ m/z 524,2. 1H NMR (300 МГц, ДМСО)8,99 (s, 2H), 7,70 (s, 1H), 7,55 (d, J=8,4 Гц, 1H), 7,47 (s, 1 Н), 7,15 (d,J=8,4 Гц, 1H), 3,88 (s, 3 Н), 3,86 (s, 3 Н), 3,80 (m, 4 Н), 3,43 (m, 4 Н), 1,43 (s,9H). Пример 20. 2-(3,4-Диметоксифенил)-5-(2-пиперазин-1-ил-пиримидин-5-ил)имидазо[2,1-b][1,3,4]тиадиазол. К суспензии трет-бутилового эфира 4-5-[2-(3,4-диметоксифенил)имидазо[2,1-b][1,3,4]тиадиазол-5 ил]пиримидин-2-илпиперазин-1-карбоновой кислоты (0,105 г, 0,201 ммоль, 1 экв.) в диоксане (1,5 мл) прибавляли 4 М HCl в диоксане (0,5 мл, 0,2 ммоль, 10 экв.) при 0 С. Реакцию оставляли нагреваться доRT и перемешивали в течение ночи. Через 18 ч дополнительно прибавляли HCl (0,5 мл) и реакцию перемешивали в течение 7 ч. Растворители удаляли при пониженном давлении и остаток обрабатывалиCH3CN. Твердые вещества отфильтровывали и промывали CH3CN с образованием желаемого продукта в виде солянокислой соли (72 мг, 77%). ВЭЖХ-МС: (5-40% В за 8 мин, 0,8 мл/мин, 50 С): tR=4,68 мин,[М+Н]+ m/z 424,2. 1(0,102 мл, 1,36 ммоль, 12 экв.) и уксусной кислоты (0,02 мл, 0,136 ммоль, 1,2 экв.) в МеОН (2 мл) прибавляли цианоборогидрид натрия (0,1 г, 1,58 ммоль, 14 экв.). Реакционную смесь перемешивали при RT в течение 2 ч. Растворители отгоняли до сухости, и остаток растворяли в насыщ. NaHCO3/EtOAc. Слои разделяли и водный слой один раз экстрагировали EtOAc. Объединенные органические слои сушили,фильтровали и упаривали. Остаток очищали при помощи ВЭЖХ с образованием желаемого продукта (6 мг, 12%). ВЭЖХ-МС: (5-40% В за 8 мин, 0,8 мл/мин, 50 С): tR=4,64 мин, [М+Н]+ m/z 438,2. 1(0,354 г, 0,775 ммоль, 1,5 экв.) и Na2CO3 (2 М водный раствор, 1 мл) в диоксане (4 мл) нагревали при 110 С в течение 2,5 ч. Реакцию охлаждали до RT и растворители удаляли при пониженном давлении. Остаток обрабатывали водой, обрабатывали ультразвуком и фильтровали. Твердое вещество промывали водой и очищали при помощи колоночной хроматографии (Biotage, cHex/EtOAc 10-100%) для получения желаемого продукта (170 мг, 56%). ВЭЖХ-МС: (5-100% В за 8 мин, 0,8 мл/мин, 50 С): tR=7,36 мин,[М+Н]+ m/z 591,2. 1H NMR (300 МГц, CDCl3)8,98 (d, J=2,0 Гц, 1 Н), 8,56 (d, J=2,2 Гц, 1H), 7,62 (s, 1H), 7,42 (m, 2H),6,95 (m, 1H), 3,98 (s, 3H), 3,96 (s, 3H), 3,57 (m, 4H), 3,31 (m, 4H), 1,50 (s, 9H). Пример 22. 2-(3,4-Диметоксифенил)-5-(6-пиперазин-1-ил-5-трифторметилпиридин-3-ил)имидазо[2,1b][1,3,4]тиадиазол. К раствору трет-бутилового эфира 4-5-[2-(3,4-диметоксифенил)имидазо[2,1-b][1,3,4]тиадиазол-5 ил]-3-трифторметилпиридин-2-илпиперазин-1-карбоновой кислоты (0,15 г, 0,254 ммоль, 1 экв.) в диоксане (4 мл) прибавляли избыток 4 М HCl в диоксане (20 экв.) при 0 С. Реакцию оставляли нагреваться доRT и перемешивали в течение 6,5 ч. Растворители удаляли при пониженном давлении для получения желаемого продукта в виде солянокислой соли (146 мг, 100%). ВЭЖХ-МС: (5-40% В за 8 мин, 0,8 мл/мин, 50 С): tR=5,65 мин и 5,96 мин, [М+Н]+ m/z 491,2. 1(0,180 мл, 2,39 ммоль, 12 экв.) и уксусной кислоты (0,02 мл, 0,239 ммоль, 1,2 экв.) в МеОН (4 мл) прибавляли цианоборогидрид натрия (0,175 г, 2,79 ммоль, 14 экв.). Реакционную смесь перемешивали приRT в течение 2 ч. Растворители отгоняли до сухости, и остаток растворяли в насыщ. NaHCO3/EtOAc. Слои разделяли, и водный слой экстрагировали один раз EtOAc. Объединенные органические слои сушили, фильтровали и упаривали. Остаток очищали на силикагеле (isolute flash-Si II, 10 г, 96:4 DCM/7NNH3 в МеОН) с образованием желаемого продукта (50 мг, 50%). ВЭЖХ-МС: (5-100% В за 8 мин, 0,8 мл/мин, 50 С): tR=3,47 мин, [М+Н]+ m/z 505,3. 1K2CO3 (0,357 г, 2,584 ммоль, 4 экв.) в смеси 1,2-диметиловый эфир/Н 2 О (9/1, 5 мл) перемешивали при RT в течение 10 мин. Затем прибавляли PdCl2(dppf) (0,053 г, 0,0646 ммоль, 0,1 экв.) и реакционную смесь нагревали при 85 С в течение 4 ч. Растворители отгоняли и к остатку прибавляли воду. Суспензию экстрагировали EtOAc (3) и объединенные органические слои сушили, фильтровали и упаривали. Остаток очищали на картридже Isolute Si II с использованием МеОН в DCM (0-1%) с образованием желаемого продукта (47 мг). Водную фазу упаривали до сухости, остаток снова растворяли в DCM и фильтровали. Фильтрат упаривали и очищали так, как описано выше, с образованием дополнительного желаемого продукта (136 мг). Общее полученное количество: 183 мг. Общий выход: 73%. ВЭЖХ-МС: (5-100% В за 8 мин, 0,8 мл/мин, 50 С): tR=5,46 мин, [М+Н]+ m/z 386,2. 1MCPBA (0,043 г, 0,249 ммоль, 1,2 экв.) прибавляли в раствор 2-(3,4-диметоксифенил)-5-(2 метилсульфанилпиримидин-5-ил)имидазо[2,1-b][1,3,4]тиадиазола (0,08 г, 0,207 ммоль, 1 экв.) в безводном DCM (мин. объем) при 0 С под Ar. Реакционную смесь оставляли до достижения RT и перемешивали в течение 2 ч. Прибавляли дополнительное количество DCM, органическую фазу промывали 2N водн.Na2CO3 (2 ), сушили (MgSO4), фильтровали, концентрировали и сушили с образованием желаемого продукта в виде бледно-желтого твердого вещества (72 мг, 87%). ВЭЖХ-МС: (5-100% В за 8 мин, 0,8 мл/мин, 50 С): tR=3.98 мин, [М+Н]+ m/z 402,1. 1N'-5-[2-(3,4-Диметоксифенил)имидазо[2,1-b][1,3,4]тиадиазол-5-ил]пиримидин-2-ил-N,N-диметилэтан-1,2-диамин. 2-(3,4-Диметоксифенил)-5-(2-метансульфинилпиримидин-5-ил)имидазо[2,1-b][1,3,4]тиадиазол (66 мг, 0,164 ммоль, 1 экв.) растворяли в 1,4-диоксане (мин. объем) при 75 С. Прибавляли N,Nдиметилэтилендиамин (0,053 мл, 0,493 ммоль, 3 экв.), и раствор нагревали при 85 С в течение 4 ч. Растворитель удаляли и остаток ресуспендировали в Et2O, фильтровали и дополнительно промывали растворителем с образованием желаемого продукта в виде бледно-желтого твердого вещества (46 мг, 66%). ВЭЖХ-МС: (5-100% В за 8 мин, 0,8 мл/мин, 50 С): tR=2,87 мин, [М+Н]+ m/z 426,3. 1(d, J=9,0 Гц, 7 Н), 3,52 (dd, J=11,4, 5,7 Гц, 2 Н), 2,56 (t, J=6,0 Гц, 2 Н), 2,28 (s, 7H) м.д. Пример 27. 2-(3,4-Диметоксифенил)-5-(5-метоксипиридин-3-ил)имидазо[2,1-b][1,3,4]тиадиазол. 2-Бром-5-иодимидазо[2,1-b][1,3,4]тиадиазол (0,20 г, 0,606 ммоль, 1 экв.) растворяли в диоксане (4 мл), и прибавляли 3,4-диметоксифенилбороновую кислоту (0,121 г, 0,667 ммоль, 1,1 экв.), затем насыщенный раствор K2CO3 (1 мл). Суспензию дегазировали (N2, 10 мин), и прибавляли Pd(dppf)Cl2.DCM(0,085 г, 0,121 ммоль, 0,2 экв.). Смесь нагревали в атмосфере азота при 110 С в течение 2 ч, до того момента, когда наблюдали полное превращение при помощи LC-MC. Прибавляли пинаколовый эфир 3 метоксипиридин-5-бороновой кислоты (0,284 г, 1,21 ммоль, 2 экв.), затем Pd(dppf)Cl2.DCM (0,085 г, 0,121 ммоль, 0,2 экв.) и насыщенный раствор K2CO3 (1 мл). Смесь перемешивали в микроволновой печи(120 С, 30 мин), охлаждали до RT и концентрировали. Остаток экстрагировали в AcOEt и N-BuOH и промывали водой. Органическую фазу отделяли, сушили (Na2SO4), фильтровали и концентрировали, и сырой продукт очищали при помощи флэш-хроматографии (SiO2, DCM/EtOAc) затем, при помощи препаративной ВЭЖХ (RP-C18, ACN/вода) с образованием желаемого продукта. ВЭЖХ-МС (10-95% В за 4 мин при 0,5 мл + 2 мин 100% В, поток 0,8 мл/мин, 50 С): tR=4,09 мин, [М+Н]+ m/z 369,1. 1(1H, s), 7,52 (1H dd, J=8,4, 2,1 Гц), 7,46 (1H, d, J=2,1 Гц), 7,12 (1H, d, J=8,4 Гц), 3,88 (3 Н, s), 3,83 (3 Н, s),3,81 (3 Н, s) м.д. Пример 28. 5-[2-(3-Метоксифенил)имидазо[2,1-b][1,3,4]тиадиазол-5-ил]-3-трифторметилпиридин-2-иламин. К реакционной смеси 2-бром-5-иодимидазо[2,1-b][1,3,4]тиадиазола (0,150 г, 0,455 ммоль), 3 метоксифенилбороновой кислоты (0,477 ммоль) и PdCl2(Ph3P)2 (0,064 г) в диоксане (3 мл), прибавляли насыщ. водн. раствор K2CO3 (1 мл). Смесь нагревали при 110 С в течение 24 ч в запаянной ампуле. Растворитель отгоняли, остаток осаждали водой и после высушивания полученное вязкое вещество промывали Et2O. Остаток суспендировали в диоксане (3 мл), прибавляли 5-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)-3-трифторметилпиридин-2-иламин (1,2 экв.), PdCl2(Ph3P)2 (0,2 экв.) и насыщ. раствор K2CO3 (1 мл) и нагревали при 100 С в течение 16 ч. Растворитель отгоняли до сухости и остаток очищали при помощи автоматизированной хроматографии в DCM/MeOH, 100:0-95:5), затем при помощи
МПК / Метки
МПК: A61P 33/00, A61P 25/00, A61P 31/12, C07D 513/04, A61P 17/06, A61P 29/00, A61K 35/00, A61K 31/41
Метки: ингибиторов, применения, качестве, киназ, имидазотиадиазолы
Код ссылки
<a href="https://eas.patents.su/30-22753-imidazotiadiazoly-dlya-primeneniya-v-kachestve-ingibitorov-kinaz.html" rel="bookmark" title="База патентов Евразийского Союза">Имидазотиадиазолы для применения в качестве ингибиторов киназ</a>
Предыдущий патент: Длинные растворимые полипептиды рн20 и их использование
Следующий патент: Циклопропильные ингибиторы полимеразы
Случайный патент: Повышение устойчивости серебра к потускнению












