Циклопропильные ингибиторы полимеразы
Номер патента: 22754
Опубликовано: 29.02.2016
Авторы: Йонкерс Тим Хьюго Мария, Рабуассон Пьер Жан-Мари Бернар, Вандик Коэн
Формула / Реферат
1. Соединение формулы (I)
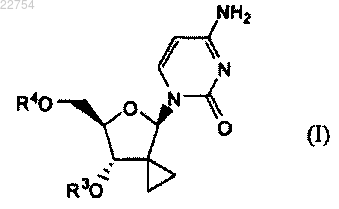
включая все его возможные стереоизомеры,
где R3 и R4 независимо выбраны из группы, состоящей из водорода, -C(=O)R5 и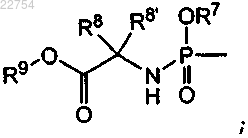
каждый R5 независимо выбран из группы, состоящей из водорода и C1-C6-алкила;
R7 является фенилом, необязательно замещенным галогеном;
R8 является водородом, C1-C6-алкилом или бензилом;
R8' является водородом, C1-C6-алкилом или бензилом;
R9 является C1-C6-алкилом или бензилом,
при условии, что R3 и R4, одновременно, не являются водородом,
или его фармацевтически приемлемые соли или сольваты.
2. Соединение по п.1, где R3 является водородом и R4 является группой формулы
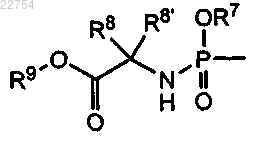
3. Соединение по п.1 или 2, где R8 является водородом и R8' является водородом или C1-C6-алкилом.
4. Соединение по п.1 или 2, где один из R3 и R4 является -C(=O)R5 и другой из R3 и R4 является водородом или где R3 и R4, оба, являются -C(=O)R5, R5 является водородом.
5. Соединение по любому из пп.1 или 2-4, где R9 является C1-C6-алкилом или бензилом.
6. Соединение по п.1, где соединение имеет формулу
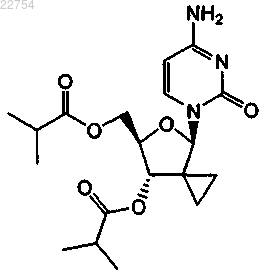
7. Соединение по п.6, где соединение находится в свободной форме.
8. Фармацевтическая композиция, содержащая эффективное противовирусное количество соединения формулы (I) по любому из пп.1-7 и фармацевтически приемлемый носитель.
9. Применение соединения формулы (I) по любому из пп.1-7, где R3 и R4 являются водородом, в качестве ингибитора ВГС.
10. Применение соединения по п.9, где в соединении формулы (I) R3 и R4 являются водородом, в качестве ингибитора ВГС.
11. Применение соединения по п.10, где соединение находится в свободной форме, в качестве ингибитора ВГС.
12. Комбинация, содержащая соединение формулы (I), в том числе и соединение формулы (I), где R3 и R4 являются водородом, с другим ингибитором ВГС.
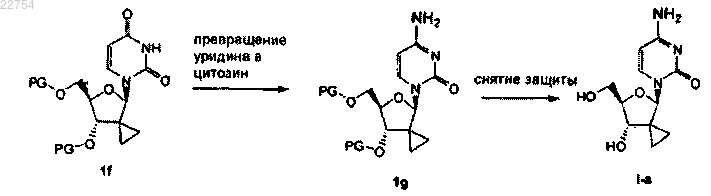
13. Способ получения соединения формулы (I) по любому из пп.1-7, в котором соединение формулы (I), где R3 и R4, оба, являются водородом, получают путем превращения урацила в цитозин, исходя из 2'-дезокси-2'-спироциклопропилуридина 1f до соответствующего 2'-дезокси-2'-спироциклопропилцитидина 1g, с последующим удалением PG защитных групп, получая соединение I-а:
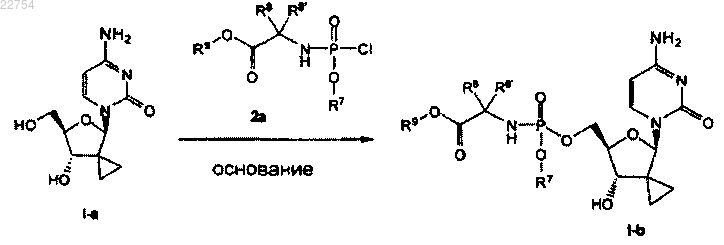
14. Способ получения соединения формулы (I) по любому из пп.1-7, в котором R3 является водородом и R4 является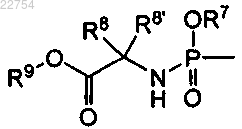 , путем реакции соединения I-а с фосфорохлоридатом 2а в присутствии основания, получая фосфорамидат I-b:
, путем реакции соединения I-а с фосфорохлоридатом 2а в присутствии основания, получая фосфорамидат I-b:
15. Способ получения соединения формулы (I) по любому из пп.1-7, в котором R3 является водородом и R4 является -C(=O)R5 или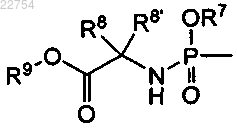 или R3 и R4 независимо друг от друга являются -C(=O)R5 или
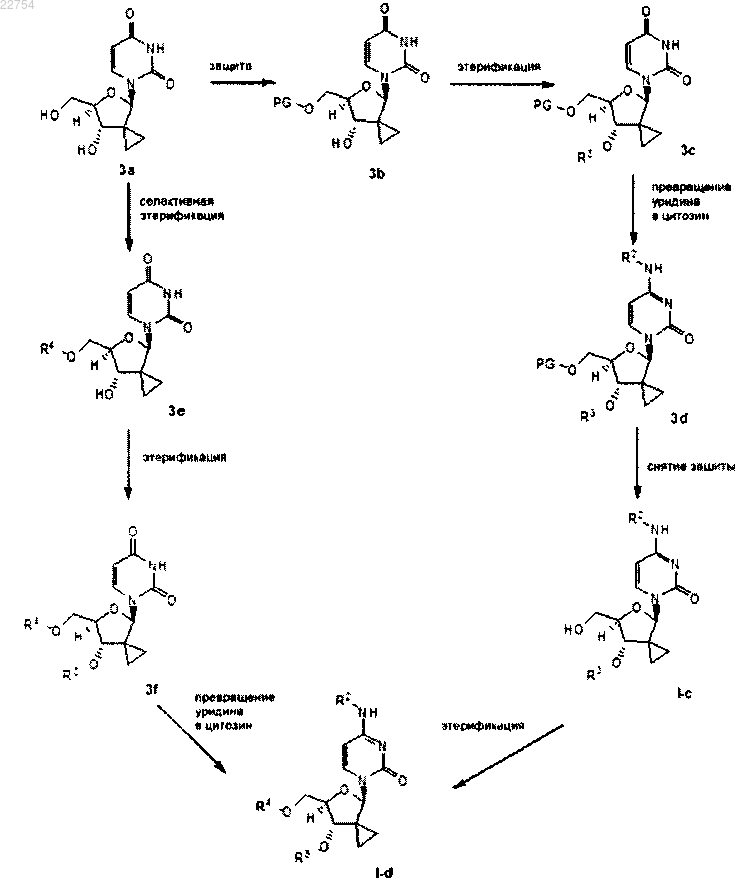
или R3 и R4 независимо друг от друга являются -C(=O)R5 или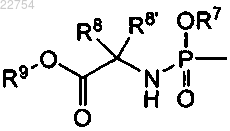 , путем селективной защиты 5'-гидроксигруппы в промежуточном соединении 3а, получая промежуточное соединение 3b, которое, в свою очередь, этерифицируется до промежуточного соединения 3с, с последующим превращением урацила в цитозин до промежуточного соединения 3d; снятие защиты последнего до 3'-моноэфира I-c или этерификация 5'-гидроксигруппы в I-c приводит к соединению I-d; или за счет селективной этерификации 5'-гидроксигруппы в промежуточном соединении 3а, вводя, таким образом, группу R4, что приводит к промежуточному соединению 3е, и промежуточное соединение 3е затем этерифицируется другой кислотой, за счет чего вводится группа R3, давая диэфирное промежуточное соединение 3f, которое вводится в реакцию превращения урацила в цитозин, давая соединение I-d:
, путем селективной защиты 5'-гидроксигруппы в промежуточном соединении 3а, получая промежуточное соединение 3b, которое, в свою очередь, этерифицируется до промежуточного соединения 3с, с последующим превращением урацила в цитозин до промежуточного соединения 3d; снятие защиты последнего до 3'-моноэфира I-c или этерификация 5'-гидроксигруппы в I-c приводит к соединению I-d; или за счет селективной этерификации 5'-гидроксигруппы в промежуточном соединении 3а, вводя, таким образом, группу R4, что приводит к промежуточному соединению 3е, и промежуточное соединение 3е затем этерифицируется другой кислотой, за счет чего вводится группа R3, давая диэфирное промежуточное соединение 3f, которое вводится в реакцию превращения урацила в цитозин, давая соединение I-d:
Текст
Йонкерс Тим Хьюго Мария,Рабуассон Пьер Жан-Мари Бернар,Вандик Коэн (BE) где R3 и R4 независимо выбраны из водорода, -C(=O)R5 и каждый R5 независимо 7 выбран из группы, состоящей из водорода и С 1-С 6-алкила; R является фенилом, необязательно замещенным галогеном; R8 и R8' являются водородом, С 1-С 6-алкилом, бензилом; R9 является С 1-С 6-алкилом, бензилом, при условии, что R3 и R4, одновременно, не являются водородом, или его фармацевтически приемлемые соли или сольваты; фармацевтические композиции с соединениямиI; применение соединений I, включая соединения формулы (I), где R3 и R4, одновременно, являются водородом, в качестве ингибиторов ВГС.(71)(73) Заявитель и патентовладелец: СЕНТОКОР ОРТО БАЙОТЕК ПРОДАКТС Эл.Пи. (US); МЕДИВИР АБ (SE) Область техники, к которой относится изобретение Настоящее изобретение относится к нуклеозидным производным, которые являются ингибиторами вируса гепатита С (HCV, ВГС), а также к их применению в лечении или профилактике ВГС. Уровень техники ВГС является одноцепочечным, положительно-полярным РНК вирусом, принадлежащим к семейству флавивирусов в роду гепацивирусов. После первоначальной острой инфекции у большинства инфицированных индивидуумов развивается хронический гепатит, так как ВГС преимущественно реплицируется в гепатоцитах, однако не является напрямую цитопатическим. В частности, отсутствие сильной реакции Т-лимфоцитов и высокая предрасположенность вируса к мутации способствуют высокой скорости хронической инфекции. Хронический гепатит может прогрессировать до печеночного фиброза, приводя к циррозу, конечной стадии болезни печени, и НСС (гепатоцеллюлярная карцинома), что делает его главной причиной трансплантации печени,Существует 6 основных генотипов ВГС и более 50 подтипов, которые по-разному распространены географически. Генотип ВГС 1 является преобладающим генотипом в Европе и США. Широкая неоднородность генетического состава ВГС имеет важные диагностические и клинические значения, возможно объясняя трудности разработки вакцин и ограниченную эффективность применяемой в настоящее время терапии. Передача ВГС может осуществляться через контакт с зараженной кровью или продуктами крови,например после переливания крови или внутривенного применения лекарственного препарата. Внедрение диагностических тестов, используемых при скрининге крови, привело к снижению тенденции заболеваемости ВГС после переливания крови. Однако, принимая во внимание медленное прогрессирование к конечным стадиям заболевания печени, существующие инфекции будут продолжать представлять серьезное медицинское и экономическое бремя в течение долгого времени. Принятые в настоящее время стандарты лечения против ВГС основаны на (пэгилированном) альфаинтерфероне (IFN-) в комбинации с рибавирином. Данная комбинация дает устойчивый вирусологический ответ для примерно 50% пациентов, зараженных генотипом 1 ВГС, и примерно 80% для тех, кто заражен генотипами 2 и 3. Помимо ограниченной эффективности против генотипа 1 ВГС, данная комбинированная терапия обладает значительными побочными эффектами и плохо переносится многими пациентами. Основные побочные эффекты включают гриппозные симптомы, гематологические расстройства и психоневрологические симптомы. Следовательно, существует потребность в более эффективных,удобных и лучше переносимых терапиях. Опыт с лекарственными средствами против ВИЧ, в частности с ингибиторами протеазы ВИЧ, показал, что недостаточно оптимальные фармакокинетические свойства и сложные режимы дозирования быстро приводят к неумышленному невыполнению режима терапии. Это, в свою очередь, означает, что 24 часовая остаточная концентрация (минимальная концентрация в плазме) для соответствующих лекарственных средств при лечении ВИЧ часто падает ниже уровня IC90 или ED90 в течение большей части дня. Считается, что для сдерживания развития мутантов, не восприимчивых к лекарству, необходим такой минимальный 24-часовой уровень, как, по меньшей мере, IC50 и более верно IC90 или ED90. Достижение необходимых фармакокинетических свойств и метаболизма лекарственного средства для достижения таких минимальных уровней обусловливает неотложную задачу при разработке лекарственного средства. Участок NS5B РНК полигена кодирует РНК зависимую РНК-полимеразу (RdRp), которая ответственна за вирусную репликацию. Следовательно, данный фермент вызывал значительный интерес среди медицинских химиков. Известны как нуклеозидные, так и ненуклеозидные ингибиторы NS5B. Нуклеозидные ингибиторы могут действовать как агент, обрывающий цепь, так и как конкурентный ингибитор,который препятствует нуклеозиду связываться с полимеразой. Для работы в качестве агента, обрывающего цепь, нуклеозидный аналог должен быть захвачен клеткой и переведен in vivo в трифосфат. Данное превращение до трифосфата обычно опосредовано клеточными киназами, которые накладывают дополнительные структурные требования на потенциальный нуклеозидный ингибитор полимеразы. Кроме того, это ограничивает прямое исследование нуклеозидов в качестве ингибиторов репликации ВГС с использованием клеточного анализа фосфорилирования in situ. Было сделано несколько попыток по разработке нуклеозидов в качестве ингибиторов RdRp ВГС,однако, несмотря на то что несколько соединений были приняты для клинических испытаний, ни одно не прошло полный путь до регистрации. Среди трудностей с ВГС-направленными нуклеозидами, известными на сегодняшний день, встречались такие, как токсичность, мутагенность, недостаточная селективность, слабая эффективность, низкая биологическая доступность, недостаточно оптимальные режимы дозирования и, вытекающая из этого, высокая нагрузка лекарственного препарата, и стоимость товаров. Несколько патентов и заявок на патент, а также научные публикации раскрывают нуклеозидные аналоги, обладающие ВГС ингибирующей активностью. WO 2004/002999 раскрывает модифицированные 2'- и 3'-нуклеозидные пролекарства для лечения инфекционных заболеваний, вызванных флавивирусами. WO 2008/043704 раскрывает 4-амино-1-2R,3S,4S,5R)-5-азидо-4-гидрокси-5-гидроксиметил-3 метилтетрагидрофуран-2-ил)-1 Н-пиримидин-2-он и сложноэфирные производные в качестве ингибито-1 022754for Microbiology, vol. 51, No. 2, p. 503-509 (2007) раскрывает фосфорилирование и ингибирование NS5B ВГС полимеразы -D-2'-дезокси-2'-фтор-2'С-метилцитидином и некоторыми аналогами. Ни одно из этих соединений не имеет 2'-спироциклопропильного заместителя. Существует потребность в ВГС ингибиторах, которые могут преодолеть один или несколько недостатков применяемой в настоящее время терапии, таких как побочные эффекты, ограниченная эффективность, возникающая устойчивость и невыполнение режима терапии, а также улучшить устойчивый вирусологический ответ. Настоящее изобретение относится к ВГС ингибирующим 4-амино-1-(7-гидрокси-6-гидроксиметил 5-оксаспиро[2.4]гепт-4-ил)-1H-пиримидин-2-онам с полезными свойствами, относящимися к одному или нескольким следующим параметрам: противовирусная активность, благоприятный профиль развития невосприимчивости, благоприятный вирусологический профиль, благоприятный токсикологический и генотоксикологический профиль, благоприятные фармакокинетические и фармакодинамические свойства и простота получения и применения. Одно такое соединение, а именно 4-амино-1-4R,6R,7S)-7 гидрокси-6-гидроксиметил-5-оксаспиро[2.4]гепт-4-ил)-1 Н-пиримидин-2-он,также называемое 2'-дезокси-2'-спироциклопропилцитидин, было описано в Can. J. Chem., vol. 71, p. 413-416, но не в качестве ВГС ингибитора. Соединения по настоящему изобретению также могут быть привлекательны, так как они не обладают активностью против других вирусов, в частности против ВИЧ. ВИЧ инфицированные пациенты часто страдают от сопутствующей инфекции, такой как ВГС. Лечение таких пациентов ВГС ингибитором, который также ингибируют ВИЧ, может приводить к возникновению устойчивых штаммов ВИЧ. Описание изобретения В одном аспекте настоящее изобретение обеспечивает соединения, которые могут быть представлены формулой (I) включая все его возможные стереоизомеры,где R3 и R4 независимо выбраны из группы, состоящей из водорода, -C(=O)R5 и каждый R5 независимо выбран из группы, состоящей из водорода, C1-C6-алкила;R9 является C1-C6-алкилом или бензилом,при условии, что R3 и R4, одновременно, не являются водородом,или их фармацевтически приемлемые соли или сольваты. В другом аспекте изобретение относится к применению соединений формулы (I), как указано в настоящем документе, включая соединение формулы (I), где R3 и R4, одновременно, являются водородом,для ингибирования и лечения ВГС инфекционного заболевания. Кроме того, обеспечивается применение для производства лекарственного препарата соединения формулы (I), как указано в настоящем документе, включая соединение, где R3 и R4, одновременно, являются водородом, для ингибирования и лечения ВГС инфекционного заболевания. Подгруппы соединений формулы (I) являются такими соединениями формулы (I) или подгруппами соединений формулы (I), как определено в настоящем документе, где R3 является водородом. Подгруппы соединений формулы (I) являются такими соединениями формулы (I) или подгруппами соединений формулы (I), как определено в настоящем документе, где R4 является водородом. Подгруппы соединений формулы (I) являются такими соединениями формулы (I) или подгруппами соединений формулы (I), как определено в настоящем документе, где один из R3 и R4 является водородом и другой из R3 и R4 выбран из ацетила, пивалоила и предпочтительно изобутирила; или один из R3 и R4 является водородом и другой из R3 и R4 выбран из лейцила, изолейцила и предпочтительно валила; илиR3 и R4, оба, выбраны из ацетила, пивалоила и предпочтительно изобутирила; или оба R3 и R4, оба, выбраны из лейцила, изолейцила и предпочтительно валила. В одном варианте осуществления R3 является водородом и R4 является таким, как указано выше. В другом варианте осуществления R4 является водородом и R3 является таким, как указано выше. Конкретными подгруппами соединений формулы (I) являются те соединения формулы (I) или подгрупп соединений формулы (I), как определено в настоящем документе, где R3 и R4, оба, являются изобутирилом (-C(=O)-CH(CH3)2). Подгруппы соединений формулы (I) являются такими соединениями формулы (I) или подгруппами соединений формулы (I), как определено в настоящем документе, где R3 является водородом или Подгруппы соединений формулы (I) являются такими соединениями формулы (I) или подгруппами соединений формулы (I), как определено в настоящем документе, где каждый R5 является C1-C6-алкилом,в частности метилом, изопропилом (1-метилэтилом), изобутилом (2-метилпропилом), втор-бутилом(1-метилпропилом). Подгруппы соединений формулы (I) являются такими соединениями формулы (I) или подгруппами соединений формулы (I), как определено в настоящем документе, где (a) R7 является фенилом, необязательно замещенным галогеном. Подгруппы соединений формулы (I) являются такими соединениями формулы (I) или подгруппами соединений формулы (I), как определено в настоящем документе, где R8 является водородом и R8' является метилом или C1-C6-алкилом, таким как изопропил или изобутил. Подгруппы соединений формулы(I) являются такими соединениями формулы (I) или подгруппами соединений формулы (I), как определено в настоящем документе, где остаток является глицилом, аланилом или валилом (Gly, Ala или Val; в частности Gly, L-Ala или L-Val). Подгруппы соединений формулы (I) являются такими соединениями формулы (I) или подгруппами соединений формулы (I), как определено в настоящем документе, где:(d) R3 является метилом, этилом или трет-бутилом. Соединения формулы (I) имеют несколько хиральных центров, в частности, при атомах углерода 1',3' и 4'. Несмотря на то что стереохимия при этих атомах углерода зафиксирована, соединения могут демонстрировать по меньшей мере 75%, предпочтительно по меньшей мере 90%, как, например, выше 95% энантиомерной чистоты при каждом хиральном центре. Хиральность также может присутствовать в за местителях, как, например, в R3 и/или R4 или, как, например, в группе которая может иметь хиральный центр при атоме углерода, несущем R8 (если R8 и R8' различны), и при атоме фосфора. Фосфорный центр может присутствовать как RP или SP, или как смесь таких стереоизомеров, включая рацематы. Также могут иметь место диастереоизомеры, обусловленные хиральным фосфорным центром и хиральным атомом углерода. Варианты осуществления изобретения относятся к применению в качестве ВГС ингибиторов соединения, указанного как 2'-дезокси-2'-спироциклопропилцитидин (соединение формулы (I), где R3 и R4,одновременно, являются водородом); или соединения, указанного как бис-3',5'-изобутирил-2'-дезокси-2'спироциклопропилцитидин (соединение формулы (I), где R3 и R4, одновременно, являются -C(=O)R5, гдеR5 является изопропилом); обоих в свободной форме или в виде их фармацевтически приемлемой соли,полученной добавлением кислоты, или в виде сольвата; в качестве ингибиторов ВГС или для лечения или профилактики ВГС инфекционных заболеваний. Один вариант осуществления относится к соединениям, указанным как соединения 1, 2 а, 2b, 2c, 2d,3, 4, 5, 6 и 7, как указано в разделе "Примеры" далее, в свободной форме. Другой вариант осуществления относится к данным соединениям, а также к их фармацевтически приемлемым солям и сольватам. Конкретный вариант осуществления относится к соединению бис-3',5'-изобутирил-2'-дезокси-2'спироциклопропилцитидин в свободной форме. Следующий конкретный вариант осуществления относится к бис-3',5'-изобутирил-2'-дезокси-2'-спироциклопропилцитидину, его фармацевтически приемлемым солям, полученным добавлением кислоты, и сольватам. В следующих аспектах изобретение обеспечивает соединение формулы (I) или его фармацевтически приемлемую соль, гидрат или сольват для применения в лечении или профилактики (или производстве лекарственного препарата для лечения или профилактики) ВГС инфекционных заболеваний. Типичные генотипы ВГС в условиях лечения или профилактики в соответствии с изобретением включают генотип 1b (преобладающий в Европе) или 1 а (преобладающий в Северной Америке). Изобретение также обеспечивает способ лечения или профилактики ВГС инфекционных заболеваний, в частности генотипа 1 а или 1b. Соединения формулы (I) представлены как определенный стереоизомер. Абсолютная конфигурация таких соединений может быть определена с использованием известных методов в области техники, та-3 022754 ких, например, как рентгенодифракционный метод или ЯМР, и/или с использованием исходных веществ с известной стереохимией. Фармацевтические композиции в соответствии с изобретением должны предпочтительно содержать практически чистые стереоизомерные препараты указанных стереоизомеров. Чистые стереоизомерные формы соединений и промежуточных соединений, как указано в настоящем документе, определены как изомеры, которые практически не содержат другие энантиомерные или диастереомерные формы такой же базовой молекулярной структуры указанных соединений или промежуточных соединений. В частности, термин "стереоизомерно чистый" относится к соединениям или промежуточным соединениям, имеющим стереомерный избыток по меньшей мере от 80% (т.е. минимум 90% одного изомера и максимум 10% других возможных изомеров) до 100% стереомерного избытка (т.е 100% одного изомера и ни одного другого), более конкретно, соединения или промежуточные соединения имеют стереомерный избыток от 90 до 100%, еще более конкретно, имеют стереомерный избыток от 94 до 100% и, наиболее конкретно, имеют стереомерный избыток от 97 до 100%. Термины "энантиомерно чистый" и "диастереомерно чистый" следует понимать аналогичным образом, но они имеют отношение к энантиомерному избытку и диастереомерному избытку, соответственно, рассматриваемой смеси. Чистые стереоизомерные формы соединений и промежуточных соединений настоящего изобретения могут быть получены с использованием известных мелодик области техники. Например, энантиомеры могут быть отделены друг от друга за счет селективной кристаллизации их диастереомерных солей с оптически активными кислотами или основаниями. Такими примерами являются винная кислота, дибензоилвинная кислота, дитолуоилвинная кислота и камфорсульфокислота. Альтернативно, энантиомеры могут быть разделены за счет хроматографических методов с использованием хиральных неподвижных фаз. Указанные чистые стереохимические изомерные формы также могут быть получены из соответствующих чистых стереохимических изомерных форм подходящих исходных веществ при условии, что реакции протекают стереоспецифично. Предпочтительно, если необходим определенный стереоизомер,то указанное соединение синтезируется с использованием стереоспецифичных методов получения. В данных методах предпочтительно используются энантиомерно чистые исходные вещества. Диастереомерные рацематы соединений формулы (I) могут быть получены отдельно традиционными методами. Предпочтительными физическими способами разделения, которые могут быть использованы, например, являются селективная кристаллизация и хроматография, например колоночная хроматография. Настоящее изобретение направлено на включение всех изотопов атомов, встречающихся в присутствующих соединениях. Изотопы включают такие атомы, которые имеют одинаковый атомный номер,но различные массовые числа. В качестве общего примера и без ограничения, изотопы водорода включают тритий и дейтерий. Изотопы углерода включают С-13 и С-14. Фармацевтически приемлемые соли, полученные добавлением, включают терапевтически активные нетоксические солевые формы, полученные добавлением кислоты и основания, соединений формулы (I). Представляющими интерес являются свободные (т.е. не соли) формы соединений формулы (I) или любая подгруппа соединений формулы (I), указанная в настоящем документе. Используемый в настоящем документе термин "свободная форма" относится к соединению формулы (I), которое не находится в форме соли или сольвата. Фармацевтически приемлемые соли, полученные добавлением кислоты, могут быть легко получены за счет обработки свободной формы подходящей кислотой. Подходящие кислоты включают, например,соляную или бромисто-водородную кислоты, серную, азотную, фосфорную и подобные кислоты; или органические кислоты, такие как, например, уксусная, пропионовая, гидроксиуксусная, молочная, пировиноградная, щавелевая (т.е. этандиовая), малоновая, янтарная (т.е. бутандиовая), малеиновая, фумаровая, яблочная (т.е. гидроксибутандиовая), винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламовая, салициловая, п-аминосалициловая, памоевая и подобные кислоты. С другой стороны, указанные солевые формы, полученные добавлением кислоты, могут быть переведены в свободную форму за счет обработки подходящим основанием. Соединения формулы (I), содержащие кислый протон, также могут быть переведены в их фармацевтически приемлемые солевые формы, полученные добавлением металла или амина, за счет обработки свободной формы подходящим органическим или неорганическим основанием. Подходящие основные солевые формы включают, например, аммонийные соли, соли щелочных или щелочно-земельных металлов, например литиевые, натриевые, калиевые, магниевые, кальциевые соли и т.п., соли с органическими основаниями, например бензатиновые, N-метил-D-глюкозаминовые, гидрабаминовые соли, и соли с аминокислотами, такими, например, как аргинин, лизин и т.п. С другой стороны, указанные солевые формы, полученные добавлением металла или амина, могут быть переведены в свободную форму за счет обработки подходящей кислотой. Термин "сольват" покрывает все фармацевтически приемлемые сольваты, которые могут образовать соединения формулы (I), a также их соли. Такими сольватами, например, являются гидраты, алкоголяты, например этанолаты, пропанолаты и т.п. Некоторые соединения формулы (I) также могут существовать в их таутомерной форме. Например,таутомерными формами амидных (-C(=O)-NH-) групп являются иминоспирты (-C(OH)=N-), которые мо-4 022754 гут быть стабилизированы в кольцах с ароматическим характером. Несмотря на то что такие формы не указаны в явном виде в приведенных в настоящем документе структурных формулах, следует понимать,что они включены в объем настоящего изобретения. Используемый в настоящем документе термин "C1-C4-алкил" является группой или частью группы,определяя насыщенную неразветвленную или разветвленную цепь углеводородных радикалов, имеющих от 1 до 4 атомов углерода, такую как, например, метил, этил, 1-пропил, 2-пропил, 1-бутил, 2-бутил,2-метил-1-пропил, 2-метил-2-пропил."C1-C6-алкил" включает C1-C4-алкильные радикалы и их высшие гомологи, имеющие 5 или 6 атомов углерода,такие,например,как 1-пентил,2-пентил,3-пентил,1-гексил, 2-гексил, 2-метил-1-бутил, 2-метил-1-пентил, 2-этил-1-бутил, 3-метил-2-пентил и т.п. Представляющими интерес среди C1-C6-алкилов являются C1-C4-алкилы."C1-C6-алкокси" означает радикал -О-C1-C6-алкил, где C1-С 6-алкил является таким, как определено выше. Примерами C1-C6-алкокси являются метокси, этокси, н-пропокси и изопропокси. Термин "галоген" является общим для фтора, хлора, брома и йода. Используемый в настоящем документе термин "(=O)" или "оксо", если присоединен к атому углерода, образует карбонильный остаток. Следует отметить, что атом может быть замещен оксогруппой в том случае, если позволяет валентность этого атома. Термин "монофосфатный, дифосфатный или трифосфатный эфир" относится к группам: Используемые в настоящем документе положения радикала в любом молекулярном остатке, используемые в определениях, могут находиться в любом месте такого остатка, если он является химически стабильным. Если какая-либо переменная присутствует более одного раза в любом данном остатке,то каждое определение данной переменной является независимым. Использование в настоящем документе термина "соединения формулы (I)", или "настоящих соединений", или аналогичных терминов означает, что они включают соединения формулы (I), включая возможные стереохимические изомерные формы и их фармацевтически приемлемые соли и сольваты. Способы получения Соединения формулы (I), где R3 и R4, оба, являются водородом, представленные в настоящем документе формулой I-а, могут быть получены за счет реакции превращения урацила в цитозин, исходя из 2'-дезокси-2'-спироциклопропилуридина 1f до соответствующего 2'-дезокси-2'спироциклопропилцитидина 1g, с последующим удалением PG защитных групп, давая целевой конечный продукт I-а. Данное превращение урацила в цитозин может быть проведено за счет реакции производного урацила с POCl3 или дихлорфосфатом, таким как фенил- или замещенный фенилдихлорфосфат,например, 4-хлорфенилдихлорфосфатом и триазолом или тетразолом. Данная реакция может быть проведена в инертном растворителе в присутствии основания, например в галогенированном углеводороде,таком как дихлорметан, в присутствии третичного амина, такого как триэтиламин. Или может быть использован основный растворитель, такой как пиридин. При необходимости, полученные триазольное или тетразольное производные с формулами могут быть выделены и очищены. Обработка последних соединений аммиаком приводит к соответствующему цитозиновому производному 1g. Удаление в конце PG групп приводит к целевому конечному продукту I. Используемое в настоящем документе обозначение PG обозначает гидроксизащитную группу, в частности одну из групп,указанных далее. Промежуточные соединения 1f, используемые в вышеописанном превращении, получают за счет реакции образования циклопропанового кольца по экзодвойной связи промежуточного соединения 1d и с последующим удалением защитной группы азота в промежуточном соединении 1 е. Образование циклопропанового кольца включает добавление диазометана к экзодвойной связи с последующей фотохимической перегруппировкой с образованием циклопропанового остатка и выделением азота, предпочтительно в присутствии фотосенсибилизатора, такого как бензофенон. Предпочтительно данные реакции проводят в инертных растворителях, например реакция с диазометаном может быть осуществлена в простом эфи-5 022754 ре, таком как диэтиловый эфир, и фотохимическая перегруппировка в ароматическом углеводороде, таком как бензол или толуол, или биполярном апротонном растворителе, таком как ацетонитрил или в их смеси. Промежуточные соединения 1d получают по реакции Виттига исходя из промежуточных соединений 1 с. В данной реакции последние реагируют с метилтрифенилфосфонийгалогенидом, предпочтительно с хлоридом или бромидом, в инертном растворителе, таком как простой эфир, например диэтиловый эфир или тетрагидрофуран. В свою очередь, промежуточные соединения 1 с получают за счет реакции окисления 2'-гидроксигруппы в промежуточных соединениях 1b, например, под действием триоксида хрома в присутствии уксусного ангидрида в пиридине. Селективная защита 4'- и 5'-гидроксигрупп в 1 а дает промежуточные соединения 1b. Во избежание протекания побочных реакций 4'- и 5'-гидроксигруппы предпочтительно защищаются гидроксизащитными группами PG, и аминофункция (NH) в остатке урацила защищается аминозащитной группой PG1. Гидроксизащитные группы PG могут быть различными или одинаковыми или вместе образовывать циклическую защитную группу. Например, PG является тетраалкилсилильной группой, такой как триметилсилильная (TMS), трет-бутилдиметилсилильная (TBDMS) или триизопропилсилильная(TIPS). Или две объединенные PG группы образуют полиалкилированную дисилоксан-1,3-диильную группу, такую как тетраизопропилдисилоксан-1,3-диил (TIPDS). Данные группы могут быть удалены под действием кислоты или фторидиона (например, NaF или тетра-н-бутиламмонийфторид - TBAF). Другой гидроксизащитной группой, которая также может быть аминозащитной группой, является тритильная группа или замещенная тритильная группа, например 4-метокситритил 4-метоксифенил)(бисфенил)метил), которая удаляется в кислых условиях, например при обработке этанол/HCl или уксусной кислотой. Аминозащитная группа PG1 выбирается так, чтобы она селективно удалялась по отношению к PG группам. Аминозащитной группой, которая может быть использована, является бензоильная группа. Другой подобной группой является диметиламинометиленовая группа, которая может быть введена с использованием диметилацеталя диметилформамида. Диметиламинометиленовая группа удаляется в кислых условиях, например при обработке этанол/HCl. Вышеописанные реакции пояснены в следующей схеме реакции. Схема 1 Общий синтез 2'-дезокси-2'-спироциклопропилцитидинов В свою очередь, соединения формулы I-а могут быть переведены в фосфорамидаты, как показано в приведенной далее схеме. Соединения I-а реагируют с фосфорохлоридатом 2 а в присутствии основания,давая фосфорамидаты I-b. Растворители, которые могут быть использованы в данной реакции, включают простые эфиры, например диэтиловый эфир, или ТГФ, или пиридин, или их смеси. Для связывания обра-6 022754 зующейся в ходе реакции кислоты может быть добавлено основание, такое как N-метилимидазол. Схема 2 Общий метод синтеза фосфорамидатов Синтез сложных моно- и диэфиров I-а изображен на схеме 3, приведенной далее. На данной схемеR3a и R4a независимо являются -C(=O)R5 или -C(=O)CHR6-NH2 или, в частности, R3a и R4a независимо являются -C(=O)R5, где R3a и R4a независимо являются -C(=O)CHR6-NH2, причем аминогруппа в последней группе предпочтительно защищена аминозащитной группой, такой как любая аминозащитная группаPG1, указанная выше, и данная группа может быть изображена как -С(=O)CHR6-NH-PG1. Аминозащитная группа может быть удалена с использованием подходящих условий реакции для удаления такой группы. Например, PG1 может быть ВОС группой и может быть удалена в кислых условиях. Аминозащитная группа может быть удалена на любой стадии, когда свободная аминогруппа больше не может препятствовать последующим стадиям реакции, однако она обычно удаляется на последней стадии. Более реакционноспособная 5'-гидроксигруппа в промежуточном соединении 3 а может быть селективно защищена как в промежуточном соединении 3b, который, в свою очередь, этерифицируется до 3 с,с последующим превращением урацила в цитозин до 3d. Удаление защитной группы в последнем дает сложный 3'-моноэфир I-c. Этерификация 5'-гидроксигруппы в I-c приводит к конечному продукту I-d. Более реакционноспособная 5'-гидроксигруппа также может быть селективно этерифицирована, что вводит группу R4, давая 3 е, и полученное 5'-сложноэфирное промежуточное соединение может быть затем этерифицировано другой кислотой, за счет чего вводится группа R3a, которая является такой, как определено выше. Данные реакции этерификации приводят к диэфирным промежуточным соединениям 3f, которые вводятся в реакцию превращения урацила в цитозин, давая конечные продукты I-d. Превращение урацила в цитозин осуществляют согласно вышеописанным методикам для промежуточного соединения 1g. Соединения формулы (I), где R3a является водородом и R4a является сложным эфиром, как указано выше, где указанные соединения представлены I-е, могут быть получены за счет защиты свободной гидроксильной группы в промежуточном соединении 3b гидроксизащитной группой, которая селективно удаляется в присутствии другой гидроксизащитной группы, приводя к промежуточным соединениям 4 а. Следующая стадия включает удаление 5'-гидроксизащитной группы, давая промежуточные соединения 4b, с последующей реакцией этерификации до промежуточного соединения 4 с. Последующее превращение урацила в цитозин дает соответствующие 4'-гидроксизащищенные производные цитидина 4d, которые деблокируются с образованием 5'-замещенных, 4'-незамещенных производных I-е. Данные реакции представлены на схеме 4, где группа PGa имеет такое же значение, как и PG, однако выбрана таким образом, что PG селективно удаляется в присутствии PGa группы. Например, PG может быть тритильной или 4-метокситритильной группой и PGa - триалкилсилильной группой, такой как триметилсилил или третбутилдиметилсилил. Соединения формулы (I), где R3a и R4a являются одинаковыми сложноэфирными группами, указанные далее I-f, могут быть получены из соединений 3 а за счет этерификации обеих гидроксильных групп одинаковыми карбоновыми кислотами. Схема 5 Синтез сложных диэфиров Исходные соединения 3 а могут быть получены за счет удаления гидроксизащитных групп PG в промежуточных соединениях 1f, которые могут быть получены, как показано выше на схеме 1. Термины "аминозащитная группа" или "N-защитная группа" включают ацильные группы, такие как формил, ацетил, пропионил, пивалоил, трет-бутилацетил, 2-хлорацетил, 2-бромацетил, трифторацетил,трихлорацетил, фталил, о-нитрофеноксиацетил, -хлорбутирил, бензоил, 4-хлорбензоил, 4-бромбензоил,4-нитробензоил и т.п.; сульфонильные группы, такие как бензолсульфонил, п-толуолсульфонил и т.п.; группы, образующие карбамат, такие как бензилоксикарбонил, п-хлорбензилоксикарбонил,п-метоксибензилоксикарбонил,п-нитробензилоксикарбонил,2-нитробензилоксикарбонил,п-бромбензилоксикарбонил,3,4-диметоксибензилоксикарбонил,4-метоксибензилоксикарбонил,2-нитро-4,5-диметоксибензилоксикарбонил, 3,4,5-триметоксибензилоксикарбонил, 1-(п-бифенил)-1 метилэтоксикарбонил, ,-диметил-3,5-диметоксибензилоксикарбонил, бензгидрилоксикарбонил, третбутоксикарбонил, диизопропилметоксикарбонил, изопропилоксикарбонил, этоксикарбонил, метоксикарбонил, аллилоксикарбонил, 2,2,2-трихлорэтоксикарбонил, феноксикарбонил, 4-нитрофеноксикарбонил,флуоренил-9-метоксикарбонил, циклопентилоксикарбонил, адамантилоксикарбонил, циклогексилоксикарбонил, фенилтиокарбонил и т.п.; алкильные группы, такие как бензил, трифенилметил, бензилоксиметил и т.п.; и силильные группы, такие как триметилсилил и т.п. Гидроксизащитные группы включают простые эфиры, такие как метиловый, замещенные метиловые эфиры,такие как метоксиметиловый,метилтиометиловый,бензилоксиметиловый,трет-бутоксиметиловый, 2-метоксиэтоксиметиловый и т.п.; силиловые эфиры, такие как триметилсилил 1-метил-1-метоксиэтиловый; трет-бутиловый, аллиловый, бензиловый, п-метоксибензиловый, дифенилметиловый, тритиловый и т.п. Сложноэфирные гидроксизащитные группы включают сложные эфиры,такие как формиат, бензилформиат, хлорацетат, метоксиацетат, феноксиацетат, пивалоат, адамантоат,мезитоат, бензоат и т.п. В следующем аспекте настоящее изобретение относится к фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы (I), как указано в настоящем документе, и фармацевтически приемлемый носитель. В данном контексте терапевтически эффективное количество является количеством, которое достаточно для профилактики, стабилизации или снижения вирусной, в частности ВГС вирусной, инфекции, у инфицированных субъектов или субъектов, подверженных риску заражения. В еще одном аспекте настоящее изобретение относится к процессу получения фармацевтической композиции, как указано в настоящем документе, который включает непосредственное смешивание фармацевтически приемлемого носителя с терапевтически эффективным количеством соединения формулы (I), как указано в настоящем документе. Соединения настоящего изобретения или их любая подгруппа могут быть включены в различные фармацевтические формы с целью применения. В качестве подходящих композиций могут быть отмечены все композиции, которые обычно применяются для систематического приема лекарственных средств. Для получения фармацевтических композиций настоящего изобретения эффективное количество конкретного соединения, необязательно, в солевой форме присоединения или металлокомплекса, в качестве активного компонента, непосредственно объединяется в смесь с фармацевтически приемлемым носителем, где носитель может принимать различные формы в зависимости от формы композиции, необходимой для введения. Данные фармацевтические композиции пригодны в виде единичной лекарственной формы, в частности для перорального применения, ректального, введения через кожу или за счет парентеральной инъекции. Например, при получении композиций в виде лекарственной формы для перорального применения, в случае жидких композиций для перорального применения, таких как суспензии, сиропы, эликсиры, эмульсии или растворы, может быть использована любая обычная среда, такая, например, как вода, гликоли, масла, спирты и т.п.; или твердые носители, такие как крахмалы, сахара, каолин,смазывающие вещества, связывающие вещества, вещества для улучшения распадаемости и т.п. в случае порошков, пилюль, капсул и таблеток. Из-за наиболее легкого применения таблетки и капсулы представляют собой наиболее предпочтительные лекарственные формы для перорального применения, и очевидно, что в данном случае используются твердые фармацевтические носители. Для парентеральных композиций носитель обычно будет содержать, по меньшей мере в значительной степени, стерильную воду,хотя могут быть включены и другие компоненты, например, для улучшения растворимости. Могут быть получены растворы для инъекций, например, в которых носитель включает солевой раствор, раствор глюкозы или смеси солевого раствора и глюкозы. Также могут быть получены суспензии для инъекций,в данном случае могут быть использованы подходящие жидкие носители, суспендирующие агенты и т.п. Также включены твердые формы композиций, которые необходимо перевести в жидкую форму композиции непосредственно перед использованием. В композициях, пригодных для введения через кожу, носитель необязательно включает агент, улучшающий проникновение, и/или подходящий смачивающий агент, возможно, вместе с подходящими добавками любой природы в малых количествах, где данные добавки не оказывают значительного вредного воздействия на кожу. Соединения настоящего изобретения также могут быть введены за счет ингаляции перорально или инсуффляции в виде раствора, суспензии или сухого порошка с использованием систем доставки, известных в данной области техники. Особенно предпочтительно приготовлять вышеуказанные фармацевтические композиции в единичной лекарственной форме для простоты приема и однородности дозировки. Единичная лекарственная форма, как в настоящем документе используется, означает физически дискретные единицы, пригодные для однократного дозирования, где каждая единица содержит заранее определенное количество активного компонента, рассчитанное для обеспечения желаемого терапевтического эффекта в сочетании с необходимым фармацевтическим носителем. Примерами таких единичных лекарственных форм являются таблетки (включая делимые и покрытые таблетки), капсулы, пилюли, суппозитории, пакетики с порошком, пластинки, растворы или суспензии для инъекций и т.п. и их отдельные группы. Соединения формулы (I) показывают активность против ВГС и могут быть использованы в лечении и профилактике ВГС инфекционных заболеваний или болезней, связанных с ВГС. Последние включают прогрессирующий печеночный фиброз, воспаление и некроз, приводящие к циррозу, конечной стадии болезни печени, и НСС. Более того, соединения настоящего изобретения могут быть активны против мутированных штаммов вирусов ВГС. Кроме того, соединения настоящего изобретения могут показать благоприятный фармакокинетический профиль и могут иметь привлекательные свойства относительно биологической доступности, включая подходящее время полувыведения, ППК (площадь под кривой) и пиковые значения, а также отсутствие неблагоприятных эффектов, таких как неэффективное быстрое нарастание концентрации и задержка в ткани. Соединения по настоящему изобретению также являются привлекательными из-за их низкой токсичности и благоприятного индекса селективности, что может быть показано, например, при испытании на токсичность на клеточном уровне. Более того, у соединений изобретения отсутствует активность по отношению к другим вирусам, в частности по отношению к ВИЧ. Применение пациентами, которые заражены разными вирусами, лекарственных средств с двойным или множественным противовирусным эффектом может приводить к недостаточному дозированию против других вирусов, что, в свою очередь,может приводить к возникновению устойчивых вирусных штаммов. Противовирусная активность против ВГС in vitro для соединений формулы (I) может быть исследована в клеточной системе репликона ВГС, основываясь на Lohmann et al. (1999), Science 285:110-113, с последующими модификациями, описанными Krieger et al. (2001), Journal of Virology, 75:4614-4624(включены в настоящем документе в виде ссылки), которые также пояснены в разделе "Примеры". Несмотря на то что данная модель не является полной инфекционной моделью для ВГС, среди доступных на сегодняшний день она общепризнана в качестве наиболее надежной и эффективной модели независимой репликации РНК ВГС. Следует понимать, что важно различать соединения, которые специфически взаимодействуют с функциями ВГС, от тех, которые оказывают цитотоксический или цитостатический эффекты на модели репликона ВГС и, как следствие, вызывают снижение РНК ВГС или концентрацию связанного репортерного белка. Известные в данной области анализы для исследования клеточной цитотоксичности, например, основаны на активности митохондриальных ферментов с использованием флуорогенных окислительно-восстановительных красителей, таких как ресазурин. Кроме этого, существует обратный скрининг клеточных областей для исследования неселективного ингибирования активности связанного репортерного гена, такого как люцифераза светлячка. В подходящих клетках может быть обеспечена стабильная трансфекция репортерного гена люциферазы, чья экспрессия зависит от конститутивной активности промотора гена, и такие клетки могут быть использованы в качестве обратного скрининга для устранения неселективных ингибиторов. Из-за их противовирусной активности, в частности их анти-ВГС свойств, соединения формулы (I),включая их любые возможные стереоизомеры, фармацевтические соли присоединения или сольваты,являются пригодными при лечении теплокровных животных, в особенности людей, инфицированных ВГС, и для профилактики ВГС инфекционных заболеваний у теплокровных животных, в особенности у людей. Кроме этого, настоящее изобретение относится к способу лечения теплокровного животного, в особенности человека, инфицированного ВГС или находящегося под угрозой заражения ВГС, где указанный способ включает введение анти-ВГС эффективного количества соединения формулы (I), как указано в настоящем документе. Следовательно, настоящее изобретение может быть применено в качестве лекарственного препарата, в частности в качестве анти-ВГС лекарственного препарата или в качестве ВГС ингибирующего лекарственного препарата. Настоящее изобретение также относится к применению соединений при производстве лекарственного препарата для лечения или профилактики ВГС инфекционного заболевания. Указанное применение в качестве лекарственного препарата или способа лечения включает систематическое введение субъектам, инфицированным ВГС, или субъектам, чувствительным к ВГС инфекции, количества соединения формулы (I), как указано в настоящем документе, эффективного для борьбы с патологическими состояниями, связанными с ВГС инфекцией. В общем предполагается, что эффективное противовирусное суточное количество должно быть от примерно 0,01 до примерно 700 мг/кг, или от примерно 0,5 до примерно 400 мг/кг, или от примерно 1 до примерно 250 мг/кг, или от примерно 2 до примерно 200 мг/кг, или от примерно 10 до примерно 150 мг/кг веса тела. Для необходимого введения дозы может быть подходящим введение в виде двух,трех, четырех или более субдоз через подходящие промежутки в течение дня. Указанные субдозы могут быть получены в виде единичных лекарственных форм, например, содержащих от примерно 1 до примерно 5000 мг, или от примерно 50 до примерно 3000 мг, или от примерно 100 до примерно 1000 мг, или от примерно 200 до примерно 600 мг, или от примерно 100 до примерно 400 мг активного компонента на единичную лекарственную форму. Изобретение также относится к комбинации соединения формулы (I), его фармацевтически приемлемой соли или сольвата и другого противовирусного соединения, в частности другого анти-ВГС соединения. Термин "комбинация" может относиться к продукту, содержащему (а) соединение формулы (I),как указано выше, и (b) возможному другому анти-ВГС соединению, в виде комбинированной композиции для одновременного, раздельного или последовательного применения для лечения ВГС инфекционных заболеваний. Анти-ВГС соединения, которые могут быть использованы в таких комбинациях, включают ингибиторы полимеразы ВГС, ингибиторы протеазы ВГС, ингибиторы других мишеней жизненного цикла ВГС и иммуномодулирующие средства и их комбинации. Ингибиторы полимеразы ВГС включают NM283(валопицитобин), R803, JTK-109, JTK-003, HCV-371, HCV-086, HCV-796 и R-1479, R-7128, MK-0608,VCH-759, PF-868554, GS9190, XTL-2125, NM-107, GSK625433, R-1626, BILB-1941, ANA-598, IDX-184,IDX-375, MK-3281, MK-1220, АВТ-333, PSI-7851, PSI-6130, VCH-916. Ингибиторы протеаз (NS2-NS3 ингибиторы и NS3-NS4A ингибиторы) включают BILN-2061, VX-950 (телапревир), GS-9132 (АСН-806),SCH-503034 (боцепревир), ТМС 435350 (также известный как ТМС 435), ТМС 493706, ITMN-191,MK-7009, BI-12202, BILN-2065, BI-201335, BMS-605339, R-7227, VX-500, BMS650032, VBY-376,- 11022754BMS790052, А-831, А-689, NIM-811 и DEBIO-025 являются примерами NS5B ингибиторы циклофилина. Ингибиторы других мишеней жизненного цикла ВГС, включая хеликазу NS3; металлопротеазные ингибиторы; антисмысловые олигонуклеотидные ингибиторы, такие как ISIS-14803 и AVI-4065; малые интерферирующие РНК, такие как SIRPLEX-140-N; кодируемые вектором короткие шпилечные РНК(shRNA); ДНК ферменты; специфичные ВГС рибозимы, такие как гептазим, RPI.13919; ингибиторы входа, такие как НереХ-С, HuMax-НерС; ингибиторы альфа-глюкозидазы, такие как целгосивир, UT-231B и т.п.; KPE-02003002 и BIVN 401. Иммуномодулирующие средства включают природные и рекомбинантные изоформы интерферона,включая -интерферон, -интерферон, -интерферон и -интерферон, такие как Intron A, Roferon-A,Canferon-А 300, Advaferon, Infergen, Humoferon, Sumiferon MP, Alfaferone, IFN-beta иFeron; интерфероны, модифицированные полиэтиленгликолем (пэгелированные), такие как ПЭГ интерферон 2 а (Pegasys), ПЭГ интерферон 2b (PEG-Intron) и пэгилированный IFNcon1; композиции пролонгированного действия и производные интерферонов, такие как альбумин-связанный интерферон альбуферон ; соединения, которые стимулируют синтез интерферона в клетках, такие как резиквимод; интерлейкины; соединения, которые усиливают выработку ответа Т-хелперных клеток типа 1,такие как SCV-07; антагонисты TOLL-подобных рецепторов, такие как CpG-10101 (актилон) и изаторибин; тимозин -1; ANA-245; ANA-246; гистамин дигидрохлорид; пропагерманий; тетрахлордекаоксида; амплиген; IMP-321; KRN-7000; антитела, такие как civacir и XTL-6865; и профилактические и терапевтические вакцины, такие как InnoVac С и HCV E1E2/MF59. Другие противовирусные средства включают рибавирин, амантадин, вирамидин, нитазоксанид; телбивудин; NOV-205; тарибавирин; ингибиторы внутренней посадки рибосомы; вирусные ингибиторы широкого спектра действия, такие как ингибиторы инозинмонофосфатдегидрогеназы (IMPDH) и микофеноловая кислота и ее производные, и, включая, но не ограничиваясь ими, VX-497 (меримеподиб),VX-148 и/или VX-944); или любые комбинации вышеперечисленных средств. Конкретные средства для использования в указанных комбинациях включают альфа-интерферон(IFN-), пэгилированный альфа-интерферон или рибавирин, а также терапевтические средства, основанные на антителах, направленных против эпитопов ВГС, малая интерферирующая РНК (Si-РНК), рибозимы, ДНК-ферменты, антисмысловые РНК, низкомолекулярные антагонисты, например NS3 протеазы,NS3 хеликазы и NS5B полимеразы. В другом аспекте обеспечиваются комбинации соединения формулы (I), как указано в настоящем документе, и анти-ВИЧ соединения. Предпочтительно последние являются такими ингибиторами ВИЧ,которые обладают положительным эффектом на метаболизм и/или фармакокинетику лекарственного средства, увеличивая биологическую доступность. Примером таких ВИЧ ингибиторов является ритонавир. Таким образом, настоящее изобретение также обеспечивает комбинацию, включающую (а) соединение формулы (I) или его фармацевтически приемлемую соль или сольват и (b) ритонавир или его фармацевтически приемлемую соль. Соединение ритонавир, его фармацевтически приемлемые соли и способы его получения описаны в WO 94/14436. US 6037157 и указанные в нем ссылки: US 5484801,US 08/402690, WO 95/07696 и WO 95/09614 раскрывают предпочтительные лекарственные формы ретиновира. Изобретение также относится к способу получения описанной в настоящем документе комбинации,который включает стадию объединения соединения формулы (I), как в настоящем документе выше, и другого средства, такого как противовирусное средство, включая антисредство против ВГС или против ВИЧ, в частности такие, которые были указаны выше. Указанные комбинации могут найти применение при получении лекарственного препарата для лечения ВГС инфекционных заболеваний у зараженных ими млекопитающих, где указанная комбинация, в частности, содержит соединение формулы (I), как указано выше, и интерферон- (IFN-), пэгилированный интерферон- или рибавирин. Или изобретение обеспечивает способ лечения млекопитающего, в особенности человека, инфицированного ВГС, включающий введение указанному млекопитающему эффективного количества указанной в настоящем документе комбинации. В частности, указанное лечение включает систематическое применение указанной комбинации, и эффективное количество является таким количеством, которое эффективно для лечения клинических заболеваний, связанных с ВГС инфекцией. В одном варианте осуществления вышеуказанные комбинации получены в виде фармацевтической композиции, которая включает активные вышеописанные компоненты и носитель, как описано выше. Каждый активный компонент может быть получен отдельно, и композиции могут быть применены совместно или может быть обеспечена одна композиция, содержащая два и, если необходимо, большее количество активных компонента. В первом случае комбинации также могут быть получены в виде совместной композиции для одновременного, отдельного или последовательного применения при терапии ВГС. Указанная композиция может иметь любые формы, описанные выше. В одном варианте осуществления оба компонента могут быть включены в одну лекарственную форму, такую как лекарственная форма с фиксированной комбинацией. В конкретном варианте осуществления настоящее изобретение обеспечивает композицию, содержащую (а) терапевтически эффективное количество соединения формулы (I), включая его возможную стереоизомерную форму, или его фармацевтически приемлемую соль,или его фармацевтически приемлемый сольват, и (b) терапевтически эффективное количество ритонавира или его фармацевтически приемлемую соль и (с) носитель. Индивидуальные компоненты комбинаций настоящего изобретения могут быть введены раздельно в различное время в ходе терапии или одновременно в раздельной или комбинированной форме. Настоящее изобретение предназначено для использования всех подобных режимов одновременного или альтернативного лечения, и термин "применение" истолковывается соответствующим образом. В предпочтительном варианте осуществления раздельные лекарственные применяются одновременно. В одном варианте осуществления комбинации настоящего изобретения содержат количество ритонавира или его фармацевтически приемлемой соли, которое достаточно для клинического улучшения биологической доступности соединения формулы (I) по сравнению с биологической доступностью, соединения формулы (I), если оно применяется отдельно. Или комбинации настоящего изобретения содержат количество ритонавира или его фармацевтически приемлемой соли, которое достаточно для увеличения по меньшей мере одной фармакокинетической переменной соединения формулы (I), выбранного из t1/2, Cmin, Cmax, Css, ППК при 12ч или ППК при 24 ч, по сравнению по меньшей мере с одной фармакокинетической переменной соединения формулы (I), если оно применяется отдельно. Комбинации настоящего изобретения могут быть введены людям при диапазонах доз, специфичных для каждого компонента, содержащегося в указанных комбинациях, например соединение формулы (I),как указано выше, и ритонавир или его фармацевтически приемлемая соль могут иметь уровни дозы в диапазоне от 0,02 до 5,0 г/день. Массовое отношение соединения формулы (I) к ритонавиру может находиться в диапазоне от примерно 30:1 до примерно 1:15, или от примерно 15:1 до примерно 1:10, или от примерно 15:1 до примерно 1:1, или от примерно 10:1 до примерно 1:1, или от примерно 8:1 до примерно 1:1, или от примерно 5:1 до примерно 1:1, или от примерно 3:1 до примерно 1:1, или от примерно 2:1 до примерно 1:1. Соединение формулы (I) и ритонавир могут быть введены совместно однократно или дважды в день, предпочтительно перорально, где количество соединения формулы (I) на каждую дозу является таким, как описано выше; и количество ритонавира на дозу составляет от 1 до примерно 2500 мг,или от примерно 50 до примерно 1500 мг, или от примерно 100 до примерно 800 мг, или от примерно 100 до примерно 400 мг, или от примерно 40 до примерно 100 мг ритонавира. Все использованные в настоящем документе ссылки включены в виде ссылки. Примеры В следующих примерах названия соединения были получены с использованием программного обеспечения Chemdraw Ultra, Cambridgesoft, версии 9.0.7. Пример 1. 4-Амино-1-(7-гидрокси-6-гидроксиметил-5-оксаспиро[2.4]гепт-4-ил)-1H-пиримидин-2-он (1)(300 мл) примешивают при комнатной температуре в течение 64 ч. Пиридин удаляют под вакуумом(30 С). Остаток растворяют в 100 мл CH2Cl2, промывают эфиром (375 мл), сушат над безводным MgSO4 и фильтруют. Фильтрат упаривают досуха и в таком виде используют в следующей реакции. ЖХ-МС: Время удержания (Rt): 3,16 мин, m/z: 487 (М+Н)+. Стадия 2. 1-6aR,8R,9aR)-2,2,4,4-Тетраизопропил-9-оксотетрагидро-6 Н-фуро[3,2f][1,3,5,2,4]триоксадисилоцин-8-ил)пиримидин-2,4(1 Н,3 Н)-дион (I-2). Промежуточное соединение I-1 (19,93 г) растворяют в 200 мл CH2Cl2, пиридина (1 экв.), добавляют уксусный ангидрид (2,91 экв.), а затем CrO3 (2,75 экв.). Смесь перемешивают при комнатной температуре, и спустя 30 мин наблюдается спокойное кипение. После перемешивания в течение 90 мин ЖХ-МС показывает, что образовался продукт реакции I-2 (50%) и осталось исходное вещество I-1 (50%). Дополнительное перемешивание в течение 2 ч приводит к 55% продукта I-2 и 45% оставшегося I-1. Еще добавляют 10 мл пиридина, 5 мл уксусного ангидрида и 5 г CrO3 и далее смесь перемешивают при комнатной температуре в течение ночи. Данные ЖХ-МС показывают небольшое улучшение. Темно-коричневый раствор выливают в 1300 мл этилацетата и остаток фильтруют через слой декалита. Осадок промывают дополнительным количеством этилацетата. Объединенные фильтраты упаривают досуха. Промежуточное соединение I-2 очищают с помощью колоночной хроматографии с использованием CH2Cl2 доCH2Cl2/этилацетат 1:1. Тонкослойная хроматография (ТСХ) показывает наличие двух пятен, в связи с чем промежуточное соединение I-2 очищают с помощью колоночной хроматографии с использованием гептана до гептан/ацетон 7:3. Содержащие продукт фракции собирают и упаривают, получая 8,5 г белого твердого вещества (I-2) ЖХ-МС: время удержания: 3,31 мин, m/z: 485 (М+Н)+, примечание: также наблюдается гидрат кетона: ЖХ-МС: время удержания: 3,20 мин, m/z: 503 (М+Н)+. Стадия 3. 1-6aR,8R,9aS)-2,2,4,4-Тетраизопропил-9-метилентетрагидро-6 Н-фуро[3,2f][1,3,5,2,4]триоксадисилоцин-8-ил)пиримидин-2,4(1 Н,3 Н)-дион (I-3).NaH (0,897 г) суспендируют в 15 мл сухого диметилсульфоксида (ДМСО) и нагревают в атмосфере аргона при 65 С в течение 1,5 ч. При перемешивании добавляют метилтрифенилфосфонийбромид(12,84 г) с последующим добавлением 30 мл сухого ДМСО и 15 мл сухого тетрагидрофурана (THF). Смесь перемешивают при комнатной температуре в течение 1,5 ч. Образуется желтая/оранжевая смесь. Затем по каплям через шприц добавляют промежуточное соединение I-2 (6,97 г), растворенное в 20 мл сухого THF, и всю смесь перемешивают в течение 1,5 ч при комнатной температуре и затем при 50 С в течение 1 ч. Затем смесь охлаждают до комнатной температуры. Осадок отфильтровывают на фильтре с декалитом, фильтрат концентрируют (для удаления THF) и остаток разделяют между CHCl3 и водой (300 мл каждого). Органический слой отделяют и водный слой повторно экстрагируют CHCl3. Объединенные слои фильтруют через слой декалита и концентрируют. Продукт очищают с помощью колоночной хроматографии с использованием в качестве элюента CH2Cl2 до CH2Cl2/этилацетат 7:3. Упаривание дает 2,97 г промежуточного соединения I-3 в виде белого твердого вещества. ЖХ-МС: время удержания: 3,56 мин, m/z: 483 (М+Н)+. Стадия 4. 3-Бензоил-1-6aR,8R,9aS)-2,2,4,4-тетраизопропил-9-метилентетрагидро-6 Н-фуро[3,2f][1,3,5,2,4]триоксадисилоцин-8-ил)пиримидин-2,4(1 Н,3 Н)-дион (I-4). Промежуточное соединение I-3 (2,4 г) дважды упаривают с 20 мл сухого пиридина. Затем повторно растворяют в 30 мл сухого пиридина. Добавляют диизопропилэтиламин (3 экв.) с последующим добавлением бензоилхлорида (1,5 экв.). Смесь перемешивают в течение 2 ч при комнатной температуре. Пиридин упаривают под вакуумом ниже 30 С и добавляют 150 мл CH2Cl2. Полученную смесь дважды промывают 50 мл насыщенного раствора NaHCO3. Органический слой сушат над MgSO4, фильтруют и упаривают и остаток сушат под вакуумом в течение 64 ч. Промежуточное соединение I-4 очищают с помощью колоночной хроматографии с использованием в качестве элюента CH2Cl2 до CH2Cl2/этилацетат 8:2. После упаривания получают 2,89 г I-4 в виде белой пены. ЖХ-МС: время удержания: 3,79 мин, m/z: 587 (М+Н)+. Стадия 5. 3-Бензоил-1-3'R,6aR,8R,9aS)-2,2,4,4-тетраизопропил-4',5',6,6 а,8,9 агексагидроспиро[фуро[3,2-f][1,3,5,2,4]триоксадисилоцин-9,3'-пиразол]-8-ил)пиримидин-2,4(1 Н,3 Н)-дион и его эпимер 3-бензоил-1-3'S,6aR,8R,9aS)-2,2,4,4-тетраизопропил-4',5',6,6 а,8,9 агексагидроспиро[фуро[3,2-f][1,3,5,2,4]триоксадисилоцин-9,3'-пиразол]-8-ил)пиримидин-2,4(1 Н,3 Н)-дионI-4 (1,072 г) в диэтиловом эфире (20 мл), охлаждаемому на ледяной бане. После окончания добавления желтый раствор перемешивают при комнатной температуре до тех пор, пока анализ ТСХ или ЖХ-МС не покажет завершение реакции. Смесь упаривают досуха, получая 1,149 г белой пены. Данные ЖХ-МС показывают наличие смеси эпимеров (I-5) 3:1, которую в таком виде используют в следующей реакции. ЖХ-МС: время удержания: 3,67 и 3,68 мин, m/z: 629 (М+Н)+. Стадия 6. 3-Бензоил-1-6a'R,8'R/9a'S)-2',2',4',4'-тетраизопропилгексагидроспиро[циклопропан-1,9'фуро[3,2-f][1,3,5,2,4]триоксадисилоцин]-8'-ил)пиримидин-2,4(1 Н,3 Н)-дион (I-6). Смесь промежуточного соединения I-5 (250 мг) и бензофенона (1 экв.), растворенную в 5 мл сухой смеси бензол/CH3CN 1:1, перемешивают при комнатной температуре в атмосфере аргона. Смесь облучают 150 Вт галогеновой лампой до тех пор, пока данные ЖХ-МС не показывают завершение конверсии исходного соединения. Смесь упаривают досуха и промежуточное соединение I-6 очищают с помощью колоночной хроматографии, используя в качестве элюента CH2Cl2. После упаривания очищенных фракций получают 1-6 в виде прозрачного масла (150 мг). ЖХ-МС: время удержания: 3,91 мин, m/z: 601 (М+Н)+. Стадия 7. 1-6a'R,8'R,9a'S)-2',2',4',4'-Тетраизопропилгексагидроспиро[циклопропан-1,9'-фуро[3,2f][1,3,5,2,4]триоксадисилоцин]-8'-ил)пиримидин-2,4(1 Н,3 Н)-дион (I-7). Промежуточное соединение I-6 (150 мг) растворяют в 3 мл CH2Cl2 и добавляют 10 мл NH3/метанол. Смесь перемешивают в течение 1 ч, упаривают досуха и очищают с помощью колоночной хроматографии с использованием в качестве элюента CH2Cl2 до CH2Cl2/этилацетат 9:1. После упаривания получают бесцветное масло, которое после затирания в диэтиловом эфире и упаривания дает 87 мг промежуточного соединения I-7 в виде белой пены. ЖХ-МС: время удержания: 3,66 мин, m/z: 497 (M+Н)+. Стадия 8. 4-Амино-1-6 а'R,8'R,9a'S)-2',2',4',4'-тетраизопропилгексагидроспиро[циклопропан-1,9'фуро[3,2-f][1,3,5,2,4]триоксадисилоцин]-8'-ил)пиримидин-2(1 Н)-он (I-8). Раствор I-7 (1,0 г) растворяют в 20 мл сухого пиридина и раствор охлаждают на ледяной бане. По каплям прибавляют 4-хлорфенилдихлорфосфат (1,5 экв.) и раствор перемешивают при охлаждении в течение 5 мин. Затем по каплям добавляют тетразол (3 экв., 0,45 М раствора в CH3CN). Ледяную баню удаляют и реакцию оставляют до тех пор, пока данные ЖХ-МС не покажут прекращение дальнейшего протекания реакции. Добавляют еще 1 экв. 4-хлорфенилдихлорфосфата и смесь перемешивают еще в течение 3 ч при комнатной температуре. По данным ЖХ-МС исходное вещество отсутствует. Смесь упаривают досуха (40 С) и остаток растворяют в CH2Cl2 (75 мл) и дважды промывают насыщенным раствором NaHCO3. Органическую фазу сушат над Na2SO4, фильтруют и упаривают. Остаток предыдущей реакции растворяют в 25 мл раствора NH3 в диоксане (0,5 М). Через регулярные промежутки времени добавляют дополнительное количество NH3 в диоксане до завершения реакции, исходя из данных ЖХ- 15022754 МС. После завершения реакции смесь упаривают досуха. Промежуточное соединение I-8 очищают с помощью колоночной хроматографии с использованием в качестве элюента CH2Cl2 до CH2Cl2/метанол 9:1. После упаривания получают 1-8 в виде клейкого твердого вещества от желтого до оранжевого цвета(1). Промежуточное соединение I-8 (840 мг) растворяют в 25 мл THF. Добавляют тетра-нбутиламмонийфторид (TBAF; 2 экв.) Смесь перемешивают при комнатной температуре в течение 1 ч и затем упаривают под вакуумом. Соединение дважды очищают с помощью колоночной хроматографии с использованием в качестве элюента CHCl3/метанол 9:1 до СНС 13/метанол 3:1. После упаривания фракций, содержащих продукт, получают соединение 1 (300 мг) в виде белого твердого вещества. ЖХ-МС: время удержания: 1,25 мин, m/z: 254 (М+Н)+. 1 Соединение 1 (100 мг) растворяют в сухой смеси THF/пиридин вместе с (2S)-бензил-2(хлор(фенокси)фосфориламино)пропионатом (279 мг, 2,0 экв.). Смесь охлаждают до -78 С. ДобавляютN-метилимидазол (NMI) (259 мг, 8 экв.) и данную смесь перемешивают в течение 15 мин при -78C и затем перемешивают при комнатной температуре в течение ночи. Полученную смесь упаривают досуха. Добавляют 10 мл CH2Cl2 и остаток промывают 10 мл 0,5 н. HCl. Органический слой отделяют, промывают 10 воды, сушат над Na2SO4, фильтруют и упаривают. Соединение очищают с помощью хроматографии на силикагеле с использованием в качестве элюента CH2Cl2 до CH2Cl2/MeOH 9-1. (Rf=0,2 в данном элюенте). Получают желтое твердое вещество, которое повторно очищают с помощью колоночной хроматографии с использованием в качестве элюента EtOAc до EtOAc/MeOH 8-2. После упаривания досуха под вакуумом получают 80 мг (33,4%) 2 а (смесь диастереомеров). ЖХ-МС: время удержания: 3,37 мин, m/z: 569 (M-Н)-. 1(м, 3 Н), 3,82-4,01 (м, 3 Н), 4,09-4,23 (м, 1 Н), 4,23-4,36 (м, 1 Н), 4,98-5,15 (м, 2 Н), 5,29-5,39 (м, 1 Н), 5,70 (д,J=7,43 Гц, 1 Н), 6,07 (с, 1 Н), 6,13 (дд, J=12,81, 10,47 Гц, 1 Н), 7,08-7,25 (м, 6 Н), 7,29-7,39 (м, 6 Н), 7,54 (д,1 Н). Следующие соединения получают аналогично.TBAF (59,8 мл, 59,8 ммоль). Смесь перемешивают при комнатной температуре в течение 1 ч. Добавляют смесь пиридина, метанола и воды (80 мл, 3:1:1) с последующим добавлением сильнокислой катионообменной смолы, Dowex 50 Wx4 (128 г), в смеси пиридина, метанола и воды (320 мл, 3:1:1). Реакционную смесь перемешивают в течение 45 мин и фильтруют. Остававшийся Dowex дважды промывают смесью пиридина метанола и воды (320 мл, 3:1:1) и объединенные фильтраты концентрируют при пониженном давлении. Смесь очищают с помощью хроматографии на силикагеле с использованием градиента элюента от 0 до 10% метанола в этилацетате, получая промежуточное соединение I-9 (5,597 г, 84%) в виде белой пены. ЖХ-МС: время удержания: 2,05 мин, m/z = 253 (М-Н)-. Промежуточное соединение I-9 (5,16 г, 20,30 ммоль) растворяют в сухом пиридине (100 мл) и рас- 17022754 твор снаружи охлаждают холодной водой. Добавляют изомасляный ангидрид (16,85 мл, 101 ммоль) и реакцию оставляют при комнатной температуре на ночь. Реакционную смесь снова охлаждают снаружи холодной водой и избыток изомасляного ангидрида гасят добавлением метанола. После перемешивания в течение 20 мин при комнатной температуре и упаривания летучих компонентов добавляют этилацетат и смесь промывают насыщенным водным раствором NaHCO3 (2). Органическую фазу сушат над MgSO4 и концентрируют под вакуумом, получая I-10 (7,68 г, 96%) в виде твердого вещества белого цвета. ЖХ-МС: время удержания: 2,26 мин, m/z = 393 (М-Н)-. К охлажденной смеси I-10 (7,68 г, 19,47 ммоль), 1 Н-1,2,4-триазола (15,20 г, 220 ммоль) и триэтиламина (30,7 мл, 220 ммоль) в сухом CH2Cl2 (50 мл) добавляют POCl3 (4,72 мл, 50,6 ммоль). Смесь перемешивают при комнатной температуре в течение 2,5 ч. Избыток POCl3 гасят добавлением холодной воды и органический слой собирают и концентрируют под вакуумом. Смесь очищают с помощью хроматографии на силикагеле с использованием градиента элюента от CH2Cl2/этилацетат 90:10 до 85:15, получая промежуточное соединение I-11 (7,5 г, 86%). ЖХ-МС: время удержания: 2,38 мин, m/z = 446 (М+Н)+. Промежуточное соединение I-11 (7,49 г, 16,81 ммоль) растворяют в THF (200 мл) и обрабатывают концентрированным водным раствором NH4OH (15 мл). Спустя 3,5 ч летучие компоненты удаляют при пониженном давлении. Смесь очищают с помощью хроматографии на силикагеле с использованием градиента элюента от 0 до 5% метанола в CH2Cl2. Продукт растворяют в этилацетате и смесь промывают водой (2) и солевым раствором (2). Органическую фазу сушат над MgSO4 и после фильтрации, концентрирования под вакуумом получают соединение 3 (5,597 г, 84%) в виде пены белого цвета. ЖХ-МС: время удержания: 1,95 мин, m/z = 394 (М+Н)+. 1 Раствор промежуточного соединения I-9 (350 мг, 1,377 ммоль) в сухом пиридине (15 мл) охлаждают в ледяной бане и добавляют (хлор(4-метоксифенил)метилен)дибензол (900 мг, 2,91 ммоль). Реакционную смесь оставляют в тающей ледяной бане и затем перемешивают при комнатной температуре в течение ночи. Добавляют избыток метанола и спустя 30 мин реакционную смесь концентрируют, сушат и ис- 18022754 пользуют в таком виде в следующей реакции. ЖХ-МС: время удержания: 2,48 мин, m/z = 525 (M-Н)-. К раствору вышеуказанного вещества в сухом ДМФА (15 мл) добавляют третбутилхлордиметилсилан (TBDMSCl; 311 мг, 2,065 ммоль) и имидазол (169 мг, 2,478 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. В течение следующего дня всего в общей сложности добавляют 6 экв. TBDMSCl и имидазола и перемешивание продолжают в течение следующей ночи. Смесь гасят метанолом и летучие компоненты частично удаляют, разбавляют этилацетатом и смесь промывают водой (2) и солевым раствором. Органическую фазу сушат над MgSO4 и после фильтрации концентрируют под вакуумом. Смесь очищают с помощью хроматографии на силикагеле с использованием градиента элюента от CH2Cl2 до CH2Cl2/метанол 19:1, получая промежуточное соединение I-13, которое используют в таком виде в следующей реакции. ЖХ-МС: время удержания: 3,70 мин, m/z = 639 (М-Н)-. Промежуточное соединение I-13 растворяют в 80% водной уксусной кислоте (10 мл) и смесь перемешивают при комнатной температуре. Спустя 8 ч летучие компоненты упаривают, и смесь очищают с помощью хроматографии на силикагеле с использованием градиента элюента от CH2Cl2 до 4% метанол/CH2Cl2. Упаривание растворителя дает промежуточное соединение I-14 (318 мг, 73%). ЖХ-МС: время удержания: 2,46 мин, m/z = 367 (М-Н)-. Промежуточное соединение I-14 (318 мг 0,863 ммоль) растворяют в сухом пиридине (8 мл) и раствор охлаждают снаружи холодной водой. Через шприц добавляют изомасляный ангидрид (430 мкл,2,59 ммоль). Реакционную смесь перемешивают при комнатной температуре в течение ночи. Избыток изомасляного ангидрида гасят добавлением метанола, затем удаляют летучие компоненты. Добавляют этилацетат и раствор промывают насыщенным раствором NaHCO3, сушат над MgSO4 и после фильтрации концентрируют в вакууме, получая промежуточное соединение I-15 (307 мг, 81%). ЖХ-МС: время удержания: 3,0 мин, m/z = 437 (М-Н)-. Промежуточное соединение I-15 (307 мг, 0,700 ммоль), 1 Н-1,2,4-триазол (546 мг, 7,91 ммоль) и триэтиламин (1,1 мл, 7,91 ммоль) растворяют в сухом CH2Cl2 (7 мл) и охлаждают до 0 С. Добавляют POCl3(0,170 мл, 1,820 ммоль), поддерживая температуру реакции ниже 25 С. Смесь перемешивают в течение ночи. Добавляют по 3,0 экв. 1 Н-1,2,4-триазола и триэтиламина вместе с CH2Cl2 (5 мл) и смесь перемешивают еще 3 ч при комнатной температуре. Избыток POCl3 гасят аккуратным добавлением холодной воды. Нижний органический слой отделяют и концентрируют упариванием под вакуумом. Смесь очищают с помощью хроматографии на силикагеле с использованием градиента элюента от CH2Cl2 до 4% метанол/CH2Cl2, получая промежуточное соединение I-16 (200 мг, 58%). ЖХ-МС: время удержания: 3,09 мин, m/z = 490 (M+Н)+. Промежуточное соединение I-16 (200 мг, 0,408 ммоль) растворяют в THF (5 мл) и обрабатывают концентрированным водным раствором NH4OH (0,5 мл). Спустя 7 ч удаляют летучие компоненты и смесь концентрируют при пониженном давлении. Смесь очищают с помощью хроматографии на силикагеле с использованием градиента элюента от CH2Cl2 до 5% метанол/CH2Cl2. После упаривания растворителя получают I-17 (17 9 мг, 100%). ЖХ-МС: время удержания: 2,74 мин, m/z = 438 (М+Н)+. К раствору промежуточного соединения I-17 (179 мг, 0,409 ммоль) и уксусной кислоты (147 мг,2,454 ммоль) в THF (10 мл) добавляют TBAF (1227 мкл, 1,227 ммоль, 1 M в THF). Смесь перемешивают при комнатной температуре. Перемешивание продолжают в течение 2 ч и затем удаляют растворитель. Смесь очищают с помощью хроматографии на силикагеле с использованием градиента элюента метанол/CH2Cl2 от 4 до 8%. Продукт (100 мг) смешивают с CaCO3 (60 мг) и Dowex 50 Wx4 (200 мг) в THF(10 мл) и перемешивают при комнатной температуре в течение 2 ч. Смесь фильтруют и после упаривания летучих компонентов очищают с помощью хроматографии на силикагеле (градиентное элюирование: от 0 до 15% метанола в хлороформе), получая соединение 4 в виде твердого вещества белого цвета Промежуточное соединение I-12 (250 мг, 0,475 ммоль) растворяют в сухом пиридине (10 мл) и раствор охлаждают снаружи холодной водой. К раствору через шприц добавляют изомасляный ангидрид(236 мкл, 1,424 ммоль) и реакцию перемешивают при комнатной температуре в течение 2 ч. Добавляют еще изомасляный ангидрид (236 мкл, 1,424 ммоль) и смесь перемешивают еще в течение 2 ч. Еще добавляют изомасляный ангидрид (236 мкл, 1,424 ммоль) и смесь перемешивают в течение ночи. Затем избыток изомасляного ангидрида гасят добавлением метанола. Раствор перешивают в течение 20 мин при комнатной температуре и концентрируют досуха. Остаток растворяют в этилацетате (30 мл) и раствор промывают насыщенным водным раствором NaHCO3 (220 мл). Органическую фазу сушат над Na2SO4,твердые частицы отфильтровывают и растворитель удаляют за счет упаривания. Получают I-18 в виде бесцветного масла, которое используют в таком виде в следующей реакции. ЖХ-МС: время удержания: 3,07 мин. К охлажденной смеси промежуточного соединения I-18 (250 мг, 0,419 ммоль), 1 Н-1,2,4-триазола(327 мг, 4,73 ммоль), триэтиламина (661 мкл, 4,73 ммоль) и CH2Cl2 (6,0 мл) добавляют POCl3 (102 мкл,1,089 ммоль), поддерживая температуру реакции ниже 25 С (что вызывает выпадение белого осадка). Реакционную смесь перемешивают при комнатной температуре в течение 4 ч. После завершения реакции избыток POCl3 гасят аккуратным добавлением холодной H2O. Органический слой отделяют и концентрируют упариванием под вакуумом. Смесь очищают с помощью хроматографии на силикагеле с использованием градиента элюента CH2Cl2/этилацетат от 90:10 до 85:15, получая промежуточное соединение I-19 в виде масла (200 мг, 74%). ЖХ-МС: время удержания: 3,15 мин. Промежуточное соединение I-19 (200 мг, 0,309 ммоль) растворяют в THF (5 мл) и обрабатывают концентрированным водным раствором NH4OH (0,6 мл). Спустя 4 ч добавляют более концентрированный водный раствор NH4OH (0,3 мл) и смесь перемешивают в течение ночи. Растворитель удаляют под вакуумом, масло растворяют в этилацетате и промывают водой и солевым раствором. После осушки надNa2SO4, фильтрации и упаривания летучих компонентов, остаток (I-20) используют как есть в следующей реакции. ЖХ-МС: время удержания: 2,86 мин, m/z = 594 (М-Н)-. Промежуточное соединение I-20 (180 мг, 0,302 ммоль) растворяют в 80% водной уксусной кислоте(5 мл) и реакционную смесь перемешивают при комнатной температуре. Спустя 9 ч удаляют летучие компоненты и смесь очищают с помощью хроматографии на силикагеле с использованием градиента элюента от 5 до 15% метанола в CH2Cl2. Полученное вещество затирают с iPr2O и сушат под вакуумом. Получают соединение 5 (60,8 мг, 62%). ЖХ-МС: время удержания: 1,25 мин, m/z = 324 (М+Н)+. 1 Пример 6. Эфир изомасляной кислоты (2S)-бензил 2-4R,6R,7S)-4-(4-амино-2-оксопиримидин 1(2 Н)-ил)-7-гидрокси-5-оксаспиро[2.4]гептан-6-ил)метокси)(фенокси)фосфориламино)пропионат (6) Соединение 5 растворяют в сухой смеси THF/пиридин вместе с (2S)-бензил 2-(хлор(фенокси)фосфориламино)пропаноатом (2,0 экв.). Смесь охлаждают до -78 С. ДобавляютN-метилимидазол (NMI) (8 экв.) и смесь перемешивают в течение 15 мин при -78 С и затем перемешивают при комнатной температуре в течение ночи. Смесь упаривают досуха. Добавляют 10 мл CH2Cl2 и остаток промывают 10 мл 0,5 н. HCl. Органический слой отделяют и промывают 10 мл воды, сушат надNa2SO4, фильтруют и упаривают. Соединение очищают с помощью хроматографии на силикагеле с использованием в качестве элюента градиента CH2Cl2/MeOH. Следуя аналогичной методике, но исходя из (2S)-этил 2-(хлор(фенокси)фосфориламино)пропаноата также получают эфир изомасляной кислоты (2S)-этил 2-4R,6R,7S)-4-(4-амино-2-оксопиримидин 1(2 Н)-ил)-7-гидрокси-5-оксаспиро[2.4]гептан-6-ил)метокси)(фенокси)фосфориламино)пропаноат (7): Биологические примеры Анализ репликации. Соединения формулы (I) исследуют на активность ингибирования репликации РНК ВГС в исследовании на клеточном уровне, направленном на идентификацию соединений, которые ингибируют ВГС функциональную реплицирующую клеточную линию, также известную как ВГС репликоны. Клеточный анализ основан на экспрессионном конструкте bicistronic, описанном Lohmann et al. (1999), Science,vol. 285, p. 110-113 с модификациями, описанными Krieger et al. (2001), Journal of Virology, 75:4614-4624,в многоцелевой стратегии скрининга. В анализе используется линия клеток со стабильной трансфекцией Huh-7 luc/neo (далее называемаяHuh-Luc). Данная линия клеток содержит RNA кодирующий экспрессионный конструкт bicistronic,включающий регионы дикого типа NS3-NS5B ВГС типа 1b, транслированные от участка внутренней посадки рибосомы (IRES) от вируса энцефаломиокардита (EMCV), с предшествующей репортерной областью (FfL-люцифераза) и областью селектируемого маркера (neoR, неомицинфосфотрансфераза). Конструкт ограничен 5-' и 3'-NTR (нетранслируемыми областями) от ВГС типа 1b. Продолжение культуры клеток репликона в присутствии G418 (neoR) зависит от репликации РНК ВГС. Для скрининга противовирусных соединений используют клетки, стабильно трансфецирующие репликон, экспрессирующий РНК ВГС, которые реплицируют автономно и до высоких уровней, кодируя в том числе люциферазу. Клетки репликона высевают на 384-луночные планшеты в присутствии тестовых и контрольных соединений, которые добавляют в различных концентрациях. После инкубации в течение трех дней измеряют ВГС репликацию, анализируя активность люциферазы (используя стандартные субстраты, и реагенты для анализа люциферазы, и Perkin Elmer ViewLux ultraHTS аппарат для визуализации микропланшетов). Клетки репликона в контрольных культурах обладают высокой экспрессией люциферазы при отсутствии какого-либо ингибитора. Ингибирующая активность соединения на активность люциферазы наблюдается на клетках Huh-Luc, позволяя получить для каждого соединения кривую дозаответ. Затем рассчитывают значения ЕС 50, которые отражают количество соединения, необходимое для снижения уровня детектируемой активности люциферазы на 50%, или, более конкретно, свойство реплицироваться РНК, генетически связанного ВГС репликона. Клеточная токсичность. Клеточную токсичность определяют в анализе репликона Huh7-CMV-Luc. Клетки репликона(2500 клеток/лунка), стабильно трансформированных с репортным геном люциферазы под контролем конститутивного промотора цитомегаловируса (CMV), культивируют в присутствии или в отсутствие концентраций исследуемого соединения. Спустя три дня после инкубации при 37 С в атмосфере СО 2 и влажности 5% количественно определяют пролиферацию клеток за счет измерения Luc активности и выражают как СС 50 значения (цитотоксичность, 50% ингибирующая концентрация роста клеток). Анализы проводят в 384-луночных планшетах. ВИЧ-анализ. Соединения по настоящему изобретению анализируют на их активность против дикого типа вируса иммунодефицита человека (ВИЧ). Противовирусная активность исследуется с использованием анализа на клеточном уровне, который проводят согласно следующей методике. Конструируют линию Т-клеток человека МТ 4 с зеленым флуоресцентным белком (GFP) и ВИЧ-специфичным промотором, HIV-1 длинным концевым повтором (LTR). Данная линия клеток, обозначенная МТ 4 LTR-EGFP, может быть использована для in vitro исследований по отношению к анти-ВИЧ активности исследуемых соединений. В инфицированных ВИЧ-1 клетках образуется Tat-белок, который активирует LTR промотор и в итоге приводит к стимулированию образования GFP репортного белка, позволяя измерять текущую ВИЧинфекцию с помощью флуорометрического анализа. Могут быть определены эффективные значения концентрации, такие как 50% эффективной концентрации (ЕС 50), и они обычно выражаются в мкМ. Значение ЕС 50 определено как концентрация анализируемого соединения, которая снижает флуоресценцию ВИЧ-инфицированных клеток на 50%. Контроль за ВИЧ-инфекцией выполняется с помощью сканирующего микроскопа. Анализ изображения позволяет проводить высокочувствительное детектирование вирусной инфекции. Измерение проводят до некроза клеток, в частности, измерения проводят спустя три дня после инфицирования. В столбце IIIB в таблице перечислены значения ЕС 50 против дикого штаммаIIIB. Результаты, которые приведены в последующей таблице, показывают, что соединения настоящего изобретения проявляют активность против ВГС, при этом отсутствует активность против ВИЧ. Они показывают благоприятные результаты в отношении токсичности и обладают допустимым индексом селективности (отношение между ЕС 50 и СС 50). Результаты анализов включая все его возможные стереоизомеры, где R3 и R4 независимо выбраны из группы, состоящей из водорода, -C(=O)R5 и каждый R5 независимо выбран из группы, состоящей из водорода и C1-C6-алкила;R9 является C1-C6-алкилом или бензилом,при условии, что R3 и R4, одновременно, не являются водородом,или его фармацевтически приемлемые соли или сольваты. 2. Соединение по п.1, где R3 является водородом и R4 является группой формулы 3. Соединение по п.1 или 2, где R8 является водородом и R8' является водородом или C1-C6-алкилом. 4. Соединение по п.1 или 2, где один из R3 и R4 является -C(=O)R5 и другой из R3 и R4 является водородом или где R3 и R4, оба, являются -C(=O)R5, R5 является водородом. 5. Соединение по любому из пп.1 или 2-4, где R9 является C1-C6-алкилом или бензилом. 6. Соединение по п.1, где соединение имеет формулу 7. Соединение по п.6, где соединение находится в свободной форме. 8. Фармацевтическая композиция, содержащая эффективное противовирусное количество соединения формулы (I) по любому из пп.1-7 и фармацевтически приемлемый носитель. 9. Применение соединения формулы (I) по любому из пп.1-7, где R3 и R4 являются водородом, в качестве ингибитора ВГС. 10. Применение соединения по п.9, где в соединении формулы (I) R3 и R4 являются водородом, в качестве ингибитора ВГС. 11. Применение соединения по п.10, где соединение находится в свободной форме, в качестве ингибитора ВГС. 12. Комбинация, содержащая соединение формулы (I), в том числе и соединение формулы (I), гдеR3 и R4 являются водородом, с другим ингибитором ВГС. 13. Способ получения соединения формулы (I) по любому из пп.1-7, в котором соединение формулы (I), где R3 и R4, оба, являются водородом, получают путем превращения урацила в цитозин, исходя из 2'-дезокси-2'-спироциклопропилуридина 1f до соответствующего 2'-дезокси-2'-спироциклопропилцитидина 1g, с последующим удалением PG защитных групп, получая соединение I-а:- 23022754 14. Способ получения соединения формулы (I) по любому из пп.1-7, в котором R3 является водородом и R4 является, путем реакции соединения I-а с фосфорохлоридатом 2 а в присутствии основания, получая фосфорамидат I-b: 15. Способ получения соединения формулы (I) по любому из пп.1-7, в котором R3 является водородом и R4 является -C(=O)R5 или или R3 и R4 независимо друг от друга являются -C(=O)R5, путем селективной защиты 5'-гидроксигруппы в промежуточном соединении 3 а, получая промежуточное соединение 3b, которое, в свою очередь, этерифицируется до промежуточного соединения 3 с, с последующим превращением урацила в цитозин до промежуточного соединения 3d; снятие защиты последнего до 3'-моноэфира I-c или этерификация 5'-гидроксигруппы в I-c приводит к соединению I-d; или за счет селективной этерификации 5'-гидроксигруппы в промежуточном соединении 3 а,вводя, таким образом, группу R4, что приводит к промежуточному соединению 3 е, и промежуточное соединение 3 е затем этерифицируется другой кислотой, за счет чего вводится группа R3, давая диэфирное промежуточное соединение 3f, которое вводится в реакцию превращения урацила в цитозин, давая соединение I-d:
МПК / Метки
МПК: A61K 31/513, A61P 31/12, C07H 19/073
Метки: полимеразы, ингибиторы, циклопропильные
Код ссылки
<a href="https://eas.patents.su/26-22754-ciklopropilnye-ingibitory-polimerazy.html" rel="bookmark" title="База патентов Евразийского Союза">Циклопропильные ингибиторы полимеразы</a>
Предыдущий патент: Имидазотиадиазолы для применения в качестве ингибиторов киназ
Следующий патент: Способы длительной терапии с применением аминопиридинов
Случайный патент: Твердые формы (e)-1-(4-((1r,2s,3r)-1,2,3,4-тетрагидроксибутил)-1h-имидазол-2-ил)этаноноксима












