Производные бензимидазола в качестве ингибиторов pi3-киназ
Номер патента: 22623
Опубликовано: 29.02.2016
Авторы: Санчес Роберт, Тедеско Розанна, Цюй Цзюнья, Риверо Ральф
Формула / Реферат
1. Соединение формулы (I)
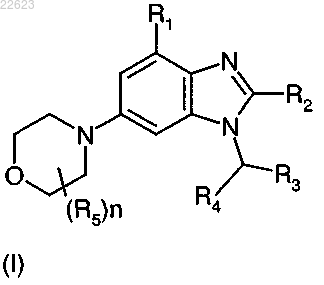
где R1 выбран из Н, C1-6алкила, C1-6алкокси, гидрокси, галогена, -CN, -NH2, -NHC(O)Ra, -NHSO2Ra, -CO2H,
-CO2Ra, -CONHRb, -CONH2, -CH2OH и гетероарила, где гетероарил может быть замещен одной или двумя C1-3алкильными группами;
R2 выбран из Н, -NHRa, C1-6алкокси, галогена, -CF3, -CHF2 и C1-6алкила;
R3 выбран из арила и гетероарила, где указанный арил или гетероарил может быть замещен одним-тремя Rc;
R4 выбран из Н или Ra;
каждый R5 независимо выбран из C1-6алкила;
каждый Ra независимо выбран из C1-3алкила;
Rb выбран из Н, C1-3алкила и SO2Me;
каждый Rc независимо выбран из C1-3алкила, галогена, -CF3 и гидрокси;
n равно 0-2,
где арил представляет собой фенил или нафтил;
гетероарил представляет собой 5-8-членную моноциклическую или 8-12-членную бициклическую ароматическую кольцевую систему, имеющую 1-4 гетероатома, выбранных из N, S и О;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, имеющее формулу (I)(C)

где каждый из R6, R7 и R8 независимо выбран из C1-3алкила, галогена, -CF3 и гидроксила, или R6 и R7 вместе с фенилом, к которому они присоединены, образуют нафтил или бициклический гетероарил, как он определен в п.1, или R7 и R8 вместе с фенилом, к которому они присоединены, образуют нафтил или бициклический гетероарил, как он определен в п.1.
3. Соединение или его фармацевтически приемлемая соль по п.1, где соединение имеет формулу
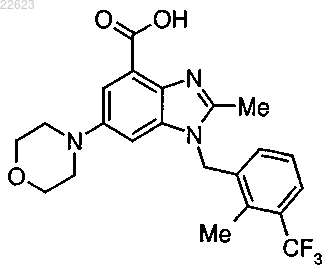
4. Фармацевтическая композиция для ингибирования активности фосфоинозитид-3-киназы, содержащая соединение по п.3 и фармацевтически приемлемый носитель.
5. Соединение по п.1 формулы
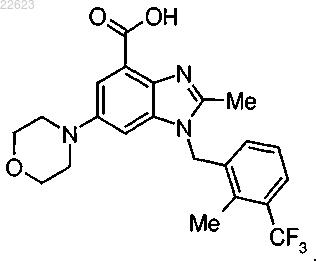
6. Фармацевтическая композиция по п.4, содержащая соединение по п.5 и фармацевтически приемлемый носитель.
7. Фармацевтически приемлемая соль по п.1 соединения формулы
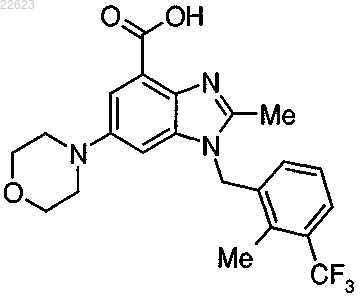
8. Фармацевтическая композиция по п.4, содержащая соединение по п.7 и фармацевтически приемлемый носитель.
9. трис-(Гидроксиметил)аминометановая соль по п.1 соединения формулы
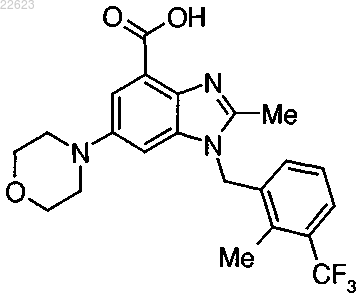
10. Фармацевтическая композиция по п.4, содержащая соединение по п.9 и фармацевтически приемлемый носитель.
11. Способ лечения неоплазмы, восприимчивой к лечению ингибитором фосфоинозитид-3-киназы, у млекопитающего, нуждающегося в этом, включающий введение млекопитающему терапевтически эффективного количества соединения по любому из пп.1-3, 5, 7 и 9.
12. Способ по п.11, где указанная неоплазма представляет собой PTEN (гомолог фосфатазы и тензина)-дефицитную неоплазму, выбранную из глиом головного мозга, лейкозов, синдрома Банаяна-Зонана, болезни Каудена, опухоли Вильмса, саркомы, рака, гигантоклеточной опухоли кости, злокачественной лимфомы и нейробластомы.
13. Способ по п.12, где PTEN-дефицитная неоплазма выбрана из глиобластом, болезни Лермитта-Дюкло, рака молочной железы, воспалительного рака молочной железы, рака толстой и прямой кишки, саркомы Юинга, рабдомиосаркомы, эпендимомы, медуллобластомы, рака головы и шеи, рака почки, рака легких, рака печени, меланомы, плоскоклеточной карциномы, рака яичников, рака поджелудочной железы, рака предстательной железы, остеосаркомы, рака щитовидной железы, Т-клеточного лимфобластного лейкоза, хронического миелолейкоза, хронического лимфолейкоза, волосатоклеточного лейкоза, острого лимфобластного лейкоза, острого миелогенного лейкоза, хронического нейтрофильного лейкоза, острого Т-клеточного лимфобластного лейкоза, плазмоцитомы, иммунобластной крупноклеточной лейкемии, мантийноклеточного лейкоза, мегакариобластного лейкоза, множественной миеломы, острого мегакариоцитарного лейкоза, промиелоцитарного лейкоза, эритролейкоза, лимфомы Ходжкина, неходжкинской лимфомы, лимфобластной Т-клеточной лимфомы, лимфомы Беркитта, фолликулярной лимфомы, рака мочевого пузыря, уротелиального рака, рака вульвы, рака шейки матки, рака эндометрия, мезотелиомы, рака пищевода, рака слюнных желез, гепатоцеллюлярного рака, рака желудка, рака носоглотки, рака щеки, рака ротовой полости, GIST (желудочно-кишечной стромальной опухоли) и рака яичка.
14. Способ по п.12, где указанная PTEN-дефицитная неоплазма выбрана из рака предстательной железы, немелкоклеточного рака легких, рака эндометрия, рака желудка, меланомы, рака головы и шеи, рака молочной железы, включая тройной негативный рак молочной железы, и глиомы.
15. Способ по любому из пп.11-14, где указанное млекопитающее представляет собой человека.
16. Способ по п.14, где указанный рак предстательной железы представляет собой гормонорезистентный рак предстательной железы.
17. Применение соединения по любому из пп.1-3, 5, 7 и 9 для ингибирования активности фосфоинозитид-3-киназы.
18. Применение фармацевтической композиции по любому из пп.4, 6, 8 и 10 для ингибирования активности фосфоинозитид-3-киназы.
19. Применение соединения по любому из пп.1-3, 5, 7 и 9 для лечения PTEN-дефицитной восприимчивой неоплазмы, выбранной из глиом головного мозга, лейкозов, синдрома Банаяна-Зонана, болезни Каудена, опухоли Вильмса, саркомы, рака, гигантоклеточной опухоли кости, злокачественной лимфомы и нейробластомы.
20. Применение по п.19, где PTEN-дефицитная неоплазма выбрана из глиобластом, болезни Лермитта-Дюкло, рака молочной железы, воспалительного рака молочной железы, рака толстой и прямой кишки, саркомы Юинга, рабдомиосаркомы, эпендимомы, медуллобластомы, рака головы и шеи, рака почки, рака легких, рака печени, меланомы, плоскоклеточной карциномы, рака яичников, рака поджелудочной железы, рака предстательной железы, остеосаркомы, рака щитовидной железы, Т-клеточного лимфобластного лейкоза, хронического миелолейкоза, хронического лимфолейкоза, волосатоклеточного лейкоза, острого лимфобластного лейкоза, острого миелогенного лейкоза, хронического нейтрофильного лейкоза, острого Т-клеточного лимфобластного лейкоза, плазмоцитомы, иммунобластной крупноклеточной лейкемии, мантийноклеточного лейкоза, мегакариобластного лейкоза, множественной миеломы, острого мегакариоцитарного лейкоза, промиелоцитарного лейкоза, эритролейкоза, лимфомы Ходжкина, неходжкинской лимфомы, лимфобластной Т-клеточной лимфомы, лимфомы Беркитта, фолликулярной лимфомы, рака мочевого пузыря, уротелиального рака, рака вульвы, рака шейки матки, рака эндометрия, мезотелиомы, рака пищевода, рака слюнных желез, гепатоцеллюлярного рака, рака желудка, рака носоглотки, рака щеки, рака ротовой полости, GIST (желудочно-кишечной стромальной опухоли) и рака яичка.
21. Применение фармацевтической композиции по любому из пп.4, 6, 8 и 10 для лечения PTEN-дефицитной восприимчивой неоплазмы, выбранной из глиом головного мозга, лейкозов, синдрома Банаяна-Зонана, болезни Каудена, опухоли Вильмса, саркомы, рака, гигантоклеточной опухоли кости, злокачественной лимфомы и нейробластомы.
22. Применение по п.21, где PTEN-дефицитная неоплазма выбрана из глиобластом, болезни Лермитта-Дюкло, рака молочной железы, воспалительного рака молочной железы, рака толстой и прямой кишки, саркомы Юинга, рабдомиосаркомы, эпендимомы, медуллобластомы, рака головы и шеи, рака почки, рака легких, рака печени, меланомы, плоскоклеточной карциномы, рака яичников, рака поджелудочной железы, рака предстательной железы, остеосаркомы, рака щитовидной железы, Т-клеточного лимфобластного лейкоза, хронического миелолейкоза, хронического лимфолейкоза, волосатоклеточного лейкоза, острого лимфобластного лейкоза, острого миелогенного лейкоза, хронического нейтрофильного лейкоза, острого Т-клеточного лимфобластного лейкоза, плазмоцитомы, иммунобластной крупноклеточной лейкемии, мантийноклеточного лейкоза, мегакариобластного лейкоза, множественной миеломы, острого мегакариоцитарного лейкоза, промиелоцитарного лейкоза, эритролейкоза, лимфомы Ходжкина, неходжкинской лимфомы, лимфобластной Т-клеточной лимфомы, лимфомы Беркитта, фолликулярной лимфомы, рака мочевого пузыря, уротелиального рака, рака вульвы, рака шейки матки, рака эндометрия, мезотелиомы, рака пищевода, рака слюнных желез, гепатоцеллюлярного рака, рака желудка, рака носоглотки, рака щеки, рака ротовой полости, GIST (желудочно-кишечной стромальной опухоли) и рака яичка.
23. Применение соединения по любому из пп.1-3, 5, 7 и 9 для изготовления лекарственного средства для лечения PTEN-дефицитной восприимчивой неоплазмы, выбранной из глиом головного мозга, лейкозов, синдрома Банаяна-Зонана, болезни Каудена, опухоли Вильмса, саркомы, рака, гигантоклеточной опухоли кости, злокачественной лимфомы и нейробластомы у млекопитающего, нуждающегося в этом.
24. Применение по п.23, где PTEN-дефицитная неоплазма выбрана из глиобластом, болезни Лермитта-Дюкло, рака молочной железы, воспалительного рака молочной железы, рака толстой и прямой кишки, саркомы Юинга, рабдомиосаркомы, эпендимомы, медуллобластомы, рака головы и шеи, рака почки, рака легких, рака печени, меланомы, плоскоклеточной карциномы, рака яичников, рака поджелудочной железы, рака предстательной железы, остеосаркомы, рака щитовидной железы, Т-клеточного лимфобластного лейкоза, хронического миелолейкоза, хронического лимфолейкоза, волосатоклеточного лейкоза, острого лимфобластного лейкоза, острого миелогенного лейкоза, хронического нейтрофильного лейкоза, острого Т-клеточного лимфобластного лейкоза, плазмоцитомы, иммунобластной крупноклеточной лейкемии, мантийноклеточного лейкоза, мегакариобластного лейкоза, множественной миеломы, острого мегакариоцитарного лейкоза, промиелоцитарного лейкоза, эритролейкоза, лимфомы Ходжкина, неходжкинской лимфомы, лимфобластной Т-клеточной лимфомы, лимфомы Беркитта, фолликулярной лимфомы, рака мочевого пузыря, уротелиального рака, рака вульвы, рака шейки матки, рака эндометрия, мезотелиомы, рака пищевода, рака слюнных желез, гепатоцеллюлярного рака, рака желудка, рака носоглотки, рака щеки, рака ротовой полости, GIST (желудочно-кишечной стромальной опухоли) и рака яичка.
25. Применение по п.23, где указанное млекопитающее представляет собой человека.
26. Применение фармацевтической композиции по любому из пп.4, 6, 8 и 10 для изготовления лекарственного средства для лечения PTEN-дефицитной восприимчивой неоплазмы, выбранной из глиом головного мозга, лейкозов, синдрома Банаяна-Зонана, болезни Каудена, опухоли Вильмса, саркомы, рака, гигантоклеточной опухоли кости, злокачественной лимфомы и нейробластомы у млекопитающего, нуждающегося в этом.
27. Применение по п.26, где РТЕ N-дефицитная неоплазма выбрана из глиобластом, болезни Лермитта-Дюкло, рака молочной железы, воспалительного рака молочной железы, рака толстой и прямой кишки, саркомы Юинга, рабдомиосаркомы, эпендимомы, медуллобластомы, рака головы и шеи, рака почки, рака легких, рака печени, меланомы, плоскоклеточной карциномы, рака яичников, рака поджелудочной железы, рака предстательной железы, остеосаркомы, рака щитовидной железы, Т-клеточного лимфобластного лейкоза, хронического миелолейкоза, хронического лимфолейкоза, волосатоклеточного лейкоза, острого лимфобластного лейкоза, острого миелогенного лейкоза, хронического нейтрофильного лейкоза, острого Т-клеточного лимфобластного лейкоза, плазмоцитомы, иммунобластной крупноклеточной лейкемии, мантийноклеточного лейкоза, мегакариобластного лейкоза, множественной миеломы, острого мегакариоцитарного лейкоза, промиелоцитарного лейкоза, эритролейкоза, лимфомы Ходжкина, неходжкинской лимфомы, лимфобластной Т-клеточной лимфомы, лимфомы Беркитта, фолликулярной лимфомы, рака мочевого пузыря, уротелиального рака, рака вульвы, рака шейки матки, рака эндометрия, мезотелиомы, рака пищевода, рака слюнных желез, гепатоцеллюлярного рака, рака желудка, рака носоглотки, рака щеки, рака ротовой полости, GIST (желудочно-кишечной стромальной опухоли) и рака яичка.
28. Применение по п.26, где указанное млекопитающее представляет собой человека.
Текст
Изобретение относится к применению производных бензимидазола формулы (I) где R1-R5 и n являются такими, как они определены в формуле изобретения, для модулирования, в особенности ингибирования, активности или функционирования семейства фосфоинозитид-3'-OHкиназ (в дальнейшем PI3-киназ), соответственно PI3K, PI3K, PI3K и/или PI3K. Соответственно настоящее изобретение относится к применению бензимидазолов в лечении одного или более чем одного болезненного состояния, выбранного из аутоиммунных расстройств, воспалительных заболеваний, сердечно-сосудистых заболеваний, нейродегенеративных заболеваний, аллергии,астмы, панкреатита, полиорганной недостаточности, заболеваний почек, агрегации тромбоцитов,рака, подвижности сперматозоидов, отторжения при трансплантации, отторжения трансплантата и повреждений легких. Более конкретно, настоящее изобретение относится к PI3K-селективным соединениям бензимидазола формулы (I) для лечения рака. Область изобретения Это изобретение относится к применению производных бензимидазола для модулирования, в особенности ингибирования активности или функции семейства фосфоинозитид-3'-OH-киназ (в дальнейшемPI3-киназы), соответственно PI3K, PI3K, PI3K и/или PI3K. Соответственно настоящее изобретение относится к применению бензимидазолов в лечении одного или более чем одного болезненного состояния, выбранного из аутоиммунных расстройств, воспалительных заболеваний, сердечно-сосудистых заболеваний, нейродегенеративных заболеваний, аллергии, астмы, панкреатита, полиорганной недостаточности, заболеваний почек, агрегации тромбоцитов, рака, подвижности сперматозоидов, отторжения при трансплантации, отторжения трансплантата и повреждений легких. Более конкретно, настоящее изобретение относится к PI3K-селективным соединениям бензимидазола для лечения рака. Предшествующий уровень техники Фосфоинозитид-3-киназный (PI3K) путь входит в число наиболее часто активируемых при раке человека, и его роль в канцерогенезе четко установлена (Samuels Y. and Ericson K. Oncogenic PI3K and itsrole in cancer. Current Opinion in Oncology, 2006; 18:77-82). Инициация сигнальной системы начинается с фосфорилирования фосфатидилинозитол-4,5-бисфосфата (PIP2) с получением фосфатидилинозитол 3,4,5-трифосфата (PIP3). PIP3 является важным вторичным посредником, который рекрутирует белки,содержащие плекстрин-гомологичные домены, к клеточной мембране, где они активируются. Наиболее изученным из этих белков является AKT, который способствует выживанию, росту и пролиферации клеток. Семейство PI3K состоит из 15 белков, которые обладают гомологией последовательностей, в частности в пределах их киназных доменов, но имеют различную субстратную специфичность и типы регуляции (Vivanco I. and Sawyers C.L. The phosphatidylinositol 3-kinase-AKT pathway in human cancer. NatureReviews Cancer, 2002; 2:489-501). PI3K I класса представляют собой гетеродимеры, состоящие из каталитической субъединицы р 110, связанной с одной из нескольких регуляторных субъединиц, известных под названием р 85, и являются наиболее широко изученными в отношении онкогенеза. Каталитические субъединицы PI3K класса 1 А содержат изоформы р 110, р 110 и р 110, которые связаны с одной из пяти различных регуляторных субъединиц, кодируемых тремя отдельными генами. Единственная каталитическая изоформа р 110 PI3K класса 1 В взаимодействует с одной из двух связанных регуляторных субъединиц (Crabbe T., Welham M.J., Ward S.G. The PI3K inhibitor arsenal: choose your weapon Trends inBiochem Sci, 2007; 32:450-456). PI3K I класса в основном отвечают за фосфорилирование ключевой сигнальной молекулы PIP2. Связь между PI3K-путем и раком была подтверждена исследованием, в котором были установлены соматические мутации в гене PIK3CA, кодирующем белок р 110. Впоследствии мутации в PIK3CA были установлены при многочисленных раковых опухолях, включая рак толстой и прямой кишки, молочной железы, глиобластомы, рак яичников и легких. В отличие от PIK3CA не установлено никаких соматических мутаций в изоформе . Однако в исследованиях сверхэкспрессии изоформу PI3K вовлекали в случае необходимости для трансформации, индуцированной путем потери или инактивации опухолевого супрессора PTEN, как in vitro, так и in vivo (Torbett N.E., Luna A., Knight Z.A. et al., A chemical screen incells. Proc Natl Acad Sci USA 2005; 102:18443-8). В соответствии с этими данными сверхэкспрессия генаPIK3CB установлена при некоторых опухолях мочевого пузыря, толстой кишки, глиобластомах и лейкемиях, и миРНК опосредованный нокдаун р 110 в линиях клеток глиобластомы приводит к супрессии опухолевого роста in vitro и in vivo (Pu P., Kang C., Zhang Z., et al. Downregulation of PIK3CB by siRNAsuppresses malignant glioma cell growth in vitro and in vivo. Technolo Cancer Res Treat 2006; 5:271-280). В более поздних данных, в которых использовали кшРНК (короткую шпилечную РНК), показано, что даун-регуляция р 110, а не р 110 приводила к инактивации PI3K-пути и последующей инактивации роста опухолевых клеток в PTEN-дефицитных раковых клетках, как in vitro, так и in vivo (Wee S. Wiederschain,Maira S-M., Loo A., Miller C. et al., PTEN-deficient cancers depend on PIK3CB. Proc Natl Acad Sci 2008; 105:13057-13062). В соответствии с ролью PIK3CB в передаче сигналов в PTEN-негативных опухолях сообщали, что р 110 является необходимым для трансформированного фенотипа в модели PTENнегативного рака предстательной железы (Jia S., Liu Z., Zhang S., Liu P., Zhang L. et al., Essential roles ofPI(3)K-p110b in cell growth, metabolism and tumorgenesis. Nature 2008; 10:1038). Кроме того, сообщалось, что фиброгенез, включая системный склероз (SSc), артрит, нефропатию,цирроз печени и некоторые виды рака, связан с дефицитом PTEN и соответствующей сверхэкспрессиейPI3K-Akt (Parapuram S.K., et al., Loss of PTEN expression by dermal fibroblasts cuases skin fibrosis. J. of Investigative Dermatology, advance online publication 9 June 2011; doi: 10.1038/jid.2011.156). Взятые вместе эти данные указывают на PI3K р 110 как на перспективную мишень для рака и других синдромов, связанных с потерей PTEN (Hollander M. Christine; Blumenthal, Gideon M.; Dennis, Phillip P.; PTEN loss in the Поэтому желательно создать мощный, селективный ингибитор PI3K-. Краткое изложение сущности изобретения Это изобретение относится к новым соединениям формулы (I) где R1 выбран из Н, C1-6 алкила, алкокси, гидрокси, галогена, -CN, -NH2, -NHC(O)Ra, -NHSO2Ra,-CO2H, -CO2Ra, -CONHRb, -CONH2, -CH2OH и гетероарила, где гетероарил может быть замещен одной или двумя группами C1-3 алкила;R3 выбран из арила и гетероарила, где указанный арил или гетероарил может быть замещен однимтремя Rc;R4 выбран из Н или Ra; каждый R5 независимо выбран из C1-6 алкила; каждый Ra независимо выбран из C1-3 алкила;Rb выбран из C1-3 алкила и SO2Me; каждый Rc независимо выбран из C1-3 алкила, галогена, -CF3 и гидрокси; иn равно 0-2,или их фармацевтически приемлемым солям. В другом аспекте настоящего изобретения предложен способ лечения восприимчивой неоплазмы у млекопитающего, нуждающегося в этом, включающий введение млекопитающему терапевтически эффективного количества соединения формулы (I) (включая любую конкретную субгенерическую формулу, описанную здесь) или его фармацевтически приемлемой соли. В другом аспекте настоящего изобретения предложено соединение формулы (I) (включая любую конкретную субгенерическую формулу, описанную здесь) или его фармацевтически приемлемая соль для применения в терапии. В другом аспекте предложено соединение формулы (I) (включая любую конкретную субгенерическую формулу, описанную здесь) или его фармацевтически приемлемая соль для применения при лечении восприимчивой неоплазмы у млекопитающего, нуждающегося в этом. В другом аспекте настоящего изобретения предложено применение соединения формулы (I) (включая любую конкретную субгенерическую формулу, описанную здесь) или его фармацевтически приемлемой соли при получении лекарственного средства для применения при лечении восприимчивой неоплазмы у млекопитающего, нуждающегося в этом. В другом аспекте настоящего изобретения предложена фармацевтическая композиция, содержащая соединение формулы (I) (включая любую конкретную субгенерическую формулу, описанную здесь) или его фармацевтически приемлемую соль, для применения при лечении восприимчивой неоплазмы у млекопитающего, нуждающегося в этом. Подробное описание изобретения Это изобретение относится к соединениям формулы (I). Согласно другому воплощению изобретение включает соединения формулы (I)(А) где R1 выбран из Н, C1-6 алкила, алкокси, гидрокси, галогена, -CN, -NH2, -NHC(O)Ra, -NHSO2Ra,-CO2H, -CO2Ra, -CONHRb, -CONH2, -CH2OH и гетероарила, где гетероарил может быть замещен одной или двумя группами C1-3 алкила, где гетероарил выбран из группы, состоящей из пиразолила, триазолила,тетразолила, оксазолила и имидазолила;R3 выбран из арила и гетероарила, где указанный арил или гетероарил может быть замещен однимтремя Rc;R4 выбран из Н или Ra; каждый R5 независимо выбран из C1-6 алкила; каждый Ra независимо выбран из C1-3 алкила;Rb выбран из C1-3 алкила и -SO2Me; каждый Rc независимо выбран из C1-3 алкила, галогена, -CF3 и гидрокси; иn равно 0-2,или их фармацевтически приемлемые соли. Согласно другому воплощению изобретение включает соединения формулы (I)(В) где R1 выбран из Н, C1-6 алкила, алкокси, гидрокси, галогена, -CN, -NH2, -NHC(O)Ra, -NHSO2Ra,-CO2H, -CO2Ra, -CONHRb, -CONH2, -CH2OH и гетероарила, где гетероарил может быть замещен одной или двумя группами C1-3 алкила;R3 выбран из арила и гетероарила, где указанный арил или гетероарил может быть замещен однимтремя Rc и где арил или гетероарил выбраны из фенила, нафтила, бензотиенила, хинолинила, изохинолинила и хиназолинила;R4 выбран из Н или Ra; каждый R5 независимо выбран из C1-6 алкила; каждый Ra независимо выбран из C1-3 алкила;Rb выбран из C1-3 алкила и -SO2Me; каждый Rc независимо выбран из C1-3 алкила, галогена, -CF3 и гидрокси; иn равно 0-2,или их фармацевтически приемлемые соли. Согласно другому воплощению изобретение включает соединения формулы (I)(В), где каждый Rc независимо представляет собой C1-3 алкил, F или Cl и n равно 0. Согласно другому воплощению изобретение включает соединения формулы (I)(В), где каждый Rc независимо представляет собой CF3 или F и n равно 0. Согласно другому воплощению изобретение включает соединения формулы (I)(С) где R1 выбран из Н, C1-6 алкила, алкокси, гидрокси, галогена, -CN, -NHC(O)Ra, -NHSO2Ra, -СО 2 Н,-CO2Ra, -CONHRb, -CONH2, -CH2OH и гетероарила, где гетероарил может быть замещен одной или двумя группами C1-3 алкила;R2 выбран из Н, -NHRa, алкокси или C1-6 алкила; каждый из R6, R7 и R8 независимо выбран из C1-3 алкила, галогена, -CF3 и гидроксила, или R6 и R7 соединяются с образованием бициклического арила или гетероарила, или R7 и R8 соединяются с образованием бициклического арила или гетероарила; каждый Ra независимо выбран из C1-3 алкила; иRb выбран из C1-3 алкила или -SO2Me; или их фармацевтически приемлемые соли. Согласно другому воплощению изобретение включает соединения формулы (I)(D) где R1 выбран из Н, C1-6 алкила, алкокси, гидрокси, галогена, -CN, -NHC(O)Ra, -NHSO2Ra, -CO2H,-CO2Ra, -CONHRb, -CONH2, -CH2OH и гетероарила, где гетероарил может быть замещен одной или двумя группами C1-3 алкила; каждый Ra независимо выбран из C1-3 алкила; иRb выбран из C1-3 алкила или SO2Me; или их фармацевтически приемлемые соли. Согласно другому воплощению изобретение включает соединения формулы (I)(Е) где R1 выбран из Н, C1-6 алкила, алкокси, гидрокси, галогена, -CN, -NHC(O)Ra, -NHSO2Ra, -CO2H,-CO2Ra, -CONHRb, -CONH2, -CH2OH и гетероарила, где гетероарил может быть замещен одной или двумя группами C1-3 алкила;R2 представляет собой Н, NHRa, алкокси или C1-6 алкил; каждый из R6 и R7 независимо выбран из C1-3 алкила, галогена, -CF3 и гидроксила; каждый Ra независимо представляет собой C1-3 алкил иRb представляет собой C1-3 алкил или SO2Me; или их фармацевтически приемлемые соли. Согласно другому воплощению изобретение включает соединения Определения Под термином "арил", который использован здесь, если не оговорено особо, подразумевают ароматическую углеводородную кольцевую систему. Кольцевая система может быть моноциклической или конденсированной полициклической (например, бициклической, трициклической и так далее). В различных воплощениях моноциклическое арильное кольцо представляет собой C5-C10, или C5-C7, или C5-C6,где данные углеродные числа относятся к числу атомов углерода, которые образуют кольцевую систему.C6-кольцевая система, то есть фенильное кольцо, является подходящей арильной группой. В различных воплощениях полициклическое кольцо представляет собой бициклическую арильную группу, где подходящие бициклические арильные группы представляют собой C8-C12 или C9-C10. Нафтильное кольцо, которое имеет 10 атомов углерода, является подходящей полициклической арильной группой. Под термином "гетероарил", который использован здесь, если не оговорено особо, подразумевают ароматическую кольцевую систему, содержащую атом(ы) углерода и по меньшей мере один гетероатом. Гетероарил может быть моноциклическим или полициклическим. Моноциклическая гетероарильная группа может иметь от 1 до 4 гетероатомов в кольце, тогда как полициклический гетероарил может содержать от 1 до 10 гетероатомов. Полициклическое гетероарильное кольцо может содержать конденсированные, спиро- или мостиковые кольцевые соединения, например бициклический гетероарил представляет собой полициклический гетероарил. Бициклические гетероарильные кольца могут содержать от 8 до 12 атомов. Моноциклические гетероарильные кольца могут содержать от 5 до 8 атомов (углерода и гетероатомов). Примеры гетероарильных групп включают бензофуран, бензотиен, бензотиофен, фуран,имидазол, индол, изотиазол, оксазол, пиразин, пиразол, пиридазин, пиридин, пиримидин, пиррол, хинолин, изохинолин, хиназолин, хиноксалин, тиазол и тиофен. Согласно альтернативному воплощению гетероарилы могут быть замещены одной-тремя алкильными группами. Под термином "алкокси", который использован здесь, подразумевают -О(алкил), включая -ОСН 3,-ОСН 2 СН 3 и -ОС(СН 3)3, где алкил является таким, как описано здесь. Под термином "гетероатом", который использован здесь, подразумевают кислород, азот или серу. Под термином "галоген", который использован здесь, подразумевают заместитель, выбранный из бромида, иодида, хлорида и фторида. Под термином "алкил" и его производными и во всех углеродных цепях, которые использованы здесь, включая алкильные цепи, определенные термином "-(CH2)n", "-(CH2)m" и тому подобными, подразумевают линейную или разветвленную, насыщенную или ненасыщенную углеводородную цепь, и, если не оговорено особо, углеродная цепь будет содержать от 1 до 12 атомов углерода. Под термином "совместное введение" и его производными, которые использованы здесь, подразумевают либо одновременное введение, либо любой способ раздельного последовательного введения соединения, ингибирующего PI3-киназу, которое описано здесь, и дополнительного активного ингредиента или ингредиентов. Термин "дополнительный активный ингредиент или ингредиенты", который использован здесь, включает любое соединение или известный терапевтический агент, или агент, который де-6 022623 монстрирует полезные свойства при введении пациенту, нуждающемуся в лечении. Соответственно, если введение не является одновременным, соединения вводят быстро одно за другим. Кроме того, не имеет значения, вводят ли соединения в одной и той же лекарственной форме, например одно соединение может быть введено местно, а другое соединение может быть введено перорально. Термин "соединение", который использован здесь, включает все изомеры соединения. Примеры таких изомеров включают энантиомеры, таутомеры, ротамеры. В формулах, где "пунктирная" связь проходит между двумя атомами, подразумевается, что такая связь может быть либо одинарной, либо двойной связью. Кольцевая система, содержащая такие связи,может быть ароматической или неароматической. Некоторые соединения, описанные здесь, могут содержать один или более хиральных атомов или же могут быть способны существовать в виде двух энантиомеров или двух или более диастереоизомеров. Таким образом, соединения по изобретению включают смеси энантиомеров/диастереоизомеров, а также очищенные энантиомеры/диастереоизомеры или энантиомерно/диастереоизомерно обогащенные смеси. Также в объем изобретения включены отдельные изомеры соединений, представленных вышеприведенной формулой (I), а также любые их полностью или частично равновесные смеси. Настоящее изобретение также охватывает отдельные изомеры соединений, представленных вышеприведенными формулами,в виде смесей с их изомерами, в которых один или более хиральные центры инвертированы. Настоящее изобретение также включает изотопомеры соединений формулы (I). Примеры таких изотопомеров включают, но не ограничиваются ими, соединения с одним или более атомов дейтерия. Соединения формулы (I) включены в фармацевтические композиции по изобретению. В тех случаях, когда присутствует группа -COOH или -OH, могут быть использованы фармацевтически приемлемые эфиры, например метиловый, этиловый, пивалоилоксиметиловый и тому подобные для группы -COOH, и ацетат, малеат и тому подобные для группы -OH, причем эти эфиры известны в данной области техники для изменения растворимости и гидролитических свойств, для применения в качестве препаратов с замедленным высвобождением или пролекарственных препаратов. Специалистам в данной области техники будет понятно, что соединения формулы (I) могут быть использованы в виде их фармацевтически приемлемых солей. Фармацевтически приемлемые соли соединений формулы (I) включают общепринятые соли, образованные из фармацевтически приемлемых(то есть нетоксичных) неорганических или органических кислот или оснований, а также четвертичные аммониевые соли. Типичные соли включают следующие: ацетат, бензолсульфонат, бензоат, бикарбонат,бисульфат, битартрат, борат, бромид, эдетат кальция, камзилат, карбонат, хлорид, клавуланат, цитрат,дигидрохлорид, эдетат, эдизилат, эстолат, эзилат, этаноламин, фумарат, глуцептат, глюконат, глутамат,гликолиларсанилат, гексилрезорцинат, гидрабамин, гидробромид, гидрохлорид, гидроксинафтоат, иодид,изетионат, лактат, лактобионат, лаурат, малат, малеат, манделат, мезилат (метансульфонат), метилбромид, метилнитрат, метилсульфат, гидромалеат калия, мукат, напсилат, нитрат, N-метилглюкамин, оксалат, памоат (эмбонат), пальмитат, пантотенат, фосфат/дифосфат, полигалактуронат, калий, салицилат,натрий, стеарат, субацетат, сукцинат, таннат, тартрат, теоклат, тозилат (метилбензолсульфонат), триэтиодид, триметиламмониум и валерат. Другие соли, такие как оксалат и трифторацетат, которые не являются фармацевтически приемлемыми, могут быть полезны в получении солей, используемых в качестве промежуточных соединений в получении соединений по изобретению, и они образуют дополнительный аспект изобретения. В одном воплощении соединение формулы (I) находится в форме свободного основания. В одном воплощении соединение формулы (I) находится в форме трис-соли, то есть трис(гидроксиметил)аминометана. В одном воплощении соединение формулы (I) находится в форме соли серной кислоты. В одном воплощении соединение формулы (I) находится в форме хлористо-водородной соли. В одном воплощении соединение формулы (I) находится в форме натриевой соли. Некоторые варианты солей соединений могут представлять собой сольваты, в частности гидраты. В одном воплощении соединение формулы (I) или его фармацевтически приемлемая соль находится в форме моно-, ди-, триили гемигидрата. На данный момент установлено, что соединения по настоящему изобретению являются ингибиторами фосфоинозитид-3-киназ (PI3K). Когда фермент фосфоинозитид-3-киназу (PI3K) ингибирует соединение по настоящему изобретению, PI3K не может проявлять свои ферментативные, биологические и/или фармакологические действия. Поэтому соединения по настоящему изобретению полезны в лечении аутоиммунных расстройств, воспалительных заболеваний, сердечно-сосудистых заболеваний, нейродегенеративных заболеваний, аллергии, астмы, панкреатита, полиорганной недостаточности, заболеваний почек, агрегации тромбоцитов, рака, подвижности сперматозоидов, отторжения при трансплантации, отторжения трансплантата и повреждений легких. Соединения формулы (I) подходят для модулирования, в особенности ингибирования, активности фосфоинозитид-3-киназ (PI3K), и более конкретно, являются селективными ингибиторами бета-изоформы фосфоинозитид-3-киназы (PI3K). Поэтому соединения по настоящему изобретению также полезны в лечении расстройств, которые опосредованы PI3K. Указанное лечение включает модулирование, в особенности ингибирование или даун-регуляцию, фосфоинозитид-3-киназ. Поскольку фармацевтически активные соединения по настоящему изобретению активны в качестве ингибиторов PI3 киназ, в частности соединения, которые ингибируют PI3K, либо селективно, либо совместно с одной или более чем одной PI3K, PI3K и/или PI3K, они обладают терапевтической ценностью в лечении восприимчивых неоплазм, в частности таких неоплазм, которые обнаруживают дефицитPTEN. Используемая здесь фраза "PTEN-дефицитный" или "дефицит PTEN" описывает опухоли с недостаточностью функции опухолевого супрессора PTEN (гомолог фосфатазы и тензина). Такая недостаточность включает мутацию в гене PTEN, уменьшение или отсутствие белков PTEN по сравнению с диким типом PTEN или мутацию или отсутствие других генов, что вызывает супрессию функции PTEN. Используемый здесь термин "лечение" или "излечение" в контексте терапевтических методов относится к облегчению конкретного состояния, устранению или уменьшению симптомов этого состояния,замедлению или прекращению прогрессирования, инвазии или диссеминации этого состояния и предупреждению или отсрочке рецидива этого состояния у ранее болевшего субъекта. Настоящее изобретение также обеспечивает применение соединений по изобретению для получения лекарственного средства в лечении некоторых состояний у млекопитающего (например, человека), нуждающегося в этом. Термин "восприимчивая неоплазма", который использован здесь, относится к неоплазмам, которые восприимчивы к лечению ингибитором киназ, и в особенности к неоплазмам, которые восприимчивы к лечению ингибитором PI3K. Неоплазмы, которые связаны с несоответствующей активностью фосфатазы PTEN, и в особенности неоплазмы, при которых обнаруживают мутацию PTEN или мутацию вышележащего активатора киназы PI3K или сверхэкспрессию вышележащего активатора киназы PI3K, и,как следствие, восприимчивы к лечению ингибитором PI3K, известны в данной области техники и включают как первичные, так и метастатические опухоли и виды рака. Согласно одному воплощению вид лечения восприимчивой неоплазмы может быть использован наравне с видом лечения рака. Согласно одному воплощению "восприимчивые неоплазмы" включают, но не ограничиваются ими,PTEN-дефицитные неоплазмы, перечисленные ниже головного мозга (глиомы),глиобластомы,лейкозы,синдром Банаяна-Зонана,болезнь Каудена,болезнь Лермитта-Дюкло,рак молочной железы,воспалительный рак молочной железы,рак толстой и прямой кишки,опухоль Вильмса,саркому Юинга,рабдомиосаркому,эпендимому,медуллобластому,рак толстой кишки,рак головы и шеи,рак почки,рак легких,рак печени,меланому,плоскоклеточную карциному,рак яичников,рак поджелудочной железы,рак предстательной железы,саркому,остеосаркому,гигантоклеточную опухоль кости,рак щитовидной железы,Т-клеточный лимфобластный лейкоз,хронический миелолейкоз,хронический лимфолейкоз,волосатоклеточный лейкоз,острый лимфобластный лейкоз,острый миелогенный лейкоз,хронический нейтрофильный лейкоз,острый Т-клеточный лимфобластный лейкоз,плазмоцитому,-8 022623 иммунобластную крупноклеточную лейкемию,мантийноклеточный лейкоз,множественную миелому,мегакариобластный лейкоз,острый мегакариоцитарный лейкоз,промиелоцитарный лейкоз,эритролейкоз,злокачественную лимфому,лимфому Ходжкина,неходжкинскую лимфому,лимфобластную Т-клеточную лимфому,лимфому Беркитта,фолликулярную лимфому,нейробластому,рак мочевого пузыря,уротелиальный рак,рак вульвы,рак шейки матки,рак эндометрия,рак почки,мезотелиому,рак пищевода,рак слюнных желез,гепатоцеллюлярный рак,рак желудка,рак носоглотки,рак щеки,рак ротовой полости,ЖКСО (желудочно-кишечную стромальную опухоль) и рак яичка. Согласно альтернативному воплощению термин "восприимчивая неоплазма" включает и ограничивается ими гормонорезистентный рак предстательной железы, немелкоклеточный рак легких, рак эндометрия, рак желудка, меланому, рак головы и шеи, рак молочной железы, включая тройной негативный рак молочной железы, и глиому. Дефицит PTEN связан с такими видами рака, которые показаны в ряде опубликованных источников (см., например, Am J Clin Pathol. 2009 Feb; 131(2):257-63 (глиобластома), J(рак молочной железы), Gynecol Oncol. 2009 Feb; 112(2):307-13 (рак яичников), Mod Pathol. 2010 Oct; 23(10):1316-24 (рак яичников), J Pathol. 2010 Feb; 220(3):392-400 (рак яичников), Lung. 2009 Mar-Apr; 187(2):104-9 (рак легких), Anticancer Res. 2007 Jan-Feb; 27(1B):575-81 (рак легких), Am J Surg. 2008 Jun; 195(6):719-25 (рак толстой кишки), J Clin Oncol. 2009 Dec 10; 27(35):5924-30 (рак толстой кишки), Gynecol Oncol. 2004 Jun; 93(3):621-7 (рак шейки матки) и J Oral Pathol Med. 2002 Aug; 31(7):379-84 (рак головы и шеи. В другом аспекте настоящего изобретения предложен способ лечения восприимчивой неоплазмы у млекопитающего, нуждающегося в этом, включающий введение млекопитающему терапевтически эффективного количества соединения формулы (I) (включая любую конкретную субгенерическую формулу, описанную здесь) или его фармацевтически приемлемой соли. В другом аспекте настоящего изобретения предложен способ лечения фиброза у млекопитающего,нуждающегося в этом, включающий введение млекопитающему терапевтически эффективного количества соединения формулы (I) (включая любую конкретную субгенерическую формулу, описанную здесь) или его фармацевтически приемлемой соли. Фиброз включает, альтернативно или в совокупности, системный склероз (CC), артрит, нефропатию и цирроз печени. В другом аспекте настоящего изобретения предложен способ лечения гормонорезистентного рака предстательной железы у млекопитающего, нуждающегося в этом, включающий введение млекопитающему терапевтически эффективного количества соединения формулы (I) (включая любую конкретную субгенерическую формулу, описанную здесь) или его фармацевтически приемлемой соли. В другом аспекте настоящего изобретения предложен способ лечения немелкоклеточного рака легкого у млекопитающего, нуждающегося в этом, включающий введение млекопитающему терапевтически эффективного количества соединения формулы (I) (включая любую конкретную субгенерическую фор-9 022623 мулу, описанную здесь) или его фармацевтически приемлемой соли. В другом аспекте настоящего изобретения предложен способ лечения рака эндометрия у млекопитающего, нуждающегося в этом, включающий введение млекопитающему терапевтически эффективного количества соединения формулы (I) (включая любую конкретную субгенерическую формулу, описанную здесь) или его фармацевтически приемлемой соли. В другом аспекте настоящего изобретения предложен способ лечения рака желудка у млекопитающего, нуждающегося в этом, включающий введение млекопитающему терапевтически эффективного количества соединения формулы (I) (включая любую конкретную субгенерическую формулу, описанную здесь) или его фармацевтически приемлемой соли. В другом аспекте настоящего изобретения предложен способ лечения меланомы у млекопитающего, нуждающегося в этом, включающий введение млекопитающему терапевтически эффективного количества соединения формулы (I) (включая любую конкретную субгенерическую формулу, описанную здесь) или его фармацевтически приемлемой соли. В другом аспекте настоящего изобретения предложен способ лечения рака головы и шеи у млекопитающего, нуждающегося в этом, включающий введение млекопитающему терапевтически эффективного количества соединения формулы (I) (включая любую конкретную субгенерическую формулу, описанную здесь) или его фармацевтически приемлемой соли. В другом аспекте настоящего изобретения предложен способ лечения тройного негативного рака молочной железы у млекопитающего, нуждающегося в этом, включающий введение млекопитающему терапевтически эффективного количества соединения формулы (I) (включая любую конкретную субгенерическую формулу, описанную здесь) или его фармацевтически приемлемой соли. В другом аспекте настоящего изобретения предложен способ лечения глиомы у млекопитающего,нуждающегося в этом, включающий введение млекопитающему терапевтически эффективного количества соединения формулы (I) (включая любую конкретную субгенерическую формулу, описанную здесь) или его фармацевтически приемлемой соли. В другом аспекте настоящего изобретения предложено соединение формулы (I), (включая любую конкретную субгенерическую формулу, описанную здесь) или его фармацевтически приемлемая соль для применения в терапии. В другом аспекте предложено соединение формулы (I) (включая любую конкретную субгенерическую формулу, описанную здесь) или его фармацевтически приемлемая соль для применения в лечении восприимчивой неоплазмы у млекопитающего, нуждающегося в этом. В другом аспекте настоящего изобретения предложено применение соединения формулы (I) (включая любую конкретную субгенерическую формулу, описанную здесь) или его фармацевтически приемлемой соли при получении лекарственного средства для применения в лечении восприимчивой неоплазмы у млекопитающего, нуждающегося в этом. В другом аспекте настоящего изобретения предложена фармацевтическая композиция, содержащая соединение формулы (I) (включая любую конкретную субгенерическую формулу, описанную здесь) или его фармацевтически приемлемую соль, для применения в лечении восприимчивой неоплазмы у млекопитающего, нуждающегося в этом. Когда соединение формулы (I) вводят для лечения рака, под термином "совместное введение" и его производными, которые использованы здесь, подразумевают либо одновременное введение, либо любой способ раздельного последовательного введения ингибирующего PI3-киназы соединения, которое описано здесь, и дополнительного активного ингредиента или ингредиентов, которые, как известно, полезны при лечении рака, включая химиотерапию и лучевую терапию. Термин "дополнительный активный ингредиент или ингредиенты", который использован здесь, включает любое соединение или известный терапевтический агент, или который демонстрирует полезные свойства при введении пациенту, нуждающемуся в лечении рака. Предпочтительно, если введение не является одновременным, соединения вводят быстро одно за другим. Кроме того, не имеет значения, вводят ли соединения в одной и той же лекарственной форме, например одно соединение может быть введено местно, а другое соединение может быть введено перорально. Как правило, любой противоопухолевый агент, который обладает активностью в отношении восприимчивой опухоли, которую подвергают лечению, может быть введен совместно при лечении рака по настоящему изобретению. Примеры таких агентов можно найти в Cancer Principles and Practice of Oncology (Рак: принципы и практика онкологии) by Devita V.T. and Hellman S. (editors), 6th edition (February 15,2001), Lippincott WilliamsWilkins Publishers). Специалист в данной области техники сможет понять,какие комбинации агентов будут полезны исходя из конкретных характеристик лекарственных препаратов и рассматриваемого рака. Типичные противоопухолевые агенты, полезные в настоящем изобретении,включают, но не ограничиваются ими, антимикротрубочковые агенты, такие как дитерпеноиды и винкаалкалоиды; координационные комплексы платины; алкилирующие агенты, такие как аналоги азотистого иприта, оксазафосфорины, алкилсульфонаты, нитрозомочевины и триазены; антибиотические агенты,такие как антрациклины, актиномицины и блеомицины; ингибиторы топоизомеразы II, такие как эпиподофиллотоксины; антиметаболиты, такие как пуриновые и пиримидиновые аналоги и антифолатные со- 10022623 единения; ингибиторы топоизомеразы I, такие как камптотецины; гормоны и гормональные аналоги; ингибиторы путей сигнальной трансдукции; ингибиторы ангиогенеза нерецепторной тирозинкиназы; иммунотерапевтические агенты; проапоптотические агенты и ингибиторы передачи сигналов клеточного цикла. Примерами дополнительного активного ингредиента или ингредиентов для применения в комбинации или совместно вводимых с соединениями по настоящему изобретению, ингибирующими PI3-киназу,являются химиотерапевтические агенты. Антимикротрубочковые или антимитотические агенты представляют собой фазоспецифичные агенты, активные против микротрубочек опухолевых клеток во время М-фазы или фазы митоза клеточного цикла. Примеры антимикротрубочковых агентов включают, но не ограничиваются ими, дитерпеноиды и винкаалкалоиды. Дитерпеноиды, которые получены из природных источников, являются фазоспецифичными противоопухолевыми агентами, которые действуют в G2/M фазах клеточного цикла. Полагают, что дитерпеноиды стабилизируют -субъединицу тубулина микротрубочек путем связывания с этим белком. Оказывается, что разборка белка в таком случае ингибируется, при этом митоз прекращается и следует гибель клетки. Примеры дитерпеноидов включают, но не ограничиваются ими, паклитаксел и его аналог доцетаксел. Паклитаксел, 5,20-эпокси-1,2,4,7,10,13-гексагидрокситакс-11-ен-9-он-4,10-диацетат-2-бензоат-13-эфир с (2R,3S)-N-бензоил-3-фенилизосерином, представляет собой природный дитерпеновый продукт, выделенный из тихоокеанского тиса Taxus brevifolia, и имеется в продаже в виде инъекционного раствора TAXOL. Он является членом таксанового семейства терпенов. Он был впервые выделен в 1971 Wani et al. (J. Am. Chem. Soc., 93:2325, 1971), которые охарактеризовали его структуру с помощью химических методов и метода рентгеновской кристаллографии. Один из механизмов его активности имеет отношение к способности паклитаксела связывать тубулин, подавляя таким образом ростраковых клеток (Schiff et al., Proc. Natl. Acad, Sci. USA, 77:1561-1565 (1980); Schiff et al., Nature, 277:665-667(1979); Kumar J. Biol. Chem, 256: 10435-10441 (1981. Для анализа синтеза и противоопухолевой активности некоторых производных паклитаксела см. D.G.I. Kingston et al., Studies in Organic Chemistry, vol. 26, entitled "New trends in Natural Products Chemistry 1986", Attaur-Rahman, P.W. Le Quesne, Eds. (Elsevier,Amsterdam, 1986) pp. 219-235. Паклитаксел принят к клиническому применению в лечении резистентного рака яичников в Соединенных Штатах (Markman et al., Yale Journal of Biology and Medicine, 64:583, 1991; McGuire et al., Ann.Intern, Med., 111:273, 1989) и для лечения рака молочной железы (Holmes et al., J. Nat. Cancer Inst.,83:1797, 1991). Он является потенциальным кандидатом для лечения неоплазм кожи (Einzig et al., Proc.Am. Soc. Clin. Oncol., 20:46) и карцином головы и шеи (Forastire et al., Sem. Oncol., 20:56, 1990). Соединение также обладает возможным потенциалом при лечении поликистоза почек (Woo et al., Nature,368:750, 1994), рака легких и малярии. Лечение пациентов паклитакселем приводит к супрессии костного мозга (разнообразные направления дифференцировки клеток, Ignoff R.J. et al., Cancer Chemotherapy Pocket Guide, 1998), связанной с продолжительностью лечения дозами выше пороговой концентрации (50 нМ)(Kearns, C.M. et al., Seminars in Oncology, 3(6) p. 16-23, 1995). Доцетаксел, (2R,3S)-N-карбокси-3-фенилизосерин, N-трет-бутиловый эфир, 13-эфир с 5-20-эпокси-1,2,4,7,10,13-гексагидрокситакс-11-ен-9-он-4-ацетат-2-бензоатом, тригидрат, имеется в продаже в виде инъекционного раствора под названием TAXOTERE. Доцетаксел показан для лечения рака молочной железы. Доцетаксел является полусинтетическим производным паклитаксела (см. выше), полученным при использовании природного предшественника, 10-диацетилбаккатина III, экстрагируемого из игл европейского тиса. Ограничивающей дозу токсичностью доцетаксела является нейтропения. Винкаалкалоиды являются фазоспецифичными противоопухолевыми агентами, полученными из барвинка. Винкаалкалоиды действуют в М фазе (митоз) клеточного цикла посредством специфического связывания с тубулином. Вследствие этого связанная молекула тубулина не способна полимеризоваться в микротрубочки. Полагают, что митоз прекращается в метафазе с дальнейшей гибелью клетки. Примеры алкалоидов барвинка включают, но не ограничиваются ими, винбластин, винкристин и винорелбин. Винбластин, винкалейкобластин сульфат, имеется в продаже под названием VELBAN в виде инъекционного раствора. Хотя он имеет возможное показание к применению в качестве терапии второй линии различных солидных опухолей, изначально он показан в лечении рака яичка и различных лимфомах,включая болезнь Ходжкина; и лимфоцитарных и гистиоцитарных лимфомах. Миелосупрессия является ограничивающим дозу побочным эффектом винбластина. Винкристин, винкалейкобластин, 22-оксо-, сульфат, имеется в продаже под названием ONCOVIN в виде инъекционного раствора. Винкристин показан для лечения острых лейкозов и также нашел применение в схемах лечения ходжкинских и неходжкинских злокачественных лимфом. Алопеция и неврологические эффекты являются самыми распространенными побочными эффектами винкристина, а миелосупрессия и мукозит желудочно-кишечного тракта встречаются в меньшей степени. Винорелбин, 3',4'-дидегидро-4'-дезокси-С'-норвинкалейкобластин [R-(R,R)-2,3-дигидроксибутан- 11022623 диоат (1:2) (соль)], имеющийся в продаже в виде инъекционного раствора винорелбина тартрата (NAVELBINE), является полусинтетическим винкаалкалоидом. Винорелбин показан в качестве единственного агента или в комбинации с другими химиотерапевтическими агентами, такими как цисплатин, в лечении различных солидных опухолей, в особенности немелкоклеточного рака легких, распространенного рака молочной железы и гормонорезистентного рака предстательной железы. Миелосупрессия является самым распространенным ограничивающим дозу побочным эффектом винорелбина. Координационные комплексы платины представляют собой нефазоспецифичные противоопухолевые агенты, которые взаимодействуют с ДНК. Комплексы платины поступают в опухолевые клетки,подвергаются гидратации и образуют внутри- и межнитевые поперечные связи с ДНК, приводя к неблагоприятным биологическим воздействиям на опухоль. Примеры координационных комплексов платины включают, но не ограничиваются ими, цисплатин и карбоплатин. Цисплатин, цис-диаминдихлорплатина, имеется в продаже под названием PLATINOL в виде инъекционного раствора. Цисплатин первоначально показан в лечении метастатического рака яичек и яичников и распространенного рака мочевого пузыря. Ограничивающими премирующую дозу побочными эффектами цисплатина являются нефротоксичность, которую можно контролировать с помощью гидратации и диуреза, и ототоксичность. Карбоплатин, платина, диамин[1,1-циклобутандикарбоксилат(2-)-О,О'], имеется в продаже под названием PARAPLATIN в виде инъекционного раствора. Карбоплатин первоначально показан в первой и второй линии терапии распространенной карциномы яичников. Супрессия костного мозга является ограничивающей дозу токсичностью карбоплатина. Алкилирующие агенты являются нефазоспецифичными противоопухолевыми агентами и сильными электрофилами. Как правило, алкилирующие агенты посредством алкилирования образуют ковалентные связи с ДНК через нуклеофильные группировки молекулы ДНК, такие как фосфатные, амино, сульфгидрильные, гидрокси, карбоксильные и имидазольные группы. Такое алкилирование нарушает функционирование нуклеиновых кислот, приводя к гибели клеток. Примеры алкилирующих агентов включают, но не ограничиваются ими, аналоги азотистого иприта, такие как циклофосфамид, мелфалан и хлорамбуцил; алкилсульфонаты, такие как бусульфан; нитрозомочевины, такие как кармустин; и триазены, такие как дакарбазин. Циклофосфамид, 2-[бис-(2-хлорэтил)амино]тетрагидро-2 Н-1,3,2-оксазафосфорин-2-оксида моногидрат, имеется в продаже в виде инъекционного раствора или таблеток под названием CYTOXAN. Циклофосфамид показан в качестве единственного агента или в комбинации с другими химиотерапевтическими агентами при лечении злокачественных лимфом, множественной миеломы и лейкозов. Алопеция, тошнота, рвота и лейкопения являются самыми распространенными ограничивающими дозу побочными эффектами циклофосфамида. Мелфалан, 4-[бис-(2-хлорэтил)амино]-L-фенилаланин, имеется в продаже в виде инъекционного раствора или таблеток под названием ALKERAN. Мелфалан показан для паллиативного лечения множественной миеломы и нерезектабельной эпителиальной карциномы яичников. Супрессия костного мозга является самым распространенным ограничивающим дозу побочным эффектом мелфалана. Хлорамбуцил, 4-[бис-(2-хлорэтил)амино]бензолбутановая кислота, имеется в продаже в виде таблеток LEUKERAN. Хлорамбуцил показан для паллиативного лечения хронического лимфоцитарного лейкоза и злокачественных лимфом, таких как лимфосаркома, гигантофолликулярная лимфома и болезнь Ходжкина. Супрессия костного мозга является самым распространенным ограничивающим дозу побочным эффектом хлорамбуцила. Бусульфан, 1,4-бутандиол диметансульфонат, имеется в продаже в виде таблеток MYLERAN. Бусульфан показан для паллиативного лечения хронического миелогенного лейкоза. Супрессия костного мозга является самым распространенным ограничивающим дозу побочным эффектом бусульфана. Кармустин, 1,3-[бис-(2-хлорэтил)-1-нитрозомочевина, имеется в продаже в виде отдельных флаконов с лиофилизированным веществом под названием BiCNU. Кармустин показан для паллиативного лечения в качестве единственного агента или в комбинации с другими агентами опухолей головного мозга, множественной миеломы, болезни Ходжкина и неходжкинских лимфом. Отсроченная миелосупрессия является самым распространенным ограничивающим дозу побочным эффектом кармустина. Дакарбазин, 5-(3,3-диметил-1-триазено)имидазол-4-карбоксамид, имеется в продаже в виде отдельных флаконов с веществом под названием DTIC-Dome. Дакарбазин показан для лечения метастатической злокачественной меланомы и в комбинации с другими агентами во второй терапии болезни Ходжкина. Тошнота, рвота и анорексия являются самыми распространенными ограничивающими дозу побочными эффектами дакарбазина. Антибиотические противоопухолевые средства являются нефазоспецифичными агентами, которые связываются с ДНК или интеркалируют в нее. Как правило, такое действие приводит к стабильным комплексам ДНК или разрыву цепей, что нарушает обычное функционирование нуклеиновых кислот, приводя к гибели клеток. Примеры антибиотических противоопухолевых агентов включают, но не ограничиваются ими, актиномицины, такие как дактиномицин, антроциклины, такие как даунорубицин и док- 12022623 сорубицин; и блеомицины. Дактиномицин, также известный как актиномицин D, имеется в продаже в инъекционной форме под названием COSMEGEN. Дактиномицин показан для лечения опухоли Вильмса и рабдомиосаркомы. Тошнота, рвота и анорексия являются самыми распространенными ограничивающими дозу побочными эффектами дактиномицина. Даунорубицин, (8S-цис-)-8-ацетил-10-[(3-амино-2,3,6-тридезоксиL-ликсогексопиранозил)окси]7,8,9,10-тетрагидро-6,8,11-тригидрокси-1-метокси-5,12-нафтацендиона гидрохлорид, имеется в продаже в виде липосомальной инъекционной формы под названием DAUNOXOME или в виде инъекционной формы под названием CERUBIDINE. Даунорубицин показан для индукции ремиссии в лечении острого нелимфобластного лейкоза и распространенной ВИЧ-ассоциированной саркомы Капоши. Миелосупрессия является самым распространенным ограничивающим дозу побочным эффектом даунорубицина. Доксорубицин, (8S,10S)-10-[(3-амино-2,3,6-тридезоксиL-ликсогексопиранозил)окси]-8-гликолоил-7,8,9,10-тетрагидро-6,8,11-тригидрокси-1-метокси-5,12-нафтацендион гидрохлорид, имеется в продаже в виде инъекционной формы под названием RUBEX или ADRIAMYCIN RDF. Доксорубицин первоначально показан для лечения острого лимфобластного лейкоза и острого миелобластного лейкоза, но также является полезным компонентом в лечении некоторых солидных опухолей и лимфом. Миелосупрессия является самым распространенным ограничивающим дозу побочным эффектом доксорубицина. Блеомицин, смесь цитотоксических гликопептидных антибиотиков, выделенная из штамма Streptomyces verticillus, имеется в продаже под названием BLENOXANE. Блеомицин показан в паллиативном лечении, в качестве единственного агента или в комбинации с другими агентами, плоскоклеточной карциномы, лимфом и карцином яичек. Легочная и кожная токсичность являются самыми распространенными ограничивающими дозу побочными эффектами блеомицина. Ингибиторы топоизомеразы II включают, но не ограничиваются ими, эпиподофиллотоксины. Эпиподофиллотоксины являются фазоспецифичными противоопухолевыми агентами, выделенными из растения мандрагора. Эпиподофиллотоксины обычно воздействуют на клетки в фазах S и G2 клеточного цикла путем образования трехкомпонентных комплексов с топоизомеразой II и ДНК, что приводит к разрывам цепей ДНК. Цепочечные разрывы накапливаются, и следует гибель клеток. Примеры эпиподофиллотоксинов включают, но не ограничиваются ими, этопозид и тенипозид. Этопозид, 4'-деметилэпиподофиллотоксин-9[4,6-0-(R)-этилиденD-глюкопиранозид], имеется в продаже в виде инъекционного раствора или капсул под названием VePESID и общеизвестен как VP16. Этопозид показан в качестве единственного агента или в комбинации с другими химиотерапевтическими агентами в лечении рака яичка и немелкоклеточного рака легких. Миелосупрессия является самым распространенным побочным эффектом этопозида. Проявление лейкопении обычно бывает более тяжелым, чем тромбоцитопении. Тенипозид, 4'-деметилэпиподофиллотоксин-9[4,6-0-(R)-тенилиденD-глюкопиранозид], имеется в продаже в виде инъекционного раствора под названием VUMON и общеизвестен как VM-26. Тенипозид показан в качестве единственного агента или в комбинации с другими химиотерапевтическими агентами в лечении острого лейкоза у детей. Миелосупрессия является самым распространенным ограничивающим дозу побочным эффектом тенипозида. Тенипозид может вызывать как лейкопению, так и тромбоцитопению. Антиметаболические неопластические агенты являются фазоспецифичными противоопухолевыми агентами, которые действуют в S фазе (синтез ДНК) клеточного цикла путем ингибирования синтеза ДНК или путем ингибирования синтеза пуриновых или пиримидиновых оснований, тем самым ограничивая синтез ДНК. В результате, фаза S не протекает, и следует гибель клеток. Примеры антиметаболических противоопухолевых агентов включают, но не ограничиваются ими, фторурацил, метотрексат,цитарабин, меркаптопурин, тиогуанин и гемцитабин. 5-Фторурацил, 5-фтор-2,4-(1H,3H)пиримидиндион, имеется в продаже под названием фторурацил. Введение 5-фторурацила приводит к ингибированию синтеза тимидилата, а также встраиванию его как в РНК, так и в ДНК. Результатом обычно является гибель клетки. 5-Фторурацил показан в качестве единственного агента или в комбинации с другими химиотерапевтическими агентами в лечении карцином молочной железы, толстой кишки, прямой кишки, желудка и поджелудочной железы. Миелосупрессия и мукозит являются ограничивающими дозу побочными эффектами 5-фторурацила. Другие аналоги фторпиримидина включают 5-фтордезоксиуридин (флоксуридин) и 5-фтордезоксиуридин монофосфат. Цитарабин, 4-амино-1D-арабинофуранозил-2-(1H)пиримидинон, имеется в продаже под названием CYTOSAR-U и общеизвестен как Ара-С. Полагают, что цитарабин проявляет фазовую специфичность в S-фазе путем ингибирования элонгации цепей ДНК посредством концевого включения цитарабина в растущую цепь ДНК. Цитарабин показан в качестве единственного агента или в комбинации с другими химиотерапевтическими агентами в лечении острого лейкоза. Другие аналоги цитидина включают 5-азацитидин и 2',2'-дифтордезоксицитидин (гемцитабин). Цитарабин вызывает лейкопению, тромбоцитопению и мукозит. Меркаптопурин, 1,7-дигидро-6 Н-пурин-6-тион моногидрат, имеется в продаже под названием PU- 13022623RINETHOL. Меркаптопурин проявляет фазовую специфичность в S-фазе путем ингибирования синтеза ДНК посредством пока еще не установленного механизма. Меркаптопурин показан в качестве единственного агента или в комбинации с другими химиотерапевтическими агентами в лечении острого лейкоза. Миелосупрессия и мукозит желудочно-кишечного тракта являются возможными побочными эффектами меркаптопурина в высоких дозах. Полезным аналогом меркаптопурина является азатиоприн. Тиогуанин, 2-амино-1,7-дигидро-6 Н-пурин-6-тион, имеется в продаже под названием TABLOID. Тиогуанин проявляет фазовую специфичность в S-фазе путем ингибирования синтеза ДНК посредством пока еще не установленного механизма. Тиогуанин показан в качестве единственного агента или в комбинации с другими химиотерапевтическими агентами в лечении острого лейкоза. Миелосупрессия,включающая лейкопению, тромбоцитопению и анемию, является самым распространенным ограничивающим дозу побочным эффектом введения тиогуанина. Однако встречаются и побочные эффекты со стороны желудочно-кишечного тракта, и они могут быть дозолимитирующими. Другие аналоги пурина включают пентостатин, эритрогидроксинониладенин, флударабин фосфат и кладрибин. Гемцитабин, 2'-дезокси-2',2'-дифторцитидин моногидрохлорид (-изомер), имеется в продаже под названием GEMZAR. Гемцитабин проявляет фазовую специфичность в S-фазе и посредством блокирования перехода клетки через границу фаз G1/S. Гемцитабин показан в комбинации с цисплатином в лечении местнораспространенного немелкоклеточного рака легких и отдельно в лечении местнораспространенного рака поджелудочной железы. Миелосупрессия, включающая лейкопению, тромбоцитопению и анемию, является самым распространенным ограничивающим дозу побочным эффектом введения гемцитабина. Метотрексат, N-[4(2,4-диамино-6-птеридинил)метил]метиламино]бензоил]-L-глутаминовая кислота, имеется в продаже в виде метотрексата натрия. Метотрексат проявляет действие в фазах клеточного цикла, особенно в S-фазе, путем ингибирования синтеза, репарации и/или репликации ДНК через ингибирование редуктазы дигидрофолиевой кислоты, которая требуется для синтеза пуриновых нуклеотидов и тимидилата. Метотрексат показан в качестве единственного агента или в комбинации с другими химиотерапевтическими агентами в лечении хориокарциномы, менингеального лейкоза,неходжкинской лимфомы и карцином молочной железы, головы, шеи, яичников и мочевого пузыря. Миелосупрессия (лейкопения, тромбоцитопения и анемия) и мукозит являются возможными побочными эффектами введения метотрексата. Камптотецины, включающие камптотецин и производные камптотецина, доступны или находятся в разработке в качестве ингибиторов топоизомеразы I. Полагают, что цитотоксическая активность камптотецинов связана с их ингибиторной активностью в отношении топоизомеразы I. Примеры камптотецинов включают, но не ограничиваются ими, иринотекан, топотекан и различные оптические формы 7-(4-метилпиперазинометилен)-10,11-этилендиокси-20-камптотецина, описанные ниже. Иринотекан HCl, (4S)-4,11-диэтил-4-гидрокси-9-[(4-пиперидинопиперидино)карбонилокси]-1H-пирано[3',4',6,7]индолизино[1,2-b]хинолин-3,14(4 Н,12 Н)дион гидрохлорид, имеется в продаже в виде инъекционного раствора CAMPTOSAR. Иринотекан является производным камптотецина, который связывается, как и его активный метаболит SN-38, с комплексом топоизомераза I-ДНК. Полагают, что цитотоксичность возникает в результате необратимых двунитевых разрывов, вызванных путем взаимодействия тройного комплекса топоизомераза 1:ДНК:иринотекан или SN-38 с ферментами репликации. Иринотекан показан в лечении метастатического рака толстой или прямой кишки. Ограничивающими дозу побочными эффектами иринотекана HCl являются миелосупрессия, включающая нейтропению, и побочные эффекты со стороны ЖКТ, включающие диарею. Топотекан HCl, (S)-10-[(диметиламино)метил]-4-этил-4,9-дигидрокси-1H-пирано[3',4',6,7]индолизино[1,2-b]хинолин-3,14-(4 Н,12 Н)дион моногидрохлорид, имеется в продаже в виде инъекционного раствора HYCAMTIN. Топотекан является производным камптотецина, который связывается с комплексом топоизомераза I-ДНК и предотвращает повторное сшивание однонитевых разрывов, вызванных топоизомеразой I в ответ на торсионное напряжение молекулы ДНК. Топотекан показан в качестве второй линии терапии метастатической карциномы яичников и мелкоклеточного рака легких. Ограничивающим дозу побочным эффектом топотекана HCl является миелосупрессия, преимущественно нейтропения. Также интерес представляет производное камптотецина следующей формулы А, на данный момент находящееся в процессе разработки, которое включает рацемическую смесь двух форм изомеров (R,S), а также R и S энантиомеры известное под химическим наименованием 7-(4-метилпиперазинометилен)-10,11-этилендиокси 20(R,S)камптотецин (рацемическая смесь) или 7-(4-метилпиперазинометилен)-10,11-этилендиокси 20(R)камптотецин (R энантиомер) или 7-(4-метилпиперазинометилен)-10,11-этилендиокси-20(S)камптотецин (S энантиомер). Такое соединение, а также родственные соединения, включая способы их получения, описаны в патентах США 6063923, 5342947, 5559235, 5491237 и находящейся на рассмотрении заявке на патент США 08/977217, поданной 24 ноября 1997 г. Гормоны и гормональные аналоги являются полезными соединениями для лечения видов рака, при которых имеется взаимосвязь между гормоном (гормонами) и ростом и/или отсутствием роста раковой опухоли. Примеры гормонов и гормональных аналогов, полезных в лечении рака, включают, но не ограничиваются ими, адренокортикостероиды, такие как преднизон и преднизолон, которые полезны в лечении злокачественной лимфомы и острого лейкоза у детей; аминоглутетимид и другие ингибиторы ароматазы, такие как анастрозол, летразол, воразол и эксеместан, полезные в лечении адренокортикальной карциномы и гормонозависимой карциномы молочной железы, содержащей рецепторы эстрогена; прогестрины, такие как мегестрол ацетат, полезный в лечении гормонозависимого рака молочной железы и эндометриальной карциномы; эстрогены, андрогены и антиандрогены, такие как флутамид, нилутамид,бикалутамид, ципротерона ацетат и 5-редуктазы, такие как финастерид и дутастерид, полезные в лечении карциномы предстательной железы и доброкачественной гиперплазии предстательной железы; антиэстрогены, такие как тамоксифен, торемифен, ралоксифен, дролоксифен, иодоксифен, а также селективные модуляторы эстрогеновых рецепторов (SERM), такие, как описаны в патентах США 5681835,5877219 и 6207716, полезные в лечении гормонозависимой карциномы молочной железы и других восприимчивых видов рака; и гонадотропин-рилизинг-гормон (ГнРГ) и его аналоги, которые стимулируют высвобождение лютеинизирующего гормона (ЛГ) и/или фолликулостимулирующего гормона (ФСГ), для лечения карциномы предстательной железы, например агонисты и антагонисты ЛГРФ (рилизинг-фактора лютеинизирующего гормона), такие как гозерелин ацетат и леупролид. Ингибиторы путей сигнальной трансдукции представляют собой такие ингибиторы, которые блокируют или ингибируют химический процесс, вызывающий внутриклеточное изменение. В данном контексте это изменение представляет собой клеточную пролиферацию или дифференцировку. Ингибиторы сигнальной трансдукции, полезные в настоящем изобретении, включают ингибиторы рецепторных тирозинкиназ, нерецепторных тирозинкиназ, блокаторов SH2/SH3-доменов, серин/треониновых киназ, фосфатидилинозитол-3-киназ, миоинозитольной передачи сигналов и онкогенов Ras. Некоторые протеинтирозинкиназы катализируют фосфорилирование специфических тирозильных остатков в различных белках, вовлеченных в регуляцию клеточного роста. Такие протеинтирозинкиназы могут быть широко классифицированы как рецепторные или нерецепторные киназы. Рецепторные тирозинкиназы представляют собой трансмембранные белки, имеющие внеклеточный лиганд-связывающий домен, трансмембранный домен и тирозинкиназный домен. Рецепторные тирозинкиназы вовлечены в регуляцию клеточного роста, и их обычно называют рецепторами ростовых факторов. Было показано, что неподходящая или неконтролируемая активация многих из этих киназ, то есть аберрантная киназная рецепторная активность в отношении ростовых факторов, например посредством сверхэкспрессии или мутации, приводит к неконтролируемому клеточному росту. Соответственно аберрантную активность таких киназ связывают со злокачественным тканевым ростом. Поэтому ингибиторы таких киназ могли бы обеспечить способы лечения рака. Рецепторы ростовых факторов включают, например, рецептор эпидермального ростового фактора (EGFr), рецептор ростового фактора тромбоцитов(PDGFr), erbB2, erbB4, рецептор фактора роста эндотелия сосудов (VEGFR), тирозинкиназу с иммуноглобулиноподобными и с гомологичными эпидермальному фактору роста доменами (TIE-2), рецептор инсулиноподобного фактора роста-I (IGF-I), макрофагальный колониестимулирующий фактор (cfms),ВТК, ckit, cmet, рецепторы факторов роста фибробластов (FGF), Trk-рецепторы (TrkA, TrkB и TrkC), эфриновые рецепторы (eph) и протоонкоген RET. Некоторые ингибиторы рецепторов ростовых факторов находятся в стадии разработки и включают антагонисты лигандов, антитела, ингибиторы тирозинкиназ и антисмысловые олигонуклеотиды. Рецепторы ростовых факторов и агенты, ингибирующие функционирование рецепторов ростовых факторов, описаны (см., например, Kath, John С., Exp. Opin. Ther. PatentsReceptors as Targets", New Molecular Targets for Cancer Chemotherapy, ed. Workman, Paul and Kerr, David,CRC press 1994, London). Тирозинкиназы, которые не являются рецепторными киназами ростовых факторов, называются нерецепторными тирозинкиназами. Нерецепторные тирозинкиназы, полезные в настоящем изобретении,которые являются мишенями или потенциальными мишенями противоопухолевых лекарственных средств, включают cSrc, Lck, Fyn, Yes, Jak, cAbl, FAK (киназа фокальной адгезии), тирозинкиназу Брутона и Bcr-Abl. Такие нерецепторные киназы и агенты, ингибирующие функционирование нерецепторных тирозинкиназ, описаны в Sinh S. and Corey S.J., (1999) Journal of Hematotherapy and Stem Cell Research 8(5):465-80; и Bolen J.B., Brugge J.S., (1997) Annual Review of Immunology, 15:371-404). Блокаторы SH2/SH3-доменов представляют собой агенты, которые нарушают связывание с SH2- илиSH3-доменами у ряда ферментов или адапторных белков, включая р 85 субъединицу PI3-K, киназы се- 15022623 мейства Src, адапторные молекулы (She, Crk, Nek, Grb2) и Ras-GAP. SH2/SH3-домены как мишени для противоопухолевых лекарственных средств обсуждаются в Smithgall, Т.Е. (1995), Journal of Pharmacological and Toxicological Methods, 34(3):125-32. Ингибиторы серин/треониновых киназ, включающие блокаторы МАР-киназного каскада, которые включают блокаторы Raf-киназ (Rafk), митоген- или внеклеточные регулируемые киназы (MEK) и внеклеточные регулируемые киназы (ERK); и блокаторы членов семейства протеинкиназ С, включающих блокаторы подтипов PKC (альфа, бета, гамма, эпсилон, мю, лямбда, йота, зета), IkB-киназного семейства(IKKa, IKKb), киназ PKB-семейства, членов семейства Akt-киназ и TGF-бета-рецепторных киназ. Такие серин/треониновые киназы и их ингибиторы описаны в Yamamoto Т., Taya S., Kaibuchi K., (1999), Journalof Biochemistry, 126(5) 799-803; Brodt P., Samani A., and Navab R. (2000), Biochemical Pharmacology, 60,1101-1107; Massague J., Weis-Garcia F. (1996) Cancer Surveys, 27:41-64; Philip P.A., and Harris A.L (1995),Cancer Treatment and Research, 78:3-27; Lackey K. et al., Bioorganic and Medicinal Chemistry Letters, (10),2000, 223-226; патенте США 6268391; и Martinez-lacaci L. et al., Int. J. Cancer (2000), 88(1), 44-52. Ингибиторы членов семейства фосфатидилинозитол-3-киназ, включающие блокаторы PI3-киназы,ATM, ДНК-РК и Ku, также полезны в настоящем изобретении. Такие киназы рассматриваются в Abraham, R.T. (1996), Current Opinion in Immunology, 8(3):412-8; Canman C.E., Lim D.S. (1998), Oncogene 17(25):3301-3308; Jackson S.P. (1997), International Journal of Biochemistry and Cell Biology, 29(7):935-8; иZhong H. et al., Cancer Res, (2000) 60(6), 1541-1545. Также полезными в настоящем изобретении являются ингибиторы миоинозитольной передачи сигналов, такие как блокаторы фосфолипазы С и аналоги миоинозитола. Такие сигнальные ингибиторы описаны в Powis G., and Kozikowski A., (1994) New Molecular Targets for Cancer Chemotherapy, ed., PaulWorkman and David Kerr, CRC press, 1994, London. Другой группой ингибиторов путей сигнальной трансдукции являются ингибиторы онкогенов Ras. Такие ингибиторы включают ингибиторы фарнезилтрансферазы, геранил-геранилтрансферазы и СААХпротеаз, а также антисмысловые олигонуклеотиды, рибозимы и иммунотерапию. Было показано, что такие ингибиторы блокируют активацию Ras в клетках, содержащих мутант Ras дикого типа, действуя,таким образом, как антипролиферативные агенты (ингибирование онкогенов Ras обсуждается в Scharovsky O.G., Rozados V.R., Gervasoni S.I., Matar P. (2000), Journal of Biomedical Science, 7(4):292-8; Ashby,M.N. (1998), Current Opinion in Lipidology, 9(2):99-102; и BioChim. Biophys. Acta, (1989) 1423(3):19-30). Как упомянуто выше, антитела против лиганд-связывающей рецепторной киназы также могут служить в качестве ингибиторов сигнальной трансдукции. Эта группа ингибиторов путей сигнальной трансдукции включает применение гуманизированных антител против внеклеточного лиганд-связывающего домена рецепторной тирозинкиназы. Например, EGFR-специфическое антитело Imclone С 225 (см. Greenin mice, Cancer Res. (2000) 60, 5117-5124). Ингибиторы ангиогенеза нерецепторных киназ также могут найти применение в настоящем изобретении. Ингибиторы ангиогенеза, связанные с VEGFR и TIE2, рассмотрены выше в отношении ингибиторов сигнальной трансдукции (оба рецептора являются рецепторными тирозинкиназами). Таким образом,ингибиторы нерецепторных тирозинкиназ могут быть использованы в комбинации с ингибиторами по настоящему изобретению. Например, анти-VEGF-антитела, которые не распознают VEGFR (рецепторная тирозинкиназа), но связываются с лигандом; низкомолекулярные ингибиторы интегрина (альфаV бета 3),которые будут ингибировать ангиогенез; эндостатин и ангиостатин (не-RTK) также могут быть пригодны в комбинации с ингибиторами раскрытого семейства (см. Bruns C.J. et al. (2000), Cancer Res., 60:29262935; Schreiber A.B., Winkler M.E., and Derynck R. (1986), Science, 232:1250-1253; Yen L. et al. (2000), Oncogene 19:3460-3469). Агенты, используемые в иммунотерапевтических схемах лечения, также могут быть полезны в комбинации с соединениями формулы (I). Существует ряд иммунологических стратегий для генерации иммунного ответа против erbB2 или EGFR. Эти стратегии лежат, в основном, в области противоопухолевых вакцинаций. Эффективность иммунологических подходов может быть в значительной степени увеличена посредством комбинированного ингибирования сигнальных путей erbB2/EGFR при использовании низкомолекулярного ингибитора. Обсуждение иммунологического подхода (противоопухолевых вакцин) в отношении erbB2/EGFR встречается в Reilly R.T. et al. (2000), Cancer Res. 60:3569-3576; и ChenY., Hu D., Eling D.J., Robbins J., and Kipps T.J. (1998), Cancer Res. 58: 1965-1971. Агенты, используемые в проапоптотических схемах лечения (например, антисмысловые олигонуклеотиды против bcl-2), также могут быть использованы в комбинации по настоящему изобретению. Члены семейства белков Bcl-2 блокируют апоптоз. Поэтому повышающую регуляцию bcl-2 связывали с резистентностью к химическому воздействию. Исследования показали, что эпидермальный ростовой фактор (EGF) стимулирует антиапоптотические члены bcl-2-семейства (то есть mcl-1). Поэтому стратегии,разработанные для понижающей регуляции экспрессии bcl-2 в опухолях, продемонстрировали клиниче- 16022623 скую эффективность и в настоящее время находятся во II/III фазе испытаний, а именно G3139, антисмысловой олигонуклеотид против bcl-2, фирмы Genta. Такие проапоптотические стратегии с использованием стратегии антисмысловых олигонуклеотидов к bcl-2 рассматриваются в Water J.S. et al. (2000), J. Clin.Oncol. 18:1812-1823; и Kitada S et al. (1994), Antisense Res. Dev. 4:71-79. Ингибиторы передачи сигналов в клеточном цикле ингибируют молекулы, вовлеченные в контроль клеточного цикла. Семейство протеинкиназ, именуемое циклинзависимые киназы (CDK), и их взаимодействие с семейством белков, называемых циклинами, контролируют ход клеточного цикла у эукариот от начала до конца. Скоординированная активация и инактивация различных комплексов циклин/CDK необходима для нормального хода по всему клеточному циклу. Несколько ингибиторов передачи сигналов в клеточном цикле находятся в стадии разработки. Например, примеры циклинзависимых киназ,включая CDK2, CDK4 и CDK6, и их ингибиторы описаны (см., например, в Rosania et al., Exp. Opin. ThenPatents (2000), 10(2):215-230). В одном воплощении способ лечения рака по заявленному изобретению включает совместное введение соединения формулы I и/или его фармацевтически приемлемой соли, гидрата, сольвата или пролекарства и по меньшей мере одного противоопухолевого агента, такого как агент, выбранный из группы,состоящей из антимикротрубочковых агентов, координационных комплексов платины, алкилирующих агентов, антибиотических агентов, ингибиторов топоизомеразы II, антиметаболитов, ингибиторов топоизомеразы I, гормонов и гормональных аналогов, ингибиторов путей сигнальной трансдукции; ингибиторов ангиогенеза нерецепторной тирозинкиназы, иммунотерапевтических агентов, проапоптотических агентов и ингибиторов передачи сигналов клеточного цикла. Фармацевтически активные соединения по настоящему изобретению включены в состав подходящих лекарственных форм, таких как капсулы, таблетки или инъекционные препараты. Используются твердые или жидкие фармацевтические носители. Твердые носители включают крахмал, лактозу, дигидрат сульфата кальция, каолин, сахарозу, тальк, желатин, агар, пектин, гуммиарабик, стеарат магния и стеариновую кислоту. Жидкие носители включают сироп, арахисовое масло, оливковое масло, физиологический раствор и воду. Аналогично, носитель или разбавитель могут включать любое вещество с замедленным высвобождением, такое как моностеарат глицерина или дистеарат глицерина, отдельно или в сочетании с воском. Количество твердого носителя изменяется в широких пределах, но предпочтительно будет составлять от примерно 25 мг до примерно 1 г на единицу дозировки. При использовании жидкого носителя препарат будет находиться в форме сиропа, эликсира, эмульсии, мягкой желатиновой капсулы,стерильной жидкости для инъекции, такой как ампула, или водной или неводной жидкой суспензии. Фармацевтические препараты получают с использованием следующих стандартных для фармацевтов методик, включающих смешивание, гранулирование и сжатие, когда это необходимо, для таблетированных форм, или смешивание, наполнение и растворение ингредиентов, как целесообразно для получения требуемых пероральных или парентеральных продуктов. Дозы фармацевтически активных соединений по настоящему изобретению в единице дозировки фармацевтического препарата, как описано выше, будут представлять собой эффективное нетоксичное количество активного соединения, предпочтительно выбранное из интервала 0,001-100 мг/кг, предпочтительно 0,001-50 мг/кг. При лечении пациента-человека, нуждающегося в ингибиторе PI3K, выбранную дозу вводят предпочтительно от 1 до 6 раз в сутки перорально или парентерально. Предпочтительные формы парентерального введения включают местное, ректальное, трансдермальное введение, посредством инъекции или посредством инфузии в течение длительного времени. Пероральные лекарственные формы для введения человеку предпочтительно содержат от 0,05 до 3500 мг активного соединения. Согласно одному воплощению пероральная доза для введения человеку составляет от 100 до 1000 мг в сутки. Пероральное введение, при котором используют более низкие дозировки, является предпочтительным. Однако парентеральное введение в высоких дозах также может быть применено, когда оно безопасно и подходит для пациента. Оптимальные дозировки для введения могут быть легко определены специалистами в данной области техники и будут изменяться в зависимости от конкретного используемого ингибитора PI3-киназы,эффективности препарата, способа введения и улучшения при болезненном состоянии. Дополнительные факторы, включая возраст, вес пациента, режим питания и время введения, зависящие от конкретного пациента, которого лечат, будут приводить к необходимости регулирования дозировки. Примеры дозировок включают пероральные препараты, эквивалентные 10, 25 и 100 мг соединения формулы (I), для введения отдельно, многократно или в комбинации. Другой пример дозировки включает пероральные препараты трис-(гидроксиметил)аминометановой соли 2-метил-1-[2-метил-3-(трифторметил)фенил]метил-6-(4-морфолинил)-1H-бензимидазол-4-карбоновой кислоты, эквивалентной 10, 25 или 100 мг свободного основания 2-метил-1-[2-метил-3-(трифторметил)фенил]метил-6-(4-морфолинил)-1H-бензимидазол-4-карбоновой кислоты. Способ индуцирования PI3-киназной ингибиторной активности у млекопитающих, включая людей,по этому изобретению включает введение субъекту, нуждающемуся в такой активности, эффективного модулирующего/ингибирующего PI3-киназы количества фармацевтически активного соединения по настоящемуизобретению. Согласно изобретению также предложено применение соединения формулы (I) в производстве лекарственного средства для применения в качестве ингибитора PI3-киназ. Согласно изобретению также предложено применение соединения формулы (I) в производстве лекарственного средства для применения в терапии. Согласно изобретению также предложено применение соединения формулы (I) в производстве лекарственного средства для применения при лечении аутоиммунных расстройств, воспалительных заболеваний, сердечно-сосудистых заболеваний, нейродегенеративных заболеваний, аллергии, астмы, панкреатита, полиорганной недостаточности, заболеваний почек, агрегации тромбоцитов, рака, подвижности сперматозоидов, отторжения при трансплантации, отторжения трансплантата и повреждений легких. Согласно изобретению также предложена фармацевтическая композиция для применения в качестве ингибитора PI3-киназ, которая содержит соединение формулы (I) и фармацевтически приемлемый носитель. Согласно изобретению также предложена фармацевтическая композиция для применения в лечении аутоиммунных расстройств, воспалительных заболеваний, сердечно-сосудистых заболеваний, нейродегенеративных заболеваний, аллергии, астмы, панкреатита, полиорганной недостаточности, заболеваний почек, агрегации тромбоцитов, рака, подвижности сперматозоидов, отторжения при трансплантации,отторжения трансплантата и повреждений легких, которая содержит соединение формулы (I) и фармацевтически приемлемый носитель. Кроме того, фармацевтически активные соединения по настоящему изобретению могут быть совместно введены с дополнительными активными ингредиентами, включая соединения, которые, как известно, полезны при применении в комбинации с ингибитором PI3-киназ. Считается, что специалист в данной области техники может при использовании предшествующего описания применить настоящее изобретение в самом полном его объеме, без дополнительного исследования. Поэтому следующие примеры следует истолковывать только как иллюстративные, а не ограничивающие объем настоящего изобретения каким бы то ни было образом. Экспериментальные методы Соединения формулы (I) могут быть получены при использовании общих схем I-VII, как описано ниже. Схема I (R2 = Me) 2,6-Динитроанилин 1 можно бромировать с помощью брома в уксусной кислоте с получением 4 бром-2,6-динитроанилина 2, который может быть восстановлен до диаминонитробензола 3 с помощью(NH4+)2S. Последующее взаимодействие соединения 3 с 2,4-пентандионом в присутствии сильной кислоты при температуре дефлегмации в спиртовом растворителе дает нитробензимидазол 4. Алкилирование с получением замещенного бензимидазола 5 может быть проведено при помощи соответствующим образом замещенного алкилгалогенида с основанием, таким как K2CO3, в полярном апротонном растворителе, таком как ДМФА (диметилформамид). Катализируемое палладием замещение ароматического брома морфолином может затем давать замещенный нитробензимидазол 6, который затем может быть восстановлен до аминобензимидазола 7. Аминобензимидазол 7 затем может быть превращен в гидроксильный аналог 8, сульфонамид 9, амид 10 и галогеновый аналог 11 при использовании стандартных приемов органической химии. 2,6-Динитроанилин 1 можно бромировать с помощью брома в уксусной кислоте с получением 4 бром-2,6-динитроанилина 2, который может быть восстановлен до диаминонитробензола 3 с помощью(NH4+)2S. Последующее взаимодействие соединения 3 с карбоновой кислотой в присутствии сильной кислоты при повышенных температурах дает нитробензимидазол 4. Алкилирование с получением замещенного бензимидазола 5 может быть проведено при помощи соответствующим образом замещенного алкилгалогенида с основанием, таким как K2CO3, в полярном апротонном растворителе, таком как ДМФА. Катализируемое палладием замещение ароматического брома морфолином может затем давать замещенный нитробензимидазол 6, который затем может быть восстановлен до аминобензимидазола 7. Аминобензимидазол 7 затем может быть превращен в гидроксильный аналог 8, сульфонамид 9, амид 10 и галогеновый аналог 11 при использовании стандартных приемов органической химии. Схема III (R1 = ОМе; R2 = Me) 2-Амино-3-нитрофенол 1 можно метилировать с помощью MeI и K2CO3 в ДМФА с получением метоксинитроанилина 2. Бромирование с помощью брома в уксусной кислоте с последующим ацетилированием уксусным ангидридом в уксусной кислоте и серной кислоте может давать промежуточное соединение 4. Катализируемое палладием замещение ароматического бромида морфолином может затем давать промежуточное соединение 5. Индуцированное железом нитровосстановление с последующим замыканием цикла может затем давать бензимидазол 6, который может быть алкилирован с помощью соответствующим образом замещенного алкилбромида при использовании основания, такого как K2CO3, в полярном апротонном растворителе, таком как ДМФА, с получением конечных продуктов 7. Схема IV Аминобензимидазол 1 может быть превращен в бромбензимидазол 2 при использовании нитрита натрия с NaBr в водном растворе HBr. Катализируемое палладием сочетание с арилбороновой кислотой в присутствии подходящего фосфина с неорганическим основанием в полярном беспротонном растворителе может затем давать конечные замещенные бензимидазолы 3. Het включает 2-, 3-фуранилы и 1,3 триазолы. Катализируемое палладием карбонилирование бромбензимидазола 1 может быть проведено посредством барботирования газообразного монооксида углерода через метанол с триэтиламином с получением метилового эфира 2. Затем может быть проведен гидролиз эфира гидроксидом лития в смеси ТГФ(тетрагидрофуран)/вода с получением конечного продукта бензимидазольной кислоты 3. Схема VI Катализируемое палладием цианирование бромбензимидазола 1 может быть проведено цианидом цинка в ДМФА с получением нитрила бензимидазола. 2. Нитрил может быть превращен в первичный карбоксамид с помощью KOH и пероксида в ТГФ с получением амида 3. Обработка карбоксамида 3 смесью ДМФА-ДМА (диметилацетамид) может давать промежуточное соединение 4, которое затем может быть циклизировано в триазольные аналоги 5 с помощью гидразина в уксусной кислоте. Схема VII Аминирование 5-хлор-2-нитробензойной кислоты О-метилгидроксиламином и трет-бутоксидом в присутствии ацетата меди может давать 3-амино-5-хлор-2-нитробензойную кислоту 2. Этерификация может быть проведена с помощью метанола и серной кислоты с получением метилового эфира 3, который может быть подвергнут взаимодействию с морфолином в ДМФА с K2CO3 с получением фенилморфолинового аналога 4. Нитровосстановление может быть проведено при использовании различных способов восстановления металлами с получением диамина 5. Конденсация соединения 5 с различными карбоновыми кислотами может давать бензимидазолметиловый эфир 6, который может быть далее превращен в конечные продукты 7 (R1 = CO2Me, СО 2 Н, CONH2, CN, триазол, тетразол) после алкилирования алкилгалогенидом с последующим применением стандартных приемов органической химии, как описано ранее. Пример 1 К перемешиваемой суспензии 2,6-динитроанилина (5 г; 27,3 ммоль) в ледяной уксусной кислоте (50 мл) по каплям добавляли бром (1,5 мл; 30 ммоль) и нагревали при 120 С в течение 2 ч. После охлаждения до температуры окружающей среды полученную смесь выливали в воду (50 мл). Осажденное твердое вещество собирали посредством фильтрации и промывали водой, затем сушили под вакуумом. Твердое вещество повторно растворяли в EtOAC, промывали водой и насыщенным рассолом. Органический слой собирали и концентрировали под вакуумом с получением требуемого продукта (6,88 г; 95%). 1H- 20022623 4-Бром-2,6-динитробензоламин растворяли в EtOH (50 мл) и в смесь добавляли (NH4)2S (2,2 мл). Реакционную смесь нагревали до 90 С в течение 1 ч. Анализ ТСХ (тонкослойная хроматография) показал новое соединение, и осталось некоторое остаточное количество исходного вещества. Дополнительно добавляли другую порцию (NH4)2S (2,5 мл). Через 1 ч анализ ТСХ показал, что осталось незначительное количество исходного вещества. Реакционную смесь концентрировали с получением темно-красного твердого вещества. Его затем очищали посредством хроматографии на силикагеле, элюируя ДХМ (дихлорметаном), с получением требуемого продукта в виде красного твердого вещества (578 мг; 50%). 1HЯМР (300 МГц, CDCl3)м.д. 3.50 (ушир. s, 2H), 5.93 (ушир. s, 2H), 7.04 (d, 1H, J = 1.8 Гц), 7.87 (d, 1H, J = 1.8 Гц); ЖХ-МС (жидкостная хроматография-масс-спектрометрия): m/e составляет 232 [M+1]+. с) 6-Бром-2-метил-4-нитро-1H-бензо[d]имидазол Смесь 5-бром-3-нитробензол-1,2-диамина (464 мг) и пентана-2,4-диона (400 мг) в EtOH (27 мл) и 5 н HCl (7,4 мл) нагревали с обратным холодильником в течение 3 ч. Смесь охлаждали до комнатной температуры и растворитель удаляли под вакуумом. Остаток растворяли в EtOAc и промывали водным раствором NaHCO3 и рассолом. Органический слой концентрировали с получением требуемого продукта в виде твердого вещества (460 мг; 90%). 1H-ЯМР (300 МГц, CDCl3)м.д. 2.73 (s, 3H), 8.11 (d, 1H, J = 1.8 Гц), 8.24 (d, 1H, J = 1.8 Гц), 10.20 (s, 1H, s); ЖХ-МС: m/е составляет 256 [M+1]+. Пример 2 (R = Н) и пример 3 (R = Ас) Смесь 6-бром-2-метил-4-нитро-1H-бензо[d]имидазола (полученного согласно методу, аналогичному методу по примеру 1) (3 г), 1-(бромметил)нафталина (2,85 г) и K2CO3(3,23 г) в ДМФА (100 мл) перемешивали при 80 С в течение ночи. Ее охлаждали до комнатной температуры и фильтровали. Фильтрат затем выливали в воду. Его затем фильтровали с получением твердого вещества, и твердое вещество промывали водой и затем сушили под вакуумом с получением требуемого продукта (4,63 г; 100%). 1HЯМР (300 МГц, ДМСО-d6)м.д. 2.54 (s, 3H), 6.16 (s, 2H), 6.32 (d, 1H, J = 7.5 Гц), 7.33 (t, 1H, J = 7.5 Гц),7.61-7.72 (m, 2H), 7.87 (d, 1H, J = 7.5 Гц), 8.01 (d, 1H, J = 7.5 Гц), 8.14 (d, 1H, J = 1.8 Гц), 8.19 (d, 1H, J = 7.5 Гц), 8.28 (d, 1H, J = 1.8 Гц); ЖХ-МС: m/е составляет 296 [M+1]+.(3,05 г), Pd2(dba)3 (1,05 г), Cs2CO3 (5,72 г) и X-Phos (1,09 г) в диоксане (100 мл) дегазировали азотом и затем перемешивали при 80C в течение ночи. Смесь охлаждали до комнатной температуры и растворитель удаляли под вакуумом. Остаток затем очищали посредством хроматографии на силикагеле, элюируя смесью EtOAc:петролейный эфир, 1:1, с получением требуемого продукта в виде желтого твердого ве- 21022623 щества (2,8 г; 60%). 1H-ЯМР (300 МГц, ДМСО-d6)м.д. 2.46 (s, 3H), 3.12 (t, 4H, J = 4.8 Гц). 3.70 (t, 4H, J= 4.8 Гц), 6.09 (s, 2H), 6.31 (d, 1H, J = 7.5 Гц), 7.34 (t, 1H, J = 7.5 Гц), 7.53 (d, 1H, J = 2.1 Гц), 7.62-7.70 (m,3H), 7.86 (d, 1H, J = 8.1 Гц), 8.01 (d, 1H, J = 7.5 Гц), 8.23 (d, 1H, J = 8.1 Гц); ЖХ-МС: m/е составляет 403[M+1]+. с) 2-Метил-6-морфолино-1-(нафтален-1-илметил)-1H-бензо[d]имидазол-4-амин и N-(2-метил-6-морфолин-4-ил-1-нафтален-1-илметил-1H-бензимидазол-4-ил)ацетамид К подвергаемой нагреванию с обратным холодильником смеси 4-(2-метил-3-(нафтален-1-илметил)7-нитро-3H-бензо[d]имидазол-5-ил)морфолина (804 мг) в НОАс (50 мл) добавляли железный порошок(336 мг) и смесь продолжали нагревать с обратным холодильником в течение 3 ч. Смесь охлаждали до комнатной температуры и НОАс удаляли под вакуумом. Остаток затем нейтрализовали водным раствором NaHCO3. Экстрагировали с помощью ДХМ и органический слой промывали рассолом, сушили над безводным Na2SO4, фильтровали и концентрировали под вакуумом. Остаток очищали посредством хроматографии на силикагеле, элюируя смесью MeOH:ДХМ= 1:30, с получением соединений по примерам 2(350 мг; 47%) и 3 (350 мг; 42%). Соединение по примеру 2: 1H-ЯМР (300 МГц, ДМСО-d6)м.д. 2.33 (s,3H), 2.91 (t, 4H, J = 4.8 Гц), 3.64 (t, 4H, J = 4.8 Гц), 5.15 (ушир. s, 2H), 5.83 (s, 2H), 6.10 (d, 1H, J = 2.1 Гц),6.12 (d, 1H, J = 2.1 Гц), 6.38 (d, 1H, J = 7.5 Гц), 7.34 (t, 1H, J = 7.5 Гц), 7.58-7.68 (m, 2H), 7.84 (d, 1H, J = 8.4 Гц), 8.01 (d, 1H, J = 7.5 Гц), 8.23 (d, 1H, J = 8.4 Гц); ЖХ-МС: m/е составляет 373 [M+1]+; соединение по примеру 3: 1H-ЯМР (300 МГц, ДМСО-d6)м.д. 2.18 (s, 3H), 2.40 (s, 3H, s), 2.96 (t, 4H, J = 4.8 Гц), 3.67 (t,4H, J = 4.8 Гц), 5.95 (s, 2H), 6.34 (d, 1H, J = 7.5 Гц), 6.68 (s, 1H), 7.34 (t, 1H, J = 7.5 Гц), 7.59-7.70 (m, 2H),7.76 (s, 1H), 7.85 (d, 1H, J = 7.5 Гц), 8.01 (d, 1H, J = 7.5 Гц), 8.23 (d, 1H, J = 7.5 Гц), 9.81 (s, 1H); ЖХ-МС:H2O (30 мл) перемешивали при температуре дефлегмации в течение ночи. Смесь охлаждали до комнатной температуры и растворитель удаляли под вакуумом. Остаток растворяли в ДХМ и фильтровали. Фильтрат затем промывали рассолом, сушили над безводным Na2SO4, фильтровали и концентрировали под вакуумом с получением требуемого продукта в виде твердого вещества (720 мг; 97%). 1H-ЯМР (300 МГц, ДМСО-d6)м.д. 2.33 (s, 3H), 2.91 (t, 4 Н, J = 4.8 Гц), 3.64 (t, 4H, J = 4.8 Гц), 5.15 (ушир. s, 2H), 5.83b) N-(2-Метил-6-морфолино-1-(нафтален-1-илметил)-1H-бензо[d]имидазол-4-ил)метансульфонамид К раствору 2-метил-6-морфолино-1-(нафтален-1-илметил)-1H-бензо[d]имидазол-4-амина (186 мг),Et3N (0,15 мл) и ДХМ (20 мл) добавляли раствор метансульфонилхлорида (69 мг) в ДХМ при 0C и затем смесь перемешивали при комнатной температуре в течение 1 ч. Смесь разбавляли ДХМ и промывали рассолом, сушили над безводным Na2SO4, фильтровали и концентрировали под вакуумом. Остаток затем очищали посредством хроматографии на силикагеле, элюируя смесью MeOH:ДХМ= 1:30, с получением требуемого продукта в виде твердого вещества (180 мг; 80%). 1H-ЯМР (300 МГц, ДМСО-d6)м.д. 2.40TiCl3 (19,7 мл) добавляли к раствору 4-(2-метил-3-(нафтален-1-илметил)-7-нитро-3H-бензо[d]имидазол-5-ил)морфолина (1,82 г), полученный согласно методу, аналогичному методу по примеру 4, иNH4OAc (4,85 г) в MeOH (150 мл). После перемешивания в течение 7 мин при комнатной температуре анализ ТСХ показал, что исходного вещества не осталось. рН смеси доводили до щелочных значений посредством добавления водного раствора Na2CO3. Растворитель удаляли при пониженном давлении и остаток экстрагировали ДХМ (250 мл 2). Объединенные органические слои промывали рассолом, сушили над безводным Na2SO4, фильтровали и концентрировали под вакуумом с получением требуемого продукта в виде белого твердого вещества (1,52 г; 91%). 1H-ЯМР (300 МГц, CDCl3)м.д. 2.47 (s, 3H), 3.02 (t,4H, J = 4.8 Гц), 3.78 (t, 4 Н, J = 4.8 Гц), 4.30 (s, 2H), 5.68 (s, 2H), 6.05 (d, 1H, J = 1.8 Гц), 6.25 (d, 1H, J = 1.8 Гц), 6.56 (d, 1H, J = 7.5 Гц), 7.27 (t, 1H, J = 7.5 Гц), 7.55-7.66 (m, 2H), 7.77 (d, 1H, J = 8.1 Гц), 7.93 (d, 1H, J= 8.1 Гц), 8.05 (d, 1H, J = 8.1 Гц); ЖХ-МС: m/e составляет 373 [M+1]+.b) 2-Метил-6-морфолино-1-(нафтален-1-илметил)-1H-бензо[d]имидазол-4-ол К раствору 2-метил-6-морфолино-1-(нафтален-1-илметил)-1H-бензо[d]имидазол-4-амина (842 мг) в Н 2 О (20 мл), MeOH (1 мл) и конц. H2SO4 (3 мл) по каплям добавляли водный раствор NaNO2 (344 мг) при 0C. Смесь перемешивали при 0C в течение 15 мин и затем перемешивали при температуре дефлегмации в течение 1 ч. Смесь охлаждали до комнатной температуры, и pH доводили до нейтральных значений водным раствором NaHCO3. Смесь экстрагировали ДХМ (100 мл 3). Объединенные органические слои промывали рассолом, сушили над безводным Na2SO4, фильтровали и концентрировали под вакуумом. Остаток затем очищали посредством хроматографии на силикагеле, элюируя смесью MeOH:ДХМ= 1:60, и затем посредством препаративной ВЭЖХ (высокоэффективной жидкостной хроматографии) с получением неочищенного требуемого продукта, ЖХ-МС: m/e составляет 374 [M+1]+, содержащего примесь, которую удаляли посредством двухстадийного процесса, описанного ниже. с) 4-[(1,1-Диметилэтил)(дифенил)силил]окси-2-метил-6-(4-морфолинил)-1-(1-нафталинилметил)1H-бензимидазол(30 мл) перемешивали при комнатной температуре в течение 1 ч. Анализ ЖХ-МС показал наличие требуемого продукта, так что растворитель удаляли под вакуумом. Остаток очищали посредством хроматографии на силикагеле, элюируя смесью EtOAc:петролейный эфир= 1:2, с получением требуемого продукта в виде TBDP эфира в виде белого твердого вещества (260 мг; 79%). 1H-ЯМР (300 МГц, CDCl3)м.д. 1.24 (s, 9H), 2.53-2.56 (m, 7H), 3.55(t, 4H, J = 4.8 Гц), 5.69 (s, 2H), 5.92 (d, 1H, J = 1.8 Гц), 6.12 (d, 1H,J= 1.8 Гц), 6.55 (d, 1H, J = 7.5 Гц), 7.25-7.45 (m, 7 Н), 7.56-7.67 (m, 2 Н), 7.78 (d, 1H, J = 8.7 Гц), 7.84-7.87d) 2-Метил-6-морфолино-1-(нафтален-1-илметил)-1H-бензо[d]имидазол-4-ол К раствору 4-[(1,1-диметилэтил)(дифенил)силил]окси-2-метил-6-(4-морфолинил)-1-(1-нафталинилметил)-1H-бензимидазола в ТГФ (50 мл) добавляли TBAF (трет-бутиламмонийфторид)(0,64 мл; 1 моль/л) при комнатной температуре и смесь перемешивали в течение 1 ч. Анализ ТСХ показал, что ис- 23022623 ходное вещество израсходовано. Растворитель удаляли под вакуумом и остаток очищали посредством хроматографии на силикагеле, элюируя смесью MeOH:ДХМ= 1:60, с получением требуемого продукта в виде белого твердого вещества (150 мг; 94%). 1H-ЯМР (300 МГц, ДМСО-d6)м.д. 2.36 (s, 3H), 2.94 (t,4H, J = 4.8 Гц), 3.65 (t, 4H, J = 4.8 Гц), 5.87 (s, 2H), 6.30 (d, 1H, J = 1.8 Гц), 6.35 (d, 1H, J = 1.8 Гц), 6.39 (d,1H, J = 7.5 Гц), 7.35 (t, 1H, J = 7.5 Гц), 7.60-7.71 (m, 2 Н), 7.86 (d, 1H, J = 8.4 Гц), 8.01 (d, 1H, J = 7.5 Гц),8.23 (d, 1H, J = 8.4 Гц); ЖХ-МС: m/e составляет 374[M+1]+. Пример 6 К смеси 2-амино-3-нитрофенола (19,25 г) и K2CO3 (19 г) в ДМФА (100 мл) добавляли MeI (11 мл) при комнатной температуре и смесь перемешивали в течение ночи и затем выливали в воду. Полученный осадок собирали посредством фильтрации и твердое вещество промывали водой с получением требуемого продукта (19 г; 90%). 1H-ЯМР (300 МГц, CDCl3)м.д. 3.92 (s, 1H), 6.43 (ушир. s, 1H), 6.61 (dd, 1H, J = 7.5, 9.0 Гц), 6.89 (dd, 1H, J = 0.9, 7.5 Гц), 7.73 (dd, 1H, J = 0.9, 9.0 Гц); ЖХ-МС: m/e составляет 169 [M+1]+.NaOAc (17,6 г) и Br2 (6,76 мл) добавляли к раствору 2-метокси-6-нитробензоламина (21,74 г) в НОАс (250 мл). Смесь перемешивали при комнатной температуре в течение 20 мин. Полученный осадок фильтровали, промывали водой и сушили под вакуумом с получением требуемого продукта в виде желтого твердого вещества (26,43 г; 83%). 1H-ЯМР (300 МГц, ДМСО-d6)3.91 (s, 3H), 7.18 (d, 1H, J = 1.8 Гц), 7.70 (d, 1H, J = 1.8 Гц); ЖХ-МС: m/e составляет 247 [M+1]+. с) N-(4-Бром-2-метокси-6-нитрофенил)ацетамид К раствору 4-бром-2-метокси-6-нитробензоламина (27,85 г) в НОАс (150 мл) и Ac2O (17 мл) добавляли конц. H2SO4 при 70C и смесь перемешивали при 70C в течение 30 мин и выдерживали при комнатной температуре в течение ночи. Образовавшийся осадок собирали посредством фильтрации и промывали гексаном с получением требуемого продукта в виде светло-желтого твердого вещества (24,45 г; 75%). 1H-ЯМР (300 МГц, ДМСО-d6)м.д. 2.01 (s, 3H), 3.92 (s, 3H), 7.61 (d, 1H, J = 1.8 Гц), 7.65 (d, 1H, J = 1.8 Гц), 9.91 (s, 1H); ЖХ-МС: m/e составляет 289 [M+1]+. Смесь N-(4-бром-2-метокси-6-нитрофенил)ацетамида (2,89 г), морфолина (2,61 г), BINAP (2,2'-бис(дифенилфосфино)-1,1'-бинафтила) (1,21 г) и t-BuOK (трет-бутоксида калия) (1,53 г) в диоксане (50 мл) дегазировали с помощью N2 и смесь перемешивали при 110C в герметичной пробирке в течение ночи. Смесь охлаждали до комнатной температуры и фильтровали. Фильтрат концентрировали под вакуумом. Остаток очищали посредством хроматографии на силикагеле, элюируя смесью MeOH/ДХМ= 1/50, с по- 24022623 лучением требуемого продукта (1,03 г; 35%). 1H-ЯМР (300 МГц, CDCl3)м.д. 2.15 (s, 1H), 3.18 (t, 4H, J = 4.8 Гц), 3.85 (t, 4H, J = 4.8 Гц), 3.88 (s, 3H), 6.63 (d, 1H, J = 2.7 Гц), 6.96 (d, 1H, J = 2.7 Гц). е) 4-(7-Метокси-2-метил-3H-бензо[d]имидазол-5-ил)морфолин К подвергаемому нагреванию с обратным холодильником раствору объединенных порций N-(2 метокси-4-морфолино-6-нитрофенил)ацетамида (2,06 г) в НОАс (60 мл) добавляли железный порошок(1,18 г) и смесь перемешивали при температуре дефлегмации в течение ночи. Смесь охлаждали до комнатной температуры и фильтровали. Фильтрат концентрировали под вакуумом и остаток промывали смесью EtOAc:петролейный эфир= 1:1, с получением неочищенного продукта в виде твердого веществаf) 1-[(2,3-Дихлорфенил)метил]-2-метил-4-(метилокси)-6-(4-морфолинил)-1H-бензимидазол Смесь 18 (1,73 г), 1-(бромметил)-2,3-дихлорбензола (1,68 г) и К 2 СО 3 (1,93 г) в ДМФА (50 мл) перемешивали при 80C в течение 72 ч. Смесь охлаждали до комнатной температуры и выливали в воду. Смесь экстрагировали EtOAc и органический слой промывали рассолом, сушили над безводным Na2SO4,фильтровали и концентрировали под вакуумом. Остаток затем очищали посредством хроматографии на силикагеле, элюируя 100% EtOAc и затем смесью MeOH:ДХМ= 1:30, с получением требуемого продукта в виде белого твердого вещества (360 мг; 9%). 1H-ЯМР (CDCl3, TMS (триметилсилан), 300 МГц)м.д. 2.48 (s, 3H), 3.11 (t, 4H, J = 4.8 Гц), 3.85 (t, 4H, J = 4.8 Гц), 4.02 (s, 3H), 5.31 (s, 2H), 6.19 (d,1H, J = 1.8 Гц),6.30 (d, 1H, J = 7.5 Гц), 6.42 (d, 1H, J = 1.8 Гц), 7.03 (t, 1H, J = 7.5 Гц), 7.41 (d, 1H, J = 7.5 Гц); ЖХ-МС: m/e составляет 406 [M+1]+. Пример 7 Смесь соединения по примеру 1 (1,17 г) (полученного, как описано ранее), 1-(бромметил)-2,3 дихлорбензола (1,19 г) и K2CO3 (1,27 г) в ДМФА (80 мл) перемешивали при 80C в течение 3 ч. Когда анализ ТСХ показал отсутствие исходного вещества, смесь охлаждали до комнатной температуры и фильтровали. Фильтрат затем выливали в воду. Затем его фильтровали с получением твердого вещества и твердое вещество промывали водой и затем сушили под вакуумом с получением требуемого продукта(1,07 г), Pd2(dba)3 (376 мг), Cs2CO3 (2 г) и X-Phos (383 мг) в диоксане (80 мл) дегазировали азотом и затем перемешивали при 80C в течение 3 ч. Когда анализ ТСХ показал, что исходное вещество полностью израсходовано, смесь охлаждали до комнатной температуры и растворитель удаляли под вакуумом. Ос- 25022623 таток экстрагировали EtOAc. Органический слой промывали рассолом, сушили над безводным Na2SO4,фильтровали и концентрировали под вакуумом. Остаток затем очищали посредством хроматографии на силикагеле, элюируя смесью EtOAc:петролейный эфир= 1:1, с получением требуемого продукта в виде желтого твердого вещества (831 мг; 48%). 1H-ЯМР (300 МГц, CDCl3)м.д. 2.62 (s, 3H), 3.18 (t, 4H, J = 4.8 Гц), 3.87 (t, 4H, J = 4.8 Гц), 5.41 (s, 2H), 6.28 (d, 1H, J = 7.8 Гц), 6.86 (d, 1H, J = 2.4 Гц), 7.08 (t, 1H, J = 7.8 Гц), 7.46 (d, 1H, J = 7.8 Гц), 7.79 (d, 1H, J = 2.4 Гц); ЖХ-МС: m/е составляет 421 [M+1]+. с) 1-[(2,3-Дихлорфенил)метил]-2-метил-6-(4-морфолинил)-1H-бензимидазол-4-амин Смесь 4-(3-(2,3-дихлорбензил)-2-метил-7-нитро-3H-бензо[d]имидазол-5-ил)морфолина (210 мг),железного порошка (56 мг) и FeSO4 (152 мг) в этаноле (25 мл) и H2O (25 мл) перемешивали при температуре дефлегмации в течение 3 ч. Когда анализ ТСХ показал, что все исходное вещество израсходовано,смесь охлаждали до комнатной температуры и фильтровали. Фильтрат концентрировали под вакуумом и остаток затем очищали посредством хроматографии на силикагеле, элюируя смесьюMeOH:ДХМ:NH3.H2O= 1:60:0,5%, с получением требуемого продукта в виде желтого твердого вещества Получение N-[1-[(2,3-дихлорфенил)метил]-2-метил-6-(4-морфолинил)-1H-бензимидазол-4-ил]метансульфонамид К раствору соединения по примеру 7 (82 мг) и Et3N (42 мг) и безводному ДХМ (20 мл) добавляли раствор метансульфонилхлорида (40 мг) в ДХМ при 0C и затем смесь перемешивали при комнатной температуре в течение 30 мин. Анализ ТСХ показал, что исходного вещества не осталось, а некоторое количество димезилированного продукта определяли посредством ЖХ-МС: m/e составляет 547 [M+1]+. Растворитель удаляли под вакуумом, добавляли ТГФ (10 мл) и 2 н водный раствор NaOH (10 мл). Смесь перемешивали при комнатной температуре в течение 2 ч. Требуемый продукт определяли как главный продукт в анализе ЖХ-МС. Продукт экстрагировали ДХМ (75 мл 2) и объединенные органические слои концентрировали под вакуумом. Остаток очищали посредством хроматографии на силикагеле, элюируя смесью MeOH:ДХМ:NH3H2O= 1:60:0,5%, с получением требуемого продукта в виде желтого твердого вещества (25 мг; 26%). 1H-ЯМР (300 МГц, ДМСО-d6)м.д. 2.40 (s, 1H), 3.03-3.04 (m, 4 Н), 3.09 (s, 3H),3.70-3.75 (m, 4 Н), 5.5-5.56 (m, 2 Н), 6.31-6.34 (m, 1H), 6.80-6.82 (m, 2 Н), 7.25-7.30 (m, 1H), 7.60-7.62 (m,1H), 9.50 (s, 1H); ЖХ-МС: m/e составляет 469 [M+1]+. Пример 9 Получение N-[1-[(2,3-дихлорфенил)метил]-2-метил-6-(4-морфолинил)-1 Н-бензимидазол-4-ил]ацетамида К раствору соединения по примеру 7 (78 мг) и Et3N (30 мг) в безводном ДХМ (30 мл) добавляли раствор Ac2O (20 мг) в ДХМ при 0C и затем смесь перемешивали при комнатной температуре в течение 2 ч. Смесь затем перемешивали при температуре дефлегмации до тех пор, пока анализ ТСХ не показал отсутствие исходного вещества. Смесь охлаждали до комнатной температуры и разбавляли ДХМ (150 мл) и промывали рассолом (100 мл 2). Органический слой концентрировали под вакуумом и остаток очищали посредством хроматографии на силикагеле, элюируя смесью MeOH:ДХМ= 1:60, и затем посредством препаративной ВЭЖХ, с получением требуемого продукта в виде желтого твердого вещества Получение 1-[(2,3-дихлорфенил)метил]-2-метил-6-(4-морфолинил)-1 Н-бензимидазол-4-ола Указанное в заголовке соединение получали согласно методу, аналогичному методу по примеру 5,заменяя 1-(бромметил)нафталин на 1-(бромметил)-2,3-дихлорбензол (130 мг; 69%). 1H-ЯМР (300 МГц,ДМСО-d6)м.д. 2.35 (s, 3H), 2.97 (t, 4H, J = 4.8 Гц), 3.68 (t, 4H, J = 4.8 Гц), 5.44 (s, 2H), 6.24 (d, 1H, J = 2.1 Гц), 6.31 (dd, 1H, J = 1.2, 7.8 Гц), 6.38 (d, 1H, J = 2.1 Гц), 7.26 (t, 1H, J = 7.8 Гц), 7.59 (dd, 1H, J = 1.2, 7.8 Гц), 9.61 (s, 1H); ЖХ-МС: m/e составляет 392 [M+1]+. Пример 11 Смесь 5-бром-3-нитробензол-1,2-диамина (полученный согласно методу, аналогичному методу по примеру 1; 5,0 г) в изомасляной кислоте (20 мл) перемешивали при 120C в течение ночи. Смесь охлаждали до комнатной температуры и выливали в воду (100 мл). pH доводили до нейтральных значений водным раствором Na2CO3. Затем экстрагировали EtOAc и органический слой промывали водой и рассолом, сушили над безводным MgSO4, фильтровали и концентрировали под вакуумом. Остаток затем очищали посредством хроматографии на силикагеле, элюируя смесью EtOAc:петролейный эфир= 1:1, с получением требуемого продукта в виде желтого твердого вещества (4,7 г; 77%). 1H-ЯМР (300 МГц, CDCl3)м.д. 1.51 (m, 6 Н, J = 6.9 Гц), 3.32 (m, 1H, J = 6.9 Гц), 8.16 (d, 1H, J = 1.5 Гц), 8.25 (d, 1H, J = 1.5 Гц), 10.26 Смесь 6-бром-2-изопропил-4-нитро-1H-бензо[d]имидазола (4,7 г), 1-(бромметил)нафталина (4,01 г) и K2CO3 (4,55 г) в ДМФА (150 мл) перемешивали при 80C в течение 2 ч. Смесь охлаждали до комнатной температуры и фильтровали. Фильтрат затем выливали в воду (1 л). Затем фильтровали с получением твердого вещества, которое промывали водой и затем сушили под вакуумом с получением неочищенного продукта (7,2 г). ЖХ-МС: m/е составляет 425 [M+1]+. с) 2-(1-Метилэтил)-6-(4-морфолинил)-1-(1-нафталинилметил)-4-нитро-1H-бензимидазол Смесь 6-бром-2-(1-метилэтил)-1-(1-нафталинилметил)-4-нитро-1H-бензимидазола (2,05 г), морфолина (1,26 г), Pd2(dba)3 (0,46 г), Cs2CO3 (2,36 г) и X-Phos (0,41 г) в диоксане (30 мл) дегазировали азотом и затем перемешивали при 80C в течение ночи. Смесь охлаждали до комнатной температуры и растворитель удаляли под вакуумом. Остаток затем очищали посредством хроматографии на силикагеле, элюируя смесью EtOAc:петролейный эфир= 1:1, с получением требуемого продукта в виде желтого твердого вещества (1,6 г; 77%). ЖХ-МС: m/е составляет 431 [M+1]+.TiCl3 (16,3 мл) добавляли к раствору 2-(1-метилэтил)-6-(4-морфолинил)-1-(1-нафталинилметил)-4 нитро-1H-бензимидазола (1,6 г) и NH4OAc (4 г) в MeOH (40 мл). После перемешивания в течение 4 ч при комнатной температуре анализ ТСХ показал отсутствие исходного вещества. pH смеси доводили до щелочных значений посредством добавления водного раствора Na2CO3. Растворитель выпаривали при пониженном давлении и остаток экстрагировали ДХМ (250 мл 2). Объединенные органические слои промывали рассолом, сушили над безводным Na2SO4, фильтровали и концентрировали под вакуумом с получением требуемого продукта в виде белого твердого вещества (1,2 г; 81%). ЖХ-МС: m/e составляет 401 [M+1]+. е) 2-(1-Метилэтил)-6-(4-морфолинил)-1-(1-нафталинилметил)-1H-бензимидазол-4-ол К раствору 2-(1-метилэтил)-6-(4-морфолинил)-1-(1-нафталинилметил)-1H-бензимидазол-4-амина(300 мг) в H2O (20 мл) и конц. H2SO4 (1 мл) по каплям добавляли водный раствор NaNO2 (78 мг) при 0C. Смесь перемешивали при 0C в течение 15 мин и затем нагревали до температуры дефлегмации в течение 1 ч. Смесь охлаждали до комнатной температуры и pH доводили до нейтральных значений водным раствором NaHCO3. Раствор экстрагировали ДХМ (250 мл 3). Объединенные органические слои промывали рассолом, сушили над безводным Na2SO4, фильтровали и концентрировали под вакуумом. Остаток затем очищали посредством хроматографии на силикагеле, элюируя смесью EtOAc:петролейный эфир= 1:1, с получением требуемого продукта в виде твердого вещества (80 мг; 27%). 1H-ЯМР (300 МГц,ДМСО-d6)м.д. 1.21 (d, 6H, J = 6.6 Гц), 2.91 (t, 4H, J = 7.5 Гц), 3.03 (m, 1H, J = 6.6 Гц), 3.64 (t, 4H, J = 7.5 Гц), 5.89 (s, 2 Н), 6.27-6.34 (m, 3H), 7.32 (t, 1H, J = 7.5 Гц), 7.59-7.70 (m, 2 Н), 7.83 (d, 1H, J = 7.5 Гц), 8.00 Получение 2-этил-6-(4-морфолинил)-1-(1-нафталинилметил)-1 Н-бензимидазол-4-ола Указанное в заголовке соединение получали согласно методу, аналогичному методу по примеру 11,заменяя изомасляную кислоту на пропионовую кислоту. 1H-ЯМР (300 МГц, ДМСО-d6)м.д. 1.20 (t, 3H,J= 7.5 Гц), 2.67 (q, 2H, J = 7.5 Гц), 2.93 (t, 4H, J = 4.5 Гц), 3.64 (t, 4H, J = 4.5 Гц), 5.86 (s, 2H), 6.26 (s, 1H),6.33-6.34 (m, 2H), 7.32 (t, 1H, J = 7.5 Гц), 7.57-7.68 (m, 2H), 7.82 (d, 1H, J = 8.1 Гц), 7.98 (d, 1H, J = 7.5 Гц),8.23 (d, 1H, J = 8.1 Гц), 9.54 (s, 1H); ЖХ-МС: m/e составляет 388 [M+1]+. Пример 13 Получение 1-[(2,3-дихлорфенил)метил]-2-(1-метилэтил)-6-(4-морфолинил)-1 Н-бензимидазол-4-ола Указанное в заголовке соединение получали согласно методу, аналогичному методу по примеру 11,заменяя 1-(бромметил)нафталин на 1-(бромметил)-2,3-дихлорбензол. 1H-ЯМР (300 МГц, CDCl3)м.д. 1.20 (d, 6H, J = 6.9 Гц), 2.94-3.06 (m, 2 Н), 3.67 (t, 4 Н, J = 4.5 Гц), 5.45 (s, 2H), 6.24-6.26 (m, 2 Н), 6.34 (s,1H), 7.23 (d, 1H, J = 7.8 Гц), 7.56 (d, 1H, J = 7.8 Гц), 9.54 (s, 1H); ЖХ-МС: m/e составляет 420 [M+1]+. Пример 14 Получение 1-[(2,3-дихлорфенил)метил]-2-этил-6-(4-морфолинил)-1H-бензимидазол-4-ола Указанное в заголовке соединение получали согласно методу, аналогичному методу по примеру 12,- 28022623 заменяя 1-(бромметил)нафталин на 1-(бромметил)-2,3-дихлорбензол. 1H-ЯМР (300 МГц, CDCl3)м.д. 1.29 (t, 3H, J = 7.5 Гц), 2.86 (q, 2H, J = 7.5 Гц), 3.10 (t, 4H, J = 4.8 Гц), 3.82 (t, 4H, J = 4.8 Гц), 5.32 (s, 2H),6.10 (d, 1H, J = 2.4 Гц), 6.37 (dd, 2H, J = 1.5, 7.8 Гц), 6.54 (d, 1H, J = 2.4 Гц), 7.04 (t, 1H, J = 7.8 Гц), 7.4 (dd,1H, J = 1.5, 7.8 Гц); ЖХ-МС: m/e составляет 406 [M+1]+. Пример 15 Получение 4-фтор-2-метил-6-(4-морфолинил)-1-(1-нафталинилметил)-1H-бензимидазола К раствору 2-метил-6-морфолино-1-(нафтален-1-илметил)-1H-бензо[d]имидазол-4-амина (получен согласно методу, аналогичному использованному для примера 2) (200 мг) в смеси 70% HF/пиридин (2 мл) в тефлоновом реакторе добавляли NaNO2 (56 мг) при -50C и смесь перемешивали при -50C в течение 30 мин и затем нагревали до 70C в течение 1 ч. Смесь охлаждали до комнатной температуры и pH доводили до нейтральных значений водным раствором Na2CO3. Затем экстрагировали ДХМ (100 мл 2). Объединенные органические слои концентрировали под вакуумом и остаток очищали посредством препаративной ТСХ, элюируя смесью EtOAc:петролейный эфир= 1:1, с получением требуемого продукта в виде твердого вещества (10 мг; 5%). 1H-ЯМР (300 МГц, CDCl3)м.д. 2.54 (s, 3H), 3.05 (t, 4H, J = 4.8 Гц),3.79 (t, 4H, J = 4.8 Гц), 5.75 (s, 2H), 6.37 (d, 1H, J = 1.8 Гц), 6.53 (d, 1H, J = 7.5 Гц), 6.66-6.71 (m, 1H), 7.30 Получение 1-[(2,3-дихлорфенил)метил]-4-фтор-2-метил-6-(4-морфолинил)-1H-бензимидазола К раствору 1-[(2,3-дихлорфенил)метил]-2-метил-6-(4-морфолинил)-1H-бензимидазол-4-амина (получен согласно методу, аналогичному методу по примеру 7; 200 мг) в смеси 70% HF/пиридин (4 мл) в тефлоновом реакторе добавляли NaNO2 (53 мг) при -50C и смесь перемешивали при -50C в течение 30 мин и затем нагревали до 70C в течение 1 ч. Смесь охлаждали до комнатной температуры и pH доводили до нейтральных значений водным раствором Na2CO3. Затем экстрагировали ДХМ (100 мл 2). Объединенные органические слои концентрировали под вакуумом и остаток очищали посредством препаративной ТСХ, элюируя смесью MeOH:ДХМ= 1:30, с получением требуемого продукта в виде твердого вещества (40 мг; 20%). 1H-ЯМР (300 МГц, CDCl3)м.д. 2.49 (s, 3H), 3.09(t, 4H, J = 4.5 Гц), 3.83 (t, 4H, J = 4.5 Гц), 5.32 (s, 2H), 6.29-6.33 (m, 2H), 6.66 (d, 1H, J = 7.8 Гц), 7.06 (t, 1H, J = 7.8 Гц), 7.42 (d, 1H, J = 7.8 Гц); ЖХ-МС: m/e составляет 394 [M+1]+. Пример 17 Получение 2-этил-4-фтор-6-(4-морфолинил)-1-(1-нафталинилметил)-1 Н-бензимидазола К раствору 2-этил-6-(4-морфолинил)-1-(1-нафталинилметил)-1H-бензимидазол-4-амина (получен согласно методу, аналогичному методу по примеру 12; 200 мг; 0,49 ммоль) в смеси 70% HF/пиридин (3 мл) добавляли NaNO2 (50 мг; 0,73 ммоль) при -50C и полученную смесь дополнительно перемешивали в течение 1 ч. Затем смесь нагревали до 70C в течение 1 ч. Смесь охлаждали до комнатной температуры и экстрагировали ДХМ (30 мл 3). Объединенные органические слои сушили над Na2SO4, концентрировали под вакуумом. Полученный остаток очищали посредством препаративной ТСХ с получением продукта(20 мг; 10%) в виде белого твердого вещества. 1H-ЯМР (300 МГц, ДМСО-d6)м.д. 1.22 (t, 3H, J = 7.5 Гц),2.69 (q, 2H, J = 7.5 Гц), 3.02 (t, 4 Н, J = 3.9 Гц), 3.66 (t, 4H, J = 3.9 Гц), 5.97 (s, 2H), 6.32 (d, 1H, J = 7.8 Гц),6.74-6.79 (m, 2 Н), 7.34 (t, 1H, J = 7.8 Гц), 7.60-7.70 (m, 2H), 7.85 (d, 1H, J = 8.4 Гц), 8.00 (d, 1H, J = 7.8 Гц),8.24 (d, 1H, J = 7.8 Гц); ЖХ-МС: m/e составляет 390 [M+1]+.
МПК / Метки
МПК: A61K 31/4164, A01N 43/52
Метки: производные, ингибиторов, качестве, pi3-киназ, бензимидазола
Код ссылки
<a href="https://eas.patents.su/30-22623-proizvodnye-benzimidazola-v-kachestve-ingibitorov-pi3-kinaz.html" rel="bookmark" title="База патентов Евразийского Союза">Производные бензимидазола в качестве ингибиторов pi3-киназ</a>
Предыдущий патент: Устройство и способ распыления жидкого продукта, наносимого на поверхность
Следующий патент: Ингибиторы вируса гепатита c
Случайный патент: Высокоэффективные полные и частичные агонисты и антагонисты рецептора ноцицептина/орфанина fq












