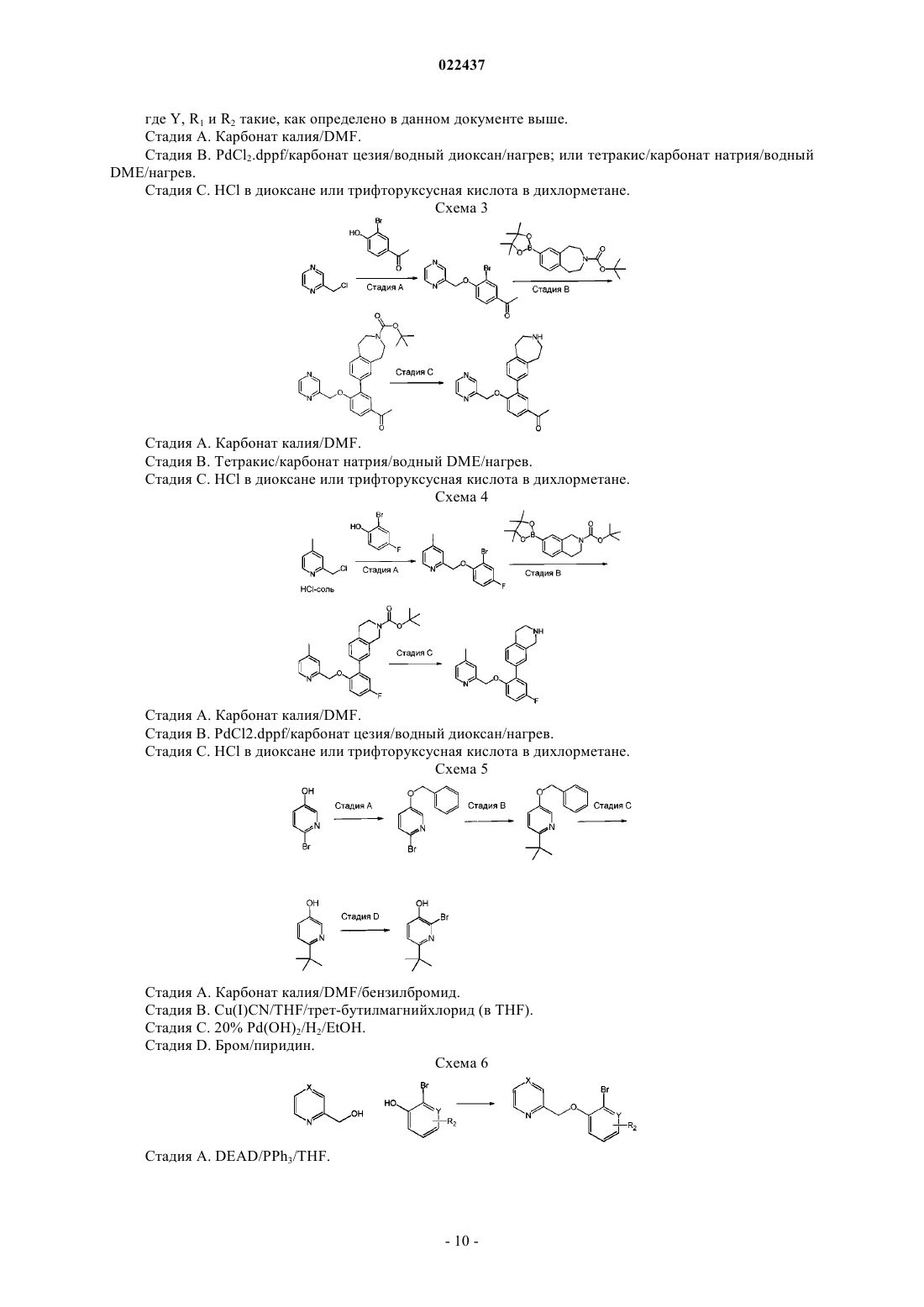
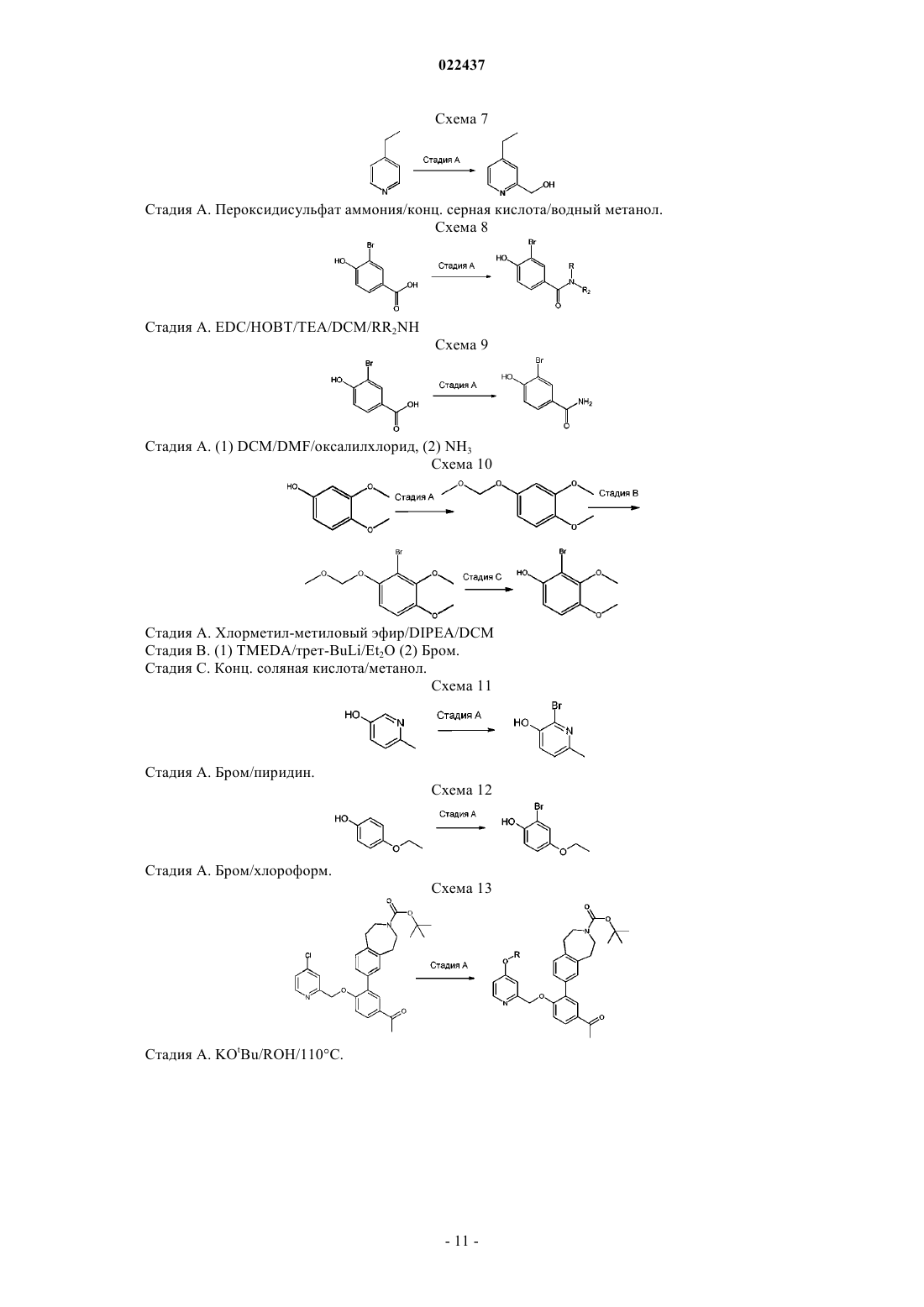
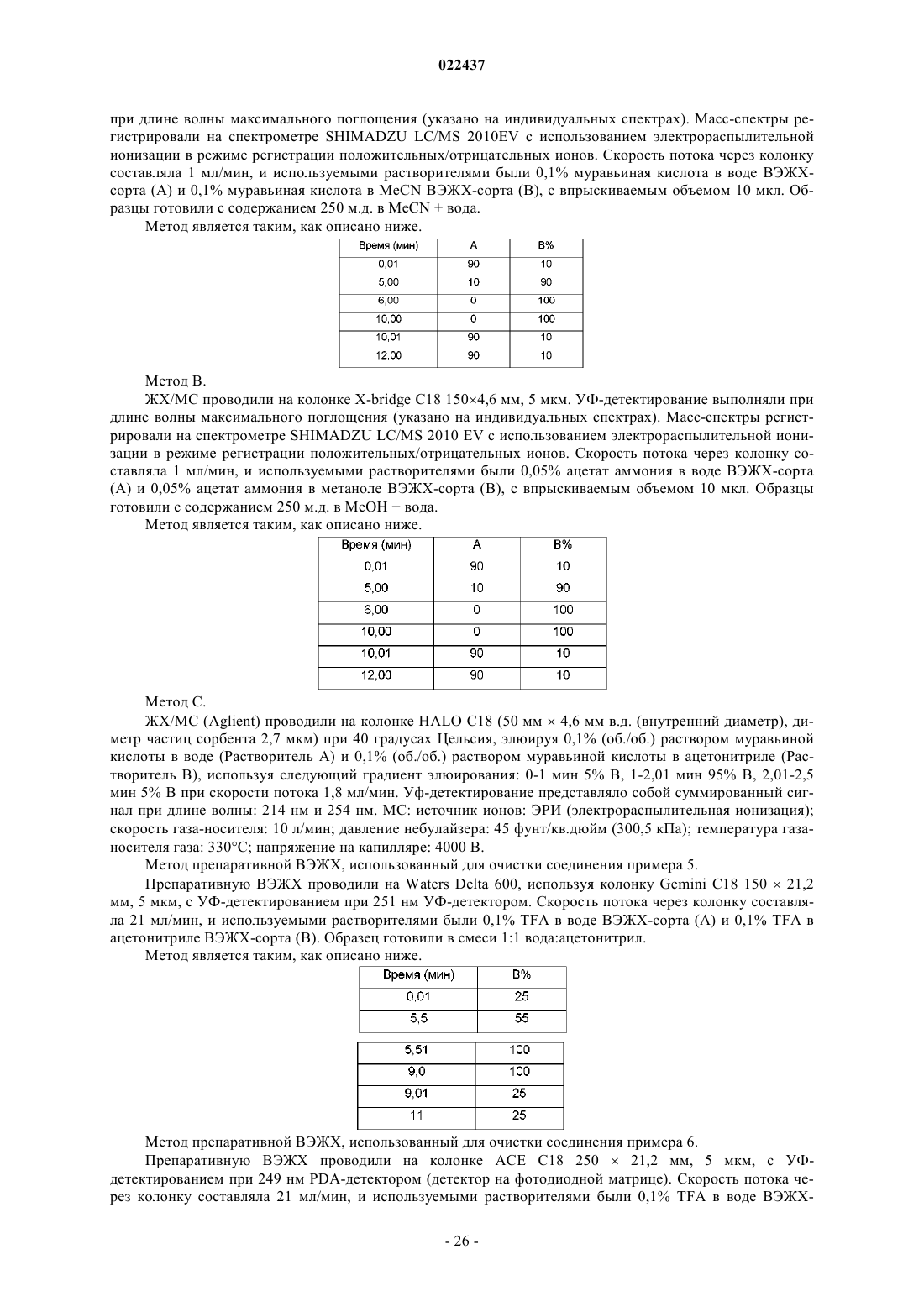
Пиридинил- и пиразинилметилоксиарильные производные, полезные в качеcтве ингибиторов селезеночной тирозинкиназы (syk)
Номер патента: 22437
Опубликовано: 30.12.2015
Авторы: Аткинсон Фрэнсис Льюис, Уилсон Дэвид Мэттью, Лиддл Джон, Баркер Майкл Дейвид
Формула / Реферат
1. Соединение формулы (I)
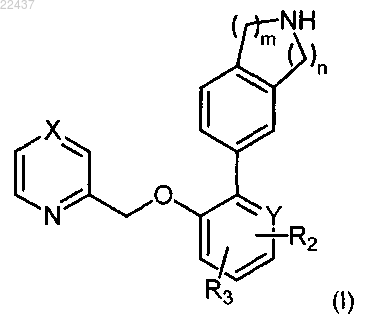
где X представляет собой CR1 или N;
Y представляет собой СН, С или N;
R1 представляет собой водород, С1-6алкокси или С1-6алкил;
R2 представляет собой водород, С1-6алкокси, галоген, -С(О)С1-6алкил, CN, галоген-С1-6алкил или C(O)NR4R5;
R3 представляет собой водород или С1-6алкокси;
R4 представляет собой водород или С1-6алкил;
R5 представляет собой водород или С1-6алкил; и
m и n означают целые числа, каждое из которых независимо выбрано из 1 и 2; или его соль.
2. Соединение по п.1, которое представляет собой соединение формулы (Ia):
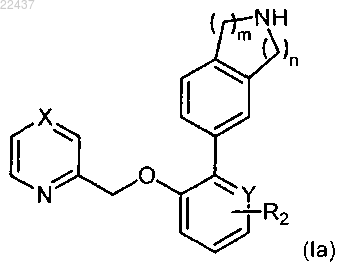
где X представляет собой CR1 или N;
Y представляет собой СН, С или N;
R1 представляет собой водород, С1-6алкокси или С1-6алкил;
R2 представляет собой водород, С1-6алкокси, галоген или -С(О)С1-6алкил и
m и n означают целые числа, каждое из которых независимо выбрано из 1 и 2;
или его соль.
3. Соединение или его соль по п.1 или 2, где X представляет собой CR1.
4. Соединение или его соль по п.3, где R1 представляет собой метил, метокси или водород.
5. Соединение или его соль по любому из пп.1-4, где Y представляет собой С.
6. Соединение или его соль по любому из пп.1-5, где R2 представляет собой водород, метокси или -С(О)СН3.
7. Соединение или его соль по любому из пп.1-6, где R3 представляет собой водород или метокси.
8. Соединение или его соль по любому из пп.1-7, где m и n оба означают 2.
9. Соединение, выбранное из
7-(3-{[(4-метил-2-пиридинил)метил]окси}-2-пиридинил)-2,3,4,5-тетрагидро-1Н-3-бензазепина;
7-(2-(метилокси)-6-{[(4-метил-2-пиридинил)метил]окси}фенил)-2,3,4,5-тетрагидро-1Н-3-бензазепина;
7-(4-(метилокси)-2-{[(4-метил-2-пиридинил)метил]окси}фенил)-2,3,4,5-тетрагидро-1Н-3-бензазепина;
1-[4-{[(4-метил-2-пиридинил)метил]окси}-3-(2,3,4,5-тетрагидро-1Н-3-бензазепин-7-ил)фенил]этанона;
1-[4-[(2-пиразинилметил)окси]-3-(2,3,4,5-тетрагидро-1Н-3-бензазепин-7-ил)фенил]этанона;
7-(5-фтор-2-{[(4-метил-2-пиридинил)метил]окси}фенил)-1,2,3,4-тетрагидроизохинолина;
7-[2-({[4-(метилокси)-2-пиридинил]метил}окси)фенил]-2,3,4,5-тетрагидро-1Н-3-бензазепина;
1-[4-[(2-пиридинилметил)окси]-3-(2,3,4,5-тетрагидро-1Н-3-бензазепин-7-ил)фенил]этанона;
7-(6-метил-3-{[(4-метил-2-пиридинил)метил]окси}-2-пиридинил)-2,3,4,5-тетрагидро-1Н-3-бензазепина;
7-(5-метил-2-{[(4-метил-2-пиридинил)метил]окси}фенил)-1,2,3,4-тетрагидроизохинолина;
7-(2-(метилокси)-6-{[(4-метил-2-пиридинил)метил]окси}фенил)-1,2,3,4-тетрагидроизохинолина;
7-(5-(этилокси)-2-{[(4-метил-2-пиридинил)метил]окси}фенил)-1,2,3,4-тетрагидроизохинолина;
7-{2-(метилокси)-6-[(2-пиразинилметил)окси]фенил}-2,3,4,5-тетрагидро-1Н-3-бензазепина;
4-{[(4-метил-2-пиридинил)метил]окси}-3-(1,2,3,4-тетрагидро-7-изохинолинил)бензонитрила;
7-[2-{[(4-метил-2-пиридинил)метил]окси}-5-(трифторметил)фенил]-1,2,3,4-тетрагидроизохинолина;
7-(5-(метилокси)-2-{[(4-метил-2-пиридинил)метил]окси}фенил)-1,2,3,4-тетрагидроизохинолина;
7-(5-(1,1-диметилэтил)-2-{[(4-метил-2-пиридинил)метил]окси}фенил)-1,2,3,4-тетрагидроизохинолина;
7-{6-метил-3-[(2-пиразинилметил)окси]-2-пиридинил}-2,3,4,5-тетрагидро-1Н-3-бензазепина;
7-(6-метил-3-{[(4-метил-2-пиридинил)метил]окси}-2-пиридинил)-2,3,4,5-тетрагидро-1Н-3-бензазепина;
7-{5-(метилокси)-2-[(2-пиразинилметил)окси]фенил}-2,3,4,5-тетрагидро-1Н-3-бензазепина;
7-[5-(метилокси)-2-({[4-(метилокси)-2-пиридинил]метил}окси)фенил]-2,3,4,5-тетрагидро-1Н-3-бензазепина;
1-[4-({[4-(метилокси)-2-пиридинил]метил}окси)-3-(2,3,4,5-тетрагидро-1Н-3-бензазепин-7-ил)фенил]этанона;
7-[2-({[4-(метилокси)-2-пиридинил]метил}окси)фенил]-2,3,4,5-тетрагидро-1Н-3-бензазепина;
7-(5-фтор-2-{[(4-метил-2-пиридинил)метил]окси}фенил)-2,3,4,5-тетрагидро-1Н-3-бензазепина;
7-(5-метил-2-{[(4-метил-2-пиридинил)метил]окси}фенил)-2,3,4,5-тетрагидро-1Н-3-бензазепина;
7-(5-(этилокси)-2-{[(4-метил-2-пиридинил)метил]окси}фенил)-2,3,4,5-тетрагидро-1Н-3-бензазепина;
7-(5-(метилокси)-2-{[(4-метил-2-пиридинил)метил]окси}фенил)-2,3,4,5-тетрагидро-1Н-3-бензазепина;
4-{[(4-метил-2-пиридинил)метил]окси}-3-(2,3,4,5-тетрагидро-1Н-3-бензазепин-7-ил)бензонитрила;
7-[2-{[(4-метил-2-пиридинил)метил]окси}-5-(трифторметил)фенил]-2,3,4,5-тетрагидро-1Н-3-бензазепина;
7-(5-(1,1-диметилэтил)-2-{[(4-метил-2-пиридинил)метил]окси}фенил)-2,3,4,5-тетрагидро-1Н-3-бензазепина;
7-(3-{[(4-этил-2-пиридинил)метил]окси}-6-метил-2-пиридинил)-2,3,4,5-тетрагидро-1Н-3-бензазепина;
7-(6-(1,1-диметилэтил)-3-{[(4-метил-2-пиридинил)метил]окси}-2-пиридинил)-2,3,4,5-тетрагидро-1Н-3-бензазепина;
1-[4-{[(4-этил-2-пиридинил)метил]окси}-3-(2,3,4,5-тетрагидро-1Н-3-бензазепин-7-ил)фенил]этанона;
1-[4-({[4-(этилокси)-2-пиридинил]метил}окси)-3-(2,3,4,5-тетрагидро-1Н-3-бензазепин-7-ил)фенил]этанона;
7-{5-(метилокси)-2-[(2-пиридинилметил)окси]фенил}-2,3,4,5-тетрагидро-1Н-3-бензазепина;
1-[4-[(2-пиридинилметил)окси]-3-(1,2,3,4-тетрагидро-7-изохинолинил)фенил]этанона;
N-метил-4-{[(4-метил-2-пиридинил)метил]окси}-3-(2,3,4,5-тетрагидро-1Н-3-бензазепин-7-ил)бензамида;
4-{[(4-метил-2-пиридинил)метил]окси}-3-(2,3,4,5-тетрагидро-1Н-3-бензазепин-7-ил)бензамида;
N,N-диметил-4-{[(4-метил-2-пиридинил)метил]окси}-3-(1,2,3,4-тетрагидро-7-изохинолинил)бензамида;
4-{[(4-метил-2-пиридинил)метил]окси}-3-(1,2,3,4-тетрагидро-7-изохинолинил)бензамида;
7-(2,3-бис(метилокси)-6-{[(4-метил-2-пиридинил)метил]окси}фенил)-1,2,3,4-тетрагидроизохинолина;
7-(2,3-бис(метилокси)-6-{[(4-метил-2-пиридинил)метил]окси}фенил)-2,3,4,5-тетрагидро-1H-3-бензазепина,
7-(5-хлор-2-{[(4-метил-2-пиридинил)метил]окси}фенил)-2,3,4,5-тетрагидро-1H-3-бензазепина,
7-{5-хлор-2-[(2-пиридинилметил)окси]фенил}-1,2,3,4-тетрагидроизохинолина,
7-[6-метил-3-({[(4-(метилокси)-2-пиридинил]метил}окси)-2-пиридинил]-2,3,4,5-тетрагидро-1H-3-бензазепина,
7-(6-хлор-3-{[(4-метил-2-пиридинил)метил]окси}-2-пиридинил)-2,3,4,5-тетрагидро-1Н-3-бензазепина,
7-(6-хлор-3-{[(4-метил-2-пиридинил)метил]окси}-2-пиридинил)-1,2,3,4-тетрагидроизохинолина,
1-[4-{[(4-{[2-(метилокси)этил]окси}-2-пиридинил)метил]окси}-3-(2,3,4,5-тетрагидро-1H-3-бензазепин-7-ил)фенил]этанона,
1-{3-(2,3-дигидро-1H-изоиндол-5-ил)-4-[(2-пиридинилметил)окси]фенил}этанона и
1-[4-[(2-пиридинилметил)окси]-3-(1,2,3,4-тетрагидро-6-изохинолинил)фенил]этанона,
или его соль
10. Соединение, которое представляет собой 7-(2-(метилокси)-6-{[(4-метил-2-пиридинил)метил]окси}фенил)-2,3,4,5-тетрагидро-1Н-3-бензазепин или его соль.
11. Соединение или его соль по любому из пп.1-10, где соль представляет собой фармацевтически приемлемую соль.
12. Соединение, которое представляет собой метансульфонат 7-(2-(метилокси)-6-{[(4-метил-2-пиридинил)метил]окси}фенил)-2,3,4,5-тетрагидро-1Н-3-бензазепина.
13. Фармацевтическая композиция, обладающая активностью ингибитора селезеночной тирозинкиназы, содержащая соединение формулы (I) или его фармацевтически приемлемую соль по п.11 или соединение по п.12 и один или более фармацевтически приемлемых носителей, разбавителей или эксципиентов
14. Фармацевтическая композиция по п.13, приготовленная с возможностью местного дермального введения.
15. Применение соединения формулы (I) или его фармацевтически приемлемой соли по п.11 или соединения по п.12 в лечении заболеваний, опосредованных активностью селезеночной тирозинкиназы.
16. Применение соединения формулы (I) или его фармацевтически приемлемой соли по п.11 или соединения по п.12 в ингибировании селезеночной тирозинкиназы.
17. Применение соединения или его фармацевтически приемлемой соли по п.11 или соединения по п.12 в лечении аутоиммунного состояния.
18. Применение по п.16, где аутоиммунное состояние представляет собой хроническую идиопатическую крапивницу с аутоантительным статусом или без аутоантительного статуса.
19. Применение соединения или его фармацевтически приемлемой соли по п.11 или соединения по п.12 для изготовления лекарственного средства для лечения аутоиммунного состояния.
Текст
Соединение формулы (I) или его соль, являющееся ингибитором селезеночной тирозинкиназы(SYK) и, следовательно, имеющее потенциальное применение в лечении заболеваний,возникающих вследствие ненадлежащей активации тучных клеток, макрофагов и В-клеток и соответствующих воспалительных ответных реакций и повреждения ткани, например воспалительных заболеваний и/или аллергических состояний, в терапии рака, особенно гематологических злокачественных новообразований, и аутоиммунных состояний. Аткинсон Фрэнсис Льюис, Баркер Майкл Дейвид, Лиддл Джон, Уилсон Дэвид Мэттью (GB) Поликарпов А.В. (RU)(71)(73) Заявитель и патентовладелец: ГЛАКСО ГРУП ЛИМИТЕД (GB) Изобретение относится к новым химическим соединениям, которые обладают активностью против селезеночной тирозинкиназы (Syk), к способам их получения, к содержащим их фармацевтически приемлемым композициям и к их применению в терапии.Syk представляет собой нерецепторную тирозинкиназу, которая вовлечена в связывание активированных иммунорецепторов с последующими событиями сигнального пути, которые опосредуют различные клеточные ответы, включая пролиферацию, дифференцировку и фагоцитоз. Syk широко экспрессируется в гематопоэтических клетках. Ингибиторы Syk обладают потенциалом противовоспалительной и иммуномодулирующей активности. Они ингибируют Syk-опосредованную передачу сигналов через IgGFc-эпсилон и гамма рецепторы и BCR-рецепторы, что приводит к ингибированию активации тучных клеток, макрофагов и В-клеток и соответствующих воспалительных ответных реакций и повреждения ткани. Тучные клетки играют главную роль в реакциях гиперчувствительности типа I и вовлечены в крапивницу, бронхиальную астму, анафилаксию и другие аллергические состояния. Соответственно, к ингибиторам Syk возник интерес во многих терапевтических областях, включая лечение ревматоидного артрита,В-клеточной лимфомы, астмы, ринита и кожных болезней, таких как острая и хроническая крапивница,мастоцитоз, кожная волчанка, атопический дерматит, аутоиммунные буллзные состояния, в том числе пемфигус и пемфигоид, и другие опосредованные тучными клетками заболевания кожи. Острая и хроническая крапивница являются частыми кожными заболеваниями, поражающими около 25% общего населения в США. Хотя крапивница может быть инициирована аллергическими реакциями, во многих случаях она имеет неясную этиологию. Хроническую крапивницу определяют как состояние, при котором широко распространенные волдыри присутствуют в течение более чем 6 недель. У пациентов с хронической крапивницей имеется много патологических сходств, по распространенности волдырей на коже, с аллерген-индуцированными реакциями дегрануляции тучных клеток и базофилов через активацию lgE. Около 40% пациентов с хронической крапивницей содержат сывороточные IgG аутоантитела, направленно воздействующие на lgE или lgE-рецептор (Fc-эпсилон рецептор), и они, как полагают, запускают высвобождение гистамина и других медиаторов посредством дегрануляции тучных клеток и базофилов. Ингибиторы Syk могут ингибировать сигнальный ответ после lgE-опосредованной активации Fc-эпсилон и могут ингибировать высвобождение медиатора, о котором известно, что он вовлечен в хронический зуд при множестве заболеваний. Кожный мастоцитоз определяют как избыточное аккумулирование тучных клеток в коже, обычно наблюдаемое как у детей, так и у взрослого населения. Полагают, что это редкое заболевание возникает вследствие дисрегуляции пролиферативной способности тучных клеток. Избыточное продуцирование тучных клеток в коже приводит к увеличению высвобождения цитокинов и гистаминов, которые вызывают зуд, поражения кожи и в некоторых случаях, если имеет место системное вовлечение, анафилактический шок или низкое давление крови. Кожная волчанка представляет собой состояние кожи, обнаруживаемое у некоторых пациентов с дискоидной формой красной волчанки. Это расстройство характеризуется появлением красной сыпи на коже лица или головы и других участках тела, и известно, что отложение тучных клеток и антител вовлечено в эти поражения. Ингибитор Syk, применяемый местно, будет снижать продуцирование цитокинов, гистаминов и других медиаторов, потенциально приводя к уменьшению зуда и воспалительного раздражения в коже. Атопический дерматит является очень распространенным и иногда продолжительным воспалительным кожным заболеванием, которое характеризуется покраснением и зудом. Это заболевание часто возникает вместе с другими аллергическими состояниями, такими как сенная лихорадка или астма, и обнаруживается преимущественно у детей младшего возраста и усиливается при контакте с аллергенами. Понятно, что вовлечение тучных клеток вызывает характерный зуд, и это влечет за собой неумеренное расчесывание, которое может приводить к усилению бактериальных инфекций в коже. Местное нанесение ингибитора Syk может уменьшать эти симптомы. Аутоиммунные буллзные состояния, в том числе пемфигус и пемфигоид, являются хроническими кожными заболеваниями, которые характеризуются образованием пузырей. Буллзный пемфигоид (ВР) является хроническим, аутоиммунным, субэпидермальным расстройством, вызывающим образование пузырей на коже (в отличие от пемфигуса, при котором образование пузырей является интраэпидермальным). Эти редкие заболевания обычно поражают людей старше 70 лет. Вырабатываются аутоантитела против базального мембранного слоя кожи, вызывающие активацию комплемента и других воспалительных медиаторов. Воспалительный процесс инициирует высвобождение ферментов, которые разрушают белки в гемидесмосомальных слоях, что, в конечном счете, приводит к образованию пузырей в виде слоев расходящейся кожи. При крапивнице сыпь и зуд обычно возникают до начала образования волдырей,поэтому ингибирование дегрануляции тучных клеток и продуцирования цитокинов после IgG антительной активации в макрофагах ингибитором Syk может быть полезным при этих заболеваниях. Ревматоидный артрит (RA) является аутоиммунным заболеванием, поражающим приблизительно 1% населения. Он характеризуется воспалением суставов, приводящим к истощающей деструкции кости и хряща. Недавние клинические исследования с ритуксимабом, который вызывает обратимое снижение количества В-клеток (J.C.W. Edwards et al. 2004, New Eng. J. Med. 350: 25: 2572-2581), показали, что на-1 022437 правленное воздействие на В-клеточную функцию является подходящей терапевтической стратегией при аутоиммунных заболеваниях, таких как RA. Клиническая польза коррелирует со снижением количества аутореактивных антител (или ревматоидного фактора), и эти исследования свидетельствуют о том, что В-клеточная функция и, безусловно, продуцирование аутоантител играют центральную роль в прогрессировании патологических процессов при этом заболевании. Исследования с использованием клеток мышей с дефицитом Syk продемонстрировали важную роль этой киназы в В-клеточной функции. Дефицит Syk характеризуется блокированием развития В-клеток(М. Turner et al. 1995 Nature 379: 298-302, и Cheng et al. 1995 Nature 378: 303-306). Эти исследования, наряду с исследованиями на зрелых В-клетках с дефицитом Syk (Kurosaki et al. 2000, Immunol. Rev. 176:1929), демонстрируют, что Syk необходима для дифференцировки и активации В-клеток. Следовательно,ингибирование Syk у пациентов с RA должно блокировать В-клеточную функцию и, следовательно,снижать продуцирование ревматоидного фактора. Помимо роли Syk в В-клеточной функции, при лечении RA важным требованием является активность Syk в Fc-рецепторной (FcR) сигнализации. Существует мнение, что активация FcR иммунными комплексами при RA вносит вклад в высвобождение множества провоспалительных медиаторов. Обзор по вкладу Syk-зависимых процессов в патологию RA опубликован в Wong et al. (2004, там же). Опубликованы результаты 12-недельного клинического испытания ингибитора Syk R788 (динатриевая соль фостаматиниба, Rigel) (Treatment of rheumatoid arthritis with a Syk inhibitor: A twelve-week,randomized, placebo-controlled trial, ArthritisRheumatism, 58(11), 2008, 3309-3318). Ингибиторы Syk могут быть также полезны в терапии рака, особенно в терапии гематологических злокачественных новообразований, в частности неходжкинских лимфом, включая фолликулярную лимфому (FL), лимфому из клеток мантийной зоны, лимфому Беркитта и диффузные крупноклеточные Вклеточные лимфомы (DLBCL). Исследования показали, что дисрегуляция Syk происходит в результате сверхэкспрессии и/или конститутивной активации в различных опухолях, представляющих собой первичные В-лимфомы, и также в клеточных линиях В-лимфом. Syk, посредством Pl3K/AKT-пути, PLD-пути и AKT-независимой сигнализации, активирует mTOR (мишень рапамицина у млекопитающих), которая в свою очередь увеличивает выживаемость и пролиферацию В-клеток. Ингибирование Syk in vitro приводит к снижению активацииmTOR и к снижению клоногенности клеток FL. Ингибирование Syk куркумином в мышиной модели Влимфомы (BKS-2) приводило к значительному сокращению опухолевой массы, которая измеряется суммарным количеством спленоцитов (Leseux L. et al. Blood 15 Dec 2006, Vol 108, No 13, pp 4156-4162, иGururajan M. et al. Journal of Immunology, 2007, 178: 111-121). Результаты фазы 2 клинических испытаний R788 (динатриевая соль фостаматиниба) у пациентов с рецидивирующей или рефракторной В-клеточной неходжкинской лимфомой (NHL) показали, что пациенты хорошо переносят данное соединение, а также продемонстрировали терапевтическую пользу у пациентов, страдающих диффузной крупноклеточной В-клеточной лимфомой (DLBCL) и хроническим лимфоцитарным лейкозом/мелкоклеточной лимфоцитарной лимфомой (CLL/SLL). Несмотря на то, что пациенты, участвующие в этом испытании, имели запущенное заболевание, и что лечение имеющимися в продаже терапевтическими средствами не было успешным, многие пациенты были особенно восприимчивыми к ингибированию Syk лекарственным средством R788 (Chen et al., Blood 2008, Vol 111, pp 2230-2237, www.Rigel.com). Ингибиторы Syk могут быть полезны также в лечении астмы и аллергического ринита, поскольку они играют важную роль в трансдукции нисходящих клеточных сигналов, ассоциированных с перекрестным связыванием рецепторов FcR1 и/или FcR1, и Syk позиционирована раньше в сигнальном каскаде. В тучных клетках, например, в ранней последовательности передачи сигнала через FcR1 после перекрестного связывания аллергеном комплексов рецептор-lgE задействована сначала Lyn (тирозинкиназа семейства Src), а затем Syk. Аллергический ринит и астма являются заболеваниями, связанными с реакциями гиперчувствительности и воспалительными событиями, в которые вовлечено множество типов клеток, включая тучные клетки, эозинофилы, Т-клетки и дендритные клетки. После воздействия аллергена высокоаффинные иммуноглобулиновые рецепторы к lgE (FcRl ) и IgG (FcRl) становятся перекрестно связанными и активируют последующие процессы в тучных клетках и других типах клеток, приводящие к высвобождению провоспалительных медиаторов и спазмогенов дыхательных путей. Например, в тучной клетке перекрестное связывание lgE-рецептора аллергеном приводит к высвобождению медиаторов, в том числе гистамина, из предварительно образовавшихся гранул, а также к синтезу и высвобождению вновь синтезированных липидных медиаторов, в том числе простагландинов и лейкотриенов. Было показано, что ингибитор Syk R112 (Rigel), который вводили интраназально в фазе I/II исследования в отношении лечения аллергического ринита, обеспечивает статистически достоверное снижение PGD2, ключевого иммунного медиатора, которое хорошо коррелируется с улучшением состояния при аллергической ринорее, а также является безопасным по всему диапазону показателей, что является первым доказательством клинической безопасности и эффективности ингибитора Syk при местном применении (смотри Meltzer Eli О.; Berkowits, Robert В.; Grossbard, Elliot B. An intranasal Syk kinase inhibitor(R112) improves the symptoms of seasonal allergic rhinitis in a park environment. Journal of Allergy and Clinical Immunology (2005), 115(4): 791-796). Однако в последующей фазе II этого клинического испытания в отношении аллергического ринита было показано, что R112 не обладает эффективностью по сравнению с плацебо (Clinical Trials.gov Identifier NCT0015089). В WO 03/057695 (Boehringer Ingelheim Pharmaceuticals, Inc.) описаны 1,6-нафтиридины, обладающие активностью ингибиторов Syk. Они также описаны в "Discovery and SAR of Novel [1,6] Naphthiridines as Potent Inhibitors of Spleen Tyrosine Kinase (SYK)" (BioorganicMedicinal Chemistry Letters 13(2003): 1415-1418). Затем последовали более поздние патентные заявки WO 2010/015518 и WO 2010/015529 (Boehringer Ingelheim Pharmaceuticals, Inc.), в которых соответственно описаны 4 диметиламинофенил-замещенные нафтиридины и замещенные нафтиридины. В WO 04/035604 раскрыты структурные координаты белка Syk человека. Тем не менее, сохраняется необходимость идентифицировать дополнительные соединения, которые являются ингибиторами Syk. Описание графических материалов На фиг. 1 представлена дифракционная картина ДРЛП (дифракция рентгеновских лучей на порошке) для формы 1. На фиг. 2 представлен Фурье-рамановский спектр для формы 1. На фиг. 3 представлена термограмма ДСК (дифференциальная сканирующая калориметрия) ФОРМЫ 1. На фиг. 4 представлена дифракционная картина ДРЛП для формы 2. На фиг. 5 представлен Фурье-рамановский спектр для формы 2. На фиг. 6 представлена термограмма ДСК формы 2. Описание изобретения Таким образом, в одном из воплощений настоящего изобретения предложено соединение формулыR3 представляет собой водород или C1-6 алкокси;R4 представляет собой водород или C1-6 алкил;R5 представляет собой водород или C1-6 алкил; иm и n означают целые числа, каждое из которых независимо выбрано из 1 и 2; или его соль. В одном из воплощений изобретения предложено соединение формулы (Ia):m и n означают целые числа, каждое из которых независимо выбрано из 1 и 2; или его соль. В одном из воплощений X представляет собой CR1 или N. В другом воплощении X представляет собой CR1. В одном из воплощений Y представляет собой СН, С или N. В другом воплощении Y представляет собой СН. В другом воплощении Y представляет собой С. В еще одном воплощении Y представляет собой N. В одном из воплощений R1 представляет собой водород, C1-6 алкокси или C1-6 алкил. В другом воплощении R1 представляет собой метил, метокси или водород. В одном из воплощений R2 представляет собой водород, C1-6 алкокси, галоген, -С(О)C1-6 алкил, CN,-3 022437 галоген-C1-6 алкил или C(O)NR4R5. В одном из воплощений R2 представляет собой водород, C1-6 алкокси,галоген или -С(О)C1-6 алкил. В другом воплощении R2 представляет собой водород, метокси, фтор или-С(О)СН 3. В еще одном воплощении R2 представляет собой водород, метокси или -С(О)СН 3. В одном из воплощений R3 представляет собой водород или C1-6 алкокси. В одном из воплощений R3 представляет собой водород или метокси. В одном из воплощений R4 представляет собой водород или C1-6 алкил. В другом воплощении R4 представляет собой водород или С 1-4 алкил. В еще одном воплощении R4 представляет собой водород или метил. В одном из воплощений R5 представляет собой водород или C1-6 алкил. В другом воплощении R5 представляет собой водород или С 1-4 алкил. В еще одном воплощении R5 представляет собой водород или метил. В одном из воплощений m и n означают целые числа, каждое из которых независимо выбрано из 1 и 2. В другом воплощении m означает 2 и n означает 1 или 2. В другом воплощении n означает 1 и m означает 1 или 2. В еще одном воплощении m и n оба означают 2. В одном из воплощений X представляет собой CR1, и R1 представляет собой метил. В другом воплощении X представляет собой CR1, R1 представляет собой метил, и Y представляет собой С. В еще одном воплощении X представляет собой CR-1, R1 представляет собой метил, Y представляет собой С, и R2 представляет собой метокси. В еще одном воплощении X представляет собой CR1, R1 представляет собой метил, Y представляет собой С, R2 представляет собой метокси и R3 представляет собой водород. В еще одном воплощении X представляет собой CR1, R1 представляет собой метил, Y представляет собой С, R2 представляет собой метокси, R3 представляет собой водород, m означает 2 и n означает 2. В одном из воплощений, соединение формулы (I) выбрано из В одном из воплощений соединение формулы (I) представляет собой 7-(3-[(4-метил-2-пиридинил)метил]окси-2-пиридинил)-2,3,4,5-тетрагидро-1 Н-3-бензазепин или его соль. В другом воплощении соединение формулы (I) представляет собой 7-(2-(метилокси)-6-[(4-метил-2-пиридинил)метил]оксифенил)-2,3,4,5-тетрагидро-1 Н-3-бензазепин или его соль. В другом воплощении соединение формулы (I) представляет собой 7-(4-(метилокси)-2-[(4-метил-2-пиридинил)метил]оксифенил)-2,3,4,5-тетрагидро-1 Н-3-бензазепин или его соль. В еще одном воплощении соединение формулы (I) представляет собой 1-[4-[(4-метил-2-пиридинил)метил]окси-3-(2,3,4,5-тетрагидро-1 Н-3-бензазепин-7 ил)фенил]этанон или его соль. Должно быть понятно, что фраза "соединение формулы (I)" охватывает соединение формулы (1a). Должно быть понятно, что соединения формулы (I) и их соли могут существовать в сольватированных формах. В другом воплощении настоящего изобретения предложены соединения формулы (I) и их соли. В другом воплощении настоящего изобретения предложены соединения формулы (I) и их фармацевтически приемлемые соли. В другом воплощении настоящего изобретения предложены соединения формулы (I) и их сольваты. В еще одном воплощении настоящего изобретения предложены соединения формулы (I) в форме свободного основания. Соединения по настоящему изобретению полезны в качестве ингибиторов Syk. Используемый в данном документе термин "алкил" относится к прямой или разветвленной насыщенной углеводородной цепи, содержащей указанное количество атомов углерода. Например, C1-6 алкил означает алкильную группу с прямой или разветвленной цепью, содержащую по меньшей мере 1 и мак-7 022437 симум 6 атомов углерода. Примерами "алкила" являются, но не ограничиваются ими, метил, этил, нпропил, н-бутил, н-пентил, н-гексил, изобутил, изопропил, трет-бутил и 1,1-диметилпропил. Используемый в данном документе термин "алкокси" относится к прямой или разветвленной насыщенной алкокси цепи, содержащей указанное количество атомов углерода. Например, C1-6 алкокси означает алкоксигруппу с прямой или разветвленной цепью, содержащую по меньшей мере 1 и самое большое 6 атомов углерода. Примерами "алкокси" являются, но не ограничиваются ими, метокси, этокси,пропокси, проп-2-окси, бутокси, бут-2-окси, 2-метилпроп-1-окси, 2-метилпроп-2-окси, пентокси или гексилокси. Используемый в данном документе термин "галоген" или, альтернативно, "галоген-" относится к атому фтора, хлора или брома. Используемый в данном документе термин "галогеналкил" относится к прямой или разветвленной насыщенной углеводородной цепи, содержащей указанное количество атомов углерода, замещенной атомами галогенов. Например, галоген-C1-6 алкил означает прямую или разветвленную алкильную группу, содержащую по меньшей мере 1 и самое большое 6 атомов углерода, замещенную 1-3 атомами галогена на атом углерода. Примерами "галогеналкила" являются, но ими не ограничиваются, фторметил,дифторметил и трифторметил. Используемый в данном документе термин "фармацевтически приемлемые" относится к тем соединениям, веществам, композициям и лекарственным формам, которые в соответствии с обоснованным медицинским суждением пригодны для применения в контакте с тканями людей и животных без чрезмерной токсичности, раздражения или других проблем или осложнений при разумном соотношении польза/риск. Специалисту в данной области будет понятно, что могут быть получены фармацевтически приемлемые соли соединения формулы (I). Используемый в данном документе термин "фармацевтически приемлемые соли" относится к солям, которые сохраняют желаемую биологическую активность рассматриваемого соединения и проявляют минимальные нежелательные токсикологические эффекты. Эти фармацевтически приемлемые соли могут быть получены in situ в процессе окончательного выделения и очистки соединения или в результате отдельного взаимодействия очищенного соединения в форме свободной кислоты или в форме свободного основания с подходящим основанием или подходящей кислотой соответственно. Фактически, в некоторых воплощениях изобретения фармацевтически приемлемые соли могут быть предпочтительными по сравнению с соответствующим свободным основанием или соответствующей свободной кислотой,поскольку такие соли придают молекуле более высокую стабильность или растворимость, что облегчает процесс приготовления лекарственной формы. Соединения формулы (I) являются основными по своей природе и, соответственно, способны образовывать фармацевтически приемлемые соли присоединения кислоты при обработке подходящей кислотой. Подходящие кислоты включают фармацевтически приемлемые неорганические кислоты и фармацевтически приемлемые органические кислоты. Репрезентативные фармацевтически приемлемые соли присоединения кислоты включают гидрохлорид, гидробромид, нитрат, метилнитрат, сульфат, бисульфат,сульфамат, фосфат, ацетат, гидроксиацетат, фенилацетат, пропионат, бутират, изобутират, валерат, малеат, гидроксималеат, акрилат, фумарат, малат, тартрат, цитрат, салицилат, парааминосалицилат, гликолят,лактат, гептаноат, фталат, оксалат, сукцинат, бензоат, ортоацетоксибензоат, хлорбензоат, метилбензоат,динитробензоат, гидроксибензоат, метоксибензоат, манделат, таннат, формиат, стеарат, аскорбат, пальмитат, олеат, пируват, памоат, малонат, лаурат, глутарат, глутамат, эстолат, метансульфонат (мезилат),этансульфонат (эзилат), 2-гидроксиэтансульфонат, бензолсульфонат (безилат), парааминобензолсульфонат, паратолуолсульфонат (тозилат) и нафталин-2-сульфонат, этандисульфонат и 2,5-дигидроксибензоат. В одном из воплощений настоящего изобретения предложена фармацевтически приемлемая соль соединения формулы (I), которая представляет собой соль гидрохлорид, мезилат, фумарат или фосфат. В одном из воплощений настоящего изобретения предложена фармацевтически приемлемая соль соединения формулы (I), которая представляет собой мезилат. Соединение формулы (I) может существовать в твердой или жидкой форме. В твердом состоянии соединение формулы (I) может существовать в кристаллической или некристаллической (аморфной) форме или в виде смеси таких форм. Что касается соединения формулы (I), которое находится в кристаллической форме, специалисту будет понятно, что могут быть образованы сольваты, такие как фармацевтически приемлемые сольваты, в которых молекулы растворителя встроены в кристаллическую решетку во время кристаллизации. Сольваты могут включать в качестве растворителя неводные растворители,такие как, без ограничения, этанол, изопропанол, н-бутанол, изобутанол, ацетон, тетрагидрофуран, диоксан, DMSO, уксусная кислота, этаноламин и этилацетат, или они могут включать воду в качестве растворителя, которая встроена в кристаллическую решетку. Сольваты, в которых растворителем является вода, встроенная в кристаллическую решетку, обычно называются "гидратами". Гидраты включают стехиометрические гидраты, а также структуры, содержащие вариабельные количества воды. Специалисту также будет понятно, что соединение формулы (I), которое существует в кристаллической форме, включая различные его сольваты, может проявлять полиморфизм (т.е. способность существовать в разных кристаллических формах). Эти разные кристаллические формы известны как "полимор-8 022437 фы". Изобретение охватывает все такие полиморфы. Полиморфы имеют одинаковый химический состав,но различаются упаковкой, геометрической группировкой и другими описательными свойствами кристаллического твердого состояния. Следовательно, полиморфы могут обладать разными физическими свойствами, такими как форма, плотность, твердость, деформируемость, стабильность и растворимость. Полиморфы обычно имеют разные точки плавления, ИК-спектры и картины дифракции рентгеновских лучей на порошке, которые могут быть использованы для идентификации. Специалисту в данной области будет понятно, что разные полиморфы могут быть получены, например, в результате изменения или корректировки реакционных условий или реагентов, используемых при получении соединения. Например, изменения температуры, давления или замена растворителя могут приводить к получению полиморфов. Кроме того, в определенных условиях один полиморф может спонтанно превращаться в другой полиморф. В еще одном аспекте настоящего изобретения предложена кристаллическая форма 7-(2(метилокси)-6-[(4-метил-2-пиридинил)метил]оксифенил)-2,3,4,5-тетрагидро-1 Н-3-бензазепина (ФОРМА 1), характеризующаяся по существу такой же картиной дифракции рентгеновских лучей на порошке(ДРЛП), как картина, представленная на фиг. 1, где эта картина ДРЛП выражена в единицах 2-тета углов и получена на дифрактометре с использованием Ка-излучения меди по методикам, описанным в данном документе. ДРЛП формы 1 показывает характеристические пики при 2-тета углах 11,7; 12,7; 13,7 и 16,0. Альтернативно или дополнительно форма 1 7-(2-(метилокси)-6-[(4-метил-2-пиридинил)метил]оксифенил)-2,3,4,5-тетрагидро-1 Н-3-бензазепина может быть охарактеризована рамановской спектроскопией, которая показана на фиг. 2, где спектр выражен в единицах см-1 и получен по методикам, описанным в данном документе. Рамановский спектр формы 1 имеет характеристические пики при 2945, 2832,1610, 1363, 994 и 784. Альтернативно или дополнительно форма 1 7-(2-(метилокси)-6-[(4-метил-2-пиридинил)метил]оксифенил)-2,3,4,5-тетрагидро-1 Н-3-бензазепина может быть охарактеризована термограммами дифференциальной сканирующей калориметрии (ДСК), представленными на фиг. 3, где ДСК выполнена по методикам, описанным в данном документе. В еще одном аспекте настоящего изобретения предложена кристаллическая форма 7-(2(метилокси)-6-[(4-метил-2-пиридинил)метил]оксифенил)-2,3,4,5-тетрагидро-1 Н-3-бензазепина (форма 2), характеризующаяся, по существу, такой же картиной дифракции рентгеновских лучей на порошке(ДРЛП), как картина, представленная на фиг. 4, где эта картина ДРЛП выражена в единицах 2-тета углов и получена на дифрактометре с использованием K-излучения меди по методикам, описанным в данном документе. ДРЛП формы 2 показывает характеристические пики при 2-тета углах 8,9; 9,9; 13,3; 15,2; 16,7. Альтернативно или дополнительно форма 2 7-(2-(метилокси)-6-[(4-метил-2-пиридинил)метил]оксифенил)-2,3,4,5-тетрагидро-1 Н-3-бензазепина может быть охарактеризована рамановской спектроскопией, которая показана На фиг. 5, где спектр выражен в единицах см-1 и получен по методикам, описанным в данном документе. Рамановский спектр формы 1 имеет характеристические пики при 2934, 1614,1371, 1005 и 777. Альтернативно или дополнительно форма 2 7-(2-(метилокси)-6-[(4-метил-2-пиридинил)метил]оксифенил)-2,3,4,5-тетрагидро-1 Н-3-бензазепина может быть охарактеризована термограммами дифференциальной сканирующей калориметрии (ДСК), представленными на фиг. 6, где ДСК выполнена по методикам, описанным в данном документе. Соединение формулы (I) может быть получено в соответствии с общими схемами синтеза, описанными в данном документе ниже. Схема 1DME/нагрев. Стадия С. HCl в диоксане или трифторуксусная кислота в дихлорметане. Схема 3 Стадия А. Карбонат калия/DMF. Стадия В. Тетракис/карбонат натрия/водный DME/нагрев. Стадия С. HCl в диоксане или трифторуксусная кислота в дихлорметане. Схема 4 Стадия А. Карбонат калия/DMF. Стадия В. PdCl2.dppf/карбонат цезия/водный диоксан/нагрев. Стадия С. HCl в диоксане или трифторуксусная кислота в дихлорметане. Схема 5 Схема 14. Альтернативный синтез соединения примера 2 в форме мезилатной соли Таким образом, в еще одном аспекте настоящего изобретения предложен способ получения соединения формулы (I), включающий взаимодействие соединения формулы (II) где X, Y и R2 такие, как определено в данном документе выше; с бороновым эфиром или бороновой кислотой формулы (III) где каждый из R6 и R7, которые могут быть одинаковыми или разными, представляет собой водород, C1-6 алкил, или R6 и R7 могут быть соединены с образованием C1-3 алкиленовой группы, возможно замещенной метильными группами в количестве вплоть до четырех, например -С(Ме)2 С(Ме)2-; Р представляет собой защитную группу иm и n такие, как определено в данном документе выше; в присутствии катализатора, в условиях, обычно используемых для реакции сочетания с бороновым эфиром/бороновой кислотой; и затем удаление любой защитной группы. Условия, обычно используемые для реакции сочетания с бороновым эфиром/бороновой кислотой,включают использование Pd(PPh3)4 в качестве катализатора с карбонатом цезия в растворителе, таком как водный 1,4-диоксан. Альтернативно условия, которые могут быть использованы, включают использование PEPPSI в качестве катализатора, с гидроксидом калия в растворителе, таком как водный диметоксиэтан (DME) с этанолом. Примеры защитных групп и методы их удаления можно найти в T.W. Greene "Protective Groups inOrganic Synthesis" (J. Wiley and Sons, 1991). Подходящие защитные группы для аминогруппы включают,но не ограничиваются ими, сульфонил (такой как тозил), ацил (такой как бензилоксикарбонил или третбутоксикарбонил) и арилалкил (такой как бензил), которые могут быть удалены посредством гидролиза или гидрогенолиза, где как подходит. Другие подходящие защитные группы для аминогруппы включают трифторацетил (-C(O)CF3), который может быть удален посредством катализируемого основанием гидролиза, или связанную с твердофазной смолой бензильную группу, например 2,6-диметоксибензильную группу, связанную со смолой Меррифилда (линкер Эллмана), которая может быть удалена посредством катализируемого кислотой гидролиза (с использованием, например, трифторуксусной кислоты). В одном из воплощений настоящего изобретения защитная группа (Р) выбрана из третбутилоксикарбонила "ВОС" и 9-флуоренилметилоксикарбонила "FmoC". Соединения формулы (I) полезны в качестве ингибиторов Syk, и поэтому их можно применять в лечении некоторых видов рака, в частности гематологических злокачественных новообразований, а также воспалительных состояний, в которые вовлечены В-клетки, и также заболеваний, обусловленных ненадлежащей активацией тучных клеток, например аллергических и воспалительных заболеваний, таких как кожные заболевания, опосредованные тучными клетками, включая острую и хроническую крапивницу,мастоцитоз, атопический дерматит и аутоиммунные заболевания, такие как кожная волчанка и аутоиммунные буллзные состояния, включая пемфигус и пемфигоид. В одном аспекте настоящего изобретения предложено соединение формулы (I) или его фармацевтически приемлемая соль для применения в терапии. В другом аспекте настоящего изобретения предложено соединение формулы (I) или его фармацевтически приемлемая соль для применения в ингибировании селезеночной тирозинкиназы (Syk). В еще одном аспекте настоящего изобретения предложен способ ингибирования селезеночной тирозинкиназы (Syk), включающий введение субъекту, в частности субъекту-человеку, нуждающемуся в этом, эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. Ингибиторы Syk могут быть полезны в терапии рака, особенно гематологических злокачественных новообразований, в частности неходжинских лимфом, включая фолликулярную лимфому (FL), лимфому из клеток мантийной зоны, мелкоклеточную лимфоцитарную лимфому/хроническую лимфоцитарную лимфому (SLL/CLL), лимфому Беркитта и диффузную крупноклеточную В-клеточную лимфому(DLBCL). Ингибиторы Syk могут быть также полезны в лечении острого миелоидного лейкоза и ретинобластомы. В одном аспекте настоящего изобретения предложено соединение формулы (I) или его фармацевтически приемлемая соль для применения в лечении рака, например острого миелоидного лейкоза, ретинобластомы, гематологических злокачественных новообразований, в частности неходжинских лимфом,включая фолликулярную лимфому (FL), лимфому из клеток мантийной зоны, мелкоклеточную лимфоцитарную лимфому/хроническую лимфоцитарную лимфому (SLL/CLL), лимфому Беркитта и диффузную крупноклеточную В-клеточную лимфому (DLBCL). В другом аспекте настоящего изобретения предложен способ лечения рака, например острого миелоидного лейкоза, ретинобластомы, гематологических злокачественных новообразований, в частности неходжинских лимфом, включая фолликулярную лимфому (FL), лимфому из клеток мантийной зоны,мелкоклеточную лимфоцитарную лимфому/хроническую лимфоцитарную лимфому (SLL/CLL), лимфому Беркитта и диффузную крупноклеточную В-клеточную лимфому (DLBCL), включающий введение субъекту, в частности субъекту-человеку, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В еще одном аспекте настоящего изобретения предложено применение соединения формулы (I) или его фармацевтически приемлемой соли для изготовления лекарственного средства для лечения рака, например острого миелоидного лейкоза, ретинобластомы, гематологических злокачественных новообразований, в частности неходжинских лимфом, включая фолликулярную лимфому (FL), лимфому из клеток мантийной зоны, мелкоклеточную лимфоцитарную лимфому/хроническую лимфоцитарную лимфому(SLL/CLL), лимфому Беркитта и диффузную крупноклеточную В-клеточную лимфому (DLBCL). Соединения формулы (I) можно также применять в химиотерапии рака в комбинации с другими классами химиотерапевтических агентов против рака, которые известны в данной области. Репрезентативные классы агентов для применения в таких комбинациях против неходжинских лимфом включают ритуксимаб, BEXXAR (тоситумомаб и йод-131/тоситумомаб) и пиксантрон. Соединения формулы (I) можно также использовать в комбинации с лекарственными средствами, применяемыми по схеме CHOP(циклофосфамид, адриамицин, винкристин, преднизон) или CHOP плюс ритуксимаб (CHOP+R). Соединения формулы (I) могут быть использованы в лечении аутоиммунных состояний, в которые вовлечена активация В-клеток и/или макрофагов, например системной красной волчанки (SLE), дискоидной (кожной) волчанки, синдрома Шегрена, гранулематоза Вегенера и других васкулитов, буллзного пемфигоида и пемфигуса, идиопатической тромбоцитопенической пурпуры (ITP), гигантоклеточного артериита, хронической идиопатической крапивницы с аутоантительным статусом и без аутоантительного статуса (хроническая аутоиммунная крапивница (New concepts in chronic urticaria, Current Opinions inImmunology 2008 20:709-716, гломерулонефрита, хронического отторжения трансплантата и ревматоидного артрита. В одном аспекте настоящего изобретения предложено соединение формулы (I) или его фармацевтически приемлемая соль для применения в лечении аутоиммунного состояния, например системной красной волчанки (SLE), дискоидной (кожной) волчанки, синдрома Шегрена, гранулематоза Вегенера и других васкулитов, буллзного пемфигоида и пемфигуса, идиопатической тромбоцитопенической пурпуры (ITP), гигантоклеточного артериита, хронической идиопатической крапивницы с аутоантительным статусом и без аутоантительного статуса (хроническая аутоиммунная крапивница (New concepts in chronic urticaria, Current Opinions in Immunology 2008 20:709-716, гломерулонефрита, хронического отторжения трансплантата и ревматоидного артрита. В одном из воплощений настоящего изобретения предложено соединение формулы (I) или его фармацевтически приемлемая соль для применения в лечении аутоиммунного состояния, которое представляет собой хроническую идиопатическую крапивницу с аутоантительным статусом и без аутоантительного статуса. В другом воплощении настоящего изобретения предложено соединение формулы (I) или его фармацевтически приемлемая соль для применения в лечении аутоиммунного состояния, которое представляет собой дискоидную (кожную) волчанку. В другом аспекте настоящего изобретения предложен способ лечения аутоиммунного состояния,например системной красной волчанки (SLE), дискоидной (кожной) волчанки, синдрома Шегрена, гранулематоза Вегенера и других васкулитов, буллзного пемфигоида и пемфигуса, идиопатической тромбоцитопенической пурпуры (ITP), гигантоклеточного артериита, хронической идиопатической крапивницы с аутоантительным статусом и без аутоантительного статуса, гломерулонефрита, хронического отторжения трансплантата и ревматоидного артрита, включающий введение субъекту, в частности субъекту-человеку, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В одном воплощении настоящего изобретения предложен способ лечения аутоиммунного заболевания, которое представляет собой хроническую идиопатическую крапивницу с аутоантительным статусом и без аутоантительного статуса, включающий введение субъекту, в частности субъекту-человеку, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В другом воплощении настоящего изобретения предложен способ лечения аутоиммунного заболевания, которое представляет собой дискоидную (кожную) волчанку, включающий введение субъекту, в частности субъекту-человеку, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В еще одном аспекте настоящего изобретения предложено применение соединения формулы (I) или его фармацевтически приемлемой соли для изготовления лекарственного средства для лечения аутоиммунного состояния, например системной красной волчанки (SLE), дискоидной (кожной) волчанки, синдрома Шегрена, гранулематоза Вегенера и других васкулитов, буллзного пемфигоида и пемфигуса,идиопатической тромбоцитопенической пурпуры (ITP), гигантоклеточного артериита, хронической идиопатической крапивницы с аутоантительным статусом и без аутоантительного статуса, гломерулонефрита, хронического отторжения трансплантата и ревматоидного артрита. В одном воплощении настоящего изобретения предложено применение соединения формулы (I) или его фармацевтически приемлемой соли для изготовления лекарственного средства для лечения аутоиммунного состояния, которое представляет собой хроническую идиопатическую крапивницу с аутоантительным статусом и без аутоантительного статуса. В другом воплощении настоящего изобретения предложено применение соединения формулы (I) или его фармацевтически приемлемой соли для изготовления лекарственного средства для лечения аутоиммунного состояния, которое представляет собой дискоидную (кожную) волчанку. В одном аспекте настоящего изобретения предложено соединение формулы (I) или его фармацевтически приемлемая соль для применения в лечении воспалительного заболевания, в которое вовлечены В-клетки. В другом аспекте настоящего изобретения предложен способ лечения воспалительного заболевания, в которое вовлечены В-клетки, включающий введение субъекту, в частности субъекту-человеку,нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В еще одном аспекте настоящего изобретения предложено применение соединения формулы (I) или его фармацевтически приемлемой соли для изготовления лекарственного средства для лечения воспалительного заболевания, в которое вовлечены В-клетки. Соединения формулы (I) могут иметь применение в лечении заболеваний, обусловленных ненадлежащей активацией тучных клеток, например аллергических и воспалительных заболеваний, в частности с кожными проявлениями. В одном аспекте настоящего изобретения предложено соединение формулы (I) или его фармацевтически приемлемая соль для применения в лечении заболевания, ассоциированного с ненадлежащей активацией тучных клеток. В другом аспекте настоящего изобретения предложен способ лечения заболевания, ассоциированного с ненадлежащей активацией тучных клеток, включающий введение субъекту, в частности субъектучеловеку, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В еще одном аспекте настоящего изобретения предложено применение соединения формулы (I) или его фармацевтически приемлемой соли для изготовления лекарственного средства для лечения заболевания, ассоциированного с ненадлежащей активацией тучных клеток. В одном аспекте настоящего изобретения предложено соединение формулы (I) или его фармацевтически приемлемая соль для применения в лечении воспалительного заболевания и/или аллергического расстройства, например хронического обструктивного заболевания легких (COPD), респираторного дистресс-синдрома взрослых (ARDS), астмы, тяжелой астмы, неспецифического язвенного колита, болезни Крона, бронхита, конъюнктивита, псориаза, склеродермы, дерматита, аллергии, ринита, кожной волчанки, аутоиммунных буллзных состояний, включая пемфигус и пемфигоид, мастоцитоза и анафилаксии. В другом аспекте настоящего изобретения предложен способ лечения воспалительного заболевания и/или аллергического расстройства, например хронического обструктивного заболевания легких (COPD),- 14022437 респираторного дистресс-синдрома взрослых (ARDS), астмы, тяжелой астмы, неспецифического язвенного колита, болезни Крона, бронхита, конъюнктивита, псориаза, склеродермы, дерматита, аллергии,ринита, кожной волчанки, аутоиммунных буллзных состояний, включая пемфигус и пемфигоид, мастоцитоза и анафилаксии, включающий введение субъекту, в частности субъекту-человеку, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В еще одном аспекте настоящего изобретения предложено применение соединения формулы (I) или его фармацевтически приемлемой соли для изготовления лекарственного средства для лечения воспалительного заболевания и/или аллергического расстройства, например хронического обструктивного заболевания легких (COPD), респираторного дистресс-синдрома взрослых (ARDS), астмы, тяжелой астмы,неспецифического язвенного колита, болезни Крона, бронхита, конъюнктивита, псориаза, склеродермы,дерматита, аллергии, ринита, кожной волчанки, аутоиммунных буллзных состояний, включая пемфигус и пемфигоид, мастоцитоза и анафилаксии. Соединения по настоящему изобретению можно также применять в комбинации с терапевтическими агентами других классов, например выбранными из противовоспалительных агентов, антихолинергических агентов (в частности антагонистов М 1/М 2/М 3 рецепторов), агонистов 2-адренорецептора, противоинфекционных агентов, таких как антибиотики или противовирусные средства, или антигистаминных агентов. В другом воплощении соединения по настоящему изобретению можно применять в комбинации с терапевтическими агентами других классов, которые известны в данной области для лечения аутоиммунных заболеваний, например с противоревматическими лекарственными средствами, модифицирующими заболевание, включая циклоспорин, метотрексат, сульфасалазин, преднизон, лефлуномид и хлорохин/гидрохлорохин, а также с биофармацевтическими агентами, такими как гуманизированные моноклональные антитела (mabs), включая, например, анти-TNF альфа блокаторы, такие как ремикад, энбрел и хумира, и терапевтические средства, снижающие количество В-клеток, такие как ритуксимаб и офатумумаб, анти-Blys mabs, такие как белилумаб. Таким образом, согласно изобретению предложена комбинация, содержащая соединение формулы(I) или его фармацевтически приемлемую соль вместе с одним или более другими терапевтически активными агентами, например выбранными из противовоспалительного агента, такого как кортикостероид или NSAID, антихолинергического агента, агониста 2-адренорецептора, противоинфекционного агента,такого как антибиотик или противовирусное средство, антигистаминного агента, противоревматического лекарственного средства, модифицирующего заболевание, и биофармацевтического агента, такого как гуманизированные моноклональные антитела (mabs), терапевтические средства, снижающие количество В-клеток, и анти-Blys mabs. Одно из воплощений изобретения охватывает комбинации, содержащие соединение формулы (I) или его фармацевтически приемлемую соль вместе с агонистом 2-адренорецептора, и/или антихолинергическим агентом, и/или ингибитором PDE-4, и/или антигистаминным агентом, и/или противоревматическим лекарственным средством, модифицирующим заболевание, и/или биофармацевтическим агентом. Одно из воплощений изобретения охватывает комбинации, содержащие один или два других терапевтических агента. Специалисту в данной области будет ясно, что в тех случаях, когда это подходит, другой(ие) терапевтический(ие) ингредиент(ы) могут быть использованы в форме соли, например соли щелочного металла или соли с амином, или в форме соли присоединения кислоты, или в форме пролекарства, или в виде эфиров, например низших алкиловых эфиров, или в виде сольватов, например гидратов, для оптимизации активности, и/или стабильности, и/или физических характеристик, таких как растворимость,терапевтического ингредиента. Будет также ясно, что в тех случаях, когда это подходит, терапевтические ингредиенты могут быть использованы в оптически чистой форме. Примеры агонистов 2-адренорецептора включают сальметерол (который может представлять собой рацемат или единственный энантиомер, например R-энантиомер), сальбутамол (который может представлять собой рацемат или единственный энантиомер, например R-энантиомер), формотерол (который может представлять собой рацемат или единственный диастереомер, например R,R-диастереомер),сальмефамол, фенотерол, кармотерол, этантерол, наминтерол, кленбутерол, пирбутерол, флербутерол,репротерол, бамбутерол, индакатерол, тербуталин и их соли, например ксинафоатная (1-гидрокси-2 нафталинкарбоксилатная) соль сальметерола, сульфатная соль или свободное основание сальбутамола или фумаратная соль формотерола. В одном из воплощений агонисты 2-адренорецептора являются длительно действующими агонистами 2-адренорецептора, например соединениями, которые обеспечивают эффективную бронходилатацию в течение примерно 12 ч или дольше. Другие агонисты 2-адренорецептора включают те из них, которые описаны в WO 02/066422, WO 02/070490, WO 02/076933, WO 03/024439, WO 03/072539, WO 03/091204, WO 04/016578, WO 04/022547,WO 04/037807, WO 04/037773, WO 04/037768, WO 04/039762, WO 04/039766, WO 01/42193 и WO 03/042160. Агонист 2-адренорецептора может быть в форме соли, образованной с фармацевтически приемлемой кислотой, выбранной из серной, соляной, фумаровой, гидроксинафтойной (например 1- или 3 гидрокси-2-нафтойной), коричной, замещенной коричной, трифенилуксусной, сульфаминовой, сульфаниловой, нафталинакриловой, бензойной, 4-метоксибензойной, 2- или 4-гидроксибензойной, 4 хлорбензойной и 4-фенилбензойной кислоты. Примеры кортикостероидов могут включать те из них, которые описаны в WO 02/088167, WO 02/100879, WO 02/12265, WO 02/12266, WO 05/005451, WO 05/005452, WO 06/072599 и WO 06/072600. Противовоспалительные кортикостероиды известны в данной области. Репрезентативные примеры включают флутиказона пропионат (смотри, например, патент США 4335121), флутиказона фуроат(смотри, например, патент США 7101866), беклометазона 17-пропионат, беклометазона 17,21 дипропионат, дексаметазон или его эфир, мометазон или его эфир (например мометазона фуроат), циклесонид, будесонид, флунисолид, метилпреднизон, преднизолон, дексаметазон и S-цианометиловый эфир 6,9-дифтор-11-гидрокси-16-метил-3-оксо-17-(2,2,3,3-тетраметилциклопропилкарбонил)оксиандроста-1,4-диен-17-карботиокислоты. Дополнительные примеры противовоспалительных кортикостероидов описаны в WO 02/088167, WO 02/100879, WO 02/12265, WO 02/12266, WO 05/005451, WO 05/005452, WO 06/072599 и WO 06/072600. Нестероидные соединения, оказывающие глюкокортикоидное агонистическое действие, которые могут обладать селективностью в отношении трансрепрессии относительно трансактивации, и которые могут быть полезны в комбинированной терапии, включают те из них, которые указаны в следующих опубликованных патентных заявках и патентах: WO 03/082827, WO 98/54159, WO 04/005229, WO 04/009017, WO 04/018429, WO 03/104195, WO 03/082787, WO 03/082280, WO 03/059899, WO 03/101932,WO 02/02565, WO 01/16128, WO 00/66590, WO 03/086294, WO 04/026248, WO 03/061651, WO 03/08277,WO 06/000401, WO 06/000398, WO 06/015870, WO 06/108699, WO 07/000334 и WO 07/054294. Примеры противовоспалительных агентов включают нестероидные противовоспалительные лекарственные средства (NSAID). Примеры NSAID включают натрия кромгликат, натриевую соль недокромила, ингибиторы фосфодиэстераз (PDE) (например теофиллин, ингибиторы PDE4 или смешанные ингибиторы PDE3/PDE4), антагонисты лейкотриенов, ингибиторы синтеза лейкотриенов (например монтелукаст), ингибиторы iNOS(индуцибельная синтаза оксида азота), ингибиторы триптазы и эластазы, антагонисты бета-2-интегрина и агонисты или антагонисты аденозиновых рецепторов (например агонисты аденозина 2 а), антагонисты цитокинов (например антагонисты хемокинов, такие как антагонист CCR3) или ингибиторы синтеза цитокинов, или ингибиторы 5-липоксигеназы. Ингибитор iNOS предпочтителен для перорального введения. Примеры ингибиторов iNOS включают ингибиторы iNOS, раскрытые в WO 93/13055, WO 98/30537,WO 02/50021, WO 95/34534 и WO 99/62875. Примеры ингибиторов CCR3 включают ингибиторы CCR3,раскрытые в WO 02/26722. Примеры ингибиторов PDE4 включают цис-4-циано-4-(3-циклопентилокси-4-метоксифенил)циклогексан-1-карбоновую кислоту, 2-карбометокси-4-циано-4-(3-циклопропилметокси-4-дифторметоксифенил)циклогексан-1-он и цис-[4-циано-4-(3-циклопропилметокси-4-дифторметоксифенил)циклогексан 1-ол], а также цис-4-циано-4-[3-(циклопентилокси)-4-метоксифенил]циклогексан-1-карбоновую кислоту(известную также как циломиласт) и ее соли, эфиры, пролекарства или физические формы (см., например, патент США 5552438). Другие соединения включают AWD-12-281 от Elbion (Hofgen, N. et al. 15th EFMC Int 25 Symp MedByk-Gulden; пумафентрин, (-)-пара-[(4aR,10bS)-9-этокси-1,2,3,4,4 а,10b-гексагидро-8-метокси-2-метилбензо[с][1,6]нафтиридин-6-ил]-N,N-диизопропилбензамид, который является смешанным ингибиторомPDE3/PDE4, который был получен и опубликован Byk-Gulden, теперь Altana; арофиллин, разрабатываемый Almirall-Prodesfarma; VM554/UM565 от Vernalis; или Т-440 (Tanabe Seiyaku; Fuji, К. et al. J Pharmacol Exp Ther,1998, 284(1): 162) и Т 2585. Дополнительные соединения раскрыты в опубликованных международных патентных заявках WO 04/024728 (Glaxo Group Ltd), WO 04/056823 (Glaxo Group Ltd) и WO 04/103998 (Glaxo Group Ltd). Примерами антихолинергических агентов являются соединения, которые действуют как антагонисты мускариновых рецепторов, в частности соединения, которые являются антагонистами M1 или М 3 рецепторов, двойственными антагонистами M1/М 3 или М 2/М 3 рецепторов или пан-антагонистами М 1/М 2/М 3 рецепторов. Типичные соединения для введения посредством ингаляции включают ипратропий (например, в виде бромида, CAS 22254-24-6, продаваемый под названием Atrovent), окситропий (например в виде бромида, CAS 30286-75-0) и тиотропий (например в виде бромида, CAS 136310-93-5, продаваемый под названием Spiriva). Представляют интерес также реватропат (например, в виде гидробромида, CAS 262586-79-8) и LAS-34273, который раскрыт в WO 01/04118. Типичные соединения для перорального введения включают пирензепин (CAS 28797-61-7), дарифенацин (CAS 133099-04-4, или CAS 133099-07-7 для гидробромида, продаваемого под названием Enablex), оксибутинин (CAS 5633-20-5,продаваемый под названием Ditropan), теродилин (CAS 15793-40-5), толтеродин (CAS 124937-51-5 илиCAS 124937-52-6 для тартрата, продаваемого под названием Detrol), отилоний (например в виде бромида,CAS 26095-59-0, продаваемый под названием Spasmomen), троспия хлорид (CAS 10405-02-4) и солифенацин (CAS 242478-37-1 или CAS 242478-38-2 для сукцината, также известного как YM-905 и продаваемого под названием Vesicare). Другие антихолинергические агенты включают соединения, которые раскрыты в заявке на патент США 60/487981, в том числе, например: Дополнительные антихолинергические агенты включают соединения, которые раскрыты в заявке на патент США 60/511009, в том числе, например: В одном из воплощений изобретения предложена комбинация, содержащая соединение формулы (I) или его фармацевтически приемлемую соль вместе с Н 1-антагонистом. Примеры Н 1-антагонистов включают, без ограничения, метапирилен, деслоратадин, амелексанокс, астемизол, азатадин, азеластин, акривастин, бромфенирамин, цетиризин, левоцетиризин, эфлетиризин, хлофенирамин, клемастин, циклизин,каребастин, ципрогептадин, карбиноксамин, дескарбоэтоксилоратидин, доксиламин, диметинден, эбастин, эпинастин, эфлетризин, фексрфенадин, гидроксизин, кетотифен, лоратидин, левокабастин, мизоластин, меквитазин, миансерин, ноберастин, меклизин, норастемизол, олопатадин, пикумаст, пириламин,прометазин, терфенадин, трипеленнамин, темеластин, тримепразин и трипролидин, в частности цетиризин, левоцетиризин, эфлетиризин и фексофенадин. В еще одном воплощении данного изобретения предложена комбинация, содержащая соединение формулы (I) или его фармацевтически приемлемую соль вместе с антагонистом (и/или обратным агонистом) Н 3. Примеры антагонистов НЗ включают, например те соединения, которые описаны в WO 2004/035556 и в WO 2006/045416. Другие антагонисты гистаминовых рецепторов, которые могут быть использованы в комбинации с соединениями формулы (I) или их фармацевтически приемлемыми солями, включают антагонисты (и/или обратные агонисты) рецептора Н 4, например соединения, раскрытые в Jablonowski etal., J. Med. Chem. 46:3957-3960 (2003). В одном из воплощений предложена комбинация, содержащая соединение формулы (I) или его фармацевтически приемлемую соль вместе с кортикостероидом. В другом воплощении предложена комбинация, содержащая соединение формулы (I) или его фармацевтически приемлемую соль вместе сNSAID. В другом воплощении предложена комбинация, содержащая соединение формулы (I) или его фармацевтически приемлемую соль вместе с антихолинергическим агентом. В другом воплощении предложена комбинация, содержащая соединение формулы (I) или его фармацевтически приемлемую соль вместе с агонистом 2-адренорецептора. В другом воплощении предложена комбинация, содержащая соединение формулы (I) или его фармацевтически приемлемую соль вместе с противоинфекционным агентом. В другом воплощении предложена комбинация, содержащая соединение формулы (I) или его фармацевтически приемлемую соль вместе с антигистаминным средством. В другом воплощении предложена комбинация, содержащая соединение формулы (I) или его фармацевтически приемлемую соль вместе с противоревматическим лекарственным средством, модифицирующим заболевание. В другом воплощении предложена комбинация, содержащая соединение формулы (I) или его фармацевтически приемлемую соль вместе с биофармацевтическим агентом. Перед тем, как вводить пациенту, соединение формулы (I) обычно, но не обязательно, готовят в виде фармацевтической композиции. Соответственно, в еще одном аспекте изобретение относится к фармацевтическим композициям, содержащим соединение формулы (I) или его фармацевтически приемлемую соль и один или более фармацевтически приемлемых носителей, разбавителей или эксципиентов. Фармацевтические композиции, содержащие соединение формулы (I), могут быть приготовлены и упакованы в нефасованной форме, из которой безопасное и эффективное количество соединения формулы (I) может быть извлечено и затем введено пациенту, например в виде порошка или сиропа. Альтернативно фармацевтические композиции, содержащие соединение формулы (I), могут быть приготовлены и упакованы в стандартной лекарственной форме, где каждая физически дискретная стандартная единица содержит безопасное и эффективное количество соединения формулы (I). Фармацевтические композиции, содержащие соединение формулы (I), могут быть также приготовлены и упакованы в виде субстандартных лекарственных форм, где две или более суб-стандартных лекарственных форм обеспечивают стандартную лекарственную форму. Фармацевтические композиции, содержащие соединение формулы (I), приготовленные в стандартной лекарственной форме, обычно содержат от примерно 0,1 до 99,9 мас.% соединения формулы (I) в зависимости от типа препарата. Кроме того, фармацевтические композиции, содержащие соединение формулы (I), возможно могут дополнительно содержать один или более дополнительных фармацевтически активных соединений. Используемое в данном документе выражение "фармацевтически приемлемый эксципиент" означает фармацевтически приемлемое вещество, композицию или носитель, включаемые в фармацевтические композиции в предоставленной форме или консистенции. Каждый эксципиент должен быть совместимым с другими ингредиентами фармацевтической композиции при смешивании, чтобы избежать взаимодействий, которые могут существенно снизить эффективность соединения формулы (I) соли при введении пациенту, и взаимодействий, которые могут привести к получению композиций, которые не являются фармацевтически приемлемыми. Кроме того, каждый эксципиент непременно должен иметь достаточно высокую чистоту, чтобы быть фармацевтически приемлемым. Композиции, содержащие соединение формулы (I) или его фармацевтически приемлемую соль и один или более фармацевтически приемлемых носителей, разбавителей или эксципиентов, обычно будут предоставлять в лекарственной форме, приготовленной с возможностью введения пациенту желаемым путем введения. Например, лекарственные формы включают лекарственные формы, приготовленные с возможностью (1) перорального введения, такие как таблетки, капсулы, каплетки, пилюли, пастилки,порошки, сиропы, эликсиры, суспензии, растворы, эмульсии, саше и облатки; (2) местного трансдермального введения, такие как кремы, мази, лосьоны, растворы, пасты, спреи, пенки и гели; (3) введения ингаляцией, такие как аэрозоли и растворы; (4) интраназального введения, такие как растворы и спреи;(5) парентерального введения, такие как стерильные растворы, суспензии и порошки для разведения; и(6) интравитреального введения. В одном из воплощений предложена лекарственная форма, приготовленная с возможностью местного трансдермального введения. Понятно, что лекарственные формы, приготовленные с возможностью перорального введения,обычно применяют для лечения аутоиммунного заболевания, включая ревматоидный артрит и системную красную волчанку, хронической идиопатической крапивницы и гематологических злокачественных новообразований. Лекарственные формы, приготовленные с возможностью местного введения в кожу,обычно применяют для лечения атопического дерматита, псориаза и состояний хронической и острой крапивницы, и аутоиммунных буллзных состояний, включая пемфигус и пемфигоид. Лекарственные формы, приготовленные с возможностью введения ингаляцией или перорального введения, обычно применяют для лечения COPD, а лекарственные формы, приготовленные с возможностью интраназального введения, обычно применяют для лечения аллергического ринита. Подходящие фармацевтически приемлемые эксципиенты будут варьировать в зависимости от выбранной конкретной лекарственной формы. Кроме того, подходящие фармацевтически приемлемые эксципиенты могут быть выбраны с учетом конкретной функции, которую они могут выполнять в композиции. Например, некоторые фармацевтически приемлемые эксципиенты могут быть выбраны ввиду того,что они способны облегчать изготовление однородных лекарственных форм. Некоторые фармацевтически приемлемые эксципиенты могут быть выбраны ввиду того, что они способны облегчать изготовление стабильных лекарственных форм. Некоторые фармацевтически приемлемые эксципиенты могут быть выбраны ввиду того, что они способны способствовать переносу или транспорту соединения формулы (I) сразу после введения пациенту из одного органа или участка тела в другой орган или участок тела. Некоторые фармацевтически приемлемые эксципиенты могут быть выбраны ввиду того, что они способны улучшать соблюдение пациентом режима и схемы лечения. Подходящие фармацевтически приемлемые эксципиенты включают следующие типы эксципиентов: разбавители, наполнители, связывающие вещества, разрыхлители, смазывающие вещества, скользящие вещества, гранулирующие агенты, покровные агенты, увлажняющие агенты, растворители, сорастворители, суспендирующие агенты, эмульгаторы, подсластители, корригенты, агенты, маскирующие вкус, красители, антислеживатели, увлажнители, хелатирующие агенты, пластификаторы, агенты, повышающие вязкость, антиоксиданты, консерванты, стабилизаторы, поверхностно-активные вещества и буферные агенты. Специалисту известно, что некоторые фармацевтически приемлемые эксципиенты могут выполнять более чем одну функцию и могут выполнять альтернативные функции в зависимости от того,насколько много эксципиента присутствует в композиции и какие другие эксципиенты присутствуют в композиции. Специалисты обладают необходимыми знаниями и способны выбрать подходящие фармацевтически приемлемые эксципиенты в соответствующих количествах для использования в данном изобретении. Кроме того, имеется большое количество доступных специалистам ресурсов, в которых описаны фармацевтически приемлемые эксципиенты, и которые могут быть полезны при выборе подходящих фармацевтически приемлемых эксципиентов. Примеры включают Remington's Pharmaceutical Sciences (MackHandbook of Pharmaceutical Additives (Gower Publishing Limited) и The Handbook of Pharmaceutical Excipients (the American Pharmaceutical Association and the Pharmaceutical Press). Фармацевтические композиции, содержащие соединения формулы (I), изготавливают с использованием методов и способов, известных специалистам в данной области техники. Некоторые способы,обычно используемые в данной области, описаны в Remington's Pharmaceutical Sciences (Mack PublishingCompany). Пероральные твердые лекарственные формы, такие как таблетки, обычно будут содержать один или более фармацевтически приемлемых эксципиентов, которые могут, например, обеспечивать удовлетворительные технологические характеристики и характеристики прессования или могут придавать таблетке дополнительные физические свойства. Такие фармацевтически приемлемые эксципиенты могут быть выбраны из разбавителей, связывающих веществ, скользящих веществ, смазывающих веществ, разрыхлителей, красителей, корригентов, подсластителей, полимеров, восков или других модулирующих растворимость веществ. Лекарственные формы для местного введения на кожу могут быть, например, в форме мазей, кремов, лосьонов, глазных мазей, глазных капель, ушных капель, импрегнированных повязок и аэрозолей и могут содержать подходящие традиционные добавки, включая, например, консерванты, растворители,способствующие всасыванию лекарственного средства, и смягчающие вещества в мазях и кремах. Такие местные композиции могут также содержать совместимые традиционные носители, например основы для кремов или мазей, и этанол или олеиловый спирт для лосьонов. Содержание таких носителей в композиции может составлять от примерно 1% до примерно 98 мас.%; чаще оно будет составлять до примерно 80 мас.%. Лекарственные формы для парентерального введения обычно будут содержать жидкие среды, в ча- 20022437 стности внутривенные жидкие среды, т.е. стерильные растворы простых химических веществ, таких как сахара, аминокислоты или электролиты, которые легко переносятся кровеносной системой и усваиваются. Такие жидкие среды обычно готовят с использованием воды для инъекций, соответствующей требованиям USP (Фармакопея США). Жидкие среды, обычно используемые для внутривенного (в.в.) введения, раскрыты в Remington, The Science and Practice of Pharmacy, (Lippincott WilliamsWilkins). pH таких в.в. жидких сред может варьировать и обычно может составлять от 3,5 до 8, как известно в данной области. Лекарственные формы для назального введения или введения ингаляцией для удобства могут быть приготовлены в виде аэрозолей, растворов, капель, гелей или сухих порошков. Лекарственные формы для местного введения в носовую полость (назального введения) включают аэрозольные препараты под давлением и водные препараты, вводимые в нос нагнетательным насосом. Препараты, которые не нагнетаются и приготовлены с возможностью назального введения, представляют особый интерес. Подходящие для этой цели композиции содержат воду в качестве разбавителя или носителя. Водные композиции для введения в нос могут содержать традиционные эксципиенты, такие как буферные агенты, агенты, модифицирующие тоничность, и т.п. Водные композиции можно также вводить в нос распылением. Лекарственные формы для назального введения предоставляют в дозирующих устройствах. Лекарственная форма может быть предоставлена в виде жидкого препарата для доставки из жидкостного дозатора, имеющего дозирующее сопло или дозирующую насадку, через которое(ую) отмеренная доза жидкой композиции распыляется, когда пользователь нажимает на насосный механизм жидкостного дозатора. Такие жидкостные дозаторы, как правило, снабжены резервуаром для множества отмериваемых доз жидкой композиции, причем эти дозы распыляются при последовательных срабатываниях насоса. Дозирующее сопло или насадка может иметь конфигурацию, подходящую для введения в ноздри пользователя для впрыскивания жидкого препарата в носовую полость. В одном из воплощений жидкостной дозатор является дозатором общего типа, который описан и проиллюстрирован в WO 2005/044354A1. Дозатор имеет корпус, в котором находится выпускающее жидкость устройство с нагнетательным насосом,установленным на контейнере, в котором находится жидкая композиция. Корпус имеет по меньшей мере один приводимый в действие пальцами боковой рычаг, который двигается внутрь относительно корпуса,перемещая контейнер вверх в корпусе посредством эксцентрика и заставляя насос сжимать и нагнетать отмеренную дозу композиции из ствола насоса через назальное сопло корпуса. Особенно предпочтительным жидкостным дозатором является дозатор общего типа, проиллюстрированный на фиг. 30-40 вWO 2005/044354. Аэрозольные композиции для введения, например, ингаляцией, могут содержать раствор или тонкодисперсную суспензию активного вещества в фармацевтически приемлемом водном или неводном растворителе. Аэрозольные композиции могут быть представлены в однократной дозе или в многократных дозах в стерильной форме в герметичном контейнере, который может иметь форму картриджа или который можно дозаправлять для применения с использованием распылителя или ингалятора. Альтернативно, герметичный контейнер может представлять собой унитарное дозирующее устройство, такое как назальный ингалятор однократной дозы или аэрозольный дозатор, оснащенный отмеривающим клапаном (ингалятор отмеренной дозы), который предназначен для утилизации сразу после того, как содержимое контейнера израсходовано. В тех случаях, когда лекарственная форма представляет собой аэрозольный дозатор, такой дозатор предпочтительно содержит подходящий пропеллент под давлением, например сжатый воздух, диоксид углерода или органический пропеллент, такой как гидрофторуглерод (HFC). Подходящие HFC пропелленты включают 1,1,1,2,3,3,3-гептафторпропан и 1,1,1,2-тетрафторэтан. Аэрозольные лекарственные формы могут также иметь форму насоса-распылителя. Аэрозоль под давлением может содержать раствор или суспензию активного соединения. Для этого может потребоваться включение в композицию дополнительных эксципиентов, например сорастворителей и/или поверхностно-активных веществ, для улучшения дисперсионных характеристик и гомогенности суспензионных препаратов. Препараты-растворы также могут требовать добавления сорастворителей, таких как этанол. Другие эксципиенты-модификаторы также могут быть включены в состав для улучшения, например, стабильности, и/или вкуса, и/или гранулометрических характеристик (количество и/или профиль) препарата. Для фармацевтических композиций, подходящих для введения ингаляцией и/или приготовленных с возможностью введения ингаляцией, предпочтительная фармацевтическая композиция представляет собой ингалируемую сухую порошковую композицию. Такая композиция может содержать порошковую основу, такую как лактоза, глюкоза, трегалоза, маннит или крахмал, соединение формулы (I) (предпочтительно в форме измельченных частиц, например в микронизированной форме) и возможно модификатор свойств, такой как L-лейцин или другая аминокислота, октаацетат целлобиозы и/или металлические соли стеариновой кислоты, такие как стеарат магния или кальция. Предпочтительно, ингалируемая сухая порошковая композиция содержит сухую порошковую смесь лактозы и соединения формулы (I). Лактоза представляет собой предпочтительно гидрат лактозы, например моногидрат лактозы, и/или предпочтительно лактозу сорта для ингаляций, и/или лактозу высшего сорта. Предпочтительно размер частиц лак- 21022437 тозы характеризуется тем, что 90% или более (по массе или по объему) частиц лактозы имеют диаметр менее 1000 мкм (микрометров) (например 10-1000 мкм, например 30-1000 мкм), и/или 50% или более частиц лактозы имеют диаметр менее 500 мкм (например 10-500 мкм). Более предпочтительно размер частиц лактозы характеризуется тем, что 90% или более частиц лактозы имеют диаметр менее 300 мкм(например 10-300 мкм, например 50-300 мкм), и/или 50% или более частиц лактозы имеют диаметр менее 100 мкм. Возможно, размер частиц лактозы характеризуется тем, что 90% или более частиц лактозы имеют диаметр менее 100-200 мкм, и/или 50% или более частиц лактозы имеют диаметр менее 40-70 мкм. Наиболее важно, предпочтительно, чтобы от примерно 3 до примерно 30% (например примерно 10%) (по массе или по объему) частиц имели диаметр менее 50 мкм или менее 20 мкм. Например, без ограничения, подходящей лактозой сорта для ингаляций является лактоза Е 9334 (10% тонкодисперсных фракций) (Borculo Domo Ingredients, Hanzeplein 25, 8017 JD Zwolle, Netherlands). Возможно, в частности для сухих порошковых ингаляционных композиций, фармацевтическая композиция для введения ингаляцией может быть заключена во множество герметично закрытых дозовых контейнеров (например, содержащих сухую порошковую композицию), размещенных в продольном направлении на полоске или на ленте внутри подходящего ингаляционного устройства. Контейнер разрывается или открывается путем снятия предохранительной пленки при срабатывании, и доза сухой порошковой композиции может быть введена ингаляцией с помощью устройства, такого как устройствоDISKUS, продаваемое фирмой GlaxoSmithKline. Ингаляционное устройство DISKUS описано, например, в GB 2242134 А, и в этом устройстве по меньшей мере один контейнер для фармацевтической композиции в форме порошка (контейнер или контейнеры, предпочтительно представляющие собой множество герметично закрытых дозовых контейнеров, размещенных в продольном направлении на полоске или на ленте) зафиксирован между двумя элементами, соединенными друг с другом с возможностью отсоединения друг от друга, и это устройство содержит средство определения местоположения открытия указанного(ых) контейнера или контейнеров, средство для отсоединения друг от друга указанных элементов в открывающем положении для открытия контейнера и выпускное отверстие, соединяющееся с открытым контейнером, через которое пользователь может вдыхать фармацевтическую композицию в порошковой форме из открытого контейнера. Композиция по изобретению, содержащая соединение формулы (I), для интраназального введения может быть также приготовлена с возможностью введения посредством инсуффляции в виде сухого порошкового препарата. Для лекарственных форм для введения ингаляцией, когда соединение формулы (I) присутствует в виде сухого порошка или в суспензии, тогда оно предпочтительно находится в форме измельченных частиц. Предпочтительно, форму измельченных частиц получают путем микронизации. Предпочтительный размер частиц измельченного (например микронизированного) соединения или соли определяется значением D50 примерно от примерно 0,5 до примерно 10 мкм (измеряют, например, методом лазерной дифракции). Понятно, что когда соединения по настоящему изобретению вводят в комбинации с другими терапевтическими агентами, которые обычно вводят ингаляционным, внутривенным, пероральным, местным или интраназальным путем, тогда полученную фармацевтическую композицию можно вводить таким же путем. Композиция может содержать от 0,1 до 100 мас.%, например от 10 до 60 мас.% активного вещества,в зависимости от способа введения. Композиция может содержать от 0 до 99 мас.%, например от 40% до 90 мас.% носителя в зависимости от способа введения. Соединения формулы (I) удобно вводить в количествах, например, от 1 мкг до 2 г. Точная доза безусловно будет зависеть от возраста и состояния пациента и конкретного выбранного пути введения. Методы биологического тестирования Соединения могут быть протестированы в отношении активности in vitro в соответствии со следующими анализами: 1. Основная ферментативная активность SYK. 3 мкл лизата SYK, 16-кратно разведенного в буфере для анализа (20 мМ TRIS, рН 7,4, 0,01% BSA(бычий сывороточный альбумин), 0,1% Pluronic F-68) добавляли в лунки, содержащие 0,1 мкл соединения в различных концентрациях или носитель DMSO (конечная концентрация 1,7%) в малообъемном 384-луночном черном планшете Greiner. После предварительного инкубирования в течение 15 мин при комнатной температуре реакцию инициировали добавлением 3 мкл реагента-субстрата, содержащего пептид Y7 Sox (Invitrogen, каталожный номер KNZ3071, конечная концентрация 5 мкМ), АТР (аденозинтрифосфат) (конечная концентрация 35 мкМ) и MgCl2 (конечная концентрация 10 мМ) в буфере для анализа. Реакционную смесь инкубировали при комнатной температуре, затем измеряли интенсивность флуоресценции (ех 360/em 485) на планшет-ридере Envision (Perkin Elmer Life Sciences, Waltham, MA,USA) через 15 минут и 55 мин после добавления субстрата. Соединения приведенных примеров тестировали, по существу, как описано выше, и было установлено, что они имеют pIC50 от 5,5 до 7,5. Соединения примеров 1-8 тестировали, по существу, как описано выше, и было установлено, что они имеют средние значения pIC50 в этом анализе 6,0. Соединение примера 2 тестировали, по существу, как описано выше, и было установлено, что оно имеет pIC50 7,1. Специалистам в данной области известно, что анализы на связывание in vitro и анализы на клетках в отношении функциональной активности допускают варьируемость. Соответственно, следует иметь в виду, что значения pIC50, указанные выше, являются только иллюстративными. Приготовление лизата SYK 1. Приготовление лизатов клеток Ramos. В-клетки Ramos (В-клетки лимфомы Беркитта человека, клон 296.4 С 10, АТСС) культивировали в суспензии в ростовой среде (RPMI-1640, Sigma; дополненная 2 мМ L-глутамина, Gibco; 10 мМ Hepes,Sigma; 1 мМ пирувата натрия, Sigma; 10% об./об. инактивированной нагреванием FCS (фетальная телячья сыворотка), Gibco). Клетки выращивали в культуральных камерах Corning Cellstack (6360 см 2) объемом 1 л и осуществляли ежесуточный мониторинг жизнеспособности и плотности клеток. Поддерживали плотность клеток 1,5106/мл и жизнеспособность 92%. Крупномасштабное продуцирование выполняли из больших промежуточных аликвот (LSIA) замороженных клеток Ramos, и было обнаружено, что это подуцирование дает более высокую воспроизводимость, чем продуцирование из непрерывно растущей культуры клеток Ramos. Клетки, продуцированные в большом количестве, получали в четыре стадии: 1. Оттаивание LSIA в 1 камере Cellstack; 2. Распределение культуры по 4 камерам Cellstack; 3. Распределение из 4 в 12 камер Cellstack; 4. Сбор из всех 12 камер Cellstack. Камеры Cellstack харвестировали в 2 л центрифужных флаконах с использованием центрифуги Sorvall Mistral, 2000 об/мин, 10 мин, 4 С (2 л 2106 клеток/мл = общее число клеток 4109).(Примечание для масштабирования клеток: если плотность клеток превышала 1,8106/мл или жизнеспособность падала ниже 90%, то препарат Syk, полученный после стимуляции, вероятно, будет иметь более низкую активность.) Кроме того, повторный пассаж клеток Ramos по всей вероятности оказывает отрицательное влияние на активность Syk, когда выращивание клеток выполняют в больших масштабах (вероятно, это не относится к культурам в небольших масштабах), поэтому рекомендуется всегда использовать LSIA и модульное масштабирование для крупномасштабных препаратов. 2. Стимуляция клеток Ramos анти-lgM антителом для продуцирования Syk и получения лизатов. Клетки стимулировали при 20106 клеток/мл с использованием 15 мкг/мл (конечная концентрация) анти-lgM антитела. После харвестирования (как описано выше) в сумме 4109 клеток ресуспендировали в 180 мл предварительно подогретого (37 С) DPBS в центрифужном флаконе Corning на 500 мл. В каждый 500-миллилитровый центрифужный флакон добавляли 20 мл анти-lgM антитела в количестве 150 мкг/мл (рабочий исходный раствор, приготовленный в DPBS, предварительно подогретом до 37 С). После добавления анти-lgM антитела клетки инкубировали в течение точно 5 мин при 37 С. После стимуляции в течение 5 мин в каждый флакон добавляли 300 мл охлажденного на льду DPBS для остановки стимуляции (температура падает до примерно 12 С), затем клетки центрифугировали при 2000 об/мин(центрифуга Sorvall Legend RT+, предварительное охлаждение до 4 С). Клетки промывали посредством ресуспендирования в охлажденном на льду DPBS и центрифугирования, как указано выше. Клеточный остаток после центрифугирования затем подвергали лизису в охлажденном на льду буфере для лизиса,содержащем 1% Triton-x-100 в соотношении 150 мкл/1107 клеток (т.е. 48 мл буфера для лизиса). После добавления буфера для лизиса клетки пипетировали вверх и вниз и выдерживали на льду в течение 15 мин. Осветленный лизат затем получали центрифугированием (Sorvall Evolution RC (ротор SLA-1500,примерно 20000 g (примерно 14500 об/мин), 45 мин, 4 С). Лизат разделяли на аликвоты, мгновенно замораживали на сухом льду и хранили при -80 С до анализа. Материалы Клетки Ramos: В-клетки человеческой лимфомы Беркитта, клон 296.4 С 10 (АТСС). Ростовая среда: 500 мл RPMI, 10% инактивированной нагреванием FCS, 2 мМ L-глутамина, 2 мМHEPES: 1M, Sigma H0887, хранение СТ 5637. Пируват натрия: 100 мМ, Sigma S8636, хранение СТ 7741. Анти-lgM антитело: антитело козы против IgM человека Fab')2-фрагменты) в PBS, Invitrogen, изготовленный по заказу препарат (не содержащий азиды и имеющий низкие уровни эндотоксинов). Каталожный номер NON0687, лот 1411913, 2,74 мг/мл.DPBS: Забуференный фосфатами физиологический раствор, модифицированный по Дульбекко,- 23022437Sigma D8537. Буфер для лизиса: 50 мМ TRIS рН 7,5 + 150 мМ NaCl + 1% Triton-X-100 + 2 мМ EGTA + коктейли ингибиторов в разведении 1:100 (коктейль ингибиторов фосфатазы, набор II, номер по каталогу Calbiochem 524625, и коктейль ингибиторов протеаз, набор V, номер по каталогу Calbiochem 539137).EGTA (этиленгликольтетрауксусная кислота): Sigma E4378. Добавляют твердой прямо в буфер. 2. Анализы в отношении активности В-клеток. 2.1. Анализ в отношении pErk в клетках Ramos. Принцип анализа В-клетки Ramos (В-клетки человеческой лимфомы Беркитта) стимулируют с использованием антиlgM антитела. Это вызывает рекрутмент Syk к В-клеточному рецептору. Последующее аутофосфорилирование Syk приводит к инициации сигнального каскада и, в результате, к активации В-клеток посредством Erk МАР-киназного пути (Erk MAP - митоген-активируемая протеинкиназа Erk). В результате, Erk фосфорилируется, и после лизиса клеток ее детектируют посредством анализа иммунного захвата. Стимуляция клеток Ramos анти-lgM антителом Клетки высевали при плотности 2,5105 на лунку в объеме 25 мкл среды для анализа (среда RPMI,содержащая 10% инактивированной нагреванием фетальной телячьей сыворотки, 1% L-глутамина) в 96 луночные полипропиленовые планшеты с V-образными лунками. Добавляли 25 мкл соответствующим образом разведенного раствора соединения, и планшет инкубировали в течение 30 мин при 37 С в атмосфере с 5% СО 2. Клетки стимулировали 5 мкл Fab'2-фрагментов антитела козы против IgM человека (конечная концентрация 5 мкг/мл) в течение 7 мин при 37 С. Клетки подвергали лизису путем добавления 55 мкл 2 лизирующего буфера RIPA в течение 2 ч при 4 С. В этой точке лизат может быть заморожен при -80 С.MSD-анализ pErk 50 мкл клеточного лизата переносили в 96-луночный планшет MSD, покрытый захватывающим антителом против pErk1/2 (Thr/Tyr: 202/204; 185/187), и инкубировали в течение 16 ч при 4 С или в течение 3 ч при комнатной температуре. Планшет промывали и добавляли детектирующее антитело против рЕгк(25 мкл на лунку) в течение 1 ч при комнатной температуре. Его извлекали, добавляли 150 мкл MSDбуфера для считывания и измеряли полученный электрохемилюминисцентный сигнал. Приготовление соединения Соединение готовили в виде 10 мМ исходного раствора в DMSO, и готовили серию разведений вDMSO в виде 9 последовательных 5-кратных разведений. Эти последовательные разведения дополнительно разбавляли средой для анализа в соотношении 1:100 с получением диапазона конечных концентраций, предназначенных для тестирования, от 510-5 до 2,5610-11 М. Разведения соединения готовили с использованием автоматических роботизированных систем пипетирования Biomek 2000 и Biomek Nx. Соединения примеров 1-4, 6, 7, 9, 10-12, 15-17, 19, 20, 22, 24, 26-39, 41, 45, 46, 48 и 49 тестировали,по существу так, как описано выше, и было обнаружено, что они имеют средние значения pIC50 от 5,2 до 6,8. Соединения примеров 1, 2, 3 и 4 тестировали, по существу, так, как описано выше, и было обнаружено, что они имеют средние значения pIC50 в этом анализе 6,0. Специалистам в данной области известно, что анализы в отношении связывания in vitro и анализы на клетках в отношении функциональной активности допускают варьируемость. Соответственно, следует иметь в виду, что значения для pIC50, перечисленные выше, являются только иллюстративными. Промежуточные соединения и примеры Сведения общего характера: все температуры даны в С; ВОС означает трет-бутоксикарбонил; ВОС 2 О означает ди-трет-бутилдикарбонат;HCl означает соляная кислота; НОВТ означает 1-гидроксибензотриазол; ВЭЖХ означает высокоэффективная жидкостная хроматография;PEPPSI означает "Pyridine-Enhanced Precatalyst Preparation Stabilization and Initiation" (катализатор на основе Pd, представляющий собой комплекс Pd с N-гетероциклическим карбеном);Pd/C означает палладий на углероде;THF означает тетрагидрофуран; ТСХ/тсх означает тонкослойная хроматография. 1 Н ЯМР спектры регистрировали на спектрометре Bruker DPX 400MHz с использованием тетраметилсилана в качестве стандарта. Масс-спектры регистрировали на спектрометре SHIMADZU ЖХ/МС 2010 EV с использованием электрораспылительной ионизации в режиме регистрации положительных/отрицательных ионов. Образцы готовили в 100% метаноле, и образцы впрыскивали через порт прямой инжекции. Методы хроматографии на диоксиде кремния включают либо автоматизированные (Flashmaster, Biotage SP4) методы, либо методы мануальной хроматографии на предварительно упакованных картриджах (SPE) или на вручную упакованных флэш-колонках. Если название коммерческого поставщика указано после названия соединения или реагента, например "соединение X (Aldrich)" или "соединение X/Aldrich", то это означает, что соединение X может быть получено от коммерческого поставщика, такого как названный коммерческий поставщик. Аналогично, если приведена ссылка на литературный источник информации или патент после названия соединения, например соединение Y (ЕР 0123456), то это означает, что соединение может быть получено, как описано в названном источнике информации. Названия вышеупомянутых соединений,Примеры получения которых приведены, получены с использованием программы присвоения названий соединениям "ACD Name Pro 6.02". Общий метод ВЭЖХ: ВЭЖХ проводили на колонке X-Bridge C18 2504,6 мм, 5 мкм при 267 нм. Скорость потока через колонку составляла 1 мл/мин, и используемыми растворителями были 0,1% TFA в воде ВЭЖХ-сорта (А) и 0,1% TFA в MeCN градиентного сорта (В) с впрыскиваемым объемом 10 мкл. Образцы готовили с содержанием 250 м.д. (миллионные доли) в смеси вода:MeCN. Метод является таким, как описано ниже. Общие методы ЖХ/МС: Метод А. ЖХ/МС проводили на колонке X-bridge C18 1504,6 мм, 5 мкм. УФ-детектирование выполняли при длине волны максимального поглощения (указано на индивидуальных спектрах). Масс-спектры регистрировали на спектрометре SHIMADZU LC/MS 2010EV с использованием электрораспылительной ионизации в режиме регистрации положительных/отрицательных ионов. Скорость потока через колонку составляла 1 мл/мин, и используемыми растворителями были 0,1% муравьиная кислота в воде ВЭЖХсорта (А) и 0,1% муравьиная кислота в MeCN ВЭЖХ-сорта (В), с впрыскиваемым объемом 10 мкл. Образцы готовили с содержанием 250 м.д. в MeCN + вода. Метод является таким, как описано ниже. Метод В. ЖХ/МС проводили на колонке X-bridge C18 1504,6 мм, 5 мкм. УФ-детектирование выполняли при длине волны максимального поглощения (указано на индивидуальных спектрах). Масс-спектры регистрировали на спектрометре SHIMADZU LC/MS 2010 EV с использованием электрораспылительной ионизации в режиме регистрации положительных/отрицательных ионов. Скорость потока через колонку составляла 1 мл/мин, и используемыми растворителями были 0,05% ацетат аммония в воде ВЭЖХ-сорта Метод С. ЖХ/МС (Aglient) проводили на колонке HALO C18 (50 мм 4,6 мм в.д. (внутренний диаметр), диметр частиц сорбента 2,7 мкм) при 40 градусах Цельсия, элюируя 0,1% (об./об.) раствором муравьиной кислоты в воде (Растворитель А) и 0,1% (об./об.) раствором муравьиной кислоты в ацетонитриле (Растворитель В), используя следующий градиент элюирования: 0-1 мин 5% В, 1-2,01 мин 95% В, 2,01-2,5 мин 5% В при скорости потока 1,8 мл/мин. Уф-детектирование представляло собой суммированный сигнал при длине волны: 214 нм и 254 нм. МС: источник ионов: ЭРИ (электрораспылительная ионизация); скорость газа-носителя: 10 л/мин; давление небулайзера: 45 фунт/кв.дюйм (300,5 кПа); температура газаносителя газа: 330 С; напряжение на капилляре: 4000 В. Метод препаративной ВЭЖХ, использованный для очистки соединения примера 5. Препаративную ВЭЖХ проводили на Waters Delta 600, используя колонку Gemini C18 15021,2 мм, 5 мкм, с УФ-детектированием при 251 нм УФ-детектором. Скорость потока через колонку составляла 21 мл/мин, и используемыми растворителями были 0,1% TFA в воде ВЭЖХ-сорта (А) и 0,1% TFA в ацетонитриле ВЭЖХ-сорта (В). Образец готовили в смеси 1:1 вода:ацетонитрил. Метод является таким, как описано ниже. Метод препаративной ВЭЖХ, использованный для очистки соединения примера 6. Препаративную ВЭЖХ проводили на колонке АСЕ С 18 25021,2 мм, 5 мкм, с УФдетектированием при 249 нм PDA-детектором (детектор на фотодиодной матрице). Скорость потока через колонку составляла 21 мл/мин, и используемыми растворителями были 0,1% TFA в воде ВЭЖХ- 26022437 Другие соединения, очищенные препаративной ВЭЖХ, очищали методами, аналогичными методам,описанным выше для примеров 5 и 6. Промежуточное соединение 1. 1,1-Диметилэтил-7-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)1,2,4,5-тетрагидро-3 Н-3-бензазепин-3-карбоксилат В дегазированную смесь 1,1-диметилэтил-7-[(трифторметил)сульфонил]окси-1,2,4,5-тетрагидро 3H-3-бензазепин-3-карбоксилата (9,9 г) (который может быть получен согласно J. Med Chem. 2007,50(21), 5076-5089), 4,4,4',4',5,5,5',5'-октаметил-2,2'-би-1,3,2-диоксаборолана (7,6 г), ацетата калия (7,3 г) иdppf (0,833 г) в диоксане (165 мл) добавляли PdCl2dppf.CH2Cl2 (1,2 г). Реакционную смесь снова дегазировали с циклами азот/вакуум. Эту смесь нагревали при 100 С в течение 18 ч. Ее разбавляли этилацетатом и фильтровали через целит. Фильтрат концентрировали с получением неочищенного продукта. Этот продукт очищали колоночной хроматографией, элюируя с градиентом 0-6% этилацетата в гексане, с получением указанного в заголовке соединения в виде белого твердого вещества (6,2 г). ЖХ/МС (метод В): Rt = 8,00 мин, [МН]+-100= 274 (потеря ВОС группы как артефакт условий массспектроскопии). Промежуточное соединение 18. 2-Бром-6-метил-3-пиридинол В раствор 5-гидрокси-2-метилпиридина (коммерческий, Aldrich, 44,5 г) в пиридине (400 мл) по каплям добавляли в течение 30 мин при комнатной температуре раствор брома (71,64 г) в пиридине (550 мл). Реакционную смесь перемешивали в течение еще 1,5 ч. Реакционную смесь вливали в воду (4 литра), перемешивали в течение нескольких минут и экстрагировали диэтиловым эфиром (4300 мл). Объединенные органические фазы сушили над сульфатом натрия и концентрировали в вакууме с получением коричневого твердого вещества, которое очищали пропусканием через диоксид кремния, используя систему 0-30% этилацетата в гексане, с получением указанного в заголовке соединения в виде бежевого твердого вещества, 37 г. ЯМР: 1 Н ЯМР (400 МГц, DMSO-d6)м.д. 10.43 (1 Н, s, ОН), 7.16 м.д. (1 Н, d, СН), 7.06 (1 Н, d, СН),2.31 (3 Н, s, CH3). Промежуточное соединение 19. (4-Этил-2-пиридинил)метанол Раствор 4-этилпиридина (коммерческий, например Sigma-Aldrich) (10,7 г), пероксидисульфата аммония (45,6 г) и концентрированной серной кислоты (4,5 мл) в метаноле (150 мл)/воде (70 мл) кипятили с обратным холодильником в течение 24 ч. Реакционную смесь медленно добавляли в водный раствор бикарбоната натрия и экстрагировали хлороформом (4500 мл). Смесь сушили над сульфатом натрия, концентрировали в вакууме и очищали пропусканием через диоксид кремния, используя 0-60% этилацетат в гексане, с получением указанного в заголовке соединения, 1,16 г. Масс-спектрометрия: [МН]+ = 138,0. Промежуточное соединение 20. 2-Бром-4-(этилокси)фенол В раствор 4-(этилокси)фенола (коммерческий, например Aldrich) (1,0 г) в хлороформе (5 мл), охлажденный до 0 С, по каплям добавляли бром (1,26 г) в течение 20 мин. Полученную смесь перемешивали при 25 С в течение 2 ч, после чего промывали последовательно водным раствором бикарбоната натрия и рассолом. Органические фазы сушили над сульфатом натрия, фильтровали и концентрировали в вакууме с получением указанного в заголовке соединения, 1,8 г. ЖХ/МС (метод A): Rt = 6,52 мин, [МН]+= 215, 217. Промежуточное соединение 65. 3-Бром-4-гидрокси-N-метилбензамидAldrich) (2,0 г), EDC (2,65 г), НОВТ (1,41 г) и TEA (6,2 мл) в DCM (60 мл) добавляли гидрохлорид метиламина (1,87 г). Эту смесь перемешивали при 25-30 С в течение 16 ч. Растворитель удаляли при пониженном давлении. Остаток растворяли в воде и экстрагировали этилацетатом. Органические фазы сушили (сульфат натрия) и концентрировали в вакууме с получением указанного в заголовке соединения, 0,57 г. ЖХ/МС (Метод В): Rt = 4,76 мин. Аналогично с использованием другого амина было получено was промежуточное соединение 66. В перемешиваемый раствор 3-бром-4-гидроксибензойной кислоты (0,5 г) и DMF (0,1 мл) в DCM (10 мл) по каплям добавляли оксалилхлорид (0,6 мл). После перемешивания в течение 2 ч пропускали газообразный аммиак. После завершения реакции (по результатам ТСХ) растворитель удаляли при пониженном давлении. Остаток растворяли в воде и экстрагировали этилацетатом. Органические фазы сушили над сульфатом натрия и концентрировали в вакууме с получением указанного в заголовке соединения,0,18 г. ЖХ/МС (метод A): Rt = 4,33 мин, [МН]+= 216, 218. Промежуточное соединение 68. 1,2-бис(Метилокси)-4-[(метилокси)метил]оксибензол В перемешиваемый раствор 3,4-бис(метилокси)фенола (коммерческий, например Alfa Aesar) (1,0 г) и DIPEA (2,28 мл) в DCM (15 мл) добавляли хлорметил-метиловый эфир (0,74 мл) при 0 С. После перемешивания при 25-30 С в течение 17 ч реакционную смесь промывали разбавленной соляной кислотой и насыщенным водным раствором бикарбоната натрия. Смесь сушили над сульфатом натрия и очищали,элюируя через диоксид кремния 0-5% этилацетатом в гексане, с получением указанного в заголовке соединения, 0,80 г. ЖХ/МС (метод A): Rt = 5,99 мин, [МН]+= 199. Промежуточное соединение 69. 2-Бром-3,4-бис(метилокси)-1-[(метилокси)метил]оксибензолTMEDA (3,93 мл) в сухом диэтиловом эфире (50 мл) добавляли трет-бутиллитий (1,7 М в пентане, 23,76 мл) при температуре -70 С. Эту реакционную смесь перемешивали при этой температуре в течение 1 ч,после чего добавляли бром (0,15 мл). Смесь перемешивали при 0 С в течение 3 ч. Реакционную смесь гасили добавлением 20% водного раствора дитионита натрия и экстрагировали этилацетатом. Органические фазы промывали разбавленной соляной кислотой, водным раствором бикарбоната натрия, рассолом и сушили над сульфатом натрия с получением неочищенного продукта. Этот продукт очищали, элюируя через диоксид кремния 0-10% этилацетатом в гексане, с получением указанного в заголовке соединения, 1,4 г. В перемешиваемый раствор 2-бром-3,4-бис(метилокси)-1-[(метилокси)метил]оксибензола в метаноле (10 мл) добавляли соляную кислоту (12 М, 0,12 мл) при 25 С. Реакционную смесь перемешивали при 40 С в течение 5 ч. Реакционную смесь распределяли между этилацетатом и насыщенным водным раствором бикарбоната натрия. Органические фазы промывали рассолом, сушили над сульфатом натрия и концентрировали в вакууме. Неочищенный продукт очищали, элюируя через диоксид кремния 0-4% этилацетатом в гексане, с получением указанного в заголовке соединения, 0,65 г. ЖХ/МС (метод В): Rt = 5,58 мин, [МН]+= 233. Промежуточное соединение 2. 2-Бром-3-[(4-метил-2-пиридинил)метил]оксипиридин(6,94 г) в DMF (25 мл) перемешивали в течение 20 мин, после чего добавляли гидрохлорид 2(хлорметил)-4-метилпиридина (его получение описано в WO 2008/141011) (3 г). Эту смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь вливали в смесь лед/вода, и образовавшееся твердое вещество собирали фильтрованием, промывали гексаном и сушили с получением указанного в заголовке соединения, 2,87 г (61%). ЖХ/МС (метод A): Rt = 4,27 мин, [МН]+ = 279, 281. Аналогично были получены следующие промежуточные соединения:
МПК / Метки
МПК: A61P 37/00, C07D 403/12, A61K 31/47, C07D 401/12
Метки: пиразинилметилоксиарильные, полезные, тирозинкиназы, производные, селезеночной, качеcтве, пиридинил, ингибиторов, syk
Код ссылки
<a href="https://eas.patents.su/30-22437-piridinil-i-pirazinilmetiloksiarilnye-proizvodnye-poleznye-v-kachectve-ingibitorov-selezenochnojj-tirozinkinazy-syk.html" rel="bookmark" title="База патентов Евразийского Союза">Пиридинил- и пиразинилметилоксиарильные производные, полезные в качеcтве ингибиторов селезеночной тирозинкиназы (syk)</a>
Предыдущий патент: Способ и установка для получения оксида алюминия из гидроксида алюминия
Следующий патент: Средство, обладающее антивирусным и антигрибковым действием при заболевании овощных культур
Случайный патент: Способ получения 3-фенилурацилов