Производные тетрагидрохинолина, полезные в качестве ингибиторов бромодомена
Номер патента: 22341
Опубликовано: 30.12.2015
Авторы: Ватсон Роберт Дж., Демон Эммануэль Юбер, Аман Доминик, Митчелл Даррен Джейсон
Формула / Реферат
1. Соединение формулы (I) или его соль
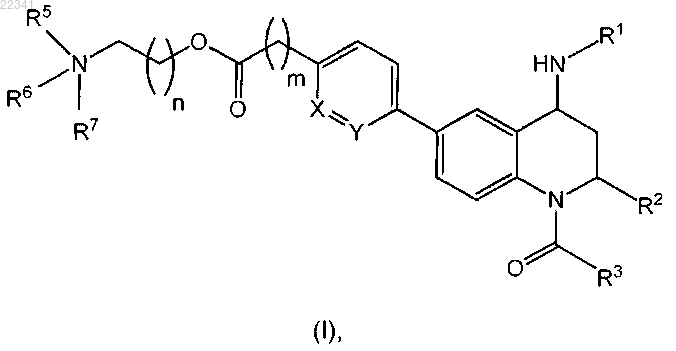
где X и Y независимо представляют собой СН или N, при условии, что по меньшей мере один из X и Y представляет собой СН;
R1 представляет собой группу C(O)OR4, где R4 представляет собой C1-4алкил или С3-7циклоалкил; или
R1 представляет собой группу, выбранную из фенила, пиридила, пиразинила и пиримидинила, где указанные группы возможно замещены одним или двумя заместителями, выбранными из галогена, С1-4алкила и CN;
R2 представляет собой С1-4алкил;
R3 представляет собой С1-4алкил;
R5 и R6 независимо представляют собой С1-4алкил;
R7 отсутствует или представляет собой С1-4алкил;
m равен 0, 1 или 2;
n равен 1 или 2.
2. Соединение или его соль по п.1, где X и Y оба представляют собой СН или где X представляет собой СН и Y представляет собой N.
3. Соединение или его соль по любому из пп.1-2, где R1 представляет собой группу C(O)OR4, где R4 представляет собой изопропил.
4. Соединение или его соль по любому из пп.1-2, где R1 представляет собой фенил или пиридил, возможно замещенные одним или двумя заместителями, выбранными из галогена, С1-4алкила и CN.
5. Соединение или его соль по п.4, где R1 представляет собой 4-хлорфенил или 5-цианопиридин-2-ил.
6. Соединение или его соль по любому из пп.1-5, где R2 представляет собой метил.
7. Соединение или его соль по любому из пп.1-6, где R3 представляет собой метил.
8. Соединение или его соль по любому из пп.1-7, где оба R5 и R6 представляют собой метил.
9. Соединение или его соль по любому из пп.1-8, где R7 отсутствует.
10. Соединение или его соль по любому из пп.1-9, где соединение формулы (I) представляет собой (2S,4R) энантиомер.
11. Соединение, выбранное из
2-(диметиламино)этил-4-((2S,4R)-1-ацетил-4-((4-хлорфенил)амино)-2-метил-1,2,3,4-тетрагидрохинолин-6-ил)бензоата;
2-((4-((2S,4R)-1-ацетил-4-((4-хлорфенил)амино)-2-метил-1,2,3,4-тетрагидрохинолин-6-ил)бензоил)окси)-N,N,N-триметилэтанаминия;
3-((4-((2S,4R)-1-ацетил-4-((4-хлорфенил)амино)-2-метил-1,2,3,4-тетрагидрохинолин-6-ил)бензоил)окси)-N,N,N-триметилпропан-1-аминия;
3-(диметиламино)пропил-4-((2S,4R)-1-ацетил-4-((4-хлорфенил)амино)-2-метил-1,2,3,4-тетрагидрохинолин-6-ил)бензоата;
3-(диметиламино)пропил-6-((2S,4R)-1-ацетил-4-((5-цианопиридин-2-ил)амино)-2-метил-1,2,3,4-тетрагидрохинолин-6-ил)никотината;
2-(диметиламино)этил-6-((2R,4R)-1-ацетил-4-((5-цианопиридин-2-ил)амино)-2-метил-1,2,3,4-тетрагидрохинолин-6-ил)никотината;
3-(диметиламино)пропил-4-((2S,4R)-1-ацетил-4-((изопропоксикарбонил)амино)-2-метил-1,2,3,4-тетрагидрохинолин-6-ил)бензоата и
2-(диметиламино)этил-4-((2S,4R)-1-ацетил-4-((изопропоксикарбонил)амино)-2-метил-1,2,3,4-тетрагидрохинолин-6-ил)бензоата
или его соли.
12. Соединение по любому из пп.1-11 или его фармацевтически приемлемая соль.
13. Фармацевтическая композиция для лечения заболеваний или состояний, для которых показан ингибитор бромодомена, содержащая соединение или его фармацевтически приемлемую соль по п.12 и один или более чем один фармацевтически приемлемый носитель, разбавитель или эксципиент.
14. Применение соединения или его фармацевтически приемлемой соли по п.12 для лечения заболеваний или состояний, для которых показан ингибитор бромодомена.
15. Применение по п.14, где указанное заболевание или состояние представляет собой рак или хроническое аутоиммунное и/или воспалительное состояние.
16. Способ лечения рака, хронического аутоиммунного и/или воспалительного состояния у субъекта, нуждающегося в этом, включающий введение терапевтически эффективного количества соединения или его фармацевтически приемлемой соли по п.12.
Текст
Область изобретения Настоящее изобретения относится к производным тетрагидрохинолина, фармацевтическим композициям, содержащим такие соединения, и к их применению в терапии. Предшествующий уровень техники Геномы эукариотических организмов сильно организованы в ядре клетки. Длинные цепи двойной ДНК обернуты вокруг октамера белков гистонов (обычно содержащих две копии гистонов Н 2 А, Н 2 В, Н 3 и Н 4) с образованием нуклеосомы. Затем этот основной элемент далее сжимается путем агрегации и сворачивания нуклеосом с образованием высоко конденсированной хроматиновой структуры. Возможен ряд различных состояний конденсации, и плотность этой структуры изменяется в ходе клеточного цикла,будучи наиболее компактной в ходе процесса деления клетки. Хроматиновая структура играет критически важную роль в регуляции транскрипции генов, которая не может проходить эффективно из сильно конденсированного хроматина. Хроматиновая структура контролируется серией посттрансляционных модификаций гистоновых белков, в частности гистонов Н 3 и Н 4, и чаще всего в пределах гистоновых хвостов, которые протягиваются за пределы центральной нуклеосомной структуры. Эти модификации включают ацетилирование, метилирование, фосфорилирование, убиквитинирование, сумоилирование. Эти эпигенетические метки вносятся и стираются особыми ферментами, которые ставят метки на конкретных остатках в гистоновом хвосте, формируя таким образом эпигенетический код, который затем интерпретируется клеткой, давая возможность ген-специфичной регуляции хроматиновой структуры и,таким образом, транскрипции. Ацетилирование гистона чаще всего связано с активацией транскрипции гена, так как эта модификация ослабляет взаимодействие ДНК и гистонового октамера за счет изменения электростатического притяжения. Кроме этого физического изменения особые белки связываются с ацетилированными лизиновыми остатками в гистонах для считывания эпигенетического кода. Бромодомены представляют собой маленькие (110 аминокислот) отличимые домены в белках, которые связываются с ацетилированными лизиновыми остатками, как правило, но не эксклюзивно, в контексте гистонов. Существует семейство,состоящее из примерно 50 белков, про которые известно, что они содержат бромодомены и имеют ряд функций в клетке. Семейство BET бромодомен-содержащих белков включает 4 белка (BRD2, BRD3, BRD4 и BRD-t),которые содержат тандемные бромодомены, способные связываться с двумя ацетилированными лизиновыми остатками, находящимися в непосредственной близости друг к другу, увеличивая специфичность взаимодействия. Как сообщается, BRD2 и BRD3 связаны с гистонами вдоль активно транскрибируемых генов и могут быть вовлечены в фасилитацию транскрипционного удлинения (Leroy et al., Mol. Cell. 2008 30(1): 51-60), в то время как BRD4, по-видимому, вовлечен в накопление комплекса pTEF- в индуцибельных генах, результатом чего является фосфорилирование РНК-полимеразы и увеличенный транскрипционный выход (Hargreaves et al. Cell, 2009, 138(1): 129-145). Также было сообщено, что BRD4 илиBRD3 могут сливаться с NUT (ядерный белок в яичках), образуя новые онкогены слияния, BRD4-NUT иBRD3-NUT, в высоко злокачественной форме эпителиальной неоплазии (French et al. Cancer Research,2003, 63, 304-307 и French et al. Journal of Clinical Oncology, 2004, 22 (20), 4135-4139). Данные указывают на то, что белки слияния BRD-NUT вносят вклад в канцерогенез (Oncogene, 2008, 27, 2237-2242). BRD-t экспрессируется исключительно в яичках и яичниках. Как было сообщено, все члены семейства обладают некоторой функцией в аспектах контроля или исполнения в клеточном цикле и, как было показано,остаются в комплексе с хромосомами во время деления клетки - что предполагает роль в поддержании эпигенетической памяти. Кроме того, некоторые вирусы используют эти белки для связывания своих геномов с хроматином клетки-хозяина как часть процесса вирусной репликации (You et al. Cell, 2004, 1 17(3): 349-60). В заявке на патент Японии JP 2008-156311 раскрыто производное бензимидазола, которое, как утверждается, является агентом, связывающим бромодомен BRD2, который является применимым в отношении вирусной инфекции/пролиферации. В заявке на патент WO 2009084693 раскрыта серия производных тиенотриазолодиазепиена, которые, как утверждается, ингибируют связывание между ацетилированным гистоном и бромодоменсодержащим белком, которые, как утверждается, являются полезными в качестве противораковых агентов. В обеих заявках на патент РСТ РСТ/ЕР 2010/06693 и РСТ/ЕР 2010/066701 раскрыта серия производных тетрагидрохинолина, которые ингибируют связывание бромодоменов семейства BET с ацетилированными лизиновыми остатками. Был найден новый класс соединений, которые ингибируют связывание бромодоменов с штатными им ацетилированными белками, более конкретно, класс соединений, которые ингибируют связывание бромодоменов семейства BET с ацетилированными лизиновыми остатками. Такие соединения будут именоваться ниже "ингибиторами бромодомена". Краткое изложение сущности изобретения В первом аспекте настоящего изобретения предложено соединение формулы (I) или его соль, более конкретно, его фармацевтически приемлемая соль Во втором аспекте настоящего изобретения предложена фармацевтическая композиция, содержащая соединение формулы (I) или его фармацевтически приемлемую соль и один или более фармацевтически приемлемых носителей, разбавителей или эксципиентов. В третьем аспекте настоящего изобретения предложено соединение формулы (I) или его фармацевтически приемлемая соль для применения в терапии, в частности в лечении заболеваний или состояний,для которых показан ингибитор бромодомена. В четвертом аспекте настоящего изобретения предложен способ лечения заболеваний или состояний, для которых показан ингибитор бромодомена, у субъекта, нуждающегося в этом, который включает введение терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. В пятом аспекте настоящего изобретения предложено применение соединения формулы (I) или его фармацевтически приемлемой соли в изготовлении лекарственного средства для лечения заболеваний или состояний, для которых показан ингибитор бромодомена. Подробное описание изобретения Настоящее изобретения относится к соединениям формулы (I) или их солям где X и Y независимо представляют собой СН или N, при условии, что по меньшей мере один из X и Y представляет собой СН;R1 представляет собой группу C(O)OR4, где R4 представляет собой C1-4 алкил или С 3-7 циклоалкил; илиR1 представляет собой группу, выбранную из фенила, пиридила, пиразинила и пиримидинила, где указанные группы возможно замещены одним или двумя заместителями, выбранными из галогена,С 1-4 алкила и CN;R5 и R6 независимо представляют собой С 1-4 алкил; илиR7 отсутствует или представляет собой С 1-4 алкил;n равен 1 или 2. В одном из воплощений изобретения предложены соединения формулы (I) с цис относительной стереохимией в тетрагидрохинолиновом кольце в отношении заместителей во 2- и 4-м положениях кольца. В одном из воплощений соединение формулы (I) или его соль представляет собой (2S, 4R) энантиомер. В одном из воплощений X и Y оба представляют собой СН. В другом воплощении X представляет собой СН и Y представляет собой N. В одном из воплощений R1 представляет собой группу C(O)OR4, где R4 представляет собой изопропил. В другом воплощении R1 представляет собой фенил или пиридил, возможно замещенные одним или двумя заместителями, выбранными из галогена, С 1-4 алкила и CN. В еще одном воплощении R1 представляет собой 4-хлорфенил или R1 представляет собой 5-цианопиридин-2-ил. В одном из воплощений R2 представляет собой метил. В одном из воплощений R3 представляет собой метил. В одном из воплощений m равен 0. В одном из воплощений n равен 0. В другом воплощении n равен 1. В одном из воплощений оба из R5 и R6 представляют собой метил. Следует понимать, что когда R7 представляет собой С 1-4 алкил, будет образована четвертичная аммонийная группировка. В одном из воплощений R7 отсутствует. Хотя воплощения для каждой переменной были в основном приведены выше раздельно для каждой переменной, данное изобретение предназначено включать все комбинации, описанные в данной заявке выше, включая их соли. Конкретными соединениями по изобретению являются 2-(диметиламино)этил-4-2S,4R)-1-ацетил-4-4-хлорфенил)амино)-2-метил-1,2,3,4-тетрагидрохинолин-6-ил)бензоат; 2-4-2S,4R)-1-ацетил-4-4-хлорфенил)амино)-2-метил-1,2,3,4-тетрагидрохинолин-6-ил)бензоил)окси)-N,N,N-триметилэтанаминий; 3-4-2S,4R)-1-ацетил-4-4-хлорфенил)амино)-2-метил-1,2,3,4-тетрагидрохинолин-6-ил)бензоил)окси)-N,N,N-триметилпропан-1-аминий; 3-(диметиламино)пропил-4-2S,4R)-1-ацетил-4-4-хлорфенил)амино)-2-метил-1,2,3,4-тетрагидрохинолин-6-ил)бензоат; 3-(диметиламино)пропил-6-2S,4R)-1-ацетил-4-5-цианопиридин-2-ил)амино)-2-метил-1,2,3,4-тетрагидрохинолин-6-ил)никотинат; 2-(диметиламино)этил-6-2R,4R)-1-ацетил-4-5-цианопиридин-2-ил)амино)-2-метил-1,2,3,4-тетрагидрохинолин-6-ил)никотинат; 3-(диметиламино)пропил-4-2S,4R)-1-ацетил-4-изопропоксикарбонил)амино)-2-метил-1,2,3,4-тетрагидрохинолин-6-ил)бензоат и 2-(диметиламино)этил-4-2S,4R)-1-ацетил-4-изопропоксикарбонил)амино)-2-метил-1,2,3,4-тетрагидрохинолин-6-ил)бензоат или их соли. На протяжении настоящего описания, если не указано иное термин "галоген" используют для описания группы, выбранной из фтора, хлора или брома; термины "С 1-4 алкил" и "C1-6 алкил" используют для описания группы или части группы, содержащей линейную или разветвленную алкильную группу, содержащую от 1 до 4 или от 1 до 6 атомов углерода соответственно. Подходящие примеры таких групп включают метил, этил, пропил, изопропил, н-бутил,изобутил, трет-бутил, пентил и гексил; термин "С 3-7 циклоалкил" используют для описания неароматического карбоциклического кольца,содержащего по меньшей мере три и максимум семь атомов углерода. Примеры С 3-7 циклоалкила включают циклопропил, циклобутил, циклопентил, циклогексил и циклогептил; термин "5- или 6-членный гетероциклил" относится к неароматическому насыщенному кольцу, содержащему 1, 2 или 3 гетероатома, выбранных из О, N и S. Примеры таких групп включают пирролидинил, морфолинил, пиперидинил и пиперазинил. Следует понимать, что настоящее изобретение покрывает соединения формулы (I) в виде свободного основания и в виде его солей, например в виде его фармацевтически приемлемых солей. В одном из воплощений изобретение относится к соединениям формулы (I) или к их фармацевтически приемлемым солям. Вследствие их возможного применения в медицине соли соединений формулы (I) желательно являются фармацевтически приемлемыми солями. Подходящие фармацевтически приемлемые соли могут включать соли добавления кислоты или основания. Как использовано в данной заявке, термин "фармацевтически приемлемая соль" означает любую фармацевтически приемлемую соль или сольват соединения по изобретению, которая при введении реципиенту способна давать (прямо или непрямо) (для обзора подходящих солей см. Berge et al. J. Pharm. Sci., 66:1-19 (1977. Типично, фармацевтически приемлемая соль может быть легко получена путем использования желаемой кислоты или основания подходящим образом. Полученная соль может осаждаться из раствора и быть собрана фильтрацией или может быть выделена путем выпаривания растворителя. Фармацевтически приемлемая соль добавления основания может быть получена в результате реакции соединения формулы (I) с подходящим неорганическим или органическим основанием (например,триэтиламином, этаноламином, триэтаноламином, холином, аргинином, лизином или гистидином), возможно, в подходящем растворителе, с получением соли добавления основания, которую выделяют обычным образом, например путем кристаллизации и фильтрации. Фармацевтически приемлемые соли добавления основания включают соли аммония, соли щелочных металлов, такие как соли натрия и калия,соли щелочно-земельных металлов, такие как соли кальция и магния, и соли органических оснований,включая соли первичных, вторичных и третичных аминов, таких как изопропиламин, диэтиламин, этаноламин, триметиламин, дициклогексиламин и N-метил-D-глюкамин. Фармацевтически приемлемая соль добавления кислоты может быть получена в результате реакции соединения формулы (I) с подходящей неорганической или органической кислотой (такой как бромистоводородная, хлористо-водородная, серная, азотная, фосфорная, янтарная, малеиновая, уксусная, пропио-3 022341 новая, фумаровая, лимонная, винная, молочная, бензойная, салициловая, глутаминовая, аспарагиновая, птолуолсульфоновая, бензолсульфоновая, метансульфоновая, этансульфоновая, нафталинсульфоновая,такая как 2-нафталинсульфоновая или гексановая кислота), возможно в подходящем растворителе, таком как органический растворитель, с получением соли, которую обычно выделяют путем кристаллизации и фильтрации. Фармацевтически приемлемая соль добавления кислоты соединения формулы (I) может содержать или представлять собой, например, гидробромидную, гидрохлоридную, сульфатную, нитратную, фосфатную, сукцинатную, малеатную, ацетатную, пропионатную, фумаратную, цитратную, тартратную, лактатную, бензоатную, салицилатную, глутаматную, аспартатную, п-толуолсульфонатную,бензолсульфонатную, метансульфонатную, этансульфонатную, нафталинсульфонатную (например, 2 нафталинсульфонатную) или гексаноатную соль. Другие фармацевтически неприемлемые соли, например формиаты, оксалаты или трифторацетаты,могут использоваться, например, при выделении соединений формулы (I) и включены в область настоящего изобретения. Изобретение включает в свою область все возможные стехиометрические и нестехиометрические формы солей соединений формулы (I). Следует понимать, что многие органические соединения могут образовывать комплексы с растворителями, в которых они реагируют или из которых их осаждают или выкристаллизовывают. Эти комплексы известны как "сольваты". Например, комплекс с водой известен как "гидрат". Для образования сольватов могут использоваться растворители с высокими температурами кипения и/или способные образовывать водородные связи, такие как вода, ксилол, N-метилпирролидон, метанол и этанол. Способы идентификации сольватов включают ЯМР и микроанализ, но не ограничиваются этим. Сольваты соединений формулы (I) включены в область изобретения. Изобретение включает в свою область все возможные стехиометрические и нестехиометрические формы сольватов соединений формулы (I). Соединения формулы (I) могут быть в кристаллической или в аморфной форме. Кроме того, некоторые из кристаллических форм соединений формулы (I) могут существовать как полиморфы, которые включены в область настоящего изобретения. Полиморфные формы соединений формулы (I) могут быть охарактеризованы и дифференцированы посредством нескольких традиционных аналитических методик,включая рентгенограммы порошковой рентгеновской дифракции (XRPD), инфракрасные (IR) спектры,Раман-спектры, дифференциальную сканирующую калориметрию (DSC), термогравиметрический анализ(TGA) и твердотельный ядерный магнитный резонанс (SSNMR), но не ограничиваясь этим. Соединения, описанные в данной заявке, содержат хиральные атомы, так что могут образовываться оптические изомеры, например энантиомеры или диастеромеры. Соответственно настоящее изобретение охватывает все изомеры соединений формулы (I) как в виде индивидуальных изомеров, выделенных так,чтобы они были, по существу, свободны от другого изомера (т.е. чистые), так и в виде смесей (т.е. рацематов и рацемических смесей). Индивидуальный изомер, выделенный так, чтобы он был, по существу,свободен от другого изомера (т.е. чистый), может быть выделен таким образом, что он будет присутствовать в смеси с менее чем 10%, в частности менее чем примерно 1%, например менее чем примерно 0,1% другого изомера. Разделение изомеров может быть достигнуто посредством традиционных методик, известных специалистам в данной области, например посредством фракционной кристаллизации, хроматографии илиHPLC (высокоэффективной жидкостной хроматографии). Определнные соединения формулы (I) могут существовать в одной из нескольких таутомерных форм. Следует понимать, что настоящее изобретение охватывает все таутомеры соединений формулы (I),как в виде индивидуальных таутомеров, так и в виде их смесей. Из вышеизложенного следует понимать, что в область изобретения включены сольваты, изомеры и полиморфные формы соединений формулы (I) и их солей. Соединения формулы (I) и их соли могут быть получены различными способами, включая стандартные химические способы. Любые определенные ранее переменные будут продолжать иметь значение, определенное ранее, если не указано иное. Иллюстративные общие способы синтеза приведены ниже, и затем конкретные соединения формулы (I) или их соли получают в рабочих примерах. В настоящем изобретении также предложен способ получения соединения формулы (I) или его соли, который включает способ, выбранный из (а) и (б), где:(а) включает взаимодействие соединения формулы (II)(б) включает взаимодействие соединения формулы (II) или его соли с соединением формулы (IV)Hal представляет собой галоген. Способ (а) Реакция между соединениями формулы (II) и (III) может быть осуществлена в присутствии подходящего активирующего агента (такого как дициклогексилкарбодиимид (DCC) или 1-этил-3-(3-диметиламинопропил)карбодиимид (EDC и подходящего катализатора переноса ацила (такого как 4-диметиламинопиридин) в подходящем растворителе (таком как дихлорметан или DMF). Соединения формулы (II) могут быть получены способами, описанными в данной заявке или аналогичными им способами. Соединения формулы (III) имеются в продаже. Способ (б) Для способа (б) подходящей группой Hal является бромо. Реакцию между соединениями формулы(II) и формулы (IV) обычно осуществляют в подходящем растворителе (таком как DMF) в присутствии подходящего основания (такого как карбонат калия). Соединения формулы (II) могут быть получены способами, описанными в данной заявке или аналогичными им способами. Соединения формулы (IV) имеются в продаже. Специалистам в данной области следует понимать, что может быть выгодным защитить одну или более функциональных групп описанных соединений. Примеры защитных групп и способы их удаления могут быть найдены в Т.W. Greene "Protective Groups in Organic Synthesis" (4th edition, J. Wiley and Sons,2006). Подходящие защитные группы для амина включают ацил (например, ацетил, карбамат (например,2',2',2'-трихлорэтоксикарбонил, бензилоксикарбонил или трет-бутоксикарбонил) и арилалкил (например,бензил), которые могут быть удалены путем гидролиза (например, с использованием кислоты, такой как соляная кислота в диоксане или трифторуксусная кислота в дихлорметане) или восстановления (например, гидрогенолиза бензиловой или бензилоксикарбонильной группы или восстановительного отщепления 2',2',2'-трихлорэтоксикарбонильной группы с использованием цинка в уксусной кислоте) подходящим образом. Другие подходящие защитные группы для амина включают трифторацетил (-COCF3), который может быть удален посредством гидролиза, катализируемого основанием. Следует понимать, что в любом из способов синтеза, описанных в данной заявке, точный порядок стадий синтеза, в ходе которых в молекулу вводятся различные группы и группировки, может быть изменен. В компетенции практикующего специалиста в данной области будет убедиться в том, что группы или группировки, введенные на одной стадии способа, не будут затронуты в ходе последующих превращений и реакций, и выбрать порядок стадий синтеза соответствующим образом. Как полагают, определенные соединения формулы (II) являются новыми и, таким образом, образуют еще один аспект изобретения. Соединения формулы (I) и их соли представляют собой ингибиторы бромодомена и поэтому, как полагают, обладают потенциальной применимостью в лечении заболеваний или состояний, для которых показан ингибитор бромодомена. Таким образом, в настоящем изобретении предложено соединение формулы (I) или его фармацевтически приемлемая соль для применения в терапии. Соединение формулы (I) или его фармацевтически приемлемая соль могут быть использованы в лечении заболеваний или состояний, для которых показан ингибитор бромодомена. Таким образом, в настоящем изобретении предложено соединение формулы (I) или его фармацевтически приемлемая соль для применения в лечении любых заболеваний или состояний для которых показан ингибитор бромодомена. Также предложено применение соединения формулы (I) или его фармацевтически приемлемой соли в изготовлении лекарственного средства для лечения заболеваний или состояний, для которых показан ингибитор бромодомена. Также предложен способ лечения заболеваний или состояний, для которых показан ингибитор бро-5 022341 модомена, у субъекта, нуждающегося в этом, который включает введение терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли. Подходящим образом, субъект, нуждающийся в этом, является млекопитающим, в частности человеком. Как использовано в данной заявке, термин "эффективное количество" означает то количество лекарственного средства или фармацевтического агента, которое вызовет тот биологический или медицинский ответ ткани, системы, животного или человека, который ожидается, например, исследователем или клиницистом. Кроме того, термин "терапевтически эффективное количество" означает любое количество, которое, по сравнению с аналогичным субъектом, который не получал такое количество, ведет к улучшенному лечению, выздоровлению, предотвращению или облегчению заболевания, расстройства или побочного эффекта, или уменьшению скорости прогрессирования заболевания или расстройства. Термин также включает в свою область количества, эффективные для улучшения нормальной физиологической функции. Как полагают, ингибиторы бромодомена являются полезными в лечении различных заболеваний или состояний, связанных с системным воспалением или воспалением ткани, воспалительным ответам на инфекцию или гипоксию, клеточной активацией и пролиферацией, липидным метаболизмом, фиброзом,и в предотвращении и лечении вирусных инфекций. Ингибиторы бромодомена могут быть полезными в лечении большого разнообразия хронических аутоиммунных и/или воспалительных состояний, таких как ревматоидныйартрит, остеоартрит, острая подагра, псориаз, системная красная волчанка, рассеянный склероз, воспалительное заболевание кишечника (болезнь Крона и язвенный колит), астма, болезнь хронической обструкции дыхательных путей,пневмония, миокардит, перикардит, миозит, экзема, дерматит (такой как атопический дерматит), алопеция, витилиго, буллезные заболевания кожи, нефрит, васкулит, атеросклероз, болезнь Альцгеймера, депрессия, синдром Шегрена, сиалоаденит, окклюзия центральной вены сетчатки, окклюзия разветвленной вены сетчатки, синдром Ирвина-Гасса (посткатарактный и постхирургический), пигментный ретинит,пирспланит, дробьевидная ретинопатия, ретинохориодопатия, эпиретинальная мембрана, кистоидный макулярный отек, телеангиэктазия парафовеолярная, тракционные макулопатии, витреомакулярные тракционные синдромы, отслоение сетчатки, нейроретинит, идиопатический макулярный отек, ретинит,сухой глаз (сухой кератоконъюнктивит), весенний конъюнктивит, атопический кератоконъюнктивит,передний увеит, панувеит, задний увеит, связанный с увеитом макулярный отек, склерит, диабетическая ретинопатия, диабетический макулярный отек, возрастная макулярная дистрофия, гепатит, панкреатит,первичный биллиарный цирроз, склерозирующий холангит, болезнь Аддисона, гипофизит, тироидит,диабет I типа и острое отторжение трансплантированных органов. Ингибиторы бромодомена могут быть полезными в лечении большого разнообразия острых воспалительных состояний, таких как острая подагра, гигантоклеточный артериит, нефрит, включая волчаночный нефрит, васкулит с вовлечением органов, такой как гломерулонефрит, васкулит, включая гигантоклеточный артериит, гранулематоз Вегенера, нодозный полиартериит, болезнь Бехчета, болезнь Кавасаки,артериит Такаясу, гангренозная пиодермия, васкулит с вовлечением органов и острое отторжение трансплантированных органов. Ингибиторы бромодомена могут быть полезными в предотвращении и лечении заболеваний или состояний, которые предполагают воспалительные ответы на инфицирования бактериями, вирусами, грибами, паразитами или их токсинами, таких как сепсис, септический синдром, септический шок, эндотоксикоз, синдром системной воспалительной реакции (SIRS), синдром мультиорганной дисфункции, синдром токсического шока, острое повреждение легких, ARDS (синдром расстройства дыхания у взрослых), острая почечная недостаточность, фульминантный гепатит, ожоги, острый панкреатит, постхирургические синдромы, саркоидоз, реакции Херксхеймера, энцефалит, миелит, менингит, малерия и SIRS,связанный с вирусными инфекциями, такими как грипп, опоясывающий лишай, простой герпес и коронавирус. Ингибиторы бромодомена могут быть полезными в предотвращении и лечении заболеваний или состояний, связанных с ишемически-реперфузионным повреждением, таким как инфаркт миокарда, цереброваскулярная ишемия (инсульт), острые коронарные синдромы, почечное реперфузионное повреждение, трансплантация органа, аортокоронарное обходное шунтирование, сердечно-сосудистые обходные процедуры, эмболия легочная, почечная, печеночная, желудочно-кишечная или периферической конечности. Ингибиторы бромодомена могут быть полезными в лечении расстройств липидного метаболизма через регуляцию АРО-А 1 (аполипопротеин А 1), таких как гиперхолистеринемия, атеросклероз и болезнь Альцгеймера. Ингибиторы бромодомена могут быть полезными в лечении фибротических состояний, таких как идиопатический легочный фиброз, почечный фиброз, постхирургический стеноз, образование келоидных рубцов, склеродерма (включая пятнистую склеродерму) и сердечный фиброз. Ингибиторы бромодомена могут быть полезными в предотвращении и лечении вирусных инфекций, таких как вирус герпеса, вирус папилломы человека, аденовирус и поксвирус и другие ДНК-вирусы. Ингибиторы бромодомена могут быть полезными в лечении рака, включая гематологический (такой как лейкемия, лимфома и множественная миелома), эпителиальный (включая карциномы легких, молочной железы и толстой кишки), срединные карциномы, мезензимальные, печеночные, почечные и неврологические опухоли. Ингибиторы бромодомена могут быть полезными в лечении кожной патологии, такой как незлокачественная меланома (актинический кератоз и базальноклеточный), in-situ меланома, плоскоклеточная карцинома и кожная Т-клеточная лимфома. В одном из воплощений заболевание или состояние, для которого показан ингибитор бромодомена,выбрано из заболеваний, связанных с синдромом системного воспалительного ответа, таких как сепсис,ожоги, панкреатит, серьезная травма, кровотечение и ишемия. В этом воплощении ингибитор бромодомена будет вводиться при постановке диагноза для уменьшения вероятности возникновения SIRS, шока,синдрома множественной дисфункции органов, который индуцирует начало острого поражения легких,ARDS, острого поражения почек, печени, сердца и желудочно-кишечного тракта и смерти. В другом воплощении ингибитор бромодомена будет вводиться перед хирургическими или иными процедурами,связанными с высоким риском сепсиса, кровотечения, обширного повреждения тканей, SIRS или MODS(синдром множественной дисфункции органов). В конкретном воплощении заболевание или состояние,для которых показан ингибитор бромодомена, представляет собой сепсис, сепсический синдром, септический шок или эндотоксикоз. В другом воплощении ингибитор бромодомена показан для лечения острого или хронического панкреатита. В другом воплощении бромодомен показан для лечения ожогов. В одном из воплощений заболевание или состояние, для которых показан ингибитор бромодомена,выбрано из инфекций и реактиваций простого герпеса, герпеса губ, инфекций и реактиваций опоясывающего герпеса, ветряной оспы, опоясывающего лишая, вируса папилломы человека, вируса иммунодефицита человека (ВИЧ), неоплазии шейки матки, инфекций аденовирусов, включая острое респираторное заболевание, инфекций группы оспы, таких как коровья оспа и черная оспа, и вируса африканской чумы свиней. В одном из конкретных воплощений ингибитор бромодомена показан для лечения инфецирований кожи или эпителия шейки матки вирусом папилломы человека. Термин "заболеваний или состояний, для которых показан ингибитор бромодомена" намеренно включает в себя любое из или все из вышеуказанных болезненных состояний. В одном из воплощений предложен способ ингибирования бромодомена, который включает контактирование бромодомена с соединением формулы (I) или его фармацевтически приемлемой солью. Хотя это допустимо для применения в терапии, что соединение формулы (I), а также его фармацевтически приемлемые соли могут быть введены в виде чистого химического вещества, обычно активный ингредиент присутствует в виде фармацевтической композиции. Таким образом, в следующем аспекте настоящего изобретения предложена фармацевтическая композиция, содержащая соединение формулы (I) или фармацевтически приемлемую соль и один или более фармацевтически приемлемых носителей, разбавителей или эксципиентов. Соединения формулы (I) и фармацевтически приемлемые соли являются такими, как описано выше. Носитель(и), разбавитель(и) или эксципиент(и) должны быть приемлемыми в том смысле, что они должны быть совместимыми с другими ингредиентами композиции и не быть вредоносными в отношении их реципиента. В соответствии с другим аспектом изобретения также предложен способ получения фармацевтической композиции,включающий смешивание соединения формулы (I) или его фармацевтически приемлемой соли с одним или более фармацевтически приемлемыми носителями, разбавителями или эксципиентами. Фармацевтическая композиция может быть предназначена для применения в лечении любого из состояний, описанных в данной заявке. Так как соединения формулы (I) и их фармацевтически приемлемые соли предназначены для использования в фармацевтических композициях, очевидно, следует понимать, что все они предпочтительно предложены, по существу, в чистой форме, например чистой по меньшей мере на 60%, более подходяще чистой по меньшей мере на 75% и предпочтительно чистой по меньшей мере на 85%, особенно чистой по меньшей мере на 98% (% на основе масса на массу). Фармацевтические композиции могут быть представлены в стандартных лекарственных формах,содержащих предварительно определенное количество активного ингредиента на стандартную дозу. Предпочтительными композициями стандартных дозировок являются композиции, содержащие суточную дозу активного ингредиента или субдозу или ее подходящую часть. Таким образом, такие стандартные дозы могут вводиться более чем один раз в сутки. Предпочтительными композициями стандартных дозировок являются композиции, содержащие суточную дозу или субдозу активного ингредиента (для введения более чем один раз в сутки), как перечислено выше в данной заявке, или ее подходящую часть. Фармацевтические композиции могут быть приспособлены для введения подходящим путем, например пероральным (включая трансбуккальный или сублингвальный), ректальным, ингаляционным,интраназальным, местным (включая трансбуккальный, сублингвальный или чрескожный), окулярным(включая местный, внутриглазной, субконъюнктивальный, эписклеральный или субтеноновый), вагинальным или парентеральными (включая подкожный, внутримышечный, внутривенный и внутрикожный) путем. Такие композиции могут быть получены любым способом, известным в области фармацев-7 022341 тики, например, путем объединения активного ингредиента с носителем(ями) или экципиентом(ами). В одном из воплощений фармацевтическая композиция приспособлена для парентерального введения, в частности внутривенного введения. В одном из воплощений фармацевтическая композиция приспособлена для перорального введения. В одном из воплощений фармацевтическая композиция приспособлена для местного введения. Предпочтительная лекарственная форма заключается в абсорбции и изменении проницаемости кожи либо для увеличения, либо для уменьшения системного контакта бромодоменовых соединений,включая, но не ограничиваясь этим, фармацевтически приемлемые формы карбоксиметилцеллюлозы,альгината, желатина или поливинилпирролидона. Фармацевтические композиции, приспособленные для парентерального введения, включают водные и неводные стерильные растворы для инъецирования, которые могут содержать антиоксиданты, буферы, бактериостаты и растворенные вещества, которые придают композиции изотоничность с кровью предполагаемого реципиента; и водные и неводные стерильные суспензии, которые могут содержать суспендирующие агенты и загустители. Композиции могут быть представлены в контейнерах стандартной дозировки или многократной дозировки, например, в запаянных ампулах и виалах, и могут храниться в высушенном сублимацией (лиофилизованном) состоянии, требующем добавления только стерильного жидкого носителя, например, воды для инъекций, непосредственно перед применением. Предназначенные для немедленного приема инъецируемые растворы и суспензии могут быть получены из стерильных порошков, гранул и таблеток. Фармацевтические композиции, приспособленные для перорального введения, могут присутствовать в виде отдельных лекарственных форм, таких как капсулы или таблетки; порошков и гранул; растворов или суспензий в водных или неводных жидкостях; съедобных пен или муссов или жидких эмульсий типа масло-в-воде или жидких эмульсий типа вода-в-масле. Например, для перорального введения в форме таблетки или капсулы активный лекарственный компонент может быть объединен с пероральным, нетоксичным фармацевтически приемлемым инертным носителем, таким как этанол, глицерин, вода и тому подобное. Порошки, подходящие для включения в таблетки или капсулы, могут быть получены путем измельчения соединения до подходящего мелкого размера (например, путем микронизации) и смешивания со сходным образом полученным фармацевтическим носителем, таким как съедобный углевод, например крахмал или маннит. Также могут присутствовать вкусовая добавка, консервант, диспергирующий агент и краситель. Капсулы могут быть изготовлены путем получения порошковой смеси, как описано выше, и заполнения формованных желатиновых оболочек. Перед операцией заполнения к порошковой смеси могут быть добавлены глиданты и лубриканты, такие как коллоидный диоксид кремния, тальк, стеарат магния,стеарат кальция и твердый полиэтиленгликоль. Для улучшения доступности лекарственного средства при заглатывании капсулы также может быть добавлен дезинтегрирующий агент или солюбилизирующий агент, такой как агар-агар, карбонат кальция или карбонат натрия. Кроме того, когда это желательно и необходимо, в смесь также могут быть включены подходящие связующие вещества, глиданты, лубриканты, подсластители, вкусовые добавки, дезинтегрирующие агенты и красители. Подходящие связующие вещества включают крахмал, желатин, природные сахара, такие как глюкоза или бета-лактоза, сахаристые вещества из кукурузы, природные и синтетические смолы,такие как гуммиарабик, трагакант или альгинат натрия, карбоксиметилцеллюлоза, полиэтиленгликоль,воски и тому подобное. Лубриканты, используемые в этих лекарственных формах, включают олеат натрия, стеарат натрия, стеарат магния, бензоат натрия, ацетат натрия, хлорид натрия и тому подобное. Дезинтегрирующие агенты включают, без ограничения, крахмал, метилцеллюлозу, агар бентонит, ксантановую камедь и тому подобное. Таблетки изготавливают в виде лекарственных форм, например, путем получения порошковой смеси, гранулирования или комкования, добавления лубриканта и агента для улучшения распадаемости и прессования в таблетки. Порошковая смесь получена путем смешивания подходящим образом измельченного соединения с разбавителем или основой, как описано выше, и возможно, со связующим, таким как карбоксиметилцеллюлоза, альгинат, желатин или поливинилпирролидон, замедлителем растворения, таким как парафин, ускорителем резорбции, таким как четвертичная соль, и/или поглощающим веществом, таким как бентонит, каолин или дикальция фосфат. Порошковая смесь может быть гранулирована путем увлажнения со связующим веществом, таким как сироп, крахмальная паста, слизистый слой акации или растворы целлюлозных или полимерных веществ, и продавливания через сито. В качестве альтернативы гранулированию порошковая смесь может быть пропущена через таблеттирующую машину, и результатом являются комки неидеальной формы, разбиваемые на гранулы. Гранулы могут быть смазаны для предотвращения прилипания к таблеттирующим штампам путем добавления стеариновой кислоты, стеаратной соли, талька или минерального масла. Затем смазанная смесь прессуется в таблетки. Соединения формулы (I) и их фармацевтически приемлемые соли также могут быть объединены со свободным инертным носителем и спрессованы в таблетки непосредственно без прохождения стадий гранулирования и комкования. Может быть предложено прозрачное или непрозрачное защитное покрытие, состоящее из герметичного покрытия шеллаком, покрытие из сахара или полимерного материала, и гладкое покрытие из воска. В эти покрытия могут быть добавлены красители для различения различных стандартных дозировок. Пероральные жидкости, такие как растворы, сиропы и эликсиры, могут быть изготовлены в виде стандартных лекарственных форм так, чтобы данное количество содержало определенное количество соединения. Сиропы могут быть получены путем растворения соединения в водном растворе с подходящей вкусовой добавкой, а эликсиры получают путем использования нетоксичного спиртового носителя. Суспензии могут быть изготовлены в виде лекарственных форм путем диспергирования соединения в нетоксичном носителе. Также могут быть добавлены солюбилизаторы и эмульгаторы, такие как этоксилированные изостеариловые спирты и полиоксиэтиленсорбитоловые простые эфиры, консерванты, вкусовые добавки, такие как масло перечной мяты, или природные подсластители, или сахарин, или другие искусственные подсластители и тому подобное. Где это является подходящим, композиции стандартной дозировки могут быть микроинкапсулированы. Также может быть изготовлен препарат пролонгированного или отложенного высвобождения, как, например, путем покрытия или включения особого вещества в полимеры, воск или тому подобное. Соединения формулы (I) и их фармацевтически приемлемые соли также могут быть введены в форме липосомных систем доставки, такой как маленькие однослойные везикулы, большие однослойные везикулы и многослойные везикулы. Липосомы могут быть образованы из различных фосфолипидов,таких как холестерин, стеариламин или фосфатидилхолины. Фармацевтические композиции, приспособленные для местного введения, могут быть изготовлены в виде мазей, кремов, суспензий, эмульсий, лосьонов, порошков, растворов, паст, гелей, спреев, пен, аэрозолей или масел. Такие фармацевтические композиции могут содержать традиционные добавки, которые включают, но не ограничиваются этим, консерванты, растворители для содействия проникновению лекарственного средства, сорастворители, смягчающие средства, пропелленты, агенты для модификации вязкости (желирующие агенты), поверхностно-активные вещества и носители. В одном из воплощений предложена фармацевтическая композиция, приспособленная для местного введения, которая содержит от 0,01 до 10% или от 0,01 до 1% соединения формулы (I) или его фармацевтически приемлемой соли от массы композиции. Для лечения глаз или других внешних тканей, например рта и кожи, композиции предпочтительно наносят в виде местного раствора, суспензии, эмульсии, мази, крема, геля, спрея или пены. При изготовлении в виде мази активный ингредиент может быть использован или с парафиновой, или с водорастворимой основой мази. Альтернативно, активный ингредиент может быть изготовлен в виде крема с основой типа масло-в-воде или типа вода-в-масле. При изготовлении в виде пены активный агент может быть изготовлен с пропеллентами, поверхностно-активными веществами, растворителями, сорастворителями и агентами для модификации вязкости. Фармацевтические композиции, приспособленные для местного введения в глаза, включают глазные капли, где активный ингредиент растворен или суспендирован в подходящем носителе, особенно в водном растворителе. Композиции, предназначенные для введения в глаза, будет иметь офтальмологически совместимый рН и осмоляльность. В композицию по изобретнию может быть включен один или более офтальмологически приемлемых регуляторов рН и/или буферов, включая кислоты, такие как уксусная, борная, лимонная, молочная, фосфорная и хлористо-водородная кислоты; основания, такие как гидроксид натрия, фосфат натрия, борат натрия, цитрат натрия, ацетат натрия и лактат натрия; и буферы,такие как цитрат/декстроза, бикарбонат натрия и хлорид аммония. Такие кислоты, основания и буферы могут быть включены в количество, требуемое для поддержания рН композиции в офтальмологически приемлемом диапазоне. Одна или более чем одна офтальмологически приемлемая соль может быть включена в композицию в количестве, достаточном для доведения осмоляльности композиции до офтальмологически приемлемого диапазона. Такие соли включают соли, имеющие катионы натрия, калия или аммония и анионы хлорида, цитрата, аскорбата, бората, фосфата, бикарбоната, сульфата, тиосульфата или бисульфита. Может быть создано устройство окулярной доставки для контролируемого высвобождения одного или более чем одного терапевтического агента с несколькими определенными скоростями высвобождения и замедленной кинетикой дозы и проницаемостью. Контролируемое высвобождение может быть получено через создание полимерных матриц, включающих различные выборы и свойства биодеградируемых/биоэродируемых полимеров (например, поли(этиленвинил)ацетат (EVA), супергидролизованный поливинилацетат (PVA, гидроксиалкилцеллюлоза (НРС), метилцеллюлоза (МС), гидроксипропилметилцеллюлоза (НРМС), поликапролактон, поли(гликолевая) кислота, поли(молочная) кислота, полиангидрид, с молекулярными массами, кристалличностью,соотношениями сополимеров, условиями обработки, поверхностной обработкой, геометрией, добавлением эксципиента и полимерными покрытиями, которые ускорят диффузию лекарственного средства, эрозию, растворение и осмос. Фармацевтические композиции для окулярной доставки также включают желируемую in situ водную композицию. Такие композиции содержат желирующий агент в концентрации, эффективной для вызывания желирования при контакте с глазом или слезной жидкостью. Подходящие желирующие агенты включают, но не ограничиваются этим, термоотверждающиеся полимеры. Термин "желируемый insitu", как использовано в данной заявке, включает не только жидкости с низкой вязкостью, которые образуют гели при контакте с глазом или слезной жидкостью, но также включает более вязкие жидкости, такие как полужидкие и тиксотропные гели, которые выказывают существенно повышенную вязкость или твердость геля при введении в глаз (см., например, Ludwig (2005). Adv. Drug Deliv. Rev. 3; 57: 1595-639,включенную в данную заявку посредством ссылки с целью доведения до сведения примеров полимеров для применения в окулярной доставке лекарственных средств). Лекарственные формы для назального или ингаляционного введения могут быть традиционно изготовлены в виде аэрозолей, растворов, суспензий, гелей или сухих порошков. Для композиций, подходящих и/или приспособленных для ингаляционного введения, предпочтительно, чтобы соединение формулы (I) и его фармацевтически приемлемые соли были в форме измельченных частиц, полученных, например, путем микронизации. Предпочтительный размер частиц измельченного (например, микронизированного) соединения или соли определен числом D50 от примерно 0,5 до примерно 10 микрон (например, как измерено посредством лазерной дифракции). Аэрозольные композиции, например для ингаляционного введения, могут содержать раствор или мелкодисперсную суспензию активного вещества в фармацевтически приемлемом водном или неводном растворителе. Аэрозольные композиции могут быть представлены в формах однократной или многократной дозировки в герметичном контейнере, который может принимать форму картриджа или модуля для повторного заполнения для использования с распылительным устройством или ингалятором. Альтернативно, герметичный контейнер может представлять собой устройство однократного распыления,такое как назальный ингалятор на одну дозу или аэрозольный распылитель, снабженный мерным клапаном (ингалятор отмеренных доз), которые предназначены для утилизации, как только содержимое контейнера закончилось. Когда лекарственная форма содержит аэрозольный распылитель, она предпочтительно содержит подходящий пропеллент под давлением, такой как сжатый воздух, диоксид углерода или органический пропеллент, такой как гидрофторуглерод (HFC). Подходящие пропелленты HFC включают 1,1,1,2,3,3,3 гептафторпропан и 1,1,1,2-тетрафторэтан. Аэрозольные лекарственные формы также могут принимать форму насоса-распылителя. Аэрозоль под давлением может содержать раствор или суспензию активного соединения. Это может требовать включения дополнительных эксципиентов, например сорастворителей и/или поверхностно-активных веществ для улучшения дисперсионных характеристик и гомогенности суспензионных препаратов. Препараты в форме растворов также могут требовать добавления сорастворителей, таких как этанол. Для фармацевтических композиций, подходящих и/или приспособленных для ингаляционного введения, фармацевтическая композиция может представлять собой композицию сухого порошка для ингаляции. Такие композиции могут содержать порошковую основу, такую как лактоза, глюкоза, трегалоза,маннит или крахмал, соединение формулы (I) или его фармацевтически приемлемую соль (предпочтительно в измельченной форме, например в микронизованной форме) и, возможно, модификатор активности, такой как L-лейцин или другая аминокислота и/или соли металлов стеариновой кислоты, такие как стеарат магния или кальция. Предпочтительно композиция сухого порошка для ингаляции содержит сухую порошковую смесь лактозы, например моногидрата лактозы, и соединения формулы (I) или его соли. Такие композиции могут быть введены пациенту при помощи подходящего устройства, такого как устройство DISKUS, поставляемого GlaxoSmithKline, которое описано, например, в GB 2242134 А. Соединения формулы (I) и их фармацевтически приемлемые соли могут быть изготовлены в виде жидкого препарата для доставки из жидкостного диспенсера, например жидкостного диспенсера, имеющего распылительную форсунку или распылительное отверстие, через которое отмеренная доза жидкого препарата выпускается при приложении пользователем силы к насосному механизму жидкостного диспенсера. Такие жидкостные диспенсеры обычно поставляют с резервуаром множественных отмеренных доз жидкого препарата, где дозы выдаются при последовательных приведениях насоса в действие. Подающая форсунка и отверстие могут быть приспособлены для вставки в ноздри пользователя для спреевого распыления жидкого препарата в носовой полости. Жидкостный диспенсер вышеупомянутого типа описан и проиллюстрирован в WO-A-2005/044354. Терапевтическиэффективное количество соединения формулы (I) или его фармацевтически приемлемой соли будет зависеть от нескольких факторов, включая, например, возраст и массу животного, точное состояние, требующее лечения, и его тяжесть, природу препарата и маршрут введения и, в конечном итоге, будет определено на усмотрение лечащего терапевта или ветеринара. В фармацевтической композиции каждая стандартная дозировка для перорального или парентерального введения предпочтительно содержит от 0,01 до 3000 мг, более предпочтительно от 0,5 до 1000 мг соединения по изобретению, рассчитанного как свободное основание. Каждая стандартная дозировка для назального или ингаляционного введения содержит от 0,001 до 50 мг, более предпочтительно от 0,01 до 5 мг соединения формулы (I) или его фармацевтически приемлемой соли, рассчитанной как свободное основание. Фармацевтически приемлемые соединения формулы (I) или их фармацевтически приемлемая соль могут быть введены суточной дозой (для взрослого пациента), например пероральной или парентеральной дозой от 0,01 до 3000 мг в сутки или от 0,5 до 1000 мг в сутки или назальной или ингаляционной дозой от 0,001 до 50 мг в сутки или от 0,01 до 5 мг в сутки соединения формулы (I) или его фармацевтически приемлемой соли, рассчитанной как свободное основание. Это количество может быть предоставлено в виде одной дозы в сутки или, более обычно, в виде нескольких (таких как две, три, четыре, пять или шесть) субдоз в сутки, так что общая суточная доза является такой же. Эффективное количество его соли может быть определено как пропорция эффективного количества соединения формулы (I) perse. Соединения формулы (I) и их фармацевтически приемлемые соли могут быть использованы отдельно или в комбинации с другими фармацентическими агентами. Таким образом, комбинационные терапии по настоящему изобретению включают введение по меньшей мере одного соединения формулы(I) или его фармацевтически приемлемой соли и использование по меньшей мере одного иного фармацевтически активного агента. Предпочтительно комбинационные терапии по настоящему изобретению включают введение по меньшей мере одного соединения формулы (I) или его фармацевтически приемлемой соли и по меньшей мере одного иного фармацевтически активного агента. Соединение(я) формулы (I) и их фармацевтически приемлемые соли и иной фармацевтически активный агент(ы) могут быть введены вместе в одной фармацевтической композиции или раздельно, и при раздельном введении это может осуществляться одновременно или последовательно в любом порядке. Количества соединения(ий) формулы (I) и их фармацевтически приемлемых солей и другого фармацевтически активного агента(ов) и относительные времена их введения будут выбраны с целью достичь целевой комбинированный терапевтический эффект. Таким образом, в другом аспекте предложен комбинационный фармацевтический продукт, содержащий соединение формулы (I) или его фармацевтически приемлемую соль и по меньшей мере один иной фармацевтически активный агент. Таким образом, в одном из аспектов соединение формулы (I) или его фармацевтически приемлемая соль и фармацевтические композиции, содержащие соединение формулы (I) или его фармацевтически приемлемую соль, могут быть использованы в комбинации с или включать один или более иных терапевтических агентов, например, выбранных из антибиотиков, противовирусных агентов, глюкокортикостероидов, антагонистов мускариновых рецепторов, агонистов бета-2 рецепторов и аналогов витаминаD3. В другом аспекте соединение формулы (I) или его фармацевтически приемлемая соль по изобретению может быть использована в комбинации с другим терапевтическим агентом, который является подходящим для лечения рака. Следует понимать, что когда соединение формулы (I) или его фармацевтически приемлемую соль вводят в комбинации с другими терапевтическими агентами, обычно вводимыми ингаляционным, внутривенным, пероральным или интраназальным путем, эта полученная фармацевтическая композиция может быть введена теми же путями. Альтернативно, индивидуальные компоненты композиции могут быть введены различными путями. Одно из воплощений изобретения охватывает комбинации, включающие один или два иных терапевтических агента. Специалисту в данной области будет ясно, что, где это является подходящим, другой терапевтический ингредиент(ы) могут быть использованы в форме солей, например в форме солей щелочного металла или амина, или в форме солей добавления кислоты, или пролекарств, или в форме сложных эфиров,например сложных эфиров низших алкилов, или в форме сольватов, например гидратов, для оптимизации активности и/или стабильности и/или физических характеристик терапевтического ингредиента, таких как растворимость. Также будет ясно, что, где это является подходящим, терапевтические ингредиенты могут быть использованы в оптически чистой форме. Комбинации, описанные выше, могут быть удобным образом подготовлены для использования в форме фармацевтической композиции, и таким образом фармацевтические композиции, содержащие комбинацию, как определено выше, вместе с фармацевтически приемлемым разбавителем или носителем представляют другой аспект изобретения. Соединения формулы (I) и их фармацевтически приемлемые соли могут быть получены способами,описанными ниже, или сходными способами. Таким образом, следующие промежуточные соединения и примеры служат для иллюстрирования получения соединений формулы (I) и их фармацевтически приемлемых солей и не должны считаться ограничивающими область изобретения каким-либо образом. Общие экспериментальные детали Все упоминаемые температуры приведены в С. Наименования следующих соединений были получены с использованием программы для наименования соединений "ACD Name Pro 6.02" или Chem Draw Ultra 12.0. СокращенияMDAP относится к управляемой массой автопрепаративной хроматографии HPLCMeCN относится к ацетонитрилу МеОН относится к метанолуMgSO4 относится к сульфату магния Мр относится к точке плавления к.т. относится к комнатной температуреTLC относится к тонкослойной хроматографии Методология LC/MS (использована для некоторых промежуточных соединений и референсных соединений)LC/MS означает жидкостную хроматографию/масс-спектрометрию Экспериментальные детали способов LC-MS А-F, как они называются в данной заявке, являются следующими.LC/MS (способ А) осуществляли на колонке Acquity UPLC ВЕН С 18 (502,1 мм i.d. (внутренний диаметр), диаметр зерна 1,7 мкм) при 40 С, элюируя раствором 10 ммоль бикарбоната аммония в воде,доведенным до рН 10 раствором аммиака (растворитель А) и ацетонитрилом (растворитель В), с использованием следующего градиента элюирования: 0-1,5 мин 1-97% В, 1,5-1,9 мин 97% В, 1,9-2,0 мин 100% В при скорости потока 1 мл/мин. УФ-детектирование представляло собой суммированный сигнал от длин волн от 210 до 350 нм. Масс-спектры записывали на масс-спектрометре Waters ZQ, используя чередующееся сканирование с положительной и отрицательной электроспрей-ионизацией. Данные ионизации округляли до ближайшего целого числа.LC/MS (способ В) осуществляли на колонке Acquity UPLC ВЕН С 18 (502,1 мм i.d., диаметр зерна 1,7 мкм) при 40 С, элюируя 0,1% об./об. раствором муравьиной кислоты в воде (растворитель А) и 0,1% об./об. раствором муравьиной кислоты в ацетонитриле (растворитель В), с использованием следующего градиента элюирования: 0-1,5 мин 3-100% В, 1,5-1,9 мин 100% В, 1,9-2,0 мин 3% В при скорости потока 1 мл/мин. УФ-детектирование представляло собой суммированный сигнал от длин волн от 210 до 350 нм. Масс-спектры записывали на масс-спектрометре Waters ZQ, используя чередующееся сканирование с положительной и отрицательной электроспрей-ионизацией. Данные ионизации округляли до ближайшего целого числа.LC/MS (способ С) осуществляли на колонке Acquity UPLC ВЕН С 18 (502,1 мм i.d., диаметр зерна 1,7 мкм) при 40 С, элюируя 0,1% об./об. раствором трифторуксусной кислоты в воде (растворитель А) и 0,1% об./об. раствором трифторуксусной кислоты в ацетонитриле (растворитель В), с использованием следующего градиента элюирования: 0-1,5 мин 3-100% В, 1,5-1,9 мин 100% В, 1,9-2,0 мин 3% В при скорости потока 1 мл/мин. УФ-детектирование представляло собой суммированный сигнал от длин волн от 210 до 350 нм. Масс-спектры записывали на масс-спектрометре Waters ZQ, используя положительную электроспрей-ионизацию. Данные ионизации округляли до ближайшего целого числа.LC/MS (способ D) осуществляли на колонке Supelcosil LCABZ+PLUS (3 мкм, 3,3 см 4,6 мм ID),элюируя 0,1% НСО 2 Н и 0,01 М ацетатом аммония в воде (растворитель А), и 95% ацетонитрил и 0,05% НСО 2 Н в воде (растворитель В), с использованием следующего градиента элюирования: 0-0,7 мин 0%В,0,7-4,2 мин 0-100% В, 4,2-5,3 мин 100%В, 5,3-5,5 мин 100-0% В при скорости потока 3 мл/мин. Массспектры (MS) записывали на масс-спектрометре Fisons VG Platform, используя положительную электроспрей-ионизацию [(ES+ с получением молекулярных ионов [М+Н]+ и [М+NH4]+] или отрицателэлектроспрей-ионизацию [(ES- с получением молекулярного иона [М-Н]-. Аналитические данные с этого прибора приведены в следующем формате: [М+Н]+ или [М-Н]-.LC/MS (способ Е) осуществляли на колонке Chromolith Performance RP 18 (1004,6 мм i.d.), элюируя 0,01 М ацетатом аммония в воде (растворитель А) и 100% ацетонитрилом (растворитель В), с использованием следующего градиента элюирования: 0-4 мин 0-100% В, 4-5 мин 100% В при скорости потока 5 мл/мин. Масс-спектры (MS) записывали на микромасс-спектрометре Platform-LC, используя режимы химической положительной ионизации при атмосферном давлении [АР+ с получением молекулярных ионов МН+] или химической отрицательной ионизации при атмосферном давлении [АР- с получением молекулярных ионов (М-Н)-]. Аналитические данные с этого прибора приведены в следующем формате: [М+Н]+ или [М-Н]-.LC/MS (способ F) осуществляли на колонке Sunfire C18 (304,6 мм i.d., диаметр зерна 3,5 мкм) при 30 С, элюируя 0,1% об./об. раствором трифторуксусной кислоты в воде (растворитель А) и 0,1% об./об. Раствором трифторуксусной кислоты в ацетонитриле (растворитель В), с использованием следующего градиента элюирования: 0-0,1 мин 3% В, 0,1-4,2 мин 3-100% В, 4,2-4,8 мин 100% В, 4,8-4,9 мин 100-3% В, 4,9-5,0 мин 3% В при скорости потока 3 мл/мин. УФ-детектирование представляло собой суммированный сигнал от длин волн от 210 до 350 нм, и масс-спектры записывали на масс-спектрометре,используя положительную электроспрей-ионизацию, где данные ионизации округляли до ближайшего целого числа.LC/MS (способ G) осуществляли на колонке Acquity UPLC ВЕН С 18 (502,1 мм i.d., диаметр зерна 1,7 мкм) при 40 С, элюируя 0,1 % об./об. раствором муравьиной кислоты в воде (растворитель А) и 0,1% об./об. раствором муравьиной кислоты в ацетонитриле (растворитель В), с использованием следующего градиента элюирования: 0-1,5 мин 1-97% В, 1,5-1,9 мин 97% В, 1,9-2,0 мин от 97 до 100% В при скорости потока 1 мл/мин. УФ-детектирование представляло собой суммированный сигнал от длин волн от 210 до 350 нм. Масс-спектры записывали на масс-спектрометре Waters ZQ, используя чередующееся сканирование с положительной и отрицательной электроспрей-ионизацией. Данные ионизации округляли до ближайшего целого числа.HPLC осуществляли на колонке Uptisphere-hsc (3 мкм, 333 мм id), элюируя 0,01 М ацетатом аммония в воде (растворитель А) и 100% ацетонитрилом (растворитель В), с использованием следующего градиента элюирования: 0-0,5 мин 5% В, 0,5-3,75 мин 5-100% В, 3,75-4,5 100% В, 4,5-5 100-5% В, 5-5,5 5% В при скорости потока 1,3 мл/мин. Масс-спектры (MS) записывали на микромасс-спектрометре LCT, используя режимы положительной электроспрей-ионизации [ES+ с получением молекулярных ионов МН+] или отрицательной электроспрей-ионизации [ES- с получением молекулярных ионов (М-Н)-].HPLC" осуществляли на системе, такой как система Waters FractionLynx, состоящей из градиентного насоса Waters 600, инжектора/сборника Waters 2767, менеджера реагентов Waters, сборника отходов GilsonAspec, постфракционного УФ-детектора Gilson 115 и компьютерной системы. Используемой колонкой обычно являлась колонка Supelco LCABZ, размеры которой составляли 20 мм внутреннего диаметра на 100 мм длины. Размер частиц неподвижной фазы составлял 5 мкм. Использовали скорость потока 20 мл/мин с 0,1% муравьиной кислотой или трифторуксусной кислотой в воде (растворитель А) и 0,1% муравьиной или трифторуксусной кислотой в ацетонитриле (растворитель В) с использованием подходящего градиента элюирования. Масс-спектры записывали на масс-спектрометре Waters Micromass ZQ с использованием режимов положительной и отрицательной электроспрей-ионизации, чередующиегося сканирования. Используемым программным обеспечением являлось MassLynx 4,0 или эквивалентные альтернативные системы. Методология LCMS Способ формиат (модификатор муравьиная кислота) Условия LC Анализ UPLC (сверхэффективная жидкостная хроматография) осуществляли на колонке AcquityUPLC ВЕН С 18 (50 мм 2,1 мм i.d., диаметр зерна 1,7 мкм) при 40 С. Использовали растворители А = 0,1% об./об. раствор муравьиной кислоты в воде; В = 0,1% об./об. раствор муравьиной кислоты в ацетонитриле. Использовали градиент УФ-детектирование представляло собой суммированный сигнал длин волн от 210 до 350 нм.MS: Waters ZQ Режим ионизации: положительный и отрицательный электроспрей с чередующимся сканированием Диапазон сканирования: от 100 до 200 а.е.м. Время сканирования: 0,27 с Задержка между сканированиями: 0,10 с Способ НрН (модификатор бикарбонат аммония) Условия LC Анализ UPLC осуществляли на колонке Acquity UPLC ВЕН С 18 (502,1 мм, i.d., диаметр зерна 1,7 мкм) при 40 С. Использовали растворители А = 10 мМ гидрокарбоната аммония в воде, доведенного до рН 10 раствором аммиака; В = ацетонитрил. Использовали градиент УФ-детектирование представляло собой суммированный сигнал длин волн от 210 до 350 нм. Условия MSMS: Waters ZQ Режим ионизации: положительный и отрицательный электроспрей с чередующимся сканированием Диапазон сканирования: от 100 до 200 а.е.м. Время сканирования: 0,27 с Задержка между сканированиями: 0,10 с Методология MDAP Способ Формиат (модификатор муравьиная кислота) Условия LC Анализ HPLC осуществляли или колонке Sunfire C18 (10019 мм, i.d., диаметр зерна 5 мкм), или колонке Sunfire C18 (15030 мм, i.d., диаметр зерна 5 мкм) при температуре окружающей среды. Использовали растворители А = 0,1% об./об. раствор муравьиной кислоты в воде; В = 0,1% об./об. раствор муравьиной кислоты в ацетонитриле. Осуществляли с градиентом в течение 15 или 25 мин (удлиненный опыт) со скоростью потока 20 мл/мин (10019 мм, i.d., диаметр зерна 5 мкм) или 40 мл/мин (внутр. диам. 15030 мм, диаметр зерна 5 мкм). УФ-детектирование представляло собой суммированный сигнал длин волн от 210 до 350 нм. Условия MSMS: Waters ZQ Режим ионизации: положительный и отрицательный электроспрей с чередующимся сканированием Диапазон сканирования: от 100 до 1000 а.е.м. Время сканирования : 0,50 с Задержка между сканированиями: 0,20 с Способ НрН (модификатор бикарбонат аммония) Условия LC Анализ HPLC осуществляли или на колонке Xbridge C18 (10019 мм, i.d., диаметр зерна 5 мкм) или колонке Xbridge C18 (10030 мм, i.d., диаметр зерна 5 мкм) при температуре окружающей среды. Использовали растворители А = 10 ммоль бикарбонат аммония в воде, доведенный до рН 10 раствором аммиака; В = ацетонитрил. Осуществляли с градиентом в течение или 15, или 25 мин (удлиненный опыт) со скоростью потока 20 мл/мин (10019 мм, i.d., диаметр зерна 5 мкм) или 40 мл/мин (10030 мм, i.d., диаметр зерна 5 мкм). УФ-детектирование представляло собой суммированный сигнал длин волн от 210 до 350 нм. Условия MSMS: Waters ZQ Режим ионизации: положительный и отрицательный электроспрей с чередующимся сканированием Диапазон сканирования: от 100 до 1000 а.е.м. Время сканирования: 0,50 с Задержка между сканированиями: 0,20 с Суспензию хлорида алюминия (41,2 г, 309 ммоль) в DCM (480 мл) при 0 С в атмосфере азота через канюлю обрабатывали раствором изопропил-2S,4R)-1-ацетил-6-бромо-2-метил-1,2,3,4-тетрагидрохинолин-4-ил)карбамата (30 г, 81 ммоль) в DCM (80 мл) и полученную смесь перемешивали при этой температуре в течение 30 мин. Затем реакционную смесь медленно через канюлю обрабатывали смесью триэтиламина (136 мл, 975 ммоль) и метанола (48 мл). Полученный осадок перемешивали с этилацетатом(800 мл), выделяли путем фильтрации и затем распределяли между DCM (800 мл) и насыщенным водным раствором NaHCO3 (800 мл). Добавляли тартрат натрия калия (300 г) и полученную смесь интенсивно перемешивали в течение 2 ч. Слои разделяли и слой DCM фильтровали через воронку с фильтром из пористого стекла. Фильтрат сушили (MgSO4) и концентрировали в вакууме с получением первой части 1-2S,4R)-4-амино-6-бромо-2-метил-3,4-дигидрохинолин-1(2H)-ил)этанона (19,6 г, 69,2 ммоль, 85%ный выход) в виде желтой пены. Далее водную фазу обрабатывали DCM (800 мл) и двухфазную смесь перемешивали в течение ночи. Затем слои разделяли и органический слой сушили над MgSO4 и концентрировали в вакууме с получением второй части 1-2S,4R)-4-амино-6-бромо-2-метил-3,4-дигидрохинолин-1(2H)-ил)этанона (3,4 г, 12,01 ммоль, 14,78%-ный выход). LCMS (НрН, 2 мин), Rt=0,77 мин,МН+ = 283 (1 Br). Промежуточное соединение 2 6-2S,4R)-1-Ацетил-6-бромо-2-метил-1,2,3,4-тетрагидрохинолин-4-ил)амино)никотинонитрил К смеси 1-2S,4R)-4-амино-6-бромо-2-метил-3,4-дигидрохинолин-1(2H)-ил)этанона (для получения см. промежуточное соединение 1) (2,28 г, 8,05 ммоль) и 6-хлорникотинонитрила (2,231 г, 16,10 ммоль) добавляли NMP (20 мл) и смесь обрабатывали DIPEA (4,22 мл, 24,16 ммоль). Смесь разделяли между 2 колбами и каждую колбу продували азотом, герметизировали и перемешивали при облучении микроволнами при 200 С в течение 2 ч. Реакционные смеси объединяли и распределяли между водой и EtOAc. Водный слой экстрагировали EtOAc (4) и объединенные органические слои промывали водой (3), затем рассолом и сушили (MgSO4), фильтровали и концентрировали в вакууме. Коричневый твердый остаток очищали посредством хроматографии (градиент EtOAc в гексанах) с получением 6-2S,4R)-1-ацетил-6-бромо-2-метил-1,2,3,4-тетрагидрохинолин-4-ил)амино)никотинонитрила (1,940 г, 5,04 ммоль,62,5%-ный выход) в виде бледно-желтой пены. LCMS (НрН, 2 мин), Rt = 1,02 мин, МН+ = 386 (1 Br). Промежуточное соединение 3 Метил-4-2S,4R)-1-ацетил-4-5-цианопиридин-2-ил)амино)-2-метил-1,2,3,4-тетрагидрохинолин-6 ил)бензоат(0) (300 мг, 0,260 ммоль) и карбонат калия (1076 мг, 7,79 ммоль), добавляли DME (20 мл) и воду (4,0 мл). Полученную смесь перемешивали при 100 С в атмосфере азота в течение 1 ч, затем охлаждали до комнатной температуры и концентрировали в вакууме. Остаток распределяли между EtOAc и водой и слои разделяли. Органическую фазу сушили (MgSO4), концентрировали в вакууме и остаток очищали посредством хроматографии (колонка 10 g, градиент MeOH/DCM) с получением метил-4-2S,4R)-1-ацетил-45-цианопиридин-2-ил)амино)-2-метил-1,2,3,4-тетрагидрохинолин-6-ил)бензоата (1002 мг, 2,275 ммоль,88%-ный выход) в виде оранжевой пены. LCMS (НрН, 2 мин), Rt = 1,09 мин, МН+ = 441.(15 мл) при комнатной температуре обрабатывали водным раствором гидроксида натрия (2 н., 2,27 мл,4,54 ммоль) и полученную смесь перемешивали при этой температуре в течение 24 ч. Объем МеОН выпаривали в вакууме и водный остаток обрабатывали уксусной кислотой (0,39 мл, 6,81 ммоль), что давало осадок, который выделяли путем фильтрации и сушили в вакууме при 40 С, с получением 4-2S,4R)-1 ацетил-4-5-цианопиридин-2-ил)амино)-2-метил-1,2,3,4-тетрагидрохинолин-6-ил)бензойной кислоты(820 мг, 1,923 ммоль, 85%-ный выход) в виде желтого твердого вещества. LCMS (НрН, 2 мин), Rt = 0,64 мин, МН+ = 427. Промежуточное соединение 5 6-2S,4R)-1-Ацетил-2-метил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,2,3,4-тетрагидрохинолин-4-ил)амино)никотинонитрил В колбу, в которую загружали 6-2S,4R)-1-ацетил-6-бромо-2-метил-1,2,3,4-тетрагидрохинолин-4 ил)амино)никотинонитрил (для получения см. промежуточное соединение 2) (847 мг, 2,199 ммоль), бис(пинаколато)дибор (1228 мг, 4,84 ммоль), PdCl2(dppf) (161 мг, 0,220 ммоль) и ацетат калия (324 мг, 3,30 ммоль), добавляли DMSO (7 мл), смесь дегазировали в атмосфере азота и перемешивали в атмосфере азота в течение 1 ч при 80 С. Добавляли дополнительные порции бис-(пинаколато)дибора (1 г),PdCl2(dppf) (100 мг) и ацетата калия (150 мг) и смесь перемешивали в течение 45 мин. Добавляли дополнительные порции бис-(пинаколато)дибора (1 г), PdCl2(dppf) (100 мг) и ацетата калия (150 мг) и смесь перемешивали в течение 45 мин. Реакционную смесь охлаждали до комнатной температуры и обрабатывали EtOAc и водой. Двухфазную смесь фильтровали через набивку Celite (10 г) и слои разделяли. Водный слой экстрагировали EtOAc (2) и объединенные органические слои промывали водой (4), затем рассолом, сушили (MgSO4) и концентрировали в вакууме. Очистка остатка посредством хроматографии [колонка 50 г, градиент EtOAc/гексаны] давала 6-2S,4R)-1-ацетил-2-метил-6-(4,4,5,5-тетраметил 1,3,2-диоксаборолан-2-ил)-1,2,3,4-тетрагидрохинолин-4-ил)амино)никотинонитрил (800 мг, 1,850 ммоль,84%-ный выход) в виде красной смолы. LCMS (формиат, 2 мин), Rt = 1,08 мин, МН+ = 433. Промежуточное соединение 6 Метил-6-2S,4R)-1-ацетил-4-5-цианопиридин-2-ил)амино)-2-метил-1,2,3,4-тетрагидрохинолин-6 ил)никотинат(8 мл) и этанол (8 мл). Полученную смесь перемешивали при 90 С в атмосфере азота в течение 3 ч., после чего добавляли порции карбоната калия (384 мг), тетракис(трифенилфосфин)палладия (0) (107 мг) и метил-6-бромоникотината (220 мг) добавляли и перемешивание реакционной смеси продолжалось в течение 5 ч. Затем смесь охлаждали до комнатной температуры и концентрировали в вакууме. Остаток распределяли между EtOAc и водой. Фазы разделяли и водный слой экстрагировали EtOAc. Объединенные органические слои промывали рассолом, сушили (MgSO4) и концентрировали в вакууме. Остаток очищали посредством хроматографии [колонка 25 г, градиент EtOAc/гексаны] с получением этил-6- 16022341(10 мл) обрабатывали водным раствором гидроксида лития (1 н., 2,55 мл, 2,55 ммоль) и полученную смесь перемешивали в течение 2 ч. Объем этанола выпаривали в вакууме и остаток разбавляли водой (ок. 5 мл). Мутную смесь обрабатывали уксусной кислотой (0,146 мл, 2,55 ммоль) и образовавшийся осадок выделяли путем фильтрации, промывали Et2O и сушили при 60 С в течение 16 ч с получением 62S,4R)-1-ацетил-4-5-цианопиридин-2-ил)амино)-2-метил-1,2,3,4-тетрагидрохинолин-6-ил)никотиновой кислоты (410 мг, 0,959 ммоль, 75%-ный выход) в виде бледно-желтого твердого вещества, которое использовали на следующей стадии без дальнейшей очистки. LCMS (НрН, 2 мин), Rt = 0,63 мин, МН+ = 428. Промежуточное соединение 8 Этил-2-(4-2S,4R)-1-ацетил-4-5-цианопиридин-2-ил)амино)-2-метил-1,2,3,4-тетрагидрохинолин-6 ил)фенил)ацетат(1,67 г, 3,86 ммоль), этил-2-(4-бромофенил)ацетата (1,127 г, 4,64 ммоль) и карбоната калия (1,602 г, 11,59 ммоль) в толуоле (10 мл) и этаноле (10,0 мл) добавляли тетракис(трифенилфосфин)палладий (0) (0,446 г,0,386 ммоль) в атмосфере азота. Реакционную смесь нагревали при 100 С в течение 1 ч, затем распределяли между EtOAc и водой. Слои разделяли и водную фазу экстрагировали EtOAc (3). Объединенные органические слои промывали рассолом, сушили (MgSO4), фильтровали и концентрировали в вакууме. Остаток очищали посредством флэш-хроматографии на силикагеле (25 г), элюируя градиентомEtOAc/циклогексан (от 10 до 80%). Подходящие фракции объединяли и концентрировали в вакууме с получением этил-2-(4-2S,4R)-1-ацетил-4-5-цианопиридин-2-ил)амино)-2-метил-1,2,3,4-тетрагидрохинолин-6-ил)фенил)ацетата (752 мг, 42%) в виде вязкого бесцветного масла. LCMS (формиат, 2 мин), Rt = 1,10 мин, МН+ = 469. Промежуточное соединение 9 2-(4-2S,4R)-1-Ацетил-4-5-цианопиридин-2-ил)амино)-2-метил-1,2,3,4-тетрагидрохинолин-6 ил)фенил)уксусной кислоты, литиевая соль К раствору этил-2-(4-2S,4R)-1-ацетил-4-5-цианопиридин-2-ил)амино)-2-метил-1,2,3,4-тетрагидрохинолин-6-ил)фенил)ацетата (для получения см. промежуточное соединение 8) (300 мг, 0,640 ммоль) в метаноле (5 мл) добавляли раствор лития гидроксида (0,768 мл, 0,768 ммоль). Полученную смесь перемешивали при 40 С в течение 2 ч, после чего ее концентрировали в вакууме с получением неочищенного карбоксилата лития 2-(4-2S,4R)-1-ацетил-4-5-цианопиридин-2-ил)амино)-2-метил-1,2,3,4-тетрагидрохинолин-6-ил)фенил)уксусной кислоты (286 мг, 100%) в виде белого твердого вещества, которое использовали на следующей стадии без дальнейшей очистки. LCMS (формиат, 2 мин), Rt = 1,10 мин, МН+ = 433. К раствору 6-2S,4R)-1-ацетил-2-метил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,2,3,4 тетрагидрохинолин-4-ил)амино)никотинонитрила (для получения см. промежуточное соединение 5) (382 мг, 0,884 ммоль) и 3-(4-бромофенил)пропановой кислоты (243 мг, 1,060 ммоль) в толуоле (6 мл) и этаноле (6 мл) последовательно добавляли тетракис(трифенилфосфин)палладий (0) (102 мг, 0,088 ммоль) и карбонат калия (366 мг, 2,65 ммоль). Полученную смесь перемешивали при 80 С в течение 2 ч, затем распределяли между водой и EtOAc. Слои разделяли и водную фазу экстрагировали EtOAc (3). Объединенные органические слои промывали рассолом, сушили (MgSO4), фильтровали и концентрировали в вакууме. Неочищенный остаток очищали посредством колоночной хроматографии на силикагеле (25 г),элюируя EtOAc в циклогексане (10-70%). Подходящие фракции объединяли и концентрировали при пониженном давлении с получением 3-(4-2S,4R)-1-ацетил-4-5-цианопиридин-2-ил)амино)-2-метил 1,2,3,4-тетрагидрохинолин-6-ил)фенил)пропановой кислоты (209 мг, 52%) в виде белого твердого вещества. LCMS (формиат, 2 мин), Rt = 0,91 мин, МН+ = 455. Промежуточное соединение 11 1-Метилэтил-(2 Е)-2-бутеноилкарбаматLara и добавляли сухой тетрагидрофуран (THF) (150 мл). Добавляли (2 Е)-2-бутеноилхлорид (31,2 мл, 326 ммоль, имеющийся в продаже у Aldrich) в атмосфере азота и теплообменную рубашку охлаждали до-30 С. Когда температура раствора достигала -17 С, добавляли раствор трет-бутоксида лития в THF (1 М, 655 мл, 655 ммоль) посредством перистальтического насоса в течение 2 ч, поддерживая температуру реакции между -10 и -18 С. Когда добавление завершали, смесь перемешивали в течение 30 мин и доводили до 0 С. Добавляли диэтиловый эфир (450 мл) и соляную кислоту (1 М, 375 мл) и смесь доводили до 20 С с интенсивным перемешиванием. Перемешивание прекращали, слоям позволяли разделиться и водный слой отделяли. Добавляли рассол (375 мл) и смесь интенсивно перемешивали. Перемешивание останавливали, слоям позволяли разделиться и водный слой отделяли. Органический слой сушили (MgSO4),фильтровали и выпаривали до коричневого масла (60 г). Масло вводили в колонку с силикагелем (40+МBiotage) и элюировали DCM/этилацетатом (от 1:1 до 0:1, 10 CV). Фракции, содержавшие продукт, выпаривали досуха и вводили в колонку с силикагелем Redisep Isco (1500 г) и элюировали градиентом этилацетата в циклогексане (0-40%). Чистые фракции, содержавшие продукт, выпаривали до беловатого твердого вещества (15,41 г). LCMS (способ С): Rt = 0,68 мин, МН+ = 172. Промежуточное соединение 12 1-Метилэтил-(3S)-3-[(4-бромофенил)амино]бутаноилкарбамат 1-Метилэтил-(2 Е)-2-бутеноилкарбамат (для получения см. промежуточное соединение 11) (9,38 г,54,8 ммоль) перемешивали в толуоле (281 мл) в атмосфере азота и добавляли (R-BINAP)дитрифлатбис(ацетонитрил)палладий (II) (промежуточное соединение 24, 3,35 г, 3,01 ммоль). Катализатор образовывал липкий шар, раствор становился непрозрачной желтой смесью, и его далее перемешивали в течение 20 мин. Добавляли 4-броманилин (14,14 г, 82 ммоль), раствор становился прозрачным светло-коричневым,и клейкий катализатор впоследствии растворялся. Смесь перемешивали в течение 16 ч. Сходным образом, вторую порцию 1-метилэтил-(2 Е)-2-бутеноилкарбамата (промежуточное соединение 11 , 8,51 г, 49,7 ммоль) перемешивали в толуоле (255 мл) в атмосфере азота и добавляли (R-BINAP)дитрифлатбис(ацетонитрил)палладий (II) (3,04 г, 2,73 ммоль). Катализатор образовывал липкий шар, раствор становился непрозрачной желтой смесью, и его далее перемешивали в течение 20 мин. Добавляли 4 броманилин (12,83 г, 74,6 ммоль), раствор становился прозрачным светло-коричневым, и клейкий ката- 18022341 лизатор впоследствии растворялся. Смесь перемешивали в течение 16 ч. Две реакционные смеси объединяли и загружали в колонку, содержащую 1,5 кг силикагеля Isco silica Redisep. Колонку элюировалиDCM/MeOH (0%-0,5%, 19 CV). Чистые, содержащие продукт фракции, выпаривали до бледнокоричневого масла. Смесь сушили в вакуумной печи в течение ночи при 40 С с получением белого твердого вещества (24,2 г, 67%-ный общий выход). LCMS (способ С): Rt = 0,91 мин, МН+ = 343, энантиомерный избыток = 92%. Промежуточное соединение 13 1-Метилэтил-[(2S,4R)-6-бромо-2-метил-1,2,3,4-тетрагидро-4-хинолинил]карбамат 1-Метилэтил-(3S)-3-[(4-бромофенил)амино]бутаноилкарбамат (для получения см. промежуточное соединение 12) (17,9 г, 52,2 ммоль) помещали в этанол (150 мл) и охлаждали до температуры менее-10 С (внутренняя температура) на бане СО 2/ацетон. Добавляли NaBH4 (1,381 г, 36,5 ммоль), затем добавляли гексагидрат хлорида магния (11,35 г, 55,8 ммоль) в воде (25 мл), поддерживая температуру ниже-5 С. Смесь перемешивали при 0 С в течение 1 ч, затем нагревали до комнатной температуры и перемешивали в течение 1 ч. Полученную вязкую суспензию вливали в смесь лимонной кислоты (25,05 г, 130 ммоль), HCl (1 M в воде, 205 мл, 205 ммоль) и DCM (205 мл). Двухфазную смесь перемешивали при комнатной температуре в течение 1 ч. Слои разделяли и органический слой сушили с Na2SO4, фильтровали и концентрировали с получением продукта в виде светло-коричневого твердого вещества (14,1 г). 1-Метилэтил-[(2S,4R)-6-бромо-2-метил-1,2,3,4-тетрагидро-4-хинолинил]карбамат (для получения см. промежуточное соединение 13) (14,1 г, 43,1 ммоль) помещали в DCM (400 мл) в атмосфере азота при комнатной температуре. Добавляли пиридин (10,46 мл, 129 ммоль), затем ацетилхлорид (4,60 мл, 64,6 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 16 ч, затем распределяли между EtOAc (2000 мл) и насыщенным водный раствором NaHCO3 (800 мл). Слои разделяли и органическую фазу промывали водой, затем рассолом (по 1500 мл каждый), затем сушили с Na2SO4 и концентрировали в вакууме с получением фиолетового твердого вещества. Неочищенный продукт вносили в минимальное количество DCM и вносили в колонку Companion XL 330 г и элюировали градиентом 1263% этилацетата в циклогексане с получением продукта в виде беловатого твердого вещества (12,37 г). 1-Метилэтил-[(2S,4R)-1-ацетил-6-бромо-2-метил-1,2,3,4-тетрагидро-4-хинолинил]карбамат (для получения см. промежуточное соединение 14), (39,0 г, 106 ммоль), 4-[(этилокси)карбонил]фенилбороновую кислоту (22,5 г, 116 ммоль) и тетракис(трифенилфосфин)палладий (0) (1,83 г, 1,58 ммоль) смешивали в DME (430 мл) и полученную смесь обрабатывали водным Na2CO3 (2 н., 210 мл, 420 ммоль). Смесь дегазировали в вакууме с несколькими продувками азотом и затем перемешивали при 105 С в атмосфере азота в течение приблизительно 6 ч, после чего оставляли остужаться до комнатной температуры. Смесь распределяли между EtOAc и водой и слои разделяли. Водную фазу экстрагировали EtOAc и объединенные органические фазы промывали рассолом. Затем органическую фазу фильтровали через картридж с 70 г диоксида кремния, картридж промывали EtOAc. Объединенный фильтрат и промывки концентрировали в вакууме. Остаток растирали с Et2O, затем отфильтровывали. Полученное твердое вещество сушили на воздухе с получением этил-4-[(2S,4R)-1-ацетил-2-метил-4-([(1-метилэтил)окси]карбониламино)-1,2,3,4-тетрагидро-6-хинолинил]бензоата (35,2 г, 80,2 ммоль, 76%) в виде серого твердого вещества. Фильтрат концентрировали в вакууме и полученный остаток растирали с Et2O(приблизительно 30 мл). Полученное твердое вещество выделяли путем фильтрации и сушили на воздухе с получением этил-4-[(2S,4R)-1-ацетил-2-метил-4-([(1-метилэтил)окси]карбониламино)-1,2,3,4-тетрагидро-6-хинолинил]бензоата в виде серого твердого вещества (5,96 г, 13,5 ммоль, 13%). LCMS (формиат,2 мин), Время удерживания: 1,16 мин, МН+ = 439. Промежуточное соединение 16 Этил-4-[(2S,4R)-1-ацетил-4-амино-2-метил-1,2,3,4-тетрагидро-6-хинолинил]бензоат Этил-4-[(2S,4R)-1-ацетил-2-метил-4-([(1-метилэтил)окси]карбониламино)-1,2,3,4-тетрагидро-6 хинолинил]бензоат (для получения см. промежуточное соединение 15) (8,90 г, 20,30 ммоль) добавляли к суспензии хлорида алюминия (10,3 г, 77 ммоль) в DCM (160 мл), охлажденной на бане лед/вода. После добавления температура повышалась с 0 С до приблизительно 6 С. Полученную смесь перемешивали при приблизительно 0 С в течение 20 мин и затем обрабатывали раствором метанола (18 мл) и триэтиламина (34 мл, 245 ммоль) в течение 30 с. Полученную смесь перемешивали при 0 С в течение 30 мин и затем распределяли между EtOAc и насыщенным водным раствором NaHCO3. Такую же реакцию осуществляли параллельно, используя этил-4-[(2S,4R)-1-ацетил-2-метил-4-([(1-метилэтил)окси]карбониламино)-1,2,3,4-тетрагидро-6-хинолинил]бензоат (для получения см. промежуточное соединение 15)(0,89 г, 2,030 ммоль), хлорид алюминия (1,03 г, 7,72 ммоль), триэтиламин (3,4 мл, 24,53 ммоль), DCM (16 мл) и МеОН (1,3 мл). Продукты обеих реакций объединяли на этой стадии и полученную смесь перемешивали при комнатной температуре в течение приблизительно 10 мин (общий объем приблизительно 1 л). Смесь фильтровали через Celite, нерастворимый остаток промывали EtOAc и насыщенным водным раствором NaHCO3 и слои разделяли. Водную фазу экстрагировали EtOAc и объединенные органические фазы промывали рассолом, сушили (гидрофобная керамика) и концентрировали в вакууме с получением этил-4-[(2S,4R)-1-ацетил-4-амино-2-метил-1,2,3,4-тетрагидро-6-хинолинил]бензоата (6,6 г, 84% с поправкой на добавку из параллельного эксперимента) в виде кремового твердого вещества. LCMS (формиат, 2 мин). Время удерживания: 0,73 мин, [M-NH2]+ = 336. Промежуточное соединение 17 Этил-4-(2S,4R)-1-ацетил-4-[(4-хлорфенил)амино]-2-метил-1,2,3,4-тетрагидро-6-хинолинилбензоат Этил-4-[(2S,4R)-1-ацетил-4-амино-2-метил-1,2,3,4-тетрагидро-6-хинолинил]бензоат (для получения см. промежуточное соединение 16) (6,6 г, 18,73 ммоль), 1-бром-4-хлорбензол (3,94 г, 20,60 ммоль), бис(дибензилиденацетон)палладий (0) (690 мг, 1,2 ммоль) и [2'-(дициклогексилфосфанил)-2-бифенилил]диметиламин (Dave-phos) (590 мг, 1,499 ммоль) смешивали в толуоле (120 мл) и полученную смесь обрабатывали трет-бутоксидом натрия (2,52 г, 26,2 ммоль). Реакционную смесь дегазировали в вакууме с несколькими продувками азотом, нагревали при 70 С в атмосфере азота в течение 16 ч, затем оставляли охлаждаться до комнатной температуры и фильтровали. Нерастворимый остаток промывали толуолом и затем Et2O. Объединенный фильтрат и промывки промывали водой (2), затем экстрагировали соляной кислотой (2 н., 20), что приводило к осаждению оранжевого масла, которое собирали с водными кислотными фазами. Кислотные экстракты промывали Et2O и объединенные органические фазы промывали рассолом, сушили (гидрофобная керамика) и концентрировали в вакууме. Остаток очищали посредством хроматографии на картридже из диоксида кремния (330 г), элюируя градиентом EtOAc/циклогексан (545%). Подходящие фракции объединяли и выпаривали досуха в вакууме с получением бледно-желтой пены. Эту пену растворяли в EtOAc (50 мл) и обрабатывали функционализированным тиомочевинной силикагелем (0,56 г, палладиевый поглотитель). Смесь перемешивали при комнатной температуре (воздушная атмосфера) в течение 20 мин и затем оставляли при комнатной температуре в течение 16 ч. Смесь фильтровали и нерастворимые остатки промывали EtOAc. Объединенные фильтрат и промывки концентрировали в вакууме с получением этил-4-(2S,4R)-1-ацетил-4-[(4-хлорфенил)амино]-2-метил- 20022341(для получения см. промежуточное соединение 17) (5,41 г, 11,69 ммоль) растворяли в этаноле (100 мл) и раствор обрабатывали водным раствором NaOH (2 М, 50 мл, 100 ммоль). Полученную смесь перемешивали при комнатной температуре (воздушная атмосфера) в течение приблизительно 2 ч, затем большую часть этанола удаляли в вакууме. Полученный желтый раствор разбавляли водой (полученной в ходе образования маслянистого желтого осадка). Водную фазу дважды промывали DCM (что не растворяло образовавшийся до этого осадок), затем подкисляли соляной кислотой (2 н.) до рН 1 и экстрагировалиEtOAc (2). Объединенные фазы EtOAc промывали рассолом, сушили (гидрофобная керамика) и концентрировали в вакууме. Оставшуюся желтую пену растирали с Et2O в течение приблизительно 1 ч. Полученное твердое вещество выделяли путем фильтрации, промывали Et2O и сушили на воздухе с получением 4-(2S,4R)-1-ацетил-4-[(4-хлорфенил)амино]-2-метил-1,2,3,4-тетрагидро-6-хинолинилбензойная кислота (4,41 г, 10,1 ммоль, 87%) в виде кремового твердого вещества. LCMS (НрН). Время удерживания 1,08 мин, [М-Н]- = 433. Промежуточное соединение 19 Метил-4-2S,4R)-1-ацетил-4-изопропоксикарбонил)амино)-2-метил-1,2,3,4-тетрагидрохинолин-6 ил)бензоат(5 г, 13,54 ммоль) и метил-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)бензоата (3,90 г, 14,89 ммоль) в DME (50 мл) и воде (10,0 мл) последовательно добавляли тетракис(трифенилфосфин)палладий (1,565 г,1,354 ммоль) и карбонат калия (5,61 г, 40,6 ммоль). Полученную смесь перемешивали при 100 С в течение 1 ч, после чего ее оставляли охлаждаться до комнатной температуры и фильтровали через Celite. Фильтрат концентрировали в вакууме и остаток распределяли между EtOAc и водой. Водную фазу экстрагировали EtOAc (3) и объединенные органические слои промывали рассолом, сушили над MgSO4,фильтровали и концентрировали в вакууме. Неочищенное соединение очищали посредством флэшхроматографии на картридже с силикагелем (50 г), элюируя EtOAc в циклогексане (5-60%). Подходящие фракции объединяли и концентрировали при пониженном давлении с получением метил-4-2S,4R)-1 ацетил-4-изопропоксикарбонил)амино)-2-метил-1,2,3,4-тетрагидрохинолин-6-ил)бензоата (4,64 г, 81%) в виде белой смолы. LCMS (формиат, 2 мин), Rt = 1,09 мин, МН+ = 425. Промежуточное соединение 20 Лития 4-2S,4R)-1-ацетил-4-изопропоксикарбонил)амино)-2-метил-1,2,3,4-тетрагидрохинолин-6 ил)бензоат К раствору метил-4-2S,4R)-1-ацетил-4-изопропоксикарбонил)амино)-2-метил-1,2,3,4-тетрагидрохинолин-6-ил)бензоата (для получения см. промежуточное соединение 19) (1,63 г, 3,84 ммоль) в метаноле (20 мл) добавляли гидроксид лития (4,61 мл, 4,61 ммоль). Полученную смесь перемешивали при 40 С в течение 6 ч, после чего ее концентрировали при пониженном давлении с получением лития 4-2S,4R)1-ацетил-4-изопропоксикарбонил)амино)-2-метил-1,2,3,4-тетрагидрохинолин-6-ил)бензоата (1,65 г,100%), который не очищали, а непосредственно использовали на следующей стадии. LCMS (формиат, 2EtOAc и соляной кислотой (2 М). Фазы разделяли и водную фазу экстрагировали EtOAc (3). Объединенные органические слои промывали рассолом, сушили над MgSO4, фильтровали и концентрировали в вакууме с получением 4-2S,4R)-1-ацетил-4-изопропоксикарбонил)амино)-2-метил-1,2,3,4-тетрагидрохинолин-6-ил)бензойной кислоты (898 мг, 87%) в виде белого твердого вещества. LCMS (формиат, 2 мин), Rt = 0,87, МН+ = 411. Промежуточное соединение 22 Этил-2-(4-2S,4R)-1-ацетил-4-изопропоксикарбонил)амино)-2-метил-1,2,3,4-тетрагидрохинолин 6-ил)фенил)ацетат В колбу, в которую загружали этил(4-бромофенил)ацетат (0,174 мл, 1,000 ммоль), 1-метилэтил[(2S,4R)-1-ацетил-2-метил-6-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-1,2,3,4-тетрагидро-4-хинолинил]карбамат (416 мг, 1 ммоль), карбонат калия (415 мг, 3,00 ммоль) и PdCl2(dppf) (73,2 мг, 0,100 ммоль),добавляли 1,4-диоксан (6 мл) и воду (2,0 мл) и колбу продували азотом. Полученную смесь перемешивали при облучении микроволнами при 120 С в течение 30 мин, затем охлаждали до комнатной температуры. Объем диоксана удаляли в вакууме и остаток распределяли между EtOAc и водой. Слои разделяли и водную фазу экстрагировали EtOAc. Объединенные органические слои промывали рассолом, сушили надMgSO4 и концентрировали в вакууме. Остаток очищали посредством хроматографии (колонка 25 г, МеОН/DCM) с получением этил-2-(4-2S,4R)-1-ацетил-4-изопропоксикарбонил)амино)-2-метил-1,2,3,4 тетрагидрохинолин-6-ил)фенил)ацетата (270 мг, 59,7%-ный выход). Это соединение использовали на следующей стадии без дополнительной очистки. LCMS (НрН, 2 мин), Rt = 1,16 мин, МН+ = 453. Промежуточное соединение 23 2-(4-2S,4R)-1-Ацетил-4-изопропоксикарбонил)амино)-2-метил-1,2,3,4-тетрагидрохинолин-6 ил)фенил)уксусная кислота К раствору этил 4-[(2S,4R)-1-ацетил-2-метил-4-([(1-метилэтил)окси]карбониламино)-1,2,3,4-тетрагидро-6-хинолинил]фенилацетата (для получения см. промежуточное соединение 22) (270 мг, 0,597 ммоль) в метаноле (6 мл) и воде (2,0 мл) добавляли водный гидроксид натрия (2 н., 0,597 мл, 1,193 ммоль) при комнатной температуре и полученную смесь перемешивали в течение 6 ч. Добавляли водный гидроксид натрия (2 н., 0,5 мл) и смесь оставляли стоять в течение ночи. Объем метанола удаляли в вакууме и полученный остаток распределяли между водой и Et2O, и слои разделяли. Водный слой подкисляли соляной кислотой (2 н., 2 мл) и дважды экстрагировали EtOAc. Объединенные органические фазы сушили над MgSO4 и концентрировали в вакууме с получением 4-[(2S,4R)-1-ацетил-2-метил-4-([(1 метилэтил)окси]карбониламино)-1,2,3,4-тетрагидро-6-хинолинил]фенилуксусной кислоты (200 мг,0,471 ммоль, 79%-ный выход) в виде коричневой пены. Это соединение использовали на следующей стадии без дополнительной очистки. LCMS (НрН, 2 мин), Rt = 0,65 мин, МН+ = 425.R-(+)-BINAP (6,08 г, 9,76 ммоль, приобретенный у Avocado) перемешивали в DCM (626 мл) и добавляли дихлорбис-(ацетонитрил)палладий (II) (2,5 г, 9,64 ммоль, приобретенный у Aldrich). Смесь перемешивали в атмосфере азота в течение 30 мин, пока суспензия не становилась раствором, и добавляли дополнительное количество DCM (100 мл). Смесь перемешивали в течение последующих 30 мин и добавляли трифлат серебра (5,00 г, 19,47 ммоль, приобретенный у Aldrich), растворенный в ацетонитриле(250 мл). Смесь меняла цвет из оранжевой мутной суспензии на желтую суспензию. Смесь перемешивали в течение 1 ч, фильтровали через Celite и выпаривали до оранжевого твердого вещества. Остаток сушили в вакууме (приблизительно при 14 мбар, 1,4 кПа) при комнатной температуре в течение выходных с получением целевого продукта (10,69 г). 1 Н ЯМР (400 МГц, MeCN-d3)м.д. (миллионные доли) 2.0 (s, 6 Н), 6.7 (d, 2H), 6.9 (br m, 4H), 7.1 (br t, 2H), 7.2 (t, 2 Н), 7.5-7.9 (m, 22 Н). Пример 1 2-(Диметиламино)этил-4-2S,4R)-1-ацетил-4-4-хлорфенил)амино)-2-метил-1,2,3,4-тетрагидрохинолин-6-ил)бензоата гидрохлорид(1 мл). Добавляли DMAP (33,7 мг, 0,276 ммоль) и DCC (52,2 мг, 0,253 ммоль) и смесь перемешивали в течение 5 мин, получая прозрачный желтый раствор. Последовательно добавляли 2-(диметиламино)этанол (20,5 мг, 0,230 ммоль) в DCM (0,5 мл) и реакционную смесь перемешивали при комнатной температуре в течение ночи. Реакционную смесь разбавляли DCM (8,5 мл) и промывали NaOH (2 н.),водой и рассолом (10 мл каждого), затем сушили с Na2SO4, фильтровали и концентрировали в вакууме с получением беловатого полутвердого вещества. Неочищенный продукт растворяли в минимальном объеме DCM (с несколькими каплями МеОН для способствования растворению) и загружали в картридж 25 г. Картридж сушили в вакууме при 40 С в течение 1 ч, затем элюировали 1% 2 М NH3 в метаноле/DCM двумя CV, затем 1-5% 2 М NH3 в метаноле в DCM в течение 10 CV, затем поддерживали при 5% в течение 5 CV. Подходящие фракции концентрировали в вакууме с получением свободного аминного продукта (18,8 мг) в виде прозрачного масла. Последний вносили в минимальное количество DCM, добавлялиHCl в Et2O (1 н., 0,19 мл, 0,190 ммоль) и растворитель выпаривали в потоке азота. Добавляли небольшое количество Et2O (1 мл) и выпаривали в атмосфере азота с получением 2-(диметиламино)этил-4(2S,4R)-1-ацетил-4-[(4-хлорфенил)амино]-2-метил-1,2,3,4-тетрагидро-6-хинолинилбензоата гидрохлорида (76,7 мг, 0,135 ммоль, 58,6%-ный выход) в виде белого твердого вещества. LCMS (формиат, 2 мин),Rt = 0,91 мин, МН+ = 506. 1 Н ЯМР (DMSO-d6):1.16 (3 Н, d), 1.30 (1 Н, m), 2.21 (3 Н, s), 2.65-2.74 (7 Н, m), 3.24 (2H, m), 4.36(170 мг, 0,690 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи,после чего ее концентрировали при пониженном давлении. Остаток растворяли в смеси 1:1 MeOH/DMSO смесь и очищали посредством MDAP (формиат). Подходящие фракции объединяли и концентрировали в вакууме с получением 2-4-2S,4R)-1-ацетил-4-4-хлорфенил)амино)-2-метил-1,2,3,4-тетрагидрохинолин-6-ил)бензоил)окси)-N,N,N-триметилэтанаминия, формиата (133 мг, 51%) в виде беловатого твердого вещества. LCMS (формиат, 2 мин), Rt = 0,89 мин, МН+ = 520. Пример 3 3-4-2S,4R)-1-Ацетил-4-4-хлорфенил)амино)-2-метил-1,2,3,4-тетрагидрохинолин-6-ил)бензоил)окси)-N,N,N-триметилпропан-1-аминий, формиат 4-(2S,4R)-1-Ацетил-4-[(4-хлорфенил)амино]-2-метил-1,2,3,4-тетрагидро-6-хинолинилбензойную кислоту (для получения см. промежуточное соединение 18) (150 мг, 0,345 ммоль) растворяли в DMF (3 мл) и добавляли K2CO3 (47,7 мг, 0,345 ммоль), затем добавляли 3-бром-N,N,N-триметил-1-пропанаминий, бромид (90 мг, 0,345 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи, после чего реакционную смесь концентрировали в вакууме и очищали посредством MDAP(10 мл) последовательно добавляли 3-(диметиламино)-1-пропанол (71,2 мг, 0,690 ммоль), EDC (220 мг,1,150 ммоль) и DMAP (7,0 мг, 0,057 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи, затем концентрировали в вакууме, растворяли в смеси 1:1 MeOH/DMSO и очищали посредством MDAP (НрН). Подходящие фракции объединяли и концентрировали при пониженном давлении с получением 3-(диметиламино)пропил-4-2S,4R)-1-ацетил-4-4-хлорфенил)амино)-2-метил 1,2,3,4-тетрагидрохинолин-6-ил)бензоата (41 мг, 17%) в виде вязкого бесцветного масла. LCMS (формиат, 2 мин), Rt = 0,94 мин, МН+ = 520. Пример 5 3-(Диметиламино)пропил-6-2S,4R)-1-ацетил-4-5-цианопиридин-2-ил)амино)-2-метил-1,2,3,4 тетрагидрохинолин-6-ил)никотинатDMAP (2,86 мг, 0,023 ммоль). Полученную смесь перемешивали при комнатной температуре в течение ночи, реакционную смесь концентрировали в вакууме, растворяли в смеси 1:1 MeOH/DMSO и очищали посредством MDAP (НрН). Подходящие фракции объединяли и концентрировали при пониженном давлении с получением 3-(диметиламино)пропил-6-2S,4R)-1-ацетил-4-5-цианопиридин-2-ил)амино)-2 метил-1,2,3,4-тетрагидрохинолин-6-ил)никотинат (23 мг, 19%) в виде бесцветного масла. LCMS (форми- 24022341DMF (5 мл) добавляли K2CO3 (26,2 мг, 0,189 ммоль) и 2-бром-N,N-диметилэтанамин (28,8 мг, 0,189 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 3 ч, реакционную смесь концентрировали при пониженном давлении и остаток растворяли в смеси 1:1 MeOH/DMSO и очищали посредством MDAP (формиат). Подходящие фракции объединяли и концентрировали в вакууме с получением 2-(диметиламино)этил-6-2R,4R)-1-ацетил-4-5-цианопиридин-2-ил)амино)-2-метил-1,2,3,4-тетрагидрохинолин-6-ил)никотината (16,5 мг, 24%) в виде вязкого бесцветного масла. LCMS (формиат, 2 мин), Rt = 0,69 мин, МН+ = 499. Пример 7 3-(Диметиламино)пропил-4-2S,4R)-1-ацетил-4-изопропоксикарбонил)амино)-2-метил-1,2,3,4 тетрагидрохинолин-6-ил)бензоат(4,88 мг, 0,040 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 2 ч, реакционную смесь разбавляли водой и добавляли EtOAc. Слои разделяли и водную фазу экстрагировалиEtOAc (3). Объединенные органические слои промывали рассолом, сушили над MgSO4, фильтровали и концентрировали в вакууме. Остаток растворяли в смеси 1:1 MeOH/DMSO и очищали посредствомMDAP (НрН). Подходящие фракции объединяли и концентрировали при пониженном давлении с получением 3-(диметиламино)пропил-4-2S,4R)-1-ацетил-4-изопропоксикарбонил)амино)-2-метил-1,2,3,4 тетрагидрохинолин-6-ил)бензоата (29,3 мг,15%) в виде вязкого бесцветного масла. LCMS (формиат, 2 мин), Rt = 0,75 мин, МН+ = 476. Пример 8 2-(Диметиламино)этил-4-2S,4R)-1-ацетил-4-изопропоксикарбонил)амино)-2-метил-1,2,3,4-тетрагидрохинолин-6-ил)бензоат К раствору лития 4-2S,4R)-1-ацетил-4-изопропоксикарбонил)амино)-2-метил-1,2,3,4-тетрагидрохинолин-6-ил)бензоата (для получения см. промежуточное соединение 20) (246 мг, 0,591 ммоль) и 2 бром-N,N-диметилэтанамина (135 мг, 0,886 ммоль) в DMF (5 мл) добавляли карбонат калия (122 мг,0,886 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 2 ч, реакционную смесь концентрировали при пониженном давлении. Остаток растворяли в смеси 1:1 MeOH/DMSO и очищали посредством MDAP (формиат). Подходящие фракции объединяли и концентрировали в вакууме с получением 2-(диметиламино)этил-4-2S,4R)-1-ацетил-4-изопропоксикарбонил)амино)-2-метил 1,2,3,4-тетрагидрохинолин-6-ил)бензоата (14,5 мг, 5%) в виде вязкого бесцветного масла. LCMS (формиат, 2 мин), Rt = 0,72 мин, МН+ = 482. Референсные соединения Референсное соединение А. 2-Метил-6-(метилокси)-4H-3,1-бензоксазин-4-он Раствор 5-метоксиантраниловой кислота (Lancaster) (41,8 г, 0,25 моль) нагревали при температуре дефлегмации в уксусном ангидриде (230 мл) в течение 3,5 ч, после чего концентрировали при пониженном давлении. Затем неочищенное соединение дважды концентрировали в присутствии толуола, после чего фильтровали и дважды промывали эфиром с получением указанного в заголовке соединения (33,7 г,71%-ный выход) в виде коричневого твердого вещества. LC/MS (способ D): m/z 192 [М+Н]+, Rt = 1,69 мин. Референсное соединение В. [2-Амино-5-(метилокси)фенил](4-хлорфенил)метанон К раствору 2-метил-6-(метилокси)-4H-3,1-бензоксазин-4-она (для получения см. референсное соединение А) (40,0 г, 0,21 моль) в смеси толуол/эфир (2/1) (760 мл) при 0 С по каплям добавляли раствор 4-хлорфенилмагния бромида (170 мл, 1 М в Et2O, 0,17 моль). Реакционную смесь оставляли нагреваться до комнатной температуры и перемешивали в течение 1 ч, после чего гасили 1 н. HCl (200 мл). Водный слой экстрагировали EtOAc (3150 мл) и объединенные органические слои промывали рассолом (100 мл), сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Затем неочищенное соединение растворяли в EtOH (400 мл) и добавляли 6 н. HCl (160 мл). Реакционную смесь нагревали при температуре дефлегмации в течение 2 ч, после чего концентрировали до одной трети объема. Полученное твердое вещество фильтровали и дважды промывали эфиром, после чего суспендировали в EtOAc и нейтрализовали 1 н. NaOH. Водный слой экстрагировали EtOAc (3150 мл) и объединенные органические слои промывали рассолом (150 мл), сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Указанное в заголовке соединение получали в виде желтого твердого вещества Метил-N-[(9H-флуорен-9-илметил)окси]карбонил-Lаспартилхлорид (Int. J. Peptide Protein Res. 1992, 40, 13-18) (93 г, 0,24 моль) растворяли в CHCl3 (270 мл) и добавляли [2-амино-5-(метилокси)фенил](4-хлорфенил)метанон (для получения см. референсное соединение В) (53 г, 0,2 моль). Полученную смесь перемешивали при 60 С в течение 1 ч, после чего охлаждали и концентрировали до 60% объема. Добавляли эфир при 0 С и полученный осадок фильтровали и отбрасывали. Фильтрат концентрировали при пониженном давлении и использовали без дальнейшей очистки. Референсное соединение D. Метил-[(3S)-5-(4-хлорфенил)-7-(метилокси)-2-оксо-2,3-дигидро-1H-1,4 бензодиазепин-3-ил]ацетат К раствору метил-N1-[2-[(4-хлорфенил)карбонил]-4-(метилокси)фенил]-N2-[(9 Н-флуорен-9-илметил)окси]карбонил-Lаспарагината (для получения см. референсное соединение С) (принимали 0,2 моль) в DCM (500 мл) добавляли Et3N (500 мл, 3,65 моль) и полученную смесь кипятили с обратным хо- 26022341 лодильником в течение 24 ч, после чего концентрировали. Полученный неочищенный амин растворяли в 1,2-DCE (1,5 л) и осторожно добавляли АсОН (104 мл, 1,8 моль). Затем реакционную смесь перемешивали при 60 С в течение 2 ч, после чего концентрировали в вакууме и растворяли в DCM. Органический слой промывали 1 н. HCl и водный слой экстрагировали DCM (3). Объединенные органические слои дважды промывали водой и рассолом, сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Неочищенное твердое вещество перекристаллизовывали в MeCN с получением указанного в заголовке соединения (51 г) в виде бледно-желтого твердого вещества. Фильтрат мог быть сконцентрирован и перекристаллизован в MeCN с получением следующей порции 10 г целевого продукта. Rf = 0,34 (DCM/MeOH: 95/5). HRMS (М+Н)+ вычисленная для C19H1835ClN2O4 373,0955; найденная 373,0957. Референсное соединение Е. Метил-[(3S)-5-(4-хлорфенил)-7-(метилокси)-2-тиоксо-2,3-дигидро-1 Н 1,4-бензодиазепин-3-ил]ацетат Суспензию P4S10 (36,1 г, 81,1 ммоль) и Na2CO3 (8,6 г, 81,1 ммоль) в 1,2-DCE (700 мл) при комнатной температуре перемешивали в течение 2 ч, после чего добавляли метил-[(3S)-5-(4-хлорфенил)-7-(метилокси)-2-оксо-2,3-дигидро-1H-1,4-бензодиазепин-3-ил]ацетат (для получения см. референсное соединение D) (16,8 г, 45,1 ммоль). Полученную смесь перемешивали при 70 С в течение 2 ч, после чего охлаждали и фильтровали. Твердое вещество дважды промывали DCM и фильтрат промывали насыщенным NaHCO3 и рассолом. Органический слой сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении. Неочищенный продукт очищали флэш-хроматографией на силикагеле(DCM/MeOH: 99/1) с получением указанного в заголовке соединения (17,2 г, 98% выход) в виде желтоватого твердого вещества. LC/MS (способ D): m/z 389 [M(35Cl)+H]+, Rt = 2,64 мин. HRMS (М+Н)+ вычисленная для C19H1835ClN2O3S 389,0727; найденная 389,0714. Референсное соединение F. Метил-[(3S)-2-[(1Z)-2-ацетилгидразино]-5-(4-хлорфенил)-7-(метилокси)-3H-1,4-бензодиазепин-3-ил]ацетат К суспензии метил-[(3S)-5-(4-хлорфенил)-7-(метилокси)-2-тиоксо-2,3-дигидро-1H-1,4-бензодиазепин-3-ил]ацетата (для получения см. референсное соединение Е (9,0 г, 23,2 ммоль) в THF (300 мл) при 0 С по каплям добавляли гидразина моногидрат (3,4 мл, 69,6 ммоль). Реакционную смесь перемешивали в течение 5 ч между 5 и 15 С, после чего охлаждали до 0 С. Затем медленно добавляли Et3N (9,7 мл, 69,6 ммоль) и по каплям добавляли ацетилхлорид (7,95 мл, 69,6 ммоль). Затем смесь оставляли нагреваться до комнатной температуры в течение 16 ч, после чего ее концентрировали при пониженном давлении. Неочищенный продукт растворяли в DCM и промывали водой. Органический слой сушили над Na2SO4,фильтровали и концентрировали в вакууме с получением неочищенного указанного в заголовке соединения (9,7 г, 98%-ный выход), которое использовали без дальнейшей очистки. Rf = 0,49 (DCM/MeOH: 90/10). Референсное соединение G. Метил-[(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]ацетат г) суспендировали в THF (100 мл) и добавляли АсОН (60 мл) при комнатной температуре. Реакционную смесь перемешивали при этой температуре в течение 2 дней, после чего концентрировали при пониженном давлении. Неочищенное твердое вещество растирали в i-Pr2O и фильтровали с получением указанного в заголовке соединения (8,7 г, 91% за 3 стадии) в виде беловатого твердого вещества. HRMS (М+Н)+ вычисленная для C21H20ClN4O3 411,1229; найденная 411,1245. Референсное соединение Н. [(4S)-6-(4-Хлорфенил)-1-метил-8-(метилокси)-4 Н-[1,2,4]триазоло[4,3 а][1,4]бензодиазепин-4-ил]уксусная кислота К раствору метил-[(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]ацетата (для получения см. референсное соединение G) (7,4 г, 18,1 ммоль) в THF (130 мл) при комнатной температуре добавляли 1 н. NaOH (36,2 мл, 36,2 ммоль). Реакционную смесь перемешивали при этой температуре в течение 5 ч, после чего гасили 1 н. HCl (36,2 мл) и концентрировали в вакууме. Затем добавляли воду, водный слой экстрагировали DCM (3) и объединенные органические слои сушили над Na2SO4, фильтровали и концентрировали при пониженном давлении с получением указанного в заголовке соединения (7 г, 98%-ный выход) в виде бледно-желтого твердого вещества. LC/MS Смесь [(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4 ил]уксусной кислоты (для получения см. референсное соединение Н) (1,0 г, 2,5 ммоль), HATU (1,9 г, 5 ммоль) и DIPEA (0,88 мл, 5 ммоль) перемешивали в течение 80 мин при комнатной температуре, к этой смеси добавляли 1,1-диметилэтил-(4-аминобутил)карбамат (1,05 мл, 5,0 ммоль, приобретенный уAldrich). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч, после чего ее концентрировали. Остаток вносили в дихлорметан и промывали 1 н. HCl. Водный слой дважды экстрагировали дихлорметаном. Органический слой промывали 1 н. гидроксидом натрия, затем насыщенным раствором хлорида натрия, сушили над сульфатом натрия и концентрировали. Остаток очищали посредством флэш-хроматографии на диоксиде кремния, используя дихлорметан/метанол 95/5 с получением указанного в заголовке соединения в виде желтого твердого вещества (1,2 г). LC/MS (способ D): Rt = 3,04 мин. Референсное соединение J. N-(5-Аминопентил)-2-[(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4 Н[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]ацетамида трифторацетат К раствору 1,1-диметилэтил-[5-([(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4H-[1,2,4]триазоло[4,3-а][1,4]бензодиазепин-4-ил]ацетиламино)пентил]карбамата (для получения см. референсное соединение I) (0,2 г, 0,34 ммоль) в дихлорметане (3 мл) по каплям добавляли трифторуксусную кислоту(0,053 мл, 0,68 ммоль) при 0 С. Реакционную смесь перемешивали в течение 3 ч при температуре от 0 С до комнатной температуры. Реакционную смесь концентрировали досуха с получением указанного в заголовке соединения в виде гигроскопичного желтого масла (200 мг) LC/MS (способ D): Rt = 2,33 мин.N-(5-Аминопентил)-2-[(4S)-6-(4-хлорфенил)-1-метил-8-(метилокси)-4 Н-[1,2,4]триазоло[4,3-а][1,4] бензодиазепин-4-ил]ацетамида трифторацетат (для получения см. референсное соединение J) (7,65 мг,0,013 ммоль) растворяли в N,N-диметилформамиде (DMF) (300 мкл) и добавляли к Alexa Fluor 488 сукцинимидному сложному эфиру карбоновой кислоты (5 мг, 7,77 ммоль, смесь 5- и 6-изомеров, приобретенный у Invitrogen, номер продукта А-20100) в пробирке Эппендорфа для центрифугирования. Добавляли основание Хунига (7,0 мкл, 0,040 ммоль) и смесь мешали на вихревой мешалке в течение ночи. По прошествии 18 ч реакционную смесь выпаривали досуха и остаток перерастворяли в смеси DMSO/вода(50%, всего 1 мл), вносили на препаративную колонку Phenomenex Jupiter C18 и элюировали градиентом от 95% А: 5% В до 100% В (А = 0,1% трифторуксусная кислота в воде, В = 0,1% TFA/90% ацетонитрил/10% вода) при скорости потока 10 мл/мин в течение 150 мин. Фракции, содержавшие примеси, объединяли и повторно очищали с использованием той же системы. Фракции объединяли и выпаривали с получением указанного в заголовке продукта (2,8 мг) в виде смеси 2 указанных региоизомеров. LC/MS(способ F): MH+ = 999, Rt = 1,88 мин. Методики биологических тестирований Тест связывания флуоресцентной анизотропии Связывание соединений формулы (I) с бромодоменами BRD2, BRD3 и BRD4 может быть оценено с использованием теста связывания флуоресцентной анизотропии. Бромодоменовый белок, флуоресцентный лиганд (см. референсное соединение K выше) и тестовое соединение в переменной концентрации инкубируют вместе до достижения термодинамического равновесия в таких условиях, чтобы в отсутствие тестового соединения флуоресцентный лиганд был значительно (50%) связан, а в присутствии достаточной концентрации мощного ингибитора анизотропия несвязанного флуоресцентного лиганда являлась измеримо отличной от значения для связанного лиганда. Все данные были нормализованы на среднее по 16 верхним и 16 нижним контрольным лункам на каждом планшете. Затем применяли четырехпараметровую аппроксимацию кривой следующей формы: где а представляет собой минимум, b представляет собой наклон кривой, с представляет собойpIC50 (концентрацию полумаксимального ингибирования) и d представляет собой максимум. Рекомбинантные человеческие бромодомены (BRD2 (1-473), BRD3 (1-435) и BRD4 (1-477 были экспрессированы в клетках E.coli (в векторе рЕТ 15b) с меткой из шести His на N-конце. His-меченый бромодомен экстрагировали из клеток E.coli с использованием 0,1 мг/мл лизоцима и обработки ультразвуком. Затем бромодомен очищали посредством аффинной хроматографии на колонке HisTRAP HP,элюируя линейным градиентом 10-500 мМ имидазола, в течение 20 CV. Конечную очистку осуществляли на эксклюзионной колонке препаративного типа Superdex 200. Очищенный белок хранили при -80 С в 20 ммоль HEPES рН 7,5 и 100 ммоль NaCl. Протокол для бромодомена BRD2 Все компоненты растворяли в буферной композиции 50 мМ HEPES рН 7,4, 150 мМ NaCl и 0,5 мМCHAPS с конечными концентрациями BRD2, 75 нмоль, флуоресцентного лиганда 5 нМ. С использованием множественного микродозатора 10 мкл этой реакционной смеси добавляли в лунки, содержавшие 100 нл различных концентраций тестового соединения или носителя DMSO (1% конечная концентрация) в черном микротитровальном планшете малого объема Greiner с 384 лунками и уравновешивали в темноте в течение 60 мин при комнатной температуре. Анизотропию флуоресценции регистрировали с помощьюEnvision (ex = 485 нм, ЕМ = 530 нм; dichroic -505 нм). Протокол для бромодомена BRD3 Все компоненты растворяли в буферной композиции 50 мМ HEPES рН 7,4, 150 мМ NaCl и 0,5 мМCHAPS с конечными концентрациями BRD3 75 нМ, флуоресцентного лиганда 5 нМ. С использованием множественного микродозатора 10 мкл этой реакционной смеси добавляли в лунки, содержавшие 100 нл
МПК / Метки
МПК: A61K 31/4706, A61P 29/00, C07D 215/44, A61K 31/4709, C07D 401/12, A61P 35/00, C07D 215/42
Метки: производные, тетрагидрохинолина, качестве, полезные, бромодомена, ингибиторов
Код ссылки
<a href="https://eas.patents.su/30-22341-proizvodnye-tetragidrohinolina-poleznye-v-kachestve-ingibitorov-bromodomena.html" rel="bookmark" title="База патентов Евразийского Союза">Производные тетрагидрохинолина, полезные в качестве ингибиторов бромодомена</a>
Предыдущий патент: Горизонтальный накопитель полосы с телескопированием тележек с опорными роликами для полосы и пассивными системами позиционирования указанных тележек
Следующий патент: Соединения с активностью антагонистов мускариновых рецепторов и агонистов адренергического рецептора бета2
Случайный патент: Фасад или прозрачная крыша с рамой из стоечных и поперечных профилей


































