Соединения и композиции, которые являются модуляторами активности tlr
Номер патента: 20962
Опубликовано: 31.03.2015
Авторы: Синг Манмохан, У Том Яо-Сянь, Чжан Сяоюэ, Юэ Кати, Кортез Алекс, Скибински Дейвид, Ли Юнкай
Формула / Реферат
1. Соединение формулы (I) или его фармацевтически приемлемая соль
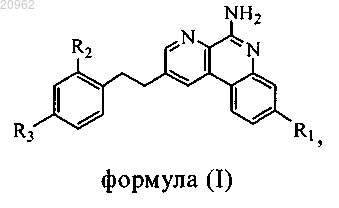
где R1 обозначает C1-C4-алкил, -L1R5, -L1R6, -L2R5 или -L2R6;
L1 обозначает -С(О)- или -О-;
L2 обозначает C1-C6-алкилен или C2-C6-алкенилен, где C1-C6-алкилен и C2-C6-алкенилен в составе L2 необязательно замещены 1-4 атомами фтора;
каждый L3 независимо выбран из C1-C6-алкилена и -((CR4R4)pO)q(CH2)p-;
L4 обозначает фенилен;
R2 обозначает C1-C4-алкил;
R3 выбран из -L1R5, -OL3R5, -OL3R7, -OL3L4L3R7, -OR8, -OL3L4R5 и -OL3L4L3R5;
каждый R4 независимо выбран из Н и фтора;
R5 обозначает -P(O)(OH)2;
R6 обозначает -CF2P(O)(OH)2 или -С(О)ОН;
R7 обозначает -CF2P(O)(OH)2;
R8 обозначает Н или C1-C4-алкил;
каждый р независимо равен 1, 2, 3, 4, 5 и 6;
q равен 1, 2, 3 или 4,
при условии, что если R3 обозначает -OR8, то R1 обозначает -L1R5, -L1R6 или -L2R5 и R6 обозначает
-CF2P(O)(OH)2.
2. Соединение по п.1, где
R1 обозначает C1-C4-алкил;
R2 обозначает C1-C4-алкил;
R3 обозначает -OL3R5 или -OL3R7;
R5 обозначает -P(O)(OH)2;
R7 обозначает -CF2P(O)(OH)2;
L3 обозначает C1-C6-алкилен.
3. Соединение по п.1, где
R1 обозначает C1-C6-алкил;
R2 обозначает C1-C6-алкил;
R3 обозначает -OL3R5 или -OL3R7;
R5 обозначает -P(O)(OH)2;
R7 обозначает -CF2P(O)(OH)2;
L3 обозначает -((CR4R4)pO)q(CH2)p-;
R4 обозначает Н;
q равен 1 или 2;
р равен 2.
4. Соединение по п.1, где
R1 обозначает -L2R6;
R2 обозначает C1-C6-алкил;
R3 обозначает -OL3R5 или -OL3R7;
R5 обозначает -P(O)(OH)2;
R6 обозначает -С(О)ОН;
R7 обозначает -CF2P(O)(OH)2;
L2 обозначает C1-C6-алкилен;
L3 обозначает C1-C6-алкилен.
5. Соединение по п.1, где
R1 обозначает -L2R6;
R2 обозначает C1-C6-алкил;
R3 обозначает -OL3R5 или -OL3R7;
R5 обозначает -P(O)(OH)2;
R6 обозначает -С(О)ОН;
R7 обозначает -CF2P(O)(OH)2;
L2 обозначает C1-C6-алкилен;
L3 обозначает -((CR4R4)pO)q(CH2)p-;
R4 обозначает Н;
q равен 1 или 2;
р равен 2.
6. Соединение по п.1, где
R1 обозначает -L1R5, -L2R5 или -L1R6;
R2 обозначает C1-C6-алкил;
R3 обозначает -OR8;
R8 обозначает C1-C6-алкил;
R5 обозначает -P(O)(OH)2;
R6 обозначает -CF2P(O)(OH)2;
L1 обозначает -С(О)-;
L2 обозначает C1-C6-алкилен или C2-C6-алкенилен, каждый необязательно замещен 1-4 атомами фтора.
7. Соединение по п.1, где
R1 обозначает C1-C6-алкил;
R2 обозначает C1-C6-алкил;
R3 обозначает -OL3L4R5, -OL3L4L3R5 или -OL3L4L3R7;
R5 обозначает -P(O)(OH)2;
R7 обозначает -CF2P(O)(OH)2;
каждый L3 независимо обозначает C1-C6-алкилен;
L4 обозначает фенилен.
8. Соединение по п.1, где
R1 обозначает C1-C6-алкил;
R2 обозначает C1-C6-алкил;
R3 обозначает -L1R5;
R5 обозначает -P(O)(OH)2;
L1 обозначает -O-.
9. Соединение по п.1 или 6, где R8 обозначает метил.
10. Соединение по любому из пп.1-3 или 7-9, где R1 обозначает метил.
11. Соединение по любому из пп.1-10, где R2 обозначает метил.
12. Соединение по п.1, выбранное из следующих соединений:
4-(4-(2-(5-амино-8-метилбензо[f][1,7]нафтиридин-2-ил)этил)-3-метилфенокси)-1,1-дифторбутилфосфоновая кислота;
3-(5-амино-2-(4-(4,4-дифтор-4-фосфонобутокси)-2-метилфенетил)бензо[f][1,7]нафтиридин-8-ил)пропановая кислота;
3-(5-амино-2-(4-(2-(3,3-дифтор-3-фосфонопропокси)этокси)-2-метилфенетил)бензо[f][1,7]нафтиридин-8-ил)пропановая кислота;
3-(5-амино-2-(2-метил-4-(2-(2-(2-фосфоноэтокси)этокси)этокси)фенетил)бензо[f][1,7]нафтиридин-8-ил)пропановая кислота;
4-(2-(5-амино-8-метилбензо[f][1,7]нафтиридин-2-ил)этил)-3-метилфенилдигидрофосфат;
(4-(2-(5-амино-8-метилбензо[f][1,7]нафтиридин-2-ил)этил)-3-метилфенокси)метилфосфоновая кислота;
5-(4-(2-(5-амино-8-метилбензо[f][1,7]нафтиридин-2-ил)этил)-3-метилфенокси)-1,1-дифторпентилфосфоновая кислота;
4-(4-(2-(5-амино-8-метилбензо[f][1,7]нафтиридин-2-ил)этил)-3-метилфенокси)-1,1-дифторбутилфосфоновая кислота;
3-(2-(4-(2-(5-амино-8-метилбензо[f][1,7]нафтиридин-2-ил)этил)-3-метилфенокси)этокси)-1,1-дифторпропилфосфоновая кислота;
2-(4-((4-(2-(5-амино-8-метилбензо[f][1,7]нафтиридин-2-ил)этил)-3-метилфенокси)метил)фенил)-1,1-дифторэтилфосфоновая кислота;
2-(5-амино-2-(4-метокси-2-метилфенетил)бензо[f][1,7]нафтиридин-8-ил)-1,1-дифтор-2-оксоэтилфосфоновая кислота;
(Е)-2-(5-амино-2-(4-метокси-2-метилфенетил)бензо[f][1,7]нафтиридин-8-ил)винилфосфоновая кислота;
2-(5-амино-2-(4-метокси-2-метилфенетил)бензо[f][1,7]нафтиридин-8-ил)этилфосфоновая кислота;
(Е)-2-(5-амино-2-(4-метокси-2-метилфенетил)бензо[f][1,7]нафтиридин-8-ил)-1-фторвинилфосфоновая кислота;
3-((4-(2-(5-амино-8-метилбензо[f][1,7]нафтиридин-2-ил)этил)-3-метилфенокси)метил)фенилфосфоновая кислота;
5-амино-2-(4-метокси-2-метилфенетил)бензо[f][1,7]нафтиридин-8-карбонилфосфоновая кислота;
3-(5-амино-2-(2-метил-4-(3-фосфонопропокси)фенетил)бензо[f][1,7]нафтиридин-8-ил)пропановая кислота;
3-(5-амино-2-(4-(2-(2-(3,3-дифтор-3-фосфонопропокси)этокси)этокси)-2-метилфенетил)бензо[f][1,7]нафтиридин-8-ил)пропановая кислота;
3-(5-амино-2-(2-метил-4-(2-(2-фосфоноэтокси)этокси)фенетил)бензо[f][1,7]нафтиридин-8-ил)пропановая кислота;
2-(4-(2-(5-амино-8-метилбензо[f][1,7]нафтиридин-2-ил)этил)-3-метилфенокси)этилфосфоновая кислота;
6-(4-(2-(5-амино-8-метилбензо[f][1,7]нафтиридин-2-ил)этил)-3-метилфенокси)гексилфосфоновая кислота;
6-(4-(2-(5-амино-8-метилбензо[f][1,7]нафтиридин-2-ил)этил)-3-метилфенокси)-1,1-дифторгексилфосфоновая кислота;
4-((4-(2-(5-амино-8-метилбензо[f][1,7]нафтиридин-2-ил)этил)-3-метилфенокси)метил)бензилфосфоновая кислота;
2-(2-(2-(4-(2-(5-амино-8-метилбензо[f][1,7]нафтиридин-2-ил)этил)-3-метилфенокси)этокси)этокси)этилфосфоновая кислота;
3-[5-амино-2-(2-{4-[2-(3,3-дифтор-3-фосфонопропокси)этокси]-2-метилфенил}этил)бензо[f][1,7]-нафтиридин-8-ил]пропановая кислота;
{5-[4-(2-{5-амино-8-метилбензо[f][1,7]-нафтиридин-2-ил}этил)-3-метилфенокси]пентил}фосфоновая кислота и
{4-[4-(2-{5-амино-8-метилбензо[f][1,7]-нафтиридин-2-ил}этил)-3-метилфенокси]бутил}фосфоновая кислота.
13. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения по любому из пп.1-12 и фармацевтически пригодный носитель.
14. Лекарственное средство для лечения пациента, страдающего от заболевания или нарушения, ассоциированного с активностью рецептора TLR7, где лекарственное средство содержит терапевтически эффективное количество соединения по любому из пп.1-12 и где соединение формулы (I) является агонистом рецептора TLR7.
15. Применение соединения по любому из пп.1-12 для получения лекарственного средства, предназначенного для лечения заболевания или нарушения у пациента, при этом наблюдается модуляция рецептора TLR7.
16. Способ активации рецептора TLR7, который заключается в том, что субъекту вводят терапевтически эффективное количество соединения по любому из пп.1-12.
17. Способ лечения заболевания или нарушения, при котором наблюдается модуляция рецептора TLR7, заключающийся в том, что субъекту, нуждающемуся в таком лечении, вводят эффективное количество соединения по любому из пп.1-12, где соединение является агонистом рецептора TLR7.
18. Способ по п.17, где заболеванием или состоянием является инфекционное заболевание, воспалительное заболевание, респираторное заболевание, дерматологическое заболевание или аутоиммунное заболевание.
19. Способ по п.17, где заболеванием или состоянием является астма, хроническое обструктивное заболевание легких, респираторный дистресс-синдром у взрослых, язвенный колит, болезнь Крона, бронхит, дерматит, актинический (старческий) кератоз, базально-клеточная карцинома, аллергический ринит, псориаз, склеродермия, уртикария, ревматоидный артрит, рассеянный склероз, рак, рак молочной железы, ВИЧ или волчанка.
20. Применение соединения по любому из пп.1-12 в способе медикаментозного лечения, где способ медикаментозного лечения предназначен для лечения заболевания, ассоциированного с активностью рецептора TLR7, где заболевание выбрано из инфекционного заболевания, воспалительного заболевания, респираторного заболевания, дерматологического заболевания или аутоиммунного заболевания и где соединением является соединение по любому из пп.1-12.
21. Применение по п.20, где заболеванием является астма, хроническое обструктивное заболевание легких, респираторный дистресс-синдром у взрослых, язвенный колит, болезнь Крона, бронхит, дерматит, актинический (старческий) кератоз, базально-клеточная карцинома, аллергический ринит, псориаз, склеродермия, уртикария, ревматоидный артрит, рассеянный склероз, рак, рак молочной железы, ВИЧ или волчанка.
22. Фармацевтическая композиция по п.13, где соединение формулы (I) связано с адъювантом, содержащим алюминий.
23. Фармацевтическая композиция по п.22, где адъювант, содержащий алюминий, выбран из гидроксида алюминия, оксигидроксида алюминия и гидрофосфата алюминия.
Текст
СОЕДИНЕНИЯ И КОМПОЗИЦИИ, КОТОРЫЕ ЯВЛЯЮТСЯ МОДУЛЯТОРАМИ АКТИВНОСТИ TLR В изобретении описан новый класс соединений формулы (I), иммуногенные композиции и фармацевтические композиции, содержащие указанные соединения, а также способы применения указанных соединений для лечения или профилактики заболеваний или нарушений,ассоциированных толл-подобными рецепторами 7. Согласно одному объекту изобретения соединения являются пригодными для использования в качестве адъювантов для повышения эффективности вакцины. Родственные заявки В заявке на данное изобретение испрашивается приоритет согласно 35 U.S.С. 119(е) в связи с предварительной заявкой US, серийный номер 61/239217, поданной 2 сентября 2009 г., содержание которой в полном объеме включено в настоящее описание в качестве ссылки. Финансовая поддержка органов государственной власти Работы по настоящему изобретению частично финансировались государством (грант DTRAHDTRA1-07-9-0001 предоставлен Министерством обороны). Государство обладает некоторыми правами на данное изобретение. Область, к которой относится изобретение В изобретении предлагаются модуляторы Toll-подобных рецепторов (TLR) и способы применения указанных соединений. Предпосылки создания изобретения Раннее обнаружение специфических классов патогенов врожденной иммунной системой осуществляется при помощи образ-распознающих рецепторов (ОРР). Патогены, которые распознаются иммунной системой, включают вирусы, бактерии, простейшие и грибы, каждый из которых конститутивно экспрессирует ряд класс-специфичных устойчивых к мутациям молекул, которые получили название патогенассоциированные молекулярные структуры (РАМР). Указанные молекулярные маркеры могут состоять из белков, углеводов, липидов, нуклеиновых кислот или их комбинаций и могут локализоваться внутри или на внешней поверхности указанных патогенов. Примеры РАМР включают бактериальные углеводы(липополисахарид или ЛПС, манноза), нуклеиновые кислоты (бактериальные или вирусные ДНК или РНК),пептидогликаны и липотейхоевые кислоты(из грамположительных бактерий),N-формилметионин, липопротеины и гликаны грибов. В ходе эволюции сформировались ОРР, которые используют три характерных свойства РАМР. Вопервых, конститутивная экспрессия позволяет "хозяину" распознавать патоген независимо от того, на какой стадии жизненного цикла он находится. Во-вторых, РАМР являются класс-специфичными молекулами, что позволяет "хозяину" отличить патогены друг от друга и, таким образом, адаптировать свою ответную реакцию. В-третьих, устойчивость к мутациям позволяет "хозяину" распознавать патоген независимо от его конкретного штамма. Роль образ-распознающих рецепторов (ОРР) не сводится только к распознаванию патогенов по их РАМР. После связывания ОРР образуют кластеры, вызывают приток других внеклеточных и внутриклеточных белков с образованием комплекса и инициируют сигнальный каскад, что, в конечном счете, приводит к мгновенному усилению транскрипции. Кроме того, ОРР принимают участие в активации системы комплемента, коагуляции, фагоцитозе, воспалении и в активации функций апоптоза в ответ на обнаружение патогена. Образ-распознающие рецепторы (ОРР) можно разделить на эндоцитозные ОРР и сигнальные ОРР. Сигнальные ОРР включают многочисленные семейства мембранно-связанных Toll-подобных рецепторов(TLR) и цитоплазматических NOD-подобных рецепторов, а эндоцитируемые ОРР участвуют в присоединении, поглощении и разрушении микроорганизмов в ходе фагоцитоза, без передачи внутриклеточного сигнала, причем указанные рецепторы обнаружены на всех фагоцитах и опосредуют удаление апоптозных клеток. Кроме того, эндоцитирующие ОРР распознают углеводы и включают рецепторы маннозы макрофагов, гликановые рецепторы, которые присутствуют на всех фагоцитах, и фагоцитарные рецепторы, которые распознают заряженные лиганды. Краткое изложение сущности изобретения В настоящем изобретении предлагаются соединения, которые являются агонистами Toll-подобного рецептора 7 (TLR7), а также их фармацевтические композиции. Указанные агонисты TLR7 являются иммуностимуляторами, которые связываются с адъювантами, содержащими алюминий, например, такими как гидроксид алюминия, оксигидроксид алюминия, гидрофосфат алюминия. Таким образом, в изобретении предлагаются также иммуногенные композиции, которые содержат антиген и агонист TLR7 по изобретению, которые обеспечивают связывание с адъювантами, содержащими алюминий. При введении указанных иммуногенных композиций субъекту, нуждающемуся в таком лечении, указанные агонистыTLR7 усиливают иммунный ответ на иммуногенную композицию. В первом объекте настоящего изобретения предлагаются соединения, а также их фармацевтически приемлемые соли, которые характеризуются структурной формулой (I)-1 020962 необязательно замещены 1-4 атомами фтора; каждый L3 независимо выбран из C1-C6-алкилена и -CR4R4)pO)q(CH2)p-;R3 выбран из -L1R5, -OL3R5, OL3R7, -OL3L4L3R7, -OR8, -OL3L4R5 и -OL3L4L3R5; каждый R4 независимо выбран из Н и фтора;-CF2P(O)(OH)2. В одних вариантах соединений формулы (I) R1 обозначает C1-C4-алкил, в других вариантах R1 обозначает метил. В других вариантах R1 обозначает -L1R5, -L1R6, -L2R5, -L2R6. В одних вариантах соединений формулы (I), если R1 обозначает -L1R5, -L1R6, -L2R5, -L2R6, то R3 обозначает -OR8. В других вариантах R1 обозначает -L1R5, -L1R6, -L2R5, -L2R6, a R3 обозначает -OMe. В некоторых вариантах соединений формулы (I) R2 обозначает C1-C4-алкил. В других вариантах 2R обозначает метил. В некоторых вариантах соединений формулы (I) R3 выбран из -L1R5. В других вариантах R3 выбран из -OL3R5, -OL3R7, -OL3L4R7, -OL3L4L3R7, -OR8, -OL3L4R5, -OL3L4L3R5. В некоторых вариантах соединений формулы (I) L3 обозначает группу формулы-CR4R4)pO)q(CH2)p-. В некоторых вариантах соединений формулы (I) L2 обозначает C1-C6-алкилен, в других вариантах 2L обозначает C1-C6-алкилен, замещенный 1-4 атомами фтора. В одних вариантах соединений формулы(I) L2 обозначает C2-C6-алкенилен, в других вариантах L2 обозначает C2-C6-алкенилен, замещенный 1-4 атомами фтора. В некоторых вариантах соединений формулы (I) L3 обозначает C1-C6-алкилен. В одних вариантах указанных соединений формулы (I) R1 обозначает C1-C4-алкил, R2 обозначаетL3 обозначает C1-C6-алкилен. В других вариантах указанных соединений формулы (I) R1 обозначает С 1-С 4-алкил, R2 обозначаетC1-C4-алкил, R3 обозначает -OL3R5 или -OL3R7, R5 обозначает -P(O)(OH)2, R7 обозначает -CF2P(O)(OH)2,L3 обозначает -CR4R4)pO)q(CH2)p-, R4 обозначает Н, q равен 1 или 2, а р равен 2. В одних вариантах указанных соединений формулы (I) R1 обозначает -L2R6, R2 обозначаетC1-C4-алкил, R3 обозначает -OL3R5 или -OL3R7, R5 обозначает -P(O)(OH)2, R6 обозначает-C(O)OH, R7 обозначает -CF2P(O)(OH)2, L2 обозначает C1-C6-алкилен, а L3 обозначает C1-C6-алкилен. В других вариантах указанных соединений формулы (I) R1 обозначает -L2R6, R2 обозначаетC1-C6-алкил, R3 обозначает -OL3R5 или -OL3R7, R5 обозначает -P(O)(OH)2, R6 обозначает -C(O)OH,R7 обозначает -CF2P(O)(OH)2, L2 обозначает C1-C6-алкилен, L3 обозначает -CR4R4)pO)q(CH2)p-, R4 обозначает Н, q равен 1 или 2, а р равен 2. В еще одних вариантах указанных соединений формулы (I) R1 обозначает -L1R5, -L2R5 или -L1R6,2R обозначает C1-C4-алкил, R3 обозначает -OR8, R8 обозначает C1-C4-алкил, R5 обозначает -P(O)(OH)2,R6 обозначает -CF2P(O)(OH)2, L1 обозначает -C(O)-, a L2 обозначает C1-C6-алкилен или C2-C6-алкенилен,причем каждый необязательно замещен 1-4 атомами фтора. В одних вариантах указанных соединений формулы (I) R1 обозначает C1-C4-алкил, R2 обозначаетC1-C4-алкил, R3 обозначает -OL3L4R5, -OL3L4L3R5 или -OL3L4L3R7, R5 обозначает -P(O)(OH)2, R7 обозначает -CF2P(O)(OH)2, каждый L3 независимо обозначает C1-C6-алкилен, a L4 обозначает фенилен. В других вариантах указанных соединений формулы (I) R1 обозначает C1-C4-алкил, R2 обозначаетC1-C4-алкил, R3 обозначает -L1R5, R5 обозначает -P(O)(OH)2, а L1 обозначает -C(O)- или -O-. В конкретных вариантах соединения формулы (I) выбраны из следующих соединений: 4-(4-(2-(5-амино-8-метилбензо[f][1,7]нафтиридин-2-ил)этил)-3-метилфенокси)-1,1 дифторбутилфосфоновая кислота; 3-(5-амино-2-(4-(4,4-дифтор-4-фосфонобутокси)-2-метилфенетил)бензо[f][1,7]нафтиридин-8 ил)пропановая кислота; 3-(5-амино-2-(4-(2-(3,3-дифтор-3-фосфонопропокси)этокси)-2 метилфенетил)бензо[f][1,7]нафтиридин-8-ил)пропановая кислота; 3-(5-амино-2-(2-метил-4-(2-(2-(2-фосфоноэтокси)этокси)этокси)фенетил)бензо[f][1,7]нафтиридин-8 ил)пропановая кислота; 4-(2-(5-амино-8-метилбензо[f][1,7]нафтиридин-2-ил)этил)-3-метилфенилдигидрофосфат;(Е)-2-(5-амино-2-(4-метокси-2-метилфенетил)бензо[f][1,7]нафтиридин-8-ил)-1 фторвинилфосфоновая кислота; 3-4-(2-(5-амино-8-метилбензо[f][1,7]нафтиридин-2-ил)этил)-3 метилфенокси)метил)фенилфосфоновая кислота; 5-амино-2-(4-метокси-2-метилфенетил)бензо[f][1,7]нафтиридин-8-карбонилфосфоновая кислота; 3-(5-амино-2-(2-метил-4-(3-фосфонопропокси)фенетил)бензо[f][1,7]нафтиридин-8-ил)пропановая кислота; 3-(5-амино-2-(4-(2-(2-(3,3-дифтор-3-фосфонопропокси)этокси)этокси)-2 метилфенетил)бензо[f][1,7]нафтиридин-8-ил)пропановая кислота; 3-(5-амино-2-(2-метил-4-(2-(2-фосфоноэтокси)этокси)фенетил)бензо[f][1,7]нафтиридин-8 ил)пропановая кислота; 2-(4-(2-(5-амино-8-метилбензо[f][1,7]нафтиридин-2-ил)этил)-3-метилфенокси)этилфосфоновая кислота; 6-(4-(2-(5-амино-8-метилбензо[f][1,7]нафтиридин-2-ил)этил)-3-метилфенокси)гексилфосфоновая кислота; 6-(4-(2-(5-амино-8-метилбензо[f][1,7]нафтиридин-2-ил)этил)-3-метилфенокси)-1,1 дифторгексилфосфоновая кислота; 4-4-(2-(5-амино-8-метилбензо[f][1,7]нафтиридин-2-ил)этил)-3 метилфенокси)метил)бензилфосфоновая кислота; 2-(2-(2-(4-(2-(5-амино-8-метилбензо[f][1,7]нафтиридин-2-ил)этил)-3 метилфенокси)этокси)этокси)этилфосфоновая кислота; 3-[5-амино-2-(2-4-[2-(3,3-дифтор-3-фосфонопропокси)этокси]-2-метилфенилэтил)бензо[f]1,7 нафтиридин-8-ил]пропановая кислота; 5-[4-(2-5-амино-8-метилбензо[f][1,7]-нафтиридин-2-илэтил)-3 метилфенокси]пентилфосфоновая кислота и 4-[4-(2-5-амино-8-метилбензо[f][1,7]-нафтиридин-2-илэтил)-3-метилфенокси]бутилфосфоновая кислота. Предпочтительные варианты соединений, композиций и способов, описанных в данном контексте,включают каждое из указанных соединений в отдельности. В другом объекте изобретения предлагается способ применения соединений формулы (I), а также фармацевтических композиций, включающих указанные соединения. В еще одном объекте изобретения предлагаются фармацевтические композиции, которые включают терапевтически эффективное количество соединения формулы (I) и фармацевтически пригодный носитель. В некоторых вариантах указанных фармацевтических композиций их перерабатывают в формы для внутривенного введения, для введения в стекловидное тело, для внутримышечного введения, для перорального введения, для ректального введения, для ингаляции, для интраназального введения, для местного введения, для введения в глаза или для введения в уши. В других вариантах фармацевтические композиции получают в форме таблетки, пиллюли, капсулы, в жидкой форме, в форме для ингаляции, раствора для назального спрея, суппозитория, раствора, эмульсии, мази, глазных капель или ушных капель. В одних вариантах указанные фармацевтические композиции включают также один или более дополнительных терапевтических агентов. В одном объекте изобретения предлагаются фармацевтические композиции, которые включают терапевтически эффективное количество соединения формулы (I), адъювант, содержащий алюминий, антиген и фармацевтически пригодный носитель. В указанных фармацевтических композициях соединение формулы (I) присутствует в количестве, достаточном для обеспечения иммуностимулирующего эффекта,после ее введения. В других вариантах указанные фармацевтические композиции перерабатывают в формы для внутривенного введения, для введения в стекловидное тело или для внутримышечного введе-3 020962 ния. Для указанных композиций адъювант, содержащий алюминий, выбран из гидроксида алюминия,оксигидроксида алюминия и гидрофосфата алюминия. В других вариантах указанных композиций адъювантом, содержащим алюминий, является оксигидроксид алюминия или гидроксид алюминия. В другом объекте изобретения предлагается фармацевтическая композиция, которая включает терапевтически эффективное количество соединения формулы (I), связанного с адъювантом, содержащим алюминий, и фармацевтически приемлемый носитель. В одних вариантах указанную композицию получают в виде полностью высушенного твердого препарата. В других вариантах указанную композицию получают в виде лиофильно высушенного твердого препарата. Для указанных композиций адъювант,содержащий алюминий, выбран из гидроксида алюминия, оксигидроксида алюминия и гидрофосфата алюминия. В некоторых указанных композициях адъювантом, содержащим алюминий, является оксигидроксид алюминия или гидроксид алюминия. В еще одном объекте изобретения предлагаются иммуногенные композиции, которые включают соединение формулы (I), адъювант, содержащий алюминий, и антиген. В некоторых вариантах соединение формулы (I) присутствует в эффективном количестве, которое обеспечивает, индуцирует или усиливает иммунный ответ на антиген у субъекта, которому ввели указанную композицию. В указанных иммуногенных композициях соединение формулы (I) присутствует в количестве, достаточном для обеспечения иммуностимулирующего эффекта после ее введения. Для указанных иммуногенных композиций адъювант, содержащий алюминий, выбран из гидроксида алюминия, оксигидроксида алюминия и гидрофосфата алюминия. В некоторых вариантах указанных иммуногенных композиций адъювантом, содержащим алюминий, является оксигидроксид алюминия или гидроксид алюминия. В некоторых вариантах указанных иммуногенных композиций антигеном является бактериальный антиген. В других вариантах указанных иммуногенных композиций антигеном является вирусный антиген или грибковый антиген. В одних вариантах указанных иммуногенных композиций антигеном является полипептид. Некоторые указанные иммуногенные композиции включают также дополнительный адъювант. В некоторых вариантах иммуногенную композицию получают в виде высушенного твердого препарата. В других вариантах указанную иммуногенную композицию получают в виде лиофильно высушенного твердого препарата. В некоторых вариантах соединения по изобретению не являются бис-фосфонатами. В одном объекте изобретения предлагается способ повышения эффективности иммуногенной композиции, где иммуногенная композиция включает адъювант, содержащий алюминий, и указанный способ включает добавление в иммуногенную композицию эффективного количества соединения формулы(I). Для указанных способов адъювант, содержащий алюминий, выбран из гидроксида алюминия, оксигидроксида алюминия и гидрофосфата алюминия. В некоторых вариантах указанных способов адъювантом, содержащим алюминий, является оксигидроксид алюминия или гидроксид алюминия. В другом объекте изобретения предлагаются способы обеспечения или индуцирования иммунного ответа у позвоночного, которые заключаются в том, что позвоночному вводят эффективное количество иммуногенной композиции по изобретению. В некоторых вариантах осуществления настоящего изобретения предлагаются способы обеспечения или индуцирования цитотоксического Т-лимфоцитарного(ЦТЛ) ответа у позвоночного, которые заключаются в том, что позвоночному вводят эффективное количество иммуногенной композиции по изобретению. В других вариантах предлагаются способы обеспечения или индуцирования гуморального иммунного ответа у позвоночного, которые заключаются в том,что позвоночному вводят эффективное количество иммуногенной композиции по изобретению. Еще в одном объекте изобретения предлагаются способы получения иммуногенных композиций,описанных в данном контексте. В другом объекте изобретения предлагаются вакцины, содержащие иммуногенную композицию по изобретению. В еще одном объекте изобретения предлагаются лекарственные средства, предназначенные для лечения пациентов, страдающих от заболевания или нарушения, ассоциированного с активностью рецептора TLR7, при этом указанные лекарственные средства включают терапевтически эффективное количество соединения формулы (I), где соединением формулы (I) является агонист рецептора TLR7. В другом объекте изобретения предлагается применение соединения формулы (I) для получения лекарственного средства, предназначенного для лечения пациента, страдающего от заболевания или нарушения, связанного с модуляцией рецептора TLR7. В одном объекте изобретения предлагаются способы активации рецептора TLR7, причем указанный способ заключается в том, что субъекту, нуждающемуся в таком лечении, вводят терапевтически эффективное количество соединения формулы (I) или его фармацевтически приемлемых солей или фармацевтических композиций, таким образом активируя рецептор TLR. В указанных способах соединением формулы (I) является агонист рецептора TLR7. Некоторые варианты указанных способов включают введение соединения в культуру клеток или ткани или в организм человека или животного. В другом объекте изобретения предлагаются способы, предназначенные для лечения заболевания или нарушения, связанного с модуляцией рецептора TLR7, причем указанный способ заключается в том,что субъекту, нуждающемуся в таком лечении, вводят эффективное количество соединения формулы (I)-4 020962 или его фармацевтически приемлемых солей или фармацевтических композиций и, таким образом, наблюдается лечение заболевания или нарушения. В указанных способах соединением формулы (I) является агонист рецептора TLR7. Некоторые варианты указанных способов включают введение соединения в культуру клеток или ткани или в организм человека или животного. В одних вариантах указанных способов заболеванием или состоянием является инфекционное заболевание, воспалительное заболевание, респираторное заболевание, дерматологическое заболевание или аутоиммунное заболевание. В некоторых вариантах указанных способов заболеванием или состоянием является астма, хроническое обструктивное заболевание легких (ХОЗЛ), респираторный дистресссиндром у взрослых (РДСВ), язвенный колит, болезнь Крона, бронхит, дерматит, актинический кератоз,базально-клеточная карцинома, аллергический ринит, псориаз, склеродермия, уртикария, ревматоидный артрит, рассеянный склероз, рак, рак молочной железы, ВИЧ или волчанка. В другом объекте изобретения предлагаются способы лечения клеточного пролиферативного заболевания, которые заключаются в том, что субъекту, нуждающемуся в таком лечении, вводят эффективное количество соединения формулы (I) его фармацевтически приемлемых солей или фармацевтических композиций, причем клеточным пролиферативным заболеванием является лимфома, остеосаркома, меланома или рак молочной железы, почек, предстательной железы, колоректальный рак, рак щитовидной железы, яичников, поджелудочной железы, нейрональная опухоль мозга, рак легких, матки или рак желудочно-кишечного тракта. В одном объекте изобретения предлагается фармацевтическая композиция, которая включает соединение формулы (I), антиген и фармацевтически пригодный носитель, причем указанными фармацевтическими композициями являются иммуногенные композиции, а соединением является иммуностимулятор, и присутствует в эффективном количестве, которое усиливает иммунный ответ на антиген у субъекта, которому ввели указанную композицию. В некоторых вариантах указанные фармацевтические композиции включают также один или более иммунорегуляторов. В некоторых вариантах один или более иммунорегуляторов включают один или более адъювантов. Некоторые указанные адъюванты выбраны из адъювантов, которые являются композицией, содержащей неорганическое соединение, масляной эмульсией, препаратом сапонина, виросомой, вирусоподобной частицей, бактериальным производным,микробным производным, иммуномодулятором человека, биоадгезивным агентом, мукоадгезивным агентом, микрочастицей, липосомой, простым эфиром полиоксиэтилена, сложным эфиром полиоксиэтилена, полифосфазеном, мурамилпептидом или имидазохинолоном. В некоторых вариантах адъювантом является масляная эмульсия. В некоторых вариантах осуществления изобретения иммуногенные композиции используют в качестве вакцин, где соединение присутствует в количестве, достаточном для обеспечения иммуностимулирующего эффекта после введения. В еще одном объекте изобретения предлагается соединение для применения в способах медикаментозного лечения, при этом способ медикаментозного лечения предназначен для лечения заболевания,ассоциированного с активностью рецептора TLR7, где заболевание выбрано из инфекционного заболевания, воспалительного заболевания, респираторного заболевания, дерматологического заболевания или аутоиммунного заболевания и где соединением является соединение формулы (I) по п.1 формулы изобретения. В некоторых указанных способах заболеванием или состоянием является астма, хроническое обструктивное заболевание легких (ХОЗЛ), респираторный дистресс-синдром у взрослых (РДСВ), язвенный колит, болезнь Крона, бронхит, дерматит, актинический кератоз, базально-клеточная карцинома,аллергический ринит, псориаз, склеродермия, уртикария, ревматоидный артрит, рассеянный склероз, рак,рак молочной железы, ВИЧ или волчанка. Краткое описание фигур На фиг. 1 показана концентрация соединения 1 в супернатанте в присутствии и в отсутствие гидроксида алюминия. Концентрацию соединения определяли методом ЖХВР. На фиг. 2 показано влияние связывания соединения 1 с адъювантом, содержащим гидроксид алюминия, на связывание антигенов Neisseria meningitis (MenB) с адъювантом, содержащим гидроксид алюминия. Подробное описание вариантов осуществления настоящего изобретения Определения терминов. Термин "алкенилен", использованный в данном контексте, обозначает частично ненасыщенный двухвалентный углеводородный радикал с разветвленной или прямой цепью, полученный из алкенильной группы. В некоторых вариантах указанный алкенилен необязательно является замещенным. Термины "C2-C3-алкенилен", "C2-C4-алкенилен", "C2-C5-алкенилен", "C2-C6-алкенилен", "C2-C7-алкенилен" и"C2-C8-алкенилен", использованные в данном контексте, обозначают алкенилен, содержащий по крайней мере 2 или более, т.е. 3, 4, 5, 6, 7 или 8 атомов углерода соответственно. Если не указано иное, термин"алкенилен" обычно обозначает C2-C6-алкенилен. Примеры алкениленов, использованных в данном контексте, включают, но не ограничиваясь только ими, этенилен, пропенилен, бутенилен, пентенилен, гексенилен, гептенилен, октенилен, ноненилен, деценилен и т.п. Термин "алкил", использованный в данном контексте, обозначает насыщенный углеводородный радикал с разветвленной или прямой цепью. В некоторых вариантах указанные алкилы необязательно яв-5 020962 ляются замещенными. Термины "C1-C3-алкил", "C1-C4-алкил", "C1-C5-алкил", "C1-C6-алкил","C1-C7-алкил" и "C1-C8-алкил", использованные в данном контексте, обозначают алкил, содержащий по крайней мере 1 или более, т.е. 3, 4, 5, 6, 7 или 8 атомов углерода соответственно. Если не указано иное,термин "алкил" обычно обозначает C1-C6-алкил. Примеры алкилов, использованных в данном контексте,включают, но не ограничиваясь только ими, метил, этил, н-пропил, изопропил, н-бутил, изобутил, вторбутил, трет-бутил, н-пентил, изопентил, гексил, гептил, октил, нонил, децил и т.п. Термин "алкилен", использованный в данном контексте, обозначает насыщенный двухвалентный углеводородный радикал с разветвленной или прямой цепью, полученный из алкильной группы. В некоторых вариантах указанные алкилены необязательно являются замещенными. Термины "C1-C3-алкилен","C1-C4-алкилен", "C1-C5-алкилен", "C1-C6-алкилен", "C1-C7-алкилен" и "C1-C8-алкилен", использованные в данном контексте, обозначают алкилен, содержащий по крайней мере 1 или более, т.е. 3, 4, 5, 6, 7 или 8 атомов углерода соответственно. Если не указано иное, термин "алкилен" обычно обозначаетC1-C6-алкилен. Примеры алкиленов, использованных в данном контексте, включают, но не ограничиваясь только ими, метилен, этилен, н-пропилен, изопропилен, н-бутилен, изобутилен, втор-бутилен, третбутилен, н-пентилен, изопентилен, гексилен и т.п. Термин "приемлемый" в отношении состава, композиции или ингредиента, использованный в данном контексте, обозначает, что они не оказывают никакого выраженного неблагоприятного воздействия на общее состояние здоровья субъекта, проходящего курс лечения. Термин "введение" соединения по изобретению обозначает введение соединения формулы (I), его фармацевтически приемлемой соли, фармацевтически пригодного сольвата или пролекарства субъекту,нуждающемуся в таком лечении. Термин "антиген" обозначает молекулу, содержащую один или более эпитопов (например, линейный, конформационный или оба типа эпитопов), которые обеспечивают иммунологический ответ. При этом термины "антиген" и "иммуноген" используют взаимозаменяемо. Термин "обеспечивает" обозначает, что соединение индуцирует, повышает, усиливает или модулирует иммунный ответ или иммунную реакцию. В некоторых вариантах термин иммунный ответ или иммунная реакция обозначает гуморальный и/или клеточный ответ. Антиген может индуцировать, ускорять, усиливать или модулировать иммунный ответ или иммунную реакцию в клетках in vitro и/или in vivo в организме субъекта и/или ex vivo в клетках или тканях субъекта. Указанный иммунный ответ или реакция включает, но не ограничиваясь только ими, продуцирование антител в организме субъекта или генерацию специфической популяции лимфоцитов, взаимодействующих с антигеном. Антигенами обычно являются чужеродные (для организма-хозяина) макромолекулы (например, белки, полисахариды, полинуклеотиды). Термин "антиген", использованный в данном контексте, включает также субъединичные антигены(т.е. антигены выделены из целого организма, с которым антиген ассоциирован в природе, в виде индивидуального продукта), а также убитые, ослабленные или инактивированные бактерии, вирусы, паразиты или другие патогены или опухолевые клетки, включая внеклеточные домены рецепторов клеточной поверхности и внутриклеточные фрагменты, содержащие T-клеточные эпитопы. Антитела, такие как антиидиотипичные антитела или их фрагменты, а также синтетические пептидные мимотопы, которые являются миметиками антигена или антигенной детерминантой, также включены в определение антигена. Термин "антиген", использованный в данном контексте, включает также олигонуклеотид или полинуклеотид, который экспрессирует иммуногенный белок, антиген или антигенную детерминанту in vivo и который используют, например, в генной терапии или при иммунизации нуклеиновыми кислотами. Термин "эпитоп" обозначает фрагмент указанных соединений (например, антигенной молекулы или антигенного комплекса), который определяет их иммунологическую специфичность. Термин "антиген" включает также эпитопы. Обычно термин "эпитоп" обозначает полипептид или полисахарид, входящий в состав природного антигена. В случае синтетических антигенов в качестве эпитопа можно использовать низкомолекулярное вещество, такое как производное арсаниловой кислоты. Обычно B-клеточный эпитоп включает по крайней мере приблизительно 5 аминокислотных остатков, но в некоторых случаях и менее 3-4 аминокислотных остатка. T-клеточный эпитоп, такой как эпитоп ЦТЛ, обычно включает по крайней мере приблизительно 7-9 аминокислотных остатков, а хелперный T-клеточный эпитоп обычно включает по крайней мере приблизительно 12-20 аминокислотных остатков. Термин "рак", использованный в данном контексте, обозначает аномальный рост клеток, который характеризуется неконтролируемой пролиферацией и в некоторых случаях метастазированием (распространением). Обычно термин "рак" включает, но не ограничиваясь только ими, солидные опухоли (такие как рак мочевого пузыря, кишечника, мозга, молочной железы, эндометрия матки, сердца, почек, легких,лимфатической ткани (лимфома), яичников, поджелудочной железы или другого органа эндокринной системы (рак щитовидной железы), предстательной железы, кожи (меланома) или гематологические опухоли (такие как лейкозы). Термин "носитель", использованный в данном контексте, обозначает химические соединения или агенты, которые ускоряют включение соединения по изобретению в клетки или ткани. Термин "совместное введение" или "комбинированное введение" или т.п., использованный в данном контексте, обозначает введение выбранных терапевтических агентов одному пациенту и включает-6 020962 курсы лечения, в которых агенты необязательно вводят одним и тем же способом или в одно и то же время. Термин "дерматологическое нарушение", использованный в данном контексте, включает нарушения кожи. Указанные дерматологические нарушения включают, но не ограничиваясь только ими, пролиферативные или воспалительные нарушения кожи, такие как атопический дерматит, буллезные нарушения, коллагеноз, контактная дерматозная экзема, болезнь Кавасаки, розовые угри, синдром ШегренаЛарссона, актинический кератоз, базально-клеточная карцинома и уртикария. Термин "разбавитель", использованный в данном контексте, обозначает химические соединения,которые используют для разбавления соединения по изобретению перед его доставкой. Разбавители можно использовать также в качестве стабилизаторов соединений по изобретению. Термины "эффективное количество" или "терапевтически эффективное количество", использованные в данном контексте, обозначает достаточное количество соединения по изобретению, при введении которого обеспечивается снижение в некоторой степени одного или более симптомов заболевания или состояния, которое предназначено для лечения. В результате указанного лечения может наблюдаться ослабление и/или снижение интенсивности признаков, симптомов заболевания или устранение причин развития заболевания или любое другое требуемое изменение биологической системы. Например, в отношении терапевтического применения термин "эффективное количество" обозначает количество композиции, содержащей соединение, как описано в данном контексте, которое требуется для достижения клинически значимого снижения симптомов заболевания. Соответственно "эффективное количество" в любом конкретном случае можно определить по стандартным методикам, например, таким как испытания с увеличением дозы. Термины "повышение" или "усиление", использованные в данном контексте, обозначают увеличение эффективности или продолжительности действия требуемого эффекта. Таким образом, в отношении усиления эффекта терапевтических агентов термин "усиление" обозначает способность увеличения эффективности или продолжительности действия других терапевтических агентов на систему. Термин "эффективное количество с увеличением активности", использованный в данном контексте, обозначает количество, достаточное для увеличения эффективности действия другого терапевтического агента на требуемую систему. Термин "эксципиент" обозначает любое вспомогательное вещество, которое необязательно может присутствовать в конечной лекарственной форме. Например, термин "эксципиент" включает носители,связующие агенты, дезинтегрирующие агенты, наполнители (разбавители), смазывающие вещества, суспендирующие агенты/диспергирующие агенты и т.п. Термины "фиброз" или "фиброзное нарушение", использованные в данном контексте, обозначают состояния, которые развиваются после острого или хронического воспалительного заболевания и ассоциированы с аномальным накоплением клеток и/или коллагена, и включают, но не ограничиваясь только ими, фиброз индивидуальных органов или тканей, таких как сердце, почки, суставы, легкие или кожа, а также включают такие нарушения, как идиопатический легочный фиброз и криптогенный фиброзирующий альвеолит. Термин "ятрогенный", использованный в данном контексте, обозначает состояние, нарушение или заболевание, которое развивается или ухудшается в ходе медикаментозного лечения или хирургической операции. Термин "иммунологически эффективное количество", использованный в данном контексте, обозначает количество, введение которого субъекту в виде однократной дозы или как часть серии, достаточно для эффективного лечения или профилактики иммунологического заболевания или нарушения. Указанное количество может изменяться в зависимости от общего или физического состояния здоровья субъекта, нуждающегося в таком лечении, возраста, таксономической группы, к которой относится субъект,нуждающийся в таком лечении (например, нечеловекоподобные приматы, приматы и т.д.), способности иммунной системы субъекта вырабатывать антитела, требуемой степени защиты, состава вакцины, врачебной оценки медицинского состояния и других факторов. Следует понимать, что указанное количество может меняться в пределах относительно широкого диапазона, который можно определить в ходе стандартных испытаний. Термин "иммунологический ответ" или "иммунный ответ" на антиген или композицию, использованный в данном контексте, обозначает продуцирование у субъекта гуморального и/или клеточного иммунного ответа на антиген или композицию. Иммунные ответы включают врожденный и приобретенный иммунные ответы. Врожденный иммунный ответ запускает быстрые ответные реакции, которые обеспечивают первую линию защиты с помощью иммунной системы. Напротив, приобретенный иммунитет использует селекцию и размножение клонов клеток иммунной системы (иммуноцитов), содержащих соматически измененные гены рецепторов (например, рецепторов Т- и B-клеток), которые распознают антигены данного патогена, или антигены, ассоциированные с данным нарушением (например, с опухолью), и таким образом обеспечивая специфичность и "иммунологическую память". Среди многих эффектов врожденного иммунного ответа следует отметить быстрый выброс воспалительных цитокинов и активацию антиген-презентирующих-7 020962 клеток (АПК), таких как макрофаги и дендритные клетки. Чтобы отличить патогены от собственных компонентов ("хозяина"), врожденная иммунная система использует различные относительно инвариабельные рецепторы, которые распознают структуры, характерные для патогенов и которые получили название патоген-ассоциированные молекулярные структуры или РАМР. Известно, что добавление микробных компонентов в экспериментальные вакцины, как известно, приводит к развитию полноценного и длительного приобретенного иммунного ответа. Сообщалось, что механизм, который обусловливает указанное усиление иммунного ответа, включает образ-распознающие рецепторы (ОРР), которые дифференцированно экспрессируются на множестве клеток иммунной системы, включая нейтрофилы, макрофаги, дендритные клетки, природные клетки-киллеры, B-клетки и некоторые клетки, не относящиеся к клеткам иммунной системы, такие как эпителиальные и эндотелиальные клетки. Участие ОРР приводит к активации некоторых указанных клеток и к секреции ими цитокинов и хемокинов, а также к созреванию и миграции других клеток. В совокупности это приводит к воспалению окружающей ткани, что, в свою очередь, приводит к развитию приобретенного иммунного ответа. ОРР включают нефагоцитарные рецепторы, такие как Toll-подобные рецепторы (TLR) и белки нуклеотид-связывающего домена олигомеризации (NOD), а также рецепторы, которые индуцируют фагоцитоз, такие как фагоцитарные рецепторы, маннозные рецепторы и рецепторы -гликана. Согласно литературным данным дендритные клетки являются одними из наиболее важных типов клеток для индукции наивных CD4+ хелперных Т (TH) клеток и для индукции дифференциации CD8+ T-клеток в клетки-киллеры. Согласно литературным данным сигнальные пути TLR играют важную роль в определении эффективности ответов указанных хелперныхT-клеток, например природа сигнального пути TLR предопределяет специфический тип ТН-клеточного ответа (например, ответ TH1 или TH2). Комбинация антителогенеза (гуморального ответа) и клеточного иммунитета включает частично ответ TH1-типа, в то время как ответ TH2-типа включает в основном антителогенез."Гуморальный иммунный ответ" обозначает иммунный ответ, опосредованный действием антител,в то время как "клеточный иммунный ответ" обозначает иммунный ответ, опосредованный Т-лимфоцитами и/или другими клетками крови. Одной из важных составляющих клеточного иммунитета является антиген-специфичный ответ, опосредованный цитолитическими T-клетками ("ЦТК"). ЦТК специфичны в отношении пептидных антигенов, которые презентируются в ассоциации с белками, которые кодируются главным комплексом гистосовместимости (ГКГ) и экспрессируются на поверхности клеток. ЦТК способствуют индукции и ускоряют внутриклеточное разрушение внутриклеточных микроорганизмов или лизис клеток, инфицированных указанными микроорганизмами. Другой составляющей клеточного иммунитета является ангитен-специфичный ответ, опосредованный хелперными T-клетками. Действие хелперных T-клеток заключается в стимуляции функции и в направлении активности неспецифических эффекторных клеток против клеток, презентирующих пептидные антигены в ассоциации с молекулами ГКГ на их поверхности. "Клеточный иммунный ответ" включает также продуцирование цитокинов, хемокинов и других соединений, продуцируемых активированными T-клетками и/или другими"лейкоцитарными клетками", включая клетки, образованные из CD4+ и CD8+ T-клеток. Композицию, такую как иммуногенная композиция или вакцина, которая вызывает клеточный иммунный ответ, можно, таким образом, использовать для повышения чувствительности позвоночного за счет презентации антигена в ассоциации с молекулами ГКГ на клеточной поверхности. Клеточноопосредованный иммунный ответ направлен на клетки или их окружение, презентирующие антиген на своей поверхности. Кроме того, могут образоваться субпопуляции антиген-специфичных Т-лимфоцитов,что обеспечит защиту иммунизированного субъекта в будущем. Способность конкретного антигена или композиции стимулировать развитие клеточно-опосредованного иммунологического ответа можно оценить множеством способов, известных в данной области техники, такими как лимфопролиферативный(активация лимфоцитов) анализ, анализ клеточной цитотоксичности ЦТК, анализ специфичности Т-лимфоцитов в отношении антигена у сенсибилизированного субъекта или оценка продуцирования цитокинов T-клетками в ответ на повторную стимуляцию антигеном. Указанные способы известны в данной области техники, например описаны в статье Erickson et al., J. Immunol., 151, 4189-4199 (1993) и в статье Doe et al., Eur. J. Immunol., 24, 2369-2376 (1994). Таким образом, термин "иммунологический ответ", использованный в данном контексте, включает иммунологический ответ, который может развиваться в результате стимуляции продуцирования ЦТК и/или продуцирования или активации хелперныхT-клеток. Исследованный антиген вызывает также гуморальный иммунный ответ. Следовательно, иммунологический ответ может включать, например, один или более следующих эффектов: продуцирование антител, например, B-клетками и/или активация супрессорных T-клеток и/илиT-клеток, специфичных непосредственно к антигену или антигенам, присутствующим в композиции или вакцине по изобретению. Указанные ответы могут обеспечивать подавление инфекции и/или опосредовать образование комплексов антитело-комплемент или антитело-зависимую клеточную цитотоксичность (АЗКЦ) и, таким образом, обеспечивать защиту иммунизированного субъекта. Указанные ответы можно оценивать, используя стандартные иммунологические анализы, известные в данной области техники.-8 020962 Иммуногенные композиции по изобретению характеризуются "повышенной иммуногенностью" в отношении данного антигена, если они вызывают более сильный иммунный ответ, чем иммунный ответ,вызываемый эквивалентным количеством антигена в другой композиции (например, когда антиген вводят в виде растворенного белка). Таким образом, композиция может характеризоваться "повышенной иммуногенностью", например, в связи с тем, что композиция вызывает более сильный иммунный ответ,или в связи с тем, что для формирования иммунного ответа у субъекта необходимо (можно) ввести более низкую дозу или меньшее число доз антигена. Указанную повышенную иммуногенность можно определить, например сравнивая результаты введения животным композиций по изобретению и контрольных антигенов. Термин "воспалительные нарушения", использованный в данном контексте, обозначает такие заболевания или состояния, которые характеризуются следующими одним или более симптомами: боль (болевые ощущения, опосредованные генерацией токсичных соединений и стимуляции нервных окончаний), тепловые ощущения (жар, опосредованный вазодилатацией), покраснение (покраснение, опосредованное вазодилатацией и усилением кровотока), плотная припухлость (отек, опосредованный чрезмерным притоком или ограничением оттока жидкости) и нарушение функций в области поражения (нарушенная функциональность может быть частичной или полной, временной или необратимой). Воспаление характеризуется множеством форм и включает, но не ограничиваясь только им, воспаление, характеризующееся одной или более следующих форм, таких как острая, адгезивная, атрофическая, катаральная,хроническая, цирротическая, диффузионная, обширная, экссудативная, фибринозная, фиброзирующая,очаговая, гранулематозная, гиперпластическая, гипертрофическая, интерстициальная, метастатическая,некротическая, облитерирующая, паренхиматозная, пластическая, продуктивная, пролиферативная,псевдомембранозная, гнойная, склерозирующая, серозно-фибринозная, серозная, простая, специфическая, подострая, гноящаяся, токсическая, травматическая и/или язвенная. Воспалительные нарушения включают также, но не ограничиваясь только ими, нарушения кровеносных сосудов (полиартериит, темпоральный артрит), суставов (артрит: кристаллический, остеоартроз, псориатический, реактивный, ревматоидный артрит, болезнь Рейтера), желудочно-кишечного тракта (заболевание), кожи (дерматит) или множества органов и тканей (системная красная волчанка). Термин "модулировать", использованный в данном контексте, обозначает прямое или опосредованное взаимодействие с мишенью с целью изменения активности мишени и включает, например, увеличение активности мишени, ингибирование активности мишени, ограничение активности мишени или продление активности мишени. Термин "модулятор", использованный в данном контексте, обозначает соединение, которое напрямую или опосредованно взаимодействует с мишенью. Взаимодействия включают, но не ограничиваясь только ими, взаимодействия с участием агониста или антагониста. Термины "глазное заболевание" или "офтальмологическое заболевание", использованные в данном контексте, обозначают заболевания, которые поражают глаз или глаза, а также окружающие их ткани. Глазные или офтальмологические заболевания включают, но не ограничиваясь только ими, конъюнктивит, ретинит, склерит, увеит, аллергический конъюнктивит, весенний конъюнктивит, папиллярный конъюнктивит и цитомегаловирусный (ЦМВ) ретинит. Термин "олигонуклеотид", использованный в данном контексте, обозначает полинуклеотид, включающий от 5 до 100 нуклеотидов, обычно в диапазоне от 5 до 30 нуклеотидов. Термин "фармацевтически приемлемый", использованный в данном контексте, обозначает материал, такой как носитель или разбавитель, которые не оказывают отрицательного действия на биологическую активность или свойства соединений, описанных в данном контексте. При введении указанных материалов субъекту они не вызывают нежелательных биологических воздействий или не взаимодействуют с любым из компонентов композиции, содержащей указанные материалы. Термин "фармацевтически приемлемая соль", использованный в данном контексте, обозначает форму соединения, которая не оказывает значительного раздражающего воздействия на организм, в который она вводится, а также характеризуется биологической активностью и свойствами соединений,описанных в данном контексте. Термины "комбинация" или "фармацевтическая комбинация", использованные в данном контексте,обозначают продукт, который получают при смешивании или комбинировании более одного активного ингредиента, и включают фиксированные и нефиксированные комбинации активных ингредиентов. Термин "фиксированная комбинация" обозначает, что активные ингредиенты, например соединение формулы (I) и дополнительный терапевтический агент, оба, вводят пациенту одновременно в составе единой формы или стандартной лекарственной формы. Термин "нефиксированная комбинация" обозначает, что активные ингредиенты, например соединение формулы (I) и дополнительный терапевтический агент,оба, вводят пациенту в виде отдельных форм одновременно, один за другим или последовательно без ограничения по времени, и при этом указанное введение обеспечивает терапевтически эффективные уровни двух соединений в организме пациента. Последнее также относится к комбинированной терапии,например к введению трех или более активных ингредиентов. Термины "композиция" или "фармацевтическая композиция", использованные в данном контексте,-9 020962 обозначают смесь по крайней мере одного соединения, такого как соединение формулы (I) по изобретению, и по крайней мере одного и необязательно более других фармацевтически приемлемых химических компонентов, таких как носители, стабилизаторы, разбавители, дезинтегрирующие агенты, суспендирующие агенты, загустители и/или эксципиенты. Термин "физиологическое значение pH" или "в диапазоне физиологических значений pH" обозначает, что значение pH находится в диапазоне от 7,2 до 8,0 включительно, обычно в диапазоне приблизительно от 7,2 до 7,6 включительно. Термины "полинуклеотид" и "нуклеиновая кислота", использованные в данном контексте, являются взаимозаменяемыми и обозначают одноцепочечные или двухцепочечные полимеры дезоксирибонуклеотидов или рибонуклеотидов. Одноцепочечные полинуклеотиды включают кодирующие цепи и антисмысловые цепи. Полинуклеотиды включают РНК и ДНК, которые можно выделить из природных источников, синтезировать in vitro или получить, комбинируя природные и синтетические соединения. Примеры полинуклеотидов включают, но не ограничиваясь только ими, гены, кДНК, мРНК, самореплицирующиеся РНК, самореплицирующиеся ДНК, последовательности геномной ДНК, последовательности геномной РНК, олигонуклеотиды. Самореплицирующиеся РНК и самореплицирующиеся ДНК способны к самоамплификации, когда проникают в клетку хозяина. Термин "полинуклеотид" включает линейные и нелинейные полинуклеотиды (например, содержащие циклические, разветвленные элементы и т.п.). Термины "полинуклеотид" и "нуклеиновая кислота" включают модифицированные варианты (например, последовательности с делецией, включением и/или заменой основания). Модифицированные варианты можно получать с использованием сайтнаправленного мутагенеза или они могут образовываться случайно в ходе спонтанных мутаций. Полинуклеотид может содержать мономеры, которые являются природными нуклеотидами (такие как ДНК и РНК) или аналогами природных нуклеотидов или комбинации обоих типов нуклеотидов. Модифицированные нуклеотиды включают нуклеотиды, в которых модифицированы сахаридные фрагменты и/или пиримидиновые или пуриновые основания. Модификация сахаридов включат, например, замену одной или более гидроксильных групп на атомы галогенов, алкилкильные группы, амины и азидные группы или остатки сахаров модифицируют с образованием простых или сложных эфиров. Кроме того,весь сахаридный фрагмент можно заменить на другие структуры, которые характеризуются подобными стерическими и зарядовыми свойствами, например, такие как азасахара и карбоциклические аналоги сахаров. Примеры модифицированных оснований включают алкилированные пурины и пиримидины, ацилированные пурины или пиримидины или другие известные гетероциклические заместители. Мономеры в составе полинуклеотидов связаны через фосфодиэфирные связи или через аналоги указанных связующих звеньев. Аналоги фосфодиэфирных связующих звеньев включают фосфоротиоат (тиофосфат), фосфородитиоат, фосфороселеноат, фосфородиселеноат, фосфороанилотиоат, фосфоранилидат, фосфорамидат и т.п. Термины "полинуклеотид" и "нуклеиновая кислота" включают также так называемые "пептиднуклеиновые кислоты", которые включают природные или модифицированные основания нуклеиновых кислот, присоединенные к полиамидной цепи. Термин "полинуклеотидсодержащие соединения", использованный в данном контексте, обозначает соединение, часть которого, по крайней мере, является полинуклеотидом. Термины "полипептид", "белок" и "пептид", использованные в данном контексте, обозначают любой полимер, содержащий множество аминокислотных остатков, независимо от длины или посттрансляционной модификации (например, за счет фосфорилирования или гликозилирования), соединенных, по крайней мере частично, ковалентными связями (например, термин "белок", использованный в данном контексте, обозначает линейные полимеры (цепи), состоящие из аминокислот, связанных пептидными связями, которые, как и белки, характеризуются вторичной, третичной и четвертичной структурой и стабилизированы различными внутримолекулярными связями и межмолекулярными взаимодействиями,такими как водородные и ван-дер-ваальсовы связи внутри пептидной цепи или между пептидными цепями). Примеры полипептидов включают, но не ограничиваясь только ими, белки, пептиды, олигопептиды, димеры, полимеры, различные производные и т.п. В некоторых вариантах в полипептиде отсутствуют модификации, например, в результате фосфорилирования и гликозилирования. Полипептид может представлять собой индивидуальный природный полипептид или его фрагмент, гибридный или синтетический полипептид, который содержит аминокислотные последовательности из двух или более природных полипептидов. Термин "полинуклеотидсодержащие соединения", использованный в данном контексте, обозначает соединение, по крайней мере часть которого является полипептидом. Примеры включают полипептиды,гликопротеины, металлобелки, липопротеины, сахаридные антигены, конъюгированные с белкаминосителями и т.п. Термин "респираторное заболевание", использованный в данном контексте, обозначает заболевания, поражающие органы дыхательной системы, такие как нос, горло, гортань, трахея, бронхи и легкие. Респираторные заболевания включают, но не ограничиваясь только ими, астму, респираторный дистресссиндром у взрослых и аллергическую (приобретенную) астму, неаллергическую (наследственную) астму,астматическое состояние, хроническую астму, острую (клиническую) астму, ночную астму, аллерген- 10020962 индуцируемую астму, аспириновую астму, астму физического напряжения, гипервентиляцию, детскую астму, астму у взрослых, кашлевую астму, профессиональную астму, стероид-резистентную астму, сезонную астму, сезонный аллергический ринит, круглогодичный аллергический ринит, хроническое обструктивное заболевание легких, включая хронический бронхит или эмфизему, легочную гипертензию,интерстициальный фиброз легких и/или воспаление дыхательных путей и кистозный фиброз, а также гипоксию. Термин "субъект" или "пациент", использованный в данном контексте, включает млекопитающих и немлекопитающих. Примеры млекопитающих включают, но не ограничиваясь только ими, человека,шимпанзе, человекообразных обезьян, крупный рогатый скот, лошадь, овцу, козу, свинью, кролика, собаку, кошку, крысу, мышь, морскую свинку и т.п. Примеры немлекопитающих включают, но не ограничиваясь только ими, птиц, рыб и т.п. Обычно субъектом является человек, прежде всего человек, у которого установлен диагноз заболевания или нарушения и который нуждается в лечении заболевания или нарушения, описанного в данном контексте. Термин "модулятор TLR7," использованный в данном контексте, обозначает соединение, которое является модулятором рецептора TLR7. Термин "TLR7 заболевание" или "заболевание или нарушение, ассоциированное с активностьюTLR7," использованный в данном контексте, обозначает любое патологическое состояние, ассоциированное с Toll-подобным рецептором. Указанные заболевания или нарушения включают, но не ограничиваясь только ими, инфекционные заболевания, воспалительные заболевания, респираторные заболевания и аутоиммунные заболевания, такие как, но не ограничиваясь только ими, астма, хроническое обструктивное заболевание легких (ХОЗЛ), респираторный дистресс-синдром у взрослых (РДСВ), болезнь Крона, бронхит, дерматит, аллергический ринит, псориаз, склеродермия, уртикария, ревматоидный артрит,рассеянный склероз, рак, ВИЧ и волчанка. Термин "терапевтически эффективное количество", использованный в данном контексте, обозначает любое количество соединения, введение которого по сравнению с соответствующим субъектом, которому не вводили указанное количество, приводит к повышению эффективности лечения, к излечению, к предотвращению развития или к снижению интенсивности симптомов заболевания или нарушения, или к снижению побочного действия. Термин включает также количества, которые эффективны в отношении нормализации физиологических функций. Термин "лечение" или "излечение", использованный в данном контексте, обозначает способы замедления развития, устранения или снижения интенсивности симптомов заболевания или состояния,профилактики preventing дополнительных симптомов, устранения или предотвращения основных метаболических причин симптомов, подавления заболевания или состояния, остановки прогрессирования заболевания или состояния, ослабления заболевания или состояния, стимуляции регрессии заболевания или состояния, снижения интенсивности симптомов, вызванных заболеванием или состоянием, или устранения симптомов заболевания или состояния в ходе профилактического и/или терапевтического лечения. Термин "векторный конструкт" обычно обозначает любую конструкцию, которая может направлять экспрессию исследуемой последовательности (последовательностей) нуклеиновой кислоты или гена (генов). "ДНК векторный конструкт" обозначает молекулу ДНК, которая может направлять экспрессию исследуемой последовательности (последовательностей) нуклеиновой кислоты или гена (генов). Одним конкретным типом ДНК векторного конструкта является плазмида, которая представляет собой эписомальную циклическую ДНК, способную автономно реплицироваться внутри клеток хозяина. Обычно плазмида представляет собой циклическую петлю двухцепочечной ДНК, в которой лигированы дополнительные сегменты ДНК. Примером определенной плазмиды, известной в данной области техники, является плазмида pCMV. Другие известные в данной области техники ДНК векторные конструкты получают на основе РНК-вирусов. Указанные ДНК векторные конструкты обычно содержат промотер, который проявляет свои функции в клетках эукариотов, 5'-последовательность кДНК, для которой продуктом транскрипции является РНК векторный конструкт (например, репликон вектора альфа-вирусной РНК) и 3'-фрагмент терминации. Другие примеры векторных конструктов включают РНК векторные конструкты(например, альфа-вирусные векторные конструкты) и т.п. Термины "РНК векторный конструкт", "РНК векторный репликон" и "репликон", использованные в данном контексте, обозначают РНК, которая может вызывать самоамплификацию или саморепликацию in vivo (обычно внутри клеток-мишеней). РНК векторный конструкт используют напрямую без необходимости введения ДНК в клетку и транспорта в ядро для осуществления транскрипции. При использовании РНК-вектора для прямого введения в цитоплазму клетки хозяина происходит эффективная автономная репликация и трансляция последовательности гетерогенной нуклеиновой кислоты. Названия соединений по изобретению получены с использованием программного обеспеченияChemDraw Ultra 10,0 (фирмы CambridgeSoft) или J. Chem, версия 5.2.2 (фирмы ChemAxon). Представляется очевидным, что после прочтения следующего подробного описания настоящего изобретения можно использовать другие объекты, признаки и преимущества способов, композиций и комбинаций, описанных в данном контексте. Однако следует понимать, что подробное описание и кон- 11020962 кретные примеры представлены только для иллюстрации вариантов осуществления настоящего изобретения. Описание предпочтительных вариантов осуществления изобретения В настоящем изобретении предлагаются соединения, которые являются агонистами Toll-подобного рецептора 7 (TLR7), а также их фармацевтические композиции. В изобретении предлагаются также соединения, фармацевтические композиции и способы, предназначенные для лечения заболеваний и/или нарушений, ассоциированных с активностью TLR7. Агонистами TLR7 по настоящему изобретению являются соединения, характеризующиеся структурной формулой (I), а также их фармацевтически приемлемые солиL2 обозначает C1-C6-алкилен или C2-C6-алкенилен, где C1-C6-алкилен и C2-C6-алкенилен в составе L2 необязательно замещены 1-4 атомами фтора; каждый L3 независимо выбран из C1-C6-алкилена и -CR4R4)pO)q(CH2)p-;R3 выбран из -L1R5, -OL3R5, OL3R7, -OL3L4L3R7, -OR8, -OL3L4R5 и -OL3L4L3R5; каждый R4 независимо выбран из Н и фтора;-CF2P(O)(OH)2. В одних вариантах соединений формулы (I) R1 обозначает C1-C4-алкил, в других вариантах R1 обозначает метил. В других вариантах R1 обозначает -L1R5, -L1R6, -L2R5, -L2R6. В одних вариантах соединений формулы (I), если R1 обозначает -L1R5, -L1R6, -L2R5, -L2R6, то R3 обозначает -OR8. В других вариантах R1 обозначает -L1R5, -L1R6, -L2R5, -L2R6, a R3 обозначает -ОМе. В некоторых вариантах соединений формулы (I) R2 обозначает C1-C4-алкил. В других вариантах 2R обозначает метил. В некоторых вариантах соединений формулы (I) R3 выбран из -L1R5. В других вариантах R3 выбран из -OL3R5, -OL3R7, -OL3L4R7, -OL3L4L3R7, -OR8, -OL3L4R5, -OL3L4L3R5. В некоторых вариантах соединений формулы (I) L3 обозначает группу формулы-CR4R4)pO)q(CH2)p-. В некоторых вариантах соединений формулы (I) L2 обозначает C1-C6-алкилен, в других вариантах 2L обозначает C1-C6-алкилен, замещенный 1-4 атомами фтора. В одних вариантах соединений формулы(I) L2 обозначает C2-C6-алкенилен, в других вариантах L2 обозначает C2-C6-алкенилен, замещенный 1-4 атомами фтора. В некоторых вариантах соединений формулы (I) L3 обозначает C1-C6-алкилен. В одних вариантах указанных соединений формулы (I) R1 обозначает C1-C4-алкил, R2 обозначаетL3 обозначает C1-C6-алкилен. В других вариантах указанных соединений формулы (I) R1 обозначает C1-C4-алкил, R2 обозначаетC1-C4-алкил, R3 обозначает -OL3R5 или -OL3R7, R5 обозначает -P(O)(OH)2, R7 обозначает -CF2P(O)(OH)2,L3 обозначает -CR4R4)pO)q(CH2)p-, R4 обозначает Н, q равен 1 или 2, а р равен 2. В одних вариантах указанных соединений формулы (I) R1 обозначает -L2R6, R2 обозначаетC1-C4-алкил, R3 обозначает -OL3R5 или -OL3R7, R5 обозначает -P(O)(OH)2, R6 обозначает -C(O)OH, R7 обозначает -CF2P(O)(OH)2, L2 обозначает C1-C6-алкилен, а L3 обозначает C1-C6-алкилен. В других вариантах указанных соединений формулы (I) R1 обозначает -L2R6, R2 обозначаетC1-C6-алкил, R3 обозначает -OL3R5 или -OL3R7, R5 обозначает -P(O)(OH)2, R6 обозначает -C(O)OH,R7 обозначает -CF2P(O)(OH)2, L2 обозначает C1-C6-алкилен, L3 обозначает -CR4R4)pO)q(CH2)p-, R4 обозначает Н, q равен 1 или 2, а р равен 2. В еще одних вариантах указанных соединений формулы (I) R1 обозначает -L1R5, -L2R6 или -L1R6,- 12020962R2 обозначает C1-C4-алкил, R3 обозначает -OR8, R8 обозначает C1-C4-алкил, R5 обозначает -P(O)(OH)2,R6 обозначает -CF2P(O)(OH)2, L1 обозначает -C(O)-, a L2 обозначает C1-C6-алкилен или C2-C6-алкенилен,причем каждый необязательно замещен 1-4 атомами фтора. В одних вариантах указанных соединений формулы (I) R1 обозначает C1-C4-алкил, R2 обозначаетC1-C4-алкил, R3 обозначает -OL3L4R5, -OL3L4L3R5 или -OL3L4L3R7, R5 обозначает -P(O)(OH)2, R7 обозначает -CF2P(O)(OH)2, каждый L3 независимо обозначает C1-C6-алкилен, a L4 обозначает фенилен. В других вариантах указанных соединений формулы (I) R1 обозначает C1-C4-алкил, R2 обозначаетC1-C4-алкил, R3 обозначает -L1R5, R5 обозначает -P(O)(OH)2, а L1 обозначает -C(O)- или -O-. Адъюванты, содержащие алюминий, такие как гидроксид алюминия, оксигидроксид алюминия и гидрофосфат алюминия, используют в вакцинах для связывания антигенов. Описание адъювантов, содержащих алюминий, и их применение в вакцинах приводятся в статьях Expert Rev. Vaccines, 46(5), 685698 (2007) и Vaccines, 25, 6618-6624 (2007), которые включены в данное описание в полном объеме в качестве ссылки. Соединения формулы (I) по изобретению являются агонистами TLR7, которые связываются с адъювантами, содержащими алюминий, например, такими гидроксид алюминия, оксигидроксид алюминия и гидрофосфат алюминия. В некоторых вариантах указанные соединения формулы (I) содержат фосфатную группу, остаток фосфоновой кислоты, фосфонатную группу, остаток фторированной фосфоновой кислоты или фторированную фосфонатную группу. В других вариантах указанные соединения формулы(I) содержат фосфатную группу, остаток фосфоновой кислоты, фосфонатную группу, остаток фторированной фосфоновой кислоты или фторированную фосфонатную группу, а также одну или более дополнительных ионогенных групп, выбранных из остатка карбоновой кислоты и сульфогруппы. В одних вариантах соединения формулы (I) по изобретению комбинируют с антигеном, адъювантом, который содержит алюминий, и необязательно носителем, фармацевтически пригодным эксципиентом, при этом получают иммуногенную композицию. В других вариантах указанная иммуногенная композиция содержит соединение формулы (I) и ангитен, где антиген включает, но не ограничиваясь только ими, бактериальный антиген, вирусный антиген, грибковый антиген, опухолевый антиген или антиген,ассоциированный с заболеванием, передающимся половым путем, болезнью Альцгеймера, респираторными нарушениями, аутоиммунными нарушениями, например, такими как ревматоидный артрит или волчанка, нарушениями, развивающимися у детей, и ожирением, при этом композиции содержат соединение в эффективном количестве, которое усиливает иммунологический ответ на антиген у субъекта после введения композиции. Антигены, пригодные для использования в указанных иммуногенных композициях, описаны в данном контексте. В некоторых вариантах указанные иммуногенные композиции включают бактериальный антиген штамма Neisseria meningitides, таким как серологические группы А, С, W135, Y и/или В. Конкретные антигены для применения в указанных композициях описаны в данном контексте. В других вариантах указанные иммуногенные композиции, а также другие композиции по изобретению используют в качестве вакцин, их применение для лечения нарушений, ассоциированных с антигеном, включенным в состав композиции, описано в данном контексте. Соединения формулы (I), их фармацевтически приемлемые соли, а также фармацевтические композиции по изобретению включают также все пригодные изотопно-меченые формы указанных соединений,а также их фармацевтически приемлемые соли, а также фармацевтические композиции. Изотопномечеными формами соединений по изобретению или их фармацевтически приемлемой солью являются формы, в которых по крайней мере один атом заменен на атом, который характеризуется тем же атомным числом, но атомной массой, отличающейся от атомной массы изотопа, который обычно присутствует в природных соединениях. Примеры изотопов, которые можно включать в соединения по настоящему изобретению и их фармацевтически приемлемые соли, включают, но не ограничиваясь только ими, изотопы водорода, углерода, азота и кислорода, такие как 2 Н, 3 Н, 11 С, 13 С, 14 С, 15N, 17 О, 18 О, 35S, 18F, 36Cl и 123I. Различные изотопно-меченые соединения по настоящему изобретению и их фармацевтически приемлемые соли, например соединения, в которые включены радиоактивные изотопы, такие как 3 Н или 14 С, являются пригодными для получения лекарственных средств и/или для изучения их распределения в тканях. В связи с простым методом получения и детектирования в конкретных вариантах можно использовать соединения, меченные 3 Н и 14 С изотопами. В других вариантах замещение изотопами, такими как дейтерий 2H, предоставляет некоторые терапевтические преимущества за счет повышенной метаболической стабильности, например, за счет увеличения времени полураспада in vivo или снижения необходимой дозы. Изотопно-меченые формы соединений, их фармацевтически приемлемые соли, сольваты,N-оксиды, пролекарства и изомеры, а также фармацевтические композиции по изобретению получают по стандартным методикам, используя соответствующие изотопно-меченые формы пригодных реагентов. Способы получения соединений формулы (I). Общие методики получения соединений формулы (I) описаны ниже в разделе "Примеры". Если конечный продукт содержит реакционноспособные функциональные группы, например гидроксигруппы,аминогруппы, иминогруппы, тиогруппы или карбоксильные группы, то перед проведением реакции их защищают для исключения их нежелательного участия в реакции. Можно использовать стандартные за- 13020962 щитные группы по стандартным методикам (см., например, книгу Т.W. Greene и P.G.М. Wuts, "ProtectiveGroups in Organic Chemistry", John WileySons (1991. В некоторых вариантах соединения формулы (I) по изобретению получают в виде фармацевтически приемлемой кислотно-аддитивной соли по реакции соединения формулы (I) в форме свободного основания и фармацевтически пригодной органической или неорганической кислоты. В других вариантах фармацевтически пригодную основно-аддитивную соль соединения формулы (I) по изобретению получают по реакции соединения формулы (I) в форме свободной кислоты и фармацевтически пригодного органического или неорганического основания. В другом варианте солевые формы соединений формулы (I) по изобретению получают, используя исходные материалы или промежуточные соединения в форме соли. В одних вариантах соединения формулы (I) по изобретению существуют в виде других солей и включают,но не ограничиваясь только ими, оксалаты и трифторацетаты. В еще одних вариантах получают полусоли кислот и оснований, например полусульфат полукальциевые соли. Указанные фармацевтически приемлемые кислотно-аддитивные соли соединений формулы (I) включают, но не ограничиваясь только ими, гидробромид, гидрохлорид, сульфат, нитрат, сукцинат, малеат, формиат, ацетат, адипинат, безилат, бикарбонат/карбонат, пропионат, фумарат, цитрат, тартрат,лактат, бензоат, салицилат, глутамат, аспартат, паратолуолсульфонат, бензолсульфонат, метансульфонат,этансульфонат, нафталинсульфонат (например, 2-нафталинсульфонат), гексаноат, бисульфат/сульфат,борат, камсилат, цикламат, эдизилат, эзилат, глюцептат, глюконат, глюкуронат, гексафторфосфат, гибензат, гидрохлорид/хлорид, гидробромид/бромид, гидройодид/йодид, изетионат, малат, малонат, мезилат,метилсульфат, нафтилат, 2-напзилат, никотинат, оротат, оксалат, пальмитат, памоат, фосфат/гидрофосфат/дигидрофосфат, пироглутамат, сахарат, стеарат, таннат, тозилат, трифторацетат и ксинофоат. Органические кислоты или неорганические кислоты, используемые для получения некоторых фармацевтически приемлемых кислотно-аддитивных солей соединений формулы (I), включают, но не ограничиваясь только ими, бромисто-водородную, хлористо-водородную, серную, азотную, фосфорную, янтарную, малеиновую, муравьиную, уксусную, пропионовую, фумаровую, лимонную, винную, молочную,бензойную, салициловую, глутаминовую, аспарагиновую, паратолуолсульфоновую, бензолсульфоновую,метансульфоновую, этансульфоновую, нафталинсульфоновую, такую как 2-нафталинсульфоновая кислота, или гексановую (капроновую) кислоту. Указанные фармацевтически приемлемые основно-аддитивные соли соединения формулы (I) включают, но не ограничиваясь только ими, соли алюминия, аргинина, бензатина, кальция, холина,диэтиламина, диоламина, глицина, лизина, магния, меглумина, оламина, калия, натрия, трометамина и цинка. В некоторых вариантах соединения формулы (I) по изобретению в форме свободной кислоты или свободного основания получают из соответствующей основно-аддитивной соли или кислотноаддитивной соли соответственно. Например, соединение формулы (I) в форме кислотно-аддитивной соли превращают в соответствующее свободное основание при его обработке пригодным основанием (например, раствором гидроксида аммония, гидроксидом натрия и т.п.). Например, соединение формулы (I) в форме основно-аддитивной соли превращают в соответствующую свободную кислоту при его обработке пригодной кислотой (например, хлористо-водородной кислотой). В некоторых вариантах соединения формулы (I) в неокисленной форме получают из N-оксидов соединений формулы (I) при их обработке восстановителем (например, таким как сера, диоксид серы, трифенилфосфин, боргидрид лития, боргидрид натрия, треххлористый фосфор, трибромид или т.п.) в пригодном инертном органическом растворителе (например, таком как ацетонитрил, этанол, водный диоксан и т.п.) при температуре от 0 до 80C. В одних вариантах пролекарства соединений формулы (I) получают по известным методикам (например, подробно описанным в статье Saulnier et al., Bioorganic and Medicinal Chemistry Letters, vol. 4,1985 (1994. Например, соответствующие пролекарства получают при взаимодействии немодифицированного соединения формулы (I) с пригодным карбамилирующим агентом (например, таким как 1,1-ацилоксиалкилкарбанохлоридат, паранитрофенилкарбонат или т.п.). В еще одних вариантах соединения формулы (I) получают в виде защищенных производных по известным методикам. Подробное описание методик для введения защитных групп и их удаления представлено в книге Т.W. Greene, "Protecting Groups in Organic Chemistry", 3-е изд., John WileySons, Inc.,(1999). В других вариантах соединения формулы (I) получают в виде сольватов (например, гидратов). В некоторых вариантах гидраты соединений формулы (I) получают перекристаллизацией из смеси вода/органический растворитель, такой как диоксан, тетрагидрофуран или метанол. В одних вариантах соединения формулы (I) получают в виде их индивидуальных стереоизомеров. В других вариантах соединения формулы (I) по изобретению получают в виде их индивидуальных стереоизомеров при взаимодействии рацемической смеси соединения с оптически активным разделяющим агентом с образованием пары диастереоизомеров, которые разделяют и выделяют оптически чистые энантиомеры. В некоторых вариантах разделение энантиомеров проводят, используя ковалентные произ- 14020962 водные диастереомеров соединений формулы (I) или используя диссоциирующие комплексы (например,кристаллические соли диастереомеров). Диастереомеры характеризуются различными физическими свойствами (например, такими как температура плавления, температура кипения, растворимость, реакционная способность и т.п.), и, таким образом, их разделяют с учетом указанных различий. В одних вариантах диастереомеры разделяют хроматографией или методами разделения/выделения с учетом различий растворимости. Затем получают оптически чистый энантиомер и разделяющий агент, используя любые стандартные способы, которые не приводят к рацемизации. Более подробное описание методик,пригодных для выделения стереоизомеров соединений из их рацемической смеси, представлено в книгеJean Jacques, Andre Collet, Samuel H. Wilen, "Enantiomers, Racemates and Resolutions," John WileySons,Inc. (1981). Соединения формулы (I) можно получить по методикам, описанным в данном контексте, а также представленным в разделе "Примеры". В некоторых вариантах соединения формулы (I) можно получить с использованием следующих стадий:(а) необязательно превращение соединения формулы (I) в фармацевтически приемлемую соль;(б) необязательно превращение солевой формы соединения формулы (I) в свободную форму;(в) необязательно превращение неокисленной формы соединения формулы (I) в фармацевтически пригодный N-оксид;(д) необязательно выделение индивидуального изомера соединения формулы (I) из смеси изомеров;(е) необязательно превращение немодифицированного соединения формулы (I) в фармацевтически приемлемое пролекарство и(ж) необязательно превращение пролекарства соединения формулы (I) в немодифицированное соединение. Схемы реакций (I)-(XI) приведены для иллюстрации примеров синтеза, используемых для получения соединений формулы (I) по изобретению, но не ограничивают его объем. На схеме(I-2) в присутствии палладиевого катализатора. В качестве галогенового заместителя в составе 3-галогенпиколинонитрилпроизводных можно использовать, например, бром или хлор. Группы RA и RB в составе бензонафтиридинов (I-3) имеют значения, описанные для заместителей в соответствующих положениях соединений формулы (I), или RA и RB обозначают группы, из которых в ходе дальнейшей модификации образуются соответствующие заместители соединений формулы (I), описанные в данном контексте. Схема I В некоторых вариантах фенилбороновые кислоты, используемые в синтезе соединений формулы(I), получают по последовательности реакций, представленных на схеме II. Согласно схеме II анилин(II-1) защищают Вос-защитной группой в присутствии основания, при этом получают соединение (II-2),затем проводят реакцию ортолитиирования, реакцию с триметилборатом, а затем обработку водой, при этом получают бороновые кислоты (I-1). Схема II Бороновые кислоты (I-1) используют, как представлено на схеме I, в реакции с цианопиридинами(I-2), при этом получают бензонафтиридины (I-3). В некоторых вариантах при синтезе соединений формулы (I) используют эквиваленты бороновых кислот, которые включают, но не ограничиваясь только ими, боронатные эфиры. На схеме III представлен синтез указанных боронатных эфиров (III-3), которые используют в качестве эквивалентов бороновой кислоты при синтезе бензонафтиридинов (I-3). Согласно схеме III 2-галогенанилины (III-1) защищают Вос-защитной группой в присутствии основания, при этом получают соединения (III-2), которые за- 15020962 тем превращают в боронатные эфиры (III-3) в присутствии палладиевого катализатора. Указанные боронатные эфиры (III-3) используют, как представлено на схеме I, в реакции с цианопиридинами (I-2), при этом получают замещенные или незамещенные бензонафтиридины (I-3). Схема III В некоторых вариантах 2-броманилины, используемые, как представлено на схеме III, синтезируют из соответствующих нитробензолпроизводных, как представлено ниже В других вариантах соединения формулы (I) синтезируют по последовательности реакций, представленной на схеме IV. Схема IV Согласно схеме IV 3-хлорбензальдегид (IV-1) сначала превращают в соответствующий гидроксиламин (IV-2), который затем используют для получения соответствующего нитрила (IV-3). Используя условия и палладиевый катализатор, как представлено на схеме I, производные нитрила (IV-3) конденсируют с бороновыми кислотами (II) (или боронатными эфирами (III-3, при этом получают бензонафтиридин (I-3). В других вариантах некоторые соединения формулы (I), содержащие заместители, присоединенные через атом углерода, включая бензонафтиридины, содержащие в положении 2 различные заместители,присоединенные через атом углерода, получают по последовательности реакций, представленной на схеме V. Схема VV из 3,5-дигалогенпиколинонитрила,например,такого как 3,5-дихлорпиколинонитрила (V-1) сначала получают монозамещенное производное, используя 1 экв. бороновой кислоты/боронатного эфира, при этом получают соответствующий пиколинонитрил (V-2). В- 16020962 более жестких условиях и в присутствии палладиевого катализатора, по сравнению со схемой I, производные нитрила (V-2) конденсируют с бороновыми кислотами (I-1) (или боронатными эфирами (III-3,при этом получают бензонафтиридин (V-3), содержащий заместители, присоединенные через атом углерода в положении 2. В некоторых вариантах заместителем, который присоединен через атом углерода,является алкен, в других вариантах указанные алкены гидрируют, при этом получают бензонафтиридины, содержащие алкильные группы в положении 2. В одних вариантах некоторые соединения формулы (I), содержащие различные заместители, включая бензонафтиридины, содержащие различные заместители в положении 2, синтезируют по последовательности реакций, представленной на схеме IV. Схема (VI)(5,6-дихлорпиридин-3-ил)метанол, сначала превращают в соответствующий нитрил (VI-2). В условиях,как представлено на схеме I, и в присутствии палладиевого катализатора производные нитрила (VI-2) конденсируют с бороновыми кислотами (I-1) (или боронатными эфирами (III-3, при этом получают бензонафтиридин (I-3). В других вариантах некоторые соединения формулы (I) синтезируют по последовательности реакций, представленной на схеме VII. Схема VII Согласно схеме VII арилбромиды или арилйодиды (VII-1) конденсируют с триэтил(этинил)силаном(или его эквивалентами) в присутствии палладиевого катализатора, при этом получают соединение(VII-2). После удаления силильной защитной группы полученные ацетиленовые производные (VII-3) конденсируют с 3,5-дихлорпиколинонитрилом (VII-4) в присутствии палладиевого катализатора, при этом получают 3-хлор-2-цианопиридины (VII-5). Производные (VII-5), например, такие как 3-хлор-5-(фенилэтинил)пиколинонитрил, конденсируют с бороновыми кислотами (I-1) (или боронатными эфирами (III-3, при этом получают бензонафтиридин (VII-6). Затем соединение (VII-6) гидрируют в соответствующих условиях, при этом получают бензонафтиридины (VII-7). Группы R2, а также RA и RB в составе бензонафтиридинов (VII-7) имеют значения заместителей соединения формулы (I) в соответствующих положениях, описанные в данном контексте. В других вариантах некоторые соединения формулы (I) синтезируют по последовательности реакций, представленной на схеме VIII. Согласно схеме VIII арилбромиды или арилйодиды (VIII-1) конденсируют с триэтил(этинил)силаном (или его эквивалентами) в присутствии палладиевого катализатора, при этом получают соединение (VIII-2). После удаления силильной защитной группы полученные ацетиленовые производные (VIII-3) конденсируют с 3,5-дихлорпиколинонитрилом (VIII-4) в присутствии палладиевого катализатора, при этом получают 3-хлор-2-цианопиридины (VIII-5). Производные (VIII-5), например,такие как 3-хлор-5-(фенилэтинил)пиколинонитрил восстанавливают, т.е. гидрируют в соответствующих условиях, при этом получают соответствующий 3-хлор-5-фенетилпиколинонитрил (VIII-6). Соединение(VIII-6) конденсируют с бороновыми кислотами (I-1) (или боронатными эфирами (III-3, при этом получают бензонафтиридины (VIII-7). Группы R2, а также RA и RB в составе бензонафтиридинов (VII-7) имеют значения заместителей соединения формулы (I) в соответствующих положениях, описанные в данном контексте. В других вариантах некоторые соединения формулы (I) синтезируют по последовательности реакций, представленной на схеме IX. Схема IX- 18020962 Согласно схеме IX соединение (IX-1), содержащее фенольную группу, алкилируют, используя различные электрофильные соединения, где R1, R2, L1, L3, L4, R5 и R7 имеют значения, описанные в данном контексте. В некоторых вариантах аналоги, содержащие в указанном положении алкоксигруппу в фенольном кольце, получают, как представлено на схеме 1, где соединение, содержащее фенольную группу, алкилируют с использованием электрофильного соединения, содержащего фосфонатную группу, при этом получают защищенный фосфонат, который обрабатывают пригодным деблокирующим агентом,при этом получают фосфоновую кислоту. Примеры соединений формулы (I) по изобретению, а также способов получения указанных соединений приведены только для иллюстрации и не ограничивают объем изобретения. Например, некоторые соединения формулы (I), содержащие в качестве заместителя в положении C-8 остаток карбоновой кислоты, получают по последовательности реакций, представленной на схеме II. Например, некоторые соединения формулы (I), содержащие в качестве заместителя в положенииC-8 остаток ,'-дифторфосфоновой кислоты, получают по последовательности реакций, представленной на схеме III, где первичный спирт окисляют до альдегида, который алкилируют, используя соответствующий фосфонат, при этом получают производное фосфоновой кислоты. Затем в составе соединения окисляют остаток бензилового спирта, при этом образуется кетогруппа, которую затем гидролизуют, при этом получают требуемое производное фосфоновой кислоты. Например, другие соединения формулы (I), содержащие в качестве заместителя в положении C-8 остаток фосфоновой кислоты, получают по последовательности реакций, представленной на схеме IV,где альдегид обрабатывают реагентом Виттига, при этом получают винилфосфонаты. Фосфонат гидролизуют, например, в присутствии триметилсилилбромида, при этом получают фосфоновую кислоту. В другом варианте винильную группу гидрируют, при этом получают алкилсвязанный фосфонат, который гидролизуют, при этом получают алкилсвязанную фосфоновую кислоту. Например, еще одни соединения формулы (I), содержащие арилфосфатные группы, получают по последовательности реакций, представленной на схеме V, где соединение, содержащее фенольную группу, обрабатывают 1-(бромметил)-3-йодбензолом и карбонатом цезия, при этом получают промежуточное соединение, которое по реакции перекрестного сочетания в присутствии палладиевого катализатора конденсируют с триэтилфосфонатом, затем полученный продукт гидролизуют в присутствии триметилсилилбромида, при этом получают соединения, содержащие остаток фосфоновой кислоты. Например, одни соединения формулы (I), содержащие в качестве заместителя в положении C-8 остаток -кетофосфоновой кислоты, получают по последовательности реакции, представленной на схемеVI, где альдегид обрабатывают трис-(триметилсилил)фосфитом, затем полученный продукт окисляют в присутствии IBX (2-йодоксибензойная кислота), при этом получают фосфоновую кислоту. Фармакология и применимость После атаки чужеродного антигена на иммунную систему в организме субъекта формируется защитный ответ, который характеризуется скоординированным взаимодействием врожденной и приобретенной иммунных систем. Указанные две взаимодействующие системы соответствуют двум в основном взаимоисключающим требованиям: скорость (функция врожденной системы) и специфичность (функция адаптивной системы). Врожденная иммунная система выполняет роль первой линии защиты против атаки патогенов,сдерживая атаку патогенов в то время, пока формируется адаптивный ответ. Врожденная система действует в течение первых минут после инфицирования по ангитен-независимому механизму, формируя ответ на широкий спектр консервативных структур патогенов (хотя указанный ответ является неспецифичным, система может различить "свои" компоненты от патогенов). Важным является тот факт, что при этом генерируются также воспалительная и совместно стимулирующая среды (которые иногда называют сигналом опасности), которые потенциируют адаптивную иммунную систему и направляют ее на формирование клеточного или гуморального ответов, которые в наибольшей степени способствуют борьбе с возбудителем инфекции. В литературе описаны модуляторы TLR для активации врожденного иммунитета в терапевтических целях (см. статьи Nature Medicine, 13, 552-559 (2007), Drug Discovery Today:Therapeutic Stategies, 3, 343-352 (2006) и Journal of Immunology, 174, 1259-1268 (2005. Адаптивный ответ формируется в течение нескольких дней или недель, но в конечном итоге обеспечивает достаточно высокую специфичность в отношении патогена, необходимую для полного уничтожения патогена и формирования иммунологической памяти. Такой ответ опосредован главным образом действием Т- и B-клеток, которые образуются в результате перестройки генов эмбрионального типа, характеризуются специфичностью и продолжительной "памятью". Однако такой ответ включает также приток элементов врожденной иммунной системы, включая специализированные фагоциты (макрофаги,нейтрофилы и т.п.) и гранулоциты (базофилы, эозинофилы и т.п.), которые способны поглощать бактерии и даже относительно большие протозойные паразиты. Как только сформируется адаптивный иммунный ответ, последующее взаимодействие с патогеном приводит к его быстрому уничтожению за счет генерирования высокоспецифичных клеток памяти, которые быстро активируются после последующего воздействия с их когнатным антигеном.- 19020962 Аутоиммунные заболевания определяются (1) гуморальным или антительным ответом на собственный антиген (например, при аутоиммунном первичном гипертиреоидизме Грейвса с участием антител к рецептору тиреотропного гормона) или (2) клеточным ответом, когда иммунные клетки разрушают неиммунные клетки, из которых образуется собственный антиген (например, тироциты (тиреоидит Хашимото) или -островковые клетки поджелудочной железы (диабет типа 1). Многие аутоиммунные заболевания представляют собой комбинацию обоих явлений, например, при тиреоидите Хашимото и диабете типа 1 образуются аутоантитела - антитироидпероксидаза (ТРО) или антиглутаминовая кислотадекарбоксилаза (ОАВ)/островковая клетка. Аутоиммунные заболевания часто включают воспалительный компонент, включая, но не ограничиваясь только ими, повышение уровня молекул адгезии (например,молекула адгезии сосудистого эндотелия-1 (VCAM-1 и измененной адгезии лейкоцитов к сосудистой сети, например, такие как колит, системная красная волчанка, системный склероз и сосудистые осложнения при диабете.Toll-подобные рецепторы (TLR) относятся к трансмембранным белкам типа I, которые содержат внеклеточный домен, включающий повторяющиеся обогащенные лейцином последовательности вN-концевой области (LRR), за которыми расположена обогащенная цистеином область, домен ТМ и внеклеточный (цитоплазматический) хвост, который содержит консервативный фрагмент, названный доменом рецептора Toll/ИЛ-1 (домен TIR). TLR являются образ-распознающими рецепторами (ОРР), которые в основном экспрессированы на иммунных клетках, включая, но не ограничиваясь только ими, дендритные клетки, Т-лимфоциты, макрофаги, моноциты и природные клетки-киллеры. Домен LLR имеет важное значение для связывания с лигандом и последующей передачи сигнала, что является общим признаком ОРР. Домен TIR играет важную роль для белок-белковых взаимодействий и связан с наследственной иммунной системой. Домен TIR входит в состав многочисленного суперсемейства ИЛ-1 R/TLR, которое состоит из трех подгрупп. Члены первой группы включают иммуноглобулиновые домены в своих внеклеточных областях и включают рецепторы ИЛ-1 и ИЛ-18, а также акцессорные белки и ST2. Вторая группа включает TLR. Третья группа включает внутриклеточные белки-адаптеры, играющие важную роль в передаче сигнала.TLR представляют собой группу образ-распознающих рецепторов (ОРР), которые связываются с патоген-ассоциированными молекулярными структурами (РАМР) из бактерий, грибов, простейших и вирусов, и действуют в качестве первой линии защиты от проникновения патогенов. TLR необходимы для индукции экспрессии генов, принимающих участие в воспалительной ответной реакции, и, кроме того, TLR и врожденная иммунная система являются определяющей стадией в формировании антигенспецифического приобретенного иммунитета. Адаптивный (гуморальный или клеточно-опосредованный) иммунитет ассоциирован с сигнальными путями TLR врожденного иммунитета. Врожденный иммунитет представляет собой быстрый защитный ответ иммунных клеток, формируемый в ответ на атаку патогенов из окружающей среды, включая,но не ограничиваясь только ими, бактериальные или вирусные агенты. Адаптивный иммунитет представляет собой более медленный ответ, который включает дифференциацию и активацию наивных Т-лимфоцитов в Т хелперные клетки 1 (Th1) или Т хелперные клетки 2 (Th2). Активация клеток Th1 приводит главным образом к формированию клеточного иммунитета, тогда как активация клеток Th2 приводит главным образом к формированию гуморального ответа. Несмотря на основную функцию врожденной иммунной системы для защиты организма-хозяина, патологическая экспрессия сигналов врожденной иммунной системы с участием пути TLR приводит к развитию аутоиммунных-воспалительных заболеваний. Предполагают, что все TLR проявляют свою функцию в виде гомодимера или гетеродимера при распознавании специфичной детерминанты или серии специфичных молекулярных детерминант, расположенных на патогенных организмах, включая бактериальные, расположенные на поверхности клеток липополисахарид, липопротеины, бактериальный флагеллин, ДНК бактерий и вирусов, а также вирусную РНК. Клеточный ответ на активацию TLR включает активацию одного или более факторов транскрипции, что приводит к продуцированию и секреции цитокинов и совместно стимулирующих молекул, таких как интерфероны, ФНО, интерлейкины, MIP-1 МСР-1, которые вносят вклад в уничтожение патогенов и устранение их проникновения. Пространственная экспрессия TLR совмещена с границей раздела между организмом-хозяина и окружающей средой. В то время как в дрозофиле клонированы лишь несколько других Toll-подобных белков, семейство TLR человека состоит по крайней мере из 11 членов, TLR1-TLR11, которые проявляют перекрывающиеся, но различные биологические ответы за счет различия в клеточной экспрессии и путях передачи сигналов, которые они индуцируют. Каждый тип TLR экспрессируется на различной субпопуляции лейкоцитов, и каждый TLR проявляет специфичность к экспрессионной структуре и чувствительность к РАМР, а также распознает различные субпопуляции патогенов, обеспечивая надежный надзор с помощью иммунной системы.TLR1 локализован в хромосоме 4 р 14, и ее последовательность кодирует белок, состоящий предположительно из 786 аминокислотных остатков (а.к.) и содержащий 18 богатых лейцином фрагментов вN-концевом фрагменте с рассчитанной молекулярной массой 84 кДа. TLR1 характеризуется наибольшей аминокислотной гомологией с TLR6 и TLR10, которая составляет 68 и 48% соответственно. мРНК TLR1 экспрессируется во всех типах клеток и присутствует в более высоких уровнях, по сравнению с мРНК других TLR. В общей популяции лейкоцитов TLR1 в наибольшей степени экспрессируется моноцитами, но экспрессируется также макрофагами, дендритными клетками, полиморфноядерными лейкоцитами, В-, T-клетками и природными клетками-киллерами. In vivo обнаружены два транскрипта TLR1 различного размера, что указывает на различный сплайсинг мРНК, что приводит к генерации двух различных форм белка. In vitro наблюдается разрегулированная экспрессия мРНК TLR1 и белка с повышением активности в моноцитарных клетках лейкоза (ТНР-1) после РМА-индуцируемой дифференциации. Экспрессия TLR1 регулируется с повышением активности аутокринным ИЛ-6 и усиливается также действием ИНФ-, ИЛ-10 и ФНО-. Однако уровень TLR1 не изменяется в присутствии грамположительных и грамотрицательных бактерий. Ех vivo экспрессия TLR1 в моноцитах и гранулоцитах регулируется с понижением активности после обработки грамотрицательными бактериями. TLR1 образует гетеродимер с TLR2. TLR1 образует также гетеродимер с TLR4, что ингибирует активностьTLR2 локализован в хромосоме 4q31-32, и ее последовательность кодирует белок, состоящий предположительно из 784 (а.к.), содержащий 19 богатых лейцином фрагментов в N-концевом фрагменте с рассчитанной молекулярной массой 84 кДа. TLR2 характеризуется наибольшей аминокислотной гомологией с TLR6, которая составляет 31%. Установлено, что мРНК TLR2 экспрессируется в тканях мозга, сердца, легких, селезенки и в наибольшей степени в лейкоцитах периферической крови (ЛПК), например, из миеломоноцитарного источника. In vivo обнаружены два транскрипта TLR2 различного размера, что указывает на различный сплайсинг мРНК. In vitro наблюдается разрегулированная экспрессия мРНК TLR2 и белка с повышением активности в моноцитарных клетках лейкоза (ТНР-1) после РМА-индуцируемой дифференциации. TLR2 регулируется с повышением активности аутокринным ИЛ-6 и ФНО-, ИЛ-1, а также ИЛ-10. Экспрессия мРНК TLR2 усиливается после воздействия на них грамположительных и грамотрицательных бактерий. TLR2 образуют гетеродимер с TLR1, TLR6 и предположительно с TLR10, причем каждый комплекс прежде всего чувствителен к подгруппе TLR2-ассоциированных РАМР. Комплексы TLR2 распознают широкий диапазон РАМР, прежде всего бактерий. Они включают, но не ограничиваясь только ими, липоарабиноманнан (ЛАМ), липополисахарид (ЛПС), липотейхоевую кислоту (ЛТК), пептидогликан (ПГ) и другие гликолипиды, гликопротеины, а также липопротеины. Комплексы TLR2 способны также распознавать вирусы, включая, но не ограничиваясь только ими, вирус кори, цитомегаловирус человека(ЦМВч) и вирус гепатита С (ВГС) и грибковые РАМР, включая, но не ограничиваясь только им, зимозан.TLR2 распознает множество липопротеинов/липопептидов из различных патогенов, например, таких как грамположительные бактерии, микобактерии, Trypanosoma cruzi, грибы и трепонема. Кроме того, TLR2 распознает ЛПС из неэнтеробактерий, например, таких как Leptospira interrogans, Porphyromonas gingivalis и Helicobacter pylori. Комплексы TLR2 способны распознавать чужеродные структуры и измененные собственные структуры, например, представленные в некротирующих клетках. TLR2 накапливается в фагосомах и принимает участие в интернализации микробных продуктов клетками.TLR3 локализован в хромосоме 4q35, и ее последовательность кодирует белок, состоящий предположительно из 904 (а.к.) и содержащий 24 богатых лейцином фрагмента в N-концевом фрагменте с рассчитанной молекулярной массой 97 кДа. TLR3 характеризуется наибольшей аминокислотной гомологией с TLR5, TLR7 и TLR8, которая составляет в каждом случае 26%. мРНК TLR3 экспрессируется на высоком уровне в плаценте и поджелудочной железе. TLR3 экспрессируется дендритными клетками, T-клетками и природными клетками-киллерами. In vivo обнаружены два различных транскрипта TLR3 различного размера, что указывает на различный сплайсинг мРНК,что приводит к генерации двух различных форм белка. In vitro в РМА-дифференцированных ТНР-1 клетках наблюдается разрегуляция TLR3 с повышением активности до умеренного уровня аутокринным ИНФ-, ИЛ-1, ИЛ-6, ИЛ-10 и ФНО-. Количество мРНК TLR3 повышается после обработки грамотрицательными бактериями и в еще большей степени повышается в ответ на грамположительные бактерии.Ex vivo экспрессия TLR3 повышается в моноцитах и гранулоцитах после обработки грамотрицательными бактериями. TLR3 образует гомодимер и распознает вирусную двухцепочечную РНК (дцРНК). Предполагается, что обычно TLR экспрессируются на поверхности клеток, однако TLR, чувствительные к внутриклеточным РАМР, таким как дцРНК в случае TLR3, локализованы внутри клетки в лизосомах.TLR4 локализован в хромосоме 9q32-33, и характеризуется высокой гомологией с полноразмерной аминокислотной последовательностью dToll. Последовательность TLR4 состоит предположительно из 839 (а.к.) и содержит 22 богатых лейцином фрагмента в N-концевом фрагменте, рассчитанная молекулярная масса составляет 90 кДа. TLR4 характеризуется наибольшей гомологией с TLR1 и TLR6, котораяIn vivo мРНК TLR4 экспрессируется в виде одного транскрипта, и обнаружена на самом высоком уровне в селезенке и ЛПК. В популяциях ЛПК TLR4 экспрессируется B-клетками, дендритными клетками, моноцитами, макрофагами, гранулоцитами и T-клетками. TLR4 экспрессируется также в миеломоноцитарных клетках и на самом высоком уровне - в мононуклеарных клетках. In vitro наблюдается разрегулированная экспрессия мРНК TLR4 и белка с повышением активности в клетках ТНР-1 после РМА-индуцированной дифференциации. TLR4 регулируется с повышением активности до умеренного уровня аутокринным ИНФ-, ИЛ-1. Экспрессия мРНК TLR4 в ТНР-1 клетках не изменяется при обработке грамположительными и грамотрицательными бактериями. Ex vivo в гранулоцитах и моноцитах экспрессия TLR4 активируется после обработки грамотрицательными бактериями.TLR4 образует гомодимер и требуется внеклеточная ассоциация с дополнительным компонентом,MD-2. Хотя комплексы TLR2 способны распознавать ЛПС, обычно TLR4 рассматривают в качестве рецептора ЛПС. Однако гомодимеры TLR4, ассоциированные с MD-2, непосредственно не связываются с ЛПС. Сначала ЛПС связывается с растворимым ЛПС-связывающим белком (ЛСБ). Затем ЛПС связывается с растворимым CD14 или с CD14, связанным с GPI. Дополнительные компоненты, в зависимости от типа клеток, необходимые TLR4 для связывания с ЛПС, включают CXCR4, GDF-5, CD55, различные белки теплового шока (HSP) и рецепторы комплемента (CR). Комплекс TLR4 распознает также несколько других бактериальных РАМР, включая LTA. Кроме того, комплекс TLR4 распознает вирусы, включая респираторно-синцитиальный вирус (РСВ), вирус гепатита С (ВГС), а также вирус опухоли молочной железы мышей (MMTV). Комплекс TLR4 может распознавать также эндогенные лиганды, например белки теплового шока (HSP60 и HSP70), фибриноген, домен А фибронектина, олигосахариды гиалуроновой кислоты, гепарансульфат, поверхностно-активный белок A (SP-A), а также -дефензины. TLR4 образует также гетеродимеры с TLR5, который усиливает его активность, а также с TLR1, который ингибирует его активность.(а.к.) с рассчитанной молекулярной массой 91 кДа. TLR5 характеризуется наибольшей гомологией сIn vivo мРНК TLR5 экспрессируется в виде одного транскрипта в яичниках, предстательной железе и ЛПК. TLR5 экспрессируется различными популяциями ЛПК и на наибольшем уровне - в моноцитах.TLR5 экспрессируется также на базолатеральной стороне эпителиальных клеток желудочно-кишечного тракта и эндотелиальных клеток желудочно-кишечного тракта в субэпителиальных компартментах. Invitro TLR5 регулируется с повышением активности в РМА-дифференцированных ТНР-1 клетках аутокринным ИЛ-6, ИЛ-10 и ФНО-, но активность увеличивается также в присутствии ИНФ-. Экспрессия мРНК TLR5 увеличивается после воздействия грамположительных и грамотрицательных бактерий.Ex vivo в гранулоцитах и моноцитах экспрессия TLR5 регулируется с понижением активности после обработки грамотрицательными бактериями. TLR5 образует гомодимер, а также гетеродимер с TLR4. Комплексы обоих типов распознают белок флагеллин жгутиковых бактерий. Экспрессия TLR5 человека в клетках СНО чувствительна к флагеллину, мономерному компоненту бактериального жгутика. Флагеллин активирует эпителиальные клетки легких, индуцируя продуцирование воспалительных цитокинов. Полиморфизм стоп-кодона в TLR5 ассоциирован с чувствительностью к пневмонии, вызванной жгутиковой бактерией Legionella pneumophila.TLR6 локализован в хромосоме 4 р 14, и последовательность TLR6 кодирует белок, содержащий предположительно 796 (а.к.) и содержащий 20 богатых лейцином фрагментов в N-концевом фрагменте с рассчитанной молекулярной массой 91 кДа. TLR6 характеризуется наибольшей аминокислотной гомологией с TLR1, TLR10 и TLR2, которая составляет 68, 46 и 31% соответственно.In vivo транскрипт TLR6 обнаружен в тимусе, селезенке и легких. Экспрессия мРНК TLR6 на высоком уровне наблюдается в B-клетках и моноцитах. In vitro наблюдается разрегулированная экспрессия мРНК TLR6 с повышением активности в ТНР-1 клетках после РМА-индуцированной дифференциации.TLR6 регулируется с повышением активности до умеренного уровня аутокринным ИНФ-, ИЛ-1. Однако экспрессия мРНК TLR6 в ТНР-1 клетках не изменяется при обработке грамположительными и грамотрицательными бактериями. Ex vivo в моноцитах и гранулоцитах экспрессия TLR6 регулируется с понижением активности после обработки грамотрицательными бактериями. TLR6 образует гетеродимер с TLR2. Принято считать, что TLR6, как и TLR1, обеспечивает или повышает чувствительность TLR2 к РАМР и принимает участие в его сигнальных путях через гетеродимеризацию.TLR7 локализован в хромосоме Хр 22 человека, и последовательность TLR7 кодирует белок, содержащий предположительно 1049 (а.к.) и содержащий 27 богатых лейцином фрагментов в N-концевом фрагменте с рассчитанной молекулярной массой 121 кДа. TLR7 характеризуется наибольшей гомологией с TLR8 и TLR9, которая составляет 43 и 36% соответственно.In vivo мРНК TLR7 экспрессируется в легких, плаценте, селезенке, лимфоузлах и миндалевидной железе. Экспрессия мРНК TLR7 на высоком уровне наблюдается в моноцитах, B-клетках и плазмоцитарных дендритных клетках. In vitro экспрессия мРНК TLR7 регулируется с повышением активности в ТНР-1 клетках после РМА-индуцированной дифференциации. TLR7 регулируется с повышением активности до высокого уровня ИЛ-6 и в меньшей степени аутокринным ИНФ-, ИЛ-1. Экспрессия мРНКTLR7 в ТНР-1 клетках повышается после обработки грамположительными и грамотрицательными бактериями. Ex vivo экспрессия TLR7 в моноцитах повышается после обработки грамположительными и грамотрицательными бактериями и в большей степени в гранулоцитах. TLR7 экспрессируется в эндосомах. Роль TLR7 заключается в обнаружении в клетке "чужеродной" одноцепочечной РНК, как ответ на проникновение вируса. В структурном отношении TLR7 представляет собой высококонсервативный белок, который распознает гуанозин- или уридин-обогащенные одноцепочечные РНК (оцРНК) из вирусов,таких как вирус иммунодефицита человека, вирус везикулярного стоматита и вирус гриппа.TLR8 локализован в хромосоме Хр 22, и последовательность TLR8 кодирует белок, содержащий предположительно 1041 (а.к.) и 26 богатых лейцином фрагментов в N-концевом с рассчитанной молекулярной массой 120 кДа. TLR8 характеризуется наибольшей аминокислотной гомологией с TLR7 и TLR9,которая составляет 43 и 35% соответственно.In vivo мРНК TLR8 экспрессируется в легких, плаценте, селезенке, лимфоузлах, костном мозге и ЛПК, самый высокий уровень экспрессии наблюдается в клетках миелоидного происхождения, таких как моноциты, гранулоциты и миелоидные дендритные клетки. In vitro экспрессия мРНК TLR8 регулируется с повышением активности в ТНР-1 клетках после РМА-индуцированной дифференциации. TLR8 регулируется с высоким повышением активности аутокринным ИЛ-1, ИЛ-6, ИЛ-10 и ФНО- и еще в большей степени усиливается при действии ИФН-. Экспрессия мРНК TLR8 в клетках ТНР-1 повышается после обработки грамположительными и грамотрицательными бактериями. Ex vivo экспрессия TLR8 в моноцитах повышается, а в гранулоцитах снижается при обработке грамотрицательными бактериями. TLR8 экспрессируется в эндосомах. Роль TLR8 заключается в обнаружении в клетке "чужеродной" одноцепочечной РНК, как ответ на проникновение вируса. В структурном отношении TLR8 представляет собой высококонсервативный белок, который распознает гуанозин- или уридин-обогащенные одноцепочечные РНК (оцРНК) из вирусов, таких как вирус иммунодефицита человека, вирус везикулярного стоматита и вирус гриппа.TLR9 локализован в хромосоме 3 р 21, и последовательность TLR9 кодирует белок, содержащий предположительно 1032 (а.к.) и 27 богатых лейцином фрагментов в N-концевом фрагменте с рассчитанной молекулярной массой 116 кДа. TLR9 характеризуется наибольшей аминокислотной гомологией сIn vivo мРНК TLR9 экспрессируется в селезенке, лимфоузлах, костном мозге и ЛПК. Как правило,мРНК TLR9 экспрессируется на высоком уровне в B-клетках и дендритных клетках. In vitro TLR9 регулируется с повышением активности до умеренного уровня аутокринным ИНФ-, ИЛ-1, ИЛ-6, ИЛ-10 и ФНО- в РМА-дифференцированных клетках ТНР-1. Экспрессия мРНК TLR9 в клетках ТНР-1 не изменяется при обработке грамположительными и грамотрицательными бактериями. Ex vivo экспрессияTLR9 в моноцитах и прежде всего в гранулоцитах регулируется с понижением активности в ответ на обработку грамотрицательными бактериями. TLR9 образует гомодимер и распознает неметилированные бактериальные ДНК. TLR9 принимает участие в воспалительных ответных реакциях на бактериальные ДНК и олигонуклеотиды, которые содержат неметилированные последовательности CpG в составе ДНК.TLR9 локализован внутри клеток предположительно в лизосомальных или эндосомальных компартментах, где существует большая вероятность взаимодействия с РАМР, включающих неметилированные последовательности CpG в составе DNA.TLR9 является рецептором для CpG в составе ДНК и распознает бактериальные и вирусные CpG ДНК. Бактериальные и вирусные ДНК содержат неметилированные мотивы CpG, которые и обусловливают их иммуностимулирующую активность. У позвоночных частота мотивов CpG значительно снижена, а цитозиновые остатки мотивов CpG в большинстве случаев являются метилированными, что приводит к отмене иммуностимулирующей активности. Существует по крайней мере два структурноразличающихся типа CpG ДНК: B/K-тип CpG ДНК является эффективным индуктором воспалительных цитокинов, таких как ИЛ-12 и ФНО-, A/D-тип CpG DNA характеризуется высокой способностью индуцировать продуцирование ИНФ- плазмоцитоидными дендритными клетками (PDC). TLR9 принимает участие также в патогенезе аутоиммунных нарушений и играет важную роль в аутоиммунном гипертиреоидизме/болезни Грейвса и продуцировании ревматоидного фактора аутореактивными B-клетками. Аналогичным образом интернализация за счет действия Fc-рецептора может служить причинойTLR9-опосредованной индукции PDC продуцирования ИНФ- с помощью иммунных комплексов, содержащих IgG и хроматин, которые принимают участие в патогенезе системной красной волчанки. TLR9 принимает участие в патогенезе ряда аутоиммунных заболеваний за счет распознавания структуры хро- 23020962 матина.Toll-подобный рецептор 10 (TLR10). Последовательность TLR10 кодирует белок, содержащий предположительно 811 (а.к.) с молекулярной массой 95 кДа. TLR10 характеризуется наибольшей гомологией с TLR1 и TLR6, которая составляет 48 и 46% соответственно.In vivo мРНК TLR10 экспрессируется на высоком уровне в тканях, связанных с иммунной системой, включая селезенку, лимфоузлы, тимус и миндалевидную железу. мРНК TLR10 экспрессируется на еще большем уровне в B-клетках и плазмоцитоидных дендритных клетках (PDC). In vitro TLR10 регулируется с повышением активности до умеренного уровня аутокринным ИНФ-, ИЛ-1, ИЛ-6, ИЛ-10 и ФНО- в РМА-дифференцированных клетках ТНР-1. Экспрессия мРНК TLR10 в клетках ТНР-1 увеличивается после обработки грамположительными и грамотрицательными бактериями. Ex vivo экспрессияTLR10 в моноцитах повышается, в то время как в гранулоцитах снижается при обработке грамотрицательными бактериями.TLR11 экспрессируется в эпителиальных клетках мочевого пузыря и опосредует у мышей резистентность к инфекциям уропатогенных бактерий. Как описано выше, TLR2 и TLR4 распознают компоненты клеточной стенки грамположительных и грамотрицательных бактериальных клеток соответственно, TLR5 распознает структурный эпитоп бактериального флагеллина, TLR3, TLR7, TLR8 и TLR9 распознают различные формы бактериальных нуклеиновых кислот. Домены TIR взаимодействуют с различными адаптерными соединениями, содержащими домен TIR(MyD88), TIR-содержащим адаптерным белком (TIRAP), TIR-содержащим адаптерным белком, индуцирующим ИНФ- (TRIF) и TRIF-подобным адаптерным соединением (TRAM), которые активируют каскад событий, что приводит к индукции факторов транскрипции. Сигнальные пути TLR.TLR распространены по всей клетке. TLR1, TLR2, TLR3 и TLR4 экспрессированы на клеточной поверхности, a TLR3, TLR7, TLR8 и TLR9 экспрессированы во внутриклеточных компартментах, таких как эндосомы. Для опосредованного рецепторами TLR3, TLR7 или TLR9 распознавания их лигандов требуется эндосомальные созревание и процессинг. Когда макрофаги, моноциты, дендритные клетки или неиммунные клетки, которые становятся антиген-презентирующими, поглощают бактерию в ходе фагоцитоза, бактерия разрушается и CpG ДНК высвобождается в фагосомы-лизосомы или в эндосомылизосомы, где они могут взаимодействовать с TLR9, который поступает из эндоплазматического ретикулума при неспецифическом поглощении CpG ДНК. Более того, когда вирусы проникают в клетку в ходе рецептор-опосредованного эндоцитоза, содержимое вируса попадает в цитоплазму при слиянии вирусной мембраны с эндосомальной мембраной. В результате происходит взаимодействие с лигандами TLR,такими как дцРНК, оцРНК и CpG ДНК, с TLR9 в фагосомальном/лизосомальном или эндосомальном/лизосомальном компартментах. В сигнальных путях среди всех TLR адаптер, содержащий домен TIR (MyD88) и расположенный за доменом TIR, играет важную роль в индукции воспалительных цитокинов, таких как ФНО- и ИЛ-12. Хотя адаптер, содержащий домен TIR (MyD88), является общим для всех TLR, индивидуальные сигнальные пути TLR отличаются друг от друга, и при активации специфического TLR происходит формирование различных профилей экспрессии генов, которые отличаются друг от друга в незначительной степени. Например, активация сигнальных путей TLR3 и TLR4 приводит к индукции интерферонов(ИНФ) типа I, а при активации путей, опосредованных TLR2 и TLR5, такая индукция не происходит. Однако индукция сигнальных путей, опосредованных TLR7, TLR8 и TLR9, также приводит к индукции ИНФ типа I, хотя такая индукция происходит по другому механизму, отличающемуся отTLR3/4-опосредованной индукции. Сразу после активации рецепторы TLR индуцируют каскад передачи сигналов, что приводит в активации NFB через белок-адаптер (первичный ответ гена 88 в виде миелоидной дифференциации(MyD88 и генерированию ИЛ-1-рецептор-ассоциированной киназы (IRAK). MyD88-зависимый путь является аналогичным сигнальному пути, опосредованному рецептором ИЛ-1, и предполагается, чтоMyD88, включающий С-концевой домен TIR и N-концевой "мертвый" домен, связывается с доменом TIR в составе TLR. После стимуляции MyD88 направляет IRAK-4 к TLR за счет взаимодействия мертвых доменов обеих молекул и ускоряет IRAK-4-опосредованное фосфорилирование IRAK-1. Затем фосфорилирование IRAK-1 приводит к притоку фактора 6, ассоциированного с рецептором ФНО (TRAF6), что, в свою очередь, приводит к активации двух различных сигнальных путей. Один путь приводит в активации факторов транскрипции АР-1 за счет активации киназ MAP. Другой путь активирует комплексTAK1/ТАВ, который повышает активность комплекса киназ (IKK). Сразу после активации комплекс IKK индуцирует фосфорилирование и последующую деградацию NFB ингибитора IB, что приводит к ядерной транслокации фактора транскрипции NFB и индукции генов транскрипции, промотеры которых содержат участки связывания NFB, такие как цитокины. MyD88-зависимый путь играет опреде- 24020962 ляющую роль и имеет большое значение для продуцирования воспалительных цитокинов с участием всех TLR. Стимуляция клеток, экспрессирующих TLR8, таких как РВМС, приводит к повышению продуцирования ИЛ-12, ИНФ-, ИЛ-1, ФНО-, ИЛ-6 и других воспалительных цитокинов. Аналогичным образом стимуляция клеток, экспрессирующих TLR7, таких как плазмацитоидные дендритные клетки, приводит к повышению продуцирования на высоком уровне ИНФ- и снижению уровней воспалительных цитокинов. Таким образом можно ожидать, что активация дендритных клеток и других антигенпрезентирующих клеток, участие TLR7, TLR8 или TLR9 и продуцирование цитокинов приводят к активации различных механизмов врожденного и приобретенного иммунного ответа, что, в свою очередь,приводит к разрушению патогенов, инфицированных клеток или раковых клеток. Соединения формулы (I), их фармацевтически приемлемые соли, сольваты, N-оксиды, пролекарства и изомеры, фармацевтические композиции и/или комбинации по изобретению являются агонистами активности Toll-подобного рецептора 7, и их можно использовать для лечения заболеваний и/или нарушений, ассоциированных с указанными рецепторами TLR7. В некоторых вариантах соединения формулы (I), их фармацевтически приемлемые соли, сольваты,N-оксиды, пролекарства и изомеры, фармацевтические композиции и/или комбинации по изобретению используют для лечения респираторных заболеваний и/или нарушений, включая, но не ограничиваясь только ими, астму, бронхиальную астму, аллергическую астму, наследственную астму, приобретенную астму, астму физического напряжения, медикаментозную астму (включая аспириновую и индуцированную НСПВП) и астму, индуцированную пылью, хроническое обструктивное заболевание легких (ХОЗЛ),бронхит, включая инфекционный и эозинофильный бронхит, эмфизему, бронхоэктаз, кистозный фиброз,саркоидоз, аллергический альвеолит у сельскохозяйственных рабочих и сопутствующие заболевания,связанный с гиперчувствительностью пневмонит, фиброз легких, включая криптогенный фиброзирующий альвеолит, идиопатическую интерстициальную пневмонию, фиброз после противораковой терапии и хронические инфекции, включая туберкулез и аспергиллез, и другие грибковые инфекции, осложнения после трансплантации легких, васкулитные и тромболитические нарушения сосудов легких и легочную гипертензию, кашель, например при лечении хронического кашля, ассоциированного с воспалительными и секреторными состояниями дыхательных путей, а также ятрогенный кашель, острый и хронический ринит, включая медикаментозный ринит и вазомоторный ринит, круглогодичный и сезонный аллергический ринит, включая нейрональный ринит (сенная лихорадка), полипоз носа, острую вирусную инфекцию, включая обычную простуду, а также инфекции, опосредованные респираторно-синцитиальным вирусом, вирусом гриппа, коронавирусом (включая острый респираторный синдром, ОРС) и аденовирусом. В некоторых вариантах соединения формулы (I), их фармацевтически приемлемые соли, сольваты,N-оксиды, пролекарства и изомеры, фармацевтические композиции и/или комбинации по изобретению используют для лечения дерматологических нарушений, включая, но не ограничиваясь только ими, псориаз, атопический дерматит, контактный дерматит или другие экзематозные дерматиты, а также гиперчувствительность замедленного типа, фито- и фотодерматит, себорейный дерматит, герпетиформный дерматит, красный плоский лишай, склеротический атрофический лишай, гангренозную приодермию,саркоидоз кожи, базально-клеточную карциному, актинический кератоз, дискоидную красную волчанку,пузырчатку, пемфигоид, буллезный эпидермоз, уртикарию, ангиоэдему, васкулит, токсическую эритему,кожную эозинофилию, гнездную алопецию, алопецию мужского типа, синдром Свита, синдром ВебераХристиана, полиморфную эритему, инфекционный и неинфекционный целлюлит, панникулит, лимфомы кожи, немеланомный рак кожи и другие диспластические поражения, нарушения, индуцированные действием медикаментов, включая фиксированную лекарственную эритему. В некоторых вариантах соединения формулы (I), их фармацевтически приемлемые соли, сольваты,N-оксиды, пролекарства и изомеры, фармацевтические композиции и/или комбинации по изобретению используют для лечения офтальмологических заболеваний и/или нарушений, включая, но не ограничиваясь только ими, блефарит, конъюнктивит, включая круглогодичный и весенний аллергический конъюнктивит, ирит, передний и задний увеит, хороидит, аутоиммунные, дегенеративные или воспалительные нарушения, поражающие сетчатку, офтальмит, включая симпатический офтальмит, саркоидоз, инфекции, включая вирусные, грибковые и бактериальные. В некоторых вариантах соединения формулы (I), их фармацевтически приемлемые соли, сольваты,N-оксиды, пролекарства и изомеры, фармацевтические композиции и/или комбинации по изобретению используют для лечения заболеваний и/или нарушений мочеполовых органов, включая, но не ограничиваясь только ими, нефрит, включая интерстициальный нефрит и гломерулонефрит, нефротический синдром, цистит, включая острый и хронический (интерстициальный) цистит и язву Ханнера, острый и хронический уретрит, простатит, эпидидимит, оофорит (воспаление придатков) и сальпингит, вульвовагинит, болезнь Пейрони, эректильную дисфункцию (мужчин и женщин). В некоторых вариантах соединения формулы (I), их фармацевтически приемлемые соли, сольваты,N-оксиды, пролекарства и изомеры, фармацевтические композиции и/или комбинации по изобретению используют для подавления реакции отторжения аллотрансплантата, включая, но не ограничиваясь толь- 25020962 ко ими, острое отторжение и синдром хронического отторжения трансплантата, например, после пересадки почки, сердца, печени, легких, костного мозга, кожи или роговицы или после переливания крови,или для лечения хронической реакции "трансплантат против хозяина". В других вариантах соединения формулы (I), их фармацевтически приемлемые соли, сольваты,N-оксиды, пролекарства и изомеры, фармацевтические композиции и/или комбинации по изобретению используют для лечения других аутоиммунных и аллергических нарушений, включая, но не ограничиваясь только ими, ревматоидный артрит, синдром раздраженного кишечника, системную красную волчанку, рассеянный склероз, тиреоидит Хашимото, болезнь Крона, воспаление кишечника, болезнь Грейвса,болезнь Аддисона, сахарный диабет, идиопатическую тромбоцитопеническую пурпуру, эозинофильный фасциит, синдром гиперпродуцирования IgE, антифосфолипидный синдром и синдром Сезари. В некоторых вариантах соединения формулы (I), их фармацевтически приемлемые соли, сольваты,N-оксиды, пролекарства и изомеры, а также фармацевтические композиции по изобретению используют для лечения рака, включая, но не ограничиваясь только ими, рак предстательной железы, молочной железы, легких, яичников, поджелудочной железы, кишечника и ободочной кишки, желудка, кожи и опухоли головного мозга, а также злокачественное заболевание, поражающее костный мозг (включая лейкозы) и заболевание лимфопролиферативной системы, такие как лимфома Ходжкина и неходжкинская лимфома, включая профилактику и лечение метастазирующей опухоли и рецидив опухоли, а также паранеопластических синдромов. В одних вариантах соединения формулы (I), их фармацевтически приемлемые соли, сольваты, N-оксиды, пролекарства и изомеры, а также фармацевтические композиции по изобретению используют в качестве модуляторов активности Toll-подобного рецептора и используют для лечения новообразований, включая, но не ограничиваясь только ими, базально-клеточную карциному, плоскоклеточную карциному, актинический кератоз, меланому, карциномы, саркомы, лейкозы, почечноклеточную карциному, саркому Капоши, миелогенный лейкоз, хронический лимфоцитарный лейкоз и множественную миелому. В одних вариантах соединения формулы (I), их фармацевтически приемлемые соли, сольваты,N-оксиды, пролекарства и изомеры, фармацевтические композиции и/или комбинации по изобретению используют для лечения инфекционных заболеваний, включая, но не ограничиваясь только ими, вирусные заболевания, такие как остроконечные бородавки, обыкновенные бородавки, подошвенные бородавки, респираторно-синцитиальный вирус (РСВ), гепатит В, гепатит С, вирус денге, вирус простого герпеса(например, ВПГ-I, ВПГ-II, ЦМВ или ВВЗ), контагиозный моллюск, вирус коровьей оспы, оспа, лентивирус, вирус иммунодефицита человека (ВИЧ), вирус папилломы человека (ВПч), цитомегаловирус (ЦМВ),вирус варицелла-зостера (ВВЗ), риновирус, энтеровирусы, аденовирус, коронавирус (например, острый респираторный синдром, ОРС), грипп, парагрипп, вирус свинки, вирус кори, паповавирус, гепаднавирус,флавивирус, ретровирус, аренавирус (например, лимфоцитарный хориоменингит, вирус Хунин, вирус Мачупо, вирус Гуанарито и лихорадка Ласса) и филовирус (например, вирус Эбола или вирус Марбург). В еще одних вариантах соединения формулы (I), их фармацевтически приемлемые соли, сольваты,N-оксиды, пролекарства и изомеры, фармацевтические композиции и/или комбинации по изобретению используют для лечения бактериальных, грибковых и протозойных инфекций, включая, но не ограничиваясь только ими, туберкулез и заболевания, опосредованные действием микобактерий Mycobacteriumavium, лепру, Pneumocystis carinii (возбудитель пневмоцистной пневмонии), криптоспоридиоз, гистоплазмоз, токсоплазмоз, трипаносомную инфекцию, лейшманиоз, инфекции, возбудителями которых являются бактерии рода Escherichia, Enterobacter, Salmonella, Staphylococcus, Klebsiella, Proteus, Pseudomonas, Streptococcus и Chlamydia, а также грибковые инфекции, такие как кандидоз, аспергиллез, гистоплазмоз, криптококковый менингит. В некоторых вариантах соединения формулы (I), их фармацевтически приемлемые соли, сольваты,N-оксиды, пролекарства и изомеры используют в качестве иммуностимуляторов. В других вариантах соединения по изобретению входят в состав иммуногенных композиций или их используют в комбинации с иммуногенными композициями. В одних вариантах иммуногенные композиции используют в качестве вакцин, и соединение присутствует в количестве, достаточном для повышения иммунного ответа на вакцину или антиген, вводимые с указанным соединением. Вакцина содержит по крайней мере один антиген, такой как бактериальный антиген или антиген, связанный с раком, или вирусный антиген. В некоторых вариантах соединения формулы (I), их фармацевтически приемлемые соли, сольваты,N-оксиды, пролекарства и изомеры, а также фармацевтические композиции по изобретению включают в состав терапевтических вакцин или используют в комбинации с терапевтическими вакцинами. В других вариантах соединения формулы (I), их фармацевтически приемлемые соли, сольваты, N-оксиды, пролекарства и изомеры, а также фармацевтические композиции по изобретению включают в состав профилактических вакцин или используют в комбинации с профилактическими вакцинами. В одних вариантах соединения формулы (I), их фармацевтически приемлемые соли, сольваты, N-оксиды, пролекарства и изомеры, а также фармацевтические композиции по изобретению включают в состав или используют в комбинации с терапевтическими вирусными вакцинами. В еще одних вариантах соединения формулы (I),их фармацевтически приемлемые соли, сольваты, N-оксиды, пролекарства и изомеры, а также фармацевтические композиции по изобретению включают в состав или используют в комбинации с противорако- 26020962 выми вакцинами. В других вариантах соединения формулы (I) или его фармацевтически приемлемая соль или сольват, описанные в данном контексте, используют для лечения повреждений или старения кожи, таких как образование рубцов и морщин. Способы введения и фармацевтические композиции. При терапевтическом применении соединения формулы (I) или их фармацевтически приемлемые соли, сольваты, N-оксиды, пролекарства и изомеры, описанные в данном контексте, вводят в терапевтически эффективных количествах в отдельности или в виде компонента фармацевтической композиции. Таким образом, в настоящем изобретении предлагаются фармацевтические композиции, которые содержат по крайней мере одно соединение формулы (I) по изобретению, их фармацевтически приемлемые соли и/или сольваты, а также один или более фармацевтически пригодных носителей, разбавителей или эксципиентов. Кроме того, указанные соединения и композиции вводят в отдельности или в комбинации с одним или более дополнительных терапевтических агентов. Способ введения указанных соединений и композиций включает, но не ограничиваясь только ими, пероральное введение, ректальное введение,парентеральное, внутривенное введение, введение в стекловидное тело, внутримышечное введение, ингаляцию, интраназальное введение, местное введение, введение в глаз или введение в ухо. Терапевтически эффективное количество может изменяться в зависимости от многих факторов,включая такие, как тип заболевания, тяжесть заболевания, возраст и состояние здоровья субъекта, активность вводимого соединения, способ введения и требуемый курс лечения. В некоторых вариантах удовлетворительные результаты достигаются при системном введении соединения формулы (I) в суточной дозе приблизительно от 0,03 до 2,5 мг/кг массы тела. В других вариантах диапазон суточной дозы соединения формулы (I), вводимого ингаляцией, составляет от 0,05 до 100 мкг/кг массы тела. В одних вариантах диапазон суточной дозы соединения формулы (I) при пероральном введении составляет от 0,01 до 100 мг/кг массы тела. Диапазон указанной ежедневной дозы соединения формулы (I) для крупного млекопитающего, например человека, составляет приблизительно от 0,5 до приблизительно 100 мг, которую обычно вводят, например, в виде разделенных доз до четырех раз в сутки или в виде лекарственной формы с контролируемым высвобождением. В еще одних вариантах стандартные лекарственные формы,предназначенные для перорального введения, содержат приблизительно от 1 до 50 мг соединения формулы (I). В других объектах изобретения предлагаются способы получения фармацевтической композиции,которая содержит по крайней мере одно соединение формулы (I) по изобретению или его фармацевтически приемлемые соли и/или сольваты. В некоторых вариантах указанные способы заключаются в том,что соединение формулы (I) по изобретению, его фармацевтически приемлемые соли и сольваты смешивают с одним или более фармацевтически пригодными носителями, разбавителями или эксципиентами. В одних вариантах фармацевтические композиции, содержащие соединение формулы (I) в свободной форме или в форме фармацевтически приемлемой соли или сольвата в комбинации по крайней мере с одним фармацевтически пригодным носителем, разбавителем или эксципиентом, получают способами,которые включают смешивание, грануляцию и/или нанесение покрытия. В других вариантах указанные композиции необязательно содержат эксципиенты, такие как консерванты, стабилизаторы, смачивающие агенты или эмульгаторы, ускорители растворения, соли для регуляции осмотического давления и/или буферные вещества. В одних вариантах указанные композиции стерилизуют. Пероральные лекарственные формы. В некоторых вариантах фармацевтические композиции, содержащие по крайней мере одно соединение формулы (I), вводят пероральным способом в виде дискретных лекарственных форм, при этом указанные лекарственные формы включают, но не ограничиваясь только ими, капсулы, желатиновые капсулы, мини-таблетки, таблетки, жевательные таблетки, порошки, гранулы, сиропы, ароматизированные сиропы, растворы или суспензии в водных или неводных жидкостях, пищевые пены или взбитые массы, а также жидкие эмульсии типа масло-в-воде или вода-в-масле. Капсулы, желатиновые капсулы, мини-таблетки, таблетки, жевательные таблетки, порошки или гранулы, предназначенные для перорального введения по крайней мере одного соединения формулы (I),получают, смешивая по крайней мере одно соединение формулы (I) (активный ингредиент) по крайней мере с одним эксципиентом, используя стандартные способы переработки, известные в фармацевтике. Примеры эксципиентов для применения в пероральных лекарственных формах по изобретению включают, но не ограничиваясь только ими, связующие агенты, наполнители, дезинтегрирующие агенты, смазывающие вещества, абсорбенты, красители, ароматизаторы, консерванты и подсластители. Примеры указанных связующих агентов включают, но не ограничиваясь только ими, кукурузный крахмал, картофельный крахмал, крахмальную пасту, предварительно желатинированный крахмал и другие крахмалы, сахара, желатин, природные и синтетические камеди, такие как аравийская камедь,альгинат натрия, альгиновую кислоту, другие альгинаты, трагакантовую камедь, гуаровую камедь, целлюлозу и ее производные (например, такие как этилцеллюлоза, ацетат целлюлозы, кальциевая соль карбоксиметилцеллюлозы, натриевая соль карбоксиметилцеллюлозы, метилцеллюлоза, гидроксипропилметилцеллюлоза и микрокристаллическая целлюлоза), алюмосиликат магния, поливинилпирролидон и их- 27020962 комбинации. Примеры указанных наполнителей включают, но не ограничиваясь только ими, тальк, карбонат кальция (например, гранулированный или порошкообразный), микрокристаллическую целлюлозу, порошкообразную целлюлозу, декстраны, каолин, маннит, кремниевую кислоту, сорбит, крахмал, предварительно желатинированный крахмал и их смеси. В некоторых вариантах фармацевтических композиций по изобретению связующий агент или наполнитель присутствуют в количестве приблизительно от 50 до приблизительно 99 мас.% в расчете на массу фармацевтической композиции или лекарственной формы. Примеры указанных дезинтегрирующих агентов включают, но не ограничиваясь только ими, агарагар, альгиновую кислоту, альгинат натрия, карбонат кальция, карбонат натрия, микрокристаллическую целлюлозу, натриевую соль кроскармеллозы, кросповидон, калиевую соль полакрилина, натриевую соль гликолята крахмала, картофельный крахмал или крахмал из тапиоки, предварительно желатинированный крахмал, другие крахмалы, глины, другие альгинаты, другие производные целлюлозы, камеди и их комбинации. В некоторых вариантах содержание дезинтегрирующего агента, используемого в фармацевтических композициях по изобретению, составляет приблизительно от 0,5 до приблизительно 15 мас.%, в других вариантах содержание дезинтегрирующего агента составляет приблизительно от 1 до приблизительно 5 мас.%. Примеры указанных смазывающих веществ включают, но не ограничиваясь только ими, стеарат натрия, стеарат кальция, стеарат магния, стеариновую кислоту, минеральное масло, минеральное масло с низкой вязкостью, глицерин, сорбит, маннит, полиэтиленгликоль, другие гликоли, лаурилсульфат натрия, тальк, гидрированное растительное масло (например, арахисовое масло, хлопковое масло, подсолнечное масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло), стеарат цинка, олеат натрия, этилолеат, этиллаурат, агар, оксид кремния, коллоидный силикагель (AEROSIL 200, фирмыW.R. Grace Co., Балтимор, Мэриленд), коагулированный аэрозоль синтетического оксида кремния (фирмы Degussa Co., Плано, Техас), CAB-O-SIL (пирогенный диоксид кремния фирмы Cabot Co., Бостон,Массачусет) и их комбинации. В некоторых вариантах содержание смазывающих веществ, используемых в фармацевтических композициях по изобретению, составляет менее 1 мас.% в расчете на массу фармацевтических композиций или лекарственных форм. Примеры указанных разбавителей включают, но не ограничиваясь только ими, лактозу, декстрозу,сахарозу, маннит, сорбит, целлюлозу, глицин или их комбинации. В некоторых вариантах таблетки и капсулы получают, смешивая по крайней мере одно соединение формулы (I) (активные ингредиенты) с жидкими носителями до образования гомогенной смеси, с тонкодисперсными твердыми носителями или с обоими агентами, а затем при необходимости перерабатывают полученный продукт в требуемую форму. В одних вариантах таблетки получают прессованием. В других вариантах таблетки получают формованием. В некоторых вариантах по крайней мере одно соединение формулы (I) вводят перорально в виде формы с контролируемым высвобождением. Указанные лекарственные формы используют для медленного или контролируемого высвобождения одного или более соединений формулы (I). Формы с контролируемым высвобождением лекарственного средства получают, используя, например, гидроксипропилметилцеллюлозу, другие полимерные матрицы, гели, проницаемые мембраны, осмотические системы,полислойные покрытия, микрочастицы, липосомы, микросферы или их комбинацию. В других вариантах лекарственные формы с контролируемым высвобождением лекарственного средства используют для повышения продолжительности действия соединения формулы (I), для снижения частоты введения лекарственных форм и повышения согласия пациента с курсом лечения. Для введения соединений формулы (I) в виде пероральных жидких форм, таких как раствор, сиропы и эликсиры, соединения перерабатывают в стандартные лекарственные формы и получают раствор,сиропы или эликсиры, содержащие требуемое количество соединения формулы (I). Сиропы получают,растворяя соединение в пригодном ароматизированном водном растворе, в то время как эликсиры получают, используя нетоксичный спиртовой носитель. Суспензии получают, диспергируя соединение в нетоксичном носителе. Примеры эксципиентов, используемых в качестве пероральных жидкостей для перорального введения, включают, но не ограничиваясь только ими, солюбилизаторы, эмульгаторы, ароматизаторы, консерванты и красители. Примеры солюбилизаторов и эмульгаторов включают, но не ограничиваясь только ими, воду, гликоли, масла, спирты, этоксилированные изостеариловые спирты и эфиры полиоксиэтиленсорбита. Примеры консервантов включают, но не ограничиваясь только им, бензоат натрия. Примеры ароматизаторов включают, но не ограничиваясь только ими, масло мяты или натуральные подсластители или сахарин или другие синтетические подсластители. Парентеральные лекарственные формы. В некоторых вариантах фармацевтические композиции, содержащие по крайней мере одно соединение формулы (I), вводят различными парентеральными способами, включая, но не ограничиваясь только ими, подкожное, внутривенное (включая струйные инъекции), внутримышечное и внутриартериальное введение. Указанные парентеральные лекарственные формы вводят в форме стерильных растворов или стерилизуемых растворов для инъекций, суспензий, высушенных и/или лиофилизированных продуктов,- 28020962 предназначенных для растворения или суспендирования в фармацевтически приемлемом носителе для инъекций (ресуспендируемые порошки) и эмульсий. Носители, используемые в указанных лекарственных формах, включают, но не ограничиваясь только ими, воду для инъекций (стандарт USP), водные носители, такие как, но не ограничиваясь только ими, раствор хлорида натрия для инъекций, раствор Рингера (для инъекций), раствор декстрозы для инъекций, раствор декстрозы и хлорида натрия для инъекций, а также раствор Рингера, содержащий лактозу, носители, которые смешиваются с водой, такие как,но не ограничиваясь только ими, этиловый спирт, полиэтиленгликоль и полипропиленгликоль, а также неводные носители, такие как, но не ограничиваясь только ими, кукурузное масло, хлопковое масло, арахисовое масло, кунжутное масло, этилолеат, изопропилмиристат и бензилбензоат. Чрескожные лекарственные формы. В некоторых вариантах фармацевтические композиции, содержащие по крайней мере одно соединение формулы (I), вводят чрескожным способом. Указанные чрескожные лекарственные средства включают пластыри "резервуарного типа" или "матричного типа", которые наносятся на кожу и удерживаются в течение определенного периода времени, в течение которого в организм проникает требуемое количество соединения формулы (I). Например, указанные чрескожные устройства получают в виде повязки, которая включает поддерживающую основу, резервуар, содержащий соединение необязательно вместе с носителями, необязательно барьерный слой для контроля скорости доставки лекарственного средства через кожу субъекта, который позволяет контролировать и поддерживать требуемую скорость проникновения лекарственного средства в течение длительного времени, а также обеспечивает надежное удерживание устройства на коже. В других вариантах применяют матричные чрескожные составы. Составы для чрескожной доставки соединения формулы (I) включают эффективное количество соединения формулы (I), носитель и необязательно разбавитель. Носителями являются, не ограничиваясь только ими, абсорбируемые фармакологически пригодные растворители, способствующие проникновению лекарственного средства через кожу субъекта, такие как вода, ацетон, этанол, этиленгликоль, пропиленгликоль, бутан-1,3-диол, изопропилмиристат, изопропилпальмитат, минеральное масло и их комбинации. В некоторых вариантах указанные чрескожные системы доставки включают агенты, повышающие проницаемость одного или более соединений формулы (I) в ткань субъекта. Указанные агенты, повышающие проницаемость лекарственного средства, включают, но не ограничиваясь только ими, ацетон,различные спирты, такие как этанол, олеиловый и тетрагидрофуриловый спирты, алкилсульфоксиды,такие как диметилсульфоксид, диметилацетамиды, диметилформамид, полиэтиленгликоль, пирролидоны, такие как поливинилпирролидон, коллидоны (повидон, поливидон), мочевину и различные водорастворимые или нерастворимые сложные эфиры сахаров, такие как твин 80 (полисорбат 80) и спан 60 (сорбитанмоностеарат). В других вариантах pH указанной чрескожной фармацевтической композиции или лекарственной формы или ткани, на которой фиксируют фармацевтическую композицию или лекарственную форму,доводят до такого уровня, который повышает скорость доставки одного или более соединений формулы(I). В одних вариантах полярность жидкого носителя, его ионную силу или тоничность оптимизируют с целью улучшения доставки лекарственного средства. В еще одних вариантах добавляют соединения,такие как стеараты, для изменения гидрофильности или липофильности одного или более соединений формулы (I) с целью улучшения доставки лекарственного средства. В некоторых вариантах указанные стеараты используют в качестве липидного носителя при получении состава по изобретению, в качестве эмульгатора или ПАВ, а также в качестве агента для улучшения доставки или повышения проницаемости. В других вариантах для оптимизации свойств композиций по изобретению используют различные соли, гидраты или сольваты соединений формулы (I). Лекарственные формы для местного введения. В некоторых вариантах по крайней мере одно соединение формулы (I) вводят в виде фармацевтической композиции, содержащей по крайней мере одно соединение формулы (I), предназначенной для местного введения, в форме лосьонов, гелей, мазей, растворов, эмульсий, суспензий или кремов. Пригодными составами для местного нанесения на кожу являются водные растворы, мази, кремы или гели, а составами, пригодными для введения в глаз, являются водные растворы. Указанные составы необязательно содержат солюбилизаторы, стабилизаторы, агенты для улучшения тоничности, буферные агенты и консерванты. Указанные составы для местного введения включают по крайней мере один носитель и необязательно по крайней мере один разбавитель. Указанные носители и разбавители включают, но не ограничиваясь только ими, воду, ацетон, этанол, этиленгликоль, пропиленгликоль, бутан-1,3-диол, изопропилмиристат, изопропилпальмитат, минеральное масло и их комбинации. В некоторых вариантах указанные составы для местного введения включают агенты, повышающие проницаемость лекарственного средства, предназначенные для улучшения доставки одного или более соединений формулы (I) в ткань субъекта. Указанные агенты, повышающие проницаемость лекарственного средства, включают, но не ограничиваясь только ими, ацетон, различные спирты, такие как этанол,олеиловый и тетрагидрофуриловый спирты, алкилсульфоксиды, такие как диметилсульфоксид,- 29
МПК / Метки
МПК: C07D 471/04, A61K 31/395, A61P 37/00
Метки: соединения, модуляторами, которые, являются, композиции, активности
Код ссылки
<a href="https://eas.patents.su/30-20962-soedineniya-i-kompozicii-kotorye-yavlyayutsya-modulyatorami-aktivnosti-tlr.html" rel="bookmark" title="База патентов Евразийского Союза">Соединения и композиции, которые являются модуляторами активности tlr</a>
Предыдущий патент: Комбинированный противотуберкулезный препарат
Следующий патент: Способ получения пара с использованием тепла, извлеченного из реакции полимеризации
Случайный патент: Пестицидная композиция, включающая фторпиколид и инсектицидное соединение


































