Макроциклические ингибиторы сериновых протеаз гепатита с
Номер патента: 20580
Опубликовано: 30.12.2014
Авторы: Кемпф Дейл Дж., Шэнли Джейсон П., Лю Дун, Гай Юнхуа, Уэгоу Сэйбл Х., Энгстрем Кен, Грамповник Дэвид Дж., Грайм Тим, Сунь Ин, Ор Ят Сунь, Чэнь Хой-Цзюй, Ку Иинь, Макдэниел Кит Ф., Шейх Ахмад, Мэй Цзяньчжан
Формула / Реферат
1. Соединение формулы (I) или (I'):
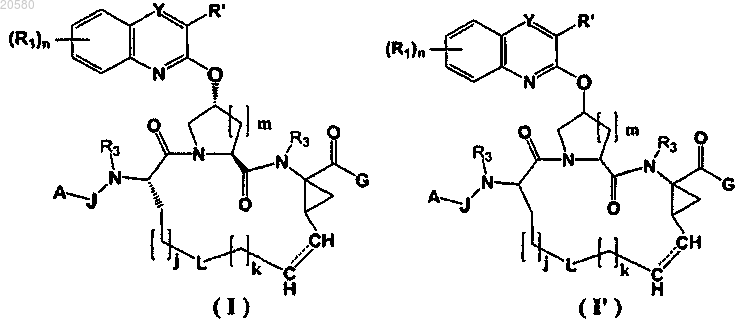
или его фармацевтически приемлемая соль,
где J представляет собой -C(O)- или -O-C(O)-;
A представляет собой (а) C3-C4-алкил, необязательно замещенный гидрокси, (b) фенил, необязательно замещенный 1, 2 или 3 галогенами, (с) C1-C6-алкокси, (d) гетероарил, содержащий 5-6 кольцевых атомов, из которых 1 или 2 атома выбраны из O, S или N, необязательно замещенный C1-C6-алкилом, (е) циклопентилокси или (f) C3-C6-циклоалкил;
каждый R1 независимо представляет собой галоген;
G представляет собой -E-R5;
Е представляет собой -N(R3)S(Op)-;
р равно 2;
R5 представляет собой (а) C3-C6-циклоалкил или (b) гетероарил, содержащий 5-6 кольцевых атомов, из которых 1 или 2 атома выбраны из О, S или N;
R3 представляет собой водород;
L отсутствует или выбран из C3-C6-алкилена;
j=0, 1, 2, 3 или 4;
k=0, 1, 2 или 3;
m=1;
n представляет собой 0, 1 или 2 и
Y представляет собой -C(R")-, R' и R", взятые вместе с атомами углерода, к которым они присоединены, образуют фенильное или гетероарильное кольцо, содержащее 5-6 кольцевых атомов, из которых 1 или 2 атома выбраны из S или N, где каждое кольцо необязательно замещено 1, 2 или 3 галогенами.
2. Соединение по п.1 или его фармацевтически приемлемая соль, где Y представляет собой -C(R")- и R' и R", взятые вместе с атомами углерода, к которым они присоединены, образуют фенильное или гетероарильное кольцо, содержащее 5-6 кольцевых атомов, из которых 1 или 2 атома выбраны из S или N, где каждое кольцо необязательно замещено 1, 2 или 3 галогенами; и где k=3, j=1 и L отсутствует.
3. Соединение по п.2 или его фармацевтически приемлемая соль, где R5 представляет собой циклопропил, циклобутил, циклопентил, циклогексил, пиридинил, пиримидинил, фуранил, тиенил, пирролил, пиразолил или имидазолил.
4. Соединение по п.2 или его фармацевтически приемлемая соль, где J представляет собой -C(O)-.
5. Соединение по п.2 или его фармацевтически приемлемая соль, где R' и R" вместе образуют фенил, необязательно замещенный 1, 2 или 3 галогенами.
6. Соединение по п.1 или его фармацевтически приемлемая соль, выбранное из:
(24) трет-бутил-(2R,6S,13aS,14aR,16aS,Z)-14a-(циклопропилсульфонилкарбамоил)-5,16-диоксо-2-(фенантридин-6-илокси)-1,2,3,5,6,7,8,9,10,11,13а,14,14а,15,16,16а-гексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-6-илкарбамата;
(25) (2R,6S,13aS,14aR,16aS,Z)-N-(циклопропилсульфонил)-5,16-диоксо-2-(фенантридин-6-илокси)-6-(пиразин-2-карбоксамидо)-1,2,3,5,6,7,8,9,10,11,13а,14,14а,15,16,16а-гексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-14а-карбоксамида;
(26) циклопентил-(2R,6S,13aS,14aR,16aS,Z)-14a-(циклопропилсульфонилкарбамоил)-5,16-диоксо-2-(фенантридин-6-илокси)-1,2,3,5,6,7,8,9,10,11,13а,14,14а,15,16,16а-гексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-6-илкарбамата;
(27) (2R,6S,13aS,14aR,16aS,Z)-N-(циклопропилсульфонил)-6-(5-метил-1Н-пиразол-3-карбоксамидо)-5,16-диоксо-2-(фенантридин-6-илокси)-1,2,3,5,6,7,8,9,10,11,13а,14,14а,15,16,16а-гексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-14а-карбоксамида;
(28) N-((2R,6S,13aS,14aR,16aS,Z)-14а-(циклопропилсульфонилкарбамоил)-5,16-диоксо-2-(фенантридин-6-илокси)-1,2,3,5,6,7,8,9,10,11,13а,14,14а,15,16,16а-гексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-6-ил)-5-метилизоксазол-3-карбоксамида;
(29) (2R,6S,13aS,14aR,16aS,Z)-N-(циклопропилсульфонил)-6-(5-метилпиразин-2-карбоксамидо)-5,16-диоксо-2-(фенантридин-6-илокси)-1,2,3,5,6,7,8,9,10,11,13а,14,14а,15,16,16а-гексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-14а-карбоксамида;
(30) N-((2R,6S,13aS,14aR,16aS,Z)-14а-(циклопропилсульфонилкарбамоил)-5,16-диоксо-2-(фенантридин-6-илокси)-1,2,3,5,6,7,8,9,10,11,13а,14,14а,15,16,16а-гексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-6-ил)тиазол-5-карбоксамида;
(31) (2R,6S,13aS,14aR,16aS,Z)-N-(циклопропилсульфонил)-6-(2-фторбензамидо)-5,16-диоксо-2-(фенантридин-6-илокси)-1,2,3,5,6,7,8,9,10,11,13а,14,14а,15,16,16а-гексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-14а-карбоксамида;
(32) (2R,6S,13aS,14aR,16aS,Z)-N-(циклопропилсульфонил)-5,16-диоксо-2-(фенантридин-6-илокси)-6-(пиридазин-4-карбоксамидо)-1,2,3,5,6,7,8,9,10,11,13а,14,14а,15,16,16а-гексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-14а-карбоксамида;
(33) (2R,6S,13aS,14aR,16aS,Z)-N-(циклопропилсульфонил)-5,16-диоксо-2-(фенантридин-6-илокси)-6-(пиримидин-4-карбоксамидо)-1,2,3,5,6,7,8,9,10,11,13а,14,14а,15,16,16а-гексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-14а-карбоксамида;
(34) (2R,6S,13aS,14aR,16aS,Z)-N-(циклопропилсульфонил)-6-(1-метил-1Н-пиразол-3-карбоксамидо)-5,16-диоксо-2-(фенантридин-6-илокси)-1,2,3,5,6,7,8,9,10,11,13а,14,14а,15,16,16а-гексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-14а-карбоксамида;
(35) (2R,6S,13aS,14aR,16aS,Z)-N-(циклопропилсульфонил)-6-(2-гидрокси-2-метилпропанамидо)-5,16-диоксо-2-(фенантридин-6-илокси)-1,2,3,5,6,7,8,9,10,11,13а,14,14а,15,16,16а-гексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-14а-карбоксамида;
(36) (2R,6S,13aS,14aR,16aS,Z)-N-(циклопропилсульфонил)-6-(1,5-диметил-1Н-пиразол-3-карбоксамидо)-5,16-диоксо-2-(фенантридин-6-илокси)-1,2,3,5,6,7,8,9,10,11,13а,14,14а,15,16,16а-гексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-14а-карбоксамида;
(37) циклопентил-(2R,6S,13aS,14aR,16aS,Z)-14a-(циклопропилсульфонилкарбамоил)-2-(2-фторфенантридин-6-илокси)-5,16-диоксо-1,2,3,5,6,7,8,9,10,11,13а,14,14а,15,16,16а-гексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-6-илкарбамата;
(38) трет-бутил-(2R,6S,13aS,14aR,16aS,Z)-14a-(циклопропилсульфонилкарбамоил)-2-(2,9-дифторфенантридин-6-илокси)-5,16-диоксо-1,2,3,5,6,7,8,9,10,11,13а,14,14а,15,16,16а-гексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-6-илкарбамата;
(39) трет-бутил-(2R,6S,13aR,14aR,16aS)-14a-(циклопропилсульфонилкарбамоил)-5,16-диоксо-2-(фенантридин-6-илокси)октадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-6-илкарбамата;
(40) циклопентил-(2R,6S,13aR,14aR,16aS)-14a-(циклопропилсульфонилкарбамоил)-5,16-диоксо-2-(фенантридин-6-илокси)октадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-6-илкарбамата;
(41) трет-бутил-(2R,6S,13aR,14aR,16aS)-5,16-диоксо-2-(фенантридин-6-илокси)-14а-(тиофен-2-илсульфонилкарбамоил)октадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-6-илкарбамата.
7. Соединение или его фармацевтически приемлемая соль, где соединение представляет собой трет-бутил-(2R,6S,13aS,14aR,16aS,Z)-14a-(циклопропилсульфонилкарбамоил)-5,16-диоксо-2-(фенантридин-6-илокси)-1,2,3,5,6,7,8,9,10,11,13a,14,14a,15,16,16a-гексадекагидроциклопропа[e]пирроло[1,2-a][1,4]диазациклопентадецин-6-илкарбамат.
8. Соединение или его фармацевтически приемлемая соль, где соединение представляет собой (2R,6S,13aS,14aR,16aS,Z)-N-(циклопропилсульфонил)-5,16-диоксо-2-(фенантридин-6-илокси)-6-(пиразин-2-карбоксамидо)-1,2,3,5,6,7,8,9,10,11,13а,14,14а,15,16,16а-гексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-14а-карбоксамид.
9. Соединение или его фармацевтически приемлемая соль, где соединение представляет собой (2R,6S,13aS,14aR,16aS,Z)-N-(циклопропилсульфонил)-6-(5-метилизоксазол-3-карбоксамидо)-5,16-диоксо-2-(фенантридин-6-илокси)-1,2,3,5,6,7,8,9,10,11,13а,14,14а,15,16,16а-гексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-14а-карбоксамид.
10. Соединение или его фармацевтически приемлемая соль, где соединение представляет собой (2R,6S,13aS,14aR,16aS,Z)-N-(циклопропилсульфонил)-6-(5-метилпиразин-2-карбоксамидо)-5,16-диоксо-2-(фенантридин-6-илокси)-1,2,3,5,6,7,8,9,10,11,13а,14,14а,15,16,16а-гексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-14а-карбоксамид.
11. Соединение или его фармацевтически приемлемая соль, где соединение представляет собой (2R,6S,13aS,14aR,16aS,Z)-N-(циклопропилсульфонил)-6-(тиазол-5-карбоксамидо)-5,16-диоксо-2-(фенантридин-6-илокси)-1,2,3,5,6,7,8,9,10,11,13а,14,14а,15,16,16а-гексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-14а-карбоксамид.
12. Соединение или его фармацевтически приемлемая соль, где соединение представляет собой (2R,6S,13aS,14aR,16aS,Z)-N-(циклопропилсульфонил)-5,16-диоксо-2-(фенантридин-6-илокси)-6-(пиридазин-4-карбоксамидо)-1,2,3,5,6,7,8,9,10,11,13а,14,14а,15,16,16а-гексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-14а-карбоксамид.
13. Соединение или его фармацевтически приемлемая соль, где соединение представляет собой (2R,6S,13aS,14aR,16aS,Z)-N-(циклопропилсульфонил)-6-(2-гидрокси-2-метилпропанамидо)-5,16-диоксо-2-(фенантридин-6-илокси)-1,2,3,5,6,7,8,9,10,11,13а,14,14а,15,16,16а-гексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-14а-карбоксамид.
14. Соединение или его фармацевтически приемлемая соль, где соединение представляет собой (2R,6S,13aS,14aR,16aS,Z)-N-(циклопропилсульфонил)-6-(1,5-диметил-1Н-пиразол-3-карбоксамидо)-5,16-диоксо-2-(фенантридин-6-илокси)-1,2,3,5,6,7,8,9,10,11,13а,14,14а,15,16,16а-гексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-14а-карбоксамид.
15. Соединение или его фармацевтически приемлемая соль, где соединение представляет собой (2R,6S,13aS,14aR,16aS,Z)-N-(циклопропилсульфонил)-6-(5-метил-1Н-пиразол-3-карбоксамидо)-5,16-диоксо-2-(фенантридин-6-илокси)-1,2,3,5,6,7,8,9,10,11,13а,14,14а,15,16,16а-гексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-14а-карбоксамид.
16. Фармацевтическая композиция для лечения вирусной инфекции гепатита C (HCV), содержащая терапевтически эффективное количество соединения по п.1 или его фармацевтически приемлемую соль в сочетании с фармацевтически приемлемым носителем или эксципиентом.
17. Фармацевтическая композиция для лечения вирусной инфекции HCV, содержащая терапевтически эффективное количество соединения по любому из пп.7-9 или 11-15 или его фармацевтически приемлемую соль в сочетании с фармацевтически приемлемым носителем или эксципиентом.
18. Фармацевтическая композиция для лечения вирусной инфекции HCV, содержащая терапевтически эффективное количество соединения по п.10 или его фармацевтически приемлемую соль в сочетании с фармацевтически приемлемым носителем или эксципиентом.
19. Способ лечения вирусной инфекции гепатита C у индивидуума, включающий введение индивидууму терапевтически эффективного количества соединения по п.1 или его фармацевтически приемлемой соли.
20. Способ получения соединения формулы (I) или его фармацевтически приемлемой соли, включающий реакцию соединения формулы (II)

где J представляет собой -C(O)- или -O-C(O)-;
А представляет собой (а) C3-C4-алкил, необязательно замещенный гидрокси, (b) фенил, необязательно замещенный 1, 2 или 3 галогенами, (с) C1-C6-алкокси, (d) гетероарил, содержащий 5-6 кольцевых атомов, из которых 1 или 2 атома выбраны из O, S или N, необязательно замещенный C1-C6-алкилом, (е) циклопентилокси или (f) C3-C6-циклоалкил;
G представляет собой -E-R5;
Е представляет собой -N(R3)S(Op)-;
р равно 2;
R5 представляет собой (а) C3-C6-циклоалкил или (b) гетероарил, содержащий 5-6 кольцевых атомов, из которых 1 или 2 атома выбраны из О, S или N;
R3 представляет собой водород;
L отсутствует или выбран из C3-C6-алкилена;
j=0, 1, 2, 3 или 4;
k=0, 1, 2 или 3;
m=1;
LG представляет собой уходящую группу,
с соединением формулы (III)
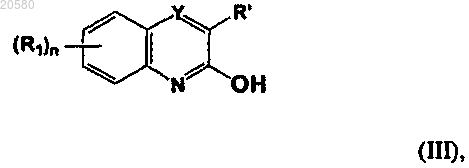
где каждый R1 независимо представляет собой галоген;
n представляет собой 0, 1 или 2;
Y представляет собой -C(R")-, R' и R", взятые вместе с атомами углерода, к которым они присоединены, образуют фенильное или гетероарильное кольцо, содержащее 5-6 кольцевых атомов, из которых 1 или 2 атома выбраны из S или N, где каждое кольцо необязательно замещено 1, 2 или 3 галогенами.
21. Способ получения соединения формулы (I) по п.1 или его фармацевтически приемлемой соли, включающий снятие защиты с соединения формулы
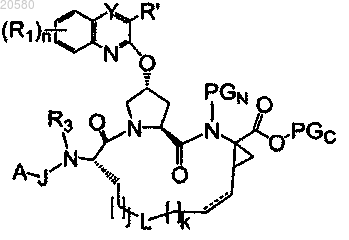
с образованием соединения формулы
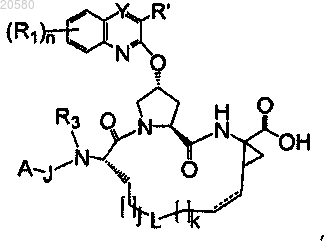
которое затем подвергают реакции с H-G с образованием соединения формулы (I),
где PGN представляет собой группу, защищающую аминогруппу;
PGC представляет собой защитную группу карбоновой кислоты;
J, A, R1, R', R3, L, Y, n, j, k и G имеют значения, указанные в п.1.
Текст
МАКРОЦИКЛИЧЕСКИЕ ИНГИБИТОРЫ СЕРИНОВЫХ ПРОТЕАЗ ГЕПАТИТА С Изобретение относится к новым макроциклическим соединениям и способам их применения. Изобретение дополнительно относится к фармацевтическим композициям, содержащим соединения по настоящему изобретению или их фармацевтически приемлемые соли, в сочетании с фармацевтически приемлемым носителем или эксципиентом. Родственные заявки По заявке на данное изобретение испрашивается приоритет предварительной патентной заявки США 61/191725, поданной 11 сентября 2008 г., и предварительной патентной заявки США 61/209689, поданной 10 марта 2009 г. Описания указанных выше патентных заявок в полном объеме включено в настоящий документ в качестве ссылки. Область техники, к которой относится изобретение Настоящее изобретение относится к новым макроциклам с активностью против вируса гепатита C(HCV) и пригодным для лечения инфекций HCV. Более конкретно, изобретение относится к макроциклическим соединениям, композициям, содержащим такие соединения, и способам их применения, а также к способам получения таких соединений. Предпосылки изобретенияHCV представляет собой основную причину гепатита, не являющегося ни гепатитом А, ни гепатитом В, и представляет собой возрастающую тяжелую проблему здравоохранения в развитом и развивающемся мире. Рассчитано, что вирус инфицирует свыше 200 млн человек по всему миру, превосходя количество индивидуумов, инфицированных вирусом иммунодефицита человека (ВИЧ), приблизительно в пять раз. Инфицированные HCV пациенты вследствие высокого процента индивидуумов, пораженных хроническими инфекциями, подвержены повышенному риску развития цирроза печени, последующей печеночно-клеточной карциномы и смертельному заболеванию печени. HCV является преобладающей причиной печеночно-клеточной злокачественной опухоли и причиной необходимости трансплантации печени у пациентов в западном мире. Существуют значительные препятствия для разработки лекарственных средств против HCV, которые включают в качестве неограничивающих примеров персистенцию вируса, генетическое разнообразие вируса при репликации у хозяина, высокую скорость возникновения вирусов, из которых развиваются устойчивые к лекарственному средству мутанты, и отсутствие воспроизводящих инфекцию культуральных систем и моделей репликации и патогенеза HCV на животных. В большинстве случаев, учитывая мягкое течение инфекции и сложную биологию печени, следует проводить тщательное исследование противовирусных лекарственных средств, которые, вероятно, имеют значительные побочные эффекты. Сущность изобретения Настоящее изобретение относится к новым макроциклическим соединениям и способам лечения инфекции гепатита C у индивидуума, нуждающегося в таком лечении, указанными макроциклическими соединениями. Соединения по настоящему изобретению препятствуют жизненному циклу вируса гепатита C и пригодны в качестве противовирусных средств. Настоящее изобретение дополнительно относится к фармацевтическим композициям, содержащим соединения по настоящему изобретению или их фармацевтически приемлемые соли в сочетании с фармацевтически приемлемым носителем или эксципиентом. В одном из аспектов изобретение относится к соединению формулы (I) или формулы (I'): или его фармацевтически приемлемой соли,где J представляет собой -C(O)- или -O-C(O)-; А представляет собой (а) C3-C4-алкил, необязательно замещенный гидрокси, (b) фенил, необязательно замещенный 1, 2 или 3 галогенами, (с) C1-C6-алкокси, (d) гетероарил, содержащий 5-6 кольцевых атомов, из которых 1 или 2 атома выбраны из О, S или N, необязательно замещенный C1-C6-алкилом, (е) циклопентилокси или (f) C3-C6-циклоалкил; каждый R1 независимо представляет собой галоген;R5 представляет собой (а) C3-C6-циклоалкил или (b) гетероарил, содержащий 5-6 кольцевых атомов,из которых 1 или 2 атома выбраны из О, S или N;L отсутствует или выбран из C3-C6-алкилена;n представляет собой 0, 1 или 2 и означает одинарную или двойную связь между атомами углерода;Y представляет собой -C(R)-, R' и R", взятые вместе с атомами углерода, к которым они присоединены, образуют фенильное или гетероарильное кольцо, содержащее 5-6 кольцевых атомов, из которых 1 или 2 атома выбраны из S или N, где каждое кольцо необязательно замещено 1, 2 или 3 галогенами. В другом аспекте изобретение относится к фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы (I) или (I') или его фармацевтически приемлемой соли в сочетании с фармацевтически приемлемым носителем или эксципиентом. В одном из аспектов изобретение относится к способу лечения вирусной инфекции у индивидуума,включающему введение индивидууму терапевтически эффективного количества соединения формулы (I) или (I') или его фармацевтически приемлемой соли или содержащей их фармацевтической композиции. Подробное описание изобретения Изобретение относится к соединению формулы (I) или (I'): или к его фармацевтически приемлемой соли,где J представляет собой -С(О)- или -O-C(O)-; А представляет собой (а) C3-C4-алкил, необязательно замещенный гидрокси, (b) фенил, необязательно замещенный 1, 2 или 3 галогенами, (с) C1-C6-алкокси, (d) гетероарил, содержащий 5-6 кольцевых атомов, из которых 1 или 2 атома выбраны из О, S или N, необязательно замещенный C1-C6-алкилом,(е) циклопентилокси или (f) C3-C6-циклоалкил; каждый R1 независимо представляет собой галоген;R5 представляет собой (а) C3-C6-циклоалкил или (b) гетероарил, содержащий 5-6 кольцевых атомов,из которых 1 или 2 атома выбраны из О, S или N;L отсутствует или выбран из C3-C6-алкилена;n представляет собой 0, 1 или 2 и означает одинарную или двойную связь между атомами углерода;Y представляет собой -C(R")-, R' и R", взятые вместе с атомами углерода, к которым они присоединены, образуют фенильное или гетероарильное кольцо, содержащее 5-6 кольцевых атомов, из которых 1 или 2 атома выбраны из S или N, где каждое кольцо необязательно замещено 1, 2 или 3 галогенами. Следует понимать, что варианты осуществления изобретения, обсуждаемые ниже относительно предпочтительного выбора переменных, можно использовать по отдельности или в сочетании с одним или несколькими из других вариантов осуществления или предпочтительного выбора переменных по изобретению, как если бы каждое сочетание было явно перечислено в настоящем документе. В одном из аспектов изобретение относится к соединению формулы (I) или (I') или его фармацевтически приемлемой соли, где Y представляет собой -C(R")-, R' и R", взятые вместе с атомами углерода, к которым они присоединены, образуют фенильное или гетероарильное кольцо, содержащее 5-6 кольцевых атомов, из которых 1 или 2 атома выбраны из S или N, где каждое кольцо необязательно замещено 1,2 или 3 галогенами. Альтернативно или дополнительно, k=3, j=1 и L отсутствует. Альтернативно или дополнительно, R' и R" вместе образуют фенил, необязательно замещенный 1, 2 или 3 галогенами. Альтернативно или дополнительно, R1 представляет собой галоген. Альтернативно или дополнительно, Е представляет собой -NHS(Op)- и р представляет собой 2. Альтернативно или дополнительно, R5 представляет собой циклопропил, циклобутил, циклопентил,циклогексил, пиридинил, пиримидинил, фуранил, тиенил, пирролил, пиразолил или имидазолил. В дополнительном варианте осуществления R5 необязательно представляет собой циклопропил или тиенил. Альтернативно или дополнительно, J представляет собой -С(O)-. Альтернативно или дополнительно, m представляет собой 1. Альтернативно или дополнительно, каждый R3 представляет собой Н. Альтернативно или дополнительно, А представляет собой (а) C3-C4-алкил, необязательно замещенный гидрокси, (b) фенил, необязательно замещенный 1, 2 или 3 галогенами, (с) C1-С 6-алкокси, (d) гетероарил, содержащий 5-6 кольцевых атомов, из которых 1 или 2 атома выбраны из О, S или N, необязательно замещенный C1-C6-алкилом, (е) циклопентилокси или (f) C3-C6-циклоалкил. В дополнительном варианте осуществления А выбран из Предпочтительно А представляет собой 5-метилпиразин-2-ил. В другом аспекте изобретение относится к соединению формулы (I) или (I') или его фармацевтически приемлемой соли, где Y представляет собой CR" и R' и R", взятые вместе с атомами углерода, к которым они присоединены, образуют гетероарильное кольцо, содержащее 5-6 кольцевых атомов, из которых 1 или 2 атома выбраны из S или N, где каждое кольцо необязательно замещено 1, 2 или 3 галогенами. Оставшиеся переменные являются такими, как определено выше, включая альтернативные или предпочтительные варианты осуществления, как если бы их повторили в данном абзаце. Изобретение также относится к соединению формулы (I) или (I') (предпочтительно формулы (I или его фармацевтически приемлемой соли, гдеY представляет собой CR" и R' и R", взятые вместе с атомами углерода, к которым они присоединены, образуют фенильное или гетероарильное кольцо, содержащее 5-6 кольцевых атомов, из которых 1 или 2 атома выбраны из S или N, где каждое кольцо необязательно замещено 1, 2 или 3 галогенами;J представляет собой -С(О)- или -O-C(O)- (предпочтительно -С(O)-); А представляет собой (а) C3-C4-алкил, необязательно замещенный гидрокси, (b) фенил, необязательно замещенный 1, 2 или 3 галогенами, (с) C1-C6-алкокси, (d) гетероарил, содержащий 5-6 кольцевых атомов, из которых 1 или 2 атома выбраны из О, S или N, необязательно замещенный C1-C6-алкилом, (е) циклопентилокси или (f) C3-C6-циклоалкил;C3-C6-циклоалкил или (b) гетероарил, содержащий 5-6 кольцевых атомов, из которых 1 или 2 атома выбраны из О, S или N; каждый R1 независимо представляет собой галоген иR3 представляет собой водород. Типичные соединения включают, но не ограничиваясь этим, следующие соединения:(41) трет-бутил-(2R,6S,13aR,14aR,16aS)-5,16-диоксо-2-(фенантридин-6-илокси)-14 а-(тиофен-2 илсульфонилкарбамоил)октадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-6 илкарбамат. В другом аспекте изобретение относится к фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы (I) или (I'), описываемого в настоящем документе,или описанные выше варианты осуществления или их фармацевтически приемлемые соли в сочетании с фармацевтически приемлемым носителем или эксципиентом. Согласно дополнительному варианту осуществления настоящее изобретение относится к способам лечения инфекции гепатита C у нуждающегося в таком лечении индивидуума посредством введения указанному индивидууму активного против вируса HCV эффективного количества или ингибирующего количества соединений или фармацевтических композиций по настоящему изобретению. Согласно другому варианту осуществления настоящее изобретение относится к способам лечения инфекции гепатита C у нуждающегося в таком лечении индивидуума посредством введения указанному индивидууму соединения или фармацевтической композиции по настоящему изобретению. Еще одним аспектом настоящего изобретения является способ получения любого из соединений,указанных в настоящем документе, применяя любые из средств синтеза, указанных в настоящем документе. Определения. Ниже перечислены определения различных терминов, используемых для описания настоящего изобретения. Эти определения применимы к терминам, как их используют на всем протяжении этого описания и формулы изобретения, если в конкретных случаях не ограничено иначе, или индивидуально, или как часть большей группы. Количество атомов углерода в алкильном заместителе можно указывать пре-4 020580 фиксом "Cx-Cy-", где х представляет собой минимальное, а у представляет собой максимальное количество атомов углерода в заместителе. Префикс "галоген" указывает на то, что заместитель, к которому присоединен префикс, замещен одним или несколькими независимо выбранными галогеновыми радикалами. Например, "галогеналкил" означает алкильный заместитель, где по меньшей мере один водородный радикал замещен галогеновым радикалом. Если связывающий элемент в изображенной структуре "отсутствует", тогда левый элемент в изображенной структуре непосредственно присоединен к правому элементу в изображенной структуре. Например, если химическая структура изображена как X-L-Y, где L отсутствует, тогда химическая структура представляет собой X-Y. Как используется в настоящем документе, термин "алкил" относится к насыщенному углеводородному радикалу с неразветвленной или разветвленной цепью, обычно содержащему от 1 до 20 атомов углерода. Например, "C1-C6-алкил" или "C1-C8-алкил" содержат от 1 до 6 или от 1 до 8 атомов углерода соответственно. Примеры алкильных радикалов включают, но не ограничиваясь этим, метильный,этильный, пропильный, изопропильный, н-бутильный, трет-бутильный, неопентильный, н-гексильный,гептильный, октильный радикалы и т.п. Как используется в настоящем документе, термин "алкенил" означает углеводородный радикал с неразветвленной или разветвленной цепью, содержащий одну или несколько двойных связей и обычно от 2 до 20 атомов углерода. Например, "C2-C6-алкенил" или "C2-C8-алкенил" содержат от 2 до 4 или от 2 до 8 атомов углерода соответственно. Алкенильные группы включают, но не ограничиваясь этим, этенил, пропенил, бутенил, 1-метил-2-бутен-1-ил, гептенил, октенил и т.п. Как используется в настоящем документе, термин "алкинил" означает углеводородный радикал с неразветвленной или разветвленной цепью, содержащий одну или несколько тройных связей и обычно от 2 до 20 атомов углерода. Например, "C2-C6-алкинил" или "C2-C8-алкинил" содержат от 2 до 6 или от 2 до 8 атомов углерода соответственно. Характерные алкинильные группы включают, но не ограничиваясь этим, этинил, 1-пропинил, 1-бутинил, гептинил, октинил и т.п. Термин "алкилен" относится к двухвалентной группе, получаемой из неразветвленной или разветвленной насыщенной углеводородной цепи, обычно содержащей от 1 до 20 атомов углерода, более типично от 1 до 8 атомов углерода и даже более типично от 1 до 6 атомов углерода. Характерные примеры алкилена включают, но не ограничиваясь этим, -CH2-, -CH2CH2-, -CH2CH2CH2-, -CH2CH2CH2CH2- и-CH2CH(CH3)CH2-. Термин "алкенилен" относится к двухвалентной ненасыщенной углеводородной группе, которая может являться линейной или разветвленной и которая содержит по меньшей мере одну двойную связь между атомами углерода. Алкениленовая группа обычно содержит 2 до 20 атомов углерода, более типично от 2 до 8 атомов углерода и даже более типично от 2 до 6 атомов углерода. Неограничивающие примеры алкениленовых групп включают -C(H)=C(H)-, -C(H)=C(H)-CH2-, -C(H)=C(H)-CH2-CH2-,-CH2-C(H)=C(H)-CH2-, -C(H)=C(H)-CH(CH3)- и -CH2-C(H)=C(H)-CH(CH2CH3)-. Термин "алкинилен" относится к двухвалентной ненасыщенной углеводородной группе, которая может являться линейной или разветвленной и которая содержит по меньшей мере одну тройную связь между атомами углерода. Характерные алкиниленовые группы включают в качестве примера -CC-,-CC-CH2-, -CC-CH2-CH2-, -CH2-CC-CH2-, -CC-CH(CH3)- и -CH2-CC-CH(CH2CH3)-. Термин "циклоалкил" означает моновалентную группу, получаемую из моноциклического или полициклического насыщенного карбоциклического циклического соединения. Примеры циклоалкила включают, но не ограничиваясь этим, циклопропил, циклобутил, циклопентил, циклогексил, бицикло[2.2.1]гептил и бицикло[2.2.2]октил и т.п. Термины "карбоцикл", или "карбоциклический", или "карбоциклил" относятся к насыщенной (например, "циклоалкил"), частично насыщенной (например, "циклоалкенил" или "циклоалкинил") или полностью ненасыщенной (например, "арил") циклической системе, не содержащей в качестве циклического атома ни одного гетероатома и содержащей, как правило, от 3 до 18 циклических атомов углерода. Карбоциклил без ограничений может представлять собой одно кольцо или два или более конденсированных кольца или циклы с мостиками или спироциклы. Карбоциклил может содержать, например, от 3 до 14 членов цикла (т.е. являться C3-C14-карбоциклилом, таким как C3-C14-циклоалкил), от 3 до 10 членов цикла (т.е. являться C3-C10-карбоциклилом, таким как C3-C10-циклоалкил), от 3 до 8 членов цикла (т.е. являться C3-C8-карбоциклилом, таким как C3-C8-циклоалкил) или от 3 до 6 членов цикла (т.е. являться C3C6-карбоциклилом, таким как C3-C6-циклоалкил). Замещенный карбоциклил может иметь или цис-, или трансструктуру. Характерные примеры карбоциклических групп включают, но не ограничиваясь этим,циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклопентенил, циклопентадиенил, циклогексадиенил, адамантил, декагидронафталинил, октагидроинденил, циклогексенил,фенил, нафтил, флуоренил, инданил, 1,2,3,4-тетрагидронафтил, инденил, изоинденил, бициклодеканил,антраценил, фенантрен, бензонафтенил (также известный как "феналенил"), декалинил и норпиранил и т.п. Карбоциклическую группу можно присоединять к основной молекулярной структуре посредством любого замещаемого атома углерода группы. Термин "арил" относится к ароматическому карбоциклилу, содержащему от 6 до 14 циклических атомов углерода. Неограничивающие примеры арилов включают фенил, нафталинил, антраценил и инденил и т.п. Арильную группу можно присоединять к основной молекулярной структуре посредством любого замещаемого атома углерода группы. Термин "аралкил" или "арилалкил" относится к алкильному остатку, присоединенному к арильному кольцу. Примеры аралкила включают, но не ограничиваясь этим, бензил, фенэтил и т.п. Термин "гетероарил" означает ароматический гетероциклил, как правило, содержащий от 5 до 18 циклических атомов. Гетероарил может представлять собой одно кольцо или два или более конденсированных кольца. Неограничивающие примеры 5-членных гетероарилов включают имидазолил; фуранил; тиофенил (или тиенил, или тиофуранил); пиразолил; оксазолил; изоксазолил; тиазолил; 1,2,3-, 1,2,4-,1,2,5- и 1,3,4-оксадиазолил и изотиазолил. Неограничивающие примеры 6-членных гетероарилов включают пиридинил; пиразинил; пиримидинил; пиридазинил и 1,3,5-, 1,2,4- и 1,2,3-триазинил. Неограничивающие примеры 6/5-членных гетероарилов с конденсированными кольцами включают бензотиофуранил, изобензотиофуранил, бензизоксазолил, бензоксазолил, пуринил и антранилил. Неограничивающие примеры 6/6-членных гетероарилов с конденсированными кольцами включают хинолинил; изохинолинил и бензоксазинил (включая хинолинил и хиназолинил). Термин "гетероаралкил" или "гетероарилалкил" относится к алкильному остатку, присоединенному к гетероарильному кольцу. Примеры включают, но не ограничиваясь этим, пиридинилметил, пиримидинилэтил и т.п. Термин "гетероциклоалкил" относится к неароматическому 3-, 4-, 5-, 6- или 7-членному кольцу или конденсированной системе би- или трициклической группы, где (i) каждое кольцо содержит от 1 до 3 гетероатомов, независимо выбранных изкислорода, серы и азота; (ii) каждое 5-членное кольцо содержит от 0 до 1 двойной связи и каждое 6-членное кольцо содержит от 0 до 2 двойных связей; (iii) гетероатомы азота и серы необязательно могут быть окисленными; (iv) гетероатом азота необязательно может быть четвертичным и (iv) любое из указанных выше колец может быть конденсированным с бензольным кольцом. Характерные гетероциклоалкильные группы включают, но не ограничиваясь этим,[1,3]диоксолан, пирролидинил, пиразолинил, пиразолидинил, имидазолинил, имидазолидинил, пиперидинил, пиперазинил, оксазолидинил, изоксазолидинил, морфолинил, тиазолидинил, изотиазолидинил и тетрагидрофурил и т.п. Термины "гетероцикл", или "гетероцикло", или "гетероциклил" относятся к насыщенной (например,"гетероциклоалкил"), частично ненасыщенной (например, "гетероциклоалкенил" или "гетероциклоалкинил") или полностью ненасыщенной (например, "гетероарил") циклической системе, обычно содержащей от 3 до 18 кольцевых атомов, где по меньшей мере один из кольцевых атомов представляет собой гетероатом (т.е. азот, кислород или серу), с оставшимися кольцевыми атомами, независимо выбранными из группы, состоящей из углерода, азота, кислорода и серы. Гетероциклическую группу можно присоединять к основной молекулярной структуре посредством любого замещаемого атома углерода или азота в группе при условии, что в результате образуется стабильная молекула. Гетероциклил без ограничений может представлять собой одно кольцо, которое обычно содержит от 3 до 14 кольцевых атомов, от 3 до 8 кольцевых атомов, от 3 до 6 кольцевых атомов или от 5 до 6 кольцевых атомов. Неограничивающие примеры гетероциклилов с одним кольцом включают фуранил, дигидрофуранил, пирролил, изопирролил, пирролинил, пирролидинил, имидазолил, изоимидазолил, имидазолинил, имидазолидинил, пиразолил, пиразолинил, пиразолидинил, триазолил, тетразолил, дитиолил, оксатиолил, оксазолил, изоксазолил,тиазолил, изотиазолил, тиазолинил, изотиазолинил, тиазолидинил, изотиазолидинил, тиодиазолил, оксатиазолил, оксадиазолил, пиранил, дигидропиранил, пиридинил, пиперидинил, пиридазинил, пиримидинил, пиразинил, пиперазинил, триазинил, изоксазинил, оксазолидинил, изоксазолидинил, оксатиазинил,оксадиазинил, морфолинил, азепинил, оксепинил, тиефинил или диазепинил. Гетероциклил может также включать, без ограничения, два или более кольца, конденсированных вместе, например, такие как нафтиридинил, тиазолпиримидинил, тиенопиримидинил, пиримидопиримидинил или пиридопиримидинил. Гетероциклил в качестве членов цикла может содержать один или несколько атомов серы; а в некоторых случаях атом(ы) серы окислены до SO или SO2. Гетероатом(ы) азота в гетероциклиле может быть или не быть четвертичным(и) и может быть или не быть окисленным(и) до N-оксида. Кроме того, гетероатом(ы) азота может быть или не быть N-защищенным(и). Как используется в настоящем документе, термины "необязательно замещенный", "необязательно замещенный алкил", "необязательно замещенный алкенил", "необязательно замещенный алкинил", "необязательно замещенный карбоцикл", "необязательно замещенный арил", "необязательно замещенный гетероарил", "необязательно замещенный гетероцикл" и любая другая необязательно замещенная группа относятся к группам, которые замещены или являются незамещенными посредством независимой замены в них одного, двух, или трех, или более атомов водорода заместителями, включающими, но не ограничиваясь этим:-NO2, -CN, CF3, N3,-NH2, защищенные амино, -NH-алкил, -NH-алкенил, -NH-алкинил, -NH-циклоалкил, -NH-арил,-NH-гетероарил, -NH-гетероцикл, -диалкиламино, -диариламино, -дигетероариламино,-О-алкил, -О-алкенил, -О-алкинил, -О-циклоалкил, -О-арил, -О-гетероарил, -О-гетероцикл,-С(О)-алкил, -С(О)-алкенил, -С(О)-алкинил, -С(О)-циклоалкил, -С(О)-арил, -С(О)-гетероарил,-С(О)-гетероциклоалкил,-CONH2, -CONH-алкил, -CONH-алкенил, -CONH-алкинил, -CONH-циклоалкил, -CONH-арил,-CONH-гетероарил, -CONH-гетероциклоалкил,-OCO2-алкил, -OCO2-алкенил, -OCO2-алкинил, -OCO2-циклоалкил, -OCO2-арил, -OCO2-гетероарил,-OCO2-гетероциклоалкил,-OCONH2,-OCONH-алкил,-OCONH-алкенил,-OCONH-алкинил,-OCONH-циклоалкил, -OCONH-арил, -OCONH-гетероарил, -OCONH-гетероциклоалкил,-NHC(O)-алкил, -NHC(О)-алкенил, -NHC(О)-алкинил, -NHC(O)-циклоалкил, -NHC(O)-арил,-NHC(О)-гетероарил, -NHC(O)-гетероциклоалкил, -NHCO2-алкил, -NHCO2-алкенил, -NHCO2-алкинил,-NHCO2-циклоалкил,-NHCO2-арил, -NHCO2-гетероарил, -NHCO2-гетероциклоалкил, -NHC(O)NH2, -NHC(О)NH-алкил,-NHC(О)NH-алкенил, -NHC(О)NH-алкенил, -NHC(О)NH-циклоалкил, -NHC(О)NH-арил, -NHC(О)NHгетероарил, -NHC(О)NH-гетероциклоалкил, -NHC(S)NH2, -NHC(S)NH-алкил, -NHC(S)NH-алкенил,-NHC(S)NH-алкинил, -NHC(S)NH-циклоалкил, -NHC(S)NH-арил, -NHC(S)NH-гетероарил, -NHC(S)NHгетероциклоалкил, -NHC(NH)NH2, -NHC(NH)NH-алкил, -NHC(NH)NH-алкенил, -NHC(NH)NH-алкинил,NHC(NH)NH-циклоалкил,-NHC(NH)NH-арил,-NHC(NH)NH-гетероарил,-NHC(NH)NHгетероциклоалкил, -NHC(NH)-алкил, -NHC(NH)-алкенил, -NHC(NH)-алкинил, -NHC(NH)-циклоалкил,-NHC(NH)-арил, -NHC(NH)-гетероарил, -NHC(NH)-гетероциклоалкил,-С(NH)NH-алкил,-С(NH)NH-алкенил,-С(NH)NH-алкинил,-С(NH)NH-циклоалкил,-С(NH)NH-арил, -С(NH)NH-гетероарил, -С(NH)NH-гетероциклоалкил,-S(О)-алкил, -S(О)-алкенил, -S(О)-алкинил, -S(O)-циклоалкил, -S(О)-арил, -S(О)-гетероарил,-S(O)-гетероциклоалкил,-SO2NH2,-SO2NH-алкил,-SO2NH-алкенил,-SO2NH-алкинил,-SO2NH-циклоалкил, -SO2NH-арил, -SO2NH-гетероарил, -SO2NH-гетероциклоалкил,-NHSO2-алкил, -NHSO2-алкенил, -NHSO2-алкинил, -NHSO2-циклоалкил, -NHSO2-арил, -NHSO2 гетероарил, -NHSO2-гетероциклоалкил,-CH2NH2, -CH2SO2CH3, -алкил, -алкенил, -алкинил, -арил, -арилалкил, -гетероарил,-гетероарилалкил, -гетероциклоалкил, -циклоалкил, -карбоцикл, -гетероцикл, полиалкоксиалкил, полиалкокси, -метоксиметокси, -метоксиэтокси, -SH, -S-алкил, -S-алкенил, -S-алкинил, -S-циклоалкил, -S-арил,-S-гетероарил, -S-гетероциклоалкил или метилтиометил. Следует понимать, что арилы, гетероарилы, карбоциклы, гетероциклы, алкилы и т.п. могут быть дополнительно замещены. Как используется в настоящем документе, термин "галоген" относится к атому, выбранному из фтора, хлора, брома и йода. Как используется в настоящем документе, термин "индивидуум" относится к млекопитающему. Таким образом, индивидуум относится, например, к собакам, кошкам, лошадям, коровам, свиньям, морским свинкам и т.п. Предпочтительно индивидуум представляет собой человека. Когда индивидуум представляет собой человека, он может представлять собой или пациента, или здорового человека. Как используется в настоящем документе, термин "группа, активирующая гидроксигруппу" относится к активной химической группе, которая известна в данной области как активирующая гидроксигруппу, так, что она не принимает участия в процедурах синтеза, таких как в реакциях замены или отщепления. Примеры групп, активирующих гидроксигруппу, включают, но не ограничиваясь этим,мезилат, тозилат, трифлат, п-нитробензоат, фосфонат и т.п. Как используется в настоящем документе, термин "уходящая группа" или "LG" относится к любой группе, которая уходит в течение химической реакции, в которой участвует группа, и включает, но не ограничиваясь этим, например, галогеновые, брозилатные, мезилатные, тозилатные, трифлатные,п-нитробензоатные, фосфонатные группы. Как используется в настоящем документе, термин "защищенная гидроксигруппа" относится к гидроксигруппе, защищенной группой, защищающей гидроксигруппу, как определено выше, включая, например, бензоильную, ацетильную, триметилсилильную, триэтилсилильную, метоксиметильную группы. Как используется в настоящем документе, термин "группа, защищающая гидроксигруппу" относится к активной химической группе, которая известна в данной области как защищающая гидроксигруппу от нежелательных реакций в течение процедур синтеза. После указанных процедур(ы) синтеза группу,защищающую гидроксигруппу, как описано в настоящем документе, можно селективно удалять. Группы,защищающие гидроксигруппы, как известно в данной области, в целом описаны в Т.Н. Greene and 2,2,2-трихлорэтоксикарбонил, 2-(триметилсилил)этоксикарбонил, 2-фурфурилоксикарбонил, аллилоксикарбонил, ацетил, формил, хлорацетил, трифторацетил, метоксиацетил, феноксиацетил, бензоил, метил,трет-бутил, 2,2,2-трихлорэтил, 2-триметилсилилэтил, 1,1-диметил-2-пропенил, 3-метил-3-бутенил, аллил,бензил, параметоксибензилдифенилметил, трифенилметил (тритил), тетрагидрофурил, метоксиметил,метилтиометил, бензилоксиметил, 2,2,2-трихлорэтоксиметил, 2-(триметилсилил)этоксиметил, метансульфонил, паратолуолсульфонил, триметилсилил, триэтилсилил, триизопропилсилил и т.п. Предпочтительные группы, защищающие гидроксигруппы, по настоящему изобретению представляют собой ацетил (Ac или -C(O)CH3), бензоил (Bz или -C(O)C6H5) и триметилсилил (TMS или -Si(CH3)3). Как используется в настоящем документе, термин "группа, защищающая аминогруппу" относится к активной химической группе, которая известна в данной области как защищающая аминогруппу от нежелательных реакций в течение процедур синтеза. После указанных процедур(ы) синтеза группу, защищающую аминогруппу, как описано в настоящем документе, можно селективно удалять. Группы, защищающие аминогруппы, как известно в данной области, в целом описаны в Т.Н. Greene and P.G.M. Wuts,Protective Groups in Organic Synthesis, 3rd edition, John WileySons, New York (1999). Примеры групп,защищающих аминогруппы, включают в качестве неограничивающих примеров трет-бутоксикарбонил,9-флуоренилметоксикарбонил, бензилоксикарбонил и т.п. Как используется в настоящем документе, термин "защищенная аминогруппа" относится к аминогруппе, защищенной группой, защищающей аминогруппу, как определено выше. Термин "алкиламино" относится к группе со структурой -N(RaRb), где Ra и Rb независимо представляют собой Н или алкил. Термин "ацил" включает остатки, получаемые из кислот, включающих, но не ограничиваясь этим,карбоновые кислоты, карбаминовые кислоты, угольные кислоты, сульфоновые кислоты и фосфорные кислоты. Примеры включают алифатические карбонилы, ароматические карбонилы, алифатические сульфонилы, ароматические сульфинилы, алифатические сульфинилы, ароматические фосфаты и алифатические фосфаты. Примеры алифатических карбонилов включают в качестве неограничивающих примеров ацетил, пропионил, 2-фторацетил, бутирил, 2-гидроксиацетил и т.п. Как используется в настоящем документе, термин "фармацевтически приемлемая соль" относится к тем солям соединений, образуемых в способе по настоящему изобретению, которые в объеме обоснованного врачебного решения пригодны для использования в контакте с тканями людей и низших животных без чрезмерной токсичности, раздражительности, аллергического ответа и т.п. и соответствуют разумному соотношению польза/риск. Фармацевтически приемлемые соли хорошо известны в данной области. Например, S.M. Berge, et al. подробно описывают фармацевтически приемлемые соли в J. PharmaceuticalSciences, 66:1-19 (1977). Соли можно получать in situ в течение конечного выделения и очистки соединений по изобретению или отдельно реакцией функциональной группы свободного основания с подходящей органической кислотой. Примеры фармацевтически приемлемых солей включают, но не ограничиваясь этим, нетоксичные соли присоединения кислот или соли аминогруппы, образуемые с неорганическими кислотами, такими как соляная кислота, бромисто-водородная кислота, фосфорная кислота, серная кислота и хлорная кислота, или с органическими кислотами, такими как уксусная кислота, малеиновая кислота, винная кислота, лимонная кислота, янтарная кислота или малоновая кислота, или посредством других способов, используемых в данной области, таких как ионный обмен. Другие фармацевтически приемлемые соли включают, но не ограничиваясь этим, адипатную, альгинатную, аскорбатную, аспартатную, бензолсульфонатную, бензоатную, бисульфатную, боратную, бутиратную, камфоратную, камфорсульфонатную, цитратную, циклопентанпропионатную, диглюконатную, додецилсульфатную, этансульфонатную, формиатную, фумаратную, глюкогептонатную, глицерофосфатную, глюконатную, гемисульфатную, гептаноатную, гексаноатную, йодогидратную,2-гидроксиэтансульфонатную, лактобионатную, лактатную, лауратную, лаурилсульфатную, малатную,малеатную, малонатную, метансульфонатную, 2-нафталинсульфонатную, никотинатную, нитратную,олеатную,оксалатную,пальмитатную,памоатную,пектинатную,персульфатную,3-фенилпропионатную, фосфатную, пикратную, пивалатную, пропионатную, стеаратную, сукцинатную,сульфатную, тартратную, тиоцианатную, п-толуолсульфонатную, ундеканоатную, валерианатную соли и т.п. Характерные соли щелочных или щелочно-земельных металлов включают соли натрия, лития, калия, кальция или магния и т.п. Когда это целесообразно, дополнительные фармацевтически приемлемые соли включают нетоксичный аммоний, четвертичный аммоний и аминокатионы, образуемые с применением противоионов, таких как галогенид, гидроксид, карбоксилат, сульфат, фосфат, нитрат, алкил с количеством атомов углерода от 1 до 6, сульфонат и арилсульфонат. Как используется в настоящем документе, термин "фармацевтически приемлемый сложный эфир" относится к сложным эфирам соединений, образуемым в способе по настоящему изобретению, которые гидролизуются in vivo и включают сложные эфиры, которые быстро разрушаются в организме человека,покидая основное соединение или его соль. Подходящие сложноэфирные группы включают, например,группы, получаемые из фармацевтически приемлемых алифатических карбоновых кислот, в частности алкановых, алкеновых, циклоалкановых кислот и алкандикислот, у которых предпочтительно каждая алкильная или алкенильная группа не содержит более 6 атомов углерода. Примеры конкретных сложных эфиров включают в качестве неограничивающих примеров формиаты, ацетаты, пропионаты, бутираты,акрилаты и этилсукцинаты. Как используется в настоящем документе, термин "фармацевтически приемлемые пролекарственные средства" относится к тем пролекарственным средствам соединений, образуемым способом по настоящему изобретению, которые в объеме обоснованного врачебного решения пригодны для использования в контакте с тканями людей и низших животных без чрезмерной токсичности, раздражительности,аллергического ответа и т.п., соответствуют разумному соотношению польза/риск и эффективны в отношении их назначаемого применения, а также, где возможно, к цвиттер-ионным формам соединений по настоящему изобретению. Как используется в настоящем документе, "пролекарственное средство" означает соединение, которое in vivo метаболическими средствами (например, гидролизом) преобразуется с образованием любого соединения, определенного формулами по настоящему изобретению. В данной области известны различные формы пролекарственных средств, например, как описано в Bundgaard,(ed.), Design of Prodrugs, Elsevier (1985); Widder, et al. (ed.), Methods in Enzymology, vol. 4, Academic PressDrug And Prodrug Metabolism: Chemistry, Biochemistry And Enzymology", John WileySons, Ltd. (2002). Настоящее изобретение также относится к фармацевтическим композициям, содержащим фармацевтически приемлемые пролекарственные средства соединений по изобретению, и к способам лечения вирусных инфекций посредством введения фармацевтически приемлемых пролекарственных средств соединений по изобретению. Например, в пролекарственные средства можно преобразовывать соединения по изобретению, имеющие свободные амино-, амидо-, гидрокси- или карбоксильные группы. Пролекарственные средства включают соединения, где аминокислотный остаток или полипептидная цепь из двух или более (например, двух, трех или четырех) аминокислотных остатков ковалентно связывают посредством амидной или сложноэфирной связи со свободной амино-, гидрокси- или карбоксильной группой соединений по изобретению. Аминокислотные остатки включают, но не ограничиваясь этим, 20 природных аминокислот, как правило, обозначаемых трехбуквенными символами, а также включают 4-гидроксипролин, гидроксилизин, десмозин, изодесмозин, 3-метилгистидин, норвалин, бета-аланин,гамма-аминомасляную кислоту, цитруллин, гомоцистеин, гомосерин, орнитин и метионинсульфон. Также включены дополнительные типы пролекарственных средств. Например, свободные карбоксильные группы можно дериватизировать в амиды или сложные алкиловые эфиры. Свободные гидроксигруппы можно дериватизировать с использованием групп, включающих, но не ограничиваясь этим, гемисукцинаты, сложные фосфатные эфиры, диметиламиноацетаты и фосфорилоксиметилоксикарбонилы в соответствии с Advanced Drug Delivery Reviews, 1996, 19, 115. Также включены карбаматные пролекарственные средства гидрокси- и аминогрупп, такие как карбонатные пролекарственные средства, сложные сульфонатные эфиры и сложные сульфатные эфиры гидроксигрупп. Также включена дериватизация гидроксигрупп в виде простых (ацилокси)метиловых и (ацилокси)этиловых эфиров, где ацильная группа может представлять собой сложный алкиловый эфир, необязательно замещенный группами, включающими, но не ограничиваясь этим, функциональные группы простых эфиров, аминов и карбоновых кислот, или где ацильная группа представляет собой сложный эфир аминокислоты, как описано выше. Пролекарственные средства этого типа описаны в J. Med. Chem. 1996, 39, 10. Свободные амины также могут быть дериватизированы в виде амидов, сульфонамидов или фосфонамидов. Все эти молекулы пролекарственных средств могут содержать группы, включающие, но не ограничиваясь этим, функциональные группы простых эфиров, аминов и карбоновых кислот. Комбинации заместителей и переменных, предусматриваемых настоящим изобретением, представляют собой только те комбинации заместителей и переменных, предусматриваемых настоящим изобретением, которые приводят к образованию стабильных соединений. Как используется в настоящем документе, термин "стабильный" относится к соединениям, обладающим стабильностью, достаточной для обеспечения производства, и сохраняющим целостность соединения в течение достаточного периода времени, чтобы их можно было применять для целей, указанных в настоящем документе (например, для терапевтического или профилактического введения индивидууму). Фармацевтические композиции. Фармацевтические композиции по настоящему изобретению содержат терапевтически эффективное количество соединения по настоящему изобретению, сформулированное вместе с одним или несколькими фармацевтически приемлемыми носителями. Как используется в настоящем документе, термин "фармацевтически приемлемый носитель" означает нетоксичные инертные твердые, полутвердые или жидкие наполнитель, разбавитель, герметизирующее вещество или вспомогательный состав любого типа. Фармацевтические композиции по настоящему изобретению можно вводить людям и другим животным перорально, ректально, парентерально, интрацистернально, интравагинально, интраперитонеально, местно(в качестве порошков, мазей или капель), буккально или в виде перорального или назального спрея. Жидкие лекарственные формы для перорального введения включают фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии, сиропы и эликсиры. В дополнение к активным соединениям, жидкие лекарственные формы могут включать инертные разбавители, как правило, применяемые в данной области, например, такие как вода, спирт или другие растворители, солюбилизаторы и эмульгаторы, такие как этиловый спирт, изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт,бензилбензоат, пропиленгликоль, 1,3-бутиленгликоль, полисорбат, диметилформамид, масла (в частности, хлопковое, арахисовое, кукурузное масла, масло ростков пшеницы, оливковое, касторовое и сезамовое масла), моно- или диглицериды, глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоли и сложные сорбитановые эфиры жирных кислот и их смеси. Кроме инертных растворителей, пероральные композиции также могут включать вспомогательные средства, такие как увлажнители, эмульгаторы, и суспендирующие средства, антиоксиданты, подсластители, придающие вкус, и ароматизирующие средства. Жидкую лекарственную форму также можно заключать в желатиновую капсулу, где соединение по настоящему изобретению можно растворять в фармацевтически приемлемом носителе, содержащем, например, один или несколько растворителей (например, полисорбат 80 и моно- и диглицериды) и другие подходящие эксципиенты (например, антиоксиданты, такие как аскорбилпальмитат, или подсластитель,или ароматизатор). Инъецируемые препараты, например стерильные инъецируемые водные или масляные суспензии,можно формулировать в соответствии с известным уровнем техники с применением подходящих диспергирующих средств или увлажнителей и суспендирующих средств. Стерильный инъецируемый препарат также может представлять собой стерильный инъецируемый раствор, суспензию или эмульсию в нетоксичном приемлемом для парентерального применения разбавителе или растворителе, например, в виде раствора в 1,3-бутандиоле. Среди приемлемых носителей и растворителей, которые можно использовать,находятся вода, раствор Рингера, степени U.S.Р. и изотонический раствор хлорида натрия. Кроме того, в качестве растворителя или суспендирующей среды, как правило, применяют стерильные жирные масла. Для этой цели можно использовать любое мягкое жирное масло, включая синтетические моно- или диглицериды. Кроме того, в препаратах для инъекций используют жирные кислоты, такие как олеиновая кислота. Для продления действия лекарственного средства часто желательно замедлить всасывание лекарственного средства после подкожной или внутримышечной инъекции. Это можно осуществлять, используя жидкую суспензию кристаллического или аморфного вещества с плохой растворимостью в воде. Тогда скорость всасывания лекарственного средства зависит от его скорости растворения, которая, в свою очередь, может зависеть от размера кристалла и кристаллической формы. Альтернативно, замедленное всасывание парентерально вводимой лекарственной формы осуществляют, растворяя или суспендируя лекарственное средство в масляном носителе. Формы с немедленным высвобождением также предусмотрены по настоящему изобретению. Композиции для ректального или вагинального введения предпочтительно представляют собой суппозитории, которые можно получать, смешивая соединения по настоящему изобретению с подходящими не вызывающими раздражения эксципиентами или носителями, такими как масло какао, полиэтиленгликоль или воск для суппозиториев, которые являются твердыми при температуре окружающей среды, но жидкими при температуре тела, и, таким образом, расплавляются в прямой кишке или полости влагалища и высвобождают активное соединение. Твердые композиции сходного типа также можно использовать в качестве наполнителей в мягких или заполненных твердым веществом желатиновых капсулах, используя такие эксципиенты, как лактоза или молочный сахар, а также высокомолекулярные полиэтиленгликоли и т.п. Активные соединения также могут находиться в микроинкапсулированной форме с одним или несколькими эксципиентами, как указано выше. Твердые лекарственные формы таблеток, драже, капсул, пилюль и гранул можно получать с покрытиями и оболочками, такими как растворяющиеся в кишечнике покрытия, контролирующие скорость высвобождения покрытиями и другие покрытия, хорошо известные в области составления рецептур фармацевтических средств. В таких твердых лекарственных формах активное соединение можно смешивать по меньшей мере с одним инертным разбавителем, таким как сахароза, лактоза или крахмал. Также такие лекарственные формы в условиях обычной практики могут содержать дополнительные вещества,отличные от инертных разбавителей, например таблетирующие смазывающие средства и другие таблетирующие вспомогательные средства, такие как стеарат магния и микрокристаллическая целлюлоза. В случае капсул, таблеток и пилюль лекарственные формы также могут содержать буферные средства. Лекарственные формы для местного или трансдермального введения соединения по настоящему изобретению включают мази, пасты, кремы, лосьоны, гели, порошки, растворы, спреи, ингалируемые средства или пластыри. Активный компонент в стерильных условиях смешивают с фармацевтически приемлемым носителем и любыми необходимыми консервантами или буферами, как может быть необходимо. Так же как находящиеся в объеме настоящего изобретения, предусмотрены офтальмический состав, глазные капли, глазные мази, порошки и растворы. Мази, пасты, кремы и гели в дополнение к активному соединению по настоящему изобретению мо- 10020580 гут содержать такие эксципиенты, как животные и растительные жиры, масла, воски, парафины, крахмал, трагакант, производные целлюлозы, полиэтиленгликоли, кремнийорганические соединения, бентониты, кремниевую кислоту, тальк и оксид цинка или их смеси. Порошки и спреи в дополнение к соединениям по настоящему изобретению могут содержать такие эксципиенты, как лактоза, тальк, кремниевая кислота, гидроксид алюминия, силикаты кальция и полиамидный порошок или смеси этих веществ. Спреи могут дополнительно содержать обычные пропелленты, такие как хлорфторуглеводороды. Трансдермальные пластыри имеют дополнительное преимущество обеспечения контролируемой доставки соединения в организм. Такие лекарственные формы можно получать, растворяя или диспергируя соединение в подходящей среде. Также можно использовать усилители всасывания для усиления прохождения соединения через кожу. Скорость можно регулировать, предоставляя контролирующую скорость мембрану или диспергируя соединение в полимерном матриксе или геле. В соответствии со способами лечения по настоящему изобретению вирусные инфекции лечат или предотвращают у индивидуума, такого как человек или другое животное, посредством введения индивидууму терапевтически эффективного количества соединения по изобретению (или его фармацевтически приемлемой соли, сложного эфира или пролекарственного средства), в таких количествах и в течение такого периода времени, как необходимо для достижения желаемого результата. Как используется в настоящем документе, термин "терапевтически эффективное количество" соединения по изобретению означает достаточное количество соединения для того, чтобы снизить вирусную нагрузку у индивидуума и/или уменьшить симптомы заражения HCV у индивидуума. Как хорошо понимают в медицинской области, терапевтически эффективное количество соединения по настоящему изобретению должно находиться в разумном соотношении польза/риск, подходящем для любого медицинского лечения. Противовирусная активность. Ингибирующие количества или дозы соединений по настоящему изобретению могут находиться в диапазоне приблизительно от 0,1 до приблизительно 500 мг/кг, альтернативно, приблизительно от 1 до приблизительно 50 мг/кг. Ингибирующие количества или дозы также варьируют в зависимости от пути введения, а также возможности совместного применения с другими средствами. В соответствии со способами лечения по настоящему изобретению вирусные инфекции лечат или предотвращают у индивидуума, такого как человек или низшее млекопитающее, посредством введения индивидууму эффективного против вируса гепатита C количества или ингибирующего количества соединения по настоящему изобретению, в таких количествах и в течение такого периода времени, как необходимо для достижения желаемого результата. Дополнительный способ по настоящему изобретению представляет собой обработку биологических образцов ингибирующим количеством соединения композиции по настоящему изобретению в таких количествах и в течение такого периода времени, как необходимо для достижения желаемого результата. Как используется в настоящем документе, термин "эффективное против вируса гепатита C количество" соединения по изобретению означает количество соединения, достаточное для того, чтобы снизить вирусную нагрузку в биологическом образцеили у индивидуума. Как хорошо понимают в медицинской области, эффективное против вируса гепатита C количество соединения по настоящему изобретению должно находиться в разумном соотношении польза/риск, подходящем для любого медицинского лечения. Термин "ингибирующее количество" соединения по настоящему изобретению означает достаточное количество для снижения вирусной нагрузки гепатита C в биологическом образце или у индивидуума. Следует понимать, что, когда указанное ингибирующее количество соединения по настоящему изобретению вводят индивидууму, оно должно находиться в разумном соотношении польза/риск, подходящем для любого медицинского лечения, как определяет врач. Как используется в настоящем документе, термин "биологический образец(цы)" означает материал биологического происхождения, предназначенный для введения индивидууму. Примеры биологических образцов включают, но не ограничиваясь этим,кровь и ее компоненты, такие как плазма, тромбоциты, субпопуляции клеток крови и т.п.; органы, такие как почка, печень, сердце, легкое и т.п.; сперму и яйцеклетку; костный мозг и его компоненты; или стволовые клетки. Таким образом, другой вариант осуществления настоящего изобретения представляет собой способ обработки биологического образца посредством приведения указанного биологического образца в контакт с ингибирующим количеством соединения или фармацевтической композиции по настоящему изобретению. После улучшения состояния индивидуума, если необходимо, можно вводить поддерживающую дозу соединения, композиции или комбинации по настоящему изобретению. Затем дозу или частоту введения или и то, и другое можно снижать как функцию симптомов до уровня, при котором поддерживается улучшенное состояние; когда симптомы ослабляются до желаемого уровня, лечение необходимо прекращать. Однако индивидууму может требоваться интермиттирующее лечение на долговременной основе после любого рецидива симптомов заболевания. Однако следует понимать, что общее суточное применение соединений и композиций по настоящему изобретению будет определять лечащий врач в объеме обоснованного врачебного решения. Конкретная ингибирующая доза для любого конкретного пациента зависит от ряда факторов, включающих подлежащее лечению нарушение и тяжесть нарушения; активность конкретного применяемого соединения; конкретную применяемую композицию; возраст, массу тела, общее состояние здоровья, пол и питание пациента; время введения, путь введения и скорость выведения конкретного применяемого соединения; продолжительность лечения; лекарственные средства, применяемые в комбинации или совместно с конкретным применяемым соединением; и подобные факторы, хорошо известные в области медицины. Общая суточная ингибирующая доза соединений по настоящему изобретению, вводимая индивидууму в одной или дробных дозах, может по количеству составлять, например, от 0,01 до 50 мг/кг массы тела или более, как правило, от 0,1 до 25 мг/кг массы тела. Однократная доза композиции может содержать такие количества или их дольные единицы для получения суточной дозы. В одном из вариантов осуществления схема лечения по настоящему изобретению включает введение нуждающемуся в таком лечении пациенту приблизительно от 10 до приблизительно 1000 мг соединения(й) по настоящему изобретению в сутки в одной или нескольких дозах. В другом варианте осуществления схема лечения включает введение нуждающемуся в таком лечении пациенту приблизительно от 25 до приблизительно 6000 мг соединения(й) по настоящему изобретению в сутки в одной или нескольких дозах, с ингибитором монооксигеназы цитохрома Р 450, таким как ритонавир, или без. Подходящая суточная доза для совместно вводимого ингибитора монооксигеназы цитохрома Р 450 (например, ритонавира) может находиться в диапазоне, без ограничения, от 10 до 200 мг. Предпочтительно соединение(я) по настоящему изобретению или комбинацию соединения(й) по изобретению и ритонавира вводят раз в сутки или дважды в сутки с обеспечением количества желаемой суточной дозы. Например, когда его применяют без ритонавира, соединение по настоящему изобретению можно вводить пациенту дважды в сутки с общей суточной дозой 4000, 4200, 4400, 4600, 4800 или 5000 мг. В другом случае, когда его применяют в комбинации с ритонавиром, соединение по настоящему изобретению можно вводить пациенту один раз или дважды в сутки с общей суточной дозой 200, 400, 600 или 800 мг, где количество ритонавира может составлять 25, 50 или 100 мг на введение. Способы синтеза. Соединения и способы по настоящему изобретению лучше будут понятны относительно приведенных ниже схем, которые иллюстрируют способы, которыми могут быть получены соединения по изобретению. Определения переменных в структурах на схемах в настоящем документе находятся в соответствии с определениями соответствующих положений в формулах, приведенных в настоящем документе. Схема 1 На схеме 1 описан синтез различных соединений по изобретению. Исходное вещество замещали по уходящим группам реакцией с нуклеофилом с получением замещенного нуклеофилом макроцикла. За щелочным гидролизом сложного эфира до кислоты следовало связывание с сульфонамидным производным. Затем у защищенного азота снимали защиту и замещали другой группой. В одном из аспектов изобретение относится к способу получения соединения формулы (I), включающему стадию реакции соединения формулы (II) где J представляет собой -C(О)- или -O-С(O)-; А представляет собой (а) C3-C4-алкил, необязательно замещенный гидрокси, (b) фенил, необязательно замещенный 1, 2 или 3 галогенами, (с) C1-C6-алкокси, (d) гетероарил, содержащий 5-6 кольцевых атомов, из которых 1 или 2 атома выбраны из О, S или N, необязательно замещенный C1-C6-алкилом,(е) циклопентилокси или (f) C3-C6-циклоалкил;R5 представляет собой (а) C3-C6-циклоалкил или (b) гетероарил, содержащий 5-6 кольцевых атомов,из которых 1 или 2 атома выбраны из О, S или N;L отсутствует или выбран из C3-C6-алкилена;m=1; означает одинарную или двойную связь между атомами углерода иLG представляет собой уходящую группу; с соединением формулы (III) где каждый R1 независимо представляет собой галоген;Y представляет собой -C(R")-, R' и R", взятые вместе с атомами углерода, к которым они присоединены, образуют фенильное или гетероарильное кольцо, содержащее 5-6 кольцевых атомов, из которых 1 или 2 атома выбраны из S или N, где каждое кольцо необязательно замещено 1, 2 или 3 галогенами; с получением, таким образом, соединения формулы (I) или (I'). Соединение формулы (I) также может быть получено в соответствии со способом, представленным на схеме 2, где A, J, L, G, Y, R', R1, R3, n, m, j и k определены выше в настоящем документе, и представляет собой и где Q представляет собой галоген или уходящую группу, каждый изPG и PGN независимо представляет собой группу, защищающую аминогруппу, и PGC представляет собой защитную группу карбоновой кислоты. Соединение (b) можно получать реакцией с галогенирующим средством, таким какPOCl3. Неограничивающие примеры группы, защищающей аминогруппу, включают C1-C6-алкоксикарбонил (например, трет-бутоксикарбонил или Boc), карбоксибензил, п-метоксибензилкарбонил,9-флуоренилметилоксикарбонил, бензил, п-метоксибензил, 3,4-диметоксибензил, п-метоксифенил, бензоил или тозил или другие подходящие сульфонамиды. Неограничивающие примеры защитной группы карбоновой кислоты включают C1-C6-алкил (например, трет-бутил, метил или этил), бензил или силил,которые все защищают группы карбоновых кислот в форме сложных эфиров. На стадии 1 соединение (а) реагирует с соединением (b) с образованием соединения (с), где реакцию можно проводить, в качестве неограничивающего примера, в присутствии трет-бутоксида натрия или трет-бутоксида калия. Предпочтительно реакцию проводят в отсутствие хлорида лантана. Также предпочтительно выход этой реакции составляет по меньшей мере 50%. Более предпочтительно выход реакции составляет по меньшей мере 60, 70 или 80%. Наиболее предпочтительно выход реакции составляет по меньшей мере 90 или 95%. Предпочтительной PG является C1-C6-алкоксикарбонил, такой как трет-бутоксикарбонил или Boc. Затем можно проводить реакцию соединения (с) с соединением (d) или его солю, такой как соль сTsOH, с образованием соединения (е) (стадия 2), с последующим снятием защиты аминогруппы с получением соединения (f) или его соли (например, соли HCl) (стадия 3). Предпочтительная PGC включает,но не ограничиваясь этим, C1-C6-алкил, такой как этил. Затем можно проводить реакцию соединения (f) с соединением (g) с образованием соединения (h) (стадия 4), которое затем защищают по аминогруппе с образованием соединения (i) (стадия 5) и затем подвергают реакции обмена с замыканием кольца с образованием соединения (j) (стадия 6). Предпочтительная PGN включает, но не ограничиваясь этим,C1-C6-алкоксикарбонил, такой как трет-бутоксикарбонил или Boc. Общие способы реакции обмена с замыканием кольца (RCM) хорошо известны в данной области. Предпочтительные способы включают применение катализаторов переходных металлов, таких как катализаторы, описанные в патенте США 6921753 и публикации патентной заявки США 20070043180. Неограничивающие примеры подхо дящих катализаторов включают Zhan Catalist-1B ( триметилфенил; также известный как Zhan-B) и Zhan Catalist-1C ( где Су представляет собой циклогексил), которые оба являются коммерчески доступными от Zannan Pharma, Ltd. (Shanghai,China). Снятие защиты с аминогруппы в соединении (j) приводит к соединению (k) (или его свободному основанию) (стадия 7). В определенных случаях соединение (h) может непосредственно претерпевать реакцию обмена с замыканием цикла с получением соединения (k) (или его свободного основания), без стадий защиты и снятия защиты аминогруппы. Затем можно проводить снятие защиты группы карбоновой кислоты в соединении (k) с образованием соединения (l) (стадия 8), которое реагирует с соединением (m) с образованием соединения (n) (стадия 9). G в соединении (m) определяют как -E-R5, где Е и R5 определены выше в настоящем документе. Соединение формулы (I'), как описано в настоящем документе, можно сходным образом получать по схеме 2. Соединения, описываемые в настоящем документе, содержат один или несколько центров асимметрии и, таким образом, являются источником энантиомеров, диастереомеров и других стереоизомерных форм, которые можно определить в терминах абсолютной стереохимии как (R)- или (S)- или как (D)- или(L)- для аминокислот. Подразумевается, что настоящее изобретение включает все такие возможные изомеры, а также их рацемические и оптически чистые формы. Оптические изомеры можно получать из их соответствующих оптически активных предшественников, посредством описанных выше процедур или разделяя рацемические смеси. Разделение можно проводить в присутствии разделяющего средства посредством хроматографии или посредством повторной хроматографии, или какого-либо сочетания этих способов, которые известны специалистам в данной области. Дополнительные подробности относительно разделения можно найти в Jacques, et al., Enantiomers, Racemates, and Resolutions (John WileySons,1981). Когда соединения, описываемые в настоящем документе, содержат олефиновые двойные связи или другие центры геометрической асимметрии и если не указано иначе, следует понимать, что соединения включают оба геометрических изомера Е и Z. Подобным образом также подразумевают, что следует включать все таутомерные формы. Конфигурация любой двойной связи между атомами углерода, присутствующая в настоящем документе, выбрана только для удобства и не предназначена для обозначения конкретной конфигурации, если в тексте так не указано; таким образом двойная связь между атомами углерода, произвольно изображаемая в настоящем документе как транс, может представлять собой цис,транс или смесь их двух в любой пропорции. Синтезированные соединения можно выделять из реакционной смеси и дополнительно очищать таким способом, как колоночная хроматография, высокоэффективная жидкостная хроматография или перекристаллизация. Специалистам в данной области очевидны дополнительные способы синтеза соединений с формулами, представленными в настоящем документе. Кроме того, для получения желаемых соединений различные стадии синтеза можно проводить в альтернативных последовательности или порядке. Кроме того, растворители, температуры, длительности реакций и т.д., указанные в настоящем документе, предназначены только для целей иллюстрации, и специалисту в данной области понятно, что вариация условий реакции может приводить к желательным соединенным мостиковой связью макроциклическим продуктам по настоящему изобретению. Способы преобразований в синтетической химии и способы с защитными группами (защита и снятие защиты), пригодные для синтеза соединений, описываемых в настоящем документе, известны в данной области и включают, например, способы, такие как описано в R. Larock, Comprehensive Organic Transformations, VCH Publishers (1989); T.W. Greene andM. Fieser, Fieser and Fieser's Reagents for Organic Synthesis, John WileySons (1994) и L. Paquette, ed.,Encyclopedia of Reagents for Organic Synthesis, John WileySons (1995) и в их последующих редакциях. Соединения по настоящему изобретению можно модифицировать, добавляя синтетическими способами, указанными в настоящем документе, различные функциональные группы для усиления селективных биологических свойств. Такие модификации известны в данной области и включают модификации,которые усиливают биологическую проницаемость в данную биологическую систему (например, кровь,лимфатическую систему, центральную нервную систему), увеличивают пероральную доступность, увеличивают растворимость для обеспечения введения посредством инъекции, изменяют метаболизм и изменяют скорость выведения. Перечисление списка химических групп в любом определении переменной в настоящем документе включает определения этой переменной как любой отдельной группы или комбинации перечисленных групп. Перечисление варианта осуществления для переменной в настоящем документе включает этот вариант осуществления как любой отдельный вариант осуществления или в сочетании с любыми другими вариантами осуществления или их частями. Примеры Соединения и способы по настоящему изобретению легче понять относительно приведенных ниже примеров, которые предназначены только для иллюстрации, а не для ограничения объема изобретения. Приведенные ниже примеры можно получать или по схеме 1, или по схеме 2, как описано выше. Специалистам в данной области очевидны различные изменения и модификации описанных вариантов осуществления, и такие изменения и модификации, включающие, без ограничения, изменения и модификации, относящиеся к химическим структурам, заместителям, производным, составам и/или способам по изобретению, можно проводить без отклонения от сущности изобретения и объема прилагаемой формулы изобретения. Пример 1. трет-Бутил-(2R,6S,13aS,14aR,16aS,Z)-2-(3-(бензо[d]тиазол-2-ил)хиноксалин-2-илокси)-14 а(циклопропилсульфонилкарбамоил)-5,16-диоксо-1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 агексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-6-илкарбамат. Пример 1 а.(2R,6S,13aS,14aR,16aS,Z)-этил-6-(трет-бутоксикарбониламино)-2-гидрокси-5,16-диоксо 1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 а-гексадекагидроциклопропа[е]пирроло[1,2 а][1,4]диазациклопентадецин-14 а-карбоксилата и DABCO в толуоле перемешивали при комнатной температуре (к.т.). К этому раствору добавляли раствор 4-бромбензол-1-сульфонилхлорида в толуоле. После завершения добавления реакционную смесь гасили 10% водным карбонатом натрия и смесь перемешивали в течение 15 мин. Добавляли тетрагидрофуран и смесь промывали 0,5 М HCl, водой и затем насыщенным водным хлоридом натрия. Органический слой сушили над безводным сульфатом магния, фильтровали, выпаривали при пониженном давлении и сушили с получением указанного в заголовке соединения. Пример 1b.(4,56 г, 25,3 ммоль) с последующим Cs2CO3 (17,1 г, 52,6 ммоль). Полученную смесь нагревали до 70 С в течение 18 ч. Реакционную смесь охлаждали до комнатной температуры и затем разделяли между этилацетатом (300 мл) и 1 н. HCl (100 мл). Органический слой разделяли, промывали насыщенным солевым раствором (100 мл), сушили над безводным сульфатом магния и концентрировали при пониженном давлении с получением неочищенного продукта в виде твердого вещества. Твердое вещество очищали посредством колоночной хроматографии на силикагеле (градиент EtOAc-гексан) с получением указанного в заголовке соединения в виде твердого вещества (6,2 г, выход 45%).(2R,6S,13aS,14aR,16aS,Z)-Этил-6-(трет-бутоксикарбониламино)-5,16-диоксо-2-(3 фенилхиноксалин-2-илокси)-1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 агексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-14 а-карбоксилат (1 с). В микроволновую камеру добавляли продукт из 1b (700 мг, 1,07 ммоль),2-(трибутилстаннил)бензо[d]тиазол (905 мг, 2,13 ммоль), палладий-тетракис-(трифенилфосфин) (113 мг,11 ммоль) и диоксан (5 мл). В камере откачивали газ и вводили азот, что повторяли дважды. Смесь подвергали реакции в микроволновом реакторе при 110 С в течение 1 ч. Реакционную смесь разбавлялиMeCN и 3 раза промывали гексаном. Слой MeCN выпаривали и очищали посредством колоночной хроматографии на силикагеле (градиент CHCl3-EtOAc) с получением указанного в заголовке соединения(2R,6S,13aS,14aR,16aS,Z)-2-(3-(Бензо[d]тиазол-2-ил)хиноксалин-2-илокси)-6-(третбутоксикарбониламино)-5,16-диоксо-1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 агексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-14 а-карбоновая кислота (1d). К раствору продукта из примера 1 с (692 мг, 0,95 ммоль) в тетрагидрофуране (5 мл)/этаноле(2,5 мл)/воде (2,5 мл) добавляли моногидрат гидроксида лития (154 мг, 3,7 ммоль). Полученную смесь нагревали до 50 С в течение 1 ч и охлаждали до комнатной температуры. Органические растворители в основном удаляли при пониженном давлении, добавляли EtOAc (100 мл) и затем промывали 1 н. HCl(30 мл). Органический слой разделяли, промывали насыщенным солевым раствором (20 мл), сушили над безводным MgSO4 и концентрировали при пониженном давлении с получением 666 мг продукта 1d. Пример 1f. К раствору продукта из примера 1d (666 мг, 0,92 ммоль) в 1,2-дихлорэтане (9 мл) добавляли 1,1'-карбонилдиимидазол (246 мг, 1,52 ммоль). Реакционную смесь перемешивали при 40 С в течение 2 ч. Затем к полученному выше раствору добавляли циклопропансульфонамид (184 мг, 1,52 ммоль) с последующим DBU (0,23 мл, 1,52 ммоль). Полученную смесь перемешивали при 40 С в течение 1 ч. Реакционную смесь разбавляли EtOAc (100 мл) и промывали 1 н. HCl (20 мл), затем насыщенным хлоридом натрия (20 мл). Органический слой разделяли, сушили над безводным MgSO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали посредством колоночной хроматографии на силикагеле (градиент CHCl3/EtOAc) с получением указанного в заголовке соединения (322 мг, выход 38%).(2R,6S,13aS,14aR,16aS,Z)-6-Амино-2-(3-(бензо[d]тиазол-2-ил)хиноксалин-2-илокси)-N(циклопропилсульфонил)-5,16-диоксо-1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 агексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-14 а-карбоксамид. К суспензии продукта из примера 1 (320 мг, 0,39 ммоль) в EtOAc (3 мл) добавляли 4 М раствор HCl в диоксане (1,9 мл, 7,7 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 20 ч. Растворитель выпаривали при пониженном давлении и полученное твердое вещество сушили в вакууме с получением гидрохлорида(2R,6S,13aR,14aR,16aS,Z)-6-амино-2-(3-(бензо[d]тиазол-2 ил)хиноксалин-2-илокси)-N-(циклопропилсульфонил)-5,16-диоксо 1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 а-гексадекагидроциклопропа[е]пирроло[1,2 а][1,4]диазациклопентадецин-14 а-карбоксамида (295 мг, количественный выход). Пример 2b. К раствору из примера 2 а (28 мг, 0,037 ммоль) в дихлорметане (0,5 мл) добавляли изоникотиновую кислоту (5,0 мг, 0,040 ммоль), HATU (16,7 мг, 0,044 ммоль) и диизопропилэтиламин (0,021 мл,0,12 ммоль). Реакционную смесь перемешивали при 25 С в течение 2 ч и выпаривали. При очистке неочищенного вещества посредством хроматографии с обращенной фазой с элюированием ацетонитрилом/водой/TFA получали указанное в заголовке соединение.(2R,6S,13aS,14aR,16aS,Z)-2-(3-(Бензо[d]тиазол-2-ил)хиноксалин-2-илокси)-N(циклопропилсульфонил)-6-(2-фторбензамидо)-5,16-диоксо-1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 агексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-14 а-карбоксамид. Соединение примера 3 получали в соответствии со способом, используемым для получения по примеру 2, заменяя изоникотиновую кислоту 2-фторбензойной кислотой. При очистке неочищенного вещества посредством хроматографии с обращенной фазой с элюированием ацетонитрилом/водой/TFA получали указанное в заголовке соединение.N-2R,6S,13aS,14aR,16aS,Z)-2-(3-(Бензо[d]тиазол-2-ил)хиноксалин-2-илокси)-14 а(циклопропилсульфонилкарбамоил)-5,16-диоксо-1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 агексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-6-ил)-5-метилизоксазол-3 карбоксамид. Соединение примера 4 получали в соответствии со способом, используемым для получения по примеру 2, заменяя изоникотиновую кислоту 5-метилизоксазол-3-карбоновой кислотой. При очистке неочищенного вещества посредством хроматографии с обращенной фазой с элюированием ацетонитрилом/водой/TFA получали указанное в заголовке соединение.(2R,6S,13aS,14aR,16aS,Z)-2-(3-(Бензо[d]тиазол-2-ил)хиноксалин-2-илокси)-N(циклопропилсульфонил)-6-(5-метилпиразин-2-карбоксамидо)-5,16-диоксо 1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 а-гексадекагидроциклопропа[е]пирроло[1,2 а][1,4]диазациклопентадецин-14 а-карбоксамид. Соединение примера 5 получали в соответствии со способом, используемым для получения по примеру 2, заменяя изоникотиновую кислоту 5-метилпиразин-2-карбоновой кислотой. При очистке неочищенного вещества посредством хроматографии с обращенной фазой с элюированием ацетонитрилом/водой/TFA получали указанное в заголовке соединение.N-2R,6S,13aS,14aR,16aS,Z)-2-(3-(Бензо[d]тиазол-2-ил)хиноксалин-2-илокси)-14 а(циклопропилсульфонилкарбамоил)-5,16-диоксо-1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 агексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-6-ил)изоксазол-5-карбоксамид. Соединение примера 6 получали в соответствии со способом, используемым для получения по примеру 2, заменяя изоникотиновую кислоту изоксазол-5-карбоновой кислотой. При очистке неочищенного вещества посредством хроматографии с обращенной фазой с элюированием ацетонитрилом/водой/TFA получали указанное в заголовке соединение.N-2R,6S,13aS,14aR,16aS,Z)-2-(3-(Бензо[d]тиазол-2-ил)хиноксалин-2-илокси)-14 а(циклопропилсульфонилкарбамоил)-5,16-диоксо-1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 агексадекагидроциклопропа[е]пирроло[1,2-a][1,4]диазациклопентадецин-6-ил)тиазол-4-карбоксамид. Соединение примера 7 получали в соответствии со способом, используемым для получения по примеру 2, заменяя изоникотиновую кислоту тиазол-4-карбоновой кислотой. При очистке неочищенного вещества посредством хроматографии с обращенной фазой с элюированием ацетонитрилом/водой/TFA получали указанное в заголовке соединение.(2R,6S,13aS,14aR,16aS,Z)-2-(3-(Бензо[d]тиазол-2-ил)хиноксалин-2-илокси)-N(циклопропилсульфонил)-6-(1-метил-1 Н-пиразол-3-карбоксамидо)-5,16-диоксо 1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 а-гексадекагидроциклопропа[е]пирроло[1,2 а][1,4]диазациклопентадецин-14 а-карбоксамид. Соединение примера 8 получали в соответствии со способом, используемым для получения по примеру 2, заменяя изоникотиновую кислоту 1-метил-1 Н-пиразол-3-карбоновой кислотой. При очистке неочищенного вещества посредством хроматографии с обращенной фазой с элюированием ацетонитрилом/водой/TFA получали указанное в заголовке соединение.(2R,6S,13aS,14aR,16aS,Z)-2-(3-(Бензо[d]тиазол-2-ил)хиноксалин-2-илокси)-N(циклопропилсульфонил)-5,16-диоксо-6-(пиримидин-4-карбоксамидо)1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 а-гексадекагидроциклопропа[е]пирроло[1,2 а][1,4]диазациклопентадецин-14 а-карбоксамид. Соединение примера 9 получали в соответствии со способом, используемым для получения по примеру 2, заменяя изоникотиновую кислоту пиримидин-4-карбоновой кислотой. При очистке неочищенного вещества посредством хроматографии с обращенной фазой с элюированием ацетонитрилом/водой/TFA получали указанное в заголовке соединение.(2R,6S,13aS,14aR,16aS,Z)-2-(3-(Бензо[d]тиазол-2-ил)хиноксалин-2-илокси)-N(циклопропилсульфонил)-6-(1,3-диметил-1 Н-пиразол-4-карбоксамидо)-5,16-диоксо 1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 а-гексадекагидроциклопропа[е]пирроло[1,2 а][1,4]диазациклопентадецин-14 а-карбоксамид. Соединение примера 10 получали в соответствии со способом, используемым для получения по примеру 2, заменяя изоникотиновую кислоту 1,3-диметил-1 Н-пиразол-4-карбоновой кислотой. При очистке неочищенного вещества посредством хроматографии с обращенной фазой с элюированием ацетонитрилом/водой/TFA получали указанное в заголовке соединение.(2R,6S,13aS,14aR,16aS,Z)-2-(3-(Бензо[d]тиазол-2-ил)хиноксалин-2-илокси)-N(циклопропилсульфонил)-6-(3-фторбензамидо)-5,16-диоксо-1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 агексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-14 а-карбоксамид. Соединение примера 11 получали в соответствии со способом, используемым для получения по примеру 2, заменяя изоникотиновую кислоту 3-фторбензоилхлоридом. При очистке неочищенного вещества посредством хроматографии с обращенной фазой с элюированием ацетонитрилом/водой/TFA получали указанное в заголовке соединение.(20,0 г,26,8 ммоль) в уксусной кислоте (80 мл), перемешивая при 40 С, добавляли порошок цинка (10,52 г,166 ммоль). После завершения добавления реакционную смесь перемешивали при 40 С в течение 1 ч. Затем смесь охлаждали до комнатной температуры, разбавляли толуолом и фильтровали через целит. Исходный раствор промывали водой, 1 н. HCl и насыщенным водным хлоридом натрия, сушили над безводным сульфатом магния и фильтровали. Затем фильтрат выпаривали при пониженном давлении с получением указанного в заголовке соединения 12 а (14,8 г, выход 97%). Пример 12b. трет-Бутил-(2R,6S,13aS,14aR,16aS,Z)-2-(3-хлорхиноксалин-2-илокси)-14 а(циклопропилсульфонилкарбамоил)-5,16-диоксо-1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 агексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-6-илкарбамат. Раствор соединения 12 а (10,0 г, 17,6 ммоль), карбоната цезия (17,2, 52,8 ммоль) и 2,3-дихлорхиноксалина (3,50 г, 17,6 ммоль) в диметилформамиде (175 мл) нагревали до 70 С в течение 18 ч. Добавляли дополнительную часть 2,3-дихлорхиноксалина (0,70 г, 3,5 ммоль) и реакционную смесь перемешивали при 70 С в течение 18 ч. Реакционную смесь охлаждали до комнатной температуры и затем разделяли между этилацетатом (300 мл) и 1 н. HCl (100 мл). Органический слой разделяли, промывали насыщенным солевым раствором (100 мл), сушили над безводным сульфатом магния и концентрировали при пониженном давлении с получением сырого продукта в виде твердого вещества. Твердое вещество очищали посредством колоночной хроматографии на силикагеле (градиент EtOAc-гексан) с получением указанного в заголовке соединения в виде твердого вещества (4,7 г, выход 37%).MS (ESI): m/z=731,1 [M+H]. Пример 12 с. В микроволновую камеру добавляли продукт из 12b (0,40 г, 0,547 ммоль), бензофуран-2 илтрибутилстаннан (0,245 г, 0,602 ммоль), трис-(дибензилиденацетон)дипалладий(0) (50 мг,0,055 ммоль), 1,3,5,7-тетраметил-2,4,8-триокса-6-фенил-6-фосфаадамантан (32 мг, 0,11 ммоль), бикарбонат натрия (46 мг, 0,547 ммоль) и диоксан (3 мл). В камере откачивали газ и вводили азот. Смесь подвергали реакции в микроволновом реакторе при 110 С в течение 1 ч. Реакционную смесь разбавляли этилацетатом, промывали 1 н. HCl с последующим насыщенным водным хлоридом натрия и сушили над безводным сульфатом магния. Смесь фильтровали через целит и выпаривали при пониженном давлении. Остаток растворяли в ацетонитриле и промывали гексаном (пять раз) и затем выпаривали при пониженном давлении. Остаток очищали посредством колоночной хроматографии на силикагеле (градиент(2R,6S,13aS,14aR,16aS,Z)-6-амино-2-(3-(бензофуран-2-ил)хиноксалин-2-илокси)-N(циклопропилсульфонил)-5,16-диоксо-1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 агексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-14 а-карбоксамида. Продукт из примера 12 (0,386 г, 0,475 ммоль) растворяли в смеси этилацетата (2,4 мл) и 4 н. HCl в диоксане (2,4 мл) и перемешивали при комнатной температуре в течение 1 ч. Затем смесь выпаривали при пониженном давлении с получением указанного в заголовке соединения (0,338 мг, выход 100%). Пример 13b. Смесь продукта из примера 13 а (30 мг, 0,040 ммоль), 5-метилизоксазол-3-карбоновой кислоты(5,1 мг, 0,040 ммоль), N-этил-N-изопропилпропан-2-амина (15,6 мг, 0,12 ммоль) и HATU (18,3 мг,0,048 ммоль) в дихлорметане (0,5 мл) перемешивали при комнатной температуре в течение 1 ч и затем выпаривали. При очистке неочищенного вещества посредством хроматографии с обращенной фазой с элюированием ацетонитрилом/водой/TFA получали указанное в заголовке соединение (14 мг, выход 42%).(2R,6S,13aS,14aR,16aS,Z)-2-(3-(Бензофуран-2-ил)хиноксалин-2-илокси)-N(циклопропилсульфонил)-6-(5-метилпиразин-2-карбоксамидо)-5,16-диоксо 1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 а-гексадекагидроциклопропа[е]пирроло[1,2 а][1,4]диазациклопентадецин-14 а-карбоксамид. Соединение примера 14 получали в соответствии со способом, используемым для получения по примеру 13, заменяя 5-метилизоксазол-3-карбоновую кислоту 5-метилпиразин-2-карбоновой кислотой. При очистке неочищенного вещества посредством хроматографии с обращенной фазой с элюированием ацетонитрилом/водой/TFA получали указанное в заголовке соединение.(2R,6S,13aS,14aR,16aS,Z)-2-(3-(Бензофуран-2-ил)хиноксалин-2-илокси)-N(циклопропилсульфонил)-6-(1-метил-1 Н-пиразол-3-карбоксамидо)-5,16-диоксо 1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 а-гексадекагидроциклопропа[е]пирроло[1,2 а][1,4]диазациклопентадецин-14 а-карбоксамид. Соединение примера 15 получали в соответствии со способом, используемым для получения по примеру 13, заменяя 5-метилизоксазол-3-карбоновую кислоту 1-метил-1 Н-пиразол-3-карбоновой кислотой. При очистке неочищенного вещества посредством хроматографии с обращенной фазой с элюированием ацетонитрилом/водой/TFA получали указанное в заголовке соединение.(2R,6S,13aS,14aR,16aS,Z)-2-(3-(Бензофуран-2-ил)хиноксалин-2-илокси)-N(циклопропилсульфонил)-6-(1,5-диметил-1 Н-пиразол-3-карбоксамидо)-5,16-диоксо 1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 а-гексадекагидроциклопропа[е]пирроло[1,2 а][1,4]диазациклопентадецин-14 а-карбоксамид. Соединение примера 16 получали в соответствии со способом, используемым для получения по примеру 13, заменяя 5-метилизоксазол-3-карбоновую кислоту 1,5-диметил-1 Н-пиразол-3-карбоновой кислотой. При очистке неочищенного вещества посредством хроматографии с обращенной фазой с элюированием ацетонитрилом/водой/TFA получали указанное в заголовке соединение.(2R,6S,13aS,14aR,16aS,Z)-2-(3-(Бензофуран-2-ил)хиноксалин-2-илокси)-N(циклопропилсульфонил)-5,16-диоксо-6-(пиримидин-4-карбоксамидо)1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 а-гексадекагидроциклопропа[е]пирроло[1,2 а][1,4]диазациклопентадецин-14 а-карбоксамид. Соединение примера 17 получали в соответствии со способом, используемым для получения по примеру 13, заменяя 5-метилизоксазол-3-карбоновую кислоту пиримидин-4-карбоновой кислотой. При очистке неочищенного вещества посредством хроматографии с обращенной фазой с элюированием ацетонитрилом/водой/TFA получали указанное в заголовке соединение.MS (ESI): m/z=818,9 [M+H]. Пример 18. трет-Бутил-(2R,6S,13aS,14aR,16aS,Z)-2-(3-(бензо[b]тиофен-2-ил)хиноксалин-2-илокси)-14 а(циклопропилсульфонилкарбамоил)-5,16-диоксо-1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 агексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-6-илкарбамат. Соединение примера 18 получали в соответствии со способом, используемым для получения по примеру 12, заменяя бензофуран-2-илтрибутилстаннан бензо[b]тиофен-2-илтрибутилстаннаном. При очистке неочищенного вещества посредством хроматографии с обращенной фазой с элюированием гексаном/этилацетатом (1:2) получали указанное в заголовке соединение.N-2R,6S,13aS,14aR,16aS,Z)-2-(3-(Бензо[b]тиофен-2-ил)хиноксалин-2-илокси)-14 а(циклопропилсульфонилкарбамоил)-5,16-диоксо-1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 агексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-6-ил)-5-метилизоксазол-3 карбоксамид. Пример 19 а. Гидрохлорид (2R,6S,13aS,14aR,16aS,Z)-6-амино-2-(3-(бензо[b]тиофен-2-ил)хиноксалин-2-илокси)N-(циклопропилсульфонил)-5,16-диоксо-1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 агексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-14 а-карбоксамида. Продукт из примера 18 (0,296 г, 0,357 ммоль) растворяли в смеси этилацетата (1,7 мл) и 4 н. HCl в диоксане (1,7 мл) и перемешивали при комнатной температуре в течение 1 ч. Затем смесь выпаривали при пониженном давлении с получением указанного в заголовке соединения (0,262 мг, выход 96%). Пример 19b. Смесь продукта из примера 19 а (30 мг, 0,039 ммоль), 5-метилизоксазол-3-карбоновой кислоты(5,0 мг, 0,039 ммоль), N-этил-N-изопропилпропан-2-амина (15,2 мг, 0,118 ммоль) и HATU (17,9 мг,0,047 ммоль) в дихлорметане (0,5 мл) перемешивали при комнатной температуре в течение 1 ч и затем выпаривали. При очистке неочищенного вещества посредством хроматографии с обращенной фазой с элюированием ацетонитрилом/водой/TFA получали указанное в заголовке соединение (18 мг, выход 53%).(2R,6S,13aS,14aR,16aS,Z)-2-(3-(Бензо[b]тиофен-2-ил)хиноксалин-2-илокси)-N(циклопропилсульфонил)-6-(5-метилпиразин-2-карбоксамидо)-5,16-диоксо 1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 а-гексадекагидроциклопропа[е]пирроло[1,2 а][1,4]диазациклопентадецин-14 а-карбоксамид. Соединение примера 20 получали в соответствии со способом, используемым для получения по примеру 19, заменяя 5-метилизоксазол-3-карбоновую кислоту 5-метилпиразин-2-карбоновой кислотой. При очистке неочищенного вещества посредством хроматографии с обращенной фазой с элюированием ацетонитрилом/водой/TFA получали указанное в заголовке соединение.(2R,6S,13aS,14aR,16aS,Z)-2-(3-(Бензо[b]тиофен-2-ил)хиноксалин-2-илокси)-N(циклопропилсульфонил)-6-(1-метил-1 Н-пиразол-3-карбоксамидо)-5,16-диоксо 1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 а-гексадекагидроциклопропа[е]пирроло[1,2 а][1,4]диазациклопентадецин-14 а-карбоксамид. Соединение примера 21 получали в соответствии со способом, используемым для получения по примеру 19, заменяя 5-метилизоксазол-3-карбоновую кислоту 1-метил-1 Н-пиразол-3-карбоновой кислотой. При очистке неочищенного вещества посредством хроматографии с обращенной фазой с элюированием ацетонитрилом/водой/TFA получали указанное в заголовке соединение.(2R,6S,13aS,14aR,16aS,Z)-2-(3-(Бензо[b]тиофен-2-ил)хиноксалин-2-илокси)-N(циклопропилсульфонил)-6-(1,5-диметил-1H-пиразол-3-карбоксамидо)-5,16-диоксо 1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 а-гексадекагидроциклопропа[е]пирроло[1,2 а][1,4]диазациклопентадецин-14 а-карбоксамид. Соединение примера 22 получали в соответствии со способом, используемым для получения по примеру 19, заменяя 5-метилизоксазол-3-карбоновую кислоту 1,5-диметил-1 Н-пиразол-3-карбоновой кислотой. При очистке неочищенного вещества посредством хроматографии с обращенной фазой с элюированием ацетонитрилом/водой/TFA получали указанное в заголовке соединение.(2R,6S,13aS,14aR,16aS,Z)-2-(3-(Бензо[b]тиофен-2-ил)хиноксалин-2-илокси)-N(циклопропилсульфонил)-5,16-диоксо-6-(пиримидин-4-карбоксамидо)1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 а-гексадекагидроциклопропа[е]пирроло[1,2 а][1,4]диазациклопентадецин-14 а-карбоксамид. Соединение примера 23 получали в соответствии со способом, используемым для получения по примеру 19, заменяя 5-метилизоксазол-3-карбоновую кислоту пиримидин-4-карбоновой кислотой. При очистке неочищенного вещества посредством хроматографии с обращенной фазой с элюированием ацетонитрилом/водой/TFA получали указанное в заголовке соединение.(2R,6S,13aS,14aR,16aS,Z)-этил-6-(трет-бутоксикарбониламино)-2-гидрокси-5,16-диоксо 1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 а-гексадекагидроциклопропа[е]пирроло[1,2 а][1,4]диазациклопентадецин-14 а-карбоксилата (22,1 г, 44,8 ммоль) и DABCO (8,5 г, 76,7 ммоль) в толуоле (88 мл) перемешивали при комнатной температуре. К этому раствору добавляли раствор 4-бромбензол-1-сульфонилхлорида (17,2 г, 67,2 ммоль) в толуоле (44 мл). После завершения добавления реакционную смесь гасили 10% водным карбонатом натрия (110 мл) и смесь перемешивали в течение 15 мин. Добавляли тетрагидрофуран (44 мл) и смесь промывали 0,5 М HCl, водой и затем насыщенным водным хлоридом натрия. Органический слой сушили над безводным сульфатом магния, фильтровали и выпаривали при пониженном давлении и сушили с получением указанного в заголовке соединения(27,7 г, выход 87%), которое использовали без дополнительной очистки. Пример 24b.(2R,6S,13aS,14aR,16aS,Z)-Этил-6-(трет-бутоксикарбониламино)-5,16-диоксо-2-(фенантридин-6 илокси)-1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 а-гексадекагидроциклопропа[е]пирроло[1,2 а][1,4]диазациклопентадецин-14 а-карбоксилат. К раствору соединения из примера 24 а (11,0 г, 15,4 ммоль) в NMP (100 мл) добавляли фенантридин 6(5H)-он (3,15 г, 16,2 ммоль) с последующим Cs2CO3 (7,53 г, 23,1 ммоль). Полученную смесь нагревали до 55 С в течение 4 ч. Реакционную смесь охлаждали до комнатной температуры и затем разделяли между этилацетатом (250 мл) и 5% водным раствором бикарбоната натрия (200 мл). Органический слой разделяли, промывали 5% водным раствором бикарбоната натрия (200 мл) с последующим насыщенным солевым раствором (150 мл), сушили над безводным сульфатом натрия и концентрировали при пониженном давлении с получением сырого продукта в виде твердого вещества. Затем твердое вещество растворяли в простом трет-бутилметиловом эфире (200 мл), полученную суспензию перемешивали при комнатной температуре в течение 1 ч и фильтровали. Фильтрат, содержащий желаемый продукт, концентрировали при пониженном давлении с получением 7,95 г продукта 24b в виде твердого вещества.(2R,6S,13aS,14aR,16aS,Z)-6-(трет-Бутоксикарбониламино)-5,16-диоксо-2-(фенантридин-6-илокси)1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 а-гексадекагидроциклопропа[е]пирроло[1,2 а][1,4]диазациклопентадецин-14 а-карбоновая кислота (24 с). К раствору продукта из примера 24b (7,8 г, 11,6 ммоль) в тетрагидрофуране (40 мл)/этаноле (40 мл) добавляли водный раствор гидроксида лития (0,84 г гидроксида лития в 40 мл Н 2 О). Полученную смесь нагревали до 50 С в течение 2 ч и охлаждали до комнатной температуры. Органические растворители в основном удаляли при пониженном давлении и полученный остаток подкисляли 10% водным раствором лимонной кислоты и экстрагировали этилацетатом (200 мл). Органический слой разделяли, промывали насыщенным солевым раствором (200 мл), сушили над безводным Na2SO4, фильтровали и концентрировали при пониженном давлении с получением светло-желтого твердого вещества, которое дополнительно сушили в вакуумной печи при 45 С в течение 18 ч с получением 7,5 г продукта 24 с в виде светложелтого твердого вещества.MS-DCI/NH3: 643 (М+Н)+. Пример 24d. трет-Бутил-(2R,6S,13aS,14aR,16aS,Z)-14a-(циклопропилсульфонилкарбамоил)-5,16-диоксо-2(фенантридин-6-илокси)-1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 агексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-6-илкарбамат. К раствору продукта из примера 24 с (7,46 г, 11,6 ммоль) в DMF (80 мл) добавляли 1,1'-карбомилдиимидазол (5,64 г, 34,8 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 6 ч. К полученному выше раствору затем добавляли циклопропансульфонамид (4,21 г,34,8 ммоль) с последующим DBU (5,73 мл, 36,0 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 14 ч. К реакционной смеси добавляли EtOAc (200 мл), 10% водный раствор лимонной кислоты (200 мл) и насыщенный водный хлорид натрия (50 мл). Органический слой разделяли,промывали насыщенным водным хлоридом натрия (100 мл), сушили над безводным Na2SO4, фильтровали и концентрировали при пониженном давлении. Остаток очищали посредством колоночной хроматографии на силикагеле (градиент этилацетат/гептан) с получением указанного в заголовке соединения в виде белого твердого вещества (6,40 г, выход 74%).(2R,6S,13aS,14aR,16aS,Z)-6-амино-N-(циклопропилсульфонил)-5,16-диоксо-2(фенантридин-6-илокси)-1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 агексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-14 а-карбоксамида. К суспензии продукта из примера 24 (0,35 г, 0,47 ммоль) в ацетонитриле (5 мл) добавляли 4 М раствор HCl в диоксане (0,6 мл, 2,4 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 4 ч. Растворитель выпаривали при пониженном давлении и полученное твердое вещество сушили в вакууме с получением указанного в заголовке соединения (0,32 г, количественный выход).(2R,6S,13aS,14aR,16aS,Z)-N-(Циклопропилсульфонил)-5,16-диоксо-2-(фенантридин-6-илокси)-6(пиразин-2-карбоксамидо)-1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 агексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-14 а-карбоксамид. К раствору из примера 25 а (320 мг, 0,47 ммоль) в диметилформамиде (5 мл) добавляли пиразинкарбоновую кислоту (0,065 г, 0,52 ммоль), HATU (214 мг, 0,56 ммоль) и диизопропилэтиламин (0,2 мл,1,18 ммоль). Реакционную смесь перемешивали при 25C в течение 2 ч и затем разделяли между 5% водным бикарбонатом натрия и этилацетатом. Органический слой сушили над безводным сульфатом магния, фильтровали и выпаривали. Остаток очищали посредством кристаллизации из этилацетата/гексана с получением желаемого продукта (155 мг, выход 44%) в виде не совсем белого твердого вещества.(2R,6S,13aS,14aR,16aS,Z)-Этил-6-(циклопентилоксикарбониламино)-5,16-диоксо-2-(фенантридин-6 илокси)-1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 а-гексадекагидроциклопропа[е]пирроло[1,2 а][1,4]диазациклопентадецин-14 а-карбоксилат. Соединение примера 26 а получали в соответствии со способом, используемым для получения по примеру 24b, заменяя соединение из примера 24 а соединением (2R,6S,13aS,14aR,16aS,Z)-этил-2-(4 бромфенилсульфонилокси)-6-(циклопентилоксикарбониламино)-5,16-диоксо 1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 а-гексадекагидроциклопропа[е]пирроло[1,2 а][1,4]диазациклопентадецин-14 а-карбоксилатом с получением указанного в заголовке соединения.(2R,6S,13aS,14aR,16aS,Z)-6-(Циклопентилоксикарбониламино)-5,16-диоксо-2-(фенантридин-6 илокси)-1,2,3,5,6,7,8,9,0,11,13 а,14,14 а,15,16,16 а-гексадекагидроциклопропа[е]пирроло[1,2 а][1,4]диазациклопентадецин-14 а-карбоновая кислота. Соединение примера 26b получали в соответствии со способом, используемым для получения по примеру 24 с, заменяя соединение 24b соединением 26 а, с получением указанного в заголовке соединения.[е]пирроло[1,2-а][1,4]диазациклопентадецин-6-илкарбамат. Указанное в заголовке соединение из примера 26 получали в соответствии со способом, используемым для получения по примеру 24, заменяя соединение 24 с соединением 26b, с получением указанного в заголовке соединения.(2R,6S,13aS,14aR,16aS,Z)-N-(Циклопропилсульфонил)-6-(5-метил-1 Н-пиразол-3-карбоксамидо)5,16-диоксо-2-(фенантридин-6-илокси)-1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 агексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-14 а-карбоксамид. Соединение примера 27 получали в соответствии со способом, используемым для получения по примеру 25, заменяя 2-пиразинкарбоновую кислоту 5-метил-1 Н-пиразол-3-карбоновой кислотой. При очистке неочищенного вещества посредством хроматографии с обращенной фазой с элюированием ацетонитрилом/водой/TFA получали указанное в заголовке соединение.N-2R,6S,13aS,14aR,16aS,Z)-14a-(Циклопропилсульфонилкарбамоил)-5,16-диоксо-2-(фенантридин 6-илокси)-1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 а-гексадекагидроциклопропа[е]пирроло[1,2 а][1,4]диазациклопентадецин-6-ил)-5-метилизоксазол-3-карбоксамид. Соединение примера 28 получали в соответствии со способом, используемым для получения по примеру 25, заменяя 2-пиразинкарбоновую кислоту 5-метилизоксазол-3-карбоновой кислотой. При очистке неочищенного вещества посредством хроматографии с обращенной фазой с элюированием ацетонитрилом/водой/TFA получали указанное в заголовке соединение.(2R,6S,13aS,14aR,16aS,Z)-N-(Циклопропилсульфонил)-6-(5-метилпиразин-2-карбоксамидо)-5,16 диоксо-2-(фенантридин-6-илокси)-1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 агексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-14 а-карбоксамид. Соединение примера 29 получали в соответствии со способом, используемым для получения по примеру 25, заменяя 2-пиразинкарбоновую кислоту 5-метилпиразин-2-карбоновой кислотой. При очистке неочищенного вещества посредством хроматографии с обращенной фазой с элюированием ацетонитрилом/водой/TFA получали указанное в заголовке соединение.N-2R,6S,13aS,14aR,16aS,Z)-14a-(Циклопропилсульфонилкарбамоил)-5,16-диоксо-2-(фенантридин 6-илокси)-1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 а-гексадекагидроциклопропа[е]пирроло[1,2 а][1,4]диазациклопентадецин-6-ил)тиазол-5-карбоксамид. Соединение примера 30 получали в соответствии со способом, используемым для получения по примеру 25, заменяя 2-пиразинкарбоновую кислоту тиазол-5-карбоновой кислотой. При очистке неочищенного вещества посредством хроматографии с обращенной фазой с элюированием ацетонитрилом/водой/TFA получали указанное в заголовке соединение.(2R,6S,13aS,14aR,16aS,Z)-N-(Циклопропилсульфонил)-6-(2-фторбензамидо)-5,16-диоксо-2(фенантридин-6-илокси)-1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 агексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-14 а-карбоксамид. Соединение примера 31 получали в соответствии со способом, используемым для получения по примеру 25, заменяя 2-пиразинкарбоновую кислоту 2-фторбензойной кислотой. При очистке неочищенного вещества посредством хроматографии с обращенной фазой с элюированием ацетонитрилом/водой/TFA получали указанное в заголовке соединение.(2R,6S,13aS,14aR,16aS,Z)-N-(Циклопропилсульфонил)-5,16-диоксо-2-(фенантридин-6-илокси)-6(пиридазин-4-карбоксамидо)-1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 агексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-14 а-карбоксамид. Соединение примера 32 получали в соответствии со способом, используемым для получения по примеру 25, заменяя 2-пиразинкарбоновую кислоту пиридазин-4-карбоновой кислотой. При очистке неочищенного вещества посредством хроматографии с обращенной фазой с элюированием ацетонитрилом/водой/TFA получали указанное в заголовке соединение.(2R,6S,13aS,14aR,16aS,Z)-N-(Циклопропилсульфонил)-5,16-диоксо-2-(фенантридин-6-илокси)-6(пиримидин-4-карбоксамидо)-1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 агексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-14 а-карбоксамид. Соединение примера 33 получали в соответствии со способом, используемым для получения по примеру 25, заменяя 2-пиразинкарбоновую кислоту пиримидин-4-карбоновой кислотой. При очистке неочищенного вещества посредством хроматографии с обращенной фазой с элюированием ацетонитрилом/водой/TFA получали указанное в заголовке соединение.(2R,6S,13aS,14aR,16aS,Z)-N-(Циклопропилсульфонил)-6-(1-метил-1 Н-пиразол-3-карбоксамидо)5,16-диоксо-2-(фенантридин-6-илокси)-1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 агексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-14 а-карбоксамид. Соединение примера 34 получали в соответствии со способом, используемым для получения по примеру 25, заменяя 2-пиразинкарбоновую кислоту 1-метил-1 Н-пиразол-3-карбоновой кислотой. При очистке неочищенного вещества посредством хроматографии с обращенной фазой с элюированием ацетонитрилом/водой/TFA получали указанное в заголовке соединение.(2R,6S,13aS,14aR,16aS,Z)-N-(Циклопропилсульфонил)-6-(2-гидрокси-2-метилпропанамидо)-5,16 диоксо-2-(фенантридин-6-илокси)-1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 агексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-14 а-карбоксамид. Соединение примера 35 получали в соответствии со способом, используемым для получения по примеру 25, заменяя 2-пиразинкарбоновую кислоту 2-гидрокси-2-метилпропионовой кислотой. При очистке неочищенного вещества посредством хроматографии с обращенной фазой с элюированием ацетонитрилом/водой/TFA получали указанное в заголовке соединение.(2R,6S,13aS,14aR,16aS,Z)-N-(Циклопропилсульфонил)-6-(1,5-диметил-1 Н-пиразол-3 карбоксамидо)-5,16-диоксо-2-(фенантридин-6-илокси)-1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 агексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-14 а-карбоксамид. Соединение примера 36 получали в соответствии со способом, используемым для получения по примеру 25, заменяя 2-пиразинкарбоновую кислоту 1,5-диметил-1 Н-пиразол-3-карбоновой кислотой. При очистке неочищенного вещества посредством хроматографии с обращенной фазой с элюированием ацетонитрилом/водой/TFA получали указанное в заголовке соединение.MS (ESI): m/z=768,1 [M+H]. Пример 37. Циклопентил-(2R,6S,13aS,14aR,16aS,Z)-14a-(циклопропилсульфонилкарбамоил)-2-(2 фторфенантридин-6-илокси)-5,16-диоксо-1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 агексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-6-илкарбамат. Пример 37 а. 5'-Фтор-2'-нитробифенил-2-карбоксилат. В микроволновую камеру добавляли 2-(метоксикарбонил)фенилбороновую кислоту (63,4 мг,0,352 ммоль), 2-бром-4-фтор-1-нитробензол (77 мг, 0,35 ммоль), диацетоксипалладий (0,93 мг,4,1 мкмоль) и дициклогексил(2',6'-диметоксибифенил-2-ил)фосфин (3,47 мг, 8,45 мкмоль). Добавляли этанол (1760 мкл) и карбонат натрия (176 мкл, 0,352 ммоль) и смесь подвергали реакции в микроволновом реакторе при 100 С в течение 30 мин. Реакционную смесь разбавляли дихлорметаном, сушили над безводным сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток очищали посредством препаративной тонкослойной хроматографии (элюант: гексан/этилацетат 9:1) с получением метил-5'-фтор-2'-нитробифенил-2-карбоксилата (37 а, 54,8 мг, 0,199 ммоль, выход 56,6%). Пример 37b. 2-Фтор-5-гидроксифенантридин-6(5H)-он. К раствору продукта из примера 37 а (метил-5'-фтор-2'-нитробифенил-2-карбоксилат (56,79 мг,0,206 ммоль) в метаноле (9 мл) добавляли 10% палладий на углероде (15,6 мг, 0,015 ммоль). Колбу заполняли посредством баллона с водородом и три раза дегазировали водородом. Реакционную смесь перемешивали, разбавляли диметилформамидом и фильтровали. Фильтрат концентрировали с получением 2-фтор-5-гидроксифенантридин-6(5H)-она (37b, 46,36 мг, 0,202 ммоль, выход 98%). Пример 37 с. 2-Фторфенантридин-6(5H)-он. Смесь продукта из примера 37b (2-фтор-5-гидроксифенантридин-6(5H)-он (46,4 мг, 0,202 ммоль),уксусной кислоты (3 мл) и цинка (99 мг, 1,517 ммоль) нагревали при температуре кипения с обратным холодильником при 130 С в течение 1 ч. Смесь разбавляли диметилформамидом, фильтровали и фильтрат концентрировали с получением желто-коричневого твердого вещества (100 мг). Твердое вещество разделяли между дихлорметаном/диметилформамидом (2/1, 50 мл) и карбонатом натрия (10 мл). Органический слой промывали водой (210 мл) и концентрировали с получением 2-фторфенантридин-6(5H)-она(2R,6S,13aS,14aR,16aS,Z)-Этил-6-(циклопентилоксикарбониламино)-2-(2-фторфенантридин-6 илокси)-5,16-диоксо-1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 а-гексадекагидроциклопропа[е]пирроло[1,2 а][1,4]диазациклопентадецин-14 а-карбоксилат. Соединение примера 37d получали в соответствии со способом, используемым для получения по примеру 37b,заменяя(2R,6S,13aS,14aR,16aS,Z)-6-(Циклопентилоксикарбониламино)-2-(2-фторфенантридин-6-илокси)5,16-диоксо-1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 а-гексадекагидроциклопропа[е]пирроло[1,2 а][1,4]диазациклопентадецин-14 а-карбоновая кислота. Соединение примера 37 е получали в соответствии со способом, используемым для получения по примеру 67 с, заменяя продукт из примера 37d на продукт из примера 24b. Пример 37f. Циклопентил-(2R,6S,13aS,14aR,16aS,Z)-14a-(циклопропилсульфонилкарбамоил)-2-(2 фторфенантридин-6-илокси)-5,16-диоксо-1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 агексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-6-илкарбамат. Соединение из примера 37 получали в соответствии со способом, используемым для получения по примеру 24, заменяя продукт из примера 37 е на продукт из примера 24 с (14,6 мг, выход 78%).MS (ESI): m/z=776,1 [M+H]. Пример 38. трет-Бутил-(2R,6S,13aS,14aR,16aS,Z)-14 а-(циклопропилсульфонилкарбамоил)-2-(2,9 дифторфенантридин-6-илокси)-5,16-диоксо-1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 агексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-6-илкарбамат. Пример 38 а. Метил-5,5'-дифтор-2'-нитробифенил-2-карбоксилат. К 2-бром-4-фтор-1-нитробензолу (185,16 мг, 0,842 ммоль) добавляли Pd2dba3 (23,12 мг,0,025 ммоль) и порошковую медь (271 мг, 4,26 ммоль). Добавляли диметилсульфоксид (2,3 мл) и метил 2-бром-4-фторбензоат (0,122 мл, 0,842 ммоль) и смесь энергично перемешивали при 100 С в течение 2 ч. Смесь охлаждали до комнатной температуры, разбавляли этилацетатом (20 мл) и фильтровали. Фильтрат промывали водой, сушили (безводный Na2SO4) и концентрировали с получением желтого масла(279,8 мг). Это масло использовали без очистки для получения по примеру 38b. Пример 38b. 2,9-Дифтор-5-гидроксифенантридин-6(5H)-он. К продукту из примера 38 а (279,8 мг) добавляли метанол (7,5 мл) и 10% палладий на углероде(76 мг, 0,071 ммоль). Колбу заполняли посредством баллона с водородом и смесь дегазировали и повторно заполняли водородом три раза. Смесь перемешивали в атмосфере водорода в течение 16 ч, разбавляли диметилформамидом и фильтровали. Фильтрат концентрировали с получением красного твердого вещества. Это вещество растирали в дихлорметане/гексане (9/1) и фильтровали с получением указанного в заголовке соединения (пример 38b, 43,15 мг, 0,175 ммоль, количественный выход). Пример 38 с. 2,9-Дифторфенантридин-6(5H)-он. Соединение примера 38 с получали в соответствии со способом, используемым для получения по примеру 37 с, заменяя продукт из примера 38b на продукт из примера 80b. Пример 38d.(2R,6S,13aS,14aR,16aS,Z)-Этил-6-(трет-бутоксикарбониламино)-2-(2,9-дифторфенантридин-6 илокси)-5,16-диоксо-1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 а-гексадекагидроциклопропа[е]пирроло[1,2 а][1,4]диазациклопентадецин-14 а-карбоксилат. Соединение примера 38d получали в соответствии со способом, используемым для получения по примеру 24 с, заменяя продукт из примера 38 с на фенантридин-6(5H)-он. Пример 38 е.(2R,6S,13aS,14aR,16aS,Z)-6-(трет-Бутоксикарбониламино)-2-(2,9-дифторфенантридин-6-илокси)5,16-диоксо-1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 а-гексадекагидроциклопропа[е]пирроло[1,2 а][1,4]диазациклопентадецин-14 а-карбоновая кислота. Соединение примера 38 е получали в соответствии со способом, используемым для получения по примеру 24 с, заменяя продукт из примера 38d на продукт из примера 24b. Пример 38f. трет-Бутил-(2R,6S,13aS,14aR,16aS,Z)-14a-(циклопропилсульфонилкарбамоил)-2-(2,9 дифторфенантридин-6-илокси)-5,16-диоксо-1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 агексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-6-илкарбамат. Соединение примера 38 получали в соответствии со способом, используемым для получения по примеру 24, заменяя продукт из примера 38 е на продукт из примера 24 с.MS (ESI): m/z=782,1 [М+Н]. Пример 39. трет-Бутил-(2R,6S,13aR,14aR,16aS)-14a-(циклопропилсульфонилкарбамоил)-5,16-диоксо-2(фенантридин-6-илокси)октадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-6 илкарбамат. К продукту из примера 24 (79,1 мг, 0,106 ммоль) и катализатору Крабтри (3,45 мг, 4,24 мкмоль)(4 мол.%) в 4 мл толстостенную пробирку добавляли дегазированный аргоном этанол (0,8 мл). Сосуд три раза барботировали аргоном и затем накачивали водородом (50 psi, 35153,48 кг/м 2). Смесь нагревали до 50 С в атмосфере водорода и перемешивали в течение 4,5 ч при 50 С. Реакционную смесь концентрировали и очищали посредством хроматографии с обращенной фазой, элюировали в градиенте ацетонитрила(1% TFA)/воды с получением указанного в заголовке соединения в виде белого твердого веществаMS (ESI): m/z=748,2 [M+H]. Пример 40. Циклопентил-(2R,6S,13aR,14aR,16aS)-14 а-(циклопропилсульфонилкарбамоил)-5,16-диоксо-2(фенантридин-6-илокси)октадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-6 илкарбамат. Соединение примера 40 получали в соответствии со способом, используемым для получения по примеру 39, заменяя продукт из примера 24 на продукт из примера 26.MS (ESI): m/z=760,2 [M+H]. Пример 41. трет-Бутил-(2R,6S,13aR,14aR,16aS)-5,16-диоксо-2-(фенантридин-6-илокси)-14a-(тиофен-2 илсульфонилкарбамоил)октадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-6 илкарбамат. Соединение примера 41 получали в соответствии со способом, используемым для получения по примеру 24, заменяя циклопропансульфонамид на тиофен-2-сульфонамид.(S)-2-(2-Метилпиримидин-5-карбоксамидо)нон-8-еновая кислота. Дициклогексиламиновую соль Вос-2(S)-амино-нон-8-еновой кислоты можно суспендировать в изопропилацетате, несколько раз промывать водным раствором лимонной кислоты и затем один раз водой. Промытый продукт, концентрированный и затем повторно разбавленный в изопропилацетате, можно подвергать реакции с HCl с получением соли HCl 2(S)-амино-нон-8-еновой кислоты. 2-Метилпиримидин-5-карбоновую кислоту, N,N'-дисукцинимидилкарбонат и N,N-диметиламинопиридин можно растворять в N-метил-2-пирролидоне (NMP) и перемешивать. Затем добавляют соль HCl 2(S)-амино-нон-8-еновой кислоты с последующим триэтиламином и перемешивают с получением указанного в заголовке соединения из примера 42 а, которое можно кристаллизовать, добавляя HCl с последующей водой. Пример 42b.(2S,4R)-N-Boc-4-гидроксипролина с 2-хлор-3-(тиофен-2 ил)хиноксалином в NMP в присутствии трет-бутоксида натрия с получением (2S,4R)-1-(третбутоксикарбонил)-4-(3-(бензо[d]тиазол-2-ил)хиноксалин-2-илокси)пирролидин-2-карбоновой кислоты. Затем можно добавлять простой трет-бутилметиловый эфир (МТВЕ) и воду. Водный слой отделяют,промывают и затем добавляют HCl с последующей экстракцией МТВЕ. Экстрагированный продукт можно смешивать с диизопропилэтиламином (DIPEA) и HATU (CAS148893-10-1) и затем проводить реакцию с тозилатной солью (1R,2S)-этил-1-амино-2-винилциклопропанкарбоксилата в диметилформамиде (DMF) и толуоле. В реакции получают (2S,4R)-трет-бутил 2-1R,2S)-1-(этоксикарбонил)-2 винилциклопропилкарбамоил)-4-(3-(бензо[d]тиазол-2-ил)хиноксалин-2-илокси)пирролидин-1 карбоксилат, который можно экстрагировать МТВЕ и промывать HCl, дополнительно экстрагировать,промывать, сушить и растворять в 2-пропаноле. К раствору 2-пропанола можно добавлять HCl с получением (1R,2S)-этил-1-2S,4R)-4-(3(бензо[d]тиазол-2-ил)хиноксалин-2-илокси)пирролидин-2-карбоксамидо)-2 винилциклопропанкарбоксилата, который можно кристаллизовать, нейтрализуя NaOH. Можно смешивать(1R,2S)-этил-1-2S,4R)-4-(3-(бензо[d]тиазол-2-ил)хиноксалин-2 илокси)пирролидин-2-карбоксамидо)-2-винилциклопропанкарбоксилат, указанное в заголовке соединение из примера 42 а, N-гидрокси-5-норборнен-2,3-дикарбоксимид и гидрохлорид N-(3 диметиламинопропил)-N'-этилкарбодиимида и перемешивать в DMF в течение нескольких часов с последующим добавлением N,N-диметилэтилендиамина. В реакции получают (1R,2S)-этил-1-2S,4R)-1S)-2-(2-метилпиримидин-5-карбоксамидо)нон-8-еноил)-4-(3-(бензо[d]тиазол-2-ил)хиноксалин-2 илокси)пирролидин-2-карбоксамидо)-2-винилциклопропанкарбоксилат, который можно растворять в изопропилацетате и экстрагировать водной Н 3 РО 4 и затем экстрагировать водным K2HPO4. Можно проводить реакцию продукта с ди-трет-бутилдикарбонатом в присутствии диметиламинопиридина с последующей экстракцией смесью раствора лимонной кислоты и раствора хлорида натрия с получением указанного в заголовке соединения из примера 42b. Пример 42 с. Гидрохлорид (2R,6S,13aS,14aR,16aS,Z)-этил-6-(2-метилпиримидин-5-карбоксамидо)-5,16-диоксо-2(3-(бензо[d]тиазол-2-ил)хиноксалин-2-илокси)-1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 агексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-14 а-карбоксилата. Продукт из примера 42b можно подвергать реакции обмена с замыканием кольца в присутствии катализатора Zhan-B в толуоле с получением (2R,6S,13aS,14aR,16aS,Z)-15-трет-бутил-14 а-этил-6-(2 метилпиримидин-5-карбоксамидо)-5,16-диоксо-2-(3-(бензо[d]тиазол-2-ил)хиноксалин-2-илокси)2,3,5,6,7,8,9,10,11,13 а,14,14 а,16,16 а-тетрадекагидроциклопропа[е]пирроло[1,2 а][1,4]диазациклопентадецин-14 а,15(1 Н)-дикарбоксилата. Катализатор после реакции можно гасить имидазолом. У продукта с замкнутым кольцом в толуоле можно заменять растворитель на ацетонитрил с последующим добавлением соляной кислоты в диоксане и нагреванием с получением указанного в заголовке соединения из примера 42 с. Пример 42d.(2R,6S,13aS,14aR,16aS,Z)-N-(Циклопропилсульфонил)-6-(2-метилпиримидин-5-карбоксамидо)-5,16 диоксо-2-(3-(бензо[d]тиазол-2-ил)хиноксалин-2-илокси)-1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 агексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-14 а-карбоксамид. Выделенный продукт из примера 42 с можно смешивать с тетрагидрофураном, водой и LiOH-H2O и затем нагревать и перемешивать. Реакционную смесь позже можно охлаждать, добавлять водную Н 3 РО 4,водный NaCl и 2-метилтетрагидрофуран и органический слой отделяют, промывают и фильтруют. К концентрированному органическому слою добавляют MeCN, нагревают и охлаждают и затем добавляют диэтиламин. Взвесь нагревают и охлаждают с получением диэтиламиновой соли(2R,6S,13aS,14aR,16aS,Z)-6-(2-метилпиримидин-5-карбоксамидо)-5,16-диоксо-2-(3-(бензо[d]тиазол-2 ил)хиноксалин-2-илокси)-1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 агексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-14 а-карбоксилата,которую можно дополнительно промывать и сушить. Диэтиламиновую соль можно смешивать с тетрагидрофураном, 2-метилтетрагидрофураном и водной Н 3 РО 4. Органический слой отделяют, промывают водным NaCl и затем концентрируют и/или очищают. Затем продукт можно смешивать с NMP с последующим добавлением карбонилдиимидазола(CDI) и затем 1,8-диазабицикло[5.4.0]ундец-7-ена (DBU). Затем можно добавлять циклопропилсульфонамид. Реакционную смесь перемешивают в течение нескольких часов. Затем можно добавлять изопропилацетат с последующим водным KH2PO4 и затем водной Н 3 РО 4. Органический слой можно отделять,промывать и очищать с получением указанного в заголовке соединения из примера 42d. Пример 43.N-2R,6S,13aS,14aR,16aS,Z)-2-(3-(Бензо[d]тиазол-2-ил)хиноксалин-2-илокси)-14 а(циклопропилсульфонилкарбамоил)-5,16-диоксо-1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 агексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-6-ил)-3-метилизоксазол-5 карбоксамид. Соединение примера 43 можно получать в соответствии со способом, описанным для получения по примеру 42, заменяя 2-метилпиримидин-5-карбоновую кислоту из примера 42 а 3-метилизоксазол-5 карбоновой кислотой из примера 43 а, с получением (S)-2-(3-метилизоксазол-5-карбоксамидо)нон-8 еновой кислоты. Все последующие стадии следует проводить сходным с примером 42 образом с получением соединения примера 43. Пример 44.N-2R,6S,13aS,14aR,16aS,Z)-2-(3-(Бензо[d]тиазол-2-ил)хиноксалин-2-илокси)-14 а(циклопропилсульфонилкарбамоил)-5,16-диоксо-1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 агексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-6-ил)-5-метилизоксазол-3 карбоксамид. Соединение примера 44 можно получать в соответствии со способом, описанным для получения по примеру 42, заменяя 2-метилпиримидин-5-карбоновую кислоту из примера 42 а 5-метилизоксазол-3 карбоновой кислотой из примера 44 а, с получением (S)-2-(5-метилизоксазол-3-карбоксамидо)нон-8 еновой кислоты. Все последующие стадии следует проводить сходным с примером 42 образом с получением соединения примера 44. Пример 45.(2R,6S,13aS,14aR,16aS,Z)-2-(3-(Бензо[d]тиазол-2-ил)хиноксалин-2-илокси)-N(циклопропилсульфонил)-6-(3-фторбензамидо)-5,16-диоксо-1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 агексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-14 а-карбоксамид. Соединение примера 45 можно получать в соответствии со способом, описанным для получения по примеру 42, заменяя 2-метилпиримидин-5-карбоновую кислоту из примера 42 а 3-фторбензойной кислотой из примера 45 а, с получением (S)-2-(3-фторбензамидо)нон-8-еновой кислоты. Все последующие стадии следует проводить сходным с примером 42 образом с получением соединения примера 45. Пример 46.(2R,6S,13aS,14aR,16aS,Z)-2-(3-(Бензо[d]тиазол-2-ил)хиноксалин-2-илокси)-N(циклопропилсульфонил)-5,16-диоксо-6-(пиримидин-4-карбоксамидо)1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 а-гексадекагидроциклопропа[е]пирроло[1,2 а][1,4]диазациклопентадецин-14 а-карбоксамид. Соединение примера 46 можно получать в соответствии со способом, описанным для получения по примеру 42, заменяя 2-метилпиримидин-5-карбоновую кислоту из примера 42 а пиримидин-4-карбоновой кислотой из примера 46 а, с получением (S)-2-(пиримидин-4-карбоксамидо)нон-8-еновой кислоты. Все последующие стадии следует проводить сходным с примером 42 образом с получением соединения примера 46.N-2R,6S,13aS,14aR,16aS,Z)-2-(3-(Бензо[d]тиазол-2-ил)хиноксалин-2-илокси)-14 а(циклопропилсульфонилкарбамоил)-5,16-диоксо-1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 агексадекагидроциклопропа[е]пирроло[1,2-а][1,4]диазациклопентадецин-6-ил)изоксазол-5-карбоксамид. Соединение примера 47 можно получать в соответствии со способом, описанным для получения по примеру 42, заменяя 2-метилпиримидин-5-карбоновую кислоту из примера 42 а изоксазол-5-карбоновой кислотой из примера 47 а, с получением (S)-2-(изоксазол-5-карбоксамидо)нон-8-еновой кислоты. Все последующие стадии следует проводить сходным с примером 42 образом с получением соединения примера 47. Пример 48.(2R,6S,13aS,14aR,16aS,Z)-2-(3-(Бензо[d]тиазол-2-ил)хиноксалин-2-илокси)-N(циклопропилсульфонил)-6-(5-метилпиразин-2-карбоксамидо)-5,16-диоксо 1,2,3,5,6,7,8,9,10,11,13 а,14,14 а,15,16,16 а-гексадекагидроциклопропа[е]пирроло[1,2 а][1,4]диазациклопентадецин-14 а-карбоксамид. Соединение примера 48 можно получать в соответствии со способом, описанным для получения по примеру 42, заменяя 2-метилпиримидин-5-карбоновую кислоту из примера 42 а 5-метилпиразин-2 карбоновой кислотой из примера 48 а, с получением (S)-2-(5-метилпиразин-2-карбоксамидо)нон-8-еновой кислоты. Все последующие стадии следует проводить сходным с примером 42 образом с получением соединения примера 48. Пример 49.(S)-2-(5-Метилпиразин-2-карбоксамидо)нон-8-еновая кислота. Дициклогексиламиновую соль Вос-2(S)-амино-нон-8-еновой кислоты можно суспендировать в изопропилацетате, несколько раз промывать водным раствором лимонной кислоты и затем один раз водой. Промытый продукт, концентрированный и затем повторно разбавленный в изопропилацетате, можно подвергать реакции с HCl с получением соли HCl 2(S)-амино-нон-8-еновой кислоты. 5-Метил-2-пиразинкарбоновую кислоту, N,N'-дисукцинимидилкарбонат и N,N-диметиламинопиридин можно растворять в N-метил-2-пирролидоне (NMP) и перемешивать. Затем добавляют соль HCl 2(S)амино-нон-8-еновой кислоты с последующим триэтиламином и перемешивают с получением указанного в заголовке соединения из примера 49 а, которое можно кристаллизовать, добавляя HCl с последующей водой. Пример 49b.(1R,2S)-Этил-1-2S,4R)-N-(трет-бутоксикарбонил)-1-S)-2-(5-метилпиразин-2-карбоксамидо)нон 8-еноил)-4-(фенантридин-6-илокси)пирролидин-2-карбоксамидо)-2-винилциклопропанкарбоксилат. Можно проводить реакцию (2S,4R)-N-Boc-4-гидроксипролина с 6-хлорфенантридином в NMP в присутствии трет-бутоксида натрия с получением (2S,4R)-1-(трет-бутоксикарбонил)-4-(фенантридин-6 илокси)пирролидин-2-карбоновой кислоты. Затем можно добавлять простой трет-бутилметиловый эфир(МТВЕ) и воду. Водный слой отделяют, промывают и затем добавляют HCl с последующей экстракцией МТВЕ. Экстрагированный продукт можно смешивать с диизопропилэтиламином (DIPEA) и HATU(CAS148893-10-1) и затем подвергать реакции с тозилатной солью (1R,2S)-этил-1-амино-2 винилциклопропанкарбоксилата в диметилформамиде (DMF) и толуоле. В реакции получают(2S,4R)-трет-бутил-2-1R,2S)-1-(этоксикарбонил)-2-винилциклопропилкарбамоил)-4-(фенантридин-6 илокси)пирролидин-1-карбоксилат, который можно экстрагировать МТВЕ и промывать HCl, дополнительно экстрагировать, промывать, сушить и растворять в 2-пропаноле. К раствору 2-пропанола можно добавлять HCl с получением (1R,2S)-этил-1-2S,4R)-4(фенантридин-6-илокси)пирролидин-2-карбоксамидо)-2-винилциклопропанкарбоксилата, который можно кристаллизовать, нейтрализуя NaOH. Можно смешивать (1R,2S)-этил-1-2S,4R)-4-(фенантридин-6-илокси)пирролидин-2-карбоксамидо)2-винилциклопропанкарбоксилат, указанное в заголовке соединение из примера 49 а, N-гидрокси-5 норборнен-2,3-дикарбоксимид и гидрохлорид N-(3-диметиламинопропил)-N'-этилкарбодиимида и перемешивать в DMF с последующим добавлением N,N-диметилэтилендиамина. В реакции получают(1R,2S)-этил-1-2S,4R)-1-S)-2-(5-метилпиразин-2-карбоксамидо)нон-8-еноил)-4-(фенантридин-6 илокси)пирролидин-2-карбоксамидо)-2-винилциклопропанкарбоксилат, который можно растворять в изопропилацетате и экстрагировать водной Н 3 РО 4 и затем экстрагировать водным K2HPO4. Можно проводить реакцию продукта с ди-трет-бутилдикарбонатом в присутствии диметиламинопиридина с последующей экстракцией смесью раствора лимонной кислоты и раствора хлорида натрия с получением указанного в заголовке соединения из примера 49b.
МПК / Метки
МПК: A61K 38/12, A61K 38/00
Метки: ингибиторы, сериновых, протеаз, макроциклические, гепатита
Код ссылки
<a href="https://eas.patents.su/30-20580-makrociklicheskie-ingibitory-serinovyh-proteaz-gepatita-s.html" rel="bookmark" title="База патентов Евразийского Союза">Макроциклические ингибиторы сериновых протеаз гепатита с</a>
Предыдущий патент: Способ лечения реперфузионных повреждений тканей
Следующий патент: Платформа для осуществления доступа в транспортное средство
Случайный патент: Соединения мочевины, обладающие активностью антагонистов мускариновых рецепторов












