Макроциклические ингибиторы вируса гепатита с
Номер патента: 14646
Опубликовано: 30.12.2010
Авторы: Вендевилль Сандрин Мари Элен, Симмен Кеннет Алан, Ван Де Фрейкен Вим, Мак Гоуен Дэвид Крейг, Рабуассон Пьер Жан-Мари Бернар, Ху Лили, Де Кок Херман Аугустинус, Сюрлеро Доминик Луи Нестор Гилейн, Тахри Абделлах
Формула / Реферат
1. Соединение формулы
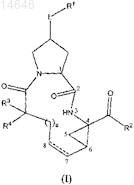
его N-оксид, аддитивная соль и стереохимически изомерная форма, где
пунктирной линией обозначена необязательная двойная связь между атомами С7 и С8;
R1 представляет собой частично ненасыщенную или полностью ненасыщенную 9-10-членную бициклическую гетероциклическую кольцевую систему, где указанная кольцевая система содержит один атом азота и где остальные члены кольца представляют собой атомы углерода; где указанная кольцевая система может быть необязательно замещена на любом атоме углерода или азота кольца одним, двумя или тремя заместителями, каждый из которых независимо выбран из Het и C1-6алкила; и где заместители на любом атоме углерода гетероциклического кольца также могут быть выбраны из -OR8, галогена;
L представляет собой -О- или -O-CO-;
R2 представляет собой -OR6или -NR5aSOpR8;
R3 и R4представляют собой водород или C1-6алкил;
n равен 3, 4, 5 или 6;
р равен 2;
R5a представляет собой водород;
R8 представляет собой C1-6алкил или C3-7циклоалкил, необязательно замещенный C1-6алкилом;
арил в качестве группы или части группы представляет собой фенил, необязательно замещенный одним, двумя или тремя заместителями, выбранными из галогена, C1-6алкила, гидрокси, С1-6алкокси;
Het в качестве группы или части группы представляет собой 5- или 6-членное полностью ненасыщенное гетероциклическое кольцо, содержащее 1 или 2 гетероатома, каждый из которых независимо выбран из азота и серы, и где группа Het может быть необязательно замещена одним, двумя или тремя заместителями, каждый из которых независимо выбран из группы, состоящей из С1-6алкила, амино, моно- или диС1-6алкиламино.
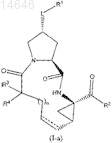
2. Соединение по п.1, где соединение имеет формулу (I-a)
3. Соединение по любому из пп.1, 2, где R1 представляет собой хинолинил (в частности, хинолин-4-ил), изохинолинил (в частности, изохинолин-1-ил), каждый из которых независимо необязательно является моно-, ди- или тризамещенным С1-6алкилом, C1-6алкокси, галогеном, -NR5aR5b, арилом, Het; где арил или Het, каждый независимо, необязательно замещены галогеном, С1-6алкилом, C1-6алкокси, амино, моно- или диС1-6алкиламино.
4. Соединение по п.3, где R1 представляет собой радикал формулы
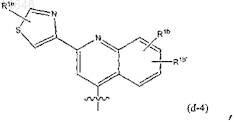
радикал формулы
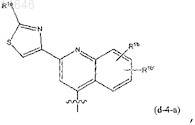
радикал формулы
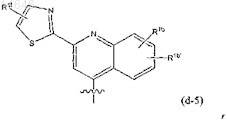
где в радикалах (d-4), (d-5), а также в (d-4-a): каждый из R1b, R1b', R1e, R1f независимо представляет собой любой из заместителей, выбранных из заместителей, приведенных в качестве возможных заместителей бициклических кольцевых систем R1, как указано в п.1.
5. Соединение по п.3, где R1 представляет собой радикал формулы
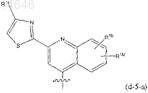
где R1f представляет собой водород, С1-6алкил, амино, моно- или диС1-6алкиламино.
6. Соединение по любому из пп.1-5, где:
(a) R2представляет собой -OR6, где R6 представляет собой водород, метил, этил или трет-бутил; или
(b) R2представляет собой -NHS(=O)2R8, где R8представляет собой циклопропил или метилциклопропил.
7. Соединение по любому из пп.1-6, где R3 и R4, оба, представляют собой водород.
8. Соединение по любому из пп.1-7, где n равен 4 или 5.
9. Соединение по любому из пп.1-8, отличное от N-оксида или соли.
10. Комбинация для ингибирования репликации HCV, содержащая:
(a) соединение, как определено в любом из пп.1-9, или его фармацевтически приемлемую соль и
(b) ритонавир или его фармацевтически приемлемую соль.
11. Фармацевтическая композиция, содержащая носитель, и в качестве активного ингредиента эффективное против вируса количество соединения по любому из пп.1-9 или комбинации по п.10.
12. Применение соединения по любому из пп.1-9 или комбинации по п.10 для изготовления лекарственного средства для ингибирования репликации HCV.
13. Способ получения соединения по любому из пп.1-9, где указанный способ включает получение соединения формулы (I), где связь между С7 и С8представляет собой двойную связь, которое представляет собой соединение формулы (I-d), посредством образования двойной связи между С7 и C8, в частности, с помощью реакции метатезиса олефинов, с одновременной циклизацией с образованием макроцикла, как показано на представленной ниже схеме
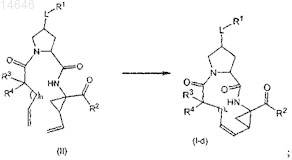
и в случае необходимости получение его солевой формы взаимодействием свободной формы соединения формулы (I) с кислотой или основанием.
14. Способ получения соединения по любому из пп.1-9, где указанный способ включает получение соединения формулы (I), где R2 представляет собой -NR5aSOpR8, где указанная группа соответствует группе -NR2-aR2-b, где указанное соединение соответствует формуле (I-d-1), образованием амидной связи между промежуточным соединением (III) и H-NR2-aR2-b (IV-a), как показано на представленной ниже схеме, где G представляет собой группу
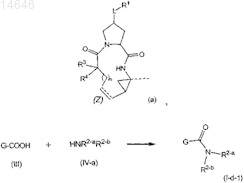
и в случае необходимости получение его солевой формы взаимодействием свободной формы соединения формулы (I) с кислотой или основанием.
Текст
МАКРОЦИКЛИЧЕСКИЕ ИНГИБИТОРЫ ВИРУСА ГЕПАТИТА С и их N-оксиды, аддитивные соли и стереохимически изомерные формы, где R1 представляет собой частично ненасыщенную или полностью ненасыщенную 9-10-членную бициклическую гетероциклическую кольцевую систему, где указанная кольцевая система содержит один атом азота и где остальные члены кольца представляют собой атомы углерода; где указанная кольцевая система может быть необязательно замещена на любом атоме углерода или азота кольца одним,двумя или тремя заместителями, каждый независимо выбранный из Het и С 1-6 алкила; и где замес Рабуассон Пьер Жан-Мари Бернар, Де Кок Херман Аугустинус, Вендевилль Сандрин Мари Элен, Ху Лили, Ван Де Фрейкен Вим, Мак Гоуен Дэвид Крейг, Тахри Абделлах, Сюрлеро Доминик Луи Нестор Гилэйн, Симмен Кеннет Алан (BE) тители на любом атоме углерода гетероциклического кольца также могут быть выбраны из -OR8,галогена; L представляет собой собой -О- или -O-CO-; R2 представляет собой -OR6 или-NR5aSOpR8; R3 и R4 представляют собой водород или C1-6 алкил; или R3 и R4 вместе могут образовывать С 3-7 циклоалкильное кольцо; n равен 3, 4, 5 или 6; р равен 2; арил представляет собой фенил, необязательно замещенный одним, двумя или тремя заместителями, выбранными из галогена, С 1-6 алкила, гидрокси, С 1-6 алкокси, Het представляет собой 5- или 6-членное насыщенное,частично ненасыщенное или полностью ненасыщенное гетероциклическое кольцо, содержащее 1-4 гетероатома, каждый независимо выбранный из азота, кислорода и серы, где кольцо необязательно конденсировано с бензольным кольцом, и где группа Het, в целом, может быть необязательно замещена; фармацевтические композиции, содержащие соединения (I), и способы получения соединений (I). Также предложены биодоступные комбинации ингибиторов HCV формулы 014646 Настоящее изобретение относится к макроциклическим соединениям, обладающим ингибирующей активностью в отношении репликации вируса гепатита С (HCV). Кроме того, оно относится к композициям, содержащим такие соединения в качестве активных ингредиентов, а также к способам получения указанных соединений и композиций. Вирус гепатита С является главной причиной хронических заболеваний печени во всем мире, и он стал предметом широкого медицинского исследования. HCV является членом семейства вирусовFlaviviridae рода hepacivirus, и является близко родственным роду flavivirus, который включает ряд вовлеченных в заболевания человека вирусов, таких как вирус денге и вирус желтой лихорадки, и семейству вирусов животных pestivirus, которое включает вирус бычьей вирусной диареи (BVDV). HCV представляет собой вирус с одноцепочечной положительной смысловой РНК с геномом приблизительно 9600 оснований. Геном содержит как 5', так и 3'-нетранслируемые области, которые определяют вторичную структуру РНК, и центральную открытую рамку считывания, которая кодирует отдельный полипротеин приблизительно из 3010-3030 аминокислот. Полипротеин кодирует десять продуктов гена, которые образуются из полипротеина-предшественника посредством регулируемой серии ко- и посттрансляционных эндопротеолитических расщеплений, опосредуемых протеазами как организма хозяина, так и вируса. Структурные белки вируса включают основной нуклеокапсидный белок, и два оболочечных гликопротеина Е 1 и Е 2. Неструктурные (NS) белки определяют некоторые необходимые вирусные ферментативные функции (хеликаза, полимераза, протеаза), а также кодируют белки неизвестной функции. Репликацию вирусного генома опосредует РНК-зависимая РНК-полимераза, кодируемая неструктурным белком 5b (NS5B). В дополнение к полимеразе, было показано, что функции вирусной хеликазы и протеазы, кодируемых в бифункциональном белке NS3, необходимы для репликации РНК HCV. В дополнение к сериновой протеазе NS3, HCV также кодирует металлопротеиназу в области NS2. После первоначальной острой инфекции у большинства инфицированных индивидуумов развивается хронический гепатит, поскольку HCV реплицируется предпочтительно в гепатоцитах, но не является непосредственно цитопатическим. В частности, отсутствие интенсивного Т-лимфоцитарного ответа и высокая способность вируса к мутациям, по-видимому, обеспечивает высокий уровень хронической инфекции. Хронический гепатит может прогрессировать в печеночный фиброз, приводящий к циррозу, заболеванию печени последней стадии, и в НСС (печеночно-клеточную карциному), что делает его основной причиной трансплантаций печени. Существует 6 основных генотипов HCV и более 50 подтипов, которые географически распределены по-разному. HCV 1 типа представляет собой преобладающий генотип в Европе и США. Выраженная генетическая гетерогенность HCV обладает высоким диагностическим и клиническим значением, являясь возможным объяснением трудностей в разработке вакцины и отсутствия ответа на лечение.HCV может передаваться через контакт с зараженной кровью или продуктами крови, например, после переливания крови или внутривенного применения лекарственного средства. Внедрение диагностических тестов, используемых для скрининга крови, вызвало тенденцию к понижению встречаемости посттрансфузионного заражения HCV. Однако, учитывая медленное прогрессирование в заболевание печени последней стадии, существующие инфекции будут оставаться серьезной медицинской и экономической проблемой в течение десятилетий. Современные способы лечения HCV основаны на (пегилированном) интерфероне-альфа (IFN-) в комбинации с рибавирином. Такая комбинированная терапия приводит к замедленному вирусологическому ответу более чем у 40% пациентов, инфицированных вирусами 1 генотипа, и приблизительно у 80% пациентов, инфицированных 2 и 3 генотипами. Помимо ограниченной эффективности HCV 1 типа,комбинированная терапия обладает значительными побочными эффектами и является плохо переносимой многими пациентами. Основные побочные эффекты включают гриппоподобные симптомы, гематологические нарушения и нейропсихиатрические симптомы. Таким образом, существует необходимость в более эффективных, удобных и лучше переносимых способах лечения. Недавно в качестве клинических кандидатов привлекли внимание два ингибитора, представляющие собой пептидомиметики протеазы HCV, а именно BILN-2061, описанный в WO 00/59929, и VX-950, описанный в WO 03/87092. Ряд аналогичных ингибиторов протеазы HCV также описан в научной и патентной литературе. К настоящему времени стало очевидно, что постоянное введение BILN-2061 или VX-950 приводит к селекции мутантных форм HCV, которые являются резистентными к соответствующему лекарственному средству, так называемых резистентных к лекарственному средству мутантных форм. Резистентные к лекарственному средству мутантные формы обладают характерными мутациями в геноме протеазы HCV, в частности, D168V, D168A и/или A156S. Таким образом, для обеспечения пациенту замены требуются дополнительные лекарственные средства с другим характером резистентности, и в будущем, вероятно, станет общепринятой комбинированная терапия несколькими лекарственными средствами, даже в качестве лечения первой линии. Опыт, связанный с лекарственными средствами против HIV, и, в частности, с ингибиторами протеазы HIV, далее показал, что субоптимальная фармакокинетика и комплексные схемы дозирования быстро приводят к непредусмотренным проблемам, связанным с режимом лечения. Это, в свою очередь,означает, что 24-часовая минимальная концентрация (минимальная концентрация в плазме) соответст-1 014646 вующих лекарственных средств в схеме лечения HIV часто снижается ниже порога IC90 или ED90 на большую часть дня. Полагают, что 24-часовой минимальный уровень по меньшей мере IC50 и, более реалистично, IC90 или ED90, является необходимым для замедления возникновения резистентных к лекарственному средству мутантных форм. Достижение необходимой фармакокинетики и метаболизма лекарственного средства для обеспечения таких минимальных уровней представляет собой важную задачу при разработке лекарственного средства. То свойство предшествующих ингибиторов протеазы HCV, что они являются исключительно пептидомиметиками с множеством пептидных связей, определяет фармакокинетические проблемы эффективных схем дозирования. Существует необходимость в ингибиторах HCV, которые могут решить проблемы современной терапии HCV, такие как побочные эффекты, ограниченная эффективность, появление резистентности и проблемы, связанные с нарушением режима лечения. Настоящее изобретение относится к ингибиторам репликации HCV, которые являются привлекательными не только с точки зрения их активности в качестве ингибиторов HCV, но также вследствие их хорошей проницаемости в клетки и сопутствующей биодоступности. Настоящее изобретение относится к ингибиторам репликации HCV, которые могут быть представлены формулой (I) к их N-оксидам, аддитивным солям и стереохимически изомерным формам, где пунктирной линией показана необязательная двойная связь между атомами С 7 и С 8;R1 представляет собой частично ненасыщенную или полностью ненасыщенную 9-10-членную бициклическую гетероциклическую кольцевую систему, где указанная кольцевая система содержит один атом азота, и где остальные члены кольца представляют собой атомы углерода; где указанная кольцевая система может быть необязательно замещена на любом атоме углерода или азота кольца одним, двумя или тремя заместителями, каждый независимо выбранный из Het и C1-6 алкила; и где заместители на любом атоме углерода гетероциклического кольца также могут быть выбраны из -OR8, галогена;R3 и R4 представляют собой водород или C1-6 алкил;R8 представляет собой C1-6 алкил или C3-7 циклоалкил, необязательно замещенный C1-6 алкилом; арил в качестве группы или части группы представляет собой фенил, необязательно замещенный одним, двумя или тремя заместителями, выбранными из галогена, С 1-6 алкила, гидрокси, С 1-6 алкокси;Het в качестве группы или части группы представляет собой 5- или 6-членное полностью ненасыщенное гетероциклическое кольцо, содержащее 1 или 2 гетероатома, каждый независимо выбранный из азота и серы, и где группа Het может быть необязательно замещена одним, двумя или тремя заместителями, каждый независимо выбранный из группы, состоящей из С 1-6 алкила, амино, моно- или диС 1-6 алкиламино. Соединения по настоящему изобретению являются необычными, поскольку, несмотря на их сниженную структурную гибкость, они представляют собой активные лекарственные средства против HCV. Это не соответствует распространенному в настоящее время мнению, которое предполагает меньшую активность лекарственных средств с менее гибкими макроциклическими кольцами. Кроме того, соединения по настоящему изобретению, имеющие относительно низкую молекулярную массу, легко синтезировать, исходя из исходных веществ, которые являются коммерчески доступными или которые являются широко доступными с помощью известных в данной области способов синтеза. Настоящее изобретение далее относится к способам получения соединений формулы (I), их Nоксидов, аддитивных солей и стереохимически изомерных форм. Настоящее изобретение относится непосредственно к применению соединений формулы (I), их Nоксидов, аддитивных солей и стереохимически изомерных форм в качестве лекарственного средства. Настоящее изобретение далее относится к фармацевтическим композициям, содержащим носитель-2 014646 и эффективное против вируса количество соединения формулы (I), как описано в настоящем описании. Фармацевтические композиции могут содержать комбинации приведенных выше соединений с другими средствами против HCV. Настоящее изобретение далее относится к указанным выше фармацевтическим композициям для введения субъекту, страдающему инфекцией HCV. Настоящее изобретение также относится к применению соединения формулы (I) или его N-оксида,аддитивной соли или стереохимически изомерных форм для изготовления лекарственного средства для ингибирования репликации HCV. Как использовано выше и в дальнейшем, применяют следующие определения, если не указано иное. Термин "галоген" означает фтор, хлор, бром и йод. Термин "полигалогенС 1-6 алкил" в качестве группы или части группы, например, в полигалогенС 1-6 алкокси, определяют как С 1-6 алкил, замещенный моно- или полигалогеном, в частности, С 1-6 алкил, замещенный одним, двумя, тремя, четырьмя, пятью, шестью или более атомами галогена, такой как метил или этил с одним или несколькими атомами фтора, например, дифторметил, трифторметил, трифторэтил. Предпочтительным является трифторметил. Также к нему относятся перфторС 1-6 алкильные группы, которые представляют собой С 1-6 алкильные группы, где все атомы водорода заменены атомами фтора, например, пентафторэтил. В случае определения полигалогенС 1-6 алкила, когда к алкильной группе присоединено более одного атома галогена, атомы галогена могут быть одинаковыми или различными. Как использовано в настоящем описании, "С 1-4 алкил" в качестве группы или части группы определяет насыщенные углеводородные радикалы с линейной или разветвленной цепью, имеющие от 1 до 4 атомов углерода, например, такие как метил, этил, 1-пропил, 2-пропил, 1-бутил, 2-бутил, 2-метил-1 пропил;"C1-6 алкил" относится к С 1-4 алкильным радикалам и высшим их гомологам, имеющим 5 или 6 атомов углерода, например, таким как 1-пентил, 2-пентил, 3-пентил, 1-гексил, 2-гексил, 2-метил-1-бутил, 2 метил-1-пентил, 2-этил-1-бутил, 3-метил-2-пентил и т.п. Среди C1-6 алкилов представляют интерес С 1-4 алкилы. Термин "С 2-6 алкенил" в качестве группы или части группы определяет углеводородные радикалы с линейной или разветвленной цепью, имеющие насыщенные углерод-углеродные связи и по меньшей мере одну двойную связь и имеющие от 2 до 6 атомов углерода, например, такие как этенил (или винил),1-пропенил, 2-пропенил (или аллил), 1-бутенил, 2-бутенил, 3-бутенил, 2-метил-2-пропенил, 2-пентенил,3-пентенил, 2-гексенил, 3-гексенил, 4-гексенил, 2-метил-2-бутенил, 2-метил-2-пентенил и т.п. Среди С 2-6 алкенилов представляют интерес С 2-4 алкенилы. Термин "С 2-6 алкинил" в качестве группы или части группы определяет углеводородные радикалы с линейной и разветвленный цепью, имеющие насыщенные углерод-углердоные связи и по меньшей мере одну тройную связь и имеющие от 2 до 6 атомов углерода, например, такие как этинил, 1-пропинил, 2 пропинил, 1-бутинил, 2-бутинил, 3-бутинил, 2-пентинил, 3-пентинил, 2-гексинил, 3-гексинил и т.п. Среди С 2-6 алкинилов представляют интерес С 2-4 алкинилы. К С 3-7 циклоалкилу относятся циклопропил, циклобутил, циклопентил, циклогексил и циклогептил. Когда C3-7 циклоалкил замещен, в частности, арилом или Het, он представляет собой циклопропил.C1-6 алкандиил определяет двухвалентные насыщенные углеводородные радикалы с линейной или разветвленной цепью, имеющие от 1 до 6 атомов углерода, например, такие как метилен, этилен, 1,3 пропандиил, 1,4-бутандиил, 1,2-пропандиил, 2,3-бутандиил, 1,5-пентандиил, 1,6-гександиил и т.п. Среди С 1-6 алкандиилов представляют интерес С 1-4 алкандиилы.C1-6 алкокси означает C1-6 алкилокси, где C1-6 алкил является таким, как определено выше. Как использовано в настоящем описании выше, группа (=O) или оксо образует карбонильную группу при присоединении к атому углерода, сульфоксидную группу при присоединении к атому серы и сульфонильную группу при присоединении двух указанных групп к атому серы. Когда кольцо или кольцевая система замещена группой оксо, атом углерода, с которым связана группа оксо, является насыщенным углеродом. Двухвалентный радикал L может представлять собой -О- или -O-CO. Радикал Het представляет собой гетероцикл, как описано в данном описании и формуле изобретения. Het представляет собой 5- или 6-членное полностью ненасыщенное гетероциклическое кольцо, содержащее 1 или 2 гетероатома, каждый независимо выбранный из азота и серы, и где группа Het может быть необязательно замещена одним, двумя или тремя заместителями, каждый независимо выбранный из группы, состоящей из C1-6 алкила, амино, моно- или диС 1-6 алкиламино. Примеры Het включают, например, пирролил, пиразолил, имидазолил, оксазолил, изоксазолил, тиазинолил, изотиазинолил, тиазолил,изотиазолил, оксадиазолил, тиадиазолил, триазолил (включая 1,2,3-триазолил, 1,2,4-триазолил), тетразолил, фуранил, тиенил, пиридил, пиримидил, пиридинизил, триазинил. Каждый из радикалов Het или R1, приведенных в предыдущем или следующем абзаце, может быть необязательно замещен количеством и типом заместителей, упомянутым в определениях соединений формулы (I) или любой из подгрупп соединений формулы (I).R1 может представлять собой частично ненасыщенную или полностью ненасыщенную 9-12-3 014646 членную бициклическую гетероциклическую кольцевую систему, как описано в данном описании и формуле изобретения. Примеры указанной бициклической кольцевой системы включают, в частности, хинолинил (в частности, хинолин-4-ил), изохинолинил (в частности, изохинолин-1-ил), каждый из которых независимо необязательно является моно-, ди- или тризамещенным C1-6 алкилом, C1-6 алкокси, галогеном,-NR5aR5b, арилом, Het; и т.п. Каждый "арил" является таким, как описано выше и предпочтительно представляет собой фенил,замещенный заместителями, описанными выше. Его применяют в равной мере с арилС 1-6 алкилом, который, в частности, может представлять собой арилметил, например, бензил. Следует отметить, что положения радикалов на любой молекулярной группе, используемой в определениях, могут быть любыми на такой группе, при условии, что она является химически стабильной. Если не указано иное, радикалы, используемые в определениях переменных, включают все возможные изомеры. Например, пиридил включает 2-пиридил, 3-пиридил и 4-пиридил; пентил включает 1 пентил, 2-пентил и 3-пентил. Когда переменная встречается более одного раза в любом составляющем, каждое определение является независимым. Как использовано далее в данном описании, термин "соединения формулы (I)" или "настоящие соединения" или сходные термины, подразумевает включение в него соединений формулы (I), любых их подгрупп, N-оксидов, аддитивных солей и стереохимически изомерных форм. Один вариант осуществления включает соединения формулы (I) или любую подгруппу соединений формулы (I), описанных в настоящем описании, а также их N-оксиды, аддитивные соли и возможные стереоизомерные формы. Другой вариант осуществления включает соединения формулы (I) или любую подгруппу соединений формулы (I), описанных в настоящем описании, а также их аддитивные соли и возможные стереоизомерные формы. Соединения формулы (I) имеют несколько центров хиральности и существуют в виде стереохимически изомерных форм. Как использовано в настоящем описании, термином "стереохимически изомерные формы" определяют все возможные соединения, состоящие из одних и тех же атомов, связанных одной и той же последовательностью связей, но имеющие различные трехмерные структуры,которыми соединения формулы (I) могут обладать, и которые не являются взаимозаменяемыми. В случаях, когда для обозначения абсолютной конфигурации хирального атома в заместителе используют (R) или (S), обозначение осуществляют, учитывая целое соединение, а не заместитель в отдельности. Если не указано или приведено иное, химическое обозначение соединения включает смесь всех возможных стереохимически изомерных форм, которыми может обладать указанное соединение. Указанная смесь может содержать все диастереомеры и/или энантиомеры основной молекулярной структуры указанного соединения. Подразумевают, что все стереохимически изомерные формы соединений по настоящему изобретению как в чистой форме, так и в смеси друг с другом, включены в объем настоящего изобретения. Чистые стереоизомерные формы соединений и промежуточных соединений, как указано в настоящем описании, определяют как изомеры, по существу не содержащие других энантиомерных или диастереомерных форм, с одинаковой основной молекулярной структурой указанных соединений или промежуточных соединений. В частности, термин "стереоизомерно чистый" относится к соединениям или промежуточным соединениям, имеющим стереоизомерный избыток по меньшей мере от 80% (т.е. минимум 90% одного изомера и максимум 10% других возможных изомеров) вплоть до избытка стереоизомера 100% (т.е. 100% одного изомера и отсутствие других), более конкретно к соединениям или промежуточным соединениям, имеющим стереоизомерный избыток от 90% вплоть до 100%, более конкретно,имеющим стереоизомерный избыток от 94% вплоть до 100% и наиболее конкретно имеющим стереоизомерный избыток от 97% вплоть до 100%. Термины "энантиомерно чистый" и "диастереомерно чистый" следует понимать аналогично, однако относительно энантиомерного избытка и диастереомерного избытка, соответственно, в представляющей интерес смеси. Чистые стереоизомерные формы соединений и промежуточных соединений по настоящему изобретению можно получать с применением известных в данной области способов. Например, энантиомеры можно разделять селективной кристаллизацией их диастереомерных солей с оптически активными кислотами или основаниями. Их примерами являются винная кислота, дибензоилвинная кислота, дитолуолвинная кислота и камфосульфоновая кислота. Альтернативно, энантиомеры можно разделять хроматографическими методами с использованием хиральных неподвижных фаз. Указанные стереохимически чистые изомерные формы также можно получать из соответствующих стереохимически чистых изомерных форм подходящих исходных веществ, при условии, что реакция проходит стереоспецифически. Предпочтительно, если требуется конкретный стереоизомер, указанное соединение синтезируют стереоспецифическими способами получения. В этих способах преимущественно используют энантиомерно чистые исходные вещества. Диастереомерные рацематы соединений формулы (I) можно получать отдельно общепринятыми способами. Подходящие физические методы разделения, которые преимущественно можно использовать, представляют собой, например, селективную кристаллизацию и хроматографию, например, коло-4 014646 ночную хроматографию. Для некоторых соединений формулы (I), их N-оксидов, аддитивных солей, сольватов и промежуточных соединений, используемых для их получения, абсолютная стереохимическая конфигурация не определена. Специалист в данной области сможет определить абсолютную конфигурацию таких соединений с использованием известных в данной области способов, например таких как рентгеновская дифракция. Также подразумевают, что настоящее изобретение включает все изотопы атомов, встречающиеся в представленных соединениях. Изотопы включают атомы, имеющие одинаковые атомные номера, но разные массовые числа. В качестве общего и неограничивающего примера, изотопы водорода включают тритий и дейтерий. Изотопы углерода включают С-13 и С-14. Как использовано в настоящем описании, термин "пролекарство" означает фармакологически приемлемые производные, такие как сложные эфиры, амиды и фосфаты, так что полученный продукт биотрансформации in vivo производного представляет собой активное лекарственное средство, как определено в соединениях формулы (I). Ссылка Goodman and Gilman (The Pharmacologial Basis of Therapeutics,8th ed, McGraw-Hill, Int. Ed. 1992, "Biotransformation of Therapeutics", p 13-15), в которой в основном описаны пролекарства, включена в настоящее описание. Пролекарства предпочтительно обладают высокой растворимостью в воде, повышенной биодоступностью и они легко метаболизируются in vivo в активные ингибиторы. Пролекарства соединения по настоящему изобретению можно получать, модифицируя функциональные группы, представленные в соединении таким образом, чтобы модифицированные соединения расщеплялись до исходного соединения, либо общепринятыми способами, либо in vivo. Предпочтительными являются фармацевтически приемлемые пролекарства в виде сложных эфиров,которые гидролизуются in vivo, и которые образованы из таких соединений формулы (I), которые имеют гидроксигруппу или карбоксильную группу. Гидролизуемый in vivo сложный эфир представляет собой сложный эфир, который гидролизуется в организме человека или животного с получением исходной кислоты или спирта. Подходящие фармацевтически приемлемые сложные эфиры в случае карбокси включают C1-6 алкоксиметиловые сложные эфиры, например, метоксиметиловый, C1-6 алканоилоксиметиловые сложные эфиры, например, пивалоилоксиметиловый, фталидиловые сложные эфиры, C3-8 циклоалкоксикарбонилоксиС 1-6 алкиловые сложные эфиры, например, 1-циклогексилкарбонилоксиэтиловый; 1,3 диоксолен-2-онилметиловые сложные эфиры, например, 5-метил-1,3-диоксолен-2-онилметиловый; и C1-6 алкоксикарбонилоксиэтиловые сложные эфиры, например, 1-метоксикарбонилоксиэтиловый, которые могут быть образованы на любой карбоксигруппе соединений по настоящему изобретению. Гидролизуемый in vivo сложный эфир соединения формулы (I), содержащего гидроксигруппу,включает неорганические сложные эфиры, такие как фосфатные сложные эфиры и -ацилоксиалкиловые простые эфиры и сходные с ними соединения, которые в результате гидролиза сложного эфира in vivo расщепляются с получением исходной гидроксигруппы. Примеры -ацилоксиалкиловых простых эфиров включают ацетоксиметокси и 2,2-диметилпропионилоксиметокси. Предпочтительные для выбора гидролизуемые in vivo образующие сложный эфир группы включают алканоил, бензоил, фенилацетил и замещенный бензоил и фенилацетил, алкоксикарбонил (с получением алкилкарбонатных сложных эфиров), диалкилкарбамоил и N-(диалкиламиноэтил)-N-алкилкарбамоил (с получением карбаматов), диалкиламиноацетил и карбоксиацетил. Примеры заместителей бензоила включают морфолино и пиперазино, связанные между атомом азота кольца и положением 3 или 4 бензоильного кольца через группу метилена. Для терапевтического применения соли соединений формулы (I) представляют собой соли, в которых противоион является фармацевтически приемлемым. Однако соли кислот и оснований, которые не являются фармацевтически приемлемыми, также можно применять, например, для получения или очистки фармацевтически приемлемого соединения. Все соли, как фармацевтически приемлемые, так и не фармацевтически приемлемые, включены в объем настоящего изобретения. Подразумевают, что фармацевтически приемлемые кислотно- и основно-аддитивные соли, как указано выше в настоящем описании, включают терапевтически активные нетоксичные кислотно- и основно-аддитивные солевые формы, которые могут образовывать соединения формулы (I). Фармацевтически приемлемые кислотно-аддитивные соли удобно получать обработкой формы основания соответствующей кислотой. Соответствующие кислоты включают, например, неорганические кислоты, такие как галогеноводороды, например, хлористо-водородная или бромисто-водородная кислота, серная, азотная,фосфорная и т.п. кислоты; или органические кислоты, например, такие как уксусная, пропионовая, гидроксиуксусная, молочная, пировиноградная, щавелевая (т.е. этандиовая), малоновая, янтарная (т.е. бутандиовая кислота), малеиновая, фумаровая, яблочная (т.е. гидроксибутандиовая кислота), винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламовая,салициловая, п-аминосалициловая, памовая и подобные кислоты. Напротив, солевые формы можно преобразовывать в форму свободного основания обработкой соответствующим основанием. Соединения формулы (I), содержащие кислотообразующий протон, также можно преобразовывать-5 014646 в их нетоксичные формы аддитивных солей металлов или аминов обработкой соответствующими органическими и неорганическими основаниями. Подходящие основные солевые формы включают, например, соли аммония, соли щелочных и щелочно-земельных металлов, например, соли лития, натрия, калия, магния, кальция и т.п., соли с органическими основаниями, например, соли с бензатином, N-метилD-глюкамином, гидрабамином, и соли с аминокислотами, например, такими как аргинин, лизин и т.п. Как использовано выше в настоящем описании, термин аддитивная соль также включает сольваты,которые могут образовывать соединения формулы (I), а также их соли. Такие сольваты представляют собой, например, гидраты, алкоголяты и т.п. Как использовано выше в настоящем описании, термин "четвертичный амин" определяет четвертичные соли аммония, которые могут образовывать соединения формулы (I) взаимодействием между основным азотом соединения формулы (I) и соответствующим способствующим образованию четвертичной соли агентом, например, таким как необязательно замещенный алкилгалогенид, арилгалогенид или арилалкилгалогенид, например, метилйодид или бензилйодид. Также можно использовать другие участвующие в реакции вещества с подходящими уходящими группами, такие как алкилтрифторметансульфонаты, алкилметансульфонаты и алкил-п-толуолсульфонаты. Четвертичный амин имеет положительно заряженный азот. Фармацевтически приемлемые противоионы включают хлор, бром, йод, трифторацетат и ацетат. Выбранный противоион можно вводить с использованием ионообменных смол. Подразумевают, что формы N-оксидов представленных соединений включают соединения формулы (I), где один или несколько атомов азота окислены до так называемого N-оксида. Понятно, что соединения формулы (I) могут обладать свойствами связывания металла, хелатирования, образования комплексов, и, таким образом, они могут существовать в виде комплексов с металлами или хелатов металлов. Подразумевают, что такие производные соединений формулы (I) с металлом включены в объем настоящего изобретения. Некоторые соединения формулы (I) также могут существовать в их таутомерной форме. Несмотря на то, что такие формы явно не указаны в представленной выше формуле, подразумевают, что они включены в объем настоящего изобретения. Как указано выше, соединения формулы (I) обладают несколькими центрами асимметрии. В целях более эффективного обозначения каждого из таких центров асимметрии, будут использовать систему нумерации, как указано в следующей структурной формуле. Центры асимметрии находятся в положениях 1, 4 и 6 макроцикла, а также в атоме углерода 3' в группе пирролидина, или остатка пролина, имеющего группу -L-R1. Каждый из таких центров асимметрии может находиться в их R или S конфигурации. Стереохимия в положении 1 предпочтительно соответствует стереохимии конфигурации Lаминокислот, т.е. конфигурации L-пролина. Соединения формулы (I) включают циклопропильную группу, как представлено в структурном фрагменте ниже: где С 7 представляет собой углерод в положении 7 и атомы углерода в положении 4 и 6 представляют собой асимметричные атомы углерода кольца циклопропана. Независимо от других возможных центров асимметрии в других сегментах соединений по настоящему изобретению, наличие двух центров асимметрии означает, что соединения могут существовать в качестве смесей диастереомеров, таких как диастереомеры соединений формулы (I), в которых атом углерода в положении 7 обладает син-конфигурацией относительно либо карбонила, либо амида, как представлено ниже. Один вариант осуществления относится к соединениям формулы (I), где атом углерода в положении 7 обладает син-конфигурацией относительно карбонила. Другой вариант осуществления относится к соединениям формулы (I), где конфигурация у атома углерода в положении 4 представляет собой R. Конкретная подгруппа соединений формулы (I) представляет собой соединения, где атом углерода в положении 7 обладает син-конфигурацией относительно карбонила и где конфигурация у атома углерода в положении 4 представляет собой R. Соединения формулы (I) также включают остаток пролина. Предпочтительными являются соединения формулы (I), где заместитель в положении 1 (или 5') и заместитель -L-R1 (в положении 3') находятся в транс-конфигурации. Особый интерес представляют собой соединения формулы (I), где положение 1 обладает конфигурацией, соответствующей L-пролину, и заместитель -L-R1 находится в трансконфигурации относительно положения 1. Предпочтительно соединения формулы (I) обладают стереохимией, как указано в структуре формулы (I-а), как изображено ниже: Один вариант осуществления настоящего изобретения относится к соединениям формулы (I) или формулы (I-а) или к любой подгруппе соединений формулы (I), где применяются одно или несколько из следующих условий:(a) R3 и R4 оба представляют собой водород;(c) двойная связь находится между атомами углерода 7 и 8. Конкретная подгруппа соединений формулы (I) представляет собой соединения, соответствующие следующей структурной формуле: Среди соединений формулы (I-b), особый интерес представляют соединения, имеющие стереохимическую конфигурацию соединений формулы (I-а). Двойная связь между атомами углерода 7 и 8 в соединениях формулы (I) или в любой подгруппе соединений формулы (I) может находиться в цис- или транс-конфигурации. Предпочтительно двойная связь между атомами углерода 7 и 8 находится в цис-конфигурации, как изображено в формуле (I-b). Другая конкретная подгруппа соединений формулы (I) представляет собой соединения, соответствующие следующей структурной формуле:-7 014646 Среди соединений формулы (I-c) особый интерес представляют соединения, имеющие стереохимическую конфигурацию соединений формулы (I-a). В (I-a), (I-b) и (I-c), когда это применимо, L, n, R1, R2, R3 и R4 являются такими, как описано в определениях соединений формулы (I) или любой из подгрупп соединений формулы (I), описанных в настоящем описании. Следует понимать, что определенные выше подгруппы соединений формулы (I-a), (I-b) или (I-c), а также любой другой подгруппы, определенной в настоящем описании, подразумевают также включениеN-оксидов, аддитивных солей и стереохимически изомерных форм таких соединений. Когда n равен 4, группа -CH2-, заключенная в скобки с показателем "n", соответствует бутандиилу в соединениях формулы (I) или в любой подгруппе соединений формулы (I). Когда n равен 5, группа-CH2-, заключенная в скобки с показателем "n", соответствует пентандиилу в соединениях формулы (I) или в любой подгруппе соединений формулы (I). Когда n равен 6, группа -СН 2-, заключенная в скобки с показателем "n", соответствует гександиилу в соединениях формулы (I) или в любой подгруппе соединений формулы (I). Конкретные подгруппы соединений формулы (I) представляют собой такие соединения, где n равен 4 или 5. Варианты осуществления настоящего изобретения представляют собой соединения формулы (I) или любую из подгрупп соединений формулы (I), где L представляет собой -O-, и R1 представляет собой хинолинил (в частности, хинолин-4-ил), изохинолинил (в частности, изохинолин-1-ил), каждый из которых независимо необязательно моно-, ди- или тризамещен C1-6 алкилом, С 1-6 алкокси, галогеном, -NR5aR5b,арилом, Het; где арил или Het, каждый независимо, необязательно замещен галогеном, C1-6 алкилом, С 1-6 алкокси, амино, моно- или диС 1-6 алкиламино. Варианты осуществления настоящего изобретения представляют собой соединения формулы (I) или любую подгруппу соединений формулы (I), где R1 представляет собой хинолинил, необязательно замещенный 1, 2 или 3 заместителями, выбранными из заместителей, указанных в качестве возможных заместителей бициклической кольцевой систем R1, как описано в определениях соединений формулы (I) или любой подгруппы соединений формулы (I). Конкретные варианты осуществления настоящего изобретения представляют собой такие соединения формулы (I) или любую подгруппу соединений формулы (I), где R1 представляет собой (d-4) радикал формулы где в радикалах (d-4)-(d-5), а также в (d-4-a): каждый из R1b, R1b', R1e, R1f независимо представляет собой любой из заместителей, выбранных из заместителей, приведенных в качестве возможных заместителей в бициклической кольцевой системахR1, как описано в определениях соединений формулы (I) или любой подгруппы соединений формулы (I). Конкретный вариант осуществления настоящего изобретения представляют собой такие соединения формулы (I) или любую подгруппу соединений формулы (I), где R1 представляет собой (d-5-a) радикал формулы-8 014646 Варианты осуществления настоящего изобретения представляют собой соединения формулы (I) или любую подгруппу соединений формулы (I), где(b) R2 представляет собой -NHS(=O)2R8, где R8 представляет собой циклопропил или метилциклопропил. Варианты осуществления настоящего изобретения представляют собой соединения формулы (I) или любую подгруппу соединений формулы (I), где R3 и R4 оба представляют собой водород. Варианты осуществления настоящего изобретения представляют собой соединения формулы (I) или любую подгруппу соединений формулы (I), где n равен 4 или 5. Варианты осуществления настоящего изобретения представляют собой соединения формулы (I) или любую подгруппу соединений формулы (I), где R1 представляет собой (е) изохинолинил (в частности, 1-изохинолинил), необязательно замещенный 1, 2 или 3 заместителями, выбранными из заместителей, приведенных в качестве возможных заместителей бициклической кольцевой систем R1, как описано в определениях соединений формулы (I) или любой подгруппы соединений формулы (I). Конкретные варианты осуществления представляет собой такие варианты осуществления, где R1 представляет собой (е-1) радикал формулы где R9a, R9b, R9c независимо друг от друга представляют собой любой из заместителей, выбранных из заместителей, приведенных в качестве возможных заместителей бициклической кольцевых систем R1,как описано в определениях соединений формулы (I) или любой подгруппы соединений формулы (I); в частности,R9a может представлять собой арил или Het, каждый из которых необязательно замещен любым из радикалов, приведенных в качестве заместителей арила или Het, как описано в определениях соединений формулы (I) или любой подгруппы соединений формулы (I) (включая количество заместителей); конкретно, указанный арил или Het может быть замещен 1, 2 или 3 (в частности, одним) C1-6 алкилом, амино,необязательно моно- или дизамещенным С 1-6 алкилом;R9b может представлять собой С 1-6 алкил, арил, Het, галоген (например, бром, хлор или фтор);R9c может представлять собой С 1-6 алкокси. В частности, R9a в изохинолинильном радикале, указанном как (е-1) или (1-e-а), включает фенил,пиридил, тиазолил, оксазолил или пиразолил, каждый из которых необязательно замещен С 1-6 алкилом(например, метилом, этилом, изопропилом, трет-бутилом), амино или C1-6 алкиламино. Варианты осуществления настоящего изобретения представляют собой соединения формулы (I) или любую подгруппу соединений формулы (I), где R1 представляет собой где R9a является таким, как определено для любой из групп или подгрупп соединений формулы (I); и R представляет собой водород или галоген. Следующие предпочтительные варианты осуществления настоящего изобретения представляют собой соединения формулы (I) или любую подгруппу соединений формулы (I), где R1 представляет собой 9b где R9a представляет собой метокси, этокси или пропокси; и R9b представляет собой водород, фтор,бром, хлор, йод, метил, этил или пропил. Следующие варианты осуществления настоящего изобретения представляют собой соединения формулы (I) или любую подгруппу соединений формулы (I), где R1 представляет собой где R9b представляет собой водород или галоген. Предпочтительными среди подгрупп соединений вариантов осуществления, где R1 представляет собой радикал (d-4)-(d-5), (е-1)-(е-3), как указано выше, являются такие соединения в данных подгруппах, где L представляет собой -О-. Варианты осуществления настоящего изобретения представляют собой соединения формулы (I) или любую подгруппу соединений формулы (I), где(b) R2 представляет собой -NHS(=O)2R8, в частности, где R8 представляет собой С 1-6 алкил, C3 С 7 циклоалкил, необязательно замещенный C1-6 алкилом, например, где R8 представляет собой метил,циклопропил или метилциклопропил. Следующие варианты осуществления настоящего изобретения представляют собой соединения формулы (I) или любую подгруппу соединений формулы (I), где(a) R3 и R4 оба представляют собой водород;(b) R3 и R4 оба представляют собой C1-6 алкил. Соединения формулы (I), имеющие в макроцикле двойную или одинарную связь (т.е. между атомами 7 и 8), соответствующие формуле (I-d) или (I-e), ниже, состоят из трех структурных элементов Р 1, Р 2,P3. Структурный элемент Р 1 дополнительно содержит Р 1'-конец. В связывание структурных элементов Р 1 с Р 2, P3 с Р 2 и необязательно Р 1 с Р 1' вовлечено образование амидной связи. Связывание структурных элементов Р 1, Р 1', Р 2 и P3 с получением соединений (I-d) или (I-c), можно проводить в любой приведенной последовательности. Одна из таких стадий включает циклизацию, посредством которой образуется макроцикл. Соединения формулы (I-e) можно получать из соединения формулы (I-b) восстановлением двойной связи. Подразумевают, что способы синтеза, описанные ниже в настоящем описании, применимы в равной степени для рацематов, стереохимически чистых промежуточных соединений или конечных продуктов, а также для любых смесей стереоизомеров. Рацематы или стереохимические смеси можно разделять на стереоизомерные формы на любой стадии в ходе синтеза. В одном варианте осуществления промежуточные соединения и конечные продукты обладают стереохимией, описанной выше в соединениях формулы (I-а). В одном варианте осуществления соединения (I-d) получают первоначальным образованием амидных связей и последующим образованием двойной связи между P3 и Р 1 с одновременной циклизацией в макроцикл. В предпочтительном варианте осуществления соединения (I), где связь между С 7 и С 8 представляет собой двойную связь, которые представляют собой соединения формулы (I-a), как определено выше,можно получать, как представлено на следующей схеме реакций: Макроцикл можно образовывать через реакцию метатезиса олефинов в присутствии подходящего катализатора на основе металла, например, такого как катализатор на основе Ru, описанный Miller, S.J.,- 10014646Blackwell, H.E., Grubbs, R.H. J. Am. Chem. Soc. 118, (1996), 9606-9614; Kingsbury, J.S., Harrity, J.P.A., Bonitatebus, P.J., Hoveyda, A.H., J. Am. Chem. Soc. 121, (1999), 791-799; и Huang et al., J. Am. Chem. Soc. 121,(1999), 2674-2678; например, катализатор Hoveyda-Grubbs. Можно использовать стабильные на воздухе катализаторы рутения, такие как бис(трициклогексилфосфин)-3-фенил-1 Н-инден-1-илиденрутенийхлорид (Neolyst M1) или бис(трициклогексилфосфин)[(фенилтио)метилен]рутений(IV)дихлорид. Другие катализаторы, которые можно использовать, представляют собой катализаторы Grubbs, т.е. бензилиден-бис(трициклогексилфосфин)дихлоррутений и (1,3 бис-(2,4,6-триметилфенил)-2-имидазолидинилиден)дихлор(фенилметилен)-(трициклогексилфосфин)рутений, соответственно. Особый интерес представляют собой катализаторы Hoveyda-Grubbs первого и второго поколения, которые представляют собой дихлор(о-изопропоксифенилметилен)(трициклогексилфосфин)рутений(II) и 1,3-бис-(2,4,6-триметилфенил)-2-(имидазолидинилиден)дихлор(о-изопропоксифенилметилен)рутений, соответственно. Также для данной реакции можно использовать другие катализаторы, содержащие другие переходные металлы, такие как Мо. Реакции метатезиса можно проводить в подходящем растворителе, например, таком как простые эфиры, например, ТГФ, диоксан; галогенированные углеводороды, например, дихлорметан, CHCl3, 1,2 дихлорэтан и т.п. В предпочтительном варианте осуществления реакцию метатезиса проводят в толуоле. Указанные реакции проводят при повышенных температурах в атмосфере азота. Соединения формулы (I), где связь между С 7 и С 8 в макроцикле представляет собой одинарную связь, т.е. соединения формулы (I-e), можно получать из соединений формулы (I-d) восстановлением двойной связи С 7-С 8 в соединениях формулы (I-a). Восстановление можно проводить каталитической гидрогенизацией водородом в присутствии катализатора на основе благородного металла, например, такого как Pt, Pd, Rh, Ru или никель Ренея. Интерес представляет Rh на оксиде алюминия. Реакцию гидрогенизации предпочтительно проводят в растворителе, например, таком как спирт, такой как метанол,этанол, или простой эфир, такой как ТГФ, или их смеси. Также в растворители или смеси растворителей можно добавлять воду. Группу R2 можно связывать со структурным элементом Р 1 на любой стадии синтеза, т.е. до или после циклизации, или до или после циклизации и восстановления, как описано в настоящем описании выше. Соединения формулы (I), где R2 представляет собой -NR5aR5b, -NHR5c, -NHSOpNR5aR5b, -NR5aSOpR8,такие группы вместе представлены -NR2-aR2-b, где указанные соединения представленные формулой (I-d1), можно получать сочетанием группы R2 с Р 1 посредством образования амидной связи между группами. Аналогично, соединения формулы (I), где R2 представляет собой -OR6, т.е. соединения (I-d-2), можно получать присоединением группы R2 к Р 1 посредством образования сложноэфирной связи. В одном варианте осуществления группы -NR2-aR2-b или -OR6 вводят на последней стадии синтеза соединений (I),как представлено на следующих схемах реакций, где G представляет собой группу: Промежуточное соединение (III) можно сочетать с амином (IV-a) реакцией образования амида, такой как любая методика образования амидной связи, описанная в настоящем описании ниже. В частности, соединение (III) можно обрабатывать агентом сочетания, например, N,N'-карбонилдиимидазолом(коммерчески доступным как РуВОР), в растворителе, таком как простой эфир, например, ТГФ, или галогенированный углеводород, например, дихлорметан, хлороформ, дихлорэтан, с последующим взаимодействием с требуемым соединением (IV-a), предпочтительно после проведения реакции соединения(III) с агентом сочетания. Взаимодействие соединения (III) с соединением (IV-a) предпочтительно проводят в присутствии основания, например, триалкиламина, такого как триэтиламин или диизопропилэтиламин, или 1,8-диазабицикло[5,4,0]ундец-7-ен (DBU). Промежуточное соединение (III) также можно- 11014646 преобразовывать в активированную форму, например, активированную форму общей формулы G-CO-Z,где Z представляет собой галоген или остаток активного сложного эфира, например, Z представляет собой группу арилокси, такую как фенокси, п-нитрофенокси, пентафторфенокси, трихлорфенокси, пентахлорфенокси и т.п.; или Z может представлять собой остаток смешанного ангидрида. В одном варианте осуществления G-CO-Z представляет собой хлорангидрид (G-CO-Cl) или смешанный ангидрид кислоты(G-CO-O-CO-R или G-CO-O-CO-OR, в последнем случае R представляет собой, например, С 1-4 алкил,такой как метил, этил, пропил, изопропил, бутил, трет-бутил, изобутил или бензил). Активированную форму G-CO-Z подвергают взаимодействию с требуемым соединением (IV-а). Активация карбоновой кислоты в соединении (III), как описано в указанных выше реакциях, может привести к реакции внутренней циклизации до промежуточного соединения азалактона формулы где L, R1, R3, R4, n являются такими, как описано выше, и где стереогенные центры могут обладать стереохимической конфигурацией, как определено выше, например, как в соединении (I-а) или (I-b). Промежуточные соединения (III-а) можно выделять из реакционной смеси с использованием общепринятых методов, и затем проводить взаимодействие выделенного промежуточного соединения (III-a) с соединением (IV-a) или, дополнительно, можно проводить взаимодействие реакционной смеси, содержащей соединение (III-a) с соединением (IV-a) без выделения соединения (III-a). В одном варианте осуществления, где реакцию с агентом сочетания проводят в несмешивающемся с водой растворителе, реакционную смесь, содержащую соединение (III-a), можно промывать водой или слегка щелочной водой в целях удаления всех растворимых в воде побочных продуктов. Затем можно проводить взаимодействие полученного таким образом промытого раствора с соединением (IV-a) без дополнительных стадий очистки. Выделение промежуточных соединений (III-a), с другой стороны, может обеспечить определенные преимущества в том, что после необязательной дополнительной очистки можно проводить реакцию выделенного продукта с соединением (IV-a), получая в результате меньшее количество побочных продуктов и упрощая контроль за реакцией. Промежуточное соединение (III) можно подвергнуть сочетанию со спиртом (IV-b) реакцией образования сложного эфира. Например, соединение (III) и соединение (IV-b) подвергают взаимодействию при одновременном удалении воды либо физически, например, при азеотропном удалении воды, или химически с использованием дегидратирующего агента. Промежуточное соединение (III) также можно преобразовывать в активированную форму G-CO-Z, такую как активированные формы, указанные выше, и затем проводить реакцию со спиртом (IV-b). Реакции образования сложных эфиров предпочтительно проводят в присутствии основания, такого как карбонат щелочного металла или гидрокарбонат, например, гидрокарбонат натрия или калия, или третичный амин, такой как амины, приведенные в настоящем описании в отношении реакций образования амида, в частности, триалкиламин, например, триэтиламин. Растворители, которые можно использовать в реакциях образования сложного эфира, включают простые эфиры, такие как ТГФ; галогенированные углеводороды, такие как дихлорметан, CHCl3; углеводороды,такие как толуол; полярные апротонные растворители, такие как ДМФА, ДМСО, DMA; и подобные растворители. Соединения формулы (I), где R2 представляет собой водород, т.е. соединения (I-d-4), можно получать из сложных эфиров (I-d-2-а), которые представляют собой промежуточные соединения формулы (Id-2), где R6 представляет собой С 1-4 алкил, реакцией восстановления до соответствующих спиртов (I-d-3),например, с комплексным гидридом металла, таким как LiAlH4 или NaBH4, с последующим окислением мягким окислителем, например, MnO2, с получением, таким образрм, промежуточных соединений (I-d4). Соединения формулы (I) также можно получать взаимодействием промежуточного соединения (V) с промежуточными соединениями (VI-а)-(VI-е), как показано на представленной ниже схеме реакций, где различные радикалы имеют значения, указанные выше и С 1-4Alk представляет собой С 1-4 алкандиил:X в соединении (VI-a) представляет собой гидроксигруппу или уходящую группу, такую как галогенид, например, бромид или хлорид, или арилсульфонильную группу, например, мезилат, трифлат или тозилат и т.п. В одном варианте осуществления взаимодействие соединения (V) с соединением (VI-a) представляет собой реакцию O-арилирования, и X представляет собой уходящую группу. Данную реакцию можно проводить в соответствии со способами, описанными Е.М. Smith et al. (J. Med. Chem. (1988), 31, 875-885). В частности, реакцию проводят в присутствии основания, предпочтительно сильного основания, в реакционно-инертном растворителе, например, в одном из растворителей, приведенных в отношении образования амидной связи. В конкретном варианте осуществления взаимодействие исходного вещества (V) с соединением (VIа) проводят в присутствии основания, которое является достаточно сильным для удаления водорода из гидроксигруппы, например, гидрида щелочного или щелочно-земельного металла, такого как LiH или гидрид натрия, или алкоксида щелочного металла, такого как метоксид или этоксид натрия или калия,трет-бутоксид калия, в реакционно-инертном растворителе, таком как биполярный апротонный растворитель, например, DMA, ДМФА и т.п. Полученный в результате алкоголят подвергают взаимодействию с арилирующим агентом (VII), где X представляет собой подходящую уходящую группу, как указано выше. Преобразование соединения (V) в соединение (I) с использованием такого типа реакции Oарилирования не изменяет стереохимической конфигурации углерода, имеющего гидроксигруппу или группу -L-R1. Альтернативно, взаимодействие соединения (V) с соединением (VI-а) также можно осуществлять по реакции Митсунобу (Mitsunobu, 1981, Synthesis, January, 1-28; Rano et al., Tetrahedron Lett., 1995, 36,22, 3779-3792; Krchnak et al., Tetrahedron Lett., 1995, 36, 5, 6193-6196; Richter et al., Tetrahedron Lett., 1994,35, 27, 4705-4706). Данная реакция включает обработку промежуточного соединения (V) соединением(VI-а), где X представляет собой гидроксил, в присутствии трифенилфосфина и активирующего вещества, такого как диалкилазокарбоксилат, например, диэтилазодикарбоксилат (DEAD), диизопропилазодикарбоксилат (DIAD) или подобные. Реакция Митсунобу изменяет стереохимическую конфигурацию углерода, имеющего гидроксигруппу или группу -L-R1. Соединения формулы (I), где L представляет собой группу уретана (L представляет собой -OС(=O)-NR5a-), можно получать взаимодействием соединения (V) с соединением (VI-b) или (VI-c) в присутствии вещества для введения карбонила. Оно включает реагенты, такие как фосген или производные фосгена, такие как карбонилдиимидазол (CDI). В одном варианте осуществления соединение (V) подвергают взаимодействию с фосгеном, получая, таким образом, соответствующий хлорформиат, который при реакции с амином, R1-NH2 или H-NR1R5a, приводит к карбаматам, т.е. L представляет собой -OC(=O)NHили -ОС(=O)NR5a-. Взаимодействие хлорформиата с амином предпочтительно проводят с использованием таких растворителей и оснований, которые приведены в отношении образования амидной связи, описанного в настоящем описании ниже, в частности, таких, которые приведены в связи с взаимодействием соединения (III) с соединением (IV-a). Конкретные основания представляют собой карбонаты щелочных металлов или гидрокарбонаты, например, гидрокарбонат натрия или калия, или третичные амины, такие как триалкиламин, например, триэтиламин. Реакция спирта (V) с кислотой (VI-d) приводит к сложным эфирам, т.е. L представляет собой -OС(=O)-. Данную реакцию образования сложного эфира можно проводить с использованием способов,аналогичных способам, описанной для реакции соединения (III) и соединения (IV-b). В частности, кислоту (VI-d) преобразуют в соответствующее вещество для ацилирования, например, ангидрид кислоты или галоидангидрид кислоты, например, хлорангидрид (R1-C(=O)Cl). Соединения формулы (I), где L представляет собой -O-С 1-4 алкандиил-, можно получать реакцией образования простого эфира с соединением (VI-е). Образование простого эфира можно проводить азеотропным удалением воды или химически, например, реакцией Вильямсона. Альтернативно, в целях получения соединений формулы (I), сначала образуют амидную связь между структурными элементами Р 2 и Р 1, и затем присоединяют структурный элемент P3 к группе Р 1 в Р 1 Р 2, с последующим образованием амидной связи между P3 и группой Р 2 в группе Р 2-Р 1-P3 с одновременным замыканием кольца. Кроме того, Р 1'-конец можно присоединять к структурному элементу Р 1 на любой стадии синтеза соединений формулы (I), например, до или после связывания структурных элементов Р 2 и Р 1; до или после связывания структурного элемента P3 с Р 1; или до или после связывания- 13014646 структурных элементов P3 и Р 2 и одновременного замыкания кольца. Другая альтернативная методика синтеза представляет собой образование амидной связи между структурными элементами Р 2 и P3, с последующим присоединением структурного элемента Р 1 к P3, и,наконец, с образованием амидной связи между Р 1 и Р 2 с одновременным замыканием кольца. Кроме того, Р 1'-конец можно присоединять к структурному элементу Р 1 на любой стадии синтеза соединений формулы (I), т.е., в данном случае, до или после связывания структурных элементов Р 2 и P3; до или после связывания структурных элементов Р 1 и P3; до или после связывания Р 1 и Р 2 с одновременным замыканием кольца. Структурные элементы Р 1 и P3 можно связывать посредством образования двойной связи между атомами углерода 7 и 8, если необходимо, с последующим восстановлением двойной связи С 7-С 8. Образованный таким образом блок Р 1-P3 можно присоединять к структурному элементу Р 2 и затем посредством образования амидных связей замыкать кольцо. В предпочтительном варианте осуществления структурный элемент Р 1-P3 не восстанавливают, а непосредственно присоединяют к Р 2 и образуют кольцо с получением соединений (1-1). Структурные элементы Р 1 и P3 в любом из предшествующих подходов можно связывать посредством образования двойной связи, например, реакцией метатезиса олефинов, описанной в настоящем описании ниже, или реакцией типа Виттига. Отдельные структурные элементы сначала можно получать, и затем связывать друг с другом, или альтернативно, предшественники структурных элементов можно сочетать друг с другом и модифицировать на последующей стадии до требуемой молекулярной композиции. Для того, чтобы избежать побочных реакций, функциональные группы каждого структурного элемента могут быть защищены. Амидные связи можно образовывать с использованием стандартных способов, таких как способы,используемые для связывания аминокислоты в пептидном синтезе. Он включает связывание карбоксильной группы одного участвующего во взаимодействии вещества с аминогруппой другого участвующего во взаимодействии вещества при удалении воды с образованием соединяющей амидной связи. Образование амидной связи можно проводить взаимодействием исходных веществ в присутствии агента сочетания или преобразованием карбоксильной функциональной группы в активную форму, такую как активированный сложный эфир, смешанный ангидрид или хлорангидрид или бромангидрид карбоновой кислоты. Общее описание таких реакций сочетания и реагентов, используемых в них, можно найти в основных пособиях по химии пептидов, например, М. Bodanszky, "Peptide Chemistry", 2nd rev. ed., Springer-Verlag,Berlin, Germany, (1993). Примеры реакций сочетания с образованием амидной связи включают азидный способ, способ со смешанным ангидридом угольной-карбоновой кислоты (изобутилхлорформиатом), способ с карбодиимидом (дициклогексилкарбодиимидом, диизопропилкарбодиимидом или растворимым в воде карбодиимидом, таким как N-этил-N'-[(3-диметиламино)пропил]карбодиимид), способ с активированным сложным эфиром (п-нитрофенильным сложным эфиром, N-гидроксиянтарным имидоэфиром), способ с реагентом Вудворда К, способ с 1,1-карбонилдиимидазолом (CDI или N,N'-карбонилдиимидазолом), способы с реагентами на основе фосфора или окислительно-восстановительные способы. Некоторые из указанных способов можно усилить добавлением подходящих катализаторов, например, добавлением 1 гидроксибензотриазола, DBU (1,8-диазабицикло[5,4,0]ундец-7-ена) или 4-DMAP в способе с карбодиимидом. Следующими агентами сочетания являются гексафторфосфат (бензотриазол-1-илокси)трис(диметиламино)фосфония либо в чистом виде, либо в присутствии 1-гидроксибензотриазола или 4DMAP; или тетрафторборат 2-(1 Н-бензотриазол-1-ил)-N,N,N',N'-тетраметилурония, или гексафторфосфат О-(7-азабензотриазол-1-ил)-N,N,N',N'-тетраметилурония. Реакции сочетания можно проводить или в растворе (жидкая фаза), или в твердой фазе. Предпочтительно образование амидной связи проводят с использованием N-этилоксикарбонил-2 этилокси-1,2-дигидрохинолина (EEDQ) или N-изобутилоксикарбонил-2-изобутилокси-1,2-дигидрохинолина (IIDQ). В отличие от классических способов с ангидридами, для EEDQ и IIDQ не требуется ни основания, ни низких температур реакции. Как правило, способ включает взаимодействие эквимолярных количеств карбоксильного и аминного компонента в органическом растворителе (можно использовать широкое множество растворителей). Затем добавляют EEDQ или IIDQ в избытке и смеси дают возможность перемешаться при комнатной температуре. Реакции сочетания предпочтительно проводятв инертном растворителе, таком как галогенированные углеводороды, например, дихлорметан, хлороформ, биполярные апротонные растворители, такие как ацетонитрил, диметилформамид, диметилацетамид, ДМСО, НМРТ, простые эфиры, такие как тетрагидрофуран (ТГФ). Во многих случаях, реакции сочетания проводят в присутствии подходящего основания, такого как третичный амин, например, триэтиламин, диизопропилэтиламин (DIPEA), N-метилморфолин, Nметилпирролидин, 4-DMAP или 1,8-диазабицикло[5,4,0]ундец-7-ен (DBU). Температура реакции может варьировать от 0 до 50 С, и время реакции может варьировать от 15 мин до 24 ч. Для того чтобы избежать образования нежелательных связей, функциональные группы в структур- 14014646 ных элементах, которые связаны друг с другом, могут быть защищены. Соответствующие защитные группы, которые можно использовать, приведены, например, в Greene, "Protective Groups in OrganicChemistry", John WileySons, New York (1999) и "The Peptides: Analysis, Synthesis, Biology", Vol. 9, Academic Press, New York (1987). Карбоксильные группы могут быть защищены как сложный эфир, который можно расщеплять с получением карбоновой кислоты. Защитные группы, которые можно использовать, включают 1) алкиловые сложные эфиры, такие как метиловый, триметилсилиловый и трет-бутиловый; 2) арилалкиловые сложные эфиры, такие как бензиловый и замещенный бензиловый; или 3) сложные эфиры, которые можно расщеплять мягким основанием или средствами для мягкого восстановления, такими как трихлорэтиловые и фенациловые сложные эфиры. Аминогруппы могут быть защищены различными N-защитными группами, такими как: 1) ацильные группы, такие как формил, трифторацетил, фталил и п-толуолсульфонил; 2) группы ароматических карбаматов, такие как бензилоксикарбонил (Cbz или Z) и замещенные бензилоксикарбонилы, и 9-флуоренилметилоксикарбонил (Fmoc); 3) группы алифатических карбаматов, такие как трет-бутилоксикарбонил (Boc), этоксикарбонил,диизопропилметоксикарбонил и аллилоксикарбонил; 4) группы циклических алкилкарбаматов, такие как циклопентилоксикарбонил и адамантилоксикарбонил; 5) алкильные группы, такие как трифенилметил, бензил или замещенный бензил, такой как 4 метоксибензил; 6) триалкилсилил, такой как триметилсилил или t.Bu-диметилсилил; и 7) содержащие тиольные группы, такие как фенилтиокарбонил и дитиасукциноил. Представляющими интерес защитными группами амино являются Boc и Fmoc. Предпочтительно аминозащитную группу отщепляют перед следующей стадией сочетания. Удаление N-защитных групп можно проводить в соответствии с известными в данной области способами. Когда используют группу Boc, предпочтительными для выбора способами являются способ с трифторуксусной кислотой, в чистом виде или в дихлорметане, или с HCl в диоксане или в этилацетате. Затем полученную соль аммония нейтрализуют либо до сочетания, либо in situ с помощью основных растворов,таких как водные буферы, или третичные амины в дихлорметане или ацетонитриле, или диметилформамид. Когда используют группу Fmoc, предпочтительными для выбора реагентами являются пиперидин или замещенный пиперидин в диметилформамиде, однако можно использовать вторичный амин. Удаление защитной группы проводят при температуре от 0 С до комнатной температуры, обычно приблизительно 15-25 С или 20-22 С. Другие функциональные группы, которые могут препятствовать реакциям сочетания структурных элементов, также могут быть защищены. Например, гидроксильные группы могут быть защищены в виде бензиловых или замещенных бензиловых простых эфиров, например, 4-метоксибензилового простого эфира, бензоиловых или замещенных бензоиловых сложных эфиров, например, 4-нитробензоилового сложного эфира, или с помощью триалкилсилильных групп (например, триметилсилила или третбутилдиметилсилила). Дополнительные аминогруппы могут быть защищены с помощью защитных групп, которые можно отщеплять селективно. Например, когда в качестве -аминозащитной группы используют Boc, подходящими являются следующие защитные группы боковых цепей: п-толуолсульфонильные (тозильные) группы можно использовать для защиты дополнительных аминогрупп; бензиловые (Bn) простые эфиры можно использовать для защиты гидроксигрупп; и бензиловые сложные эфиры можно использовать для защиты дополнительных карбоксильных групп. Иными словами, когда для защиты -амино выбираютFmoc, обычно подходящими являются защитные группы на основе трет-бутила. Например, Boc можно использовать для дополнительных аминогрупп; трет-бутиловые простые эфиры для гидроксильных групп и трет-бутиловые сложные эфиры для дополнительных карбоксильных групп. Любую защитную группу можно удалить на любой стадии процесса синтеза, однако, предпочтительно, защитные группы любой функциональной группы, не вовлеченной в стадии реакции, удаляют после завершения образования макроцикла. Удаление защитных групп можно проводить любым способом, определяемым выбором защитных групп, хорошо известным специалистам в данной области. Промежуточные соединения формулы (II) можно получать взаимодействием промежуточного соединения (VII) с алкенкарбоновой кислотой или ее производным (VIII), как представлено на следующей схеме реакций. Промежуточное соединение (VII) подвергают взаимодействию с алкенильной кислотой (VIII), используя реакционные методики образования амидной связи, как описано выше. Альтернативно, промежуточные соединения (II) можно получать следующим образом:PG1 представляет собой О-защитную группу, которая может представлять собой любую из групп,приведенных в настоящем описании, и, в частности, она представляет собой бензоильную или замещенную бензоильную группу, такую как 4-нитробензоил. Взаимодействие соединения (VIII) с соединением (IX) приводит к промежуточным соединениям(X). Удаление защитных групп осуществляют, в частности, с использованием приведенных выше условий реакции. Например, когда PG1 представляет собой бензоил или замещенный бензоил, указанную группу удаляют взаимодействием с гидроксидом щелочного металла (LiOH, NaOH, KOH), в частности,когда PG1 представляет собой 4-нитробензоил, с LiOH, в водной среде, содержащей воду и растворимый в воде органический растворитель, такой как алканол (метанол, этанол) и ТГФ. Полученный спирт (XI) подвергают взаимодействию с промежуточными соединениями (VI-а)-(VI-е), как описано выше для взаимодействия соединения (V) с соединением (VI-a)-(VI-е), и данная реакция приводит к промежуточным соединениям (II). Промежуточные соединения формулы (III) можно получать первоначальной циклизацией незамкнутого сложного эфира (XII) в макроциклический сложный эфир (XIII), который, в свою очередь, преобразуют в соответствующую макроциклическую карбоновую кислоту (III) следующим образом:L является таким, как определено выше, и PG2 представляет собой защитную группу карбоксила,например, одну из защитных групп карбоксила, приведенных выше, в частности, С 1-4 алкиловый или бензиловый сложный эфир, например, метиловый, этиловый или трет-бутиловый сложный эфир. Преобразование соединения (X) в соединение (XI) представляет собой реакцию обмена и ее проводят, как описано выше. Группу PG2 удаляют в соответствии со способами, также описанными выше. Когда группа PG1 представляет собой С 1-4 алкиловый сложный эфир, ее удаляют щелочным гидролизом, например, с NaOH или предпочтительно LiOH, в водном растворителе, например, смеси С 1-4 алканол/вода. Бензильную группу можно удалять каталитической гидрогенизацией. В альтернативном способе синтеза промежуточные соединения (III) можно получать следующим образом: Группу PG1 можно удалять с использованием известных в данной области способов, например, в случае метилового или этилового сложных эфиров, обработкой гидроксидом щелочного металла в водной среде, в случае трет-бутиловых сложных эфиров, слабой кислотой, и в случае бензиловых сложных эфиров, сильной кислотой, или каталитической гидрогенизацией. Когда L представляет собой радикал(а), данная последовательность реакций приводит к промежуточным соединениям (III). Также их можно получать удалением L, представляющего собой О-защитную группу, и преобразованием в простой эфир полученного таким образом спирта с помощью промежуточного соединения (VI-а), как описано выше. Сначала промежуточные соединения (XIV) подвергают циклизации до макроциклического сложного эфира (XV), снятие защитных групп у соединения (XV) осуществляют путем удаления группы PG1 с получением соединения (XVI), которое подвергают взаимодействию с промежуточными соединениями(VI-а)-(VI-е) с получением промежуточных соединений (XIII), с последующим удалением защитной группы карбоксила PG2 с получением промежуточных соединений (III). Циклизацию, удаление защитной группы PG1 и PG2 и сочетание с соединениями (VI-а)-(VI-е) можно проводить, как описано выше. Группы R2 можно вводить на любой стадии синтеза, либо в качестве последней стадии, как описано выше, либо ранее, до образования макроцикла. На представленной ниже схеме группа -NR2-aR2-b является такой, как определено выше:L и PG2 являются такими, как определено выше, и L2 представляет собой защитную группу азота(PG, как определено выше) или L2 представляет собой группу такими, как определено выше. Промежуточные соединения (XIX-а) и (XIX-b), где L1 представляет собой группу (b), соответствуют промежуточным соединениям (II), и их можно далее обрабатывать, как описано выше. Сочетание структурных элементов Р 1 и Р 2 Структурные элементы Р 1 и Р 2 сочетают с использованием реакции образования амида в соответствии со способами, описанными выше. Структурный элемент Р 1 может иметь защитную группу карбоксила PG2 (как в (XVI-a) ) или он уже может быть связан с группой Р 1' (как в (XVI-b. L3 представляет собой гидрокси, -OPG1 или группу -L-R1, как указано выше. Когда в какой-либо из представленных ниже схем реакций L3 представляет собой гидрокси, его можно защитить перед каждой стадией с образовани- 17014646 ем группы -OPG1 и, если необходимо, затем снова удалить защитную группу до свободной гидрокси функциональной группы. Аналогично, функциональную гидроксигруппу можно преобразовать в группу В способе по указанной выше схеме циклопропиловую аминокислоту (XXI-а) или (XXI-b) сочетают с функциональной группой кислоты структурного элемента Р 2 с использованием реакции образования амида, такой как стандартные условия сочетания пептидов, описанные выше. Получают промежуточные соединения (XVII) или (XXII). Некоторые из них соответствуют промежуточным соединениям (XIX-а) или (XIX-b) на предыдущей схеме реакций. Удаление защитной группы кислоты в соединении (XVII), с использованием условий, соответствующих используемой защитной группе, с последующим сочетанием с амином HNR2-aR2-b (IV-a) или с HOR6 (IV-b), как описано выше, снова приводит к промежуточным соединениям (XXII), где -COR2 представляют собой амидную или сложноэфирную группы. В одном варианте осуществления L2 представляет собой группу (b) и указанные реакции включают сочетание Р 1 с Р 2-P3, которое приводит к промежуточным соединениям (X) или (II), указанным выше. В другом варианте осуществления L2 представляет собой N-защитную группу PG, которая является такой,как определено выше, и реакция сочетания приводит к промежуточному соединению (XXII-а), из которого можно удалить группу PG с получением промежуточных соединений (XVII-a), которые представляют собой промежуточные соединения (XVII), как описано выше, где L2 представляет собой водород, с использованием условий реакции, также приведенных выше: В одном варианте осуществления PG в данной реакции представляет собой группу ВОС. Когда,кроме того, L представляет собой гидрокси, исходное вещество представляет собой Вос-1 гидроксипролин. В указанных выше схемах, группа L3 может представлять собой группу -О-PG1, которую вводят в исходное вещество (XX), где L3 представляет собой гидрокси. В этом примере PG1 выбирают таким образом, чтобы происходило селективное расщепление по группе PG. Сочетание структурных элементов P3 и Р 2 Структурные элементы P3 и Р 2 связывают с использованием реакции образования амида в соответствии со способами, описанными выше для сочетания соединения (VII) с соединением (VIII). Основной процесс показан на представленной ниже схеме реакций, где L3 является таким, как определено выше, иL4 представляет собой группу -O-PG2, или группу- 18014646 Когда L4 в соединении (XXIII) представляет собой группу -OPG2, PG2 можно удалить и полученную кислоту можно подвергнуть сочетанию с циклопропиловыми аминокислотами (XXI-а) или (XXI-b), с образованием промежуточных соединений (XVII) или (XXII), где L2 представляет собой радикал (b). Структурные элементы Р 1, Р 1', Р 2 и P3, используемые для получения соединений формулы (I),можно получать, начиная с известных в данной области промежуточных соединений. Ряд таких способов синтеза описан более подробно в настоящем описании ниже. Синтез структурных элементов Р 2 Структурные элементы Р 2 содержат группу пирролидина, замещенную группой -L-R1. Группу R1 можно сочетать с кольцом пирролидина на любой подходящей стадии синтеза соединений в соответствии с настоящим изобретением. Один подход представляет собой первоначальное сочетание группы R1 с пирролидиновым кольцом и последовательное добавление других требуемых структурных элементов,т.е. Р 1 (необязательно с Р 1'-концом) и P3, с последующим образованием макроцикла. Другой подход состоит в сочетании структурных элементов Р 2, не имеющих заместителя R1, с каждым из Р 1 и P3, и добавлении группы R1 либо до, либо после образования макроцикла. Структурные элементы Р 2 можно получать при взаимодействии производного гидроксипролина(XXV) с промежуточными соединениями (VI-а)-(VI-e), как описано выше для синтеза (I), начиная с соединения (V). Данная реакция представлена ниже на схеме, где L5 представляет собой гидрокси или группу -OPG2, или L5 может представлять собой группу Р 1, такую как группы (b) и (с), как описано выше, и где дополнительно группы L2 и PG2 являются такими, как указано выше. В одном варианте осуществления L2 представляет собой PG, т.е. N-защитную группу В одном варианте осуществления группа L2 представляет собой группу PG, которая является третбутоксикарбонилом (Boc), L5 представляет собой гидрокси, и исходное вещество (XXV) является коммерчески доступным Вос-гидроксипролином или любой другой его стереоизомерной формой, например,Вос-1-гидроксипролином, в частности, его трансизомером. Когда L5 в соединении (XXVI) представляет собой -OPG2, защитную группу карбоксила можно удалять в соответствии со способами, описанными выше, с образованием производных гидроксипролина(XXVII). В одном варианте осуществления L2 представляет собой Boc, и L5 представляет собой -OPG2,где PG2 является сложным низшим алкиловым эфиром, в частности, метиловым или этиловым сложным эфиром. Гидролиз сложных эфиров до кислоты можно проводить стандартными способами, например,кислотным гидролизом хлористо-водородной кислотой в метаноле или этаноле с гидроксидом щелочного металла, таким как NaOH, в частности, LiOH. Промежуточные соединения (VI-а), (VI-b), (VI-c), (VI-d) и (VI-e) представляют собой известные в данной области соединения или их можно получать в соответствии с известными в данной области способами с использованием известных исходных веществ. Промежуточные соединения (VI-а), которые представляют собой производные хинолина, такие как соединения, где R1 представляет собой радикал (d-1), (d-2), (d-3), (d-4), (d-4-a), (d-5) или (d-5-a), как описано выше, можно получать, как представлено ниже:- 19014646 Ацилирование Фриделя-Крафтса 3-метоксианилина (XXVIII), доступного либо коммерчески, либо с помощью известных в данной области способов, с использованием ацилирующего агента, такого как ацетилхлорид или подобные, в присутствии одной или нескольких кислот Льюиса, таких как трихлорид бора и трихлорид алюминия, в растворителе, таком как дихлорметан, приводит к соединению (XXIX). Сочетание соединения (XXIX) с 4-изопропилтиазол-2-карбоновой кислотой (XXX), предпочтительно в щелочных условиях, таких как пиридин, в присутствии активирующего агента для карбоксилатной группы, например, POCl3, с последующей циклизацией и дегидратацией в щелочных условиях, таких как трет-бутоксид калия в трет-бутаноле, приводит к производному хинолина (VI-a-1). Его можно преобразовать в соединение (VI-a-2), где LG представляет собой уходящую группу, например, взаимодействием соединения (VI-a-1) с галогенирующим агентом, например, фосфорилхлоридом или подобным, или арилсульфонилхлоридом, например, тозилхлоридом. Замещенные анилины (XXVIII) коммерчески доступны или их можно получить из подходящей замещенной бензойной кислоты (XXXII), которую подвергают взаимодействию с дифенилфосфорилазидом при повышенной температуре, и затем обрабатывают С 1-4 алканолом, в частности, трет-бутанолом, с получением С 1-4 алкоксикарбониламинов, таких как соединение (XXXIII). Удаление защитной группы из соединения (XXXIII) приводит к замещенным анилинам (XXVIII). Альтернативно, замещенные анилины (XXVIII) можно получать из соответствующих замещенных нитробензолов восстановлением их элементарным цинком, оловом или железом в присутствии кислоты. В указанном выше синтезе можно использовать множество карбоновых кислот с общей структурой(XXX). Такие кислоты либо коммерчески доступны, либо их можно получать с помощью известных в данной области способов. Пример получения производных 2-(замещенного)аминокарбоксиаминотиазола, следуя методике, описанной Berdikhina et al. in Chem. Heterocycl. Compd. (Engl. Transl.) (1991),427-433, показан на представленной ниже схеме реакций, которая иллюстрирует получение 2-карбокси 4-изопропилтиазола (ХХХ-а): Этилтиооксамат (XXXIV) подвергают взаимодействию с -бромкетоном (XXXV) с получением сложного эфира тиазолилкарбоновой кислоты (XXXVI), который гидролизуют до соответствующей кислоты (ХХХ-а). Этиловый сложный эфир в таких промежуточных соединениях можно заменять другими защитными группами карбоксила PG2, как определено выше. Бромкетон (XXXV) можно получать из 3-метилбутан-2-она (MIK) с помощью силилирующего агента (такого как TMSC1) в присутствии подходящего основания (в частности, LiHMDS) и брома. Промежуточные соединения (XXVIII), имеющие заместитель метокси, где указанные промежуточные соединения соответствуют формуле (XXVIII-a), можно получать, как описано Brown et al. J. Med.Chem. 1989, 32, 807-826, или как показано на представленной ниже схеме. Исходные вещества этилацетилацетат и этоксиметиленмалононитрил, которые являются коммерчески доступными, подвергают взаимодействию в присутствии подходящего основания, такого как этоксид натрия, и растворителя, такого как этанол и т.п. Данная реакция приводит к промежуточному соединению (XXXVI). Его гидролизуют, например, основанием, таким как гидроксид щелочного металла, например, NaOH или LiOH, в подходящем растворителе, таком как этанол/вода, с получением (XXXVII). Декарбоксилирование промежуточного соединения (XXXVII) до промежуточного соединения (XXXVIII) проводят при повышенной температуре до прекращения выделения газа, предпочтительно в присутствии- 20014646 основного растворителя, такого как хинолин. Метилирование промежуточного соединения (XXXVIII), в частности, метилирующим агентом, таким как MeI, в присутствии подходящего основания (например,K2CO3) в подходящем растворителе (таком как ДМФА и т.п.) приводит к соединению (XXXIX). Его подвергают взаимодействию с реагентом Гриньяра, таким как MeMgBr, в присутствии подходящего растворителя (например, ТГФ), с последующим гидролизом, например, водным раствором HCl, с получением промежуточного соединения (XXVIII-а). Синтез дополнительных карбоновых кислот (XXX), в частности, замещенных аминотиазолкарбоноваых кислот (ХХХ-b) представлен ниже: Тиомочевину (XLII) с различными алкильными заместителями R' можно получать взаимодействием соответствующего амина (XL) с трет-бутилизотиоцианатом в присутствии основания, такого как диизопропилэтиламин, в растворителе, таком как дихлорметан, с последующим удалением трет-бутильной группы в кислотных условиях. Последующая конденсация производного тиомочевины (XLII) с 3 бромпировиноградной кислотой приводит к тиазолкарбоновой кислоте (ХХХ-b). Соединения по настоящему изобретению или структурные элементы Р 2, где гетероциклическая группа R1 присоединена через азот кольца непосредственно к кольцу пирролидина, т.е. L представляет собой прямую связь в общей формуле (I), можно получать, например, с использованием реакции замещения, где подходящую уходящую группу на кольце пирролидина заменяют содержащей азот циклической группой. Это можно осуществлять на стадии структурного элемента или после сборки и/или циклизации структурных элементов. В одном способе производное пирролидина (V), (XI), (XVI), (XXV) или любое промежуточное соединение, имеющее группу L3, которая представляет собой гидрокси, подвергают взаимодействию с вводящим уходящую группу реагентом, таким как галогенирующий агент, например, фосфорилхлорид или подобные, или арилсульфонилхлорид, например, с тозилхлоридом. Полученное таким образом промежуточное соединение затем подвергают взаимодействию с гетероциклом,имеющим азот в кольце, замещенный водородом (т.е. N-H). Соединения формулы (I), где L представляет собой прямую связь, и R1 представляет собой кольцевую систему, соединенную с группой пирролидина через атом углерода, можно получать образованием кольца, исходя из гидрокси-соединений. Это можно осуществлять либо на стадии структурного элемента, либо после сборки и/или циклизации структурных элементов. Например, функциональную гидроксигруппу можно преобразовывать в уходящую группу, которая, в свою очередь, замещена цианогруппой. Эту цианогруппу, в свою очередь, можно далее преобразовывать в требуемые гетероциклы. Например,соединения, где производное тетразола присоединяют через атом углерода тетразольного кольца, удобно получать встраиванием тетразольной группы непосредственно в предшественник кольца пирролидина. Это можно осуществлять, например, конденсацией с последующим введением цианогруппы путем взаимодействия с азидным реагентом, таким как азид натрия. Производные триазола также можно встраивать непосредственно в предшественник содержащего азот кольца, например, преобразованием гидроксигруппы предшественника, содержащего азот кольца, в азидную группу с последующим взаимодействием циклоприсоединения 3+2 полученного азида с подходящим производным алкина. Структурно разнообразные тетразолы для применения в указанных выше реакциях введения группы R1 можно получать взаимодействием коммерчески доступных соединений нитрила с азидом натрия. Производные триазола можно получать взаимодействием соединения алкина и триметилсилилазида. Подходящие соединения алкинов либо коммерчески доступны, либо их можно получать, например, в соответствии с реакцией Sonogashira, т.е. взаимодействием первичного алкина, арилгалогенида и триэтиламина в присутствии PdCl2(PPh)3 и CuI, как описано, например, A. Elangovan, Y.-H. Wang, T.-I. Но, Org.Lett., 2003, 5, 1841-1844. Гетероциклический заместитель также можно модифицировать при присоединении к структурному элементу Р 2 либо до, либо после связывания структурного элемента Р 2 с другими структурными элементами. Дополнительные альтернативы для получения соединений, где L представляет собой связь и R1 представляет собой необязательно замещенный гетероцикл, можно найти, например, в WO 2004/072243. Синтез структурных элементов Р 1 Циклопропановая аминокислота, используемая для получения фрагмента Р 1, коммерчески доступна или ее можно получать с использованием известных в данной области способов. Аминовинилциклопропилэтиловый сложный эфир (XXI-а) можно получать, следуя методике, описанной в WO 00/09543, или как показано на представленной ниже схеме, где PG2 представляет собой защитную группу карбоксила, как описано выше: Обработка коммерчески доступного или легко получаемого имина (XLIII) 1,4-дигалобутеном в присутствии основания приводит к соединению (XLIV), которое после гидролиза приводит к циклопропиловой аминокислоте (XXI-а), имеющей аллильный заместитель в син-конформации относительно карбоксильной группы. Разделение энантиомерной смеси (XXI-а) приводит к соединению (XXI-a-1). Разделение проводят с использованием известных в данной области методов, таких как ферментативное разделение; кристаллизация с хиральной кислотой; или химическое преобразование в производное; или посредством хиральной колоночной хроматографии. Промежуточные соединения (XXI-а) или (XXI-a-1) можно подвергнуть сочетанию с образованием соответствующих производных пролина, как описано выше. Введение N-защитной группы PG и удаление PG2 приводит к циклопропильным аминокислотам(XXI-с), которые преобразуют в амиды (XXI-b-1) или сложные эфиры (XXI-b-2), как показано в представленной ниже схеме реакций, где R2-a, R2-b и PG являются такими, как описано выше. Взаимодействие соединения (XXI-c) с амином (IV-a) представляет собой реакцию образования амида. Аналогичное взаимодействие с соединением (IV-b) представляет собой реакцию образования сложного эфира. Обе реакции можно проводить в соответствии с описанными выше способами. Данная реакция приводит к промежуточным соединениям (XXI-d-1) или (XXI-d-2), из которых аминозащитную группу удаляют стандартными способами, такими как способы, описанные выше. Это, в свою очередь,приводит к требуемому промежуточному соединению (XXI-b-1). Исходные вещества (XXI-c) можно получать из промежуточных соединений (XXI-а) первоначальным введением N-защитной группы PG с последующим удалением группы PG2. В частности, реакцию соединения (XXI-c) с соединением (IV-а) проводят путем обработки аминокислоты агентом сочетания, например, N,N'-карбонилдиимидазолом (CDI) или подобным, в растворителе, таком как ТГФ, с последующим взаимодействием с соединением (IV-a) в присутствии основания,такого как 1,8-диазабицикло[5,4,0]ундец-7-ен (DBU). Альтернативно, аминокислоту можно обрабатывать соединением (IV-a) в присутствии основания, такого как диизопропилэтиламин, с последующей обработкой агентом сочетания, таким как гексафторфосфат бензотриазол-1-илокси-трис-пирролидинофосфония (коммерчески доступный как РуВОР), для введения сульфонамидной группы. Промежуточные соединения (XXI-b-1) или (XXI-b-2), в свою очередь, можно подвергнуть сочетанию с соответствующими производными пролина, как описано выше. Синтез структурных элементов P3 Структурные элементы P3 являются коммерчески доступными или их можно получать в соответствии со способами, известными специалисту в данной области. На представленной ниже схеме показано получение структурных элементов P3. Сложный эфир (XLV) можно преобразовать в соответствующую кислоту (IX) гидролизом в присутствии кислоты или основания. R3, R4 и n являются такими, как определено выше. Сочетание соответствующего структурного элемента P3 с группой Р 2-Р 1 или с группой Р 2 отдельно- 22014646 можно проводить посредством образования амидной связи, как описано выше (реакция соединения(XXIII) с соединением (IX. Сочетание структурного элемента P3 с группой Р 1 отдельно (с Р 1'-концом или без него) можно проводить посредством реакции метатезиса олефинов, как описано в настоящем описании выше. Соединения формулы (I) можно преобразовать друг в друга в соответствии с известными в данной области реакциями преобразования функциональных групп. Соединения формулы (I) можно преобразовывать в соответствующие формы N-оксидов в соответствии с известными в данной области способами преобразования трехвалентного азота в его форму Nоксида. Указанную реакцию N-окисления можно, особенно, проводить взаимодействием исходного вещества формулы (I) с подходящим органическим или неорганическим пероксидом. Подходящие неорганические пероксиды включают, например, пероксид водорода, пероксиды щелочных металлов или щелочно-земельных металлов, например пероксид натрия, пероксид калия; подходящие органические пероксиды могут включать пероксикислоты, например, такие как бензолкарбопероксокислота или замещенная галогеном бензолкарбопероксокислота, например 3-хлорбензолкарбопероксокислота, пероксоалкановые кислоты, например пероксоуксусная кислота, алкилгидропероксиды, например третбутилгидропероксид. Подходящие растворители представляют собой, например, воду, низшие спирты,например, этанол и т.п., углеводороды, например толуол, кетоны, например 2-бутанон, галогенированные углеводороды, например дихлорметан, и смеси таких растворителей. Стереохимически чистые изомерные формы соединений формулы (I) можно получать с применением известных в данной области способов. Диастереомеры можно разделять физическими методами, такими как селективная кристаллизация, и хроматографическими методами, например противоточное распределение, жидкостная хроматография и т.п. Соединения формулы (I) можно получать в виде рацемических смесей энантиомеров, которые можно отделять друг от друга в соответствии с известными в данной области методами разделения. Рацемические соединения формулы (I), которые являются достаточно основными или кислыми, можно преобразовать в соответствующие диастереомерные солевые формы взаимодействием с подходящей хиральной кислотой, хиральным основанием, соответственно. Указанные диастереомерные солевые формы затем разделяют, например, селективной или фракционированной кристаллизацией, и энантиомеры выделяют из них с помощью щелочи или кислоты. Альтернативные методы разделения энантиомерных форм соединений формулы (I) включают жидкостную хроматографию, в частности, жидкостную хроматографию с использованием хиральной неподвижной фазы. Указанные стереохимически чистые изомерные формы также можно получать из соответствующих стереохимически чистых изомерных форм подходящих исходных веществ при условии, что реакция происходит стереоспецифически. Предпочтительно, если требуется конкретный стереоизомер, указанное соединение можно синтезировать стереоспецифическими способами получения. В таких способах преимущественно могут использоваться энантиомерно чистые исходные вещества. В следующем аспекте настоящее изобретение относится к фармацевтической композиции, содержащей терапевтически эффективное количество соединения формулы (I), как описано в настоящем описании, или соединение любой подгруппы соединений формулы (I), как описано в настоящем описании, и фармацевтически приемлемый носитель. Терапевтически эффективное количество в данном случае представляет собой количество, достаточное для профилактического воздействия на вирусную инфекцию, для стабилизации или уменьшения вирусной инфекции, и, в частности, вирусной инфекции HCV, у инфицированных субъектов или субъектов, обладающих риском инфицирования. В следующем аспекте настоящее изобретение относится к способу получения фармацевтической композиции, как описано в настоящем описании, который включает однородное смешивание фармацевтически приемлемого носителя с терапевтически эффективным количеством соединения формулы (I), как описано в настоящем описании, или соединения любой подгруппы соединений формулы (I), как описано в настоящем описании. Таким образом, для целей введения соединения по настоящему изобретению или любую их подгруппу можно составлять в различные фармацевтические формы. В качестве подходящих композиций можно назвать все композиции, обычно используемые для системного введения лекарственных средств. Для получения фармацевтических композиций по настоящему изобретению эффективное количество конкретного соединения, необязательно в форме аддитивной соли или комплекса с металлом, в качестве активного ингредиента смешивают в однородную смесь с фармацевтически приемлемым носителем, который может находиться в различных в формах в зависимости от требуемого препарата для введения. Желательно, чтобы фармацевтические композиции были представлены в единичной дозированной форме, в частности, для орального, ректального, подкожного введения или для парентеральной инъекции. Например, для получения композиций в оральной дозированной форме можно использовать любую обычную фармацевтическую среду, например, такую как вода, гликоли, масла, спирты и т.п. в случае оральных жидких препаратов, таких как суспензии, сиропы, эликсиры, эмульсии и растворы; или твердые носители, такие как крахмалы, сахара, каолин, лубриканты, связующие вещества, дезинтегрирующие вещества и т.п. в случае порошков, пилюль, капсул и таблеток. Вследствие простоты введения, таблетки- 23014646 и капсулы представляют собой наиболее предпочтительные оральные единичные дозированные формы,в случае которых обычно используют твердые фармацевтические носители. В случае парентеральных композиций, носитель, как правило, содержит, стерильную воду, составляющую по меньшей мере большую его часть, хотя в него могут быть включены другие ингредиенты, например, для обеспечения растворимости. Например, можно получать инъецируемые растворы, в которых носитель содержит физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Также можно получать инъецируемые суспензии, в случае которых можно использовать подходящие жидкие носители, суспендирующие вещества и т.п. Также рассматривают препараты в твердой форме, которые необходимо превращать, непосредственно перед применением, в препараты в жидкой форме. В композициях, подходящих для чрескожного введения, носитель необязательно содержит усиливающее проникновение вещество и/или подходящее смачивающее вещество, необязательно в комбинации с подходящими добавками любой структуры в небольших пропорциях, которые не оказывают значительных неблагоприятных эффектов на кожу. Соединения по настоящему изобретению также можно вводить посредством оральной ингаляции или инсуффляции с помощью способов и составов, используемых в данной области для введения таким способом. Таким образом, главным образом, соединения по настоящему изобретению можно вводить в легкие в форме раствора, суспензии или сухого порошка, где раствор является предпочтительным. Для введения представленных соединений пригодна любая система, сконструированная для доставки растворов, суспензий или сухих порошков посредством оральной ингаляции или инсуффляции. Таким образом, настоящее изобретение также относится к фармацевтической композиции, адаптированной для введения посредством ингаляции или инсуффляции через полость рта, содержащей соединение формулы (I) и фармацевтически приемлемый носитель. Соединения по настоящему изобретению можно вводить посредством ингаляции раствора в распыленных или пульверизованных дозах. Особенно предпочтительным является составление приведенных выше фармацевтических композиций в единичную дозированную форму для простоты введения и единообразия дозирования. Как использовано в настоящем описании, единичная дозированная форма относится к физически дискретным единицам, подходящим в качестве единичных доз, где каждая единица содержит определенное количество активного ингредиента, вычисленное для обеспечения требуемого терапевтического эффекта, совместно с требуемым фармацевтическим носителем. Примерами таких единичных дозированных форм являются таблетки (включая таблетки с насечкой или таблетки, имеющие покрытие), капсулы, пилюли,суппозитории, пакеты с порошком, вафли, инъецируемые растворы или суспензии и т.п., и отдельные их типы. Соединения формулы (I) обладают противовирусными свойствами. Вирусные инфекции и ассоциированные с ними заболевания, подвергаемые лечению с использованием соединений и способов по настоящему изобретению, включают инфекции, вызываемые HCV и другими патогенными флавивирусами,такими как вирусы желтой лихорадки, лихорадки денге (типов 1-4), энцефалита Сент-Луис, японского энцефалита, энцефалита долины Муррей, вирус лихорадки западного Нила и Кунжин. Заболевания, обусловленные HCV, включают прогрессирующий фиброз печени, воспаление и некроз, ведущие к циррозу,заболевание печени последней стадии и НСС; и, в случае других патогенных флавивирусов, заболевания включают желтую лихорадку, лихорадку денге, геморрагическую лихорадку и энцефалит. Более того,некоторые соединения по настоящему изобретению являются активными в отношении мутантных штаммов HCV. Кроме того, некоторые соединения по настоящему изобретению обладают благоприятным фармакокинетическим профилем и обладают привлекательными свойствами с точки зрения биодоступности, включая приемлемое время полужизни, AUC (площадь под кривой) и максимальные значения, и лишены неблагоприятных эффектов, таких как недостаточное быстрое начало действия и задерживание в тканях. Противовирусную активность соединений формулы (I) в отношении HCV тестировали в клеточной системе репликона HCV на основе Lohmann et al. (1999) Science 285:110-113, с дополнительными модификациями, описанными Krieger et al. (2001) Journal of Virology 75: 4614-4624, которые далее проиллюстрированы в разделе "Примеры". Несмотря на то что такая модель не является полной моделью инфекции HCV, она широко распространена в качестве наиболее надежной и эффективной модели автономной репликации РНК HCV, доступной в настоящее время. Соединения, обладающие активностью противHCV на данной клеточной модели, рассматривают в качестве кандидатов для дальнейшей разработки для лечения инфекции HCV у млекопитающих. Следует понимать, что важно отличать соединения, которые специфично препятствуют функционированию HCV, от соединений, которые оказывают цитотоксические или цитостатические эффекты на модели репликона HCV и вследствие этого приводят к снижению РНК HCV или концентрации связанного с ней репортерного фермента. В данной области известны способы анализа для оценки клеточной цитотоксичности на основе, например, активности митохондриальных ферментов с использованием флуорогенных окислительно-восстановительных красителей, таких как резазурин. Более того, существуют способы скрининга с подсчетом клеток, для оценки неселективного ингибирования активности связанного репортерного гена, такого как ген люциферазы светляков. Подходящие типы клеток можно адаптировать посредством стабильной трансфекции люциферазным репор- 24014646 терным геном, экспрессия которого зависит от конститутивно активного промотора гена, и такие клетки можно использовать в качестве способа скрининга с подсчетом для устранения неселективных ингибиторов. Вследствие их противовирусных свойств, в частности, их свойств, направленных против HCV, соединения формулы (I) или любая их подгруппа, их N-оксиды, аддитивные соли, четвертичные амины,комплексы с металлами и стереохимически изомерные формы, являются полезными для лечения индивидуумов, имеющих вирусную инфекцию, в частности, инфекцию HCV, и для профилактики таких инфекций. Как правило, соединения по настоящему изобретению могут быть полезными для лечения теплокровных животных, инфицированных вирусами, в частности, флавивирусами, такими как HCV. Соединения по настоящему изобретению или любую их подгруппу, таким образом, можно использовать в качестве лекарственных средств. Указанное применение в качестве лекарственного средства или способ лечения включает системное введение инфицированным вирусом субъектам или восприимчивым к вирусным инфекциям субъектам количества, эффективного для борьбы с состояниями, обусловленными вирусной инфекцией, в частности, инфекцией HCV. Настоящее изобретение также относится к применению представленных соединений или любой их подгруппы для изготовления лекарственного средства для лечения или профилактики вирусных инфекций, в частности, инфекции HCV. Более того, настоящее изобретение относится к способу лечения теплокровного животного, инфицированного вирусом или обладающего риском инфицирования вирусом, в частности, HCV, где указанный способ включает введение эффективного против вируса количества соединения формулы (I), как описано в настоящем описании, или соединения любой подгруппы соединений формулы (I), как описано в настоящем описании. Также в качестве лекарственного средства в комбинированной терапии можно использовать комбинацию ранее известного соединения против HCV, например, такого как интерферон- (IFN-), пегилированный интерферон- и/или рибавирин, и соединения формулы (I). Термин "комбинированная терапия" относится к продукту, содержащему модулирующее (а) соединение формулы (I), и (b) необязательно другое соединение против HCV, в качестве комбинированного препарата для одновременного, раздельного или последовательного применения при лечении инфекций HCV, в частности, для лечения инфекций HCV. Соединения против HCV включают средства, выбранные из ингибитора полимеразы HCV, ингибитора протеазы HCV, ингибитора другой мишени в жизненном цикле HCV, и иммуномодулирующего средства, противовирусного средства и их комбинаций. Ингибиторы полимеразы HCV включают, но не ограничиваются ими, NM283 (валопицитабин),R803, JTK-109, JTK-003, HCV-371, HCV-086, HCV-796 и R-1479. Ингибиторы протеаз HCV (ингибиторы NS2-NS3 и ингибиторы NS3-NS4A) включают, но не ограничиваются ими, соединения WO02/18369 (см., например, стр. 273, строки 9-22 и со стр. 274, строки 4 до стр. 276, строки 11); BILN-2061, VX-950, GS-9132 (АСН-806), SCH-503034, и SCH-6. Следующие средства, которые можно использовать, представляют собой средства, описанные в WO 98/17679, WO 00/056331 (Vertex); WO 98/22496 (Roche); WO 99/07734 (Boehringer Ingelheim), WO 2005/073216, WO 2005073195 (Medivir) и структурно сходные средства. Ингибиторы других мишеней в жизненном цикле HCV, включают ингибиторы хеликазы NS3; ингибиторы металлопротеиназ; ингибиторы на основе антисмысловых олигонуклеотидов, такие как ISIS14803, AVI-4065 и т.п.; siRNA, такие как SIRPLEX-140-N и т.п.; кодируемая вектором короткая шпилечная РНК (shRNA); ДНКзимы; HCV-специфичные рибозимы, такие как гептазим, RPI.13919 и т.п.; ингибиторы проникновения, такие как НереХ-С, HuMax-НерС и т.п.; ингибиторы альфа-глюкозидазы, такие как целгосивир, UT-23 IB и т.п.; KPE-02003002 и BIVN 401. Иммуномодулирующие средства включают, но не ограничиваются ими; природные и рекомбинантные соединения изоформ интерферона, включая -интерферон, -интерферон, -интерферон, -интерферон и т.п., такие как Интрон А, Роферон-А, Канферон-A300, Адваферон, Инферген, Гумоферон, Сумиферон MP, Альфаферон, IFN-бета, Ферон и т.п.; модифицированные посредством полиэтиленгликоля (пегилированные) соединения интерферона, такие как PEG интерферон 2 а (Пегасис), PEG интерферон 2b (PEG-Интрон), пегилированный IFNcon1 и т.п.; длительно действующие препараты и производные соединений интерферона, такие как конденсированный с альбумином альбуферони т.п.; соединения, которые стимулируют синтез интерферона в клетках, такие как резиквимод и т.п.; интерлейкины; соединения, которые усиливают развитие ответа Т-хелперов 1 типа, такие как SCV-07 и т.п.; агонисты TOLL-подобного рецептора, такие как CpG-10101 (актилон), исаторибин и т.п.; тимозин -1; ANA-245; ANA-246; гистамина дигидрохлорид; пропагерманий; тетрахлордекаоксид; амплиген; IMP-321; KRN-7000; антитела, такие как сивасир, XTL-6865 и т.п.; и профилактические и терапевтические вакцины, такие как InnoVac С, HCV E1E2/MF59, и т.п. Другие противовирусные средства включают, но не ограничиваются ими, рибавирин, амантадин,вирамидин, нитазоксанид; телбувидин; NOV-205; тарибавирин; ингибиторы связывания собственных- 25014646 рибосом; вирусные ингибиторы широкого спектра, такие как ингибиторы IMPDH (например, соединения по US 5807876, US 6498178, US 6344465, US 6054472, WO 97/40028, WO 98/40381, WO 00/56331, и микофеноловая кислота и их производные, и включая, но не ограничиваясь ими, VX-950, меримеподиб(VX-497), VX-148 и/или VX-944); или комбинации любых из указанных выше средств. Таким образом, для борьбы с инфекциями или лечения инфекций HCV, соединения формулы (I) можно совместно вводить, например, с интерфероном- (IFN-), пегилированным интерферономи/или рибавирином, а также с лекарственными средствами на основе антител, нацеленных против эпитопов HCV, малых интерферирующих РНК (SiRNA), рибозимов, ДНКзимов, антисмысловой РНК, низкомолекулярных антагонистов, например, протеазы NS3, хеликазы NS3 и полимеразы NS5B. Таким образом, настоящее изобретение относится к применению соединений формулы (I) или любой их подгруппы, как определено выше, для изготовления лекарственного средства, полезного для ингибирования активности HCV у млекопитающего, инфицированного вирусами HCV, где указанное лекарственное средство используют в комбинированной терапии, где указанная комбинированная терапия предпочтительно включает соединение формулы (I) и другое ингибирующее HCV соединение, например,(пегилированный) IFN- и/или рибавирин. В другом аспекте предусмотрены комбинации соединения формулы (I), как описано в настоящем описании, и соединения против HIV. Последние предпочтительно представляют собой ингибиторы HIV,которые оказывают положительный эффект на метаболизм лекарственного средства и/или обладают фармакокинетикой, которая повышает биодоступность. Примером такого ингибитора HIV является ритонавир. По существу, настоящее изобретение далее относится к комбинации, содержащей (а) ингибитор протеазы HCV NS3/4a формулы (I) или его фармацевтически приемлемую соль; и (b) ритонавир или его фармацевтически приемлемую соль. Соединение ритонавир и его фармацевтически приемлемые соли и способы их получения описаны в WO 94/14436. Для предпочтительных дозированных форм ритонавира см. US 6037157 и документы,цитированные в нем: US 5484801, US 08/402690, WO 95/07696 и WO 95/09614. Ритонавир имеет следующую формулу: В следующем варианте осуществления комбинация, содержащая (а) ингибитор протеазы HCVNS3/4a формулы (I) или его фармацевтически приемлемую соль; и (b) ритонавир или его фармацевтически приемлемую соль; дополнительно содержит дополнительное соединение против HCV, выбранное из соединений, как описано в настоящем описании. В одном варианте осуществления настоящего изобретения предусмотрен способ получения комбинации, как описано в настоящем описании, включающий стадию объединения ингибитора протеазы HCVNS3/4a формулы (I) или его фармацевтически приемлемой соли и ритонавира или его фармацевтически приемлемой соли. Альтернативный вариант осуществления настоящего изобретения относится к способу, где комбинация содержит одно или несколько дополнительных средств, как описано в настоящем описании. Комбинации по настоящему изобретению можно использовать в качестве лекарственных средств. Указанное применение в качестве лекарственного средства или способ лечения включают системное введение инфицированным HCV субъектам количества, эффективного для борьбы с состояниями, обусловленными HCV и другими патогенными флавивирусами и пестивирусами. Таким образом, комбинации по настоящему изобретению можно использовать для изготовления лекарственного средства, полезного для лечения, профилактики инфекции или для борьбы с инфекцией или заболеванием, обусловленным инфекцией HCV у млекопитающего, в частности, для лечения состояний, обусловленных HCV и другими патогенными флавивирусами и пестивирусами. В одном варианте осуществления настоящего изобретения предусмотрена фармацевтическая композиция, содержащая комбинацию в соответствии с любым одним из вариантов осуществления, описанных в настоящем описании, и фармацевтически приемлемый эксципиент. В частности, настоящее изобретение относится к фармацевтической композиции, содержащей:(a) терапевтически эффективное количество ингибитора протеазы HCV NS3/4a формулы (I) или его фармацевтически приемлемой соли,(b) терапевтически эффективное количество ритонавира или его фармацевтически приемлемой соли, и(с) фармацевтически приемлемый эксципиент. Необязательно, фармацевтическая композиция дополнительно содержит дополнительное средство, выбранное из ингибитора полимеразы HCV, ингибито- 26014646 ра протеазы HCV, ингибитора другой мишени в жизненном цикле HCV, и иммуномодулирующее средство, противовирусное средство и их комбинации. Композиции можно составлять в подходящие фармацевтические дозированные формы, такие как дозированные формы, описанные выше. Каждый активный ингредиент можно составлять отдельно и препараты вводить совместно или может быть предоставлен один препарат, содержащий оба ингредиента и, если желательно, дополнительные активные ингредиенты. Как использовано в настоящем описании, подразумевается, что термин "композиция" включает продукт, содержащий указанные ингредиенты, а также любой продукт, к которому приводит, прямо или косвенно, комбинация указанных ингредиентов. В одном варианте осуществления комбинации, представленные в настоящем описании, также можно составлять в качестве комбинированного препарата для одновременного, раздельного или последовательного применения при лечении HIV. В таком случае, соединение общей формулы (I) или любой ее подгруппы, составляют в фармацевтическую композицию, содержащую другие фармацевтически приемлемые эксципиенты, и ритонавир составляют отдельно в фармацевтическую композицию, содержащую другие фармацевтически приемлемые эксципиенты. Удобно, чтобы указанные две отдельные фармацевтические композиции могли быть частями набора для одновременного, раздельного или последовательного применения. Таким образом, отдельные компоненты комбинации по настоящему изобретению можно вводить раздельно в различное время в течение курса терапии или одновременно в формах раздельных комбинаций или одной комбинации. Таким образом, следует понимать, что настоящее изобретение относится ко всем таким схемам одновременного или поочередного лечения, и термин "введение" следует интерпретировать соответствующим образом. В предпочтительном варианте осуществления разделенные дозированные формы вводят приблизительно в одно время. В одном варианте осуществления комбинация по настоящему изобретению содержит количество ритонавира или его фармацевтически приемлемой соли, которое является достаточным для клинического повышения биодоступности ингибитора протеазы HCV NS3/4a формулы (I) по сравнению с биодоступностью, когда указанный ингибитор протеазы HCV NS3/4a формулы (I) вводят отдельно. В другом варианте осуществления комбинация по настоящему изобретению содержит количество ритонавира или его фармацевтически приемлемой соли, которое является достаточным для повышения по меньшей мере одной фармакокинетической переменной ингибитора протеазы HCV NS3/4a формулы(I), выбранной из t1/2, Cmin, Cmax, Css, AUC через 12 ч или AUC через 24 ч, по сравнению с указанной по меньшей мере одной фармакокинетической переменной, когда ингибитор протеазы HCV NS3/4a формулы (I) вводят отдельно. Следующий вариант осуществления относится к способу повышения биодоступности ингибитора протеазы HCV NS3/4a, включающему введение индивидууму, нуждающемуся в таком повышении, комбинации, как определено в настоящем описании, содержащей терапевтически эффективное количество каждого компонента указанной комбинации. В следующем варианте осуществления, настоящее изобретение относится к применению ритонавира или его фармацевтически приемлемой соли в качестве средства для улучшения по меньшей мере одной фармакокинетической переменной ингибитора протеазы HCV NS3/4a формулы (I), выбранной из t1/2,Cmin, Cmax, Css, AUC через 12 ч или AUC через 24 ч; при условии, что указанное применение не проводят в организме человека или животного. Как использовано в настоящем описании, термин "индивидуум" относится к животному, предпочтительно млекопитающему, наиболее предпочтительно человеку, который является объектом лечения,наблюдения или эксперимента. Биодоступность определяют как долю введенной дозы, достигшую системного кровотока, tm представляет собой время полужизни или время, необходимое для снижения концентрации в плазме до половины ее исходного значения. Css представляет собой равновесную концентрацию, т.е. концентрацию, при которой скорость введения лекарственного средства является равной скорости выведения. Cmin определяют как наименьшую (минимальную) концентрацию, измеряемую в ходе интервала при дозировании.Cmax представляет собой наибольшую (максимальную) концентрацию, определяемую в ходе интервала при дозировании. AUC определяют как площадь под кривой "концентрация в плазме-время" за определенный период времени. Комбинации по настоящему изобретению можно вводить человеку в диапазоне доз, конкретном для каждого компонента, представленного в таких комбинациях. Компоненты, находящиеся в указанных комбинациях, можно вводить совместно или по отдельности. Ингибиторы протеазы NS3/4a формулы (I) или любая их подгруппа и ритонавир или его фармацевтически приемлемая соль или сложный эфир, могут иметь уровни дозировок порядка от 0,02 до 5,0 г в сутки. Когда ингибитор протеазы HCV NS3/4a формулы (I) и ритонавир вводят в комбинации, подходящее массовое соотношение ингибитора протеазы HCV NS3/4a формулы (I) и ритонавира находится в диапазоне приблизительно от 40:1 до приблизительно 1:15, или приблизительно от 30:1 до приблизительно 1:15, или приблизительно от 15:1 до приблизительно 1:15, как правило, приблизительно от 10:1 до при- 27014646 близительно 1:10 и более конкретно приблизительно от 8:1 до приблизительно 1:8. Также подходящими являются массовые соотношения ингибиторов протеазы HCV NS3/4a формулы (I) и ритонавира, находящиеся в диапазоне приблизительно от 6:1 до приблизительно 1:6, или приблизительно от 4:1 до приблизительно 1:4, или приблизительно от 3:1 до приблизительно 1:3, или приблизительно от 2:1 до приблизительно 1:2, или приблизительно от 1,5:1 до приблизительно 1:1,5. В одном аспекте количество ингибиторов протеазы HCV NS3/4a формулы (I) по массе равно или превышает количество ритонавира, где подходящее массовое соотношение ингибитора протеазы HCV NS3/4a формулы (I) и ритонавира находится в диапазоне приблизительно от 1:1 до приблизительно 15:1, как правило, приблизительно от 1:1 до приблизительно 10:1 и более конкретно приблизительно от 1:1 до приблизительно 8:1. Также являются подходящими массовые соотношения ингибитора протеазы HCV NS3/4a формулы (I) и ритонавира, находящиеся в диапазоне приблизительно от 1:1 до приблизительно 6:1, или приблизительно от 1:1 до приблизительно 5:1, или приблизительно от 1:1 до приблизительно 4:1, или приблизительно от 3:2 до приблизительно 3:1, или приблизительно от 1:1 до приблизительно 2:1, или приблизительно от 1:1 до приблизительно 1,5:1. Как использовано в настоящем описании, термин "терапевтически эффективное количество" означает то количество активного соединения или компонента или фармацевтического средства, которое вызывает биологический или медицинский ответ, который включает смягчение симптомов заболевания,подлежащего лечению, в ткани, системе, у животного или человека, и которого добивается исследователь, ветеринар, врач или другой клиницист, с помощью настоящего изобретения. Поскольку настоящее изобретение относится к комбинациям, содержащим два или более средств, "терапевтически эффективное количество" представляет собой такое количество средств, взятых вместе, чтобы комбинированный эффект вызывал требуемый биологический или медицинский ответ. Например, терапевтически эффективное количество композиции, содержащей (а) соединение формулы (I) и (b) ритонавир, представляет собой количество соединения формулы (I) и количество ритонавира, которые, вместе взятые, обладают комбинированным эффектом, который является терапевтически эффективным. Как правило, подразумевают, что противовирусное эффективное суточное количество может составлять от 0,01 до 500 мг/кг массы тела, более предпочтительно от 0,1 до 50 мг/кг массы тела. Может быть подходящим введение требуемой дозы в виде одной, двух, трех, четырех или более субдоз через соответствующие интервалы в течение суток. Указанные субдозы можно составлять в качестве единичных дозированных форм, например, содержащих от 1 до 1000 мг, и в частности, от 5 до 200 мг активного ингредиента на единичную дозированную форму. Точная дозировка и частота введения зависят от конкретного используемого соединения формулы(I), конкретного подлежащего лечению состояния, тяжести подлежащего лечению состояния, возраста,массы, пола, выраженности нарушения и общего физического состояния конкретного пациента, а также других лекарственных средств, которые может принимать индивидуум, как хорошо известно специалистам в данной области. Более того, очевидно, что указанное эффективное суточное количество может быть снижено или повышено в зависимости от ответа подвергаемого лечению субъекта и/или в зависимости от оценки врача, назначающего соединения по настоящему изобретению. Эффективные диапазоны суточного количества, приведенные в настоящем описании выше, таким образом, являются только рекомендациями. В соответствии с одним вариантом осуществления ингибитор протеазы HCV NS3/4a формулы (I) и ритонавир можно совместно вводить один или два раза в сутки, предпочтительно орально, где количество соединений формулы (I) на дозу составляет приблизительно от 1 до приблизительно 2500 мг, и количество ритонавира на дозу составляет от 1 до приблизительно 2500 мг. В другом варианте осуществления количества на дозу для однократного или двукратного суточного совместного введения составляют приблизительно от 50 до приблизительно 1500 мг соединения формулы (I) и приблизительно от 50 до приблизительно 1500 мг ритонавира. В другом варианте осуществления количества на дозу для однократного или двукратного суточного совместного введения составляют приблизительно от 100 до приблизительно 1000 мг соединения формулы (I) и приблизительно от 100 до приблизительно 800 мг ритонавира. В другом варианте осуществления количества на дозу для однократного или двукратного суточного введения составляют приблизительно от 150 до приблизительно 800 мг соединения формулы (I) и приблизительно от 100 до приблизительно 600 мг ритонавира. В другом варианте осуществления количества на дозу для однократного или двукратного суточного совместного введения составляют приблизительно от 200 до приблизительно 600 мг соединения формулы (I) и приблизительно от 100 до приблизительно 400 мг ритонавира. В другом варианте осуществления количества на дозу для однократного или двукратного суточного совместного введения составляют приблизительно от 200 до приблизительно 600 мг соединения формулы (I) и приблизительно от 20 до приблизительно 300 мг ритонавира. В другом варианте осуществления количества на дозу для однократного или двукратного суточного совместного введения составляют приблизительно от 100 до приблизительно 400 мг соединения формулы (I) и приблизительно от 40 до приблизительно 100 мг ритонавира. Иллюстративные комбинации соединения формулы (I) (мг)/ритонавир (мг) для однократного или двукратного суточного дозирования включают 50/100, 100/100, 150/100, 200/100, 250/100, 300/100,- 28
МПК / Метки
МПК: C07K 5/078, C07K 5/06, A61P 31/14, A61K 38/05, C07D 487/04
Метки: ингибиторы, гепатита, вируса, макроциклические
Код ссылки
<a href="https://eas.patents.su/30-14646-makrociklicheskie-ingibitory-virusa-gepatita-s.html" rel="bookmark" title="База патентов Евразийского Союза">Макроциклические ингибиторы вируса гепатита с</a>
Предыдущий патент: Циклопентадиенильно-флуоренильные лиганды с углеродными мостиками
Следующий патент: Гибридные полипептиды с селектируемыми свойствами
Случайный патент: 2-(3,5-бистрифторометилфенил)-n-метил-n-(6-морфолин-4-ил-4-ортотолилпиридин-3-ил)изобутирамид












