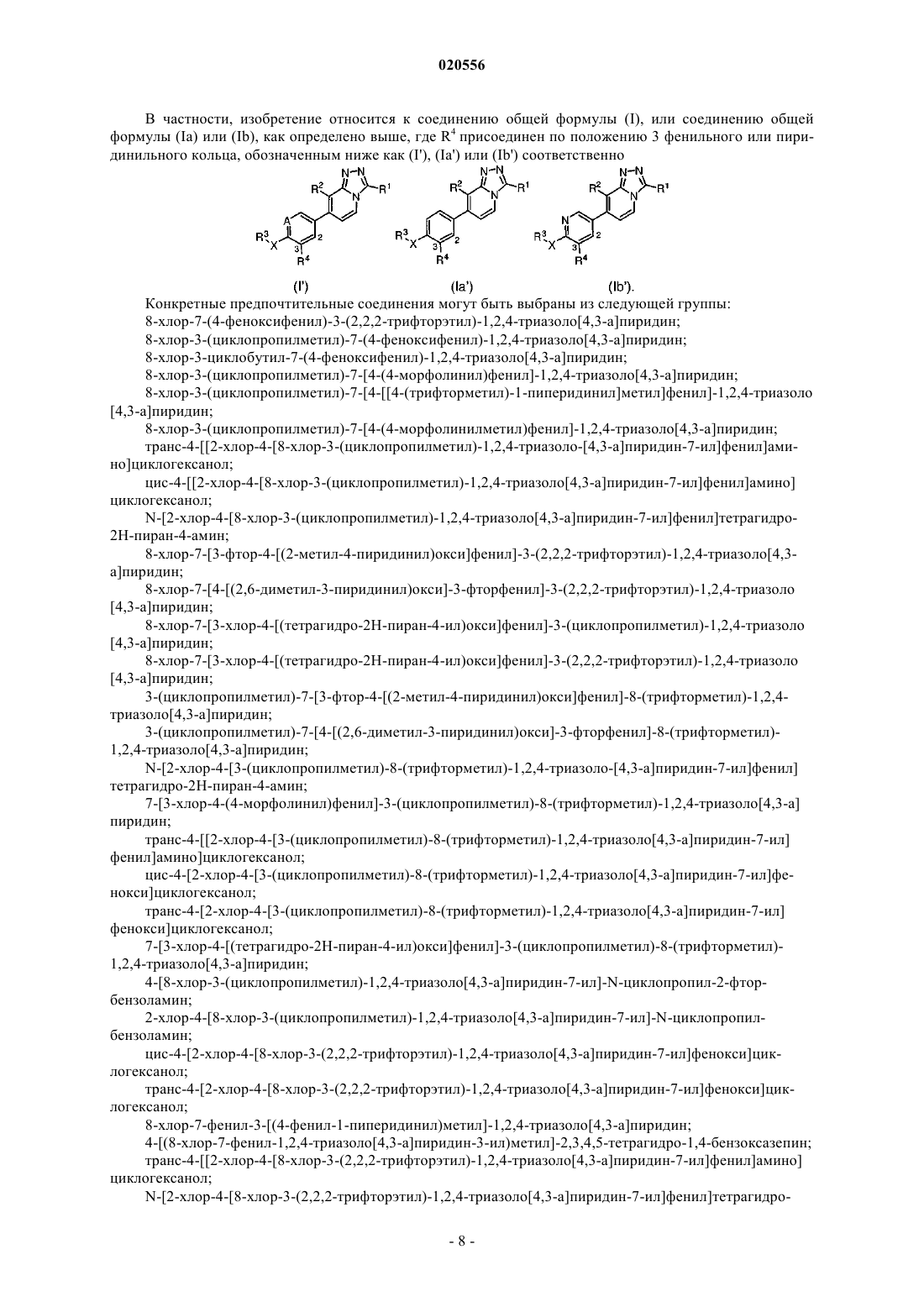
Производные 7-арил-1,2,4-триазоло[4,3-a]пиридина и их применение в качестве положительных аллостерических модуляторов рецепторов mglur2
Номер патента: 20556
Опубликовано: 30.12.2014
Авторы: Трабанко-Суарес Андрес Авелино, Макдональд Грегор Джеймс, Сид-Нуньес Хосе Мария, Де Лукас Оливарес Ана Изабель
Формула / Реферат
1. Соединение формулы (I)
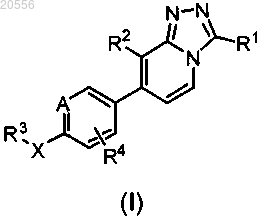
или его стереохимически изомерная форма, где
А представляет собой СН или N;
R1 выбран из группы, состоящей из (C1-3алкилокси)C1-3алкила; C1-3алкила, замещенного 1-3 заместителями галогено; незамещенного C3-7циклоалкила; (C3-7циклоалкил)C1-3алкила; 4-(2,3,4,5-тетрагидробензо[f][1,4]оксазепин)метила и Het1C1-3алкила;
R2 выбран из группы, состоящей из галогено; C1-3алкила; C3-7циклоалкила и C1-3алкила, замещенного 1-3 заместителями галогено;
R3 выбран из группы, состоящей из водорода; C1-3алкила; незамещенного C3-7циклоалкила; C3-7циклоалкила, замещенного 1-2 заместителями, каждый из которых независимо выбран из гидроксила и C3-7циклоалкила; незамещенного фенила; Het3; незамещенного пиридила и пиридила, замещенного 1-2 заместителями, каждый из которых независимо выбран из группы, состоящей из C1-3алкила, C1-3алкилокси, C3-7циклоалкила и галогено;
R4 представляет собой водород или галогено;
X выбран из группы, состоящей из ковалентной связи, C1-3алкандиила, О, СН2О, CH2NH, NHCH2 и NH;
каждый Het1 представляет собой пиперидинил, возможно замещенный незамещенным фенилом;
каждый Het3 представляет собой насыщенный гетероциклический радикал, выбранный из группы, состоящей из пирролидинила; пиперидинила; пиперазинила; тетрагидропиранила и морфолинила; каждый из которых возможно может быть замещен 1-2 заместителями, каждый из которых независимо выбран из группы, состоящей из C1-6алкила, галогено, гидроксила и C1-3алкила, замещенного 1-3 заместителями галогено; и галогено выбран из фторо и хлоро;
или его фармацевтически приемлемая соль.
2. Соединение по п.1 или его стереохимически изомерная форма, где
R1 выбран из группы, состоящей из (C1-3алкилокси)C1-3алкила; C1-3алкила, замещенного 1-3 заместителями галогено; (C3-7циклоалкил)-C1-3алкила;
R2 выбран из группы, состоящей из галогено; C1-3алкила; C1-3алкила, замещенного 1-3 заместителями галогено;
R3 выбран из группы, состоящей из незамещенного C3-7циклоалкила; пиперазин-1-ила; тетрагидро-2H-пиран-4-ила и пиридила, замещенного 1-2 заместителями, каждый из которых независимо выбран из группы, состоящей из C1-3алкила; C1-3алкилокси; C3-7циклоалкила и галогено;
А представляет собой СН;
X выбран из ковалентной связи; -О-; CH2NH и -NH- и
R4 выбран из водорода; фторо и хлоро;
или его фармацевтически приемлемая соль.
3. Соединение по п.1 или его стереохимически изомерная форма, где
R1 выбран из группы, состоящей из CH2CF3; этоксиметила и циклопропилметила;
R2 выбран из группы, состоящей из хлоро, метила и CF3;
R3 выбран из группы, состоящей из 2-метилпиридин-4-ила; 2,6-диметилпиридин-3-ила; циклопропила; 2-циклопропилпиридин-4-ила; 3-фторпиридин-4-ила и пиперазин-1-ила;
А представляет собой СН;
X выбран из ковалентной связи; -О- и -NH- и
R4 выбран из водорода; фторо и хлоро;
или его фармацевтически приемлемая соль.
4. Соединение по п.1 или его стереохимически изомерная форма, где
А представляет собой СН;
R1 выбран из (C1-3алкилокси)C1-3алкила; моно-, ди- или тригалоген-C1-3алкила; незамещенного C3-7циклоалкила; (C3-7циклоалкил)C1-3алкила; 4-(2,3,4,5-тетрагидробензо[f][1,4]оксазепин)метила и Het1C1-3алкила;
R2 выбран из галогено; моно, ди- или тригалоген-С1-3алкила; C1-3алкила и C3-7циклоалкила;
R3 выбран из водорода; незамещенного C3-7циклоалкила; C3-7циклоалкила, замещенного 1 или 2 заместителями, выбранными из гидроксила; незамещенного фенила; Het3 или пиридила, замещенного 1 или 2 заместителями, независимо выбранными из C1-3алкила;
R4 выбран из водорода и галогено и
X выбран из группы, состоящей из ковалентной связи, C1-3алкандиила, О, NH и О-СН2;
где каждый Het1 представляет собой пиперидинил, возможно замещенный 1 незамещенным фенилом; и
каждый Het3 представляет собой насыщенный гетероциклический радикал, выбранный из пирролидинила; пиперидинила; пиперазинила; тетрагидропиранила и морфолинила; каждый из которых возможно может быть замещен 1 или 2 заместителями, независимо выбранными из группы, состоящей из C1-6 алкила, моно-, ди- и тригалогенС1-3алкила;
или его фармацевтически приемлемая соль.
5. Соединение по п.1, включая любую его стереохимически изомерную форму, где указанное соединение выбрано из группы, состоящей из
8-хлор-7-[3-фтор-4-[(2-метил-4-пиридинил)окси]фенил]-3-(2,2,2-трифторэтил)-1,2,4-триазоло[4,3-а]пиридина;
3-(циклопропилметил)-7-[3-фтор-4-[(2-метил-4-пиридинил)окси]фенил]-8-(трифторметил)-1,2,4-триазоло[4,3-а]пиридина;
8-хлор-7-[4-[(2,6-диметил-3-пиридинил)окси]-3-фторфенил]-3-(2,2,2-трифторэтил)-1,2,4-триазоло[4,3-а]пиридина;
2-хлор-N-циклопропил-4-[3-(циклопропилметил)-8-(трифторметил)-1,2,4-триазоло[4,3-а]пиридин-7-ил]бензоламина;
8-хлор-7-[4-(2-метилпиридин-4-илокси)-3-фторфенил]-3-(циклопропилметил)-1,2,4-триазоло[4,3-а]пиридина;
8-хлор-7-[3-хлор-4-[(2-метил-4-пиридинил)окси]фенил]-3-(этоксиметил)-1,2,4-триазоло[4,3-а]пиридина;
7-[4-[(2,6-диметил-3-пиридинил)окси]-3-фторфенил]-3-(этоксиметил)-8-метил-1,2,4-триазоло[4,3-а]пиридина;
7-[3-хлор-4-[(2-циклопропил-4-пиридинил)окси]фенил]-3-(циклопропилметил)-8-(трифторметил)-1,2,4-триазоло[4,3-а]пиридина;
3-(циклопропилметил)-7-[4-[(3-фтор-4-пиридинил)окси]фенил]-8-(трифторметил)-1,2,4-триазоло[4,3-а]пиридина и
7-(3-хлор-4-пиперазин-1-илфенил)-3-(циклопропилметил)-8-(трифторметил)[1,2,4]триазоло[4,3-а]пиридина;
и его фармацевтически приемлемые соли.
6. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения по любому из пп.1-5 и фармацевтически приемлемый носитель или эксципиент.
7. Применение соединения по любому из пп.1-5 в качестве лекарственного средства.
8. Применение соединения по любому из пп.1-5 или фармацевтической композиции по п.6 в лечении или предупреждении расстройства центральной нервной системы, выбранного из группы тревожных расстройств, психотических расстройств, расстройств личности, расстройств, связанных с веществами, расстройств питания, расстройств настроения, мигрени, эпилепсии или судорожных расстройств, детских расстройств, когнитивных расстройств, нейродегенерации, нейротоксичности и ишемии.
9. Применение соединения по п.8 в лечении или предупреждении расстройства центральной нервной системы, выбранного из тревоги, шизофрении, мигрени, депрессии, эпилепсии, поведенческих и психологических симптомов деменции, большого депрессивного расстройства, депрессии, устойчивой к лечению, биполярной депрессии, генерализованного тревожного расстройства, посттравматического стрессового расстройства, биполярной мании, злоупотребления веществами и смешанной тревоги и депрессии.
10. Применение соединения по любому из пп.1-5 в комбинации с ортостерическим агонистом mGluR2 в лечении или предупреждении расстройства, указанного в п.8 или 9.
11. Способ получения фармацевтической композиции по п.6, отличающийся тем, что фармацевтически приемлемый носитель равномерно смешан с терапевтически эффективным количеством соединения по любому из пп.1-5.
12. Фармацевтическая комбинация, содержащая
(а) соединение по любому из пп.1-5 и
(б) ортостерический агонист mGluR2,
в виде комбинированного препарата для одновременного, раздельного или последовательного применения в лечении или предупреждении состояния, при котором полезен нейромодуляторный эффект положительных аллостерических модуляторов mGluR2.
13. Способ лечения или предупреждения расстройства центральной нервной системы, выбранного из тревожных расстройств, психотических расстройств, расстройств личности, расстройств, связанных с веществами, расстройств питания, расстройств настроения, мигрени, эпилепсии или судорожных расстройств, детских расстройств, когнитивных расстройств, нейродегенерации, нейротоксичности и ишемии, включающий введение субъекту, нуждающемуся в этом, соединения по любому из пп.1-5 или фармацевтической композиции по п.6.
Текст
ПРОИЗВОДНЫЕ 7-АРИЛ-1,2,4-ТРИАЗОЛО[4,3-a]ПИРИДИНА И ИХ ПРИМЕНЕНИЕ В КАЧЕСТВЕ ПОЛОЖИТЕЛЬНЫХ АЛЛОСТЕРИЧЕСКИХ МОДУЛЯТОРОВ РЕЦЕПТОРОВ mGluR2 Поликарпов А.В. (RU) Настоящее изобретение относится к новым производным триазоло[4,3-а]пиридина формулы (I), 020556 Сид-Нуньес Хосе Мария, Де Лукас Оливарес Ана Изабель, ТрабанкоСуарес Андрес Авелино (ES),Макдональд Грегор Джеймс (BE) где все радикалы такие, как они определены в формуле изобретения. Соединения по изобретению являются положительными аллостерическими модуляторами метаботропного глутаматного рецептора подтипа 2 ("mGluR2"), которые полезны для лечения или предупреждения неврологических и психиатрических расстройств, ассоциированных с глутаматной дисфункцией,и заболеваний, в которые вовлечены метаботропные рецепторы подтипа mGluR2. Данное изобретение также относится к фармацевтическим композициям, содержащим такие соединения,к способам получением таких соединений и композиции, и к применению таких соединений для предупреждения или лечения неврологических и психиатрических расстройств и заболеваний, в которые вовлечен mGluR2. Область изобретения Настоящее изобретение относится к новым производным триазоло[4,3-а]пиридина, которые являются положительными аллостерическими модуляторами метаботропного глутаматного рецептора подтипа 2 ("mGluR2") и которые являются полезными для лечения или предупреждения неврологических и психиатрических расстройств, ассоциированных с глутаматной дисфункцией, и заболеваний, в которые вовлечен mGluR2-подтип метаботропных рецепторов. Изобретение также относится к фармацевтическим композициям, содержащим такие соединения, к способам получения таких соединений и композиций, к применению таких соединений и фармацевтических композиций для предупреждения или лечения неврологических и психиатрических расстройств и заболеваний, в которые вовлечен mGluR2. Предшествующий уровень техники Глутамат является главным аминокислотным нейромедиатором в центральной нервной системе млекопитающих. Глутамат играет главную роль в многочисленных физиологических функциях, таких как обучение и память, а также сенсорное восприятие, развитие синаптической пластичности, регуляция моторики, дыхание и регуляция сердечно-сосудистой функции. Кроме того, глутамат находится в центре нескольких различных неврологических и психиатрических заболеваний, где существует дисбаланс в глутаматергической нейротрансмиссии. Глутамат опосредует синаптическую нейротрансмиссию посредством активации каналов ионотропных глутаматных рецепторов (iGluRs) и NMDA(N-метил-D-аспартат)-, АМРА(альфа-амино-3-гидрокси-5-метил-4-изоксазол-пропионовая кислота)- и каинатных рецепторов, которые отвечают за быструю передачу возбуждения. Кроме того, глутамат активирует метаботропные глутаматные рецепторы (mGluRs), которые играют в большей степени модуляторную роль, которая вносит вклад в тонкую настройку синаптической эффективности. Глутамат активирует mGluR посредством связывания с большим внеклеточным аминоконцевым доменом рецептора, называемым в данном описании ортостерическим участком связывания. Это связывание индуцирует конформационное изменение в рецепторе, которое приводит к активации G-белка и внутриклеточных сигнальных путей. Подтип mGluR2 отрицательно связан с аденилатциклазой через активацию Gi-белка, и его активация приводит к ингибированию высвобождения глутамата в синапсе. В центральной нервной системе(ЦНС) mGluR2-рецепторы присутствуют в основном в коре головного мозга, таламических областях,добавочной обонятельной луковице, гиппокампе, миндалевидном теле, хвостатом ядре-скорлупе и прилежащем ядре. Активация mGluR2, как было показано в клинических испытаниях, является эффективной для лечения тревожных расстройств. Кроме того, активация mGluR2 в различных животных моделях, как было показано, является эффективной, представляя таким образом потенциально новый терапевтический подход для лечения шизофрения, эпилепсии, лекарственной аддикции/зависимости, болезни Паркинсона,боли, расстройств сна и болезни Хантингтона. В настоящее время большинство доступных фармакологических средств, нацеленных на mGluR,представляют собой ортостерические лиганды, которые активируют несколько членов данного семейства, поскольку они являются структурными аналогами глутамата. Новый подход к разработке селективных соединений, действующих на mGluR, состоит в идентификации соединений, которые действуют через аллостерические механизмы, модулируя рецептор посредством связывания с участком, отличным от высококонсервативного ортостерического участка связывания. Положительные аллостерические модуляторы mGluR появились недавно в качестве новых фармакологических объектов, предлагающих данную привлекательную альтернативу. Различные соединения были описаны как положительные аллостерические модуляторы mGluR2. Ни одно из конкретно раскрытых в данном описании изобретения соединений не связано структурно с соединениями, раскрытыми в данной области техники. Было показано, что такие соединения сами по себе не активируют рецептор. Скорее, они позволяют рецептору вызывать максимальный ответ на такую концентрацию глутамата, которая индуцирует минимальный ответ. Мутационный анализ ясно продемонстрировал, что связывание положительных аллостерических модуляторов mGluR2 происходит не на ортостерическом участке, а на аллостерическом участке, расположенном в пределах седьмой трансмембранной области рецептора. Данные на животных показывают, что положительные аллостерические модуляторы mGluR2 оказывают эффекты в моделях тревоги и психоза, сходные с эффектами, полученными с ортостерическими агонистами. Аллостерические модуляторы mGluR2, как было показано, являются активными в моделях тревоги, представляющих собой реакцию вздрагивания, усиленную испугом, и стресс-индуцированную гипертермию. Кроме того, как было показано, такие соединения являются активными в реверсировании кетамин- или амфетамин-индуцированной гиперлокомоции и в реверсировании амфетамининдуцированного нарушения предимпульсного ингибирования акустической реакции вздрагивания в моделях шизофрении. Недавние исследования на животных также свидетельствуют о том, что селективный положительный аллостерический модулятор метаботропного глутаматного рецептора подтипа 2 бифенилинданон(BINA) блокирует галлюциногенную лекарственную модель психоза, поддерживая стратегию нацеливания на mGluR2-рецепторы для лечения глутаматергической дисфункции при шизофрении. Положительные аллостерические модуляторы способствуют потенцированию глутаматного ответа,а также, как было показано, потенцируют ответ на ортостерические агонисты mGluR2, такие какLY379268 1S,2R,5R,6R)-2-амино-4-оксабицикло[3,1,0]гексан-2,6-дикарбоновая кислота) или DCG-IV 1R,2R)-3-[(1S)-1-амино-2-гидрокси-2-оксоэтил]циклопропан-1,2-дикарбоновая кислота). Эти данные свидетельствуют в пользу еще одного нового терапевтического подхода к лечению вышеупомянутых неврологических и психиатрических заболеваний, вовлекающих mGluR2, который заключается в применении комбинации положительного аллостерического модулятора mGluR2 вместе с ортостерическим агонистом mGluR2. Производные триазолопиридина по настоящему изобретению представляют собой ЦНС-активные,сильнодействующие соединения, обеспечивающие альтернативные положительные аллостерические модуляторы mGluR2 с улучшенной растворимостью и солеобразующими свойствами. Подробное описание изобретения Настоящее изобретение относится к соединениям, обладающим активностью модуляторов метаботропного глутаматного рецептора 2, имеющим формулу (I) или их стереохимически изомерным формам, где А представляет собой СН или N;R3 выбран из группы, состоящей из водорода; C1-3 алкила; незамещенного С 3-7 циклоалкила; С 3-7 циклоалкила, замещенного 1-2 заместителями, каждый из которых независимо выбран из гидроксила и С 3-7 циклоалкила; незамещенного фенила; Het3; незамещенного пиридила и пиридила, замещенного 1-2 заместителями, каждый из которых независимо выбран из группы, состоящей из C1-3 алкила, C1-3 алкилокси, С 3-7 циклоалкила и галогено;R4 представляет собой водород или галогено;X выбран из группы, состоящей из ковалентной связи, C1-3 алкандиила, О, СН 2 О, CH2NH, NHCH2 иNH; каждый Het1 представляет собой пиперидинил, возможно замещенный незамещенным фенилом; каждый Het3 представляет собой насыщенный гетероциклический радикал, выбранный из группы,состоящей из пирролидинила; пиперидинила; пиперазинила; тетрагидропиранила и морфолинила; каждый из которых возможно может быть замещен 1-2 заместителями, каждый из которых независимо выбран из группы, состоящей из С 1-6 алкила, галогено, гидроксила и C1-3 алкила, замещенного 1-3 заместителями галогено; и галогено выбран из фторо и хлоро; или их фармацевтически приемлемым солям. Изобретение предпочтительно относится к соединениям формулы (I) или их стереохимически изомерным формам, гдеR3 выбран из группы, состоящей из незамещенного C3-7 циклоалкила; пиперазин-1-ила; тетрагидро 2 Н-пиран-4-ила; и пиридила, замещенного 1-2 заместителями, каждый из которых независимо выбран из группы, состоящей из C1-3 алкила, C1-3 алкилокси; С 3-7 циклоалкила и галогено; А представляет собой СН;X выбран из ковалентной связи; -О-; CH2NH и -NH-; иR4 выбран из водорода; фторо и хлоро; или их фармацевтически приемлемым солям. Также предпочтительно изобретение относится к соединениям формулы (I) или их стереохимиче-2 020556X выбран из ковалентной связи; -О- и -NH-; иR4 выбран из водорода; фторо и хлоро; или их фармацевтически приемлемым солям. Также предпочтительно изобретение относится к соединениям формулы (I) или их стереохимически изомерным формам, где А представляет собой СН;R3 выбран из водорода; незамещенного C3-7 циклоалкила; C3-7 циклоалкила, замещенного 1 или 2 заместителями, выбранными из гидроксила; незамещенного фенила; Het3 или пиридила, замещенного 1 или 2 заместителями, независимо выбранными из C1-3 алкила;R4 выбран из водорода и галогено; иX выбран из группы, состоящей из ковалентной связи, C1-3 алкандиила, О, NH и О-СН 2; где каждый Het1 представляет собой пиперидинил, возможно замещенный 1 незамещенным фенилом; и каждый Het3 представляет собой насыщенный гетероциклический радикал, выбранный из пирролидинила; пиперидинила; пиперазинила; тетрагидропиранила и морфолинила; каждый из которых возможно может быть замещен 1 или 2 заместителями, независимо выбранными из группы, состоящей из С 1-6 алкила, моно-, ди- и тригалогенС 1-3 алкила; или их фармацевтически приемлемым солям. Также предпочтительно изобретение относится к соединениям формулы (I), включая любую стереохимически изомерную форму, где соединение выбрано из группы, состоящей из 8-хлор-7-[3-фтор-4-[(2-метил-4-пиридинил)окси]фенил]-3-(2,2,2-трифторэтил)-1,2,4-триазоло[4,3 а]пиридина; 3-(циклопропилметил)-7-[3-фтор-4-[(2-метил-4-пиридинил)окси]фенил]-8-(трифторметил)-1,2,4 триазоло[4,3-а]пиридина; 8-хлор-7-[4-[(2,6-диметил-3-пиридинил)окси]-3-фторфенил]-3-(2,2,2-трифторэтил)-1,2,4-триазоло[4,3-а]пиридина и 7-(3-хлор-4-пиперазин-1-илфенил)-3-(циклопропилметил)-8-(трифторметил)[1,2,4]триазоло[4,3 а]пиридина; или их фармацевтически приемлемым солям. Изобретение также относится к фармацевтической композиции, содержащей терапевтически эффективное количество соединения по изобретению и фармацевтически приемлемый носитель или эксципиент. Изобретение также относится к применению соединения по изобретению в качестве лекарственного средства. Изобретение также относится к применению соединения по изобретению или фармацевтической композиции по изобретению в лечении или предупреждении расстройства центральной нервной системы, выбранного из группы тревожных расстройств, психотических расстройств, расстройств личности,расстройств, связанных с веществами, расстройств питания, расстройств настроения, мигрени, эпилепсии или судорожных расстройств, детских расстройств, когнитивных расстройств, нейродегенерации,нейротоксичности и ишемии. Предпочтительно расстройство центральной нервной системы выбрано из тревоги, шизофрении, мигрени, депрессии, эпилепсии, поведенческих и психологических симптомов деменции, большого депрессивного расстройства, депрессии, устойчивой к лечению, биполярной депрессии, генерализованного тревожного расстройства, посттравматического стрессового расстройства,биполярной мании, злоупотребления веществами и смешанной тревоги и депрессии. Изобретение также относится к применению соединения по изобретению в комбинации с ортостерическим агонистом mGluR2 в лечении или предупреждении любого указанного выше расстройства. Изобретение также относится к способу получения фармацевтической композиции по изобретению,отличающемуся тем, что фармацевтически приемлемый носитель равномерно смешан с терапевтически эффективным количеством соединения по изобретению. Изобретение также относится к фармацевтической комбинации, содержащей(а) соединение по изобретению и(б) ортостерический агонист mGluR2,в виде комбинированного препарата для одновременного, раздельного или последовательного применения в лечении или предупреждении состояния, при котором полезен нейромодуляторный эффект положительных аллостерических модуляторов mGluR2. Изобретение также относится к способу лечения или предупреждения расстройства центральной нервной системы, выбранного из тревожных расстройств, психотических расстройств, расстройств личности, расстройств, связанных с веществами, расстройств питания, расстройств настроения, мигрени,эпилепсии или судорожных расстройств, детских расстройств, когнитивных расстройств, нейродегенерации, нейротоксичности и ишемии, включающему введение субъекту, нуждающемуся в этом, соединения по изобретению или фармацевтической композиции по изобретению. Названия соединений по настоящему изобретению были составлены в соответствии с правилами номенклатуры, принятыми Химической реферативной службой (the Chemical Abstracts Service (CAS, с использованием программного обеспечения Advanced Chemical Development, Inc. (ACD/Name продуктversion 10.01; Build 15494, 1 декабря 2006 г.). В случае таутомерных форм было составлено название изображенной таутомерной формы данной структуры. Однако следует понимать, что другая, неизображенная таутомерная форма также включена в объем настоящего изобретения. Определения Термин "галоген" или "галогено", используемый в данном описании отдельно или как часть другой группы, относится к фторо, хлоро, бромо или йодо, причем фторо или хлоро являются предпочтительными. Термин "C1-3 алкил" или "С 1-6 алкил", используемый в данном описании отдельно или как часть другой группы, если не указано иное, относится к насыщенному углеводородному радикалу с прямой или разветвленной цепью, имеющему, если не указано иное, от 1 до 3 или от 1 до 6 атомов углерода, который присоединен к остальной молекуле простой связью, такому как метил, этил, пропил, бутил, 1-пентил, 1 метилэтил, 1,1-диметилэтил, 2-метилпропил, 3-метилбутил и 1-гексил. Термин "C1-3 алкандиил", используемый в данном описании отдельно или как часть другой группы,если не указано иное, относится к двухвалентному прямоцепочечному насыщенному углеводородному радикалу, имеющему от 1 до 3 атомов углерода, такому как, например, метилен; 1,2-этандиил; 1,3 пропандиил; и его разветвленные изомеры. Термин "C3-7 циклоалкил", используемый в данном описании отдельно или как часть другой группы,если не указано иное, является обобщенным обозначением циклопропила, циклобутила, циклопентила,циклогексила и циклогептила. Термин "С 3-7 циклоалкилС 1-3 алкил", используемый в данном описании отдельно или как часть другой группы, означает насыщенный циклический углеводородный радикал, имеющий от 3 до 7 атомов углерода, связанных посредством насыщенного углеводородного радикала с прямой цепью, имеющего от 1 до 3 атомов углерода, такой как циклопропилметил, циклопропилэтил, циклобутилметил и тому подобное. Термин "моно-, ди- или тригалогенС 1-3 алкил", используемый в данном описании отдельно или как часть другой группы, означает алкильную группу, как она определена выше, замещенную 1, 2 или 3 атомами галогена, такую как фторметил; дифторметил; трифторметил; 2,2,2-трифторэтил; 1,1-дифторэтил; 3,3,3-трифторпропил. Предпочтительными примерами этих групп являются трифторметил, 2,2,2 трифторэтил, 3,3,3-трифторпропил и 1,1-дифторэтил. Термин "C1-3 алкил, замещенный одним или более независимо выбранными заместителями галогено", используемый в данном описании отдельно или как часть другой группы, означает алкильную группу, как она определена выше, замещенную 1,2,3 или более атомами галогена, такую как фторметил; дифторметил; трифторметил; 2,2,2-трифторэтил; 1,1-дифторэтил; 3,3,3-трифторпропил. Предпочтительными примерами этих групп являются трифторметил, 2,2,2-трифторэтил, 3,3,3-трифторпропил и 1,1 дифторэтил. Всякий раз, когда в настоящем изобретении используется термин "замещенный", он означает, если иное не указано или не ясно из контекста, что один или более атомов водорода, предпочтительно от 1 до 3 атомов водорода, более предпочтительно от 1 до 2 атомов водорода, более предпочтительно 1 атом водорода, на атоме или радикале, указанном в выражении с использованием слова "замещенный", заменены выбранными из указанной группы, при условии, что не превышена нормальная валентность и что замещение приводит к химически стабильному соединению, т.е. соединению, которое является достаточно устойчивым для того, чтобы выдержать выделение из реакционной смеси с полезной степенью чистоты и изготовление в виде препарата терапевтического агента. Заместители, подпадающие под термины Het1 или Het3, могут быть присоединены к остальной части молекулы формулы (I) через любой доступный кольцевой атом углерода или гетероатом подходящим образом, если не указано иное. Так, например, когда заместитель Het1 представляет собой морфолинил,тогда он может представлять собой 2-морфолинил, 3-морфолинил или 4-морфолинил. Предпочтительными заместителями Het1 и Het3 являются заместители, связанные с остальной частью молекулы через атом азота. Когда X определен как СН 2-О, CH2-NH или HN-CH2, связи следует читать от R3 к фенильному или пиридинильному кольцу, так что, когда X определен как CH2-NH, следует понимать, что метилен связан с R3, a NH связан с фенильным или пиридинильным кольцом. Очевидно, что некоторые соединения формулы (I) и их фармацевтически приемлемые соли присоединения и их сольваты могут содержать один или более чем один центр хиральности и существовать в виде стереоизомерных форм. Термин "стереоизомерные формы" при использовании здесь выше означает все возможные изомерные формы, которые могут иметь соединения формулы (I). Если не упомянуто или не указано иное, химическое обозначение соединений означает смесь всех возможных стереохимически изомерных форм,где указанные смеси содержат все диастереомеры и энантиомеры основной молекулярной структуры. Более конкретно, стереогенные центры могут иметь R- или S-конфигурацию; заместители на двухвалентных циклических (частично) насыщенных радикалах могут иметь либо цис-, либо трансконфигурацию. Соединения, содержащие двойные связи, могут иметь Е- или Z-стереохимию при указанной двойной связи. Стереоизомерные формы соединений формулы (I) входят в объем данного изобретения. Когда указана конкретная стереоизомерная форма, это означает, что указанная форма, по существу,не содержит, т.е. ассоциирована менее чем с 50%, предпочтительно менее чем с 20%, более предпочтительно менее чем 10%, еще более предпочтительно менее чем 5%, в частности менее чем 2% и наиболее предпочтительно менее чем с 1% других изомеров. Таким образом, когда соединение формулы (I), например, указано как (R), это означает, что это соединение, по существу, не содержит (S)-изомер. Согласно правилам номенклатуры CAS, когда в соединении присутствуют два стереогенных центра известной абсолютной конфигурации, дескриптор R или S присваивается (на основании правила последовательности Кана-Инголда-Прелога) хиральному центру с наименьшим номером, центру отсчета. Конфигурацию второго стереогенного центра указывают, используя относительные дескрипторы [R,R] или [R,S], где R всегда указывается как центр отсчета и [R,R] указывает центры с такой же хиральностью и [R,S] указывает центры с другой хиральностью. Например, если в соединении хиральный центр с наименьшим номером имеет S-конфигурацию, а второй центр имеет R-конфигурацию, стереодескриптор будет указан как S-[R,S]. Предпочтительные аспекты соединений по данному изобретению изложены ниже. В одном воплощении изобретение относится к соединениям формулы (I) или их стереохимически изомерным формам, гдеX выбран из ковалентной связи; СН 2; -О-; СН 2 О; CH2NH или NH; или их фармацевтически приемлемым солям. В одном воплощении изобретение относится к соединениям формулы (I) и его стереохимически изомерным формам, где А представляет собой СН или N;R3 выбран из группы, состоящей из водорода; пропан-2-ила; циклопропила; 4-гидроксициклогексила; 4-гидрокси-4-циклопропил-циклогексила; фенила; 3,3-дифторпирролидин-1-ила; пиперидин-1-ила; 4-метил-4-гидроксипиперидин-1-ила; пиперазинила; 4-метилпиперазинила; тетрагидро-2 Нпиран-4-ила; морфолин-4-ила; 4-трифторметил-пиперидин-1-ила; 2-метил-пиридин-4-ила; 2-этилпиридин-4-ила; 2-циклопропил-пиридин-4-ила; 2-метил-пиридин-5-ила; 2-метокси-пиридин-5-ила; 3 фтор-пиридин-4-ила; 2,6-диметил-пиридин-4-ила и 2,6-диметил-пиридин-3-ила; и R4 и X такие, как определено выше; или их фармацевтически приемлемым солям. В одном воплощении изобретение относится к соединениям формулы (I) или их стереохимически изомерным формам, где А представляет собой СН или N;R3 выбран из группы, состоящей из пропан-2-ила; циклопропила; 4-гидрокси-4-циклопропилциклогексила; 3,3-дифторпирролидин-1-ила; пиперидин-1-ила; 4-метил-4-гидроксипиперидин-1-ила; пиперазинила; 4-метилпиперазинила; тетрагидро-2 Н-пиран-4-ила; морфолин-4-ила; 2-метил-пиридин-4 ила; 2-этил-пиридин-4-ила; 2-циклопропил-пиридин-4-ила; 2-метил-пиридин-5-ила; 2-метокси-пиридин 5-ила; 3-фтор-пиридин-4-ила; 2,6-диметил-пиридин-4-ила и 2,6-диметил-пиридин-3-ила; и R4 и X такие, как определено выше; или их фармацевтически приемлемым солям. В одном воплощении изобретение относится к соединениям формулы (I) или их стереохимически изомерным формам, гдеX выбран из ковалентной связи; -О-; CH2NH и -NH-; иR4 выбран из водорода; фторо и хлоро; или их фармацевтически приемлемым солям. В одном воплощении изобретение относится к соединениям формулы (I) или их стереохимически изомерным формам, гдеR3 выбран из группы, состоящей из незамещенного С 3-7 циклоалкила; пиперазин-1-ила; и пиридила,замещенного 1-2 заместителями, каждый из которых независимо выбран из группы, состоящей из C1-3 алкила, С 3-7 циклоалкила и галогено; А представляет собой СН;X выбран из ковалентной связи; -О- и -NH-;R4 выбран из водорода; фторо и хлоро; или их фармацевтически приемлемым солям. В одном воплощении изобретение относится к соединениям формулы (I) или их стереоизомерным формам, где А представляет собой СН;R3 выбран из водорода; незамещенного C3-7 циклоалкила; C3-7 циклоалкила, замещенного 1 или 2 заместителями, выбранными из гидроксила; незамещенного фенила; Het3; незамещенного пиридила; пиридила, замещенного 1 или 2 заместителями, независимо выбранными из C1-3 алкила;R4 выбран из водорода или галогено; иX выбран из группы, состоящей из ковалентной связи, C1-3 алкандиила, О, NH и СН 2-О; где каждый Het1 представляет собой пиперидинил, возможно замещенный незамещенным фенилом; и каждый Het3 представляет собой насыщенный гетероциклический радикал, выбранный из пирролидинила; пиперидинила; пиперазинила; тетрагидропиранила и морфолинила; каждый из которых возможно может быть замещен 1 или 2 заместителями, независимо выбранными из группы, состоящей из C1-6 алкила, моно-, ди- и тригалогенС 1-3 алкила; или их фармацевтически приемлемым солям. В одном воплощении изобретение относится к соединениям формулы (I) или их стереохимически изомерным формам, гдеR2 выбран из галогено и тригалогенС 1-3 алкила;R3 выбран из водорода; незамещенного C3-7 циклоалкила; С 3-7 циклоалкила, замещенного 1 или 2 заместителями гидроксила; незамещенного фенила; Het3; незамещенного пиридила и пиридила, замещенного 1 или 2 заместителями, независимо выбранными из C1-3 алкила;R4 представляет собой водород или галогено;X выбран из группы, состоящей из ковалентной связи, C1-3 алкандиила, О и NH; и A, Het1 и Het3 такие, как определено выше; или их фармацевтически приемлемым солям. В одном воплощении изобретение относится к соединениям формулы (I) или их стереохимически изомерным формам, гдеX выбран из ковалентной связи, СН 2, -О- и NH; и А такой, как определено выше; или их фармацевтически приемлемым солям. В одном воплощении изобретение относится к соединениям формулы (I) или их стереохимически изомерным формам, гдеR2 представляет собой хлор или CF3; иR3 выбран из группы, состоящей из водорода; циклопропила; 4-гидрокси-циклогексила; фенила; тетрагидропиран-4-ила; морфолин-4-ила; 4-трифторметил-пиперидин-1-ила; 2-метил-пиридин-4-ила и 2,6-диметил-пиридин-3-ила; и А, X и R4 такие, как определено выше; или их фармацевтически приемлемым солям. В другом воплощении изобретение относится к соединениям в соответствии с любыми другими воплощениями, где R3 представляет собой циклопропил. В другом воплощении изобретение относится к соединениям в соответствии с любыми другими воплощениями, где R3 представляет собой пиридил, замещенный 1 заместителем, выбранным из фтора,этила, циклопропила и метокси. В другом воплощении изобретение относится к соединениям в соответствии с любыми другими воплощениями, где R3 представляет собой пиридил, замещенный 1 или 2 радикалами метил. В другом воплощении изобретение относится к соединениям в соответствии с любыми другими воплощениями, где R3 представляет собой пиперазинил. В частности, изобретение относится к соединению общей формулы (Ia) или соединению общей формулы (Ib), где А представляет собой СН или N, соответственно, и остальные переменные такие, как определено выше В частности, изобретение относится к соединению общей формулы (I), или соединению общей формулы (Ia) или (Ib), как определено выше, где R4 присоединен по положению 3 фенильного или пиридинильного кольца, обозначенным ниже как (I'), (Ia') или (Ib') соответственно Конкретные предпочтительные соединения могут быть выбраны из следующей группы: 8-хлор-7-(4-феноксифенил)-3-(2,2,2-трифторэтил)-1,2,4-триазоло[4,3-а]пиридин; 8-хлор-3-(циклопропилметил)-7-(4-феноксифенил)-1,2,4-триазоло[4,3-а]пиридин; 8-хлор-3-циклобутил-7-(4-феноксифенил)-1,2,4-триазоло[4,3-а]пиридин; 8-хлор-3-(циклопропилметил)-7-[4-(4-морфолинил)фенил]-1,2,4-триазоло[4,3-а]пиридин; 8-хлор-3-(циклопропилметил)-7-[4-4-(трифторметил)-1-пиперидинил]метил]фенил]-1,2,4-триазоло[1,2,4]триазоло[4,3-а]пиридин; 7-[3-хлор-4-(пиперазин-1-илметил)фенил]-3-(циклопропилметил)-8-(трифторметил)[1,2,4]триазоло[4,3-а]пиридин; 2-фтор-4-[3-(циклопропилметил)-8-(трифторметил)[1,2,4]триазоло[4,3-а]пиридин-7-ил]-N-[(6-метоксипиридин-3-ил)метил]анилин; 2-фтор-4-[3-(циклопропилметил)-8-(трифторметил)[1,2,4]триазоло[4,3-а]пиридин-7-ил]-N-[(6-метилпиридин-3-ил)метил]анилин; 3-циклопропилметил-7-[3-фтор-4-(6-метокси-пиридин-3-илметокси)фенил]-8-трифторметил[1,2,4] триазоло[4,3-а]пиридин; 3-циклопропилметил-7-[3-фтор-4-(6-метокси-пиридин-3-илметокси)фенил]-8-трифторметил[1,2,4] триазоло[4,3-а]пиридин и 7-(3-хлор-4-(4'-метил)пиперазин-1-илфенил)-3-(циклопропилметил)-8-(трифторметил)[1,2,4]триазоло[4,3-а]пиридин; и их стереоизомерных форм и солей присоединения кислоты. В одном воплощении соединение формулы (I) выбрано из следующей группы: 8-хлор-7-[3-фтор-4-[(2-метил-4-пиридинил)окси]фенил]-3-(2,2,2-трифторэтил)-1,2,4-триазоло[4,3-а] пиридин; 3-(циклопропилметил)-7-[3-фтор-4-[(2-метил-4-пиридинил)окси]фенил]-8-(трифторметил)-1,2,4 триазоло[4,3-а]пиридин; 8-хлор-7-[4-[(2,6-диметил-3-пиридинил)окси]-3-фторфенил]-3-(2,2,2-трифторэтил)-1,2,4-триазоло[4,3-а]пиридин и 7-(3-хлор-4-пиперазин-1-илфенил)-3-(циклопропилметил)-8-(трифторметил)[1,2,4]триазоло[4,3-а] пиридин; и их стереоизомерных форм и солей присоединения кислоты. Для терапевтического применения соли соединений формулы (I) представляют собой соли, в которых противоион является фармацевтически приемлемым. Однако соли кислот и оснований, которые не являются фармацевтически приемлемыми, также могут найти применение, например, в получении или очистке фармацевтически приемлемого соединения. Все соли, независимо от того, являются ли они фармацевтически приемлемыми или нет, включены в объем настоящего изобретения. Подразумевается, что фармацевтически приемлемые соли присоединения кислот и оснований, как упомянуто выше или ниже в данном описании, содержат терапевтически активные формы солей присоединения нетоксичных кислот и оснований, которые способны образовывать соединения формулы (I). Фармацевтически приемлемые соли присоединения кислот могут быть получены соответственно путем обработки основной формы такой подходящей кислотой. Подходящие кислоты включают, например,неорганические кислоты, такие как галогеноводородные кислоты, например соляная или бромистоводородная кислота, серная, азотная, фосфорная и тому подобные кислоты; или органические кислоты,такие как, например, уксусная, пропановая, гидроксиуксусная, молочная, пировиноградная, щавелевая(т.е. этандиовая), малоновая, янтарная (т.е. бутандиовая кислота), малеиновая, фумаровая, яблочная,винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламовая, салициловая, п-аминосалициловая, памовая и тому подобные кислоты. И наоборот, указанные солевые формы могут быть превращены путем обработки подходящим основанием в форму свободного основания. Соединения формулы (I), содержащие кислотный протон, также могут быть превращены в их нетоксичные формы солей присоединения металлов или аминов путем обработки подходящими органическими и неорганическими основаниями. Подходящие формы солей оснований включают, например, аммониевые соли, соли щелочных и щелочно-земельных металлов, например соли лития, натрия, калия,магния, кальция и тому подобные, соли с органическими основаниями, например первичными, вторичными и третичными алифатическими и ароматическими аминами, такими как метиламин, этиламин,пропиламин, изопропиламин, четыре изомера бутиламина, диметиламин, диэтиламин, диэтаноламин,дипропиламин, диизопропиламин, ди-н-бутиламин, пирролидин, пиперидин, морфолин, триметиламин,триэтиламин, трипропиламин, хинуклидин, пиридин, хинолин и изохинолин; соли бензатина, N-метилD-глюкамина, гидрабамина и соли с аминокислотами, такими как, например, аргинин, лизин и тому подобное. И наоборот, солевая форма может быть превращена посредством обработки кислотой в свободную кислотную форму. Термин "сольват" включает формы присоединения растворителя, а также их соли, которые способны образовывать соединения формулы (I). Примерами таких форм присоединения растворителя являются, например, гидраты, алкоголяты и тому подобное. В рамках данной заявки элемент, в частности, когда он упоминается в отношении соединения формулы (I), содержит все изотопы и изотопные смеси этого элемента, либо встречающиеся в природе, либо синтетически полученные, либо с естественной распространенностью, либо в изотопно обогащенной форме. Меченые радиоактивными изотопами соединения формулы (I) могут содержать радиоактивный изотоп, выбранный из группы 3 Н, 11 С, 18F, 122I, 123I, 125I, 131I, 75Br, 76Br, 77Br и 82Br. Предпочтительно радиоактивный изотоп выбран из группы 3 Н, 11 С и 18F. Получение Соединения по изобретению обычно могут быть получены с помощью последовательности стадий,каждая из которых известна специалисту. В частности, соединения могут быть получены согласно сле- 11020556 дующим способам синтеза. Соединения формулы (I) могут быть синтезированы в форме рацемических смесей энантиомеров,которые могут быть отделены друг от друга с помощью процедур разделения, известных из уровня техники. Рацемические соединения формулы (I) могут быть превращены в соответствующие формы диастереомерных солей путем взаимодействия с подходящей хиральной кислотой. Указанные формы диастереомерных солей затем разделяют, например, посредством селективной или фракционной кристаллизации и энантиомеры высвобождают из них щелочью. Альтернативный способ разделения энантиомерных форм соединений формулы (I) включает жидкостную хроматографию с использованием хиральной стационарной фазы. Указанные чистые стереохимически изомерные формы также могут быть получены из соответствующих чистых стереохимически изомерных форм подходящих исходных веществ, при условии, что реакция протекает стереоспецифически. А. Получение конечных соединений Экспериментальная процедура 1 Конечное соединение формулы (I) может быть получено посредством взаимодействия промежуточного соединения формулы (II) с соединением формулы (III) в соответствии с реакционной схемой (1),взаимодействия, которое осуществляют в подходящем реакционно-инертном растворителе, таком как,например, 1,4-диоксан или в смесях инертных растворителей, такой как, например, 1,4 диоксан/DMF(диметилформамид), в присутствии подходящего основания, такого как, например, водныйNaHCO3 или Na2CO3, катализатора на основе Pd-комплекса, такого как, например, Pd(PPh3)4, в условиях нагревания, таких как, например, нагревание реакционной смеси при 150 С при помощи микроволнового излучения, например, в течение 10 мин. На реакционной схеме (1) все переменные определены, как в формуле (I), и галогено представляет собой хлоро, бромо или йодо. R7 и R8 могут представлять собой водород или алкил, или могут быть взяты вместе с образованием, например, двухвалентного радикала формулы -СН 2 СН 2-, -СН 2 СН 2 СН 2- или -С(СН 3)2 С(СН 3)2-. Реакционная схема 1 Экспериментальная процедура 2 Конечные соединения формулы (I) можно получать с помощью процедур, известных из уровня техники, посредством циклизации промежуточного соединения формулы (II) в присутствии галогенирующего агента, такого как, например, оксихлорид фосфора(V) (POCl3) или смесь трихлорацетонитрилтрифенилфосфин, в подходящем растворителе, таком как, например, 1,2-дихлорэтан или ацетонитрил,перемешивая при микроволновом облучении в течение подходящего периода времени, который обеспечивает завершение реакции, такого как, например, 50 мин, при температуре от 140 до 200 С. Альтернативно, конечные соединения формулы (I) могут быть получены путем нагревания промежуточного соединения формулы (IV) в течение подходящего периода времени, который обеспечивает завершение реакции, такого как, например, 1 ч при температуре 140-200 С. В реакционной схеме (2) все переменные являются такими, как определено в формуле (I). Реакционная схема 2 Экспериментальная процедура 3 Конечные соединения формулы (I) могут быть получены с помощью процедур, известных из уровня техники, по аналогии с синтезом, описанным в J. Org. Chem., 1966, 31, 251, или J. Heterocycl. Chem.,1970, 7, 1019, посредством циклизации промежуточного соединения формулы (V) в подходящих условиях в присутствии подходящего сложного ортоэфира формулы (VI), где R представляет собой подходящий заместитель, такой как, например, метильная группа, согласно реакционной схеме (3). Реакция может быть осуществлена в подходящем растворителе, таком как, например, ксилол. Обычно, смесь можно перемешивать в течение периода времени от 1 до 48 ч при температуре от 100 до 200 С. В реакционной схеме (3) все переменные являются такими, как определено в формуле (I). Альтернативно, конечные соединения формулы (I) могут быть получены с помощью процедур, известных из уровня техники, по аналогии с синтезом, описанным в Tetrahedron Letters, 2007, 48, 22372240, путем взаимодействия промежуточного соединения формулы (VI) с карбоновыми кислотами формулы (VII) или эквивалентами кислоты, такими как галогенангидриды формулы (VIII), с получением конечных соединений формулы (I). Реакцию можно осуществлять с использованием галогенирующего агента, такого как, например, смесь трихлорацетонитрил-трифенилфосфин, в присутствии подходящего растворителя, такого как, например, 1,2-дихлорэтан, перемешивая при температуре от 100 до 200 С в течение периода времени от 1 до 48 ч или при микроволновом облучении в течение 20 мин. В реакционной схеме (3) все переменные являются такими, как определено в формуле (I). Реакционная схема 3 Экспериментальная процедура 4 Конечные соединения формулы (I), где R1 представляет собой заместитель Het1-С 1 алкил или 4(2,3,4,5-тетрагидро-бензо[f][1,4]оксазепин)метил, как определено выше, где Het1 связан через атом азота,названные в данном описании (I-a), могут быть получены с помощью процедур, известных из уровня техники, путем взаимодействия промежуточного соединения формулы (IX) в стандартных условиях Манниха с промежуточным соединением формулы (X). Реакцию можно осуществлять в присутствии формальдегида с подходящим растворителем, таким как, например, уксусная кислота, перемешивая при подходящей температуре, например 80 С, в течение периода времени, который обеспечивает завершение реакции, например 16 ч. В реакционной схеме (4) все переменные являются такими, как определено в формуле (I). Реакционная схема 4 Экспериментальная процедура 5 Альтернативно, конечные соединения формулы (I), где R1 представляет собой заместитель Het1 С 1 алкил или 4-(2,3,4,5-тетрагидро-бензо[f][1,4]оксазепин)метил, как определено выше, где Het1 связан через атом азота, названные в данном описании (I-a), могут быть получены путем взаимодействия промежуточного соединения формулы (X) с промежуточным соединением формулы (XI) в условиях восстановительного аминирования, которые известны специалистам в данной области. Это проиллюстрировано на реакционной схеме (5), где все переменные являются такими, как определено в формуле (I). Реакция может быть осуществлена, например, в присутствии триацетоксиборгидрида в подходящем реакционноинертном растворителе, таком как, например, DCE, при подходящей температуре, обычно при к.т., в течение подходящего периода времени, который обеспечивает завершение реакции. Реакционная схема 5 Экспериментальная процедура 6 Конечные соединения формулы (I), где R3 представляет собой циклический радикал, названные в данном описании (I-b), могут быть получены посредством взаимодействия промежуточного соединения формулы (XII) в восстанавливающих условиях, которые известны специалистам в данной области. Реакция показана на реакционной схеме (6), где все заместители определены, как в формуле (I). Взаимодействие можно проводить в присутствии, например, боргидрида натрия в подходящем растворителе, таком как, например, метанол. Взаимодействие может быть осуществлено при подходящей температуре, обычно комнатной температуре, в течение подходящего периода времени, который обеспечивает завершение реакции. R5 и n такие, как они определены для радикала R3 в определении формулы (а). Экспериментальная процедура 7 Конечные соединения формулы (I), где R3 представляет собой циклический радикал, называемое в данном описании (I-e), могут быть получены известными в данной области способами, посредством взаимодействия промежуточного соединения формулы (XII) с промежуточным соединением формулы (XIII) в соответствии с реакционной схемой (7). Реакцию можно проводить в инертном растворителе, таком как, например, THF (тетрагидрофуран), диэтиловый эфир или диоксан. Обычно смесь можно перемешивать в течение 1-48 ч при температуре 0-100C. В реакционной схеме (7) все переменные определены как в формуле (I). R5 и n такие, как они определены для радикала R3 в определении формулы (а). Реакционная схема 7 Превращения разных функциональных групп, присутствующих в конечных соединениях, в другие функциональные группы формулы (I), могут быть осуществлены способами синтеза, хорошо известными специалисту в данной области техники. Например, соединения формулы (I), которые содержат карбаматную функциональную группу в своей структуре, могут быть гидролизованы следующими способами,известными специалисту в данной области техники, с получением конечных соединений формулы (I),содержащих амино. В. Получение промежуточных соединений Экспериментальная процедура 8 Промежуточные соединения формулы (IV) могут быть получены известными способами, по аналогии с описанными в J. Org. Chem., 1966, 31, 251, или J. Heterocycl. Chem., 1970, 7, 1019, путем взаимодействия промежуточного соединения формулы (V) в подходящих условиях в присутствии подходящего сложного ортоэфира формулы (VI), где R представляет собой подходящую группу, например метил, в соответствии с реакционной схемой (8). Реакцию можно проводить в подходящем растворителе, таком как, например, ксилол. Обычно смесь можно перемешивать в течение 1-48 ч при температуре 100-200C. В реакционной схеме (8) все переменные определены, как в формуле (I). Альтернативно, конечные соединения формулы (IV) могут быть получены известными в данной области способами по аналогии с синтезом, описанным в Tetrahedron Lett., 2007, 48, 2237-2240, посредством взаимодействия промежуточного соединения формулы (V) с карбоновой кислотой формулы (VII) или эквивалентами кислоты, такими как галогенангидриды формулы (VIII), с получением конечных соединений формулы (IV). Реакцию можно проводить, используя галогенирующий агент, такой как, например, смесь трихлорацетонитрил-трифенилфосфин, в присутствии подходящего растворителя, такого как, например, 1,2-дихлорэтан, и перемешивании при температуре 100-200 С в течение 1-48 ч, или при помощи микроволнового излучения в течение 20 мин. В реакционной схеме (8) все переменные определены, как в формуле (I). Реакционная схема 8 Экспериментальная процедура 9 Промежуточные соединения формулы (V) могут быть получены путем взаимодействия промежуточного соединения формулы (XIV) с гидразином согласно реакционной схеме (9), взаимодействия, которое осуществляют в подходящем реакционно-инертном растворителе, таком как, например, этанол илиTHF, в термических условиях, таких как, например, нагревание реакционной смеси, например, при 160 С при микроволновом облучении в течение 20 мин или классическое термическое нагревание при 90 С в течение 16 ч. В реакционной схеме (9) все переменные являются такими, как определено в формуле (I), и галогено представляет собой хлоро, бромо или йодо. Экспериментальная процедура 10 Промежуточные соединения формулы (XIV) могут быть получены посредством взаимодействия промежуточного соединения формулы (XV) с соединением формулы (III) в соответствии с реакционной схемой (10). Все переменные определены, как в формуле (I); галогено представляет собой хлоро, бромо или йодо, и R7 и R8 такие, как они определены в экспериментальной процедуре 1. Реакционная схема 10 Экспериментальная процедура 11 Промежуточные соединения формулы (IX) могут быть получены с помощью процедур, известных из уровня техники, по аналогии с синтезом, описанным в J. Org. Chem., 1966, 31, 251, или J. Heterocyclic.Chem., 1970, 7, 1019, посредством циклизации промежуточного соединения формулы (V) в подходящих условиях в присутствии подходящего сложного ортоэфира формулы (VI), где R1 представляет собой водород, и R представляет собой подходящую группу, такую как метил, например метилортоформиат (VIa), согласно реакционной схеме (11). Реакция может быть осуществлена без растворителя или в подходящем растворителе, таком как, например, ксилол. Обычно смесь можно перемешивать в течение периода времени от 1 до 48 ч при температуре 100-200 С. В реакционной схеме (11) все переменные являются такими, как определено в формуле (I). Реакционная схема 11 Экспериментальная процедура 12 Промежуточные соединения формулы (XI) могут быть получены путем взаимодействия промежуточного соединения формулы (IX) в стандартных условиях реакции Вильсмайера-Хаака (VilsmeierHaack), таких как, например, DMF и оксихлорид фосфора(V) (POCl3), при температуре от к.т. до 140 С при классическом термическом нагревании или при микроволновом облучении в течение подходящего периода времени, который обеспечивает завершение реакции, такого как, например, 1 ч. В реакционной схеме (12) все переменные являются такими, как определено в формуле (I). Реакционная схема 12 Экспериментальная процедура 13 Промежуточные соединения формулы (II) можно получать с помощью процедур, известных из уровня техники, посредством циклизации промежуточного соединения формулы (XVI) в присутствии галогенирующего агента, такого как, например, оксихлорид фосфора(V) (POCl3), в подходящем растворителе, таком как, например, 1,2-дихлорэтан, перемешивая при микроволновом облучении в течение подходящего периода времени, который обеспечивает завершение реакции, например 5 мин при температуре 140-200 С. В реакционной схеме (13) все переменные являются такими, как определено в формуле (I), и галогено представляет собой хлоро, бромо или йодо. Экспериментальная процедура 14 Альтернативно, промежуточные соединения формулы (II) могут быть получены с помощью процедур, известных из уровня техники, посредством циклизации промежуточного соединения формулы(XVII) при нагревании в течение подходящего периода времени, который обеспечивает завершение реакции, например 1 ч при температуре 140-200 С. В реакционной схеме (14) все переменные являются такими, как определено в формуле (I), и галогено представляет собой хлоро, бромо или йодо. Реакционная схема 14 Экспериментальная процедура 15 Промежуточные соединения формулы (XVI) могут быть получены с помощью процедур, известных из уровня техники, путем взаимодействия промежуточного соединения формулы (XVIII) с галогенангидридами формулы (VIII). Реакция может быть осуществлена с использованием инертного растворителя,такого как, например, DCM, в присутствии основания, такого как, например, TEA, например, при комнатной температуре в течение подходящего периода времени, который обеспечивает завершение реакции, например 20 мин. В реакционной схеме (15) все переменные являются такими, как определено в формуле (I). Реакционная схема 15 Экспериментальная процедура 16 Промежуточные соединения формулы (XVII) могут быть получены с помощью процедур, известных из уровня техники, путем взаимодействия промежуточного соединения формулы (XIX) с галогенангидридами формулы (VIII). Реакция может быть осуществлена с использованием инертного растворителя, такого как, например, DCM, в присутствии основания, такого как, например, TEA, например при к.т. в течение подходящего периода времени, который обеспечивает завершение реакции, например 20 мин. В реакционной схеме (16) все переменные являются такими, как определено в формуле (I), и галогено представляет собой хлоро, бромо или йодо. Реакционная схема 16 Экспериментальная процедура 17 Промежуточные соединения формулы (XIX) могут быть получены путем взаимодействия промежуточного соединения формулы (XV) с гидразином согласно реакционной схеме (17), реакции, которую осуществляют в подходящем реакционно-инертном растворителе, таком как, например, этанол, THF или 1,4-диоксан, в термических условиях, таких как, например, нагревание реакционной смеси, например при 160 С при микроволновом облучении в течение 30 мин или классическое термическое нагревание при 70 С в течение 16 ч. В реакционной схеме (17) R2 является таким, как определено в формуле (I), и галогено представляет собой хлоро, бромо или йодо. Экспериментальная процедура 18 Промежуточные соединения формулы (XVIII) могут быть получены путем взаимодействия промежуточного соединения формулы (XX) с гидразином согласно реакционной схеме (18), реакции, которую осуществляют в подходящем реакционно-инертном растворителе, таком как, например, этанол, THF или 1,4-диоксан, в температурных условиях, таких как, например, нагревание реакционной смеси, например при 160 С при микроволновом облучении в течение 30 мин или классическое термическое нагревание при 70 С в течение 16 ч. В реакционной схеме (18) R2 является таким, как определено в формуле (I), и галогено представляет собой хлоро, бромо или йодо. Реакционная схема 18 Экспериментальная процедура 19 Промежуточные соединения формулы (XX) могут быть получены путем взаимодействия промежуточного соединения формулы (XV) с бензиловым спиртом согласно реакционной схеме (19), реакции,которую осуществляют в подходящем реакционно-инертном растворителе, таком как, например, N,Nдиметилформамид, в присутствии подходящего основания, такого как, например, гидрид натрия, при комнатной температуре в течение подходящего периода времени, который обеспечивает завершение реакции, такого как, например, 1 ч. В реакционной схеме (19) R2 является таким, как определено в формуле(I), и галогено представляет собой хлоро, бромо или йодо. Реакционная схема 19 Экспериментальная процедура 20 Промежуточные соединения формулы (XV), где R2 представляет собой трифторметил, названные в данном описании (XV-a), могут быть получены путем взаимодействия промежуточного соединения формулы (XV), где R2 представляет собой йод, названного в данном описании (XV-b), с подходящим трифторметилирующим агентом, таким как, например, метиловый эфир фторсульфонил(дифтор)уксусной кислоты,согласно реакционной схеме (28). Эту реакцию осуществляют в подходящем реакционно-инертном растворителе, таком как, например, N,N-диметилформамид, в присутствии подходящего агента сочетания, такого как, например, йодид меди, в термических условиях, таких как, например, нагревание реакционной смеси,например при 160 С при микроволновом облучении в течение 45 мин. В реакционной схеме (20) галогено представляет собой хлоро, бромо или йодо. Реакционная схема 20 Экспериментальная процедура 21 Промежуточные соединения формулы (XV), где R2 представляет собой йод, названные в данном описании (XV-b), могут быть получены путем взаимодействия промежуточного соединения формулы(XXI) с сильным основанием, таким как, например, н-бутиллитий, и дополнительной обработки йодирующим агентом, таким как, например, йод. Эту реакцию осуществляют в подходящем реакционноинертном растворителе, таком как, например, THF, при низкой температуре, такой как, например, -78 С,в течение периода времени, который обеспечивает завершение реакции, такого как, например, 2 ч. В реакционной схеме (21) галогено может представлять собой хлоро, бромо или йодо. Экспериментальная процедура 22 Промежуточные соединения формулы (III) могут быть получены с помощью процедур, известных в данной области, посредством взаимодействия промежуточного соединения формулы (XXII) с подходящим источником бора, таким как, например, бис(пинаколато)дибор в присутствии палладиевого катализатора, такого как, например, 1,1'-бис(дифенилфосфино)ферроценпалладий(II)дихлорид, в инертном растворителе, таком как, например, DCM, в присутствии подходящей соли, такой как, например, ацетат калия, при умеренно высокой температуре, такой как, например, 110 С, в течение, например, 16 ч. Кроме того, соединения формулы (III) могут быть получены с помощью процедур, известных в данной области, посредством обмена металл-галоген и последующего взаимодействия с соответствующим источником бора из соединений формулы (XXII). Таким образом, например, взаимодействие промежуточного соединения формулы (XXII) с органолитиевым соединением, таким как, например, нбутиллитий, при умеренно низкой температурой, такой как, например, -40C, в инертном растворителе,таком как, например, THF, с последующим взаимодействием с соответствующим источником бора, таким как, например, триметоксиборгидрид. В реакционной схеме (22) все переменные определены, как в формуле (I), и R7 и R8 такие, как они определены в экспериментальной процедуре 1. Реакционная схема 22 Экспериментальная процедура 23 Промежуточные соединения формулы (XXII), где X представляет собой О, N, S, SO, SO2,С(ОН)(СН 3), СН 2-О, О-СН 2, CH2-NH, HN-CH2, CHF или CF2, могут быть получены с помощью процедур,известных в данной области, посредством взаимодействия промежуточного соединения формулы (XXIV) с подходящим промежуточным соединением формулы (XXIII), в присутствии подходящего основания,такого как, например, гидрид натрия, в инертном растворителе, таком как, например, диметилформамид,при умеренно высокой температуре, такой как, например, 180 С, либо при классическом или микроволновом нагревании, в течение подходящего периода времени, чтобы обеспечить завершение реакции. В реакционной схеме (23) все переменные определены, как в формуле (I), галогено может представлять собой хлоро, бромо или йодо, и LG представляет собой подходящую уходящую группу, такую как галоген или нитро. Реакционная схема 23 Экспериментальная процедура 24 Кроме того, соединения формулы (XXII) могут быть получены с помощью процедур, известных в данной области, из промежуточного соединения формулы (XXV) посредством взаимодействия сандермейеровского типа. В реакционной схеме (24) все переменные определены, как в формуле (I), галогено может представлять собой хлоро, бромо или йодо. Реакционная схема 24 Экспериментальная процедура 25 Промежуточные соединения формулы (XXV) могут быть получены с помощью процедур, известных в данной области, из промежуточного нитросоединения формулы (XXVI) через восстановление нитрогруппы до функциональной группы амино с помощью процедур, известных в данной области, таких как каталитическое гидрирование или применение хлорида олова(II) дигидрата в качестве восстановителя. В реакционной схеме (25) X представляет собой О, NH, S, SO, SO2, C(OH)(CH3), CH2-O, O-CH2, CH2NH, HN-СН 2, CHF и CF2, а все другие переменные определены, как в формуле (I). Экспериментальная процедура 26 Промежуточные соединения формулы (XXVI) могут быть получены с помощью процедур, известных в данной области, посредством взаимодействия промежуточного соединения формулы (XXVII) с подходящим промежуточным соединением формулы (XXVIII), в присутствии подходящего основания,такого как, например, Cs2CO3, в инертном растворителе, таком как, например, тетрагидрофуран, нагревания при подходящей температуре и в течение подходящего периода времени, который обеспечивает завершение реакции, или с традиционным нагреванием или при микроволновом облучении. В реакционной схеме (26) все переменные определены, как в формуле (I); и X представляет собой О, NH, S, SO, SO2,C(OH)(CH3), CH2-O, O-CH2, CH2-NH, HN-СН 2, CHF или CF2. Реакционная схема 26 Экспериментальная процедура 27 Промежуточные соединения формулы (III), где R3 представляет собой циклический радикал, называемые в данном описании (III-а), могут быть получены с помощью процедур, известных в данной области, посредством взаимодействия промежуточного соединения формулы (XXII), где R3 представляет собой циклический радикал, называемого в данном описании (XXII-а), с подходящим источником бора,как определено в экспериментальной процедуре (22). В реакционной схеме (27) все переменные определены, как в формуле (I). Реакционная схема 27 Экспериментальная процедура 28 Кроме того, соединения формулы (III), где R3 представляет собой циклический радикал, и X представляет собой NH, названные в данном описании (III-b), могут быть получены посредством взаимодействия промежуточного соединения формулы (XXIX) с циклическим кетонным производным формулы(XXX) в условиях восстановительного аминирования, которые известны специалистам в данной области,таких как, например, в присутствии триацетоксиборгидрида в подходящем реакционно-инертном растворителе, таком как, например, 1,2-дихлорэтан, при подходящей температуре, обычно комнатной температуре, в течение подходящего периода времени, который позволяет завершить реакцию. В реакционной схеме (28) все переменные определены, как в формуле (III). Реакционная схема 28 Экспериментальная процедура 29 Промежуточные соединения формулы (XXII), где R3 представляет собой циклический радикал, и X представляет собой N, называемые в данном описании (XXII-b), могут быть получены с помощью процедур, известных в данной области, посредством взаимодействия промежуточного соединения формулы(XXXI) с циклическим кетонным производным формулы (XXX), в условиях восстановительного аминирования, которые известны специалистам в данной области, например в присутствии триацетоксиборгидрида в подходящем реакционно-инертном растворителе, таком как, например, 1,2-дихлорэтан, при подходящей температуре, обычно комнатной температуре, в течение подходящего периода время, который позволяет завершить реакцию. В реакционной схеме (29) все переменные определены, как в формуле (I), и галогено может представлять собой хлоро, бромо или йодо. Экспериментальная процедура 30 Промежуточные соединения формулы (XXII), где R3 представляет собой циклический радикал, и X представляет собой О, называемые в данном описании (XXII-с), могут быть получены с помощью процедур, известных в данной области, посредством взаимодействия промежуточного соединения формулы(XXXII) с циклическим спиртом формулы (XXXIII), в присутствии фосфина, такого как, например, трифенилфосфин, и подходящего агента сочетания для Мицунобу-подобных сочетаний, такого как, например, ди-трет-бутилазадикарбоксилат в инертном растворителе, таком как, например, DCM, при умеренно низкой температуре, такой как, например, 25 С, в течение, например, 2 ч. В реакционной схеме (30) все переменные определены, как в формуле (I), и галогено может представлять собой хлоро, бромо или йодо. Реакционная схема 30 Исходные вещества формул (VI), (VII), (VIII), (X), (XIII), (XXII), (XXIV), (XXVIII), (XXIX), (XXX),(XXXI), (XXXII) и (XXXIII) представляют собой соединения, которые либо имеются в продаже, либо могут быть получены в соответствии с традиционными реакционными процедурами, обычно известными специалистам в данной области. Для получения HCl соли формы соединений можно использовать некоторые процедуры, известные специалистам в данной области. В типичной методике, например, свободное основание может быть растворено в DIPE или Et2O и затем может быть добавлен по каплям 6 н. раствор HCl в 2-пропаноле или 1 н. раствор HCl в Et2O. Смесь обычно перемешивают в течение 10 мин, после чего продукт можно отфильтровать. HCl соль обычно сушат в вакууме. Специалистам в данной области следует понимать, что в способах, описанных выше, функциональные группы промежуточных соединений могут нуждаться в блокировании защитными группами. В случае, когда функциональные группы промежуточных соединений были блокированы защитными группами, защиту этих функциональных групп можно удалить после реакционной стадии. Фармакология Соединения, предложенные в настоящем изобретении, являются положительными аллостерическими модуляторами (РАМ) метаботропных глутаматных рецепторов, в частности, они являются положительными аллостерическими модуляторами mGluR2. Соединения по настоящему изобретению, повидимому, связываются не с участком распознавания глутамата-ортостерическим участком связывания лиганда, а с аллостерическим участком в пределах седьмого трансмембранного участка рецептора. В присутствии глутамата или агониста mGluR2 соединения по настоящему изобретению увеличивают ответ mGluR2. Ожидается, что соединения, предложенные в настоящем изобретении, будут оказывать свое влияние на mGluR2 благодаря их способности увеличивать ответ таких рецепторов на глутамат или агонисты mGluR2, усиливая ответ данного рецептора. Как использовано в данном описании, термин "лечение" относится ко всем способам, при которых может наблюдаться замедление, прерывание, блокирование или прекращение развития заболевания, но не обязательно указывает на полное устранение всех симптомов. Следовательно, настоящее изобретение относится к соединению общей формулы (I), его стереоизомерным формам и фармацевтически приемлемым солям присоединения кислот или оснований и их сольватам для применения в качестве лекарственного средства. Изобретение также относится к применению соединения общей формулы (I), его стереоизомерных форм и фармацевтически приемлемых солей присоединения кислот или оснований и их сольватов или фармацевтической композиции по изобретению для изготовления лекарственного средства. Изобретение также относится к соединению общей формулы (I), его стереоизомерным формам и фармацевтически приемлемым солям присоединения кислот или оснований и их сольватам или к фармацевтической композиции по изобретению для применения в лечении или предупреждении, в частности лечении, состояния у млекопитающего, включая человека, лечение или предупреждение которого подвержено влиянию или облегчается нейромодуляторным эффектом аллостерических модуляторовmGluR2, в частности, его положительных аллостерических модуляторов. Настоящее изобретение также относится к применению соединения общей формулы (I), его стереоизомерных форм и фармацевтически приемлемых солей присоединения кислот или оснований и их сольватов или фармацевтической композиции по изобретению для изготовления лекарственного средства для лечения или предупреждения, в частности лечения, состояния у млекопитающего, включая человека,- 20020556 лечение или предупреждение которого подвержено влиянию или облегчается нейромодуляторным эффектом аллостерических модуляторов mGluR2, в частности, его положительных аллостерических модуляторов. Настоящее изобретение также относится к соединению общей формулы (I), его стереоизомерным формам и фармацевтически приемлемым солям присоединения кислот или оснований и их сольватам или к фармацевтической композиции по изобретению для применения в лечении, предупреждении,уменьшении интенсивности, контроле или уменьшении риска различных неврологических и психиатрических расстройств, ассоциированных с глутаматной дисфункцией у млекопитающего, включая человека, лечение или предупреждение которых подвержено влиянию или облегчается нейромодуляторным эффектом положительных аллостерических модуляторов mGluR2. Кроме того, настоящее изобретение относится к применению соединения общей формулы (I), его стереоизомерных форм и фармацевтически приемлемых солей присоединения кислот или оснований и их сольватов или к фармацевтической композиции по изобретению для изготовления лекарственного средства для лечения, предупреждения, уменьшения интенсивности, контроля или уменьшения риска различных неврологических и психиатрических расстройств, ассоциированных с глутаматной дисфункцией у млекопитающего, включая человека, лечение или предупреждение которых подвержено влиянию или облегчается нейромодуляторным эффектом положительных аллостерических модуляторов mGluR2. В частности, неврологические и психиатрические расстройства, ассоциированные с глутаматной дисфункцией, включают в себя одно или более из следующих состояний или заболеваний: острые неврологические и психиатрические расстройства, такие как, например, церебральная недостаточность после операции коронарного шунтирования и трансплантации сердца, инсульт, церебральная ишемия, травма спинного мозга, травма головы, перинатальная гипоксия, остановка сердца, гипогликемическое повреждение нейронов, деменция (включая СПИД-индуцированную деменцию), болезнь Альцгеймера, хорея Хантингтона, боковой амиотрофический склероз, поражение глаз, ретинопатия, когнитивные расстройства, идиопатическая и индуцированная лекарственными средствами болезнь Паркинсона, мышечные спазмы и расстройства, ассоциированные с мышечной спастичностью, включающие треморы, эпилепсию, судороги, мигрень (включая мигренозную головную боль), недержание мочи, толерантность к веществам, отмена веществ (включая такие вещества, как, например, опиаты, никотин, табачные продукты,спирт, бензодиазепины, кокаин, седативные средства, снотворные средства и т.д.), психоз, шизофрения,тревога (включая генерализованное тревожное расстройство, паническое расстройство и обсессивнокомпульсивное расстройство), расстройства настроения (включая депрессию, большое депрессивное расстройство, устойчивую к лечению депрессию, манию, биполярные расстройства, такие как биполярная мания), посттравматическое стрессовое расстройство, невралгия тройничного нерва, потеря слуха, шум в ушах, дегенерация желтого пятна глаза, рвота, отек головного мозга, боль (включая острые и хронические состояния, тяжелая боль, хроническая боль, невропатическая боль и посттравматическое боль),поздняя дискинезия, расстройства сна (включая нарколепсию), расстройство дефицита внимания/гиперактивности и расстройство поведения. В частности, состояние или заболевание представляет собой расстройство центральной нервной системы, выбранное из тревожных расстройств, психотических расстройств, расстройств личности, расстройств, ассоциированных с веществами, расстройств питания, расстройств настроения, мигрени, эпилепсии или судорожных расстройств, детских расстройств, когнитивных расстройств, нейродегенерации,нейротоксичности и ишемии. Предпочтительно расстройство центральной нервной системы представляет собой тревожное расстройство, выбранное из агорафобии, генерализованного тревожного расстройства (GAD), смешанной тревоги и депрессии, обсессивно-компульсивного расстройства (OCD), панического расстройства, посттравматического стрессового расстройства (PTSD), социофобии и других фобий. Предпочтительно расстройство центральной нервной системы представляет собой психотическое расстройство, выбранное из шизофрении, бредового расстройства, шизоаффективного расстройства, шизофреноформного расстройства и индуцированного веществами психотического расстройства. Предпочтительно расстройство центральной нервной системы представляет собой расстройство личности, выбранное из обсессивно-компульсивного расстройства личности и шизоидного, шизотипического расстройства. Предпочтительно расстройство центральной нервной системы представляет собой злоупотребление веществами или расстройство, связанное с веществами, выбранное из злоупотребления алкоголем, алкогольной зависимости, отмены алкоголя, делирия, связанного с отменой алкоголя, алкогольиндуцированного психотического расстройства, амфетаминовой зависимости, отмены амфетамина, кокаиновой зависимости, отмены кокаина, никотиновой зависимости, отмены никотина, опиоидной зависимости и отмены опиоидов. Предпочтительно расстройство центральной нервной системы представляет собой расстройство питания, выбранное из нервной анорексии и нервной булимии. Предпочтительно расстройство центральной нервной системы представляет собой расстройство настроения, выбранное из биполярных расстройств (I и II), циклотимического расстройства, депрессии,- 21020556 дистимического расстройства, большого депрессивного расстройства, устойчивой к лечению депрессии,биполярной депрессии и индуцированного веществами расстройства настроения. Предпочтительно расстройство центральной нервной системы представляет собой мигрень. Предпочтительно расстройство центральной нервной системы представляет собой эпилепсию или судорожное расстройство, выбранное из генерализованной несудорожной эпилепсии, генерализованной судорожной эпилепсии, эпилептического статуса малых припадков, эпилептического статуса больших припадков, парциальной эпилепсии с нарушением или без нарушения сознания, младенческих судорог,постоянной парциальной эпилепсии и других форм эпилепсии. Предпочтительно расстройство центральной нервной системы представляет собой расстройство дефицита внимания/гиперактивности. Предпочтительно расстройство центральной нервной системы представляет собой когнитивное расстройство, выбранное из делирия, индуцированного веществами персистирующего делирия, деменции, деменции вследствие ВИЧ-заболевания, деменции вследствие болезни Хантингтона, деменции вследствие болезни Паркинсона, деменции альцгеймеровского типа, поведенческих и психологических симптомов деменции, индуцированной веществами персистирующей деменции и умеренного когнитивного ухудшения. Из расстройств, упоминаемых выше, особое значение имеет лечение психоза, такого как шизофрения, поведенческих и психологических симптомов деменции, большого депрессивного расстройства,устойчивой к лечению депрессии, биполярной депрессии, тревоги, депрессии, генерализованного тревожного расстройства, посттравматического стрессового расстройства, биполярной мании, злоупотребления веществами и смешанной тревоги и депрессии. Из расстройств, упоминаемых выше, особое значение имеет лечение тревоги, шизофрении, мигрени, депрессии и эпилепсии. В настоящее время, в четвертом издании Справочника по диагностике и статистике психических расстройств (DiagnosticStatistical Manual of Mental Disorders) (DSM-IV) Американской психиатрической ассоциации предложено средство диагностики для идентификации расстройств, описанных в данной заявке. Специалист в данной области понимает, что существуют альтернативные терминологии, нозологии и системы классификации неврологических и психиатрических расстройств, описанных в данной заявке, и что они эволюционируют по мере развития медицины и науки. Поэтому изобретение также относится к соединению общей формулы (I), его стереоизомерным формам и фармацевтически приемлемым солям присоединения кислот или оснований и их сольватам для применения в лечении любого из заболеваний, упомянутых выше. Изобретение также относится к соединению общей формулы (I), его стереоизомерным формам и фармацевтически приемлемым солям присоединения кислот или оснований и их сольватам для применения в лечении любого из заболеваний, упомянутых выше. Изобретение также относится к соединению общей формулы (I), его стереоизомерным формам и фармацевтически приемлемым солям присоединения кислот или оснований и их сольватам для лечения или предупреждения, в частности лечения, любого из заболеваний, упомянутых выше. Изобретение также относится к применению соединения общей формулы (I), его стереоизомерных форм и фармацевтически приемлемых солей присоединения кислот или оснований и их сольватов для изготовления лекарственного средства для лечения или предупреждения любого из болезненных состояний, упомянутых выше. Изобретение также относится к применению соединения общей формулы (I), его стереоизомерных форм и фармацевтически приемлемых солей присоединения кислот или оснований и их сольватов для изготовления лекарственного средства для лечения любого из болезненных состояний, упомянутых выше. Соединения по настоящему изобретению можно вводить млекопитающим, предпочтительно людям, для лечения или предупреждения любого из заболеваний, упомянутых выше. С учетом полезности соединений формулы (I) предложен способ лечения теплокровных животных,включая людей, страдающих от любого из заболеваний, упомянутых выше, и способ предупреждения у теплокровных животных, включая людей, любого из заболеваний, упомянутых выше. Указанные способы включают введение, т.е. системное или местное введение, предпочтительно пероральное введение, терапевтически эффективного количества соединения формулы (I), его стереоизомерной формы и его фармацевтически приемлемой соли присоединения или сольвата, теплокровным животным, включая людей. Следовательно, изобретение также относится к способу предупреждения и/или лечения любого из заболеваний, упомянутых выше, включающему введение терапевтически эффективного количества соединения по изобретению пациенту, нуждающемуся в этом. Специалисту в данной области понятно, что терапевтически эффективное количество РАМ по настоящему изобретению представляет собой количество, достаточное для модулирования активностиmGluR2, и что это количество варьируется, наряду с прочим, в зависимости от типа заболевания, концентрации соединения в терапевтическом препарате и состояния пациента. Обычно количество РАМ, вво- 22020556 димого в качестве терапевтического агента для лечения заболеваний, при которых модуляция mGluR2 является полезной, таких как расстройства, описанные в данной заявке, будет определяться в каждом конкретном случае лечащим врачом. Обычно подходящая доза представляет собой дозу, которая дает в результате концентрацию РАМ в участке лечения в диапазоне от 0,5 нМ до 200 мкМ, чаще всего от 5 нМ до 50 мкМ. Для получения этих лечебных концентраций пациенту, нуждающемуся в лечении, вероятно будут вводить эффективное терапевтическое суточное количество от примерно 0,01 до примерно 50 мг/кг массы тела, предпочтительно от примерно 0,01 до примерно 25 мг/кг массы тела, более предпочтительно от примерно 0,01 до примерно 10 мг/кг массы тела, более предпочтительно от примерно 0,01 до примерно 2,5 мг/кг массы тела, еще более предпочтительно от примерно 0,05 до примерно 1 мг/кг массы тела, более предпочтительно от примерно 0,1 до примерно 0,5 мг/кг массы тела. Количество соединения согласно настоящему изобретению, также называемого здесь активным ингредиентом, которое требуется для достижения терапевтического эффекта, конечно, будет варьироваться в каждом конкретном случае в зависимости от конкретного соединения, пути введения, возраста и состояния реципиента, а также конкретного расстройства или заболевания, которое лечат. Способ лечения также может включать введение активного ингредиента в режиме от одного до четырех приемов внутрь в сутки. В этих способах лечения соединения по изобретению предпочтительно готовят в виде препаратов перед приемом. Как описано в данной заявке ниже, подходящие фармацевтические препараты получают с помощью известных процедур, используя хорошо известные и легкодоступные ингредиенты. Поскольку такие положительные аллостерические модуляторы mGluR2, включая соединения формулы (I), усиливают ответ mGluR2 на глутамат, предпочтительно, чтобы в способах по настоящему изобретению использовался эндогенный глутамат. Поскольку положительные аллостерические модуляторы mGluR2, включая соединения формулы (I),усиливают ответ mGluR2 на агонисты, понятно, что настоящее изобретение распространяется на лечение неврологических и психиатрических расстройств, ассоциированных с глутаматной дисфункцией, путем введения эффективного количества положительного аллостерического модулятора mGluR2, включая соединения формулы (I), в комбинации с агонистом mGluR2. Примеры агонистов mGluR2 включают в себя, например, LY379268; DCG-IV; LY-354740; LY-404039; LY-544344; LY-2140023; LY-181837; LY-389795; LY-446433; LY450477; талаглуметад; MGS0028; MGS0039; (-)-2-окса-4-аминобицикло[3,1,0]гексан-4,6-дикарбоксилат; (+)-4 амино-2-сульфонилбицикло[3,1,0]гексан-4,6-дикарбоновую кислоту; (+)-2-амино-4-фторбицикло [3,1,0] гексан-2,6-дикарбоновую кислоту; 1S,2R,5S,6S-2-амино-6-фтор-4-оксобицикло[3,1,0]гексан-2,6-дикарбоновую кислоту; 1S,2R,4S,6S-2-амино-6-фтор-4-гидроксибицикло[3,1,0]гексан-2,6-дикарбоновую кислоту; 1S,2R,3R,5S,6S-2-амино-3-фторбицикло[3,1,0]гексан-2,6-дикарбоновую кислоту; 1S,2R,3R,5S,6S-2-амино-6 фтор-3-гидроксибицикло[3,1,0]гексан-2,6-дикарбоновую кислоту; (+)-4-амино-2-сульфонилбицикло [3,1,0] гексан-4,6-дикарбоновую кислоту; (+)-2-амино-4-фторбицикло[3,1,0]гексан-2,6-дикарбоновую кислоту; 1S,2R,5S,6S-2-амино-6-фтор-4-оксобицикло[3,1,0]гексан-2,6-дикарбоновую кислоту; 1S,2R,4S,5S,6S-2-амино 6-фтор-4-гидроксибицикло[3,1,0]гексан-2,6-дикарбоновую кислоту; 1S,2R,3R,5S,6S-2-амино-3-фторбицикло[3,1,0]гексан-2,6-дикарбоновую кислоту; или 1S,2R,3S,5S,6S-2-амино-6-фтор-3-гидроксибицикло[3,1,0] гексан-2,6-дикарбоновую кислоту. Более предпочтительные агонисты mGluR2 включают в себя LY-379268;DCG-IV; LY-354740; LY-404039; LY-544344 или LY-2140023. Соединения по настоящему изобретению могут быть использованы в комбинации с одним или более другими лекарственными средствами в лечении, предупреждении, контроле, уменьшении интенсивности или уменьшении риска заболеваний или состояний, для которых соединения формулы (I) или другие лекарственные средства могут быть полезны, где комбинация лекарственных средств является более безопасной или более эффективной, чем любое из лекарственных средств по отдельности. Фармацевтические композиции В настоящем изобретении также предложены композиции для предупреждения или лечения заболеваний, при которых модулирование mGluR2-рецептора является полезным, таких как расстройства,описанные в данной заявке. Хотя активный ингредиент можно вводить сам по себе, предпочтительно представлять его в виде фармацевтической композиции. Соответственно, настоящее изобретение также относится к фармацевтической композиции, содержащей фармацевтически приемлемый носитель или разбавитель и, в качестве активного ингредиента,терапевтически эффективное количество соединения по изобретению, в частности соединения формулы(I), его фармацевтически приемлемой соли, его сольвата или его стереохимически изомерной формы. Носитель или разбавитель должны быть "приемлемыми" в смысле совместимости с другими ингредиентами композиции и невредными для реципиентов. Соединения по изобретению, в частности соединения формулы (I), их фармацевтически приемлемые соли, сольваты и их стереохимически изомерные формы, или любая их подгруппа или комбинация,могут быть приготовлены в виде различных фармацевтических форм для целей введения. В качестве подходящих композиций могут быть перечислены все композиции, обычно используемые для системного введения лекарственных средств. Фармацевтические композиции по настоящему изобретению могут быть получены любыми способами, хорошо известными в фармакологии, например с использованием таких способов, как способы,описанные в Gennaro et al. Remington's Pharmaceutical Sciences (18th ed., Mack Publishing Company, 1990,см. особенно часть 8: Фармацевтические препараты и их изготовление). Для получения фармацевтических композиций по настоящему изобретению терапевтически эффективное количество конкретного соединения, возможно в форме соли, в качестве активного ингредиента объединяют в однородной смеси с фармацевтически приемлемым носителем или разбавителем, который может принимать разнообразные формы в зависимости от формы препарата, желательной для введения. Эти фармацевтические композиции желательны в однократной лекарственной форме, подходящей, в частности, для перорального, местного, ректального или подкожного введения, посредством парентеральной инъекции или посредством ингаляции. Например, при получении композиций в пероральной лекарственной форме можно использовать любую из обычных фармацевтических сред, таких как, например, вода, гликоли, масла, спирты и тому подобное в случае пероральных жидких препаратов, таких как, например, суспензии, сиропы, эликсиры, эмульсии и растворы; или твердые носители, такие как, например, крахмалы, сахара, каолин, разбавители, смазывающие вещества, связующие вещества, разрыхлители и тому подобное в случае порошков, пилюль, капсул и таблеток. Из-за легкости введения пероральное введение является предпочтительным, таблетки и капсулы представляют наиболее полезные пероральные стандартные лекарственные формы, и в этом случае используют твердые фармацевтические носители. Для парентеральных композиций носитель обычно будет содержать стерильную воду, по меньшей мере в значительной степени, хотя могут быть включены и другие ингредиенты, например поверхностно-активные вещества, способствующие растворению. Например, могут быть получены инъецируемые растворы, в которых носитель содержит физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Также могут быть получены инъецируемые суспензии, в этом случае могут быть использованы подходящие жидкие носители, суспендирующие агенты и тому подобное. Также включены препараты в твердой форме, которые предназначены для превращения, непосредственно перед применением, в препараты в жидкой форме. В композициях, подходящих для подкожного введения, носитель возможно содержит агент для усиления проникновения и/или подходящий увлажняющий агент, возможно объединенный с подходящими добавками любой природы в небольших пропорциях, где указанные добавки не оказывают значительного вредного эффекта на кожу. Указанные добавки могут облегчать введение в кожу и/или могут быть полезными для получения желательных композиций. Эти композиции можно вводить различными путями, например в виде трансдермального пластыря, точечно, в виде мази. Особенно предпочтительно готовить вышеупомянутые фармацевтические композиции в стандартной лекарственной форме для удобства введения и однородности дозировки. Стандартная лекарственная форма, используемая в данной заявке, относится к физически дискретным единицам, применимым в качестве однократных дозировок, причем каждая единица содержит заданное количество активного ингредиента, рассчитанное для получения желательного терапевтического эффекта в сочетании с необходимым фармацевтическим носителем. Примерами таких стандартных лекарственных форм являются таблетки (включая таблетки с насечкой или таблетки с покрытием), капсулы, пилюли, пакетики с порошком,лепешки, суппозитории, инъецируемые растворы или суспензии и тому подобное, объем чайной ложки,объем столовой ложки и их раздельные кратные единицы. Поскольку соединения по изобретению представляют собой перорально вводимые соединения,фармацевтические композиции, содержащие указанные соединения для перорального введения, являются особенно предпочтительными. С целью увеличения растворимости и/или стабильности соединений формулы (I) в фармацевтических композициях может быть предпочтительным использование -, - или -циклодекстринов или их производных, в частности гидроксиалкил-замещенных циклодекстринов, например 2-гидроксипропил-циклодекстрина или сульфобутилциклодекстрина. Также сорастворители, такие как спирты, могут улучшать растворимость и/или стабильность соединений по изобретению в фармацевтических композициях. Точная дозировка и частота введения зависит от конкретного используемого соединения формулы(I), конкретного состояния, которое лечат, тяжести состояния, которое лечат, возраста, массы, пола, степени расстройства и общего физического состояния конкретного пациента, а также от другого лекарственного средства, которое пациент может принимать, как хорошо известно специалистам в данной области. Более того, очевидно, что указанное эффективное суточное количество может быть уменьшено или увеличено в зависимости от реакции субъекта, которого лечат, и/или в зависимости от оценки врача,прописывающего соединения по настоящему изобретению. В зависимости от способа введения фармацевтическая композиция будет содержать от 0,05 до 99 мас.%, предпочтительно от 0,1 до 70 мас.%, более предпочтительно от 0,1 до 50 мас.% активного ингредиента и от 1 до 99,95 мас.%, предпочтительно от 30 до 99,9 мас.%, более предпочтительно от 50 до 99,9 мас.% фармацевтически приемлемого носителя, где все количества в процентах основаны на общей массе композиции. Как уже упомянуто, изобретение также относится к фармацевтической композиции, содержащей соединения по изобретению и одно или более других лекарственных средств, для применения в качестве лекарственного средства или для применения в лечении, предупреждении, контроле, уменьшении интенсивности или уменьшении риска заболеваний или состояний, для которых соединения формулы (I) или другие лекарственные средства могут быть полезны. Также предполагается применение такой композиции для изготовления лекарственного средства, а также применение такой композиции для изготовления лекарственного средства в лечении, предупреждении, контроле, уменьшении интенсивности или уменьшении риска заболеваний или состояний, для которых соединения формулы (I) или другие лекарственные средства могут быть полезны. Настоящее изобретение также относится к комбинации соединения по настоящему изобретению и ортостерического агониста mGluR2. Настоящее изобретение также относится к такой комбинации для применения в качестве лекарственного средства. Настоящее изобретение также относится к продукту, содержащему: (а) соединение по настоящему изобретению, его фармацевтически приемлемую соль или его сольват, и (б) ортостерический агонист mGluR2, в виде комбинированного препарата для одновременного, раздельного или последовательного применения в лечении или предупреждении состояния у млекопитающего, включая человека, лечение или предупреждение которого подвержено влиянию или облегчается нейромодуляторным эффектом аллостерических модуляторовmGluR2, в частности положительных аллостерических модуляторов mGluR2. Различные лекарственные средства такой комбинации или продукта могут быть объединены в одном препарате вместе с фармацевтически приемлемыми носителями или разбавителями, или каждое из них может находиться в отдельном препарате вместе с фармацевтически приемлемыми носителями или разбавителями. Следующие примеры предназначены для иллюстрации, но не для ограничения объема настоящего изобретения. Примеры Химия Некоторые способы получения соединений по настоящему изобретению проиллюстрированы в следующих примерах. Если не указано иное, все исходные вещества получали от коммерческих поставщиков и использовали без дополнительной очистки. Ниже в данном описании "CI" означает химическую ионизацию; "DAD" означает детектор с диодной матрицей; "THF" означает тетрагидрофуран; "DMF" означает N,N-диметилформамид; "EtOAc" означает этилацетат; "DCM" означает дихлорметан; "DCE" означает 1,2-дихлорэтан; "BINAP" означает 1,1'[1,1'-бинафталин]-2,2'-диилбис[1,1-дифенил-фосфин]; "DBU" означает 1,8-диаза-7-бицикло[5,4,0] ундецен; "л" означает литр; "LRMS" означает масс-спектрометрию/спектры низкого разрешения; "HRMS" означает масс-спектры/спектрометрию высокого разрешения; "NH4Ac" означает ацетат аммония;"Na2S2O3" означает тиосульфат натрия; "АсОН" означает уксусную кислоту; "т.пл." означает точку плавления; "мин" означает минуты; "ч" означает часы; "с" означает секунду(ы); "к.т." означает комнатную температуру; "Et3N" или "TEA" означают триэтиламин; "TOF" означает время пролета; "NH4Cl" означает хлорид аммония; "Cs2CO3" означает карбонат цезия; "K2CO3" означает карбонат калия; "Pd(PPh3)4" означает тетракис(трифенилфосфин)палладий(0). Реакции с использованием микроволн проводили в одномодовом реакторе: микроволновом реакторе Initiator Sixty EXP (Biotage AB), или в многомодовом реакторе: MicroSYNTH Labstation (Milestone,Inc.). Тонкослойную хроматографию (TLC) осуществляли на пластинах с силикагелем 60 F254 (Merck),используя химически чистые растворители. Колоночную флэш-хроматографию осуществляли на силикагеле с размером частиц 60 , меш = 230-400 (Merck), используя стандартные процедуры. Автоматизированную колоночную флэш-хроматографию осуществляли, используя готовые для присоединения картриджи от Merck, на нерегулярном силикагеле с размером частиц 15-40 мкм (одноразовые флэш-колонки с нормальной фазой) в системе SPOT или FLASH от Armen Instrument. Подготовительный пример 1 2,4-Дибром-никотинонитрил (D1) К раствору имеющегося в продаже 4-метокси-2-оксо-1,2-дигидро-3-пиридинкарбонитрила (95,47 г,333 ммоль) [C.A.S. 21642-98-8] в CH3CN (670 мл) добавляли порциями оксибромид фосфора(V) (250 г,166 ммоль). Полученную суспензию нагревали при 60 С в течение 16 ч. После охлаждения до к.т. реакционную смесь разбавляли EtOAc и промывали водой. Органический слой отделяли и промывали NaHCO3 (водный нас. раствор), сушили (MgSO4) и концентрировали в вакууме. Неочищенный продукт,- 25020556 полученный таким образом, растирали с DIPE с получением промежуточного соединения D1 (34,5 г,79%) в виде белого твердого вещества. Подготовительный пример 2 4-Бензилокси-2-бром-никотинонитрил (D2) К суспензии NaH (1,756 г, 45,818 ммоль, минеральное масло 60%) в DMF (200 мл), охлажденной при 0 С, добавляли бензиловый спирт (4,542 г, 42 ммоль). Полученную смесь перемешивали в течение 5 мин. Затем быстро добавляли соединение D1 (10 г, 38,18 ммоль). Полученную реакционную смесь постепенно нагревали до к.т. и перемешивали в течение 1 ч, затем гасили NH4Cl (водный нас. раствор) и разбавляли Н 2 О. Полученную смесь экстрагировали Et2O. Органический слой отделяли, сушили (Na2SO4) и концентрировали в вакууме. Неочищенный продукт очищали посредством колоночной хроматографии(силикагель; DCM/7 М раствор NH3 в МеОН вплоть до 1% в качестве элюента). Целевые фракции собирали и концентрировали в вакууме с получением промежуточного соединения D2 (9,2 г, 83%). Подготовительный пример 3 4-Бензилокси-2-гидразино-никотинонитрил (D3) К раствору промежуточного соединения D2 (1,2 г, 4,15 ммоль) в THF (12 мл) добавляли моногидрат гидразина (0,416 г, 8,301 ммоль). Реакционную смесь подвергали микроволновому нагреванию при 150 С в течение 1 мин. После охлаждения дополнительное количество моногидрата гидразина (1 экв.) добавляли в реакционную смесь, которую затем подвергали микроволновому нагреванию при 150 С в течение 0,5 мин. После охлаждения реакционную смесь концентрировали в вакууме. Полученный таким образом остаток растирали с Et2O с получением промежуточного соединения D3 (0,95 г, 95%). Подготовительный пример 4 К раствору промежуточного соединения D3 (4,099 г, 17,06 ммоль) в сухом DCM (112 мл) добавляли триэтиламин (2,76 г, 27,294 ммоль) и циклопропил-ацетилхлорид (3,438 г, 29 ммоль). Полученную реакционную смесь перемешивали при к.т. в течение 20 мин, затем концентрировали в вакууме с получением промежуточного соединения D4 (5 г, 91%), которое использовали без дополнительной очистки. Подготовительный пример 5 7-Хлор-3-(циклопропилметил)[1,2,4]триазоло[4,3-а]пиридин-8-карбонитрил (D5) Промежуточное соединение D4 (1,4 г, 4,343 ммоль) и оксихлорид фосфора(V) (0,810 мл, 8,686 ммоль) в DCE (15 мл) подвергали микроволновому нагреванию при 150 С в течение 5 мин. После охлаждения смесь разбавляли DCM и промывали NaHCO3 (водный нас. раствор). Органический слой отделяли, сушили (Na2SO4) и концентрировали в вакууме. Неочищенный продукт очищали посредством колоночной хроматографии (силикагель; DCM/7 М раствор NH3 в МеОН вплоть до 2% в качестве элюента). Целевые фракции собирали и концентрировали в вакууме с получением промежуточного соединения D5 К раствору н-бутиллития (27,6 мл, 69 ммоль, 2,5 М в гексанах) в сухом Et2O (150 мл), охлажденному при -78C, в атмосфере азота добавляли по каплям 2,2,6,6-тетраметилпиперидин (11,64 мл, 69 ммоль). Полученную реакционную смесь перемешивали при -78 С в течение 10 мин. Затем добавляли по каплям раствор 2,3-дихлорпиридина (10 г, 67,57 ммоль) в сухом THF (75 мл). Смесь перемешивали при -78 С в течение 30 мин и затем добавляли раствор йода (25,38 г, 100 ммоль) в сухом THF (75 мл). Смесь оставля- 26020556 ли нагреваться до к.т. в течение ночи, гасили Na2S2O3 (водный нас. раствор) и дважды экстрагировалиEtOAc. Объединенные органические экстракты промывали NaHCO3 (водный нас. раствор), сушили(Na2SO4) и концентрировали в вакууме. Неочищенный остаток осаждали гептаном, отфильтровывали и сушили с получением промежуточного соединения D6 (8,21 г, 44%) в виде бледно-кремового твердого вещества. Подготовительный пример 7 К раствору промежуточного соединения D6 (8 г, 29,21 ммоль) в 1,4-диоксане (450 мл) добавляли моногидрат гидразина (14,169 мл, 175,255 ммоль). Реакционную смесь нагревали в герметично закрытой пробирке при 70 С в течение 16 ч. После охлаждения к реакционной смеси добавляли NH4OH (32%-ный водный раствор) и концентрировали ее в вакууме. Белый твердый остаток, полученный таким образом,переносили в EtOH и нагревали. Суспензию, полученную таким образом, оставляли охлаждаться и полученный осадок отфильтровывали, промывали EtOH и сушили в эксикаторе с получением промежуточного соединения D7 (2,67 г, 52%) в виде белого твердого вещества. Подготовительный пример 8 К раствору промежуточного соединения D7 (0,73 г, 2,709 ммоль) в сухом DCM (8 мл), охлажденному при 0C, добавляли триэтиламин (0,562 мл, 4,064 ммоль) и циклопропил-ацетилхлорид (0,385 г, 3,251 ммоль). Полученную реакционную смесь перемешивали при к.т. в течение 16 ч. К этой смеси затем добавляли NaHCO3 (водный нас. раствор). Полученный раствор затем экстрагировали DCM. Органический слой отделяли, сушили (MgSO4) и концентрировали в вакууме с получением промежуточного соединения D8 (0,94 г, 99%). Подготовительный пример 9 8-Хлор-3-циклопропилметил-7-йодо-1,2,4-триазоло[4,3-а]пиридин (D9) Промежуточное соединение D8 (0,74 г, 2,389 ммоль) нагревали при 160 С в течение 40 мин. После охлаждения коричневую смолу растирали с DIPE, получая промежуточное соединение D9 (0,74 г, 93%). Подготовительный пример 10 К раствору промежуточного соединения D7 (2,528 г, 9,38 ммоль) в сухом DCM (15 мл), охлажденному при 0C, добавляли триэтиламин (3,244 мл, 23,45 ммоль) и 3,3,3-трифторпропионилхлорид (1,924 г,13,132 ммоль). Полученную реакционную смесь перемешивали при к.т. в течение 3 ч. После данного периода времени добавляли NaHCO3 (водный нас. раствор). Полученный раствор затем экстрагировалиDCM. Органический слой отделяли, сушили (MgSO4) и концентрировали в вакууме. Полученный таким образом остаток растирали с DIPE с получением промежуточного соединения D10 (4 г, 55%). Промежуточное соединение D10 (4 г, 5,27 ммоль) нагревали при 170 С в течение 4 ч. После охлаждения коричневую камедь растирали с DIPE. Полученное таким образом твердое вещество затем переносили в МеОН и полученную суспензию отфильтровывали. Маточные растворы затем концентрировали в вакууме. Неочищенный продукт очищали посредством колоночной хроматографии (силикагель; градиент DCM (7 М раствор NH3 в МеОН)/EtOAc в качестве элюента). Целевые фракции собирали и концентрировали в вакууме с получением промежуточного соединения D11 (0,85 г, 45%). Подготовительный пример 12 2,4-Дихлор-3-йод-пиридин (D12) К раствору 2,4-дихлорпиридина (5,2 г, 35,137 ммоль) и диизопропиламина (3,911 г, 38,651 ммоль) в сухом THF (40 мл), охлажденному при -78 С, в атмосфере азота добавляли по каплям н-бутиллитий(24,157 мл, 38,651 ммоль, 1,6 М в гексанах). Полученную реакционную смесь перемешивали при -78 С в течение 45 мин, затем добавляли по каплям раствор йода (9,81 г, 38,651 ммоль) в сухом THF (20 мл) и смесь дополнительно перемешивали при -78 С в течение 1 ч. Смесь оставляли нагреваться до к.т., разбавляли EtOAc и гасили NH4Cl (водный нас. раствор) и Na2S2O3 (водный нас. раствор). Органический слой отделяли, промывали NaHCO3 (водный нас. раствор), сушили (Na2SO4) и концентрировали в вакууме. Неочищенный продукт очищали посредством колоночной хроматографии (силикагель; гептан/DCM вплоть до 20% в качестве элюента). Целевые фракции собирали и концентрировали в вакууме с получением промежуточного соединения D12 (7,8 г, 81%). Подготовительный пример 13 2,4-Дихлор-3-трифторметил-пиридин (D13) К смеси промежуточного соединения D12 (2 г, 7,302 ммоль) в DMF (50 мл) добавляли метиловый эфир фторсульфонил-дифторуксусной кислоты (1,858 мл, 14,605 ммоль) [C.A.S. 680-15-9] и йодид меди(I) (2,796 г, 14,605 ммоль). Реакционную смесь нагревали в герметично закрытой пробирке при 100 С в течение 5 ч. После охлаждения растворитель выпаривали в вакууме. Неочищенный продукт очищали посредством колоночной хроматографии (силикагель; DCM в качестве элюента). Целевые фракции собирали и концентрировали в вакууме с получением промежуточного соединения D13 (1,5 г, 95%). Подготовительный пример 14 4-Бензилокси-3-трифторметил-2-хлор-пиридин (D14) К суспензии NaH (0,487 г, 12,732 ммоль, 60%-ное минеральное масло) в DMF (50 мл), охлажденной при 0 С, добавляли бензиловый спирт (1,262 мл, 12,2 ммоль). Полученную смесь перемешивали в течение 2 мин. Затем добавляли промежуточное соединение D13 (2,5 г, 11,575 ммоль). Полученную реакционную смесь перемешивали в течение 1 ч, позволяя ей постепенно нагреваться до к.т., гасили водой и экстрагировали Et2O. Органический слой отделяли, сушили (Na2SO4) и концентрировали в вакууме. Неочищенный продукт очищали посредством колоночной хроматографии (силикагель; градиент гептан/DCM в качестве элюента). Целевые фракции собирали и концентрировали в вакууме с получением промежуточного соединения D14 (1,1 г, 33%). Подготовительный пример 15 К суспензии промежуточного соединения D14 (1,09 г, 3,789 ммоль) в 1,4-диоксане (9 мл) добавляли моногидрат гидразина (3,676 мл, 75,78 ммоль). Реакционную смесь подвергали микроволновому нагре- 28020556 ванию при 160 С в течение 30 мин. После охлаждения полученный раствор концентрировали в вакууме. Полученный таким образом остаток растворяли в DCM и промывали NaHCO3 (водный нас. раствор). Органический слой отделяли, сушили (Na2SO4) и концентрировали в вакууме с получением промежуточного соединения D15 (0,890 г, 83%) в виде белого твердого вещества. Подготовительный пример 16 К раствору промежуточного соединения D15 (0,890 г, 3,142 ммоль) в сухом DCM (3 мл) добавляли триэтиламин (0,653 мл, 4,713 ммоль) и циклопропил-ацетилхлорид [C.A.S. 543222-65-5] (0,373 г, 3,142 ммоль). Полученную реакционную смесь перемешивали при 0C в течение 20 мин. Полученную смесь затем концентрировали в вакууме с получением промежуточного соединения D16 (1,1 г, 96%). Подготовительный пример 17 7-Хлор-8-трифторметил-3-циклопропилметил-1,2,4-триазоло[4,3-а]пиридин (D17) Раствор промежуточного соединения D16 (1,14 г, 1,872 ммоль) и оксихлорида фосфора(V) (0,349 г,3,744 ммоль) в CH3CN (10 мл) нагревали при 150 С при микроволновом облучении в течение 10 мин. После охлаждения полученную реакционную смесь разбавляли DCM и промывали NaHCO3 (водный нас. раствор), сушили (Na2SO4) и концентрировали в вакууме. Неочищенный продукт очищали посредством колоночной хроматографии (силикагель; DCM/7 М раствор NH3 в МеОН вплоть до 20% в качестве элюента). Целевые фракции собирали и концентрировали в вакууме с получением промежуточного соединения D17 (0,261 г, 51%) в виде белого твердого вещества. Подготовительный пример 18 2,3-Дихлор-4-фенил-пиридин (D18) К смеси промежуточного соединения D6 (0,5 г, 1,826 ммоль) в 1,4-диоксане (5 мл) в атмосфере азота добавляли фенилбороновую кислоту (0,267 г, 2,191 ммоль), Pd(PPh3)4 (0,211 г, 0,183 ммоль) и NaHCO3(5 мл, водный нас. раствор). Реакционную смесь подвергали микроволновому нагреванию при 150 С в течение 10 мин. После охлаждения смесь фильтровали через подушку диатомитовой земли и промывалиEtOAc. Фильтрат упаривали в вакууме и остаток очищали посредством колоночной хроматографии (силикагель; DCM/MeOH вплоть до 2% в качестве элюента). Целевые фракции собирали и упаривали в вакууме с получением промежуточного соединения D18 (0,4 г, 98%). Подготовительный пример 19 К раствору промежуточного соединения D18 (0,4 г, 1,785 ммоль) в EtOH (4 мл) добавляли моногидрат гидразина (1,732 мл, 35,7 ммоль). Реакционную смесь подвергали микроволновому нагреванию при 160C в течение 20 мин. После охлаждения растворитель упаривали в вакууме. Полученный таким образом остаток переносили в DCM, сушили (Na2SO4) и упаривали в вакууме с получением промежуточного соединения D19 (0,3 г, 77%) в виде белого твердого вещества. Подготовительный пример 20 8-Хлор-7-(4-фенил)-1,2,4-триазоло[4,3-а]пиридин (D20) Промежуточное соединение D19 (0,25 г, 1,138 ммоль) и триэтилортоформиат (2,839 мл, 17,071 ммоль) в ксилоле (3 мл) нагревали в герметично закрытой пробирке при 180 С в течение 1 ч. После охлаждения полученную смесь упаривали в вакууме. Полученный таким образом остаток растирали с Et2O
МПК / Метки
МПК: A61K 31/444, C07D 471/04, A61K 31/445, A61P 25/00, A61K 31/437
Метки: положительных, рецепторов, mglur2, 7-арил-1,2,4-триазоло[4,3-a]пиридина, аллостерических, качестве, модуляторов, производные, применение
Код ссылки
<a href="https://eas.patents.su/30-20556-proizvodnye-7-aril-124-triazolo43-apiridina-i-ih-primenenie-v-kachestve-polozhitelnyh-allostericheskih-modulyatorov-receptorov-mglur2.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 7-арил-1,2,4-триазоло[4,3-a]пиридина и их применение в качестве положительных аллостерических модуляторов рецепторов mglur2</a>
Предыдущий патент: Крыльчатка для перемешивания гидросмеси в металлургических процессах
Следующий патент: Плита уплотнительная для вентиляционных шахт
Случайный патент: Имидазопиридиновые производные, способ их получения и терапевтическое использование