Имидазопиридиновые производные, способ их получения и терапевтическое использование
Номер патента: 22690
Опубликовано: 29.02.2016
Авторы: Эрбер Корантен, Алькуфф Шанталь, Кирш Райнхард, Лассаль Жильбер
Формула / Реферат
1. Соединение формулы (I)
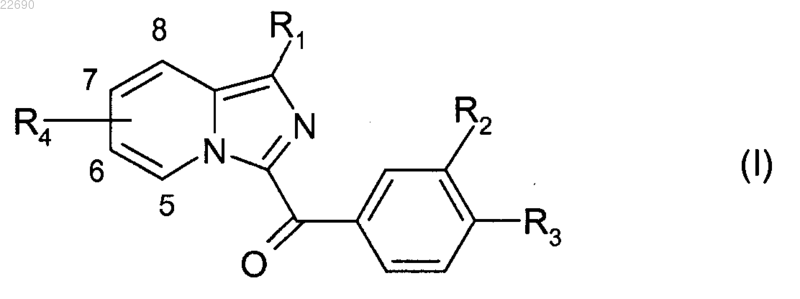
в которой R1 представляет собой атом водорода, С3-С6-алкильную группу, необязательно замещенную -COOR5, С2-С6-алкенильную группу, необязательно замещенную -COOR5, -CONR5R6-группу, -NR5-SO2R6-группу или С6-С10-арильную группу, С5-С10-гетероарильную группу, указанная С6-С10-арильная или С5-С10-гетероарильная группа необязательно замещена одной или двумя группами, выбранными из атомов галогена, C1-С6-алкильных групп, циклоалкильных групп, -COOR5, -CF3, -OCF3, -CN, -C(NH2)NOH, -OR5, -O-C1-С6-алкиленовая цепь-COOR5, -O-С1-С6-алкиленовая цепь-NR5R6, -O-C1-С6-алкиленовая цепь-NR7R8, -C1-С6-алкиленовая цепь-OR5, -C1-C6-алкиленовая цепь-COOR5, -CONR5R6, -CO-NR5-OR6, -CO-NR5-SO2R7, -CONR5-C1-С6-алкиленовая цепь-NR5R6, -CONR5-C1-С6-алкиленовая цепь-NR7R8, -NR5R6, -NC(O)N(CH3)2, -CO-C1-C6-алкиленовая цепь, -CO(OC1-С6-алкиленовая цепь)nОН, СОО-С1-С6-алкиленовая цепь-NR5R6, COO-C1-С6-алкиленовая цепь-NR7R8 и 5-членных гетероарильных групп, указанные гетероарильные группы необязательно замещены одной или двумя C1-С6-алкильными группами или оксогруппой;
n является целым числом от 1 до 3;
R2 и R3 вместе образуют с атомами углерода фенильного ядра, с которыми они связаны, 6-членный азотсодержащий гетероцикл, соответствующий одной из формул (А), (В) или (С), представленных ниже
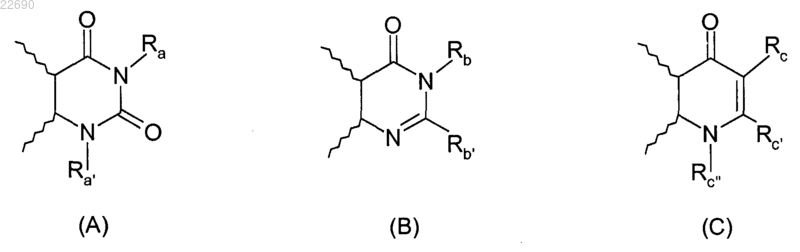
в которых волнистые линии представляют собой фенильное ядро, с которым группы R2 и R3 связаны; и
Ra представляет собой атом водорода или С1-С6-алкильную группу, галоген-С1-С6-алкильную группу, группы -Alk-CF3, -Alk-COOR5, -Alk-CONR5R6, -Alk-NR7R8, -Alk-циклоалкильную, -Alk-C6-C10-арильную, -Alk-O-С6-С10-арильную, -Alk-гетероарильную или гетероарильную группу, где С6-С10-арильная или гетероарильная группа необязательно замещена одним или двумя атомами галогена и/или C1-С6-алкильными, циклоалкильными группами, группами -CF3, -OCF3 или -O-R5;
Ra' представляет собой атом водорода или линейную разветвленную С1-С6-алкильную группу, С3-С6-циклическую или С1-С6-алкилС3-С6-циклоалкильную, С3-С6-циклоалкилС1-С6-алкильную и С1-С6-алкилС3-С6-циклоалкилС1-С6-алкильную группу, или группу -Alk-OR5, -Alk-NR5R6 или -Alk-NR7R8, группа Ra' необязательно замещена одним или двумя атомами галогена;
Rb представляет собой атом водорода или С1-С6-алкильную группу;
Rb' представляет собой атом водорода или С1-С6-алкильную, циклоалкильную, фенильную или -Alk-COOR5 группу;
Rc представляет собой атом водорода или группу -CO-NR5R6;
Rс' представляет собой атом водорода или С1-С6-алкильную группу;
Rс'' представляет собой атом водорода или С1-С6-алкильную группу;
R4-группа, локализованная в положении 6, 7 или 8 имидазопиридинового ядра, представляет собой
атом водорода,
группу -COOR5,
группу -CO-NR5-C1-С6-алкиленовая цепь-NR5R6,
группу -CO-NR5-C1-С6-алкиленовая цепь-NR7R8 или
группу -CO-NR5-C1-С6-алкиленовая цепь-OR6;
R5 и R6, которые могут быть идентичными или различными, представляют собой атомы водорода, С1-С6-алкильные группы, циклоалкильные группы или Ms-(мезил) группу, где C1-C6-алкильные группы необязательно замещены -NR7R8 группой;
R7 и R8, которые могут быть идентичными или различными, представляют собой атомы водорода или С1-С6-алкильные группы или иначе R7 и R8 вместе образуют от 3- до 8-членное насыщенное кольцо, которое может необязательно содержать гетероатом, выбранный из азота и/или кислорода;
Alk представляет собой линейную разветвленную C1-C6-алкиленовую цепь, циклический С3-С6-алкилен или С1-С6-алкилС3-С6-циклоалкилен, С3-С6-циклоалкилС1-С6-алкилен и С1-С6-алкилС3-С6-циклоалкилС1-С6-алкилен;
гетероарильная группа содержит от 5 до 10 атомов, включая от 1 до 4 гетероатомов, выбранных из азота, кислорода или серы;
циклоалкильная группа содержит от 3 до 8 атомов углерода,
необязательно в виде его фармацевтически приемлемой соли.
2. Соединение по п.1, в котором R1 представляет собой
атом водорода,
C1-С6-алкильную группу, которая не замещена или замещена -COOR5,
С2-С6-алкенильную группу, которая не замещена или замещена -COOR5,
-CONR5R6-группу,
-NR5-SO2R6-группу или
фенильную группу, необязательно замещенную одной или двумя группами, выбранными из
атомов галогена;
С1-С6-алкильных групп, необязательно замещенных -COOR5;
-CN, -C(NH2)NOH, -COOR5, -CONR5R6, -CO-NR5-OR6, -CO-NR5-SO2R6, -COC1-С6-алкиленовой цепи,
-CO(ОАС1-С6-алкиленовая цепь)nOH, -OR5, -OCF3, -О-С1-С6-алкиленовая цепь-COOR5, -C1-C6-алкиленовая цепь-OR5, -NR5R6 или -NC(О)N(CH3)2 групп,
5-членных гетероарилов, необязательно замещенных С1-С6-алкильной группой или атомом кислорода,
в котором R5 и R6, которые могут быть идентичными или различными, представляют собой атомы водорода или С1-С6-алкильные группы, необязательно замещенные группой -NR7R8,
R7 представляет собой атом водорода, алкильную группу, содержащую 1 или 2 атома углерода, n является целым числом от 1 до 3, или
гетероарильную группу, которая необязательно конденсирована и/или необязательно замещена одной или двумя группами, выбранными из С1-С6-алкильных групп, групп OR5, COOR5, -NR5R6 и циклоалкильных групп, и атома кислорода, в которой R5 и R6, которые могут быть идентичными или различными, представляют собой атомы водорода или алкильные группы, содержащие 1 или 2 атома углерода,
необязательно в виде его фармацевтически приемлемой соли.
3. Соединение по п.1, в котором R2 и R3 вместе образуют с атомами углерода фенильного ядра, с которыми они связаны, 6-членный азотсодержащий гетероцикл, соответствующий любой из формул (А) и (В), как определено в п.1, необязательно в виде его фармацевтически приемлемой соли.
4. Соединение по п.1, в котором R2 и R3 вместе образуют с атомами углерода фенильного ядра, с которыми они связаны, 6-членный азотсодержащий гетероцикл, соответствующий формуле (А), как определено в п.1, необязательно в виде его фармацевтически приемлемой соли.
5. Соединение по любому одному из предыдущих пунктов, в котором формула (А) или (В) является такой, что
Ra представляет собой атом водорода или алкильную группу, необязательно замещенную одним или двумя галогенами; -AlkCONR5R6; галогеналкильную группу; -CH2-COOR5; -Alk-гетероарильную, -Alk-O-фенильную или -Alk-фенильную группу, где фенильная группа необязательно замещена одной или двумя алкильными группами, и/или OR5, и/или атомами галогена; -Alk-циклоалкил,
Ra' представляет собой атом водорода или линейную, разветвленную, циклическую или частично циклическую алкильную группу, или группу -CH2-OR5 или -Alk-NR5R6,
Rb представляет собой атом водорода или алкильную группу,
Rb' представляет собой атом водорода или алкильную, фенильную или -CH2-COOR5 группу, в которой алкильные группы содержат от 1 до 6 атомов углерода, группа R5 является такой, как описано в п.1,
необязательно в виде его фармацевтически приемлемой соли.
6. Соединение по любому одному из предыдущих пунктов, в котором R4 представляет собой атом водорода или группы -СООН, -CO-NH-Alk-NR7R8 или -CO-NH-Alk-OH, или иначе алкильную группу, предпочтительно содержащую от 1 до 3 атомов углерода, которая не замещена, в котором группы Alk, R7 и R8 являются такими, как описано в п.1.
7. Соединение по любому одному из предыдущих пунктов, выбранное из следующих соединений:
6-(имидазо[1,5-а]пиридин-3-илкарбонил)-3-пропилхиназолин-2,4(1H,3H)-диона,
3-{3-[(2,4-диоксо-3-пропил-1,2,3,4-тетрагидрохиназолин-6-ил)карбонил]имидазо[1,5-а]пиридин-1-ил}бензойной кислоты,
3-[(2,4-диоксо-3-пропил-1,2,3,4-тетрагидрохиназолин-6-ил)карбонил]имидазо[1,5-а]пиридин-6-карбоновой кислоты,
3-(3-{[3-(4-фторбензил)-1-метил-2,4-диоксо-1,2,3,4-тетрагидрохиназолин-6-ил]карбонил}имидазо[1,5-а]пиридин-1-ил)бензойной кислоты,
3-{3[(2,4-диоксо-3-пропил-1,2,3,4-тетрагидрохиназолин-6-ил)карбонил]имидазо[1,5-а]пиридин-1-ил}бензамида,
6-({1-[3-(5-метил-1,3,4-оксадиазол-2-ил)фенил]имидазо[1,5-а]пиридин-3-ил}карбонил)-3-пропилхиназолин-2,4(1H,3H)-диона,
6-({1-[3-(3-метил-1,2,4-оксадиазол-5-ил)фенил]имидазо[1,5-а]пиридин-3-ил}карбонил)-3-пропилхиназолин-2,4(1H,3H)-диона,
N-{3-[(2,4-диоксо-3-пропил-1,2,3,4-тетрагидрохиназолин-6-ил)карбонил]имидазо[1,5-а]пиридин-1-ил}метансульфонамида,
2-морфолин-4-илэтил 3-(3-{[3-(4-фторбензил)-1-метил-2,4-диоксо-1,2,3,4-тетрагидрохиназолин-6-ил]карбонил}имидазо[1,5-а]пиридин-1-ил)бензоата,
N-[2-(диметиламино)этил]-3-(3-{[3-(4-фторбензил)-1-метил-2,4-диоксо-1,2,3,4-тетрагидрохиназолин-6-ил]карбонил}имидазо[1,5-а]пиридин-1-ил)бензамида,
3-(3-{[3-(4-фторбензил)-1-пропил-2,4-диоксо-1,2,3,4-тетрагидрохиназолин-6-ил]карбонил}имидазо[1,5-а]пиридин-1-ил)бензойной кислоты,
3-(4-фторбензил)-1-метил-6-[(1-пиридин-3-илимидазо[1,5-а]пиридин-3-ил)карбонил]хиназолин-2,4(1H,3H)-диона,
3-{3-[(2-метил-4-оксо-3-пропил-3,4-дигидрохиназолин-6-ил)карбонил]имидазо[1,5-а]пиридин-1-ил}бензойной кислоты,
3-{3-[(2-метил-4-оксо-3-пропил-3,4-дигидрохиназолин-6-ил)карбонил]имидазо[1,5-а]пиридин-1-ил}бензамида,
6-(имидазо[1,5-а]пиридин-3-илкарбонил)хиназолин-4(3H)-она,
N,N,1,2-тетраметил-4-оксо-6-{[1-(пиридин-3-ил)имидазо[1,5-а]пиридин-3-ил]карбонил}-1,4-дигидрохинолин-3-карбоксамида,
3-[3-({3-[2-(4-фторфенокси)этил]-1-пропил-2,4-диоксо-1,2,3,4-тетрагидрохиназолин-6-ил}карбонил)имидазо[1,5-а]пиридин-1-ил]бензойной кислоты,
необязательно в виде его фармацевтически приемлемой соли.
8. Соединение формулы
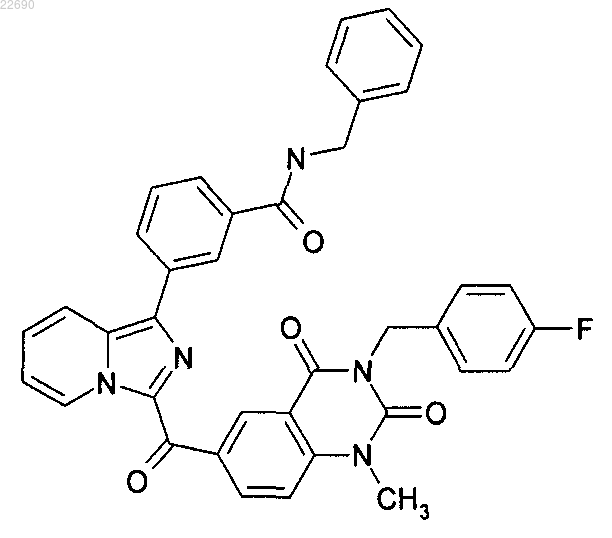
необязательно в виде его фармацевтически приемлемой соли.
9. Способ получения соединений формулы (I) по любому одному из пп.1-7, в которой R2 и R3 вместе образуют азотсодержащий гетероцикл формулы (А), как определено в п.1, в которой R1 и Ra' представляют собой атомы водорода, отличающийся тем, что
соединение формулы (IV)
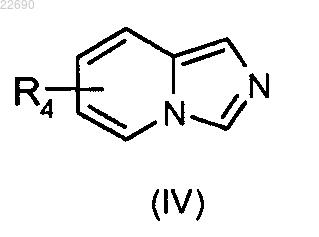
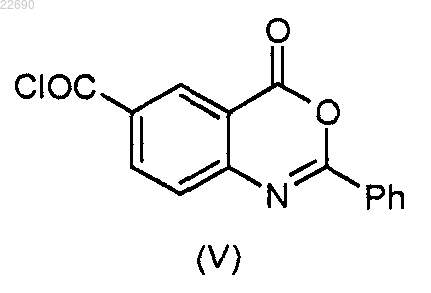
в которой группа R4 является такой, как определено в п.1, конденсируют с соединением формулы (V)
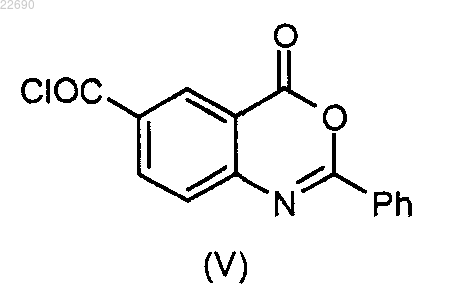
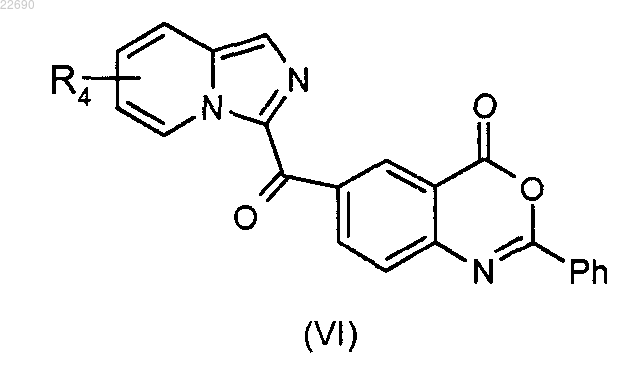
с получением соединения формулы (VI)
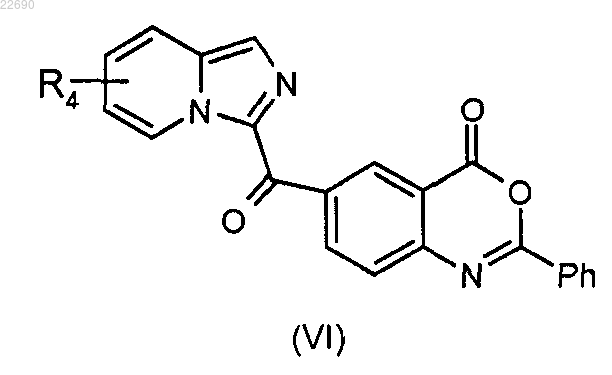
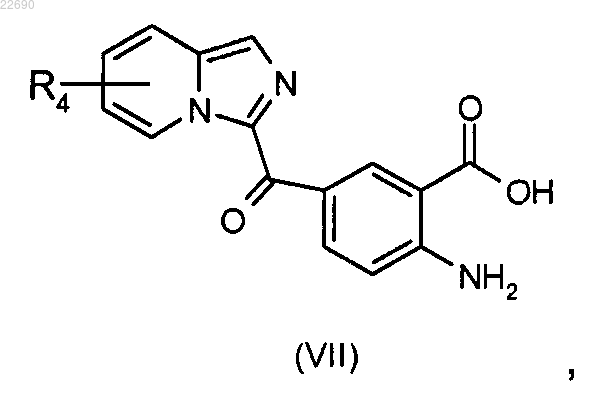
соединение формулы (VI) подвергают реакции гидролиза в основной среде для получения соединения формулы (VII)
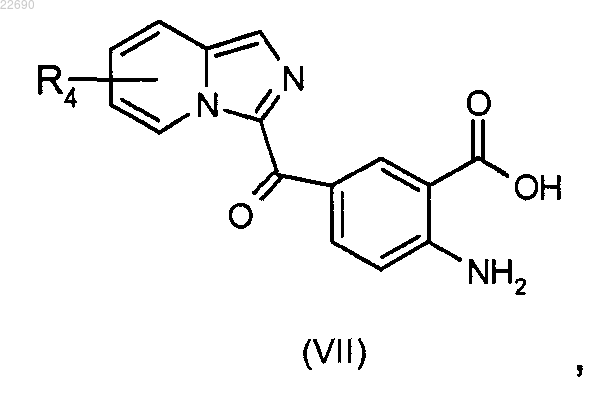
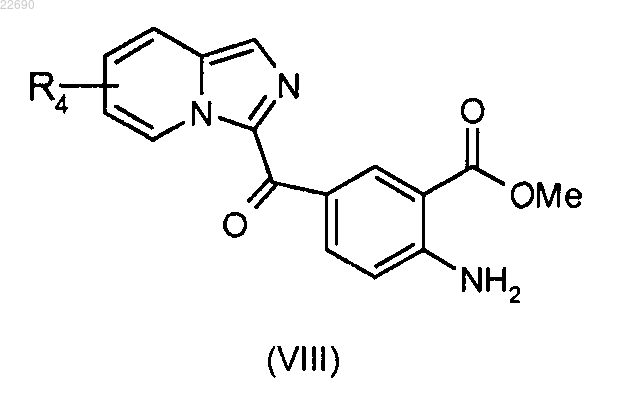
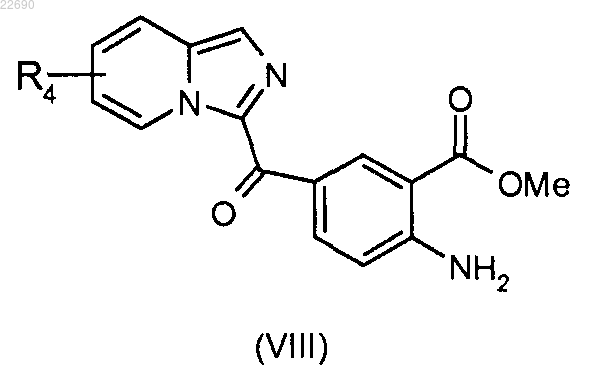
реакцию этерификации соединения формулы (VII) осуществляют с тем, чтобы получить соединение формулы (VIII)
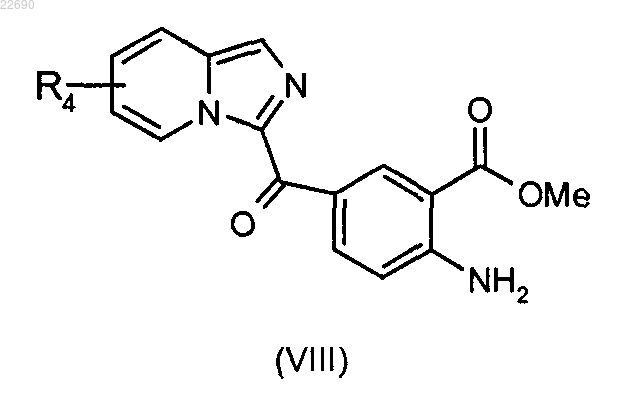
соединение формулы (VIII) подвергают действию трифосгена с образованием изоцианата, соответствующего соединению (VIII), и затем полученный изоцианат конденсируют с амином формулы RaNH2, где группа Ra является такой, как определено в п.1, для получения мочевины формулы (IX)
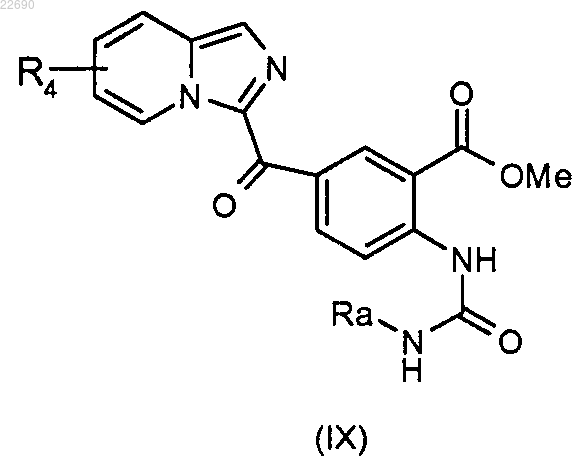
мочевину формулы (IX) подвергают реакции циклизации в основной среде.
10. Способ получения производного соединения формулы (I) по одному из пп.1-7, в которой R2 и R3 вместе образуют азотсодержащий гетероцикл формулы (А), как определено в п.1, группа R1 является такой, как определено в п.1, при условии, что R1 не представляет собой атом водорода, и группа R4 является такой, как определено в п.1, отличающийся тем, что
соединение формулы (IV)
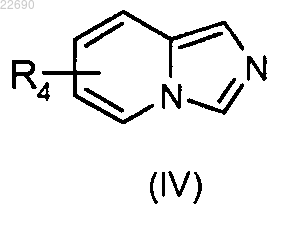
в которой группа R4 является такой, как определено в п.1, конденсируют с соединением формулы (V)
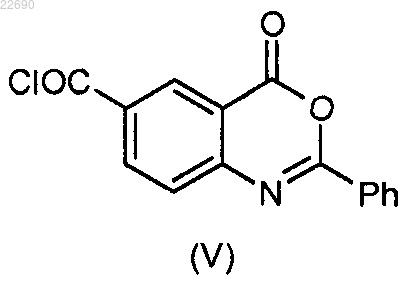
для получения соединения формулы (VI)
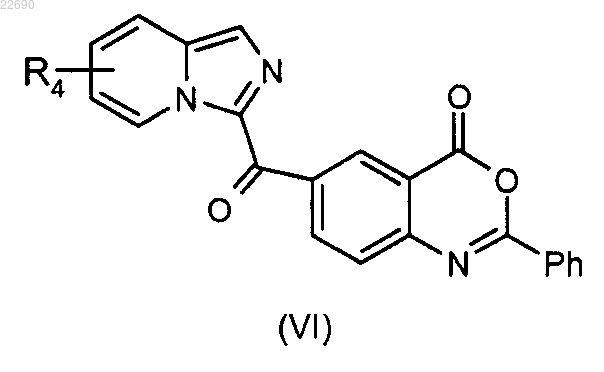
соединение формулы (VI) подвергают реакции гидролиза в основной среде для получения соединения формулы (VII)
реакцию этерификации соединения формулы (VII) осуществляют с тем, чтобы получить соединение формулы (VIII)
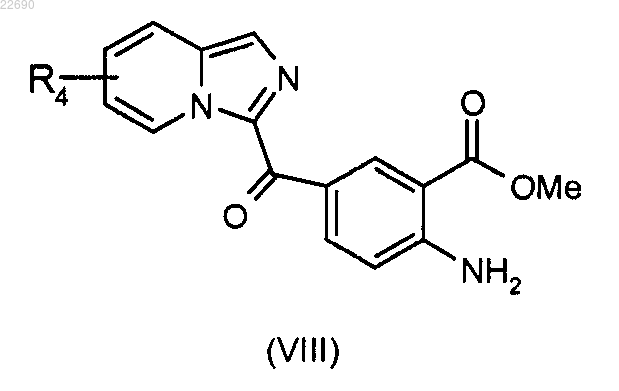
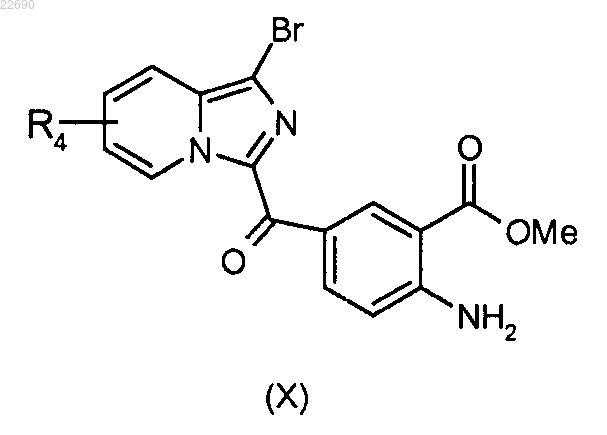
соединение формулы (VIII) подвергают реакции бромирования для получения соединения формулы (X)
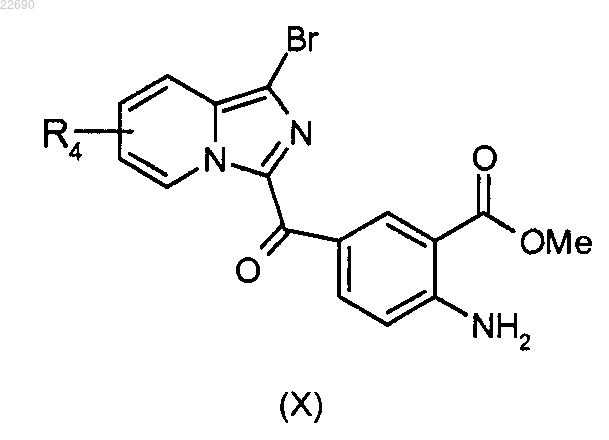
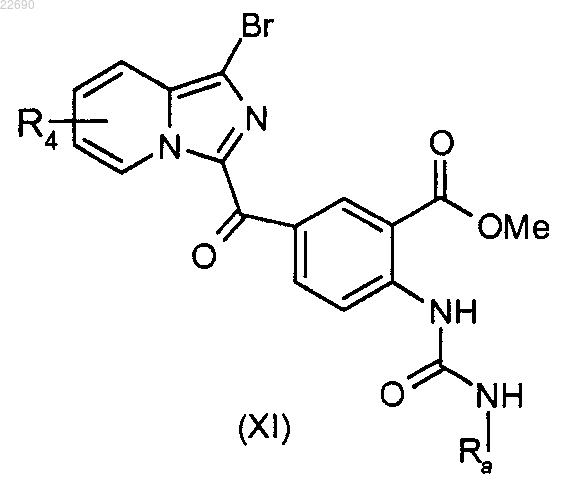
производное соединение формулы (X) подвергают действию трифосгена и образуется изоцианат, соответствующий соединению формулы (X), который конденсируют с амином формулы RaNH2, где группа Ra является такой, как определено в п.1, для получения мочевины формулы (XI)
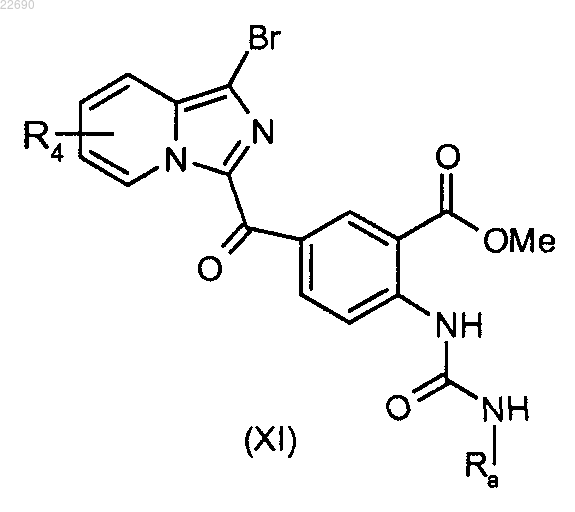
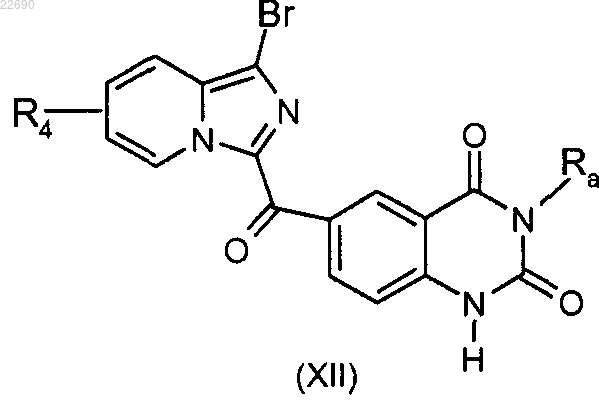
соединение формулы (XI) подвергают реакции циклизации в основной среде для получения соединения формулы (XII)
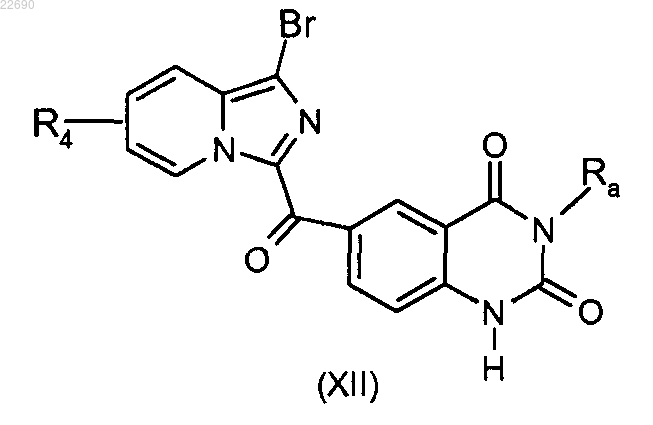
соединение формулы (XII) подвергают реакции алкилирования в присутствии основания и галогенированного производного Ra'X, где группа Ra' является такой, как определено в п.1, для получения соединения формулы (XIII)
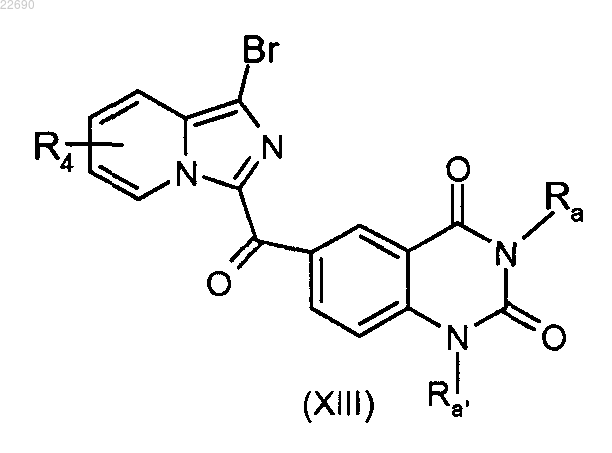
соединение формулы (XIII) подвергают в присутствии палладиевого катализатора, лиганда и основания
реакции с эфиром фенилбороновой или гетероарилбороновой кислоты, или эфиром фенилбороната, или эфирными производными гетероарилбороната согласно реакции сочетания Сузуки,
или иначе реакции иминирования с бензофенонимином с последующим гидролизом в кислой среде и реакцией алкилирования с сульфонилхлоридом формулы R6SO2Cl,
или иначе реакции цианирования с цианидом цинка с последующим гидролизом в кислой среде и этерификацией или реакцией образования пептидной связи с амином R5R6NH2, где R5 и R6 определены в п.1.
11. Способ получения соединения формулы (I) по любому одному из пп.1-7, в которой R2 и R3 вместе образуют азотсодержащий гетероцикл формулы (А), как определено в п.1, и в которой R1 и R4 представляют собой группы, как определено в п.1, при условии, что R1 не является атомом водорода, отличающийся тем, что
соединение формулы (IV)
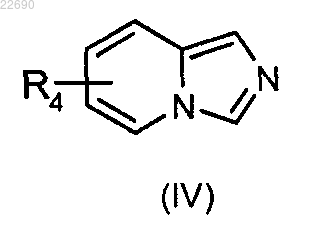
в которой группа R4 является такой, как определено в п.1, конденсируют с соединением формулы (V)
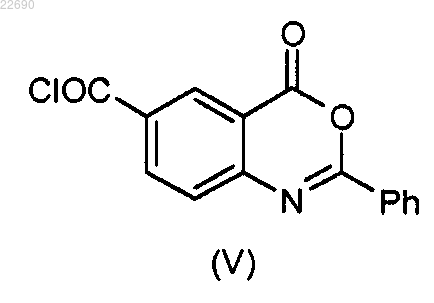
для получения соединения формулы (VI)
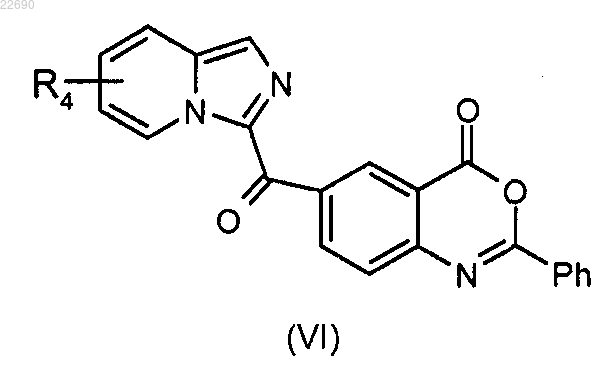
соединение формулы (VI) подвергают реакции гидролиза в основной среде для получения соединения формулы (VII)
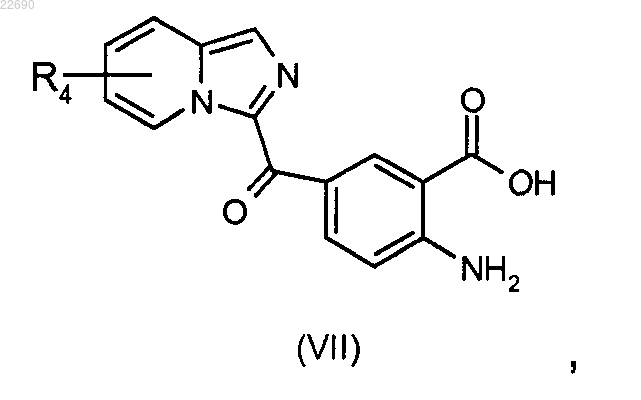
реакцию этерификации соединения формулы (VII) осуществляют с тем, чтобы получить соединение формулы (VIII)
соединение формулы (VIII) подвергают реакции бромирования для получения соединения формулы (X)
соединение формулы (X) подвергают в присутствии палладиевого катализатора, лиганда и основания
реакции с эфиром фенилбороновой или гетероарилбороновой кислоты, или эфиром фенилбороната, или эфирными производными гетероарилбороната согласно реакции сочетания Сузуки,
или иначе реакции иминирования с бензофенонимином с последующим гидролизом в кислой среде и реакцией алкилирования с сульфонилхлоридом формулы R6SO2Cl,
или иначе реакции цианирования с цианидом цинка с последующим гидролизом в кислой среде и этерификацией или реакцией образования пептидной связи с амином R5R6NH2, где R5 и R6 определены в п.1,
для получения соединения формулы (XIV)
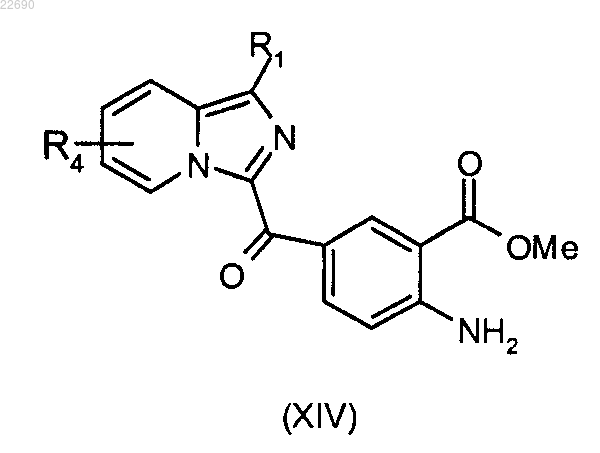
производное соединение формулы (XIV) подвергают действию трифосгена с тем, чтобы образовать соответствующий изоцианат, полученный изоцианат конденсируют с амином формулы RaNH2 для получения мочевины формулы (XV), где группа Ra является такой, как определено в п.1
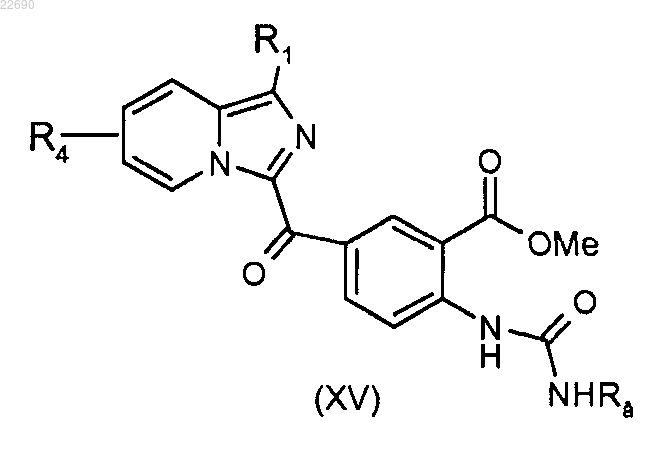
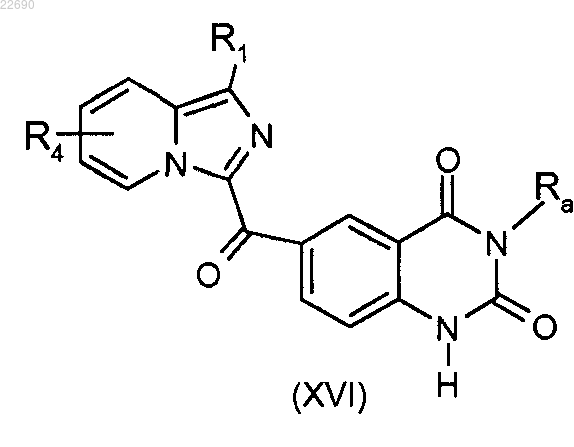
производное соединение формулы (XV) подвергают реакции циклизации в основной среде для получения соединения формулы (XVI)
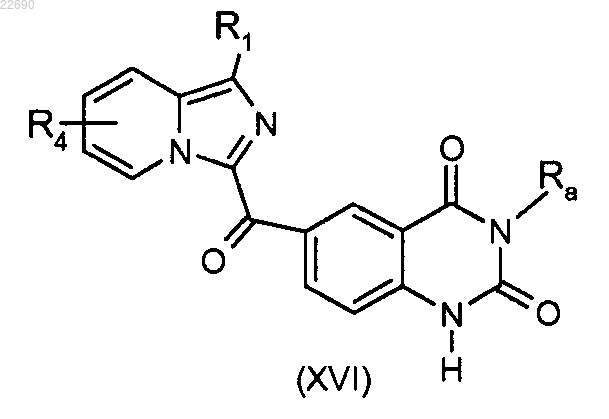
соединение формулы (XVI) подвергают реакции алкилирования в присутствии основания и галогенированного производного Ra'X, где группа Ra' является такой, как определено в п.1, и X является галогеном.
12. Способ получения соединений формулы (I) по пп.1-7, в которой R2 и R3 вместе образуют азотсодержащий гетероцикл формулы (А) и в которой R1 представляет собой группу, определенную в п.1, при условии, что R1 не представляет собой атом водорода, группа R4 является такой, как определено в п.1, отличающийся тем, что
соединение формулы (IV)
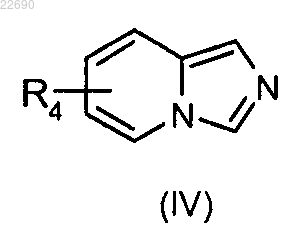
в которой группа R4 является такой, как определено в п.1, конденсируют с соединением формулы (V)

для получения соединения формулы (VI)
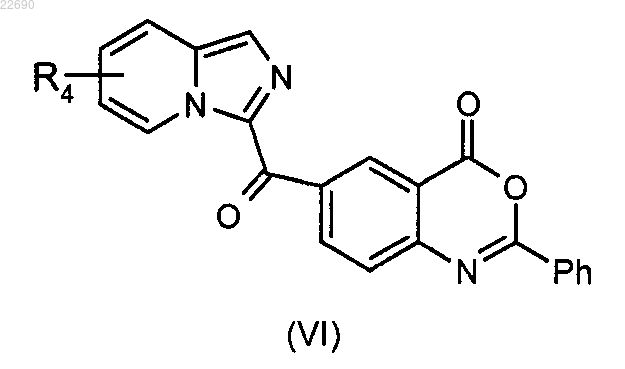
соединение формулы (VI) подвергают реакции гидролиза в основной среде для получения соединения формулы (VII)
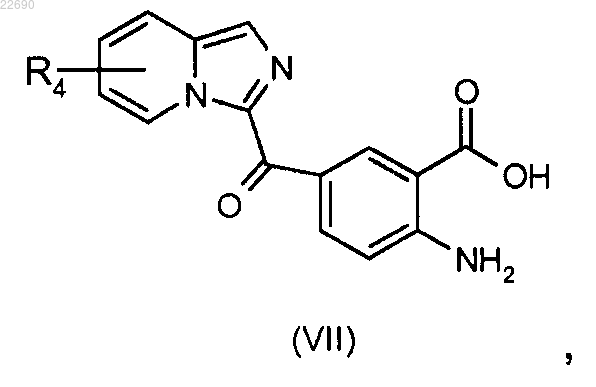
реакцию этерификации соединения формулы (VII) осуществляют с тем, чтобы получить соединение формулы (VIII)
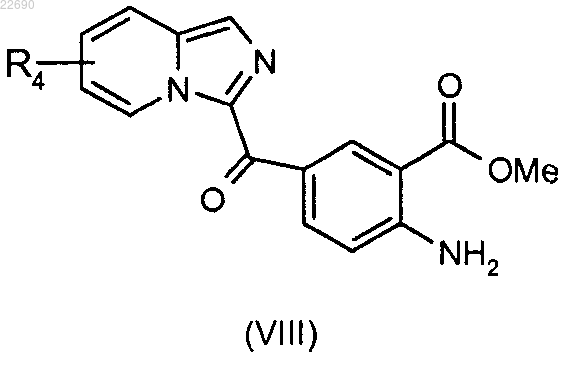
соединение формулы (VIII) подвергают реакции бромирования для получения соединения формулы (X)
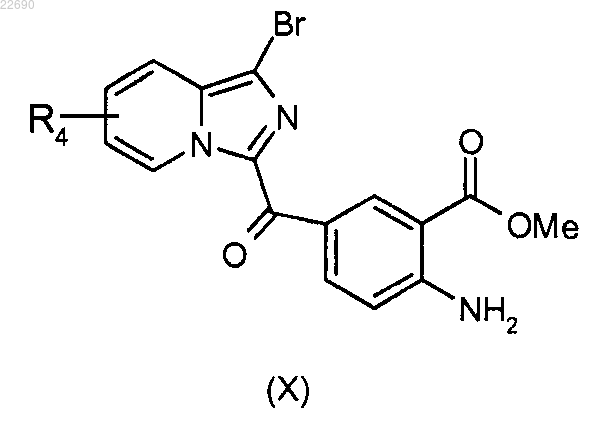
производное соединение формулы (X) подвергают действию трифосгена и образуется изоцианат, соответствующий соединению формулы (X), который конденсируют с амином формулы RaNH2, где группа Ra определена в п.1, для получения мочевины формулы (XI)
соединение формулы (XI) подвергают реакции циклизации в основной среде для получения соединения формулы (XII)
соединение формулы (XII) подвергают в присутствии палладиевого катализатора, лиганда и основания
реакции с эфиром фенилбороновой или гетероарилбороновой кислоты или, эфиром фенилбороната, или эфирными производными гетероарилбороната согласно реакции сочетания Сузуки,
или иначе реакции иминирования с бензофенонимином с последующим гидролизом в кислой среде и реакцией алкилирования с сульфонилхлоридом формулы R6SO2Cl,
или иначе реакции цианирования с цианидом цинка с последующим гидролизом в кислой среде и этерификацией или реакцией образования пептидной связи с амином R5R6NH2, где R5 и R6 являются такими, как определено в п.1, для получения соединения формулы (XVI), в которой группа R1 является такой, как определено в п.1, при условии, что группа R1 не представляет собой атом водорода,
соединение формулы (XVI) подвергают реакции алкилирования в присутствии основания и галогенированного производного Ra'X, группа Ra' является такой, как определено в п.1, и X является галогеном.
13. Способ получения соединений формулы (I) по пп.1-7, в которой R2 и R3 вместе образуют азотсодержащий гетероцикл формулы (В), как определено в п.1, где группа R4 является такой, как определено в п.1, и R1 представляет собой атом водорода, отличающийся тем, что
соединение формулы (IV)
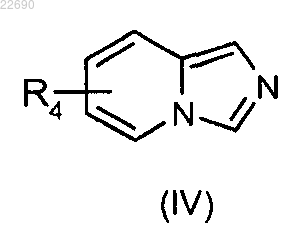
в которой группа R4 является такой, как определено в п.1, конденсируют с соединением формулы (V)
для получения соединения формулы (VI)
соединение формулы (VI) подвергают реакции гидролиза в основной среде для получения соединения формулы (VII)

реакцию этерификации соединения формулы (VII) осуществляют с тем, чтобы получить соединение формулы (VIII)
соединение формулы (VIII) подвергают реакции омыления для получения соединения (XXIV)
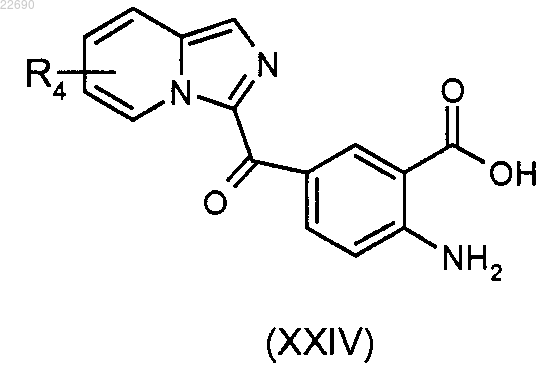
соединение (XXIV) затем подвергают реакции конденсации с алкил- или арилангидридом (Rb'CO)2O для получения соединения формулы (XVII)
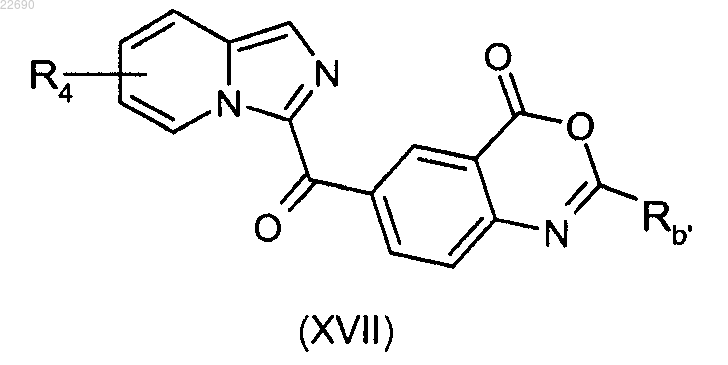
соединение формулы (XVII) подвергают реакции конденсации с амином RbNH2, Rb и Rb' являются такими, как определено в п.1.
14. Способ получения соединений формулы (I) по пп.1-7, в которой R2 и R3 вместе образуют азотсодержащий гетероцикл формулы (В), как определено в п.1, где группа R4 является такой, как определено в п.1, и группа R1 является такой, как определено в п.1, при условии, что R1 не представляет собой атом водорода, отличающийся тем, что
соединение формулы (IV)
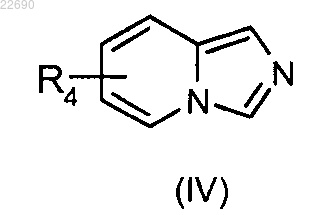
в которой группа R4 является такой, как определено в п.1, конденсируют с соединением формулы (V)

для получения соединения формулы (VI)
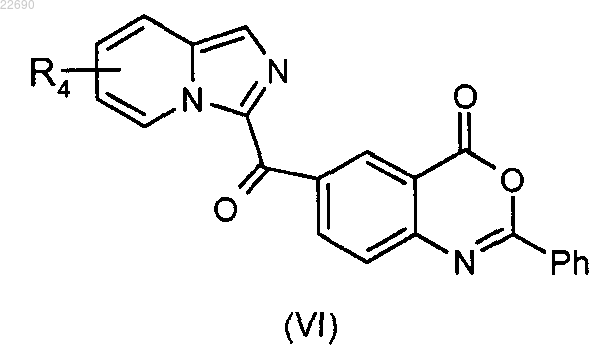
соединение формулы (VI) подвергают реакции гидролиза в основной среде для получения соединения формулы (VII)
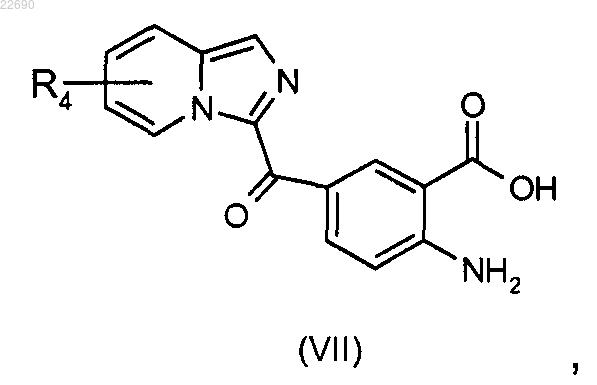
реакцию этерификации соединения формулы (VII) осуществляют с тем, чтобы получить соединение формулы (VIII)
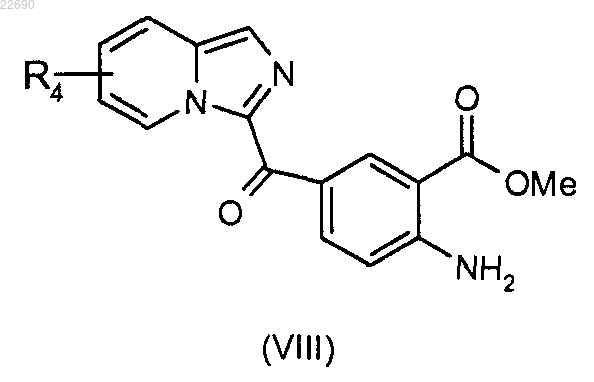
соединение формулы (VIII) подвергают реакции бромирования для получения соединения формулы (X)

соединение формулы (X) подвергают в присутствии палладиевого катализатора, лиганда и основания
реакции с эфиром фенилбороновой или гетероарилбороновой кислоты, или эфиром фенилбороната, или эфирными производными гетероарилбороната согласно реакции сочетания Сузуки,
или иначе реакции иминирования с бензофенонимином с последующим гидролизом в кислой среде и реакцией алкилирования с сульфонилхлоридом формулы R6SO2Cl,
или иначе реакции цианирования с цианидом цинка с последующим гидролизом в кислой среде и этерификацией или реакцией образования пептидной связи с амином R5R6NH2, где R5 и R6 определены в п.1,
для получения соединения формулы (XIV)

соединение (XIV) подвергают реакции омыления для получения соединения (XXV)
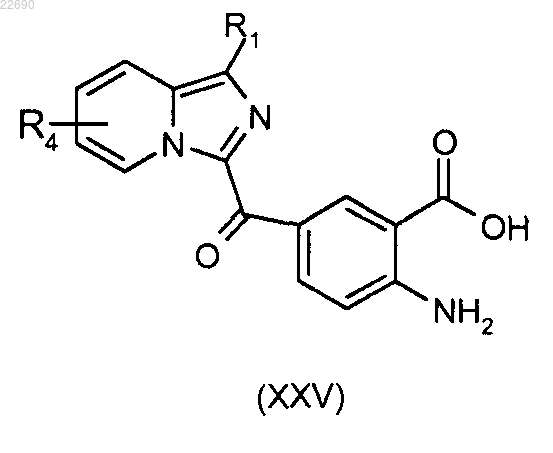
соединение (XXV) затем подвергают реакции конденсации с алкил- или арилангидридом (Rb'CO)2O, где группа Rb' является такой, как определено в п.1, для получения соединения формулы (XVIII)
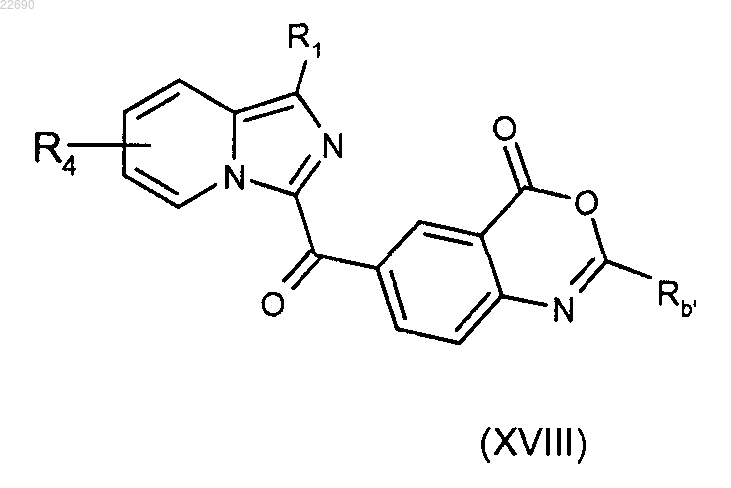
соединение формулы (XVIII) подвергают реакции конденсации с амином RbNH2, группа Rb является такой, как определено в п.1.
15. Фармацевтическая композиция для лечения и предотвращения заболеваний, предусматривающих модуляцию факторов b-FGF, содержащая в качестве активного ингредиента производное соединение формулы (I) по любому одному из пп.1-8, необязательно в комбинации с одним или более подходящими инертными наполнителями.
16. Применение соединения по любому одному из пп.1-8 для лечения и предотвращения заболеваний, предусматривающих модуляцию факторов b-FGF.
17. Применение соединения по п.6 для лечения и предотвращения злокачественных опухолей, в частности карцином, которые отличаются высокой степенью васкуляризации, таких как карциномы легкого, молочной железы, предстательной железы, поджелудочной железы, толстой кишки, почки и пищевода, злокачественных опухолей, которые индуцируют метастазы, таких как рак толстой кишки, рак печени и рак желудка, меланомы, глиомы, лимфомы, лейкозы и также тромбопении.
18. Применение по п.17, где соединение используют в комбинации с одним или более противораковым активным ингредиентом(ами), и/или с радиационной терапией, и/или с любой анти-VEGF терапией.
19. Применение по п.16, для лечения и предотвращения сердечно-сосудистых заболеваний, таких как атеросклероз или рестеноз после ангиопластики, заболеваний, связанных с осложнениями, которые встречаются после имплантации эндоваскулярных стентов и/или аортокоронарного шунтирования или других сосудистых трансплантатов, гипертрофии сердца, сосудистых осложнений в результате диабета, таких как диабетические ретинопатии, фиброзы печени, почки и легкого, невропатическая боль, хронические воспалительные заболевания, такие как ревматоидный артрит или IBD, гиперплазия предстательной железы, псориаз, светлоклеточная акантома, остеоартрит, хондродистрофия (АСН), гипохондроплазия (НСН), TD (танатофорная дисплазия), ожирение и дегенерация желтого пятна, такая как связанная с возрастом дегенерация желтого пятна (ARMD).
Текст
ИМИДАЗОПИРИДИНОВЫЕ ПРОИЗВОДНЫЕ, СПОСОБ ИХ ПОЛУЧЕНИЯ И ТЕРАПЕВТИЧЕСКОЕ ИСПОЛЬЗОВАНИЕ в которой R2 и R3 вместе образуют с атомами углерода фенильного ядра, с которыми они связаны, 6-членный азотсодержащий гетероцикл, соответствующий одной из формул (А), (В) и (С),представленных ниже: в которых волнистые линии представляют собой фенильное ядро, с которым R2 и R3 связаны. Изобретение также относится к способу получения и терапевтическому использованию соединений.FGF (факторы роста фибробластов), к способам их получения и к терапевтическому использованию данных производных. Факторы роста фибробластов FGF представляют собой семейство полипептидов, синтезируемых большим числом клеток в процессе развития эмбриона и клетками тканей взрослого человека при различных патологических состояниях. Индолизиновые производные, которые являются антагонистами связывания FGF с их рецепторами,описаны в международных патентных заявках WO 03/084956 и WO 2005/028476. Имидазо[1,5-а]пиридиновые производные, которые являются антагонистами FGF, описаны в международной патентной заявке WO 2006/097625. Новые имидазопиридиновые производные, которые являются антагонистами связывания FGF с их рецепторами, в настоящей работе идентифицированы. Таким образом, объектом настоящего изобретения являются соединения, имидазопиридиновые производные, соответствующие формуле (I)R1 представляет собой атом водорода или галогена, алкильную группу, необязательно замещенную-COOR5, алкенильную группу, необязательно замещенную -COOR5, -COOR5-группу или -CONR5R6 группу, -NR5COR6-группу или -NR5-SO2R6-группу или арильную группу, в частности, фенильную группу или гетероарильную группу, указанная арильная или гетероарильная группа необязательно замещена одной или более группами, выбранными из атомов галогена, алкильных групп, циклоалкильных групп,групп -COOR5, -CF3, -OCF3, -CN, -C(NH2)NOH, -OR5, -O-Alk-COOR5, -O-Alk-NR5R6, -O-Alk-NR7R8, -AlkOR5, -Alk-COOR5, -CONR5R6, -CO-NR5-OR6, -CO-NR5-SO2R7, -CONR5-Alk-NR5R6, -CONR5-Alk-NR7R8,-Alk-NR5R6, -NR5R6, -NC(O)N(CH3)2, -CO-Alk, -CO(OAlk)nOH, COO-Alk-NR5R6, COO-Alk-NR7R8 и 5 членных гетероарильных групп, указанные гетероарильные группы необязательно замещены одной или более группами, выбранными из атомов галогена и алкила, групп -CF3, -CN, -COOR5, -Alk-OR5, -AlkCOOR5, -CONR5R6, -CONR7R8, -CO-NR5-OR6, -CO-NR5-SO2R6, -NR5R6 и -Alk-NR5R6, или гидроксильной группой или атомом кислорода,n является целым числом, колеблющимся от 1 до 3,R2 и R3 вместе с атомами углерода фенильного ядра, с которыми они связаны, образуют 6-членный азотсодержащий гетероцикл, соответствующий одной из формул (А), (В) или (С), представленных ниже: в которых волнистые линии представляют собой фенильное ядро, с которым группы R2 и R3 связаны, иRa представляет собой атом водорода или алкильную, галогеналкильную группу, группы -Alk-CF3,-Alk-COOR5, -Alk-COOR5, -Alk-CONR5R6, -Alk-CONR5R6, -Alk-CONR7R8, -Alk-NR5R6, -AlkCONR5-OR6,-Alk-NR7R8, -Alk-циклоалкильную группу, -Alk-O-R5, -Alk-S-R5, -Alk-CN, -OR5, -OAlkCOOR5, -NR5R6,-NR5-COOR6, -Alk-арильную, -Alk-O-арильную, -Alk-O-гетероарильную, -Alk-гетероарильную или гетероарильную группу, где арильная или гетероарильная группа необязательно замещена одним или более атомами галогена и/или алкильными, циклоалкильными группами, -CF3, -OCF3, -O-R5 или -S-R5 группами,Ra' представляет собой атом водорода или линейную, разветвленную, циклическую или частично циклическую алкильную группу, или группу -Alk-ORs, -Alk-NR5R6 или -Alk-NR7R8, группа Ra' необязательно замещена одним или более атомами галогена,Rb представляет собой атом водорода или алкильную или -Alk-COOR5 группу,Rb- представляет собой атом водорода или алкильную, галогеналкильную, циклоалкильную, фенильную группу или группу -Alk-COOR5,Rc представляет собой атом водорода или алкильную, -CN, -COOR5, -CO-NR5R6, -CONR7R8, -CONR5-Alk-NR5R6, -CONR5-Alk-OR5, -CONR5SO2R5, -Alk-арильную или -Alk-гетероарильную группу, где арильная или гетероарильная группа необязательно замещена одним или более атомами галогена и/или алкильными, циклоалкильными, -CF3, -OCF3, -О-алкильными или -S-алкильными группами,Rc' представляет собой атом водорода или алкильную группу,Rc представляет собой атом водорода или алкильную, алкенильную, галогеналкильную, циклоалкильную, -Alk-NR5R6, -Alk-NR7R8, -Alk-OR5 или -Alk-SR5 группу,R4-группа, локализованная в положении 6, 7 или 8 имидазопиридинового ядра, представляет собой: атом водорода,группу -COOR5,группу -CO-NR5-Alk-NR5R6,группу -CO-NR5-Alk-NR7R8 или группу -CO-NR5-Alk-OR6,группы R5 и R6, которые могут быть идентичными или различными, представляют собой атомы водорода, галогеналкильные группы или алкильные группы, циклоалкильные группы или Ms-(мезил) группу,группы R7 и R8, которые могут быть идентичными или различными, представляют собой атомы водорода или алкильные или фенильные группы, или иначе группы R7 и R8 вместе образуют от 3-до 8 членное насыщенное кольцо, которое может необязательно содержать гетероатом,Alk представляет собой линейную или разветвленную алкиленовую цепь иAlk' представляет собой линейную, разветвленную, циклическую или частично циклическую алкиленовую цепь,указанные соединения необязательно присутствуют в виде их фармацевтически приемлемой соли. Соединения формулы (I) могут содержать один или более асимметричные атомы углерода. Следовательно, они могут существовать в виде энантиомеров или диастереоизомеров. Указанные энантиомеры и диастереомеры и также их смеси, включая рацемические смеси, являются частью изобретения. Соединения формулы (I) могут существовать в виде оснований или кислот или могут образовывать соли с кислотами или основаниями, в частности, фармацевтически приемлемыми кислотами или основаниями. Такие аддитивные соли могут составлять часть изобретения. Указанные соли предпочтительно получают с фармацевтически приемлемыми кислотами или основаниями, но соли других кислот или оснований, которые находят применение, например, для очистки или выделения соединений формулы (I),также составляют часть изобретения. Соединения формулы (I) также могут существовать в виде гидратов или сольватов, а именно в виде ассоциаций или комбинаций с одной или более молекулами воды или с растворителем. Такие гидраты или сольваты также являются частью изобретения. В контексте изобретения, и если не указано иное в тексте, термин"алкил" означает линейную или разветвленную, насыщенную, основанную на углеводороде алифатическую группу, содержащую от 1 до 6 атомов углерода;"циклоалкил" означает циклическую алкильную группу, включающую от 3 до 8 членов в кольце,содержащем между 3 и 6 атомами углерода и необязательно содержащем один или более гетероатомов,например, 1 или 2 гетероатома, такие как азот и/или кислород, указанная циклоалкильная группа необязательно замещена одним или более атомами галогена и/или алкильными группами. В качестве примеров можно упомянуть циклопропильные, циклопентильные, пиперазинильные, пирролидинильные и пиперидинильные группы;"частично циклическая алкильная группа" предназначена означать алкильную группу, у которой только часть образует кольцо;"алкилен" означает линейную или разветвленную двухвалентную алкильную группу, содержащую от 1 до 6 атомов углерода;"галогеналкил" означает алкильную цепь, в которой все или некоторые из атомов водорода заменены атомами галогена, такими как атомы фтора;"арил" означает циклическую ароматическую группу, содержащую между 5 и 10 атомами углерода,например, фенильную группу;"гетероарил" означает циклическую ароматическую группу, содержащую между 3 и 10 атомами углерода, включающую один или более гетероатомов, например, между 1 и 4 гетероатомами, такими как азот, кислород или сера, указанная группа, включающая одно или более, предпочтительно одно или два кольца. Гетероциклы могут включать несколько конденсированных колец. Гетероарилы необязательно замещены одной или более алкильными группами или атомом кислорода. В качестве примеров, можно упомянуть тиенильные, пиридинильные, пиразолильные, имидазолильные, тиазолильные и триазолильные группы; и"5-членный гетероарил" означает гетероарильную группу, состоящую из 5-членного кольца, содержащего от 1 до 4 гетероатомов (таких как атомы кислорода и/или азота), необязательно замещенную одной или более алкильными группами или гидроксильной группой или атомом кислорода. Можно упомянуть, например, оксадиазолильные и тетразолильные группы; галогены предпочтительно выбирают из F и Cl. Среди соединений формулы (I) согласно изобретению, можно упомянуть подгруппу соединений, в которой R1 представляет собой водород или атом галогена,алкильную группу, которая не замещена или замещена -COOR5,алкенильную группу, которая не замещена или замещена COOR5,-2 022690-COOR5-группу,-CONR5R6-группу,-NR5-SO2R6-группу или фенильную группу, необязательно замещенную одной или двумя группами, выбранными из атомов галогена; алкильных групп, необязательно замещенных -COOR5; групп -CN(циано), -C(NH2)NOH, -COOR5, -CONR5R6, NR5-OR6, -CO-NR5-SO2R6, -COAlk,-CO(OAlk)nOH, -OR5, -OCF3, -O-Alk-COOR5, -Alk-OR5, -NR5R6 или -NC(O)N(CH3)2,5-членных гетероарилов, необязательно замещенных алкильной группой и/или гидроксильной группой или атомом кислорода,в которой R5 и R6, которые могут быть идентичными или различными, представляют собой атомы водорода или алкильные группы, необязательно замещенные группой -NR7R8,R7 представляет собой атом водорода, алкильную группу, содержащую 1 или 2 атома углерода, или фенильную группу, n является целым числом, колеблющимся от 1 до 3, или гетероарильную группу, которая необязательно конденсирована и/или необязательно замещена одной или двумя группами, выбранными из алкильных групп, OR5, -COOR5, -NR5R6 и циклоалкильных групп, и атома кислорода, в которойR5 и R6, которые могут быть идентичными или различными, представляют собой атомы водорода или алкильные группы, содержащие 1 или 2 атома углерода. Среди соединений формулы (I) согласно изобретению можно упомянуть другую подгруппу соединений, в которой R2 и R3 вместе образуют с атомами углерода фенильного ядра, с которыми они связаны,6-членный азотсодержащий гетероцикл, соответствующий одной из двух формул (А) и (В), определенных выше, предпочтительно соответствующий формуле (А). Формула (А) или (В) предпочтительно является таковой, чтоRa представляет собой атом водорода или алкильную группу, необязательно замещенную одним или более галогенами; AlkCONR5R6; галогеналкил; -CH2-COOR5; -Alk-гетероарил, -Alk-O-фенил или-Alk-фенил, где фенильная группа необязательно замещена одной или двумя алкильными группами и/или OR5 и/или атомами галогена; -Alk-циклоалкил,Ra' представляет собой атом водорода или линейную, разветвленную, циклическую или частично циклическую алкильную группу, или группу -CH2-OR5 или -Alk-NR5R6,Rb представляет собой атом водорода или алкильную группу,Rb' представляет собой атом водорода или алкил, фенил или группу -CH2-COOR5,в которой алкильные группы содержат от 1 до 6 атомов углерода, группа R5 является такой, как определено выше. Среди соединений формулы (I) согласно изобретению можно упомянуть другую подгруппу соединений, в которой R4 представляет собой атом водорода или группу -СООН, -CO-NH-Alk-NR7R8 или -CONH-Alk-OH, где Alk, R7 и R8 являются такими, как определено выше, или иначе алкильную группу,предпочтительно содержащую от 1 до 3 атомов углерода, которая не замещена. В соединениях формулы (I) согласно изобретению группа R4 преимущественно локализована в положении 6 или 7 имидазопиридинового ядра. Среди соединений, которые являются предметом изобретения, можно упомянуть следующие соединения: 5-3-[(2,4-диоксо-3-пропил-1,2,3,4-тетрагидрохиназолин-6-ил)карбонил]имидазо[1,5-а]пиридин-1 ил-2-фторбензойную кислоту,3-3-[(2,4-диоксо-3-пропил-1,2,3,4-тетрагидрохиназолин-6-ил)карбонил]имидазо[1,5-а]пиридин-1 илбензойную кислоту,3-3-[(1-метил-2,4-диоксо-3-пропил-1,2,3,4-тетрагидрохиназолин-6-ил)карбонил]имидазо[1,5-а]пиридин-1-илбензойную кислоту,3-(3-[3-(4-фторбензил)-1-метил-2,4-диоксо-1,2,3,4-тетрагидрохиназолин-6-ил]карбонилимидазо имидазо[1,5-а]пиридин-1-ил]бензойную кислоту. В следующем тексте термин "защитная группа" означает группу, которая позволяет, во-первых, защитить реакционноспособную функцию, такую как гидроксил или амин в процессе синтеза, и, вовторых, регенерировать интактную реакционноспособную функцию в конце синтеза. Примеры защитных групп и также способы защиты и удаления защитных групп представлены в публикации "ProtectiveGroups in Organic Synthesis", Green et al., 3rd Edition (John WileySons, Inc., New York). В остальной части текста термин "уходящая группа" означает группу, которая может быть легко отщеплена от молекулы путем гетеролитического разрыва химической связи, с уходом пары электронов. Таким образом, указанная группа может быть легко заменена другой группой, например, в течение реакции замещения. Подобными уходящими группами являются, например, галогены или активированная гидроксильная группа, такие как мезил, тозил, трифлат, ацетил, паранитрофенил и т.д. Примеры уходящих групп и также способы их получения представлены в публикации "Advances in Organic Chemistry", J.March, 3rd Edition, Wiley Interscience, p. 310-316. В соответствии с изобретением, соединения общей формулы (I) могут быть получены способами,представленными ниже. Соединения формулы (IV) получены способами, известными в литературе, исходя из подходяще замещенных соответствующих 2-аминометилпиридинов, по следующей реакционной схеме, описанной в публикации J. Chem. Soc. (1955), 2834-2836. Когда R4 представляет собой COOR5, соединения формулы (II) получают согласно реакционной схеме, описанной в международной публикации WO 06/097625. На схеме 1 представлен путь получения соединений формулы (I), в которой R2 и R3 вместе образуют азотсодержащий гетероцикл формулы (А), как определено выше, и в которой R1 и Ra' представляют собой атомы водорода. Схема 1 (способ 1) Соединение формулы (IV), в которой группа R4 является такой, как определено выше для соединения формулы I, конденсируют с соединением формулы V для получения соединения формулы VI. Соединение формулы VI подвергают реакции гидролиза в щелочной среде для получения соединения формулы VII. Этерификация соединения формулы VII приводит к соединению формулы VIII. При участии в реакции трифосгена, образуется изоцианат, соответствующий соединению формулы VIII, который конденсируют с амином формулы RaNH2 для получения мочевины формулы IX. Соединение формулы IX подвергают реакции циклизации в основной среде для получения соединения формулы I, в которой R4 иRa являются такими, как определено выше. На схеме 2 представлен путь получения соединения формулы (I), в которой R2 и R3 вместе образуют азотсодержащий гетероцикл формулы (А), как определено выше, и в которой R1 представляет собой группу, как определено в общей формуле, за исключением атома водорода. Схема 2 (способ 2) Соединение формулы VIII подвергают реакции бромирования для получения соединения формулыX. При участии в реакции трифосгена, образуется изоцианат, соответствующий соединению формулы X,который конденсируют с амином формулы RaNH2 для получения мочевины формулы XI. Соединение формулы XI подвергают реакции циклизации в основной среде для получения соединения формулы XII. Соединение XII подвергают реакции алкилирования в присутствии основания и галогенированного производного Ra'X для получения соединения формулы XIII. Соединение формулы XIII подвергают в присутствии палладиевого катализатора, лиганда и основания реакции с эфиром фенилбороновой или гетероарилбороновой кислоты или эфиром фенилбороната или эфирными производными гетероарилбороната согласно реакции сочетания Сузуки,или иначе реакции иминирования с бензофенонимином с последующим гидролизом в кислой среде и реакцией алкилирования с сульфонилхлоридом формулы R6SO2Cl,или иначе реакции цианирования с цианидом цинка с последующим гидролизом в кислой среде и этерификациеи или реакции образования пептидной связи с амином R5R6NH2,для получения соединения формулы I, в которой R1, R4, Ra и Ra' являются такими, как определено выше. На схеме 3 представлен путь получения соединений формулы (I), в которой R2 и R3 вместе образуют азотсодержащий гетероцикл формулы (А), как определено выше, и в которой R1 представляет собой группу, определенную в общей формуле, за исключением атома водорода, и в которой группа R4 является такой, как определено выше. Схема 3 (способ 3) Соединение формулы X подвергают в присутствии палладиевого катализатора, лиганда и основания,реакции с эфиром фенилбороновой или гетероарилбороновой кислоты или эфиром фенилбороната или эфирными производными гетероарилбороната согласно реакции сочетания Сузуки,или иначе реакции иминирования с бензофенонимином с последующим гидролизом в кислой среде и реакцией алкилирования с сульфонилхлоридом формулы R6SO2Cl,или иначе реакции цианирования с цианидом цинка с последующим гидролизом в кислой среде и этерификациеи или реакции образования пептидной связи с амином R5R6NH2, где R5 и R6 определены выше,для получения соединения формулы XIV, в которой группа R1 определена выше. При участии в реакции трифосгена, образуется изоцианат, соответствующий соединению формулы XIV, который конденсируют с амином формулы RaNH2 для получения мочевины формулы XV. Соединение формулы XV подвергают реакции циклизации в основной среде для получения соединения формулы XVI. СоединениеXVI подвергают реакции алкилирования в присутствии основания и галогенированного производногоRa'X для получения соединения формулы I. На схеме 4 представлен путь получения соединений формулы (I), в которой R2 и R3 вместе образуют азотсодержащий гетероцикл формулы (А), как определено выше, и в которой R1 представляет собой группу, определенную в общей формуле, за исключением атома водорода, и в которой группа R4 является такой, как определено выше. Схема 4 (схема 4) Соединение формулы XII подвергают, в присутствии палладиевого катализатора, лиганда и основания,реакции с эфиром фенилбороновой или гетероарилбороновой кислоты или эфиром фенилбороната или эфирными производными гетероарилбороната согласно реакции сочетания Сузуки,или иначе реакции иминирования с бензофенонимином с последующим гидролизом в кислой среде и реакцией сульфонилирования с сульфонилхлоридом формулы R6SO2Cl,-5 022690 или иначе реакции цианирования с цианидом цинка с последующим гидролизом в кислой среде и этерификациеи или реакции образования пептидной связи с амином R5R6NH2,для получения соединения формулы XVI, в которой группа R1 определена выше. Соединение формулы XVI подвергают реакции алкилирования в присутствии основания и галогенированного производного Ra'X для получения соединения формулы I. На схеме 5 представлен путь получения соединений формулы (I), в которой R2 и R3 вместе образуют азотсодержащий гетероцикл формулы (В), как определено выше, в которой R1 представляет собой атом водорода и в которой группа R4 является такой, как определено выше. Схема 5 (способ 5) Соединение VIII подвергают реакции омыления для получения соединения XXIV. СоединениеXXIV последовательно подвергают реакции конденсации с алкил- или арилангидридом (Rb'CO)2O для получения соединения формулы XVII. Соединение формулы XVII подвергают реакции конденсации с амином RbNH2 для получения соединения формулы I, в которой Rb и Rb' являются такими, как определено выше. На схеме 6 представлен путь получения соединений формулы (I), в которой группы R2 и R3 вместе образуют азотсодержащий гетероцикл формулы (В), как определено выше, и в которой группа R1 является такой, как определено выше, за исключением атома водорода, и в которой группа R4 является такой,как определено выше. Схема 6 (способ 6) Соединение XIV подвергают реакции омыления для получения соединения XXV. Соединение XXV последовательно подвергают реакции конденсации с алкил- или арилангидридом (Rb'CO)2O для получения соединения формулы XVIII. Соединение формулы XVIII подвергают реакции конденсации с аминомRbNH2 для получения соединения формулы I, в которой Rb и Rb' являются такими, как определено выше. На схеме 7 представлен путь получения соединений формулы (I), в которой R2 и R3 вместе образуют азотсодержащий гетероцикл формулы (С), как определено выше, и в которой RC и также R1 и R4 являются такими, как определено выше. Схема 7 (способ 7) Соединение X подвергают реакции омыления для получения соединения XIX. Соединение XIX подвергают реакции конденсации в присутствии трифосгена для получения соединения XX. СоединениеXX подвергают реакции алкилирования в присутствии галогенированного производного RC"X или защитной группы для получения соединения XXI. Соединение XXI подвергают реакции конденсации с производным малоновой кислоты для получения соединения формулы XXII, в которой Rc' и Rc являются такими, как определено выше. Соединение XXII подвергают в присутствии палладиевого катализатора,лиганда и основания реакции с эфиром фенилбороновой или гетероарилбороновой кислоты или эфиром фенилбороната или эфирными производными гетероарилбороната согласно реакции сочетания Сузуки,или иначе реакции иминирования с бензофенонимином с последующим гидролизом в кислой среде и реакцией сульфонилирования с сульфонилхлоридом формулы R6SO2Cl,или иначе реакции цианирования с цианидом цинка с последующим гидролизом в кислой среде и этерификациеи или реакции образования пептидной связи с амином R5R6NH2,для получения соединения формулы XXIII, в которой группа R1 определена выше. Соединение формулы XXIII подвергают реакции удаления защитной группы для получения соединений формулы I, в которой Rc является атомом водорода. На предыдущих схемах исходные соединения и реагенты, когда способ их получения не описан,являются коммерчески доступными или описанными в литературе, или также могут быть получены способами, которые представлены в описании, или которые известны специалистам в данной области. Предметом изобретения согласно другому из аспектов изобретения являются также соединения формул от II до XXIII, определенных выше. Указанные соединения находят применение в качестве промежуточных соединений для синтеза соединений формулы (I). Следующие примеры описывают получение некоторых соединений в соответствии с изобретением. Указанные примеры не являются ограничивающими и только иллюстрируют настоящее изобретение. Число соединений, приведенных в качестве примеров, соотносится с числом, данным в таблице ниже,которая иллюстрирует химические структуры и физические свойства некоторых соединений согласно изобретению. Реагенты и промежуточные соединения, когда их получение не изложено, являются известными в литературе или коммерчески доступными. Некоторые промежуточные соединения, которые находят применение для получения соединений формулы I, также могут служить в качестве конечных продуктов формулы (I), как будет очевидно в примерах, представленных в описании ниже. Подобным образом некоторые соединения формулы (I) согласно изобретению могут служить в качестве промежуточных соединений, которые находят применение для получения соединений формулы (I) согласно изобретению. Например, производные формулы (I) выбирают из следующих соединений: 6-(имидазо[1,5-а]пиридин-3-илкарбонил)-3-пропилхиназолин-2,4(1H,3H)-диона,3-3-[(2,4-диоксо-3-пропил-1,2,3,4-тетрагидрохиназолин-6-ил)карбонил]имидазо[1,5-а]пиридин-1 илбензойной кислоты,3-[(2,4-диоксо-3-пропил-1,2,3,4-тетрагидрохиназолин-6-ил)карбонил]имидазо[1,5-а]пиридин-6 карбоновой кислоты,3-(3-[3-(4-фторбензил)-1-метил-2,4-диоксо-1,2,3,4-тетрагидрохиназолин-6-ил]карбонилимидазоBinap: 2,2-бис(дифенилфосфино)-1,1-бинафтил. Анализы ЯМР осуществляли на приборах Bruker Avance 2 50 МГц, 300 МГц и 400 МГц. Температуры плавления измеряли на приборе Buchi B-450. Анализы масс-спектрометрии осуществляли на приборах Waters Alliance 2695 (УФ: PDA996, МС: LCZ), Alliance 2695 (УФ: PDA 996, МС: ZQWaters SQD. Пример 1 (соединение 1). 6-(Имидазо[1,5-a]пиридин-3-илкарбонил)-3-пропилхиназолин-2,4(1H,3H)-дион. Метил 2-амино-5-(имидазо[1,5-а]пиридин-3-илкарбонил)бензоат. Триэтиламин 13,4 мл (96 ммоль ) добавляли к 3,5 г (30 ммоль) имидазо[1,5-а]пиридина [описан в публикации J. Chem. Soc; (1955), 2834-2836] в 250 мл 1,2-дихлорэтана с последующим добавлением в атмосфере азота при 0 С 13,7 г (48 ммоль) 4-оксо-2-фенил-4H-3,1-бензоксазин-6-карбонилхлорида (описан в WO 05/028476). После перемешивания в течение 4,5 ч при температуре окружающей среды реакционную среду фильтровали. Полученный остаток промывали 1,2-дихлорэтаном. После сушки в течение ночи при 40 С при пониженном давлении получали 3 г желтого твердого вещества. Полученный остаток растворяли в 100 мл NMP. Раствор 8,4 г (0,15 моль) KOH в 10 мл воды добавляли по каплям в атмосфере азота при температуре окружающей среды. Реакционную среду нагревали при 80 С в течение 6 ч и затем выливали при температуре окружающей среды в 1N водный раствор хлористо-водородной кислоты. Образованный осадок отфильтровывали, промывали водой и затем сушили при 40 С при пониженном давлении в течение ночи. После колоночной хроматографии на силикагеле,элюируя смесью дихлорметан/метанол/0,1% триэтиламин, получали 5,5 г желтого твердого вещества. Добавляли 7 г (0,022 моль) карбоната цезия и затем по каплям 1,34 мл (0,022 моль) метилйодида, в атмосфере азота при температуре окружающей среды, к 5,5 г (0,02 моль) полученного остатка в 100 мл ДМФ. После перемешивания в течение 24 ч при температуре окружающей среды реакционную среду выливали в воду. Образованный осадок отфильтровывали, промывали водой и затем сушили в течение ночи при 40 С при пониженном давлении. Получали 5,1 г желтого твердого веществ. Температура плавления: 192 С. МН+: 296. Метил 5-(имидазо[1,5-а]пиридин-3-илкарбонил)-2-[(пропилкарбамоил)амино]бензоат. Трифосген 0,35 г (1,2 ммоль) добавляли при температуре окружающей среды в атмосфере азота к суспензии 0,5 г (1,7 ммоль) метил 2-амино-5-(имидазо[1,5-а]пиридин-3-илкарбонил)бензоата в 20 мл безводного диоксана. После нагревания в течение 2 ч при 100 С, 0,28 мл (3,4 ммоль) n-пропиламина и затем 0,71 мл (5 ммоль) триэтиламина добавляли к реакционной среде при температуре окружающей среды. После перемешивания в течение 18 ч при температуре окружающей среды добавляли H2O. Водную фазу экстрагировали дихлорметаном. Органическую фазу сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученное желтое твердое вещество очищали колоночной хроматографией на силикагеле, элюцию осуществляли смесью дихлорметан/метанол (98/2). Получали 0,410 г желтого твердого вещества. Температура плавления: 205 С. MH+: 381. 6-(Имидазо[1,5-а]пиридин-3-илкарбонил)-3-пропилхиназолин-2,4-(1 Н,3 Н)-дион. 1N Водный раствор гидроксида натрия 1,3 8 мл (1,38 ммоль) добавляли при температуре окружающей среды к суспензии 0,43 6 г (1,15 ммоль) метил 5-(имидазо[1,5-а]пиридин-3-илкарбонил)-2-[(пропилкарбамоил)амино]бензоата в 10 мл метанола. После кипячения с обратным холодильником в течение 2 ч метанол концентрировали при пониженном давлении. Добавляли 1N водный раствор хлористоводородной кислоты. Образовавшийся осадок отфильтровывали, промывали водой и затем сушили в течение ночи при 40 С при пониженном давлении. Получали 0,27 г желтого твердого вещества. Температура плавления: 304 С. 1N-Бромсукцинимид 0,42 г (2,4 ммоль) добавляли в атмосфере азота при температуре окружающей среды к раствору 0,67 г (2,4 ммоль) метил 2-амино-5-(имидазо[1,5-а]пиридин-3-илкарбонил)бензоата в 20 мл дихлорметана. После перемешивания в течение 2 ч 30 добавляли воду. Образовавшийся осадок отфильтровывали, промывали водой и сушили в течение ночи при 40 С при пониженном давлении. Получали 0,77 г желтого твердого вещества. Температура плавления: 230 С. МН+: 375, 377. Метил 2-амино-5-(1-[3-(метоксикарбонил)фенил]имидазо[1,5-а]пиридин-3-илкарбонил)бензоат.[4-(Метоксикарбонил)фенил]бороновую кислоту 0,248 г (1,38 ммоль), 0,57 г (2,30 ммоль) карбоната калия в 2 мл воды и 0,027 г (0,02 ммоль) тетракис(трифенилфосфин)палладия добавляли к раствору 0,43 г (1,15 ммоль) метил 2-амино-5-[(1-бромимидазо[1,5-а]пиридин-3-ил)карбонил]бензоата в 10 мл DME, в атмосфере инертного аргона. Реакционную среду нагревали при 90 С в течение 2 ч. Реакционную среду подкисляли 1N водным раствором хлористо-водородной кислоты и экстрагировали дихлорметаном. Органическую фазу промывали водой, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученное твердое вещество растворяли в 5 мл ДМФ. Добавляли метилйодид 30 мкл (0,5 ммоль) и 0,052 г (0,16 ммоль) карбоната цезия. После перемешивания в течение 24 ч при температуре окружающей среды реакционную среду подвергали гидролизу водой и затем экстрагировали этилацетатом. Органическую фазу сушили над сульфатом натрия, фильтровали и затем концентрировали при пониженном давлении. Полученное твердое вещество поглощали метанолом. После фильтрования и сушки в течение ночи при 50 С при пониженном давлении получали 0,379 г желтого порошка. Температура плавления: 203 С. МН+: 430. Метил 5-(1-[3-(метоксикарбонил)фенил]имидазо[1,5-а]пиридин-3-илкарбонил)-2-[(пропилкарбамоил)амино]бензоат. Трифосген 0,181 г (0,61 ммоль) добавляли в инертной атмосфере к 0,75 г (0,87 ммоль) метил 2 амино-5-(1-[3-(метоксикарбонил)фенил]имидазо[1,5-а]пиридин-3-илкарбонил) бензоата в 10 мл диоксана. Реакционную среду нагревали при 100 С в течение 3 ч. Добавляли пропиламин 0,14 мл (1,75 ммоль) и 0,37 мл (2,62 ммоль) триэтиламина при температуре окружающей среды. После перемешивания в течение 2 ч при температуре окружающей среды реакционную среду подвергали гидролизу водой. Смесь фильтровали, промывали водой и сушили при пониженном давлении при 50 С в течение ночи. Полученное твердое вещество очищали колоночной хроматографией на силикагеле, используя для элюции смесь дихлорметан/метанол (95/5). Получали 0,27 г желтого порошка. Температура плавления: 212 С. МН+: 515. 3-3-[(2,4-Диоксо-3-пропил-1,2,3,4-тетрагидрохиназолин-6-ил)карбонил]имидазо[1,5-а]пиридин-1 илбензойная кислота. 1N Водный раствор гидроксида натрия 1,31 мл (1,31 ммоль) добавляли к 0,27 г (0,52 ммоль) метил 5-(1-[3-(метоксикарбонил)фенил]имидазо[1,5-а]пиридин-3-илкарбонил)-2[(пропилкарбамоил)амино]бензоата в 8 мл метанола. Реакционную среду нагревали при 70 С в течение 5,5 ч. Метанол концентрировали при пониженном давлении. Остаток поглощали водой. Водную фазу подкисляли 1N водным раствором хлористо-водородной кислоты и затем экстрагировали дихлорметаном. Органическую фазу сушили над сульфатом натрия, фильтровали и затем концентрировали при пониженном давлении. Полученное твердое вещество поглощали метанолом и затем фильтровали и сушили при 50 С при пониженном давлении в течение ночи. Получали 0,245 г желтого твердого вещества. Температура плавления: 365 С. МН+: 469. Натриевая соль 3-3-[(2,4-диоксо-3-пропил-1,2,3,4-тетрагидрохиназолин-6-ил)карбонил]имидазо[1,5-а]пиридин-1-илбензойной кислоты. 1N Водный раствор гидроксида натрия 0,51 мл (0,51 ммоль) добавляли к 0,245 г (0,52 ммоль) 3-3[(2,4-диоксо-3-пропил-1,2,3,4-тетрагидрохиназолин-6-ил)карбонил]имидазо[1,5-а]пиридин-1-илбензойной кислоты в 5 мл метанола. Реакционную среду перемешивали в течение 1,5 ч при температуре окружающей среды. После добавления диизопропилового эфира образовавшийся осадок отфильтровывали,промывали диизопропиловым эфиром и сушили при 50 С при пониженном давлении в течение ночи. Получали 0,242 г желтого порошка. Температура плавления: 383 С. МН+: 469. 1(т, J=1,7 Гц, 1 Н), 8,74 (д, J=8,7 Гц, 1 Н), 9,14 (д, J=1,9 Гц, 1 Н), 9,82 (д, J=7 Гц, 1 Н), 11,9 (уш.с, 1 Н). Пример 3 (соединение 8). 3-[(2,4-Диоксо-3-пропил-1,2,3,4-тетрагидрохиназолин-6-ил)карбонил] имидазо[1,5-а]пиридин-6-карбоновая кислота. 3-[(4-Амино-3-карбоксифенил)карбонил]имидазо[1,5-а]пиридин-6-карбоновая кислота. Триэтиламин 3,68 мл (0,026 моль) и затем в атмосфере азота при температуре окружающей среды 1,5 г (8,5 ммоль) метил имидазо[1,5-а]пиридин-6-карбоксилата [описан в WO 06/097625] добавляли к 4,02 г (0,014 моль) 4-оксо-2-фенил-4 Н-3,1-бензоксазин-6-карбонилхлорида в 60 мл 1,2-дихлорэтана. После перемешивания в течение 24 ч при температуре окружающей среды реакционную среду фильтровали и промывали 1,2-дихлорэтаном, затем 1N водным раствором хлористо-водородной кислоты и затем водой. После сушки в течение ночи при пониженном давлении при 40 С полученный продукт растворяли в 60 мл NMP. Добавляли гидроксид калия 3,59 г (6,4 ммоль), растворенный в 11 мл воды. Реакционную среду нагревали при 100 С в течение 4 ч и затем выливали в 1N водный раствор хлористо-водородной кислоты. После фильтрования полученное твердое вещество промывали водой и затем сушили в течение ночи в сушильном шкафу при пониженном давлении при 40 С. Получали 5,45 г желтого твердого вещества. МН+: 326. Метил 3-[4-амино-3-(метоксикарбонил)фенил]карбонилимидазо[1,5-а]пиридин-6-карбоксилат. Карбонат цезия 9,4 г (2,9 ммоль) и затем 1,8 мл (2,9 ммоль) метилйодида при температуре окружающей среды добавляли в инертной атмосфере к 4,2 г (1,3 ммоль) 3-[(4-амино-3-карбоксифенил)карбонил]имидазо[1,5-а]пиридин-6-карбоновой кислоты в 60 мл ДМФ. После перемешивания в течение 4,5 ч при температуре окружающей среды реакционную среду подвергали гидролизу водой. Образовавшийся осадок отфильтровывали, промывали водой и затем сушили при 40 С при пониженном давлении в течение ночи. Полученное твердое вещество очищали колоночной хроматографией на силикагеле, элюцию осуществляли дихлорметаном. Получали 1,3 г желтого твердого вещества. МН+: 354. Метил 3-(3-(метоксикарбонил)-4-[(пропилкарбамоил)амино]имидазо[1,5-а]пиридин-6-карбоксилат. Трифосген 0,14 г (0,49 ммоль) добавляли при температуре окружающей среды в атмосфере азота к 0,3 г (0,7 ммоль) метил 3-[4-амино-3-(метоксикарбонил)фенил]карбонилимидазо[1,5-а]пиридин-6 карбоксилата в 10 мл безводного диоксана. После нагревания в течение 1 ч 15 при 100 С 0,12 мл (1,4 ммоль) n-пропиламина и 0,29 мл (2 ммоль) триэтиламина добавляли к реакционной среде при температуре окружающей среды. После перемешивания в течение 4 ч при температуре окружающей среды реакционную среду подвергали гидролизу водой. Образовавшийся осадок отфильтровывали, промывали водой и затем сушили при пониженном давлении при 40 С в течение ночи. Полученное твердое вещество растирали в ТГФ и затем фильтровали и сушили при пониженном давлении при 40 С в течение ночи. Получали 0,21 г желтого твердого вещества. Температура плавления: 266 С. МН+: 439. 3-[(2,4-Диоксо-3-пропил-1,2,3,4-тетрагидрохиназолин-6-ил)карбонил]имидазо[1,5-а]пиридин-6-карбоновая кислота. 1N Водный раствор гидроксида натрия 1,2 мл (1,2 ммоль) добавляли при температуре окружающей среды к 0,21 г метил 3-(3-(метоксикарбонил)-4-[(пропилкарбамоил)амино]имидазо[1,5-а]пиридин-6 карбоксилата в 5 мл метанола. После кипячения с обратным холодильником в течение 4 ч реакционную среду подкисляли 1N водным раствором хлористо-водородной кислоты. Образовавшийся осадок отфильтровывали и затем промывали водой и сушили при пониженном давлении при 40 С в течение ночи. Полученное твердое вещество перекристаллизовывали из горячего метанола и затем сушили при пониженном давлении при 40 С в течение ночи. Получали 0,118 г желтого твердого вещества. Температура плавления: 384 С. МН+: 393. 1H-ЯМР (D6-ДМСО, 400 МГц): 0,92 (т, J=7,2 Гц, ЗН), 1,59-1,68 (м, 2 Н), 3,87-3,94 (м, 2 Н), 7,33 (д,J=8,2 Гц, 1 Н), 7,72 (д, J=9,3 Гц, 1 Н), 7,98 (с, 1 Н), 8,06 (д, J=9,3 Гц, 1 Н), 8,59 (д, J=8,51 Гц, 1 Н), 9,20 (д,J=2,03 Гц, 1 Н), 11,8 (с, 1 Н), 13,7 (с, 1 Н). Пример 4 (соединение 49). Натриевая соль 3-(3-[3-(4-фторбензил)-1-метил-2,4-диоксо-1,2,3,4 тетрагидрохиназолин-6-ил]карбонилимидазо[1,5-а]пиридин-1-ил)бензойной кислоты. Метил 2-[(4-фторбензил)карбамоил]амино-5-(1-[3-(метоксикарбонил)фенил]имидазо[1,5-а]пиридин-3-илкарбонил)бензоат. Трифосген 2,14 г (7,2 ммоль) добавляли при температуре окружающей среды в инертной атмосфере к 2,58 г (6 ммоль) метил 2-амино-5-(1-[3-(метоксикарбонил)фенил]имидазо[1,5-а]пиридин-3-илкарбонил)бензоата в 50 мл диоксана. После кипячения с обратным холодильником в течение 7 ч, 2,25 г (18 ммоль) 4-фторбензиламина и 1,82 г (18 ммоль) триэтиламина добавляли при температуре окружающей среды. Реакционную среду кипятили с обратным холодильником в течение 3 ч и затем концентрировали при пониженном давлении. Остаток растирали в воде. После фильтрования, твердое вещество промывали метанолом и затем сушили при пониженном давлении при 40 С в течение ночи. Получали 3,3 г желтого твердого вещества. МН+: 581. 3-(3-[3-(4-Фторбензил)-2,4-диоксо-1,2,3,4-тетрагидрохиназолин-6-ил]карбонилимидазо[1,5-а]пиридин-1-ил)бензойная кислота. 1N Водный раствор гидроксида натрия 2,85 мл (0,0285 моль) добавляли к 3,3 г (5,7 ммоль) метил 2[(4-фторбензил)карбамоил]амино-5-(1-[3-(метоксикарбонил)фенил]имидазо[1,5-а]пиридин-3-илкарбонил)бензоата, растворенного в 250 мл метанола. После кипячения с обратным холодильником в течение 2 ч реакционную среду подкисляли 50 мл 1N водного раствора хлористо-водородной кислоты и затем разбавляли 700 мл воды. Образовавшийся осадок отфильтровывали и сушили при пониженном давлении при 40 С в течение ночи. Получали 3,01 г желтого твердого вещества. МН+: 535. Метил 3-(3-[3-(4-фторбензил)-1-метил-2,4-диоксо-1,2,3,4-тетрагидрохиназолин-6-ил]карбонил имидазо[1,5-а]пиридин-1-ил)бензоат. Карбонат цезия 2,4 4 г (7,5 ммоль ) и 1,0 6 г (7,5 ммоль ) метилйодида добавляли в инертной атмосфере к 1,3 г (2,5 ммоль) 3-(3-[3-(4-фторбензил)-2,4-диоксо-1,2,3,4-тетрагидрохиназолин-6-ил]карбонилимидазо[1,5-а]пиридин-1-ил)бензойной кислоты в 50 мл ДМФ. Реакционную среду перемешивали в течение 3 ч при температуре окружающей среды в атмосфере азота и затем концентрировали при пониженном давлении. Полученный остаток промывали 200 мл воды и затем сушили при пониженном давлении при 40 С в течение ночи. Получали 1,35 г желтого твердого вещества. МН+: 563. Натриевая соль 3-(3-[3-(4-фторбензил)-1-метил-2,4-диоксо-1,2,3,4-тетрагидрохиназолин-6-ил]карбонилимидазо[1,5-а]пиридин-1-ил)бензойной кислоты. 1N Водный раствор гидроксида лития 24 мл (24 ммоль) добавляли к 1,3 г (2,4 ммоль) метил 3-(3[3-(4-фторбензил)-1-метил-2,4-диоксо-1,2,3,4-тетрагидрохиназолин-6-ил]карбонилимидазо[1,5-а]пиридин-1-ил)бензоата в 120 мл ТГФ. Реакционную среду кипятили с обратным холодильником в течение 5 ч и затем подкисляли при 5 С 45 мл 1N водного раствора хлористо-водородной кислоты и, в конечном счете, разбавляли 200 мл воды. После фильтрования полученный остаток сушили при пониженном давлении при 40 С в течение ночи. 1N Водный раствор гидроксида натрия 0,62 мл (0,62 ммоль) добавляли к 0,35 г (0,64 ммоль) полученного желтого твердого вещества в 20 мл метанола. После фильтрования, полученный остаток сушили при пониженном давлении при 40 С в течение ночи. Получали 0,38 г желтого твердого вещества. МН+: 549. 1(м, 1 Н), 9,88-9,91 (пс д, J=7,2 Гц, 1 Н). Пример 5 (соединение 29). 3-3-[(2,4-Диоксо-3-пропил-1,2,3,4-тетрагидрохиназолин-6-ил)карбонил]имидазо[1,5-а]пиридин-1-илбензамид. Хлорид аммония 10,7 мг (0,2 ммоль), 5,17 мг (0,4 ммоль) N,N-диизопропилэтиламина и 49,2 мг (0,2 ммоль) TOTU добавляли при 0 С в инертной атмосфере к 46,8 мг (0,1 ммоль) 3-3-[(2,4-диоксо-3 пропил-1,2,3,4-тетрагидрохиназолин-6-ил)карбонил]имидазо[1,5-а]пиридин-1-илбензойной кислоты в 2 мл ДМФ. Реакционную среду перемешивали в течение 12 ч при температуре окружающей среды и затем выливали в 30 мл насыщенного раствора бикарбоната натрия. Образовавшийся осадок отфильтровывали,промывали водой и сушили при пониженном давлении при 40 С в течение ночи. Получали 0,042 г желтого твердого вещества. МН+: 468. 1N'-Ацетил-3-3-[(2,4-диоксо-3-пропил-1,2,3,4-тетрагидрохиназолин-6-ил)карбонил]имидазо[1,5-а] пиридин-1-илбензогидразид. Ацетогидразид 29,6 мг (0,4 ммоль), 98,4 мг (0,3 ммоль) TOTU и 0,104 мл (0,6 ммоль) N,Nдиизопропилэтиламина добавляли в инертной атмосфере при 0 С к 93,7 мг (0,2 ммоль) 3-3-[(2,4-диоксо 3-пропил-1,2,3,4-тетрагидрохиназолин-6-ил)карбонил]имидазо[1,5-а]пиридин-1-илбензойной кислоты в 6 мл ДМФ. Реакционную среду перемешивали в течение 1 ч при 0 С и затем в течение 6 ч при 50 С и затем концентрировали при пониженном давлении. Остаток поглощали 10 мл метанола. Образовавшийся осадок отфильтровывали, промывали диэтиловым эфиром и пентаном и затем сушили при пониженном давлении при 40 С в течение ночи. Получали 45 мг желтого твердого вещества. МН+: 525. 6-(1-[3-(5-Метил-1,3,4-оксадиазол-2-ил)фенил]имидазо[1,5-а]пиридин-3-илкарбонил-3-пропилхиназолин-2,4(1 Н,3 Н)-дион.N-Ацетил-3-3-[(2,4-диоксо-3-пропил-1,2,3,4-тетрагидрохиназолин-6-ил)карбонил]имидазо[1,5-а] пиридин-1-илбензогидразид 35 мг (0,066 ммоль) в 1 мл хлорокиси фосфора нагревали при 100 С в течение 15 мин. Реакционную среду концентрировали при пониженном давлении. Полученный остаток подвергали гидролизу водой и насыщенным раствором бикарбоната натрия. Водную фазу экстрагировали дихлорметаном. Органическую фазу концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле, элюцию осуществляли метанолом. Получали 0,025 г желтого твердого вещества. МН+: 507. 1 3,93 (т, J=7,5 Гц, 2 Н), 7,33-7,43 (м, 2 Н), 7,58-7,64 (м, 1 Н), 7,77-7,84 (м, 1 Н), 8,04-8,06 (м, 1 Н), 8,28-8,32 (м,1 Н), 8,39-8,43 (м, 1 Н), 8,59 (с, 1 Н), 8,71-8,74 (м, 1 Н), 9,37 (с, 1 Н), 9,86-9,90 (с, 1 Н), 11,85 (уш. с, 1 Н). Пример 7 (соединение 36). 6-(1-[3-(3-Метил-1,2,4-оксадиазол-5-ил)фенил]имидазо[1,5-а]пиридин-3-илкарбонил)-3-пропилхиназолин-2,4(1 Н, 3 Н)-дион. 3-3-[(2,4-Диоксо-3-пропил-1,2,3,4-тетрагидрохиназолин-6-ил)карбонил]имидазо[1,5-а]пиридин-1 ил-N-[(1E)-гидроксиэтанимидоил]бензамид. 1,1-Карбонилдиимидазол 39 мг (0,24 ммоль) добавляли при температуре окружающей среды в инертной атмосфере к 94 мг (0,2 ммоль) 3-3-[(2,4-диоксо-3-пропил-1,2,3,4-тетрагидрохиназолин-6-ил) карбонил]имидазо[1,5-а]пиридин-1-илбензойной кислоты в 5 мл ДМФ. После перемешивания в течение 12 ч при температуре окружающей среды добавляли 22,2 мг (0,3 ммоль) ацетамидоксима. Реакционную среду перемешивали в течение 5 ч при температуре окружающей среды и затем концентрировали при пониженном давлении. Остаток растирали в диэтиловом эфире, фильтровали и затем сушили при пониженном давлении при 40 С в течение ночи. Получали 0,101 г желтого твердого вещества. МН+: 525. 6-(1-[3-(3-Метил-1,2,4-оксадиазол-5-ил)фенил]имидазо[1,5-а]пиридин-3-илкарбонил)-3-пропилхиназолин-2,4(1 Н,3 Н)-дион. Раствор 0,1 г (0,19 ммоль) 3-3-[(2,4-диоксо-3-пропил-1,2,3,4-тетрагидрохиназолин-6-ил)карбонил] имидазо[1,5-а]пиридин-1-ил-N-[(1E)-гидроксиэтанимидоил]бензамида в 3 мл ДМФ нагревали при 120 С в течение 5 ч. Реакционную среду концентрировали при пониженном давлении. Полученный остаток поглощали диэтиловым эфиром, фильтровали и затем сушили при пониженном давлении при 40 С в течение ночи. Получали 0,083 г желтого твердого вещества. МН+: 507. 1H-ЯМР (D6-ДМСО): 0,91 (т, J=7,5 Гц, 3 Н), 1,65 (кв. т, J=7,5 Гц, 7,5 Гц, 2 Н), 2,47 (с, 3 Н), 3,94 (т,J=7,5 Гц, 2 Н), 7,36-7,45 (м, 2 Н), 7,59-7,66 (м, 1 Н), 7,82-7,89 (м, 1 Н), 8,13-8,19 (м, 1 Н), 8,36-8,45 (м, 2 Н),8,68 (с, 1 Н), 8,75-8,79 (м, 1 Н), 9,25, 9,28 (м, 1 Н), 9,85-9,90 (м, 1 Н), 11,85 (уш. с, 1 Н). Пример 8 (соединение 13). N-3-[(2,4-Диоксо-3-пропил-1,2,3,4-тетрагидрохиназолин-6-ил)карбонил]имидазо[1,5-а]пиридин-1-илметансульфонамид. Метил 5-[(1-бромимидазо(1,5-а)пиридин-3-ил)карбонил]-2-[(пропилкарбамоил)аминобензоат. Трифосген 0,55 г (0,0019 моль) добавляли при температуре окружающей среды в инертной атмосфере к 1 г (2,7 ммоль) метил 2-амино-5-[1-бром(имидазо[1,5-а]пиридин-3-ил)карбонил)]бензоата в 30 мл безводного диоксана. Реакционную среду нагревали в течение 1,5 ч при 100 С. n-Пропиламин 0,44 мл(5,3 ммоль) и 1,12 мл (8 ммоль) триэтиламина добавляли при температуре окружающей среды. После 2 ч 30 мин реакционную среду подвергали гидролизу водой. Водную фазу экстрагировали дихлорметаном. Органическую фазу сушили над сульфатом натрия, фильтровали и затем концентрировали при пониженном давлении. Полученное твердое вещество растирали в дихлорметане, фильтровали и затем сушили при пониженном давлении при 40 С в течение ночи. МН+: 459, 461. Температура плавления: 236 С. 6-[(1-Бромимидазо[1,5-а]пиридин-3-ил)карбонил]-3-пропилхиназолин-2,4(1 Н,3 Н)-дион. 1N Водный раствор гидроксида натрия 3,14 мл (3,1 ммоль) добавляли при температуре окружающей среды к 1,2 г (2,6 ммоль) метил 5-[(1-бромимидазо(1,5-а)пиридин-3-ил)карбонил]-2-[(пропилкарбамоил)аминобензоата в 20 мл метанола. После кипячения с обратным холодильником в течение 3 ч реакционную среду подвергали гидролизу 1N водным раствором хлористо-водородной кислоты. Образовавшийся осадок отфильтровывали, промывали метанолом и затем сушили при пониженном давлении при 40 С в течение ночи. Получали 1,09 г желтого твердого вещества. МН+: 427, 429. Температура плавления: 322 С. 6-[(1-Аминоимидазо[1,5-а]пиридин-3-ил)карбонил]-3-пропилхиназолин-2,4(1 Н,3 Н)-дион. Карбонат цезия 1,4 5 г (4,7 ммоль), 1,13 мл (6,7 ммоль) бензофенонимина, 0,278 г (0,45 ммоль) binap и 0,204 г (0,22 ммоль) дибензилиденацетона дипалладия добавляли при температуре окружающей среды в атмосфере аргона к 0,955 г (2 ммоль) 6-[(1-бромимидазо(1,5-а)пиридин-3-ил)карбонил]-3-пропилхиназолин-2,4-(1H,3H)диона в 20 мл ДМСО. Реакционную среду нагревали при 110 С в течение 18 ч. Реакционную среду экстрагировали этилацетатом. Органическую фазу сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученный остаток растворяли в 40 мл ТГФ. 2N Водный раствор хлористо-водородной кислоты 4,5 мл (9 ммоль) добавляли при температуре окружающей среды. После перемешивания в течение 4 ч при температуре окружающей среды реакционную среду концентрировали при пониженном давлении. Полученный остаток промывали дихлорметаном и метанолом и затем сушили при пониженном давлении при 40 С в течение ночи. Получали 0,558 г красного твердого вещества. МН+: 364. После добавления метанола реакционную среду концентрировали при пониженном давлении. Остаток поглощали дихлорметаном. Органическую фазу промывали 1N водным раствором хлористо-водородной кислоты и затем водой, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Остаток перекристаллизовывали из горячего метанола, очищали на силикагеле с фритой, элюцию осуществляли ДМФ. Получали 0,057 г оранжевого твердого вещества. Температура плавления: 334 С. МН+: 442. 1 Н-ЯМР (D6-ДМСО, 400 МГц): 0,88 (т, J=7,37 Гц, 3 Н), 1,55-1,65 (м, 2 Н), 3,29 (с, 3 Н), 3,87-3,90 (м,2 Н), 7,27-7,31 (м, 2 Н), 7,40-7,44 (M, 1H) 7,92 (д, J=9 Гц, 1 Н), 8,52 (д, J=8,46 Гц, 1 Н), 9,15 (д, J=2,18 Гц,1H), 9,71 (д, J=7,1 Гц, 1 Н), 10,2 (с, 1 Н), 11,8 (с, 1 Н). Пример 9 (соединение 82). 2-Морфолин-4-илэтил 3-(3-[3-(4-фторбензил)-1-метил-2,4-диоксо 1,2,3,4-тетрагидрохиназолин-6-ил]карбонилимидазо[1,5-а]пиридин-1-ил)бензоата гидрохлорид. 4-(2-Хлорэтил)морфолина гидрохлорид 0,022 г (0,61 ммоль) и 0,189 г (1,37 ммоль) карбоната калия добавляли в инертной атмосфере к 0,3 г (0,55 ммоль) 3-(3-[3-(4-фторбензил)-1-метил-2,4-диоксо-1,2,3,4 тетрагидрохиназолин-6-ил]карбонилимидазо[1,5-а]пиридин-1-ил)бензойной кислоты в 8 мл ДМФ. После перемешивания в течение 18 ч при температуре окружающей среды и затем в течение 8 ч при 50 С,реакционную среду подвергали гидролизу водой и экстрагировали этилацетатом. Органическую фазу промывали водой, сушили над сульфатом натрия, фильтровали и затем концентрировали при пониженном давлении. Полученное желтое твердое вещество очищали колоночной хроматографией на силикагеле, элюцию осуществляли смесью дихлорметан/метанол (95/5). 1N Водный раствор хлористоводородной кислоты 0,61 мл добавляли к 0,334 г полученного желтого твердого вещества в 5 мл метанола. Реакционную среду перемешивали в течение 1 ч при температуре окружающей среды. Диэтиловый эфир добавляли и затем реакционную среду фильтровали. Образовавшийся осадок промывали диэтиловым эфиром и затем сушили при пониженном давлении при 50 С в течение ночи. Получали 0,298 г желтого твердого вещества. Температура плавления: 215 С. МН+: 662. 1N,N-Диметилэтилендиамин 0,0 6 мл (0,55 ммоль), 0,134 г (0,41 ммоль) TOTU и 0,14 мл (0,82 ммоль) диизопропилэтиламина добавляли к 0,15 г (0,27 ммоль) 3-(3-[3-(4-фторбензил)-1-метил-2,4-диоксо 1,2,3,4-тетрагидрохиназолин-6-ил]карбонилимидазо[1,5-а]пиридин-1-ил)бензойной кислоты в 5 мл ДМФ. Реакционную среду нагревали при 80 С в течение 16 ч. Реакционную среду подвергали гидролизу водой и экстрагировали этилацетатом. Органическую фазу промывали водой, сушили над сульфатом натрия, фильтровали и концентрировали при пониженном давлении. Полученное желтое твердое вещество очищали колоночной хроматографией на силикагеле, элюцию осуществляли смесью дихлорметан/метанол (95/5). 1N Раствор 0,23 мл хлористо-водородной кислоты в диэтиловом эфире добавляли к 0,095 г полученного желтого твердого вещества. После перемешивания в течение 1 ч добавляли диэтиловый эфир. Образовавшийся осадок отфильтровывали, промывали водой и затем сушили при пониженном давлении при 50 С в течение ночи. Получали 0,1 г желтого твердого вещества. Температура плавления: 247 С. МН+: 619. 1H-ЯМР (D6-ДМСО, 400 МГц): 2,50 (м, 6 Н), 2,84 (с, 2 Н), 3,31 (с, 3 Н), 3,61 (с, 1 Н), 3,64-6,70 (м, 1 Н),5,16 (с, 2 Н), 7,7,11-7,17 (м, 2 Н), 7,37-7,46 (м, 3 Н), 7,55-7,60 (м, 1 Н), 7,67-7,71 (м, 2 Н), 7,93 (д, J=8,19 Гц,1 Н), 8,19 (д, J=7,51 Гц, 1 Н), 8,38-8,43 (м, 2 Н), 8,87 (д, J=8,88 Гц, 1 Н), 8,92 (т, J=5, 12 Гц, 1 Н), 9,27 (д, J=2 Гц, 1 Н), 9,81 (с, 1 Н), 9,84 (д, J=7,1 Гц, 1 Н). Пример 11 (соединение 72). Натриевая соль 3-(3-[3-(4-фторбензил)-1-пропил-2,4-диоксо-1,2,3,4 тетрагидрохиназолин-6-ил]карбонилимидазо[1,5-а]пиридин-1-ил)бензойной кислоты. Пропил 3-(3-[3-(4-фторбензил)-1-пропил-2,4-диоксо-1,2,3,4-тетрагидрохиназолин-6-ил]карбонил имидазо[1,5-а]пиридин-1-ил)бензоат. Карбонат цезия 1,371 г (4,21 ммоль) и 0,715 г (4,21 ммоль) пропилйодида добавляли в инертной атмосфере к 0,75 г (1,4 ммоль) 3-(3-[3-(4-фторбензил)-2,4-диоксо-1,2,3,4-тетрагидрохиназолин-6-ил]карбонилимидазо[1,5-а]пиридин-1-ил)бензойной кислоты в 30 мл ДМФ. Реакционную среду перемешивали в течение 3 ч при температуре окружающей среды в атмосфере азота и затем концентрировали при пониженном давлении. Полученный остаток промывали 100 мл воды и затем сушили при пониженном давлении при 40 С в течение ночи. Полученное твердое вещество очищали колоночной хроматографией на силикагеле, элюцию осуществляли смесью дихлорметан/метанол (75/1). Получали 0,55 г желтого твердого вещества. МН+: 619. Натриевая соль 3-(3-[3-(4-фторбензил)-1-пропил-2,4-диоксо-1,2,3,4-тетрагидрохиназолин-6-ил] карбонилимидазо[1,5-а]пиридин-1-ил)бензойной кислоты. 1N Водный раствор гидроксида лития 8,9 мл (8,9 ммоль) добавляли к 0,55 г (0,889 ммоль) пропил 3(3-[3-(4-фторбензил)-1-пропил-2,4-диоксо-1,2,3,4-тетрагидрохиназолин-6-ил]карбонилимидазо[1,5-а] пиридин-1-ил)бензоата в 50 мл ТГФ. Реакционную среду кипятили с обратным холодильником в течение 6 ч и затем подкисляли при 5 С 17 мл 1N водного раствора хлористо-водородной кислоты и в конце разбавляли 100 мл воды. После фильтрования полученный остаток сушили при пониженном давлении при 40 С в течение ночи. 1N водного раствора гидроксида натрия 0,408 мл (0,408 ммоль) добавляли к 0,24 г (0,416 ммоль) полученного желтого твердого вещества в 20 мл метанола. После фильтрования, образовавшийся остаток сушили при пониженном давлении при 40 С в течение ночи. Получали 0,24 г желтого твердого вещества. МН+: 577. 1H-ЯМР (D6-ДМСО, 500 МГц): 0,97 (т, J=7,5 Гц, 3 Н), 1,71 (т,кв., J1/J2=7,5 Гц, 2 Н), 4,18 (т, J=7,5 Гц,2 Н), 5,20 (с, 2 Н), 7,17 (пс т, J=9,3 Гц, 2H), 7,37-7,41 (м, 1H), 7,44-7,49 (3 м, 3 Н), 7,59 (м, 1 Н), 7,78 (пс д,J=8,5 Гц, 1 Н), 7,91 (2 м, 2 Н), 8,28 (пс д, J=9, 8 Гц, 1 Н), 8,45 (м, 1 Н), 8,99-9,02 (м, 1 Н), 9,23 (м, 1 Н), 9,90 (пс д, J=7,5 Гц, 1 Н). Пример 12 (соединение 113). 3-(4-Фторбензил)-1-метил-6-[(1-пиридин-3-илимидазо[1,5-а]пиридин-3-ил)карбонил]хиназолин-2,4(1 Н,3 Н)-дион. Метил 5-[(1-бромимидазо[1,5-а]пиридин-3-ил)карбонил]-2-[(4-фторбензил)карбамоил]аминобензоат. Трифосген 3 г (10,4 ммоль), разбавленный в 40 мл диоксана, добавляли к 5,57 г (14,9 ммоль) метил 2-амино-5-[1-бром(имидазо[1,5-а]пиридин-3-ил)карбонил]бензоата в 160 мл диоксана в инертной атмосфере. Реакционную среду кипятили с обратным холодильником в течение 1 ч. 4-Фторбензиламина 3,7 г(0,030 моль) и 6,22 мл (0,045 моль) триэтиламина добавляли при температуре окружающей среды. Реакционную среду перемешивали в течение 4 ч при температуре окружающей среды и затем гидролизовали водой. Образовавшийся осадок отфильтровывали, промывали водой и сушили при пониженном давлении при 50 С в течение ночи. Полученное твердое вещество поглощали метанолом, фильтровали, промывали метанолом и сушили при пониженном давлении в течение ночи. Получали 12 г желтого твердого вещества (выход=95,5%). МН+: 525, 527. Температура плавления: 203 С. 6-[(1-Бромимидазо[1,5-а]пиридин-3-ил)карбонил]-3-(4-фторбензил)хиназолин-2,4(1 Н,3 Н)-дион. 1N Водный раствор гидроксида натрия 22,33 мл (22,33 ммоль) добавляли к 7,8 г (0,0149 моль) метил 5-[(1-бромимидазо[1,5-а]пиридин-3-ил)карбонил]-2-[(4-фторбензил)карбамоил]аминобензоата в 100 мл метанола. Реакционную среду кипятили с обратным холодильником в течение 2,5 ч. После гидролиза водой образовавшийся осадок отфильтровывали, промывали водой и сушили при пониженном давлении при 50 С в течение ночи. Полученное твердое вещество поглощали 0,1N водным раствором хлористо-водородной кислоты,фильтровали, промывали водой и сушили при пониженном давлении при 50 С в течение ночи. Получали 5,4 г желтого твердого вещества. Температура плавления: 325 С. МН+: 494, 496. 6-[(1-Бромимидазо[1,5-а]пиридин-3-ил)карбонил]-3-(4-фторбензил)-1-метилхиназолин-2,4(1 Н,3 Н)дион. Карбонат цезия 1,8 7 г (5,7 ммоль ) и 0,39 мл (6,2 ммоль) метилйодида добавляли при температуре окружающей среды в инертной атмосфере к 2,6 г (5,17 ммоль) 6-[(1-бромимидазо[1,5-а]пиридин-3 ил)карбонил]-3-(4-фторбензил)хиназолин-2,4(1H,3H)-диона в 50 мл безводного ДМФ. Реакционную среду перемешивали в течение 18 ч при температуре окружающей среды и затем фильтровали. Осадок промывали водой и затем сушили при пониженном давлении при 50 С в течение ночи. Получали 2,54 г желтого твердого вещества. Температура плавления: 280 С. МН+: 507, 509. 3-(4-Фторбензил)-1-метил-6-[(1-пиридин-3-илимидазо[1,5-а]пиридин-3-ил)карбонил]хиназолин 2,4(1H,3H)-дион. 3-Пиридилбороновую кислоту 0,04 г (0,32 ммоль), 0,2 г (0,81 ммоль) дигидрата фосфата калия, растворенного в 0,29 мл воды, и 6,2 мг (0,01 ммоль) тетракис(трифенилфосфин)палладия добавляли к 0,15 г(1H,3H)-диона в 3 мл ДМФ в атмосфере инертного аргона. Реакционную среду нагревали в СВЧ-печи при 150 С в течение 20 мин. После фильтрования через тальк, реакционную среду концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле, элюцию осуществляли смесью дихлорметан/метанол (95/5). Получали 0,12 г желтого твердого вещества. Температура плавления: 207 С. МН+: 506. 3-(4-Фторбензил)-1-метил-6-[(1-пиридин-3-илимидазо[1,5-а]пиридин-3-ил)карбонил]хиназолин 2,4(1H,3 Н)-диона гидрохлорид. 1N Раствор хлористо-водородной кислоты 0,35 мл (0,35 ммоль) в диэтиловом эфире добавляли к 0,12 г (0,23 ммоль) 3-(4-фторбензил)-1-метил-6-[(1-пиридин-3-илимидазо[1,5-а]пиридин-3-ил) карбонил] хиназолин-2, 4 (1H, 3H) -диона в 3 мл метанола. После перемешивания в течение 1 ч при температуре окружающей среды, реакционную среду фильтровали. Образовавшийся осадок промывали диэтиловым эфиром и сушили при пониженном давлении при 50 С в течение ночи. Получали 0,12 г желтого твердого вещества. МН+: 506. Температура плавления: 267 С. 1H-ЯМР (D6-ДМСО, 400 МГц): 3,60 (с, 3 Н), 5,16 (с, 2 Н), 7,14 (т, J=8,34 Гц, 2 Н), 7,36-7,47 (м, 3 Н),7,60 (т, J=7,05 Гц, 1 Н), 7,65 (д, J=8,98 Гц, 1 Н), 7,83 (т, J=7,05 Гц, 1 Н), 8,43 (д, J=8,98 Гц, 1 Н), 8,66-8,75 (м,2 Н), 8,83 (д, J=8,98 Гц, 1 Н), 9,30 (м, 2 Н), 9,81 (д, J=7,05 Гц, 1 Н). Пример 13 (соединение 53). 3-3-[(2-Метил-4-оксо-3-пропил-3,4-дигидрохиназолин-6-ил)карбонил]имидазо[1,5-а]пиридин-1-илбензойная кислота. 2-Амино-5-(1-бромимидазо[1,5-а]пиридин-3-илкарбонил)бензойная кислота. 1N Водный раствор гидроксида натрия 60 мл (60 ммоль) добавляли при температуре окружающей среды к 3,74 г (10 ммоль) метил 2-амино-5-[1-бром(имидазо[1,5-а]пиридин-3-ил)карбонил]бензоата в 300 мл метанола и 125 мл воды. Реакционную среду кипятили с обратным холодильником в течение 6 ч и затем добавляли 140 мл 1N водного раствора хлористо-водородной кислоты. После концентрирования метанола при пониженном давлении образовавшийся осадок отфильтровывали, промывали водой и затем сушили при пониженном давлении при 40 С в течение 18 ч. Получали 3,53 г желтого твердого вещества. МН+: 360, 362. 2-(Ацетиламино)-5-[(1-бромимидазо[1,5-а]пиридин-3-ил)карбонил]бензойная кислота. 2-Амино-5-(1-бромимидазо[1,5-а]пиридин-3-илкарбонил)бензойную кислоту 0,92 г (2,56 ммоль) в 30 мл уксусного ангидрида кипятили с обратным холодильником в течение 5,5 ч. Реакционную среду концентрировали при пониженном давлении. Остаток поглощали водой и затем фильтровали и сушили при пониженном давлении в течение ночи при 40 С. Получали 1,1 г желтого твердого вещества. МН+: 402, 404. 6-[(1-Бромимидазо[1,5-а]пиридин-3-ил)карбонил]-2-метил-3-пропилхиназолин-4(3 Н)-онn-Пропиламин 1,32 г (22,4 ммоль) добавляли при 0 С в инертной атмосфере к 0,9 г (2,2 ммоль) 6[(1-бромимидазо[1,5-а]пиридин-3-ил)карбонил]-2-метил-4H-3,1-бензоксазин-4-она в 15 мл ледяной уксусной кислоты. Реакционную среду нагревали в СВЧ-печи в течение 45 мин при 160 С. Реакционную среду концентрировали при пониженном давлении. Полученный остаток поглощали насыщенным водным раствором карбоната натрия. Образовавшийся осадок отфильтровывали и затем сушили при пониженном давлении при 50 С в течение ночи. Получали 0,67 г желтого твердого вещества. МН+: 425, 427. Метил 3-3-[(2-метил-4-оксо-3-пропил-3,4-дигидрохиназолин-6-ил)карбонил]имидазо[1,5-а]пиридин-1-илбензоат. 3-Метоксикарбонилфенилбороновую кислоту 0,35 г (1,95 ммоль), 0,689 г (3,24 ммоль) фосфата калия, растворенного в 3 мл воды, и 0,037 г (0,032 ммоль) тетракис(трифенилфосфин)палладия добавляли к 0,69 г (1,62 ммоль) 6-[(1-бромимидазо[1,5-а]пиридин-3-ил)карбонил]-2-метил-3-пропилхиназолин-4(3H)она в 15 мл NMP. Реакционную среду нагревали в СВЧ-печи в течение 15 мин при 150 С и затем концентрировали при пониженном давлении. После добавления 100 мл воды осадок отфильтровывали и затем сушили при пониженном давлении при 50 С в течение ночи. Полученное твердое вещество очищали колоночной хроматографией на силикагеле, элюцию осуществляли смесью дихлорметан/метанол (50/1). МН+: 481. 3-3-[(2-Метил-4-оксо-3-пропил-3,4-дигидрохиназолин-6-ил)карбонил]имидазо[1,5-а]пиридин-1 илбензойная кислота. 1N Водный раствор гидроксида натрия 7,65 мл добавляли к 0,735 г (1,53 ммоль) метил 3-3-[(2 метил-4-оксо-3-пропил-3,4-дигидрохиназолин-6-ил)карбонил]имидазо[1,5-а]пиридин-1-илбензоата в 30 мл ТГФ. Реакционную среду кипятили с обратным холодильником в течение 2,5 ч. После подкисления 10 мл 1N водного раствора хлористо-водородной кислоты, реакционную среду концентрировали при пониженном давлении. Остаток поглощали 20 мл воды. Образовавшийся осадок отфильтровывали и сушили при пониженном давлении при 50 С в течение ночи. Получали 0,52 г желтого твердого вещества. МН+: 467. 1(м, 1 Н), 8,79-8,82 (м, 1 Н), 9,30-9,34 (м, 1 Н), 9,88-9,22 (м, 1 Н), 13,23 (уш. с, 1 Н). Пример 14 (соединение 55). 3-3-[(2-Метил-4-оксо-3-пропил-3,4-дигидрохиназолин-6-ил)карбонил]имидазо[1,5-а]пиридин-1-илбензамид. Хлорид аммония 0,107 г (2 ммоль), 0,32 8 г (1 ммоль) TOTU и 0,517 г (4 ммоль) N,N-диизопропилэтиламина добавляли при температуре окружающей среды в инертной атмосфере к 0,233 г (0,5 моль) 33-[(2-метил-4-оксо-3-пропил-3,4-дигидрохиназолин-6-ил)карбонил]имидазо[1,5-а]пиридин-1-илбензойной кислоты в 30 мл ДМФ. Реакционную среду перемешивали в течение 5 ч при температуре окру- 15022690 жающей среды и затем концентрировали при пониженном давлении. К остатку добавляли 50 мл насыщенного раствора бикарбоната натрия. Образовавшийся осадок отфильтровывали и затем сушили при пониженном давлении при 50 С в течение ночи. Получали 0,230 г желтого твердого вещества. МН+: 466. 1H-ЯМР (D6-ДМСО, 500 МГц): 0,98 (т, J=8 Гц, 3 Н), 1,74 (м, 2 Н), 2,71 (с, 3 Н), 4,10 (т, J=8,1 Гц, 2 Н),7,40-7,45 (м, 1 Н), 7,54-7,64 (м, 2 Н), 7,67,-7,71 (м, 1 Н), 7,75-7,80 (м, 1 Н), 7,96-8,00 (м, 1 Н), 8,19-8,23 (м,2 Н), 8,42-8,48 (м, 2 Н), 8,82-8,85 (м, 1 Н), 9,39-9,41 (м, 1 Н), 9,90-9,95 (м, 1 Н). Пример 15 (соединение 3). 6-(Имидазо[1,5-а]пиридин-3-илкарбонил)хиназолин-4(3 Н)-он. Формамидинацетат 0,3 6 г (3,6 ммоль) добавляли к 0,2 г (0,72 ммоль) 2-амино-5-(имидазо[1,5 а]пиридин-3-илкарбонил)бензойной кислоты (описана в WO 06/097625) в 7 мл этанола. Реакционную среду нагревали в СВЧ-печи при 150 С в течение 25 мин. Реакционную среду подвергали гидролизу 1N водным раствором гидроксида натрия. Водную фазу экстрагировали дихлорметаном. Гетерогенную органическую фазу фильтровали. Полученное твердое вещество очищали колоночной хроматографией на силикагеле, элюцию осуществляли смесью дихлорметан/метанол (90/10). Получали 54 мг желтого твердого вещества. МН+: 291. Температура плавления: 289 С. 1H-ЯМР (D6-ДМСО, 400 МГц): 7,29-7,47 (м, 2 Н), 7,80-7,82 (м, 1 Н), 7,96 (с, 1 Н), 8,04-8,07 (м, 1 Н),8,23 (с, 1 Н), 8,67-8,70 (м, 1 Н), 9,29 (с, 1 Н), 9,52-9,53 (м, 1 Н), 12,5 (с, 1 Н). Пример 16 (соединение 177). N,N-1,2-Тетраметил-4-оксо-6-[1-(пиридин-3-ил)имидазо[1,5-а] пиридин-3-ил]карбонил-1,4-дигидрохинолин-3-карбоксамид. 6-[(1-Бромимидазо[1,5-а]пиридин-3-ил)карбонил]-2 Н-3,1-бензоксазин-2,4(1 Н)-дион. Трифосген 1,30 г (4,37 ммоль), растворенный в 10 мл диоксана, добавляли в инертной атмосфере при температуре окружающей среды к 1,05 г (2,91 ммоль) 2-амино-5-(1-бромимидазо[1,5-а]пиридин-3 илкарбонил)бензойной кислоты. Реакционную среду кипятили с обратным холодильником в течение 4 ч и затем концентрировали при пониженном давлении. Воду (100 мл) добавляли к остатку. Образовавшийся осадок отфильтровывали при пониженном давлении при 40 С в течение 18 ч. Получали 1,1 г желтого твердого вещества. МН+: 386, 388. 6-[(1-Бромимидазо[1,5-а]пиридин-3-ил)карбонил]-1-метил-2 Н-3,1-бензоксазин-2,4(1 Н)-дион. Метилйодид 808 мг (5,7 ммоль ) и 164 мг (3,42 ммоль) 50% гидрида натрия добавляли при температуре окружающей среды в инертной атмосфере к 1,1 г (2,85 ммоль) 6-[(1-бромимидазо[1,5-а]пиридин-3 ил)карбонил]-2H-3,1-бензоксазин-2,4(1H)-диона в 20 мл ДМФ. После перемешивания в течение 3 ч реакционную среду выливали в 200 мл ледяной воды. Осадок отфильтровывали, промывали водой и затем сушили при пониженном давлении в течение 18 ч при 40 С. Получали 1,13 г желтого твердого вещества. МН+: 402, 403,95. 6-[(1-Бромимидазо[1,5-а]пиридин-3-ил)карбонил]-N,N-1,2-тетраметил-4-оксо-1,4-дигидрохинолин 3-карбоксамид. 2N Водный раствор гидроксида натрия 1,25 мл добавляли при температуре окружающей среды к 333 мг (2,5 ммоль) N,N-диметилацетоацетамида в 3 мл ДМФ. После перемешивания в течение 1 ч добавляли 400 мг (1 ммоль) 6-[(1-бромимидазо[1,5-а]пиридин-3-ил)карбонил]-1-метил-2H-3,1-бензоксазин-2,4(1H)-диона, растворенного в 25 мл ДМФ. Реакционную среду нагревали в течение 6 ч при 50 С в инертной атмосфере. Реакционную среду концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле, элюцию осуществляли смесью дихлорметан/метанол 20/1. Получали 220 мг желтого масла. МН+: 467, 469.N,N-1,2-Тетраметил-4-оксо-6-[1-(пиридин-3-ил)имидазо[1,5-а]пиридин-3-ил]карбонил-1,4 дигидрохинолин-3-карбоксамид. 3-Пиридинилбороновую кислоту 115 мг (0,37 ммоль), 331 мг (1,56 ммоль) фосфата калия, растворенного в 1 мл воды, и 18 мг (15,6 мкмоль) тетракис(трифенилфосфин)палладия добавляли при температуре окружающей среды в инертной атмосфере к 365 мг (0,78 ммоль) 6-[(1-бромимидазо[1,5-а]пиридин 3-ил)карбонил]-N,N-1,2-тетраметил-4-оксо-1,4-дигидрохинолин-3-карбоксамида в 20 мл N-метилпирролидона. Реакционную среду нагревали в СВЧ-печи при 150 С в течение 25 мин и затем концентрировали при пониженном давлении. Полученный остаток очищали колоночной хроматографией на силикагеле, элюцию осуществляли смесью дихлорметан/метанол 9/1. Получали 0,290 г желтого масла. МН+: 466. 1H-ЯМР (D6-ДМСО, 500 МГц): 2,44 (с, 3 Н), 2,89 (с, 3 Н), 3,03 (с, 3 Н), 3,89 (с, 3 Н), 7,397,43 (м, 1 Н), 7,59-7,64 (2 м, 2 Н), 8,07 (д, J=9,7 Гц, 1 Н), 8,44-8,49 (2 м, 2 Н), 8,67 (д, J=4,8 Гц, 1 Н), 8,86 (дд,J=9,7 Гц и 2,2 Гц, 1 Н), 9,32-9,34 (м, 1 Н), 9,55 (д, J 5=2,2 Гц, 1 Н), 9,93 (д, J=7,4 Гц, 1 Н). Пример 17 (соединение 223). Натриевая соль 3-[3-(3-[2-(4-фторфенокси)этил]-1-пропил-2,4-диоксо-1,2,3,4-тетрагидрохиназолин-6-илкарбонил)имидазо[1,5-а]пиридин-1-ил]бензойной кислоты. Метил 5-[(1-бромимидазо[1,5-а]пиридин-3-ил)карбонил]-2-([2-(4-фторфенокси)этил]карбамоил амино)бензоат. Трифосген 4,7 5 г (16 ммоль) добавляли при температуре окружающей среды в инертной атмосфере к 4,99 г (13,33 ммоль) метил 2-амино-5-(1-[3-(метоксикарбонил)фенил]имидазо[1,5-а]пиридин-3 илкарбонил)бензоата в 220 мл диоксана. После кипячения с обратным холодильником в течение 5 ч,6,21 г (40 ммоль) 2-(4-фторфенокси)-1-этиламина и 4,05 г (40 ммоль) триэтиламина добавляли при температуре окружающей среды. Реакционную среду кипятили с обратным холодильником в течение 3 ч и затем концентрировали при пониженном давлении. Остаток растирали в воде. После фильтрования,твердое вещество промывали метанолом и затем сушили при пониженном давлении при 40 С в течение ночи. Получали 6,67 г желтого твердого вещества. МН+: 555. 6-[(1-Бромимидазо[1,5-а]пиридин-3-ил)карбонил]-3-[2-(4-фторфенокси)этил]хиназолин-2,4(1H,3H) дион. 1N Водный раствор гидроксида натрия 60,1 мл (60,1 ммоль) добавляли к 6,67 г (12 ммоль) метил 5[(1-бромимидазо[1,5-а]пиридин-3-ил)карбонил]-2-([2-(4-фторфенокси)этил]карбамоиламино)бензоата,растворенного в 600 мл метанола. После кипячения с обратным холодильником в течение 2 ч реакционную среду подкисляли 120 мл 1N водного раствора хлористо-водородной кислоты и затем разбавляли 2000 мл воды. Образовавшийся осадок отфильтровывали и сушили при пониженном давлении при 40 С в течение ночи. Получали 5,83 г желтого твердого вещества. МН+: 523,2, 525,2. 6-[(1-Бромимидазо[1,5-а]пиридин-3-ил)карбонил]-3-[2-(4-фторфенокси)этил]-1-пропилхиназолин 2,4(1H,3H)-дион. Карбонат цезия 7,22 г (22,16 ммоль) и 5,65 г (33,24 ммоль) пропилйодида добавляли в инертной атмосфере к 5,6 г (11,08 ммоль) 6-[(1-бромимидазо[1,5-а]пиридин-3-ил)карбонил]-3-[2-(4-фторфенокси) этил]хиназолин-2,4(1H,3H)-диона в 300 мл ДМФ. Реакционную среду перемешивали в течение 12 ч при температуре окружающей среды в атмосфере азота и затем концентрировали при пониженном давлении. Полученный остаток промывали 700 мл воды и затем сушили при пониженном давлении при 40 С в течение ночи. Получали 5,74 г желтого твердого вещества. МН+: 565, 567. Метил 3-[3-(3-[2-(4-фторфенокси)этил]-1-пропил-2,4-диоксо-1,2,3,4-тетрагидрохиназолин-6-ил карбонил)имидазо[1,5-а]пиридин-1-ил]бензоат. 3-Метоксикарбонилфенилбороновую кислоту 2,178 г (12,1 ммоль), 4,279 г (20,16 ммоль) фосфата калия, растворенного в 30 мл воды, и 582,4 г (0,504 ммоль) тетракис(трифенилфосфин)палладия добавляли к 5,7 г (10,08 ммоль) 6-[(1-бромимидазо[1,5-а]пиридин-3-ил)карбонил]-3-[2-(4-фторфенокси)этил]1-пропилхиназолин-2,4(1H, 3H)-диона в 180 мл NMP. Реакционную среду нагревали в СВЧ-печи в течение 15 мин при 120 С и затем концентрировали при пониженном давлении. Полученное твердое вещество очищали колоночной хроматографией на силикагеле, элюцию осуществляли смесью дихлорметан/метанол (100/1). Получали 4,32 г желтого твердого вещества.MH+: 621,3. Натриевая соль 3-[3-(3-[2-(4-фторфенокси)этил]-1-пропил-2,4-диоксо-1,2,3,4-тетрагидрохиназолин-6-илкарбонил)имидазо[1,5-а]пиридин-1-ил]бензойной кислоты. 1N Водный раствор гидроксида лития 69,6 мл (69,6 ммоль) добавляли к 4,32 г (6,96 ммоль) метил 3[3-(3-[2-(4-фторфенокси)этил]-1-пропил-2,4-диоксо-1,2,3,4-тетрагидрохиназолин-6-илкарбонил)имидазо[1,5-а]пиридин-1-ил]бензоата в 500 мл ТГФ. Реакционную среду кипятили с обратным холодильником в течение 3 ч и затем подкисляли при температуре окружающей среды 150 мл 1N водного раствора хлористо-водородной кислоты и в конце разбавляли 700 мл воды. После фильтрования полученный остаток сушили при пониженном давлении при 40 С в течение ночи. 1N Водный раствор гидроксида натрия 5,8 8 мл (5,88 ммоль) добавляли к 4,11 г (6 ммоль) полученного желтого твердого вещества в 100 мл метанола. После фильтрования образовавшийся остаток сушили при пониженном давлении при 40 С в течение ночи. Получали 3,46 г желтого твердого вещества. МН+: 607,3. Т.пл.: 190-205 С (разложение). 1(м, 1 Н), 8,97-9,02 (м, 1 Н), 9,26-9,28 (м, 1 Н), 9,89-9,93 (м, 1 Н). Таблица, которая следует далее, иллюстрирует химические структуры и физические свойства некоторых соединений согласно изобретению. В данной таблице:Me и Et представляют собой, соответственно, метильные и этильные группы; волнистые линии указывают на связь, присоединенную к остальной части молекулы;"Мр" представляет собой температуру плавления соединения, выраженную в градусах Цельсия;"М+Н+" представляет собой массу соединения, полученную в результате ЖХ-МС (Жидкостная хроматография - Масс-спектроскопия).
МПК / Метки
МПК: A61K 31/437, C07D 471/04, A61P 35/00
Метки: использование, производные, получения, имидазопиридиновые, терапевтическое, способ
Код ссылки
<a href="https://eas.patents.su/30-22690-imidazopiridinovye-proizvodnye-sposob-ih-polucheniya-i-terapevticheskoe-ispolzovanie.html" rel="bookmark" title="База патентов Евразийского Союза">Имидазопиридиновые производные, способ их получения и терапевтическое использование</a>
Предыдущий патент: Устройство и способ сушки и торрификации потока по меньшей мере одного углеродсодержащего материала в многоярусной печи
Следующий патент: Способ получения гепатопротекторного средства на основе пиностробина из почек тополя бальзамического (populus balsamifera l.)
Случайный патент: Смесь для рафинирования и модифицирования стали и чугуна












