Производные l-(пиперидин-4-ил)пиразола в качестве модуляторов gpr119
Номер патента: 20106
Опубликовано: 29.08.2014
Авторы: Макклюр Ким Фрэнсис, Манчхоф Майкл Джон, Денинно Майкл Пол, Лефкер Брюс Аллен, Вей-Шун Кун Дэниел, Масситти Винсент, Ральф Пелтон, Футацуги Кентаро
Формула / Реферат
1. Соединение, имеющее формулу I
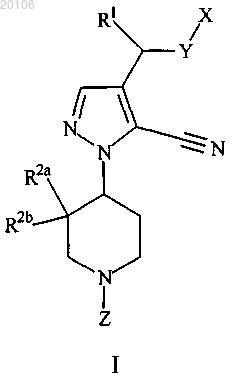
где X представляет собой 
Y представляет собой О;
m равно 1 или 2;
Z представляет собой -C(O)-O-R6;
R1 представляет собой водород;
R2a представляет собой водород;
R2b представляет собой водород;
каждый R3 независимо представляет собой гидрокси, галоген, циано, CF3, OCF3, С1-С4алкил, С1-С4алкокси,
-SO2-R7, -P(O)(OR8)(OR9), -CO-NR8R9 или 5-6-членную гетероарильную группу, содержащую 1, 2, 3 или 4 гетероатома, каждый из которых независимо выбран из кислорода и азота, где атом углерода в указанной гетероарильной группе возможно замещен R4a, или атом азота в указанной гетероарильной группе возможно замещен R4b;
R4a представляет собой водород, С1-С4алкил, С1-С4алкокси, С1-С4галогеноалкил или галоген, где указанный алкил возможно замещен гидроксилом или С1-С4алкокси;
R4b представляет собой водород, С1-С4алкил, -СН2-С1-С3галогеноалкил, -С2-С4алкил-ОН или -СН2-С1-С4алкокси;
R6 представляет собой С1-С4алкил или С3-С6циклоалкил, где один атом углерода указанной циклоалкильной группировки возможно может быть замещен метилом или этилом;
R7 представляет собой С1-С4алкил, С3-С6циклоалкил, NH2 или -(СН2)2-ОН;
R8 представляет собой водород или С1-С4алкил и
R9 представляет собой водород, С1-С4алкил, С3-С6циклоалкил, -(СН2)2-ОН, -(СН2)2-О-СН3, -(СН2)3-ОН,
-(СН2)3-О-СН3, 3-оксетанил или 3-гидроксициклобутил;
или когда R3 представляет собой -C(O)-NR8R9, тогда R8 и R9 могут быть взяты вместе с атомом азота, к которому они присоединены, с образованием азетидинового, пирролидинового, пиперидинового или морфолинового кольца;
или его фармацевтически приемлемая соль.
2. Соединение по п.1, где каждый R3 независимо представляет собой фторо, метил, циано, -C(O)NR8R9 ,
-SO2-R7, тетразол, пиразол, имидазол или триазол.
3. Соединение по пп.1 или 2, где каждый R3 независимо представляет собой фторо, метил, циано,
-C(O)NR8R9, -SO2-R7,
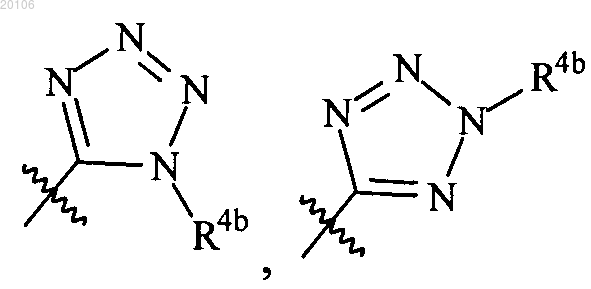
или
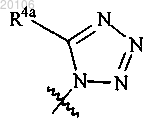
и каждый из R4a и R4b независимо представляет собой водород, С1-С4алкил или С2-С4алкил-ОН.
4. Соединение по любому из пп.1-3, где R6 представляет собой изопропил или 1-метилциклопропил.
5. Соединение, выбранное из
1-метилциклопропил-4-{4-[(4-карбамоил-3-фторфенокси)метил]-5-циано-1Н-пиразол-1-ил}пиперидин-1-карбоксилата;
1-метилциклопропил-4-{4-[(4-карбамоил-2-фторфенокси)метил]-5-циано-1Н-пиразол-1-ил}пиперидин-1-карбоксилата;
изопропил-4-(5-циано-4-{[4-(1Н-пиразол-1-ил)фенокси]метил}-1Н-пиразол-1-ил)пиперидин-1-карбоксилата;
1-метилциклопропил-4-{5-циано-4-[(2,3-дифторфенокси)метил]-1Н-пиразол-1-ил}пиперидин-1-карбоксилата;
1-метилциклопропил-4-{5-циано-4-[(2,5-дифторфенокси)метил]-1Н-пиразол-1-ил}пиперидин-1-карбоксилата;
1-метилциклопропил-4-{5-циано-4-[(2,3,6-трифторфенокси)метил]-1Н-пиразол-1-ил}пиперидин-1-карбоксилата;
изопропил-4-[5-циано-4-({2-фтор-4-[1-(2-гидроксиэтил)-1Н-тетразол-5-ил]фенокси}метил)-1Н-пиразол-1-ил]пиперидин-1-карбоксилата;
изопропил-4-[5-циано-4-({2-фтор-4-[2-(2-гидроксиэтил)-2Н-тетразол-5-ил]фенокси}метил)-1Н-пиразол-1-ил]пиперидин-1-карбоксилата;
изопропил-4-(5-циано-4-{[2-фтор-4-(1-метил-1Н-имидазол-2-ил)фенокси]метил}-1Н-пиразол-1-ил)пиперидин-1-карбоксилата;
1-метилциклопропил-4-{5-циано-4-[(4-цианофенокси)метил]-1Н-пиразол-1-ил}пиперидин-1-карбоксилата;
1-метилциклопропил-4-{4-[(4-карбамоилфенокси)метил]-5-циано-1Н-пиразол-1-ил}пиперидин-1-карбоксилата;
1-метилциклопропил-4-(5-циано-4-{[4-(1-метил-1Н-тетразол-5-ил)фенокси]метил}-1Н-пиразол-1-ил)пиперидин-1-карбоксилата;
1-метилциклопропил-4-(5-циано-4-{[2-фтор-4-(1-метил-1Н-тетразол-5-ил)фенокси]метил}-1Н-пиразол-1-ил)пиперидин-1-карбоксилата;
изопропил-4-(5-циано-4-{[2-фтор-4-(1-метил-1Н-имидазол-5-ил)фенокси]метил}-1Н-пиразол-1-ил)пиперидин-1-карбоксилата;
изопропил-4-{5-циано-4-[(2,3,6-трифторфенокси)метил]-1Н-пиразол-1-ил}пиперидин-1-карбоксилата;
изопропил-4-{5-циано-4-[(2,4-дифторфенокси)метил]-1Н-пиразол-1-ил}пиперидин-1-карбоксилата;
1-метилциклопропил-4-(5-циано-4-{[(2-метилпиридин-3-ил)окси]метил}-1Н-пиразол-1-ил)пиперидин-1-карбоксилата;
изопропил-4-[5-циано-4-({[2-метил-6-(1Н-1,2,4-триазол-1-ил)пиридин-3-ил]окси}метил)-1Н-пиразол-1-ил]пиперидин-1-карбоксилата;
изопропил-4-[5-циано-4-({[2-метил-6-(1Н-1,2,4-триазол-1-ил)пиридин-3-ил]амино}метил)-1Н-пиразол-1-ил]пиперидин-1-карбоксилата;
изопропил-4-[5-циано-4-({[2-метил-6-(метилсульфонил)пиридин-3-ил]амино}метил)-1Н-пиразол-1-ил]пиперидин-1-карбоксилата;
изопропил-4-{5-циано-4-[(2-метилфенокси)метил]-1Н-пиразол-1-ил}пиперидин-1-карбоксилата;
изопропил-4-(5-циано-4-{[2-фтор-4-(1-метил-1Н-тетразол-5-ил)фенокси]метил}-1Н-пиразол-1-ил)пиперидин-1-карбоксилата;
изопропил-4-(5-циано-4-{[2-фтор-4-(2-метил-2Н-тетразол-5-ил)фенокси]метил}-1Н-пиразол-1-ил)пиперидин-1-карбоксилата;
изопропил-4-(5-циано-4-{[(2-метилпиридин-3-ил)амино]метил}-1Н-пиразол-1-ил)пиперидин-1-карбоксилата;
изопропил-4-(5-циано-4-{1-[(2-метилпиридин-3-ил)окси]этил}-1Н-пиразол-1-ил)пиперидин-1-карбоксилата;
изопропил-4-[5-циано-4-({[2-фтор-4-(метилсульфонил)фенил]амино}метил)-1Н-пиразол-1-ил]пиперидин-1-карбоксилата;
изопропил-4-(5-циано-4-{1-[2-фтор-4-(метилсульфонил)фенокси]этил}-1Н-пиразол-1-ил)пиперидин-1-карбоксилата;
изопропил-4-(5-циано-4-{2-[2-фтор-4-(метилсульфонил)фенил]пропил}-1Н-пиразол-1-ил)пиперидин-1-карбоксилата;
изопропил-4-(5-циано-4-{[2-фтор-4-(1Н-тетразол-5-ил)фенокси]метил}-1Н-пиразол-1-ил)пиперидин-1-карбоксилата;
изопропил-4-(5-циано-4-{2-[2-фтор-4-(метилсульфонил)фенил]этил}-1Н-пиразол-1-ил)пиперидин-1-карбоксилата;
изопропил-4-{5-циано-4-[(4-циано-2-фторфенокси)метил]-1Н-пиразол-1-ил}пиперидин-1-карбоксилата;
изопропил-4-(5-циано-4-{[4-(диметоксифосфорил)-2-фторфенокси]метил}-1Н-пиразол-1-ил)пиперидин-1-карбоксилата;
изопропил-4-(5-циано-4-{[(2-метилпиридин-3-ил)окси]метил}-1Н-пиразол-1-ил)пиперидин-1-карбоксилата;
изопропил-4-[5-циано-4-({2-фтор-4-[(2-гидроксиэтил)сульфонил]фенокси}метил)-1Н-пиразол-1-ил]пиперидин-1-карбоксилата;
изопропил-4-(5-циано-4-{[2-фтор-4-(1Н-тетразол-1-ил)фенокси]метил}-1Н-пиразол-1-ил)пиперидин-1-карбоксилата;
изопропил-4-(5-циано-4-{[4-(1Н-тетразол-1-ил)фенокси]метил}-1Н-пиразол-1-ил)пиперидин-1-карбоксилата или
изопропил-4-(5-циано-4-{[2-фтор-4-(метилсульфонил)фенокси]метил}-1Н-пиразол-1-ил)пиперидин-1-карбоксилата;
или его фармацевтически приемлемая соль.
6. Фармацевтическая композиция, модулирующая активность G-белоксопряженного рецептора GPR119, содержащая соединение по любому из пп.1-5, присутствующее в терапевтически эффективном количестве, в смеси по меньшей мере с одним фармацевтически приемлемым эксципиентом.
7. Способ лечения диабета, включающий введение эффективного количества соединения по любому из пп.1-5 пациенту, нуждающемуся в этом.
8. Способ лечения метаболического или связанного с метаболизмом заболевания, состояния или расстройства, включающий стадию введения пациенту терапевтически эффективного количества соединения по любому из пп.1-5.
9. Способ лечения состояния, выбранного из группы, состоящей из гиперлипидемии, диабета I типа, сахарного диабета II типа, идиопатического диабета I типа (типа Ib), латентного аутоиммунного диабета взрослых (LADA), диабета 2 типа с ранним началом (EOD), юношеского атипичного диабета (YOAD), диабета взрослого типа у молодых (MODY), диабета, связанного с недостаточностью питания, гестационного диабета, коронарной болезни сердца, ишемического инсульта, рестеноза после ангиопластики, заболевания периферических сосудов, перемежающейся хромоты, инфаркта миокарда (например, некроза и апоптоза), дислипидемии, постпрандиальной липемии, состояний нарушенной толерантности к глюкозе (IGT), состояний нарушенной гликемии в плазме натощак, метаболического ацидоза, кетоза, артрита, ожирения, остеопороза, гипертензии, застойной сердечной недостаточности, гипертрофии левого желудочка, заболевания периферических артерий, диабетической ретинопатии, дегенерации желтого пятна, катаракты, диабетической нефропатии, гломерулосклероза, хронической почечной недостаточности, диабетической невропатии, метаболического синдрома, синдрома X, предменструального синдрома, коронарной болезни сердца, стенокардии, тромбоза, атеросклероза, инфаркта миокарда, преходящих ишемических атак, инсульта, сосудистого рестеноза, гипергликемии, гиперинсулинемии, гиперлипидемии, гипертриглицеридемии, инсулинорезистентности, нарушенного метаболизма глюкозы, состояний нарушенной толерантности к глюкозе, состояний нарушенной гликемии в плазме натощак, ожирения, эректильной дисфункции, расстройств кожи и соединительной ткани, изъязвлений стопы и неспецифического язвенного колита, эндотелиальной дисфункции и нарушенной растяжимости сосудов, гипер-апо-В-липопротеинемии, болезни Альцгеймера, шизофрении, нарушенных когнитивных способностей, воспалительного заболевания кишечника, неспецифического язвенного колита, болезни Крона и синдрома раздраженного кишечника, включающий введение терапевтически эффективного количества соединения по любому из пп.1-5.
10. Применение соединения по пп.1-5 для изготовления лекарственного средства для лечения заболевания, состояния или расстройства, которое модулирует активность G-протеинсопряженного рецептора GPR119.
11. Применение соединения по любому из пп.1-5 для изготовления лекарственного средства для лечения диабета или ассоциированных с ним осложнений.
Текст
В изобретении описаны соединения формулы I, которые модулируют активность Gбелоксопряженного рецептора GPR119, и их применения в лечении заболеваний, связанных с модуляцией G-белоксопряженного рецептора GPR119 у животных. Область изобретения Настоящее изобретение относится к новому классу цианопиразолов, фармацевтическим композициям, содержащим эти соединения, и к их применению для модулирования активности Gбелоксопряженного рецептора (GPCR) - GPR119. Предшествующий уровень техники Сахарный диабет представляет собой расстройства, при которых наблюдаются высокие уровни глюкозы в крови вследствие нарушения гомеостаза глюкозы. Самыми распростаненными формами диабета являются диабет I типа (также известный как инсулинозависимый сахарный диабет) и диабет II типа(также известный как инсулинонезависимый сахарный диабет). Диабет II типа, к которому относится примерно 90% всех случаев диабета, представляет собой серьезное прогрессирующее заболевание, которое приводит к микрососудистым осложнениям (включающим ретинопатию, невропатию и нефропатию), а также макрососудистым осложнениям (включающим ускоренный атеросклероз, коронарную болезнь сердца и инсульт). В настоящее время не существует лекарства от диабета. Стандартные способы лечения заболевания ограничены и нацелены на контролирование уровней глюкозы в крови с целью минимизации или отсрочки осложнений. Существующие способы лечения нацелены либо на инсулинорезистентность (метформин, тиазолидиндионы), либо на высвобождение инсулина из -клеток (сульфонилмочевины, эксенатид). Сульфонилмочевины и другие соединения, которые действуют через деполяризацию -клеток, вызывают гипогликемию, так как они стимулируют секрецию инсулина независимо от концентраций циркулирующей глюкозы. Одно из разрешенных лекарственных средств - эксенанид - стимулирует секрецию инсулина только в присутствии высоких уровней глюкозы, но должен вводиться посредством инъекции вследствие недостаточной пероральной биодоступности. Ситаглиптин - ингибитор дипептидилпептидазы IV - представляет собой новое лекарственное средство, которое увеличивает в крови уровни инкретиновых гормонов, которые могут увеличивать секрецию инсулина, уменьшать секрецию глюкагона и оказывают другие, в меньшей степени охарактеризованные эффекты. Однако ситаглиптин и другие ингибиторы дипептидилпептидазы IV могут влиять также на уровни других гормонов и пептидов в тканях, и долгосрочные последствия этого более широкого эффекта до конца не изучены. При диабете II типа мышечные, жировые и печеночные клетки не могут нормально отвечать на инсулин. Это состояние (инсулинорезистентность) может быть следствием сниженных количеств клеточных рецепторов инсулина, нарушения клеточных сигнальных путей, или того и другого. Вначале клетки компенсируют инсулинорезистентность путем увеличения продукции инсулина. Однако в конце концов -клетки становятся неспособными продуцировать достаточное количество инсулина для поддержания нормальных уровней глюкозы (эугликемия), что указывает на развитие диабета II типа. При диабете II типа наблюдается гипергликемия натощак вследствие инсулинорезистентности в сочетании с дисфункцией -клеток. Существуют два аспекта дефектной дисфункции -клеток: 1) увеличенное базовое высвобождение инсулина (происходящее при низких, нестимулирующих концентрациях глюкозы). Его наблюдают на характеризующихся ожирением инсулинорезистентных преддиабетических стадиях, а также при диабете II типа, и 2) в ответ на гипергликемический стимул, неспособность увеличить высвобождение инсулина сверх уже увеличенного базового уровня. Это не наблюдается на преддиабетических стадиях и может служить сигналом перехода от нормогликемических инсулинорезистентных состояний в выраженный диабет II типа. Существующие способы лечения последнего аспекта включают в себя ингибиторы АТФ-чувствительных калиевых каналов -клеток для инициирования высвобождения запасов эндогенного инсулина и введение экзогенного инсулина. Ни один из способов лечения не достигает правильной нормализации уровней глюкозы в крови, и оба несут риск индуцирования гипогликемии. Таким образом, существовал большой интерес в разработке агентов, которые функционируют глюкозозависимым образом. Физиологические сигнальные пути, которые функционируют таким образом,хорошо известны, включая кишечные пептиды GLP-1 (глюкагоноподобный пептид) и GIP (глюкозозависимый инсулинотропный полипептид). Эти гормоны передают сигнал через когнатные Gбелоксопряженные рецепторы для стимулирования продукции цАМФ в -клетках поджелудочной железы. Увеличенный уровень цАМФ, по-видимому, не приводит к стимулированию высвобождения инсулина натощак или в препрандиальном (до приема пищи) состоянии. Однако целый ряд биохимических мишеней цАМФ, включая АТФ-чувствительный калиевый канал, потенциал-чувствительные калиевые каналы и экзоцитозный аппарат, модулируются таким образом, что секреция инсулина вследствие постпрандиальной стимуляции глюкозы значительно увеличивается. Поэтому агонистические модуляторы новых, функционирующих схожим образом, GPCRs -клеток, включая GPR119, также будут стимулировать высвобождение эндогенного инсулина и способствовать нормализации уровней глюкозы у пациентов с диабетом II типа. Также было показано, что повышенный уровень цАМФ, например, в результате стимуляции GLP-1, активирует пролиферацию -клеток, ингибирует гибель -клеток и таким образом увеличивает массу островка Лангерганса. Этот положительный эффект на массу -клеток должен быть полезным при диабете II типа, при котором продуцируется недостаточное количество инсулина. Хорошо известно, что метаболические заболевания оказывают отрицательные эффекты и на другие физиологические системы, и частно существует совместное возникновение множества болезненных состояний (например, диабет I типа, диабет II типа, нарушенная толерантность к глюкозе, инсулинорезистентность, гипергликемия, гиперлипидемия, гипертриглицеридемия, гиперхолестеролемия, дислипидемия, ожирение или сердечно-сосудистое заболевание в "синдроме X") или вторичных заболеваний, которые возникают вторично относительно диабета, такие как заболевание почек и периферическая невропатия. Таким образом, лечение диабетического состояния должно быть полезным для таких взаимосвязанных болезненных состояний. Краткое изложение сущности изобретения Согласно настоящему изобретению был открыт новый класс модуляторов GPR119. Эти соединения могут быть представлены формулой I, как показано ниже:R2b представляет собой водород; каждый R3 независимо представляет собой гидрокси, галоген, циано, CF3, OCF3, С 1-С 4 алкил, С 1 С 4 алкокси, -SO2-R7, -P(O)(OR8)(OR9), -CO-NR8R9 или 5-6-членную гетероарильную группу, содержащую 1, 2, 3 или 4 гетероатома, каждый из которых независимо выбран из кислорода и азота, где атом углерода в указанной гетероарильной группе возможно замещен R4a, или атом азота в указанной гетероарильной группе возможно замещен R4b;R4a представляет собой водород, С 1-С 4 алкил, С 1-С 4 алкокси, С 1-С 4 галогеноалкил или галоген, где указанный алкил возможно замещен гидроксилом или С 1-С 4 алкокси;R6 представляет собой С 1-С 4 алкил или С 3-С 6 циклоалкил, где один атом углерода указанной циклоалкильной группировки возможно может быть замещен метилом или этилом;R8 представляет собой водород или С 1-С 4 алкил иR9 представляет собой водород, С 1-С 4 алкил, С 3-С 6 циклоалкил, -(СН 2)2-ОН, -(СН 2)2-О-СН 3, -(СН 2)3 ОН, -(СН 2)3-О-СН 3, 3-оксетанил или 3-гидроксициклобутил; или когда R3 представляет собой -C(O)-NR8R9, тогда R8 и R9 могут быть взяты вместе с атомом азота, к которому они присоединены, с образованием азетидинового, пирролидинового, пиперидинового или морфолинового кольца; или их фармацевтически приемлемыми солями. Более того, настоящее изобретение направлено на соединения: 1-метилциклопропил-4-4-[(4-карбамоил-3-фторфенокси)метил]-5-циано-1 Н-пиразол-1-илпиперидин-1-карбоксилат; 1-метилциклопропил-4-4-[(4-карбамоил-2-фторфенокси)метил]-5-циано-1H-пиразол-1-илпиперидин-1-карбоксилат; изопропил-4-(5-циано-4-[4-(1 Н-пиразол-1-ил)фенокси]метил-1 Н-пиразол-1-ил)пиперидин-1 карбоксилат; 1-метилциклопропил-4-5-циано-4-[(2,3-дифторфенокси)метил]-1H-пиразол-1-илпиперидин-1 карбоксилат; 1-метилциклопропил-4-5-циано-4-[(2,5-дифторфенокси)метил]-1 Н-пиразол-1-илпиперидин-1-2 020106 ридин-1-карбоксилат; или их фармацевтически приемлемые соли. Соединения формулы I модулируют активность G-белоксопряженного рецептора. Более конкретно,соединения модулируют GPR119. Как таковые указанные соединения являются полезными для лечения заболеваний, таких как диабет, при которых активность GPR119 вносит вклад в патологию или симптомы указанного заболевания. Примеры таких состояний включают в себя гиперлипидемию, диабет I типа,сахарный диабета II типа, идиопатический диабет I типа (тип Ib), латентный аутоиммунный диабет взрослых (LADA), диабет 2 типа с ранним началом (EOD), юношеский атипичный диабет (YOAD), диабет взрослого типа у молодых (MODY), диабет, связанный с недостаточностью питания, гестационный диабет, коронарную болезнь сердца, ишемический инсульт, рестеноз после ангиопластики, заболевание периферических сосудов, перемежающуюся хромоту, инфаркт миокарда (например, некроз и апоптоз),дислипидемию, постпрандиальную липемию, состояния нарушенной толерантности к глюкозе (IGT),состояния нарушенной гликемии в плазме натощак, метаболический ацидоз, кетоз, артрит, ожирение,остеопороз, гипертензию, застойную сердечную недостаточность, гипертрофию левого желудочка, заболевание периферических артерий, диабетическую ретинопатию, дегенерацию желтого пятна, катаракту,диабетическую нефропатию, гломерулосклероз, хроническую почечную недостаточность, диабетическую невропатию, метаболический синдром, синдром X, предменструальный синдром, коронарную болезнь сердца, стенокардию, тромбоз, атеросклероз, преходящие ишемические атаки, инсульт, сосудистый рестеноз, гипергликемию, гиперинсулинемию, гиперлипидемию, гипертриглицеридемию, инсулинорезистентность, нарушенный метаболизм глюкозы, состояния нарушенной толерантности к глюкозе, состояния нарушенной гликемии в плазме натощак, ожирение, эректильную дисфункцию, расстройства кожи и соединительной ткани, изъязвления стопы и неспецифический язвенный колит, эндотелиальную дисфункцию и нарушенную растяжимость сосудов. Данные соединения могут быть использованы для лечения неврологических расстройств, таких как болезнь Альцгеймера, шизофрения и нарушенные когнитивные способности. Данные соединения будут также полезны при желудочно-кишечном заболевании,таком как воспалительное заболевание кишечника, неспецифический язвенный колит, болезнь Крона,синдром раздраженного кишечника и т.д. Как указано выше, данные соединения также могут быть использованы для стимулирования потери массы у пациентов с ожирением, особенно у пациентов, страдающих диабетом. Другое воплощение изобретения направлено на фармацевтические композиции, содержащие соединение формулы I. Такие препараты обычно будут содержать соединение формулы I в смеси по меньшей мере с одним фармацевтически приемлемым эксципиентом. Такие препараты также могут содержать по меньшей мере один дополнительный фармацевтический агент. Примеры таких агентов включают в себя агенты против ожирения и/или противодиабетические агенты. Дополнительные аспекты изобретения относятся к применению соединений формулы I для получения лекарственных средств для лечения диабета и родственных состояний, как описано в данной заявке. Следует понимать, что и предшествующее краткое изложение сущности изобретения, и последующее подробное описание являются лишь иллюстративными и пояснительными и не ограничивают изобретение, заявленное в формуле изобретения. Подробное описание изобретения Настоящее изобретение может стать более понятным посредством ссылки на следующее подробное описание иллюстративных воплощений изобретения и примеров, включенных в данное описание. Следует понимать, что данное изобретение не ограничивается конкретными синтетическими способами получения, которые, разумеется, могут варьироваться. Следует также понимать, что терминология,используемая в данной заявке, предназначена лишь для описания конкретных воплощений и не предназначена быть ограничивающей. Множественное число и единственное число следует рассматривать как взаимозаменяемые, в отличие от обозначения числа: а) "галоген" относится к атому хлора, фтора, йода или брома; б) "С 1-С 5 алкил" относится к алкильной группе с разветвленной или прямой цепью, содержащей от 1 до 5 атомов углерода, такой как метил, этил, н-пропил, изопропил, н-бутил, изобутил, пентил и т.д.; в) "С 1-С 5 алкокси" относится к алкоксигруппе с прямой или разветвленной цепью, содержащей от 1 до 5 атомов углерода, такой как метокси, этокси, н-пропокси, изопропокси, н-бутокси, изобутокси, пентокси и т.д.; г) "С 3-С 6 циклоалкил" относится к неароматическому кольцу, которое является полностью гидрированным и существует в виде отдельного кольца. Примеры таких карбоциклических колец включают в себя циклопропил, циклобутил, циклопентил и циклогексил; д) "5-10-членный гетероарил" означает карбоциклическую ароматическую систему, имеющую в целом от 5 до 10 кольцевых атомов и содержащую один, два, три или четыре гетероатома, независимо выбранных из кислорода, азота и серы, и имеющую одно, два или три кольца, где такие кольца могут быть конденсированы. Термин "конденсированный" означает, что второе кольцо присутствует (т.е. присоединено или образовано) за счет двух смежных атомов, которые являются общими (т.е. разделенными) с первым кольцом. Термин "конденсированный" эквивалентен термину "слитый". Термин "гетероарил" охватывает ароматические радикалы, такие как пиридин, пиридазин, пиразин, пиримидин, имидазо[1,2 а]пиридин, имидазо[1,5-а]пиридин, [1,2,4]триазоло[4,3-а]пиридин, [1,2,4]триазоло[4,3-b]пиридазин,[1,2,4]триазоло[4,3-а]пиримидин и [1,2,4]триазоло[1,5-а]пиридин; е) "терапевтически эффективное количество" означает количество соединения по настоящему изобретению, которое (1) лечит или предупреждает конкретное заболевание, состояние или расстройство,(2) ослабляет, облегчает или устраняет один или более симптомов конкретного заболевания, состояния или расстройства, или (3) предупреждает или замедляет возникновение одного или более симптомов конкретного заболевания, состояния или расстройства, описанного в данной заявке; ж) "пациент" относится к теплокровным животным, таким как, например, морские свинки, мыши,крысы, песчанки, кошки, кролики, собаки, обезьяны, шимпанзе и люди; з) "лечить" охватывает как превентивное, т.е. профилактическое, так и паллиативное лечение, т.е. уменьшение, ослабление или замедление развития заболевания (или состояния) пациента или любого повреждения тканей, ассоциированного с данным заболеванием; и) термины "модулированный", "модулирующий" или "модулирует(ют)", как использовано в данной заявке, если не указано иное, относятся к активации G-белоксопряженного рецептора GPR119 посредством соединений по настоящему изобретению; к) "фармацевтически приемлемый" обозначает, что вещество или композиция должны быть совместимы химически и/или токсикологически с другими ингредиентами, содержащимися в препарате, и/или с млекопитающим, которого этим лечат; л) "соли" относятся к фармацевтически приемлемым солям и солям, подходящим для применения в промышленных способах, таких как получение соединения; м) "фармацевтически приемлемые соли" относятся либо к "фармацевтически приемлемым солям присоединения кислот", либо к "фармацевтически приемлемым солям присоединения оснований", в зависимости от фактической структуры соединения; н) "фармацевтически приемлемые соли присоединения кислот" относятся к любым нетоксичным органическим или неорганическим солям присоединения кислот щелочных соединений, представленных формулой I, или к любым их промежуточным соединениям. Типичные неорганические кислоты, которые образуют подходящие соли, включают в себя соляную, бромисто-водородную, серную и фосфорную кислоту и кислотные соли металлов, такие как моногидроортофосфат натрия и гидросульфат калия. Типичные органические кислоты, которые образуют подходящие соли, включают в себя моно-, ди- и трикарбоновые кислоты. Примерами таких кислот являются уксусная, гликолевая, молочная, пировиноградная,малоновая, янтарная, глутаровая, фумаровая, яблочная, винная, лимонная, аскорбиновая, малеиновая,гидроксималеиновая, бензойная, гидроксибензойная, фенилуксусная, коричная, салициловая, 2 феноксибензойная, п-толуолсульфоновая кислота и сульфоновые кислоты, такие как метансульфоновая кислота и 2-гидроксиэтансульфоновая кислота. Такие соли могут существовать либо в гидратированной,либо по существу в безводной форме. Обычно соли присоединения кислот этих соединений являются растворимыми в воде и различных гидрофильных органических растворителях; о) "фармацевтически приемлемые соли присоединения оснований" относятся к любым нетоксичным органическим или неорганическим солям присоединения оснований соединений, представленных формулой I, или к любым их промежуточным соединениям. Типичные основания, которые образуют подходящие соли, включают в себя гидроксиды щелочных и щелочноземельных металлов, такие как гидроксиды натрия, калия, кальция, магния или бария; аммиак, и алифатические, алициклические или ароматические органические амины, такие как метиламин, диметиламин, триметиламин и пиколин. п) "соединение формулы I", "соединения по изобретению" и "соединения" используются взаимозаменяемо во всей заявке и должны рассматриваться как синонимы; р) "изомер" означает "стереоизомер" и "геометрический изомер", как определено ниже. "Стереоизомер" относится к соединениям, которые имеют один или более хиральных центров, и каждый центр может существовать в R- или S-конфигурации. Стереоизомеры включает в себя все диастереомерные,энантиомерные и эпимерные формы, а также рацематы и их смеси. "Геометрический изомер" относится к соединениям, которые могут существовать в цис-, транс-, анти-, син-, entgegen (E) и zusammen (Z) формах, а также к их смесям. Некоторые из соединений формулы (I) могут существовать в виде геометрических изомеров. Соединения формулы (I) могут иметь один или более асимметрических центров, таким образом существуя в виде двух или более стереоизомерных форм. Настоящее изобретение включает в себя все индивидуальные стереоизомеры и геометрические изомеры соединений формулы (I) и их смеси. Индивидуальные энантиомеры могут быть получены посредством хирального разделения или с использованием соответствующего энантиомера в синтезе. Кроме того, соединения по настоящему изобретению могут существовать в несольватированных, а также сольватированых формах с фармацевтически приемлемыми растворителями, такими как вода, этанол и тому подобное. Обычно сольватированные формы считаются эквивалентными несольватированным формам для целей настоящего изобретения. Соединения также могут существовать в одном или более кристаллических состояниях, т.е. в виде сокристаллов, полиморфных модификациях, или они могут существовать в виде аморфных твердых веществ. Все такие формы охвачены изобретением и формулой изобретения. В одном из воплощений по данному изобретению каждый R3 независимо представляет собой фторо, метил, циано, -C(O)NR8R9, -SO2-R7, тетразол, пиразол, имидазол или триазол. В другом воплощении соединения по данному изобретению каждый R3 независимо представляет собой фторо, метил, циано, -C(O)NR8R9, -SO2-R7, или каждый из R4a и R4 независимо представляет собой водород, С 1-С 4 алкил или С 2-С 4 алкил-ОН. В другом воплощении в соединениях по данному изобретению R6 представляет собой изопропил или 1-метилциклопропил. В другом воплощении в композиции по данному изобретению указанная композиция также включает по меньшей мере один дополнительный фармацевтический агент, выбранный из группы, состоящей из агента против ожирения и противодиабетического агента. Типичные агенты против ожирения включают в себя дирлотапид, митратапид, имплитапид, R56918 (CAS403987), CAS913541-47-6, лоркасерин, цетилистат, PYY3-36, налтрексон, олеоил-эстрон, обинепитид, прамлинтид, тесофенсин, лептин,лираглутид, бромокриптин, орлистат, эксенатид, AOD-9604 (CAS221231-10-3) и сибутрамин. Типичные противодиабетические агенты включают в себя метформин, ацетогексамид, хлорпропамид, диабинезе, глибенкламид, глипизид, глибурид, глимепирид, гликлазид, глипентид, гликвидон, глизоламид, толазамид, толбутамид, тендамистат, трестатин, акарбозу, адипозин, камиглибозу, эмиглитат, миглитол, воглибозу, прадимицин-Q, салбостатин, балаглитазон, циглитазон, дарглитазон, энглитазон, изаглитазон,пиоглитазон, росиглитазон, троглитазон, эксендин-3, эксендин-4, тродусквемин, резерватрол, гиртиосаловый экстракт (hyrtiosal extract), ситаглиптин, вилдаглиптин, алоглиптин и саксаглиптин. В другом воплощении способа по данному изобретению соединения или композиции по изобретению могут быть введены в эффективном количестве для лечения состояния, выбранного из группы, состоящей из гиперлипидемии, диабета I типа, сахарного диабета II типа, идиопатического диабета I типа(типа Ib), латентного аутоиммунного диабета взрослых (LADA), диабета 2 типа с ранним началом (EOD),юношеского атипичного диабета (YOAD), диабета взрослого типа у молодых (MODY), диабета, связанного с недостаточностью питания, гестационного диабета, коронарной болезни сердца, ишемического инсульта, рестеноза после ангиопластики, заболевания периферических сосудов, перемежающейся хромоты, инфаркта миокарда (например, некроза и апоптоза), дислипидемии, постпрандиальной липемии,состояний нарушенной толерантности к глюкозе (IGT), состояний нарушенной гликемии в плазме натощак, метаболического ацидоза, кетоза, артрита, ожирения, остеопороза, гипертензии, застойной сердечной недостаточности, гипертрофии левого желудочка, заболевания периферических артерий, диабетической ретинопатии, дегенерации желтого пятна, катаракты, диабетической нефропатии, гломерулосклероза, хронической почечной недостаточности, диабетической невропатии, метаболического синдрома, синдрома X, предменструального синдрома, коронарной болезни сердца, стенокардии, тромбоза, атеросклероза, инфаркта миокарда, преходящих ишемических атак, инсульта, сосудистого рестеноза, гипергликемии, гиперинсулинемии, гиперлипидемии, гипертриглицеридемии, инсулинорезистентности, нарушенного метаболизма глюкозы, состояний нарушенной толерантности к глюкозе, состояний нарушенной гликемии в плазме натощак, ожирения, эректильной дисфункции, расстройств кожи и соединительной ткани, изъязвлений стопы и неспецифического язвенного колита, эндотелиальной дисфункции и нарушенной растяжимости сосудов, гипер-апо-В-липопротеинемии, болезни Альцгеймера, шизофрении, нарушенных когнитивных способностей, воспалительного заболевания кишечника, неспецифического язвенного колита, болезни Крона и синдрома раздраженного кишечника. В другом воплощении способ также включает в себя введение второй композиции, содержащей по меньшей мере один дополнительный фармацевтический агент, выбранный из группы, состоящей из агента против ожирения и противодиабетического агента, и по меньшей мере один фармацевтически приемлемый эксципиент. Этот способ может быть использован для введения композиций одновременно или последовательно и в любом порядке. В еще одном воплощении соединения по данному изобретению являются полезными в изготовлении лекарственного средства для лечения заболевания, состояния или расстройства, которое модулирует активность G-белоксопряженного рецептора GPR119. Более того, соединения являются полезными в изготовлении лекарственного средства для лечения диабета или осложнений, ассоциированных с указанным диабетом. Синтез Для иллюстративных целей, в реакционных схемах, изображенных ниже, предложены потенциальные пути синтеза соединений по настоящему изобретению, а также ключевых промежуточных соединений. Для более детального описания отдельных реакционных стадий см. ниже раздел Примеры. Специалистам в данной области будет понятно, что для синтеза соединений по изобретению могут быть использованы и другие синтетические пути. Хотя конкретные исходные вещества и реагенты изображены в схемах и обсуждаются ниже, они легко могут быть заменены другими исходными веществами и реагентами с получением разнообразных производных и/или реакционных условий. Кроме того, многие из соединений, полученных способами, описанными ниже, могут быть дополнительно модифицированы в свете настоящего описания с использованием традиционной химии, хорошо известной специалистам в данной области техники. Соединения по изобретению могут быть синтезированы синтетическими путями, которые включают процессы, аналогичные процессам, хорошо известным в области химии, особенно, в свете описания,имеющегося в данной заявке. Исходные вещества обычно доступны из коммерческих источников, таких как Aldrich Chemicals (Milwaukee, WI), или могут быть легко получены с использованием способов, известных специалистам в данной области техники (например, могут быть получены способами, в основном описанными в Louis F. Fieser and Mary Fieser, Reagents for Organic Synthesis, v. 1-19, Wiley, New York(1967-1999 ed.), или Beilsteins Handbuch der organischen Chemie, 4, Aufl. ed. Springer-Verlag, Berlin, включая приложения (также доступные через базу данных Beilstein в режиме онлайн). Соединения формулы I могут быть получены с использованием способов, аналогичных способам,известным в данной области техники для получения простых эфиров. Внимание читателя направляют на такие тексты, как: 1) Hughes, D. L.; Organic Reactions 1992, 42 Hoboken, NJ, United States; 2) Tikad, A.;Globisch, D.; Pedersen, E. В.; La Colla, P.; Collu, G.; Loddo, R. J. Het. Chem. 2008, 45, 1161-6, в которых такие реакции описаны более подробно. Схема 1 Соединения формулы I, где R2b представляет собой Н, могут быть получены, как показано на схеме 1. На стадии 1 соединения формулы С могут быть получены посредством реакции конденсации соедине-7 020106 ний формулы А и коммерческого соединения В (Sigma-Aldrich) в широком спектре растворителей, включая, но не ограничиваясь этим, этанол, толуол и ацетонитрил, при температурах, варьирующихся от 22 до 130 С, в зависимости от используемого растворителя в течение периода времени от 1 до 72 ч. В случаях, когда соединения формулы А представляют собой соли соляной или трифторуксусной кислоты, для нейтрализации этих солей могут быть добавлены щелочные модификаторы, такие как ацетат натрия или бикарбонат натрия, в количестве от одного до трех эквивалентов. Реакция может быть осуществлена в полярных протонных растворителях, таких как метанол и этанол, при температурах, варьирующихся от 22 до 85 С. Типичные условия для этой трансформации включают применение 3 эквивалентов ацетата натрия в этаноле, нагреваемом при 85 С в течение 3 ч. Соединения формулы А могут быть получены посредством четырехстадийной процедуры, начиная с гидрохлоридных солей замещенного или незамещенного 4-пиперидинона (J. Med. Chem. 2004, 47,2180). Сначала эти соли обрабатывают подходящим алкилхлорформиатом или бис(алкил)дикарбонатом в присутствии избытка основания с образованием соответствующего алкилкарбамата. Затем кетоновую группу конденсируют с трет-бутоксикарбонилгидразидом с образованием соответствующего N-(третбутокси)карбонил-(ВОС) защищенного гидразонового производного. Затем его восстанавливают до соответствующего ВОС-защищенного гидразинового производного с использованием восстанавливающих агентов, таких как цианоборгидрид натрия или триацетоксиборгидрид натрия. Наконец, N-(третбутокси)карбонильную группу удаляют в кислотных условиях, таких как трифторуксусная кислота или соляная кислота, с получением соединений формулы А, которые обычно выделяют и используют в виде соответствующих солей (например, дигидрохлоридной соли). На стадии 2 соединения формулы D могут быть получены из соединений формулы С посредством образования промежуточных диазониевых солей с помощью реакции Зандмейера (Comp. Org. Synth,1991, 6, 203). Эти соли могут быть получены посредством диазотирования соединений формулы С нитритом натрия и водными кислотами, такими как соляная, бромисто-водородная, серная, азотная, фосфорная и уксусная, отдельно или в комбинациях. Эту реакцию обычно осуществляют в воде при температуре от 0 до 100 С. Альтернативно, могут быть использованы безводные условия с использованием алкилнитритов, таких как трет-бутилнитрит, с растворителями, такими как ацетонитрил (J. Med. Chem. 2006, 49, 1562), при температурах, варьирующихся от 0 до 95 С. Эти диазониевые промежуточные соединения затем оставляют реагировать с солями меди, такими как бромид меди(II), бромид меди(I), или с трибромметаном с образованием соединений формулы D. Типичные условия для этого превращения включают применение трет-бутилнитрита, бромида меди(II) в ацетонитриле при 65 С в течение 30 мин. На стадии 3 соединения формулы Е может быть получены из соединений формулы D с использованием восстанавливающих агентов, таких как алюмогидрид лития, боргидрид натрия, боргидрид лития,боран-диметилсульфид, боран-тетрагидрофуран, в полярных апротонных растворителях, таких как тетрагидрофуран, диэтиловый эфир, 1,4-диоксан или 1,2-диметоксиэтан, при температурах, варьирующихся от 0 до 110 С, в течение периода времени от 1 до 24 ч. Типичные условия включают применение борандиметилсульфида в тетрагидрофуране при 70 С в течение 14 ч. Для того чтобы получить соединения формулы F из соединений формулы Е, следует ввести цианогруппу (стадия 4). Это может быть достигнуто с помощью различных условий. Одним из способов введения цианогруппы может быть применение соли меди, такой как цианид меди, в полярном апротонном растворителе, таком как N,N-диметилформамид (DMF), N-метилпирролидинон (NMP), N,Nдиметилацетамид (DMA), при температурах, варьирующихся от 22 до 200 С, в течение периода времени от 1 до 24 ч. Цианид меди в N,N-диметилформамиде, нагреваемый при 165 С в течение 5 ч, является типичным протоколом для этого превращения. Альтернативно, на стадии 4, для добавления цианогруппы в этот субстрат могут быть использованы цианидные соли щелочных металлов, такие как цианид калия или натрия, совместно с катализаторами,такими как 18-краун-6 (US 2005020564) и/или бромид тетрабутиламмония(J. Med. Chem. 2003, 46, 1144),в полярных апротонных растворителях, таких ацетонитрил и диметилсульфоксид, при температурах,варьирующихся от 22 до 100 С. Наконец, распространенным является применение металлического катализа для превращения, изображенного на стадии 4. Распространенные цианидные соли, используемые в каталитических процедурах, включают в себя цианид цинка, цианид меди, цианид натрия и гексацианоферрат(II) калия. Металлические катализаторы могут представлять собой медные катализаторы, такие как йодид меди, и/или палладиевые катализаторы, такие как трис(дибензилиденацетон)дипалладий (Pd2(dba)3), тетракистрифенилфосфинпалладий (Pd(PPh3)4) или дихлор(дифенилфосфиноферроцен)палладий (Pd(dppf)Cl2). Эти катализаторы могут быть использованы отдельно или в любой комбинации с любой из вышеуказанных цианидных солей. В эти реакции могут быть добавлены лиганды, такие как 1,1'бис(дифенилфосфино)ферроцен (dppf), или металлические добавки, такие как металлический цинк или медь. Реакции осуществляют в полярных апротонных растворителях, таких как NMP, DMF, DMA, с водой или без воды в качестве добавки. Реакции осуществляются при температурах, варьирующихся от 22 до 150 С, посредством традиционного или микроволнового нагревания в течение периода времени от 1 до 48 ч и могут осуществляться в закрытом герметично или незакрытом реакционном сосуде. Типичные условия для стадии 4 включают применение цианида цинка, Pd2(dba)3, dppf и цинковой пыли в DMA,нагретом при 120 С в микроволновом реакторе в течение 1 ч (J. Med. Chem. 2005, 48, 1132). На стадии 5 соединения формулы G, где X, Z и R2a являются такими, как определено для соединений формулы I, могут быть синтезированы из соединений формулы F с помощью реакции Мицунобу. Реакция Мицунобу была описана в литературе по синтезу (например, Chem. Asian. J. 2007, 2, 1340; Eur. J.Org. Chem. 2004, 2763; S. Chem. Eur. J. 2004, 10, 3130), и могут быть использованы многочисленные протоколы синтеза, перечисленные в этих обзорах. Применение реакции Мицунобу подразумевает использование азодикарбоксилатов,таких как диэтилазодикарбоксилат(DEAD),ди-третбутилазодикарбоксилат (TBAD), диизопропилазодикарбоксилат (DIAD), и фосфиновых реагентов, таких как трифенилфосфин (PPh3), трибутилфосфин (PBu3) и трифенилфосфин на полимерной подложке (PSPPh3), которые объединяют с соединениями формулы F и соединением общей структуры Х-ОН, где X является таким, как определено для соединений формулы I. Растворители, используемые в этой реакции,могут включать в себя апротонные растворители, такие как толуол, бензол, THF, 1,4-диоксан и ацетонитрил, при температурах, варьирующихся от 0 до 130 С, в зависимости от растворителя и используемых азодикарбоксилатов. Типичными условиями для этого превращения являются применение DEAD сPS-PPh3 в 1,4-диоксане при 22 С в течение 15 ч. Альтернативой реакции Мицунобу для получения соединений формулы G, где X, Z и R2a являются такими, как определено для соединений формулы I, является превращение соединений формулы F в соответствующие метансульфонатные или пара-толуолсульфонатные производные с использованием метансульфонилхлорида или пара-толуолсульфонилхлорида, соответственно, в присутствии основания,такого как триэтиламин или пиридин. Промежуточное соединение сульфонатный сложный эфир затем объединяют с соединеним общей формулы Х-ОН, где X является таким, как определено для соединений формулы I, в присутствии основания, такого как карбонат калия, гидрид натрия или трет-бутилат калия,с получением соединений формулы G, где X, Z и R2a являются такими, как определено для соединений формулы I. На стадии 6 (схема 1) соединения формулы Н образуются посредством процедуры окисления,включающей применение от 1 до 20 экв. активированного диоксида марганца в растворителях, включающих, но не ограничивающихся этим, дихлорметан, ацетонитрил, гексан или ацетон, отдельно или в комбинациях, в течение периода времени от 1 до 72 ч при температуре от 22 до 80 С. Альтернативно, это окисление может быть осуществлено с помощью от 1 до 3 эквивалентов трихлоризоциануровой кислоты в присутствии от 0,1 до 1 эквивалента 2,2,6,6-тетраметилпиперидин-1-оксила (TEMPO) в дихлорметане или хлороформе при температурах, варьирующихся от 0 до 22 С, в течение периода времени от 0,1 до 12 ч. Типичные условия для этого превращения включают применение трихлоризоциануровой кислоты в присутствии 0,1 экв. TEMPO в дихлорметане при 22 С в течение 1 ч. В определенных случаях можно изменять порядок стадий, показанных на схеме 1. Например, на схеме 1 иногда можно вводить цианогруппу в пиразольное кольцо на последней стадии, т.е. изменяя порядок проведения стадий 4 и 5. Также в некоторых случаях предпочтительным является введение или модификация заместителей R3 на группе X (где R3 и X являются такими, как определено для соединений формулы I) позднее в ходе синтеза, даже на последней стадии. Например, когда R3 представляет собойSO2R7, группа SO2R7 может быть образована на последней стадии путем окисления соответствующего соединения, несущего заместитель общей формулы S-R7. Как вполне очевидно специалисту в данной области техники, может быть необходима защита удаленных функциональных групп (например, первичного или вторичного амина) промежуточных соединений. Необходимость в такой защите будет варьироваться в зависимости от природы удаленных функциональных групп и условий способов получения. Подходящие защитные группы для амино (NH-Pg) включают в себя ацетил, трифторацетил, трет-бутоксикарбонил (ВОС), бензилоксикарбонил (CBZ) и 9 флуоренилметиленоксикарбонил (FmoB). Аналогично, "защитная группа для гидрокси" относится к заместителю гидроксигруппы, который блокирует или защищает гидроксифункциональную группу. Подходящие защитные группы для гидроксила (О-Pg) включают в себя, например, аллил, ацетил, силил, бензил, пара-метоксибензил, тритил и тому подобное. Необходимость такой защиты легко определяется специалистом в данной области техники. Для общего описания защитных групп и их применения см. Т.W. Greene, Protective Groups in Organic Synthesis, John WileySons, New York, 1991. Как указано выше, некоторые из соединений по данному изобретению являются кислотными и образуют соли с фармацевтически приемлемыми катионами. Некоторые из соединений по данному изобретению являются щелочными и образуют соли с фармацевтически приемлемыми анионами. Все такие соли включены в объем данного изобретения и могут быть получены традиционными способами, такими как объединение кислотных и щелочных группировок, обычно, в стехиометрическом соотношении, либо в водных, либо в неводных или частично водных средах подходящим образом. Соли выделяют либо путем фильтрации, осаждения нерастворителем с последующей фильтрацией, выпаривания растворителя,либо, в случае водных растворов, путем лиофилизации подходящим образом. Соединения получают в кристаллической форме согласно процедурам, известным в данной области техники, таким как растворение в подходящем(их) растворителе(ях), таких как этанол, гексаны или смеси вода/этанол. Как указано выше, некоторые из соединений существуют в виде изомеров. Эти изомерные смеси могут быть разделены на их индивидуальные изомеры на основе их физическо-химических различий способами, хорошо известными специалистам в данной области техники, такими как хроматография и/или фракционная кристаллизация. Энантиомеры могут быть разделены путем превращения энантиомерной смеси в диастереомерную смесь путем взаимодействия с подходящим оптически активным соединением (например, с хиральным вспомогательным соединением, таким как хиральный спирт или хлорид кислоты Мошера), разделения диастереоизомеров и превращения (например, гидролиза) индивидуальных диастереоизомеров в соответствующие чистые энантиомеры. Энантиомеры также могут быть разделены с использования хиральной колонки HPLC. Альтернативно, специфические стереоизомеры могут быть синтезированы с использованием оптически активного исходного вещества путем асимметрического синтеза с использованием оптически активных реагентов, субстратов, катализаторов или растворителей, или путем превращения одного стереоизомера в другой посредством асимметрического превращения. Настоящее изобретение также охватывает меченые изотопами соединения по настоящему изобретению, которые являются идентичными соединениям, перечисленным в данной заявке, за исключением того факта, что один или более атомов заменены атомом, имеющим атомную массу или массовое число,отличные от атомной массы или массового числа, обычно встречающихся в природе. Примеры изотопов,которые могут быть включены в соединения по изобретению, включают в себя изотопы водорода, углерода, азота, кислорода, фосфора, серы, фтора, йода и хлора, такие как 2 Н, 3 Н, 11 С, 13 С, 14 С, 13N, 15N, 15 О,17 О, 18 О, 31 Р, 32 Р, 35S, 18F, 123I, 125I и 36Cl, соответственно. Некоторые меченые изотопами соединения по настоящему изобретению (например, соединения,меченые 3 Н и 14 В) являются полезными для анализов распределения соединения и/или субстрата в тканях. Некоторые меченые изотопами лиганды, включающие тритий, 14 С, 35S и 125I, могут быть полезными для анализов связывания радиолигандов. Изотопы тритий (т.е. 3 Н) и углерод-14 (т.е. 14C) являются особенно предпочтительными из-за простоты их получения и детекции. Кроме того, замещение более тяжелыми изотопами, такими как дейтерий (т.е. 2 Н), может давать некоторые терапевтические преимущества,являющиеся следствием большей метаболической стабильности (например, увеличенного периода полувыведения in vivo или требований уменьшенных дозировок) и, следовательно, может быть предпочтительным в некоторых обстоятельствах. Позитрон-испускающие изотопы, такие как 15 О, 13N, 11 С и 18F,являются полезными для исследований методом позитронно-эмиссионной томографии (PET) для изучения занятости рецепторов. Меченые изотопами соединения по настоящему изобретению обычно могут быть получены с помощью процедур, аналогичных процедурам, изложенным на схемах и/или в примерах ниже в данной заявке, путем замены немеченого изотопом реагента на меченый изотопом реагент. Некоторые соединения по настоящему изобретению могут существовать в более чем одной кристаллической форме (обычно называемые "полиморфными модификациями"). Полиморфные модификации могут быть получены путем кристаллизации в различных условиях, например, с использованием различных растворителей или различных смесей растворителей для перекристаллизации; кристаллизации при различных температурах; и/или различных режимов охлаждения, варьирующихся от очень быстрого до очень медленного охлаждения во время кристаллизации. Полиморфные модификации также могут быть получены путем нагревания или плавления соединения по настоящему изобретению с последующим постепенным или быстрым охлаждением. Присутствие полиморфных модификаций может быть определено посредством твердофазной ЯМР-спектроскопии, ИК-спектроскопии, дифференциальной сканирующей калориметрии, рентгеновской дифракции на порошке или других подобных методов. Медицинское применение Соединения по настоящему изобретению модулируют активность G-белоксопряженного рецептораGPR119. Как таковые указанные соединения являются полезными для профилактики и лечения заболеваний, таких как диабет, при которых активность GPR119 вносит вклад в патологию или симптомы данного заболевания. Поэтому другой аспект настоящего изобретения включает способ лечения метаболического заболевания и/или связанного с метаболизмом расстройства у индивидуума, который включает введение индивидууму, нуждающемуся в таком лечении, терапевтически эффективного количества соединения по изобретению, соли указанного соединения или фармацевтической композиции, содержащей такое соединение. Метаболическое заболевание и связанные с метаболизмом расстройства выбраны, но не ограничивается этим, из гиперлипидемии, диабета I типа, сахарного диабета II типа, идиопатического диабета I типа (типа Ib), латентного аутоиммунного диабета взрослых (LADA), диабета 2 типа с ранним началом (EOD), юношеского атипичного диабета (YOAD), диабета взрослого типа у молодых (MODY),диабета, связанного с недостаточностью питания, гестационного диабета, коронарной болезни сердца,ишемического инсульта, рестеноза после ангиопластики, заболевания периферических сосудов, перемежающейся хромоты, инфаркта миокарда (например, некроза и апоптоза), дислипидемии, постпрандиальной липемии, состояний нарушенной толерантности к глюкозе (IGT), состояний нарушенной гликемии в плазме натощак, метаболического ацидоза, кетоза, артрита, ожирения, остеопороза, гипертензии, застой- 10020106 ной сердечной недостаточности, гипертрофии левого желудочка, заболевания периферических артерий,диабетической ретинопатии, дегенерации желтого пятна, катаракты, диабетической нефропатии, гломерулосклероза, хронической почечной недостаточности, диабетической невропатии, метаболического синдрома, синдрома X, предменструального синдрома, коронарной болезни сердца, стенокардии, тромбоза, атеросклероза, инфаркта миокарда, преходящих ишемических атак, инсульта, сосудистого рестеноза, гипергликемии, гиперинсулинемии, гиперлипидемии, гипертриглицеридемии, инсулинорезистентности, нарушенного метаболизма глюкозы, состояний нарушенной толерантности к глюкозе, состояний нарушенной гликемии в плазме натощак, ожирения, эректильной дисфункции, расстройств кожи и соединительной ткани, изъязвлений стопы, эндотелиальной дисфункции, гипер-апо-В-липопротеинемии и нарушенной растяжимости сосудов. Кроме того, соединения могут быть использованы для лечения неврологических расстройств, таких как болезнь Альцгеймера, шизофрения и нарушение когнитивных способностей. Соединения также будут полезны при желудочно-кишечных заболеваниях, таких как воспалительное заболевание кишечника, неспецифический язвенный колит, болезнь Крона, синдром раздраженного кишечника и т.д. Как указано выше, соединения также могут быть использованы для стимулирования потери массы у пациентов с ожирением, особенно у пациентов, страдающих диабетом. В соответствии с вышесказанным, в настоящем изобретении также предложен способ предупреждения или облегчения симптомов любого из описанных выше заболеваний или расстройств у субъекта,нуждающегося в этом, который включает введение субъекту терапевтически эффективного количества соединения по настоящему изобретению. Другие аспекты изобретения включают изготовление лекарственных средств для лечения диабета и связанных с ним сопутствующих осложнений. Для демонстрации терапевтических свойств, описанных выше, соединения следует вводить в количестве, достаточном для модулирования активации G-белоксопряженного рецептора GPR119. Это количество может варьироваться в зависимости от конкретного заболевания/состояния, которое лечат, тяжести заболевания/состояния пациента, самого пациента, конкретного вводимого соединения, пути введения и наличия других основных болезненных состояний у пациента и т.д. При системном введении соединения обычно демонстрируют свой эффект в диапазоне дозировок от примерно 0,1 мг/кг/сут. до примерно 100 мг/кг/сут. для любого из заболеваний или состояний, перечисленных выше. Многократное суточное введение может быть желательным и будет варьироваться в зависимости от состояний, перечисленных выше. Соединения по настоящему изобретению можно вводить различными путями. Их можно вводить перорально. Соединения также можно вводить парентерально (т.е. подкожно, внутривенно, внутримышечно, внутрибрюшинно или интратекально), ректально или местно. Совместное введение Соединения по данному изобретению также могут быть использованы совместно с другими фармацевтическими агентами для лечения заболеваний, состояний и/или расстройств, описанных в данной заявке. Поэтому также предложены способы лечения, которые включают введение соединений по настоящему изобретению в комбинации с другими фармацевтическими агентами. Подходящие фармацевтические агенты, которые могут быть использованы в комбинации с соединениями по настоящему изобретению, включают в себя агенты против ожирения (включая средства для подавления аппетита), противодиабетические агенты, анти-гипергликемические агенты, гиполипидемические агенты и антигипертензивные агенты. Подходящие противодиабетические агенты включают в себя ингибитор ацетил-КоА-карбоксилазы 2 (АСС-2), ингибитор диацилглицерин-О-ацилтрансферазы 1 (DGAT-1), ингибитор фосфодиэстеразыSB-219994), бигуанид (например, метформин), агонист глюкагоноподобного пептида 1 (GLP-1) (например, эксендин-3 и эксендин-4), ингибитор протеинтирозинфосфатазы-1 В (РТР-1 В) (например, тродусквемин, гиртиосаловый экстракт и соединения, указанные в Zhang, S., et al., Drug Discovery Today. 12(DPP-IV) (например, ситаглиптин, вилдаглиптин, алоглиптин и саксаглиптин), агент, увеличивающий секрецию инсулина, ингибитор окисления жирных кислот, антагонист А 2, ингибитор c-jun аминоконцевой киназы (JNK), инсулин, миметик инсулина, ингибитор гликогенфосфорилазы, агонист рецептораVPAC2 и ингибитор SGLT2 (ингибиторы натрий-зависимого глюкозного транспортера, такие как дапаглифлозин и др.). Предпочтительными противодиабетическими агентами являются метформин и ингибиторы DPP-IV (например, ситаглиптин, вилдаглиптин, алоглиптин и саксаглиптин). Подходящие агенты против ожирения включают в себя ингибиторы 11- 11020106 гидроксистероиддегидратазы-1 (11-HSD типа 1), ингибитор стеароил-КоА-десатуразы-1 (SCD-1), агонисты MCR-4, агонисты холецистокинина-А (CCK-А), ингибиторы обратного захвата моноаминов (такие как сибутрамин), симпатомиметические агенты, 3-адренергические агонисты, агонисты дофамина (такие как бромокриптин), аналоги меланоцит-стимулирующего гормона, агонисты 5 НТ 2 с, антагонисты меланин-концентрирующего гормона, лептин (ОВ белок), аналоги лептина, агонисты лептина, антагонисты галанина, ингибиторы липазы (такие как тетрагидролипстатин, т.е. орлистат), аноректические агенты(включая его аналоги), тиреомиметические агенты, дегидроэпиандростерон или его аналог, глюкокортикоидные агонисты или антагонисты, орексиновые антагонисты, агонисты глюкагоноподобного пептида 1, цилиарные нейтрофические факторы (такие как Axokine, доступный от Regeneron Pharmaceuticals,Inc., Tarrytown, NY и ProcterGamble Company, Cincinnati, ОН), ингибиторы человеческого агутисвязанного белка (AGRP), антагонисты грелина, антагонисты или обратные агонисты гистамина 3, агонисты нейромедина U, ингибиторы МТР/АроВ (например, селективные для кишечника ингибиторы МТР, такие как дирлотапид), опиоидный антагонист, орексиновый антагонист и тому подобное. Предпочтительные агенты против ожирения для применения в комбинированных аспектах настоящего изобретения включают в себя селективные для кишечника ингибиторы МТР (например, дирлотапид, митратапид и имплитапид, R56918 (CAS403987) и CAS913541-47-6), агонисты CCKa (например, N-бензил-2-[4-(1 Н-индол-3-илметил)-5-оксо-1-фенил-4,5-дигидро-2,3,6,10b-тетрааза-бензо[е]азулен 6-ил]-N-изопропил-ацетамид, описанный в публикация РСТWO 2005/116034 или публикации США 2005-0267100 А 1), агонисты 5 НТ 2 с (например, лоркасерин), агонист MCR4 (например, соединения,описанные в US 6818658), ингибитор липазы (например, цетилистат), PYY3-36 (как использовано в данной заявке, "PYY3-36" включает в себя аналоги, такие как пэгилированный PYY3-36, например, описанные в публикации США 2006/0178501), опиоидные антагонисты (например, налтрексон), олеоил-эстрон (CAS180003-17-2), обинепитид (ТМ 30338), прамлинтид (Symlin), тесофенсин (NS2330), лептин, лираглутид, бромокриптин, орлистат, эксенатид (Byetta), AOD-9604 (CAS221231-10-3) и сибутрамин. Предпочтительно соединения по настоящему изобретению и комбинированные лекарственные препараты вводят совместно с упражнениями и разумной диетой. Все перечисленные выше патенты и публикации США включены в данную заявку посредством ссылки. Фармацевтические препараты В настоящем изобретении также предложены фармацевтические композиции, которые содержат терапевтически эффективное количество соединения или его фармацевтически приемлемой соли в смеси по меньшей мере с одним фармацевтически приемлемым эксципиентом. Композиции включают в себя композиции в форме, адаптированной для перорального, местного или парентерального применения, и могут быть использованы для лечения диабета и связанных с ним состояний, как описано выше. Композиция может быть приготовлена для введения любым путем, известным в данной области техники, таким как подкожный, ингаляционный, пероральный, местный, парентеральный и т.д. Композиции могут находиться в любой форме, известной в данной области техники, включая, но не ограничиваясь этим, таблетки, капсулы, порошки, гранулы, пастилки или жидкие препараты, такие как пероральные или стерильные парентеральные растворы или суспензии. Таблетки и капсулы для перорального введения могут быть представлены в виде стандартной дозы и могут содержать традиционные эксципиенты, такие как связывающие агенты, например, сироп, камедь, желатин, сорбит, трагакант или поливинилпирролидон; наполнители, например, лактозу, сахар,кукурузный крахмал, фосфат кальция, сорбит или глицин; смазывающие агенты для таблетирования,например, стеарат магния, тальк, полиэтиленгликоль или диоксид кремния; разрыхлители, например,картофельный крахмал; или приемлемые увлажняющие агенты, такие как лаурилсульфат натрия. Таблетки могут быть покрыты согласно способам, хорошо известным в обычной фармацевтической практике. Пероральные жидкие препараты могут находиться в форме, например, водных или масляных суспензий, растворов, эмульсий, сиропов или эликсиров, или могут быть представлены в виде сухого продукта для растворения водой или другим подходящим носителем перед применением. Такие жидкие препараты могут содержать традиционные добавки, такие как суспендирующие агенты, например, сорбит, метилцеллюлоза, глюкозный сироп, желатин, гидроксиэтилцеллюлоза, карбоксиметилцеллюлоза,гель стеарата алюминия или гидрогенизированные пищевые жиры, эмульгирующие агенты, например,лецитин, сорбитанмоноолеат или гуммиарабик; неводные носители (которые могут включать пищевые масла), например, миндальное масло, сложные эфиры масел, такие как глицерин, пропиленгликоль или этиловый спирт; консерванты, например, метил- или пропил-п-гидроксибензоат или сорбиновую кислоту, и, при желании, традиционные ароматизаторы или красители. Жидкие стандартные лекарственные формы для парентерального введения получают с использованием соединения и стерильного носителя, причем вода является предпочтительной. Соединение, в зависимости от используемого носителя и концентрации, может быть либо суспендировано, либо растворено в носителе или другом подходящем растворителе. При приготовлении растворов соединение можно рас- 12020106 творить в воде для инъекций и простерилизовать на фильтре перед тем, как поместить в подходящий флакон или ампулу и герметично закрыть. Предпочтительно агенты, такие как местные анестетики, консерванты и буферные агенты и т.д., могут быть растворены в носителе. Для увеличения стабильности композицию можно заморозить после помещения во флакон, а воду удалить под вакуумом. Затем сухой лиофилизированный порошок герметизируют во флаконе, и сопровождающий флакон с водой для инъекций может поставляться для восстановления жидкости перед применением. Парентеральные суспензии получают по существу таким же образом, за исключением того, что соединение суспендируют в носителе вместо растворения, и стерилизация не может быть достигнута путем фильтрации. Соединение можно стерилизовать, подвергая воздействию этиленоксида перед суспендированием в стерильном носителе. Предпочтительно в композицию включено поверхностно-активное вещество или увлажняющий агент для облегчения однородного распределения соединения. Композиции могут содержать, например, от примерно 0,1 до примерно 99 мас.% активного вещества, в зависимости от способа введения. Когда композиции включают дозовые единицы, тогда каждая единица будет содержать, например, от примерно 0,1 до 900 мг активного ингредиента, типично от 1 до 250 мг. Соединения по изобретению могут быть приготовлены в виде препаратов для введения любым удобным путем для применения в человеческой или ветеринарной медицине, по аналогии с другими противодиабетическими агентами. Такие способы известны в данной области техники и были рассмотрены выше. Для более детального обсуждения, касающегося получения таких препаратов, см. Remington's Pharmaceutical Sciences. 21st Edition, by University of the Sciences in Philadelphia. Воплощения настоящего изобретения проиллюстрированы следующими примерами. Однако следует понимать, что воплощения изобретения не ограничиваются конкретными деталями этих примеров,поскольку другие их вариации будут известны или очевидны в свете настоящего описания среднему специалисту в данной области техники. Примеры Если не указано иное, исходные вещества обычно доступны из коммерческих источников, таких как Aldrich Chemicals Co. (Milwaukee, WI), Lancaster Synthesis, Inc. (Windham, NH), Acros Organics (Fairlawn, NJ), Maybridge Chemical Company, Ltd. (Cornwall, England), Tyger Scientific (Princeton, NJ) и AstraZeneca Pharmaceuticals (London, England), Mallinckrodt Baker (Phillipsburg NJ); EMD (Gibbstown, NJ). Общие экспериментальные процедуры Спектры ЯМР регистрировали на Varian Unity 400 (DG400-5 зонд) или 500 (DG500-5 зонд - оба производства Varian Inc., Palo Alto, CA) при комнатной температуре при 400 или 500 МГц, соответственно, для протонного анализа. Химические сдвиги выражены в миллионных долях (дельта) относительно остаточного растворителя в качестве внутреннего стандарта. Формы пиков обозначены следующим образом: s, синглет; d, дублет; dd, дублет дублетов; t, триплет; q, квартет; т, мультиплет; bs, уширенный синглет; 2s, два синглета. Масс-спектры с химической ионизацией при атмосферном давлении (APCI) получали на спектрометре Waters (Micromass ZMD, газ-носитель: азот) (производство Waters Corp., Milford, MA, USA) при скорости потока 0,3 мл/мин и с использованием элюентной системы вода/ацетонитрил 50:50. Массспектры с ионизацией электрораспылением (ES) получали на жидкостном хроматомасс-спектрометреWaters (прибор Micromass ZQ или ZMD (газ-носитель: азот) (Waters Corp., Milford, MA, USA) с использованием градиента 95:5-0:100 воды в ацетонитриле с 0,01% муравьиной кислоты, добавленной в каждый растворитель. В этих приборах использовали колонку Varian Polaris 5 С 18-А 202,0 мм (VarianInc., Palo Alto, CA) при скоростях потока 1 мл/мин в течение 3,75 мин или 2 мл/мин в течение 1,95 мин. Колоночную хроматографию осуществляли с использованием силикагеля либо на колонках Flash 40Biotage (ISC, Inc., Shelton, CT), либо на картридже Biotage SNAP KPsil или Redisep Rf с силикагелемWaters FractionLynx с фотодиодной матрицей (Waters 2996) и масс-спектрометрической (Waters/Micromass ZQ) схемой детекции. Работу с аналитической HPLC осуществляли на Waters 2795 Alliance HPLC или Waters ACQUITY UPLC с фотодиодной матрицей, со схемами детекции одноквадрупольным масс-спектрометром или испарительным детектором светорассеяния. Концентрация в вакууме относится к выпариванию растворителя при пониженном давлении с использованием роторного испарителя. Если не указано иное, химические реакции осуществляли при комнатной температуре (примерно 23 С). Также, если не указано иное, химические реакции осуществляли в атмосфере азота. Фармокологические данные Полезность изобретения для лечения заболеваний, модулируемых агонистической активацией Gбелоксопряженного рецептора GPR119 с помощью соединений по изобретению, может быть подтверждена активностью в одном или более функциональных анализах, описанных в данной заявке ниже. Фирма-производитель указана в скобках. Функциональные анализы in vitro-лактамаза В анализе агонистов GPR119 используют клеточную (-лактамаза hGPR119 HEK293-CRE) репортерную конструкцию, где агонистическая активация человеческого GPR119 сопряжена с продукцией лактамазы через цАМФ-отвечающий элемент (CRE от англ. cyclic AMP response element). АктивностьhGPR119-HEK-CRE (Invitrogen 2,5107/мл) брали из хранилища с жидким азотом и разбавляли в среде для посева (среда Игла в модификации Дульбекко с высокой концентрацией глюкозы (DMEM; Gibco,кат.11995-065), 10% инактивированной нагреванием фетальной бычьей сыворотки (HIFBS; Sigma,кат.F4135), 1X MEM заменимые аминокислоты (Gibco, кат.15630-080), 25 мМ HEPES, рН 7,0(Gibco, кат.15630-080), 200 нМ клавуланата калия (Sigma, кат.Р 3494). Концентрацию клеток корректировали с использованием среды для посева клеток и 50 мкл этой клеточной суспензии (12,5104 жизнеспособных клеток) добавляли в каждую лунку черного, с прозрачным дном, покрытого поли-dлизином 384-луночного планшета (Greiner Bio-One, кат.781946) и инкубировали при 37 С во влажной окружающей среде, содержащей 5% диоксида углерода. Через 4 ч среду для посева удаляли и заменяли на 40 мкл среды для анализа (среда для анализа представляет собой среду для посева без клавуланата калия и HIFBS). Затем добавляли варьирующиеся концентрации каждого тестируемого соединения в объеме 10 мкл (конечная концентрация ДМСО 0,5%) и клетки инкубировали в течение 16 ч при 37 С во влажной окружающей среде, содержащей 5% диоксида углерода. Планшеты удаляли из инкубатора и оставляли достигать комнатной температуры в течение приблизительно 15 мин. В каждую лунку добавляли 10 мкл 6 X CCF4/AM рабочего красящего раствора (полученного согласно инструкциям в набореLive Blazer FRET-B/G Loading kit, Invitrogen, кат.K1027) и инкубировали при комнатной температуре в течение 2 ч в темноте. Флуоресценцию измеряли посредством флуориметрического планшета-ридераEnVision, возбуждение 405 нм, испускание 460 нм/535 нм. Определения EC50 проводили из анализа кривых агонист-ответ, проанализированных с помощью программы аппроксимации, с использованием 4 параметрического логарифмического уравнения доза-ответ. цАМФ Активность агониста GPR119 также определяли с помощью клеточного анализа с использованием набора для детекции цАМФ посредством HTRF (однородная флуоресценция с разрешением во времени)(цАМФ dynamic 2 Assay Kit; Cis Bio, кат.62AM4PEB), который измеряет уровни цАМФ в клетке. Способ представляет собой конкурентный иммуноанализ между нативным цАМФ, продуцируемым клетками, и цАМФ, меченым красителем d2. Связывание метки визуализируют с помощью Mab (моноклональное антило) против цАМФ, меченого Cryptate. Специфический сигнал (т.е. перенос энергии) обратно пропорционален концентрации цАМФ либо в стандарте, либо в образце. Конкретно, -лактамазные клетки hGPR119 HEK-CRE (Invitrogen 2,5107/мл; та же клеточная линия, что и линия, используемая в анализе -лактамазы, описанном выше) брали из криохранилища и разбавляли в ростовой среде (среда Игла в модификации Дульбекко с высокой концентрацией глюкозы(DMEM; Gibco, кат.11995-065), 1% обработанной декстраном на угле фетальной бычьей сыворотки(CD сыворотка; HyClone, кат.SH30068.03), 1MEM заменимые аминокислоты (Gibco, кат.15630080) и 25 мМ HEPES рН 7,0 (Gibco, кат.15630-080. Концентрацию клеток доводили до 1,5105 клеток/мл и 30 мл этой суспензии добавляли во флакон Т-175 и инкубировали при 37 С во влажной окружающей среде с 5% диоксида углерода. Через 16 ч (в течение ночи) клетки удаляли из флакона Т-175(путем постукивания по стенке флакона), центрифугировали при 800 g и затем ресуспендировали в среде для анализа (1HBSS+CaCl2+MgCl2 (Gibco, кат.14025-092) и 25 мМ HEPES рН 7,0 (Gibco, кат.15630-080. Концентрацию клеток доводили до 6,25105 клеток/мл с помощью среды для анализа и 8 мкл этой клеточной суспензии (5000 клеток) добавляли в каждую лунку белого 384-луночного планшета для анализа с малым объемом лунок Greiner (VWR, кат.82051-458). Различные концентрации каждого тестируемого соединения разбавляли буфером для анализа, содержащим 3-изобутил-1-метилксантин (IBMX; Sigma, кат.15879), и добавляли в лунки аналитического планшета в объеме 2 мкл (конечная концентрация IBMX составляла 400 мкМ, а концентрация конечная ДМСО составляла 0,58%). После 30 мин инкубации при комнатной температуре в каждую лунку аналитического планшета добавляли 5 мкл меченого d2 цАМФ и 5 мкл антитела против цАМФ (оба разбавляли 1:20 в буфере для лизиса клеток; как описано в протоколе анализа от производителя). Затем планшеты инкубировали при комнатной температуре и через 60 мин считывали изменения сигнала HTRF с помощью планшет-ридера Envision 2104 multilabel с использованием возбуждения при 330 нм и испусканий при 615 и 665 нм. Необработанные данные переводили в нМ цАМФ путем интерполяции со стандартной кривой цАМФ (как описано в протоколе анализа от производителя), и определения ЕС 50 осуществляли из кривых агонист-ответ, анализируемых с помощью программы аппроксимации кривых, с использованием 4-параметрического логарифмического уравнения доза-ответ. Следует понимать, что цАМФ ответы вследствие активации GPR119 могут индуцироваться в клетках, отличных от специфической клеточной линии, используемой в данном тесте.-аррестин Активность агониста GPR119 также определяли с помощью клеточного анализа с использованием технологии анализа -аррестина клеток DiscoverX PathHunter и -аррестиновой клеточной линии U2OShGPR119 (DiscoverX, кат.93-О 356 С 3). В этом анализе активацию агониста определяют путем измерения агонист-индуцированного взаимодействия -аррестина с активированным GPR119. Небольшой, состоящий из 42 аминокислот, фрагмент фермента, называемый ProLink, присоединяли к С-концу GPR119. Аррестин подвергали слиянию с более крупным фрагментом фермента, называемым ЕА (акцептор фермента). Активация GPR119 стимулирует связывание аррестина и ускоряет комплементацию двух фрагментов фермента, что приводит к образованию функционального фермента -галактозидазы, способного гидролизовать субстрат и генерировать хемилюминесцентный сигнал. Конкретно, -аррестиновые клетки U2OS hGPR119 (DiscoverX 1107/мл) брали из криохранилища и разбавляли ростовой средой (минимальная питательная среда (MEM; Gibco, кат.11095-080), 10% инактивированной нагреванием фетальной бычьей сыворотки (HIFBS; Sigma, кат.F4135-100), 100 мМ пирувата натрия (Sigma, кат.S8636), 500 мкг/мл G418 (Sigma, кат.G8168) и 250 мкг/мл гигромицина В (Invitrogen, кат.10687-010). Концентрацию клеток доводили до 1,66105 клеток/мл и 30 мл этой суспензии добавляли во флакон Т-175 и инкубировали при 37 С во влажной окружающей среде с 5% диоксида углерода. Через 48 ч клетки удаляли из флакона Т-175 с помощью не содержащего ферментов буфера для диссоциации клеток (Gibco, кат.13151-014), центрифугировали при 800 g и затем ресуспендировали в среде для посева (Opti-MEM I (Invitrogen/BRL, кат.31985-070) и 2% обработанной декстраном на угле фетальной бычьей сыворотки (CD сыворотка; HyClone, кат.SH30068.03). Концентрацию клеток доводили до 2,5105 клеток/мл с помощью среды для посева и 10 мкл этой клеточной суспензии (2500 клеток) добавляли в каждую лунку белого 384-луночного аналитического планшета с малым объемом лунок Greiner (VWR, кат.82051-458) и планшеты инкубировали при 37 С во влажной окружающей среде с 5% диоксида углерода. Через 16 ч (в течение ночи) аналитические планшеты удаляли из инкубатора и различные концентрации каждого тестируемого соединения (разбавленного в буфере для анализа (1HBSS +CaCl2+MgCl2(Gibco, кат.14025-092), 20 мМ HEPES рН 7,0 (Gibco, кат.15630-080) и 0,1% БСА (Sigma, кат.А 9576 добавляли в лунки аналитического планшета в объеме 2,5 мкл (конечная концентрация ДМСО составляла 0,5%). После 90-минутной инкубации при 37 С во влажной окружающей среде с 5% диоксида углерода в каждую лунку аналитического планета добавляли 7,5 мкл -галактозидазного субстрата Galacton Star (PathHunter Detection Kit (DiscoveRx, кат.93-0001); полученного, как описано в протоколе анализа от производителя). Планшеты инкубировали при комнатной температуре и через 60 мин изменения люминесценции считывали с помощью планшет-ридера Envision 2104 multilabel с 0,1 с на лунку. Определения ЕС 50 осуществляли из кривых агонист-ответ, анализируемых с помощью программы аппроксимации кривых, с использованием 4-параметрического логарифмического уравнения доза-ответ. Экспрессия GPR119 с использованием BacMam и анализ связывания GPR119 Человеческий GPR119 дикого типа (фиг. 1) амплифицировали с помощью полимеразной цепной реакции (ПЦР) (Pfu Turbo Mater Mix, Stratagene, La Jolla, CA), используя pIRES-puro-hGPR119 в качестве матрицы и следующие праймеры:(вставки EcoRI сайт на 3'-конце) Амплифицированный продукт очищали (Qiaquick Kit, Qiagen, Valencia, CA) и переваривали с помощью BamHI и EcoRI (New England BioLabs, Ipswich, MA) согласно протоколу производителя. ВекторpFB-VSVG-CMV-poly (фиг. 2) переваривали с помощью BamHI и EcoRI (New England BioLabs, Ipswich,MA). Переваренную ДНК разделяли посредством электрофореза на 1%-ном агарозном геле; фрагменты вырезали из геля и очищали (Qiaquick Kit, Qiagen, Valencia, CA). Вектор и генные фрагменты лигировали(Rapid Ligase Kit, Roche, Pleasanton, CA) и трансформировали в клетки OneShot DH5 T1R (Invitrogen,Carlsbad, СА). Восемь ампициллин-устойчивых колоний ("клоны 1-8") выращивали для минипрепаративного анализа (Qiagen Miniprep Kit, Qiagen, Valencia, CA) и секвенировали для подтверждения идентичности и правильной ориентации вставки. Конструкцию pFB-VSVG-CMV-poly-hGPR119 (клон 1) трансформировали в клетки OneShotDH10Bac (Invitrogen, Carlsbad, СА) согласно протоколам производителя. Восемь положительных (т.е. белых) колоний пересевали штрихом для подтверждения статуса "положительных" и затем выращивали для выделения бакмиды. Рекомбинантную бакмиду hGPR119 выделяли с помощью модифицированной процедуры щелочного лизиса с использованием буферов от Qiagen Miniprep Kit (Qiagen, Valencia, CA). Кратко, осажденные клетки лизировали в буфере Р 1, нейтрализовали в буфере Р 2 и осаждали буферомN3. Осадок осаждали посредством центрифугирования (17900g в течение 10 мин) и супернатант объе- 15020106 диняли с изопропанолом для осаждения ДНК. ДНК осаждали посредством центрифугирования (17900g в течение 30 мин), однократно промывали 70%-ным этанолом и ресуспендировали в 50 мкл буфера ЕВ(Трис-HCL, рН 8,5). Для подтверждения присутствия вставки hGPR119 в бакмиде использовали полимеразную цепную реакцию (ПЦР) с коммерчески доступными праймерами (M13F, M13R, Invitrogen, Carlsbad, CA). Создание рекомбинантного бакуловируса hGPR119 Создание вирусного материала Р 0 Суспензию адаптированных клеток Sf9, выращенных в среде Sf900II (Invitrogen, Carlsbad, CA),трансфицировали 10 мкл бакмидной ДНК hGPR119 согласно протоколу производителя (Cellfectin, Invitrogen, Carlsbad, CA). Через пять суток инкубации кондиционированную среду (т.е. вирусный материал"Р 0") центрифугировали и фильтровали через 0,22-мкм фильтр (Steriflip, Millipore, Billerica, MA). Создание замороженного (BIIB) вирусного материала Для долгосрочного хранения и создания рабочего (т.е. "Р 1") вирусного материала создавали замороженный ВПС (инфицированные бакуловирусом клетки насекомых) материал: суспензию адаптированных клеток Sf9 выращивали в среде Sf900II (Invitrogen, Carlsbad, CA) и инфицировали вирусным материалом hGPR119 Р 0. Через 24 ч роста инфицированные клетки осторожно центрифугировали (приблизительно 100g), ресуспендировали в среде для замораживания (10% ДМСО, 1% альбумина в средеSf900II) до конечной плотности 1107 клеток/мл и замораживали согласно стандартным протоколам замораживания в аликвотах по 1 мл. Создание рабочего ("Р 1") вирусного материала Суспензию адаптированных клеток Sf9, выращенных в среде Sf900II (Invitrogen, Carlsbad, СА), инфицировали разведением 1:100 оттаянного материала hGPR119 ВПС и инкубировали в течение нескольких суток (27 С со встряхиванием). Когда жизнеспособность клеток достигала 70%, тогда кондиционированную среду собирали центрифугированием и титр вируса определяли с помощью ELISA (BaculoElisaKit, Clontech, Mountain View, CA). Сверхэкспрессия hGPR119 в клетках HEK 293FT, адаптированных к суспензии Клетки HEK 293FT (Invitrogen, Carlsbad, CA) выращивали во встряхиваемом флаконе в среде 293Freestyle (Invitrogen), дополненной 50 мкг/мл неомицина и 10 мМ HEPES (37 С, 8% диоксида углерода, встряхивание). Клетки осторожно центрифугировали (приблизительно 500g, 10 мин) и осадок ресуспендировали в смеси PBS Дульбекко (минус Mg/-Са), дополненной 18% фетальной бычьей сыворотки (Sigma Aldrich) и P1 вируса так, чтобы множественность заражения (MOI) составляла 10, и конечная плотность клеток составляла 1,3106/мл (общий объем 2,5 л). Клетки переносили в 5-литровый биореактор Wave Bioreactor Wavebag (Wave Technologies, MA) и инкубировали в течение 4 ч при 27 С(17 встряхиваний/мин, угол платформы 7); в конце инкубационного периода добавляли равный объем(2,5 л) среды 293Freestyle, дополненной 30 мМ бутирата натрия (Sigma Aldrich) (конечная концентрация= 15 мМ), и клетки выращивали в течение 20 ч (37 С, 8% СО 2 [0,2 л/мин], 25 встряхиваний/мин, угол платформы 7). Клетки собирали посредством центрифугирования (3000g, 10 мин), однократно промывали на DPBS (минус Ca/Mg), ресуспендировали в 0,25 М сахарозе, 25 мМ HEPES, 0,5 мМ EDTA,рН 7,4 и замораживали при -80 С. Получение мембран для анализов связывания радиолиганда Замороженные клетки оттаивали на льду и центрифугировали при 700g (1400 об/мин) в течение 10 мин при 4 С. Клеточный осадок ресуспендировали в 20 мл забуференного фосфатами физиологического раствора и центрифугировали при 1400 об/мин в течение 10 мин. Затем клеточный осадок ресуспендировали буфере для гомогенизации (10 мМ HEPES (Gibco15630), рН 7,5, 1 мМ EDTA (BioSolutions,BIO260-15), 1 мМ EGTA (Sigma,Е-4378), 0,01 мг/мл бензамидина (SigmaВ 6506), 0,01 мг/мл бацитрацина (SigmaВ 0125), 0,005 мг/мл лейпептина (SigmaL 8511), 0,005 мг/мл апротинина (SigmaА 1153 и инкубировали на льду в течение 10 мин. Затем клетки лизировали с помощью 15 плавных перемещений в плотно пригнанном стеклянном гомогенизаторе Даунса (Dounce). Гомогенат центрифугировали при 1000g (2200 об/мин) в течение 10 мин при 4 С. Супернатант переносили в свежие центрифужные пробирки на льду. Клеточный осадок ресуспендировали в буфере для гомогенизации и снова центрифугировали при 1000g (2200 об/мин) в течение 10 мин при 4 С, после чего супернатант удаляли и осадок ресуспендировали в буфере для гомогенизации. Эту процедуру повторяли третий раз, после чего супернатанты объединяли, добавляли бензоназу (Novagen71206) и MgCl2 (Fluka63020) до конечной концентрации 1 ед./мл и 6 мМ, соответственно, и инкубировали на льду в течение 1 ч. Затем раствор центрифугировали при 25000g (15000 об/мин) в течение 20 мин при 4 С, супернатант удаляли и осадок ресуспендировали в свежем буфере для гомогенизации (минус бензоназа и MgCl2). После повторения стадии центрифугирования при 25000g конечный осадок мембран ресуспендировали в буфере для гомогенизации и замораживали при -80 С. Концентрацию белка определяли с использованием набора для анализа белка Pierce BCA (реагенты Pierce A23223 и В 23224).(изопропил-4-(1-(4-(метилсульфонил)фенил)-3 а,7 а-дигидро-1 Н-пиразоло[3,4d]пиримидин-4-илокси)пиперидин-1-карбоксилат, как показано выше) (4 мг, 0,009 ммоль) растворяли в 0,5 мл дихлорметана и полученный раствор обрабатывали гексафторфосфатом (1,5 циклооктадиен)(пиридин)(трициклогексилфосфин)иридия (I) (J. Organometal. Chem. 1979, 168, 183) (5 мг,0,006 ммоль). Реакционный сосуд герметично закрывали и раствор перемешивали в атмосфере газообразного трития в течение 17 ч. Реакционный растворитель удаляли при пониженном давлении и полученный остаток растворяли в этаноле. Очистку неочищенного [3 Н]-Соединения А осуществляли посредством препаративной HPLC с использованием следующих условий. Колонка: Atlantis, 4,6150 мм, 5 мкм Подвижная фаза А: вода/ацетонитрил/муравьиная кислота (98/2/0,1) Подвижная фаза В: ацетонитрил Градиент: Время %В 0,00 - 30,0 1,00 - 30,0 13,00 - 80,0 Время прогона (Run time): 16 мин Время восстановления колонки (Post time): 5 мин Скорость потока: 1,5 мл/мин Инж. объем: 20-50 мкл Инж. растворитель: ДМСО Детекция: УФ при 210 и 245 нм Специфическую активность очищенного [3 Н]-Соединения А определяли посредством массспектроскопии, и она составляла 70 Ки/ммоль. Альтернативно, анализ связывания может быть осуществлен с [3 Н]-Соединением В. Синтез и очистка [3 Н]-Соединения В(трет-бутил-4-(1-(4-(метилсульфонил)фенил)-1 Н-пиразоло[3,4-d]пиримидин-4 илокси)пиперидин-1-карбоксилат, как показано выше) (5 мг, 10,6 мкмоль) растворяли в 1,0 мл дихлорметана и полученный раствор обрабатывали катализатором Крэбтри (Crabtree) (5 мг, 6,2 мкмоль). Реакционный сосуд герметично закрывали и раствор перемешивали в атмосфере газообразного трития в течение 17 ч. Реакционный растворитель удаляли при пониженном давлении, и полученный остаток растворяли в этаноле. Очистку неочищенного [3 Н]-Соединения В осуществляли посредством флэшхроматографии на колонке с силикагелем, элюируя смесью 70% гексаны/30% этилацетат, с последующей флэш-хроматографией на колонке с силикагелем, элюируя смесью 60% петролейный эфир/40% этилацетат. Специфическую активность очищенного [3 Н]-Соединения В определяли посредством массспектроскопии, и она составляла 57,8 Ки/ммоль. Анализ связывания радиолиганда GPR119 Тестируемые соединения последовательно разбавляли в 100% ДМСО (J.T. Baker 922401). 2 мкл каждого разведения добавляли в подходящие лунки 96-луночного планшета (каждая концентрация в трех повторностях). Немеченое соединение А (или соединение В) в конечной концентрации 10 мкМ использовали для определения неспецифического связывания.[3 Н]-Соединение А (или [3 Н]-Соединение В) разбавляли в буфере для связывания (50 мМ Трис-HCl,рН 7,5 (Sigma T7443), 10 мМ MgCl2 (Fluka 63020), 1 мМ EDTA (BioSolutions BIO260-15), 0,15% бычьего сывороточного альбумина (Sigma А 7511), 0,01 мг/мл бензамидина (Sigma B 6506), 0,01 мг/мл бацитрацина (Sigma B 0125), 0,005 мг/мл лейпептина (Sigma L 8511), 0,005 мг/мл апротинина (Sigma A 1153 до концентрации 60 нМ и 100 мкл добавляли во все лунки 96-луночного планшета (Nalge Nunc267245). Мембраны, экспрессирующие GPR119, оттаивали и разбавляли до конечной концентрации 20 мкг/100 мкл на лунку в буфере для связывания, и 100 мкл разбавленных мембран добавляли в каждую лунку 96-луночного планшета. Планшет инкубировали в течение 60 мин при встряхивании при комнатной температуре (приблизительно 25 С). Анализ останавливали вакуумной фильтрацией на фильтр-планшетах GF/C (Packard6005174), предварительно смоченных 0,3%-ным полиэтиленамином, используя коллектор Packard. Затем фильтры промывали шесть раз, используя буфер для промывки (50 мМ Трис-HCl, рН 7,5, выдерживая при 4 С). Затем фильтр-планшеты сушили на воздухе при комнатной температуре в течение ночи. В каждую лунку добавляли 30 мкл сцинцилляционной жидкости (Ready Safe, Beckman Coulter141349),планшеты герметично закрывали и измеряли радиоактивность, связанную с каждым фильтром, с использованием сцинцилляционного счетчика для планшетов Wallac Trilux MicroBeta.Kd для [3 Н]-Соединения А (или [3 Н]-Соединения В) определяли путем проведения насыщающего связывания, с анализом данных с помощью нелинейной регрессии, подгонкой к гиперболе связывания в одном сайте (one-site hyperbola) (Graph Pad Prism). Определения IC50 проводили из кривых конкуренции,анализируемых с помощью фирменной программы для аппроксимации кривых (SIGHTS) и 4 параметрического логарифмического уравнения доза-ответ. Значения Ki вычисляли из значений IC50 с использованием уравнения Ченга-Прусоффа. Следующие результаты получили для -лактамазных и -аррестиновых функциональных анализов. Внутренняя активность представляет собой процент максимальной активности тестируемого соединения относительно активности стандартного агониста GPR119,4-6-[(2-фтор-4 метилсульфонилфенил)амино]пиримидин-4-ил]окси]пиперидин-1 карбоновой кислоты изопропилового эфира (WO 2005121121), в конечной концентрации 10 мкМ. кривая экстраполирована к 100% для вычисления ЕС 50. Следующие результаты получили для цАМФ и анализов связывания. Внутренняя активность представляет собой процент максимальной активности тестируемого соединения относительно активности стандартного агонистаGPR119, 4-6-[(2-фтор-4 метилсульфонилфенил)амино]пиримидин-4-ил]окси]пиперидин-1-карбоновой кислоты изопропилового эфира (WO 2005121121), в конечной концентрации 10 мкМ; кривая экстраполирована к 100% для вычисления ЕС 50. Получение исходных веществ Подготовительный пример 1. Изопропил-4-гидразинопиперидин-1-карбоксилата дигидрохлоридная соль Изопропил-4-2-(трет-бутоксикарбонил)гидразинилпиперидин-1-карбоксилат (полученный, как описано в WO 2008137436) (20,2 г, 67,02 ммоль) растворяли в абсолютном этаноле (250 мл) и раствор перемешивали в атмосфере азота при комнатной температуре. Медленно добавляли концентрированную водную соляную кислоту (27,9 мл, 335 ммоль). Раствор перемешивали в атмосфере азота при комнатной температуре в течение 4 ч. Реакционную смесь концентрировали до белого твердого вещества, которое содержало некоторое количество исходного вещества. Твердое соединение обрабатывали 4 М раствором хлористого водорода в 1,4-диоксане (100 мл, 400 ммоль) и полученную смесь перемешивали в течение 14 ч при комнатной температуре. Затем реакционную смесь концентрировали при пониженном давлении с получением белого твердого вещества, которое обрабатывали гептаном (100 мл) и снова концентрировали с получением указанного в заголовке соединения в виде белого твердого вещества (15 г, 81%). 1(80 мл) перемешивали при 85 С в течение 3 ч. Смесь концентрировали до примерно трети первоначального объема. Добавляли воду (50 мл), насыщенный бикарбонат натрия (50 мл) и рассол (50 мл). Полученную смесь экстрагировали этилацетатом (250 мл). Объединенные органические экстракты промывали рассолом и сушили над сульфатом магния. Смесь фильтровали и фильтрат концентрировали под вакуумом с получением неочищенного указанного в заголовке соединения в виде светло-желтого твердого вещества (9,8 г), которое использовали на следующей стадии без очистки. Аналитический образец получали в результате очистки посредством хроматографии на силикагеле, элюируя 30-60%-ным раствором этилацетата в гептане. 1 Н ЯМР (500 МГц, дейтерохлороформ) дельта 1.26 (d, 6 Н), 1.35 (t, 3 Н), 1.86-1.95 (m, 2 Н), 2.04-2.17 Чистый трет-бутилнитрит (4,8 мл, 39,3 ммоль) медленно добавляли к перемешиваемой смеси изопропил-4-[5-амино-4-(этоксикарбонил)-1 Н-пиразол-1-ил]-пиперидин-1-карбоксилата (подготовительный пример 2) (8,5 г, 26,2 ммоль) и бромида меди(II) (3,7 г, 16 ммоль) в ацетонитриле (100 мл) при комнатной температуре. Наблюдали значительный экзотермический эффект, причем смесь нагревалась до примерно 50 С. После продолжения нагревания при 65 С в течение 30 мин реакционную смесь охлаждали до комнатной температуры и затем концентрировали под вакуумом. Добавляли избыток 10%-ного водного аммиака и смесь экстрагировали этилацетатом. Органическую фазу промывали водой и рассолом и концентрировали под вакуумом. Остаток очищали посредством хроматографии на силикагеле, элюируя от 30 до 70% этилацетата в гептане с получением указанного в заголовке соединения в виде желтого масла, которое было примерно на 70% чистым согласно ЯМР и LCMS. Вещество использовали на следующей стадии без дополнительной очистки. 1 НЯМР (400 МГц, дейтерохлороформ) дельта 1.23 (d, 6 Н), 1.34 (t, 3 Н), 1.84-1.95 (m, 2 Н), 2.01-2.15(3,59 г, 6,5 ммоль) в тетрагидрофуране (32 мл), охлажденному до 0 С, добавляли 2 М раствор боранметилсульфидного комплекса в тетрагидрофуране (14,6 мл, 29,2 ммоль). Реакционную смесь нагревали при температуре флегмообразования в течение 21 ч и затем перемешивали в течение 4 ч при комнатной температуре. Смесь охлаждали до 0 С и добавляли метанол. Полученный раствор нагревали до комнатной температуры и перемешивали в течение 10 мин. Раствор снова охлаждали до 0 С и добавляли по каплям водный 2 М раствор гидроксида натрия (10 мл). Полученную смесь разбавляли этилацетатом и энергично перемешивали в течение 30 мин. Слои разделяли и водную фазу дважды экстрагировали этилацетатом. Объединенные органические слои промывали последовательно водой и рассолом и затем сушили над сульфатом магния. Смесь фильтровали и фильтрат концентрировали под вакуумом. В результате хроматографии на силикагеле с элюцией 55-70%-ным этилацетатом в гептане получали указанное в заголовке соединение в виде масла (1,89 г, 84%). 1 Н ЯМР (400 МГц, дейтерохлороформ) дельта 1.23 (d, 6 Н), 1.87-1.95 (br m, 3 Н), 2.06 (qd, 2 Н), 2.89(497 мг, 4,23 ммоль) и N,N-диметилацетамид (20 мл) объединяли во флаконе для микроволновой обработки. Флакон продували азотом, герметично закрывали и нагревали при 120 С в течение 1 ч в микроволновом реакторе (Biotage Initiator 2.2). Реакционную смесь пропускали через набивку Florisil, разбавляли этилацетатом и затем добавляли воду. Водную фазу экстрагировали 3 раза этилацетатом и объединенные органические слои сушили над сульфатом магния. Смесь фильтровали и фильтрат упаривали под вакуумом. В результате хроматографии на силикагеле с элюцией 55-70%-ным этилацетатом в гептане получали указанное в заголовке соединение в виде зеленого масла, которое отверждалось при стоянии К раствору 4-бром-2-фторфенола (0,75 мл, 6,8 ммоль) и диизопропилэтиламина (3,5 мл, 20,09 ммоль) в 1,4-диоксане (35 мл) добавляли 9,9-диметил-4,5-бис(дифенилфосфино)ксантен (415 мг, 0,717 ммоль), бис(дибензилиденацетон)палладий (322 мг, 0,351 ммоль) и 2-меркаптоэтанол (0,46 мл, 6,86 ммоль) и темно-коричневый реакционный раствор нагревали при 110 С в течение 16 ч. Реакционную смесь оставляли охлаждаться до комнатной температуры, разбавляли водой и четыре раза экстрагировали этилацетатом. Органические экстракты объединяли и сушили над сульфатом магния. Смесь фильтровали и фильтрат концентрировали при пониженном давлении с получением темно-бордового масла, которое очищали посредством хроматографии на силикагеле с получением указанного в заголовке соединения (985 мг, 76%) в виде темно-бордового твердого вещества. 1 Н ЯМР (400 МГц, дейтерохлороформ) дельта 3.00 (t, 2H, J=5,95 Гц), 3.69 (d, 2 ч, J=3,71 Гц), 6.896.95 (m, 1 Н), 7.11 (ddd, 1 ч, J=8,39, 2,15, 1,17 Гц), 7.17 (dd, 1 ч, J=10,54, 2,15 Гц). Подготовительный пример 7. 4-[(2-[трет-Бутил(диметил)силил]оксиэтил)тио]-2-фторфенол К раствору 2-фтор-4-[(2-гидроксиэтил)тио]фенола (985 мг, 5,24 ммоль) и имидазола (371 мг, 5,30 ммоль) в N,N-диметилформамиде (5 мл) порциями добавляли трет-бутилдиметилсилилхлорид (814 мг,5,24 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 4 ч. Реакционную смесь концентрировали при пониженном давлении и остаток разбавляли водой с последующей экстракцией этилацетатом три раза. Объединенные органические экстракты промывали рассолом и сушили над сульфатом магния. Смесь фильтровали и фильтрат концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде оранжевого масла (1,43 г, 90%), которое использовали без дополнительной очистки. LCMS (ES+): 301,1 (М-1). Подготовительный пример 8. 1-[4-(Бензилокси)-3-фторфенил]-1H-тетразол К суспензии 4-(бензилокси)-3-фторанилина (1,04 г, 4,8 ммоль) (WO 2005030140) в атмосфере азота добавляли уксусную кислоту (2,3 мл, 38,3 ммоль), триэтилортоформиат (2,44 мл, 14,4 ммоль) и азид натрия (0,34 г, 5,3 ммоль) и реакционную смесь нагревали при 95 С в течение 2,5 ч. Затем раствор оставляли охлаждаться до комнатной температуры и добавляли воду с последующей экстракцией этилацетатом три раза. Экстракты объединяли и промывали рассолом и сушили над сульфатом магния. Смесь фильт- 24020106 ровали и концентрировали при пониженном давлении и неочищенное вещество очищали посредством хроматографии на силикагеле (20-40% этилацетата в гептане) с получением указанного в заголовке соединения в виде белого твердого вещества (1,12 г, 86%). 1 Н ЯМР (400 МГц, дейтерометанол) дельта 9.65 (s, 1H), 7.73-7.68 (dd, 1H, J=11, 2,5 Гц), 7.60-7.57 (m,1 Н), 7.47-7.45 (m, 2 Н), 7.40-7.30 (m, 5 Н), 5.24 (s, 2H); LCMS (ES+): 271,1 (М+1). Подготовительный пример 9. 2-Фтор-4-(1 Н-тетразол-1-ил)фенол К 1-[4-(бензилокси)-3-фторфенил]-1H-тетразолу (1,12 г, 4,14 ммоль) в шейкерной колбе Парра добавляли этанол (40 мл) и раствор продували газообразным азотом. Добавляли 10%-ный палладий на углероде (0,30 г) и реакционную смесь гидрировали в шейкерном аппарате Парра при 40 фунтах на кв. дюйм (275,8 кПа) водорода в течение 30 мин. Затем смесь фильтровали через микропористый фильтр и фильтрат концентрировали при пониженном давлении с получением указанного в заголовке соединения в виде белого твердого вещества (0,67 г, 90%), которое использовали без очистки. 1 Н ЯМР (400 МГц, дейтерометанол) дельта 9.62 (s, 1H), 7.65-7.62 (dd, 1 Н, J=11, 2,5 Гц), 7.50-7.46 (m,1H), 7.47-7.45 (dd, 1H, J=9,0, 9,0 Гц); LCMS (ES+): 181,1 (М+1). Подготовительный пример 10. Изопропил-4-(5-циано-4-метилсульфонилокси)метил)-1 Н-пиразол 1-ил)пиперидин-1-карбоксилат Изопропил-4-(5-циано-4-(гидроксиметил)-1 Н-пиразол-1-ил)пиперидин-1-карбоксилат (подготовительный пример 5) (75 мг, 0,24 ммоль) растворяли в 1 мл безводного дихлорметана и добавляли триэтиламин (0,1 мл, 0,74 ммоль). Реакционную смесь охлаждали в ледяной бане и затем добавляли метансульфоновый ангидрид (62 мг, 0,34 ммоль). Раствор удаляли из ледяной бани и перемешивали в течение 30 мин. Реакционную смесь гасили путем добавления насыщенного водного бикарбоната натрия и слои разделяли. Водный слой еще три раза экстрагировали дихлорметаном. Органические экстракты объединяли и промывали рассолом, сушили над сульфатом натрия, фильтровали и фильтрат концентрировали с получением масла (75 мг, выход 100%). Неочищенное вещество использовали на последующих стадиях без дополнительной очистки. Подготовительный пример 11. трет-Бутил-4-гидразинопиперидин-1-карбоксилата гидрохлоридная соль В раствор трет-бутил-4-оксопиперидин-1-карбоксилата (50 г, 0,25 ммоль) в метаноле (500 мл) в автоклаве добавляли моно-гидрохлорид гидразина (17,2 г, 0,25 ммоль) в воде (100 мл). Белую смесь перемешивали в атмосфере аргона с последующим добавлением 5%-ной платины на углероде (750 мг) в виде суспензии в воде. Автоклав герметично закрывали и заполняли водородом до достижения давления 60 атм (6,08 МПа) и реакционную смесь перемешивали в течение 15 ч. После завершения реакционную смесь фильтровали через Celite и набивку промывали метанолом. Это получение проводили шесть раз. Объединенные фильтраты концентрировали при пониженном давлении и полученный белый осадок побочного продукта (ди-трет-бутил-4,4'-гидразин-1,2-диилдипиперидин-1-карбоксилата) собирали путем фильтрации и несколько раз промывали водой. Водный фильтрат затем концентрировали при пониженном давлении с получением желаемого продукта (221 г, 59%) в виде бесцветного твердого вещества. 1 Н ЯМР (400 МГц, дейтерохлороформ) дельта 4.13 (br s, 2 Н), 3.32 (br t, 1H), 2.77 (br t, 2 Н), 2.16 (m,2 Н), 1.66 (m, 2 Н), 1.43 (s, 9 Н). Подготовительный пример 12. трет-Бутил-4-[5-амино-4-(этоксикарбонил)-1 Н-пиразол-1 ил]пиперидин-1-карбоксилат Смесь трет-бутил-4-гидразинопиперидин-1-карбоксилата гидрохлоридной соли (221 г, 880 ммоль),этил-2-циано-3-этоксиакрилата (153 г, 880 ммоль), тригидрата ацетата натрия (477 г, 352 ммоль) и этанола (2000 мл) перемешивали при 85 С в течение 8 ч. Смесь концентрировали при пониженном давлении и остаток растворяли в этилацетате и воде. Слои разделяли и водный слой экстрагировали этилацетатом. Затем объединенные органические экстракты сушили над сульфатом магния. Смесь фильтровали и фильтрат концентрировали при пониженном давлении. Неочищенное вещество очищали посредством фильтрации через короткую набивку силикагеля, элюируя 40%-ным этилацетатом в гептане, с получением продукта в виде бледно-желтого твердого вещества (214 г, 72%). 1 Н ЯМР (500 МГц, дейтерохлороформ) дельта 7.60 (s, 1 Н), 5.27 (br s, 2 Н), 4.23 (br q, 4 Н), 3.91 (m,1H), 2.81 (br s, 2H), 2.04 (m, 2H), 1.86 (m, 2H), 1.44 (s, 9H), 1.29 (t, 3H). Подготовительный пример 13. трет-Бутил-4-[5-бром-4-(этоксикарбонил)-1H-пиразол-1 ил]пиперидин-1-карбоксилат К раствору бромида меди(II) (1,69 г, 770 ммоль) в ацетонитриле (1000 мл) медленно добавляли трет-бутилнитрит (112 мл, 960 ммоль) и раствор нагревали до 65 С. К этому добавляли по каплям раствор трет-бутил-4-[5-амино-4-(этоксикарбонил)-1 Н-пиразол-1-ил]пиперидин-1-карбоксилата (215 г, 640 ммоль) в ацетонитриле (650 мл) в течение 30 мин. Через 4 ч реакционную смесь оставляли охлаждаться до комнатной температуры и затем вливали в 2 М соляную кислоту (1500 мл) во льду. Смесь три раза экстрагировали этилацетатом и объединенные органические экстракты промывали насыщенным водным бикарбонатом натрия и затем сушили над сульфатом магния. Смесь фильтровали и фильтрат концентрировали при пониженном давлении. Полученный остаток очищали посредством фильтрации через короткую набивку силикагеля, элюируя сначала 10% гептана в дихлорметане, затем дихлорметаном, с получением указанного в заголовке соединения (137 г, 53%) в виде желтого масла, которое отверждалось при стоянии. 1(137 г, 0,34 моль) в тетрагидрофуране (1300 мл), охлажденному до 0 С, медленно добавляли боранметилсульфид (97 мл, 1,02 моль). Раствор оставляли нагреваться до комнатной температуры и затем нагревали при температуре флегмообразования в течение 15 ч. Затем реакционную смесь охлаждали в ледяной бане и добавляли по каплям метанол (40 мл). Затем раствор перемешивали при комнатной температуре в течение 20 мин. Добавляли 2 М водный гидроксид натрия (1200 мл) и слои разделяли. Водный слой экстрагировали этилацетатом и объединенные органические слои промывали рассолом, сушили над сульфатом магния и растворитель удаляли при пониженном давлении. Полученный остаток очищали посредством фильтрации через короткую набивку силикагеля, элюируя 30%-ным этилацетатом в гептане, с получением указанного в заголовке соединения в виде бесцветного твердого вещества (61,4 г, 50%). Загрязненное вещество после этой очистки дополнительно очищали посредством вышеуказанной хроматографической процедуры с получением второй партии указанного в заголовке соединения (22 г, 18%) в виде бесцветного твердого вещества. 1 Н ЯМР (400 МГц, дейтерохлороформ) дельта 7.59 (s, 1 Н), 4.52 (s, 2 Н), 4.37 (m, 1 Н), 4.25 (br s, 2 Н),2.86 (br s, 2 Н), 2.06 (m br s, 2 Н), 1.89 (m, 2 Н), 1.45 (s, 9H). Подготовительный пример 15. трет-Бутил-4-[5-циано-4-(гидроксиметил)-1H-пиразол-1 ил]пиперидин-1-карбоксилат Цианид меди(I) (2,97 г, 33,3 ммоль) добавляли к перемешиваемому раствору трет-бутил-4-[5-бром 4-(гидроксиметил)-1 Н-пиразол-1-ил]пиперидин-1-карбоксилата (10 г, 27,8 ммоль) в дегазированном диметилформамиде (100 мл). Затем реакционную смесь нагревали при 165 С в течение 4 ч и оставляли охлаждаться до комнатной температуры. Затем ее охлаждали в ледяной бане и добавляли раствор этилендиамина (5,5 мл) в воде (20 мл) с последующим разведением дополнительным количеством воды (70 мл). Затем смесь экстрагировали этилацетатом и слои разделяли. Органический слой промывали последовательно водой и рассолом и затем сушили над сульфатом магния. Смесь фильтровали и фильтрат концен- 26020106 трировали при пониженном давлении. Эту процедуру осуществляли в 8 партиях. Конечные неочищенные остатки объединяли и очищали посредством повторной хроматографии на колонке с силикагелем,элюируя 40%-ным этилацетатом в гептане, с получением указанного в заголовке соединения (11,6 г,17%) в виде бесцветного твердого вещества. 1 Н ЯМР (400 МГц, дейтерохлороформ) 7.59 (s, 1H), 4.71 (s, 2H), 4.45 (m, 1H), 4.26 (br s, 2H), 2.88 (br(0,18 мл, 1,32 ммоль), затем метансульфоновый ангидрид (189 мг, 1,1 ммоль) при комнатной температуре. Смесь перемешивали в течение 4,5 ч, затем разбавляли дихлорметаном и насыщенным водным бикарбонатом. Слои разделяли и водный слой экстрагировали дихлорметаном. Объединенные органические экстракты промывали рассолом, сушили над сульфатом магния, фильтровали и фильтрат концентрировали в вакууме с получением трет-бутил-4-(5-циано-4-метилсульфонилокси)метил)-1H-пиразол-1 ил)пиперидин-1-карбоксилата в виде масла, которое использовали без дополнительной очистки. Подготовительный пример 17. 2-Фтор-4-(1-2-(триметилсилил)этокси)метил)-1H-тетразол-5 ил)фенол и 2-фтор-4-(2-2-(триметилсилил)этокси)метил)-2 Н-тетразол-5-ил)фенолA) 4-(Бензилокси)-3-фторбензонитрил К перемешиваемому раствору 3-фтор-4-гидроксибензонитрила (1,00 г, 7,30 ммоль) в 20 мл ацетонитрила порциями добавляли карбонат калия (2,02 г, 14,6 ммоль). Полученную смесь перемешивали в течение 10 мин, затем добавляли бензилбромид (1,33 мл, 10,9 ммоль). Смесь перемешивали при комнатной температуре в течение 70 ч, затем ее разбавляли этилацетатом и водой. Органическую фазу отделяли и промывали водой, рассолом, сушили над сульфатом магния, фильтровали и фильтрат концентрировали в вакууме. Остаток очищали посредством флэш-хроматографии, элюируя градиентом от 5 до 20% этилацетата в гептане, с получением 4-(бензилокси)-3-фторбензонитрила в виде белого твердого вещества(1,33 г). Б) 5-(4-(Бензилокси)-3-фторфенил)-1 Н-тетразол и 5-(4-(бензилокси)-3-фторфенил)-2 Н-тетразол Флакон, содержащий 4-(бензилокси)-3-фторбензонитрил (250 мг, 1,10 ммоль), азид натрия (214 мг,3,30 ммоль), хлорид аммония (176 мг, 3,30 ммоль) и 3 мл N,N-диметилформамида, нагревали при 110 С в течение 18 ч. Реакционную смесь охлаждали до комнатной температуры, разбавляли водой и этилацетатом и рН корректировали до 3 водной 1 н. соляной кислотой. Органическую фазу отделяли и промывали рассолом, сушили над сульфатом магния, фильтровали и фильтрат концентрировали в вакууме с получением указанного в заголовке содинения в виде белого твердого вещества (270 мг). Это вещество использовали на последующих стадиях без очистки. В) 5-(4-(Бензилокси)-3-фторфенил)-1-2-(триметилсилил)этокси)метил)-1 Н-тетразол и 5-(4(бензилокси)-3-фторфенил)-2-2-(триметилсилил)этокси)метил)-2 Н-тетразол К раствору 5-(4-(бензилокси)-3-фторфенил)-1H-тетразола и 5-(4-(бензилокси)-3-фторфенил)-2 Нтетразола (270 мг, 1 ммоль), растворенных в тетрагидрофуране, четырьмя порциями добавляли гидрид натрия (44 мг, 1,1 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 15 минут. Затем добавляли (2-(хлорметокси)этил)триметилсилан (0,19 мл, 1,0 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 16 ч. Реакционную смесь гасили путем добавления воды и добавляли этилацетат. Органическую фазу отделяли и водную фазу дважды экстрагировали этилацетатом. Объединенные органические экстракты промывали рассолом, сушили над сульфатом магния,фильтровали и фильтрат концентрировали при пониженном давлении. В результате очистки посредством флэш-хроматографии с элюцией градиентом этилацетата и гептана (от 5 до 20% этилацетата) получали желаемый продукт в виде белого твердого вещества (270 мг, выход 67%). Г) 2-Фтор-4-(1-2-(триметилсилил)этокси)метил)-1H-тетразол-5-ил)фенол и 2-фтор-4-(2-2(триметилсилил)этокси)метил)-2 Н-тетразол-5-ил)фенол К раствору 5-(4-(бензилокси)-3-фторфенил)-1-2-(триметилсилил)этокси)метил)-1 Н-тетразола и 5(4-(бензилокси)-3-фторфенил)-2-2-(триметилсилил)этокси)метил)-2 Н-тетразола (140 мг, 0,35 ммоль),растворенных в смеси 2 мл этанола и 2 мл тетрагидрофурана, добавляли черный палладий (56 мг, 0,53 ммоль) и муравьиную кислоту (0,14 мл, 3,5 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 4 ч, затем фильтровали через набивку Celite. Фильтрат концентрировали при пониженном давлении и полученное неочищенное вещество использовали на следующей стадии без дополнительной очистки. Подготовительный пример 18. 5-(4-(Бензилокси)-3-фторфенил)-1-(2-(триметилсилилокси)этил)-1Hтетразол и 5-(4-(бензилокси)-3-фторфенил)-2-(2-(триметилсилилокси)этил)-2 Н-тетразол К раствору 5-(4-(бензилокси)-3-фторфенил)-1 Н-тетразола и 5-(4-(бензилокси)-3-фторфенил)-2 Нтетразола (подготовительный пример 17, стадия Б) (550 мг, 2 ммоль), растворенных в N,Nдиметилформамиде (8 мл), двумя порциями добавляли гидрид натрия (163 мг, 4 ммоль) и полученную смесь перемешивали при комнатной температуре в течение 5 мин. Затем добавляли (2 бромэтокси)триметилсилан (1,3 мл, 6 ммоль) и реакционную смесь перемешивали при 70 С в течение 16 ч, затем охлаждали до комнатной температуры. Реакционную смесь гасили путем добавления воды и добавляли этилацетат. Органическую фазу отделяли и водную фазу дважды экстрагировали этилацетатом. Объединенные органические экстракты промывали рассолом, сушили над сульфатом магния, фильтровали и концентрировали при пониженном давлении. Остаток очищали посредством флэшхроматографии, элюируя градиентом этилацетата и гептана (от 5 до 30% этилацетата), с получением 5(4-(бензилокси)-3-фторфенил)-1-(2-(триметил силилокси)этил)-1 Н-тетразола (100 мг, выход 12%) и 5-(4(бензилокси)-3-фторфенил)-2-(2-(триметилсилилокси)этил)-2 Н-тетразола (600 мг, выход 69%). Подготовительный пример 19. 2-Фтор-4-(2-(2-(триметилсилилокси)этил)-2 Н-тетразол-5-ил)фенол К раствору 5-(4-(бензилокси)-3-фторфенил)-2-(2-(триметилсилилокси)этил)-2 Н-тетразола (подготовительный пример 18) (230 мг, 0,54 ммоль), растворенного в смеси 6 мл этанола и 6 мл тетрагидрофурана, добавляли черный палладий (86 мг, 0,806 ммоль) и муравьиную кислоту (0,215 мл, 5,4 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 4 ч, затем фильтровали через набивку Celite. Фильтрат концентрировали при пониженном давлении и полученное неочищенное вещество(180 мг) использовали на следующей стадии без дополнительной очистки. Подготовительный пример 20. 2-Фтор-4-(1-(2-(триметилсилилокси)этил)-1H-тетразол-5-ил)фенол К раствору 5-(4-(бензилокси)-3-фторфенил)-1-(2-(триметилсилилокси)этил)-1 Н-тетразола (подготовительный пример 18) (130 мг, 0,30 ммоль), растворенного в смеси 2 мл этанола и 2 мл тетрагидрофурана, добавляли черный палладий (48 мг, 0,45 ммоль) и муравьиную кислоту (0,12 мл, 3 ммоль). Полученную смесь перемешивали при комнатной температуре в течение 4 ч, затем фильтровали через набивкуCelite. Фильтрат концентрировали при пониженном давлении и полученное неочищенное вещество (94 мг) использовали на следующей стадии без дополнительной очистки. Подготовительный пример 21. 2-Фтор-4-(1-метил-1 Н-тетразол-5-ил)фенол метил-2 Н-тетразол К перемешиваемому раствору 5-(4-(бензилокси)-3-фторфенил)-1 Н-тетразола и 5-(4-(бензилокси)-3 фторфенил)-2 Н-тетразола (подготовительный пример 17, стадия Б) (1,50 г, 5,55 ммоль) в 30 мл тетрагидрофурана добавляли двумя порциями гидрид натрия (444 мг, 11,1 ммоль) при комнатной температуре. Через 5 мин добавляли йодметан (1,04 мл, 16,6 ммоль) и реакционную смесь перемешивали в атмосфере азота в течение 15 ч при комнатной температуре. Смесь разбавляли водой и дважды экстрагировали этилацетатом. Объединенные органические экстракты промывали рассолом, сушили сульфатом магния,фильтровали и фильтрат концентрировали в вакууме. Остаток очищали посредством флэшхроматографии, элюируя 10-40%-ным этилацетатом в гептане, с получением 5-(4-(бензилокси)-3 фторфенил)-2-метил-2 Н-тетразола в виде белого твердого вещества (1,1 г) и 5-(4-(бензилокси)-3 фторфенил)-1-метил-1H-тетразола в виде белого твердого вещества (450 мг). 5-(4-(Бензилокси)-3-фторфенил)-1-метил-1H-тетразол 1 Н ЯМР (400 МГц, дейтерохлороформ) дельта 4.15 (s, 3 Н), 5.23 (s, 2 Н), 7.15 (t, J=8,39 Гц, 1 Н), 7.317.48 (m, 6 Н), 7.52 (dd, J=11,13, 2,15 Гц, 1 Н). LCMS (М+1): 285,1. Б) 2-Фтор-4-(1-метил-1H-тетразол-5-ил)фенол К раствору 5-(4-(бензилокси)-3-фторфенил)-1-метил-1H-тетразола (500 мг, 1,76 ммоль) в 6 мл этанола и 6 мл тетрагидрофурана добавляли муравьиную кислоту (0,7 мл, 17,6 ммоль), затем черный палладий (281 мг, 2,64 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 4 ч. Реакционную смесь фильтровали через Celite и фильтрат концентрировали в вакууме с получением 2 фтор-4-(1-метил-1 Н-тетразол-5-ил)фенола в виде белого твердого вещества (330 мг), которое использовали в последующих реакциях без дополнительной очистки. Подготовительный пример 22. 4-(1-Метил-1 Н-тетразол-5-ил)фенол А) 4-(Бензилокси)-N-метилбензамид В колбу, содержащую тионилхлорид (0,35 мл, 4,82 ммоль), добавляли раствор коммерчески доступной 4-бензилоксибензойной кислоты (1,00 г, 4,38 ммоль) в 10 мл дихлорметана и 0,01 мл N,Nдиметилформамида при 0 С при перемешивании. Ледяную баню удаляли и раствор перемешивали в течение 4 ч при комнатной температуре. Смесь концентрировали в вакууме с получением белого твердого вещества. Это твердое вещество растворяли в 10 мл метиламина (2 M в тетрагидрофуране) и полученный раствор перемешивали при комнатной температуре в течение 70 ч. Смесь разбавляли этилацетатом и водой и органический слой отделяли, сушили над сульфатом магния, фильтровали и фильтрат концентрировали в вакууме с получением белого твердого вещества. Это твердое соединение перекристаллизовывали из этилацетата и гептана с получением 4-(бензилокси)-N-метилбензамида в виде белых игл (850 мг). Б) 5-(4-(Бензилокси)фенил)-1-метил-1 Н-тетразол К перемешиваемому раствору 4-(бензилокси)-N-метилбензамида (200 мг, 0,829 ммоль) в 3 мл ацетонитрила и одной капле N,N'-диметилформамида в колбе, снабженной обратным холодильником, добавляли триэтиламин (0,12 мл) в атмосфере азота. Реакционную смесь перемешивали в течение 10 мин,затем добавляли по каплям тионилхлорид (0,078 мл, 1,08 ммоль). Желтую реакционную смесь перемешивали в течение 1 ч при комнатной температуре в атмосфере азота. Затем медленно добавляли триэтиламин (0,36 мл) с последующим добавлением тетрабутилхлорида аммония (37,4 мг, 0,12 ммоль) и азида натрия (611 мг, 1,82 ммоль). Полученную желтую суспензию энергично перемешивали в течение 70 ч при комнатной температуре в атмосфере азота. Смесь разбавляли водой и этилацетатом. Органический слой отделяли, промывали рассолом, сушили над сульфатом магния, фильтровали и фильтрат концентрировали в вакууме. Остаток очищали посредством флэш-хроматографии, элюируя градиентом от 10 до 40% этилацетата в гептане, с получением 5-(4-(бензилокси)фенил)-1-метил-1H-тетразола в виде белого твердого вещества (180 мг). В) 4-(1-Метил-1 Н-тетразол-5-ил)фенол К перемешиваемому раствору 5-(4-(бензилокси)фенил)-1-метил-1H-тетразола (180 мг, 0,676 ммоль) в 3 мл этанола и 3 мл тетрагидрофурана добавляли муравьиную кислоту (0,27 мл, 6,76 ммоль), затем черный палладий (108 мг, 1,01 ммоль). Смесь перемешивали при комнатной температуре в течение 4 ч. Реакционную смесь фильтровали через Celite и фильтрат концентрировали с получением 4-(1-метил-1Hтетразол-5-ил)фенола в виде белого твердого вещества (110 мг), которое использовали в последующих реакциях без дополнительной очистки.
МПК / Метки
МПК: C07D 401/14, A61K 31/4545, A61P 3/10, C07D 401/04, A61K 31/454
Метки: производные, модуляторов, l-(пиперидин-4-ил)пиразола, качестве, gpr119
Код ссылки
<a href="https://eas.patents.su/30-20106-proizvodnye-l-piperidin-4-ilpirazola-v-kachestve-modulyatorov-gpr119.html" rel="bookmark" title="База патентов Евразийского Союза">Производные l-(пиперидин-4-ил)пиразола в качестве модуляторов gpr119</a>
Предыдущий патент: Ферритно-аустенитная нержавеющая сталь
Следующий патент: Контейнер для жидких и сыпучих продуктов
Случайный патент: Применение ферментированного экстракта зародышей пшеницы в кормлении животных












