Производные пиперидин- или пиперазинзамещенной тетрагидронафталин 1-карбоновой кислоты, ингибирующие мтр
Номер патента: 16311
Опубликовано: 30.04.2012
Авторы: Линдерс Йоаннес Теодорус Мария, Бертело Дидье Жан-Клод, Мерпул Ливен, Вьейевуа Марсель, Бакс Лео Якобус Йозеф, Яроскова Либуше, Бюсхер Гююске Фредерике
Формула / Реферат
1. Соединение формулы (I)
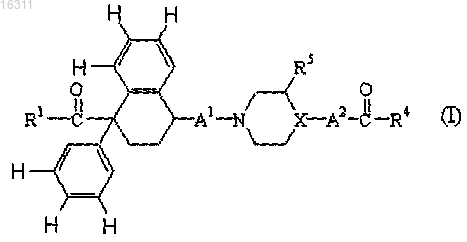
его фармацевтически приемлемые соли присоединения кислот, N-оксиды и стереохимически изомерные формы, где
X представляет собой N или CH; когда X представляет собой CH, тогда A2 представляет собой
-NR6-, где R6 представляет собой водород или C1-4алкил, или, когда X представляет собой N, тогда A2 отсутствует;
A1 представляет собой -(C=O)- или -CH2- ;
R1 представляет собой NR7R8, где каждый R7 и R8 независимо выбраны из
водорода;
C1-8алкила;
C1-8алкила, замещенного одним или двумя заместителями, каждый из которых независимо от другого выбран из гидрокси, C1-4алкилокси, C1-4алкилоксикарбонила, гидроксикарбонила, NR10R11, CONR12R13, арила или гетероарила; где гетероарил представляет собой индолил;
или арила;
или R1 представляет собой NR7R8, где R7 и R8 вместе с атомом азота, с которым они связаны, образуют пирролидинильное или пиперидинильное кольца, где каждое из этих колец может необязательно быть замещено одним или двумя заместителями, каждый из которых независимо выбран из C1-4алкила, C1-4алкилокси, гидрокси, гидроксикарбонила или C1-4алкилоксикарбонила;
или R1 представляет собой OR9, где R9 представляет собой C1-6алкил или C3-8алкенил;
R10 представляет собой водород, C1-4алкил, C1-4алкилкарбонил, C1-4алкилоксикарбонил или R12-NH-карбонил;
R11 представляет собой водород;
R12 представляет собой водород;
R13 представляет собой водород;
R4 представляет собой фенил; или
фенил, замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из C1-4алкила, галогена, гидрокси, C1-4алкилокси, полигалогенС1-4алкилокси, сульфамоила, фенила, замещенного трифторметилом, или гетероциклической группы, где указанная гетероциклическая группа представляет собой морфолинил или пиперазинил, замещенный C1-4алкилом; или
R4 представляет собой гетероарил, где указанный гетероарил представляет собой пиридинил или пиридазинил, необязательно замещенные одним или двумя заместителями, каждый из которых независимо выбран из C1-4алкила, гидрокси, C1-4алкилокси или оксо;
R5 представляет собой водород или C1-4алкилокси; и
арил представляет собой фенил; или фенил, замещенный заместителями в количестве от одного до двух, каждый из которых независимо выбран из C1-4алкила, C1-4алкилокси, галогена или гидрокси.
2. Соединение по п.1, где A1 представляет собой -(C=O)-.
3. Соединение по п.1, где A1 представляет собой -CH2-.
4. Соединение по п.1, где R1 представляет собой NR7R8.
5. Соединение по п.1, где R1 представляет собой OR9.
6. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и терапевтически активное количество соединения по любому из пп.1-5.
7. Способ получения фармацевтической композиции по п.6, где терапевтически активное количество соединения по любому из пп.1-5 непосредственно смешано с фармацевтически приемлемым носителем.
8. Применение соединения по любому из пп.1-5 в качестве лекарственного средства.
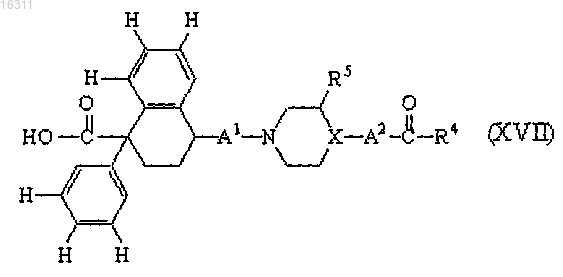
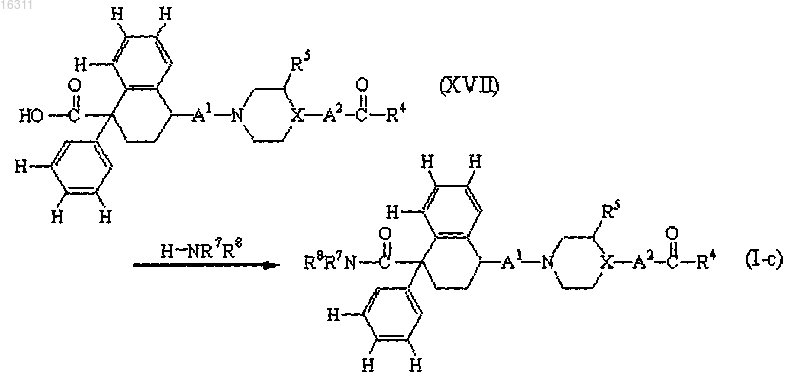
9. Промежуточное соединение формулы (XVII) или его фармацевтически приемлемые соли присоединения кислот, N-оксиды и стереохимически изомерные формы, где заместители R4, R5, A1, A2 и X являются такими, как определено в п.1
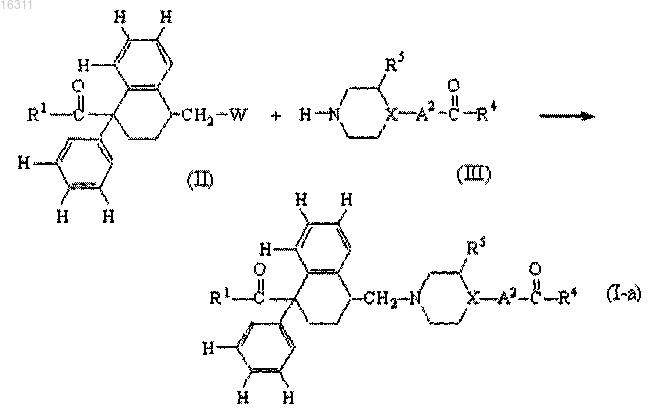
10. Способ получения соединения формулы (I), заключающийся во взаимодействии промежуточного соединения формулы (II), где W представляет собой соответствующую удаляемую группу, с промежуточным соединением формулы (III) в инертном растворителе и, необязательно, в присутствии подходящего основания, с получением соединения формулы (I-a), представляющего собой соединение формулы (I), где A1 представляет собой -CH2-;
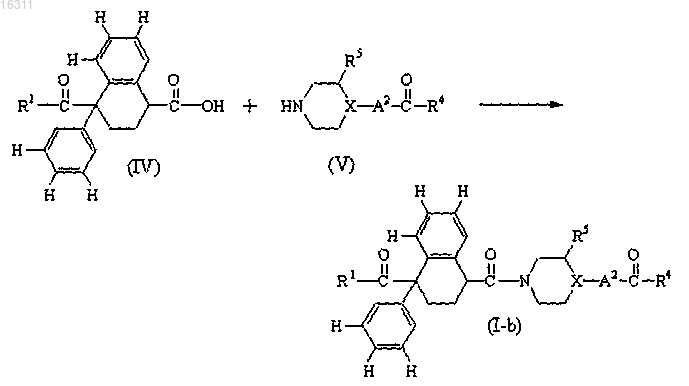
11. Способ получения соединения формулы (I), заключающийся во взаимодействии промежуточного соединения формулы (IV) с промежуточным соединением формулы (V) в инертном растворителе и, необязательно, в присутствии подходящего связующего реагента и/или подходящего основания, с получением соединения формулы (I-b), представляющего собой соединение формулы (I), где A1 представляет собой -(C=O)-;
12. Способ получения соединения формулы (I), заключающийся в преобразовании соединения формулы (XVII), определенного в п.9, в соединение формулы (I-с), представляющего собой соединение формулы (I), где R1 представляет собой NR7R8, N-алкилированием, с использованием H-NR7R8 в качестве реагента;
13. Способ получения соединения формулы (XVII) или его фармацевтически приемлемых солей присоединения кислот, N-оксидов и стереохимически изомерных форм, определенных в п.9, заключающийся в преобразовании соединения формулы (I), где R1 представляет собой OR9, и R9 представляет собой С1-6алкил, путем гидролиза в кислотных условиях.
14. Способ получения соединения формулы (XVII) или его фармацевтически приемлемых солей присоединения кислот, N-оксидов и стереохимически изомерных форм, определенных в п.9, заключающийся в преобразовании соединения формулы (I), где R1 представляет собой OR9, и R9 представляет собой C3-8алкенил, восстановлением натрийборгидридом в присутствии тетракис(трифенилфосфин)палладия в подходящем растворителе.
15. Способ получения соединения формулы (XVII) или его фармацевтически приемлемых солей присоединения кислот, N-оксидов и стереохимически изомерных форм, определенных в п.9, заключающийся в преобразовании соединения формулы (I), где R1 представляет собой OR9, и R9 представляет собой защитную группу, способами удаления защитных групп.
Текст
ПРОИЗВОДНЫЕ ПИПЕРИДИН- ИЛИ ПИПЕРАЗИНЗАМЕЩЕННОЙ ТЕТРАГИДРОНАФТАЛИН 1-КАРБОНОВОЙ КИСЛОТЫ, ИНГИБИРУЮЩИЕ МТР Изобретение относится к новым производным пиперидин- или пиперазинзамещенной тетрагидронафталин-1-карбоновой кислоты формулы (I), обладающим ингибирующей активностью в отношении секреции апоВ/МТР и сопутствующей гиполипидемической активностью. Кроме того, изобретение относится к способам получения таких соединений,фармацевтическим композициям, содержащим указанные соединения, а также использованию указанных соединений в качестве лекарственного средства для лечения атеросклероза,панкреатита, ожирения, гипертриглицеридемии, гиперхолестеринемии, гиперлипидемии, диабета и диабета по типу II. Мерпул Ливен (BE), Линдерс Йоаннес Теодорус Мария (NL), Яроскова Либуше (BE), Вьейевуа Марсель (NL),Бакс Лео Якобус Йозеф, Бертело Дидье Жан-Клод, Бюсхер Гююске Фредерике (BE) Медведев В.Н. (RU)(71)(73) Заявитель и патентовладелец: ЯНССЕН ФАРМАЦЕВТИКА НВ (BE) 016311 Изобретение относится к новым пиперидин- или пиперазинзамещенным производным тетрагидронафталин-1-карбоновой кислоты, обладающим ингибирующей активностью в отношении секреции апоВ/МТР и сопутствующей гиполипидемической активностью. Кроме того, изобретение относится к способам получения указанных соединений, фармацевтическим композициям, содержащим указанные соединения, а также к применению указанных соединений в качестве лекарственного средства для лечения атеросклероза, панкреатита, ожирения, гипертриглицеридемии, гиперхолестеринемии, гиперлипидемии, диабета и диабета по типу II. Ожирение является причиной множества серьезных проблем со здоровьем, таких как развитие диабета и заболевания сердца у взрослых. Кроме того, снижение массы тела является навязчивой идеей у возрастающей части населения. В настоящее время широко признается причинно-следственная связь между гиперхолестеринемией,особенно связанной с повышенными концентрациями в плазме крови липопротеинов низкой плотности(здесь далее обозначаются как ЛНП) и липопротеинов очень низкой плотности (здесь далее обозначаются как ЛОНП) и преждевременным развитием атеросклероза и/или сердечно-сосудистого заболевания. Тем не менее, в настоящее время для лечения гиперлипидемии доступно только ограниченное количество лекарственных препаратов. Лекарственные препараты, в основном применяемые для лечения гиперлипидемии, включают полимеры для связывания желчных кислот, такие как холестирамин и холестипол, производные фиброевой кислоты, такие как безафибрат, клофибрат, фенофибрат, ципрофибрат и гемфиброзил, никотиновая кислота и ингибиторы синтеза холестерина, такие как ингибиторы HMG кофермент-A редуктазы. Тем не менее, остается потребность в новых средствах для снижения уровней липидов, обладающих большей эффективностью и/или действующие посредством других механизмов, чем вышеуказанные лекарственные препараты. Липопротеины плазмы представляют собой водорастворимые высокомолекулярные комплексы, образованные из липидов (холестерин, триглицеридов, фосфолипидов) и аполипопротеинов. В соответствии с их плотностью (определяемой ультрацентрифугированием) определены пять основных групп липопротеинов, которые различаются по количеству липидов и типу аполипопротеина, все они образуются в печени и/или кишечнике. Они включают ЛНП, ЛОНП, липопротеины промежуточной плотности (здесь в дальнейшем обозначаются как ЛПП), липопротеины высокой плотности (здесь далее обозначаются как ЛВП) и хиломикроны. Идентифицировано десять основных аполипопротеинов в плазме человека. ЛОНП, которые секретируются печенью и содержат аполипопротеин В (здесь далее обозначаются как Апо-B), подвергаются разложению до ЛНП, которые переносят 60-70% от общего количества холестерина в сыворотке крови. Кроме того, Апо-B является основным белковым компонентом ЛНП. Повышенный уровень ЛНП-холестерина в сыворотке крови вследствие избыточного синтеза или пониженного метаболизма причинно связан с атеросклерозом. Напротив, липопротеины высокой плотности (здесь и далее указаны как ЛВП), которые содержат аполипопротеин A1, обладают защитным действием и обратно пропорционально соотносятся с риском развития заболевания коронарных сосудов сердца. Таким образом, соотношение ЛВП/ЛНП представляет собой удобный способ оценки атерогенного потенциала липидного профиля плазмы крови у индивидуума. Две изоформы аполипопротеина (апо) B, апо B-48 и апо B-100, являются важными белками в липопротеиновом метаболизме человека. Апо B-48 имеет размер, составляющий около 48% от апо B-100 при анализе в натрий додецилсульфат полиакриламидных гелях, синтезируется в кишечнике человека. АпоB-48 неоходим для сборки хиломикрон и, следовательно, играет необходимую роль в процессе всасывания жиров пищи в кишечнике. Апо B-100, который вырабатывается в печени человека, необходим для синтеза и секреции ЛОНП. ЛНП, которые содержат примерно 2/3 холестерина плазмы крови человека,представляют собой продукты метаболизма ЛОНП. Фактически, апо B-100 представляет только один белковый компонент ЛНП. Признано, что повышенные концентрации апо B-100 и ЛНП-холестерина в плазме крови являются факторами риска для развития атеросклеротического заболевания коронарных сосудов. Большое количество наследственных и приобретенных заболеваний может привести к гиперлипидемии. Их можно подразделить на первичные и вторичные гиперлипидемические состояния. Наиболее частыми причинами вторичных гиперлипидемии являются сахарный диабет, злоупотребление алкоголем, лекарственными препаратами, гипотиреоидизм, хроническая почечная недостаточность, нефротический синдром, холестаз и булимия. Первичные гиперлипидемии также подразделяются на обычную гиперхолестеринемию, семейную комбинированную гиперлипидемию, семейную гиперхолестеринемию,остаточную гиперлипидемию, синдром хиломикронемии и семейную гипертриглицеридемию. Известно, что микросомальный белок переноса триглицеридов (здесь далее обозначается как MTP) катализирует транспорт триглицеридов, холестерилового эфира и фосфолипидов, таких как фосфатидилхолин. Это указывает на то, что MTP необходим для синтеза Апо B-содержащих липопротеинов, таких как хиломикроны и ЛОНП, предшественников ЛНП. Следовательно, это означает, что ингибитор MTP будет ингибировать синтез ЛОНП и ЛНП, тем самым снижая уровни ЛОНП, ЛНП, холестерина и триглицеридов у человека.-1 016311 Полагают, что соединения, способные ингибировать MTP, могут быть использованы при лечении расстройств, таких как ожирение, гиперлипидемия, гиперхолестеринемия, гипертриглицеридемия, диабет по типу II, атеросклероз, и для снижения возникающих после приема пищи сывороточных уровней триглицеридов в плазме. Настоящее изобретение основано на неожиданном открытии того, что группа производных тетрагидронафталин-1-карбоновой кислоты обладает ингибирующей активностью в отношении секреции апо В/МТР. Эти соединения формулы (I) могут действовать системно и/или в качестве избирательных ингибиторов MTP, то есть способны избирательно блокировать MTP на уровне стенки кишечника у млекопитающих. Настоящее изобретение относится к семейству новых соединений формулы (I) их фармацевтически приемлемым солям присоединения кислот, их N-оксидам и их стереохимически изомерным формам, где-NR -, где R6 представляет собой водород или C1-4 алкил, или, когда X представляет собой N, тогда A2 отсутствует;R1 представляет собой NR7R8, где каждый R7 и R8 независимо выбраны из водорода;C1-8 алкила, замещенного одним или двумя заместителями, каждый из которых независимо от другого выбран из гидрокси, C1-4 алкилокси, C1-4 алкилоксикарбонила, гидроксикарбонила, NR10R11, CONR12R13,арила или гетероарила; где гетероарил представляет собой индолил; или арила; или R1 представляет собой NR7R8, где R7 и R8 вместе с атомом азота, с которым они связаны, образуют пирролидинильное или пиперидинильное кольца, где каждое из этих колец может необязательно быть замещено одним или двумя заместителями, каждый из которых независимо выбран из C1-4 алкила,C1-4 алкилокси, гидрокси, гидроксикарбонила или C1-4 алкилоксикарбонила; или R1 представляет собой OR9, где R9 представляет собой C1-6 алкил или C3-8 алкенил;R13 представляет собой водород,R4 представляет собой фенил; или фенил, замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из C1-4 алкила,галогена, гидрокси, C1-4 алкилокси, полигалогенС 1-4 алкилокси, сульфамоила, фенила, замещенного трифторметилом, или гетероциклической группы, где указанная гетероциклическая группа представляет собой морфолинил или пиперазинил, замещенный C1-4 алкилом; илиR4 представляет собой гетероарил, где указанный гетероарил представляет собой пиридинил или пиридазинил, необязательно замещенные одним или двумя заместителями, каждый из которых независимо выбран из C1-4 алкила, гидрокси, C1-4 алкилокси или оксо;R5 представляет собой водород или C1-4 лкилокси; и арил представляет собой фенил; или фенил, замещенный заместителями в количестве от одного до двух, каждый из которых независимо выбран из C1-4 алкила, C1-4 алкилокси, галогена или гидрокси. Как используется в вышеуказанных определениях галоген включает фтор, хлор, бром и йод;C1-4 алкил обозначает насыщенные углеводородные радикалы с прямой или разветвленной цепью,содержащие от 1 до 4 атомов углерода, такие как, например, метил, этил, пропил, бутил, 1-метилэтил, 2 метилпропил и тому подобное;C1-6 алкил включает C1-4 алкил и его более высокие гомологи, содержащие 5 или 6 атомов углерода,такие как, например, 2-метилбутил, пентил, гексил и тому подобное;C1-8 алкил включает C1-6 алкил и его более высокие гомологи, содержащие от 7 до 8 атомов углерода,такие как, например, гептил, этилгексил, октил и тому подобное; полигалоген C1-4 алкил определен как полигалогензамещенный C1-4 алкил, в частности C1-4 алкил (какC3-8 алкенил обозначает углеводородные радикалы с прямой или разветвленной цепью, содержащие одну двойную связь и содержащие от 3 до 8 атомов углерода, такие как, например, 2-пропенил, 3 бутенил, 2-бутенил, 2-пентенил, 3-пентенил, 3-метил-2-бутенил, 3-гексенил, 2-гексенил, 2-пентенил, 2 октенил и тому подобное;C3-8 алкинил обозначает углеводородные радикалы с прямой или разветвленной цепью, содержащие одну тройную связь и содержащие от 3 до 8 атомов углерода, такие как, например, 2-пропинил, 3 бутинил, 2-бутинил, 2-пентинил, 3-пентинил, 3-метил-2-бутинил, 3-гексинил, 2-гексинил, 2-пентинил, 2 октинил и тому подобное. Фармацевтически приемлемые соли присоединения кислот, описанные в настоящем документе выше, включают виды терапевтически активных нетоксичных солей присоединения кислот, которые могут быть образованы соединениями формулы (I). Обычно, эти фармацевтически приемлемые соли присоединения кислот могут быть получены обработкой соединения в виде основания такой соответствующей кислотой. Подходящие кислоты включают, например, неорганические кислоты, такие как галогенводородные кислоты, например, хлористоводородная кислота или бромистоводородная кислота, серная, азотная, фосфорная и тому подобные кислоты; или органические кислоты, такие как, например, уксусная,пропановая, гидроксиуксусная, молочная, пировиноградная, щавелевая (то есть этандионовая), малоновая, янтарная (то есть бутандионовая кислота), малеиновая, фумаровая, яблочная, винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламовая, салициловая,п-аминосалициловая, памовая и тому подобные кислоты. С другой стороны, указанные соли можно преобразовать в свободное основание обработкой соответствующим основанием. Соединения формулы (I) могут быть как в несольватированном, так и в сольватированном виде. Для описания молекулярного комплекса, содержащего соединение по изобретению и одну или несколько молекул фармацевтически приемлемого растворителя, например этанола, в настоящем документе используют термин "сольват". Когда указанный растворитель представляет собой воду, используют терминN-оксидная форма соединения в соответствии с формулой (I) включает соединение формулы (I), где один или несколько атомов азота окислены до так называемых N-оксидов, в частности до N-оксидов, где один или несколько третичных атомов азота (например, пиперазинильного или пиперидинильного радикала) являются N-окисленными. Такие N-оксиды могут быть легко получены специалистом в данной области, не обладающим какими-либо изобретательскими навыками, и они, очевидно, являются альтернативами соединения в соответствии с формулой (I), так как эти соединения представляют собой метаболиты, образующиеся путем окисления в организме человека при усвоении. Общеизвестно, что окисление обычно является первой стадией метаболизма лекарственного препарата (Textbook of Organic Medicinal и Pharmaceutical Chemistry, 1977, pages 70-75). Кроме того, общеизвестно, что почти с такими же эффектами человеку вместо самого соединения также могут быть введены соединения в виде метаболитов. Соединение формулы (I) может быть преобразовано в соответствующую форму N-оксида в соответствии со способами, известными в данной области для пребразования тривалентного азота в форму его N-оксида. Обычно, указанная реакция N-окисления может быть выполнена путем взаимодействия соединения формулы (I) с подходящим органическим или неорганическим пероксидом. Подходящие неорганические пероксиды содержат, например пероксид водорода, пероксиды щелочных или щелочноземельных металлов, например пероксид натрия, пероксид калия; подходящие органические пероксиды могут содержат пероксокислоты, такие как, например, пероксобензойная кислота или галоген замещенная пероксобензойная кислота, например, 3-хлорпероксобензойная кислота, пероксоалкановые кислоты,например, пероксоуксусная кислота, алкилгидропероксиды, например, трет-бутил гидропероксид. Подходящими растворителями являются, например, вода, низшие спирты, например этанол и тому подобное,углеводороды, например толуол, кетоны, например 2-бутанон, галогенированные углеводороды, например дихлорметан, и смеси таких растворителей. Используемый в настоящем документе выше термин "стереохимически изомерные формы" обозначает все возможные изомерные формы, которые могут иметь соединения формулы (I). Если не указано иное, химическое название соединений обозначает смесь всевозможных стереохимически изомерических форм, при этом указанные смеси содержат все диастереомеры и энантиомеры основной молекулярной структуры. Более конкретно, стереоцентры могут быть R- или S-конфигурации; заместители на бивалентных циклических (частично) насыщенных радикалах могут быть или цис- или транс-конфигурации. Соединения, содержащие двойные связи, могут иметь E или Z-стереохимию указанной двойной связи.-3 016311 Очевидно, что стереохимически изомерные формы соединений формулы (I) входят в объем настоящего изобретения. Абсолютная стереохимическая конфигурация соединений формулы (I) и промежуточных соединений, используемых при их получении, может легко быть определена специалистом в данной области путем использования хорошо известных методов, таких как, например, дифракция рентгеновских лучей. Соединения формулы (I) имеют по меньшей мере два асимметрических атома углерода, как показано ниже на схеме, где асимметрические атомы углерода обозначены знаком. Ввиду присутствия по меньшей мере двух асимметрических атомов углерода общий термин "соединение формулы (I)" включает смесь четырех стереоизомеров. Большая часть полученных соединений по настоящему изобретению имеет или трансконфигурацию или цис-конфигурацию: Каждое из иллюстрированных выше "цис"- или "транс-" соединений состоит из рацемической смеси двух энантиомеров, и для обозначения указанной относительно стереохимической конфигурации использовали обозначение связей жирным шрифтом или штриховкой. В случае, когда "цис"- или "транс"-соединение разделено на два отдельных энантиомера, обозначение связей жирным шрифтом или штриховкой заменено на клиновидное обозначение этих связей для указания того, что соединение представляет собой индивидуальный энантиомер. Если абсолютная стереохимия конкретного хирального атома углерода в отдельном энантиомере не определена, тогда ее стереохимическая конфигурация обозначена как R, или S, обозначая относительную стереохимию. Кроме того, некоторые соединения формулы (I) и некоторые промежуточные соединения, используемые при их получении, могут проявлять полиморфизм. Понятно, что настоящее изобретение включает любые полиморфные формы, обладающие свойствами, которые могут быть использованы при лечении указанных выше состояний. Некоторые соединения формулы (I) могут также быть в виде таутомерных форм. Предполагается,что такие формы, хотя и не указанные конкретно в вышеуказанной формуле, включены в объем настоящего изобретения. Например, когда ароматическое гетероциклическое кольцо замещено гидроксигруппой, то кетоформа может представлять наиболее распространенный таутомер. В объеме настоящей заявки выражение "соединение по изобретению" также включает соединение,соответствующее общей формуле (I), и его пролекарство или их изотопно-меченное соединение. Также в объем изобретения включены так называемые "пролекарства" соединений формулы (I). Пролекарства представляют собой некоторые производные фармацевтически активных соединений, ко-4 016311 торые могут обладать небольшой или не обладать фармакологической активностью сами по себе, но способные при введении в организм преобразовываться в соединения формулы (I), обладающие желаемой фармацевтической активностью, например, путем гидролитического расщепления. Такие производные называют "пролекарствами". В объеме настоящей заявки соединение по изобретению, по существу, включает все изотопные сочетания его химических элементов. В объеме настоящей заявки химический элемент, в частности, когда указано для соединения в соответствии с формулой (I), содержит все изотопы и изотопные смеси этого элемента либо природные, либо полученные путем синтеза, либо в распространенной в природе форме,либо в изотопно-обогащенной форме. В частности, когда указан водород, понятно, что имеется в виду 1H, 2H, 3H и их смеси; когда указан углерод, понятно, что имеется в виду 11C, 12C, 13C, 14C и их смеси; когда указан азот, понятно, что имеется в виду 13N, 14N, 15N и их смеси; когда указан кислород, понятно, что имеется в виду 14O, 15O, 16O, 17O, 18O и их смеси; и когда указан фтор, понятно, что имеется в виду 18F, 19F и их смеси. Соответственно, соединение по изобретению, по существу, охватывает соединение с одним или несколькими изотопами одного или нескольких элементов и их смеси, включая радиоактивное соединение,также называемое радиомеченым соединением, где один или несколько нерадиоактивных атомов заменены на один из своих радиоактивных изотопов. Термин "радиомеченое соединение" обозначает любое соединение в соответствии с формулой (I), его фармацевтически приемлемую соль присоединения кислот или оснований, его N-оксидную форму, или его соль четвертичного аммония, которые содержат по меньшей мере один радиоактивный атом. Например, соединение может быть мечено позитроном или гамма-активными радиоизотопами. Для метода радиолигандного связывания (исследование мембранного рецептора), 3H-атом или 125I-атом представляет собой атом для замещения, по выбору. Для получения изображения чаще всего используемыми радиоактивными изотопами, испускающими позитроны (PET),являются 11C, 18F, 15O и 13N, каждый из которых получен на ускорителе элементарных частиц и имеет период полураспада 20, 100, 2 и 10 мин, соответственно. Так как эти радиоактивные изотопы имеют очень короткий период полураспада, то возможность их использования имеется лишь в учреждениях,имеющих собственный ускоритель для их получения, ограничивая таким образом их применение. Наиболее часто используемыми из них являются 18F, 99mTc, 201Tl и 123I. Способы обращения с этими радиоактивными изотопами, их получение, выделение и введение в молекулу хорошо известны специалисту в данной области. В частности, радиоактивный атом выбран из группы, включающей водород, углерод, азот, серу, кислород и галоген. Предпочтительно, радиоактивный атом выбран из группы, включающей водород, углерод и галоген. В частности, радиоактивный изотоп выбран из группы, включающей 3H, 11C, 18F, 122I, 123I, 125I, 131I,75 76Br, Br, 77Br и 82Br. Предпочтительно, радиоактивный изотоп выбран из группы, включающей 3H, 11 С и 18F. Представляющие интерес соединениями формулы (I) являются соединения формулы (I), где имеют место одно или несколько следующих ограничений:e) R1 представляет собой NR7R8, где каждый R7 и R8 независимо выбран из водорода; C1-8 алкила;C1-8 алкила, замещенного одним или двумя заместителями, каждый из которых независимо от другого выбран из гидрокси, C1-4 алкилокси, C1-4 алкилоксикарбонила, гидроксикарбонила, NR10R11, CONR12R13,арила или гетероарила; или арила; илиf) R1 представляет собой NR7R8, где R7 и R8 объединены с атомом азота, несущим R7 и R8, с образованием пирролидинильного или пиперидинильного кольца, где каждое из этих колец может необязательно быть замещено одним или двумя заместителями, каждый из которых независимо выбран из C1-4 алкила, C1-4 алкилокси, гидрокси, гидроксикарбонила или C1-4 алкилоксикарбонила; илиh) R4 представляет собой фенил; фенил, замещенный 1, 2 или 3 заместителями, каждый из которых независимо выбран из C1-4 алкила, галогена, гидрокси, C1-4 алкилокси, полигалогенС 1-4 алкилокси, сульфамоила, фенила, замещенного трифторметилом, или гетероциклической группы, где указанная гетероциклическая группа представляет собой морфолинил или пиперазинил, замещенные C1-4 алкилом; илиi) R4 представляет собой гетероарил, где указанный гетероарил представляет собой пиридинил или пиридазинил, необязательно замещенные одним или двумя заместителями, каждый из которых независимо выбран из C1-4 алкила, гидрокси, C1-4 алкилокси или оксо; илиj) арил представляет собой фенил; или фенил, замещенный одним или двумя заместителями, каждый из которых независимо выбран из C1-4 алкила, C1-4 алкилокси, галогена или гидрокси; илиk) R9 представляет собой гетероарил, где гетероарил представляет собой индолил; илиl) R5 представляет собой водород или C1-4 алкилокси.-5 016311 В одном варианте осуществления настоящее изобретение относится к соединениям формулы (I), гдеR6 представляет собой водород или C1-4 алкил, или, когда X представляет собой N, тогда A2 отсутствует;A1 представляет собой -(C=O)- или -CH2-; R1 представляет собой NR7R8, где каждый R7 и R8 независимо выбраны из водорода; C1-8 алкила; C1-8 алкила, замещенного одним или двумя заместителями, каждый из которых независимо от другого выбран из гидрокси, C1-4 алкилокси, C1-4 алкилоксикарбонила, гидроксикарбонила, NR10R11, CONR12R13, арила или гетероарила; или арила; или R1 представляет собой NR7R8, гдеR7 и R8 объединены с атомом азота, несущим R7 и R8, с образованием пирролидинильного или пиперидинильного кольца, где каждое из этих колец может необязательно быть замещено одним или двумя заместителями, каждый из которых независимо выбран из C1-4 алкила, C1-4 алкилокси, гидрокси, гидроксикарбонила или C1-4 алкилоксикарбонила; или R1 представляет собой OR9, где R9 представляет собой C14 6 алкил или C3-8 алкенил; R представляет собой фенил; или фенил, замещенный 1, 2 или 3 заместителями,каждый из которых независимо выбран из C1-4 алкила, галогена, гидрокси, C1-4 алкилокси, полигалогенС 14 алкилокси, сульфамоила, фенила, замещенного трифторметилом, или гетероциклической группы, где указанная гетероциклическая группа представляет собой морфолинил или пиперазинил, замещенный C14 4 алкилом; или R представляет собой гетероарил, где указанный гетероарил представляет собой пиридинил или пиридазинил, необязательно замещенные одним или двумя заместителями, каждый из которых независимо выбран из C1-4 алкила, гидрокси, C1-4 алкилокси или оксо; R5 представляет собой водород илиC1-4 алкилокси; арил представляет собой фенил; или фенил, замещенный заместителями в количестве от одого до двух, каждый из которых независимо выбран из C1-4 алкила, C1-4 алкилокси, галогена или гидрокси; и гетероарил представляет собой индолил. В другом варианте осуществления настоящее изобретение относится кa) соединениям формулы (I), где R4 представляет собой фенил, замещенный гетероциклической группой, где указанная гетероциклическая группа представляет собой пиперазинил, замещенный C1-4 алкилом, в частности метилом или изопропилом;(1R,4S) конфигурацию. Конкретными соединениями формулы (I) являются соединения (34), (39), (47), (129), (199), (208),(246), (247), (248), (249), (252) и (276). Обычно соединения формулы (I-a), определенные как соединения формулы (I), где A1 представляет собой -CH2-, могут быть получены путем N-алкилирования промежуточного соединения формулы (III) промежуточным соединением формулы (II), где W представляет собой подходящую удаляемую группу,такую как, например, галоген, например, хлор, бром, йод, или, в некоторых случаях, W может также представлять собой сульфонилоксигруппу, например метансульфонилокси, арилсульфонилокси, такой как бензолсульфонилокси или п-метилбензолсульфонилокси, трифторметансульфонилокси и тому подобные реакционноспособные удаляемые группы. Взаимодействие может быть выполнено в реакционноинертном растворителе, таком как, например, ацетонитрил, 2-пентанол, изобутанол, диметилацетамид,дихлорметан, хлороформ, 1,2-дихлорэтан или ДМФ, и, необязательно, в присутствии подходящего основания, такого как, например, карбонат натрия, карбонат калия или триэтиламин. Перемешивание может повысить скорость реакции. Взаимодействие можно, соответственно, проводить при температуре в пределах от комнатной температуры до температуры кипения реакционной смеси. Скорость реакции и выход продукта могут быть повышены с помощью микроволнового воздейсвия. Соединения формулы (I-b), определенные как соединения формулы (I), в которых радикал A1 представляет собой -(C=O)-, могут быть получены путем взаимодействия промежуточного соединения формулы (V) с промежуточным соединением формулы (IV), по меньшей мере в одном реакционно-инертном растворителе и, необязательно, в присутствии по меньшей мере одного подходящего конденсирующего агента, например, такого как описан в "Solid-Phase Synthesis: A Practical Guide" pages 275 - 330 by S. Katesand F. Albericio, Marcel Dekker, Inc., 2000, (ISBN 0-8247-0359-6) и/или подходящего основания, такого как карбонат натрия, карбонат калия, карбонат цезия, триэтиламин, N,N-диизопропилэтиламин или N-6 016311 метилморфолин, при этом указанный способ также необязательно включает преобразование соединения формулы (I-b) в его соль присоединения, и/или получение его стереохимически изомерных форм. Скорость реакции и выход продукта могут быть повышены с помощью микроволнового воздействия. Может быть удобным преобразовать промежуточное соединение формулы (IV) в производное ацилгалогенида путем его взаимодействия, например, с тионилхлоридом, оксалилбромидом, оксалилхлоридом, фосгеном, трихлоридом фосфора или трибромидом фосфора, с последующим добавлением промежуточного соединения формулы (V) и подходящего основания. Также может быть удобным активировать карбоновую кислоту формулы (IV) путем добавления эффективного количества промотора реакции. Неограничивающие примеры таких промоторов реакции включают карбонилдиимидазол, диимиды, такие как N,N'-дициклогексил-карбодиимид или 1-(3 диметиламинопропил)-3-этилкарбодиимид и их функциональные производные. В случае использования хирально чистого реагента формулы (IV) можно провести быстрое и без энантиомеризации взаимодействие промежуточного соединения формулы (IV) с указанным промежуточным соединением (V) в присутствии, дополнительно, эффективного количества соединения, такого как гидроксибензотриазол (HOBT),бензотриазолилокситрис(диметиламино)фосфоний гексафторфосфат, тетрапирролидинофосфоний гексафторфосфат, бромтрипирролидинофосфоний гексафторфосфат или их функциональные производные,как описано D. Hudson, J. Org. Chem. (1988), 53:617. Или может быть удобным преобразовать промежуточное соединение формулы (IV) в производное ацилгалогенида путем аго взаимодействия, например, с тионилхлоридом, оксалилбромидом, оксалилхлоридом, фосгеном, трихлоридом фосфора или трибромидом фосфора, с последующим добавлением промежуточного соединения формулы (V) и подходящего основания. Промежуточные соединения формулы (XVII), где заместители R4, R5, A1, A2 и X являются такими,как определено для соединений формулы (I), могут быть преобразованы в соединения формулы (I-e),определенные как соединения формулы (I), где R1 представляет собой NR7R8, известными в данной области способами N-ацилирования, используя в качестве реагента H-NR7R8. Также соединения формулы (I), где R1 представляет собой OR9, и R9 представляет собой C1-6 алкил,могут быть преобразованы в соединения формулы (I), где R1 представляет собой OR9, и R9 представляет собой водород, путем гидролиза в кислотных условиях. Соединения формулы (I), где R1 представляет собой OR9 и R9 представляет собой C3-8 алкенил, могут быть преобразованы в соединения формулы (I),где R1 представляет собой OR9, и R9 представляет собой водород, известными в данной области способами восстановления, такими как, например, обработка натрийборгидридом в присутствии тетракис(трифенилфосфин)палладия в подходящем растворителе, таком как, например, ТГФ. Соединения формулы (I), где R1 представляет собой OR9, и R9 представляет собой защитную группу, такую как аллил,бензил или трет-бутил, могут быть преобразованы в соединения формулы (I), где R1 представляет собойOR9, и R9 представляет собой водород, известными в данной области способами удаления защитных групп, такими как гидролиз в присутствии палладия, катализируемое кислотой и основанием снятие защитной группы, или любым способом, описанным в "Protective Groups in Organic Synthesis" by T.W.Greene and P.G.M. Wuts, Wiley-Interscience; 3 edition (May 15, 1999) (ISBN 0471160199). Промежуточные соединения формулы (XIII), определенные как промежуточные соединения формулы (IV), где R1 представляет собой OR9, могут быть получены способом, представленным ниже. Промежуточные соединения формулы (XV) могут быть получены способом, описанным ниже. Промежуточные соединения формулы (XV) представляют собой промежуточные соединения формулы Промежуточные соединения формулы (II) могут быть получены способом, приведенным ниже. Промежуточные соединения формулы (II-a) определены как промежуточные соединения формулы (II),где R1 представляет собой NR7R8, и промежуточные соединения формулы (II-b) определены как промежуточные соединения формулы (II), где R1 представляет собой OR9.-8 016311 Соединения формулы (I), полученные способами, описанными выше, можно синтезировать в виде рацемических смесей энантиомеров, которые можно отделить друг от друга, в соответствии с известными в данной области способами разделения. Эти соединения формулы (I), полученные в виде рацематов,можно преобразовать в со ответствующие формы диастереомерных солей путем взаимодействия с подходящей хиральной кислотой. Затем указанные формы диастереомерных солей разделяют, например, с помощью селективной или фракционной кристаллизации, и энантиомеры выделяют с помощью щелочи. Альтернативный способ разделения энантиомерных форм соединений формулы (I) включает жидкостную хроматографию с использованием хиральной стационарной фазы. Указанные стереохимически чистые формы изомеров можно также получить из соответствующих стереохимически чистых форм изомеров соответствующих исходных веществ, при условии, что реакция протекает стереоспецифически. Если желаемым является стереоизомер, то указанное соединение, предпочтительно, следует синтезировать стереспецифическими способами получения. В этих способах преимущественно будут использоваться энантиомерно чистые исходные вещества. Соединения формулы (I), их N-оксидные формы, их фармацевтически приемлемые соли и стереоизомерные формы оказывают положительное влияние на секрецию апоВ и обладают ингибирующей активностью в отношении MTP, а также сопутствующей гиполипидемической активностью. Следовательно, соединения по настоящему изобретению формулы (I) могут быть использованы в качестве лекарственного средства, особенно в способе лечения пациентов, страдающих гиперлипидемией, ожирением,атеросклерозом или диабетом по типу II. Соответственно, соединения по настоящему изобретению могут быть использованы при получении лекарственного средства для лечения расстройств, вызванных избытком липопротеинов очень низкой плотности (ЛОНП) или липопротеинов низкой плотности (ЛНП), и особенно расстройств, вызванных холестерином, связанным с указанными ЛОНП и ЛНП. В частности,соединения по настоящему изобретению могут быть использованы при получении лекарственного средства для лечения гиперлипидемии, ожирения, атеросклероза или диабета по типу II. Оказалось, что основной механизм действия соединений формулы (I) включает ингибирование активности MTP (микросомального белка переноса триглицеридов) в гепатоцитах и эпителиальных клетках кишечника, приводя, соответственно, к снижению уровня ЛОНП и выработке хиламикронов. Это представляет собой новый и инновационный подход к лечению гиперлипидемии, и полагают, что он приводит к снижению уровня ЛНП-холестерина и триглицеридов посредством снижения выработки ЛОНП в печени и хиломикронов в кишечнике. Большое количество наследственных и приобретенных заболеваний может привести к развитию гиперлипидемии. Их можно подразделить на первичные и вторичные гиперлипидемические состояния. Наиболее частыми причинами вторичных гиперлипидемии являются сахарный диабет, злоупотребление алкоголем, лекарственными препаратами, гипотиреоз, хроническая почечная недостаточность, нефротический синдром, холестаз и булимия. Первичными гиперлипидемиями, как правило, являются гиперхолестеринемия, семейная комбинированная гиперлипидемия, семейная гиперхолестеринемия, остаточная гиперлипидемия, синдром хиломикронемии, семейная гипертриглицеридемия. Соединения по настоящему изобретению также можно использовать для профилактики или лечения пациентов, страдающих ожирением или атеросклерозом, в частности коронарным атеросклерозом, и более того, в целом заболеваний, которые связаны с атеросклерозом, таких как ишемическая болезнь сердца, заболевание периферических сосудов, церебрально-васкулярное заболевание. Соединения по настоящему изобретению могут приводить к регрессии атеросклероза и подавлять клинические последствия атеросклероза, в частности заболеваемость и смертность. С точки зрения полезности соединений формулы (I) следует, что настоящее изобретение также относится к способу лечения теплокровных животных, включая человека, (обычно называемого здесь пациентом) страдающих расстройствами, вызванными избыточным количеством липопротеинов очень низкой плотности (ЛОНП) или липопротеинов низкой плотности (ЛНП), и, в частности, расстройствами,вызванными холестерином, связанным с указанными ЛОНП и ЛНП. Следовательно, предложен способ лечения пациентов, страдающих, например, такими заболеваниями, как, например, гиперлипидемия,ожирение, атеросклероз или диабет по типу II. Апо B-48, синтезируемый в кишечнике, необходим для сборки хиломикронов и поэтому играет важную роль во всасывании пищевых жиров в кишечнике. Настоящее изобретение относится к соединениям, которые действуют в качестве селективных ингибиторов MTP на уровне стенки кишечника. Кроме того, настоящее изобретение относится к фармацевтическим композицям, содержащим по меньшей мере один фармацевтически приемлемый носитель и терапевтически эффективное количество соединения формулы (I). Для получения фармацевтических композиций по настоящему изобретению эффективное количество конкретного соединения в виде соли присоединения оснований или кислот в качестве активного ингредиента объединяют в однородной смеси по меньшей мере с одним фармацевтически приемлемым носителем, который может быть разного вида в зависимости от вида препарата, предназначенного для введения. Эти фармацевтические композиции при желании имеют вид лекарственной формы для однократного приема, подходящей предпочтительно для перорального введения, ректального введения, чрез-9 016311 кожного введения или парентеральной инъекции. Например, при получении композиций в виде лекарственного препарата для перорального введения можно использовать, в случае жидких лекарственных форм для перорального введения, таких как суспензии, сиропы, эликсиры и растворы, любые обычные жидкие фармацевтические носители, такие как,например, вода, гликоли, масла, спирты и тому подобное; или, в случае порошков, пилюль, капсул и таблеток, твердые фармацевтические носители, такие как крахмалы, сахара, каолин, смазывающие вещества, связующие вещества, разрыхляющие вещества и тому подобное. Ввиду простоты введения, таблетки и капсулы являются наиболее предпочтительными стандартными пероральными лекарственными средствами, при этом обычно используются твердые фармацевтические носители. Для композиций для парентерального введения фармацевтический носитель будет в основном содержать стерильную воду, хотя могут быть включены другие ингредиенты для улучшения растворимости активного вещества. Например, инъецируемые растворы можно получить с использованием фармацевтического носителя, содержащего физиологический раствор, раствор глюкозы или смесь их обоих. Также могут быть получены инъецируемые суспензии с использованием подходящих жидких носителей, суспендирующих веществ и тому подобное. В композициях, подходящих для введения через кожу, фармацевтический носитель может необязательно содержать средство для усиления проникновения и/или подходящее смачивающее вещество,необязательно, в смеси с небольшими количествами подходящих добавок, которые не оказывают существенного раздражающего действия на кожу. Указанные добавки можно выбрать для облегчения нанесения активного ингредиент на кожу и/или для содействия в получении желаемых композиций. Эти композиции для местного нанесения можно вводить различными способами, например, в виде трансдермального пластыря, наклейки или мази. Аддитивные соли соединений формулы (I), вследствие их повышенной водорастворимости по сравнению с формой соответствующего основания, очевидно, являются более подходящими при получении водных композиций. Для простоты введения и единообразия дозирования особенно предпочтительно изготавливать фармацевтические композиции по изобретению в виде стандартных лекарственных форм для однократного приема. Используемый в настоящем документе термин "стандартная лекарственная форма" относится к физически дискретным единицам, пригодным в качестве однократных доз, где каждая единица содержит заранее определенное количество активного ингредиента, рассчитанное для получения желаемого терапевтического эффекта, в смеси с необходимым фармацевтическим носителем. Примерами таких стандартных лекарственных форм являются таблетки (включая таблетки с риской или покрытые оболочкой таблетки), капсулы, пилюли, пакеты с порошками, облатки, инъецируемые растворы или суспензии, препарат объемом чайной ложки, препарат в объеме столовой ложки и тому подобное, и их объединенные множественные дозы. Для перорального введения фармацевтические композиции по настоящему изобретению могут быть представлены в виде твердых дозированных форм, например, в виде таблеток (как в форме для проглатывания, так и в форме для жевания), капсул или мягких капсул, полученных обычными способами, с фармацевтически приемлемыми наполнителями и носителями, такими как связывающие вещества (например, предварительно желатинизированный кукурузный крахмал, поливинилпирролидон, гидроксипропилметилцеллюлоза и тому подобное), наполнители (например, лактоза, микрокристаллическая целлюлоза, фосфат кальция и тому подобное), смазывающие вещества (например, стеарат магния, тальк,диоксид кремния и тому подобное), разрыхляющие вещества (например, картофельный крахмал, натрий гликолят крахмал и тому подобное), увлажняющие вещества (например, лаурилсульфат натрия) и тому подобное. Также такие таблетки могут быть покрыты оболочками способами, хорошо известными в данной области. Жидкие препараты для перорального введения могут иметь вид, например, растворов, сиропов или суспензий, или их можно изготовить в виде сухого продукта для смешивания с водой и/или другим подходящим жидким носителем перед применением. Такие жидкие препараты можно получить обычными способами, необязательно, с другими фармацевтически приемлемыми добавками, такими как суспендирующие вещества (например, сироп сорбита, метилцеллюлоза, гидроксипропилметилцеллюлоза или гидрогенизированные пищевые жиры), эмульгирующие вещества (например, лецитин или аравийская камедь), неводные носители (например, миндальное масло, жирные эфиры или этиловый спирт), подсластители, вещества, придающие вкус, вещества, маскирующие вкус и запах, и консерванты (например,метил- или пропил-п-гидроксибензоаты или сорбиновая кислота). Фармацевтически приемлемые подсластители, используемые в фармацевтических композициях по изобретению, содержат, предпочтительно по меньшей мере один интенсивный подсластитель, такой как аспартам, ацесульфам калия, цикломат натрия, элитам, подсластитель дигидрохалькон, монеллин, стевиозид, сукралозу (4,1',6'-трихлор-4,1',6'-тридеоксигалактосахароза) или предпочтительно сахарин, сахарин натрия или кальция, и, необязательно, по меньшей мере один объемный подсластитель, такой как сорбит, маннит, фруктоза, сахароза, мальтоза, солод, глюкоза, гидрогенизированный глюкозный сироп,ксилит, карамель или мед. Обычно интенсивные подсластители применяют в низких концентрациях. Например, в случае сахарина натрия указанная концентрация может находится в пределах от около 0,04% до 0,1% (мас./об.) от конечной композиции. Объемный подсластитель можно эффективно использовать в- 10016311 более высоких концентрациях от около 10 до около 35%, предпочтительно от около 10 до 15% (мас./об.). Фармацевтически приемлемые вкусовые вещества, которые могут маскировать горький вкус ингредиентов в композициях с низкими дозами, предпочтительно, представляют собой фруктовые вкусовые вещества, например, со вкусом и запахом вишни, малины, черной смородины или клубники. Очень хорошие результаты может давать сочетание двух вкусовых веществ. В композициях с высокими дозами могут быть необходимыми более сильные фармацевтически приемлемые вкусовые вещества, такие какCaramel Chocolate, Mint Cool, Fantasy и тому подобное. Каждое вкусовое вещество может быть в конечной композиции в концентрации в пределах от около 0,05 до 1% (мас./об.). Преимущественно, применяют сочетания указанных сильных вкусовых веществ. Предпочтительно, используют вкусовое вещество,которое не претерпевает какого-либо изменения или потери вкуса и/или цвета в условиях композиции. Соединения формулы (I) могут входить в состав препарата для парентерального введения путем инъекции, обычно внутривенной, внутримышечной или подкожной инъекции, например, болюсинъекции или длительной внутривенной инфузией. Композиции для инъекции могут быть в виде стандартной лекарственной формы, например, в виде ампул или контейнеров для дробных доз, включающих добавленный консервант. Они могут быть в виде таких форм, как суспензии, растворы или эмульсии в масляных или водных носителях, и могут содержать агенты, используемые при изготовлении препаратов, такие как изотонирующие, суспендирующие, стабилизирующие и/или диспергирующие вещества. Альтернативно, активный ингредиент может быть в виде порошка для смешивания с подходящим носителем перед использованием, например, для смешивания со стерильной непирогенной водой. Соединения формулы (I) могут входить в состав препарата в виде композиции для ректального применения в виде суппозиториев или удерживающих клизм, например, содержащие обычные основы для суппозиториев, такие как масло какао и/или другие глицериды. Соединения формулы (I) можно использовать в сочетании с другими фармацевтическими средствами, в частности, фармацевтические композиции по настоящему изобретению могут дополнительно содержать по меньшей мере одно дополнительное средство для снижения уровней липидов, обеспечивая таким образом так называемую комбинированную терапию для снижения уровня липидов. Указанное дополнительное средство для снижения уровня липидов может представлять собой, например, известный препарат, обычно применяемый для контроля гиперлипидемии, такой как, например, полимер для связывания желчных кислот, производное фиброевой кислоты или никотиновой кислоты, как уже упоминалось выше в разделе "уровень техники". Подходящие дополнительные средства для снижения уровня липидов также включают другие ингибиторы биосинтеза холестерина и ингибиторы всасывания холестерина, в частности ингибиторы HMG-CoA редуктазы и ингибиторы HMG-CoA-синтазы, ингибиторы гена экспрессии HMG-CoA-редуктазы, ингибиторы СЕТР, ингибиторы АСАТ, ингибиторы скваленсинтетазы, антагонисты CB-1, ингибиторы всасывания холестерина, такие как эзетимиб и тому подобное. Любой ингибитор HMG-CoA редуктазы можно использовать в качестве второго соединения в аспекте комбинированной терапии по настоящему изобретению. Используемый в настоящем документе термин "ингибитор HMG-CoA редуктазы", если не указано иное, относится к соединению, которое ингибирует биотрансформацию гидроксиметилглутарил-кофермента A в мевалоновую кислоту, катализируемую ферментом HMG-CoA редуктазой. Такими "ингибиторами HMG-CoA редуктазы" являются, например, ловастатин, симвастатин, флувастатин, правастатин, ривастатин и аторвастатин. Любой ингибитор HMG-CoA-синтазы можно использовать в качестве второго соединения в аспекте комбинированной терапии настоящего изобретения. Используемый в настоящем документе термин "ингибитор HMG-CoA-синтазы", если не указано иное, относится к соединению, которое ингибирует биосинтез гидроксиметилглутарил-кофермента A из ацетил-кофермента A и ацетоацетил-кофермента А,катализируемый ферментом HMG-CoA-синтазой. Любой ингибитор гена экспрессии HMG-CoA-редуктазы можно использовать в качестве второго соединения в аспекте комбинированной терапии настоящего изобретения. Эти средства могут быть ингибиторами транскрипции HMG-CoA-редуктазы, которые блокируют транскрипцию ДНК, или ингибиторами трансляции, которые предупреждают трансляцию мРНК, кодирующей HMG-CoA-редуктазы, в белок. Такие ингибиторы могут оказывать влияние на транскрипцию или трансляцию непосредственно или могут биотрансформироваться в соединения, обладающие вышеуказанными свойствами, под действием одного или нескольких ферментов в каскаде биосинтеза холестерина, или могут привести к накоплению метаболита, обладающего вышеуказанными активностями. Любой ингибитор СЕТР можно использовать в качестве второго соединения в аспекте комбинированной терапии настоящего изобретения. Используемый в настоящем документе термин "ингибитор СЕТР", если не указано иное, относится к соединению, которое ингибирует транспортный белок холестеринового эфира (СЕТР), опосредуемого транспорт различных холестериновых эфиров и триглицеридов от ЛВП до ЛНП и ЛОНП. Любой ингибитор АСАТ можно использовать в качестве второго соединения в аспекте комбинированной терапии настоящего изобретения. Используемый в настоящем документе термин "ингибитор АСАТ", если не указано иное, относится к соединению, которое ингибирует внутриклеточную этерификацию холестерина пищи, осуществляемую под действием фермента ацил CoA:холестерин- 11016311 ацилтрансферазы. Любой ингибитор скваленсинтетазы можно использовать в качестве второго соединения в аспекте комбинированной терапии настоящего изобретения. Используемый в настоящем документе термин термин "ингибитор скваленсинтетазы", если не указано иное, относится к соединению, которое ингибирует конденсацию двух молекул фарнезилпирофосфата с образованием сквалена, катализируемую ферментом скваленсинтетазой. Специалист в области лечения гиперлипидемии легко сможет определит терапевтически эффективное количество соединения формулы (I) на основе результатов тестов, представленных ниже. Обычно предполагается, что терапевтически эффективная доза будет находиться в пределах от около 0,001 мг/кг до около 50 мг/кг массы тела, более предпочтительно от около 0,01 мг/кг до около 5 мг/кг массы тела пациента, подвергаемого лечению. Может быть удобным вводить терапевтически эффективную дозу в виде двух или более субдоз с соответствующими интервалами в течение суток. Указанные субдозы могут быть изготовлены в виде лекарственных форм для однократного приема, например, каждая содержащая от около 0,1 мг до около 350 мг, более предпочтительно от около 1 до около 200 мг, активного ингредиента на одну лекарственную форму для однократного приема. Точная дозировка и частота введения зависят от конкретного используемого соединения формулы(I), конкретного состояния, подвергаемого лечению, тяжести подвергаемого лечению состояния, возраста, массы и общего физического состояния конкретного пациента, а также от вида другого медикаментозного лечения (включая вышеуказанные дополнительные средства для снижения уровня липидов), которому может подвергаться пациент, как это хорошо известно специалисту в данной области. Кроме того, указанное эффективное суточное количество может быть снижено или повышено в зависимости от ответной реакции пациента, подвергаемого лечению, и/или в зависимости от оценки врача, назначающего соединения по настоящему изобретению. Таким образом, пределы эффективных суточных количеств,указанных выше, являются только рекомендациями. Экспериментальная часть. В способах, описанных далее, использованы следующие аббревиатуры: "DCM" обозначает дихлорметан; "DMA" обозначает N,N-диметилацетамид, "ДМФ" обозначает N,N-диметилформамид; "ТФУ" обозначает трифторуксусную кислоту, "ТГФ" обозначает тетрагидрофуран; "EtOH" обозначает этанол;N-циклогексилкарбодиимид N-метил полистирольная HL смола (1,90 ммоль/г) представляет собой смолу Novabiochem 01-64-021; карбонатно основная [полистирилметил]-триметил аммоний бикарбонатная смола на полимерной основе (5,8 ммоль/г) представляет собой смолу Novabiochem 01-64-041; полистирол-карбодиимидная смола (1,90 ммоль/г) представляет собой смолу Novabiochem 01-64-024; полистирол-N-метил морфолиновая HL (3,80 ммоль/г) смола представляет собой смолу Novabiochem 01-640211; полистиролбикарбонатная (5,8 ммоль/г) смола представляет собой смолу Novabiochem-01-0640419. Смолы Novabiochem могут быть получены от фирмы Calbiochem-Novabiochem AG, Weidenmattweg 4, CH-4448 Lufelfingen, Швейцария.PS-изоцианатная смола (1% поперечносвязанный полистирол-со-дивинилбензольная смола с бензилизоцианатными функциональными группами) получены от фирмы Argonaut (Biotage), New Road, Hengoed,Mid Glamorgan, Великобритания.Extrelut является продуктом фирмы Merck KgaA, Дармштадт, Германия, и представляет собой короткую колонку, содержащую диатомовую землю. Chiralcel OD, OJ и AD представляют собой материалы колонки с хиральной неподвижной фазой от фирмы Daicel Chemical Industries, Ltd., Япония. КолонкаProchrom Dynamic Axial Compression получена от фирмы Novasep S.A.S., Boulevard de la Moselle, B.P. 50 F- 54340 Pompey, Франция. Абсолютную стереохимическую конфигурацию некоторых соединений определяли, используя колебательно-вращательный дихроизм (vibrational circular dichroism (VCD. Описание использования VCD при определении абсолютной конфигурации может быть найдено в работе Dyatkin A.B. et. al, Chirality,14:215-219 (2002). промежуточного соединения (1). Метиловый эфир 2-гидрокси-2-фенилпропионовой кислоты (0,1 моль) добавляли к раствору серной кислоты (300 мл) в воде (250 мл) и реакционную смесь перемешивали при температуре 100C в течение 20 ч. Осадок отделяли фильтрованием и растворяли в DCM (600 мл) и промывали водой и насыщенным солевым раствором. Органический слой отделяли, сушили, фильтровали и растворитель упаривали до- 12016311 объема в 100 мл. Осадок отделяли фильтрованием и сушили, получая 9 г промежуточного соединения промежуточного соединения (2) (транс). Смесь промежуточного соединения (1) (1,327 моль) в сухом этаноле (2360 мл) перемешивали и добавляли концентрированную серную кислоту (4 мл). Реакционную смесь кипятили с обратным холодильником в течение 22 ч в атмосфере азота и затем реакционную смесь оставляли охлаждаться в течение ночи до комнатной температуры. Образовавшийся осадок отделяли фильтрованием, промывали сухим этанолом и сушили, получая 120 г промежуточного соединения (2) (т.пл. 186-187C). Этанольные слои объединяли и упаривали, и полученный остаток растворяли в DCM (1450 мл),промывали водным раствором NaHCO3 (дважды по 500 мл), сушили и растворитель упаривали. Остаток перемешивали в DIPE (680 мл) при температуре 50-55C и остаток DCM отгоняли, а концентрат оставляли стоять в течение более 2 ч при комнатной температуре. Выпавшие твердые продукты удаляли фильтрованием, промывали с помощью DIPE (120 мл) и пентана и затем сушили при температуре 40C, получая еще дополнительно 103,2 г промежуточного соединения (2) (т.пл. 187-188C). Получение промежуточного соединения (3) (цис). Указанные выше слои DIPE/пентан упаривали и остаток растворяли в сухом ацетонитриле (200 мл),затем растворитель вновь упаривали, получая 166,3 г промежуточного соединения (3) (т.пл. 75C). Пример A.3. Получение промежуточного соединения (4). Промежуточное соединение (2) (0,03 моль) перемешивали в хлороформе (50 мл). Добавляли тионилхлорид (0,06 моль) и реакционную смесь перемешивали и кипятили с обратным холодильником в течение 4 ч до прекращения выделения газа. Реакционную смесь концентрировали путем упаривания растворителя. Добавляли хлороформ (200 мл) и растворитель вновь упаривали, получая остаток, который медленно добавляли в сухой этанол (100 мл), охлаждаемый на водно-ледяной бане до температуры 5C. Водно-ледяную баню отставляли и реакционную смесь оставляли нагреваться до комнатной температуры. Реакционную смесь перемешивали в течение 4 ч при комнатной температуре. Растворитель упаривали, получая промежуточное соединение (4) (т.пл. 78-80C). Промежуточное соединение (5) получали аналогичным образом, но исходя из промежуточного соединения (3). Получение промежуточного соединения (6). Смесь промежуточного соединения (4) (0,05 67 моль) и п-толуолсульфоновой кислоты (1 г) перемешивали и кипятили с обратным холодильником в смеси муравьиной кислоты (500 мл) и концентрированной HCl (125 мл) в течение 3 ч. Реакционную смесь концентрировали путем упаривания растворителя, остаток растворяли в DCM, промывали водным раствором NaHCO3 и сушили. Растворитель упарива- 13016311 ли и остаток очищали с помощью колоночной хроматографии на силикагеле (элюент: этилацетат/гексан 1/9), получая промежуточное соединение (6) (т.пл. 115-118C). Промежуточное соединение (7) (т.пл. 133-135C) получали аналогичным образом, но исходя из промежуточного соединения (5). Получение промежуточного соединения (8). Промежуточное соединение (1) (0,1 моль) растворяли в этаноле (500 мл), добавляли H2SO4 (5 мл) и реакционную смесь перемешивали и кипятили с обратным холодильником в течение ночи, затем охлаждали, и этанол упаривали. Остаток растворяли в DCM, промывали водой (2200 мл) и насыщенным солевым раствором (100 мл). Органический слой сушили, растворитель концентрировали и остаток растирали в DIPE, фильтровали и сушили, получая 18 г промежуточного соединения (8). промежуточного соединения (9). К раствору промежуточного соединения (8) (0,03409 моль) в трихлорметане (200 мл) добавляли тионилхлорид (0,255 моль). Смесь перемешивали и кипятили с обратным холодильником в течение 4 ч. Растворитель упаривали. Остаток растворяли в DCM (125 мл) в токе азота. Смесь охлаждали до температуры -10C. Добавляли по каплям раствор бензоламина (0,230 моль) в DCM (75 мл) при температуре-10C в токе азота. Смесь перемешивали при комнатной температуре в течение ночи. Осадок отделяли фильтрованием, промывали 1 М HCl (до pH 7), промывали водой (до pH 7), промывали насыщенным раствором NaCl, сушили, фильтровали и растворитель упаривали. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (элюент: (гексан/этилацетат 2/1)/CH2Cl2). Чистые фракции собирали и растворитель упаривали, получая 10,244 г промежуточного соединения (9). промежуточного соединения (10). Раствор промежуточного соединения (9) (0,01985 моль) в сухом ТГФ (400 мл) охлаждали до температуры 0C в токе азота. Добавляли по каплям LiBH4 (2M в ТГФ) (0,1 моль) при температуре 0C в токе азота. Смесь перемешивали в течение 15 мин. Добавляли этанол (100 мл). Смесь перемешивали при комнатной температуре в течение ночи. Добавляли 1 М раствор HCl (200 мл). Смесь экстрагировали водой(дэтилацетатом (500 мл). Органический слой отделяли, промывали водой до pH 7), промывали насыщенным раствором NaCl, сушили, фильтровали и растворитель упаривали. Полученный остаток очищали с помощью колоночной хроматографии на силикагеле (элюент: гексан/этилацетат 1/2). Чистые фракции собирали и растворитель упаривали. Оставшуюся фракцию (6,62 г, 90%) сушили в вакууме при температуре 60C в течение выходных, получая промежуточное соединение (10). промежуточного соединения (11). 4-Метилбензолсульфонил хлорид (0,024 моль) добавляли по частям к раствору промежуточного со- 14016311 единения (10) (0,00782 моль) в пиперидине (75 мл) в токе азота. Смесь перемешивали при комнатной температуре в течение 16 ч. Растворитель упаривали. Остаток растворяли в DCM (300 мл) и промывали водой и насыщенным солевым раствором. Органический слой отделяли, промывали HCl (0,1 М), промывали водой (до pH 7), промывали насыщенным раствором NaCl, сушили и растворитель упаривали. Остаток растворяли в толуоле. Растворитель упаривали дважды и полученный остаток очищали с помощью колоночной хроматографии на силикагеле (элюент: гексан/этилацетат 2/1). Чистые фракции собирали и растворитель упаривали, получая 3,57 г промежуточного соединения (11). Пример A.6. промежуточного соединения (12). К раствору промежуточного соединения (8) (0,0031 моль) в трихлорметане (20 мл) добавляли тионилхлорид (0,01551 моль). Смесь перемешивали при температуре 80C в течение 4 ч. Растворитель упаривали. Остаток растворяли в DCM (20 мл). Смесь охлаждали до температуры -10C. Добавляли по каплям раствор бензоламина (0,05487 моль) в DCM (20 мл) при температуре -10C в токе азота. Смесь перемешивали при комнатной температуре в течение 15 ч. Осадок отделяли фильтрованием. Фильтрат промывали три раза водой (20 мл), промывали насыщенным раствором NaCl, сушили, фильтровали и растворитель упаривали. Остаток растворяли в 1 М HCl (100 мл). Смесь экстрагировали DCM, промывали несколько раз водой и промывали насыщенным раствором NaCl. Органический слой сушили, фильтровали и растворитель упаривали. Полученную фракцию обрабатывали DIPE. Осадок отделяли фильтрованием и сушили, получая 0,6355 г промежуточного соединения (12). промежуточного соединения (13). Смесь промежуточного соединения (12) (0,00439 моль) в 36%-ном растворе HCl (50 мл) перемешивали и кипятили с обратным холодильником в течение ночи. Осадок отделяли фильтрованием. Остаток перемешивали в DCM (несколько мл) в течение 1 ч. Добавляли гексан и смесь перемешивали. Осадок отделяли фильтрованием и сушили, получая 1,2 г промежуточного соединения (13). Пример A.7. Получение промежуточного соединения (14). Смесь промежуточного соединения (9) (0,00469 моль) в 36%-ном растворе HCl (40 мл) перемешивали и кипятили с обратным холодильником в течение ночи. Растворитель упаривали. Остаток сушили, а затем перемешивали в 1 М NaOH. Смесь экстрагировали дважды DCM (220 мл) и слои разделяли. Водный слой подкисляли с помощью раствора HCl и экстрагировали DCM. Объединенный органический слой промывали насыщенным раствором NaCl, сушили, фильтровали и растворитель упаривали. Остаток сушили в вакууме, получая 1,07 г промежуточного соединения (14). Пример A.8. промежуточного соединения (15). К раствору промежуточного соединения (8) (0,00852 моль) в трихлорметане (50 мл) добавляли тионилхлорид (0,0426 моль). Смесь перемешивали при температуре 80C в течение 4 ч. Растворитель упаривали. Остаток растворяли в сухом DCM (60 мл). Смесь охлаждали до температуры -10C. Добавляли по- 15016311 каплям смесь 1-пропанамина (0,1338 моль) в сухом DCM (50 мл) при температуре -10C в токе азота. Смесь перемешивали в течение ночи, при этом температура поднималась до комнатной температуры, а затем промывали водой, 0,5 М HCl (20 мл) и водой. Органический слой отделяли, промывали насыщенным раствором NaCl, сушили, фильтровали и растворитель упаривали. Полученную таким образом фракцию очищали с помощью колоночной хроматографии на силикагеле (элюент: DCM 100%). Чистые фракции собирали и растворитель упаривали. Остаток суспендировали в DIPE. Осадок отделяли фильтрованием и сушили, получая 2,694 г промежуточного соединения (15). промежуточного соединения (16). Смесь промежуточного соединения (15) (0,00548 моль) в растворе HCl (36%, 50 мл) перемешивали и кипятили с обратным холодильником в течение 3 ч. Добавляли еще раствор HCl (36%, 20 мл). Смесь перемешивали и кипятили с обратным холодильником в течение ночи. Осадок отделяли фильтрованием и сушили, получая 0,516 г промежуточного соединения (16). Пример A.9. промежуточного соединения (17). Реакция в атмосфере азота. Промежуточное соединение (15) (0,00478 моль) растворяли в сухом ТГФ (150 мл) и охлаждали до 0C. При температуре 0C добавляли LiBH4 (2M в ТГФ) (0,028 моль). Смесь перемешивали в течение 15 мин. Добавляли этанол (20 мл), и реакционную смесь перемешивали в течение ночи при комнатной температуре. Добавляли 1 М HCl (100 мл). Добавляли этилацетат (125 мл) и слои разделяли. Органический слой промывали водой, один раз насыщенным солевым раствором, сушили, фильтровали и растворитель упаривали, получая 1,5 г промежуточного соединения (17). промежуточного соединения (18). 4-Метилбензолсульфонил хлорид (0,0418 моль) добавляли по частям к раствору промежуточного соединения (17) (0,00836 моль) в пиперидине (75 мл). Смесь перемешивали при комнатной температуре в течение 20 ч. Растворитель упаривали. Остаток растворяли в DCM (250 мл). Органический слой отделяли, промывали HCl (0,1 М), промывали водой (до pH=7), промывали насыщенным раствором NaCl, сушили, и растворитель упаривали. Остаток растворяли в толуоле (220 мл). Растворитель упаривали, и оставшуюся фракцию очищали с помощью колоночной хроматографии на силикагеле (элюент:гексан/этилацетат 2:1). Чистые фракции собирали и растворитель упаривали. Полученную фракцию суспендировали в DIPE. Осадок отделяли фильтрованием и сушили, получая 3,305 г промежуточного соединения (18). Пример A.10. промежуточного соединения (21) смесь цис/транс. Раствор промежуточного соединения (8) (0,14 моль) в DCM (600 мл) и хлороформе (600 мл) перемешивали при температуре 20C в атмосфере азота, затем в течение 5 мин добавляли тионилхлорид (79 мл), и реакционную смесь перемешивали и кипятили с обратным холодильником в течение 4 мин. Смесь охлаждали до температуры 20C и растворитель упаривали. Остаток растворяли в ТГФ (1000 мл) и раствор охлаждали до температуры -5C в атмосфере азота, затем по каплям добавляли раствор этанамина(1,4 моль, 70%-ный водный раствор) в ТГФ (100 мл), поддерживая температуру ниже 0C. Смесь затем нагревали до температуры 20C и перемешивали в течение 2 ч. Добавляли эфир (1000 мл) и органический слой отделяли, затем промывали водой (3 раза по 400 мл) и насыщенным солевым раствором (400 мл). Смесь сушили и растворитель упаривали, получая промежуточное соединение (21), которое может быть выделено с помощью хроматографии в виде транс-изомера промежуточного соединения (19) и цисизомера промежуточного соединения (20). промежуточного соединения (23) транс. Суспензию промежуточного соединения (21) (0,04 3 моль) в 37%-ном растворе концентрированнойHCl (200 мл) перемешивали и кипятили с обратным холодильником в течение ночи, затем отгоняли раствор HCl ( 100 мл) и остаток разбавляли водой (400 мл). Полученную смесь экстрагировали DCM (2 раза по 200 мл) и объединенные экстракты сушили. Растворитель упаривали и твердый остаток очищали с помощью флеш колоночной хроматографии (элюент: сначала эфир/гексан 1/1, затем эфир/гексан 1/0). Фракции продукта собирали с получением смеси цис/транс-изомеров, которую очищали с помощью флеш колоночной хроматографии (элюент 1: эфир; элюент 2: этилацетат/петролейный эфир 80/20; элюент 3: этилацетат). Желаемые фракции продукта собирали и растворитель упаривали. Остаток промывали эфиром (2 раза по 100 мл), получая твердый остаток (I) и эфирные промывки (II). Остаток (I) (9,8 г) кристаллизовали из этилацетата и образовавшиеся кристаллы собирали, получая остаток (Ia) (4,6 г 'ТРАНС'-изомер, т.пл.: 182-187C). Эфирные промывки (II) очищали с помощью флеш колоночной хроматографии (элюент:DCM/этилацетат 70/30) и затем очищали с помощью флеш колоночной хроматографии (элюент:DCM/этилацетат 80/20). Две фракции продукта собирали и растворитель упаривали. Обе оставшиеся фракции кристаллизовали из этилацетата и собирали. Одну полученную фракцию, 4,9 г остатка (IIa),объединяли с остатком (Ia), получая 9,5 г промежуточного соединения (23) (т.пл.: 182-187C). Другую полученную фракцию, 2: 7 г остатка (IIb) собирали, получая промежуточное соединение (22) (т.пл.: 179182C). Пример A.11. промежуточного соединения (24). Раствор промежуточного соединения (8) (0,15 моль) в 0,15 М растворе NaHCO3 в воде (200 мл) перемешивали и добавляли трикаприлилметиламмоний хлорид (Aliquat 336) (0,15 моль) и 3-бром-1 пропен (0,75 моль) в DCM (200 мл), затем реакционную смесь перемешивали в течение 4 дней при температуре 20C и органический слой отделяли. Водный слой экстрагировали DCM (300 мл) и объединенные органические слои сушили. Растворитель упаривали и остаток перемешивали в гексане (500 мл),затем охлаждали до 0C. Образовавшийся осадок отделяли фильтрованием, промывали гексаном и су- 17016311 шили в течение ночи при температуре 60C, получая 46 г промежуточного соединения (24). промежуточного соединения (26) смесь цис/транс (25:75). Раствор 28%-ной концентрированной HCl (100 мл) и 4-метилбензолсульфоновой кислоты (0,7 г) добавляли к раствору промежуточного соединения (24) (0,13 моль) в муравьиной кислоте (400 мл), затем реакционную смесь перемешивали и кипятили с обратным холодильником в течение 6 ч. Растворитель упаривали и остаток распределяли между DCM (300 мл) и насыщенным водным раствором NaHCO3 (200 мл). DCM-слой отделяли, сушили и растворитель упаривали. Остаток растирали в эфире с получением твердого продукта (I) и маточные слои концентрировали, затем кристаллизовали из смеси этилацетат/гексан с получением твердого продукта (II). Твердые продукты (I) и (II) объединяли и очищали с помощью флеш колоночной хроматографии (элюент: DCM/CH3OH 95/5). Фракции продукта собирали, растворитель упаривали, и остаток растирали в гексане. Вновь выделенный остаток (9,5 г) затем растирали в эфире и отделяли фильтрованием. Одну фракцию твердого продукта собирали, получая 7 г промежуточного соединения (25) ('ТРАНС'-изомер, т.пл.: 138-139C), и собранные маточные слои концентрировали,получая 2 г промежуточного соединения (26) ('ЦИС/ТРАНС'-смесь 25/75). Пример A.12. a) Получение промежуточного соединения (27) цис. Раствор промежуточного соединения (3) (0,0031 моль) и NaHCO3 (0,0031 моль) в воде (10 мл) и смесь трикаприлилметиламмоний хлорида (Aliquat 336) (0,0031 моль) и 3-бром-1-пропена (0,0031 моль) в DCM (10 мл) энергично перемешивали в течение 3 дней. Реакционную смесь экстрагировалиDCM, сушили, концентрировали и очищали с помощью флеш колоночной хроматографии (элюент:CH3OH/CHCl3 10/90). Чистые фракции продукта собирали и растворитель упаривали, получая промежуточное соединение (27). промежуточного соединения (28) цис. Смесь промежуточного соединения (27) (0,0165 моль) в муравьиной кислоте (100 мл) и раствор концентрированной HCl (50 мл) с метансульфоновой кислотой (каталитическое количество) перемешивали и кипятили с обратным холодильником в течение ночи, затем реакционную смесь охлаждали и растворитель упаривали. Остаток растворяли в DCM, промывали насыщенным раствором NaHCO3, сушили и растворитель упаривали, получая 1,81 г промежуточного соединения (28). Пример A.13. промежуточного соединения (29) транс. Раствор промежуточного соединения (19) (0,05 68 моль) в ТГФ (800 мл) охлаждали до температуры 0C в атмосфере азота, затем одной порцией добавляли бромид лития (0,17 моль) и боргидрид натрия(0,17 моль) и реакционную смесь перемешивали в течение 1 ч при температуре 0C. Добавляли этанол(300 мл) и смесь перемешивали в течение ночи при температуре 20C. Добавляли HCl (1 н., 100 мл) и ор- 18016311 ганический слой отделяли, промывали насыщенным солевым раствором и сушили. Растворитель упаривали и полученный остаток растирали в эфире. Твердый остаток затем отделяли фильтрованием и кристаллизовали из эфира, получая 16,3 г промежуточного соединения (29) (т.пл. 122-129C). промежуточного соединения (30) транс. Раствор промежуточного соединения (29) (0,0038 моль) и тозилхлорида (0,019 моль) в пиперидине(35 мл) перемешивали при комнатной температуре (16C) в течение 20 ч, затем реакционную смесь выливали в воду со льдом (100 мл) и смесь перемешивали в течение 1 ч. Водный раствор экстрагировалиDCM (3 раза по 50 мл), затем органические слои объединяли, промывали насыщенным солевым раствором, сушили, и растворитель упаривали, получая 0,9 г промежуточного соединения (30) (т.пл. 130132C). Пример A.14. промежуточного соединения (31) транс. Тионилхлорид (15 мл) добавляли к суспензии промежуточного соединения (2) (0,05 моль) в DCM. Реакционную смесь перемешивали и кипятили с обратным холодильником в течение одного часа. Растворитель упаривали. Добавляли DCM (100 мл). Растворитель упаривали. Остаток растворяли в DCM. Добавляли концентрированный NH4OH/H2O (100 мл) и реакционную смесь перемешивали в течение ночи. Органический слой отделяли, сушили, фильтровали и растворитель упаривали, получая промежуточное соединение (31). промежуточного соединения (32) транс. Смесь промежуточного соединения (31) (0,05 моль) в концентрированной HCl (60 мл) и диоксане(60 мл) перемешивали и кипятили с обратным холодильником в течение 2 ч. Смесь охлаждали до комнатной температуры. Добавляли воду (200 мл) и перемешивание продолжали в течение одного часа. Осадок отделяли фильтрованием, промывали водой и 2-пропанолом, затем сушили, получая 13,1 г промежуточного соединения (32). Пример A.15.(400 мл). Органический раствор промывали водой, 1 н. HCl (300 мл), водным раствором NaHCO3 (300 мл), насыщенным солевым раствором (300 мл), затем сушили, фильтровали и растворитель упаривали. Остаток очищали с помощью колоночной хроматографии на силикагеле (элюент: гексан/этилацетат 2/1). Фракции продукта собирали и растворитель упаривали, получая 5,16 г промежуточного соединения (33).- 19016311 Раствор промежуточного соединения (33) (4,5 г, 0,0087 моль) и трифенилфосфина (2,28 г, 0,0087 моль) в сухом ацетонитриле (60 мл) перемешивали при комнатной температуре в атмосфере азота. Добавляли пирролидин (0,75 мл) и тетракис(трифенилфосфин)палладий (0,5 г, 5 моль%) и реакционную смесь перемешивали в течение 18 ч при комнатной температуре. Добавляли этилацетат (80 мл) и смесь экстрагировали насыщенным водным раствором NaHCO3 (4100 мл). Объединенные основные экстракты подкисляли с помощью 1 н. HCl, затем экстрагировали DCM (3150 мл). Объединенные органические слои сушили, фильтровали и растворитель упаривали, получая 2,82 г промежуточного соединения (34). промежуточного соединения (35) транс. Смесь промежуточного соединения (34) (0,001 моль), карбоната калия (0,003 моль) и йодметана (0,0 65 мл) в ДМФ (6 мл) перемешивали в течение 92 ч при комнатной температуре. Затем реакционную смесь выливали в воду (15 мл) и полученные твердые продукты удаляли фильтрованием, которые очищали с помощью флеш хроматографии Biotage (элюент 1: DCM; элюент 2: гексан/этилацетат 4/13/12/11/11/2). Чистые фракции собирали и растворитель упаривали. Остаток перемешивали в течение ночи в гексане, получая промежуточное соединение (35) (т.пл. 190-191C; транс). Пример A.16.(0,2 моль) и смесь перемешивали. Добавляли несколько капель ДМФ и реакционную смесь перемешивали и кипятили с обратным холодильником в течение одного часа. Растворитель упаривали. ДобавлялиDCM, затем вновь упаривали. Остаток растворяли в DCM, перемешивали и добавляли концентрированный NH4OH/вода 1/1 (50 мл; 1/1). Реакционную смесь перемешивали в течение 2 ч. Слои разделяли. Органический слой сушили, фильтровали и растворитель упаривали, получая 16 г промежуточного соединения (36). промежуточного соединения (37) цис. Смесь промежуточного соединения (36) (0,05 моль) в концентрированной HCl (60 мл) и диоксане промежуточного соединения (38) транс. Промежуточное соединение (6) (0,154 моль) перемешивали в DCM (200 мл) и добавляли ДМФ (5 капель), затем тионилхлорид (37 мл). Смесь перемешивали и кипятили с обратным холодильником в течение 1 ч и затем растворитель упаривали. Добавляли свежеперегнанный DCM (100 мл) и растворитель упаривали два раза, получая промежуточное соединение (38). Пример A.18.- 20016311 промежуточного соединения (41). Сначала 2-метокси-3-пиперидинкарбоновую кислоту преобразовывали в ее хлорангидрид путем кипячения с обратным холодильником карбоновой кислоты в DCM (100 мл, чистый для анализа) и тионилхлорида (7 мл). Растворитель упаривали. К смеси данного остатка (0,02 4 моль) в водном насыщенном растворе NaHCO3 (75 мл) добавляли смесь 1-(фенилметил)-4-пиперидинамина (0,024 моль) в DCM(150 мл). Реакционную смесь перемешивали в течение 2 ч. Слои разделяли. Отделенный органический слой сушили (MgSO4), фильтровали и растворитель упаривали. Остаток очищали с помощью колоночной хроматографии (CH3OH/CH2Cl2 1/99). Желаемые фракции собирали и растворитель упаривали. Остаток растирали в диизопропиловом эфире, получая 7,38 г промежуточного соединения (41). промежуточного соединения (42). Смесь промежуточного соединения (41) (7 г, 0,021 моль) в метаноле (50 мл) гидрировали при комнатной температуре на 10%-ном палладии-на-угле (1 г) в качестве катализатора. После воздействия водорода (1 эквивалент) катализатор отделяли фильтрованием и фильтрат упаривали. Добавляли небольшое количество HCl в 2-пропаноле, что приводило к образованию белого твердого продукта и получению таким образом 4,08 г промежуточного соединения (42). Пример A.19.(160 мл) перемешивали на ледяной бане. Добавляли по каплям раствор 2-метокси-5-хлорбензоилхлорида(0,072 моль) в толуоле (40 мл). Реакционную смесь перемешивали в течение ночи и добавляли воду. Органический слой отделяли, промывали дважды водой, сушили и упаривали. Твердый остаток кристаллизовали из DIPE, получая 16,2 г промежуточного соединения (43) (т.пл. 113,2C). промежуточного соединения (44). HCl (1:1). Смесь промежуточного соединения (43) (0,044 моль), гидроксида калия (12 г), изопропанола (150 мл) и воды (1 мл) перемешивали и кипятили с обратным холодильником в течение 3 ч. Реакционную смесь упаривали и остаток растворяли в смеси воды и хлороформа. Органический слой отделяли, промывали дважды водой, сушили и упаривали. Остаток растворяли в метилизобутилкетоне и подкисляли путем добавления изопропанола, насыщенного HCl. Образовавшийся осадок отделяли фильтрованием и сушили, получая 9,1 г промежуточного соединения (44). Промежуточное соединение (45) получали аналогичным образом, но исходя из этилового эфира цис-4-амино-3-метоксипиперидин-1-карбоновой кислоты и 2-метоксибензойной кислоты. Получение промежуточного соединения (46). 6-Амино-н-гексановую кислоту (0,01 моль) растворяли в пропаноле (30 мл) и добавляли серную кислоту (1 мл) и реакционную смесь кипятили с обратным холодильником в течение 48 ч. Растворитель упаривали, получая 2,1 г промежуточного соединения (46). Пример A.21. промежуточного соединения (47). Смесь (S)-2-аминопентандиовой кислоты (0,0068 моль) и серной кислоты (0,00816 моль) в пропаноле (40 мл) кипятили с обратным холодильником в течение 48 ч. Растворитель упаривали и остаток сушили, получая промежуточное соединение (47). Пример A.22. Получение промежуточного соединения (48). Серную кислоту (0,00816 моль) добавляли к раствору (S)-2-аминопентандиовой кислоты (0,0136 моль) в изопропаноле (40 мл) и кипятили с обратным холодильником в течение 48 ч. Растворитель упаривали, получая промежуточное соединение (48). Пример A. 23. Получение промежуточного соединения (49). Серную кислоту (0,012 моль) добавляли к раствору 4-аминобутановой кислоты (0,01 моль) в изопропаноле (30 мл) и кипятили с обратным холодильником в течение 48 ч. Растворитель упаривали, получая промежуточное соединение (49). Пример A.24.N6-[(1,1-диметилэтокси)карбонил]-N2-[(9H-флуорен-9-илметокси)карбонил]-L-лизин (5 г) растворяли в метаноле (100 мл, сухой) и затем добавляли карбонат цезия (17 г, 0,5 эквивалент). Раствор перемешивали в течение 10 мин. Растворитель упаривали и остаток упаривали вместе с толуолом. Остаток растворяли в ацетонитриле (30 мл, сухой) и добавляли по частям 1-йодпропан (18 г, 10 эквивалентов). Реакционную смесь перемешивали. Растворитель упаривали при пониженном давлении, поддерживая температуру как можно более низкой. Остаток обрабатывали водой и экстрагировали эфиром. Органические слои разделяли и растворитель упаривали. Остаток очищали с помощью колоночной хроматографии(элюент: этилацетат/гексан 1/4). Желаемые фракции собирали и растворитель упаривали. Остаток перемешивали в воде и отделяли фильтрованием, получая 2 г промежуточного соединения (50). Промежуточного соединения (51). Промежуточное соединение (50) (4 г, 0,0078 моль) растворяли в DCM (30 мл) и добавляли ТФУ (10 мл). Реакционную смесь перемешивали при комнатной температуре до тех пор, пока данные ТСХ не свидетельствовали об окончании реакции. Растворитель упаривали при пониженном давлении, поддерживая температуру как можно более низкой, получая промежуточное соединение (51).- 22016311 промежуточного соединения (52). Промежуточное соединение (51) (0,0078 моль) растворяли в DCM (200 мл). Добавляли насыщенный водный раствор NaHCO3 (200 мл) и реакционную смесь перемешивали в течение 20 мин в атмосфере азота. Затем по частям добавляли 1-метилэтиловый эфир хлоркарбоновой кислоты (11,4 мл). Реакционную смесь перемешивали и слои разделяли. Отделенный органический слой промывали водой, сушили, и растворитель упаривали, получая 3,5 г промежуточного соединения (52). промежуточного соединения (53). Промежуточное соединение (52) (3,5 г, 0,007 моль) растворяли в ацетонитриле (40 мл) и затем добавляли пиперидин (10 мл). Реакционную смесь перемешивали в течение 10 мин. Растворитель упаривали досуха. Остаток сырого продукта использовали как таковой в следующей реакции, получая промежуточное соединение (53). Пример A.25. промежуточного соединения (54). Тионилхлорид (0,0965 моль) добавляли по каплям к раствору 2-(4-морфолинил)-бензойной кислоты(0,029 моль) в DCM (150 мл). Затем добавляли несколько капель ДМФ и реакционную смесь кипятили с обратным холодильником в течение 2 ч. Растворитель упаривали, добавляли немного DCM и растворитель вновь упаривали. Вновь добавляли немного DCM. В реакционную смесь добавляли 1-(фенилметил)4-пиперидинамин (0,029 моль). Затем добавляли в реакционную смесь насыщенный водный растворNaHCO3 (75 мл) и перемешивали в течение 2 ч. Отделенный органический слой сушили, фильтровали и растворитель упаривали. Остаток растирали в DIPE. Осадок отделяли фильтрованием и сушили, получая 10,06 г промежуточного соединения (54). промежуточного соединения (55). Смесь промежуточного соединения (54) (0,026 моль) в DCM (150 мл) и ТГФ (10 мл) гидрировали на 10%-ном палладии-на-угле (2 г) в качестве катализатора. Катализатор отделяли фильтрованием. Затем к фильтрату добавляли еще немного 10%-ного палладия-на-угле (2 г). Эту смесь опять гидрировали водородом (1 эквивалент для завершения процесса). Катализатор отделяли фильтрованием и растворитель упаривали, получая 5,3 г промежуточного соединения (55). Пример A.26. промежуточного соединения (57). Промежуточное соединение (2) очищали с помощью сверхкритической флюидной хроматографии на колонке AD-H (20250 мм) со скоростью потока 50 мл/мин (элюент:CO2/(метанол с 0,1% 2-пропанола) 85/15). Температура колонки была установлена 40C, и давление на входе было 100 бар. Две различные- 23016311 фракции продукта собирали и растворитель упаривали, получая промежуточное соединение (56) и промежуточное соединение (57) OR: -7,46 (с = 0,7502 масс./об.%, MeOH, 20C, 365 нм). промежуточного соединения (58). Промежуточное соединение (57) (0,000308 моль, 0,1 г) растворяли в DCM (3 мл). Добавляли тионилхлорид (0,045 мл) и ДМФ (одна капля) и смесь кипятили с обратным холодильником. Реакционную смесь концентрировали и опять добавляли DCM (3 мл). Растворитель упаривали. Остаток медленно добавляли в этанол (6 мл) и охлаждали до температуры 0C на ледяной бане. Ледяную баню отставляли и реакционной смеси давали достичь комнатной температуры. Реакционную смесь перемешивали при комнатной температуре в течение 4 ч. Растворитель упаривали. Остаток растворяли в DCM и промывали насыщенным водным раствором NaHCO3. Затем очищали с помощью колоночной хроматографии (от 100% CH2Cl2 до 2% MeOH/CH2Cl2). Одну фракцию продукта собирали и растворитель упаривали, получая промежуточное соединение (58).(0,050 г), муравьиной кислоте (25 мл) и концентрированной соляной кислоте (6 мл). Реакционную смесь кипятили с обратным холодильником. Реакционную смесь концентрировали в вакууме. Остаток затем растворяли в DCM, промывали насыщенным водным раствором NaHCO3, сушили и растворитель упаривали. Остаток очищали с помощью колоночной хроматографии (этилацетат/гексан 1/9). Фракции продукта собирали и растворитель упаривали, получая 0,74 г промежуточного соединения (59) и 0,75 г промежуточного соединения (60). Пример A.27. промежуточного соединения (61). 2-(4-Метил-1-пиперазинил)бензойную кислоту (6,33 г, 0,0287 моль) растворяли в DCM (150 мл) и добавляли ДМФ (1 капля). Затем добавляли тионилхлорид (8,34 мл, 0,1148 моль, 4 эквивалента) и смесь кипятили с обратным холодильником в течение 2 ч и 30 мин. Растворитель упаривали и опять добавлялиDCM (150 мл). Растворитель упаривали и добавляли DCM (150 мл) в три захода. Затем добавляли 1(фенилметил)-4-пиперидинамин (5,46 г, 0,0287 моль) и насыщенный водный раствор NaHCO3 (75 мл) и двухслойную систему перемешивали при комнатной температуре. Слои разделяли. Отделенный органический слой сушили (MgSO4), фильтровали и растворитель упаривали. Остаток очищали с помощью колоночной хроматографии (элюент: CH3OH/CH2Cl2 1/9). Желаемые фракции собирали и растворитель упаривали. Остаток кристаллизовали из DCM и изопропилового эфира, получая 10,03 г промежуточного соединения (61).- 24016311 Смесь промежуточного соединения (61) (7 г, 0,017 моль) в метаноле (100 мл) гидрировали на 10%ном палладии-на-угле (2 г) в качестве катализатора. После завершения воздействия водорода (1 эквивалент) катализатор отделяли фильтрованием и фильтрат упаривали, получая промежуточное соединение промежуточного соединения (64). Промежуточное соединение (25) очищали с помощью сверхкритической флюидной хроматографии на колонке AD-H (20250 мм) со скоростью потока 50 мл/мин (элюент: CO2/CH3OH с 0,1% 2 пропанолом) 85/15). Температура колонки была установлена 40C, и давление на входе было 100 бар. Две различные фракции продукта собирали и растворитель упаривали, получая 7,23 г промежуточного соединения (63) (1R, 4S) и 7,55 г промежуточного соединения (64) (1S, 4R). Пример A.29. промежуточного соединения (65). 2-Метоксибензойную кислоту (10,655 г, 0,0699 моль) растворяли в DCM (100 мл). Добавляли тионилхлорид (10,09 мл, 0,1398 моль, 2 эквивалента) и ДМФ (1 капля) и смесь кипятили с обратным холодильником в течение 2 ч. Растворитель упаривали и опять добавляли DCM (100 мл). Растворитель упаривали и опять DCM (100 мл) добавляли. Затем добавляли 1-бензил-4-(метиламино)пиперидин (14,2 г,0,0699 моль) и насыщенный водный раствор NaHCO3 (50 мл). Двухслойную систему перемешивали и слои разделяли. Отделенный органический слой сушили (MgSO4), фильтровали и растворитель упаривали, получая 22,8 3 г промежуточного соединения (65). промежуточного соединения (66). Смесь промежуточного соединения (65) (0,0 67 моль) в метаноле (250 мл) гидрировали при температуре 50C на 10%-ном палладии-на-угле (2 г) в качестве катализатора. После завершения воздействия водорода (1686 мл), катализатор отделяли фильтрованием и фильтрат упаривали, получая 16 г промежуточного соединения (66). Пример A.30. промежуточного соединения (67). Триметилсилил цианид (48 мл, 0,36 моль) и йодид цинка (0,114 г, 0,00036 моль) добавляли к 3 ацетил-1-фторбензолу (44,6 мл, 0,36 моль). Реакционную смесь медленно нагревали до 50C (температура повышалась на 10C каждые 15 мин). Смесь перемешивали в течение 3 ч при температуре 50C и затем в течение 20 ч при комнатной температуре. Растворитель упаривали и упаривали вместе с толуолом,получая промежуточное соединение (67).- 25016311 промежуточного соединения (68). Метанол (400 мл) охлаждали до температуры 0C и растворитель насыщали газообразным HCl. Добавляли охлажденное промежуточное соединение (67) (85,4 г, 0,36 моль) и реакционную смесь перемешивали при комнатной температуре в течение 30 мин. Затем смесь нагревали в течение ночи при температуре 60C. Добавляли раствор NaHCO3 до установления pH 7 и смесь экстрагировали дважды с помощью DCM. Отделенный органический слой сушили (MgSO4), фильтровали и растворитель упаривали. Остаток очищали с помощью колоночной хроматографии (CH2Cl2). Желаемые фракции собирали и растворитель упаривали, получая 55,3 г промежуточного соединения (68). промежуточного соединения (69). Промежуточное соединение (68) (5,8 г, 0,02 г) растворяли в метансульфоновой кислоте (36 мл) и раствор нагревали до 80C и перемешивали в течение ночи. Затем смесь гасили водой и добавляли этилацетат. Отделенный органический слой сушили (MgSO4), фильтровали и растворитель упаривали. Остаток очищали с помощью колоночной хроматографии (CH2Cl2). Собирали две различные фракции продукта и растворитель упаривали. Первую фракцию идентифицировали как метиловый эфир 3-фтор-метилен-бензолуксусной кислоты. Вторую фракцию растворяли в этилацетате и раствор промывали раствором NaOH и затем раствором серной кислоты. Органический слой сушили (MgSO4), фильтровали и растворитель упаривали, получая 1,2 г промежуточного соединения (69). промежуточного соединения (71). Промежуточное соединение (69) (10 г, 0,06 моль) растворяли в 50% водном растворе H2SO4 (80 мл) и раствор нагревали в течение ночи при 100C. Осадок отделяли фильтрованием и промывали DCM. Смесь опять оставляли взаимодействовать в течение ночи и опять осадок отделяли фильтрованием, промывали DCM и очищали с помощью жидкостной хроматографии высокого разрешения с обращенной фазой (Shandon Hyperprep C18 BDS (Base Deactivated Silica) 8 мкм, 250 г, I.D. 5 см). Применяли градиент с буферным раствором и органическими растворителями. Две различные фракции продукта собирали и растворитель упаривали. Каждый остаток растворяли в небольшом количестве метанола. Затем добавляли DCM, и раствор промывали HCl (1 н.). Растворитель в обеих фракциях упаривали, получая 1,8 г промежуточного соединения (70) и 2,67 г промежуточного соединения (71). промежуточного соединения (72). Промежуточное соединение (70) (0,2 г, 0,000602 моль) растворяли в DCM (6 мл) и затем добавляли тионилхлорид (10 г, 0,0015 моль, 2,5 эквивалента). Реакционную смесь кипятили с обратным холодильником в течение 2 ч. Смесь охлаждали до комнатной температуры и добавляли сухой этанол (2 мл). Смесь перемешивали в течение 2 ч. Растворитель упаривали. Остаток очищали с помощью колоночной хроматографии. Желаемые фракции собирали и растворитель упаривали, получая промежуточное соединение (72).- 26016311 промежуточного соединения (73). Промежуточное соединение (72) растворяли в смеси муравьиной кислоты (2 мл) и концентрированной HCl (2 мл). Смесь нагревали в течение 3 ч. Смесь очищали с помощью колоночной хроматографии(CH3OH/CH2Cl2 1/9). Желаемые фракции собирали и растворитель упаривали, получая промежуточное соединение (73). Пример A.31. промежуточного соединения (74). Смесь 1-(фенилметил)-4-пиперидинамина (7 г, 0,037 моль) в DCM (100 мл) добавляли к смеси 2 метоксибензоил хлорида (6,4 г, 0,037 моль) в DCM (100 мл). Затем добавляли раствор гидрокарбоната натрия (100 мл) и смесь перемешивали в течение 2 ч при комнатной температуре. Слои разделяли. Отделенный органический слой сушили и растворитель упаривали. Остаток растирали в DIPE, отделяли фильтрованием и сушили, получая 10,6 г промежуточного соединения (74). промежуточного соединения (75). Смесь промежуточного соединения (74) (10,7 г, 0,033 моль) в метаноле (150 мл) гидрировали на 10%-ном палладии-на-угле (1 г) в качестве катализатора. После завершения воздействия водорода (1 эквивалент), катализатор отделяли фильтрованием и фильтрат упаривали. Остаток растворяли в 2 пропаноле и раствор подкисляли с помощью раствора хлористоводородной кислоты в 2-пропаноле. Продукт кристаллизовали из этого раствора. Осадок отделяли фильтрованием и сушили, получая 8,3 г промежуточного соединения (75). Пример A.32. промежуточного соединения (76). 2-Бром-1-(2-метоксифенил)этанон (0,1 г, 0,000436 моль) растворяли в сухом DCM (4 мл) и добавляли 1-(фенилметил)пиперазин (0,077 г) и триэтиламин (0,061 мл, 1,2 эквивалента). Смесь перемешивали в течение 2 ч при комнатной температуре. Затем смесь промывали водой и водный слой экстрагировалиDCM, получая промежуточное соединение (76). промежуточного соединения (77). Смесь промежуточного соединения (76) (0,00308 моль) в метаноле (100 мл) гидрировали на 10%ном палладии-на-угле (0,050 г) в качестве катализатора в присутствии 2-пропанола, насыщенного HCl (5 мл). После завершения реакции катализатор отделяли фильтрованием и фильтрат упаривали, получая 0,46 г промежуточного соединения (77). Пример A.33DCM (10 мл) и добавляли тионилхлорид (12,7 г) и каплю ДМФ. Реакционную смесь перемешивали и(10 мл) и упаривали. Добавляли еще DCM (10 мл), затем упаривали. Добавляли 1-(фенилметил)-4 пиперидинамин (10,20 г) и насыщенным водный раствор NaHCO3 (5 мл) и реакционную смесь перемешивали при комнатной температуре до завершения реакции. Еще несколько раз добавляли DCM и насыщенный водный раствор NaHCO3 и органический слой отделяли, сушили (MgSO4), фильтровали и растворитель упаривали, получая 4,24 г промежуточного соединения (84). промежуточного соединения (85). Смесь промежуточного соединения (84) (4,24 г, 0,0107 моль) в метаноле гидрировали на палладиина-активированном угле (2 г) в качестве катализатора. После завершения воздействия водорода (1 эквивалент), катализатор отделяли фильтрованием через целит и фильтрат упаривали, получая промежуточное соединение (85). Пример A.34. промежуточного соединения (87). Промежуточное соединение (71) (0,2 г, 0,00052 моль) растворяли в этаноле (5 мл) и добавляли серную кислоту (0,5 мл). Реакционную смесь предварительно перемешивали в течение 10 с в микроволновой печи и затем нагревали в течение 2 ч при температуре 100C и затем в течение 2 ч при температуре 140C. Растворитель упаривали, получая промежуточное соединение (87). промежуточного соединения (88). Промежуточное соединение (87) (0,00052 моль) растворяли в муравьиной кислоте (2 мл), добавляли концентрированную соляную кислоту (1 мл) и п-толуолсульфоновую кислоту (каталитическое количество). Раствор нагревали в течение 3 ч. Затем растворитель упаривали и остаток очищали с помощью жидкостной хроматографии высокого разрешения с обращенной фазой (Shandon Hyperprep C18 BDS (BaseDeactivated Silica) 8 мкм, 250 г, I.D. 5 см). Применяли градиент с буферным раствором и органическими растворителями. Желаемые фракции собирали и обрабатывали, получая промежуточное соединение (88). Пример A.35. промежуточного соединения (89). Триметилсилил цианид (0,05 моль) и йодид цинка (50 мг) добавляли к 1-ацетил-4-бромбензолу (5 г,0,05 моль). Эту смесь перемешивали в течение 5,5 ч при температуре 50C и затем в течение 12 ч при комнатной температуре. Осадок отделяли фильтрованием, промывали толуолом и фильтрат упаривали,получая 15 г промежуточного соединения (89). промежуточного соединения (90). Промежуточное соединение (89) (0,05 моль) добавляли к охлажденному раствору метанола, насыщенному хлористоводородной кислотой (150 мл). Смесь перемешивали и кипятили с обратным холо- 28016311 дильником в течение 20 ч, нейтрализовали насыщенным раствором NaHCO3 (220 мл) и экстрагировали три раза с помощью DCM (100 мл). Объединенный органический слой промывали насыщенным раствор промежуточного соединения (91). Раствор промежуточного соединения (90) (0,05 моль) в серной кислоте (50%) (300 мл) перемешивали при температуре 100C в течение 20 ч. Осадок отделяли фильтрованием и растворяли в DCM и 2 пропаноне. Смесь разделяли на слои. Водный слой экстрагировали DCM (200 мл). Объединенный органический слой сушили (MgSO4), фильтровали и растворитель упаривали. Остаток растворяли в DCM. Добавляли гексан. Осадок отделяли фильтрованием и сушили, получая 4 г остатка. Остаток растирали в 2-пропаноне. Осадок отделяли фильтрованием и сушили. Остаток растирали в диэтиловом эфире. Осадок отделяли фильтрованием и сушили, получая 1 г промежуточного соединения (91). промежуточного соединения (92). Промежуточное соединение (94) (0,1 г, 0,0002 моль) растворяли в ацетонитриле (2 мл) и добавляли промежуточное соединение (91) (0,09 г, 0,0002 моль) и триэтиламин (0,033 мл). Смесь перемешивали в течение 6 дней. Остаток очищали с помощью жидкостной хроматографии высокого разрешения с обращенной фазой (Shandon Hyperprep C18 BDS (Base Deactivated Silica) 8 мкм, 250 г, I.D. 5 см). Применяли градиент с двумя или тремя подвижными фазами (фаза A: 0,25%-ный раствор в воде NH4HCO3; фаза B:CH3OH (оптический); фаза C: CH3CN). Желаемые фракции собирали и растворитель упаривали, получая 0,031 г промежуточного соединения (92). Пример A.36. Получение промежуточного соединения (93). Промежуточное соединение (42) (0,0043 моль) растворяли в 2-пропаноле (10 мл). Добавляли гидроксид калия (2,38 г) и реакционную смесь кипятили с обратным холодильником в течение 24 ч. Реакционную смесь охлаждали до комнатной температуры. Избыток растворителя удаляли в вакууме. Реакционную смесь экстрагировали водой и этилацетатом. Органический слой сушили и растворитель упаривали,получая промежуточное соединение (93). Пример A.37. Получение промежуточного соединения (94). 2-Метокси-N-4-пиперидинилбензамид моногидрохлорид (0,1 г, 0,000426 моль) растворяли в DCM. Сначала добавляли 1,1'-карбонилбисимидазол (0,083 г, 1,2 эквивалента) и затем триэтиламин (0,120 мл) и реакционную смесь перемешивали в течение ночи. Затем смесь промывали водой, фильтровали через изолют (Isolute) и растворитель упаривали. Остаток растворяли в ацетонитриле. Добавляли йодметан и смесь встряхивали. Затем растворитель и избыток йодметана упаривали в вакууме, получая 0,127 г промежуточного соединения (94). Другие промежуточные соединения, которые были использованы при получении целевых соединений, являются известными соединениями, такие как 4-(фенилкарбоксамидо)пиперидин, 4-(2-метокси- 29
МПК / Метки
МПК: C07D 241/20, C07D 295/10, C07D 211/58, C07D 401/12
Метки: пиперазинзамещенной, ингибирующие, пиперидин, 1-карбоновой, производные, тетрагидронафталин, кислоты, мтр
Код ссылки
<a href="https://eas.patents.su/30-16311-proizvodnye-piperidin-ili-piperazinzameshhennojj-tetragidronaftalin-1-karbonovojj-kisloty-ingibiruyushhie-mtr.html" rel="bookmark" title="База патентов Евразийского Союза">Производные пиперидин- или пиперазинзамещенной тетрагидронафталин 1-карбоновой кислоты, ингибирующие мтр</a>
Предыдущий патент: Предварительная композиция серного цемента, способ ее приготовления, ее применение, серно-цементный продукт и способ его получения
Следующий патент: Ингибиторы mapk/erk-киназ
Случайный патент: Способ определения стволовых клеток рака молочной железы и применение антагонистов cxcr1 для лечения рака












