8-замещенные пиридо[2,3-в]пиразины и их применение
Номер патента: 19974
Опубликовано: 30.07.2014
Авторы: Менард Дельфин, Никулеску-Дувас Дэн, Спрингер Кэролайн Джой, Замбон Альфонсо, Сейкербейк Бартоломеус Маринус Йозефус Мария, Мараис Ричард, Никулеску-Дувас Йон, Нурри Арнауд
Формула / Реферат
1. Соединение, выбранное из соединений следующей формулы и его фармацевтически приемлемых солей:
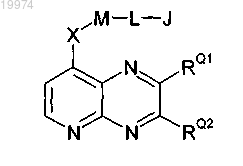
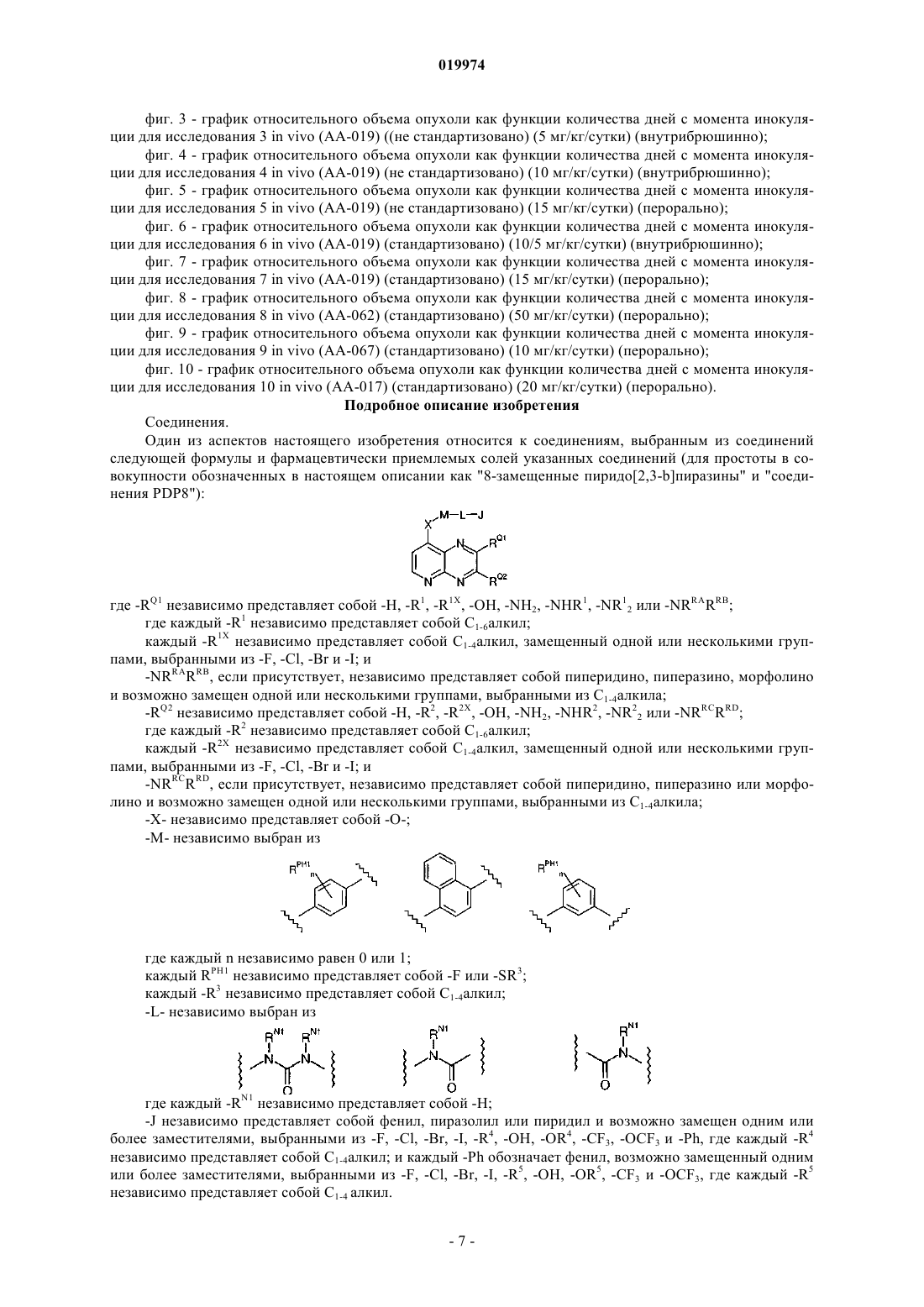
где -RQ1 независимо представляет собой -Н, -R1, -R1X, -ОН, -NH2, -NHR1, -NR12 или -NRRARRB;
где каждый -R1 независимо представляет собой C1-6алкил;
каждый -R1X независимо представляет собой C1-4алкил, замещенный от одной до трех группами, выбранными из -F, -Cl, -Br и -I;
-NRRARRB, если присутствует, независимо представляет собой пиперидино, пиперазино или морфолино и возможно замещен одной группой, представляющей собой C1-4алкил;
-RQ2 независимо представляет собой -Н, -R2, -R2X, -ОН, -NH2, -NHR2, -NR22 или -NRRCRRD;
где каждый -R2 независимо представляет собой C1-6алкил;
каждый -R2X независимо представляет собой C1-4алкил, замещенный от одной до трех группами, выбранными из -F, -Cl, -Br и -I;
-NRRCRRD, если присутствует, независимо представляет собой пиперидино, пиперазино или морфолино и возможно замещен одной группой, представляющей собой C1-4алкил;
-Х- независимо представляет собой -О-;
-M- независимо выбран из
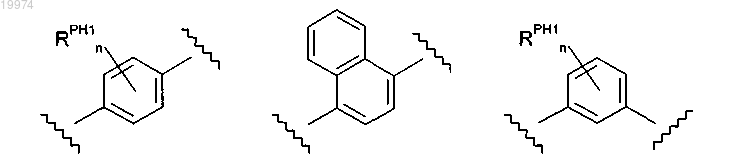
где каждый n независимо равен 0 или 1;
каждый RPH1 независимо представляет собой -F или -SR3;
где каждый -R3 независимо представляет собой C1-4алкил;
-L- независимо выбран из
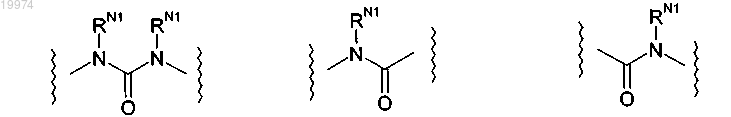
где каждый -RN1 независимо представляет собой -Н;
-J независимо представляет собой фенил, пиразолил или пиридил и возможно замещен одним или двумя заместителями, выбранными из -F, -Cl, -Br, -I, -R4, -ОН, -OR4, -CF3, -OCF3 и -Ph, где каждый -R4 независимо представляет собой C1-4алкил и каждый -Ph обозначает фенил, возможно замещенный одним заместителем, выбранным из -F, -Cl, -Br, -I, -R5, -ОН, -OR5, -CF3 и -OCF3, где каждый -R5 независимо представляет собой С1-4алкил.
2. Соединение по п.1, отличающееся тем, что
-RQ1 независимо представляет собой -Н, -ОН, -Me, -CF3, -CH2Br, -NH2, -NHMe, -NMe2, морфолино, пиперазино или N-метилпиперазино;
-RQ2 независимо представляет собой -Н, -ОН, -Me, -CF3, -CH2Br, -NH2, -NHMe, -NMe2, морфолино, пиперазино или N-метилпиперазино.
3. Соединение по п.1, отличающееся тем, что или
-RQ1 независимо представляет собой -Н, -ОН, -Me, -CF3, -CH2Br, -NH2, -NHMe, -NMe2, морфолино, пиперазино или N-метилпиперазино и
-RQ2 независимо представляет собой -ОН, -Me, -CF3, -CH2Br, -NH2, -NHMe, -NMe2, морфолино, пиперазино или N-метилпиперазино; или
-RQ1 независимо представляет собой -ОН, -Me, -CF3, -CH2Br, -NH2, -NHMe, -NMe2, морфолино, пиперазино или N-метилпиперазино и
-RQ2 независимо представляет собой -Н, -ОН, -Me, -CF3, -CH2Br, -NH2, -NHMe, -NMe2, морфолино, пиперазино или N-метилпиперазино.
4. Соединение по п.1, отличающееся тем, что или
-RQ1 представляет собой -ОН и
-RQ2 независимо представляет собой -Н, -Me, -NH2, -NHMe, морфолино, пиперазино или N-метилпиперазино, или
-RQ1 независимо представляет собой -Н, -Me, -NH2, -NHMe, морфолино, пиперазино или N-метилпиперазино и
-RQ2 представляет собой -ОН.
5. Соединение по п.1, отличающееся тем, что или
-RQ1 представляет собой -Me или -NH2 и
-RQ2 представляет собой -ОН; или
-RQ1 представляет собой -ОН и
-RQ2 представляет собой -Me или -NH2.
6. Соединение по п.1, отличающееся тем, что
-RQ1 представляет собой -ОН и
-RQ2 представляет собой -Н.
7. Соединение по п.1, отличающееся тем, что
-RQ1 представляет собой -Н и
-RQ2 представляет собой -ОН.
8. Соединение по п.1, отличающееся тем, что
-RQ1 представляет собой -ОН и
-RQ2 представляет собой -ОН.
9. Соединение по п.1, отличающееся тем, что или
-RQ1 независимо представляет собой -Н, -Me, -NH2, -NHMe, морфолино, пиперазино или N-метилпиперазино и
-RQ2 независимо представляет собой -Me, -NH2, -NHMe, морфолино, пиперазино или N-метилпиперазино; или
-RQ1 независимо представляет собой -Me, -NH2, -NHMe, морфолино, пиперазино или N-метилпиперазино и
-RQ2 независимо представляет собой -Н, -Me, -NH2, -NHMe, морфолино, пиперазино или N-метилпиперазино.
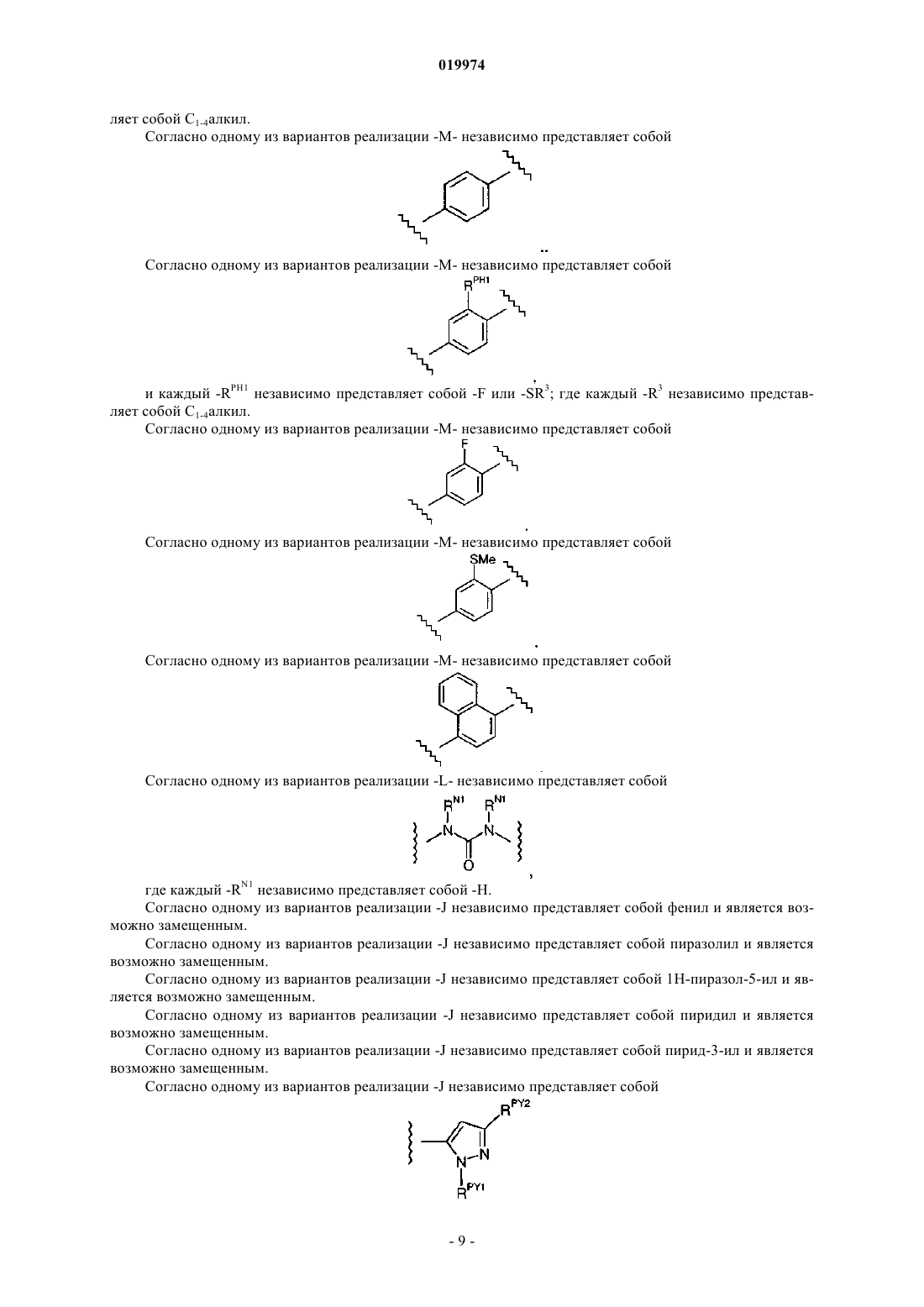
10. Соединение по любому из пп.1-9, отличающееся тем, что -M- независимо представляет собой
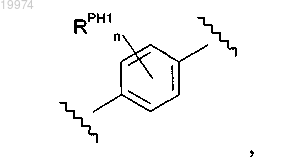
и каждый -RPH1 независимо представляет собой -F или -SR3; где каждый -R3 независимо представляет собой C1-4алкил.
11. Соединение по любому из пп.1-9, отличающееся тем, что -M- независимо представляет собой
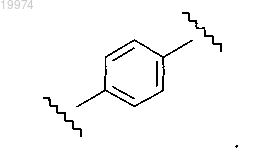
12. Соединение по любому из пп.1-9, отличающееся тем, что -M- независимо представляет собой
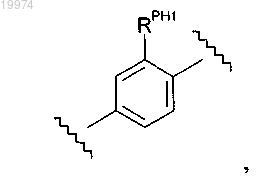
и каждый -RPH1 независимо представляет собой -F или -SR3; где каждый -R3 независимо представляет собой C1-4алкил.
13. Соединение по любому из пп.1-9, отличающееся тем, что -M- независимо представляет собой
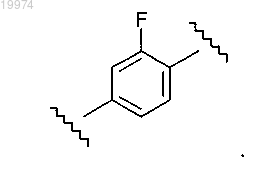
14. Соединение по любому из пп.1-9, отличающееся тем, что -M- независимо представляет собой
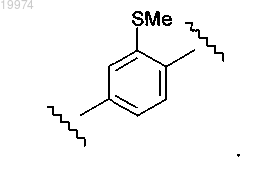
15. Соединение по любому из пп.1-9, отличающееся тем, что -M- независимо представляет собой
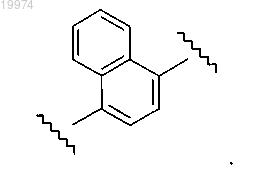
16. Соединение по любому из пп.1-15, отличающееся тем, что -L- независимо представляет собой
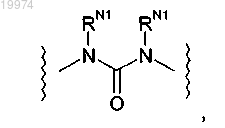
где каждый -RN1 независимо представляет собой -Н.
17. Соединение по любому из пп.1-16, отличающееся тем, что -J независимо представляет собой фенил и является возможно замещенным.
18. Соединение по любому из пп.1-16, отличающееся тем, что -J независимо представляет собой пиразолил и является возможно замещенным.
19. Соединение по любому из пп.1-16, отличающееся тем, что -J независимо представляет собой 1Н-пиразол-5-ил и является возможно замещенным.
20. Соединение по любому из пп.1-16, отличающееся тем, что -J независимо представляет собой пиридил и является возможно замещенным.
21. Соединение по любому из пп.1-16, отличающееся тем, что -J независимо представляет собой пирид-3-ил и является возможно замещенным.
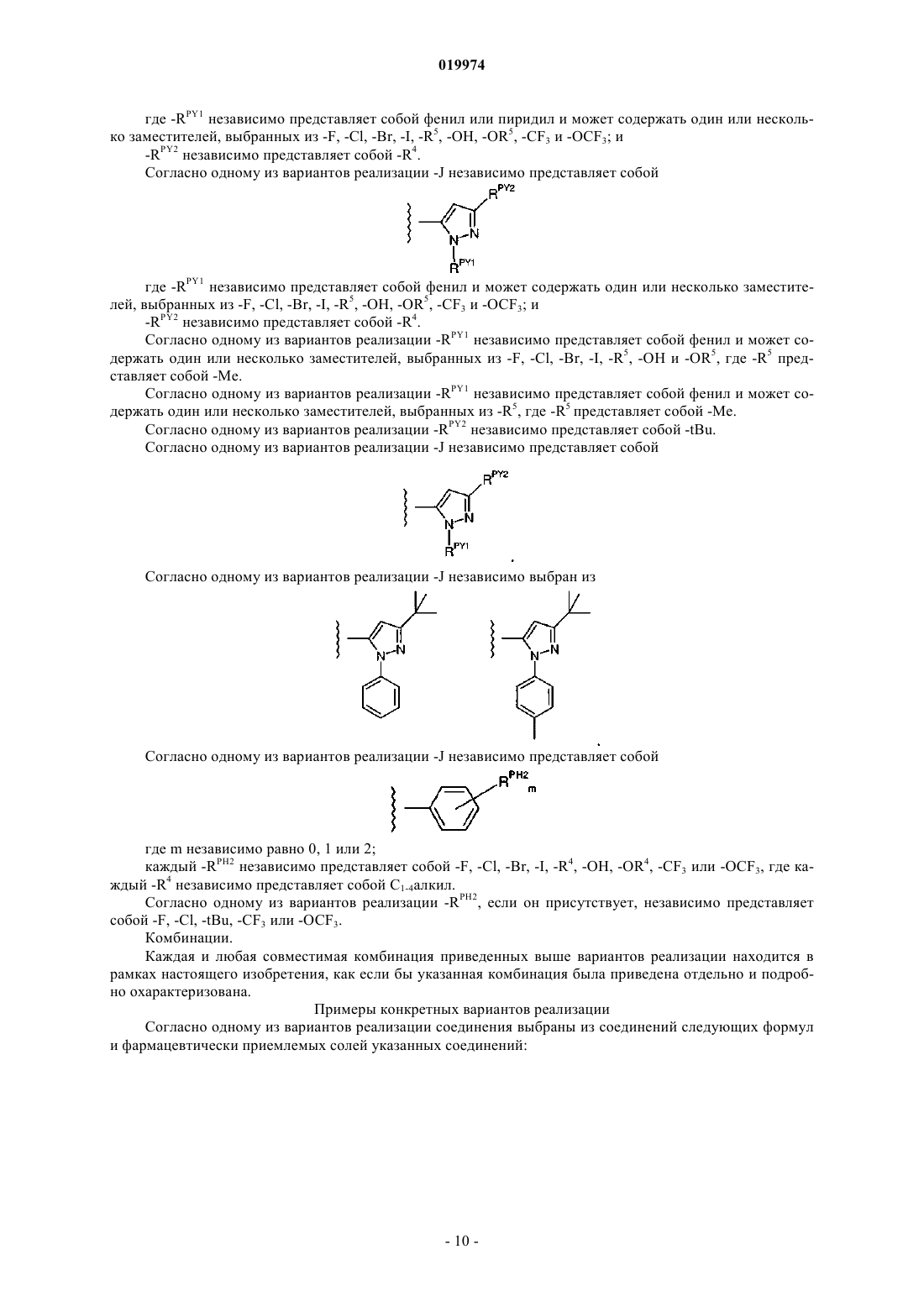
22. Соединение по любому из пп.1-16, отличающееся тем, что -J независимо представляет собой
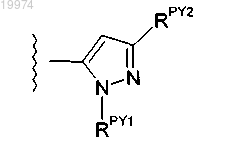
где -RPY1 независимо представляет собой фенил или пиридил и возможно содержит один заместитель, выбранный из -F, -Cl, -Br, -I, -R5, -ОН, -OR5, -CF3 и -OCF3; и -RPY2 независимо представляет собой -R4.
23. Соединение по любому из пп.1-16, отличающееся тем, что -J независимо представляет собой
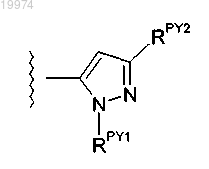
где -RPY1 независимо представляет собой фенил и возможно содержит один заместитель, выбранный из -F,
-Cl, -Br, -I, -R5, -ОН, -OR5, -CF3 и -OCF3; и -RPY2 независимо представляет собой -R4.
24. Соединение по п.23, отличающееся тем, что -RPY1 независимо представляет собой фенил и возможно содержит один заместитель, выбранный из -F, -Cl, -Br, -I, -R5, -ОН и -OR5, где -R5 представляет собой -Me.
25. Соединение по п.23, отличающееся тем, что -RPY1 независимо представляет собой фенил и возможно содержит один заместитель, выбранный из -R5, где -R5 представляет собой -Me.
26. Соединение по любому из пп.22-25, отличающееся тем, что -RPY2 независимо представляет собой -tBu.
27. Соединение по любому из пп.22-26, отличающееся тем, что -J независимо представляет собой
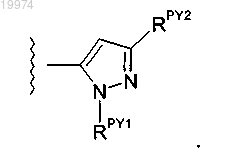
28. Соединение по любому из пп.1-16, отличающееся тем, что -J независимо выбран из
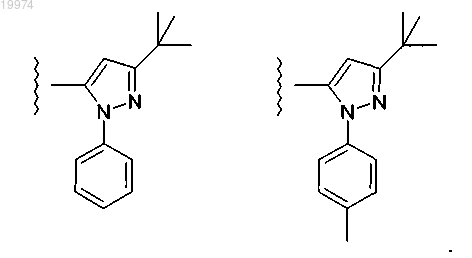
29. Соединение по любому из пп.1-16, отличающееся тем, что -J независимо представляет собой
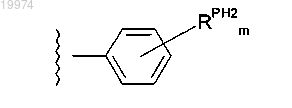
где m независимо равно 0, 1 или 2;
каждый -RPH2 независимо представляет собой -F, -Cl, -Br, -I, -R4, -ОН, -OR4, -CF3 или -OCF3, где каждый -R4 независимо представляет собой С1-4алкил.
30. Соединение по п.29, отличающееся тем, что каждый -RPH2, если он присутствует, независимо представляет собой -F, -Cl, -tBu, -CF3 или -OCF3.
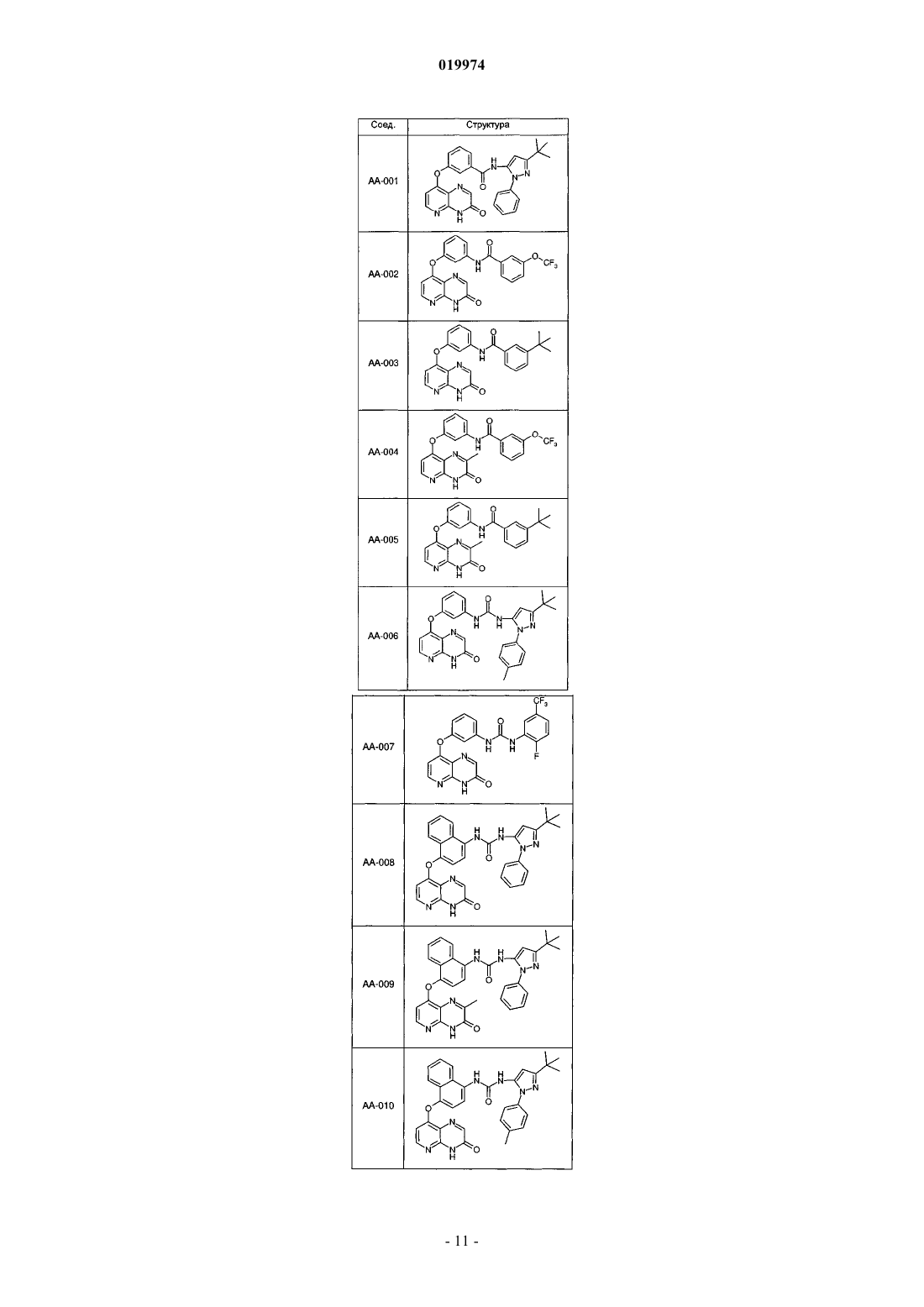
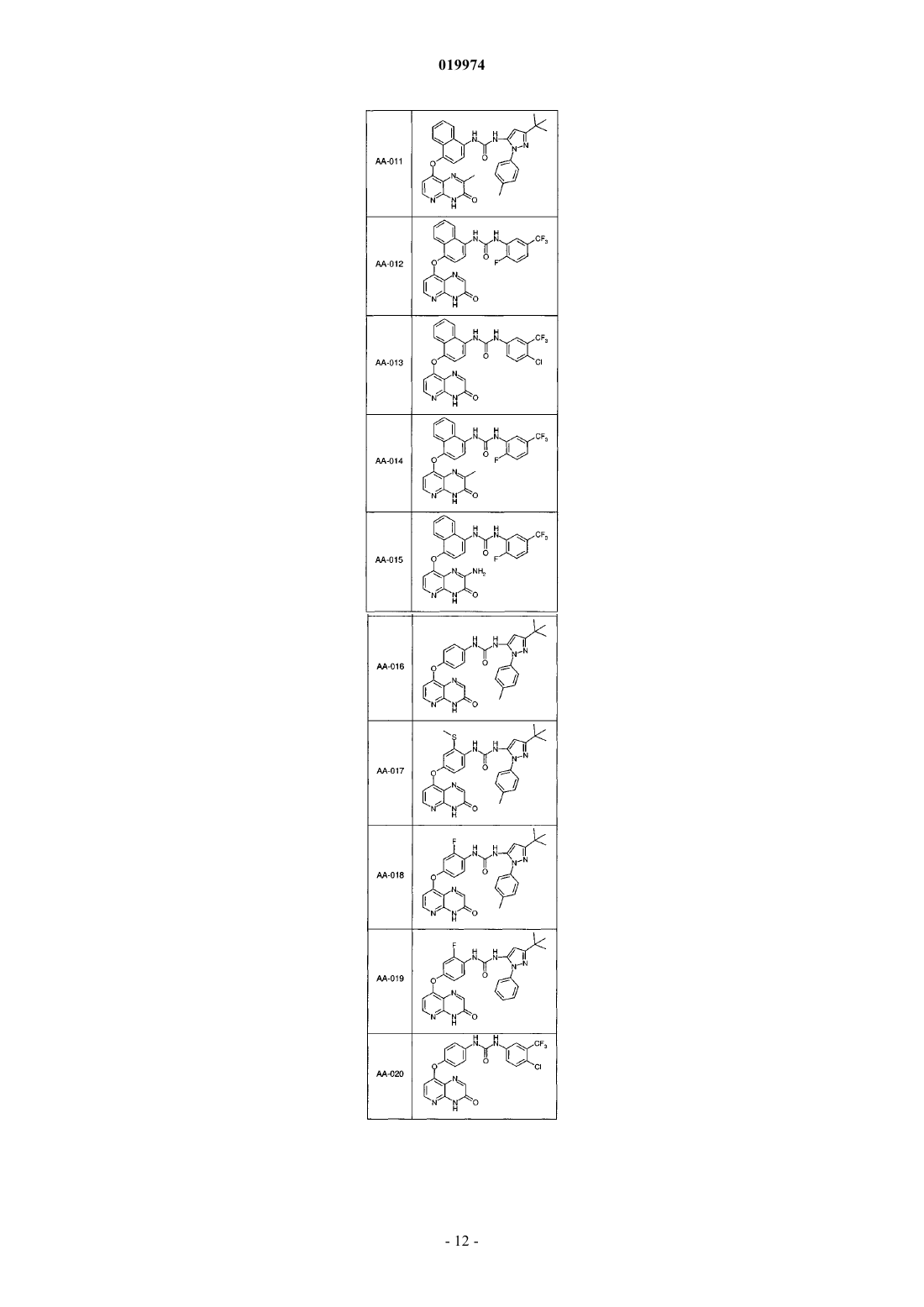
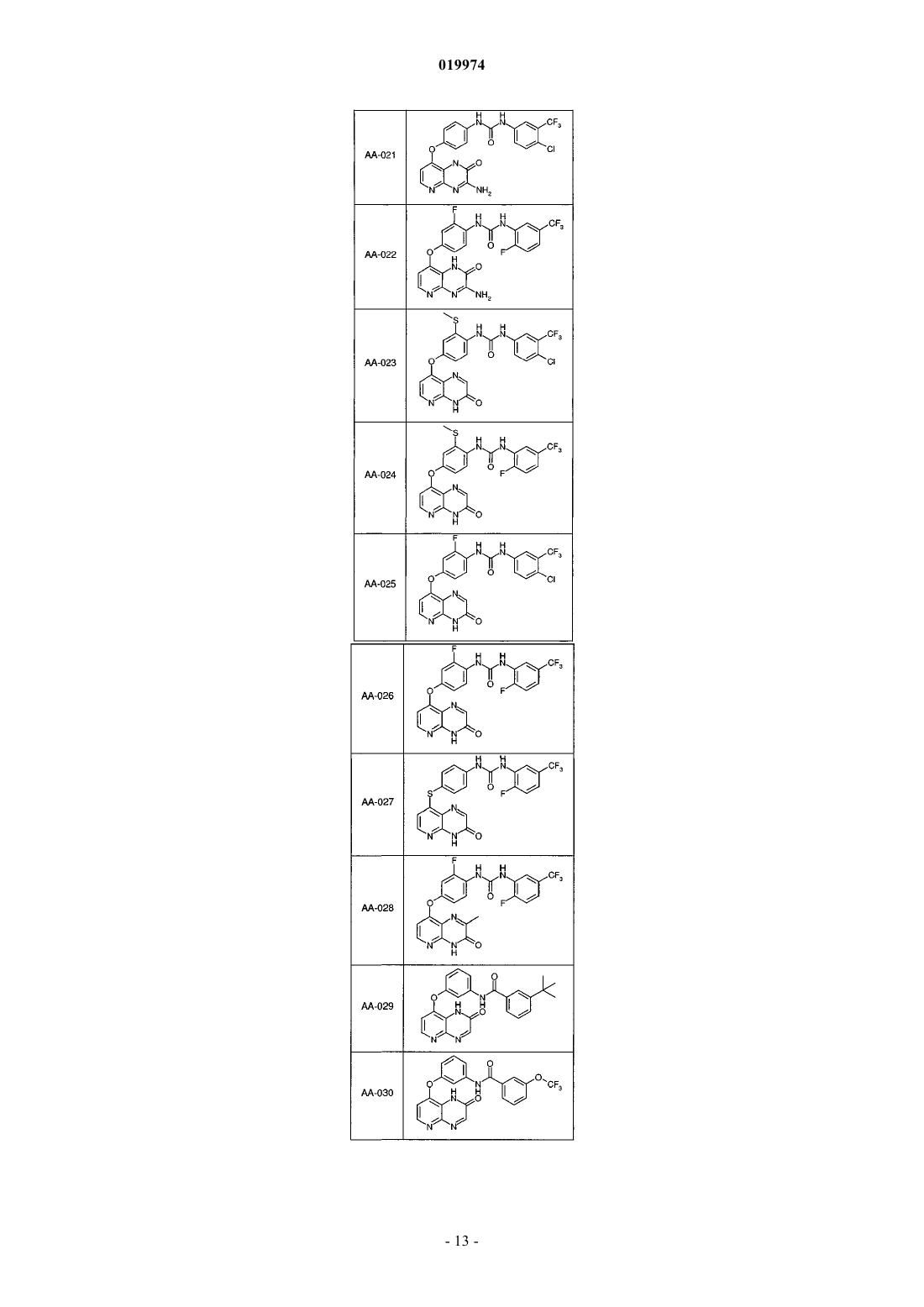
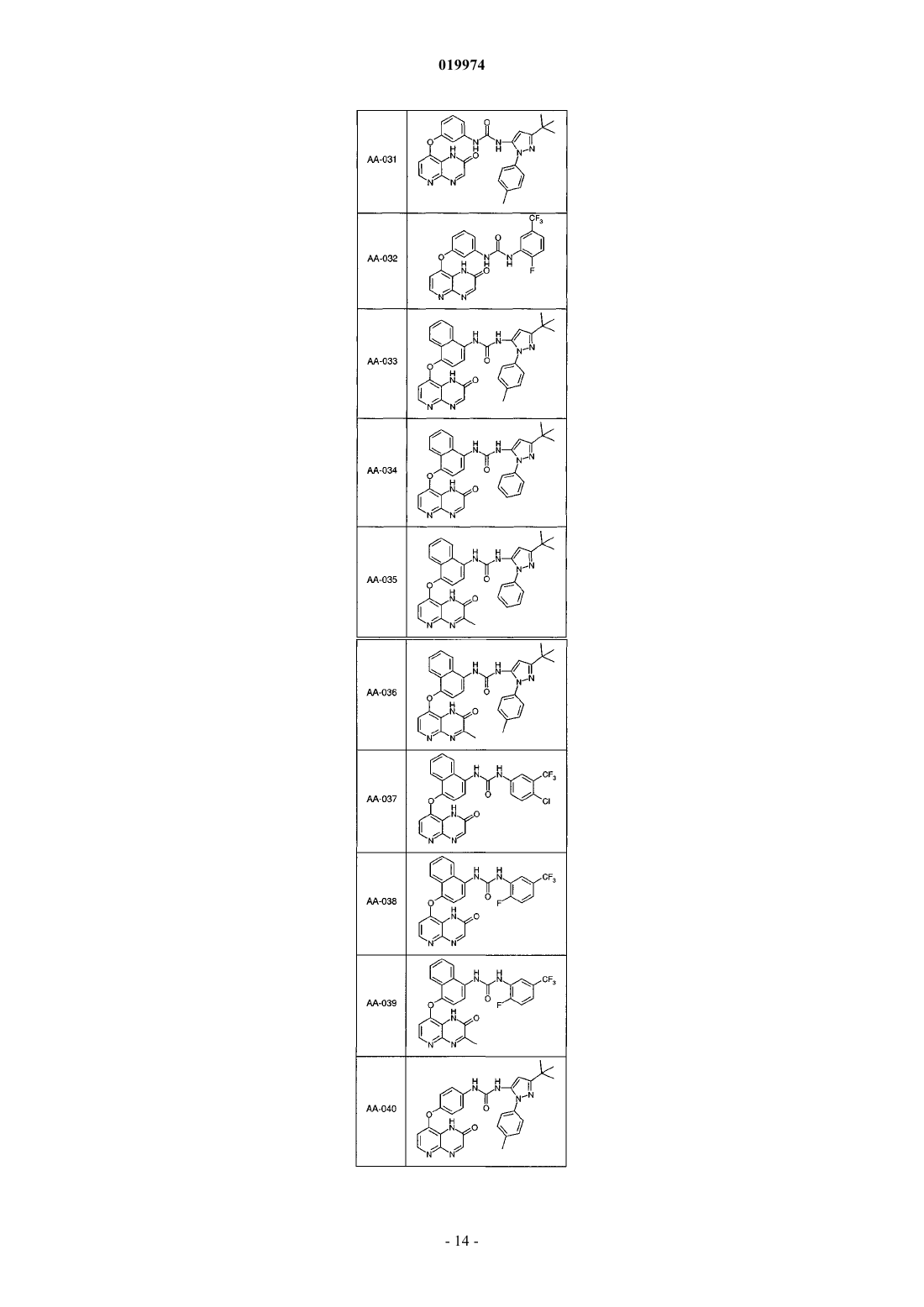
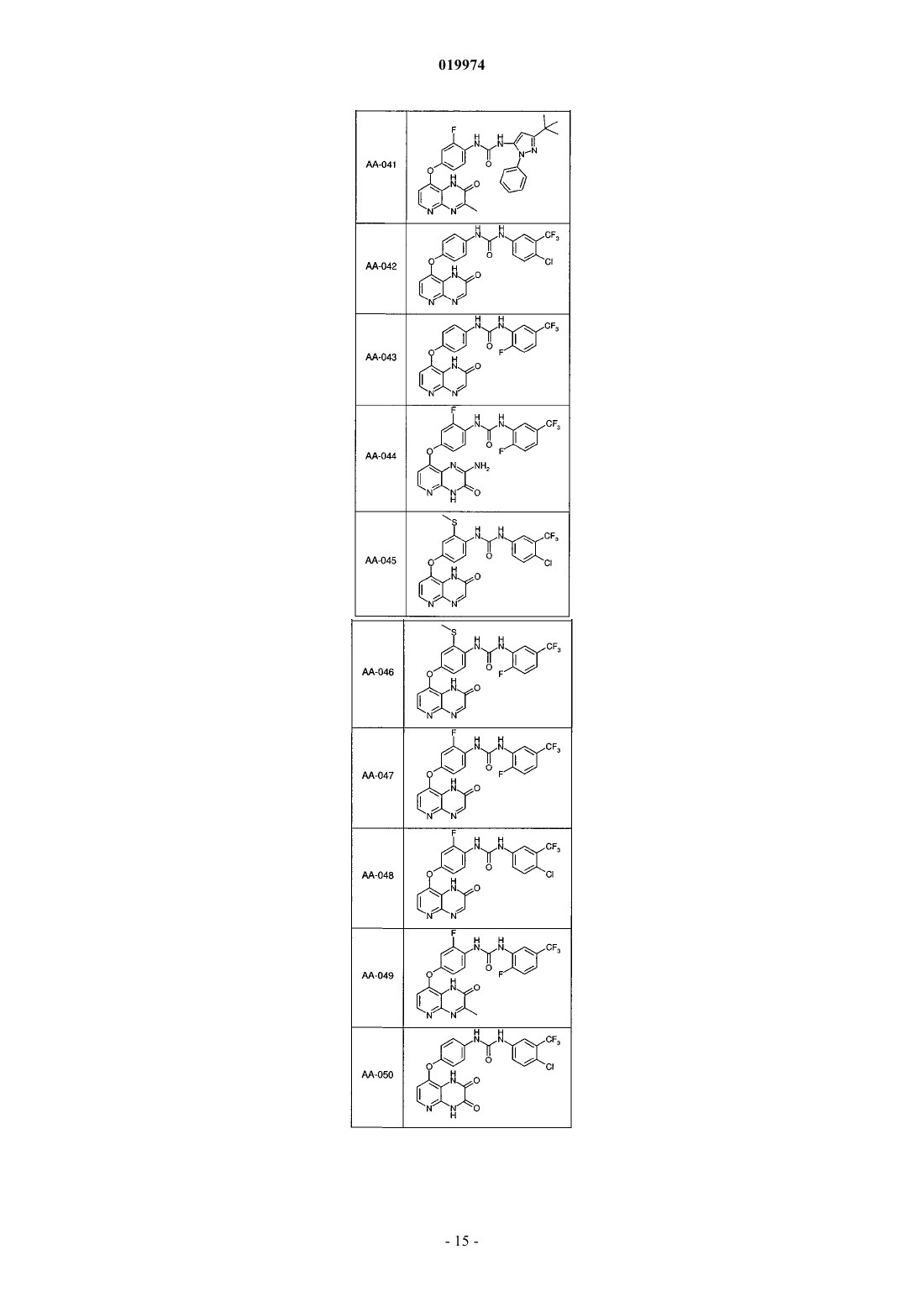
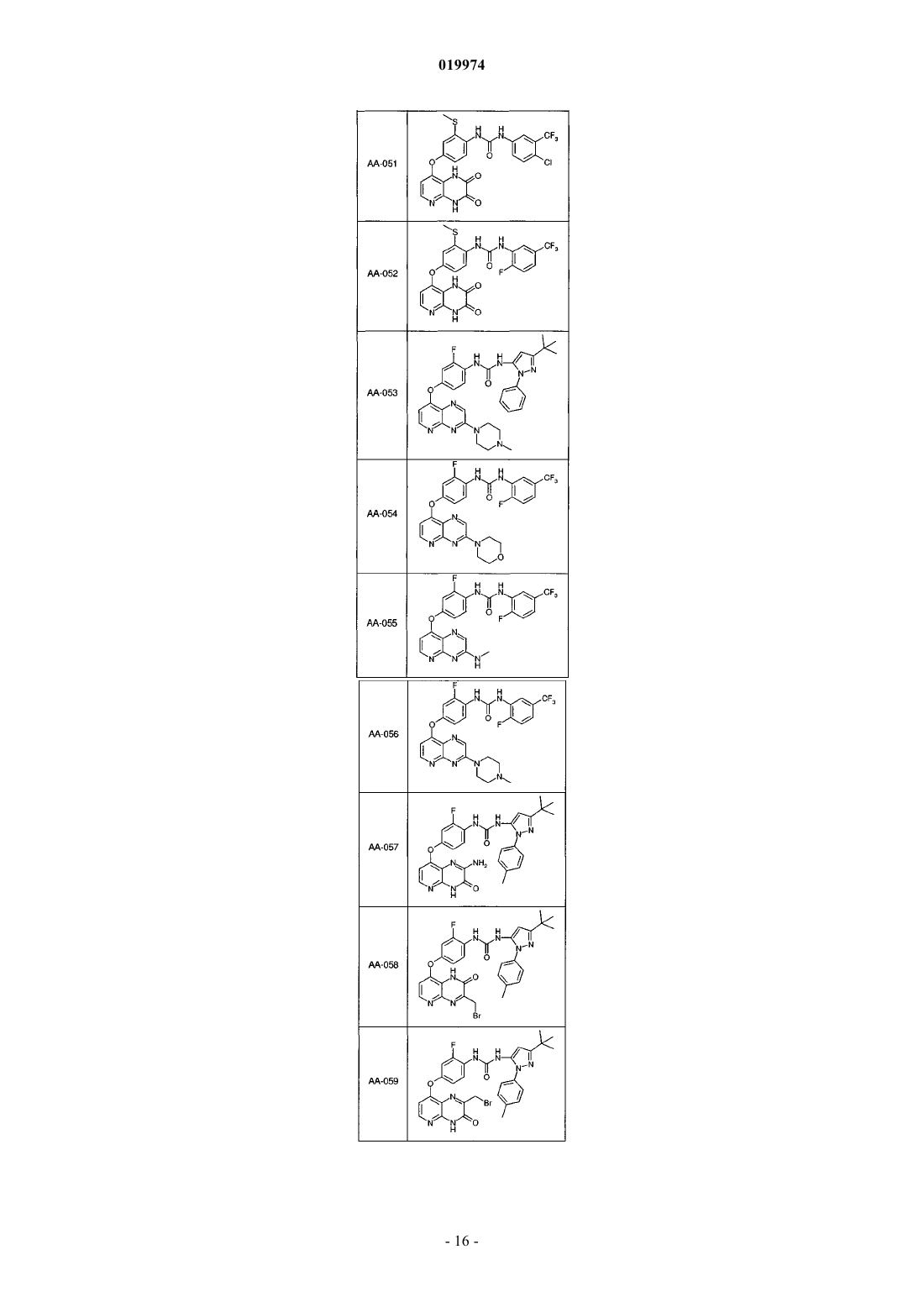
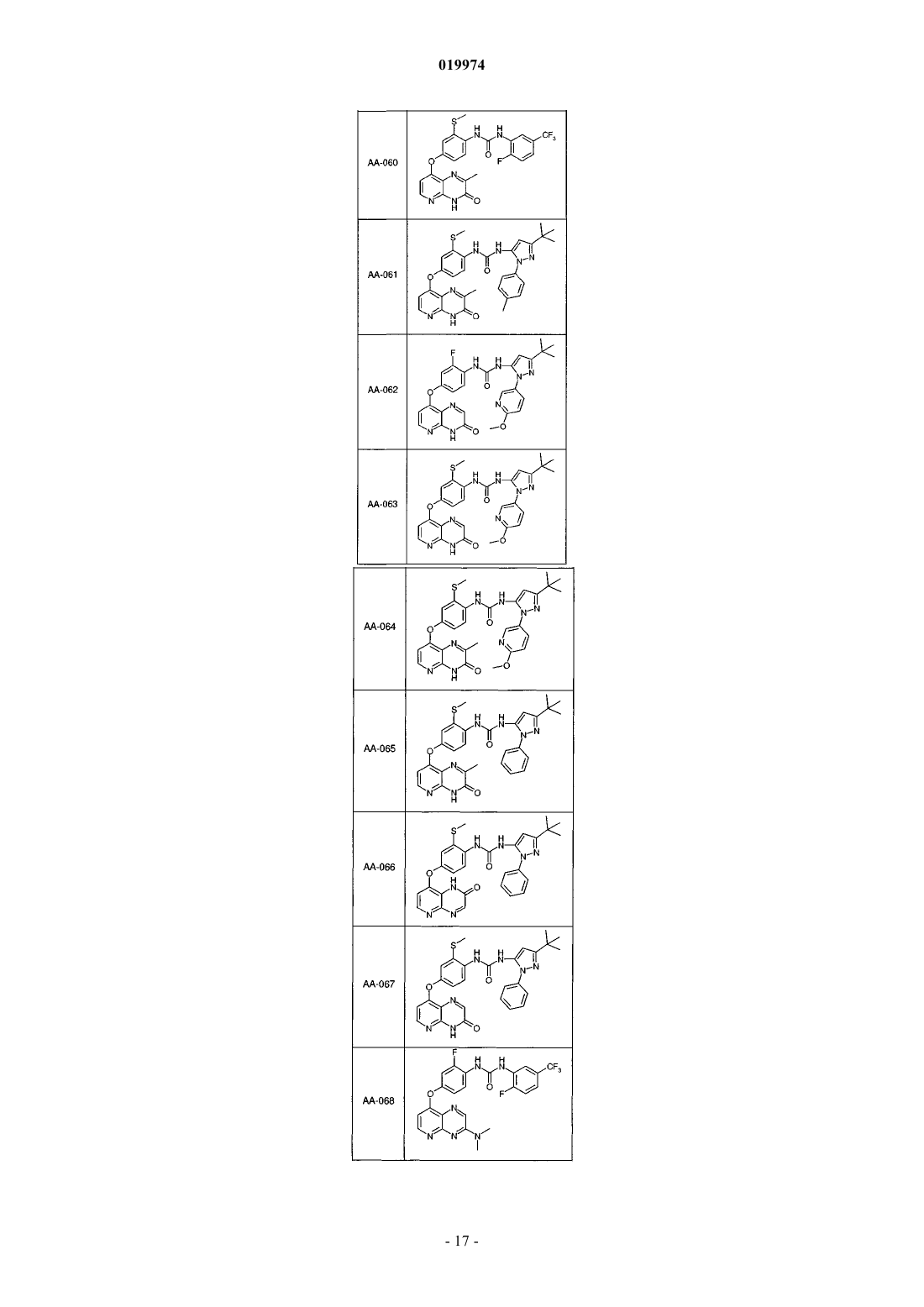
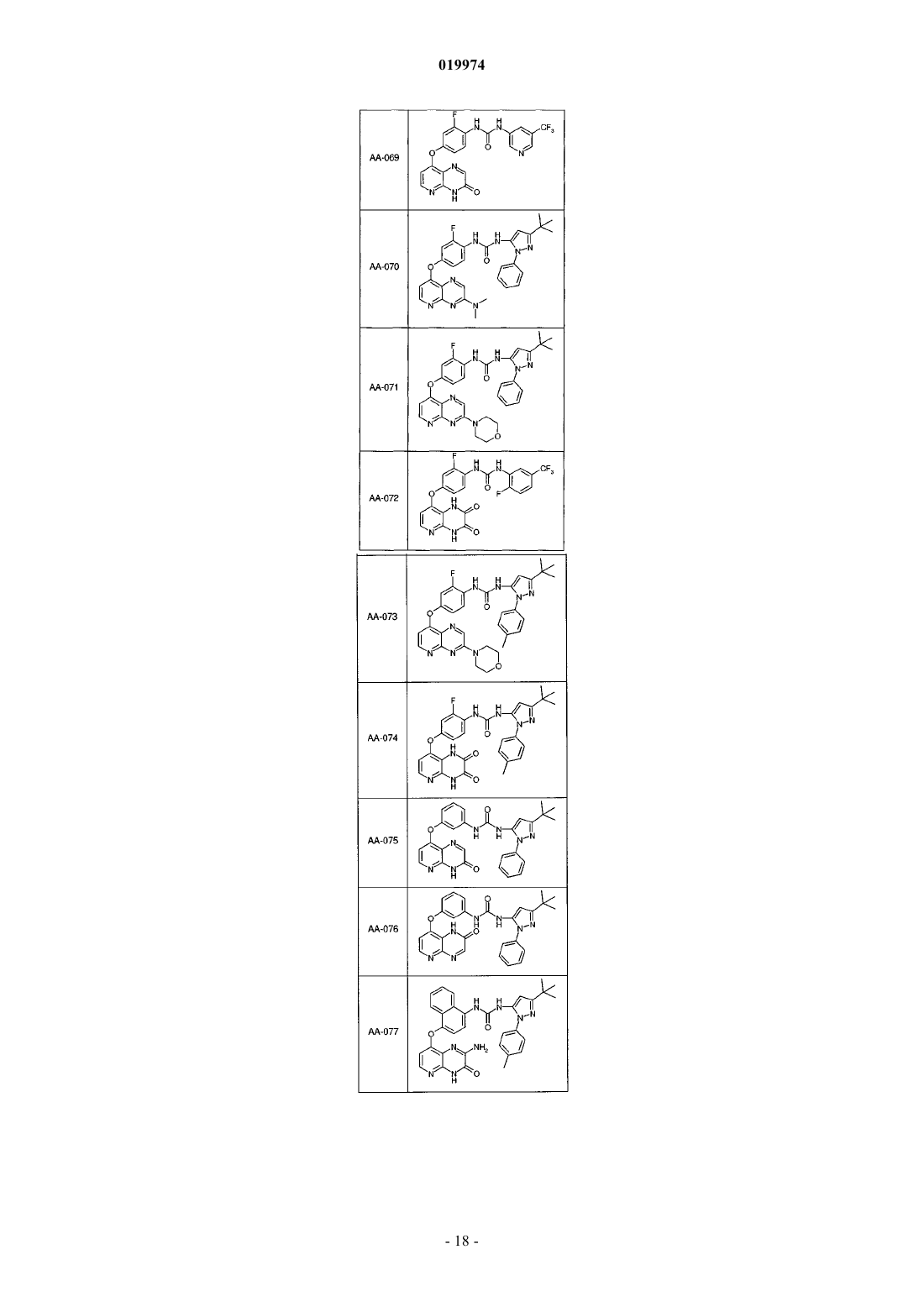
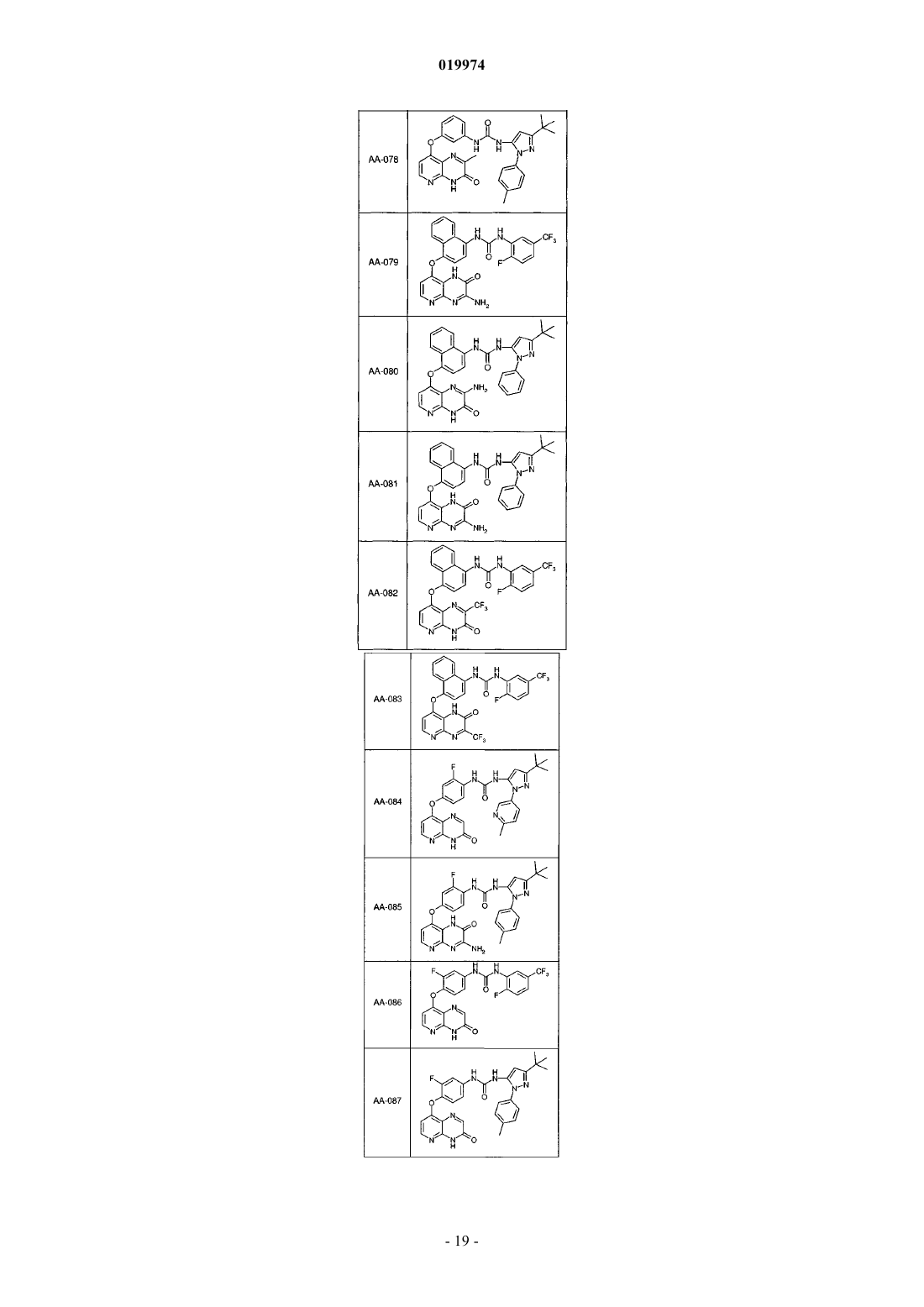
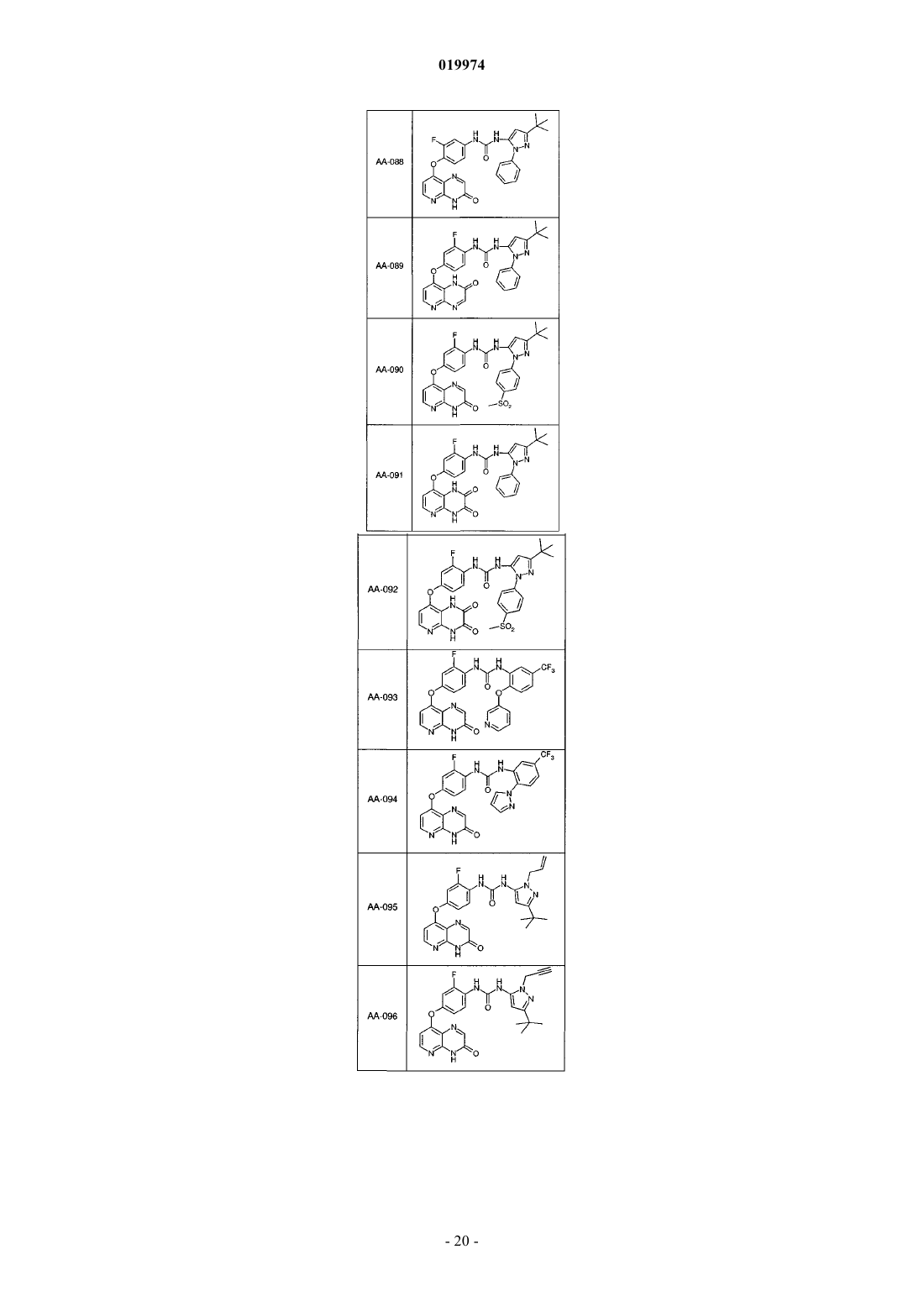
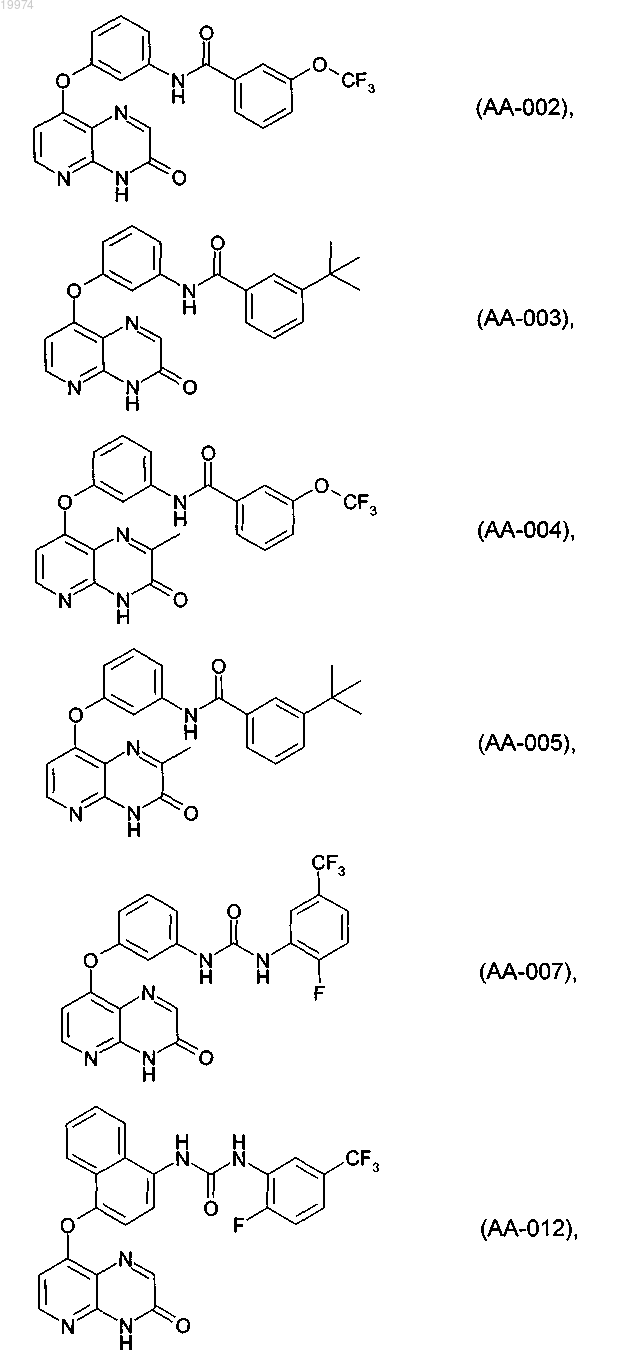
31. Соединение по п.1, выбранное из следующих соединений, а также их фармацевтически приемлемых солей:
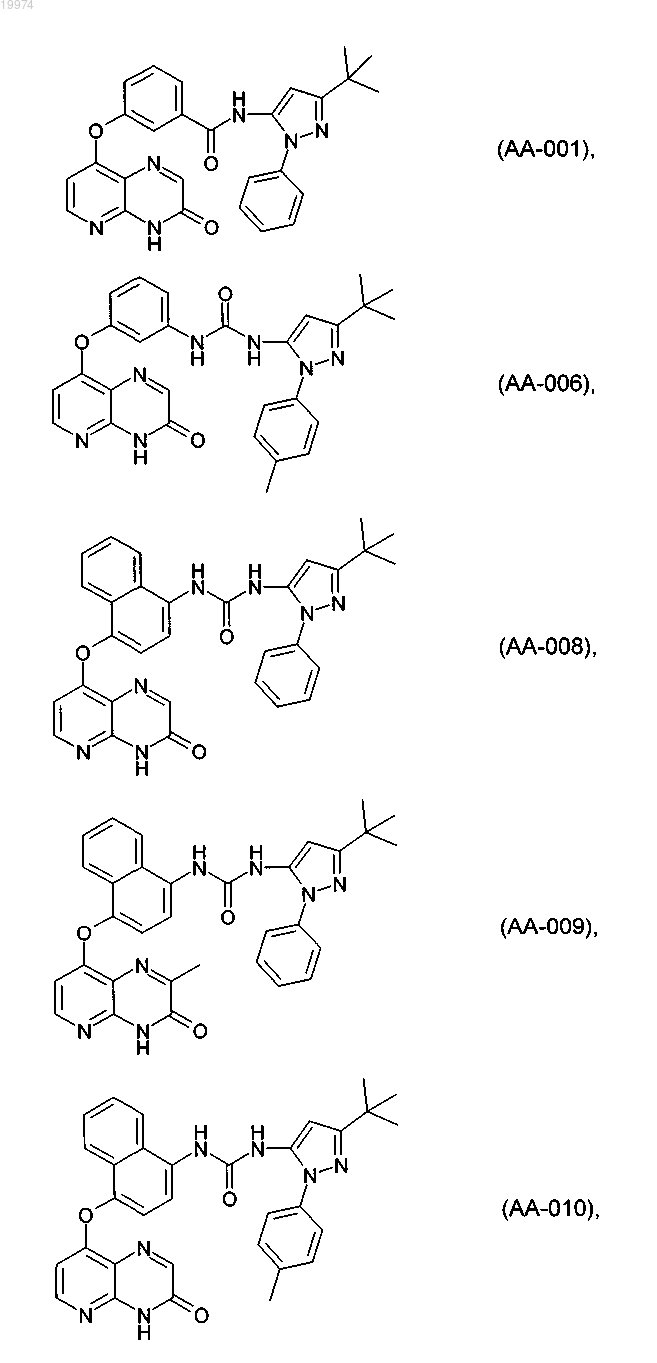

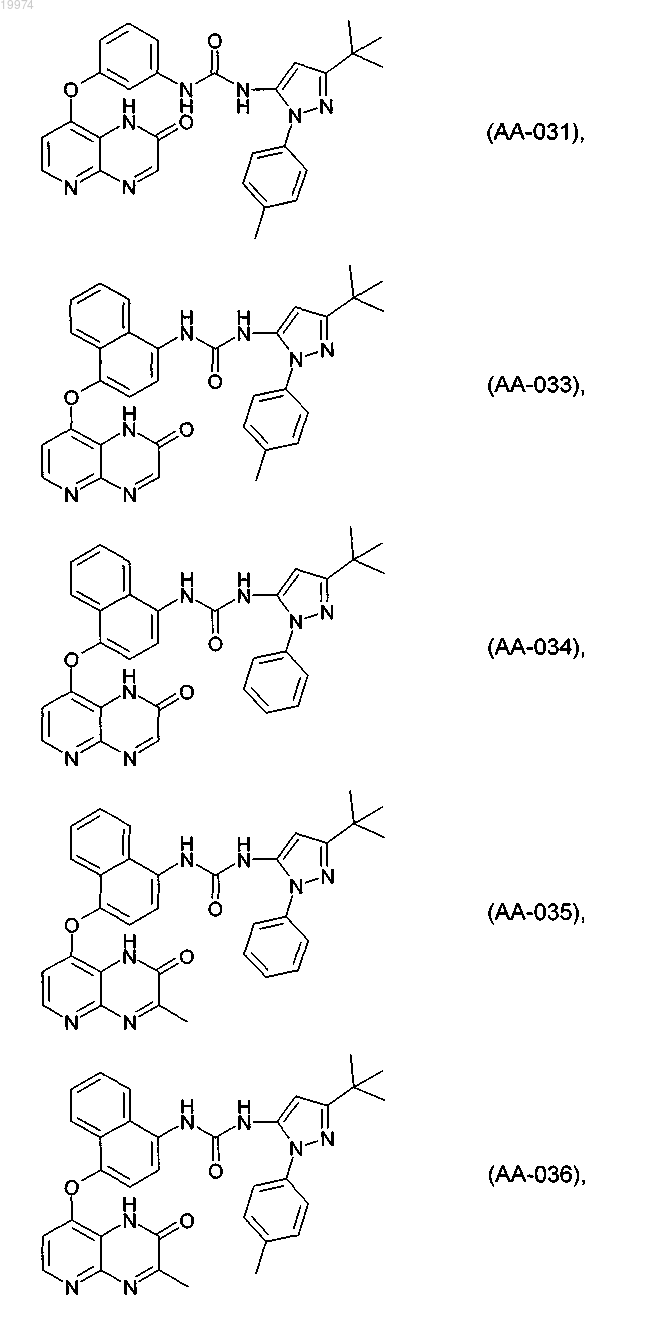
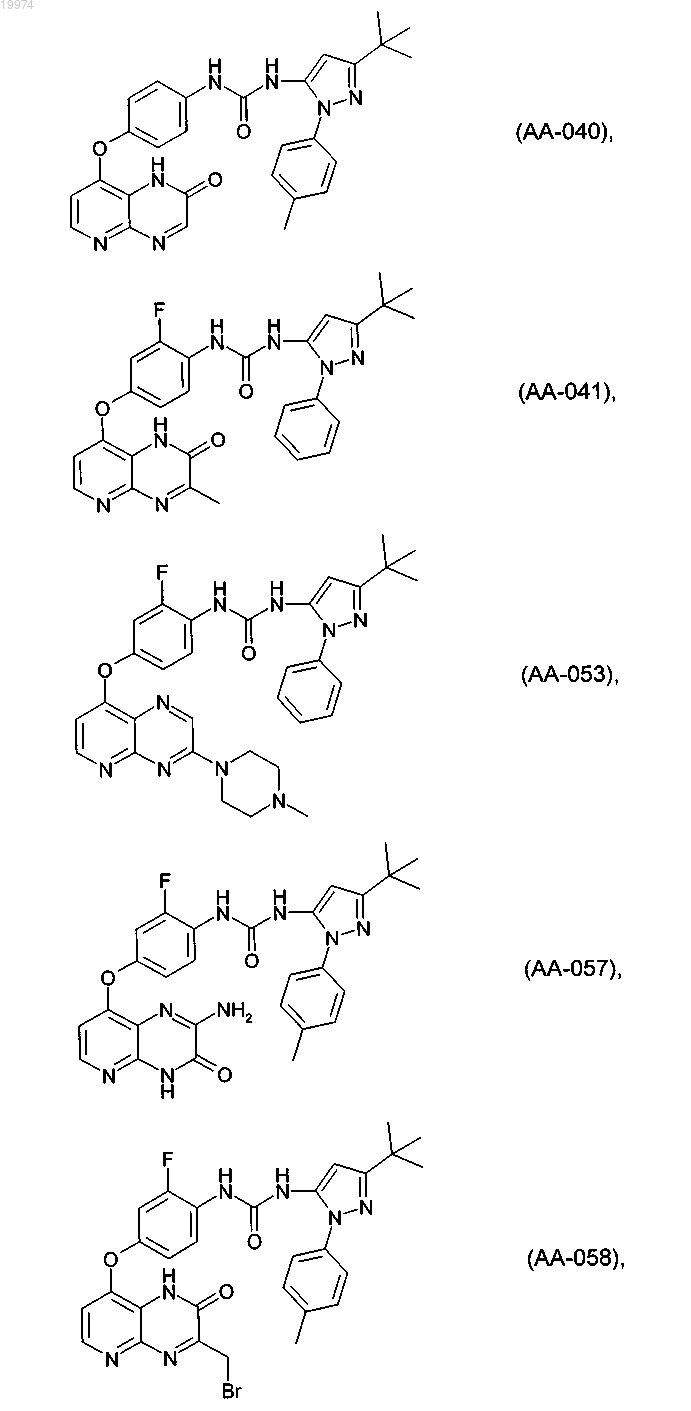
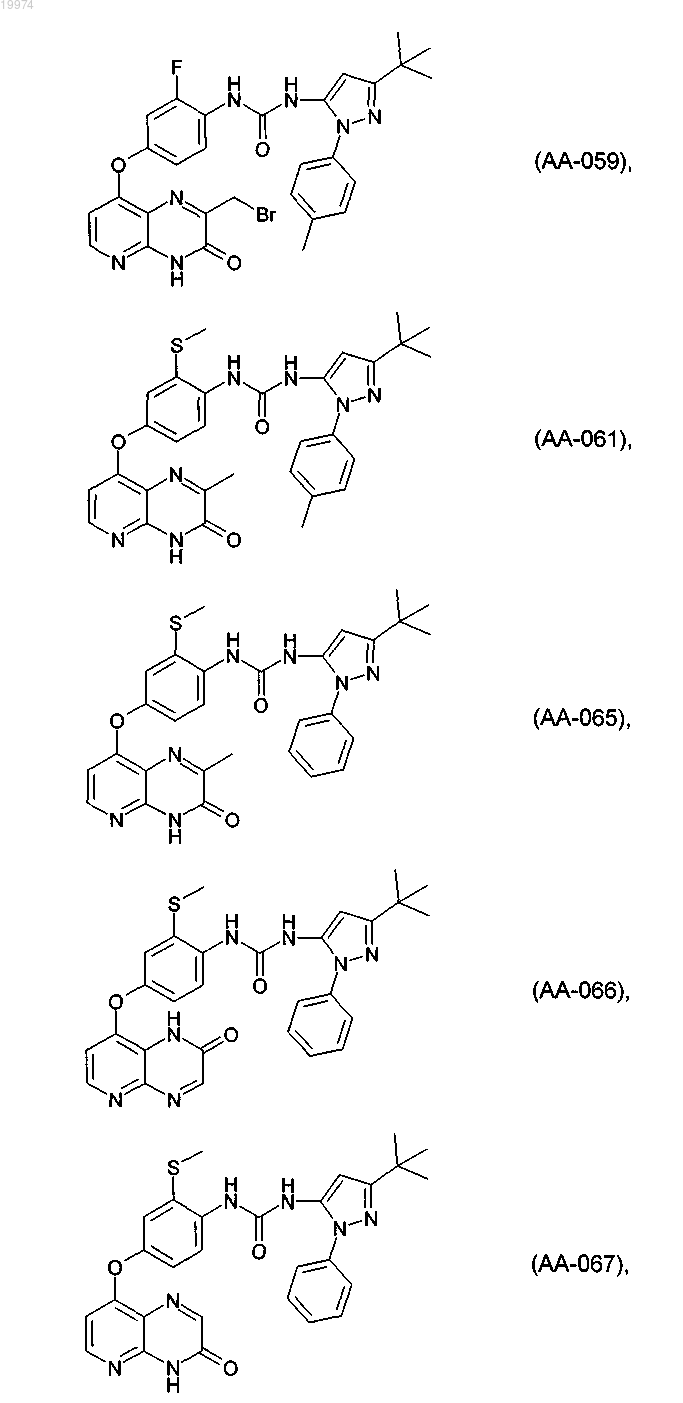
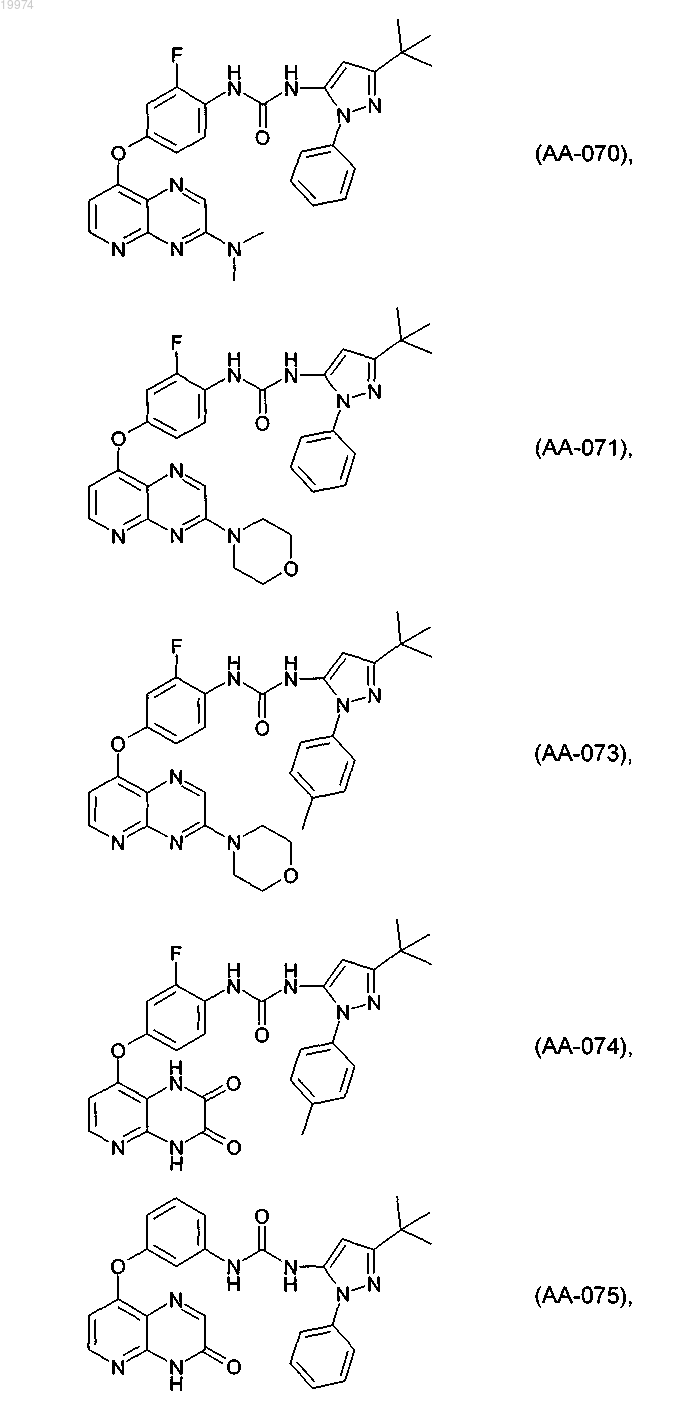
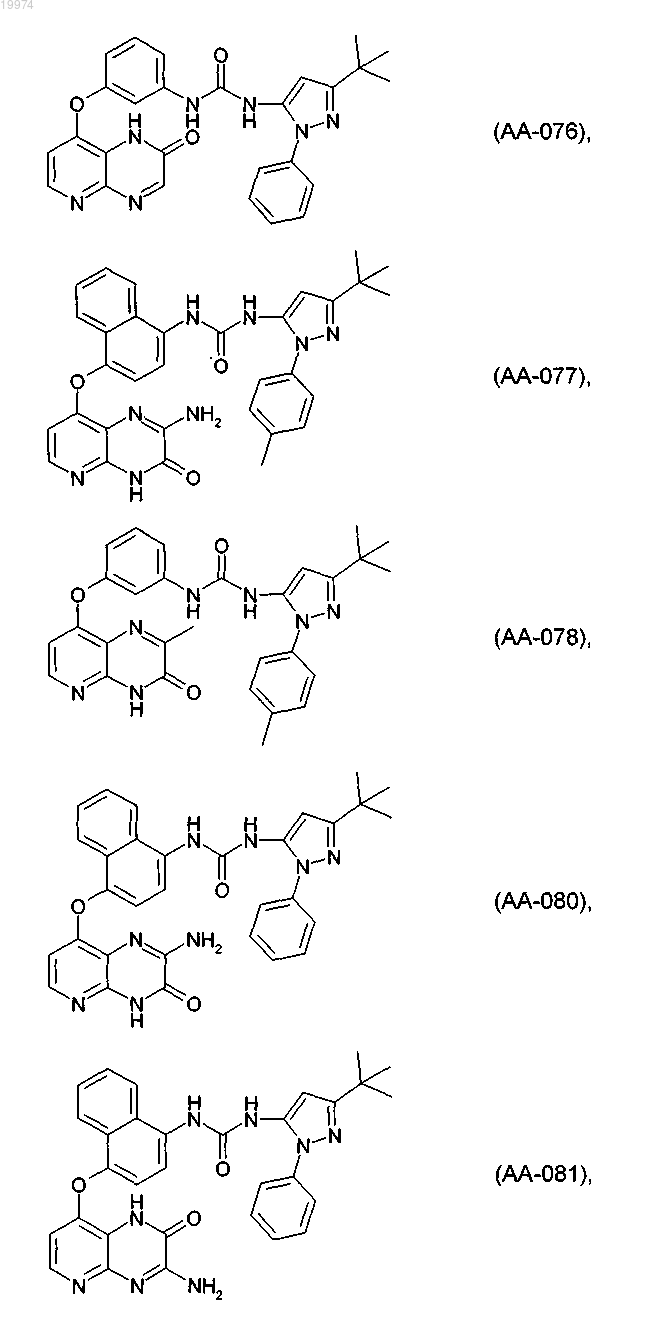
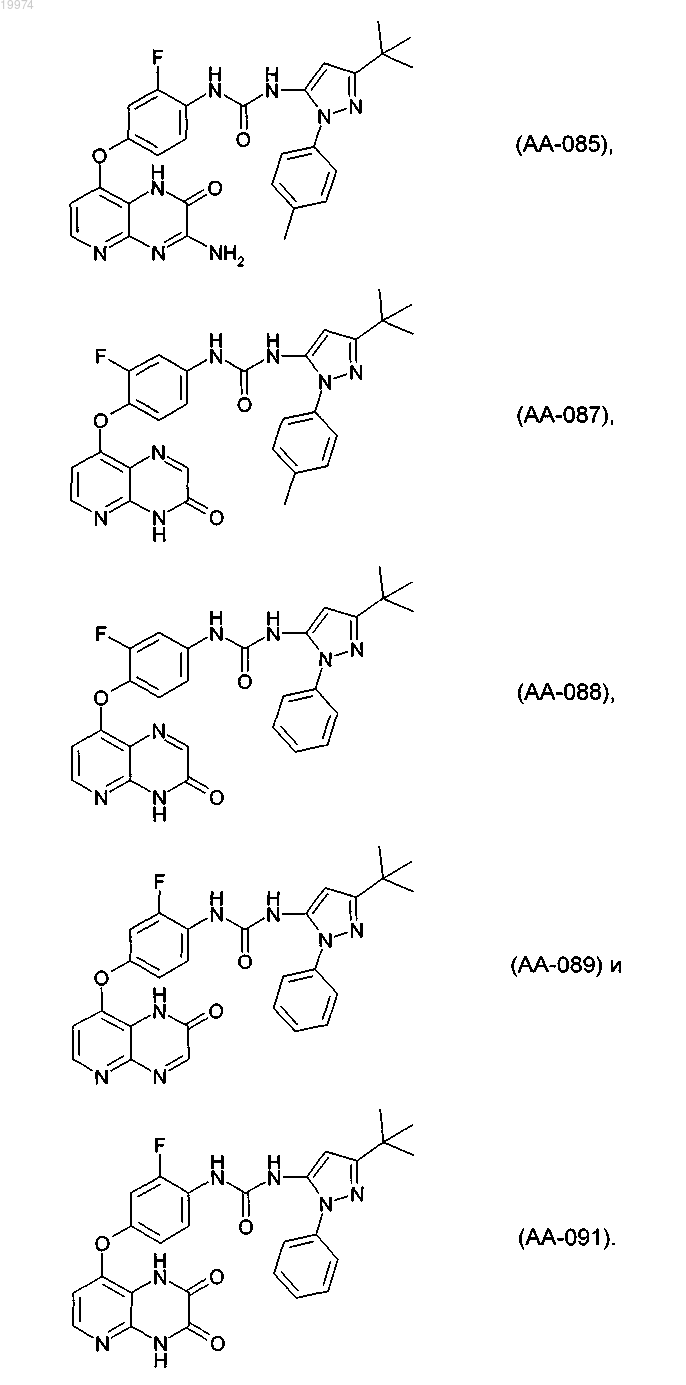
32. Соединение по п.1, выбранное из следующих соединений, а также их фармацевтически приемлемых солей:
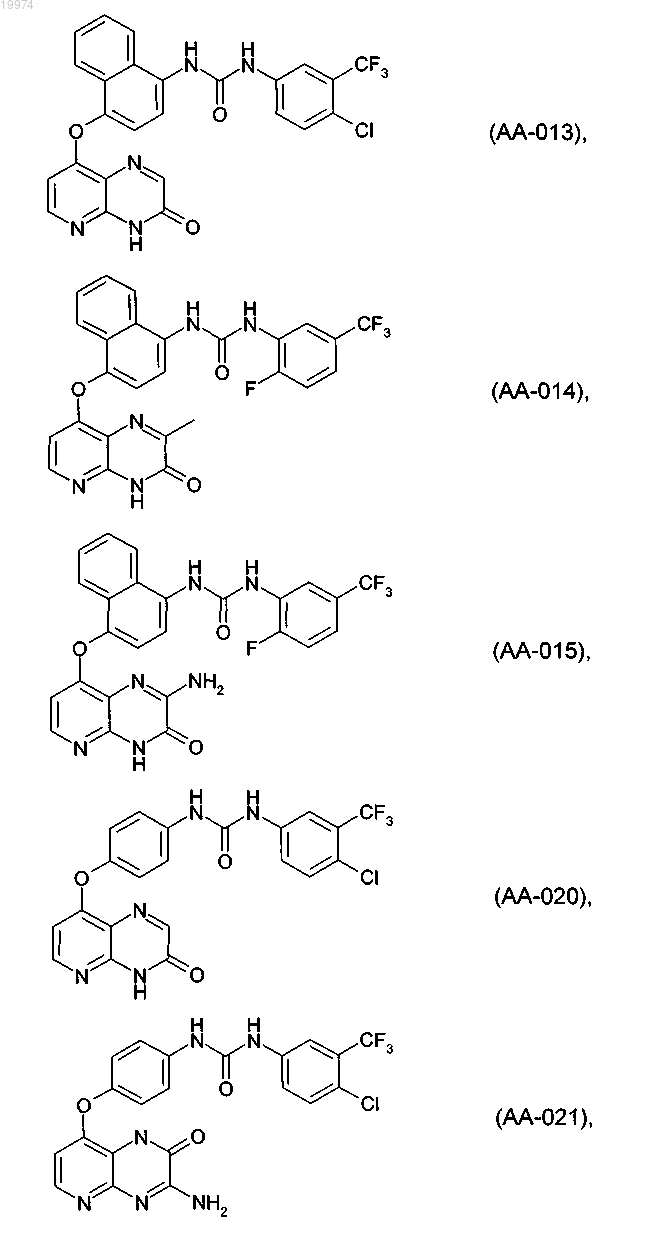
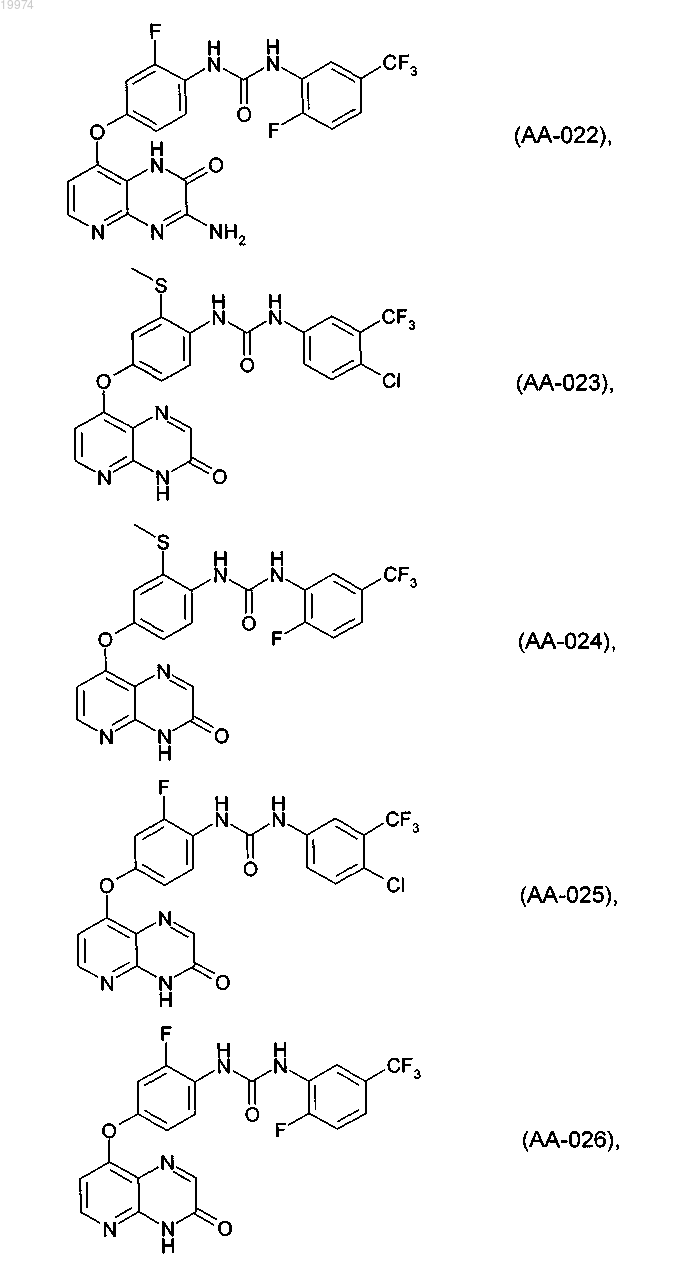

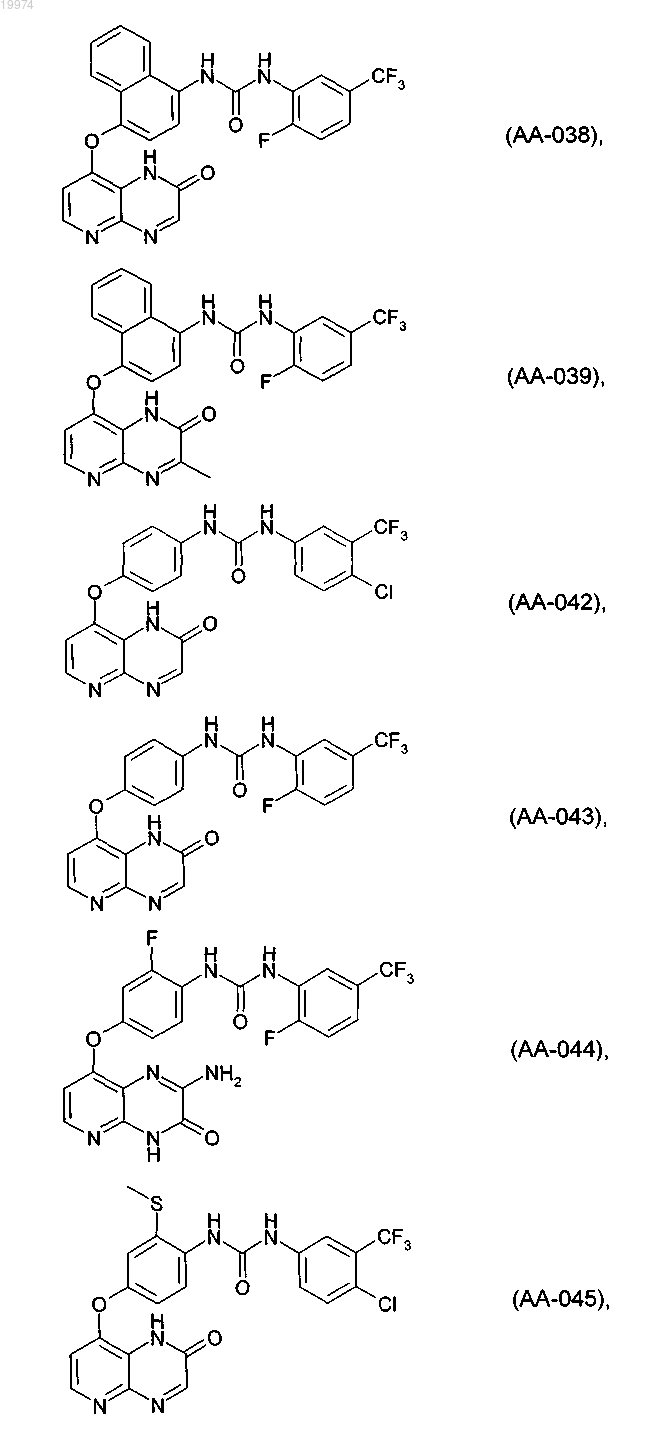
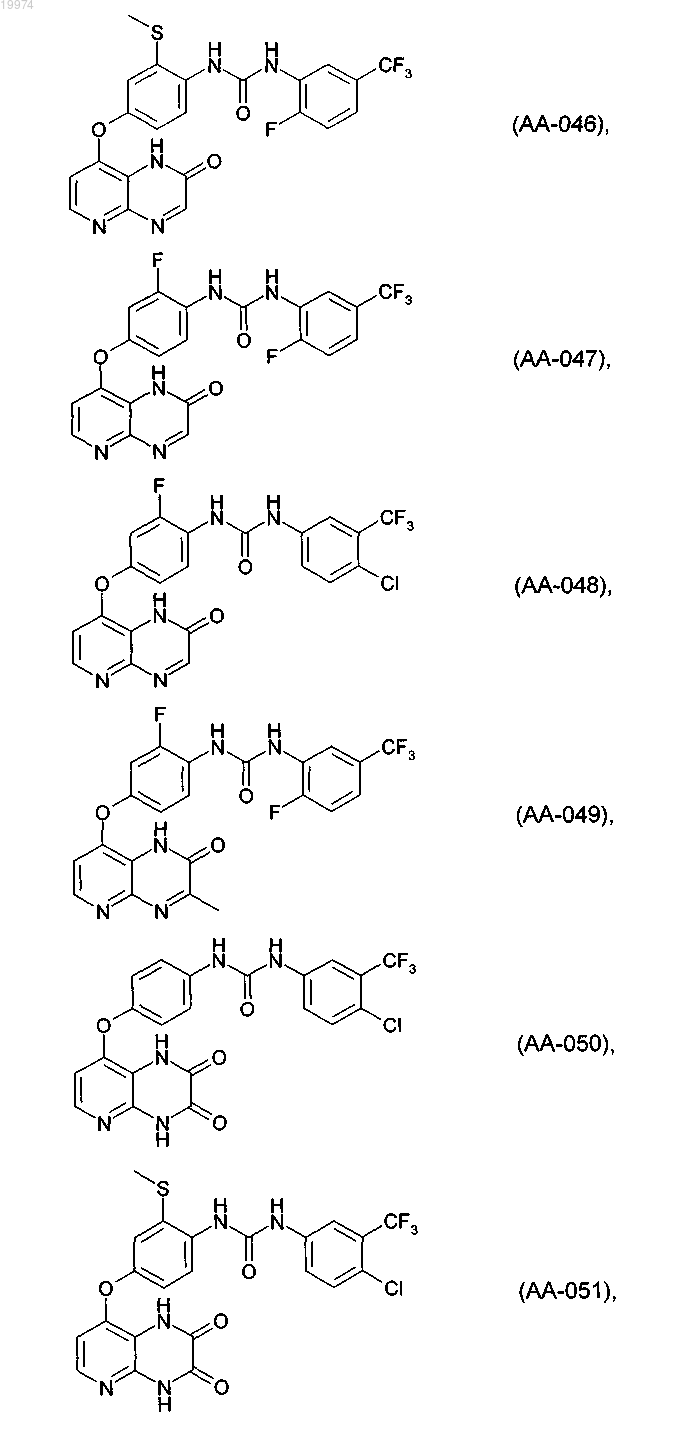

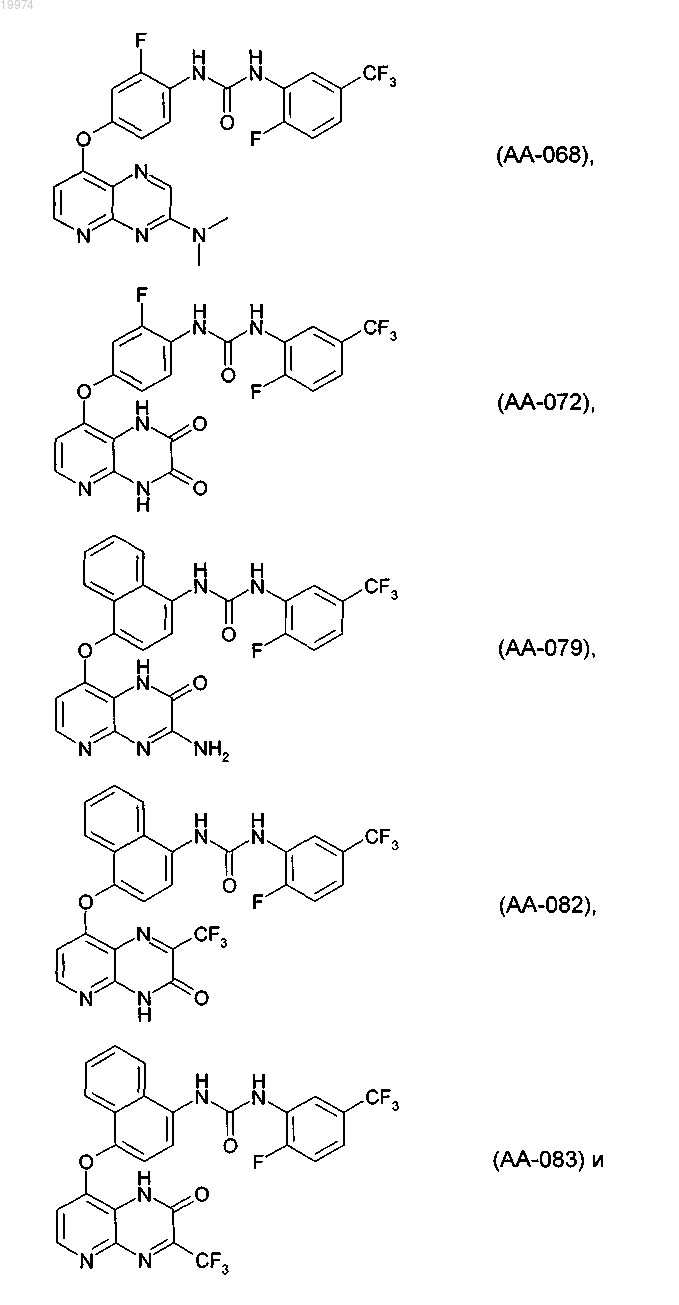
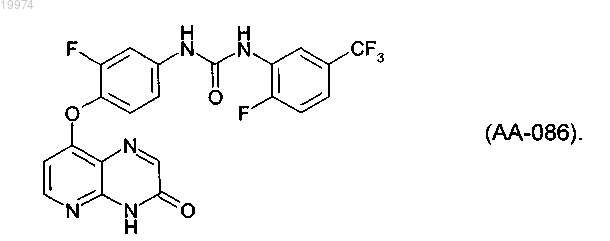
33. Соединение по п.1, представляющее собой следующее соединение или его фармацевтически приемлемую соль:
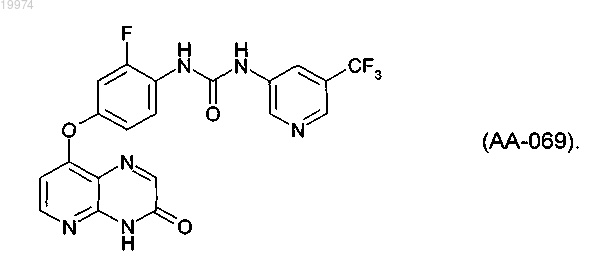
34. Фармацевтическая композиция, содержащая соединение по любому из пп.1-33 и фармацевтически приемлемый носитель или разбавитель.
35. Способ получения фармацевтической композиции, включающий стадию смешивания соединения по любому из пп.1-33 и фармацевтически приемлемого носителя или разбавителя.
36. Применение соединения по любому из пп.1-33 для лечения человека или животного.
37. Применение соединения по любому из пп.1-33 для лечения пролиферативного нарушения.
38. Применение по п.37, отличающееся тем, что указанное пролиферативное нарушение представляет собой рак.
39. Применение по п.38, отличающееся тем, что указанный рак представляет собой меланому или колоректальный рак.
40. Применение соединения по любому из пп.1-33 для получения лекарственного средства для лечения пролиферативного нарушения.
41. Применение по п.40, отличающееся тем, что указанное пролиферативное нарушение представляет собой рак.
42. Применение по п.41, отличающееся тем, что указанный рак представляет собой меланому или колоректальный рак.
43. Способ лечения пролиферативного нарушения, включающий введение субъекту, нуждающемуся в указанном лечении, терапевтически эффективного количества соединения по любому из пп.1-33.
44. Способ по п.43, отличающийся тем, что указанное пролиферативное нарушение представляет собой рак.
45. Способ по п.44, отличающийся тем, что указанный рак представляет собой меланому или колоректальный рак.
46. Способ ингибирования пролиферации клеток, ингибирования развития клеточного цикла, стимулирования апоптоза или осуществления комбинации одного или нескольких из указанных воздействий, in vitro или in vivo, включающий приведение клетки в контакт с эффективным количеством соединения по любому из пп.1-33.
Текст
Настоящее изобретение относится в целом к области терапевтических соединений для лечения пролиферативных нарушений, рака и т.д. и, в частности, к некоторым 8-замещенным пиридо[2,3b]пиразинам, охарактеризованным в настоящем описании, которые, в числе прочего, подавляют активность RAF (например, B-RAF). Настоящее изобретение также относится к фармацевтическим композициям, содержащим указанные соединения, и к применению указанных соединений и композиций как in vitro, так и in vivo, для подавления активности RAF (например,BRAF), подавления активности рецепторных тирозинкиназ (РТК), подавления пролиферации клеток и лечения заболеваний и нарушений, облегчаемых путем подавления RAF, РТК и т.д.,пролиферативных нарушений, таких как рак (например, колоректальный рак, меланома) и т.д. Спрингер Кэролайн Джой, НикулескуДувас Дэн, Никулеску-Дувас Йон, Мараис Ричард, Сейкербейк Бартоломеус Маринус Йозефус Мария, Замбон Альфонсо (GB), Нурри Арнауд (FR), Менард Дельфин (GB) Нилова М.И. (RU)(71)(73) Заявитель и патентовладелец: КАНСЕР РИСЕРЧ ТЕКНОЛОДЖИ ЛИМИТЕД; ИНСТИТЬЮТ ОФ КАНСЕР РИСЕРЧ: РОЙЯЛ КАНСЕР ХОСПИТАЛ (ЗЕ) (GB) Родственные заявки Настоящая заявка связана с предварительной заявкой на патент США 61/015019, поданной 19 декабря 2007 г., содержание которой полностью включено в настоящее описание посредством ссылки. Область техники Настоящее изобретение в целом относится к области терапевтических соединений для лечения пролиферативных нарушений, рака и т.д. и, в частности, к некоторым 8-замещенным пиридо[2,3b]пиразинам, охарактеризованным в настоящем описании, которые, в числе прочего, подавляют активность RAF (например, B-RAF). Настоящее изобретение также относится к фармацевтическим композициям, содержащим указанные соединения, и к применению указанных соединений и композиций как invitro, так и in vivo, для подавления активности RAF (например, B-RAF), подавления активности рецепторной тирозинкиназы (РТК), подавления пролиферации клеток и лечения заболеваний и нарушений,облегчаемых путем подавления RAF, РТК и т.д., пролиферативных нарушений, таких как рак (например,колоректальный рак, меланома) и т.д. Уровень техники В настоящем изобретении упоминается ряд патентов и публикаций с целью более полно описать и раскрыть настоящее изобретение и уровень техники, к которому относится настоящее изобретение. Содержание каждого из упоминаемых документов полностью включено в настоящее описание посредством ссылки в той же степени, как если бы в случае каждого конкретного документа было указано, что его содержание включено в настоящее описание посредством ссылки. В настоящем описании, включая приведенную далее формулу изобретения, если из контекста не следует иное, слово "включать" и его варианты, такие как "включает" и "включающий", следует понимать как подразумевающее включение указанного целого числа или стадии или группы целых чисел или стадий, но не исключение любого другого целого числа или стадии или группы целых чисел или стадий. Необходимо отметить, что в настоящем описании и пунктах прилагаемой формулы изобретения формы единственного числа включают множественное число, если из контекста явным образом не следует иное. Так, например, указание на "фармацевтический носитель" включает смеси двух или нескольких указанных носителей и т.п. В настоящем описании диапазоны часто выражают в виде от "примерно" одной конкретной величины и/или до "примерно" другой конкретной величины. Если указан подобный диапазон, другой вариант реализации включает значения от указанной одной конкретной величины и/или до другой конкретной величины. Аналогичным образом, если величины представлены как приблизительные путем использования предшествующего термина "примерно", следует понимать, что конкретная величина образует другой вариант реализации. Настоящее описание содержит информацию, которая может быть полезна для понимания настоящего изобретения. При этом не предполагается, что любая приведенная в настоящем описании информация характеризует уровень техники или относится к заявленному изобретению или что любая конкретно или неявным образом упоминаемая публикация представляет собой уровень техники.RAF, пролиферативные нарушения и рак. Мутации в генах, прямо или опосредованно контролирующих рост и дифференцировку клеток, в общем случае считают основной причиной рака. Злокачественные опухоли развиваются через ряд постепенных прогрессирующих изменений, которые приводят к утрате характеристик контроля роста раковых клеток, т.е. постоянной нерегулируемой пролиферации, способности к внедрению в окружающие ткани и способности к образованию метастаз в различных органах. Тщательно контролируемые исследования invitro помогли определить факторы, характеризующие рост нормальных и опухолевых клеток, и привели к идентификации конкретных белков, контролирующих рост и дифференцировку клеток.RAF представляет собой ключевую расположенную ниже по каскаду мишень для ГТФазы ras и опосредует активацию каскада МАП-киназы, состоящего из raf-MEK-ERK. Активированная ERK представляет собой киназу, последовательно воздействующую на ряд белков, отвечающих, среди прочего, за опосредование роста, выживания и транскрипционных функций данного пути. Указанные белки включают транскрипционные факторы ELK1, C-JUN, семейство Ets (включая Ets 1, 2 и 7) и семейство FOS. Путь сигнальной трансдукции ras-raf-MEK-ERK активируется в ответ на многие клеточные стимулы,включая такие факторы роста, как ЭФР (EGF), ТРФ (PDGF), ФРК (KGF) и т.д. Поскольку указанный путь представляет собой основную мишень, на которую воздействуют факторы роста, было обнаружено,что повышающая регуляция raf-MEK-ERK имеет место во многих опухолях, зависимых от факторов роста. Наблюдаемая примерно в 20% всех опухолей активирующая мутация в одном из белков ras указывает на то, что данный путь вносит более широкий вклад в онкогенез. Появляется все больше доказательств того, что активирующие мутации в других компонентах указанного пути также имеют место в опухолях у людей. Указанное справедливо и для RAF. Семейство онкогенов RAF включает три высококонсервативных гена, обозначаемых A-RAF, B-RAF и C-RAF (также называемый Raf-1). Гены RAF кодируют протеинкиназы, которые, как полагают, играют важную регуляторную роль в процессах сигнальной трансдукции, регулирующих пролиферацию клеток. Гены RAF кодируют высококонсервативные серин-треонин-специфичные протеинкиназы, которые при-1 019974 влекаются к плазматической мембране с последующим непосредственным связыванием с малыми гуанин-нуклеотидсвязывающими белками ras, и указанное событие является инициирующим в активацииRAF. Белки RAF являются частью пути сигнальной трансдукции, который, как полагают, состоит из рецепторных тирозинкиназ, р 21 Ras, протеинкиназ RAF, киназ MEK1 (активатор ERK или МАПКК) и киназ ERK (МАПК), которые в конечном итоге фосфорилируют некоторые клеточные субстраты, включая транскрипционные факторы. Передача сигналов по указанному пути может опосредовать дифференцировку, пролиферацию или онкогенную трансформацию в различном клеточном окружении. Так, полагают, что киназы RAF играют фундаментальную роль в нормальном клеточном пути сигнальной трансдукции, объединяя множество факторов роста для их совокупного действия - пролиферации клеток. Поскольку белки RAF являются непосредственными расположенными ниже по каскаду эффекторами функции белка ras, полагают, что терапия, направленная против киназ RAF, будет полезна при лечении rasзависимых опухолей. Киназы RAF регулируются и экспрессируются дифференцированно; C-RAF охарактеризована наиболее подробно и экспрессируется во всех органах и во всех исследованных клеточных линиях. A-RAF иB-RAF также, по-видимому, присутствуют повсеместно, но наиболее высоко экспрессируются в урогенитальных и мозговых тканях соответственно. Поскольку B-RAF высоко экспрессируется в тканях нервной системы, полагали, что она ограничивается указанными тканями, но впоследствии было обнаружено,что она экспрессируется более широко. Хотя все белки RAF могут связываться с активным Ras, B-raf наиболее сильно активируется онкогенным Ras и может быть основной мишенью онкогенного Ras в трансформированных клетках. Последние данные показали, что мутационная активация B-RAF обнаружена в ряде различных опухолей, включая более 65% злокачественных меланом, более 10% случаев колоректального рака (Davies,H., et al., 2002, Nature, Vol. 417, pp. 949-954; Rajagopalan, H., et al., 2002, Nature. Vol. 418, p. 934), рака яичников (Singer, G., et al., 2003, J. Natl. Cancer Inst. Vol. 95, pp. 484-486) и папиллярного рака щитовидной железы (Brose, М., et al., 2002, Cancer Res. Vol. 62, pp. 6997-7000; Cohen, Y., et al., 2003, Invest. Ophthalmol. Vis. Sci. Vol. 44, pp. 2876-2878). Ряд различных мутаций B-RAF идентифицированы в различных опухолях, при этом наиболее часто встречается мутация V600E в так называемой активационной петле киназного домена (Davies, H., et al., 2002, Nature, Vol. 417, pp. 949-954). Другие мутации B-RAF, которые, как обнаружено, связаны с раковыми заболеваниями у человека,необязательно могут активировать B-RAF непосредственно, но обеспечивают повышающую регуляцию активности пути ras-raf-MEK-ERK по механизмам, которые еще не полностью понятны, но могут включать перекрестное влияние с другими изоформами RAF, такими как A-RAF (Wan, P., et al., 2004, Cell,Vol. 116, pp. 855-867). В таких случаях подавление активности RAF также является целью, обеспечивающей положительный эффект при лечении рака. Помимо связи между B-RAF и некоторыми видами рака, имеется значительное количество данных,указывающих на то, что более широкое подавление активности RAF может обеспечивать преимущество в качестве противоопухолевой терапии. Блокирование пути на уровне B-RAF могло бы быть эффективным для противодействия повышающей регуляции указанного пути, вызванной онкогенными мутациямиras, а также в случае опухолей, отвечающих на активацию фактора роста по указанному пути. Результаты генетических исследований на Drosophila и С. elegans показывают, что гомологи RAF важны для rasзависимого воздействия на дифференцировку (Dickson, В., et al., 1993, Nature. Vol. 360, pp. 600-603). Введение конститутивно активной MEK в клетки NIH3T3 может оказывать трансформирующее действие, в то время как экспрессия доминантных негативных белков MEK может подавлять онкогенность rasтрансформированных клеточных линий (Mansour, S.J., et al., 1994, Science, Vol. 265, pp. 966-970; Cowely,S., et al., 1994, Cell, Vol. 77, pp. 841-852). Также было обнаружено, что экспрессия доминантного негативного белка raf подавляет ras-зависимую передачу сигналов, так же, как это делает подавление экспрессии raf при помощи антисмыслового олигонуклеотидного конструкта (Koch, W., et al., 1991, Nature.Vol. 349, pp. 426-428; Bruder, T.T., et al., 1992, Genes and Development. Vol. 6, pp. 545-556). Эти и другие данные позволяют предположить, что подавление активности RAF (например, B-RAF) могло бы обеспечивать преимущество при лечении рака, и что подавление активности RAF (например,B-RAF) обеспечивало бы особенное преимущество при тех видах рака, которые содержат конститутивно активированную мутацию B-raf. Путь raf-MEK-ERK оказывает воздействие вниз по каскаду с привлечением многих рецепторов и раздражителей, что указывает на широкий спектр влияния на регуляцию клеточных функций. По указанной причине ингибиторы RAF могут найти применение при других болезненных состояниях, связанных с повышающей регуляцией передачи сигналов по указанному пути. Путь raf-MEK-ERK также является важным компонентом нормального ответа нетрансформированных клеток на действие фактора роста. Поэтому ингибиторы RAF могут быть полезны при заболеваниях, при которых имеет место ненадлежащая или избыточная пролиферация нормальных тканей. Указанные заболевания включают, но не ограничиваются ими, гломерулонефрит и псориаз. Путь передачи сигналов в клетках, частью которого является RAF, также связывают с воспалительными нарушениями, характеризующимися пролиферацией Тклеток (активацией и ростом Т-клеток), такими как отторжение ткани трансплантата, эндотоксический шок и гломерулонефрит. Было показано, что RAF (например, B-RAF) является подходящей терапевтической мишенью при гиперпролиферативных расстройствах, таких как рак. Активированные варианты RAF (например, BRAF) способны трансформировать клетки млекопитающих, обеспечивая возможность приобретения ими характеристик раковых клеток, при этом рост указанных клеток становится зависимым от мутантного белка RAF (например, В-RAF). Подавление активности RAF (например, B-RAF) в линии клеток рака человека, экспрессирующих мутантные формы RAF (например, B-RAF), блокирует их рост и в конечном итоге вызывает их гибель. Ангиогенез. Хронические пролиферативные заболевания часто сопровождаются сильным ангиогенезом, который может вносить вклад, или поддерживать воспалительное и/или пролиферативное состояние, или приводить к разрушению тканей за счет инвазивной пролиферации кровеносных сосудов (Folkman, 1997,EXS, Vol. 79, pp. 1-81; Folkman, 1995, Nature Medicine. Vol. 1, pp. 27-31; Folkman and Shing, 1992, J. Biol.Chem., Vol. 267, p. 10931). Ангиогенез в общем случае используют для описания развития новых или замещающих кровеносных сосудов или неоваскуляризации. Это необходимый и физиологически нормальный процесс, благодаря которому формируется сосудистая сеть у эмбриона. В целом, ангиогенез не наблюдается в большинстве нормальных тканей у взрослых, за исключением мест протекания овуляции, менструации и заживления ран. Однако многие заболевания характеризуются персистирующим и нерегулируемым ангиогенезом. Например, при артрите новые капиллярные кровеносные сосуды внедряются в сустав и разрушают хрящ (Colville-Nash and Scott, 1992, Ann. Rhum. Dis., Vol. 51, p. 919). При диабете (и при многих различных болезнях глаз) новые сосуды внедряются в пятно или сетчатку или другие структуры глаза и могут привести к слепоте (Brooks et al., 1994, Cell, Vol. 79, p. 1157). С ангиогенезом связывают процесс атеросклероза (Kahlon et al., 1992, Can. J. Cardiol. Vol. 8, p. 60). Обнаружено, что рост опухоли и метастазирование зависят от ангиогенеза (Folkman, 1992, Cancer Biol., Vol. 3, p. 65; Denekamp, 1993, Br. J. Rad.Vol. 66, p. 181; Fidlerand Ellis, 1994, Cell, Vol. 79, p. 185). Выявление вовлеченности ангиогенеза в основные заболевания сопровождалось исследованиями,направленными на идентификацию и разработку ингибиторов ангиогенеза. Указанные ингибиторы в общем случае классифицируют по отклику на отдельные мишени в каскаде ангиогенеза, такому как активация эндотелиальных клеток ангиогенным сигналом; синтез и высвобождение деструктивных ферментов; миграция эндотелиальных клеток; пролиферация эндотелиальных клеток; и образование капиллярных трубок. Следовательно, ангиогенез протекает на многих стадиях, и предпринимаются попытки обнаружения и разработки соединений, которые блокируют ангиогенез на указанных различных стадиях. В ряде публикаций сообщается, что ингибиторы ангиогенеза, действующие по различным механизмам, оказывают положительный эффект при таких заболеваниях, как рак и метастазирование (O'Reilly etal., 1995, Cell. Immun., Vol. 160, p. 178) и гемангиома (Taraboletti et al., 1995, J. Natl. Cancer Inst., Vol. 87,p. 293). РТК. Рецепторные тирозинкиназы (РТК) играют важную роль в передаче биохимических сигналов через плазматическую мембрану клеток. Указанные трансмембранные молекулы характеристически состоят из внеклеточного лиганд-связывающего домена, соединенного через сегмент в плазматической мембране с внутриклеточным доменом тирозинкиназы. Связывание лиганда с рецептором приводит к стимуляции связанной с рецептором активности тирозинкиназы, что ведет к фосфорилированию остатков тирозина как в рецепторе, так и в других внутриклеточных белках, приводя ко множеству клеточных ответов. В настоящее время идентифицировано по меньшей мере девятнадцать отдельных подсемейств РТК, определяемых гомологией аминокислотных последовательностей. ФРФ-Р. Сигнальные полипептиды из семейства фактора роста фибробластов (ФРФ) регулируют широкий спектр физиологических функций, включая митогенез, заживление ран, дифференцировку клеток и ангиогенез, и развитие. Как нормальный, так и злокачественный рост клеток, а также пролиферация подвержены воздействию изменений локальной концентрации указанных внеклеточных сигнальных молекул, выступающих в качестве аутокринных и паракринных факторов. Аутокринная передача сигналов ФРФ может вносить особый вклад в прогрессирование зависимых от стероидных гормонов видов рака и состояние независимости от гормонов (Powers et al., 2000, Endocr. Relat. Cancer. Vol. 7, pp. 165-197). ФРФ и их рецепторы экспрессируются в повышенных количествах в некоторых тканях и клеточных линиях, и полагают, что сверхэкспрессия вносит вклад в злокачественный фенотип. Кроме того, ряд онкогенов являются гомологами генов, кодирующих рецепторы факторов роста, и существует потенциал для аберрантной активации зависимой от ФРФ передачи сигналов при раке поджелудочной железы у людей (Ozawa et al., 2001, Teratoq. Carcinoq. Mutagen., Vol. 21, pp. 27-44). Двумя прототипными членами семейства являются кислотный фактор роста фибробластов (кФРФ или ФРФ 1) и основный фактор роста фибробластов (оФРФ или ФРФ 2), и к настоящему моменту идентифицировано по меньшей мере двадцать отдельных членов семейства ФРФ. Клеточный ответ на ФРФ передается через четыре типа высокоаффинных трансмембранных тирозинкиназных рецепторов фактора роста фибробластов, пронумерованных от 1 до 4 (от ФРФ-Р 1 до ФРФ-Р 4). При связывании лиганда рецептор димеризуется и ауто- или транс-фосфорилирует конкретные цитоплазматические остатки тирозина для переноса внутриклеточного сигнала, который в конечном итоге достигает эффекторов транскрипционного фактора в ядре. Разрушение пути ФРФ-Р 1 должно влиять на пролиферацию опухолевых клеток, поскольку указанная киназа активируется во многих типах опухолей в дополнение к пролиферации эндотелиальных клеток. В сверхэкспрессии и активации ФРФ-Р 1 в связанной с опухолью сосудистой сети, как полагают, и заключается роль указанных молекул в опухолевом ангиогенезе. ФРФ-Р 2 является высокоаффинным к кислотному и/или основному факторам роста фибробластов,а также к лигандам фактора роста кератиноцитов. ФРФ-Р 2 также передает мощное остеогенное действие ФРФ в процессе роста и дифференцировки остеобластов. Было показано, что мутации в ФРФ-Р 2, приводящие к комплексным функциональным изменениям, индуцируют патологическое окостенение черепных швов (краниосиностоз), что подразумевает главную роль передачи сигналов ФРФ-Р во внутримембранном формировании кости. Например, большинство случаев синдрома Апера (АР), характеризующегося преждевременным окостенением черепных швов, связано с точечными мутациями, приводящими к появлению новой функции белкового продукта гена (gain-of-function), в ФРФ-Р 2 (Lemonnier et al., 2001,J. Bone Miner. Res., Vol. 16, pp. 832-845). Некоторые серьезные отклонения в развитии скелета человека, включая синдромы Апера, Крузона,Джексона-Вейсса, cutis gyrata Биара-Стивенсона и синдром Пфейфера, связаны с мутациями в ФРФ-Р 2. Большинство, если не все, случаи синдрома Пфейффера (PS) также вызваны de novo мутацией в гене ФРФ-Р 2 (Meyers et al., 1996, Am. J. Hum. Genet. Vol. 58, pp. 491-498; Plomp et al., 1998, Am. J. Med. Genet.Vol. 75, 245-251), при этом недавно было показано, что мутации в ФРФ-Р 2 приводят к нарушению одного из основных принципов управления специфичностью лигандов. В частности, две мутантных сплайсированных формы рецептора фактора роста фибробластов, ФРФ-Р 2 с и ФРФ-Р 2b, обладают приобретенной способностью связываться с нетипичными лигандами ФРФ и активироваться ими. Потеря лигандной специфичности приводит к аберрантной передаче сигналов, что позволяет предположить, что тяжелые фенотипы указанных болезненных синдромов являются результатом эктопической лигандзависимой активации ФРФ-Р 2 (Yu et al., 2000, Proc. Natl. Acad. Sci. U.S.A., Vol. 97, pp. 14536-14541). Активирующие мутации рецепторной тирозинкиназы ФРФ-Р 3, такие как хромосомные транслокации или точечные мутации, приводят к появлению конститутивно активных рецепторов ФРФ-Р 3 с нарушенной регуляцией, которые связывают с развитием множественной миеломы и карцином мочевого пузыря и шейки матки (Powers, C.J., et al., 2000, Endocr. Rel. Cancer. Vol. 7, p. 165). Соответственно, подавление ФРФ-Р 3 могло бы быть полезным при лечении множественной миеломы, карцином мочевого пузыря и шейки матки. СЭФР-Р. Сосудистый эндотелиальный фактор роста (СЭФР), представляющий собой полипептид, является митогенным для эндотелиальных клеток in vitro и стимулирует ангиогенные ответы in vivo. СЭФР также связывают с ненадлежащим ангиогенезом (Pinedo, H.M., et al., 2000, The Oncologist, Vol. 5 (90001), pp. 12). СЭФР-Р представляют собой белковые тирозинкиназы (БТК). БТК катализируют фосфорилирование конкретных тирозильных остатков в белках, участвующих в регуляции роста клеток и дифференцировки.Immunol., Vol. 7(4), pp. 267-277; Chan, A.C., 1996, Curr. Opin. Immunol., Vol. 8(3), pp. 394-401). Были идентифицированы три рецептора БТК для СЭФР: СЭФР-Р 1 (Flt-1), СЭФР-Р 2 (Flk-1 илиKDR) и СЭФР-Р 3 (Flt-4). Указанные рецепторы участвуют в ангиогенезе и принимают участие в сигнальной трансдукции (Mustonen, Т., et al., 1995, J. Cell. Biol. Vol. 129, pp. 895-898). Особый интерес представляет СЭФР-Р 2, который представляет собой трансмембранный рецептор БТК, экспрессируемый преимущественно в эндотелиальных клетках. Активация СЭФР-Р 2 под действием СЭФР является критической стадией в пути сигнальной трансдукции, инициирующем опухолевый ангиогенез. Экспрессия СЭФР может быть конститутивной особенностью опухолевых клеток, а также может подвергаться повышающей регуляции в ответ на некоторые стимулы. Одним из подобных стимулов является гипоксия, при которой имеет место повышающая регуляция экспрессии СЭФР как в опухоли,так и в связанных с ней тканях организма-хозяина. Лиганд СЭФР активирует СЭФР-Р 2 путем связывания с внеклеточным центром связывания СЭФР. Это приводит к димеризации рецептора СЭФР-Р и аутофосфорилированию остатков тирозина во внутриклеточном домене киназы СЭФР-Р 2. Домен киназы обеспечивает перенос фосфата от АТФ к остаткам тирозина, тем самым обеспечивая центры связывания для сигнальных белков, расположенных в каскаде ниже СЭФР-Р 2, что приводит в конечном итоге к инициированию ангиогенеза (McMahon, G., 2000, The Oncologist. Vol. 5(90001), pp. 3-10). Подавление в центре связывания киназного домена СЭФР-Р 2 блокировало бы фосфорилирование остатков тирозина и обеспечивало нарушение инициирования ангиогенеза.TIE. Ангиопоэтин 1 (Ang1), лиганд эндотелий-специфической рецепторной тирозинкиназы TIE-2, представляет собой новый ангиогенный фактор (Davis et al., 1996, Cell., Vol. 87, pp. 1161-1169; Partanen et al.,1992, Mol. Cell. Biol., Vol. 12, pp. 1698-1707; патенты США 5521073; 5879672; 5877020; и 6030831). Аббревиатура TIE означает "тирозинкиназа, содержащая домены, гомологичные Ig и ЭФР". TIE применяют для идентификации класса рецепторных тирозинкиназ, которые экспрессируются исключительно в клетках сосудистого эндотелия и ранних кроветворных клетках. Обычно рецепторные киназы TIE характеризуются присутствием ЭФР-подобного домена и иммуноглобулин-подобного домена, который состоит из внеклеточных доменов, стабилизированных межцепочечными дисульфидными связями (Partanen etal., 1999, Curr. Topics Microbiol. Immunol., Vol. 237, pp. 159-172). В отличие от СЭФР, который действует на ранних стадиях развития сосудов, Ang1 и его рецептор TIE-2 действуют на поздних стадиях развития сосудов, т.е. в ходе сосудистого ремоделирования (ремоделирование относится к образованию просвета сосудов) и созревания (Yancopoulos et al., 1998, Cell., Vol. 93, pp. 661-664; Peters, K.G., 1998, Circ. Res.,Vol. 83(3), pp. 342-343; Suri et al., 1996, Cell., Vol. 87, pp. 1171-1180). Следовательно, подавление TIE-2 предположительно могло бы подходить для нарушения ремоделирования и созревания новой сосудистой сети, инициируемых ангиогенезом, тем самым нарушая процесс ангиогенеза.Eph. Самое большое подсемейство рецепторных тирозинкиназ (РТК), семейство Eph, и их лиганды (эфрины) играют важную роль в физиологических и патологических сосудистых процессах. Как Eph (рецепторы), так и эфрины (лиганды) подразделяются на две группы - подсемейства А и В (Eph NomenclatureCommittee, 1997). Связывание эфриновых лигандов с рецепторами Eph зависит от взаимодействий клетка-клетка. Недавно было показано, что взаимодействия эфринов и Eph осуществляются посредством двунаправленной передачи сигналов. Эфрины, связываясь с рецепторами Eph, инициируют фосфорилирование конкретных остатков тирозина в цитоплазматическом домене рецепторов Eph. В ответ на связывание с рецептором Eph эфриновый лиганд также подвергается фосфорилированию тирозина, так называемой "обратной" передаче сигнала (Holland, S.J., et al., 1996, Nature, Vol. 383, pp. 722-725; Bruckner etPTK Eph и их эфриновые лиганды играют важную роль в эмбриональном развитии сосудов. Разрушение конкретных рецепторов Eph и лигандов (включая эфрин-В 2) приводит к нарушениям ремоделирования сосудов, формирования сосудистой структуры и разрастанию сосудов, приводя к гибели эмбриона(Wang, H.U., et al., 1998, Cell., Vol. 93, pp. 741-753; Adams, R.H., et al., 1999, Genes Dev. Vol. 13, pp. 295306; Gale and Yancopoulos, 1999, Genes Dev, Vol. 13, pp. 1055-1066; Helbling, P.M., et al., 2000, Development, Vol. 127, pp. 269-278). Координированная экспрессия системы Eph/эфрин определяет фенотип эмбриональных сосудистых структур: эфрин-В 2 присутствует в артериальных эндотелиальных клеткахEph и эфрины вовлечены в процессы роста опухолей и ангиогенеза. Было обнаружено, что Eph и эфрины сверхэкспрессируются во многих опухолях у людей. В частности, идентифицирована роль EphB2 в мелкоклеточной карциноме легких (Tang, X.X., et al., 1999, ClinCancer Res. Vol. 5, pp. 455-460), нейробластомах у людей (Tang, X.X., et al., 1999, Clin Cancer Res, Vol. 5,pp. 1491-1496) и колоректальном раке (Liu, W., et al., 2004, Brit. J. Canc. Vol. 90, pp. 1620-1626), а также обнаружено, что более высокие уровни экспрессии Eph и эфринов, включая EphB2, коррелируют с большей скоростью развития и метастазирования опухолей (Nakamoto, M. and Bergemann, A.D., 2002,Microsc. Res. Tech. Vol. 59, pp. 58-67). Следовательно, полагают, что подавление EphB2 способно обеспечивать нарушение ангиогенеза, в частности, в некоторых опухолях, в которых наблюдается сверхэкспрессия. Авторами настоящего изобретения были обнаружены соединения, которые, например, подавляют активность RAF (например, B-RAF) и/или подходят для лечения, например, пролиферативных нарушений, рака и т.д. Краткое описание изобретения Один из аспектов настоящего изобретения относится к некоторым 8-замещенным пиридо[2,3b]пиразинам (обозначенным в настоящем описании как "соединения PDP8"), приведенным в настоящем описании. Другой аспект настоящего изобретения относится к композиции (например, фармацевтической композиции), содержащей соединение PDP8 согласно настоящему описанию и фармацевтически приемлемый носитель или разбавитель. Другой аспект настоящего изобретения относится к способу получения композиции (например,фармацевтической композиции), включающему стадию смешивания соединения PDP8 согласно настоящему описанию и фармацевтически приемлемого носителя или разбавителя. Другой аспект настоящего изобретения относится к способу подавления активности RAF (напри-5 019974 мер, B-RAF) в клетке, in vitro или in vivo, включающему приведение указанной клетки в контакт с эффективным количеством соединения PDP8 согласно настоящему описанию. Другой аспект настоящего изобретения относится к способу подавления активности рецепторной тирозинкиназы (РТК), такой как ФРФ-Р, Tie, СЭФР-Р и/или активности Eph, например ФРФ-Р 1, ФРФ-Р 2,ФРФ-Р 3, Tie2, СЭФР-Р 2 и/или активности EphB2 в клетке, in vitro или in vivo, включающему приведение указанной клетки в контакт с эффективным количеством соединения PDP8 согласно настоящему описанию. Другой аспект настоящего изобретения относится к способу регулирования (например, подавления) клеточной пролиферации (например, пролиферации клетки), подавления развития клеточного цикла,стимулирования апоптоза или сочетанию одного или нескольких указанных способов, in vitro или in vivo,включающему приведение указанной клетки в контакт с эффективным количеством соединения PDP8 согласно настоящему описанию. Другой аспект настоящего изобретения относится к способу лечения, включающему введение субъекту, нуждающемуся в указанном лечении, терапевтически эффективного количества соединения PDP8 согласно настоящему описанию предпочтительно в виде фармацевтической композиции. Другой аспект настоящего изобретения относится к соединению PDP8 согласно настоящему описанию для применения в способе лечения человека или животного при помощи терапии. Другой аспект настоящего изобретения относится к соединению PDP8 согласно настоящему описанию для применения в способе лечения человека или животного, причем указанное соединение применяют в сочетании с другими фармацевтически активными веществами. Другой аспект настоящего изобретения относится к применению соединения PDP8 согласно настоящему описанию для получения лекарственного средства для применения при лечении. Согласно одному из вариантов реализации указанное лечение представляет собой лечение заболевания или нарушения (например, рака), характеризующегося повышающей регуляцией и/или активациейRAF (например, B-RAF) и/или облегчаемого путем подавления RAF (например, B-RAF). Согласно одному из вариантов реализации указанное лечение представляет собой лечение заболевания или нарушения (например, рака), характеризующегося повышающей регуляцией и/или активацией рецепторной тирозинкиназы (РТК) и/или облегчаемого путем подавления рецепторной тирозинкиназы(РТК). Примеры РТК включают ФРФ-Р, Tie, СЭФР-Р и/или Eph, например ФРФ-Р 1, ФРФ-Р 2, ФРФ-Р 3,Tie2, СЭФР-Р 2 и/или EphB2. Согласно одному из вариантов реализации указанное лечение представляет собой лечение заболевания или нарушения, характеризующегося ненадлежащим, избыточным и/или нежелательным ангиогенезом. Согласно одному из вариантов реализации указанное лечение представляет собой лечение пролиферативного нарушения. Согласно одному из вариантов реализации указанное лечение представляет собой лечение рака. Согласно одному из вариантов реализации указанное лечение представляет собой лечение меланомы. Согласно одному из вариантов реализации указанное лечение представляет собой лечение колоректального рака. Другой аспект настоящего изобретения относится к набору, содержащему (а) соединение PDP8 согласно настоящему описанию, предпочтительно представленное в виде фармацевтической композиции и в подходящем контейнере и/или подходящей упаковке; и (б) инструкции по применению, например письменные инструкции по введению указанного соединения. Другой аспект настоящего изобретения относится к соединению PDP8, которое может быть получено при помощи способа синтеза согласно настоящему описанию или способа, включающего способ синтеза согласно настоящему описанию. Другой аспект настоящего изобретения относится к соединению PDP8, полученному по способу синтеза согласно настоящему описанию или способу, включающему способ синтеза согласно настоящему описанию. Другой аспект настоящего изобретения относится к новым промежуточным соединениям согласно настоящему описанию, подходящим для применения в способах синтеза согласно настоящему описанию. Другой аспект настоящего изобретения относится к применению указанных новых промежуточных соединений согласно настоящему описанию в способах синтеза согласно настоящему описанию. Для специалиста в данной области техники очевидно, что признаки и предпочтительные варианты реализации одного из аспектов настоящего изобретения будут также относиться к другим аспектам настоящего изобретения. Краткое описание чертежей Фиг. 1 представляет собой график относительного объема опухоли как функции количества дней с момента инокуляции для исследования 1 in vivo (AA-018) (не стандартизовано) (5 мг/кг/сутки) (внутрибрюшинно); фиг. 2 - график относительного объема опухоли как функции количества дней с момента инокуляции для исследования 2 in vivo (AA-018) (не стандартизовано) (10 мг/кг/сутки) (внутрибрюшинно); фиг. 3 - график относительного объема опухоли как функции количества дней с момента инокуляции для исследования 3 in vivo (AA-019) не стандартизовано) (5 мг/кг/сутки) (внутрибрюшинно); фиг. 4 - график относительного объема опухоли как функции количества дней с момента инокуляции для исследования 4 in vivo (AA-019) (не стандартизовано) (10 мг/кг/сутки) (внутрибрюшинно); фиг. 5 - график относительного объема опухоли как функции количества дней с момента инокуляции для исследования 5 in vivo (AA-019) (не стандартизовано) (15 мг/кг/сутки) (перорально); фиг. 6 - график относительного объема опухоли как функции количества дней с момента инокуляции для исследования 6 in vivo (AA-019) (стандартизовано) (10/5 мг/кг/сутки) (внутрибрюшинно); фиг. 7 - график относительного объема опухоли как функции количества дней с момента инокуляции для исследования 7 in vivo (AA-019) (стандартизовано) (15 мг/кг/сутки) (перорально); фиг. 8 - график относительного объема опухоли как функции количества дней с момента инокуляции для исследования 8 in vivo (AA-062) (стандартизовано) (50 мг/кг/сутки) (перорально); фиг. 9 - график относительного объема опухоли как функции количества дней с момента инокуляции для исследования 9 in vivo (AA-067) (стандартизовано) (10 мг/кг/сутки) (перорально); фиг. 10 - график относительного объема опухоли как функции количества дней с момента инокуляции для исследования 10 in vivo (AA-017) (стандартизовано) (20 мг/кг/сутки) (перорально). Подробное описание изобретения Соединения. Один из аспектов настоящего изобретения относится к соединениям, выбранным из соединений следующей формулы и фармацевтически приемлемых солей указанных соединений (для простоты в совокупности обозначенных в настоящем описании как "8-замещенные пиридо[2,3-b]пиразины" и "соединения PDP8"): где -RQ1 независимо представляет собой -Н, -R1, -R1X, -ОН, -NH2, -NHR1, -NR12 или -NRRARRB; где каждый -R1 независимо представляет собой C1-6 алкил; каждый -R1X независимо представляет собой C1-4 алкил, замещенный одной или несколькими группами, выбранными из -F, -Cl, -Br и -I; и-NRRARRB, если присутствует, независимо представляет собой пиперидино, пиперазино, морфолино и возможно замещен одной или несколькими группами, выбранными из C1-4 алкила;-RQ2 независимо представляет собой -Н, -R2, -R2X, -ОН, -NH2, -NHR2, -NR22 или -NRRCRRD; где каждый -R2 независимо представляет собой С 1-6 алкил; каждый -R2X независимо представляет собой C1-4 алкил, замещенный одной или несколькими группами, выбранными из -F, -Cl, -Br и -I; и-NRRCRRD, если присутствует, независимо представляет собой пиперидино, пиперазино или морфолино и возможно замещен одной или несколькими группами, выбранными из C1-4 алкила;-Х- независимо представляет собой -О-; где каждый n независимо равен 0 или 1; каждый RPH1 независимо представляет собой -F или -SR3; каждый -R3 независимо представляет собой C1-4 алкил; где каждый -RN1 независимо представляет собой -Н;-J независимо представляет собой фенил, пиразолил или пиридил и возможно замещен одним или более заместителями, выбранными из -F, -Cl, -Br, -I, -R4, -ОН, -OR4, -CF3, -OCF3 и -Ph, где каждый -R4 независимо представляет собой C1-4 алкил; и каждый -Ph обозначает фенил, возможно замещенный одним или более заместителями, выбранными из -F, -Cl, -Br, -I, -R5, -ОН, -OR5, -CF3 и -OCF3, где каждый -R5 независимо представляет собой C1-4 алкил. Согласно одному из вариантов реализации указанное соединение выбрано из соединений следующей формулы и фармацевтически приемлемых солей указанных соединений: где -RQ1 независимо представляет собой -Н, -ОН, -Me, -CF3, -CH2Br, -NH2, -NHMe, -NMe2, морфолино, пиперазино или N-метилпиперазино;-RQ2 независимо представляет собой -ОН, -Me, -CF3, -CH2Br, -NH2, -NHMe, -NMe2, морфолино, пиперазино или N-метилпиперазино или-RQ1 независимо представляет собой -ОН, -Me, -CF3, -CH2Br, -NH2, -NHMe, -NMe2, морфолино, пиперазино или N-метилпиперазино;-RQ2 независимо представляет собой -Н, -ОН, -Me, -CF3, -CH2Br, -NH2, -NHMe, -NMe2, морфолино,пиперазино или N-метилпиперазино;-Х- независимо представляет собой -О-. Согласно одному из вариантов реализации-RQ1 независимо представляет собой -Н, -ОН, -Me, -CF3, -CH2Br, -NH2, -NHMe, -NMe2, морфолино,пиперазино или N-метилпиперазино и-RQ2 независимо представляет собой -ОН, -Me, -CF3, -CH2Br, -NH2, -NHMe, -NMe2, морфолино, пиперазино или N-метилпиперазино; или-RQ1 независимо представляет собой -ОН, -Me, -CF3, -CH2Br, -NH2, -NHMe, -NMe2, морфолино, пиперазино или N-метилпиперазино и-RQ2 независимо представляет собой -Н, -ОН, -Me, -CF3, -CH2Br, -NH2, -NHMe, -NMe2, морфолино,пиперазино или N-метилпиперазино. Согласно одному из вариантов реализации-RQ2 независимо представляет собой -Н, -Me, -NH2, -NHMe, морфолино, пиперазино или Nметилпиперазино, или-RQ1 независимо представляет собой -Н, -Me, -NH2, -NHMe, морфолино, пиперазино или Nметилпиперазино и-RQ2 представляет собой -ОН. Согласно одному из вариантов реализации-RQ2 представляет собой -Me или -NH2. Согласно одному из вариантов реализации -RQ1 представляет собой -ОН и -RQ2 представляет собой-Н. Согласно одному из вариантов реализации -RQ1 представляет собой -Н и -RQ2 представляет собой-ОН. Согласно одному из вариантов реализации -RQ1 представляет собой -ОН и -RQ2 представляет собой-ОН. Согласно одному из вариантов реализации-RQ1 независимо представляет собой -Н, -Me, -NH2, -NHMe, морфолино, пиперазино или Nметилпиперазино и-RQ2 независимо представляет собой -Me, -NH2, -NHMe, морфолино, пиперазино или Nметилпиперазино; или-RQ1 независимо представляет собой -Me, -NH2, -NHMe, морфолино, пиперазино или Nметилпиперазино и-RQ2 независимо представляет собой -Н, -Me, -NH2, -NHMe, морфолино, пиперазино или Nметилпиперазино. Согласно одному из вариантов реализации и каждый -RPH1 независимо представляет собой -F или -SR3; где каждый -R3 независимо представ-8 019974 ляет собой C1-4 алкил. Согласно одному из вариантов реализации -M- независимо представляет собой Согласно одному из вариантов реализации -M- независимо представляет собой и каждый -RPH1 независимо представляет собой -F или -SR3; где каждый -R3 независимо представляет собой С 1-4 алкил. Согласно одному из вариантов реализации -M- независимо представляет собой Согласно одному из вариантов реализации -M- независимо представляет собой Согласно одному из вариантов реализации -M- независимо представляет собой Согласно одному из вариантов реализации -L- независимо представляет собой где каждый -RN1 независимо представляет собой -Н. Согласно одному из вариантов реализации -J независимо представляет собой фенил и является возможно замещенным. Согласно одному из вариантов реализации -J независимо представляет собой пиразолил и является возможно замещенным. Согласно одному из вариантов реализации -J независимо представляет собой 1 Н-пиразол-5-ил и является возможно замещенным. Согласно одному из вариантов реализации -J независимо представляет собой пиридил и является возможно замещенным. Согласно одному из вариантов реализации -J независимо представляет собой пирид-3-ил и является возможно замещенным. Согласно одному из вариантов реализации -J независимо представляет собой-9 019974 где -RPY1 независимо представляет собой фенил или пиридил и может содержать один или несколько заместителей, выбранных из -F, -Cl, -Br, -I, -R5, -ОН, -OR5, -CF3 и -OCF3; и-RPY2 независимо представляет собой -R4. Согласно одному из вариантов реализации -J независимо представляет собой где -RPY1 независимо представляет собой фенил и может содержать один или несколько заместителей, выбранных из -F, -Cl, -Br, -I, -R5, -ОН, -OR5, -CF3 и -OCF3; и-RPY2 независимо представляет собой -R4. Согласно одному из вариантов реализации -RPY1 независимо представляет собой фенил и может содержать один или несколько заместителей, выбранных из -F, -Cl, -Br, -I, -R5, -ОН и -OR5, где -R5 представляет собой -Me. Согласно одному из вариантов реализации -RPY1 независимо представляет собой фенил и может содержать один или несколько заместителей, выбранных из -R5, где -R5 представляет собой -Me. Согласно одному из вариантов реализации -RPY2 независимо представляет собой -tBu. Согласно одному из вариантов реализации -J независимо представляет собой Согласно одному из вариантов реализации -J независимо выбран из Согласно одному из вариантов реализации -J независимо представляет собой где m независимо равно 0, 1 или 2; каждый -RPH2 независимо представляет собой -F, -Cl, -Br, -I, -R4, -ОН, -OR4, -CF3 или -OCF3, где каждый -R4 независимо представляет собой C1-4 алкил. Согласно одному из вариантов реализации -RPH2, если он присутствует, независимо представляет собой -F, -Cl, -tBu, -CF3 или -OCF3. Комбинации. Каждая и любая совместимая комбинация приведенных выше вариантов реализации находится в рамках настоящего изобретения, как если бы указанная комбинация была приведена отдельно и подробно охарактеризована. Примеры конкретных вариантов реализации Согласно одному из вариантов реализации соединения выбраны из соединений следующих формул и фармацевтически приемлемых солей указанных соединений: По существу, очищенные формы. Один из аспектов настоящего изобретения относится к соединениям PDP8 согласно настоящему описанию, по существу, в очищенной форме и/или в форме, по существу, не содержащей примесей. Согласно одному из вариантов реализации, по существу, очищенная форма составляет по меньшей мере 50 мас.%, например по меньшей мере 60 мас.%, например по меньшей мере 70 мас.%, например по меньшей мере 80 мас.%, например по меньшей мере 90 мас.%, например по меньшей мере 95 мас.%, например по меньшей мере 97 мас.%, например по меньшей мере 98 мас.%, например по меньшей мере 99 мас.%. Если не указано иное, по существу, очищенная форма относится к соединению в любой стереоизомерной или энантиомерной форме. Например, согласно одному из вариантов реализации, по существу,очищенная форма относится к смеси стереоизомеров, т.е. очищенной по отношению к другим соединениям. Согласно одному из вариантов реализации, по существу, очищенная форма относится к одному стереоизомеру, например оптически чистому стереоизомеру. Согласно одному из вариантов реализации,по существу, очищенная форма относится к смеси энантиомеров. Согласно одному из вариантов реализации, по существу, очищенная форма относится к эквимолярной смеси энантиомеров (т.е. рацемической смеси, рацемату). Согласно одному из вариантов реализации, по существу, очищенная форма относится к одному энантиомеру, например оптически чистому энантиомеру. Согласно одному из вариантов реализации примеси присутствуют в количестве не более 50 мас.%,например не более 40 мас.%, например не более 30 мас.%, например не более 20 мас.%, например не более 10 мас.%, например не более 5 мас.%, например не более 3 мас.%, например не более 2 мас.%, например не более 1 мас.%. Если не указано иное, "примеси" относится к другим соединениям, т.е. к соединениям, отличным от стереоизомеров или энантиомеров. Согласно одному из вариантов реализации "примеси" относится к другим соединениям и другим стереоизомерам. Согласно одному из вариантов реализации "примеси" относится к другим соединениям и другому энантиомеру. Согласно одному из вариантов реализации, по существу, очищенная форма является по меньшей мере на 60% оптически чистой (т.е. 60% соединения в молярном соотношении представляет собой целевой стереоизомер или энантиомер, а 40% представляет собой нецелевой стереоизомер или энантиомер),например по меньшей мере на 70% оптически чистой, например по меньшей мере на 80% оптически чистой, например по меньшей мере на 90% оптически чистой, например по меньшей мере на 95% оптически чистой, например по меньшей мере на 97% оптически чистой, например по меньшей мере на 98% оптически чистой, например по меньшей мере на 99% оптически чистой. Изомеры. Некоторые соединения могут существовать в виде одной или нескольких конкретных геометрических, оптических, энантиомерных, диастереомерных, эпимерных, атропоизомерных, стереоизомерных,таутомерных, конформационных или аномерных форм, включая, но не ограничиваясь ими, цис- и трансформы; Е- и Z-формы; с-, t- и r-формы; эндо- и экзоформы; R-, S- и мезоформы; D- и L-формы; d- и l- 21019974 формы; (+)- и (-)-формы; кето-, енол- и енолятформы; син- и антиформы;синклинальные и антиклинальные формы; - и -формы; аксиальные и экваториальные формы; формы "ванна", "кресла", "твист","конверт" и "полукресло" и комбинации указанных форм, здесь и далее обобщенно упоминаемых как"изомеры" (или "изомерные формы"). Следует отметить, что за исключением обсуждаемых ниже таутомерных форм из термина "изомеры" согласно настоящему описанию специально исключены структурные изомеры (или изомеры строения) (т.е. изомеры, которые отличаются соединениями между атомами, а не только расположением атомов в пространстве). Например, указание метоксигруппы, -ОСН 3, не следует рассматривать как указание ее структурного изомера, гидроксиметильной группы -СН 2 ОН. Аналогично, указание ортохлорфенила не следует рассматривать как указание его структурного изомера, метахлорфенила. Однако указание класса структур вполне может включать структурно изомерные формы, попадающие в указанный класс (например, C1-7 алкил включает н-пропил и изопропил; бутил включает н-, изо-, втор- и трет-бутил; метоксифенил включает орто-, мета- и параметоксифенил). Вышеуказанное исключение не относится к таутомерным формам, например кето-, енол- и енолятформам, таким как, например, следующие таутомерные пары: кето/енол (показана ниже), имин/енамин,амид/иминоспирт, амидин/амидин, нитрозо/оксим, тиокетон/ентиол, N-нитрозо/гидроксиазо и нитро/ацинитро. Следует отметить, что в термин "изомер" специально включены соединения с одним или несколькими изотопными замещениями. Например, Н может находиться в любой изотопной форме, включая 1 Н,2 Н (D) и 3 Н (Т); С может находиться в любой изотопной форме, включая 12 С, 13 С и 14 С; О может находиться в любой изотопной форме, включая 16 О и 18 О; и т.п. Если не указано иное, указание конкретного соединения включает все такие изомерные формы,включая смеси (например, рацемические смеси) указанных форм. Способы получения (например, асимметрический синтез) и разделения (например, дробная кристаллизация и хроматографические методы) указанных изомерных форм либо известны в данной области техники, либо легко могут быть получены путем адаптирования способов, приведенных в настоящем описании, или известных способов, известным образом. Соли. Может быть удобно или желательно получать, очищать и/или обрабатывать соответствующую соль соединения, например фармацевтически приемлемую соль. Примеры фармацевтически приемлемых солей обсуждаются в Berge et al., 1977, "Pharmaceutically Acceptable Salts". J. Pharm. Sci., Vol. 66, pp. 1-19. Например, если соединение обладает анионной природой или содержит функциональную группу,которая может образовывать анион (например, -СООН может существовать в виде СОО-), соль может быть образована подходящим катионом. Примеры подходящих неорганических катионов включают, но не ограничиваются ими, ионы щелочных металлов, такие как Na+ и K+, щелочно-земельные катионы,такие как Са 2+ и Mg2+, и другие катионы, такие как Al+3. Примеры подходящих органических катионов включают, но не ограничиваются ими, ион аммония (т.е. NH4+) и замещенные ионы аммония (например,NH3R+, NH2R2+, NHR3+, NR4+). Примерами некоторых подходящих замещенных ионов аммония являются ионы, полученные из этиламина, диэтиламина, дициклогексиламина, триэтиламина, бутиламина, этилендиамина, этаноламина, диэтаноламина, пиперазина, бензиламина, фенилбензиламина, холина, меглумина и трометамина, а также аминокислот, таких как лизин и аргинин. Примером обычного четвертичного аммониевого иона является N(CH3)4+. Если соединение имеет катионную природу или содержит функциональную группу, которая может образовывать катион (например, -NH2 может существовать в виде -NH3+), соль может быть образована подходящим анионом. Примеры подходящих неорганических анионов включают, но не ограничиваются ими, анионы, полученные из следующих неорганических кислот: соляной, бромисто-водородной, йодисто-водородной, серной, сернистой, азотной, азотистой, фосфорной и фосфористой. Примеры подходящих органических анионов включают, но не ограничиваются ими, анионы, полученные из следующих органических кислот: 2-ацетоксибензойной, уксусной, аскорбиновой, аспарагиновой, бензойной, камфорсульфоновой, коричной, лимонной, этилендиаминтетрауксусной, этандисульфоновой, этансульфоновой, фумаровой, глюкогептоновой, глюконовой, глутамовой, гликолевой, гидроксималеиновой, гидроксинафталинкарбоновой, изэтионовой, молочной, лактобионовой, лауриловой, малеиновой, яблочной, метансульфоновой, муциновой, олеиновой, щавелевой, пальмитиновой, памовой, пантотеновой, фенилуксусной, фенилсульфоновой, пропионовой, пировиноградной, салициловой, стеариновой, янтарной, сульфаниловой, виннокаменной, толуолсульфоновой и валериановой. Примеры подходящих полимерных органических анионов включают, но не ограничиваются ими, анионы, полученные из следующих полимерных кислот: дубильной кислоты, карбоксиметилцеллюлозы. Если не указано иное, указание конкретного соединения также включает солевые формы указанного соединения. Химически защищенные формы. Может быть удобно или желательно получать, очищать и/или обрабатывать соединение в химически защищенной форме. Термин "химически защищенная форма", используемый в настоящем описании в общеупотребительном в области химии смысле, относится к соединению, в котором одна или несколько реакционноспособных функциональных групп защищены от нежелательных химических реакций в определенных условиях (например, рН, температура, излучение, растворитель и т.п.). На практике используют широкоизвестные химические способы для того, чтобы обратимо сделать нереакционноспособной функциональную группу, которая иначе была бы реакционноспособной в определенных условиях. В химически защищенной форме одна или несколько реакционноспособных функциональных групп находится в форме защищенной или защитной группы (также известной как маскируемая или маскирующая группа или блокированная или блокирующая группа). Благодаря защите реакционноспособной функциональной группы можно осуществлять реакции, в которых участвуют другие незащищенные реакционноспособные функциональные группы, не воздействуя при этом на защищенную группу; защитные группы можно удалить обычно на последующей стадии, по существу, не затрагивая остальную часть молекулы. См., например, Protective Groups in Organic Synthesis (Т. Green and P. Wuts; 3rd Edition; JohnWiley and Sons, 1999). Широкий спектр подобных способов "защиты", "блокирования" или "маскировки" широко используется и хорошо известен в органическом синтезе. Например, соединение, содержащее две неэквивалентные реакционноспособные функциональные группы, каждая из которых может вступать в реакцию при определенных условиях, можно превратить в производное, чтобы сделать одну из функциональных групп "защищенной" и вследствие этого нереакционноспособной в определенных условиях; защищенное таким образом соединение можно использовать в качестве реагента, содержащего фактически только одну реакционноспособную функциональную группу. После завершения целевой реакции (с участием другой функциональной группы) с защищенной группы можно "снять защиту", чтобы вернуть ей ее изначальные функциональные свойства. Например, гидроксильную группу можно защитить в виде простого эфира (-OR) или сложного эфира (-OC(=O)R), например в виде трет-бутилового простого эфира; бензилового, бензгидрилового (дифенилметилового) или тритилового (трифенилметилового) простого эфира; триметилсилилового или третбутилдиметилсилилового простого эфира; или ацетилового сложного эфира (-ОС(=О)СН 3, -ОАс). Например, альдегидную или кетонную группу можно защитить в виде ацеталя (R-CH(OR)2) или кеталя (R2C(OR)2) соответственно, в которых карбонильная группа (С=О) превращена в диэфирную(C(OR)2), путем взаимодействия, например, с первичным спиртом. Альдегидную или кетонную группу легко регенерировать путем гидролиза с использованием большого избытка воды в присутствии кислоты. Например, аминную группу можно защитить, например, в виде амида (-NRCO-R) или уретана(-NH-Nvoc), 2-триметилсилилэтилоксиамида (-NH-Teoc), 2,2,2-трихлорэтилоксиамида (-NH-Troc), аллилоксиамида (-NH-Alloc), 2-(-фенилсульфонил)этилоксиамида (-NH-Psec); или в подходящих случаях (например, циклические амины) в виде радикала нитроксида (N-O). Например, карбоксильную группу можно защитить в виде сложного эфира, например в виде C1-7 алкилового сложного эфира (например, метилового сложного эфира, трет-бутилового сложного эфира);C1-7 галоалкилового сложного эфира (например, С 1-7 тригалоалкилового сложного эфира); три-С 1-7 алкилсилил-С 1-7 алкилового сложного эфира или С 5-20 арил-С 1-7 алкилового сложного эфира (например, бензилового сложного эфира, нитробензилового сложного эфира); или в виде амида, например в виде метиламида. Например, тиольную группу можно защитить в виде тиоэфира (-SR), например в виде бензилового тиоэфира; в виде ацетамидометилового тиоэфира (-S-CH2NHC(=O)CH3). Пролекарства. Может быть удобно или желательно получать, очищать и/или обрабатывать соединение в виде пролекарства. Термин "пролекарство" в настоящем описании относится к соединению, которое, метаболизируясь (например, in vivo), превращается в целевое активное соединение. Обычно пролекарство неактивно или менее активно, чем целевое активное соединение, но может обеспечивать преимущества с точки зрения переработки, введения или метаболических свойств. Например, некоторые пролекарства представляют собой сложные эфиры активного соединения(например, физиологически приемлемые метаболически неустойчивые сложные эфиры). В процессе метаболизма сложноэфирная группа (-C(=O)OR) отщепляется с образованием активного лекарственного средства. Подобные сложные эфиры можно получить этерификацией, например, любой из групп карбоновой кислоты (-С(=О)ОН) в исходном соединении, при помощи, если необходимо, предварительной защиты любых других реакционноспособных групп, присутствующих в исходном соединении, с последующим снятием защиты, если необходимо. Также некоторые пролекарства активируются ферментативно с образованием активного соединения или соединения, которое, подвергаясь дальнейшим химическим реакциям, приводит к образованию активного соединения (например, как в ADEPT, GDEPT, LIDEPT и т.д.). Например, пролекарство может представлять собой производное сахара или другой гликозидный конъюгат или может представлять собой сложноэфирное производное аминокислоты. Химический синтез. В настоящем описании приведены некоторые способы химического синтеза соединений PDP8 согласно настоящему изобретению. Указанные и/или другие широкоизвестные способы можно модифицировать и/или адаптировать известными путями для облегчения синтеза дополнительных соединений в рамках настоящего изобретения. Композиции. Один из аспектов настоящего изобретения относится к композиции (например, фармацевтической композиции), содержащей соединение PDP8 согласно настоящему описанию и фармацевтически приемлемый носитель, разбавитель или наполнитель. Другой аспект настоящего изобретения относится к способу получения композиции (например,фармацевтической композиции), содержащей соединение PDP8 согласно настоящему описанию и фармацевтически приемлемый носитель, разбавитель или наполнитель. Применения. Соединения согласно настоящему описанию подходят для применения, например, при лечении заболеваний и нарушений, которые облегчаются путем подавления RAF (например, B-RAF), например,таких как пролиферативные нарушения, рак и т.д. Применение способов подавления RAF (например, B-RAF). Один из аспектов настоящего изобретения относится к способу подавления функции RAF (например, B-RAF), in vitro или in vivo, включающему приведение RAF (например, B-RAF) в контакт с эффективным количеством соединения PDP8 согласно настоящему описанию. Один из аспектов настоящего изобретения относится к способу подавления функции RAF (например, B-RAF) в клетке, in vitro или in vivo, включающему приведение указанной клетки в контакт с эффективным количеством соединения PDP8 согласно настоящему описанию. Согласно одному из вариантов реализации указанный способ осуществляют in vitro. Согласно одному из вариантов реализации указанный способ осуществляют in vivo. Средний специалист в данной области техники способен без труда определить, является ли и/или в какой степени рассматриваемое соединение ингибитором функции RAF (например, B-RAF). Подходящие тесты для определения подавления функции RAF (например, B-RAF) приведены в настоящем описании и/или известны в данной области техники. Исследования B-RAF. Активность киназы B-raf измеряли при помощи 4-уровневого каскадного ферментного теста, подобного тому, который описан Marais R., et al., 1997, J. Biol. Chem, Vol. 272, pp. 4378-4383. B-Raf, содержащая мутацию V600E (Davies, H., et al., 2002, Nature, Vol. 417, pp. 949-954) и N-концевую меткуMDRGSH6, экспрессировали в клетках SF9 насекомых. Растворимые в поверхностно-активном веществе экстракты указанных клеток разбавляли 1:100 смесью для анализа, содержащей GST-MEK-H6 (6,5 мкг/мл) и GST-ERK-H6 (100 мкг/мл) в буферном растворе, содержащем 800 мкМ АТФ и соответствующие концентрации ингибитора или разбавителя в качестве контроля. Полученную смесь инкубировали до 10 мин при 30C для активации ERK зависимым от B-Raf образом в каскаде. Затем реакцию останавливали добавлением 20 мМ ЭДТА. Затем определяли степень активации GST-ERK путем добавления части указанной погашенной реакционной смеси к дополнительной реакционной смеси, содержащей МСБ и 100 мкМ АТФ/ [32 Р]АТФ. После 12-минутного инкубирования при 30C определяли включение[32 Р] в субстрат МСБ, как меру активности B-raf, путем осаждения фосфорной кислотой и выделения путем фильтрования через фосфоцеллюлозную бумагу р 81. % подавления активности киназы B-raf вычисляли и наносили на график для определения концентрации исследуемого соединения, необходимой для подавления 50% активности киназы B-raf (IC50). Как вариант, активность киназы B-raf измеряли при помощи другого 4-уровневого каскадного ферментного теста. B-Raf, содержащая мутацию V600E (Davies, H., et al., 2002, Nature, Vol. 417, pp. 949-954) и N-концевую метку MDRGSH6, экспрессировали в клетках SF9 насекомых. Растворимые в поверхностно-активном веществе экстракты указанных клеток разбавляли 1:250 смесью для анализа, содержащейGST-MEK-H6 (25 мкг/мл), GST-ERK-H6 (281,25 мкг/мл) и МСБ в буферном растворе, содержащем соответствующие концентрации ингибитора или разбавителя в качестве контроля. Добавляли 0,03 мкл (100 мкМ) АТФ и инкубировали полученную смесь до 10 мин при 30C для активации ERK зависимым от BRaf образом в каскаде. Затем определяли степень активации GST-ERK путем добавления 0,033 мкл (100 мкМ) НОТ 32 Р. После 10-минутного инкубирования при 30C реакцию останавливали путем выделения части реакционной смеси на фосфоцеллюлозной бумаге р 81 и погружения указанной бумаги в 0,4% ортофосфорную кислоту. Включение [32 Р] в субстрат МСБ, как меру активности В-raf, определяли при по- 24019974 мощи счетчика Packard Cernekov counter. % подавления активности киназы B-raf вычисляли и наносили на график для определения концентрации исследуемого соединения, необходимой для подавления 50% активности киназы B-raf (IC50). Исследование C-RAF.C-raf (человека) разбавляли в 10 с получением рабочего раствора в 50 мМ Трис рН 7,5, 0,1 мМ ЭГТА, 0,1 мМ ванадата натрия, 0,1% -меркаптоэтанола, 1 мг/мл БСА. Одна единица равнялась включению 1 нмоль фосфата в минуту в миелиновый основной белок за минуту. В конечном реакционном объеме 25 мкл инкубировали c-raf (5-10 мЕд) с 25 мМ Трис рН 7,5, 0,02 мМ ЭГТА, 0,66 мг/мл миелинового основного белка, 10 мМ ацетата магния, [-33 Р-АТФ] (специфическая активность прибл. 500 распадов в мин/пмоль, концентрация по необходимости) и соответствующими концентрациями ингибитора или разбавителя в качестве контроля. Реакцию инициировали добавлением Mg2+[-33 Р-АТФ]. После инкубирования в течение 40 мин при комнатной температуре реакцию останавливали добавлением 5 мкл 3% раствора фосфорной кислоты. 10 мкл реакционной смеси наносили на фильтровальную подложку Р 30 и промывали 3 раза по 5 мин в 75 мМ фосфорной кислоте и один раз в метаноле с последующим высушиванием и подсчетом для определения активности C-raf. % подавления активности киназы C-raf вычисляли и наносили на график для определения концентрации исследуемого соединения, необходимой для подавления 50% активности киназы C-raf (IC50). Селективность. Согласно одному из вариантов реализации соединение PDP8 селективно подавляет одну RAF (например, B-RAF) по сравнению с другой RAF (например, A-RAF и/или C-RAF). Например, согласно одному из вариантов реализации отношение величины IC50 для B-RAF к величине IC50 для другой RAF (например, A-RAF и/или C-RAF) составляет по меньшей мере 10, более предпочтительно по меньшей мере 100, наиболее предпочтительно по меньшей мере 1000. Применение в способах подавления пролиферации клеток и т.д. Соединения PDP8 согласно настоящему описанию, например, (а) регулируют (например, подавляют) пролиферацию клеток; (б) подавляют развитие клеточного цикла; (в) стимулируют апоптоз или (г) обеспечивают комбинацию одного или нескольких из указанных действий. Один из аспектов настоящего изобретения относится к способу регулирования (например, подавления) пролиферации клеток (например, пролиферации клетки), подавления развития клеточного цикла,стимуляции апоптоза или сочетанию одного или нескольких из указанных действий in vitro или in vivo,включающему приведение указанной клетки в контакт с эффективным количеством соединения PDP8 согласно настоящему описанию. Согласно одному из вариантов реализации указанный способ представляет собой способ регулирования (например, подавления) пролиферации клеток (например, пролиферации клетки) in vitro или invivo, включающий приведение указанной клетки в контакт с эффективным количеством соединенияPDP8 согласно настоящему описанию. Согласно одному из вариантов реализации указанный способ осуществляют in vitro. Согласно одному из вариантов реализации указанный способ осуществляют in vivo. Согласно одному из вариантов реализации соединение PDP8 представлено в виде фармацевтически приемлемой композиции. Можно воздействовать на любой тип клеток, включая, но не ограничиваясь ими, клетки легкого,желудочно-кишечного тракта (включая, например, кишечник, толстую кишку), груди (молочной железы), яичника, простаты, печени, почки, мочевого пузыря, поджелудочной железы, мозга и кожи. Средний специалист в данной области техники легко сможет определить, является или нет исследуемое соединение регулятором (например, ингибитором) пролиферации клеток и т.д. Например, тесты,которые легко можно использовать для оценки активности, которой обладает конкретное соединение,приведены в настоящем описании. Например, образец клеток (например, из опухоли) можно вырастить in vitro, привести указанное соединение в контакт с указанными клетками и наблюдать действие указанного соединения на указанные клетки. В качестве примера "действия" можно определять морфологический статус клеток (например,живые или мертвые и т.д.). Если обнаружено, что соединение оказывает влияние на клетки, это можно использовать как прогностический или диагностический маркер эффективности соединения в способах лечения пациента, являющегося носителем клеток того же клеточного типа. Применение в терапевтических способах. Другой аспект настоящего изобретения относится к соединению PDP8 согласно настоящему описанию для применения в способе лечения человека или животного с помощью терапии. Применение для получения лекарственных средств. Другой аспект настоящего изобретения относится к применению соединения PDP8 согласно настоящему описанию для получения лекарственного средства для применения при лечении. Согласно одному из вариантов реализации указанное лекарственное средство содержит соединение Способы лечения. Другой аспект настоящего изобретения относится к способу лечения, включающему введение пациенту, нуждающемуся в указанном лечении, терапевтически эффективного количества соединенияPDP8 согласно настоящему описанию предпочтительно в виде фармацевтической композиции. Состояния, подвергаемые лечению - состояния, облегчаемые подавлением RAF. Согласно одному из вариантов реализации (например, применения в способах терапии, применения для получения лекарственных средств, способов лечения) лечение представляет собой лечение заболевания или нарушения, характеризующегося повышающей регуляцией и/или активацией RAF (например, BRAF) и/или облегчаемого подавлением RAF (например, B-RAF). Согласно одному из вариантов реализации лечение представляет собой лечение рака, характеризующегося повышающей регуляцией и/или активацией RAF (например, B-RAF) и/или облегчаемого подавлением RAF (например, B-RAF). Состояния, подвергаемые лечению - состояния, облегчаемые подавлением РТК. Согласно одному из вариантов реализации (например, применения в способах терапии, применения для получения лекарственных средств, способов лечения) лечение представляет собой лечение заболевания или нарушения, характеризующегося повышающей регуляцией и/или активацией рецепторной тирозинкиназы (РТК) и/или облегчаемого подавлением рецепторной тирозинкиназы (РТК). Примеры РТК включают ФРФ-Р, Tie, СЭФР-Р и/или Eph, например ФРФ-Р 1, ФРФ-Р 2, ФРФ-Р 3, Tie2, СЭФР-Р 2 и/илиEphB2. Согласно одному из вариантов реализации лечение представляет собой лечение рака, характеризующегося повышающей регуляцией и/или активацией рецепторной тирозинкиназы (РТК), и/или облегчаемого подавлением рецепторной тирозинкиназы (РТК). Состояния, подвергаемые лечению - состояния, характеризующиеся ангиогенезом. Согласно одному из вариантов реализации (например, применения в способах терапии, применения для получения лекарственных средств, способов лечения) лечение представляет собой лечение заболевания или нарушения, характеризующегося несоответствующим, избыточным и/или нежелательным ангиогенезом (в качестве "противоангиогенных средств"). Примеры подобных заболеваний обсуждаются в настоящем описании. Состояния, подвергаемые лечению - пролиферативные нарушения и рак. Соединения PDP8 подходят для применения при лечении пролиферативных нарушений (в качестве"противопролиферативных средств"), рака (в качестве "противораковых средств") и т.д. Согласно одному из вариантов реализации (например, применения в способах терапии, применения для получения лекарственных средств, способов лечения) лечение представляет собой лечение пролиферативного нарушения. Термин "пролиферативное нарушение" в настоящем описании относится к нежелательной или неконтролируемой пролиферации избыточных или патологических клеток, которая является нежелательной, такой как неопластический или гиперпластический рост. Согласно одному из вариантов реализации лечение представляет собой лечение пролиферативного нарушения, характеризующегося доброкачественной, предраковой или злокачественной клеточной пролиферацией, включая, но не ограничиваясь ими, неоплазмы, гиперплазии и опухоли (например, гистоцитома,глиома, астроцитома, остеома), рак (см. ниже), псориаз, заболевания костей, фибропролиферативные нарушения (например, соединительных тканей), легочный фиброз, атеросклероз, пролиферацию клеток гладкой мускулатуры в кровеносных сосудах, такую как стеноз или рестеноз после ангиопластики. Согласно одному из вариантов реализации лечение представляет собой лечение рака. Согласно одному из вариантов реализации лечение представляет собой лечение: рака легкого, мелкоклеточного рака легкого, немелкоклеточного рака легкого, рака органов желудочно-кишечного тракта,рака желудка, рака кишечника, рака толстой кишки, рака прямой кишки, колоректального рака, рака щитовидной железы, рака груди, рака яичника, рака эндометрия, рака простаты, рака яичка, рака печени,рака почки, почечноклеточной карциномы, рака мочевого пузыря, рака поджелудочной железы, рака мозга, глиомы, саркомы, остеосаркомы, рака кости, рака кожи, сквамозного рака, саркомы Капоши, меланомы, злокачественной меланомы, лимфомы или лейкемии. Согласно одному из вариантов реализации лечение представляет собой лечение карциномы, например карциномы мочевого пузыря, груди, толстой кишки (например, колоректальных карцином, таких как аденокарцинома толстой кишки и аденома толстой кишки), почки, эпидермиса, печени, легкого (например, аденокарцинома, мелкоклеточный рак легкого и немелкоклеточные карциномы легкого), пищевода,желчного пузыря, яичника, поджелудочной железы (например, карцинома экзокринной поджелудочной железы), желудка, шейки матки, щитовидной железы, простаты, кожи (например, сквамозноклеточная карцинома); опухоли кроветворной ткани лимфоидного происхождения, например лейкемии, острой лимфоцитарной лейкемии, В-клеточной лимфомы, Т-клеточной лимфомы, лимфомы Ходжкина, нехожкиндской лимфомы, лейкоза ворсистых клеток или лимфомы Буркетта; опухоли кроветворной ткани миелоидного происхождения, например острой и хронической миело- 26019974 генных лейкемий, миелопластического синдрома или промиелоцитарной лейкемии; опухоли мезенхимного происхождения, например фибросаркомы или рабдомиосаркомы; опухоли центральной или периферической нервной системы, например астроцитомы, нейробластомы, глиомы или шванномы; меланомы; семиномы; тератокарциномы; остеосаркомы; пигментной ксеродермы; кератоакантомы; фолликулярного рака щитовидной железы или саркомы Капоши. Согласно одному из вариантов реализации лечение представляет собой лечение видов рака, характеризующихся солидными опухолями. Согласно одному из вариантов реализации лечение представляет собой лечение меланомы или злокачественной меланомы. Согласно одному из вариантов реализации лечение представляет собой лечение колоректального рака. Противораковое действие может возникать по одному или нескольким механизмам, включая, но не ограничиваясь ими, регулирование пролиферации клеток, подавление развития клеточного цикла, подавление ангиогенеза (образования новых кровеносных сосудов), подавление метастазирования (распространения опухоли из места ее образования), подавление инвазии (распространения опухолевых клеток в соседние нормальные структуры) или стимуляции апоптоза (программируемой гибели клеток). Соединения PDP8 согласно настоящему изобретению можно применять для лечения указанных в настоящем описании видов рака вне зависимости от обсуждаемых в настоящем описании механизмов. Состояния, подвергаемые лечению - пролиферативные нарушения и рак, связанные с RAF. Виды рака, например, с активирующими мутациями ras, raf и РЭФР или со сверхэкспрессией ras, raf и РЭФР, включая любые изоформы указанных белков, могут быть особенно чувствительны к ингибиторам активностиRAF (например, B-RAF). Пациенты с активирующими мутациями RAF (например, BRAF) могут также получать особую пользу от лечения ингибиторами активности RAF (например, BRAF). Виды рака с другими отклонениями, приводящими к повышающему регулированию сигнального пути raf-MEK-ERK, могут также быть особенно чувствительны к лечению ингибиторами активностиRAF (например, B-RAF). Примеры подобных отклонений включают конститутивную активацию рецептора фактора роста, сверхэкспрессию одного или нескольких рецепторов факторов роста и сверхэкспрессию одного или нескольких факторов роста. Согласно одному из вариантов реализации (например, применения в способах терапии, применения для получения лекарственных средств, способов лечения) лечение представляет собой лечение пролиферативного нарушения, указанного выше, например рака, характеризующегося:(в) повышающей регуляцией сигнального пути raf-MEK-ERK;(г) повышающей регуляцией рецепторов факторов роста, таких как ERBB2 и РЭФР. Согласно одному из вариантов реализации пролиферативное нарушение характеризуется присутствием клеток со сверхэкспрессией RAF (например, B-RAF) или экспрессией или сверхэкспресией мутантной raf (например, B-RAF). Согласно одному из вариантов реализации пролиферативное заболевание характеризуется присутствием клеток со сверхэкспрессией raf (например, B-RAF). Согласно одному из вариантов реализации пролиферативное нарушение характеризуется присутствием клеток с экспрессией или сверхэкспрессией мутантной RAF (например, B-RAF). Согласно одному из вариантов реализации пролиферативное нарушение характеризуется присутствием клеток со сверхэкспрессией RAF (например,B-RAF) или сверхэспрессией мутантной RAF (например, B-RAF) по сравнению с соответствующими нормальными клетками. Согласно одному из вариантов реализации сверхэкспрессия характеризуется коэффициентом 1,5, 2, 3, 5, 10 или 20. Согласно одному из вариантов реализации (например, применения в способах терапии, применения для получения лекарственных средств, способов лечения), лечение представляет собой лечение заболевания или нарушения, связанного с мутированными формами RAF (например, B-RAF), такими как, например, мутации, описанные в Wan, P., et al., 2004, Cell, Vol. 116, pp. 855-867 и Stratton et al., 2003, опубликованной международной заявке на патентWO 03/056036. Состояния, подвергаемые лечению - воспаление и т.д. Соединения PDP8 подходят для применения для лечения нарушений, связанных с воспалением (в качестве "противовоспалительных средств") и т.д. Функционирование воспалительных клеток контролируется многими факторами, действие которых опосредуется различными путями сигнальной трансдукции. Хотя некоторые ключевые воспалительные функции опосредуются киназой р 38 Map (например, высвобождение ФНО), другие функции опосредуются другими путями. Путь raf-MEK-ERK, в частности, является важным активирующим и пролиферативным сигналом во многих воспалительных клетках. В- и Т-лимфоциты, в частности, требуют активации пути raf-MEK-ERK для клональной экспансии и выработки популяций эффекторов (см., например,Cantrell, D.A., 2003, Immunol Rev Vol. 192, pp. 122-130; Genot, E. and Cantrell, D.A., 2000, Curr. Opin. Согласно одному из вариантов реализации лечение представляет собой лечение воспалительных заболеваний, таких как ревматоидный артрит, остеоартрит, ревматоидный спондилит, подагрический артрит, травматический артрит, краснушный артрит, псориатический артрит, и другие артритические состояния; болезнь Альцгеймера, синдром токсического шока, воспалительная реакция, вызванная эндотоксином или воспалительное заболевание кишечника; туберкулез; атеросклероз; мышечная дегенерация; синдром Рейтера; подагра; острый синовит; сепсис; септический шок; эндотоксический шок; грамотрицательный сепсис; респираторный дистресс-синдром у взрослых; церебральная малярия; хроническое воспалительное заболевание легких; силикоз; легочный саркоидоз; болезни резорбции кости; реперфузионное повреждение; реакция трансплантат-против-хозяина; отторжения аллотрансплантатов; лихорадки и миалгии, вызванные инфекциями, такими как грипп, кахексия, особенно кахексия, вторичная по отношению к инфекции или злокачественности, кахексия, вторичная к синдрому приобретенного иммунодефицита (СПИД); СПИД; САК (СПИД-ассоциированный комплекс); образование келоидов; образование рубцовой ткани; болезнь Крона; язвенный колит; лихорадка; хроническая обструктивная болезнь легких (ХОБЛ); острый респираторный дистресс-синдром (ОРДС); астма; легочный фиброз; бактериальная пневмония. Согласно одному предпочтительному варианту реализации лечение представляет собой лечение артритических состояний, включая ревматоидный артрит и ревматоидный спондилит; воспалительного заболевания кишечника, включая болезнь Крона и язвенный колит и хронической обструктивной болезни легких (ХОБЛ). Согласно одному предпочтительному варианту реализации лечение представляет собой лечение воспалительного нарушения, характеризующегося пролиферацией Т-клеток (активацией и ростом Тклеток), например отторжение ткани трансплантата, эндотоксический шок и гломерулонефрит. Скрининг. Перед лечением пациент может проходить скрининг для определения, является ли заболевание или нарушение, которым страдает или может страдать указанный пациент, одним из заболеваний, чувствительных к лечению соединением, подавляющим активность RAF (например, B-RAF) или обладающим активностью против РТК (например, ФРФ-Р 1, ФРФ-Р 2, ФРФ-Р 3, СЭФР-Р 2, Tie2, EphB2). Например, биологический образец, взятый у пациента, можно анализировать для определения, является ли заболевание или нарушение, такое как рак, которым страдает или может страдать указанный пациент, одним из заболеваний, характеризующихся повышенной экспрессией или активацией RAF (например, B-RAF), или РТК (например, ФРФ-Р 1, ФРФ-Р 2, ФРФ-Р 3, СЭФР-Р 2, Tie2, EphB2), или же является результатом активирующей мутации. Следовательно, пациента можно подвергнуть диагностическому исследованию для определения маркерной характеристики сверхэкспрессии или активации RAF (например, B-RAF), или РТК (например, ФРФ-Р 1, ФРФ-Р 2, ФРФ-Р 3, СЭФР-Р 2, Tie2, EphB2), или мутации указанных белков. В настоящем описании термин "маркер" включает генетические маркеры (включая, например, измерение состава ДНК для идентификации мутаций raf, ras, MEK, ERK или фактора роста, такого какERBB2 или РЭФР) и маркеры, характерные для повышающей регуляции raf, ras, MEK, ERK, рецепторов фактора роста, таких как ERBB2 или РЭФР, включая активность фермента, уровни фермента, состояние фермента (например, фосфорилированный или нет) и уровни мРНК вышеуказанных белков. Способы идентификации и анализа мутаций широко известны. См., например, Anticancer Research, 1999, Vol. 19(4A), pp. 2481-2483; Clin. Chem., 2002, Vol. 48, p. 428; Cancer Research, 2003, Vol. 63(14), pp. 3955-3957. Термин "маркер" дополнительно включает генетические маркеры, включая, например, измерение состава ДНК для идентификации мутаций РТК, например ФРФ-Р 1, ФРФ-Р 2, ФРФ-Р 3, СЭФР-Р 2, Tie2 иEphB2. Термин "маркер" также включает маркеры, характерные для повышающей регуляции РТК, включая активность фермента, уровни фермента, состояние фермента (например, фосфорилированный или нет) и уровни мРНК вышеуказанных белков. Повышающая регуляция включает повышенную экспрессию или сверхэкспрессию, включая амплификацию гена (т.е. многочисленные копии гена), повышенную экспрессию вследствие транскрипционного эффекта, гиперактивность и активацию, включая активацию вследствие мутаций. Другие опухоли, повышающая регуляция которых протекает через сигнальный путь raf-MEK-ERK,также могут быть особенно чувствительны к ингибиторам активности RAF (например, B-RAF). Существует ряд тестов, которые могут идентифицировать опухоли, проявляющие повышающую регуляцию в пути raf-MEK-ERK, включая имеющийся в продаже тест MEK1/2 (МАПК киназа) от Chemicon International. Повышающая регуляция может быть обусловлена сверхэкспрессией или активацией рецепторов факторов роста, таких как ERBB2 и РЭФР, или мутантных белков ras или raf. Обычные способы скрининга на сверхэкспрессию, повышающую регуляцию или мутации, включают, но не ограничиваются ими, стандартные способы, такие как полимеразная цепная реакция с обратной транскрипцией (ОТ-ПЦР) или гибридизация in-situ. При скрининге с использованием ОТ-ПЦР оценивают уровень мРНК вышеуказанных белков в опухоли путем создания кДНК копии указанной мРНК с последующей амплификацией указанной кДНК посредством ПЦР. Способы амплификации ПЦР, выбор праймеров и условия амплификации хорошо известны специалистам в данной области техники. Манипуляции с нуклеиновой кислотой и ПЦР проводят при помощи стандартных способов, описанных, например, в Ausubel, F.M. et al., eds., Current Protocols in Molecular Biology, 2004 (John WileySons Inc.); Innis, M.A. et al., eds., PCR Protocols: A Guide toMethods and Applications. 1990 (Academic Press). Методики проведения реакций и манипуляций, в которых участвует нуклеиновая кислота, также описаны в Sambrook et al., Molecular Cloning: A LaboratoryManual, 3rd edition. 2001 (Cold Spring Harbor Laboratory Press). Как вариант, можно применять имеющийся в продаже набор для ОТ-ПЦР (например, Roche Molecular Biochemicals) или методологию, описанную в патентах США 4666828; 4683202; 4801531; 5192659, 5272057, 5882864 и 6218529. Примером методики гибридизации in-situ может являться флуоресцентная гибридизация in situ(FISH) (см., например, Angerer, 1987, Meth. Enzymol., Vol. 152, p. 649). В целом, гибридизация in situ включает следующие основные стадии: (1) фиксация анализируемой ткани; (2) прегибридизационная обработка образца для увеличения доступности целевой нуклеиновой кислоты и уменьшения неспецифического связывания; (3) гибридизация смеси нуклеиновых кислот с получением нуклеиновой кислоты в биологической структуре или ткани; (4) постгибридизационные промывки для удаления фрагментов нуклеиновых кислот, не связанных при гибридизации, и (5) детектирование гибридизованных фрагментов. Зонды, применяемые в подобных целях, обычно помечают, например, радиоизотопами или флуоресцентными репортерами. Предпочтительные зонды являются достаточно длинными, например примерно от 50, 100 или 200 нуклеотидов примерно до 1000 или более нуклеотидов, чтобы обеспечить специфическую гибридизацию с целевой нуклеиновой кислотой(ами) в жестких условиях. Стандартные способы выполнения FISH описаны, например, в Ausubel, F.M. et al., eds., Current Protocols in MolecularMedicine). March 2004, pp. 77-88 (ISBN: 1-59259-760-2). Как вариант, белковые продукты, экспрессированные мРНК, можно исследовать путем иммунохимического анализа срезов опухолей, твердофазного иммуноанализа на микротитрационных планшетах,вестерн-блоттинга, 2-мерного электрофореза на SDS-полиакриламидном геле, ELISA и другими способами, известными в данной области техники, для детектирования конкретных белков. Способы детектирования могут включать применение сайт-специфических антител, таких как фосфо-raf, фосфо-ERK,фосфо-MEK или фосфотирозин. Кроме биопсий опухолей можно использовать другие образцы, включающие плевральную жидкость, перитонеальную жидкость, биопсии стула, мокроту, кровь (выделение и обогащение распространяющихся опухолевых клеток). Кроме того, мутантные формы raf, РЭФР или ras можно идентифицировать прямым секвенированием, например, биопсий опухолей, с использованием ПЦР и способов секвенирования продуктов ПЦР непосредственно, например, при помощи способов согласно настоящему описанию. Можно применять указанные и другие широкоизвестные методики детектирования сверхэкспрессии, активации или мутаций. Также можно измерить отклоняющиеся от нормы уровни белков, таких как raf, ras и РЭФР, при помощи обычных ферментных тестов, например тестов на raf согласно настоящему описанию. Альтернативные способы измерения сверхэкспрессии или активации киназ ФРФ-Р, Tie, СЭФР-Р или Eph, в частности СЭФР-Р, включая изоформы указанного белка, включают измерение плотности микрососудов. Указанную плотность можно измерить, например, с использованием способов, описанныхOrre and Rogers, 1999, Int. J. Cancer. Vol. 84(2), pp. 101-108. Способы исследования также включают применение маркеров; например, в случае СЭФР-Р маркеры включают CD31, CD34 и CD105 (Mineo et al.,2004, J. Clin. Pathol. Vol. 57(6), pp. 591-597). Лечение. Термин "лечение" в настоящем описании в контексте лечения заболевания или нарушения относится в целом к лечению и терапии как человека, так и животного (например, в ветеринарии), при котором достигается некий желаемый терапевтический эффект, например, подавление развития заболевания или нарушения, и включает уменьшение скорости развития, остановку развития, облегчение симптомов заболевания или нарушения, облегчение заболевания или нарушения и излечение заболевания или нарушения. Также указанный термин включает лечение как профилактическую меру (т.е. профилактику). Например, применение у пациента, у которого еще не развилось заболевание или нарушение, но имеется риск развития заболевания или нарушения, включено в термин "лечение". Например, лечение включает профилактику рака, уменьшение заболеваемости раком, облегчение симптомов рака и т.д. Термин "терапевтически эффективное количество" в настоящем описании относится к такому количеству соединения или вещества, композиции или дозированной формы, содержащей соединение, которое эффективно для получения некоторого желаемого терапевтического эффекта, соразмерного с разумным соотношением риск/польза, при введении в соответствии с выбранной схемой лечения. Комбинированная терапия. Термин "лечение" включает комбинированные виды лечения и терапии, при которых комбинируют два или несколько видов лечения или терапии, например, последовательно или одновременно. Например,- 29
МПК / Метки
МПК: C07D 471/04
Метки: 8-замещенные, применение, пиридо[2,3-в]пиразины
Код ссылки
<a href="https://eas.patents.su/30-19974-8-zameshhennye-pirido23-vpiraziny-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">8-замещенные пиридо[2,3-в]пиразины и их применение</a>
Предыдущий патент: Ингибиторы syk протеинкиназ
Следующий патент: Установка для купания
Случайный патент: Активирующее ppar соединение и содержащая его фармацевтическая композиция