Замещенные пиридо- или пиримидосодержащие 6,6- или 6,7-бициклические производные
Формула / Реферат
1. Соединение формулы
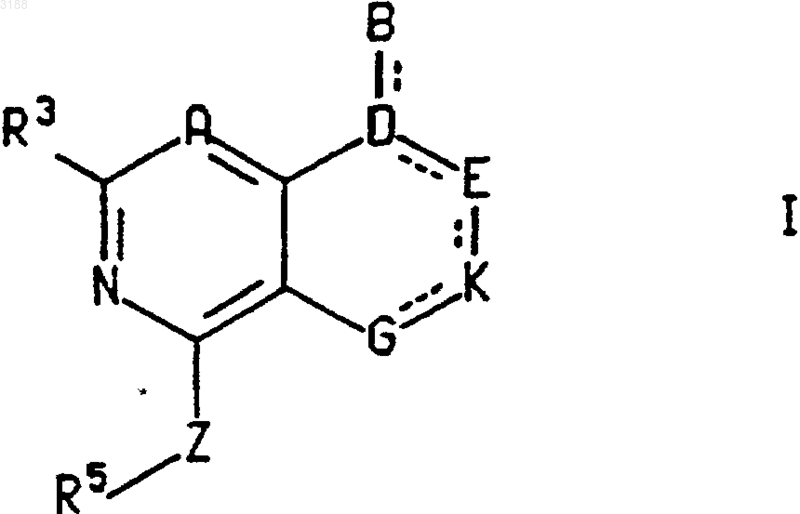
пунктирные линии представляют собой возможные двойные связи;
A является CR7;
B является -CR1R2R10, -CR2R10NHR1, -CR2R10OR1, -CR2R10SR1 или -COR2 и связан простой связью с D;
D является азотом или CR4 и связан простой связью со всеми атомами, к которым он присоединен;
E является кислородом, C=O или CR6R12;
K является C=O, кислородом или NR8, когда он связан простой связью с обоими примыкающими атомами кольца, либо CR8, когда он связан двойной связью с примыкающим атомом кольца;
G является NR8, когда он связан простой связью с обоими примыкающими атомами кольца, либо N или CR8, когда он связан двойной связью с примыкающим атомом кольца;
6-членное кольцо, которое содержит D, E, K и G, может содержать одну двойную связь, от нуля до двух гетероатомов, представляющих собой кислород, и от нуля до двух C=O групп, где атомы углерода таких групп являются частью кольца, а атомы кислорода являются заместителями на этом кольце;
R1 является C1-C6алкилом;
R2 является C1-C12алкилом; C3-C8циклоалкилом или (C1-C6алкилен)(C3-C8циклоалкилом);
R3 является C1-C4алкилом, -O(C1-C4алкилом) или -S(C1-C4алкилом);
R4 является водородом;
каждый R6 и R8, который присоединен к атому углерода, независимо выбран из водорода, С1-C2алкила, -O(C1-C2алкила), -S(C1-C2алкила) или -C(=O)O(C1-C2алкила);
R5 является замещенным фенилом или нафтилом, где каждая из упомянутых выше R5 групп замещена двумя или тремя заместителями R15, независимо выбранными из C1-C6алкила, -O(C1-C6алкила) и -S(C1-C6алкила);
R7 является водородом;
R10 является водородом;
R12 является водородом; и
Z является NH, кислородом, серой или -N(C1-C4алкилом);
при условии, что (a) в шестичленных кольцах структур формулы I не может быть двух двойных связей, примыкающих друг к другу;
или фармацевтически приемлемая соль такого соединения.
2. Соединение по п.1, где B является -CHR1R2, R1 является C1-C6алкилом, и R2 является C1-C6алкилом.
3. Соединение по п.2, где R3 является метилом, этилом или метокси.
4. Соединение по п.3, где A является CH.
5. Соединение по п.4, где D является N; E---K---G является CR6R12C(=O)-NH, CR6R12C(=O)-NCH3, C(=O)-CR8=CR8, C(=O)-C(=O)-NH.
6. Соединение по п.5, где CR6R12 является CH2.
7. Соединение по п.5, где CR8 является CH.
8. Соединение по п.5, где CR6R12 является CH2 и CR8 является CH.
9. Соединение по п.8, где R5 является ди- или тризамещенным фенилом, в котором два или три заместителя независимо выбраны из C1-C4алкила и O-(C1-C4алкила).
10. Соединение по п.2, где B является CHR1R2, а кольцо, содержащее D, E, K и G, является бензольным, пиридиновым или пиримидиновым кольцом.
11. Соединение по п.10, где R5 является ди- или тризамещенным фенилом, в котором два или три заместителя независимо выбраны из C1-C4 алкила и O-(C1-C4алкила).
12. Соединение по п.2, где R5 является ди- или тризамещенным фенилом, в котором два или три заместителя независимо выбраны из C1-C4алкила и O-(C1-C4алкила).
13. Соединение по п.1, где R3 является метилом, этилом или метокси; R6 и R8 независимо выбраны из водорода и метила; R5 является ди- или тризамещенным фенилом, в котором два или три заместителя могут быть независимо выбраны из C1-C4алкила и -O-(C1-C4алкила); и Z является кислородом или NH.
14. Соединение по п.1, где A является CH.
15. Соединение по п.1, где D является азотом, а E---K является CH2-C=O.
16. Соединение по п.1, где D является азотом, E---K является CH2-C=O или CH2-O, a G является NH или NCH3.
17. Соединение по п.1, выбранное из
1-(1-этилпропил)-4,7-диметил-5-(2,4,6-триметилфенокси)-1,4-дигидро-2H-пиридо[3,4-b]пиразин-3-она;
1-(1-этилпропил)-4,7-диметил-5-(2,4,6-триметилфенокси)-1,2,3,4-тетрагидропиридо[3,4-b]пиразина;
1-(1-этилпропил)-7-метил-5-(2,4,6-триметилфенокси)-1,2,3,4-тетрагидропиридо[3,4-b]пиразина;
метилового эфира 1-(1-этилпропил)-7-метил-2-оксо-5-(2,4,6-триметилфенокси)-1,2,3,4-тетрагидро[1,6]нафтиридин-3-карбоновой кислоты;
изопропилового эфира 1-(1-этилпропил)-7-метил-2-оксо-5-(2,4,6-триметилфенокси)-1,2,3,4-тетрагидро[1,6]нафтиридин-3-карбоновой кислоты;
1-(1-этилпропил)-7-метил-5-(2,4,6-триметилфенокси)-3,4-дигидро-1H-[1,6]нафтиридин-2-она;
1-(1-этилпропил)-7-метил-5-(2,4,6-триметилфенокси)-1,2,3,4-тетрагидро-[1,6]нафтиридина;
1-(1-этилпропил)-7-метил-5-(2,4,6-триметилфенокси)-1,4-дигидро-2H-3-окса-1,6-диазанафталина;
1-(1-этилпропил)-4,7-диметил-5-(2,4,6-триметилфенокси)-1,4-дигидро-2H-3-окса-1,6-диазанафталина;
1-(1-этилпропил)-3,7-диметил-5-(2,4,6-триметилфенокси)-3,4-дигидро-1H-3-окса[1,6]нафтиридин-2-она и
1-(1-этилпропил)-3,3,6-триметил-4-(2,4,6-триметилфенокси)-2,3-дигидро-1H-пирроло[3,2-c]пиридина.
Текст
1 Предпосылки изобретения Это изобретение относится к определенным фармацевтически активным замещенным пиридо- или пиримидосодержащим 6,6- или 6,7 бициклическим производным. Замещенные гетероциклические производные, заявленные в данном случае, проявляют активность как антагонисты кортикотропин высвобождающего фактора (гормона) КВФ (КВГ). Антагонисты КВФ упоминаются в Патентах US 4.605.642 и 5.063.245 по отношению к пептидам и пиразолинонам соответственно. На них также ссылаются в следующих случаях: РСТ заявка РСТ/IВ 95/00439 на патент, в которой указаны США, подана 6 июня 1995 г. и опубликована 14 декабря 1995 г; РСТ заявкаPCT/IB95/00373 на патент, в которой указаны США, подана 18 мая 1995 г. и опубликована 21 декабря 1995 г; заявка 08/448.539 на патент США, которая была подана в РСТ 12 ноября 1993 г. и вступила в национальную фазу США 14 июня 1995 г; РСТ заявка WO 95/10506 на патент, которая была подана 12 октября 1993 г. и опубликована 20 апреля 1995 г. и заявка 08/481.413 на патент США, которая была подана в РСТ 26 ноября 1993 г. и вступила в национальную фазу США 24 июля 1995 г; заявка 08/254.820 на патент США, которая была подана 19 апреля 1995 г; Предварительная заявка 60/008.396 на патент США, которая была подана 8 декабря 1995 г; и Предварительная заявка 60/006.333 на патент США, которая была подана 8 ноября 1995 г. Все упомянутые выше патентные заявки включены сюда полностью путем ссылки. Важность антагонистов КВФ изложена в литературе, например Р. Black, Scientific American SCIENCEMEDICINE, 1995, p.16-25; Т.Lovenberg, et al, Current Pharmaceutical Design,1995, 1, 305-316; и Патент 5.063.245 США, на который ссылались ранее. Недавно описание различных активностей, которыми обладают антагонисты КВФ, было сделано в M.J. Owens etal., Pharm. Rev., Vol.43, pages 425 - 473 (1991),также включенной сюда путем ссылки. Основываясь на исследованиях, описанных в этих двух и других ссылках, антагонисты КВФ эффективны при лечении широкого ряда заболеваний,связанных со стрессом, эмоциональных расстройств, таких как депрессия, сильная депрессия, однократная эпизодическая депрессия, повторяющаяся депрессия, вызванная злоупотреблениями детская депрессия, послеродовая депрессия, дистимия, биполярные расстройства и циклотимия; синдром хронической усталости; расстройства приема пищи, такие как анорексия и нервно-психическая булимия; расстройство генерализованной тревоги; паническое расстройство; фобии; обсессивно-компульсивное расстройство; посттравматическое стрессовое расстройство; перцепция боли, такая как фибромиалгия; головная боль; желудочно-кише 003188 2 чные заболевания; геморрагический стресс; язвы; вызванные стрессом психотические эпизоды, лихорадка, диарея, послеоперационный илеус, гиперчувствительность толстой кишки,синдром раздраженного кишечника, гранулематозная болезнь (болезнь Крона); слизистый колит; воспалительные заболевания, такие как ревматоидный артрит и остеоартрит; боль; астма; псориаз; аллергии; остеопороз; преждевременные роды; гипертензия; застойная сердечная недостаточность; расстройства сна; нейродегенеративные заболевания, такие как болезнь Альцгеймера, старческая деменция Альцгеймеровского типа, мультиинфарктная деменция,болезнь Паркинсона, и болезнь Хантингтона; травма головы; ишемическое нейрональное повреждение; эксцитотоксическое нейрональное повреждение; эпилепсия; удар; травма спинного мозга; психосоциальная недоразвитость; синдром эутиреоидной слабости; синдром несоответствующего антидиаретического гормона(НАГ); ожирение; химические зависимости и аддикции; симптомы лекарственной и алкогольной абстиненции; бесплодие; рак; бесплодие; мышечные спазмы; недержание мочи; гипогликемия и иммунные дисфункции, включая иммунные дисфункции, вызванные стрессом, подавление иммунитета и инфекции вируса иммунодефицита человека; и вызванные стрессом инфекции у человека и животных. Соединения по настоящему изобретению также считаются ингибиторами КВГ связывающего белка и, таким образом, пригодны при лечении расстройств, лечение которых может быть осуществлено или облегчено ингибированием этого белка. Примерами таких расстройств являются болезнь Альцгеймера и ожирение. Краткое изложение сущности изобретения Настоящее изобретение относится к соединениям формулы пунктирные линии представляют собой возможные двойные связи; А является CR7; В является -CR1R2R10, -CR2R10NHR1,2 10-CR R OR1, -CR2R10SR1 или -COR2 и связан простой связью с D;D является азотом или CR4 и связан простой связью со всеми атомами, к которым он присоединен; Е является кислородом, С=O или CR6R12; К является С=O, кислородом или NR8, когда он связан простой связью с обоими примыкающими атомами кольца, либо CR8, когда он связан двойной связью с примыкающим атомом кольца;G является NR8, когда он связан простой связью с обоими примыкающими атомами 3 кольца, либо N или CR8, когда он связан двойной связью с примыкающим атомом кольца; 6-членное кольцо, которое содержит D, Е,К и G, может содержать одну двойную связь, от нуля до двух гетероатомов, представляющих собой кислород, и от нуля до двух С=O групп,где атомы углерода таких групп являются частью кольца, а атомы кислорода являются заместителями на этом кольце;R4 является водородом; каждый R6 и R8, который присоединен к атому углерода, независимо выбран из водорода, С 1-С 2 алкила, -O(С 1-С 2 алкила), -S(С 1-С 2 алкила) или -С(=O)O(С 1-С 2 алкила);R5 является замещенным фенилом или нафтилом, где каждая из упомянутых выше R5 групп замещена двумя или тремя заместителями R15,независимо выбранными из C1-С 6 алкила, -O(С 1 С 6 алкила) и -S(С 1-С 6 алкила);-N(С 1-С 4 алкилом); при условии, что (а) в шестичленных кольцах структур формулы I не может быть двух двойных связей, примыкающих друг к другу; и фармацевтически приемлемым солям таких соединений. Примерами более конкретных воплощений формулы I являются следующие, где (R)n представляет собой заместители от нуля до двух, где такие заместители являются такими, как определено выше в определении формулы I. Более конкретные воплощения этого изобретения включают в себя соединения формулы I, где В является -CHR1R2, и R1 является C1-С 6 алкилом, иR2 является С 1-С 6 алкилом. Другие более конкретные воплощения данного изобретения включают соединения формулы I, где R3 является метилом, этилом или метокси; R6 и R8 независимо выбраны из водорода и метила; R5 является ди- или тризамещенным фенилом, где заместители могут быть независимо выбраны из С 1-С 4 алкила и -O(С 1-С 4 алкила), Z является кислородом или NH. Другие более конкретные воплощения данного изобретения включают в себя соединения формулы I, где А является СН. Другие более конкретные воплощения данного изобретения включают в себя соединения формулы I, где D является N; EKG является СR6R12 С(=О)-NН, CR6R12C(=O)-NCH3,C(=O)-CR8=CR8, C(=O)-C(=O)-NH. Другие более конкретные воплощения данного изобретения включают в себя соединения формулы I, где CR6R12 является СН 2. Другие более конкретные воплощения данного изобретения включают в себя соединения формулы I, где CR8 является СН. Другие более конкретные воплощения данного изобретения включают в себя соединения формулы I, где В является CHR1R2, а кольцо, содержащее D, Е, К и G, является бензольным, пиридиновым или пиримидиновым кольцом. Другие более конкретные воплощения данного изобретения включают в себя соединения формулы I, где D является азотом, а ЕК является СН 2-С=O. Другие более конкретные воплощения данного изобретения включают в себя соединения формулы I, где D является азотом, ЕК является СН 2-С=O или СН 2-O, а G является NH или NСН 3. Примерами предпочтительных соединений изобретения являются 1-(1-этилпропил)-4,7-диметил-5-(2,4,6-триметилфенокси)-1,4-дигидро-2 Н-пиридо[3,4-b]пиразин-3-он; 1-(1-этилпропил)-4,7-диметил-5-(2,4,6 триметилфенокси)-1,2,3,4-тетрагидропиридо[3,4-b]пиразин; 1-(1-этилпропил)-7-метил-5-(2,4,6 триметилфенокси)-1,2,3,4-тетрагидропиридо[3,4-b]пиразин; метиловый эфир 1-(1-этилпропил)-7 метил-2-оксо-5-(2,4,6-триметилфенокси)-1,2,3,4 тетрагидро-[1,6]нафтиридин-3-карбоновой кислоты; 5 изопропиловый эфир 1-(1-этилпропил)-7 метил-2-оксо-5-(2,4,6-триметилфенокси)1,2,3,4-тетрагидро-[1,6]нафтиридин-3 карбоновой кислоты; 1-(1-этилпропил)-7-метил-5-(2,4,6 триметилфенокси)-3,4-дигидро-1 Н-[1,6]нафтиридин-2-он; 1-(1-этилпропил)-7-метил-5-(2,4,6 триметилфенокси)-1,2,3,4-тетрагидро-[1,6]нафтиридин; 1-(1-этилпропил)-7-метил-5-(2,4,6-триметилфенокси)-1,4-дигидро-2 Н-3-окса-1,6-диазанафталин; 1-(1-этилпропил)-4,7-диметил-5-(2,4,6 триметилфенокси)-1,4-дигидро-2 Н-3-окса-1,6 диазанафталин; 1-(1-этилпропил)-3,7-диметил-5-(2,4,6 триметилфенокси)-3,4-дигидро-1 Н-3-окса[1,6]нафтиридин-2-он; и 1-(1-этилпропил)-3,3,6-триметил-4-(2,4,6 триметилфенокси)-2,3-дигидро-1 Н-пирроло[3,2-с]пиридин. Другие соединения формулы I включают в себя следующие:[1-втор-бутил-7-метил-1,2,3,4-тетрагидропиридо[3,4-b]пиразин-5-ил]-(2,4,6-триметилфенил)-амин; 1-втор-бутил-7-метил-5-(2,4,6-триметилфенокси)-1,2,3,4-тетрагидропиридо[4,3-d]пиримидин; 1-втор-бутил-3,7-диметил-5-(2,4,6-триметилфенокси)-1,2,3,4-тетрагидропиридо[4,3-d]пиримидин и 1-втор-бутил-4,7-диметил-5-(2,4,6-триметилфенокси)-1,2,3,4-тетрагидропиридо[4,3-d]пиримидин. Если не указано иначе, алкильные группы,указанные здесь, также как и алкильные группировки других групп, указанные здесь (например алкокси) могут быть линейными или разветвленными и они могут также быть циклическими (например циклопропил, циклобутил,циклопентил или циклогексил) или быть линейными или разветвленными и содержать циклические группировки. 7 Изобретение далее включает в себя промежуточные соединения формул-ОSО 2 СF3; U является CN, -СОО(С 1-С 4 алкил),хлоро, бромо, йодо, -OSO2CF3, гидрокси или амино, когда D является углеродом, а U является водородом, когда D является азотом. Это изобретение включает в себя все оптические изомеры и другие стереоизомеры соединений формулы I. Когда такие соединения содержат один или более чем один хиральный центр, понятно, что изобретение включает в себя рацемические смеси, также как и все индивидуальные энантиомеры и диастереомеры таких соединений и их смесей. Соединения этого изобретения включают в себя соединения, идентичные соединениям,описанным выше, но с тем, что один или более атом водорода, азота или углерода замещены изотопами таковых (например изотопами трития или углерода-14). Такие соединения пригодны, как средства для исследований и диагностики при фармакокинетических изучениях метаболизма и в тестах на связывание. Подробное описание изобретения Следующие соединения, имеющие формулы II, III и IV пригодны, как промежуточные при синтезе соединений формулы I. 8 В вышеуказанных соединениях формул со II по IV М является хлоро, бромо, йодо, -OSO2 СF3 илиZR5; Р является NH, CHCN или CHCOO(C1 С 4 алкил); Q является амино, -(С 1-С 2 алкил)СН[СОО(С 1-С 4 алкил)]2, (C2-С 3 алкил)-СN, гидрокси или меркапто, и А, В, D, Е, К и G являются такими,как определено выше. Способы получения соединений и композиций этого изобретения описаны ниже. В последующем обсуждении и схемах реакций от R1 до R14, R12, А, В, D, Е, К, G, Z, Т, М, Р, Q и U,пунктирные линии и структурные формулы I, II,III и IV, если не указано иначе, являются такими, как определено выше. Схема 1 Соединения формулы I могут быть получены путем взаимодействия соединения формулы II с соответствующим соединением формулыR5ZH. Эту реакцию обычно проводят в присутствии или в отсутствие растворителя, в присутствии основания, при температуре от приблизительно 0 С до приблизительно 270 С, при давлении от приблизительно 96,53 кПа (14 фунтов/кв. дюйм) до приблизительно 2,07 МПа (300 фунтов/кв. дюйм). Подходящие растворители включают в себя органические растворители, 9 такие как тетрагидрофуран (ТГФ), ацетонитрил,N,N-диметилформамид (ДМФ), диметилсульфоксид (ДМСО), ацетон, С 2-С 15 спирты, хлороформ, диоксан, хлорбензол, бензол, толуол, ксилол, сульфолан, пиридин, хинолин, 2,4,6 триметилпиридин, ацетамид, ди-(С 1-С 2)алкилацетамид и 1-метил-2-пирролидинон (НМП). Когда Z является NH, избыток R5ZH может быть использован как реагент и как основание. Примеры оснований других, чем R5ZH, которые могут быть использованы, включают в себя карбонат калия, гидрид натрия, гидрид калия, (С 1 С 4)алкоксиды натрия, (С 1-С 4)алкоксиды калия,натрий,амид натрия,три-[(С 1-С 6)алкил]амины, литийорганические или натрийорганические соединения, такие как н-бутиллитий,втор-бутиллитий, трет-бутиллитий, диизопропиламид лития, бис(триметилсилил)амид лития,диизопропиламид натрия или бис(триметилсилил)амид натрия и металлоорганические основания, такие как реактивы Гриньяра. Эту реакцию обычно проводят в подходящем растворителе (например ТГФ, диоксане, сульфолане,ДМСО, толуоле, ДМФ или НМП, в присутствии или в отсутствие дополнительного катализатора, такого как галогенид, оксид или сульфат меди (например Cul, CuBr, Cu2O, CuCl, CuSO4,Cul2, CuBr2, CuCl2 или Cu(O), соль Pd(0), такая как Рd(РРН 3)4, соль Pd(ll), такая как Pd(OAc)2(где ОАс является ацетатом) с рацемическим или (R)- или (S)-2,2-бис(дифенилфосфино)-1,1 бинафтилом (БИНАФ) при температуре от приблизительно комнатной температуры до приблизительно 270 С. Когда Z является кислородом или серой,может быть использовано основание, которое способно депротонизировать R5ZH, такое как карбонат калия, карбонат натрия, натрий, амид натрия, гидрид щелочного металла, такой как гидрид натрия или калия, (С 1-С 4 алкоксид) натрия, (С 1-С 4 алкоксид) калия, амид натрия, три[(С 1-С 6)алкил]амин или металлоорганическое основание, такое как н-бутиллитий, вторбутиллитий, трет-бутиллитий, диизопропиламид лития, бис(триметилсилил)амид лития, диизопропиламид натрия или бис(триметилсилил)амид натрия. Температура реакции может варьировать от приблизительно 0 до приблизительно 180 С и преимущественно составляет от приблизительно 50 до приблизительно 140 С. Подходящие растворители включают в себя ДМСО, ТГФ, сульфолан, диоксан и НМП. Когда Z является CHCN или СНСОО(С 1 С 4 алкил), может быть использовано основание,которое способно депротонизировать R5ZH,такое как гидрид щелочного металла (например гидрид натрия или калия), (C1-С 4 алкоксид) натрия или металлоорганическое основание, такое как н-бутиллитий, втор-бутиллитий, третбутиллитий, диизопропиламид лития, бис(триметилсилил)амид лития, диизопропиламид натрия или бис(триметилсилил)амид натрия, в 10 подходящем растворителе, например ТГФ,ДМСО, диоксане, метиленхлориде, хлороформе,толуоле, ксилоле, бензоле или С 1-С 6 алканоле. Когда Z является CR13CN, соединения формулы I могут быть получены путем взаимодействия соответствующих соединений, где Z является CHCN, сначала с основанием, таким как гидрид щелочного металла, таким как гидрид натрия или калия, н-бутиллитий, вторбутиллитий, трет-бутиллитий, диизопропиламид лития, бис(триметилсилил)амид лития или диизопропиламид натрия и затем с соединением формулы R13L, где L является уходящей группой, такой как йод, хлор, бром, мезилат (ОМ) или тозилат (ОТ). Соединения формулы I, где Z являетсяCHR13, могут быть получены кислотным гидролизом (используя, например, 85%-ую фосфорную кислоту) соответствующих соединений, гдеZ является CR13CN, за чем следует декарбоксилирование при нагревании в масляной бане при температуре от приблизительно 120 до приблизительно 180 С. Дальнейшее алкилирование в присутствии основания и соединения формулы и R14L, где L такое, как определено выше, приведет к получению соответствующих соединений формулы I, где Z является CR13R14. Когда Z является N(С 1-С 4 алкил), соединения формулы I могут быть получены путем взаимодействия соответствующих соединений,где Z является NH, сначала с основанием, а затем с соединением формулы (С 1-С 4 алкил)-L, гдеL такое, как определено выше. Могут быть использованы основания, такие как диизопропиламид лития, бис(триметилсилил)амид лития,диизопропиламид натрия. Подходящие растворители включают ТГФ,метиленхлорид(CH2Cl2), ДМСО, ДМФ, НМП и диоксан. Температура реакции может варьировать от приблизительно 20 до приблизительно 150 С и, предпочтительно, от приблизительно комнатной температуры до приблизительно 100 С. Соединения формулы I, где D является углеродом и В является -NR1R2, -OCHR1R2 или -SCHR1R2 могут быть получены путем взаимодействия соответствующих соединений формулы III, где U является хлоро, бромо или йодо, с соединением формулы ВН в присутствии основания, используя способы,аналогичные способам, описанным выше для превращения соединений формулы II в соединения формулы I. Соединения формулы I, где D является углеродом и В является -CR1R2R10, -C(=CR2R11)R1,-CR2R10NHR1, -CR2R10OR1, -CR2R10SR1 или-COR2, могут быть получены путем взаимодействия соответствующих соединений формулыIII, где U является циано, с реактивом Гриньяра,содержащим желаемую группу R2 для образования соединения формулы I, где В являетсяCOR2. Дальнейшее взаимодействие этого соединения с реактивом Гриньяра, содержащим 11 желаемую R1 группу, приведет к образованию соединения формулы I, где В является -CR1R2(OH). Соединения формулы I, где В является-CR1R2R11 или -C(=CR2R11)R1, могут быть получены при использовании общепринятых способов, хорошо известных специалистам. Например, взаимодействие соединений формулы I, где В является -C(OH)R1R2, с кислотой, такой как концентрированная серная кислота в уксусной кислоте, или внутренняя соль Бургесса (такая как (метиловый эфир карбоксисульфамоил)триэтиламмония гидроксида) приводит к образованию соединения формулы I, где В является -C(=CR2R11)R1. Гидрогенизация соединения формулы I, где В является -C(=CR2R11)R1, с применением катализатора Pd/C (палладий на угле) или оксида платины, с использованием стандартных способов, хорошо известных среди специалистов, приведет к образованию соединения формулы I, где В является -CHR1R2. Взаимодействие соединений формулы I, где В является -CR1R2(OH) с трифторидом диэтиламиносеры или трифенилфосфин/четыреххлористым углеродом, приведет к образованию соединения формулы I, где В является -CR1R2F или -CR1R2Cl, соответственно. Восстановление соединений формулы I,где В является -COR2 борогидридом натрия, в реакционно-инертном растворителе, таком как(С 1-С 4 спирт), ТГФ или диоксан, предпочтительно метаноле, при температуре от приблизительно комнатной температуры до приблизительно 100 С, предпочтительно от приблизительно комнатной температуры до приблизительно 60 С, приведет к получению соединения формулы I, где В является -CHR2OH. Алкилирование группы -CHR2RH с алкилгалогенидом (таким как алкилйодид) в присутствии основания(такого как гидрид натрия, гидрид калия или бис(триметилсилил)амид натрия или лития) при приблизительно комнатной температуре приведет к образованию соответствующего соединения формулы I, где В является -CHR2OR1. Соединения формулы I, где В являетсяCR2R10NHR1, могут также быть получены путем общепринятых способов, хорошо известных специалистам, таким как гидроаминирование соответствующих соединений формулы I, где В является -COR2 с подходящим амином и восстанавливающим агентом (например, цианоборгидридом натрия или триацетоксиборгидридом натрия) в подходящем растворителе (например низшем спирте или уксусной кислоте). Соединения формулы III, где U является CN,могут быть получены путем взаимодействия соответствующих соединений формулы III, где U является хлором, бромом, йодом или -ОСОСF3, с цианидом калия или цианидом меди в диметилсульфоксиде, ТГФ, метиленхлориде, толуоле или ДМФ, в присутствии или в отсутствие катализатора Pd(0) или Pd(II), при температуре от приблизительно комнатной до приблизительно 180 С, 003188 12 предпочтительно при приблизительно температуре дефлегмации. Соединения формулы III, где U является хлором, бромом, йодом или -OCOCF3, могут быть получены из соответствующих соединений формулы III, где U является гидрокси или амино. Соединения формулы III, где U является галогено или -OCOCF3, могут быть получены путем взаимодействия соединения формулы III,где U является амино, с соединением формулы(С 1-С 5 алкил)-O-N=O и галогенидом меди (II) в подходящем растворителе, таком как ацетонитрил, ацетон, толуол, метиленхлорид или дихлорэтан, при температуре от приблизительно комнатной температуры до приблизительно температуры дефлегмации. Эту реакцию преимущественно проводят в ацетонитриле при температуре дефлегмации. Соединения формулы III, где U является хлоро или бромо, могут быть получены путем взаимодействия соответствующих соединений формулы III, где U является гидрокси, с соединением формулы РОХ 3, где Х является хлоро или бромо, в присутствии или в отсутствие ди(С 1-С 4 алкил)анилина. Эта реакция может быть проведена без примесей или в растворителе,таком как диметилформамид, дихлорэтан или метиленхлорид, при температуре от приблизительно 100 до приблизительно 180 С. Соединения формулы III, где U является -ОТф (где Тф является трифлатом), могут быть получены путем взаимодействия соответствующих соединений формулы III, где U является ОН, с Тф 2O в присутствии основания, такого как три-(С 1 С 4 алкил)амин или пиридин или подходящее производное пиридина (например диметиламинопиридин) в подходящем растворителе, таком как метиленхлорид, ДМФ, ДМСО, хлороформ или ТГФ. Взаимодействие соединений формулыIII, где U является Отф, с соединением формулы КХ, NaX или СuХ (где Х является хлором, бромом или йодом) в подходящем растворителе,таком как ДМФ, диметилацетамид, N-метилпирролидон (НМП) или ДМСО, при температуре между приблизительно комнатной температурой и приблизительно 180 С приведет к образованию соединений формулы III, где U является хлоро, бромо или йодо. Соединения формулы I, II III, где Z и R5 являются такими, как определено выше для формулы I, и R3 является -O-(С 1-С 4)алкилом или-S-(С 1-С 4)алкилом (здесь и далее R20), могут быть получены путем взаимодействия соответствующих соединений формулы I, где R3 является хлоро, бромо, ОТ или йодо, с нуклеофилом формулы R20H, где R20H является (С 1 С 6)алканолом или (С 1-С 6)алкантиолом, возможно в присутствии органического или неорганического основания. Подходящие основания включают в себя натрий, гидрид натрия, гидрид калия, диизопропиламид лития, бис(триметилсилил)амид лития и диизопропиламид натрия. 13 Соединения формулы I, где R3 является фторо,могут быть получены путем взаимодействия соответствующих соединений, где R3 является хлоро, бромо, йодо, -ОСОСF3 или -OSO2CF3, с фторидом тетрабутиламмония, фторидом калия или другим подходящим фторидным агентом,используя стандартные методики, хорошо известные специалистам. Соединения формулы I, где G является О,S или NR8, могут быть получены из соединений формулы IV-a, как показано на схеме 1. В соответствии со схемой 1, соединения формулы IV-b могут быть получены путем взаимодействия подходящего соединения формулы IV-a, где В является -CR1R2R10, -C(=CR2R11)R1, CR1R10OR1,CR2R10SR1 или COR2; Y является О, S, NR8; и А является CR7 или N, с ацилгалогенидом, таким как L-(СН 2)n-СОХ (где Х является хлоро, бромо,йодо, мезилатом, тозилатом, трифлатом или ОСОСF3; и L является хлоро, бромо, йодо, гидрокси, мезилатом, тозилатом, трифлатом илиOCOCF3), или ангидридом (таким как [С 1-С 4 алкил)СО]2 О) в присутствии основания, такого как три(С 1-С 4 алкил)амин, пиридин или замещенный пиридин, в подходящем растворителе, таком как метиленхлорид, хлороформ, ТГФ, ДМСО, диоксан, простой эфир, диметоксиэтан, при температуре от приблизительно 0 до приблизительно 180 С, предпочтительно от приблизительно комнатной температуры и приблизительно 60 С. Соединения формулы Ia могут быть получены путем взаимодействия соответствующих соединений формулы IV-b с основанием. Подходящие основания для использования в этой реакции включают натрий, гидрид натрия, гидрид калия, диизопропиламид лития, бутиллития,бис(триметилсилил)амид лития, диизопропиламид натрия или карбонат натрия или калия. Алкилирование полученных соединений формулыla с основанием, с последующим быстрым охлаждением с алкилгалогенидом в подходящем растворителе, таком как простой эфир, ТГФ,метиленхлорид, диоксан, бензол, толуол или диметоксиэтан (ДМЭ), в присутствии или в отсутствие гексаметилфосфорамида (ГМФА), при температуре от приблизительно -78 С до приблизительно комнатной температуры, приведет к образованию соединения формулы Ic. Подходящие основания для использования в этой реакции включают в себя диизопропиламид лития,бис(триметилсилил)амид лития, диизопропиламид натрия и бутиллития. Восстановление соединений формулы I-а или I-с восстанавливающим агентом, таким как боранметил сульфид комплекс (ВН 3 ДМС), боран (ВН 3), боран ТГФ комплекс (ВН 3 ДМС), гидрид диизобутилалюминия или гидрид литий алюминия дает в результате соответствующие соединения формулы 14 Соединения формулы I, где G является углеродом, могут быть получены из соединений формулы IV-c, как показано на схеме 2. В соответствии со схемой 2 соединения формулы I-е могут быть получены путем циклизации соединений формулы IV-c, где Q является (C1 С 2 алкил)CR4(СООС 1-C4 алкил)2,(С 1-С 2 алкил)CR4(СООС 1-C4 алкил),(C1-C2aлкил)CR4(CN)2,(С 1-С 2 алкил)CR4(СN) или (С 1-C2 алкил)CR4(CООН), используя стандартные способы для образования амида, которые хорошо известны из литературы. Такие способы включают кислотную циклизацию, такую как: (а) нагревание в 40-85%-ой фосфорной кислоте при температуре от приблизительно 100 до приблизительно 150 С; (б) нагревание в водной уксусной кислоте/соляной кислоте; или (в) основной гидролиз; с последующим декарбоксилированием и затем амидной циклизацией. Соединения формулы I-f могут быть получены путем восстановления соответствующих соединений формулы I-е, используя способы, аналогичные способам, описанным выше для превращения соединений формулы I-а в соединения формулы I-b. Соединения формулы IV-c, где Q является(С 1-C2 алкил)CR4(СООС 1-С 4 алкил)2 или (С 1-С 2 алкил)CR4(СN)2, могут быть получены путем взаимодействия соединения формулы Na-, К- или LiCR4(COOC1-C4aлкил)2 или Na-, К- или LiCR4(CN)2 с соединением формулы IV-c, где Q является CHR8X или CHR8CHR4X (где Х является хлором, бромом или йодом) при температуре между приблизительно 0 и приблизительно 150 С, предпочтительно между приблизительно 10 до приблизительно 60 С, в подходящем растворителе, таком как ТГФ, ДМСО, ДМФ, (C1C5 алкил)-спирт, ацетонитрил, ацетон, толуол,НМП или диметилацетамид. Предпочтительным растворителем является ДМСО. Другие соединения формулы IV могут быть приготовлены способами, аналогичными способам, описанным в международной заявке на патент WO 95/33750, в которой указаны США и которая была опубликована 18 мая 1995 г. Эта заявка включена сюда путем ссылки полностью. Соединения формулы I, где Е являетсяCR6, G является CR8, D является азотом и К является кислородом, могут быть получены путем взаимодействия соединений формулы IV-c, гдеQ является CHR8OH, с водным формальдегидом или R6CHO в подходящем растворителе, таком как бензол, толуол, ксилол, С 1-С 5 алкиловый спирт или ацетонитрил, в присутствии кислого катализатора, такого как пара-ТзОН, H2SO4 илиHCl, при температуре от приблизительно комнатной температуры до приблизительно 160 С,предпочтительно при приблизительно температуре дефлегмации. Предпочтительными растворителями являются толуол или бензол. Соединения формулы IV-c могут быть получены способами, описанными в заявке на па 15 тент WO 95/33750, в которой указаны США и которая была опубликована 18 мая 1995 г. Соли соединений формулы, полученные присоединением кислоты, могут быть получены общепринятым способом, путем обработки раствора или суспензии соответствующего свободного основания одним химическим эквивалентом фармацевтически приемлемой кислоты. Общепринятые методики концентрирования или кристаллизации могут быть использованы для выделения солей. Показательными из подходящих кислот являются уксусная, молочная, янтарная, малеиновая, винная, лимонная, глюконовая, аскорбиновая, бензойная, коричная, фумаровая, серная,фосфорная, соляная, бромисто-водородная, иодисто-водородная, сульфаминовая, сульфоновые кислоты, такие как метансульфоновая, бензолсульфоновая, пара-толуолсульфоновая и родственные кислоты. Соединения формулы I и их фармацевтически приемлемые соли (здесь и далее называемые собирательно как активные соединения по изобретению) могут быть введены отдельно или в комбинации с фармацевтически приемлемыми носителями, либо в виде разовой, либо в виде множественной дозы. Подходящие фармацевтические носители включают инертные твердые разбавители или наполнители, стерильные водные растворы и различные органические растворители. Фармацевтические композиции,образованные комбинированием новых соединений формулы I и фармацевтически приемлемых носителей, могут быть затем легко введены в ряде лекарственных форм, таких как таблетки,порошки, лепешки, сиропы, растворы для инъекций и подобное. Эти фармацевтические композиции могут, при желании, содержать дополнительные ингредиенты, такие как корригенты,связывающие агенты, эксципиенты и подобные. Таким образом, в целях перорального назначения, таблетки, содержащие различные эксципиенты, такие как цитрат натрия, карбонат кальция и фосфат кальция, могут быть использованы вместе с различными разрыхлителями, такими как крахмал, метилцеллюлоза, альгиновая кислота и некоторые сложные силикаты, вместе со связывающими агентами, такими как поливинилпирролидон, сахароза, желатин и акация. Дополнительно, смазывающие агенты, такие как стеарат магния, лаурилсульфат натрия и тальк часто полезны для целей таблетирования. Твердые композиции подобного типа могут также быть использованы как наполнители в твердых и мягких заполняемых желатиновых капсулах. Предпочтительные для этого материалы включают в себя лактозу или молочный сахар и полиэтиленгликоль высокой молекулярной массы. Когда для перорального введения желательны водные суспензии или эликсиры, существенный активный ингредиент в них может быть комбинирован с различными подслащающими агентами или корригентами, красителями или крас 003188 16 ками и, при желании, эмульгаторами или суспендирующими агентами, вместе с разбавителями, такими как вода, этанол, пропиленгликоль, глицерин и их комбинациями. Для парентерального введения, могут быть использованы растворы, содержащие активное соединение по этому изобретению или его фармацевтически приемлемую соль в масле кунжута или арахисовом масле, водном пропиленгликоле или в стерильном водном растворе. Такие водные растворы должны быть забуферены при необходимости, и жидкий разбавитель сначала превращен в изотонический достаточным количеством солевого раствора или глюкозы. Эти отдельные водные растворы особенно подходят для внутривенного, внутримышечного, подкожного и внутрибрюшинного введения. Используемые стерильные водные среды все легко доступны с помощью стандартных методик, известных среди специалистов. Эффективные дозировки для активных соединений данного изобретения будут зависеть от выбранного пути введения и факторов, таких как возраст и масса пациента, как обычно известно врачу. Дозировки будут также зависеть от конкретного заболевания, которое будут лечить. Например, суточная дозировка для болезней, вызванных стрессом, воспалительных расстройств, болезни Альцгеймера, желудочнокишечных заболеваний, нервно-психической анорексии, геморрагического стресса и симптомов лекарственной и алкогольной абстиненции будет обычно варьировать от приблизительно 0,1 до приблизительно 50 мг/кг массы пациента,подлежащего лечению. Способы, которые могут быть использованы для определения антагонистической в отношении КВФ активности активных соединений данного изобретения и их фармацевтически приемлемых солей, описаны в Endocrinology,116. 1653-1659 (1985) и Peptides, 10, 179-188(1985). Связывающие активности соединений формулы I, выраженные как значения IC50,обычно варьируют от приблизительно 0,5 наномолярной до приблизительно 10 микромолярной. Способы, которые могут быть использованы для определения ингибирующей КВФсвязывающий белок активности соединений формулы I могут быть определены, используя способ, описанный в Brain Research, (1997), 745(1,2), 248-255. Настоящее изобретение иллюстрируется следующими примерами. Должно быть понятно,однако, что данное изобретение не ограничено специфическими деталями этих примеров. Точки плавления не откорректированы. Протонные спектры ядерного магнитного резонанса (1 НNMR) и С 13 ядерного магнитного резонанса (С 13NMR) были измерены для растворов в дейтерохлороформе (CDCl3), и положения пиков были выражены в частях на миллион (млн-1) от тетраметилсилана (ТМС). Формы спектра обозначе 17 ны следующим образом: s, синглет; d, дублет; t,триплет; q, квартет; m, мультиплет; b, широкий. В примерах использованы следующие сокращения: Ф(Рh)-фенил; иПр(iРr)-изопропил; МСВР (НRМS)-масс-спектры высокого разрешения. Пример 1. 1-(1-Этилпропил)-7-метил-5(2,4,6-триметилфенокси)-1,4-дигидро-2 Н-пиридо[3,4-b]пиразин-3-он. К раствору 2-хлор-N-[4-(1-этилпропиламино)-6-метил-2-(2,4,6-триметилфенокси)пиридин-3-ил]-ацетамида (170 мг, 0,42 ммоля) в 2 мл сухого ТГФ добавили раствор 1 М бис(триметилсилил)амида лития в ТГФ (0,84 мл,0,84 ммоля) при -78 С. Смесь постепенно нагрели до комнатной температуры и перемешивали при комнатной температуре в течение 2 ч. Дополнительно добавили 0,42 мл 1 М бис(триметилсилил)амида в ТГФ при -78 С и полученную смесь перемешивали при комнатной температуре в течение ночи. Смесь быстро охладили водой и экстрагировали этилацетатом. Органический слой высушили и сконцентрировали до сухости для получения 160 мг желтого твердого вещества. Твердый остаток был очищен с помощью колоночной хроматографии на силикагеле, используя 15% этилацетата (ЭтОАц) в гексане как элюент, для получения 91 мг(m, 6H) млн-1. Пример 2. 1-(1-Этилпропил)-4,7-диметил 5-(2,4,6-триметилфенокси)-1,4-дигидро-2 Н-пиридо[3,4-b]пиразин-3-он. К раствору 1-(1-этилпропил)-7-метил-5(2,4,6-триметилфенокси)-1,4-дигидро-2 Н-пиридо[3,4-b]пиразин-3-она (50 мг, 0,136 ммоля) в 2 мл сухого ТГФ добавили 1 М бис(триметилсилил)амид лития в ТГФ (0,14 мл) при -78 С и смесь перемешивали при этой температуре в течение 20 мин. При -78 С добавили избыток метилйодида и полученную смесь перемешивали при этой температуре в течение 20 мин, затем постепенно нагрели до комнатной температуры и перемешивали в течение дополнительных 2 ч. Смесь быстро охладили водой и экстрагировали этилацетатом. Органический слой высушили и сконцентрировали для получения 61 мг светло-желтого твердого вещества. Твердое вещество очистили с помощью колоночной хроматографии на силикагеле, используя 10% этилацетат в гексане как элюент, для получения 28 мг указанного соединения в виде белых кристаллов, т.пл. 112114 С. 1(ВН 3 ДМС) (0,07 мл, 0,14 ммоля) в 2 мл сухого ТГФ нагревали при температуре дефлегмации в течение 3 ч. Смесь охладили до 0 С и быстро остановили реакцию путем добавления 0,2 мл МеОН и 0,2 мл концентрированной соляной кислоты (HCl). Полученную смесь перемешивали при комнатной температуре в течение 2 ч и концентрировали до сухости. Остаток быстро охладили водой и экстрагировали хлороформом. Органический слой высушили и сконцентрировали для получения 19 мг прозрачного масла,которое очистили с помощью колоночной хроматографии на силикагеле, используя 10% этилацетат в гексане как элюент, для получения 11 мг указанного в заголовке соединения в виде белых кристаллов, т. пл. 78-80 С. 1(t, 6H) млн-1. Пример 4. 1-(1-Этилпропил)-7-метил-5(2,4,6-триметилфенокси)-1,2,3,4-тетрагидропиридо[3,4-b]пиразин. Указанное в заголовке соединение было получено в виде рыже-коричневых кристаллов,т. пл. 138-140 С, способом, аналогичным способу примера 3, начиная с 1-(1-этилпропил)-7 метил-5-(2,4,6-триметилфенокси)-1,4-дигидро 2 Н-пиридо[3,4-b]пиразин-3-она. 1 Н ЯМР (CDCl3)6,87 (s, 2H), 6,17 (s,1H),3,62 (m, 1H), 3,39 (m, 2 Н), 3,32 (m, 2H), 2,29 (s,3 Н), 2,13 (s, 3H), 2.11 (s, 6H), 1,59 (m, 4H), 0,91(t, 6H) млн-1. Пример 5. 1-(1-Этилпропил)-7-метил-2 оксо-5-(2,4,6-триметилфенокси)-1,2,3,4-тетрагидро-[1,6]нафтиридин-3-карбоновой кислоты метиловый эфир. Смесь диметилового эфира 2-[4-(1-этилпропиламино)-6-метил-2-(2,4,6-триметилфенокси)-пиридин-3-илметил]малоновой кислоты (22 мг, 0,048 ммоля) и 2 мл уксусной кислоты и барботируемый через нее HCl (газ) нагревали при 130 С в течение 30 ч. Реакционную смесь охладили и концентрировали до сухости. Остаток быстро охладили водой и экстрагировали этилацетатом. Органический слой высушили и сконцентрировали для получения 7 мг указанного в заголовке соединения. 1 Н ЯМР (СDСl3)6,89 (s, 2H), 6,59 (s, 1H),4,4 (m, 1H), 3,72 (s, 3H), 3,6-3,8 (m, 1H), 3,4-3.6 19 Пример 6. 1-(1-Этилпропил)-7-метил-2 оксо-5-(2,4,6-триметилфенокси)-1,2,3,4-тетрагидро-[1,6]нафтиридин-3-карбоновой кислоты изопропиловый эфир. Указанное в заголовке соединение было получено способом, аналогичным способу примера 5, начиная с диизопропилового эфира 2-[4(1-этилпропиламино)-6-метил-2-(2,4,6-триметилфенокси)-пиридин-3-илметил]малоновой кислоты. 1(t, 6H) млн-1. Пример 7. 1-(1-Этилпропил)-7-метил-5-(2,4,6 триметилфенокси)-3,4-дигидро-1 Н-[1,6]нафтиридин-2-он. Смесь диизопропилового эфира 2-[4-(1 этилпропиламино)-6-метил-2-(2,4,6-триметилфенокси)-пиридин-3-илметил]малоновой кислоты (40 мг, 0,078 ммоля) и 85%-ой фосфорной кислоты нагревали при 73 С в течение ночи и затем нагревали при 133 С в течение 1 ч. Реакционную смесь охладили, быстро охладили водой и экстрагировали этилацетатом. Органический слой промыли соляным раствором, высушили и сконцентрировали для получения коричневого масла. Масляный остаток очистили с помощью колоночной хроматографии на силикагеле, используя 3% этилацетат в гексане как элюент, для получения 28 мг (98%) указанного в заголовке соединения. 1(t, 6H) млн-1. Пример 8. 1-(1-Этилпропил)-7-метил-5(2,4,6-триметилфенокси)-1,2,3,4-тетрагидро[1,6]нафтиридин. Указанное в заголовке соединение было получено в виде белого твердого вещества, способом, аналогичным способу примера 3, начиная с 1-(1-этилпропил)-7-метил-5-(2,4,6-триметилфенокси)-3,4-дигидро-1 Н-[1,6]нафтиридин 2-она. 1(пара-ТсОН) (35 мг) в 3,5 мл толуола нагревали при температуре дефлегмации под ловушкой Дина-Старка (Dean-Stark) в течение 15 ч. Смесь быстро охладили водой, насыщенным бикарбонатом натрия и экстрагировали этилацетатом. 20 Органический слой высушили и сконцентрировали для получения 52 мг сырого продукта в виде светло-зеленого твердого вещества. Сырое вещество было очищено с помощью колоночной хроматографии на силикагеле, используя 1:1 гексан/СНCl3, как элюент, для получения 34 мгH ЯМР (CDCl3)6,86 (s, 2H), 6,25 (s, 1H),4,92 (s, 2H), 4,68 (s, 2H), 3,54 (m, 1H), 2,29 (s,3H); 2,17 (s, 3H), 2,07 (s, 6H), 1,5-1,7 (m, 4H),0,95 (t, 6H) млн-1. Пример 10. 1-(1-Этилпропил)-4,7-диметил 5-(2,4,6-триметилфенокси)-1,4-дигидро-2 Н-3 окса-1,6-диазанафталин. Указанное в заголовке соединение было получено как белое твердое вещество способом,аналогичным способу, описанному в примере 9,начиная с 1-[4-(1-этилпропиламино)-6-метил-2(2,4,6-триметилфенокси)-пиридин-3-ил]-этанола. 1(m, 4H), 0,96 (m, 6H) млн-1. Пример 11. 1-(1-Этилпропил)-3,7-диметил 5-(2,4,6-триметилфенокси)-3,4-дигидро-1 Н-3 окса-[1,6]-нафтиридин-2-он. Смесь диметилового эфира 2-[4-(1-этилпропиламино)-6-метил-2-(2,4,6-триметилфенокси)-пиридин-3-ил]метил]-2-метилмалоновой кислоты (130 мг) и 85%-ой фосфорной кислоты (4 мл) и воды (4 мл) нагревали при температуре дефлегмации в течение 16 ч. Смесь быстро охладили водой и экстрагировали этилацетатом. Органический слой промыли водой и насыщенным бикарбонатом натрия и соляным раствором, высушили и сконцентрировали для получения 80 мг прозрачного масла. Масло очистили с помощью колоночной хроматографии на силикагеле, используя от гексана до 10% этилацетата в гексане как элюент, для получения 67 мг (64%) указанного в заголовке соединения в виде белого твердого вещества. 1(d, 3 Н), 0,86 (t, 6H) млн-1. Пример 12. 1-(1-Этилпропил)-3,3,6-триметил-4-(2,4,6-триметилфенокси)-2,3-дигидро 1 Н-пирроло[3,2-с]пиридин. Раствор 1-(1-этилпропил)-3,7-диметил-5(2,4,6-триметилфенокси)-1,4-дигидро-1 Н-3 окса-[1,6]-нафтиридин-2-она (56 мг) в 4 мл сухого ТГФ обработали 2,0 М комплексом борандиметил сульфид в ТГФ (0,3 мл) и нагревали при температуре дефлегмации в течение 1 ч. Смесь быстро охладили водой и экстрагировали этилацетатом. Органический слой высушили и сконцентрировали для получения 50 мг указанного в заголовке соединения в виде бесцветного масла. Масло очистили с помощью колоночной 21 хроматографии на силикагеле, используя 10% этилацетата в гексане как элюент, для получения 22 мг указанного соединения в виде белого твердого вещества. 1(s, 6H), 1,95 (m, 1H), 1,57 (m, 4H), 1,07 (d, 3 Н),0,87 (t, 6H) млн-1. Пример 13. [1-(1-Этилпропил)-7-метил-1,4 дигидро-2 Н-3-окса-1,6-диазанафталин-5-ил](2,4,6-триметилфенил)-амин. Смесь [4-(1-Этилпропиламино)-6-метил-2(2,4,6-триметилфениламино)-пиридин-3-ил]-метанола (280 мг, 0,82 ммоля), 37% водного формальдегида (0,35 мл) и пара-ТсОН (78 мг, 0,41 ммоля) в 10 мл толуола нагревали при температуре дефлегмации, используя прибор ДинаСтарка (Dean-Stark), в течение 3 ч. Смесь быстро охладили водой и экстрагировали этилацетатом. Органический слой отделили, высушили и сконцентрировали для получения 280 мг зеленого масла. Масло очистили при помощи колоночной хроматографии на силикагеле, используя ЭтОАц, как элюент, для получения указанного в заголовке соединения в виде коричневого масла. 1H ЯМР (CDCl3)6,89 (s, 2H), 6,09 (s, 1H),4,51 (s, 2H), 4,19 (s, 2H), 3,53 (m, 1H), 2,25 (s,6H), 2,15 (s, 6H), 1,55 (m, 4H), 0,90 (t, 6H) млн-1. Пример 14. 1-(1-Этилпропил)-7-метил-5(2,4,6-триметилфениламино)-3,4-дигидро-1 Н[1,6]-нафтиридин-2-он. Смесь диметилового эфира 2-[4-(1-этилпропиламино)-6-метил-2-(2,4,6-триметилфениламино)-пиридин-3-илметил]-малоновой кислоты(100 мг, 0,219 ммоля), 85%-ой фосфорной кислоты (3 мл) и воды (3 мл) нагревали при температуре дефлегмации в течение 2 ч. Реакционную смесь охладили до комнатной температуры,развели водой и нейтрализовали до рН 6 разбавленным NaOH и экстрагировали этилацетатом. Органический слой промыли соляным раствором, высушили над безводным МgSO4, профильтровали и сконцентрировали досуха для получения 61 мг желтой пены. Масло очистили при помощи колоночной хроматографии на силикагеле, используя 10% ЭтОАц в гексане, как элюент для получения 41 мг указанного в заголовке соединения в виде рыже-коричневого твердого вещества, т. пл. 44-46 С. 1(m, 2H), 1,76 (m, 2H), 0,86 (t, 6H) млн-1. Пример 15. 1-(1-Этилпропил)-7-метил-5(2,4,6-триметилфенокси)-3,4-дигидро-1 Н-пиридо[4,3-d]пиримидин-2-он. К смеси [3-аминометил-6-метил-2-(2,4,6 триметилфенокси)-пиридин-4-ил]-(1-этилпропил)-амин (100 мг, 0,292 ммоля) в сухом ТГФ добавили трифосген (34 мг, 0,114 ммоля) при 22 0 С. Реакционную смесь оставили постепенно нагреваться до комнатной температуры и перемешивали в течение 2 ч. Смесь быстро охладили водой и экстрагировали этилацетатом. Органический слой высушили и сконцентрировали досуха для получения 130 мг прозрачного масла. Твердое вещество очистили с помощью колоночной хроматографии на силикагеле, используя 10% ЭтОАц в гексане как элюент, для получения 89 мг (82,4%) указанного в заголовке соединения в виде белого кристаллического твердого вещества, т. пл. 197-199 С. 1(t, 6H) млн-1. Получение А. 2-Хлор-N-[4-(1-этилпропиламино)-6-метил-2-(2,4,6-триметилфенокси)-пиридин-3-ил]-ацетамид. Смесь 2-(2,4,6-триметилфенокси)-N4-(1 этилпропил)-6-метилпиридин-3,4-диамина (250 мг, 0,76 ммоля) и триэтиламина (0,11 мл, 0,76 ммоля) в 5 мл сухого ТГФ обработали хлорацетилхлоридом (0,06 мл, 0,76 ммоля) при 0 С. Полученную смесь перемешивали при комнатной температуре в течение 1 ч. Смесь быстро охладили водой и экстрагировали этилацетатом. Органический слой высушили и сконцентрировали для получения 310 мг зеленых кристаллов, которые были очищены с помощью колоночной хроматографии на силикагеле, используя 10% этилацетата в гексане как элюент, для получения 280 мг (90%) указанного в заголовке соединения в виде рыже-коричневых кристаллов, т. пл. 152-154 С. 1 Н ЯМР (CDCl3)8,07 (s, 1 Н), 6,88 (s, 2H),6,16 (s, 1H), 4,75 (brs, 1H), 4,25 (s, 2H), 3,33 (m,1H), 2,30 (s, 3 Н), 2,18 (s, 3 Н), 2,08 (s, 6H), 1,41,8(т, 4 Н), 0,97(t, 6 Н)млн-1. Получение В. Диметиловый эфир 2-[4-(1 этилпропиламино)-6-метил-2-(2,4,6-триметилфенокси)-пиридин-3-ил-метил]-2-метилмалоновой кислоты. Смесь метилдиметилмалоната (260 мг) и 60% гидрида натрия в масле (70 мг) в 4 мл ДМСО перемешивали при комнатной температуре в течение 10 мин. Добавили раствор 3 хлорметил-6-метил-2-(2,4,6-триметилфенокси)пиридин-4-ил-(1-этилпропил)-амина (200 мг) в 2 мл ДМСО. Смесь перемешивали при комнатной температуре в течение 3 ч. Смесь быстро охладили водой и экстрагировали этилацетатом. Органический слой высушили и сконцентрировали для получения сырого материала, который был очищен на силикагеле, используя от гексана до 10% этилацетата в гексане как элюент, для получения 137 мг диметилового эфира 2-[4-(1 этилпропиламино)-6-метил-2-(2,4,6-триметилфенокси)-пиридин-3-ил-метил]-2-метилмалоновой кислоты в виде белого твердого вещества. 1 пунктирные линии представляют собой возможные двойные связи; А является CR7; В является -CR1R2R10, -CR2R10NHR1,2 10-CR R OR1, -CR2R10SR1 или -COR2 и связан простой связью с D;D является азотом или CR4 и связан простой связью со всеми атомами, к которым он присоединен; Е является кислородом, С=O или CR6R12; К является С=O, кислородом или NR8,когда он связан простой связью с обоими примыкающими атомами кольца, либо CR8,когда он связан двойной связью с примыкающим атомом кольца;G является NR8, когда он связан простой связью с обоими примыкающими атомами кольца, либо N или CR8, когда он связан двойной связью с примыкающим атомом кольца; 6-членное кольцо, которое содержит D, Е,К и G, может содержать одну двойную связь, от нуля до двух гетероатомов, представляющих собой кислород, и от нуля до двух С=O групп,где атомы углерода таких групп являются частью кольца, а атомы кислорода являются заместителями на этом кольце;R4 является водородом; каждый R6 и R8, который присоединен к атому углерода, независимо выбран из водорода, С 1-С 2 алкила, -O(С 1-С 2 алкила), -S(С 1 С 2 алкила) или -С(=O)O(С 1-С 2 алкила);R5 является замещенным фенилом или нафтилом, где каждая из упомянутых выше R5 групп замещена двумя или тремя заместителямиR15, независимо выбранными из С 1-С 6 алкила,-O(С 1-С 6 алкила) и -S(С 1-С 6 алкила);Z является NH, кислородом, серой или -N(С 1 С 4 алкилом); при условии, что (а) в шестичленных кольцах структур формулы I не может быть двух двойных связей, примыкающих друг к другу; 24 или фармацевтически приемлемая соль такого соединения. 2. Соединение по п.1, где В является -CHR1R2,1R является С 1-С 6 алкилом, и R2 является С 1 С 6 алкилом. 3. Соединение по п.2, где R3 является метилом, этилом или метокси. 4. Соединение по п.3, где А является СН. 5. Соединение по п.4, где D является N; EKG является CR6R12C(=O)-NH, CR6R12C(=O)NCH3, C(=O)-CR8=CR8, C(=O)-C(=O)-NH. 6. Соединение по п.5, где CR6R12 является СH2. 7. Соединение по п.5, где CR8 является СН. 8. Соединение по п.5, где CR6R12 является СН 2, и CR8 является СН. 9. Соединение по п.8, где R5 является диили тризамещенным фенилом, в котором два или три заместителя независимо выбраны из С 1 С 4 алкила и O-(С 1-С 4 алкила). 10. Соединение по п.2, где В являетсяCHR1R2, а кольцо, содержащее D, Е, К и G,является бензольным, пиридиновым или пиримидиновым кольцом. 11. Соединение по п.10, где R5 является диили тризамещенным фенилом, в котором два или три заместителя независимо выбраны из C1C4 алкила и O-(С 1-С 4 алкила). 12. Соединение по п.2, где R5 является диили тризамещенным фенилом, в котором два или три заместителя независимо выбраны из C1C4 алкила и O-(С 1-С 4 алкила). 13. Соединение по п.1, где R3 является метилом, этилом или метокси; R6 и R8 независимо выбраны из водорода и метила; R5 является ди- или тризамещенным фенилом, в котором два или три заместителя могут быть независимо выбраны из С 1-С 4 алкила и -O-(С 1 С 4 алкила); и Z является кислородом или NH. 14. Соединение по п.1, где А является СН. 15. Соединение по п.1, где D является азотом, а ЕК является СН 2-С=O. 16. Соединение по п.1, где D является азотом, ЕК является СН 2-С=O или CH2-O, a G является NH или NСН 3. 17. Соединение по п.1, выбранное из 1-(1-этилпропил)-4,7-диметил-5-(2,4,6-триметилфенокси)-1,4-дигидро-2 Н-пиридо[3,4-b]пиразин-3-она; 1-(1-этилпропил)-4,7-диметил-5-(2,4,6 триметилфенокси)-1,2,3,4-тетрагидропиридо[3,4-b]пиразина; 1-(1-этилпропил)-7-метил-5-(2,4,6-триметилфенокси)-1,2,3,4-тетрагидропиридо[3,4-b]пиразина; метилового эфира 1-(1-этилпропил)-7 метил-2-оксо-5-(2,4,6-триметилфенокси)-1,2,3,4 тетрагидро[1,6]нафтиридин-3-карбоновой кислоты; изопропилового эфира 1-(1-этилпропил)-7 метил-2-оксо-5-(2,4,6-триметилфенокси)-1,2,3,4 25
МПК / Метки
МПК: A61P 25/24, C07D 471/04, A61K 31/519
Метки: пиридо, 6,7-бициклические, пиримидосодержащие, замещенные, производные
Код ссылки
<a href="https://eas.patents.su/14-3188-zameshhennye-pirido-ili-pirimidosoderzhashhie-66-ili-67-biciklicheskie-proizvodnye.html" rel="bookmark" title="База патентов Евразийского Союза">Замещенные пиридо- или пиримидосодержащие 6,6- или 6,7-бициклические производные</a>
Предыдущий патент: Лиганд, родственный фактору некроза опухоли
Следующий патент: Производные триазола, обладающие противогрибковой активностью, предназначенные для человека и животных
Случайный патент: Способ заправки и промывки комплекта трубок для крови, комплект трубок для крови и экстракорпоральная система для лечения крови












