Бензофуропиримидиноны в качестве ингибиторов протеинкиназ, фармацевтические композиции, их содержащие, и их применение
Номер патента: 19785
Опубликовано: 30.06.2014
Авторы: Браун С.Дэвид, Колтун Елена С., Ричардс Стивен Джеймс, Францини Маурицио, Ду Хунван, Цухако Эми Л., Ким Моон Хван, Хуан Пин, Захария Кристиана А., Галан Адам Энтони, Керни Патрик
Формула / Реферат
1. Соединение формулы I
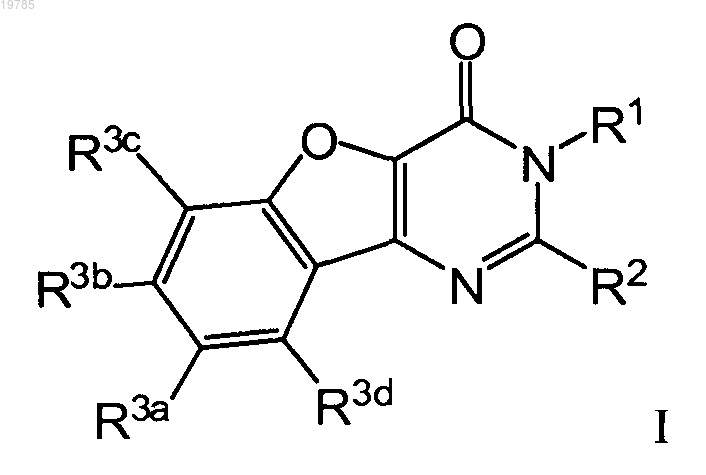
или его фармацевтически приемлемая соль, в которой
R1 представляет собой атом водорода или (C1-C12)алкил;
R2 выбран из -NH-фенила, -NH-пиперидинила, -NH-пиридинила, -NH(C1-C3)алкилфенила, необязательно замещенного по любому положению в фениле пиперазинилом или метилпиперазинилом, -NH(C1-C3)алкил-N-(СН3)2, -NH(C1-C3)алкил-ОН, -(C1-C3)алкил-О-фенила, -(C1-C3)алкил-О(C1-C3)алкил-(5-6-членного)гетероциклоалкила, -(C1-С3)алкил-N(Н)-гетероарила, -(C1-С3)алкил-(5-10-членного)гетероарила, необязательно замещенного -(C1-C3)алкилом, галогеном или фенилом, оксопирролидинила, необязательно замещенного ОН или пиперидинилом, -(C1-C4)алкил-(3-9-членного)гетероциклоалкила, необязательно замещенного по (3-9-членному)гетероциклоалкилу Xd, -(C1-C6)алкил-NRzb(C1-С4)алкила, в котором -(C1-C4)алкильная часть замещена Хе, -(C1-С3)алкил-NH(С3-С6)циклоалкила, -(СН2)-NH(С3-С6)циклогексила,
-(C1-С3)алкил-NH2, где -(С1-С3)алкильная часть -(C1-C3)алкил-NH2 замещена Xf, и -(3-9-членного)гетероциклоалкила, необязательно замещенного Xg;
Xd выбран из (C1-C12)алкила, 1-3 галогенов, -СООН, фенила, необязательно замещенного 1 или 2 группами, выбыранными из галогена, метила и метилфенила, фенилметила, спиропиперидина, трифторметилфенилметила, -(C1-C3)алкокси, пиридинила, диметиламино (C1-C3)алкила, диметиламино, гидроксил(C1-C3)алкила, диметиламино(C1-C3)алкиламинокарбонила, (C1-C3)алкиламино, амино(C1-C3)алкила, диметиламинокарбонил(C1-C3)алкила, диэтиламино(C1-C3)алкилкарбонила, -(C1-C3)алкил-(5-6-членного)гетероциклоалкила, (5-6-членного)гетероциклоалкила, необязательно замещенного -(C1-C3)алкилом, -NH2, -ОН, (4-12-членного)гетероциклоалкил(C1-C3)алкиламино, (C1-C3)алкокси(C1-С3)алкила,
-С(O)СН3, -С(O)NH(C1-С3)алкилфенила, необязательно замещенного 1-3 галогенами;
Хе выбран из ди(C1-C3)алкиламино, амино, 1-3 -ОН, (C1-С3)алкокси, 4-метилпиперазинилфенила, диметиламинофенила, фенила, необязательно замещенного 1-3 группами, выбранными из галогена и метокси, (5-12-членного)гетероарила, -(C1-C3)алкил-C(O)NH2, -C(O)NH2, -C(O)OH, -(C1-C3)алкил-С(O)ОН и (4-12-членного)гетероциклоалкила, необязательно замещенного 1-2 (C1-С3)алкилами;
Xf выбран из (C3-C14)циклоалкила, спиро-(C3-C14)циклоалкила, фенила, фенил(C1-C3)алкила, необязательно замещенного фенилметилокси или (C1-C3)алкокси, и тиенил (C1-C3)алкила;
Xg выбран из (C1-C3)алкила, (C1-C3)алкилкарбонила, (4-12-членного)гетероциклоалкилкарбонила, диалкиламино(C1-С3)алкилкарбонила, 1-метилпиперидинила, диалкиламино(C1-С3)алкила, (5-12-членного)гетероарилкарбонила, (C1-С3)алкокси (C1-C3)алкилкарбонила, фенилкарбонила, фенил(С1-С3)алкилкарбонила, оксо, фенил(C1-C3)алкила, -(5-6-членного)гетероарил(C1-C3)алкила, пиперидинилокси,
-ОН, оксо, 1-2 галогенов и 1-2 метилов; и
Rzb представляет собой водород или (C1-C3)алкил, необязательно замещенный 1-3 -ОН;
R3a выбран из галогена, (C1-C3)алкила, -NO2, (C1-С3)алкокси, (C2-C12)алкинила, необязательно замещенного R14, (C1-С3)алкоксикарбонил(C1-C3)алкила, (C6-C14)арил(C1-C3)алкокси, -C(O)N(H)(C1-C3)алкила, -N(H)С(О)-(C1-C3)алкила, -C(O)-(C1-С3)алкила, -CN, фенила, -OCF3, -N(H)-R13, -ОН, -CF3, -S-CH3 и гидроксиметил(C2-C12)алкинила;
R3b, R3c и R3d независимо выбраны из Н, -ОН, -N+(O)OH, (C1-С3)алкоксила и галогена;
либо R3a и R3d вместе с атомами углерода, к которым они присоединены, образуют 5-членный гетероарил, необязательно замещенный метилом или -NH2, или 5-6-членный гетероциклоалкил;
R13 выбран из (C6-C14)арил(C1-С3)алкила, при этом арильная часть арилалкила является необязательно замещенной 1, 2 или 3 (С1-С3)алкокси, галогенами, метилами, метокси, -CF3, (C3-C14)циклоалкилами и (5-12-членными)гетероарилалкилами; и
R14 выбран из гидроксил(C1-C12)алкила, Н и TMS.
2. Соединение по п.1 или его фармацевтически приемлемая соль, где R3a выбран из галогена, (C1-C3)алкила, -NO2, (С1-С3)алкокси, (С2-С12)алкинила, необязательно замещенного R14, (C1-С3)алкоксикарбонил(С1-С3)алкила, (C6-C14)арил(C1-C3)алкокси, -C(O)N(H)(С1-С3)алкила, -N(Н)С(O)(C1-C3)алкила, -C(O)-(C1-С3)алкила, -CN-, фенила, -OCF3, -N(H)-R13, -ОН, -CF3, -S-CH3 и гидроксиметил(С2-С12)алкинила и
каждый из R3b, R3c и R3d представляет собой Н.
3. Соединение по п.1 или его фармацевтически приемлемая соль, где R3a представляет собой галоген, (C1-C3)алкокси или -OCF3 и каждый из R3b, R3c и R3d представляет собой Н.
4. Соединение по п.1 или его фармацевтически приемлемая соль, где
R2 представляет собой (3-9-членный)гетероциклоалкил, необязательно замещенный Xg;
R3a представляет собой галоген, (C1-C3)алкокси или -OCF3 и
каждый из R3b, R3c и R3d представляет собой Н.
5. Соединение по п.1 или его фармацевтически приемлемая соль, где
R2 представляет собой -(C1-C3)алкил-(5-10-членный)гетероарил, где гетероарил необязательно замещен -(C1-С3)алкилом, галогеном или фенилом;
R3a представляет собой галоген, (C1-C3)алкокси или -OCF3 и
каждый из R3b, R3c и R3d представляет собой Н.
6. Соединение по п.1 или его фармацевтически приемлемая соль, где
R2 представляет собой -(C1-C4)алкил-(3-9-членный)гетероарил, необязательно замещенный по любому положению (3-9-членного)гетероарила с помощью Xd;
R3a представляет собой галоген, (C1-C3)алкокси или -OCF3 и
каждый из R3b, R3c и R3d представляет собой Н.
7. Соединение по п.1 или его фармацевтически приемлемая соль, где
R2 представляет собой гетероциклоалкил, выбранный из пиперазинила, пиперидинила, пирролидинила, изоксазолила, азетидинила, морфолинила, тетрагидрофуранила, тиазолидинила или октагидро-1Н-индолила, где гетероциклоалкил необязательно замещен Xg;
R3a представляет собой галоген, (C1-C3)алкокси или -OCF3 и
каждый из R3b, R3c и R3d представляет собой Н.
8. Соединение по п.1 или его фармацевтически приемлемая соль, где R2 представляет собой (3-9-членный)гетероциклоалкил(C1-C3)алкил, при этом гетероциклоалкильная часть гетероциклоалкилалкила представляет собой пирролидинил, пиперидинил, пиперазинил, азетидинил, морфолинил, 1,4-диазепанил, 2,5-диазабицикло[2,2,1]гептил, азабицикло[2,2,1]гептан, 8-азабицикло[3,2,1]окт-8-ил, (1S,4S)-2,5-диазабицикло[2,2,1]гептил, 2,5-дигидро-1Н-пирролил, (1R,4R)-2,5-диазабицикло[2,2,1]гептан-2-ил, (1R,5S)-8-азабицикло[3,2,1]октил, (8aS)-гексагидропиррол[1,2-а]пиразин-2(1Н)ил, диметилпиперазинил или (3aR,6aS)гексагидропиррол[3,4-с]пирролил.
9. Соединение по п.1 или его фармацевтически приемлемая соль, где
R2 представляет собой (5-10-членный)гетероарил(C1-С3)алкил, необязательно замещенный по любому положению кольца -(C1-C3)алкилом, галогеном и фенилом;
R3a представляет собой галоген, (C1-C3)алкокси или -OCF3 и
каждый из R3b, R3c и R3d представляет собой Н.
10. Соединение по п.1 или его фармацевтически приемлемая соль, где R2 представляет собой
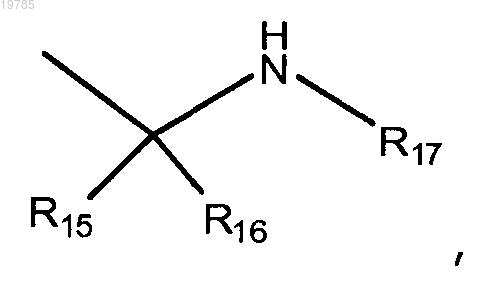
при этом R15 выбран из Н или -(C1-С6)алкила,
R16 выбран из Н, фенила и -(C1-C6)алкила,
R17 выбран из Н, -(C1-C3)алкил-C(O)NH2, -(C1-С3)алкил-С(O)ОН и (4-12-членного)гетероциклоалкил(C1-C3)алкила.
11. Соединение по п.1, выбранное из следующих соединений:
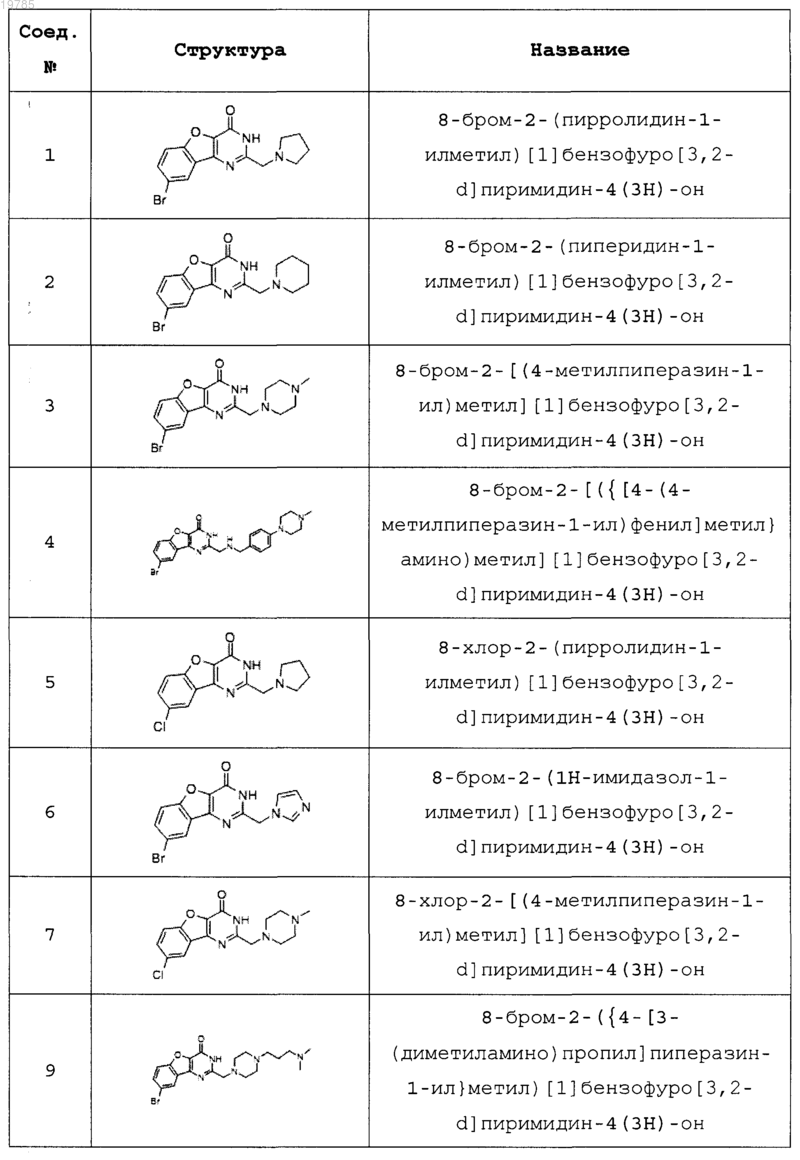

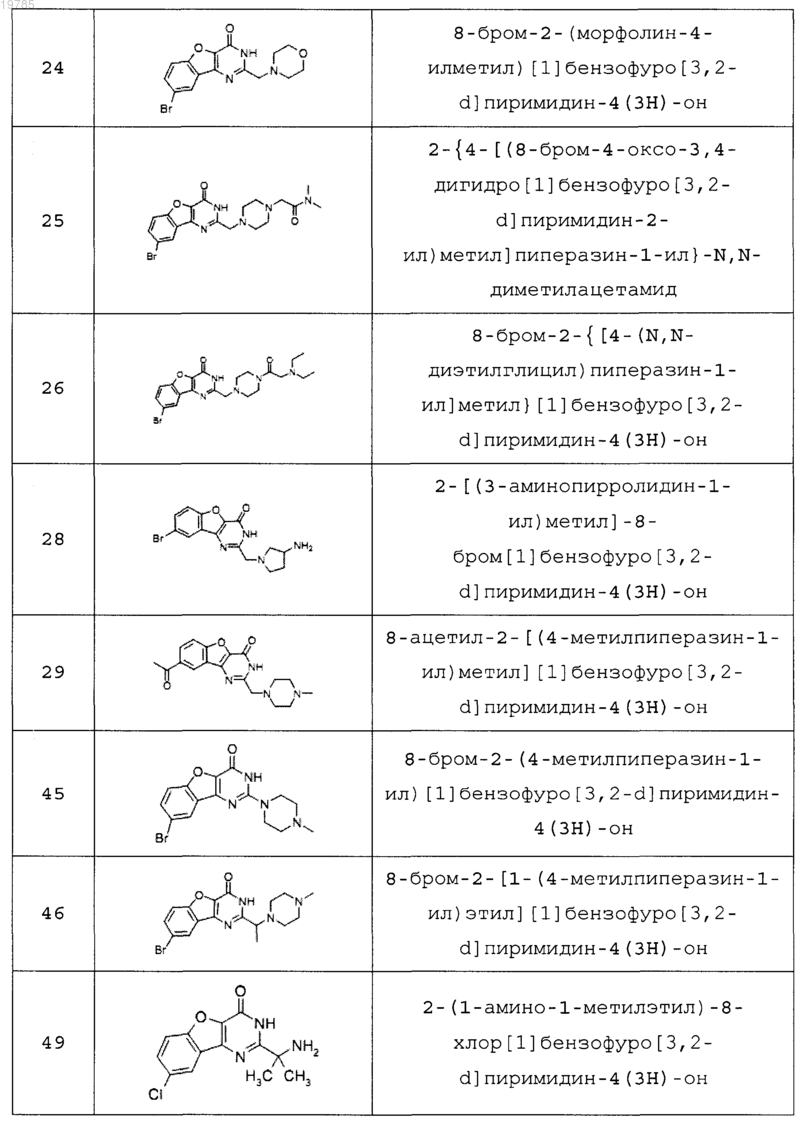

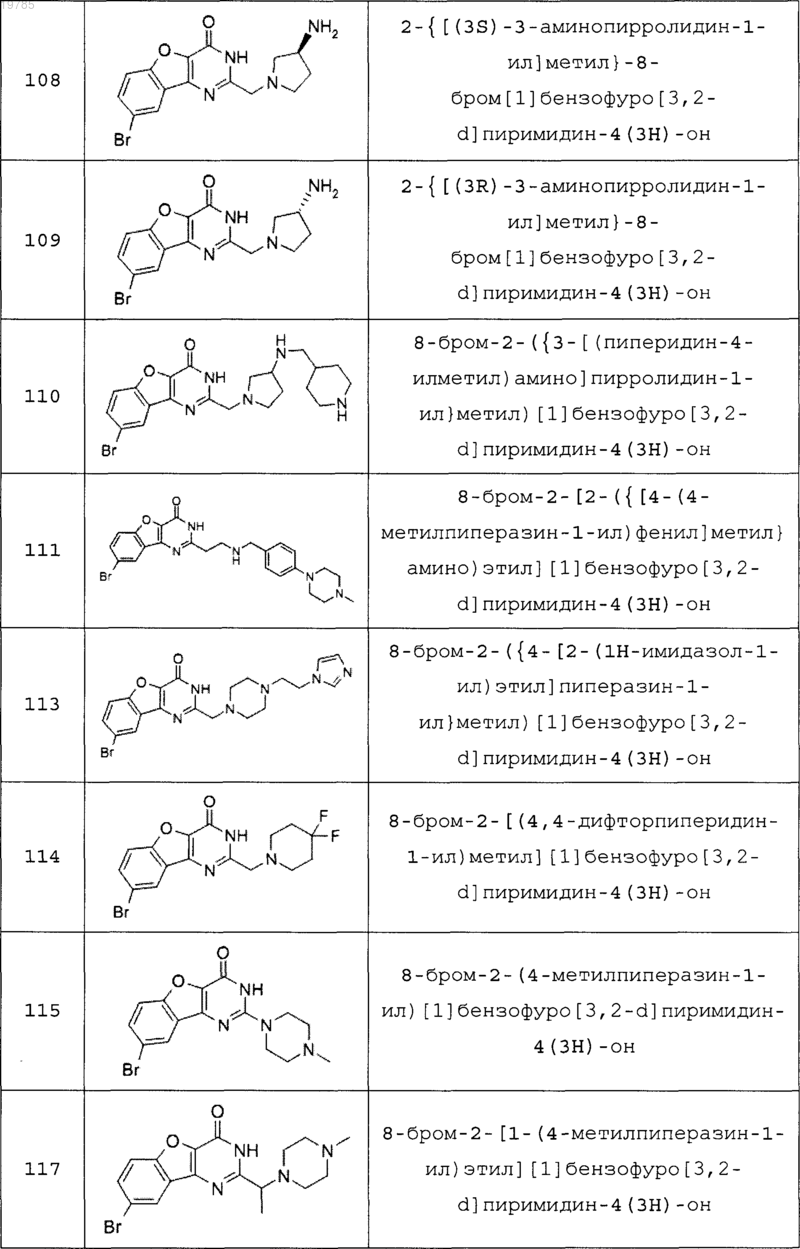

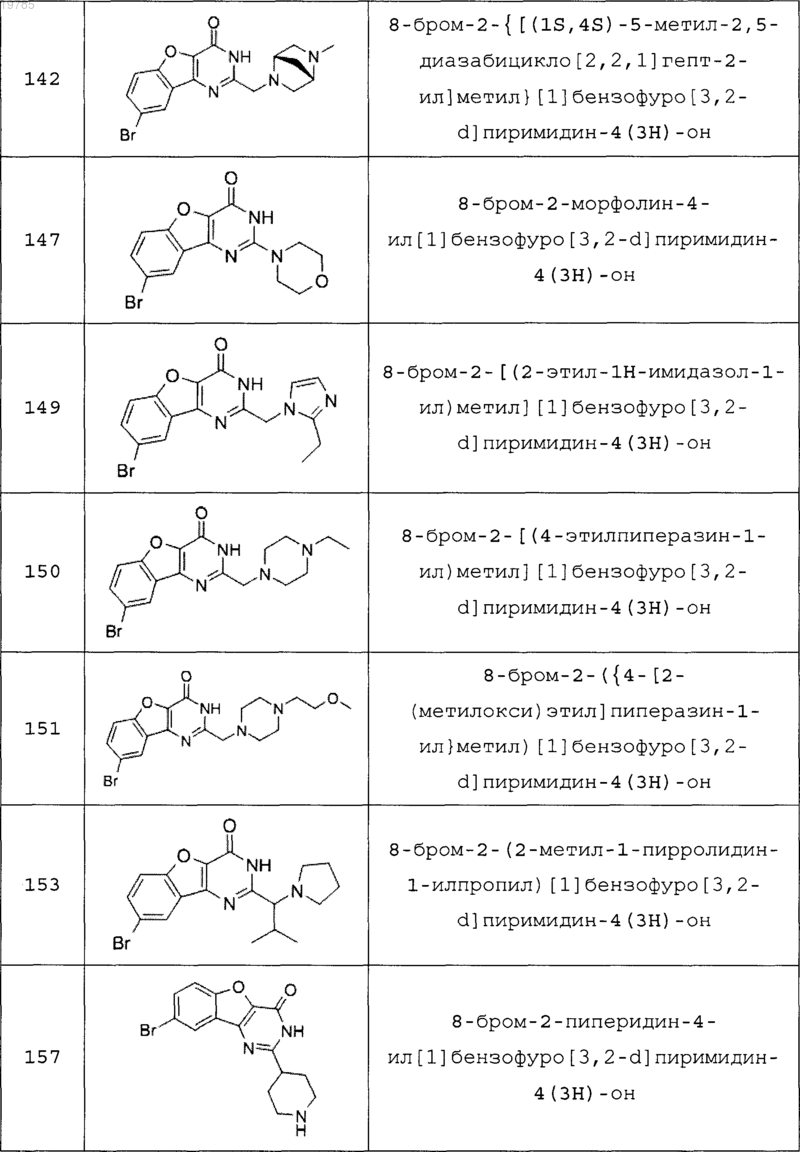
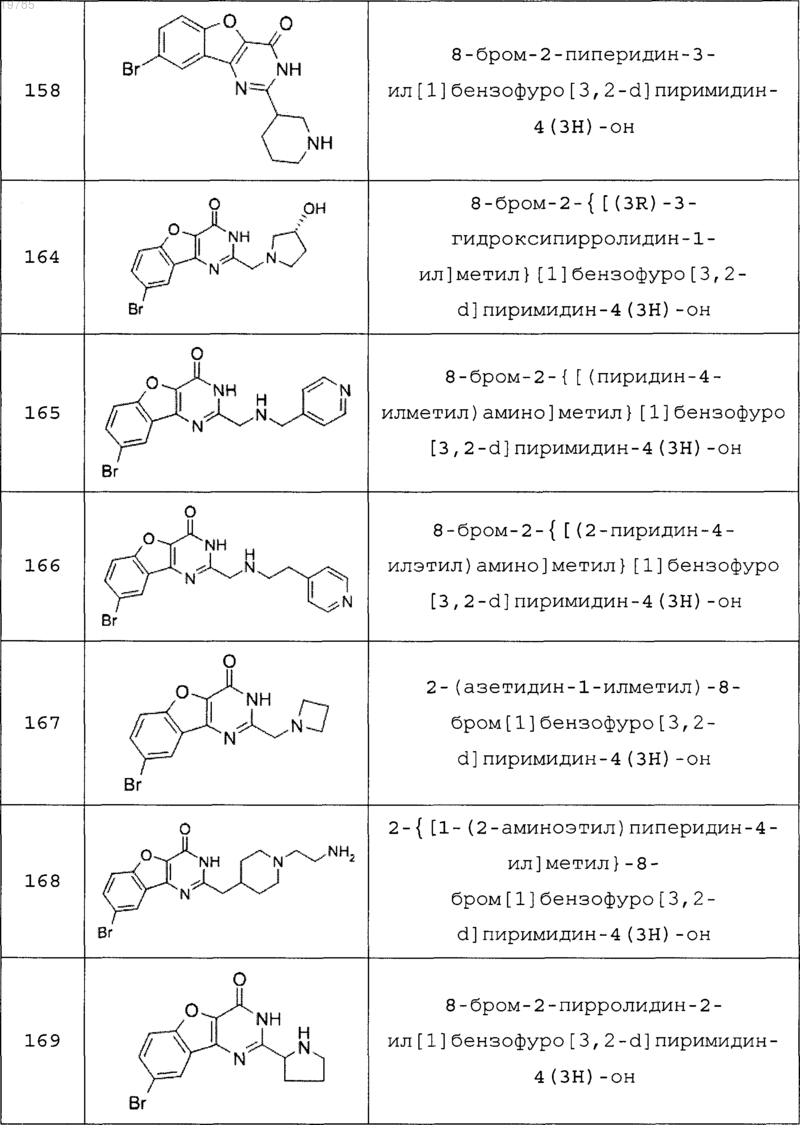
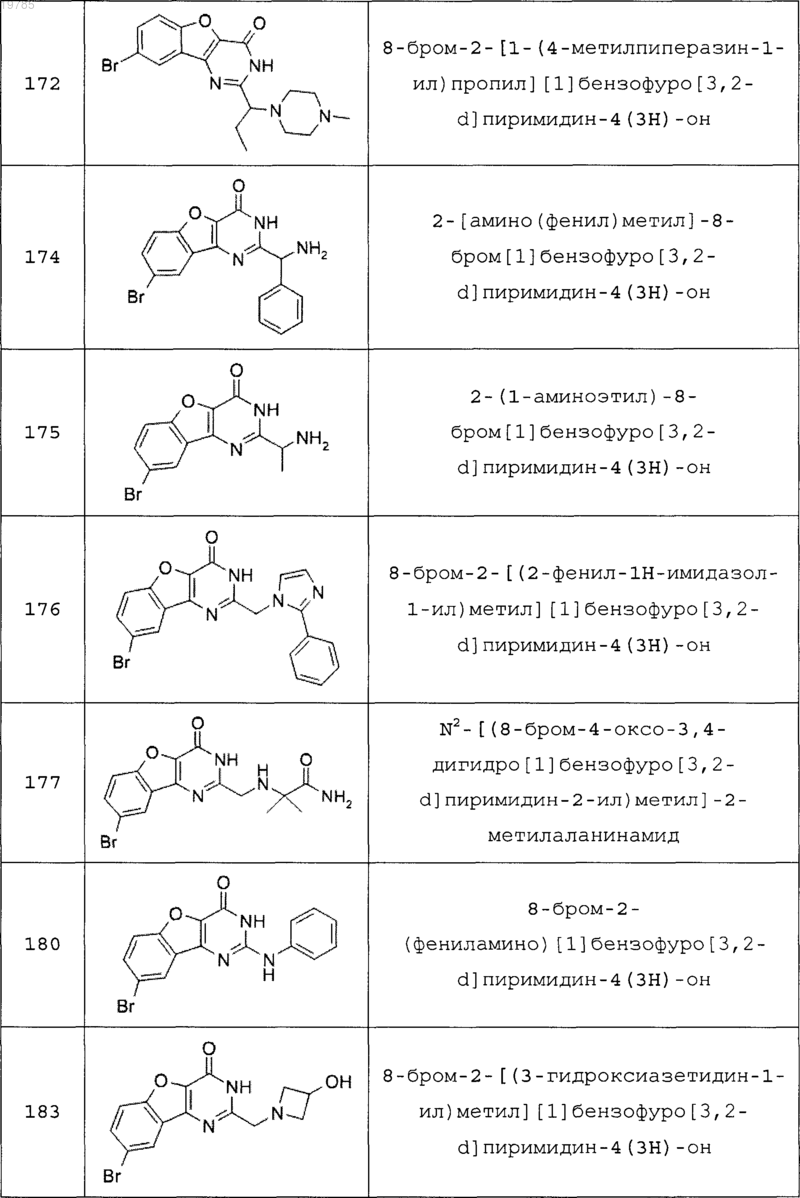
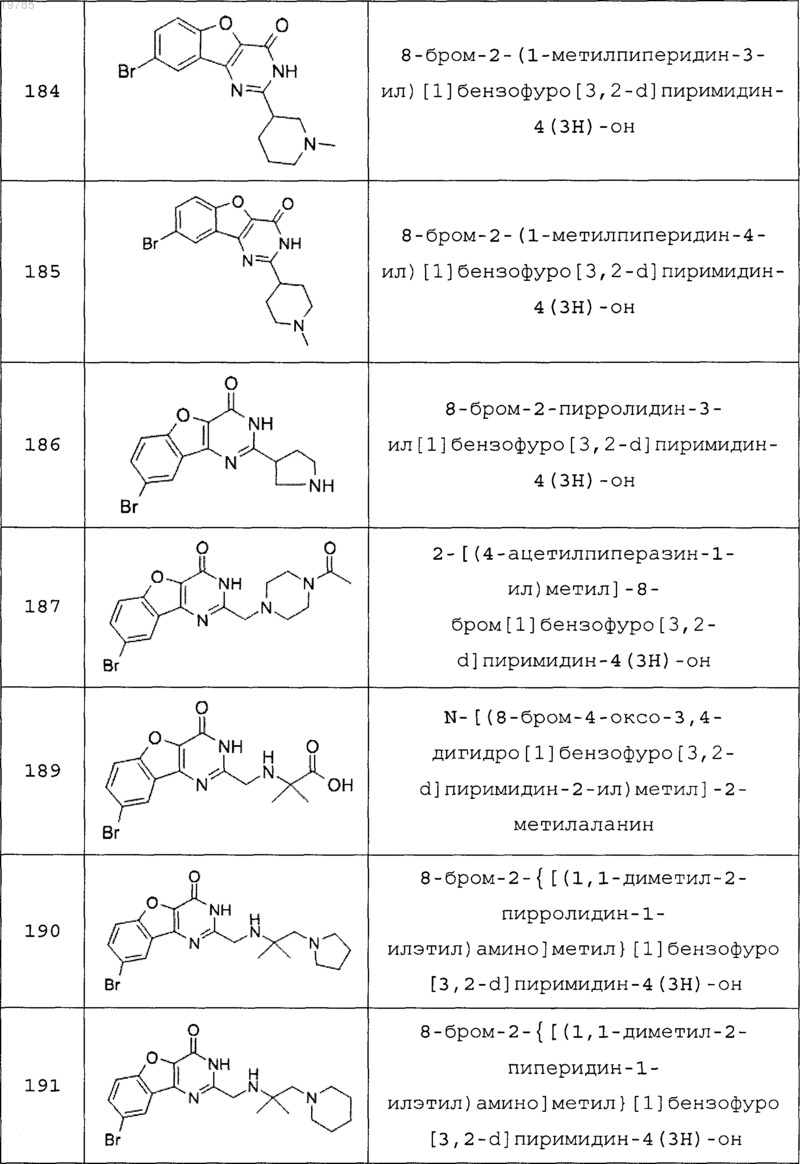
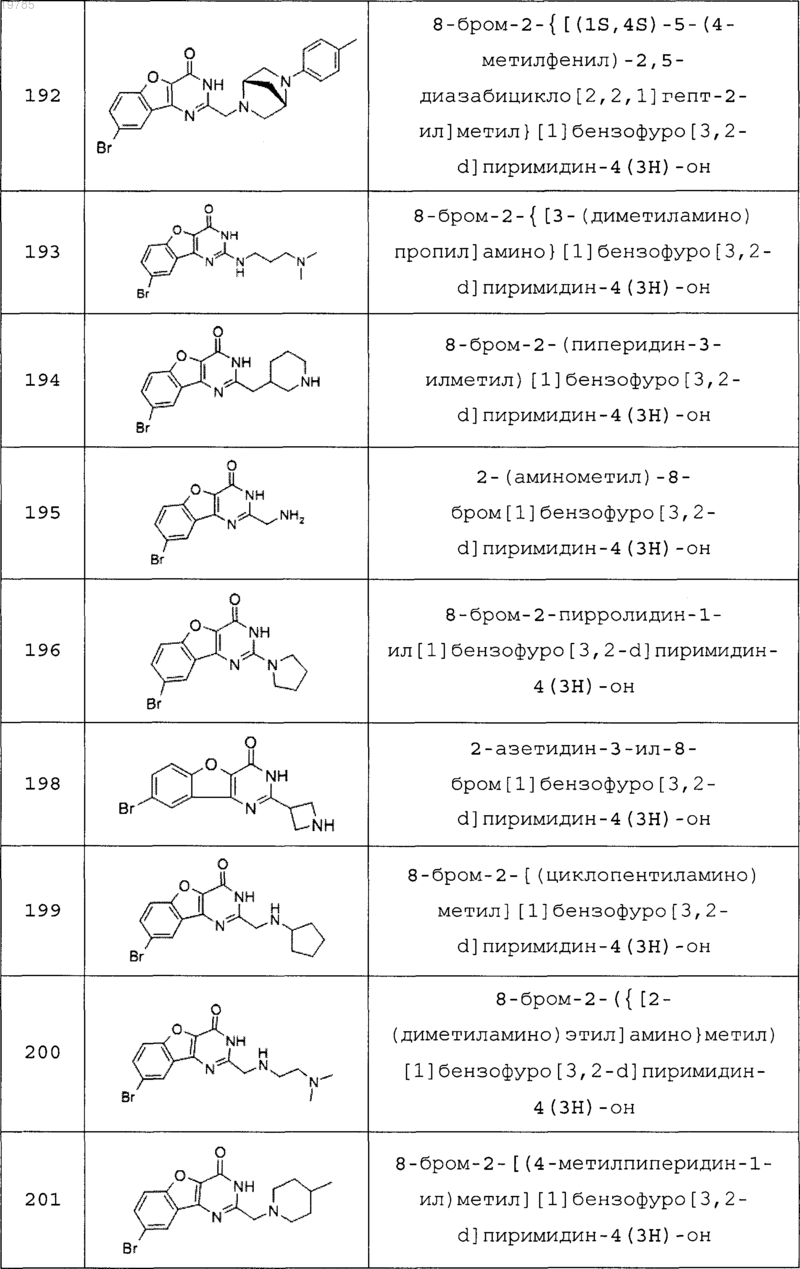
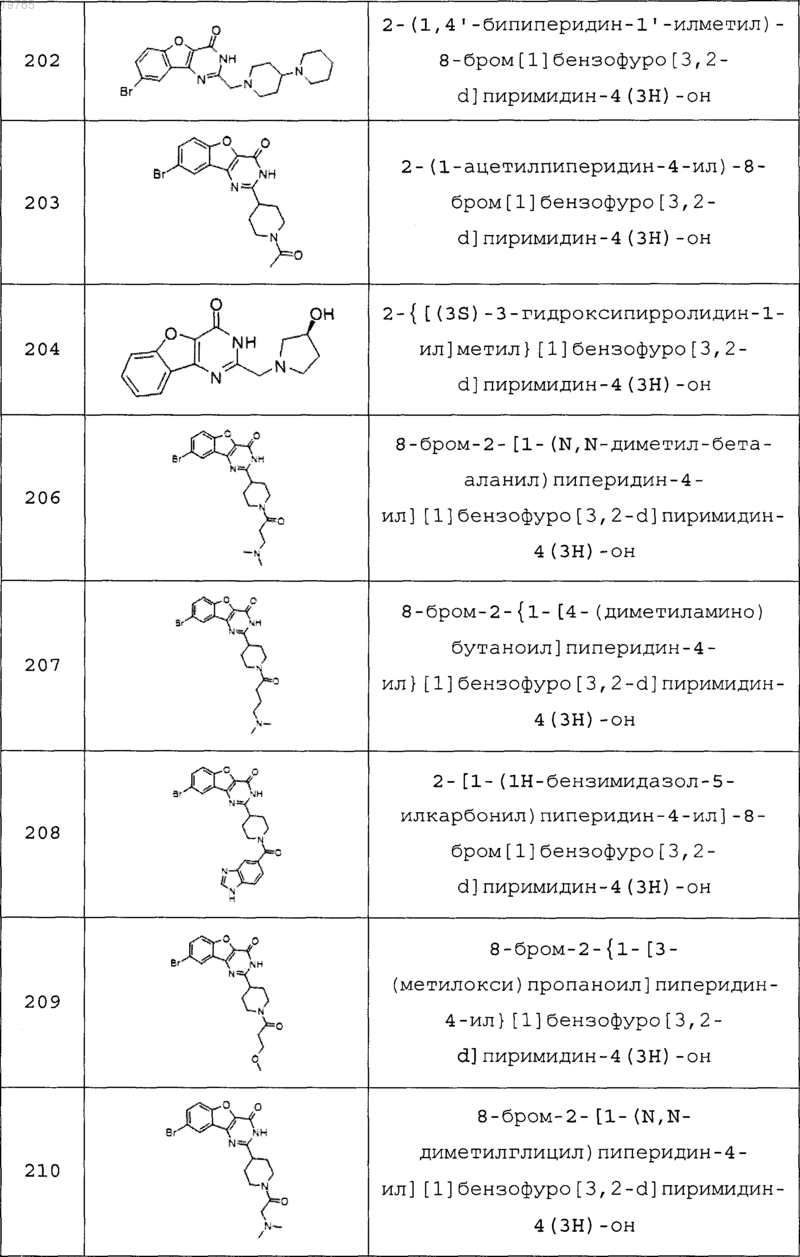

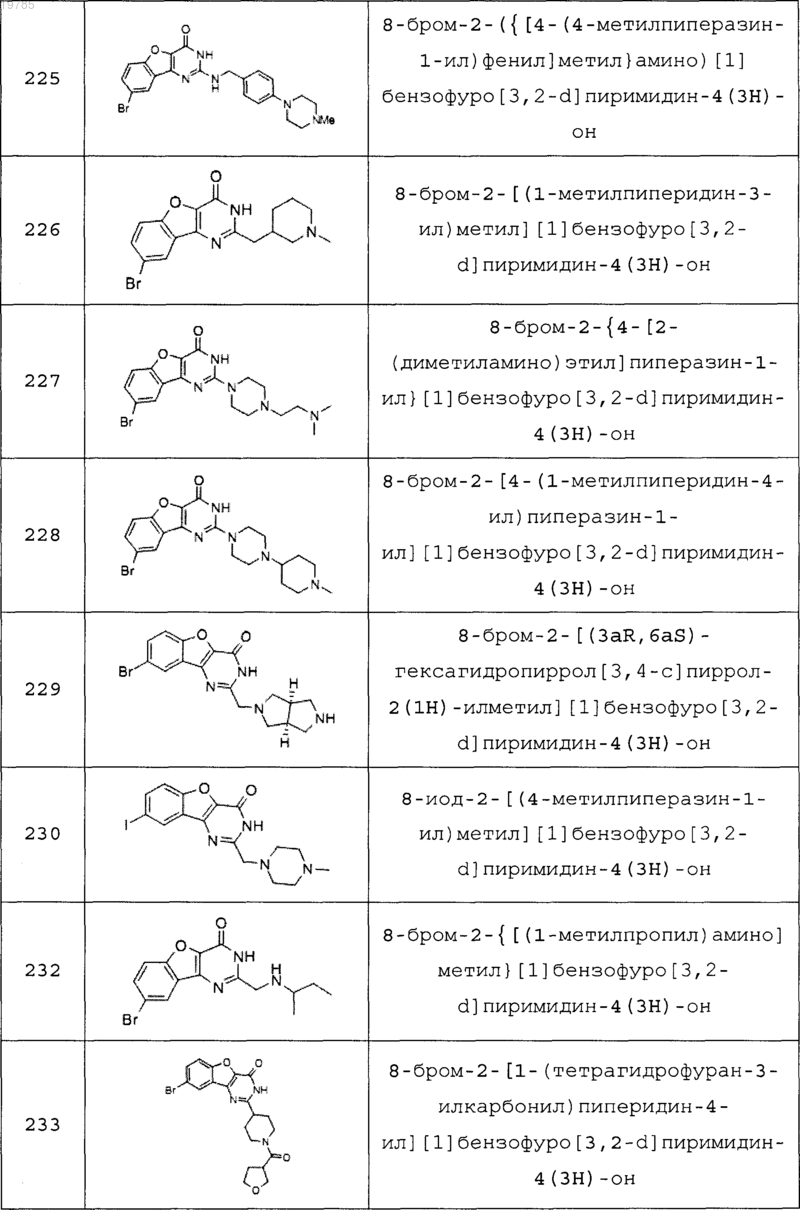
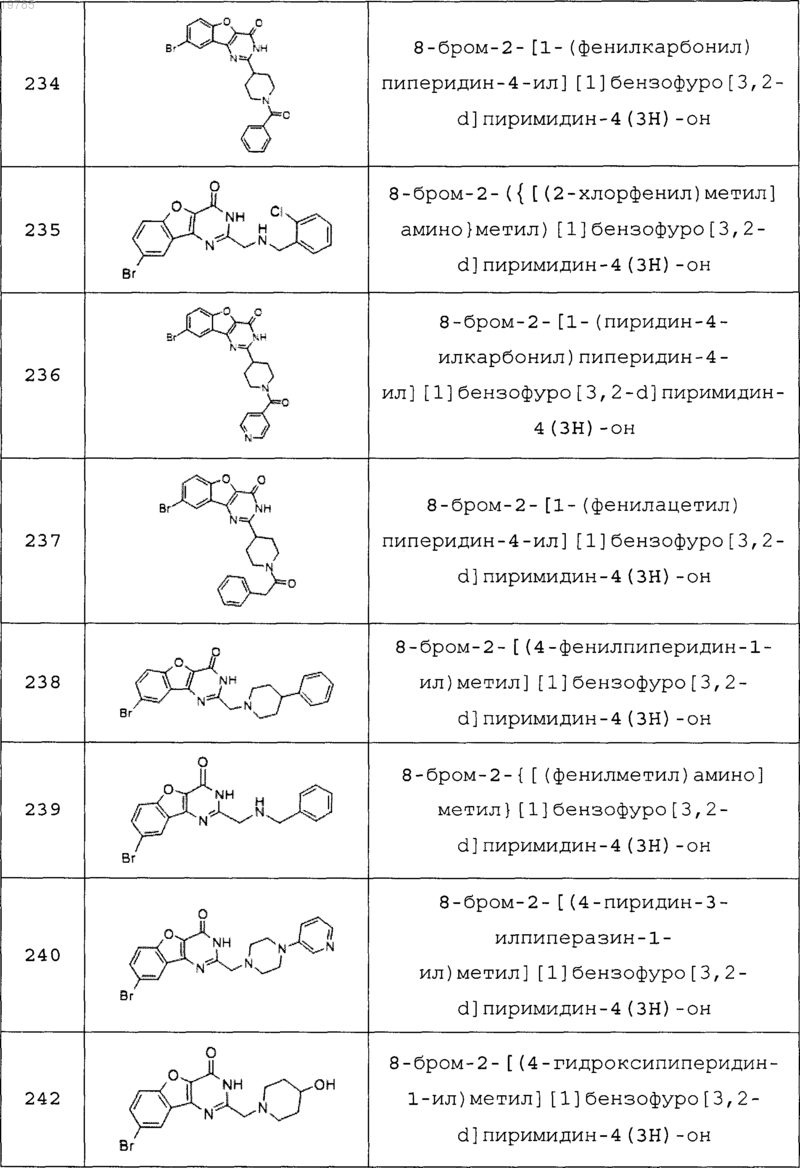
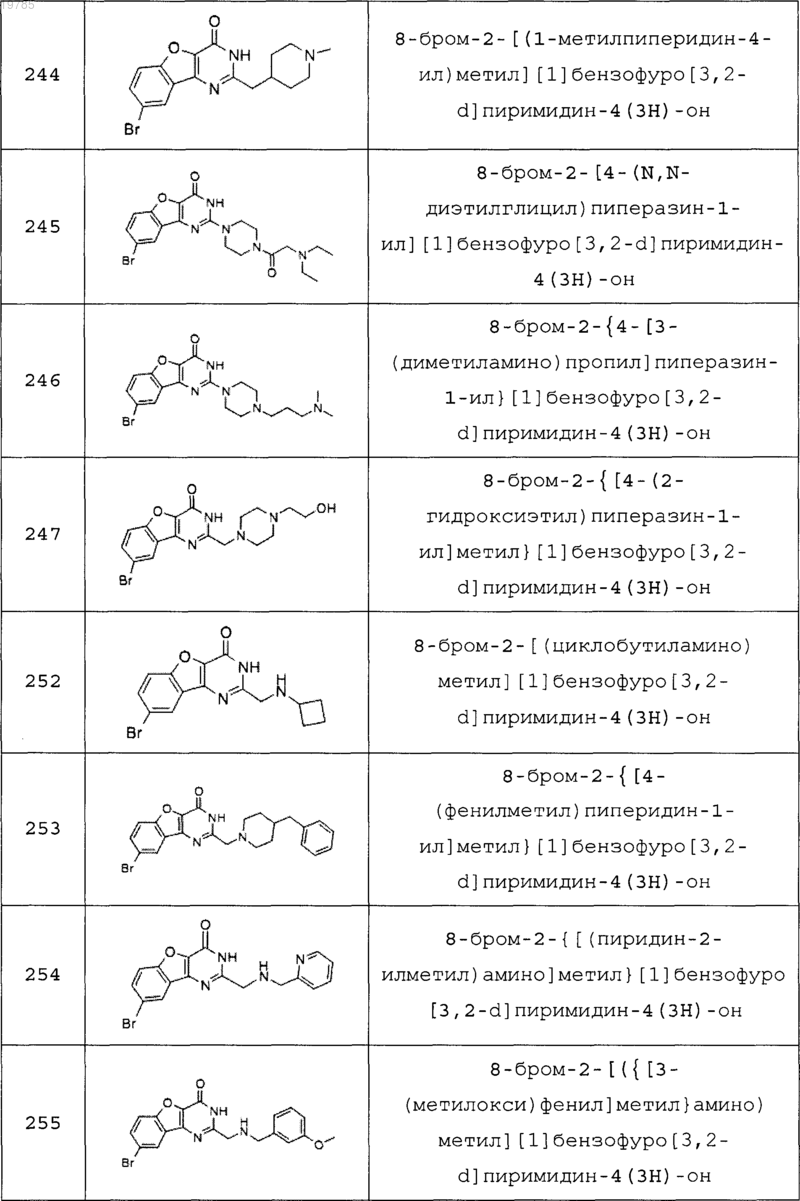

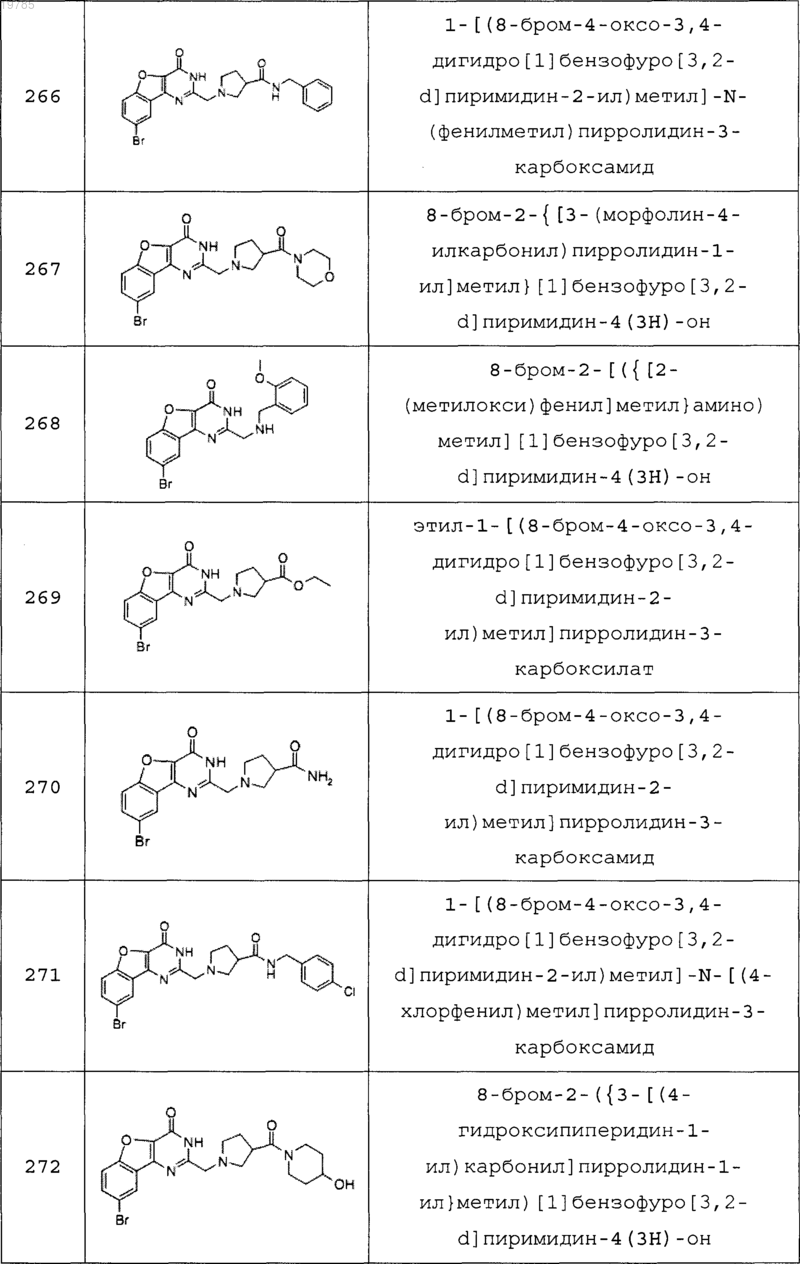
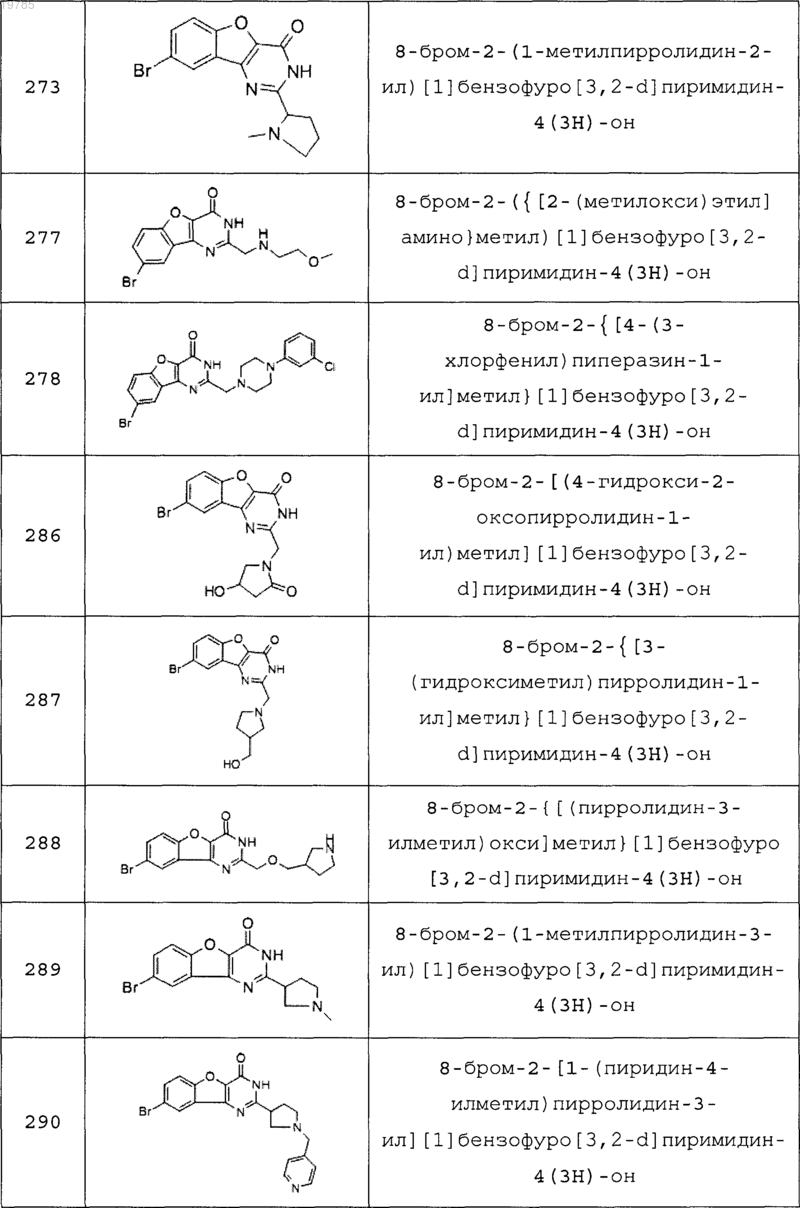

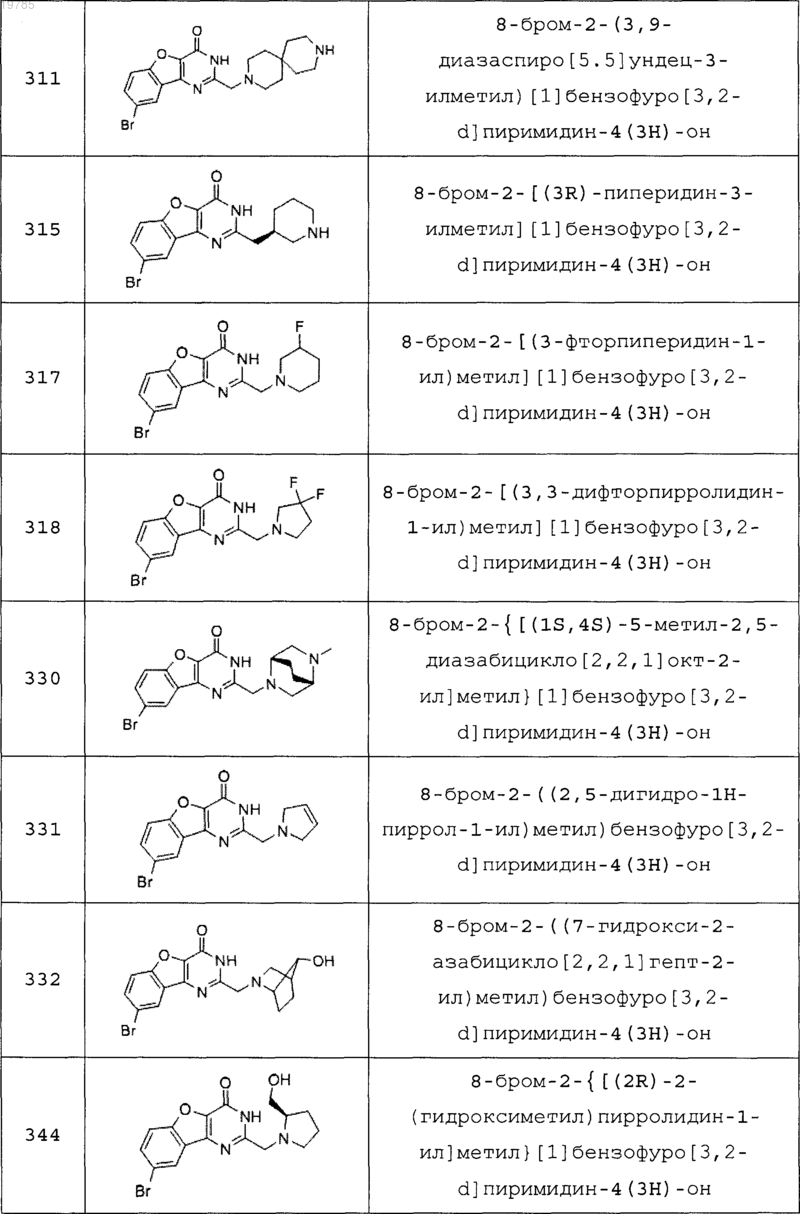
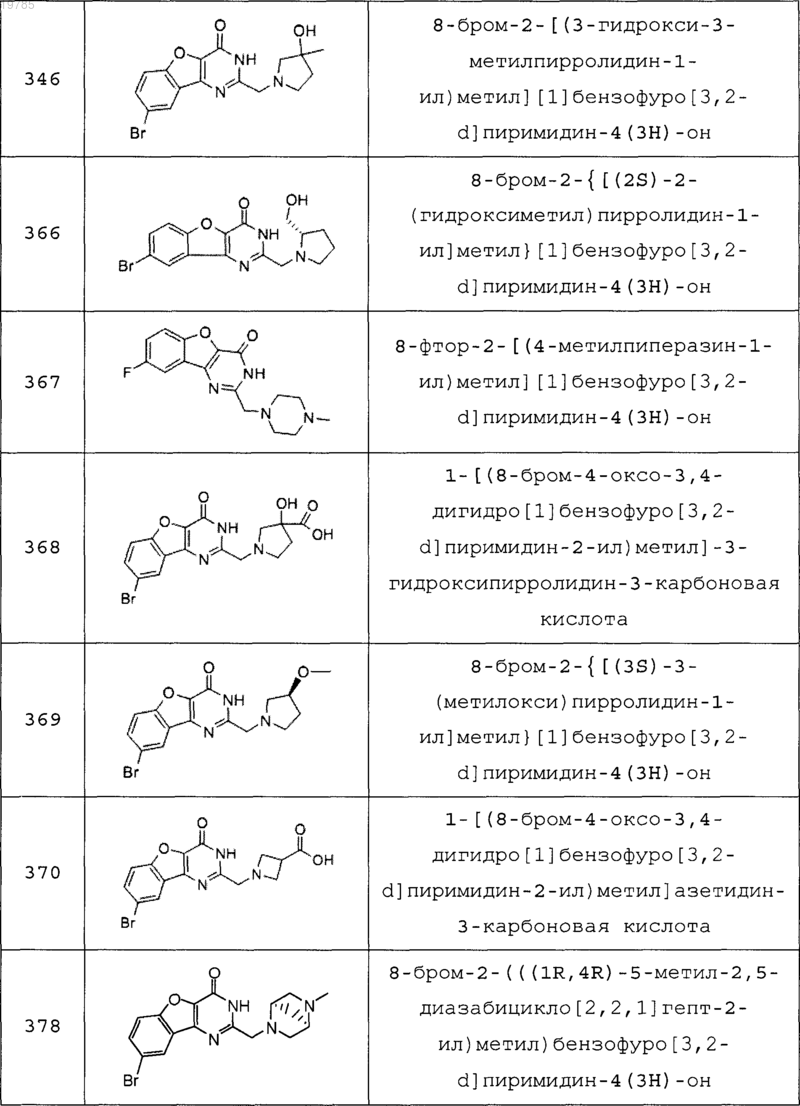
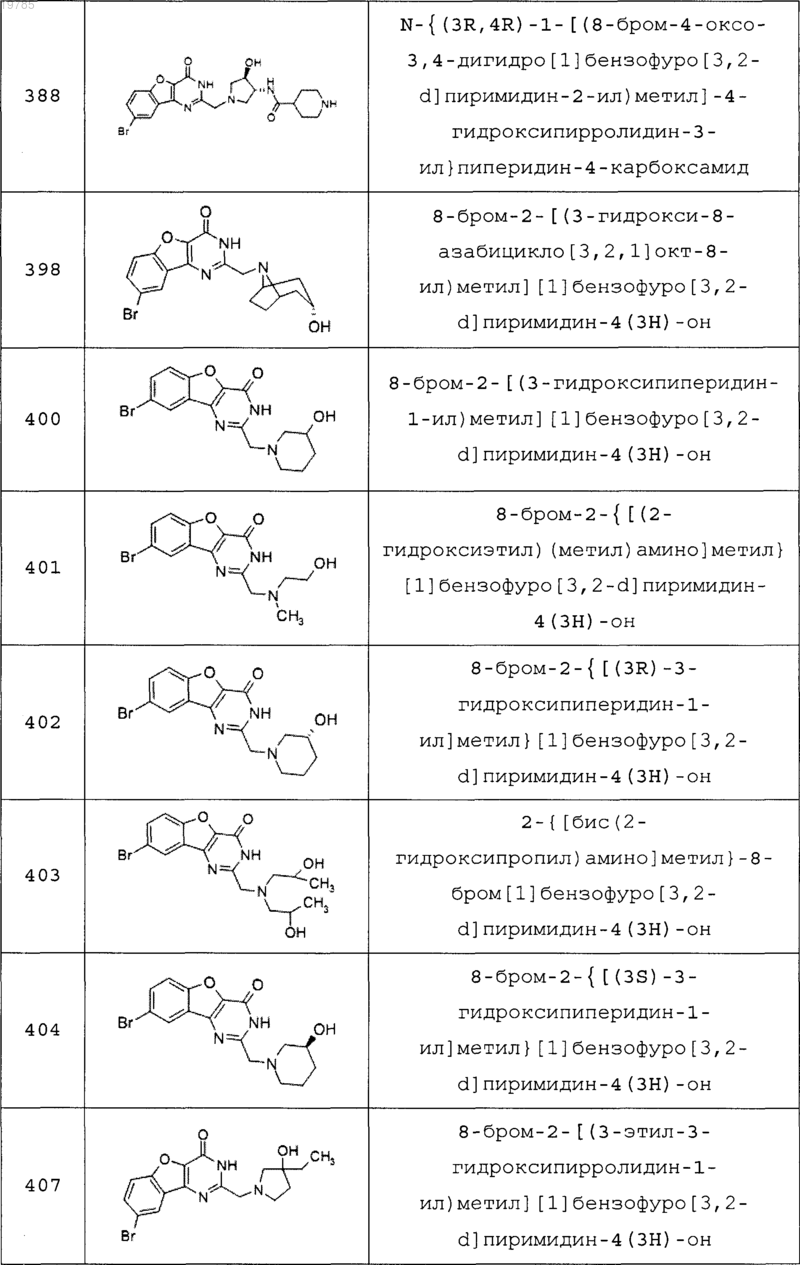
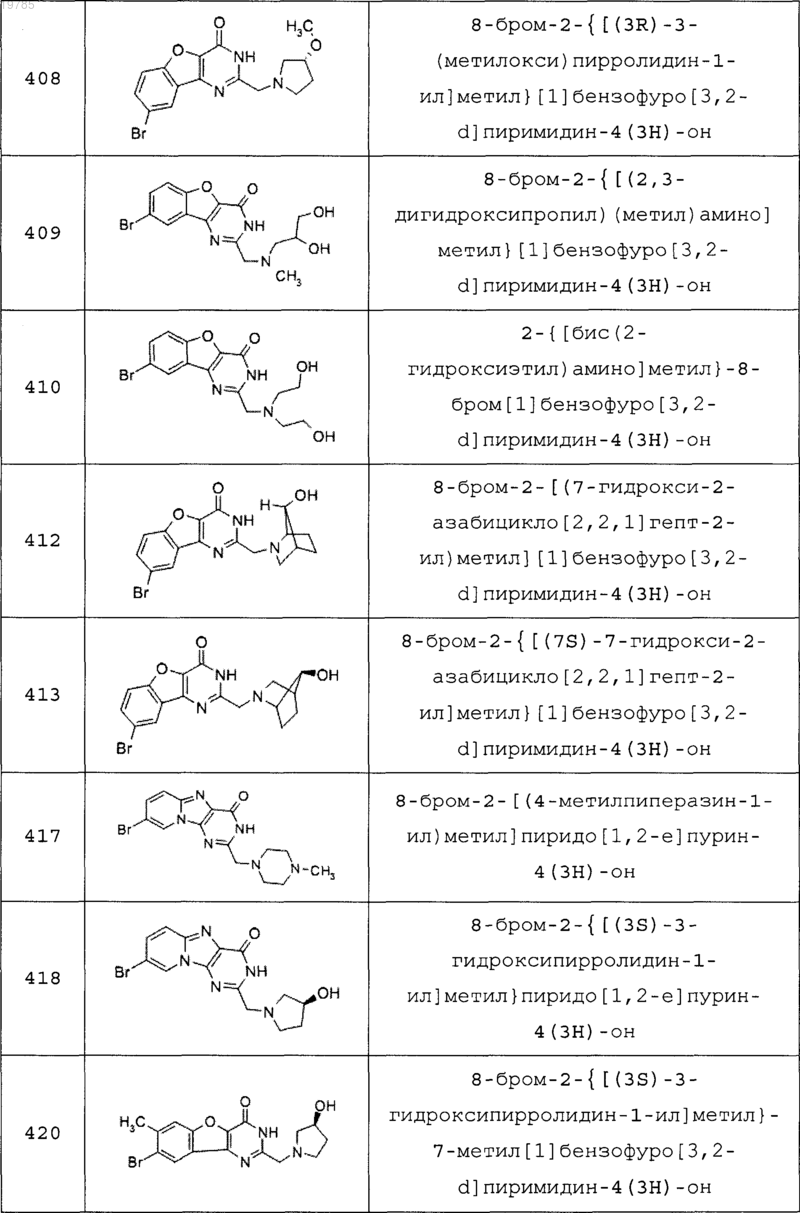
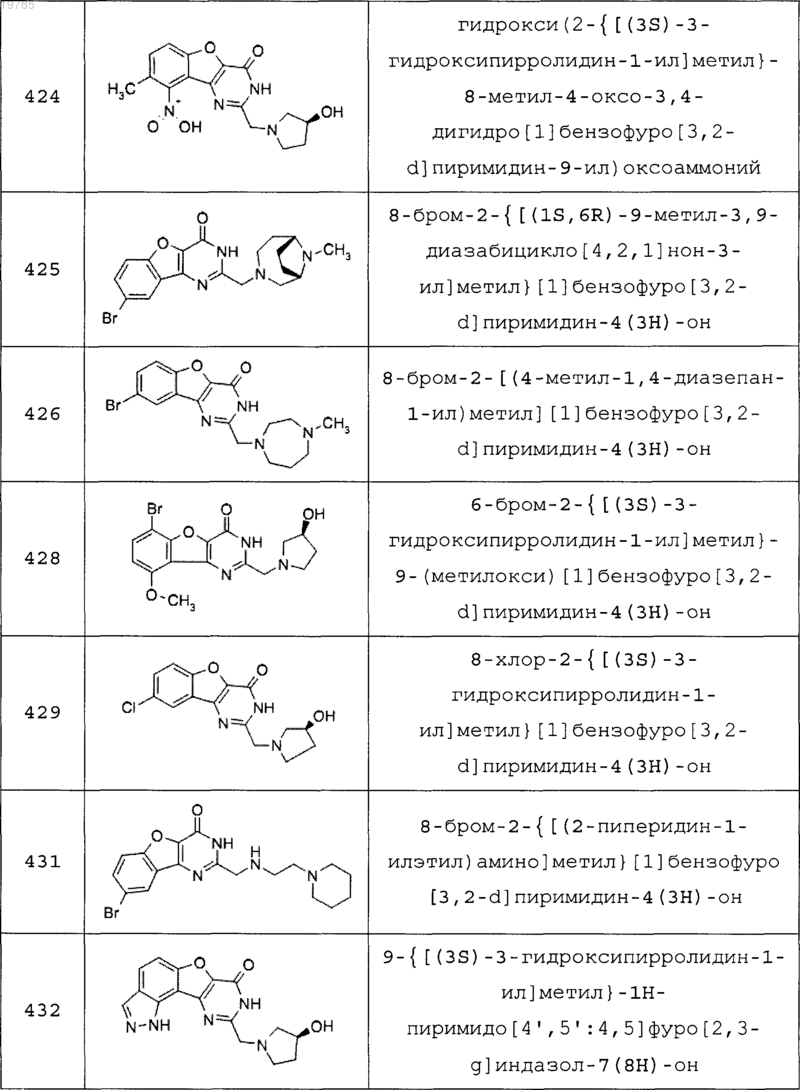
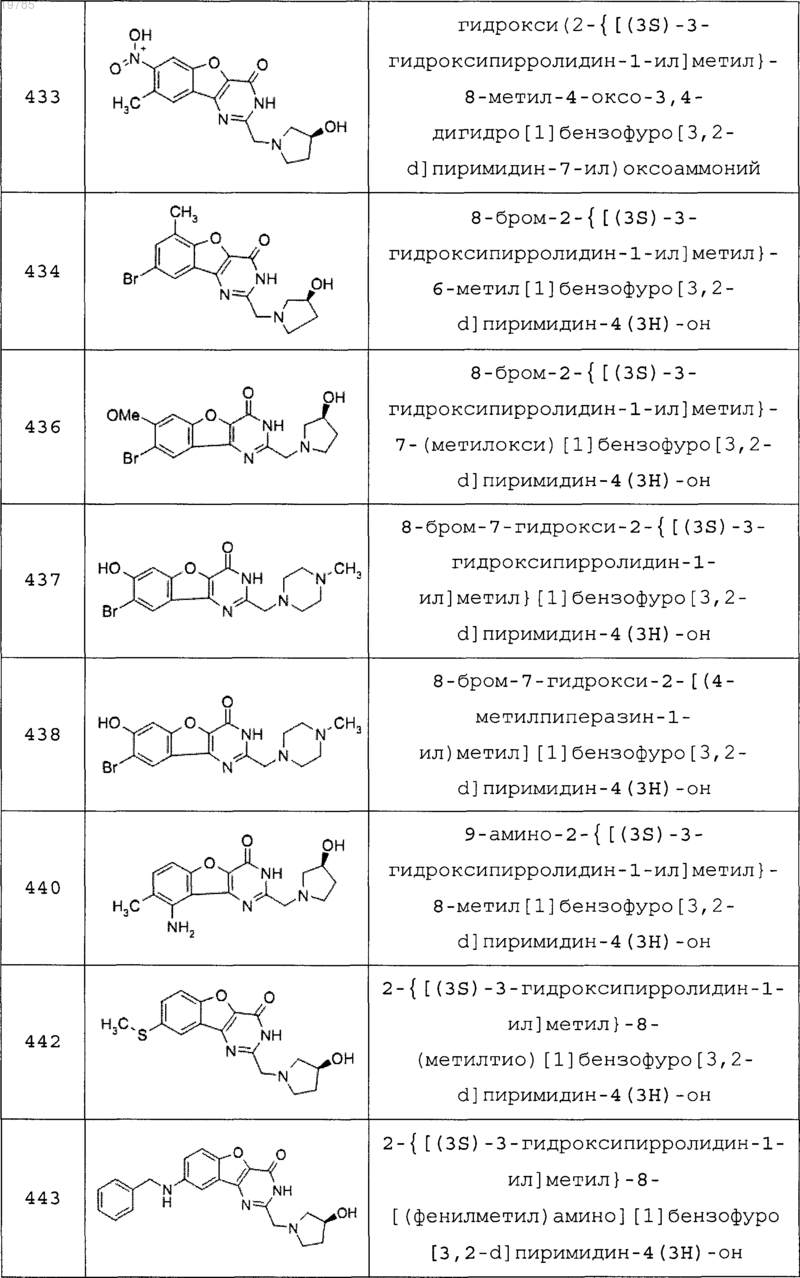
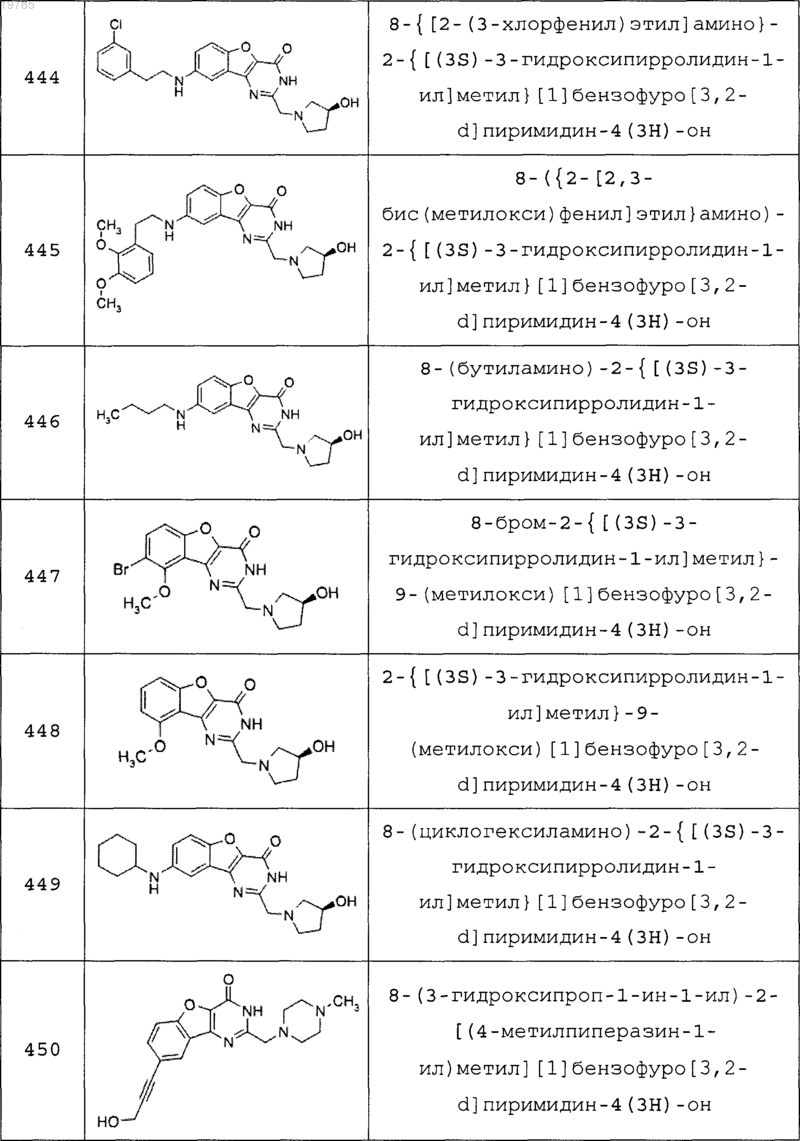
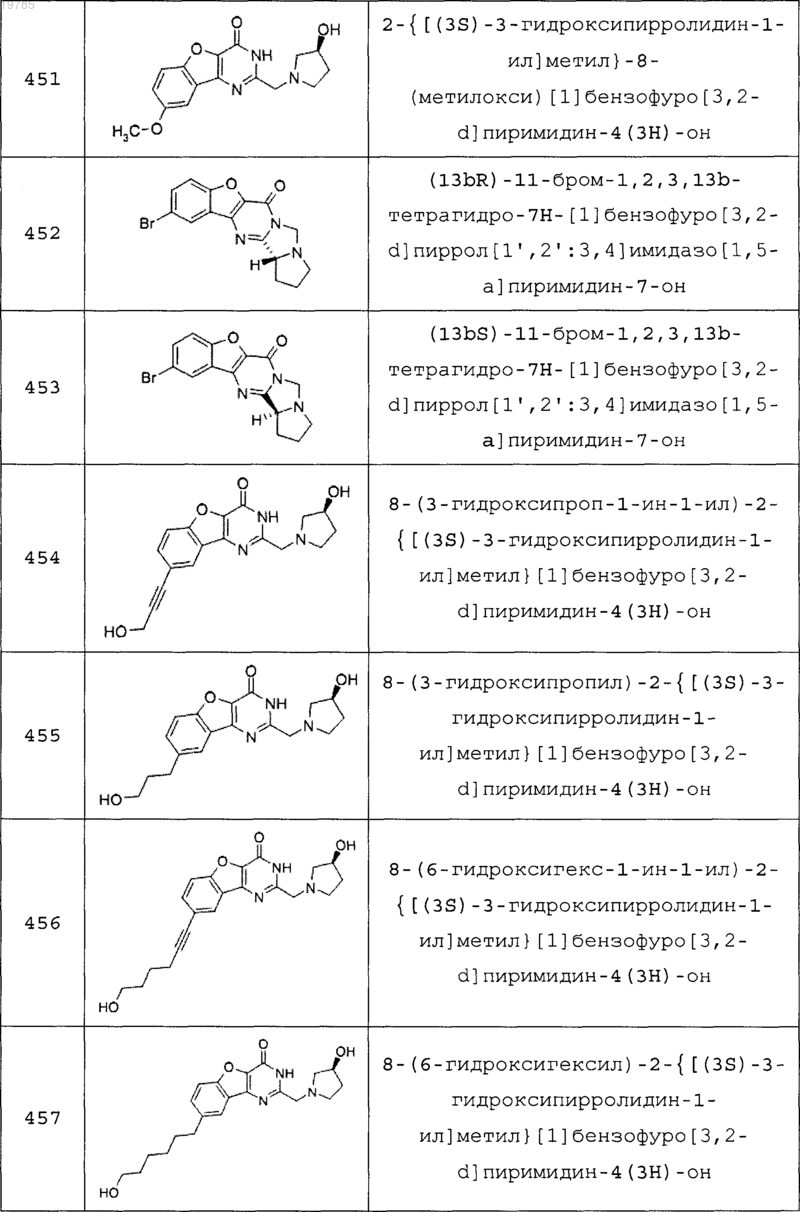

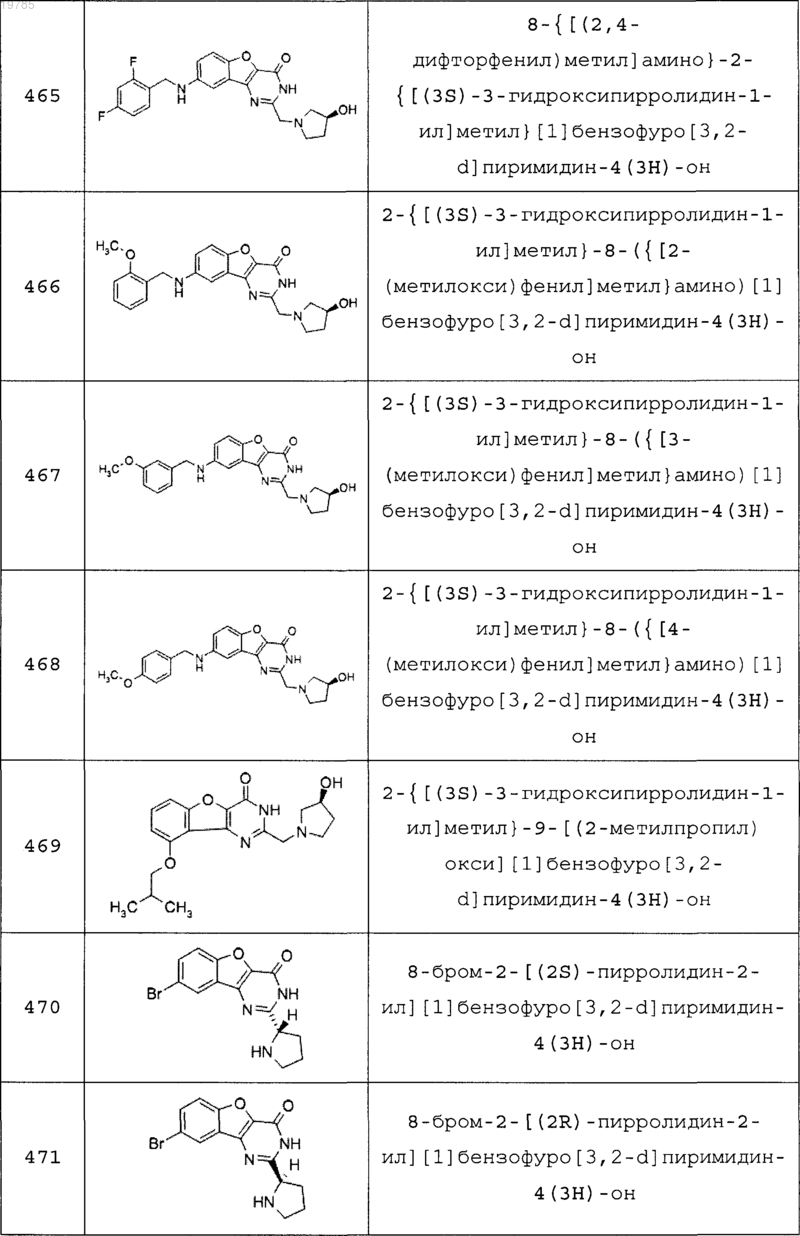
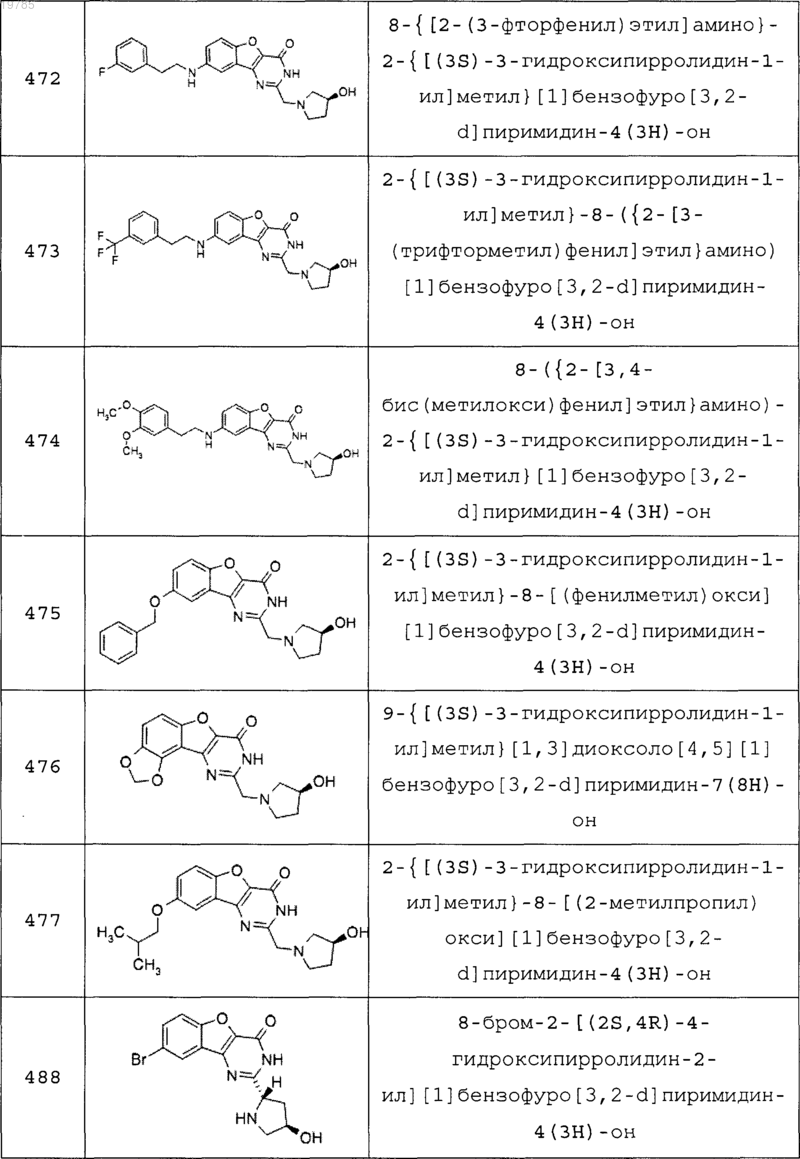
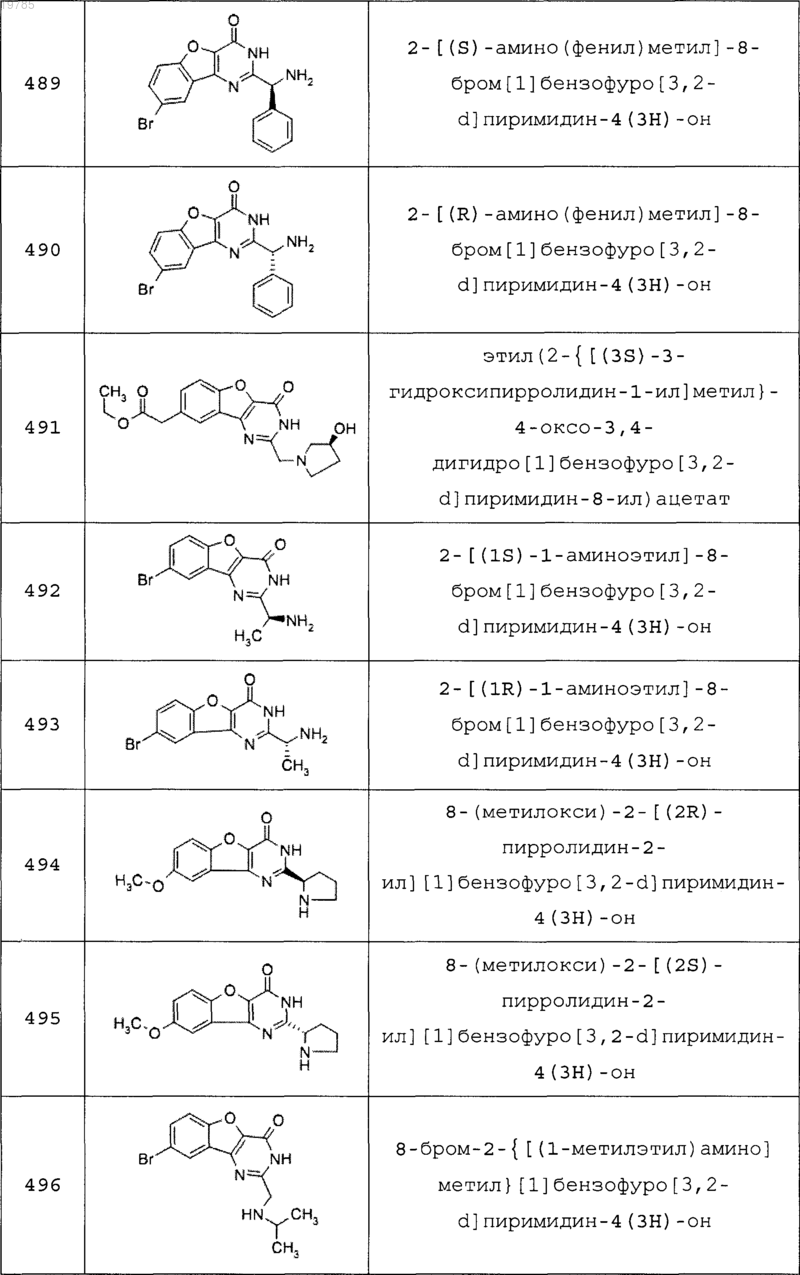

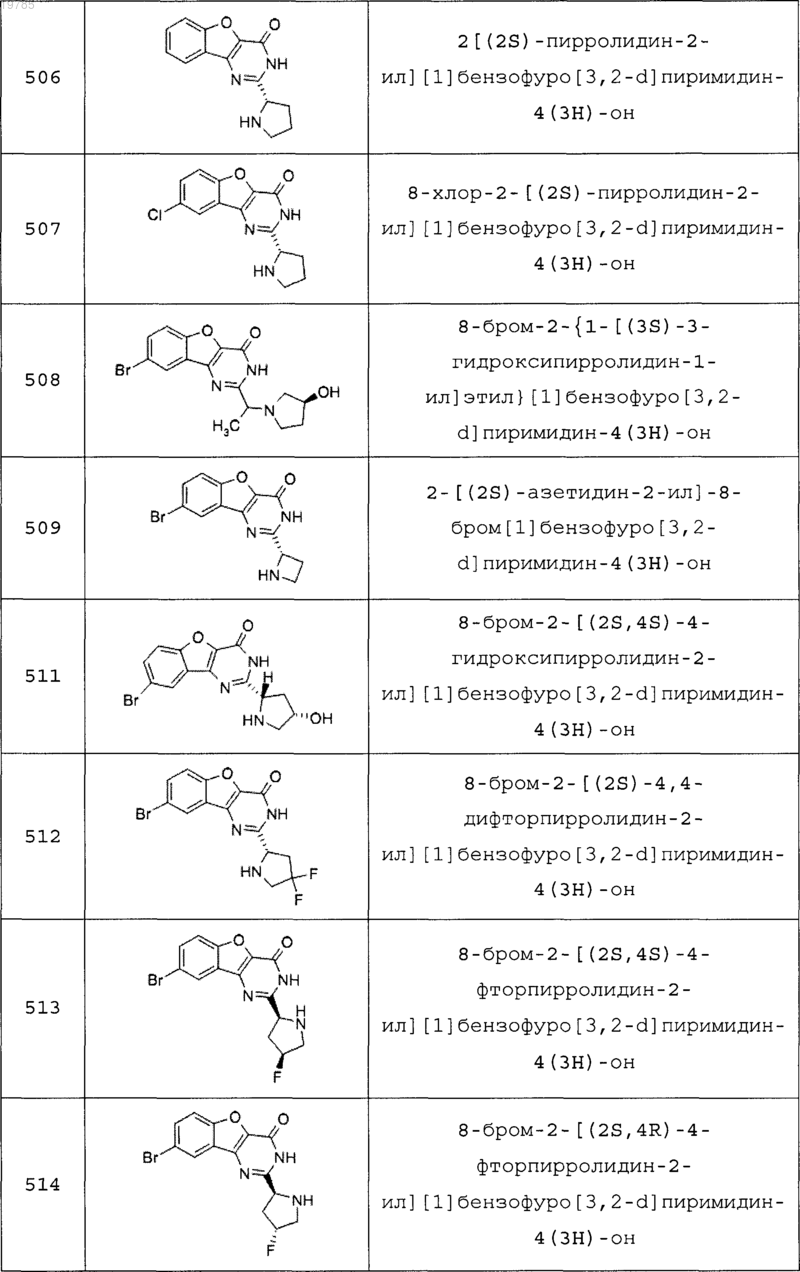
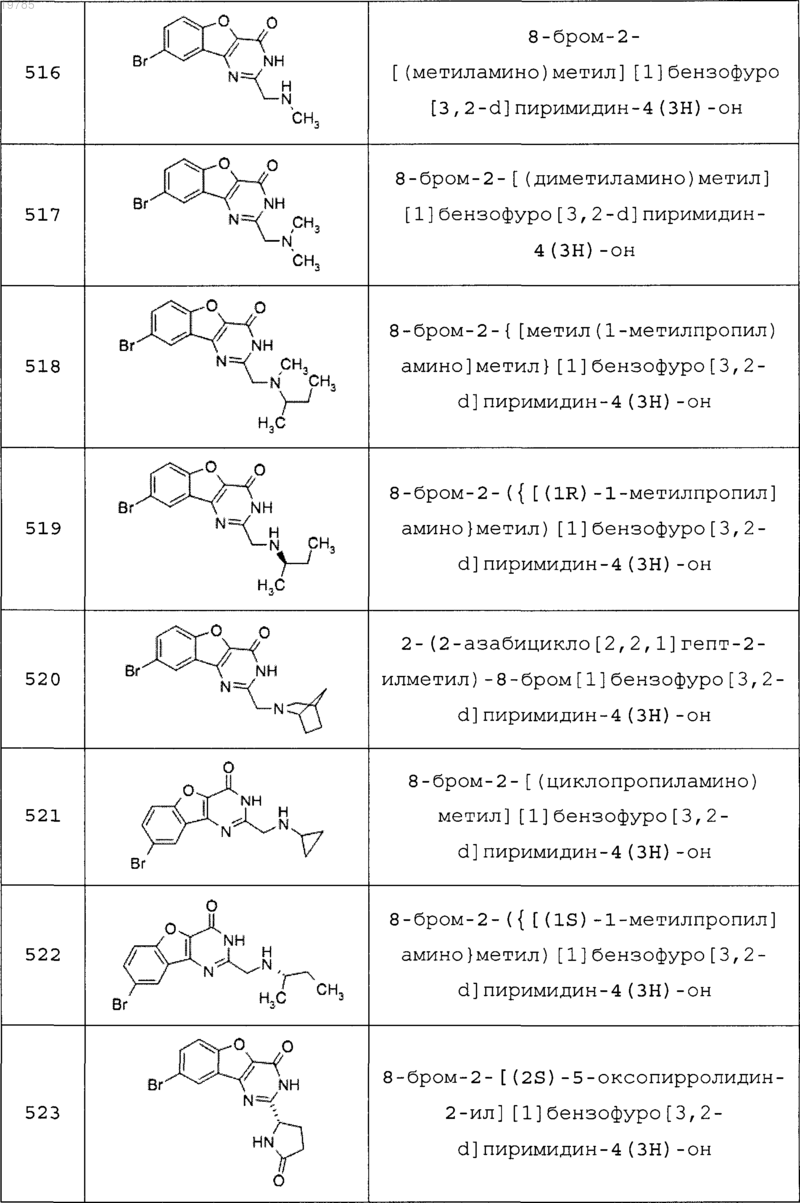
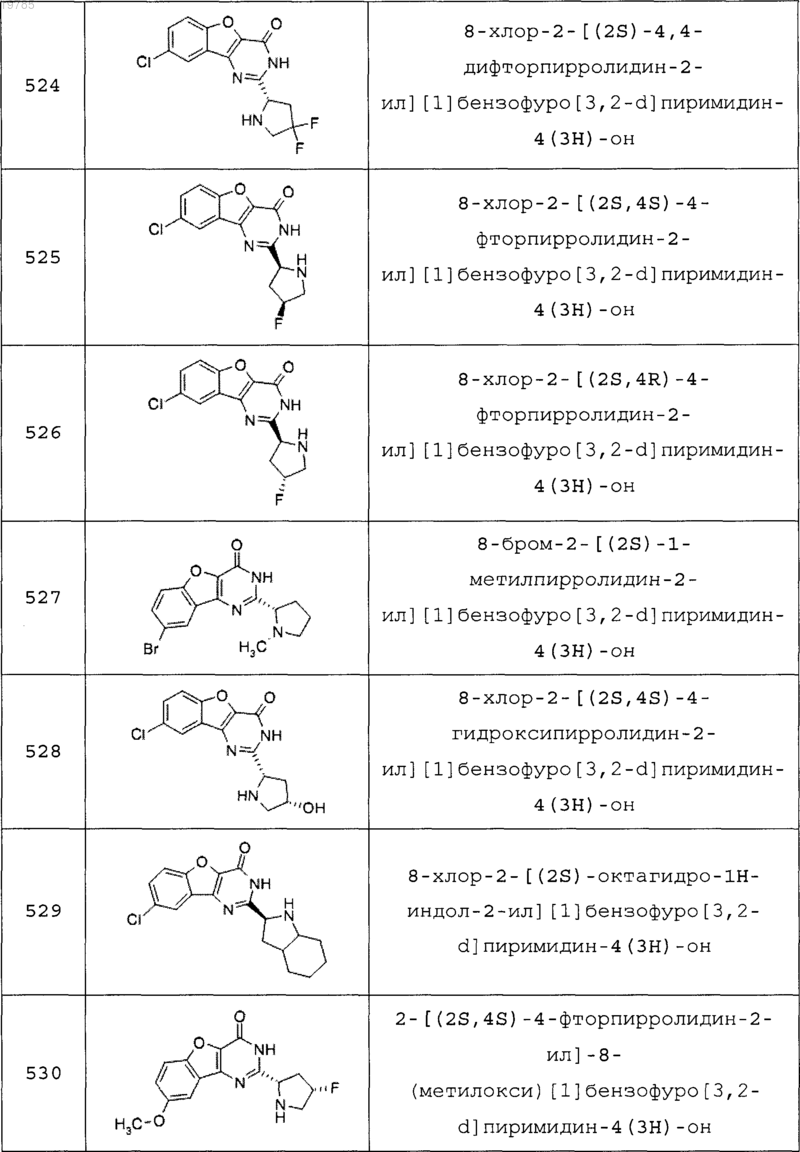

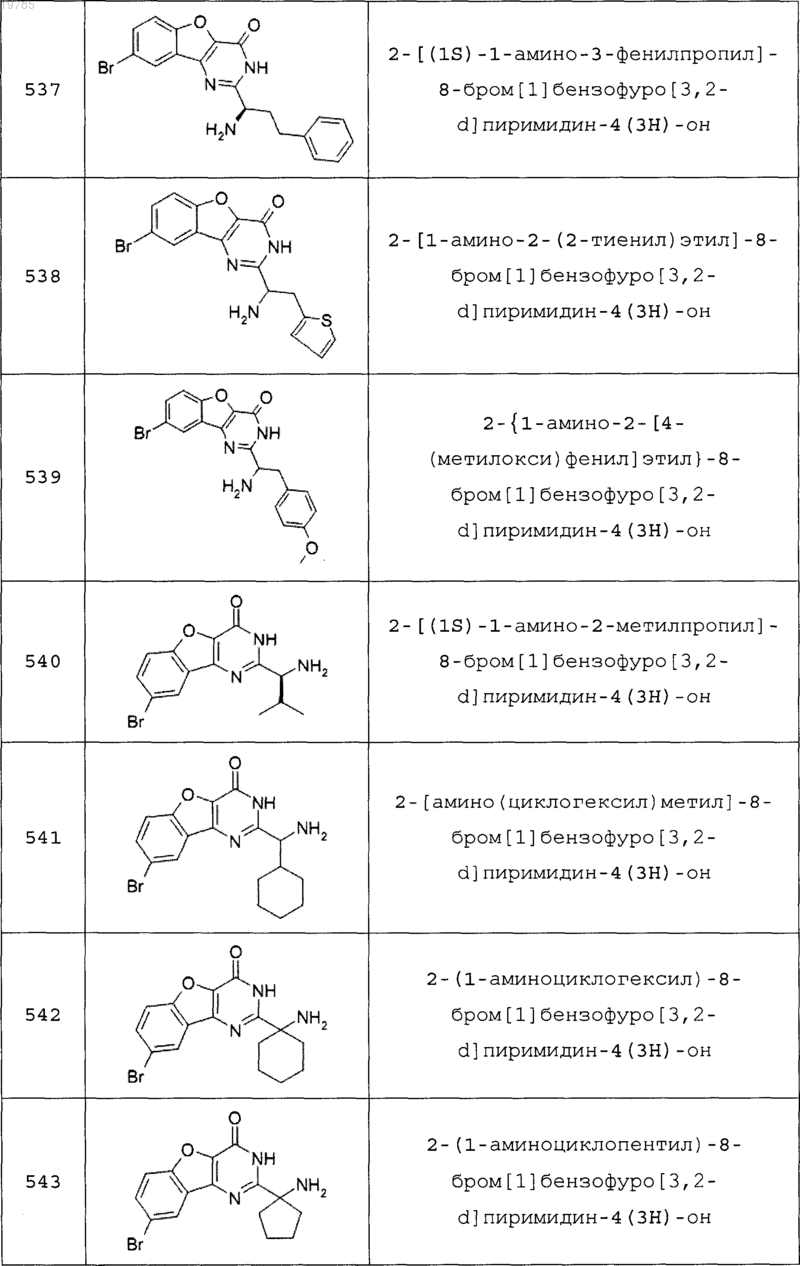

12. Соединение по п.1, которое представляет собой
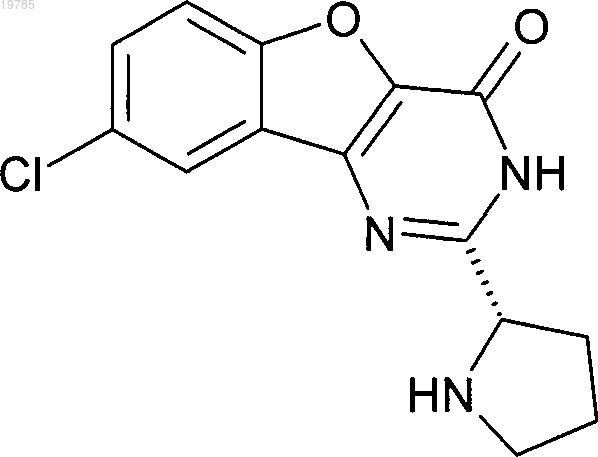
8-хлор-2-[(2S)пирролидин-2-ил][1]бензофуро[3,2-d]пиримидин-4(3Н)-он, или его фармацевтически приемлемая соль.
13. Фармацевтическая композиция для лечения рака, содержащая соединение по любому одному из пп.1-12 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель, наполнитель или разбавитель.
14. Фармацевтическая композиция для ингибирования PIM, CDC7 или CK2, содержащая соединение по любому одному из пп.1-12 или его фармацевтически приемлемую соль и фармацевтически приемлемый носитель, наполнитель или разбавитель.
15. Способ ингибирования PIM, CDC7 или CK2 в клетке, включающий приведение клетки, в которой требуется ингибирование PIM, CDC7 или CK2, в контакт с соединением по любому одному из пп.1-12 или его фармацевтически приемлемой солью, или фармацевтической композицией по любому из пп.13 или 14.
16. Применение соединения по любому одному из пп.1-12 или его фармацевтически приемлемой соли для ингибирования PIM, CDC7 или CK2 в клетке.
17. Применение соединения по любому одному из пп.1-12 или его фармацевтически приемлемой соли при получении лекарственного средства для ингибирования PIM, CDC7 или CK2 в клетке.
Текст
или его фармацевтически приемлемая соль, где R1, R2, R3a, R3b, R3c и R3d соответствуют определениям в описании изобретения, фармацевтическая композиция для лечения рака на его основе, фармацевтическая композиция для ингибирования PIM, CDC7 или CK2 на его основе,применение соединения формулы I в получении лекарственного средства для ингибированияPIM, CDC7 или CK2, способ ингибирования PIM, CDC7 или CK2 в клетке с использованием соединения формулы I или композиции на его основе, а также применение соединения формулы I или композиции на его основе для ингибирования PIM, CDC7 или CK2 в клетке. Перекрестная ссылка на родственные заявки Настоящая заявка испрашивает приоритет на основании предварительной заявки на патент США 61/008907, поданной 21 декабря 2007 г., и предварительной заявки на патент США 61/070971, поданной 25 марта 2008 г. Область техники, к которой относится изобретение Настоящее изобретение относится к некоторым бензофуропиримидиноновым соединениям. В частности, настоящее изобретение относится к некоторым бензофуропиримидиноновым соединениям, подходящим для применения в качестве ингибиторов протеинкиназ. Уровень техники Семейство протеинкиназ PIM, состоящее из близкородственных PIM-1, 2 и 3, связывают с различными биологическими процессами, такими как выживание, пролиферация и дифференцировка клеток.PIM-1 играет активную роль в ряде сигнальных каскадов, имеющих большое значение для онкогенеза[обзор приведен в BachmannMoroy, Internat. J. Biochem. Cell Biol., 37, 726-730 (2005)]. Многие из них участвуют в развитии клеточного цикла и апоптозе. Было показано, что PIM-1 действует как антиапоптозный фактор, инактивируя проапоптозный фактор Bad. Это открытие указывает на непосредственную роль PIM-1 в предотвращении гибели клеток, поскольку инактивация Bad может усиливать активность Вс 1-2 и, таким образом, способствовать выживанию клеток [Aho et al., FEBS Letters, 571, 43-49 (2004)]. Также было установлено, что PIM-1 является положительным регулятором развития клеточного цикла.PIM-1 связывает и фосфорилирует CDC25A, что приводит к увеличению ее фосфатазной активности и способствует переходу G1/S [обзор приведен в Losman et al., JBC, 278, 4800-4805 (1999)]. Кроме того,было обнаружено, что ингибитор циклинзависимых киназ p2lWaf, подавляющий протекание G1/S, инактивируется PIM-1 [Wang et al., Biochim. Biophys. Act. 1593, 45-55 (2002)]. Более того, Pim-1 путем фосфорилирования инактивирует С-ТАК 1 и активирует Cdc25C, что приводит к ускорению перехода G2/M[Bachman et al., JBC, 279, 48319-48 (2004)]. Представляется, что PIM-1 играет значительную роль в пролиферации кроветворных клеток. Обладающая киназной активностью PIM-1 необходима для gp130-опосредуемого пролиферативного сигналаPIM-1 сверхэкспрессируется или даже мутирует в ряде опухолей и различных типов опухолевых клеточных линий и приводит к нестабильности генома. Примерами возможного участия PIM-1 в развитии опухолей у людей являются рак предстательной железы, рак полости рта и лимфома Беркитта (GaidanoDalla Faver, 1993). Все эти сведения указывают на важную роль PIM-1 в инициации и развитии раковых заболеваний у людей, и представляется, что подавление активности PIM-1 низкомолекулярными соединениями является перспективной терапевтической стратегией. В конечном счете функции PIM-2 иPIM-3 частично совпадают с функциями PIM-1, и ингибирование более чем одной изоформы может обеспечивать дополнительный терапевтический эффект. Серин-треонинкиназа CDC7 играет значительную роль в инициации репликации ДНК в эукариотических клетках (Jiang et al., EMBO J 18:5703 (1999. После сборки предрепликативного комплекса в точке инициации репликации киназа CDC7 фосфорилирует белки МСМ (minichromosome maintenance сохранения минихромосом) и обеспечивает посадку CDC45 и ДНК-полимеразы, тем самым инициируя репликацию ДНК (Kim et al., Mutation Research 532:29(2003. Для активации киназы требуется связываниеCDC7 с одним из ее кофакторов, ASK (также известным как DBF4) или ASKL1 (также известным какCDC7, погибают в период между 3,5 и 6,5 сутками, что указывает на роль CDC7 в раннем эмбриональном развитии (Kim et al., EMBO J 21: 2168 (2002. Программируемый нокдаун CDC7 в линиях ЭСклеток мыши (CDC7-/-tg) выявил немедленное подавление пролиферации клеток, быстрое прекращение синтеза ДНК и блокировку прогрессии в S-фазе (Kim et al. (2002. CDC7 связывают с передачей сигнала в каскаде контрольных точек повреждения ДНК в ответ на обработку этопозидом или одноцепочечные разрывы ДНК (Costanzo et al., J Mol Cell 11:203 (2003. Роль CDC7 в ответе на повреждение ДНК подтверждается наблюдениями очагов накопления RAD51 в ядрах CDC7-дефицитных ЭС-клеток мышей(Kim et al. (2002. Делеция CDC7 у дрожжей приводит к гиперчувствительности к обработке гидроксимочевиной (Weinreich et al., EMBO J 18:5334 (1999. Серин-треонинкиназа CDC7 играет важную роль в инициации репликации ДНК, при этом недавно появились сообщения о ее вовлеченности в сигнальный каскад контрольной точки S-фазы (обзор приведен в Kim, Yamada and Masai, "Functions of mammalian CDC7 kinase in initiation/monitoring of DNA replication and development" Mutat Res 532 (1-2) :29-40 (2003. Киназа CDC7 образует комплекс с Dbf4, своей регуляторной субъединицей, также известной как ASK, с образованием активной Ser/Thr киназы. Киназная активность CDC7/Dbf4 необходима для инициации репликации ДНК и последующего перехода в Sфазу клеточного цикла. Второй белок-активатор CDC7, называемый Drf1 или ASKL1, был идентифицирован в клетках человека и предположительно вовлечен в прогрессирование как S-, так и М-фазы (Montagnoli et al., "Drfl, a novel regulatory subunit for human CDC7 kinase" EMBO J. 21 (12): 3171-81 (2002); Yoshizawa-Sugata, "A second human Dbf4/ASK-related protein, Drf1/ASKL1, is required for efficient progressionand p53-dependent cell death" EMBO J. 21(9): 2168-79 (2002. Вместе с тем, анализ программируемого нокаута как CDC7, так и Dbf4 в линиях ЭС-клеток выявил ключевые роли обоих белков в синтезе ДНК и пролиферации клеток у млекопитающих (Kim et al., "Hypomorphic mutation in an essential cell-cycle kinaseES cells" Genes Cells 10(6): 551-63 (2005. В последнее время CDC7 рассматривают в качестве привлекательной мишени для терапии рака. Подавление CDC7 с помощью олигонуклеотидов миРНК приводит к индукции апоптоза в раковых клеточных линиях, в то время как нормальные фибробластные клетки кожи не затрагиваются (Montagnoli etal. , Cancer Res 64, 7110 (2004. Кроме того, были выявлены сайты CDC7-опосредованного фосфорилирования МСМ 2, МСМ 4 и МСМ 6 в опухолевых клетках, но функциональную значимость этих сайтов еще предстоит определить (Montagnoli et al., J of Biol Chem 281:10281 (2006); Tsuji et al., Mol Biol Cell 17:4459-4472 (2006); Masai et al., J Biol Chem 281: 39249-39261 (2006); Sheu et al., Mol. Cell 24: 101-113(2006. Существуют доказательства того, что комплекс CDC7/Dbf4 является мишенью ответа контрольной точки S на генотоксический стресс. В S. cerevisiae, обработанных HU, Rad53 фосфорилирует Dbf4,что приводит к удалению этого киназного комплекса из хроматина и подавлению киназной активностиCDC7/Dbf4. Делеция CDC7 приводит к гиперчувствительности к HU (Weinreich M и Stillman В., 1999). Кроме того, обработка экстракта яйцеклеток Xenopus этопозидом, ингибитором топоизомеразы II, применяемым в клинической практике в качестве противоракового агента, привела к активации контрольной точки повреждения ДНК, для которой необходима ATR, блокирующая киназную активность CDC7/Dbf4(Costanzo 2003). Это противоречит последним данным, показывающим, что киназа CDC7/Dbf4 активна во время репликационного стресса и вносит вклад в гиперфосфорилирование МСМ 2 в ответ на обработку HU и этопозидом (Tenca P et al., 2007). Дальнейшее подавление CDC7 с помощью миРНК в присутствии этих лекарств увеличивает гибель клеток. В соответствии с этим существует потребность в сильнодействующих и специфичных ингибиторахPIM, CDC7 или CK2, или любой их комбинации. Также существует потребность в способах леченияPIM-, CDC7- или CK2-опосредованных заболеваний, таких как рак. Краткое описание изобретения Настоящее изобретение относится к соединениям и фармацевтическим композициям соединений для ингибирования таких протеинкиназ, как PIM (PIM-1, PIM-2 и/или PIM-3), CDC7 или CK2. Один аспект настоящего изобретения относится к соединениям, примером которых являются соединения формулы I, описанные в настоящем документе. Еще один аспект настоящего изобретения относится к фармацевтической композиции для лечения рака, содержащей соединение формулы I и фармацевтически приемлемый носитель, наполнитель или разбавитель. Еще один аспект настоящего изобретения относится к фармацевтической композиции для ингибирования PIM, CDC7 или СК 2, содержащей соединение формулы I и фармацевтически приемлемый носитель, наполнитель или разбавитель. Еще один аспект настоящего изобретения относится к способу ингибирования PIM, CDC7 или СК 2 в клетке, включающему приведение клетки, в которой требуется ингибирование PIM, CDC7 или СК 2, в контакт с соединением формулы I или содержащей его фармацевтической композиции согласно одному из аспектов настоящего изобретения. Еще один аспект настоящего изобретения относится к применению соединения формулы I или фармацевтической композиции согласно одному из аспектов настоящего изобретения для ингибированияPIM, CDC7 или CK2 в клетке. Еще один аспект настоящего изобретения относится к применению соединения формулы I в получении лекраственного средства для ингибирования PIM, CDC7 или CK2. Заболевание или состояние, для лечения которого можно применять соединения формулы I и фармацевтические композиции на их основе, включает рак. Неограничивающие примеры видов рака, которые можно подвергать лечению, включают рак яичников, рак поджелудочной железы, рак предстательной железы, гепатоцеллюлярную карциному, лимфомы, лейкозы, рак шейки матки, рак молочной железы(включая карциному молочной железы), колоректальный рак (включая колоректальную карциному), злокачественную меланому, немелкоклеточный рак легкого (NSCL) или глиобластомы. В еще одном варианте реализации, заболевание или состояние, для лечения которого можно применять соединение Формулы I, включает рак поджелудочной железы, рак предстательной железы, гепатоцеллюлярную карциному, лимфомы, лейкозы, колоректальный рак, карциному молочной железы, колоректальную карциному, злокачественную меланому и немелкоклеточный рак легкого. В еще одном варианте реализации, заболевание или состояние, для лечения которого можно применять соединение формулы I, включает карциному молочной железы, колоректальную карциному, злокачественную меланому и немелкоклеточный рак легкого (NSCL). Существует много различных аспектов соединений, фармацевтических композиций на их основе и способов их применения, как описано ниже, при этом каждый аспект не ограничивает настоящее изобретение. Переходный термин "содержащий", являющийся синонимом терминов "включающий", "содержащий в себе" или "характеризующийся", в настоящем описании является инклюзивным или открытым и не исключает дополнительных неуказанных элементов или этапов способа. Вышеизложенное лишь обобщает некоторые аспекты настоящего изобретения и, как таковое, не накладывает ограничений. Эти и другие аспекты и варианты реализации изобретения более подробно описаны ниже. Подробное описание изобретения Существует много различных аспектов изобретения, описанных ниже, при этом каждый аспект не ограничивает настоящее изобретение. Подразумевается, что термины "аспекты" и "варианты реализации" не являются ограничивающими, независимо от того, где термины "аспекты" и "варианты реализации" встречаются в настоящем описании изобретения. Переходный термин "содержащий", являющийся синонимом терминов "включающий", "содержащий в себе" или "характеризующийся", в настоящем описании является инклюзивным или открытым и не исключает дополнительных неуказанных элементов или этапов способа. Первый аспект настоящего изобретения относится к соединению формулы I или его фармацевтически приемлемой соли, гдеR1 представляет собой водород или (C1-C12)алкил;R2 выбран из -NH-фенила, -NH-пиперидинила, -NH-пиридинила, -NH(C1-C3)алкилфенила, необязательно замещенного по любому положению в фениле пиперазинилом или метилпиперазинилом, NH(C1C3)алкил-N-(СН 3)2-, -NH(C1-C3)алкил-ОН, -(C1-C3)алкил-О-фенила, -(C1-C3)алкил-О(C1-C3)алкил-(5-6 членным)гетероциклоалкилом, -(C1-C3)алкил-N(Н)гетероарила, (C1-C3)алкил-(5-10-членного)гетероарила, необязательно замещенного -(C1-C3)алкилом, галогеном или фенилом, оксопирролидинила, необязательно замещенного ОН или пиперидинилом, -(C1-C4)алкил-(3-9-членным)гетероциклоалкилом, необязательно замещенным по (3-9-членному)гетероциклоалкилу Xd, -(С 1-С 6)алкил-NRzb(C1-C4)алкила, в котором -(C1-C4)алкильная часть замещена Хе, -(C1-C3)алкил-NH(С 3-С 6)циклоалкила, -(СН 2)-NH(С 3 С 6)циклогексила, -(C1-C3)алкил-NH2, где -(C1-C3)алкильная часть -(C1-C3)алкил-NH2 замещена Xf, и -(3-9 членного)гетероциклоалкила, необязательно замещенного Xg;Xd выбран из (C1-C12)алкила, 1-3 галогенов, -СООН, фенила, необязательно замещенного 1 или 2 группами, выбыранными из галогена, метила и метилфенила, фенилметила, спиропиперидина, трифторметилфенилметила, -(C1-C3)алкокси, пиридинила, диметиламино(C1-C3)алкила, диметиламино, гидроксил(C1-C3)алкила, диметиламино(C1-C3)алкиламинокарбонила, (C1-C3)алкиламино, амино(C1-C3)алкила,диметиламинокарбонил(C1-C3)алкила,диэтиламино(С 1-С 3)алкилкарбонила,-(C1-C3)алкил-(5-6 членного)гетероциклоалкила, (5-6-членного)гетероциклоалкила, необязательно замещенного -(C1C3)алкилом, -NH2, -ОН, (4-12-членного)гетероциклоалкил(С 1-С 3)алкиламино, (С 1-С 3)алкокси(С 1 С 3)алкила, -С(O)СН 3, -С(O)NH(С 1-С 3)алкилфенила, необязательно замещенного 1-3 галогенами; Хе выбран из ди (C1-С 3)алкиламино, амино, 1-3 -ОН, (C1-С 3)алкокси, 4-метилпиперазинилфенила,диметиламинофенила, фенила, необязательно замещенного 1-3 группами, выбранными из галогена и метокси, (5-12-членного)гетероарила, -(C1-С 3)алкил-C(O)NH2, -C(O)NH2, -C(O)OH, -(C1-C3)алкил-С(O)ОН иXf выбран из (С 3-С 14)циклоалкила, спиро-(С 3-С 14)циклоалкила, фенила, фенил(C1-С 3)алкила, необязательно замещенного фенилметилокси или (C1-С 3)алкокси, и тиенил (C1-С 3)алкила;Rzb представляет собой водород или (C1-С 3)алкил, необязательно замещенный 1-3 -ОН;R3b, R3c и R3d независимо выбраны из Н, -ОН, -N+(O)OH, (C1-С 3)алкоксила и галогена; либо R3a и R3d вместе с атомами углерода, к которым они присоединены, образуют пятичленный гетероарил, необязательно замещенный метилом или -NH2, или 5-6-членный гетероциклоалкил;R13 выбран из (C6-C14)арил(C1-C3)алкила, при этом арильная часть арилалкила является необяза-3 019785R14 выбран из гидроксил (C1-C12)алкила, Н и TMS. Во втором варианте реализации формулы I R3a выбран из галогена, (C1-C3)алкила, -NO2, (C1C3)алкокси, (С 2-С 12)алкинила, необязательно замещенного R14, (C1-C3)алкоксикарбонил(C1-С 3)алкила,(C6-C14)арил(C1-C3)алкокси, -С(О)N(Н)(C1-C3)алкила, N(H)C(O)(C1-C3)алкила, -С(О)-(C1-C3)алкила, -CN,фенила, -OCF3, -N(H)-R13, -ОН, -CF3, -S-CH3 и гидроксиметил (C2-C12)алкинила; и каждый из R3b, R3c и R3d представляет собой водород. В третьем варианте реализации формулы I R3a представляет собой галоген, (C1-C3)алкокси или-OCF3 и каждый из R3b, R3c и R3d представляет собой водород. В четвертом варианте реализации формулыR3a представляет собой галоген, (C1-C3)алкокси или -OCF3 и каждый из R3b, R3c и R3d представляет собой Н. В пятом варианте реализации формулы R2 представляет собой -(C1-C3)алкил-(5-10 членный)гетероарил, где гетероарил необязательно замещен -(С 1-С 3)алкилом, галогеном или фенилом;R3a представляет собой галоген, (C1-C3)алкокси или -OCF3 и каждый из R3b, R3c и R3d представляет собой Н. В шестом варианте реализации формулы I R2 представляет собой -(C1-C4)алкил-(3-9 членный)гетероарил, необязательно замещенный по любому положению (3-9-членного)гетероарила с помощью Xd;R3a представляет собой галоген, (C1-С 3)алкокси или -OCF3; и каждый из R3b, R3c и R3d представляет собой Н. Все соединения, приведенные в настоящем документе, включают либо форму их нейтрального основания, либо их фармацевтически приемлемые соли независимо от того, указано ли в настоящем описании, что эти соединения могут существовать в виде фармацевтически приемлемой соли, или нет. Так,например, для любого конкретного варианта реализации соединения формулы I (включая варианты реализации, относящиеся к соединениям как таковым или способам их применения) этот вариант реализации включает либо форму соответствующего нейтрального основания, либо любую из фармацевтически приемлемых солей соединения, независимо от того, указано ли это в данном варианте реализации или нет. В седьмом варианте реализации формулы I R2 представляет собой гетероциклоалкил, выбранный из пирролидинила, пиперазинила, пиперидинила, изоксазолила, азетидинила, морфолинила, тетрагидрофуранила, тиазолидинила или октагидро-1 Н-индолила, где гетероциклоалкил необязательно замещен Xg;R3a представляет собой галоген, (C1-C3)алкокси или -OCF3 и каждый из R3b, R3c и R3d представляет собой водород. В восьмом варианте реализации формулы I R2 представляет собой (3-9-членный) гетероциклоалкил(C1-C3)алкил, при этом гетероциклоалкильная часть гетероциклоалкилалкила представляет собой пирролидинил,пиперидинил,пиперазинил,азетидинил,морфолинил,1,4-диазепанил,2,5 диазабицикло[2,2,1]гептил,азабицикло[2,2,1]гептан,8-азабицикло[3,2,1]окт-8-ил,(1S,4S)-2,5 диазабицикло[2,2,1]гептил,2,5-дигидро-1 Н-пирролил,(1R,4R)-2,5-диазабицикло[2,2,1]гептан-2-ил,(1R,5S)-8-азабицикло[3,2,1]октил, (8aS)-гексагидропиррол[1,2-а]пиразин-2(1 Н)ил, диметилпиперазинил или (3aR,6aS)гексагидропиррол[3,4-с]пирролил. В девятом варианте реализации формулы I R2 представляет собой (5-10-членный) гетероарил (C1C3)алкил, необязательно замещенный по любому положению кольца -(C1-C3)алкилом, галогеном и фенилом;R3a представляет собой галоген, (C1-C3)алкокси или -OCF3 и каждый из R3b, R3c и R3d представляет собой Н. В десятом варианте реализации формулы I R2 представляет собой(4-12 членного)гетероциклоалкил(C1-C3)алкила. Все соединения формулы I для каждого варианта реализации, приведенного выше, включают любой из приведенных альтернативных вариантов реализации для каждого из Rl7 R2, R3a, R3b, R3c или R3d, в комбинации с любым другим из приведенных альтернативных вариантов реализации для каждого из R1,-4 019785R2, R3a, R3b, R3c или R3d, а также любую фармацевтически приемлемую соль и стереоизомер любой из таких комбинаций. Если в рамках настоящего изобретения указано, что химический фрагмент содержит один или несколько необязательных заместителей по любой кольцевой части, это означает то же самое, что и в случае, когда химический фрагмент может содержать один или несколько необязательных заместителей по любому положению кольца, что подразумевает то же самое, что и в случае, когда химический фрагмент может содержать один или несколько необязательных заместителей в кольце, где каждый из этих "одного или нескольких необязательных заместителей" замещает атом водорода по любому положению кольца, и если число заместителей больше одного, то оставший(е)ся заместитель(и) замещают любой из других оставшихся атомов водорода в этом кольце. Все соединения, приведенные в настоящем описании, включают форму либо их свободного основания, либо их фармацевтически приемлемые соли, независимо от того, указано ли в описании изобретения, что эти соединения могут существовать в виде их фармацевтически приемлемой соли, или нет. Так,например, для любого конкретного варианта реализации соединения формулы I (включая варианты реализации, относящиеся к соединениям как таковым или способам их применения), этот вариант реализации включает либо форму соответствующего свободного основания, либо фармацевтически приемлемые соли соединения, независимо от того, указано ли это в рамках данного варианта реализации или нет. В табл. 1 приведены некоторые примеры соединений согласно настоящему изобретению, отвечающие формуле I, и их фармацевтически приемлемые соли. Эти примеры в табл. 1 являются лишь иллюстративными и никоим образом не ограничивают настоящее изобретение. Таблица 1
МПК / Метки
МПК: A61K 31/519, A61P 35/00, C07D 491/04
Метки: композиции, содержащие, фармацевтические, протеинкиназ, бензофуропиримидиноны, применение, качестве, ингибиторов
Код ссылки
<a href="https://eas.patents.su/30-19785-benzofuropirimidinony-v-kachestve-ingibitorov-proteinkinaz-farmacevticheskie-kompozicii-ih-soderzhashhie-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Бензофуропиримидиноны в качестве ингибиторов протеинкиназ, фармацевтические композиции, их содержащие, и их применение</a>
Предыдущий патент: Соли ингибитора янус-киназы (r)-3-(4-(7h-пирроло[2,3-d]пиримидин-4-ил)-1h-пиразол-1-ил)-3-циклопентилпропаннитрила
Следующий патент: Бытовой прибор для сушки белья, содержащий компонент, обтекаемый рабочим воздухом процесса
Случайный патент: Скважинный фильтр, имеющий внутренний дополнительный проток












