Фосфонатные аналоги соединений ингибиторов вич, фармацевтическая композиция и набор, их включающие, и способ лечения нарушений, ассоциированных с вич
Номер патента: 19419
Опубликовано: 31.03.2014
Авторы: Рэй Эйдриен С., Петраковский Олег В., Мэкмэн Ричард Л., Буджамра Константин Г., Маркевич Дэвид Й., Линь Куэй-Ин, Чжан Лицзюнь
Формула / Реферат
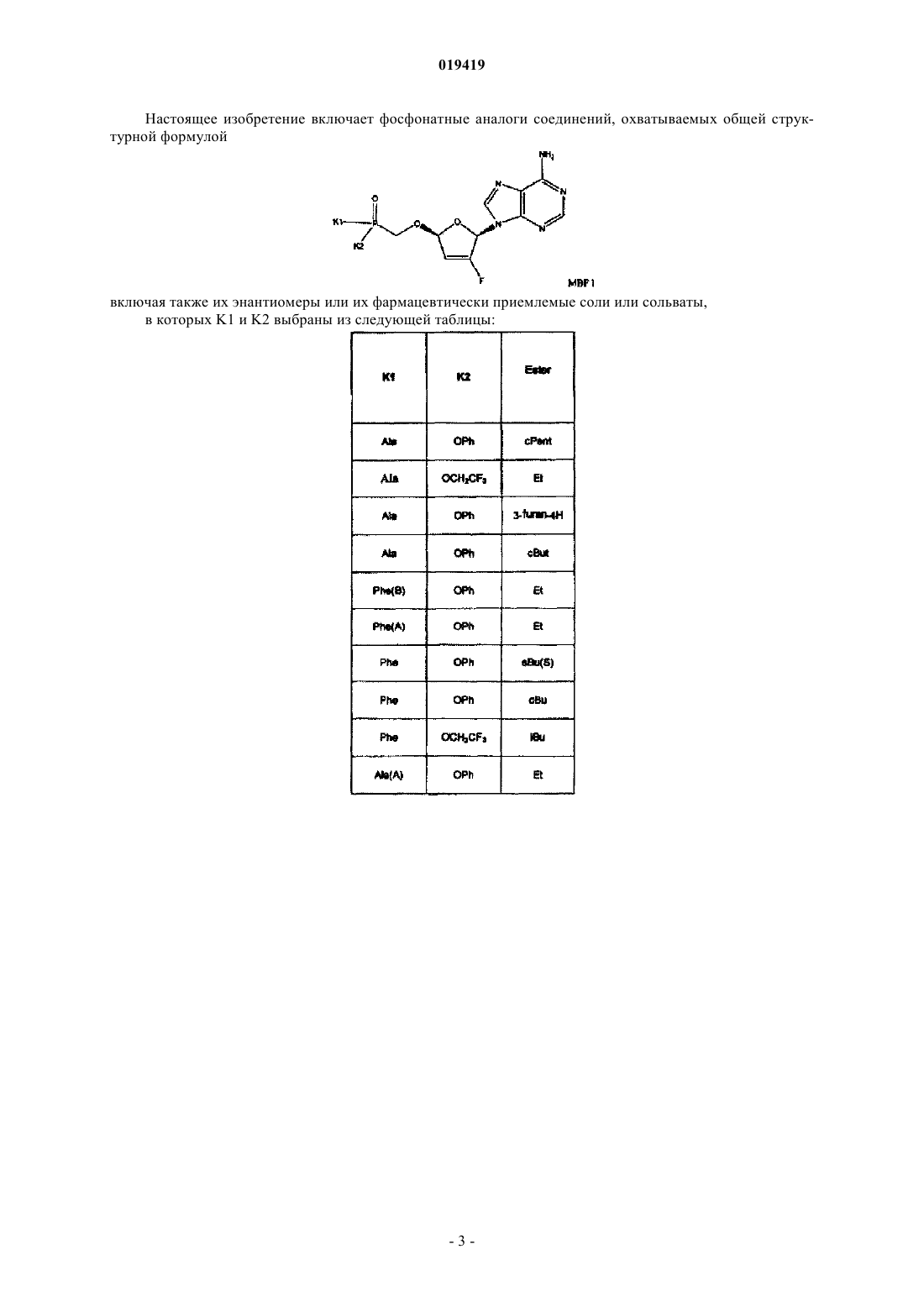
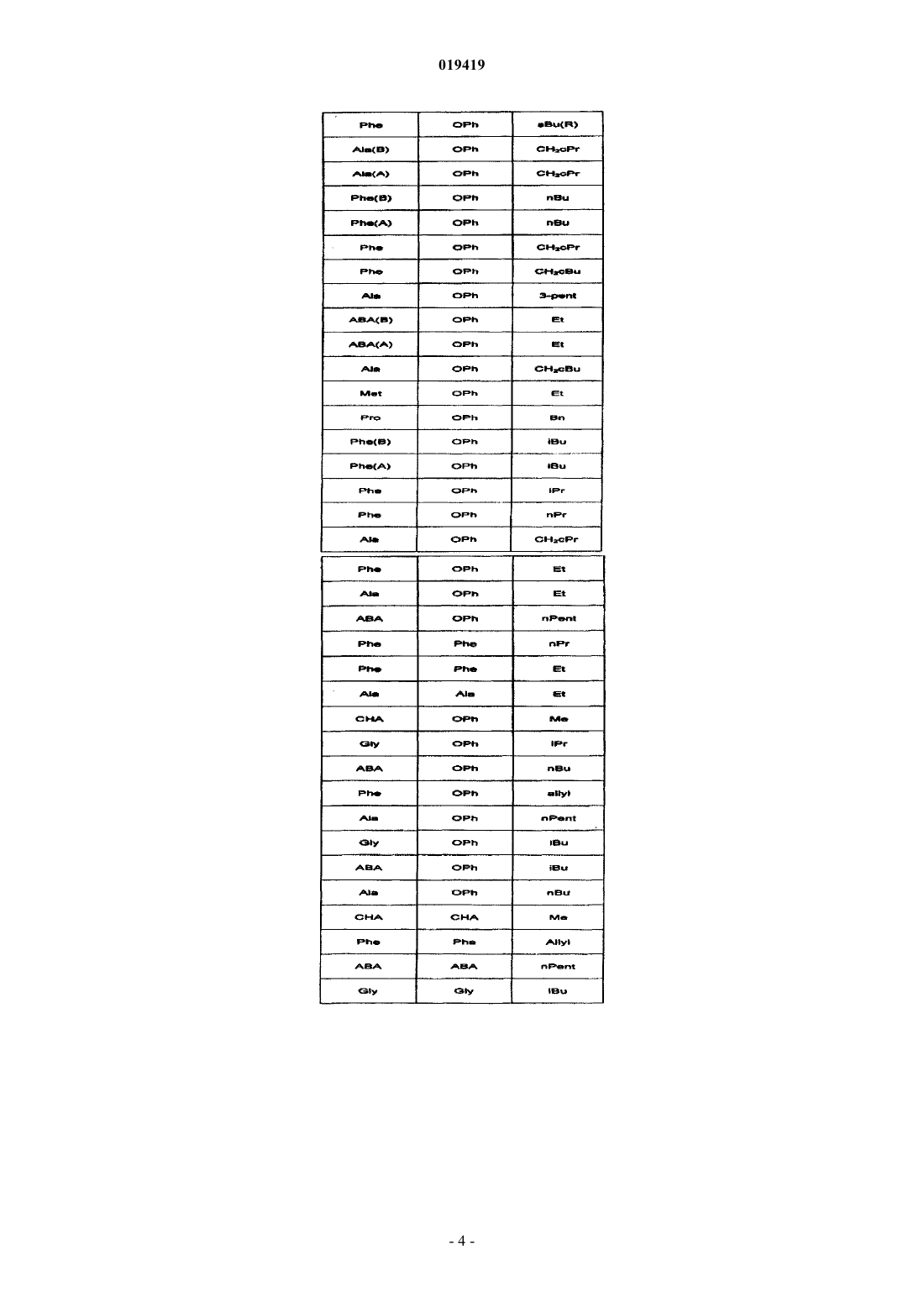
1. Фосфонатные аналоги соединений ингибиторов ВИЧ, охватываемые общей структурной формулой
или их фармацевтически приемлемые соли,
где K1 и K2 выбраны из следующей таблицы:
в которой Ala представляет собой L-аланин;
Phe представляет собой L-фенилаланин;
Met представляет собой L-метионин;
ABA представляет собой (S)-2-аминомасляную кислоту;
Pro представляет собой L-пролин;
СНА представляет собой 2-амино-3-(S)-циклогексилпропионовую кислоту;
Gly представляет собой глицин;
карбоксильные группы аминокислот K1 или K2 этерифицированы, как показано в колонке эфиров, где
cPent означает циклопентановый эфир;
Et означает этиловый эфир;
3-фуран-4Н означает (R)-тетрагидрофуран-3-иловый эфир;
cBut означает циклобутановый эфир;
sBu(S) означает (S)-втор-бутиловый эфир;
sBu(R) означает (R)-втор-бутиловый эфир;
iBu означает изобутиловый эфир;
CH2cPr означает метилциклопропановый эфир;
nBu означает н-бутиловый эфир;
CH2cBu означает метилциклобутановый эфир;
3-pent означает 3-пентиловый эфир;
nPent означает н-пентиловый эфир;
iPr означает изопропиловый эфир;
nPr означает н-пропиловый эфир;
аллил означает аллиловый эфир;
Me означает метиловый эфир;
Bn означает бензиловый эфир;
А или В в скобках обозначают один стереоизомер по атому фосфора, причем менее полярный изомер показан как (А) и более полярный показан как (В).
2. Аналоги по п.1, имеющие формулу (XX)
или их фармацевтически приемлемые соли.
3. Фосфонатный аналог соединения ингибитора ВИЧ, имеющий формулу (XXX)
или его фармацевтически приемлемая соль.
4. Фармацевтическая композиция для лечения ВИЧ или ВИЧ-ассоциированного нарушения, включающая фармацевтический наполнитель и эффективное в отношении вирусов количество аналогов по п.1.
5. Композиция по п.4, включающая второе вещество, активное в отношении вирусов.
6. Набор для лечения ВИЧ или ВИЧ-ассоциированного нарушения, включающий аналоги по п.1 и по меньшей мере один ингредиент, активный в отношении вирусов.
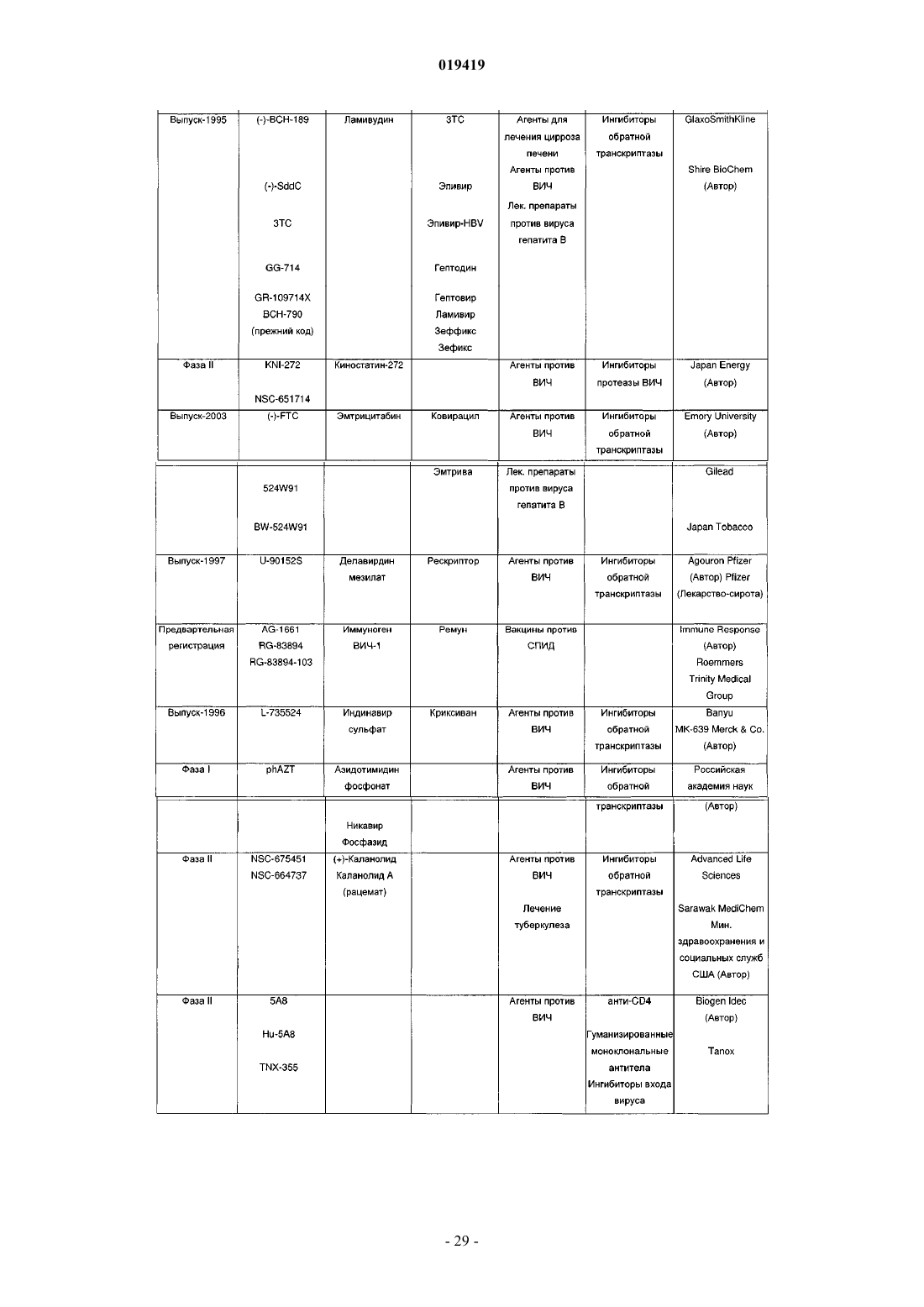
7. Набор по п.6, в котором по меньшей мере один активный ингредиент выбран из группы, включающей алдеслейкин, ламивудин, никавир, гадолиний тексафирин, энфувиритид, семапимод гидрохлорид, элвуцитабин, циановирин N, азодикарбамид, тенофовир дизопроксил фумарат, сампидин, сульфат целлюлозы, дапивирин, этравирин, адарджилейкин-α, глиминокс, додецилсульфат натрия, анкривирок, 2-гидроксипропил-β-циклодекстрин, дарунавир, маравирок, сульфонированный гесперидин, иммунитор V-1, ацетат фталат целлюлозы.
8. Набор по п.7, в котором один из активных ингредиентов выбран из группы, состоящей из антивирусных соединений: трувада, виреад, эмтрива, d4T, сустива или ампренавир.
9. Набор по п.6, в котором по меньшей мере один активный ингредиент выбран из группы, включающей абакавир сульфат, абакавир сульфат/ламивудин, адефовир дипивоксил, ампренавир, атазанавир сульфат, делавирдин мезилат, дидезоксицитидин/зальцитабин, дидезоксицитидин/диданозин, эфавиренц, эмтрицитабин, фосампренавир кальция, фоскарнет натрия, индинавир сульфат, ламивудин, ламивудин/зидовудин, лопинавир, лопинавир/ритонавир, нелфмавир мезилат, невирапин, ритонавир, саквинавир мезилат, ставудин, тенофовир дизопроксил фумарат/эмтрицитабин, типранавир, зидовудин/азидотимидин.
10. Набор по п.9, в котором один из активных ингредиентов выбран из группы, состоящей из антивирусных соединений: трувада, виреад, эмтрива, d4T, сустива или ампренавир.
11. Набор по п.8 для применения в терапевтическом лечении.
12. Набор по п.10 для применения в терапевтическом лечении.
13. Фармацевтическая композиция по п.4 для применения в терапевтическом лечении.
14. Фармацевтическая композиция по п.5 для применения в терапевтическом лечении.
15. Аналоги по п.1 для применения в лечении от ретровирусов и гепаднавирусов.
16. Применение аналогов по п.1 для получения лекарственного средства для лечения ВИЧ или ВИЧ-ассоциированного нарушения.
17. Терапевтический способ лечения ВИЧ или ВИЧ-ассоциированных нарушений при использовании аналогов по п.1.
18. Способ лечения нарушений, ассоциированных с ВИЧ, включающий введение пациенту, инфицированному ВИЧ-инфекцией или находящемуся в группе риска ВИЧ-инфекции, фармацевтической композиции, которая включает терапевтически эффективное количество аналогов по любому из пп.1-3.
19. Фармацевтическая композиция для лечения ВИЧ или ВИЧ-ассоциированного нарушения, включающая фармацевтический наполнитель и эффективное в отношении вирусов количество фосфонатного аналога по п.3.
20. Композиция по п.19, включающая второе вещество, активное в отношении вирусов.
21. Применение фосфонатного аналога по п.3 для получения лекарственного средства для лечения ВИЧ или ВИЧ-ассоциированного нарушения.
22. Применение фосфонатного аналога по п.3 в качестве лекарственного средства при лечении ретровирусных заболеваний и вирусных гепатитов.
Текст
ФОСФОНАТНЫЕ АНАЛОГИ СОЕДИНЕНИЙ ИНГИБИТОРОВ ВИЧ,ФАРМАЦЕВТИЧЕСКАЯ КОМПОЗИЦИЯ И НАБОР, ИХ ВКЛЮЧАЮЩИЕ, И СПОСОБ ЛЕЧЕНИЯ НАРУШЕНИЙ, АССОЦИИРОВАННЫХ С ВИЧ Изобретение относится к фосфонатным аналогам соединений ингибиторов ВИЧ, которые охватываются следующей структурной формулой: где K1 и K2 являются такими, как указано в описании настоящего изобретения. Согласно одному варианту осуществления изобетение относится к композициям и наборам, включающим указанные аналоги для лечения ВИЧ или заболеваний, ассоциированных с ВИЧ. Согласно другому варианту осуществления изобретение относится к способу лечения ВИЧ или заболеваний, ассоциированных с ВИЧ, с помощью указанных аналогов. Область техники, к которой относится изобретение Изобретение относится в основном к соединениям с антивирусной активностью и, более подробно,со свойствами против ВИЧ. Уровень техники Синдром приобретенного иммунодефицита (СПИД) представляет собой главную проблему здравоохранения во всем мире. Хотя лекарственные препараты, направленные на вирусы ВИЧ, широко применяются и продемонстрировали эффективность, токсичность и появление устойчивых штаммов ограничивают их использование. Способы анализа, способные определить присутствие, отсутствие или количество вирусов ВИЧ, находят практическое применение в поиске ингибиторов, а также в диагностике присутствия ВИЧ. Инфекция вируса иммунодефицита человека (ВИЧ) и связанное с ней заболевание представляют собой главную проблему здравоохранения во всем мире. Как правило, считают, что вирус иммунодефицита человека типа 1 (ВИЧ-1) из группы ретровирусов, представитель семейства лентивирусов приматов(1996), Lancet, 348:31-35), является возбудителем синдрома приобретенного иммунодефицита, см. статьюTarrago et al. FASEB Journal. 1994, 8:497-503). СПИД представляет собой результат повторяющейся репликации ВИЧ-1 и снижения иммунной активности, наиболее очевидно, снижения числа лимфоцитовCD4+. Зрелый вирус имеет геном в виде однонитевой РНК, который кодирует 15 белков (см. статьиFrankel et al. (1998), Annual Review of Biochemistry, 67:1-25; Katz et al. (1994), Annual Review of Biochemistry, 63:133-173), включая три ключевых фермента: (i) протеазу (Prt) (см. статью von der Helm K. (1996),Biological Chemistry, 377:765-774); (ii) обратную транскриптазу (RT) (см. статью Hottiger et al. (1996),Biological Chemistry Hoppe-Seyler, 377:97-120), фермент, уникальный для ретровирусов; и (iii) интегразуVirus Research. 52:335-350; Esposito et al. (1999), Advances in Virus Research. 52:319-333). Протеаза отвечает за переработку предшественников вирусных полипротеинов, интеграза отвечает за интеграцию вирусного генома в форме двунитевой в ДНК хозяина и RT представляет собой ключевой фермент в репликации вирусного генома. В репликации вируса RT действует как обе, РНК- и ДНК-зависимая ДНКполимераза, превращая геном в форме однонитевой РНК в двунитевую ДНК. Поскольку кодируемая вирусом обратная транскриптаза (RT) опосредует специфические реакции во время естественной репродукции вируса, ингибирование RT ВИЧ является важной терапевтической мишенью для лечения ВИЧ-инфекции и родственного заболевания. Анализ последовательностей полных геномов из ряда инфекционных и неинфекционных изолятов ВИЧ внес определенную ясность в понимание структуры вируса и типов молекул, которые важны для его репликации и созревания с образованием инфекционных частиц. Протеаза ВИЧ важна для переработки вирусных полипептидов gag и gag-pol с образованием белков зрелого вириона (см. статьи L. Ratneret al., Nature, 313:277-284 (1985); L.H. Pearl и W.R. Taylor, Nature, 329:351 (1987. ВИЧ демонстрирует такую же организацию gag/pol/env, какую наблюдают у других ретровирусов (см. статьи L. Ratner et al.,выше; S. Wain-Hobson et al., Cell, 40:9-17 (1985); R. Sanchez-Pescador et al., Science, 227:484-492 (1985) и М.A. Muesing et al., Nature, 313:450-458 (1985). Лекарственные препараты, одобренные в Соединенных Штатах Америки для терапии СПИДа,включают нуклеозидные ингибиторы RT (см. статью Smith et al. (1994), Clinical Investigator, 17:226-243),ингибиторы протеазы и ненуклеозидные ингибиторы RT (NNRTI) (см. статьи Johnson et al. (2000),Advances in Internal Medicine, 45 (1-40; Porche D.J. (1999), Nursing Clinics of North America, 34:95-112). Ингибиторы протеазы ВИЧ используют для ограничения образования и развития инфекции путем терапевтического применения, а также в диагностических анализах ВИЧ. Лекарственные препараты ингибиторов протеазы, одобренные FDA (Управление по контролю за продуктами и лекарствами США),включают саквинавир (Invirase, Fortovase, Hoffman-La Roche, EP-00432695 и ЕР-00432694); ритонавир (Norvir, Abbott Laboratories); индинавир (Crixivan, MerckCo.); нелфинавир (Viracept, Pfizer); ампренавир (Agenerase, GlaxoSmithKline, Vertex Pharmaceuticals); лопинавир/ритонавир (Kaletra, Abbott Laboratories). Экспериментальные лекарственные препараты ингибиторов протеазы включают фосампренавир (GlaxoSmithKline, Vertex Pharmaceuticals); типранавир (Boehringer Ingelheim); атазанавир (Bristol-Myers Squibb). Существует потребность в терапевтических агентах против ВИЧ, т.е. лекарственных препаратах,обладающих улучшенными антивирусными и фармакокинетическими свойствами с повышенной активностью против развития устойчивости ВИЧ, улучшенной пероральной биодоступностью, повышенной активностью и увеличенным эффективным периодом полураспада существования in vivo. Новые антиви-1 019419 русные агенты против ВИЧ должны быть активными в отношении мутантных штаммов ВИЧ, иметь определенные устойчивые профили, меньше побочных эффектов, менее сложные схемы дозирования и быть активными при пероральном применении. В частности, необходима менее обременительная схема дозирования, такая как прием одной пилюли один раз в день. Хотя лекарственные препараты, направленные на RT ВИЧ, находят широкое применение и показали эффективность, в частности, при комбинированном применении, токсичность и возникновение устойчивых штаммов ограничивают их использование. Показано, что комбинированная терапия антивирусными агентами против ВИЧ является высокоэффективной в плане подавления репликации вируса до количественно неопределяемых уровней в течение продолжительного периода времени. Кроме того, комбинированная терапия с использованием RT и других ингибиторов ВИЧ продемонстрировала синергические эффекты при подавлении репликации ВИЧ. К сожалению, многие пациенты в настоящее время не получают комбинированную терапию вследствие развития лекарственной устойчивости, несогласия со сложными схемами дозирования, фармакокинетическими взаимодействиями, токсичностью и отсутствием активности. Вследствие этого имеется потребность в новых ингибиторах RT ВИЧ, которые являются синергическими в комбинации с другими ингибиторами ВИЧ. Центральной проблемой множества исследований в течение многих лет являлось усовершенствование доставки лекарственных препаратов и других агентов в клетки- и ткани-мишени. Несмотря на многие попытки, предпринимаемые с целью создания эффективных способов введения биологически активных молекул в клетки как in vivo, так и in vitro, ни одна из них, как показано, не была полностью удовлетворительной. Оптимизация ассоциации ингибирующего лекарственного препарата со своей внутриклеточной мишенью при сведении к минимуму межклеточного перераспределения лекарственного препарата, например в соседние клетки, часто является сложной или неэффективной. Большинство агентов, в настоящее время вводимых пациенту парентерально, не являются направленными, что в результате приводит к системной доставке агента в клетки и ткани тела, где это не является необходимым и часто бывает нежелательным. Это может в результате вызвать вредные побочные эффекты лекарственного препарата и часто ограничивает дозу лекарственного препарата (например, цитотоксических агентов и других противораковых и антивирусных лекарственных препаратов), которая может быть введена. По сравнению с этим, хотя пероральное введение лекарственных препаратов в общем признают как удобный и экономичный способ введения, пероральное введение может привести либо (а) к поглощению лекарственного препарата через клеточные и тканевые барьеры, например гематоэнцефалический, эпителиальный, клеточную мембрану, приводя к нежелательному системному распределению, либо (b) к временному нахождению лекарственного препарата в желудочно-кишечном тракте. Соответственно, основная цель состояла в разработке способов получения специфической направленности агентов на клетки и ткани. Преимущества данного лечения включают возможность избежать общих физиологических эффектов несоответствующей доставки данных агентов в другие клетки и ткани, такие как неинфицированные клетки. Внутриклеточная направленность может достигаться с помощью способов и композиций, которые обеспечивают накопление или удерживание биологически активных агентов внутри клеток. Краткое описание изобретения Настоящее изобретение представляет новые соединения с активностью против ВИЧ, т.е. новые ингибиторы RT ретровирусов человека. Вследствие этого соединения, соответствующие изобретению, могут ингибировать ретровирусную RT и, таким образом, ингибировать репликацию вируса. Их используют для лечения больных людей, инфицированных ретровирусом человека, таким как вирус иммунодефицита человека (штаммы ВИЧ-1 или ВИЧ-2) либо вирусы T-клеточного лейкоза человека (HTLV-I илиHTLV-II), которые приводят в результате к синдрому приобретенного иммунодефицита (СПИДу) и/или связанным с ним заболеваниям. Настоящее изобретение включает новые фосфонатные соединения ингибиторов RT ВИЧ и фосфонатные аналоги известных одобренных и экспериментальных ингибиторов протеазы. Соединения, соответствующие настоящему изобретению, могут накапливаться в клетке, как представлено ниже. Настоящее изобретение в основном относится к накоплению или удерживанию терапевтических соединений в клетках. Изобретение более конкретно относится к достижению высоких концентраций фосфонатсодержащих молекул в инфицированных ВИЧ клетках. Внутриклеточная направленность может достигаться с помощью способов и композиций, которые обеспечивают накопление или удерживание биологически активных агентов в клетках. Данная эффективная направленность может быть применима к ряду терапевтических препаратов и процедур. Композиции, соответствующие настоящему изобретению, включают новые соединения RT, имеющие по меньшей мере одну фосфонатную группу. Изобретение включает все известные одобренные и эспериментальные ингибиторы протеазы по меньшей мере с одной фосфонатной группой. Настоящее изобретение включает фосфонатные аналоги соединений, охватываемых общей структурной формулой включая также их энантиомеры или их фармацевтически приемлемые соли или сольваты,в которых K1 и K2 выбраны из следующей таблицы:Pro представляет собой L-пролин; СНА представляет собой 2-амино-3-(S)-циклогексилпропионовую кислоту;Gly представляет собой глицин; карбоксильные группы аминокислот K1 или K2 эстерифицированы, как показано в колонке эфиров,гдеnPr означает н-пропиловый эфир; аллил означает аллиловый эфир;Bn означает бензиловый эфир; А или В в скобках показывают один стереоизомер по атому фосфора, причем менее полярный изомер показан как (А) и более полярный - как (В). Подробное описание иллюстративных вариантов осуществления Теперь будет сделана подробная ссылка на ряд вариантов осуществления изобретения, примеры которых проиллюстрированы сопровождающими структурами и формулами. Хотя изобретение будет описано в связи с множеством вариантов, следует иметь в виду, что они не предусматривают ограничение изобретения данными вариантами. Напротив, предусматривают, что изобретение покрывает все альтернативные решения, модификации и эквивалентные варианты, которые могут быть включены в объем настоящего изобретения, как определено вариантами. Определения. Пока не указано иначе, предусматривают, что следующие термины и выражения, как используют в данном контексте, имеют следующие значения. Когда в данном контексте используют торговые названия, заявители предусматривают независимое включение продукта, соответствующего торговому названию, и активного фармацевтического ингредиента(ов) продукта, соответствующего торговому названию."Биодоступность" является степенью, в которой фармацевтически активный агент становится доступным для ткани-мишени после введения агента в организм. Повышение биодоступности фармацевтически активного агента может обеспечить более рациональное и эффективное лечение пациентов, поскольку для данной дозы больше фармацевтически активного агента будет доступно в областях тканеймишеней. Термины "фосфонат" и "фосфонатная группа" включают функциональные группы или структуры в молекуле, содержащие атом фосфора, который 1) связан одинарной связью с углеродом, 2) связан двойной связью с гетероатомом, 3) связан одинарной связью с гетероатомом и 4) связан одинарной связью с другим гетероатомом, причем каждый гетероатом может быть таким же или иным. Термины "фосфонат" и "фосфонатная группа" также включают функциональные группы или структуры, которые содержат атом фосфора в той же степени окисления, как вышеописанный атом фосфора, а также функциональные группы или структуры, которые включают пролекарственную часть, которая может отделяться от соединения, так что соединение сохраняет атом фосфора, имеющий вышеописанные характеристики. Например, термины "фосфонат" и "фосфонатная группа" включают фосфоновую кислоту, фосфоновый моноэфир, фосфоновый диэфир, фосфонамидатную и фосфонтиоатную функциональные группы. В одном конкретном варианте осуществления изобретения термины "фосфонат" и "фосфонатная группа" включают функциональные группы или структуры в молекуле, содержащие атом фосфора, который 1) связан одинарной связью с углеродом, 2) связан двойной связью с кислородом, 3) связан одинарной связью с кислородом и 4) связан одинарной связью с другим атомом кислорода, а также функциональные группы или структуры, которые включают пролекарственную часть, которая может отделяться от соединения, так что соединение сохраняет атом фосфора, имеющий вышеописанные характеристики. В другом конкретном варианте осуществления изобретения термины "фосфонат" и "фосфонатная группа" включают функциональные группы или структуры в молекуле, содержащие атом фосфора, который 1) связан одинарной связью с углеродом, 2) связан двойной связью с кислородом, 3) связан одинарной связью с кислородом или азотом и 4) связан одинарной связью с другим атомом кислорода или азота, а также функциональные группы или структуры, которые включают пролекарственную часть, которая может отделяться от соединения, так что соединение сохраняет атом фосфора, имеющий вышеописанные характеристики. Термин "пролекарственная форма", используемый в данном контексте, относится к любому соединению, которое при введении в биологическую систему образует лекарственную субстанцию, т.е. активный ингредиент как результат спонтанной химической реакции(й), катализируемой ферментом химической реакции(й), фотолиза и/или метаболической химической реакции(й). Пролекарственная форма, таким образом, представляет собой ковалентно модифицированный аналог или латентную форму терапевтически активного соединения. Термин "пролекарственная часть" относится к лабильной функциональной группе, которая отделяется от активного ингибирующего соединения в процессе метаболизма, системно, внутри клетки, путем гидролиза, ферментного расщепления или посредством какого-либо другого процесса (см. работуAcademic Publishers, p. 113-191). Ферменты, которые способны к реализации механизма ферментной активации фосфонатных пролекарственных соединений, соответствующих изобретению, включают, но без ограничения перечисленным, амидазы, эстеразы, микробные ферменты, фосфолипазы, холинэстеразы и фосфазы. Пролекарственные части могут служить для повышения растворимости, всасывания и липофильности с целью оптимизации доставки, биодоступности и эффективности лекарственного препарата. Пролекарственная часть может включать активный метаболит или сам лекарственный препарат. Примеры пролекарственных частей включают гидролитически чувствительные или лабильные ацилоксиметиловые эфиры -CH2OC(=O)R9 и ацилоксиметилкарбонаты -CH2OC(=O)OR9, в которых R9 представляет собой C1-C6-алкил, C1-C6-замещенный алкил, C6-C20-арил или C6-C20-замещенный арил. Ацилоксиалкиловый эфир впервые использован в качестве стратегии пролекарственной формы для карбоновых кислот и затем применен к фосфатам и фосфонатам в работах Farquhar et al. (1983), J. Pharm. Sd. 72: 324, см. также патенты США 4816570, 4968788, 5663159 и 5792756. Впоследствии ацилоксиалкиловый эфир был использован для доставки фосфоновых кислот через клеточные мембраны и для повышения биодоступности при пероральном введении. Близкий вариант ацилоксиалкилового эфира, алкоксикарбонилоксиалкиловый эфир (карбонат), может также повышать биодоступность при пероральном применении, как пролекарственная часть в соединениях наборов, соответствующих настоящему изобретению. Примером ацилоксиметилового эфира является пивалоилоксиметокси,(РОМ)-СН 2 ОС(=О)С(СН 3)3. Примером ацилоксиметилкарбонатной пролекарственной части является пивалоилоксиметилкарбонат (РОС)-СН 2 ОС(=О)ОС(СН 3)3. Фосфонатная группа может представлять собой фосфонатную пролекарственную часть. Пролекарственная часть может быть чувствительной к гидролизу, как, но без ограничения перечисленным, пивалоилоксиметилкарбонат (РОС) или группа РОМ. Альтернативно, пролекарственная часть может быть чувствительной к усиленному ферментами расщеплению, например, как сложный эфир молочной кислоты или фосфонамидатноэфирная группа. Ариловые эфиры фосфорных групп, в особенности фениловые эфиры, как показано, повышают биодоступность при пероральном применении (см. статью De Lombaert et al. (1994), J. Med. Chem. 37:498). Описаны также фениловые эфиры, включающие карбоксильный эфир в орто-положении относительно фосфата (см. статью Khamnei and Torrence (1996), J. Med. Chem. 39:4109-4115). Бензиловые эфиры, как описано, образуют исходную фосфоновую кислоту. В ряде случаев заместители в орто- или параположении могут ускорять гидролиз. Бензиловые аналоги с ацилированным фенолом или алкилированным фенолом могут образовывать фенольное соединение под воздействием ферментов, например эстераз, оксидаз и т.п., которые, в свою очередь, подвергаются расщеплению по бензильной С-O связи, образуя фосфорную кислоту и хинонметильное промежуточное соединение. Примеры данного класса пролекарственных форм описаны в работах Mitchell et al. (1992), J. Chem. Soc. Perkin Trans. II2345; GlazierWO 91/19721. Описаны еще одни бензильные пролекарственные формы, включающие группу, содержащую карбоксильный эфир, присоединенную к бензильному метилену (см. Glazier WO 91/19721). Представлены тиосодержащие пролекарственные формы для применения с целью внутриклеточной доставки фосфонатных лекарственных препаратов. Данные проэфиры включают этилтиогруппу, в которой тиоловая группа либо этерифицирована ацильной группой, либо объединена с другой тиоловой группой с образованием дисульфида. Деэтерификация или восстановление дисульфида образует свободное промежуточное тиосоединение, которое затем распадается на фосфорную кислоту и эписульфид (см. статьи Puechet al. (1993), Antiviral Res., 22:155-174; Benzaria et al. (1996), J. Med. Chem., 39:4958). Циклические фосфонатные эфиры также описаны как пролекарственные формы фосфорсодержащих соединений (см. статью Erion et al., патент США 6312662). Термин "защитная группа" относится к части соединения, которая маскирует или изменяет свойства функциональной группы или свойства соединения в целом. Химические защитные группы и стратегии защиты/снятия защиты хорошо известны в области техники. См., например, монографию ProtectiveSons, Inc., New York, 1991. Защитные группы часто используют для маскировки реакционности ряда функциональных групп, с целью помощи в эффективности желательных химических реакций, например создания и расщепления химических связей определенным и запланированным образом. Защита функциональных групп соединения изменяет другие физические свойства кроме реакционности защищенной функциональной группы, такие как полярность, липофильность (гидрофобность) и другие свойства, которые могут быть измерены с помощью обычных аналитических инструментов. Химически защищенные промежуточные соединения сами могут быть биологически активными или неактивными. Защищенные соединения могут также проявлять измененные и, в ряде случаев, оптимизированные свойства in vitro и in vivo, такие как прохождение через клеточные мембраны и устойчивость к ферментному разложению или выведению. В данной роли защищенные соединения с предполагаемыми терапевтическими эффектами могут рассматриваться как пролекарственные формы. Другая функция защитной группы состоит в превращении исходного лекарственного препарата в пролекарственную форму, причем исходный лекарственный препарат высвобождается при превращении пролекарственной формы in vivo. Поскольку активные пролекарственные формы могут всасываться более эффективно, чем исходный лекарственный препарат, пролекарственные формы могут обладать более высокой активностью in vivo, чем исходный лекарственный препарат. Защитные группы удаляют либо in vitro, в случае химических промежуточных соединений, либо in vivo, в случае пролекарственных форм. Для химических промежуточных соединений не особенно важно, чтобы полученные в результате промежуточные соединения после снятия защиты, например спирты, были физиологически приемлемыми, хотя, как правило, более жела-7 019419 тельно, чтобы продукты были фармакологически безопасными. Любая ссылка на любое из соединений, соответствующих изобретению, также включает ссылку на его физиологически приемлемую соль. Примеры физиологически приемлемых солей соединений, соответствующих изобретению, включают соли, полученные из подходящего основания, такого как щелочной металл (например, натрий), щелочно-земельный металл (например, магний), аммоний и NX4+ (где X означает C1-C4-алкил). Физиологически приемлемые соли атома водорода или аминогруппы включают соли карбоновых кислот, таких как уксусная, бензойная, молочная, фумаровая, винная, малеиновая, малоновая, яблочная, изетионовая, лактобионовая и янтарная кислоты; органических сульфоновых кислот,таких как метансульфоновая, этансульфоновая, бензолсульфоновая и п-толуолсульфоновая кислоты, и неорганических кислот, таких как хлористо-водородная, серная, фосфорная и сульфаминовая кислоты. Физиологически приемлемые соли гидроксильной группы соединения включают анион данного соединения в комбинации с подходящим катионом, таким как Na+ и NX4+ (где X независимо выбрано из Н илиC1-C4-алкильной группы). Для терапевтического применения соли активных ингредиентов соединений, соответствующих изобретению, будут физиологически приемлемыми, т.е. они будут представлять собой соли, полученные из физиологически приемлемой кислоты или основания. Однако соли кислот или оснований, которые не являются физиологически приемлемыми, также могут найти применение, например, при получении или очистке физиологически приемлемого соединения. Все соли, получены они или не получены из физиологически приемлемой кислоты или основания, входят в объем настоящего изобретения."Алкил" представляет собой C1-C18-углеводород, включающий нормальные, вторичные,третичные или циклические атомы углерода. Примерами являются метил (Me, -СН 3), этил"Алкенил" представляет собой C2-C18-углеводород, включающий нормальные, вторичные, третичные или циклические атомы углерода по меньшей мере с одним центром ненасыщенности, т.е. углеродуглеродной, sp2-двойной связью. Примеры включают, но без ограничения перечисленным, этилен или винил (-СН=СН 2), аллил (-СН 2 СН=СН 2), циклопентенил (-С 5 Н 7) и 5-гексенил (-CH2CH2CH2CH2CH=CH2)."Алкинил" представляет собой C2-C18-углеводород, включающий нормальные, вторичные, третичные или циклические атомы углерода по меньшей мере с одним центром ненасыщенности, т.е. углеродуглеродной sp-тройной связью. Примеры включают, но без ограничения перечисленным, ацетилен(-ССН) и пропаргил (-СН 2 ССН). Термин "алкилен" относится к насыщенному, имеющему разветвленную или неразветвленную цепь либо циклическому, углеводородному радикалу из 1-18 атомов углерода и имеющему два одновалентных центра радикала, полученных путем удаления двух атомов водорода у одного и того же или двух разных атомов углерода исходного алкана. Типичные алкиленовые радикалы включают, но без ограничения перечисленным, метилен (-СН 2-), 1,2-этил (-СН 2 СН 2-), 1,3-пропил (-СН 2 СН 2 СН 2-), 1,4-бутил(-СН 2 СН 2 СН 2 СН 2-) и т.п. Термин "алкенилен" относится к ненасыщенному, имеющему разветвленную или неразветвленную цепь либо циклическому углеводородному радикалу из 2-18 атомов углерода и имеющему два одновалентных центра радикала, полученных путем удаления двух атомов водорода у одного и того же или двух разных атомов углерода исходного алкена. Типичные алкениленовые радикалы включают, но без ограничения перечисленным, 1,2-этилен (-СН=СН-). Термин "алкинилен" относится к ненасыщенному, имеющему разветвленную или неразветвленную цепь либо циклическому углеводородному радикалу из 2-18 атомов углерода и имеющему два одновалентных центра радикала, полученных путем удаления двух атомов водорода из одного и того же или двух разных атомов углерода исходного алкина. Типичные алкиниленовые радикалы включают,но без ограничения перечисленным, ацетилен (-С=С-), пропаргил (-СН 2 С=С-) и 4-пентинил(-СН 2 СН 2 СН 2 С=СН-). Термин "арил" означает одновалентный ароматический углеводородный радикал из 6-20 атомов углерода, полученный посредством удаления одного атома водорода у одного атома углерода исходной системы ароматического цикла. Типичные арильные группы включают, но без ограничения перечисленным, радикалы, полученные из бензола, замещенного бензола, нафталина, антрацена, бифенила и т.п. Термин "арилалкил" относится к ациклическому алкильному радикалу, в котором один из атомов-8 019419 водорода, связанный с атомом углерода, как правило, с концевым или sp3 атомом углерода, замещен арильным радикалом. Типичные арилалкильные группы включают, но без ограничения перечисленным,бензил, 2-фенилэтан-1-ил, нафтилметил, 2-нафтилэтан-1-ил, нафтобензил, 2-нафтофенилэтан-1-ил и т.п. Арилалкильная группа включает 6-20 атомов углерода, например алкильная группа, включающая алканильную, алкенильную или алкинильную группы арилалкильной группы, состоит из 1-6 атомов углерода, и арильная часть состоит из 5-14 атомов углерода. Термины "замещенный алкил", "замещенный арил" и "замещенный арилалкил" означают алкил,арил и арилалкил соответственно, в которых каждый из одного или более атомов водорода независимо друг от друга замещены заместителем. Типичные заместители включают, но без ограничения перечисленным, -X, -R, -О-, -OR, -SR, -S-, -NR2, -NR3, =NR, -CX3, -CN, -OCN, -SCN, -N=C=O, -NCS, -NO, -NO2,=N2, -N3, NC(=O)R, -C(=O)R, -C(=O)NRR, -S(=O)2O-, -S(=O)2OH, -S(=O)2R, -OS(=O)2OR, -S(=O)2NR,-S(=O)R, -OP(=O)O2RR, -P(=O)O2RR, -P(=O)(O-)2, -P(=O)(OH)2, -C(=O)R, -C(=O)X, -C(S)R, -C(O)OR,-C(O)O-, -C(S)OR, -C(O)SR, -C(S)SR, -C(O)NRR, -C(S)NRR, -C(NR)NRR, где каждый Х представляет собой независимо друг от друга галоген: F, Cl, Br или I и каждый R представляет собой независимо друг от друга -Н, алкил, арил, гетероцикл или пролекарственную часть. Алкиленовая, алкениленовая и алкиниленовая группы могут быть также аналогичным образом замещенными. Термин "гетероцикл", используемый в данном контексте, включает в качестве примера, а не ограничения, те гетероциклы, которые описаны в монографиях Paquette, Leo A., Principles of Modern Heterocyclic Chemistry (Принципы современной химии гетероциклических соединений) (W.A. Benjamin, NewSoc. (1960), 82:5566. В одном конкретном варианте осуществления изобретения "гетероцикл" включает"карбоцикл", как определено в данном контексте, в котором один или более (например, 1, 2, 3 или 4) атомов углерода замещены гетероатомом (например, О, N или S). Примеры гетероциклов включают в качестве примера, а не ограничения перечисленным, пиридил,дигидропиридил, тетрагидропиридил (пиперидил), тиазолил, тетрагидротиофенил, тетрагидротиофенил с окисленной серой, пиримидинил, фуранил, тиенил, пирролил, пиразолил, имидазолил, тетразолил, бензофуранил, тианафталенил, индолил, индоленил, хинолинил, изохинолинил, бензимидазолил, пиперидинил, 4-пиперидонил, пирроллидинил, 2-пирроллидинил, пирролинил, тетрагидрофуранил, тетрагидрохинолинил, тетрагидроизохинолинил, декагидрохинолинил, октагидроизохинолинил, азоцинил, триазинил,6 Н-1,2,5-тиадиазинил, 2 Н,6 Н-1,5,2-дитиазинил, тиенил, тиантренил, пиранил, изобензофуранил, хроменил, ксантенил, феноксатинил, 2 Н-пирролил, изотиазолил, изоксазолил, пиразинил, пирадазинил, индолизинил, изоиндолил, 3 Н-индолил, 1 Н-идазолил, пуринил, 4 Н-хинолизинил, фталазинил, нафтиридинил,хиноксалинил, хиназолинил, циннолинил, птеридинил, 4 аН-карбазолил, карбазолил, p-карболинил, фенантридинил, акридинил, пиримидинил, фенантролинил, феназинил, фенотиазинил, фуразанил, феноксазинил, изоклироманил, хроманил, имидазолидинил, имидазолинил, пиразолидинил, пиразолинил, пиперазинил, индолинил, изоиндолинил, хинуклидинил, морфолинил, оксазолидинил, бензотриазолил, бензизоксазолил, оксиндолил, бензоксалинил, изатиноил и бис-тетрагидрофуранил: В качестве примера и без ограничения перечисленным, углеродсвязанные гетероциклы связаны в положении 2, 3, 4, 5 или 6 пиридина, положении 3, 4, 5 или 6 пиридазина, положении 2, 4, 5 или 6 пиримидина, положении 2, 3, 5 или 6 пиразина, положении 2, 3, 4 или 5 фурана, тетрагидрофурана, тиофурана, тиофена, пиррола или тетрагидропиррола, положении 2, 4 или 5 оксазола, имидазола или тиазола,положении 3, 4 или 5 изоксазола, пиразола или изотиазола, положении 2 или 3 азиридина, положении 2,3 или 4 азетидина, положении 2, 3, 4, 5, 6, 7 или 8 хинолина или положении 1, 3, 4, 5, 6, 7 или 8 изохинолина. Еще более типично, когда углеродсвязанные гетероциклы включают 2-пиридил, 3-пиридил, 4 пиридил, 5-пиридил, 6-пиридил, 3-пиридазинил, 4-пиридазинил, 5-пиридазинил, 6-пиридазинил, 2 пиримидинил, 4-пиримидинил, 5-пиримидинил, 6-пиримидинил, 2-пиразинил, 3-пиразинил, 5-пиразинил,6-пиразинил, 2-тиазолил, 4-тиазолил или 5-тиазолил. В качестве примера и без ограничения перечисленным, азотсвязанные гетероциклы связаны в положении 1 азиридина, азетидина, пиррола, пирролидина, 2-пирролина, 3-пирролина, имидазола, имидазолидина, 2-имидазолидина, 3-имидазолидина, пиразола, пиразолина, 2-пиразолина, 3-пиразолина, пиперидина, пиперазина, индола, индолина, 1 Н-индазола, положении 2 изоиндола или изоиндолина, положении 4 морфолина и положении 9 карбазола или -карболина. Еще более типично, когда азотсвязанные гетероциклы включают 1-азиридил, 1-азетедил, 1-пирролил, 1-имидазолил, 1-пиразолил и 1 пиперидинил. Термин "карбоцикл" относится к насыщенному, ненасыщенному или ароматическому циклу, включающему 3-7 атомов углерода в виде моноцикла, 7-12 атомов углерода в виде бицикла и приблизительно до 20 атомов углерода в виде полицикла. Моноциклические карбоциклы включают 3-6 атомов цикла,еще более типично 5 или 6 атомов цикла. Бициклические карбоциклы включают 7-12 атомов цикла, например, организованных в виде бицикло[4,5]-, [5,5]-, [5,6]- или [6,6]-системы или 9 или 10 атомов цикла организованы в виде бицикло[5,6]- или [6,6]-системы. Примеры моноциклических карбоциклов включают циклопропил, циклобутил, циклопентил, 1-циклопент-1-енил, 1-циклопент-2-енил, 1-циклопент-3 енил, циклогексил, 1-циклогекс-1-енил, 1-циклогекс-2-енил, 1-циклогекс-3-енил, фенил, спирил и нафтил. Термин "линкер" или "связывающий агент" относится к химической группе, включающей ковалентную связь или цепь либо группу атомов, которые ковалентно присоединяют фосфонатную группу к лекарственному препарату. Линкеры содержат фрагменты заместителей А 1 и А 3, которые включают такие части, как повторяющиеся звенья алкилоксигруппы (например, полиэтиленоксигруппы, ПЭГ, полиметиленоксигруппы) и алкиламиногруппы (например, полиэтиленаминогруппы, Jeffamine), а также эфир дикислоты и амиды, включая сукцинат, сукцинамид, дигликолят, малонат и капроамид. Термин "хиральный" относится к молекулам, которые обладают свойством неналожения зеркального изображения партнера, тогда как термин "нехиральный" относится к молекулам, которые могут накладываться на зеркальное изображение своего партнера. Термин "стереоизомеры" относится к соединениям, которыеимеют идентичное химическое строение, но различаются в плане расположения атомов или групп в пространстве. Термин "диастереомер" относится к стереоизомеру с двумя или более центрами хиральности, молекулы которого не являются зеркальными изображениями друг друга. Диастереомеры обладают различными физическими свойствами, например точками плавления, точками кипения, спектральными свойствами и реакционными способностями. Смеси диастереомеров можно разделить с помощью высокоэффективных аналитических процедур, таких как электрофорез и хроматография. Термин "энантиомеры" относится к стереоизомерам соединения, которые являются ненакладывающимися зеркальными изображениями друг друга. Термин "терапия" или "лечение" в той мере, в которой он относится к заболеванию или состоянию,включает предупреждение возникновения заболевания или состояния, подавление заболевания или состояния, устранение заболевания или состояния и/или облегчение одного или более симптомов заболевания или состояния. Стереохимические определения и условия, используемые в данном контексте, в основном соответствуют словарю под ред. S.P. Parker, McGraw-Hill Dictionary of Chemical Terms (Словарь химических терминов), (1984), McGraw-Hill Book Company, New York и монографии Eliel E. и Wilen S., Stereochemistry of Organic Compounds (Стереохимия органических соединений), (1994), John WileySons, Inc., NewYork. Многие органические соединения существуют в оптически активных формах, т.е. они обладают способностью вращать плоскость плоскополяризованного света. В описании оптически активного соединения используют приставки D и L или R и S, чтобы обозначить абсолютную конфигурацию молекулы относительно ее хирального центра(ов). Приставки d и I или (+) и (-) используют для обозначения знака вращения плоскополяризованного света соединением, причем (-) или I означает, что соединение является левовращающим. Соединение с приставкой (+) или d является правовращающим. Для заданной химической структуры данные стереоизомеры являются идентичными, за исключением того, что они представляют собой зеркальные изображения друг друга. Специфический стереоизомер может быть также обозначен как энантиомер, и смесь данных изомеров часто называют энантиомерной смесью. Смесь энантиомеров 50:50 называют рацемической смесью или рацематом, который может существовать, когда в химической реакции или процессе отсутствует стереоселекция или стереоспецифичность. Термины "рацемическая смесь" и "рацемат" относятся к эквимолярной смеси двух энантиомерных молекул, лишенной оптической активности. Защитные группы. В контексте настоящего изобретения защитные группы включают пролекарственные части и химические защитные группы. Имеются широко известные и используемые защитные группы, и их можно использовать для предупреждения побочных реакций с помощью защитной группы во время процедур синтеза, т.е. путей и способов получения соединений, соответствующих изобретению. В основном решение, касающееся того,какие группы защищать, когда это делать, и природы химической защитной группы "ЗГ", будет зависеть от химических условий реакции, которую следует защищать, например от кислотных, щелочных, окислительных, восстановительных или других условий, и намеченного направления синтеза. Не требуется,чтобы ЗГ были, и, как правило, они не являются одними и теми же, если соединение является замещенным множеством ЗГ. В основном ЗГ будут использовать для защиты функциональных групп, таких как карбоксильная, гидроксильная, тио- или аминогруппы, и, таким образом, препятствовать побочным реакциям или иным образом помогать эффективности синтеза. Порядок снятия защиты для получения свободных групп со снятой защитой зависит от намеченного направления синтеза и условий реакции, с ко- 10019419 торыми сталкиваются, может осуществляться в любой очередности, как определяет специалист. Можно защитить различные функциональные группы соединений, соответствующих изобретению. Например, защитные группы для групп -OH (любых из гидроксила, карбоновой кислоты, фосфоновой кислоты или других функций) включают "группы, образующие простой или сложный эфир". Группы,образующие простой или сложный эфир, способны действовать как химические защитные группы в схемах синтеза, приведенных в данном контексте. Однако ряд защитных групп гидроксила и тиогруппы представляют собой группы, не образующие ни простой, ни сложный эфир, как будут иметь в виду компетентные специалисты в области техники, и включены с обсуждаемыми ниже амидами. Очень большое число защитных групп гидроксила и амидобразующих групп и соответствующих реакций химического расщепления описано в монографии Protective Groups in Organic Synthesis (Защитные группы в синтезе органических соединений), Theodora W. Greene (John WileySons, Inc., New York,1991, ISBN 0-471-62301-6) ("Greene"). См. также монографию Kocienski, Philip J., Protecting Groups (Защитные группы) (Georg Thieme Verlag Stuttgart, New York, 1994), которые включены в данном контексте в виде ссылки во всей своей полноте. См., в частности, глава 1, Protecting Groups (Защитные группы): обзор, стр. 1-20, глава 2, Hydroxyl Protecting Groups (Защитные группы гидроксила), стр. 21-94, Chapter 3,Diol Protecting Groups (Защитные группы диолов), стр. 95-117, глава 4, Carboxyl Protecting Groups (Защитные группы карбоксила), стр. 118-154, глава 5, Carbonyl Protecting Groups (Защитные группы карбонила), стр. 155-184. Относительно защитных групп для карбоновой кислоты, фосфоновой кислоты, фосфоната, сульфоновой кислоты и других защитных групп для кислот см. Greene, как приведено ниже. Данные группы включают в качестве примера, а не ограничения перечисленным, сложные эфиры, амиды, гидразиды и т.п. Защитные группы, образующие простой и сложный эфир. Группы, образующие сложный эфир, включают (1) группы, образующие фосфонатные сложные эфиры, такие как фосфонамидатные эфиры, фосфортиоатные сложные эфиры, фосфонатные сложные эфиры и фосфон-бис-амидаты; (2) группы, образующие карбоксилсодержащие сложные эфиры; и(3) группы, образующие серосодержащие сложные эфиры, такие как сульфонат, сульфат и сульфинат. Необязательные фосфонатные группы соединений, соответствующих изобретению, могут являться или не являться группами пролекарственных форм, т.е. они могут быть или могут не быть чувствительными к гидролитическому или ферментному расщеплению или модификации. Некоторые фосфонатные группы стабильны при большей части или почти при всех метаболических состояниях. Например, диалкилфосфонат, в котором алкильные группы включают два или более атомов углерода, может обладать существенной стабильностью in vivo вследствие низкой скорости гидролиза. В контексте фосфонатных групп пролекарственных форм для фосфоновых кислот описано большое число разнообразных по структуре пролекарственных форм (см. статью Freeman и Ross, Progress in Medicinal Chemistry. 34:112-147 (1997, и они включены в объем настоящего изобретения. Примером группы, образующей фосфонатный сложный эфир, является фенильный карбоцикл в субструктуре A3,имеющей формулу в которой R1 может представлять собой Н или C1-C12-алкил;m1 означает 1, 2, 3, 4, 5, 6, 7 или 8,и фенильный карбоцикл замещен 0-3 группами R2. Когда Y1 представляет собой О, образуется сложный эфир молочной кислоты, и когда Y1 представляет собой N(R2), N(OR2) или N(N(R22, результатом является фосфонамидатный сложный эфир. В роли образования сложного эфира защитная группа, как правило, связывается с любой кислотной группой, такой как, например, и без ограничения перечисленным, группа -СО 2 Н или -C(S)OH, приводя,таким образом, к образованию -CO2Rx, где Rx включает множество сложноэфирных групп, представленных в WO 95/07920. Примеры защитных групп включают:C3-C12-гетероцикл (описан выше) или арил. Данные ароматические группы необязательно являются полициклическими или моноциклическими. Примеры включают фенил, спирил, 2- и 3-пирролил, 2- и 3-тиенил, 2- и 4-имидазолил, 2-, 4- и 5-оксазолил, 3- и 4-изоксазолил, 2-, 4- и 5-тиазолил, 3-, 4- и 5-изотиазолил, 3- и 4-пиразолил, 1-, 2-, 3- и 4-пиридинил и 1-, 2-, 4- и 5-пиримидинил;-СН 2-пиримидинил), замещенный в арильной группе 3-5 атомами галогена или 1-2 атомами или группами, выбранными из галогена, C1-C12-алкоксигруппы (включая метокси- и этоксигруппу), циано-, нитрогруппы, ОН, C1-C12-галогеналкила (1-6 атомов галогена, включая -CH2CCl3), C1-C12-алкила (включая метил и этил), C2-C12-алкенила или C2-C12-алкинила; алкоксиэтил [C1-C6-алкил, включая -СН 2-СН 2-О-СН 3(метоксиэтил)]; алкил, замещенный любой из вышеуказанных групп для арила, в частности ОН, или 1-3 атомами галогена (включая -СН 3, -СН(СН 3)2, -С(СН 3)3, -СН 2 СН 3, -(СН 2)2 СН 3, -(CH2)SCH3, -(CH2)4CH3,-(СН 2)5 СН 3,-CH2CH2F, CH2CH2Cl, -CH2CF3 и -CH2CCl3);; -N-2-пропилморфолиногруппой, 2,3-дигидро-6 гидроксиинденом, сезамолом, моноэфиром катехола, -CH2-C(O)-N(R1)2, -CH2-S(O)(R1), -CH2-S(O)2(R1),-CH2-CH(OC(O)CH2R1)-CH(OC(O)CH2R1), холестерином, енолпируватом (HOOC-С(=СН 2)-), глицерином; моносахарид из 5-6 атомов углерода, дисахарид или олигосахарид (3-9 моносахаридных остатков); триглицериды, такие как 6-Dдиглицериды, в которых жирные кислоты, составляющие глицеридлипиды, как правило, представляют собой природные насыщенные или ненасыщенные C6-26, C6-18 или С 6-10 жирные кислоты, такие как линоленовая, лауриновая, миристиновая, пальмитиновая, стеариновая,олеиновая, пальмитоленовая, линоленовая и т.п., связанные с ацилом представленных в данном контексте исходных соединений через глицериловый атом кислорода триглицерида; фосфолипиды, связанные с карбоксильной группой через фосфат фосфолипида; фталидил (показанный на фиг. 1 статьи Clayton et al., Antimicrob. Agents Chemo. (1974), 5(6):670671); циклические карбонаты, такие как (5-Rd-2-оксо-1,3-диоксолен-4-ил)метиловые эфиры (см. статью. арил; и Гидроксильные группы соединений, соответствующих данному изобретению, необязательно могут быть замещены одной из групп III, IV или V, описанных в WO 94/21604, или изопропилом. В табл. А перечислены примеры сложноэфирных частей защитных групп, которые, например, могут быть связаны через атом кислорода с группами -С(О)О- и -Р(О)(О-)2. Показан также ряд амидатов,которые связаны непосредственно с -С(О)- или -Р(О)2-. Сложные эфиры структур 1-5, 8-10 и 16, 17, 19-22 синтезируют, проводя реакцию представленного в данном контексте соединения, имеющего свободный гидроксил, с соответствующим галогенидом (хлоридом или ацилхлоридом и т.п.) и N,N-дициклогексилN-морфолинкарбоксамидин (или другое основание, такое как DBU, триэтиламин, CsCO3,N,N-диметиланилин и т.п.) в ДМФ (диметилформамиде) (или другом растворителе, таком как ацетонитрил или N-метилпирролидон). Когда соединение, которое должно быть защищено, представляет собой фосфонат, сложные эфиры структур 5-7, 11, 12, 21 и 23-26 синтезируют посредством реакции спирта или соли алкоксида (или соответствующих аминов в случае таких соединений, как 13, 14 и 15) с монохлорфосфонатом или дихлорфосфонатом (или другим активированным фосфонатом). Хиральный центр представляет собой (R), (S) или рацемат. Другие сложные эфиры, которые подходят для применения в данном контексте, описаны в ЕР 632048. Защитные группы также включают "двойной сложный эфир", образующий такие профункциональ, -CH2SCOCH3, -CH2OCON(CH3)2, или алкильные или арилацилоксиности, как -CH2OC(O)OCH3,алкильные группы структуры -CH(R1 или W5)OCO)R37) или -CH(R1 или W5)CO)OR38) (связанные с кислородом кислотной группы), где R37 и R38 представляют собой алкильную, арильную или алкиларильную группы (см. патент США 4968788). Часто R37 и R38 представляют собой объемные группы,такие как разветвленный алкил или ортозамещенный арил, метазамещенный арил или их комбинации,включая нормальные, вторичные, изо- и третичные алкилы из 1-6 атомов углерода. Примером является пивалоилоксиметильная группа. Данные группы особенно применимы с пролекарственными формами для перорального применения. Примерами данных эффективных защитных групп являются алкилацилоксиметиловые эфиры и их производные, включая CH(CH2CH2OCH3)OC(O)C(CHS)3,;-СН 2 ОС(О)С 10 Н 15, -СН 2 ОС(О)С(СН 3)3, -СН(СН 2 ОСН 3)ОС(О)С(СН 3)3, -СН(СН(СН 3)2)ОС(О)С(СН 3)3,-СН 2 ОС(О)СН 2 СН(СН 3)2, -СН 2 ОС(О)С 6 Н 11, -СН 2 ОС(О)С 6 Н 5, -СН 2 ОС(О)С 10 Н 15, -СН 2 ОС(О)СН 2 СН 3,-СН 2 ОС(О)СН(СН 3)2, -СН 2 ОС(О)С(СН 3)3 и -СН 2 ОС(О)СН 2 С 6 Н 5. В некоторых вариантах осуществления защитная кислотная группа представляет собой сложный эфир кислотной группы и является остатком гидроксилсодержащей функциональности. В других вариантах осуществления аминосоединение используют для защиты кислотной функциональности. Остатки подходящих гидроксил- или аминосодержащих функциональностей приведены выше или их можно найти в WO 95/07920. Особенный интерес представляют остатки аминокислот, сложных эфиров аминокислот, полипептидов или арилспиртов. Типичные остатки аминокислот, полипептидов и этерифицированных по карбоксилу аминокислот описаны на стр. 11-18 и в соответствующем тексте WO 95/07920, как группы L1 или L2. В WO 95/07920 специально описаны амидаты фосфоновых кислот, но следует иметь в виду, что данные амидаты образуются с любой из кислотных групп, представленных в данном контексте,и остатки аминокислот приведены в WO 95/07920. Типичные сложные эфиры для защиты кислотных функциональностей также описаны вWO 95/07920, снова имея в виду, что такие же сложные эфиры могут быть образованы с кислотными группами, в данном контексте с фосфонатом из публикации '920. Типичные сложноэфирные группы оп- 13019419 ределяют, по меньшей мере, на стр. 89-93 WO 95/07920 (как R31 или R35), в таблице на стр. 105 и стр. 2123 (как R). Особенный интерес представляют сложные эфиры незамещенного арила, такого как фенил или арилалкил, например бензил или гидрокси-, галоген-, алкокси-, карбокси- и/или алкилэфиркарбоксизамещенный арил или алкиларил,в частности фенил,ортоэтоксифенил илиC1-C4-алкилэфиркарбоксифенил (салицилат C1-C12-алкилэфиры). Защищенные кислотные группы, особенно с использованием сложных эфиров и амидов, представленных в WO 95/07920, эффективны как пролекарственные формы для перорального применения. Однако для эффективного перорального введения соединений, соответствующих данному изобретению, неважно, чтобы кислотная группа была защищена. Когда соединения, соответствующие изобретению,имеющие защитные группы, в частности амидаты аминокислот или замещенные и незамещенные арилэфиры, вводят системно или перорально, они способны гидролитически расщепляться in vivo с образованием свободной кислоты. Защищают один или больше кислотных гидроксилов. Если защищают больше чем один кислотный гидроксил, то используют одинаковые или различные защитные группы, например сложные эфиры могут быть различными или одинаковыми, либо используют смешанный амидат и сложный эфир. Типичные гидроксильные защитные группы, описанные в монографии Greene (см. стр. 14-118),включают замещенные метиловые и алкиловые эфиры, замещенные бензиловые эфиры, силиловые эфиры, сложные эфиры, включая эфиры сульфоновых кислот, и карбонаты. Например: простые эфиры (метиловый, трет-бутиловый, аллиловый); замещенные простые метиловые эфиры(метоксиметиловый,метилтиометиловый,трет-бутилтиометиловый,(фенилдиметилсилил)метоксиметиловый,бензилоксиметиловый,п-метоксибензилоксиметиловый,(4-метоксифенокси)метиловый,гвайаколметиловый,третбутоксиметиловый,4-пентенилоксиметиловый,силоксиметиловый,2-метоксиэтоксиметиловый,2,2,2-трихлорэтоксиметиловый, бис-(2-хлорэтокси)метиловый, 2-(триметилсилил)этоксиметиловый,тетрагидропираниловый,3-бромтетрагидропираниловый,тетрагидротиопираниловый,1-метоксициклогексиловый, 4-метокситетрагидропираниловый, 4-метокситетрагидротиопираниловый,4-метокситетрагидротиопираниловый, S,S-диоксидо,1-[(2-хлор-4-метил)фенил]-4-метоксипиперидин-4 иловый, 1,4-диоксан-2-иловый, тетрагидрофураниловый, тетрагидротиофураниловый, 2,3,3 а,4,5,6,7,7 аоктагидро-7,8,8-триметил-4,7-метанобензофуран-2-иловый); замещенные простые этиловые эфиры (1-этоксиэтиловый, 1-(2-хлорэтокси)этиловый, 1-метил-1 метоксиэтиловый,1-метил-1-бензилоксиэтиловый,1-метил-1-бензилокси-2-фторэтиловый,2,2,2-трихлорэтиловый, 2-триметилсилилэтиловый, 2-(фенилселенил)этиловый, 2,4-динитрофениловый,бензиловый); замещенные простые бензиловые эфиры (п-метоксибензиловый, 3,4-диметоксибензиловый,о-нитробензиловый,п-нитробензиловый,п-галогенбензиловый,2,6-дихлорбензиловый,п-цианобензиловый, п-фенилбензиловый, 2- и 4-пиколиловый, 3-метил-2-пиколиловый, N-оксидо, дифенилметиловый,п,п'-динитробензгидриловый,5-дибензосубериловый,трифенилметиловый,6-нафтилдифенилметиловый,п-метилоксифенилдифенилметиловый,ди(п-метоксифенил)фенилметиловый,три(п-метоксифенил)метиловый,(4'-бромфенацилокси)фенилдифенилметиловый,4,4',4"-трис-(4,5-дихлорфталемидофенил)метиловый,4,4',4"-трис-(левулиноилоксифенил)метиловый,4,4',4"-трис-(бензоилоксифенил)метиловый,3-(имидазол-1-илметил)-бис-(4',4"-диметоксифенил)метиловый, 1,1-бис-(4-метоксифенил)-1'-пиренилметиловый, 9-антриловый, 9-(9-фенил)ксантениловый,9-(9-фенил-10-оксо)антриловый, 1,3-бензодитиолан-2-иловый, бензизотиазолил S,S'-диоксидиловый); простые силиловые эфиры (триметилсилиловый, триэтилсилиловый, триизопропилсилиловый, диметилизопропилсилиловый,диэтилизопропилсилиловый,диметилгексилсилиловый,третбутилдиметилсилиловый, трет-бутилдифенилсилиловый, трибензилсилиловый, три-п-ксилилсилиловый,трифенилсилиловый, дифенилметилсилиловый, трет-бутилметоксифенилсилиловый); сложные эфиры (муравьиной, бензоилмуравьиной, уксусной, хлоруксусной, дихлоруксусной, трихлоруксусной, трифторуксусной, метоксиуксусной, трифенилметоксиуксусной, феноксиуксусной,п-хлорфеноксиуксусной, п-полифенилуксусной, 3-фенилпропионовой, 4-оксопентановой (левулиновой),4,4-(этилендитио)пентановой, пивалиновой, адамантановой, кротоновой, 4-метоксикротоновой, бензойной, п-фенилбензойной, 2,4,6-триметилбензойной (мезитоновой) кислоты); карбонаты (метил-, 9-флуоренилметил-, этил-, 2,2,2-трихлорэтил-, 2-(триметилсилил)этил-,2-(фенилсульфонил)этил-, 2-(трифенилфосфонио)этил-, изобутил-, винил-, аллил-, п-нитрофенил-, бензил-, п-метоксибензил-, 3,4-диметоксибензил-, о-нитробензил-, п-нитробензил-, п-бензилтиокарбонат,4-этокси-1-нафтил-, метилдитиокарбонат); группы со вспомогательным расщеплением(2-йодбензоат,4-азидобутират,4-нитро-4-метилпентоноат, о-(дибромметил)бензоат, 2-формилбензолсульфонат, 2-(метилтиометокси)этилкарбонат, 4-(метилтиометокси)бутират, 2-(метилтиометоксиметил)бензоат); эфиры из разных групп (2,6-дихлор-4-метилфеноксиуксусной кислоты, 2,6-дихлор-4-(1,1,3,3 тетраметилбутил)феноксиуксусной кислоты, 2,4-бис-(1,1-диметилпропил)феноксиуксусной кислоты,- 14019419 хлордифенилуксусной кислоты, изомасляной кислоты, моноэфир янтарной кислоты, (Е)-2-метил-2 бутеновой кислоты (тиглиновой кислоты), о-(метоксикарбонил)бензойной кислоты, п-полибензойной кислоты, -нафтеновой кислоты, азотной кислоты, алкил-N,N,N',N'-тетраметилфосфордиамидат,N-фенилкарбамат, борной кислоты, диметилфосфинтиоиловой кислоты, 2,4-динитрофенилсульфенат); сульфонаты (сульфат, метансульфонат (мезилат), бензилсульфонат, тозилат). Типичные 1,2-диоловые защитные группы (соответственно, в основном такие, в которых две группы ОН взяты совместно с защищаемой функциональностью) описаны в монографии Greene на стр. 118142 и включают циклические ацетали и кетали (метилен, этилиден, 1-трет-бутилэтилиден,1-фенилэтилиден, (4-метоксифенил)этилиден, 2,2,2-трихлорэтилиден, ацетонид (изопропилиден), циклопентилиден,циклогексилиден,циклогептилиден,бензилиден,п-метоксибензилиден,2,4-диметоксибензилиден, 3,4-диметоксибензилиден, 2-нитробензилиден); циклические сложные ортоэфиры (метоксиметилен, этоксиметилен, диметоксиметилен, 1-метоксиэтилиден, 1-этоксиэтилиден,1,2-диметоксиэтилиден, -метоксибензилиден, 1-(N,N-диметиламино)этилиденовое производное,-(N,N-диметиламино)бензилиденовое производное, 2-оксациклопентилиден); силиловые производные(ди-трет-бутилсилиленовая группа, 1,3-(1,1,3,3-тетраизопропилдисилоксанилиден) и тетра-третбутоксидисилоксан-1,3-диилиден), циклические карбонаты, циклические боронаты, этилборонат и фенилборонат. Более типично, когда 1,2-диоловые защитные группы включают те, которые представлены в таблице, еще более типично, когда они включают эпоксиды, ацетониды, циклические кетали и арилкетали. Таблица В где R9 представляет собой C1-C6-алкил. Аминозащитные группы. Другой набор защитных групп содержит любые из типичных аминозащитных групп, описанных в монографии Greene на с. 315-385. Они включают: карбаматы:(фенотиазинил-(10)-карбонил,N-п-толуолсульфониламинокарбонил, N'-фениламинотиокарбонил); карбаматы из различных групп: (трет-амил, S-бензилтиокарбамат, п-цианобензил, циклобутил, циклогексил,циклопентил,циклопропилметил,п-децилоксибензил,диизопропилметил,2,2-диметоксикарбонилвинил,о-(N,N-диметилкарбоксамидо)бензил,1,1-диметил-3-(N,Nдиметилкарбоксамидо)пропил, 1,1-диметилпропинил, ди(2-пиридил)метил, 2-фуранилметил, 2-йодоэтил,изоборнил,изобутил,изоникотинил,п-(п'-метоксифенилазо)бензил,1-метилциклобутил,1-метилциклогексил, 1-метил-1-циклопропилметил, 1-метил-1-(3,5-диметоксифенил)этил, 1-метил-1-(пфенилазофенил)этил, 1-метил-1-фенилэтил, 1-метил-1-(4-пиридил)этил, фенил, п-(фенилазо)бензил,2,4,6-три-трет-бутилфенил, 4-(триметиламмоний)бензил, 2,4,6-триметилбензил); амиды: (N-формил, N-ацетил, N-хлорацетил, N-трихлорацетил, N-трифторацетил, N-фенилацетил,N-3-фенилпропионил, N-пиколиноил, N-3-пиридилкарбоксамид, N-бензоилфенилаланил, N-бензоил,- 15019419N-сульфониловые производные (N-п-толуолсульфонил, N-бензолсульфонил, N-2,3,6-триметил-4 метоксибензолсульфонил,N-2,4,6-триметоксибензолсульфонил,N-2,6-диметил-4-метоксибензолсульфонил, N-пентаметилбензолсульфонил, N-2,3,5,6-тетраметил-4-метоксибензолсульфонил, N-4 метоксибензолсульфонил,N-2,4,6-триметилбензолсульфонил,N-2,6-диметокси-4-метилбензолсульфонил, N-2,2,5,7,8-пентаметилхроман-6-сульфонил, N-метансульфонил, N- -триметилсилилэтансульфонил,N-9-антраценсульфонил,N-4-(4',8'-диметоксинафтилметил)бензолсульфонил,N-бензилсульфонил, N-трифторметилсульфонил, N-фенацилсульфонил). Более типично, когда защищенные аминогруппы включают карбаматы и амиды, еще более типично, когда включают -NHC(O)R1 или -N=CR1N(R1)2. Другая защитная группа, также используемая в качестве пролекарственной формы для аминогруппы или -NH(R5), представляет собой См., например, статью Alexander J. et al. (1996), J. Med.Chem. 39:480-486. Аминокислотная или полипептидная защитная группа и конъюгаты. Аминокислотная или полипептидная защитная группа соединения, соответствующего изобретению,имеет структуру R15NHCH(R16)C(O)-, в которой R15 означает Н, остаток аминокислоты, или полипептида или R5 и R16 определен ниже.R16 представляет собой низший алкил или низший алкил (C1-C6), замещенный аминогруппой, карбоксилом, амидом, карбоновым эфиром, гидроксилом, C6-C7-арилом, гвайнидинилом, имидазолилом,индолилом, сульфгидрилом, сульфоксидом и/или алкилфосфатом. Кроме того, R10, взятый совместно с аминокислотойN, образует остаток пролина (R10=(-СН 2)3-). Однако R10, как правило, представляет собой боковую группу природной аминокислоты, такую как Н,-СН 3, -СН(СН 3)2, -СН 2-СН(СН 3)2, -СНСН 3-СН 2-СН 3, -СН 2-С 6 Н 5, -CH2CH2-S-CH3, -CH2OH, -СН(ОН)-СН 3,-CH2-SH, -СН 2-С 6 Н 4 ОН, -CH2-CO-NH2, -CH2-CH2-CO-NH2, -CH2-COOH, -CH2-CH2-COOH, -(CH2)4-NH2 и-(CH2)3-NH-C(NH2)-NH2. R10 также включает 1-гвайнидинопроп-3-ил, бензил, 4-гидроксибензил, имидазол-4-ил, индол-3-ил, метоксифенил и этоксифенил. Другой набор защитных групп включает остаток аминосодержащего соединения, в частности аминокислоты, полипептида, защитной группы, -NHSO2R, NHC(O)R, -N(R)2, NH2 или -NH(R)(H), причем,например, карбоновая кислота реагирует, т.е. связывается, с амином с образованием амида, как вC(O)NR2. Можно провести реакцию фосфоновой кислоты с амином с образованием фосфонамидата, как в -P(O)(OR)(NR2). Как правило, аминокислоты имеют структуру R17C(O)CH(R16)NH-, в которой R17 представляет собой -ОН, -OR, остаток аминокислоты или полипептида. Аминокислоты являются низкомолекулярными соединениями с молекулярной массой порядка величины приблизительно 1000 или меньше, которые содержат по меньшей мере одну амино- или иминогруппу и по меньшей мере одну карбоксильную группу. В основном аминокислоты обнаруживают в природных условиях, т.е. их можно выявить в биологическом материале, таком как бактерии или другие микроорганизмы, растения, животные или человек. Подходящими аминокислотами обычно являются -аминокислоты, т.е. соединения, характеризующиеся одним аминным или иминным атомом азота, отделенным от атома углерода одной карбоксильной группы посредством однозамещенного или незамещенного -атома углерода. Особенный интерес представляют гидрофобные остатки, такие как моно- или диалкил- или ариламинокислоты, циклоалкиламинокислоты и т.п. Данные остатки участвуют в проникновении в клетку посредством повышения коэффициента распределения исходного лекарственного препарата. Как правило, остаток не содержит сульфгидрильный или гвайнидиновый заместитель. Остатки природных аминокислот являются теми остатками, которые в естественных условиях обнаруживают в растениях, животных или микроорганизмах, особенно в их белках. Наиболее типично,когда полипептиды будут в существенной мере состоять из данных остатков природных аминокислот. Этими аминокислотами являются глицин, аланин, валин, лейцин, изолейцин, серин, треонин, цистеин,метионин, глутаминовая кислота, аспарагиновая кислота, лизин, гидроксилизин, аргинин, гистидин, фенилаланин, тирозин, триптофан, пролин, аспарагин, глутамин и гидроксипролин. Кроме того, включены неприродные аминокислоты, например валанин, фенилглицин и гомоаргинин. Часто встречающие аминокислоты, которые не кодируются генами, также могут быть использованы в настоящем изобретении. Все аминокислоты, используемые в настоящем изобретении, могут представлять собой D- илиL-оптический изомер. Кроме того, в настоящем изобретении можно также использовать другие пептидомиметики. В качестве общего обзора см. раздел Spatola A.F. в монографии Chemistry and Biochemistry ofWeinstein, Marcel Dekker, New York, p. 267 (1983). Как правило, -амино- или -карбоксильная группа аминокислоты или концевой амино- или карбоксильной группы полипептида связаны с исходными функциональностями, т.е. карбоксильные или аминогруппы в боковых цепях аминокислот обычно не используют для образования амидных связей с исходным соединением (хотя может потребоваться защитить данные группы в процессе синтеза конъюгатов, как далее описано ниже). Данные сложноэфирные или амидные связи с амино- или карбоксильными группами боковой цепи,подобно сложным эфирам или амидам исходной молекулы, необязательно гидролизуются in vivo или invitro в кислотных (pH3) или щелочных (pH10) условиях. Альтернативно, они в существенной степени стабильны в желудочно-кишечном тракте человека, но ферментативно гидролизуются в крови или внутриклеточных условиях. Сложные эфиры или аминокислоты либо амидаты полипептидов также используют в качестве промежуточных соединений для получения исходной молекулы, включающей свободные амино- или карбоксильные группы. Свободную кислоту или основание исходного соединения, например, легко получить из сложных эфиров или аминокислот либо полипептидных конъюгатов, соответствующих данному изобретению, путем принятых методов гидролиза. Когда остаток аминокислоты включает один или более хиральных центров, могут быть использованы любые из их D-, L-, мезо-, трео- или эритро-изомеров (соответственно), рацематов, пропорциональных составов или их смеси. Как правило, если промежуточные соединения должны быть неферментативно гидролизованы (как было бы в случае использования амидов в качестве химических промежуточных продуктов для получения свободных кислот или свободных оснований), используют D-изомеры. С другой стороны, L-изомеры более универсальны, поскольку они могут быть чувствительными как к неферментативному, так и ферментативному гидролизу и более эффективно транспортируются системами транспорта аминокислот или дипептидилов в желудочно-кишечный тракт. Примеры подходящих аминокислот включают следующее: глицин; аминополикарбоновые кислоты, например аспарагиновая кислота, -гидроксиаспарагиновая кислота, глутаминовая кислота, -гидроксиглутаминовая кислота, -метиласпарагиновая кислота,-метилглутаминовая кислота, ,-диметиласпарагиновая кислота, -гидроксиглутаминовая кислота-дигидроксиглутаминовая кислота, -фенилглутаминовая кислота, -метиленглутаминовая кислота,3-аминоадипиновая кислота, 2-аминопимелиновая кислота, 2-аминосубеироновая кислота и 2-аминосебациновая кислота; амиды аминокислот, такие как глутамат и аспарагин; полиамино- или многоосновные монокарбоновые кислоты, такие как аргинин, лизин,-аминоаланин, -аминобутирин, орнитин, цитруллин, гомоаргинин, гомоцитруллин, гидроксилизин,аллогидроксилизин и диаминомасляная кислота; другие остатки основных аминокислот, такие как гистидин; диаминодикарбоновые кислоты, такие как ,'-диаминоянтарная кислота, ,'-диаминоглутаровая кислота, ,'-диаминоадипиновая кислота, ,'-диаминопимелиновая кислота, ,'-диамино-гидроксипимелиновая кислота, ,'-диаминосубериновая кислота, ,'-диаминоазелаиновая кислота и-амино, -, -, - или -гидроксикислоты, такие как остатки гомосерина, -гидроксинорвалина,-гидроксинорвалина и -гидроксинорлейцина; канавин и каналин; -гидроксиоритин; 2-гексозаминовые кислоты, такие как D-глюкозаминовая кислота или D-галактозаминовая кислота;-аминотиолы, такие как пеницилламин, -тиолнорвалин или -тиобутирин; другие остатки серосодержащих аминокислот, включая цистеин; гомосерин, -фенилметионин, метионин, S-аллил-L-цистеинсульфоксид, 2-тиолгистидин, цистатионин и тиоловые эфиры цистеина и гомоцистеина; фенилаланин, триптофан и -аминокислоты с замещенным циклом, такие как фенил- или циклогексиламинокислоты, -аминофенилуксусная кислота, -аминоциклогексилуксусная кислота и -амино-циклогексилпропионовая кислота; аналоги и производные фенилаланил, включающие арил, низший алкил, гидрокси-, гуанидиногруппу, оксиалкилэфир, нитро-, серо- или галогензамещенный фенил (например, тирозин, метилтирозин и о-хлор-, п-хлор-, 3,4-дихлор, о-, м- или п-метил-, 2,4,6-триметил-, 2-этокси 5-нитро-, 2-гидрокси-5-нитро- и п-нитрофенилаланин); фурил-, тиенил-, пиридил-, пиримидинил-, пуринил- или нафитилалаинины; и аналоги и производные триптофана, включая кинуренин,3-гидроксикинуренин, 2-гидрокситриптофан и 4-карбокситриптофан;-гидрокси- и замещенные -гидроксиаминокислоты, включая серин, треонин, аллотреонин, фосфосерин и фосфотреонин. Полипептиды представляют собой полимеры аминокислот, в которых карбоксильная группа одного аминокислотного мономера связана с амино- или иминогруппой следующего аминокислотного мономера амидной связью. Полипептиды включают дипептиды, низкомолекулярные полипептиды (молекулярной массы приблизительно 1500-5000) и белки. Белки необязательно содержат 3, 5, 10, 50, 75, 100 или более остатков, и соответственно их последовательности являются в существенной мере гомологичными с человеческими, животными, растительными и микробными белками. Они включают ферменты (например,пероксидазу водорода), а также иммуногены, такие как KLH (гемоцианин моллюска блюдечко), или антитела либо белки любого типа, против которых требуется получить иммунный ответ. Природа и идентичность полипептида может очень широко варьировать. Амидаты полипептидов используют в качестве иммуногенов при получении антител против либо полипептида (если он не является иммуногенным для животного, которому его вводят), либо эпитопов на остальной части соединения, соответствующего данному изобретению. Антитела, способные связываться с исходным непептидильным соединением, используют для выделения исходного соединения из смесей, например при диагностике или изготовлении исходного соединения. Конъюгаты исходного соединения и полипептида, как правило, более иммуногены, чем полипептиды у животных с близкой гомологией, и, следовательно, делают полипептид более иммуногенным,способствуя возникновению антител против него. Соответственно, может не требоваться, чтобы полипептид или белок был иммуногенным для животного, обычно используемого для получения антител,например для кролика, мыши, лошади или крысы, но конъюгат конечного продукта должен быть иммуногенным по меньшей мере для одного из данных животных. Полипептид необязательно включает центр расщепления пептидолитического фермента по пептидной связи между первым и вторым остатком, прилежащим к кислотному гетероатому. Данные центры расщепления фланкированы структурами распознавания ферментом, например определенной последовательностью остатков, распознаваемой пептидолитическим ферментом. Пептидолитические ферменты для расщепления полипептидных конъюгатов, соответствующих данному изобретению, хорошо известны и, в частности, включают карбоксипептидазы. Карбоксипептидазы разлагают полипептиды путем удаления С-концевых остатков и являются специфическими во многих случаях в отношении определенных С-концевых последовательностей. Данные ферменты и их требования к субстрату в основном хорошо известны. Например, дипептид (имеющий заданную пару остатков и свободный карбоксильный конец) ковалентно связан через свою -аминогруппу с атомами фосфора или углерода соединений, описанных в данном контексте. Трипептидные остатки также используют в качестве защитных групп. Когда требуется защитить фосфонат, последовательность -Х 4-рго-Х 5- (в которой X4 представляет собой остаток любой аминокислоты и X5 представляет собой остаток аминокислоты, карбоксильный эфир пролина или водород) будет расщепляться карбоксипептидазой просвета кишки с образованием X4 со свободным карбоксилом, который, в свою очередь, как полагают, автокаталитически расщепляет фосфоноамидатную связь. Карбоксигруппа X5 необязательно эстерифицируется бензилом. Дипептидные или трипептидные молекулы можно выбрать на основе известных транспортных свойств и/или чувствительности к пептидазам, которые могут влиять на транспорт к слизистой оболочке кишки или другому типу клеток. Дипептиды и трипептиды, не имеющие -аминогруппы, представляют собой транспортные субстраты для транспортера пептидов, обнаруженного в мембране щеточной каемки клеток слизистой оболочки кишки (см. статью Bai J.P.F. (1992), Pharm Res. 9:969-978). Транспортные компетентные пептиды могут быть, таким образом, использованы для повышения биодоступности амидатных соединений. Ди- или трипептиды, включающие одну или более аминокислот в D-конфигурации,также совместимы с транспортом пептидов и могут быть использованы в амидатных соединениях, соответствующих данному изобретению. Аминокислоты D-конфигурации могут быть использованы для снижения чувствительности ди- или трипептида к гидролизу протеазами, обычными для щеточной каемки, такими как аминопептидаза N. Кроме того, ди- или трипептиды альтернативно выбирают на основе их относительной устойчивости к гидролизу протеазами, обнаруженными в просвете кишки. Например,трипептиды или полипептиды, не содержащие asp и/или glu, являются бедными субстратами для аминопептидазы А, ди- или трипептиды, не содержащие остатки аминокислот на N-концевой стороне гидрофобных аминокислот (leu, tyr, phe, val, tap), являются бедными субстратами для эндопептидазы, и пептиды, не содержащие остаток pro в предпоследнем положении от свободного карбоксильного конца, являются бедными субстратами для карбоксипептидазы Р. Аналогичные рассуждения могут быть также применимы к выбору пептидов, которые являются либо относительно устойчивыми, либо относительно чувствительными к гидролизу цитозольными, почечными, печеночными, сывороточными или другими пептидазами. Данные слабо расщепляющиеся амидаты полипептидов являются иммуногенами или их используют для связывания с белками с целью получения иммуногенов. Внутриклеточная направленность. Необязательно введенная фосфонатная группа соединений, соответствующих изобретению, может расщепляться in vivo на стадиях, последующих за достижением ими желательного центра действия, т.е. внутри клетки. Один из механизмов действия внутри клетки может предусматривать сначала расщепление, например, эстеразой с образованием отрицательно заряженного "запертого" промежуточного соединения. Отщепление концевой сложноэфирной группы в соединении, соответствующем изобретению,таким образом, приводит к образованию нестабильного промежуточного соединения, которое выделяет отрицательно заряженное "запертое" промежуточное соединение. После прохода в клетку внутриклеточное ферментативное расщепление или модификация фосфонатного или пролекарственного соединения может привести в результате к внутриклеточному накоплению расщепленного или модифицированного соединения с помощью "захватывающего" механизма. Расщепленное или модифицированное соединение затем может быть "заперто" клеткой посредством существенного изменения заряда, полярности или изменения другого физического свойства, которое снижает уровень, на котором расщепленное или модифицированное соединение может находиться в клетке,относительно уровня, на котором оно входит как фосфонатная пролекарственная форма. Могут также действовать другие механизмы, благодаря которым достигается терапевтический эффект. Ферменты,которые способны к осуществлению механизма ферментной активации фосфонатных пролекарственных соединений, соответствующих изобретению, включают, но без ограничения перечисленным, амидазы,эстеразы, микробные ферменты, фосфолипазы, холинэстеразы и фосфатазы. Исходя из изложенного, будет очевидно, что многие различные лекарственные препараты могут быть дериватизированы в соответствии с настоящим изобретением. Множество данных лекарственных препаратов специально упоминают в данном контексте. Однако следует иметь в виду, что предусматривается не исчерпывающее, а только иллюстративное обсуждение семейств лекарственных препаратов и их конкретных представителей в плане дериватизации в соответствии с данным изобретением. Соединения, подавляющие ВИЧ. Соединения, соответствующие изобретению, включают обладающие активностью подавления ВИЧ. Соединения, соответствующие изобретению, необязательно несут одну или более (например, 1, 2, 3 или 4) фосфонатных групп, которые могут представлять собой пролекарственную часть. Термин "соединение, подавляющее ВИЧ" включает такие соединения, которые подавляют ВИЧ. Как правило, соединения, соответствующие изобретению, имеют молекулярную массу от приблизительно 400 до приблизительно 10000 а.е.м. (атомных единиц массы); в специфическом варианте осуществления изобретения соединения имеют молекулярную массу меньше чем приблизительно 5000 а.е.м.; в другом специфическом варианте осуществления изобретения соединения имеют молекулярную массу меньше чем приблизительно 2500 а.е.м.; в другом специфическом варианте осуществления изобретения соединения имеют молекулярную массу меньше чем приблизительно 1000 а.е.м.; в другом специфическом варианте осуществления изобретения соединения имеют молекулярную массу меньше чем приблизительно 800 а.е.м.; в другом специфическом варианте осуществления изобретения соединения имеют молекулярную массу меньше чем приблизительно 600 а.е.м. и в другом специфическом варианте осуществления изобретения соединения имеют молекулярную массу меньше чем приблизительно 600 а.е.м. и больше чем приблизительно 400 а.е.м. Соединения, соответствующие изобретению, кроме того, как правило, имеют logD (полярность) меньше чем приблизительно 5. В одном варианте осуществления изобретение представляет соединения,имеющие logD меньше чем приблизительно 4; в другом варианте осуществления изобретение представляет соединения, имеющие logD меньше чем приблизительно 3; в другом варианте осуществления изобретение представляет соединения, имеющие logD больше чем приблизительно -5; в другом варианте осуществления изобретение представляет соединения, имеющие logD больше чем приблизительно -3 и в другом варианте осуществления изобретение представляет соединения, имеющие logD больше чем приблизительно 0 и меньше чем приблизительно 3. Выбранные заместители в соединениях, соответствующих изобретению, присутствуют в рекурсивной степени. В данном контексте "рекурсивный заместитель" означает, что заместитель может быть представленным другим вариантом самого себя. Теоретически в связи с рекурсивной природой данных заместителей в любом данном варианте осуществления может присутствовать большое число примеров. Обычный специалист в области медицинской химии понимает, что общее число данных заместителей довольно ограничено желательными свойствами предусматриваемого соединения. Данные свойства включают в качестве примера, а не ограничения перечисленным, физические свойства, такие как молекулярная масса, растворимость или logP, свойства, связанные с применением, такие как активность в отношении предназначенной мишени, и практические свойства, такие как простота синтеза. Рекурсивные заместители представляют собой предусмотренный аспект изобретения. Обычный специалист в области медицинской химии имеет в виду поливариантность данных заместителей. В той мере, в которой рекурсивные заместители присутствуют в варианте осуществления изобретения, общее число будут определять, как представлено выше. В любом случае, когда соединение, описанное в данном контексте, замещено больше чем одной из одинаково обозначенных групп, следует иметь в виду, что группы могут быть одинаковыми или различными, т.е. каждая группа выбрана независимо. Волнистые линии указывают участок присоединений ковалентных связей к соседним группам, молекулам или атомам. В одном варианте осуществления изобретения соединение находится в выделенной и очищенной форме. Как правило, термин "выделенный и очищенный" означает, что соединение в существенной мере свободно от биологических материалов (например, крови, ткани, клеток и т.п.). В одном специфическом варианте осуществления изобретения термин означает, что соединение или конъюгат, соответствующие изобретению, по меньшей мере приблизительно на 50 мас.% свободны от биологических материалов; в другом специфическом варианте термин означает, что соединение или конъюгат, соответствующие изобретению, по меньшей мере приблизительно на 75 мас.% свободны от биологических материалов; в другом специфическом варианте термин означает, что соединение или конъюгат, соответствующие изобретению, по меньшей мере приблизительно на 90 мас.% свободны от биологических материалов; в другом специфическом варианте термин означает, что соединение или конъюгат, соответствующие изобретению, по меньшей мере приблизительно на 98 мас.% свободны от биологических материалов и в другом специфическом варианте термин означает, что соединение или конъюгат, соответствующие изобретению, по меньшей мере приблизительно на 99 мас.% свободны от биологических материалов. В другом специфическом варианте изобретение представляет соединение или конъюгат, соответствующие изобретению, которые получены путем синтеза (например, ex vivo). Накопление в клетке. В одном варианте осуществления изобретение представляет соединения, способные накапливаться в человеческих РВМС (мононуклеарных клетках периферической крови). Термин РВМС относится к клеткам крови, имеющим округлые лимфоциты и моноциты. Физиологически РВМС являются важными компонентами противоинфекционного механизма. РВМС можно выделить из гепаринизированной цель- 20019419 ной крови нормальных здоровых доноров или лейкоцитных пленок с помощью стандартного центрифугирования в градиенте плотности и собрать с границы раздела, промыть (например, в забуференном фосфатом солевом растворе) и хранить в среде для замораживания. РВМС можно культивировать в многолуночных планшетах. В различные периоды культивирования супернатант можно отобрать для анализа или собрать и проанализировать клетки (см. статью Smith R. et al. (2003), Blood. 102(7):2532-2540). Соединения, соответствующие данному варианту осуществления, могут далее включать фосфонат или фосфонатную пролекарственную форму. Как правило, соединения, соответствующие изобретению, демонстрируют увеличенный внутриклеточный полупериод существования соединений или внутриклеточных метаболитов соединений в человеческих РВМС по сравнению с аналогами соединений, не содержащих фосфонат или не имеющих фосфонатной пролекарственной формы. Как правило, полупериод существования увеличивается по меньшей мере приблизительно на 50%, более типично по меньшей мере в интервале 50-100%, еще более типично по меньшей мере приблизительно на 100%, еще более типично больше чем приблизительно на 100%. В одном варианте осуществления изобретения внутриклеточный полупериод существования метаболита соединения в человеческих РВМС увеличен по сравнению с аналогом соединения, не включающим фосфонат или не имеющим фосфонатной пролекарственной формы. В данных вариантах осуществления метаболит будет образовываться внутриклеточно, например генерироваться внутри человеческих РВМС. Метаболит может представлять собой продукт расщепления фосфонатной пролекарственной формы внутри человеческих РВМС. Необязательно фосфонатсодержащая фосфонатная пролекарственная форма может расщепляться с образованием метаболита, имеющего по меньшей мере один отрицательный заряд при физиологическом pH. Фосфонатная пролекарственная форма может расщепляться ферментами в человеческой РВМС с образованием фосфоната, имеющего по меньшей мере один активный атом водорода формы Р-ОН. Стереоизомеры. Соединения, соответствующие изобретению, могут иметь хиральные центры, например хиральные атомы углерода или фосфора. Соединения, соответствующие изобретению, таким образом, включают рацемические смеси всех стереоизомеров, включая энантиомеры, диастереомеры и атропизомеры. Кроме того, соединения, соответствующие изобретению, включают обогащенные или разделенные оптические изомеры по любому или всем асимметричным хиральным атомам. Другими словами, хиральные центры,очевидные из описаний, представлены как хиральные изомеры или рацемические смеси. Все, как рацемические, так и диастереомерные смеси, а также индивидуальные оптические изомеры, выделенные или синтезированные, в существенной степени свободные от своих энантиомерных или диастереомерных партнеров, входят в объем изобретения. Рацемические смеси разделяют на индвидуальные в существенной степени оптически чистые изомеры с помощью хорошо известных методов, таких как, например,разделение диастереомерных солей, образованных с оптически активными вспомогательными агентами,например кислотами или основаниями с последующим обратным превращением в оптически активные субстанции. В большинстве случаев желательный оптический изомер синтезируют посредством стереоспецифических реакций, начиная с соответствующего стереоизомера необходимого исходного материала. Соединения, соответствующие изобретению, могут также в ряде случаев существовать в виде таутомерных изомеров. Хотя может быть описана только одна структура деполяризованного резонанса,предусматривают, что все данные формы входят в объем изобретения. Например, могут существовать ен-аминные таутомеры пуриновой, пиримидиновой, имидазоловой, гуанидиновой, амидиновой и татразоловой систем, и все их возможные таутомерные формы вводят в объем изобретения. Соли и гидраты. Композиции, соответствующие данному изобретению, необязательно включают соли соединений в данном контексте, особенно фармацевтически приемлемые нетоксичные соли, содержащие, например,Na+, Li+, K+, Ca+2 и Mg+2. Данные соли могут включать полученные путем сочетания подходящих катионов, таких как ионы щелочных и щелочно-земельных металлов или ионы аммония и четвертичного аммония, с частью аниона кислоты, как правило, карбоновой кислоты. Если требуется водорастворимая соль, предпочтительны одновалентные соли. Соли металлов, как правило, получают путем реакции гидроксида металла с соединением, соответствующим данному изобретению. Примерами солей металлов, которые получены данным образом, являются соли, содержащие Li+, Na+ и K+. Менее растворимую соль металла можно осадить из раствора более растворимой соли добавлением подходящего соединения металла. Кроме того, соли могут быть образованы из кислот добавлением ряда органических и неорганических кислот, например HCl, HBr, H2SO4, H3PO4, или органических сульфоновых кислот к щелочным центрам, как правило аминам, или к кислотным группам. Наконец, следует иметь в виду, что композиции в данном контексте включают соединения, соответствующие изобретению, в неионизированной, а также в цвиттерионной форме и комбинации со стехиметрическими количествами воды, как в гидратах. В объем данного изобретения включены также соли исходных соединений с одной или более аминокислотами. Подходят любые из вышеописанных аминокислот, особенно природные аминокислоты,- 21019419 обнаруженные как компоненты белков, хотя аминокислота, как правило, представляет собой аминокислоту, несущую боковую цепь с основной или кислотной группой, например лизин, аргинин или глутаминовая кислота, или нейтральной группой, такая как глицин, серин, треонин, аланин, изолейцин или лейцин. Способы подавления ВИЧ. Другой аспект изобретения относится к способам подавления активности ВИЧ, включающим стадию обработки образца, предположительно содержащего ВИЧ, композицией, соответствующей изобретению. Композиции, соответствующие изобретению, могут действовать как ингибиторы ВИЧ, как промежуточные соединения для данных ингибиторов или обладать другими полезными свойствами, как описано ниже. Ингибиторы будут в основном связываться с положениями на поверхности или в полости печени. Композиции, связывающиеся в печени, могут связываться с различной степенью обратимости. Данные соединения, связывающиеся практически необратимо, являются идеальными кандидатами для применения в данном способе, соответствующем изобретению. После введения метки практически необратимо связывающиеся композиции используют в качестве зондов для выявления ВИЧ. Соответственно,изобретение относится к способам детекции NS3 в образце, предположительно содержащем ВИЧ, включающим стадии обработки образца, предположительно содержащего ВИЧ, композицией, включающей соединение, соответствующее изобретению, связанное с меткой, и наблюдения эффекта образца на активность метки. Подходящие метки хорошо известны в области диагностики и включают стабильные свободные радикалы, флуорофоры, радиоизотопы, ферменты, хемолюминесцентные группы и хромогены. Соединения в данном контексте метят принятым образом, используя функциональные группы, такие как гидроксил, или аминогруппу. В контексте изобретения образцы, предположительно содержащие ВИЧ, включают природные или неприродные материалы, такие как живые организмы, ткани или клеточные культуры, биологические образцы, такие как образцы биологического материала (кровь, сыворотку, мочу, спинно-мозговую жидкость, слезную жидкость, мокроту, слюну, образцы тканей и т.п.); лабораторные образцы, образцы пищевых продуктов, воды, воздуха, образцы биопродуктов, такие как экстракты клеток, в частности рекомбинантных клеток, синтезирующих желательный гликопротеин, и т.п. Как правило, образец будет предположительно содержать ВИЧ. Образцы могут находиться в любой среде, включая воду и смеси органического растворителя/воды. Образцы включают живые организмы, такие как человек и созданные человеком материалы, такие как клеточные структуры. Стадия обработки, соответствующая изобретению, включает добавление композиции, соответствующей изобретению, к образцу или она заключается в добавлении предшественника композиции к образцу. Стадия добавления включает любой способ введения, как описано выше. При необходимости активность ВИЧ после введения композиции можно исследовать любым методом, включая прямые и опосредованные методы детекции активности ВИЧ. Предусмотрены все качественные, количественные и полуколичественные методы определения активности ВИЧ. Как правило, используют один из вышеописанных методов скрининга, однако применим также любой другой метод, такой как исследование физиологических свойств живого организма. Многие организмы содержат ВИЧ. Соединения, соответствующие данному изобретению, используют для лечения или профилактики состояний, ассоциированных с активацией ВИЧ у животных или человека. Однако при скрининге соединений, способных подавлять ВИЧ, следует иметь в виду, что результаты ферментных анализов могут не коррелировать с анализами на клеточных культурах. Таким образом,анализ на клеточной основе должен быть основным инструментом скрининга. Способы скрининга ингибиторов ВИЧ. Проводят скрининг композиций, соответствующих изобретению, на подавляющую активность в отношении ВИЧ посредством любой из принятых методик оценки активности фермента. В контексте изобретения, как правило, сначала проводят скрининг композиций на ингибирование ВИЧ in vitro и композиции, проявляющие ингибирующую активность, затем подвергают скринингу на активность in vivo. Для применения in vivo предпочтительны композиции, имеющие in vitro Ki (константы ингибирования) меньше чем приблизительно 510-6 М, обычно меньше чем приблизительно 110-7 М и предпочтительно меньше чем приблизительно 510-8 М. Используемые in vitro методы скрининга описаны подробно. Фармацевтические препараты. Соединения, соответствующие данному изобретению, получены с принятыми носителями и наполнителями, которые будут выбраны в соответствии с обычной практикой. Таблетки будут включать наполнители, скользящие агенты, инертные наполнители, связующие агенты и т.п. Водные препараты готовят в стерильной форме и, когда они предназначены для доставки путем, отличным от перорального введения, будут, как правило, изотоническими. Все препараты будут необязательно включать наполнители, такие как приведены в Handbook of Pharmaceutical Excipients (Справочник по фармацевтическим наполнителям) (1986). Наполнители включают аскорбиновую кислоту и другие антиоксиданты, хелатирующие агенты, такие как ЭДТА (этилендиаминтетрауксусная кислота), углеводороды, такие как декст- 22019419 рин, гидроксиалкилцеллюлоза, гидроксиалкилметилцеллюлоза, стеариновая кислота и т.п. pH препаратов составляет от приблизительно 3 до приблизительно 11, но обычно составляет приблизительно 7-10. Хотя возможно введение активных ингредиентов в виде монокомпонента, может быть предпочтительным представлять их в виде фармацевтических препаратов. Препараты как для ветеринарного, так и для медицинского применения изобретения включают по меньшей мере один активный ингредиент, как определено выше, совместно с одним или более приемлемых для них носителей и необязательно другими терапевтическими ингредиентами. Носитель(и) должен быть "приемлемым" в смысле совместимости с другими ингредиентами препарата и физиологической безвредности для самого реципиента. Препараты включают те, которые подходят для вышеуказанных путей введения. Препараты легко могут быть представлены в унифицированной дозированной форме и могут быть получены любым из методов, хорошо известных в области фармации. Методики и составы, как правило, можно найти в Remington's Pharmaceutical Sciences (Справочник по фармацевтическим наукам Ремингтона) (Mack PublishingCo., Easton, PA). Данные методы включают стадию осуществления соединения активного ингредиента с носителем, который составляют один или более вспомогательных ингредиентов. В общем препараты получают путем осуществления однородного и тесного соединения активного ингредиента с жидкими носителями или тонко измельченными твердыми носителями либо обоими с последующим приданием формы продукту при необходимости. Препараты, соответствующие настоящему изобретению, подходящие для перорального применения, могут находиться в виде отдельных элементов, таких как капсулы, саше или таблетки, каждый из которых содержит заданное количество активного ингредиента; в виде порошка или гранул; в виде раствора или суспензии в водной или неводной жидкости либо в виде жидкой эмульсии типа масло-в-воде или жидкой эмульсии типа вода-в-масле. Активный ингредиент может также применяться в виде болюса,электуария или пасты. Таблетку изготавливают прессованием или формованием, необязательно с добавлением одного или более вспомогательных ингредиентов. Прессованные таблетки можно изготовить прессованием в подходящем оборудовании активного ингредиента в сыпучей форме, такой как порошок или гранулы, необязательно смешанные со связующим агентом, смазывающим агентом, инертным разбавителем, консервантом, поверхностно-активным или разрыхляющим агентом. Формованные таблетки можно изготовить формованием в подходящем оборудовании смеси порошкового активного ингредиента, увлажненного инертным жидким разбавителем. Таблетки необязательно могут быть покрытыми или иметь насечки и необязательно изготовлены так, чтобы обеспечить замедленное или контролируемое высвобождение из них активного ингредиента. Для введения в глаз или другие наружные ткани, например полость рта и кожу, предпочтительно, когда препараты наносят в виде наружной мази или крема, содержащего активный ингредиент(ы) в количестве, например, 0,075-20% мас./мас. (включая активный ингредиент(ы) в интервале от 0,1 до 20% с увеличением на 0,1% мас./мас., например 0,6% мас./мас., 0,7% мас./мас. и т.п.),предпочтительно от 0,2 до 15% мас./мас. и наиболее предпочтительно от 0,5 до 10% мас./мас. В составе мази активные ингредиенты можно использовать либо с вазелиновой, либо со смешивающейся с водой основой мази. Альтернативно, активные ингредиенты можно ввести в состав крема с кремовой основой типа масло-в-воде. При необходимости водная фаза кремовой основы может включать, например, по меньшей мере 30% мас./мас. многоатомного спирта, т.е. спирта, имеющего две или более гидроксильных групп, таких как пропиленгликоль, бутан-1,3-диол, маннит, сорбит, глицерин и полиэтиленгликоль (включая ПЭГ 400) и их смеси. Желательно, когда наружные препараты включают соединение, которое повышает всасывание и проникновение активного ингредиента через кожу или другие пораженные области. Примеры данных агентов, усиливающих проникновение через кожу, включают диметилсульфоксид или близкие аналоги. Масляную фазу эмульсий, соответствующих изобретению, можно составить из известных ингредиентов известным образом. Хотя фаза может включать просто эмульгатор (иначе известный как эмульсификатор), желательно, когда она включает смесь по меньшей мере одного эмульгатора с жиром или маслом или обоими, жиром и маслом. Предпочтительно, когда гидрофильный эмульгатор включают совместно с липофильным эмульгатором, который действует как стабилизатор. Предпочтительно также, когда она включает как жир, так и масло. Вместе взятые, эмульгатор(ы) со стабилизатором(ами) или без него образуют так называемый эмульсионный воск, и воск совместно с маслом и жиром образуют так называемую эмульсионную мазевую основу, которая формирует масляную дисперсную фазу кремовых препаратов. Эмульгаторы и стабилизаторы эмульсии, пригодные для применения в препарате, соответствующем изобретению, включают Твин 60, Span 80, цетостеариловый спирт, бензиловый спирт, миристиловый спирт, глицерил-моностеарат и лаурилсульфат натрия. Выбор подходящих масел и жиров для препарата основан на достижении требующихся косметических свойств. Крем предпочтительно должен быть нежирным, неокрашивающим и смываемым продуктом подходящей консистенции, чтобы избежать вытекания из тюбиков или других контейнеров. Можно использовать одно- или двухосновные алкилэфиры с неразветвленной или разветвленной цепью, такие как диизоадипат, изоцетилстеарат, пропиленгликолевый диэфир кокосовых жирных кислот, изопропилмиристат, децилолеат, изопропилпальмитат, бутилстеарат, 2-этилгексилпальмитат или смесь сложных эфиров с разветвленной цепью, известная как Crodamol CAP, причем три последних эфира предпочтительны. Их можно использовать как монокомпоненты или в комбинации (в наборах) в зависимости от требующихся свойств. Альтернативно, используют липиды с высокой температурой плавления, такие как белый мягкий вазелин и/или вазелиновое масло либо другие минеральные масла. Фармацевтические препараты, соответствующие настоящему изобретению, включают одно или более соединений, соответствующих изобретению, совместно с одним или более фармацевтически приемлемых носителей или наполнителей и необязательно другие терапевтические агенты. Фармацевтические препараты, включающие активный ингредиент, могут быть в форме, пригодной для предназначенного способа введения. Для использования при пероральном применении можно приготовить, например, таблетки, пилюли, лепешки, водные или масляные суспензии, дисперсные порошки или гранулы, эмульсии,твердые или мягкие капсулы, сиропы и эликсиры. Композиции, предназначенные для перорального применения, могут быть приготовлены согласно известному в области техники способу изготовления фармацевтических композиций, и данные композиции могут включать один или более агентов, в том числе подсластители, вкусовые добавки, красители и консерванты, для получения препарата с приятным вкусом. Приемлемыми являются таблетки, содержащие активный ингредиент в смеси с нетоксичным фармацевтически приемлемым наполнителем, который подходит для изготовления таблеток. Данные наполнители могут представлять собой, например, инертные разбавители, такие как карбонат кальция или натрия, лактоза, моногидрат лактозы, кроскармеллоза натрия, повидон, фосфат кальция или натрия; гранулирующие и разрыхляющие агенты, такие как кукурузный крахмал или альгиновая кислота; связующие агенты, такие как целлюлоза, микрокристаллическая целлюлоза, крахмал, желатин и акация; и смазывающие агенты, такие как стеарат магния, стеариновая кислота или тальк. Таблетки могут быть непокрытыми или могут быть покрыты с помощью известных методов, включая микроинкапсуляцию с целью задержки распада и всасывания в желудочно-кишечном тракте, и, таким образом, обеспечивают замедленное действие в течение более длительного периода времени. Например, можно использовать материал, дающий задержку во времени, такой как глицерилмоностеарат или глицерилдистеарат в виде монокомпонента или вместе с воском. Препараты для перорального применения могут быть также представлены в виде твердых желатиновых капсул, в которых активный ингредиент смешан с инертным твердым разбавителем, например фосфатом кальция или каолином, или в виде мягких желатиновых капсул, в которых активный ингредиент смешан с водной или масляной средой, такой как арахисовое масло, вазелиновое масло или оливковое масло. Водные суспензии, соответствующие изобретению, включают активные материалы в смеси с наполнителями, подходящими для изготовления водных суспензий. Данные наполнители включают суспендирующий агент, такой как карбоксиметилцеллюлоза натрия, метилцеллюлоза, гидроксипропилметилцеллюлоза, альгинат натрия, поливинилпирролидон, камедь трагаканта и камедь акации, и разрыхляющие или смачивающие агенты, такие как природный фосфатид (например, лецитин), продукт конденсации алкиленоксида с жирной кислотой (например, полиоксиэтиленстеарат), продукт конденсации этиленоксида с алифатическим спиртом с длинной цепью (например, гептадекаэтиленоксицетанол), продукт конденсации этиленоксида с частичным сложным эфиром, полученным из жирной кислоты и гекситолового ангидрида (например, полиоксиэтиленсорбитмоноолеат). Водная суспензия также может включать один или более консервантов, таких как этил- или н-пропил-п-гидроксибензоат, один или более красителей, одну или более вкусовых добавок, один или более подсластителей, таких как сахароза или сахарин. Масляные суспензии можно получить суспендированием активного ингредиента в растительном масле, таком как арахисовое масло, оливковое масло, кунжутное масло или кокосовое масло, или в минеральном масле, таком как вазелиновое масло. Пероральные суспензии могут включать сгуститель, такой как пчелиный воск, вазелин или цетиловый спирт. Подсластители, такие как приведены выше, и вкусовые добавки могут быть добавлены для получения приятного на вкус перорального препарата. Данные композиции могут быть законсервированы добавлением антиоксиданта, такого как аскорбиновая кислота. Дисперсные порошки и гранулы, соответствующие изобретению, подходящие для получения водной суспензии путем добавления воды, дают активный ингредиент в смеси с дисперсионным или смачивающим агентом, суспендирующим агентом и одним или более консервантами. Примерами подходящих дисперсионных или смачивающих агентов и суспендирующих агентов являются вышеописанные агенты. Могут также присутствовать дополнительные наполнители, например подсластители, вкусовые добавки и красители. Фармацевтические композиции, соответствующие изобретению, могут быть также в форме эмульсий типа масло-в-воде. Масляная фаза может представлять собой растительное масло, такое как оливковое масло или арахисовое масло, минеральное масло, такое как вазелиновое масло, или их смесь. Подходящие эмульгаторы включают природные камеди, такие как камедь акации и камедь трагаканта, природные фосфатиды, такие как соевый лецитин, сложные эфиры и частичные сложные эфиры, полученные из жирных кислот гекситоловых ангидридов, такие как сорбитмоноолеат, и продукты конденсации данных частичных эфиров с этиленоксидом, такие как полиоксиэтиленсорбитмоноолеат. Эмульсия может также включать подсластители и вкусовые добавки. Сиропы и эликсиры могут быть приготовлены с подсластителями, такими как глицерин, сорбит или сахароза. Данные препараты могут также включать болеутоляющий агент, консервант, вкусовую добавку или краситель. Фармацевтические композиции, соответствующие изобретению, могут находиться в форме стерильного инъекционного препарата, стерильной инъекционной водной или масляной суспензии. Данная суспензия может быть приготовлена согласно известному уровню техники при использовании тех подходящих дисперсионных или смачивающих агентов и суспендирующих агентов, которые упомянуты выше. Стерильный инъекционный препарат может также представлять собой стерильный инъекционный раствор или суспензию в нетоксичном приемлемом для парентерального введения разбавителе или растворителе, таком как раствор в 1,3-бутан-диоле, или получены в виде лиофилизированного порошка. Среди приемлемых носителей и растворителей, которые могут быть использованы, находятся вода, раствор Рингера и изотонический раствор хлорида натрия. Кроме того, стерильные жирные (нелетучие) масла можно условно использовать в качестве растворителя или суспендирующей среды. Для данной цели можно использовать любое мягкое жирное масло, включая синтетические моно- или диглицериды. Кроме того, при получении инъекционных препаратов аналогичным образом могут быть использованы жирные кислоты, такие как олеиновая кислота. Количество активного ингредиента, которое можно смешивать с материалом носителя для получения одноразовой дозированной формы, будет варьировать в зависимости от хозяина, которого лечат, и конкретного способа введения. Например, препарат с высвобождением в течение времени, предназначенный для перорального введения человеку, может включать приблизительно 1-1000 мг активного материала, смешанного с подходящим и удобным количеством материала носителя, которое может варьировать от приблизительно 5 до приблизительно 95% от общих композиций (мас./мас.). Можно приготовить фармацевтическую композицию для получения легко измеряемых количеств для введения. Например, водный раствор, предназначенный для внутривенного вливания, может включать от приблизительно 3 до 500 мкг активного ингредиента/мл раствора, чтобы можно было провести вливание подходящего объема со скоростью приблизительно 30 мл/ч. Препараты, подходящие для введения в глаз, включают глазные капли, в которых активный ингредиент растворяют или суспендируют в подходящем носителе, в особенности в водном растворителе для активного ингредиента. Предпочтительно, когда активный ингредиент находится в данных препаратах в концентрации 0,5-20%, преимущественно 0,5-10%, в частности приблизительно 1,5% мас./мас. Препараты, подходящие для местного применения в полости рта, включают лепешки, содержащие активный ингредиент в основе с вкусовой добавкой, обычно сахарозой и акацией или трагакантом; пастилки, включающие активный ингредиент в инертной основе, такой как желатин и глицерин или сахароза и акация, и полоскания для рта, включающие активный ингредиент в подходящем жидком носителе. Препараты для ректального применения могут быть представлены в виде суппозитория с подходящей основой, включающей, например, масло какао или салицилат. Препараты, подходящие для внутрилегочного или назального введения, имеют размер частиц, например, в интервале 0,1-500 мкм (включая размеры частиц в интервале от 0,1 до 500 мкм с таким приращением, как 0,5, 1, 30, 35 мкм и т.п.), которые вводят путем быстрой ингаляции через носовой проход или посредством ингаляции через рот так, чтобы они достигали альвеолярных мешочков. Подходящие препараты включают водные или масляные растворы активного ингредиента. Препараты, подходящие для аэрозольного введения или введения сухого порошка, могут быть получены согласно принятым способам и могут быть доставлены с другими терапевтическими агентами, такими как соединения, ранее используемые для лечения и профилактики состояний, ассоциированных с активностью ВИЧ. Препараты, подходящие для вагинального введения, могут быть представлены в виде пессариев,тампонов, кремов, гелей, паст, пен или препаратов в форме спреев, включающих, кроме активного ингредиента, такие носители, которые, как известно в области техники, являются подходящими. Препараты, подходящие для парентерального введения, включают водные и неводные стерильные инъекционные растворы, которые могут включать антиоксиданты, буферы, бактериостатики и растворенные вещества, которые делают препарат изотоническим относительно крови предусматриваемого пациента, а также водные и неводные стерильные суспензии, которые могут включать суспендирующие агенты и сгустители. Препараты находятся в однодозных или многодозных контейнерах, например запаянных ампулах и флаконах, и могут храниться в высушенном путем замораживания (лиофилизированном) состоянии, требуя только добавления стерильного жидкого носителя, например воды для инъекций, непосредственно перед использованием. Приготовленные для немедленного применения инъекционные растворы и суспензии получают из стерильных порошков, гранул и таблеток ранее описанного типа. Предпочтительными унифицированными дозированными препаратами являются содержащие суточную дозу или унифицированную суточную субдозу, как указано выше в данном контексте, или ее соответствующую фракцию активного ингредиента. Следует иметь в виду, что, кроме ингредиентов, особо упомянутых выше, препараты, соответствующие данному изобретению, могут включать другие агенты, принятые в данной области, имеющие отношение к типу рассматриваемого препарата, например те, которые подходят для перорального применения, могут включать вкусовые добавки. Изобретение далее представляет ветеринарные композиции, содержащие по меньшей мере один активный ингредиент, как определено выше, совместно со своим ветеринарным носителем. Ветеринарные носители представляют собой материалы, используемые с целью введения композиции, и могут быть твердыми, жидкими и газообразными материалами, которые в других отношениях являются инертными и приемлемыми для ветеринарии и совместимыми с активным ингредиентом. Данные ветеринарные композиции можно вводить перорально, парентерально или другим желательным путем. Соединения, соответствующие изобретению, могут быть также приготовлены, чтобы получить контролируемое высвобождение активного ингредиента с целью обеспечения менее частого дозирования или улучшения фармакокинетического профиля или профиля токсичности активного ингредиента. Соответственно, изобретение представляет также композиции, включающие одно или более соединений, соответствующих изобретению, приготовленных для замедленного или контролируемого высвобождения. Эффективная доза активного ингредиента зависит, по меньшей мере, от природы состояния, подлежащего лечению, токсичности, от того, используют ли соединение профилактически (в более низких дозах), способа доставки и фармацевтического препарата и будет определяться клиническим врачом при использовании принятых исследований повышения дозы. Можно ожидать, что она будет составлять от приблизительно 0,0001 до приблизительно 100 мг/кг массы тела в день, как правило, от приблизительно 0,01 до приблизительно 10 мг/кг массы тела в день. Более типично, когда она составляет от приблизительно 0,1 до приблизительно 5 мг/кг массы тела в день. Более типично от приблизительно 0,05 до приблизительно 0,5 мг/кг массы тела в день. Например, суточная исследуемая доза для взрослого человека массой тела приблизительно 70 кг будет составлять от 1 до 1000 мг, предпочтительно от 5 до 500 мг и может иметь форму однократной или множества дозы. Способы введения. Одно или более соединений, соответствующих изобретению (в данном контексте называемых активными ингредиентами), вводят любым способом, подходящим длясостояния, подлежащего лечению. Подходящие способы включают пероральный, ректальный, назальный, местный (включая защечный и подъязычный), вагинальный и парентеральный (включая подкожный, внутримышечный, внутривенный,внутрикожный, интратекальный и эпидуральный) и т.п. Следует иметь в виду, что предпочтительный способ может меняться, например, в зависимости от состояния реципиента. Преимущество соединений,соответствующих данному изобретению, состоит в том, что они биодоступны при пероральном применении и могут дозироваться при пероральном применении. Комбинированная терапия. Соединения, соответствующие изобретению, можно использовать в наборах с другими терапевтическими агентами для лечения и профилактики вышеуказанных инфекций или состояний. Примеры данных дополнительных терапевтических агентов включают агенты, которые эффективны для лечения или профилактики вирусных, паразитарных или бактериальных инфекций или подобных состояний либо для лечения опухолей или подобных состояний, в том числе 3'-азидо-3'-дезокситимидин (зидовудин, АЗТ),2'-дезокси-3'-тиацитидин (ЗТС), 2',3'-дидезокси-2',3'-дидегидроаденозин (D4A), 2',3'-дидезокси-2',3'дидегидротимидин (D4T), карбовир (карбоциклический 2',3'-дидезокси-2',3'-дидегидрогуанозин),3'-азидо-2',3'-дидезоксиуридин,5-фтортимидин,(Е)-5-(2-бромвинил)-2'-дезоксиуридин(FIAC),тетрагидроимидазо(4,5,1-jk)-(1,4)бензодиазепин-2(1 Н)-тион (TIBO), 2'-норциклический ГМФ, 6-метоксипуринарабинозид (ara-М),6-метоксипуринарабинозид-2'-O-валерат, цитозинарабинозид (ara-С), 2',3'-дидезоксинуклеозиды, такие как 2',3'-дидезоксицитидин (ddC), 2',3'-дидезоксиаденозин (ddA) и 2',3'-дидезоксиинозин (ddI), ациклические нуклеозиды, такие как ацикловир, пенцикловир, фамцикловир, ганцикловир НРМРС, РМЕА, PMEG,PMPA, PMPDAP, FPMPA, HPMPA, HPMPDAP, (2R,5R)-9-тетрагидро-5-(фосфонометокси)-2 фураниладенин, (2R,5R)-1-тетрагидро-5-(фосфонометокси)-2-фуранилтимин, другие антивирусные препараты, включая рибавирин (аденинарабинозид), 2-тио-6-азауридин, туберцидин, ауринтрикарбоновую кислоту, 3-деазанеопланоцин, неопланоцин, римантидин, адамантин и фоскарнет (фосфотоформиат тринатрия), антибактериальные агенты, включая бактерицидные фторхинолоны (ципрофлоксацин, пефлоксацин и т.п.), аминогликозидные бактерицидные антибиотики (стрептомицин, гентамицин, амикацин и т.п.), ингибиторы -лактамазы (цефалоспорины, пенициллины и т.п.), другие антибактериальные агенты,включая тетрациклин, изониазид, рифампин, цефоперазон, клейтромицин и азитромицин, антипаразитарные или противогрибковые агенты, включая пентамидин (1,5-бис-(4'-аминофенокси)пентан), 9-деазаинозин, сульфаметоксазол, сульфадиазин, квинапирамин, хинин, флюканазол, кетоконазол, итраконазол,амфотерицин В, 5-фторцитозин, клотримазол, гексадецилфосфохолин и нистатин, ингибиторы почечного выделения, такие как пробеницид, ингибиторы транспорта нуклеозидов, такие как дипиридамол, дилазеп и нитробензилтиоинозин, иммуномодуляторы, такие как FK506, циклоспорин А, тимозин -1, цитокины,включая ФНО (фактор некроза опухолей) и TGF (фактор роста тканей)-, интерфероны, включая ИФН-,ИФН- и ИФН-, интерлейкины, включая различные интерлейкины, макрофагальный/гранулоцитарный колониестимулирующие факторы, включая СМ-СББ, С-СББ, М-СББ, антагонисты цитокинов, включая антитела против ФНО, антитела против интерлейкина, растворимые интерлейкиновые рецепторы, ингибиторы протеинкиназы и т.п. Кроме того, терапевтические агенты, описанные в табл. 1 и 2, направленные на ВИЧ, могут быть использованы в наборах с соединениями, соответствующими настоящему изобретению. Например, табл. 1 раскрывает примеры терапевтических препаратов против ВИЧ/СПИДа и табл. 2 раскрывает примеры антивирусных препаратов против ВИЧ с соответствующими им номерами патентов США. Таблица 1 Примеры терапевтических препаратов против ВИЧ/СПИДа
МПК / Метки
МПК: C07F 9/38, A61K 31/662, A61P 31/18, A61K 47/48
Метки: включающие, композиция, фосфонатные, соединений, набор, фармацевтическая, лечения, ассоциированных, вич, ингибиторов, нарушений, аналоги, способ
Код ссылки
<a href="https://eas.patents.su/30-19419-fosfonatnye-analogi-soedinenijj-ingibitorov-vich-farmacevticheskaya-kompoziciya-i-nabor-ih-vklyuchayushhie-i-sposob-lecheniya-narushenijj-associirovannyh-s-vich.html" rel="bookmark" title="База патентов Евразийского Союза">Фосфонатные аналоги соединений ингибиторов вич, фармацевтическая композиция и набор, их включающие, и способ лечения нарушений, ассоциированных с вич</a>
Предыдущий патент: Нагревательное устройство для средства транспортировки углеводородсодержащей жидкости
Следующий патент: Пирролидиновые ингибиторы иап (ингибиторов апоптоза)
Случайный патент: Способ получения твердых лекарственных форм солифенацина и его фармацевтически приемлемых солей для перорального введения