Аналоги нуклеозида (варианты) и их применение, комбинация и способ лечения вирусных инфекций, фармацевтическая композиция
Формула / Реферат
1. цис-Нуклеозид формулы I
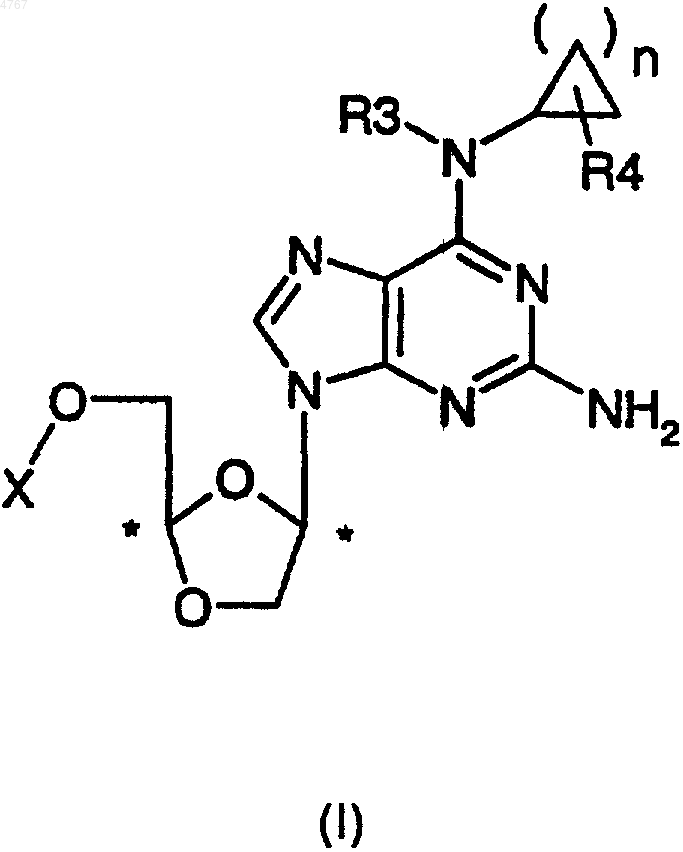
и его фармацевтически приемлемые соли, где
n равно 1 или 2,
R4 выбирают из следующих заместителей: H, COOH, CONH2, OH, SH, NH2, NO2, C1-6алкил, C2-6алкенил, C2-6алкинил, галоген, CORa, где Ra означает C1-6алкил, C2-6алкенил, C2-6алкинил или COORb, где Rb означает C1-6алкил, C2-6алкенил или C2-6алкинил;
R3 означает H или C1-6алкил, C2-6алкенил, C2-6алкинил;
X выбирают из H, монофосфата, дифосфата, трифосфата, карбонила, замещенного следующими группами: C1-6алкил, C2-6алкенил, C2-6алкинил, C6-10арил;
причем упомянутый нуклеозид присутствует в форме (-)-энантиомера, (+)-энантиомера и их смесей, включая рацемические смеси.
2. Нуклеозид по п.1, отличающийся тем, что он по меньшей мере на 95% представлен формой (-)-энантиомера.
3. Нуклеозид по п.1, отличающийся тем, что он по меньшей мере на 97% представлен формой (-)-энантиомера.
4. Нуклеозид по п.1, отличающийся тем, что он по меньшей мере на 99% представлен формой (-)-энантиомера.
5. Нуклеозид по п.1, отличающийся тем, что защитная группа для гидроксильной группы выбрана из ацетил-2-тиоэтилового эфира, пивалоилоксиметилового эфира или изопропилоксикарбонилоксиметилового эфира.
6. Нуклеозид по п.1, отличающийся тем, что X означает H.
7. Нуклеозид по п.1, отличающийся тем, что n равно 1.
8. Нуклеозид по п.7, отличающийся тем, что R3 означает H или метил или R4 означает H.
9. Нуклеозид по п.7, отличающийся тем, что R4 означает H, COOH, CONH2, C1-6алкил, C2-6алкенил, C2-6алкинил или COORb, где Rb означает C1-6алкил, C2-6алкенил, C2-6алкинил.
10. Нуклеозид по п.7, отличающийся тем, что R4 означает H, COOH или C1-6алкил.
11. Нуклеозид по п.7, отличающийся тем, что R4 означает метил или этил.
12. Нуклеозид по п.7, отличающийся тем, что R4 означает COOH.
13. Нуклеозид по п.7, отличающийся тем, что R3 и R4 означают H.
14. цис-2-Гидроксиметил-4-(2'-амино-6'-циклопропиламинопурин-9'-ил)-1,3-диоксолан и его фармацевтически приемлемые соли.
15. цис-2-Гидроксиметил-4-(2'-амино-6'-циклобутиламинопурин-9'-ил)-1,3-диоксолан и его фармацевтически приемлемые соли.
16. цис-2-Гидроксиметил-4-(2'-амино-6'-[1-карбоновая кислота-циклопропиламино]пурин-9'-ил)-1,3-диоксолан и его фармацевтически приемлемые соли.
17. (-)-(2R,4R)-2-Гидроксиметил-4-(2'-амино-6'-циклопропиламинопурин-9'-ил)-1,3-диоксолан, представленный в форме (-)-энантиомера по меньшей мере на 97%.
18. (+)-(2S,4S)-2-Гидроксиметил-4-(2'-амино-6'-циклопропиламинопурин-9'-ил)-1,3-диоксолан, представленный в форме (+)-энантиомера по меньшей мере на 97%.
19. (-)-(2R,4R)-2-Гидроксиметил-4-(2'-амино-6'-циклобутиламинопурин-9'-ил)-1,3-диоксолан, представленный в форме (-)-энантиомера по меньшей мере на 97%.
20. (+)-(2S,4S)-2-Гидроксиметил-4-(2'-амино-6'-циклобутиламинопурин-9'-ил)-1,3-диоксолан, представленный в форме (+)-энантиомера по меньшей мере на 97%.
21. (-)-(2R,4R)-2-Гидроксиметил-4-(2'-амино-6'-[1-карбоновая кислота-циклопропиламино]пурин-9'-ил)-1,3-диоксолан, представленный в форме (-)-энантиомера по меньшей мере на 97%.
22. (+)-(2S,4S)-2-Гидроксиметил-4-(2'-амино-6'-[1-карбоновая кислота-циклопропилламино]пурин-9'-ил)-1,3-диоксолан, представленный в форме (+)-энантиомера по меньшей мере на 97%.
23. Применение нуклеозида по любому из пп.1-22 в качестве лекарственного средства для медицинской терапии.
24. Применение по п.23 в качестве средства для лечения вирусных инфекций.
25. Применение по п.24 в качестве средства для лечения инфекции ВИЧ.
26. Применение по п.24 в качестве средства для лечения инфекции ВГВ.
27. Применение по п.23 в качестве активного компонента лекарственного средства для лечения вирусных инфекций.
28. Комбинация, используемая для лечения вирусных инфекций, отличающаяся тем, что она содержит по крайней мере одно соединение по любому из пп.1-21 или его фармацевтически приемлемые соли и по крайней мере один дополнительный терапевтический агент, выбранный из нуклеозидных аналогов, ненуклеозидных ингибиторов обратной транскриптазы или ингибиторов протеаз.
29. Комбинация по п.28, отличающаяся тем, что в качестве нуклеозидного аналога она содержит зидовудин, диданозин, зальцитабин, ставудин или ламивудин.
30. Комбинация по п.28, отличающаяся тем, что в качестве ненуклеозидного ингибитора обратной транскриптазы она содержит невирапин, делавирдин или эфавиренц.
31. Комбинация по п.28, отличающаяся тем, что в качестве ингибитора протеаз она содержит индинавир, нелфинавир, саквинавир или ритонавир.
32. Способ лечения вирусных инфекций, отличающийся тем, что вводят терапевтически эффективное количество соединения по любому из пп.1-22 субъекту, нуждающемуся в таком лечении.
33. Способ по п.32, отличающийся тем, что проводят лечение вирусной инфекции, представленной инфекцией вируса иммунодефицита человека.
34. Способ по п.32, отличающийся тем, что проводят лечение вирусной инфекции, представленной инфекцией вируса гепатита В.
35. Фармацевтическая композиция, отличающаяся тем, что она содержит по крайней мере одно соединение по любому из пп.1-22 и по крайней мере один фармацевтически приемлемый носитель или наполнитель.
Текст
1 Область техники, к которой относится изобретение Настоящее изобретение относится к новым аналогам пуриновых нуклеозидов, используемых в качестве противовирусных агентов. В частности, изобретение относится к пуриновым нуклеозидам с улучшенными фармакокинетическими свойствами. Уровень техники Каждый год в США происходит более 12 миллионов новых случаев венерических заболеваний (ВЗ). Из десяти зарегистрированных заболеваний в США пять относятся к ВЗ, включая хламидию, гонорею, сифилис, синдром приобретенного иммунодефицита (СПИД) и инфекцию вирусом гепатита В (ВГВ), из которых инфекции СПИД и ВГВ не поддаются лечению. В случае СПИД Всемирная организация здравоохранения (ВОЗ) предсказывает, что в 2000 г. во всем мире число людей, инфицированных вирусом иммунодефицита человека(ВИЧ), то есть вирусом, который вызывает СПИД, достигнет 40 млн человек. Инфицирование гепатитом поражает в 5 раз больше людей,чем вирусом ВИЧ. По опубликованным ВОЗ данным, 2 млрд человек, живущих в настоящее время, инфицированы ВГВ, причем из них 350 миллионов инфицированы хронически и, следовательно, входят в группу риска смертности от заболевания печени. Хотя коэффициент смертности от СПИД снижается благодаря новым терапевтическим средствам, СПИД остается второй главной причиной смертности взрослых в возрасте от 29 до 40 лет. В настоящее время стандартным способом лечения инфицированных ВИЧ людей является сочетание средств против ВИЧ. В настоящее время существует 11 лекарственных средств против ВИЧ, доступных по назначению врача. Указанные средства против ВИЧ разделяются на три категории: аналоги нуклеозидов,которые включают зидовудин, диданозин, зальцитабин, ставудин или ламивудин; ингибиторы протеаз, которые включают индинавир, нелфинавир, саквинавир и ритонавир; и ненуклеозидные ингибиторы обратной транскриптазы(ННИОТ), которые включают невирапин, делавирдин и эфавиранц. По сравнению с ВИЧ, в настоящее время существует лишь несколько лицензионных лекарственных средств для случаев хронического ВГВ, к которым относятся интерферон и ламивудин. Другие лекарственные средства в настоящее время находятся на стадии клинических испытаний, включая фамцикловир, лобукавир и адефовир. Однако многие исследования показали, что у большинства пациентов наблюдается рецидив после завершения лечения и развивается устойчивость к лекарственным средствам. Основной проблемой при лечении инфекций ВИЧ и ВГВ оказалось развитие устойчивости (резистентности). Обычно устойчивость 2 развивается, если используемые лекарственные средства не достаточно эффективны для полного прекращения размножения вируса. Если вирус может полностью воспроизводиться в присутствии лекарственных средств, то существует возможность возникновения изменений в его структуре, называемых мутациями, до тех пор,пока не будет найден один тип мутации, который может воспроизводиться несмотря на лекарственные средства. Как только мутация произошла, этот тип вируса растет необнаруженным и скоро становится основным штаммом вируса в данном организме. Лекарственное средство становится все менее эффективным по отношению к новому штамму. Существуют также возрастающие проблемы с перекрестной устойчивостью. Перекрестная устойчивость возникает, если мутации, которые приводят к устойчивости к одному лекарственному средству, вызывают также устойчивость к другому лекарственному средству. Некоторые исследования показали, что объединение двух лекарственных средств замедляет развитие устойчивости к одному или обоим лекарственным средствам по сравнению с использованием каждого лекарственного средства в отдельности. Другие исследования позволяют предположить, что объединение трех лекарственных средств даже еще в большей степени усиливает указанный эффект. В результате многие люди полагают,что лучшим способом предотвращения или, по крайней мере, замедления возникновения устойчивости является использование при лечении комбинаций из многих лекарственных средств. Однако при увеличении числа лекарственных средств увеличивается риск взаимодействия лекарственных веществ и токсичности. Одним из способов увеличения эффективности лекарственного средства является улучшение его фармакокинетических свойств, которые вносят вклад в его терапевтическую активность. Фармакокинетикой называют исследование факторов, которые определяют количество химических агентов в участках проявления их биологического действия в различные периоды времени после введения агента или лекарственного средства в биологическую систему. Фармакокинетика включает исследование абсорбции и распределения лекарственного средства("биотранслокализации"), исследование химических изменений, которые могут происходить в структуре лекарственного средства в организме ("биотрансформации") и исследование механизмов, по которым лекарственные средства сохраняются в организме и выводятся из него. При лечении хронических заболеваний биодоступность является наиболее важным фактором,так как она определяет степень абсорбции лекарственного средства и его попадания в кровоток или, в другом случае, степень доступности в участке организма, подлежащем лечению. Биодоступность напрямую связана со способностью 3 лекарственного средства растворяться в биологических жидкостях. Согласно опубликованным данным, (-)-D-2,6-диаминопуриндиоксолан (ДАПД) и (-)-D-1,3-диоксолангуанин (ДГ) являются высокоэффективными по отношению к ВИЧ-1 в различных клеточных системах, обладают минимальной перекрестной устойчивостью с ламивудином и низкой токсичностью. Однако эти соединения обладают низкими фармакокинетическими свойствами, которые следует усилить. Таким образом, существует необходимость в разработке соединений с улучшенной фармакокинетикой для использования при лечении пациентов, инфицированных ВИЧ и ВГВ. Сущность изобретения Одним объектом настоящего изобретения являются новые пуриновые цис-нуклеозиды,представленные формулой I и их фармацевтически приемлемые соли, гдеn равно 1 или 2,R4 выбирают из следующих заместителей: Н, СООН, СОNН 2, ОН, SH, NH2, NO2, С 1-6 алкил,С 2-6 алкенил, С 2-6 алкинил, галоген, CORa, где Ra означает С 1-6 алкил, С 2-6 алкенил, С 2-6 алкинил или где каждый Rc независимо выбирают из Н, С 1-6 алкила, С 2-6 алкенила, С 2-6 алкинила или защитной группы для гидроксильной группы; причем упомянутый нуклеозид присутствует в форме (-)-энантиомера, (+)-энантиомера и их смесей, включая рацемические смеси. Соединения по настоящему изобретению пригодны для лечения, прежде всего, в качестве противовирусных средств. Другим объектом изобретения является способ лечения вирусных инфекций у субъекта,который нуждается в таком лечении, причем способ включает введение субъекту терапевти 004767 4 чески эффективного количества соединения или композиции по настоящему изобретению. Другим объектом является фармацевтическая композиция, включающая в себя соединение по настоящему изобретению в комбинации с фармацевтически приемлемым носителем или наполнителем. Одним аспектом настоящего изобретения является разработка способа лечения вирусных инфекций у субъекта, который нуждается в таком лечении, причем способ включает введение субъекту комбинации, включающей в себя по крайней мере одно соединение формулы I и по крайней мере один дополнительный терапевтический агент, выбранный из аналогов нуклеозидов, ненуклеозидных ингибиторов обратной транскриптазы (ННИОТ) или ингибиторов протеаз. Другим аспектом изобретения является разработка фармацевтической композиции, содержащей по крайней мере одно соединение формулы I, по крайней мере один дополнительный терапевтический агент, выбранный из аналогов нуклеозидов, ненуклеозидных ингибиторов обратной транскриптазы (ННИОТ) или ингибиторов протеаз, и фармацевтически приемлемый носитель или наполнитель. Еще одним объектом настоящего изобретения является использование соединения формулы I для производства лекарственного средства для лечения вирусных инфекций. Перечень фигур чертежей На фигуре представлены результаты анализа токсичности соединения А (-) по отношению к митохондриальной ДНК. Сведения, подтверждающие возможность осуществления изобретения Согласно одному варианту воплощения изобретения соединения по настоящему изобретению включают те соединения, которые представлены в следующих вариантах воплощения изобретения, либо каждое соединение независимо, либо в их комбинации. В одном из вариантов воплощения Х означает Н. В другом варианте Х означает, где каждый Rс независимо выбирают из Н, С 1-6 алкила, С 2-6 алкенила, С 2-6 алкинила или защитной группы для гидроксильной группы, выбранной из S-ацилтиоэтилового эфира, ацилоксиметилового эфира или алкилметилкарбоната. В другом варианте Х означает, где каждый Rс независимо означает защитную группу для гидроксильной группы, выбранную из ацетил-2 тиоэтилового эфира, пивалоилоксиметилового эфира или изопропилоксикарбонилоксиметилового эфира. В другом варианте n равно 1. В другом варианте R3 означает Н или метил. В другом варианте R3 означает Н. 5 В другом варианте R4 выбирают из следующих заместителей: Н, СООН, CONH2, С 1-6 алкил, С 2-6 алкенил, С 2-6 алкинил или COORb, гдеRb означает С 1-6 алкил, С 2-6 алкенил или С 26 алкинил. В другом варианте R4 означает Н, СООН или С 1-6 алкил. В другом варианте R4 означает Н, СООН,метил или этил. В другом варианте R4 означает метил или этил. В другом варианте R4 означает СООН. В другом варианте R4 означает Н. В другом варианте R3 означает Н или метил, а R4 означает Н. В другом варианте R4 и R3 означают Н. В одном варианте соединения по настоящему изобретению представлены формулой Ia и их фармацевтически приемлемыми солями,где каждый из X, R3 и R4 определены выше. Специалистами в данной области будет оценено то, что соединения формулы I и Iа содержат по меньшей мере два хиральных центра,отмеченных звездочкойв общей формуле I иIа. Таким образом, соединения формулы I и Iа существуют в форме двух различных оптических изомеров (т.е. (+)- или (-)-энантиомеры или-L и -D). Все подобные энантиомеры и их смеси, включая рацемические смеси, включены в объем притязаний настоящего изобретения. Отдельный оптический изомер или энантиомер может быть получен методом, хорошо известным в данной области техники, таким как хиральная ВЭЖХ, ферментативное разделение или вспомогательное хиральное вещество, или может быть синтезирован стереоспецифичным способом. В соответствии с настоящим изобретением разработаны соединения, обладающие улучшенными фармакокинетическими свойствами. Согласно одному из вариантов воплощения настоящего изобретения разработаны соединения, обладающие улучшенной биодоступностью. Согласно другому варианту воплощения настоящего изобретения разработан способ лечения субъекта, инфицированного вирусной инфекцией и нуждающегося в таком лечении,причем способ включает введение субъекту терапевтически эффективного количества соединения формулы I или его фармацевтически приемлемой соли. 6 Согласно следующему варианту воплощения настоящего изобретения разработан способ лечения субъекта, инфицированного ретровирусной инфекцией и нуждающегося в таком лечении, причем способ включает введение субъекту терапевтически эффективного количества соединения формулы I или его фармацевтически приемлемой соли. Согласно другому варианту воплощения настоящего изобретения разработан способ лечения субъекта, инфицированного ВИЧ, включающий введение субъекту терапевтически эффективного количества соединения формулы I или его фармацевтически приемлемой соли. Согласно еще одному варианту воплощения настоящего изобретения разработан способ лечения субъекта, инфицированного ВГВ,включающий введение субъекту терапевтически эффективного количества соединения формулыI или его фармацевтически приемлемой соли. Соединения по настоящему изобретению включают соединение А: цис-2-гидроксиметил-4-(2'амино-6'-циклопропиламинопурин-9'-ил)-1,3 диоксолан В другом варианте воплощения настоящего изобретения соединения по настоящему изобретению включают соединение А (-): (-)-(2R,4R)-2-гидроксиметил-4-(2'-амино-6'-циклопропиламинопурин 9'-ил)-1,3-диоксолан В одном варианте воплощения настоящего изобретения соединение по настоящему изобретению получают в форме (+)-энантиомера, по меньшей мере 95% которого не содержат соответствующего (-)-энантиомера. В одном варианте воплощения настоящего изобретения соединение по настоящему изобретению получают в форме (+)-энантиомера, по меньшей мере 97% которого не содержат соответствующего (-)-энантиомера. В следующем варианте воплощения настоящего изобретения соединение по настоящему изобретению получают в форме (+)-энантиомера, по меньшей мере 99% которого не содержат соответствующего (-)-энантиомера. В другом варианте воплощения настоящего изобретения соединение по настоящему изобретению получают в форме (-)-энантиомера, по меньшей мере 95% которого не содержат соответствующего (+)-энантиомера. Еще в одном варианте воплощения настоящего изобретения соединение по настоящему изобретению получают в форме (-)-энантиомера, по меньшей мере 97% которого не содержат соответствующего (+)-энантиомера. В следующем варианте воплощения настоящего изобретения соединение по настоящему изобретению получают в форме (-)-энантиомера, по меньшей мере 99% которого не содержат соответствующего (+)-энантиомера. В одном варианте воплощения настоящего изобретения соединением по настоящему изобретению является соединение А. 8 В другом варианте воплощения настоящего изобретения соединением по настоящему изобретению является соединение А (-). Разработаны также фармацевтически приемлемые соли по настоящему изобретению. Термин "фармацевтически приемлемые соли" соединений общей формулы I и Iа означает соли, полученные из фармацевтически приемлемых неорганических и органических кислот и оснований. Примеры подходящих кислот включают соляную, бромисто-водородную, серную,азотную, перхлорную, фумаровую, малеиновую,фосфорную, гликолевую, молочную, салициловую, янтарную, толуол-п-сульфоновую, винную, уксусную, лимонную, метансульфоновую,муравьиную, бензойную, малоновую, нафталин 2-сульфоновую и бензолсульфоновую кислоты. Другие кислоты, такие как щавелевая кислота,не будучи фармацевтически приемлемыми, могут использоваться в качестве промежуточных соединений при получении соединений по настоящему изобретению и их фармацевтически приемлемых кислотно-аддитивных солей. Соли, полученные из соответствующих оснований, включают соли щелочных металлов(где R означает С 1-4 алкил). Ссылки на соединения по настоящему изобретению, использованные в данном описании, включают соединения общей формулы I иIа и их фармацевтически приемлемые соли. Если специально не отмечено, все технические и научные термины, использованные в данном описании, имеют те значения, которые приняты в данной области техники, к которой принадлежит настоящее изобретение. Все публикации, заявки на выдачу патентов, патенты и другие ссылки, упомянутые в данном описании,полностью включены в описание в виде ссылок. В случае конфликтной ситуации настоящее описание изобретения, включая определения,будет отрегулировано. Кроме того, все материалы, способы и примеры приведены только для иллюстрации и не ограничивают объем притязаний изобретения. Термин "алкил", использованный в данном описании, означает незамещенный или замещенный (следующими группами: галоген, нитро, CONH2, СООН, О-С 1-6 алкил, О-С 2-6aлкенил,О-С 2-6 алкинил, гидроксил, амино или COOQ,где Q означает С 1-6 алкил, С 2-6 алкенил, С 2-6 алкинил), неразветвленный, разветвленный или циклический углеводородный остаток (например,изопропил, этил, фторгексил или циклопропил). Термин алкил также означает алкилы, в которых один или более атомов водорода замещены галогеном, более предпочтительно фтором (например, СF3- или CF3CH2-). Термины "алкенил" и "алкинил" означают алкил, содержащий по крайней мере одну ненасыщенную группу (например, аллил). 9 Термин "защитная группа для гидроксильной группы" хорошо известен в области органической химии. Такие защитные группы описаны в книге Т. Greene, Protective Groups In OrganicSynthesis (Защитные группы в органическом синтезе), John WileySons, 1981. Примеры защитных групп для гидроксильных групп включают в себя без ограничения перечисленным ацетил-2-тиоэтиловый эфир, пивалоилоксиметиловый эфир и изопропилоксикарбонилоксиметиловый эфир. Если присутствует атом серы, то он может быть в различной степени окисления: S, SO илиSO2. Все указанные степени окисления атома серы включены в объем притязаний настоящего изобретения. Термин "галоген", использованный в данном описании, означает фтор, хлор, бром, йод,например фтор. Следует понимать, что количество соединения по настоящему изобретению, требуемое для лечения, будет изменяться не только в соответствии с определенным выбранным соединением, но также в соответствии со способом введения, природой патологического состояния,подлежащего лечению, возрастом и состоянием пациента, а также, в конечном итоге, будет зависеть от мнения практикующего врача или ветеринара. Однако, в основном, подходящая доза находится в диапазоне от приблизительно 0,1 до приблизительно 750 мг/кг массы тела пациента в сутки, предпочтительно в диапазоне от 0,5 до 60 мг/кг/сутки и наиболее предпочтительно в диапазоне от 1 до 20 мг/кг/сутки. Как обычно, необходимую дозу можно вводить в виде однократной дозы или разделенной на несколько доз, которые вводят через соответствующие интервалы, например две, три,четыре или более доз в сутки. Обычно соединение вводят в форме стандартной дозы, например, содержащей от 10 до 1500 мг, обычно от 20 до 1000 мг, более предпочтительно от 50 до 700 мг активного компонента в стандартной лекарственной форме. В идеальном случае активный компонент следует вводить таким образом, чтобы максимальная концентрация активного соединения в плазме достигала от приблизительно 1 до приблизительно 75 мкМ, предпочтительно от приблизительно 2 до 50 мкМ, более предпочтительно от приблизительно 3 до приблизительно 30 мкМ. Такие концентрации могут быть получены, например, с помощью внутривенной инъекции от 0,1 до 5%-ного раствора активного компонента, по выбору в физиологическом растворе, или с помощью перорального приема болюсов, содержащих от приблизительно 1 до приблизительно 500 мг активного компонента. Требуемый уровень в крови можно поддерживать с помощью капельницы - от приблизительно 0,01 до приблизительно 5,0 мг/кг/ч, с помощью дробного вливания, содержащего от при 004767 10 близительно 0,4 до приблизительно 15 мг/кг активного компонента. В то время как при использовании в терапии существует возможность вводить соединение по изобретению в виде неочищенного химического соединения, предпочтительным является присутствие активного компонента в составе фармацевтической композиции. В настоящем изобретении разработана фармацевтическая композиция, включающая соединение формулы I или Iа или их фармацевтически приемлемую соль, наряду с одним или несколькими фармацевтически приемлемыми носителями, и по выбору с другими терапевтическими и/или профилактическими компонентами. Носитель(и) должен быть "приемлемым", то есть совместимым с другими компонентами композиции и не оказывать отрицательного действия на реципиента. Фармацевтические композиции включают подходящие для орального, ректального, назального, местного (включая трансбуккальный и подъязычный), чрескожного, вагинального и парентерального (включая внутримышечный,подкожный и внутривенный) способов введения или композиции, подходящие для лечения ингаляционным способом или путем вдувания. В соответствующих случаях композиции традиционно могут быть представлены в виде отдельных стандартных доз и могут быть получены любым способом, хорошо известным в области фармакологии. Все способы включают стадию объединения активного компонента с жидкими носителями, или мелкоизмельченными твердыми носителями, или с обоими и затем,при необходимости, обработку продукта для получения требуемой композиции. Фармацевтические композиции, подходящие для перорального введения, могут быть представлены в виде стандартных форм, таких как капсулы, крахмальные капсулы или таблетки, каждая из которых содержит определенное количество активного компонента, в виде порошка или гранул, в виде раствора, суспензии или эмульсии. Активный компонент может быть также представлен в виде болюса, электуария и пасты. Таблетки и капсулы для перорального введения могут содержать обычные наполнители, такие как связующие агенты, наполнители, замасливатели, дезинтеграторы и смачивающие агенты. Таблетки могут иметь покрытия, полученные согласно методам, хорошо известным в данной области. Жидкие составы для перорального введения могут быть в форме, например, водной или масляной суспензий, растворов, эмульсий, сиропов или эликсиров или могут быть представлены в виде сухого продукта, который необходимо растворить в воде или другом растворителе перед использованием. Такие жидкие составы могут содержать обычные добавки, такие как суспендирующие агенты, эмульгаторы, неводные растворители(которые могут включать пищевые масла) или консерванты. Соединения по настоящему изобретению могут быть также получены в формах для парентерального введения (например, путем инъекции, например путем струйного вливания или путем непрерывного вливания) и могут быть представлены в виде унифицированной лекарственной формы в ампулах, предварительно наполненных шприцах, капельницах небольшого объема или контейнерах, содержащих множество доз с добавленным консервантом. Композиции могут быть использованы в виде таких форм, как суспензии, растворы или эмульсии в масляных или водных растворителях, и могут содержать вспомогательные агенты, такие как суспендирующие агенты, стабилизаторы и/или диспергирующие агенты. В другом случае активный компонент может быть в порошкообразной форме, полученной путем выделения стерильного твердого вещества в стерильных условиях или лиофилизацией из раствора для последующего растворения в подходящем растворителе, например в стерильной апирогенной воде перед использованием. Для местного введения на эпидермис соединения по настоящему изобретению могут быть получены в виде мазей, кремов или лосьонов или пластырей (повязок) для чрескожного введения. Такие пластыри для чрескожного введения могут содержать усилители проницаемости, такие как линалоол, карвакрол, тимол, цитраль, ментол и трет-анетол. Мази и кремы могут, например, быть на жидкой или масляной основе с добавлением подходящих загустителей и/или гелеобразующих агентов. Лосьоны могут содержать водную или масляную основу и, в основном, могут также содержать один или более эмульгаторов, стабилизаторов, диспергирующих агентов, суспендирующих агентов, загустителей или красителей. Композиции, подходящие для местного введения в полость рта, включают таблетки,включающие активный компонент на основе ароматизатора, обычно на основе сахарозы, аравийской камеди или трагаканта; пастилки,включающие активный компонент на инертной основе, такой как желатин и глицерин или сахароза и аравийская камедь; и жидкость для полоскания рта, включающую активный компонент в подходящем жидком носителе. Фармацевтические композиции, подходящие для ректального введения, в которых носителем является твердое вещество, наиболее предпочтительно представлены в виде суппозиториев со стандартной дозой. Подходящие носители включают масло какао и другие материалы, хорошо известные в данной области техники, и суппозитории могут быть получены обычным смешиванием активного компонента с размягченным или расплавленным носите 004767 12 лем(ями), с последующим охлаждением и формованием в пресс-форме. Композиции, подходящие для вагинального введения, могут быть представлены в виде вагинальных суппозиториев, тампонов, кремов,гелей, паст, мыл или спреев, содержащих кроме активного компонента носители, которые хорошо известны в данной области техники. Для интраназального введения соединения по настоящему изобретению могут быть использованы в виде жидкого спрея или диспергированного порошка или в форме капель. Капли могут содержать водную или неводную основу, а также один или более диспергирующих агентов, солюбилизаторов или суспендирующих агентов. Жидкие спреи обычно вводят из упаковок под давлением. Для введения путем ингаляций соединения по настоящему изобретению обычно вводят из порошковдувателя, распылителя или из упаковок под давлением или из других удобных стандартных упаковок для распыления аэрозолей. Упаковки под давлением могут включать подходящий газ-вытеснитель, такой как дихлордифторметан, трихлорфторметан, дихлортетрафторэтан, диоксид углерода или другой подходящий газ. В случае аэрозольной упаковки под давлением стандартную дозу можно дозировать с помощью специального клапана для введения определенного количества. В другом случае для введения путем ингаляции или вдувания соединения по настоящему изобретению могут быть в форме сухой порошкообразной композиции, например в порошкообразной смеси соединения и подходящей основы, такой как лактоза или крахмал. Порошокообразная композиция может быть представлена в виде капсул или картриджей или, например, в виде желатиновых или блистерных упаковок, из которых порошок может быть введен с помощью ингаляции или порошковдувания. При необходимости могут быть использованы описанные выше композиции, приспособленные для пролонгированного выделения активного компонента. Соединения по настоящему изобретению могут быть также использованы в комбинации с другими противовирусными агентами. В одном варианте воплощения настоящего изобретения комбинации по настоящему изобретению включают комбинации, которые представлены следующими вариантами воплощения изобретения, либо независимо, либо в сочетании. В одном варианте воплощения настоящего изобретения соединения по настоящему изобретению могут быть использованы вместе по крайней мере с одним другим противовирусным агентом, который выбирают из нуклеозидных аналогов, ННИОТ или ингибиторов протеаз. 13 В одном варианте воплощения настоящего изобретения нуклеозидным аналогом является аналог 1,3-оксатиолана. В другом варианте воплощения настоящего изобретения аналогом 1,3-оксатиолана является ламивудин, ковирацил или 2-гидроксиметил-4-(цитозин-1'-ил)-1,3-оксатиолан. В другом варианте воплощения настоящего изобретения аналогом 1,3-оксатиолана является 2-гидроксиметил-4-(цитозин-1'-ил)-1,3-оксатиолан. В следующем варианте воплощения настоящего изобретения аналогом 1,3-оксатиолана является 2R-гидроксиметил-4R-(цитозин-1'-ил)1,3-оксатиолан. В другом варианте воплощения настоящего изобретения аналогом 1,3-оксатиолана является 2S-гидроксиметил-4S-(цитозин-1'-ил)-1,3 оксатиолан. Еще в одном варианте воплощения настоящего изобретения соединения по настоящему изобретению могут быть использованы вместе по крайней мере с одним другим противовирусным агентом, который выбирают из следующего ряда: зидовудин, диданозин, зальцитабин, ставудин, ламивудин, невирапин, делавирдин, эфавиренц, индинавир, нелфинавир,саквинавир или ритонавир. В другом варианте воплощения настоящего изобретения соединения по настоящему изобретению могут быть использованы вместе по крайней мере с одним другим противовирусным агентом, который выбирают из ряда: невирапин,эфавиренц, зидовудин, ставудин или ламивудин. В одном варианте воплощения настоящего изобретения соединения по настоящему изобретению могут быть использованы вместе по крайней мере с одним другим противовирусным агентом, который выбирают из следующего ряда: эфавиренц, зидовудин, ставудин или ламивудин. В одном варианте воплощения настоящего изобретения соединения по настоящему изобретению могут быть использованы вместе по крайней мере с одним другим противовирусным агентом, который выбирают из эфавиренца, зидовудина или ламивудина. В одном варианте воплощения настоящего изобретения соединения по настоящему изобретению используют вместе с эфавиренцом, зидовудином или ламивудином. В одном варианте воплощения настоящего изобретения соединения по настоящему изобретению могут быть использованы вместе по крайней мере с одним другим противовирусным агентом, который выбирают из невирапина, зидовудина, ставудина или ламивудина. В одном варианте воплощения настоящего изобретения соединения по настоящему изобретению используют вместе с невирапином, зидовудином, ставудином или ламивудином. В другом варианте воплощения настоящего изобретения соединения по настоящему изо 004767 14 бретению могут быть использованы вместе по крайней мере с одним другим противовирусным агентом, который выбирают из зидовудина, ставудина или ламивудина. В одном варианте воплощения настоящего изобретения соединения по настоящему изобретению используют вместе с зидовудином, ставудином или ламивудином. В одном варианте воплощения настоящего изобретения соединения по настоящему изобретению могут быть использованы вместе с зидовудином. В другом варианте воплощения настоящего изобретения соединения по настоящему изобретению могут быть использованы вместе со ставудином. В одном варианте воплощения настоящего изобретения соединения по настоящему изобретению могут быть использованы вместе с ламивудином. В следующем варианте воплощения настоящего изобретения соединения по настоящему изобретению могут быть использованы вместе с невирапином. Еще в одном варианте воплощения настоящего изобретения соединения по настоящему изобретению могут быть использованы вместе с эфавиренцом. Комбинации, описанные выше, традиционно могут быть представлены для использования в виде фармацевтических составов, включающих в себя комбинации, описанные выше,наряду с фармацевтически приемлемым носителем и, следовательно, представляют собой еще один аспект изобретения. Индивидуальные компоненты таких комбинаций могут вводиться либо последовательно, либо одновременно, в виде отдельных или объединенных фармацевтических составов. В случае, если соединения I и Iа или их фармацевтически приемлемые соли используют в комбинации со вторым терапевтическим агентом, активным против того же вируса, доза каждого соединения может быть одинаковой или отличаться от дозы соединения, используемого отдельно. Подходящие дозы могут быть легко определены специалистами в данной области. Соотношение соединение по настоящему изобретению/второй терапевтический агент может быть легко определено специалистами,компетентными в данной области. Например,соотношение соединение по настоящему изобретению/второй терапевтический агент может составлять от приблизительно 1:1 до приблизительно 1:50. В другом варианте воплощения настоящего изобретения соотношение соединение по настоящему изобретению/второй терапевтический агент может составлять от приблизительно 1:1 до приблизительно 1:30. В следующем варианте воплощения настоящего изобретения соотношение соединение по настоящему изобретению/второй терапевтический агент 15 может составлять от приблизительно 1:1 до приблизительно 1:20. В следующем варианте воплощения настоящего изобретения соотношение соединение по настоящему изобретению/второй терапевтический агент может составлять от приблизительно 1:1 до приблизительно 1:15. В следующем варианте воплощения настоящего изобретения соотношение соединение по настоящему изобретению/второй терапевтический агент может составлять от приблизительно 1:1 до приблизительно 1:10. В следующем варианте воплощения настоящего изобретения соотношение соединение по настоящему изобретению/второй терапевтический агент может составлять от приблизительно 1:1 до приблизительно 1:5. В следующем варианте воплощения настоящего изобретения соотношение соединение по настоящему изобретению/ второй терапевтический агент может составлять от приблизительно 1:1 до приблизительно 1:3. Если добавляют дополнительный терапевтический агент, соотношения могут быть подобраны соответствующим образом. Соединения по настоящему изобретению могут быть получены следующим образом. Следующие примеры представлены для иллюстрации различных вариантов воплощения настоящего изобретения, и их не следует рассматривать как ограничивающие объем притязаний настоящего изобретения.f) NН 3, МеОН. Конечное соединение может быть получено в соответствии со следующей схемой. Стадия а. 2-Бензоилоксиацетальдегид 1 взаимодействует с метиловым эфиром (R)-(+)-2,2-диметил-1,3-диоксолан-4-карбоновой кислоты 2 в присутствии п-толуолсульфокислоты (п-ТСК) в условиях переацетализации, при этом получают 2-бензоилоксиметил-1,3-диоксолан-4-карбоксиметиловый эфир 3 в виде смеси цис- и трансизомеров в соотношении 3:1, обогащенной цисизомером. 16 Стадия б. Карбоксиметиловый эфир 3 подвергают селективному гидролизу с использованием гидроксида лития, при этом получают соответствующие производные кислоты 4 а и 4b. Смесь разделяют экспресс-хроматографией и каждый изомер в дальнейшем используют отдельно. Стадия в. Затем карбоксильную функциональную группу соединения 4 а превращают в замещаемую ацетоксигруппу путем обработки тетраацетатом свинца. Стадия г.(2R)-2-Бензоилоксиметил-1,3-диоксолан-4 ацетокси 4 а конденсируют с силилированным 2 амино-6-хлорпурином с использованием в качестве активатора триметилсилилтрифторметилсульфоната (ТМСТФ), при этом получают смесь цис- и транс-изомеров нуклеозидных аналогов 6 а и 6b в соотношении 1,2:1, обогащенную цисизомером. Затем смесь разделяют экспрессхроматографией и каждый изомер в дальнейшем используют отдельно. Стадия д.(-)-(2R,4R)-2-Бензоилоксиметил-4-(2'-амино 6'-хлорпурин-9'-ил)-1,3-диоксолан 6 а обрабатывают циклопропиламином в этаноле, при этом получают соответствующий (-)-(2R,4R)-2-бензоилоксиметил-4-(2'-амино-6'-циклопропиламинопурин-9'-ил)-1,3-диоксолан 7 с хорошим выходом. Стадия е. Удаление бензоильной защитной группы достигают обработкой (-)-(2R,4R)-2-бензоилоксиметил-4-(2'-амино-6'-циклопропиламинопурин 9'-ил)-1,3-диоксолана 7 раствором аммиака в метаноле, при этом получают требуемый продукт (-)-(2R,4R)-2-гидроксиметил-4-(2'-амино-6'циклопропиламинопурин-9'-ил)-1,3-диоксолан А с хорошим выходом. Пример 1. Метиловый эфир 2-(R,S)-бензоилоксиметил-1,3-диоксолан-4-(R)-карбоновой кислоты. К раствору метил-2,3-O-изопропилиден-Dглицерата (производства фирмы Fluka, номер по каталогу 59449), (9,76 г, 60,9 ммоль, 1 экв.) и бензоилоксиацетальдегида (10 г, 60,9 ммоль, 1 экв.) в толуоле (20 мл) при 80 С добавляют ртолуолсульфокислоту (460 мг, 2,4 ммоль, 4 мол.%). Реакционную колбу выдерживают в вакууме в течение 1 ч и в течение этого периода времени собирают дистиллят (80-85 С). Остаток охлаждают до комнатной температуры и очищают колоночной хроматографией на силикагеле с использованием в качестве элюента смеси гексан/этилацетат, при этом получают 13,2 г (81%) требуемого соединения в виде смеси цис- и транс-изомеров в соотношении 3:1. Цис-изомер: К раствору метилового эфира 2-(R,S)-бензоилоксиметил-1,3-диоксолан-4-(R)-карбоновой кислоты (411 г, 1,54 ммоль, 1 экв., смесь цис- и транс-изомеров 2:1) в смеси ТГФ и воды 1:1 в течение 30 мин порциями добавляют гидроксид лития (64,8 г, 1,54 моль, 1 экв.), при этом температуру в реакционной колбе поддерживают ниже 30 С. Через 90 мин ТГФ удаляют в вакууме и водный раствор подкисляют до рН 2,5-3,2 путем добавления по каплям 30 мас.%-ного раствора серной кислоты. Полученный раствор экстрагируют дихлорметаном (4 х 400 мл). Объединенную органическую фазу промывают солевым раствором, сушат над сульфатом натрия и концентрируют, при этом получают 380 г масла темного цвета. Изомеры разделяют колоночной хроматографии на силикагеле, с использованием 2%-ной уксусной кислоты в дихлорметане,при этом получают 220 г цис-изомера (56,5%) и 116 г транс-изомера (30%). Каждый изомер используют отдельно на следующей стадии. Цис-изомер: К раствору (2R,4R)-2-бензоилоксиметил 1,3-диоксолан-4-карбоновой кислоты (130 г,0,515 моль, 1 экв.) и пиридина (60 мл, 0,741 моль,1,44 экв.) в ацетонитриле при 4C в течение 20 мин добавляют тетраацетат свинца (по данным 18 анализа, 95%, 300 г, 0,678 моль, 1,25 экв.). Реакционную смесь перемешивают в течение 18 ч при комнатной температуре. Неорганические вещества удаляют фильтрованием, фильтрат выливают в насыщенный раствор бикарбоната натрия (2 л), затем добавляют твердый бикарбонат натрия (рН=7-8). Органическую фазу отделяют и водную фазу экстрагируют этилацетатом(3 х 400 мл). Объединенную органическую фазу концентрируют и очищают колоночной хроматографией на силикагеле с использованием в качестве элюента смеси гексан/этилацетат, при этом получают 93,5 г (68%) требуемого соединения в виде смеси цис- и транс-изомеров в соотношении 2:1. Смесь используют на следующей стадии. Цис/транс-изомеры: 1 2-Амино-6-хлорпурин (4,15 г, 1,3 экв.) в 50 мл гексаметилдисилазана (ГМДС), содержащего 100 мг сульфата аммония, нагревают с обратным холодильником в течение 3 ч, после чего прозрачный раствор упаривают досуха в вакууме. Остаток растворяют в 100 мл безводного 1,2-дихлорэтана.(2R)-2-Бензоилоксиметил-4 ацетокси-1,3-диоксолан (5 г) сушат путем совместного упаривания с бензолом дважды (2 х 30 мл) и растворяют в 100 мл безводного 1,2 дихлорэтана. Затем раствор переносят в реакционную колбу, содержащую раствор силилированного 2-амино-6-хлорпурина. Смесь помещают на предварительно нагретую до 60 С масляную баню на 15 мин, затем добавляют триметилсилилтрифлат (ТМСТФ, 3,8 мл, 1,1 экв.). Смесь нагревают с обратным холодильником в атмосфере азота в течение 3 ч, после чего раствор становится коричневым. По данным ТСХ(гексан/ЕtOАс, 7:3 для сахарида и гексан/ЕtOАс,1:4 для продукта), реакция завершается с исчезновением сахарида и с появлением двух хорошо разрешимых пятен цис-и транс-продуктов. Реакционную смесь охлаждают до комнатной температуры, выливают в насыщенный раствор бикарбоната натрия (100 мл) и перемешивают в течение 10 мин. Органический слой собирают и водный слой экстрагируют дважды хлористым метиленом (2 х 50 мл). Объединенный органический раствор промывают водой, солевым раствором и сушат над MgSO4 обычным способом,растворитель упаривают досуха, при этом получают пенообразный продукт (7 г). Данные НЯМР для неочищенного продукта свидетельст 19 вуют о том, что происходит прямая реакция с образованием цис- и транс-продуктов в соотношении 1,2:1 с обогащением по цис-изомеру. Неочищенный продукт очищают на силикагеле с использованием в качестве элюента градиента концентрации смеси гексан/этилацетат, 7:3, 1:1 и 2:3, при этом получают 2,5 г транс-изомера(менее полярного, -аномера) в виде пены, который кристаллизуется из этилового спирта, 3 г цис-изомера (более полярного, -аномера) в виде пены, которая кристаллизуется из этилового спирта, и 0,3 г смеси цис- и транспродуктов,обогащенной цис-изомером, в виде пены, с общим выходом 82%. Транс-изомер: Раствор (-)-(2R,4R)-2-бензоилоксиметил-4(2'-амино-6'-циклопропиламинопурин-9'-ил)-1,3 диоксолана (480 мг) в 30 мл насыщенного раствора аммиака в метаноле перемешивают при комнатной температуре в течение 18 ч. Смесь упаривают досуха в вакууме. Остаток растворяют в 20 мл воды, дважды промывают 10 мл хлористым метиленом и высушивают лиофильно, при этом получают 283 мг твердого вещества белого цвета с выходом 80%.(600 мг) в этаноле (30 мл) добавляют циклопропиламин (2 мл, 18 экв.) Смесь слабо нагревают с обратным холодильником (80-85 С) в течение 18 ч и охлаждают до комнатной температуры. Растворитель упаривают досуха в вакууме. Остаток растворяют в 100 мл хлористого метилена,промывают насыщенным раствором NаНСО 3,водой, солевым раствором и сушат над МgSO4. Растворитель удаляют в вакууме и остаток очищают на силикагеле с использованием в качестве элюента смеси ЕtOАс/МеОН, при этом получают требуемый продукт в виде пены с выходом 80% (506 мг).(250 мг) в этаноле (25 мл) добавляют циклобутиламин (0,17 мл, 3 экв.) Смесь слабо нагревают с обратным холодильником (80-85 С) в течение 18 ч и охлаждают до комнатной температуры. Растворитель упаривают досуха в вакууме. Остаток растворяют в 100 мл хлористого метилена,промывают насыщенным раствором NаНСО 3,водой, солевым раствором и сушат над МgSО 4. Растворитель удаляют в вакууме и остаток очищают на силикагеле с использованием в качестве элюента смеси ЕtOАс/МеОН, 95:5, при этом получают требуемый продукт в виде пены с выходом 84% (230 мг). Раствор (-)-(2R,4R)-2-бензоилоксиметил-4(2'-амино-6'-циклобутиламинопурин-9'-ил)-1,3 диоксолана (214 мг) в 20 мл насыщенного раствора аммиака в метаноле перемешивают при комнатной температуре в течение 18 ч. Смесь упаривают досуха в вакууме. Остаток растворяют в 20 мл воды, дважды промывают 10 мл эфира и упаривают досуха совместным упариванием с этанолом, при этом получают 154 мг чистого продукта в виде пены с выходом 96%.(210 мг) в этаноле (30 мл) добавляют 1-амино-1 циклопропанкарбоновую кислоту (113 мг, 2 экв.) и триэтиламин (0,2 мл, 2,5 экв.). Смесь слабо нагревают с обратным холодильником (80-85 С) в течение 72 ч и охлаждают до комнатной температуры. Растворитель упаривают досуха в вакууме. Остаток растворяют в растворе аммиака в метаноле (20 мл) и перемешивают в течение ночи. Растворитель удаляют в вакууме, и остаток очищают на силикагеле с использованием градиента концентрации смеси CH2Cl2/MeOH от 95:5 до 9:1 для удаления побочного продукта реакции, и, наконец, элюируют требуемый продукт смесью CH2Cl2/MeOH 4:1, содержащей 0,5% 22 уксусной кислоты, при этом получают 80 мг чистого продукта (выход 42,5%).H-ЯМР (ДМСОd-6)(часть/млн): 1,05 (b,2H, CH2 циклопропила), 1,45 (b, 2H, CH2 циклопропила), 3,58 (b, 2H, СН 2-ОН), 4,17 (dd, 1H, C5H), 4,41 (dd, 1H, C5-Н), 5,12 (t, 1H, С 2-Н), 5,15 (b,1H, ОН), 5,82 (b, 1H, NH), 6,19 (dd, 1H, С 4-Н),7,71 (b, H, NH), 7,86 (s, 1H, C8'-8). УФ-спектр (СН 3 ОН) макс.: 283 и 264 нм. Пример 10. Противовирусная активность против ВИЧ. Определение противовирусной активности. Активность соединения А (-) против ВИЧ-1 оценивают с использованием ВИЧ-1IIIB на ряде типов клеток, как описано ранее (Gu и соавт.,Novel mutation in the human immunodeficiency virustype 1 reverse transcriptase gene that encodes crossresistance to 2',3'-dideoxyinosine and 2',3'dideoxycytidine (Новая мутация гена обратной транскриптазы ВИЧ-1, которая кодирует перекрестную устойчивость к 2',3'-дидезоксиинозину и 2',3'-дидезоксицитидину), J. Virol., (1992) 66:12-19;IKKK обратной транскриптазы, которая кодирует перекрестную устойчивость ВИЧ-1 к 2',3'дидезоксицитидину и 2',3'-дидезокситиацитидину), Antimicrob. Agents Chemother.,(1994) 38:275-281; Gu и соавт., Mechanism of actionhuman immunodeficiency virus type 1 variants (Механизм действия и активность in vitro аналогов 1',3'-диоксоланилпуринового нуклеозида против вариантов чувствительных и устойчивых к лекарственным средствам ВИЧ-1), Antimicrobial Agentshuman immunodeficiency virus type 1 (Сравнение мононуклеарных клеток из пуповинной и периферийной крови в качестве мишеней для выделения вируса и исследования чувствительности лекарственных средств, включая ВИЧ-1), J. Clin.Microbiol., (1994) 32:2000-2002). Клетки инкубируют с вирусом при множественности заражения(MOI) 0,005 в случае Т клеток и 0,5 в случае моноцитарных клеток в течение 3 ч. Несвязанный вирус удаляют путем промывки клеток с последующим пересевом клеток на 96-луночном план 23 шете. Инфицированные клетки культивируют в присутствии серийных разведений концентрации тестируемого соединения в течение 5-7 суток. Противовирусную эффективность против ВИЧ-1 оценивают путем определения активности RT или уровня р 24 для ВИЧ-1 в супернатантах клеточной культуры. Все определения выполняют, дважды повторяя каждое определение. В каждом эксперименте в качестве контроля используют зидовудин и/или ламивудин. Сравнение соединения А (-) с разрешенными к применению агентами против ВИЧ-1. Величина ЕС 50 для соединения А (-) против ВИЧ-1IIIB на клетках МТ-2 составляет 0,083 мкМ,что равно уровню активности против ВИЧ-1 ламивудина, ставудина, зальцитабина и абакавира, но ниже активности зидовудина (табл. 1). Таблица 1 Сравнение активности против ВИЧ-1 соединения А (-) с разрешенными к применению агентами против ретровирусов Активность соединения А (-) против ВИЧ 1 на различных клетках. Активность соединения А (-) против ВИЧ 1 определяют с использованием различных типов клеток, включая линии клеток периферических моноцитов человека (PBMCs), Т клеток(МТ-2 и МТ-4) и моноцитарных клеток (U937). Соединение А (-) характеризуется субмикромолярными величинами EC50 против ВИЧ-1IIIB на различных исследованных типах клеток (табл. 2). Таблица 2 Эффективность соединения А (-) против ВИЧ-1 на различных типах клеток Числа в скобках означают число определений. 24 Кроме того, определяют активность соединения А (-) против ретровирусов с использованием различных штаммов ВИЧ-1. Результаты,представленные в табл. 3, свидетельствуют о том, что соединение А (-) проявляет активность против не индуцирующего синцитий (ВИЧ 19881), дуального трофического (ВИЧ-1macBAL) и моноцитрофического (ВИЧ-1WRM8488) штаммов. Таблица 3 Противовирусная активность соединения А (-) против различных типов штаммов ВИЧ-1(определено по уровню антигена р 24) Пример 11. Оценка токсичности. Клеточную токсичность соединений оценивают на различных клетках с использованием включения [3H]тимидина. Различные клетки,включая Molt-4, НТ 1080, DU-145, HepG-2 иHSF, вносят в лунки с концентрацией 1-2 х 103 клеток в лунке 96-луночного планшета. После инкубирования в течение 24 ч в культуральную среду добавляют 10-кратные серийные разбавления соединений (от 10-4 до 10-10 М) и клетки снова инкубируют в течение 72 ч. [3H]Тимидин добавляют в течение последних 18 ч инкубирования. После инкубирования с [3H]тимидином клетки промывают 1 раз буферным раствором PBS, обрабатывают трипсином, если клетки слипаются,и затем ресуспендируют в воде (гипотонический лизис клеток). Экстракт клеток непосредственно вносят в прибор для сбора клеток Tomtec Harvester 96. С помощью указанного прибора экстрагированную ДНК адсорбируют на фильтры, промывают и определяют число импульсов включенного [3 Н]тимидина. 50%-ную цитотоксическую концентрацию (CC50) определяют путем сравнения числа радиоактивных импульсов в мин для образцов в присутствии соединений и числа импульсов в контрольных образцах. Клеточную токсичность соединений определяют также с использованием проявления реагентом WST-1 для оченки пролиферации клеток МТ-2, Н 9, Jurkat, U937 и CBMCs. Исследуемые клеточные линии культивируют в средеRPMI в 96-луночных планшетах с плотностью 5 х 104 клеток в лунке, в то время как клеткиCBMCs наносят с концентрацией 0,5 х 106 клеток в лунке. В нулевой день в лунки добавляют 10 кратные серийные разведения соединения (10-410-7 М). На четвертый день клетки пересевают путем замены половины среды, содержащей соответственно разбавленное соединение. Клеточную активность определяют на седьмой день н/о - не определеноЭффект прироста веса тела при внутрибрюшинном введении у мышей (CDI, взрослые особи,самцы) в дозе 50 мг/кг/день в течение 5 дней. Пример 12. Предварительные фармакокинетические исследования. Биодоступность соединений определяют у взрослых самцов крыс, получивших внутривенную дозу через хвостовую вену (5 мг/кг) и пероральную дозу (20 мг/кг). Образцы плазмы собирают через 2, 5, 15, 30, 60, 90, 120 и 240 мин после внутривенного введения и через 5, 15, 30, 60, 90,120, 240 и 360 мин после перорального введения. Методики эксперимента Подготовка плазмы. Образцы крови (1 мл) как в случае внутривенного, так и в случае перорального введения отбирают из хвостов крыс в вакуумированный контейнер, содержащий ЭДТУ (3 мл). Образцы плазмы получают путем центрифугирования при 2000 х g в течение 15 мин при 4 С. Анализ ВЭЖХ. Условия анализа. Система ВЭЖХ: две системы с насосомWaters 616 и две системы Alliance 2690 с приставкой PDA 996. Колонка: Phenomenex Luna C18 (2), 5 мкм,250 х 4,6 мм. Градиент: 0-35% растворителя А в течение 20 мин, растворитель А содержит 0,01% ТФУ в ацетонитриле, и растворитель В содержит 0,01% ТФУ в воде Millipore (фильтр 0,25 мкм). Скорость потока: 1,0 мл/мин, УФ: 200-350 нм. Твердофазная экстракция. Образцы плазмы (разбавленные до 1 мл водой) наносят на сорбент Abselut Nexus ( 12103100) и отсасывают в низком вакууме приблизительно 16,931 кН/м 2 (приблизительно 5" ртутного столба). К сорбенту добавляют 1 мл деионизированной воды и отсасывают в вакууме. Экстракционную колонку высушивают в высоком вакууме 33,863 кН/м 2 (10" ртутного столба). В колонку с сорбентом Abselut Nexus добавляют 1 мл метанола и элюент собирают при скорости 1-2 мл/мин. Элюент упаривают досуха на приборе SpeedVac и образцы снова растворяют в 120 мкл воды; для нанесения используют 100 мкл. Результаты представлены в табл. 5. Пример 14. Устойчивость соединения А (-) в качестве лекарственного средства. Рекомбинантные варианты ВИЧ-1 получают путем введения определенных мутаций в HXB2-D с помощью сайт-направленного мутагенеза по описанной методике (Gu и соавт., J. Virol.,(1992) 66:12-19; Gu и соавт., Antimicrob. AgentsChemother., (1994) 38:275-281). Биомассу вируса получают путем трансфекции клеток МТ-4 конструкциями инфекционной вирусной ДНК. Противовирусную активность соединения А (-) определяют, как описано в примере 10. Соединение А (-) обладает несколько сниженной активностью против вариантов ВИЧ-1, содержащих мутации K65R и/или М 184V в обратной транскриптазе, но сохраняет чувствительность к другим вариантам, которые устойчивы к зидовудину, не нуклеозидным ингибиторам и ингибиторам протеаз (табл. 6). Таблица 6 Эффективность соединения А (-) к рекомбинантным вариантам ВИЧ-1, устойчивым к лекарственным средствам (определено по активности RT) 1. EC50 для невирапина составляет 10.М 27 2. ЕС 50 для саквинавира составляет 0,028.М; EC50wt НХВ 2-D для саквинавира составляет 0,0015.М. Пример 15. Эффективность соединения А(-) против клинических изолятов ВИЧ-1. Клинические штаммы выделяют из клетокPBMCs субъектов, инфицированных ВИЧ-1, путем совместного культивирования с PBMCs из нормальных доноров. Для определения генотипа RT клинических изолятов ВИЧ-1 провирусную ДНК экстрагируют из Т-клеток или PBMCs, инфицированных CD4+, и методом ПЦР амплифицируют полные кодирующие участки RT, как описано ранее (Gu и соавт., J. Virol., (1992) 66:12-19). Продукт ПЦР очищают и затем напрямую секвенируют с использованием праймера (5'-CCAAAAGTTAAACAATGGC-3'), который расположен в 5'-фрагменте кодирующего участка RT (нуклеотид 26032621 в координатах HXB2-D). Противовирусную активность определяют, как описано в примере 10. Таблица 7 Активность соединения А (-) против клинических изолятов ВИЧ-1 (определено по активности RT)b. Средние величины ЕС 50. с. Диапазоны величин ЕС 50 изолятов в одной и той же группе. Таблица 8 Активность соединения А (-) против клинических изолятов, устойчивых к лекарственным средствам,в клетках PBMCs (определено по уровню р 24) 28 Пример 16. Эффекты комбинации лекарственных средств. Эффекты комбинации соединения А (-) с противовирусными агентами против ВИЧ-1 определяют в клетках МТ-2 или PBMCs с использованием ВИЧ-1IIIB. Комбинации осуществляли с использованием концентраций лекарственных средств, определенных по схеме шахматной конфигурации. Противовирусную активность определяли путем измерения активности RT в супернатантах культур. Данные анализируют по методу, описанному Chou и Talalay (Chou and Talalay,Quantitative analysis of dose effect relationships:inhibitors (Количественный анализ действия соотношений доз: действие объединения многих лекарственных средств или ингибиторов ферментов), Adv. Enzyme Regul., (1984) 22:27-55) иthree-dimentional analysis of antiviral drug combinations (Стратегия разработки и трехмерного анализа комбинаций противовирусных лекарственных средств), Antimicrob. Agents Chemother.,(1993) 37:540-545). Индексы комбинации (CI) соединения А (-) с другими агентами против ВИЧ-1 рассчитывают с использованием программного обеспечения CalcuSyn (фирмы Biosoft,Cambridge, UK). Теоретически величина CI, равная 1, означает аддитивный эффект, CI1 указывает на антагонизм, а CI1 указывает на синергизм. Для расчета объема синергизма или антагонизма комбинации лекарственных средств используют программное обеспечение MacSynergy II. Таблица 9 Эффект комбинации соединения А (-) и зидовудина в клетках МТ-2 Таблица 10 Эффект комбинации соединения А (-) и AZT 29 Таблица 11 Эффект комбинации соединения А (-) и ламивудина в клетках МТ-2 Таблица 12 Эффект комбинации соединения А (-) и ставудина (d4T) в клетках МТ-2 Таблица 13 Эффект комбинации соединения А (-) и невирапина в клетках МТ-2 Пример 17. Анализ цитотоксичности. Клеточную токсичность определяют методом включения [3H]тимидина (de Muys и соавт.,Anti-human immunodeficiency virus type 1(Оценка противовурусной активности против ВИЧ-1, метаболизма и фармакокинетических свойств 2'-дезокси-3'-окса-4'-тиоцитидина),Аntimicrob. Agents Chemother., (1999) 43:18351844) и с помощью проявления реагентом WST1. В экспериментах по включению 30 при концентрации 4 х 104 клеток в лунке. После предварительного инкубирования в течение 24 ч добавляют тестируемые соединения (от 10-4 М до 10-10 М) и клетки снова инкубируют в течение 72 ч. [3H]Тимидин добавляют в течение последних 18 ч инкубирования. Затем клетки промывают 1 раз буферным раствором PBS, обрабатывают трипсином, если клетки являются поверхностно-зависимыми, и затем ресуспендируют в воде (гипотонический лизис клеток). Экстракт клеток непосредственно вносят в прибор для сбора клеток Tomtec Harvester 96. 50%ную цитотоксическую концентрацию (СС 50) определяют путем сравнения числа радиоактивных импульсов в мин для образцов, тестируемых в качестве лекарственных средств, и числа импульсов в контрольных (необработанных) клетках. В экспериментах с проявлением реагентомWST-1 клеточные линии культивируют в средеRPMI в 96-луночных планшетах с плотностью 5 х 104 клеток в лунке. Клетки CBMCs наносят с концентрацией 0,5 х 106 клеток в лунке. В нулевой день добавляют соединения (10-4-10-7 М). Клеточную активность определяют на седьмой день с использованием реагента WST-1 (производства фирмы Boehringer Mannheim) по методике, представленной фирмой-производителем. Соединение А (-) обладает значительно меньшей цитотоксичностью по сравнению с зидовудином и зальцитабином на различных типах клеток, причем цитотоксичность определяют по включению [3H]тимидина и с проявлением реагентом WST-1 (табл. 14). Таблица 14 Цитотоксичность соединения А (-) Пример 18. Анализ токсичности по отношению к митохондриальной ДНК. Токсичность соединения А (-) по отношению к митохондриальной ДНК определяют на клетках HepG2. Клетки культивируют в присутствии соединения в течение 28 суток. Клетки пересевают 1 раз в неделю. Однако культуральную среду, содержащую соответствующую концентрацию соединения, заменяют 2 раза в неделю. В качестве контроля используют зальцитабин. Токсичность определяют по соотношению 31 содержания митохондриальной ДНК и ядерной ДНК (рибосомальная ДНК 28s), которое измеряют методом саузерн-гибридизации (de Muys и соавт., Antimicrob. Agents Chemother., (1999) 43:1835-1844). Соединение А (-) не проявляет значительной токсичности по отношению к митохондриальной ДНК при концентрации вплоть до 100 мкМ, то есть при самой высокой из исследованных концентраций (см. фигуру). Пример 19. Фармакокинетическое исследование соединений по изобретению. Соединение А (-), ДФПД и ДГ вводят в виде однократной дозы либо внутривенно в шейную вену в дозе 10 мг/кг, либо перорально в дозе 20, 125, 500, 1000 или 2000 мг/кг. Перед пероральным введением все крысы голодают в течение 12 ч. В качестве носителей как для внутривенного, так и для перорального введения используют 0,1% карбоксиметилцеллюлозу и 0,1% Твин 80 в дистиллированной воде,подкисленные 1 н. HCl до рН 3,15. В случае всех пероральных доз у крыс отбирают образцы крови через промежутки времени, указанные на представленной ниже схеме. У всех 10 крыс для каждого введения образцы крови отбирают через семь временных периодов (2, 5, 15, 30, 60,120 и 240 мин) в случае внутривенного введения в шейную вену и в случае перорального введения в дозе 20 мг/кг через периоды 5-360 мин, а при пероральном введении в дозе 125-2000 мг/кг образцы крови отбирают в двух дополнительных точках времени через 480 и 1440 мин. В результате через каждый временной период отбирают по четыре пробы, за исключением 1440 мин, когда образцы крови отбирают через шейную вену у всех крыс перед бустированием. Схема отбора образцов крови у крыс,получивших оральную дозу Плазму получают приблизительно из 1 мл крови, отобранной через каждый период времени у каждой крысы. 32 Методики эксперимента Подготовка плазмы. Образцы крови (1 мл) как в случае внутривенного, так и в случае перорального введения отбирают из хвостов крыс в вакуумированный контейнер, содержащий ЭДТУ (3 мл). Образцы плазмы получают путем центрифугирования при 2000 х g в течение 15 мин при 4 С. Анализ ВЭЖХ. Условия анализа. Система ВЭЖХ: две системы с насосомWaters 616 и две системы Alliance 2690 с приставкой PDA 996. Колонка: Phenomenex Luna C18 (2), 5 мкм,250 х 4,6 мм. Градиент: 0-35% растворителя А в течение 20 мин, растворитель А содержит 0,01% ТФУ в ацетонитриле, и растворитель В содержит 0,01% ТФУ в воде Millipore (фильтр 0,25 мкм). Скорость потока: 1,0 мл/мин, УФ: 200-350 нм. Твердофазная экстракция. Образцы плазмы (разбавленные до 1 мл водой) наносят на сорбент Abselut Nexus (12103100) и отсасывают в низком вакууме приблизительно 16,931 кН/м 2 (приблизительно 5" ртутного столба). К сорбенту добавляют 1 мл деионизированной воды и отсасывают в вакууме. Экстракционную колонку высушивают в высоком вакууме 33,863 кН/м 2 (10" ртутного столба) в течение 1 мин. В колонку с сорбентомAbselut Nexus добавляют 1 мл метанола и элюент собирают при скорости 1-2 мл/мин. Элюент упаривают досуха на приборе SpeedVac и образцы снова растворяют в 120 мкл воды; для нанесения используют 100 мкл. Результаты представлены в табл. 15 и 16. Таблица 15 Фармакокинетические параметры соединения А (-) после внутривенного введения (10 мг/кг) или перорального введения (20 мг/кг) крысам 33 Таблица 16 Фармакокинетические параметры ДАПД и ДГ после внутривенного введения или перорального введения ДАПД самцам и самкам крыс Ниже представлен полный список публикаций, использованных в описании настоящего изобретения. 1. De Muys J.-M., H. Gourdeau, N. NguyenBa, D.T. Taylor, P.S. Ahmed, T. Mansour, C. Locas,N. Richard, M.A. Wainberg и R.F. Rando. 1999.evaluation of 2'-deoxy-3'-oxa-4'-thiocytidine (Оценка противовурусной активности против ВИЧ-1,метаболизма и фармакокинетических свойств 2'дезокси-3'-окса-4'-тиоцитидина), Antimicrob. Agentsgene that encodes cross-resistance to 2',3'dideoxyinosine and 2',3'-dideoxycytidine (Новая мутация гена обратной транскриптазы ВИЧ-1,которая кодирует перекрестную устойчивость к 2',3'-дидезоксиинозину и 2',3'-дидезоксицитидину), J. Virol., 66:12-19. 3. Gu Z., Q. Gao, H. Fang, H. Salomon, M.A.resistance to 2',3'-dideoxycytidine and 2',3'dideoxy-3'-thiacytidine (Идентификация мутации в кодоне 65 мотива IKKK обратной транскриптазы, которая кодирует перекрестную устойчивость ВИЧ-1 к 2',3'-дидезоксицитидину и 2',3'дидезокситиацитидину), Antimicrob. Agents 34 диоксоланилпуринового нуклеозида против вариантов чувствительных и устойчивых к лекарственным средствам ВИЧ-1), Antimicrobialeffects of multiple drugs or enzyme inhibitors (Количественный анализ действия соотношений доз: действие объединения многих лекарственных средств или ингибиторов ферментов), Adv.analysis of antiviral drug combinations (Стратегия разработки и трехмерного анализа комбинаций противовирусных лекарственных средств), Antimicrob. Agents Chemother., 37:540-545. 7. Rando R., J. Ojwang, A. Elbaggari, G.R.type 1 (Сравнение мононуклеарных клеток из пуповинной и периферийной крови в качестве мишеней для выделения вируса и исследования чувствительности лекарственных средств, включая ВИЧ-1), J. Clin. Microbiol., 32:2000-2002. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. цис-Нуклеозид формулы I и его фармацевтически приемлемые соли, гдеn равно 1 или 2,R4 выбирают из следующих заместителей: Н, СООН, CONH2, ОН, SH, NH2, NO2, С 1-6 алкил,С 2-6 алкенил, С 2-6 алкинил, галоген, CORa, где Ra означает С 1-6 алкил, С 2-6 алкенил, С 2-6 алкинил или СООRb, где Rb означает С 1-6 алкил, С 2-6aлкенил или С 2-6 алкинил;R3 означает Н или С 1-6 алкил, С 2-6 алкенил,С 2-6 алкинил; Х выбирают из Н, монофосфата, дифосфата, трифосфата, карбонила, замещенного сле 35 дующими группами: С 1-6 алкил, С 2-6 алкенил, С 2-6 алкинил, С 6-10 арил; причем упомянутый нуклеозид присутствует в форме (-)-энантиомера, (+)-энантиомера и их смесей, включая рацемические смеси. 2. Нуклеозид по п.1, отличающийся тем,что он по меньшей мере на 95% представлен формой (-)-энантиомера. 3. Нуклеозид по п.1, отличающийся тем,что он по меньшей мере на 97% представлен формой (-)-энантиомера. 4. Нуклеозид по п.1, отличающийся тем,что он по меньшей мере на 99% представлен формой (-)-энантиомера. 5. Нуклеозид по п.1, отличающийся тем,что защитная группа для гидроксильной группы выбрана из ацетил-2-тиоэтилового эфира, пивалоилоксиметилового эфира или изопропилоксикарбонилоксиметилового эфира. 6. Нуклеозид по п.1, отличающийся тем,что Х означает Н. 7. Нуклеозид по п.1, отличающийся тем,что n равно 1. 8. Нуклеозид по п.7, отличающийся тем,что R3 означает Н или метил или R4 означает Н. 9. Нуклеозид по п.7, отличающийся тем,что R4 означает Н, СООН, СОNН 2, С 1-6 алкил, С 2-6aлкенил, С 2-6aлкинил или COORb, где Rb означает С 1-6 алкил, С 2-6aлкенил, С 2-6 алкинил. 10. Нуклеозид по п.7, отличающийся тем,что R4 означает Н, СООН или С 1-6 алкил. 11. Нуклеозид по п.7, отличающийся тем,что R4 означает метил или этил. 12. Нуклеозид по п.7, отличающийся тем,что R4 означает СООН. 13. Нуклеозид по п.7, отличающийся тем,что R3 и R4 означают Н. 14. цис-2-Гидроксиметил-4-(2'-амино-6'-циклопропиламинопурин-9'-ил)-1,3-диоксолан и его фармацевтически приемлемые соли. 15. цис-2-Гидроксиметил-4-(2'-амино-6'-циклобутиламинопурин-9'-ил)-1,3-диоксолан и его фармацевтически приемлемые соли. 16. цис-2-Гидроксиметил-4-(2'-амино-6'-[1 карбоновая кислота-циклопропиламино]пурин 9'-ил)-1,3-диоксолан и его фармацевтически приемлемые соли. 17. (-)-(2R,4R)-2-Гидроксиметил-4-(2'-амино 6'-циклопропиламинопурин-9'-ил)-1,3-диоксолан,представленный в форме (-)-энантиомера по меньшей мере на 97%. 18. (+)-(2S,4S)-2-Гидроксиметил-4-(2'-амино 6'-циклопропиламинопурин-9'-ил)-1,3-диоксолан,представленный в форме (+)-энантиомера по меньшей мере на 97%. 19. (-)-(2R,4R)-2-Гидроксиметил-4-(2'-амино 6'-циклобутиламинопурин-9'-ил)-1,3-диоксолан,представленный в форме (-)-энантиомера по меньшей мере на 97%. 20. (+)-(2S,4S)-2-Гидроксиметил-4-(2'-амино 6'-циклобутиламинопурин-9'-ил)-1,3-диоксолан, 004767 36 представленный в форме (+)-энантиомера по меньшей мере на 97%. 21. (-)-(2R,4R)-2-Гидроксиметил-4-(2'-амино-6'-[1-карбоновая кислота-циклопропиламино] пурин-9'-ил)-1,3-диоксолан, представленный в форме (-)-энантиомера по меньшей мере на 97%. 22. (+)-(2S,4S)-2-Гидроксиметил-4-(2'-амино-6'-[1-карбоновая кислота-циклопропиламино] пурин-9'-ил)-1,3-диоксолан, представленный в форме (+)-энантиомера по меньшей мере на 97%. 23. Применение нуклеозида по любому из пп.1-22 в качестве лекарственного средства для медицинской терапии. 24. Применение по п.23 в качестве средства для лечения вирусных инфекций. 25. Применение по п.24 в качестве средства для лечения инфекции ВИЧ. 26. Применение по п.24 в качестве средства для лечения инфекции ВГВ. 27. Применение по п.23 в качестве активного компонента лекарственного средства для лечения вирусных инфекций. 28. Комбинация, используемая для лечения вирусных инфекций, отличающаяся тем, что она содержит по крайней мере одно соединение по любому из пп.1-21 или его фармацевтически приемлемые соли и по крайней мере один дополнительный терапевтический агент, выбранный из нуклеозидных аналогов, ненуклеозидных ингибиторов обратной транскриптазы или ингибиторов протеаз. 29. Комбинация по п.28, отличающаяся тем, что в качестве нуклеозидного аналога она содержит зидовудин, диданозин, зальцитабин,ставудин или ламивудин. 30. Комбинация по п.28, отличающаяся тем, что в качестве ненуклеозидного ингибитора обратной транскриптазы она содержит невирапин, делавирдин или эфавиренц. 31. Комбинация по п.28, отличающаяся тем, что в качестве ингибитора протеаз она содержит индинавир, нелфинавир, саквинавир или ритонавир. 32. Способ лечения вирусных инфекций,отличающийся тем, что вводят терапевтически эффективное количество соединения по любому из пп.1-22 субъекту, нуждающемуся в таком лечении. 33. Способ по п.32, отличающийся тем, что проводят лечение вирусной инфекции, представленной инфекцией вируса иммунодефицита человека. 34. Способ по п.32, отличающийся тем, что проводят лечение вирусной инфекции, представленной инфекцией вируса гепатита В. 35. Фармацевтическая композиция, отличающаяся тем, что она содержит по крайней мере одно соединение по любому из пп.1-22 и по крайней мере один фармацевтически приемлемый носитель или наполнитель.
МПК / Метки
МПК: A61K 31/52, C07D 473/16, A61P 31/12
Метки: вирусных, фармацевтическая, лечения, способ, применение, варианты, композиция, комбинация, инфекций, нуклеозида, аналоги
Код ссылки
<a href="https://eas.patents.su/20-4767-analogi-nukleozida-varianty-i-ih-primenenie-kombinaciya-i-sposob-lecheniya-virusnyh-infekcijj-farmacevticheskaya-kompoziciya.html" rel="bookmark" title="База патентов Евразийского Союза">Аналоги нуклеозида (варианты) и их применение, комбинация и способ лечения вирусных инфекций, фармацевтическая композиция</a>
Предыдущий патент: Модуляция функции возбуждаемых тканей за счет периферического введения эритропоэтина
Следующий патент: Фармацевтические композиции, содержащие олигосахариды, и их получение
Случайный патент: Замок с многоточечным запиранием












