Активаторы глюкокиназы
Номер патента: 19104
Опубликовано: 30.01.2014
Авторы: Чикарелли Марк Джозеф, Уоллес Эли М., Тёрнер Тимоти М., Хинклин Рональд Джей, Гунавардана Индрани В., Эйчер Томас Дэниэл, Фишер Джон П., Фелл Джей Брэдфорд, Бойд Стивен Армен, Сингх Эджей, Кондроски Кевин Рональд
Формула / Реферат
1. Соединение общей формулы (I)

или его фармацевтически приемлемая соль, где
L представляет собой О;
D2 представляет собой N;
R2 представляет собой 5-6-членную гетероарильную группу, имеющую 1-3 атомов азота и необязательно замещенную с помощью от одной до трех групп, независимо выбранных из C1-C6-алкила, Cl, CF3 и (C1-C6-алкила)ОН;
R3 представляет собой SR6 или OR6;
R6 представляет собой hetAr4, (C1-C3-алкокси)(C1-C6-алкил), фенил или циклопропил(C1-C6-алкил);
hetAr4 представляет собой 5-6-членное гетероарильное кольцо, имеющее 1-3 атомов азота и необязательно замещенное с помощью от одной до трех групп, независимо выбранных из C1-C6-алкила;
R13 представляет собой 1,2-дигидрокси(C2-C6-алкил) или метокси(дигидрокси(C3-C6-алкил)).
2. Соединение по п.1, имеющее формулу (Ic)
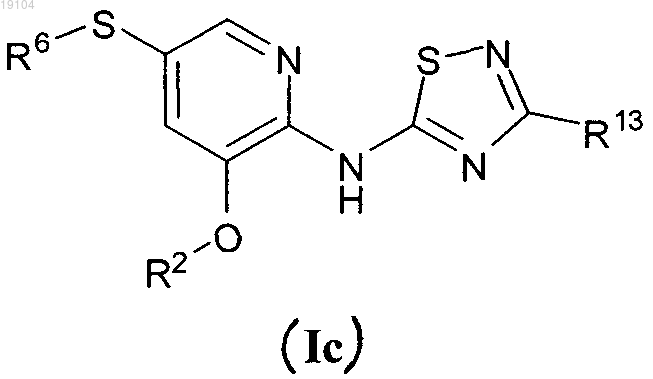
или его фармацевтически приемлемая соль, где
R13 представляет собой 1,2-дигидрокси(C2-C6-алкил) или метокси(дигидрокси(C3-C6-алкил));
R2 представляет собой пиридильное или пиразолильное кольцо, каждое из которых необязательно замещено от одной до трех групп, независимо выбранных из C1-C6-алкила;
R6 представляет собой (C1-C3-алкокси)(C1-C6-алкил), циклопропил(C1-C6-алкил) или пиридил, необязательно замещенный с помощью C1-C6-алкила.
3. Соединение по п.1, имеющее формулу (Id)
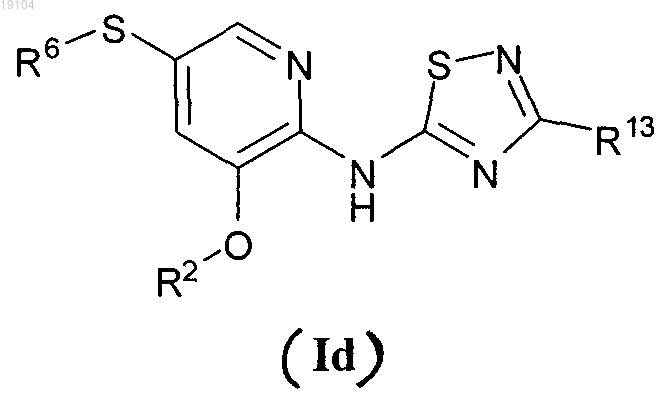
или его фармацевтически приемлемая соль, где
R13 представляет собой 1,2-дигидрокси(C2-C6-алкил) или метокси(1,2-дигидрокси(C3-C6-алкил));
R2 представляет собой пирид-3-ил, пиразол-4-ил или пиразол-5-ил, каждый из которых необязательно замещен от одной до трех групп, независимо выбранных из C1-C6-алкила;
R6 представляет собой метокси(C2-C3-алкил), циклопропилметил или пиридил-2-ил, необязательно замещенный с помощью C1-C6-алкила.
4. Соединение по п.2 или 3, в котором R13 выбран из
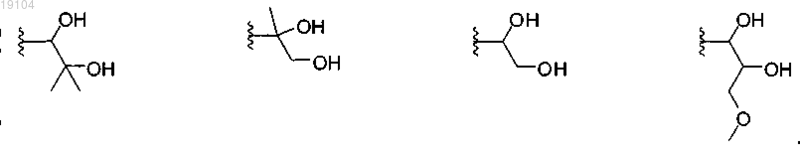
5. Соединение по п.1, выбранное из группы, состоящей из
(S)-1-(5-(3-(2-метилпиридин-3-илокси)-5-(пиридин-2-илтио)пиридин-2-иламин)-1,2,4-тиадиазол-3-ил)этан-1,2-диола;
(1S,2S)-1-(5-(3-(2-этилпиридин-3-илокси)-5-(пиридин-2-илтио)пиридин-2-иламино)-1,2,4-тиадиазол-3-ил)-3-метоксипропан-1,2-диола;
(S)-2-метил-1-(5-(5-(пиридин-2-илтио)-3-(1,3,5-триметил-1Н-пиразол-4-илокси)пиридин-2-иламино)-1,2,4-тиадиазол-3-ил)пропан-1,2-диола
и их фармацевтически приемлемых солей.
6. Соединение по п.1, выбранное из
(S)-1-(5-(3-(2,6-диметилпиридин-3-илокси)-5-(пиридин-2-илтио)пиридин-2-иламино)-1,2,4-тиадиазол-3-ил)этан-1,2-диола;
(S)-1-(5-(3-(2-этилпиридин-3-илокси)-5-(пиридин-2-илтио)пиридин-2-иламино)-1,2,4-тиадиазол-3-ил)этан-1,2-диола;
(S)-1-(5-(5-(3-метилпиридин-2-илтио)-3-(2-метилпиридин-3-илокси)пиридин-2-иламино)-1,2,4-тиадиазол-3-ил)этан-1,2-диола;
(S)-1-(5-(3-(2,4-диметилпиридин-3-илокси)-5-(пиридин-2-илтио)пиридин-2-иламино)-1,2,4-тиадиазол-3-ил)этан-1,2-диола;
(S)-2-метил-1-(5-(3-(2-метилпиридин-3-илокси)-5-(пиридин-2-илтио)пиридин-2-иламино)-1,2,4-тиадиазол-3-ил)пропан-1,2-диола;
(S)-1-(5-(5-(пиридин-2-илтио)-3-(1,3,5-триметил-1H-пиразол-4-илокси)пиридин-2-иламино)-1,2,4-тиадиазол-3-ил)этан-1,2-диола;
(R)-1-(5-(3-(2-метилпиридин-3-илокси)-5-(пиридин-2-илтио)пиридин-2-иламино)-1,2,4-тиадиазол-3-ил)этан-1,2-диола;
(S)-2-(5-(3-(2-метилпиридин-3-илокси)-5-(пиридин-2-илтио)пиридин-2-иламино)-1,2,4-тиадиазол-3-ил)пропан-1,2-диола;
(R)-2-(5-(3-(2-метилпиридин-3-илокси)-5-(пиридин-2-илтио)пиридин-2-иламино)-1,2,4-тиадиазол-3-ил)пропан-1,2-диола
и их фармацевтически приемлемых солей.
7. Соединение по п.1, выбранное из
(S)-1-(5-(5-(циклопропилметилтио)-3-(2-метилпиридин-3-илокси)пиридин-2-иламино)-1,2,4-тиадиазол-3-ил)этан-1,2-диола;
(S)-1-(5-(5-(3-метоксипропилтио)-3-(2-метилпиридин-3-илокси)пиридин-2-иламино)-1,2,4-тиадиазол-3-ил)этан-1,2-диола;
(S)-1-(5-(3-(1-этил-1Н-пиразол-5-илокси)-5-(пиридин-2-илтио)пиридин-2-иламино)-1,2,4-тиадиазол-3-ил)этан-1,2-диола;
(S)-1-(5-(3-(1-этил-1Н-пиразол-5-илокси)-5-(пиридин-2-илтио)пиридин-2-иламино)-1,2,4-тиадиазол-3-ил)-2-метилпропан-1,2-диола;
(S)-1-(5-(5-(2-метоксиэтилтио)-3-(2-метилпиридин-3-илокси)пиридин-2-иламино)-1,2,4-тиадиазол-3-ил)этан-1,2-диола;
(S)-1-(5-(5-(2-метоксиэтилтио)-3-(1,3,5-триметил-1Н-пиразол-4-илокси)пиридин-2-иламино)-1,2,4-тиадиазол-3-ил)этан-1,2-диола.
8. Фармацевтическая композиция, содержащая соединение формул (I), (Ic) или (Id) по любому из пп.1-5 или его фармацевтически приемлемую соль и фармацевтически приемлемый разбавитель или носитель.
9. Способ лечения заболеваний или расстройств, которые могут быть пролечены посредством активации глюкокиназы, включающий введение млекопитающему терапевтически эффективного количества соединения формул (I), (Ic) или (Id) по любому из пп.1-5 или его фармацевтически приемлемой соли.
10. Применение соединения формул (I), (Ic) или (Id) по любому из пп.1-5 или его фармацевтически приемлемой соли для получения лекарственного препарата для лечения заболеваний или расстройств, которые могут быть пролечены посредством активации глюкокиназы.
11. Применение по п.10, при котором заболевание или расстройство представляет собой диабет.
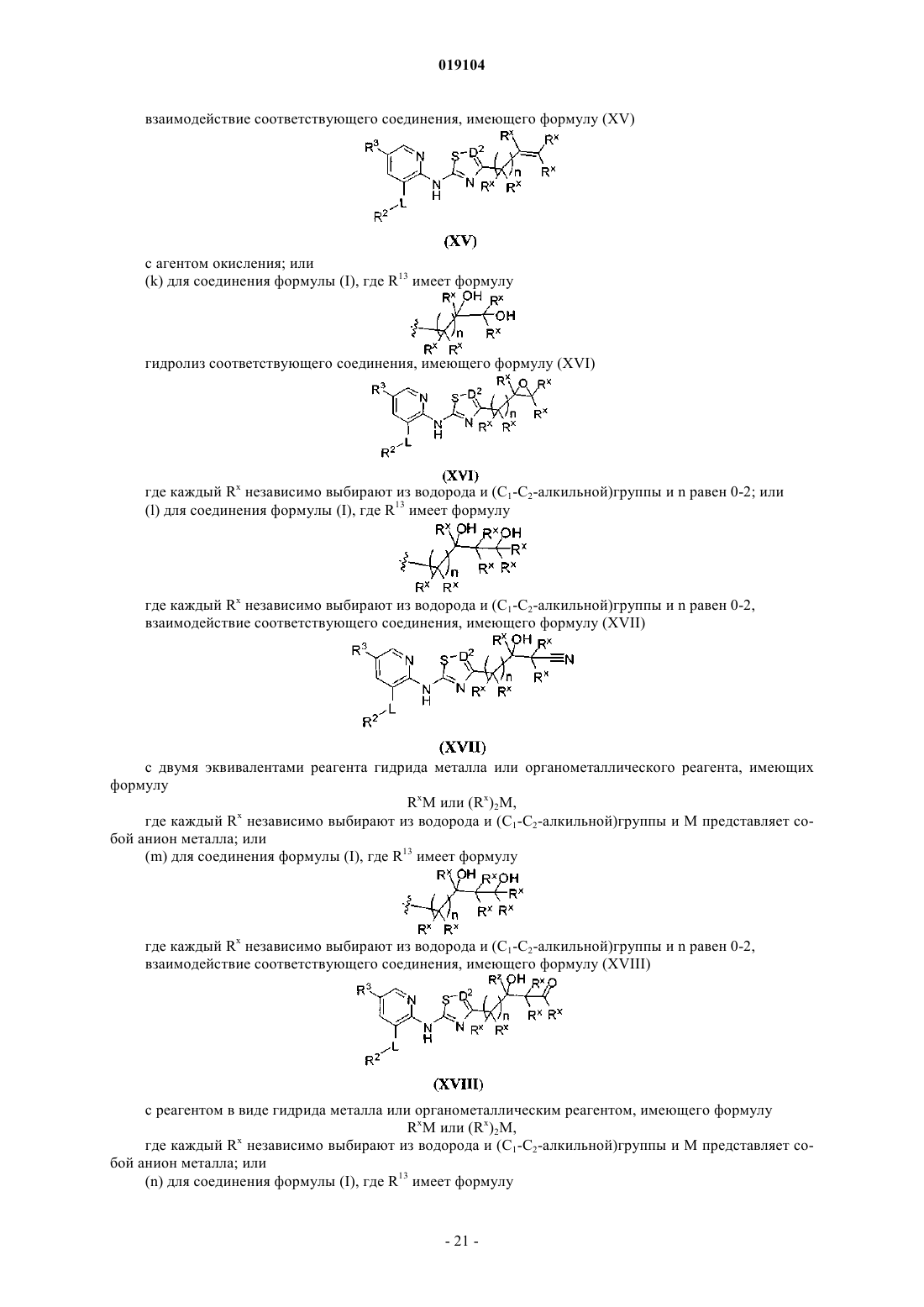
12. Способ получения соединения по п.1 или его фармацевтически приемлемой соли, включающий
взаимодействие соединения формулы (II)

где R2, R3 и L такие, как определено в п.1,
с соединением формулы (III)
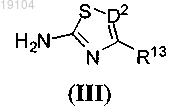
где R13 и D2 такие, как определено в п.1,
в присутствии основного катализатора или металлического катализатора.
13. Способ получения соединения по п.1 или его фармацевтически приемлемой соли, включающий
взаимодействие соединения формулы (IV)
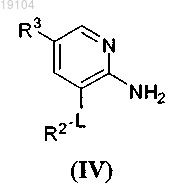
где R2, R3 и L такие, как определено в п.1,
с соединением формулы (V)
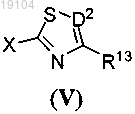
где R13 и D2 такие, как определено в п.1;
X представляет собой уходящий атом или группу в присутствии основного катализатора или металлического катализатора.
14. Способ получения соединения по п.1 или его фармацевтически приемлемой соли, где D2 представляет собой N, включающий взаимодействие соединения формулы (VII)
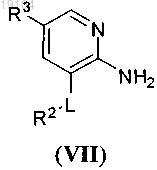
где R2, R3 и L такие, как определено в п.1,
с соединением, имеющим формулу (VIII)
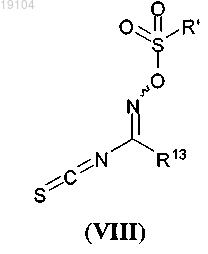
где R' представляет собой C1-C6-алкил, фенил или нафтил, необязательно замещенный с помощью C1-C6-алкила;
R13 такой, как определен в п.1, в присутствии основания.
15. Соединение формулы
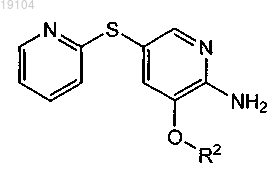
где R2 такой, как определен в п.1.
16. Соединение формулы
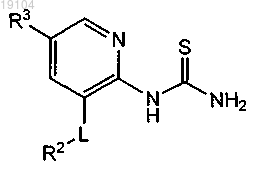
где R2, R3 и L такие, как определено в п.1.
Текст
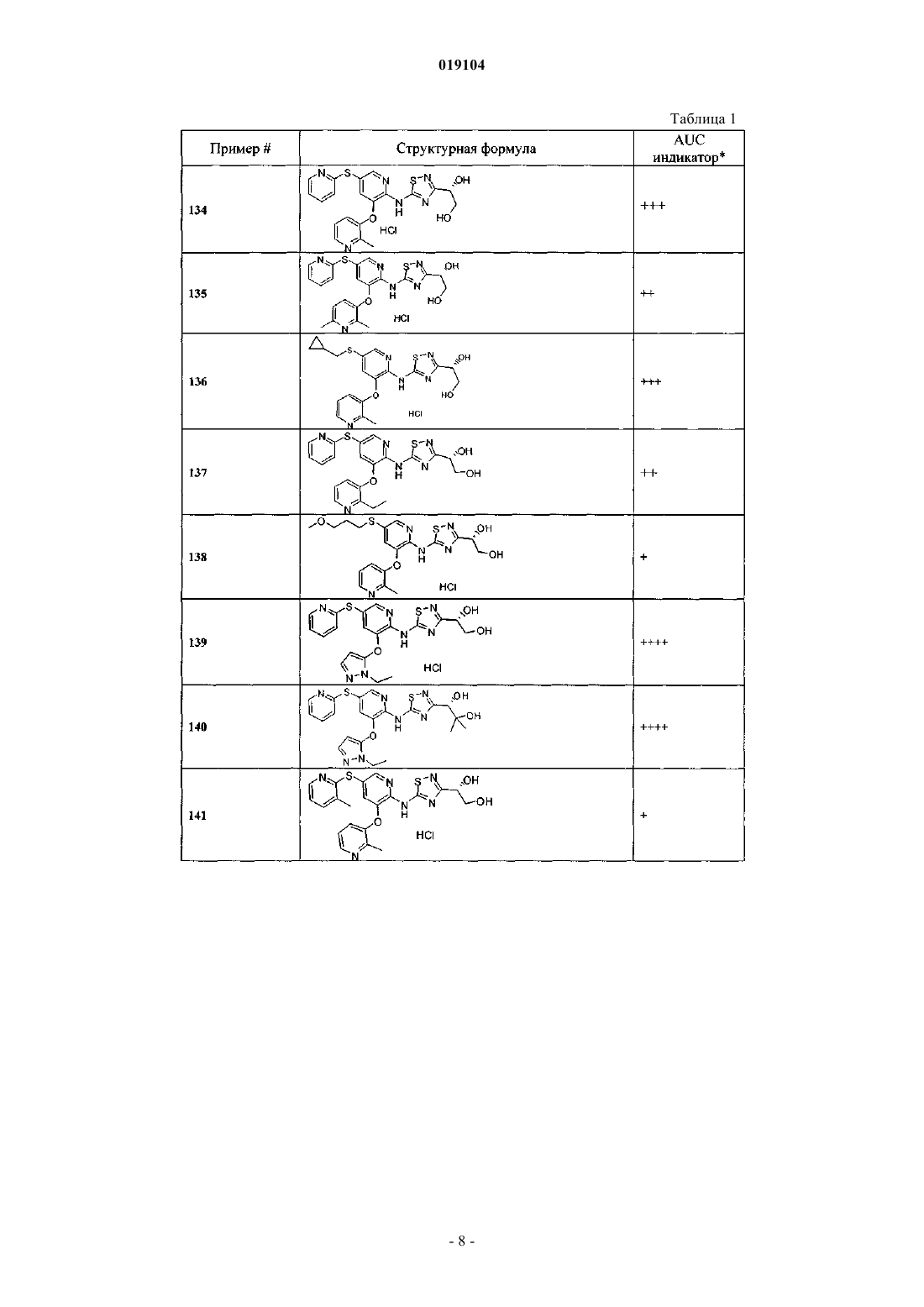
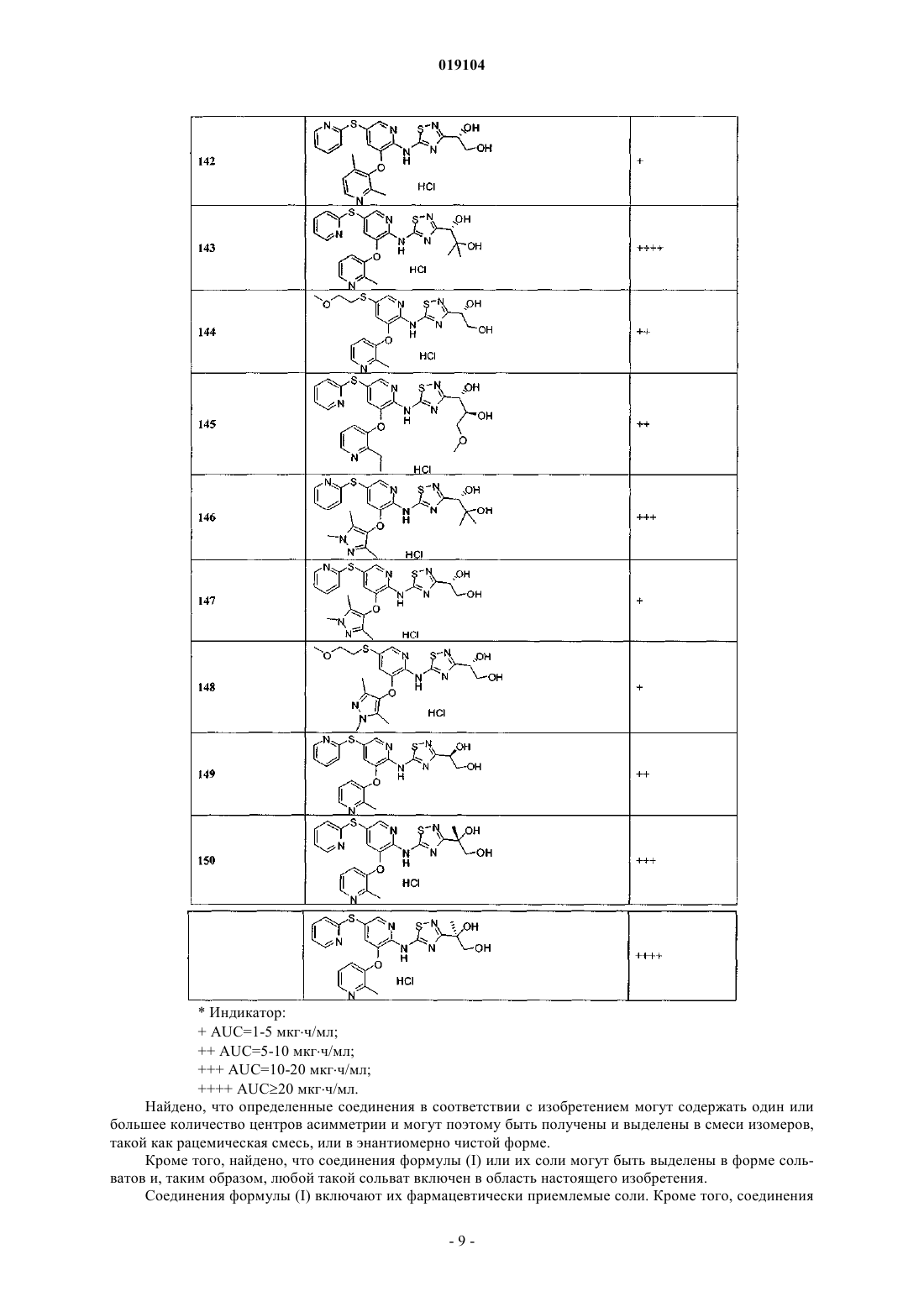
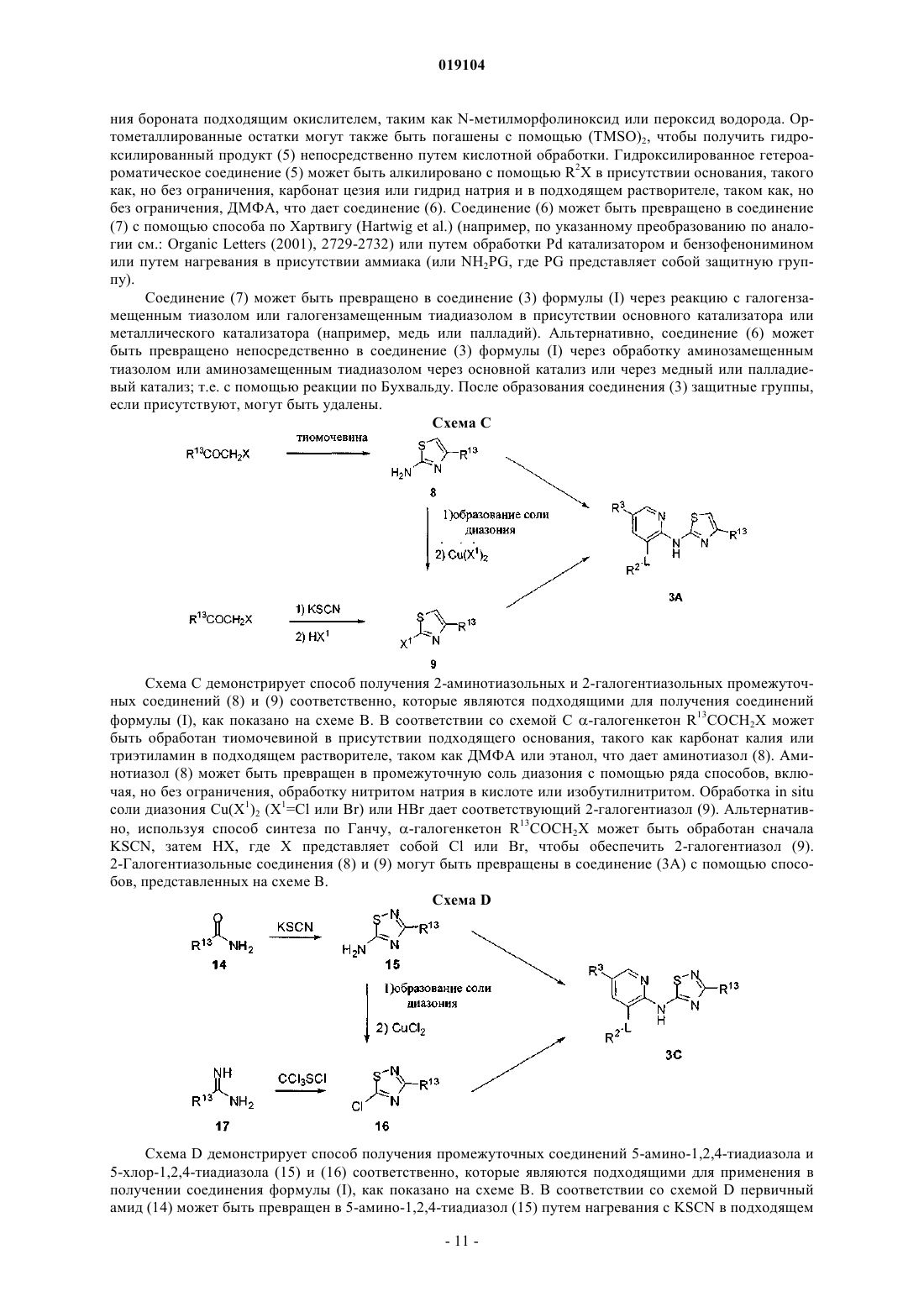
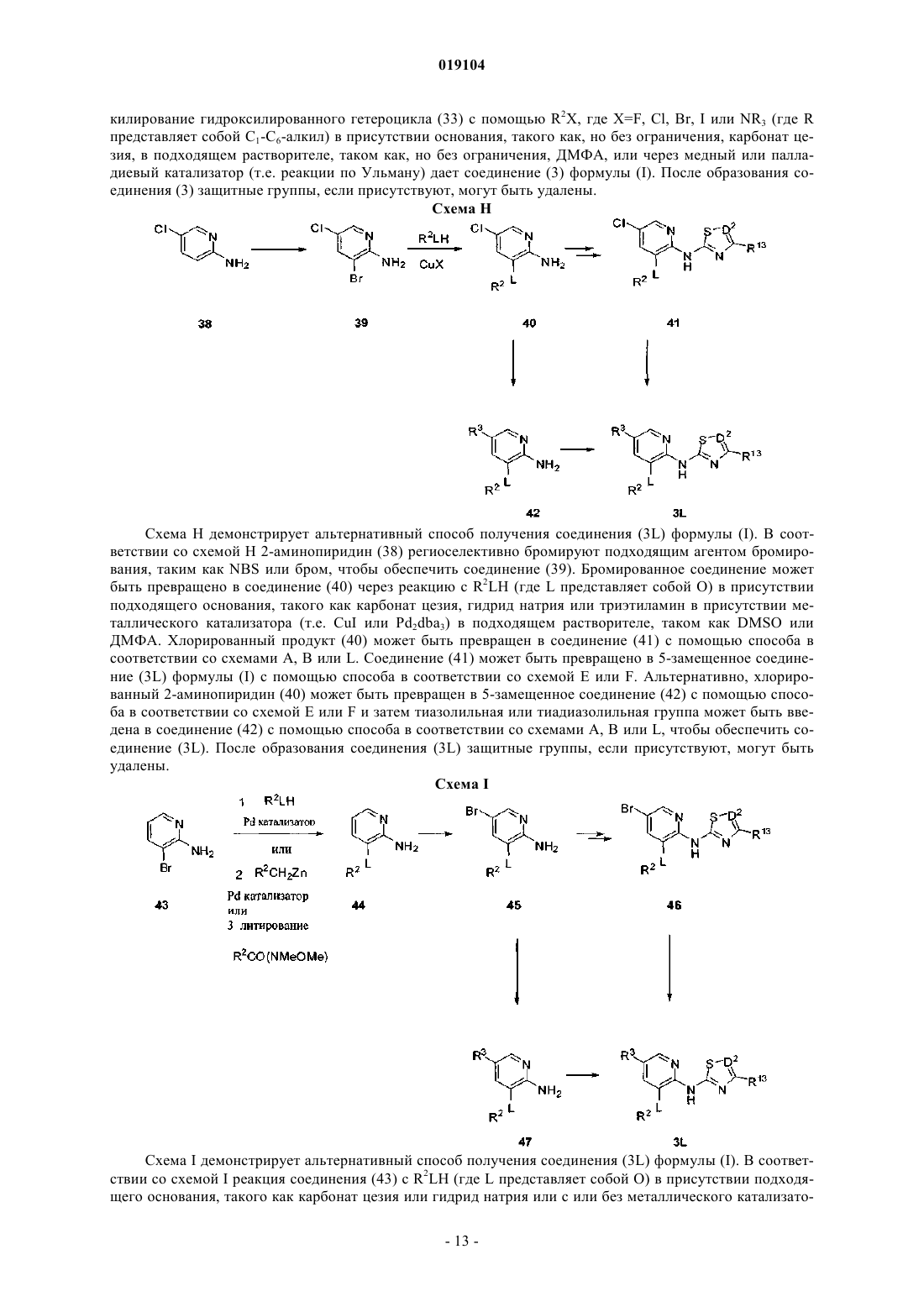
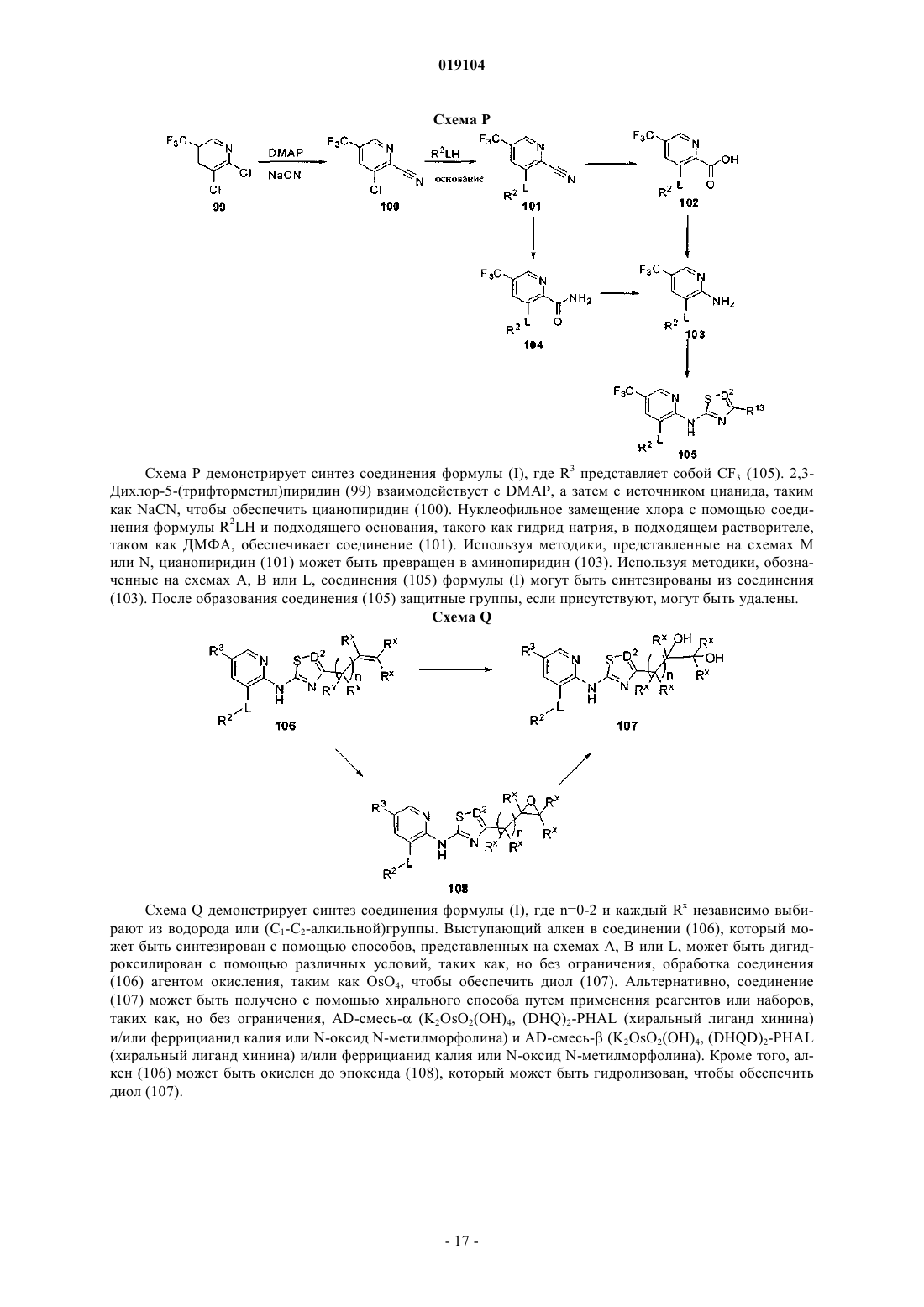
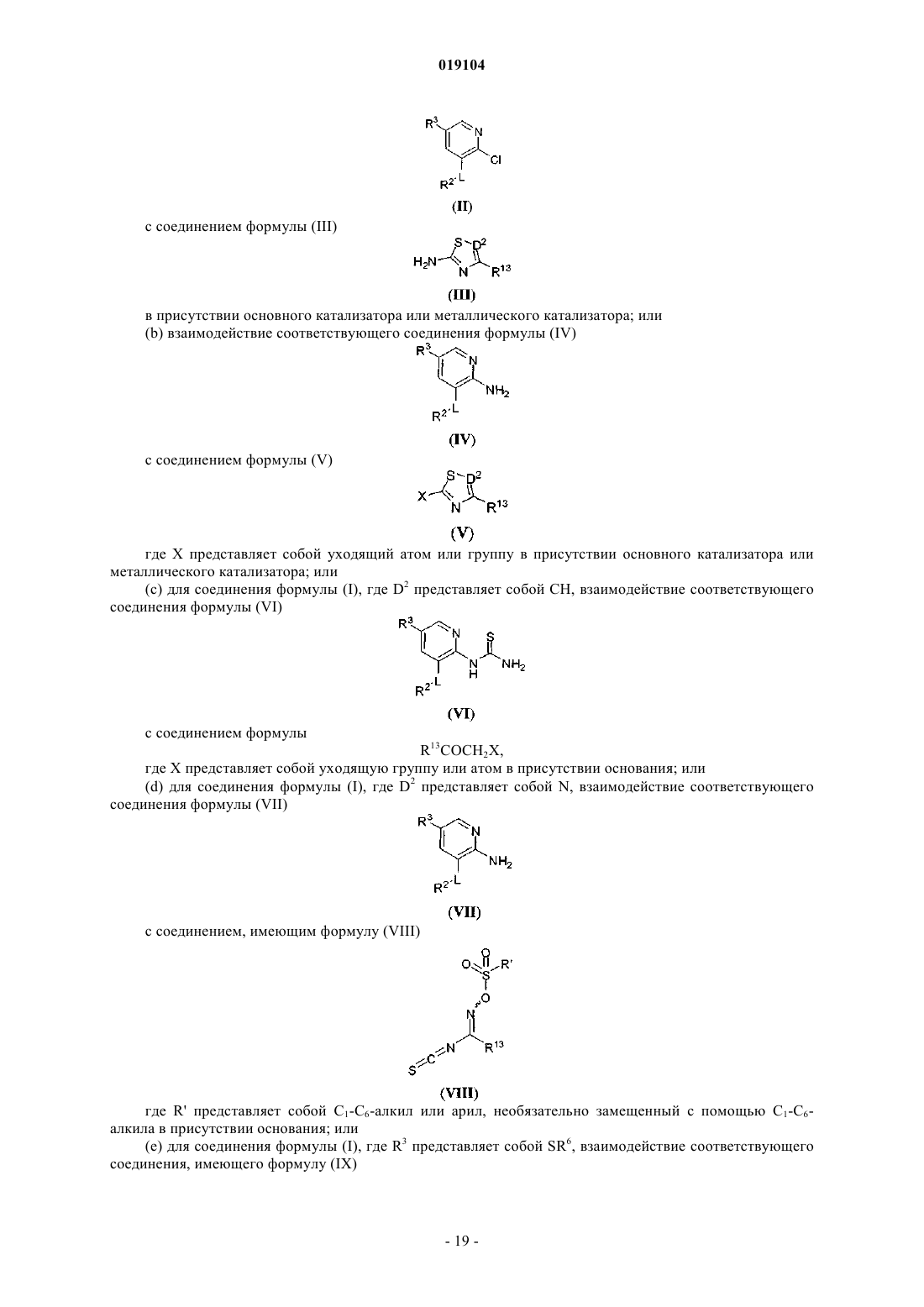
Представлены соединения формулы (I) где R2, R3, R13, L и D2 являются такими, как определено в описании, которые являются полезными при лечении и/или предупреждении заболеваний или расстройств, которые могут быть пролечены посредством активации глюкокиназы, включая сахарный диабет, нарушенную толерантность к глюкозе, IFG (нарушенный уровень глюкозы натощак) и IFG (нарушенная гликемия натощак). Настоящее изобретение относится к новым соединениям, фармацевтическим композициям, содержащим эти соединения, к процессу получения этих соединений и к применению этих соединений с целью лечения. Более конкретно, оно относится к некоторым активаторам глюкокиназы, применимым для лечения заболеваний и расстройств, при которых ожидается польза от активации глюкокиназы. Глюкокиназа (гексокиназа IV или D) является гликолитическим ферментом, который играет важную роль в регуляции уровня сахара в крови, связанной с утилизацией и метаболизмом глюкозы в печени и бета-клетках поджелудочной железы. Действуя как сенсор глюкозы, глюкокиназа контролирует уровни глюкозы в плазме. Глюкокиназа играет двойную роль в понижении уровней глюкозы в плазме: опосредованная глюкозой активация данного фермента в гепатоцитах способствует модификации глюкозы в печени и синтезу гликогена, тогда как в бета-клетках поджелудочной железы она, в конечном счете,вызывает секрецию инсулина. Оба эти эффекта, в свою очередь, снижают уровни глюкозы в плазме. Клинические данные показали, что варианты глюкокиназы со сниженной или повышенной активностью связаны с диабетом молодых (MODY2) и персистирующей гиперинсулинемической гипогликемией у детей (PHHI) соответственно. Также сообщается, что у пациентов с инсулиннезависимым сахарным диабетом (NIDDM) неадекватно низкая активность глюкокиназы. Более того, сверхэкспрессия глюкокиназы в алиментарных и генетических моделях диабета на животных либо предотвращает, облегчает,либо приводит к обратному развитию прогресс патологических симптомов заболевания. По этим причинам фармацевтическая промышленность нуждается в соединениях, которые активируют глюкокиназу. Международная патентная заявка WO 2007/053345, которая была опубликована 10 мая 2007 г., раскрывает в качестве активаторов глюкокиназы некоторые 2-аминопиридиновые производные, несущие в 3 позиции метиленоксисвязанную ароматическую группу и гетероарильное кольцо на аминогруппе, такое как тиазолил или 1,2,4-тиадиазолил. К настоящему времени обнаружено, что 2-аминопиридиновые производные, несущие в 3 позиции окси- или тиосвязанную ароматическую группу и на аминогруппе тиазолил или 1,2,4-тиадиазолил, замещенные полигидроксиалкильной или полигидроксициклоалкильной группой в 4 и 3 позиции тиазольного или тиадиазольного кольца соответственно, являются активаторами глюкокиназы. Некоторые из этих соединений, как было обнаружено, обладают выдающейся комбинацией свойств, которые делают их особенно подходящими для перорального приема с контролируемыми уровнями глюкозы в плазме. В соответствии с одним из аспектов настоящее изобретение обеспечивает соединение общей формулы (I) или его фармацевтически приемлемую соль, гдеR2 представляет собой 5-6-членную гетероарильную группу, имеющую 1-3 атомов азота и необязательно замещенную с помощью от одной до трех групп, независимо выбранных из C1-C6-алкила, Cl, CF3 и (C1-C6-алкила)ОН;hetAr4 представляет собой 5-6-членное гетероарильное кольцо, имеющее 1-3 атомов азота и необязательно замещенное с помощью от одной до трех групп, независимо выбранных из C1-C6-алкила;R13 представляет собой 1,2-дигидрокси(C2-C6-алкил) или метокси(дигидрокси(C3-C6-алкил. Термины "C1-C6-алкил", "C1-C3-алкил" и "C2-C6-алкил", используемые в настоящем описании, относятся к насыщенной линейной или разветвленной цепи одновалентного углеводородного радикала,имеющего от одного до шести, от одного до трех или от двух до шести атомов углерода соответственно. Примеры включают, но без ограничения, метил, этил, 1-пропил, 2-пропил, 1-бутил, 2-метил-1-пропил, 2 бутил, 2-метил-2-пропил, 2,2-диметилпропил, 1-пентил, 2-пентил, 3-пентил, 2-метил-2-бутил, 3-метил-2 бутил, 3-метил-1-бутил, 2-метил-1-бутил, 1-гексил, 2-гексил, 3-гексил, 2-метил-2-пентил, 3-метил-2 пентил, 4-метил-2-пентил, 3-метил-3-пентил, 2-метил-3-пентил, 2,3-диметил-2-бутил и 3,3-диметил-2 бутил. В определенных воплощениях соединений формулы (I) R13 выбирают из структурных формул В определенных воплощениях соединений формулы (I) альфа-углерод находится в S конфигурации. В других воплощениях альфа-углерод находится в R конфигурации. В определенных воплощениях R13 представляет собой дигидрокси(C2-C6-алкильную)группу, в которой одна из гидроксигрупп находится на альфа-углероде. В одном из воплощений альфа-углерод находится в S конфигурации. В других воплощениях альфа-углерод находится в R конфигурации. Особенное значение для R13 представляет собой (S)-1,2-дигидроксиэтил или (R)-1,2-дигидроксиэтил, который может быть представлен соответственно с помощью структурных формул В одном из воплощений R2 является незамещенным. В другом воплощении R2 замещен с помощью одной или большего количества групп, независимо выбранных из C1-C6-алкила, Cl, CF3 и (C1-C6 алкила)ОН. В одном из воплощений R2 представляет собой необязательно замещенную 6-членную гетероарильную группу, имеющую 1-2 кольцевых атомов азота. Примеры R2 включают незамещенные или замещенные пиридильные, пиразинильные и пиридазинильные группы. В определенном воплощении 6 членный R2 является незамещенным или замещенным с помощью одной или большего количества групп,независимо выбранных из метила, этила, изопропила, хлора, CF3, СН 2 ОН и СН 2 СН 2 ОН. Примеры включают пиридил, метилпиридил, диметилпиридил, этилпиридил, изопропилпиридил, хлорпиридил, трифторметилпиридил, гидроксиметилпиридил, гидроксиэтилпиридил, метилпиразинил и метилпиридазинил. В другом воплощении R2 представляет собой необязательно замещенную 5-членную гетероарильную группу, имеющую 1-3 кольцевых атомов азота. Примеры включают пиразолильные, имидазолильные и триазолильные группы. В определенных воплощениях 5-членный R2 является незамещенным или замещенным с помощью одной или большего количества групп, независимо выбранных из C1-C6-алкила,CF3, Cl или (C1-C3-алкила)ОН, например, с помощью одной или большего количества групп, независимо выбранных из метила, этила, изопропила, CF3, СН 2 ОН и СН 2 СН 2 ОН. Примеры включают пиразолильные,метилпиразолильные, диметилпиразолильные, имидазолильные, метилимидазолильные, диметилимидазолильные, гидроксиэтилпиразолильные и диметилгидроксиэтилпиразолильные группы. Дополнительные примеры R2 включают этилпиразолильные и триметилпиразолильные группы. Особенные значения для R2 включают структурные формулы-2 019104 Дополнительные значения для R2 включают структурные формулы В определенных воплощениях соединений формулы (I) R2 представляет собой пиридильное или пиразолильное кольцо, замещенное с помощью одной или большего количества групп, независимо выбранных из C1-C6-алкила. В определенных воплощениях R2 представляет собой пирид-3-ил, пиразол-4-ил или пиразол-5-ил, замещенный с помощью одной или большего количества групп, независимо выбранных из метила и этила. Особенные значения для R2 включают структурные формулы Относительно R3 группы соединений формулы (I) в определенных воплощениях R3 представляет собой SR6. В определенном воплощении R3 представляет собой SR6 и R6 представляет собой фенил. Характерные воплощения R3, когда он представлен -S-фенил, включают фенилтио, (хлорфенил)тио,(фторфенил)тио, (метилфенил)тио, (трифторметилфенил)тио, (диметилфенил)тио, (цианотрифторметилфенил)тио, (цианофенил)тио и (метоксифенил)тио. Особенные значения R3, когда он представлен -S-фенил, включают структурные формулы В другом воплощении соединений формулы (I) R3 представляет собой SR6, где R6 представляет собой hetAr4 и hetAr4 представляет собой необязательно замещенное 5-6-членное гетероарильное кольцо,имеющее 1-3 кольцевых атомов азота. Примеры включают необязательно замещенный пиридильные,пиримидильные, пирролильные, имидазолильные и триазолильные кольца. В определенных воплощениях hetAr4 является незамещенным или замещенным с помощью одной или большего количества групп,независимо выбранных из C1-C6-алкила. Особенные значения для R3, когда он представлен с помощью -S-hetAr4, включают структурные формулы Дополнительное значение для -S-hetAr4 включает структурную формулу Особенная ссылка сделана для -S-hetAr4 групп, выбранных из -S-(метилпиридила), -S(диметилпиридила), -S-(метилимидазолила) и -S-(метилтриазолила). В определенных воплощениях R3 представляет собой SR6, где R6 представляет собой (C1-C3 алкокси)(C1-C6-алкил). Примеры R6 включают метокси(C1-C6-алкильные) группы. Особенные значения для SR6 включают -S(СН 2 СН 2)ОМе и -S(CH2CH2CH2)OMe. В определенных воплощениях R3 представляет собой SR6, где R6 представляет собой циклопропил(C1-C6-алкил). Особенным значением для SR6 является -SCH2(циклопропил). В определенных воплощениях R3 представляет собой SR6, где R6 выбирают из (C1-C3-алкокси)(C1C6-алкила), циклопропил(C1-C6-алкила). Особенные значения для R6 формулы (I) включают структурные формулы В определенных воплощениях R3 представляет собой арил. В особенном воплощении R3 представляет собой фенил. В определенных воплощениях R3 представляет собой OR6. В одном из воплощений R6 представляет собой фенил. В других воплощениях R6 представляет собой необязательно замещенный hetAr4. В определенных воплощениях hetAr4 представляет собой 6-членный гетероарил, имеющий 1-2 кольцевых атомов азота, например пиридил. Примеры R6 групп включают фенил, хлорфенил, пиридил и метилпиридил. Особенные значения R3, когда он представлен с помощью OR6, включают структурные формулы или его фармацевтически приемлемая соль, гдеR2 представляет собой пиридильное или пиразолильное кольцо, каждое из которых необязательно замещено от одной до трех групп, независимо выбранных из C1-C6-алкила; иR6 представляет собой (C1-C3-алкокси)(C1-C6-алкил), циклопропил(C1-C6-алкил) или пиридил, необязательно замещенные с помощью одной или большего количества групп, независимо выбранных изC1-C6-алкила. В одном из воплощений соединений формулы (Ic) R13 представляет собой 1,2-дигидрокси(C2-C6 алкил) или метокси(дигидрокси(C3-C6-алкил, такой как 3-метокси-1,2-дигидрокси(C3-C4-алкил). В одном из воплощений соединений формулы (Ic) альфа-углерод R13 группы находится в S конфигурации. В другом воплощении альфа-углерод R13 группы находится в R конфигурации. В одном из воплощений соединений формулы (Ic) R13 выбирают из структурных формул Особенные значения R13 для формулы (Ic) могут быть представлены с помощью структурных формул В определенных воплощениях соединений формулы (Ic) R2 представляет собой пирид-3-ил, пиразол-4-ил или пиразол-5-ил, каждый из которых необязательно замещен с помощью одной или большего количества групп, независимо выбранных из C1-C6-алкила, например, одной или большего количества групп, независимо выбранных из метила и этила. Особенные значения для R2 включают структурные формулы В одном из воплощений соединений формулы (Ic) R6 представляет собой (C1-C3-алкокси)(C1-C6 алкил). В одном из воплощений R6 представляет собой СН 3 О-(C2-C3-алкил). Особенные значения R6 для формулы (Ic) включают структурные формулы В одном из воплощений соединений формулы (Ic) R6 представляет собой циклопропил(C1-C6 алкил). В особенном воплощении R6 представляет собой циклопропилметил. В одном из воплощений соединений формулы (Ic) R6 представляет собой пиридил, необязательно замещенный с помощью одной или большего количества групп, независимо выбранных из C1-C6-алкила. В одном из воплощений R6 представляет собой пиридил-2-ил, необязательно замещенный с помощью одной или большего количества групп, независимо выбранных из C1-C6-алкила, например одной или большего количества групп, независимо выбранных из метила или этила. Особенные значения для R6 формулы (Ic) включают структурные формулы Формула (I) также включает соединение общей формулы (Id) или его фармацевтически приемлемую соль, гдеR2 представляет собой пирид-3-ил, пиразол-4-ил или пиразол-5-ил, каждый из которых необязательно замещен от одной до трех групп, независимо выбранных из C1-C6-алкила;R6 представляет собой метокси(C2-C3-алкил), циклопропилметил или пиридил-2-ил, необязательно замещенный с помощью C1-C6-алкила. В одном из воплощений соединений формулы (Id) альфа-углерод R13 группы находится в S конфигурации. В другом воплощении альфа-углерод R13 группы находится в R конфигурации. В одном из воплощений соединений формулы (Id) R13 представляет собой 1,2-дигидрокси(C2-C4 алкил) или метокси(1,2-дигидрокси(C3-C4-алкил, такой как 3-метокси-1,2-дигидрокси(C3-C4-алкил). В одном из воплощений соединений формулы (Id) R13 выбирают из структурных формул Особенные значения R13 для формулы (Id) могут быть представлены с помощью структурных формул В определенных воплощениях соединений формулы (Id) R2 необязательно замещен с помощью от одной до трех групп, независимо выбранных из C1-C6-алкила, например от одной до трех групп, независимо выбранных из метила и этила. Особенные значения для R2 включают структурные формулы В определенном воплощении соединений формулы (Id) R6 представляет собой метокси(C2-C3 алкил). Особенные значения включают структурные формулы В определенных воплощениях соединений формулы (Id) R6 представляет собой циклопропилметил. В определенных воплощениях соединений формулы (Id) R6 представляет собой пиридил-2-ил, необязательно замещенный с помощью C1-C6-алкила, например метил или этил. Особенные значения для Было обнаружено, что соединения с формулами (Ic) и (Id) обладают, в частности, неожиданными и желательными свойствами. Например, данные соединения обладают достаточной растворимостью,включая условия низкого рН, чтобы обладать дозозависимой фармакокинетикой. Соединения с формулами (Ic) и (Id) также обладают большей активностью в присутствии белков плазмы (т.е. в присутствии 4% HSA), при тестировании в исследовании, описанном в примере А. Соединения с формулами (Ic) и (Id) также неожиданно имеют более низкий клиренс посредством реакций конъюгации. Основным путем выведения соединений с формулами (Ic) и (Id) является окисле-6 019104 ние в печени 5-SR6 функциональной группы, а не конъюгация с и/или окисление диольной группы. Это свойство уменьшает вероятность насыщения механизма клиренса, обеспечивая хорошую предсказуемость уровней активного соединения в крови и способствуя дозозависимой фармакокинетике. Кроме того, соединения с формулами (Ic) и (Id) неожиданно достигают высокого показателя AUC при пероральном введении (площадь под кривой зависимости концентрации препарата в плазме от времени после приема внутрь небольшой дозы), что приводит к большему количеству соединения, которое доступно для связывания с ферментом глюкокиназой. Вместе с линейной и дозозависимой фармакокинетикой это позволяет предсказуемым образом достигать терапевтических концентраций соединения. Дозозависимость и большая экспозиция соединений с формулами (Ic) и (Id) позволяет иметь фармакокинетические параметры, которые не будут изменяться при введении различных доз или при введении препарата различными путями или в виде однократной или многократных доз. В результате менее вероятно, что пациенты получат передозировку при некотором повышении доз. Кроме того, более низкие дозы будут необходимы для достижения терапевтического эффекта. Наоборот, препараты с нелинейными свойствами могут обладать более низкой биодоступностью из-за нескольких возможных причин, включая достижение концентрации лекарства предела растворимости в желудочно-кишечном тракте, или насыщаемой транспортной системы для всасывания или повышенной пероральной биодоступностью за счет насыщаемого метаболизма при высоких концентрациях. Конкретные примеры соединений с формулами (Ic) и (Id) представлены в табл. 1, которая также включает относительные значения для AUC при пероральном приеме (при 10 мг/кг), при тестировании в исследовании, описанном в примере В. Соединения в табл. 1, как было обнаружено, обладают уровнем ЕС 50 менее чем 1 мкМ, при тестировании в 4% HS согласно исследованию, описанному в примере А.+ AUC=1-5 мкгч/мл;AUC=5-10 мкгч/мл;AUC=10-20 мкгч/мл;AUC20 мкгч/мл. Найдено, что определенные соединения в соответствии с изобретением могут содержать один или большее количество центров асимметрии и могут поэтому быть получены и выделены в смеси изомеров,такой как рацемическая смесь, или в энантиомерно чистой форме. Кроме того, найдено, что соединения формулы (I) или их соли могут быть выделены в форме сольватов и, таким образом, любой такой сольват включен в область настоящего изобретения. Соединения формулы (I) включают их фармацевтически приемлемые соли. Кроме того, соединения формулы (I) также включают другие соли таких соединений, которые являются необязательно фармацевтически приемлемыми солями и которые могут быть полезны в качестве промежуточных соединений для получения и/или очистки соединений формулы (I) и/или для разделения энантиомеров соединений формулы (I). Соединения по настоящему изобретению могут быть синтезированы с помощью методов синтеза,которые включают способы, аналогичные тем, которые хорошо известны в химической технологии, в особенности в свете ссылок, включенных в настоящее описание. Исходные продукты являются в основном доступными из коммерческих источников, таких как Aldrich Chemicals (Milwaukee, WI) или являются легко полученными, используя способы, хорошо известные среднему специалисту (например, полученные с помощью способов, в основном описанных в Louis F. Fieser and Mary Fieser, Reagents for Organic Synthesis, v. 1-19, Wiley, N.Y. (1967-1999 ed.) или Beilsteins Handbuch der organischen Chemie, 4,Aufl. ed. Springer-Verlag, Berlin, включая приложения). Для целей иллюстрации представлены схемы A-S, которые демонстрируют общие способы получения соединений по настоящему изобретению так же, как ключевых промежуточных соединений. Для более подробного описания конкретных этапов реакции, см. раздел "Примеры", представленный ниже. Схема А Схема А демонстрирует способ получения соединений (3 А) формулы (I). Чтобы получить соединение (3 А), 2-аминогетероцикл (1) взаимодействует с бензоилизотиоцианатом, что дает промежуточную бензоилтиомочевину, которую гидролизуют до тиомочевины (2) с помощью основания, такого как, но без ограничения, карбонат калия в подходящем растворителе, таком как, но без ограничения, этанол. Альтернативно, аминогетероцикл (1) может быть обработан неорганическим или аммонийным изотиоцианатом, например, в соответствии с методикой Меклера, в присутствии кислоты, что дает тиомочевинуNR3 (где R=C1-C6-алкил), в подходящем основании, таком как триэтиламин, основанием Ханига, DBU,щелочным карбонатом, гидроксидом натрия и т.д., и подходящем растворителе, таком как этанол, дает тиазол (3 А). Если требуемый -галогенкетон R13COCH2X не является коммерчески доступным, он может быть получен с помощью различных способов, известных среднему специалисту. Примеры включают, но без ограничения, бромирование коммерческих или легко синтезируемых метилкетонов (Tempahedron(1970), 5611-5615; Organic Synthesis (1946), 13-15; Tempahedron (1990), 2943-2964), диазометановую обработку карбонилхлоридов, окисление 1-хлор-2-алканолов, бромирование силиленоловых эфиров или галогенирование -кетоэфиров с последующим декарбоксилированием. После образования тиазола (3 А) защитные группы, если присутствуют, могут быть удалены. Схема В Схема В демонстрирует альтернативный способ получения соединения формулы (I). В соответствии со схемой В гидроксилированный гетероарилгалоид (5) (если не является коммерчески доступным) может быть получен из гетероарилгалоида (4) с помощью: 1) ортометаллирования с помощью LDA или другого подходящего основания; 2) превращения аниона в боронат через реакцию с B(OR)3 и 3) окисле- 10019104 ния бороната подходящим окислителем, таким как N-метилморфолиноксид или пероксид водорода. Ортометаллированные остатки могут также быть погашены с помощью (TMSO)2, чтобы получить гидроксилированный продукт (5) непосредственно путем кислотной обработки. Гидроксилированное гетероароматическое соединение (5) может быть алкилировано с помощью R2X в присутствии основания, такого как, но без ограничения, карбонат цезия или гидрид натрия и в подходящем растворителе, таком как, но без ограничения, ДМФА, что дает соединение (6). Соединение (6) может быть превращено в соединение(7) с помощью способа по Хартвигу (Hartwig et al.) (например, по указанному преобразованию по аналогии см.: Organic Letters (2001), 2729-2732) или путем обработки Pd катализатором и бензофенонимином или путем нагревания в присутствии аммиака (или NH2PG, где PG представляет собой защитную группу). Соединение (7) может быть превращено в соединение (3) формулы (I) через реакцию с галогензамещенным тиазолом или галогензамещенным тиадиазолом в присутствии основного катализатора или металлического катализатора (например, медь или палладий). Альтернативно, соединение (6) может быть превращено непосредственно в соединение (3) формулы (I) через обработку аминозамещенным тиазолом или аминозамещенным тиадиазолом через основной катализ или через медный или палладиевый катализ; т.е. с помощью реакции по Бухвальду. После образования соединения (3) защитные группы,если присутствуют, могут быть удалены. Схема С Схема С демонстрирует способ получения 2-аминотиазольных и 2-галогентиазольных промежуточных соединений (8) и (9) соответственно, которые являются подходящими для получения соединений формулы (I), как показано на схеме В. В соответствии со схемой С -галогенкетон R13COCH2X может быть обработан тиомочевиной в присутствии подходящего основания, такого как карбонат калия или триэтиламин в подходящем растворителе, таком как ДМФА или этанол, что дает аминотиазол (8). Аминотиазол (8) может быть превращен в промежуточную соль диазония с помощью ряда способов, включая, но без ограничения, обработку нитритом натрия в кислоте или изобутилнитритом. Обработка in situ соли диазония Cu(X1)2 (X1=Cl или Br) или HBr дает соответствующий 2-галогентиазол (9). Альтернативно, используя способ синтеза по Ганчу, -галогенкетон R13COCH2X может быть обработан сначалаKSCN, затем НХ, где X представляет собой Cl или Br, чтобы обеспечить 2-галогентиазол (9). 2-Галогентиазольные соединения (8) и (9) могут быть превращены в соединение (3 А) с помощью способов, представленных на схеме В. Схема D Схема D демонстрирует способ получения промежуточных соединений 5-амино-1,2,4-тиадиазола и 5-хлор-1,2,4-тиадиазола (15) и (16) соответственно, которые являются подходящими для применения в получении соединения формулы (I), как показано на схеме В. В соответствии со схемой D первичный амид (14) может быть превращен в 5-амино-1,2,4-тиадиазол (15) путем нагревания с KSCN в подходящем растворителе, таком как метанол или этанол (Adv. Heterocycl. Chem. (1982), 32, 285). Образование соли диазония соединения (15) с последующей обработкой in situ соли диазония с помощью CuCl2 дает соответствующий 5-хлор-1,2,4-тиадиазол (16). Соответствующее производное брома может также быть синтезировано путем применения CuBr2. Альтернативно, реакцию амидина (17) с перхлорметилмеркаптаном дает 5-хлор-1,2,4-тиадиазол (16) (Bioorg. Med. Chem. (2003), 11, 5529-5537). Промежуточные соединения(15) и (16) могут быть превращены в соединение (3C) формулы (I) с помощью способов, представленных на схеме В. Схема Е Схема Е демонстрирует альтернативный способ получения соединения (3G) формулы (I). В соответствии со схемой Е галогензамещенный гетероцикл (28) (получают с помощью способа в соответствии со схемой А или В, где X1 представляет собой Cl, Br или I) вначале обрабатывают подходящим количеством метиллитиевого раствора, чтобы удалить обменные протон(ы) и затем трансметаллируют алкиллитиевым реагентом, таким как n-BuLi, втор-бутил или трет-бутиллития или реагентом Гриньяра, таким как изо-PrMg-галоид. Полученный анион затем гасят с помощью электрофила, чтобы обеспечить соединение (3G). После образования соединения (3G) защитные группы, если присутствуют, могут быть удалены. Схема F Схема F демонстрирует способ получения соединений (3 Н) формулы (I) из галогензамещенного гетероцикла (28). В соответствии со схемой F галогензамещенный гетероцикл (28), полученный с помощью способа в соответствии со схемой А или В, может быть превращен в тиол (29) через одну из нескольких методик. В соответствии с одним из способов галогензамещенный гетероцикл (28) вначале обрабатывают подходящим количеством метиллитиевого раствора, чтобы удалить обменный протон(ы) и затем трансметаллируют алкиллитиевым реагентом, таким как n-BuLi, втор-бутил или трет-бутиллития или реагентом Гриньяра, таким как изо-PrMg-галоид. Полученный анион гасят с помощью или элементарной серы, или пероксида бис-(триметилсилила), чтобы образовать соответствующее меркаптозамещенное соединение (29). Альтернативно, галоид (28) может быть превращен через Pd-опосредованные условия в тиол (29), используя триизопропилсилантиолат калия (Tempahedron Letters (1994), 3225-3226). Тиол может взаимодействовать с различными электрофилами, используя обычные реакционные условия,чтобы обеспечить соответствующий эфир (3 Н) формулы (I). Подходящие электрофилы включают, но без ограничения, активированные гетероарилгалоиды, такие как, но без ограничения, 2-фторцианобензол, 4 фторцианобензол, 2-фторнитробензол, 4-фторнитробензол, 2-хлор-4-нитропиридин, 2-галогенпиридин,2-галогенпиримидин, 4-галогенпиримидин, арилгалоиды и гетероарилгалоиды. После образования соединения (3 Н) защитные группы, если присутствуют, могут быть удалены. Схема G Схема G демонстрирует альтернативный способ введения линкера OR2 в ядро гетероцикла, чтобы обеспечить соединение (3) формулы (I). В соответствии со схемой G бензиловый эфир (32), полученный с помощью способа в соответствии со схемой А или В, может быть превращен в гидроксилзамещенный гетероцикл (33), например, путем гидролиза с помощью сильной кислоты (например, 6N HCl) или путем гидрирования (например, H2 или формиатом аммония в присутствии металлического катализатора). Ал- 12019104 килирование гидроксилированного гетероцикла (33) с помощью R2X, где X=F, Cl, Br, I или NR3 (где R представляет собой C1-C6-алкил) в присутствии основания, такого как, но без ограничения, карбонат цезия, в подходящем растворителе, таком как, но без ограничения, ДМФА, или через медный или палладиевый катализатор (т.е. реакции по Ульману) дает соединение (3) формулы (I). После образования соединения (3) защитные группы, если присутствуют, могут быть удалены. Схема Н Схема Н демонстрирует альтернативный способ получения соединения (3L) формулы (I). В соответствии со схемой Н 2-аминопиридин (38) региоселективно бромируют подходящим агентом бромирования, таким как NBS или бром, чтобы обеспечить соединение (39). Бромированное соединение может быть превращено в соединение (40) через реакцию с R2LH (где L представляет собой О) в присутствии подходящего основания, такого как карбонат цезия, гидрид натрия или триэтиламин в присутствии металлического катализатора (т.е. CuI или Pd2dba3) в подходящем растворителе, таком как DMSO или ДМФА. Хлорированный продукт (40) может быть превращен в соединение (41) с помощью способа в соответствии со схемами А, В или L. Соединение (41) может быть превращено в 5-замещенное соединение (3L) формулы (I) с помощью способа в соответствии со схемой Е или F. Альтернативно, хлорированный 2-аминопиридин (40) может быть превращен в 5-замещенное соединение (42) с помощью способа в соответствии со схемой Е или F и затем тиазолильная или тиадиазолильная группа может быть введена в соединение (42) с помощью способа в соответствии со схемами А, В или L, чтобы обеспечить соединение (3L). После образования соединения (3L) защитные группы, если присутствуют, могут быть удалены. Схема I Схема I демонстрирует альтернативный способ получения соединения (3L) формулы (I). В соответствии со схемой I реакция соединения (43) с R2LH (где L представляет собой О) в присутствии подходящего основания, такого как карбонат цезия или гидрид натрия или с или без металлического катализато- 13019104 ра (т.е. Pd2dba3 или CuI) в DMSO или ДМФА дает соединение (44), где L представляет собой О. 2-Аминопиридин (44) затем региоселективно бромируют подходящим агентом бромирования, таким как NBS или бром, чтобы обеспечить соединение (45). Бромированный продукт (45) может быть превращен в соединение (46) с помощью способа в соответствии со схемами А, В или L. Соединение (46) может быть превращено в 5-замещенное соединение (3L) формулы (I) с помощью способа в соответствии со схемой Е или F. Альтернативно, бромированный 2-аминопиридин (45) может быть превращен в 5 замещенное соединение (47) с помощью способа в соответствии со схемой Е или F и затем тиазолильная или тиадиазолильная группа может быть введена в соединение (47) с помощью способа в соответствии со схемами А, В или L, чтобы обеспечить соединение (3L). После образования соединения (3L) защитные группы, если присутствуют, могут быть удалены. Схема J Схема J демонстрирует альтернативный способ получения соединения (3L) формулы (I). В соответствии со схемой J реакцию соединения (48) (которое если не является коммерчески доступным, может быть проведена с коммерческими аминопиридинами через региоселективное бромирование) в присутствии подходящего основания, такого как карбонат цезия или гидрид натрия и с или без металлического катализатора (например, Pd2db3 или CuI) в DMSO или ДМФА дает соединение (49) с помощью способа,такого как ипсозамещение, используя R6SH; путем образования по Бухвальду тиоэфира с R6SH и т.д. в соответствии с методиками, хорошо известными из уровня техники. 2-Аминопиридин (49) затем региоселективно бромируют подходящим агентом бромирования, таким как NBS или бром, чтобы обеспечить соединение (50). Бромированный продукт (50) может быть превращен в соединение (51) с помощью способа в соответствии со схемами А, В или L. Соединение (51) может быть превращено в 5-замещенное соединение (3L) формулы (I) путем образования по Бухвальду тиоэфира с R2OH. Альтернативно, бромированный 2-аминопиридин (50) может вначале быть превращен в соединение (52) с помощью химии по Бухвальду и соединение (52) может быть превращено в соединение (3L) с помощью методики в соответствии со схемами А, В или L. После образования соединения (3L) защитные группы, если присутствуют,могут быть удалены. Схема K Схема K демонстрирует альтернативный способ получения соединения (3L) формулы (I). Обработ- 14019104 ка соединения (53) R2X в присутствии подходящего основания, такого как карбонат цезия или гидрид натрия, с или без металлического катализатора дает соединение 54. После этого соединение (54) может быть региоселективно бромировано, что дает соединение (55). Указанное соединение может быть превращено в соединение (56) через способы, описанные на схемах Е или F. Соединение (56) затем превращают в соединение (3L) через методики, представленные на схемах А, В или L. Альтернативно, соединение (55) может быть превращено в соединение (57) через методики, представленные на схемах А, В илиL, и затем превращено в соединение (3L) через методики, представленные на схемах Е или F. После образования соединения (3L) защитные группы, если присутствуют, могут быть удалены. Схема L Схема L демонстрирует альтернативный способ получения соединения формулы 3 С, где D2 представляет собой N. Образование оксима (80) из альдегида (79) позволяет путем хлорирования с помощьюC1-C6-алкила (например, толила) в присутствии основания, такого как, но без ограничения, триэтиламин,что дает соединение (82) (см., например, Gibbons, L. US Patent No. 3983246). Реакцию соединения (82) с тиоцианатной солью, такой как NaNCS, в подходящем растворителе, таком как ацетонитрил и в присутствии основания, такого как, но без ограничения пиридин, дает активированное промежуточное соединение (83) (см., например, Takeuchi, K., JP 2001081084). Промежуточное соединение (83) может взаимодействовать in situ с соответствующим аминогетероциклом (7), что дает соединение (3 С) формулы (I). После образования соединения (3 С) защитные группы, если присутствуют, могут быть удалены. Схема М Схема М демонстрирует альтернативный способ получения соединения формулы (I). Исходя из коммерчески доступного 2-цианопиридина (84), селективное нуклеофильное замещение может быть достигнуто с помощью соединения формулы R2LH и подходящего основания, такого как гидрид натрия, в подходящем растворителе, таком как ДМФА, чтобы обеспечить соединение (85). Добавление второго нуклеофила, имеющего формулу R6SH, в аналогичных условиях, дает функциональный 2-цианопиридин(86). Гидролиз нитрила может происходить во множестве условий, с NaOH в водном растворе этанола является предпочтительным, что дает пиколинат (87). Пререгруппировка по Куртису в присутствии подходящего спирта дает карбамат (88). Карбамат может быть удален, используя различные условия, в зависимости от применяемого спирта на предшествующей стадии, чтобы обеспечить 2-аминопиридин (89). Используя методики, обозначенные на схемах А, В или L, соединение (90) формулы (I) может быть синтезировано из соединения (89). После образования соединения (90) защитные группы, если присутствуют, могут быть удалены. Схема N Схема N демонстрирует другой альтернативный способ получения соединения формулы (I). Исходя из коммерчески доступного 5-бром-3-нитропиколинонитрила (84), селективное нуклеофильное замещение может быть достигнуто с помощью соединения формулы R2LH и подходящего основания, такого как гидрид натрия, в подходящем растворителе, таком как ДМФА, чтобы обеспечить соединение (85). Добавление второго нуклеофила, имеющего формулу R6SH, в аналогичных условиях дает функциональный 2-цианопиридин (86). Гидролиз нитрила до амида (91) может быть осуществлен в обычных условиях,таких как в присутствии концентрированной H2SO4. Реакция по Хофману для превращения соединения(91) в аминопиридин (92) может быть осуществлена в обычных условиях, таких как с NaOBr. Используя методики, обозначенные на схемах А, В или L, соединение (93) формулы (I) может быть синтезировано из соединения (92). После образования соединения (93) защитные группы, если присутствуют, могут быть удалены. Схема О Схема О демонстрирует альтернативный способ получения соединения формулы (I). Исходя из коммерчески доступного, замещенного пиридина (94), в котором X представляет собой Br или Cl, селективное нуклеофильное замещение может быть достигнуто с соединением формулы R2LH и подходящим основанием, таким как гидрид натрия, в подходящем растворителе, таком как ДМФА, чтобы обеспечить соединение (95). Гидролиз нитрила до амида (96) может быть осуществлен в обычных условиях, таких как в присутствии концентрированной H2SO4. Реакция по Хофману для превращения соединения (96) в аминопиридин (97) может быть осуществлена в обычных условиях, таких как с NaOBr. Используя методики, обозначенные на схемах А, В, Е, F или L, соединение (98) формулы (I) может быть синтезировано из соединения (97). После образования соединения (98) защитные группы, если присутствуют, могут быть удалены. Схема Р демонстрирует синтез соединения формулы (I), где R3 представляет собой CF3 (105). 2,3 Дихлор-5-(трифторметил)пиридин (99) взаимодействует с DMAP, а затем с источником цианида, таким как NaCN, чтобы обеспечить цианопиридин (100). Нуклеофильное замещение хлора с помощью соединения формулы R2LH и подходящего основания, такого как гидрид натрия, в подходящем растворителе,таком как ДМФА, обеспечивает соединение (101). Используя методики, представленные на схемах М или N, цианопиридин (101) может быть превращен в аминопиридин (103). Используя методики, обозначенные на схемах А, В или L, соединения (105) формулы (I) могут быть синтезированы из соединения(103). После образования соединения (105) защитные группы, если присутствуют, могут быть удалены. Схема Q Схема Q демонстрирует синтез соединения формулы (I), где n=0-2 и каждый Rx независимо выбирают из водорода или (C1-C2-алкильной)группы. Выступающий алкен в соединении (106), который может быть синтезирован с помощью способов, представленных на схемах А, В или L, может быть дигидроксилирован с помощью различных условий, таких как, но без ограничения, обработка соединения(106) агентом окисления, таким как OsO4, чтобы обеспечить диол (107). Альтернативно, соединение(107) может быть получено с помощью хирального способа путем применения реагентов или наборов,таких как, но без ограничения, AD-смесь- (K2OsO2(OH)4, (DHQ)2-PHAL (хиральный лиганд хинина) и/или феррицианид калия или N-оксид N-метилморфолина) и AD-смесь- (K2OsO2(OH)4, (DHQD)2-PHAL(хиральный лиганд хинина) и/или феррицианид калия или N-оксид N-метилморфолина). Кроме того, алкен (106) может быть окислен до эпоксида (108), который может быть гидролизован, чтобы обеспечить диол (107). Схема R демонстрирует альтернативный синтез соединения формулы (I), где n=0-2 и каждый Rx независимо выбирают из водорода или (C1-C2-алкильной)группы. В соответствии со схемой R эпоксид(108) может быть раскрыт с помощью источника цианида, такого как NaCN, что дает соединение (109). Соединение (109) может взаимодействовать с одним или двумя эквивалентами реагента в виде гидрида щелочного металла (например, LiAlH4, DIBAL-H или ВН 3) или органометаллическим реагентом RxM или(Rx)2M, где М представляет собой металл (например, RxLi, (Rx)2Zn или (Rx)2CuLi), что дает соединение(110) или (111) соответственно. Альтернативно, соединение (110) может быть в дальнейшем восстановлено с помощью реагента в виде гидрида щелочного металла (например, LiAlH4, DIBAL-H или ВН 3) или органометаллическим реагентом RxM или (Rx)2M, где М представляет собой металл (например, RxLi,(Rx)2Zn или (Rx)2CuLi), что дает соединение (111). Схема S Схема S демонстрирует синтез соединений формулы (I), где n=0-2 и каждый Rx независимо выбирают из Н или (C1-C2-алкильной)группы. Карбонильное соединение (112), которое может быть синтезировано с помощью способов, представленных на схемах А, В или L, может быть превращено в цианогидрин (113). Цианогидрин (113) может быть обработан 1 или 2 эквивалентами реагента в виде гидрида щелочного металла (например, LiAlH4, DIBAL-H или ВН 3) или органометаллическим реагентом RxM или(Rx)2M, где М представляет собой металл (например, RxLi, (Rx)2Zn или (Rx)2CuLi), чтобы обеспечить соединение (114) или (115) соответственно. Альтернативно, соединение (114) может в дальнейшем взаимодействовать с реагентом в виде гидрида щелочного металла RxM или (Rx)2M, где М представляет собой металл (например, LiAlH4, DIBAL-H или ВН 3) или органометаллическим реагентом (например, RxLi,(Rx)2Zn или (Rx)2CuLi), что дает соединение (115). Таким образом, другое воплощение изобретения обеспечивает способ получения соединение формулы (I) или его соли, влючающий:(а) взаимодействие соответствующего соединения формулы (II) в присутствии основного катализатора или металлического катализатора; или(b) взаимодействие соответствующего соединения формулы (IV) где X представляет собой уходящий атом или группу в присутствии основного катализатора или металлического катализатора; или(с) для соединения формулы (I), где D2 представляет собой СН, взаимодействие соответствующего соединения формулы (VI)R13COCH2X,где X представляет собой уходящую группу или атом в присутствии основания; или(d) для соединения формулы (I), где D2 представляет собой N, взаимодействие соответствующего соединения формулы (VII)(е) для соединения формулы (I), где R3 представляет собой SR6, взаимодействие соответствующего соединения, имеющего формулу (IX) где Xa представляет собой уходящий атом или группу,с соединением, имеющим формулуR3-Xb,b где X представляет собой уходящий атом или уходящую группу, в присутствии подходящего основания; или(g) для соединения формулы (I), где R3 представляет собой SR6, взаимодействие соответствующего соединения, имеющего формулу (XII)R6-Xc,где X представляет собой уходящий атом или группу в присутствии подходящего основания; или(h) для соединения формулы (I), где L представляет собой О, взаимодействие соответствующего соединения, имеющего формулу (XIII)R2-Xd,где X представляет собой уходящий атом или группу в присутствии основания или в присутствии медного или палладиевого катализатора; или где Xe представляет собой уходящую группу или атом,с соединением, имеющим формулуR2LH,где L представляет собой О или S, в присутствии палладиевого катализатора и подходящего основания; или(j) для соединения формулы (I), где R13 имеет формулу где каждый Rx независимо выбирают из водорода и (C1-C2-алкильной)группы и n равен 0-2,- 20019104(k) для соединения формулы (I), где R13 имеет формулу где каждый Rx независимо выбирают из водорода и (C1-C2-алкильной)группы и n равен 0-2; или(l) для соединения формулы (I), где R13 имеет формулу где каждый Rx независимо выбирают из водорода и (C1-C2-алкильной)группы и n равен 0-2,взаимодействие соответствующего соединения, имеющего формулу (XVII) с двумя эквивалентами реагента гидрида металла или органометаллического реагента, имеющих формулуRxM или (Rx)2M,x где каждый R независимо выбирают из водорода и (C1-C2-алкильной)группы и М представляет собой анион металла; или(m) для соединения формулы (I), где R13 имеет формулу где каждый Rx независимо выбирают из водорода и (C1-C2-алкильной)группы и n равен 0-2,взаимодействие соответствующего соединения, имеющего формулу (XVIII) с реагентом в виде гидрида металла или органометаллическим реагентом, имеющего формулуRxM или (Rx)2M,x где каждый R независимо выбирают из водорода и (C1-C2-алкильной)группы и М представляет собой анион металла; или(n) для соединения формулы (I), где R13 имеет формулу где каждый Rx независимо выбирают из водорода и (C1-C2-алкильной)группы и n равен 0-2,взаимодействие соответствующего соединения, имеющего формулу (XIX) с двумя эквивалентами реагента в виде гидрида металла или органометаллическим реагентом,имеющего формулуRxM или (Rx)2M,x где каждый R независимо выбирают из водорода и (C1-C2-алкильной)группы и М представляет собой анион металла; или(о) для соединения формулы (I), где R13 имеет формулу где каждый Rx независимо выбирают из водорода и (C1-C2-алкильной)группы и n равен 0-2,взаимодействие соответствующего соединения, имеющего формулу (XX) с реагентом в виде гидрида металла или органометаллическим реагентом, имеющего формулуRxM или (Rx)2M,x где каждый R независимо выбирают из водорода и (C1-C2-алкильной)группы и М представляет собой анион металла; и удаления любой защитной группы или групп и, если требуется, образования соли. Ссылаясь на способ (b), X может быть уходящим атомом (например, Cl, Br) или уходящей группой(например, OTs или OTf). Ссылаясь на способ (с), X может быть уходящей группой (такой как OTs или NR3, где R представляет собой C1-C6-алкил) или уходящим атомом (например, Cl, Br или I). Ссылаясь на способ (е), подходящим основанием может быть, например, основание алкиллития, такое как метиллития, бутиллития или их смесь. Ссылаясь на способ (f), Xa может быть уходящим атомом, таким как галоген (например, F, Cl илиBr), или уходящей группой, такой как сульфонат (например, OMs или OTs). Xb может быть уходящим атомом, таким как галоген (например, F, Cl или Br), или уходящей группой, такой как сульфонат (например, OMs или OTs). Подходящим основанием может быть, например, алкоксид щелочного металла, такой как трет-бутоксид калия. Ссылаясь на способ (g), Xc может быть уходящим атомом, таким как галоген, такой как Br, Cl или I. Подходящим основанием может быть, например, алкиллитий, такой как метиллитий, бутиллитий или их комбинация. Ссылаясь на способ (h), Xd может быть уходящим атомом, таким как галоген (например, F, Cl илиBr), или уходящей группой, такой как сульфонат (например, OMs или OTs). Ссылаясь на способ (i), Xe может быть уходящей группой или атомом, например галоген, такой какCl или Br; или трифлатной или тозилатной группой. Подходящие основания включают карбонаты щелочного металла, такого как CsCO3. Ссылаясь на способ (j), подходящие агенты окисления включают OsO4, KMnO4, AD-смесь-, ADсмесь- и подобные им. Ссылаясь на способ (k), гидролиз эпоксида может проходить или в кислотных, или в основных условиях. Ссылаясь на способы (l), (m), (n) и (о), подходящие реагенты гидрида металла включают LiAlH4,- 22019104DIBAL-H и ВН 3. Ссылаясь на способы (l), (m), (n) и (о), подходящие органометаллические реагенты включают реагенты алкиллития, алкилцинка и алкилмеди. Соединения формул (IX), (XI), (XII), (XIII), (XIV), (XV), (XVI), (XVII), (XVIII), (XIX) и (XX) являются, также как полагают, новыми и обеспечивают в дальнейшем аспекты настоящего изобретения. При получении соединений формулы (I) может быть необходима защита удаленных функциональных групп промежуточных соединений (например, первичных или вторичных аминов и т.д.). Потребность в такой защите будет изменяться в зависимости от природы отдаленной функциональности и условий методов получения. Подходящие аминозащитные группы (NH-Pg) включают ацетил, трифторацетил,трет-бутоксикарбонил (ВОС), бензилоксикарбонил (CBz) и 9-флоренилметиленоксикарбонил (Fmoc). Потребность в такой защите с готовностью определяется средним специалистом. Для общего описания защитных групп и их использования см. Т.W. Greene, Protective Groups in Organic Synthesis, John WileySons, New York, 1991. Соединения по настоящему изобретению могут применяться в качестве профилактических или терапевтических агентов для лечения заболеваний или расстройств, опосредованных недостаточным уровнем активности глюкокиназы, или которые могут быть пролечены посредством активации глюкокиназы,включая помимо прочего сахарный диабет, нарушенную толерантность к глюкозе, IFG (нарушенный уровень глюкозы натощак) и IFG (нарушенная гликемия натощак), так же как другие заболевания и расстройства, такие как обсуждаемые ниже. Более того, соединения по настоящему изобретению могут также применяться для профилактики прогрессирования пограничного типа, нарушенной толерантности к глюкозе, IFG (нарушенный уровень глюкозы натощак) и IFG (нарушенная гликемия натощак) до сахарного диабета. Соответственно другой аспект данного изобретения предусматривает способы лечения или профилактики заболеваний или патологических состояний, описанных здесь, путем введения млекопитающему, такому как человек, терапевтически эффективного количества соединения с формулой I. Фраза "терапевтически эффективное количество" означает количество соединения по настоящему изобретению, которое (i) лечит или предотвращает конкретную болезнь, патологическое состояние или расстройство, (ii) ослабляет, облегчает или удаляет один или более симптомов конкретной болезни, патологического состояния или расстройства или (iii) предотвращает или замедляет начало одного или более симптомов конкретного заболевания, патологического состояния или расстройства, описанного здесь. Количество соединения с формулой I, представляющее собой такое количество, будет зависеть от таких факторов, как конкретное соединение, патологическое состояние и его тяжесть, характеристика(например, вес) млекопитающего, которое нуждается в лечении, но может быть, тем не менее, определено обычным способом средним специалистом. Термины "лечить" и "лечение" относятся и к лечебному воздействию, и к профилактическим или предупредительным мерам, при этом у объекта предотвращается или замедляется (уменьшается) нежелательные физиологические изменения или расстройство. Для целей этого изобретения полезные или желаемые клинические результаты включают помимо прочего ослабление симптомов, уменьшение степени распространения заболевания, стабилизация (т.е. отсутствие ухудшения) течения болезни, остановка или замедление прогрессирования заболевания, облегчение или смягчение болезненного состояния и ремиссию (полную или частичную), либо определяемые, либо неопределяемые. "Лечение" может также означать продление жизни по сравнению с ожидаемой продолжительностью жизни при отсутствии лечения. Нуждающиеся в лечении включают тех, кто уже страдает патологическим состоянием или заболеванием,также как и тех, у кого ожидается развитие патологического состояния или расстройства или тех, у которых патологическое состояние или заболевание должно быть предотвращено. В данном описании термин "млекопитающее" относится к теплокровным животным, которые страдают от заболевания или находятся в группе риска развития заболевания, описанного здесь, и включают,помимо прочего, морских свинок, собак, кошек, крыс, мышей, хомяков и приматов, включая людей. В некоторых воплощениях способы данного изобретения применимы для лечения сахарного диабета. Сахарный диабет - это состояние, при котором уровень глюкозы в плазме натощак (концентрация глюкозы в венозной крови) выше или равна 126 мг/дл (определенный при двух измерениях) и уровень глюкозы в плазме через 2 ч после приема 75 г глюкозы в ходе перорального теста толерантности к глюкозе (OGTT) выше или равен 200 мг/дл. Дополнительные классические симптомы включают полидипсию, полифагию и полиурию. В некоторых воплощениях способы данного изобретения применимы для лечения синдрома нарушенной толерантности к глюкозе (IGT). IGT диагностируется путем выявления уровня глюкозы в плазме натощак менее чем 126 мг/дл и уровня глюкозы через 2 ч после перорального приема выше 140 мг/дл. Соединения по настоящему изобретению могут также применяться в качестве профилактических или лечебных агентов при осложнениях диабета, таких как, помимо прочего, нейропатия, нефропатия,ретинопатия, катаракта, макроангиопатия, остеопения, диабетическая гиперосмолярная кома, инфекционные осложнения (например, респираторная инфекция, мочевая инфекция, инфекция желудочно- 23019104 кишечного тракта, инфекция мягких тканей кожи, инфекция нижних конечностей и т.п.), диабетическая гангрена, ксеростомия, снижение слуха, цереброваскулярная болезнь, нарушение периферической циркуляции и т.д. Соединения по настоящему изобретению могут также применяться в качестве профилактических или лечебных агентов для лечения заболеваний и расстройств, таких как, помимо прочего, ожирение,метаболический синдром (синдром X), гиперинсулинемия, расстройство чувствительности, вызванное гиперинсулинемией, дислипопротеинемия (присутствие патологических липопротеинов в крови), включая диабетическую дислипидемию, гиперлипидемия, гиперлипопротеинемия (избыток липопротеинов в крови), включая типы I, II-а (гиперхолестеринемия), II-b, III, IV (гипертриглицеридемия) и V (гипертриглицеридемия), низкий уровень ЛВП, высокий уровень ЛНП, атеросклероз и его проявления, сосудистый рестеноз, нейродегенеративное заболевание, депрессия, расстройства ЦНС, стеатоз печени, остеопороз,гипертензия, почечные заболевания (например, диабетическая нефропатия, гломерулонефрит, гломерулосклероз, нефротический синдром, гипертонический нефросклероз, терминальное почечное расстройство и т.п.), инфаркт миокарда, стенокардия и цереброваскулярная болезнь (например, ишемический и геморрагический инсульт). Соединения по настоящему изобретению могут также применяться в качестве профилактических или лечебных агентов для лечения заболеваний и расстройств, таких как, помимо прочего, остеопороз,жировая дистрофия печени, гипертензия, синдром инсулинорезистентности, воспалительные заболевания (например, хронический ревматоидный артрит, деформирующий спондилит, остеоартроз, люмбаго,подагра, послеоперационное или травматическое воспаление, ремиссия отеков, невралгия, фаринголарингит, цистит, гепатит (включая неалкогольный стеатогепатит), пневмония, воспалительный колит, язвенный колит), панкреатит, синдром висцерального ожирения, кахексия (например, кахексия при карциноматозе, кахексия при туберкулезе, диабетическая кахексия, гемопатическая кахексия, эндокринопатическая кахексия, инфекционная кахексия, кахексия, вызванная синдромом приобретенного иммунодефицита), синдром поликистозных яичников, мышечная дистрофия, опухоль (например, лейкоз, рак молочной железы, рак предстательной железы, рак кожи и т.п.), синдром раздраженной кишки, острая или хроническая диарея, деформирующий спондилит, остеоартроз, ремиссия отека, невралгия, фаринголарингит, цистит, SIDS и т.п. Соединения по настоящему изобретению могут применяться в комбинации с одним или более дополнительными препаратами, например соединением, которое функционирует посредством того же или другого механизма действия, такого как препараты инсулина, агенты для коррекции инсулинорезистентности, ингибиторы альфа-глюкозидазы, бигуаниды, стимуляторы секреции инсулина, ингибиторы дипептидилпептидазы IV (DPP IV), бета-3 агонисты, агонисты амилина, ингибиторы фосфотирозинфосфатазы, ингибиторы глюконеогенеза, ингибиторы натрий-глюкозного котранспортера, известные терапевтические агенты от осложнений диабета, антигиперлипидемические агенты, гипотензивные агенты и агенты против ожирения. Примером агента для коррекции инсулинорезистентности является агонист гамма-рецептора, активируемого пролифератором пероксисом (PPAR-). Соединения по настоящему изобретению могут быть введены любым подходящим путем, например в желудочно-кишечный тракт (например, ректально или перорально), нос, легкие, мышцы или сосуды или чрескожно. Данные соединения могут быть введены посредством любой подходящей лекарственной формы, например в виде таблеток, порошков, капсул, растворов, дисперсий, суспензий, сиропов, спреев,суппозиториев, гелей, эмульсий, пластырей и т.п. Такие композиции могут содержать компоненты, традиционные для фармацевтических препаратов, например разбавители, носители, модификаторы рН, подсластители, агенты-наполнители и другие активные агенты. Если желательно парентеральное введение,данные композиции должны быть стерильными и в форме раствора или суспензии, подходящих для инъекции или инфузии. Такие композиции образуют дальнейший аспект данного изобретения. Согласно другому аспекту настоящее изобретение предусматривает фармацевтическую композицию, которая включает соединение с формулой I или его фармацевтически приемлемую соль, как определено выше. В одном воплощении фармацевтическая композиция включает соединение с формулой I вместе с фармацевтически приемлемым разбавителем или носителем. Данное изобретение также предусматривает применение соединения с формулой I в лечении заболеваний или расстройств, опосредованных недостаточным уровнем активности глюкокиназы или которые могут быть пролечены посредством активации глюкокиназы. Дополнительным аспектом данного изобретения является применение соединения с формулой I в приготовлении лекарственного препарата для лечения или профилактики заболеваний или расстройств,опосредованных недостаточным уровнем активности глюкокиназы или которые могут быть пролечены посредством активации глюкокиназы. Примеры Следующие примеры иллюстрируют изобретение. В описанных примерах, если иное не указано,все значения температур приведены в градусах Цельсия. Реагенты приобретены из коммерческих источников, таких как Aldrich Chemical Company, Lancaster, TCI или Maybridge и используют без последующей очистки, если иное не указано. Тетрагидрофуран (THF), дихлорметан (CH2Cl2, хлористый метилен),толуол и диоксан приобретают от Aldrich в безопасных герметичных бутылях и используют как таковые. Реакции, представленные ниже, проводят в целом при положительном давлении азота или аргона или в трубках для сушки (если иное не оговорено) в безводных растворителях и в реакционные колбы обычно устанавливают резиновые перегородки для введения субстратов и реагентов через шприц. Стеклянную посуду сушат в сушильной печи и/или при высокой температуре. 1 Н ЯМР спектр получают из CDCl3, CD3OD, D2O или d6-DMSO растворов (представленных в част./млн), используя тетраметилсилан (0.00 част./млн) или остаточный растворитель (CDCl3: 7.25 част./млн; CD3OD: 3.31 част./млн; D2O: 4.79 част./млн; d6-DMSO: 2.50 част./млн) в виде обычной ссылки. Когда представлены многообразные пики, используют следующие сокращения: s (синглет), d Стадия А. К раствору (R)-1,4-диоксаспиро[4.5]декан-2-карбальдегида (9.0 г, 52.9 ммоль) в ТГФ (120 мл и 60 мл воды) добавляют гидрохлорид гидроксиламина (3.73 г, 52.9 ммоль) и полученную реакционную смесь перемешивают, пока она не станет прозрачной (10 мин). Добавляют карбонат натрия (2.75 г,25.9 ммоль) и полученную реакционную смесь перемешивают в течение ночи при температуре окружающей среды. Реакционную смесь выливают в этилацетат (500 мл) и слои разделяют. Органику промывают водой (200 мл), рассолом (200 мл), сушат над сульфатом магния и концентрируют в вакууме, чтобы получить на выходе оксим (S)-1,4-диоксаспиро[4.5]декан-2-карбальдегида (9.08 г, 49 ммоль, 92.7%). Стадия В. К раствору оксима (S)-1,4-диоксаспиро[4.5]декан-2-карбальдегида (9.08 г, 49 ммоль) в ДМФА (50 мл) добавляют 1-хлорпирролидин-2,5-дион (7.20 г, 53.9 ммоль) и полученную реакционную смесь перемешивают в течение ночи при температуре окружающей среды. Реакционную смесь выливают в воду (500 мл) и экстрагируют эфиром. Органику промывают рассолом и сушат над сульфатом магния. Продукт концентрируют в вакууме, чтобы получить на выходе (R)-N-гидрокси-1,4 диоксаспиро[4.5]декан-2-карбимидоилхлорид (10.4 г, 47 ммоль, 96.6%). Стадия С. К раствору (R)-N-гидрокси-1,4-диоксаспиро[4.5]декан-2-карбимидоилхлорида (10.4 г,47.3 ммоль), охлажденному до температуры 0 С, в ТГФ (150 мл) добавляют метансульфонилхлорид (5.97 г, 52.1 ммоль), а затем N-этил-N-изопропилпропан-2-амин (6.73 г, 52.1 ммоль) и полученную реакционную смесь перемешивают в течение 1 ч при температуре окружающей среды. Реакционную смесь концентрируют в вакууме. Продукт растворяют в дихлорметане и хроматографируют, используя смесь от 8:1 гексан/EtOAc до 4:1 гексан/EtOAc (2 колонки), что дает (R)-N-(метилсульфонилокси)-1,4 диоксаспиро[4.5]декан-2-карбимидоилхлорид в виде вязкого масла, которое застывает при стоянии (12 г,40 ммоль, 85% выход). Стадия D. Колбу заполняют 2-метилпиридин-3-олом (3.0 г, 27.5 ммоль) и ДМФА (100 мл). Добавляют гидрид натрия (0.760 г, 30.2 ммоль) и полученную смесь перемешивают в течение 5 мин. Добавляют 5-бром-3-нитропиколинонитрил (6.26 г, 27.5 ммоль) и полученную смесь перемешивают в течение 10 мин. Реакционную смесь выливают в колбу, содержащую 300 мл насыщенного NH4Cl и 300 мл воды,с энергичным перемешиванием. Твердые вещества отфильтровывают и сушат в высоком вакууме, что дает 5-бром-3-(2-метилпиридин-3-илокси)пиколинонитрил (7.78 г, 97.6% выход) в виде твердого вещества светло-желтого цвета. Стадия E. Колбу заполняют 5-бром-3-(2-метилпиридин-3-илокси)пиколинонитрилом (60 г, 207 ммоль) и серной кислотой (203 г, 2068 ммоль). Реакционную смесь перемешивают при температуре окружающей среды в течение ночи. Осторожно добавляют воду (500 мл) и нейтрализуют, используя 50% гидроксид натрия, до значения рН 5.0. Смесь экстрагируют дихлорметаном и этилацетатом, сушат и концентрируют, что дает 5-бром-3-(2-метилпиридин-3-илокси)пиколинамид (63.0 г, 204 ммоль, 98.9% выход) в виде твердого вещества желтого цвета. Стадия F. Колбу заполняют 2 М раствором гидроксида натрия (256 мл, 511 ммоль) и охлаждают до температуры 0 С. Добавляют бром (7.85 мл, 153 ммоль) и полученную смесь перемешивают в течение 15 мин. Добавляют 5-бром-3-(2-метилпиридин-3-илокси)пиколинамид (31.5 г, 102 ммоль) в диоксане (650 мл) и полученную смесь перемешивают при температуре окружающей среды в течение ночи. Водный слой экстрагируют этилацетатом и CH2Cl2. Органические слои промывают водой, рассолом, сушат, концентрируют и очищают на силикагеле (25-50-75-100% этилацетат в гексане), что дает 5-бром-3-(2 метилпиридин-3-илокси)пиридин-2-амин (12 г, 43 ммоль, 41.9% выход) в виде твердого вещества желтого цвета. Стадия G. (R)-N-(Метилсульфонилокси)-1,4-диоксаспиро[4.5]декан-2-карбимидоилхлорид (1.86 г,6.25 ммоль), пиридин (1.13 г, 14.3 ммоль) и тиоцианат натрия (0.58 г, 7.14 ммоль) растворяют в ацетонитриле (45 мл). Раствор нагревают до температуры 40 С в течение 40 мин. Добавляют 5-бром-3-(2 метилпиридин-3-илокси)пиридин-2-амин (1.0 г, 3.57 ммоль) и полученную реакционную смесь нагревают при температуре 60 С в течение ночи. Раствор охлаждают до температуры 0 С, фильтруют и твердое вещество сушат,что дает(S)-N-(5-бром-3-(2-метилпиридин-3-илокси)пиридин-2-ил)-3-(1,4 диоксаспиро[4.5]декан-2-ил)-1,2,4-тиадиазол-5-амин (0.90 г, 1.78 ммоль, 50% выход) в виде твердого вещества белого цвета. Стадия Н. К раствору(S)-N-(5-бром-3-(2-метилпиридин-3-илокси)пиридин-2-ил)-3-(1,4 диоксаспиро[4.5]декан-2-ил)-1,2,4-тиадиазол-5-амина (0.072 г, 0.20 ммоль) в метаноле (10 мл) добавляют концентрированную HCl (3 капли) и полученную реакционную смесь нагревают до температуры 80 С в течение 3 ч. Реакционную смесь концентрируют в вакууме. Продукт растирают в порошок со смесью этилацетат/метанол 1/1 (10 мл), что дает (S)-1-(5-(5-бром-3-(2-метилпиридин-3-илокси)пиридин-2 иламино)-1,2,4-тиадиазол-3-ил)этан-1,2-диол (0.070 г, 0.16 ммоль, 83%) в виде твердого вещества белого цвета (APCI POS 424,426 М+H). Пример 2. Стадия А. К раствору 2-метилпиридин-3-ола (0.96 г, 8.8 ммоль) в ДМФА (10 мл), охлажденному до температуры 0 С, добавляют порциями NaH (0.35 г, 8.8 ммоль) и полученную реакционную смесь нагревают до температуры окружающей среды. К указанной смеси добавляют 5-бром-3-нитропиколинонитрил(2.0 г, 8.8 ммоль) и полученную реакционную смесь перемешивают в течение ночи при температуре окружающей среды. К ней добавляют тиофенол (0.96 г, 8.8 ммоль) и реакционную смесь охлаждают до температуры 0 С. Добавляют NaH (0.35 г, 8.8 ммоль) и полученную реакционную смесь нагревают до температуры окружающей среды и затем смесь перемешивают при температуре окружающей среды в течение ночи. Реакционную смесь выливают в воду (1000 мл) и водный слой экстрагируют эфиром(S)-1-(5-(3-(2-Метилпиридин-3-илокси)-5-(пиридин-2-илтио)пиридин-2-иламино)-1,2,4-тиадиазол-3 ил)этан-1,2-диол (APCI POS 455 М+Н) синтезируют в соответствии с методикой, представленной в примере 3, заменяя 2-тиопиридин на тиофенол на стадии А. Пример 6. Стадия А. К диоксану (50 мл), через который постоянно пробулькивают N2, добавляют по очередиPd2dba3 (0.041 г, 0.046 ммоль), ксанфос (xanphos) (0.055 г, 0.091 ммоль), (S)-N-(5-бром-3-(2 метилпиридин-3-илокси)пиридин-2-ил)-3-(1,4-диоксаспиро[4.5]декан-2-ил)-1,2,4-тиадиазол-5-амин (0.46 г, 0.091 ммоль), этил-2-меркаптоацетат (0.11 г, 0.091 ммоль) и основание Ханига (0.12 г, 0.091 ммоль) и полученную реакционную смесь нагревают до температуры 80 С в течение 6 ч. Реакционную смесь концентрируют в вакууме и продукт хроматографируют, используя 40% EtOAc в виде элюента, что дает (S)этил-2-(6-(3-(1,4-диоксаспиро[4.5]декан-2-ил)-1,2,4-тиадиазо-5-иламино)-5-(2-метилпиридин-3 илокси)пиридин-3-илтио)ацетат (0.30 г, 0.55 ммоль). Стадия В. К раствору (S)-этил-2-(6-(3-(1,4-диоксаспиро[4.5]декан-2-ил)-1,2,4-тиадиазо-5-иламино)5-(2-метилпиридин-3-илокси)пиридин-3-илтио)ацетата (0.30 г, 0.55 ммоль) в ТГФ (20 мл), охлажденному до температуры 0 С, добавляют LiAlH4 (1 M раствор в ТГФ) (0.55 мл, 0.55 ммоль) и полученную реакционную смесь перемешивают в течение 3 ч, пока происходит нагревание до температуры окружающей среды. Реакционную смесь гасят путем добавления воды и выливают в этилацетат (100 мл) и слои разделяют. Органику промывают рассолом, сушат над MgSO4 и концентрируют в вакууме, что дает (S)-2-(6(3-(1,4-диоксаспиро[4.5]декан-2-ил)-1,2,4-тиадиазо-5-иламино)-5-(2-метилпиридин-3-илокси)пиридин-3 илтио)этанол (0.28 г, 0.55 ммоль). Стадия С. (S)-1-(5-(5-(2-Гидроксиэтилтио)-3-(2-метилпиридин-3-илокси)пиридин-2-иламино)-1,2,4 тиадиазол-3-ил)этан-1,2-диол (APCI POS 422 М+Н) синтезируют в соответствии с методикой, представленной в примере 1, заменяя (S) 2-(6-(3-(1,4-диоксаспиро[4.5]декан-2-ил)-1,2,4-тиадиазо-5-иламино)-5-(2 метилпиридин-3-илокси)пиридин-3-илтио)этанол на Стадия А. Колбу заполняют 4-фторфенолом (44 г, 365 ммоль) и ДМФА (500 мл). Реакционную смесь охлаждают до температуры 0 С. Добавляют гидрид натрия (16.6 г, 414 ммоль) и полученную смесь перемешивают в течение 10 мин. Добавляют 5-бром-3-нитропиколинонитрил (90 г, 395 ммоль) и смесь перемешивают при температуре окружающей среды в течение 30 мин. Реакционную смесь выливают в колбу, содержащую воду (5000 мл), и полученную смесь перемешивают в течение 10 мин. Значение рН доводят до 10, что дает 5-бром-3-(4-фторфенокси)пиколинонитрил (121 г, 413 ммоль, 105% выход) в виде твердого вещества. Стадия В. К раствору пиридин-2-тиола (2.5 г, 23 ммоль) в DMA (25 мл), охлажденному до температуры 0 С, добавляют NaH (0.90 г, 23 ммоль), и полученную реакционную смесь перемешивают при температуре окружающей среды в течение 20 мин, с последующим добавлением 5-бром-3-(4 фторфенокси)пиколинонитрила (6.6 г, 23 ммоль) и перемешивают в течение ночи при температуре окружающей среды. Реакционную смесь выливают в воду (250 мл) и образуется твердое вещество. Твердое вещество собирают, промывают водой и сушат в вакууме, чтобы получить на выходе 3-4 фторфенокси)-5-пиридин-2-илтио)пиколинонитрил (5 г, 16 ммоль, 70%). Стадия С. (S)-1-5-(3-(4-Фторфенокси)-5-пиридин-2-илтио)пиридин-2-иламино)-1,2,4-тиадиазол-3 ил)этан-1,2-диол (APCI POS 458 М+Н) синтезируют в соответствии с методикой, представленной в примере 1, заменяя 3-4-фторфенокси)-5-пиридин-2-илтио)пиколинонитрил на 5-бром-3-(2-метилпиридин 3-илокси)пиколинонитрил на стадии Е. Пример 8. Стадия А. Колбу заполняют 5-бром-3-(4-фторфенокси)пиколинонитрилом (10 г, 34 ммоль) и серной кислотой (50 мл). Реакционную смесь перемешивают при температуре окружающей среды в течение ночи. Осторожно добавляют воду (500 мл) и значение рН смеси доводят до значения 5.0, используя 50% гидроксид натрия. Смесь экстрагируют дихлорметаном и этилацетатом, сушат и концентрируют, что дает 5-бром-3-(4-фторфенокси)пиколинамид (10.6 г, 34 ммоль, 100% выход) в виде твердого вещества желтого цвета. Стадия В. Колбу заполняют 2 М раствором гидроксида натрия (115 мл, 230 ммоль) и охлаждают до температуры 0 С. Добавляют бром (9.3 г, 58 ммоль) и смесь перемешивают в течение 15 мин. Добавляют 5-бром-3-(4-фторфенокси)пиколинамид (15.8 г, 51 ммоль) в диоксане (200 мл) и смесь перемешивают при температуре окружающей среды в течение ночи. Водный слой экстрагируют этилацетатом и CH2Cl2. Органические слои промывают водой, рассолом, сушат над MgSO4, концентрируют и очищают с помощью хроматографии (25-50-75-100% этилацетат в гексане), что дает 5-бром-3-(2-фторфенокси)пиридин 2-амин (12 г, 42 ммоль, 82% выход) в виде твердого вещества желтого цвета. Стадия С. К раствору 5-бром-3-(2-фторфенокси)пиридин-2-амина (17 г, 60 ммоль) в ТГФ (500 мл) добавляют бензоилизотиоцианат (9.8 г, 60 ммоль) и полученную реакционную смесь перемешивают при температуре окружающей среды в течение ночи. Реакционную смесь выливают в гексан (2 л), твердое вещество собирают и сушат в вакууме, что дает N-(5-бром-3-(4-фторфенокси)пиридин-2 илкарбамотиолил)бензамид (25 г, 56 ммоль, 93% выход). Стадия D. К раствору N-(5-бром-3-(4-фторфенокси)пиридин-2-илкарбамотиолил)бензамида (25 г,56 ммоль) в этаноле (150 мл) добавляют NaOH (2 М) (56 мл, 112 ммоль) и полученную реакционную смесь перемешивают при температуре 80 С. Смесь выливают в воду и полученную суспензию фильтруют. Собранное твердое вещество сушат в вакууме, чтобы получить на выходе 1-(5-бром-3-(4 фторфенокси)пиридин-2-ил)тиомочевину (15.4 г, 45 ммоль). Стадия Е. К раствору (S)-метил-2,2-диметил-1,3-диоксолан-4-карбоксилата (1.3 г, 8.1 ммоль) и хлориодометана (4.3 г, 24 ммоль) в ТГФ (50 мл) при температуре -78 С добавляют раствор LDA (16.2 мл, 24 ммоль) порциями в течение 10 мин. Реакционную смесь перемешивают при температуре -78 С в течение 10 мин. К указанной смеси добавляют 10% раствор уксксной кислоты (50 мл) в ТГФ при температуре-78 С. После завершения добавления суспензию нагревают до температуры окружающей среды. Реакционную смесь выливают в EtOAc (200 мл) и водный слой подщелачивают, используя 1 N раствор NaOH. Органику разделяют и промывают рассолом, сушат над MgSO4 и концентрируют в вакууме. Продукт очищают с помощью хроматографии, используя DCM в виде элюента, что дает (S)-2-хлор-1-(2,2 диметил-1,3-диоксолан-4-ил)этанон (0.60 г, 3.4 ммоль, 42% выход) в виде масла. Стадия F. К 1-(5-бром-3-(4-фторфенокси)пиридин-2-ил)тиомочевине (0.5 г, 1.5 ммоль) в этаноле(50 мл) добавляют (S)-2-хлор-1-(2,2-диметил-1,3-диоксолан-4-ил)этанон (0.34 г, 1.9 ммоль) и полученную реакционную смесь перемешивают при температуре 80 С в течение 1 ч. Реакционную смесь выливают в воду (250 мл) и фильтруют. Твердое вещество растирают в порошок с этилацетатом и метанолом. Твер- 28019104 дое вещество суспендируют в этилацетат (500 мл) и промывают 1 N раствором NaOH (500 мл). Органику концентрируют и сырой продукт очищают с помощью хроматографии, используя от 3 до 10% смесь МеОН/CH2Cl2 в виде элюента, что дает (R)-1-(2-(5-бром-3-(4-фторфенокси)пиридин-2-иламино)тиазол-4 ил)этан-1,2-диол (0.043 г, 0.10 ммоль, 7%) (APCI POS 426, 428 М+Н). Пример 9. Стадия А. POCl3 (12.9 мл, 141.2 ммоль) добавляют в ДМФА (10.9 мл, 141.2 ммоль) при температуре 0 С. Реакционную смесь сразу нагревают до температуры окружающей среды и полученную смесь перемешивают в течение 30 мин. Добавляют 2,2-диэтоксиэтокси)метил)бензол (10.6 г, 47.1 ммоль) в виде раствора в 80 мл хлороформа. Раствор перемешивают при температуре 75 С в течение 3.5 ч. Раствор охлаждают, выливают на воду со льдом и нейтрализуют Na2CO3. Остаток экстрагируют хлороформом и органический слой сушат Na2SO4 и концентрируют. Остаток повторно растворяют в МеОН (450 мл). Добавляют NaOMe (25% в МеОН, 58 мл, 253 ммоль), а затем 2-гидразинилэтанол (10.6 г, 139 ммоль). Реакционную смесь перемешивают в течение ночи при температуре окружающей среды. Продукт концентрируют в вакууме, а затем разбавляют насыщенным раствором NH4Cl. Продукт экстрагируют с помощью
МПК / Метки
МПК: A61K 31/433, A61P 3/10, C07D 417/14, C07D 417/12
Метки: активаторы, глюкокиназы
Код ссылки
<a href="https://eas.patents.su/30-19104-aktivatory-glyukokinazy.html" rel="bookmark" title="База патентов Евразийского Союза">Активаторы глюкокиназы</a>
Предыдущий патент: Конденсированный аминопиридин в качестве ингибиторов hsp90
Следующий патент: Долото ударного действия для роторного бурения грунта и способ его работы
Случайный патент: Заправочная система для заправки вещества в контейнеры