Активаторы рецептора ampa
Номер патента: 12310
Опубликовано: 28.08.2009
Авторы: Кастано Мансанет Ана Мария, Цзян Дэлу, Хун Цзянь Эрик, Хорнбек Уилльям Джозеф, Домингес-Мансанарес Эстебан, Кордье Фредерик Лоран
Формула / Реферат
1. Соединение формулы I
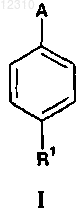
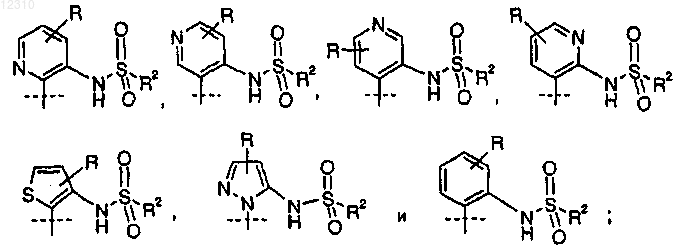
где А выбран из группы, состоящей из следующего:
R представляет собой Н, галоген, -СООН или -СН2СООН;
R1 представляет собой фенил, необязательно замещенный первым заместителем, выбранным из группы, состоящей из галогена, циано, C1-C4-ацила, -СООН, -NHR3, C1-C2-алкила, замещенного -NHCH3, -N(SO2(C1-C3-алкил))2, -СООН, -CONH2, циано, гидрокси или тетразол-5-илом, -ОСН2СООН,
-SCH2COOH, -С(O)СН2СН2СООН, -SO2NH2, тетразол-5-ила и 1,2,4-триазол-1-ила; необязательно дополнительно замещенный вторым заместителем, выбранным из группы, состоящей из галогена, трифторметила, циано, нитро, C1-C4-алкокси, гидрокси, C1-C4-алкила, C1-C4-алкилтио, -NHCH2CN, -OCH2CN,
-NHSO2CH (СН3)2 и -C(O)NHR4; необязательно дополнительно замещенный третьим заместителем, выбранным из группы, состоящей из галогена и циано; необязательно дополнительно замещенный четвертым заместителем, выбранным из группы, состоящей из галогена;
R2 представляет собой C1-C4-алкил или диметиламино;
R3 представляет собой -SO2 (C1-C3-алкил), C1-C4-ацил, C1-C4-алкил или водород;
R4 представляет собой водород, C1-C4-алкил или -SO2(C1-C4-алкил);
или его фармацевтически приемлемая соль.
2. Соединение по п.1, где А представляет собой
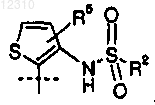
3. Соединение по п.2, где R2 представляет собой изопропил.
4. Соединение, представляющее собой 2-циано-4'-[3-(пропан-2-сульфониламино)тиофен-2-ил]бифенил-4-карбоновую кислоту или его фармацевтически приемлемую соль.
5. Соединение, представляющее собой 2-этокси-4'-[3-(пропан-2-сульфониламино)тиофен-2-ил]бифенил-4-карбоновую кислоту или его фармацевтически приемлемую соль.
6. Фармацевтический препарат, содержащий соединение по любому из пп.1-5 в комбинации с фармацевтически приемлемым носителем, разбавителем или вспомогательным веществом.
7. Применение соединения по любому из пп.1-5 для получения лекарственного средства для лечения болезни Альцгеймера.
8. Применение соединения по любому из пп.1-5 для получения лекарственного средства для лечения болезни Паркинсона.
9. Соединение формулы I для применения в качестве фармацевтического средства.
10. Соединение формулы II
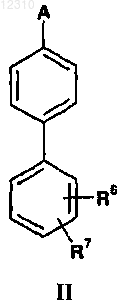
где А выбран из группы, состоящей из
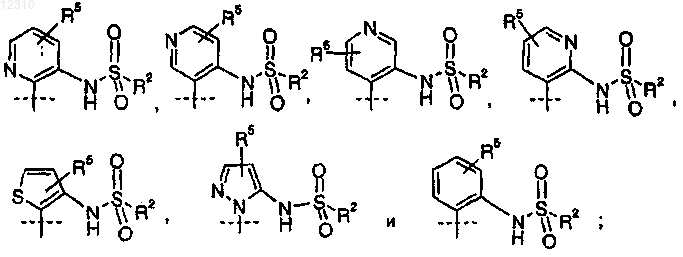
R2 представляет собой C1-C4-алкил или диметиламино;
R5 представляет собой Н, галоген, -COOR8 или -CH2COOR8;
R6 представляет собой Н, циано, C1-C4-алкокси, галоген, гидрокси, трифторметил или метилтио;
R7 представляет собой -COOR9, -C(О)CH2CH2COOR9, -OCH2COOR9, -SCH2COOR9 или C1-C2-алкил, замещенный -COOR9;
каждый из R8 и R9 независимо выбран из группы, состоящей из водорода и C1-C4-алкила, при условии, что как минимум один из R8 и R9 не является водородом;
или его аддитивная соль с основанием.
Текст
012310 Предпосылки изобретения Глутамат представляет собой основной возбуждающий нейромедиатор в центральной нервной системе. Идентифицированы три подтипа ионных каналов рецептора глутамата на основе их чувствительности к селективным активаторам (агонистам) N-метил-D-аспартату (NMDA), -амино-3-гидрокси-5 метил-4-изоксазолпропионовой кислоте (АМРА) и каинату. Рецепторы АМРА опосредуют клеточные реакции на глутамат с помощью прямых и непрямых механизмов. При активации глутаматом или АМРА ионные каналы рецептора АМРА позволяют ионам натрия (Na+) и ионам кальция (Са 2+) проходить непосредственно через канал. Кроме того, ионные каналы рецептора АМРА могут облегчить активацию рецепторов NMDA, инициируя клеточную деполяризацию,которая ослабляет зависимый от иона магния (Mg2+) блок рецепторов NMDA. Идентифицировано и клонировано множество подтипов рецептора АМРА: GluR1, GluR2, GluR3 иGluR4, как описано в Hollmann and Heinemann, Ann. Rev. Neurosci., 17, 31-108 (1994). Каждая субъединица состоит из последовательности длиной приблизительно 900 аминокислот. Считается, что происходит сборка четырех субъединиц для образования тетрамерного комплекса ионного канала с функциональными свойствами данного ионного канала, которые, вероятнее всего, определяются его субъединичным составом. Токи ионного канала, активированные глутаматом посредством рецепторов АМРА, быстротечны. Протекание токов во времени модифицирует состояния сопротивления, вызванные в ходе связывания с глутаматом, которое обозначается как десенсибилизация, и скоростью удаления глутамата из сайта связывания ионного канала, которое приводит к деактивации. Входящий поток ионов через рецепторы АМРА может быть усилен соединениями, которые препятствуют десенсибилизации, или соединениями,которые замедляют скорость деактивации. Соединения, которые увеличивают стимулированный глутаматом входящий поток ионов в рецепторах АМРА, известны как позитивные аллостерические модуляторы рецептора АМРА или активаторы рецептора АМРА. Одним из таких соединений, которое селективно активирует функцию рецептора АМРА, является циклотиазид. Поскольку рецепторы АМРА играют центральную роль в опосредовании быстрой возбуждающей передачи в центральной нервной системе, молекулы, которые усиливают функцию рецептора АМРА, имеют множество терапевтических мишеней. Показано, что соединения, которые аллостерически активируют рецепторы АМРА, увеличивают синаптическую активность in vitro и in vivo, как описано, например, I. Ito, et al., J. Physiol., 424, 533-543(1990) и A. Copani, et al., Journal of Neurochemistry, 58, 1199-1204 (1992). Показано также, что такие соединения улучшают обучение и память у крыс, обезьян и человека (см. обзор в Gouliaev and Senning,Brain Research Reviews, 19, 180-222 (1994. Международная патентная заявка WO 98/33496, опубликованная 6 августа 1998 г., раскрывает некоторые сульфонамидные производные, полезные, например, для лечения психиатрических и неврологических расстройств, таких как расстройства когнитивной функции, болезнь Альцгеймера, старческая деменция, старческое нарушение памяти, поздняя дискинезия, хорея Хантингтона, миоклонус, болезнь Паркинсона, устранение вызванных лекарственными средствами состояний (например, состояния, вызванные кокаином, амфетаминами, алкоголем), депрессия, синдром дефицита внимания, синдром дефицита внимания, вызванный гиперактивностью, психоз, связанные с психозом расстройства познавательной способности, а также вызванный лекарственными средствами психоз. P.L. Ornstein, et al. J. Med.Chem., 43, 4354 (2000), дополнительно раскрывают биарилпропилсульфонамиды, которые являются мощными активаторами рецепторов АМРА. Кроме того, X. Li, et al., Neuropharwacology, 40, 1028 (2001),раскрывают подобные антидепрессанту действия активаторов рецептора АМРА. D.D. Schoepp, et al. andTizzano, et al., Society for Neuroscience Abstracts, 26(1-2), 528.19 and 528.20, 30th Annual Meeting, New Orleans (November 4-9, 2000), раскрывают активный при пероральном приеме активатор рецептора АМРА,который улучшает пространственное обучение и работу памяти у крыс, а также устраняет связанный с фармакологическими средствами и возрастной дефицит обучения и памяти у крыс. Необходимы новые активаторы рецептора АМРА для лечения перечисленных неврологических заболеваний. Краткое описание изобретения Данное изобретение предлагает соединения формулы IR1 представляет собой фенил, необязательно замещенный первым заместителем, выбранным из группы, состоящей из галогена, циано, C1-C4-ацила, -СООН, -NHR3, C1-C2-алкила, замещенного -NHCH3,-N(SO2(C1-C3-алкил 2, -COOH, -CONH2, циано, гидрокси или тетразол-5-илом, -ОСН 2 СООН,-SCH2COOH, -C(O)CH2CH2COOH, -SO2NH2, тетразол-5-ила и 1,2,4-триазол-1-ила; необязательно дополнительно замещенный вторым заместителем, выбранным из группы, состоящей из галогена, трифторметила, циано, нитро, C1-C4-алкокси, гидрокси, C1-C4-алкила, C1-C4-алкилтио, -NHCH2CN, -OCH2CN,-NHSO2CH(СН 3)2 и -C(O)NHR4; необязательно дополнительно замещенный третьим заместителем, выбранным из группы, состоящей из галогена и циано; необязательно дополнительно замещенный четвертым заместителем, выбранным из группы, состоящей из галогена;R4 представляет собой водород, C1-C4-алкил или -SO2(C1-C4-алкил); или их фармацевтически приемлемые соли. Данное изобретение также предлагает промежуточные соединения формулы IIR7 представляет собой -COOR9, -С(О)CH2CH2COOR9, -OCH2COOR9, -SCH2COOR9 или C1-C2-алкил,замещенный-COOR9; каждый из R8 и R9 независимо выбран из группы, состоящей из водорода и C1-C4-алкила, при условии, что как минимум один из R8 и R9 не является водородом; или аддитивные соли с основаниями. Настоящее изобретение предлагает соединение формулы I для применения в качестве фармацевтического препарата. Данное изобретение дополнительно предлагает способ активирования функции рецептора глутамата у пациента, который включает введение указанному пациенту, нуждающемуся в таком лечении, эффективного количества соединения формулы I или его фармацевтически приемлемой соли. Кроме того, настоящее изобретение предлагает способ лечения шизофрении, связанных с шизофренией когнитивных дефицитов, болезни Альцгеймера, деменции по типу Альцгеймера, легкого нарушения когнитивной функции, болезни Паркинсона или депрессии у пациента, который включает введение пациенту, нуждающемуся в таком лечении, эффективного количества соединения формулы I или его фармацевтически приемлемой соли. В соответствии с другим аспектом данное изобретение предлагает применение соединения формулы I или его фармацевтически приемлемой соли для получения лекарственного средства для лечения-2 012310 шизофрении, связанных с шизофренией когнитивных дефицитов, болезни Альцгеймера, деменции по типу Альцгеймера, легкого нарушения когнитивной функции, болезни Паркинсона или депрессии. Кроме того, настоящее изобретение предлагает применение соединения формулы I или его фармацевтически приемлемой соли для лечения шизофрении, связанных с шизофренией когнитивных дефицитов, болезни Альцгеймера, деменции по типу Альцгеймера, легкого нарушения когнитивной функции,болезни Паркинсона или депрессии. Изобретение дополнительно предлагает фармацевтические композиции, которые содержат соединение формулы I или его фармацевтически приемлемую соль, а также фармацевтически приемлемый носитель, разбавитель или вспомогательное вещество. Кроме того, применение соединений формулы I в сочетании с антипсихотическими средствами, антидепрессантами и лекарственными средствами, пригодными для лечения когнитивного расстройства,находится в рамках контекста данного изобретения. WO 2005/040110 раскрывает применение соединений, которые активируют функцию рецептора глутамата, в сочетании с антипсихотическими средствами,антидепрессантами и лекарственными средствами, пригодными для лечения когнитивного расстройства. Подробное описание изобретения В данном описании термин "активирующий функцию рецептора глутамата" означает любую повышенную способность рецепторов глутамата, например рецепторов АМРА, реагировать на глутамат или агонист и включает, не ограничиваясь ими, ингибирование быстрой десенсибилизации или деактивации рецепторов АМРА по отношению к глутамату. Широкий спектр состояний может поддаваться лечению или профилактике с помощью соединений формулы I и их фармацевтически приемлемых солей посредством их действия в качестве активаторов функции рецептора глутамата. Такие состояния включают состояния, связанные с гипофункцией глутамата, например психиатрические и неврологические расстройства, такие как когнитивные расстройства и нейродегенеративные расстройства, например болезнь Альцгеймера; деменция по типу Альцгеймера,возрастная деменция; возрастное нарушение памяти; когнитивные дефициты в результате аутизма, синдром Дауна и другие расстройства центральной нервной системы, возникающие в детском возрасте, постэлектрошоковая терапия когнитивных дефицитов, двигательные расстройства, такие как, например,поздняя дискинезия, хорея Хантингтона, миоклонус, дистония, спастичность, болезнь Паркинсона; устранение вызванных лекарственными средствами состояний (например, состояния, вызванные кокаином,амфетаминами, алкоголем); депрессия; синдром нарушения внимания; синдром дефицита внимания и гиперактивности; психоз, такой как шизофрения; связанные с психозом когнитивные дефициты, такие как шизофрения, индуцированный лекарственными средствами психоз, инсульт и сексуальная дисфункция. Соединения формулы I также могут быть пригодны для улучшения памяти (как краткосрочной, так и долгосрочной), а также способности к обучению. Настоящее изобретение предлагает применение соединений формулы I для лечения каждого из перечисленных состояний. Среднему специалисту в данной области понятно, что познание включает различные "области". Такие области включают краткосрочную память, долгосрочную память, оперативную память, исполнительную функцию и внимание. В данном описании термин "расстройство когнитивной функции" означает любое расстройство, которое характеризуется дефицитом в одной или больше когнитивных областей,в том числе, не ограничиваясь ими, краткосрочной памяти, долгосрочной памяти, оперативной памяти,исполнительной функции и внимания. Кроме того, понятно, что термин "когнитивное расстройство" включает, не ограничиваясь ими, следующие расстройства когнитивной функции: возрастное понижение когнитивной функции, мягкое нарушение когнитивной функции, болезнь Альцгеймера, деменцию, деменцию по типу Альцгеймера, деменцию Паркинсона, деменцию, ассоциированную с тельцами Леви,вызванную химическими веществами стойкую деменцию, вызванную алкоголем стойкую деменцию,вызванное алкоголем нарушение когнитивной функции, вызванную СПИД деменцию, расстройства обучения, когнитивные дефициты после кардиохирургического шунтирования и трансплантации, инсульт,ишемию головного мозга, травму спинного мозга, травму головы, перинатальную гипоксию, остановку сердца, а также гипогликемическое повреждение нейронов, сосудистую деменцию, мультиинфарктную деменцию, когнитивные дефициты, связанные с амиотрофным латеральным склерозом, а также когнитивные дефициты, связанные с рассеянным склерозом. Мягкое когнитивное расстройство определяется как потенциальная продромальная фаза деменции, связанная с болезнью Альцгеймера на основе клинической картины и прогресса заболевания от легкого нарушения когнитивной функции до деменции Альцгеймера со временем (Morris, et al., Arch. Neurol., 58, 397-405 (2001); Petersen, et al., Arch. Neurol., 56,303-308 (1999. Четвертое издание The Diagnostic and Statistical Manual of Mental Disorders (DSM-IV) (1994, American Psychiatric Association, Washington, D.C.) предлагает диагностический инструмент для идентификации многих из описанных в данном описании расстройств. Специалисту в данной области будет понятно,что существуют альтернативные номенклатуры, нозологии и системы классификации описанных в данном описании расстройств, в том числе описанные в Международной статистической классификации заболеваний и сходных медицинских проблем, десятое издание (ICD-10) (1992, Всемирная организация здравоохранения, Женева), и что терминология и системы классификации эволюционируют по мере на-3 012310 учного прогресса в области медицины. Данное изобретение включает фармацевтически приемлемые соли соединений, определенных формулой I. Соединение по данному изобретению может содержать в достаточной мере кислотную группу и соответствующим образом реагировать с любым из целого ряда органических и неорганических оснований с образованием фармацевтически приемлемой соли. Термин "фармацевтически приемлемая соль" в данном описании обозначает соли соединений формулы I, в существенной мере нетоксичные для живых организмов. Типичные фармацевтически приемлемые соли включают соли, которые получают реакцией соединений по данному изобретению с фармацевтически приемлемым органическим или неорганическим основанием. Такие соли известны как аддитивные соли с основаниями. Такие соли включают фармацевтически приемлемые соли, перечисленные в Journal of Pharmaceutical Science, 66, 2-19 (1977), которые известны квалифицированному специалисту. Соли магния, диэтиламина, гемипиперазина и трет-бутиламина являются предпочтительными. Соли трет-бутиламина являются наиболее предпочтительными. Некоторые из соединений по настоящему изобретению содержат один или больше хиральных центров и могут существовать в виде разнообразных стереоизомерных конфигураций. Как результат наличия таких хиральных центров, соединения по настоящему изобретению существуют в форме рацематов,смесей энантиомеров, а также в виде отдельных энантиомеров, а также как диастереомеры и смеси диастереомеров. Все такие рацематы, энантиомеры и диастереомеры находятся в рамках настоящего изобретения. Конкретные стереоизомеры и энантиомеры соединений формулы I могут быть получены средним специалистом в данной области с использованием способов и методов, таких как раскрытые в J. Jacques,et al., "Enantiomers, Racemates, and Resolutions", John Wiley and Sons, Inc., 1981, and E.L. Eliel andS.H. Wilen," Stereochemistry of Organic Compounds", (Wiley-Interscience 1994), а также в европейской патентной заявкеЕР-А-838448, опубликованной 29 апреля 1998 г. Примеры разделения включают методы повторной кристаллизации или хиральную хроматографию. В данном описании термины "галоген", "галогенид" или "гало" означают атом хлора, брома, йода или фтора, если в данном описании не указано иное. В данном описании термин "C1-C4-алкил" обозначает прямую или разветвленную одновалентную,насыщенную алифатическую цепь с четырьмя атомами углерода и включает, не ограничиваясь ими, метил, этил, пропил, изопропил, бутил, изобутил и трет-бутил. Термин "C1-C4-алкил" включает термин"C1-C3-алкил". В данном описании термин "C1-C4-алкокси" обозначает неразветвленную или разветвленную алкильную цепь, содержащую от одного до четырех атомов углерода, присоединенную к атому кислорода. Типичные C1-C4-алкоксигруппы включают метокси, этокси, пропокси, изопропокси, бутокси,трет-бутокси и т.п. Термин "C1-C4-алкокси" включает термин "C1-C3-алкокси". В данном описании термин "C1-C4-ацил" обозначает неразветвленную или разветвленную алкильную цепь, содержащую от одного до трех атомов углерода, присоединенную к карбонильной группе. Примеры включают, не ограничиваясь ими, ацетил, пропионил, бутирил, 2-метилпропионил и т.п. Термин "C1-C4-ацил" включает термин "C1-C3-ацил". В данном описании термин "C1-C4-алкилтио" обозначает неразветвленную или разветвленную алкильную цепь, содержащую от одного до четырех атомов углерода, присоединенную к атому серы. Типичные C1-C4-алкилтиогруппы включают метилтио, этилтио, пропилтио изопропилтио, бутилтио,трет-бутилтио и т.п. Термин "C1-C4-алкилтио" включает термин "C1-C3-алкилтио". Дополнительный вариант данного изобретения представляет собой соединения формулы I, где А выбран из группы, состоящей из следующего: Некоторые классы соединений формулы I являются предпочтительными активаторами АМРА. В следующих абзацах описаны такие предпочтительные классы: а) А представляет собойn) соединение формулы I, которое представляет собой свободную кислоту; о) соединение формулы I, которое представляет собой соль; р) соединение формулы I, которое представляет собой гидрат;q) соединение формулы I, которое представляет собой безводное вещество;r) соединение формулы I, которое представляет собой соль гемипиперазина;s) соединение формулы I, которое представляет собой соль диэтиламина;t) соединение формулы I, которое представляет собой соль трет-бутиламина. Предпочтительные варианты изобретения включают все комбинации пп.a)-t). Особенно предпочтительными соединениями формулы I являются соединения, где А представляет собойC1-C4-алкил. Также предпочтительными являются соединения, где А представляет собойR2 представляет собой изопропил. Особенно предпочтительными являются соединения, где А представляет собойR2 представляет собой изопропил. Наиболее предпочтительными являются соединения, где А представляет собой-5 012310 Хотя все промежуточные соединения формулы II пригодны для получения соединений по данному изобретению, некоторые классы являются предпочтительными:z) R6 находится в положении 2 фенильного кольца, к которому он присоединен, и выбран из группы, состоящей из водорода, циано и C1-C4-алкокси; аа) R9 представляет собой C1-C4-алкил. Особенно предпочтительными соединениями формулы II являются соединения, где А представляет собойR6 находится в положении 2 фенильного кольца, к которому присоединен, и выбран из группы, состоящей из циано и C1-C4-алкокси;R9 представляет собой C1-C4-алкил. Также предпочтительными являются соединения, где А представляет собойR9 представляет собой C1-C4-алкил. Наиболее предпочтительными являются соединения, где А представляет собойR9 представляет собой метил или этил. Соединения формулы I могут быть получены средним специалистом в данной области по известным из уровня техники методикам и способам. Более конкретно, соединения формулы I могут быть получены в соответствии со схемами, способами и примерами, приведенными ниже. Реагенты и исходные материалы доступны среднему специалисту в данной области. Все заместители, если не указано иное,являются такими, как было определено выше. Соединения формулы I, где А и R1 являются такими, как определено выше, могут быть получены,как проиллюстрировано на следующей схеме, где (i) представляет собой подходящую арилбороновую кислоту, арилтриметилстаннил или арилбороновый сложный эфир и X представляет собой бром, йод,хлор или трифторметансульфокси. Осуществляют сочетание соединения структуры (ii) с подходящей фенилбороновой кислотой, подходящим фенилбороновым сложным эфиром или подходящим фенилтриметилстаннаном (i) в условиях реакции сочетания по типу Сузуки или Штилле, хорошо известных среднему специалисту в данной области, с получением соединения формулы I. См. Suzuki, A., Journal of Organometallic Chemistry, 576, 147168 (1999) and Miyaura and Suzuki, Chemical Reviews, 95, 2457-2483 (1995) относительно примеров общих техник перекрестного сочетания и способов получения подходящих исходных материалов и реактивов. Более конкретно, соединение структуры (ii) объединяют с приблизительно 1,0-1,5 экв. подходящей фенилбороновой кислоты или эфира (i) в подходящем органическом растворителе или подходящей смеси растворителей. Примеры подходящих органических растворителей включают 1,4-диоксан, диметоксиэтан (ДМЭ), ДМФА, бензол, толуол, ацетон, этанол (EtOH) и т.п. Примеры подходящих смесей растворителей включают ДМЭ/EtOH, ТГФ:вода и т.п. Подходящий катализатор, такой как тетракис-(трифенилфосфин)палладий, дихлор-бис-(трифенилфосфин)палладий(II), Pd(PCy3)2Cl2 или[1,1-бис-(дифенилфосфино)ферроцен]дихлорпалладий(II) или палладий черный и подходящее основание, например карбонат натрия, добавляют к реакционной смеси при перемешивании. Альтернативно, квалифицированный специалист будет понимать, что соединения формулы (I) также можно получить сочетанием подходящего арилгалогенида с подходящей арилбороновой кислотой,подходящим арилбороновым сложным эфиром или подходящим арилтриметилстанниловым соединением в условиях реакции сочетания типа Сузуки или Штилле, хорошо известных среднему специалисту в данной области, с получением соединения формулы I. Необходимые производные бороновой кислоты и эфиры могут быть получены в соответствии со следующей схемой, где А является таким, как было определено выше, и Hal представляет собой бром или йод. Схема II Подходящим образом замещенный фенол (iii) реагирует с трифлатным реагентом, таким как трифлатный ангидрид или N-фенилтрифторметансульфонимид, в присутствии основания, например ДМАП или гидроксида натрия, в подходящем растворителе, таком как метиленхлорид или тетрагидрофуран, с получением трифлата (iv). Полученный трифлат растворяют в подходящем растворителе, таком как ацетонитрил или диметилсульфоксид, и проводят реакцию в присутствии основания, такого как триэтиламин или ацетат калия, катализатора, такого как [1,1'-комплекс бис-(дифенилфосфино)ферроцен]дихлорпалладия(II), и борана, такого как бис-(пинаколят)боран, с образованием необходимого боронового эфира (ia). Альтернативно, при необходимости или желании могут использоватьсяPdCl2(dppf) и основание ацетат калия в диметилформамиде. Сложный эфир бороновой кислоты также может быть получен реакцией фенилгалогенида (v) в подходящем растворителе, таком как ацетонитрил или диметилсульфоксид, с добавлением основания, такого как триэтиламин или ацетат калия. Добавляют катализатор, такой как комплекс [1,1'-бис-(дифенилфосфино)ферроцен]дихлорпалладия(II), и боран, такой как бис-(пинаколят)боран. Квалифицированному специалисту будет понятно, что полученный сложный эфир бората может быть гидролизован в условиях, хорошо известных в данной области, с помощью кислоты, такой как хлористо-водородная кислота, или в подходящем растворителе, таком как ацетон, в присутствии окислителя, такого как раствор периодата натрия и ацетата аммония, с получением бороновой кислоты (ib).-7 012310 Необходимые фенилгалогениды (v) могут быть получены, как показано на схеме III, где А является таким, как было определено выше. Схема III Анилин (vi) реагирует с подходящим окислителем, таким как изоамилнитрит, в подходящем растворителе, таком как ацетонитрил, в присутствии источника галогенида, такого как дийодметан, с получением соединения формулы (v). Некоторые соединения формулы I могут служить промежуточными соединениями для дальнейшего синтеза соединений формулы I посредством реакций и превращений функциональных групп, знакомых специалистам в данной области. См. Larock, R., "Comprehensive Organic Transformations," VCH Publishing, Inc., New York, 1989. Например, аминогруппа реагирует с подходящим сульфонилхлоридом в присутствии пиридина или водного основания, такого как триэтиламин, в условиях, хорошо известных из уровня техники, с получением соответствующего сульфонамида. Кроме того, нитрозамещенные производные легко превращаются в амины путем реакции содержащего нитрогруппу соединения с подходящим восстанавливающим агентом, таким как хлорид олова, в подходящем растворителе, например этаноле. Кроме того, эфиры карбоновых кислот формулы II превращают в карбоновые кислоты формулы I в условиях, хорошо известных опытному специалисту, например, путем обработки эфира формулы II в подходящем растворителе или смеси растворителей, таких как ТГФ, метанол, этанол и т.п., водой с небольшим избытком подходящего основания, такого как гидроксид лития, гидроксид натрия, гидроксид калия и т.п. Полученную карбоновую кислоту затем превращают в первичный амид в хорошо известных условиях. Например, соединение карбоновой кислоты формулы I растворяют в подходящем органическом растворителе, таком как метиленхлорид или ТГФ, и обрабатывают оксалилхлоридом, необязательно с последующим добавлением каталитического количества ДМФА, при перемешивании. Реакционную смесь перемешивают и упаривают, затем растворяют в подходящем органическом растворителе, таком как метиленхлорид или ТГФ, и обрабатывают небольшим избытком гидроксида аммония или раствором аммиак/метанол или аммиак/диоксан при перемешивании. Первичный амид соединения формулы I может быть превращен в тетразолильное соединение формулы I в стандартных условиях. Например, первичное амидное соединение формулы I реагирует с тетрахлоридом силикона и азидом натрия в присутствии подходящего органического растворителя, такого как ацетонитрил. Альтернативно, тетразолильные соединения формулы I получают реакцией содержащего цианогруппу соединения формулы I с азидом натрия и триэтиламином в подходящем органическом растворителе. Описанные в данном описании примеры представляют типичный синтез соединений по данному изобретению. Реагенты и исходные материалы доступны среднему специалисту в данной области. Номенклатура для примеров данного описания соответствует AutoNom 2000 Add-in для MDLISIS/Desktop. В данном описании приведенные в таблице ниже термины имеют следующие значения.(1995), кипятят с обратным холодильником (120 С) метил-3-аминотиофен-2-карбоксилат (42,8 г,0,27 моль) с 2 M водным раствором гидроксида натрия (270 мл) в течение 30 мин. Охлаждают реакционную смесь до 0 С и подкисляют до рН 5,0 (Конго красный) с помощью концентрированной хлористоводородной кислоты. Густой осадок отфильтровывают. Твердое вещество сушат, растворяют в ацетоне(300 мл) и сушат полученный раствор (MgSO4), отфильтровывают и упаривают при 20 С. Полученное густое масло немедленно обрабатывают дигидратом щавелевой кислоты (26,7 г) в 2-пропаноле (100 мл) при 38 С в течение 45 мин. Дают смеси остыть до комнатной температуры и разбавляют диэтиловым эфиром (40 мл). Твердое вещество отфильтровывают и промывают диэтиловым эфиром. Полученное твердое вещество белого цвета (33,1 г) становится бледно-сиреневым под действием света и воздуха. Растворяют полученную соль (33,1 г) в воде (400 мл) и подщелачивают концентрированным раствором гидроксида аммония. Экстрагируют смесь метиленхлоридом (3200 мл), экстракты объединяют и сушат(MgSO4), отфильтровывают и упаривают с получением коричневого масла (15 г, 56%). Растворяют полученный материал (15 г, 0,15 моль) в метиленхлориде (300 мл) и добавляют Et3N (42,2 мл, 0,3 моль) при 0 С. По каплям при 0 С добавляют раствор (Вос)2O (39,3 г, 0,18 моль) в метиленхлориде (100 мл) и перемешивают смесь в течение ночи при комнатной температуре. Контролируют полноту исчезновения исходного материала с помощью ТСХ (гексан/EtOAc 9:1). Гасят реакцию добавлением воды (200 мл). Экстрагируют смесь метиленхлоридом (2200 мл) и объединяют экстракты, сушат (MgSO4), отфильтровывают и выпаривают. Очищают неочищенный материал флэш-хроматографией (силикагель,гексан/EtOAc 9:1) с получением 20,1 г (67%) (трет-бутокси)-N-(3-тиофенил)карбоксамида в виде твердого вещества белого цвета. По способу, аналогичному описанному Campaigne, E. и Monroe, P. A. J.A.C.S., 76, 2447-2450 (1954),к кипящему раствору (трет-бутокси)-N-(3-тиофенил)карбоксамида (21,0 г, 0,1 моль) в метиленхлориде(400 мл) маленькими порциями добавляют N-йодсукцинимид (23,7 г, 0,1 моль). Устанавливают температуру нагревательной бани на уровне 65 С в течение 20 мин. Переносят реакционную смесь в среду с комнатной температурой, выпаривают растворитель и очищают неочищенный материал флэшхроматографией (силикагель, гексан/EtOAc 9:1) с получением 30,0 г (88%) (трет-бутокси)-N-(2-йод(3 тиофенилкарбоксамида в виде твердого вещества белого цвета. Нагревают (трет-бутокси)-N-(2-йод(3-тиофенилкарбоксамид (16,88 г, 0,52 моль), 4-бромфенилбороновую кислоту (15,65 г, 0,78 моль), Na2CO3 (1,01 г, 1,04 моль) и Pd(PPh3)4 (5,79 г, 0,052 моль) в 375 мл безводной и дезоксигенированной смеси 2:1 ДМЭ/EtOH до 80 С в атмосфере азота в течение 24 ч. Выпаривают органические растворители, после чего добавляют воду (200 мл). Экстрагируют смесь метиленхлоридом (3150 мл) и объединяют органические фракции, сушат (безводный MgSO4), отфильтровывают и упаривают до получения неочищенной смеси в виде твердого вещества желтоватого цвета. Очистка флэш-хроматографией (силикагель, гексан/EtOAc 49:1) дает 10,8 г (60%) (трет-бутокси)-N-[2-(4 бромфенил)(3-тиофенил)]карбоксамида в виде бледно-желтого твердого вещества. По каплям обрабатывают раствор (трет-бутокси)-N-[2-(4-бромфенил)(3-тиофенил)]карбоксамида(10,8 г, 0,3 моль) в EtOAc (75 мл) при 0 С 244 мл (8 мл/ммоль) свежеприготовленной 1 н. HCl в EtOAc и перемешивают смесь при комнатной температуре в течение ночи. Растворяют белый осадок в Н 2 О(100 мл) и нейтрализуют насыщенным раствором NaHCO3. Экстрагируют смесь EtOAc (3100 мл) и объединяют органические фракции, сушат и упаривают с получением слабоокрашенного твердого вещества. Очистка неочищенного материала флэш-хроматографией (силикагель, гексан/AcOEt 49:1, затем 9:1) дает 5,7 г (74%) 2-(4-бромфенил)тиофен-3-иламина в виде бледно-желтого твердого вещества. Медленно добавляют к раствору 2-(4-бромфенил)тиофен-3-иламина (0,6 г, 2,36 ммоль) в сухом дихлорметане (10 мл) при 0 С, ДБУ 1,41 мл (9,45 ммоль) и изопропилсульфонилхлорида (0,53 мл,4,72 ммоль) (температура все время находится на уровне 0 С). Ледяную баню удаляют и перемешивают смесь при комнатной температуре в течение ночи. Добавляют насыщенный водный раствор NH4Cl(10 мл) и экстрагируют раствор EtOAc (210 мл). Объединенные органические фракции сушат и упаривают под вакуумом. Очищают неочищенный остаток флэш-хроматографией (силикагель, гексан/EtOAc 4:1) с получением 0,8 г (94%) [2-(4-бромфенил)тиофен-3-ил]амида пропан-2-сульфоновой кислоты. Дезоксигенируют смесь [2-(4-бромфенил)тиофен-3-ил]амида пропан-2-сульфоновой кислотыPd(dppf)Cl2 (0,3 г, 0,37 ммоль) в сухом ДМФА (20 мл), продувая ее азотом, и нагревают смесь до 80 С в течение ночи. Добавляют воду (20 мл) и экстрагируют реакционную смесь диэтиловым эфиром(320 мл). Промывают объединенные органические фракции водой, сушат и упаривают с получением неочищенного темного твердого вещества. Очистка флэш-хроматографией (силикагель, гексан/AcOEt 7:1) дает 0,65 г (43%) указанного в заголовке соединения в виде бледно-желтого твердого вещества. Получение 2. (4'-(Бороновой кислоты)бифенил-2-ил)амид пропан-2-сульфоновой кислоты. Добавляют 4-бромфенилбороновую кислоту (5,0 г, 24,82 ммоль), тетракис-(трифенилфосфин)палладий(0) (0,717 г, 0,620 ммоль) и 2 М раствор Na2CO3 (10 мл) к раствору 2-йоданилина (4,5 г,20,69 ммоль) в смеси толуола (2 мл):этанола (20 мл), дезоксигенируют и нагревают до 80 С в атмосфере азота. Через 4 ч добавляют воду и экстрагируют EtOAc. Объединенные органические фракции сушат над сульфатом натрия, отфильтровывают и упаривают при пониженном давлении с получением остатка. Остаток очищают флэш-хроматографией (силикагель, EtOAc/гексан 1:12), с получением 4'-бромбифенил-2 иламина (3,53 г, 69%). МС (m/е): 248 (M+1); 249 (M+2). Добавляют по каплям ДБУ (8,76 мл, 56,92 ммоль) к раствору 4'-бромбифенил-2-иламина (3,53 г,14,23 ммоль) в дихлорметане (50 мл) при 0 С с последующим добавлением по каплям изопропилсульфонилхлорида (3,29 мл, 28,46 ммоль) и перемешивают реакционную смесь при комнатной температуре в течение 24 ч. Растворитель выпаривают при пониженном давлении, остаток очищают на диоксиде кремния, элюируя смесью от EtOAc/гексан (1:4) до EtOAc с получением указанного в заголовке соединения- 10012310 Нагревают до 80 С смесь (4'-бромбифенил-2-ил)амида пропан-2-сульфоновой кислоты (4,0 г,11,22 ммоль), бис-(пинаколят)диборона (3,22 г, 12,34 ммоль), комплекса [1,1'-бис-(дифенилфосфино)ферроцен]дихлорпалладия(II) с дихлорметаном (1:1) (0,276 г, 0,337 ммоль) и ацетата калия (3,32 г, 33,87 ммоль) в сухом диметилсульфоксиде (25 мл). Через 16 ч добавляют воду и экстрагируют EtOAc. Объединяют органические фракции, сушат над сульфатом натрия и выпаривают при пониженном давлении. Растворяют остаток в дихлорметане и промывают раствором 0,1 н. HCl. Объединяют органические фракции, сушат над сульфатом натрия, отфильтровывают и упаривают при пониженном давлении. Очищают остаток флэш-хроматографией (силикагель, EtOAc/гексан 1:3) с получением(4,07 г, 90%). МС (m/е): 424 (М+23); 400 (М-1). Добавляют периодат натрия (1,12 г, 5,25 ммоль) с последующим добавлением 1 н. раствора ацетата аммония (8 мл) к суспензии [4'-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)бифенил-2-ил)амида пропан-2-сульфоновой кислоты (0,7 г, 1,75 ммоль) в смеси ацетона (16 мл) и воды (0,8 мл). Перемешивают смесь при комнатной температуре в атмосфере азота на протяжении 20 ч. Осадок отфильтровывают и органическую фракцию упаривают. Экстрагируют водный слой дихлорметаном. Органические фракции объединяют, сушат над сульфатом натрия и выпаривают растворитель при пониженном давлении. К остатку добавляют гексан и трет-бутилметиловый эфир до тех пор, пока образуется твердое вещество, которое отфильтровывают с получением указанного в заголовке соединения (0,37 г, 67%). МС (m/е): 337 (M+18); 318 (M-1). Получение 3. 4-[4-(4,4,5,5-Тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]пиридин-3-иламид пропан-2-сульфоновой кислоты. Переносят 4-гидрокси-3-нитропиридин (6,18 г, 44,2 ммоль) в оксихлорид фосфора (16 мл) и нагревают до 45 С. Как только температура 45 С достигнута, добавляют пентахлорид фосфора (8,04 г,38,6 ммоль) в виде единой порции. Энергично перемешивают полученную суспензию желтого цвета и нагревают при кипячении с обратным холодильником (масляная баня, до 125 С) в инертной атмосфере. Через 3 ч при 125 С суспензия желтого цвета превращается в прозрачный раствор желтого цвета. Охлаждают смесь до комнатной температуры, упаривают до состояния масла, охлаждают до 0 С на ледяной бане и обрабатывают 10 мл воды и 20 мл дихлорметана при энергичном перемешивании. Водную фракцию подщелачивают насыщенным раствором бикарбоната натрия и экстрагируют дихлорметаном (3). Сушат объединенные органические фракции над безводным сульфатом натрия, отфильтровывают и упаривают с получением 6,98 г 4-хлор-3-нитропиридина, который кристаллизуется при отстаивании (выход 99%). 4-Хлор-3-нитропиридин (6,9 г, 43,5 ммоль), 4-бромфенилбороновую кислоту (8,05 г, 40,1 ммоль),карбонат калия (11,10 г, 80,3 ммоль) и тетракис-трифенилфосфинпалладий (2,31 г, 2,0 ммоль) переносят в ДМЭ (200 мл) и нагревают при кипячении с обратным холодильником (100 С) в течение ночи. Смесь охлаждают до комнатной температуры и фильтруют через слой Celite, который промывают EtOAc. Фильтрат упаривают с получением неочищенного коричневого масла. Очистка флэш-хроматографией(силикагель, гексан/EtOAc) дает 4-(4-бромфенил)-3-нитропиридин (8,52 г) в виде желтого масла (выход 76%). Перемешивают 4-(4-бромфенил)-3-нитропиридин (8,52 г, 30,5 ммоль) в ледяной уксусной кислоте(150 мл) и добавляют порошок железа с размером частиц 325 меш (8,40 г, 150,4 ммоль). Нагревают смесь до 80 С в течение 40 мин, после чего смесь приобретает серый цвет. Смесь фильтруют через Celite и промывают твердое вещество EtOAc. Органическую фракцию промывают водой. Водную фракцию подщелачивают до рН 8 раствором NaOH и экстрагируют EtOAc (2). Объединенные органические фракции промывают водой, насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом натрия, отфильтровывают и упаривают с получением 7,25 г неочищенного масла коричневого цвета. Очистка флэш-хроматографией (силикагель, гексан/EtOAc) дает 4-(4-бромфенил)пиридин-3-иламин(4,64 г) в виде твердого вещества белого цвета (выход 61%). Помещают 4-(4-бромфенил)пиридин-3-иламин (4,6 г, 18,5 ммоль) в безводный дихлорметан(100 мл). Добавляют ДБУ (11 мл, 73,5 ммоль) и перемешивают раствор при 0 С в течение 3 мин в инертной атмосфере. По каплям добавляют изопропилсульфонилхлорид на протяжении 10 мин. Дают смеси нагреться до комнатной температуры и кипятят с обратным холодильником (40 С) в течение ночи. Гасят смесь добавлением насыщенного раствора хлорида аммония. Водную фракцию экстрагируют дихлорметаном (2). Промывают объединенные органические фракции насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом натрия, отфильтровывают и упаривают с получением 9,1 г неочищенного остатка коричневого цвета. Очистка флэш-хроматографией (силикагель, гексан/EtOAc) с последующей обратной очисткой дает целевое соединение [4-(4-бромфенил)пиридин-3-ил]амид пропан 2-сульфоновой кислоты (2,68 г) в виде твердого вещества белого цвета (выход 41%).[1,1'-бис-(дифенилфосфино)ферроцен]дихлорпалладия(II) с дихлорметаном (1:1) (0,277 г, 0,339 ммоль) в безводный ДМФА (12 мл) и нагревают до 80 С в инертной атмосфере в течение ночи. Добавляют воду (4 мл) и реакционную смесь фильтруют через тонкий слой диоксида кремния. Промывают слой диоксида кремния EtOAc. Промывают органический фильтрат 0,05 н. HCl, водой (4), сушат над безводным сульфатом натрия, отфильтровывают и упаривают с получением 3,8 г неочищенного темного остатка. Очистка флэш-хроматографией (силикагель, гексан/EtOAc) дает указанное в заголовке соединение (1,85 г) в виде твердого вещества бежевого цвета (выход 79%). Получение 4. Этиловый эфир 4'-[3-(пропан-2-сульфониламинотиофен-2-ил]бифенил-4-карбоновой кислоты В укупоренной пробирке нагревают при перемешивании 2-[4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)фенил]тиофен-3-иламид пропан-2-сульфоновой кислоты (0,5 ммоль), этиловый эфир 4-йодбензойной кислоты (0,75 ммоль), 2 М водный раствор Na2CO3 (0,2 мл) и Pd(PPh3)4(0,05 ммоль) в 4,0 мл безводного ДМЭ до 100 С в течение 24 ч. Органический растворитель выпаривают перед добавлением воды (10 мл). Экстрагируют смесь дихлорметаном (320 мл), объединенные органические фракции сушат (Na2SO4) и упаривают до получения неочищенной смеси. Очистка флэшхроматографией (силикагель, гексан/EtOAc) дает указанное в заголовке соединение. Получение. 5-(4-Бромбензил)-2 Н-тетразол. Перемешивают смесь SiCl4 (1,7 г, 10 ммоль, 2 экв.) и NaN3 (1,95 г, 30 ммоль, 6 экв.) в 50 мл ацетонитрила в течение 2 ч. Добавляют 1,07 г 2-(4-бромфенил)ацетамида (5 ммоль, 1 экв.) и нагревают до 85 С в течение 5 ч. Охлаждают до комнатной температуры, твердое вещество отфильтровывают и промываютEtOAc. Промывают эфирный слой водой, насыщенным водным раствором хлорида натрия, сушат надMgSO4 и растворитель выпаривают с получением 900 мг указанного в заголовке соединения (80%). МС (m/е): 237,0. Получение 6. 3-(4-Бромфенил)-N-метилпропионамид. Добавляют оксалилхлорид (1,75 мл, 2,54 г, 4 экв.) к раствору 3-(4-бромфенил)пропионовой кислоты в метиленхлориде (100 мл), который содержит 0,1 мл ДМФА, при 0 С, дают реакционной смеси нагреться до комнатной температуры и перемешивают в течение 1 ч. Выпаривают растворитель и растворяют остаток в 10 мл ТГФ. Добавляют половину раствора ТГФ к 20 мл метиламина (2 М) и перемешивают еще в течение 1 ч. К раствору добавляют воду для растворения твердого вещества, промывают органическую фракцию 2 н. HCl, водой, насыщенным водным раствором хлорида натрия и сушат над MgSO4. Выпаривают растворитель с получением 500 мг, 41% указанного в заголовке соединения. МС: 246,0. Получение 7. 4-[1,2,4]-Триазол-1-ил-фениловый эфир трифторметансульфоновой кислоты. Добавляют пиридин (0,74 г, 9,3 ммоль, 3 экв.) к раствору 4-[1,2,4]триазол-1-илфенола (500 мг,3,1 ммоль, 1 экв.) при -78 С и перемешивают в течение 15 мин. Медленно добавляют трифлатный ангидрид (1,05 г, 3,7 ммоль, 1,2 экв.). Реакционной смеси дают нагреться до комнатной температуры и перемешивают в течение 3 ч. Выливают смесь в 20 мл 1 н. HCl (холодный). Промывают органическую фракцию водой (210 мл), насыщенным бикарбонатом натрия и насыщенным водным раствором хлорида натрия. Сушат и выпаривают с получением 860 мг (95%) указанного в заголовке соединения. МС: 294,0. Получение 8. Метиловый эфир 4-метилсульфанил-2-трифторметансульфонилоксибензойной кислоты. Объединяют метиловый эфир 2-гидрокси-4-метилсульфанилбензойной кислоты (5,072 г,25,58 ммоль), пиридин и CH2Cl2 при 0 С и перемешивают. По каплям добавляют трифлатный ангидрид(5,1 мл, 30,31 ммоль) на протяжении нескольких минут. Через 4 ч разбавляют смесь CH2Cl2 и промывают 1 н. HCl, H2O и сушат над Na2SO4, фильтруют и упаривают при пониженном давлении с получением метилового эфира 4-метилсульфанил-2-трифторметансульфонилоксибензойной кислоты (7,775 г, 92%). МС (m/е): 330,8 (М+1). Получение 9. (4'-Бромбифенил-2-ил)амид пропан-2-сульфоновой кислоты. Объединяют 4-бромфенилбороновую кислоту (6,064 г, 30,195 ммоль), 2-йодфениламин (5,532 г,25,257 ммоль), толуол, 2 н. Na2CO3 (13 мл, 26 ммоль) и тетракис-(трифенилфосфин)палладий(0) (0,849 г) и нагревают до 80 С. Через 4 ч охлаждают до комнатной температуры и перемешивают в течение 16 ч. Разбавляют реакционную смесь EtOAc и снова экстрагируют водный слой EtOAc. Объединяют органи- 12012310 ческие фракции, промывают Н 2 О и сушат над Na2SO4, отфильтровывают и упаривают при пониженном давлении. Очищают остаток флэш-хроматографией (силикагель), элюируя гексаном с градиентом до смеси 10% EtOAc/гексан с получением 4'-бромбифенил-2-иламина (4,008 г, 64%). ЖХ/МС 247. Добавляют 4'-бромбифенил-2-иламин (1,038 г, 4,183 ммоль) к CH2Cl2 и охлаждают до 0 С. По каплям в колбу добавляют сначала ДБУ (2,6 мл, 17,038 ммоль), затем изопропилсульфонилхлорид (0,95 мл,8,206 ммоль) и нагревают колбу до комнатной температуры. Через 18 ч контролируют протекание реакции. Если исходный материал все еще присутствует в реакционной смеси, добавляют ДБУ (1 мл), затем изопропилсульфонилхлорид (0,4 мл) и перемешивают еще в течение 2 ч. Полученный продукт очищают с использованием флэш-хроматографии (силикагель, 25% EtOAc/гексан) с получением (4'-бромбифенил 2-ил)амида пропан-2-сульфоновой кислоты (1,116 г, 75%). МС (m/е): 351,9 (M-1). Получение 10. трет-Бутиловый эфир 5-(4-бромфенил)пиразол-1-карбоновой кислоты. Перемешивают смесь 5-(4-бромфенил)пиразола (577 мг, 2,6 ммоль, 1 экв.), ди-трет-бутилдикарбоната (737 мг, 3,38 ммоль) и диметиламинопиридина (32 мг, 0,25 ммоль) в 16 мл ацетонитрила в течение ночи. Добавляют 200 мл диэтилового эфира и 50 мл воды. Органическую фракцию промывают водой, насыщенным водным раствором хлорида натрия и выпаривают растворитель с получением указанного в заголовке соединения (800 мг, 95%). Получение 11. (4-Бромфенокси)ацетонитрил. При комнатной температуре в инертной атмосфере смешивают 4-бромфенол (1,4 ммоль) с ацетонитрилом (5 мл) и водой (2 мл) (в смеси 5 мл ацетонитрила и 2 мл воды), добавляют K2CO3 (3 ммоль) и бромацетонитрил (1,5 ммоль). Нагревают смесь до 80 С в течение 16 ч. Образование конечного продукта контролируют с помощью ЖХ/МС. Выпаривают растворитель и добавляют воду. Продукт экстрагируют ДХМ (3), органические фракции объединяют и выпаривают с получением указанного в заголовке соединения. Получение 12. 2-Бром-5-(цианометиламино)бензонитрил. Смешивают 5-амино-2-бромбензонитрил (0,76 ммоль) в безводном ТГФ (3 мл),N,N-диизопропилэтиламине (0,92 ммоль) и бромацетонитриле (1,0 ммоль) при комнатной температуре в инертной атмосфере. Нагревают смесь до 100 С в течение 16 ч в запаянной пробирке. Охлаждают на ледяной бане, осадок отфильтровывают и фильтрат упаривают досуха с получением неочищенного остатка. Очищают флэш-хроматографией (силикагель, CHCl3/этанол/NH4OH 9:1:0,1) с получением указанного в заголовке соединения. Получение 13. Метиловый эфир 4-бром-3-(пропан-2-сульфониламино)бензойной кислоты. Добавляют SnCl2-2H2O (8,5 ммоль) к раствору метилового эфира 4-бром-3-нитробензойной кислоты(1,2 ммоль) в EtOH (40 мл). Нагревают реакционную смесь до 70 С в течение 30 мин и затем выдерживают при комнатной температуре в течение ночи. Добавляют насыщенный раствор NaHCO3 (рН 11-12) и экстрагируют EtOAc (250 мл). Сушат над NaSO4, отфильтровывают и выпаривают досуха с получением метилового эфира 4-бром-3-аминобензойной кислоты. По каплям добавляют ДБУ (0,5 ммоль) к суспензии предварительно подготовленного амина(0,1 ммоль) в дихлорметане (15 мл) при 0 С с последующим добавлением по каплям изопропилсульфонилхлорида (0,2 ммоль) и перемешивают реакционную смесь при комнатной температуре в течение 24 ч. Растворитель удаляют при пониженном давлении. Очищают флэш-хроматографией (силикагель,гексан/EtOAc). Целевые фракции упаривают с получением указанного в заголовке соединения. Получение 14. Метиловый эфир 4-бром-3-(метансульфониламино)бензойной кислоты. Добавляют метансульфонилхлорид (0,12 ммоль) к суспензии метилового эфира 4-бром-3 аминобензойной кислоты (0,1 ммоль) и Et3N (0,1 ммоль) в дихлорметане при 0 С. Перемешивают в течение 4 ч при комнатной температуре. Добавляют насыщенный раствор NaCl (15 мл) и экстрагируют дихлорметаном (250 мл). Сушат над NaSO4, отфильтровывают и упаривают досуха. Очищают остаток с использованием флэш-хроматографии (силикагель, гексан/EtOAc) с получением указанного в заголовке соединения. Получение 15. Метиловый эфир 4'-йод-5-трифторметилбифенил-2-карбоновой кислоты. Нагревают раствор метилового эфира 4'-амино-5-трифторметилбифенил-2-карбоновой кислоты(1,0 ммоль), ацетонитрила и дийодметана (3,5 ммоль) до 35 С с перемешиванием в атмосфере азота. Как только температура 35 С достигнута, медленно добавляют изоамилнитрит (2,5 ммоль), чтобы избежать слишком интенсивного выделения тепла. Нагревают реакционную смесь до 65-70 С в течение 2 ч. Источник тепла убирают и реакционную смесь упаривают под вакуумом. Очищают радиальной хроматографией, элюируя смесью EtOAc/дихлорметан/гексаны, с получением конечного продукта (52%). МС (m/е): 408,0 (М+1).- 13012310 Получение 16. Метиловый эфир 3-хлор-4-трифторметансульфонилоксибензойной кислоты. Трифлатный ангидрид (6,7 мл, 39,8 ммоль) по каплям добавляют к раствору метил 3-хлор-4-гидроксибензоата (5,42 г, 29,0 ммоль), ДМАП (490 мг, 4,0 ммоль) и триэтиламина (5,6 мл,40,1 ммоль) в безводном дихлорметане (200 мл). При комнатной температуре в атмосфере азота перемешивают смесь в течение ночи. Гасят смесь добавлением насыщенного водного раствора хлорида аммония. Органическую фракцию отделяют, водную фракцию экстрагируют дихлорметаном (3). Объединенные органические фракции промывают насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом натрия, отфильтровывают и упаривают с получением неочищенного коричневого масла. Переносят полученное неочищенное масло в гексан и промывают органическую фракцию водой(3), сушат над безводным сульфатом натрия, отфильтровывают и упаривают с получением указанного в заголовке соединения. Получение 17. Этиловый эфир 4-этокси-3-йодбензойной кислоты. Этил-4-гидроксибензоат (102,2 г, 0,61 моль) растворяют в АсОН (200 мл) при 65 С, по каплям добавляют раствор ICl в АсОН (500 мл). По окончании добавления смесь перемешивают при 65 С в течение 6 ч. После охлаждения выливают в смесь воды со льдом, отфильтровывают и промывают водой. Полученное твердое вещество растворяют в CH2Cl2, сушат над MgSO4, отфильтровывают и упаривают под вакуумом. Неочищенный продукт очищают флэш-хроматографией (силикагель, CH2Cl2) с получением 131,3 г этилового эфира 4-гидрокси-3-йодбензойной кислоты (выход 74%). К смеси полученного эфира (3,10 г, 10,61 ммоль) и карбоната калия (2,87 г, 20,75 ммоль) в 40 мл ацетонитрила добавляют йодэтан (1,3 мл, 16,25 ммоль) при комнатной температуре и энергичном перемешивании. Полученную белую суспензию кипятят с обратным холодильником в течение 1,5 ч. Ацетонитрил выпаривают и заменяют EtOAc. Промывают органическую фракцию водой, затем насыщенным водным раствором хлорида натрия. Сушат над безводным сульфатом натрия, отфильтровывают и упаривают с получением указанного в заголовке соединения в виде желтого масла. Получение 18. Этиловый эфир 3-гидрокси-4-йодбензойной кислоты. Растворяют 3-гидрокси-4-йодбензойную кислоту (2,02 г, 7,65 ммоль) в этаноле, насыщенном газообразным HCl (50 мл). Раствор кипятят с обратным холодильником в течение ночи. Этанол выпаривают с получением указанного в заголовке соединения (выход 97%). Получение 19. 5-Бром-1,3-дифтор-2-метоксибензол. По каплям добавляют йодметан (2,0 мл, 32,1 ммоль) к суспензии 4-бром-2,6-дифторфенола (5,90 г,28,2 ммоль) и карбоната калия (4,40 г, 31,8 ммоль) в ацетоне (50 мл) при комнатной температуре и энергичном перемешивании. Смесь кипятят с обратным холодильником в течение ночи. Выпаривают ацетон и добавляют дихлорметан. Фильтруют через слой диоксида кремния, элюируя продукт дихлорметаном/EtOAc. Упаривают с получением указанного в заголовке соединения. Получение 20. 6-Бром-2,4-дифтор-3-метоксибензальдегид. При 0 С добавляют 1,6 н. н-бутиллитий (22 мл, 35,2 ммоль) к диизопропиламину (4,8 мл,34,2 ммоль) в безводном ТГФ (7 мл). Перемешивают полученный раствор желтого цвета в течение 30 мин при 0 С. Полученный раствор ЛДА с помощью канюли добавляют по каплям к раствору 5-бром-1,3-дифтор-2-метоксибензола (5,83 г, 26,17 ммоль) в безводном ТГФ (40 мл) при -78 С в течение 40 мин. Перемешивают полученный раствор светло-желтого цвета в течение 50 мин при -78 С. Добавляют безводный ДМФА (2,7 мл, 34,8 ммоль) и перемешивают смесь в течение 1,5 ч при -78 С. Заливают смесь разбавленной серной кислотой и экстрагируют продукт EtOAc (3). Промывают объединенные органические фракции водой (3), насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия. Фильтруют и упаривают с получением неочищенного продукта. Очистка флэшхроматографией (силикагель, гексан/EtOAc) дает указанное в заголовке соединение. Получение 21. 6-Бром-2,4-дифтор-3-метоксибензонитрил. Добавляют гидрохлорид гидроксиламина (608 мг, 8,8 ммоль) к раствору 6-бром-2,4-дифтор-3 метоксибензальдегида (2,0 г, 7,96 ммоль) в безводном ДМФА (4 мл). Нагревают смесь до 150 С в течение 2 ч. К охлажденной смеси добавляют воду и экстрагируют продукт EtOAc (2). Объединенные органические фракции промывают водой (3), насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия. Фильтруют и упаривают. Растворяют остаток в безводном ТГФ и добавляют 3 экв. реактива Бурже (Burgess) гидроксид метоксикарбонилсульфамоил)триэтиламмония, внутренняя соль). Смесь кипятят с обратным холодильником в течение ночи в атмосфере азота. Упаривают с получением неочищенного остатка. Очистка флэш-хроматографией (силикагель, гексан/EtOAc) дает указанное в заголовке соединение. Получение 22. Метиловый эфир 3-бром-4-цианобензойной кислоты. Растворяют метиловый эфир 4-бром-3-нитробензойной кислоты (4,25 г, 16,3 ммоль) в этаноле(100 мл) и воде (30 мл). Добавляют дитионит натрия (15 г, 7 5 ммоль) в виде одной порции и смесь кипетят с обратным холодильником в течение 4 ч. Выпаривают этанол и добавляют воду. Подщелачивают водную фракцию 10% раствором карбоната натрия. Экстрагируют продукт EtOAc (2). Объединенные- 14012310 органические фракции сушат над безводным сульфатом натрия, отфильтровывают и упаривают с получением метилового эфира 3-амино-4-бромбензойной кислоты (51%). Добавляют цианид цинка (1,5 г, 12,77 ммоль), тетракис-палладий (675 мг, 0,584 ммоль) к метиловому эфиру 3-амино-4-бромбензойной кислоты (1,328 г, 5,77 ммоль) в безводном ДМФА (3 мл). Продувают азотом в течение нескольких минут и в атмосфере азота нагревают до 120 С в течение ночи. Охлаждают смесь до комнатной температуры и добавляют воду. Экстрагируют продукт EtOAc (2). Промывают объединенные органические фракции 2 н. раствором гидроксида аммония (2), водой (2), насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия, отфильтровывают и упаривают с получением неочищенного продукта. Очистка флэш-хроматографией (силикагель, гексан/EtOAc) дает метиловый эфир 3-амино-4-цианобензойной кислоты (94%). При перемешивании добавляют метиловый эфир 3-амино-4-цианобензойной кислоты (1,1 г,6,24 ммоль) к раствору нитрита натрия (511 мг, 7,4 ммоль) в концентрированной серной кислоте (5 мл) и ледяной уксусной кислоте (5 мл) при 40 С. Через 30 мин при 40 С выливают полученный раствор оранжевого цвета в холодный раствор бромида меди (1,42 г, 9,89 ммоль) в 48% бромисто-водородной кислоте(5 мл). После окончания выделения азота смесь нагревают до 90 С в течение 30 мин. Охлаждают до комнатной температуры и выливают смесь на измельченный лед. Отфильтровывают полученное темное твердое вещество, промывают водой. Переносят полученное твердое вещество в хлороформ и отфильтровывают неорганический остаток. Фильтрат упаривают с получением неочищенного остатка желтого цвета. Очистка флэш-хроматографией (силикагель, гексан/EtOAc) дает указанное в заголовке соединение(56%). Получение 23. 4-Бром-2,6-дифторфениловый эфир 2,2-диметилпропионовой кислоты. При перемешивании добавляют триэтиламин (10,0 мл, 71,7 ммоль) к 4-бром-2,6-дифторфенолу(9,92 г, 47,4 ммоль) в безводном дихлорметане (100 мл) при 0 С в инертной атмосфере. По каплям добавляют пивалоилхлорид (8 мл, 64,9 ммоль) на протяжении 10 мин. Дают раствору нагреться до комнатной температуры в течение ночи. Добавляют воду и экстрагируют водную фракцию дихлорметаном (2). Промывают объединенные органические фракции водой (2), насыщенным водным раствором хлорида натрия, сушат над безводным сульфатом натрия, отфильтровывают и упаривают с получением 15,5 г прозрачного неочищенного масла. Очистка флэш-хроматографией (силикагель, гексан/диэтиловый эфир) дает указанное в заголовке соединение (13,1 г) в виде прозрачного масла (выход 94%). Получение 24. 4-Бром-2,6-дифтор-3-формилфениловый эфир 2,2-диметилпропионовой кислоты. Добавляют н-бутиллитий 1,6 н. (23 мл, 36,8 ммоль) к диизопропиламину (5,0 мл, 35,6 ммоль) в безводном ТГФ (7 мл) при 0 С. Перемешивают полученный раствор желтого цвета в течение 30 мин при 0 С. С помощью канюли полученный раствор ЛДА по каплям добавляют к раствору 4-бром-2,6-дифторфенилового эфира 2,2-диметилпропионовой кислоты (8,01 г, 27,33 ммоль) в безводном ТГФ (40 мл) при -78 С на протяжении 40 мин. Перемешивают полученный раствор светло-желтого цвета в течение 1 ч при -78 С. Добавляют безводный ДМФА (2,8 мл, 35,0 ммоль) и перемешивают смесь в течение 1,5 ч при -78 С. Заливают смесь разбавленной серной кислотой и экстрагируют продукт EtOAc (3). Промывают объединенные органические фракции водой (3), насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия. Фильтруют и упаривают с получением неочищенного продукта. Очистка флэш-хроматографией (силикагель, гексан/EtOAc) дает 8,35 г указанного в заголовке соединения (выход 95%). Получение 25. 4-Бром-3-циано-2,6-дифторфениловый эфир 2,2-диметилпропионовой кислоты. Добавляют гидрохлорид гидроксиламина (2,33 г, 33,6 ммоль) и йодид натрия (2,09 г, 13,96 ммоль) к раствору 4-бром-2,6-дифтор-3-формилфенилового эфира 2,2-диметилпропионовой кислоты (8,34 г,25,97 ммоль) в ацетонитриле (100 мл). Смесь нагревают с обратным холодильником (100 С) в течение 3 ч. ТСХ (гексан/этилацетат, 4:1) показывает неполное превращение. Охлаждают смесь до 60 С и добавляют еще порцию гидрохлорида гидроксиламина (2,24 г, 33,0 ммоль). Нагревают смесь до 100 С в течение 1,5 ч. Гасят смесь 5% водным Na2S2O3 и перемешивают в течение 5 мин до тех пор, пока краснокоричневое окрашивание не исчезнет. Экстрагируют продукт этилацетатом (2). Промывают объединенные органические фракции водой (3), насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия. Фильтруют и упаривают. Остаток растворяют в безводном ТГФ и добавляют 1,7 экв. реактива Бурже (Burgess) гидроксид метоксикарбонилсульфамоил)триэтиламмония, внутренняя соль) (10,0 г, 41,96 ммоль). Смесь кипятят с обратным холодильником в атмосфере азота в течение 4 ч. Упаривают с получением неочищенного остатка. Очистка флэш-хроматографией (силикагель,гексан/EtOAc) дает 5,87 г указанного в заголовке соединения в виде бледно-желтого твердого вещества- 15012310 Получение 26. [2-(4-Бромфенил)-2 Н-пиразол-3-ил]амид пропан-2-сульфоновой кислоты. Добавляют ДБУ (5,14 мл, 33,69 ммоль) к раствору этилового эфира 5-амино-1-(4-бромфенил)-1 Нпиразол-4-карбоновой кислоты (2,612 г, 8,42 ммоль) в дихлорметане (25 мл) при 0 С. Перемешивают в течение 15 мин при 0 С, после чего добавляют изопропилсульфонилхлорид (1,94 мл, 16,84 ммоль). Смесь погружают в предварительно нагретую масляную баню (50 С). После перемешивания в течение 5 мин добавляют еще порцию изопропилсульфонилхлорида (0,97 мл, 8,42 ммоль). Перемешивают в течение ночи при 50 С. Добавляют 1,0 M HCl (водный) до рН 5, промывают водой (250 мл), сушат над сульфатом натрия, отфильтровывают и упаривают. Адсорбируют соединение на силикагель и подвергают колоночной флэш-хроматографии на силикагеле (15-30% EtOAc/н-гексан) с получением этилового эфира 1-(4-бромфенил)-5-(пропан-2-сульфониламино)-1 Н-пиразол-4-карбоновой кислоты (2,55 г, 73%). Растворяют этиловый эфир 1-(4-бромфенил)-5-(пропан-2-сульфониламино)-1 Н-пиразол-4 карбоновой кислоты (2,549 г, 6,12 ммоль) в этаноле (10 мл) (денатурирован метанолом), после чего добавляют водный раствор гидроксида натрия (12,5 мл, 2,0 М). Полученную смесь погружают в предварительно нагретую масляную баню (65 С) и перемешивают в течение ночи, после чего упаривают для удаления этанола/метанола, промывают полученную водную смесь дихлорметаном и упаривают для удаления остатков дихлорметана. Охлаждают водную смесь до 0 С, добавляют 1,0 M HCl до рН 4 (может наблюдаться обильное осаждение кислоты) и перемешивают в течение 15 мин. Фильтруют смесь при пониженном давлении. Фильтрату дают остыть при пониженном давлении и отфильтровывают вторую порцию продукта. Объединяют две порции с получением 1-(4-бромфенил)-5-(пропан-2-сульфониламино)-1 Н-пиразол-4 карбоновой кислоты (2,031 г, 85%). Растворяют 1-(4-бромфенил)-5-(пропан-2-сульфониламино)-1 Н-пиразол-4-карбоновую кислоту(1,952 г, 5,03 ммоль) в хинолине (2,79 мл) в запаянной пробирке. Добавляют медь (0,16 г, 2,51 ммоль),погружают в предварительно нагретую (180 С) масляную баню и перемешивают в течение 15 мин. Охлаждают до комнатной температуры и растворитель удаляют при пониженном давлении. Разбавляют дихлорметаном, промывают 1,0 M HCl (250 мл), сушат над сульфатом натрия, фильтруют и упаривают с получением остатка. Очистка колоночной флэш-хроматографией на силикагеле (15-55% EtOAc/нгексан) дает указанное в заголовке соединение (1,323 г, 76%). Пример 1. (2-Бифенил-4-илтиофен-3-ил)амид пропан-2-сульфоновой кислоты. При перемешивании нагревают в укупоренной пробирке [2-(4-бромфенил)тиофен-3-ил]амид пропан-2-сульфоновой кислоты (0,5 ммоль), фенилбороновую кислоту (0,75 ммоль), 2 M водный растворNa2CO3 (0,2 мл) и Pd(PPh3)4 (0,05 ммоль) в 4,0 мл безводной дезоксигенированной смеси ДМЭ/EtOH (2:1) до 80-100 С в течение 24 ч. Смесь фильтруют через тонкий слой диоксида кремния и элюируют EtOAc. Фильтрат упаривают. Продукт очищают флэш-хроматографией (силикагель, гексан/EtOAc) с получением указанного в заголовке соединения. МС (ES-): 356 (М-1).- 16012310 Следующие соединения получают по способу, аналогичному методике, описанной в примере выше. Следующие соединения получают по способу, аналогичному методике, описанной в примере 1 выше. Экстрагируют полученное соединение этилацетатом, трижды промывают органическую фракцию водой, сушат над MgSO4, отфильтровывают и упаривают с получением указанного в заголовке соединения. Следующие соединения получают по способу, аналогичному методике, описанной в подготовительном примере 4 выше. Пример 28. 2-[4'-(2-Гидроксиэтил)бифенил-4-ил]тиофен-3-иламид пропан-2-сульфоновой кислоты. Смешивают 2-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]тиофен-3-иламид пропан 2-сульфоновой кислоты (0,10 г), 0,1 экв. Тетракис-трифенилфосфинпалладия(0), 2 экв. 2 М водного раствора карбоната натрия в смеси ДМЭ (2 мл) и EtOH (1 мл) и нагревают до 90-95 С. После нагревания в течение 2 мин добавляют 2-(4-бромфенил)этанол (1,3 экв.) и перемешивают при указанной температуре в течение 1,5 ч. Выпаривают растворители над Celite и очищают с помощью картриджей с силикагелемStrata, элюируя с градиентом смеси гексан/EtOAc с получением 0,041 г указанного в заголовке соединения. МС (ES+) (m/z): 402 (M+1). Пример 29. 6-(Пропан-2-сульфониламино)-4'-[3-(пропан-2-сульфониламино)тиофен-2-ил]бифенил 2-карбоновая кислота. Нагревают смесь 2-[4-4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]тиофен-3-иламида пропан-2-сульфоновой кислоты (662 мг, 1,65 ммоль), метилового эфира 2-бром-3-нитробензойной кислоты (390 мг, 1,5 ммоль), Na2CO3 (2 M, 2,2 мл, 4,5 ммоль) и Pd(PPh3)4 (260 мг, 0,26 ммоль) и 15 мл 1,4 диоксана в атмосфере азота до 80 С в течение ночи. После охлаждения до комнатной температуры разбавляют диэтиловым эфиром (200 мл). Промывают водой, насыщенным водным раствором хлорида натрия и сушат над MgSO4. Растворитель удаляют и очищают флэш-хроматографией (силикагель-гексан/EtOAc) с получением метилового эфира 6-нитро-4'-[3-(пропан-2-сульфониламино)тиофен-2-ил]бифенил-2 карбоновой кислоты (250 мг). МС (m/е): 478,7 (М+1). Добавляют SnCl22 Н 2 О (470 мг, 2,8 ммоль) к раствору метилового эфира 6-нитро-4'-[3-(пропан-2 сульфониламино)тиофен-2-ил] бифенил-2-карбоновой кислоты (250 мг, 0,54 ммоль) в EtOH (5 мл). Нагревают реакционную смесь до 80 С в течение 3 ч. Добавляют 100 мл EtOAc и промывают насыщенным раствором NaHCO3, водой и насыщенным водным раствором хлорида натрия (50 мл). Сушат над Na2SO4,отфильтровывают и выпаривают досуха с получением метилового эфира 6-амино-4'-[3-(пропан-2 сульфониламино)тиофен-2-ил]бифенил-2-карбоновой кислоты (208 мг). МС (m/е): 429,1 (M-1). При 0 С добавляют 1,8-диазабицикло[5.4.0]ундец-7-ен (ДБУ) по каплям (0,51 мл, 3,6 ммоль) к суспензии метилового эфира 6-амино-4'-[3-(пропан-2-сульфониламино)тиофен-2-ил]бифенил-2-карбоновой кислоты (208 мг 0,48 ммоль) в дихлорметане (9 мл), с последующим добавлением по каплям изопропилсульфонилхлорида (0,21 мл, 0,9 ммоль) и перемешивают реакционную смесь при комнатной температуре в течение ночи. Растворитель удаляют при пониженном давлении. Очищают с помощью флэшхроматографии (силикагель, гексан/EtOAc). Целевые фракции упаривают с получением метилового эфира 6-(пропан-2-сульфониламино)-4'-[3-(пропан-2-сульфониламино)тиофен-2-ил]бифенил-2-карбоновой кислоты (50 мг). МС (m/е): 535,1 (М-1). Нагревают смесь метилового эфира 6-(пропан-2-сульфониламино)-4'-[3-(пропан-2 сульфониламино)тиофен-2-ил]бифенил-2-карбоновой кислоты (46 мг, 0,08 ммоль) и LiOH (30 мг,1,25 ммоль) в 3 мл смеси ТГФ/метанол/вода (3/2/1, об./об./об.) до 60 С в течение 3 ч. Растворитель удаляют и остаток растворяют в воде (35 мл). Промывают метиленхлоридом (220 мл). Нейтрализуют водный раствор до рН между 2 и 3. Затем очищают с помощью флэш-хроматографии с получением указанного в заголовке соединения. МС (m/е): 521,1 (М-1). Пример 30. 2-[4'-(2 Н-Тетразол-5-илметил)бифенил-4-ил]тиофен-3-иламид пропан-2-сульфоновой кислоты. Дезоксигенируют и нагревают смесь 4'-(5 Н-тетразол-5-илметил)бифенил-4-илового эфира трифторметансульфоновой кислоты (48 мг, 0,2 ммоль), 2-[4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2 ил)фенил]тиофен-3-иламида пропан-2-сульфоновой кислоты (95 мг, 0,24 ммоль, 1,2 экв.), октагидрата гидроксида бария (189 мг, 0,6 ммоль, 3 экв.) и Pd(dffp) (29 мг, 0,04 ммоль, 0,2 экв.) в 2 мл смеси ДМФА и воды (4/1, об./об.) до 80 С в течение ночи. Охлаждают смесь до комнатной температуры и разбавляют 30 мл EtOAc. Промывают водой (310 мл) и насыщенным водным раствором хлорида натрия, сушат и- 19012310 растворитель удаляют. Очистка флэш-хроматографией (силикагель, CH2Cl2/MeOH (1/50, об./об. дает указанное в заголовке соединение (50 мг, 53%). МС (m/е): 441,1 (M+1). Следующие соединения получают по способу, в значительной мере сходному с методикой, описанной в примере выше.(158 мг, 0,50 ммоль) в ДМФА-Н 2 О (об./об. 4:1, 2,5 мл) до 80 С в атмосфере азота в течение 20 ч. Выливают в смесь Н 2 О (50 мл) и дихлорметана (50 мл), затем экстрагируют Н 2 О (450 мл) и сушат объединенные органические фракции (MgSO4). Упаривают до получения неочищенной смеси в виде желтоватого твердого вещества. Очистка флэш-хроматографией (силикагель, гексан/EtOAc) дает указанное в заголовке соединение в виде бледно-желтого твердого вещества (выход 65-80%). МС (ES-): 430,1 (М-1). Следующее соединение получают по способу, в значительной мере сходному с методикой, описанной в примере выше. Пример 37. 2-Хлор-4'-[3-(пропан-2-сульфониламино)тиофен-2-ил]бифенил-4-карбоновая кислота. В укупоренной пробирке при перемешивании нагревают 2-[4-(4,4,5,5 тетраметил[1,3,2]диоксаборолан-2-ил)фенил]тиофен-3-иламид пропан-2-сульфоновой кислотыNa2CO3 (0,2 мл) и Pd(PPh3)4 (0,05 ммоль) в 4,0 мл смеси ДМЭ/этанол (2:1) до 80 С в течение 24 ч. Фильтруют смесь через тонкий слой диоксида кремния и элюируют EtOAc. Фильтрат упаривают и полученное соединение очищают флэш-хроматографией (силикагель, гексан/EtOAc). Добавляют 2 М раствор NaOH (1 мл) к полученному эфиру (0,128 ммоль) в этаноле (1 мл) и перемешивают в течение 24 ч. Добавляют 6 н. HCl до рН приблизительно 1 с образованием осадка твердого вещества белого цвета. Твердое вещество отфильтровывают с получением указанного в заголовке соединения. МС (ES-): 435 (М-1).- 20012310 Следующие соединения получают по способу, аналогичному методике, описанной в примере выше. Пример 53. 4'-[3-(Пропан-2-сульфониламино)тиофен-2-ил]бифенил-4-карбоновая кислота. Добавляют 2 M NaOH (1 мл) к суспензии этилового эфира 4'-[3-(пропан-2-сульфониламино)тиофен 2-ил]бифенил-4-карбоновой кислоты (0,128 ммоль) в этаноле (1 мл) и перемешивают в течение 24 ч. Добавляют 6 н. HCl до рН приблизительно 1 с образованием осадка твердого вещества белого цвета. Твердое вещество отфильтровывают с получением указанного в заголовке соединения. МС (ES-): 400 (М-1). Следующее соединение получают по способу, в значительной мере сходному с методикой, описанной в примере выше.(642 мг, 3,40 ммоль) в раствор [2-(2'-циано-5'-нитробифенил-4-ил)тиофен-3-ил]амида пропан-2 сульфоновой кислоты (279 мг, 0,654 ммоль) в этаноле (6,54 мл). Нагревают смесь до 90 С в течение 3 ч. Охлаждают до комнатной температуры. Упаривают под вакуумом до удаления растворителя. Разбавляют дихлорметаном и добавляют водный раствор бикарбоната натрия до рН 8. Экстрагируют дихлорметаном(3100 мл), объединенные органические фракции сушат и упаривают с получением слабоокрашенного твердого вещества. Очистка флэш-хроматографией (силикагель, гексан/EtOAc 2:1) дает 212 мг,0,534 ммоль (82%) указанного в заголовке соединения в виде бледно-желтого твердого вещества. МС (m/е): 396,1 (M-1).- 22012310 Пример 56. [2-(2'-Циано-3',5'-дифтор-4'-гидроксибифенил-4-ил)тиофен-3-ил]амид пропан-2 сульфоновой кислоты. В укупоренной пробирке при перемешивании нагревают 2-[4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)фенил]тиофен-3-иламид пропан-2-сульфоновой кислоты (0,5 ммоль),6-бром-2,4-дифтор-3-гидроксибензонитрил (0,75 ммоль), 2 М водный раствор Na2CO3 (0,2 мл) и Pd(PPh3)4(0,05 ммоль) в 4,0 мл смеси ДМЭ/этанол (2:1) до 80 С в течение 24 ч. Фильтруют смесь через тонкий слой диоксида кремния и элюируют EtOAc. Фильтрат упаривают и полученное соединение очищают флэш-хроматографией (силикагель, метанол). Перемешивают полученный продукт (271 мг, 0,604 ммоль) с йодидом тетрабутиламмония (313 мг,0,847 ммоль) в безводном дихлорметане при -78 С в атмосфере азота. Добавляют 1 н. раствор трихлорида бора в дихлорметане (5,0 мл, 5 ммоль) на протяжении 2 мин. Перемешивают полученную смесь коричневого цвета в течение 5 мин при -78 С и дают смеси нагреться до комнатной температуры на протяжении 1 ч. Гасят реакцию измельченным льдом, перемешивают в течение 30 мин, нейтрализуют насыщенным водным раствором бикарбоната натрия до рН 7 и экстрагируют продукт дихлорметаном (3). Промывают объединенные органические фракции водой (3), насыщенным водным раствором хлорида натрия и сушат над безводным сульфатом натрия. Фильтруют и упаривают с получением неочищенного коричневого масла. Очистка флэш-хроматографией (силикагель, гексан/EtOAc) и очистка обращенно-фазовой хроматографией дают указанное в заголовке соединение. МС (ES-): 433 (М-1). Пример 57. 4-Оксо-4-4'-[3-(пропан-2-сульфониламино)тиофен-2-ил]бифенил-4-илбутановая кислота. При перемешивании нагревают в укупоренной пробирке 2-[4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)фенил]тиофен-3-иламид пропан-2-сульфоновой кислоты (0,5 ммоль),4-(4-бромфенил)-4-оксобутановую кислоту (0,75 ммоль), 2 М водный раствор Na2CO3 (0,2 мл) и Pd(PPh3)4(0,05 ммоль) в 4,0 мл безводного ДМЭ до 100 С в течение 24 ч. Упаривают и очищают фильтрат флэшхроматографией (силикагель, гексан/EtOAc). Добавляют 2 М раствор NaOH (1 мл) к суспензии полученного сложного эфира (0,128 ммоль) в этаноле (1 мл) и перемешивают в течение 24 ч. Добавляют 6 н. HCl до рН приблизительно 1 с образованием осадка твердого вещества белого цвета. Твердое вещество отфильтровывают с получением указанного в заголовке соединения. МС (ES-): 456 (М-1). Следующие соединения получают по способу, аналогичному методике, описанной в примере выше.- 23012310 Пример 67. 6-Циано-4'-[3-(пропан-2-сульфониламино)тиофен-2-ил]бифенил-3-илоксиуксусная кислота. Нагревают этиловый эфир (3-хлор-4-цианофенокси)уксусной кислоты (120 мг, 0,50 ммоль),2-[4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)фенил]тиофен-3-иламид пропан-2-сульфоновую кислоту (204 мг, 0,50 ммоль), 2 M водный раствор Na2CO3 (0,75 мл) и Pd(PCy3)2Cl2 (55,4 мг, 0,075 ммоль) в 1,4-диоксане (3,0 мл) до 80 С в атмосфере азота на протяжении 20 ч. Выливают в 0,1 М раствор HCl и доводят рН до 7, после чего экстрагируют диэтиловым эфиром (350 мл), объединенные органические фракции сушат (MgSO4) и упаривают до получения неочищенной смеси в виде желтоватого твердого вещества. Очистка флэш-хроматографией (силикагель, гексан/диэтиловый эфир 1:1) дает 201 мг,0,42 ммоль (83%) этилового эфира 6-циано-4'-[3-(пропан-2-сульфониламино)тиофен-2-ил]бифенил-3 илоксиуксусной кислоты в виде бледно-желтого твердого вещества. Готовят водный раствор LiOH растворением 50 мг LiOH в 1,0 мл воды. Медленно добавляют водный раствор LiOH к раствору полученного выше эфира (200 мг, 0,415 ммоль) в смеси ТГФ (2,0 мл) иMeOH (1,0 мл). Перемешивают смесь при 60 С в течение 3 ч. Упаривают для удаления растворителя. Разбавляют Н 2 О (50 мл). Промывают дихлорметаном (250 мл). Добавляют 0,1 М раствор HCl до рН 3. Экстрагируют дихлорметаном (250 мл) и диэтиловым эфиром (250 мл). Сушат объединенные органические фракции и упаривают при пониженном давлении с получением 137 мг, 0,300 ммоль (72%) указанного в заголовке соединения. МС (m/е): 455,1 (M-1). Пример 68. (2-Циано-[1,1';4',1]терфенил-2-ил)амид пропан-2-сульфоновой кислоты. Нагревают в укупоренной пробирке при перемешивании (4'-бромбифенил-2-ил)амид пропан-2 сульфоновой кислоты (0,5 ммоль), 2-(цианофенил)бороновую кислоту (0,75 ммоль), K3PO4H2O(1,8 ммоль) PPh3 (0,12 ммоль) и Pd(OAc)2 (0,06 ммоль) в 3,0 мл безводного дезоксигенированого 1,4-диоксана до 110 С в течение 4 ч. Охлаждают реакционную смесь и выдерживают при комнатной температуре в течение ночи. Добавляют EtOAc и воду. Экстрагируют водную фракцию дихлорметаном(320 мл), объединенные органические фракции сушат (Na2SO4) и упаривают до получения неочищенной смеси. Очистка флэш-хроматографией (силикагель, гексан/EtOAc) дает указанное в заголовке соединение. МС (ES-): 375 (М-1). Следующее соединение получают по способу, в значительной мере аналогичному методике, описанной в примере выше. Пример 70. [2-(Пропан-2-сульфониламино)-[1,1';4',1]терфенил-2-ил]амид пропан-2-сульфоновой кислоты. Нагревают в укупоренной пробирке при перемешивании 2-йодфениламин (0,5 ммоль),2-(фенилизопропилсульфамид)бороновую кислоту (0,75 ммоль), 2 М водный раствор Na2CO3 (0,2 мл) иPd(PPh3)4 (0,05 ммоль) в 4,0 мл безводного ДМЭ до 100 С в течение 24 ч. Выпаривают органический растворитель, после чего добавляют воду (10 мл). Экстрагируют смесь дихлорметаном (320 мл) и сушат объединенные органические фракции (Na2SO4). Упаривают до получения неочищенной смеси. Очищают флэш-хроматографией (силикагель-гексан /EtOAc). Добавляют по каплям ДБУ (8,76 мл, 56,92 ммоль) к раствору полученного амина (14,23 ммоль) в дихлорметане (50 мл) при 0 С с последующим добавлением по каплям изопропилсульфонилхлорида(3,29 мл, 28,46 ммоль) и перемешивают реакционную смесь при комнатной температуре в течение 24 ч. Растворитель удаляют при пониженном давлении и очищают остаток диоксидом кремния, элюируя с градиентом от смеси EtOAc/гексан (1:4) до EtOAc с получением указанного в заголовке соединения(10 мл) и нагревают смесь до 60 С в течение 7 ч. Выпаривают растворители и добавляют 3 н. HCl для подкисления смеси. Наносят кислую смесь на 2 г картридж интенсивного катионного обмена. Элюируют картридж интенсивного катионного обмена метанолом (3) для удаления соединений, не обладающих основной природой. Элюируют продукт 2 н. аммиаком в метаноле с получением после выпаривания- 24012310 55,2 мг указанного в заголовке соединения в виде твердого вещества желтого цвета (выход 50%). МС (ES-): 403. Пример 72. 2-Циано-4'-[3-(пропан-2-сульфониламино)тиофен-2-ил]бифенил-4-карбоновая кислота. В реактор объемом 10 л с двойным кожухом, оборудованный механической мешалкой, в инертной атмосфере аргона помещают трет-бутиловый эфир [2-(4-бромфенил)тиофен-3-ил]карбаминовой кислоты(800 г, 2,25 моль) и EtOAc (3,2 л). Охлаждают раствор желтого цвета до 16,9 С и добавляют через воронку-капельницу 5-6 н. раствор HCl/ИПА (1600 мл) на протяжении 10 мин при температуре от 10 С до 25 С. Нагревают реакционную смесь до 50 С. Перемешивают полученную суспензию в течение 90 мин при 50 С. Охлаждают суспензию до температуры ниже 10 С и добавляют 2 н. раствор NaOH (2773 мл) на протяжении 25 мин, поддерживая температуру ниже 20 С. Добавляют 2 н. раствор NaOH (450 мл) до рН 12-13. Разделяют две фракции декантацией. Снова экстрагируют водную фракцию EtOAc (500 мл). Сушат объединенные органические фракции над MgSO4 (200 г) и выпаривают досуха с получением 2-(4-бромфенил)тиофен-3-иламина (562,3 г, 2,21 моль) в виде твердого вещества бежевого цвета. 1H ЯМР (250 МГц, CDCl3): 3,70 (ушир.с, 2 Н), 6,65 (д, 1 Н, J=5,4 Гц), 7,06 (д, 1 Н, J=5,2 Гц), 7,32 (д,2 Н, J=8,9 Гц), 7,45 (д, 2 Н, J=8,8 Гц). В реактор объемом 20 л с двойным кожухом, оборудованный механической мешалкой, в инертной атмосфере аргона помещают 2-(4-бромфенил)тиофен-3-иламин (562 г, 2,21 моль) и CH2Cl2 (9,435 л). Образуется прозрачный раствор. Добавляют ДБУ (1,999 л) и охлаждают смесь до 9,4 С. Добавляют пропан 2-сульфонилхлорид (0,616 г) на протяжении 20 мин, поддерживая температуру ниже 25 С. Перемешивают реакционную смесь на протяжении 22 ч при 20 С. После завершения реакции охлаждают реакционную смесь до 11 С и добавляют насыщенный водный раствор NH4Cl (7,65 л), охлаждают до 10 С, выдерживая при этой температуре на протяжении 5 мин. Нагревают смесь до 20 С и отделяют водную фракцию. Промывают органическую фракцию 2 н. HCl (5,12 л), выпаривают досуха и переносят остаток в этиловый спирт (800 г). Нагревают смесь до полного растворения при 70 С. Охлаждают раствор до 41 С и добавляют воду (1384 мл). Перемешивают суспензию в течение ночи при 22 С, отфильтровывают и дважды промывают 254 мл смеси EtOH/H2O (1:1). Сушат полученное твердое вещество бежевого цвета под вакуумом при 26 С в течение 4 дней с получением [2-(4-бромфенил)тиофен-3-ил]амида пропан-2 сульфоновой кислоты (688 г, 1,9 моль). 1(д, 2 Н, J=8,5 Гц), 7,6 (д, 2 Н, J=8,5 Гц). В реактор объемом 10 л с двойным кожухом, оборудованный механической мешалкой, обратным холодильником, в атмосфере N2 помещают [2-(4-бромфенил)тиофен-3-ил]амид пропан-2-сульфоновой кислоты (688 г, 1,91 моль), ДМФА (7,74 л), бис-(пинаколят)диборон (533 г, 2,09 моль), PdCl2dppf (78 г) и ацетат калия (562 г). Нагревают полученную смесь до 80 С в течение 1 ч. Охлаждают смесь до 20 С. Гасят смесь водой (8650 мл) и экстрагируют EtOAc (3440 мл). Снова экстрагируют водную фракцию EtOAc(4587 мл). Объединяют все органические фракции и выпаривают досуха с получением 1420 г неочищенного материала. Очищают неочищенный материал фильтрацией на силикагеле (7 кг), элюируя смесью н-гептан/EtOAc(6:3) с получением после упаривания досуха 2-[4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)фенил]тиофен-3-иламида пропан-2-сульфоновой кислоты в виде твердого вещества желтого цвета (747 г). 1H ЯМР (250 МГц, CDCl3): 1,19 (д, 6 Н, J=6,9 Гц), 1,37 (с, 12 Н), 3,12 (гепт, 1 Н, J=6,9 Гц), 7,27 (д, 1 Н,J=5,2 Гц), 7,32 (д, 1 Н, J=5,2 Гц), 7,43 (д, 1 Н, J=8,1 Гц), 7,89 (д, 2 Н, J=8,1 Гц). В реактор объемом 10 л с двойным кожухом, оборудованный механической мешалкой, обратным холодильником помещают этиловый эфир 4-гидроксибензойной кислоты (967 г, 8,81 моль) и уксусную кислоту (5,8 л). Нагревают смесь до 65 С и добавляют раствор ICl (1010 г) в уксусной кислоте (1 л) на протяжении 1/2 ч. Перемешивают полученную смесь при 60-62 С в течение 16 ч. Охлаждают черный раствор до 20 С и переносят в смесь воды (5 л) и льда (7,5 кг). Перемешивают полученную суспензию на протяжении 1 ч при 20 С, отфильтровывают и промывают розетку фильтра водой (2 л) и циклогексаном (6 л). Сушат твердое вещество под вакуумом при 55 С до постоянной массы с получением этилового эфира 4-гидрокси-3-йодбензойной кислоты (1372,8 г, 4,70 моль). 1H ЯМР (250 МГц, CDCl3): 1,38 (т, J=7,1 Гц, 3 Н), 4,35 (кв, J=7,1 Гц, 2 Н), 5,8 (с, 1H), 7,01 (д, J=8,5 Гц,1 Н), 7,95 (дд, J=8,5 Гц, 2,0 Гц, 1 Н), 8,37 (д, J=2 Гц, 1H). В реактор объемом 10 л с двойным кожухом, оборудованный механической мешалкой и обратным холодильником, в атмосфере N2 помещают этиловый эфир 4-гидрокси-3-йодбензойной кислоты (1312 г,4,49 моль), диметилсульфоксид (3277 мл) и CuCN (442,3 г). Нагревают смесь до 105 С в течение 2,5 ч. Охлаждают коричневый раствор до 20 С. Добавляют воду при 48 С (6,5 л). Фильтруют смесь при 20 С,затем промывают розетку фильтра водой (2 л). Суспендируют розетку фильтра в EtOAc (5 л) и перемешивают на протяжении 1 ч при 20 С. Фильтруют суспензию на Hyflo Super Cel (250 г) и промываютEtOAc (3 л). Фильтраты декантируют, затем упаривают органическую фракцию досуха. Остаток переносят в н-гептан (10 л). Отгоняют 2 л н-гептана, затем добавляют CH2Cl2 (400 мл). Смесь охлаждают до 27 С, фильтруют и промывают розетку фильтра н-гептаном (2 л). Сушат на протяжении 48 ч при 55 С под давлением с получением этилового эфира 4-гидрокси-3-цианобензойной кислоты (777,7 г,- 25012310 4,067 моль). 1(дд, J=8,8 Гц, 2,2 Гц, 1 Н), 8,16 (д, J=2,2 Гц), 12,11 (ушир.с, 1 Н). В реактор объемом 20 л с двойным кожухом, оборудованный механической мешалкой, в инертной атмосфере аргона помещают этиловый эфир 4-гидрокси-3-цианобензойной кислоты (720 г, 3,766 моль) иCH2Cl2. Охлаждают коричневую суспензию до 5 С и добавляют Et3N (792 мл) с образованием коричневого раствора. Добавляют ДМАП (69,1 г) при 5 С. Добавляют трифторметансульфоновый ангидрид(950 мл) на протяжении 25 мин, поддерживая температуру в интервале от 2 до 23 С. Перемешивают в течение 30 мин при 20 С, затем добавляют 1 н. HCl (8 л). Разделяют водную и органическую фракции,промывают органическую фракцию 10% водным раствором NaHCO3 (8 л). Обрабатывают органическую фракцию 300 г MgSO4 и упаривают досуха с получением этилового эфира 3-циано-4 трифторметоксикарбонилоксибензойной кислоты в виде коричневого твердого вещества (1218,7 г,3,77 моль). 1 Н ЯМР (250 МГц, CDCl3): 1,52 (т, J=7,1 Гц, 3 Н), 4,55 (кв, J=7,1 Гц, 2 Н), 7,69 (д, J=8,8 Гц, 1 Н), 8,49(дд, J=8,8 Гц, J=2,2 Гц, 1 Н), 8,55 (д, J=2,2 Гц, 1 Н). В реактор объемом 10 л с двойным кожухом, оборудованный механической мешалкой и обратным холодильником, в атмосфере N2 помещают ацетат палладия (41 г) и ДМЭ (6,29 л). К оранжевому раствору добавляют трифенилфосфин (190 г). Образуется желтый осадок. Смесь перемешивают в течение 15 мин при 20 С. Добавляют 2-[4-(4,4,5,5-тетраметил-[1,3,2]диоксаборолан-2-ил)фенил]тиофен-3 иламид пропан-2-сульфоновой кислоты (747 г; 1,83 моль), этиловый эфир 3-циано-4 трифторметоксикарбонилоксибензойной кислоты (822 г, 2,54 моль), этиловый спирт (3,14 л) и 2 н. водный Na2CO3 (1,82 л) и смесь нагревают до кипения с обратным холодильником. Через 1 ч может возникнуть необходимость в добавлении еще порции этилового эфира 3-циано-4 трифторметоксикарбонилоксибензойной кислоты для полного расходования 2-[4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)фенил]тиофен-3-иламида пропан-2-сульфоновой кислоты. Охлаждают темно-коричневую смесь до 20 С, гасят H2O (9250 мл) и экстрагируют CH2Cl2 (9250 мл). Отделенную органическую фракцию дважды промывают 7 л 1 н. водного Na2CO3 и выпаривают досуха с получением 1126 г масла. Растворяют неочищенное масло в этиловом спирте (4,1 л) и переносят в реакторную емкость объемом 10 л с инертной атмосферой. Добавляют Н 2 О (6,6 л) и 9 н. раствор NaOH (1,9 л) при 20 С. Нагревают коричневую смесь до 50 С и перемешивают в течение 1 ч. Охлаждают смесь и выпаривают при пониженном давлении в колбе роторного испарителя объемом 20 л. Отгоняют 2 л этанола при медленном добавлении 37% HCl (1500 мл) к смеси в ходе дистилляции. Контролируют рН и добавляют 200 мл 37% HCl до рН 0-1. Продолжают дистилляцию до получения 5-6 л дистиллята. Охлаждают полученный остаток до 10-20 С и добавляют CH2Cl2 (1332 мл). Перемешивают смесь на протяжении 4 ч при 21 С, отфильтровывают и промывают H2O (400 мл) и CH2Cl2 (400 мл). Сушат коричневое твердое вещество под вакуумом при 55 С на протяжении 16 ч с получением 546,3 г указанного в заголовке соединения. 1H ЯМР (250 МГц, ДМСО-d):м.д. 1,32 (т, J=6, 6 Гц, 6 Н), 3,26 (септет, J=6, 6 Гц, 1 Н), 7,32 (д,J=5,4 Гц, 1 Н), 7,79 (д, J=5,4 Гц, 1 Н), 7,93 (д, J=8,2 Гц, 1 Н), 8,01 (д, J=7,9 Гц, 1 Н), 8,04 (д, J=8,2 Гц, 2 Н),8,48 (дд, J=8,2 Гц, 2,2 Гц, 1 Н), 9,5 (с, 1 Н), 13,79 (ушир.с, 1 Н). Пример 73. 2-Этокси-4'-[3-(пропан-2-сульфониламино)тиофен-2-ил]бифенил-4-карбоновая кислота. Получают указанное в заголовке соединение сочетанием 2-[4-(4,4,5,5-тетраметил[1,3,2]диоксаборолан-2-ил)фенил]тиофен-3-иламида пропан-2-сульфоновой кислоты с этиловым эфиром 3-этокси-4-йодбензойной кислоты (31,5 г, 98,3 ммоль) по способу, аналогичному методике, описанной в подготовительном примере 4, с использованием PdCl2(dppf) и Na2CO3 при температуре реакции 60 С. Полученный эфир может быть гидролизован следующим способом: смешивают этиловый эфир 2-этокси-4'-[3-(пропан-2-сульфониламино)тиофен-2-ил]бифенил-4-карбоновой кислоты (38 г, 80 ммоль) в этаноле (100 мл) и 2 М раствор NaOH в воде (400 мл) и перемешивают реакционную смесь в течение 1 ч при комнатной температуре. Выпаривают этанол и промывают водную смесь 200 мл EtOAc. Подкисляют водную смесь до рН 2 с использованием 1 н. HCl. Экстрагируют целевой продукт EtOAc. Растворяют неочищенный продукт в нагретом ацетоне (500 мл) и добавляют воду (600 мл), поддерживая температуру на уровне 55 С. Перемешивают смесь при 60 С в течение 1 ч и затем при комнатной температуре в течение ночи. Отфильтровывают осадок и сушат под вакуумом при 45 С в течение ночи. Выход 28 г, 78%. 1 Н ЯМР (300 МГц, ДМСО):1,14 (д, J=7,0 Гц, 6 Н), 1,31 (т, J=7,0 Гц, 3 Н), 3,06 (с, J=7,0 Гц, 1 Н), 4,13(кв, J=7,0 Гц, 2 Н), 7,10 (д, J=5,3 Гц, 1H), 7,48 (д, J=7,6 Гц, 1H), 7,54 (д, J=5,3 Гц, 1H), 7,58-7,68 (м, 4 Н),7,72 (д, J=8,4 Гц, 2 Н), 9,22 (ушир.с, 1 Н), 13,04 (ушир.с, 1 Н). Для получения этилового эфира 3-этокси-4-йодбензойной кислоты кипятят с обратным холодильником 3-гидрокси-4-йодбензойную кислоту (38 г, 144 ммоль) и насыщенный раствор HCl в этанолеH ЯМР (300 МГц, CDCl3):1,39 (т, J=7,1 Гц, 3 Н), 4,36 (кв, J=7,1 Гц, 2 Н), 7,33 (дд, J=8,3 и 2,0 Гц,1 Н), 7,64 (д, J=2,0 Гц, 1 Н), 7,75 (д, J=8,3 Гц, 1 Н). Добавляют этилйодид (33,8 г, 216 ммоль) к раствору этилового эфира 3-гидрокси-4-йодбензойной кислоты (42 г, 144 ммоль) и K2CO3 (39,9 г, 288 ммоль) в ацетонитриле (4 00 мл) при перемешивании с помощью магнитной мешалки. Нагревают реакционную смесь до 65 С в течение 2 ч, дают смеси остыть и выдерживают при комнатной температуре в течение ночи. Выпаривают растворитель и добавляют этилацетат к неочищенному веществу. Твердое вещество отфильтровывают с использованием Celite и выпаривают растворитель. Выход 42 г, 96%. 1 Н ЯМР (300 МГц, CDCl3):1,39 (т, J=7,1 Гц, 3 Н), 1,50 (т, J=7,0 Гц, 3 Н), 4,16 (кв, J=7,0 Гц, 2 Н), 4,37(кв, J=7,1 Гц, 2 Н), 7,36 (дд, J=8,1 и 1,8 Гц, 1 Н), 7,42 (д, J=1,8 Гц, 1 Н), 7,84 (д, J=8,1 Гц, 1 Н). Пример 74. 2-[4'-1 Н-Тетразол-5-ил)бифенил-4-ил]тиофен-3-иламид пропан-2-сульфоновой кислоты. Нагревают в укупоренной пробирке при перемешивании [2-(4'-цианобифенил-4-ил)тиофен-3 ил]амид пропан-2-сульфоновой кислоты (0,5 ммоль), Bu3SnN3 (2,0 ммоль) до 100 С в течение 24 ч. При необходимости, добавляют толуол или дихлорметан для завершения реакции (добавляют 1,0 мл дихлорметана). Выпаривают органический растворитель, если была добавлена дополнительная порция, после чего добавляют воду (10 мл). Экстрагируют смесь дихлорметаном (320 мл) и сушат объединенные органические фракции (Na2SO4). Упаривают до получения неочищенной смеси. Очистка флэшхроматографией (силикагель-CH2Cl2/метанол 8:1) дает указанное в заголовке соединение. МС (ES-): 424 (M-1). Следующие соединения получают по способу, сходному с методикой, описанной в примере выше.(50 мл). Перемешивают в течение 15 ч при 70 С. Упаривают досуха при пониженном давлении. Растворяют полученный остаток в 20 мл NH4Cl и экстрагируют ДХМ и водным EtOAc. Упаривают все органические фракции досуха. Очищают с помощью ВЭЖХ с получением указанного в заголовке соединения. МС (ES-): 449 (M-1). Следующие соединения получают по способу, аналогичному методике, описанной в примере выше.- 27012310 Пример 81. Метиламид 2-(пропан-2-сульфониламино)-4'-[3-(пропан-2-сульфониламино)тиофен-2 ил]бифенил-4-карбоновой кислоты. Добавляют оксалилхлорид (0,12 ммоль) к суспензии 2-(пропан-2-сульфониламино)-4'-[3-(пропан-2 сульфониламино)тиофен-2-ил]бифенил-4-карбоновой кислоты (0,1 ммоль) и ДМФА (0,05 ммоль) в дихлорметане при 0 С. Перемешивают в течение 1 ч при комнатной температуре. Упаривают досуха при пониженном давлении. Растворяют полученный остаток в 3 мл СН 2 С 12 и добавляют (2,8 ммоль) MeNH2(2 M в ТГФ). Упаривают реакционную смесь досуха и очищают флэш-хроматографией (силикагель,элюируют смесью 5% MeOH/CH2Cl2). Упаривают целевые фракции с получением указанного в заголовке соединения. МС (ES-): 534 (M-1). Следующие амиды получают по способу, в существенной мере сходному с методикой, описанной в примере выше.(0,2 ммоль) к суспензии 2-циано-4'-[3-(пропан-2 сульфониламино)тиофен-2-ил]бифенил-4-карбоновой кислоты (0,1 ммоль) в дихлорметане при комнатной температуре. Перемешивают смесь в течение 1 ч при 50 С и упаривают досуха при пониженном давлении. К полученному остатку добавляют 0,5 ммоль MeNH2 (2M в ТГФ). Упаривают реакционную смесь досуха и очищают с помощью флэш-хроматографии (силикагель, 5% MeOH/CH2Cl2). Упаривают целевые фракции с получением указанного в заголовке соединения. МС (ES-): 438 (M-1). Пример 85. [2-(5'-Амино-3'-фторбифенил-4-ил)тиофен-3-ил]амид пропан-2-сульфоновой кислоты. Добавляют SnCl22H2O (8,5 ммоль) к раствору пропан-2-сульфоновой кислоты [2-(3'-фтор-5'нитробифенил-4-ил)тиофен-3-ил]амида (1,2 ммоль) в EtOH (40 мл). Нагревают реакционную смесь до 70 С в течение 30 мин и затем при комнатной температуре в течение ночи. Добавляют насыщенный раствор NaHCO3 (рН 11-12) и экстрагируют EtOAc (250 мл). Сушат над NaSO4, отфильтровывают и выпаривают досуха с получением указанного в заголовке соединения. МС (ES-): 389 (М-1). Следующее соединение получают по способу, в значительной мере сходному с методикой, описанной в примере выше.(0,16 ммоль) в 1,2-дихлорэтане (2 мл) и добавляют 2 н. метиламин в ТГФ (0,16 мл, 0,32 ммоль) при комнатной температуре. Перемешивают полученный раствор в течение 5 мин перед добавлениемNa(OAc)3BH (0,32 ммоль). Перемешивают смесь при комнатной температуре в течение 16 ч. Анализируют конечный продукт с помощью ЖХ/МС. Добавляют насыщенный водный раствор NaHCO3 и дихлорметан и отфильтровывают смесь через гидрофобный фильтр. Фильтрат упаривают и помещают остаток на картридж интенсивного катионного обмена, элюируют смесью метанол/ДХМ для удаления материалов, не являющихся основаниями, с последующим добавлением 2 н. NH3 в МеОН с получением неочищенного продукта. Очищают флэш-хроматографией (силикагель, дихлорметан/метанол, 7:1) с получением указанного в заголовке соединения. МС (ES-): 399 (М-1).- 28012310 Пример 88. (2-2',2'-бис-[(Пропан-2-сульфониламино)метил]бифенил-4-илтиофен-3-ил)амид пропан-2-сульфоновой кислоты и (2-2'-[(пропан-2-сульфониламино)метил]бифенил-4-илтиофен-3-ил)амид пропан-2-сульфоновой кислоты. Медленно добавляют раствор BH3Me2S (0,05 мл, 0,5 ммоль, 2 экв.) в 1,5 мл ТГФ к раствору 95 мг[2-(2"-цианобифенил-4-ил)тиофен-3-ил]амида пропан-2-сульфоновой кислоты (0,25 ммоль, 1 экв.) в 1,5 мл ТГФ. Нагревают смесь до кипения с обратным холодильником в течение 2 ч, затем охлаждают до комнатной температуры. Разлагают избыток борана добавлением 0,1 мл метанола и затем смеси 0,1 мл метанола и 0,03 мл раствора гидрохлорида. Реакционную смесь кипятят с обратным холодильником еще в течение 15 мин. Растворитель удаляют и добавляют 6 мл этанола для удаления тиоэфира. Твердое вещество суспендируют в 20 мл насыщенного водного раствора хлорида натрия и подщелачивают аммиаком. Экстрагируют EtOAc (310), сушат и растворитель удаляют. Очистка флэш-хроматографией (силикагель, гексан/EtOAc) дает [2-(2'-аминометилбифенил-4-ил)тиофен-3-ил]амид пропан-2-сульфоновой кислоты (100 мг, 62%). МС (m/е): 387,2 (M+1). При 0 С по каплям добавляют 1,8-диазабицикло [5,4,0] ундец-7-ен (ДБУ) (85 мг, 0,6 ммоль) к суспензии [2-(2'-аминометилбифенил-4-ил)тиофен-3-ил]амида пропан-2-сульфоновой кислоты (57 мг,0,15 ммоль) в дихлорметане (2 мл), с последующим добавлением по каплям изопропилсульфонилхлорида (42 мг, 0,3 ммоль), и перемешивают реакционную смесь при комнатной температуре в течение ночи. Растворитель удаляют при пониженном давлении. Очищают с помощью флэш-хроматографии (силикагель, гексан/EtOAc). Целевые фракции упаривают с получением(0,021 г) в сухом тетрагидрофуране (0,5 мл) при 0 С и добавляют N-хлорсукцинимид (0,007 г). Дают реакционной смеси нагреться до комнатной температуры и перемешивают в течение 72 ч. Добавляют диэтиловый эфир, упаривают под вакуумом и очищают с помощью картриджей силикагеля Strata, элюируя с градиентом смеси дихлорметан/метанол. Очищают обращенно-фазовой ВЭЖХ с получением 0,004 г указанного в заголовке соединения в виде твердого вещества белого цвета. МС (ES-) (m/z): 459 (M-1). Пример 90. [2-(2'-Циано-4'-метансульфониламинокарбонилбифенил-4-ил)тиофен-3-ил]амид пропан 2-сульфоновой кислоты. Добавляют метансульфонамид (0,28 ммоль), EDCI (0,28 ммоль) и ДМАП (0,28 ммоль) к раствору 2-циано-4'-[3-(пропан-2-сульфониламино)тиофен-2-ил]бифенил-4-карбоновой кислоты (0,235 ммоль) в ДХМ. Перемешивают в течение 8 ч при комнатной температуре. Добавляют 1 н. HCl и экстрагируют ДХМ. Упаривают все органические фракции досуха. Очищают с помощью ВЭЖХ с получением указанного в заголовке соединения. МС (ES-): 502 (М-1). Пример 91. 5-Метилсульфанил-3-(пропан-2-сульфониламино)-[1,1';4',1]терфенил-2-карбоновая кислота. Смешивают метиловый эфир 4-метилсульфанил-2-трифторметансульфонилоксибензойной кислоты(1,216 г, 3,682 ммоль), 4,4,5,5-тетраметил-1,3,2-диоксаборолан (0,85 мл, 5,682), Et3N (1,55 мл,11,121 ммоль) и ацетонитрил (40 мл) затем кипятят с обратным холодильником в течение 16 ч. Разбавляют реакционную смесь EtOAc и промывают водой. Упаривают при пониженном давлении. Далее добавляют (4'-бромбифенил-2-ил)амид пропан-2-сульфоновой кислоты (0,532 г, 1,502 ммоль), 2 н. растворNa2CO3 (7 мл, 14 ммоль), 1,4-диоксан (35 мл) и тетракис-трифенилфосфинпалладий (0,177 г,0,153 ммоль). Нагревают до 80 С в течение 16 ч. Охлаждают реакционную смесь, разбавляют EtOAc и промывают Н 2 О, после чего промывают насыщенным водным раствором хлорида натрия. Сушат с помощьюNa2SO4 и упаривают при пониженном давлении. Очищают реакционную смесь флэш-хроматографией(силикагель, толуол, затем до 20% EtOAc/гексан) с получением метилового эфира 5-метилсульфанил-3(пропан-2-сульфониламино)-[1,1';4',1]терфенил-2-карбоновой кислоты (0,431 г, 63%). МС (m/е): 456 (М+1). Смешивают полученный сложный эфир (0,120 г, 0,263 ммоль), 1 н. раствор NaOH (1 мл, 1 ммоль) и МеОН (1 мл), нагревают колбу до кипения с обратным холодильником в течение 1 ч и перемешивают в течение 16 ч. Затем добавляют 0,2 н. HCl (5 мл, 1 ммоль) и охлаждают на ледяной бане. Твердое вещество(0,195 г, 0,521 ммоль) и дихлорметан (6 мл), затем охлаждают до 0 С. К раствору по каплям добавляют ДБУ (0,33 мл, 2,162 ммоль), ClSO2CH(СН 3)2 (0,13 мл, 1,128 ммоль) и перемешивают в течение 16 ч. Если данные ТСХ показывают наличие исходного материала, добавляют еще порцию ДБУ (0,3 мл) иClSO2CH(CH3)2 (0,1 мл) и перемешивают в течение 16 ч. Разбавляют реакционную смесь CH2Cl2 (50 мл) и промывают Н 2 О, насыщенным водным раствором хлорида натрия, сушат с помощью Na2SO4 и упаривают при пониженном давлении. Анализируют с помощью ТСХ, и если данные ТСХ показывают наличие исходного материала, добавляют МеОН (2 мл) и 1 н. NaOH (1 мл, 1 ммоль). Нагревают до кипения с обратным холодильником в течение 6 ч. Добавляют 1 н. HCl (1 мл, 1 ммоль) и экстрагируют дихлорметаном. Очищают реакционную смесь флэш-хроматографией (силикагель, дихлорметан, затем до 10% MeOH/дихлорметан), с получением 6-циано-5-метилсульфанил-3-(пропан-2-сульфониламино)-[1,1';4',1]терфенил-2-карбоновой кислоты(0,008 г). МС (m/е): 467 (М+1). Пример 93. (2-Бифенил-4-ил-2 Н-пиразол-3-ил)амид пропан-2-сульфоновой кислоты. Добавляют фторид цезия (0,221 г, 1,45 ммоль) и аддукт дихлор[1,1'-бис-(дифенилфосфино)ферроцен]палладий(II)дихлорметана (0,024 г, 0,029 ммоль) к смеси [2-(4-бромфенил)-2 Н-пиразол-3 ил]амида пропан-2-сульфоновой кислоты (0,100 г, 0,290 ммоль) и фенил-4-бороновой кислоты (0,037 г,0,290 ммоль) в безводном 1,2-диметоксиэтан (5,0 мл). Дезоксигенируют смесь трижды, погружают в предварительно нагретую (85 С) масляную баню и перемешивают в течение 30 ч. Разбавляют смесь водой и дихлорметаном, фильтруют через Celite и промывают дихлорметаном. Упаривают смесь, снова растворяют в дихлорметане, адсорбируют на силикагель и подвергают колоночной флэш-хроматографии на силикагеле (колонка 12 г, элюируют с градиентом смеси метанол/дихлорметан [0-10%] в течение 40 мин с последующим элюированием (20% 2,0 М NH3 в смеси метанол/дихлорметан) с получением указанного в заголовке продукта в виде не совсем белого твердого вещества (22 мг, 22%). МС (m/е): 342,3 (М+1), 340,3 (М-1). Пример 94. [2-(2'-Цианобифенил-4-ил)-2 Н-пиразол-3-ил]амид пропан-2-сульфоновой кислоты. Добавляют фторид цезия (0,221 г, 1,45 ммоль) и аддукт дихлор [1,1'-бис-(дифенилфосфино)ферроцен]палладия(II)дихлорметана (0,024 г, 0,029 ммоль) к смеси [2-(4-бромфенил)-2H-пиразол-3 ил]амида пропан-2-сульфоновой кислоты (0,100 г, 0,290 ммоль) и 2-цианофенилбсроновой кислоты(0,043 г, 0,290 ммоль) в безводном 1,2-диметоксиэтане (5,0 мл). Трижды дезоксигенируют смесь, погружают в предварительно нагретую (85 С) масляную баню и перемешивают в течение 30 ч. Разбавляют смесь водой и дихлорметаном, фильтруют через Celite и промывают дихлорметаном. Смесь упаривают,снова растворяют в дихлорметане, адсорбируют на силикагель и подвергают колоночной флэшхроматографии на силикагеле (колонка 12 г, элюируют с градиентом смеси метанол/дихлорметан[0-10%] в течение 40 мин, с последующим элюированием (20% 2,0 М NH3 в смеси метанол/дихлорметан) с получением указанного в заголовке продукта в виде светло-коричневого твердого вещества (0,036 г,34%). МС (m/е): 367,0 (М+1), 365,0 (М-1). Общая методика получения солей и кристаллов. Готовят основной планшет, добавляя по 250 мкл свободной кислоты исследуемого соединения в метаноле (0,1 М) во все лунки 96-луночного планшета. Массив оснований распределяют по ячейкам в количестве 1 и 2 молярных эквивалентов. Растворители выпаривают из всех 96 лунок с использованием испарителя Genevac Series II с получением остатка твердого вещества на основном планшете. Массив растворителей распределяют в каждую из указанных лунок с помощью крышечки (cap mat), после чего нагревают до 55 С при перемешивании и позволяют уравновеситься в течение 60-90 мин приблизительно при 55 С. После этого каждый образец фильтруют в горячем состоянии и переносят в соответствующие лунки на испарительном планшете, планшете для осаждения и планшете для охлаждения. Испарительный планшет готовят, помещая 200 мкл фильтрата с основного планшета с использованием нагретых до 55 С шприцов на планшет для титрования с открытыми лунками, после чего упаривают досуха в течение ночи при комнатной температуре и влажности. Планшет для осаждения готовят, добавляя 100 мкл фильтрата с основного планшета с использованием нагретых до 55 С шприцов для покрытия 96 луночного планшета для титрования, где каждая лунка содержит в качестве антирастворителя 200 мкл гептана или 2-пропанола. После уравновешивания на протяжении 9 ч при комнатной температуре избыток раствора удаляют с использованием предварительно нарезанной фильтровальной бумаги Whatman. Охлаждающий планшет готовят, помещая по 200 мкл фильтрата с основного планшета в отдельные лун- 30
МПК / Метки
МПК: C07D 213/75, A61K 31/44, C07C 311/00, A61K 31/381, C07D 257/04, C07D 237/04, C07D 333/36, A61P 25/00, C07D 409/10
Метки: активаторы, рецептора
Код ссылки
<a href="https://eas.patents.su/30-12310-aktivatory-receptora-ampa.html" rel="bookmark" title="База патентов Евразийского Союза">Активаторы рецептора ampa</a>
Предыдущий патент: Применение макролидов для лечения флегмоны кишечника
Следующий патент: Способ лазерной резки хрупких прозрачных неметаллических материалов
Случайный патент: Гидрофобные агонисты допамина, введенные в дерму












