Пирролопиримидины и их применение
Номер патента: 19094
Опубликовано: 30.01.2014
Авторы: Конгрив Майлс Стьюарт, Врона Войцех, Хэ Гуо, Брукс Клинтон А., Сун Му, Хоу Ин, Брейн Кристофер Томас, Лагу Бхарат, Ли Йю, Вудхед Стивен, Смит Трой, Хауард Стивен, Лю Ипинь, Безонг Гильберт, Дагостин Клаудио, Мортенсон Пол
Формула / Реферат
1. Соединение формулы I
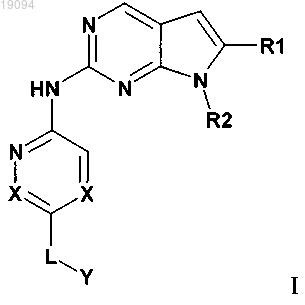
или его фармацевтически приемлемая соль, в которой
X обозначает CR9;
R1 обозначает CONR5R6, где R5 и R6 оба обозначают метил;
R2 обозначает циклопентил;
L обозначает связь, -СН2-, -СН2СН2-, -СН2СН2СН2-, С(О) или C(O)NH;
Y является частью следующей группы:
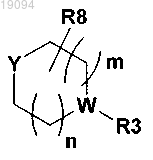
где m и n равны 1 или 2;
Y и W обозначают N;
где может содержаться 0-3 R8 и R8 обозначает C1-C8-алкил, оксогруппу, галоген или два или более R8 могут образовать мостиковую алкильную группу;
R3 обозначает Н, C1-C8-алкил или C1-C8-алкил-ОН;
R9 обозначает Н.
2. Соединение формулы I или его фармацевтически приемлемая соль по п.1, в которой R3 обозначает Н, метил, этил, пропил, изопропил, СН2ОН или СН2СН2ОН.
3. Соединение формулы I по любому из пп.1, 2, в которой Y является частью следующей группы:
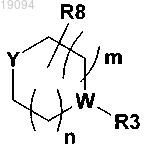
где m и n равны 1;
Y и W обозначают N.
4. Соединение формулы I или его фармацевтически приемлемая соль по п.1, в которой m равно 2 и n равно 1.
5. Соединение формулы I или его фармацевтически приемлемая соль по любому из пп.1-4, в которой R8 обозначает метил, этил, пропил, бутил, оксогруппу или два R8 могут образовывать мостиковую группу.
6. Соединение формулы I или его фармацевтически приемлемая соль по любому из пп.1-5, в которой L обозначает связь.
7. Соединение, выбранное из группы, включающей
диметиламид 7-циклопентил-2-[4-(2-гидроксиэтил)-3,4,5,6-тетрагидро-2Н-[1,2']бипиразинил-5'-иламино]-7Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-[5-((R)-3-метилпиперазин-1-ил)пиридин-2-иламино]-7Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-[5-((S)-3-метилпиперазин-1-ил)пиридин-2-иламино]-7Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-[5-(3-метилпиперазин-1-ил)пиридин-2-иламино]-7Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-{5-[4-(3-гидроксипропил)пиперазин-1-ил]пиридин-2-иламино}-7Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-{5-[4-(2-гидроксиэтил)пиперазин-1-ил]пиридин-2-иламино}-7Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-{5-[4-(2-гидрокси-1-метилэтил)пиперазин-1-ил]пиридин-2-иламино}-7Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-[5-(пиперазин-1-карбонил)пиридин-2-иламино]-7Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-(1',2',3',4',5',6'-гексагидро[3,4']бипиридинил-6-иламино)-7Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-[5-((S)-3-метилпиперазин-1-илметил)пиридин-2-иламино]-7Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-{5-[4-((S)-2-гидроксипропил)пиперазин-1-ил]пиридин-2-иламино}-7Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-{5-[4-((R)-2-гидроксипропил)пиперазин-1-ил]пиридин-2-иламино}-7Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-[5-(4-изопропилпиперазин-1-ил)пиридин-2-иламино]-7Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-[5-(4-изопропилпиперазин-1-карбонил)пиридин-2-иламино]-7Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-{5-[4-(4-метилпентил)пиперазин-1-ил]пиридин-2-иламино}-7Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-{5-[4-(2-гидрокси-2-метилпропил)пиперазин-1-ил]пиридин-2-иламино}-7Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-[5-(3,3-диметилпиперазин-1-ил)пиридин-2-иламино]-7Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-[5-(3,8-диазабицикло[3.2.1]окт-3-илметил)пиридин-2-иламино]-7Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-(5-пиперазин-1-илпиридин-2-иламино)-7Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-[5-(4-этилпиперазин-1-ил)пиридин-2-иламино]-7Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-(1'-изопропил-1',2',3',4',5',6'-гексагидро[3,4']бипиридинил-6-иламино)-7Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-{5-[(R)-4-(2-гидроксиэтил)-3-метилпиперазин-1-ил]пиридин-2-иламино}-7Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-{5-[(S)-4-(2-гидроксиэтил)-3-метилпиперазин-1-ил]пиридин-2-иламино}-7Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-{5-[4-(2-гидроксиэтил)пиперазин-1-илметил]пиридин-2-иламино}-7Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-{5-[4-(2-этилбутил)пиперазин-1-ил]пиридин-2-иламино}-7Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-{5-[4-(2-метилбутил)пиперазин-1-ил]пиридин-2-иламино}-7Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты;
диметиламид 7-циклопентил-2-[1'-(2-гидроксиэтил)-1',2',3',4',5',6'-гексагидро[3,4']бипиридинил-6-иламино]-7Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты,
или его фармацевтически приемлемая соль.
8. Соединение по п.1, которое представляет собой диметиламид 7-циклопентил-2-(5-пиперазин-1-илпиридин-2-иламино)-7Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты, обладающий следующей формулой:
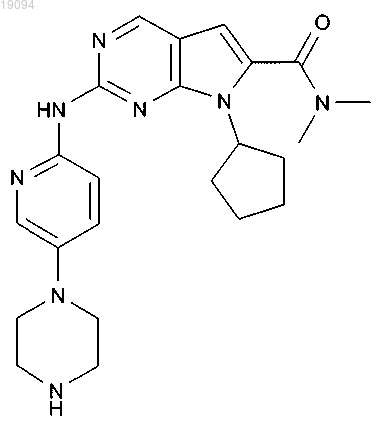
или его фармацевтически приемлемая соль.
9. Соединение по п.1, которое представляет собой диметиламид 7-циклопентил-2-(5-пиперазин-1-илпиридин-2-иламино)-7Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты, обладающий следующей формулой:
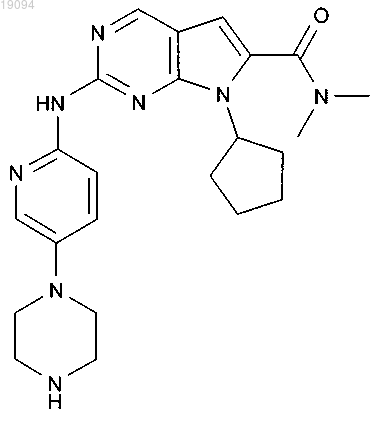
10. Фармацевтическая композиция, содержащая соединение или его фармацевтически приемлемую соль по любому из пп.1-8 и фармацевтически приемлемый носитель.
11. Способ лечения рака, включающий введение нуждающемуся в этом пациенту соединения по любому из пп.1-8 или его фармацевтически приемлемой соли в эффективном количестве.
12. Способ по п.11, в котором рак выбирают из группы, состоящей из рака молочной железы, рака поджелудочной железы, колоректального рака, рака легких, саркомы, лейкоза, глиомы, наследственной меланомы и меланомы.
13. Способ по п.11, в котором рак представляет собой карциному мочевого пузыря, молочной железы, толстой кишки, почек, эпидермиса, печени, легких, пищевода, желчного пузыря, яичников, поджелудочной железы, желудка, шейки матки, щитовидной железы, носа, головы и шеи, предстательной железы, или кожи; гематопоэтическую опухоль лимфоидного происхождения; гематопоэтическую опухоль миелоидного происхождения; фолликулярный рак щитовидной железы; опухоль мезенхимального происхождения; опухоль центральной или периферической нервной системы; меланому; семиному; тератокарциному; остеосаркому; пигментную ксеродерму; кератоакантому; фолликулярный рак щитовидной железы или саркому Капоши.
14. Способ по п.13, в котором гематопоэтическая опухоль лимфоидного происхождения представляет собой лейкоз, острый лимфолейкоз, хронический лимфолейкоз, В-клеточную лимфому, Т-клеточную лимфому, множественную миелому, Ходжкинскую лимфому, неходжкинскую лимфому, волосатоклеточную лимфому или лимфому Беркитта.
Текст
В изобретении описаны соединения формулы I относящиеся к средствам лечения нарушений, связанных с протеинкиназой, а также соединения,применимые для устранения, или предупреждения, или облегчения протекания одного или более симптомов рака, отторжений трансплантата и аутоиммунных заболеваний. Уровень техники В последние годы поиску новых терапевтических средств значительно способствовало лучшее изучение структуры ферментов и других биомолекул, связанных с заболеваниями. Одним важным классом ферментов, оказавшимся объектом многочисленных исследований, являются протеинкиназы. Протеинкиназы представляют собой большую группу структурно родственных ферментов, которые обеспечивают регулирование различных процессов передачи сигналов в клетке (Hardie, G. and Hanks, S.The Protein Kinase Facts Book, I and II, Academic Press, San Diego, Calif.: 1995). Ввиду сохранения их структуры и каталитического действия предполагается, что протеинкиназы образовались из общего анцестрального гена. Почти все киназы включают сходный, содержащий 250-300 аминокислот каталитический домен. Киназы можно разделить на группы в соответствии с субстратами, которых они фосфорилируют (например, протенитирозин, протеинсерин/треонин, липиды и т.п.). Идентифицированы группы последовательностей, которые обычно соответствуют каждой из этих групп киназ (см., например, Hanks,S.K., Hunter, Т., FASEB J. 1995, 9, 576-596; Knighton et al., Science 1991, 253, 407-414; Hiles et al., Cell 1992, 70, 419-429; Kunz et al., Cell 1993, 73, 585-596; Garcia-Bustos et al., EMBO J. 1994, 13, 2352-2361). Обычно протеинкиназы опосредуют внутриклеточные сигналы путем воздействия на перенос фосфорильных групп от нуклеозидтрифосфата к акцепторному белку, который участвует в пути передачи сигнала. Эти акты фосфорилирования выступают в качестве молекулярных переключателей, которые могут модулировать или регулировать биологические функции целевого белка. Эти акты фосфорилирования в конечном счете инициируются в ответ на различные внутриклеточные и другие воздействия. Примеры таких воздействий включают сигналы вызванных окружающей средой и химических стрессов(например, осмотического шока, теплового шока, ультрафиолетового излучения, бактериального эндотоксина и Н 2 О 2), цитокинов (например, интерлейкина-1 (IL-1) и факторанекроза опухоли (TNF- и факторов роста (например, колониеобразующего гранулоцитарно-моноцитарно-макрофагального фактора (GM-CSF) и фактора роста фибробластов (FGF. Внеклеточные воздействия могут влиять на один или более клеточных ответов, связанных с ростом, миграцией, дифференциацией клеток, секрецией гормонов, активацией факторов транскрипции, сокращением мышц, метаболизмом глюкозы, регулирования синтеза белка и регулирования клеточного цикла. Многие заболевания связаны с аномальными ответами клеток, вызванными опосредуемыми протеинкиназой проявлениями, описанными выше. Эти заболевания включают, но не ограничиваются только ими, аутоиммунные заболевания, воспалительные заболевания, заболевания кости, метаболические заболевания, неврологические и нейродегенеративные заболевания, рак, сердечно-сосудистые заболевания,аллергии и астму, болезнь Альцгеймера и связанные с гормонами заболевания. В связи с этим в медицинской химии предпринимались значительные усилия по поиску ингибиторов протеинкиназы, которые эффективны в качестве лекарственных средств. Инициирование, прогрессирование и завершение клеточного цикла у млекопитающих регулируется различными комплексами циклинзависимой киназы (CDK), которые являются критически важными для роста клеток. Эти комплексы включают, по меньшей мере, каталитическую (сама CDK) и регуляторную(циклин) субъединицы. Некоторые из комплексов, наиболее важных для регуляции клеточного цикла,включают циклин A (CDK1, также обозначаемый как cdc2 и CDK2), циклин В 1-В 3 (CDK1) и циклин D1D3 (CDK2, CDK4, CDK5, CDK6), циклин Е (CDK2). Каждый из этих комплексов участвует в конкретной фазе клеточного цикла. Однако не все представители группы CDK участвуют только в регулировании клеточного цикла. Так, CDK 7, 8, и 9 участвуют в регуляции транскрипции и CDK5 участвует в нейронной и секреторной функции клетки. Активность CDK регулируется после трансляции с помощью временных ассоциаций с другими белками и с помощью изменения их положения в клетке. Развитие опухоли тесно связано с генетическим изменением и нарушением регуляции CDK и их регуляторов и это показывает, что ингибиторы CDK могут быть полезными противораковыми лекарственными средствами. И действительно, полученные ранее результаты показывают, что изменившиеся и нормальные клетки различаются по их потребности, например, в циклине A/CDK2 и что можно разработать новые противоопухолевые средства, не проявляющие обычной токсичности по отношению к реципиенту, наблюдающейся у обычных цитотоксичных и цитостатических лекарственных средств. Хотя ингибирование связанных с клеточным циклом CDK прямо относится, например, к применению в онкологии, к ней может не относится ингибирование CDK, регулирующих РНК-полимеразу. С другой стороны, ингибирование функции CDK-9/циклин Т недавно было связано с предупреждением репликации ВИЧ (вирус иммунодефицита человека) и исследование новых биологических характеристик CDK продолжает способствовать появлению новых терапевтических показаний для ингибиторов CDK (Sausville, E.A. Trends Molec. Med. 2002, 8, S32-S37). Функцией CDK является фосфорилирование и тем самым активация или дезактивация некоторых белков, включая, например, белки ретинобластомы, ламины, гистон H1 и компоненты митотического веретена. Каталитическая стадия, опосредуемая CDK, включает реакции переноса фосфорсодержащих групп от АТФ (аденозинтрифосфат) к макромолекулярному ферменту субстрата. Обнаружено, что некоторые группы соединений (обзор приведен, например, в публикации Fischer,P.M. Curr. Opin. Drug Discovery Dev. 2001, 4, 623-634) обладают антипролиферативной способностью вследствие CDK-специфического антагонизма к АТФ. На молекулярном уровне для опосредования активности комплекса cdk/циклин необходима последовательность актов стимулирующего и ингибирующего фосфорилирования или дефосфорилирования. Фосфорилирование cdk осуществляет группа активирующих cdk киназ (САК) и/или киназ, таких какKAP. Активность комплекса cdk/циклин также могут регулировать два семейства эндогенных клеточных белковых ингибиторов: семейства Kip/Cip или семейства INK. Белки INK специфически связывают cdk4 и cdk6. p16INK4 (также известный как MTS1) является потенциальным опухолевым супрессорным геном,который мутирует или исключается в большом количестве первичных раковых заболеваний. СемействоKip/Cip включает такие белки, как p21Cip1, Waf1, p27Kipl и р 57Kip2. Как отмечено выше, р 21 индуцируется посредством р 53 и способен инактивировать комплексы cdk2/циклин(E/A) и cdk4/циклин(D1/D2/D3). Атипично низкие уровни экспрессирования р 27 наблюдались при раке молочной железы, толстой кишки и предстательной железы. Напротив, показано, что сверхэкспрессирование циклина Е в солидных опухолях коррелирует с плохим прогнозом для пациента. Сверхэкспрессирование циклина D1 было связано с карциномами пищевода, молочной железы, плоскоклеточной и немелкоклеточной карциномами легких. Ключевая роль cdk и связанных с ними белков в координации и осуществлении клеточного цикла пролиферирующих клеток описана выше. Также описаны некоторые биохимические пути, в которых cdk играют ключевую роль. Поэтому весьма желательна разработка средств монотерапии для лечения пролиферативных нарушений, таких как рак, с использованием средств, специально направленных на cdk или конкретные cdk. Ингибиторы cdk, вероятно, можно использовать для лечения других патологических состояний, таких как, в частности, вирусные инфекции, аутоиммунные заболевания и нейродегенеративные заболевания. Воздействующие на cdk лекарственные средства также могут привести к благоприятным результатам при лечении описанных ранее заболеваний при их использовании в комбинированной терапии вместе с имеющимися или новыми лекарственными средствами. Воздействующие на cdk противораковые лекарственные средства, вероятно, могут обладать преимуществами по сравнению с многими существующими противоопухолевыми средствами, поскольку они непосредственно не взаимодействуют с ДНК и поэтому уменьшают опасность развития вторичных опухолей. Таким образом, постоянно необходимо проводить поиск новых лекарственных средств для лечения заболеваний людей. В соответствии с этим необходимы новые ингибиторы протеинкиназ, таких какCDK1, CDK2, CDK4, CDK5, CDK6, CDK7, CDK8 и CDK9. Краткое изложение сущности изобретения Необходимы новые средства и методики лечения нарушений, связанных с протеинкиназой. Также необходимы новые соединения, применимые для устранения, предупреждения или облегчения одного или большего количества симптомов рака, отторжений трансплантатов и аутоиммунных заболеваний. Кроме того, необходимы способы модулирования активности протеинкиназ, таких как CDK1, CDK2,CDK4, CDK5, CDK6, CDK7, CDK8 и CDK9, с использованием соединений, предлагаемых в настоящем изобретении. Одним объектом настоящего изобретения является соединение формулы I. В одном варианте осуществления настоящее изобретение относится к соединению формулы I или его фармацевтически приемлемым солям,в которой X обозначает CR9;Y является частью следующей группы:-2 019094 где может содержаться 0-3 R8 и R8 обозначает C1-C8-алкил, оксогруппу, галоген или два или болееR могут образовать мостиковую алкильную группу;R9 обозначает Н. Подробное описание изобретения В одном варианте осуществления настоящее изобретение относится к соединениям формулы I, в которой Y обозначает 8 где m и n равны 1 или 2 и Y и W обозначают N. В одном варианте осуществления m равно 1 или 2. В другом варианте осуществления n равно 1 или 2. В одном варианте осуществления m равно 1 и n равно 2. В другом варианте осуществления m равно 2 и n равно 1. В другом варианте осуществления m и n оба равны 1. В одном варианте осуществления в соединениях формулы I содержится 0-2 R8. Следует понимать,что если содержится 0 групп R8, то Н присоединен к атомам углерода циклической структуры. В одном варианте осуществления R8 обозначает метил, этил, пропил, бутил, оксогруппу или два R8 могут образовывать мостиковую группу. В одном варианте осуществления R8 обозначает метил. В другом варианте осуществления R8 отсутствует. В одном варианте осуществления настоящее изобретение относится к соединениям формулы I, в которой R3 обозначает Н, C1-C8-алкил, такой как метил, этил, пропил, изопропил, бутил, пентил или гексил; C1-C8-алкил-ОН, такой как СН 2 ОН, СН 2 СН 2 ОН, СНОНСН 3, СН 2 СН 2 СН 2 ОН, СНОНСН 2 СН 3 или СН 2 СНОНСН 3. В другом варианте осуществления настоящее изобретение относится к соединению формулы I, в которой R3 обозначает Н, C1-C8-алкил, такой как метил, этил, пропил или изопропил; или C1-C8-алкилОН, такой как СН 2 ОН или СН 2 СН 2 ОН. В другом варианте осуществления R3 обозначает Н, изопропил,СН 2 ОН или СН 2 СН 2 ОН. В другом варианте осуществления R3 обозначает Н. В одном варианте осуществления соединением является соединение формулы I, в которой R3 обозначает Н или C1-C8-алкил. В одном варианте осуществления соединением является соединение формулы I, в которой L обозначает связь. В одном варианте осуществления соединение представляет собой диметиламид 7-циклопентил-2(5-пиперазин-1-илпиридин-2-иламино)-7 Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты, обладающий следующей формулой: или его фармацевтически приемлемую соль. В одном варианте осуществления соединение представляет собой диметиламид 7-циклопентил-2(5-пиперазин-1-илпиридин-2-иламино)-7 Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты, обладающий следующей формулой: В другом варианте осуществления настоящее изобретение относится к способу лечения рака, который включает введение нуждающемуся в этом пациенту соединения формулы I или его фармацевтически приемлемой соли в эффективном количестве. В другом варианте осуществления настоящее изобретение относится к способу лечения рака, в котором рак выбирают из группы, состоящей из рака молочной железы, рака поджелудочной железы, колоректального рака, рака легких, саркомы, лейкоза, глиомы, наследственной меланомы и меланомы. В другом варианте осуществления настоящее изобретение относится к способу лечения рака, в котором рак представляет собой карциному мочевого пузыря, молочной железы, толстой кишки, почек,эпидермиса, печени, легких, пищевода, желчного пузыря, яичников, поджелудочной железы, желудка,шейки матки, щитовидной железы, носа, головы и шеи, предстательной железы, или кожи; гематопоэтическую опухоль лимфоидного происхождения; гематопоэтическую опухоль миелоидного происхождения; фолликулярный рак щитовидной железы; опухоль мезенхимального происхождения; опухоль центральной или периферической нервной системы; меланому; семиному; тератокарциному; остеосаркому; пигментную ксеродерму; кератоакантому; фолликулярный рак щитовидной железы или саркому Капоши. В другом варианте осуществления настоящее изобретение относится к способу лечения рака, в котором гематопоэтическая опухоль лимфоидного происхождения представляет собой лейкоз, острый лимфолейкоз, хронический лимфолейкоз, В-клеточную лимфому, Т-клеточную лимфому, множественную миелому, Ходжкинскую лимфому, неходжкинскую лимфому, волосатоклеточную лимфому или лимфому Беркитта. В другом варианте осуществления настоящее изобретение относится к фармацевтической композиции, содержащей соединение формулы I и фармацевтически приемлемый носитель. Выражение "фармацевтически приемлемый" означает соединения и композиции, которые при введении человеку являются физиологически переносимыми и обычно не приводят к аллергическим или аналогичным нежелательным реакциям, таким как расстройства желудка, головокружение и т.п. При использовании в настоящем изобретении термин "фармацевтически приемлемый" предпочтительно означает утвержденный регулятивным органом федерального правительства или правительства штата, или указанный в Фармакопее США или другой общепризнанной Фармакопее, как применимый для животных и более предпочтительно для человека. Термин "носитель" означает разбавитель, вспомогательное вещество, инертный наполнитель или растворитель, вместе с которым вводят соединение. Такие фармацевтические носители могут представлять собой стерильные жидкости, такие как вода или масла, включая масла, полученные из нефти, и масла животного, растительного или синтетического происхождения, такие как арахисовое масло, соевое масло, минеральное масло, кунжутное масло и т.п. В качестве носителей, в особенности для растворов,предназначенных для инъекций, предпочтительно использовать воду или водные физиологические растворы и водные растворы декстрозы и глицерина. Подходящие фармацевтические носители описаны в публикации "Remington's Pharmaceutical Sciences" by E.W. Martin. Выражение "терапевтически эффективное количество" используется в настоящем изобретении для указания количества, достаточного для составляющего по меньшей мере примерно 15%, предпочтительно по меньшей мере 50%, более предпочтительно по меньшей мере 90% ослабления клинически значимого дефицита активности, функции и ответа реципиента, и наиболее предпочтительно его предупреждение. Альтернативно, терапевтически эффективное количество достаточно для обеспечения улучшения клинически значимого состояния/симптома у реципиента."Средство" означает все вещества, которые можно использовать для приготовления фармацевтических и диагностических композиций, или которыми могут быть соединения, нуклеиновые кислоты, полипептиды, фрагменты, изоформы, варианты или другие вещества, которые независимо можно использовать для таких целей, все в соответствии с настоящим изобретением."Аналог" при использовании в настоящем изобретении означает небольшое органическое соединение, нуклеотид, белок или полипептид, который обладает сходной или такой же активностью или функ-4 019094 цией (функциями), как соединение, нуклеотид, белок или полипептид или соединение, обладающее необходимой активностью и терапевтическим воздействием в соответствии с настоящим изобретением(например, подавляет рост опухоли), но не обязательно включает последовательность или структуру,которая сходна или идентична с последовательностью или структурой предпочтительного варианта осуществления."Производное" означает соединение, белок или полипептид, который включает аминокислотную последовательность исходного белка или полипептида, которая изменена путем замещений, удалений или добавлений аминокислотных остатков, или нуклеиновую кислоту или нуклеотид, который модифицирован путем введения или удалений, добавлений или мутаций нуклеотидных заместителей. Производное нуклеиновой кислоты, нуклеотида, белка или полипептида выполняет сходную или такую же функцию, как исходный полипептид. При использовании в настоящем изобретении "галоген" означает фтор, хлор, бром или йод. При использовании в настоящем изобретении "алкил" означает обладающую линейной или разветвленной цепью насыщенную углеводородную группу. В некоторых вариантах осуществления алкильная группа может содержать от 1 до 10 атомов углерода (например, от 1 до 8 атомов углерода). Примеры алкильных групп включают метильную (Me), этильную (Et), пропильные (например, н-пропильную и изопропильную), бутильные (например, н-бутильную, изобутильную, втор-бутильную, трет-бутильную),пентильные группы (например, н-пентильную, изопентильную, неопентильную), гексильные группы(например, н-гексил и его изомеры) и т.п. Низш. алкильная группа обычно содержит до 4 атомов углерода. Примеры низш. алкильных групп включают метильную, этильную, пропильные (например, нпропильную и изопропильную) и бутильные группы (например, н-бутильную, изобутильную, вторбутильную, трет-бутильную). В одном варианте осуществления алкильная группа или две или более алкильных групп могут образовать мостиковую алкильную группу. Это происходит, когда алкильная группа двумя атомами присоединяется к двум положениям другой группы (в частности, это иллюстрируется циклической группой) с образованием кольца, содержащего мостик из алкильной цепи, т.е. с образованием мостикового конденсированного цикла. Это иллюстрируется случаем, но не ограничивается только им, когда две или более групп R8 являются мостиковыми алкильными группами в кольцевой группе Y и образуют кольцо с мостиком из алкильной цепи. При использовании в настоящем изобретении "оксо" означает кислород, связанный двойной связью(т.е. =O). Также следует понимать, что обозначение С(O) означает группу -С=O, независимого от того,входит ли она в кетон, альдегид или кислоту, или производное кислоты. Аналогичным образом, S(O) означает группу -S=O. В объем настоящего изобретения входят все фармацевтически приемлемые изотопно-меченые соединения формулы (I), в которой один или более атомов заменены атомами, обладающими таким же атомным номером, но атомной массой или массовым числом, отличающимся от атомной массы или массового числа, обычно встречающихся в природе. Примеры изотопов, подходящих для включения в соединения, предлагаемые в настоящем изобретении, включают изотопы водорода, такие как 2 Н и 3 Н, углерода, такие как 11 С, 13 С и 14 С, хлора, такие как 36O и 18O, фосфора, такие как 32 Р, и серы, такие как 35S. Некоторые изотопно-меченые соединения формулы I, например, содержащие радиоактивный изотоп, применимы для исследования распределения лекарственного средства и/или субстрата в тканях. Радиоактивные изотопы тритий, т.е. 3 Н, и углерод-14, т.е. 14 С, являются особенно подходящими для этой цели вследствие легкости их включения и простых средств детектирования. Замещение более тяжелыми изотопами, такими как дейтерий, т.е. 2 Н, может привести к некоторым терапевтическим преимуществам, обусловленным большей метаболической стабильностью, например,увеличенной длительностью полувыведения in vivo или возможностью использования меньших доз, и поэтому при некоторых обстоятельствах они могут быть предпочтительными. Замещение изотопами, испускающими позитроны, такими как 11 С, 18F, 15O и I3N, может быть полезно для изучения занятости рецепторов с помощью позитронной эмиссионной томографии (ПЭТ). Изотопно-меченые соединения формулы (I) обычно можно получить по обычным методикам, известным специалистам в данной области техники, или по методикам, аналогичным описанным в прилагающихся примерах и разделах, посвященных синтезу, с использованием подходящего изотопномеченого реагента вместо использовавшегося ранее немеченого реагента. Биологическая активность. Соединения формул (I) и их подгруппы являются ингибиторами циклинзависимых киназ. Например, соединения, предлагаемые в настоящем изобретении, являются ингибиторами циклинзависимых киназ и предпочтительно являются ингибиторами циклинзависимых киназ, выбранных из группы, включающей CDK1, CDK2, CDK3, CDK4, CDK5, CDK6 и CDK9, и более предпочтительно выбранных из группы, включающей CDK1, CDK2, CDK3, CDK4, CDK5 и CDK9. Соединения, предлагаемые в настоящем изобретении, также обладают активностью по отношению к гликогенсинтазакиназе-3 (GSK-3). Вследствие их активности при модулировании или ингибированииCDK и гликогенсинтазакиназы они предположительно могут быть применимы для получения средств,предназначенных для остановки или восстановления регулирования клеточного цикла аномально делящихся клеток. Поэтому предполагается, что эти соединения будут применимы для лечения или предупреждения пролиферативных нарушений, таких как раковые заболевания. Также предполагается, что соединения, предлагаемые в настоящем изобретении, будут применимы для лечения патологических состояний, таких как вирусные инфекционные заболевания, сахарный диабет типа II или инсулиннезависимый сахарный диабет, аутоиммунные заболевания, травма головы, удар,эпилепсия, нейродегенеративные заболевания, такие как болезнь Альцгеймера, заболевание двигательного нейрона, прогрессирующий супрануклеарный паралич, кортикобазальная дегенерация и болезнь Пика,например аутоиммунные заболевания и нейродегенеративные заболевания. Одна подгруппа заболеваний и патологических состояний, для которой предполагается, что будут применимы соединения, предлагаемые в настоящем изобретении, включает вирусные инфекционные заболевания, аутоиммунные заболевания и нейродегенеративные заболевания.CDK играют роль в регуляции клеточного цикла, апоптоза, транскрипции, дифференциации и функции и ЦНС (центральная нервная система). Поэтому ингибиторы CDK могут быть применимы для лечения заболеваний, при которых имеется нарушение пролиферации, апоптоза или дифференциации,такое как рак. В частности, опухоли RB+ve могут быть особенно чувствительны к ингибиторам CDK. Они включают опухоли, содержащие мутации в ras, Raf, рецепторах факторов роста, или сверхэкспрессирующие рецепторы факторов роста. Кроме того, могут проявлять чувствительность и опухоли с гиперметилированными промоторные участками ингибиторов CDK, а также опухоли, сверхэкспрессирующие циклиновых партнеров циклинзависимых киназ. Опухоли RB-ve также могут быть чувствительны к ингибиторам CDK. Примеры раковых заболеваний, которые можно подавлять, включают, но не ограничиваются только ими, карциному, например карциному мочевого пузыря, молочной железы, толстой кишки (например,колоректальные карциномы, такие как аденокарцинома толстой кишки и аденома толстой кишки), почек,эпидермиса, печени, легких, например, аденокарцинома, мелкоклеточный рак легких и немелкоклеточные легких карциномы, пищевода, желчного пузыря, яичников, поджелудочной железы, например экзокринная карцинома поджелудочной железы, желудка, шейки матки, щитовидной железы, носа, головы и шеи, предстательной железы, или кожи, например плоскоклеточная карцинома; гематопоэтическую опухоль лимфоидного происхождения, например лейкоз, острый лимфолейкоз, хронический лимфолейкоз,В-клеточную лимфому (такую как диффузная крупноклеточная В-клеточная лимфома), Т-клеточную лимфому, множественную миелому, ходжкинскую лимфому, неходжкинскую лимфому, волосатоклеточную лимфому или лимфому Беркитта; гематопоэтическую опухоль миелоидного происхождения, например острые и хронические миелолейкозы, миелодиспластический синдром, или промиелоцитарный лейкоз; фолликулярный рак щитовидной железы; опухоль мезенхимального происхождения, например фибросаркома или рабдомиосаркома; опухоль центральной или периферической нервной системы, например астроцитому, нейробластому, глиому или шванному; меланому; семиному; тератокарциному; остеосаркому; пигментную ксеродерму; кератоакантому; фолликулярный рак щитовидной железы или саркому Капоши. Раковыми заболеваниями могут быть раковые заболевания, которые чувствительны к ингибированию любой одной или большего количества циклинзависимых киназ, выбранных из группы, включающей CDK1, CDK2, CDK3, CDK4, CDK5 и CDK6, например, одной или большего количества киназ CDK,выбранных из группы, включающей CDK1, CDK2, CDK4 и CDK5, например CDK1 и/или CDK2. Является или не является конкретный тип рака чувствительным к ингибированию циклинзависимой киназы ингибитором, можно определить с помощью исследования роста клеток, описанного в приведенных ниже примерах, или по методике, описанной в разделе под названием "Методики диагностики". Также известно, что CDK играют роль при апоптозе, пролиферации, дифференциации и транскрипции и поэтому ингибиторы CDK также могут быть применимы для лечения следующих заболеваний, не являющихся раком: вирусные инфекционные заболевания, например, вызванные вирусом герпеса, поксвирусом, вирусом Эпштейна-Барра, вирусом Синдбис, аденовирусом, ВИЧ (вирус иммунодефицита человека), ВПЧ (вирус папилломы человека), HCV (вирус гепатита С) и ЦМВЧ (цитомегаловирус человека); для предупреждения развития СПИД (синдром приобретенного иммунодефицита) у инфицированных посредством ВИЧ индивидуумов; хронических воспалительных заболеваний, например, системной красной волчанки, аутоиммунно обусловленного гломерулонефрита, ревматоидного артрита, псориаза,воспалительной болезни кишечника и аутоиммунного сахарного диабета; сердечно-сосудистых заболеваний, например гипертрофии сердца, рестеноза, атеросклероза; нейродегенеративных нарушений, например, болезни Альцгеймера, связанного со СПИД слабоумия, болезни Паркинсона, бокового амиотрофического склероза, пигментной дегенерации сетчатки, атрофии остистых мышц и дегенерации мозжечка; гломерулонефрита; миелодиспластических синдромов, инфарктов миокарда, связанных с ишемическим поражением, удара и реперфузионного поражения, аритмии, атеросклероза, вызванных токсином или связанных с алкоголем заболеваний печени, заболеваний крови, например хронической анемии и апластической анемии; дегенеративных заболеваний опорно-двигательного аппарата, например остеопо-6 019094 роза и артрита, чувствительного к аспирину риносинусита, муковисцидоза, рассеянного склероза, заболеваний почек, заболеваний глаз, включая возрастную дегенерацию желтого пятна, увеита и боли при раке. Также установлено, что некоторые ингибиторы циклинзависимой киназы можно использовать в комбинации с другими противораковыми средствами. Например, ингибитор циклинзависимой киназы флавопиридол использовали вместе с другими противораковыми средствами при комбинированной терапии. Таким образом, для фармацевтических композиций, применений или способов, предлагаемых в настоящем изобретении для лечения заболевания или патологического состояния, включающего аномальный рост клеток, заболевание или патологическое состояние, включающее аномальный рост клеток, в одном варианте осуществления представляет собой рак. Одна группа раковых заболеваний включает раковые заболевания молочной железы человека (например, первичные опухоли молочной железы, рак молочной железы без поражения лимфатических узлов, инвазивные аденокарциномы протоков молочной железы, неэндометриоидные раковые заболевания молочной железы); и лимфом из клеток зоны мантии. Кроме того, другими раковыми заболеваниями являются колоректальные и эндометриальные раковые заболевания. Другая подгруппа раковых заболеваний включает гематопоэтические опухоли лимфоидного происхождения, например лейкоз, хронический лимфолейкоз, лимфому из клеток зоны мантии и В-клеточную лимфому (такую как диффузная крупноклеточная В-клеточная лимфома). Одним конкретным типом рака является хронический лимфолейкоз. Другим конкретным типом рака является лимфома из клеток зоны мантии. Другим конкретным типом рака является диффузная крупноклеточная В-клеточная лимфома. Другая подгруппа раковых заболеваний включает рак молочной железы, рак яичников, рак толстой кишки, рак предстательной железы, рак пищевода, плоскоклеточный рак и немелкоклеточные карциномы легких. Другая подгруппа раковых заболеваний включает рак молочной железы, рак поджелудочной железы, колоректальный рак, рак легких и меланому. Другая подгруппа раковых заболеваний, а именно раковых заболеваний, при которых особым терапевтическим преимуществом могут обладать соединения, обладающие ингибирующей активностью по отношению к CDK4, включает ретинобластомы, мелкоклеточные карциномы легких, немелкоклеточные карциномы легких, саркомы, глиомы, раковые заболевания поджелудочной железы, раковые заболевания головы, шеи и молочной железы и лимфомы из клеток зоны мантии. Другая подгруппа раковых заболеваний, при которых особым терапевтическим преимуществом могут обладать соединения, обладающие ингибирующей активностью по отношению к CDK4, включает мелкоклеточный рак легких, немелкоклеточный рак легких, рак поджелудочной железы, рак молочной железы, полиморфную глиобластому, Т-клеточный острый лимфолейкоз и лимфому из клеток зоны мантии. Другая подгруппа раковых заболеваний, для лечения которых могут быть применимы соединения,предлагаемые в настоящем изобретении, включает саркомы, лейкозы, глиому, наследственную меланому и меланому. Методики диагностики. До введения соединения формулы (I) пациента можно обследовать для определения того, является ли заболевание или патологическое состояние, которым страдает или может страдать пациент, поддающимся лечению соединением, обладающим активностью по отношению к циклинзависимым киназам. Например, взятый у пациента образец можно проанализировать и определить, является ли заболевание или патологическое состояние, такое как рак, которым страдает или может страдать пациент, таким, которое характеризуется генетической аномалией или аномальной экспрессией белка, которая приводит к сверхактивации CDK или к сенсибилизации пути, ведущего к нормальной активности CDK. Примеры таких аномалий, которые приводят к активации или к сенсибилизации сигнала CDK2, включают повышающую регуляцию циклина Е (Harwell R.M., Mull B.B., Porter D.C., Keyomarsi K.; J. Biol Chem. 2004 Mar 26; 279(13):12695-705) или утрату р 21 или р 27, или наличие вариантов CDC4 (Rajagopalan H.,Jallepalli P.V., Rago С., Velculescu V.E., Kinzler K.W., Vogelstein B., Lengauer C.; Nature. 2004 Mar 4; 428(6978):77-81). Опухоли, содержащие мутанты CDC4 или характеризующиеся повышающей регуляцией, в частности, сверхэкспрессией циклина Е или утратой р 21 или р 27, могут быть особенно чувствительны к ингибиторам CDK. Термин "повышающая регуляция" включает повышенную экспрессию или сверхэкспрессию, включая амплификацию гена (т.е. образование множества копий гена) и повышенную экспрессию вследствие эффекта транскрипции, и гиперактивность, и активацию, включая активацию с помощью мутаций. Таким образом, для пациента можно провести диагностическое обследование для определения маркера, характерного для повышающей регуляции циклина Е, или утраты р 21 или р 27, или наличия вариантов CDC4. Термин "диагностика" включает скрининг. В число маркеров мы включаем генетические маркеры, включая, например, изучение состава ДНК для выявления мутаций CDC4. Термин "маркер" также включает маркеры, которые характерны для повышающей регуляции циклина Е, включая активность фермента, содержание фермента, состояние фермента (например, фосфорилирован он или нет) и содержание мРНК указанных белков. Опухоли с повышающей регуляцией циклина Е или утратой р 21 или р 27 могут быть особенно чувствительны к ингибиторам CDK. Для опухолей до лечения предпочтительно можно провести скрининг с целью обнаружения повышающей регуляции циклина Е или утраты р 21 или р 27. Таким образом, для пациента можно провести диагностическое обследование для определения маркера, характерного для повышающей регуляции циклина Е, или утраты р 21 или р 27. Диагностические обследования обычно проводят для биологического образца, выбранного из группы, включающей полученные с помощью биопсии образцы опухоли, образцы крови (выделение и обогащение отделившихся от опухоли клеток, находящихся в крови), образцы фекалий, мокроты, анализ хромосом, плевральной жидкости, жидкости брюшной полости или мочи. В публикации Rajagopalan et al. (Nature, 2004 Mar 4; 428(6978):77-81) установлено, что при колоректальных раковых заболеваниях и эндометриальных раковых заболеваниях человека (Spruck et al., CancerRes. 2002 Aug 15; 62(16):4535-9) в CDC4 наблюдаются мутации (также известные под названиями Fbw7 или Archipelago). Установление того, что у индивидуума наблюдаются мутации в CDC4, может означать,что пациент является особенно подходящим для лечения ингибитором CDK. Для опухолей до лечения предпочтительно можно провести скрининг для обнаружения варианта CDC4. Процедура скрининга обычно включает прямое секвенирование, анализ микропоследовательности олигонуклеотида или использование специфичных по отношению к мутанту антител. Методики идентификации и анализа мутаций и повышающей регуляции белков хорошо известны специалисту в данной области техники. Методики скрининга могут включать, но не ограничиваются только ими, стандартные методики, такие как полимеразная цепная реакция обратной транскриптазы(ОТ-ПЦР) или гибридизация in situ. При скрининге с помощью ОТ-ПЦР содержание мРНК в опухоли определяют путем образования кДНК копии мРНК с последующей амплификацией кДНК с помощью ПЦР. Методики амплификации с помощью ПЦР, выбор праймеров и условий проведения амплификации известны специалисту в данной области техники. Операции с нуклеиновой кислотой и ПЦР проводят по стандартным методикам, описанным, например, в публикации Ausubel, F.M. et al., eds. Current Protocols in Molecular Biology, 2004,John WileySons Inc., или Innis, M.A. et al., eds. PCR Protocols: a guide to methods and applications, 1990,Academic Press, San Diego. Реакции и операции с использованием методик, основанных на применении нуклеиновых кислот, также описаны в публикации Sambrook et al., 2001, 3rd Ed, Molecular Cloning: ALaboratory Manual, Cold Spring Harbor Laboratory Press. Альтернативно, можно использовать имеющийся в продаже набор для проведения ОТ-ПЦР (например, Roche Molecular Biochemicals) или методологию,описанную в патентах США 4666828, 4683202, 4801531, 5192659, 5212057, 5882864 и 6218529, которые включены в настоящее изобретение в качестве ссылки. Примером методики гибридизации in situ для оценки экспрессии мРНК является гибридизация insitu с использованием флуоресценции (FISH) (см. Angerer, 1987, Met. Enzymol., 152: 649). Обычно гибридизация in situ включает следующие основные стадии: (1) фиксацию исследуемой ткани; (2) предварительную гибридизацию образца для улучшения доступности целевой нуклеиновой кислоты и уменьшения неспецифического связывания; (3) гибридизацию смеси нуклеиновых кислот с нуклеиновой кислотой в биологической структуре или ткани; (4) проводимую после гибридизации промывку для удаления фрагментов нуклеиновых кислот, не связавшихся при гибридизации, и (5) детектирование гибридизированных фрагментов нуклеиновой кислоты. Образцы, использующиеся при таких исследованиях, обычно метят, например, радиоизотопами или флуоресцентными репортерными группами. Предпочтительные зонды для обеспечения специфической гибридизации с целевой нуклеиновой кислотой (кислотами) в жестких условиях являются достаточно длинными, например, содержат от примерно 50, 100 или 200 нуклеотидов до примерно 1000 или большего количества нуклеотидов. Стандартные методики проведения FISH описаны в публикациях Ausubel, F.M. et al., eds. Current Protocols in MolecularBartlett in Molecular Diagnosis of Cancer, Methods and Protocols, 2nd ed.; ISBN: 1-59259-760-2; March 2004,p. 077-088; Series: Methods in Molecular Medicine. Альтернативно, белки, экспрессированные из мРНК, можно исследовать с помощью иммуногистохимического анализа образцов опухоли, твердофазного иммунологического анализа с использованием микропланшетов для титрования, вестерн-блоттинга, двумерного электрофореза на полиакриламидном геле с использованием додецилсульфата натрия, иммуноферментного анализа (ELISA), проточной цитометрии и других методик, известных в данной области техники для детектирования конкретных белков. Методики детектирования включают использование сайт-специфических антител. Специалист в данной области техники должен понимать, что в данном случае могут быть применимы все такие хорошо известные методики детектирования повышающей регуляции циклина Е или утраты р 21 или р 27, или детектирования вариантов CDC4. Поэтому все эти методики также можно использовать для идентификации опухолей, особенно подходящих для лечения соединениями, предлагаемыми в настоящем изобретении. Опухоли с мутантами CDC4 или повышающей регуляцией, в частности, сверхэкспрессией циклина Е или утратой р 21 или р 27 могут быть особенно чувствительны к ингибиторам CDK. Для опухолей до лечения предпочтительно можно провести скрининг с целью обнаружения повышающей регуляции, в частности сверхэкспрессии циклина Е (Harwell R.M., Mull B.B., Porter D.C., Keyomarsi K.; J. Biol. Chem. 2004 Mar 26; 279(13): 12695-705) или утраты р 21 или p27 или вариантов CDC4 (Rajagopalan H., JallepalliP.V., Rago C., Velculescu V.E., Kinzler K.W., Vogelstein B., Lengauer C.; Nature. 2004 Mar 4; 428(6978):7781). Пациентов, страдающих лимфомой из клеток зоны мантии (ЛКМ), можно отобрать для лечения соединением, предлагаемым в настоящем изобретении, с использованием диагностических исследований,описанных в настоящем изобретении. ЛКМ является особой клинико-патологической нозологической формой неходжкинской лимфомы, характеризующейся пролиферацией лимфоцитов от малых до промежуточных с совместной экспрессией CD5 и CD20, с агрессивным и неизлечимым клиническим течением и часто с транслокацией t(11; 14)(q13; q32). Сверхэкспрессирование мРНК циклина D1, обнаруживающееся при лимфоме из клеток зоны мантии (ЛКМ), является критически важным диагностическим маркером. Yatabe et al. (Blood. 2000 Apr 1; 95(7):2253-61) предположили, что положительную пробу на циклин D1 следует включать в качестве одного из стандартных критериев для ЛКМ и что новейшие средства лечения этого неизлечимого заболевания следует разрабатывать на основе этих новых критериев. Jones etal. (J. Mol. Diagn. 2004 May; 6(2):84-9) разработали количественный анализ обратной транскрипции ПЦР в реальном масштабе времени для определения экспрессии циклина D1 (CCND1) с целью содействия диагностике лимфомы из клеток зоны мантии (ЛКМ). Howe et al. (Clin Chem. 2004, Jan; 50(l):80-7) использовали количественный анализ ОТ-ПЦР в реальном масштабе времени для определения экспрессии мРНК циклина D1 и установили, что количественный анализ ОТ-ПЦР с нормированием на мРНК CD 19 можно использовать для диагностики ЛКМ в крови, костном мозге и ткани. Альтернативно, пациентов,страдающих раком молочной железы, можно отобрать для лечения ингибитором CDK с использованием диагностических исследований, описанных выше. Опухолевые клетки обычно сверхэкспрессируют циклин Е и показано, что циклин Е сверхэкспрессируется при раке молочной железы (Harwell et al., CancerRes, 2000, 60, 481-489). Поэтому рак молочной железы, в частности, можно лечить ингибитором CDK,предлагаемым в настоящем изобретении. Кроме того, раковую опухоль можно исследовать на утрату функции INK4a и RB и сверхэкспрессирование циклина D1 или CDK4 или мутацию CDK4. Утрата RB и мутации, инактивирующие функцию р 16INK4a, или гиперметилирование p16INK4a происходит во многих типах опухолей. Rb инактивирован в 100% случаев ретинобластом и в 90% случаев немелкоклеточных карцином легких. Циклин D1 амплифицирован в 40% случаев раковых заболеваний головы и шеи, сверхэкспрессирован в 50% случаев раковых заболеваний молочной железы и 90% случаев лимфом из клеток зоны мантии. Р 16 утрачен в 60% случаев лимфом из клеток зоны мантии и в 40% случаев раковых заболеваний поджелудочной железы.CDK4 амплифицирован в 20% случаев саркомы и в 10% случаев глиомы. Проявления, приводящие к инактивации RB или p16INK4a посредством мутации, делеции или эпигенетической блокировки или к сверхэкспрессии циклина D1 или Cdk4, можно идентифицировать по методикам, описанным в настоящем изобретении. Опухоли с повышающей регуляцией, в частности, сверхэкспрессией циклина D илиCDK4 или утратой INK4a или RB могут быть особенно чувствительны к ингибиторам CDK. Таким образом, для пациента можно провести диагностическое обследование для определения маркера, характерного для сверхэкспрессии циклина D или CDK4 или утраты INK4a или RB. Раковые заболевания, характеризующиеся утратой функции INK4a и RB и сверхэкспрессией циклина D1 или CDK4, включают мелкоклеточный рак легких, немелкоклеточный рак легких, рак поджелудочной железы, рак молочной железы, полиморфную глиобластому, Т-клеточный острый лимфолейкоз и лимфому из клеток зоны мантии. Поэтому пациентов, у которых наблюдается мелкоклеточный рак легких, немелкоклеточный рак легких, рак поджелудочной железы, рак молочной железы, полиморфная глиобластома, Т-клеточный острый лимфолейкоз или лимфома из клеток зоны мантии, можно выбрать для лечения ингибитором CDK с использованием описанных выше диагностических исследований и их,в частности, можно лечить ингибитором CDK, предлагаемым в настоящем изобретении. Пациентов, страдающих конкретными раковыми заболеваниями, вызванными нарушениями путиD-Циклин-CDK4/6-INK4-Rb, можно выявить по методикам, описанным в настоящем изобретении, и затем лечить ингибитором CDK, предлагаемым в настоящем изобретении. Примеры аномалий, которые активируют или сенсибилизируют опухоли по отношению к сигналу CDK4, включают активацию рецептора, например, Her-2/Neu при раке молочной железы, мутации ras, например, при раке поджелудочной железы, колоректальном раке или раке легких, мутации raf, например, при меланоме, мутации р 16, например, при меланоме, делеции p16, например, при раке легких, метилирование р 16, например, при раке легких или сверхэкспрессию циклина D, например, при раке молочной железы. Таким образом, пациента можно отобрать для лечения соединением, предлагаемым в настоящем изобретении, с использованием диагностических исследований, описанных в настоящем изобретении, для выявления повышающей регуляции пути D-Циклин-CDK4/6-INK4-Rb, например, путем сверхэкспрессии циклина D, мутации CDK4,мутации или делеции pRb, делеции p16-INK4, мутации, делеции или метилирования р 16, или путем ак-9 019094 тивации проявлений, происходящих после воздействия киназы CDK4/6, например, мутации Ras или мутации Raf или гиперактивации или сверхэкспрессирования рецепторов, таких как Her-2/Neu. Соединения, предлагаемые в настоящем изобретении, обладают особыми преимуществами, заключающимися в том, что они являются ингибиторами CDK4, более селективными, чем по отношению к другим циклинзависимым киназам. В PCT/US2007/069595 в общем раскрыты соединения этого класса,однако соединения, предлагаемые в настоящем изобретении, обладают более высокой активностью и селективностью по отношению к CDK4, чем по отношению к другим циклинзависимым киназам. Это является преимуществом для разработки лекарственного средства, пригодного для использования в качестве ингибитора CDK4. Точнее и с учетом указанной заявки приведенные ниже в табл. 1 соединения (изPCT/US2007/069595) представляют собой соединения предшествующего уровня техники, наиболее близкие к хемотипу настоящего изобретения. Таблица 1 В представленной ниже табл. 2 приведены данные по ингибированию соответствующих мишеней для соединений предшествующего уровня техники в сопоставлении с соединениями, предлагаемыми в настоящем изобретении. Намного лучшая селективность соединений, предлагаемых в настоящем изобретении, по отношению к другим представителям семейства CDK и другим киназам, означает, что по сравнению с другими соединениями, обладающими меньшей селективностью, соединения, предлагаемые в настоящем изобретении, обладают меньшей активностью по отношению к объектам, которые не являются мишенями, и поэтому обладают меньшей непредвиденной токсичностью в клетках. Если рассмотреть результаты анализа клеточного цикла, проведенного с использованием соединений, предлагаемых в настоящем изобретении, и, например, с использованием соединения 200 предшествующего уровня техники, то становится понятно, что в то время как соединения, предлагаемые в настоящем изобретении, обеспечивают полное блокирование G1 даже при концентрации, равной 10 мкМ, соединение 200 начинает приводить к блокированию фазы G2/M при концентрациях, равных 1 и 10 мкМ, и это показывает, что оно проявляет активность по отношению к объектам, которые не являются мишенями, при концентрациях, превышающих 1 мкМ. Кроме того, ингибирующее воздействие ингибитора CDK4 полностью зависит от наличия белка ретинобластомы (pRb). Активность предполагающихся ингибиторов CDK4 в клетках, не содержащихpRb, показывает, что соединения проявляют активность по отношению к объектам, которые не являются мишенями, и не селективны. По сравнению с соединениями, предлагаемыми в настоящем изобретении,которые инертны по отношению к клеткам, не содержащим pRb, соединение 200 при высоких концентрациях не ингибирует пролиферацию клеток, не содержащих pRb, что свидетельствует об их активности по отношению к объектам, которые не являются мишенями. Кроме того, было показано, что активность CDK4 не нужна для нормальной пролиферации фибробласта, ингибирование CDK1, видимо, является нежелательным эффектом. В отличие от соединений предшествующего уровня техники соединения, предлагаемые в настоящем изобретении, при введении животным, должны приводить к меньшей цитотоксичности. Поэтому соединения, предлагаемые в настоящем изобретении, являются лучшими ингибиторами CDK4 по сравнению с соединениями, обладающими такими же основными структурами и такой же активности по отношению к CDK4, но меньшей селективностью по отношению к другим киназам CDK, поскольку эти соединения должны обладать более значительным терапевтическим индексом, чем менее селективные соединения. В другом варианте осуществления настоящее изобретение относится к следующим соединениям: диметиламид 7-циклопентил-2-[4-(2-гидроксиэтил)-3,4,5,6-тетрагидро-2 Н-[1,2']бипиразинил-5'иламино]-7 Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты; диметиламид 7-циклопентил-2-[5-R)-3-метилпиперазин-1-ил)пиридин-2-иламино]-7 Нпирроло[2,3-d]пиримидин-6-карбоновой кислоты; диметиламид 7-циклопентил-2-[5-S)-3-метилпиперазин-1-ил)пиридин-2-иламино]-7 Нпирроло[2,3-d]пиримидин-6-карбоновой кислоты; диметиламид 7-циклопентил-2-[5-(3-метилпиперазин-1-ил)пиридин-2-иламино]-7 Н-пирроло[2,3d]пиримидин-6-карбоновой кислоты; диметиламид 7-циклопентил-2-5-[4-(3-гидроксипропил)пиперазин-1-ил]пиридин-2-иламино-7 Нпирроло[2,3-d]пиримидин-6-карбоновой кислоты; диметиламид 7-циклопентил-2-5-[4-(2-гидроксиэтил)пиперазин-1-ил]пиридин-2-иламино-7 Нпирроло[2,3-d]пиримидин-6-карбоновой кислоты; диметиламид 7-циклопентил-2-5-[4-(2-гидрокси-1-метилэтил)пиперазин-1-ил]пиридин-2 иламино-7 Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты; диметиламид 7-циклопентил-2-[5-(пиперазин-1-карбонил)пиридин-2-иламино]-7 Н-пирроло[2,3d]пиримидин-6-карбоновой кислоты; диметиламид 7-циклопентил-2-(1',2',3',4',5',6'-гексагидро[3,4']бипиридинил-6-иламино)-7 Нпирроло[2,3-d]пиримидин-6-карбоновой кислоты; диметиламид 7-циклопентил-2-[5-S)-3-метилпиперазин-1-илметил)пиридин-2-иламино]-7 Нпирроло[2,3-d]пиримидин-6-карбоновой кислоты; диметиламид 7-циклопентил-2-5-[4-S)-2-гидроксипропил)пиперазин-1-ил]пиридин-2-иламино 7 Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты; диметиламид 7-циклопентил-2-5-[4-R)-2-гидроксипропил)пиперазин-1-ил]пиридин-2-иламино 7 Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты; диметиламид 7-циклопентил-2-[5-(4-изопропилпиперазин-1-ил)пиридин-2-иламино]-7 Нпирроло[2,3-d]пиримидин-6-карбоновой кислоты; диметиламид 7-циклопентил-2-[5-(4-изопропилпиперазин-1-карбонил)пиридин-2-иламино]-7 Нпирроло[2,3-d]пиримидин-6-карбоновой кислоты; диметиламид 7-циклопентил-2-5-[4-(4-метилпентил)пиперазин-1-ил]пиридин-2-иламино-7 Нпирроло[2,3-d]пиримидин-6-карбоновой кислоты; диметиламид 7-циклопентил-2-5-[4-(2-гидрокси-2-метилпропил)пиперазин-1-ил]пиридин-2 иламино-7 Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты; диметиламид 7-циклопентил-2-[5-(3,3-диметилпиперазин-1-ил)пиридин-2-иламино]-7 Нпирроло[2,3-d]пиримидин-6-карбоновой кислоты; диметиламид 7-циклопентил-2-[5-(3,8-диазабицикло[3.2.1]окт-3-илметил)пиридин-2-иламино]-7 Нпирроло[2,3-d]пиримидин-6-карбоновой кислоты; диметиламид 7-циклопентил-2-(5-пиперазин-1-илпиридин-2-иламино)-7 Н-пирроло[2,3d]пиримидин-6-карбоновой кислоты; диметиламид 7-циклопентил-2-[5-(4-этилпиперазин-1-ил)пиридин-2-иламино]-7 Н-пирроло[2,3d]пиримидин-6-карбоновой кислоты; диметиламид 7-циклопентил-2-(1'-изопропил-1',2',3',4',5',6'-гексагидро[3,4']бипиридинил-6 иламино)-7 Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты; диметиламид 7-циклопентил-2-5-[(R)-4-(2-гидроксиэтил)-3-метилпиперазин-1-ил]пиридин-2 иламино-7 Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты; диметиламид 7-циклопентил-2-5-[(S)-4-(2-гидроксиэтил)-3-метилпиперазин-1-ил]пиридин-2 иламино-7 Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты; диметиламид 7-циклопентил-2-5-[4-(2-гидроксиэтил)пиперазин-1-илметил]пиридин-2-иламино 7 Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты; диметиламид 7-циклопентил-2-5-[4-(2-этилбутил)пиперазин-1-ил]пиридин-2-иламино-7 Нпирроло[2,3-d]пиримидин-6-карбоновой кислоты; диметиламид 7-циклопентил-2-5-[4-(2-метилбутил)пиперазин-1-ил]пиридин-2-иламино-7 Нпирроло[2,3-d]пиримидин-6-карбоновой кислоты; диметиламид 7-циклопентил-2-[1'-(2-гидроксиэтил)-1',2',3',4',5',6'-гексагидро[3,4']бипиридинил-6 иламино]-7 Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты; или их фармацевтически приемлемые соли. Анализы. Ингибирование активности протеинкиназы соединениями, предлагаемыми в настоящем изобретении, можно исследовать с помощью целого ряда анализов, использующихся в данной области техники. Примеры таких анализов описаны в представленном ниже разделе "Примеры осуществления изобретения". Фармацевтические композиции. Выражение "эффективное количество" соединения означает количество, необходимое или достаточное для лечения или предупреждения нарушения, связанного с протеинкиназой, например предупреждения различных морфологических и соматических симптомов нарушения и/или заболевания или патологического состояния, связанного с протеинкиназой, описанного в настоящем изобретении. В одном примере эффективное количество соединения, предлагаемого в настоящем изобретении, означает количество, достаточное для лечения у субъекта нарушения, связанного с протеинкиназой. Эффективное количество может меняться в зависимости от таких факторов, как размер и масса субъекта, тип заболевания или конкретное соединение, предлагаемое в настоящем изобретении. Например, выбор соединения,предлагаемого в настоящем изобретении, может повлиять на то, что составляет "эффективное количество". Специалист с общей подготовкой в данной области техники должен уметь исследовать факторы,указанные в настоящем изобретении, и без чрезмерного количества экспериментальных исследований определить эффективное количество соединений, предлагаемых в настоящем изобретении. Режим введения может повлиять на то, что составляет эффективное количество. Соединение, предлагаемое в настоящем изобретении, можно вводить субъекту до или после возникновения нарушения,связанного с протеинкиназой. Кроме того, ежедневно можно вводить несколько разделенных доз, а также вводить их поочередно или последовательно, или дозу можно вводить путем непрерывного вливания или болюсного вливания. Кроме того, дозы соединения (соединений), предлагаемого в настоящем изо- 12019094 бретении, можно пропорционально увеличивать или уменьшать в соответствии с требованиями текущего лечения или профилактики. Соединения, предлагаемые в настоящем изобретении, можно применять для лечения патологических состояний, нарушений или заболеваний, описанных в настоящем изобретении, или для приготовления фармацевтических композиций, предназначенных для применения для лечения этих заболеваний. Способы применения соединений, предлагаемых в настоящем изобретении, для лечения этих заболеваний, или фармацевтические препараты, содержащие соединения, предлагаемые в настоящем изобретении, предназначенные для лечения этих заболеваний. Выражение "фармацевтическая композиция" включает препараты, пригодные для введения млекопитающим, например людям. Если соединения, предлагаемые в настоящем изобретении, вводят в виде фармацевтических средств млекопитающим, например людям, их можно вводить по отдельности или в виде фармацевтической композиции, содержащей, например, от 0,1 до 99,5% (более предпочтительно от 0,5 до 90%) активного ингредиента в комбинации с фармацевтически приемлемым носителем. Выражение "фармацевтически приемлемый носитель" известно в данной области техники и включает фармацевтически приемлемое вещество, композицию или разбавитель, пригодный для введения млекопитающим соединений, предлагаемых в настоящем изобретении. Носители включают жидкий или твердый наполнитель, разбавитель, инертный наполнитель, растворитель или капсулирующее вещество,участвующее в переносе или транспортировке соответствующего средства от органа или части организма к другому органу или в другую часть организма. Каждый носитель должен быть "приемлемым" в том смысле, что он должен быть совместим с другими ингредиентами композиции и не быть вредным для пациента. Некоторые примеры веществ, которые могут выступать в качестве фармацевтически приемлемых носителей, включают сахара, такие как лактоза, глюкоза и сахароза; крахмалы, такие как кукурузный крахмал и картофельный крахмал; целлюлозу и ее производные, такие как натриевая соль карбоксиметилцеллюлозы, этилцеллюлоза и ацетилцеллюлоза; порошкообразную трагакантовую камедь; мальтозу; желатин; тальк; инертные наполнители, такие как масло какао и воска для суппозиториев; масла, такие как арахисовое масло, хлопковое масло, сафлоровое масло, кунжутное масло, оливковое масло, кукурузное масло и соевое масло; гликоли, такие как пропиленгликоль; полиолы, такие как глицерин, сорбит, маннит и полиэтиленгликоль; сложные эфиры, такие как этилолеат и этиллаурат; агар; буферные вещества, такие как гидроксид магния и гидроксид алюминия; альгиновую кислоту; апирогенную воду; изотонический солевой раствор; раствор Рингера; этиловый спирт; фосфатные буферные растворы и другие нетоксичные совместимые вещества, использующиеся в фармацевтических препаратах. В композициях также могут содержаться смачивающие агенты, эмульгаторы и смазывающие вещества, такие как лаурилсульфат натрия и стеарат магния, а также окрашивающие агенты, агенты, обеспечивающие отделение от пресс-форм, агенты для нанесения покрытий, подсластители, вкусовые добавки и отдушки, консерванты и антиоксиданты. Примеры фармацевтически приемлемых антиоксидантов включают растворимые в воде антиоксиданты, такие как аскорбиновая кислота, цистеингидрохлорид, бисульфат натрия, метабисульфит натрия,сульфит натрия и т.п.; маслорастворимые антиоксиданты, такие как аскорбилпальмитат, бутилированный гидроксианизол (БГА), бутилированный гидрокситолуол (БГТ), лецитин, пропилгаллат, токоферол и т.п.; и реагенты, образующие хелаты с металлами, такие как лимонная кислота, этилендиаминтетрауксусная кислота (ЭДТК), сорбит, винная кислота, фосфорная кислота и т.п. Препараты, предлагаемые в настоящем изобретении, включают пригодные для перорального, назального, местного, трансбуккального, сублингвального, ректального, вагинального и/или парентерального введения. Препараты можно легко приготовить в виде разовых дозированных форм и можно приготовить по любым методикам, хорошо известным в области фармацевтики. Количество активного ингредиента, которое можно объединить с носителем с получением разовой дозированной формы, обычно является таким количеством соединения, которое приводит к терапевтическому эффекту. Обычно это количество составляет менее 100% и меняется в диапазоне от примерно 1 до примерно 99% активного ингредиента, предпочтительно от примерно 5 до примерно 70%, наиболее предпочтительно от примерно 10 до примерно 30%. Методики приготовления этих препаратов или композиций включают стадию объединения соединения, предлагаемого в настоящем изобретении, с носителем и необязательно с одним или более вспомогательных ингредиентов. Обычно препараты готовят путем тщательного и равномерного объединения соединения, предлагаемого в настоящем изобретении, с жидкими носителями или тонкоизмельченными твердыми носителями, или с обоими типами носителей, при необходимости с формованием продукта. Препараты, предлагаемые в настоящем изобретении, пригодные для перорального введения, могут находиться в форме капсул, облаток, пилюль, таблеток, пастилок (с использованием вкусовой основы,обычно сахарозы и камеди акации или трагакантовой камеди), порошков, гранул, или в виде раствора или суспензии в водной или неводной жидкости, или в виде жидкой эмульсии типа масло-в-воде или вода-в-масле, или в виде эликсира или сиропа, или в виде лепешек (с использованием инертной основы,такой как желатин и глицерин, или сахарозы, или камеди акации) и/или в виде жидкостей для полоскания рта и т.п., каждая из которых содержит заранее заданное количество соединения, предлагаемого в настоящем изобретении, в качестве активного ингредиента. Соединение, предлагаемое в настоящем изобретении, можно вводить в виде болюса, электуария или пасты. В твердых дозированных формах, предлагаемых в настоящем изобретении для перорального введения (капсулы, таблетки, пилюли, драже, порошки, гранулы и т.п.), активный ингредиент смешан с одним или более фармацевтически приемлемых носителей, таких как цитрат натрия или дикальцийфосфат,и/или любым из следующих веществ: наполнители или средства, увеличивающие объем, такие как крахмалы, лактоза, сахароза, глюкоза, маннит и/или кремниевая кислота; связующие, такие как, например,карбоксиметилцеллюлоза, альгинаты, желатин, поливинилпирролидон, сахароза и/или камедь акации; влагоудерживающие вещества, такие как глицерин; разрыхлители, такие как агар-агар, карбонат кальция,картофельный или маниоковый крахмал, альгиновая кислота, некоторые силикаты и карбонат натрия; агенты, замедляющие растворение, такие как парафин; ускорители впитывания, такие как четвертичные аммониевые соединения; смачивающие агенты, такие как, например, цетиловый спирт и глицеринмоностеарат; абсорбенты, такие как каолин и бентонитовая глина; смазывающие вещества, такие как тальк,стеарат кальция, стеарат магния, твердые полиэтиленгликоли, лаурилсульфат натрия и их смеси; и окрашивающие агенты. В случае капсул, таблеток и пилюль фармацевтические композиции также могут включать буферные агенты. Твердые композиции аналогичного типа также можно использовать в качестве наполнителей в заполненных капсулах из мягкого или твердого желатина с применением таких инертных наполнителей, как лактоза или молочный сахар, а также обладающие большой молекулярной массой полиэтиленгликоли и т.п. Таблетку можно приготовить путем прессования или формования, необязательно с одним или более дополнительных ингредиентов. Прессованные таблетки можно приготовить с использованием связующего (например, желатина или гидроксипропилметилцеллюлозы), смазывающего вещества, инертного разбавителя, консерванта, разрыхлителя (например, натриевой соли гликолята крахмала или сшитой натриевой соли карбоксиметилцеллюлозы), поверхностно-активного или диспергирующего вещества. Формованные таблетки можно приготовить путем проводимого в подходящей машине формования смеси порошкообразного соединения, увлажненного инертным жидким разбавителем. Таблетки и другие твердые дозированные формы фармацевтических композиций, предлагаемых в настоящем изобретении, такие как драже, капсулы, пилюли и гранулы, необязательно можно снабдить насечками или приготовить с покрытиями и оболочками, такими как энтеросолюбильные покрытия и другие покрытия, хорошо известные в технологии приготовления фармацевтических средств. Их также можно приготовить так, чтобы обеспечить медленное или регулируемое высвобождение содержащегося в них активного ингредиента, например, с использованием гидроксипропилметилцеллюлозы при разных содержаниях, обеспечивающих необходимый режим высвобождения, других полимерных матриц, липосом и/или микросфер. Их можно стерилизовать, например, фильтрованием через задерживающий бактерии фильтр или путем введения стерилизующих средств и получить стерильные твердые композиции,которые непосредственно перед использованием можно растворить в стерильной воде или другой стерильной среде для инъекции. Эти композиции также необязательно могут содержать агенты, придающие непрозрачность, а также могут обладать таким составом, чтобы активный ингредиент (ингредиенты) высвобождался только или предпочтительно на определенном участке желудочно-кишечного тракта, необязательно в замедленном режиме. Примеры веществ, которые можно использовать для таких целей,включают полимерные вещества и воска. Активный ингредиент также может находиться в микрокапсулированном виде, если это целесообразно, то с одним или более инертных наполнителей, указанных выше. Жидкие дозированные формы для перорального введения соединений, предлагаемых в настоящем изобретении, включают фармацевтически приемлемые эмульсии, микроэмульсии, растворы, суспензии,сиропы и эликсиры. В дополнение к активному ингредиенту жидкие дозированные формы могут содержать инертный разбавитель, обычно использующийся в данной области техники, такой как, например,вода или другие растворители, солюбилизирующие агенты и эмульгаторы, такие как этиловый спирт,изопропиловый спирт, этилкарбонат, этилацетат, бензиловый спирт, бензилбензоат, пропиленгликоль,1,3-бутиленгликоль, масла (в частности, хлопковое, арахисовое, кукурузное, из зародышей, оливковое,касторовое и кунжутное масла), глицерин, тетрагидрофурфуриловый спирт, полиэтиленгликоли и сложные эфиры сорбита и жирных кислот и их смеси. Кроме инертных разбавителей композиции для перорального введения также могут содержать вспомогательные вещества, такие как смачивающие агенты, эмульгирующие и суспендирующие агенты,подсластители, вкусовые добавки, красители, отдушки и консерванты. Суспензии в дополнение к активным соединениям могут содержать суспендирующие агенты, такие как, например, этоксилированные изостеариловые спирты, полиоксиэтилен, сорбит и сложные эфиры сорбита, микрокристаллическую целлюлозу, метагидроксид алюминия, бентонит, агар-агар и трагакантовую камедь и их смеси. Препараты фармацевтических композиций, предлагаемые в настоящем изобретении, предназначенные для ректального или вагинального введения, могут представлять собой суппозитории, которые можно приготовить путем смешивания одного или большего количества соединений, предлагаемых в на- 14019094 стоящем изобретении, с одним или более подходящих не оказывающих раздражающее воздействие инертных наполнителей или носителей, таких как, например, масло какао, полиэтиленгликоль, воск для суппозиториев или салицилат, которые являются твердыми при комнатной температуре, но жидкими при температуре тела и поэтому плавятся в прямой кишке или полости влагалища и высвобождают активное соединение. Препараты, предлагаемые в настоящем изобретении, которые пригодны для вагинального введения,также включают пессарии, тампоны, кремы, гели, пасты, пенки или спреи, содержащие такие носители,которые известны в данной области техники как подходящие. Дозированные формы для местного или чрескожного введения соединения, предлагаемого в настоящем изобретении, включают порошки, спреи, мази, пасты, кремы, лосьоны, гели, растворы, пластыри и формы для ингаляции. Активное соединение в стерильных условиях можно смешать с фармацевтически приемлемым носителем и любыми консервантами, буферными веществами или пропеллентами,которые могут потребоваться. Мази, пасты, кремы и гели в дополнение к активному соединению, предлагаемому в настоящем изобретении, могут содержать инертные наполнители, такие как животные и растительные жиры, масла,воска, парафины, крахмал, трагакантовая камедь, производные целлюлозы, полиэтиленгликоли, силиконы, бентониты, кремниевая кислота, тальк и оксид цинка или их смеси. Порошки и спреи в дополнение к соединению, предлагаемому в настоящем изобретении, могут содержать инертные наполнители, такие как лактоза, тальк, кремниевая кислота, гидроксид алюминия, силикаты кальция и порошкообразный полиамид или смеси этих веществ. Спреи могут дополнительно содержать обычные пропелленты, такие как хлорфторуглеводороды и летучие незамещенные углеводороды, такие как бутан и пропан. Чрескожные пластыри обладают тем дополнительным преимуществом, что обеспечивают регулируемое введение в организм соединения, предлагаемого в настоящем изобретении. Такие дозированные формы можно приготовить путем растворения или диспергирования соединения в подходящей среде. Для увеличения потока соединения через кожу также можно использовать средства, улучшающие впитывание. Скорость такого потока можно регулировать путем использования регулирующей скорость мембраны или путем диспергирования активного соединения в полимерной матрице или геле. Офтальмологические композиции, глазные мази, порошки, растворы и т.п. также входят в объем настоящего изобретения. Фармацевтические композиции, предлагаемые в настоящем изобретении, пригодные для парентерального введения, представляют собой одно или более соединений, предлагаемых в настоящем изобретении, в комбинации с одним или более фармацевтически приемлемых стерильных изотонических водных или неводных растворов, дисперсий, суспензий или эмульсий, или стерильные порошки, которые непосредственно перед применением можно восстановить в стерильные растворы или дисперсии для инъекций, которые могут содержать антиоксиданты, буферы, бактериостатики, растворенные вещества,которые делают композицию изотонической с кровью предполагаемого реципиента, или суспендирующие или загущающие агенты. Примеры подходящих водных и неводных носителей, которые можно использовать в фармацевтических композициях, предлагаемых в настоящем изобретении, включают воду, этанол, полиолы (такие как глицерин, пропиленгликоль, полиэтиленгликоль и т.п.) и их подходящие смеси, растительные масла,такие как оливковое масло, и пригодные для инъекций органические сложные эфиры, такие как этилолеат. Надлежащую сыпучесть или текучесть можно обеспечить, например, путем нанесения покрытий такими веществами, как лецитин, путем поддержания необходимого размера частиц в случае дисперсий и путем использования поверхностно-активных веществ. Эти композиции также могут содержать вспомогательные вещества, такие как консерванты, смачивающие агенты, эмульгирующие агенты и диспергирующие агенты. Предупреждение воздействия микроорганизмов можно обеспечить путем включения различных антибактериальных и противогрибковых средств, например парабена, хлорбутанола, фенола, сорбиновой кислоты и т.п. Также может быть желательным включение в композиции изотонических средств, таких как сахара, хлорид натрия и т.п. Кроме того, пролонгированное всасывание вводимой путем инъекции фармацевтической формы можно обеспечить путем включения агентов, которые задерживают всасывание, таких как моностеарат алюминия и желатин. В некоторых случаях для пролонгирования воздействия лекарственного средства желательно замедлить всасывание лекарственного средства при подкожной или внутримышечной инъекции. Это можно осуществить путем использования жидкой суспензии кристаллического или аморфного вещества,плохо растворимого в воде. В этом случае скорость всасывания лекарственного средства зависит от скорости его растворения, которая, в свою очередь, может зависеть от размера кристалла и кристаллической формы. Альтернативно, замедленное всасывание лекарственной формы, введенной парентерально, обеспечивают путем растворения или супендирования лекарственного средства в маслообразном разбавителе. Вводимые путем инъекции формы-депо готовят путем формирования микрокапсулированных мат- 15019094 риц указанных соединений в биологически разлагающихся полимерах, таких как полилактидполигликолид. Скорость высвобождения лекарственного средства можно регулировать путем изменения отношения количества лекарственного средства к количеству полимера и типа конкретного использующегося полимера. Примеры других биологически разлагающихся полимеров включают полиортоэфиры и полиангидриды. Вводимые путем инъекции формы-депо также готовят путем включения лекарственного средства в липосомы или микроэмульсии, которые совместимы с тканями организма. Препараты, предлагаемые в настоящем изобретении, можно вводить перорально, парентерально,местно или ректально. Разумеется, их вводят в формах, пригодных для соответствующего пути введения. Например, их вводят в форме таблеток или капсул, путем инъекции, ингаляции, в форме жидкого средства для глаз, мази, суппозитория и т.п., вводят путем инъекции, вливания или ингаляции; местно с помощью лосьона или мази; и ректально с помощью суппозитория. Пероральное и/или внутривенное введение является предпочтительным. Выражения "парентеральное введение" и "введенный парентерально" при использовании в настоящем изобретении означают пути введения, не являющиеся энтеральным и местным введением, обычно путем инъекции, и включают, но не ограничиваются только ими, внутривенное, внутримышечное, внутриартериальное, внутриоболочечное, внутрикапсулярное, внутриорбитальное, внутрисердечное, внутрикожное, внутрибрюшинное, трахеальное, подкожное, подкутикулярное, внутрисуставное, подкапсулярное, субарахноидальное, внутрипозвоночное и надчревное вливание и инъекцию. Выражения "системное введение", "введенный системно", "периферическое введение" и "введенный периферически" при использовании в настоящем изобретении означают введение соединения, лекарственного средства или другого вещества не непосредственно в центральную нервную систему, так что оно поступает в систему пациента и поэтому подвергается метаболизму или изменяется с помощью других аналогичных процессов, например подкожное введение. Для проведения лечения эти соединения можно вводить людям и другим животным с помощью любого подходящего пути введения, в том числе перорально, назально, как, например, в виде спрея, ректально, вагинально, парентерально, внутрицистернально и местно с помощью порошков, мазей или капель, в том числе трансбуккально и сублингвально. Независимо от выбранного пути введения соединения, предлагаемые в настоящем изобретении, которые можно применять в подходящей гидратированной форме, и/или фармацевтические композиции,предлагаемые в настоящем изобретении, готовят в виде фармацевтически приемлемых дозированных форм по обычным методикам, известным специалистам в данной области техники. Реальные дозы активных ингредиентов в фармацевтических композициях, предлагаемых в настоящем изобретении, могут меняться, так чтобы обеспечить количество активного ингредиента, которое эффективно для достижения необходимого терапевтического эффекта для конкретного пациента, композиции и пути введения, без токсического воздействия на пациента. Выбранная доза зависит от различных факторов, включая активность конкретного использующегося соединения, предлагаемого в настоящем изобретении, или его сложного эфира, соли или амида, пути введения, времени введения, скорости выведения конкретного использующегося активного соединения,длительности лечения, других лекарственных средств, соединений и/или веществ, применяющихся в комбинации с конкретным использующимся соединением, возраста, пола, массы, патологического состояния, общего состояния здоровья и анамнеза подвергающегося лечению пациента и аналогичных факторов, хорошо известных в медицине. Врач или ветеринар с общей подготовкой в данной области техники может легко определить и назначить эффективное количество необходимой фармацевтической композиции. Например, врач или ветеринар может начать с доз соединений, предлагаемых в настоящем изобретении, использующихся в фармацевтической композиции в содержаниях, меньших, чем требующиеся для достижения необходимого терапевтического эффекта, и постепенно увеличивать дозу, пока не будет достигнут необходимый эффект. Обычно подходящая суточная доза соединения, предлагаемого в настоящем изобретении, будет такой, которая является наименьшей дозой, достаточной для обеспечения терапевтического эффекта. Такая эффективная доза обычно зависит от факторов, описанных выше. Обычно внутривенная и подкожная дозы соединений, предлагаемых в настоящем изобретении, вводимые пациенту для обеспечения необходимых анальгетических эффектов, составляет от примерно 0,0001 до примерно 100 мг/(кг массы тела в сутки), более предпочтительно от примерно 0,01 до примерно 50 мг/(кг в сутки) и еще более предпочтительно от примерно 1,0 до примерно 100 мг/(кг в сутки). Эффективное количество представляет собой количество, необходимое для лечения нарушения, связанного с протеинкиназой. При необходимости эффективную суточную дозу активного соединения можно вводить в виде 2, 3,4, 5, 6 или большего количества разделенных доз, вводимых по отдельности через подходящие промежутки времени в течение суток, необязательно в разовых дозированных формах. Если соединение, предлагаемое в настоящем изобретении, можно вводить по отдельности, то предпочтительно вводить соединение в виде фармацевтической композиции. Методика синтеза. Соединения, предлагаемые в настоящем изобретении, получают из общедоступных соединений по методикам, известным специалистам в данной области техники, включая любое одно или более указанных ниже условий, но не ограничиваясь только ими. В объеме настоящего описания только легко удаляемая группа, которая не является компонентом конкретных искомых конечных соединений, предлагаемых в настоящем изобретении, называется "защитной группой ", если в контексте не указано иное. Защита функциональных групп такими защитными группами, сами защитные группы и реакции их отщепления описаны, например, в стандартных справочниках, таких как, например, Science of Synthesis: Houben-Weyl Methods of Molecular Transformation. GeorgMonosaccharides and Derivatives), Georg Thieme Verlag, Stuttgart, 1974. Особенностью защитных групп является то, что их можно удалить легко (т.е. без протекания нежелательных вторичных реакций), например, путем сольволиза, восстановления, фотолиза или, альтернативно, при физиологических условиях (например, путем ферментативного отщепления). Соли соединений, предлагаемых в настоящем изобретении, обладающих по меньшей мере одной солеобразующей группой, можно получить по общеизвестным методикам. Например, соли соединений,предлагаемых в настоящем изобретении, содержащих кислотные группы, можно получить, например,путем обработки этих соединений соединениями металлов, такими как соли щелочных металлов подходящих органических карбоновых кислот, например, натриевой солью 2-этилгексановой кислоты, органическими соединениями щелочных металлов или щелочно-земельных металлов, такими как соответствующие гидроксиды, карбонаты или гидрокарбонаты, такими как гидроксид, карбонат или гидрокарбонат натрия или калия, соответствующими соединениями кальция или аммиаком, или подходящим органическим амином, предпочтительно использовать стехиометрические количества или лишь небольшой избыток солеобразующего реагента. Соли присоединения с кислотами соединений, предлагаемых в настоящем изобретении, получают обычным образом, например, путем обработки соединений кислотой или подходящим анионообменным реагентом. Внутренние соли соединений, предлагаемых в настоящем изобретении, содержащих кислотную и основную солеобразующие группы, например, свободную карбоксигруппу и свободную аминогруппу, можно получить, например, путем нейтрализации солей, таких как соли присоединения с кислотами, до изоэлектрической точки, например, слабыми основаниями или путем обработки ионообменниками. Соли можно обычным образом превратить в свободные соединения; соли металлов и аммония можно превратить, например, путем обработки подходящими кислотами и соли присоединения с кислотами, например, путем обработки подходящим основным реагентом. Смеси изомеров, получаемые в контексте настоящего изобретения, можно разделить по известной методике на отдельные изомеры; диастереоизомеры можно разделить, например, путем распределения в многофазной смеси растворителей, перекристаллизацией и/или с помощью хроматографического разделения, например, на силикагеле, или, например, с помощью жидкостной хроматографии среднего давления на колонке с обращенной фазой, и рацематы можно разделить, например, путем образования солей с оптически чистыми солеобразующими реагентами, и получаемую таким образом смесь диастереоизомеров разделить, например, с помощью фракционной кристаллизации или с помощью хроматографии на колонках с оптически активными веществами. Промежуточные и конечные продукты можно обработать и/или очистить по стандартным методикам, например, с помощью хроматографических методик, методик распределения, (пере)кристаллизации и т.п. Общие условия осуществления способа. Приведенные ниже положения применимы в целом ко всем способам, указанным в настоящем изобретении. Стадии способа синтеза соединений, предлагаемых в настоящем изобретении, можно выполнить при условиях проведения реакций, которые сами по себе известны, предпочтительно при специально указанных, при отсутствии или обычно в присутствии растворителей или разбавителей, включая, например, растворители или разбавители, которые инертны по отношению к используемым реагентам и растворяют их, при отсутствии или в присутствии катализаторов, конденсирующих или нейтрализующих реагентов, например, ионообменников, таких как катионообменники, например, в Н+ форме; в зависимости от природы реакции и/или реагентов при пониженной, нормальной или повышенной температуре,например, при температуре в диапазоне от примерно -100 до примерно 190 С; предпочтительно от при- 17019094 мерно -80 до примерно 150 С, например от -80 до -60 С, при комнатной температуре при температуре от-20 до 40 С или при температуре кипения; при атмосферном давлении или в закрытом сосуде, когда это целесообразно, то под давлением и/или в инертной атмосфере, например, в атмосфере аргона или азота. На всех стадиях реакций образующиеся смеси изомеров можно разделить на отдельные изомеры,например диастереоизомеры или энантиомеры, или на любую необходимую смесь изомеров, например рацематы или смеси диастереоизомеров, например по методикам, аналогичным описанным в публикацииScience of Synthesis: Houben-Weyl Methods of Molecular Transformation. Georg Thieme Verlag, Stuttgart,Germany, 2005. Растворители, из числа которых можно выбрать растворители, которые являются подходящими для любой конкретной реакции, включают указанные специально или, например, воду, сложные эфиры, такие как (низш.) алкил-(низш ) алканоаты, например этилацетат, простые эфиры, такие как алифатические простые эфиры, например диэтиловый эфир, или циклические простые эфиры, например тетрагидрофуран и диоксан, жидкие ароматические углеводороды, такие как бензол или толуол, спирты, такие как метанол, этанол или 1- или 2-пропанол, нитрилы, такие как ацетонитрил, галогенированные углеводороды,такие как метиленхлорид или хлороформ, амиды кислот, такие как диметилформамид или диметилацетамид, основания, такие как гетероциклические азотистые основания, например пиридин или Nметилпирролидин-2-он, ангидриды карбоновых кислот, такие как ангидриды (низш.) алкановых кислот,например уксусный ангидрид, циклические, линейные или разветвленные углеводороды, такие как циклогексан, гексан или изопентан, или смеси этих растворителей, например водные растворы, если в описании способов не указано иное. Такие смеси растворителей также можно использовать при обработке,например, с помощью хроматографии или распределения. Соединения, включая их соли, также можно получить в виде гидратов или их кристаллы могут, например, включать растворитель, применяющийся для кристаллизации. Могут содержаться разные кристаллические формы. Настоящее изобретение также относится к таким вариантам осуществления способа, в которых соединение, получаемое на любой стадии способа в качестве промежуточного продукта, применяется в качестве исходного вещества, а затем выполняются остальные стадии способа, или в которых исходное вещество образуется при условиях проведения реакции или применяется в виде производного, например,в защищенной форме или в форме соли, или соединение, получаемое способом, предлагаемым в настоящем изобретении, получают при условиях проведения реакции и затем обрабатывают in situ. Пролекарства. Настоящее изобретение также относится к фармацевтическим композициям, содержащим соединения, предлагаемые в настоящем изобретении, и к способам лечения нарушений, связанных с протеинкиназой, путем введения фармацевтически приемлемых пролекарств соединений, предлагаемых в настоящем изобретении. Например, соединения, предлагаемые в настоящем изобретении, содержащие свободные аминогруппы, амидные группы, гидроксигруппы или карбоксигруппы, можно превратить в пролекарства. Пролекарства включают соединения, в которых аминокислотный остаток или полипептидная цепь двух или большего количества (например, двух, трех или четырех) аминокислотных остатков с помощью амидной или сложноэфирной связи ковалентно связана со свободной аминогруппой, гидроксигруппой или карбоксигруппой соединений, предлагаемых в настоящем изобретении. Аминокислотные остатки включают, но не ограничиваются только ими, 20 природных аминокислот, обычно обозначаемых трехбуквенными символами, и также включает 4-гидроксипролин, гидроксилизин, демозин, изодемозин,3-метилгистидин, норвалин, бета-аланин, гамма-аминомасляную кислоту, цитруллин, гомоцистеин, гомосерин, орнитин и метионинсульфон. Также включены дополнительные типы пролекарств. Например,свободные карбоксигруппы можно превратить в производные, такие как амидные или алкиловые сложноэфирные. Свободные гидроксигруппы можно превратить в производные с помощью групп, включая,но не ограничиваясь только ими, гемисукцинаты, фосфаты, диметиламиноацетаты и фосфорилоксиметоксикарбонилы, как это описано в публикации Advanced Drug Delivery Reviews, 1996, 19, 115. Также включены карбаматные пролекарства гидроксигрупп и аминогрупп, а также карбонатные пролекарства,сульфонаты и сульфаты гидроксигрупп. Также включены такие производные гидроксигрупп, как (ацилокси)метиловые и (ацилокси)этиловые простые эфирные, в которых ацильной группой может быть алкиловый сложный эфир, необязательно замещенный такими группами, включая, но не ограничиваясь только ими, как простая эфирная, аминогруппа и карбоксигруппа, или в которых ацильной группой может быть сложноэфирная группа аминокислоты, как это описано выше. Пролекарства этого типа описаны в публикации J. Med. Chem. 1996, 39, 10. Свободные амины можно превратить в такие производные,как амиды, сульфонамиды или фосфонамиды. Все эти пролекарственные фрагменты могут включать, но не ограничиваются только ими, простые эфирные группы, аминогруппы икарбоксигруппы. Поэтому любое указание на соединение, предлагаемое в настоящем изобретении, следует понимать как указание и на соответствующие пролекарства соединения, предлагаемого в настоящем изобретении,если это является подходящим и целесообразным. Комбинации. Соединение, предлагаемое в настоящем изобретении, также можно использовать в комбинации с другими средствами, например, с дополнительным ингибитором протеинкиназы, которое является или не является соединением, предлагаемым в настоящем изобретении, для лечения у субъекта нарушения,связанного с протеинкиназой. Термин "комбинация" означает или фиксированную комбинацию в одной разовой дозированной форме, или набор компонентов, предназначенный для комбинированного введения, с помощью которого соединение, предлагаемое в настоящем изобретении, и компонент комбинации можно вводить независимо одновременно или по отдельности через промежутки времени, которые позволяют компонентам комбинации проявить совместный, например, синергетический эффект, и любую их комбинацию. Соединения, предлагаемые в настоящем изобретении, можно вводить одновременно или последовательно с противовоспалительным, антипролиферативным, химиотерапевтическим средством, иммунодепрессантом, противораковым, цитотоксическим средством или ингибитором киназы, который не является соединением формулы I или его солью. Другие примеры средств, которые можно вводить в комбинации с соединениями, предлагаемыми в настоящем изобретении, включают, но не ограничиваются только ими, ингибитор PTK, циклоспорин A, CTLA4-Ig, антитела, выбранные из группы, включающей анти-ICAM-3, анти-IL-2 рецептор, анти-CD45RB, анти-CD2, анти-CD3, анти-CD4, анти-CD80, анти-CD86 и моноклональные антитела OKT3, средства, блокирующие взаимодействия между CD40 и gp39, белки слияния, образованные из CD40 и gp39, ингибиторы NF-каппа В функции, нестероидные противовоспалительные лекарственные средства, стероиды, соединения золота, антипролиферативные средства,FK506, микофенолят мотефил, цитотоксические лекарственные средства, ингибиторы TNF-, анти-TNF антитела или растворимый рецептор TNF, рапамицин, лефлунимид, ингибиторы циклооксигеназы-2,паклитаксел, цисплатин, карбоплатин, доксорубицин, карминомицин, даунорубицин, аминоптерин, метотрексат, метоптерин, митомицин С, эктеинасцидин 743, порфиромицин, 5-фторурацил, 6 меркаптопурин, гемцитабин, цитозин арабинозид, подофиллотоксин, этопозид, этопозид фосфат, тенипозид, мелфалан, винбластин, винкристин, лейрозидин, эпотилон, виндезин, лейрозин или их производные. Соединение, предлагаемое в настоящем изобретении, и любое дополнительное средство можно включить в разные дозированные формы. Альтернативно, для уменьшения количества дозированных форм, вводимых пациенту, соединение, предлагаемое в настоящем изобретении, и любое дополнительное средство можно приготовить совместно в любой комбинации. Например, соединение, предлагаемое в настоящем изобретении, являющееся ингибитором, можно включить в одну дозированную форму и дополнительное средство можно включить совместно в другую дозированную форму. Любые отдельные дозированные формы можно вводить в одно и то же время или в разные моменты времени. Альтернативно, композиция, предлагаемая в настоящем изобретении, включает дополнительное средство, описанное в настоящем изобретении. Каждый компонент может содержаться в отдельных композициях, комбинациях композиций или в одной композиции. Примеры осуществления изобретения Настоящее изобретение дополнительно иллюстрируется приведенными ниже примерами, которые не следует рассматривать в качестве дополнительно ограничивающих. При осуществлении настоящего изобретения, если не указано иное, используются обычные методики биологии клеток, культур клеток,молекулярной биологии, трансгенной биологии, микробиологии и иммунологии, которые известны специалистам в данной области техники. Экспериментальные методики. Аналитические методики. Соединения, полученные в примерах, характеризуют с помощью жидкостной хроматографии и масс-спектроскопии с использованием систем и экспериментальных условий, указанных ниже. Если содержатся атомы различных изотопов и приведена одна масса, то масса, приведенная для соединения,является моноизотопной массой (т.е. 35Cl; 79Br и т.п.). Используют несколько систем, которые описаны ниже, и они оборудованы и настроены для использования при очень сходных экспериментальных условиях. Использованные экспериментальные условия также описаны ниже. Анализ с помощью ЖХМС (жидкостная хроматография-масс-спектроскопия) проводят с использованием следующих методик: Система Waters Platform LC-MS: Система ВЭЖХ:Waters 2795 Детектор масс-спектрометра: Micromass Platform LC ДФМ (детектор на фотодиодной матрице): Waters 2996 PDA Чистоту определяют с помощью УФ-детектора на диодной матрице (210-340 нм) Методика А. Элюент А: Н 2 О (10 мМ буфера NH4HCO3, значение рН доводят до 9,2 с помощью NH4OH) Элюент В: CH3CN Градиентный режим: 5-95% элюента В за 15 мин Скорость потока: 0,8 мл/мин Колонка: Waters XBridge C18 5 мкм, 2,150 мм Методика В. Элюент А: Н 2 О (10 мМ буфера NH4HCO3, значение рН доводят до 9,2 с помощью NH4OH) Элюент В: CH3CN Градиентный режим: 5-95% элюента В за 3,5 мин Скорость потока: 0,8 мл/мин Колонка: Waters XBridge C18 5 мкм, 2,150 мм Методика С. Элюент А: Н 2 О (0,1% муравьиной кислоты) Элюент В: CH3CN (0,1% муравьиной кислоты) Градиентный режим: 5-95% элюента В за 3,5 мин Скорость потока: 0,8 мл/мин Колонка: Phenomenex Synergi 4 мкм, MAX-RP 80A, 2,0 50 мм Методика D. Элюент А: Н 2 О (0,1% муравьиной кислоты) Элюент В: CH3CN (0,1% муравьиной кислоты) Градиентный режим: 5-95% ацетонитрил/вода за 7,75 мин Скорость потока: 1,0 мл/мин Колонка: Inertsil ODS3 1003 мм С 18 Система Waters Fractionlynx LC-MS: Система ВЭЖХ: автоматический пробоотборник 2767 - насос для подачи двух компонентов в градиентном режиме 2525 Детектор масс-спектрометра: Waters ZQ ДФМ: Waters 2996 PDA Чистоту определяют с помощью УФ-детектора на диодной матрице (200-340 нм) Методика Е. Элюент А: Н 2 О (10 мМ буфера NH4HCO3, значение рН доводят до рН 9,2 с помощью NH4OH) Элюент В: CH3CN Градиентный режим: 5-95% элюента В за 3,5 мин Скорость потока: 2,0 мл/мин Методика проведения препаративной ЖХ с отбором по массе (ЖХМС) Система Waters Fractionlynx: двойной петлевой пробоотборник 2767/устройство сбора фракций 2525 препаративный насосRMA (система подготовки реагентов Waters) в качестве насоса для подготовки Масс-спектрометр Waters ZQ Детектор на фотодиодной матрице Waters 2996 Масс-спектрометр Waters ZQ Программное обеспечениеMasslynx 4.1 Режим работы Waters MS Напряжение на капилляре: 3,5 кВ (3,2 кВ при ионизации электрораспылением в режиме отрицательных ионов) Напряжение на конусе: 25 В Температура источника: 120 С Умножитель: 500 В Диапазон сканирования: 125-800 ат. ед. массы Режим ионизации: ионизация электрораспылением в режиме положительных ионов или ионизация электрораспылением в режиме отрицательных ионов Если аналитическая система является подходящей для проведения хроматографии, то выбирают подходящую препаративную методику такого же типа. Стандартными экспериментальными условиями являются: Колонка.Waters XBridge C18 5 мкм, 10019 мм или Phenomenex Gemini, 5 мкм, 10021,2 мм) Подвижная фаза Растворитель А: Н 2 О + 10 мМ NH4HCO3 + NH4OH, pH 9,2 Растворитель В: CH3CN Скорость потока: 24 мл/мин Градиентный режим: Обычно все градиентные режимы включают начальную стадию, составляющую 0,4 мин, с использованием 95% А + 5% В. Затем в соответствии с аналитической системой выбира- 20019094 ют градиентный режим для обеспечения эффективного разделения, которое составляет 3,6 мин (например, от 5 до 50% В для слабо удерживающихся соединений; от 35 до 80% В для средне удерживающихся соединений и т.п.). Изократический режим: стадию прокачки в изократическом режиме в течение 1,2 мин проводят в конце градиентного режима. Восстановление равновесия: стадию восстановления равновесия, составляющую 2,1 мин, проводят для подготовки системы для следующего цикла. Подобранная скорость потока: 1 мл/мин. Все соединения обычно растворяют в 100% МеОН или 100% ДМСО (диметилсульфоксид). Экспериментальные методики. Общая методика А (удаление защитной группы Вос). Исходное вещество обрабатывают избытком HCl (4 М раствор в диоксане). В случае необходимости для облегчения растворения добавляют МеОН и/или CHCl3. Через 16 ч образец выпаривают в вакууме и остаток очищают с помощью хроматографии на SiO2, ионообменной хроматографии или препаративной ЖХМС. Нитрильные аналоги. Пример А. При перемешивании к раствору 5-бром-2-нитропиридина (4,93 г, 24,3 ммоль) и трет-бутилового эфира пиперазин-1-карбоновой кислоты (4,97 г, 26,7 ммоль) в CH3CN (60 мл) добавляют ДИПЭА (N,Nдиизопропилэтиламин) (4,65 мл, 26,7 ммоль). Смесь кипятят с обратным холодильником в течение 72 ч,затем охлаждают до комнатной температуры и осадившийся продукт собирают фильтрованием. Фильтрат концентрируют и очищают с помощью колоночной флэш-хроматографии при элюировании смесью 30% EtOAc/петролейный эфир. Объединенные продукты перекристаллизовывают из смеси Смесь трет-бутилового эфира 4-(6-нитропиридин-3-ил)пиперазин-1-карбоновой кислоты (3,40 г,11,0 ммоль) и 10% Pd-C (400 мг, 0,376 ммоль) в этаноле (100 мл) и этилацетате (100 мл) перемешивают при давлении водорода, равном 1 атм, в течение ночи. Смесь фильтруют, концентрируют и получают трет-бутиловый эфир 4-(6-аминопиридин-3-ил)пиперазин-1-карбоновой кислоты (2,87 г, выход 94%). МС (ИЭР) m/z 278 (М+Н)+. При перемешивании к раствору (5-бром-2-хлорпиримидин-4-ил)циклопентиламина (1,00 г, 3,62 ммоль) и PdCl2(dppf)дихлорметан (148 мг, 0,181 ммоль) в ТГФ (тетрагидрофуран) (10 мл) при комнатной температуре последовательно добавляют Et3N (0,757 мл, 5,43 ммоль) и 3,3-диэтоксипропин (0,778 мл,5,43 ммоль). Смесь дегазируют в токе N2 и перемешивают при комнатной температуре в течение 10 мин,затем добавляют CuI (29 мг, 0,154 ммоль). Реакционный сосуд откачивают и повторно заполняют с помощью N2 (3) и нагревают при 60 С в течение 48 ч. Смеси дают охладиться, ее разбавляют с помощьюEtOAc, фильтруют и подвергают распределению между H2O и этилацетатом. Фазы разделяют и затем водный слой экстрагируют с помощью EtOAc (3), объединенные органические экстракты сушат(MgSO4), фильтруют и концентрируют. Остаток очищают с помощью хроматографии на SiO2 при элюировании в градиентном режиме от смеси 5% EtOAc/петролейный эфир до смеси 20% EtOAc/петролейный эфир и получают [2-хлор-5-(3,3-диэтоксипроп-1-инил)пиримидин-4-ил]циклопентиламин (636 мг, 54%). МС (ИЭР) m/z 324,2 (М+Н)+.[2-хлор-5-(3,3-диэтоксипроп-1-инил)пиримидин-4 ил]циклопентиламина (7,50 г, 23,3 ммоль) в ТГФ (45 мл) при комнатной температуре добавляют 1 н. раствор ТБАФ (тетрабутиламмонийфторид) в ТГФ (100 мл, 116 ммоль). Реакционную смесь кипятят с обратным холодильником в течение ночи. После охлаждения смесь подвергают распределению между Н 2 О и дихлорметаном. Фазы разделяют и водный слой экстрагируют дихлорметаном (2). Объединенные органические экстракты сушат (MgSO4), фильтруют и концентрируют. Остаток очищают с помощью хроматографии на SiO2 при элюировании в градиентном режиме от смеси 10% EtOAc/петролейный эфир до смеси 30% EtOAc/петролейный эфир и получают 2-хлор-7-циклопентил-6-диэтоксиметил-7 Нпирроло[2,3-d]пиримидин (5,68 г, 76%). МС (ИЭР) m/z 324,1 (М+Н)+. При перемешивании к раствору 2-хлор-7-циклопентил-6-диэтоксиметил-7 Н-пирроло[2,3d]пиримидина (6,29 г, 19,5 ммоль) в 1,4-диоксане (68 мл) при комнатной температуре добавляют концентрированную HCl (19 мл). Реакционную смесь перемешивают в течение 30 мин, затем нейтрализуют 2 н. водным раствором NaOH и насыщенным водным раствором NaHCO3. Смесь экстрагируют с помощьюEtOAc (3), объединенные органические экстракты сушат (MgSO4), фильтруют, концентрируют и получают 6 г неочищенного 2-хлор-7-циклопентил-7 Н-пирроло[2,3-d]пиримидин-6-карбальдегида в виде бежевого твердого вещества. При перемешивании к суспензии неочищенного 2-хлор-7-циклопентил-7 Нпирроло[2,3-d]пиримидин-6-карбальдегида в MeCN (125 мл) и Н 2 О (125 мл) при комнатной температуре добавляют H2N-SO3H (6,62 г, 58,5 ммоль). Реакционную смесь перемешивают в течение 3 ч, затем 2 н. водным раствором NaOH значение рН доводят до составляющего 10 и реакционную смесь перемешивают в течение 1 ч. Смесь экстрагируют дихлорметаном (3), объединенные органические экстракты сушат (MgSO4), фильтруют и концентрируют. Остаток очищают с помощью хроматографии на SiO2 при элюировании в градиентном режиме от смеси 5% EtOAc/петролейный эфир до смеси 20%EtOAc/петролейный эфир и получают 4,00 г 2-хлор-7-циклопентил-7 Н-пирроло[2,3-d]пиримидин-6 карбонитрила в виде белого твердого вещества, выход 83%. МС (ИЭР) m/z 247,0 (М+Н)+. Методика Бухвальда А. При перемешивании к раствору 2-хлор-7-циклопентил-7 Н-пирроло[2,3-d]пиримидин-6 карбонитрила (80 мг, 0,324 ммоль) в толуоле (5,0 мл) последовательно добавляют Pd2(dba)3 (16 мг, 0,0162 ммоль), 2-ди-трет-бутилфосфино-2',4',6'-триизопропилбифенил (14 мг, 0,0324 ммоль) и трет-бутиловый эфир 4-(6-аминопиридин-3-ил)пиперазин-1-карбоновой кислоты (пример В) (99 мг, 0,357 ммоль). Смесь дегазируют в токе N2, затем добавляют LiHMDS (1 M раствор в ТГФ; 0,650 мл, 0,650 ммоль). Реакционную смесь нагревают при 110 С в течение ночи. При комнатной температуре смесь разбавляют с помощью EtOAc, фильтруют и концентрируют. Остаток очищают с помощью хроматографии на SiO2 при элюировании с помощью EtOAc и получают 35 мг вещества, которое растирают со смесью 1:1EtOAc/петролейный эфир и получают трет-бутиловый эфир 4-[6-(6-циано-7-циклопентил-7 Нпирроло[2,3-d]пиримидин-2-иламино)пиридин-3-ил]пиперазин-1-карбоновой кислоты (20 мг). По общей методике А из трет-бутилового эфира 4-[6-(6-циано-7-циклопентил-7 Н-пирроло[2,3d]пиримидин-2-иламино)пиридин-3-ил]пиперазин-1-карбоновой кислоты (20 мг) получают неочищенный продукт, который очищают на колонке SCX (при элюировании смесью 1:17 (2 М NH3 в МеОН)/дихлорметан) и получают твердое вещество. Растирание с диэтиловым эфиром дает 7-циклопентил 2-(5-пиперазин-1-илпиридин-2-иламино)-7 Н-пирроло[2,3-d]пиримидин-6-карбонитрил (8,8 мг, 7%) (за 2 стадии). МС (ИЭР) m/z 389,2 (М+Н)+ (методика А). 1 Н ЯМР (400 МГц, ДМСО-d6): 9,68 (1 Н, s), 8,91 (1 Н, s), 8,11 (1 Н, d), 8,01 (1 Н, d), 7,51 (1 Н, s), 7,43[М-Н]+=219,1. По методике Бухвальда А из 2-хлор-7-циклопентил-7 Н-пирроло[2,3-d]пиримидин-6-карбонитрила(95 мг, 0,385 ммоль) и 5-(4-диметиламинопиперидин-1-ил)пиридин-2-иламина (93 мг, 0,424 ммоль) получают 7-циклопентил-2-4-диметиламинопиперидин)-1-илпиридин-2-иламино)-7 Н-пирроло[2,3d]пиримидин-6-карбонитрил (77 мг, 46%) [после растирания со смесью 1:1 EtOAc/петролейный эфир]. МС (ИЭР) m/z 431,2 (М+Н)+ (методика А). 1 Н ЯМР (400 МГц, ДМСО-d6): 9,66 (1 Н, s), 8,90 (1 Н, s), 8,09 (1 Н, d), 8,02 (1 Н, d), 7,51 (1 Н, s), 7,45 Путем повторения методик, описанных в примере А, из трет-бутилового эфира 2-метилпиперазин 1-карбоновой кислоты (1,08 г, 5,40 ммоль) получают трет-бутиловый эфир 2-метил-4-(6-нитропиридин-3 ил)пиперазин-1-карбоновой кислоты (0,610 г, 39%) (после хроматографии на SiO2 при элюировании смесью 2% МеОН/дихлорметан). МС (ИЭР) m/z 323 (М+Н)+. По методике Бухвальда А из 2-хлор-7-циклопентил-7 Н-пирроло[2,3-d]пиримидин-6-карбонитрила[после хроматографии на SiO2 при элюировании смесью 1-2,5% МеОН/дихлорметан и последующего растирания с диэтиловым эфиром]. Вещество используют на следующей стадии без обработки. По общей методике А из трет-бутилового эфира 4-[6-(6-циано-7-циклопентил-7 Н-пирроло[2,3d]пиримидин-2-иламино)пиридин-3-ил]-2-метилпиперазин-1-карбоновой кислоты получают 7 циклопентил-2-[5-(3-метилпиперазин-1-ил)пиридин-2-иламино]-7 Н-пирроло[2,3-d]пиримидин-6 карбонитрил (91 мг, 59% за 2 стадии) [после очистки на колонке Strata-NH2 при элюировании смесью 1:1 МеОН/дихлорметан и последующего растирания с диэтиловым эфиром]. МС (ИЭР) m/z 403,2 (М+Н)+ (методика А). Путем повторения методик, описанных в примере А, из трет-бутилового эфира [1,4]диазепан-1 карбоновой кислоты (1,08 г, 5,40 ммоль) в CH3CN (20 мл) получают трет-бутиловый эфир 4-(6 нитропиридин-3-ил)-[1,4]диазепан-1-карбоновой кислоты (533 мг) [после хроматографии на SiO2 при элюировании смесью 2% МеОН/дихлорметан]. МС (ИЭР) m/z 323 (М+Н)+. По методике Бухвальда А из 2-хлор-7-циклопентил-7 Н-пирроло[2,3-d]пиримидин-6-карбонитрила(95 мг, 0,385 ммоль) и трет-бутилового эфира 4-(6-аминопиридин-3-ил)-[1,4]диазепан-1-карбоновой кислоты (124 мг, 0,424 ммоль) получают трет-бутиловый эфир 4-[6-(6-циано-7-циклопентил-7 Нпирроло[2,3-d]пиримидин-2-иламино)пиридин-3-ил]-[1,4]диазепан-1-карбоновой кислоты (96 мг) [после хроматографии на SiO2 при элюировании смесью 1-3% МеОН/дихлорметан и последующего растирания с диэтиловым эфиром]. Вещество используют на следующей стадии без обработки. По общей методике А из трет-бутилового эфира 4-[6-(6-циано-7-циклопентил-7 Н-пирроло[2,3d]пиримидин-2-иламино)пиридин-3-ил]-[1,4]диазепан-1-карбоновой кислоты получают 7-циклопентил-2(5-[1,4]диазепан-1-илпиридин-2-иламино)-7 Н-пирроло[2,3-d]пиримидин-6-карбонитрил (71 мг, 46% за 2 стадии) [после очистки на колонке Strata-NH2 при элюировании смесью 1:1 МеОН/дихлорметан и последующего растирания с диэтиловым эфиром]. МС (ИЭР) m/z 403,2 (М+Н)+ (методика А). 1 Н ЯМР (400 МГц, ДМСО-d6): 9,01 (1 Н, s), 8,67 (2 Н, s), 7,95-7,80 (2 Н, m), 7,73-7,54 (2 Н, m), 5,14 По методике Бухвальда А из 2-хлор-7-циклопентил-7 Н-пирроло[2,3-d]пиримидин-6-карбонитрила(пример С) получают 114 мг 2-[5-(трет-бутилдиметилсиланилоксиметил)пиридин-2-иламино]-7 циклопентил-7 Н-пирроло[2,3-d]пиримидин-6-карбонитрила [после хроматографии на SiO2 при элюировании смесью 1-2% МеОН/дихлорметан и последующего растирания с диэтиловым эфиром]. При перемешивании к раствору 2-[5-(трет-бутилдиметилсиланилоксиметил)пиридин-2-иламино]-7 циклопентил-7 Н-пирроло[2,3-d]пиримидин-6-карбонитрила в ТГФ (2,0 мл) при 0 С добавляютHFпиридин (0,080 мл). Реакционную смесь перемешивают при комнатной температуре в течение 16 ч,затем ее разбавляют этилацетатом, промывают насыщенным раствором NaHCO3, сушат (MgSO4), фильтруют и концентрируют. Растирание с диэтиловым эфиром дает 7-циклопентил-2-(5 гидроксиметилпиридин-2-иламино)-7 Н-пирроло[2,3-d]пиримидин-6-карбонитрил, 68 мг, выход 53% (за 2 стадии). МС (ИЭР) m/z 335,0 (М+Н)+ (методика А). 1 Н ЯМР (400 МГц, ДМСО-d6): 9,96 (1 Н, s), 8,97 (1 Н, s), 8,33-8,21 (2 Н, m), 7,75 (1 Н, dd), 7,55 (1 Н, s),5,19 (1 Н, t), 5,10 (1 Н, квинтет), 4,49 (2 Н, d), 2,37-2,10 (4 Н, m), 2,10-1,92 (2 Н, m), 1,85-1,67 (2 Н, m). Пример 9. Диметиламид 2-5-[4-(2-цианоэтил)пиперазин-1-ил]пиридин-2-иламино-7-циклопентил-7Hпирроло[2,3-d]пиримидин-6-карбоновой кислоты Путем повторения методик, описанных в примере А (при нагревании в микроволновом реакторе СЕМ Discovery при 130 С в течение 1 ч вместо кипячения с обратным холодильником), из 3-пиперазин 1-илпропионитрила (510 мг, 3,63 ммоль) получают 3-[4-(6-нитропиридин-3-ил)пиперазин-1 ил]пропионитрил в виде белого кристаллического твердого вещества (212 мг, 25%); после хроматографии на SiO2 при элюировании смесью 0-10% метанол/дихлорметан и последующей кристаллизации из смеси этилацетат/петролейный эфир (212 мг, 25%). МС (ИЭР) m/z 262,1 (М+Н)+. Путем повторения методик, описанных в примере В, из 3-[4-(6-нитропиридин-3-ил)пиперазин-1 ил]пропионитрила (200 мг, 0,763 ммоль) получают 3-[4-(6-аминопиридин-3-ил)пиперазин-1 ил]пропионитрил (165 мг, 94%), который используют на следующей стадии без дополнительной очистки. МС (ИЭР) m/z 232,1 (М+Н)+. По методике Бухвальда А из 3-[4-(6-аминопиридин-3-ил)пиперазин-1-ил]пропионитрила (173 мг,0,751 ммоль) и диметиламида 2-хлор-7-циклопентил-7 Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты (200 мг, 0,683 ммоль) получают диметиламид 2-5-[4-(2-цианоэтил)пиперазин-1-ил]пиридин-2 иламино-7-циклопентил-7 Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты (34 мг, 10%) [после очи- 26019094 Путем повторения методик, описанных в примере А (при нагревании в микроволновом реакторе СЕМ Discovery при 130 С в течение 1 ч вместо кипячения с обратным холодильником), из 1-(2,2,2 трифторэтил)пиперазина (1,31 г, 5,41 ммоль) получают 1-(6-нитропиридин-3-ил)-4-(2,2,2 трифторэтил)пиперазин (210 мг, 15%) [после очистки с помощью хроматографии на SiO2 при элюировании смесью 0-10%МеОН/дихлорметан]. МС (ИЭР) m/z 291,1 (М+Н)+. Путем повторения методик, описанных в примере В, из 6-нитропиридин-3-ил)-4-(2,2,2 трифторэтил)пиперазина (210 мг, 0,724 ммоль) получают 5-[4-(2,2,2-трифторэтил)пиперазин-1 ил]пиридин-2-иламин (158 мг, 84%), который используют на следующей стадии без дополнительной очистки. МС (ИЭР) m/z 261,1 (М+Н)+. Методика Бухвальда В. Смесь 5-[4-(2,2,2-трифторэтил)пиперазин-1-ил]пиридин-2-иламина (158 мг, 0,607 ммоль), диметиламида 2-хлор-7-циклопентил-7 Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты (118 мг, 0,405 ммоль), Pd2(dba)3 (18,5 мг, 0,020 ммоль), БИНАФ (2,2'-бис-(дифенилфосфино)-1,1'-бинафтил) (25 мг,0,040 ммоль) и трет-бутоксида натрия (70 мг, 0,728 ммоль) в диоксане (3,5 мл) дегазируют и нагревают в микроволновом реакторе СЕМ Discovery при 100 С в течение 1 ч. Реакционную смесь подвергают распределению между дихлорметаном и насыщенным раствором NaHCO3. Органический слой отделяют и затем водный слой экстрагируют дихлорметаном. Объединенные органические вещества промывают рассолом, сушат (MgSO4), фильтруют и концентрируют. Неочищенный продукт очищают с помощью хроматографии на силикагеле (от 0 до 10% метанол/дихлорметан) и получают диметиламид 7-циклопентил-2-5-[4-(2,2,2-трифторэтил)пиперазин-1 ил]пиридин-2-иламино-7 Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты, который дополнительно очищают путем растирания с ацетонитрилом (115 мг, 55%). МС (ИЭР) m/z 517,2 (М+Н)+ (методика А). 1 Н ЯМР (400 МГц, Me-d3-OD): 8,72 (1 Н, s), 8,24 (1 Н, d), 7,98 (1 Н, d), 7,50 (1H, dd), 6,62 (1 Н, s), 4,814,72 (1 Н, m), 3,27-3,09 (12 Н, m), 2,89 (4 Н, t), 2,61-2,49 (2 Н, m), 2,16-2,01 (4 Н, m), 1,81-1,69 (2 Н, m). Пример 8. Диметиламид 7-циклопентил-2-(5-[1,4]диазепан-1-илпиридин-2-иламино)-7H-пирроло[2,3d]пиримидин-6-карбоновой кислоты По методике Бухвальда А из диметиламида 2-хлор-7-циклопентил-7 Н-пирроло[2,3-d]пиримидин-6- 27019094 карбоновой кислоты (0,13 г, 0,444 ммоль) получают трет-бутиловый эфир 4-[6-(7-циклопентил-6 диметилкарбамоил-7 Н-пирроло[2,3-d]пиримидин-2-иламино)пиридин-3-ил]-[l,4]диазепан-l-карбоновой кислоты (66 мг, 27%) [после очистки с помощью хроматографии на SiO2 при элюировании с помощью 03% МеОН в дихлорметане]. МС (ИЭР) m/z 549,3 (М+Н)+. По общей методике А с использованием трет-бутилового эфира 4-[6-(7-циклопентил-6 диметилкарбамоил-7 Н-пирроло[2,3-d]пиримидин-2-иламино)пиридин-3-ил]-[1,4]диазепан-1-карбоновой кислоты (66 мг, 0,12 ммоль) получают диметиламид 7-циклопентил-2-(5-[1,4]диазепан-1-илпиридин-2 иламино)-7 Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты (35 мг, 65%) в виде желтоватого твердого вещества [после очистки с помощью хроматографии на колонке SCX при элюировании смесью 15% (2 М Путем повторения методик, описанных в примере А, из трет-бутилового эфира пирролидин-3 илкарбаминовой кислоты (2,52 г, 13,5 ммоль) получают трет-бутиловый эфир [1-(6-нитропиридин-3 ил)пирролидин-3-ил]карбаминовой кислоты в виде желтого твердого вещества (2,16 г, 57%) [после растирания с EtOAc]. Путем повторения методик, описанных в примере В, из трет-бутилового эфира [1-(6-нитропиридин 3-ил)пирролидин-3-ил]карбаминовой кислоты (2,16 г, 7,01 ммоль) получают трет-бутиловый эфир [1-(6 аминопиридин-3-ил)пирролидин-3-ил]карбаминовой кислоты в виде пурпурного твердого вещества (1,12 г, 56%) [после хроматографии на SiO2 при элюировании смесью 2,5-7,5% МеОН/дихлорметан). По методике Бухвальда А из диметиламида 2-хлор-7-циклопентил-7 Н-пирроло[2,3-d]пиримидин-6 карбоновой кислоты (0,13 г, 0,444 ммоль) и трет-бутилового эфира [1-(6-аминопиридин-3 ил)пирролидин-3-ил]карбаминовой кислоты (0,136 г, 0,488 ммоль) получают трет-бутиловый эфир 1-[6(7-циклопентил-6-диметилкарбамоил-7 Н-пирроло[2,3-d]пиримидин-2-иламино)пиридин-3-ил]пирролидин-3-илкарбаминовой кислоты (35 мг, 15%) (после хроматографии на SiO2 при элюировании смесью 0-3% МеОН/дихлорметан). МС (ИЭР) m/z 535,3 (М+Н)+. По общей методике А из трет-бутилового эфира 1-[6-(7-циклопентил-6-диметилкарбамоил-7 Нпирроло[2,3-d]пиримидин-2-иламино)пиридин-3-ил]пирролидин-3-илкарбаминовой кислоты (35 мг,0,0655 ммоль) получают диметиламид рац-2-[5-(3-аминопирролидин-1-ил)пиридин-2-иламино]-7 циклопентил-7 Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты в виде желтого твердого вещества(11 мг, 39%) [после хроматографии на SiO2 при элюировании смесью 5% (2,0 М NH3 в МеОН)/ДХМ]. МС (ИЭР) m/z 435,2 (М+Н)+ (методика С). 1 Н ЯМР (400 МГц, Me-d3-OD): 8,68 (1 Н, s), 8,10 (1 Н, d), 7,66 (1 Н, d), 7,11 (1 Н, dd), 6,60 (1 Н, s), 4,794,66 (1 Н, m), 3,76-3,65 (1 Н, m), 3,60-3,46 (2 Н, m), 3,17 (6 Н, s), 3,15-2,87 (2 Н, m), 2,62-2,44 (2 Н, m), 2,372,22 (1 Н, m), 2,17-1,98 (4 Н, m), 1,98-1,80 (1 Н, m), 1,80-1,63 (2 Н, m). Пример 19. Диметиламид 7-циклопентил-2-[5-(3-метилпиперазин-1-ил)пиридин-2-иламино]-7H-пирроло[2,3d]пиримидин-6-карбоновой кислоты. По методике Бухвальда А из диметиламида 2-хлор-7-циклопентил-7 Н-пирроло[2,3-d]пиримидин-6 карбоновой кислоты (0,142 г, 0,485 ммоль) и трет-бутилового эфира (+/-)-4-(6-аминопиридин-3-ил)-2 метилпиперазин-1-карбоновой кислоты (0,156 г, 0,533 ммоль) получают 4-[6-(7-циклопентил-6 диметилкарбамоил-7 Н-пирроло[2,3-d]пиримидин-2-иламино)пиридин-3-ил]-2-метилпиперазин-1 карбоновой кислоты трет-бутиловый эфир (260 мг, 97%) (после хроматографии на SiO2 при элюировании смесью 0-3% МеОН/дихлорметан). МС (ИЭР) m/z 549,3 (М+Н)+. По общей методике А из трет-бутилового эфира 4-[6-(7-циклопентил-6-диметилкарбамоил-7 Нпирроло[2,3-d]пиримидин-2-иламино)пиридин-3-ил]-2-метилпиперазин-1-карбоновой кислоты (260 мг,0,474 ммоль) получают диметиламид 7-циклопентил-2-[5-(3-метилпиперазин-1-ил)пиридин-2-иламино]7 Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты в виде бежевого твердого вещества (67 мг, 31%)[после хроматографии на SiO2 при элюировании смесью 5% (2,0 М NH3 в метаноле)/дихлорметан]. МС (ИЭР) m/z 449,4 (М+Н)+ (методика D). 1 Н ЯМР (400 МГц, ДМСО-d6): 9,23 (1 Н, s), 8,76 (1 Н, s), 8,13 (1 Н, d), 7,98 (1 Н, d), 7,41 (1 Н, dd), 6,60 К раствору гидрохлорида диметиламида 7-циклопентил-2-(5-пиперазин-1-илпиридин-2-иламино)7 Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты (150 мг, 0,318 ммоль) и карбоната калия (132 мг,0,955 ммоль) в ацетонитриле (3 мл) и ДМФ (диметилформамид) (2 мл) добавляют 1-бром-2-фторэтан(0,035 мл, 0,478 ммоль) и реакционную смесь нагревают в герметизированном реакционном сосуде при 80 С в течение 24 ч. При охлаждении реакционную смесь подвергают распределению между дихлорметаном и водой. Органический слой отделяют и затем водный слой экстрагируют дихлорметаном. Объединенные органические вещества промывают рассолом, сушат (MgSO4), фильтруют и концентрируют. Неочищенный продукт очищают с помощью хроматографии на силикагеле (от 0 до 10% метанола/дихлорметан) и получают диметиламид 7-циклопентил-2-5-[4-(2-фторэтил)пиперазин-1-ил]пиридин 2-иламино-7 Н-пирроло[2,3-d]пиримидин-6-карбоновой кислоты (84 мг, 55%) в виде почти белого твердого вещества. МС (ИЭР) m/z 481,2 (М+Н)+ (методика В).
МПК / Метки
МПК: A61K 31/519, A61P 35/00, C07D 487/04
Метки: применение, пирролопиримидины
Код ссылки
<a href="https://eas.patents.su/30-19094-pirrolopirimidiny-i-ih-primenenie.html" rel="bookmark" title="База патентов Евразийского Союза">Пирролопиримидины и их применение</a>
Предыдущий патент: Новые бензофураны, подходящие в качестве предшественников соединений, которые являются полезными для визуализации амилоидных отложений
Следующий патент: Комбинированный поршневой двигатель
Случайный патент: Способ волочения высоко-, сверхвысоко - и ультравысокопрочной латунированной проволоки.