Применение для лечения лейкемии
Формула / Реферат
1. Применение соединения N-[2-(2,1,3-бензотиадиазол-5-иламино)-6-(2,6-дихлорфенил)пиридо[2,3-d]пиримидин-7-ил]-N'-(1,1-диметилэтил)мочевина или его гидрата, соли или сольвата для получения лекарственного средства, предназначенного для лечения миелолейкозов.
2. Применение по п.1 для получения лекарственного средства, предназначенного для лечения лейкемии типа AML.
3. Применение по п.2 для получения лекарственного средства, предназначенного для лечения лейкемии типа AML, причем лекарственное средство предназначено для использования путем внутривенного введения.
4. Применение по п.2 для получения лекарственного средства, предназначенного для лечения лейкемии типа AML, причем лекарственное средство предназначено для использования путем перорального введения.
5. Применение по п.2 для получения лекарственного средства, предназначенного для лечения лейкемии типа AML, причем лекарственное средство предназначено для использования путем внутривенного и перорального введения.
6. Применение по п.1 для получения лекарственного средства, предназначенного для лечения лейкемии типа CML.
7. Применение по п.6 для получения лекарственного средства, предназначенного для лечения лейкемии типа CML, причем лекарственное средство предназначено для использования путем внутривенного введения.
8. Применение по п.6 для получения лекарственного средства, предназначенного для лечения лейкемии типа CML, причем лекарственное средство предназначено для использования путем перорального введения.
9. Применение по п.6 для получения лекарственного средства, предназначенного для лечения лейкемии типа CML, причем лекарственное средство предназначено для использования путем внутривенного и перорального введения.
Текст
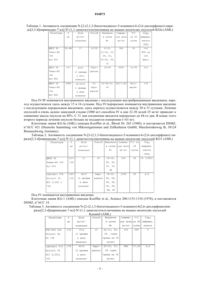
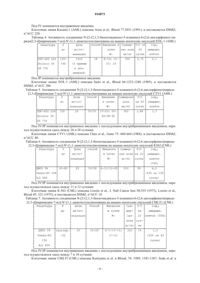
ПРИМЕНЕНИЕ ДЛЯ ЛЕЧЕНИЯ ЛЕЙКЕМИИ Объектом изобретения является новое терапевтическое применение N-[2-(2,1,3-бензотиадиазол-5 иламино)-6-(2,6-дихлорфенил)пиридо[2,3-d]пиримидин-7-ил]-N'-(1,1-диметилэтил)мочевины для лечения миелолейкозов. 016873 Изобретение относится к лечению лейкемии, в частности миелолейкозов. Лейкемия является раковым заболеванием костного мозга и крови. Можно различить четыре типа лейкемии: хронический миелолейкоз, острый миелолейкоз, хронический лимфолейкоз, острый лимфолейкоз. Миелолейкозы острого типа с быстрым развитием называются AML или острым миелолейкозом. Миелолейкозы хронического типа с постепенным менее резким развитием называются CML или хроническим миелолейкозом. Они представляют собой клональные болезни костного мозга, отличающиеся клональной экспансией миелоидных клеток, которые не могут нормально дифференцироваться и накапливаются в костном мозге и крови. В 2006 году в США согласно оценкам исследования Американского Ракового Общества будет диагностировано 11930 новых случаев AML и 4500 новых случаев CML. За период с 2002 по 2006 годы доля оставшихся в живых в течение 5 лет составляет 20,4% для AML и 42,3% для CML (Cancer and FactsFigures 2006, American Cancer Society, www.leukemia-lymphoma.org.). Согласно Французско-Американо-Британской классификации (FAB) от 1976 года, существует 8 подтипов AML, обозначаемых М 0-М 7, в соответствии с типом клеток, из каких развивается лейкемияcooperative group". Br J Haematol 33 (4): 451-8). Около 95% пациентов, страдающих CML, имеют генетическую транслокацию между хромосомами 9 и 22 лейкемических клеток. Эта известная аномалия в качестве хромосомы Philadelphia (Ph1) вызывает пролиферацию и неконтролируемое размножение всех типов белых кровяных телец и тромбоцитов. В настоящее время имеется множество лекарственных средств для лечения лейкемии. Однако остается потребность в новых активных терапевтических соединениях для улучшения стратегии лечения пациентов, страдающих лейкемией, или для создания лечения, альтернативного уже известным типам лечения (Plo et al., Mol Pharmacol, 2002, 62:304-312). В международной заявке WO2007/003765 описан продукт N-[2-(2,1,3-бензотиадиазол-5-иламино)-6(2,6-дихлорфенил)пиридо[2,3-d]пиримидин-7-ил]-N'-(1,1-диметилэтил)мочевина. Его формула представлена ниже: Описан также способ получения соединения N-[2-(2,1,3-бензотиадиазол-5-иламино)-6-(2,6-дихлорфенил)пиридо[2,3-d]пиримидин-7-ил]-N'-(1,1-диметилэтил)мочевина. Хотя это соединение может иметь существенную противоопухолевую активность на клетках в тестах in vitro, новые параметры, такие как распределение соединения в тканях, количество продукта в сыворотке, фармакокинетика и метаболизм, вносящие вклад в получение эффекта in vivo, нельзя предсказать, исходя из тестов in vitro. Кроме того, было показано, что противоопухолевая активность in vitro не всегда предсказывает активность in vivo (Cancer Res. 1988 Oct 1;48(19):5447-54, Cancer Chemother Pharmacol. 1996 38:548-552). Тестами in vivo было продемонстрировано, что соединение N-[2-(2,1,3-бензотиадиазол-5-иламино)6-(2,6-дихлорфенил)пиридо[2,3-d]пиримидин-7-ил]-N'-(1,1-диметилэтил)мочевина имеет значительную противоопухолевую активность in vivo на животных-носителях лейкемии человека. Объектом настоящего изобретения является применение соединения N-[2-(2,1,3-бензотиадиазол-5 иламино)-6-(2,6-дихлорфенил)пиридо[2,3-d]пиримидин-7-ил]-N'-(1,1-диметилэтил)мочевины или его гидрата, соли или сольвата для получения лекарственного средства, предназначенного для лечения миелолейкоза. В частности, настоящее изобретение относится к применению соединения N-[2-(2,1,3-бензотиадиазол-5-иламино)-6-(2,6-дихлорфенил)пиридо[2,3-d]пиримидин-7-ил]-N'-(1,1-диметилэтил)мочевина или его гидрата, соли или сольвата для получения лекарственного средства, предназначенного для лечения лейкемии типа AML. В частности, настоящее изобретение относится к применению соединения N-[2(2,1,3-бензотиадиазол-5-иламино)-6-(2,6-дихлорфенил)пиридо[2,3-d]пиримидин-7-ил]-N'-(1,1-диметилэтил)мочевина или его гидрата, соли или сольвата для получения лекарственного средства, предназначенного для лечения лейкемии типа CML. Объект настоящего изобретения относится к указанному выше применению для лечения млекопитающих, в частности человека. В настоящем изобретении соединение N-[2-(2,1,3-бензотиадиазол-5-иламино)-6-(2,6-дихлорфенил) пиридо[2,3-d]пиримидин-7-ил]-N'-(1,1-диметилэтил)-мочевина может вводиться испытуемому животному перорально, внутривенно, внутрибрюшинно или же внутривенно с последующим внутрибрюшинным введением, или же внутривенно с последующим пероральным введением. Для человека обычным путем введения являемся внутривенный и/или пероральный путь. Одним объектом настоящего изобретения является применение соединения N-[2-(2,1,3-бензотиа-1 016873 диазол-5-иламино)-6-(2,6-дихлорфенил)пиридо[2,3-d]пиримидин-7-ил]-N'-(1,1-диметилэтил)мочевина или его гидрата, соли или сольвата для получения лекарственного средства, предназначенного для лечения лейкемии типа AML, причем лекарственное средство предназначено для использования путем внутривенного введения. Одним объектом настоящего изобретения является применение соединения N-[2-(2,1,3-бензотиадиазол-5-иламино)-6-(2,6-дихлорфенил)пиридо[2,3-d]пиримидин-7-ил]-N'-(1,1-диметилэтил)мочевина или его гидрата, соли или сольвата для получения лекарственного средства, предназначенного для лечения лейкемии типа AML, причем лекарственное средство предназначено для использования путем перорального введения. Одним объектом настоящего изобретения является применение соединения N-[2-(2,1,3 бензотиадиазол-5-иламино)-6-(2,6-дихлорфенил)пиридо[2,3-d]пиримидин-7-ил]-N'-(1,1-диметилэтил) мочевина или его гидрата, соли или сольвата для получения лекарственного средства, предназначенного для лечения лейкемии типа AML, причем лекарственное средство предназначено для использования путем внутривенного и перорального введения. Одним объектом настоящего изобретения является применение соединения N-[2-(2,1,3-бензотиадиазол-5-иламино)-6-(2,6-дихлорфенил)пиридо[2,3-d]пиримидин-7-ил]-N'-(1,1-диметилэтил)мочевина или его гидрата, соли или сольвата для получения лекарственногосредства, предназначенного для лечения лейкемии типа CML, причем лекарственное средство предназначено для использования путем внутривенного введения. Одним объектом настоящего изобретения является применение соединения N-[2-(2,1,3-бензотиадиазол-5-иламино)-6-(2,6-дихлорфенил)пиридо[2,3-d]пиримидин-7-ил]-N'-(1,1-диметилэтил)мочевина или его гидрата, соли или сольвата для получения лекарственного средства, предназначенного для лечения лейкемии типа CML, причем лекарственное средство предназначено для использования путем перорального введения. Одним объектом настоящего изобретения является применение соединения N-[2-(2,1,3-бензотиадиазол-5-иламино)-6-(2,6-дихлорфенил)пиридо[2,3-d]пиримидин-7-ил]-N'-(1,1-диметилэтил)мочевина или его гидрата, соли или сольвата для получения лекарственного средства, предназначенного для лечения лейкемии типа CML, причем лекарственное средство предназначено для использования путем внутривенного и перорального введения. В настоящем изобретении соединение N-[2-(2,1,3-бензотиадиазол-5-иламино)-6-(2,6-дихлорфенил) пиридо[2,3-d]пиримидин-7-ил]-N'-(1,1-диметилэтил)мочевина обычно составляют для введения в виде композиции, приемлемой в плане фармацевтики. Эти фармацевтические композиции содержат эффективную дозу соединения N-[2-(2,1,3-бензотиадиазол-5-иламино)-6-(2,6-дихлорфенил)пиридо[2,3-d]пиримидин-7-ил]-N'-(1,1-диметилэтил)мочевина или фармацевтически приемлемой соли, гидрата или сольвата указанного соединения, а также по меньшей мере один фармацевтически приемлемый эксципиент. Указанные эксципиенты выбирают, в соответствии с фармацевтической формой и желаемым способом введения, из обычных эксципиентов, известных специалисту. В фармацевтические композиции по настоящему изобретению для перорального или внутривенного введения соединение N-[2-(2,1,3-бензотиадиазол-5-иламино)-6-(2,6-дихлорфенил)пиридо[2,3-d]пиримидин-7-ил]-N'-(1,1-диметилэтил)мочевина или его соль, сольват или возможный гидрат, могут вводиться в стандартной лекарственной форме, в смеси с классическими фармацевтическими эксципиентами, животным и человеку для профилактики или лечения указанных выше расстройств или заболеваний. Для лечения мышей-носителей опухолей Kasumil путем внутривенного введения предпочтительно используют состав ПЭГ-400 22%/Solutol 5%/G5 73%. Для лечения мышей-носителей опухолей Kasumil или KG1 путем перорального введения предпочтительно используют состав Labrasol 21%/Solutol 5%/HCl 0,001 н. 74%. Для лечения мышей-носителей опухолей EOL-1 путем внутрибрюшинного введения предпочтительно используют состав ПЭГ-400 22%/Solutol 5%/G5 73%. Для лечения мышей-носителей опухолей CTV1 путем внутривенного введения с последующим внутрибрюшинным введением предпочтительно используют состав ПЭГ-400 22%/Solutol 5%/G5 73%. Для лечения мышей-носителей опухолей KG1a путем перорального введения или внутривенного введения с последующим внутрибрюшинным введением, или же внутривенного введения с последующим пероральным введением предпочтительно используют состав ДМСО 5%/Tween-80 10%/H2O 85%. Для лечения мышей-носителей опухолей К 5 62 или CMLT1 путем внутривенного введения с последующим внутрибрюшинным введением предпочтительно используют состав ДМСО 5%/Tween-80 10%/H2O 85%. Для лечения мышей-носителей опухолей KG1 путем внутривенного введения предпочтительно используют состав ДМСО 5%/Tween-80 10%/H2O 85%. Подходящие стандартные лекарственные формы приема включают формы для перорального введения, такие как таблетки, мягкие или твердые желатиновые капсулы, порошки, гранулы и пероральные растворы или суспензии, и формы для внутривенного введения. Могут возникнуть особые случаи, когда подойдут более высокие или более низкие дозировки; та-2 016873 кие дозировки не выходят за рамки изобретения. Согласно обычной практике, дозы, подходящие для каждого пациента, определяет врач в соответствии со способом введения, массой тела и индивидуальной реакцией указанного пациента. Терапия соединением N-[2-(2,1,3-бензотиадиазол-5-иламино)-6-(2,6-дихлорфенил)пиридо[2,3-d] пиримидин-7-ил]-N'-(1,1-диметилэтил)мочевина согласно настоящему изобретению может применяться одновременно с другими видами лечения. В частности, соединение N-[2-(2,1,3-бензотиадиазол-5 иламино)-6-(2,6-дихлорфенил)пиридо[2,3-d]пиримидин-7-ил]-N'-(1,1-диметилэтил)-мочевина по изобретению может вводиться в комбинации с одним или несколькими противораковыми активными веществами, в частности, такими противоопухолевыми соединениями, как: алкилирующие средства, такие как алкилсульфонаты (бусульфан), дакарбазин, прокарбазин, клоретазин, горчичные газы (хлорметин, мелфалан, хлорамбуцил, циклофосфамид, ифосфамид), нитрозомочевины, такие как кармустин, ломустин, семустин, стрептозоцин, альтретамин; противоопухолевые алкалоиды, такие как винкристин, винбластин, винорелбин, виндезин; таксаны, такие, как паклитаксел или таксотер; противоопухолевые антибиотики, такие как актиномицин, блеомицин; вещества, образующее соединение внедрения, такие как митоксантрон; противоопухолевые антиметаболиты: антагонисты фолатов, метотрексат; ингибиторы синтеза пуринов; аналоги пуринов, такие как меркаптопурин, 6-тиогуанин; ингибиторы синтеза пиримидина, ингибиторы ароматазы, капецитабин, аналоги пиримидинов, такие как фторурацил, гемцитабин, цитарабин и цитозинарабинозид; бреквинар, неларабин; ингибиторы топоизомераз, такие как иринотекан, экзатекан, топотекан, тенипозид, камптотехин или этопозид; противораковые агонисты и антагонисты гормонов, включая тамоксифен; ингибиторы киназы, такие как иматиниб, нилотиниб и дасатиниб, мидаусторин, сорафениб, лестауртиниб, тандутиниб; ингибиторы факторов роста; противовоспалительные средства, такие как пентозан полисульфат, кортикостероиды, преднизон,дексаметазон;Ceplene (дихлоргидрат гистамина); антрациклины, такие как даунорубицин, эпирубицин, пирарубцин, идарубицин, зорубицин, акларубицин, аннамицин, доксорубицин, митомицин и метрамицин; противораковые металлокомплексные соединения, комплексы платины: цисплатин, карбоплатин,оксалиплатин, сатраплатин; альфа-интерферон; трифенилтиофосфорамид; антиангиогенные средства; талидомид; ингибиторы фарнезил-трансферазы, такие как типифарниб; ингибиторы ДНК-метилтрансферазы, как MG98; адъюванты для иммунотерапии, такие как гемтузумаб озогамицин, HuM 195; биотерапевтические средства, такие как CT388-IL3; антисенсы, такие как GTI-2040; вакцины. В частности, соединение N-[2-(2,1,3-бензотиадиазол-5-иламино)-6-(2,6-дихлорфенил)пиридо[2,3-d] пиримидин-7-ил]-N'-(1,1-диметилэтил)мочевина согласно изобретению может вводиться в комбинации с одним или несколькими соединениями семейства антрациклинов. В частности, соединение N-[2-(2,1,3-бензотиадиазол-5-иламино)-6-(2,6-дихлорфенил)пиридо[2,3d]пиримидин-7-ил]-N'-(1,1-диметилэтил)мочевина согласно изобретению может вводиться в комбинации с даунорубицином или в комбинации с цитозинарабинозидом, или же в комбинации с даунорубицином и цитозинарабинозидом. Согласно настоящему изобретению, соединение N-[2-(2,1,3-бензотиадиазол-5-иламино)-6-(2,6 дихлорфенил)пиридо[2,3-d]пиримидин-7-ил]-N'-(1,1-диметилэтил)мочевина может также вводиться в комбинации с одним или несколькими другим активными веществами, полезными в случае одной из названных выше патологий, например, с противорвотным, противоболевым, противовоспалительным средством, средством от кахексии. Соединения по настоящему изобретению можно также комбинировать с лечением облучением. Эти виды лечения могут использоваться одновременно, раздельно, последовательно или разделенными во времени. Лечение подбирается практикующим врачом в зависимости от больного, которому требуется лечение. В настоящем изобретении продукт N-[2-(2,1,3-бензотиадиазол-5-иламино)-6-(2,6-дихлорфенил)пиридо[2,3-d]пиримидин-7-ил]-N'-(1,1-диметилэтил)мочевина вводится в соответствии с дозировкой, которая позволяет лечение лейкемии. Дозировка зависит от способа введения и от физических характеристик-3 016873 пациента. Доза, подходящая для этой цели, соответствует дозировкам, обладающим терапевтической эффективностью для расстройств, являющихся результатом аномальной клеточной пролиферации. Продукт N-[2-(2, 1,3-бензотиадиазол-5-иламино)-6-(2,6-дихлорфенил)пиридо[2,3-d]пиримидин-7-ил]-N'-(1,1 диметилэтил)мочевина может приниматься настолько часто, как это необходимо, чтобы получить искомый терапевтический эффект. Эффективность действия соединения N-[2-(2,1,3-бензотиадиазол-5-иламино)-6-(2,6-дихлорфенил) пиридо[2,3-d]пиримидин-7-ил]-N'-(1,1-диметилэтил)-мочевина на лейкемию можно определить экспериментально, как в следующем примере, который иллюстрирует изобретение. Пример. Материалы и методы. Используют мышей Scid CB-17 (поставляемые Charles River, Лион, Франция). При рандомизации животные имеют средний вес 20-22 г и возраст от 6 до 9 недель. Животных приобретают по меньшей мере за месяц до эксперимента, чтобы позволить им идеально акклиматизироваться. Здоровье животных проверяют в день, предшествующий пересадке опухоли, и перед рандомизацией, чтобы гарантировать, что для проведения экспериментов будут использоваться только здоровые животные. Их помещают в клетки из макролона, тип III, с фильтрующимися крышками(максимум 8 мышей на клетку) в стерильном помещении, где воздух постоянно фильтруется, чтобы избежать любых загрязнений. Стерильность помещения проверяют раз в месяц. Клетки стерилизуют при 121 С перед использованием и меняют два раза в неделю. В помещении поддерживают температуру 22 С и относительную влажность 60 +/-10%. Животных помещают в условия естественного освещения. Воду стерилизуют при 121 С в течение 30 мин. Потребление воды отслеживается визуально каждый день, и бутылки меняют 2 раза в неделю. Корм и вода даются ad libitum. Подстилку стерилизуют при 121 С в течение 30 мин и меняют дважды в неделю. В день, предшествующий первому введению соединения, животных-носителей опухолей делят на несколько групп. Выбирают только животных-носителей двух пальпируемых опухолей или опухолей определенного веса и распределяют случайным образом на группы, принимающие лечение, и контрольные группы. Каждая группа состоит из 5-10 мышей. В начале исследования на каждую клетку наклеивается этикетка, указывающая день пересадки опухоли, тип опухоли, тестируемое соединение и способ введения. Пересадку опухолей проводили следующим образом: после изъятия опухоли у мыши-донора, опухоль разрезали на фрагменты диаметром 2-3 мм, помещали в буфер фосфатной соли, и вживляли с двух сторон подходящим троакаром. Определение противоопухолевой активности Объем опухолей и его выражение в весе оценивались по формуле: вес (в мг) = (аb2)/2, где а и b означают соответственно длину и ширину опухоли (в мм) . Опухоли измеряли два раза в неделю штангенциркулем. В следующих таблицах Р указывает вес опухоли в начале лечения. Использовались два параметра оценки противоопухолевой активности: log10 умерщвленных клеток(Log cell kill) и Т/С. Расчет log10 умерщвленных клеток=(Т-С)/3,32Td, где (Т-С) есть задержка роста опухоли, и Td есть время удвоения объема (и веса) опухоли (выражено в сутках). Т есть среднее время в сутках до поражения фиксированной величины (например, 1000 мг) в группе, получавшей лечение, и С есть среднее время в сутках до поражения этой же величины, в контрольной группе. Величина log10 убитых клеток, превышающая 0,7, является показателем противоопухолевой активности молекулы. Значение log10 убитых клеток, превышающее 2,8, свидетельствует об очень высокой противоопухолевой активности молекулы (J.Liang et al., Invest New Drugs 2005; 23 (3):213-24) . Расчет Т/С: группы, получавшие лечение, и контрольные группы оцениваются, когда опухоли в контрольной группе достигнут приблизительно 1000 мг (среднее значение по группе). Тогда определяется средний вес опухолей в каждой группе, получавшей лечение. Величина Т/С вес опухолей в группах,принимавших лечение/вес опухолей в контрольных группах)100) в процентах является показателем противоопухолевой эффективности: значение Т/С, равное или ниже 42%, указывает на противоопухолевую активность согласно Национальному институту рака США (NCI). Значение Т/С ниже 10% показательно для очень высокой противоопухолевой активности. Число мышей, не имеющих больше опухолей через значительное время после последнего введения(TFS=tumor-free survival) и считающихся вылеченными, также может рассматриваться как параметр активности молекулы. Оценка токсичности тестируемого соединения: потеря веса, равная или превышающая 20%, или появление какой-либо летальности в связи с соединением рассматривается как чрезмерно токсичное лечение. В следующих табл. 1-7 в качестве примеров приведены результаты, полученные с соединением N[2-(2,1,3-бензотиадиазол-5-иламино)-6-(2,6-дихлорфенил)пиридо[2,3-d]пиримидин-7-ил]-N'-(1,1-диметилэтил)мочевина. Под IV/IP понимается внутривенное введение с последующим внутрибрюшинным введением, переход осуществлялся здесь между 15 и 16 сутками. Под IV/перорально понимается внутривенное введение с последующим пероральным введением, здесь переход осуществляется между 30 и 31 сутками. Лечение опухолей в очень далеко зашедшей стадии (1000 мг) способом IV в дни 22-30 дозой 25 мг/кг приводит к снижению массы опухоли на 80%. С 31 дня соединение вводится перорально до 44-го дня. В конце этого второго периода лечения опухоли больше не поддаются измерению (63 мг). Клеточная линия KG-la (AML) описана Koeffler et al., Blood 56: 265 (1980), и поставляется DSMZ,nACC 421 (Deutsche Sammlung von Mikroorganismen und Zellkulturen GmbH, Mascheroderweg lb, 38124 Под IV/IP понимается внутривенное введение с последующим внутрибрюшинным введением, переход осуществлялся здесь между 26 и 28 сутками. Клеточная линия CTV1 (AML) описана Chen et al., Gann 75: 660-664 (1984), и поставляется DSMZ,nACC 40. Таблица 6. Активность соединения N-[2-(2,1,3-бензотиадиазол-5-иламино)-6-(2,6-дихлорфенил)пиридо Под IV/IP понимается внутривенное введение с последующим внутрибрюшинным введением, переход осуществлялся здесь между 11 и 12 сутками. Клеточная линия К-562 (CML) описана Lozzio et al., J. Natl Cancer Inst 50:535 (1973), Lozzio et al.,Blood 45: 321 (1975), и поставляется DSMZ, nACC 10. Таблица 7. Активность соединения N-[2-(2,1,3-бензотиадиазол-5-иламино)-6-(2,6-дихлорфенил)пиридо Под IV/IP понимается внутривенное введение с последующим внутрибрюшинным введением, переход осуществлялся здесь между 7 и 10 сутками. Клеточная линия CMLTl (CML) описана Kuriyama et al. в Blood, 74: 1989, 1381-1387, Soda et al. вBritish Journal of Haematology, 59:1985, 671-679, и Drexler, в Leukemia Research, 18: 1994, 919-927, и поставляется компанией DSMZ, nACC 7. ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение соединения N-[2-(2,1,3-бензотиадиазол-5-иламино)-6-(2,6-дихлорфенил)пиридо[2,3d]пиримидин-7-ил]-N'-(1,1-диметилэтил)мочевина или его гидрата, соли или сольвата для получения лекарственного средства, предназначенного для лечения миелолейкозов. 2. Применение по п.1 для получения лекарственного средства, предназначенного для лечения лейкемии типа AML. 3. Применение по п.2 для получения лекарственного средства, предназначенного для лечения лейкемии типа AML, причем лекарственное средство предназначено для использования путем внутривенного введения. 4. Применение по п.2 для получения лекарственного средства, предназначенного для лечения лейкемии типа AML, причем лекарственное средство предназначено для использования путем перорального введения. 5. Применение по п.2 для получения лекарственного средства, предназначенного для лечения лейкемии типа AML, причем лекарственное средство предназначено для использования путем внутривенного и перорального введения. 6. Применение по п.1 для получения лекарственного средства, предназначенного для лечения лейкемии типа CML. 7. Применение по п.6 для получения лекарственного средства, предназначенного для лечения лейкемии типа CML, причем лекарственное средство предназначено для использования путем внутривенного введения. 8. Применение по п.6 для получения лекарственного средства, предназначенного для лечения лейкемии типа CML, причем лекарственное средство предназначено для использования путем перорального введения. 9. Применение по п.6 для получения лекарственного средства, предназначенного для лечения лейкемии типа CML, причем лекарственное средство предназначено для использования путем внутривенного и перорального введения.
МПК / Метки
МПК: A61K 31/433, A61K 45/06, A61K 31/519, A61P 35/02
Метки: лейкемии, применение, лечения
Код ссылки
<a href="https://eas.patents.su/8-16873-primenenie-dlya-lecheniya-lejjkemii.html" rel="bookmark" title="База патентов Евразийского Союза">Применение для лечения лейкемии</a>