Пирролопиримидины и фармацевтические композиции, включающие эти соединения.
Номер патента: 1428
Опубликовано: 26.02.2001
Авторы: Фрай Йорг, Болд Гидо, Брилл Карл-Дитер Вольфганг, Тракслер Питер
Формула / Реферат
1. Производное 7Н-пирроло[2,3-d] пиримидина формулы I
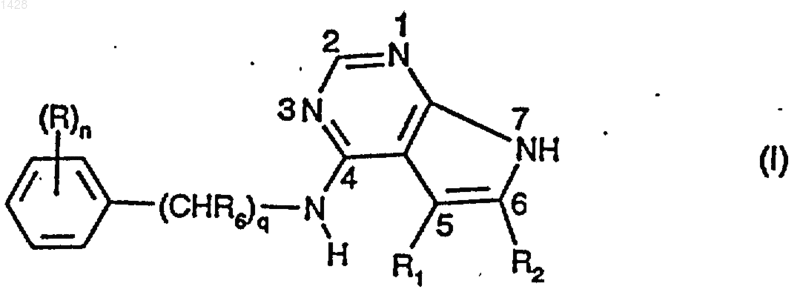
в которой
q - 0 или 1,
n - от 1 до 3, если q=0, или от 0 до 3, если q=1,
R - галоген, С1-С7алкил, гидрокси, С1-С7алканоилокси, C1-С7алкокси, карбокси, С1-С7алкоксикарбонил, карбамоил, N-С1-С7алкилкарбамоил, N,N-ди-С1-С7алкилкарбамоил, циано, амино, С1-С7алканоиламино, С1-С7алкиламино, N,N-ди-С1-С7алкиламино или трифторметил, причем, если в молекуле присутствуют несколько радикалов R, они могут быть одинаковыми или разными,
a) R1 и R2 - каждый независимо друг от друга означают
a ) фенил, замещенный карбамоилметокси-, карбоксиметокси-, бензилоксикарбонилметоксигруппой, С1-С7алкоксикарбонилметоксигруппой, фенилом, амино-, С1-С7алканоиламино-, С1-С7алкиламино-, N,N-ди-С1-С7алкиламино-, гидроксильной, С1-С7алканоилокси-, карбоксигруппой, С1-С7-алкоксикарбонилом, карбамоилом, N-С1-С7алкилкарбамбилом, N,N-ди-С1-С7-алкилкарбамоилом, циано или нитрогруппой;
при условии, что R1 и R2 не могут одновременно означать водород;
b ) водород;
g ) незамещенный или гало- или С1-С7алкилзамещенный пиридил;
d ) N-бензилпиридиний-2-ил; нафтил; циано; карбокси; С1-С7алкоксикарбонил; карбамоил; N-С1-С7алкилкарбамоил; N,N-ди-С1-С7алкилкарбамоил; N-бензилкарбамоил; формил; С1-С7алканоил; С1-C7алкенил; С1-С7алкенилокси; или
у) С1-С7алкил, замещенный
уa ) галогеном, амино, С1-С7алкиламино, пиперазино, ди-С1-С7-алкиламино,
уb ) фениламино, который незамещен или замещен в фенильном фрагменте галогеном, С1-С7алкилом, гидрокси-, С1-С7алканоилокси-, С1-С7алкокси-, карбоксигруппой, С1-С7алкоксикарбонилом, карбамоилом, N-С1-С7алкилкарбамоилом, N,N-ди-С1-С7алкилкарбамоилом, циано, амино, С1-С7-алканоиламино, С1-С7алкиламино, N,N-ди-С1-С7алкиламино или трифторметилом,
уg ) гидроксилом, С1-С7алкоксилом, циано, карбоксилом, С1-С7-алкоксикарбонилом, карбамоилом, N-С1-С7алкилкарбамоилом, N,N-ди-C1-C7-алкилкарбамоилом, меркапто или
уd ) радикалом формулы R3-S(O)m-, в которой R3 обозначает С1-С7алкил и m = 0, 1 или 2, или
b) если q=0, один из радикалов R1 и R2 обозначает незамещенный C1-C7алкил или незамещенный фенил, а другой из радикалов R1 и R2 имеет одно из значений, указанных выше в пункте а), за исключением водорода, или
c) если q=1, R1 и R2 - каждый независимо от другого незамещенный С1-С7алкил или незамещенный фенил, или имеют одно из значений, указанных выше в пункте а), и
R6 - водород, С1-С7алкил, С1-С7алкоксикарбонил, карбамоил, N-C1-C7-алкилкарбамоил или N,N-ди-С1-С7алкилкарбамоил, или его соль,
за исключением соединения формулы I, в которой n=0 или 2, q=1, R1 и R6 - каждый водород, R2 - метил, a R обозначает 3,4-метоксигруппу.
2. Соединение формулы I по п.1, в которой
q - 0 или 1,
n - от 1 до 3, если q=0, или от 0 до 3, если q=1,
R - галоген, С1-С7алкил, гидрокси, С1-С7алканоилокси, С1-С7алкокси, карбокси, С1-С7алкоксикарбонил, карбамоил, N-С1-С7алкилкарбамоил, N,N-ди-С1-С7алкилкарбамоил, циано, амино, С1-С7алканоиламино, C1-С7-алкиламино, N,N-ди-С1-С7алкиламино или трифторметил, причем, если в молекуле присутствуют несколько радикалов R, они могут быть одинаковыми или разными;
a) R1 - водород, a R2 - фенил, замещенный карбамоилметокси, карбоксиметокси, бензилоксикарбонилметокси, C1-С7алкоксикарбонилметокси, фенилом, амино, С1-С7алканоиламино, С1-С7алкиламино, N,N-ди-С1-С7алкиламино, гидрокси, C1-C7алканоилокси, карбокси, С1-С7алкоксикарбонилом, карбамоилом, N-C1-C7алкилкарбамоилом, N,N-ди-С1-С7алкилкарбамоилом, циано или нитро; незамещенный или гало- или С1-С7алкилзамещенный пиридил; N-бензилпиридиний-2-ил; нафтил; циано; карбокси; C1-С7алкоксикарбонил; карбамоил; Н-С1-С7алкилкарбамоил; N,N-ди-C1-C7-алкилкарбамоил; N-бензилкарбамоил; формил; С1-С7алканоил; С1-С7алкенил; С1-С7алкенилокси; или С1-С7алкил, замещенный галогеном; фениламино, который незамещен или замещен в фенильном фрагменте галогеном, С1-С7алкилом, С1-С7алканоилокси, гидрокси, С1-С7алкокси, карбокси, С1-С7алкоксикарбонилом, карбамоилом, N-С1-С7алкилкарбамоилом, N,N-ди-С1-С7алкилкарбамоилом, циано, амино, С1-С7алканоиламино, С1-С7алкиламино, N,N-ди-С1-С7алкиламино или трифторметилом; С1-С7алкокси, циано, карбокси, С1-С7алкоксикарбонилом, карбамоилом, N-С1-С7алкилкарбамоилом, N,N-ди-C1-C7aлкилкapбaмoилoм, меркапто или радикалом формулы R3-S(О)m-, в которой R3 - С1-С7алкил и m = 0, 1 или 2, или
b) если q=0, один из радикалов R1 и R2 - незамещенный С1-С7алкил или незамещенный фенил, а другой из радикалов R1 и R2 имеет одно из значений, указанных выше в пункте а), за исключением водорода, или
с) если q=1, R1 - водород и R2 - незамещенный фенил, и R6 - водород, С1-С7алкил, С1-С7алкоксикарбонил, карбамоил, N-C1-C7-алкилкарбамоил или N,N-ди-С1-С7алкилкарбамоил, или его соль.
3. Соединение формулы I по п.1, в котором
q - 0 или 1,
n - от 1 до 3, если q=0, или от 0 до 3, если q=1,
R - галоген, C1-С7алкил, гидрокси, C1-С3алканоилокси, C1-С7алкокси, карбокси, С1-С7алкоксикарбонил, карбамоил, N-С1-С7алкилкарбамоил, N,N-ди-С1-С7алкилкарбамоил, циано, амино, С1-С7алканоиламино, С1-С7алкиламино, N,N-ди-С1-С7алкиламино или трифторметил, причем, если в молекуле присутствуют несколько радикалов R, они могут быть одинаковыми или разными,
a) R1 и R2 - кажфыщ независимо от другого фенил, замещенный карбамоилметокси, карбоксиметокси, бензилоксикарбонилметокси, С1-С7алкоксикарбонилметокси, фенилом, амино, С1-С7алканоиламино, C1-C7-алкиламино, N,N-ди-С1-С7алкиламино, гидрокси, С1-С7алканоилокси, карбокси, С1-С7алкоксикарбонилом, карбамоилом, N-С1-С7алкилкарбамоилом, N,N-ди-С1-С7алкилкарбамоилом, циано или нитро; водород при условии, что R1 и R2 не могут быть одновременно водородами; незамещенный или гало- или С1-С7алкилзамещенный пиридил; N-бензилпиридиний-2-ил; нафтил; циано; карбокси; C1-C7алкоксикарбонил; карбамоил; N-С1-С7алкилкарбамоил; N,N-ди-С1-С7алкилкарбамоил; N-бензилкарбамоил; формил; С1-С7алканоил; С1-С7 алкенил; С1-С7алкенилокси; или С1-С7алкил, замещенный галогеном, амино, С1-С7алкиламино, пиперазино, ди-С1-С7алкиламино, пиперазино, ди-C1-C7-алкиламино, гидрокси, С1-С7алкокси, циано, карбокси, С1-С7алкоксикарбонилом, карбамоилом, N-C1-C7алкилкарбамоилом, N,N-ди-С1-С7алкилкарбамоилом, меркапто или радикалом формулы R3-S(O)m-, в которой R3 - С1-С7алкил и m = 0, 1 или 2, или
b) если q=0, один из радикалов R1 и R2 - незамещенный С1-С7алкил или незамещенный фенил, а другой из радикалов R1 и R2 имеет одно из значений, указанных выше в пункте а), за исключением водорода, или
c) если q=1, R1 и R2 - каждый независимо от другого незамещенный С1-C7алкил или незамещенный фенил, или имеют одно из значений, указанных выше в пункте а), и
R6 - водород, С1-С7алкил, С1-С7алкоксикарбонил, карбамоил, N-C1-C7-алкилкарбамоил или N,N-ди-С1-С7алкилкарбамоил,
или его соль,
за исключением соединения формулы I, в которой n=0 или 2, q=1, R1 и R6 - каждый водород, R2 - метил, a R - 3,4-метоксигруппа.
4. Соединение формулы I по п.1, в котором
q - 0 или 1,
n - от 1 до 3, когда q=0, или n от 0 до 3, когда q=1;
R обозначает галоген С1-С7алкил, гидрокси, С1-С7алканоилокси, С1-С7алкокси, карбокси, С1-С7алкоксикарбонил, карбамоил, N-C1-С7алкилкарбамоил, N,N-ди-С1-С7алкилкарбамоил, циано, амино, С1-С7алканоиламино, C1-С7алкиламино, N,N-ди-С1-С7алкиламино или трифторметил, причем в случае, если в молекуле присутствует несколько радикалов R, то они могут быть одинаковыми или различными;
R1 обозначает водород или С1-С7алкил, который незамещен или замещен ди-С1-С7алкиламиногруппой, и
R2 обозначает фенил, замещенный карбамоилметокси, карбоксиметокси, бензилоксокарбонилметокси, С1-С7алкоксикарбонилметокси, С1-С7алкоксикарбонил, карбокси, N,N-ди-С1-С7алкилкарбамоил, фенил, амино, С1-С7алкиламино, ди-С1-С7алкиламино, С1-С7алканоиламино, гидрокси или нитрогруппой;
R6 обозначает водород, С1-С7алкил, С1-С7алкоксикарбонил, карбамоил, N-С1-С7алкилкарбамоил, N,N-ди-С1-С7алкилкарбамоил, или их соли,
за исключением случая, когда в соединении формулы I, n обозначает 0 или 2, q=l, R1 и R2 каждый обозначает водород, R2 - метил, а R - 3,4-метокси.
5. Соединение формулы I по п.1, где
q = 0,
n - от 1 до 3,
R - галоген, С1-С7алкил, гидрокси, С1-С7алканоилокси, С1-С7алкокси, карбокси, С1-С7алкоксикарбонил, карбамоил, N-С1-С7алкилкарбамоил, N,N-ди-С1-С7алкилкарбамоил, циано, амино, С1-С7алканоиламино, С1-С7-алкиламино, N,N-ди-С1-С7алкиламино или трифторметил, при условии, что если в молекуле присутствуют несколько радикалов R, они могут быть одинаковыми или разными,
a) R1 и R2 - каждый независимо от другого обозначает фенил, замещенный фенилом, амино, С1-С7алканоиламино, С1-С7алкиламино, N,N-ди-С1-С7алкиламино, гидрокси, С1-С7алканоилокси, карбокси, С1-С7алкоксикарбонилом, карбамоилом, N-С1-С7алкилкарбамоилом, N,N-ди-С1-С7алкилкарбамоилом, циано или нитрогруппой; водород при условии, что R1 и R2 одновременно не могут быть водородами; незамещенный или гало- или C1-С7алкилзамещенный пиридил; N-бeнзилпиpидиний-2-ил; нафтил; циано; карбокси; С1-С7алкоксикарбонил; карбамоил; N-С1-С7алкилкарбамоил, N,N-ди-С1-С7алкилкарбамоил; формил; С1-С7алканоил; С1-С7алкенил; C1-C7-алкенилокси; или С1-С7алкил, замещенный галогеном; амино, С1-С7алкиламино, пиперазино, ди-С1-C7алкиламино, гидрокси, С1-С7алкокси, циано, карбокси, С1-С7алкоксикарбонилом, карбамоилом, N-С1-С7алкилкарбамоилом, N,N-ди-С1-С7алкилкарбамоилом, меркапто или радикалом формулы R3-S(O)m-, в которой R3 - С1-С3алкил и m = 0, 1 или 2, или
b) один из радикалов R1 и R2 - незамещенный С1-С7алкил или незамещенный фенил, а другой из радикалов R1 и R2 имеет одно из значений, указанных выше в пункте а), за исключением водорода, или его соль.
6. Соединение формулы I по п.1, в которой
q=0,
n - 1 или 2,
R - галоген, при том, что, если в молекуле присутствуют несколько радикалов R, они могут быть одинаковыми или разными, и
a) R1 и R2 - каждый независимо от другого фенил, замещенный фенилом, амино, гидрокси или нитро; водород; пиридил; N-бензилпиридиний-2-ил; нафтил; или С1-С7алкил, замещенный ди-С1-С7алкиламино, или
b) один из радикалов R1 и R2 - незамещенный С1-С7алкил или незамещенный фенил, и другой из радикалов R1 и R2 имеет одно из значений, указанных выше в пункте а), за исключением водорода, или его соль.
7. Соединение формулы I по п.1,
где q = 0,
n - 1 или 2,
R - галоген, при том, что если в молекуле присутствуют несколько радикалов R, они могут быть одинаковыми или разными, и
R1 - водород, или С1-С7алкил, незамещенный или замещенный ди-С1-С7-алкиламино, и R2 - фенил, замещенный фенилом, амино, гидрокси или нитро; пиридил; N-бензилпиридиний-2-ил; или нафтил;
или его соль.
8. Соединение формулы I по п.1,
где q - 0 или 1,
n - 1 или 2, если q = 0, или n от 0 до 2, если q = 1,
R - галоген или С1-С7алкил, причем если в молекуле присутствуют несколько радикалов R, они могут быть одинаковыми шыш разными, и
а) R1 - водород, или С1-С7алкил, незамещенный или замещенный ди-С1-С7алкиламино, и R2 - фенил, замещенный карбамоилметокси, карбоксиметокси, бензилоксикарбонилметокси, С1-С7алкоксикарбонилметокси, С1-C7алкоксикарбонилом, карбокси, N,N-ди-С1-С7алкилкарбамоилом, фенилом, амино, С1-С7алкиламино, ди-С1-С7алкиламино, С1-С7алканоиламино, гидрокси, или нитрогруппой; гидрокси-С1-С7алкил, амино-С1-С7алкил, ди-С1-С7алкиламино-С1-С7алкил, пиперазино-С1-С7алкил, формил, циано, карбокси; С1-С7алкоксикарбонил; карбамоил; N-C1-C7алкилкарбамоил; N,N-ди-С1-С7алкилкарбамоил, пиридил; N-бензилкарбамоил, N-бензилпиридиний-2-ил; или нафтил, или
b) если q - 1, R1 и R2 - каждый метил, и
R6 - водород, метил или С1-С7алкоксикарбонил,
или его фармацевтически приемлемая соль.
9. Соединение формулы I по п.1,
где q - 0 или 1,
n - 1 или 2, если q - 0, или n от 0 до 2, если q - 1,
R - галоген, причем, если в молекуле присутствуют несколько радикалов R, они могут быть одинаковыми или разными, и
a) R1 - водород, или C1-С7алкил, незамещенный или замещенный ди-C1-С7алкиламино, и R2 - фенил, замещенный карбамоилметокси, карбоксиметокси, бензилоксикарбонилметокси, метоксикарбонилметокси, этоксикарбонилом, карбокси, фенилом, амино, ацетамино, гидрокси, или нитрогруппой; карбокси; этоксикарбонил; Н-С1-С7алкилкарбамоил; пиридил; N-бензилпиридиний-2-ил; или нафтил, или
b) если q - 1, R1 и R2 - каждый метил, а
R6 - водород, метил или метоксикарбонил,
или его соль.
10. Соединение формулы I по любому из пп.1, 2, 3, 4, 8 или 9, где q=1.
11. Соединение формулы I по п.1 или его фармацевтически приемлемая соль, выбранное из
4-(3-хлороанилино)-6-(пирид-2-ил)-7Н-пирроло[2,3-d]пиримидина,
4-(3-хлороанилино)-6-(пирид-2-ил)-7Н-пирроло[2,3-d]пиримидина гидрохлорида,
4-(3-хлороанилино)-5-диметиламинометил-6-(пирид-2-ил)-7Н-пирроло[2,3-d]пиримидина,
4-(3-хлоро-4-фтороанилино)-6-(пирид-2-ил)-7Н-пирроло[2,3-d]пиримидина,
4-(3-хлороанилино)-5-метил-6-(пирид-2-ил)-7Н-пирроло[2,3-d]пиримидина,
4-(3-хлороанилино)-5-метил-6-(N-бензилпиридиний-2-ил)-7Н-пирроло[2,3-d]пиримидина гидробромида,
4-(3-хлоро-4-фтороанилино)-5-метил-6-(пирид-2-ил)-7Н-пирроло[2,3-d] пиримидина,
4-(3-хлороанилино)-6-(бифен-4-ил)-7Н-пирроло[2,3-d]пиримидина,
4-(3-хлороанилино)-6-(нафт-2-ил)-7Н-пирроло[2,3-d]пиримидина,
4-(3-хлороанилино)-6-(2-гидроксифенил)-7Н-пирроло[2,3-d]пиримидина,
4-(3-хлороанилино)-6-(3-гидроксифенил)-7Н-пирроло[2,3-d]пиримидина,
4-(3-хлороанилино)-6-(4-гидроксифенил)-7Н-пирроло[ 2,3-d]пиримидина,
4-(3-хлороанилино)-5-диметиламинометил-6-(4-гидроксифенил)-7Н-пирроло[2,3-d]пиримидина,
4- (3-хлороанилино)-5-диметиламинометил-6-фенил-7Н-пирроло[2,3-d]пиримидина,
4-(3-хлороанилино)-5-метил-6-(4-гидроксифенил)-7Н-пирроло[2,3-d]пиримидина гидробромида,
4-(3-хлороанилино)-6-(4-нитрофенил)-7Н-пирроло[2,3-d]пиримидина и
4-(3-хлороанилино)-6-(4-аминофенил)-7Н-пирроло[2,3-d]пиримидина,
и их фармацевтически приемлемых кислотно-аддитивных солей.
12. Соединение формулы I по п.1 или его фармацевтически приемлемая соль, выбранное из
a) бензиламино-5,6-диметил-7Н-пирроло[2,3-d]пиримидина,
b) (R)-5,6-диметил-4-[(1-фенилэтил)-амино]-7Н-пирроло[2,3-d]пиримидина,
c) (S)-5,6-диметил-4-[(1-фенилэтил)-амино]-7Н-пирроло[2,3-d]пиримидина,
d) (R)-6-(4-аминофенил)-4- [(1-фенилэтил)-амино]-7Н-пирроло[2,3-d]пиримидина,
e) (S)-6-(4-аминофенил)-4-[(1-фецилэтил)-амино]-7Н-пирроло[2,3-d]пиримидина,
f) 6-(4-аминофенил)-4-бензиламино-7Н-пирроло[2,3-d]пиримидина,
g) 6-(4-аминофенил)-4-[(3-хлоробензил)-амино]-7Н-пирроло[2,3-d]пиримидина,
h) (R)-6-(4-аминофенил)-4-[(1-метоксикарбонилбензил)-амино]-7Н-пирроло[2,3-d]пиримидина,
i) (S)-6-(4-аминофенил)-4-[(1-метоксикарбонилбензил)-амино]-7Н-пирроло[2,3-d]пиримидина,
j) 6-(4-ацетиламинофенил)-4-(3-хлороанилино)-7Н-пирроло[2,3-d]пиримидина,
k) 6-(4-карбамоилметоксифенил)-4-(3-хлороанилино)-7Н-пирроло[2,3-d] пиримидина,
l) 6-(4-аминофенил)-4-(3-метиланилино)-7Н-пирроло[2,3-d]пиримидина,
m) 6-(4-аминофенил)-4-(3-хлоро-4-фтороанилино)-7Н-пирроло[2,3-d]пиримидина,
n) 6-(3-ацетиламинофенил)-4-(3-хлороанилино)-7Н-пирроло[2,3-d]пиримидина,
о) 6-(3-аминофенил)-4-(3-хлороанилино)-7H-пирроло[2,3-d]пиримидина,
р) 6-(4-карбоксиметоксифенил)-4-(3-хлороанилино)-7Н-пирроло[2,3-d]пиримидина,
q) 6-(4-[бензилоксикарбонилметокси]-фенил)-4-(3-хлороанилино)-7Н-пирроло[2,3-d]пиримидина,
r) 6-(3-карбоксиметоксифенил)-4-(3-хлороанилино)-7Н-пирроло[2,3-d]пиримидина,
s) 4-(3-хлороанилино)-6-(4-метоксикарбонилметоксифенил)-7Н-пирроло [2,3-d]пиримидина,
t) 4-(3-хлороанилино)-6-(3-метоксикарбонилметоксифенил)-7Н-пирроло [2,3-d]пиримидина,
u) 6-карбокси-4-(3-хлороанилино)-7Н-пирроло[2,3-d]пиримидина,
v) 4-(3-хлоранилино)-6-этоксикарбонил-7H-пирроло[2,3-d]пиримидина,
w) 6-(N-н-бутилкарбамоил)-4-(3-хлороанилино)-7Н-пирроло [2,3-d]пиримидина,
х) 4-(3-хлороанилино)-6-(4-этоксикарбонилфенил)-7Н-пирроло[2,3-d]пиримидина,
у) 6-(4-карбоксифенил)-4-(3-хлороанилино)-7Н-пирроло[2,3-d]пиримидина,
z) 6-(N-бензилкарбамоил)-4-(3-хлороанилино)-7Н-пирроло[2,3-d]пиримидина,
za) 4-(3-хлороанилино)-6-(N- [3-метил-бут-1-ил]-карбамоил)-7Н-пирроло[2,3-d]пиримидина
и их фармацевтически приемлемых солей.
13. Соединение формулы I по п.1 или его фармацевтически приемлемая соль, выбранная из
а) 4-(3-хлороанилино)-6-(4-пропиониламинофенил)-7Н-пирроло[2,3-d]пиримидина,
b) 4-(3-хлороанилино)-6-(3-пропиониламинофенил)-7Н-пирроло[2,3-d]пиримидина,
c) (R)-6-(4-ацетиламинофенил)-4-[(1-фенилэтил)-амино]-7Н-пирроло[2,3-d]пиримидина,
d) (R)-4-[(1-фенилэтил)-амино]-6-(4-пропиониламинофенил)-7Н-пирроло[2,3-d]пиримидина,
e) (R)-6-(3-ацетиламинофенил)-4-[(1-фенилэтил)-амино]-7Н-пирроло[2,3-d]пиримидина,
f) 4-(3-хлороанилино)-6-(4-изобутириламинофенил)-7Н-пирроло[2,3-d]пиримидина,
g) 4-(3-хлороанилино)-6-(4-пивалоиламинофенил)-7Н-пирроло[2,3-d]пиримидина,
h) 4-(3-хлороанилино)-6-[4-(DL-2-метилбутириламино)-фенил]-7Н-пирроло[2,3-d]пиримидина,
i) 4-(3-хлороанилино)-6-(4-изовалериламинофенил)-7Н-пирроло[2,3-d]пиримидина,
j) 4-(3-хлороанилино)-6-(3-изобутириламинофенил)-7Н-пирроло[2,3-d]пиримидина,
k) 4-(3-хлороанилино)-6-(4-этиламинофенил)-7Н-пирроло[2,3-d]пиримидина,
l) 6-(4-этиламинофенил)-4-[(1-фенилэтил)-амино]-7Н-пирроло[2,3-d]пиримидина,
m) 4-(3-хлороанилино)-6-(4-диметиламинофенил)-7Н-пирроло[2,3-d]пиримидина,
n) 4-(3-хлороанилино)-6-(3-этиламинофенил)-7Н-пирроло[2,3-d]пиримидина, и
о) 6-(4-диметиламинофенил)-4-[(1-фенилэтил)-амино]-7Н-пирроло[2,3-d]пиримидина и
их фармацевтически приемлемых солей.
14. Соединение формулы I по п.1 или его фармацевтически приемлемая соль, выбранные из
6-(4-аминофенил)-4-(3-метилбензиламино)-7Н-пирроло[2,3-d]пиримидина,
(R)-6-(3-аминофенил)-4-[(1-фенилэтил)-амино]-7Н-пирроло[2,3-d]пиримидина,
(R,S)-6-(4-аминофенил)-4-[(1-(3-хлорофенил)-этил)-амино]-7Н-пирроло[2,3-d]пиримидина,
(R)-4-[(1-фенилэтил)-амино]-6-(4-пропиониламинофенил)-7Н-пирроло[2,3-d]пиримидина,
(R)-4-[(1-фенилэтил)-амино]-6-(3-пропиониламинофенил)-7Н-пирроло[2,3-d]пиримидина,
(R)-6-(3-изобутириламинофенил)-4-[(1-фенилэтил)-амино]-7Н-пирролю[2,3-d]пиримидина,
(R)-6-(4-изобутириламинофенил)-4-[(1-фенилэтил)-амино]-7Н-пирроло[2,3-d]пиримидина,
(R)-6-(4-пивалоиламинофенил)-4-[(1-фенилэтил)-амино]-7Н-пирроло[2,3-d]пиримидина,
(R)-6-(3-пивалоиламинофенил)-4-[(1-фенилэтил)-амино]-7Н-пирроло[2,3-d]пиримидина,
4-(3-хлороанилино)-6-(3-этоксикарбонилфенил)-7Н-пирроло[2,3-d]пиримидина,
4-(3-хлороанилино)-6-(3-карбоксифенил)-7Н-пирроло[2,3-d]пиримидина,
4-(3-хлороанилино)-6-(4-метоксикарбонилфенил)-7Н-пирроло[2,3-d]пиримидина,
4-(3-хлороанилино)-6-(4-пропилоксикарбонилфенил)-7Н-пирроло[2,3-d]пиримидина,
4-(3-хлороанилино)-6-(4-изопропилоксикарбонилфенил)-7Н-пирроло[2,3-d]пиримидина,
4-(3-хлороанилино)-6-(4-изобутилоксикарбонилфенил)-7Н-пирроло[2,3-d]пиримидина,
4-(3-хлороанилино)-6-(4-диметиламинокарбонилфенил)-7Н-пирроло[2,3-d]пиримидина,
4-(3-хлороанилино)-6-(4-диэтиламинокарбонилфенил)-7Н-пирроло[2,3-d]пиримидина,
(R)-6-(4-диэтиламинофенил)-4-[(1-фенилэтил)-амино]-7Н-пирроло[2,3-d]пиримидина,
4-(3-хлороанилино)-6-(3-диметиламинофенил)-7Н-пирроло[2,3-d]пиримидина,
(R)-6-(4-гидроксифенил)-4-[(1-фенилэтил)-амино] -7Н-пирроло[2,3-d]пиримидина,
4-(3-хлороанилино)-5-диметиламинометил-6-(4-гидроксифенил)-7Н-пирроло[2,3-d]пиримидина,
4-(3-хлороанилино)-6-(N,N-диметилкарбамоил)-7Н-пирроло[2,3-d]пиримидина,
6-аминокарбонил-4-(3-хлороанилино)-7Н-пирроло[2,3-d]пиримидина,
4-(3-хлороанилино)-6-метиламинокарбонил-7Н-пирроло[2,3-d]пиримидина,
4-(3-хлороанилино)-6-гидроксиметил-7Н-пирроло[2,3-d]пиримидина,
4-(3-хлороанилино)-6-формил-7Н-пирроло[2,3-d]пиримидина,
(R)-6-этоксикарбонил-4-[1-фенилэтиламино]-7Н-пирроло[2,3-d]пиримидина,
(R)-6-метиламинокарбонил-4-[1-фенилэтиламино]-7Н-пирроло[2,3-d]пиримидина,
(R)-6-карбамоил-4-[1-фенилэтиламино]-7Н-пирроло[2,3-d]пиримидина,
(R)-6-циано-4-[1-фенилэтиламино]-7Н-пирроло[2,3-d]пиримидина,
4-(3-хлороанилино)-6-циано-7Н-пирроло[2,3-d]пиримидина,
d) (R)-6-формил-4-[1-фенилэтиламино]-7Н-пирроло[2,3-d]пиримидина,
(R)-6-аминометил-4-[1-фенилэтиламино]-7Н-пирроло[2,3-d]пиримидина,
6-аминометил-4-(3-хлороанилино)-7Н-пирроло[2,3-d]пиримидина,
4-(3-хлороанилино)-6-(диметиламинометил)-7Н-пирроло[2,3-d]пиримидина,
(R)-6-(диметиламинометил)-4-[1-фенилэтиламино]-7Н-пирроло[2,3-d]пиримидина,
(R)-6-(пиперазинометил)-4-[1-фенилэтиламино]-7Н-пирроло[2,3-d]пиримидина,
4-(3-хлороанилино)-6-(пиперазинометил)-7Н-пирроло[2,3-d]пиримидина,
4-(3-хлороанилино)-6-метоксиметил-7Н-пирроло[2,3-d]пиримидина,
6-(N-трет-бутилкарбамоил)-4-(3-хлороанилино)-7Н-пирроло[2,3-d]пиримидина,
4-(3-хлороанилино)-6-(N,N-диметиламинометил)-7Н-пирроло[2,3-d]пиримидина,
6-карбокси-4-(3-хлороанилино)-5-метил-7Н-пирроло[2,3-d]пиримидина,
4-(3-хлороанилино)-6-формил-5-метил-7Н-пирроло[2,3-d]пиримидина,
4-(3-хлороанилино)-6-гидроксиметил-5-метил-7Н-пирроло[2,3-d]пиримидина,
5-карбокси-4-(3-хлороанилино)-6-метил-7Н-пирроло[2,3-d]пиримидина,
4-(3-хлороанилино)-5-формил-6-метил-7Н-пирроло[2,3-d]пиримидина,
4-(3-хлороанилино)-5-гидроксиметил-6-метил-7Н-пирроло[2,3-d]пиримидина и
их фармацевтически приемлемых солей.
15. Фармацевтическая композиция, включающая соединение формулы I по любому из пп.1-14 или фармацевтически приемлемую соль такого соединения вместе с фармацевтическим носителем.
Текст
1 Изобретение относится к производным 7 Нпирроло[2,3-d]пиримидина, и к фармацевтическим композициям, включающим такие производные. Задачей настоящего изобретения является разработка новых производных 7 Н-пирроло[2,3-d]пиримидина, пригодных для химиотерапевтического лечения опухолей, и создание на их основе фармацевтических композиций. Поставленная задача достигается разработкой производного 7 Н-пирроло[2,3-d]пиримидина формулы IR - галоген, С 1-С 7 алкил, гидрокси, С 1 С 7 алканоилокси, С 1-С 7 алкокси, карбокси, С 1 С 7 алкоксикарбонил,карбамоил,N-С 1N,N-ди-С 1-С 7 алкилкарбаС 7 алкилкарбамоил,моил, циано, амино, С 1-С 7 алканоиламино, C1-C7 алкиламино,N,N-ди-С 1-С 7 алкиламино или трифторметил, причем, если в молекуле присутствуют несколько радикалов R, они могут быть одинаковыми или разными; а) R1 и R2 каждый независимо друг от друга означают ) фенил, замещенный карбамоилметокси-, карбоксиметокси-, бензилоксикарбонилметоксигруппой,C1-С 7 алкоксикарбонилметоксигруппой, фенилом, амино-, С 1-С 7 алканоиламино-, С 1-С 7 алкиламино-, N,N-ди-C1 С 7 алкиламино-, гидроксильной, С 1-С 7 алканоилокси-, карбоксигруппой, С 1-С 7-алкоксикарбонилом, карбамоилом, N-С 1-С 7 алкилкарбамоилом, N,N-ди-С 1-С 7-алкилкарбамоилом, циано или нитрогруппой; ) водород; при условии, чтоR1 и R2 не могут одновременно означать водород; ) незамещенный или гало- или С 1 С 7 алкилзамещенный пиридил;N-бензилкарбамоил; формил; С 1 С 7 алканоил; С 2-С 7 алкенил; С 2-С 7 алкенилокси; или ) С 1-С 7 алкил, замещенный ) галогеном,амино, С 1-C7 алкиламино, пиперазино, ди-С 1-С 7 алкиламино, ) фениламино, который незамещен или замещен в фенильном фрагменте галогидрокси-,С 1 геном,С 1-С 7 алкилом,С 7 алканоилокси-, С 1-С 7 алкокси-, карбоксигруппой, С 1-С 7 алкоксикарбонилом, карбамоилом, NС 1-С 7 алкилкарбамоилом,N,N-ди-С 1-С 7 алкилкарбамоилом,циано,амино,C1-C7 алканоиламино, С 1-С 7 алкиламино, N,N-ди-С 1 С 7 алкиламино или трифторметилом, ) гидроксилом, С 1-С 7 алкоксилом, циано, карбоксилом,С 1-С 7-алкоксикарбонилом, карбамоилом, N-С 1 001428b) если q=0, один из радикалов R1 и R2 обозначает незамещенный C1-C7-алкил или незамещенный фенил, а другой из радикалов R1 иR2 имеет одно из значений, указанных выше в пункте а), за исключением водорода, или с) если q=1, R1 и R2 - каждый независимо от другого незамещенный C1-С 7 алкил или незамещенный фенил, или имеют одно из значений,указанных выше в пункте а), и R6 - водород, С 1 С 7 алкил, С 1-С 7 алкоксикарбонил, карбамоил, NилиN,N-ди-С 1C1-C7-алкилкарбамоил С 7 алкилкарбамоил, или его соли, за исключением соединения формулы I, в которой n=0 или 2,q=1, R1 и R6 -каждый водород, R2 - метил, a R обозначает 3,4-метоксигруппу.C1-C7 в указанных радикалах означает радикал, обычно называемый "низшим", который имеет или включает максимально до 7, в частности, максимально 4, а конкретно 1 или 2 атома углерода. Предпочтительно n = 2, или лучше 1. Если имеется только один заместитель R,этот заместитель находится предпочтительно в 3 положении фенильного кольца. Если имеются 2 заместителя R, эти заместители находятся предпочтительно в 3 и 4 положениях. Галоген R представляет собой бром, йод или предпочтительно фтор или хлор. Если n=l,R предпочтительно хлор. Низший алкил представляет собой, например, метил. Низший алканоилокси представляет собой, например, ацетокси. Низший алкокси представляет собой,например, метокси. Низший алкоксикарбонил представляет собой, например, метоксикарбонил. N-низший алкилкарбамоил означает, например,N-метилкарбамоил,N-(н-бутил)карбамоил или N-(3-метилбут-1-ил)-карбамоил.N,N-ди-низший алкилкарбамоил представляет собой, например, N,N-диметилкарбамоил. Низший алканоиламино представляет собой, например, ацетиламино. Низший алкиламино представляет собой, например, метиламино.N,N-ди-низший алкиламино представляет собой, например, диметиламино. Низший алкоксикарбонилметокси представляет собой, например, метоксикарбонилметокси. Когда R1 или R2 представляют замещенный фенил, то фенил может нести один или больше, но предпочтительно не более 3 заместителей, которые могут быть одинаковыми или разными. R1 или R2, представляющий собой замещенный фенил, предпочтительно имеет только один заместитель, который может быть в орто-, мета- или лучше пара-положении. 3 Галоген в радикале R1 или R2 означает фтор,бром, йод или предпочтительно хлор. Нафтил представляет собой, например, 2 нафтил. Низший алкенил представляет собой,например, винил, проп-1-енил или проп-2-енил(аллил). Низший алкенилокси представляет собой, например, винилокси, проп-1-енилокси или проп-2-енилокси (аллилокси). Когда R1 или R2 означает замещенный низший алкил, то он может нести один или несколько, но предпочтительно не более трех заместителей, которые могут быть одинаковыми или разными, причем наиболее предпочтительно только один заместитель. Когда R1 или R2 означает низший алкил,замещенный фениламино, который не замещен или замещен в фенильном фрагменте галогеном,низшим алкилом, гидрокси, низшим алканоилокси, низшим алкокси, карбокси, низшим алкоксикарбонилом, карбамоилом, N-низшим алкилкарбамоилом, N,N-ди-низшим алкилкарбамоилом, циано, амино, низшим алканоиламино,низшим алкиламино, N,N-ди-низшим алкиламино или трифторметилом, то он представляет собой предпочтительно метил, который замещен указанными заместителями, например,анилинометил или 4-метоксианилинометил. Солями соединения формулы I являются кислотно-аддитивные соли органических или неорганических кислот, в частности, фармацевтически приемлемые нетоксичные соли. Подходящие неорганические кислоты представляют собой, например, угольную кислоту (лучше в виде карбонатов или кислых карбонатов); галоидоводородные кислоты, такие как хлористоводородная кислота; серную кислоту; или фосфорную кислоту. Приемлемыми органическими кислотами являются, например, карбоновая, фосфиновая,сульфаминовая кислоты или сульфокислота,например, уксусная, пропионовая, каприловая,декановая, додекановая, гликолевая, молочная кислоты, 2-оксимасляная кислота, глюконовая,глюкозомонокарбоновая, фумаровая, янтарная,адипиновая, пимелиновая, пробковая, азелаиновая, яблочная, винная, лимонная, глюкаровая,галактаровая кислоты; аминокислоты, такие как глутаминовая, аспарагиновая кислоты, Nметилглицин, ацетиламиноуксусная кислота, Nацетиласпарагин или N-ацетилцистин, пировиноградная, ацетоуксусная кислоты, фосфосерин,2- или 3-глицерофосфорная кислота, глюкозо-6 фосфорная кислота, глюкозо-1-фосфорная кислота, фруктозо-1,6-бисфосфорная кислота, малеиновая, оксималеиновая, метилмалеиновая кислоты, циклогексанкарбоновая кислота, адамантанкарбоновая кислота, бензойная, салициловая кислоты, 1- или 3-гидроксинафтил-2 карбоновые кислоты,3,4,5-триметоксибензойная кислота, 2-феноксибензойная кислота, 2-ацетоксибензойная кислота, 4-аминосалициловая кислота, фталевая, фенилуксусная, 001428 4 миндальная, коричная, никотиновая, изоникотиновая, глюкуроновая, галактуроновая кислоты, метан- или этансульфокислота, 2-гидроксиэтансульфокислота, этан-1,2-дисульфокислота,бензолсульфокислота, 2-нафталинсульфокислота, 1,5-нафталиндисульфокислота, 2-, 3- или 4 метилбензолсульфокислота, метилсульфокислота, этилсульфокислота, додецилсульфокислота,N-циклогексилсульфаминовая кислота,Nметил-, N-этил- или N-пропилсульфаминовая кислота, или другие органические протоновые кислоты, такие как аскорбиновая кислота. Соединения формулы I, имеющие, по меньшей мере, одну свободную карбоксигруппу, способны образовывать внутренние соли или соли металлов или аммониевые соли, такие как соли щелочных или щелочноземельных металлов, например, соли натрия, магния, калия или кальция, или аммониевые соли с аммиаком или подходящими оганическими аминами, такими как третичные моноамины, например, триэтиламин или три(2-гидроксиэтил)амин, или гетероциклические основания, например, Nэтилпиперидин или N,N'-диметилпиперазин. Для выделения или очистки целевых соединений можно применять фармацевтически неприемлемые соли, например, пикраты или перхлораты. Для терапевтического применения пригодны только соли, которые фармацевтически приемлемы и нетоксичны (в соответствующих дозировках) и поэтому эти соли предпочтительны. Ввиду тесной связи между новыми соединениями в свободной форме и в форме их солей,включая соли, которые применяют в качестве промежуточных соединений, например, при очистке или идентификации новых соединений,любую ссылку ранее и в последующем на свободные соединения следует понимать как относящуюся также и к нужным соответствующим солям. Соединения формулы I обладают ценными фармакологическими свойствами. В частности,они демонстрируют специфические подавляющие активности, представляющие интерес с точки зрения фармакологии. Они особенно эффективны в качестве ингибиторов тирозинпротеинкиназы и/или, кроме того, в качестве ингибиторов серин/треонинпротеинкиназ; например,они демонстрируют мощное подавление активности тирозинкиназы, ассоциируемой с рецептором эпидермального фактора роста (EGF) и сerbВ 2 киназы. Эти специфические ферментные активности рецептора играют ключевую роль в передаче сигнала в большом количестве клеток млекопитающих, включая человеческие клетки,особенно эпителиальные клетки, клетки иммунной системы и клетки центральной и периферической нервной системы. Например, в клетках различных типов индуцированная EGF активация тирозинпротеинкиназы соответствующего рецептора (EGF-R-TPK) является предпосылкой 5 клеточного деления и следовательно пролиферации популяции клеток. Таким образом, увеличение количества ингибиторов специфической тирозинкиназы рецептора EGF подавляет пролиферацию клеток. То же самое по аналогии можно отнести и к другим протеинкиназам,упомянутым ранее и в последующем. Кроме подавления тирозинпротеинкиназыEGF-рецептора, соединения формулы I подавляют также в различной степени другие тирозинпротеинкиназы, которые участвуют в передаче сигналов посредством трофических факторов, например, abl киназу, в частности, v-abl киназу, киназы из семейства src киназ, в частности, c-src киназу, lck, fyn; другие киназы из семейства EGF, например, c-erbB2 киназу (HER2), с-еrbВ 3 киназу, c-erbB4 киназу; члены семейства тирозинпротеинкиназ PDGF-рецептораKit-рецептора, киназу VEGF-рецептора (например, KDR и Fit-1) и киназу FGF-рецептора; киназу рецептора инсулиноподобного фактора роста (IGF-1 киназу), и серин/треонинкиназы,например, протеинкиназу С или cdc киназы, все из которых играют роль в регуляции роста и трансформации в клетках млекопитающих,включая человеческие клетки. Ингибирование специфической тирозинпротеинкиназы рецептора EGF (EGF-R-TPK) можно продемонстрировать с применением известных методов, используя, например, рекомбинантный внутриклеточный домен EGFрецептора [EGF-R ICD; см., например, Е.(1992)]. В сравнении с контрольным ферментом без ингибитора соединения формулы I подавляют активность фермента на 50% (IC50), например, в концентрации от 0,0005 до 1 M, в частности от 0,001 до 0,1 M. Действие соединений формулы I на клеточное фосфорилирование тирозина, стимулированное EGF в рецепторе EGF можно определить в человеческой клеточной линии эпителиальной карциномы А 431 посредством ELISA(ферментного иммуносорбентного теста), который описан Trinks et al., J. Med. Chem. 37: 7,1015-1027 (1994). В этом тесте (EGFR-ELISA) соединения формулы I демонстрируют IC50 приблизительно от 0,001 до 1 М. Стимуляция находящихся в состоянии покоя клеток BALB/сЗТЗ посредством EGF быстро индуцирует экспрессию c-fos мРНК. Предварительная обработка клеток соединением формулы I до стимуляции посредством EGF тормозит экспрессию c-fos с показателем IC50 приблизительно в концентрации от 0,001 до 0,1 М. Этот тест также описан U.Trinks et al., J. Med. 6 В микромолярной концентрации соединения формулы I также демонстрируют, например, ингибирование клеточного роста EGFзависимых клеточных линий, например, эпидермоидной клеточной линии кератиноцитовS.A., Cell 32, 599 (1983) или клеточной линии А 431, которые считаются подходящими стандартными источниками EGF-зависимых эпителиальных клеток [см., Carpenter и G.Zendegni, J.Anal. Biochem. 153, 279-282 (1985]. Согласно известному методу тестирования [см. Meyer etal., Int. J. Cancer 43, 851 (1989)] ингибирующую активность соединений формулы I определяют вкратце следующим образом: клетки BALB/MK(10000/лунку микротитровального планшета) переносят на 96-луночные титровальные планшеты. Тестуемые соединения, растворенные в ДМСО, добавляют в разных концентрациях (серийных разбавлениях) таким образом, что конечная концентрация ДМСО составляет не более 1% (об./об.). После добавления планшеты инкубируют 3 дня, в течение которых контрольные культуры без тестуемых соединений проходят, по меньшей мере, три цикла клеточного деления. Рост МК клеток определяют посредством окрашивания метиленовым голубым: после инкубации клетки фиксируют глутаральдегидом, промывают водой и окрашивают 0,05% метиленовым голубым. После стадии промывания пятно элюируют 3% НСl и оптическую плотность в лунке микротитровального планшета измеряют посредством Titertek Multiscan при 665 нм. Величины IC50 определяют компьютерной системой по формуле:IC50 = [(ODтестуемая - ODначальная)/(ODконтрольная ODначальная)]x 100. Величина IC50 в этих экспериментах представлена как концентрация конкретного тестуемого соединения, при которой количество клеток на 50% меньше количества, полученного в контрольных тестах без ингибитора. Например,соединения формулы I демонстрируют ингибирующую активность в микромолярном диапазоне значений IC50, приблизительно от 0,1 до 1 М. Соединения формулы I демонстрируют также ингибирование роста опухолевых клетокin vivo, как показано, например, экспериментом,описанным ниже: тест основан на ингибировании роста человеческой эпидермоидной карциномы линии А 431 [АТССCRL 1555; Коллекция культур американского типа, Rockville,Maryland, USA; см. Santon J.B. et al., Cancer Research 46, 4701-4705 (1986) и Ozawa S. et al, Int.J.Cancer 40, 706-710 (1987)], которую трансплантируют в BALB/c обезволошенным самкам мышей (Bomholtgard, Дания). Эта карцинома проявляет рост, который зависит от степени экспрессии EGF-рецептора. В эксперименте опухоли объемом около 1 см, культивированные in(0,2 мл/мышь в фосфатнобуферном растворе) в левый бок животных. Альтернативно, можно ввести 1 х 10 клеток из in vitro культуры в 0,2 мл фосфатнобуферного физраствора. Лечение тестуемыми соединениями формулы I начинают на 5 или 7 день после трансплантации, когда опухоли достигли диаметра 4-5 мм. Конкретное тестуемое соединение назначают (в разных дозах для разных групп животных) 1 раз в день в течение последующих 15 дней. Рост опухоли измеряют определением диаметра опухолей по трем взаимоперпендикулярным осям. Объем опухоли просчитывают по известной формуле р х L x D2/6 [см. Evans B.D. et al., Brit. J. Cancer 45,466-468 (1982)]. Результаты представлены в виде процентного выражения лечение/контроль(Т/С х 100 = Т/С %). При дозе от 3 до 50 мг/кг активного ингредиента явное подавление роста опухоли происходит при величинах Т/С% менее 10, что указывает на сильное подавление роста опухоли. Помимо или вместо ингибирования тирозинпротеинкиназы EGF-рецептора соединения формулы также ингибируют другие тирозинпротеинкиназы, которые участвуют в передаче сигналов посредством трофических факторов,например, abl киназу, в частности, v-abl киназу(IС 50, например, от 0,01 до 5 M), киназы из семейства src киназ, такие как c-src киназу (IC50,например, от 0,1 до 10 М) и с-еrbВ 2 киназу(HER-2), а также серин/треонинкиназы, например, протеинкиназу С, все из которых вовлечены в регуляцию и трансформацию роста в клетках млекопитающих, включая человеческие клетки. Вышеуказанное ингибирование v-alb тирозинкиназы определяют методами N.Lydon et al.,Oncogene Research 5, 161-173 (1990) и[см. C.House et al., Europ. J. Biochem. 140, 363367 (1984)] c-erbB2 киназу можно выделить и определить ее активность известными per se методами, например, по методу Akiyama et al.,Science 232, 1664 (1986). Соединения формулы I, которые ингибируют активность тирозинкиназы рецептора эпидермального фактора роста (EGF) или других тирозинпротеинкиназ, полезны, например, при лечении доброкачественных или злокачественных опухолей. Они способны регрессировать развитие опухолей и воспрепятствовать образованию метастазов и росту микрометастазов. В частности, их можно применять для лечения 8 эпидермальной гиперпролиферации (псориаза),лечения неоплазий эпителиального характера,например, карцином молочной железы и лейкоза. Кроме того, соединения формулы I можно применять для лечения тех нарушений иммунной системы, в которых участвуют несколько или особенно отдельные тирозинпротеинкиназы и/или, кроме того, серин/треонинпротеинкиназы. Соединения формулы I можно также применять для лечения тех расстройств центральной или периферической нервной системы, при которых передача сигналов осуществляется несколькими или, в частности, конкретной(ными) тирозинпротеинкиназой(зами) и/или,кроме того, серин/треонинпротеинкиназой (зами). Соединения по изобретению можно применять как в чистом виде, так и в сочетании с другими фармацевтически активными соединениями, например, вместе с ингибиторами ферментов синтеза полиамина, ингибиторами протеинкиназы С, ингибиторами других тирозинкиназ, цитокинами, отрицательными регуляторами роста, например, TGF- или IFN-, ингибиторами ароматазы, антиоэстрогенами и/или цитостатическими препаратами. В объектах изобретения, упомянутых выше, общие определения можно заменить там,где уместно, более конкретными, указанными вначале. Предпочтение отдается соединению формулы I, в которой q - 0 или 1, n - от 1 до 3, еслиq=0, или от 0 до 3, если q=1, R - галоген, С 1 С 7 алкил, гидрокси, С 1-С 7 алканоилокси, С 1 С 7 алкокси, карбокси, С 1-С 7 алкоксикарбонил,карбамоил, N-C1-С 7 алкилкарбамоил, N,N-ди-С 1 С 7 алкилкарбамоил,циано,амино,С 1 С 7 алканоиламино, С 1-С 7-алкиламино, N,N-диС 1-С 7 алкиламино или трифторметил, причем,если в молекуле присутствуют несколько радикалов R, они могут быть одинаковыми или разными;a) R1 - водород, a R2 - фенил, замещенный карбамоилметокси, карбоксиметокси, бензилоксикарбонилметокси,С 1-С 7 алкоксикарбонилметокси, фенилом, амино, С 1-С 7 алканоиламино,С 1-С 7 алкиламино,N,N-ди-C1-С 7 алкиламино,гидрокси, С 1-С 7 алканоилокси, карбокси, С 1 С 7 алкоксикарбонилом, карбамоилом, N-C1 С 7 алкилкарбамоилом, N,N-ди-С 1-С 7 алкилкарбамоилом, циано или нитро; незамещенный или гало- или С 1-С 7 алкилзамещенный пиридил; Nбензилпиридиний-2-ил; нафтил; циано; карбокси; С 1-С 7 алкоксикарбонил; карбамоил; N-С 1 С 7 алкилкарбамоил; N,N-ди-C1-C7 алкилкарбамоил; N-бензилкарбамоил; формил; С 1-С 7 алканоил; С 2-С 7 алкенил; С 2-С 7 алкенилокси; или С 1 С 7 алкил, замещенный галогеном; фениламино,который незамещен или замещен в фенильном фрагменте галогеном, C1-С 7 алкилом, С 1 С 7 алканоилокси, гидрокси, С 1-С 7 алкокси, карбокси, С 1-С 7 алкоксикарбонилом, карбамоилом, 9N-С 1-С 7 алкилкарбамоилом, N,N-ди-С 1-С 7 алкилкарбамоилом, циано, амино, С 1-С 7 алканоиламино, C1-С 7 алкиламино, N,N-ди-С 1-С 7 алкиламино или трифторметилом; С 1-С 7 алкокси, циано, карбокси, С 1-С 7 алкоксикарбонилом, карбамоилом, N-C1-С 7 алкилкарбамоилом, N,N-ди-С 1 С 7 алкилкарбамоилом, меркапто или радикалом формулы R3-S(О)m-, в которой R3 - С 1-С 7 алкил иb) если q=0, один из радикалов R1 и R2 незамещенный С 1-С 7 алкил или незамещенный фенил, а другой из радикалов R1 и R2 имеет одно из значений, указанных выше в пункте а), за исключением водорода, или с) если q=1, R1 - водород и R2 - незамещенный фенил, и R6 - водород, С 1-С 7 алкил, С 1 С 7 алкоксикарбонил,карбамоил,N-C1-C7 алкилкарбамоил или N,N-ди-С 1-С 7 алкилкарбамоил, или его солям. Предпочтение также отдается соединению формулы I, в которой q - 0 или 1, n - от 1 до 3,если q=0, или от 0 до 3, если q=1, R - галоген,С 1-С 7 алкил, гидрокси, С 1-С 3 алканоилокси, С 1 С 7 алкокси, карбокси, С 1-С 7 алкоксикарбонил,карбамоил, N-С 1-C7 алкилкарбамоил, N,N-ди-С 1 С 7 алкилкарбамоил,циано,амино,С 1 С 7 алканоиламино, С 1-С 7 алкиламино, N,N-ди-С 1 С 7 алкиламино или трифторметил, причем, если в молекуле присутствуют несколько радикаловR, они могут быть одинаковыми или разными,a) R1 и R2 - каждый независимо от другого фенил, замещенный карбамоилметокси, карбоксиметокси, бензилоксикарбонилметокси, С 1 С 7 алкоксикарбонилметокси, фенилом, амино,С 1-С 7 алканоиламино, C1-C7-алкиламино, N,Nди-С 1-С 7 алкиламино, гидрокси, С 1-С 7 алканоилокси, карбокси, С 1-С 7 алкоксикарбонилом, карбамоилом, N-С 1-С 7 алкилкарбамоилом, N,N-диC1-C7aлкилкapбaмoилoм, циано или нитро; водород при условии, что R1 и R2 не могут быть одновременно водородами; незамещенный или гало- или С 1-С 7 алкилзамещенный пиридил; Nбензилпиридиний-2-ил; нафтил; циано; карбокси; С 1-С 7 алкоксикарбонил; карбамоил; N-C1 С 7 алкилкарбамоил; N,N-ди-С 1-С 7 алкилкарбамоил;N-бензилкарбамоил; формил; С 1 С 7 алканоил; С 2-С 7 алкенил; С 2-С 7 алкенилокси; или С 1-С 7 алкил, замещенный галогеном, амино,С 1-С 7 алкиламино, пиперазино, ди-С 1-С 7 алкиламино, пиперазино, ди-С 1-С 7-алкиламино, гидрокси, С 1-С 7 алкокси, циано, карбокси, С 1 С 7 алкоксикарбонилом, карбамоилом, N-С 1 С 7 алкилкарбамоилом,N,N-ди-С 1-С 7 алкилкарбамоилом, меркапто или радикалом формулы R3-S(О)m-, в которой R3 -С 1-С 7 алкил и m = 0,1 или 2, илиb) если q=0, один из радикалов R1 и R2 незамещенный С 1-С 7 алкил или незамещенный фенил, а другой из радикалов R1 и R2 имеет одно из значений, указанных выше в пункте а), за исключением водорода, илиc) если q=1, R1 и R2 - каждый независимо от другого незамещенный C1-С 7 алкил или незамещенный фенил, или имеют одно из значений,указанных выше в пункте а), и R6 - водород, С 1 С 7 алкил, С 1-С 7 алкоксикарбонил, карбамоил, NC1-C7 алкилкарбамоил или N,N-ди-С 1-С 7 алкилкарбамоил, или его солям, за исключением соединения формулы I, в которой n=0 или 2, q=1,R1 и R6 -каждый водород, R2 - метил, a R - 3, 4 метоксигруппа. Предпочтительным является соединение формулы I, в котором q - 0 или 1, n - от 1 до 3,когда q=0, или n от 0 до 3, когда q=1; R обозначает галоген, С 1-С 7 алкил, гидрокси, С 1 С 7 алканоилокси, C1-С 7 алкокси, карбокси, С 1 С 7 алкоксикарбонил,карбамоил,N-C1 С 7 алкилкарбамоил, N,N-ди-С 1-С 7 алкилкарбамоил, циано, амино, С 1-С 7 алканоиламино, С 1 С 7 алкиламино, N,N-ди-С 1-С 7 алкиламино или трифторметил, причем в случае, если в молекуле присутствует несколько радикалов R, то они могут быть одинаковыми или различными; R1 обозначает водород или С 1-С 7 алкил, который незамещен или замещен ди-С 1-С 7 алкиламиногруппой, и R2 обозначает фенил, замещенный карбамоилметокси, карбоксиметокси, бензилоксокарбонилметокси, С 1-С 7 алкоксикарбонилметокси, С 1-С 7 алкоксикарбонил, карбокси, N,Nди-С 1-С 7 алкилкарбамоил, фенил, амино, С 1 С 7 алкиламино, ди-С 1-С 7 алкиламино, С 1-С 7 алканоиламино, гидрокси или нитрогруппой; R6 обозначает водород, С 1-С 7 алкил, С 1-С 7 алкоксикарбонил, карбамоил, N-С 1-С 7 алкилкарбамоил, N,N-ди-С 1-С 7 алкилкарбамоил, или его соли, за исключением случая, когда в соединении формулы I, n обозначает 0 или 2, q=1, R1 иR2 каждый обозначает водород, R2 - метил, a R 3,4-метокси. Предпочтение также отдается производным 7 Н-пирроло[2,3-d]пиримидина формулы Iа где R - галоген, С 1-С 7 алкил, гидрокси, С 1 С 7 алканоилокси, С 1-С 7 алкокси, карбокси, С 1 С 7 алкоксикарбонил,карбамоил,N-С 1 С 7 алкилкарбамоил, N,N-ди-С 1-С 7 алкилкарбамоил, циано, амино, C1-С 7 алканоиламино, C1-C7 алкиламино,N,N-ди-C1-C7aлкилaминo или трифторметил, при условии, что если в молекуле присутствуют несколько радикалов R, они могут быть одинаковыми или разными;a) R1 и R2 каждый независимо от другого обозначает фенил, замещенный фенилом, амино, С 1-С 7 алканоиламино, С 1-С 7 алкиламино, N,Nди-С 1-С 7 алкиламино, гидрокси, С 1-С 7 алканоилокси, карбокси, С 1-С 7 алкоксикарбонилом, карбамоилом, N-C1-С 7 алкилкарбамоилом, N,N-диС 1-С 7 алкилкарбамоилом, циано или нитрогруп 11 пой; водород при условии, что R1 и R2 одновременно не могут быть водородами; незамещенный или гало- или С 1-С 7 алкилзамещенный пиридил; N-бензилпиридиний-2-ил; нафтил; циано; карбокси; С 1-С 7 алкоксикарбонил; карбамоил;N,N-ди-С 1 С 7 алкилкарбамоил; формил; С 1-С 7 алканоил; С 2 С 7 алкенил; С 2-С 7 алкенилокси; или С 1-С 7 алкил,замещенный галогеном, амино, С 1-С 7 алкиламино, пиперазино, ди-С 1-С 7 алкиламино, гидрокси, С 1-С 7 алкокси, циано, карбокси, С 1 С 7 алкоксикарбонилом, карбамоилом, N-С 1 С 7 алкилкарбамоилом, N,N-ди-С 1-С 7 алкилкарбамоилом, меркапто или радикалом формулы R3S(O)m-, в которой R3 - С 1-С 3 алкил и m = 0, 1 или 2, илиb) один из радикалов R1 и R2 - незамещенный C1-С 7 алкил или незамещенный фенил, а другой из радикалов R1 и R2 имеет одно из значений, указанных выше в пункте а), за исключением водорода, или их солям. Особое предпочтение отдается соединениям формулы I, в которой n - от 1 до 3, и q - 0,R - галоген, С 1-С 7 алкил, гидрокси, С 1-С 7 алканоилокси, С 1-С 7 алкокси, карбокси, С 1-С 7 алкоксикарбонил, карбамоил, N-С 1-С 7 алкилкарбамоил, N,N-ди-С 1-С 7 алкилкарбамоил, циано,амино, С 1-С 7 алканоиламино, С 1-С 7 алкиламино,N,N-ди-С 1-С 7 алкиламино или трифторметил,при условии, что если в молекуле присутствуют несколько радикалов R, они могут быть одинаковыми или разными, иa) R1 и R2 - каждый независимо от другого фенил, замещенный фенилом, амино, C1 С 7 алканоиламино, С 1-С 7 алкиламино, N,N-ди-С 1 С 7 алкиламино, гидрокси, С 1-С 7 алканоилокси,карбокси, С 1-С 7 алкоксикарбонилом, карбамоилом, N-С 1-С 7 алкилкарбамоилом, N,N-ди-С 1 С 7 алкилкарбамоилом, циано или нитрогруппой; незамещенный или гало- или С 1-С 7 алкилзамещенный пиридил; N-бензилпиридиний-2-ил; нафтил; циано; карбокси; С 1-С 7 алкоксикарбонил; карбамоил; N-C1-С 7 алкилкарбамоил;N,N-ди-С 1-С 7 алкилкарбамоил; формил; С 1 С 7 алканоил; С 2-С 7 алкенил; С 2-С 7 алкенилокси; или С 1-С 7 алкил, замещенный галогеном, амино,С 1-С 7 алкиламино, пиперазино, ди-С 1-С 7 алкиламино, гидрокси, С 1-С 7 алкокси, циано, карбокси, С 1-С 7 алкоксикарбонилом, карбамоилом, NС 1-С 7 алкилкарбамоилом,N,N-ди-С 1-С 7 алкилкарбамоилом, меркапто или радикалом формулы R3-S(O)m-, в которой R3 - С 1-С 7 алкил и m = 0,1 или 2, илиb) один из радикалов R1 и R2 - водород, незамещенный С 1-С 7 алкил или незамещенный фенил, а другой из радикалов R1 и R2 имеет одно из значений, указанных выше в пункте а),или их солям. Кроме того, предпочтительны соединения формулы I, в которой q=0, n - 1 или 2, R - галоген, при условии, что, если в молекуле присут 001428 12 ствуют несколько радикалов R, они могут быть одинаковыми или разными, иa) R1 и R2 - каждый независимо от другого фенил, замещенный фенилом, амино, гидрокси или нитро; водород; пиридил;b) один из радикалов R1 и R2 - незамещенный C1-С 7 алкил или незамещенный фенил, и другой из радикалов R1 и R2 имеет одно из значений, указанных выше в пункте а), за исключением водорода, или их соли. Кроме того, особое предпочтение отдается соединениям формулы I, в которой q - 0, n - 1 или 2, R - галоген, при условии, что если в молекуле присутствуют несколько радикалов R,они могут быть одинаковыми или разными, иR1 - водород, или С 1-С 7 алкил, незамещенный или замещенный ди-С 1-С 7-алкиламино, и R2 фенил, замещенный фенилом, амино, гидрокси или нитро; пиридил; N-бензилпиридиний-2-ил; или нафтил; или их солям. Также предпочтительны соединения формулы I, в которой q - 1, n - от 0 до 3, R - галоген,С 1-С 7 алкил, гидрокси, С 1-С 7 алканоилокси, С 1 С 7 алкокси, карбокси, С 1-С 7 алкоксикарбонил,карбамоил, N-С 1-С 7 алкилкарбамоил, N,N-ди-С 1 С 7 алкилкарбамоил,циано,амино,С 1 С 7 алканоиламино, С 1-С 7 алкиламино, N,N-ди-С 1 С 7 алкиламино или трифторметил, при условии,что если в молекуле присутствуют несколько радикалов R, они могут быть одинаковыми или разными,a) R1 и R2 каждый независимо от другого означают фенил, замещенный карбамоилметокси, карбоксиметокси, бензилоксикарбонилметокси, C1-С 4 алкоксикарбонилметокси, фенилом,амино, С 1-С 4 алканоиламино, С 1-С 4 алкиламино,N,N-ди-С 1-С 4 алкиламино, гидрокси, С 1-С 4 алканоилокси, карбокси, С 1-С 4 алкоксикарбонилом,карбамоилом, N-С 1-С 4 алкилкарбамоилом, N,Nди-С 1-С 4 алкилкарбамоилом, циано или нитро; водород, при условии, что R1 и R2 не могут одновременно означать водород; незамещенный или гало- или С 1-С 7 алкилзамещенный пиридил;N-бензилкарбамоил; формил; С 1 С 7 алканоил; С 2-С 7 алкенил; С 2-С 7 алкенилокси; или С 1-С 7 алкил, замещенный галогеном, амино,C1-С 7 алкиламино, пиперазино, ди-С 1-С 7 алкиламино, гидрокси, С 1-С 7 алкокси, циано, карбокси, С 1-С 7 алкоксикарбонилом, карбамоилом, NC1-С 7 алкилкарбамоилом,N,N-ди-С 1-С 7 алкилкарбамоилом, меркапто или радикалом формулы R3-S(O)m-, в которой R3 - С 1-С 7 алкил и m = 0,1 или 2, илиb) R1 и R2 - каждый независимо от другого незамещенный С 1-С 7 алкил или незамещенный фенил, или имеют одно из значений, указанных выше в пункте а), и R6 - водород, С 1-С 7 алкил, 13 С 1-С 7 алкоксикарбонил,карбамоил,N-C1 С 7 алкилкарбамоил или N,N-ди-С 1-С 7 алкилкарбамоил, и их соли. Более предпочтительны соединения формулы I, в которой q - 0 или 1, n - 1 или 2, если q= 0, или n от 0 до 2, если q = 1, R - галоген или С 1-С 7 алкил, причем если в молекуле присутствуют несколько радикалов R, они могут быть одинаковыми или разными, иa) R1 - водород, или С 1-С 7 алкил, незамещенный или замещенный ди-С 1-С 7 алкиламино,и R2 - фенил, замещенный карбамоилметокси,карбоксиметокси, бензилоксикарбонилметокси,C1-С 7 алкоксикарбонилметокси, C1-С 7 алкоксикарбонилом, карбокси, N,N-ди-С 1-С 7 алкилкарбамоилом, фенилом, амино, C1-С 7 алкиламино, ди-С 1-С 7 алкиламино, С 1-С 7 алканоиламино, гидрокси, или нитрогруппой; гидрокси-С 1 С 7 алкил, амино-С 1-С 7 алкил, ди-С 1-С 7 алкилпиперазино-С 1-С 7 алкил,амино-С 1-С 7 алкил,формил, циано, карбокси; С 1-С 7 алкоксикарбонил; карбамоил; N-C1-С 7 алкилкарбамоил;b) если q - 1, R1 и R2 - каждый метил, и R6 водород, метил или С 1-С 7 алкоксикарбонил, или их фармацевтически приемлемые соли. Кроме того, особое предпочтение отдают соединениям формулы I, в которой q - 0 или 1,n - 1 или 2, если q - 0, или n от 0 до 2, если q - 1,R - галоген, причем, если в молекуле присутствуют несколько радикалов R, они могут быть одинаковыми или разными, иa) R1 - водород, или С 1-С 7 алкил, незамещенный или замещенный ди-С 1-С 7 алкиламино,и R2 - фенил, замещенный карбамоилметокси,карбоксиметокси, бензилоксикарбонилметокси,метоксикарбонилметокси, этоксикарбонилом,карбокси, фенилом, амино, ацетамино, гидрокси, или нитрогруппой; карбокси; этоксикарбонил; N-С 1-С 7 алкилкарбамоил; пиридил; Nбензилпиридиний-2-ил; или нафтил, илиb) если q - 1, R1 и R2 - каждый метил, а R6 водород, метил или метоксикарбонил, или их солям. Среди вышеперечисленных соединений особенно предпочтительны соединения формулы I, где q=1. Самыми предпочтительными являются соединения формулы I или их фармацевтически приемлемые соли, описанные в примерах. Изобретение относится также к соединению 4-(3-хлороанилино)-пиримидо[4,5-b] индолу, которое не входит в объем формулы I, и которое получают по примеру (ссылочному примеру) 15, и к его фармацевтически приемлемым солям. Соединения формулы I и их соли могут быть получены известными в данной области способами, которые включают: в которой Х - соответствующая уходящая группа, Z - водород или 1-арил (низший алкил) и остальные заместители те же, что указаны выше для соединений формулы I, при этом любые функциональные свободные группы, присутствующие в радикалах R1 и R2, при необходимости защищены легко удаляемыми защитными группами, с амином формулы III в которой R, R6, n и q имеют те же значения, что указаны выше для соединений формулы I, при этом любые функциональные свободные группы, присутствующие в радикале R, при необходимости защищены легко удаляемыми защитными группами, и удаление всех присутствующих защитных групп и присутствующего радикала Z 1-арил (низшего алкила), или б) взаимодействие указанного выше амина формулы III, в присутствии дегидратирующего агента и третичного амина с производным пирроло[2,3-d]пиримидин-4-она формулы IV в которой Z' - 1-арил (низший алкил) и R1 и R2 имеют те же значения, что указаны выше для соединений формулы I, при этом любые функциональные свободные группы, присутствующие в радикалах R1 и R2, при необходимости защищены легко удаляемыми защитными группами, и удаление всех присутствующих защитных групп, или в) для получения соединения формулы I, в которой R означает диметиламинометил и остальные заместители те же, что указаны выше для соединений формулы I, взаимодействие с йодидом N,N-диметилметилениммония соединения, соответствующего формуле I, в которойR1 - водород, а остальные заместители те же, что указаны выше для соединений формулы I, при этом любые функциональные свободные группы, присутствующие в радикалах R1 и R2, при необходимости защищены легко удаляемыми защитными группами, и удаление всех присутствующих защитных групп, или г) для получения соединения формулы I, в которой, по меньшей мере, один из радикалов R,R1 и R2 означает гидроксизамещенный фенил и остальные заместители те же, что указаны выше для соединений формулы I, взаимодействие с 15 трехбромистым бором соединения, соответствующего формуле I, в которой, по меньшей мере, один из радикалов R, R1 и R2 представляет собой метоксизамещенный фенил, а остальные заместители те же, что указаны выше для соединений формулы I, при этом любые функциональные свободные группы, присутствующие в радикалах R, R1 и R2, при необходимости защищены легко удаляемыми защитными группами,и удаление всех присутствующих защитных групп, или д) для получения соединения формулы I, в которой, по меньшей мере, один из радикалов R,R1 и R2 означает аминозамещенный фенил, а остальные заместители те же, что указаны выше для соединений формулы I, проведение каталитического гидрирования соединения, соответствующего формуле I, в которой, по меньшей мере, один из радикалов R, R1 и R2 - нитрозамещенный фенил, а остальные заместители те же,что указаны выше для соединений формулы I,при этом любые функциональные свободные группы, присутствующие в радикалах R, R1 иR2, при необходимости защищены легко удаляемыми защитными группами, и удаление всех присутствующих защитных групп, и после проведения одного из вариантов а)-д) способа, при необходимости получения соли, преобразование полученного свободного соединения формулы I в соль, или при необходимости получения свободного соединения преобразование полученной соли соединения формулы I в свободное основание. Указанные выше способы подробно описываются ниже (см. также DE3036390 А,опубликованный 13 мая 1982 г., и A.Jorgensen etal., J. Heterocycl. Chem. 22, 859 [1985]). В более точном последующем описании, если не указано иначе, радикалы R, R1 и R2 и n имеют те же значения, что указаны для соединений формулыI. Конечные соединения формулы I могут содержать заместители, которые также используются в качестве защитных групп в исходных материалах для получения других конечных соединений формулы I. Если в контексте не указано иначе, термин "защитная группа" применяют в этом тексте для обозначения только легко удаляемой группы, которая не входит в определенное нужное конечное соединение формулы I. Способ а). В соединении формулы II подходящая уходящая группа Х означает предпочтительно галоген, такой как бром, йод или, в частности,хлор. Z-1-Арил(низший алкил) означает предпочтительно 1-фенил (низший алкил), в частности, такой как 1-фенилэтил, или лучше бензил. Свободными функциональными группами,присутствующими в радикалах R1 и R2, которые при необходимости защищены легко удаляемы 001428 16 ми защитными группами, являются амино или низший алкиламино. Защитные группы и их введение и удаление описаны, например, в "Protective Groups inW.Greene в "Protective Groups in Organis Synthesis", John WileySons, New York 1981. Для защитных групп характерно то, что их можно легко удалить, то есть без нежелательных вторичных реакций, например, сольволизом, восстановлением, фотолизом или в физиологических условиях. Защищенная аминогруппа может быть представлена, например, в форме легко расщепляемых групп ациламино, арилметиламино, этерифицированного меркаптоамино- или 2-ацилнизшей алк-1-ениламиногруппы. В такой ациламиногруппе ацил представляет собой, например, ацильный радикал органической карбоновой кислоты, имеющей, например, до 18 атомов углерода, в частности,незамещенной или замещенной, например, галоили арилзамещенной алканкарбоновой кислоты или незамещенной или замещенной, например,гало-, низший алкокси- или нитрозамещенной бензойной кислоты или полуэфира карбоновой кислоты. Это такие ацильные группы, как, например, низший алканоил, такой как формил,ацетил или пропионил, галонизший алканоил,такой как 2-галоацетил, в частности, 2-хлор-, 2 бром-, 2-йод-, 2,2,2-трифтор- или 2,2,2 трихлорацетил, незамещенный или замещенный, например, гало-, низший алкокси- или нитрозамещенный бензоил, например, бензоил,4-хлорбензоил, 4-метоксибензоил или 4 нитробензоил, или низший алкоксикарбонил,который является разветвленным в 1 положении радикала низшего алкила или замещен соответствующим образом в 1 или 2 положении, в частности, трет.-низший алкоксикарбонил, например, трет.-бутоксикарбонил; арилметоксикарбонил, имеющий один или два арильных радикала,представляющих собой предпочтительно фенил,который является незамещенным или моно- или полизамещенным, например, низшим алкилом,в частности, трет.-низшим алкилом, таким как трет.-бутил, низшим алкокси, таким как метокси, гидрокси, галогеном, например, хлором,и/или нитро, таким как незамещенный или замещенный бензилоксикарбонил, например, 4 нитробензилоксикарбонил, незамещенный или замещенный дифенилметоксикарбонил, например, бензгидрилоксикарбонил или ди-(4 метоксифенил)метоксикарбонил, ароилметоксикарбонил, в котором ароильная группа предпочтительно представляет собой бензоил, который незамещен или замещен, например, галогеном, таким как бром, например, фенацилоксикарбонил, 2-галонизший алкоксикарбонил, на 17 пример,2,2,2-трихлорэтоксикарбонил,2 бромэтоксикарбонил или 2-йодоэтоксикарбонил, или 2-(три-замещенный силил)-этоксикарбонил, в которых заместители каждый независимо от других незамещенный или замещенный, например, низший алкил-, низший алкокси-, арил-, гало- или нитрозамещенный алифатический, аралифатический, циклоалифатический или ароматический углеводородный радикал, имеющий до 15 атомов углерода, такой как соответствующий незамещенный или замещенный низший алкил, фенилнизший алкил, циклоалкил или фенил, например, 2-3-низший алкилсилилэтоксикарбонил, такой как 2-триметилсилилэтоксикарбонил или 2-(ди-н-бутилметилсилил)этоксикарбонил или 2-триарилсилилэтоксикарбонил, такой как 2-трифенилсилилэтоксикарбонил. В арилметиламино группе, которая представляет собой моно-, ди- или особенно триарилметиламиногруппу, арильные радикалы являются незамещенными или замещенными фенильными радикалами. Это такие группы как,например, бензил-, дифенилметил- и особенно тритиламино. Этерифицированный меркаптогруппой в аминогруппе, защищенной таким радикалом,является, в частности, арилтио или арилнизший алкилтио, где арил означает, в частности, фенил,незамещенный или замещенный, например,низшим алкилом, таким как метил или трет.бутил, низшим алкокси, таким как метокси, галогеном, таким как хлор, и/или нитро. Соответствующая аминозащитная группа представляет собой, например, 4-нитрофенилтио. В 2-ацил-низшем алк-1-ен-1-ильном радикале, который используют как аминозащитную группу, ацил является, например, соответствующим радикалом низшей алканкарбоновой кислоты, бензойной кислоты, незамещенным или замещенным, например, низшим алкилом,таким как метил или трет.-бутил, низшим алкокси, таким как метокси, галогеном, таким как хлор, и/или нитро, или лучше полуэфира карбоновой кислоты, такого как низшего алкилового полуэфира карбоновой кислоты. Соответствующие защитные группы представляют собой,в частности, 1-низший алканоил-проп-1-ен-2-ил,такой как 1-ацетил-проп-1-ен-2-ил, или низший алкоксикарбонил-проп-1-ен-2-ил, например, 1 этоксикарбонил-проп-1-ен-2-ил. Предпочтительными аминозащитными группами являются ацильные радикалы полуэфиров карбоновой кислоты, в частности, трет.бутилоксикарбонил, бензилоксикарбонил, которые не замещены или замещены, например, как указано. Это 4-нитробензилоксикарбонил, или дифенилметоксикарбонил, или 2-галонизший алкоксикарбонил,такой как 2,2,2 трихлорэтоксикарбонил, кроме того, тритил или формил. 18 Реакция между производным формулы II и амином формулы III проходит в подходящих инертных полярных растворителях, в частности,спиртах, например, низших алканолах, таких как метанол, пропанол, изопропанол или особенно этанол или н-бутанол. В некоторых случаях хорошо добавлять вещество, способствующее растворимости, такое как 1,3-диметил 3,4,5,6-тетрагидро-2(1 Н)-пиримидинон (ДМП). Реакция проходит при повышенных температурах, например, в температурном диапазоне от 70 до 150 С, предпочтительно в условиях флегмации. Если Z в соединении формулы II означает 1-арил(низший алкил), этот радикал удаляют в полученном предшественнике соединения формулы I (Z вместо атома водорода на азоте). Удаление проводят обработкой протонными кислотами, такими как соляная кислота, фосфорные кислоты или полифосфорная кислота, лучше при температурах от 20 до 150 С и, где приемлемо, в присутствии воды (в частности, это желательный способ для Z = 1-фенилэтил); или обработкой кислотами Льюиса, особенно AlCl3,в ароматическом растворителе, в частности,бензоле и/или толуоле при повышенной температуре, в частности, при флегмации [это наиболее предпочтительный вариант для Z = бензил; см. также аналогичный способ в Chem. Pharm.Bull. 39(5), 1152 (1991)]. Удаление защитных групп, которые не входят в конечное целевое соединение формулыI, проводят известным способом, например, посредством сольволиза, в частности, гидролизом,алкоголизом или ацидолизом, либо восстановлением, например, гидрогенолизом или химическим восстановлением поэтапно или одновременно. Аминозащитную группу удаляют известным способом, и в зависимости от характера защитных групп различными способами, лучше сольволизом или восстановлением. 2-Галонизший алкоксикарбониламино (где следует после преобразования группы 2-бромонизшего алкоксикарбониламино в группу 2-йодонизший алкоксикарбониламино), ароилметоксикарбониламино или 4-нитробензилоксикарбониламино можно расщепить, например, обработкой подходящим агентом химического восстановления,таким как цинк, в присутствии приемлемой карбоновой кислоты, такой как водная уксусная кислота. Ароилметоксикарбониламино можно также расщепить обработкой нуклеофильным,предпочтительно солеобразующим реагентом,таким как тиофенолят натрия,и 4 нитробензилоксикарбониламино также обработкой дитионитом щелочного металла, например, дитионитом натрия. Незамещенный или замещенный дифенилметоксикарбониламино,трет.-низший алкоксикарбониламино или 2 тризамещенный силилэтоксикарбониламино можно расщепить обработкой подходящей ки 19 слотой, например, муравьиной кислотой или трифторуксусной кислотой; незамещенный или замещенный бензилоксикарбониламино можно расщепить, например, посредством гидрогенолиза, то есть обработкой водородом в присутствии подходящего гидрирующего катализатора,такого как палладиевый катализатор; незамещенный или замещенный триарилметиламино или формиламино можно расщепить, например,обработкой кислотой, такой как минеральная кислота, например соляной кислотой, или органической кислотой, например муравьиной, уксусной или трифторуксусной кислотой, там, где приемлемо, в присутствии воды; и аминогруппу, защищенную органической силильной группой, можно высвободить, например, посредством гидролиза или алкоголиза. Аминогруппу,защищенную 2-галоацетилом, например 2 хлорацетилом, можно высвободить обработкой тиомочевиной в присутствии основания, или солью тиолята, такой как тиолят щелочного металла тиомочевины и последующим сольволизом, таким как алкоголиз или гидролиз, полученного продукта конденсации. Аминогруппу,защищенную 2-замещенным силилэтоксикарбонилом, можно преобразовать в свободную аминогруппу также обработкой солью фтористоводородной кислоты, которая дает ионы фторида. Способ б).Z'-1-арил (низший алкил) в соединении формулы IV представляет собой, в частности, 1 фенилэтил, а также бензил. Соединение формулы IV находится в таутомерном равновесии (лактам/лактимная форма) с преобладанием формы лактама (формула IV). Для представления двух возможных равновесных форм используют формулу IV. Лактимная форма имеет формулу IVa в которой радикалы те же, что указаны для соединений формулы IV. В качестве дегидратирующего агента используют главным образом сильный химический дегидратирующий агент, в частности,фосфорный ангидрид (P4O10). В качестве третичного амина наиболее приемлем аммиак, замещенный тремя радикалами, выбранными независимо один от другого из алкила, лучше низшего алкила, такого как метил или этил, и циклоалкила с 3-7 атомами углерода, в частности циклогексила, напримерN,N-диметил-N-циклогексиламина, N-этил-N,Nдиизопропиламина или триэтиламина, или, кроме того, пиридина, N-метилморфолина или 4 диметиламинопиридина. Реакцию между пирролопиримидиноном формулы IV и амином формулы III проводят 20 при повышенной температуре, например, от 200 до 250 С. Способ в). Реакцию проводят в отсутствии влаги в подходящем инертном растворителе, например, подходящем эфире, таком как циклический эфир, в частности тетрагидрофуран, при повышенной температуре, лучше в условиях флегмации. Способ г). Реакцию проводят в отсутствии влаги в подходящем инертном растворителе, например,подходящем галогенированном углеводороде,таком как, в частности, метиленхлорид, при температурах от -20 до +50 С, лучше с ледяным охлаждением или при комнатной температуре. Способ д). Гидрирование проводят при повышенном давлении или лучше при нормальном давлении в присутствии подходящего гидрирующего катализатора, в частности, такого как скелетный никелевый катализатор гидрирования (никель Ренея), в инертном растворителе или смеси растворителей, такой как, в частности, смесь подходящего циклического эфира и низшего алканола, например, смесь тетрагидрофурана и метанола, при температурах около от 0 до +50 С,лучше при комнатной температуре. Исходные соединения Исходные соединения формулы II являются новыми. Их можно получить способами, аналогичными способам, описанным в DE2818676 А (опубликованном 8 ноября 1979 г.) иDE3036390 А (опубликованном 13 мая 1982 г.). Исходное соединение формулы II, в которой Х - хлор, получают, например, из соединения аналогичного формуле II, в которой Х гидрокси, реакцией с хлорокисью фосфора(хлористым фосфорилом, Р(=O)Сl3) в отсутствии влаги при температуре флегмации. При желании последующую реакцию исходного соединения формулы II, в которой Х - хлор, полученного таким образом, можно провести с амином формулы III в том же реакционном сосуде, то есть как непрерывную реакцию. Для этого, когда реакция с хлорокисью фосфора завершена,реакционную смесь, полученную этой реакцией концентрируют досуха выпариванием, остаток суспендируют в подходящем растворителе, таком как н-бутанол, и подвергают последующей реакции с амином формулы III. Соединение, аналогичное формуле II, в которой Х - гидрокси, получают, например, из соединения формулы V в которой обозначения те же, что указаны выше,реакцией с муравьиной кислотой, которую предпочтительно применяют в избытке по от 21 ношению к соединению формулы V, например,в молярном избытке 10-30, в присутствии, если необходимо, инертных растворителей, таких как диметилформамид, при повышенной температуре, например, при температурах от 80 С до температуры кипения. В другом варианте соединение, аналогичное формуле II, в которой Х - гидрокси, а остальные символы те же, что указаны выше, получают, например, из соединения формулы VI в которой R4 - низший алкил, такой как, в частности, этил, остальные символы те же, что указаны выше, реакцией с большим избытком формамида в смеси безводного диметилформамида и муравьиной кислоты. Реакцию проводят при повышенной температуре, например, от 100 до 150 С, и предпочтительно в защитном газе. 1-(Z')-2-амино-3-цианопирролы формулыV, применяемые в качестве промежуточных соединений, с хорошим выходом можно получить известными способами, которые были опубликованы [см., например, Roth H.J. и Eger К. Arch. Pharmaz. 308, 179 (1975)]. Для этой цели соединение формулы VII вначале подвергают реакции с амином формулыZ'-NH2 для получения соединения формулы VIII которое затем преобразуют динитрилом малоновой кислоты формулы CH2(CN)2 в нужное промежуточное соединение формулы V. Реакцию с амином Z'-NH2 проводят в обычных условиях конденсации, например, в присутствии каталитических количеств сильной кислоты,например,соляной кислоты или птолуолсульфокислоты при повышенной температуре (лучше температуре кипения) в подходящем растворителе, например бензоле или толуоле, с удалением воды для получения соответствующего -аминокетона формулы VIII. Последний не выделяют, а сразу же конденсируют с динитрилом малоновой кислоты при нагревании с дальнейшим удалением воды, при необходимости с добавлением небольшого количества основания, такого как пиперидин, и получают соединение формулы V. Соединения формулы VI, в которой R2 - Nбензилпиридиний-2-ил и остальные символы те же, что определены выше, и которые применяют в качестве промежуточных соединений,получают, например, реакцией соединения 22 формулы VI, в которой R2 - водород, а остальные символы известны, с бромидом N-бензил-2 бромопиридиния в подходящем растворителе,таком как галогенированный углеводород, например метиленхлорид. Реакцию лучше проводить в защитном газе, в темноте и безводных условиях при комнатной температуре или повышенной температуре, например, от 20 до 80 С, и в присутствии 2,6-диметилпиридинаVI получают, например, реакцией низшего алкилового эфира 2-амидиноуксусной кислоты формулы IX в которой R4 имеет те же значения, что указаны выше, с производным 2-Х-1-R2-этан-1-она формулы Х в которой обозначения определены выше. Уходящая группа Х - предпочтительно бром. Низший алкиловый эфир 2-амидиноуксусной кислоты формулы IX высвобождается из его соли кислотного присоединения, например, гидрохлорида до начала реакции с помощью эквинормальных количеств основания, такого как, в частности, этанолят натрия, в условиях с ледяным охлаждением. Реакцию проводят в подходящем растворителе, например низшем алканоле, предпочтительно этаноле при температурах от 0 до 50 С, лучше при комнатной температуре. Общие условия способа Свободные соединения формулы I, обладающие солеобразующими свойствами, полученные в соответствии со способом, можно преобразовать в их соли известными способами,например, обработкой кислотами или их производными путем добавления соответствующей кислоты к соединению формулы I, растворенному в нужном растворителе, например эфире,таком как циклический эфир, в частности, диоксане или лучше тетрагидрофуране. Смеси полученных по изобретению изомеров можно разделить известными способами на отдельные изомеры. Рацематы можно разделить, например,образованием солей с оптически чистыми солеобразующими реагентами, и отделением смеси полученных таким образом диастереоизомеров,например, фракционной кристаллизацией. Описанные выше реакции проводят в известных реакционных условиях в отсутствие или, как правило, в присутствии растворителей или разбавителей, лучше инертных по отношению к применяемым реагентам и растворителям для них, в отсутствие или присутствии катализаторов, агентов конденсации (например, фос 23 форного ангидрида) или нейтрализующих агентов, например оснований, в частности, азотистых оснований, таких как гидрохлорид триэтиламина, в зависимости от характера реакции и/или реагентов при пониженной, нормальной или повышенной температуре, например, в температурном диапазоне от около -80 до около 200 С, лучше от -20 до около 150 С, например,при температуре кипения применяемого растворителя, при атмосферном давлении или в закрытом реакторе, там, где необходимо, под давлением и/или в инертной атмосфере, например, в атмосфере азота. В каждом случае следует придерживаться условий каждой конкретной реакции. Растворителями и разбавителями являются, например, вода, спирты, например гидроксиды низших алкилов, такие как метанол, этанол,пропанол, или лучше бутанол, диолы, такие как этиленгликоль, триоды, такие как глицерин, или арильные спирты, такие как фенол, амиды кислот, например амиды карбоновых кислот, такие как диметилформамид, диметилацетамид или 1,3-диметил-3,4,5,6-тетрагидро-2(1 Н)-пиримидинон (ДМП), карбоновые кислоты, особенно муравьиная или уксусная кислоты, амиды неорганических кислот, такие как триамид гексаметилфосфорной кислоты, эфиры, например, циклические эфиры, такие как тетрагидрофуран или диоксан, или ациклические эфиры, такие как диэтиловый эфир или диметиловый эфир этиленгликоля, галогенированные углеводороды,такие как галонизшие алканы, например, метиленхлорид, или хлороформ, кетоны, такие как ацетон, нитрилы, такие как ацетонитрил, ангидриды кислот, такие как уксусный ангидрид,сложные эфиры, такие как этилацетат, бисалкансульфоксиды, такие как диметилсульфоксид,азотосодержащие гетероциклические соединения, такие как пиридин, углеводороды, например, низшие алканы, такие как гептан, или ароматические соединения, такие как бензол, толуол или ксилол(ы), или смеси этих растворителей, в каждом случае для вышеуказанных реакций выбирают соответствующие растворители. При получении соединений формулы I или их солей применяют традиционные способы обработки, например, сольволиз избыточных реагентов; перекристаллизацию; хроматографию, например, распределительную, ионную или гелевую хроматографию; распределенные между фазами неорганических и органических растворителей; однократную или многократную экстракцию, особенно после подкисления или повышения основности или содержания соли; высушивание над гигроскопичными солями; дигерирование; фильтрование; промывание,растворение; концентрирование выпариванием(при необходимости в вакууме или высоком вакууме); перегонку; кристаллизацию, например, соединений, полученных в виде масла или из маточной жидкости, возможна также затрав 001428 24 ка кристаллом конечного продукта; или комбинацию двух или нескольких из упомянутых методов обработки, которые можно применять повторно, и другие. Исходные материалы и промежуточные соединения можно применять в чистом виде,например, после указанной обработки, в частично очищенном виде или также непосредственно в виде сырого продукта. Учитывая тесную связь между соединениями формулы I в свободной форме и в виде солей, любую предшествующую и последующую ссылку на свободные основания и их соли следует понимать как включающую также соответствующие соли и свободные соединения,соответственно, где это уместно, при условии,что соединения содержат солеобразующие группы. Соединения, включая их соли, можно также получить в виде гидратов, или их кристаллы могут включать, например, растворители, применяемые для кристаллизации. В соответствии с изобретением применяемыми исходными соединениями предпочтительно являются те, из которых получают новые соединения формулы I, описанные ранее как наиболее ценные. Фармацевтические композиции, их приготовление и применение соединений формулы I и композиций, включающих эти соединения в качестве активных ингредиентов. Объектом настоящего изобретения является также фармацевтическая композиция, включающая одно из соединений формулы I в качестве активного ингредиента, которую применяют, в частности, в лечении заболеваний, упомянутых в начале описания. Наиболее предпочтительны формы композиции для назначения внутрь назально, буккально, ректально или орально, а также для парентерального введения,такого как внутривенное, внутримышечное или подкожное введение теплокровным животным,особенно людям. Композиция включают активный ингредиент в чистом виде или лучше вместе с фармацевтически приемлемым носителем. Дозировка активного ингредиента зависит от конкретного заболевания пациента, его возраста, веса и индивидуального состояния, индивидуальных фармакокинетических данных, и от способа назначения. Предпочтение отдается фармацевтической композиции, которая приемлема для назначения теплокровному животному, особенно человеку,страдающему заболеванием, восприимчивым к подавлению протеинкиназы, например, псориазом или опухолью, и которая содержит соединений формулы I или его соль, если присутствуют солеобразующие группы, в количестве,эффективном для подавления протеинкиназы,вместе, по меньшей мере, с одним фармацевтически приемлемым носителем. 25 Фармацевтические композиции включают приблизительно от 1 до 95% активного ингредиента, при этом дозированные формы однократной дозы содержат приблизительно от 20 до 90% активного инредиента, а дозированные формы многократного назначения предпочтительно включают активный ингредиент в количестве от 5 до 20%. Унифицированные дозированные формы представляют собой, например,драже, таблетки, ампулы, флаконы, суппозитории или капсулы. Другими формами назначения могут быть мази, кремы, пасты, пены, настойки,губные помады, капли, спреи, дисперсии и другие. Примерами являются капсулы, включающие примерно от 0,05 г до 1,0 г активного ингредиента. Фармацевтические композиции настоящего изобретения готовят известными способами,например, традиционным смешиванием, гранулированием, смешиванием в сиропе, растворением или лиофилизацией. Предпочтение отдается применению растворов активного ингредиента, а также суспензиям или дисперсиям, в частности, изотоническим водным растворам, дисперсиям или суспензиям, которые как в случае с лиофилизированными композициями, которые включают активный ингредиент в чистом виде или с носителем, например маннитом, можно приготовить непосредственно перед применением. Фармацевтические композиции можно стерилизовать и/или они могут включать наполнители, например, консерванты, стабилизаторы, смачивающие агенты и/или эмульгаторы, вещества, способствующие растворению, соли для регулирования осмотического давления и/или буферы, и их готовят известными в данной области техники способами, например, способами обычного растворения и лиофилизации. Упомянутые растворы или суспензии могут содержать вещества,повышающие вязкость, такие как натрий карбоксиметилцеллюлозу, карбоксиметилцеллюлозу, декстран, поливинилпирролидон или желатин. Суспензии в масле в качестве масляного компонента содержат растительные, синтетические или полусинтетические масла, которые обычно используют для инъекций. Здесь следует особенно упомянуть жидкие эфиры жирных кислот, которые в качестве кислотного компонента содержат жирную кислоту, имеющую 822, в частности 12-22 атомов углерода в цепи,такую как лауриновую кислоту, тридекановую,миристиновую, пентадекановую, пальмитиновую, маргариновую, стеариновую, арахиновую,бегеновую кислоты или другие ненасыщенные кислоты, например, олеиновую, элаидиновую,эруковую, брассидиновую или линолевую кислоты, при необходимости с добавлением антиокислителей, например, витамина Е, -каротина или 3,5-ди-трет.-бутил-4-гидрокситолуола. Спиртовой компонент этих эфиров жирных ки 001428 26 слот имеет максимально 6 атомов углерода и представляет собой одно- или многоатомный спирт, например, одно-, двух- или трехатомный спирт, такой как метанол, этанол, пропанол,бутанол или пентанол, или их изомеры, лучше гликоль и глицерин. Можно упомянуть в качестве примеров следующие эфиры жирных кислот: этилолеат, изопропилмиристат, изопропилпальмитат, "Labrafil M 2375" (полиоксиэтиленглицерина триолеат, Gattefosse, Paris),"Labrafil M 1944 CS" (ненасыщенные полигликозилированные глицериды, полученные алкоголизом масла абрикосовых косточек и состоящие из глицеридов и эфира полиэтиленгликоля; "Labrasol" (насыщенные полигликозилированные глицериды, полученные алкоголизом ТСМ и состоящие из глицеридов и эфира полиэтиленгликоля, Gattefosse, France) и/или"Miglyol 812" (триглицерид насыщенных жирных кислот с длиной цепи С 8-С 12, Huls AG,Germany), но особенно растительные масла,такие как хлопковое, миндальное, оливковое,касторовое, кунжутное, соевое масла, и особенно арахисовое масло. Композиции для инъекций готовят обычным способом и в стерильных условиях; то же самое относится и к введению композиций в ампулы или флаконы и герметичному их запаиванию. Фармацевтические композиции для орального введения могут быть получены смешением активного ингредиента с одним или несколькими твердыми носителями, если желательно гранулированием полученной смеси и обработкой смеси или гранул при необходимости с добавлением других наполнителей для получения таблеток или драже. Подходящими носителями являются такие наполнители, как сахара, например, лактоза,сахароза, маннит или сорбит, препараты целлюлозы и/или фосфаты кальция, например, трикальцийфосфат или вторичный кислый фосфат кальция, а также связующие вещества, такие как крахмалы, например, кукурузный, пшеничный,рисовый или картофельный крахмалы, метилцеллюлоза,гидроксипропилметилцеллюлоза,натрий карбоксиметилцеллюлоза и/или поливинилпирролидон, и/или при необходимости вещества, способствующие распаду, такие как вышеуказанные крахмалы, карбоксиметилированный крахмал, перекрестносшитый поливинилпирролидон, альгиновая кислота или ее соли, такие как альгинат натрия. Другие наполнители представляют собой вещества, влияющие на текучесть и смазывающие вещества, например, салициловая кислота, тальк, стеариновая кислота или ее соли, такие как стеарат кальция или магния, и/или полиэтиленгликоль или его производные. Сердцевину драже можно покрыть подходящими для желудочно-кишечного тракта веществами. Это могут быть концентрированные 27 сахарные растворы с аравийской камедью, тальком, поливинилпирролидоном, полиэтиленгликолем и/или двуокисью титана, либо покрывающие растворы в подходящих органических растворителях или смесях растворителей, либо растворы подходящих целлюлозных препаратов, таких как фталат ацетилцеллюлозы или гидроксипропилметилцеллюлозы. В покрытия для таблеток или драже можно добавить красители или пигменты, например, в целях идентификации или указания разных дозировок активного ингредиента. Кроме того, оральные фармацевтические композиции включают капсулы с сухим веществом, состоящие из желатина, и мягкие запаянные капсулы, состоящие из желатина и пластификатора, такого как глицерин или сорбит. Капсулы с сухим веществом могут содержать активный ингредиент в виде гранул, например, в смеси с наполнителем, таким как кукурузный крахмал, связующими веществами и/или веществами, способствующими скольжению, такими как тальк или стеарат магния, и могут включать стабилизаторы. В мягких капсулах активный ингредиент преимущественно растворен или суспендирован в подходящих жидких наполнителях, таких как жирные масла, парафиновое масло или жидкие полиэтиленгликоли, либо эфиры этилен- или пропиленгликоля и жирных кислот, к которым также можно добавить стабилизаторы или детергенты типа эфира жирной кислоты и полиоксиэтиленсорбитана. Другими дозированными формами орального назначения являются сиропы, приготовленные традиционным способом и включающие активный ингредиент в суспендированной форме в концентрации около 5-20%, лучше около 10% или в аналогичной концентрации, обеспечивающей приемлемую разовую дозу при назначении в количестве от 5 до 10 мл. Приемлемы также порошковые или жидкие концентраты для приготовления болтушек, например, в молоке. Такие концентраты можно упаковать в разовые дозированные формы. Для ректального назначения подходят суппозитории, состоящие из активного ингредиента и основы для суппозиториев. Таковыми являются, например, природные или синтетические триглицериды, углеводороды парафинового ряда, полиэтиленгликоли или высшие алканолы. Для парентерального назначения существуют специальные водные растворы активного ингредиента в водорастворимой форме, например, в виде водорастворимой соли или водных инъекционных суспензий, содержащих вещества, повышающие вязкость, например, натрий карбоксиметилцеллюлозу, сорбит и/или декстран и при необходимости стабилизаторы. Активный ингредиент предпочтительно вместе с наполнителями может быть также в форме лиофилизата, который путем добавления подходя 001428 28 щих растворителей превращают в раствор непосредственно перед парентеральным введением. Растворы, применяемые для парентерального введения, пригодны также как растворы для вливания. Предпочтительными консервантами являются антиокислители, такие как аскорбиновая кислота или бактерициды - сорбиновая или бензойная кислоты. Жидкие мази представляют собой эмульсии масло-в-воде, содержащие до 70%, лучше от 20 до 50% воды или водной фазы. В качестве жировой фазы лучше всего подходят углеводороды, например вазелин, парафиновое масло или твердые парафины, которые для повышения водосвязующей способности содержат подходящие гидроксисоединения, такие как спирты жирного ряда или их эфиры, например цетиловый спирт или ланолиновые спирты, такие как ланолин. В качестве эмульгаторов применяют липофильные вещества, такие как эфиры жирной кислоты и сорбитана (Spans), например,олеат сорбитана и/или изостеарат сорбитана. Как присадки к водной фазе применяют увлажнители. Это многоатомные спирты, например глицерин, пропиленгликоль, сорбит и/или полиэтиленгликоль, а также консерванты и отдушки. Жирные мази не содержат воды, и основой для них служат углеводороды, например парафин, вазелин или парафиновое масло, природные или частично полусинтетические жиры,например триглицерид жирной кислоты кокосового масла, или отвержденные масла, например гидрированные арахисовое или касторовое масла, кроме того, полуэфиры жирных кислот и глицерина, например моно- и/или дистеарат глицерина, и кроме того, спирты жирного ряда,повышающие абсорбцию воды, эмульгаторы и/или присадки, упомянутые в связи с жидкими мазями. Кремы представляют собой эмульсии масло-в-воде и содержат более 50% воды. В качестве масляной основы, в частности, используют спирты жирного ряда, например лауриловый,цетиловый или стеариловый спирт, жирные кислоты, например пальмитиновую или стеариновую кислоты, жидкие и твердые воски, например изопролилмиристат, ланолин или пчелиный воск, и/или углеводороды, например вазелин или парафиновое масло. Подходящие эмульгаторы представляют собой поверхностноактивные вещества, обладающие значительными гидрофильными свойствами. Это соответствующие неионные эмульгаторы, например, эфиры жирных кислот и многоатомных спиртов или их аддукты с этиленоксидом, такие как полиглицериновые эфиры жирных кислот или эфиры жирной кислоты и полиоксиэтиленсорбитана(Tweens), кроме того, эфиры полиоксиэтилена и спиртов жирного ряда или эфиры жирных кислот, или соответствующие ионные эмульгаторы, такие как соли щелочных металлов сульфа 29 тов спиртов жирного ряда, например лаурилсульфат натрия, цетилсульфат натрия или стеарилсульфат натрия, которые обычно применяют в присутствии спиртов жирного ряда, например цетилового или стеарилового спиртов. Присадками к водной фазе являются агенты, снижающие высыхание кремов, например, многоатомные спирты, такие как глицерин, сорбит, пропиленгликоль и/или полиэтиленгликоли, а также консерванты и отдушки. Пастами являются кремы и мази, в состав которых входят порошковые компоненты, поглощающие секреции, такие как окислы металлов, например окись титана или цинка, кроме того, силикаты талька или алюминия, цель которых связывать любую присутствующую влагу или секрецию. Пены применяют из баллончиков под давлением и они представляют собой жидкие эмульсии масло-в-воде в аэрозольной форме; в качестве реактивных газов применяют галогенированные углеводороды, такие как хлорфторнизшие алканы, например, дихлордифторметан и дихлортетрафторэтан, или лучше газообразные углеводороды, воздух, N2O или углекислый газ. В качестве масляной фазы применяют вещества, уже упоминаемые в связи с жидкими мазями и кремами; здесь же применяют и указанные присадки. Для настоек и растворов используют, в основном, водно-этанольную основу, к которой добавляют многоатомные спирты: глицерин,гликоли и/или полиэтиленгликоль в качестве увлажнителей для уменьшения испарения, и вещества, восстанавливающие жир, такие как эфиры жирных кислот с низкомолекулярными полиэтиленгликолями, то есть липофильные вещества, растворимые в водной смеси как восполняющие жировые вещества, удаляемые из кожи этанолом, и при необходимости другие вспомогательные вещества и присадки. Соединения формулы I можно назначать как таковые или в виде фармацевтических композиций профилактически или терапевтически,лучше в количестве, эффективном для лечения указанных заболеваний теплокровного животного, в частности человека, нуждающегося в таком лечении, при этом соединения применяют преимущественно в виде фармацевтических композиций. Для пациента с весом тела около 70 кг ежедневная доза составляет приблизительно от 0,1 до 5 г, лучше от 0,5 до 2 г соединения настоящего изобретения. Следующие примеры иллюстрируют изобретение, не ограничивая его объем. Используемые здесь сокращения и аббревиатура означают следующее: Элюанты (градиенты): Градиенты HPLC:HPLC - жидкостная хроматография высокого давления."Гексан" означает смесь изомеров гексана."Бутанол" означает "н-бутанол". Пример 1. 4-(3-Хлороанилино)-6-(пирид-2-ил)-7 Нпирроло[2,3-d]-пиримидин. В атмосфере аргона 40 мл DMPU добавляют к 6,53 г (28,3 мМ [ммоль]) 4-хлор-6(пирид-2-ил)-7 Н-пирроло[2,3-d]пиримидина и 4,46 мл (42,5 мМ) 3-хлор-анилина в 90 мл нбутанола и реакционную смесь перемешивают при 140 С 12 ч. Суспензию темно-коричневого цвета охлаждают и фильтруют. Остальной продукт можно получить из маточной жидкости осаждением 100 мл воды. Дигерирование этанолом/ТНР дает соединение; т.пл. 300 С. 1MS:(M)+ = 321. Исходное соединение получают следующим образом: Стадия 1.1: 2-(5-Амино-4-этоксикарбонил 1 Н-пиррол-2-ил)-N-бензилпиридиния бромид. В атмосфере аргона 658 мг (2,0 мМ) бромида N-бензил-2-бромопиридиния (получение 31 см: J. Heterocyclic Chem.28, 1083 (1991 вводят в 20 мл абсолютного метиленхлорида и туда добавляют 308 мг (2,0 мМ) этилового эфира 2 аминопиррол-3-карбоновой кислоты (получение см: J. Heterocyclic Chem., 1555 (1986. Реакционную смесь перемешивают 2 дня в темноте. Поскольку реакция не завершена, добавляют 232 /м (мкл) (2 мМ) 2,6-лутидина и еще 0,20 мМ этилового эфира 2-аминопиррол-3 карбоновой кислоты. После перемешивания еще в течение 12 ч реакционную смесь концентрируют выпариванием и остаток дигерируют в изопропаноле. Фильтрование, промывание гексаном и высушивание дает указанное соединение, которое в соответствии с 1H-ЯМР спектром все еще содержит приблизительно 10% бромида-N-бензил-2-бромопиридиния. 1[2,3-d]пиримидин-4-ол. В атмосфере защитного газа 27,07 г бромида 2-(5-амино-4-этоксикарбонил-1 Н-пиррол 2-ил)-N-бензилпиридиния в 195 мл формамида нагревают в течение 16 ч при 150 С с 97,6 млDMF (высушенного над молекулярным ситом 4 А) и 48,8 мл муравьиной кислоты. После охлаждения темно-коричневой реакционной смеси в ледяной бане названное соединение кристаллизуется и его можно отфильтровать и промыть изопропанолом и диэтиловым эфиром. 1 Н-ЯМР (300 МГц, DMSO-d6): 12,5 и 11,9=213. Стадия 1.3: 4-Хлоро-6-(пирид-2-ил)-7 Нпирроло-[2,3-d]пиримидин. В отсутствие влаги 7,05 г (33,2 мМ) 6(пирид-2-ил)-7 Н-пирроло-[2,3-d]пиримидин-4 ола и 70 мл хлорокиси фосфора нагревают при кипении в течение 2 ч. Темно-коричневую суспензию концентрируют выпариванием до остаточного объема в 20 мл. Остаток частями вводят в воду, нейтрализуют твердым NаНСО 3 и к смеси добавляют 0,2 л этилацетата. Фильтрование и промывание горячим THF дает названное соединение. 1 Н-ЯМР (300 МГц, DMSO-d6): 13,2 (шир.с,1H), 8,72 (д,1=7,1 Н), 8,63 (с, 1 Н), 8,23=7,J2=11,1H), 7,35 (с,1 Н). Остальной продукт можно выделить из фильтрата и промывочного раствора THF концентрированием выпариванием, разделением между этилацетатом/водой и дигерированием в этилацетате/диэтиловом эфире.(см. пример 1) суспендируют в 115 мл диоксана; при охлаждении добавляют 46 мл 0,1 н. раствора НСl (0,1 нормального раствора соляной кислоты) и реакционную суспензию перемешивают при комнатной температуре 2,5 ч. Суспензию концентрируют выпариванием и остаток перемешивают в 400 мл горячего метанола и фильтруют. Фильтрат фильтруют в горячем состоянии через активированный уголь, концентрируют выпариванием и дигерируют в холодном этаноле; т.пл. 276-278 С. 1 Н-ЯМР (200 МГц, DMSO-d6): 13,1 и 10,7Buchs/Switzerland) добавляют к 80,4 мг (0,25 мМ) 4-(3-хлороанилино)-6-(пирид-2-ил)-7 Нпирроло-[2,3-d]-пиримидина (см. пример 1) в 3 мл абсолютного THF и реакционную смесь кипятят с флегмацией 3 дня. Далее реакционную смесь разделяют между этилацетатом и насыщенным раствором Nа 2 СО 3, неорганическую фазу отделяют и экстрагируют 2 порциями этилацетата. Органические фазы промывают 3 раза водой и 1 раз насыщенным раствором хлорида натрия, высушивают с MaSO4 и концентрируют выпариванием. Дигерирование этилацетатом/диэтиловым эфиром дает названное соединение; т.пл. 247-251 С. 1(м, 2 Н), 7,03 (д, J=8,1H), 4,18 (с, 2 Н), 2,40 (с,6 Н); MS:(M)+=378. Пример 4. 4-(3-Хлоро-4-фтороанилино)-6-(пирид-2 ил)-7 Н-пирроло[2,3-d]пиримидин. В атмосфере защитного газа 20 мг (0,09 мМ) 6-(пирид-2-ил)-7 Н-пирроло[2,3-d]-пиримидин-4-ола (см. стадию 1.2) нагревают при кипении с 1 мл хлорокиси фосфора в течение 30 мин. Реакционную смесь концентрируют до сухости выпариванием и суспендируют в 1 мл нбутанола. Добавляют 16,4 мг (0,108 мМ) 3 хлоро-4-фтороанилина и суспензию кипятят с флегмацией 2 ч. Затем темно-коричневую суспензию концентрируют выпариванием и остаток растворяют в метаноле. Добавляют силикагель и проводят высушивание. Порошок подают на колонну с силикагелем и элюирование проводят этилацетатом. Получают названное соединение.HPLC: tRet(Grad20) = 10,4 мин; MS:(M)+ = 339. Пример 5. 4-(3-Хлороанилино)-5-метил-6-(пирид-2 ил)-7 Н-пирроло[2,3-d]пиримидин и бромид 4-(3 хлороанилино)-5-метил-6-(N-бензилпиридиний 2-ил)-7 Н-пирроло[2,3-d]пиримидина. В отсутствие воздуха 529 л (5,0 мМ) 3 хлороанилина добавляют приблизительно к 1,2 мМ 4-хлоро-5-метил-6-(N-бензилпиридиний-2 ил)-7 Н-пирроло[2,3-d]пиримидина в 10 мл изопропанола и реакционную смесь кипятят с флегмацией. Реакционную смесь концентрируют выпариванием и остаток хроматографируют на силикагеле. Элюирование метиленхлоридом/ этанолом (7:3) и метиленхлоридом/метанолом(А), а затем бромид 4-(3-хлороанилино)-5 метил-6-(N-бензилпиридиний-2-ил)-7 Н-пирроло-[2,3-d]пиримидина (В). А получают также нагреванием соединения В. Соединение А: т.пл. 251-252 С. 1= 426. Исходное соединение получают следующим образом: Стадия 5.1: 2-(5-Амино-4-циано-3-метил 1 Н-пиррол-2-ил)-N-бензилпиридиния бромид. В атмосфере аргона 1,81 г (5,5 мМ) бромида N-бензил-2-бромопиридиния [получение см.J. Heterocyclic Chem. 28, 1083 (1991)] добавляют к 605,5 мг (5,0 мМ) 2-амино-3-циано-4 метилпиррола [получение см. Synthesis (1976),51] в 40 мл метиленхлорида и 639 м (5,5 мМ) лутидина. После перемешивания в течение 5,5 ч при комнатной температуре реакционную смесь концентрируют выпариванием приблизительно до половины ее первоначального объема. Фильтрование суспензии и промывание метиленхлоридом/этилацетатом (1:1) и этилацетатом/гексаном (1:1) дает названное соединение. 1 Н-ЯМР (300 МГц, DMSO-d6): 10,83 (с,1 Н), 9,10 (д, J=7,1 Н), 8,49 (т, J=7,1H), 7,96 (м,2 Н), 7,30 (м, 3 Н), 6,95 (м, 2 Н), 6,57 и 5,80 (2 с,каждый 2 Н), 1,76 (с,3 Н); FAB-MS:(M+H)+ = 289. Стадия 5.2: 5-Метил-6-(N-бензилпиридиний-2-ил)-7 Н-пирроло [2,3-d]пиримидин-4-ол. 34 В атмосфере защитного газа 1,182 г (3,2 мМ) бромида 2-(5-амино-4-циано-3-метил-1 Нпиррол-2-ил)-N-бензилпиридиния в 12 мл муравьиной кислоты нагревают при 110 С 90 мин. Реакционную смесь концентрируют выпариванием, остаток лиофилизируют из воды и дважды из диоксана, содержащего небольшое количество воды, с получением названного соединения. 1(м, 2 Н), 7,98 (с, 1 Н), 7,27 (м, 3 Н), 6,90 (м, 2 Н),5,92 (с, 2 Н), 2,04 (c, 3H); HPLC tRet(Grad20) = 5,8 мин; FAB-MS:(M+H)+ = 317. Стадия 5.3: 4-Хлоро-5-метил-6-(N-бензилпиридиний-2-ил)-7 Н-пирроло[2,3-d]пиримидин. В отсутствие влаги 500 мг (1,2 мМ) 5 метил-6-(N-бензилпиридиний-2-ил)-7 Н-пирроло-[2,3-d]-пиримидин-4-ола и 15 мл хлорокиси фосфора нагревают при кипении 2 ч. Концентрирование реакционной смеси выпариванием дает названное соединение;tRet(Grad20)=8,8 мин; FAB-MS:(M+H)+ = 335. Пример 6. 4-(3-Хлоро-4-фтороанилино)-5-метил-6(пирид-2-ил)-7 Н-пирроло [2,3-d]пиримидин. Названное соединение получают аналогично примеру 5 из 3-хлоро-4-фтороанилина; т.пл. 277-278 С. 1(м,1 Н), 2,83 (с, 3 Н); MS:(M)+ = 353. Пример 7 (ссылочный). 4-(3-Хлороанилино)-7 Н-пирроло[2,3-d] пиримидин. 133 мг (0,866 мМ) 4-Хлоро-7 Н-пирроло[2,3-d]-пиримидина [получение см: Chem. Ber. 112, 3526 (1979)] и 136 л (1,3 мМ) 3 хлороанилина нагревают при кипении в 4 мл нбутанола 90 мин. Темно-зеленый реакционный раствор разбавляют этанолом и фильтруют в горячем состоянии через активированный уголь. Концентрирование выпариванием, перемешивание в изопропаноле, фильтрование и рекристаллизация из горячего изопропанола, содержащего небольшое количество этанола, дают названное соединение; т.пл. 230-233 С; 12,5 и 10,7 (2 шир.с., 2 Н), 8,42 и 7,97 (2 с, 2 Н), 7,67 (д, J=8,1 Н),7,48 (т, J=8,1H), 7,43 (м, 1 Н), 7,29 (д, J=8,1 Н),6,93 (шир.с.,1 Н); FAB-MS:(M+H)+ = 245. Пример 8. 4-(3-Хлороанилино)-6-(бифен-4-ил)-7 Нпирроло[2,3-d]-пиримидин. Суспензию 220 мг (0,72 мМ) 4-хлоро-6(бифен-4-ил)-7 Н-пирроло-[2,3-d] -пиримидина и 151 л (1,44 мМ) 3-хлороанилина в 5 мл бутанола нагревают при кипении всю ночь. Охлаждение, фильтрование и промывание большим количеством этанола и, наконец, гексана дают названное соединение.MS:(M)+ = 397. Исходное соединение получают следующим образом: Стадия 8.1: 2-Амино-3-этоксикарбонил-5(бифен-4-ил)-1 Н-пиррол. В атмосфере аргона 1,65 г (10 мМ) гидрохлорида этилового эфира 2-амидиноуксусной кислоты [получение см: Liebigs Ann. Chem.,1895 (1977)] вводят в 10 мл этанола и при 0-5 С туда добавляют 0,73 г (10 мМ) этанолята натрия. Ярко-желтую суспензию перемешивают 20 мин, а затем к ней добавляют 1,4 г (5 мМ) 2 бромо-1-(бифен-4-ил)-этан-1-она(2-бромо-4'фенилацетофенон; Aldrich; Milwaukee/USA). После перемешивания при комнатной температуре в течение 48 ч реакционную смесь концентрируют выпариванием и остаток растворяют в этилацетате и промывают 3 порциями воды и насыщенным раствором хлорида натрия. Водные фазы экстрагируют дважды этилацетатом и органические фазы высушивают над сульфатом магния и концентрируют выпариванием. Колоночная хроматография (SiO2;-этилацетат/гексан[2,3-d]пиримидин-4-ол. 766 мг (2,5 мМ) 2-амино-3-этоксикарбонил-5-(бифен-4-ил)-1 Н-пиррола перемешивают в 5 мл формамида, 2,5 мл DMF и 1,25 мл муравьиной кислоты при 150 С в течение 20 ч. Реакционную смесь разбавляют изопропанолом и фильтруют. Промывание изопропанолом и гексаном дают названное соединение; т.пл. 300 С; FAB-MS:(M+H)+ = 288. Стадия 8.3: 4-Хлоро-6-(бифен-4-ил)-7 Нпирроло [2,3-d] пиримидин. В атмосфере защитного газа 430,5 мг (1,5 мМ) 6-(бифен-4-ил)-7 Н-пирроло-[2,3-d]-пиримидин-4-ола в 6 мл хлорокиси фосфора кипятят 4 ч. Реакционную смесь выливают в воду и этилацетат. Водную фазу отделяют и экстрагируют этилацетатом. Концентрирование органических фаз выпариванием и перемешивание остатка в горячем THF/изопропаноле дают названное соединение; т.пл. 295-300 С (разложение); FAB-MS:(M+H)+ = 306. Пример 9. 4-(3-Хлороанилино)-6-(нафт-2-ил)-7 Нпирроло[2,3-d]-пиримидин. 98 мг (0,35 мМ) 4-Хлоро-6-(нафт-2-ил)-7 Нпирроло[2,3-d]-пиримидина и 73 л (0,7 мМ) 3 хлороанилина в 8 мл бутанола нагревают при кипении 5 ч. Охлаждение, фильтрование и промывание изопропанолом и гексаном дают названное соединение; т.пл. 278-284 С; TLC-Rf = 36 0,5 (этилацетат/гексан [1:1]; FAB-MS:(M+H)+ = 371. Исходное соединение получают следующим образом: Стадия 9.1: 2-Амино-3-этоксикарбонил-5(нафт-2-ил)1 Н-пиррол. В атмосфере аргона 834 мг (5 мМ) гидрохлорида этилового эфира 2-амидиноуксусной кислоты [получение см: Liebigs Ann.Chem.,1895(1977)] вводят в 10 мл этанола и при 0-5 С туда добавляют 358 мг (5 мМ) этанолята натрия. Ярко-желтую суспензию перемешивают 15 мин,а затем к ней добавляют 623 мг (2,5 мМ) 2 бромо-1-(нафт-2-ил)-этан-1-она(2-бромо-2'ацетонафтон; Aldrich; Milwaukee/USA). После перемешивания при комнатной температуре в течение 3 дней реакционную смесь концентрируют выпариванием. Остаток обрабатывают этилацетатом/водой, фильтруют и органическую фазу отделяют и промывают 3 порциями воды и насыщенным раствором хлорида натрия. Водные фазы экстрагируют этилацетатом и органические фазы высушивают над сульфатом магния и концентрируют выпариванием. Колоночная хроматография (SiO2; этилацетат/гексан[1:1]; FAB-MS:(M+H)+ = 281. Стадия 9.2: 6-(Нафт-2-ил)-7 Н-пирроло[2,3d]пиримидин-4-ол. 420 мг (1,5 мМ) 2-Амино-3-этоксикарбонил-5-(нафт-2-ил)-1 Н-пиррола перемешивают в 3 мл формамида, 1,5 мл DMF и 0,75 мл муравьиной кислоты при 150 С в течение 22 ч. Реакционную смесь разбавляют приблизительно 1 мл изопропанола и фильтруют. Промывание этанолом, изопропанолом и гексаном дает названное соединение; т.пл. 300 С. 1 Н-ЯМР (200 МГц, DMSO-d6): 12,2(м, 2 Н), 7,11 (с, 1 Н). Стадия 9.3: 4-Хлоро-6-(нафт-2-ил)-7 Нпирроло [2,3-d] пиримидин. В атмосфере защитного газа 198,5 мг (0,76 мМ) 6-(нафт-2-ил)-7 Н-пирроло-[2,3-d]-пиримидин-4-ола в 3 мл хлорокиси фосфора нагревают при кипении 5 ч. Реакционную смесь выливают в ледяную воду и перемешивают 1 ч, чтобы завершить реакцию. Кристаллы отфильтровывают и промывают водой. Растворение сырого продукта в THF/метаноле, фильтрование через активированный уголь, концентрирование фильтрата выпариванием, перемешивание остатка в изопропаноле и промывание гексаном дают названное соединение; т.пл. 268-2 б 9 С (разложение); FAB-MS:(M+H)+ = 280. Пример 10. 4-(3-Хлороанилино)-6-(2-гидроксифенил)7 Н-пирроло [2,3-d] пиримидина гидробромид. В сухом аппарате в атмосфере аргона 6,72 г (19,16 мМ) 4-(3-хлороанилино)-6-(2-метокси 37 фенил)-7 Н-пирроло-[2,3-d]-пиримидина вводят в 150 мл метиленхлорида. Туда в течение 1 ч с ледяным охлаждением по каплям добавляют раствор 18,4 мл (191,6 мМ) трехбромистого бора в 100 мл метиленхлорида. После трехчасового перемешивания на ледяной бане суспензию выливают в 0,5 л ледяной воды и фильтруют. Остаток обрабатывают этилацетатом и промывают насыщенным раствором NаНСО 3, водой и насыщенным раствором хлорида натрия. Водные фазы экстрагируют дважды этилацетатом и органические фазы высушивают над MgSO4,концентрируют выпариванием и кристаллизуют из этанола/гексана, получая названное соединение. 1= 337. Исходное соединение получают следующим образом: Стадия 10.1: 2-Амино-3-этоксикарбонил-5(2-метоксифенил)-1H-пиррол. Аналогично стадии 8.1, 14,5 г (87 мМ) гидрохлорида этилового эфира 2 амидиноуксусной кислоты в 150 мл абсолютного этанола реагирует с 5,9 г (87 мМ) этанолята натрия и 10,3 г (44 мМ) 2-бромо-1(метоксифенил)-этан-1-он(2-бромо-2'-метоксиацетофенон; Aldrich; Milwaukee/USA) с получением названного соединения; т.пл. 128 С; TLCRf = 0,25 (гексан/этилацетат [2:1]. Стадия 10.2: 6-(2-Метоксифенил)-7 Нпирроло[2,3-d]-пиримидин-4-ол. В атмосфере защитного газа 7,66 г (31 мМ) 2-амино-3-этоксикарбонил-5-(2-метоксифенил)1 Н-пиррола в 63 мл формамида, 31,5 мл DMF и 17,7 мл муравьиной кислоты нагревают при 150 С всю ночь. Последовательность, аналогичная стадии 8.2, дает названное соединение;TLC-Rf = 0,33 (гексан/этилацетат [1:1]. Стадия 10.3: 4-Хлоро-6-(2-метоксифенил)7 Н-пирроло[2,3-d]-пиримидин. В атмосфере аргона 6,2 г (25,7 мМ) 6-(2 метоксифенил)-7 Н-пирроло[2,3-d]-пиримидин 4-ола в 62 мл хлорокиси фосфора нагревают при 125 С 1,5 ч. Реакционную смесь выливают в ледяную воду и три раза экстрагируют этилацетатом. Органические фазы промывают водой,раствором NaHCO3 и насыщенным раствором хлорида натрия, высушивают над MgSО 4 и концентрируют выпариванием. Фильтрование через колонну с силикагелем с этилацетатом дает названное соединение; TLC-Rf=0,8 (гексан/этилацетат [1:1]. Стадия 10.4: 4-(3-Хлороанилино)-6-(2-метоксифенил)-7 Н-пирроло-[2,3-d] пиримидин. 6,6 г(25,4 мМ) 4-Хлоро-6-(2 метоксифенил)-7 Н-пирроло-[2,3-d]-пиримидина и 5,34 мл (50,8 мМ) 3-хлороанилина в 100 мл бутанола нагревают при кипении 1,5 ч. Реакци 001428 38 онную смесь охлаждают, фильтруют и промывают диэтиловым эфиром и гексаном. Флеш хроматография (SiO2, в сухом виде; гексан/этилацетат [2:1] - этанол/ацетон [1:1]) дает названное соединение; т.пл. 221-222 С; TLC-Rf= 351. Пример 11. 4-(3-Хлороанилино)-6-(3-гидроксифенил)7 Н-пирроло[2,3-d]пиримидина гидробромид. Аналогично примеру 10, 4,53 г (12,91 мМ) 4-(3-хлороанилино)-6-(3-метоксифенил)-7 Нпирроло[2,3-d]пиримидина в 150 мл метиленхлорида подвергают реакции с 12,4 мл (129 мМ) трехбромистого бора в 150 мл метиленхлорида для получения названного соединения; HPLC:H-ЯМР (500 МГц, DMSO-d6): 12,61, 10,07 и 9,68 (3 шир.с., 3 Н), 8,35 (с, 1 Н), 8,09 (с, 1 Н),7,76 (д, J=8,1 Н), 7,39 (дд, J=8,1H), 7,27 (м, 2 Н),7,23 (с, 1 Н), 7,12 (1 Н), 7,11 (с, 1H), 6,77 (м, 1 Н). Исходное соединение получают следующим образом: Стадия 11.1: 2-Амино-3-этоксикарбонил-5(3-метоксифенил)1 Н-пиррол. Аналогично стадии 8.1, 14,5 г (87 мМ) гидрохлорида этилового эфира 2-амидиноуксусной кислоты в 150 мл абсолютного этанола реагируют с 5,9 г (87 мМ) этанолята натрия и 10,3 г (44 мМ) 2-бромо-1-(3-метоксифенил)этан-1-онаJanssen) для получения названного соединения; т.пл. 96-97 С; TLC-Rf = 0,2 (гексан/этилацетат[2:1]). Стадия 11.2: 6-(3-Метоксифенил)-7 Н-пирроло[2,3-d]пиримидин-4-ол. В атмосфере защитного газа 7,19 г (29 мМ) 2-амино-3-этоксикарбонил-5-(3-метоксифенил)1H-пиррола в 59 мл формамида, 29,5 мл DMF и 14,7 мл муравьиной кислоты нагревают при 150 С всю ночь. Последовательность, аналогичная проведению стадии 8.2, дает названное соединение; TLC-Rf = 0,3 (гексан/этилацетат[1:1]). Стадия 11.3: 4-Хлоро-6-(3-метоксифенил)7 Н-пирроло[2,3-d]пиримидин. В отсутствие влаги 5,28 г (21,9 мМ) 6-(3 метоксифенил)-7 Н-пирроло-[2,3-d]-пиримидин 4-ола в 53 мл хлорокиси фосфора нагревают при кипении 1,5 ч. Реакционную смесь охлаждают и фильтруют. Остаток растворяют в этилацетате и промывают раствором NаНСО 3, водой и насыщенным раствором хлорида натрия. Водные фазы один раз экстрагируют этилацетатом, высушивают над MgSO4 и концентрируют выпариванием для получения названного соединения; TLC-Rf = 0,73 (гексан/этилацетат [1:1]). Стадия 11.4: 4-(3-Хлороанилино)-6-(3-метоксифенил)-7 Н-пирроло-[2,3-d]пиримидин. 5,68 г (21,9 мМ) 4-хлоро-6-(3-метоксифенил)-7 Н-пирроло-[2,3-d]пиримидина и 4,59 мл (43,7 мМ) 3-хлороанилина в 75 мл н 39 бутанола нагревают при кипении 1,5 ч. Последовательность аналогичная стадии 10.4 дает названное соединение; т.пл. 262-263 С; FABMS: (М+Н)+ = 351. Пример 12. 4-(3-Хлороанилино)-6-(4-гидроксифенил)7 Н-пирроло[2,3-d]пиримидина гидробромид. В отсутствие влаги при температуре около 0 С 6 мл трехбромистого бора в 100 мл метиленхлорида добавляют в течение 40 мин к 2,0 г(5,7 мМ) 4-(3-хлороанилино)-6-(4-метоксифенил)-7 Н-пирроло-[2,3-d]-пиримидина в 60 мл метиленхлорида. После перемешивания в течение 21 ч при комнатной температуре реакционную смесь фильтруют. Сырой продукт осаждают из фильтрата приблизительно 1 л гексана,отфильтровывают и промывают гексаном. Остаток обрабатывают 0,2 л воды и 0,6 л этилацетата и нейтрализуют 5%-ным раствором NаНСО 3. Органическую фазу отделяют, промывают водой и насыщенным раствором хлорида натрия,высушивают над MgSO4 и концентрируют выпариванием. Кристаллизация гексаном из горячего метанола дает названное соединение; анализ,рассчитанный для С 18 Н 14N4OвrСl(д, J=8,2H). Исходное соединение получают следующим образом: Стадия 12.1: 2-Амино-3-этоксикарбонил-5(4-метоксифенил)-1 Н-пиррол. Аналогично стадии 8.1, 1,67 г (10 мМ) гидрохлорида этилового эфира 2-амидиноуксусной кислоты в 20 мл абсолютного этанола реагируют с 716 мг (10 мМ) этанолята натрия и 1,145 г (5,0 мМ) 4-метоксифенацилбромида(гексан/этилацетат [1:1]); FAB-MS:(M+H)+ = 261. Стадия 12.2: 6-(4-Метоксифенил)-7 Нпирроло[2,3-d]-пиримидин-4-ол. В атмосфере защитного газа 611 мг (2,3 мМ) 2-амино-3-этоксикарбонил-5-(4-метоксифенил)-1 Н-пиррола в 5 мл формамида, 2,5 млDMF и 1,25 мл муравьиной кислоты нагревают при 150 С всю ночь. Последовательность, аналогичная проведению стадии 8.2, дает названное соединение; т.пл. 300 С; FAB-MS:(M+H)+ = 242. Стадия 12.3: 4-Хлоро-6-(4-метоксифенил)7 Н-пирроло[2,3-d]-пиримидин. В отсутствие влаги 121 мг (0,50 мМ) 6-(4 метоксифенил)-7 Н-пирроло[2,3-d]пиримидин-4 ола и 1 мл хлорокиси фосфора нагревают при кипении 1,5 ч. Реакционную смесь выливают в 40 ледяную воду и дважды экстрагируют этилацетатом. Органические фазы трижды промывают водой и насыщенным раствором хлорида натрия, высушивают над MgSO4 и концентрируют выпариванием. Перемешивание остатка в диэтиловом эфире дает названное соединение; т.пл. 248-249 С; FAB-MS:(M+H)+ = 260. Стадия 12.4: 4-(3-Хлороанилино)-6-(4 метоксифенил)-7 Н-пирроло-[2,3-d] пиримидин. Раствор 95 мг (0,365 мМ) 4-хлоро-6-(4 метоксифенил)-7 Н-пирроло[2,3-d]пиримидина и 77 л (0,732 мМ) 3-хлороанилина в 3 мл нбутанола и нескольких каплях DMPU нагревают при кипении 2 ч. Реакционную смесь охлаждают, разбавляют диэтиловым эфиром и изопропанолом и фильтруют; т.пл. 294-295 С; FABMS:(M+H)+ = 351. Пример 13. 4-(3-Хлороанилино)-5-диметиламинометил 6-(4-гидроксифенил)-7 Н-пирроло[2,3-d]пиримидин. В атмосфере аргона 96,2 мг (0,52 мМ) йодидаBuchs/Switzerland) добавляют к 134,7 мг (0,40 мМ) 4-(3-хлороанилино)-6-(4-гидроксифенил)7 Н-пирроло[2,3-d]пиримидина в 4,8 мл абсолютного THF и реакционную смесь кипятят с флегмацией 1,5 ч. Последовательность обработки, как описано в примере 3, и рекристаллизация из горячего этанола дает названное соединение; т.пл. 269-271 С; TLC-Rf = 0,31H-ЯМР (500 МГц, DMSO-d6):12,48, 11,91 и 9,75 (3 с, 3 Н), 8,32 и 8,25 (2 с 2 Н), 7,40 (д,J=8,1H), 7,34 (1 Н), 7,32 (д, J=8,2H), 7,00 (д,J=8,1 Н), 6,89 (д, J=8,2H), 3,72 (с, 2 Н), 2,36 (с,6 Н). Пример 14. 4-(3-Хлороанилино)-5-диметиламинометил-6-(фенил-7 Н-пирроло[2,3-d]пиримидин. В атмосфере аргона 898,2 мг (2,80 мМ) 4(3-хлороанилино)-6-фенил-7 Н-пирроло[2,3-d] пиримидина в 33,6 мл абсолютного THF кипятят с флегмацией всю ночь с 673,4 мг (3,64 мМ) йодида N,N-диметилметилениммония (Fluka;Buchs/Switzerland). Реакционную смесь разделяют между этилацетатом и 1 н. соляной кислотой. Органическую фазу отделяют и промывают три раза водой. Водные фазы вновь экстрагируют один раз этилацетатом и делают основными твердым карбонатом натрия с получением суспензии, к которой добавляют этилацетат, в результате чего твердое вещество концентрируется в органической фазе. Органическую фазу промывают три раза водой до нейтрального состояния и водные фазы вновь экстрагируют этилацетатом. Соединенные органические фазы(суспензии) концентрируют выпариванием. Перемешивание остатка в диэтиловом эфире дает названное соединение; MS:(M)+ = 377. 1H-ЯМР (200 МГц, DMSO-d6): 12,57 и 12,12 (2 с, 2 Н), 8,38 (с, 1 Н), 8,29 (м, 1 Н), 7,55 (м, 41 4 Н), 7,50-7,30 (м, 3 Н), 7,04 (дм, J=8,1 Н), 3,79 (с,2 Н), 2,38 (с, 6 Н). Исходное соединение получают следующим образом: Стадия 14.1: 6-Фенил-7 Н-пирроло[2,3d]пиримидин-4-ол. В атмосфере защитного газа 2,30 г (10 мМ) 2-амино-3-этоксикарбонил-5-фенил-1H-пиррола[получение см: Synthesis, 272 (1987)] в 20 мл формамида, 10 мл DMF и 5 мл муравьиной кислоты нагревают при 150 С 24 ч. Реакционную смесь охлаждают и фильтруют и остаток промывают изопропанолом/гексаном. Перемешивание в горячем изопропаноле дает названное соединение; т.пл. 300 С; FAB-MS:(M+H)+ = 212. Стадия 14.2: 4-Хлоро-6-фенил-7 Н-пирроло[2,3-d] пиримидин. В отсутствие влаги 1,795 г (8,5 мМ) 6 фенил-7 Н-пирроло[2,3-d]-пиримидин-4-ола и 27 мл хлорокиси фосфора нагревают при кипении 3 ч. Выливание реакционной смеси в ледяную воду, фильтрование и промывание горячим изопропанолом и гексаном дает названное соединение; FAB-MS:(M+H)+ = 230. Стадия 14.3: 4-(3-Хлороанилино-)-6-фенил 7 Н-пирроло[2,3-d]-пиримидин. Суспензию 1,251 г (5,45 мМ) 4-хлоро-6 фенил-7 Н-пирроло[2,3-d] пиримидина и 1,15 мл(10,9 мМ) 3-хлороанилина в 20 мл н-бутанола и 0,5 мл DMPU нагревают при кипении 2 ч. Реакционную смесь охлаждают и фильтруют. Перемешивание остатка в горячем THF/метаноле дает названное соединение; т.пл. 285-286 С; 5,7 г (15 мМ) N-бензил-4-(3-хлороанилино)пиримидо[4,5-b]индола добавляют к суспензии 7,6 г безводного АlСl3 в 50 мл толуола и реакционную смесь нагревают при 100 С в течение 45 мин. Реакционную смесь охлаждают до комнатной температуры, выливают в ледяную воду и перемешивают приблизительно 30 мин, при этом осаждается сырой продукт. Сырой продукт отфильтровывают отсасыванием и промывают водой. Фильтрат выбрасывают. Сырой продукт растворяют в THF/этилацетате, промывают 5%ным раствором бикарбоната натрия и затем насыщенным раствором NaCl, высушивают и концентрируют. После выстаивания в холодильнике кристаллы 4-(3-хлороанилино)-пиримидо[4,5-b]индола осаждаются. При добавлении циклогексана продукт полностью выпадает в осадок. Дальнейшую очистку проводят дигерированием в этилацетате. Названное соединение 42 получают в виде слегка розоватых кристаллов; т.пл. 260 С. 1 Н-ЯМР (360 МГц, DMSO-d6): 12,20 (с,пиррол NH), 8,97 (с, анилин NH), 7,1-8,5 (м,8 ароматический Н, + пиримидин Н); FABMS:(M+H)+ = 295. Соль НСl. 2,8 г 4-(3-Хлороанилино)-пиримидо[4,5b]индола растворяют при нагревании в 400 млTHF и охлаждают до комнатной температуры и при перемешивании к нему добавляют 2,8 мл 5 М раствора НСl в диэтиловом эфире. После добавления примерно 250 мл диэтилового эфира и охлаждения на ледяной бане гидрохлорид 4-(3 хлороанилино)-пиримидо[4,5-b]индола осаждается в виде бесцветных кристаллов с т.пл. 280286 С. Исходное соединение получают следующим образом: Стадия 15.1: 4-Гидрокси-5,6-тетраметилен 7-бензилпирроло[2,3-d]-пиримидин. 15 г 2-Амино-1-бензил-3-циано-4,5,6,7 тетрагидроиндола (полученного из 2-гидроксициклогексанона, бензиламина и малонодинитрила с применением известного способа (см.H.J. Roth и К. Eger, Pharmaz. 308, 179 [1975] кипятят со 100 мл 85%-ной муравьиной кислоты при 110 С 5 ч. Реакционный раствор охлаждают на ледяной бане с осаждением светлокоричневых кристаллов. Суспензию выливают приблизительно в 200 мл ледяной воды и перемешивают около 10 мин. Затем осадок отфильтровывают отсасыванием. Кристаллы промывают водой и затем гексаном и высушивают с получением названного соединения с температурой плавления 104-105 С, FAB-MS:(M+H)+ = 280. Стадия 15.2: 4-(3-Хлороанилино)-5,6 тетраметилен-7-бензилпирроло[2,3-d]пиримидин. 0,65 г 4-Хлоро-5,6-тетраметилен-7 бензилпирроло[2,3-d] пиримидина и 0,27 мл 3 хлороанилина в 10 мл этанола нагревают с флегмацией 17 ч. Коричневый раствор концентрируют до сухости выпариванием, остаток растворяют этилацетатом, этилацетатный раствор промывают раствором бикарбоната натрия и водой до нейтрального состояния, высушивают и концентрируют выпариванием. Остаток кристаллизуют из этилацетата/гексана. Названное соединение получают в виде белых кристаллов с т.пл. 145-147 С; FAB-MS:(M+H)+ = 389. Стадия 15.3: N-Бензил-4-(3-хлороанилино)-пиримидо[4,5-b]индол. 14,1 г (62 мМ) 2,3-Дихлоро-5,6-дициано 1,4-бензохинона (DDQ) добавляют к раствору 12,1 г (31 мМ) 4-(3-хлороанилино)-5,6 тетраметилен-7-бензилпирроло[2,3-d]пиримидина в 260 мл толуола. Раствор темно-красного цвета нагревают с флегмацией 30 мин и затем охлаждают до комнатной температуры. Нерастворимый материал отфильтровывают и фильтрат концентрируют выпариванием с применени 43 ем ротационного выпарного аппарата. Сырой продукт подвергают хроматографии на силикагеле (элюирование гексаном/этилацетатом) с получением бесцветных кристаллов названного соединения с т.пл. 174-176 С. 1H-ЯМР (360 МГц, CDCL3): 12,20 (с, пиррол NH), 9,0 (с, анилин Н), 7,0-8,6 (м, 13 ароматический Н и 1 пиримидин Н), 5,66 (с,2 Н,бензильная группа); FAB-MS:(M+H)+ = 385. Пример 16. 4-(3-Хлороанилино)-5-метил-6-(4-гидроксифенил)-7 Н-пирроло[2,3-d]пиримидина гидробромид. Данное соединение в виде бесцветного порошка получают аналогично примеру 10 удалением метильной группы из 5 г (6,85 мМ) 4-(3 хлороанилино)-5-метил-6-(4-метоксифенил)-7 Нпирроло[2,3-d]пиримидина посредством 4,4 г трехбромистого бора в 30 мл метиленхлорида; т.пл. 295-296 С. 1 Н-ЯМР (360 МГц, DMSO-d6): 11,85 (с,пиррол NH), 9,68 (с, фенольный Н), 8,29 (с, анилин NH), 8,27 (с, пиримидин Н), 7,94 (м, аромат. Н), 7,70 (м, аромат. Н), 7,42 (д, аромат. Н), 7,35(т, аромат. Н), 7,06 (м, аромат. Н), 6,90 (д, 2 аромат. Н), 2,58 (c,3H); FAB-MS:(M+H)+= 351. Соль НСl. Для получения соли НСl 600 мг гидробромида 4-(3-хлороанилино)-5-метил-6-(4-гидроксифенил)-7 Н-пирроло[2,3-d]пиримидина в горячем виде растворяют в 50 мл этилацетата и при комнатной температуре посредством 1N NaOHpH доводят до 9,5 и органическую фазу дважды промывают водой. Органическую фазу высушивают и концентрируют выпариванием. Остаток растворяют в 30 мл этанола и к нему добавляют 5 н. (= 5 нормальный) раствор HCl в этаноле. При 0 С, перемешивая и добавляя диэтиловый эфир, получают гидрохлорид 4-(3-хлороанилино)-5-метил-6-(4-гидроксифенил)-7 Н-пирроло[2,3-d]пиримидина в виде бесцветного порошка с т.пл. 280-282 С. Исходное соединение получают следующим образом: Стадия 16.1: 4-Хлоро-5-метил-6-(4-метоксифенил)-7 Н-пирроло-[2,3-d]пиримидин. Аналогично стадии 1.3 названное соединение получают из 4-гидрокси-5-метил-6-(4 метоксифенил)-7 Н-пирроло[2,3-d]пиримидина кипячением в хлорокиси фосфора; FAB-MS:(M+H)+ = 274. Стадия 16.2: 4-(3-Хлороанилино)-5-метил 6-(4-метоксифенил)-7 Н-пирроло[2,3-d]пиримидин. 4 г 4-Хлоро-5-метил-6-(4-метоксифенил)7 Н-пирроло[2,3-d]пиримидина и 8,45 мл 3 хлороанилина нагревают с флегмацией в 400 мл н-бутанола 20 ч. Коричневый раствор концентрируют, при этом нужный продукт уже выпадает в осадок. Раствор выдерживают всю ночь в холодильнике, продукт отфильтровывают отсасыванием, промывают гексаном/этилацетатом с 44 получением названного соединения в виде бесцветных кристаллов; т.пл. 265-268 С; FABMS:(M+H)+ = 365. Пример 17. 4-(3-Хлороанилино)-6-(4-нитрофенил)-7 Нпирроло-[2,3-d]пиримидин. Данное соединение в виде кристаллов цвета ржавчины получают аналогично примеру 5 кипячением 0,25 г (0,91 мМ) 4-хлоро-6-(4 нитрофенил)-7 Н-пирроло[2,3-d]пиримидина с 0,19 мл 3-хлороанилина в 5 мл н-бутанола; т.пл. 250 С. 1H-ЯМР (360 МГц, DMSO-d6): 12,95 (с,пиррол NH), 10,3 (с, анилин NH), 8,45 (с, пиримидин Н), 8,24 (с, аромат.Н), 7,18-8,40 (7 аромат.Н + пиррол 5 Н); МS:(М)+ = 365. Исходное соединение получают следующим образом: Стадия 17.1: 2-Амино-3-этоксикарбонил-5(4-нитрофенил)-пиррол. В сухой трехгорловой колбе под аргоном 75 мл абсолютного этанола и 6,5 г (390 мМ) гидрохлорида этилового эфира 2-амидиноуксусной кислоты [получение см. Liebigs Ann.Chem., 1895 (1977)] охлаждают до 0-5 С и туда добавляют 2,65 г (390 мМ) этанолята натрия. Затем добавляют 5 г (195 мМ) 2-бромо-1-(4 нитрофенил)-этан-1-она, реакционной смеси дают нагреться до комнатной температуры и затем перемешивают 48 ч. Потом ее разделяют между водой и этилацетатом. Фазу этилацетата трижды промывают водой и один раз насыщенным раствором хлорида натрия, высушивают и фильтруют, фильтрат концентрируют выпариванием. Красно-коричневый остаток суспендируют в гексане и названное соединение осаждается в виде сырого продукта (чистота 93%), который применяют для следующей стадии без дальнейшей очистки; MS:(M)+ = 275. Стадия 17.2: 4-Гидрокси-6-(4-нитрофенил)-7 Н-пирроло-[2,3-d] пиримидин. 2,5 г (97 мМ) 2-Амино-3-этоксикарбонил 5-(4-нитрофенил)-пиррола, 19,4 мл формамида,9,7 мл DMF и 3,1 мл муравьиной кислоты перемешивают вместе при 150 С 22 ч. К горячей реакционной смеси добавляют 1 мл изопропанола. Реакционную смесь охлаждают и осажденный продукт отфильтровывают. Затем продукт последовательно промывают 3 раза 10 мл этанола каждый раз, дважды 10 мл изопропанола каждый раз и дважды 10 мл гексана каждый раз с получением названного соединения в виде кристаллов цвета ржавчины, которые применяют для следующей стадии; MS:(M)+ = 256. Стадия 17.3: 4-Хлоро-6-(4-нитрофенил)7 Н-пирроло[2.3-d] пиримидин. Аналогично стадии 1.3 4-хлоро-6-(4-нитрофенил)-7 Н-пирроло[2,3-d]пиримидин получают нагреванием 4-гидрокси-6-(4-нитрофенил)-7 Нпирроло[2,3-d]пиримидина с РОСl3 (чистота 93%); т.пл. 280 С; FAB-MS:(M+H)+ = 275. 45 Пример 18. 4-(3-Хлороанилино)-6-(4-аминофенил)-7 Нпирроло-[2,3-d]пиримидин. 150 мг (0,41 мМ) 4-(3-хлороанилино)-6-(4 нитрофенил)-7 Н-пирроло[2,3-d]пиримидина гидрируют 5 ч с 50 мг никеля Ренея в 20 мл ТНР/метанола при комнатной температуре и при нормальном давлении, при этом нужный продукт уже выпадает в осадок. Катализатор отфильтровывают и остаток после фильтрации промывают горячим THF. Фильтрат концентрируют до сухости выпариванием. Сухой продукт очищают несколько раз дигерированием в метаноле и осаждают из THF/гексана, что дает названный продукт в виде светло-бежевых кристаллов; т.пл. 290 С. 1[3',2':4,5]-пирроло В атмосфере азота при перемешивании в течение 1 ч при 120 С нагревают смесь 0,034 г(4,99 мМ) 3-хлороанилина. Реакционную смесь охлаждают до комнатной температуры и затем к ней добавляют 5 мл этанола. После дальнейшего охлаждения до 0 С реакционную смесь фильтруют и кристаллы промывают этанолом и высушивают в высоком вакууме. Полученное названное соединение имеет т.пл. 260 С; EIMS:M = 295 (С 15 Н 10 СlN5). Пример 20. Применяя способы, описанные в этой заявке, получают: a) 4-бензиламино-5,6-диметил 7 Н-пирроло[2,3-d]пиримидина гидрохлорид,т.пл. 115-117 С, b) (R)-5,6-диметил-4-[(1-фенилэтил)-амино]-7 Н-пирроло[2,3-d]пирими-дин,т.пл. 206-208 С, c) (S)-5,6-диметил-4-[(1-фенилэтил)-амино]-7 Н-пирроло[2,3-d]пиримидин,т.пл. 206-207 С, d) (R)-6-(4-аминофенил)-4-[(1 фенилэтил)-амино]-7 Н-пирроло[2,3-d]пиримидин, т.пл. 234-235 С, FAB-MS:(M+H)+ = 330(получен восстановлением соответствующего нитросоединения с использованием катализатора никеля Ренея аналогично примеру 18), e) (S)6-(4-аминофенил)-4-[(1-фенилэтил)-амино]-7 Нпирроло[2,3-d]пиримидин, т.пл. 235-236 С, FAB-MS:(M+H)+ = 330 (получен восстановлением соответствующего нитросоединения с использованием катализатора никеля Ренея аналогично примеру 18), f) 6-(4-аминофенил)-4-бензиламино-7 Н-пирроло[2,3-d]пиримидин (получен 46 восстановлением соответствующего нитро соединения с использованием катализатора никеля Ренея аналогично примеру 18), g) 6-(4 аминофенил)-4-[(3-хлоробензил)-амино]-7 Нпирроло[2,3-d]пиримидин (получен восстановлением соответствующего нитросоединения с использованием никеля Ренея в качестве катализатора аналогично примеру 18), h) (R)-6-(4 аминофенил)-4-[(1-метоксикарбонилбензил)амино]-7 Н-пирроло [2,3-d] пиримидин, i) (S)-6(4-аминофенил)-4-[(1-метоксикарбонилбензил)амино] -7 Н-пирроло [2,3-d] пиримидин, j) 6-(4 ацетиламинофенил)-4-(3-хлороанилино)-7 Нпирроло[2,3-d]пиримидин, т.пл. 310 С; MS:(M)+ = 377, k) 6-(4-карбамоилметокси-фенил)-4(3-хлороанилино)-7 Н-пирроло[2,3-d]пиримидин,т.пл. 297-298 С, 1) 6-(4-аминофенил)-4-(3 метиланилино)-7 Н-пирроло[2,3-d]пиримидин,т.пл. 288-290 С, (получен восстановлением соответствующего нитросоединения с использованием никеля Ренея в качестве катализатора аналогично примеру 18), m) 6-(4-аминофенил)4-(3-хлоро-4-фтороанилино)-7 Н-пирроло[2,3-d] пиримидин, т.пл. 300 С; MS:(M)+ = 353 (получен восстановлением соответствующего нитросоединения с использованием никеля Ренея в качестве катализатора аналогично примеру 18),n) 6-(3-ацетиламинофенил)-4-(3-хлороанилино)-7 Н-пирроло[2,3-d]пиримидин (предпочтительно получен аналогично примеру 21), т.пл. 300 С; MS:(M)+ = 377, о) 6-(3-аминофенил)-4(3-хлороанилино)-7 Н-пирроло[2,3-d]пиримидин,т.пл. 293-295 С; (получен восстановлением соответствующего нитросоединения с использованием никеля Ренея в качестве катализатора аналогично примеру 18), р) 6-(4-карбоксиметоксифенил)-4-(3-хлороани-лино)-7 Нпирроло[2,3-d]пиримидин, т.пл. 305-307 С, q) 6(4-[бензилоксикарбонилметокси]-фенил)-4-(3 хлороанилино)-7 Н-пирроло[2,3-d]пиримидин,т.пл. 263-265 С, r) 6-(3-карбоксиметоксифенил)[2,3-d]пиримидин. Вышеупомянутые соединения примеров 20 а, 20d, 20e, 20f, 20g, 20l и 20m предпочтительно получают восстановлением соответствующего нитросоединения с использованием никеля Ренея в качестве катализатора аналогично примеру 18. Пример 21. 6-(4-Ацетиламинофенил)-4-(3-хлороанилино)-7 Н-пирроло[2,3-d]пиримидин (см. пример 20j). 0,05 мл (0,56 мМ) уксусного ангидрида добавляют к 0,2 г (0,56 мМ) 6-(4-аминофенил)-4(3-хлороамино)-7 Н-пирроло[2,3-d]пиримидина,суспендированного в 0,5 мл пиримидина, и реакционную смесь перемешивают при 0 С 1 ч,пока TLC не покажет никаких следов исходного материала. Реакционную смесь выливают в 50 мл ледяной воды и осадок отфильтровывают и промывают гексаном. Сырой продукт подвергают хроматографии в колонке с силикагелем. Названное соединение кристаллизуют из= 377. Пример 22. Аналогично примеру 1 или другим примерам, представленным ниже, получают следующие соединения а) 4-(3-хлороанилино)-6-(4 пропиониламинофенил)-7 Н-пирроло[2,3-d]пиримидин (получен аналогично примеру 21); т.пл. 300 С; MS:(M)+ = 391, b) 4(3-хлороанилино)-6-(3-пропиониламинофенил)-7 Нпирроло[2,3-d]пиримидин (получен аналогично примеру 21); т.пл. 300, MS: (M)+ = 391, c) (R)6-(4-ацетиламинофенил)-4-[(1-фенилэтил)амино]-7 Н-пирроло[2,3-d]пиримидин (получен аналогично примеру 21); т.пл. 304-305 С;(R)-6-(3-ацетиламинофенил)-4-[(1-фенилэтил)амино]-7 Н-пирроло[2,3-d]пиримидин; т.пл. 150180 С; MS:(M)+ = 371. Пример 23. 4-(3-Хлороанилино)-6-(4-изобутириламинофенил)-7 Н-пирроло [2,3-d]пиримидин. 0,2 г (0,56 мМ) 6-(4-Аминофенил)-4-(3 хлороанилино)-7 Н-пирроло[2,3-d]пиримидина и 0,064 мл (0,62 мМ) изобутирилхлорида перемешивают при 0 С 2 ч с 1 мл абсолютного диметилацетамида до тех пор, пока TLC не показала отсутствия исходного материала. Реакционную смесь выливают в 20 мл ледяной воды и продукт выпадает в осадок. Продукт экстрагируют приблизительно 60 мл этилацетата, около 2 млTHF и 20 мл 5% раствора NаНСО 3. Органическую фазу промывают водой, высушивают и концентрируют выпариванием, при этом нужное соединение кристаллизуется. Осадок отфильтровывают и промывают холодным этилацетатом. Еще какую-то часть соединения получают из маточной жидкости добавлением гексана; т.пл. 300 С; MS:(M)+ = 405. Пример 24. Следующие соединения получают аналогично примеру 23: а) 4-(3-хлороанилино)-6-(4 пивалоиламинофенил)-7 Н-пирроло[2,3-d]пиримидин; т.пл. 300 С; MS:(M)+ = 419, b) 4-(3 хлороанилино)-6-[4-(DL-2-метилбутириламино)-7 Н-пирроло [2,3-d]пиримидин. При 5 С 110 л (1,93 мМ) ацетальдегида добавляют к 0,3 г (0,89 мМ) 6-(4-аминофенил)4-(3-хлороанилино)-7 Н-пирроло[2,3-d]пиримидина, растворенного в 15 мл THF и реакционную смесь перемешивают при 5 С 24 ч (оранжевый раствор). Затем добавляют 75 мг (1,15 мМ) цианоборогидрида натрия. Реакционный раствор перемешивают еще 5 ч при комнатной температуре и затем концентрируют выпариванием в вакууме. Остаток экстрагируют этилацетатом и рН доводят до 2 1 н. НСl. Фазу этилацетата промывают водой, высушивают и концентрируют выпариванием. Сырой продукт хроматографируют на колонке с силикагелем. Названное соединение кристаллизуют из метанола/гексана или этилацетата/гексана; т.пл. 265270 С; MS:(M)+ = 363. Пример 26. Следующие соединения получают аналогично примеру 25: а) (R)-6-(4-диэтил-аминофенил)-4-[(1-фенилэтил)-амино]-7 Н-пирроло[2,3-d]пиримидина с формальдегидом), c) 4-(3 хлороанилино)-6-(3-этиламинофенил)-7 Нпирроло[2,3-d]пиримидин; MS:(M)+ = 363 и d) 6(4-диметиламинофенил)-4-[(1-фенилэтил)амино]-7 Н-пирроло[2,3-d]пиримидин. Пример 27. Восстановление соответствующего нитросоединения с использованием никеля Ренея в качестве катализатора аналогично примеру 18 дает следующие соединения: a) 6-(4-аминофенил)-4-(3-метилбензиламино)-7 Н-пирроло(R,S)-6-(4-аминофенил)-4-[(1-(3-хлорофенил)этил)-амино]-7 Н-пирроло[2,3-d]пиримидин; т.пл. 281-283 С; FAB-MS:(M+H)+ = 364. Пример 28. Следующие соединения получают аналогично примеру 21: a) (R)-4-[(1-фенилэтил)амино]-6-(4-пропиониламинофенил)-7 Н-пирроло-[2,3-d]пиримидин; MS:(M)+ = 385 (см. пример 22d), b) (R)-4-[(1-фенилэтил)-амино]-6-(3 пропиониламинофенил)-7 Н-пирроло[2,3-d]пиримидин; MS: (М)+ = 385. Пример 29: По аналогии с примером 23 получают следующие соединения: a) (R)-6-(3-изобутириламинофенил)-4-[(1-фенилэтил)-амино]-7 Нпирроло[2,3-d]пиримидин, т.пл. 206-208 С;FAB-MS:(M+H)+ = 414. Пример 30. 4-(3-Хлороанилино)-6-(4-этоксикарбонилфенил)-7 Н-пирроло[2,3-d]пиримидин. 900 мг (2,95 мМ) 4-Хлоро-6-(4-этоксикарбонилфенил)-7 Н-пирроло[2,3-d]пиримидина нагревают с флегмацией 2,5 ч с 0,63 мл (6 мМ) 3-хлороанилина и 22 мл н-бутанола. Названное соединение либо подвергают хроматографии на колонне с силикагелем, либо кристаллизуют из тетрагидрофурана/диэтилового эфира; т.пл. 300 С; FAB-MS:(M+H)+ = 393. Исходное соединение получают следующим образом: Стадия 30.1: 2-Амино-3-этоксикарбонил-5(4-этоксикарбонилфенил)-1H-пиррол. Аналогично стадии 8.1, 4,92 г (29,5 мМ) гидрохлорида этилового эфира 2-амидиноуксусной кислоты в 40 мл абсолютного этанола реагируют с 2,0 г (29,5 мМ) этанолята натрия и 4,0 г (14,8 мМ) 2-бромо-(4-этоксикарбонил) ацетофенона с получением названного соединения; т.пл. 150-151 С; MS:(M)+ = 302. Стадия 30.2: 6-(4-Этоксикарбонилфенил)7 Н-пирроло-[2,3-d] пиримидин-4-ол. Аналогично стадии 8.2, 2,6 г (8,6 мМ) 2 амино-3-этоксикарбонил-5-(4-этоксикарбонилфенил)-1 Н-пиррола нагревают при 150 С в атмосфере защитного газа в течение ночи с 19 мл формамида, 8 мл DMF и 0,6 мл муравьиной кислоты. Проведение процесса аналогично стадии 8.2 дает названное соединение; т.пл. 250 С; 50 Стадия 30.3: 4-Хлоро-6-(4-этоксикарбонилфенил)-7 Н-пирроло-[2,3-d]пиримидин. Аналогично стадии 8.3, 1,45 г 6-этоксикарбонилфенил-7 Н-пирроло[2,3-d]пиримидин-4 ола в 15 мл хлорокиси фосфора нагревают в атмосфере защитного газа 2 ч с последующим проведением процесса аналогично стадии 8.3,что приводит к получению названного соединения; т.пл. 250 С (разложение): TLC-Rf = 0,63(этилацетат/гексан [1:1]); FAB-MS:(M+H)+ = 302. Пример 31. 4-(3-Хлороанилино)-6-(3-этоксикарбонилфенил)-7 Н-пирроло[2,3-d]пиримидин. Названное соединение получают аналогично примеру 30; т.пл. 300 С; TLC-RF = 0,66(этилацетат/гексан [1:1]); FAB-MS:(M+H)+ = 393. Исходное соединение получают следующим образом: Стадия 31.1: 2-Амино-3-этоксикарбонил-5(3-этоксикарбонилфенил)-1H-пиррол. Названное соединение получают аналогично стадии 30.1; т.пл. 136-137 С; TLC-Rf = 0,37 (этилацетат/гексан[1:1]); MS:(M)+ = 302. Стадия 31.2: 6-(3-этоксикарбонилфенил)-7 Нпирроло-[2,3-d]пиримидин-4-ол. Названное соединение получают аналогично стадии 30.2; т.пл. 250 С; TLC-Rf = 0,29(этилацетат/гексан[1:1]); FAB-MS:(M+H)+ = 284. Стадия 31.3: 4-Хлоро-6-(3-этоксикарбонилфенил)-7 Н-пирроло[2,3-d]пиримидин. Названное соединение получают аналогично стадии 30.3; т.пл. 250 С; TLC-Rf = 0,62(этилацетат/гексан[1:1]); FAB-MS:(M+H)+ = 302. Пример 32. 4-(3-Хлороанилино)-6-(4-карбоксифенил)7 Н-пирроло[2,3-d]пиримидин (см. пример 20 у). 0,2 г (0,51 мМ) 4-(3-Хлороанилино)-6-(4 этоксикарбонилфенил)-7 Н-пирроло[2,3-d]пиримидина, растворенного в 1,2 мл абсолютного этанола нагревают с флегмацией с 62,7 мг (1,52 мМ) гидроксида лития, растворенного в 1 мл воды до тех пор, пока TLC не покажет, что исходного материала уже не осталось (12 ч). Раствор охлаждают до комнатной температуры и рН доводят до 2 1 н. раствором NaOH. Нужный продукт осаждается и его отфильтровывают. Названное соединение кристаллизуют из этанола/воды или THF/гексана; т.пл. 300 С; Rf = 0,47 (этилацетат/метанол [60:40]); FAB-MS:(M+H)+ = 365. Пример 33. 4-(3-Хлороанилино)-6-(3-карбоксифенил)7 Н-пирроло[2,3-d]пиримидин. Названное соединение получают аналогично примеру 32; т.пл. 300 С; Rf = 0,5 (этилацетат/метанол [60:40]); FAB-MS:(M+H)+ = 365. Пример 34. 4-(3-Хлороанилино)-6-(4-метоксикарбонилфенил)-7 Н-пирроло[2,3-d]пиримидин. 51 0,5 г (1,37 мМ) 4-(3-хлороанилино)-6-(4 карбоксифенил)-7 Н-пирроло[2,3-d]пиримидина,суспендированного в 100 мл метанола нагревают с флегмацией 24 ч с 0,1 мл концентрированной серной кислоты. Раствор концентрируют и перемешивают в метаноле/диэтиловом эфире. Кристаллы отфильтровывают и затем суспендируют в метаноле/воде. рН суспензии доводят раствором бикарбоната натрия до 7-8 и перемешивают при комнатной температуре 30 мин. Кристаллы отфильтровывают отсасыванием,промывают водой, метанолом и диэтиловым эфиром и высушивают. Названное соединение получают в виде бесцветных кристаллов; т.пл. 300 С; TLC-Rf = 0,6 (толуол/этилацетат [3:7]);FAB-MS: (М + Н)+ = 378. Пример 35. Следующие соединения получают аналогично примеру 34: а) 4-(3-хлороанилино)-6-(4 этоксикарбонилфенил)-7 Н-пирроло[2,3-d]пиримидин; т.пл.300 С; FAB-MS: (M+H)+ = 393,b) 4-(3-хлороанилино)-6-(4-пропилоксикарбонилфенил)-7 Н-пирроло[2,3-d]пиримидин; т.пл. 250 С; Rf = 0,41 (этилацетат/гексан [1:1]);FAB-MS:(M+H)+ = 421. Пример 36. 4-(3-Хлороанилино)-6-(4-диметиламинокарбонилфенил)-7 Н-пирроло [2,3-d] пиримидин. 369 мг (1,01 мМ) 6-(4-карбоксифенил)-4(3-хлороанилино)-7 Н-пирроло[2,3-d]пиримидина, 0,4 мл (2,3 мМ) диметиламина и 0,3 мл (1,51 мМ) DEPC (Aldrich) в 10 мл DMF перемешивают при комнатной температуре 1 ч. Коричневую суспензию разбавляют водой и фильтруют и кристаллы промывают водой, метанолом и диэтиловым эфиром. Названное соединение получают в виде бесцветных кристаллов; т.пл. 250 С; FAB-MS:(M+H)+ = 392. Пример 37. 4-(3-Хлороанилино)-6-(4-диэтиламинокарбонилфенил)-7 Н-пирроло[2,3-d]пиримидин. Названное соединение получают аналогично примеру 8; т.пл. 250 С; FAB-MS:(M+H)+-амино]-7 Н-пирроло[2,3-d]пиримидин. Названное соединение в виде бесцветного порошка получают аналогично примеру 10 удалением метильной группы из (R)-6-(4 001428 52 метоксифенил)-4-[(1-фенилэтил)-амино]-7 Нпирроло[2,3-d]пиримидина трехбромистым бором; т.пл. 216-218 С; FAB-MS:(M+H)+ = 331. Исходное соединение получают следующим образом: Стадия 39.1: (R)-6-(4-Метоксифенил)-4[(1-фенилэтил)-амино]-7 Н-пирроло[2,3-d]пиримидин. Названное соединение получают аналогично примеру 8 или 9 из 4-хлоро-6-(4 метоксифенил)-7 Н-пирроло[2,3-d]пиримидина и-6-(4-гидроксифенил)-7 Н-пирроло[2,3-d]пиримидин. Названное соединение получают аналогично примеру 3 из 4-(3-хлороанилино)-6-(4 гидроксифенил)-7 Н-пирроло[2,3-d]пиримидина и йодида N,N-диметилметилениммония; т.пл. 243-244 С; MS:(M)+ = 393. Пример 41. 4-(3-Хлороанилино)-6-этоксикарбонил-7 Нпирроло [2,3-d]пиримидин. В атмосфере аргона 29,0 г (128 мМ) 4 хлоро-6-этоксикарбонил-7 Н-пирроло[2,3-d]пиримидина и 18,0 мл (171 мМ) 3-хлороанилина в 430 мл н-бутанола перемешивают при 100 С 3 ч(спустя 1 ч почти растворяются и образуется густая суспензия). Реакционную смесь охлаждают до около 50 С, затем к ней добавляют 400 мл изопропанола/гексана (1:1). Реакционную смесь охлаждают до комнатной температуры и продукт отфильтровывают и промывают изопропанолом и гексаном. Перемешивание в диэтиловом эфире дает названное соединение. 1(дм, J=8,1 Н), 4,37 (кв, J=7,2H), 1,37 (т, J=7,3H). Исходное соединение получают следующим образом: Стадия 41.1: 2-Амино-3,5-бис(этоксикарбонил)-1 Н-пиррол. При 0 С 56,0 г (0,43 М) этилового эфира 2 амидиноуксусной кислоты [получение см. Liebigs Ann.Chem., 1561 (1981)] вводят в 172 млDMPU. В течение 30 мин к ним по каплям добавляют 56,0 мл (0,45 М) этилового эфира бромопировиноградной кислоты и потом реакционную смесь нагревают при 60 С 3 ч. Темнокоричневый реакционный раствор выливают в 1 л ледяной воды и экстрагируют 1 л этилацетата и дважды 0,5 л этилацетата каждый раз. Органические фазы промывают трижды 0,5 л воды и 0,5 л насыщенного раствора хлорида натрия,высушивают (Na2SO4) и концентрируют выпариванием. Колоночная хроматография (SiO2,гексан/этилацетат [1:1]) и кристаллизация из 53 диэтилового эфира/гексана дают названное соединение; т.пл. 147-149 С; MS:(M)+ = 226. Стадия 41.2: 6-Этоксикарбонил-4-гидрокси-7 Н-пирроло[2,3-d]пиримидин. В отсутствие воздуха 51,5 г (227 мМ) 2 амино-3,5-бис(этоксикарбонил)-1H-пиррола,455 мл формамида, 227 мл DMF и 113 мл муравьиной кислоты перемешивают при 140 С 27 ч. Полученную суспензию желтого цвета охлаждают до 0-5 С. Фильтрование и промывание изопропанолом и гексаном дает названное соединение. 1H-ЯМР (DMSO-d6): 13-12 (2 НХ), 7,99 и 7,11 (2 с, 2 Н), 4,31 (кв, J=7,2H), 1,32 (т, J=7,3 Н). Стадия 41.3: 4-Хлоро-6-этоксикарбонил 7 Н-пирроло[2,3-d]пиримидин. В атмосфере N2 32,0 г (154 мМ) 6 этоксикарбонил-4-гидрокси-7 Н-пирроло[2,3-d] пиримидина суспендируют при комнатной температуре в 308 мл (338 мМ) POCl3 и при перемешивании нагревают при 120 С, при этом твердое вещество растворяется. После трехчасового перемешивания при 120 С избытокPOCl3 отгоняют (наружная температура 65 С; 15 мбар). Остаток суспендируют в 50 мл ледяного толуола, фильтруют и промывают толуолом с получением названного соединения; т.пл. 219-221 С; 1 Н-ЯМР (DMSO-d6): 8,77 и 7,24 (2 с, 2 Н),4,39 (кв, J=7,2H), 1,36 (т, J=7,3H). Остальной продукт можно получить из фильтрата концентрированием выпариванием и затем перемешиванием в этилацетате/воде. Пример 42. 6-Карбокси-4-(3-хлороанилино)-7 Н-пирроло[2,3-d]пиримидин. Раствор 25 мг (0,6 мМ) LiOH H2O в 0,4 мл Н 2 О по каплям добавляют к суспензии 95 мг-7 Н-пирроло[2,3-d]пиримидина в 0,7 мл метанола. Реакционную смесь нагревают при кипении в течение 4,5 ч, затем охлаждают на ледяной бане и окисляют 0,6 мл 1 н. раствора НСl. Фильтрование и промывание водой дают названное соединение; HPLC: tRet(Grad20) = 8,7;FAB-MS:(M+H)+ = 289. Пример 43. 6-(N-н-Бутилкарбамоил)-4-(3-хлороанилино)-7 Н-пирроло[2,3-d]пиримидин. 95 мг (0,30 мМ) 4-(3-Хлороанилино)-6 этоксикарбонил-7 Н-пирроло[2,3-d]пиримидина в 1 мл н-бутиламина нагревают при 60 С 20 ч. Светло-желтый раствор концентрируют выпариванием и остаток перемешивают с изопропанолом, фильтруют и промывают гексаном с получением названного соединения; т.пл. 282284 С; TLC-Rf= 0,45 (СН 2 Сl2/метанол [10:1]); 54 95 мг (0,30 мМ) 4-(3-Хлороанилино)-6 этоксикарбонил-7 Н-пирроло[2,3-d]пиримидина в 0,5 мл бензиламина нагревают при 100 С 27 ч. Реакционную смесь охлаждают ледяной водой,перемешивают с 1 мл изопропанола и 1 мл гексана, фильтруют и высушивают с получением названного соединения; FAB-MS:(M+H)+ = 378. Пример 45. 4-(3-Хлороанилино)-6-[N-(3-метилбут-1 ил)-карбамоил]-7 Н-пирроло[2,3-d]пиримидин(см. пример 20za). 95 мг (0,30 мМ) 4-(3-Хлороанилино)-6 этоксикарбонил-7 Н-пирроло[2,3-d]пиримидина в 1 мл (3-метилбут-1-ил)-амина нагревают при 80 С 12 ч. Реакционную смесь концентрируют выпариванием, остаток растворяют в THF,вновь концентрируют выпариванием, перемешивают с диэтиловым эфиром и фильтруют с получением названного соединения; т.пл. 304306 С; FAB-MS:(M+H)+ = 358. Пример 46. 4-(3-Хлороанилино)-6-(N,N-диметилкарбамоил)-7 Н-пирроло[2,3-d]пиримидин. В атмосфере азота 97,6 мг (0,338 мМ) 6 карбокси-4-(3-хлороанилино)-7 Н-пирроло[2,3-d] пиримидина вводят в 7 мл DMF и к нему добавляют 119 мг (0,40 мМ) TPTU и раствор 164 мгDMF. Спустя 2 ч к реакционному раствору добавляют еще 30 мг TPTU и его перемешивают при комнатной температуре 2 дня, затем выливают в 30 мл ледяной воды, перемешивают,фильтруют и промывают водой с получением названного соединения; HPLC: tRet(Grad20) = 9,5;[2,3-d]пиримидина в 30 мл метанола и около 5 г аммиака нагревают при 120 С 48 ч. К реакционной смеси добавляют силикагель и концентрируют выпариванием, в виде порошка подают в колонку с силикагелем и, наконец, элюируют метиленхлоридом/метанолом/THF (210:35:10). Фильтрование с метанолом через колонку с оксидом алюминия (основным) и перемешивание в этилацетате дает названное соединение;MS:(M+H)+ = 288,0669 (расчетное 288,0652) +. В альтернативном варианте названное соединение получают следующим образом: Смесь 2,165 г (7,5 мМ) 6-карбокси-4-(3 хлороанилино)-7 Н-пирроло[2,3-d]пиримидина(см. пример 42) в 60 мл THF и 10 мл DMPU подвергают флегмации в течение 30 мин и затем охлаждают до 0 С с получением тонкой суспензии. Затем по каплям добавляют 824 л (7,5 мМ) изобутилхлорформиата в 10 мл THF. Спустя 1 ч 55 при 0 С добавляют еще 824 л Nметилморфолина и 981 л изобутилхлорформиата. Смесь перемешивают 1 ч и затем по каплям добавляют к 70 мл насыщенного раствораNН 3 в диоксане. Спустя 3 ч смесь концентрируют в вакууме. Остаток выливают в воду, осадок фильтруют и промывают водой и кипящим изопропанолом с получением названного соединения. Еще некоторое количество продукта можно выделить из изопропанолового фильтрата. Пример 48. 4-(3-Хлороанилино)-6-метиламинокарбонил-7 Н-пирроло[2,3-d]пиримидин. В запаянной стеклянной трубке в футляре 95 мг (0,30 мМ) 6-этоксикарбонил-7 Н-пирроло[2,3-d]пиримидина в 6 мл метиламина (33% в этаноле) нагревают при 50 С 96 ч. Реакционную смесь концентрируют выпариванием. HPLC и перемешивание в диэтиловом эфире дают названное соединение; HPLC: tRet(Grad20) = 8,6;TLC-Rf = 0,49 (СН 2Cl2/ТНF/этанол [6:2:1]); FABMS:(M+H)+ = 302. Пример 49. 4-(3-Хлороанилино)-6-гидроксиметил-7 Нпирроло-[2,3-d] пиримидин. В атмосфере азота 1,4 г (37 мМ) алюмогидрида лития добавляют порциями к 5,70 г (18 мМ) 4-(3-хлороанилино)-6-этоксикарбонил-7 Нпирроло[2,3-d]пиримидина в 300 мл THF. После двухчасового перемешивания при 50 С к реакционной смеси по каплям добавляют 100 мл воды и ее фильтруют через Celite (целит). Воду добавляют к фильтрату, который затем экстрагируют три раза этилацетатом. Органические фазы три раза промывают водой и насыщенным раствором хлорида натрия, высушивают(СН 3 Сl2/метанол [10:1]); MS:(M)+ = 274. Пример 50. 4-(3-Хлороанилино)-6-формил-7 Н-пирроло-[2,3-d]пиримидин. При охлаждении льдом 1,9 г двуокиси марганца (85%) добавляют к суспензии 715 мг(2,6 мМ) 4-(3-хлороанилино)-6-гидроксиметил 7 Н-пирроло[2,3-d]пиримидина в 170 мл метиленхлорида и реакционную смесь перемешивают при комнатной температуре 20 ч. Затем к ней добавляют 20 мл DMPU, перемешивают 1 ч и фильтруют через Hyflo. Остаток после фильтрации вновь перемешивают в 50 мл метиленхлорида/DMPU 1 ч (1:1) и снова фильтруют. Два фильтрата соединяют, концентрируют выпариванием и обрабатывают этилацетатом/THF и водой. Водные фазы дважды экстрагируют этилацетатом и органические фазы четыре раза промывают водой и насыщенным раствором хлорида натрия, высушивают(MgSO4) и концентрируют выпариванием до остаточного объема около 20 мл. Добавление диэтилового эфира и фильтрация дают назван 001428(стадия 41.3) и 1,12 мл (8,8 мМ) 1(R)фенилэтиламина в 10 мл н-бутанола перемешивают при 150 С 17 ч (вначале раствор, затем густая суспензия). Реакционную смесь охлаждают и названное соединение затем отфильтровывают и промывают изопроланолом и гексаном; HPLC: tRet(Grad20) = 10,6; TLC-Rf = 0,49(R)-6-Метиламинокарбонил-4-[1-фенилэтиламино]-7 Н-пирроло[2,3-d]пиримидин. В запаянной стеклянной трубке в футляре 155 мг(33% в этаноле) нагревают при 50 С 30 ч. Реакционную смесь растворяют в THF, к ней добавляют 25 мл воды и концентрируют выпариванием до остаточного объема около 25 мл. Полученные кристаллы отфильтровывают и промывают водой. Рекристаллизация из горячего THF и этилацетата дает названное соединение;[2,3-d]пиримидин, b) (R)-6-циано-4-[1-фенилэтиламино]-7 Н-пирроло[2,3-d]пиримидин [полученный из вышеуказанного соединения а)], c) 4-(3-хлороанилино)-6-циано-7 Н-пирроло[2,3-d] пиримидин [полученный из соединения, описанного в примере 47, см. пример 54], d) (R)-6 формил-4-[1-фенилэтиламино]-7 Н-пирроло[2,3d]пиримидин, e) (R)-6-аминометил-4-[1-фенилэтиламино]-7 Н-пирроло[2,3-d]пиримидин [полученный из вышеуказанного соединения d) восстановительным аминированием], f) 6-аминометил-4-(3-хлороанилино)-7 Н-пирроло[2,3-d] пиримидин [полученный из соединения, описанного в примере 50 восстановительным аминированием], g) 4-(3-хлороанилино)-6-(диметиламинометил)-7 Н-пирроло[2,3-d]пиримидин, h) 6-(диметиламинометил)-4-[1(R)-фенилэтиламино]-7 Н-пирроло[2,3-d]пиримидин,i) 6(пиперазинометил)-4-[1(R)-фенилэтиламино]7 Н-пирроло[2,3-d]пиримидин и(см. пример 47) и 0,7 мл N,N-диметилацетамида добавляют 13 мл хлорокиси фосфора. После перемешивания в течение 1 ч при комнатной температуре и 4 ч при 100 С реакционную смесь выливают в охлажденный льдом насыщенный раствор NaHCO3. Экстракция этилацетатом (3 раза), промывание органических слоев насыщенным раствором NaHCO3, водой и насыщенным раствором хлорида натрия, высушивание (Na2SO4) и концентрирование дают твердое вещество. Колоночная хроматография (SiO2; этилацетат) и перемешивание сырого продукта в диэтиловом эфире и гексане позволяют получить названное соединение; т.пл. 284-287 С;tRet(Grad20) = 11,8. Пример 55. 4-(3-Хлороанилино)-6-метоксиметил-7 Нпирроло [2,3-d] пиримидин. К охлажденной льдом суспензии 82,5 мг(0,30 мМ) 4-(3-хлороанилино)-6-гидроксиметил 7 Н-пирроло[2,3-d]пиримидина (см. пример 49) в 5 мл диэтилового эфира добавляют под аргоном 14 л (0,15 мМ) трехбромистого фосфора. После перемешивания в течение 18 ч при 0 С и 18 ч при комнатной температуре к полученному 4(3-хлороанилино)-6-бромометил-7 Н-пирроло[2,3-d]пиримидину добавляют 2 мл метанола. Смесь перемешивают 2 ч и затем по каплям добавляют 1 мл метанолята натрия (5,4 М в метаноле). После 18 ч смесь концентрируют в вакууме; остаток вновь растворяют в метаноле,добавляют силикагель и смесь выпаривают до сухого порошка. Порошок переносят на верх хроматографической колонкиtRet/Grad20) = 9,7. Пример 56. 6-(1N-трет-Бутилкарбамоил)-4-(3-хлороанилино)-7 Н-пирроло [2,3-d] пиримидин. К раствору 144 мг (0,50 мМ) 6-карбокси-4(3-хлороанилино)-7 Н-пирроло[2,3-d]пиримидина (см. пример 42) и 116 л (1,1 мМ) трет-бутиламина в 5 мл DMF добавляют 114 л (0,75 мМ) диэтилцианофосфата (Aldrich; Milwaukee/USA). Спустя 4 ч реакционную смесь выливают в ледяную воду, перемешивают 30 мин и,наконец, фильтруют. Остаток вновь растворяют в изопропаноле, обрабатывают древесным углем и фильтруют. Концентрирование в вакууме и промывание дихлорметаном/диэтиловым эфиром дают названное соединение; HPLC:(см. пример 50), 110 л (0,8 мМ) диметиламина (33% в этаноле) и 50 л (0,88 мМ) уксусной кислоты в 6 мл метанола и 1 мл DMPU встряхивают в течение 1 ч при 50 С. Затем добавляют около 20 мг катализатора никеля Ренея гидрирования и смесь гидрируют при 50 С. Катализатор отфильтровывают, интенсивно промывают метанолом и фильтрат концентрируют. Остаток растворяют в этилацетате и насыщенном растворе бикарбоната натрия, водный слой отделяют и дважды экстрагируют этилацетатом. Органические фазы промывают 2 раза водой и насыщенным раствором хлорида натрия, высушивают(СН 2 Сl2/метанол [10:1]); HPLC: tRet/Grad20) = 7,2. Пример 58. Используя способы, описанные в этой заявке, получают следующие соединения: a) 6 карбокси-4-(3-хлороанилино)-5-метил-7 Н-пирроло[2,3-d]пиримидин, b) 4-(3-хлороанилино)6-формил-5-метил-7 Н-пирроло[2,3-d]пиримидин, c) 4-(3-хлороанилино)-6-гидроксиметил-5 ме-тил-7 Н-пирроло[2,3-d]пиримидин,d) 5 карбокси-4-(3-хлороанилино)-6-метил-7 Нпирроло[2,3-d]пиримидин, e) 4-(3-хлороанилино)-5-формил-6-метил-7 Н-пирроло[2,3-d]пиримидин и f) 4-(3-хлороанилино)-5-гидроксиметил-6-метил-7 Н-пирроло[2,3-d]пиримидин. Пример 59. Капсулы с сухим веществом. 5000 капсул, каждая из которых содержит в качестве активного ингредиента 0,25 г одного из соединений формулы I, упомянутых в предшествующих примерах, готовят следующим образом: Композиция Активный ингредиент 1250 г Тальк 180 г Пшениный крахмал 120 г Стеарат магния 80 г Лактоза 20 г Способ приготовления: упомянутые вещества измельчают в порошок и пропускают через сито размером 0,6 мм меш. Смесь порциями по 0,33 г вводят в желатиновые капсулы с помощью машины для заполнения капсул. Пример 60. Мягкие капсулы 5000 мягких желатиновых капсул, каждая из которых содержит в качестве активного ингредиента 0,05 г одного из соединений формулы Способ приготовления: активный ингредиент измельчают в порошок и суспендируют в лаурогликоле (лаурат пропиленгликоля, Gattefosse S.A., Saint Priest, France) и подвергают обработке во влажном атомизаторе до размера частиц приблизительно от 1 до 3 м. Далее смесь порциями по 0,419 г вводят в мягкие желатиновые капсулы с помощью машины для заполнения капсул. Пример 61. Мягкие капсулы. 5000 мягких желатиновых капсул, каждая из которых содержит в качестве активного ингредиента 0,05 г одного из соединений формулыI, упомянутых в предшествующих примерах,готовят следующим образом: Композиция Активный ингредиент 250 гTween 80 1 л Способ приготовления: активный ингредиент измельчают в порошок и суспендируют вTween 80 (полиоксиэтиленсорбитана монолаурат, Atlas Chem. Ind. Inc., USA, от Fluka, Switzerland) и обрабатывают во влажном атомизаторе до размера частиц приблизительно от 1 до 3 м. Далее смесь порциями по 0,43 г вводят в мягкие желатиновые капсулы с помощью машины для заполнения капсул. Данные по биологической активности соединений формулы I в вышеописанных тестах приведены в нижеследующей таблице. Биологическая активность соединений формулы I При- EGF-R ICD ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Производное мидина формулы Iq=1,R - галоген, С 1-С 7 алкил, гидрокси, С 1 С 7 алканоилокси, C1-С 7 алкокси, карбокси, С 1 С 7 алкоксикарбонил, карбамоил, N-С 1-С 7 алкилкарбамоил, N,N-ди-С 1-С 7 алкилкарбамоил, циано, амино, С 1-С 7 алканоиламино, С 1-С 7 алкиламино, N,N-ди-С 1-С 7 алкиламино или трифторметил, причем, если в молекуле присутствуют несколько радикалов R, они могут быть одинаковыми или разными;a) R1 и R2 каждый независимо друг от друга означают ) фенил, замещенный карбамоилметокси-, карбоксиметокси-, бензилоксикарбонилметоксигруппой, С 1-С 7 алкоксикарбонилметоксигруппой, фенилом, амино-, С 1-С 7 алканоиламино-, С 1-С 7 алкиламино-, N,N-ди-С 1-С 7 алкиламино-, гидроксильной, С 1-С 7 алканоилокси-,карбоксигруппой,С 1-С 7-алкоксикарбонилом,карбамоилом, N-С 1-С 7 алкилкарбамоилом, N,Nди-С 1-С 7-алкилкарбамоилом, циано или нитрогруппой; при условии, что R1 и R2 не могут одновременно означать водород; ) водород; ) незамещенный или гало- или С 1-С 7 алкилзамещенный пиридил; ) N-бензилпиридиний-2 ил; нафтил; циано; карбокси; С 1-С 7 алкоксикарбонил; карбамоил; N-С 1-С 7 алкилкарбамоил;
МПК / Метки
МПК: A61P 35/00, A61K 31/519, C07D 471/14, C07D 487/04
Метки: пирролопиримидины, соединения, фармацевтические, композиции, включающие, эти
Код ссылки
<a href="https://eas.patents.su/30-1428-pirrolopirimidiny-i-farmacevticheskie-kompozicii-vklyuchayushhie-eti-soedineniya.html" rel="bookmark" title="База патентов Евразийского Союза">Пирролопиримидины и фармацевтические композиции, включающие эти соединения.</a>
Предыдущий патент: Тиеноазепиновые производные в качестве антагонистов вазопрессина.
Следующий патент: Антимикробная композиция для полоскания рта ( её варианты )
Случайный патент: Лифтовое устройство












