Способ лечения атеросклероза, дислипидемий и связанных с ними состояний и фармацевтические композиции
Формула / Реферат
1. Применение антагониста рецептора DP и никотиновой кислоты или ее фармацевтически приемлемой соли или сольвата в изготовлении лекарственного средства для лечения атеросклероза у пациента-человека в отсутствие существенной гиперемии.
2. Применение антагониста рецептора DP и никотиновой кислоты или ее фармацевтически приемлемой соли или сольвата в изготовлении лекарственного средства для повышения уровней HDL в сыворотке у пациента-человека в отсутствие существенной гиперемии.
3. Применение по п.1 или 2, где вводят никотиновую кислоту или ее фармацевтически приемлемые соль или сольват, и антагонист рецептора DP вызывает избирательную модуляцию рецептора DP и не вызывает существенной модуляции рецептора CRTH2.
4. Применение по пп.1 или 2, где антагонист рецептора DP выбран из группы, состоящей из соединений
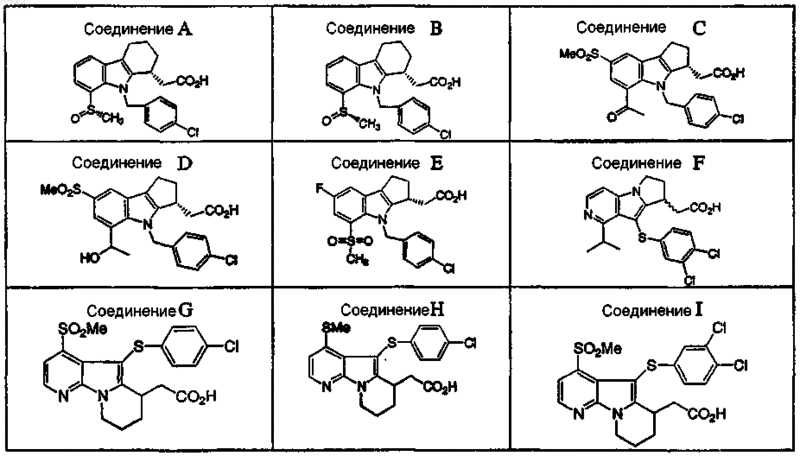

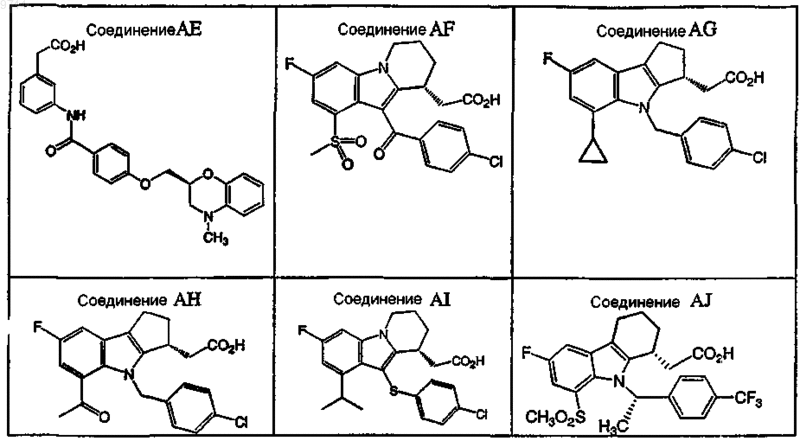
или их фармацевтически приемлемой соли или сольвата.
5. Фармацевтическая композиция, включающая в себя никотиновую кислоту или ее фармацевтически приемлемые соль или сольват, или другой агонист рецептора никотиновой кислоты и антагонист рецептора DP в сочетании с фармацевтически приемлемым носителем.
6. Фармацевтическая композиция по п.5, включающая в себя никотиновую кислоту и антагонист рецептора DP в сочетании с фармацевтически приемлемым носителем.
7. Фармацевтическая композиция по п.6, где антагонист DP выбран из группы, состоящей из соединений
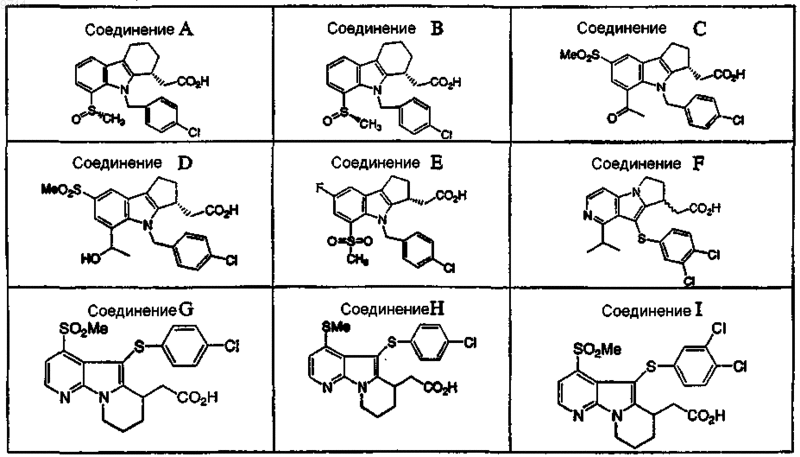
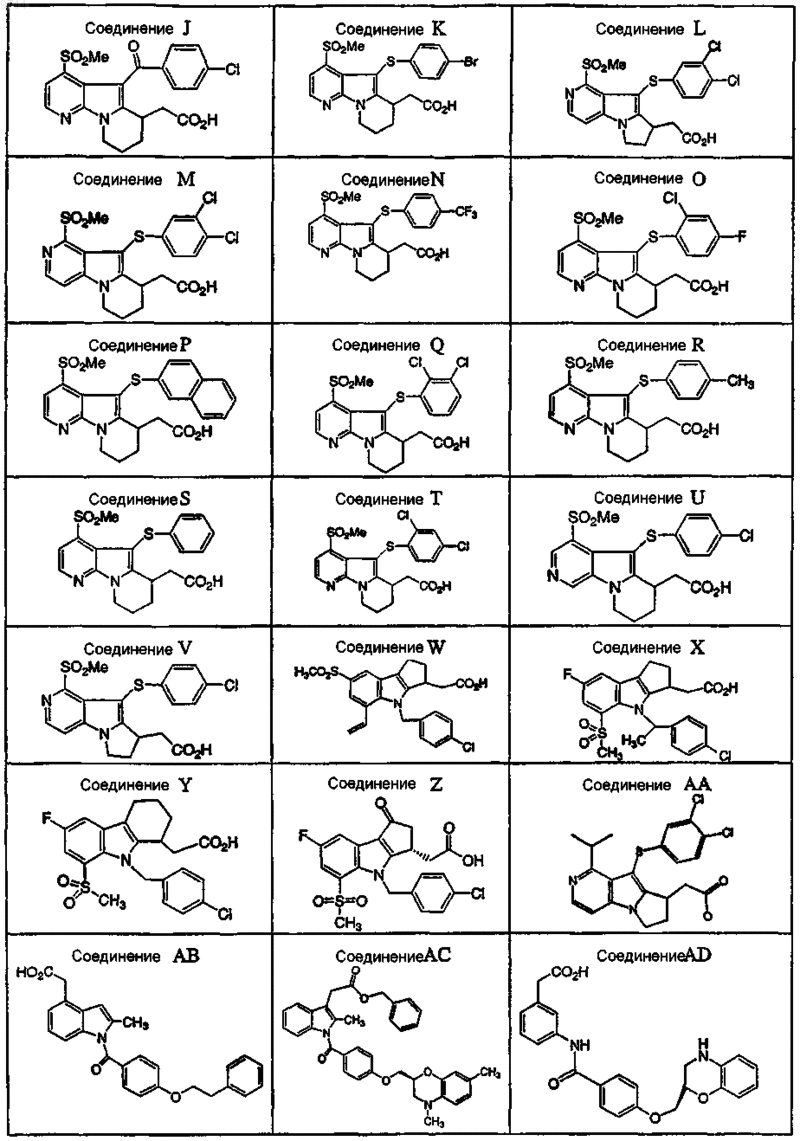
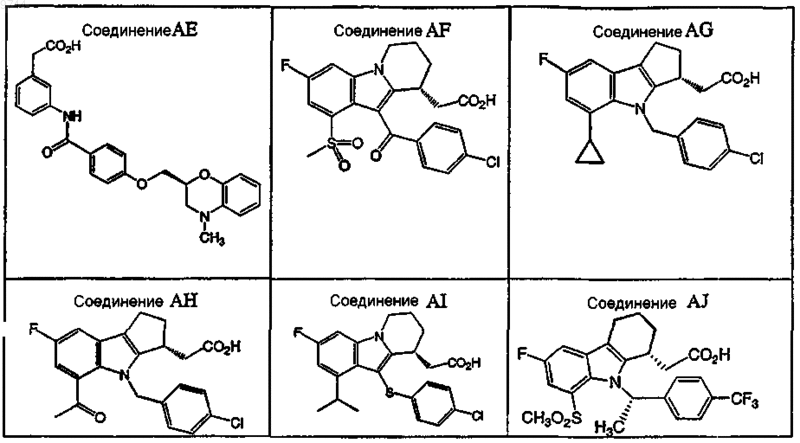
или их фармацевтически приемлемой соли или сольвата.
8. Фармацевтическая композиция по п.7, где антагонист DP выбран из группы, состоящей из соединений А, В, D, Е, X, АА, AF, AG, АН, AI и AJ.
9. Фармацевтическая композиция по пп.5, 6, 7 или 8, дополнительно включающая в себя соединение, ингибирующее HMG Со-А-редуктазу.
10. Фармацевтическая композиция по п.9, где соединение, ингибирующее HMG Со-А-редуктазу, представляет собой симвастатин.
11. Фармацевтическая композиция, содержащая никотиновую кислоту и соединение формулы Е

или их фармацевтически приемлемую соль или сольват, в сочетании с фармацевтически приемлемым носителем.
12. Фармацевтическая композиция, содержащая приблизительно 1000 мг никотиновой кислоты и антагонист DP формулы Е или их соль или сольват, в сочетании с фармацевтически приемлемым носителем.
13. Фармацевтическая композиция по п.12, где антагонист DP соединения формулы Е или его соль или сольват присутствует в количестве, составляющем приблизительно от 1 примерно до 500 мг.
14. Фармацевтическая композиция, содержащая ниацин, соединение формулы Е
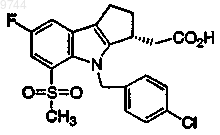
или его фармацевтически приемлемую соль или сольват и симвастатин, в сочетании с фармацевтически приемлемым носителем.
15. Фармацевтическая композиция по п.14, которая содержит приблизительно 1000 мг никотиновой кислоты, приблизительно от 1 до 500 мг антагониста DP соединения Е или его соли, или сольвата и приблизительно 20 мг симвастатина.
16. Фармацевтическая композиция, содержащая приблизительно 1000 мг никотиновой кислоты, приблизительно от 1 до 500 мг соединения Е или его фармацевтически приемлемой соли или сольвата; приблизительно от 20 до 40 мг симвастатина и фармацевтически приемлемый носитель.
17. Фармацевтическая композиция по любому из пп.5-16, представленная в виде таблетки или капсулы.
18. Фармацевтическая композиция по любому из пп.5-17, представленная в виде таблетки.
19. Фармацевтическая композиция по любому из пп.5-17, представленная в виде таблетки или капсулы с замедленным высвобождением.
20. Фармацевтическая композиция по п.18, представленная в виде таблетки с замедленным высвобождением.
21. Фармацевтическая композиция, содержащая никотиновую кислоту и соединение формулы F или АА

или их фармацевтически приемлемую соль или сольват, в сочетании с фармацевтически приемлемым носителем.
22. Фармацевтическая композиция, содержащая приблизительно 1000 мг никотиновой кислоты и антагонист DP формулы F или АА или его соль или сольват, в сочетании с фармацевтически приемлемым носителем.
23. Фармацевтическая композиция по п.22, в которой антагонист DP соединения формулы F или АА или его соли или сольвата присутствует в количестве, составляющем приблизительно от 1 до 500 мг.
24. Фармацевтическая композиция, содержащая ниацин, соединение формулы F или АА

или их фармацевтически приемлемую соль или сольват и симвастатин, в сочетании с фармацевтически приемлемым носителем.
25. Фармацевтическая композиция по п.24, которая содержит приблизительно 1000 мг никотиновой кислоты, приблизительно от 1 до 500 мг антагониста DP соединения формулы F или АА или их соли или сольвата и приблизительно 20 мг симвастатина.
26. Фармацевтическая композиция, которая содержит приблизительно 1000 мг никотиновой кислоты, приблизительно от 1 до 500 мг соединения формулы F или АА или его фармацевтически приемлемой соли или сольвата, приблизительно от 20 до 40 мг симвастатина и фармацевтически приемлемый носитель.
27. Фармацевтическая композиция по любому из пп.21-26, представленная в виде таблетки или капсулы.
28. Фармацевтическая композиция по любому из пп.21-26, представленная в виде таблетки.
29. Фармацевтическая композиция по любому из пп.21-27, представленная в виде таблетки или капсулы с замедленным высвобождением.
30. Фармацевтическая композиция по п.28, представленная в виде таблетки с замедленным высвобождением.
Текст
009744 Предпосылки изобретения Ниацин, или никотиновая кислота (пиридин-3-карбоновая кислота), представляет собой лекарственное средство, широко известное своим эффектом повышения уровня липопротеинов высокой плотности (HDL) в сыворотке. Однако применение никотиновой кислоты часто связано с расширением кровеносных сосудов кожи, иногда называемым гиперемией. Этот побочный эффект обусловлен зависимым от никотиновой кислоты высвобождением в коже простагландина D2 и является столь тяжелым, что многие пациенты прерывают лечение никотиновой кислотой. Настоящее изобретение относится к лечению атеросклероза, дислипидемий, диабета и связанных с ними состояний посредством введения никотиновой кислоты или другого агониста рецептора никотиновой кислоты в сочетании с соединением, так снижающим или устраняющим происходящее в противном случае расширение кровеносных сосудов кожи, что лечение можно продолжать без существенной гиперемии. У человека это достигают посредством введения никотиновой кислоты или агониста рецептора никотиновой кислоты и соединения, являющегося антагонистом рецептора DP. С простагландином D2 взаимодействуют рецепторы различных подтипов. Один рецептор простагландина D2 обозначают как "DP", а другой рецептор простагландина D2 известен как "CRTH2". Для предотвращения, минимизирования или снижения гиперемии, которая может происходить в противном случае, в настоящем изобретении используют антагонизм к рецептору DP. Таким образом, одной из целей настоящего изобретения является устранение или снижение существенной гиперемии (частоты и/или тяжести) в качестве побочного эффекта в процессе лечения у человека атеросклероза, дислипидемии, диабета и связанных с ними состояний с использованием никотиновой кислоты или другого агониста рецептора никотиновой кислоты. Другой целью настоящего изобретения является обеспечение комбинированного лечения атеросклероза, снижающего побочные эффекты в целом. Еще одной целью является обеспечение фиксированной комбинации фармацевтической композиции для перорального применения. Эти и другие цели очевидны из предоставленного здесь описания изобретения. Сущность изобретения Представлен способ лечения атеросклероза у пациента-человека при необходимости такого лечении, включающий в себя получение пациентом никотиновой кислоты, или ее соли, или сольвата, или другого агониста рецептора никотиновой кислоты и антагониста рецептора DP в количествах, эффективных для лечения атеросклероза в отсутствие существенной гиперемии. Краткое описание черетжей Изобретение иллюстрируют посредством прилагающихся здесь фигур, в которых на фиг. 1 представлен график, на котором показано ингибирование соединением D вызываемого простагландином D2 расширения кровеносных сосудов у мыши; на фиг. 2 - график, на котором показано ингибирование соединением D вызываемого никотиновой кислотой расширения кровеносных сосудов у мыши; на фиг. 3 - график, на котором показано ингибирование другими выбранными соединениями вызываемого никотиновой кислотой расширения кровеносных сосудов у мыши. Подробное описание изобретения Ниацин, или никотиновая кислота (пиридин-3-карбоновая кислота), представляет собой лекарственное средство, широко известное своим эффектом повышения уровня липопротеинов высокой плотности (HDL) в сыворотке, а также другими благоприятными изменениями липидного профиля (снижением липопротеинов очень низкой плотности (VLDL) и низкой плотности (LDL), триглицеридов, свободных жирных кислот (FFA) и липопротеина(a)[Lp(а)]). При получении человеком в терапевтически эффективных дозах, таких как приблизительно от 50 мг до таких высоких как приблизительно 8 г в сутки, никотиновая кислота повышает уровень HDL. Однако никотиновая кислота часто вызывает расширение кровеносных сосудов кожи, иногда называемое гиперемией. Гиперемия обычно вызывает покраснение кожи,сопровождающееся ощущением тепла, зудом или раздражением. Она может быть исключительно неприятна и столь тяжела, что многие пациенты прерывают лечение никотиновой кислотой. Настоящее изобретение относится к лечению, профилактике или обращению развития атеросклероза и других заболеваний и состояний, здесь описанных, никотиновой кислотой, или ее солью, или сольватом, или другим агонистом рецептора никотиновой кислоты без существенной гиперемии. У человека этого достигают посредством введения никотиновой кислоты, или ее соли, или сольвата, или другого агониста рецептора никотиновой кислоты и соединения, представляющего собой антагонист рецептора DP, что предотвращает, снижает или минимизирует частоту и/или тяжесть эффекта гиперемии. Существуют по меньшей мере два рецептора, взаимодействующих с простагландином D2 и обозначающихся как "DP" и "CRTH2". Настоящее изобретение преимущественно относится к никотиновой кислоте или агонистам рецептора никотиновой кислоты, применяемым в сочетании с антагонистами рецептора DP. В одном из аспектов, представляющем интерес, изобретение относится к способу лечения атеросклероза у пациента-человека при необходимости такого лечения, включающему в себя получение паци-1 009744 ентом никотиновой кислоты, или ее соли, или сольвата, или другого агониста рецептора никотиновой кислоты и антагониста рецептора DP в количествах, эффективных для лечения атеросклероза в отсутствие существенной гиперемии. В другом представляющем интерес аспекте изобретение относится к способу повышения уровняHDL в сыворотке пациента-человека, при необходимости такого лечения, включающему в себя получение пациентом никотиновой кислоты, или ее соли, или сольвата, или другого агониста рецептора никотиновой кислоты и антагониста рецептора DP, где указанное сочетание эффективно для повышения уровня HDL в сыворотке пациента в отсутствие существенной гиперемии. В другом представляющем интерес аспекте изобретение относится к способу лечения дислипидемии у пациента-человека, при необходимости такого лечения, включающему в себя получение пациентом никотиновой кислоты, или ее соли, или сольвата, или другого агониста рецептора никотиновой кислоты и антагониста рецептора DP в количествах, эффективных для лечения дислипидемии в отсутствие существенной гиперемии. В другом представляющем интерес аспекте изобретение относится к способу снижения уровнейVLDL или LDL в сыворотке пациента-человека, при необходимости такого лечения, включающему в себя получение пациентом никотиновой кислоты, или ее соли, или сольвата, или другого агониста рецептора никотиновой кислоты и антагониста рецептора DP в количествах, эффективных для снижения уровней VLDL или LDL в сыворотке пациента в отсутствие существенной гиперемии. В другом представляющем интерес аспекте изобретение относится к способу снижения уровня триглицеридов в сыворотке пациента-человека, при необходимости такого лечения, включающему в себя получение пациентом никотиновой кислоты, или ее соли, или сольвата, или другого агониста рецептора никотиновой кислоты и антагониста рецептора DP в количествах, эффективных для снижения уровня триглицеридов в сыворотке пациента в отсутствие существенной гиперемии. В другом представляющем интерес аспекте изобретение относится к способу снижения уровняLp(a) в сыворотке пациента-человека, при необходимости такого лечения, включающему в себя получение пациентом никотиновой кислоты, или ее соли, или сольвата, или другого агониста рецептора никотиновой кислоты и антагониста рецептора DP в количествах, эффективных для снижения уровня Lp(a) в сыворотке пациента в отсутствие существенной гиперемии. Здесь Lp(a) относится к липопротеину(а). В представляющем особый интерес аспекте изобретение относится к каждому из вышеописанных способов, где используют никотиновую кислоту, или ее соль, или сольват. Более конкретный интерес представляет собой применение никотиновой кислоты. Кроме того, в еще одном представляющем интерес аспекте изобретение относится к избирательной модуляции рецептора DP антагонистом рецептора DP в количествах, эффективных для снижения или предотвращения эффекта гиперемии у пациента. В другом представляющем особый интерес аспекте изобретение относится к каждому из вышеописанных способов, где используют никотиновую кислоту и антагонист рецептора DP вызывает избирательную модуляцию рецептора DP и не вызывает существенной модуляции рецептора CRTH2. В другом представляющем особый интерес аспекте изобретение относится к способу лечения атеросклероза, дислипидемий, диабета или связанных с ними состояний у пациента-человека при необходимости такого лечения, включающему в себя получение пациентом никотиновой кислоты, или ее соли,или сольвата, или другого агониста рецептора никотиновой кислоты и антагониста рецептора DP, где указанное сочетание вводят в количестве, эффективном для лечения атеросклероза, дислипидемий, диабета или связанного с ними состояния в отсутствие существенной гиперемии. В еще одном аспекте изобретение относится к применению соединения антагониста рецептора DP в сочетании с никотиновой кислотой, или ее солью, или сольватом, или другим агонистом рецептора никотиновой кислоты для лечения атеросклероза у человека в отсутствие существенной гиперемии. В другом представляющем особый интерес аспекте изобретение относится к вышеописанным способам, где антагонист рецептора DP выбран из группы, включающей в себя соединения от А до AJ и их фармацевтически приемлемые соли и сольваты. Примеры соединений, особенно подходящих для применения в качестве селективных антагонистов рецепторов DP и подавляющих эффект гиперемии, включают в себя следующие: а также их фармацевтически приемлемые соли и сольваты. Здесь атеросклероз относится к форме сосудистого заболевания, характеризующегося накоплением атеросклеротических бляшек, содержащих холестерин и липиды во внутренней оболочке стенок крупных и средних артерий. Атеросклероз включает в себя сосудистые заболевания и состояния, которые распознаются врачами, практикующими в соответствующих областях медицины, и понятны им. Термины "атеросклероз" и "атеросклеротическая болезнь" описывают атеросклеротическое сердечнососудистое заболевание, включающее в себя рестеноз вследствие процедур реваскуляризации, коронарную болезнь сердца (также известную как болезнь коронарных артерий или ишемическая болезнь сердца), цереброваскулярную болезнь, включая мультиинфарктную деменцию, и болезнь периферических сосудов, включая эректильную дисфункцию, поскольку все они представляют собой клинические проявления атеросклероза. Термин "дислипидемия", применяемый в общепринятом смысле, относится к отклоняющимся от нормы уровням таких липидов плазмы как HDL (низкий), LDL (высокий), VLDL (высокий), триглицериды (высокий), липопротеин(а) (высокий), FFA (высокий) и других липидов сыворотки или их сочетаний. Это может быть неосложненное состояние или звено конкретного соответствующего заболевания или состояния, такого как диабет (диабетическая дислипидемия), метаболический синдром и т.п. Таким образом, в настоящее изобретение включены неосложненные дислипидемии, а также те, что связаны с лежащими в их основе состояниями. Термин "пациент" включает в себя млекопитающих, в особенности человека, применяющих настоящие активные вещества для профилактики или лечения медицинского состояния. Введение пациентом лекарственных средств включает в себя как введение самим пациентом, так и введение пациенту другим индивидуумом. У пациента может быть необходимость в лечении уже имеющегося заболевания или медицинского состояния или желание профилактического лечения для предотвращения или снижения риска развития атеросклероза. Под термином "терапевтически эффективное количество" предполагают количество лекарственного средства, вызывающее требуемый биологический или медицинский ответ. Например, никотиновую кислоту часто вводят в дозах приблизительно от 50 мг до приблизительно 8 г каждые сутки. Термины "профилактически эффективное количество" и "количество, эффективное для предотвра-4 009744 щения", относятся к количеству лекарственного средства, предотвращающего или снижающего риск развития биологического или медицинского события, которое нужно предотвратить. Во многих случаях профилактически эффективное количество - то же, что и терапевтически эффективное количество. Описанное здесь изобретение включает в себя введение соединений и композиций, описанных здесь, для предотвращения или снижения риска развития или повторного развития, если существует такая вероятность, события ишемической болезни сердца, цереброваскулярного события и/или перемежающейся хромоты. Под явлениями коронарной болезни сердца (CHD) подразумевают, в частности,смерть от CHD, инфаркт миокарда (т.е. сердечный приступ) и процедуры коронарной реваскуляризации. Под цереброваскулярными явлениями подразумевают, в частности, ишемический или геморрагический инсульты (известные также как острые нарушения мозгового кровообращения) и транзиторные ишемические атаки. Перемежающаяся хромота представляет собой клиническое проявление болезни периферических сосудов. Здесь под термином "событие атеросклеротической болезни" подразумевают, в частности, явления коронарной болезни сердца, цереброваскулярные явления и перемежающуюся хромоту. Предполагается, что индивидуумы, перенесшие одно или более несмертельных событий атеросклеротической болезни, представляют собой индивидуумов, для которых существует вероятность повторного развития таких событий. Соответственно, настоящее изобретение также предоставляет способ предотвращения или снижения риска первичного или последующего развития явлений атеросклеротической болезни, включающий в себя введение пациенту, в случае наличия риска такого события, профилактически эффективного количества соединений, описанных здесь, с предотвращением или минимизацией существенной гиперемии. Во время введения пациент может уже иметь атеросклеротическую болезнь или риск ее развития. Кроме того, способ относится к предотвращению или замедлению формирования нового очага поражения или атеросклеротической бляшки и предотвращению или замедлению развития существующих очагов поражения или бляшек, а также обращению развития существующих очагов поражения или бляшек с предотвращением или минимизацией существенной гиперемии. Соответственно, в одном из аспектов настоящее изобретение относится к способу остановки или замедления развития атеросклероза, а также остановки или замедления развития атеросклеротических бляшек, включающему в себя получение пациентом, при необходимости такого лечения, терапевтически эффективного количества любого из описанных здесь антагонистов рецептора DP в сочетании с никотиновой кислотой или другим агонистом рецептора никотиновой кислоты. Этот способ также относится к остановке или замедлению развития атеросклеротических бляшек, существующих на момент начала настоящего лечения (т.е. "существующих атеросклеротических бляшек"), а также к остановке или замедлению образования новых атеросклеротических бляшек у пациентов с атеросклерозом. В другом аспекте настоящее изобретение относится к способу предотвращения или снижения риска разрыва атеросклеротической бляшки, включающему в себя введение пациенту, при необходимости такого лечения, профилактически эффективного количества любого из описанных здесь соединений вместе с никотиновой кислотой или другим агонистом рецептора никотиновой кислоты. Как применяют здесь,разрыв относится к отрыву бляшки, могущей попасть в кровеносные сосуды. В дополнительном аспекте настоящее изобретение относится к способу предотвращения или снижения риска развития атеросклероза, включающему в себя получение пациентом, при необходимости такого лечения, профилактически эффективного количества описанных здесь соединений. В другом аспекте изобретение относится к способу лечения или предотвращения атеросклероза,дислипидемий или связанного с ними состояния, включающему в себя предварительное лечение пациента-человека, при необходимости такого лечения, эффективным для ингибирования или снижения гиперемии количеством антагониста рецептора DP, а затем лечение указанного пациента никотиновой кислотой, ее солью, или сольватом, или другим агонистом рецептора никотиновой кислоты в количествах, эффективных для лечения или предотвращения указанных атеросклероза, дислипидемий или связанного с ними состояния в отсутствие существенной гиперемии. Кроме того, в другом аспекте изобретение относится к вышеописанному способу, дополнительно включающему в себя предварительное лечение или лечение пациента ингибитором HMG Со-Аредуктазы. В другом аспекте изобретение относится к способу лечения или предотвращения вышеуказанных состояний, где ингибитор HMG Со-А-редуктазы представляет собой симвастатин. В одном из аспектов описанные здесь способы относятся к применению никотиновой кислоты или соединения другого агониста рецептора никотиновой кислоты в количестве, эффективном для достижения описанных здесь результатов, и антагониста рецептора DP, избирательно регулирующего рецепторDP без существенной регуляции рецептора CRTH2. Так, антагонист рецептора DP обладает сродством к рецептору DP (т.е. Ki), по меньшей мере приблизительно в 10 раз более высоким (численно меньшей величиной Ki), чем сродством к рецептору CRTH2. Любое соединение, избирательно взаимодействующее сDP согласно этим правилам, считается "DP-селективным". Фраза "в отсутствие существенной гиперемии" относится к побочному эффекту, который часто на-5 009744 блюдают при введении никотиновой кислоты в терапевтических количествах. Гиперемический эффект никотиновой кислоты обычно становится менее частым и менее тяжелым по мере развития у пациента толерантности к лекарственному средству в терапевтических дозах, однако,в некоторой степени эффект гиперемии все равно присутствует. Таким образом, "в отсутствие существенной гиперемии" относится к снижению тяжести гиперемии, когда она возникает, или меньшим, чем происходит в ином случае, событиям гиперемии. Предпочтительно частоту возникновения гиперемии снижают по меньшей мере приблизительно на треть, более предпочтительно, если частоту возникновения снижают наполовину, и наиболее предпочтительно, если частоту возникновения гиперемии снижают приблизительно на две трети и более. Сходным образом, тяжесть предпочтительно снижают по меньшей мере приблизительно на треть, более предпочтительно по меньшей мере наполовину и наиболее предпочтительно по меньшей мере приблизительно на две трети. Очевидно, что стопроцентное снижение частоты возникновения и тяжести гиперемии представляет собой наиболее предпочтительное, но не требующееся. Специфические для любого конкретного пациента уровни дозы и режим введения дозы зависят от различных факторов, включая возраст пациента, массу его тела, общее состояние здоровья, пол, диету,время введения, способ введения, скорость выведения, комбинацию лекарственных средств и тяжесть состояния пациента. Рассмотрение этих факторов входит в сферу действий обычного клинического врача-специалиста в целях определения терапевтически эффективного или профилактически эффективного количества дозы, необходимой для предотвращения, обращения или остановки развития состояния. Предполагается, что описанные здесь соединения будут вводиться на ежедневной основе в течение периода, предназначенного для лечения или предотвращения соответствующего медицинского состояния пациента, включая курс лечения, продолжающийся месяцы, годы или всю жизнь пациента. С описанными здесь соединениями можно вводить одно или более дополнительных активных веществ. Дополнительное активное вещество или вещества могут представлять собой соединения, модифицирующие липиды, или вещества, обладающие другими фармацевтическими активностями, или вещества, обладающие как липид-модифицирующими эффектами, так и другими фармацевтическими активностями. Примеры дополнительных активных веществ, которые можно применять, включают в себя, не ограничиваясь ими, ингибиторы HMG-CoA-редуктазы, которые, в свою очередь, включают в себя статины в форме лактона или свободной дигидроксилированной кислоты и их фармацевтически приемлемые соли и сложные эфиры, включая, но не ограничиваясь ими, ловастатин (см. патент США 4342767),симвастатин (см. патент США 4444784), симвастатин в форме свободной дигидроксилированной кислоты, в особенности ее аммониевой или кальциевой солей, правастатин, в особенности его натриевую соль (см. патент США 4346227), флувастатин, в особенности его натриевую соль (см. патент США 5354772), аторвастатин, в особенности его кальциевую соль (см. патент США 5273995), питавастатин, также известный в качестве NK-104 (см. номер международной публикации РСТ WO 97/23200) и розувастатин, также известный в качестве ZD-4522, (CRESTOr; см. патент США 5260440); ингибиторы HMG-CoA-синтазы; ингибиторы сквален-эпоксидазы; ингибиторы сквален-синтетазы (также известные в качестве ингибиторов сквален-синтазы); ингибиторы ацил-СоА-холестерин-ацилтрансферазы(АСАТ), включая селективные ингибиторы АСАТ-1 или АСАТ-2, а также ингибиторы двойного действия, АСАТ-1 и -2; ингибиторы микросомального белка-переносчика триглицеридов (МТР); ингибиторы эндотелиальной липазы; средства, связывающие желчные кислоты; средства, индуцирующие рецепторLPL; ингибиторы агрегации тромбоцитов, например антагонисты гликопротеинового IIb/IIIa рецептора фибриногена и аспирин; агонисты активируемого пероксисомным пролифератором рецептора гамматипа человека (PPAR), включая соединения, обычно известные в качестве глитазонов, например пиоглитазон и росиглитазон, и включая соединения, входящие в структурный класс, известный в качестве тиазолидиндионов, а также агонисты PPAR, не входящие в структурный класс тиазолидиндионов; агонисты PPAR, такие как клофибрат, фенофибрат, включая микронизированный фенофибрат, и гемфиброзил; агонисты PPAR двойного действия, /; витамин В 6 (также известный в качестве пиридоксина) и его фармацевтически приемлемые соли, такие как соль HCl; витамин В 12 (также известный в качестве цианкобаламина); фолиевая кислота или ее фармацевтически приемлемые соль или сложный эфир, такие как натриевая соль и метилглукаминовая соль; витамины-антиоксиданты, такие как витамины С и Е и бета-каротин; бета-блокаторы; антагонисты ангиотензина I, такие как лозартан; ингибиторы ангиотензинпревращающего фермента, такие как эналаприл и каптоприл; ингибиторы ренина; блокаторы кальциевых каналов, такие как нифедипин и дилтиазем; антагонисты эндотелина; вещества, повышающие экспрессию гена АВСА 1; соединения, ингибирующие белок-переносчик эфиров холестерина (СЕТР); соединения, ингибирующие белок-активатор) 5-липоксигеназы (FLAP); соединения, ингибирующие 5 липоксигеназу (5-LO); лиганды Х-рецептора фарнезоида (FXR), включающие в себя как антагонисты, так и агонисты; лиганды Х-рецептора печени типа альфа (LXR); лиганды LXR-бета; соединения дифосфонатов, такие как алендронат натрия; ингибиторы циклооксигеназы-2, такие как рофекоксиб и целекоксиб; и соединения, снижающие сосудистое воспаление. В настоящем изобретении можно также применять ингибиторы всасывания холестерина. Такие со-6 009744 единения препятствуют перемещению холестерина из просвета кишечника в энтероциты стенки тонкого кишечника, снижая таким образом уровень холестерина в сыворотке. Примеры ингибиторов всасывания холестерина описаны в патентах США 5846966, 5631365, 5767115, 6133001, 5886171, 5856473,5756470, 5739321, 5919672 и заявках РСТWO 00/63703, WO 00/60107, WO 00/38725, WO 00/34240,WO 00/20623, WO 97/45406, WO 97/16424, WO 97/16455 и WO 95/08532. Наиболее значимый ингибитор всасывания холестерина представляет собой эзетимиб, также известный в качестве 1-(4-фторфенил)3(R)-[3(S)-(4-фторфенил)-3-гидроксипропил)]-4(S)-(4-гидроксифенил)-2-азетидинона, описанный в патентах США 5767115 и 5846966. Терапевтически эффективные количества ингибиторов всасывания холестерина включают в себя дозы приблизительно от 0,01 мг на кг массы тела приблизительно до 30 мг на кг массы тела в сутки,предпочтительно приблизительно от 0,1 мг/кг приблизительно до 15 мг/кг. Пациенты, больные диабетом, могут получать соединения, используемые в настоящем изобретении,с традиционными диабетическими лекарственными средствами. Например, пациент, больной диабетом,которому проводят описанное здесь лечение, может также принимать инсулин или антидиабетическое лекарственное средство перорального применения. Метформин представляет собой один из примеров такого антидиабетического лекарственного средства перорального применения. Информация о дозах Как применяют здесь, никотиновая кислота относится к пиридин-3-карбоновой кислоте. Однако в настоящем изобретении применяют также соли и сольваты никотиновой кислоты, и в настоящем изобретении применимы многочисленные фармацевтически приемлемые соли и сольваты никотиновой кислоты. Применимые, как описано здесь, соли представляют собой соли щелочных металлов, в частности натриевые и калиевые. Сходным образом, щелочно-земельные металлы, в частности кальций и магний,образуют применимые здесь соли. Также применимые здесь соли представляют собой различные соли аминов, таких как аммоний и соединения замещенного аммония. Сходным образом в объеме настоящего изобретения применимы сольватированные формы никотиновой кислоты. Примеры включают в себя полугидрат, моно-, ди-, три- и полуторогидраты. Особый интерес в настоящем изобретении представляет применение свободной кислоты, пиридин-3-карбоновой кислоты. Как описано здесь, для снижения или предотвращения эффекта гиперемии у пациентов млекопитающих, в особенности человека, применимы антагонисты DP в дозах в диапазоне от таких низких, как приблизительно 0,01 мг/кг/сутки, до таких высоких, как приблизительно 100 мг/кг/сутки, вводимых как разовая или дробная суточная доза. Предпочтительны дозы разовые или дробные суточные дозы приблизительно от 0,1 мг/сутки до таких высоких, как приблизительно 1,0 г/сутки. Как описано здесь, подходящая разовая или дробная суточная доза никотиновой кислоты входит в диапазон от такой низкой, как приблизительно 50 мг/сутки, до такой высокой, как приблизительно 8 г/сутки. Первоначально можно применять низкие дозы, а для дальнейшего снижения эффекта гиперемии дозы можно повышать. Дозы агонистов рецептора никотиновой кислоты, отличных от никотиновой кислоты, варьируют в широком диапазоне. В основном применимые для лечения атеросклероза агонисты рецептора никотиновой кислоты получают в количествах в диапазоне от таких низких, как приблизительно 0,01 мг/кг/сутки,до таких высоких, как приблизительно 100 мг/кг/сутки, в разовой или дробной дозах. Обычная доза составляет приблизительно от 0,1 мг/сутки до приблизительно 2 г/сутки. Соединения, применяемые в настоящем изобретении, можно вводить посредством любого общепринятого способа введения. Предпочтителен пероральный способ введения. Никотиновую кислоту, ее соль, или сольват, или другой агонист рецептора никотиновой кислоты и антагонист DP можно вводить вместе или последовательно в суточных дозах, однократно или многократно, например два, три или четыре раза в сутки, оставаясь в объеме изобретения. Если желательно особо длительное высвобождение, такое, когда длительное высвобождение продукта характеризуют профилем высвобождения, выходящим за пределы 24 ч, дозы можно вводить каждые следующие сутки. Однако предпочтительны однократные суточные дозы. Сходным образом можно применять введение доз утром или вечером. Фармацевтические композиции Описанные здесь фармацевтические композиции в основном включают в себя никотиновую кислоту или другой агонист рецептора никотиновой кислоты, антагонист рецептора DP и фармацевтически приемлемый носитель. Примеры приемлемых композиций для перорального применения включают в себя таблетки, капсулы, пастилки, лекарственные леденцы, суспензии, дисперсные порошки или гранулы, эмульсии, сиропы и эликсиры. Примеры ингредиентов носителя включают в себя разбавители, связующие вещества,дезинтегрирующие вещества, смазывающие вещества, подсластители, ароматизаторы, красители, консерванты и т.п. Примеры разбавителей включают в себя, например, карбонат кальция, карбонат натрия,лактозу, фосфат кальция и фосфат натрия. Примеры гранулярных веществ и дезинтегрирующих веществ включают в себя кукурузный крахмал и альгиновую кислоту. Примеры связующих веществ включают в себя крахмал, желатин и гуммиарабик. Примеры смазывающих веществ включают в себя стеарат магния,-7 009744 стеарат кальция, стеариновую кислоту и тальк. Таблетки могут быть не покрытыми или покрытыми оболочкой посредством известных способов. Такие оболочки могут задерживать распад и, таким образом,всасывание в желудочно-кишечном тракте и посредством этого обеспечивать длительное действие в течение более продолжительного периода. В одном из осуществлений изобретения никотиновую кислоту, ее соль, или сольват, или другой агонист рецептора никотиновой кислоты сочетают с антагонистом рецептора DP и носителем, образуя фиксированную комбинацию продукта. Эта фиксированная комбинация продукта может представлять собой таблетку или капсулу для перорального применения. Более конкретно, в другом осуществлении изобретения таблетку или капсулу для перорального применения получают, сочетая никотиновую кислоту, или ее соль, или сольват, или другой агонист рецептора никотиновой кислоты (от приблизительно 1 до приблизительно 1000 мг) и антагонист рецептораDP (от приблизительно 1 до приблизительно 500 мг) с фармацевтически приемлемым носителем. Длительное высвобождение в течение более продолжительного периода может быть особенно важно в подборе состава фармацевтических композиций никотиновой кислоты. Особенно предпочтительны таблетки длительного высвобождения. Например, можно применять такие вещества, создающие временную задержку, как глицерилмоностеарат или глицерилдистеарат. Лекарственные формы могут быть также покрыты оболочкой посредством способов, описанных в патентах США 4256108; 4166452 и 4265874, образуя таблетки терапевтического осмотического действия с контролируемым высвобождением. Также доступны и входят сюда другие способы контролируемого высвобождения. Обычные ингредиенты, применимые для замедления высвобождения никотиновой кислоты из таблеток с длительным высвобождением, включают в себя различные соединения целлюлозы, такие как метилцеллюлоза, этилцеллюлоза, пропилцеллюлоза, гидроксипропилцеллюлоза, гидроксиэтилцеллюлоза, гидроксипропилметилцеллюлоза, микрокристаллическая целлюлоза, крахмал и т.п. В составах лекарственных средств длительного высвобождения также применимы различные естественные и синтетические вещества. Примеры включают в себя альгиновую кислоту и различные альгинаты, поливинилпирролидон, трагакантовую камедь, смолу плодоворожкового дерева, гуаровую камедь, желатин, различные длинноцепочечные спирты, такие как цетиловый спирт, и пчелиный воск. Особенный интерес представляют таблетки длительного высвобождения, в которых применяют никотиновую кислоту в сочетании с одним или более указанными выше соединениями целлюлозы, прессованные для образования полимерной основы в таблетки длительного высвобождения. Соединение антагониста DP можно включать в смесь перед прессованием или покрывать им наружную поверхность основы. В осуществлении, представляющем больший интерес, сочетают никотиновую кислоту и основообразующее вещество и прессуют, образуя ядро длительного высвобождения, а соединение антагониста DP смешивают с одним или более покровных веществ и покрывают наружную поверхность ядра. Еще больший интерес представляет собой вышеописанная таблетка, которую дополнительно, но не обязательно, покрывают ингибитором HMG Со-А-редуктазы, например симвастатином. Это конкретное осуществление включает в себя, таким образом, три активных вещества, ингибитор HMG Со-Аредуктазы и антагонист DP, высвобождение которых может в основном происходить при проглатывании,и никотиновую кислоту, высвобождение которой может происходить в течение более продолжительного периода, как описано выше. Обычные временные пределы высвобождения для таблеток длительного высвобождения в соответствии с настоящим изобретением входят в диапазон приблизительно от 1 до столь длительных как приблизительно 48 ч, предпочтительно приблизительно от 4 приблизительно до 24 ч и более предпочтительно приблизительно от 8 приблизительно до 16 ч. Другую твердую лекарственную форму для перорального применения составляют твердые желатиновые капсулы. Такие капсулы сходным образом, как описано выше, включают в себя активные вещества в смеси с веществами-носителями. Мягкие желатиновые капсулы включают в себя активные вещества в смеси с водорастворимыми растворителями, такими как пропиленгликоль, полиэтиленгликоль и этанол, или с маслами, такими как арахисовое масло, вазелиновое масло или оливковое масло. Также рассматривают водные суспензии в качестве содержащих активное вещество в смеси с эксципиентами, приемлемыми для получения водных суспензий. Такие эксципиенты включают в себя суспендирующие вещества, например карбоксиметилцеллюлозу натрия, метилцеллюлозу, гидроксипропилметилцеллюлозу, альгинат натрия, поливинилпирролидон, трагакантовую камедь и гуммиарабик; диспергирующие вещества или увлажнители, например лецитин; консерванты, например этил- или нпропил-пара-гидроксибензоат; красители; ароматизаторы; подсластители и т.п. Смесь активных веществ с диспергирующим веществом или увлажнителем, суспендирующим веществом и одним или более консервантами получают посредством добавления воды к дисперсным порошкам и гранулам, приемлемым для получения водной суспензии. Примеры приемлемых диспергирующих веществ или увлажнителей и суспендирующих веществ уже приведены выше. Также в рецептуру могут входить сиропы и эликсиры.-8 009744 Фармацевтическая композиция, представляющая особый интерес, представляет собой таблетку длительного высвобождения, включающую в себя никотиновую кислоту, или ее соль, или сольват и антагонист рецептора DP в сочетании с фармацевтически приемлемым носителем. Другая фармацевтическая композиция, представляющая особый интерес, представляет собой таблетку длительного высвобождения, включающую в себя никотиновую кислоту, или ее соль, или сольват,антагонист рецептора DP и ингибитор HMG Со-А-редуктазы в сочетании с фармацевтически приемлемым носителем. Еще одна фармацевтическая композиция, представляющая еще больший интерес, представляет собой таблетку длительного высвобождения, включающую в себя никотиновую кислоту, антагонист рецептора DP и симвастатин в сочетании с фармацевтически приемлемым носителем. Еще одна фармацевтическая композиция, представляющая особый интерес, представляет собой таблетку длительного высвобождения, включающую в себя никотиновую кислоту и антагонист рецептораDP, который выбран из группы, включающей в себя соединения от А до AJ, в сочетании с фармацевтически приемлемым носителем. Еще одна фармацевтическая композиция, представляющая больший интерес, включает в себя никотиновую кислоту и соединение в качестве антагониста рецептора DP, который выбран из группы, включающей в себя соединения А, В, D, Е, X, АА, AF, AG, АН, AI и AJ в сочетании с фармацевтически приемлемым носителем. Еще одна фармацевтическая композиция, представляющая особый интерес, включает в себя никотиновую кислоту и соединение А в качестве антагониста рецептора DP в сочетании с фармацевтически приемлемым носителем. Еще одна фармацевтическая композиция, представляющая больший интерес, включает в себя никотиновую кислоту и соединение В в качестве антагониста рецептора DP в сочетании с фармацевтически приемлемым носителем. Еще одна фармацевтическая композиция, представляющая больший интерес, включает в себя никотиновую кислоту и соединение D в качестве антагониста рецептора DP в сочетании с фармацевтически приемлемым носителем. Еще одна фармацевтическая композиция, представляющая больший интерес, включает в себя никотиновую кислоту и соединение Е в качестве антагониста рецептора DP в сочетании с фармацевтически приемлемым носителем. Еще одна фармацевтическая композиция, представляющая больший интерес, включает в себя никотиновую кислоту и соединение X в качестве антагониста рецептора DP в сочетании с фармацевтически приемлемым носителем. Еще одна фармацевтическая композиция, представляющая больший интерес, включает в себя никотиновую кислоту и соединение АА в качестве антагониста рецептора DP в сочетании с фармацевтически приемлемым носителем. Еще одна фармацевтическая композиция, представляющая больший интерес, включает в себя никотиновую кислоту и соединение AF в качестве антагониста рецептора DP в сочетании с фармацевтически приемлемым носителем. Еще одна фармацевтическая композиция, представляющая больший интерес, включает в себя никотиновую кислоту и соединение AG в качестве антагониста рецептора DP в сочетании с фармацевтически приемлемым носителем. Еще одна фармацевтическая композиция, представляющая больший интерес, включает в себя никотиновую кислоту и соединение АН в качестве антагониста рецептора DP в сочетании с фармацевтически приемлемым носителем. Еще одна фармацевтическая композиция, представляющая больший интерес, включает в себя никотиновую кислоту и соединение AI в качестве антагониста рецептора DP в сочетании с фармацевтически приемлемым носителем. Еще одна фармацевтическая композиция, представляющая больший интерес, включает в себя никотиновую кислоту и соединение AJ в качестве антагониста рецептора DP в сочетании с фармацевтически приемлемым носителем. Еще одна фармацевтическая композиция, представляющая еще больший интерес, включает в себя никотиновую кислоту, одно из указанных выше соединений антагонистов рецептора DP и симвастатин в сочетании с фармацевтически приемлемым носителем. Еще одна фармацевтическая композиция, имеющая больший интерес, представляет собой таблетку длительного высвобождения, включающую в себя никотиновую кислоту, антагонист рецептора DP, который выбран из группы, включающей в себя соединения от А до AJ, и симвастатин в сочетании с фармацевтически приемлемым носителем. Еще одна фармацевтическая композиция, имеющая еще больший интерес, представляет собой таблетку длительного высвобождения, включающую в себя никотиновую кислоту, антагонист рецептораDP, который выбран из группы, включающей в себя соединения А, В, D, Е, X, АА, AF, AG, АН, AI и AJ,и симвастатин в сочетании с фармацевтически приемлемым носителем.-9 009744 Термин "композиция", в дополнение к описанию вышеизложенных фармацевтических композиций,также описывает любой продукт, который получают прямо или косвенно в результате сочетания, комплексирования или агрегации любых двух и более ингредиентов, активного или эксципиента, или в результате диссоциации одного или более ингредиентов, или в результате других типов реакций и взаимодействий одного или более ингредиентов. Соответственно, фармацевтическая композиция согласно изобретению включает в себя любую композицию, полученную посредством смешивания или иного объединения соединений, любого дополнительного активного ингредиента (ингредиентов) и фармацевтически приемлемых эксципиентов. В другом аспекте изобретение относится к применению никотиновой кислоты, или ее соли, или сольвата, или другого агониста рецептора никотиновой кислоты и антагониста DP для получения лекарственного средства. Это лекарственное средство применяют, как описано здесь. Более конкретно, в другом аспекте изобретение относится к применению никотиновой кислоты,или ее соли, или сольвата, или другого агониста рецептора никотиновой кислоты, антагониста DP и ингибитора HMG Со-А-редуктазы, такого как симвастатин, для получения лекарственного средства. Это лекарственное средство применяют, как описано здесь. В дополнение к никотиновой кислоте, которая представляет собой эталон агониста рецептора никотиновой кислоты, описаны многочисленные агонисты рецептора никотиновой кислоты. Соединения,представляющие собой агонисты рецептора никотиновой кислоты, описаны в следующих публикациях:(2003), и Van Herk, T. et al. Journal of Medicinal Chemistry 46: 3945-3951 (2003). Указано, что настоящие композиции и способы лечения включают в себя частичные агонисты рецептора никотиновой кислоты, такие как описанные van Herk, et al. Кроме того, рецептор никотиновой кислоты был установлен и охарактеризован в WO 02/084298A2,опубликованной 24 октября 2002, и у Soga, Т. et al., Tunaru, S. et al. and Wise, A. et al. (ссылки выше). Способы согласно изобретению включают в себя многочисленные опубликованные и применимые соединения-антагонисты рецептора DP. Например, антагонисты рецептора DP можно получать в соответствии с WO01/79169, опубликованной 25 октября 2001, ЕР 1305286, опубликованной 2 мая 2003, WO 02/094830, опубликованной 28 ноября 2002, и WO 03/062200, опубликованной 31 июля 2003. Соединение АВ можно получать в соответствии с описанием, указанным в WO 01/66520A1, опубликованной 13 сентября 2001; соединение АС можно получать в соответствии с описанием, указанным в WO 03/022814A1,опубликованной 20 марта 2003, и соединения AD и АЕ можно получать в соответствии с описанием, указанным в WO 03/078409, опубликованной 25 сентября 2003. Другие предоставленные соединенияантагонисты DP, применяемые в настоящем изобретении, можно получать в соответствии с примерами,приведенными ниже. Пример 1. [5-[(4-Хлорфенил)тио]-4-(метилсульфонил)-6,7,8,9-тетрагидропиридо[3,2-b]индолизин-6 ил] уксусная кислота (соединение G) Стадия 1. 4-Хлорникотинальдегид. Указанное в заголовке соединение получали, как описано у F. Marsais et al., J. Heterocyclic Chem.,25, 81(1988). Стадия 2. 4-(Метилтио)никотинальдегид. К раствору NaSMe (9,5 г, 135 ммоль) в МеОН (250 мл) добавляли 4-хлорникотинальдегид (13,5 г,94,4 ммоль) со стадии 1 в МеОН (250 мл). Реакционную смесь выдерживали при 60 С 15 мин. Реакционную смесь выливали на NH4Cl и EtOAc. Органическую фазу отделяли, промывали Н 2 О и сушили надNa2SO4. Затем для получения указанного в заголовке соединения соединение очищали на силикагеле с 50% EtOAc в гексане. Стадия 3. Метил (2Z)-2-азидо-3-[4-(метилтио) пиридин-3-ил]проп-2-еноат. К раствору 25% NaOMe в МеОН (16,9 мл, 78 ммоль) при -12 С добавляли раствор 4(метилтио)никотинальдегида (4,8 г, 31 ммоль) и метилазидоацетата (9,0 г, 78 ммоль) в МеОН (50 мл). Проводили наблюдение за внутренней температурой и поддерживали ее от -10 до -12 С в течение дополнительных 30 мин. Полученную смесь затем несколько часов перемешивали на ледяной бане с последующим выдерживанием на ледяной бане в течение ночи в холодной комнате. Затем суспензию выливали в смесь льда и NH4Cl и после 10 мин перемешивания взвесь фильтровали. Для получения указанного в заголовке соединения в качестве твердого вещества бежевого цвета (7,4 г), включающего в себя несколько солей, продукт промывали холодной H2O и затем сушили в вакууме. Затем соединение очищают на силикагеле с EtOAc.- 10009744 Стадия 4. Метил-4-(метилтио)-1 Н-пирроло[2,3-b]пиридин-2-карбоксилат. Суспензию соединения со стадии 3 (0,40 г, 1,6 ммоль) в ксилоле (16 мл) медленно нагревали до 140 С. После периода продолжительностью 15 мин при 140 С желтый раствор охлаждали при комнатной температуре. Вследствие возможности экзотермического эффекта, вызываемого образованием азота,должны быть приняты меры предосторожности. Затем для получения указанного в заголовке соединения суспензию охлаждали до 0 С, фильтровали и промывали ксилолом. Стадия 5. Этил-4-(метилтио)-6-оксо-6,7,8,9-тетрагидропиридо[3,2-b]индолизин-7-карбоксилат. К раствору соединения со стадии 4 (0,35 г, 1,6 ммоль) в DMF (20 мл) при 0 С добавляли NaH (1,2 экв.). После периода продолжительностью 5 мин добавляли nBu4NI (0,10 г) и этил-4-бромбутират (0,40 мл). После периода продолжительностью 1 ч при комнатной температуре реакционную смесь выливали на насыщенные NH4Cl и EtOAc. Органическую фазу отделяли, промывали H2O и сушили над Na2SO4. После выпаривания неочищенный продукт очищали флеш-хромотографией. Затем бис-сложный эфир растворяли в THF (7,0 мл) и добавляли при 0 С 1,06 М раствор трет-бутилата калия (2,2 мл) в THF. После периода продолжительностью 1 ч при комнатной температуре реакционную смесь выливали на насыщенные NH4Cl и EtOAc. Для получения указанного в заголовке соединения в качестве смеси сложных этилового и метилового эфиров органическую фазу отделяли, сушили над Na2SO4 и выпаривали при пониженном давлении. Стадия 6. 4-(Метилтио)-8,9-дигидропиридо[3,2-b]индолизин-6(7 Н)-он. К соединению со стадии 5 (0,32 г) добавляли EtOH (8,0 мл) и концентрированную HCl (2,0 мл). Полученную суспензию кипятили 5 ч с обратным холодильником. Реакционную смесь распределяли междуEtOAc и Na2CO3. Для получения указанного в заголовке соединения отделяли и выпаривали органическую фазу. Стадия 7. Этил(2 Е,2Z)-[4-(метилтио)-8,9-дигидропиридо[3,2-b]индолизин-6(7 Н)-илиден]этаноат. К раствору триэтилфосфоноацетата (0,45 г, 2,17 ммоль) в DMF (12 мл) добавляли 80% NaH (0,06 г,2,00 ммоль) и соединение со стадии 6 (0,22 г, 1,00 ммоль). После периода продолжительностью 4 ч при 55 С реакционную смесь выливали на насыщенный NH4Cl и EtOAc. Органическую фазу отделяли и выпаривали при пониженном давлении. Для получения указанного в заголовке соединения неочищенный продукт очищали флеш-хроматографией. Стадия 8. Этил[4-(метилтио)-6,7,8,9-тетрагидропиридо[3,2-b]индолизин-6-ил]ацетат. Соединение со стадии 7 растворяли в MeOH-THF, применяя для растворения нагревание. К предыдущему охлажденному раствору добавляли при комнатной температуре PtO2 и полученную смесь выдерживали 18 ч при атмосферном давлении водорода. Реакционную смесь осторожно фильтровали через целит, применяя CH2Cl2. Для получения указанного в заголовке соединения фильтрат выпаривали при пониженном давлении. Альтернативно, соединение со стадии 7 можно гидрогенизировать посредствомPd(OH)2 в EtOAc при 40 фунт/кв.дюйм Н 2 в течение 18 ч. Стадия 9. Этил[4-(метилсульфонил)-6,7,8,9-тетрагидропиридо[3,2-b]индолизин-6-ил]ацетат. К соединению со стадии 8 (0,08 г, 0,27 ммоль) в МеОН (3,0 мл) добавляли Na2WO4 (0,10 г) и 30%H2O2 (600 мкл). После периода продолжительностью 1 ч реакционную смесь распределяли между H2O иEtOAc. Органическую фазу промывали H2O, отделяли и выпаривали. Указанное в заголовке соединение очищали флеш-хромотографией. Стадия 10. Этил[5-[(4-хлорфенил)тио]-4-(метилсульфонил)-6,7,8,9-тетрагидропиридо[3,2-b]индолизин-6-ил]ацетат. К раствору 4,4'-дихлордифенилдисульфида (0,24 г) в 1,2-дихлорэтане (2,0 мл) добавляли SO2Cl2 (50 мкл). К соединению со стадии 9 (0,05 г) в DMF (2,0 мл) добавляли предыдущую смесь (180 мкл). Реакционную смесь подвергали анализу 1 Н ЯМР и выдерживали при комнатной температуре до исчезновения исходного вещества. Реакционную смесь выливали на насыщенные NaHCO3 и EtOAc. Органическую фазу отделяли, выпаривали и указанное в заголовке соединение очищали флеш-хроматографией. Стадия 11. [5-[(4-Хлорфенил)тио]-4-(метилсульфонил)-6,7,8,9-тетрагидропиридо[3,2-b]индолизин 6-ил]уксусная кислота. К соединению со стадии 10, растворенному в 1/1 смеси THF-МеОН, добавляли 1 н NaOH. После периода продолжительностью 18 ч при комнатной температуре реакционную смесь распределяли между насыщенными NH4Cl и EtOAc. Для получения указанного в заголовке соединения органическую фазу отделяли, сушили над Na2SO4 и выпаривали. 1 Указанное в заголовке соединение можно получать из соединения со стадии 8 примера 1, способом,сходным с описанным для стадий 10 и 11 примера 1. m/z 418. Пример 3. [5-[(3,4-Дихлорфенил)тио]-4-(метилсульфонил)-6,7,8,9-тетрагидропиридо[3,2-b]индолизин-6-ил]уксусная кислота (соединение I) Указанное в заголовке соединение получали, как описано в примере 1, применяя на стадии 10 бис(3,4-дихлорфенил)дисульфид. 1(м, 1 Н), 4,15 (м, 1 Н), 3,80 (м, 1 Н), 3,40 (с, 3H), 2,80-2,10 (м, 6 Н). m/z 484. Энантиомеры разделяли на колонке Chiralecel OD 25 см 20 мм, применяя 30% изопропанол, 17% этанол, 0,2% уксусную кислоту в гексане, с объемной скоростью потока 8 мл/мин. Степень чистоты энантиомеров проверяли на колонке Chiralecel OD 25 см 4,6 мм, применяя 35% изопропанол, 0,2% уксусную кислоту в гексане, с объемной скоростью потока 1,0 мл/мин. Для более подвижного энантиомераTr=9,7 мин, для менее подвижного энантиомера Tr=11,1 мин. Пример 4. [5-(4-Хлорбензоил)-4-(метилсульфонил)-6,7,8,9-тетрагидропиридо[3,2-b]индолизин-6 ил]уксусная кислота (соединение J)(0,24 г, 1,8 ммоль). После периода продолжительностью 5 мин к предыдущей смеси добавляли раствор этил[4-(метилтио)-6,7,8,9-тетрагидропиридо[3,2-b]индолизин-6-ил]ацетата со стадии 8 примера 1, (0,15 г,0,47 ммоль) в 1,2-дихлорэтане (6,0 мл). После периода продолжительностью 4 ч при 80 С реакционную смесь распределяли между EtOAc и NaHCO3. Органическую фазу отделяли, сушили над Na2SO4 и выпаривали. Указанное в заголовке соединение очищали флеш-хроматографией. Стадия 2. Этил[5-(4-хлорбензоил)-4-(метилсульфонил)-6,7,8,9-тетрагидропиридо[3,2-b]индолизин 6-ил]ацетат. К раствору этил[5-(4-хлорбензоил)-4-(метилтио)-6,7,8,9-тетрагидропиридо[3,2-b]индолизин-6 ил]ацетата (0,12 г, 0,27 ммоль) в МеОН (5,0 мл) добавляли Na2WO4 (0,1 г) и 30% H2O2 (300 мкл). Реакционную смесь перемешивали 1 ч при 55 С. Затем реакционную смесь распределяли между H2O и EtOAc. Органическую фазу промывали H2O, сушили над Na2SO4 и выпаривали. Указанное в заголовке соединение очищали флеш-хроматографией. Стадия 3. [5-(4-Хлорбензоил)-4-(метилсульфонил)-6,7,8,9-тетрагидропиридо[3,2-b]индолизин-6-ил] уксусная кислота. Для получения указанного в заголовке соединения этил[5-(4-хлорбензоил)-4-(метилсульфонил)6,7,8,9-тетрагидропиридо[3,2-b]индолизин-6-ил]ацетат обрабатывали, как описано для стадии 11 примера 1. 1 Стадия 1. 2-(Метилтио)никотинальдегид. Указанное в заголовке соединение получали из 2-бромникотинальдегида (A. Numata Synthesis 1999p. 306), как описано для стадии 2 примера 1, за исключением того, что раствор нагревали 2 ч при 55 С. Стадия 2. Метил(2Z)-2-азидо-3-[2-(метилтио)пиридин-3-ил]проп-2-еноат. Указанное в заголовке соединение получали, как описано для стадии 3 примера 1. Стадия 3. Метил-4-(метилтио)-1 Н-пирроло[3,2-c]пиридин-2-карбоксилат. Раствор метил(2Z)-2-азидо-3-[2-(метилтио)пиридин-3-ил]проп-2-еноата (1,00 г, 4,00 ммоль) в мезитилене (50 мл) нагревали при 160 С в течение периода продолжительностью 1 ч. Для получения указанного в заголовке соединения реакционную смесь охлаждали до комнатной температуры, а затем до 0 С,осадок фильтровали и промывали холодным мезитиленом. Стадия 4. Метил-1-(метилтио)-8-оксо-7,8-дигидро-6H-пиридо[3,4-b]пирролизин-7-карбоксилат. К суспензии метил-4-(метилтио)-1 Н-пирроло[3,2-c]пиридин-2-карбоксилата (0,30 г, 1,35 ммоль) вTHF (3 мл)-толуоле (12,0 мл) добавляли 1,06 М раствор трет-бутилата калия (1,42 мл/1,41 ммоль) в THF и метилакрилат (300 мкл). Полученную смесь нагревали 18 ч при 80 С. Смесь распределяли междуEtOAc и NH4Cl и фильтровали через целит. Для получения указанного в заголовке соединения органическую фазу отделяли, сушили над Na2SO4 и фильтровали. Стадия 5. 1-(Метилтио)-6,7-дигидро-8 Н-пиридо[3,4-b]пирролизин-8-он. Метил-1-(метилтио)-8-оксо-7,8-дигидро-6H-пиридо[3,4-b]пирролизин-7-карбоксилат преобразовывали в указанное в заголовке соединение, как описано для стадии 6 примера 1. Стадия 6. Метил[8-гидрокси-1-(метилтио)-7,8-дигидро-6 Н-пиридо[3,4-b]пирролизин-8-ил]ацетат. Смесь 1-(метилтио)-6,7-дигидро-8 Н-пиридо[3,4-b]пирролизин-8-она (0,15 г, 0,68 ммоль), метилбромацетата (0,34 мл), Zn-Cu (0,226 г) в THF (3,0 мл) подвергали в течение 2 ч воздействию ультразвука. Затем смесь нагревали 5 мин при 60 С до завершения реакции. Реакционную смесь распределяли междуEtOAc и NH4Cl. Для получения указанного в заголовке соединения органическую фазу отделяли, сушили над Na2SO4, фильтровали и выпаривали при пониженном давлении. Соединение очищали флешхроматографией. Стадия 7. Метил[1-(метилтио)-7,8-дигидро-6 Н-пиридо[3,4-b]пирролизин-8-ил]ацетат. К NaI (0,300 г) в CH3CN (3,2 мл) добавляли TMSCl (0,266 мл). Эту смесь добавляли к суспензии метил[8-гидрокси-1-(метилтио)-7,8-дигидро-6H-пиридо[3,4-b]пирролизин-8-ил]ацетата (0,15 г, 0,515 ммоль) в CH3CN (1,5 мл) на водяной бане. После периода продолжительностью 0,5 ч реакционную смесь распределяли между EtOAc и NaHCO3. Органическую фазу отделяли, промывали тиосульфатом натрия,сушили над MgSO4 и выпаривали. Указанное в заголовке соединение очищали флеш-хроматографией. Стадия 8. Метил [1-(метилсульфонил)-7,8-дигидро-6 Н-пиридо[3,4-b]пирролизин-8-ил]ацетат. Метил[1-(метилтио)-7,8-дигидро-6H-пиридо[3,4-b]пирролизин-8-ил]ацетат преобразовывали в указанное в заголовке соединение, как описано для стадии 9 примера 1. Стадия 9. [9-[(3,4-Дихлорфенил)тио]-1-(метилсульфонил)-7,8-дигидро-6H-пиридо[3,4-b]пирролизин-8-ил]уксусная кислота. Метил[1-(метилсульфонил)-7,8-дигидро-6H-пиридо[3,4-b]пирролизин-8-ил]ацетат преобразовывали в указанное в заголовке соединение, как описано для стадий 10 и 11 примера 1, применяя на стадии 10 бис-(3,4-дихлорфенил)дисульфид. 1- 13009744 Применр 6. Способ 2. [9-[(3,4-Дихлорфенил)тио]-1-(метилсульфонил)-7,8-дигидро-6H-пиридо[3,4-b]пирролизин-8-ил]уксусная кислота. Стадия 1. 1-(Метилтио)-7,8-дигидро-6H-пиридо[3,4-b]пирролизин-8-ол. К суспензии 1-(метилтио)-6,7-дигидро-8 Н-пиридо[3,4-b]пирролизин-8-она со стадии 5 способа 1 примера 6 (0,55 г, 2,2 ммоль) в EtOH (10 мл)-ТНF (1 мл) добавляли NaBH4 (0,10 г, 2,6 ммоль) при 0 С. После периода продолжительностью 30 мин при комнатной температуре реакцию гасили добавлением ацетона. Растворители выпаривали при пониженном давлении и к остатку добавляли EtOAC и H2O. Органическую фазу отделяли, сушили над MgSO4 и выпаривали. Указанное в заголовке соединение промывали смесью EtOAc/гексан и фильтровали. Стадия 2. Диметил-2-[1-(метилтио)-7,8-дигидро-6H-пиридо[3,4-b]пирролизин-8-ил]малонат. К суспензии 1-(метилтио)-7,8-дигидро-6H-пиридо[3,4-b]пирролизин-8-ола (0,54 г, 2,1 ммоль) в THF(10 мл) при -78 С добавляли 1 М NaHMDS в THF (2,35 мл, 2,4 ммоль) и дифенилхлорфосфат (0,53 мл, 2,6 ммоль). После периода продолжительностью 30 мин добавляли диметилмалонат (0,73 мл, 6,4 ммоль) и 1 М NaHMDS в THF (6,8 мл, 6,8 ммоль). Реакционную смесь доводили до 0 С, а затем до комнатной температуры. Затем смесь распределяли между EtOAc и NH4Cl. Органическую фазу сушили над MgSO4,фильтровали и выпаривали. Указанное в заголовке соединение очищали флеш-хроматографией. Стадия 3. Метил[1-(метилтио)-7,8-дигидро-6 Н-пиридо[3,4-b]пирролизин-8-ил]ацетат. К смеси диметил-2-[1-(метилтио)-7,8-дигидро-6 Н-пиридо[3,4-b] пирролизин-8-ил]малоната (0,59 г,2,17 ммоль) и DMSO (4 мл) добавляли NaCl (0,45 г) в H2O (0,45 мл). После периода продолжительностью 18 ч при 150 С реакционную смесь распределяли между EtOAc и H2O. Органическую фазу отделяли,сушили над Na2SO4 и выпаривали. Указанное в заголовке соединение очищали флеш-хроматографией. Стадия 4. [9-[(3,4-Дихлорфенил)тио]-1-(метилсульфонил)-7,8-дигидро-6H-пиридо[3,4-b]пирролизин-8-ил]уксусная кислота. Указанное в заголовке соединение получали из метил[1-(метилтио)-7,8-дигидро-6 Н-пиридо[3,4b]пирролизин-8-ил]ацетата, как описано для стадий с 8 по 9 способа 1 примера 6. Пример 7. [10-[(3,4-Дихлорфенил)сульфанил]-1-(метилсульфонил)-6,7,8,9-тетрагидропиридо[3,4b]индолизин-9-ил]уксусная кислота (соединение М) Стадия 1. Этил [1-(метилсульфонил)-6,7,8,9-тетрагидропиридо[3,4-b]индолизин-9-ил]ацетат. Указанное в заголовке соединение получали из продукта стадии 3 примера 6, способом, сходным как описано для стадий с 5 по 9 примера 1. Стадия 2. [10-[(3,4-Дихлорфенил)сульфанил]-1-(метилсульфонил)-6,7,8,9-тетрагидропиридо[3,4b]индолизин-9-ил]уксусная кислота. Продукт со стадии 1 преобразовывали в указанное в заголовке соединение способом, сходным, как описано для стадий 10-11 примера 1, применяя на стадии 10 бис-(3,4-дихлорфенил)дисульфид. MS- 15009744 Указанное в заголовке соединение получали, как описано в примере 1, применяя бис-(2,4 дихлорфенил)дисульфид. Дисульфид получали из 2,4-дихлортиофенила, применяя Br2 в эфире. 1(Heterocycles p. 151, 1993), за исключением того, что конечное образование цикла проводили добавлением азида к декалину при кипячении с обратным холодильником. 1 Указанное в заголовке соединение получали из продукта со стадии 8 способа 1 примера 6, как описано в процедурах, указанных для стадий 10 и 11 примера 1, применяя на стации 10 бис-(4 хлорфенил)дисульфид. 1 Раствор 10,00 г 4-фтор-2-йоданилина, 6,57 г этил-2-(2-оксоциклопентил) ацетата и 121 мг птолуолсульфоновой кислоты в 100 мл бензола кипятили с обратным холодильником с ловушкой ДинаСтарка в атмосфере N2 24 ч. После этого периода времени бензол удаляли дистилляцией. Затем добавляли 60 мл DMF и дегазировали раствор перед последовательным добавлением 19 мл основания Hunig'a и 405 мг Pd(OAc)2. Раствор нагревали до 115 С 3 ч, затем охлаждали до комнатной температуры. Для гашения реакции добавляли 300 мл 1 н HCl и 200 мл этилацетата и фильтровали смесь через целит. Фазы разделяли и кислотную фазу дважды экстрагировали 200 мл этилацетата. Органические слои объединяли, промывали насыщенным солевым раствором, сушили над безводным Na2SO4, фильтровали через целит и концентрировали. Для получения указанного в заголовке соединения неочищенное вещество дополнительно очищали флеш-хроматографией, проводя элюирование 100% толуолом. 1 К раствору 1,2 4 г сложного эфира со стадии 1 в 14 мл тетрагидрофурана (THF) при комнатной температуре добавляли последовательно 7 мл МеОН и 7 мл 2 н NaOH. После 2,5 ч реакционную смесь вы- 16009744 ливали в делительную воронку, содержащую этилацетат (EtOAc)/1 н HCl. Фазы разделяли и кислотную фазу дважды экстрагировали EtOAc. Для получения неочищенного масла, которое применяли как таковое на следующей стадии (степень чистоты 90%), органические слои объединяли, промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и выпаривали до сухого состояния. 1 К раствору 2,20 г кислоты со стадии 2 (степень чистоты 90%) в 30 мл пиридина добавляли 6,85 г трибромида пиридиния (степень чистоты 90%) при -40 С. Суспензию перемешивали 10 мин при 0 С и нагревали 30 мин до комнатной температуры. Затем растворитель удаляли в глубоком вакууме без нагревания. Неочищенное вещество растворяли в 40 мл АсОН и к холодному раствору при 0 С добавляли порционно 2,88 г порошка Zn. Суспензию перемешивали 15 мин при 15 С и нагревали дополнительно 15 мин до комнатной температуры. В это время реакционную смесь гасили добавлением 1 н HCl и эту смесь выливали в делительную воронку, содержащую насыщенный солевой раствор/EtOAc. Слои разделяли и органический слой промывали водой, насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали. Это вещество применяли без дополнительной очистки на следующей стадии. 1 К раствору 2,13 г кислоты со стадии 3 в 10 мл THF добавляли в избытке раствор диазометана в эфире до полного, как наблюдают на TLC, поглощения кислоты. Затем растворители удаляли в глубоком вакууме. К раствору полученного таким образом неочищенного сложного метилового эфира в 20 млDMF добавляли 539 мг суспензии NaH (60% в масле) при -78 С. Суспензию перемешивали 10 мин при 0 С, охлаждали снова до -78 С и обрабатывали 1,70 г 4-хлорбензилбромида. После 5 мин температуру поднимали до 0 С и смесь перемешивали 20 мин. В это время реакцию гасили добавлением 2 мл АсОН и эту смесь выливали в делительную воронку, содержащую 1 н HCl/EtOAc. Слои разделяли и органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали. Алкилированное вещество гидролизировали, применяя процедуру, описанную для стадии 2. Для получения указанного в заголовке соединения неочищенное вещество дополнительно очищали растиранием в смеси EtOAc/гексан. 1 К раствору 2,35 г кислоты со стадии 4 в 130 мл EtOH при 80 С добавляли 780 мкл (S)-(-)-1-(1 нафтил)этиламина. Раствор охлаждали до комнатной температуры и перемешивали в течение ночи. Восстановленную соль (1,7 г) снова перекристаллизовывали с 200 мл EtOH. После фильтрации полученную белую твердую соль нейтрализовали посредством 1 н HCl и продукт экстрагировали EtOAc. Органический слой промывали насыщенным солевым раствором, сушили над безводным Na2SO4 и концентрировали. Для получения указанного в заголовке энантиомера вещество фильтровали через подушку SiO2,проводя элюирование EtOAc. Время удерживания для двух энантиомеров составило, соответственно, 7,5 мин и 9,4 мин [колонка ChiralPak AD, гексан/2-пропанол/уксусная кислота (95:5:0,1)]. Избыток более полярного энантиомера составил 98%. Избыток энантиомера = 98%; время удерживания =9,4 мин [колонка ChiralPak AD: 2504,6 мм, гексан/2-пропанол/уксусная кислота (75:25:0,1) ]; []D21 = +39,2 (с 1,0, МеОН). Стадия 6. (-)-[4-(4-Хлорбензил)-7-фтор-5-(метансульфонил)-1,2,3,4-тетрагидроциклопента[b]индол- 17009744 3-ил]уксусная кислота и натриевая соль. Сначала кислоту со стадии 5 (15,4 г) эстерифицировали диазометаном. Сульфонилирование выполняли смешиванием полученного таким образом сложного эфира с 16,3 г натриевой соли метансульфиновой кислоты и 30,2 г CuI(I) в N-метилпирролидиноне. Суспензию дегазировали в потоке: N2, нагревали до 150 С и перемешивали 3 ч, затем охлаждали до комнатной температуры. Для гашения реакции добавляли 500 мл этилацетата и 500 мл гексана и фильтровали смесь через подушку SiO2, проводя элюирование EtOAc. Органические фазы концентрировали. Неочищенное масло растворяли в EtOAc, промывали три раза водой и один раз насыщенным солевым раствором, сушили над безводным Na2SO4, фильтровали и концентрировали. Для получения 14 г сульфонированного сложного эфира, который гидролизировали,применяя процедуру, описанную для стадии 2, неочищенное вещество дополнительно очищали флешхроматографией, проводя элюирование в градиенте от 100% толуола до 50% толуола в EtOAc. Указанное в заголовке соединение получали после двух последовательных перекристаллизаций: изопропилацетат/гептан и последующей CH2Cl2/гексан. 1MS(-APCI) m/z 436,1, 434,1 (М-Н)-. Избыток энантиомера = 97%; время удерживания = 15,3 мин [колонка ChiralCel OD: 2504,6 мм,гексан/2-пропанол/этанол/уксусная кислота (90:5:5:0, 2)]; [] D21 = -29,3 (с 1,0, МеОН). Мр 175,0 С. Натриевую соль получали обработкой 6,45 г (14,80 ммоль) вышеуказанного соединения кислоты вEtOH (100 мл) 14,80 мл водного раствора 1 н NaOH. Органический растворитель удаляли в вакууме и неочищенное твердое вещество растворяли при кипячении с обратным холодильником в 1,2 л изопропилового спирта. Конечный объем снижали до 500 мл дистилляцией растворителя. Натриевую соль кристаллизовали охлаждением до комнатной температуры. Для получения указанного в заголовке соединения в качестве натриевой соли кристаллическую натриевую соль суспендировали в H2O, замораживали на сухой ледяной ванне и лиофилизировали в глубоком вакууме. 1H-ЯМР (500 МГц, ДМСО-d6)7,63 (дд, 1 Н, J1=8,5 Гц, J2=2,6 Гц), 7,47 (дд, 1 Н, J1=9,7 Гц, J2=2,6 Гц),7,33 (д, 2 Н, J=8,4 Гц), 6,70 (д, 2 Н, J=8,4 Гц), 6,06 (д, 1 Н, JAB=17,9 Гц), 5,76 (д, 1 Н, JAB=17,9 Гц ), 3,29 (м,1 Н), 3,08 (с, 3H), 2,80 (м, 1 Н), 2,69 (м, 1 Н), 2,55 (м, 1 Н), 2,18 (м, 2 Н), 1,93 (дд, 1 Н, J1=14,4 Гц, J2=9,7 Гц). Пример 17 А. Альтернативная процедура для (+/-)-[5-бром-4-(4-хлорбензил)-7-фтор-1,2,3,4-тетрагидроциклопента[b]индол-3-ил]уксусной кислоты (стадия 4 примера 17). Стадия 1. Дициклогексиламиновая (DCHA) соль (+/-)-(7-фтор-1,2,3,4-тетрагидроциклопента[b]индол-3-ил)уксусной кислоты. 0,526 М раствор 2-бром-4-фторанилина в ксилоле вместе с этил(2-оксоциклопентил)ацетатом (1,5 экв.) и серной кислотой (0,02 экв.) кипятили с обратным холодильником 20 ч. Воду азеотропно удаляли в устройстве Дина-Старка. Реакционную смесь подвергали ЯМР анализу и спустя 20 ч, в основном, наблюдали 80-85% преобразование в требуемое промежуточное соединение имина. Реакционную смесь промывали 1 М гидрокарбонатом натрия (0,2 объема) 15 мин и выпаривали органическую фракцию. Оставшийся концентрированный раствор дистиллировали в вакууме (0,5 мм.рт.ст.). Остатки ксилола дистиллировали при 30 С, затем в диапазоне 50-110 С выделяли избыток кетона и непрореагировавшего анилина; имин получали во фракции 110-180 С в качестве светло-коричневой прозрачной жидкости со степенью чистоты 83%. Затем промежуточное соединение имина добавляли к дегазированной смеси ацетата калия (3 экв.),тетра-n-бутиламмонийхлорид моногидрата (1 экв.), ацетата палладия (0,03 экв.) и N,N-диметилацетамида(конечная концентрация имина = 0,365 М). Реакционную смесь нагревали до 115 С 5 ч и позволяли охладиться до комнатной температуры. Затем добавляли 3 н KOH (3 экв.) и смесь перемешивали при комнатной температуре 1 ч. Реакционную смесь разбавляли водой (1,0 объем), промывали толуолом (30,75 объема). Водную фазу подкисляли до рН 1 посредством 3 н HCl и экстрагировали трет-бутилметиловым эфиром (20,7 5 объема). Объединенные органические фракции промывали водой (0,75 объема). К прозрачному светло-коричневому раствору добавляли дициклогексиламин (1 экв.) и раствор перемешивали при комнатной температуре 16 ч. Для получения указанного в заголовке соединения соль фильтровали,промывали этилацетатом, трет-бутилметиловым эфиром и позволяли сушиться. Анализ: 94 А%. 1H-ЯМР (500 МГц, CDCl3)9,24 (с, 1 Н), 7,16-7,08 (м, 2 Н), 6,82 (т, 1 Н), 6,2 (уш., 2 Н), 3,6-3,5 (м, 1 Н),3,04-2,97 (м, 2 Н), 2,88-2,70 (м, 3H), 2,66 (дд, 1 Н), 2,45-2,37 (м, 1 Н), 2,13-2,05 (м, 2,05), 1,83 (д, 4 Н), 1,67 (д,2 Н), 1,55-1,43 (м, 4 Н), 1,33-1,11 (м, 6 Н). Стадия 2. (+/-)-(5-Бром-7-фтор-1,2,3,4-тетрагидроциклопента[b]индол-3-ил)уксусная кислота. Взвесь соли DCHA с вышеуказанной стадии 1 в дихлорметане (0,241 М раствор) охлаждали до температуры в диапазоне от -20 до -15 С. Добавляли за один цикл пиридин (2 экв.) и к взвеси добавляли по каплям бром (2,5 экв.) в течение от 30 до 45 мин, поддерживая температуру в диапазоне от -20 до -15 С.(При добавлении приблизительно 1/3 брома реакционная смесь загустевала и требовалось эффективное перемешивание. Со временем, при добавлении приблизительно 1/2 брома, смесь снова становилась"жидкой"). После завершения добавления реакционную смесь дополнительно выдерживали 1 ч при-15 С. Затем добавляли в течение 5 мин уксусную кислоту (3,04 экв.) и порционно добавляли порошок цинка (3,04 экв.). (Порцию цинка добавляли при -15 С и смесь выдерживали приблизительно 5 мин для удостоверения в том, что произошел экзотермический эффект (с -15 до -10 С. Эту процедуру повторяли приблизительно с 5 порциями цинка в течение приблизительно 30 мин. Когда экзотермического эффекта более не наблюдали, оставшийся цинк добавляли быстрее. Вся процедура занимала приблизительно от 30 до 45 мин. После завершения добавления порцию вещества нагревали до комнатной температуры, выдерживали 1 ч и концентрировали. Реакционную смесь переносили в трет-бутилметиловый эфир (МТВЕ, 0,8 объема) и добавляли 10% водный раствор уксусной кислоты (0,8 объема). Смесь (кристаллизации солей,например, феназопиридина) выдерживали 1 ч при комнатной температуре и фильтровали через древесную целлюлозу. Подушку древесной целлюлозы промывали МТВЕ (приблизительно 0,2 объема) и переносили фильтрат (двухфазный, МТВЕ/водная фаза) в экстрактор. Органическую фазу промывали водой(0,8 объема). Экстракт МТВЕ концентрировали и для кристаллизации соединения переносили в изопропиловый спирт (IPA, 0,25 объема). Добавляли воду (0,25 объема) и порцию вещества выдерживали 1 ч. В течение 1 ч добавляли дополнительно воду (0,33 объема). После завершения добавления воды порцию вещества выдерживали дополнительно 1 ч, фильтровали и промывали смесью IPA/вода в соотношении 30/70 (0,15 объема). Кристаллическую бромокислоту сушили в сушильном шкафе при +45 С. Стадия 3. (+/-)-[5-Бром-4-(4-хлорбензил)-7-фтор-1,2,3,4-тетрагидроциклопента[b]индол-3-ил]уксусная кислота. Бромокислоту со стадии 2 растворяли в диметилацетамиде (0,416 М раствор) и добавляли одной порцией карбонат цезия (2,5 экв.). К взвеси добавляли одной порцией 4-хлорбензилхлорид (2,5 экв.) и порцию вещества нагревали до 50 С 20 ч. Охлаждали порцию вещества до комнатной температуры и добавляли в течение 5 мин гидроксид натрия 5 н (4,00 экв.) (температура повышалась до +40 С). Реакционную смесь выдерживали при 50 С приблизительно 3 ч, охлаждали до комнатной температуры и переносили в L экстрактор. Раствор разбавляли изопропилацетатом (IPAc, 2 объема) и охлаждали до +15 С. Раствор подкисляли посредством 5 н HCl до рН 2. Слои разделяли и органический слой промывали водой (22 объема). Раствор IPAc концентрировали и для кристаллизации продукта переносили в IPA (0,8 объема). Для получения указанного в заголовке соединения добавляли в течение 2 ч воду (8 л) и фильтровали порцию вещества. Порцию вещества можно сушить в сушильном шкафу при +40 С 24 ч. Пример 18. (+/-)-4-[1-(4-хлорфенил)этил]-7-фтор-5-метансульфонил-1,2,3,4-тетрагидроциклопента Указанное в заголовке соединение получали в соответствие с описанием, предоставленным в РСТ Указанное в заголовке соединение получали в соответствие с описанием, предоставленным в РСТ Указанное в заголовке соединение получали в соответствие с описанием, предоставленным в РСТ Стадия 1. 2-Хлорникотинальдегид. К раствору диизопропиламина (110 мл, 780 ммоль) в THF (500 мл) добавляли при -40 С 2,5 М раствор n-BuLi (300 мл, 750 ммоль) в гексане. После 5 мин реакционную смесь охлаждали до -95 С, а затем последовательно добавляли DMPU (15 мл) и 2-хлорпиридин (50 мл, 532 ммоль). Полученную смесь затем нагревали и перемешивали при -78 С 4 ч. После этого периода времени, перед добавлением DMF (70 мл), желтую суспензию снова охлаждали до -95 С. Конечную реакционную смесь нагревали до -78 С и перемешивали при этой температуре 1,5 ч. Реакционную смесь выливали в холодную водную HCl (3 н,800 мл) и перемешивали 5 мин. Для доведения рН до 7,5 добавляли концентрированный водный NH4OH. Водный слой трижды экстрагировали посредством EtOAc. Объединенный органический слой промывали водным NH4Cl и насыщенным солевым раствором, сушили над безводным Na2SO4, фильтровали и концентрировали. Для получения указанного в заголовке соединения в качестве бледно-желтого твердого вещества неочищенное вещество дополнительно очищали на подушке силикагеля, проводя элюирование в градиенте от 100% гексана до 100% EtOAc, и продукт кристаллизовали в холодном гексане. Стадия 2. Метил(2Z)-2-азидо-3-(2-хлорпиридин-3-ил)проп-2-еноат. К раствору 25% NaOMe в МеОН (80 мл, 349 ммоль) добавляли при -20 С раствор 2 хлорникотинальдегида (20,0 г, 139,9 ммоль) и метилазидоацетат (32,2 мл, 349,7 ммоль) в МеОН (168 мл). Проводили наблюдение за внутренней температурой и поддерживали ее на уровне -20 С в течение дополнительных 30 мин. Полученную смесь затем несколько часов перемешивали на ледяной бане с последующим выдерживанием на ледяной бане в течение ночи в холодной комнате. Затем суспензию выливали в смесь льда и NH4Cl и после 10 мин перемешивания взвесь фильтровали. Продукт промывали холодной H2O и затем сушили в вакууме. Неочищенное вещество растворяли в CH2Cl2 и добавляли MgSO4. Суспензию фильтровали через подушку силикагеля, промывали посредством CH2Cl2. Для получения осадка бежевого цвета (20 г) указанного в заголовке соединения фильтрат концентрировали при пониженном давлении. Стадия 3. Метил-4-хлор-1 Н-пирроло[3,2-c]пиридин-2-карбоксилат. Раствор метил(2Z)-2-азидо-3-(2-хлорпиридин-3-ил)проп-2-еноата (21 г, 88 ммоль) в мезитилене (880 мл) кипятили с обратным холодильником в течение периода продолжительностью 1 ч. Реакционную смесь охлаждали до комнатной температуры, а затем до 0 С и осадок фильтровали и промывали холодным гексаном. Для получения указанного в заголовке соединения в качестве бледно-желтого твердого вещества (13,2 г) вещество перемешивали в смеси 1:20 EtOAc/гексан в течение ночи и фильтровали. Стадия 4. Метил-1-хлор-8-оксо-7,8-дигидро-6 Н-пиридо[3,4-b]пирролизин-7-карбоксилат. К суспензии метил-4-хлор-1 Н-пирроло[3,2-c]пиридин-2-карбоксилата (12,5 г, 59 ммоль) в THF (116 мл) толуоле (460 мл) добавляли 1,0 М раствор трет-бутилата калия (64 мл, 64 ммоль) в THF и метилакрилат (55 мл, 611 ммоль). Полученную смесь нагревали при 100 С 18 ч. После этого времени суспензию охлаждали до комнатной температуры и выливали ее в смесь насыщенного водного NH4Cl (400 мл) и гексана (400 мл). Для получения указанного в заголовке соединения твердые вещества отстаивали,фильтровали и промывали H2O и гексаном. Стадия 5. 1-Хлор-6,7-дигидро-8 Н-пиридо[3,4-b] пирролизин-8-он. К соединению с предыдущей стадии добавляли изопропанол (8,0 мл) и концентрированную HCl(2,0 мл) при нагревании в течение 1 ч при 100 С. Реакционную смесь распределяли между EtOAc иNa2CO3. Для получения указанного в заголовке соединения отделяли и выпаривали органическую фазу. Стадия 6. 1-Изопропенил-6,7-дигидро-8 Н-пиридо[3,4-b]пирролизин-8-он. К смеси 1-хлор-6,7-дигидро-8 Н-пиридо[3,4-b]пирролизин-8-она (5,0 г, 24,3 ммоль), трис(дибензилиденацетон)-дипалладия (0) (1,0 г, 1,09 ммоль) и трифениларсина (2,70 г, 8,82 ммоль) в DMF(100 мл) добавляли трибутилизопропенилолово (9,60 г, 29,00 ммоль). Полученную смесь дегазировали и нагревали при 78 С в течение периода продолжительностью 18 ч. Растворитель выпаривали при пониженном давлении. К полученной смеси добавляли CH2Cl2 и целит и затем фильтровали через целит. Указанное в заголовке соединение очищали флеш-хроматографией (от 50% до 100% EtOAc в гексане). Стадия 7. Этил (2 Е)-(1-изопропенил-6,7-дигидро-8 Н-пиридо[3,4-b]пирролизин-8-илиден)этаноат. К раствору 1-изопропенил-6,7-дигидро-8 Н-пиридо[3,4-b]пирролизин-8-она (0,60 г, 2,8 ммоль) и триэтилфосфоноацетата (1,00 г, 4,46 ммоль) в THF (24 мл) добавляли при -78 С 80% NaH (0,12 г, 4,00 ммоль), реакционной смеси позволяли нагреваться до 0 С, а затем до комнатной температуры. Реакци- 20009744 онную смесь выливали в насыщенные NH4Cl и EtOAc. Органическую фазу отделяли, сушили над Na2SO4 и выпаривали. Указанное в заголовке соединение очищали флеш-хроматографией (40% EtOAc в гексане). Стадия 8. Этил(1-изопропил-7,8-дигидро-6 Н-пиридо[3,4-b]пирролизин-8-ил)ацетат. К раствору этил(2 Е)-(1-изопропенил-6,7-дигидро-8 Н-пиридо[3,4-b]пирролизин-8-илиден)этаноата(0,40 г, 1,4 ммоль) в МеОН (20 мл) добавляли Pd(OH)2 (0,20 г). Смесь перемешивали 3 ч при давлении Н 2 1 атм. Для получения указанного в заголовке соединения смесь фильтровали через целит и выпаривали. Стадия 9. Этил 9-[(3,4-дихлорфенил)тио]-1-изопропил-7,8-дигидро-6H-пиридо[3,4-b]пирролизин-8 илацетат. К раствору бис-(3,4-дихлорфенил)дисульфида (0,24 г, 0,67 ммоль) в CH2Cl2 (5,6 мл) добавлялиSO2Cl2 (0,036 мл). Полученную желтую смесь перемешивали при комнатной температуре 1 ч. Этот раствор добавляли при 0 С к раствору этил(1-изопропил-7,8-дигидро-6H-пиридо[3,4-b]пирролизин-8 ил)ацетата (0,15 г, 0,52 ммоль) в DMF (5,6 мл). После 1,5 ч при 0 С реакционную смесь выливали в насыщенные NaHCO3 и EtOAc. Органическую фазу отделяли, сушили над Na2SO4 и выпаривали. Указанное в заголовке соединение очищали флеш-хроматографией (от 30% до 40% EtOAc в гексане). Стадия 10. 9-[(3,4-Дихлорфенил)тио]-1-изопропил-7,8-дигидро-6H-пиридо[3,4-b]пирролизин-8 илуксусной кислоты. К раствору этил 9-[(3,4-дихлорфенил)тио]-1-изопропил-7,8-дигидро-6H-пиридо[3,4-b]пирролизин 8-илацетата (0,23 г, 0,50 ммоль) в THF (5 мл) и МеОН (2,5 мл) добавляли 1,0 М NaOH (1,5 мл, 1,5 ммоль). После перемешивания в течение 18 ч при комнатной температуре добавляли НОАс (0,25 мл) и выпаривали растворитель. Остаток помещали в EtOAc/H2O и промывали органический слой H2O и насыщенным солевым раствором. После высушивания (Na2SO4) раствор фильтровали и выпаривали. Для получения указанного в заголовке соединения в качестве белого твердого вещества остаток перемешивали со смесью 1:1 EtOAc:гексан и фильтровали. 1H-ЯМР (MeOH-d4)1,14-1,26 (м, 6 Н), 2,47-2,56 (м, 1 Н), 2,56-2,64 (м, 1 Н), 2,94-3,05 (м, 2 Н), 3,813,89 (м, 1 Н), 4,22-4,30 (м, 1 Н), 4,33-4,44 (м, 2 Н), 6,93-6,99 (м, 1 Н), 7,14-7,19 (м, 1 Н), 7,33-7,39 (м, 1 Н),7,54-7,59 (м, 1 Н), 8,16-8,21 (м, 1 Н). Продукт со стадии 10 преобразовывали в его сложный метиловый эфир, применяя CH2N2, и сложный эфир подвергали разделению посредством HPLC в хиральной неподвижной фазе (колонка chiralcelOD 225 см), проводя элюирование в 12% 2-пропаноле в гексане при объемной скорости потока 6 мл/мин. Время удерживания энантиомера А (менее полярного) составило 31,9 мин, а время удерживания энантиомера В (более полярного) составило 35,5 мин. Для получения энантиомеров А и В указанного в заголовке соединения и А и В гидролизировали, как указано для стадии 10 примера 17. Пример 22. 1R)-6-Фтор-8-(метилсульфонил)-9-(IS)-1-[4-(трифторметил)фенил]этил-2,3,4,9 тетрагидро-1 Н-карбазол-1-ил)уксусная кислота (соединение AJ)-10 С 10,0 М водный раствор NaNO2 (1,1 экв.). Смесь перемешивали при 0 С 2,5 ч. Затем, поддерживая внутреннюю температуру ниже 10 С, медленно добавляли холодный (-30 С) раствор SnCl2 (3,8 М) в концентрированной HCl. Полученную смесь механически перемешивали 20 мин при 10 С, а затем 1 ч при комнатной температуре. Густую взвесь фильтровали и твердый осадок сушили на воздухе в течение ночи. Твердый осадок ресуспендировали в холодной HCl и снова фильтровали. Для получения указанного в заголовке соединения в качестве бежевого твердого вещества высушенное вещество ресуспендировали вEt2O, перемешивали 10 мин, фильтровали и сушили на воздухе в течение ночи. Стадия 2. (+/-)-Этил(8-бром-6-фтор-2,3,4,9-тетрагидро-1 Н-карбазол-1-ил)ацетат. К суспензии соединения со стадии 1 (1 экв.) в АсОН (0,5 М) добавляли этил (2 оксоциклогексил)ацетат (1 экв.). Смесь перемешивали при кипячении с обратным холодильником 16 ч,охлаждали и удаляли АсОН выпариванием при пониженном давлении. Остаток разбавляли EtOAc и промывали водой и насыщенным водой NaHCO3. Органический слой сушили над Na2SO4 и концентрировали. Затем остаток очищали на подушке силикагеля, проводя элюирование толуолом. Для получения указанного в заголовке соединения в качестве белого твердого вещества фильтрат концентрировали и перемешивали в гексане, а затем фильтровали. MS (+APCI) m/z 354,2 (М+Н)+. Стадия 3. (+/-)-Этил[6-фтор-8-(метилсульфонил)-2,3,4,9-тетрагидро-1 Н-карбазол-1-ил]ацетат. К раствору соединения со стадии 2 (1 экв.) в безводном DMS0 (0,28 М) добавляли метансульфинат натрия (3 экв.) и йодид меди (3 экв.). Барботировали N2 через смесь 5 мин и затем перемешивали реакци- 21009744 онную смесь при 100 С в атмосфере N2. После 12 ч добавляли еще метансульфинат натрия (2 экв.) и йодид меди (2 экв.). Смесь перемешивали дополнительно 12 ч при 100 С, охлаждали, разбавляли посредством EtOAc и для подкисления смеси добавляли 1 н HCl. Суспензию перемешивали 30 мин и фильтровали через целит. Фильтрат промывали водой, сушили над Na2SO4 и концентрировали. Остаток фильтровали через подушку силикагеля сначала для удаления неполярных примесей, проводя элюирование толуолом,а затем смесью 2:1 гексан/EtOAc для элюирования требуемого продукта. Для получения указанного в заголовке соединения в качестве бледно-желтого твердого вещества фильтрат концентрировали после элюирования смесью гексан/EtOAc. MS (-APCI) m/z 352,1 (М-Н)-. Стадия 4. Этил[(1R)-6-фтор-8-(метилсульфонил)-2,3,4,9-тетрагидро-1 Н-карбазол-1-ил]ацетат. Смесь рацематов со стадии 3 разделяли посредством препаративной HPLC на препаративной колонке chiralpak AD, проводя элюирование смесью 15% iPrOH в гексане. На основании активности конечного продукта за указанное в заголовке соединение принимали более полярный энантиомер (с более продолжительным временем удерживания). Стадия 5. Этил[(1R)-9-[(1S)-1-(4-хлорфенил)этил]-6-фтор-8-(метилсульфонил)-2,3,4,9-тетрагидро 1 Н-карбазол-1-ил]ацетат. К раствору соединения со стадии 4 (1 экв.), трифенилфосфина (1,5 экв.) и (1R)-1-(4 хлорфенил)этанола (1,5 экв., полученного в соответствие с общей процедурой, описанной в справочном примере 1) в THF (0,175 М) добавляли в течение 10 мин раствор ди-трет-бутилазодикарбоксилата (2,1 М в THF, 1,5 экв.). Смесь перемешивали при комнатной температуре 2 ч и концентрировали. Для получения требуемого продукта (степень чистоты 90%), который применяли в качестве такового в следующей реакции, остаток очищали флеш-хроматографией на силикагеле, проводя элюирование 7% EtOAc в толуоле. Стадия 6. [(1R)-9-[(1S)-l-(4-Хлорфенил)этил]-6-фтор-8-(метилсульфонил)-2,3,4, 9-тетрагидро-1 Нкарбазол-1-ил]уксусная кислота и [(1S)-9-[(lS)-1-(4-хлорфенил)этил]-6-фтор-8-(метилсульфонил)-2,3,4,9 тетрагидро-1 Н-карбазол-1-ил]уксусная кислота. К раствору соединения со стадии 5 в смеси THF и метанола (0,1 М) 2:1 добавляли 1 н водный LiOH(3 экв. ). Смесь перемешивали при комнатной температуре 2 ч, добавляли АсОН и удаляли растворитель выпариванием. Остаток переносили в смесь EtOAc/H2O и органический слой промывали насыщенным солевым раствором, сушили над Na2SO4, фильтровали и концентрировали. Для получения указанного в заголовке соединения в качестве белого твердого вещества остаток перемешивали с 30% EtOAc в гексане, ресуспендировали продукт в диэтиловом эфире и подвергали в течение 45 мин воздействию ультразвуком, фильтровали и сушили в глубоком вакууме при 50 С 24 ч. MS (-APCI) m/z 462,1(M-H). Альтернативно, для получения смеси 2 диастереомеров: этил[(1R)-9-[(lS)-l-(4-хлорфенил)этил]-6 фтор-8-(метилсульфонил)-2,3,4,9-тетрагидро-1 Н-карбазол-1-ил]ацетата и этил[(1S)-9-[(1S)-1-(4-хлорфенил)этил]-6-фтор-8-(метилсульфонил)-2,3,4,9-тетрагидро-1 Н-карбазол-1-ил]ацетата в реакции алкилирования на стадии 5 применяли (+/-)-этил[6-фтор-8-(метилсульфонил)-2,3,4,9-тетрагидро-1 Н-карбазол-1 ил]ацетат. Смесь диастереомеров разделяли посредством избирательного гидролиза, применяя для получения требуемой [(1R)-9-[(1S)-1-(4-хлорфенил)этил]-6-фтор-8-(метилсульфонил)-2,3,4,9-тетрагидро-1 Нкарбазол-1-ил]уксусной кислоты следующую процедуру. Разделение Смесь диастереомеров этил[(1R)-9-[(1S)-1-(4-хлорфенил)этил]-6-фтор-8-(метилсульфонил)-2,3,4,9 тетрагидро-1 Н-карбазол-1-ил]ацетата и этил[(1S)-9-[(1S)-l-(4-хлорфенил)этил]-6-фтор-8-(метилсульфонил)2,3,4,9-тетрагидро-1 Н-карбазол-1-ил]ацетата (1 экв.) растворяли в смеси 3,5/1 THF/MeOH (0,25 М) и охлаждали при 0 С. Медленно добавляли водный 1 н LiOH (1 экв.) и перемешивали смесь при 0 С 12 ч или до почти полного гидролиза этил[(1R)-9-[(1S)-1-(4-хлорфенил)этил]-6-фтор-8-(метилсульфонил)-2,3,4,9-тетрагидро-1 Нкарбазол-1-ил]ацетата, тогда как гидролиз другого диастереомера в этих условиях проходил в незначительной степени. Добавляли АсОН и удаляли растворитель выпариванием. Остаток переносили в смесь EtOAc/H2O и органический слой промывали насыщенным солевым раствором, сушили над Na2SO4, фильтровали и концентрировали. Этил[(1S)-9-[(1S)-1-(4-хлорфенил)этил]-6-фтор-8-(метилсульфонил)-2,3,4,9-тетрагидро-1 Н-карбазол-1-ил]ацетат и [(1R)-9-[(1S)-1-(4-хлорфенил)этил]-6-фтор-8-(метилсульфонил)-2,3,4,9-тетрагидро-1 Н-карбазол-1-ил]уксусную кислоту разделяли флеш-хроматографией, проводя элюирование 40% EtOAc в гексане,содержащем 1% АсОН, для получения требуемой [(1R)-9-[(1S)-1-(4-хлорфенил)этил]-6-фтор-8-(метилсульфонил)-2,3,4,9-тетрагидро-1 Н-карбазол-1-ил]уксусной кислоты с избытком диастереомера 90%, которую затем, для получения требуемого соединения в качестве белого твердого вещества с избытком диастереомера 95% перемешивали с 30% EtOAc в гексане. Стадия 7. Метил[(1R)-6-фтор-8-(метилсульфонил)-2,3,4,9-тетрагидро-1 Н-карбазол-1-ил]ацетат. К раствору(10% мас./мас.). Барботировали поток N2 через смесь в течение 5 мин. Реакционную смесь перемешивали при комнатной температуре в атмосфере H2 (баллон) 24 ч и фильтровали через подушку целита, проводя элюирование CH2Cl2. Для получения соединения метил[(1R)-6-фтор-8-(метилсульфонил)-2,3,4,9-тетрагидро-1 Нкарбазол-1-ил]ацетата растворители удаляли выпариванием при пониженном давлении и остаток переносили Стадия 8. 1R)-6-Фтор-8-(метилсульфонил)-9-(1S)-1-[4-(трифторметил)фенил]этил-2,3,4,9-тетрагидро-1 Н-карбазол-1-ил)уксусная кислота (соединение AJ). К раствору соединения со стадии 7 (1 экв.), трифенилфосфина (1,5 экв.) и (1R)-1-[4(трифторметил)фенил]этанола (1,5 экв.) в THF (0,2 М) добавляли в течение периода продолжительностью 20 мин раствор ди-трет-бутилазодикарбоксилата (1 М в THF, 1,5 экв.). Смесь перемешивали при комнатной температуре 2 ч и концентрировали. Для получения метил 1R)-6-фтор-8-(метилсульфонил)-9-(1S)-1-[4(трифторметил)фенил]этил-2,3,4,9-тетрагидро-1 Н-карбазол-1-ил)ацетата (степень чистоты 90%), который применяли в качестве такового в следующей реакции, остаток очищали флеш-хроматографией на силикагеле,проводя элюирование 10% EtOAc в толуоле. К раствору вышеуказанного сложного эфира (1 экв.) в смеси 3,5/1 THF/MeOH (0,25 М) медленно добавляли при 0 С водный 1 н LiOH (1 экв.) и смесь перемешивали при 0 С 16 ч или до почти полного гидролиза сложного эфира; скорость гидролиза в этих условиях другого, побочного диастереомера, намного ниже. Добавляли АсОН и удаляли в вакууме растворитель. Остаток переносили в смесьEtOAc/H2O и органический слой промывали насыщенным солевым раствором, сушили над Na2SO4,фильтровали и концентрировали. Для удаления непрореагировавшего сложного метилового эфира остаток фильтровали через подушку силикагеля, проводя сначала элюирование в смеси 10% EtOAc/толуол, а затем в смеси 60% EtOAc/толуол, содержащей 1% АсОН. Для получения указанного в заголовке соединения в качестве белого твердого вещества с избытками диастереомера и энантиомера 95% (проверяли посредством хиральной HPLC) остаток перемешивали со смесью 30% EtOAc/гексан и сушили в глубоком вакууме при 50 С 16 ч. MS(-APCI) m/z 496,0 (М-Н)-. []D=-181 в МеОН. Биология Соединения, применяемые в настоящем изобретении, функционирующие в качестве селективных антагонистов DP, обычно обладают сродством (Ki) к DP по меньшей мере приблизительно в 10 раз более высоким (численно меньшей величиной Ki), чем сродством (Ki) к рецепторам CRTH2. Обычные антагонисты DP, применяемые в настоящем изобретении, обладают по меньшей мере приблизительно в 10 раз большей селективностью по отношению к рецептору DP, чем к рецептору CRTH2. Более конкретно, селективный антагонист рецептора DP обладает по меньшей мере приблизительно в 100 раз большей селективностью к рецептору DP в сравнении с рецептором CRTH2. Еще более конкретно, соединение селективного антагониста DP обладает по меньшей мере приблизительно в 800-1000 раз большей селективностью к рецептору DP в сравнении с рецептором CRTH2, т.е. сродством (Ki) к рецептору DP по меньшей мере приблизительно в 800-1000 раз более высоким, чем сродством (Ki) к рецептору CRTH2. Как применяют здесь, соединение "избирательно регулирует рецептор DP" означает, что соединение связывается и воздействует в качестве антагониста на рецептор DP в концентрации, достижимой при терапевтических дозах, но существенно не регулирует рецептор CRTH2 в таких терапевтически достижимых концентрациях. Как применяют здесь, в основном, антагонисты DP обладают сродством (Ki) к рецептору CRTH2 приблизительно 0,5 мкмоль/л или выше. Для ингибирования эффекта гиперемии, наблюдающегося при введении никотиновой кислоты без таких селективных антагонистов DP, применимы соединения, обладающие аффинностью связывания с рецептором CRTH2 приблизительно 0,5 мкмоль/л или выше и селективностью к рецептору DP по меньшей мере приблизительно в 10 раз большей, чем к CRTH2. Определение сродства и селективности соединений к рекомбинантным рецепторам DP и CRTH2 человека Сродство и селективность соединений к рецепторам DP и CRTH2 определяли, применяя анализы радиолигандного связывания, как описано в Abramovitz M., et al. Biochem. Biophys. Acta (2000) 1483: 285-293, and Sawyer N., et al. Br. J. Pharmacol. (2002); 137: 1163-1172. Вкратце, стабильные линии клеток,которые по отдельности экспрессируют рецепторы DP и CRTH2 человека, устанавливали, применяя клетки (обозначенные HEIK293E линии клеток) почки эмбриона человека (НЕK) 293EBNA (ядерный антиген вируса Эпштейна-Барра). Для определения сродства и селективности соединений к рецепторамDP и CRTH2 применяли полученные из этих рекомбинантных линий клеток фракции мембраны в анализах радиолигандного связывания при равновесном конкурировании. кДНК DP и CRTH2, соответствующие полноразмерным кодирующим последовательностям, переносили в соответствующие участки экспрессирующего вектора млекопитающего рСЕР 4 (Invitrogen) и экспрессировали в клетках HEK293 Е. Мембраны получали посредством дифференциального центрифугирования (1000g в течение 10 мин, затем 160000g в течение 30 мин, все при 4 С) после лизиса клеток посредством порообразования азотом при 800 фунт/кв.дюйм в течение 30 мин на льду в присутствии ингибиторов протеазы (2 мМAEBSF, 10 мкМ Е-64, 100 мкМ лейпептина и 0,05 мг/мл пепстатина). Осадки 160000g ресуспендировали в 10 мМ HEPES/KOH (рН 7,4), содержащем 1 мМ EDTA при приблизительно от 5 до 10 мг/мл белка, посредством гомогенизации Dounce (Dounce A; 10 ударов), замораживали в жидком азоте и хранили при -80 С. Анализы связывания рецептора проводили в конечном объеме для инкубации 0,2 мл в 10 мМ HEPES/KOH (рН 7,4),содержащем 1 мМ EDTA, 10 мМ MnCl2 и 0,7 нМ [3 Н]PGD2 (200 Ки/ммоль). Реакцию инициировали посредством добавления белка мембраны (приблизительно 30 мкг для DP и 10 мкг для CRTH2) из фракции 160000g. Лиганды добавляли в диметилсульфоксиде (DMSO), который сохраняли постоянным, 1% (об./об.), во всех инкубациях. Неспецифическое связывание определяли в присутствие 10 мкМ нерадиоактивного PGD2. Инкубации проводили на мини-орбитальном шейкере при комнатной температуре 60 мин. Анализ связывания останавливали посредством быстрой фильтрации через 96-луночный Unifilter GF/C (Canberra Packard), повторно смачивая в применяемом для анализа буфере для инкубации, без EDTA, (при 4 С), применяя 96-луночный полуавтоматический сборщик клеток Tomtec Mach III. Фильтры промывали от 3 до 4 мл того же буфера, сушили 90 мин при 55 С и остаточную радиоактивность, связанную с отдельными фильтрами, определяли измерением активности сцинтилляционным способом с добавлением 50 мкл Ultima Gold F (Canberra Packard),применяя счетчик 1450 MicroBeta (Wallac). Максимальное специфическое связывание определяли как разницу между общим связыванием и неспецифическим связыванием в отсутствие конкурента. Специфическое связывание определяли при каждой концентрации соединения и выражали в качестве процентов от максимального специфического связывания. Сигмоидальные кривые равновесного конкурирования строили, выражая процент максимального специфического связывания в качестве функции анализируемой концентрации соединения и анализировали посредством сконструированного по особым условиям пакета программного обеспечения, применяя симплексалгоритм нелинейного подбора кривой методом наименьших квадратов, использующий для определения точки перегиба (InPt) уравнение с четырьмя параметрами. Аффинность связывания анализируемого соединения определяли, вычисляя константу равновесия ингибирования (Ki) из уравнения Ki = InPt/1+([радиолиганд]/Kd),где Kd представляет собой константу равновесия диссоциации для взаимодействия радиолиганд-рецептор. В случае невозможности определения InPt использовали IC50 (т.е. концентрацию анализируемого соединения,необходимую для ингибирования 50% максимального специфического связывания). В основном, соединения, применяемые в настоящем изобретении, обладают Ki для рецептора DP приблизительно от такой низкой, как 0,4 нМ, до такой высокой, как приблизительно 16,3 нМ. Сходным образом соединение, применяемое в настоящем изобретении, в основном, обладает Ki для рецептораCRTH2 приблизительно от такой низкой, как 180 нМ, до такой высокой, как приблизительно 22000 нМ. Действие соединений на вызываемое никотиновой кислотой расширение кровеносных сосудов у мыши Эффективность селективных антагонистов DP, описанная здесь, может быть показана при измерении эффекта ингибирования гиперемии с применением мышиной модели вызываемой никотиновой кислотой гиперемии человека. Кровоток в ухе мыши (мера расширения кровеносных сосудов, заметная составляющая гиперемии человека) измеряли после введения никотиновой кислоты мыши, которой проводили предварительное лечение индифферентным веществом (в качестве контроля) или антагонистом DP. Конкретно, в исследовании использовали самцов мыши C57BL/6 (25 г). В каждой анализируемой группе оценивали пять мышей. Нембутал разбавляли водой до конечной концентрации 5 мг/мл и вводили 0,3 мл/мышь посредством внутрибрюшинной инъекции. Антагонисты DP растворяли в 5% гидроксипропилциклодекстрине до конечной концентрации 5 мг/мл и соединения вводили внутрибрюшинно в объеме 0,2 мл/мышь (40 мг/кг). Никотиновую кислоту растворяли в 5% гидроксипропилциклодекстрине до конечной концентрации 12,5 мг/мл. Исходный раствор никотиновой кислоты доводили до рН 7,4 посредством 2 н NaOH и вводили 0,2 мл/мышь посредством подкожной инъекции (100 мг/кг). Кровоснабжение кожного покрова уха мыши оценивали, применяя лазерную доплеровскую систему изображения кровотока (PeriScan PIMII, Perimed, Sweden), каждые 30 с в течение 15 мин, начиная за 5 мин до введения никотиновой кислоты. Вычисляли процентное изменение средней величины кровотока за период времени продолжительностью 10 мин после введения индифферентного вещества или никотиновой кислоты и строили для каждого животного график зависимости процентного изменения средней величины кровотока от времени. Затем для каждого графика вычисляли площадь под кривой (AUC) средней величины кровотока (%мин.) и результаты выражали в средней величине AUCSEM для каждой группы. Соединение D подавляло вызываемое PGD-2 расширение кровеносных сосудов у мыши (фиг. 1). Анализируемые антагонисты DP подавляли вызываемое никотиновой кислотой расширение кровеносных сосудов у мыши; данные для избранных соединений предоставлены на фиг. 2 и 3. Все цитируемые здесь патенты, патентные заявки и публикации приведены здесь полностью в качестве ссылки. Хотя здесь детально описаны конкретные предпочтительные осуществления, многочисленные альтернативные осуществления рассматривают в качестве входящих в объем изобретения.- 24009744 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Применение антагониста рецептора DP и никотиновой кислоты или ее фармацевтически приемлемой соли или сольвата в изготовлении лекарственного средства для лечения атеросклероза у пациентачеловека в отсутствие существенной гиперемии. 2. Применение антагониста рецептора DP и никотиновой кислоты или ее фармацевтически приемлемой соли или сольвата в изготовлении лекарственного средства для повышения уровней HDL в сыворотке у пациента-человека в отсутствие существенной гиперемии. 3. Применение по п.1 или 2, где вводят никотиновую кислоту или ее фармацевтически приемлемые соль или сольват и антагонист рецептора DP вызывает избирательную модуляцию рецептора DP и не вызывает существенной модуляции рецептора CRTH2. 4. Применение по пп.1 или 2, где антагонист рецептора DP выбран из группы, состоящей из соединений или их фармацевтически приемлемых соли или сольвата. 5. Фармацевтическая композиция, включающая в себя никотиновую кислоту, или ее фармацевтически приемлемые соль, или сольват, или другой агонист рецептора никотиновой кислоты и антагонист рецептора DP в сочетании с фармацевтически приемлемым носителем. 6. Фармацевтическая композиция по п.5, включающая в себя никотиновую кислоту и антагонист рецептора DP в сочетании с фармацевтически приемлемым носителем. 7. Фармацевтическая композиция по п.6, где антагонист DP выбран из группы, состоящей из соединений или их фармацевтически приемлемых соли или сольвата. 8. Фармацевтическая композиция по п.7, где антагонист DP выбран из группы, состоящей из соединений А, В, D, Е, X, АА, AF, AG, АН, AI и AJ. 9. Фармацевтическая композиция по пп.5, 6, 7 или 8, дополнительно включающая в себя соединение, ингибирующее HMG Со-А-редуктазу. 10. Фармацевтическая композиция по п.9, где соединение, ингибирующее HMG Со-А-редуктазу,представляет собой симвастатин. 11. Фармацевтическая композиция, содержащая никотиновую кислоту и соединение формулы Е или их фармацевтически приемлемую соль или сольват в сочетании с фармацевтически приемлемым носителем. 12. Фармацевтическая композиция, содержащая приблизительно 1000 мг никотиновой кислоты и антагонист DP формулы Е или их соль или сольват в сочетании с фармацевтически приемлемым носителем. 13. Фармацевтическая композиция по п.12, где антагонист DP соединения формулы Е или его соль или сольват присутствует в количестве, составляющем приблизительно от 1 примерно до 500 мг. 14. Фармацевтическая композиция, содержащая ниацин, соединение формулы Е или его фармацевтически приемлемую соль или сольват и симвастатин, в сочетании с фармацевтически приемлемым носителем. 15. Фармацевтическая композиция по п.14, которая содержит приблизительно 1000 мг никотиновой кислоты, приблизительно от 1 до 500 мг антагониста DP соединения Е или его соли, или сольвата и приблизительно 20 мг симвастатина. 16. Фармацевтическая композиция, содержащая приблизительно 1000 мг никотиновой кислоты,приблизительно от 1 до 500 мг соединения Е или его фармацевтически приемлемой соли или сольвата приблизительно от 20 до 40 мг симвастатина и фармацевтически приемлемый носитель. 17. Фармацевтическая композиция по любому из пп.5-16, представленная в виде таблетки или капсулы. 18. Фармацевтическая композиция по любому из пп.5-17, представленная в виде таблетки. 19. Фармацевтическая композиция по любому из пп.5-17, представленная в виде таблетки или капсулы с замедленным высвобождением. 20. Фармацевтическая композиция по п.18, представленная в виде таблетки с замедленным высвобождением. 21. Фармацевтическая композиция, содержащая никотиновую кислоту и соединение формулы F или АА или их фармацевтически приемлемую соль или сольват в сочетании с фармацевтически приемлемым носителем. 22. Фармацевтическая композиция, содержащая приблизительно 1000 мг никотиновой кислоты и антагонист DP формулы F или АА или его соль или сольват в сочетании с фармацевтически приемлемым носителем. 23. Фармацевтическая композиция по п.22, в которой антагонист DP соединения формулы F или АА или его соли или сольвата присутствует в количестве, составляющем приблизительно от 1 до 500 мг. 24. Фармацевтическая композиция, содержащая ниацин, соединение формулы F или АА или их фармацевтически приемлемую соль или сольват и симвастатин в сочетании с фармацевтически приемлемым носителем. 25. Фармацевтическая композиция по п.24, которая содержит приблизительно 1000 мг никотиновой кислоты, приблизительно от 1 до 500 мг антагониста DP соединения формулы F или АА или их соли или сольвата и приблизительно 20 мг симвастатина.- 28009744 26. Фармацевтическая композиция, которая содержит приблизительно 1000 мг никотиновой кислоты, приблизительно от 1 до 500 мг соединения формулы F или АА или его фармацевтически приемлемой соли или сольвата, приблизительно от 20 до 40 мг симвастатина и фармацевтически приемлемый носитель. 27. Фармацевтическая композиция по любому из пп.21-26, представленная в виде таблетки или капсулы. 28. Фармацевтическая композиция по любому из пп.21-26, представленная в виде таблетки. 29. Фармацевтическая композиция по любому из пп.21-27, представленная в виде таблетки или капсулы с замедленным высвобождением. 30. Фармацевтическая композиция по п.28, представленная в виде таблетки с замедленным высвобождением.
МПК / Метки
МПК: A61P 3/06, A61K 31/455, A61K 31/00, A61K 31/538, A61K 31/437, A61K 31/403
Метки: композиции, способ, связанных, ними, состояний, дислипидемий, лечения, фармацевтические, атеросклероза
Код ссылки
<a href="https://eas.patents.su/30-9744-sposob-lecheniya-ateroskleroza-dislipidemijj-i-svyazannyh-s-nimi-sostoyanijj-i-farmacevticheskie-kompozicii.html" rel="bookmark" title="База патентов Евразийского Союза">Способ лечения атеросклероза, дислипидемий и связанных с ними состояний и фармацевтические композиции</a>
Предыдущий патент: Производные пиримидин-4-она и их применение в качестве модуляторов киназы p38
Следующий патент: Рецепторный комплекс тканезащитных цитокинов, способы идентификации тканезащитных соединений и их применение
Случайный патент: Способы и нуклеиновые кислоты для анализов клеточных пролиферативных нарушений












