Сульфоксиминные производные как ингибиторы p38 мар киназы
Номер патента: 15497
Опубликовано: 31.08.2011
Авторы: Пател Гаутам Д., Пател Панкадж Раманбхай, Джаин Мукул Р., Лохрай Видья Бхушан, Чакрабарти Ганес, Лохрай Брадж Бхушан, Чаттерджи Абхиджит, Шетти Шанкар Джайрам
Формула / Реферат
1. Соединения общей формулы (I)
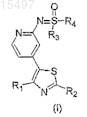
или их фармацевтически приемлемые соли,
где R1, R2 могут быть одинаковыми или различными и независимо представляют собой атом водорода, необязательно замещенные группы, выбранные из линейного или разветвленного (C1-С6)алкила, (С3-С7)циклоалкила, фенила или нафтила;
R3 и R4могут быть одинаковыми или различными и независимо могут быть выбраны из необязательно замещенного линейного или разветвленного (C1-С6)алкила, (С3-С7)циклоалкила, фенила или нафтила или R3и R4 вместе с атомом серы, к которому они присоединены, образуют 3-7-членную кольцевую систему, которая может необязательно содержать 1-3 гетероатома, выбранных из N, О или S,
причем заместители в составе необязательно замещенных групп выбраны из гидроксила, оксо, галогена, тио, нитро, амино, циано и формила.
2. Соединение по п.1, выбранное из следующих соединений:
S-циклопентил-S-фенил-N-[4-(2-этил-4-(3-метилфенил)-1,3-тиазол-5-ил)пиридин-2-ил]сульфоксимин;
S,S-дициклогексил-N-[4-(2-этил-4-м-толилтиазол-5-ил)пиридин-2-ил]сульфоксимин;
S-метил-S-4-метоксифенил-N-[4-(2-этил-4-м-толилтиазол-5-ил)пиридин-2-ил]сульфоксимин;
S-метил-S-фенил-N-[4-(2-этил-4-(3-метилфенил)-1,3-тиазол-5-ил)пиридин-2-ил]сульфоксимин;
(+)-(S)-метил-S-фенил-N-[4-(2-этил-4-(3-метилфенил)-1,3-тиазол-5-ил)пиридин-2-ил]сульфоксимин;
(-)-(S)-метил-S-фенил-N-[4-(2-этил-4-(3-метилфенил)-1,3-тиазол-5-ил)пиридин-2-ил]сульфоксимин;
S-метил-S-(4-фторфенил)-N-[4-(2-этил-4-(3-метилфенил)-1,3-тиазол-5-ил)пиридин-2-ил]сульфоксимин;
S-изобутил-S-фенил-N-[4-(2-этил-4-м-толилтиазол-5-ил)пиридин-2-ил]сульфоксимин;
S-(3-фторфенил)-S-метил-N-[4-(2-этил-4-м-толилтиазол-5-ил)пиридин-2-ил]сульфоксимин;
S-(3-метилфенил)-S-метил-N-[4-(2-этил-4-м-толилтиазол-5-ил)пиридин-2-ил]сульфоксимин;
S,S-дифенил-N-[4-(2-этил-4-м-толилтиазол-5-ил)пиридин-2-ил]сульфоксимин;
S-(2-метилфенил)-S-метил-N-[4-(2-этил-4-м-толилтиазол-5-ил)пиридин-2-ил]сульфоксимин;
S-изопропил-S-фенил-N-[4-(2-этил-4-(3-метилфенил)-1,3-тиазол-5-ил)пиридин-2-ил]сульфоксимин;
S-этил-S-фенил-N-[4-(2-этил-4-(3-метилфенил)-1,3-тиазол-5-ил)пиридин-2-ил]сульфоксимин;
S-метил-S-4-метилфенил-N-[4-(2-этил-4-(3-метилфенил)-1,3-тиазол-5-ил)пиридин-2-ил]сульфоксимин;
ди-н-бутил-N-[4-(2-этил-4-(3-метилфенил)-1,3-тиазол-5-ил)пиридин-2-ил]сульфоксимин;
S-метил-S-(3-хлор-4-фторфенил)-N-[4-(2-этил-4-(3-метилфенил)-1,3-тиазол-5-ил)пиридин-2-ил]сульфоксимин;
1-имино-N-[4-(2-этил-4-(3-метилфенил)-1,3-тиазол-5-ил)пиридин-2-ил]тетрагидро-2Н-тиопиран-1-оксид;
1-имино-N-[4-(2-этил-4-(3-метилфенил)-1,3-тиазол-5-ил)пиридин-2-ил]тетрагидротиофен-1-оксид;
(-)-(S)-метил-S-фенил-N-[4-(2-этил-4-фенил-1,3-тиазол-5-ил)пиридин-2-ил]сульфоксимин;
(+)-(S)-метил-S-фенил-N-[4-(2-этил-4-фенил-1,3-тиазол-5-ил)пиридин-2-ил]сульфоксимин;
S-изопропил-S-фенил-N-[4-(2-этил-4-фенил-1,3-тиазол-5-ил)пиридин-2-ил]сульфоксимин;
S-(4-метоксифенил)-S-метил-N-[4-(2-этил-4-фенил-1,3-тиазол-5-ил)пиридин-2-ил]сульфоксимин;
S-метил-S-(3-метилфенил)-N-[4-{2-этил-4-фенилтиазол-5-ил}пиридин-2-ил]сульфоксимин;
S-метил-S-(3-фторфенил)-N-[4-{2-этил-4-фенилтиазол-5-ил}пиридин-2-ил]сульфоксимин;
4-[2-этил-4-фенилтиазол-5-ил]-2-(дициклогексилсульфоксимин)пиридин;
S-метил-S-(4-фторфенил)-N-[4-{2-этил-4-фенилтиазол-5-ил}пиридин-2-ил]сульфоксимин;
S-циклопентил-S-фенил-N-[4-{2-этил-4-фенилтиазол-5-ил}пиридин-2-ил]сульфоксимин;
(-)-S-циклопентил-S-фенил-N-[4-(2-этил-4-фенил-1,3-тиазол-5-ил)пиридин-2-ил]сульфоксимин;
(+)-S-циклопентил-S-фенил-N-[4-(2-этил-4-фенил-1,3-тиазол-5-ил)пиридин-2-ил]сульфоксимин;
S-метил-S-фенил-N-[4-(2-этил-4-фенил-1,3-тиазол-5-ил)пиридин-2-ил]сульфоксимин;
S,S-дифенил-N-[4-(2-этил-4-фенилтиазол-5-ил)пиридин-2-ил]сульфоксимин;
(-)-S-метил-S-фенил-N-{4-[2-этил-4-(4-фторфенил)тиазол-5-ил]пиридин-2-ил}сульфоксимин;
S-(4-метоксифенил)-S-метил-N-{4-[2-этил-4-(4-фторфенил)тиазол-5-ил]пиридин-2-ил}сульфоксимин;
S-изопропил-S-фенил-N-{4-[2-этил-4-(4-фторфенил)тиазол-5-ил]пиридин-2-ил}сульфоксимин;
(-)-изопропил-S-фенил-N-{4-[2-этил-4-(4-фторфенил)тиазол-5-ил]пиридин-2-ил}сульфоксимин;
(+)-S-изопропил-S-фенил-N-{4-[2-этил-4-(4-фторфенил)тиазол-5-ил]пиридин-2-ил}сульфоксимин;
S-этил-S-фенил-N-{4-[2-этил-4-(4-фторфенил)тиазол-5-ил]пиридин-2-ил}сульфоксимин;
S-метил-S-фенил-N-[4-(2-этил-4-(4-фторфенил)-1,3-тиазол-5-ил)пиридин-2-ил]сульфоксимин;
(+)-S-метил-S-фенил-N-[4-(2-этил-4-(4-фторфенил)-1,3-тиазол-5-ил)пиридин-2-ил]сульфоксимин;
S-метил-S-4-фторфенил-N-[4-(2-этил-4-(4-фторфенил)-1,3-тиазол-5-ил)пиридин-2-ил]сульфоксимин;
S-циклопентил-S-фенил-N-[4-(2-этил-4-(4-фторфенил)-1,3-тиазол-5-ил)пиридин-2-ил]сульфоксимин;
(-)-S-метил-S-4-фторфенил-N-[4-(2-этил-4-(4-фторфенил)-1,3-тиазол-5-ил)пиридин-2-ил]сульфоксимин;
(+)-S-метил-S-4-фторфенил-N-[4-(2-этил-4-(4-фторфенил)-1,3-тиазол-5-ил)пиридин-2-ил]сульфоксимин;
S,S-дифенил-N-[4-(2-этил-4-(4-фторфенил)тиазол-5-ил)пиридин-2-ил]сульфоксимин;
S-метил-S-3-метилфенил-N-[4-(2-этил-4-фторфенилтиазол-5-ил)пиридин-2-ил]сульфоксимин;
S-метил-S-3-фторфенил-N-[4-{2-этил-4-(4-фторфенил)тиазол-5-ил}пиридин-2-ил]сульфоксимин;
S-циклогексил-S-фенил-N-{4-[2-этил-4-(4-фторфенил)тиазол-5-ил]пиридин-2-ил}сульфоксимин;
S-метил-S-фенил-N-[4-(2-этил-4-м-бензойная кислота-тиазол-5-ил)пиридин-2-ил]сульфоксимин;
S-метил-S-фенил-N-[4-(2-этил-4-(3-фторфенил)-1,3-тиазол-5-ил)пиридин-2-ил]сульфоксимин;
S-изопропил-S-фенил-N-[4-(2-этил-4-(3-фторфенил)-1,3-тиазол-5-ил)пиридин-2-ил]сульфоксимин;
S-циклопентил-S-фенил-N-[4-(2-этил-4-(3-фторфенил)-1,3-тиазол-5-ил)пиридин-2-ил]сульфоксимин;
S-метил-S-фенил-N-{4-[2-этил-4-нафталин-1-илтиазол-5-ил]пиридин-2-ил}сульфоксимин;
S-метил-S-фенил-N-{4-[2-этил-4-(3-трифторметилфенил)тиазол-5-ил]пиридин-2-ил}сульфоксимин;
S-метил-S-фенил-N-{4-[2-этил-4-(4-метоксифенил)тиазол-5-ил]пиридин-2-ил}сульфоксимин;
S-метил-S-фенил-N-{4-[2-(4-метилсульфанилфенил)-4-м-толилтиазол-5-ил]пиридин-2-ил}сульфоксимин;
S-метил-S-фенил-N-{4-[2-(4-метилсульфинилфенил)-4-м-толилтиазол-5-ил]пиридин-2-ил}сульфоксимин;
S-метил-S-фенил-N-{4-[2-этил-4-(3,4-дифторфенил)тиазол-5-ил]пиридин-2-ил}сульфоксимин;
S-метил-(4-фторфенил)-N-{4-[2-этил-4-(3,4-дифторфенил)тиазол-5-ил]пиридин-2-ил}сульфоксимин;
S-изопропил-S-фенил-N-{4-[2-этил-4-(3,4-дифторфенил)тиазол-5-ил]пиридин-2-ил}сульфоксимин;
S-изопропил-S-фенил-N-{4-[2-этил-4-(3,5-дифторфенил)тиазол-5-ил]пиридин-2-ил}сульфоксимин;
S-метил-S-фенил-N-{4-[2-этил-4-(3,5-дифторфенил)тиазол-5-ил]пиридин-2-ил}сульфоксимин;
S,S-дифенил-N-{4-[2-этил-4-(3,5-дифторфенил)тиазол-5-ил]пиридин-2-ил}сульфоксимин;
S-метил-S-фенил-N-{4-[2-этил-4-п-толилтиазол-5-ил]пиридин-2-ил}сульфоксимин;
S-циклопентил-S-фенил-N-{4-[2-(2,6-дифторфенил)-4-(3-фторфенил)-(1,3)-тиазол-5-ил]пиридин-2-ил}сульфоксимин;
S-изопропил-S-фенил-N-{4-[2-(2,6-дифторфенил)-4-(3-фторфенил)-(1,3)-тиазол-5-ил]пиридин-2-ил}сульфоксимин;
S-циклогексил-S-фенил-N-{4-[2-(2,6-дифторфенил)-4-(3-фторфенил)-(1,3)-тиазол-5-ил]пиридин-2-ил}сульфоксимин;
S-циклогексил-S-фенил-N-{4-[2-(4-фторфенил)-4-(3-фторфенил)-(1,3)-тиазол-5-ил]пиридин-2-ил}сульфоксимин;
S-изопропил-S-фенил-N-{4-[2-(4-фторфенил)-4-(3-фторфенил)-(1,3)-тиазол-5-ил]пиридин-2-ил}сульфоксимин;
метансульфонат (+)-S-изопропил-S-фенил-N-{4-[2-этил-4-(4-фторфенил)-(1,3)-тиазол-5-ил]пиридин-2-ил}сульфоксимина;
N-оксид метансульфонат (+)-S-изопропил-S-фенил-N-{4-[2-этил-4-(4-фторфенил)-(1,3)-тиазол-5-ил]пиридин-2-ил}сульфоксимина;
S-циклопентил-S-фенил-N-[4-(3-фторфенил-(1,3)-тиазол-5-ил)пиридин-2-ил]сульфоксимин;
S-метил-S-фенил-N-[4-(3-фторфенил-(1,3)-тиазол-5-ил)пиридин-2-ил]сульфоксимин;
S-изопропил-S-фенил-N-[4-(3-фторфенил-(1,3)-тиазол-5-ил)пиридин-2-ил]сульфоксимин;
S-метил-S-фенил-N-[4-(4-фторфенил-(1,3)-тиазол-5-ил)пиридин-2-ил]сульфоксимин;
S-изопропил-S-фенил-N-[4-(4-фторфенил-(1,3)-тиазол-5-ил)пиридин-2-ил]сульфоксимин;
S-циклопентил-S-фенил-N-[4-(4-фторфенил-(1,3)-тиазол-5-ил)пиридин-2-ил]сульфоксимин;
S-метил-S-фенил-N-[(4-фенил-(1,3)-тиазол-5-ил)пиридин-2-ил]сульфоксимин;
S-изопропил-S-фенил-N-[4-фенил-1,3-тиазол-5-ил)пиридин-2-ил]сульфоксимин;
S-циклопентил-S-фенил-N-[(4-фенилтиазол-5-ил)пиридин-2-ил]сульфоксимин.
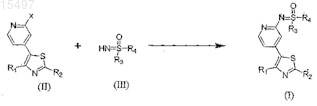
3. Способ получения соединения формулы (I) по п.1 или 2, включающий взаимодействие соединения формулы (II), где X представляет собой подходящую уходящую группу и R1и R2 такие, как указано в п.1, с сульфоксиминным соединением формулы (III), где R3 и R4 такие, как указано в п.1, при использовании подходящего(их) катализатора(ов) сочетания, выбранного(ых) из ацетата палладия, солей меди, в присутствии подходящего лиганда(ов), выбранного из N,N'-диметилэтилендиамина (DMEDA), в присутствии подходящего(их) неорганического(их) основания(ий), выбранного(ых) из карбоната цезия, ацетата цезия, карбоната калия, фосфата калия, гидроксида калия, гидроксида натрия, карбоната натрия, гидроксида лития, гидрида натрия, гидрида калия или их смесей, с получением соединения формулы (I), где R1-R4 такие, как указано в п.1
4. Способ лечения воспалительных заболеваний, обусловленных активацией р38 MAP киназы, включающий введение эффективного нетоксичного количества соединения формулы (I) по п.1 или 2 нуждающемуся в этом пациенту.
5. Способ по п.4, где воспалительным заболеванием является ревматоидный артрит.
6. Применение соединения формулы (I) по п.1 или 2 в качестве лекарственного средства, подходящего для лечения заболеваний, упомянутых в любом из пп.4 или 5.
Текст
ОПИСАНИЕ ИЗОБРЕТЕНИЯ К ЕВРАЗИЙСКОМУ ПАТЕНТУ Дата публикации и выдачи патента СУЛЬФОКСИМИННЫЕ ПРОИЗВОДНЫЕ КАК ИНГИБИТОРЫ p38 МАР КИНАЗЫ Настоящее изобретение относится к новым соединениям общей формулы (I), где R1-R4 определены в формуле изобретения, их фармацевтически приемлемым солям и к способу их получения. Настоящее изобретение также относится к способу лечения воспалительных заболеваний, обусловленных активацией р 38 MAP киназы, в частности ревматоидного артрита,с использованием соединения формулы (I). Кроме того, настоящее изобретение относится к применению соединения формулы (I) в качестве лекарственного средства, подходящего для лечения указанных заболеваний.(71)(73) Заявитель и патентовладелец: КАДИЛА ХЕЛЗКЭР ЛИМИТЕД (IN) 015497 Область техники, к которой относится изобретение Настоящее изобретение относится к новым соединениями формулы (I) и их фармацевтически приемлемым солям, которые могут быть использованы для лечения воспалительных заболеваний, обусловленных активацией р 38 MAP киназы, а также к способу их получения. Уровень техники Настоящее изобретение раскрывает новые соединения для лечения заболеваний, вызванных провоспалительными цитокинами/медиатором(ами), за счет ингибирования р 38 MAP киназы. Этиология и патогенез заболеваний, вызванных провоспалительными цитокинами, до сих пор полностью не выяснены. Полагают, что воздействие фактора окружающей среды, возможно инфекционного агента, на генетически предрасположенного индивидуума приводит к возникновению иммунного ответа,который сопровождается активацией широкого ряда генов провоспалительных цитокинов. Клетки, которые играют важную роль, являются макрофагами, CD4+ Т-клетками, В-клетками, дендритными клетками и мастоцитами. Они значительно влияют на различные аспекты заболевания либо за счет межклеточных взаимодействий, либо за счет образования цитокинов и других медиаторов. Ингибирование образования цитокинов за счет транскрипционного ингибирования представляет собой альтернативную стратегию для терапевтического вмешательства. Фактор- некроза опухоли (TNF-) представляет собой провоспалительный цитокин, продуцируемый главным образом активированными моноцитами и макрофагами. Считают, что избыточная выработка TNF- лежит в основе развития многих серьезных воспалительных заболеваний, таких как ревматоидный артрит (RA), болезнь Крона и псориаз. Последние клинические данные, полученные при использовании химерных антител TNF- и слитых белков растворимого рецептора TNF- при лечении RA,подтвердили важную роль TNF- при данных воспалительных состояниях. Данные агенты обычно хорошо переносятся, но обладают недостатками, связанными с расходами пациента, эффективностью получения и введением в виде инъекций. Поэтому исследование воспаления было направлено на разработку перорально активных мелкомолекулярных ингибиторов выделения цитокинов. Протеинкиназы участвуют в различных клеточных ответах на внешнеклеточные сигналы. Семейство митоген-активированных протеинкиназ (MAPK) включает Ser/Thr киназы, которые активируют субстраты путем двойного фосфорилирования. MAP киназы являются репортерами изменений в межклеточной среде, которые приводят к клеточному ответу, обеспечивающему адаптацию к изменившимся физиологическим и патологическим условиям. MAP киназы действуют как "экстренный выключатель",который обеспечивает широкий клеточный ответ путем активации генов-мишеней факторов транскрипции, цитокинов и их поверхностных рецепторов. Поэтому считают, что данные белки являются перспективной мишенью для будущих терапевтических соединений, целью которых является лечение заболеваний, вызванных провоспалительными цитокинами/медиатором(ами). Одной особенно интересной MAP киназой является р 38, которая также известна как связывающий белок подавляющего цитокин противовоспалительного лекарства (CSBP) и RK. Активирование р 38 MAP киназы наблюдали в клетках под воздействием широкого ряда стимуляторов, таких как обработка LPS,УФ, анизомицином или осмотический шок, и обработка цитокинами, такими как IL-1 и TNF-. Ингибирование р 38 киназы приводит к блокаде образования как IL-1, так и TNF-, IL-1 и TNF- стимулируют образование других провоспалительных цитокинов, таких как IL-6 и IL-8, и участвуют в развитии острых и хронических воспалительных заболеваний и постменопаузного остеопороза. р 38 MAP киназа играет центральную роль в различных провоспалительных ответах и регулирует множество путей развития воспаления. р 38 MAP киназа активно экспрессируется в клетках многих типов, включая иммунные,воспалительные и эндотелиальные клетки.MAP киназа р 38 имеет четыре изоформы (известные к настоящему моменту), а именно р 38MAPK, p38 MAPK, р 38 MAPK и р 38 MAPK, которые кодируются отдельными генами. Данные киназы все являются членами CMGC (CDK (циклинзависимой киназы), MAPK GSK3 (киназы гликогенсинтазы), CLK (Cdc-2 подобной киназы) ветви человеческого кинома. р 38 MAPK и р 38 MAPK киназы на 75% являются гомологами, тогда как р 38 MAPK и р 38 MAPK приблизительно на 60% являются гомологами р 38 MAPK. р 38 MAPK специально индуцирует синтез таких протеаз, как стромелизин 1 (матричная металлопротеиназа 3) или коллагеназа 1 (матричная металлопротеиназа 1), которые важны для опосредованного разрушения хряща при RA. р 38 MAPK действует как белок выживания, индуцирующий белок теплового удара 70, потенциальный антиапоптический фактор, индуцированный в синовиаль-1 015497 ной мембране больных RA. Поддержание состояния для выживания клетки считается ключевым признаком активации р 38 MAPK. О р 38 MAPK, которая участвует в дифференцировке миоцитов, известно мало, или о р 38 MAPK, которая действует на микротрубчатую организацию (которая должна быть важной в организации синовиальных микрососудов). р 38 MAPK изоформа наиболее близко связана с воспалительными ответами. Множество факторов, включая стресс, эндотоксин, цитокиназы, такие какTNF- и IL-1, и сигаретный дым активируют р 38 MAP киназы. Будучи активированной, р 38 MAPK фосфорилирует субстраты, нижерасположенные по метаболическому пути, с инициированием каскадного сигнала, который регулирует синтез различных провоспалительных медиаторов. TNF-, IL-1 и СОХ-2 относятся к наиболее важным провоспалительным медиаторам, регулируемым р 38 MAPK. Показано, что ингибирование каждого из данных воспалительных медиаторов приводит к клиническому преимуществу при лечении заболеваний, вызванных провоспалительными цитокинами/медиатором(ами), с учетом одобренных биологических средств и NSAID. Помимо регулирования выработки медиаторов,таких как TNF-, IL-1, p38 MAPK активируется после связывания TNF-, IL-1 и RANKL с их рецепторами и отвечает за некоторые из эффектов. Поэтому ингибирование р 38 MAPK предлагает две возможности для участия в процессах, включающих данные цитокины. Помимо ингибирования выработки самих цитокинов, ингибирование р 38 MAPK потенциально блокирует отрицательные эффекты любого цитокина, которые все еще могут вырабатываться. По этой причине ингибиторы р 38 MAPK могут быть потенциально более эффективными при различных заболеваниях, что можно предсказать по уровню ингибирования выработки цитокинов, наблюдаемому в модельных системах. Подробная этиология, физиологическое действие, формы и т.п. р 38 МАР киназ и их применение при лечении воспалительных процессов и других заболеваний рассмотрены в WO 2006018718 А 1,WO 2006094187, WO 2006084017, WO 2006013095, WO 2004024699, WO 2004021988, WO 2004032861 и нескольких других патентах и не патентной литературе. Они включены в настоящий документ в виде ссылки для понимания механизма активации, эффектов и применения р 38 MAP киназ. Разработано несколько соединений, которые ингибируют р 38 MAP киназы, и остаются в процессе разработки для лечения воспалительных заболеваний и по другим показаниям. Они включают те, что описаны в WO 2006099495, WO 2006089798, WO 2006067444, WO 20060111416, WO 2006047354,WO 2006040666, WO 2006026235, WO 2006018735, WO 2006018727, WO 2006010082, WO 2005115991,WO 2005108387, WO 2005085244, WO 2005085206, WO 2005085248, WO 2005085249, WO 2004024699,WO 2004014870, WO 2004032861, WO 03068746, WO 03068229, WO 03072569, WO 03032989,WO 03015828, WO 03005999, WO 02007772, WO 02085859, WO 03068746, WO 03068229, WO 9932111,WO 9932110, WO 9932106, WO 9852558, WO 0041698, WO 0043384, WO 9923091, US 20050261354,US 20020065296, US 20030232856, US 20020058678, US 6525046 и т.д., которые включены сюда во всей своей полноте в виде ссылки.J. Med. Chem. 2005, 48, 5966-5979 описывает "Новый ингибитор р 38 MAP киназы как противо-TNF лекарственное средство: открытие N-[4-[2-этил-4-(3-метилфенил)-1,3-тиазол-5-ил]-2-пиридил]бензамида (TAK-715) как потенциального и перорально активного агента против ревматоидного артрита". US 20040053973 описывает замещенные 1,3-тиазольные соединения следующей общей формулы,обладающие хорошей активностью по отношению к р 38 MAP киназе:WO 2006051826 раскрывает азотистое гетероциклическое соединение, обладающее активностью в отношении р 38 MAP киназы, следующей общей формулы: Однако, поскольку не существует методов лечения, доступных на рынке услуг и основанных на потенциальных возможностях данных методов лечения, сохраняется необходимость в разработке более новых соединений, обладающих хорошей активностью и безопасностью.-2 015497 Авторы изобретения раскрывают в настоящем документе новые соединения, которые оказывают ингибирующее действие на р 38 MAP киназы и поэтому могут быть подходящими для лечения ревматоидного артрита (RA). Сущность изобретения Настоящее изобретение раскрывает новые соединения, полезные в качестве ингибиторов р 38 MAP киназ. Новые соединения характеризуются следующей общей формулой (I): Данные соединения и их фармацевтически приемлемые соли могут быть, помимо прочего, пригодны для лечения или ослабления симптомов ревматоидного артрита и других воспалительных заболеваний, при которых р 38 играет важную биологическую роль. Настоящее изобретение относится к новым соединениям общей формулы (I), где R1-R4 определены ниже, и их фармацевтически приемлемым солям и к способу получения указанных соединений. Далее, изобретение относится к способу лечения воспалительных заболеваний, обусловленных активацией р 38 MAP киназы, включающему введение эффективного нетоксичного количества соединения формулы (I) нуждающемуся в этом пациенту, а также к применению соединения формулы (I) в качестве лекарственного средства, подходящего для лечения указанных заболеваний. Предпочтительным воспалительным заболеванием является ревматоидный артрит. Подробное описание изобретения Новые соединения настоящего изобретения определяются общей формулой (I), представленной ниже где R1, R2 могут быть одинаковыми или различными и независимо представляют собой атом водорода, необязательно замещенные группы, выбранные из линейного или разветвленного (C1-С 6)алкила,(С 3-С 7)циклоалкила, фенила или нафтила;R3 и R4 могут быть одинаковыми или различными и независимо могут быть выбраны из необязательно замещенного линейного или разветвленного (C1-С 6)алкила, (С 3-С 7)циклоалкила, фенила или нафтила или R3 и R4 вместе с атомом серы, к которому они присоединены, образуют 3-7-членную кольцевую систему, которая может необязательно содержать 1-3 гетероатома, выбранных из N, О или S,причем заместители в составе необязательно замещенных групп выбраны из гидроксила, оксо, галогена, тио, нитро, амино, циано и формила."Алкил" означает линейный или разветвленный радикал, содержащий от одного до шести атомов углерода, выбранный из таких радикалов, как метил, этил, н-пропил, изопропил, н-бутил, втор-бутил,трет-бутил, амил, т-амил, н-пентил, н-гексил, изогексил и т.п."Циклоалкил" выбран из циклических радикалов, содержащих от трех до семи атомов углерода, более предпочтительно из таких групп, как циклопропил, циклобутил, циклопентил, циклогексил, циклогептил и т.п. В предпочтительном варианте осуществления изобретения соединения настоящего изобретения могут быть выбраны из таких соединений, какS-циклопентил-S-фенил-N-[(4-фенилтиазол-5-ил)пиридин-2-ил]сульфоксимин. Соединения формулы (I), где все символы имеют значения, определенные ранее, могут быть синтезированы с использованием описанных ниже методов или в комбинации с подходящим образом модифицированными традиционными методами, известными специалистам в области органического синтеза,или их вариантами по выбору специалистов в данной области. Предпочтительный способ получения соединения формулы (I) включает взаимодействие соединения формулы (II), где X представляет собой подходящую уходящую группу и R1 и R2 такие, как указано выше, с сульфоксиминным соединением формулы (III), где R3 и R4 такие, как указано выше, при использовании подходящего(их) катализатора(ов) сочетания, выбранного(ых) из ацетата палладия, солей меди,в присутствии подходящего лиганда(ов), выбранного из N,N'-диметилэтилендиамина (DMEDA), в присутствии подходящего(их) неорганического(их) основания(ий), выбранного(ых) из карбоната цезия, ацетата цезия, карбоната калия, фосфата калия, гидроксида калия, гидроксида натрия, карбоната натрия,гидроксида лития, гидрида натрия, гидрида калия или их смесей, с получением соединения формулы (I),где R1-R4 такие, как указано выше. Реакцию можно осуществлять в среде подходящего растворителя, выбранного из таких растворителей, как толуол, DMSO, диоксан и т.п. или их смеси, и реакцию можно осуществлять при температурах в интервале от 0 С до температуры кипения использованного растворителя(ей), а продолжительность реакции может составлять от 1 до 72 ч. Будет понятно, что в любой из упомянутых выше реакций любая реакционная группа в молекуле субстрата может быть защищена согласно существующей химической практике. Подходящими защитными группами являются те группы, которые используют в традиционной химической практике. Более подробно изобретение пояснено примерами, представленными ниже, которые даны только для пояснительных целей и поэтому не должны рассматриваться как ограничивающие объем притязаний изобретения. Данные 1 Н ЯМР спектра, приведенные в конце каждого из соединений (см. ниже), записаны с использованием спектрометра 300 МГц (Bruker AVANCE-300) и представлены в единицах химического сдвига . Если не указано иначе, растворителем, использованным для получения спектра ЯМР, являетсяCDCl3, и тетраметилсилан использован в качестве внутреннего стандарта сравнения.(0,15 г) в сухом толуоле добавляли S-циклопентил-S-фенилсульфоксимин (77,27 мг), йодид меди(I)(7 мг), N,N'-диметилэтилендиамин (6,5 мг) и карбонат цезия (0,3 г). Реакционную смесь нагревали при повышенной температуре (по меньшей мере 100 С) в атмосфере азота в течение ночи. После завершения реакции содержимое выливали в воду и экстрагировали этилацетатом. Органический слой сушили надNa2SO4 и растворители выпаривали под вакуумом, в результате чего получали коричневое масло. Неочищенный продукт подвергали флэш-хроматографии на силикагеле. После элюирования 50% этилацетатом в гексане получали целевой продукт в виде белого твердого вещества (0,093 мг). Выход=32%. 1 Н ЯМР (CDCl3, 300 МГц): 1,40-1,45 (3 Н, т, J=7,57 Гц); 1,68-1,75 (4 Н, шир.); 2,01-2,17 (3 Н, шир.); 2,3 (1 Н, с); 2,34-2,36 (1 Н, шир.); 3,75-3,8 (1 Н, м); 6,54-6,51 (1 Н, дд, J=1,56, J=5,29 Гц); 6,87 (1 Н, с); 7,17,17 (3 Н, м); 7,36 (1 Н, с); 7,50-7,58 (3 Н, м); 7,86-7,91 (3 Н, м). Пример 2.(0,15 г) в сухом толуоле добавляли S,S-дициклогексилсульфоксимин (77,27 мг), йодид меди(I) (7 мг),N,N'-диметилэтилендиамин (6,5 мг) и карбонат цезия (0,3 г). Реакционную смесь нагревали при повышенной температуре (по меньшей мере 100 С) в атмосфере азота в течение ночи. После завершения реакции содержимое выливали в воду и экстрагировали этилацетатом. Органический слой сушили надNa2SO4 и растворители выпаривали под вакуумом, в результате чего получали коричневое масло. Неочищенный продукт подвергали флэш-хроматографии на силикагеле. После элюирования этилацетатом в гексане получали целевой продукт (0,09 мг) в виде белого твердого вещества. Выход=32%. 1(1 Н, дд, J=5,32 Гц). Следующие соединения получали методами, аналогичными тем, что описаны в примерах 1 или 2,при соответствующем выборе реагентов, условий реакции и количества реагентов, с учетом навыков специалиста в данной области. Пример 3.S-Метил-S-фенил-N-3-(2-этил-4-сложный этиловый эфир м-бензойной кислоты)тиазол-5 илпиридин-2-илсульфоксимин (0,205 г) растворяли в ТГФ и МеОН при температуре окружающей среды. К реакционной смеси добавляли LiOHH2O (0,035 г), растворенный в воде, и перемешивали при температуре окружающей среды от 2 до 4 ч. Реакционную смесь подщелачивали до рН 8 добавлением раствора бикарбоната натрия. Водный слой экстрагировали этилацетатом, органический слой собирали,сушили над сульфатом натрия и выпаривали под лабораторным вакуумом. Неочищенное соединениеS-метил-S-фенил-4-[2-(4-метилсульфанилфенил)-4-мтолилтиазол-5-ил]пиридин-2-илсульфоксимин (0,250 г) в ДМФ, охлаждали. В нее добавляли метахлорпербензойную кислоту (0,163 г) и перемешивали при температуре окружающей среды в течение нескольких часов. После завершения реакции реакционную смесь экстрагировали этилацетатом. Органический слой отделяли, сушили и выпаривали с получением коричневого масла. Неочищенное соединение очищали колоночной флэш-хроматографией с получением бледно-желтого твердого вещества (0,079 г). 1(1 Н, с). Выход=36%. Пример 79. Метансульфонат (+)-S-изопропил-S-фенил-N-4-[2-этил-4-(4-фторфенил)-(1,3)-тиазол-5-ил]пиридин 2-илсульфоксимина. К раствору (+)-S-изопропил-S-фенил-N-4-[2-этил-4-(4-фторфенил)-(1,3)-тиазол-5-ил]пиридин-2 илсульфоксимина (0,2 г) в ТГФ добавляли метансульфоновую кислоту (37 мг) и перемешивали при температуре окружающей среды в течение нескольких часов. Растворители выпаривали и получали твердое соединение (0,24 г). 1(+)-S-изопропил-S-фенил-N-4-[2-этил-4-(4-фторфенил)-(1,3)-тиазол-5 ил]пиридин-2-илсульфоксимина. К раствору (-)-S-изопропил-S-фенил-N-4-[2-этил-4-(4-фторфенил)-(1,3)-тиазол-5-ил]пиридин-2 илсульфоксимина (0,3 г) в сухом хлороформе добавляли м-хлорпербензойную кислоту (0,344 г) и реакционную смесь нагревали при повышенной температуре примерно в течение 8 ч. После завершения реакции реакционную смесь выливали в насыщенный раствор NaHCO3 и экстрагировали этилацетатом. Органические слои объединяли, сушили над сульфатом натрия, растворитель выпаривали и получали коричневое масло (0,3 г). Неочищенный продукт очищали колоночной флэш-хроматографией (0,15 г). Выход=48%. Стадия 2. N-Оксид метансульфоната (+)-S-изопропил-S-фенил-N-4-[2-этил-4-(4-фторфенил)-(1,3)тиазол-5-ил]пиридин-2-илсульфоксимина. Процесс был аналогичен тому, что описан в примере 70. 1H ЯМР (CDCl3, 300 МГц): 8,22 (д, 1 Н, J=7,1 Гц); 8,10 (д, 2 Н, J=7,3 Гц); 7,76-7,68 (м, 3 Н); 7,37 (дд,2H, J=5,4, 8,6 Гц); 7,06 (д, 1 Н, J=2,1 Гц); 6,98 (т, 2 Н, J=8,6 Гц); 6,79 (дд, 1H, J=2,2, 7,1 Гц); 3,93 (кв., 1 Н,J=6,7 Гц); 3,12 (кв., 2 Н, J=7,5 Гц); 1,55 (д, 3 Н, J=6,7 Гц); 1,45 (т, 3 Н, J=7,5 Гц); 1,31 (д, 3 Н, J=6,7 Гц). Выход=67%. Получение неорганических солей. При перемешивании к раствору сульфоксимина в метаноле добавляли метанольный раствор кислоты, такой как метанольный раствор соляной кислоты, метанольный раствор серной кислоты и т.п. Реакционную смесь перемешивали при температуре окружающей среды в течение нескольких часов. Растворитель выпаривали и получали твердое соединение. А) Подтверждение эффективности соединений ex vivo. Делали забор крови из вены у 3 различных добровольцев в отдельные гепаринизированные пробирки (100 МЕ/мл) и инкубировали в присутствии 10 и 100 мкМ тестируемых соединений в течение 1 ч при 37 С. После этого добавляли LPS (конечной концентрацией 1 нг/мл) и инкубирование продолжали в течение 5 ч. Реакцию прекращали погружением образцов в лед на 10 мин. Затем образцы центрифугировали, отделяли плазму и хранили при -70 С до проведения анализа на TNF- и IK-1 методом ELISA. Полученные результаты представлены в табл. 1. В) Подтверждение эффективности соединений in vivo. Мышей Balb/c содержали для акклиматизации в камере наблюдения в течение 2 дней перед экспериментом. В день эксперимента животных взвешивали и рассчитывали количество вводимого тестируемого соединения на 10 мг/кг массы тела в расчете на общий объем 2 мл. Контрольные группы получал только разбавитель, тогда как опытные группы получали тестируемое соединение, в обоих случаях пероральным способом, за 30 мин до внутривенной инъекции LPS (50 мкг/кг). Забор крови осуществляли через 60 мин после инъекции LPS из ретроорбитального сплетения, отделяли сыворотку и хранили в глубокой заморозке до момента определения TNF методом ELISA. Таблица 2- 15015497 С) Подтверждение активности in vitro. Соединения скринировали при использовании in vitro анализа ELISA активности р 38 MAP киназы. Активированная р 38 MAP киназа в процессе ее биологического действия фосфорилирует субстраты. Анализ основан на определении фосфорилированного субстрата р 38 MAP киназы при использованииATF-2 в качестве биологического субстрата. Чем больше активность ингибитора р 38 MAP киназы в реакционной смеси, тем меньше будет количество активной р 38 MAP киназы, доступной для фосфорилирования ATF-2. Так, более низкая величина OD будет указывать на более сильное ингибирование р 38MAP киназы специфическим ингибитором р 38 MAP киназы. Количественную оценку фосфорилированной ATF-2 при различных концентрациях ингибитора р 38 MAP киназы использовали для определенияIC50 по соответствию результатов логистической программе доза-ответ (Graphpad Prism, CA). IC50 определяли как концентрацию соединения, требуемую для достижения 50% ингибирования активности р 38MAP киназы. Это можно видеть из табл. 3. Таблица 3- 16015497 ФОРМУЛА ИЗОБРЕТЕНИЯ 1. Соединения общей формулы (I) или их фармацевтически приемлемые соли,где R1, R2 могут быть одинаковыми или различными и независимо представляют собой атом водорода, необязательно замещенные группы, выбранные из линейного или разветвленного (C1-С 6)алкила,(С 3-С 7)циклоалкила, фенила или нафтила;R3 и R4 могут быть одинаковыми или различными и независимо могут быть выбраны из необязательно замещенного линейного или разветвленного (C1-С 6)алкила, (С 3-С 7)циклоалкила, фенила или нафтила или R3 и R4 вместе с атомом серы, к которому они присоединены, образуют 3-7-членную кольцевую систему, которая может необязательно содержать 1-3 гетероатома, выбранных из N, О или S,причем заместители в составе необязательно замещенных групп выбраны из гидроксила, оксо, галогена, тио, нитро, амино, циано и формила. 2. Соединение по п.1, выбранное из следующих соединений:S-циклопентил-S-фенил-N-[(4-фенилтиазол-5-ил)пиридин-2-ил]сульфоксимин. 3. Способ получения соединения формулы (I) по п.1 или 2, включающий взаимодействие соединения формулы (II), где X представляет собой подходящую уходящую группу и R1 и R2 такие, как указано в- 18015497 п.1, с сульфоксиминным соединением формулы (III), где R3 и R4 такие, как указано в п.1, при использовании подходящего(их) катализатора(ов) сочетания, выбранного(ых) из ацетата палладия, солей меди, в присутствии подходящего лиганда(ов), выбранного из N,N'-диметилэтилендиамина (DMEDA), в присутствии подходящего(их) неорганического(их) основания(ий), выбранного(ых) из карбоната цезия, ацетата цезия, карбоната калия, фосфата калия, гидроксида калия, гидроксида натрия, карбоната натрия, гидроксида лития, гидрида натрия, гидрида калия или их смесей, с получением соединения формулы (I), где 4. Способ лечения воспалительных заболеваний, обусловленных активацией р 38 MAP киназы,включающий введение эффективного нетоксичного количества соединения формулы (I) по п.1 или 2 нуждающемуся в этом пациенту. 5. Способ по п.4, где воспалительным заболеванием является ревматоидный артрит. 6. Применение соединения формулы (I) по п.1 или 2 в качестве лекарственного средства, подходящего для лечения заболеваний, упомянутых в любом из пп.4 или 5.
МПК / Метки
МПК: C07D 417/04, A61K 31/427, A61P 29/00
Метки: сульфоксиминные, производные, ингибиторы, киназы, мар
Код ссылки
<a href="https://eas.patents.su/20-15497-sulfoksiminnye-proizvodnye-kak-ingibitory-p38-mar-kinazy.html" rel="bookmark" title="База патентов Евразийского Союза">Сульфоксиминные производные как ингибиторы p38 мар киназы</a>
Предыдущий патент: Бифенилкарбоксамиды
Следующий патент: Способ получения г-ксф человека
Случайный патент: Композиционное декоративно-защитное покрытие












