Аналоги пиридона и пиридазона как модуляторы gpr119
Формула / Реферат
1. Соединение формулы I
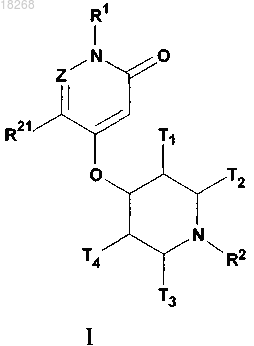
или его энантиомер, диастереомер или фармацевтически приемлемая соль, при этом
Z представляет собой СН или N;
R1 представляет собой фенил, бензил, бензо[d]оксазолил или пиридинил, любой из которых необязательно может быть замещен одним или более радикалами R6;
R2 представляет собой пиримидинил или -C(=O)OR5, при этом пиримидинил необязательно может быть замещен одним или более радикалами R6;
R5 представляет собой (С1-С8)алкил, который необязательно может быть замещен одним или более радикалами R6;
R6 в каждом случае независимо выбран из (С1-С8)алкила, 3-10-членной насыщенной или частично ненасыщенной циклической углеводородной группы, содержащей от 1 до 3 колец, которые могут быть соединены с 1 или 2 ароматическими кольцами, выбранными из фенила и нафтила, галогена, -CN, -NO2,
-CF3, -OCHF2, -OR10, -ОН, -C(=O)R10 или -S(O)2R10;
R9 в каждом случае независимо выбран из водорода или (С1-С8)алкила;
R10 в каждом случае независимо представляет собой (С1-С8)алкил;
R21 представляет собой водород, (С1-С8)алкил, галоген(С1-С8)алкил, гидрокси(С1-С8)алкил, фенил, галоген,
-NH2, -CN, -C(=O)OH, -C(=O)OR10 или -C(=O)NR9R9;
T1, Т2, Т3, Т4 представляют собой водород, галоген или (С1-С8)алкил;
при условии, что, когда Z представляет собой СН, a R1 представляет собой фенил или пиридинил, все радикалы T1, T2, Т3 и Т4 не могут быть представлены водородом.
2. Соединение, его энантиомер, диастереомер или фармацевтически приемлемая соль по п.1, при этом соединение формулы I представляет собой соединение формулы II(у)
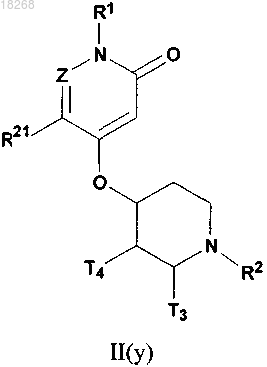
при этом Z, R1, R2, R21, Т3 и Т4 определяются, как в п.1.
3. Соединение, его энантиомер, диастереомер или фармацевтически приемлемая соль по п.1, при этом соединение формулы I представляет собой соединение формулы II(z)
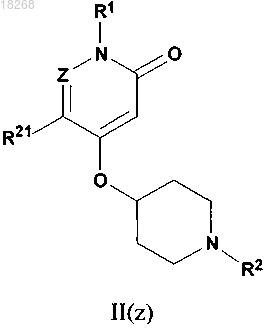
при этом Z, R1, R2 и R21 определяются, как в п.1.
4. Соединение, его энантиомер, диастереомер или фармацевтически приемлемая соль по п.1, при этом
Z представляет собой СН или N;
R1 представляет собой фенил, бензил или пиридинил, любой из которых необязательно может быть замещен одним или более радикалами R6;
R2 представляет собой пиримидинил или -C(=O)OR5, при этом пиримидинил необязательно может быть замещен одним или более радикалами R6;
R5 представляет собой (С1-С8)алкил, который необязательно может быть замещен одним или более радикалами R6;
R6 в каждом случае независимо выбран из (С1-С8)алкила, 3-10-членной насыщенной или частично ненасыщенной циклической углеводородной группы, содержащей от 1 до 3 колец, которые могут быть соединены с 1 или 2 ароматическими кольцами, выбранными из фенила и нафтила, галогена, -CN, -NO2,
-CF3, -OCHF2, -OR10, -ОН, -C(=O)R10 или -S(O)2R10;
R9 в каждом случае независимо выбран из водорода или (С1-С8)алкила;
R10 в каждом случае независимо представляет собой (С1-С8)алкил;
R21 представляет собой водород, (С1-С8)алкил, галоген(С1-С8)алкил, гидрокси(С1-С8)алкил, фенил, галоген,
-NH2, -CN, -C(=O)OH, -C(=O)OR10 или -C(=O)NR9R9;
T1, Т2, Т3, Т4 представляют собой водород или (С1-С8)алкил.
5. Соединение, его энантиомер, диастереомер или фармацевтически приемлемая соль по п.1, при этом
Z представляет собой СН или N;
R1 представляет собой фенил, бензил, бензо[d]оксазолил или пиридинил, любой из которых необязательно может быть замещен одним или более радикалами R6;
R2 представляет собой пиримидинил или -C(=O)R5, при этом пиримидинил необязательно может быть замещен одним или более радикалами R6;
R5 представляет собой (С3-С4)алкил;
R6 в каждом случае независимо выбран из (С1-С4)алкила, циклопропила, галогена, -CN, -NO2, -CF3, -OCHF2, -OR10 или -S(O)2R10;
R9 в каждом случае независимо выбран из водорода или метила;
R10 в каждом случае независимо представляет собой метил;
R21 представляет собой водород, гидроксиметил, фенил, галоген, -CN, -C(=O)OR10 или -C(=O)NR9R9;
T1, Т2, Т3, Т4 представляют собой водород или метил.
6. Соединение, его энантиомер, диастереомер или фармацевтически приемлемая соль по п.1, при этом
Z представляет собой СН или N;
R1 представляет собой фенил, бензил, бензо[d]оксазолил или пиридинил, любой из которых необязательно может быть замещен одним или более радикалами R6;
R2 представляет собой пиримидинил или -C(=O)OR5, при этом пиримидинил необязательно может быть замещен одним или более радикалами R6;
R5 представляет собой (С3-С4)алкил;
R6 в каждом случае независимо выбран из (С1-С4)алкила, циклопропила, галогена, -CN, -NO2, -CF3, -OCHF2, -OR10, -C(=O)R10 и -S(O)2R10;
R9 в каждом случае независимо выбран из водорода или метила;
R10 в каждом случае независимо представляет собой метил;
R21 представляет собой водород, гидроксиметил, фенил, галоген, -CN, -C(=O)OR10 или -C(=O)NR9R9;
T1 и Т2 представляют собой водород;
Т3, Т4 представляют собой водород или метил.
7. Соединение, его энантиомер, диастереомер или фармацевтически приемлемая соль по п.1, при этом
Z представляет собой СН или N;
R1 представляет собой фенил, бензил, бензо[d]оксазолил или пиридинил, любой из которых необязательно может быть замещен одним или более радикалами R6;
R2 представляет собой пиримидинил или -C(=O)OR5, при этом пиримидинил необязательно может быть замещен одним или более радикалами R6;
R5 представляет собой (С3-С4)алкил;
R6 в каждом случае независимо выбран из (С1-С4)алкила, циклопропила, галогена, -CN, -NO2, -CF3, -OCHF2, -OR10, -C(=O)R10 и -S(O)2R10;
R9 в каждом случае независимо выбран из водорода или метила;
R10 в каждом случае независимо представляет собой метил;
R21 представляет собой водород, гидроксиметил, фенил, галоген, -CN, -C(=O)OR10 или -C(=O)NR9R9;
T1, T2 и Т4 представляют собой водород и
Т3 представляет собой водород или метил.
8. Соединение, его энантиомер, диастереомер или фармацевтически приемлемая соль по п.1, при этом
Z представляет собой СН или N;
R1 представляет собой фенил, бензо[d]оксазолил или пиридинил, любой из которых необязательно может быть замещен одним или более радикалами R6;
R2 представляет собой пиримидинил или -C(=O)OR5, при этом пиримидинил необязательно может быть замещен одним или более радикалами R6;
R5 представляет собой (С3-С4)алкил;
R6 в каждом случае независимо выбран из (С1-С4)алкила, циклопропила, галогена, -CN, -NO2, -CF3, -OCHF2, -OR10, -C(=O)R10 и -S(O)2R10;
R9 в каждом случае независимо выбран из водорода или метила;
R10 в каждом случае независимо представляет собой метил;
R21 представляет собой водород, гидроксиметил, фенил, галоген, -CN, -C(=O)OR10 или -C(=O)NR9R9;
T1, T2 и Т4 представляют собой водород и
Т3 представляет собой водород или метил.
9. Соединение по п.1, представляющее собой
транс-трет-бутил-2-метил-4-(1-(4-(метилсульфонил)фенил)-2-оксо-1,2-дигидропиридин-4-илокси)пиперидин-1-карбоксилат;
цис-трет-бутил-2-метил-4-(1-(4-(метилсульфонил)фенил)-2-оксо-1,2-дигидропиридин-4-илокси)пиперидин-1-карбоксилат;
цис-4-(2-метил-1-(5-пропилпиримидин-2-ил)пиперидин-4-илокси)-1-(4-(метилсульфонил)фенил)пиридин-2(1Н)-он, соль TFA;
транс-4-(2-метил-1-(5-пропилпиримидин-2-ил)пиперидин-4-илокси)-1-(4-(метилсульфонил)фенил)пиридин-2(1Н)-он, соль TFA;
1-(2-метилбензо[d]оксазол-5-ил)-4-(1-(5-пропилпиримидин-2-ил)пиперидин-4-илокси)пиридин-2(1Н)-он;
1-(2-изопропилбензо[d]оксазол-5-ил)-4-(1-(5-пропилпиримидин-2-ил)пиперидин-4-илокси)пиридин-2(1Н)-он;
1-(2-метилбензо[d]оксазол-6-ил)-4-(1-(5-пропилпиримидин-2-ил)пиперидин-4-илокси)пиридин-2(1Н)-он, солянокислая соль;
трет-бутил-4-(1-(4-(метилсульфонил)фенил)-6-оксо-1,6-дигидропиридазин-4-илокси)пиперидин-1-карбоксилат;
2-(4-(метилсульфонил)фенил)-5-(1-(5-пропилпиримидин-2-ил)пиперидин-4-илокси)пиридазин-3(2Н)-он;
5-(1-(5-циклопропилпиримидин-2-ил)пиперидин-4-илокси)-2-(4-(метилсульфонил)фенил)пиридазин-3(2Н)-он;
5-(1-(5-ацетилпиримидин-2-ил)пиперидин-4-илокси)-2-(4-(метилсульфонил)фенил)пиридазин-3(2Н)-он;
5-(1-(5-этилпиримидин-2-ил)пиперидин-4-илокси)-2-(4-(метилсульфонил)фенил)пиридазин-3(2Н)-он;
трет-бутил-4-(1-(4-метоксибензил)-6-оксо-3-фенил-1,6-дигидропиридазин-4-илокси)пиперидин-1-карбоксилат;
метил-4-(1-(трет-бутоксикарбонил)пиперидин-4-илокси)-1-(3,4-дихлорфенил)-6-оксо-1,6-дигидропиридазин-3-карбоксилат;
трет-бутил-4-(1-(3,4-дихлорфенил)-3-(метилкарбамоил)-6-оксо-1,6-дигидропиридазин-4-илокси)пиперидин-1-карбоксилат;
трет-бутил-4-(3-карбамоил-1-(3,4-дихлорфенил)-6-оксо-1,6-дигидропиридазин-4-илокси)пиперидин-1-карбоксилат;
трет-бутил-4-(1-(3,4-дихлорфенил)-3-(гидроксиметил)-6-оксо-1,6-дигидропиридазин-4-илокси)пиперидин-1-карбоксилат;
метил-4-(1-(трет-бутоксикарбонил)пиперидин-4-илокси)-1-(4-(метилсульфонил)фенил)-6-оксо-1,6-дигидропиридазин-3-карбоксилат;
трет-бутил-4-(1-(4-метоксибензил)-6-оксо-1,6-дигидропиридазин-4-илокси)пиперидин-1-карбоксилат;
трет-бутил-4-(3-циано-1-(3,4-дихлорфенил)-6-оксо-1,6-дигидропиридазин-4-илокси)пиперидин-1-карбоксилат;
4-(1-(5-циклопропилпиримидин-2-ил)пиперидин-4-илокси)-1-(3,4-дихлорфенил)-6-оксо-1,6-дигидропиридазин-3-карбонитрил;
1-(3,4-дихлорфенил)-6-оксо-4-(1-(5-пропилпиримидин-2-ил)пиперидин-4-илокси)-1,6-дигидропиридазин-3-карбонитрил;
4-(1-(5-хлорпиримидин-2-ил)пиперидин-4-илокси)-1-(3,4-дихлорфенил)-6-оксо-1,6-дигидропиридазин-3-карбонитрил;
1-(3,4-дихлорфенил)-4-(1-(5-йодпиримидин-2-ил)пиперидин-4-илокси)-6-оксо-1,6-дигидропиридазин-3-карбонитрил;
трет-бутил-4-(3-амино-1-(3,4-дихлорфенил)-6-оксо-1,6-дигидропиридазин-4-илокси)пиперидин-1-карбоксилат;
1-(3,4-дихлорфенил)-6-оксо-4-(1-(5-(трифторметил)пиримидин-2-ил)пиперидин-4-илокси)-1,6-дигидропиридазин-3-карбонитрил;
трет-бутил-4-(3-хлор-1-(3,4-дихлорфенил)-6-оксо-1,6-дигидропиридазин-4-илокси)пиперидин-1-карбоксилат;
2-(3,4-дихлорфенил)-5-(1-(5-пропилпиримидин-2-ил)пиперидин-4-илокси)пиридазин-3(2Н)-он;
метил-4-(1-(трет-бутоксикарбонил)пиперидин-4-илокси)-1-(4-циано-3-фторфенил)-6-оксо-1,6-дигидропиридазин-3-карбоксилат;
метил-4-(1-(трет-бутоксикарбонил)пиперидин-4-илокси)-1-(6-цианопиридин-3-ил)-6-оксо-1,6-дигидропиридазин-3-карбоксилат;
трет-бутил-4-(3-циано-1-(4-(метилсульфонил)фенил)-6-оксо-1,6-дигидропиридазин-4-илокси)пиперидин-1-карбоксилат;
метил-1-(4-циано-3-фторфенил)-6-оксо-4-(1-(5-пропилпиримидин-2-ил)пиперидин-4-илокси)-1,6-дигидропиридазин-3-карбоксилат;
метил-1-(4-циано-3-фторфенил)-4-(1-(5-циклопропилпиримидин-2-ил)пиперидин-4-илокси)-6-оксо-1,6-дигидропиридазин-3-карбоксилат;
трет-бутил-4-(3-циано-1-(4-циано-3-фторфенил)-6-оксо-1,6-дигидропиридазин-4-илокси)пиперидин-1-карбоксилат;
трет-бутил-4-(3-циано-1-(6-цианопиридин-3-ил)-6-оксо-1,6-дигидропиридазин-4-илокси)пиперидин-1-карбоксилат;
1-(4-циано-3-фторфенил)-4-(1-(5-йодпиримидин-2-ил)пиперидин-4-илокси)-6-оксо-1,6-дигидропиридазин-3-карбонитрил;
1-(6-цианопиридин-3-ил)-4-(1-(5-йодпиримидин-2-ил)пиперидин-4-илокси)-6-оксо-1,6-дигидропиридазин-3-карбонитрил;
1-(4-циано-3-фторфенил)-6-оксо-4-(1-(5-пропилпиримидин-2-ил)пиперидин-4-илокси)-1,6-дигидропиридазин-3-карбонитрил;
1-(4-циано-3-фторфенил)-6-оксо-4-(1-(5-(трифторметил)пиримидин-2-ил)пиперидин-4-илокси)-1,6-дигидропиридазин-3-карбонитрил;
1-(6-цианопиридин-3-ил)-6-оксо-4-(1-(5-(трифторметил)пиримидин-2-ил)пиперидин-4-илокси)-1,6-дигидропиридазин-3-карбонитрил;
4-(1-(5-бромпиримидин-2-ил)пиперидин-4-илокси)-1-(4-циано-3-фторфенил)-6-оксо-1,6-дигидропиридазин-3-карбонитрил;
метил-4-(1-(5-бромпиримидин-2-ил)пиперидин-4-илокси)-1-(4-циано-3-фторфенил)-6-оксо-1,6-дигидропиридазин-3-карбоксилат;
метил-1-(4-бром-3-фторфенил)-4-(1-(трет-бутоксикарбонил)пиперидин-4-илокси)-6-оксо-1,6-дигидропиридазин-3-карбоксилат;
метил-1-(4-бром-2-фторфенил)-4-(1-(трет-бутоксикарбонил)пиперидин-4-илокси)-6-оксо-1,6-дигидропиридазин-3-карбоксилат;
трет-бутил-4-(1-(4-бром-3-фторфенил)-3-циано-6-оксо-1,6-дигидропиридазин-4-илокси)пиперидин-1-карбоксилат;
трет-бутил-4-(1-(4-бром-2-фторфенил)-3-циано-6-оксо-1,6-дигидропиридазин-4-илокси)пиперидин-1-карбоксилат;
4-(1-(5-хлорпиримидин-2-ил)пиперидин-4-илокси)-1-(4-(метилсульфонил)фенил)-6-оксо-1,6-дигидропиридазин-3-карбонитрил;
4-(1-(5-йодпиримидин-2-ил)пиперидин-4-илокси)-1-(4-(метилсульфонил)фенил)-6-оксо-1,6-дигидропиридазин-3-карбонитрил;
1-(4-(метилсульфонил)фенил)-6-оксо-4-(1-(5-(трифторметил)пиримидин-2-ил)пиперидин-4-илокси)-1,6-дигидропиридазин-3-карбонитрил;
6-(гидроксиметил)-5-(1-(5-хлорпиримидин-2-ил)пиперидин-4-илокси)-2-(4-(метилсульфонил)фенил)пиридазин-3(2Н)-он;
6-(гидроксиметил)-5-(1-(5-йодпиримидин-2-ил)пиперидин-4-илокси)-2-(4-(метилсульфонил)фенил)пиридазин-3(2Н)-он;
4-(1-(5-цианопиримидин-2-ил)пиперидин-4-илокси)-1-(4-(метилсульфонил)фенил)-6-оксо-1,6-дигидропиридазин-3-карбонитрил;
1-(4-бром-3-фторфенил)-4-(1-(5-хлорпиримидин-2-ил)пиперидин-4-илокси)-6-оксо-1,6-дигидропиридазин-3-карбонитрил;
1-(4-бром-2-фторфенил)-4-(1-(5-хлорпиримидин-2-ил)пиперидин-4-илокси)-6-оксо-1,6-дигидропиридазин-3-карбонитрил;
трет-бутил-4-(1-(4-циано-3-фторфенил)-3-(гидроксиметил)-6-оксо-1,6-дигидропиридазин-4-илокси)пиперидин-1-карбоксилат;
трет-бутил-4-(3-циано-1-(4-нитрофенил)-6-оксо-1,6-дигидропиридазин-4-илокси)пиперидин-1-карбоксилат;
4-(1-(5-(дифторметокси)пиримидин-2-ил)пиперидин-4-илокси)-1-(4-(метилсульфонил)фенил)-6-оксо-1,6-дигидропиридазин-3-карбонитрил;
изопропил-4-(3-циано-1-(4-циано-3-фторфенил)-6-оксо-1,6-дигидропиридазин-4-илокси)пиперидин-1-карбоксилат;
изопропил-4-(3-циано-1-(4-(метилсульфонил)фенил)-6-оксо-1,6-дигидропиридазин-4-илокси)пиперидин-1-карбоксилат;
транс-трет-бутил-4-(5-хлор-1-(4-циано-3-фторфенил)-2-оксо-1,2-дигидропиридин-4-илокси)-3-метилпиперидин-1-карбоксилат или
цис- и транс-изомеры 4-(5-хлор-4-(1-(5-циклопропилпиримидин-2-ил)-3-метилпиперидин-4-илокси)-2-оксопиридин-1(2Н)-ил)-2-фторбензонитрила.
10. Фармацевтическая композиция для предупреждения, подавления или лечения прогрессирования или начала заболеваний или расстройств, связанных с активностью рецептора GPR119, связанного с G-белком, состоящая из терапевтически эффективного количества соединения по п.1 или его энантиомера, диастереомера или фармацевтически приемлемой соли и фармацевтически приемлемого носителя.
Текст
АНАЛОГИ ПИРИДОНА И ПИРИДАЗОНА КАК МОДУЛЯТОРЫ GPR119 Новые соединения структурной формулы I или их энантиомеры, диастереомеры или фармацевтически приемлемые соли предлагаются как модуляторы рецептора GPR119, связанного с G-белком, при этом Z, R1, R2, R21, Т 1, Т 2, Т 3 и Т 4 определены в данном описании. Модуляторы рецептора GPR119, связанного с G-белком, полезны для лечения, предупреждения или замедления прогрессирования заболеваний, требующих модуляторной терапии для рецептора GPR119,связанного с G-белком. Таким образом, раскрытие также касается композиций, содержащих эти новые соединения, и способов лечения заболеваний или патологических состояний, имеющих отношение к активности рецептора GPR119, связанного с G-белком, при этом указанные способы основаны на применении любого из этих новых соединений или композиций, включающих любое из таких новых соединений. Область техники, к которой относится изобретение Настоящее изобретение предлагает новые соединения и аналоги пиридона и пиридазона, которые являются модуляторами рецептора GPR119, связанного с G-белком, содержащие их композиции, а также способы их применения, например, для предупреждения и/или лечения заболеваний или расстройств,ассоциированных с активностью рецептора GPR119, связанного с G-белком, например диабета и ожирения. Предпосылки создания изобретения Сахарный диабет представляет собой тяжелое заболевание, которым страдают более 100 миллионов человек во всем мире. В Соединенных Штатах Америки насчитывается более 12 миллионов диабетиков и ежегодно диагностируют более 600 тыс. новых случаев этого заболевания. Сахарный диабет (СД) является диагностическим термином для группы заболеваний, характеризующихся нарушенным гомеостазом глюкозы, что приводит к повышению уровня сахара в крови. Существует множество типов диабета, но двумя наиболее частыми являются диабет 1 типа (также называемый инсулинозависимым сахарным диабетом или ИЗСД) и СД 2 типа (также называемый неинсулинозависимым сахарным диабетом или НИЗСД). Этиология разных типов диабета неодинакова, однако для любого больного диабетом характерны две общие особенности: избыточная выработка глюкозы печенью и пониженная способность или полное отсутствие способности перемещать глюкозу из крови в клетки, где она играет роль основного горючего для организма. У людей, не страдающих диабетом, в метаболизме активно используется инсулин, гормон, вырабатываемый поджелудочной железой, который перемещает глюкозу из крови в клетки организма. Однако у людей, страдающих диабетом, инсулин либо не вырабатывается, либо вырабатывается, но неэффективно используется, следовательно, у таких людей глюкоза не может попасть в клетки. Глюкоза накапливается в крови, создавая состояние, которое называется гипергликемией, что со временем может вызвать серьезные нарушения здоровья. Диабет представляет собой синдром с взаимосвязанными метаболическими, сосудистыми и невропатическими компонентами. Метаболический синдром, как правило, характеризуется гипергликемией,включает изменения углеводного, жирового и белкового метаболизма, обусловленные отсутствием или выраженным снижением секреции инсулина и/или неэффективным действием инсулина. Сосудистый синдром состоит из аномалий кровеносных сосудов, приводящих к осложнениям в сердечно-сосудистой системе, сетчатке и почках. Частью диабетического синдрома также являются аномалии периферической и автономной нервной системы. Диабет также вовлечен в развитие заболевания почек, заболевания глаз и проблем, связанных с нервной системой. Заболевание почек, также известное под названием нефропатия, развивается, когда поврежден "фильтрующий механизм" почек, в результате чего белок просачивается в мочу в избыточном количестве и, в конечном итоге, почки утрачивают свою функцию. Диабет также является главной причиной повреждения сетчатки, расположенной на глазном дне, и увеличивает риск развития катаракты и глаукомы. И, наконец, диабет ассоциирован с повреждением нервов, особенно на ногах и стопах, что сопряжено с болевой чувствительностью и способствует развитию тяжелых инфекций. В совокупности осложнения диабета являются одной из главных причин смертности на национальном уровне. Многие люди с НИЗСД ведут малоподвижный образ жизни и страдают ожирением - их вес приблизительно на 20% превышает рекомендуемые значения, определенные для конкретного роста и телосложения. Кроме того, для ожирения характерны гиперинсулинемия и инулинорезистентность, признаки,сопутствующие НИЗСД, гипертонии и атеросклерозу. Ожирение, которое является результатом дисбаланса между потреблением калорий и расходованием энергии, проявляет высокую корреляцию с инсулинорезистентностью и диабетом у экспериментальных животных и человека. Однако молекулярные механизмы, вовлеченные в синдромы ожирениядиабета, неясны. На начальных стадиях развития ожирения повышенная секреция инсулина уравновешивает инсулинорезистентность и защищает больных от гипергликемии (Le Stunff с соавт., Diabetes,43:696-702 (1989. Однако со временем функция -клеток ухудшается и приблизительно у 20% лиц в этой части популяции развивается неинсулинозависимый диабет (Pederson, P., Diab. Metab. Rev., 5:505509 (1989) и Brancati, F.L. с соавт., Arch. Intern. Med., 159:957-963 (1999. Учитывая высокое распространение ожирения в современном обществе, неудивительно, что оно стало ведущим фактором риска развития НИЗСД (Hill, J.O. с соавт., Science, 280:1371-1374 (1998. Однако факторы, которые предрасполагают часть больных ожирением к изменению секреции инсулина в ответ на накопление жира, остаются неизвестными. Наиболее частыми заболеваниями при ожирении являются сердечно-сосудистые заболевания (особенно гипертония), диабет (ожирение усугубляет развитие диабета), заболевания желчного пузыря (особенно рак) и репродуктивные заболевания. Научные исследования показали, что даже умеренное снижение веса тела соответствует значительному снижению риска развития коронарной болезни сердца. Ожирение также значительно увеличивает риск развития других сердечно-сосудистых заболеваний. На переднем крае сердечно-сосудистых осложнений, индуцируемых ожирением, находятся коронарная-1 018268 недостаточность, атероматозное заболевание и сердечная недостаточность. По оценкам специалистов,если бы все населяющие Землю люди имели идеальный вес, то риск коронарной недостаточности снизился бы на 25%, а риск сердечной недостаточности и цереброваскулярных осложнений - на 35%. У лиц моложе 50 лет, которые имеют избыточный вес тела, увеличенный на 30%, частота коронарных заболеваний удвоена. Продолжительность жизни больных диабетом сокращается на 30%. В возрасте старше 45 лет лица с диабетом приблизительно в три раза чаще страдают тяжелыми заболеваниями сердца по сравнению с людьми без диабета и приблизительно в пять раз чаще подвержены инсультам. Эти цифры подчеркивают взаимосвязь между факторами риска НИЗСД, ожирения и коронарной болезни сердца, а также потенциальное значение интегрированного подхода, включающего лечение как ожирения, так и диабета (Perry, I.J. с соавт., BMJ, 310:560-564 (1995. Диабет 2 типа развивается в результате прогрессирующей утраты функции -клеток поджелудочной железы при наличии инсулинорезистентности, что приводит к общему уменьшению выработки инсулина (Prentki, M. с соавт., "Islet failure in type 2 diabetes", J. Clin. Invest., 116:1802-1812 (2006. -клетки представляют собой тип клеток, которые запасают инсулин и выбрасывают его в ответ на повышение уровня глюкозы в плазме или в ответ на гормональные сигналы из пищеварительного тракта после приема пищи. Данные исследований позволяют предположить, что у больных диабетом 2 типа темпы гибели-клеток (апоптоза) превышают развитие новых -клеток, что приводит к общему снижению количества-клеток (Butler, A.E. с соавт., " -cell deficit and increased -cell apoptosis in humans with type 2 diabetes",Diabetes, 52:102-110 (2003. Апоптоз -клеток может развиваться в результате постоянных повышений уровня глюкозы в плазме (глюкотоксичность) и/или уровня липидов в плазме (липотоксичность). Известно, что рецепторы, связанные с G-белком (GPCR), которые экспрессируются на -клетках,модулируют выброс инсулина в ответ на изменения уровня глюкозы в плазме (Ahren, В., "Autonomicregulation of islet hormone secretion - Implications for health and disease", Diabetologia, 43:393-410 (2003. Было показано, что эти GPCR, специфически связанные с повышением цАМФ через субъединицу Gs альфа G-белка, усиливают стимулированный глюкозой выброс инсулина из -клеток. СтимулированиеGPCR на -клетках циклическим АМФ затрагивает такие рецепторы, как GLP-1, GIP, 2 адренергические рецепторы и GPR119. Известно, что увеличение концентрации цАМФ в -клетках приводит к активации PKA (протеинкиназы А), которая, по-видимому, предупреждает открытие калиевых каналов на поверхности -клеток. Уменьшение оттока ионов K+ деполяризует -клетки, приводя к притоку ионов Са, что стимулирует выброс инсулина. Рецептор GPR119 (например, GPR119 человека, GENBANK, инвентарный номер ААР 72125, и его аллели, а также мышиный GPR119, GENBANK, инвентарный номер AY288423, и его аллели) представляет собой рецептор GPCR, локализованный в хромосомном положении Хр 26.1 (Fredricksson, R. с соавт., "Seven evolutionarily conserved human rhodopsin G protein-coupled receptors lacking close relatives",FEBS Lett., 554:381-388 (2003. Рецептор связан с G-белком и, будучи стимулированным, обеспечивает повышение цАМФ во многих типах клеток, включая инсуломы, полученные из -клеток (Soga, Т. с соавт., "Lysophosphatidylcholine enhances glucose-dependent insulin secretion via an orphan G-protein-coupledWO 04/065380, WO 04/076413, WO 05/007647, WO 05/007658, WO 05/121121, WO 06/083491 и ЕР 1338651). Было показано, что у многих биологических видов этот рецептор локализован в -клетках поджелудочной железы cells, а также в специфических типах клеток желудочно-кишечного тракта. Активация GPR119 лигандами агонистов, таких как лизофосфатидилхолин, способствует зависящему от глюкозы повышению секреции инсулина из первичных островков мыши и разных линий клеток инсуломы, таких как NIT-1 и HIT-T15 (Soga, Т. с соавт., "Lysophosphatidylcholine enhances glucose-dependent(2005); Chu, Z.L. с соавт., "A role for -cell-expressed GPR119 in glycemic control by enhancing glucosedependent insulin release", Endocrinology, doi: 10.1210/en.2006-1608 (2007. Когда перед проведением орального теста на толерантность к глюкозе здоровым мышам или мышам, предрасположенным к диабету вследствие генетической мутации, вводят активаторы GPR119, наблюдается улучшение толерантности к глюкозе. У животных, получивших такое лечебное вмешательство, также наблюдается кратковременное повышение в плазме уровней глюкагоноподобного пептида-1 и инсулина (Chu, Z.L. с соавт., "A role for -cell-expressed GPR119 in glycemic control by enhancing glucosedependent insulin release", Endocrinology, doi:10.1210/ en.2006-1608 (2007. Было продемонстрировано,что в дополнение к воздействиям на уровень глюкозы в плазме активаторы GPR119 при их хроническом введении способствуют уменьшению быстрого потребления пищи и снижению веса тела у крыс (Overton,H.A. с соавт., "Deorphanization of a G protein-coupled receptor for oleoylethanolamide and its use in the discovery of small-molecule hypophagic agents", Cell Metabolism, 3:167-175 (2006), международные патентные заявки WO 05/007647 и WO 05/007658). Сущность изобретения В соответствии с настоящим изобретением предлагаются соединения, которые имеют общую структуру по формуле I или их энантиомеры, диастереомеры или фармацевтически приемлемые соли, при этом Z, R1, R2,R , Т 1, Т 2, Т 3 и Т 4 определены ниже. Соединения по настоящему изобретению модулируют активность рецепторов, связанных с Gбелком. Предпочтительные соединения по настоящему изобретению модулируют активность рецептораGPR119 G, связанного с G-белком. Следовательно, соединения по настоящему изобретению можно применять для лечения множества заболеваний или расстройств, связанных с GPR119, таких как диабет и родственные состояния, микрососудистые осложнения, связанные с диабетом, макрососудистые осложнения, связанные с диабетом, сердечно-сосудистые заболевания, метаболический синдром и патологические состояния, являющиеся его компонентами, ожирение и другие заболевания/расстройства. Примеры заболеваний или расстройств, ассоциированных с модулированием рецептора GPR119, связанного с Gбелком, которые можно предупреждать, модулировать или лечить в соответствии с настоящим изобретением, включают, но не ограничиваясь ими, диабет, гипергликемию, нарушенную толерантность к глюкозе, инсулинорезистентность, гиперинсулинемию, ретинопатию, нейропатию, нефропатию, длительное заживление ран, атеросклероз и его следствия, нарушения функции сердца, ишемию миокарда, инсульт,метаболический синдром, гипертонию, ожирение, дислипидемию, гиперлипидемию, гипертриглицеридемию, гиперхолестеринемию, низкий уровень ЛПВП, высокий уровень ЛПНП, несердечную ишемию,инфекцию, рак, сосудистый рестеноз, панкреатит, нейродегенеративные заболевания, липидные нарушения, когнитивный спад и деменцию, костные заболевания, ВИЧ, липодистрофию, связанную с протеазой,и глаукому. В дополнение к этому настоящее изобретение относится к составленному рецептурному продукту,при этом выбранный рецептурный состав изготовлен посредством применения соединения формулы I в виде единственного активного ингредиента или при комбинировании (а) соединения формулы I (используя любой из вариантов осуществления соединений, перечисленных в данном описании) и (b) дополнительного активного ингредиента, например ингибитора дипептидилпептидазы-IV (DPP4) (например,агента, выбранного из саксаглиптина, ситаглиптина, вилдаглиптина и алоглиптина). Таким образом, еще в одном аспекте настоящее изобретение предлагает соединения формулы I,фармацевтические композиции, содержащие такие соединения и способы применения таких соединений. В частности, настоящее изобретение предлагает фармацевтическую композицию, включающую терапевтически эффективное количество соединения формулы I, в чистом виде или в комбинации с фармацевтически приемлемым носителем. Далее, еще в одном аспекте настоящее изобретение предлагает способ модулирования, лечения или предупреждения прогрессирования либо начала заболеваний/расстройств, ассоциированных с активностью рецептора GPR119, связанного с G-белком, таких, которые определены в данном описании выше и ниже, при этом терапевтически эффективное количество соединения формулы I вводят млекопитающему, т.е. больному человеку, нуждающемуся в лечении. Соединения согласно настоящему изобретению можно применять самостоятельно, в комбинации с другими соединениями по настоящему изобретению либо в комбинации с одним или более другими средствами. Далее, настоящее изобретение предлагает способ предупреждения, модулирования или лечения заболеваний, определенных в данном описании выше и ниже, при этом терапевтически эффективное количество комбинации соединения формулы I и другого соединения формулы I и/или как минимум одного терапевтического средства другого типа вводят млекопитающему, т.е. больному человеку, нуждающемуся в лечении. 21 Подробное описание изобретения В первом аспекте настоящего изобретения предлагаются соединения формулы I В первом варианте осуществления первого аспекта настоящее изобретение предлагает соединение формулы I или его энантиомер, диастереомер или фармацевтически приемлемую соль, при этомZ представляет собой СН или N;R1 представляет собой фенил, бензил, бензо[d]оксазолил или пиридинил, любой из которых необязательно может быть замещен одним или более радикалами R6;R2 представляет собой пиримидинил или -C(=O)OR5, при этом пиримидинил необязательно может быть замещен одним или более радикалами R6;R5 представляет собой (С 1-С 8)алкил, который необязательно может быть замещен одним или более радикалами R6;R6 в каждом случае независимо выбран из (С 1-С 8)алкила, 3-10-членной насыщенной или частично ненасыщенной циклической углеводородной группы, содержащей от 1 до 3 колец, которые могут быть соединены с 1 или 2 ароматическими кольцами, выбранными из фенила и нафтила, галогена, -CN, -NO2,-CF3, -OCHF2, -OR10, -ОН, -C(=O)R10 или -S(O)2R10;R9 в каждом случае независимо выбран из водорода или (С 1-С 8)алкила;R10 в каждом случае независимо представляет собой (С 1-С 8)алкил;T1 представляет собой водород, галоген или (С 1-С 8)алкил; Т 2 представляет собой водород, галоген или (С 1-С 8)алкил; Т 3 представляет собой водород, галоген или (С 1-С 8)алкил и Т 4 представляет собой водород, галоген или (С 1-С 8)алкил; при условии, что, когда Z представляет собой СН, a R1 представляет собой фенил или пиридинил,все радикалы Т 1, Т 2, Т 3 и Т 4 не могут быть представлены водородом. Термины "формула I" и все варианты ее осуществления будут включать энантиомеры, диастереомеры, сольваты и их соли (особенно энантиомеры, диастереомеры и их фармацевтически приемлемые соли). Во втором варианте осуществления первого аспекта настоящее изобретение предлагает соединение формулы I либо его энантиомер, диастереомер или фармацевтически приемлемую соль, при этом соединение формулы I представляет собой соединение формулы II(у) при этом Z, R1, R2, R21, Т 3 и Т 4 определены так, как это сформулировано выше. В третьем варианте осуществления первого аспекта настоящее изобретение предлагает соединение формулы I либо его энантиомер, диастереомер или фармацевтически приемлемую соль, при этом соединение формулы I представляет собой соединение формулы II(z) при этом Z, R1, R2 и R21 определены так, как это сформулировано выше. В четвертом варианте осуществления первого аспекта настоящее изобретение предлагает соединение формулы I или его энантиомер, диастереомер или фармацевтически приемлемую соль, при этомZ представляет собой СН или N;R1 представляет собой фенил, бензил или пиридинил, любой из которых необязательно может быть замещен одним или более радикалами R6;R2 представляет собой пиримидинил или -C(=O)OR5, при этом пиримидинил необязательно может быть замещен одним или более радикалами R6;R5 представляет собой (С 1-С 8)алкил, который необязательно может быть замещен одним или более радикалами R6;R6 в каждом случае независимо выбран из (С 1-С 8)алкила, 3-10-членной насыщенной или частично ненасыщенной циклической углеводородной группы, содержащей от 1 до 3 колец, которые могут быть соединены с 1 или 2 ароматическими кольцами, выбранными из фенила и нафтила, галогена, -CN, -NO2,-CF3, -OCHF2, -OR10, -ОН, -C(=O)R10 или -S(O)2R10;R9 в каждом случае независимо выбран из водорода или (С 1-С 8)алкила;R10 в каждом случае независимо представляет собой (С 1-С 8)алкил;T1 представляет собой водород или (С 1-С 8)алкил; Т 2 представляет собой водород или (С 1-С 8)алкил; Т 3 представляет собой водород или (С 1-С 8)алкил и Т 4 представляет собой водород или (С 1-С 8)алкил. В пятом варианте осуществления первого аспекта настоящее изобретение предлагает соединение формулы I либо его энантиомер, диастереомер или фармацевтически приемлемую соль, при этомZ представляет собой СН или N;R1 представляет собой фенил, бензил, бензо[d]оксазолил или пиридинил, любой из которых необязательно может быть замещен одним или более радикалами R6;R2 представляет собой пиримидинил или -C(=O)R5, при этом пиримидинил необязательно может быть замещен одним или более радикалами R6;R6 в каждом случае независимо выбран из (С 1-С 4)алкила, циклопропила, галогена, -CN, -NO2, -CF3,-OCHF2, -OR10 или -S(O)2R10;R9 в каждом случае независимо выбран из водорода и метила;R10 в каждом случае независимо представляет собой метил;T1 представляет собой водород или метил; Т 2 представляет собой водород или метил; Т 3 представляет собой водород или метил и Т 4 представляет собой водород или метил. В шестом варианте осуществления первого аспекта настоящее изобретение предлагает соединение формулы I либо его энантиомер, диастереомер или фармацевтически приемлемую соль, при этомZ представляет собой СН или N;R1 представляет собой фенил, бензил, бензо[d]оксазолил или пиридинил, любой из которых необязательно может быть замещен одним или более радикалами R6;R2 представляет собой пиримидинил или -C(=O)OR5, при этом пиримидинил необязательно может быть замещен одним или более радикалами R6;R6 в каждом случае независимо выбран из (С 1-С 4)алкила, циклопропила, галогена, -CN, -NO2, -CF3,-OCHF2, -OR10, -C(=O)R10 и -S(O)2R10;R9 в каждом случае независимо выбран из водорода или метила;R10 в каждом случае независимо представляет собой метил;T1 и Т 2 представляют собой водород; Т 3 представляет собой водород или метил и Т 4 представляет собой водород или метил. В седьмом варианте осуществления первого аспекта настоящее изобретение предлагает соединение формулы I либо его энантиомер, диастереомер или фармацевтически приемлемую соль, при этомZ представляет собой СН или N;R1 представляет собой фенил, бензил, бензо[d]оксазолил или пиридинил, любой из которых необязательно может быть замещен одним или более радикалами R6;R2 представляет собой пиримидинил или -C(=O)OR5, при этом пиримидинил необязательно может быть замещен одним или более радикалами R6;R6 в каждом случае независимо выбран из (С 1-С 4)алкила, циклопропила, галогена, -CN, -NO2, -CF3,-OCHF2, -OR10, -C(=O)R10 и -S(O)2R10;R9 в каждом случае независимо выбран из водорода или метила;R10 в каждом случае независимо представляет собой метил;T1, T2 и Т 4 представляют собой водород и Т 3 представляет собой водород или метил. В восьмом варианте осуществления первого аспекта настоящее изобретение предлагает соединение формулы I либо его энантиомер, диастереомер или фармацевтически приемлемую соль, при этомZ представляет собой СН или N;R1 представляет собой фенил, бензо[d]оксазолил или пиридинил, любой из которых необязательно может быть замещен одним или более радикалами R6;R2 представляет собой пиримидинил или -C(=O)OR5, при этом пиримидинил необязательно может быть замещен одним или более радикалами R6;R6 в каждом случае независимо выбран из (С 1-С 4)алкила, циклопропила, галогена, -CN, -NO2, -CF3,-OCHF2, -OR10, -C(=O)R10 и -S(O)2R10;R9 в каждом случае независимо выбран из водорода или метила;R10 в каждом случае независимо представляет собой метил;T1, T2 и Т 4 представляют собой водород и Т 3 представляет собой водород или метил. В девятом варианте осуществления первого аспекта настоящее изобретение предлагает соединение формулы I либо его энантиомер, диастереомер или фармацевтически приемлемую соль, при этом соединение выбрано в одном из примеров. Для каждого из вариантов осуществления изобретения, описанного в этом изобретении, другие и более специфичные значения терминов, употребляемых в каждом варианте осуществления изобретения,могут быть выбраны из приведенных ниже определений; эти значения могут быть использованы как индивидуально в любом из вариантов осуществления изобретения, так и в комбинациях. Следует отметить,что в любом случае обозначение "=О" может применяться во взаимосвязи с соответствующей структурой в том участке, с которым он связан, что должны принимать во внимание компетентные специалисты. Для каждого из вариантов осуществления изобретения, описанных в этом изобретении, добавочные и более специфические значения терминов, использованных в каждом варианте, могут быть выбраны из следующих определений; эти значения могут быть использованы индивидуально в любом из вариантов осуществления изобретения или в любых комбинациях. Следует отметить, что в любом случае использования "=О" этот символ можно использовать во взаимосвязи со структурой валентных связей в участке его использования, которое должно быть понятным для компетентных специалистов. Во втором аспекте настоящее изобретение предлагает соединение либо его энантиомер, диастереомер или фармацевтически приемлемую соль, при этом соединение выбрано из группы, состоящей из соединений, показанных в примерах. В третьем аспекте настоящее изобретение относится к фармацевтическим композициям, включающим терапевтически эффективное количество соединения по настоящему изобретению, одного или необязательно в комбинации с фармацевтически приемлемым носителем и/или одним и более других средств, например, агонистом рецептора глюкагоноподобного пептида-1 или его фрагментом. В одном из вариантов осуществления третьего аспекта настоящее изобретение предлагает фармацевтическую композицию, включающую терапевтически эффективное количество соединения формулыI, II(у), или II(z), как это определено выше, одного или, необязательно, в комбинации с фармацевтически-6 018268 приемлемым носителем и/или одним и более других средств, например агонистом рецептора глюкагоноподобного пептида-1 или его фрагментом. Еще в одном варианте осуществления третьего аспекта настоящее изобретение предлагает фармацевтическую композицию, включающую терапевтически эффективное количество соединения, выбранного из группы соединений, показанных в примерах, по одному или, необязательно, в комбинации с фармацевтически приемлемым носителем и/или одним и более других средств, например, агонистом рецептора глюкагоноподобного пептида-1 или его фрагментом. В четвертом аспекте настоящее изобретение относится к способам модулирования активности рецептора GPR119, связанного с G-белком, при этом указанные способы включают введение больному млекопитающему, например больному человеку, нуждающемуся в лечении, терапевтически эффективного количества соединения по настоящему изобретению, одного или необязательно в комбинации с другим соединением по настоящему изобретению и/или как минимум одним терапевтическим средством другого типа. В одном из вариантов осуществления четвертого аспекта настоящее изобретение относится к способу предупреждения, модулирования или лечения заболеваний/расстройств, ассоциированных с активностью рецептора GPR119, связанного с G-белком, при этом указанный способ включают введение больному млекопитающему, например больному человеку, нуждающемуся в лечении, терапевтически эффективного количества соединения по настоящему изобретению, одного или необязательно в комбинации с другим соединением по настоящему изобретению и/или как минимум одним терапевтическим средством другого типа. Примеры заболеваний или расстройств, ассоциированных с активностью рецептора GPR119, связанного с G-белком, которые можно предупреждать, модулировать или лечить в соответствии с настоящим изобретением, включают, без ограничения, диабет, гипергликемию, нарушенную толерантность к глюкозе, инсулинорезистентность, гиперинсулинемию, ретинопатию, нейропатию, нефропатию, длительное заживление ран, атеросклероз и его следствия, нарушения функции сердца, ишемию миокарда,инсульт, метаболический синдром, гипертонию, ожирение, дислипидемию, гиперлипидемию, гипертриглицеридемию, гиперхолестеринемию, низкий уровень ЛПВП, высокий уровень ЛПНП, несердечную ишемию, инфекцию, рак, сосудистый рестеноз, панкреатит, нейродегенеративные заболевания, липидные нарушения, когнитивный спад и деменцию, костные заболевания, ВИЧ, липодистрофию, связанную с протеазой, и глаукому. Еще в одном варианте осуществления четвертого аспекта настоящее изобретение относится к способу лечения, модулирования или предупреждения начала или прогрессирования диабета, гипергликемии, ожирения, дислипидемии, гипертонии и когнитивного спада, при этом указанный способ включает введение больному млекопитающему, например больному человеку, нуждающемуся в лечении, терапевтически эффективного количества соединения по настоящему изобретению, одного или необязательно в комбинации с другим соединением по настоящему изобретению и/или как минимум одним терапевтическим средством другого типа. Еще в одном варианте осуществления четвертого аспекта настоящее изобретение относится к способу лечения, модулирования или предупреждения начала или прогрессирования диабета, при этом указанный способ включает введение больному млекопитающему, например больному человеку, нуждающемуся в лечении, терапевтически эффективного количества соединения по настоящему изобретению,одного или необязательно в комбинации с другим соединением по настоящему изобретению и/или как минимум одним терапевтическим средством другого типа. Еще в одном варианте осуществления четвертого аспекта настоящее изобретение относится к способу лечения, модулирования или предупреждения начала или прогрессирования гипергликемии, при этом указанный способ включает введение больному млекопитающему, например больному человеку,нуждающемуся в лечении, терапевтически эффективного количества соединения по настоящему изобретению, одного или необязательно в комбинации с другим соединением по настоящему изобретению и/или как минимум одним терапевтическим средством другого типа. Еще в одном варианте осуществления четвертого аспекта настоящее изобретение относится к способу лечения, модулирования или предупреждения начала или прогрессирования ожирения, при этом указанный способ включает введение больному млекопитающему, например больному человеку, нуждающемуся в лечении, терапевтически эффективного количества соединения по настоящему изобретению, одного или необязательно в комбинации с другим соединением по настоящему изобретению и/или как минимум одним терапевтическим средством другого типа. Еще в одном варианте осуществления четвертого аспекта настоящее изобретение относится к способу лечения, модулирования или предупреждения начала или прогрессирования дислипидемии, при этом указанный способ включает введение больному млекопитающему, например больному человеку,нуждающемуся в лечении, терапевтически эффективного количества соединения по настоящему изобретению, одного или необязательно в комбинации с другим соединением по настоящему изобретению и/или как минимум одним терапевтическим средством другого типа. Еще в одном варианте осуществления четвертого аспекта настоящее изобретение относится к спо-7 018268 собу лечения, модулирования или предупреждения начала или прогрессирования гипертонии, при этом указанный способ включает введение больному млекопитающему, например больному человеку, нуждающемуся в лечении, терапевтически эффективного количества соединения по настоящему изобретению, одного или необязательно в комбинации с другим соединением по настоящему изобретению и/или как минимум одним терапевтическим средством другого типа. Еще в одном варианте осуществления четвертого аспекта настоящее изобретение относится к составленному рецептурному продукту, при этом выбранный рецептурный состав изготовлен посредством комбинирования (а) соединения формулы I (с применением любого из вариантов осуществления соединений, перечисленных выше) и (b) ингибитора дипептидилпептидазы-IV (DPP4) (например, агента, выбранного из саксаглиптина, ситаглиптина, вилдаглиптина и алоглиптина). Изобретение может быть осуществлено в других специфических формах без каких-либо отклонений от его духа или основных существенных признаков. Это изобретение также охватывает все комбинации альтернативных аспектов изобретения, упомянутых в данном описании. Следует понимать, что для описания дополнительных вариантов осуществления настоящего изобретения любой вариант осуществления настоящего изобретения можно рассматривать в совокупности с любым другим вариантом его осуществления. Кроме того, для описания дополнительных вариантов осуществления настоящего изобретения любые элементы любого варианта его осуществления можно комбинировать с любыми другими элементами любых других вариантов осуществления настоящего изобретения. Определения Соединения, приведенные в настоящем описании, могут иметь асимметричные центры. Соединения согласно настоящему изобретению, содержащие асимметрично замещенный атом, могут быть выделены в оптически активной или рацемической формах. В данной области техники хорошо известно, как можно изготовить оптически активные формы, например, посредством расщепления рацемических форм или посредством синтеза из оптически активных исходных материалов. В числе соединений, описанных в данном патенте, также могут быть представлены многие геометрические изомеры олефинов, двойные связи C=N и т.п., причем все стабильные изомеры такого типа рассматриваются в настоящем изобретении. Описаны геометрические изомеры соединений по настоящему изобретению типа цис и транс, которые могут быть выделены в виде смеси изомеров или раздельных изомерных форм. Подразумеваются все хиральные, диастереометрические, рацемические формы и все геометрические изомерные формы структуры, если специально не указаны специфические стереохимические или изомерные формы. Один энантиомер соединения формулы I может проявлять большую активность по сравнению с другим энантиомером. Таким образом, в качестве составной части настоящего изобретения рассматриваются все стереохимические варианты. При необходимости рацемический материал можно разделять посредством высокоэффективной жидкостной хроматографии (ВЭЖХ), применяя хиральную колонку,или посредством разложения на составные части с применением разделяющего агента, такого как камфановый хлорид, что описано в ссылке Young, S.D. с соавт., Antimicrobial Agents and Chemotherapy, 26022605 (1995). Все таутомерные формы такого типа рассматриваются в данном описании как часть настоящего изобретения в тех пределах, в которых соединения формулы I и их соли могут существовать в таутомерных формах. Термин "замещенный" при использовании в данном описании означает, что один или более водородов в обозначенной атомной или кольцевой структуре замещены с выбором из индикаторной группы при том условии, что нормальная валентность указанных атомов или кольцевых атомов не превышается, а замещение приводит к образованию стабильного соединения. Если заместитель представляет собой кето(т.е. =O), то в атоме замещаются 2 водорода. Если любой переменный радикал (например, R4) встречается более одного раза в любом компоненте или любой формуле соединения, то его определение в каждом случае не зависит от его определения во всех других случаях. Так, например, если показано, что группа замещена (R4)m, a m равно 0-3, то указанная группа необязательно может быть замещена группами R4 числом до трех, причем R4 в каждом случае выбирается независимо от определения R4. Кроме того, комбинации заместителей и/или переменных радикалов допустимы только в том случае, если такие комбинации приводят к стабильным соединениям. Если показано, что связь с заместителем пересекает связь, соединяющую два атома в кольце, то такой заместитель может быть связан с любым атомом в кольце. Если заместитель перечисляется без указания атома, через который этот заместитель связан с остальной частью соединения в данной формуле,то такой заместитель может быть связан через любой атом в этом заместителе. Комбинации заместителей и/или переменных радикалов допустимы только в том случае, если такие комбинации приводят к стабильным соединениям. При использовании в данном описании термин "алкил" включает как разветвленные, так и неразветвленные насыщенные алифатические углеводородные группы, содержащие от 1 до 20 углеродов(атомов углерода), предпочтительно от 1 до 10 углеродов, более предпочтительно от 1 до 8 углеродов в нормальной цепи, такой как метил, этил, пропил, изопропил, бутил, t-бутил, изобутил, пентил, гексил,изогексил, гептил, 4,4-диметилпентил, октил, 2,2,4-триметилпентил, нонил, децил, ундецил, додецил, их-8 018268 различные изомеры с разветвленной цепью и т.п., кроме того, такие группы необязательно могут включать от 1 до 4 заместителей, таких как галоген, например F, Br, Cl, или I, либо CF3, алкил, алкокси, арил,арилокси, арил(арил) или диарил, арилалкил, арилалкилокси, алкенил, циклоалкил, циклоалкилалкил,циклоалкилалкилалкилокси, амино, гидрокси, гидроксиалкил, ацил, гетероарил, гетероарилокси, гетероарилалкил, гетероалиралкокси, арилоксиалкил, алкилтио, арилалкилтио, арилоксиарил, алкиламидо,алканоиламино, арилкарбониламино, нитро, циано, тиол, галоалкил, тригалоалкил и/или алкилтио. Если не указано иное, термин "алкенил" при использовании в данном описании отдельно или в виде части другой группы относится к радикалам с прямой или разветвленной цепью, содержащим от 2 до 20 углеродов, предпочтительно от 2 до 12 углеродов, более предпочтительно от 2 до 8 углеродов в нормальной цепи, которая включает от одной до шести двойных связей в нормальной цепи, таким как винил,2-пропенил, 3-бутенил, 2-бутенил, 4-пентенил, 3-пентенил, 2-гексенил, 3-гексенил, 2-гептенил, 3 гептенил, 4-гептенил, 3-октенил, 3-ноненил, 4-деценил, 3-ундеценил, 4-додеценил, 4,8,12 тетрадекатриенил и т.п., которые необязательно могут быть замещены 1-4 заместителями, а именно галогеном, галоалкилом, алкилом, алкокси, алкенилом, алкинилом, арилом, арилалкилом, циклоалкилом,амино, гидрокси, гетероарилом, циклогетероалкилом, алканоиламино, алкиламидо, арилкарбониламино,нитро, циано, тиолом, алкилтио, и/или любым из заместителей алкила, указанных в данном описании. Если не указано иное, термин "алкинил" при использовании в данном описании отдельно или в виде части другой группы относится к радикалам с прямой или разветвленной цепью, содержащим от 2 до 20 углеродов, предпочтительно от 2 до 12 углеродов, более предпочтительно от 2 до 8 углеродов в нормальной цепи, которая включает одну тройную связь в нормальной цепи, таким как 2-пропинил, 3 бутинил, 2-бутинил, 4-пентинил, 3-пентинил, 2-гексинил, 3-гексинил, 2-гептинил, 3-гептинил, 4 гептинил, 3-октинил, 3-нонинил, 4-децинил,3-ундецинил, 4-додецинил и т.п., которые необязательно могут быть замещены 1-4 заместителями, а именно галогеном, галоалкилом, алкилом, алкокси, алкенилом, алкинилом, арилом, арилалкилом, циклоалкилом, амино, гетероарилом, циклогетероалкилом, гидрокси, алканоиламино, алкиламидо, арилкарбониламино, нитро, циано, тиолом, алкилтио, и/или любым из заместителей алкила, указанных в данном описании. Если не указано иное, термин "циклоалкил" при использовании в данном описании отдельно или в виде части другой группы включает насыщенные или частично ненасыщенные (содержащие 1 или 2 двойных связи) циклические углеводородные группы, имеющие от 1 до 10 колец, предпочтительно от 1 до 3 колец, включая моноциклический алкил, бициклический алкил (или бициклоалкил) и трициклический алкил, содержащие в общей сложности от 3 до 20 углеродов, образующих кольцо, предпочтительно от 3 до 15 углеродов, более предпочтительно от 3 до 10 углеродов, образующих кольцо, которые могут быть соединены с 1 или 2 ароматическими кольцами, как это описано для арила, который включает циклопропил, циклобутил, циклопентил, циклогексил, циклогептил, циклооктил, циклодецил, циклододецил, циклогексенил, причем любая из этих групп необязательно может быть замещена 1-4 заместителями, такими как галоген, алкил, алкокси, гидрокси, арил, арилокси, арилалкил, циклоалкил, алкиламидо, алканоиламино,оксо, ацил, арилкарбониламино, амино, нитро, циано, тиол и/или алкилтио, и/или любым из заместителей алкила. Если алкильные группы, как это определено выше, имеют одинарные связи для присоединения к другим группам через два разных атома углерода, они называются "алкиленовыми" группами и необязательно могут быть замещены, как это определено выше для "алкила". Если алкенильные группы, как это определено выше, и алкинильные группы, как это определено выше, соответственно имеют одинарные связи для присоединения через два разных атома углерода, такие группы называются "алкениленовыми группами" и "алкиниленовыми группами" соответственно и необязательно могут быть замещены, как это определено выше для "алкенила" и "алкинила". Термин "гало" или "галоген" при использовании в данном описании относится к фтору, хлору, брому и йоду (в соединениях), а термин "галогеналкил" включает как разветвленные, так и неразветвленные насыщенные алифатические углеводородные группы, например CF3, имеющие определенное число атомов углерода, которые замещены 1 или более галогеном (например, -CVFW, где v = от 1 до 3, a w = от 1 до(2v+1. Если не указано иное, термин "арил" при использовании в данном описании отдельно или в виде части другой группы относится к моноциклическим и бициклическим ароматическим группам, содержащим от 6 до 10 углеродов в кольцевой части (таким как фенил или нафтил, включая 1-нафтил и 2-9 018268 нафтил), причем арил необязательно может включать от 1 до 3 дополнительных колец, соединенных с карбоциклическим кольцом или гетероциклическим кольцом, таким как арильное, циклоалкильное, гетероарильное или циклогетероалкильное кольцо, например и необязательно может быть замещен через доступные атомы углерода 1, 2 или 3 заместителями,например, водородом, галогеном, галогеналкилом, алкилом, галогеналкилом, алкокси, галоалкокси, алкенилом, трифторметилом, трифторметокси, алкинилом, циклоалкилалкилом, циклогетероалкилом, циклогетероалкилалкилом, арилом, гетероарилом, арилалкилом, арилокси, арилоксиалкилом, арилалкокси,арилтио, арилазо, гетероарилалкилом, гетероарилалкенилом, гетероарилгетероарилом, гетероарилокси,гидрокси, нитро, циано, амино, замещенным амино, при этом амино включает 1 или 2 заместителя (которые представляют собой алкил, арил, или любое другое арильное соединение, упомянутое в определениях), тиолом, алкилтио, арилтио, гетероарилтио, арилтиоалкилом, алкоксиарилтио, алкилкарбонилом,арилкарбонилом, алкиламинокарбонилом, ариламинокарбонилом, алкоксикарбонилом, аминокарбонилом, алкилкарбонилокси, арилкарбонилокси, алкилкарбониламино, арилкарбониламино, арилсульфинилом, арилсульфинилалкилом, арилсульфониламино или арилсульфонаминокарбонилом, и/или любым из заместителей алкила, упомянутых в данном описании. Если не указано иное, термин "низший алкокси", "алкокси", "арилокси" или "аралкокси" при использовании в данном описании отдельно или в виде части другой группы включает любую из указанных выше алкильных, аралкильных или арильных групп, присоединенных к атому кислорода. Если не указано иное, термин "амино" при использовании в данном описании отдельно или в виде части другой группы относится к амино(группе), которая может быть замещена одним или двумя заместителями, которые могут быть одинаковыми или разными, такими как алкил, арил, арилалкил, гетероарил, гетероарилалкил, циклогетероалкил, циклогетероалкилалкил, циклоалкил, циклоалкилалкил, галоалкил, гидроксиалкил, алкоксиалкил или тиоалкил. В дополнение к этому, заместители амино могут быть взяты вместе с атомом азота, к которому они присоединены, образуя 1-пирролидинил, 1-пиперидинил, 1 азепинил, 4-морфолинил, 4-тиаморфолинил, 1-пиперазинил, 4-алкил-1-пиперазинил, 4-арилалкил-1 пиперазинил, 4-диарилалкил-1-пиперазинил, 1-пирролидинил, 1-пиперидинил, или 1-азепинил, необязательно замещенные алкилом, алкокси, алкилтио, гало, трифторметилом или гидрокси. Если не указано иное, термин "низший алкилтио", "алкилтио", "арилтио" или "аралкилтио" при использовании в данном описании отдельно или в виде части другой группы включает любую из указанных выше алкильных, аралкильных или арильных групп, присоединенных к атому серы. Если не указано иное, термин "низший алкиламино", "алкиламино", "ариламино" или "арилалкиламино" при использовании в данном описании отдельно или в виде части другой группы включает любую из указанных выше алкильных, арильных или аралкильных групп, присоединенных к атому азота. При использовании в данном описании термин "гетероциклил" или "гетероциклическая система" означает стабильное моноциклическое, бициклическое или трициклическое гетероциклическое кольцо(от 4- до 14-членного), которое насыщено или частично ненасыщено и которое состоит из атомов углерода и 1, 2, 3 или 4 гетероатомов, независимо выбранных из группы, состоящей из N, NH, О и S, а также включает любую бициклическую группу, в которой любое из определенных выше гетероциклических колец соединено с бензольным кольцом. Гетероатомы азота и серы необязательно могут быть окислены. Гетероциклическое кольцо может быть присоединено к его боковой подвешенной группе через любой гетероатом или атом углерода, что приводит к стабильной структуре. Гетероциклические кольца, описанные в данном описании, могут быть замещены в атоме углерода или атоме азота, если полученное в результате соединение будет стабильным. Если специально указано, азот в гетероцикле необязательно может быть кватернизирован. Предпочтительно, чтобы в том случае, когда общее число атомов S и О в гетероцикле превышает 1, эти гетероатомы не находились рядом друг с другом. Примеры гетероциклов включают, но не ограничиваясь ими, пирролидонил, 4-пиперидонил, хроманил, декагидрохинолинил, дигидрофуро[2,3-b]тетрагидрофуран, индолинил, изохроманил, изоиндолинил, октагидроизохинолинил, пиперазинил, пиперидинил, пиперидонил, 4-пиперидонил, тетрагидрофуранил, тетрагидроизохинолинил, тетрагидрохинолинил, морфолинил, дигидрофуранил, тетрагидротиофенил, пиранил, дигидропиранил, 1,4-диоксанил и 1,3-диоксанил. Также включены слитые кольцевые- 10018268 соединения и спиросоединения, содержащие, например, вышеуказанные гетероциклы. При использовании в данном описании термин "ароматическая гетероциклическая система" или"гетероарил" означает стабильное моноциклическое или бициклическое кольцо (от 5- до 7-членного),либо бициклическое гетероциклическое ароматическое кольцо (от 7- до 10-членного), которое состоит из атомов углерода и от 1 до 4 гетероатомов, независимо выбранных из группы, состоящей из N, О и S, и является ароматическим по своей природе. Примерами гетероарилов являются 1H-индазол, 2 Н,6 Н-1,5,2-дитиазинил, индолил, 4 аН-карбазол,4 Н-хинолизинил, 6 Н-1,2,5-тиадиазинил, акридинил, азоцинил, бензимидазолил, бензофуранил, бензотиофуранил, бензотиофенил, бензоксазолил, бензтиазолил, бензтриазолил, бензтетразолил, бензизоксазолил, бензизотиазолил, бензимидазалонил, карбазолил, 4aH-карбазолил, -карболинил, хроманил, хроменил, циннолинил, декагидрохинолил, 2H,6H-1,5,2-дитиазинил, дигидрофуро-[2,3-b]тетрагидрофуран,фуранил, фуразанил, имидазолидинил, имидазолинил, имидазолил, индазолил, индоленил, индолинил,индолизинил, индолил, изобензофуранил, изохроманил, изоиндазолил, изоиндолинил, изоиндолил, изохинолинил (бензимидазолил), изотиазолил, изоксазолил, морфолинил, нафтиридинил, октагидроизохинолинил, оксадиазолил, 1,2,3-оксадиазолил, 1,2,4-оксадиазолил, 1,2,5-оксадиазолил, 1,3,4-оксадиазолил,оксазолидинил, оксазолил, оксазолидинилперимидинил, фенантридинил, фенантролинил, фенарсазинил,феназинил, фенотиазинил, феноксатиинил, феноксазинил, фталазинил, пиперазинил, пиперидинил, птеридинил, пуринил, пиранил, пиразинил, пиразолидинил, пиразолинил, пиразолил, пиразолотриазинил,пиридазинил, пиридооксазол, пиридоимидазол, пиридотиазол, пиридинил, пиридил, пиримидинил, пирролидинид, хиназолинил, хинолинил, 4H-хинолизинил, хиноксалинил, хинуклидинил, карболинил, 6H1,2,5-тиадиазинил, 1,2,3-тиадиазолил, 1,2,4-тиадиазолил, 1,2,5-тиадиазолил, 1,3,4-тиадиазолил, тиантренил, тиазолил, тиенил, тиенотиазолил, тиенооксазолил, тиеноимидазолил, тиофенил, триазинил, 1,2,3 триазолил, 1,2,4-триазолил, 1,2,5-триазолил, 1,3,4-триазолил, тетразолил и ксантенил. Еще в одном аспекте изобретения примерами гетероарилов являются индолил, бензимидазолил, бензофуранил, бензотиофуранил, бензоксазолил, бензтиазолил, бензтриазолил, бензтетразолил, бензизоксазолил, бензизотиазолил, бензимидазолонил, циннолинил, фуранил, имидазолил, индазолил, индолил, изохинолинил, изотиазолил, изоксазолил, оксазолил, пиразинил, пиразолил, пиразолотриазинил, пиридазинил, пиридил,пиридинил, пиримидинил, пирролил, хиназолинил, хинолинил, тиазолил, тиенил и тетразолил. Термин "гетероциклилалкил" при использовании в данном описании отдельно или в виде части другой группы относится к гетероциклильным группам, как это определено выше, соединенным через атом С или гетероатом с алкильной цепью. Термин "гетероарилалкил" или "гетероарилалкенил" при использовании в данном описании отдельно или в виде части другой группы относится к гетероарильным группам, как это определено выше, соединенным через атом С или гетероатом с алкильной цепью, алкиленом или алкениленом, как это определено выше. Термин "циано" при использовании в данном описании относится к группе -CN. Термин "нитро" при использовании в данном описании относится к группе -NC2. Термин "гидрокси" при использовании в данном описании относится к группе ОН. Фраза "фармацевтически приемлемый" при использовании в данном описании относится к тем соединениям, материалам, композициям и/или стандартным дозовым формам, которые по результатам тщательной медицинской оценки пригодны для применения в контакте с тканями человеческого и животного организма и при этом не вызывают эффектов избыточной токсичности, раздражения, аллергической реакции либо других проблем или осложнений, т.е. соизмеримы с разумным соотношением польза/риск. При использовании в данном описании терминологическое определение "фармацевтически приемлемые соли" относится к производным раскрытых соединений, при этом родительское соединение модифицировано посредством изготовления его кислых или основных солей. Примеры фармацевтически приемлемых солей включают, но не ограничиваясь ими, минеральные или органические кислые соли основных остатков, таких как амины, щелочные или кислые соли кислых остатков, таких как карбоновые кислоты и т.п. Фармацевтически приемлемые соли включают обычные нетоксические соли или четвертичные аммониевые соли родительского соединения, образованные, например, из нетоксических органических или неорганических кислот. Например, такие обычные нетоксические соли включают соли, полученные из неорганических кислот, таких как соляная, бромоводородная, серная, сульфаминовая, фосфорная, азотная и т.п., а также соли, приготовленные из органических кислот, таких как уксусная, пропионовая, янтарная, гликолевая, стеариновая, молочная, малоновая, винная, лимонная, аскорбиновая,памовая, малеиновая, гидроксималеиновая, фенилуксусная, глутаминовая, бензойная, салициловая,сульфаниловая, 2-ацетоксибензойная, фумаровая, толуолсульфоновая, метансульфоновая, этандисульфоновая, щавелевая, изэтионовая и т.п. Фармацевтически приемлемые соли по настоящему изобретению могут быть синтезированы традиционными химическими способами из родительского соединения, содержащего основной или кислый компонент. Как правило, такие соли можно изготовить посредством осуществления реакции этих соединений, представленных в свободной кислой или основной форме, со стехиометрическим количеством- 11018268 соответствующего основания или кислоты в воде, в органическом растворителе или в смеси воды и органического растворителя. Обычно предпочтительны безводные среды типа эфира, этилацетата, этанола,изопропанола или ацетонитрила. Списки подходящих солей можно найти в монографии Remington'sPharmaceutical Sciences, 17th ed., Mack Publishing Company, Easton, PA, p. 1418 (1985), раскрытие которой включено в этот документ в качестве ссылки. Любое соединение, которое можно трансформировать in vivo в биоактивный агент (т.е. соединение формулы I), является пролекарством, входящим в объем притязаний и сущность изобретения. Термин "пролекарства" при использовании в данном описании включает сложные эфиры и карбонаты (соли углекислоты), образованные в результате реакции одного или более гидроксилов соединений по формуле I с алкил-, алкокси- или арилзамещенными ацилирующими агентами, в которой задействованы процедуры, известные компетентным специалистам в данной области и создающие ацетаты, пивалаты, метилкарбонаты, бензоаты и т.п. Различные формы пролекарств хорошо известны в данной области техники и описаны в следующих источниках:d) Testa, В. с соавт., Hydrolysis in Drug and Prodrug Metabolism, Wiley-VCH (2003). Указанные источники включены в этот документ в качестве ссылок, особенно в отношении описания пролекарств. В дополнение к этому предпочтительно, чтобы соединения формулы I после их приготовления были выделены и очищены для получения композиции, которая содержит весовое количество соединения формулы I, равное или превышающее 99% ("по существу, чистое" соединение); затем указанная композиция используется непосредственно или включается в рецептурный состав, как описано в данном описании. Такие "по существу, чистые" соединения формулы I также рассматриваются в данном описании как часть настоящего изобретения. Все стереоизомеры соединений по настоящему изобретению рассматриваются или в смеси, или в чистой, или по существу в чистой форме. Соединения по настоящему изобретению могут иметь асимметричные центры в любом из атомов углерода, включая любой из заместителей R, и/или проявлять полиморфизм. Следовательно, соединения формулы I могут существовать в энантиомерных формах, в диастереомерных формах, или в смесях этих форм. В процессах изготовления могут быть использованы такие стартовые материалы, как рацематы, энантиомеры или диастереомеры. Когда изготавливают диастереомерные или энантиомерные продукты, их можно сепарировать посредством традиционных способов,например хроматографических или фракционной кристаллизации. Изобретение также включает изотопически меченые соединения по изобретению, в которых один или более атомов замещены атомом, имеющим такое же атомное число, но атомную массу или массовое число, отличающиеся от атомной массы или массового числа, обычно обнаруживаемых в природе. Примеры изотопов, пригодных для включения в соединения по изобретению, включают изотопы водорода,такие как 2 Н и 3 Н, углерода, такие как 11 С, 13 С и 14 С, хлора, такие как 36Cl, фтора, такие как 18F, йода, такие как 123I и 125I, азота, такие как 13N и 15N, кислорода, такие как 15 О, 17 О и 18 О, фосфора, такие как 32 Р, и серы, такие как S. Некоторые изотопически меченые соединения по изобретению, например соединения со встроенным радиоактивным изотопом, полезны в исследованиях по распределению лекарства и/или субстрата в тканях. В этом отношении особенно полезны такие радиоактивные изотопы, как тритий (3 Н) и углерод-14 (14 С) вследствие простоты их встраивания и доступности средств выявления. Замещение более тяжелыми изотопами, такими как дейтерий (2 Н), может дать некоторые терапевтические преимущества за счет большей метаболической стабильности, например, удлиненный период полувыведения invivo или уменьшенная дозовая потребность, следовательно, в определенных обстоятельствах также замещение может оказаться предпочтительным. Замещение позитронно-активными изотопами, такими как 11C, 18F, 15O и 13N, может оказаться полезным в исследованиях с позитрон-эмиссионной томографией(ПЭТ/PET) по изучению степени занятости рецептора субстратом. Изотопно меченые соединения по изобретению обычно можно изготовить на основе традиционных методик, известных компетентным специалистам, или посредством процессов, аналогичных описанным в данном описании, с применением подходящего изотопно меченого реактива вместо немеченого реактива, используемого в других случаях. Термины "стабильное соединение" и "стабильная структура" означают соединение, которое достаточно устойчиво при выделении и очистке в нужной степени от других компонентов реакционной смеси,а также при введении в эффективный лечебный рецептурный состав. Настоящее изобретение предназначено для включения стабильных соединений. Терминологическое определение "терапевтически эффективное количество" включает такое количество соединения (одного) по настоящему изобретению или такое количество комбинации заявленных соединений, или такое количество соединения по настоящему изобретению в комбинации с другими ак- 12018268 тивными ингредиентами, которое эффективно для модуляции GPR119 либо эффективно для лечения/предупреждения различных заболеваний. При использовании в данном описании термины "лечение" или "терапия" охватывают лечение болезненного состояния у млекопитающего, особенно человека, и включают (а) предупреждение начала болезненного состояния у млекопитающего, в особенности, если указанное млекопитающее предрасположено к такому болезненному состоянию, но оно фактически еще не было диагностировано; (b) модулирование болезненного состояния, т.е. задержка его развития; и/или (с) облегчение болезненного состояния, т.е. индуцирование регрессии болезненного состояния. Синтез Соединения по настоящему изобретению можно изготовить множеством способов, хорошо известных компетентным специалистам в области органического синтеза. Соединения по настоящему изобретению можно синтезировать, применяя способы, описанные ниже, вместе со способами синтеза, известными в области синтетической органической химии, или вариации этих способов, известные компетентным специалистам в этой области. Предпочтительные способы включают, без ограничения, способы,описанные ниже. Все источники, процитированные в данном описании, включены сюда во всей полноте своего содержания в качестве ссылок применительно к релевантному предмету, упоминаемому при цитировании. Новые соединения формулы I можно изготовить, применяя реакции и методики, описанные в этом разделе. Реакции проводят в растворителях, соответствующих задействованным реактивам и материалам, а также пригодным для осуществляемых трансформаций. Кроме того, приведенное ниже описание синтетических способов необходимо понимать таким образом, что все предложенные условия реакции,включая растворитель, атмосферу реакции, температуру реакции, длительность эксперимента и рабочие процедуры, выбираются в качестве стандартных условий для этой реакции, которые должны легко распознаваться компетентным специалистом. Опытный специалист в области органической химии понимает, что функциональность, представленная в разных частях указанной молекулы, должна быть совместима с предложенными реактивами и реакциями. Не все соединения формулы I, попадающие в данный класс, могут быть совместимы с некоторыми условиями реакции, необходимыми для некоторых описанных способов. Такие ограничения, налагаемые на заместители, которые совместимы с условиями реакции, будут вполне понятны для компетентных специалистов, которые должны применять альтернативные способы. На следующих схемах n1 представляет собой 1 и n2 представляет собой 1. Схема 1 Соединения формулы I можно изготовить посредством процедур, отображенных на схеме 1. Промежуточный продукт 1, полученный из коммерческих источников, может реагировать с R1X (где R1 отличается от Н, как определено в отношении формулы I, a X представляет собой галид) в присутствии лиганда, такого как 8-гидроксихинолин, CuI и основание, такое как K2CO3 в подходящем растворителе,таком как DMF, DMSO и т.д., при повышенной температуре, давая на выходе промежуточный продукт 2. Расщепление бензильной группы промежуточного продукта 2 можно проводить, используя способы,известные в данной области техники, такие как гидрогенолиз, катализируемый палладием. Затем промежуточный продукт 3 можно алкилировать промежуточным продуктом 4, который можно получить в результате реакции соответствующих спиртов с метансульфохлоридом в присутствии основания, такого как K2CO3 при повышенной температуре. Вышеупомянутые спирты доступны на коммерческой основе или могут быть изготовлены различными способами, известными компетентным специалистам, например, описанными в ссылке Sandler, S. с соавт., Organic Functional Group Preparations, Vol. I, AcademicPress, Inc. (1983). Снятие защитной группы ("ЗГ/PG") с промежуточного продукта 5 можно осуществить с соответствующими реактивами, известными компетентным специалистам (специфические подробности см. в ссылке Greene, T.W. с соавт., Protecting Groups in Organic Synthesis, John WileySons Inc. (1991. Затем продукт со снятой защитой можно обработать R2X (где R2 определяется, как в формуле I, a X представляет собой уходящую группу, такую как галид, мезилат, трифлат и т.д.), который доступен на коммерческой основе или может быть изготовлен различными способами, известными в данной области техники, при наличии условий, являющихся общепринятыми для компетентных специалистов в области- 13018268 органического синтеза, чтобы можно было получить соединения формулы I. В альтернативном варианте для получения соединений по формуле I промежуточный продукт 6 также можно ввести в реакцию с изоцианатами или изотиоцианатами в присутствии основания, такого как Et3N. Схема 2 В альтернативном варианте соединения формулы I можно синтезировать, как это представлено на схеме 2. Промежуточный продукт 21, полученный из коммерческих источников, можно ввести в реакцию с промежуточным продуктом 4, полученным, как это описано на схеме 1, с получением промежуточного продукта 22. Гидролиз промежуточного продукта 22 достигается при его обработке DABCO в присутствии основания, такого как K2CO3 в смеси диоксан/вода при повышенной температуре. Промежуточный продукт 23 можно обработать R1X (где R1 определяется по формуле I, a X представляет собой галид) в присутствии лиганда, такого как 8-гидроксихинолин, CuI и основания, такого какK2CO3 в подходящем растворителе, таком как DMF, DMSO и т.д., при повышенной температуре, получая на выходе промежуточный продукт 24. Промежуточный продукт 24 можно довести до соединений по формуле I, следуя процедурам, описанным выше на схеме 1, и используя промежуточный продукт 24 вместо промежуточного продукта 5. Схема 3 Соединения формулы I, в которых R21 определяется как Н, a Y как -О-, можно получить посредством процедур, отображенных на схеме 3. Промежуточный продукт 28, полученный из коммерческих источников, можно ввести в реакцию с R1X (где R1, иной, нежели Н, определяется, как в формуле I, а X представляет собой галид) в присутствии лиганда, такого как 8-гидроксихинолин, CuI и основания, такого как K2CO3, в подходящем растворителе, таком как DMF, DMSO и т.д., при повышенной температуре,получая на выходе промежуточный продукт 29 (в альтернативном варианте его можно ввести в реакцию с R1X (где R1, иной, нежели Н, определяется, как в формуле I, a X представляет собой галид), в присутствии основания, такого как NaH, в подходящем растворителе, таком как DMF, DMSO и т.д., при повышенной температуре). Расщепление метоксигруппы промежуточного продукта 29 можно осуществить,используя способы, известные в данной области техники, такие как гидролиз при воздействии NaOH. Затем промежуточный продукт 30 можно алкилировать промежуточным продуктом 4, который можно получить в результате реакции соответствующих спиртов с метансульфохлоридом в присутствии основания, такого как K2CO3 при повышенной температуре. Вышеупомянутые спирты доступны на коммерческой основе или могут быть получены различными способами, известными компетентному специалисту (типичные примеры описаны в ссылке Sandler, S. с соавт., Organic Functional Group Preparations, Vol.I, Academic Press, Inc. (1983). Снятие защитной группы с промежуточного продукта 31 можно осуществить соответствующими реактивами, хорошо известными компетентным специалистам (специфические подробности см. в ссылке Greene, T.W. с соавт., Protecting Groups in Organic Synthesis, John WileySonsInc. (1991. Затем продукт со снятой защитой можно обработать R2X (где R2 определяется, как в формуле I, a X представляет собой уходящую группу, такую как галид, мезилат, трифлат и т.д.), который дос- 14018268 тупен на коммерческой основе или может быть получен различными способами, известными в данной области техники, при различных условиях, являющихся общепринятыми для компетентных специалистов в области органического синтеза, чтобы можно было получить соединения формулы I. В альтернативном варианте для получения соединений по формуле I промежуточный продукт 32 также можно ввести в реакцию с изоцианатами или изотиоцианатами в присутствии основания, такого как Et3N. Схема 4 В альтернативном варианте соединения формулы I, в которых R21 определяется как Н, a Y как -О-,можно получить посредством процедур, отображенных на схеме 4. Затем промежуточный продукт 30 можно алкилировать промежуточным продуктом 33, который можно получить в результате реакции соответствующих спиртов с метансульфохлоридом в присутствии основания, такого как K2CO3, при повышенной температуре. Вышеупомянутые спирты доступны на коммерческой основе или могут быть получены различными способами, известными компетентному специалисту (типичные примеры описаны в ссылке Sandler, S. с соавт., Organic Functional Group Preparations, Vol. I, Academic Press, Inc. (1983, для получения соединений по формуле I. Схема 5 В альтернативном варианте соединения формулы I, в которых R21 определяется как галоген, a Y как-О-, можно получить посредством процедур, проиллюстрированных на схеме 5. Промежуточный продукт 34, полученный из коммерческих источников, можно ввести в реакцию с промежуточным продуктом 35, который также доступен на коммерческой основе или может быть получен различными способами, хорошо известными компетентным специалистам (типичные примеры описаны в ссылке Sandler, S. с соавт., Organic Functional Group Preparations, Vol. I, Academic Press, Inc. (1983, в присутствии основания, такого как NaH, в подходящем растворителе, таком как DMF, DMSO и т.д., при повышенной температуре, получая на выходе промежуточный продукт 36. Конденсация промежуточного продукта 36 под воздействием R1NHNH2 (где R1, иной, нежели Н, определяется, как в формуле I) дает промежуточный продукт 37. Обработка промежуточного продукта 37 РОХ 3 при повышенной температуре дает на выходе промежуточный продукт 38. Снятие защитной группы с промежуточного продукта 39 можно осуществить, применяя соответствующие реактивы, известные компетентным специалистам (для получения специальных подробностей см. ссылку Greene, T.W. с соавт., Protecting Groups in Organic Synthesis, JohnWileySons Inc. (1991. Затем продукт со снятой защитой можно обработать алкилирующим агентомR2Z (где R2 определяется, как в формуле I, a Z представляет собой уходящую группу, такую как галид,мезилат, трифлат и т.д.), который доступен на коммерческой основе или может быть получен различными способами, известными в данной области техники, при наличии условий, являющихся общепринятыми для компетентных специалистов в области органического синтеза, чтобы можно было получить соединения формулы I. В альтернативном варианте для получения соединений по формуле I промежуточный продукт 39 также можно ввести в реакцию с изоцианатами или изотиоцианатами в присутствии основания, такого как Et3N. В альтернативном варианте соединения формулы I, в которых Y определяется как -О-, a R21 как CN,амины, алкокси, алкилы, арилы, алкены или алкины, можно получить посредством процедур, описанных на схеме 6. Затем промежуточный продукт 40 а (где n3 определяется как D) можно соединить с доступны- 15018268 ми на коммерческой основе CuCN, аминами, спиртами, бориновыми кислотами, используя различные способы, известные в данной области техники, в разных условиях, которые являются общепринятыми для компетентных специалистов в области органического синтеза, чтобы получить соединения формулы I. Схема 6 В альтернативном варианте соединения формулы I, в которых Y определяется как -О-, a R21 как сложные эфиры и амиды, можно получить посредством процедур, проиллюстрированных на схеме 7. Промежуточный продукт 41, полученный из коммерческих источников, можно ввести в реакцию с хлоридом арилдиазония, который доступен на коммерческой основе, а также с последующим термическим закрытием кольца для получения на выходе промежуточного продукта 42 (типичные примеры можно найти в ссылке Schober, B.D., J. Heterocyclic Chem., 26:169 (1989. Затем промежуточный продукт 42 можно алкилировать промежуточным продуктом 4, который можно получить в результате реакции соответствующих спиртов с метансульфохлоридом в присутствии основания, такого как K2CO3 при повышенной температуре. Вышеупомянутые спирты доступны на коммерческой основе или могут быть получены различными способами, известными компетентному специалисту (типичные примеры описаны в ссылке Sandler, S. с соавт., Organic Functional Group Preparations, Vol. I, Academic Press, Inc. (1983. Снятие защитной группы с промежуточного продукта 43 можно осуществить соответствующими реактивами, хорошо известными компетентным специалистам (специфические подробности см. в ссылке Greene,T.W. с соавт., Protecting Groups in Organic Synthesis, John WileySons Inc. (1991. Затем промежуточный продукт со снятой защитой можно обработать R2X (где R2 определяется, как в формуле I, a X представляет собой уходящую группу, такую как галид, мезилат, трифлат и т.д.), который доступен на коммерческой основе или может быть получен различными способами, известными в данной области техники, в различных условиях, являющихся рутинными для компетентных специалистов в области органиче- 16018268 ского синтеза, чтобы можно было получить соединения формулы I как промежуточный продукт 45. В альтернативном варианте промежуточный продукт 44 также можно ввести в реакцию с изоцианатами или изотиоцианатами в присутствии основания, такого как Et3N, для получения соединений по формуле I как промежуточного продукта 45. Дальнейшая разработка промежуточного продукта 45 коммерчески доступными аминами при повышенной температуре может дать альтернативные соединения формулы I. Сокращения В примерах и в других местах этого документа использованы следующие сокращения:LRMS = масс-спектрометрия низкого разрешения; ЯМР = ядерный магнитный резонанс. Примеры Следующие примеры предложены в качестве иллюстративных пояснений, частично представляющих объем и конкретные варианты осуществления изобретения, т.е. они никоим образом не ограничивают объем изобретения. Аббревиатуры и химические символы имеют обычные и общепринятые значения,если не указано иное. Если специально не указано иное, то соединения, указанные в данном описании,были изготовлены, выделены и охарактеризованы с применением схем и других способов, раскрытых в данном описании, или могут быть приготовлены с их же применением. Пример 1. Транс-трет-бутил 2-метил-4-(1-(4-(метилсульфонил)фенил)-2-оксо-1,2-дигидропиридин-4 илоркси)пиперидин-1-карбоксилат Этап А. Получение трет-бутил 4-гидрокси-2-метилпиперидин-1-карбоксилата. К раствору трет-бутил 2-метил-4-оксопиперидин-1-карбоксилата (727 мг, 3,41 ммоль, Small Molecules Inc.) в МеОН (6,0 мл) при 0 С добавляли борогидрид натрия (193 мг, 5,11 ммоль, Aldrich) несколькими порциями. Реакционную смесь перемешивали при 0 С в течение 1 ч, согревали до комнатной температуры и продолжали перемешивать еще 2,5 ч. Затем полученную смесь гасили насыщенным водным раствором NH4Cl и выпаривали под сниженным давлением для удаления МеОН с последующей экстракцией CH2Cl2 (3). Объединенные экстракты высушивали (Na2SO4) и концентрировали в вакууме, получая целевое соединение (745 мг) в виде бесцветного вязкого масла, которое использовали без дополнительной очистки.- 17018268 Этап В. Получение трет-бутил 2-метил-4-(метилсульфонилокси)пиперидин-1-карбоксилата. К смеси трет-бутил 4-гидрокси-2-метилпиперидин-1-карбоксилата (745 мг, 3,46 ммоль) и триэтиламина (0,965 мл, 6,92 ммоль, EMD) в CH2Cl2 (20,0 мл) при 0 С по каплям добавляли метансульфохлорид(0,324 мл, 4,15 ммоль, Aldrich). Реакционную смесь перемешивали при 0 С в течение 5 мин и при комнатной температуре в течение 3 ч, а затем гасили 0,5N раствором HCl. Смесь сепарировали и водный слой дополнительно экстрагировали CH2Cl2 (2). Объединенные органические слои отмывали рассолом,высушивали (Na2SO4) и выпаривали под сниженным давлением. Остаток очищали флэш-хроматографией на силикагеле gel (0-100% EtOAc в гексане), получая как цис-, так и транс-изомеры трет-бутил 4 гидрокси-2-метилпиперидин-1-карбоксилата (цис-изомер, 498,1 мг, желтоватое твердое вещество, 49%; транс-изомер, 146,4 мг, бесцветное масло, 14%). Определение структур основывали на 1D-NOE ЯМР. Этап С. Получение 4-(бензилокси)-1-(4-(метилсульфонил)фенил)пиридин-2(1 Н)-она. Смесь 4-бензилокси-2(1 Н)пиридона (6,87 г, 34,1 ммоль, Aldrich), 4-бромфенил метилсульфона (8,01 г, 34,1 ммоль, Combi-Blocks Inc.), иодида меди(I) (1,30 г, 6,82 ммоль, Aldrich), 8-гидроксихинолина (0,99 г, 6,82 ммоль, Alfa Aesar) и карбоната калия (6,12 г, 44,3 ммоль, EMD) в DMSO (100 мл) нагревали при 145 С в течение 6 ч, охлаждали до комнатной температуры, а затем разбавляли 10% водным растворомNH4OH (50 мл) и EtOAc (100 мл). Полученную смесь фильтровали, а твердый остаток отмывали Н 2 О иEtOAc, получая 8,0 г неочищенного продукта в виде зеленоватого твердого вещества.MS (ESI) 356 (М+Н). Этап D. Получение 4-гидрокси-1-(4-(метилсульфонил)фенил)пиридин-2(1 Н)-она. Перемешиваемую смесь 4-(бензилокси)-1-(4-(метилсульфонил)фенил)пиридин-2(1 Н)-она (3,0 г,8,44 ммоль) и палладия на активированном угле (1,63 г, 10 вес.%, влажный, Aldrich) в THF (150 мл) и метаноле (250 мл) выдерживали в водороде (баллон) в течение 1 ч. Полученную смесь очищали азотом, а затем разбавляли THF (150 мл) и метанолом (50 мл). После перемешивания в азотной атмосфере в течение 30 мин смесь фильтровали через вспомогательную фильтрующую присадку CELITE 545, а фильтрат выпаривали под сниженным давлением, получая 2,28 г неочищенного продукта в виде темного зеленоватого твердого вещества.MS (ESI) 266 (М+Н). Этап Е. Смесь 4-гидрокси-1-(4-(метилсульфонил)фенил)пиридин-2(1 Н)-она (173 мг, 0,652 ммоль), цис-третбутил 2-метил-4-(метилсульфонилокси)пиперидин-1-карбоксилата (191 мг, 0,652 ммоль) и карбоната калия (180 мг, 1,304 ммоль) в DMF (3,0 мл) нагревали при 140 С в течение 6 ч и при 100 С в течение ночи. К вышеуказанной смеси добавляли дополнительный карбонат калия (90 мг, 1 экв.) и реакционную смесь нагревали при 120 С в течение 3 ч, а затем охлаждали до комнатной температуры. Смесь разбавляли EtOAc и водой, а водный слой дополнительно экстрагировали EtOAc (4). Объединенные органические слои отмывали смесью рассол/вода (1:1, 2), высушивали (Na2SO4) и выпаривали под сниженным давлением. Остаток очищали флэш-хроматографией на силикагеле (0-100% EtOAc/гексан), получая на выходе транс-изомер трет-бутил 2-метил-4-(1-(4-(метилсульфонил)фенил)-2-оксо-1,2-дигидропиридин-4 илокси)пиперидин-1-карбоксилата (31,4 мг,10,4%) в виде желтоватого твердого вещества. 1 Н NMR (500 МГц, CDCl3)8,07 (d, J=8,25 Гц, 2 Н), 7,61 (d, J=8,25 Гц, 2 Н), 7,22 (d, J=7,70 Гц, 1 Н),6,02 (dd, J=7,70, 2,20 Гц, 1 Н), 5,97 (d, J=2,20 Гц, 1 Н), 4,50-4,66 (m, 2 Н), 4,09-4,13 (m, 1H), 3,09 (s, 3 Н),2,91-3,05 (m, 1H), 2,10-2,22 (m, 1 Н), 1,96-2,07 (m, 1 Н), 1,69-1,85 (m, 1 Н), 1,51-1,64 (m, 1 Н), 1,48 (s, 9 Н),1,23 (d, J=7,15 Гц, 3 Н). Смесь 4-гидрокси-1-(4-(метилсульфонил)фенил)пиридин-2(1 Н)-она (125 мг, 0,471 ммоль), транстрет-бутил 2-метил-4-(метилсульфонилокси)пиперидин-1-карбоксилата (138,2 мг, 0,471 ммоль, пример 1) и карбоната калия (163 мг, 1,178 ммоль) в DMF (4,0 мл) нагревали при 110 С в течение 20 ч. Реакционную смесь охлаждали до комнатной температуры и разбавляли EtOAc и водой. Водный слой дополнительно экстрагировали EtOAc (3). Объединенные органические слои отмывали смесью рассол/вода (1:1,2), высушивали (Na2SO4) и выпаривали под сниженным давлением. Остаток очищали флэшхроматографией на силикагеле (0-100% EtOAc в гексане), получая на выходе цис-изомер трет-бутил 2 метил-4-(1-(4-(метилсульфонил)фенил)-2-оксо-1,2-дигидропиридин-4-илокси)пиперидин-1-карбоксилата(114,6 мг, выход 52%) в виде желтоватого твердого вещества. 1 Н NMR (500 МГц, CDCl3)8,07 (d, J=8,80 Гц, 2 Н), 7,62 (d, J=8,25 Гц, 2 Н), 7,24 (d, J=7,70 Гц, 1 Н),- 18018268 6,06 (dd, J=7,70, 2,75 Гц, 1 Н), 5,95 (d, J=2,20 Гц, 1 Н), 4,64-4,70 (m, 1H), 4,35-4,45 (m, 1H), 3,91-3,98 (m,1H), 3,18-3,28 (m, 1 Н), 3,09 (s, 9 Н), 1,95-2,04 (т, 2 Н), 1,89-1,96 (т, 1 Н), 1,75-1,84 (т, 1 Н), 1,48 (s, 9 Н), 1,27 Этап А. Получение солянокислой соли цис-4-(2-метилпиперидин-4-илокси)-1-(4(метилсульфонил)фенил)пиридин-2(1 Н)-она. К раствору цис-трет-бутил 2-метил-4-(1-(4-(метилсульфонил)фенил)-2-оксо-1,2-дигидропиридин-4 илокси)пиперидин-1-карбоксилата (98,9 мг, 0,214 ммоль) в МеОН (1,0 мл) при 0 С добавляли соляную кислоту (2,0 мл, 8,00 ммоль, 4,0 М в диоксане, Aldrich). Реакционную смесь нагревали до комнатной температуры и непрерывно перемешивали при комнатной температуре. После перемешивания в течение 1,5 ч смесь выпаривали под сниженным давлением, получая целевое соединение (114,5 мг) в виде желтоватого твердого вещества. Этот материал использовали на следующем этапе без дополнительной очистки.MS (ESI) 363 (М+Н). Этап В. Смесь солянокислой соли цис-4-(2-метилпиперидин-4-илокси)-1-(4-(метилсульфонил)фенил)пиридин-2(1 Н)-она (45 мг, 0,124 ммоль), 2-хлор-5-пропилпиримидин (38,9 мг, 0,248 ммоль, Wako) и карбоната цезия (162 мг, 0,497 ммоль, Aldrich) в DMF (0,8 мл) нагревали в микроволновой печи (180 С, 2 ч). Полученную смесь разбавляли EtOAc и водой. Водный слой дополнительной экстрагировали EtOAc (3). Объединенные экстракты отмывали рассолом, высушивали (Na2SO4) и выпаривали под сниженным давлением. Остаток очищали препаративной ВЭЖХ (колонка С 18; 0-100% метанола в воде, содержащей 0,05% трихлоруксусной кислоты), получая на выходе соединение по примеру 3 (12,7 мг, желтоватое твердое вещество, 20%) при лиофилизации. 1 Н NMR (500 МГц, CDCl3)8,40 (s, 2 Н), 8,09 (d, J=8,80 Гц, 2 Н), 7,63 (d, J=8,80 Гц, 2 Н), 7,30 (d,J=7,70 Гц, 1 Н), 6,15 (dd, J=7,70, 2,20 Гц, 1 Н), 6,12 (d, J=2,75 Гц, 1 Н), 4,99-5,07 (m, 1 Н), 4,79 (арр brs, 1 Н),4,51-4,58 (m, 1 Н), 3,51-3,63 (m, 1 Н), 3,11 (s, 3 Н), 2,50 (t, J=7,70 Гц, 2 Н), 2,21 (t, J=14,57 Гц, 2 Н), 1,91-2,13 Соединение по примеру 4 было получено в соответствии с процедурами, описанными в примере 3,с заменой цис-трет-бутил 2-метил-4-(1-(4-(метилсульфонил)фенил)-2-оксо-1,2-дигидропиридин-4 илокси)пиперидин-1-карбоксилата на этапе А транс-трет-бутил 2-метил-4-(1-(4(метилсульфонил)фенил)-2-оксо-1,2-дигидропиридин-4-илокси)пиперидин-1-карбоксилатом. 1 Н NMR (500 МГц, CDCl3)8,33 (s, 2 Н), 8,08 (d, J=8,25 Гц, 2 Н), 7,62 (d, J=8,80 Гц, 2 Н), 7,21-7,29 (m,1H), 6,17 (d, J=2,75 Гц, 1 Н), 6,09 (dd, J=7,70, 2,75 Гц, 1 Н), 5,11-5,27 (m, 1H), 4,69-4,82 (m, 2 Н), 3,16-3,32(6,36 г, 46,0 ммоль, EMD) в DMF (15 мл) при комнатной температуре добавляли 2-хлор-5 пропилпиримидин (4,33 г, 27,6 ммоль, Wako). Реакционную смесь нагревали при 100 С в течение 3 ч, а затем разбавляли Н 2 О. Полученную смесь экстрагировали EtOAc (2). Органические слои объединяли,высушивали над Na2SO4 и концентрировали в вакууме до коричневого масла. Масло очищали флэшхроматографией (SiO2, от 0 до 100% EtOAc в CH2Cl2), получая на выходе 5,01 г желаемого продукта в виде белого твердого вещества.MS (ESI) 222 (М+Н). Этап В. Получение 1-(5-пропилпиримидин-2-ил)пиперидин-4-ил метансульфоната. К перемешиваемому раствору 1-(5-пропилпиримидин-2-ил)пиперидин-4-ола (9,2 г, 41,6 ммоль),Et3N (12,85 мл, 91 ммоль, Aldrich) в CH2Cl2 (80 мл) при 0 С по каплям добавляли раствор метансульфохлорида (3,54 мл, 45,7 ммоль, ACROS) в CH2Cl2 (20 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч и отмывали 1N HCl в Н 2 О, насыщенным раствором NaHCO3 в Н 2 О и рассолом. Органический слой высушивали над Na2SO4 и концентрировали (concentrated) в вакууме, получая на выходе 11,7 г желаемого продукта в виде желтоватого твердого вещества.MS (ESI) 300 (М+Н). Этап С. Получение 4-(1-(5-пропилпиримидин-2-ил)пиперидин-4-илокси)пиридин-2(1 Н)-она. Перемешиваемую суспензию 4-гидроксипиридин-2(1 Н)-она (5,23 г, 47,1 ммоль, Aldrich), 1-(5 пропилпиримидин-2-ил)пиперидин-4-ил метансульфоната (11,7 г, 39,2 ммоль), карбоната калия (12,5 г,90,0 ммоль, EMD) и DMSO (48 мл) нагревали при 100 С в течение 3 ч, а затем охлаждали до комнатной температуры. Полученную смесь разбавляли Н 2 О и экстрагировали EtOAc (2). Органические слои объединяли и концентрировали в вакууме до коричневого масла. Твердое вещество очищали флэшхроматографией (SiO2, 100% EtOAc, а затем SiO2, 10% МеОН в CH2Cl2), получая на выходе 5,00 г желаемого продукта в виде желтоватого твердого вещества.(2 мл) нагревали в микроволновой печи при 160 С в течение 30 мин. Полученную смесь разбавляли Н 2 О и экстрагировали EtOAc (2). Объединенные органические слои концентрировали в вакууме до зеленого масла коричневого масла. Масло очищали флэш-хроматографией (SiO2, от 0 до 5% МеОН в CH2Cl2), получая на выходе 37 г желаемого продукта в виде светло-коричневого твердого вещества. 1 Н NMR (400 МГц, DMSO-d6)ppm 8,30 (s, 2 Н), 7,81 (d, J=8,53 Гц, 1H), 7,74 (d, J=2,01 Гц, 1H), 7,66 Соединение по примеру 6 получали в соответствии с процедурами, описанными в примере 5, заменяя 5-бром-2-метилбензо[d]оксазол на этапе D на 5-бром-2-изопропилбензо[d]оксазол. 1 Н NMR (400 МГц, CDCl3)ppm 8,18 (s, 2 Н), 7,64 (d, J=2,20 Гц, 1H), 7,57 (d, J=8,25 Гц, 1H), 7,32- 20018268 Соединение по примеру 7 получали в соответствии с процедурами, описанными в примере 5, заменяя 5-бром-2-метилбензо[d]оксазола на этапе D на 6-бром-2-метилбензо[d]оксазол, за тем исключением,что продукт растворяли в CH2Cl2 и добавляли 1 экв. HCl (1N HCl в Et2O); полученную смесь перемешивали в течение 5 мин, а затем концентрировали в вакууме, получая соединение по примеру 3. 1 Н NMR (400 МГц, DMSO-d6)ppm 8,29 (s, 2 Н), 7,77 (d, J=1,76 Гц, 1 Н), 7,73 (d, J=8,28 Гц, 1 Н), 7,61 Этап А. Получение 5-метокси-2-(4-(метилсульфонил)фенил)пиридазин-3(2 Н)-она. К смеси 5-метоксипиридазин-3(2 Н)-она (631 мг, 5,00 ммоль) в DMF (5 мл) при комнатной температуре под аргоном добавляли NaH (240 мг, 6,0 ммоль) тремя порциями в течение 2 мин. После перемешивания реакционной смеси при комнатной температуре в течение 30 мин к ней добавляли 1-фтор-4(метилсульфонил)бензол (1,045 г, 6,0 ммоль). Полученную реакционную смесь нагревали при 100 С под аргоном в течение 5 ч. После охлаждения реакционной смеси до комнатной температуры добавляли 3 мл 1 М раствора NaOH. Полученную реакционную смесь нагревали при 60 С в течение 3 ч. После охлаждения реакции до комнатной температуры добавляли 10 мл Et2O наряду с 20 мл воды. Органический слой отделяли и выбрасывали. Водную фазу подкисляли 1N HCl до рН 5. Твердые осадки собирали фильтрацией и дополнительно отмывали водой (5 мл 2) и метанолом (3 мл 2), получая на выходе 231 мг продукта в виде желто-коричневого твердого вещества. Фильтрат экстрагировали EtOAc (10 мл 3). Объединенные органические фазы отмывали рассолом brine (20 мл), высушивали (MgSO4), фильтровали и концентрировали. Первичный продукт очищали флэш-хроматографией (от 60 до 100% EtOAc/гексаны), получая на выходе 371 мг дополнительного продукта. Общее количество желательного продукта составило 602 мг (45%). 1 Н NMR (400 МГц, DMSO)ppm 3,26 (s, 3 Н), 6,10 (d, J=2,64 Гц, 1 Н), 7,82 (d, J=8,79 Гц, 2 Н), 7,89 (d,J=2,64 Гц, 1 Н), 8,01 (d, J=8,79 Гц, 2 Н), 11,85 (s, 1H).MS (ESI) 267 (М+Н). Этап В. Получение трет-бутил 4-(метилсульфонилокси)пиперидин-1-карбоксилата. К перемешиваемому раствору трет-бутил-4-гидрокси-1-пиперидинкарбоксилата (10,28 г, 51,08 ммоль, Aldrich) и Et3N (14,25 мл, 102,16 ммоль, EMD) в CH2Cl2 (300 мл) при комнатной температуре по каплям добавляли метансульфохлорид (4,35 мл, 56,19 ммоль, Aldrich). Реакционную смесь перемешивали при комнатной температуре в течение 4 ч и отмывали 0,1N водным раствором HCl, Н 2 О и рассолом. Органический слой высушивали Na2SO4 и концентрировали в вакууме, получая на выходе 14,3 г неочищенного продукта в виде светло-оранжевого твердого вещества. Этап С. К смеси 5-гидрокси-2-(4-(метилсульфонил)фенил)пиридазин-3(2 Н)-она (26,6 мг, 0,10 ммоль) в DMF(1 мл) при комнатной температуре под аргоном добавляли карбонат калия (41,4 мг, 0,30 ммоль, EMD) и трет-бутил 4-(метилсульфонилокси)пиперидин-1-карбоксилат (53,3 мг, 0,15 ммоль). Реакционную смесь нагревали при 90 С в течение ночи, а затем охлаждали до комнатной температуры. Полученную смесь разбавляли EtOAc (10 мл) и Н 2 О (10 мл), после чего водный слой дополнительно экстрагировали EtOAc(5 мл 2). Объединенные экстракты отмывали рассолом (10 мл 3), высушивали (Na2SO4) и выпаривали. Остаток очищали флэш-хроматографией (от 0 до 10% МеОН/CH2Cl2), получая на выходе 38,9 мг (87%) соединения по примеру 8 в виде белого твердого вещества. 1 Н NMR (400 МГц, CDCl3)1,39-1,51 (m, 9 Н), 1,68-1,86 (m, 2 Н), 1,91-2,07 (m, 2 Н), 3,06 (s, 3 Н), 3,213,42 (m, 2 Н), 3,64-3,82 (m, 2 Н), 4,35-4,58 (m, 1 Н), 6,21 (d, J=2,64 Гц, 1 Н), 7,72 (d, J=2,64 Гц, 1 Н), 7,88 (d,J=8,79 Гц, 2 Н), 8,03 (d, J=8,79 Гц, 2 Н). Соединение по примеру 9 получали с выходом 60% в соответствии с процедурами, описанными в примере 8, заменяя трет-бутил 4-(метилсульфонилокси)пиперидин-1-карбоксилат на 1-(5 пропилпиримидин-2-ил)пиперидин-4-ила метансульфонат. 1 Н NMR (400 МГц, CDCl3)0,93 (t, J=7,47 Гц, 3 Н), 1,44-1,71 (m, 2 Н), 1,72-1,97 (m, 2 Н), 1,97-2,18 (m,2 Н), 2,40 (t, J=7,47 Гц, 2 Н), 3,07 (s, 3 Н), 3,43-3,78 (m, 2 Н), 4,00-4,36 (m, 2 Н), 4,44-4,74 (m, 1 Н), 6,26 (d,J=2,64 Гц, 1 Н), 7,74 (d, J=2,64 Гц, 1 Н), 7,89 (d, J=8,35 Гц, 2 Н), 8,03 (d, J=8,79 Гц, 2 Н), 8,17 (s, 2 Н). Соединение по примеру 10 получали с выходом 45% в соответствии с процедурами, описанными в примере 8, заменяя трет-бутил 4-(метилсульфонилокси)пиперидин-1-карбоксилат на 1-(5 циклопропилпиримидин-2-ил)пиперидин-4-ила метансульфонат. 1 Н NMR (400 МГц, CDCl3)0,59 (d, J=6,15 Гц, 2 Н), 0,79-1,00 (m, 2 Н), 1,65-1,77 (m, 1 Н), 1,77-1,94 Соединение по примеру 11 получали с выходом 45% в соответствии с процедурами, описанными в примере 8, заменяя трет-бутил 4-(метилсульфонилокси)пиперидин-1-карбоксилат на 1-(5 ацетилпиримидин-2-ил)пиперидин-4-ила метансульфонат. 1 Н NMR (400 МГц, CDCl3)ppm 1,80-1,99 (m, 2 Н), 2,01-2,21 (m, 2 Н), 2,41-2,59 (m, 3 Н), 3,07 (s, 3 Н),3,80-4,03 (m, 2 Н), 4,10-4,36 (m, 2 Н), 4,50-4,76 (m, 1 Н), 7,75 (d, J=3,08 Гц, 1H), 7,89 (d, J=8,79 Гц, 2H), 8,03 Этап А. Получение соли TFA 2-(4-(метилсульфонил)фенил)-5-(пиперидин-4-илокси)пиридазин 3(2 Н)-она. Смесь по примеру 8 (10 мг, 0,022 ммоль) и TFA (17 мкл, 0,22 ммоль) в CH2Cl2 (1 мл) перемешивали в течение 5 ч, а затем концентрировали в вакууме. Полученное твердое вещество растворяли в метаноле(2 мл) и выпаривали для получения 9,7 мг неочищенного продукта в виде желто-коричневого твердого вещества.(9,7 мг, 0,02 ммоль) в DMF (1 мл) при комнатной температуре под аргоном добавляли DIPEA (7,7 мкл,0,04 ммоль) и 2-хлор-5-этилпиримидин (4,7 мг, 0,03 ммоль). Реакционную смесь нагревали при 95 С в течение ночи и охлаждали до комнатной температуры. Полученную смесь разбавляли EtOAc (10 мл) и Н 2 О (10 мл), после чего водный слой дополнительно экстрагировали EtOAc (5 мл 2). Объединенные экстракты отмывали рассолом (10 мл 3), высушивали (Na2SO4) и выпаривали. Первичный продукт очищали препаративной ВЭЖХ (колонка С 18; 10-100% метанола в воде), получая соединение по примеру 12 Этап А. Получение 5-хлор-2-(4-(метоксибензил-6-фенилпиридазин-3(2 Н)-она. К смеси 5-хлор-6-фенилпиридазин-3(2 Н)-она (207 мг, 1,0 ммоль) в DMF (3 мл) при комнатной температуре под аргоном добавляли K2CO3 (415 мг, 3,0 ммоль), а затем добавляли 1-(бромметил)-4 метоксибензол (241 мг, 1,2 ммоль). Полученную реакционную смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли воду (25 мл) и перемешивали в течение 1 ч. Продукт собирали фильтрацией и высушивали в течение ночи под сниженным давлением, получая на выходе 278 мг (81%) 5-хлор-2-(4-метоксибензил)-6-фенилпиридазин-3(2 Н)-она в виде желтокоричневого твердого вещества.MS (ESI) 327 (M+H). Этап В. К смеси трет-бутил 4-гидроксипиперидин-1-карбоксилата (121 мг, 0,60 ммоль) в THF (3 мл) при комнатной температуре под аргоном добавляли NaH (24 мг, 0,60 ммоль). После перемешивания при комнатной температуре под аргоном в течение 30 минут добавляли 5-хлор-2-(4-метоксибензил)-6 фенилпиридазин-3(2 Н)-он (163 мг, 0,50 ммоль). Полученную реакционную смесь перемешивали при комнатной температуре в течение трех суток. К реакционной смеси добавляли EtOAc (10 мл) и рассол(10 мл). Слои разделяли. Органический слой отмывали водой (15 мл) и рассолом (15 мл). Органическую фазу высушивали (MgSO4), фильтровали и концентрировали. Неочищенный продукт растворяли в небольшом количестве DCM (2 мл) и загружали в 40 г колонку ISCO с силикагелем, которую элюировали в течение 20 мин с градиентом от 0 до 100% смеси EtOAc/гексаны. В результате получали 138,9 мг(56,3%) трет-бутил-4-(1-(4-метоксибензил)-6-оксо-3-фенил-1,6-дигидропиридазин-4-илокси)пиперидин 1-карбоксилата в виде белого твердого вещества. 1 Н NMR (400 МГц, CDCl3)ppm 1,43 (s, 9 Н), 1,62-1,82 (m, 2 Н), 1,80-1,98 (m, 2 Н), 3,16-3,57 (т,J=5,27, 5,27 Гц, 4 Н), 3,76 (s, 1 Н), 4,35-4,64 (m, 1 Н), 5,26 (s, 2 Н), 6,21 (s, 1 Н), 6,84 (d, J=8,79 Гц, 2 Н), 7,337,53 (т, 5 Н), 7,64 (dd, J=6,81, 3,30 Гц, 2 Н). Этап А. Получение 3,4-дихлорбензолдиазония. К смеси 3,4-дихлоранилина (3,24 г, 20 ммоль) в 10 мл конц. HCl и воды (20 мл) при 0 С добавляли нитрит натрия (1,38 г, 20 ммоль) в 15 мл воды. Полученную реакционную смесь перемешивали при 0 С в течение 30 мин. Анализ ВЭЖХ показал, что реакция была завершена. Реакционную смесь использовали непосредственно на следующем этапе.- 23018268 Этап В. Получение (Е)-диметил 2-(2-(3,4-дихлорфенил)гидразоно)-3-оксопентандиоата. К смеси диметил 3-оксопентандиоата (3,48 г, 20 ммоль) в этаноле (12 мл) и воде (40 мл) при комнатной температуре добавляли ацетат натрия (12,0 г, 146 ммоль), а затем добавляли раствор 3,4 дихлорбензолдиазония (20 ммоль). Полученную реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Продукт собирали фильтрацией, затем отмывали водой (50 мл) и высушивали в течение ночи под сниженным давлением, получая на выходе 6,776 г (93%) (Е)-диметил 2-(2-(3,4 дихлорфенил)гидразоно)-3-оксопентандиоата в виде желтого твердого вещества.(Е)-диметил 2-(2-(3,4-дихлорфенил)гидразоно)-3-оксопентандиоат (6,7 г, 19,3 ммоль) в 1,2 дихлорбензоле (20 мл) нагревали при 180 С в течение ночи. После охлаждения реакции до комнатной температуры к реакционной смеси добавляли 50 мл воды и перемешивали ее в течение 1 ч. Продукт собирали фильтрацией и дополнительно отмывали водой 20 мл и метанолом (10 мл 3), а затем высушивали в течение ночи под сниженным давлением, получая на выходе 3,73 г (55,2%) метил 1-(3,4-дихлорфенил)4-гидрокси-6-оксо-1,6-дигидропиридазин-3-карбоксилата в виде желто-коричневого твердого вещества.(315 мг, 1,0 ммоль) в DMF (3 мл) при комнатной температуре под аргоном добавляли K2CO3 (415 мг,3,0 ммоль) и трет-бутил 4-(метилсульфонилокси)пиперидин-1-карбоксилат (419 мг, 1,5 ммоль). Реакционную смесь нагревали при 95 С в течение ночи. К реакционной смеси добавляли EtOAc (20 мл) и воду(20 мл). Слои разделяли. Органический слой отмывали водой (15 мл) и рассолом (15 мл). Органическую фазу высушивали (MgSO4), фильтровали и концентрировали. Неочищенный продукт растворяли в небольшом количестве DCM (2 мл) и загружали в 40 г колонку ISCO с силикагелем, которую элюировали в течение 20 мин с градиентом от 20 до 100% смеси EtOAc/гексаны. В результате было получено 72 мг Этап А. Получение 4-(1-(трет-бутоксикарбонил)пиперидин-4-илокси)-1-(3,4-дихлорфенил)-6-оксо 1,6-дигидропиридазин-3-карбоновой кислоты. К метил 4-(1-(трет-бутоксикарбонил)пиперидин-4-илокси)-1-(3,4-дихлорфенил)-6-оксо-1,6 дигидропиридазин-3-карбоксилату (пример 14) (59,8 мг, 0,12 ммоль) в THF (2 мл) при комнатной температуре под аргоном добавляли 2 М NaOH (0,18 мл, 0,36 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Большая часть продукта выпадала в осадок. Растворители удаляли в вакууме. Добавляли 10 мл воды и 1 мл 1 М HCl. Продукт собирали фильтрацией и дополнительно отмывали водой (3 мл 2). После высушивания в течение ночи было получено 56,7 мг (96%) 4-(1-(третбутоксикарбонил)пиперидин-4-илокси)-1-(3,4-дихлорфенил)-6-оксо-1,6-дигидропиридазин-3-карбоновой кислоты в виде белого твердого вещества.MS (ESI) 428 (M+H-tBu). Этап В. К смеси 4-(1-(трет-бутоксикарбонил)пиперидин-4-илокси)-1-(3,4-дихлорфенил)-6-оксо-1,6 дигидропиридазин-3-карбоновой кислоты (23 мг, 0,047 ммоль) в THF (1 мл) при комнатной температуре под аргоном добавляли HOBt (8,0 мг, 0,052 ммоль), EDC (10,01 мг, 0,052 ммоль), а затем 1 М метиламин в THF (0,237 мл, 0,237 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли EtOAc (10 мл) и 1N NaOH (10 мл). Слои разделяли. Органический слой отмывали водой (10 мл) и рассолом (10 мл). Органическую фазу высушивали (MgSO4), фильтровали и концентрировали. Первичный продукт очищали препаративной ВЭЖХ (колонка C18; 10-100% метанола Соединение по примеру 16 получали с выходом 68,7% в соответствии с процедурами, описанными в примере 15, заменяя 0,5 М аммиак в диоксане на 1 М метиламин в THF. 1 Н NMR (400 МГц, CDCl3)ppm 1,46 (s, 9 Н), 1,77-2,10 (m, 4 Н), 3,38-3,57 (m, 2 Н), 3,57-3,73 (m, 2 Н),4,44-4,78 (m, 1 Н), 5,57 (s, 1 Н), 6,30 (s, 1 Н), 6,65 (s, 1 Н), 7,47 (dd, 1 Н), 7,51-7,58 (m, 1 Н), 7,71 (d, J=2,20 Гц,1H). К смеси 4-(1-(трет-бутоксикарбонил)пиперидин-4-илокси)-1-(3,4-дихлорфенил)-6-оксо-1,6 дигидропиридазин-3-карбоновой кислоты (из примера 15, этап А) (5 мг, 0,01 ммоль) в THF (1 мл) при комнатной температуре под аргоном добавляли 1 М ВН 3 в THF (31 мкл, 0,031 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Метанол (2 мл) осторожно добавляли к реакционной смеси и перемешивали при комнатной температуре в течение 2 ч. Растворители удаляли в вакууме. К реакционной смеси добавляли EtOAc (10 мл) и 1N NaOH (10 мл). Слои разделяли. Органический слой отмывали водой (10 мл) и рассолом (10 мл). Органическую фазу высушивали (MgSO4), фильтровали и концентрировали. Первичный продукт очищали препаративной ВЭЖХ (колонка C18; 10-100% метанола в воде без TFA), получая трет-бутил 4-(1-(3,4-дихлорфенил)-3-(гидроксиметил)-6-оксо-1,6 дигидропиридазин-4-илокси)пиперидин-1-карбоксилат (2,3 мг, смола, 42,6%). 1 Н NMR (400 МГц, CDCl3)ppm 1,45-1,48 (m, 9 Н), 1,68-1,93 (m, J=3,95 Гц, 2H), 1,88-2,17 (m, 2 Н),2,65-2,84 (m, 1 Н), 3,27-3,46 (m, 2 Н), 3,55-3,76 (m, 2 Н), 4,43-4,60 (m, 1 Н), 4,67 (s, 2 Н), 6,08-6,35 (m, 1 Н),7,40-7,62 (m, 2 Н), 7,63-7,83 (m, 1 Н). Этап А. Получение 4-(метилсульфонил)бензолдиазония. К смеси 4-(метилсульфонил) анилина (3,42 г, 20 ммоль) в 10 мл конц. HCl и воды (20 мл) при 0 С добавляли нитрит натрия (1,38 г, 20 ммоль) в 15 мл воды. Полученную реакционную смесь перемешивали при 0 С приблизительно 30 мин. Реакционную смесь использовали непосредственно на следующем этапе. Этап В. Получение (Е)-диметил 2-(2-(4-метилсульфонил)фенил)гидразоно-3-оксопентандиоата. К смеси диметил 3-оксопентандиоата (3,48 г, 20 ммоль) в этаноле (12 мл) и воде (40 мл) при ком- 25018268 натной температуре добавляли ацетат натрия (12,0 г, 146 ммоль), а затем добавляли раствор 4(метилсульфонил)бензолдиазония (20 ммоль). Полученную реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Продукт собирали фильтрацией, затем отмывали водой (50 мл) и высушивали в течение ночи под сниженным давлением, получая на выходе 7,0 г (83%) (Е)-диметил 2-(2-(4(метилсульфонил)фенил)гидразоно)-3-оксопентандиоата в виде желтого твердого вещества.MS (ESI) 357 (М+Н). Этап С. Получение метил 4-гидрокси-1-(4-(метилсульфонил)фенил)-6-оксо-1,6-дигидропиридазин 3-карбоксилата. Смесь (Е)-диметил 2-(2-(4-(метилсульфонил)фенил)гидразоно)-3-оксопентандиоата (7,0 г, 19,6 ммоль) в 1,2 дихлорбензоле (20 мл) нагревали при 180 С в течение ночи. После охлаждения реакции до комнатной температуры к реакционной смеси добавляли 50 мл воды и перемешивали ее в течение 1 ч. Продукт собирали фильтрацией и дополнительно отмывали водой 20 мл и метанолом (10 мл 3), затем высушивали в течение ночи под сниженным давлением, получая на выходе 3,13 г (49,1%) метил 4 гидрокси-1-(4-(метилсульфонил)фенил)-6-оксо-1,6-дигидропиридазин-3-карбоксилата.MS (ESI) 325 (М+Н). Этап D. Соединение по примеру 18 получали с выходом 12,2% в соответствии с процедурами, описанными в примере 14, заменяя метил 4-гидрокси-1-(4-(метилсульфонил)фенил)-6-оксо-1,6-дигидропиридазин-3 карбоксилат на метил 1-(3,4-дихлорфенил)-4-гидрокси-6-оксо-1,6-дигидропиридазин-3-карбоксилат. 1 Н NMR (400 МГц, CDCl3)ppm 1,40-1,50 (m, 9 Н), 1,68-1,82 (m, 1 Н), 1,92 (d, J=3,08 Гц, 3 Н), 3,233,45 (m, 2 Н), 3,49-3,59 (m, 1 Н), 3,59-3,73 (m, 1 Н), 3,82-4,03 (m, 3 Н), 4,48-5,43 (m, 1 Н), 6,12-6,38 (m, 1 Н),7,38-7,64 (m, 2 Н), 7,75 (dd, J=7,91, 2,20 Гц, 1H).(3 мл) при комнатной температуре под аргоном добавляли K2CO3 (256 мг, 1,855 ммоль), а затем добавляли 1-(бромметил)-4-метоксибензол (149 мг, 0,742 ммоль). Полученную реакционную смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли EtOAc (20 мл) и рассол(30 мл). Слои разделяли. Органический слой отмывали водой (15 мл) и рассолом (15 мл). Органическую фазу высушивали (MgSO4), фильтровали и концентрировали. Неочищенный продукт (117 мг) (MS (ESI) 247 (М+Н использовали непосредственно на следующем этапе. Этап В. Получение 5-гидрокси-2-(4-метоксибензил)пиридазин-3(2 Н)-она. К перемешиваемому раствору 5-метокси-2-(4-метоксибензил)пиридазин-3(2 Н)-она (117 мг, 0,47 ммоль) в THF (3 мл) при комнатной температуре под аргоном добавляли 1 М NaOH (2,0 мл, 2,0 ммоль). Полученную реакционную смесь нагревали при 80 С под аргоном в течение дня и мониторировали посредством LCMS вплоть до завершения реакции. К реакционной смеси добавляли EtOAc (20 мл), 1 МHCl (2 мл) и воду (10 мл). Слои разделяли. Органический слой отмывали водой (15 мл) и рассолом(15 мл). Органическую фазу высушивали (MgSO4), фильтровали и концентрировали. Неочищенный продукт растворяли в небольшом количестве DCM (2 мл) и загружали в 40 г колонку ISCO с силикагелем,которую элюировали в течение 20 мин с градиентом от 20 до 100% смеси EtOAc/гексаны. В результате было получено 95 мг (77%) 5-гидрокси-2-(4-метоксибензил)пиридазин-3(2 Н)-она в виде смолы.MS (ESI) 233 (М+Н). Этап С. Соединение по примеру 19 получали с выходом 84% в соответствии с процедурами, описанными в примере 14, заменяя 5-гидрокси-2-(4-метоксибензил)пиридазин-3(2 Н)-он на метил 1-(3,4-дихлорфенил)4-гидрокси-6-оксо-1,6-дигидропиридазин-3-карбоксилат. 1 Н NMR (400 МГц, CDCl3)ppm 1,45 (s, 9 Н), 1,71 (dd, J=12,08, 4,17 Гц, 2 Н), 1,83-2,00 (m, 2 Н), 3,183,38 (m, 2 Н), 3,56-3,74 (m, 2 Н), 3,77 (s, 3 Н), 4,10-4,55 (m, 1H), 5,18 (s, 2 Н), 6,08 (d, J=2,64 Гц, 1 Н), 6,84 (d,J=8,79 Гц, 2 Н), 7,36 (d, J=8,79 Гц, 2 Н), 7,51 (d, J=2,64 Гц, 1 Н). 4-(3-циано-1-(3,4-дихлорфенил)-6-оксо-1,6-дигидропиридазин-4-илокси)пиперидин-1 К перемешиваемому раствору трет-бутил 4-(3-карбамоил-1-(3,4-дихлорфенил)-6-оксо-1,6 дигидропиридазин-4-илокси)пиперидин-1-карбоксилата (пример 16) (9 мг, 0,019 ммоль) в THF (1 мл) при комнатной температуре под аргоном добавляли TEA (5,65 мг, 0,056 ммоль), а затем добавляли TFAA(11,73 мг, 0,056 ммоль). Полученную реакционную смесь перемешивали при комнатной температуре в течение ночи. Растворитель удаляли в вакууме. Первичный продукт очищали препаративной ВЭЖХ (колонка C18; 10-100% метанола в воде без TFA), получая трет-бутил 4-(3-циано-1-(3,4-дихлорфенил)-6 оксо-1,6-дигидропиридазин-4-илокси)пиперидин-1-карбоксилат (6 мг, белое твердое вещество, 69,2%). 1 Н NMR (400 МГц, CDCl3)ppm 1,47 (s, 9 Н), 1,74-1,94 (m, 2 Н), 1,92-2,12 (m, 2 Н), 3,32-3,55 (m, 2 Н),3,58-3,81 (m, 2 Н), 4,42-4,72 (m, 1 Н), 6,26 (s, 1 Н), 7,45 (dd, J=8,79, 2,20 Гц, 1H), 7,55 (d, 1 Н), 7,72 (d, J=2,20 Гц, 1H). Этап А. Получение соли HCl 1-(3,4-дихлорфенил)-6-оксо-4-(пиперидин-4-илокси)-1,6 дигидропиридазин-3-карбонитрила. К перемешиваемому раствору из примера 20 (400 мг, 0,860 ммоль) в DCM (3 мл) при комнатной температуре под аргоном добавляли 4 М HCl в диоксане (1,075 мл, 4,3 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. К реакционной смеси добавляли Et2O (10 мл). Твердый продукт собирали фильтрацией и дополнительно отмывали эфиром (5 мл 2). После высушивания под вакуумом в течение 2 ч получали 302 мг (96%) солянокислой соли 1-(3,4-дихлорфенил)-6-оксо-4(пиперидин-4-илокси)-1,6-дигидропиридазин-3-карбонитрила в виде желтоватого твердого вещества.MS (ESI) 365 (М+Н). Этап В. К перемешиваемому раствору 1-(3,4-дихлорфенил)-6-оксо-4-(пиперидин-4-илокси)-1,6 дигидропиридазин-3-карбонитрила HCl (50 мг, 0,137 ммоль) в NMP (2 мл) при комнатной температуре под аргоном добавляли DIPEA (53,1 мг, 0,411 ммоль) и 2-хлор-5-циклопропилпиримидина (31,7 мг,0,205 ммоль). Полученную реакционную смесь нагревали при 100 С под аргоном в течение ночи. К реакционной смеси добавляли 15 мл EtOAc. Реакционную смесь отмывали водой (15 мл) и рассолом(15 мл). Органическую фазу высушивали (MgSO4), фильтровали и концентрировали. Неочищенный продукт растворяли в небольшом количестве DCM (2 мл) и загружали в 40 г колонку ISCO с силикагелем,которую элюировали в течение 20 мин с градиентом от 20 до 100% смеси EtOAc/гексаны. В результате было получено 27 мг (38,8%) 4-(1-(5-циклопропилпиримидин-2-ил)пиперидин-4-илокси)-1-(3,4 дихлорфенил)-6-оксо-1,6-дигидропиридазин-3-карбонитрила в виде белого твердого вещества. 1 Н NMR (400 МГц, CDCl3)ppm 0,50-0,66 (m, 2 Н), 0,82-0,98 (m, 2 Н), 1,64-1,79 (m, 1 Н), 1,83-1,99 Соединение по примеру 22 получали с выходом 31% в соответствии с процедурами, описанными в примере 21, заменяя 2-хлор-5-пропилпиримидин на 2-хлор-5-циклопропилпиримидин. 1 Н NMR (400 МГц, CDCl3)ppm 0,93 (t, J=7,47 Гц, 3 Н), 1,45-1,67 (m, 4 Н), 1,81-2,00 (m, 2 Н), 2,002,17 (m, 2 Н), 2,41 (t, J=7,47 Гц, 2H), 3,57-3,89 (m, 2 Н), 4,01-4,29 (m, 2 Н), 4,57-4,79 (m, 1 Н), 6,26-6,36 (m,1 Н), 7,38-7,50 (m, 1 Н), 7,50-7,63 (m, 1 Н), 7,73 (d, J=2,64 Гц, 1H), 8,07-8,28 (m, 2 Н). Соединение по примеру 23 получали с выходом 42% в соответствии с процедурами, описанными в примере 21, заменяя 5-хлор-2-йодпиримидин на 2-хлор-5-циклопропилпиримидин. 1 Н NMR (400 МГц, CDCl3)ppm 1,86-2,00 (m, 2 Н), 2,01-2,13 (m, 2 Н), 3,71-3,94 (m, 2 Н), 3,95-4,19 Этап А. Получение 2-хлор-5-йодпиримидина. К перемешиваемому раствору 5-йодпиримидин-2-амина (2,21 г, 10,0 ммоль) в CH3CN (20 мл) при комнатной температуре под аргоном добавляли хлорид меди(II) (2,02 г, 15 ммоль) и трет-бутил нитрит(1,55 г, 15 ммоль). Реакционную смесь помещали в предварительно нагретую масляную баню (60 С) под аргоном. Реакционную смесь охлаждали до комнатной температуры и добавляли 20 мл эфира. Полученный нерастворимый материал отфильтровывали, а фильтрат концентрировали. Неочищенный продукт растворяли в небольшом количестве DCM (2 мл) и загружали в 80 г колонку ISCO с силикагелем, которую элюировали в течение 20 мин с градиентом от 0 до 100% смеси EtOAc/гексаны. В результате было получено 778 мг (31%) 2-хлор-5-йодпиримидина в виде желтоватого твердого вещества. 1 Н NMR (400 МГц, CDCl3)ppm 8,79 (s, 2 Н). Этап В. Соединение по примеру 24 получали с выходом 52% в соответствии с процедурами, описанными в примере 21, заменяя 2-хлор-5-йодпиримидин на 2-хлор-5-циклопропилпиримидин. 1 Н NMR (400 МГц, CDCl3)ppm 1,86-2,00 (m, 2 Н), 2,01-2,13 (m, 2 Н), 3,71-3,94 (m, 2 Н), 3,95-4,19 4-(3-амино-1-(3,4-дихлорфенил)-6-оксо-1,6-дигидропиридазин-4-илокси)пиперидин-1 Этап А. Получение трет-бутил 4-(1-(3,4-дихлорфенил)-6-оксо-3-2-(триметилсилил)этокси)карбониламино)-1,6-дигидропиридазин-4-илокси)пиперидин-1-карбоксилата. К перемешиваемому раствору 4-(1-(трет-бутоксикарбонил)пиперидин-4-илокси)-1-(3,4 дихлорфенил)-6-оксо-1,6-дигидропиридазин-3-карбоновой кислоты (из примера 15, этап А) (48 мг, 0,10 ммоль) в диоксане (10 мл) при комнатной температуре под аргоном добавляли дифенилфосфоразидат(65 мг, 0,20 ммоль) и TEA (51 мг, 0,50 ммоль). Полученную реакционную смесь перемешивали при комнатной температуре в течение 1 ч, затем добавляли 2-(триметилсилил)этанол (118 мг, 1,0 ммоль). Полученную реакционную смесь нагревали при 80 С под аргоном в течение ночи. Растворитель концентрировали. Неочищенную реакционную смесь использовали непосредственно на следующем этапе.(60 мг, 0,10 ммоль) в THF (10 мл) при комнатной температуре под аргоном добавляли 1 М TBAF в THF(1 мл, 1,0 ммоль). Реакционную смесь перемешивали при комнатной температуре в течение ночи. Растворитель удаляли в вакууме. Первичный продукт напрямую очищали препаративной ВЭЖХ (колонка К перемешиваемому раствору 1-(3,4-дихлорфенил)-4-(1-(5-йодпиримидин-2-ил)пиперидин-4 илокси)-6-оксо-1,6-дигидропиридазин-3-карбонитрила (пример 24) (49,3 мг, 0,087 ммоль) в DMF (2 мл) при комнатной температуре под аргоном добавляли йодид меди(I) (33 мг, 0,173 мкмоль) и метиловый эфир фторсульфонил(дифтор)уксусной кислоты (33,3 мг, 0,173 моль). Реакционную смесь нагревали при 100 С в течение ночи. Реакцию охлаждали до комнатной температуры. К реакционной смеси, которую отмывали рассолом (15 мл 3), добавляли EtOAc (10 мл). Органическую фазу высушивали (MgSO4),фильтровали и концентрировали. Неочищенный продукт растворяли в небольшом количестве DCM (2 мл) и загружали в 40 г колонку ISCO с силикагелем, которую элюировали в течение 20 мин с градиентом от 0 до 100% смеси EtOAc/гексаны. В результате было получено 43 мг (92%) 1-(3,4-дихлорфенил)-6 оксо-4-(1-(5-(трифторметил)пиримидин-2-ил)пиперидин-4-илокси)-1,6-дигидропиридазин-3 карбонитрила в виде коричневого твердого вещества. 1 Н NMR (400 МГц, CDCl3)ppm 1,86-2,00 (m, 2 Н), 2,01-2,13 (m, 2 Н), 3,71-3,94 (m, 2 Н), 3,95-4,19
МПК / Метки
МПК: A61P 3/06, A61P 31/00, C07D 401/14, A61P 3/00, A61P 25/02, C07D 401/12, A61K 31/4545, A61P 3/10, A61P 3/04, C07D 413/14, A61P 35/00, A61P 9/10, A61P 9/12, A61P 19/08, A61P 25/28
Метки: пиридона, модуляторы, gpr119, аналоги, пиридазона
Код ссылки
<a href="https://eas.patents.su/30-18268-analogi-piridona-i-piridazona-kak-modulyatory-gpr119.html" rel="bookmark" title="База патентов Евразийского Союза">Аналоги пиридона и пиридазона как модуляторы gpr119</a>
Предыдущий патент: Микроволновый плазменный двигатель
Следующий патент: Получение сжиженного природного газа
Случайный патент: Дисперсия агрохимиката












