Диаминопиридиновые, пиримидиновые и пиридазиновые модуляторы гистаминового рецептора h4
Номер патента: 18198
Опубликовано: 28.06.2013
Авторы: Куироз Джордж А., Чавез Франк, Данфорд Пол Дж., Медуна Стивен П., Вэй Дзяньмэй, Волин Рональд Л., Турмонд Робин Л., Гринспан Эндрю Дж., Тайс Кевин Л., Савалль Брэд М., Чжан Сяоху, Цай Хой
Формула / Реферат
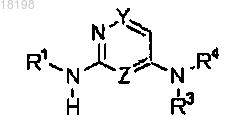
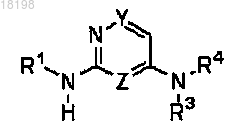
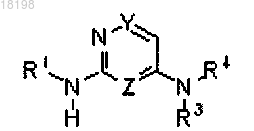
1. Соединение формулы (I)

где Z представляет собой CH или N;
Y представляет собой CH или N;
Z и Y определяются независимо друг от друга, и содержащее упомянутые Y и Z кольцо имеет не более двух атомов азота; при условии, что
i) когда Y представляет собой СН и Z представляет собой CH или N, то R1 представляет собой:
а) -(СН2)2OCH3, -(CH2)2SCH3 или C1-8алкил, каждый из которых независимо не замещен или замещен -OH или CF3;
б) -(СН2)0-2-Ar1, -CHR2-Ar1 или -(СН2)0-2-Ar2, причем каждый из упомянутых Ar1 и Ar2 независимо не замещен или замещен галогеном, -СН3 или -OCH3,
Ar1 представляет собой 6-членное ароматическое карбоциклическое кольцо,
Ar2 представляет собой 5- или 6-членное гетероароматическое кольцо, содержащее N, S или О; или
в) C3-12циклоалкил, -(СН2)-(моноциклический C3-8циклоалкил), -(CHR2)-(моноциклический C3-8циклоалкил), -(CH2)0-1-тетрагидрофуранил или -(СН2)0-1-тетрагидропиранил, причем каждый из упомянутых циклоалкильных фрагментов независимо не замещен или замещен одним, двумя или тремя C1-4алкильными заместителями; бицикло[2.2.1]гепт-2-илметил, (6,6-диметилбицикло[3.1.1]гепт-2-ил)метил;
R2 представляет собой -С1-4алкил;
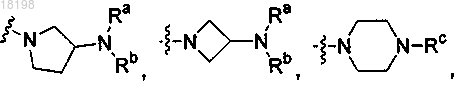
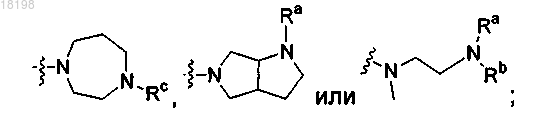
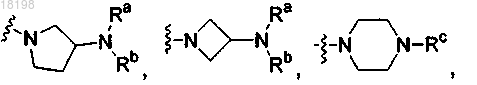
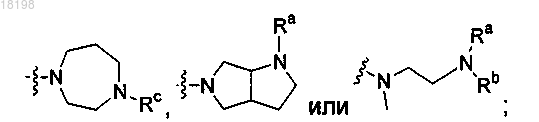
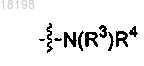 представляет собой
представляет собой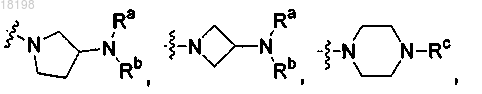
где Ra, Rb и Rc, каждый независимо, представляет собой H или C1-3алкил;
при условии, что
если R1 представляет собой изопропил, то Rc представляет собой метил;
если R1 представляет собой 4-метилфенил, то Rc представляет собой метил;
когда Z представляет собой N, Y представляет собой СН и R1 представляет собой бензил, незамещенный или замещенный галогеном, то Rc представляет собой метил;
ii) когда Y представляет собой N и Z представляет собой СН, то R1 представляет собой:
а) -(СН2)2OCH3, -(CH2)2SCH3 или C1-8алкил, каждый из которых независимо не замещен или замещен -OH или -CF3;
б) -(СН2)0-2-Ar1, -CHR2-Ar1, -(СН2)0-2-Ar2, причем каждый из упомянутых Ar1 и Ar2 независимо не замещен или замещен галогеном, -СН3, -OCH3,
Ar1 представляет собой 6-членное ароматическое карбоциклическое кольцо,
Ar2 представляет собой 5- или 6-членное гетероароматическое кольцо, содержащее N, S или О; или
в) C3-12циклоалкил, -(СН2)-(моноциклический C3-8циклоалкил), -(CHR2)-(моноциклический C3-8циклоалкил), -(СН2)0-1-тетрагидрофуранил и -(СН2)0-1-тетрагидропиранил, причем каждый из упомянутых фрагментов не замещен или замещен одним, двумя или тремя С1-4алкильными заместителями; бицикло[2.2.1]гепт-2-илметил, (6,6-диметилбицикло[3.1.1]гепт-2-ил)метил;
R2 представляет собой -С1-4алкил;

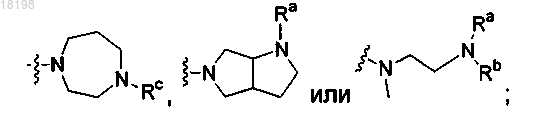
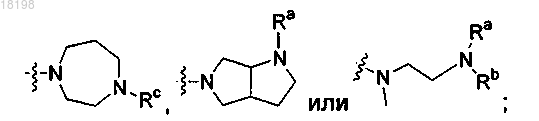
где Ra, Rb и Rc, каждый независимо, представляет собой Н или C1-3алкил;
или фармацевтически приемлемые соли соединений формулы (I).
2. Соединение по п.1, в котором Y представляет собой CH и Z представляет собой CH или N.
3. Соединение по п.1, в котором Y представляет собой N и Z представляет собой CH.
4. Соединение по п.2, в котором R1 выбирают из группы, включающей:
а) C1-8алкил, незамещенный или замещенный -OH или -CF3;
б) фенил, пиридил, бензил, пиридин-2-илметил, фенилэтил, 1-фенилэтил, каждый из которых независимо не замещен или замещен галогеном, -СН3, -OCH3; и
в) C3-12циклоалкил, -(СН2)-(моноциклический C3-8циклоалкил), -(CHR2)-(моноциклический C3-8циклоалкил), -(СН2)0-1-тетрагидрофуранил и -(СН2)0-1-тетрагидропиранил, каждый из которых независимо не замещен или замещен одним, двумя или тремя С1-4алкильными заместителями; бицикло[2.2.1]гепт-2-илметил, (6,6-диметилбицикло[3.1.1]гепт-2-ил)метил.
5. Соединение по п.2, в котором R1 выбирают из группы, включающей:
а) 2,2-диметилпропанол, 2,2-диметилпропан-1-ол, 2,2-диметилпропил, 2-метил-1-пропан-2-ол, 2-метилпропан-2-ол, 3-пропанол, (1-метилэтил), 2,2-диметилпропил, 2-метоксиэтил, 2-метипропил, 4,4,4-трифторбутил, пропил, бутил, трет-бутил, пропан-1-ол, 2-(метилсульфанил)этил;
б) 2-фенилэтил, фуран-3-илметил, пиридин-2-илметил, (1R)-1-фенилэтил, бензил, фенил, 4-фторбензил, 4-метоксибензил, 4-метилбензил; и
в) бицикло[2.2.1]гепт-2-илметил, тетрагидро-2Н-пиран-4-ил, тетрагидрофуран-2-илметил, (1R,2R,3R,5S)-2,6,6-триметилбицикло[3.1.1]гепт-3-ил, (1R,2S,4R)-1,7,7-триметилбицикло[2.2.1]гепт-2-ил, (1S,2S,3S,5R)-2,6,6-триметилбицикло[3.1.1]гепт-3-ил, (1S,2S,4R)-бицикло[2.2.1]гепт-2-ил, (1S,5R)-2,6,6-триметилбицикло[3.1.1]гепт-3-ил, (2R)-тетрагидрофуран-2-илметил, (2S)-бицикло[2.2.1]гепт-2-ил, (2S)-тетрагидрофуран-2-илметил, (3R)-тетрагидрофуран-3-ил, бицикло[2.2.1]гепт-2-ил, циклобутил, циклогексил, циклопентил, циклопропил, циклогексилметил, циклопентилметил, циклопропилметил, адамантан-1-ил, 2-адамантил, бицикло[2.2.1]гепт-2-ил и (6,6-диметилбицикло[3.1.1]гепт-2-ил)метил.
6. Соединение по п.2, в котором R1 выбирают из группы, состоящей из

7. Соединение по п.2, в котором
выбирают из группы, состоящей из
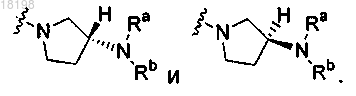
8. Соединение по п. 2, в котором

9. Соединение по п.2, в котором
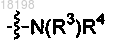 представляет собой
представляет собой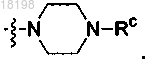
10. Соединение по п.2, в котором
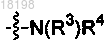 представляет собой
представляет собой
11. Соединение по п.2, в котором
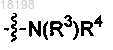 представляет собой
представляет собой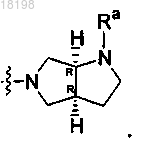
12. Соединение по п.2, в котором
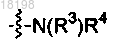 представляет собой
представляет собой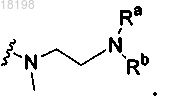
13. Соединение по п.2, в котором Ra представляет собой Н.
14. Соединение по п.2, в котором Rb представляет собой Н или метил.
15. Соединение по п.2, в котором Rc представляет собой Н или метил.
16. Соединение по п.2, в котором R2 представляет собой метил.
17. Соединение по п.2, в котором Z представляет собой CH.
18. Соединение по п.2, в котором Z представляет собой N.
19. Соединение по п.3, в котором R1 выбирают из группы, включающей:
а) C1-8алкил, незамещенный или замещенный -OH или -CF3;
б) фенил, пиридил, бензил, пиридин-2-илметил, фенилэтил, 1-фенилэтил, каждый из которых независимо не замещен или замещен галогеном, -СН3, -OCH3; и
в) C3-12циклоалкил, -(СН2)-(моноциклический C3-8циклоалкил), -(CHR2)-(моноциклический C3-8циклоалкил), -(СН2)0-1-тетрагидрофуранил и -(СН2)0-1-тетрагидропиранил, каждый из которых независимо не замещен или замещен одним, двумя или тремя С1-4алкильными заместителями; бицикло[2.2.1]гепт-2-илметил, (6,6-диметилбицикло[3.1.1]гепт-2-ил)метил.
20. Соединение по п.3, в котором R1 выбирают из группы, включающей:
а) 2,2-диметилпропанол, 2,2-диметилпропан-1-ол, 2,2-диметилпропил, 2-метил-1-пропан-2-ол, 2-метилпропан-2-ол, 3-пропанол, (1-метилэтил), 2,2-диметилпропил, 2-метоксиэтил, 2-метипропил, 4,4,4-трифторбутил, пропил, бутил, трет-бутил, пропан-1-ол, 2-(метилсульфанил)этил;
б) 2-фенилэтил, фуран-3-илметил, пиридин-2-илметил, (1R)-1-фенилэтил, бензил, фенил, 4-фторбензил, 4-метоксибензил, 4-метилбензил; и
в) бицикло[2.2.1]гепт-2-илметил, тетрагидро-2Н-пиран-4-ил, тетрагидрофуран-2-илметил, (1R,2R,3R,5S)-2,6,6-триметилбицикло[3.1.1]гепт-3-ил, (1R,2S,4R)-1,7,7-триметилбицикло[2.2.1]гепт-2-ил, (1S,2S,3S,5R)-2,6,6-триметилбицикло[3.1.1]гепт-3-ил, (1S,2S,4R)-бицикло[2.2.1]гепт-2-ил, (1S,5R)-2,6,6-триметилбицикло[3.1.1]гепт-3-ил, (2R)-тетрагидрофуран-2-илметил, (2S)-бицикло[2.2.1]гепт-2-ил, (2S)-тетрагидрофуран-2-илметил, (3R)-тетрагидрофуран-3-ил, бицикло[2.2.1]гепт-2-ил, циклобутил, циклогексил, циклопентил, циклопропил, циклогексилметил, циклопентилметил, циклопропилметил, адамантан-1-ил, 2-адамантил, бицикло[2.2.1]гепт-2-ил и (6,6-диметилбицикло[3.1.1]гепт-2-ил)метил.
21. Соединение по п.3, в котором R1 выбирают из группы, включающей

22. Соединение по п.3, в котором
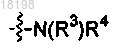
выбирают из группы, включающей
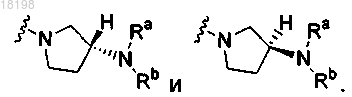
23. Соединение по п.3, в котором
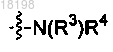 представляет собой
представляет собой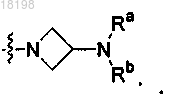
24. Соединение по п.3, в котором
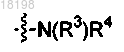 представляет собой
представляет собой
25. Соединение по п.3, в котором
 представляет собой
представляет собой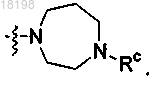
26. Соединение по п.3, в котором
 представляет собой
представляет собой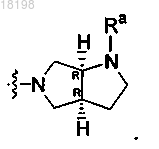
27. Соединение по п.3, в котором
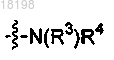 представляет собой
представляет собой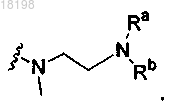
28. Соединение по п.3, в котором Ra представляет собой Н.
29. Соединение по п.3, в котором Rb представляет собой Н или метил.
30. Соединение по п.3, в котором Rc представляет собой Н или метил.
31. Соединение по п.3, в котором R2 представляет собой метил.
32. Соединение по п.3, в котором Z представляет собой CH.
33. Соединение, выбираемое из группы, включающей
бицикло[2.2.1]гепт-2-ил-[4-((3R)-3-метиламинопирролидин-1-ил)пиридин-2-ил]амина дигидрохлорид;
N-циклопентил-4-[(3R)-3-(метиламино)пирролидин-1-ил]пиридин-2-амин;
4-[(3R)-3-(метиламино)пирролидин-1-ил]-N-пропилпиридин-2-амина дигидрохлорид;
N-(циклопропилметил)-4-[(3R)-3-(метиламино)пирролидин-1-ил]пиридин-2-амина дитрифторацетат;
4-[(3R)-3-(метиламино)пирролидин-1-ил]-N-[(3R)-тетрагидрофуран-3-ил]пиридин-2-амина дигидрохлорид;
4-[(3R)-3-(метиламино)пирролидин-1-ил]-N-[тетрагидрофуран-2-илметил]пиридин-2-амина дигидрохлорид;
N-(4-фторбензил)-4-[(3R)-3-(метиламино)пирролидин-1-ил]пиридин-2-амина дигидрохлорид;
N-циклопропил-4-[(3R)-3-(метиламино)пирролидин-1-ил]пиридин-2-амина дигидрохлорид;
4-[(3R)-3-(метиламино)пирролидин-1-ил]-N-[(1S,2S,3S,5R)-2,6,6-триметилбицикло[3.1.1]гепт-3-ил]пиридин-2-амин;
4-[(3R)-3-(метиламино)пирролидин-1-ил]-N-[(1R,2R,3R,5S)-2,6,6-триметилбицикло[3.1.1]гепт-3-ил]пиридин-2-амин;
N-бензил-4-[(3R)-3-(метиламино)пирролидин-1-ил]пиридин-2-амин;
4-[(3R)-3-(метиламино)пирролидин-1-ил]-N-(1-метилэтил)пиридин-2-амин;
4-[(3R)-3-аминопирролидин-1-ил]-N-(1-метилэтил)пиридин-2-амин;
4-[(3S)-3-аминопирролидин-1-ил]-N-(2-метилпропил)пиридин-2-амин;
4-[(3S)-3-(метиламино)пирролидин-1-ил]-N-(2-метилпропил)пиридин-2-амин;
N-циклопентил-4-пиперазин-1-илпиридин-2-амин;
4-пиперазин-1-ил-N-пропилпиридин-2-амина дигидрохлорид;
N-бензил-4-пиперазин-1-илпиридин-2-амин;
N-(2-метилпропил)-4-пиперазин-1-илпиридин-2-амин;
4-[(3R)-3-аминопирролидин-1-ил]-N-(2-метилпропил)пиридин-2-амин;
4-(4-метилпиперазин-1-ил)-N-(2-метилпропил)пиридин-2-амин;
4-[(3R)-3-(метиламино)пирролидин-1-ил]-N-(2-метилпропил)пиридин-2-амин;
4-[(3R)-3-(метиламино)пирролидин-1-ил]-1H-фенилпиридин-2-амин;
4-[3-(метиламино)азетидин-1-ил]-N-(2-метилпропил)пиридин-2-амин;
N-(циклопропилметил)-4-пиперазин-1-илпиридин-2-амин;
N-бутил-4-пиперазин-1-илпиридин-2-амин;
N-(2-метоксиэтил)-4-пиперазин-1-илпиридин-2-амин;
N-фенил-4-пиперазин-1-илпиридин-2-амин;
4-пиперазин-1-ил-N-(тетрагидрофуран-2-илметил)пиридин-2-амин;
N-(4-фторбензил)-4-пиперазин-1-илпиридин-2-амин;
N-(2,2-диметилпропил)-4-[(3R)-3-(метиламино)пирролидин-1-ил]пиридин-2-амин;
N-(2-метоксиэтил)-4-[(3R)-3-(метиламино)пирролидин-1-ил]пиридин-2-амин;
4-[(3S)-3-(метиламино)пирролидин-1-ил]-N-[(1R,2S,4R)-1,7,7-триметилбицикло[2.2.1]гепт-2-ил]пиридин-2-амин;
адамантан-2-ил-[4-(4-метилпиперазин-1-ил)пиридин-2-ил]амин;
адамантан-2-ил-[4-(3R)-(3-метиламинопирролидин-1-ил)пиридин-2-ил]амин;
N-[(1R)-1-циклогексилэтил]-4-[(3R)-3-(метиламино)пирролидин-1-ил]пиридин-2-амин;
адамантан-1-ил- [4-(3S)-(3-метиламинопирролидин-1-ил)пиридин-2-ил]амин;
N-(циклогексилметил)-4-[(3R)-3-(метиламино)пирролидин-1-ил]пиридин-2-амин;
N-(циклогексилметил)-4-(4-метилпиперазин-1-ил)пиридин-2-амин;
N-[(1R)-1-циклогексилэтил]-4-[(3S)-3-(метиламино)пирролидин-1-ил]пиридин-2-амин;
N-[(1R)-1-циклогексилэтил]-4-(4-метилпиперазин-1-ил)пиридин-2-амин;
адамантан-2-ил-[4-(3S)-(3-метиламинопирролидин-1-ил)пиридин-2-ил]амин;
3-{[4-(4-метилпиперазин-1-ил)пиридин-2-ил]амино}пропан-1-ол;
N-{[(1S,2S,5S)-6,6-диметилбицикло[3.1.1]гепт-2-ил]метил}-4-[(3R)-3-(метиламино)пирролидин-1-ил]пиридин-2-амин;
адамантан-1-ил-[4-(3R)-(3-метиламинопирролидин-1-ил)пиридин-2-ил]амин;
адамантан-1-ил-[4-(4-метилпиперазин-1-ил)пиридин-2-ил]амин;
адамантан-1-илметил-[4-(3R)-(3-метиламинопирролидин-1-ил)пиридин-2-ил]амин;
N-{[(1S,2S,5S)-6,6-диметилбицикло[3.1.1]гепт-2-ил]метил}-4-(4-метилпиперазин-1-ил)пиридин-2-амин;
4-[(3R)-3-(метиламино)пирролидин-1-ил]-N-(тетрагидро-2Н-пиран-4-ил)пиридин-2-амин;
4-(4-метилпиперазин-1-ил)-N-(тетрагидро-2Н-пиран-4-ил)пиридин-2-амин;
N-{[(1S,2S,5S)-6,6-диметилбицикло[3.1.1]гепт-2-ил]метил}-4-[(3S)-3-(метиламино)пирролидин-1-ил]пиридин-2-амин;
N-(циклогексилметил)-4-[(3S)-3-(метиламино)пирролидин-1-ил]пиридин-2-амин;
N-(циклопентилметил)-4-[(3R)-3-(метиламино)пирролидин-1-ил]пиридин-2-амин;
N-(циклопентилметил)-4-[(3S)-3-(метиламино)пирролидин-1-ил]пиридин-2-амин;
N-циклопентил-4-[(3S)-3-(метиламино)пирролидин-1-ил]пиридин-2-амин;
4-[(3S)-3-(метиламино)пирролидин-1-ил]-N-(пиридин-2-илметил)пиридин-2-амин;
4-[(3S)-3-(метиламино)пирролидин-1-ил]-N-[(1S,5R)-2,6,6-триметилбицикло[3.1.1]гепт-3-ил]пиридин-2-амин;
N-бицикло[2.2.1]гепт-2-ил-4-[(3S)-3-(метиламино)пирролидин-1-ил]пиридин-2-амин;
4-(4-метилпиперазин-1-ил)-N-[(1S,5R)-2,6,6-триметилбицикло[3.1.1]гепт-3-ил]пиридин-2-амин;
N-трет-бутил-4-[(3S)-3-(метиламино)пирролидин-1-ил]пиридин-2-амин;
3-({4-[(3S)-3-(метиламино)пирролидин-1-ил]пиридин-2-ил}амино)пропан-1-ол;
N-циклопропил-4-[(3S)-3-(метиламино)пирролидин-1-ил]пиридин-2-амин;
N-(циклопентилметил)-4-(4-метилпиперазин-1-ил)пиридин-2-амин;
N-бензил-4-[(3S)-3-(метиламино)пирролидин-1-ил]пиридин-2-амин;
N-(2-метоксиэтил)-4-[(3S)-3-(метиламино)пирролидин-1-ил]пиридин-2-амин;
N-(2-метоксиэтил)-4-(4-метилпиперазин-1-ил)пиридин-2-амин;
2-метил-1-({4-[(3R)-3-(метиламино)пирролидин-1-ил]пиридин-2-ил}амино)пропан-2-ол;
2-метил-1-{[4-(4-метилпиперазин-1-ил)пиридин-2-ил]амино}пропан-2-ол;
2-метил-1-({4-[(3S)-3-(метиламино)пирролидин-1-ил]пиридин-2-ил}амино)пропан-2-ол;
N-бутил-4-[(3S)-3-(метиламино)пирролидин-1-ил]пиридин-2-амин;
4-(4-метилпиперазин-1-ил)-N-(пиридин-2-илметил)пиридин-2-амин;
4-[(3S)-3-(метиламино)пирролидин-1-ил]-N-(2-фенилэтил)пиридин-2-амин;
N-(4-фторбензил)-4-[(3S)-3-(метиламино)пирролидин-1-ил]пиридин-2-амин;
4-[(3R)-3-(метиламино)пирролидин-1-ил]-N-[(1R,2S,4R)-1,7,7-триметилбицикло[2.2.1]гепт-2-ил]пиридин-2-амин;
N-циклопентил-4-(4-метилпиперазин-1-ил)пиридин-2-амин;
N-(4-фторбензил)-4-(4-метилпиперазин-1-ил)пиридин-2-амин;
4-(4-метилпиперазин-1-ил)-N-(2-фенилэтил)пиридин-2-амин;
адамантан-1-илметил-[4-(3S)-(3-метиламинопирролидин-1-ил)пиридин-2-ил]амин;
4-(4-метилпиперазин-1-ил)-N-[(1R,2S,4R)-1,7,7-триметилбицикло[2.2.1]гепт-2-ил]пиридин-2-амин;
N-(бицикло[2.2.1]гепт-2-илметил)-4-[(3R)-3-(метиламино)пирролидин-1-ил]пиридин-2-амин;
4-[(3R)-3-аминопирролидин-1-ил]-N-бутилпиридин-2-амин;
адамантан-1-илметил-[4-(4-метилпиперазин-1-ил)пиридин-2-ил]амин;
N-(циклогексилметил)-4-[(3aR,6aR)-гексагидропирроло[3,4-b]пиррол-5(1H)-ил]пиридин-2-амин;
4-[(3aR,6aR)-гексагидропирроло[3,4-b]пиррол-5(1H)-ил]-N-(2-метилпропил)пиридин-2-амин;
4-[(3S)-3-аминопирролидин-1-ил]-N-(пиридин-2-илметил)пиридин-2-амин;
N-циклопентил-4-[3-(метиламино)азетидин-1-ил]пиридин-2-амин;
4-пиперазин-1-ил-N-(пиридин-2-илметил)пиридин-2-амин;
N-(циклопентилметил)-4-[(3aR,6aR)-гексагидропирроло[3,4-b]пиррол-5(1H)-ил]пиридин-2-амин;
N-циклопентил-4-[(3aR,6aR)-гексагидропирроло[3,4-b]пиррол-5(1H)-ил]пиридин-2-амин;
4-[(3S)-3-аминопирролидин-1-ил]-N-(4-фторбензил)пиридин-2-амин;
4-[(3S)-3-аминопирролидин-1-ил]-N-(2-метоксиэтил)пиридин-2-амин;
N-бицикло[2.2.1]гепт-2-ил-4-(1,4-диазепан-1-ил)пиридин-2-амин;
адамантан-2-ил-[4-(3aR,6aR)-(гексагидропирроло[3,4-b]пиррол-5-ил)пиридин-2-ил]амин;
4-[(3S)-3-аминопирролидин-1-ил]-N-бензилпиридин-2-амин;
4-[(3S)-3-аминопирролидин-1-ил]-N-циклопентилпиридин-2-амин;
4-пиперазин-1-ил-N-[(1S,5R)-2,6,6-триметилбицикло[3.1.1]гепт-3-ил]пиридин-2-амин;
4-[(3R)-3-аминопирролидин-1-ил]-N-бицикло[2.2.1]гепт-2-илпиридин-2-амин;
N-[(1R)-1-циклогексилэтил]-4-[(3aR,6aR)-гексагидропирроло[3,4-b]пиррол-5(1H)-ил]пиридин-2-амин;
4-[(3S)-3-аминопирролидин-1-ил]-N-[(1S,5R)-2,6,6-триметилбицикло[3.1.1]гепт-3-ил]пиридин-2-амин;
1-({4-[(3S)-3-аминопирролидин-1-ил]пиридин-2-ил}амино)-2-метилпропан-2-ол;
4-[(3R)-3-аминопирролидин-1-ил]-N-циклогексилпиридин-2-амин;
N-(циклопентилметил)-4-[3-(метиламино)азетидин-1-ил]пиридин-2-амин;
4-[(3S)-3-аминопирролидин-1-ил]-N-(2-фенилэтил)пиридин-2-амин;
4-[(3aR,6aR)-гексагидропирроло[3,4-b]пиррол-5(1H)-ил]-N-(тетрагидро-2Н-пиран-4-ил)пиридин-2-амин;
4-[(3R)-3-аминопирролидин-1-ил]-N-(циклопентилметил)пиридин-2-амин;
1-({4-[(3R)-3-аминопирролидин-1-ил]пиридин-2-ил}амино)-2-метилпропан-2-ол;
N-трет-бутил-4-[3-(метиламино)азетидин-1-ил]пиридин-2-амин;
N-циклопропил-4-[3-(метиламино)азетидин-1-ил]пиридин-2-амин;
2-метил-1-({4-[3-(метиламино)азетидин-1-ил]пиридин-2-ил}амино)пропан-2-ол;
3-({4-[3-(метиламино)азетидин-1-ил]пиридин-2-ил}амино)пропан-1-ол;
4-[3-(метиламино)азетидин-1-ил]-N-[(1S,5R)-2,6,6-триметилбицикло[3.1.1]гепт-3-ил]пиридин-2-амин;
N-бензил-4-[3-(метиламино) азетидин-1-ил]пиридин-2-амин;
N-(2-метоксиэтил)-4-[3-(метиламино)азетидин-1-ил]пиридин-2-амин;
4-[(3aR,6aR)-гексагидропирроло[3,4-b]пиррол-5(1H)-ил]-N-[(1S,5R)-2,6,6-триметилбицикло[3.1.1]гепт-3-ил]пиридин-2-амин;
N-трет-бутил-4-[(3aR,6aR)-гексагидропирроло[3,4-b]пиррол-5(1H)-ил]пиридин-2-амин;
4-[(3R)-3-аминопирролидин-1-ил]-N-(2-метоксиэтил)пиридин-2-амин;
2-метил-1-[(4-пиперазин-1-илпиридин-2-ил)амино]пропан-2-ол;
N-{[(1S,2S,5S)-6,6-диметилбицикло[3.1.1]гепт-2-ил]метил}-4-[(3aR,6aR)-гексагидропирроло[3,4-b]пиррол-5(1H)-ил]пиридин-2-амин;
4-[(3R)-3-аминопирролидин-1-ил]-N-циклопентилпиридин-2-амин;
N-(2,2-диметилпропил)-4-[(3aR,6aR)-гексагидропирроло[3,4-b]пиррол-5(1H)-ил]пиридин-2-амин;
4-[3-(метиламино)азетидин-1-ил]-N-(2-фенилэтил)пиридин-2-амин;
N-(4-фторбензил)-4-[3-(метиламино)азетидин-1-ил]пиридин-2-амин;
адамантан-1-ил-[4-(3aR,6aR)-(гексагидропирроло[3,4-b]пиррол-5-ил)пиридин-2-ил]амин;
4-[3-(метиламино)азетидин-1-ил]-N-(пиридин-2-илметил)пиридин-2-амин;
N-(циклопентилметил)-4-пиперазин-1-илпиридин-2-амин;
4-[(3R)-3-аминопирролидин-1-ил]-N-(2-метилпропил)пиримидин-2-амин;
4-[(3R)-3-аминопирролидин-1-ил]-N-(циклопропилметил)пиримидин-2-амин;
4-[(3R)-3-аминопирролидин-1-ил]-N-циклопентилпиримидин-2-амин;
4-[(3R)-3-аминопирролидин-1-ил]-N-(2,2-диметилпропил)пиримидин-2-амин;
1-({4-[(3R)-3-аминопирролидин-1-ил]пиримидин-2-ил}амино)-2-метилпропан-2-ол;
4-[(3R)-3-аминопирролидин-1-ил]-1H-циклобутилпиримидин-2-амин;
4-[(3R)-3-аминопирролидин-1-ил]-N-[(3R)-тетрагидрофуран-3-ил]пиримидин-2-амин;
4-[(3R)-3-аминопирролидин-1-ил]-N-(тетрагидро-2Н-пиран-4-ил)пиримидин-2-амин;
изобутил-[4-(4-метилпиперазин-1-ил)пиримидин-2-ил]амин;
4-[(3R)-3-(метиламино)пирролидин-1-ил]-N-(2-метилпропил)пиримидин-2-амин;
4-[(3R)-3-аминопирролидин-1-ил]-N-[бицикло[2.2.1]гепт-2-ил]пиримидин-2-амин;
N-[бицикло[2.2.1]гепт-2-ил]-4-(4-метилпиперазин-1-ил)пиримидин-2-амин;
N-(циклопропилметил)-4-(4-метилпиперазин-1-ил)пиримидин-2-амин;
4-[(3R)-3-аминопирролидин-1-ил]-N-бутилпиримидин-2-амин;
N-бутил-4-(4-метилпиперазин-1-ил)пиримидин-2-амин;
N-циклопентил-4-(4-метилпиперазин-1-ил)пиримидин-2-амин;
N-(2,2-диметилпропил)-4-(4-метилпиперазин-1-ил)пиримидин-2-амин;
4-(4-метилпиперазин-1-ил)-N-(тетрагидрофуран-2-илметил)пиримидин-2-амин;
4-[(3R)-3-аминопирролидин-1-ил]-N-(тетрагидрофуран-2-илметил)пиримидин-2-амин;
4-[(3R)-3-аминопирролидин-1-ил]-N-(1-метилэтил)пиримидин-2 -амин;
N-(1-метилэтил)-4-(4-метилпиперазин-1-ил)пиримидин-2-амин;
N-циклобутил-4-(4-метилпиперазин-1-ил)пиримидин-2-амин;
4-[(3R)-3-аминопирролидин-1-ил]-N-циклопропилпиримидин-2-амин;
N-циклопропил-4-(4-метилпиперазин-1-ил)пиримидин-2-амин;
4-[(3R)-3-аминопирролидин-1-ил]-N-(4-фторбензил)пиримидин-2 -амин;
N-(4-фторбензил)-4-(4-метилпиперазин-1-ил)пиримидин-2-амин;
4-[(3R)-3-аминопирролидин-1-ил]-N-(2-метоксиэтил)пиримидин-2-амин;
N-(2-метоксиэтил)-4-(4-метилпиперазин-1-ил)пиримидин-2-амин;
4-[(3R)-3-аминопирролидин-1-ил]-N-(пиридин-2-илметил)пиримидин-2-амин;
4-(4-метилпиперазин-1-ил)-N-(пиридин-2-илметил)пиримидин-2-амин;
циклопентил-(4-пиперазин-1-илпиримидин-2-ил)амин;
(2,2-диметилпропил)-(4-пиперазин-1-илпиримидин-2-ил)амин;
изобутил-(4-пиперазин-1-илпиримидин-2-ил)амин;
циклопропилметил-(4-пиперазин-1-илпиримидин-2-ил)амин;
изопропил-(4-пиперазин-1-илпиримидин-2-ил)амин;
бутил-(4-пиперазин-1-илпиримидин-2-ил)амин;
(R)-(4-пиперазин-1-илпиримидин-2-ил)-(тетрагидрофуран-2-илметил)амин;
бицикло[2.2.1]гепт-2-ил-(4-пиперазин-1-илпиримидин-2-ил)амин;
(4-пиперазин-1-илпиримидин-2-ил)-(2,6,6-триметилбицикло[3.1.1]гепт-3-ил)амин;
N-(2-метоксиэтил)-4-пиперазин-1-илпиримидин-2-амин;
бутил-[4-(3R)-(3-метиламинопирролидин-1-ил)пиримидин-2-ил]амин;
бицикло[2.2.1]гепт-2-ил-[4-(3R)-(3-метиламинопирролидин-1-ил)пиримидин-2-ил]амин;
циклопентил-[4-(3R)-(3-метиламинопирролидин-1-ил)пиримидин-2-ил]амин;
(2,2-диметилпропил)-[4-(3R)-(3-метиламинопирролидин-1-ил)пиримидин-2-ил]амин;
циклопропилметил-[4-(3R)-(3-метиламинопирролидин-1-ил)пиримидин-2-ил]амин;
изопропил-[4-(3R)-(3-метиламинопирролидин-1-ил)пиримидин-2-ил]амин;
(4-фторбензил)-[4-(3R)-(3-метиламинопирролидин-1-ил)пиримидин-2-ил]амин;
циклопропил-[4-(3R)-(3-метиламинопирролидин-1-ил)пиримидин-2-ил]амин;
[4-(3R)-(3-метиламинопирролидин-1-ил)пиримидин-2-ил]-(тетрагидрофуран-2-илметил)амин;
(2-метоксиэтил)-[4-(3R)-(3-метиламинопирролидин-1-ил)пиримидин-2-ил]амин;
[4-(3R)-(3-метиламинопирролидин-1-ил)пиримидин-2-ил]пиридин-2-илметиламин;
[4-(3-аминоазетидин-1-ил)пиримидин-2-ил]бутиламин;
4-(3-аминоазетидин-1-ил)-N-циклопентилпиримидин-2-амин;
4-(3-аминоазетидин-1-ил)-N-(циклопропилметил)пиримидин-2-амин;
4-(3-аминоазетидин-1-ил)-N-бицикло[2.2.1]гепт-2-илпиримидин-2-амин;
4-(3-аминоазетидин-1-ил)-N-(2,2-диметилпропил)пиримидин-2-амин;
4-(3-аминоазетидин-1-ил)-N-(2-метилпропил)пиримидин-2-амин;
4-(3-аминоазетидин-1-ил)-N-(1-метилэтил)пиримидин-2-амин;
4-(3-аминоазетидин-1-ил)-N-циклопропилпиримидин-2-амин;
4-(3-аминоазетидин-1-ил)-N-(4-фторбензил)пиримидин-2-амин;
4-(3-аминоазетидин-1-ил)-N-[(3R)-тетрагидрофуран-3-ил]пиримидин-2-амин;
4-(3-аминоазетидин-1-ил)-N-[(2R)-тетрагидрофуран-2-илметил]пиримидин-2-амин;
N-(циклогексилметил)-4-[3-(метиламино)азетидин-1-ил]пиримидин-2-амин;
4-[(3R)-3-аминопирролидин-1-ил]-N-[(1R)-1-циклогексилэтил]пиримидин-2-амин;
N-{[(1S,2S,5S)-6,6-диметилбицикло[3.1.1]гепт-2-ил]метил}-4-[(3aR,6aR)-гексагидропирроло[3,4-b]пиррол-5(1H)-ил]пиримидин-2-амин;
N-[(6,6-диметилбицикло[3.1.1]гепт-2-ил)метил]-4-[3-(метиламино)азетидин-1-ил]пиримидин-2-амин;
4-[(3R)-3-аминопирролидин-1-ил]-N-[(6,6-диметилбицикло[3.1.1]гепт-2-ил)метил]пиримидин-2-амин;
N-(циклогексилметил)-4-[(3aR,6aR)-гексагидропирроло[3,4-b]пиррол-5(1H)-ил]пиримидин-2-амин;
4-[3-(метиламино)азетидин-1-ил]-N-(тетрагидро-2Н-пиран-4-ил)пиримидин-2-амин;
4-[(3S)-3-аминопирролидин-1-ил]-N-(циклопропилметил)пиримидин-2-амин;
1-({4-[(3S)-3-аминопирролидин-1-ил]пиримидин-2-ил}амино)-2-метилпропан-2-ол;
4-[(3S)-3-аминопирролидин-1-ил]-N-(2,2-диметилпропил)пиримидин-2-амин;
N-циклопропил-4-пиперазин-1-илпиримидин-2-амин;
N-[(1R)-1-циклогексилэтил]-4-[3-(метиламино)азетидин-1-ил]пиримидин-2-амин;
2-метил-1-({4-[(3R)-3-(метиламино)пирролидин-1-ил]пиримидин-2-ил}амино)пропан-2-ол;
N-[(1R)-1-циклогексилэтил]-4-[(3aR,6aR)-гексагидропирроло[3,4-b]пиррол-5(1H)-ил]пиримидин-2-амин;
4-[(3R)-3-аминопирролидин-1-ил]-N-[(1S,2S,3S,5R)-2,6,6-триметилбицикло[3.1.1]гепт-3-ил]пиримидин-2-амин;
4-[(3R)-3-аминопирролидин-1-ил]-N-(2-фенилэтил)пиримидин-2-амин;
4-[(3S)-3-аминопирролидин-1-ил]-N-(пиридин-2-илметил)пиримидин-2-амин;
N-(циклопентилметил)-4-(4-метилпиперазин-1-ил)пиримидин-2-амин;
2-метил-1-{[4-(4-метилпиперазин-1-ил)пиримидин-2-ил]амино}пропан-2-ол;
N-(циклопентилметил)-4-[(3R)-3-(метиламино)пирролидин-1-ил]пиримидин-2-амин;
2-метил-1-({4-[3-(метиламино)азетидин-1-ил]пиримидин-2-ил}амино)пропан-2-ол;
4-[(3R)-3-аминопирролидин-1-ил]-N-(циклопентилметил)пиримидин-2-амин;
N-[2-(метилсульфанил)этил]-4-пиперазин-1-илпиримидин-2-амин;
4-[(3aR,6aR)-гексагидропирроло[3,4-b]пиррол-5(1H)-ил]-N-[(1R,2S,4R)-1,7,7-триметилбицикло[2.2.1]гепт-2-ил]пиримидин-2-амин;
4-[3-(метиламино)азетидин-1-ил]-N-[(1R,2S,4R)-1,7,7-триметилбицикло[2.2.1]гепт-2-ил]пиримидин-2-амин;
4-[(3R)-3-аминопирролидин-1-ил]-N-[(1R,2S,4R)-1,7,7-триметилбицикло[2.2.1]гепт-2-ил]пиримидин-2-амин;
4-[(3S)-3-аминопирролидин-1-ил]-N-(2-метоксиэтил)пиримидин-2-амин;
4-[(3S)-3-аминопирролидин-1-ил]-N-циклогексилпиримидин-2-амин;
3-({4-[(3S)-3-аминопирролидин-1-ил]пиримидин-2-ил}амино)-2,2-диметилпропан-1-ол;
N-бензил-4-пиперазин-1-илпиримидин-2-амин;
N-(2-фенилэтил)-4-пиперазин-1-илпиримидин-2-амин;
N-бицикло[2.2.1]гепт-2-ил-4-пиперазин-1-илпиримидин-2-амин;
4-пиперазин-1-ил-N-[(1S, 2S,3S,5R)-2,6,6-триметилбицикло[3.1.1]гепт-3-ил]пиримидин-2-амин;
3-({4-[3-(метиламино)азетидин-1-ил]пиримидин-2-ил}амино)пропан-1-ол;
2,2-диметил-3-({4-[3-(метиламино)азетидин-1-ил]пиримидин-2-ил}амино)пропан-1-ол;
3-[(4-пиперазин-1-илпиримидин-2-ил)амино]пропан-1-ол;
4-[(3aR,6aR)-гексагидропирроло[3,4-b]пиррол-5(1H)-ил]-N-(2-метилпропил)пиримидин-2-амин;
N-циклопентил-4-[(3aR,6aR)-гексагидропирроло[3,4-b]пиррол-5(1H)-ил]пиримидин-2-амин;
4-[(3aR,6aR)-гексагидропирроло[3,4-b]пиррол-5(1H)-ил]-N-(2-метоксиэтил)пиримидин-2-амин;
4-[(3aR,6aR)-гексагидропирроло[3,4-b]пиррол-5(1H)-ил]-N-[(1R)-1-фенилэтил]пиримидин-2-амин;
N-(4-фторбензил)-4-[(3aR,6aR)-гексагидропирроло[3,4-b]пиррол-5(1H)-ил]пиримидин-2-амин;
N-циклопропил-4-[(3aR,6aR)-гексагидропирроло[3,4-b] пиррол-5(1H)-ил]пиримидин-2-амин;
N-(4-метоксибензил)-4-пиперазин-1-илпиримидин-2-амин;
N-циклопропил-4-[(3S)-3-(метиламино)пирролидин-1-ил]пиримидин-2-амин;
4-[(3S)-3-аминопирролидин-1-ил]-N-бицикло[2.2.1]гепт-2-илпиримидин-2-амин;
N-бицикло[2.2.1]гепт-2-ил-4-[3-(метиламино)азетидин-1-ил]пиримидин-2-амин;
3-({4-[(3aR,6aR)-гексагидропирроло[3,4-b]пиррол-5(1H)-ил]пиримидин-2-ил}амино)-2,2-диметилпропан-1-ол;
4-[(3S)-3-аминопирролидин-1-ил]-N-(циклопентилметил)пиримидин-2-амин;
4-[(3R)-3-аминопирролидин-1-ил]-N-(4,4,4-трифторбутил)пиримидин-2-амин;
3-{[4-(3-аминоазетидин-1-ил)пиримидин-2-ил]амино}-2,2-диметилпропан-1-ол;
3-({4-[(3S)-3-(метиламино)пирролидин-1-ил]пиримидин-2-ил}амино)пропан-1-ол;
3-({4-[(3R)-3-аминопирролидин-1-ил]пиримидин-2-ил}амино)-2,2-диметилпропан-1-ол;
3-({4-[(3R)-3-аминопирролидин-1-ил]пиримидин-2-ил}амино)пропан-1-ол;
3-{[4-(3-аминоазетидин-1-ил)пиримидин-2-ил]амино}пропан-1-ол;
N-(4-метилбензил)-4-пиперазин-1-илпиримидин-2-амин;
4-пиперазин-1-ил-N-(пиридин-2-илметил)пиримидин-2-амин;
2,2-диметил-3-({4-[(3S)-3-(метиламино)пирролидин-1-ил]пиримидин-2-ил}амино)пропан-1-ол;
3-({4-[(3aR,6aR)-гексагидропирроло[3,4-b]пиррол-5(1H)-ил]пиримидин-2-ил}амино)пропан-1-ол;
4-[(3S)-3-аминопирролидин-1-ил]-N-циклопентилпиримидин-2-амин;
3-{[4-(4-метилпиперазин-1-ил)пиримидин-2-ил]амино}пропан-1-ол;
N-бицикло[2.2.1]гепт-2-ил-4-[(3S)-3-(метиламино)пирролидин-1-ил]пиримидин-2-амин;
N-(4-метилбензил)-4-(4-метилпиперазин-1-ил)пиримидин-2-амин;
4-(4-метилпиперазин-1-ил)-N-[2-(метилсульфанил)этил]пиримидин-2-амин;
N-бензил-4-(4-метилпиперазин-1-ил)пиримидин-2-амин;
2,2-диметил-3-[(4-пиперазин-1-илпиримидин-2-ил)амино]пропан-1-ол;
3-({4-[(3R)-3-(метиламино)пирролидин-1-ил]пиримидин-2-ил}амино)пропан-1-ол;
4-(4-метилпиперазин-1-ил)-N-[(1S,2S,3S,5R)-2,6,6-триметилбицикло[3.1.1]гепт-3-ил]пиримидин-2-амин;
2,2-диметил-3-({4-[(3R)-3-(метиламино)пирролидин-1-ил]пиримидин-2-ил}амино)пропан-1-ол;
4-[(3R)-3-(метиламино)пирролидин-1-ил]-N-(4-метилбензил)пиримидин-2-амин;
4-[3-(метиламино)азетидин-1-ил]-N-(2-метилпропил)пиримидин-2-амин;
N-циклопентил-4-[3-(метиламино)азетидин-1-ил]пиримидин-2-амин;
4-(4-метилпиперазин-1-ил)-N-(2-фенилэтил)пиримидин-2-амин;
N-бензил-4-[(3R)-3-(метиламино)пирролидин-1-ил]пиримидин-2-амин;
4-[(3R)-3-аминопирролидин-1-ил]-N-[(1R)-1-фенилэтил]пиримидин-2-амин;
N-(4-метоксибензил)-4-[(3R)-3-(метиламино)пирролидин-1-ил]пиримидин-2-амин;
2-метил-1-[(4-пиперазин-1-илпиримидин-2-ил)амино]пропан-2-ол;
N-(4-фторбензил)-4-[3-(метиламино)азетидин-1-ил]пиримидин-2-амин;
4-[(3R)-3-аминопирролидин-1-ил]-N-бензилпиримидин-2-амин;
4-[(3R)-3-(метиламино)пирролидин-1-ил]-N-[(1R)-1-фенилэтил]пиримидин-2-амин;
4-[(3R)-3-аминопирролидин-1-ил]-N-циклогексилпиримидин-2-амин;
N-(2-метоксиэтил)-4-[3-(метиламино)азетидин-1-ил]пиримидин-2-амин;
4-[(3R)-3-(метиламино)пирролидин-1-ил]-N-(2-фенилэтил)пиримидин-2-амин;
4-[(3R)-3-(метиламино)пирролидин-1-ил]-N-[(1S,2S,3S,5R)-2,6,6-триметилбицикло[3.1.1]гепт-3-ил]пиримидин-2-амин;
4-[(3R)-3-аминопирролидин-1-ил]-N-(4-метоксибензил)пиримидин-2-амин;
4-[(3R)-3-аминопирролидин-1-ил]-N-(4-метилбензил)пиримидин-2-амин;
N-(циклопентилметил)-4-пиперазин-1-илпиримидин-2-амин;
4-[3-(метиламино)азетидин-1-ил]-N-(пиридин-2-илметил)пиримидин-2-амин;
4-[(3R)-3-(метиламино)пирролидин-1-ил]-N-[(3S,5S,7S)-трицикло[3.3.1.1.3.7]дец-1-илметил]пиримидин-2-амин;
4-[(3R)-3-(метиламино)пирролидин-1-ил]-N-[(1R,2S,4R)-1,7,7-триметилбицикло[2.2.1]гепт-2-ил]пиримидин-2-амин;
N-(циклогексилметил)-4-[(3R)-3-(метиламино)пирролидин-1-ил]пиримидин-2-амин;
N-циклогексил-4-[(3R)-3-(метиламино)пирролидин-1-ил]пиримидин-2-амин;
N-{[(1S,2S,5S)-6,6-диметилбицикло[3.1.1]гепт-2-ил]метил}-4-[(3R)-3-(метиламино)пирролидин-1-ил]пиримидин-2-амин;
4-(1,4-диазепан-1-ил)-N-(2,2-диметилпропил)пиримидин-2-амин;
N-бицикло[2.2.1]гепт-2-ил-4-(1,4-диазепан-1-ил)пиримидин-2 -амин;
4-[(3S)-3-аминопирролидин-1-ил]-N-бутилпиримидин-2-амин;
4-[(3R)-3-аминопирролидин-1-ил]-N-(циклогексилметил)пиримидин-2-амин;
4-[(3S)-3-аминопирролидин-1-ил]-N-(2-метилпропил)пиримидин-2-амин;
4-[(3S)-3-аминопирролидин-1-ил]-N-(4-фторбензил)пиримидин-2-амин;
4-[(3S)-3-(метиламино)пирролидин-1-ил]-N-(пиридин-2-илметил)пиримидин-2-амин;
N-циклопентил-4-[(3S)-3-(метиламино)пирролидин-1-ил]пиримидин-2-амин;
4-[(3S)-3-(метиламино)пирролидин-1-ил]-N-(2-метилпропил)пиримидин-2-амин;
N-(2,2-диметилпропил)-4-[(3S)-3-(метиламино)пирролидин-1-ил]пиримидин-2-амин;
N-бензил-4-[(3S)-3-(метиламино)пирролидин-1-ил]пиримидин-2-амин;
4-[(3R)-3-аминопирролидин-1-ил]-N-[(1R,5R,7S)-трицикло[3.3.1.1.3.7]дец-2-ил]пиримидин-2-амин, а также их фармацевтически приемлемые соли.
34. Соединение, выбираемое из группы, включающей
5-[(3R)-3-(метиламино)пирролидин-1-ил]-N-(2-метилпропил)пиридазин-3-амин;
N-бицикло[2.2.1]гепт-2-ил-5-[(3R)-3-(метиламино)пирролидин-1-ил]пиридазин-3-амин;
5-[(3R)-3-(метиламино)пирролидин-1-ил]-N-[(1S,2S,3S,5R)-2,6,6-триметилбицикло[3.1.1]гепт-3-ил]пиридазин-3-амин;
N-циклогексил-5-[(3R)-3-(метиламино)пирролидин-1-ил]пиридазин-3-амин;
N-(циклопропилметил)-5-[(3R)-3-(метиламино)пирролидин-1-ил]пиридазин-3-амин;
N-бутил-5-[(3R)-3-(метиламино)пирролидин-1-ил]пиридазин-3-амин;
5-(4-метилпиперазин-1-ил)-N-(2-метилпропил)пиридазин-3-амин;
5-[(3R)-3-аминопирролидин-1-ил]-N-(2-метоксиэтил)пиридазин-3-амин;
5-[3-(метиламино)азетидин-1-ил]-N-(4,4,4-трифторбутил)пиридазин-3-амин;
N5-(2-аминоэтил)-N3-(2,2-диметилпропил)-N5-метилпиридазин-3,5-диамин;
5-[3-(метиламино)азетидин-1-ил]-N-[(1S,5R)-2,6,6-триметилбицикло[3.1.1]гепт-3-ил]пиридазин-3-амин;
N5-(2-аминоэтил)-N3-бицикло[2.2.1]гепт-2-ил-N5-метилпиридазин-3,5-диамин;
N5-(2-аминоэтил)-N3-(циклопентилметил)-N5-метилпиридазин-3,5-диамин;
5-[(3S)-3-аминопирролидин-1-ил]-N-(бицикло[2.2.1]гепт-2-илметил)пиридазин-3-амин;
3-({5-[(3aR,6aR)-гексагидропирроло[3,4-b]пиррол-5(1H)-ил]пиридазин-3-ил}амино)пропан-1-ол;
5-(3-аминоазетидин-1-ил)-N-{[(1S,2S,5S)-6,6-диметилбицикло[3.1.1]гепт-2-ил]метил}пиридазин-3-амин;
5-(1,4-диазепан-1-ил)-N-(2,2-диметилпропил)пиридазин-3-амин;
N-бицикло[2.2.1]гепт-2-ил-5-(1,4-диазепан-1-ил)пиридазин-3-амин;
N-циклопропил-5-[(3aR,6aR)-гексагидропирроло[3,4-b]пиррол-5(1H)-ил]пиридазин-3-амин;
N-бутил-5-[(3aR,6aR)-гексагидропирроло[3,4-b]пиррол-5(1H)-ил]пиридазин-3-амин;
5-[(3R)-3-аминопирролидин-1-ил]-N-(бицикло[2.2.1]гепт-2-илметил)пиридазин-3-амин;
3-({5-[(3R)-3-аминопирролидин-1-ил]пиридазин-3-ил}амино)пропан-1-ол;
3-[(5-пиперазин-1-илпиридазин-3-ил)амино]пропан-1-ол;
N-циклопропил-5-пиперазин-1-илпиридазин-3-амин;
N-(циклопентилметил)-5-(1,4-диазепан-1-ил)пиридазин-3-амин;
5-[(3S)-3-аминопирролидин-1-ил]-N-(циклопентилметил)пиридазин-3-амин;
5-[(3aR,6aR)-гексагидропирроло[3,4-b]пиррол-5(1H)-ил]-N-(2-метилпропил)пиридазин-3-амин;
5-[3-(метиламино)азетидин-1-ил]-N-(2-метилпропил)пиридазин-3-амин;
N-(2-метоксиэтил)-5-[3-(метиламино)азетидин-1-ил]пиридазин-3-амин;
5-[(3R)-3-аминопирролидин-1-ил]-N-[(1R)-1-фенилэтил]пиридазин-3-амин;
5-(3-аминоазетидин-1-ил)-N-бицикло[2.2.1]гепт-2-илпиридазин-3-амин;
5-(3-аминоазетидин-1-ил)-N-(2,2-диметилпропил)пиридазин-3-амин;
N-(2,2-диметилпропил)-5-[3-(метиламино)азетидин-1-ил]пиридазин-3-амин;
N-циклогексил-5-[3-(метиламино)азетидин-1-ил]пиридазин-3-амин;
5-(3-аминоазетидин-1-ил)-N-циклопентилпиридазин-3-амин;
N-(циклопропилметил)-5-[3-(метиламино)азетидин-1-ил]пиридазин-3-амин;
5-(3-аминоазетидин-1-ил)-N-(2-метилпропил)пиридазин-3-амин;
5-(3-аминоазетидин-1-ил)-N-бензилпиридазин-3-амин;
N-бензил-5-[3-(метиламино)азетидин-1-ил]пиридазин-3-амин;
N-бицикло[2.2.1]гепт-2-ил-5-[3-(метиламино)азетидин-1-ил]пиридазин-3-амин;
N-циклопентил-5-[3-(метиламино)азетидин-1-ил]пиридазин-3-амин;
5-(3-аминоазетидин-1-ил)-N-циклопропилпиридазин-3-амин;
3-({5-[3-(метиламино)азетидин-1-ил]пиридазин-3-ил}амино)пропан-1-ол;
5-(3-аминоазетидин-1-ил)-N-(2-метоксиэтил)пиридазин-3-амин;
5-[(3S)-3-аминопирролидин-1-ил]-N-циклопропилпиридазин-3-амин;
5-[(3R)-3-аминопирролидин-1-ил]-N-(пиридин-2-илметил)пиридазин-3-амин;
3-({5-[(3S)-3-аминопирролидин-1-ил]пиридазин-3-ил}амино)пропан-1-ол;
5-[(3S)-3-аминопирролидин-1-ил]-N-(2-метилпропил)пиридазин-3-амин;
5-[(3R)-3-аминопирролидин-1-ил]-N-бензилпиридазин-3-амин;
5-[(3R)-3-аминопирролидин-1-ил]-N-(4-метоксибензил)пиридазин-3-амин;
5-[(3R)-3-аминопирролидин-1-ил]-N-(4-фторбензил)пиридазин-3-амин;
5-[(3R)-3-аминопирролидин-1-ил]-N-(4-метилбензил)пиридазин-3-амин;
N-(4-метилбензил)-5-пиперазин-1-илпиридазин-3-амин;
N-циклопентил-5-[(3aR,6aR)-гексагидропирроло[3,4-b]пиррол-5(1H)-ил]пиридазин-3-амин;
N-(4-фторбензил)-5-пиперазин-1-илпиридазин-3-амин;
N-(4-метоксибензил)-5-пиперазин-1-илпиридазин-3-амин;
N-бензил-5-пиперазин-1-илпиридазин-3-амин;
N-[(1R)-1-фенилэтил]-5-пиперазин-1-илпиридазин-3-амин;
3-({5-[(3R)-3-аминопирролидин-1-ил]пиридазин-3-ил}амино)-2,2-диметилпропан-1-ол;
N-циклопропил-5-[3-(метиламино)азетидин-1-ил]пиридазин-3-амин;
5-[3-(метиламино)азетидин-1-ил]-N-(пиридин-2-илметил)пиридазин-3-амин;
5-[(3R)-3-аминопирролидин-1-ил]-N-(2-метилпропил)пиридазин-3-амин;
N-циклопентил-5-пиперазин-1-илпиридазин-3-амин;
N-циклогексил-5-пиперазин-1-илпиридазин-3-амин;
N-бутил-5 -пиперазин-1-илпиридазин-3-амин;
N-(2,2-диметилпропил)-5-пиперазин-1-илпиридазин-3-амин;
5-(3-аминоазетидин-1-ил)-N-(циклопентилметил)пиридазин-3-амин;
5-[(3R)-3-аминопирролидин-1-ил]-N-(циклопентилметил)пиридазин-3-амин;
N-(циклопентилметил)-5-[(3aR,6aR)-гексагидропирроло[3,4-b]пиррол-5(1H)-ил]пиридазин-3-амин;
N-(циклопропилметил)-5-пиперазин-1-илпиридазин-3-амин;
N-(2-фенилэтил)-5-пиперазин-1-илпиридазин-3-амин;
N-(циклопентилметил)-5-пиперазин-1-илпиридазин-3-амин;
5-[(3R)-3-аминопирролидин-1-ил]-N-(2-фенилэтил)пиридазин-3-амин;
5-[(3R)-3-аминопирролидин-1-ил]-N-циклогексилпиридазин-3-амин;
2,2-диметил-3-[(5-пиперазин-1-илпиридазин-3-ил)амино]пропан-1-ол;
5-[(3R)-3-аминопирролидин-1-ил]-N-бутилпиридазин-3-амин;
5-[(3R)-3-аминопирролидин-1-ил]-N-циклопентилпиридазин-3-амин;
5-[(3R)-3-аминопирролидин-1-ил]-N-(циклопропилметил)пиридазин-3-амин;
N-(циклопентилметил)-5-[3-(метиламино)азетидин-1-ил]пиридазин-3-амин;
5-[(3R)-3-аминопирролидин-1-ил]-N-(2,2-диметилпропил)пиридазин-3-амин;
5-[(3R)-3-(метиламино)пирролидин-1-ил]-N-(2-фенилэтил)пиридазин-3-амин;
N-[(1R)-1-циклогексилэтил]-5-[(3S)-3-(метиламино)пирролидин-1-ил]пиридазин-3-амин;
N-(бицикло[2.2.1]гепт-2-илметил)-5-[(3S)-3-(метиламино)пирролидин-1-ил]пиридазин-3-амин;
N-(бицикло[2.2.1]гепт-2-илметил)-5-[(3R)-3-(метиламино)пирролидин-1-ил]пиридазин-3-амин;
N-(2-метоксиэтил)-5-[(3S)-3-(метиламино)пирролидин-1-ил]пиридазин-3-амин;
N-циклопропил-5-[(3R)-3-(метиламино)пирролидин-1-ил]пиридазин-3-амин;
N-[(1R)-1-циклогексилэтил]-5-[(3R)-3-(метиламино)пирролидин-1-ил]пиридазин-3-амин;
5-[(3S)-3-(метиламино)пирролидин-1-ил]-N-(2-метилпропил)пиридазин-3-амин;
N-циклопентил-5-[(3S)-3-(метиламино)пирролидин-1-ил]пиридазин-3-амин;
N-бицикло[2.2.1]гепт-2-ил-5-[(3S)-3-(метиламино)пирролидин-1-ил]пиридазин-3-амин;
N-(циклопентилметил)-5-[(3S)-3-(метиламино)пирролидин-1-ил]пиридазин-3-амин;
2,2-диметил-3-({5-[(3S)-3-(метиламино)пирролидин-1-ил]пиридазин-3-ил}амино)пропан-1-ол;
5-[(3R)-3-(метиламино)пирролидин-1-ил]-N-(4-метилбензил)пиридазин-3-амин;
N-(2,2-диметилпропил)-5-[(3S)-3-(метиламино)пирролидин-1-ил]пиридазин-3-амин;
5-[(3R)-3-(метиламино)пирролидин-1-ил]-N-(4,4,4-трифторбутил)пиридазин-3-амин;
N-(фуран-3-илметил)-5-[(3R)-3-(метиламино)пирролидин-1-ил]пиридазин-3-амин;
N-[(6,6-диметилбицикло[3.1.1]гепт-2-ил)метил]-5-[(3R)-3-(метиламино)пирролидин-1-ил]пиридазин-3-амин;
5-[(3S)-3-(метиламино)пирролидин-1-ил]-N-(4,4,4-трифторбутил)пиридазин-3-амин;
3-({5-[(3R)-3-(метиламино)пирролидин-1-ил]пиридазин-3-ил}амино)пропан-1-ол;
N-(циклогексилметил)-5-[(3R)-3-(метиламино)пирролидин-1-ил]пиридазин-3-амин;
N-(2,2-диметилпропил)-5-[(3R)-3-(метиламино)пирролидин-1-ил]пиридазин-3-амин;
N-(2-метоксиэтил)-5-[(3R)-3-(метиламино)пирролидин-1-ил]пиридазин-3-амин;
N-[(6,6-диметилбицикло[3.1.1]гепт-2-ил)метил]-5-[(3S)-3-(метиламино)пирролидин-1-ил]пиридазин-3-амин;
N-циклопропил-5-[(3S)-3-(метиламино)пирролидин-1-ил]пиридазин-3-амин;
N-(циклогексилметил)-5-[(3S)-3-(метиламино)пирролидин-1-ил]пиридазин-3-амин;
N-бензил-5-[(3R)-3-(метиламино)пирролидин-1-ил]пиридазин-3-амин;
N-(4-фторбензил)-5-[(3R)-3-(метиламино)пирролидин-1-ил]пиридазин-3-амин;
N-(4-фторбензил)-5-[(3S)-3-(метиламино)пирролидин-1-ил]пиридазин-3-амин;
N-(4-метоксибензил)-5-[(3R)-3-(метиламино)пирролидин-1-ил]пиридазин-3-амин;
5-[(3R)-3-(метиламино)пирролидин-1-ил]-N-[(1R)-1-фенилэтил]пиридазин-3-амин;
5-[(3S)-3-(метиламино)пирролидин-1-ил]-N-(пиридин-2-илметил)пиридазин-3-амин;
3-({5-[(3S)-3-(метиламино)пирролидин-1-ил]пиридазин-3-ил}амино)пропан-1-ол;
N-(2,2-диметилпропил)-5-(4-метилпиперазин-1-ил)пиридазин-3-амин;
N-(2-метоксиэтил)-5-(4-метилпиперазин-1-ил)пиридазин-3-амин;
N-бицикло[2.2.1]гепт-2-ил-5-(4-метилпиперазин-1-ил)пиридазин-3-амин;
N-циклопентил-5-(4-метилпиперазин-1-ил)пиридазин-3-амин;
N-(циклопентилметил)-5-(4-метилпиперазин-1-ил)пиридазин-3-амин;
5-(4-метилпиперазин-1-ил)-N-(2-фенилэтил)пиридазин-3-амин;
N-бензил-5-(4-метилпиперазин-1-ил)пиридазин-3-амин;
5-(4-метилпиперазин-1-ил)-N-(пиридин-2-илметил)пиридазин-3-амин;
N-циклопентил-5-[(3R)-3-(метиламино)пирролидин-1-ил]пиридазин-3-амин;
(R)-5-(3-(метиламино)пирролидин-1-ил)-N-(1-адамантил)пиридазин-3-амина дигидрохлорид;
(R)-5-(3-(метиламино)пирролидин-1-ил)-N-(2-
адамантил)пиридазин-3-амина дигидрохлорид;
(S)-5-(3-(метиламино)пирролидин-1-ил)-N-(2-адамантил)пиридазин-3-амина дигидрохлорид;
(S)-5-(3-(метиламино)пирролидин-1-ил)-N-(1-
адамантил)пиридазин-3-амина дигидрохлорид, а также их фармацевтически приемлемые соли.
35. Фармацевтическая композиция для модулирования активности гистаминового рецептора Н4, содержащая эффективное количество по меньшей мере одного из соединений формулы (I)
где Z представляет собой CH или N;
Y представляет собой CH или N;
Z и Y определяются независимо друг от друга, и содержащее упомянутые Y и Z кольцо имеет не более двух атомов азота; при условии, что
i) когда Y представляет собой СН и Z представляет собой СН или N, то
R1 представляет собой:
а) -(СН2)2OCH3, -(CH2)2SCH3 или C1-8алкил, каждый из которых независимо не замещен или замещен -OH или -CF3;
б) -(СН2)0-2-Ar1, -CHR2-Ar1 или -(СН2)0-2-Ar2, причем каждый из упомянутых Ar1 и Ar2 независимо не замещен или замещен галогеном, -СН3 или -OCH3,
Ar1 представляет собой 6-членное ароматическое карбоциклическое кольцо,
Ar2 представляет собой 5- или 6-членное гетероароматическое кольцо, содержащее N, S или О; или
в) C3-12циклоалкил, -(СН2)-(моноциклический C3-8циклоалкил), -(CHR2)-(моноциклический C3-8циклоалкил), -(CH2)0-1-тетрагидрофуранил или -(СН2)0-1-тетрагидропиранил, причем каждый из упомянутых циклоалкильных фрагментов независимо не замещен или замещен одним, двумя или тремя C1-4алкильными заместителями; бицикло[2.2.1]гепт-2-илметил, (6,6-диметилбицикло[3.1.1]гепт-2-ил)метил;
R2 представляет собой -С1-4алкил;
где Ra, Rb и Rc, каждый независимо, представляет собой H или C1-3алкил;
при условии, что
если R1 представляет собой изопропил, то Rc представляет собой метил;
если R1 представляет собой 4-метилфенил, то Rc представляет собой метил;
когда Z представляет собой N, Y представляет собой СН и R1 представляет собой бензил, незамещенный или замещенный галогеном, то Rc представляет собой метил;
ii) когда Y представляет собой N и Z представляет собой СН, то
R1 представляет собой
а) -(СН2)2OCH3, -(CH2)2SCH3 или C1-8алкил, каждый из которых независимо не замещен или замещен -OH или -CF3;
б) -(СН2)0-2-Ar1, -CHR2-Ar1, -(СН2)0-2-Ar2, причем каждый из упомянутых Ar1 и Ar2 независимо не замещен или замещен галогеном, -СН3, -OCH3,
Ar1 представляет собой 6-членное ароматическое карбоциклическое кольцо,
Ar2 представляет собой 5- или 6-членное гетероароматическое кольцо, содержащее N, S или О; или
в) C3-12циклоалкил, -(СН2)-(моноциклический C3-8циклоалкил), -(CHR2)-(моноциклический C3-8циклоалкил), -(СН2)0-1-тетрагидрофуранил или -(СН2)0-1-тетрагидропиранил, причем каждый из упомянутых фрагментов независимо не замещен или замещен одним, двумя или тремя C1-4алкильными заместителями; бицикло[2.2.1]гепт-2-илметил, (6,6-диметилбицикло[3.1.1]гепт-2-ил)метил;
R2 представляет собой -C1-4алкил;
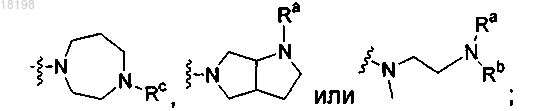
где Ra, Rb и Rc, каждый независимо, представляет собой H или C1-3алкил; и
фармацевтически приемлемых солей соединений формулы (I), и фармацевтически приемлемый наполнитель.
36. Фармацевтическая композиция по п.35, где Y представляет собой CH и Z представляет собой CH или N.
37. Фармацевтическая композиция по п.35, где Y представляет собой N и Z представляет собой CH.
38. Фармацевтическая композиция для модулирования активности гистаминового рецептора Н4, содержащая эффективное количество по меньшей мере одного из химических соединений по п.33 и фармацевтически приемлемый наполнитель.
39. Фармацевтическая композиция для модулирования активности гистаминового рецептора Н4, содержащая эффективное количество по меньшей мере одного из химических соединений по п.34 и фармацевтически приемлемый наполнитель.
40. Способ лечения пациента, который страдает от или у которого диагностировано заболевание, расстройство или медицинское состояние, опосредованное активностью гистаминового рецептора Н4, включающий введение нуждающемуся в подобном лечении пациенту эффективного количества по меньшей мере одного из химических соединений, выбираемых из соединений формулы (I)
где Z представляет собой CH или N;
Y представляет собой CH или N;
Z и Y определяются независимо друг от друга, и содержащее упомянутые Y и Z кольцо имеет не более двух атомов азота; при условии, что
i) когда Y представляет собой СН и Z представляет собой СН или N, то
R1 представляет собой:
а) -(СН2)2OCH3, -(CH2)2SCH3 или C1-8алкил, каждый из которых независимо не замещен или замещен -OH или -CF3;
б) -(СН2)0-2-Ar1, -CHR2-Ar1 или -(СН2)0-2-Ar2, причем каждый из упомянутых Ar1 и Ar2 независимо не замещен или замещен галогеном, -СН3 или -OCH3,
Ar1 представляет собой 6-членное ароматическое карбоциклическое кольцо,
Ar2 представляет собой 5- или 6-членное гетероароматическое кольцо, содержащее N, S или О; или
в) C3-12циклоалкил, -(СН2)-(моноциклический C3-8циклоалкил), -(CHR2)-(моноциклический C3-8циклоалкил), -(CH2)0-1-тетрагидрофуранил или -(СН2)0-1-тетрагидропиранил, причем каждый из упомянутых циклоалкильных фрагментов не замещен или замещен одним, двумя или тремя С1-4алкильными заместителями; бицикло[2.2.1]гепт-2-илметил, (6,6-диметилбицикло[3.1.1]гепт-2-ил)метил;
R2 представляет собой -С1-4алкил;
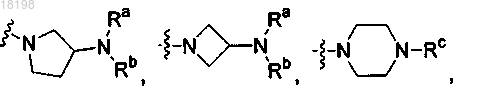
где Ra, Rb и Rc, каждый независимо, представляет собой H или C1-3алкил;
при условии, что
если R1 представляет собой изопропил, то Rc представляет собой метил;
если R1 представляет собой 4-метилфенил, то Rc представляет собой метил;
когда Z представляет собой N, Y представляет собой СН и R1 представляет собой бензил, незамещенный или замещенный галогеном, то Rc представляет собой метил;
ii) когда Y представляет собой N и Z представляет собой СН, то
R1 представляет собой:
а) -(СН2)2OCH3, -(CH2)2SCH3 или C1-8алкил, каждый из которых независимо не замещен или замещен -OH или -CF3;
б) -(СН2)0-2-Ar1, -CHR2Ar1, -(СН2)0-2-Ar2, причем каждый из упомянутых Ar1 и Ar2 независимо не замещен или замещен галогеном, -СН3, -OCH3,
Ar1 представляет собой 6-членное ароматическое карбоциклическое кольцо,
Ar2 представляет собой 5- или 6-членное гетероароматическое кольцо, содержащее N, S или О; или
в) C3-12циклоалкил, -(СН2)-(моноциклический C3-8циклоалкил), -(CHR2)-(моноциклический C3-8циклоалкил), -(СН2)0-1-тетрагидрофуранил или -(СН2)0-1-тетрагидропиранил, причем каждый из упомянутых фрагментов независимо не замещен или замещен одним, двумя или тремя C1-4алкильными заместителями; бицикло[2.2.1]гепт-2-илметил, (6,6-диметилбицикло[3.1.1]гепт-2-ил)метил;
R2 представляет собой -С1-4алкил;
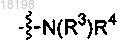 представляет собой
представляет собой
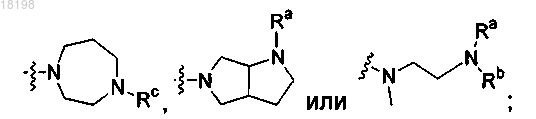
где Ra, Rb и Rc, каждый независимо, представляет собой Н или C1-3алкил; и
фармацевтически приемлемых солей соединений формулы (I).
41. Способ по п.40, в котором Y представляет собой CH и Z представляет собой CH или N.
42. Способ по п.40, в котором Y представляет собой N и Z представляет собой CH.
43. Способ лечения пациента, который страдает от или у которого диагностировано заболевание, расстройство или медицинское состояние, опосредованное активностью гистаминового рецептора Н4, включающий введение нуждающемуся в подобном лечении пациенту эффективного количества по меньшей мере одного из химических соединений по п.33.
44. Способ лечения пациента, который страдает от или у которого диагностировано заболевание, расстройство или медицинское состояние, опосредованное активностью гистаминового рецептора Н4, включающий введение нуждающемуся в подобном лечении пациенту эффективного количества по меньшей мере одного из химических соединений по п.34.
45. Способ по п.40, в котором упомянутые заболевание, расстройство или медицинское состояние представляют собой воспаление.
46. Способ по п.40, в котором упомянутые заболевание, расстройство или медицинское состояние выбирают из группы, включающей воспалительные расстройства, аллергические расстройства, дерматологические расстройства, аутоиммунные заболевания, лимфатические расстройства и иммунодефицитные расстройства.
47. Способ по п.40, в котором упомянутые заболевание, расстройство или медицинское состояние выбирают из группы, включающей следующие заболевания: аллергию, астму, синдром сухого глаза, хроническое обструктивное заболевание легких (COPD), атеросклероз, ревматоидный артрит, рассеянный склероз, воспалительные заболевания кишечника, колит, болезнь Крона, язвенный колит, псориаз, прурит, кожный зуд, атопический дерматит, аллергическую сыпь, крапивницу, воспаление глаз, конъюнктивит, носовые полипы, аллергический ринит, носовой зуд, склеродермию, аутоиммунные заболевания щитовидной железы, послеоперационные спайки, иммуно-опосредованный сахарный диабет (1 типа), сахарный диабет 2 типа, хроническую почечную недостаточность, гепатический холестаз, волчанку, тяжелую псевдопаралитическую миастению (Myasthenia gravis), аутоиммунные нейропатии, синдром Гийана-Барре (Guillain-Barré), аутоиммунный увеит, аутоиммунную гемолитическую анемию, злокачественную анемию, аутоиммунную тромбоцитопению, височный артериит, антифосфолипидный синдром, васкулитиды, грануломатоз Вегенера, болезнь Бехчета, герпетиформный дерматит, пузырчатку обыкновенную, витилиго, первичный билиарный цирроз печени, аутоиммунный гепатит, аутоиммунный оофорит, аутоиммунный орхит, аутоиммунное заболевание надпочечников, полимиозит, дерматомиозит, спондилоартропатии, анкилозирующий спондилоартрит, синдром Съергена, большое депрессивное расстройство, биполярное аффективное расстройство, не поддающееся лечению большое депрессивное расстройство, не поддающееся лечению биполярное аффективное расстройство, генерализованное тревожное расстройство, социофобии, посттравматическое стрессовое расстройство и болевой синдром.
48. Способ по п.40, в котором упомянутые заболевание, расстройство или медицинское состояние выбирают из группы, включающей следующие заболевания: аллергию, астму, ревматоидный артрит, аутоиммунные заболевания и кожный зуд.
49. Способ модуляции активности гистаминового рецептора Н4, включающий воздействие на гистаминовый рецептор Н4 эффективного количества по меньшей мере одного из химических соединений, выбираемых из соединений формулы (I)
где Z представляет собой CH или N;
Y представляет собой CH или N;
Z и Y определяются независимо друг от друга, и содержащее упомянутые Y и Z кольцо имеет не более двух атомов азота; при условии, что
i) когда Y представляет собой СН и Z представляет собой СН или N, то
R1 представляет собой:
а) -(СН2)2OCH3, -(CH2)2SCH3 или C1-8алкил, каждый из которых независимо не замещен или замещен -OH или -CF3;
б) -(СН2)0-2-Ar1, -CHR2-Ar1 или -(СН2)0-2-Ar2, причем каждый из упомянутых Ar1 и Ar2 независимо не замещен или замещен галогеном, -СН3 или -OCH3,
Ar1 представляет собой 6-членное ароматическое карбоциклическое кольцо,
Ar2 представляет собой 5- или 6-членное гетероароматическое кольцо, содержащее N, S или О; или
в) С3-12циклоалкил, -(СН2)-(моноциклический C3-8циклоалкил), -(CHR2)-(моноциклический C3-8циклоалкил), -(CH2)0-1-тетрагидрофуранил или -(СН2)0-1-тетрагидропиранил, причем каждый из упомянутых циклоалкильных фрагментов независимо не замещен или замещен одним, двумя или тремя С1-4алкильными заместителями; бицикло[2.2.1]гепт-2-илметил, (6,6-диметилбицикло[3.1.1]гепт-2-ил)метил;
R2 представляет собой -С1-4алкил;
 представляет собой
представляет собой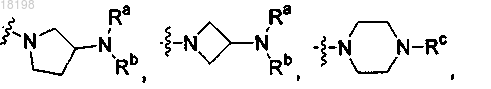
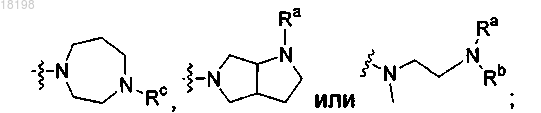
где Ra, Rb и Rc, каждый независимо, представляет собой H или C1-3алкил;
при условии, что
если R1 представляет собой изопропил, то Rc представляет собой метил;
если R1 представляет собой 4-метилфенил, то Rc представляет собой метил;
когда Z представляет собой N, Y представляет собой СН и R1 представляет собой бензил, незамещенный или замещенный галогеном, то Rc представляет собой метил;
ii) когда Y представляет собой N и Z представляет собой СН, то
R1 представляет собой:
а) -(СН2)2OCH3, -(CH2)2SCH3 или C1-8алкил, каждый из которых независимо не замещен или замещен -OH или -CF3;
б) -(СН2)0-2-Ar1, -CHR2-Ar1, -(СН2)0-2-Ar2, причем каждый из упомянутых Ar1 и Ar2 независимо не замещен или замещен галогеном, -СН3, -OCH3,
Ar1 представляет собой 6-членное ароматическое карбоциклическое кольцо,
Ar2 представляет собой 5- или 6-членное гетероароматическое кольцо, содержащее N, S или О; или
в) С3-12циклоалкил, -(СН2)-(моноциклический C3-8циклоалкил), -(CHR2)-(моноциклический C3-8циклоалкил), -(CH2)0-1-тетрагидрофуранил или -(СН2)0-1-тетрагидропиранил, причем каждый из упомянутых фрагментов не замещен или замещен одним, двумя или тремя С1-4алкильными заместителями; бицикло[2.2.1]гепт-2-илметил, (6,6-диметилбицикло[3.1.1]гепт-2-ил)метил;
R2 представляет собой -С1-4алкил;

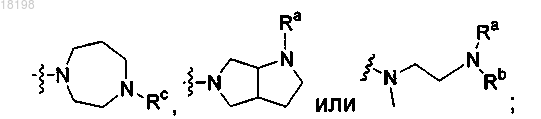
где Ra, Rb и Rc, каждый независимо, представляет собой Н или C1-3алкил;
и фармацевтически приемлемых солей соединений формулы (I).
50. Способ по п.49, в котором Y представляет собой CH и Z представляет собой CH или N.
51. Способ по п.49, в котором Y представляет собой N и Z представляет собой CH.
52. Способ модуляции активности гистаминового рецептора Н4, включающий воздействие на гистаминовый рецептор Н4 эффективного количества по меньшей мере одного из соединений по п.33.
53. Способ модуляции активности гистаминового рецептора Н4, включающий воздействие на гистаминовый рецептор Н4 эффективного количества по меньшей мере одного из соединений по п.34.
54. Способ по п.49, в котором указанную модуляцию активности гистаминового рецептора Н4 осуществляют в организме пациента, в частности человека.
55. Способ по п.54, в котором упомянутый пациент страдает от или у которого диагностировано заболевание, расстройство или медицинское состояние, опосредованное активностью гистаминового рецептора Н4.
56. Способ по п.55, в котором упомянутые заболевание, расстройство или медицинское состояние выбираются из группы, включающей следующие расстройства и заболевания: аллергия, ревматоидный артрит, астма, аутоиммунные заболевания и кожный зуд.
57. Способ по п.40, в котором упомянутое введение представляет собой местное применение.
58. Способ по п.57, в котором упомянутое расстройство или медицинское состояние представляет собой воспаление.
59. Способ по п.57, в котором упомянутое расстройство или медицинское состояние представляет собой по меньшей мере одно из следующих расстройств: кожный зуд, аллергическая сыпь или атопический дерматит.
Текст
ДИАМИНОПИРИДИНОВЫЕ, ПИРИМИДИНОВЫЕ И ПИРИДАЗИНОВЫЕ МОДУЛЯТОРЫ ГИСТАМИНОВОГО РЕЦЕПТОРА H4 Диаминопиридиновые, пиримидиновые и пиридазиновые соединения формулы (I), которые могут использоваться в качестве модуляторов рецептора Н 4, а также в составе фармацевтических композиций и в способах лечения заболеваний, расстройств или патологических состояний,опосредованных активностью рецептора Н 4, таких как аллергия, астма, аутоиммунные заболевания и кожный зуд.(71)(73) Заявитель и патентовладелец: ЯНССЕН ФАРМАЦЕВТИКА НВ (BE) Область изобретения Изобретение относится к некоторым диаминопиридиновым, пиримидиновым и пиридазиновым соединениям, содержащим их фармацевтическим композициям, способам получения данных соединений и способам их применения для модулирования гистаминового рецептора H4 и для лечения болезненных и патологических состояний, а также расстройств, опосредованных активностью гистаминового рецептора Н 4. Предпосылки создания изобретения Гистаминовый рецептор H4 (H4R), иногда просто обозначаемый "H4" или "H4", является самым последним из выявленных рецепторов гистамина (обзоры можно найти в работах: Fung-Leung, W.-P., et al.,Curr. Opin. Invest. Drugs 2004, 5(11), 1174-1183; de Esch, I.J.P., et al., Trends Pharmacol. Sci. 2005, 26(9),462-469; Zhang, M. et al. Pharmacol. Ther. 2007, 113, 594-606; Thurmond, R.L. et al. Nat. Rev. Drug Disc. 2008, 7, 41-53; Zhang, M. et al. Expert Opin. Investig. Drugs 2006, 15(11), 1443-1452). Данный рецептор локализуется в костном мозге и селезенке и экспрессируется эозинофилами, базофилами, тучными клетками (Liu, С, et al., Mol. Pharmacol. 2001, 59(3), 420-426; Morse, K.L., et al., J. Pharmacol. Exp. Ther. 2001,296(3), 1058-1066; Hofstra, C.L., et al., J. Pharmacol. Exp. Ther. 2003, 305(3), 1212-1221; Lippert, U., et al., J.CD8+ (Gantner, F., et al., J. Pharmacol. Exp. Ther. 2002, 303(1), 300-307), дендритными клетками и человеческими синовиальными клетками пациентов, страдающих ревматоидным артритом (Ikawa, Y., et al.,Biol. Pharm. Bull. 2005, 28(10), 2016-2018). Повышенный уровень экспрессии гистаминового рецептораH4 также наблюдается в тканях носовых полипов человека (Jokuti, A. et al. Cell. Biol. Int. 2007, 31, 13671370). Однако экспрессия в нейтрофилах и моноцитах выражена не столь явно (Ling, P., et al., Br. J.Pharmacol. 2004, 142(1), 161-171; Damaj, B.B. et al. J. Immunol. 2007, 179, 7907-7915). Уровень экспрессии рецептора, по меньшей мере частично, контролируется различными воспалительными стимулами (Coge,F., et al., Biochem. Biophys. Res. Commun. 2001, 284(2), 301-309; Morse, et al., 2001), тем самым поддерживая гипотезу, что активация рецептора H4 оказывает влияние на воспалительную реакцию. Из-за предпочтительной экспрессии на иммунокомпетентных клетках рецептор H4 тесно связан с регуляторными функциями гистамина в ходе иммунного ответа. Биологическая активность гистамина в контексте иммунологии и аутоиммунных заболеваний тесно связана с аллергической реакцией и ее вредным воздействием, таким как воспаление. Явления, вызывающие воспалительную реакцию, включают физическое раздражение (в том числе травмирование), химическое раздражение, инфицирование и вторжение инородного тела. Воспалительная реакция характеризуется наличием боли, повышенной температурой, покраснением, опуханием или нарушением функции органа или ткани, а также сочетанием указанных симптомов. Дегрануляция тучных клеток (экзоцитоз) сопровождается высвобождением гистамина и приводит к воспалительной реакции, которая исходно может быть охарактеризована модулированной гистамином кожной аллергической реакцией. К активации, миграции и дегрануляции тучных клеток может приводить широкий спектр иммунологических (например, аллергенов или антител) и неиммунологических(например, химических) стимулов. Активация тучных клеток инициирует аллергическую воспалительную реакцию, которая, в свою очередь, вызывает миграцию других эффекторных клеток, что приводит к дальнейшему развитию воспалительной реакции. Было показано, что гистамин индуцирует хемотаксис тучных клеток мыши (Hofstra, et al., 2003), причем хемотаксис не наблюдается при использовании тучных клеток, полученных из мышей с выключенным геном рецептора Н 4. Кроме того, указанная реакция блокируется H4-специфичным антагонистом, но не блокируется антагонистами рецепторов H1, H2 и Н 3in vivo также показали, что вызванная гистамином миграция тучных клеток зависит от рецептора H4(Thurmond, et al., 2004). Указанная миграция тучных клеток может играть роль в развитии аллергического ринита и аллергии, где обнаружено повышение численности тучных клеток (Kirby, J.G., et al., Am.Crit. Care Med. 2000, 161 (5), 1473-1478; Kassel, O., et al., Clin. Exp. Allergy 2001, 31 (9), 1432-1440). Кроме того, известно, что в ответ на воздействие аллергена происходит перераспределение тучных клеток с увеличением их количества в эпителиальном слое слизистой оболочки носа (Fokkens, W.J., et al., Clin.Exp. Allergy 1992, 22(7), 701-710; Slater, A., et al., J. Laryngol. Otol. 1996, 110, 929-933). Эти результаты показывают, что хемотаксический отклик тучных клеток на гистамин опосредован гистаминовыми рецепторами H4. Было показано, что гистамин также может вызывать хемотаксис эозинофилов (O'Reilly, M., et al., J.Recept. Signal Transduction 2002, 22 (1-4), 431-448; Buckland, K.F., et al., Br. J. Pharmacol. 2003, 140 (6),1117-1127; Ling et al., 2004). С использованием Н 4-селективных лигандов было показано, что индуцированный гистамином хемотаксис эозинофилов опосредован рецептором H4 (Buckland, et al., 2003; Ling etal., 2004). Уровень экспрессии молекул адгезии CD11b/CD18 (LFA-1) и CD54 (ICAM-1) на клеточной поверхности эозинофилов после обработки гистамином возрастает (Ling, et al., 2004). Этот рост блокируется антагонистами рецептора H4, но не блокируется антагонистами рецепторов H1, H2 и H3.-1 018198 Рецептор H4 также важен для дендритных клеток и T-клеток. В производных от моноцитов дендритных клетках человека стимулирование рецептора H4 подавляет продукцию IL-12p70 и вызывает индуцированный гистамином хемотаксис (Gutzmer, R., et al., J. Immunol. 2005, 174 (9), 5224-5232). Также указывалось на роль рецептора H4 в T-клетках типа CD8+. В работе Gantner, et al., (2002) было показано,что как рецептор H4, так и рецептор H2 контролируют индуцированное гистамином высвобождение IL-16 из человеческих T-клеток типа CD8+. IL-16 обнаруживается в бронхоальвеолярной жидкости пациентов с бронхиальной астмой после аллергенной или гистаминовой провокации (Mashikian, V.M., et al., J. AllergyClin. Immunol. 1998, 101 (6, Part 1), 786-792; Krug, N., et al., Am. J. Resp. Crit. Care Med. 2000, 162 (1), 105111) и считается важным фактором в миграции клеток типа CD4+. Активность рецептора H4 в клетках перечисленных типов указывает на его важную роль в адаптивных иммунных ответах, например, ответах, активных при аутоиммунных заболеваниях.In vivo антагонисты рецептора H4 оказались способны блокировать нейтрофилию в моделях индуцированного цимозаном перитонита и плеврита (Takeshita, K., et al., J. Pharmacol. Exp. Ther. 2003, 307 (3),1072-1078; Thurmond, et al., 2004). Кроме того, антагонисты рецептора H4 показывают активность и в широко используемой и хорошо охарактеризованной модели колита (Varga, С, et al., Eur. J. Pharmacol. 2005, 522(1-3), 130-138). Эти результаты подтверждают вывод, что антагонисты рецептора H4 обладают противовоспалительной активностью in vivo. Еще одной физиологической функцией гистамина является опосредование кожного зуда, и антагонисты рецептора H1 не показывают здесь полной клинической эффективности. Недавно было указано на возможное участие рецептора H4 в индуцированном гистамином зуде у мышей (Bell, J.K., et al., Br. J.Pharmacol. 2004, 142(2), 374-380). Антагонисты рецептора H4 блокировали эти эффекты гистамина. Перечисленные результаты подтверждают гипотезу об участии рецептора H4 в индуцированном гистамином кожном зуде и о возможном положительном эффекте антагонистов рецептора H4 при лечении кожного зуда. Было показано, что антагонисты гистаминового рецептора H4 приводят к облегчению зуда в экспериментальных моделях (Dunford, P.J. et al. J. Allergy Clin. Immunol. 2007, 119(1), 176-183). Модулирование рецепторов H4 контролирует высвобождение медиаторов воспаления и ингибирует миграцию лейкоцитов, тем самым давая возможность профилактики и(или) лечения опосредованных рецептором H4 заболеваний и патологических состояний, включая отрицательное воздействие аллергических реакций, такие как воспаление. Соединения, составляющие предмет настоящего изобретения,обладают свойствами, модулирующими рецептор H4. Соединения, составляющие предмет настоящего изобретения, обладают свойствами, ингибирующими миграцию лейкоцитов. Соединения, составляющие предмет настоящего изобретения, обладают противовоспалительными свойствами. Модулирование гистаминового рецептора H4 также обсуждалось в контексте снятия болевого синдрома (Межд. патентная заявка WO 2008/060766 (Abbott). В постоянно растущем количестве публикаций сообщается о повышенных уровнях экспрессии многих провоспалительных цитокинов у пациентов, страдающих большой депрессией (Frommberger etal., European Archives of PsychiatryClinical Neuroscience. 1997, 247 (4), 228-33; Sluzewska A., et al., Psychiatry Research, 1996, 64 (3), 161-7; Ortiz-Dominguez, et al., Bip. Disporder 9, 2007; O'Brien, et al., J. Affective Disorders, 2006, 90, 263-267; Anisman H. et al., Biological Psychiatry, 1999, 46 (12),1649-55) (в сравнении с недепрессивными субъектами или, в ряде случаев, в корреляции со степенью тяжести симптома). Последние включают в себя белки острой фазы (Kling et al., Biol. Phychiatry, 2007, 62, 309-313; Kim et al.,Progress in Neuro-PsychopharmacologyBiological Psychiatry, 2007, 31, 1044-1053; (С-реактивный белок,альфа-1 кислый гликопротеин, альфа-1 антихимотрипсин и гаптоглобин), повышенный уровень экспрессии хемокинов и молекул клеточной адгезии (включая человеческий хемоаттрактантный белок-1 макрофагов (МСР-1), растворимую внутриклеточную молекулу адгезии-1 (sICAM-1) и Е-селектин), повышенные концентрации интерлейкина (IL)-1-, IL-6 и фактора некроза опухолей (TNF)- в сыворотке и (или) плазме, как в периферическом кровотоке, так и в центральной нервной системе (особенно в спинномозговой жидкости) с более высоким уровнем консистенции при измерении TNF- и IL-6 (O'Brien et al.,Journal of Psychiatric Research, 2007, 41, 326-331; Moorman et al., J. of Cardiac Failure, 2007, 13 (9), 738-43;Soygur et al., Progress in Neuro-PsychopharmacologyBiolofical Psychiatry, 2007, 31, 1242-1247). Кроме того, аллельные варианты генов для белков IL-1 и TNF- повышают риск депрессии и ассоциируются с пониженной восприимчивостью к антидепрессантной терапии. Наконец, результаты ряда доклинических исследований подтверждают гипотезу об участии некоторых цитокинов в моделях депрессии, имеются также клинические данные о вовлечении антагонизма цитокинов в лечение симптомов депрессии у пациентов, страдающих острыми воспалительными заболеваниями (Kim et al., Progress in NeuroPsychopharmacologyBiological Psychiatry, 2007, 31, 1044-1053).[5-(4,6-диметил-1H-бензоимидазол-2-ил)-4-метилпиримидин-2-ил]-[3-(1-метилпиперидин-4-ил)пропил]амин (патент США 7507737, пример 2) является эффективным антагонистом рецептора H4(H4R) с величиной Ki 8,4 нМ и более чем 25-кратной селективностью относительно других гистаминовых рецепторов in vitro. Указанный амин ингибировал индуцированные гистамином изменения формы эозинофилов, хемотаксис тучных клеток и продуцирование IL-6 в тучных клетках. В экспериментах in vivo[5-(4,6-диметил-1H-бензоимидазол-2-ил)-4-метилпиримидин-2-ил]-[3-(1-метилпиперидин-4-ил)пропил] амин приводил к снижению воспаления в мышиных моделях астмы, артрита и дерматита. Указанное соединение также ингибировало индуцированную липополисахаридами (LPS) выработку фактора некроза опухолей альфа (TNF-) и других цитокинов in vivo. На основе этих наблюдений и эффектов антагонизма к H4R предполагается, что [5-(4,6-диметил-1Hбензоимидазол-2-ил)-4-метилпиримидин-2-ил]-[3-(1-метилпиперидин-4-ил)пропил]амин и семейство химически родственных ему соединений обладает антидепрессантными и (или) анксиолитическими свойствами, позволяющими использовать его для терапии аффективных расстройств (включая, помимо прочего, большое депрессивное расстройство, биполярное аффективное расстройство, не поддающееся лечению большое депрессивное расстройство и не поддающееся лечению биполярное аффективное расстройство), тревожных расстройств (включая, помимо прочего, генерализованное тревожное расстройство, социофобию и посттравматическое стрессовое расстройство). Предполагается, что антагонисты рецептора H4 также будут обладать подобными свойствами, позволяющими использовать их для лечения указанных расстройств. Связанные с ожирением воспаление и инсулинорезистентность связаны с развитием сахарного диабета 2 типа, жирового гепатита и атеросклероза. Макрофаги мигрируют в жировую ткань и атеросклеротические бляшки и активируются, высвобождая воспалительные цитокины и хемокины. Связанные с развитием подобных состояний рационы с высоким содержанием жиров могут приводить к повышенной проницаемости кишечника и дислипидемии. Последующая активация толл-подобных рецепторов 2 и 4(TLR2, TLR4) адипоцитов и макрофагов бактериями и повышенным уровнем свободных жирных кислот приводит к воспалительному фенотипу и резистентности к инсулину. Более конкретно, эффективность опосредованных инсулином каскадов передачи сигналов может быть ослаблена такими цитокинами, какTNF- и IL-6, и активацией киназ, включая c-jun-киназу, NKkB или PKC, далее по каскаду после стимулирования рецепторов TLR2/4. Эффекты модуляции опосредованных инсулином каскадов передачи сигналов усиливаются повышенным притоком моноцитов/макрофагов в ткань из-за высвобождения таких хемокинов, как МСР-1.H4R представляет собой рецептор с высоким сродством к гистамину, экспрессируемый на популяциях моноцитов/макрофагов и иных гематопоэтических клетках. Было показано, что антагонизм к H4R снижает эффективность сигнального каскада TLR4 in vitro и снижает опосредованную TLR2 и TLR4 выработку воспалительных цитокинов in vitro и in vivo. Было неоднократно показано, что экспрессия провоспалительных медиаторов, включая TNF-, IL-6 и LTB4, в TLR-зависимых системах ингибируется антагонизмом к H4R. Полученные в контексте настоящего изобретения данные подтверждают заявление,что антагонисты H4R могут быть полезны при лечении сахарного диабета 2 типа и родственных метаболических нарушений благодаря их способности снимать воспаление. Антагонисты гистаминового рецептора H4 при систематическом приеме демонстрируют противовоспалительную и противозудовую активность в моделях животных. Настоящее изобретение также относится к использованию композиций для местного применения, содержащих антагонисты к рецепторуH4, для местного лечения кожного воспаления и зуда. Местное лечение при терапии кожных расстройств,таких как аллергическая сыпь и атопический дерматит, может оказаться более предпочтительным по сравнению с системным введением препарата из-за более благоприятных показателей безопасности. В контексте настоящего изобретения было проверено местное применение антагониста рецептора H4 (5 хлор-1H-индол-2-ил)-(4-метилпиперазин-1-ил)метанона (патент США 6803362, пример 1) на мышиной модели кожного зуда. Полученные результаты подтверждают заявление, что местное применение антагониста рецептора H4 может быть полезно при местном лечении кожного зуда, и предположительно может также быть полезно при местном противовоспалительном лечении. Содержащие подобные антагонисты композиции для местного применения могут быть полезны как в здравоохранении человека, так и в ветеринарии. Примеры англоязычных учебников в области воспаления включают следующие книги: 1) Gallin,J.I.; Snyderman, R., Inflammation: Basic Principles and Clinical Correlates, 3rd ed.; Lippincott WilliamsWilkins: Philadelphia, 1999; 2) Stvrtinova, V., et al., Inflammation and Fever. Pathophysiology Principles of Diseases (учебник для студентов медицинских специальностей); Academic Press: New York, 1995; 3) Cecil; etal. Textbook of Medicine, 18th ed.; W.B. Saunders Co., 1988; и 4) Stedman's Medical Dictionary. Обзорную и базовую информацию по воспалениям и связанным с ними состояниями можно найти в следующих работах: Nathan, С, Nature 2002, 420(6917), 846-852; Tracey, K.J., Nature 2002, 420(6917), 853859; Coussens, L.M., et al., Nature 2002, 420(6917), 860-867; Libby, P., Nature 2002, 420, 868-874; Benoist, C,et al., Nature 2002, 420(6917), 875-878; Weiner, H.L., et al., Nature 2002, 420(6917), 879-884; Cohen, J., Nature 2002, 420(6917), 885-891; Steinberg, D., Nature Med. 2002, 8(11), 1211-1217. Таким образом, низкомолекулярные модуляторы гистаминового рецептора H4 в соответствии с настоящим изобретением контролируют высвобождение медиаторов воспаления и ингибируют миграцию лейкоцитов, и могут найти применение в терапии воспалений различной этиологии, включая следующие заболевания и патологические состояния: воспалительные расстройства, аллергические расстройства,-3 018198 дерматологические расстройства, аутоиммунные заболевания, лимфатические расстройства, кожный зуд и иммунодефицитные расстройства. Опосредованные активностью гистаминового рецептора H4 заболевания, расстройства и патологические состояния включают заболевания, расстройства и патологические состояния, указанные в настоящей заявке. Ряд диаминозамещенных пиридинов приведен в следующих публикациях: межд. патентная заявкаChem. 2005, 42(7), 1289-1295; евр. патентная заявкаЕР 1437348 (14 июля 2004 г.); патент США 3907801 (23 сентября 1975 г.); Lespagnol, A. et al. Chim. Therap. 1971, 6(2), 105-108; Willecomme, В. Annales de Chimie 1969, 4(6), 405-428; Lespagnol, A. et al. Chim. Therap. 1965, 1, 26-31; межд. патентная заявка WO 2001/62233 (30 августа 2007 г.); межд. патентная заявка WO 2001/47921 (5 июля 2001 г.); заявка на патент США 2007/0167459 (Опо Pharmaceutical Co., 19 июля 2007 г.); заявка на патент США 2003/0105106 (Pfizer, 5 июня 2003 г.); заявка на патент США 2002/0147200 (Nilsson, 10 октября 2002 г.); и патент США 5147876 (Mitsui, 15 сентября 1992 г.). Ряд аминозамещенных 2-аминопиридазинов раскрыт в следующих публикациях: Heinisch, G. Heterocycles 1999, 51(5), 1035-1050; заявка на патент США 2005182067 (Amgen Inc., 18 августа 2005 г.) и межд. патентная заявка WO 2002/022605 (Vertex Pharmaceuticals Inc., 21 марта 2002 г.). Кроме того, коммерчески доступен (5-пиперазин-1-илпиридазин-3-ил)-п-толиламин (CAS1092336-93-0). Ряд замещенных 2-аминопиримидинов в качестве антагонистов гистаминового рецептора H4 раскрыт в следующих публикациях: межд. патентная заявка WO 2008/074445 (UCB Pharma, 26 июня 2008 г.); WO 2005/054239 (Bayer Healthcare AG; 16 июня 2005 г.) и ЕР 1505064 (Bayer Healthcare AG; 9 февраля 2005 г.; имеющий равную силу с межд. патентной заявкой WO 2005/014556). Замещенные пиримидины описаны в качестве лигандов к гистаминовому рецептору H4 в следующих публикациях: заявка на патент США 2007/0185075 (Pharmacia Corp.; 9 августа 2007 г.), межд. патентная заявка WO 2007/031529(Palau Pharma S.A.; 22 марта 2007 г.) и заявка на патент США Per.12/070051 (14 февраля 2008 г.). Применение аминопиримидинов в качестве лигандов гистаминового рецептора H4 дополнительно раскрыто в следующих публикациях: межд. патентные заявкиWO 2007/090852, WO 2007/090853 и WO 2007/090854 (16 августа 2007 г.) и ЕР 1767537 (28 марта 2007 г.), все поданные компанией Cellzome Ltd.,межд. патентные заявкиWO 2008/031556 (UCB Pharma; 20 марта 2008 г.), WO 2006/050965(Argenta; 18 мая 2006 г.) и WO 2007/072163 (Pfizer; 28 июня 2007 г.). Однако остается потребность в эффективных модуляторах гистаминового рецептора H4 с желаемыми фармацевтическими свойствами. В контексте настоящего изобретения было обнаружено, что ряд диаминопиридиновых, пиримидиновых и пиридазиновых производных обладают модулирующей активностью в отношении гистаминового рецептора Н 4. Краткое описание изобретения Один аспект настоящего изобретения относится к соединениям формулы (I) где Z представляет собой СН или N;Y представляет собой СН или N;Z и Y определяются независимо друг от друга, и содержащее упомянутые Y и Z кольцо имеет не более двух атомов азота; при условии, чтоi) когда Y представляет собой СН и Z представляет собой СН или N, то R1 представляет собой: а) -(СН 2)2 ОСН 3, -(CH2)2SCH3 или C1-8 алкил, каждый из которых независимо не замещен или замещен -ОН или CF3; б) -(СН 2)0-2-Ar1, -CHR2-Ar1 или -(СН 2)0-2-Ar2, причем каждый из упомянутых Ar1 и Ar2 независимо не замещен или замещен галогеном, -СН 3 или -ОСН 3,Ar1 представляет собой 6-членное ароматическое карбоциклическое кольцо,Ar2 представляет собой 5- или 6-членное гетероароматическое кольцо, содержащее N, S или О; или в) C3-12 циклоалкил, -(СН 2)-(моноциклический C3-8 циклоалкил), -(CHR2)-(моноциклический C3-8 циклоалкил), -(CH2)0-1-тетрагидрофуранил или -(СН 2)0-1-тетрагидропиранил, причем каждый из упомянутых циклоалкильных фрагментов независимо не замещен или замещен одним, двумя или тремя C1-4 алкильными заместителями; бицикло[2.2.1]гепт-2-илметил, (6,6-диметилбицикло[3.1.1]гепт-2-ил)метил; где Ra, Rb и Rc, каждый независимо, представляет собой H или C1-3 алкил; при условии, что,если R1 представляет собой изопропил, то Rc представляет собой метил; если R1 представляет собой 4-метилфенил, то Rc представляет собой метил; когда Z представляет собой N, Y представляет собой CH и R1 представляет собой бензил, незамещенный или замещенный галогеном, то Rc представляет собой метил;ii) когда Y представляет собой N и Z представляет собой CH, то R1 представляет собой: а) -(СН 2)2 ОСН 3, -(CH2)2SCH3 или C1-8 алкил, каждый из которых независимо не замещен или замещен -OH или -CF3; б) - (CH2)0-2-Ar1, -CHR2Ar1, - (CH2)0-2-Ar2, причем каждый из упомянутых Ar1 и Ar2 независимо не замещен или замещен галогеном, -CH3, -ОСН 3,Ar1 представляет собой 6-членное ароматическое карбоциклическое кольцо,Ar2 представляет собой 5- или 6-членное гетероароматическое кольцо, содержащее N, S или О; или в) C3-12 циклоалкил, -(СН 2)-(моноциклический C3-8 циклоалкил), -(CHR2)-(моноциклический C3-8 циклоалкил), -(СН 2)0-1-тетрагидрофуранил и -(CH2)0-1-тетрагидропиранил, причем каждый из упомянутых фрагментов не замещен или замещен одним, двумя или тремя C1-4 алкильными заместителями; бицикло[2.2.1]гепт-2-илметил, (6,6-диметилбицикло[3.1.1]гепт-2-ил)метил; где Ra, Rb и Rc, каждый независимо, представляет собой H или C1-3 алкил. В других осуществлениях настоящее изобретение относится к соединениям формулы (I), где Y представляет собой CH и Z представляет собой СН или N. В дальнейших осуществлениях настоящее изобретение относится к соединениям формулы (I), где Y представляет собой N и Z представляет собой СН. В дальнейших осуществлениях настоящее изобретение относится к фармацевтически приемлемым солям соединений формулы (I), фармацевтически приемлемым пролекарствам и фармацевтически активных метаболитам. В ряде вариантов осуществления настоящего изобретения соединение формулы (I) представляет собой соединение, выбираемое из соединений, описанных или проиллюстрированных в приведенном ниже подробном описании. В дальнейшем аспекте настоящее изобретение относится к фармацевтическим композициям для лечения заболевания, расстройства или патологического состояния, опосредованного активностью гистаминового рецептора H4, в состав которых входит эффективное количество по меньшей мере одного из химических соединений, выбираемых из соединений формулы (I), фармацевтически приемлемых солей,фармацевтически приемлемых пролекарств и фармацевтически активных метаболитов. В состав соответствующих целям настоящего изобретения фармацевтических композиций может также входить фармацевтически приемлемый наполнитель. В другом аспекте настоящее изобретение направлено на способ лечения пациента, который страдает от или у которого диагностировано заболевание, расстройство или патологическое состояние, опосредованное активностью гистаминового рецептора H4, включающий введение нуждающемуся в подобном лечении пациенту эффективного количества по меньшей мере одного из химических соединений, выбираемых из соединений формулы (I), фармацевтически приемлемых солей, фармацевтически приемлемых пролекарств и фармацевтически активных метаболитов. В ряде предпочтительных осуществлений способа, составляющего предмет настоящего изобретения, упомянутые заболевание, расстройство или патологическое состояние представляют собой воспаление. Используемый в настоящей заявке термин "воспаление" относится к реакции, которая развивается в-5 018198 ответ на высвобождение гистамина, которое, в свою очередь, вызывается по меньшей мере одним стимулом. Примерами подобных стимулов являются иммунологические стимулы и неиммунологические стимулы. В другом аспекте химические осуществления настоящего изобретения могут найти применение в качестве модуляторов гистаминового рецептора H4. Таким образом, настоящее изобретение направлено на способ модуляции активности гистаминового рецептора H4, включая ситуации, когда подобный рецептор находится в организме пациента, включающий воздействие на гистаминовый рецептор H4 эффективного количества по меньшей мере одного из химических соединений, выбираемых из соединений формулы (I), фармацевтически приемлемых солей, фармацевтически приемлемых пролекарств и фармацевтически активных метаболитов. Целью настоящего изобретения является преодоление или смягчение по меньшей мере одного из недостатков стандартных методологий и (или) известных способов, либо предоставление полезных альтернатив для последних. Дополнительные варианты осуществления изобретения, особенности и достоинства изобретения станут понятны из приведенного далее подробного описания и практического осуществления изобретения. Подробное описание изобретения и предпочтительные варианты его осуществления Содержание всех цитируемых по ходу письменного изложения заявки источников, включая, помимо прочего, патенты и заявки на патенты, полностью включено в настоящую заявку путем ссылки. Термины "включающий", "содержащий", "состоящий" используются в настоящем документе в их открытом, неограниченном значении. Используемый в настоящей заявке термин "алкил" относится к алкильной группе с линейной или разветвленной цепью, содержащей от 1 до 12 атомов углерода. Примеры алкильных групп включают следующие группы: метил (Me), этил (Et), н-пропил, изопропил, бутил, изобутил, втор-бутил, трет-бутил(tBu), пентил, изопентил, трет-пентил, гексил, изогексил, а также группы, которые в свете общепринятых знаний, ожидаемых от специалиста в данной области, и приведенных в настоящей заявке описаний могут считаться эквивалентными одному из вышеприведенных примеров. Используемый в настоящей заявке термин "циклоалкил" относится к насыщенному или частично насыщенному карбоциклу, такому как моноциклический, конденсированный полициклический, мостиковый моноциклический, мостиковый полициклический или спирополициклический карбоцикл, содержащему от 3 до 12 атомов углерода на карбоцикл. Если термин "циклоалкил" уточняется конкретным модификатором, таким как "моноциклический", "конденсированный полициклический", "мостиковый полициклический" или "спирополициклический", то используемый термин "циклоалкил" относится только к охарактеризованному таким образом карбоциклу. Типичные примеры циклоалкильных групп включают следующие фрагменты, в виде соответствующим образом связанных фрагментов: Используемый в настоящей заявке термин "гетероциклоалкил" относится к моноциклической либо конденсированной, мостиковой или спиро-полициклической кольцевой структуре, которая является насыщенной или частично насыщенной и содержит от 3 до 12 кольцевых атомов на кольцевую структуру,выбираемых из атомов углерода, и до трех гетероатомов, выбираемых из азота, кислорода и серы. Упомянутая кольцевая структура может также содержать до двух оксогрупп на углеродных или серных членах кольца. Типичные примеры в виде соответствующим образом связанных фрагментов включают в себя:-6 018198 Используемый в настоящей заявке термин "гетероарил" означает моноциклический, конденсированный бициклический или конденсированный полициклический ароматический гетероцикл (кольцевую структуру, имеющую в кольце атомы, выбираемые из атомов углерода и до четырех гетероатомов, выбираемых из азота, кислорода и серы), содержащий от 3 до 12 кольцевых атомов на гетероцикл. Типичные примеры гетероарильных групп включают в себя следующие фрагменты, в виде соответствующим образом связанных фрагментов: Специалисты в данной области определят, что перечисленные или проиллюстрированные выше гетероарильные, циклоалкильные и гетероциклоалкильные группы не исчерпывают все возможности, и в рамках целей настоящего изобретения могут быть выбраны и иные группы указанных типов. Используемый в настоящей заявке термин "галоген" означает хлор, фтор, бром или йод. Используемый в настоящей заявке термин "гало" означает хлор-, фтор-, бром- или йод-. Используемый в настоящей заявке термин "замещенный" означает, что указанная функциональная группа или фрагмент замещены одним или несколькими заместителями. Используемый в настоящей заявке термин "незамещенный" означает, что указанная группа не имеет заместителей. Используемый в настоящей заявке термин "дополнительно замещенный" означает, что указанная группа либо не имеет заместителей, либо замещена одним или несколькими заместителями. Если термин "замещенный" используется для описания структурной системы, это значит, что замещение производится по любому допускаемому валентностью положению системы. Каждая формула из приведенных в настоящей заявке формул представляет как соединения со структурами, показанными данной структурной формулой, так и некоторые вариации или формы подобных структур. В частности, соединения по любой из приведенных в настоящей заявке формул могут иметь асимметричные центры и поэтому существовать в различных энантиомерных формах. Все оптические изомеры и стереоизомеры соединений по приведенной общей формуле, а также любые их смеси,считаются представленными в рамках данной формулы. Таким образом, любая приводимая в настоящей заявке формула представляет рацемат, одну или несколько энантиомерных форм, одну или несколько диастереомерных форм, одну или несколько атропизомерных форм указанного соединения, а также их смеси. Кроме того, некоторые структуры могут существовать в форме геометрических изомеров (например, цис- и транс-изомеры), в форме таутомеров или в форме атропизомеров. Кроме того, каждая приведенная в настоящей заявке формула, помимо собственно соединения, также относится к его гидратам,сольватам и полиморфам, а также их смесям, даже если такие формы не указаны явно. В ряде осуществлений растворитель представляет собой воду, а сольваты являются гидратами. Для большей сжатости описания ряд приводимых в настоящей заявке количественных выражений дается без модификатора "приблизительно". Подразумевается, что независимо от того, указывается ли модификатор "приблизительно" явным образом или нет, каждое приводимое в настоящей заявке численное значение относится к конкретному приведенному значению, а также к приближению к данному приведенному значению, которое может быть разумным образом оценено любым специалистом, включая эквиваленты и приближения, связанные с условиями проведения эксперимента и (или) измерения для подобного приведенного значения. При указании выхода соединения в процентах приводимый выход относится к массе соединения, для которого указывается выход, по отношению к максимально достижимому количеству данного соединения в конкретных стехиометрических условиях. Если не указано иное,приводимые в процентах концентрации относятся к массовым соотношениям. Упоминание химического соединения в настоящей заявке означает отсылку к любому из следующего: (а) буквально указанной форме данного соединения, и (б) любой форме упомянутого соединения в той среде, где данное соединение находится на момент упоминания. Например, упоминание в настоящей заявке такого соединения, как R-COOH, включает отсылку к любой, например, из следующих форм: RCOOH(S), R-COOH(sol) и R-COO-(sol). В приведенном примере R-COOH(S) относится к твердому соединению, например, в виде таблетки или иной твердой фармацевтической формы или композиции; RCOOH(sol) относится к недиссоциированной форме соединения в растворителе; и R-COO-(sol) относится к диссоциированной форме соединения в растворителе, такой как диссоциированная форма соединения в водной среде, независимо от того, получена ли данная диссоциированная форма из R-COOH, из его соли-7 018198 или из любой другой структурной единицы, которые дают R-COO- при диссоциации в рассматриваемой среде. В другом примере такое выражение, как "действие на химическое соединение соединением по формуле R-COOH", означает действие на упомянутое химическое соединение формой или формами соединения R-COOH, которая существует или которые существуют в той среде, где производится описываемое воздействие. В этой связи, если подобное химическое соединение находится, например, в водной среде, подразумевается, что упомянутое соединение R-COOH находится в той же среде, и поэтому на упомянутое химическое соединение действуют такие реагенты, как R-COOH(aq) и (или) R-COO-(aq), где нижний индекс "(aq)" означает "водный" в соответствии с его общепринятым значением в химии и биохимии. В описанных примерах используемой номенклатуры применяется карбоксильная функциональная группа, однако этот выбор ни в коей мере не является ограничением и был сделан только для иллюстрации. Подразумевается, что аналогичные примеры могут быть приведены и для иных функциональных групп, включая, помимо прочего, такие группы, как гидроксильная группа, азотная основная группа,например, в аминах, а также любые другие группы, которые известным образом взаимодействуют или перестраиваются в содержащей данное соединение среде. Подобные взаимодействия и перестройки включают, помимо прочего, диссоциацию, ассоциацию, таутомеризм, сольволиз, включая гидролиз,сольватацию, включая гидратацию, протонирование и депротонирование. В настоящей заявке не приводится дальнейших примеров в этой связи, поскольку возможные взаимодействия и перестройки в каждой конкретной среде хорошо известны специалистам в данной области. Каждая из приведенных в настоящей заявке формул также представляет как немеченые, так и изотопно-меченные формы соответствующих соединений. Изотопно-меченные соединения имеют структуры, соответствующие представленным в настоящей заявке формулам, за исключением того, что один или более атомов в них заменены атомом, имеющим определенную атомную массу или массовое число. Примеры изотопов, которые могут быть введены в соединения настоящего изобретения, включают изотопы водорода, углерода, азота, кислорода, фосфора, фтора, хлора и йода, такие как 2 Н, 3 Н, 11 С, 13 С, 14 С,15N, 18O, 17O, 31 Р, 32 Р, 35S, 18F, 36Cl и 125I, соответственно. Подобные изотопно-меченные соединения полезны при изучении метаболизма (предпочтительно с использованием 14 С), кинетики реакций (например,с использованием 2 Н или 3 Н), для способов детектирования или получения изображений [таких как позитронно-эмиссионная томография (PET) или однофотонная эмиссионная компьютерная томография(SPECT)], включая анализ распределения лекарства или субстрата по тканям, или при радиотерапии пациентов. В частности, соединения, меченные 18F или 11 С, могут оказаться особенно предпочтительными для исследований способами PET или SPECT. Кроме того, замещение более тяжелыми изотопами, такими как дейтерий (т.е. 2 Н), может дать определенные терапевтические преимущества, как следствие большей метаболической стабильности соединений, например, повышенный период полувыведения invivo или снижение необходимой дозировки. Изотопно-меченные соединения по настоящему изобретению и их пролекарства могут быть, как правило, получены путем осуществления процедур согласно схемам или примерам и способам получения, описанным ниже, путем замены не содержащего меченых атомов реагента на легкодоступный реагент с мечеными атомами. При обсуждении любой приведенной в настоящей заявке формулы выбор конкретного фрагмента из списка возможных вариантов для конкретной химической переменной не означает фиксирование такого выбора фрагмента для данной переменной в других формулах. Другими словами, если какая-либо химическая переменная присутствует в формуле более чем в одном месте, выбор варианта для нее из списка возможных в одном месте не зависит от выбора варианта для той же переменной в другом месте формулы, если не указано иное. В качестве первого примера по используемой для обозначения заместителей терминологии, если заместитель S1 пример представляет собой один из S1 и S2 и заместитель S2 пример представляет собой один изS3 и S4, то указанные выборы заместителей относятся к осуществлениям настоящего изобретения со следующими наборами заместителей: S1 пример представляет собой S1 и S2 пример представляет собой S3;S1 пример представляет собой S1 и S2 пример представляет собой S4; S1 пример представляет собой S2 и S2 пример представляет собой S3; S1 пример представляет собой S2 и S2 пример представляет собой S4; а также эквиваленты каждого из перечисленных наборов заместителей. Поэтому для краткости изложения без ограничения общности в настоящей заявке используется сокращенная терминология: "S1 пример представляет собой один из S1 и S2, а S2 пример представляет собой один из S3 и S4". Приведенный выше первый пример по используемой для обозначения заместителей терминологии, данный в общих терминах, иллюстрирует различные варианты обозначения заместителей, описанные в настоящей заявке. Описанный выше способ обозначения заместителей распространяется, если применимо, на такие группы, как R1-4, Ra-c и Z, а также на любые другие общие обозначения заместителей, используемых в настоящей заявке. Кроме того, если для любого участника химической структуры или заместителя приводится более чем один вариант, варианты осуществления настоящего изобретения включают различные независимые сочетания вариантов из списков возможных заместителей, а также их эквиваленты. В качестве второго примера по используемой для обозначения заместителей терминологии, если в настоящей заявке указано, что заместитель Sпример представляет собой один из S1, S2 и S3, данный перечень включает варианты осуществления настоящего изобретения, в которых Sпример представляет собой S1; Sпример представляет-8 018198 собой S2; Sпример представляет собой S3; Sпример представляет собой один из S1 и S2; Sпример представляет собой один из S1 и S3; Sпример представляет собой один из S2 и S3; Sпример представляет собой один из S1, S2 и S3; и Sпример представляет собой любой эквивалент каждого из перечисленных вариантов. Поэтому для краткости изложения без ограничения общности в настоящей заявке используется сокращенная терминология: "Sпример представляет собой один из S1, S2 и S3". Приведенный выше второй пример по используемой для обозначения заместителей терминологии, данный в общих терминах, иллюстрирует различные варианты обозначения заместителей, описанные в настоящей заявке. Описанный выше способ обозначения заместителей распространяется, если применимо, на такие группы, как R1-4, Ra-c и Z, а также на любые другие общие обозначения заместителей, используемых в настоящей заявке. Номенклатура "Ci-j,", где ji, используемая в настоящей заявке для обозначения класса заместителей, включает варианты осуществления настоящего изобретения, для которых индивидуально реализовано каждое и все возможные количества атомов углерода, от i до j, включая i и j. В качестве примера термин "C1-3" относится независимо к вариантам осуществления, в которых имеется один атом углерода(C1), вариантам осуществления, в которых имеются два атома углерода (С 2), и вариантам осуществления,в которых имеются три атома углерода (C3). Используемый в настоящей заявке термин "Cn-m алкил" означает линейную или разветвленную алифатическую цепь с полным количеством N углеродных центров в цепи, удовлетворяющей условиюnNm, где mn. Любое упоминание в настоящей заявке дивалентного заместителя включает различные варианты присоединения упомянутого заместителя, если имеется более одной такой возможности. Например, упоминание дивалентного заместителя -A-B-, где AB, в настоящей заявке относится к такому дивалентному заместителю -A-B-, где фрагмент A присоединяется к первому замещаемому центру и фрагмент B присоединяется ко второму замещаемому центру, а также к такому дивалентному заместителю -A-B-, где фрагмент A присоединяется ко второму замещаемому центру и фрагмент B присоединяется к первому замещаемому центру. В соответствии с приведенными выше соображениями по обозначению заместителей и используемой номенклатуре подразумевается, что в настоящей заявке явное упоминание некоторого набора возможностей означает, при наличии химического смысла и если не указано иное, независимую отсылку ко всем возможным вариантам осуществления данного набора, а также отсылку ко всем и каждому возможному варианту осуществления подмножеств явно указанного набора возможных вариантов. Некоторые осуществления настоящего изобретения даются соединениями формулы (I), где Y представляет собой CH, Z представляет собой CH или N, и R1 представляет собой C1-8 алкил (незамещенный или замещенный -OH или -CF3), фенил, пиридил, бензил, пиридин-2-илметил, фенилэтил, 1-фенилэтил(каждый из которых независимо не замещен или замещен галогеном, -CH3, -ОСН 3, C3-12 циклоалкил,-(СН 2)-(моноциклический C3-8 циклоалкил), -(CHR2)-(моноциклический C3-8 циклоалкил), -(CH2)0-1 тетрагидрофуранил и -(CH2)0-1-тетрагидропиранил, каждый из которых независимо не замещен или замещен одним, двумя или тремя C1-4 алкильными заместителями; бицикло[2.2.1]гепт-2-илметил, (6,6-диметилбицикло[3.1.1]гепт-2-ил)метил. В ряде таких осуществлений R1 представляет собой 2,2-диметилпропанол, 2,2-диметилпропан-1-ол,2,2-диметилпропил, 2-метил-1-пропан-2-ол, 2-метилпропан-2-ол, 3-пропанол, (1-метилэтил), 2,2-диметилпропил, 2-метоксиэтил, 2-метилпропил, 4,4,4-трифторбутил, пропил, бутил, трет-бутил, пропан-1-ол,2-(метилсульфанил)этил, 2-фенилэтил, фуран-3-илметил, пиридин-2-илметил, (1R)-1-фенилэтил, бензил,фенил, 4-фторбензил, 4-метоксибензил, 4-метилбензил, бицикло[2.2.1]гепт-2-илметил, тетрагидро-2 Нпиран-4-ил, тетрагидрофуран-2-илметил, (1R,2R,3R,5S)-2,6,6-триметилбицикло[3.1.1]гепт-3-ил, (1R,2S,4R)-1,7,7-триметилбицикло[2.2.1]гепт-2-ил,(1S,2S,3S,5R)-2,6,6-триметилбицикло[3.1.1]гепт-3-ил,(1S,2S,4R)-бицикло[2.2.1]гепт-2-ил, (1S,5R)-2,6,6-триметилбицикло[3.1.1]гепт-3-ил, (2R)-тетрагидрофуран-2-илметил, (2S)-бицикло[2.2.1]гепт-2-ил], (2S)-тетрагидрофуран-2-илметил, (3R)-тетрагидрофуран-3-ил, (6,6-диметилбицикло[3.1.1]гепт-2-ил) метил, бицикло[2.2.1]гепт-2-ил, циклобутил, циклогексил, циклопентил, циклопропил, циклогексилметил, циклопентилметил, циклопропилметил, адамантан-1-ил, 2-адамантил, бицикло[2.2.1]гепт-2-ил или (6,6-диметилбицикло[3.1.1]гепт-2-ил)-метил. В ряде осуществлений настоящего изобретения, где Y представляет собой фрагмент СН и Z представляет собой CH или N, R1 представляет собой В ряде осуществлений настоящего изобретения, где Y представляет собой СН и Z представляет собой СН или N,представляет собой В ряде осуществлений настоящего изобретения, где Y представляет собой СН и Z представляет собой СН или N,представляет собой В ряде осуществлений настоящего изобретения, где Y представляет собой СН и Z представляет собой СН или N, представляет собой В ряде осуществлений настоящего изобретения, где Y представляет собой СН и Z представляет собой СН или N, представляет собой В ряде осуществлений настоящего изобретения, где Y представляет собой СН и Z представляет собой СН или N,представляет собой В ряде осуществлений настоящего изобретения, где Y представляет собой СН и Z представляет собой СН или N,представляет собой В ряде осуществлений настоящего изобретения, где Y представляет собой CH и Z представляет собой CH или N, Ra представляет собой Н. В ряде осуществлений настоящего изобретения, где Y представляет собой CH и Z представляет собой CH или N, Rb представляет собой Н или метил. В ряде осуществлений настоящего изобретения, где Y представляет собой CH и Z представляет собой CH или N, Rc представляет собой Н или метил. В ряде осуществлений настоящего изобретения, где Y представляет собой CH и Z представляет собой CH или N, R2 представляет собой -CH3. В ряде осуществлений настоящего изобретения Y и Z представляют собой СН. В ряде осуществлений настоящего изобретения Y и Z представляют собой атомы N. Некоторые дальнейшие осуществления настоящего изобретения представлены соединениями формулы (I), где Y представляет собой N, Z представляет собой CH, и R1 представляет собой C1-8 алкил (незамещенный или замещенный -OH или -CF3, фенил, пиридил, бензил, пиридин-2-илметил, фенилэтил, 1 фенилэтил (каждый из которых независимо не замещен или замещен галогеном, -CH3, -ОСН 3, C3-12 циклоалкил, -(СН 2)-(моноциклический C3-8 циклоалкил), -(CHR2)-(моноциклический C3-8 циклоалкил),-(CH2)0-1-тетрагидрофуранил и -(CH2)0-1-тетрагидропиранил, каждый из которых независимо не замещен или замещен одним, двумя или тремя C1-4 алкильными заместителями; бицикло[2.2.1]гепт-2-илметил,(6,6-диметилбицикло[3.1.1]гепт-2-ил)метил. В ряде таких осуществлений R1 представляет собой 2,2-диметилпропанол, 2,2-диметилпропан-1-ол,2,2-диметилпропил, 2-метил-1-пропан-2-ол, 2-метилпропан-2-ол, 3-пропанол, (1-метилэтил), 2,2 диметилпропил, 2-метоксиэтил, 2-метилпропил, 4,4,4-трифторбутил, пропил, бутил, трет-бутил, пропан 1-ол, 2-(метилсульфанил)этил, 2-фенилэтил, фуран-3-илметил, пиридин-2-илметил, (1R)-1-фенилэтил,- 10018198 бензил, фенил, 4-фторбензил, 4-метоксибензил, 4-метилбензил, бицикло[2.2.1]гепт-2-илметил, тетрагидро-2H-пиран-4-ил, тетрагидрофуран-2-илметил, (1R,2R,3R,5S)-2,6,6-триметилбицикло[3.1.1]гепт-3-ил,(1R,2S,4R)-1,7,7-триметилбицикло[2.2.1]гепт-2-ил, (1S,2S,3S,5R)-2,6,6-триметилбицикло[3.1.1]гепт-3-ил,(1S,2S,4R)-бицикло[2.2.1]гепт-2-ил, (1S, 5R)-2,6,6-триметилбицикло[3.1.1]гепт-3-ил, (2R)-тетрагидрофуран-2-илметил, (2S)-бицикло[2.2.1]гепт-2-ил], [(2S)-тетрагидрофуран-2-илметил, (3R)-тетрагидрофуран-3-ил, (6,6-диметилбицикло[3.1.1]гепт-2-ил)метил, бицикло[2.2.1]гепт-2-ил, циклобутил, циклогексил, циклопентил, циклопропил, циклогексилметил, циклопентилметил, циклопропилметил, адамантан 1-ил, 2-адамантил, бицикло[2.2.1]гепт-2-ил или (6,6-диметилбицикло[3.1.1]гепт-2-ил)метил. В ряде осуществлений настоящего изобретения, где Y представляет собой N и Z представляет собой фрагмент CH, R1 представляет собой В ряде осуществлений настоящего изобретения, где Y представляет собой N и Z представляет собой СН,представляет собой В ряде осуществлений настоящего изобретения, где Y представляет собой N и Z представляет собой СН,представляет собой В ряде осуществлений настоящего изобретения, где Y представляет собой N и Z представляет собой СН,представляет собой В ряде осуществлений настоящего изобретения, где Y представляет собой N, и Z представляет собой СН,представляет собой В ряде осуществлений настоящего изобретения, где Y представляет собой N и Z представляет собой СН,представляет собой В ряде осуществлений настоящего изобретения, где Y представляет собой N и Z представляет собой СН,представляет собой В ряде осуществлений настоящего изобретения, где Y представляет собой N и Z представляет собойCH, Ra представляет собой Н. В ряде осуществлений настоящего изобретения, где Y представляет собой N и Z представляет собой- 11018198 В ряде осуществлений настоящего изобретения, где Y представляет собой N и Z представляет собойCH, Rc представляет собой Н или метил. В ряде осуществлений настоящего изобретения, где Y представляет собой N и Z представляет собойCH, R2 представляет собой -CH3. В ряде осуществлений настоящего изобретения, где Y представляет собой N, и Z представляет собой CH. Настоящее изобретение также включает фармацевтически приемлемые соли соединений, представляемых формулой (I), предпочтительно соединений, описанных выше, и тех конкретных соединений,которые перечислены в настоящей заявке, а также способы применения упомянутых солей. Термин "фармацевтически приемлемая соль" означает соль свободной кислоты или основание соединения, представленного формулой (I), которая является нетоксичной, биологически переносимой или иным образом биологически допустимой для назначения пациенту. Для общей информации см. работуG.S. Paulekuhn, et al., "Trends in Active Pharmaceutical Ingredient Salt Selection based on Analysis of the Orange Book Database" (Дж.С. Полекун и др. "Тенденции в выборе активных фармацевтических ингредиентов солей на основании анализа базы данных "Оранжевой книги"), J. Med. Chem., 2007, 50:6665-72, S.M.Berge, et al., "Pharmaceutical Salts" (С.М. Берг и др. "Фармацевтические соли"), J. Pharm Sci., 1977, 66:119, и Справочник фармацевтических солей, свойства, выбор и применение, Stahl and Wermuth, Eds.,Wiley-VCH and VHCA, Zurich, 2002. Примерами фармацевтически приемлемых солей являются соли,которые имеют фармакологический эффект и допустимы для контакта с тканями пациентов без чрезмерной раздражающей, токсической или аллергической реакции. Соединение формулы (I) может иметь в достаточной степени кислую группу, в достаточной степени основную группу или оба типа функциональных групп и вступать в соответствующие реакции с рядом неорганических или органических оснований, а также неорганических или органических кислот с образованием фармацевтически приемлемых солей. Примеры фармацевтически приемлемых солей включают следующие соли: сульфаты, пиросульфаты, бисульфаты, сульфиты, бисульфиты, фосфаты, моногидрогенфосфаты, дигидрогенфосфаты, метафосфаты, пирофосфаты, хлориды, бромиды, йодиды, ацетаты, пропионаты, деканоаты, каприлаты, акрилаты, формиаты, изобутираты, капроаты, гептаноаты, пропиолаты, оксалаты, малонаты, сукцинаты, субераты, себакаты, фумараты, малеаты, бутин-1,4-диоаты, гексин-1,6-диоаты, бензоаты, хлорбензоаты,метилбензоаты, динитробензоаты, гидроксибензоаты, метоксибензоаты, фталаты, сульфонаты, ксиленсульфонаты, фенилацетаты, фенилпропионаты, фенилбутираты, цитраты, лактаты, -гидроксибутираты,гликоляты, тартраты, метансульфонаты, пропансульфонаты, нафталин-1-сульфонаты, нафталин-2 сульфонаты и манделаты. Если соединение формулы (I) содержит основный атом азота, то желательная фармацевтически приемлемая соль может быть получена по любой соответствующей известной специалистам методике,например, обработкой свободного основания неорганической кислотой, такой как хлористоводородная кислота, бромистоводородная кислота, серная кислота, сульфаминовая кислота, азотная кислота, борная кислота, фосфорная кислота и им подобные, или органической кислотой, такой как уксусная кислота,фенилуксусная кислота, пропионовая кислота, стеариновая кислота, молочная кислота, аскорбиновая кислота, малеиновая кислота, гидроксималеиновая кислота, изэтионовая кислота, янтарная кислота, валериановая кислота, фумаровая кислота, малоновая кислота, пировиноградная кислота, щавелевая кислота, гликолевая кислота, салициловая кислота, олеиновая кислота, пальмитиновая кислота, лауриновая кислота, пиранозидиловой кислотой, такой как глюкуроновая кислота или галактуроновая кислота, альфа-гидроксикислотой, такой как миндальная кислота, лимонная кислота или винная кислота, аминокислотой, такой как аспарагиновая кислота, глутаровая или глутаминовая кислота, ароматической кислотой,такой как бензойная кислота, 2-ацетоксибензойная кислота, нафтойная кислота или коричная кислота,сульфоновой кислотой, такой как лаурилсульфоновая кислота, п-толуолсульфоновая кислота, метансульфоновая кислота, этансульфоновая кислота, любой совместимой смесью кислот, таких как приведенные в примерах настоящего документа, и любой иной кислотой или смесью кислот, которые рассматриваются как эквивалентные или приемлемые заменители в свете в данной технологии. Если соединение формулы (I) содержит более одного основного атома азота, специалист в данной области определит, что соответствующие целям настоящего изобретения соли включают в себя соли,образованные с одним или более эквивалентом неорганической или органической кислоты. В предпочтительных осуществлениях формулы (I) подобные соли включают в себя бис-гидрохлоридные соли. Если соединение формулы (I) является кислотой, такой как карбоновая кислота или сульфоновая кислота, то желательная фармацевтически приемлемая соль может быть получена любым подходящим способом, например, обработкой свободной кислоты неорганическим или органическим основанием,таким как амин (первичный, вторичный или третичный), гидроксид щелочного металла, гидроксид щелочноземельного металла, любой совместимой смесью оснований, таких как приведенные в примерах настоящего документа, и любым иным основанием и смесью оснований, которые рассматриваются как эквивалентные или приемлемые заменители в свете данной технологии. Характерные примеры соответствующих солей включают в себя органические соли (производные аминокислот), таких как N-метил-Dглюкамин, лизин, холин, глицин и аргинин, аммониевые соли, карбонаты, бикарбонаты, первичные, вто- 12018198 ричные и третичные амины, и циклические амины, такие как трометамин, бензиламины, пирролидины,пиперидин, морфолин и пиперазин, и неорганические соли - производные натрия, кальция, калия, магния, марганца, железа, меди, цинка, алюминия и лития. Настоящее изобретение также относится к фармацевтически приемлемым пролекарствам соединений формулы (I) и способам с использованием подобных фармацевтически приемлемых пролекарств. Используемый в настоящей заявке термин "пролекарство" означает предшественника указанного соединения, который после назначения пациенту дает соединение in vivo посредством химического или физиологического процесса, такого как сольволиз или ферментативное расщепление, или при физиологических условиях (например, пролекарство, приведенное к определенному физиологическому значению рН,превращается в соединение формулы (I. "Фармацевтически приемлемое пролекарство" означает пролекарство, которое является нетоксичным, биологически переносимым и иным образом биологически допустимым для назначения пациенту. Характерные процедуры выбора и получения соответствующих целям настоящего изобретения производных-пролекарств описаны, например, в книге "Design of Prodrugs",ed. H. Bundgaard, Elsevier, 1985. Примеры пролекарств включают соединения, имеющие аминокислотный остаток или полипептидную цепочку из двух или более (например, двух, трех или четырех) аминокислотных остатков, ковалентно связанных через амидную или эфирную связь со свободной аминогруппой, гидроксигруппой или карбоксильной группой соединения формулы (I). Примеры аминокислотных остатков включают в себя двадцать существующих в природе аминокислот, которые обычно обозначаются тремя буквами, а также 4 гидроксипролин, гидроксилизин, демозин, изодемозин, 3-метилгистидин, норвалин, бета-аланин, гаммааминомасляная кислота, цитруллин гомоцистеин, гомосерин, орнитин и метионинсульфон. Дополнительные типы пролекарств могут быть получены, например, при использовании свободных карбоксильных групп структур формулы (I) для получения амидных или алкилэфирных производных. Примеры амидов включают производные аммония, первичных C1-6 алкиламинов и вторичных ди(C1-6 алкил)аминов. Вторичные амины включают 5- или 6-членные циклические гетероциклоалкильные или гетероарильные фрагменты. Примеры амидов включают производные аммония, первичных C1-3 алкиламинов и ди(C1-2 алкил)аминов. Примеры эфиров для целей настоящего изобретения включают C1-7 алкил,C5-7 циклоалкил, фенил и фенил(C1-6 алкил) эфиры. Предпочтительные эфиры включают в себя метиловые эфиры. Пролекарства также могут быть получены функционализацией свободных гидроксильных групп с использованием групп, включающих гемисукцинаты, фосфатные эфиры, диметиламиноацетаты и фосфорилоксиметилоксикарбонилы, в соответствии с процедурами, описанными в работе Fleisher et al., Adv.Drug Delivery Rev. 1996, 19, 115-130. Карбаматные производные гидрокси- и аминогрупп могут также давать пролекарства. Карбонатные производные, сульфонатные эфиры и сульфатные эфиры гидроксигрупп могут также давать пролекарства. Также для получения пролекарств возможна функционализация гидроксигрупп до (ацилокси)метил- и (ацилокси)этил эфиров, где ацильная группа может быть алкилэфиром, возможно, замещенным одной или более эфирными, амино или карбоксильными функциональными группами, или где упомянутая ацильная группа представляет собой эфир аминокислоты, как описано выше. Пролекарства этого типа можно получить, следуя процедурам, описанным в работе Robinsonet al., J. Med. Chem. 1996, 39, 10-18. Свободные аминогруппы могут также быть использованы для получения амидных, сульфонамидных или фосфонамидных производных. Все перечисленные фрагменты пролекарств могут иметь в своей структуре дополнительные функциональные группы, такие как эфирные, амино и карбоксильные группы. Настоящее изобретение также относится к фармацевтически активным метаболитам соединений формулы (I) и возможностям использования подобных метаболитов в способах, составляющих предмет настоящего изобретения. "Фармацевтически активный метаболит" означает фармакологически активный продукт метаболизма в организме соединения формулы (I) или его соли. Пролекарства и активные метаболиты соединения могут быть определены с помощью обычных способов, известных и доступных специалистам в данной области. См., например, работы Bertolini et al., J. Med. Chem. 1997, 40, 2011-2016;and Application of Prodrugs, Drug Design and Development (Krogsgaard-Larsen et al., eds., Harwood Academic Publishers, 1991). Соединения формулы (I) и их фармацевтически приемлемые соли, фармацевтически приемлемые пролекарства и фармацевтически активные метаболиты, по отдельности или в любых сочетаниях (собирательно именуемые "активные агенты"), составляющие предмет настоящего изобретения, могут найти применение в качестве модуляторов гистаминового рецептора H4 в способах настоящего изобретения. Подобные способы модуляции активности гистаминового рецептора H4 включают воздействие на гистаминовый рецептор H4 эффективного количества по меньшей мере одного из химических соединений,выбираемых из соединений формулы (I), фармацевтически приемлемых солей, фармацевтически приемлемых пролекарств и фармацевтически активных метаболитов. Осуществления настоящего изобретения ингибируют активность гистаминового рецептора Н 4. В ряде осуществлений настоящего изобретения, таких как описанные в настоящей заявке, упомяну- 13018198 тый гистаминовый рецептор H4 находится в теле пациента с заболеванием, расстройством или медицинским состоянием, опосредованным активностью гистаминового рецептора H4. Симптомы или болезненные состояния также охватываются терминами "медицинские состояния, расстройства или заболевания". Соответственно, настоящее изобретение относится к способам применения описываемых в настоящей заявке активных агентов для лечения пациентов, которые страдают от или у которых диагностировано заболевание, расстройство или медицинское состояние, опосредованное активностью гистаминового рецептора H4, такое как воспаление. Таким образом, активные агенты в соответствии с настоящим изобретением могут применяться в качестве противовоспалительных агентов. Активные агенты в соответствии с настоящим изобретением могут также применяться для лечения болевого синдрома. В ряде вариантов осуществления активный агент в соответствии с настоящим изобретением вводится для лечения воспаления. Воспаление может быть связано с различными заболеваниями, расстройствами и состояниями, такими как воспалительные расстройства, аллергические расстройства, дерматологические расстройства, аутоиммунные заболевания, лимфатические расстройства и иммунодефицитные расстройства, включая более конкретные состояния и заболевания, перечисленные ниже. В плане возникновения и развития воспаления, к воспалительным или опосредованным воспалением заболеваниям и состояниям помимо прочего относятся острое воспаление, аллергическое воспаление и хроническое воспаление. Лечение воспаления в соответствии с настоящим изобретением включает местное лечение, например, местное лечение таких состояний, как кожный зуд, аллергическая сыпь и атопический дерматит. Типичные примеры воспалений, для лечения которых может применяться модулирующий гистаминовый рецептор H4 агент, включают в себя воспаления, связанные с одним или несколькими из таких состояний, как аллергия, астма, синдром сухого глаза, хроническое обструктивное заболевание легких(COPD), атеросклероз, ревматоидный артрит (см. Ohki, E. et al. Biol. Pharm. Bull. 2007, 30(11), 2217-2220),множественный склероз, воспалительные заболевания кишечника (включая колит, болезнь Крона и язвенный колит), псориаз, прурит, чесотка, кожный зуд, атопический дерматит, аллергическая сыпь (крапивница), воспаление глаз (например, пост-хирургическое воспаление глаз), конъюнктивит, носовые полипы, аллергический ринит, носовой зуд, склеродермия, аутоиммунные заболевания щитовидной железы, послеоперационные спайки (см. заявку на патент США 2007/0185163), иммуно-опосредованный (1 типа) сахарный диабет и волчанка, которые характеризуются избыточным или затянутым во времени воспалением на одной из стадий заболевания. В рамках настоящего изобретения также предусматривается возможность лечения расстройств метаболизма, таких как сахарный диабет 2 типа. Возможность лечения других расстройств метаболизма, предусматриваемая в рамках настоящего изобретения, включает лечение хронической почечной недостаточности, гепатического холестаза и сахарного диабета. Другие ведущие к воспалению аутоиммунные заболевания включают следующие заболевания: тяжелую псевдопаралитическую миастению (Myasthenia gravis), аутоиммунные нейропатии, такие как синдром Гийана-Барре (Guillain-Barr), аутоиммунный увеит, аутоиммунную гемолитическую анемию, злокачественную анемию, аутоиммунную тромбоцитопению, височный артериит, антифосфолипидный синдром, васкулитиды, такие как грануломатоз Вегенера, болезнь Бехчета (Behcet), герпетиформный дерматит, пузырчатку обыкновенную, витилиго, первичный билиарный цирроз печени, аутоиммунный гепатит, аутоиммунный оофорит и орхит, аутоиммунное заболевание надпочечников, полимиозит, дерматомиозит, спондилоартропатии, такие как анкилозирующий спондилоартрит, и синдром Съергена. Зуд, для лечения которого может применяться агент, модулирующий гистаминовый рецептор H4 в соответствии с настоящим изобретением, включает зуд, который является симптомом аллергических кожных заболеваний (таких как атопический дерматит и крапивница). В рамках настоящего изобретения также предусматривается возможность лечения аффективных и тревожных расстройств. Примеры подобных аффективных расстройств включают большое депрессивное расстройство, биполярное аффективное расстройство, не поддающееся лечению большое депрессивное расстройство и не поддающееся лечению биполярное аффективное расстройство. Примеры подобных тревожных расстройств включают генерализованное тревожное расстройство, социофобии и посттравматическое стрессовое расстройство. В других осуществлениях активный агент в соответствии с настоящим изобретением вводится для лечения таких заболеваний, как аллергия, ревматоидный артрит, астма, аутоиммунные заболевания или зуд. Таким образом, упомянутые активные агенты могут применяться для лечения пациентов, которые страдают от или у которых диагностировано заболевание, расстройство или медицинское состояние,опосредованное активностью гистаминового рецептора H4. Используемый в настоящей заявке термин"лечить" или "лечение" относится к назначению активного агента или композиции в соответствии с настоящим изобретением пациенту для получения желательного терапевтического или профилактического эффекта посредством модуляции активности гистаминового рецептора H4. Лечение включает в себя обращение течения, улучшение, облегчение, замедление прогрессирования, уменьшение чувствительности или предотвращение заболевания, расстройства или состояния, или одного или более симптомов такого заболевания, расстройства или состояния, обусловленного активностью гистаминового рецептора H4.- 14018198 Используемый в настоящей заявке термин "пациент" относится к представителю млекопитающих, нуждающихся в обсуждаемом лечении, например к человеку. Предусматривается применение некоторых осуществлений настоящего изобретения в ветеринарии. "Модуляторы" включают одновременно и ингибиторы, и активаторы, где термин "ингибиторы" относится к соединениям, которые снижают, блокируют, инактивируют, ослабляют чувствительность или понижают уровень экспрессии или активность гистаминового рецептора H4, а "активаторы" представляют собой соединения, которые повышают, активируют, облегчают, усиливают чувствительность или повышают уровень экспрессии или активность гистаминового рецептора Н 4. В способах лечения в соответствии с настоящим изобретением пациентам, которые страдают от или у которых диагностировано заболевание, расстройство или медицинское состояние, вводят эффективное количество по меньшей мере одного активного агента в соответствии с настоящим изобретением. "Эффективное количество" означает количество или дозировку, достаточную для достижения в общем желательного терапевтического или профилактического эффекта для пациента, нуждающегося в таком лечении при указанном заболевании, расстройстве или состоянии. Эффективные количества или дозировки активных агентов в соответствии с настоящим изобретением могут быть определены стандартными способами, такими как моделирование, исследования с увеличением дозы или клинические испытания, а также путем принятия во внимания стандартных факторов, таких как способ или путь введения или доставки лекарства, фармакокинетика агента, степень тяжести и характер течения болезни, расстройства или состояния, текущая или предшествующая терапии пациента, состояние здоровья и реакция на лекарства пациента, а также здравый смысл лечащего врача. Типичная доза может находиться в диапазоне от приблизительно 0,001 до приблизительно 200 мг активного агента на кг веса тела пациента в день, предпочтительно от приблизительно 0,05 до приблизительно 100 мг/кг/день, или от приблизительно 0,1 до приблизительно 35 мг/кг/день, или от приблизительно 0,1 до приблизительно 10 мг/кг/день в виде однократной дозировки или дробного введения (например, два, три или четыре раза в день). Для пациента весом 70 кг типичный диапазон соответствующих дозировок составляет от приблизительно 1 до приблизительно 200 мг/день или от приблизительно 5 до приблизительно 50 мг/день. После улучшения состояния пациента, облегчения симптомов заболевания или расстройства дозировка может быть скорректирована для профилактического или поддерживающего лечения. Например,дозировка, частота введения или и то и другое могут быть снижены в зависимости от симптомов до уровня, при котором поддерживается желательный терапевтический или профилактический эффект от приема препарата. Разумеется, если симптомы облегчены до приемлемого уровня, лечение можно прекратить. Однако при наличии рецидивов симптомов пациенту может потребоваться долговременное периодическое лечение. Кроме того, активные агенты в соответствии с настоящим изобретением могут применяться в сочетании с дополнительными активными компонентами для лечения перечисленных выше состояний. Упомянутые дополнительные активные компоненты могут вводиться пациенту отдельно от активного агента формулы (I) или вводиться одновременно с подобным агентом в составе фармацевтической композиции согласно настоящему изобретению. В одном из примеров осуществления упомянутые активные компоненты представляют собой компоненты, для которых известна либо обнаружена эффективность в лечении состояний, расстройств или болезней, опосредованных активностью гистаминового рецептора H4,такие как другой модулятор гистаминового рецептора H4 или соединение с активностью против другой мишени, связанной с данным конкретным состоянием, расстройством или заболеванием. Упомянутое сочетание компонентов может служить для повышения эффективности (например, путем включения в состав данной комбинации соединения, повышающего эффективность или активность агента в соответствии с настоящим изобретением), ослабления одного или нескольких побочных эффектов или снижения требуемой дозировки активного агента в соответствии с настоящим изобретением. Применительно к модулированию целевого рецептора "эффективное количество" означает количество, достаточное для воздействия на активность подобного рецептора. Измерение активности целевого рецептора может быть выполнено стандартными аналитическими способами. Модуляция целевого рецептора может быть полезна в ряде обстоятельств, включая проведение анализов. Активные агенты по настоящему изобретению используются, самостоятельно или в сочетании с одним или несколькими дополнительными активными компонентами, для приготовления фармацевтических композиций, соответствующих целям настоящего изобретения. В состав соответствующей целям настоящего изобретения фармацевтической композиции входит (а) эффективное количество по меньшей мере одного активного агента в соответствии с настоящим изобретением; и, возможно, дополнительно(б) фармацевтически приемлемый наполнитель. Термин "фармацевтически приемлемый наполнитель" означает нетоксичное, биологически переносимое и по остальным параметрам биологически допустимое для введения пациенту вещество, такое как инертное вещество, добавляемое в фармакологическую композицию или иным образом используемое в качестве средства доставки, носителя или разбавителя для облегчения введения агента и совместимое с последним. Примеры наполнителей включают в себя карбонат кальция, фосфат кальция, различные сахара и типы крахмалов, производные целлюлозы, желатин, растительные масла и полиэтиленгликоли.- 15018198 Формы доставки фармацевтических композиций, содержащих одну или более единиц дозирования активных агентов, могут быть приготовлены с использованием соответствующих фармацевтических наполнителей и способов приготовления, известных специалистам сегодня или доступных в будущем. Описываемые композиции могут в соответствии с целями настоящего изобретения вводиться любым соответствующим путем, например, перорально, парентерально, ректально, местно, в глаза либо через ингалятор. Композиция может быть приготовлена в форме таблеток, капсул, саше, драже, порошков, гранул,пастилок, порошков для восстановления, жидких препаратов или суппозиториев. Предпочтительно композиции формулируются для внутривенного вливания, местного применения или перорального введения. Для перорального введения активные агенты в соответствии с настоящим изобретением могут быть приготовлены в форме таблеток или капсул, а также в форме раствора, эмульсии или суспензии. Для приготовления композиций для перорального введения активные компоненты могут вводиться в композиции в количествах, обеспечивающих дозировки, например, от приблизительно 0,05 до приблизительно 50 мг/кг/день, или от приблизительно 0,05 до приблизительно 20 мг/кг/день, или от приблизительно 0,1 до приблизительно 10 мг/кг/день. Таблетки для перорального введения могут включать активные компоненты, смешанные с совместимыми фармацевтически приемлемыми наполнителями, такими как разбавители, вещества для улучшения распадаемости таблеток, связывающие агенты, смазывающие вещества, подсластители, вкусовые добавки, красители и консерванты. Соответствующие инертные наполнители включают карбонаты натрия и кальция, фосфаты натрия и кальция, лактозу, крахмал, сахар, глюкозу, метилцеллюлозу, стеарат магния, маннит, сорбит и т.п. Примеры жидких наполнителей для орального введения включают этанол,глицерин, воду и т.п. Типичные компоненты для улучшения распадаемости таблеток включают крахмал,поливинилпирролидон (PVP), крахмала натрия гликолят, микрокристаллическую целлюлозу и альгиновую кислоту. Связывающие агенты могут включать крахмал и желатин. Функции смазывающего агента,если он присутствует, может выполнять стеарат магния, стеариновая кислота или тальк. При необходимости таблетки могут быть покрыты таким материалом, как глицерилмоностеарат или глицерилдистеарат, для замедления всасывания в желудочно-кишечном тракте или могут иметь энтеросолюбильную оболочку. Капсулы для перорального применения включают твердые и мягкие желатиновые капсулы. Для приготовления твердых желатиновых капсул активные компоненты могут быть смешаны с твердым, полужидким или жидким разбавителем. Мягкие желатиновые капсулы могут быть приготовлены путем смешивания активного компонента с водой, маслом, таким как арахисовое или оливковое масло, вазелиновым маслом, смесью моно- и диглицеридов короткоцепочечных жирных кислот, полиэтиленгликолем 400 или пропиленгликолем. Возможные жидкости для перорального применения включают суспензии, растворы, эмульсии или сиропы, либо могут быть лиофилизованы и поставляться в сухом виде для восстановления водой или иным соответствующим носителем перед использованием. В состав подобных жидких композиций могут входить следующие компоненты: фармацевтически приемлемые наполнители, такие как суспендирующие агенты (например, сорбит, метилцеллюлоза, альгинат натрия, желатин, гидроксиэтилцеллюлоза,карбоксиметилцеллюлоза, гелеобразный стеарат алюминия и т.д.); неводные носители, например масла(например, миндальное масло или фракционированное кокосовое масло), пропиленгликоль, этиловый спирт или вода; консерванты (например, метил- или пропил-п-гидроксибензоат или сорбиновая кислота); смачивающие агенты, такие как лецитин; а также, при необходимости, ароматизаторы или красители. Активные агенты, составляющие предмет настоящего изобретения, могут также вводиться пациенту непероральными путями. Например, композиции могут быть приготовлены в виде суппозиториев для ректального применения. В случае композиций для парентерального введения, включая внутривенное,внутримышечное, внутрибрюшинное или подкожное введение, агенты в соответствии с настоящим изобретением могут быть приготовлены в форме стерильных водных растворов или суспензий, с добавлением соответствующих растворов до получения требуемых значений pH и изотоничности, либо в виде парентерально приемлемого масла. Соответствующие жидкие носители включают раствор Рингера и изотонический раствор хлорида натрия. Подобные лекарственные формы могут быть приготовлены в виде однодозовой формы, такой как ампула или одноразовое приспособление для инъекций, в виде многодозовой формы, такой как флаконы, из которых может быть отобрано требуемое количество препарата, или в твердой форме или в форме первичного концентрата, который может быть использован для приготовления составов для инъекций. Характерные дозы для инъекций находятся в диапазоне от приблизительно 1 до 1000 мкг/кг/мин активного агента в виде смеси с фармацевтическим носителем в течение промежутка времени от нескольких минут до нескольких дней. Для местного применения агенты могут быть смешаны с фармацевтическим носителем в концентрации от приблизительно 0,1% до приблизительно 10% препарата в носителе. Другой способ введения агентов, составляющих предмет настоящего изобретения, может включать использование пластырей для трансдермальной доставки препарата.- 16018198 Альтернативно в целях настоящего изобретения активные агенты могут вводиться путем ингаляции, через нос или рот, например, в виде спрея, содержащего также соответствующий носитель. Далее типичные химические соединения, которые могут применяться в способах, составляющих предмет настоящего изобретения, будут описаны со ссылкой на приведенные ниже типичные синтетические схемы для их общего получения и следующие далее конкретные примеры. Как определят специалисты в данной области, для получения различных раскрываемых в настоящей заявке соединений могут быть соответствующим образом выбраны исходные материалы, так чтобы требуемые в конечном соединении заместители могли быть проведены через схему реакции при наличии или в отсутствие защиты, в зависимости от ситуации, с образованием желаемого продукта. В качестве альтернативы может оказаться необходимым или желательным ввести вместо желаемого заместителя соответствующую группу, которая может быть проведена через схему реакции и затем заменена соответствующим образом на требуемый заместитель. Каждая из приведенных на Схеме А реакций предпочтительно проводится при температуре от приблизительно комнатной до температуры кипения используемого органического растворителя. Если не указано иное, все химические переменные в формулах определяются согласно данному выше описанию формулы (I). Схема A Как показано на схеме А, соединения формулы (I) получают путем последовательного введения соединений (X) в реакцию с аминами (XI) и затем аминами (XIII). Если Y и Z представляют собой CH, Hal1 представляет собой хлор, и Hal2 представляет собой хлор, бром или йод, присоединение аминов (XI) в катализируемой палладием реакции аминирования дает соединения (XII). Реакции аминирования проводят в присутствии содержащего палладий(0) катализатора, такого как трис(дибензилиденацетон)дипалладий(0) (Pd2(dba)3) или тетракис(трифенилфосфин)палладий, лиганда, такого как 4,5-бис(дифенилфосфино)-9,9-диметилксантен (Xantphos), 2-дициклогексилфосфино-2',4',6'-триизопропилбифенил (X-Phos),1,1'-бис(дифенилфосфино)ферроцен (dppf), 2,2'-бис(дифенилфосфино)-1,1'-бинафтил (BINAP), Cy-MAP[(2'-дициклогексилфосфанилбифен-2-ил)диметиламин], Cy2P(Ph-Ph) (дициклогексил-2-бифенилфосфан),tBu2P(Ph-Ph) (ди-трет-бутил-2-бифенилфосфан), tBu3P или IPrHCl (IPr=1,4-бис(2,6-диизопропил)имидазол-2-илиден), и основания, такого как трет-бутоксид натрия, трет-бутоксид калия, бис(триметилсилил)амид лития или натрия или Cs2CO3, в растворителе, таком как толуол, тетрагидрофуран (THF), диметилацетамид (DMA), диметоксиэтан (DME) или трет-бутанол, или их смеси, при температуре от приблизительно 50C до приблизительно 140C (Ji et al. J. Org. Chem. 2003, 24, 4611-4614). Предпочтительно реакции проводят с использованием Pd2(dba)3, Xantphos и трет-бутоксида натрия в толуоле при температуре от приблизительно 70C до приблизительно 110C. Затем соединения (XII), в которых Y и Z представляют собой CH, и Hal1 представляет собой хлор,превращают в пиридины формулы (I) в катализируемой палладием реакции аминирования с аминами(XIII), как описано выше. Предпочтительно реакции проводят с использованием ацетата палладия(II)(Pd(OAc)2), BINAP и трет-бутоксида натрия в толуоле, DMA или трет-бутаноле (либо их смеси) при температуре от приблизительно 50C до приблизительно 110C. Если Y представляет собой CH, и Z представляет собой N, Hal1 представляет собой хлор, и Hal2 представляет собой хлор, бром или йод, соединения (X) вводят в реакцию замещения с аминами (XI), в присутствии или в отсутствие основного третичного амина (такого как диизопропилэтиламин или триэтиламин), в органическом растворителе, таком как метанол, этанол, изопропанол, трет-амиловый спирт,пентан-1-ол, THF или ацетонитрил или их смеси, при температуре от приблизительно 0C до приблизительно 180C, при традиционном нагреве либо в условиях микроволнового нагрева, с получением соединений формулы (XII). Затем соединения (XII), в которых Y представляет собой CH, и Z представляет собой N, и Hal1 представляет собой хлор, вводят в реакцию с аминами (XIII) в условиях реакции замещения, как описано выше, получая пиримидины формулы (I). Дополнительно соединения формулы (I) получают путем последовательного введения соединенийN, и Z представляет собой CH, Hal1 и Hal2 представляют собой атомы хлора, вводят в реакцию с аминами, в присутствии или в отсутствие основного третичного амина (такого как диизопропилэтиламин или триэтиламин), в таком растворителе, как THF, DMF или им подобном, при температуре от приблизительно 23C до приблизительно 110C, с получением соединений (XII). Затем присоединением аминов(XIII), либо в описанной выше реакции катализируемого палладием аминирования, либо путем замещения атома хлора амином (XIII), чистым или в полярном растворителе, таком как DME, в присутствии или в отсутствие основного третичного амина (такого как диизопропилэтиламин или триэтиламин), при температурах в диапазоне от 100 до 250C в условиях традиционного или микроволнового нагрева, получают пиридазины формулы (I). Как показано на схеме В, соединения формулы (I) получают путем последовательного введения соединений (XIV) в реакцию с аминами (XIII) и затем аминами (XI). Соединения (XIV), в которых Y и Z представляют собой CH, Hal3 представляет собой фтор, и Hal4 представляет собой йод или бром, вводят в реакцию с аминами (XIII) в полярном растворителе, таком как N-метилпирролидинон (NMP), N,Nдиметилформамид, DMA, диметилсульфоксид или их смесь, при температуре от приблизительно 50C до приблизительно 110C, в условиях традиционного или микроволнового нагрева и получают соединения(XV). Затем присоединением аминов (XI), либо в реакции катализируемого палладием аминирования(как описано для схемы А), либо в реакции ароматического нуклеофильного замещения в присутствии кислоты Льюиса, такой как трифторметансульфонат иттербия (Yb(OTf)3), в полярном растворителе, таком как DMA или NMP, при температуре от приблизительно 150C до приблизительно 250C в условиях традиционного или микроволнового нагрева получают пиридины формулы (I). Соединения (XIV), в которых Y представляет собой CH, и Z представляет собой N, Hal3 представляет собой хлор, и Hal4 представляет собой хлор, вводят в реакцию замещения с аминами (XIII), давая соединения (XV), и затем с аминами (XI), давая пиримидины формулы (I). Реакции замещения проводят способом, описанным для схемы А. Схема C Как показано на схеме С, соединения (XVII), в которых Y представляет собой N, Z представляет собой С, и Hal1 представляет собой хлор, получают хлорированием соединений (XVI) с использованием условий, известных специалистам в данной области, например, в реакции с хлористым фосфорилом, при температурах в диапазоне от 65C до приблизительно 120C, с получением соединений (XVII). Полученные соединения (XVII) вводят в реакцию замещения с аминами (XI) в присутствии основного третичного амина (например, диизопропилэтиламина или триэтиламина) в органическом растворителе, таком как метанол, этанол, изопропанол, трет-амиловый спирт, пентан-1-ол, THF или ацетонитрил, или их смеси,при температуре от приблизительно 23 до 180C, при традиционном нагреве либо в условиях микроволнового нагрева. Затем соединения (XVIII) вводят в реакцию с аминами (XIII) в описанных выше условиях реакции замещения, получая пиридазины (XIX). Реакцией галопиридазинов (XIX) с таким восстановителем, как 10% палладий на углероде, в присутствии формиата аммония в полярном растворителе, таком как метанол, при температурах в диапазоне от 65 до 85C, затем получают соединения формулы (I). Схема D Как показано на схеме D, соединения (XVI), в которых Y представляет собой N, Z представляет собой С, и Hal1 представляет собой хлор, вводят в реакцию с йодистоводородной кислотой (57%) при температурах в диапазоне от 100 до 150C с получением промежуточного продукта (XXI), 5-йод-4H-пирида- 18018198 зин-3-она. Затем реакцией промежуточного продукта (XXI) с аминами (XI) в условиях реакции замещения в органическом растворителе, таком как метанол, этанол, изопропанол, трет-амиловый спирт, пентан-1-ол, THF или ацетонитрил или их смеси, при температуре от 23 до 180C, при традиционном нагреве либо в условиях микроволнового нагрева, получают соединения формулы (XXII). Затем хлорированием соединений (XXII) с использованием условий, известных специалистам в данной области, например, в реакции с хлористым фосфорилом, при температурах в диапазоне от 65C до приблизительно 120C, получают соединения (XXIII). Полученные соединения (XXIII) вводят в реакцию с аминами (XIII) в условиях реакции замещения в органическом растворителе, таком как метанол, этанол, изопропанол, третамиловый спирт, пентан-1-ол, THF или ацетонитрил, или их смеси, при температуре от приблизительно 23 до 200C, при традиционном нагреве либо в условиях микроволнового нагрева, и получают соединения формулы (I). В описанных выше схемах, если диамин HNR3R4 (XIII) содержит защитную группу для атома азота,такую как трет-бутоксикарбонильную группу (Boc) или бензильную группу, вместо заместителя Ra илиRc, защитная группа затем снимается в известных специалистам в данной области условиях с получением соединений, в которых заместители Ra или Rc представляют собой Н. Например, третбутоксикарбонильная группа снимается с использованием органической кислоты, такой как TFA (чистой или в растворителе, таком как CH2Cl2), или неорганической кислоты, такой как HCl (в таком растворителе, как 1,4-диоксан, эфир, метанол, изопропанол, муравьиная кислота или их смесь). Для превращения соединений, в которых заместитель Rc представляет собой Н, в соединения, где Rc представляет собойC1-3 алкил, могут использоваться процедуры восстановительного аминирования или алкилирования. Соединения формулы (I) могут быть преобразованы в соответствующие соли с использованием известных в данной области способов. Например, обработка амина формулы (I) трифторуксусной кислотой, HCl или лимонной кислотой в таком растворителе, как Et2O, CH2Cl2, THF, MeOH, хлороформ или изопропанол, дает соответствующую солевую форму. Альтернативно соли трифторуксусной или муравьиной кислоты могут быть получены в результате очистки соединений в условиях высокоэффективной жидкостной хроматографии с обращенными фазами. Кристаллические формы фармацевтически приемлемых солей соединений формулы (I) могут быть получены в кристаллической форме путем перекристаллизации из полярных растворителей (включая смеси полярных растворителей и водные смеси полярных растворителей) или из неполярных растворителей (включая смеси неполярных растворителей). Соединения, полученные в соответствии с описанными выше схемами, могут быть получены как отдельно взятые энантиомеры, диастереомеры или региоизомеры путем энантио-, диастерео- или региоспецифичного синтеза, или путем разделения. Соединения, полученные в соответствии с описанными выше схемами, могут альтернативно быть получены как рацемические (1:1) или нерацемические (не 1:1) смеси или как смеси диастереомеров или региоизомеров. При получении рацемических и нерацемических смесей энантиомеров, индивидуальные энантиомеры могут быть выделены с помощью известных специалистам в данной области традиционных способов разделения, таких как хиральная хроматография, перекристаллизация, образование диастереомерной соли, превращение в диастереомерные аддукты,биотрансформация или ферментативная трансформация. При получении смесей региоизомеров или диастереомеров индивидуальные изомеры могут быть выделены с использованием традиционных способов,таких как хроматография или кристаллизация. Приведенные ниже конкретные примеры более подробно иллюстрируют настоящее изобретение и его различные предпочтительные осуществления. Примеры Если не указано иное, для получения описанных в приведенных ниже примерах соединений и соответствующих аналитических данных использовались следующие экспериментальные и аналитические процедуры. Если иное не оговорено особо, реакционные смеси перемешивали на магнитной мешалке при комнатной температуре в атмосфере азота. Если растворы были "осушены", для этого, как правило, использовали осушающий агент, такой как Na2SO4 или MgSO4. Если смеси, растворы и экстракты были "концентрированы", то их обычно концентрировали на роторном испарителе при пониженном давлении. Для очистки с использованием колоночной флэш-хроматографии использовали силикагель (SiO2) и указанный в скобках элюент. Микроволновой нагрев выполняли на системе Emrys Optimizer компании Personal Chemistry, используя пробирки для микроволнового синтеза Biotage. Аналитическую высокоэффективную жидкостную хроматографию (HPLC) с обращенными фазами выполняли на анализаторе HPLC Series 1100 компании Hewlett Packard, используя монолитные колонкиONYX C18 (5 мкм, 4,6100 мм) компании Phenomenex. Детектирование выполняли на длинах волн=230, 254 и 280 нм. Использовали скорость потока 1 мл/мин и градиент от 10 до 90% ацетонитрил/вода(20 мМ NH4OH) за период 5,0 мин. Препаративную высокоэффективную жидкостную хроматографию с обращенными фазами проводили на системе Dionex с колонками YMC Pack ODS 25030 мм и градиентом от 10 до 50% NH4OH в ацетонитриле (0,05% воды) за период 15 мин при скорости потока 70 мл/мин.- 19018198 Альтернативно соединения очищали на жидкостном хроматографе с масс-спектроскопическим детектированием Waters LC/MS с колонкой Waters XBridge C18 (10030 мм), используя градиент от 1 до 25% ацетонитрил/вода (0,05% трифторуксусной кислоты (TFA за период 15 мин при скорости потока 44 мл/мин. Аналитическую высокоэффективную жидкостную хроматографию с обращенными фазами выполняли на анализаторе Agilent с колонкой С 18 (5 мкм, 4,6150 мм). Детектирование выполняли на длинах волн =214 и 254 нм. Использовали скорость потока 1 мл/мин и градиент от 10 до 90% ацетонитрил/вода (0,1% муравьиной кислоты) за период 10 мин. Препаративную тонкослойную хроматографию (TLC/TCX) проводили на пластинках размером 2020 см с силикагелем 60 F254, толщина слоя 0,5 мм. Препаративную высокоэффективную жидкостную хроматографию с обращенными фазами проводили на колонке Gemini C18 (15021,2 мм) с градиентом от 5 до 60% ацетонитрил/вода (0,1% трифторуксусной кислоты или 0,1% муравьиной кислоты) за период 14 мин при скорости потока 20 мл/мин с контролем на длине волны 214 нм. Соединения анализировали в форме свободного основания, гидрохлоридной или трифторацетатной соли. Гидрохлоридные соли получали или: 1) в процессе удаления трет-бутилкарбамоильной группы(Boc); или 2) путем обработки раствора очищенного свободного основания в THF, CHCl3 или CH2Cl2(DCM) по меньшей мере двумя эквивалентами раствора HCl в 1,4-диоксане с последующей концентрацией. Трифторацетатные соли получали непосредственно в процессе хроматографической очистки. Спектры ядерного магнитного резонанса (ЯМР) получали на спектрометрах Bruker DRX (400 МГц или 500 МГц) или Varian (300 МГц). Далее используется следующий формат представления данных 1 Н ЯМР: химический сдвиг в миллионных долях в сторону слабого поля от сигнала, используемого в качестве стандарта тетраметилсилана (мультиплетность, константа спин-спинового взаимодействия J в Гц,интеграция). Масс-спектры (МС) получали на анализаторе Agilent серии 1100 MSD или 1200 MSD при электрораспылительной ионизации (ЭРИ) в положительном или отрицательном режимах, как указано при характеризации соединения. Масс-спектрометрические данные представлены в форме полученных значенийm/z (как правило, [M+H]+) для молекулярного иона. Химические названия генерировали с помощью программного пакета ACD/Name версии 10 (Advanced Chemistry Development, Торонто, Онтарио, Канада) или ChemDraw версии 6.0.2 (CambridgeSoft,Кембридж, Массачусетс, США). Пример 1. Бицикло[2.2.1]гепт-2-ил-[4-3R)-3-метиламинопирролидин-1-ил)пиридин-2-ил]амина дигидрохлорид.(3R)-[1-(2-хлорпиридин-4-ил)пирролидин-3-ил]-метиламин. К раствору 2-хлор-4-бромпиридина (4,3 г, 22,1 ммоль) в толуоле (100 мл) при перемешивании добавили (R)-метилпирролидин-3-иламин (1,7 г,17,0 ммоль) и трет-бутоксид натрия (2,5 г, 26,0 ммоль). Колбу откачали и дважды продули газообразнымN2. Затем в один прием добавили смесь 4,5-бис(дифенилфосфино)-9,9-диметилксантена (Xantphos; 590 мг, 1,0 ммоль) и трис(дибензилиденацетон)-дипалладия(0) (Pd2(dba)3; 310 мг, 0,34 ммоль) и выдержали полученную смесь при температуре 85C в течение 20 ч. Полученную смесь охладили до комнатной температуры, разбавили H2O (75 мл) и экстрагировали этилацетатом (EtOAc; 3). Объединенные органические фазы высушили и сконцентрировали, получив прозрачное масло коричневого цвета. Полученное масло очистили (флэш-хроматография, 0-5% 2 М раствора NH3 в MeOH/CH2Cl2) и получили искомое соединение в виде твердого вещества коричневого цвета (1,1 г, 30%). МС (ЭРИ): рассчитано дляC10H14ClN3: 211,09; получено m/z: 212,1 [M+H]. 1H ЯМР (DMSO-d6): 7,86 (д, J=5,9, 1H); 6,47-6,38 (м, 2H); 3,45-3,17 (м, 4H); 3,11-3,01 (м, 1H); 2,29 (с, 3H); 2,15-2,00 (м, 1 Н); 1,82 (уш.с, 1 Н); 1,79-1,65 (м, 1H). Бицикло[2.2.1]гепт-2-ил-[(3R)-4-(3-метиламинопирролидин-1-ил)пиридин-2-ил]амин. К помещенной в сцинтилляционный флакон смеси [(3R)-1-(2-хлорпиридин-4-ил)пирролидин-3-ил]метиламина (97 мг, 0,46 ммоль), экзо-2-аминонорборнана (164 мкл, 1,4 ммоль) в диметиловом эфире этиленгликоля(DME; 4 мл) при перемешивании добавили трет-бутоксид натрия (245 мг, 2,6 ммоль). К полученной смеси при перемешивании в один прием добавили Pd(OAc)2 (16 мг, 0,024 ммоль) и рацемический 2,2'бис(дифенилфосфино)-1,1'-бинафтил (BINAP; 19 мг, 0,031 ммоль). Полученную смесь выдержали при температуре 65C в течение 20 ч, охладили до комнатной температуры и профильтровали через пробку из диатомовой земли. Затем пробку промыли MeOH (2 мл) и очистили непосредственно фильтрат (флэшхроматография, 5% 2 М раствора NH3 в MeOH/CH2Cl2), получив прозрачное масло золотистого цвета (70 мг, 54%). Бицикло[2.2.1]гепт-2-ил- [(3R)-4-(3-метиламинопирролидин-1-ил)-пиридин-2-ил]-амин. К раствору бицикло[2.2.1]гепт-2-ил-[(3R)-4-(3-метиламинопирролидин-1-ил)-пиридин-2-ил]-амина в 1:1 смесиEt2O/CH2Cl2 (8 мл) при перемешивании добавили 1 Н раствор HCl в Et2O (1 мл). Органические фазы разделили и сконцентрировали, получив искомый продукт (89 мг, 100%) в виде твердого вещества бежевого цвета. МС (ЭРИ): рассчитано для C17H26N4: 286,2; получено m/z: 287,3 [M+H]+. 1H ЯМР (DMSO-d6): 12,07(с, 1H); 9,57 (уш.с, 1H); 9,46 (уш.с, 1H); 7,81 (д, J=5,1, 1H); 7,66 (д, J=4,6, 1H); 6,28 (д, J=7,4, 1H); 5,64 (с,1 Н); 3,89 (уш.с, 1 Н); 3,85-3,61 (м, 3H); 3,49 (уш.с, 2 Н); 2,60 (с, 3H); 2,35-2,20 (м, 3H); 2,18 (с, 1H); 1,951,85 (м, 1H); 1,55-1,46 (м, 3H); 1,37-1,25 (м, 2 Н); 1,21-1,09 (м, 2H). Соединения в примерах 2-15 получили с помощью способов, аналогичных описанным для примера 1. Пример 2. N-Циклопентил-4-[(3R)-3-(метиламино)пирролидин-1-ил]пиридин-2-амин. Искомое соединение получили в виде смеси диастереомеров. МС (ЭРИ): рассчитано для C15H24N4O: 276,2; получено m/z: 277,2 [M+H]+ . 1H ЯМР (DMSO-d6): 12,34 (с, 1H); 9,63 (уш.с, 1H); 9,60 (с, 1H); 7,757,61 (м, 2H); 6,27 (д, J=7,4, 1H); 5,77 (с, 1H); 4,05-3,96 (м, 1 Н); 3,96-3,83 (м, 1 Н); 3,82-3,61 (м, 6 Н); 3,383,30 (м, 2H); 2,58 (с, 3H); 2,48-2,38 (м, 2H); 2,04-1,85 (м, 3H); 1,78-1,72 (м, 1H). Пример 7. N-(4-Фторбензил)-4-[(3R)-3-(метиламино)пирролидин-1-ил]пиридин-2-амина дигидрохлорид. 4-(2-Хлорпиридин-4-ил)пиперазин-1-карбоновой кислоты трет-бутиловый эфир. К раствору 2-хлор 4-бромпиридина (4,3 г, 22,5 ммоль) в толуоле (100 мл) при перемешивании добавили трет-бутиловый эфир пиперазин-1-карбоновой кислоты (3,2 г, 17,2 ммоль) и трет-бутоксид натрия (2,5 г, 26,0 ммоль). Колбу откачали и дважды продули газообразным N2. Затем в один прием добавили смесь Xantphos (600 мг, 1,0 ммоль) и Pd2(dba)3 (318 мг, 0,35 ммоль) и выдержали полученную смесь при температуре 85C в течение 20 ч. Полученную смесь охладили до комнатной температуры, разбавили Н 2 О (75 мл) и экстрагировали EtOAc (3). Объединенные органические фазы высушили и сконцентрировали, получив прозрачное масло золотистого цвета. Полученное масло очистили (флэш-хроматография, 0-5% 2 М раствораNH3 в MeOH/CH2Cl2) и получили искомое соединение в виде твердого вещества бежевого цвета (5,1 г,100%). МС (ЭРИ): рассчитано для C14H20ClN3O2: 297,1; получено m/z: 298,2 [M+H]+. 1H ЯМР (DMSO-d6): 7,95 (д, J=5,9, 1H); 6,88-6,78 (м, 2H); 3,46-3,32 (м, 8H); 1,42 (с, 9H). трет-Бутил 4-[2-(циклопентиламино)пиридин-4-ил]пиперазин-1-карбоксилат. К помещенному во флакон раствору трет-бутилового эфира 4-(2-хлорпиридин-4-ил)пиперазин-1-карбоновой кислоты (163 мг, 0,55 ммоль) в толуоле (2 мл) при перемешивании добавили циклопентиламин (136 мкл, 1,38 ммоль) и трет-бутоксид натрия (161 мг, 1,68 ммоль). К полученной смеси при перемешивании в один прием добавили смесь рацемического BINAP (20 мг, 0,032 ммоль) и Pd(OAc)2 (18 мг, 0,027 ммоль) и выдержали ее при температуре 85C в течение 20 ч. Полученную смесь охладили до комнатной температуры и непосредственно очистили (флэш-хроматография, 0-5% 2 М раствора NH3 в MeOH/CH2Cl2), получив искомое соединение в виде твердого вещества белого цвета (34 мг, 17%). МС (ЭРИ): рассчитано для C19H30N4O2: 346,2; получено m/z: 347,3 [M+H]+ . 1H ЯМР (DMSO-d6): 7,65 (д, J=6,0, 1H); 6,10 (д, J=6,0, 1H); 5,92 (д,J=7,1, 1H); 5,78 (с, 1 Н) 4,08-4,02 (м, 1H); 3,41 (т, J=5,4, 4H); 3,16 (т, J=5,4, 4H); 1,89-1,82 (м, 2H); 1,67-1,61N-Циклопентил-4-пиперазин-1-илпиридин-2-амина дигидрохлорид. К раствору трет-бутил 4-[2(циклопентиламино)пиридин-4-ил]пиперазин-1-карбоксилата (34 мг, 0,1 ммоль) в 96% муравьиной кислоте (4 мл) при перемешивании добавили 6 Н водный раствор HCl (2 капли). Полученную смесь перемешивали в течение 2 ч и сконцентрировали, получив искомый продукт в виде твердого вещества белого цвета (26 мг, 93%). МС (ЭРИ): рассчитано для C14H22N4: 246,2; получено m/z: 247,2 [M+H]+. 1H ЯМР(м, 1H); 3,73 (т, J=4,9, 4H); 3,20 (т, J=5,0, 4H); 2,03-1,95 (м, 2H); 1,73-1,68 (м, 2H); 1,64-1,52 (м, 2H); 1,501,42 (м, 2H). Соединения в примерах 17-20 получили с помощью способов, аналогичных описанным для примера 16. Пример 17. 4-Пиперазин-1-ил-N-пропилпиридин-2-амина дигидрохлорид.N-метилпирролидиноне (10 мл) при комнатной температуре обработали изобутиламином (2,5 мл, 2,5 ммоль) и выдержали полученную смесь при температуре 100C в течение 6 ч. Затем смесь охладили до комнатной температуры, разбавили EtOAc (50 мл) и промыли водой (210 мл). Объединенные водные экстракты обратно экстрагировали EtOAc, и объединенные органические фазы высушили и сконцентрировали, получив густое масло, которое при стоянии превратилось в твердое вещество (2,6 г, 95%). Полученное твердое вещество использовали без дальнейшей очистки. 1H ЯМР (CDCl3): 7,72 (д, J=5,3, 1H); 6,89(дд, J=5,3; 1,4, 1H); 6,77 (д, J=1,1, 1H); 4,58 (с, 1H); 3,04 (дд, J=6,8; 5,9, 2H); 1,87 (дквинт, J=13,4; 6,7, 1H); 0,98 (д, J=6,7, 6H). 4-(4-Метилпиперазин-1-ил)-N-(2-метилпропил)пиридин-2-амин. Суспензию (4-йодпиридин-2-ил)изобутиламина (78 мг, 0,3 ммоль), N-метилпиперазина (0,04 мл, 0,4 ммоль), 2-дициклогексилфосфино 2',4',6'-триизопропилбифенила (X-phos) (5,4 мг, 4 мол.%), Pd2dba3 (3,2 мг, 2 мольных %) в THF (1 мл) обработали бис(триметилсилил)амидом лития (1,0 М раствор в THF; 0,8 мл, 0,8 ммоль) и выдержали полученную смесь при температуре 65C в течение 16 ч. Полученный раствор охладили до комнатной температуры и сконцентрировали до минимального объема, а затем непосредственно очистили (флэшхроматография, 0-10% 2 М раствора NH3 в MeOH/CH2Cl2), получив искомый продукт (29 мг, 41%). МС(ЭРИ): рассчитано для C14H24N4: 248,4; получено m/z: 249,3 [M+H]+. 1H ЯМР (CDCl3): 7,79 (д, J=6,1, 1H); 6,12 (дд, J=6,2, 2,3, 1H); 5,69 (д, J=2,2, 1H); 4,62 (с, 1H); 3,54-3,23 (м, 4H); 3,03 (дд, J=6,7; 5,8, 2H); 2,592,22 (м, 7H); 1,89 (дквинт, J=13,4; 6,7, 1H); 1,19-0,78 (м, 6H). Способ В. 4-Бром-N-изобутилпиридин-2-амин. Раствор 4-бром-2-фторпиридина (352 мг, 2 ммоль) и 2-метилпропан-1-амина (584 мг, 8 ммоль) в Nметил-2-пирролидиноне (NMP, 10 мл) в течение 1 ч перемешивали при температуре 100C. Затем смеси дали остыть до комнатной температуры, разбавили ее DCM (50 мл) и промыли водой (10 мл 2). Отделенный органический слой высушили над Na2SO4, профильтровали и сконцентрировали. Полученный остаток очистили колоночной хроматографией (0-20% градиентное элюирование смесью EtOAc/петролейный эфир) и получили искомый продукт в виде масла (382 мг, 83%). 1H ЯМР (300 МГц, CDCl3): 7,86(153 мг, 0,7 ммоль), 1-метилпиперазина (80 мг, 0,8 ммоль), Pd2(dba)3 (6,1 мг, 0,007 ммоль) и X-phos (12,7 мг, 0,028 ммоль) в безводном THF (4 мл) обработали LiHMDS (1,0 М, 2,0 мл, 2 ммоль) в атмосфере азота. Полученную реакционную смесь перемешивали в течение 3 ч при температуре 65C, затем дали ей ос- 24018198 тыть до комнатной температуры, разбавили DCM (20 мл) и промыли водой (4 мл). Отделенный органический слой высушили над Na2SO4, профильтровали и сконцентрировали. Полученный остаток очистили колоночной хроматографией (0-10% градиентное элюирование смесью MeOH/DCM) и получили искомый продукт (60 мг, 34%). 1H ЯМР (300 МГц, CDCl3): 7,74 (д, J=6,6, 1H); 6,12 (д, J=6,3, 1H); 5,66 (с, 1H); 3,31 (т, J=5,4, 4H); 3,01 (д, J=6,0, 2H); 2,51 (т, J=5,4, 4H); 2,34 (с, 3H); 1,90-1,88 (м, 1H); 1,00 (с, 3H); 0,98N-Изобутил-4-(4-метилпиперазин-1-ил)пиридин-2-амина дигидрохлорид. N-изобутил-4-(4-метилпиперазин-1-ил)пиридин-2-амин (60 мг, 0,24 ммоль) растворили в MeOH (1 мл) и добавили в полученный раствор водную HCl (6 Н, 0,5 мл). Полученную реакционную смесь перемешивали в течение 2 ч при температуре 30C. Затем смесь сконцентрировали при пониженном давлении и получили искомый продукт (80 мг, 93%). 1 Н ЯМР (300 МГц, DMSO-d6): 12,59 (с, 1H); 11,49 (уш.с, 1H); 7,97 (с, 1H); 7,72 (м, 1H); 6,60 (д, J=6,9, 1H); 6,12 (с, 1H); 4,20 (д, J=14,0, 2H); 4,00 (уш.с, 2H); 3,50-3,42 (м, 2H); 3,10 (м, 4H); 2,77 (с,3H); 1,88-1,79 (м, 1H); 0,94 (д, J=6,6, 6H); ЖХ-МС, m/z=249,2 [M+H]+, tR=0,1 мин; HPLC: 96% (214 нм),96% (254 нм), tR=4,5 мин. Пример 22. 4-[(3R)-3-(Метиламино)пирролидин-1-ил]-N-(2-метилпропил)пиридин-2-амин.(0,08 мл, 0,8 ммоль) и Yb(OTf)3 (215 мг, 0,4 ммоль) в DMA (2 мл) выдержали в течение 2 ч при температуре 200C в условиях микроволнового нагрева. Полученный раствор охладили до комнатной температуры и сконцентрировали до минимального объема, затем непосредственно очистили (флэшхроматография, 0-10% 2 М раствора NH3 в MeOH/CH2Cl2). Полученный таким образом материал (58 мг) очистили далее с использованием высокоэффективной жидкостной хроматографии с обращенными фазами (условия Dionex), получив в итоге искомое соединение (10 мг, 11%). МС (ЭРИ): рассчитано для[(3R)-1-(2-Хлорпиримидин-4-ил)пирролидин-3-ил]карбаминовой кислоты трет-бутиловый эфир. К кашице из 2,4-дихлорпиримидина (2,05 г, 13,7 ммоль) и N,N-диизопропилэтиламина (3,60 мл, 20,6 ммоль) в i-PrOH (12 мл) добавили (R)-3-N-Вос-аминопирролидин (2,69 г, 14,4 ммоль). Полученную смесь выдержали в течение 2 ч при температуре 160C в условиях микроволнового нагрева. Затем реакционную смесь охладили до комнатной температуры, сконцентрировали и очистили сырой остаток (флэшхроматография, 0-50% смеси EtOAc/гексаны), получив твердое вещество белого цвета (2,10 г, 51%). МС(1,5 мл) добавили изопропиламин (30 мг, 0,41 ммоль). Полученную смесь выдержали в течение 6 ч при температуре 140C в условиях микроволнового нагрева. Полученную реакционную смесь охладили до комнатной температуры и сконцентрировали. Сырой остаток очистили (флэш-хроматография, 0-10% смеси MeOH/CH2Cl2), получив искомый продукт (93 мг, 80%). МС (ЭРИ): рассчитано для C17H29N5O2: 335,2; получено m/z: 336,3 [M+H]+. 1H ЯМР (CDCl3): 7,83 (д, J=5,9, 1H); 5,64 (д, J=5,9, 1H); 4,98-4,80 (м,1H); 4,78-4,61 (м, 1H); 4,38-4,20 (м, 1H); 3,79-3,26 (м, 4H); 3,23-3,11 (м, 2H); 2,32-2,09 (м, 1H); 1,99-1,77(м, 2H); 1,45 (с, 9H); 0,95 (д, J=6,7, 6H). 4-[(3R)-3-Аминопирролидин-1-ил]-N-(2-метилпропил)пиримидин-2-амин. К раствору трет-бутилового эфира [(3R)-1-(2-изобутиламинопиримидин-4-ил)пирролидин-3-ил]-карбаминовой кислоты (93 мг,0,28 ммоль) в MeOH (0,5 мл) добавили HCl (4,0 М раствор в 1,4-диоксане; 1,0 мл). Реакционную смесь перемешивали в течение 2 ч при комнатной температуре, затем сконцентрировали и очистили сырой остаток (флэш-хроматография, 0-20% 2 М раствора NH3 в MeOH/CH2Cl2), получив искомый продукт (65 мг, 100%). МС (ЭРИ): рассчитано для C12H21N5: 235,2; получено m/z: 236,2 [M+H]+. 1H ЯМР (CDCl3): 7,82- 25018198 Соединения в примерах 24-30 получили с помощью способов, аналогичных описанным для примера 23. Пример 24. 4-[(3R)-3-Аминопирролидин-1-ил]-N-(циклопропилметил)пиримидин-2-амин.(4-Хлорпиримидин-2-ил)-изобутиламин и (2-хлорпиримидин-4-ил)-изобутиламин. К кашице из 2,4 дихлорпиримидина (1,48 г, 10,0 ммоль) и N,N-диизопропилэтиламина (2,60 мл, 15,0 ммоль) в i-PrOH (8 мл) добавили изобутиламин (0,77 г, 10,5 ммоль). Полученную смесь выдержали в течение 1 ч при температуре 160C в условиях микроволнового нагрева. Затем полученную реакционную смесь охладили до комнатной температуры и сконцентрировали,получив смесь региоизомеров.C8H12ClN3: 185,1; получено m/z: 186,1 [M+H]+ . 1H ЯМР (CDCl3): 8,19-7,75 (м, 1H); 6,69-6,18 (м, 2H); 3,402,98 (м, 2H); 1,98-1,83 (м, 1H); 0,96 (д, J=6,6, 6H). Изобутил-[4-(4-метил-пиперазин-1-ил)-пиримидин-2-ил]амин. К кашице из неизмеренной массы смеси из предыдущей стадии (60 мг, 0,32 ммоль) в i-PrOH (2,0 мл) добавили 1-метилпиперазин (80 мг,0,80 ммоль). Полученную смесь выдержали в течение 1 ч при температуре 160C в условиях микроволнового нагрева. Затем полученную реакционную смесь охладили до комнатной температуры и сконцентрировали, а сырой остаток очистили с использованием препаративной ТСХ (7% 2 М раствора NH3 вMeOH/CH2Cl2), получив искомый продукт (12 мг). МС (ЭРИ): рассчитано для C13H23N5: 249,2; полученоm/z: 250,3 [M+H]+. 1H ЯМР (CDCl3): 7,87 (д, J=6,0, 1H); 5,85 (д, J=6,1, 1H); 4,87 (с, 1H); 3,70-3,51 (м, 4H); 3,19 (дд, J=6,7; 6,0, 2H); 2,52-2,38 (м, 4H); 2,33 (с, 3H); 1,92-1,79 (м, 1H); 0,96 (д, J=6,7, 6H). Соединение в примере 32 получили с помощью способов, аналогичных описанным для примера 31. Пример 32. 4-[(3R)-3-(Метиламино) пирролидин-1-ил]-N-(2-метилпропил)пиримидин-2-амин. МС (ЭРИ): рассчитано для C13H23N5: 249,2; получено m/z: 250,3 [M+H]+. 1H ЯМР (CDCl3): 7,82 (д,J=5,9, 1H); 5,65 (д, J=5,9, 1H); 4,86 (с, 1H); 3,79-3,26 (м, 4H); 3,24-3,15 (м, 3H); 2,48 (с, 3H); 2,23-2,09 (м,1H); 1,93-1,74 (м, 3H); 0,95 (д, J=6,7, 6H). Соединения в примерах 33-42 получили с помощью способов, аналогичных описанным для примера 1 или примера 16. Пример 33. 4-[(3R)-3-(Метиламино)пирролидин-1-ил]-N-фенилпиридин-2-амин. МС (ЭРИ): рассчитано для C13H22N4O: 250,4; получено m/z: 251,2 [M+H]+. 1H ЯМР (DMSO-d6): 12,13 (с, 1H); 9,53 (с, 1H); 9,41 (с, 1H); 7,70-7,60 (м, 2H); 6,29 (дд, J=7,4; 2,2, 1H); 5,75 (с, 1H); 3,89 (с, 1H); 3,85-3,62 (м, 4H); 3,50 (т, J=4,8, 2H); 3,44 (т, J=5,5, 2H); 3,29 (с, 3H); 2,60 (с, 3H); 2,45-2,33 (м, 2H). Соединения в примерах 43-83 получили с помощью способов, аналогичных описанным для примера 23. Пример 43. 4-[(3R)-3-Аминопирролидин-1-ил]-N-[бицикло[2.2.1]гепт-2-ил]пиримидин-2-амин.
МПК / Метки
МПК: C07D 237/20, A61K 31/50, C07D 401/04, C07D 487/04, C07D 405/14, C07D 403/04, C07D 213/74, C07D 401/14
Метки: гистаминового, рецептора, модуляторы, пиридазиновые, диаминопиридиновые, пиримидиновые
Код ссылки
<a href="https://eas.patents.su/30-18198-diaminopiridinovye-pirimidinovye-i-piridazinovye-modulyatory-gistaminovogo-receptora-h4.html" rel="bookmark" title="База патентов Евразийского Союза">Диаминопиридиновые, пиримидиновые и пиридазиновые модуляторы гистаминового рецептора h4</a>
Предыдущий патент: Микрооптическая система формирования динамических визуальных изображений
Следующий патент: Сосательная композиция для лечения воспалительных заболеваний полости рта и глотки
Случайный патент: Способ получения слоистых металлических материалов путем кристаллизации в силовом поле центрифуги












