Тризамещенные 1,2,4-триазолы в качестве модуляторов никотиновых ацетилхолиновых рецепторов
Номер патента: 18186
Опубликовано: 28.06.2013
Авторы: Макдональд Грегор Джеймс, Тюринг Йоханнес Вильхельмус Йохн Ф., Станиславский Полин Карол, Ван Росбрук Ив Эмиль Мария, Чжуан Вэй, Ван Ден Кейбюс Франс Альфонс Мария
Формула / Реферат
1. Соединение формулы (I)
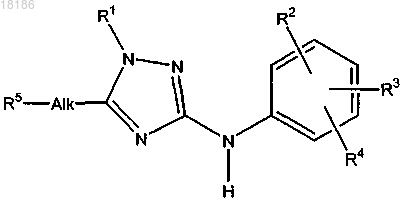
или его стереоизомерная форма, где
R1 представляет собой незамещенный бензодиоксан-6-ил; незамещенный пиридинил, или фенил, или пиридинил, замещенный 1, 2 или 3 заместителями, выбранными из группы, состоящей из галогена, трифторметокси, C1-3алкила, C1-3алкилокси, C1-3алкилоксиС1-3алкила, C1-3алкиламино и С3-6циклоалкиламино;
R2 представляет собой водород, галоген, C1-3алкил, C1-3алкилокси или трифторметокси;
R3 представляет собой водород, галоген или трифторметил;
R4 представляет собой водород или галоген;
R2 и R3 могут образовывать радикал -OCF2-O-;
Alk представляет собой линейный или разветвленный С1-6алкандиил или С2-6алкендиил;
R5 представляет собой гидрокси, C1-3алкилокси, галоген, R6R7N-C(=O)- или R8-O-C(=O)-;
R6 представляет собой C1-3алкил, С3-6циклоалкил или (С3-6циклоалкил)C1-3алкил;
R7 представляет собой водород или C1-3алкил или
R6 и R7 образуют пирролидинил, необязательно замещенный гидроксилом;
R8 представляет собой водород или С1-4алкил,
или его фармацевтически приемлемая аддитивная соль, или гидрат, или сольват.
2. Соединение формулы (I) по п.1, в котором
R1 представляет собой незамещенный бензодиоксан-6-ил; незамещенный пиридинил, или фенил, или пиридинил, замещенный 1, 2 или 3 заместителями, выбранными из группы, состоящей из галогена, трифторметокси, C1-3алкила, C1-3алкилокси, C1-3алкилоксиС1-3алкила, C1-3алкиламино и С3-6циклоалкиламино;
R2 представляет собой галоген, C1-3алкил, С1-3алкилокси или трифторметокси;
R3 представляет собой водород, галоген или трифторметил;
R4 представляет собой водород или галоген;
R2 и R3 могут образовывать радикал -OCF2-O-;
Alk представляет собой линейный или разветвленный С1-6алкандиил или С2-6алкендиил;
R5 представляет собой гидрокси, C1-3алкилокси, галоген, R6R7N-C(=O)- или R8-O-C(=O)-;
R6 представляет собой C1-3алкил, С3-6циклоалкил или (С3-6циклоалкил)C1-3алкил;
R7 представляет собой водород или С1-3алкил или
R6 и R7 образуют пирролидинил, необязательно замещенный гидроксилом;
R8 представляет собой водород или С1-4алкил,
или его фармацевтически приемлемая аддитивная соль, или гидрат, или сольват.
3. Соединение формулы (I) по п.1, в котором
R1 представляет собой незамещенный бензодиоксан-6-ил; незамещенный пиридинил, или фенил, или пиридинил, замещенный 1 или 2 заместителями, выбранными из группы, состоящей из галогена, трифторметокси, C1-3алкила, C1-3алкилокси, C1-3алкилоксиС1-3алкила и C1-3алкиламино;
R2 представляет собой водород, галоген, метил, метокси или трифторметокси;
R3 представляет собой водород, галоген или трифторметил;
R4 представляет собой водород или галоген;
R2 и R3 могут образовывать радикал -OCF2-O- в 3, 4 положении;
Alk представляет собой линейный или разветвленный C1-6алкандиил или С2-6алкендиил;
R5 представляет собой гидрокси, C1-3алкилокси, галоген, R6R7N-C(=O)- или R8-O-C(=O)-;
R6 представляет собой C1-3алкил, С3-6циклоалкил или (С3-6циклоалкил)C1-3алкил;
R7 представляет собой водород или C1-3алкил или
R6 и R7 образуют пирролидинил, необязательно замещенный гидроксилом;
R8 представляет собой водород или С1-4алкил,
или его фармацевтически приемлемая аддитивная соль, или гидрат, или сольват.
4. Соединение формулы (I) по п.1, в котором
R1 представляет собой незамещенный бензодиоксан-6-ил; незамещенный пиридинил или пиридинил, замещенный 1 или 2 заместителями, выбранными из группы, состоящей из хлора, метила, этила, метоксиметила и этиламино;
R2 представляет собой водород, галоген, метил, метокси или трифторметокси;
R3 представляет собой водород, галоген или трифторметил;
R4 представляет собой водород или галоген;
R2 и R3 могут образовывать радикал -OCF2-O- в 3, 4 положении;
Alk представляет собой линейный или разветвленный C1-6алкандиил;
R5 представляет собой гидроксил или R6R7N-C(=O)-;
R6 представляет собой метил, этил, циклопропил, циклобутил или (циклопропил)метил;
R7 представляет собой водород или метил,
или его фармацевтически приемлемая аддитивная соль, или гидрат, или сольват.
5. Соединение по п.1, выбранное из
(αS)-α-этил-3-[[3-метокси-5-(трифторметил)фенил]амино]-1-(2-метил-4-пиридинил)-1H-1,2,4-триазол-5-этанола;
3-[(2,2-дифтор-1,3-бензодиоксол-5-ил)амино]-1-(2,6-диметил-4-пиридинил)-N-этил-1H-1,2,4-триазол-5-ацетамида;
N-циклопропил-3-[(2,2-дифтор-1,3-бензодиоксол-5-ил)амино]-1-(2,6-диметил-4-пиридинил)-1H-1,2,4-триазол-5-ацетамида;
(αS)-α-этил-1-(2-метил-4-пиридинил)-3-[(2,3,4-трифторфенил)амино]-1H-1,2,4-триазол-5-этанола;
(αS)-1-(2,6-диметил-4-пиридинил)-α-этил-3-[(2,3,4-трифторфенил)амино]-1H-1,2,4-триазол-5-этанола;
(αS)-1-(2,6-диметил-4-пиридинил)-α-метил-3-[(2,3,4-трифторфенил)амино]-1H-1,2,4-триазол-5-этанола;
3-[(3,4-дифторфенил)амино]-1-(2,6-диметил-4-пиридинил)-N-этил-1H-1,2,4-триазол-5-ацетамида;
N-циклопропил-1-(2,6-диметил-4-пиридинил)-3-[[3-(трифторметокси)фенил]амино]-1H-1,2,4-триазол-5-ацетамида;
3-[(3-хлор-2-фторфенил)амино]-1-(2,6-диметил-4-пиридинил)-N-этил-1H-1,2,4-триазол-5-ацетамида;
(αS)-1-(2,6-диметил-4-пиридинил)-α-этил-3-[(3,4,5-трифторфенил)амино]-1H-1,2,4-триазол-5-этанола;
(αS)-α-этил-1-(2-метил-4-пиридинил)-3-[(3,4,5-трифторфенил)амино]-1H-1,2,4-триазол-5-этанола;
(αS)-α-этил-3-[(3-фтор-5-метоксифенил)амино]-1-(2-метил-4-пиридинил)-1H-1,2,4-триазол-5-этанола;
(αS)-1-(2,6-диметил-4-пиридинил)-α-этил-3-[(3-фтор-5-метоксифенил)амино]-1H-1,2,4-триазол-5-этанола;
(αS)-3-[(3-хлор-5-метоксифенил)амино]-1-(2,6-диметил-4-пиридинил)-α-этил-1H-1,2,4-триазол-5-этанола;
3-[(3,4-дифторфенил)амино]-1-(2,6-диметил-4-пиридинил)-N,N-диметил-1H-1,2,4-триазол-5-пропанамида и
3-[(2,2-дифтор-1,3-бензодиоксол-5-ил)амино]-1-(2,6-диметил-4-пиридинил)-N,N-диметил-1H-1,2,4-триазол-5-пропанамида
и их кислых аддитивных солей и сольватов.
6. Применение соединения для получения лекарственного средства для предотвращения или лечения психотических нарушений, нарушений или заболеваний, связанных с умственными расстройствами, или воспалительных заболеваний или нарушений, в котором соединение представляет собой соединение по любому из пп.1-5.
7. Фармацевтическая композиция, содержащая фармацевтически приемлемый носитель и в качестве активного ингредиента терапевтически эффективное количество соединения по любому из пп.1-5.
8. Способ получения композиции по п.7, отличающийся тем, что фармацевтически приемлемый носитель тщательно смешан с терапевтически эффективным количеством соединения по любому из пп.1-5.
Текст
ТРИЗАМЕЩЕННЫЕ 1,2,4-ТРИАЗОЛЫ В КАЧЕСТВЕ МОДУЛЯТОРОВ НИКОТИНОВЫХ АЦЕТИЛХОЛИНОВЫХ РЕЦЕПТОРОВ Настоящее изобретение относится к производным 1-арил-3-анилин-5-алкил-1,2,4-триазола формулы (I) и их аналогам или фармацевтически приемлемым солям, к способам их получения,к содержащим их фармацевтическим композициям и к их применению в терапии. Изобретение,в частности, относится к сильным положительным аллостерическим модуляторам никотиновых ацетилхолиновых рецепторов, причем такой положительный аллостерический модулятор обладает способностью увеличивать эффективность агонистов никотиновых рецепторов. Макдональд Грегор Джеймс, Тюринг Йоханнес Вильхельмус Йохн Ф.,Станиславский Полин Карол, Чжуан Вэй, Ван Росбрук Ив Эмиль Мария,Ван Ден Кейбюс Франс Альфонс Мария (BE) Медведев В.Н. (RU)(71)(73) Заявитель и патентовладелец: ЯНССЕН ФАРМАЦЕВТИКА НВ (BE) Настоящее изобретение относится к производным 1-арил-3-анилин-5-алкил-1,2,4-триазола и к их фармацевтически приемлемым солям, к способам их получения, к содержащим их фармацевтическим композициям и к их применению в терапии. Изобретение, в частности, относится к сильным положительным аллостерическим модуляторам никотиновых ацетилхолиновых рецепторов, причем такие положительные аллостерические модуляторы обладают способностью увеличивать эффективность агонистов никотиновых рецепторов. Уровень техники Европейский патент 1044970 описывает 3-алкиламино-1,2,4-триазолы в качестве лигандов рецептора нейропептида Y. Статья Makara G.M. с соавторами (Organic Letters (2002), vol. 4(10); 1751-1754) описывает твердофазный синтез 3-алкиламино-1,2,4-триазолов и дает пример неудачного синтеза N-(4-метоксифенил)-1 метил-5-(4-метилфенил)-1H-1,2,4-триазол-3-амина [CAS433710-55-5] и ничего не упоминает о потенциальном терапевтическом применении данного соединения, в частности о его применении в качестве положительного аллостерического модулятора никотинового ацетилхолинового 7-рецептора. Статья Chen Chen с соавторами в BioorganicMedicinal Chemistry Letters 11 (2001) 3165-3168 описывает синтез 1-алкил-3-амино-5-арил-1H-[1,2,4]триазолов, в частности N-(2-метоксифенил)-1-метил-5(2,4-дихлорфенил)-1H-1,2,4-триазол-3-амина, и их применение в качестве антагонистов рилизингфактора-1 кортикотропина (CRF1). Публикация WO 2001/44207 раскрывает похожие соединения, обладающие сродством к CRFрецепторам. Публикация WO 2007/118903 раскрывает 3-анилин-5-арил-1,2,4-триазолы в качестве положительных модуляторов никотиновых ацетилхолиновых рецепторов, подходящих для лечения неврологических, дегенеративных и психиатрических нарушений. Предпосылки создания изобретения Холинергические рецепторы обычно связывают эндогенный нейромедиатор ацетилхолин (ACh),запуская, тем самым, открытие ионных каналов. Рецепторы ACh в центральной нервной системе млекопитающих могут быть подразделены на мускариновые (mAChR) и никотиновые (nAChR) подтипы, основываясь на агонистической активности мускарина и никотина соответственно. Никотиновые ацетилхолиновые рецепторы представляют собой лигандзависимые ионные каналы, содержащие пять субъединиц. Члены генного семейства nAChR-субъединиц были подразделены на две группы на основе их аминокислотных последовательностей: одну группу, содержащую так называемые -субъединицы, и вторую группу, содержащую -субъединицы. Было показано, что три вида -субъединиц: 7, 8 и 9, образуют функциональные рецепторы, когда экспрессируются в одиночку, и, таким образом, предполагается, что они образуют гомоолигомерные пентамерные рецепторы. Была разработана модель аллостерического переходного состояния для nAChR, которая включает,по меньшей мере, состояние покоя, активированное состояние и "десенсибилизированное" состояние с закрытым каналом, т.е. процесс, посредством которого рецепторы становятся нечувствительными к агонисту. Различные лиганды nAChR могут стабилизировать конформационное состояние рецептора, с которым они предпочтительно связываются. Например, агонисты ACh и (-)-никотин, соответственно, стабилизируют активное и десенсибилизированное состояния. Изменения активности никотиновых рецепторов вовлечены в ряд заболеваний. Некоторые из них,например миастения и аутосомно-доминантная ночная лобная эпилепсия (ADNFLE), связаны с уменьшением активности никотиновой передачи либо вследствие уменьшения числа рецепторов, либо вследствие повышенной десенсибилизации. Предполагают также, что уменьшение числа никотиновых рецепторов служит связующим звеном для дефицитов познавательной способности, наблюдаемых при заболеваниях, таких как болезнь Альцгеймера и шизофрения. Эффектны табачного никотина также опосредованы никотиновыми рецепторами, и поскольку эффект никотина заключается в стабилизации рецепторов в десенсибилизированном состоянии, повышенная активность никотиновых рецепторов может уменьшить желание курить. Соединения, которые связывают nAChR, были предложены для лечения различных нарушений,включающих пониженную холинергическую функцию, таких как дефицит обучаемости, дефицит познавательной способности, дефицит внимания или потеря памяти. Предполагается, что модуляция активности никотинового 7-рецептора дает положительный эффект в случае ряда заболеваний, включающих болезнь Альцгеймера, деменцию при болезни телец Леви, нарушение, характеризующееся дефицитом внимания и гиперактивностью, тревогу, шизофрению, манию, биполярную депрессию, болезнь Паркинсона, болезнь Гантингтона, синдром Туретта, травму мозга или другие неврологические, дегенеративные или психиатрические нарушения, при которых имеется потеря холинергических синапсов, включая нарушение суточного ритма, пристрастие к никотину, боль. Однако лечение агонистами никотиновых рецепторов, которые действуют на те же участки, что иACh, является проблематичным, поскольку ACh не только активирует, но также блокирует активность рецепторов посредством процессов, которые включают десенсибилизацию и неконкурентную блокаду. Более того, кажется, что продолжительная активация индуцирует длительную инактивацию. Следовательно, можно ожидать, что агонисты ACh снижают активность так же, как увеличивают ее. На никотиновых рецепторах в общем, и особенно на никотиновом 7-рецепторе, десенсибилизация ограничивает длительность действия примененного агониста. Описание изобретения Авторы настоящего изобретения неожиданно обнаружили, что некоторые новые производные триазола могут увеличивать эффективность агонистов никотиновых ацетилхолиновых рецепторов (nAChR). Соединения, обладающие данным типом активности (здесь далее названные "положительными аллостерическими модуляторами"), вероятно, могут подходить для лечения состояний, связанных с ухудшениями никотиновой передачи. В ходе терапии такие соединения могли бы восстановить нормальную межнейронную связь, не влияя на временный профиль активации. Кроме того, предполагается, что положительные аллостерические модуляторы не будут вызывать длительную инактивацию рецепторов, как это может происходить при долговременном применении агонистов. Положительные nAChR-модуляторы настоящего изобретения подходят для лечения или профилактики психотических нарушений, нарушений или заболеваний, связанных с умственными расстройствами, воспалительных заболеваний или состояний, при которых модуляция никотинового 7-рецептора дает полезный эффект. Настоящее изобретение относится к производным 1-(арил)-3-анилин-5-алкил-1,2,4-триазола, обладающим свойствами положительных аллостерических модуляторов, в частности увеличивающих эффективность агонистов никотинового 7-рецептора. Изобретение дополнительно относится к способам их получения и к включающим их фармацевтическим композициям. Изобретение также относится к применению данных производных для получения лекарственного средства для лечения или профилактики психотических нарушений, нарушений или заболеваний, связанных с умственными расстройствами, или воспалительных заболеваний или состояний, при которых модуляция никотинового 7-рецептора дает полезный эффект. Соединения по настоящему изобретению отличаются структурно от соединений известного уровня техники и фармакологически своей повышенной активностью в качестве положительных аллостерических модуляторов никотинового ацетилхолинового 7-рецептора. Настоящее изобретение относится к соединению формулы (I)R1 представляет собой незамещенный фенил; незамещенный бензодиоксан-6-ил; незамещенный пиридинил; или фенил или пиридинил, замещенный 1, 2 или 3 заместителями, выбранными из группы,состоящей из галогена, трифторметила, трифторметокси, C1-3 алкила, C1-3 алкилокси, С 1-3 алкилоксиС 1-3 алкила, C1-3 алкиламино, С 3-6 циклоалкила, С 3-6 циклоалкилокси, С 3-6 циклоалкиламино, (С 3-6 циклоалкил)R4 представляет собой водород или галоген;R2 и R3 могут образовывать радикал -OCF2-O-;Alk представляет собой линейный или разветвленный C1-6 алкандиил или С 2-6 алкендиил;R7 представляет собой водород или C1-3 алкил; илиR6 и R7 образуют пирролидинил или пиперидинил, каждый необязательно замещенный гидроксилом;R8 представляет собой водород или С 1-4 алкил; или к его фармацевтически приемлемой аддитивной соли, или гидрату, или сольвату. Настоящее изобретение относится, в частности, к соединению формулы (I) или к его стереоизомерной форме, в которойR1 представляет собой незамещенный фенил; незамещенный бензодиоксан-6-ил; незамещенный пиридинил или фенил или пиридинил, замещенный 1, 2 или 3 заместителями, выбранными из группы,состоящей из галогена, трифторметокси, C1-3 алкила, C1-3 алкилокси, С 1-3 алкилоксиС 1-3 алкила, C1-3 алкиламино, С 3-6 циклоалкила, С 3-6 циклоалкилокси, С 3-6 циклоалкиламино, (С 3-6 циклоалкил)C1-3 алкила, (С 3-6R4 представляет собой водород или галоген;R2 и R3 могут образовывать радикал -OCF2-O-;Alk представляет собой линейный или разветвленный C1-6 алкандиил или С 2-6 алкендиил;R7 представляет собой водород или C1-3 алкил; илиR6 и R7 образуют пирролидинил или пиперидинил, каждый необязательно замещенный гидроксилом;R8 представляет собой водород или С 1-4 алкил,или к его фармацевтически приемлемой аддитивной соли, или гидрату, или сольвату. Настоящее изобретение относится, в частности, к соединению формулы (I) или к его стереоизомерной форме, в которойR1 представляет собой незамещенный фенил; незамещенный бензодиоксан-6-ил; незамещенный пиридинил или фенил или пиридинил, замещенный 1 или 2 заместителями, выбранными из группы, состоящей из галогена, трифторметокси, C1-3 алкила, C1-3 алкилокси, С 1-3 алкилоксиС 1-3 алкила и C1-3 алкиламино;R4 представляет собой водород или галоген;R2 и R3 могут образовывать радикал -OCF2-O- в 3, 4 положении;Alk представляет собой линейный или разветвленный C1-6 алкандиил или С 2-6 алкендиил;R7 представляет собой водород или C1-3 алкил; илиR8 представляет собой водород или С 1-4 алкил; или к его фармацевтически приемлемой аддитивной соли, или гидрату, или сольвату. Настоящее изобретение, конкретнее, относится к соединению формулы (I) или к его стереоизомерной форме, в которойR1 представляет собой незамещенный бензодиоксан-6-ил; незамещенный пиридинил или пиридинил, замещенный 1 или 2 заместителями, выбранными из группы, состоящей из хлора, метила, этила,метоксиметила и этиламино;R4 представляет собой водород или галоген;R2 и R3 могут образовывать радикал -OCF2-O- в 3, 4 положении;Alk представляет собой линейный или разветвленный C1-6 алкандиил;R5 представляет собой гидроксил или R6R7N-C(=O)-;R7 представляет собой водород или метил; или к его фармацевтически приемлемой аддитивной соли, или гидрату, или сольвату. Настоящее изобретение, в особенности, относится к соединению формулы (I) или к его стереоизомерной форме, в которойR1 представляет собой незамещенный бензодиоксан-6-ил; пиридинил, замещенный 1 метильной или этиламинной группой; или пиридинил, замещенный 2 метильными группами;R4 представляет собой водород или фтор;R2 и R3 могут образовывать радикал -OCF2-O- в 3, 4 положении;Alk представляет собой линейный или разветвленный C1-6 алкандиил;R5 представляет собой гидроксил или R6R7N-C(=O)-;R7 представляет собой водород или метил; или к его фармацевтически приемлемой аддитивной соли, или гидрату, или сольвату. Настоящее изобретение относится, в частности, к соединению формулы (I) или к его стереоизомерной форме, в которойR1 представляет собой незамещенный фенил; незамещенный бензодиоксан-6-ил; незамещенный пиридинил или фенил или пиридинил, замещенный 1 или 2 заместителями, выбранными из группы, состоящей из галогена, трифторметокси, C1-3 алкила, C1-3 алкилокси, С 1-3 алкилоксиС 1-3 алкила и C1-3 алкил-3 018186R4 представляет собой водород или галоген;R2 и R3 могут образовывать радикал -OCF2-O- в 3, 4 положении;Alk представляет собой линейный или разветвленный C1-5 алкандиил или С 2-5 алкендиил;R7 представляет собой водород или C1-3 алкил илиR8 представляет собой водород или C1-3 алкил; или к его фармацевтически приемлемой аддитивной соли, или гидрату, или сольвату. Настоящее изобретение, конкретнее, относится к соединению формулы (I) или к его стереоизомерной форме, в которойR1 представляет собой незамещенный бензодиоксан-6-ил; незамещенный пиридинил или пиридинил, замещенный 1 или 2 заместителями, выбранными из группы, состоящей из хлора, метила, этила,метоксиметила и этиламино;R4 представляет собой водород или галоген;Alk представляет собой линейный или разветвленный C1-5 алкандиил;R5 представляет собой гидроксил или R6R7N-C(=O)-;R6 представляет собой метил или этил;R7 представляет собой водород или метил,или к его фармацевтически приемлемой аддитивной соли, или гидрату, или сольвату. Настоящее изобретение, в особенности, относится к соединению формулы (I) или к его стереоизомерной форме, в которойR1 представляет собой незамещенный бензодиоксан-6-ил; пиридинил, замещенный 1 метильной или этиламинной группой; или пиридинил, замещенный 2 метильными группами;R4 представляет собой водород или фтор;Alk представляет собой линейный или разветвленный C1-5 алкандиил;R5 представляет собой гидроксил или R6R7N-C(=O)-;R6 представляет собой метил или этил;R7 представляет собой водород или метил; или к его фармацевтически приемлемой аддитивной соли, или гидрату, или сольвату. Предпочтительными соединениями являются соединения(S)-3-[(3-хлор-5-метоксифенил)амино]-1-(2,6-диметил-4-пиридинил)этил-1H-1,2,4-триазол-5 этанол - Е 205; 3-[(3,4-дифторфенил)амино]-1-(2,6-диметил-4-пиридинил)-N,N-диметил-1 Н-1,2,4-триазол-5 пропанамид - Е 234 и 3-[(2,2-дифтор-1,3-бензодиоксол-5-ил)амино]-1-(2,6-диметил-4-пиридинил)-N,N-диметил-1H-1,2,4 триазол-5-пропанамид - Е 235; и их кислые аддитивные соли и сольваты. Использованные в данной заявкеC1-3 алкил в качестве группы или части группы определяет насыщенные углеводородные радикалы с линейной или разветвленной цепью, имеющие от 1 до 3 атомов углерода, такие как метил, этил, пропил и 1-метилэтил; С 3-6 циклоалкил в качестве группы или части группы определяет циклопропил, циклобутил, циклопентил и циклогексил;C1-6 алкандиил определяет двухвалентные насыщенные углеводородные радикалы с линейной и разветвленной цепью, имеющие от 1 до 6 атомов углерода, такие как, например, метилен, 1,2-этандиил, 1,3 пропандиил, 1,4-бутандиил, 1,5-пентандиил и их разветвленные изомеры; С 2-6 алкендиил определяет двухвалентные ненасыщенные углеводородные радикалы с линейной и разветвленной цепью, имеющие от 2 до 6 атомов углерода, такие как, например, 1,2-этендиил, 1,3-проп 1-ендиил и т.п.; галоген представляет собой фтор, хлор, бром или иод. Следует принять во внимание, что некоторые из соединений формулы (I) и их аддитивные соли,гидраты и сольваты могут содержать один или более центров хиральности и могут существовать в виде стереоизомерных форм. Термин "стереоизомерные формы", использованный в данной заявке, определяет все возможные стереоизомерные формы, которыми могут обладать соединения формулы (I) и их аддитивные соли. Если иное не упомянуто или не указано, химическое наименование соединений обозначает смесь всех стереохимически возможных изомерных форм, причем указанные смеси содержат все диастереомеры и энантиомеры базовой молекулярной структуры, а также каждую из индивидуальных изомерных форм формулы (I) и их солей, сольватов, по существу, свободную от других изомеров, т.е. содержащую менее 10%, предпочтительно менее 5%, в особенности менее 2% и наиболее предпочтительно менее 1% других изомеров. Подходящими для терапевтического использования солями соединений формулы (I) являются соли,в которых противоион является фармацевтически приемлемым. Однако соли кислот и оснований, которые не являются фармацевтически приемлемыми, также могут найти применение, например, при получении или очистке фармацевтически приемлемого соединения. Все соли, фармацевтически приемлемые или неприемлемые, включены в объем настоящего изобретения. Подразумевается, что фармацевтически приемлемые кислотно- и основно-аддитивные соли, упомянутые в данной заявке, включают терапевтически активные нетоксичные кислотно- и основноаддитивные солевые формы, которые способны образовывать соединения формулы (I). Фармацевтически приемлемые кислотно-аддитивные соли могут быть легко получены обработкой основной формы подходящей фармацевтически приемлемой кислотой. Подходящие кислоты включают, например, неорганические кислоты, такие как галогеноводородные кислоты, например хлористо-водородную или бромистоводородную кислоту, серную, азотную, фосфорную и подобные кислоты; или органические кислоты,такие как, например, уксусную, пропановую, гидроксиуксусную, молочную, пировиноградную, щавелевую (т.е. этандиовую), малоновую, янтарную (т.е. бутандиовую кислоту), малеиновую, фумаровую, яблочную, винную, лимонную, метансульфоновую, этансульфоновую, бензолсульфоновую, птолуолсульфоновую, цикламовую, салициловую, п-аминосалициловую, памоиновую и подобные кислоты. Наоборот, указанные солевые формы могут быть превращены обработкой подходящим основанием в форму свободного основания. Термин сольваты относится к алкоголятам, которые могут образовывать соединения формулы (I), а также их соли. Некоторые из соединений формулы (I) могут также существовать в виде своих таутомерных форм. Подразумевается, что такие формы, хотя они явно не указаны в вышеприведенной формуле, включены в объем настоящего изобретения. Получение соединений Соединение по изобретению может быть, в общем, получено последовательностью стадий, каждая из которых известна специалисту в данной области. В частности, соединения в данной патентной заявке могут быть получены согласно одному или более из следующих способов получения. В следующих схемах, и если иное не указано, все варьируемые группы использованы, как определено в формуле (I). Q представляет где R2, R3 и R4 являются таковыми, как определено в формуле (I). В некоторых из следующих промежуточных структур определение радикала R5 расширено, так что оно включает НО-СН 2 (Ie), замещенный силилокси (If и IV-a) и (алкил или арил)сульфонилокси (Ig). Схема 1 Соединения данного изобретения могут быть получены согласно схеме 1 превращением метилового сложноэфирного производного N-ацилкарбоимидотиокислоты общей формулы (II) в 1,2,4-триазолы формулы (I), используя подходящее производное (III) гидразина, в условиях известного уровня техники. Данное превращение типично проводят в апротонном растворителе, таком как DMF или т.п., и наиболее предпочтительно его проводят в присутствии мягкой кислоты Льюиса, в частности хлорида ртути(II)(HgCl2), и оно требует температуры в диапазоне от комнатной температуры до 150 С. В конкретном варианте осуществления температура реакции находится между 70 и 120 С и наиболее предпочтительно составляет 80 С. Интермедиаты формулы (II) могут присутствовать в Е- или Z-конфигурации или в виде их смеси, а также в таутомерной форме (II-а) также в Е- или Z-конфигурации или в виде их смеси (схема 2). Схема 2 Общий интермедиат (II) в синтезе тризамещенных триазолов настоящего изобретения типично получают, используя методику, которая состоит из 3 синтетических превращений (схема 2), исходя из хлорангидрида карбоновой кислоты общей формулы (IV). На первой стадии ацилхлорид (IV) вводят в реакцию с тиоцианатом моновалентного катиона (M-NCS на схеме 2), таким как, например, тиоцианат калия или тиоцианат аммония, получая соответствующий ацилизотиоцианат in situ. Данную реакцию обычно проводят, используя ацетон в качестве растворителя и при температуре в диапазоне от 0 до 70 С, предпочтительно при комнатной температуре. Промежуточный ацилизотиоцианат не выделяют, а обрабатывают в той же реакционной среде подходящим ароматическим амином (V), получая N-ацилтиомочевину общей формулы (VI). Данное превращение обычно проводят при температуре от 0 до 70 С, предпочтительно при комнатной температуре. На конечной стадии S-метилирование N-ацилтиомочевины (VI) дает метиловое сложноэфирное производное N-ацилкарбоимидотиокислоты общей формулы (II). Данное превращение осуществляют,используя метилиодид, и оно требует присутствия сильного основания, предпочтительно сильного неорганического основания, такого как NaH, и его проводят в апротонном растворителе, таком как, например,DMF, THF и т.п., при температуре в диапазоне от -70 С до комнатной температуры, предпочтительно при 0 С. Более предпочтительно указанное превращение осуществляют в присутствии карбоната калия в качестве неорганического основания в ацетоне в качестве растворителя при температуре от 0 до 60 С,предпочтительно при комнатной температуре. Необязательно, в тех случаях, когда ацилхлорид (IV) не является коммерчески доступным, указанный ацилхлорид (IV) может быть получен из соответствующей карбоновой кислоты (IX) в условиях известного уровня техники. Например, ацилхлорид (IV) может быть получен обработкой карбоновой кислоты (IX) избытком оксалилхлорида, необязательно, в присутствии DMF в качестве катализатора при температуре предпочтительно в диапазоне от 0 до 50 С. Указанное превращение может быть также осуществлено в присутствии органического растворителя, такого как дихлорметан или т.п. В конкретных примерах соединений, описанных в настоящем изобретении, ацилхлорид (IV) требует предварительной функционализации и защиты некоторых функциональных групп, чтобы быть совместимым с условиями реакций, следующими далее во всей синтетической последовательности. Например, когда R5 представляет собой гидроксил, можно следовать синтетической последовательности,показанной на схеме 3, чтобы получить ацилхлорид общей формулы (IVa) с защищенным гидроксилом На первой стадии гидроксильный фрагмент в сложном эфире алканкарбоновой кислоты общей формулы (VIIa) защищают подходящей силильной защитной группой. В частности, может быть использована дифенил-трет-бутильная группа, поскольку данная группа инертна к условиям реакций, описанным в данной заявке. В предпочтительном варианте осуществления гидроксилсодержащий сложный эфир (VIIa) обрабатывают трет-бутил(хлор)дифенилсиланом в присутствии имидазола в качестве основания, необязательно в присутствии диметиламинопиридина (DMAP) в качестве катализатора. Предпочтительным растворителем является полярный апротонный растворитель, такой как DMF или т.п. Температура реакции предпочтительно находится в диапазоне от 0 С до комнатной температуры. В последующем превращении сложный эфир алкилкарбоновой кислоты гидролизуют с получением соответствующей карбоновой кислоты общей формулы (VIIIa). Данное превращение может быть осуществлено,используя гидроксид металла (М-ОН), такой как гидроксид калия или более предпочтительно гидроксид лития. Реакцию проводят в водной среде и наиболее предпочтительно осуществляют в присутствии по меньшей мере одного или более предпочтительно двух смешивающихся с водой органических сорастворителей, таких как THF и метанол или т.п. Хлорангидрид кислоты общей формулы (IVa) может быть получен обработкой карбоновой кислоты(VIIIa) избытком оксалилхлорида, необязательно, в присутствии DMF в качестве катализатора, при температуре предпочтительно в диапазоне от 0 до 50 С. Указанное превращение может быть также осуществлено в присутствии органического растворителя, такого как дихлорметан или т.п. Несколько соединений общей формулы (I) могут быть получены посредством превращений функциональных групп, включающих заместитель R5. Схемы 4-8 представляют примеры указанных превращений функциональных групп. Схема 4 представляет получение амидов карбоновых кислот общей формулы (Ib) из соответствующих сложных эфиров карбоновых кислот (Ic), включающее обработку первичным или вторичным алифатическим амином HNR6R7. В одном варианте осуществления указанное превращение может быть осуществлено непосредственно исходя из сложного эфира (Ic). Предпочтительным растворителем является протонный растворитель, такой как низший алкиловый спирт, например метанол или т.п. Предпочтительная температура реакции находится между комнатной температурой и 120 С. Схема 4 Альтернативно, сложный эфир карбоновой кислоты (Ic) сначала гидролизуют с получением соответствующей карбоновой кислоты общей формулы (Ib). Данное превращение может быть осуществлено,используя гидроксид металла (М-ОН), такой как гидроксид калия или более предпочтительно гидроксид лития. Реакцию проводят в водной среде и наиболее предпочтительно осуществляют в присутствии по меньшей мере одного или более предпочтительно двух смешивающихся с водой органических сорастворителей, таких как THF и метанол или т.п. Дальнейшее превращение карбоновой кислоты (Id) в амиды формулы (Ib) проводят, используя известные в данной области методики, такие как, например, обработку первичным или вторичным амином HNR6R7, как определено выше, в присутствии обычного сочетающего реагента для получения амидов, такого как HBTU (гексафторфосфат О-бензотриазол-N,N,N',N'-7 018186 тетраметилурония), EDCI (моногидрохлорид N'-(этилкарбонимидоил)-N,N-диметил-1,3-пропандиамина) или EDAC (N'-(этилкарбонимидоил)-N,N-диметил-1,3-пропандиамин), в апротонном растворителе, таком как DCM, или более предпочтительно в полярном апротонном растворителе, таком как THF или DMF, в присутствии добавки аминного основания, такой как диизопропилэтиламин. В некоторых обстоятельствах применение НОВТ (1-гидрокси-1 Н-бензотриазол) в качестве добавки является предпочтительным. Когда R5 в соединении общей формулы (I) представляет собой первичную гидроксильную функцию, такую как в соединениях общей формулы (Ie), данные соединения могут быть получены, как показано на схеме 5, исходя из сложного эфира карбоновой кислоты (Ic). Данное превращение может быть успешно проведено, используя боргидрид натрия в присутствии хлорида кальция. в системе растворителя, состоящей из низшего алкилового спирта, такого как метанол, и апротонного растворителя, такого как THF. Предпочтительная температура реакции находится между 0 С и комнатной температурой. Альтернативно, когда реакционная способность сложноэфирного фрагмента ниже, предпочтительно может быть использован более сильный восстановитель. Конкретнее, литийалюмогидрид в апротонном растворителе, таком как диэтиловый эфир или THF или т.п., может давать первичный спирт (Ie). Предпочтительная температура реакции находится между 0 С и комнатной температурой. Схема 5 В тех случаях, когда R5 представляет собой гидроксильную функцию в соединении общей формулы(I) и когда указанная гидроксильная группа присоединена к вторичному атому углерода, соединение общей формулы (Ie') может быть получено удалением силильной защитной группы, как показано на схеме 6. В конкретном варианте осуществления дифенил-трет-бутильную группу в соединении общей формулы (If) удаляют при помощи источника нуклеофильного фтора, такого как фторид тетрабутиламмония(TBAF). Данное превращение проводят предпочтительно в апротонном растворителе, таком как THF или т.п. Предпочтительная температура реакции находится между 0 и 50 С, в частности равна комнатной температуре. Схема 6 Соединения общей формулы (I), в которых R5 представляет собой галоген, могут быть получены,как показано на схеме 7. На первой стадии гидроксильный фрагмент в (Ie') функционализируют в метилсульфонатную группу, получая (Ig). Данное превращение осуществляют обработкой (Ie') метансульфонилхлоридом в присутствии аминного основания, такого как триэтиламин или т.п., в галогенированном растворителе, таком как дихлорметан или т.п., необязательно в присутствии диметиламинопиридина(DMAP) в качестве катализатора. Предпочтительная температура реакции находится между 0 С и комнатной температурой. В данных условиях образуется значительное количество хлорированного соединения (In). Когда смесь (Ig) и (Ih) обрабатывают источником нуклеофильного фтора, таким как фторид тетрабутиламмония, указанный метансульфонат (Ig) превращается во фторалкан (Ii). Предпочтительным растворителем является апротонный растворитель, такой как THF или т.п. Предпочтительная температура реакции находится между 0 и 70 С, более предпочтительно между комнатной температурой и 50 С. В одном конкретном случае настоящего изобретения 5-алкилиден-1,2,4-триазолы общей формулы (Ij) могут быть получены в условиях реакции Мицунобу, исходя из вторичного спирта общей формулы (Ie). Вторичный спирт (Ie) обрабатывают ароматической карбоновой кислотой, такой как бензойная кислота или 4-нитробензойная кислота или т.п., в присутствии фосфина, такого как трифенилфосфин или т.п., и азодикарбоксилата, такого как диизопропилазодикарбоксилат (DIAD) или т.п., что дает алкилиден (Ij). Схема 8 В одном конкретном случае настоящего изобретения, когда Alk в соединении общей формулы (I) представляет фрагмент разветвленного С 3-5 алкандиила, указанное разветвление может быть введено в интермедиат общей формулы (VIa), давая интермедиат общей формулы (IIb) (схема 9). Соединение (VIa),которое содержит активированную метиленовую функцию, обрабатывают галогеноС 1-4 алканом, таким как иодметан, в апротонном растворителе, таком как ацетон, в присутствии неорганического основания,такого как карбонат калия или т.п., что дает соединение общей формулы (IIb). Предпочтительная температура реакции находится между 0 и 50 С, в частности равна комнатной температуре. Подобно тому, что было описано выше, соединение (IIb) может быть превращено в соединение общей формулы (I), как описано на схеме 1. Схема 9 В другом варианте осуществления настоящего изобретения соединения общей формулы (I) могут быть получены превращениями функциональных групп, включающих заместитель R1. Схемы 10-12 представляют примеры указанных превращений функциональных групп. Алкоксизамещенный пиридинил-1,2,4-триазол общей формулы (II), в которой R9 представляет водород, галоген, C1-3 алкил, C1-3 алкилокси, C1-3 алкиламино, С 3-6 циклоалкил, С 3-6 циклоалкилокси, С 3-6 циклоалкиламино, (С 3-6 циклоалкил)С 1-3 алкил, (С 3-6 циклоалкил)C1-3 алкилокси или (С 3-6 циклоалкил)C1-3 алкиламино, может быть получен обработкой хлорзамещенного пиридинил-1,2,4-триазола общей формулы (Ik) алкоксидом натрия, NaOC1-3 алкил в соответствующем спиртовом растворителе HOC1-3 алкил, например в метаноле, когда в качестве реагента использован метоксид натрия, и при нагревании при высоких температурах, предпочтительно при 100-130 С в пробирке, выдерживающей высокое давление, или в микроволновой печи (схема 10). Аналогично могут быть получены С 3-6 циклоалкилокси- и (С 3-6 циклоалкил)C1-3 алкилоксизамещенные пиридинилпроизводные. Схема 10 килокси, С 3-6 циклоалкиламино, (С 3-6 циклоалкил)С 1-3 алкил, (С 3-6 циклоалкил)C1-3 алкилокси или (С 3-6 циклоалкил)C1-3 алкиламино, может быть получен обработкой хлорзамещенного пиридинил-1,2,4-триазола общей формулы (Ik) C1-3 алкиламином в спиртовом растворителе, таком как этанол или т.п., и при нагревании при высоких температурах, предпочтительно при 100-200 С в пробирке, выдерживающей высокое давление, или в микроволновой печи (схема 11). Аналогично могут быть получены С 3-6 циклоалкиламино- и (С 3-6 циклоалкил)C1-3 алкиламинозамещенные пиридинилпроизводные. Схема 11 Моно- или ди-С 1-3 алкилзамещенный пиридинил-1,2,4-триазол общей формулы (In), в которой R10 представляет водород, галоген, C1-3 алкил, C1-3 алкилокси или C1-3 алкиламино, может быть получен обработкой хлор- или дихлорзамещенного пиридинил-1,2,4-триазола общей формулы (Io) избытком (3-15 экв.) реактива Гриньяра С 1-3 алкил-MgBr в присутствии каталитического количества Fe(acac)3 в системе растворителя, состоящей из 85% THF и 15% NMP. Указанное превращение может быть проведено в диапазоне температур от -10 до 50 С, наиболее предпочтительно от 0 до 25 С (схема 12). Будет понятно, что используя данную методологию могут быть получены как 2-C1-3 алкил-, так и 2,6-ди-С 1-3 алкилпиридинильные соединения общей формулы (In), исходя из соответствующих 2-хлор- или 2,6-дихлорпредшественников (Io) соответственно. Пиридинильные производные, замещенные С 3-6 циклоалкилом или (С 3-6 циклоалкил)C1-3 алкилом, могут быть получены аналогично. Схема 12 Фармакология Было обнаружено, что соединения по настоящему изобретению представляют собой положительные аллостерические модуляторы никотинового 7-рецептора. Никотиновый 7-рецептор (7-nAChR) принадлежит к суперсемейству имеющих cys-петлю, ионотропных лигандзависимых ионных каналов,которое включает в себя семейства 5-НТ 3-, GABAA- и глицинового рецепторов. Он активируется ацетилхолином и продуктом его распада холином, и основным признаком 7-nAChR является его быстрая десенсибилизация в случае постоянного присутствия агониста. Он представляет собой второй наиболее встречаемый подтип никотинового рецептора в головном мозге и является важным регулятором высвобождения многих нейромедиаторов. Он имеет дискретное распределение в нескольких структурах головного мозга, имеющих отношение к связанным с вниманием и познавательным процессам, в таких как гиппокамп и префронтальная кора головного мозга, и вовлечен в разнообразные психиатрические и неврологические нарушения у людей. Он также вовлечен в холинергический воспалительный путь. Генетическое доказательство его связи с шизофренией видно в форме сильного сцепления между маркером шизофрении (нарушение чувствительности воротного механизма ионных каналов) и 7 локусом на 15q13-14 и полиморфизма в центральной промоторной области 7-гена. Патологическое доказательство указывает на потерю 7-иммунореактивности и -Btx-связывания в гиппокампе, фронтальной и поясной коре шизофренического головного мозга, при болезни Паркинсона и Альцгеймера и паравентрикулярном ядре и в nucleus reuniens при аутизме. Фармакологическое доказательство, такое как выраженная привычка к курению больных шизофренией по сравнению со здоровыми людьми, было интерпретировано как попытка пациентов к самолечению, чтобы компенсировать дефицит 7-никотинергической передачи. Временная нормализация дефектов чувствительности воротного механизма ионных каналов (преимпульсное ингибирование PPI) как на животных моделях, так и у человека при введении никотина и временное восстановление нормальной чувствительности воротного механизма ионных каналов у больных шизофренией, когда холинергическая активность переднего мозга низка (например, сон во 2 стадии), были интерпретированы как результат временной активации никотинового 7-рецептора, за которой следовала десенсибилизация. Таким образом, имеется достаточное основание предположить, что активация 7-nAChR будет давать терапевтически полезные эффекты в случае ряда нарушений ЦНС (психиатрических и неврологических). Как уже упоминалось, 7-nAChR быстро десенсибилизируется в случае постоянного присутствия естественного медиатора ацетилхолина, а также экзогенных лигандов, таких как никотин. В десенсибилизированном состоянии рецептор остается связанным с лигандом, но является функционально неактивным. Это не представляет большой проблемы в случае естественных медиаторов, таких как ацетилхолин и холин, поскольку они являются субстратами весьма мощных механизмов расщепления (ацетилхолинэстераза) и очистки (переносчик холина). Данные механизмы расщепления/очистки от медиатора, вероятно, поддерживают баланс между активируемым и десенсибилизированным 7-nAChR в физиологически подходящем диапазоне. Однако понятно, что синтетические агонисты, которые не являются субстратами механизмов естественного расщепления и очистки, потенциально склонны как к чрезмерной стимуляции, а также к смещению равновесия в популяции 7-nAChR в сторону постоянно десенсибилизированного состояния, что нежелательно при нарушениях, в которых играет роль недостаточность в экспрессии или функции 7-nAChR. Агонисты по своей природе должны быть нацелены на карман связывания ACh,который высококонсервативен у различных подтипов никотинового рецептора, приводя к потенциальной возможности неблагоприятных реакций из-за неспецифической активации других подтипов никотинового рецептора. Следовательно, чтобы избежать данных потенциальных склонностей, альтернативная терапевтическая стратегия для 7-агонизма заключается в том, чтобы повысить чувствительность рецептора к естественным агонистам, используя положительный аллостерический модулятор (РАМ). РАМ определяют как агент, который связывается с участком, отличным от участка связывания агониста, и, следовательно, ожидается, что он не будет обладать агонистическими или десенсибилизирующими свойствами, но будет повышать чувствительность 7-nAChR к естественному медиатору. Достоинство данной стратегии состоит в том, что для данного количества медиатора сила 7-nAChR-ответа увеличивается в присутствии РАМ относительно уровня передачи, возможной в его отсутствии. Итак, в случае нарушений, при которых существует дефицит 7-nAChR-белка, РАМ-индуцированное усиление 7 никотиненергической передачи может быть полезным. Поскольку РАМ зависит от присутствия естественного медиатора, потенциал сверхстимуляции ограничен механизмами расщепления/очистки для естественного медиатора. Соединения по настоящему изобретению классифицированы на относящиеся к типам 1-4, основываясь на качественных кинетических свойствах, определенных регистрацией данных, полученных методом фиксации напряжения в конфигурации целой клетки. Данная классификация основана на воздействии 7-РАМ-соединения, описанного в данной заявке, на сигнал, вызванный применением агониста. В частности, указанный агонист представляет собой холин с концентрацией 1 мМ. В предпочтительном экспериментальном исполнении указанным 7-РАМ-соединением и холином одновременно воздействуют на клетку, как описано в данном описании. Десенсибилизацию определяют как закрытие рецептора после активации в ходе применения агониста в электрофизиологических измерениях методом фиксации напряжения в конфигурации целой клетки, наблюдаемое как уменьшение выходящего тока после начальной активации агонистом. Определение 1-4 типов РАМ описано ниже. Тип 0: соединения минимально увеличивают эффективную величину тока, вызванного 1 мМ холина. Тип 1: соединения увеличивают эффективную величину тока, вызванного 1 мМ холина, но минимально изменяют кинетику рецептора. В частности, скорость и степень десенсибилизации, вызванной агонистом, не подвергается воздействию. Модулированный соединением ответ на 1 мМ холина, следовательно, близок к линейному масштабированию ответа на 1 мМ холина в отсутствии 7-РАМ-соединения. Тип 2: соединения увеличивают эффективную величину тока, вызванного 1 мМ холина, уменьшая в то же время скорость и/или степень десенсибилизации. Тип 3: соединения увеличивают эффективную величину тока, вызванного 1 мМ холина. При тестировании при более высоких концентрациях вплоть до 10 мкМ они полностью ингибируют десенсибилизацию, в частности вызванную применением 1 мМ холина и составляющую 250 мс. Тип 4: соединения допускают начальную десенсибилизацию рецептора, за которой следует повторное открытие рецептора в ходе применения агониста. При обеспечивающих малую активность концентрациях 7-РАМ-соединения индуцированная агонистом активация, за которой следует десенсибилизация, все еще может быть обособлена от индуцированного соединением повторного открытия в виде начального максимума входящего тока. При обеспечивающих более высокую активность концентрациях 7-РАМ-соединения повторное открытие происходит быстрее, чем закрытие вследствие десенсибилизации, так что начальный максимум тока исчезает. Соответственно, задача настоящего изобретения заключается в том, чтобы предоставить способы лечения, которые включают либо введение положительного аллостерического модулятора в качестве единственного активного вещества, таким образом модулируя активность эндогенных агонистов никотиновых рецепторов, таких как ацетилхолин, или холин, либо введение положительного аллостерического модулятора вместе с агонистом никотинового рецептора. В частном варианте данного аспекта изобретения способ лечения включает терапию положительным аллостерическим модулятором никотинового 7-рецептора, описанным здесь, и агонистом или частичным агонистом никотинового 7-рецептора. Примеры подходящих соединений, обладающих агонистической активностью в отношении никотинового 7-рецептора, включают моногидрохлорид 4-бромфенилового эфира 1,4-диазабицикло[3.2.2]нонан-4-карбоновой кислотыAZD-0328 и МЕМ 63908. Положительные nAChR-модуляторы настоящего изобретения пригодны для лечения или профилактики психотических нарушений, нарушений или заболеваний, связанных с умственными расстройствами, или состояний, при которых модуляция никотинового 7-рецептора дает полезный эффект. Конкретный аспект способа изобретения представляет собой способ лечения дефицита обучаемости, дефицита познавательной способности, дефицита внимания или потери памяти; предполагается, что модуляция активности никотинового 7-рецептора дает положительный эффект в случае ряда заболеваний, включающих болезнь Альцгеймера, деменцию при болезни телец Леви, нарушение, характеризующееся дефицитом внимания и гиперактивностью, тревогу, шизофрению, манию, биполярную депрессию, болезнь Паркинсона, болезнь Гантингтона, синдром Туретта, травму мозга или другие неврологические, дегенеративные или психиатрические нарушения, при которых имеется потеря холинергических синапсов,включая нарушение суточного ритма, пристрастие к никотину, боль. Соединения могут также найти терапевтическое применение в качестве противовоспалительных лекарственных средств, поскольку 7-субъединица никотинового ацетилхолинового рецептора является существенной для ингибирования синтеза цитокинов посредством холинергического воспалительного пути. Примерами показаний, при которых может быть использована терапия данными соединениями,являются эндотоксемия, эндотоксический шок, сепсис, ревматоидный артрит, астма, множественный склероз, псориаз, крапивница, воспалительное заболевание кишечника, воспалительное заболевание желчного пузыря, болезнь Крона, неспецифический язвенный колит, послеоперационная непроходимость кишечника, панкреатит, сердечная недостаточность, острое повреждение легкого и отторжение аллотрансплантата. Соединения изобретения могут найти терапевтическое применение при следующих показаниях,как, например, нарушение познавательной способности при шизофрении, нарушение познавательной способности при болезни Альцгеймера, мягкое нарушение познавательной способности, болезнь Паркинсона, нарушение, характеризующееся дефицитом внимания и гиперактивностью, неспецифический язвенный колит, панкреатит, артрит, сепсис, послеоперационная непроходимость кишечника и острое повреждение легкого. Принимая во внимание описанные выше фармакологические свойства, соединения формулы (I) или любая их подгруппа, их фармацевтически приемлемые аддитивные соли, четвертичные аммонийные и стереохимически изомерные формы могут быть использованы в качестве лекарственного средства. В частности, настоящие соединения могут быть использованы для получения лекарственного средства для лечения или профилактики психотических нарушений, нарушений или заболеваний, связанных с умственными расстройствами, или состояний, при которых модуляция никотинового 7-рецептора дает полезный эффект. Принимая во внимание полезность соединений формулы (I), предоставлен способ лечения теплокровных животных, включая людей, страдающих от упомянутых далее заболеваний, или способ предотвращения развития у теплокровных животных, включая людей, заболеваний, при которых модуляция никотинового 7-рецептора дает положительный эффект, таких как шизофрения, мания и биполярная депрессия, тревога, болезнь Альцгеймера, дефицит обучаемости, дефицит познавательной способности,дефицит внимания, потеря памяти, деменция при болезни телец Леви, нарушение, характеризующееся дефицитом внимания и гиперактивностью, болезнь Паркинсона, болезнь Гантингтона, синдром Туретта,травма мозга, нарушение суточного ритма, пристрастие к никотину и боль. Указанные способы включают введение, т.е. систематическое или местное введение, предпочтительно пероральное введение, эффективного количества соединения формулы (I), включая все его стереохимически изомерные формы,его фармацевтически приемлемой аддитивной соли, сольвата или его четвертичной аммонийной формы,теплокровным животным, включая людей. Специалисту в данной области будет ясно, что терапевтически эффективное количество РАМ настоящего изобретения представляет собой количество, достаточное для того, чтобы модулировать активность никотинового 7-рецептора, и что данное количество варьируется среди прочего в зависимости от типа заболевания, концентрации соединения в терапевтической рецептуре и состояния пациента. Обычно количество РАМ, подлежащего введению в качестве терапевтического агента для лечения заболеваний,при которых модуляция никотинового 7-рецептора дает положительный эффект, таких как шизофрения, мания и биполярная депрессия, тревога, болезнь Альцгеймера, дефицит обучаемости, дефицит познавательной способности, дефицит внимания, потеря памяти, деменция при болезни телец Леви, нарушение, характеризующееся дефицитом внимания и гиперактивностью, болезнь Паркинсона, болезнь Гантингтона, синдром Туретта, травма мозга, нарушение суточного ритма, пристрастие к никотину и боль, будет определяться в каждом отдельном случае лечащим врачом. Обычно, подходящая доза представляет собой такую, которая дает концентрацию РАМ в подвергаемом лечению участке в диапазоне от 0,5 нМ до 200 мкМ и обычнее от 5 нМ до 50 мкМ. Чтобы получить данные терапевтические концентрации, пациент, нуждающийся в лечении, вероятно получит введение от 0,01 до 2,50 мг/кг массы тела, в частности от 0,1 до 0,50 мг/кг массы тела. Количество соединения согласно настоящему изобретению, названного здесь активным ингредиентом, которое требуется для достижения терапевтического эффекта, конечно, будет изменяться в каждом отдельном случае в зависимости от конкретного соединения, пути введения, возраста и состояния реципиента и конкретного нарушения или заболевания, подвергающегося лечению. Способ лечения может также включать введение активного ингредиента в режиме от одного до четырех приемов в сутки. В данных способах лечения соединения по настоящему изобретению составляют в рецептуры, предпочтительно, перед поступлением в лечебное учреждение. Как описано в данной заявке, подходящие фармацевтические рецептуры получают согласно известным методикам, используя хорошо известные и легкодоступные ингредиенты. Настоящее изобретение также предоставляет композиции для предотвращения или лечения заболеваний, при которых модуляция никотинового 7-рецептора дает положительный эффект, таких как шизофрения, мания и биполярная депрессия, тревога, болезнь Альцгеймера, дефицит обучаемости, дефицит познавательной способности, дефицит внимания, потеря памяти, деменция при болезни телец Леви, нарушение, характеризующееся дефицитом внимания и гиперактивностью, болезнь Паркинсона, болезнь Гантингтона, синдром Туретта, травма мозга, нарушение суточного ритма, пристрастие к никотину и боль. Указанные композиции включают терапевтически эффективное количество соединения формулы(I) и фармацевтически приемлемый носитель или разбавитель. Хотя возможным является введение одного активного ингредиента, предпочтительно предоставлять его в виде фармацевтической композиции. Соответственно, настоящее изобретение дополнительно предоставляет фармацевтическую композицию, включающую соединение по настоящему изобретению вместе с фармацевтически приемлемым носителем или разбавителем. Носитель или разбавитель должен быть "приемлемым" в смысле своей совместимости с другими ингредиентами композиции и не являться вредным для реципиента. Фармацевтические композиции данного изобретения могут быть получены любыми способами, хорошо известными в области фармации, например, используя такие способы, которые описаны в публикации Gennaro и др. Remington's Pharmaceutical Sciences (18th ed., Mack Publishing Company, 1990, см. в особенности часть 8: Pharmaceutical preparations and their Manufacture). Терапевтически эффективное количество конкретного соединения в форме основания или форме аддитивной соли в качестве активного ингредиента объединяют в тщательно смешанной смеси с фармацевтически приемлемым носителем, который может принимать разнообразные формы в зависимости от формы препарата, требующегося для введения. Данные фармацевтические композиции по желанию находятся в виде стандартной лекарственной формы, подходящей предпочтительно для систематического введения, такого как пероральное, чрескожное или парентеральное введение; или для местного введения, такого как введение посредством ингаляции, носового спрея, глазных капель или посредством крема, геля, шампуня или тому подобное. Например, при получении композиций в виде пероральной стандартной лекарственной формы может быть использована любая из обычных фармацевтических сред, такая как, например, вода, гликоли, масла,спирты и тому подобное в случае пероральных жидких препаратов, таких как суспензии, сиропы, эликсиры и растворы; или же в случае порошков, пилюль, капсул и таблеток могут быть использованы твердые носители, такие как крахмалы, сахара, каолин, смазывающие вещества, связующие, дезинтегрирующие агенты и т.п. Вследствие легкости их введения таблетки и капсулы представляют наиболее предпочтительные пероральные стандартные лекарственные формы, в случае которых применение твердых фармацевтических носителей очевидно. В случае парентеральных композиций носитель будет обычно включать стерильную воду, по меньшей мере, по большей части, хотя могут быть включены другие ингредиенты, например для улучшения растворимости. Могут быть получены, например, инъецируемые растворы, в которых носитель включает физиологический раствор, раствор глюкозы или смесь физиологического раствора и раствора глюкозы. Могут быть получены также инъецируемые суспензии, в случае которых могут быть использованы подходящие жидкие носители, суспендирующие агенты и т.п. В композициях, подходящих для чрескожного введения, носитель необязательно включает агент, увеличивающий проникновение, и/или подходящий смачивающий агент, необязательно объединенный с подходящими добавками любой природы в минорных количествах, где данные добавки не вызывают каких-либо вредных воздействий на кожу. Указанные добавки могут облегчать введение в кожу и/или могут способствовать получению желаемых композиций. Данные композиции могут быть ведены различными путями, например, как трансдермальный пластырь, как средство точечного нанесения или как мазь. Особенно предпочтительно составлять рецептуры вышеупомянутых фармацевтических композиций в виде стандартной лекарственной формы в целях легкости введения и единообразия дозировки. Термин стандартная лекарственная форма, использованный в настоящих описании и формуле изобретения, относится к физически дискретным единицам, подходящим в качестве стандартных дозировок, причем каждая единица содержит заданное количество активного ингредиента, рассчитанное таким образом, чтобы давать желаемый терапевтический эффект в сочетании с обязательным фармацевтическим носителем. Примерами таких стандартных лекарственных форм являются таблетки (включая таблетки с риской или покрытые оболочкой), капсулы, пилюли, пакеты с порошком, облатки, инъецируемые растворы или суспензии, чайные ложки, столовые ложки и т.п., и отдельные кратные им количества. Настоящие соединения могут быть использованы для систематического введения, такого как пероральное, чрескожное или парентеральное введение, или местного введения, такого как введение посредством ингаляции, носового спрея, глазных капель или посредством крема, геля, шампуня или т.п. Соединения вводят предпочтительно перорально. Точная дозировка и частота введения зависят от конкретного использованного соединения формулы (I), конкретного состояния, подвергающегося лечению, тяжести состояния, подвергающегося лечению, возраста, массы, пола, степени распространения нарушения и общего физического состояния конкретного пациента, а также от других лекарственных средств, которые может принимать индивидуум, как это хорошо известно специалистам в данной области. Более того,очевидно, что указанное эффективное суточное количество может быть снижено или увеличено в зависимости от ответа подвергаемого лечению субъекта и/или в зависимости от оценки врача, назначающего соединения по настоящему изобретению. Описание композиций с формообразующими (%). В зависимости от способа введения фармацевтическая композиция будет включать от 0,05 до 99 мас.%, предпочтительно от 0,1 до 70 мас.%, более предпочтительно от 0,1 до 50 мас.% активного ингредиента и от 1 до 99,95 мас.%, предпочтительно от 30 до 99,9 мас.%, более предпочтительно от 50 до 99,9 мас.% фармацевтически приемлемого носителя, причем все процентные содержания рассчитаны на суммарную массу композиции. Соединения формулы (I) могут быть также использованы в сочетании с другими традиционными агонистами никотинового 7-рецептора, такими как, например, моногидрохлорид 4-бромфенилового эфира 1,4-диазабицикло[3.2.2]нонан-4-карбоновой кислоты (SSR180711A); (-)-спиро[1-азабицикло[2.2.2] октан-3,5'-оксазолидин]-2'-он; дигидрохлорид 3-[(2,4-диметокси)бензилиден]анабазина(GTS-21); [гидрохлорид N-[(3R)-1-азабицикло[2.2.2]окт-3-ил]-4-хлорбензамида] PNU-282987; никотин; варениклин; МЕМ 3454; AZD-0328 и МЕМ 63908. Таким образом, настоящее изобретение также относится к сочетанию соединения формулы (I) и агониста никотинового 7-рецептора. Указанное сочетание может быть использовано в качестве лекарственного средства. Настоящее изобретение также относится к продукту,включающему в себя (а) соединение формулы (I) и (b) агонист никотинового 7-рецептора, как комбинированному препарату для одновременного, раздельного или последовательного применения в лечении заболеваний, при которых модуляция никотинового 7-рецептора дает положительный эффект. Различные лекарственные средства могут быть объединены в единственном препарате вместе с фармацевтически приемлемыми носителями. Экспериментальная часть Несколько способов получения соединений данного изобретения проиллюстрированы в следующих примерах. Если иное не указано, все исходные материалы получали от коммерческих поставщиков и использовали без дополнительной очистки. Здесь и далее "THF" означает тетрагидрофуран; "DMF" означает N,N-диметилформамид; "EtOAc" означает этилацетат; "DCM" означает дихлорметан; "DIPE" означает диизопропиловый эфир; "DMSO" означает диметилсульфоксид; "DMAP" означает 4-(диметиламино)пиридин; "мин" означает минуты;"нас." означает насыщенный; "МеОН" означает метанол; "EtOH" означает этанол; "Et2O" означает диэтиловый эфир; "асас" означает ацетилацетонат; "TBAF" означает фторид тетрабутиламмония; "DIAD" означает диизопропилдиазодикарбоксилат; "NH4OAc" означает ацетат аммония и "к.т." означает комнатную температуру. Реакции при содействии микроволнового излучения осуществляли в одномодовом реакторе микроволновый реактор Initiator Sixty EXP (Biotage AB) или в многомодовом реакторе Micro-SYNTH Labstation (Milestone, Inc.). Следующие примеры предназначены иллюстрировать, но не ограничивать объем настоящего изобретения. Описание 1. Метиловый эфир (3S)-3-(1,1-диметилэтил)дифенилсилил]окси]бутановой кислоты (D1) трет-Бутил(хлор)дифенилсилан (15,282 г, 55,6 ммоль) добавляли по каплям к охлаждаемому льдом и перемешиваемому раствору метилового эфира (S)-3-гидроксибутановой кислоты (5,473 г, 46,3 ммоль),1 Н-имидазола (6,939 г, 102 ммоль) и DMAP (0,566 г, 4,63 ммоль) в DMF (250 мл). Спустя 10 мин мутной реакционной смеси позволяли нагреться до комнатной температуры и перемешивали ее в течение ночи. Реакционную смесь растворяли в EtOAc, затем промывали последовательно Н 2 О (3), 1N HCl и насыщенным раствором NaHCO3. Органическую фазу высушивали (Na2SO4), профильтровывали и концентрировали с получением вязкого бесцветного масла. Выход: 10,614 г интермедиата D1 (64%). Описание 2. (3S)-3-(1,1-Диметилэтил)дифенилсилил]окси]бутановая кислота (D2) Раствор гидроксида лития (2,1 г, 89,3 ммоль) в МеОН/Н 2 О (80 мл/80 мл) добавляли к перемешиваемому раствору интермедиата D1 (10,6 г, 29,8 ммоль) в THF (80 мл) при комнатной температуре. Реакционную смесь перемешивали в течение ночи. Затем растворитель удаляли при пониженном давлении и остаток распределяли между H2O/EtOAc. Слои разделяли и водную фазу экстрагировали EtOAc (3), затем подкисляли до рН 1 концентрированной HCl и снова экстрагировали EtOAc (3). Объединенные органические экстракты высушивали (Na2SO4), фильтровали и концентрировали при пониженном давлении, с получением светло-желтого вязкого масла. Выход: 11 г интермедиата D2 (99,9%). Описание 3. (3S)-3-(1,1-Диметилэтил)дифенилсилил]окси]бутаноилхлорид (D3) Оксалилхлорид (4,1 мл, 48 ммоль; плотность 1,5 г/мл) добавляли по каплям к перемешиваемому раствору интермедиата D2 (11 г, 32 ммоль) и DMF (1 мл) в DCM (300 мл) при комнатной температуре в течение 90 мин. Реакционную смесь упаривали при пониженном давлении совместно с толуолом (3), с получением сырого интермедиата D3 в виде желтого масла. Данный материал был использован на следующей стадии последовательности реакций без какой-либо дополнительной очистки. Описание 4. (3S)-3-(1,1-Диметилэтил)дифенилсилил]окси]-N-4-фтор-3-(трифторметил)фенил] амино]тиоксометил]бутанамид (D4) Интермедиат D3 (5,4 г, 14,9 ммоль) добавляли по каплям к перемешиваемому раствору тиоцианата аммония (1,1 г, 14,9 ммоль) в ацетоне (150 мл) при комнатной температуре. Спустя 2 ч добавляли 4 фтор-(3-трифторметил)анилин (2,7 г, 14,9 ммоль) и реакционную смесь перемешивали в течение ночи при комнатной температуре. Растворитель удаляли при пониженном давлении и остаток распределяли между Н 2 О/DCM. Слои разделяли и водную фазу экстрагировали DCM (2). Объединенные органические экстракты промывали рассолом, высушивали (Na2SO4) и фильтровали. Затем растворитель упаривали с получением сырого материала в виде вязкого темно-оранжевого масла с выходом 8,8 г (104,9%). Данный материал очищали флэш-хроматографией (Biotage; колонка 40 М; элюент: EtOAc/гептан, градиентное элюирование от 0/100 до 40/60). Выход 3,7 г интермедиата D4 (44,4%) в виде вязкого, желтого Смесь аммонийной соли тиоциановой кислоты (5 г, 0,065 моль) в CH3CN (42 мл) перемешивали в течение 15 мин при комнатной температуре. Этиловый эфир 4-хлор-4-оксобутановой кислоты (0,061 моль) добавляли по каплям и смесь перемешивали в течение 30 мин при 60 С. Смесь охлаждали до 0 С и затем по каплям добавляли 3,4-дифторанилин (6 мл, 0,061 моль). Реакционную смесь перемешивали в течение 30 мин при комнатной температуре. Затем смесь разбавляли ледяной водой и перемешивали в течение 15 мин при 0 С. Смесь фильтровали через фильтр из пористого стекла, высушивали и азеотропной отгонкой с толуолом удаляли оставшуюся воду. Выход: 16,40 г интермедиата D5 (85%, желтое твердое вещество). Подобным образом получали следующие интермедиаты:K2CO3 (1 г, 7,3 ммоль) добавляли к перемешиваемому раствору интермедиата D4 (получен согласно описанию 4) (3,7 г, 6,6 ммоль) в ацетоне (70 мл) при комнатной температуре. Спустя 50 мин по каплям добавляли CH3I (0,5 мл, 7,9 ммоль) и реакционную смесь перемешивали при комнатной температуре в течение 145 мин. Растворитель удаляли при пониженном давлении и полученный остаток распределяли между Н 2 О/DCM. Слои разделяли и водную фазу экстрагировали DCM (2). Объединенные органические экстракты промывали рассолом, высушивали (Na2SO4), фильтровали и растворитель упаривали, с получением сырого продукта в виде вязкого желтого масла. Выход: 3,8 г интермедиата D9 (99,4%). Подобным образом получали следующие интермедиаты: Хлорид ртути(II) (1,8 г, 6,5 ммоль) добавляли к перемешиваемому раствору интермедиата D9 (получен согласно описанию 9) (3,8 г, 6,5 ммоль) и 4-гидразин-2-метилпиридина (0,8 г, 6,5 ммоль) в DMF(65 мл) при комнатной температуре. Реакционную смесь нагревали при 80 С в течение 140 мин. Охлажденную реакционную смесь выливали на лед и осажденный продукт отделяли фильтрованием, с получением желтого полутвердого вещества. Выход: 4,2 г интермедиата D14 (101,2%). Описание 15. Этиловый эфир 3-4-фтор-3-(трифторметил)фенил]амино]тиоксометил]амино]-3 оксопропановой кислоты (D15) Этиловый эфир 3-хлор-3-оксопропановой кислоты (5 г; 33,2 ммоль)медленно добавляли к перемешиваемому раствору аммонийной соли тиоциановой кислоты (1:1) (2,781 г; 36,5 ммоль) в CH3CN (110 мл) при комнатной температуре. Спустя 2 ч добавляли 4-фтор-3-(трифторметил)бензоламин (4,27 мл; 33,2 ммоль). Растворитель удаляли при пониженном давлении. Полученный остаток распределяли между Н 2 О/DCM и разделяли фазы. Водную фазу экстрагировали DCM (2) и объединенные органические экстракты промывали рассолом, высушивали и фильтровали. Выход: 3,656 г интермедиата D15. Описание 16. Этиловый эфир 3-(1Z)-4-фтор-3-(трифторметил)фенил]амино](метилтио)метилен] амино]-2-метил-3-оксопропановой кислоты (D16)K2CO3 (0,831 г; 6,01 ммоль) добавляли к перемешиваемому раствору интермедиата D15 (1,765 г; 5,01 ммоль) в ацетоне (50 мл) при комнатной температуре. Спустя 40 мин по каплям добавляли CH3I(0,624 мл; 10,0 ммоль). Реакционную смесь перемешивали при комнатной температуре. Растворитель удаляли при пониженном давлении и остаток распределяли между Н 2 О/DCM. Водную фазу экстрагировали DCM и объединенные органические экстракты промывали рассолом, высушивали (Na2SO4) и фильтровали с получением оранжевого масла. LCMS показала 4 различных продукта, которые разделяли флэш-хроматографией, используя систему Biotage (колонка 40 М), элюент: градиентное элюирование отDCM до 10% MeOH/DCM. Третья фракция содержала желаемое соединение. Выход: 401 мг интермедиата D16. Описание D18. 5-[(2S)-2-(1,1-Диметилэтил)дифенилсилил]окси]бутил]-N-[3-метокси-5-(трифторметил)фенил]-1-(2-метил-4-пиридинил)-1 Н-1,2,4-триазол-3-амин (D18) Хлорид ртути(II) (5,2 г; 19,1 ммоль) добавляли к перемешиваемому раствору интермедиата D17DMF (180 мл) при комнатной температуре. Спустя 5 мин реакционную смесь нагревали при 80 С в течение 120 мин. Реакционную смесь охлаждали до комнатной температуры и растворитель удаляли при пониженном давлении. Остаток распределяли между H2O/EtOAc. Водную фазу экстрагировали EtOAc (2) и объединенные органические экстракты промывали рассолом, высушивали (Na2SO4) и фильтровали с получением желтого масла. Выход: интермедиат D18 (41%). Интермедиат D18 (29 г; несколько объединенных порций) растворяли в 1,5 л EtOAc. Добавляли раствор Na2S в воде (20 мл) и смесь энергично перемешивали в течение 2 ч. Образовывался черный нерастворимый осадок (HgS). Реакционную смесь фильтровали через дикалит и снова обрабатывали раствором Na2S. Органический слой отделяли и промывали рассолом. Органический слой высушивали надMgSO4, фильтровали и обрабатывали силикагель-S-тиолом (22 ч при 50 С). Смесь фильтровали через дикалит и упаривали. Продукт выкристаллизовывался, когда упаривание было практически завершено. Добавляли Et2O и осадок отфильтровывали. Продукт высушивали в вакуумной печи при 50 С. Выход: 25,70 г интермедиата D18. Описание D19. Метиловый эфир 3-2-фтор-3-(трифторметил)фенил]амино]тиоксометил]амино]3-оксопропановой кислоты (D19) Метиловый эфир 3-хлор-3-оксопропановой кислоты (7,5 г) в MeCN (50 мл) медленно добавляли к перемешиваемому раствору тиоцианата аммония (4,6 г) в MeCN (400 мл) при комнатной температуре. Спустя 1,5 ч реакционную смесь охлаждали до 0 С и медленно добавляли раствор 2-фтор-3(трифторметил)анилина (9,8 г) в MeCN (50 мл). Спустя 5-10 мин полученной реакционной смеси позволяли нагреться до комнатной температуры и спустя 1 ч растворитель удаляли при пониженном давлении и полученный остаток распределяли между H2O/DCM и разделяли фазы. Водную фазу экстрагировалиDCM (2) и объединенные органические экстракты промывали рассолом, затем высушивали (Na2SO4). Фильтровали и концентрировали с получением сырого материала в виде янтарного масла. Выход: 17,1 г интермедиата D19 (60%). Охлаждаемый льдом раствор интермедиата D19 (17,1 г) в THF (450 мл) перемешивали в атмосфереN2. Добавляли NaOtBu (1 экв.) и спустя 30 мин добавляли по каплям раствор иодметана (3,15 мл) в THF. По прошествии дополнительных 30 мин добавляли дополнительное количество NaOtBu (1 экв.) и содержимое перемешивали при 0 С. По прошествии 45 мин, когда реакция завершилась, добавляли насыщенный раствор NH4Cl и реакционную смесь разбавляли EtOAc. Фазы разделяли и водную фазу экстрагировали EtOAc (2). Объединенные органические экстракты промывали рассолом, затем высушивали(Na2SO4). Фильтровали и концентрировали при пониженном давлении с получением сырого материала в виде янтарного масла. Выход: 17,2 г интермедиата D20 (59%). Описание D21. Метиловый эфир 1-(2,6-диметил-4-пиридинил)-3-2-фтор-3-(трифторметил)фенил] амино]-1 Н-1,2,4-триазол-5-уксусной кислоты (D21) Хлорид ртути(II) (7 г) добавляли к перемешиваемому раствору интермедиата D20 (9,1 г) и 2,6 диметил-4-гидразинпиридина HCl (4,48 г) в DMF (200 мл) при комнатной температуре. По прошествии 5 мин при комнатной температуре полученную реакционную смесь нагревали до 70 С и перемешивали при этой температуре в течение ночи (реакция прошла на 40%). Содержимое охлаждали до комнатной температуры и растворитель удаляли при пониженном давлении. Полученный остаток распределяли между Н 2 О и EtOAc и фазы разделяли. Водную фазу экстрагировали EtOAc (2) и объединенные органические экстракты промывали рассолом, затем высушивали (Na2SO4). Фильтровали и концентрировали с получением желтого масла, которое растворяли в EtOAc, и добавляли раствор сульфида натрия (4 г) в Н 2 О (образовывался черный осадок). Полученную реакционную смесь энергично перемешивали при комнатной температуре в течение нескольких часов, затем фильтровали через дикалит. Фазы разделяли и водную фазу экстрагировали EtOAc (2) и объединенные органические экстракты промывали H2O, затем рассолом и высушивали (Na2SO4). Содержимое фильтровали и концентрировали и полученное масло растворяли в DCM и добавляли Si-тиол (функционализированный силикагель). Полученную суспензию энергично перемешивали при комнатной температуре в течение нескольких часов, затем фильтровали и упаривали с получением янтарного масла, которое очищали флэшхроматографией, используя систему Biotage, элюент: градиентное элюирование от 20% EtOAc:80% гептана до 100% EtOAc (элюирование большинства примесей), затем 10% MeOH/DCM, чтобы элюировать желаемый продукт в виде тягучего желтого масла. Желтое масло перемешивали в DIPE в течение ночи,затем содержимое фильтровали с получением бледно-желтого порошка. Выход: 814 мг интермедиатаLiOHН 2 О (0,00277 моль) добавляли к перемешиваемому при комнатной температуре раствору соединения Е 114 (получено согласно описанию 14) (0,00158 моль) в THF (9 мл), МеОН (3 мл) и Н 2 О (3 мл). Реакционную смесь перемешивали в течение 1 ч при комнатной температуре. Растворители упаривали при пониженном давлении. Добавляли HCl (2 М, 20 мл) и получившийся осадок отфильтровывали и высушивали. Выход: 0,570 г соединения Е 1 (90%, серое твердое вещество).THF (1,9 мл; 0,0038 моль) и раствор кипятили в течение 12 ч. Приблизительно каждые 3 ч добавляли дополнительную порцию CH3NH2, 2,0 М в МеОН (1,9 мл; 0,0038 моль) и THF (1 мл). Смесь охлаждали и растворитель упаривали при пониженном давлении. Коричневый твердый остаток очищали колоночной хроматографией на силикагеле (элюент: DCM/(MeOH/NH3) от 100/0 до 90/10). Фракции продукта собирали и растворитель упаривали. Выход: 0,013 г соединения Е 2 (16%). Пример 3. 3-[(3,4-Дифторфенил)амино]-1-(2,3-дигидро-1,4-бензодиоксин-6-ил)-N,N-диметил-1 Н 1,2,4-триазол-5-пропанамид (Е 3)(1:1) (0,00186 моль) и N-этил-N-(1-метилэтил)-2-пропанамин (0,00248 моль), затем добавляли гидрохлорид диметиламина (1:1) (0,00124 моль). Реакционную смесь перемешивали в течение 3 ч при комнатной температуре. Реакционную смесь выливали в воду. Смесь экстрагировали CHCl3. Органический слой отделяли, промывали 1 М раствором HCl, затем промывали рассолом и фильтровали через гидрофобную фритту. Растворители упаривали при пониженном давлении с получением желтого твердого остатка,который дополнительно высушивали в течение 1 ч (в GeneVac). Остаток затирали с диэтиловым эфиром, отфильтровывали и высушивали. Выход: 0,245 г соединения Е 3 (92%). Пример 4. 1-(2-Метокси-3-пиридинил)-N,N-диметил-3-3-(трифторметокси)фенил]амино]-1 Н-1,2,4 триазол-5-пропанамид (Е 4) Смесь соединения Е 76 (получено согласно примеру 3) (0,20 г; 0,0004 моль), NaOCH3 в МеОН (1 мл) и МеОН (4 мл) перемешивали в течение 30 мин при 100 С в микроволновой печи. Реакционную смесь упаривали и остаток очищали высокоэффективной жидкостной хроматографией на обращенной фазе Смесь соединения Е 76 (получено согласно примеру 3) (0,20 г; 0,0004 моль), Fe(acac)3 (0,031 г; 0,0001 моль), THF (5 мл) и 1-метил-2-пирролидинона (1,5 мл) перемешивали при комнатной температуре перед добавлением CH3MgBr в Et2O, 2 М (2 мл) и МеОН (5 мл). Реакционную смесь упаривали и растворяли в DCM и Н 2 О и фильтровали через дикалит. Фильтрат высушивали над MgSO4 и фильтровали. Фильтрат упаривали. Продукт растворяли в DIPE/H2O. Органический слой отделяли, высушивали(MgSO4) и фильтровали. Фильтрат упаривали и остаток очищали высокоэффективной жидкостной хроматографией на обращенной фазе (Shandon Hyperprep C18 BDS (дезактивированный основанием силикагель), 8 мкм, 250 г, I.D. 5 см). Использовали градиент с 2 подвижными фазами. Фаза А: 0,25% раствор(20 мл) перемешивали в течение 16 ч при 160 С. Впоследствии растворитель упаривали и остаток очищали высокоэффективной жидкостной хроматографией на обращенной фазе (Shandon Hyperprep C18BDS (дезактивированный основанием силикагель), 8 мкм, 250 г, I.D. 5 см). Использовали градиент с 3 подвижными фазами. Фаза А: 0,25% раствор NH4HCO3 в воде; фаза В: МеОН; фаза С: CH3CN. Чистые фракции собирали и растворитель упаривали. Желаемое соединение высушивали. Выход: 0,091 г соединения Е 6 (46%). Пример 7. 3-4-Фтор-3-(трифторметил)фенил]амино]-1-(2-метил-4-пиридинил)-1 Н-1,2,4-триазол-5 пропанол (Е 7)LiAlH4 (10,5 ммоль) добавляли частями к охлаждаемому льдом и перемешиваемому раствору соединения Е 113 (получено согласно описанию D14) (6,98 ммоль) в Et2O (80 мл) в атмосфере N2. Спустя 5 мин смеси позволяли нагреться до комнатной температуры и затем перемешивали в течение ночи. Затем реакционную смесь охлаждали до 0 С и добавляли дополнительное количество Et2O (20,9 ммоль). Спустя 5 мин реакционную смесь нагревали до комнатной температуры. Добавляли дополнительное количество LiAlH4 (3 экв.; 21,0 ммоль) к охлажденной реакционной смеси и смесь перемешивали в течение 1 ч. Реакционную смесь охлаждали и осторожно гасили 10% NaOH. Затем смеси позволяли нагреться до комнатной температуры и ее фильтровали через подушку диатомовой земли. Фильтрат экстрагировалиEtOAc. Объединенные органические экстракты промывали рассолом, высушивали (Na2SO4), фильтровали и концентрировали с получением 0,634 г желтого твердого вещества (выход = 23%). Продукт очищали высокоэффективной жидкостной хроматографией на обращенной фазе (Shandon Hyperprep C18 BDSCH3CN. Желаемые фракции собирали и растворитель упаривали с получением белого твердого вещества. Добавляли Н 2 О и смесь нейтрализовали насыщенным NaHCO3. Затем содержимое экстрагировали DCM. Объединенные органические экстракты промывали рассолом, высушивали (Na2SO4), фильтровали и концентрировали с получением белого твердого вещества. Выход: 0,084 г соединения Е 7 (3%). Примеры 8 и 9. 5-(3-Фторпропил)-N-[4-фтор-3-(трифторметил)фенил]-1-(2-метил-4-пиридинил)-1 Н 1,2,4-триазол-3-амин Метансульфонилхлорид (0,986 моль) добавляли по каплям к охлаждаемой льдом и перемешиваемой суспензии соединения Е 7 (получено согласно примеру 7) (0,493 ммоль), N-этил-N-(1-метилэтил)-2 пропанамина (0,986 ммоль) и DMAP (0,049 ммоль) в DCM (5 мл). Спустя 5 мин реакционной смеси позволяли нагреться до комнатной температуры. К реакционной смеси добавляли насыщенный растворNH4Cl, затем добавляли Н 2 О. Фазы разделяли. Водную фазу экстрагировали DCM. Объединенные органические экстракты промывали рассолом, затем высушивали (Na2SO4), фильтровали и растворитель упаривали с получением оранжевого масла. Данное масло растворяли в THF (5 мл) и охлаждали до 0 С. Добавляли TBAF (1,0 М в THF) (2,50 ммоль) и спустя 5-10 мин реакционной смеси позволяли нагреться до комнатной температуры. Затем смесь перемешивали в течение ночи. Добавляли дополнительное количество TBAF (1,0 М в THF) (2,50 ммоль) и реакционную смесь нагревали при 50 С в течение 2 ч. Растворитель удаляли при пониженном давлении и остаток распределяли между Н 2 О и DCM. Слои разделяли. Водную фазу экстрагировали DCM и объединенные органические экстракты промывали, высушивали(Na2SO4), фильтровали и концентрировали с получением оранжевого масла. Данное масло сначала очищали флэш-хроматографией (Biotage; колонка 40 М; элюент: DCM/MeOH, градиентное элюирование от 100/0 до 90/10). Полученный материал дополнительно очищали высокоэффективной жидкостной хроматографией на обращенной фазе (Shandon Hyperprep C18 BDS (дезактивированный основанием силикагель), 8 мкм, 250 г, I.D. 5 см). Использовали градиент с 2 подвижными фазами. Фаза А: 0,25% растворNH4HCO3 в воде; фаза В: CH3CN. Желаемые фракции собирали и обрабатывали. Выход: 13 мг соединения Е 8 и 36 мг соединения Е 9 (6,6% и 17,7% соответственно). Пример 10. 3-4-Фтор-3-(трифторметил)фенил]амино]- -метил-1-(2-метил-4-пиридинил)-( S)-1 Н 1,2,4-триазол-5-этанол (Е 10)TBAF (16,3 мл; 16,3 ммоль; 1,0 М в THF) добавляли к охлаждаемой льдом и перемешиваемой суспензии интермедиата D14 (получен согласно описанию D14) (4,1 г; 6,5 ммоль) в THF (60 мл). Спустя 5 мин полученной реакционной смеси позволили нагреться до комнатной температуры. Через 170 мин добавляли насыщенный раствор NH4Cl и смесь экстрагировали EtOAc. Объединенные органические экстракты промывали рассолом, высушивали (Na2SO4), фильтровали и концентрировали с получением оранжевого масла. Данный материал сначала очищали флэш-хроматографией (Biotage; колонка 40 М; элюент: DCM/MeOH, градиентное элюирование от 100/0 до 90/10). Желаемые фракции собирали и растворитель упаривали с получением желтого маслянистого твердого вещества. Данный материал растворяли в MeOH/DCM. Полученную смесь фильтровали и фильтрат концентрировали при пониженном давлении с получением 1,251 г желтого маслянистого твердого вещества. Продукт дополнительно очищали высокоэффективной жидкостной хроматографией на обращенной фазе (Shandon Hyperprep C18 BDS(дезактивированный основанием силикагель), 8 мкм, 250 г, I.D. 5 см). Использовали градиент с 2 подвижными фазами. Фаза А: 0,25% раствор NH4HCO3 в воде; фаза В: CH3CN. Желаемые фракции собирали с получением (после упаривания растворителя) кремового порошка. Выход: 357 мг соединения Е 10DIAD (0,3 мл; 1,5 ммоль) добавляли по каплям к охлаждаемому льдом и перемешиваемому раство- 22018186(230,2 мг; 1,4 ммоль) и трифенилфосфина (401,4 мг; 1,5 ммоль) в THF (6 мл) (в атмосфере N2). Реакционной смеси позволили нагреться до комнатной температуры в течение 1 ч и затем ее перемешивали в течение ночи при комнатной температуре. Растворитель удаляли при пониженном давлении с получением желтого масла. Данный материал очищали флэш-хроматографией (Biotage; колонка 40 М; элюент:DCM/MeOH, градиентное элюирование от 100/0 до 90/10). Желаемые фракции объединяли с получением бледно-желтого маслянистого твердого вещества. Данный материал перемешивали в DIPE в течение нескольких часов. Затем смесь фильтровали и осевшее твердое вещество промывали DIPE и DCM с получением мелкого кремового порошка. Выход: 92 мг соединения Е 11 (79,7%). Пример 12. 1-(3-Хлор-4-пиридинил)-N-[4-фтор-3-(трифторметил)фенил]-5-(3-метоксипропил)-1 Н 1,2,4-триазол-3-амин (Е 12) Метансульфонилхлорид (0,050 мл; 0,646 ммоль) добавляли по каплям к охлаждаемой льдом и перемешиваемой суспензии соединения Е 14 (получено согласно примеру 7) (0,111 г; 0,258 ммоль), N,Nдиэтилэтанамина (0,090 мл; 0,646 ммоль) и DMAP (0,003 г; 0,026 ммоль) в DCM (2,5 мл). Спустя 5-10 мин реакционной смеси позволяли нагреться до комнатной температуры. Через 2,5 ч LCMS показала присутствие мезилата и отсутствие остатков исходного материала. К реакционной смеси добавляли насыщенный раствор NH4Cl, затем добавляли воду. Водную фазу экстрагировали DCM и объединенные органические экстракты промывали рассолом, высушивали (Na2SO4), фильтровали и концентрировали с получением оранжевого масла. Масло обрабатывали NaOMe (5 мл) и полученный раствор перемешивали в течение ночи при комнатной температуре. Добавляли дополнительное количество NaOMe (5 мл) и реакционную смесь нагревали при 50 С в течение 2 ч. Реакционную смесь охлаждали и добавляли насыщенный раствор NH4Cl, затем добавляли воду и фазы разделяли. Водную фазу экстрагировали DCM и объединенные органические экстракты промывали рассолом, затем высушивали (Na2SO4), фильтровали и концентрировали с получением бледно-желтого масла. Данный остаток очищали хроматографией на системе Biotage, элюент: от DCM до 10% MeOH/DCM. Объединенные подходящие фракции давали желтое масло и были очищены RP-хроматографией с получением кремового твердого вещества. Выход: 22 мг соединения Е 12 (100%). Пример 137. (S)этил-3-3-метокси-5-(трифторметил)фенил]амино]-1-(2-метил-4-пиридинил)1H-1,2,4-триазол-5-этанол (Е 137)D18 (получен согласно описанию D18) (12,6 г; 19,1 ммоль) в THF (200 мл). Смесь перемешивали в течение 24 ч. Добавляли насыщенный раствор NH4Cl и смесь перемешивали еще в течение 5-10 мин. Смесь экстрагировали EtOAc (3). Объединенные органические экстракты промывали водой (5) до удаления большей части TBAF, затем промывали рассолом, высушивали (Na2SO4), фильтровали и концентрировали при пониженном давлении с получением янтарного масла. Данный материал очищали флэшхроматографией, используя системы Flashmaster и Biotage, элюент от DCM до 5% СН 3 ОН/DCM, градиентное элюирование от 100/0 до 90/10, подходящие фракции объединяли с получением из них кремового порошка. Выход: 1,3 г соединения Е 137 (16,1%). Пример 257. N-Циклопропил-1-(2,6-диметил-4-пиридинил)-3-2-фтор-(трифторметил)фенил]амино]-1 Н-1,2,4-триазол-5-ацетамид (Е 257) Циклопропиламин (5 мл) добавляли к перемешиваемой суспензии интермедиата D21 (получен согласно D21) (1,41 ммоль) в МеОН (5 мл) и полученную реакционную смесь перемешивали при 40 С в течение ночи. Реакционную смесь концентрировали при пониженном давлении с получением бледножелтого/кремового порошка. Данный материал кристаллизовали из MeCN (продукт растворяется при 80 С), затем содержимое фильтровали и высушивали с получением рыхлого белого порошка. Выход: 527 мг соединения Е 257 (83%). В табл. 1 и 2 перечислены соединения формулы (I), которые были получены согласно одному из приведенных выше примеров. Таблица 1
МПК / Метки
МПК: C07D 401/14, A61K 31/4196, C07D 401/04, C07D 249/14, C07D 405/04, A61K 31/4439, A61P 25/00
Метки: ацетилхолиновых, модуляторов, никотиновых, рецепторов, тризамещенные, качестве, 1,2,4-триазолы
Код ссылки
<a href="https://eas.patents.su/30-18186-trizameshhennye-124-triazoly-v-kachestve-modulyatorov-nikotinovyh-acetilholinovyh-receptorov.html" rel="bookmark" title="База патентов Евразийского Союза">Тризамещенные 1,2,4-триазолы в качестве модуляторов никотиновых ацетилхолиновых рецепторов</a>
Предыдущий патент: Новые производные 1-бензил-3-гидроксиметилиндазола и их применение при лечении заболеваний, обусловленных экспрессией мср-1 или сх3сr1
Следующий патент: Тризамещенные пиразолы в качестве модуляторов рецепторов ацетилхолина
Случайный патент: Новые тетрагидропиридины, способ их получения и содержащие их фармацевтические композиции












