Производные 1,2-дизамещенного 4-бензиламинопирролидина в качестве ингибиторов белка-переносчика холестерилового эфира, используемые для лечения заболеваний, таких как гиперлипидемия или артериосклероз
Номер патента: 17939
Опубликовано: 30.04.2013
Авторы: Моги Мунето, Омори Осаму, Имасе Хидетомо, Мияке Такахиро, Ясошима Кайо, Каванами Тошио, Ямада Кен
Формула / Реферат
1. Соединение формулы (I)

в которой R1 обозначает (C1-C7)алкил-O-C(O)-, (C1-C7)алканоил, пиримидинил или тетразолил, где указанный пиримидинил необязательно содержит от 1 до 3 заместителей, выбранных из группы, включающей галоген, ди(C1-C7)алкиламиногруппу, (C1-C7)алкоксигруппу, гетероциклил, где заместитель гетероциклил дополнительно необязательно содержит от 1 до 3 заместителей, выбранных из группы, включающей (C1-C7)алкил, гидроксигруппу или (C1-C7)алканоил, и где тетразолил необязательно замещен (C1-C7)алкилом;
R2 обозначает (C1-C7)алкил, (C1-C7)алкокси(C1-C7)алкил или H;
R3 обозначает R8-O-C(O)-, (R8)(R9)N-C(O)-, R8-C(O)-, (C6-C10)арил или гетероциклил, где R8 и R9 независимо обозначают водород, (C1-C7)алкил, -C(O)O-(C1-C7)алкил, (C1-C7)алкил-O(O)С-(C1-C7)алкил-, амино-(O)C-(C1-C7)алкил-, (C3-C6)циклоалкил, (C6-C10)арил, гетероциклил, (C6-C10)арил(C1-C7)алкил-, гетероциклил(C1-C7)алкил- или (C3-C6)циклоалкил(C1-C7)алкил-, где каждый (C1-C7)алкил, (C3-C6)циклоалкил, (C6-C10)арил, (C6-C10)арил(C1-C7)алкил- или (C3-C6)циклоалкил(C1-C7)алкил- необязательно содержит от 1 до 3 заместителей, выбранных из группы, включающей (C1-C7)алкил, гидроксигруппу, галоген, нитрогруппу, карбоксигруппу, тиогруппу, цианогруппу, HSO3-, (C3-C6)циклоалкил, (C2-C7)алкенил, (C1-C7)алкоксигруппу, (C3-C6)циклоалкоксигруппу, (C2-C7)алкенилоксигруппу, галоген(C1-C7)алкил, (C1-C7)алкил-O-C(O)-, (C1-C7)алканоил, карбамимидоил, (C1-C7)алкил-S-, (C1-C7)алкил-SO-, (C1-C7)алкил-SO2-, аминогруппу, H2N-SO2- и гетероциклил; R8 и R9, взятые вместе, могут образовать 5- или 6-членный гетероциклил, который может содержать заместители, выбранные из группы, включающей (C1-C7)алкил, гидроксигруппу, галоген, нитрогруппу, карбоксигруппу, тиогруппу, цианогруппу, HSO3-, (C3-C6)циклоалкил, (C2-C7)алкенил, (C1-C7)алкоксигруппу, (C3-C6)циклоалкоксигруппу, (C2-C7)алкенилоксигруппу, галоген(C1-C7)алкил, (C1-C7)алкил-O-C(O)-, (C1-C7)алканоил, карбамимидоил, (C1-C7)алкил-S-, (C1-C7)алкил-SO-, (C1-C7)алкил-SO2-, аминогруппу, H2N-SO2-, HO-C(O)-(C1-C7)алкил, ацетил и гетероциклил;
R4 обозначает водород или бензил;
R6 и R7 независимо обозначают галоген, (C1-C7)алкил, галоген(C1-C7)алкил или (C1-C7)алкоксигруппу;
гетероциклил означает полностью насыщенную или ненасыщенную ароматическую или неароматическую циклическую группу, которая представляет собой 4-7-членный моноцикл, который содержит 1, 2 или 3 гетероатома, выбранных из группы, включающей атомы азота, атомы кислорода и атомы серы, где гетероатомы азота и серы также необязательно могут быть окислены,
или его фармацевтически приемлемая соль, или его оптический изомер, или смесь оптических изомеров.
2. Соединение по п.1, в котором
R1 обозначает (C1-C7)алкил-O-C(O)-, (C1-C7)алканоил, пиримидинил или тетразолил, где указанный пиримидинил необязательно содержит от 1 до 3 заместителей, выбранных из группы, включающей галоген, ди(C1-C7)алкиламиногруппу, (C1-C7)алкоксигруппу, гетероциклил, где заместитель гетероциклил дополнительно необязательно содержит от 1 до 3 заместителей, выбранных из группы, включающей (C1-C7)алкил, гидроксигруппу или (C1-C7)алканоил, и где тетразолил необязательно замещен (C1-C7)алкилом;
R2 обозначает (C1-C7)алкил;
R3 обозначает (C1-C7)алкил-O-C(O)- или 5- или 6-членный циклоалкил-C(O)-;
R4 обозначает водород;
R6 и R7 независимо обозначают галоген, (C1-C7)алкил, галоген(C1-C7)алкил или (C1-C7)алкоксигруппу,
или его фармацевтически приемлемая соль, или его оптический изомер, или смесь оптических изомеров.
3. Соединение по п.1, выбранное из группы, включающей
трет-бутиловый эфир (2S,3S,5R)-2-бензил-3-[(3,5-бис-трифторметилбензил)метоксикарбониламино]-5-этилпирролидин-1-карбоновой кислоты;
изопропиловый эфир (2S,3S,5R)-2-бензил-3-[(5-бромпиримидин-2-ил)-(3-хлор-5-трифторметилбензил)амино]-5-этилпирролидин-1-карбоновой кислоты;
изопропиловый эфир (2S,3S,5R)-2-бензил-3-{(3-хлор-5-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-5-этилпирролидин-1-карбоновой кислоты;
трет-бутиловый эфир (2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-карбоновой кислоты;
4-карбоксициклогексиловый эфир (2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-карбоновой кислоты;
4-карбоксициклогексиловый эфир (2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-карбоновой кислоты;
2-карбокси-2-метилпропиловый эфир (2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-карбоновой кислоты;
3-карбокси-3-метилбутиловый эфир (2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-карбоновой кислоты;
3-карбоксициклобутиловый эфир (2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-карбоновой кислоты;
4-карбоксициклогексилметиловый эфир (2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-карбоновой кислоты;
3-карбоксициклобутиловый эфир (2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-карбоновой кислоты;
1-карбоксициклопентилметиловый эфир (2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-карбоновой кислоты;
4-{[((2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-карбонил)этиламино]метил}циклогексанкарбоновую кислоту;
4-карбоксиметилциклогексилметиловый эфир (2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-карбоновой кислоты;
(S)-1-((2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-карбонил)пирролидин-2-карбоновую кислоту;
(S)-1-((2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-карбонил)пиперидин-2-карбоновую кислоту;
4-[((2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-карбонил)амино]циклогексанкарбоновую кислоту;
4-[((2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-карбонил)метиламино]циклогексанкарбоновую кислоту;
этиловый эфир ((2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-ил)оксоуксусной кислоты;
1-((2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-ил)этанон;
1-((2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-ил)-3-метилбутан-1-он;
((2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-ил)циклогексилметанон;
изопропиловый эфир (2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-карбоновой кислоты;
изобутиловый эфир (2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-карбоновой кислоты;
2,2-диметилпропиловый эфир (2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-карбоновой кислоты;
4-метоксикарбонилциклогексиловый эфир (2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-карбоновой кислоты;
2-метоксикарбонил-2-метилпропиловый эфир (2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-карбоновой кислоты;
1-этоксикарбонил-1-метилэтиловый эфир (2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-карбоновой кислоты;
3-этоксикарбонил-3-метилбутиловый эфир (2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-карбоновой кислоты;
тетрагидропиран-4-иловый эфир (2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-карбоновой кислоты;
3-метоксикарбонилфениловый эфир (2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-карбоновой кислоты;
тетрагидропиран-4-илметиловый эфир (2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-карбоновой кислоты;
3-метоксикарбонилциклобутиловый эфир (2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-карбоновой кислоты;
3-метоксикарбонилциклобутиловый эфир (2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-карбоновой кислоты;
4-метоксикарбонилциклогексилметиловый эфир (2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-карбоновой кислоты;
циклогексилметиловый эфир (2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-карбоновой кислоты;
1-метоксикарбонилциклопентилметиловый эфир (2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-карбоновой кислоты;
4-этоксикарбонилметилциклогексилметиловый эфир (2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-карбоновой кислоты;
3-карбоксифениловый эфир (2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-карбоновой кислоты;
3-метилоксетан-3-илметиловый эфир (2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-карбоновой кислоты;
1-этилпропиловый эфир (2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-карбоновой кислоты;
2,2,2-трифторэтиловый эфир (2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-карбоновой кислоты;
циклопентиловый эфир (2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-карбоновой кислоты;
(R)-втор-бутиловый эфир (2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-карбоновой кислоты;
(S)-втор-бутиловый эфир (2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-карбоновой кислоты;
3-этилоксетан-3-илметиловый эфир (2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-карбоновой кислоты;
трет-бутиловый эфир (5R)-3-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-5-этил-2-оксопирролидин-1-карбоновой кислоты;
изопропиловый эфир (2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-((S)-3-гидроксипирролидин-1-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-карбоновой кислоты;
трет-бутиловый эфир (2R,4S)-4-[(3,5-бис-трифторметилбензил)-(5-морфолин-4-илпиримидин-2-ил)амино]-2-этилпирролидин-1-карбоновой кислоты;
2-карбамоил-2-метилпропиловый эфир (2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-карбоновой кислоты;
2-метил-2-метилкарбамоилпропиловый эфир (2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-карбоновой кислоты;
1-диметилкарбамоил-1-метилэтиловый эфир (2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-карбоновой кислоты;
изопропиловый эфир (2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-карбоновой кислоты;
этиловый эфир 2-((2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-ил)оксазол-4-карбоновой кислоты;
((2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-ил)пирролидин-1-илметанон;
метиловый эфир 4-{[((2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-карбонил)этиламино]метил}циклогексанкарбоновой кислоты;
((2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-ил)пиперидин-1-илметанон;
этиловый эфир (S)-1-((2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-карбонил)пиперидин-3-карбоновой кислоты;
метиловый эфир (S)-1-((2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-карбонил)пиперидин-2-карбоновой кислоты;
((2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-ил)циклогексилметанон;
1-[4-((2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-карбонил)пиперазин-1-ил]этанон;
((2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-ил)-(2-циклогексилпирролидин-1-ил)метанон;
4-((2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-карбонил)пиперазин-2-он;
((2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-ил)морфолин-4-илметанон;
(2R,4S)-4-{(3,5-бис-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}-2-этилпирролидин-1-карбоновой кислоты диметиламид;
изопропиловый эфир (S)-3-{(3-хлор-5-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино}пирролидин-1-карбоновой кислоты;
2-{2-(3,5-бис-трифторметилфенил)-1-[(3R,5R)-5-этил-1-(2-метоксиметил-4-трифторметилфенил)пирролидин-3-ил]этил}-5-(1-метил-1H-пиразол-4-ил)пиримидин;
изопропиловый эфир (2R,4S)-4-[(3,5-бис-трифторметилбензил)-(5-бромпиримидин-2-ил)амино]-2-этилпирролидин-1-карбоновой кислоты;
изопропиловый эфир (2R,4S)-4-[(3,5-бис-трифторметилбензил)-(5-морфолин-4-илпиримидин-2-ил)амино]-2-этилпирролидин-1-карбоновой кислоты;
(3,5-бис-трифторметилбензил)-[(3S,5R)-5-этил-1-(5-трифторметилпиридин-2-ил)пирролидин-3-ил]-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амин;
(3,5-бис-трифторметилбензил)-[(3S,5R)-1-(6-хлорпиримидин-4-ил)-5-этилпирролидин-3-ил]-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амин,
или его фармацевтически приемлемая соль.
4. Соединение по п.1, в котором R1 обозначает
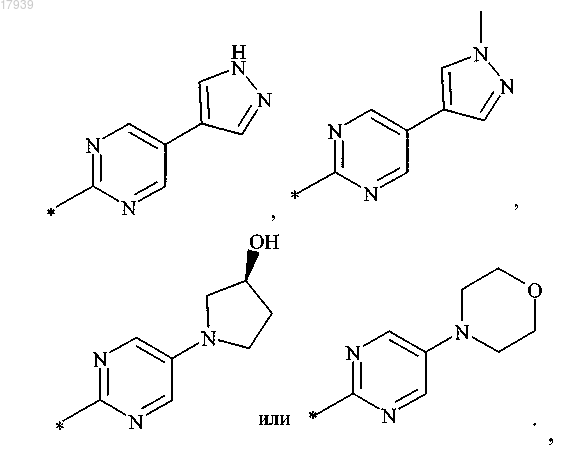
или его фармацевтически приемлемая соль.
5. Способ ингибирования активности белка-переносчика холестерилового эфира (БПХЭ) у субъекта, включающий введение субъекту соединения формулы (I) по любому из пп.1-4 в терапевтически эффективном количестве.
6. Способ лечения у субъекта нарушения или заболевания, опосредуемого БПХЭ или реагирующего на ингибирование БПХЭ, включающий введение субъекту соединения формулы (I) по любому из пп.1-4 в терапевтически эффективном количестве.
7. Способ по п.6, в котором нарушение или заболевание выбрано из группы, включающей гиперлипидемию, атеросклероз, заболевание периферических сосудов, дислипидемию, гипер-бета-липопротеинемию, гипо-альфа-липопротеинемию, гиперхолестеринемию, гипертриглицеридемию, семейную гиперхолестеринемию, сердечно-сосудистое нарушение, коронарную болезнь сердца, заболевание коронарной артерии, заболевание коронарных сосудов, стенокардию, ишемию, тромбоз, инфаркт сердца, удар, заболевание периферических сосудов, реперфузионное поражение, рестеноз после ангиопластики, гипертензию, застойную сердечную недостаточность, диабет, сосудистые осложнения при диабете, ожирение и эндотоксикоз.
8. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения формулы (I) по любому из пп.1-4 и фармацевтически приемлемые носители.
9. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения по любому из пп.1-4 и одно или большее количество терапевтических средств, выбранных из группы, включающей:
(i) ингибитор HMG-Co-A редуктазы или его фармацевтически приемлемую соль,
(ii) антагонист ангиотензинового рецептора II или его фармацевтически приемлемую соль,
(iii) ингибитор ангиотензинпревращающего фермента (АПФ) или его фармацевтически приемлемую соль,
(iv) блокатор кальциевых каналов или его фармацевтически приемлемую соль,
(v) ингибитор альдостеронсинтазы или его фармацевтически приемлемую соль,
(vi) антагонист альдостерона или его фармацевтически приемлемую соль,
(vii) двойной ингибитор ангиотензинпревращающего фермента/нейтральной эндопептидазы (АПФ/НЭП) или его фармацевтически приемлемую соль,
(viii) антагонист эндотелина или его фармацевтически приемлемую соль,
(ix) ингибитор ренина или его фармацевтически приемлемую соль,
(x) диуретик или его фармацевтически приемлемую соль,
(xi) миметик АроА-I.
10. Применение соединения формулы (I) по любому из пп.1-4 для приготовления лекарственного средства, предназначенного для лечения у субъекта нарушения или заболевания, опосредуемого БПХЭ или реагирующего на ингибирование БПХЭ.
11. Применение по п.10, в котором нарушение или заболевание выбрано из группы, включающей гиперлипидемию, атеросклероз, заболевание периферических сосудов, дислипидемию, гипер-бета-липопротеинемию, гипо-альфа-липопротеинемию, гиперхолестеринемию, гипертриглицеридемию, семейную гиперхолестеринемию, сердечно-сосудистое нарушение, коронарную болезнь сердца, заболевание коронарной артерии, заболевание коронарных сосудов, стенокардию, ишемию, тромбоз, инфаркт сердца, удар, заболевание периферических сосудов, реперфузионное поражение, рестеноз после ангиопластики, гипертензию, застойную сердечную недостаточность, диабет, сосудистые осложнения при диабете, ожирение и эндотоксикоз.
Текст
ПРОИЗВОДНЫЕ 1,2-ДИЗАМЕЩЕННОГО 4-БЕНЗИЛАМИНОПИРРОЛИДИНА В КАЧЕСТВЕ ИНГИБИТОРОВ БЕЛКА-ПЕРЕНОСЧИКА ХОЛЕСТЕРИЛОВОГО ЭФИРА, ИСПОЛЬЗУЕМЫЕ ДЛЯ ЛЕЧЕНИЯ ЗАБОЛЕВАНИЙ, ТАКИХ КАК ГИПЕРЛИПИДЕМИЯ ИЛИ АРТЕРИОСКЛЕРОЗ В изобретении приведено описание соединения формулы в которой варианты значений R1, R2, R3, R4, R6, R7 определены в настоящем изобретении,указанное соединение является ингибитором БПХЭ (белка-переносчика холестерилового эфира) и поэтому может быть использовано для лечения нарушения или заболевания, опосредуемого БПХЭ или реагирующего на ингибирование БПХЭ. 017939 Настоящее изобретение относится к новому соединению формулы (I) где R1 обозначает (C1-C7)алкил-O-C(O)-, (C1-C7)алканоил, пиримидинил или тетразолил, где указанный пиримидинил необязательно содержит от 1 до 3 заместителей, выбранных из группы, включающей галоген, ди(C1-C7)алкиламиногруппу, (C1-C7)алкоксигруппу, гетероциклил, где заместитель гетероциклил дополнительно необязательно содержит от 1 до 3 заместителей, выбранных из группы, включающейR3 обозначает R8-O-C(O)-, (R8)(R9)N-C(O)-, R8-C(O)-, (C6-C10)арил или гетероциклил, где R8 и R9 независимо обозначают водород, (C1-C7)алкил, -С(О)О-(C1-C7)алкил, (C1-C7)алкил-О(О)С-(C1-C7)алкил-,амино-(О)С-(C1-C7)алкил-, (C3-C6)циклоалкил, (C6-C10)арил, гетероциклил, (C6-C10)арил-(C1-C7)алкил-,гетероциклил-(C1-C7)алкил- или (C3-C6)циклоалкил-(C1-C7)алкил-, где каждый (C1-C7)алкил,(C3-C6)циклоалкил, (C6-C10)арил, (C6-C10)арил-(C1-C7)алкил- или (C3-C6)циклоалкил-(C1-C7)алкилнеобязательно содержит от 1 до 3 заместителей, выбранных из группы, включающей (C1-C7)алкил, гидроксигруппу,галоген,нитрогруппу,карбоксигруппу,тиогруппу,цианогруппу,HSO3-,(C3-C6)циклоалкил,(C2-C7)алкенил,(C1-C7)алкоксигруппу,(C3-C6)циклоалкоксигруппу,(C2-C7)алкенилоксигруппу, галоген(C1-C7)алкил, (C1-C7)алкил-O-C(O)-, (C1-C7)алканоил, карбамимидоил,(C1-C7)алкил-S-, (C1-C7)алкил-SO-, (C1-C7)алкил-SO2-, аминогруппу, H2N-SO2- и гетероциклил, R8 и R9 взятые вместе, могут образовать 5- или 6-членный гетероциклил, который может содержать заместители,выбранные из группы, включающей (C1-C7)алкил, гидроксигруппу, галоген, нитрогруппу, карбоксигруппу, тиогруппу, цианогруппу, HSO3-, (C3-C6)циклоалкил, (C2-C7)алкенил, (C1-C7)алкоксигруппу,(C3-C6)циклоалкоксигруппу, (C2-C7)алкенилоксигруппу, галоген(C1-C7)алкил, (C1-C7)алкил-O-C(O)-,(C1-C7)алканоил, карбамимидоил, (C1-C7)алкил-S-, (C1-C7)алкил-SO-, (C1-C7)алкил-SO2-, аминогруппу,H2N-SO2-, HO-C(O)-(C1-C7)алкил, ацетил и гетероциклил;R4 обозначает водород или бензил;(C1-C7)алкоксигруппу; гетероциклил означает полностью насыщенную или ненасыщенную ароматическую или неароматическую циклическую группу, которая представляет собой 4-7-членный моноцикл, содержащий 1, 2 или 3 гетероатома, выбранных из группы, включающей атомы азота, атомы кислорода и атомы серы, где гетероатомы азота и серы также необязательно могут быть окислены; или к его фармацевтически приемлемой соли, или к его оптическому изомеру, или к смеси оптических изомеров. Настоящее изобретение также относится к способу получения этих соединений, к применению этих соединений и к фармацевтическим препаратам, содержащим такое соединение (I) в свободной форме или в форме фармацевтически приемлемой соли. Тщательные фармакологические исследования показали, что соединения (I) и их фармацевтически приемлемые соли, например, характеризуются выраженной селективностью ингибирования БПХЭ (белка-переносчика холестерилового эфира). БПХЭ участвует в метаболизме любого липопротеина в живых организмах и играет главную роль в обращении системы переноса холестерина. В частности, БПХЭ привлек внимание в связи с механизмом предупреждения накопления холестерина в периферических клетках и предупреждения атеросклероза. В связи с тем, что ЛВП (липопротеин высокой плотности) играет важную роль в этой системе переноса холестерина, целый ряд исследователей эпидемиологии показали,что уменьшение содержания ХЭ (холестерилового эфира), содержащегося в ЛВП, в крови является одним из факторов риска развития заболеваний коронарной артерии. Также установлено, что активность БПХЭ является разной у разных видов животных и атеросклероз, обусловленный высоким содержанием холестерина, почти не возникает у животных с более низкой активностью и, напротив, легко возникает у животных с более высокой активностью, и что гипер-ЛВП-емия и гипо-ЛНП-емия (ЛНП-липопротеин низкой плотности) возникают в случае недостатка БПХЭ, что затрудняет развитие атеросклероза, что, в свою очередь, приводит к выводу о важности содержания ЛВП, а также о важности содержания БПХЭ,который опосредует перенос ХЭ, содержащегося в ЛВП, в ЛНП, содержащемся в крови. Хотя за последние годы предпринято много попыток разработки лекарственного средства, которое ингибирует такую активность БПХЭ, до сих пор не получено соединение, обладающее удовлетворительной активностью.-1 017939 Подробное описание изобретения Для разъяснения настоящего описания используются указанные ниже определения, и, когда это является подходящим, термины, использующиеся в единственном числе, включают множественное число,и наоборот. При использовании в настоящем изобретении термин "алкил" означает полностью насыщенный разветвленный или неразветвленный углеродный фрагмент. Предпочтительно, если алкил включает от 1 до 20 атомов углерода, более предпочтительно от 1 до 16 атомов углерода, от 1 до 10 атомов углерода, от 1 до 7 атомов углерода или от 1 до 4 атомов углерода. Типичные примеры алкила включают, но не ограничиваются только ими, метил, этил, н-пропил, изопропил, н-бутил, втор-бутил, изобутил, трет-бутил,н-пентил, изопентил, неопентил, н-гексил, 3-метилгексил, 2,2-диметилпентил, 2,3-диметилпентил,н-гептил, н-октил, н-нонил, н-децил и т.п. Если алкильная группа содержит одну или большее количество кратных связей, то ее можно назвать алкенильной (двойная связь) или алкинильной (двойная связь) группой. Если алкильная группа может быть замещенной, то она предпочтительно содержит 1, 2 или 3 заместителя, выбранных из группы, включающей гидроксигруппу, галоген, нитрогруппу, карбоксигруппу, тиогруппу, цианогруппу, HSO3-, циклоалкил, алкенил, алкоксигруппу, циклоалкоксигруппу, алкенилоксигруппу, алкоксикарбонил, карбамимидоил, алкил-S-, алкил-SO-, алкил-SO2-, аминогруппу,H2N-SO2-, алканоил и гетероциклил, более предпочтительно выбранных из группы, включающей гидроксигруппу, галоген, нитрогруппу, карбоксигруппу, тиогруппу, цианогруппу, алкоксигруппу и аминогруппу. Термин "арил" означает моноциклические или бициклические ароматические углеводородные группы, содержащие в кольцевом фрагменте 6-20 атомов углерода. Предпочтительно, если арил означает(C6-C10)арил. Неограничивающие примеры включают фенил, бифенил, нафтил или тетрагидронафтил,наиболее предпочтительно фенил, каждый из которых необязательно может содержать 1-4 заместителя,таких как алкил, галогеналкил, такой как трифторметил, циклоалкил, галоген, гидроксигруппу, алкоксигруппу, алкил-C(O)-O-, арил-O-, гетероарил-O-, аминогруппу, ацил, тиогруппу, алкил-S-, арил-S-, нитрогруппу, цианогруппу, карбоксигруппу, алкил-O-C(O)-, карбамоил, алкил-S(O)-, сульфонил, сульфонамидную группу, гетероциклил, алкенил, галогеналкоксигруппу, циклоалкоксигруппу, алкенилоксигруппу, алкоксикарбонил, алкил-SO-, алкил-SO2-, аминогруппу, моно- или дизамещенную (алкил, циклоалкил, арил и/или арилалкил)аминогруппу или H2N-SO2. Кроме того, термин "арил" при использовании в настоящем изобретении означает ароматический заместитель, который может являться одиночным ароматическим кольцом или несколькими ароматическими кольцами, которые сконденсированы друг с другом, связаны ковалентной связью или связаны с общей группой, такой как метиленовый или этиленовый фрагмент. Общей связывающей группой также может быть карбонил, как в бензофеноне, или кислород, как в дифениловом эфире, или азот, как в дифениламине. При использовании в настоящем изобретении термин "алкоксигруппа" означает алкил-O-, где алкил определен выше в настоящем изобретении. Типичные примеры алкоксигрупп включают, но не ограничиваются только ими, метоксигруппу, этоксигруппу, пропоксигруппу, 2-пропоксигруппу, бутоксигруппу, трет-бутоксигруппу, пентилоксигруппу, гексилоксигруппу, циклопропилоксигруппу, циклогексилоксигруппу и т.п. Предпочтительно, если алкоксигруппы содержат примерно 1-7, более предпочтительно примерно 1-4 атомов углерода. При использовании в настоящем изобретении термин "ацил" означает группу R-C(O)-, содержащую от 1 до 10 атомов углерода, обладающую линейной, разветвленной или циклической конфигурацией, или их комбинацию, присоединенную к основной структуре через карбонильную группу. Такая группа может быть насыщенной или ненасыщенной и алифатической или ароматической. Предпочтительно, еслиR в ацильном остатке обозначает алкил, или алкоксигруппу, или арил, или гетероарил. Если R обозначает алкил, то этот фрагмент называется алканоилом. Также предпочтительно, если один или большее количество атомов углерода в ацильном остатке могут быть заменены на азот, кислород или серу при условии, что сохраняется присоединение к основной структуре через карбонильную группу. Примеры включают, но не ограничиваются только ими, ацетил, бензоил, пропионил, изобутирил, третбутоксикарбонил, бензилоксикарбонил и т.п. Низший ацил означает ацил, содержащий от 1 до 4 атомов углерода. При использовании в настоящем изобретении термин "ациламиногруппа" означает ацил-NH-, где"ацил" определен в настоящем изобретении. При использовании в настоящем изобретении термин "карбамоил" означает H2NC(O)-, алкилNHC(O)-, (алкил)2NC(O)-, арил-NHC(O)-, алкил(арил)-NC(O)-, гетероарил-NHC(O)-, алкил(гетероарил)NC(O)-, арилалкил-NHC(O)-, алкил(арилалкил)-NC(O)- и т.п. При использовании в настоящем изобретении термин "сульфонил" означает R-SO2-, где R обозначает водород, алкил, арил, гетероарил, арилалкил, гетероарилалкил, арил-O-, гетероарил-O-, алкоксигруппу, арилоксигруппу, циклоалкил или гетероциклил. При использовании в настоящем изобретении термин "сульфонамидная группа" означает алкилS(O)2-NH-, арил-S(O)2-NH-, арилалкил-S(O)2-NH-, гетероарил-S(O)2-NH-, гетероарилалкил-S(O)2-NH-,-2 017939 алкил-S(O)2-N(алкил)-, арил-S(O)2-N(алкил)-, арилалкил-S(O)2-N(алкил)-, гетероарил-S(O)2-N(алкил)-,гетероарилалкил-S(O)2-N(алкил)- и т.п. При использовании в настоящем изобретении термин "алкоксикарбонил" или "алкил-O-C(O)-" означает алкокси-C(O)-, где алкоксигруппа определена в настоящем изобретении. При использовании в настоящем изобретении термин "алканоил" означает алкил-C(O)-, где алкил определен в настоящем изобретении. При использовании в настоящем изобретении термин "алкенил" означает линейную или разветвленную углеводородную группу, содержащую от 2 до 20 атомов углерода и содержащую по меньшей мере одну двойную связь. Алкенильные группы предпочтительно содержат примерно от 2 до 8 атомов углерода. При использовании в настоящем изобретении термин "алкенилоксигруппа" означает алкенил-O-,где алкенил определен в настоящем изобретении. При использовании в настоящем изобретении термин "циклоалкоксигруппа" означает циклоалкилO-, где циклоалкил определен в настоящем изобретении. При использовании в настоящем изобретении термин "гетероциклил" означает необязательно замещенную, полностью насыщенную или ненасыщенную ароматическую или неароматическую циклическую группу, например, которая представляет собой 4-7-членную моноциклическую, 7-12-членную бициклическую или 10-15-членную трициклическую кольцевую систему, которая содержит по меньшей мере один гетероатом по меньшей мере в одном кольце, содержащем атомы углерода. Каждое кольцо гетероциклической группы, содержащей гетероатом, может содержать 1, 2 или 3 гетероатома, выбранных из группы, включающей атомы азота, атомы кислорода и атомы серы, где гетероатомы азота и серы также необязательно могут быть окислены. Гетероциклическая группа может быть присоединена по гетероатому или атому углерода. Типичные моноциклические гетероциклические группы включают пирролидинил, пирролил, пиразолил, оксетанил, пиразолинил, имидазолил, имидазолинил, имидазолидинил, триазолил, оксазолил, оксазолидинил, изоксазолинил, изоксазолил, тиазолил, тиадиазолил, тиазолидинил, изотиазолил, изотиазолидинил,фурил,тетрагидрофурил,тиенил,оксадиазолил,пиперидинил,пиперазинил,2-оксопиперазинил, 2-оксопиперидинил, 2-оксопирролодинил, 2-оксоазепинил, азепинил, пиперазинил,пиперидинил, 4-пиперидонил, пиридил, пиразинил, пиримидинил, пиридазинил, тетрагидропиранил,морфолинил, тиаморфолинил, тиаморфолинил сульфоксид, тиаморфолинил сульфон, 1,3-диоксолан и тетрагидро-1,1-диоксотиенил, 1,1,4-триоксо-1,2,5-тиадиазолидин-2-ил и т.п. Типичные бициклические гетероциклические группы включают индолил, дигидроиндолил, бензотиазолил, бензоксазинил, бензоксазолил, бензотиенил, бензотиазинил, хинуклидинил, хинолинил, тетрагидрохинолинил, декагидрохинолинил, изохинолинил, тетрагидроизохинолинил, декагидроизохинолинил, бензимидазолил, бензопиранил, индолизинил, бензофурил, хромонил, кумаринил, бензопиранил,циннолинил, хиноксалинил, индазолил, пирролопиридил, фуропиридинил (такой как фуро[2,3c]пиридинил, фуро[3,2-b]пиридинил или фуро[2,3-b]пиридинил), дигидроизоиндолил, 1,3-диоксо-1,3 дигидроизоиндол-2-ил, дигидрохиназолинил (такой как 3,4-дигидро-4-оксохиназолинил), фталазинил и т.п. Типичные трициклические гетероциклические группы включают карбазолил, дибензоазепинил, дитиеноазепинил, бензиндолил, фенантролинил, акридинил, фенантридинил, феноксазинил, фенотиазинил,ксантенил, карболинил и т.п. Если гетероциклил является ароматическим, то этот фрагмент называют "гетероарил". При использовании в настоящем изобретении термин "гетероарил" означает 5-14-членную моноциклическую или бициклическую или конденсированную полициклическую кольцевую систему, содержащую от 1 до 8 гетероатомов, выбранных из группы, включающей N, О и S. Предпочтительно, если гетероарил представляет собой 5-10-членную кольцевую систему. Типичные гетероарильные группы включают 2- или 3-тиенил, 2- или 3-фурил, 2- или 3-пирролил, 2-, 4- или 5-имидазолил, 3-, 4- или 5-пиразолил, 2-, 4- или 5-тиазолил, 3-, 4- или 5-изотиазолил, 2-, 4- или 5-оксазолил, 3-, 4- или 5-изоксазолил, 3- или 5-1,2,4-триазолил, 4- или 5-1,2,3-триазолил, тетразолил, 2-, 3- или 4-пиридил,3- или 4-пиридазинил, 3-, 4- или 5-пиразинил, 2-пиразинил, 2-, 4- или 5-пиримидинил, каждый из которых необязательно может содержать 1-4 заместителя, таких как алкил, галогеналкил, такой как трифторметил, замещенный или незамещенный циклоалкил, галоген, гидроксигруппу, алкоксигруппу, алкилC(O)-O-, арил-O-, гетероарил-O-, аминогруппу, ацил, тиогруппу, алкил-S-, арил-S-, нитрогруппу, цианогруппу, карбоксигруппу, алкил-O-C(O)-, карбамоил, алкил-S(O)-, сульфонил, сульфонамидную группу,замещенный или незамещенный гетероциклил, алкенил, галогеналкоксигруппу, циклоалкоксигруппу,алкенилоксигруппу, алкоксикарбонил, алкил-SO-, алкил-SO2-, аминогруппу, моно- или дизамещенную(алкил, циклоалкил, арил и/или арилалкил)аминогруппу или H2N-SO2. Термин "гетероарил" также означает группу, в которой гетероароматическое кольцо сконденсировано с одним или большим количеством арильных, циклоалифатических или гетероциклических колец, в которой радикал или положение присоединения находится в гетероароматическом кольце. Неограничивающие примеры включают, но не ограничиваются только ими, 1-, 2-, 3-, 5-, 6-, 7- или 8-индолизинил,-3 017939 1-, 3-, 4-, 5-, 6- или 7-изоиндолил, 2-, 3-, 4-, 5-, 6- или 7-индолил, 2-, 3-, 4-, 5-, 6- или 7-индазолил, 2-, 4-,5-, 6-, 7- или 8-пуринил, 1-, 2-, 3-, 4-, 6-, 7-, 8- или 9-хинолизинил, 2-, 3-, 4-, 5-, 6-, 7- или 8-хинолил, 1-, 3-,4-, 5-, 6-, 7- или 8-изохинолил, 1-, 4-, 5-, 6-, 7- или 8-фталазинил, 2-, 3-, 4-, 5- или 6-нафтиридинил, 2-, 3-,5-, 6-, 7- или 8-хиназолинил, 3-, 4-, 5-, 6-, 7- или 8-циннолинил, 2-, 4-, 6- или 7-птеридинил, 1-, 2-, 3-, 4-,5-, 6-, 7- или 8-4 аН-карбазолил, 1-, 2-, 3-, 4-, 5-, 6-, 7- или 8-карбазолил, 1-, 3-, 4-, 5-, 6-, 7-, 8- или 9-карболинил, 1-, 2-, 3-, 4-, 6-, 7-, 8-, 9- или 10-фенантридинил, 1-, 2-, 3-, 4-, 5-, 6-, 7-, 8- или 9-акридинил,1-, 2-, 4-, 5-, 6-, 7-, 8- или 9-пиримидинил, 2-, 3-, 4-, 5-, 6-, 8-, 9- или 10-фенантролинил, 1-, 2-, 3-, 4-, 6-, 7-,8- или 9-феназинил, 1-, 2-, 3-, 4-, 6-, 7-, 8-, 9- или 10-фенотиазинил, 1-, 2-, 3-, 4-, 6-, 7-, 8-, 9- или 10-феноксазинил, 2-, 3-, 4-, 5-, 6- или 1-, 3-, 4-, 5-, 6-, 7-, 8-, 9- или 10-бензизохинолинил, 2-, 3-, 4- или тиено[2,3-b]фуранил, 2-, 3-, 5-, 6-, 7-, 8-, 9-, 10- или 11-7H-пиразино[2,3-c]карбазолил, 2-, 3-, 5-, 6- или 72H-фуро[3,2-b]пиранил, 2-, 3-, 4-, 5-, 7- или 8-5H-пиридо[2,3-d]-о-оксазинил, 1-, 3- или 5-1Hпиразоло[4,3-d]оксазолил, 2-, 4- или 54H-имидазо[4,5-d]тиазолил, 3-, 5- или 8-пиразино[2,3d]пиридазинил, 2-, 3-, 5- или 6-имидазо[2,1-b]тиазолил, 1-, 3-, 6-, 7-, 8- или 9-фуро[3,4-с]циннолинил, 1-,2-, 3-, 4-, 5-, 6-, 8-, 9-, 10- и 11-4H-пиридо[2,3-c]карбазолил, 2-, 3-, 6- или 7-имидазо[1,2b][1,2,4]триазинил, 7-бензо[b]тиенил, 2-, 4-, 5-, 6- или 7-бензоксазолил, 2-, 4-, 5-, 6- или 7-бензимидазолил, 2-, 3-, 4-, 5-, 6- или 7-бензотиазолил, 1-, 2-, 4-, 5-, 6-, 7-, 8- или 9-бензоксапинил, 2-, 4-,5-, 6-, 7- или 8-бензоксазинил, 1-, 2-, 3-, 5-, 6-, 7-, 8-, 9-, 10- или 11-1H-пирроло[1,2-b][2]бензазапинил. Типичные конденсированные гетероарильные группы включают, но не ограничиваются только ими, 2-,3-, 4-, 5-, 6-, 7- или 8-хинолинил, 1-, 3-, 4-, 5-, 6-, 7- или 8-изохинолинил, 2-, 3-, 4-, 5-, 6- или 7-индолил,2-, 3-, 4-, 5-, 6- или 7-бензо[b]тиенил, 2-, 4-, 5-, 6- или 7-бензоксазолил, 2-, 4-, 5-, 6- или 7-бензимидазолил, 2-, 4-, 5-, 6- или 7-бензотиазолил. Гетероарильная группа может быть моно-, би-, три- или полициклической, предпочтительно моно-,би- или трициклической, более предпочтительно моно- или бициклической. Термин "гетероциклил" также означает гетероциклические группы, определенные в настоящем изобретении, содержащие 1, 2 или 3 заместителя, выбранных из группы, включающей следующие: алкил; галогеналкил, гидроксигруппу (или защищенную гидроксигруппу); галоген; оксогруппу, т.е. =O; аминогруппу, моно- или дизамещенную (алкил, циклоалкил, арил и/или арилалкил)аминогруппу, такую как алкиламиногруппу или диалкиламиногруппу; алкоксигруппу; циклоалкил; алкенил; карбоксигруппу; гетероциклооксигруппу, где гетероциклооксигруппа означает гетероциклическую группу, присоединенную через кислородный мостик; алкил-O-C(O)-; меркаптогруппу; HSO3; нитрогруппу; цианогруппу; сульфамоил или сульфонамидную группу; арил; алкил-C(O)-O-; арил-C(O)-O-; арил-S-; циклоалкоксигруппу; алкенилоксигруппу; алкоксикарбонил; арилоксигруппу; карбамоил; алкил-S-; алкил-SO-, алкилSO2-; формил, т.е. HC(O)-; арилалкил-; ацил, такой как алканоил; гетероциклил и арил, замещенный алкилом, циклоалкилом, алкоксигруппой, гидроксигруппой, аминогруппой, алкил-C(O)-NH-, алкиламиногруппой, диалкиламиногруппой или галогеном. При использовании в настоящем изобретении термин "циклоалкил" означает необязательно замещенные насыщенные или ненасыщенные, моноциклические, бициклические или трициклические углеводородные группы, содержащие 3-12 атомов углерода, каждая из которых может содержать один или большее количество заместителей, таких как алкил, галоген, оксогруппа, гидроксигруппа, алкоксигруппа, алканоил, ациламиногруппа, карбамоил, алкил-NH-, (алкил)2N-, тиогруппа, алкилтиогруппа, нитрогруппа, цианогруппа, карбоксигруппа, алкил-O-C(O)-, сульфонил, сульфонамидная группа, сульфамоил,гетероциклил и т.п. Типичные моноциклические углеводородные группы включают, но не ограничиваются только ими, циклопропил, циклобутил, циклопентил, циклопентенил, циклогексил и циклогексенил и т.п. Типичные бициклические углеводородные группы включают бронил, индил, гексагидроиндил,тетрагидронафтил,декагидронафтил,бицикло[2.1.1]гексил,бицикло[2.2.1]гептил,бицикло[2.2.1]гептенил, 6,6-диметилбицикло[3.1.1]гептил, 2,6,6-триметилбицикло[3.1.1]гептил, бицикло[2.2.2]октил и т.п. Типичные трициклические углеводородные группы включают адамантил и т.п. При использовании в настоящем изобретении термин "сульфамоил" означает H2NS(O)2-, алкилNHS(O)2-, (алкил)2NS(O)2-, арил-NHS(O)2-, алкил(арил)-NS(O)2-, (арил)2NS(O)2-, гетероарил-NHS(O)2-,арилалкил-NHS(O)2-, гетероарилалкил-NHS(O)2- и т.п. При использовании в настоящем изобретении термин "арилоксигруппа" означает и -O-арильную, и-O-гетероарильную группу, где арил и гетероарил определены в настоящем изобретении. При использовании в настоящем изобретении термин "галоген" означает фтор, хлор, бром или йод. При использовании в настоящем изобретении термин "галогеналкил" означает алкил, определенный в настоящем изобретении, замещенный одной или большим количеством галогенидных групп, определенных в настоящем изобретении. Предпочтительно, если галогеналкил может представлять собой моногалогеналкил, дигалогеналкил или полигалогеналкил, включая пергалогеналкил. Моногалогеналкил может содержать в алкильной группе один атом йода, брома, хлора или фтора. Дигалогеналкильные и полигалогеналкильные группы могут содержать в алкильной группе два или большее количество одинаковых атомов галогенов или представлять собой комбинацию разных галогенидных групп с алкилом. Предпочтительно, если полигалогеналкил содержит до 12, 10, или 8, или 6, или 4, или 3, или 2 галогенидных групп. Неограничивающие примеры галогеналкилов включают фторметил, дифторметил,-4 017939 трифторметил, хлорметил, дихлорметил, трихлорметил, пентафторэтил, гептафторпропил, дифторхлорметил, дихлорфторметил, дифторэтил, дифторпропил, дихлорэтил и дихлорпропил. Пергалогеналкил означает алкил, в котором все атомы водорода заменены на атомы галогенов. При использовании в настоящем изобретении термин "диалкиламиногруппа" означает аминогруппу, которая дважды замещена алкилом, причем две алкильные группы могут быть одинаковыми или разными. Предпочтительно, если диалкиламиногруппа может содержать одинаковые алкильные заместители. Неограничивающие примеры диалкиламиногруппы включают диметиламиногруппу, диэтиламиногруппу и диизопропиламиногруппу. При использовании в настоящем изобретении термин "арилалкил" используется взаимозаменяемым образом с термином "арилалкил-", где арил и алкил определены в настоящем изобретении. При использовании в настоящем изобретении термин "циклоалкилалкил-" используется взаимозаменяемым образом с термином "циклоалкилалкил", где циклоалкил и алкил определены в настоящем изобретении. При использовании в настоящем изобретении термин "изомеры" означает разные соединения, которые обладают одной и той же молекулярной формулой. Кроме того, при использовании в настоящем изобретении термин "оптический изомер" означает любую из разных стереоизомерных конфигураций,которые могут существовать для данного соединения, предлагаемого в настоящем изобретении, и включает геометрические изомеры. Следует понимать, что заместитель может быть присоединен к атому углерода, являющемуся хиральным центром. Поэтому настоящее изобретение включает энантиомеры, диастереоизомеры и рацематы соединения. "Энантиомеры" представляют собой пару стереоизомеров, которые являются зеркальными изображениями, не налагающимися друг на друга. Смесь двух энантиомеров состава 1:1 называется "рацемической" смесью. Этот термин используется для обозначения рацемической смеси, если это является подходящим. "Диастереоизомеры" являются стереоизомерами, которые содержат не менее двух асимметрических атомов, но которые не являются зеркальными изображениями друг друга. Абсолютную стереохимическую конфигурацию описывают с помощью R-S системы КанаИнгольда-Прелога. Если соединение является чистым энантиомером, то стереохимическую кинфигурацию каждого хирального атома углерода можно описать, как R или S. Разделенные соединения, абсолютная конфигурация которых не установлена, можно описать с помощью символов (+) или (-) в зависимости от направления, в котором они вращают плоскость поляризации света при длине волны линии D натрия (право- и левовращающие). Некоторые соединения, описанные в настоящем изобретении, содержат один или большее количество асимметрических центров и поэтому могут образовывать энантиомеры, диастереоизомеры и другие стереоизомерные формы, абсолютную стереохимическую конфигурацию которых можно обозначить как (R)- или (S)-. В объем настоящего изобретения входят все такие возможные изомеры, включая рацемические смеси, оптически чистые формы и смеси промежуточного состава. Оптически активные (R)- и (S)-изомеры можно получить с помощью хиральных синтонов или хиральных реагентов или выделить по обычным методикам. Если соединение содержит двойную связь, то заместители могут находиться в E- или Z-конфигурации. Если соединение представляет собой дизамещенный циклоалкил, то заместители циклоалкила могут находиться в цис- или транс-конфигурации. Предполагается, что в объем настоящего изобретения входят все таутомерные формы. При использовании в настоящем изобретении термин "фармацевтически приемлемые соли" означает соли, которые сохраняют биологическую эффективность и свойства соединений, предлагаемых в настоящем изобретении, и которые не являются нежелательными в биологическом или ином отношении. Неограничивающие примеры солей включают нетоксичные, образованные с неорганическим или органическим основанием или кислотой соли присоединения соединений, предлагаемых в настоящем изобретении. Во многих случаях соединения, предлагаемые в настоящем изобретении, могут образовывать соли с кислотой и/или основанием вследствие наличия аминогрупп и/или карбоксигрупп или аналогичных им групп. Фармацевтически приемлемые соли присоединения с кислотами можно образовать с неорганическими кислотами и с органическими кислотами. Неорганические кислоты, из которых можно образовать соли, включают, например, хлористо-водородную, бромисто-водородную, серную, азотную,фосфорную кислоты и т.п. Органические кислоты, из которых можно образовать соли, включают, например, уксусную, пропионовую, гликолевую, пировиноградную, щавелевую, малеиновую, малоновую,янтарную, фумаровую, винную, лимонную, бензойную, коричную, миндальную, метансульфоновую,этансульфоновую, п-толуолсульфоновую, салициловую кислоты и т.п. Фармацевтически приемлемые соли присоединения с основанием можно образовать с неорганическими и органическими основаниями. Неорганические основания, из которых можно образовать соли, включают, например, основания натрия,калия, лития, аммония, кальция, магния, железа, цинка, меди, марганца, алюминия и т.п., особенно предпочтительными являются соли аммония, калия, кальция и магния. Органические основания, из которых можно образовать соли, включают, например, первичные, вторичные и третичные амины, замещенные амины, включая природные замещенные амины, циклические амины, основные ионообменные смолы и т.п., предпочтительно такие как изопропиламин, триметиламин, диэтиламин, триэтиламин,трипропиламин и этаноламин. Фармацевтически приемлемые соли, предлагаемые в настоящем изобретении, можно синтезировать из исходного соединения, основного или кислотного фрагмента по обыч-5 017939 ным химическим методикам. Обычно такие соли можно получить по реакции свободных кислотных форм этих соединений со стехиометрическим количеством соответствующего основания (такого как гидроксид, карбонат, бикарбонат и т.п. Na, Ca, Mg или K) или по реакции свободных основных форм этих соединений со стехиометрическим количеством соответствующей кислоты, такие реакции обычно проводят в воде или в органическом растворителе или в их смеси. Обычно, если это возможно, являются предпочтительными неводные среды, такие как эфир, этилацетат, этанол, изопропанол или ацетонитрил. Перечни дополнительных подходящих солей приведены, например, в публикации Remington's Pharmaceutical Sciences, 20th ed., Mack Publishing Company, Easton, Pa. (1985), которая включена в настоящее изобретение в качестве ссылки. При использовании в настоящем изобретении термин "фармацевтически приемлемый носитель" включает любой и все растворители, диспергирующие среды, покрытия, поверхностно-активные вещества, антиоксиданты, консерванты (например, бактерицидные агенты, фунгицидные агенты), изотонические агенты, агенты, задерживающие всасывание, соли, консерванты, лекарственные средства, стабилизаторы лекарственных средств, связующие, инертные наполнители, разрыхлители, смазывающие агенты,подсластители, ароматизаторы, красители, аналогичные материалы и их комбинации, как это должно быть известно специалисту с общей подготовкой в данной области техники (см., например, публикациюRemington's Pharmaceutical Sciences, 18th Ed. Mack Printing Company, 1990, p. 1289-1329, которая включена в настоящее изобретение в качестве ссылки). За исключением случаев, когда обычный носитель несовместим с активным ингредиентом, подразумевается его использование в терапевтических или фармацевтических композициях. Термин "терапевтически эффективное количество" соединения, предлагаемого в настоящем изобретении, означает количество соединения, предлагаемого в настоящем изобретении, которое приводит к биологической или медицинской реакции субъекта, или облегчает симптомы, замедляет или задерживает прогрессирование заболевания, или предупреждает заболевание и т.п. В предпочтительном варианте осуществления "эффективное количество" означает количество, которое ингибирует или уменьшает экспрессирование или активность БПХЭ. При использовании в настоящем изобретении термин "субъект" означает животное. Предпочтительно, если животным является млекопитающее. Субъект также означает, например, приматов (например, людей), коров, овец, коз, лошадей, собак, кошек, кроликов, крыс, мышей, рыб, птиц и т.п. В предпочтительном варианте осуществления субъектом является человек. При использовании в настоящем изобретении термин "нарушение" или "заболевание" означает любое расстройство или аномалию функции; болезненное физическое или умственное состояние. См. публикацию Dorland's Illustrated Medical Dictionary (W.B. Saunders Co. 27th ed. 1988). При использовании в настоящем изобретении термин "ингибирование" или "подавление" означает ослабление или подавление данного патологического состояния, симптома, или нарушения, или заболевания или значительное ослабление исходной биологической активности или процесса. Предпочтительно, если патологическое состояние, или симптом, или нарушение, или заболевание опосредуется активностью БПХЭ или реагирует на ингибирование БПХЭ. При использовании в настоящем изобретении термин "лечение" любого заболевания или нарушения в одном варианте осуществления означает улучшение протекания заболевания или нарушения (т.е. остановку или ослабление развития заболевания или по меньшей мере одного из его клинических симптомов). В другом варианте осуществления "лечение" означает улучшение по меньшей мере одного физического параметра, который может не ощущаться пациентом. В еще одном варианте осуществления"лечение" означает изменение протекания заболевания или нарушения, физическое (например, стабилизацию проявляющегося симптома), или физиологическое (например, стабилизацию физикального параметра), или и то, и другое. В еще одном варианте осуществления "лечение" означает предупреждение или задержку начала, или развития, или прогрессирования заболевания или нарушения. При использовании в настоящем изобретении (в особенности в формуле изобретения) термины, использующиеся в единственном числе, включают множественное число, и наоборот, если в настоящем изобретении не указано иное и если это явно не противоречит контексту. Указание диапазонов значений в настоящем изобретении используется просто для краткого указания на все отдельные значения, находящиеся в этом диапазоне. Если в настоящем изобретении не указано иное, то каждое отдельное значение включено в описание, как если бы оно было специально указано в настоящем изобретении. Все методики, описанные в настоящем изобретении, можно проводить в любом подходящем порядке, если в настоящем изобретении не указано иное и если это явно не противоречит контексту. Использование любого и всех примеров или указаний на типичные значения (например, "такой как") в настоящем изобретении предназначено просто для лучшего описания настоящего изобретения и не налагает ограничения на объем настоящего изобретения, определяющийся формулой изобретения. Никакое выражение в описании не следует рассматривать как указывающее на какой-либо незаявленный элемент, важный для практического осуществления настоящего изобретения. Приведенные ниже предпочтительные варианты осуществления фрагментов и символов в формуле(I) могут использоваться независимо друг от друга для замены более общих определений и, таким обра-6 017939 зом, определяют особенно предпочтительные варианты осуществления настоящего изобретения, а остальные определения можно оставлять в широком смысле, как это определено в вариантах осуществления настоящего изобретения, определенных выше или ниже. Различные варианты осуществления настоящего изобретения описаны ниже. Следует понимать, что особенности, указанные в каждом варианте осуществления, можно объединять с другими указанными особенностями и получить другие варианты осуществления. Один вариант осуществления настоящего изобретения относится к соединению формулы (I), в которойR1 обозначает (C1-C7)алкил-O-C(O)-, (C1-C7)алканоил, пиримидинил или тетразолил, где указанный пиримидинил необязательно содержит от 1 до 3 заместителей, выбранных из группы, включающей галоген, ди(C1-C7)алкиламиногруппу, (C1-C7)алкоксигруппу, гетероциклил, где заместитель гетероциклил дополнительно необязательно содержит от 1 до 3 заместителей, выбранных из группы, включающей(C1-C7)алкоксигруппу, или его фармацевтически приемлемой соли, или его оптическому изомеру, или смеси оптических изомеров. Предпочтительные определения для R1. Предпочтительно, если R1 обозначает Предпочтительные определения для R2. Предпочтительно, если R2 обозначает обладающий линейной или разветвленной цепьюC1-C6-алкил, определенный выше в настоящем изобретении. Примеры включают метил, этил, изопропил,н-пропил, изобутил, н-бутил или втор-бутил, более предпочтительно этил или изобутил, наиболее предпочтительно этил. Предпочтительные определения для R3. Предпочтительно, если R3 обозначает алкил-O-C(O)-, циклоалкил-O-C(O)-, арилалкил-O-C(O)-, (алкил)2N-C(O)-, арилалкил-C(O)- или гетероарил. Предпочтительные примеры алкил-O-C(O)- включают фрагменты, в которых алкил выбран из группы, включающей обладающий линейной или разветвленной цепью, предпочтительно разветвленной цепью C1-C6-алкил, определенный выше в настоящем изобретении, такой как метил, этил, изопропил, изобутил или трет-бутил, наиболее предпочтительно изопропил. Предпочтительные примеры циклоалкил-O-C(O)- включают фрагменты, в которых циклоалкил выбран из группы, включающей C3-C12-циклоалкил, определенный выше в настоящем изобретении, такой как циклогексил или адамантил. Предпочтительные примеры арилалкил-O-C(O)- включают фрагменты, в которых арил выбран из группы, включающей C6-C20-арил, определенный выше в настоящем изобретении, такой как фенил или нафтил, более предпочтительно фенил. Предпочтительные примеры арилалкила включают бензил, фенетил, более предпочтительно бензил. Предпочтительные примеры (алкил)2N-C(O)- включают фрагменты, в которых алкил выбран из группы, включающей обладающий линейной или разветвленной цепью, предпочтительно линейной цепью C1-C6-алкил, определенный выше в настоящем изобретении, такой как метил, этил, изопропил, изобутил или трет-бутил, наиболее предпочтительно метил или этил. Предпочтительные примеры арилалкил-C(O)- включают фрагменты, в которых арил выбран из группы, включающей C6-C20-арил, определенный выше в настоящем изобретении, такой как фенил или нафтил, более предпочтительно фенил. Предпочтительные примеры арилалкила включают бензил, фенетил, более предпочтительно бензил.-7 017939 Предпочтительные примеры гетероарила включают гетероарил, выбранный из группы, включающей замещенный или незамещенный пиридил или пиримидил, более предпочтительно замещенный пиримидил. Наиболее предпочтительно, если R3 обозначает алкил-O-C(O)-, определенный в настоящем изобретении. Предпочтительные определения для R4. Предпочтительно, если R4 обозначает водород или бензил. Предпочтительные определения для R6 и R7. Предпочтительно, если R6 и R7 независимо обозначают алкил, галогеналкил, галоген или алкоксигруппу. Более предпочтительно, если R6 и R7 независимо обозначают алкил или галогеналкил, такой как трифторметил. В другом предпочтительном варианте осуществления оба R6 и R7 являются одинаковыми и определены в настоящем изобретении, наиболее предпочтительно трифторметил. Положения R6 и R7 в фенильном кольце предпочтительно являются следующими: Любой асимметрический атом углерода в соединениях, предлагаемых в настоящем изобретении,может обладать (R)-, (S)- или (R,S)-конфигурацией, предпочтительно (R)- или (S)-конфигурацией. Заместители атомов, образующих кратную связь, если это возможно, могут находиться в цис-(Z)- или транс(E)-конфигурации. Поэтому соединения, предлагаемые в настоящем изобретении, могут находиться в форме одного из возможных изомеров или в виде их смесей, например в виде в основном чистых геометрических (цис- или транс-) изомеров, диастереоизомеров, оптических изомеров (антиподов), рацематов или их смесей. Предпочтительные изомеры соединения, предлагаемого в настоящем изобретении, можно представить следующей формулой: Любые полученные смеси изомеров с использованием различий физико-химических характеристик компонентов можно разделить на чистые геометрические или оптические изомеры, диастереоизомеры,рацематы, например, с помощью хроматографии и/или фракционной кристаллизации. Любые полученные рацематы конечных продуктов или промежуточных продуктов можно разделить на оптические антиподы по известным методикам, например путем разделения солей их диастереоизомеров, полученных с оптически активной кислотой или основанием, выделения оптически активного кислотного или основного соединения. В частности, таким образом можно использовать имидазолильный фрагмент, чтобы разделить соединения, предлагаемые в настоящем изобретении, на оптические антиподы, например, с помощью фракционной кристаллизации соли, образованной с оптически активной кислотой, например винной кислотой, дибензоилвинной кислотой, диацетилвинной кислотой, ди-O,O'-птолуилвинной кислотой, миндальной кислотой, яблочной кислотой или камфор-10-сульфоновой кисло-8 017939 той. Рацемические продукты также можно разделить с помощью хиральной хроматографии, например высокоэффективной жидкостной хроматографии (ВЭЖХ) с использованием хирального сорбента. В заключение отметим, что соединения, предлагаемые в настоящем изобретении, получают в свободной форме, в виде соли или в виде их пролекарственных производных. Если в соединениях, предлагаемых в настоящем изобретении, содержится основная группа, то соединения можно превратить в соли присоединения с кислотами, в частности в соли присоединения с кислотами по имидазолильному фрагменту структуры, предпочтительно в их фармацевтически приемлемые соли. Они образуются с неорганическими кислотами или с органическими кислотами. Подходящие неорганические кислоты включают, но не ограничиваются только ими, хлористо-водородную кислоту,серную кислоту, фосфорную кислоту и галогенводородную кислоту. Подходящие органические кислоты включают, но не ограничиваются только ими, карбоновые кислоты, такие как (C1-C4)алканкарбоновые кислоты, которые, например, являются незамещенными или замещены галогеном, например, уксусную кислоту, такие как насыщенные или ненасыщенные дикарбоновые кислоты, например щавелевую, янтарную, малеиновую или фумаровую кислоту, такие как гидроксикарбоновые кислоты, например гликолевую, молочную, яблочную, винную или лимонную кислоту, такие как аминокислоты, например аспарагиновую или глутаминовую кислоту, органические сульфоновые кислоты, такие как(C1-C4)алкилсульфоновые кислоты, например метансульфоновую кислоту; или арилсульфоновые кислоты, которые являются незамещенными или замещены, например, галогеном. Предпочтительными являются соли, образованные с хлористо-водородной кислотой, метансульфоновой кислотой и малеиновой кислотой. Если в соединениях, предлагаемых в настоящем изобретении, содержится кислотная группа, то соединения можно превратить в соли с фармацевтически приемлемыми основаниями. Такие соли включают соли щелочных металлов, такие как соли натрия, лития и калия; соли щелочно-земельных металлов,такие как соли кальция и магния; соли аммония и соли с органическими основаниями, например соли с триметиламином, соли с диэтиламином, соли с трис-(гидроксиметил)метиламином, соли с дициклогексиламином и соли с N-метил-D-глюкамином; соли с аминокислотами, такими как аргинин, лизин и т.п. Соли можно получить по обычным методикам, предпочтительно в присутствии эфирного или спиртового растворителя, такого как низший алканол. Из раствора в последнем соли можно осадить простыми эфирами, например диэтиловым эфиром. Полученные соли можно превратить в свободные соединения путем обработки кислотами. Эти и другие соли также можно использовать для очистки полученных соединений. Если в одной молекуле содержатся одновременно основная группа и кислотная группа, то соединения, предлагаемые в настоящем изобретении, также могут образовывать внутренние соли. Настоящее изобретение также относится к пролекарствам соединений, предлагаемых в настоящем изобретении, которые in vivo превращаются в соединения, предлагаемые в настоящем изобретении. Пролекарство представляет собой активное или неактивное соединение, которое после введения пролекарства субъекту химически изменяется вследствие физиологического воздействия in vivo, такого как гидролиз, метаболизм и т.п., с превращением в соединение, предлагаемое в настоящем изобретении. Методики приготовления и применения пролекарств и их применимость хорошо известны специалистам в данной области техники. Пролекарства можно по характеру разделить на две неэксклюзивные категории, пролекарства-биологические предшественники и пролекарства-носители. См. публикацию The Practice ofMedicinal Chemistry, Ch. 31-32 (Ed. Wermuth, Academic Press, San Diego, Calif., 2001). Обычно пролекарства-биологические предшественники являются соединениями, которые неактивны или обладают низкой активностью по сравнению с активным лекарственным соединением, содержат одну или большее количество защитных групп и превращаются в активную форму вследствие метаболизма или сольволиза. И активная форма лекарства, и любой высвободившийся продукт метаболизма должны обладать приемлемо низкой токсичностью. Обычно образование активного лекарственного соединения включает метаболический процесс или реакцию, которая относится к одному из следующих типов. 1. Реакции окисления, такие как окисление оксигруппы, карбонильной и карбоксигруппы, гидроксилирование алифатических атомов углерода, гидроксилирование алициклических атомов углерода,окисление ароматических атомов углерода, окисление двойных углерод-углеродных связей, окисление азотсодержащих функциональных групп, окисление кремния, фосфора, мышьяка и серы, окислительноеN-дезалкилирование, окислительное O- и S-дезалкилирование, окислительное дезаминирование, а также другие реакции окисления. 2. Реакции восстановления, такие как восстановление карбонильных групп, восстановление гидроксигрупп и двойных углерод-углеродных связей, восстановление азотсодержащих функциональных групп и другие реакции восстановления. 3. Реакции без изменения состояния окисления, такие как гидролиз простых и сложных эфиров,гидролитическое расщепление неароматических гетероциклов, гидратация и дегидратация по кратным связям, образование новых связей с помощью реакций дегидратации, гидролитическое дегалогенирование, удаление молекулы галогенводорода и другие такие реакции.-9 017939 Пролекарства-носители являются лекарственными соединениями, которые содержат фрагментпереносчик, например, которые улучшают всасывание или локализуют высвобождение в центре (центрах) воздействия. Для такого пролекарства-носителя предпочтительно, чтобы связь между лекарственным фрагментом и фрагментом-переносчиком была ковалентной, пролекарство было неактивным или менее активным, чем лекарственное соединение, и любой высвобождающийся фрагмент-переносчик являлся в приемлемой степени нетоксичным. В случае пролекарства, для которого фрагмент-переносчик предназначен для усиления всасывания, высвобождение фрагмента-переносчика обычно должно быть быстрым. В других случаях предпочтительно использовать фрагмент, который обеспечивает медленное высвобождение, например некоторые полимеры или другие фрагменты, такие как циклодекстрины. См.,Cheng et al., US20040077595, заявка 10/656838, которая включена в настоящее изобретение в качестве ссылки. Такие пролекарства-носители часто предпочтительны для лекарственных средств, вводимых перорально. Пролекарства-носители, например, можно использовать для улучшения одной или большего количества следующих характеристик: увеличения липофильности, увеличения длительности фармакологического воздействия, улучшения специфичности на участке воздействия, уменьшения токсичности и побочных реакций и/или улучшения характеристик лекарственного препарата (например, стабильности,растворимости в воде, подавления нежелательных органолептических или физико-химических характеристик). Например, липофильность можно увеличить путем образования сложных эфиров гидроксигрупп с липофильными карбоновыми кислотами или карбоксигрупп со спиртами, например алифатическими спиртами. Wermuth, The Practice of Medicinal Chemistry, Ch. 31-32, Ed. Werriuth, Academic Press, SanDiego, Calif., 2001. Типичными пролекарствами являются, например, эфиры карбоновых кислот с S-ацил- и Oацилпроизводными тиолов, спиртов и фенолов, где ацил обладает значением, определенным в настоящем изобретении. Предпочтительными являются фармацевтически приемлемые сложные эфиры, которые посредством гидролиза в физиологических условиях превращаются в исходную карбоновую кислоту, например низшие алкиловые сложные эфиры, циклоалкиловые сложные эфиры, низшие алкениловые сложные эфиры, бензиловые сложные эфиры, моно- или дизамещенные низшие алкиловые сложные эфиры, такие как -(аминогруппу, моно- или динизший алкиламино-, карбокси-, низший алкоксикарбонил)-низшие алкиловые сложные эфиры, -(низший алканоилокси-, низший алкоксикарбонил- или динизший алкиламинокарбонил)-низшие алкиловые сложные эфиры, такие как пивалоилоксиметиловый эфир и т.п., обычно применяющиеся в данной области техники. Кроме того, амины маскируют путем образования арилкарбонилоксиметилпроизводных, которые in vivo расщепляются эстеразами с высвобождением свободного лекарственного средства и формальдегида (Bundgaard, J. Med. Chem. 2503(1989. Кроме того, лекарственые средства, содержащие кислую группу NH, такую как имидазольную,имидную, индольную и т.п., маскируют с помощью N-ацилоксиметильных групп (Bundgaard, Design ofProdrugs, Elsevier (1985. Гидроксигруппы маскируют путем образования сложных и простых эфиров. ВEP 039051 (Sloan and Little) раскрыты пролекарства, являющиеся основаниями Манниха гидроксамовых кислот, их получение и применение. Ввиду близкого родства между этими соединениями, соединениями в форме их солей и пролекарствами любое указание на соединения, предлагаемые в настоящем изобретении, следует понимать и как указание на соответствующие пролекарства соединений, предлагаемых в настоящем изобретении, если это является подходящим и целесообразным. Кроме того, соединения, предлагаемые в настоящем изобретении, включая их соли, также можно получить в форме их гидратов или с включением других растворителей, использовавшихся для их кристаллизации. Соединения, предлагаемые в настоящем изобретении, обладают ценными фармакологическими характеристиками. Соединения, предлагаемые в настоящем изобретении, применимы в качестве ингибиторов белка-переносчика холестерилового эфира (БПХЭ). БПХЭ представляет собой гликопептид, обладающий молекулярной массой, равной 74 кДа, он вырабатывается в печени и является ключевым средством, облегчающим перенос липидов между различными липопротеинами, содержащимися в плазме. Главной функцией БПХЭ является перераспределение холестериловых эфиров (ХЭ) и триглицеридов между липопротеинами. См. публикацию Assmann, G. et al., "HDL cholesterol and protective factors inatherosclerosis", Circulation, 109: 1118-1114 (2004). Поскольку большинство триглицеридов, содержащихся в плазме, поступает из ЛОНП (липопротеины очень низкой плотности) и большинство ХЭ образуется в частицах ЛВП (липопротеины высокой плотности) по реакции, катализируемой лецитин:холестеринацилтрансферазой, активность БПХЭ приводит к суммарному переносу массы триглицеридов из ЛОНП в ЛНП (липопротеины низкой плотности) ЛНП и ЛВП и суммарному переносу массы ХЭ из ЛВП в ЛОНП и ЛНП. Таким образом, БПХЭ потенциально снижает содержание HDL-X, повышает содержание ЛНП-холестерина (ЛНП-Х) и уменьшает размер частиц ЛВП и ЛНП, и ингибирование БПХЭ может представлять собой терапевтическое средство для повышения содержания ЛВПхолестерина (ЛВП-Х), что оказывает благоприятное влияние на профиль липопротеинов и снижает опасность сердечно-сосудистых заболеваний. Соответственно, соединения, предлагаемые в настоящем изо- 10017939 бретении в качестве ингибиторов БПХЭ, применимы для задержки прогрессирования и/или лечения нарушения или заболевания, которое опосредуется БПХЭ или реагирует на ингибирование БПХЭ. Нарушения, патологические состояния и заболевания, которые можно лечить соединениями, предлагаемыми в настоящем изобретении, включают, но не ограничиваются только ими, гиперлипидемию, артериосклероз, атеросклероз, заболевание периферических сосудов, дислипидемию, гипер-бета-липопротеинемию,гипо-альфа-липопротеинемию, гиперхолестеринемию, гипертриглицеридемию, семейную гиперхолестеринемию, сердечно-сосудистое нарушение, коронарную болезнь сердца, заболевание коронарной артерии, заболевание коронарных сосудов, стенокардию, ишемию, ишемию сердца, тромбоз, инфаркт сердца,такой как инфаркт миокарда, удар, заболевание периферических сосудов, реперфузионное поражение,рестеноз после ангиопластики, гипертензию, застойную сердечную недостаточность, диабет, такой как сахарный диабет типа II, сосудистые осложнения при диабете, ожирение, заражение шистосомами или развитие их яиц, эндотоксикоз и т.п. Кроме того, настоящее изобретение относится к соединению, предлагаемому в настоящем изобретении, описанному выше в настоящем изобретении, предназначенному для применения в качестве лекарственного средства; применению соединения, предлагаемого в настоящем изобретении, описанного выше в настоящем изобретении, для приготовления фармацевтической композиции, предназначенной для задержки прогрессирования и/или лечения нарушения или заболевания, опосредуемого БПХЭ или реагирующего на ингибирование БПХЭ; применению соединения, предлагаемого в настоящем изобретении, описанного выше в настоящем изобретении, для приготовления фармацевтической композиции, предназначенной для задержки прогрессирования и/или лечения нарушения или заболевания, выбранного из группы, включающей гиперлипидемию, артериосклероз, атеросклероз, заболевание периферических сосудов, дислипидемию, гипербета-липопротеинемию, гипо-альфа-липопротеинемию, гиперхолестеринемию, гипертриглицеридемию,семейную гиперхолестеринемию, сердечно-сосудистое нарушение, коронарную болезнь сердца, заболевание коронарной артерии, заболевание коронарных сосудов, стенокардию, ишемию, ишемию сердца,тромбоз, инфаркт сердца, такой как инфаркт миокарда, удар, заболевание периферических сосудов, реперфузионное поражение, рестеноз после ангиопластики, гипертензию, застойную сердечную недостаточность, диабет, такой как сахарный диабет типа II, сосудистые осложнения при диабете, ожирение и эндотоксикоз и т.п. Соединения формулы (I) можно получить по методикам, описанным в следующих разделах. Обычно соединения формулы (I) можно получить в соответствии с приведенными ниже общими процедурами и схемами. На всех этих схемах варианты групп R1, R2, R3, R4, R5, R6, R7 и R8 обладают значениями, приведенными в настоящем изобретении, если не указано иное. 1. Общая процедура А: использование алкоксипирролидина А 1 где R8 является таким, как определено в настоящем изобретении, например H, Me, метоксиметил,трет-бутилдиметилсилил, тетрагидрофуранил, Bn, аллил. R9 является таким, как определено в настоящем изобретении, например Me, Et, i-Pr, t-Bu, Bn, 2,2,2-трихлорэтил, аллил, 9-флуоренилметил. На стадии а) используют стандартные методики восстановления карбоновой кислоты, такие как применение гидридного реагента например BH3 или его комплексов, таких как пиколин-боран и боранпиридин, LiAlH4, 9-ББН, Alpine боран, LiB(s-Bu)3H, LiB(Sia)3H, или активацию карбоновой кислоты путем ее превращения в хлорангидрид, смешанный ангидрид или эфир с последующимвосстановлением гидридным реагентом, таким как NaBH4. На стадии b) используют стандартные методики превращения спирта в отщепляющуюся группу(LG; например, мезилат, тозилат или бромид). Методики включают использование MsCl/основание или- 11017939 На стадии c) используют стандартные условия для нуклеофильного замещения, такие как применение R5Mx (Mx; например, Li, MgCl, MgBr или MgI) в присутствии CuI (R5 = алкил) или гидридного реагента (R5 = H). 1.2. Путь AII, когда R4 обозначает водород:R10 является таким, как определено в настоящем изобретении, например H, Me, Et, t-Bu, i-Bu, Ph,метоксиметил, Bn, 2,2,2-трихлорэтил, аллил, триэтилсилил, трет-бутилдиметилсилил. На стадии a) используют стандартные методики восстановления карбонильной группы, такие как применение гидридного реагента, например BH3 или его комплексов, таких как пиколин-боран и боранпиридин, LiAlH4, 9-ББН, Alpine боран, LiB(s-Bu)3H, LiB(Sia)3H, или активацию карбоновой кислоты путем ее превращения в хлорангидрид, смешанный ангидрид или эфир с последующим восстановлением гидридным реагентом, таким как NaBH4. На стадии b) используют стандартные методики окисления спирта, такие как использующие комплекс хрома (например, ПДХ (пиридинийдихромат), ПХХ (пиридинийхлорхромат) или Na2Cr2O7),Pr4NRuO4, никеля Ренея, NCS(N-хлорсукцинимид)/ТЕМРО (2,6,6-тетраметил-1-пиперидинилоксил), реагент, содержащий гипервалентный йод (например, перйодинан Десса-Мартина, PhI(OAc)2/ТЕМРО),NCS/ДМС (диметилсульфид)/основание или реагент на основе ДМСО (например, ДМСО/ДЦК (дициклогексилкарбодиимид)/H3PO4, ДМСО/оксалилхлорид/основание или ДМСО/SO3/пиридин). Альтернативно, стадии a) и b) можно заменить на превращение в хлорангидрид с последующей реакцией, такой как восстановление с помощью LiAl(OtBu)3 или гидрогенолиз с помощью H2 и Pd-BaSO4,превращение в сложный тиоэфир с последующим восстановлением с помощью Et3SiH/Pd-C, на превращение в амид с последующим восстановлением гидридным реагентом, например LiAlH4, ДИБАГ (диизобутилалюминийгидрид), LiAl(O-t-Bu)3, диазоамилбораном или Ph2SiH2-Ti(OiPr)4, путем обработки карбоновой кислоты с помощью Li в MeNH2 или NH3 с последующим гидролизом или путем восстановления эфира карбоновой кислоты гидридным реагентом, например ДИБАГ или LiAlH4-Et2NH. На стадии c) используют стандартные методики превращения альдегида, такие как применение реагента Теббе, или реагента Виттига, или реагентов Хорнера-Вадсворта-Эммонса и с последующим гидрированием двойной связи подходящим восстановительным реагентом (например, Pd/C, Pd(OH)2, PtO2 или никелем Ренея при условиях, хорошо известных в данной области техники). 1.3. Путь AIII, когда R4 обозначает водород:R9 является таким, как определено в настоящем изобретении, например Me, Et, i-Pr, t-Bu, Bn,2,2,2-трихлорэтил, аллил, Y = O или S. На стадии a) N-метокси-N-метиламид (называющийся амином Вайнреба амид) получают путем использования N,O-диметилгидроксиламина с применением активированного производного (например,ДЦК, тионилхлорида или оксалилхлорида) карбоновой кислоты. На стадии b) используют стандартные методики алкилирования, такие как применение R5Mx (Mx; например, Li, MgCl, MgBr, MgI). На стадии c) используют стандартные методики деоксигенирования кетона, такие как:i) применение никеля Ренея после получения тиокарбонила или тиоацеталя; На стадии a) используют стандартные методики 1,3-дипольного циклоприсоединения нитрилоксида, такие как применение i) HONH2 [образование оксима] ii) одновременной обработки или постадийной обработки через образование нитрила хлорамином T, альфа,бета-ненасыщенным сложным эфиром (см. выше), когда R10 обозначает, например, Me, Et. На стадии b) используют стандартные методики гидрирования изоксазолина подходящим восстановительным реагентом (например, Pd/C, Pd(OH)2, PtO2, никель Ренея или Mg при условиях, хорошо известных в данной области техники) с последующей циклизацией с получением гамма-лактама. На стадии c) используют стандартные методики восстановления амидной группы с получением соответствующего амина, такие как применение гидридного реагента, например BH3 или его комплексов,таких как пиколин-боран и боран-пиридин, LiAlH4, 9-ББН, Alpine боран, LiB(s-Bu)3H, LiB(Sia)3H,NaBH(OAc)3, NaBH3CN, NaBH4 или LiBH4. На стадии d) используют стандартные методики введения R3, который определен в формуле изобретения, для защиты аминного фрагмента от нежелательных реакций. 1.5. Путь AV:R11 является таким, как определено в настоящем изобретении, например H, MOM, Bn, TMC (триметилсилил), ТБС, аллил; Мх обозначает, например, MgBr, MgI, MgCl, Li, a также комбинацию с соединениями, содержащими Cu. Превращение R3, R8 и R11 можно провести по стандартной методике превращения функциональной группы, хорошо известной в данной области техники или специально описанной в настоящем изобретении (за исключением случаев, когда R3, R8 или R11 обозначают H). На стадии b) используют стандартные методики превращения спирта в отщепляющуюся группу(LG; например, мезилат, тозилат или бромид). Методики включают использование MsCl/основание, илиTsCl/основание, или SOCl2, или NBS/PPh3, или CBr4/PPh3, или Tf2O при условиях, хорошо известных в данной области техники. На стадии c) используют стандартные методики реакции нуклеофильного замещения содержащими анион CN веществами (например, NaCN, KCN). На стадии g) реакцию циклизации с R12X (R12 обозначает замещенный или незамещенный арил или замещенный или незамещенный алкил, X = галоген или OMs, OTs, OTf) проводят в присутствии содержащих Pd катализаторов, дополнительного лиганда и основания. Иллюстративный пример этой реакции приведен в публикации Organic Letters, 2007, vol. 9, p. 457-460. 1.6. Путь AVI:- 13017939 Превращение R3 и R8 можно провести по стандартной методике превращения функциональной группы, хорошо известной в данной области техники или специально описанной в настоящем изобретении (за исключением случаев, когда R4, R8 обозначают H). На стадии a) используют стандартные методики альдольной реакции с акролеином в присутствии сильного основания, такого как NaH, KOtBu, LHMDS или ДАЛ. На стадии b) используют стандартные методики введения первичной аминогруппы, такие как использующие: эквивалент NH3 [например, NH3/EtOH, NH4Cl, NH4OH], гидридный реагент [например,NaBH(OAc)3, NaBH3CN или комбинацию Ti(OiPr)4 с гидридными реагентами, такими как NaBH4],i) одновременную или последовательную обработку с образованием имина посредством BnNH2,гидридным реагентом (см. выше), ii) каталитическое гидрирование; обработку с помощью BnNH2 при условиях каталитического гидрирования;i) одновременную или последовательную обработку с образованием имина посредством PMBNH2,гидридным реагентом (см. выше), ii) НЦА (нитрат церия-аммония) или ДДХ (окислительное дебензилирование) или ТФК;i) одновременную или последовательную обработку с образованием имина посредством Ph2CHNH2(бензгидриламин), гидридным реагентом (см. выше), ii) удаление защитной группы с помощью ТФК/Et3SiH или каталитическое гидрирование;i) RONH2 [образование оксима], ii) Na или BH3 или каталитическое гидрирование (например, Ra-Ni,Pd-C, Pt-C) [восстановление оксима], где R обозначает, например, бензил, п-метоксибензил или аллил;i) гидридный реагент [восстановление в спирт], ii) реакция Мицунобу с использованием PPh3,ДЭАД, аниона N3 или мезилирование с помощью MsCl и основания, затем обработка анионом N3 или бромирование с использованием таких реагентов, как NBS/PPh3, PBr3/PPh3, CBr4/PPh3, затем обработка анионом N3 или с помощью PBr3/PPh3, затем обработка анионом N3, iii) PR3 или каталитическое гидрирование [восстановление азида], где R обозначает, например, этил или фенил. На стадии c) используют стандартные методики реакции нуклеофильного замещения содержащими анион CN веществами (например, NaCN, KCN). На стадии e) реакцию циклизации с R12X (R12 обозначает замещенный или незамещенный арил или замещенный или незамещенный алкил, X = галоген или OMs, OTs, OTf) проводят в присутствии содержащих Pd катализаторов, дополнительного лиганда и основания. Иллюстративный пример этой реакции приведен в публикации Organic Letters, 2007, vol. 9, p. 457-460. 1.7. Путь AVII: где R8 является таким, как определено в настоящем изобретении, например H, Me, MOM, ТБС, тетрагидрофуранил, Bn, аллил. Мх обозначает, например, MgBr, MgI, MgCl, Li, также комбинация с ZnCl2 или соединениями, содержащими Cu. Превращение R3 и R8 можно провести по стандартной методике превращения функциональной группы, хорошо известной в данной области техники или специально описанной в настоящем изобретении (за исключением случаев, когда обозначают Н как R3, R8). На стадии a) используют стандартные методики введения аминоспирта, такие как использующие:iv) защита с помощью источника группы R3;iii) окисление аллила (например, с помощью SeO2). На стадии c) реакцию циклизации с R12X (R12 обозначает замещенный или незамещенный арил или замещенный или незамещенный алкил, X = галоген или OMs, OTs, OTf) проводят в присутствии содержащих Pd катализаторов, дополнительного лиганда и основания. Иллюстративный пример этой реакции приведен в публикации Organic Letters, 2007, vol. 9, p. 457-460.R13 обозначает электроноакцепторную группу (например, CHO, COOMe, COOEt, COOBn, CN). Превращение R3 и R8 можно провести по стандартной методике превращения функциональной группы, хорошо известной в данной области техники или специально описанной в настоящем изобретении (за исключением случаев, когда обозначают Н как R3, R8). На стадии a) используют стандартные методики введения аминоспирта, такие как использующие:iii) винил-Mx (Mx обозначает, например, MgBr, MgI, MgCl, Li, также комбинация с соединениями,содержащими Zn или Cu). На стадии c) реакцию циклизации с R12X (R12 обозначает замещенный или незамещенный арил или замещенный или незамещенный алкил, X = галоген или OMs, OTs, OTf) проводят в присутствии содержащих Pd катализаторов, дополнительного лиганда и основания. Иллюстративный пример этой реакции приведен в публикации Organic Letters, 2007, vol. 9, p. 457-460. 1.9. Путь AIX:R14 обозначает электронноакцепторную группу (например, COOMe, COOEt, COOBn, CN). Превращение R3, R8 можно провести по стандартной методике превращения функциональной группы, хорошо известной в данной области техники или специально описанной в настоящем изобретении(за исключением случаев, когда обозначают H как R3, R8). На стадии a) используют стандартные методики аза-реакции Михаэля, такие как использующие: методику Мак-Миллана (см.: Journal of the American Chemical Society, 2006, vol. 128, No. 29,p. 9328-9329), когда R14 обозначает CHO; методику Бадиа (см.: The Journal of Organic Chemistry, 2004, vol. 69, No. 7, 2588-2590 и цитированную в ней литературу), когда R14 обозначает, например, диалкил-, или диариламид, или алкиловый сложный эфир с последующим восстановлением для получения соответствующего альдегида. На стадии c) используют стандартную методику присоединения винил-Mx (Mx обозначает, например, MgBr, MgI, MgCl, Li, а также комбинацию с соединениями, содержащими Zn или Cu). На стадии d) реакцию циклизации с R12X (R12 обозначает замещенный или незамещенный арил или замещенный или незамещенный алкил, X = галоген или OMs, OTs, OTf) проводят в присутствии содержащих Pd катализаторов, дополнительного лиганда и основания. Иллюстративный пример этой реакции приведен в публикации Organic Letters, 2007, vol. 9, p. 457-460. 1.10. Путь AX: Соединения формулы (A1) можно получить по методике синтеза, описанной в публикацииWO 2006002004 A1, непосредственно или аналогично. 1.11. Путь AXI: Соединения формулы (A1) можно получить по методике синтеза, описанной в публикации Synlett,2001, No. 10, 1602-1604, непосредственно или аналогично. 1.12. Путь AXII: Соединения формулы (A1) можно получить по методике синтеза, описанной в публикации TheJournal of Organic Chemistry, 1194, vol. 59, No. 8, 1958-1960, непосредственно или аналогично. 1.13. Путь AXIII: Соединения формулы (A1) можно получить по методике синтеза, описанной в публикации Journal- 15017939 По любому из описанных выше путей AI-AXIII алкоксипирролидин А 1 можно превратить в соединение формулы (I) с использованием одного из путей AXIV, AXV или AXVI, представленных ниже. 1.14. Путь AXIV: На стадии a) удаление R8 можно провести по стандартной методике превращения функциональной группы, хорошо известной в данной области техники или специально описанной в настоящем изобретении. На стадии b) используют стандартные методики окисления спирта, такие как применение комплекса хрома (например, PDC, PCC или Na2Cr2O7), Pr4NRuO4, никеля Ренея, NCS/TEMPO, реагента, содержащего гипервалентный йод (например, перйодинан Десса-Мартина, PhI(OAc)2/ТЕМРО),NCS/DMS/основание или реагента на основе ДМСО(например,ДМСО/ДЦК/Н 3 РО 4,ДМСО/оксалилхлорид/основание или ДМСО/SO3/пиридин). На стадии c) используют стандартные методики восстановительного аминирования, такие как применение ArCH2NH2, гидридного реагента [например, NaBH(OAc)3, NaBH3CN, NaBH3CN, NaBH4, LiBH4,BH3, комплекс пиколин-боран, боран-пиридин] или Ti(OiPr)4; затем гидридного реагента, такого какNaBH(OAc)3, NaBH3CN, NaBH4, LiBH4, боран, комплекс пиколин-боран, боран-пиридин, LiAlH4, 9-ББН,Alpine боран, LiB(s-Bu)3H, LiB(Sia)3H; или образования имина, не катализируемого или катализируемого кислотой, с последующим восстановлением гидридными реагентами (см. выше). На стадии d) группу R1 вводят по обычным методикам превращения функциональной группы в аминогруппу, таким как алкилирование, образование карбамата, образование мочевины, замещение SRN1,аминирование арила и восстановительное аминирование. Группу R3 можно модифицировать на подходящей стадии и получить необходимое значение, указанное в формуле изобретения, представляющее собой стандартную защитную группу атома азота, как это известно в данной области техники или описано в настоящем изобретении. 1.15. Путь AXV: На стадии a) удаление R8 можно провести по стандартной методике превращения функциональной группы, хорошо известной в данной области техники или специально описанной в настоящем изобретении. На стадии b) используют стандартные методики окисления спирта, такие как использующие комплекс хрома (например, PDC, PCC или Na2Cr2O7), Pr4NRuO4, никель Ренея, NCS/TEMPO,реагент, содержащий гипервалентный йод (например, перйодинан Десса-Мартина, PhI(OAc)2/ТЕМРО),NCS/DMS/основание или реагент на основе ДМСО(например,ДМСО/ДЦК/Н 3 РО 4,ДМСО/оксалилхлорид/основание или ДМСО/SO3/пиридин). На стадии c) используют стандартные методики введения первичной аминогруппы, такие как использующие: эквивалент NH3 [например, NH3/EtOH, NH4Cl, NH4OH], гидридный реагент [например,NaBH(OAc)3, NaBH3CN или комбинацию Ti(OiPr)4 с гидридными реагентами, такими как NaBH4],i) одновременную или последовательную обработку с образованием имина посредством BnNH2,гидридным реагентом (см. выше),- 16017939ii) каталитическое гидрирование; обработку с помощью BnNH2 при условиях каталитического гидрирования:i) одновременную или последовательную обработку с образованием имина посредством PMBNH2,гидридным реагентом (см. выше),ii) НЦА или ДДХ (окислительное дебензилирование) или ТФК;i) одновременную или последовательную обработку с образованием имина посредством Ph2CHNH2(бензгидриламин), гидридным реагентом (см. выше),ii) удаление защитной группы с помощью ТФК/Et3SiH или каталитическое гидрирование;i) RONH2 [образование оксима],ii) Na или BH3 или каталитическое гидрирование (например, Ra-Ni, Pd-C, Pt-C) [восстановление оксима], где R обозначает, например, бензил, п-метоксибензил или аллил;MsCl и основания, затем обработка анионом N3 или бромирование с использованием таких реагентов,как NBS/PPh3, PBr3/PPh3, CBr4/PPh3, затем обработка анионом N3 или с помощью PBr3/PPh3, затем обработка анионом N3,iii) PR3 или каталитическое гидрирование [восстановление азида], где R обозначает, например, этил или фенил. На стадиях d) и е) группу R1 или замещенное бензильное кольцо соответственно вводят по стандартным методикам превращения функциональной группы в аминогруппу, таким как алкилирование,образование карбамата, образование мочевины, замещение SRN1, аминирование арила и восстановительное аминирование для стадии d) и предпочтительно алкилирование для стадии e). Группу R3 можно модифицировать на подходящей стадии и получить необходимое значение, указанное в формуле изобретения, представляющее собой стандартную защитную группу атома азота, как это известно в данной области техники или описано в настоящем изобретении. 1.16. Путь AXVI: На стадии a) удаление R8 можно провести по стандартной методике превращения функциональной группы, хорошо известной в данной области техники или специально описанной в настоящем изобретении. На стадии b) используют стандартные методики введения первичной аминогруппы, такие как использующие: i) реакцию Мицунобу с использованием PPh3, ДЭАД, аниона N3 или мезилирование с помощью MsCl и основания, затем обработка анионом N3 или бромирование с использованием таких реагентов, как NBS/PPh3, PBr3/PPh3, CBr4/PPh3, затем обработка анионом N3 или PBr3/PPh3, затем обработка анионом N3, ii) PR3 или каталитическое гидрирование [восстановление азида]. На стадиях с) и d) группу R1 или замещенное бензильное кольцо соответственно вводят по стандартным методикам превращения функциональной группы в аминогруппу, таким как алкилирование,образование карбамата, образование мочевины, замещение SRN1, аминирование арила и восстановительное аминирование для стадии c) и предпочтительно алкилирование для стадии d). 2. Общая процедура В: использование нитропирролидина В 1 Соединения формулы (В 1) можно получить по методике синтеза, описанной в публикации Synlett,2007, No. 15, р. 2355-2358, непосредственно или аналогично. По указанному выше пути нитропирролидин В 1 можно превратить в соединение формулы (I), например, с использованием приведенного ниже пути BI. На стадии a) используют стандартные методики реакции Нефа, такие как применение окислительного реагента (например, KMNO4, оксон) и H2O или основания, а затем протонной кислоты (например,HCl, H2SO4, AcOH) и H2O. На стадии b) используют стандартные методики введения первичной аминогруппы, описанные выше в методике А. На стадии c) используют стандартные методики восстановления нитрогруппы с образованием соответствующей первичной аминогруппы, такие как применение Zn/HCl, SmI2, NiCl2/NaBH4,Et3SiH/RhCl(PPh3)3 или Pd/C. На стадии d) этот пирролидин можно ввести в последующие реакции с образованием соединения формулы (I) по методикам алкилирования и методикам использования защитной группы атома азота,описанные выше в методике А. 3. Общая процедура С: использование иноатоа. Соединения формулы (I) можно получить по методике синтеза, описанной в публикации Synlett,2004, No. 1, p. 119-121, The Journal of Organic Chemistry, 2005, vol. 70, No. 5, p. 1791-1795 или The Journalof Organic Chemistry, 1992, vol. 57, No. 5, p. 1323-1324, непосредственно или аналогично. 4. Общая процедура D: использование N-ацилиминиевого иона. Соединения формулы (I) можно получить по методике синтеза, описанной в публикации ChemistryLetters, 1991, vol. 20, No. 1, p. 81-84, непосредственно или аналогично. 5. Общая процедура Е: получение из замещенного пиррола. Соединения формулы (I) аналогичным образом можно получить из замещенного пиррола с превращением полученного пирролидина по методикам, приведенным выше, например для путей AXIV, AXV,AXVI или BI. Иллюстративный пример получения замещенного пирролидина из пиррола приведен в публикации Journal of Organic Chemistry, 2002, vol. 67, No. 10, p. 3479-3486. 6. Общая процедура F: использование 1,3-дипольного циклоприсоединения. Соединения формулы (I) аналогичным образом можно получить из азометинилидов и енамина. Иллюстративный пример этой реакции приведен в публикации Tetrahedron, 1999, vol. 55, No. 31, p. 95359558. 7. Общая процедура G: использование ,-диаминокислот. Соединения формулы (I) аналогичным образом можно получить из нитроолефина и -аминоэфира(или -аминоамида) с последующим гидрогенолизом с превращением полученного пирролидина по методикам, приведенным выше, например для путей AXIV, AXV, AXVI или BI. Иллюстративный пример этой реакции приведен в публикации Chemical Communications, 2001, No. 2, p. 207-208. Полученные рацематы и смеси диастереоизомеров по известным методикам с использованием различий физико-химических характеристик компонентов можно разделить на чистые изомеры или рацематы, например, с помощью фракционной кристаллизации или хиральной хроматографии или с помощью ВЭЖХ с использованием хиральных стационарных фаз. Полученные рацематы можно дополнительно разделить на оптические антиподы по известным методикам, например с помощью перекристаллизации из оптически чистого растворителя, хроматографии с использованием хирального сорбента, с помощью подходящих микроорганизмов, путем расщепления специфическими иммобилизованными ферментами,путем образования соединений включения, например, с использованием хиральных краун-эфиров, с которыми образует комплекс только один энантиомер, или путем превращения в соли диастереоизомеров,например, по реакции рацемата основного конечного соединения с оптически активной кислотой, такой как карбоновая кислота, например винная или яблочная кислота, или с сульфоновой кислотой, например камфорсульфоновой кислотой, и с разделением полученной таким образом смеси диастереоизомеров,например на основании разных растворимостей, на диастереоизомеры, из которых путем обработки подходящими реагентами можно выделить необходимый энантиомер. Предпочтительно выделять наиболее активный энантиомер. В объем настоящего изобретения входят все фармацевтически приемлемые изотопно-меченые соединения формулы (I), в которой один или большее количество атомов заменены атомами, обладающими таким же атомным номером, но атомной массой или массовым числом, отличающимся от атомной массы или массового числа, обычно встречающихся в природе.- 18017939 Примеры изотопов, подходящих для включения в соединения, предлагаемые в настоящем изобретении, включают изотопы водорода, такие как 2H и 3H, углерода, такие как 11C, 13C 14C, хлора, такие как 36O и 18O, фосфора, такие как 32P, и серы, такие как 35S. Замещение более тяжелыми изотопами, такими как дейтерий, т.е. 2H, может привести к некоторым терапевтическим преимуществам, обусловленным большей метаболической стабильностью, например увеличенным периодом полувыведения in vivo или возможностью использования меньших доз, и, следовательно, при некоторых обстоятельствах может быть предпочтительным. Изотопно-меченые соединения формулы (I) обычно можно получить по обычным методикам, известным специалистам в данной области техники, или по методикам, аналогичным описанным в прилагающихся примерах и разделах, посвященных синтезу, с использованием подходящего изотопномеченого реагента вместо использовавшегося ранее немеченого реагента. В исходных соединениях и промежуточных продуктах, которые превращают в соединения, предлагаемые в настоящем изобретении, по методикам, описанным в настоящем изобретении, содержатся функциональные группы, такие как аминогруппы, тиогруппы, карбоксигруппы и гидроксигруппы, которые необязательно защищены с помощью обычных защитных групп, которые типичны для препаративной органической химии. Защищенными аминогруппами, тиогруппами, карбоксигруппами и гидроксигруппами являются такие, которые в мягких условиях можно превратить в свободные аминогруппы, тиогруппы, карбоксигруппы и гидроксигруппы без разрушения структуры молекулы и протекания других нежелательных побочных реакций. Задачей введения защитных групп является защита функциональных групп от нежелательных реакций с реакционноспособными компонентами при условиях, использующихся для проведения химических превращений. Необходимость и выбор защитных групп для конкретной реакции известны специалистам в данной области техники и зависят от характера защищаемой функциональной группы (гидроксигруппы, аминогруппы и т.п.), структуры и стабильности молекулы, частью которой является заместитель, и условий проведения реакции. Хорошо известные защитные группы, которые соответствуют этим условиям, и их введение и удаление описаны, например, в публикациях McOmie, "Protective Groups in Organic Chemistry", Plenum Press,London, NY (1973) и Greene and Wuts, "Protective Groups in Organic Synthesis", John Wiley and Sons, Inc.,NY (1999). Указанные выше реакции проводят по стандартным методикам в присутствии или при отсутствии разбавителя, предпочтительно, такого как инертный по отношению к реагентами и его растворителям,катализаторов, конденсирующих или других реагентов, в инертной атмосфере, при низкой температуре,комнатной температуре или повышенной температуре, предпочтительно при температуре кипения использующихся растворителей или близкой к ней температуре, при атмосферном или более высоком, чем атмосферное, давлении. Предпочтительные растворители, катализаторы и условия проведения реакций указаны в прилагающихся иллюстративных примерах. Настоящее изобретение дополнительно включает любой вариант описанных способов, в котором промежуточный продукт, получаемый на любой стадии, используют в качестве исходного вещества и проводят последующие стадии, или в котором исходное вещество образуется in situ при проведении реакции, или в котором компоненты реакции используются в виде солей или оптически чистых антиподов. Соединения, предлагаемые в настоящем изобретении, и промежуточные продукты также можно превратить друг в друга по методикам, которые являются общеизвестными. Другим объектом настоящего изобретения является фармацевтическая композиция, включающая соединение, предлагаемое в настоящем изобретении, и фармацевтически приемлемый носитель. Фармацевтическую композицию можно приготовить для конкретных путей введения, таких как пероральное введение, парентеральное введение и ректальное введение и т.п. Кроме того, фармацевтические композиции, предлагаемые в настоящем изобретении, можно приготовить в твердой форме, включая капсулы,таблетки, пилюли, гранулы, порошки или суппозитории, или в жидкой форме, включая растворы, суспензии или эмульсии. Фармацевтические композиции можно подвергнуть обычной фармацевтической обработке, такой как стерилизация, и/или они могут содержать обычные инертные разбавители, смазывающие агенты или буферные агенты, а также вспомогательные вещества, такие как консерванты, стабилизаторы, смачивающие агенты, эмульгаторы и буферные агенты и т.п. Предпочтительно, если фармацевтические композиции являются таблетками или капсулами из желатина, включающими активный ингредиент, а также:b) смазывающие агенты, например диоксид кремния, тальк, стеариновую кислоту, ее магниевую или кальциевую соль и/или полиэтиленгликоль; для таблеток такжеc) связующие, например алюмосиликат магния, крахмальная паста, желатин, трагакантовую камедь,метилцеллюлозу, натриевую соль карбоксиметилцеллюлозы и/или поливинилпирролидон; при необходимости;d) разрыхлители, например крахмалы, агар, альгиновую кислоту или ее натриевую соль или шипучие смеси; и/илиe) абсорбенты, красители, ароматизаторы и подсластители. На таблетки по методикам, известным в данной области техники, можно нанести пленочное покрытие или энтеросолюбильное покрытие. Композиции, подходящие для перорального введения, включают эффективное количество соединения, предлагаемого в настоящем изобретении, в виде таблеток, лепешек, водных или масляных суспензий, диспергирующихся порошков или гранул, эмульсий, твердых или мягких капсул или сиропов или эликсиров. Композиции, предназначенные для перорального применения, получают по любой методике,известной в данной области техники для приготовления фармацевтических композиций, и такие композиции могут содержать один или большее количество агентов, выбранных из группы, включающей подсластители, ароматизаторы, красители и консерванты, чтобы получить фармацевтически привлекательные и обладающие приятным вкусом препараты. Таблетки содержат активный ингредиент в смеси с нетоксичными фармацевтически приемлемыми инертными наполнителями, которые являются подходящими для изготовления таблеток. Этими инертными наполнителями являются, например, инертные разбавители, такие как карбонат кальция, карбонат натрия, лактоза, фосфат кальция или фосфат натрия; гранулирующие и обеспечивающие распадаемость агенты, например кукурузный крахмал или альгиновая кислота; связывающие агенты, например крахмал, желатин или камедь акации; и смазывающие агенты,например, стеарат магния, стеариновая кислота или тальк. Таблетки не содержат покрытия или на них по известным методикам наносят покрытие для задержки распада и всасывания в желудочно-кишечном тракте, что обеспечивает непрерывное воздействие в течение более длительного периода времени. Например, можно использовать такое замедляющее вещество, как глицерилмоностеарат или глицерилдистеарат. Препараты для перорального применения также могут представлять собой капсулы из твердого желатина, в которых активный ингредиент смешан с инертным твердым разбавителем, например карбонатом кальция, фосфатом кальция или каолином, или капсулы из мягкого желатина, в которых активный ингредиент смешан с водой или масляной средой, например арахисовым маслом, жидким парафином или оливковым маслом. Композиции для инъекций предпочтительно представляют собой изотонические водные растворы или суспензии, а суппозитории предпочтительно готовят из эмульсий или суспензий жиров. Указанные композиции можно стерилизовать и/или прибавлять к ним вспомогательные вещества, такие как консервирующие, смачивающие или эмульгирующие агенты, стимуляторы растворения, соли для регулирования осмотического давления и/или буферные агенты. Кроме того, они также могут содержать другие терапевтически ценные вещества. Указанные композиции получают по обычным технологиям смешивания, гранулирования или нанесения покрытий, и они содержат примерно 0,1-75%, предпочтительно примерно 1-50% активного ингредиента. Композиции, подходящие для чрескожного введения, включают эффективное количество соединения, предлагаемого в настоящем изобретении, с носителем. Предпочтительные носители включают впитывающиеся фармакологически приемлемые растворители, способствующие проникновению через кожу реципиента. Например, устройства для чрескожного введения представляют собой повязку, включающую защитный слой, резервуар, содержащий соединение необязательно с носителями, необязательно барьер, регулирующий доставку соединения через кожу реципиента с заданной скоростью в течение пролонгированного периода времени, и средства закрепления устройства на коже. Композиции, подходящие для местного введения, например на кожу или в глаза, включают водные растворы, суспензии, мази, кремы, гели или распыляемые композиции, например, для подачи в виде аэрозоля и т.п. Такие устройства местного действия являются особенно подходящими для воздействия на кожу, например, для лечения рака кожи, например, для использования профилактических средств в солнцезащитных кремах, лосьонах, аэрозольных препаратах и т.п. Поэтому они являются особенно подходящими для использования в средствах местного действия, включая косметические, хорошо известных в данной области техники. Они могут содержать солюбилизаторы, стабилизаторы, агенты, регулирующие тоничность, буферные агенты и консерванты. Настоящее изобретение также относится к безводным фармацевтическим композициям и дозированным формам, включающим соединения, предлагаемые в настоящем изобретении, в качестве активных ингредиентов, поскольку вода может облегчать разложение некоторых соединений. Например, прибавление воды (например, 5%) широко используется в фармацевтике в качестве средства улучшения долговременной сохранности и определения таких характеристик, как срок годности при хранении и стабильность композиции во времени. См., например, Jens T. Carstensen, Drug Stability PrinciplesPractice,2nd Ed., Marcel Dekker, NY, N.Y., 1995, p. 379-80. На самом деле вода и тепло ускоряют разложение некоторых соединений. При этом влияние воды на композицию может быть более значительным, поскольку вода и/или влажность обычно воздействуют при изготовлении, обращении, упаковке, транспортировке и применении препаратов.- 20017939 Безводные фармацевтические композиции и дозированные формы, предлагаемые в настоящем изобретении, можно получить с использованием безводных или обладающих низкой влажностью ингредиентов в условиях низкой влажности. Предпочтительно, чтобы фармацевтические композиции и дозированные формы, которые включают лактозу и по меньшей мере один активный ингредиент, который включает первичный или вторичный амин, являлись безводными, если при изготовлении, упаковке и/или хранении предполагается воздействие влаги. Безводную фармацевтическую композицию следует готовить и хранить так, чтобы она оставалась безводной. В соответствии с этим безводные композиции предпочтительно упаковывать в материалы,для которых известно, что они защищают от воздействия воды, так чтобы их можно было включить в подходящие наборы препаратов. Примеры подходящих упаковочных средств включают, но не ограничиваются только ими, герметично запаиваемую фольгу, пластмассы, контейнеры для разовых доз (например, флаконы), блистерные упаковки и ленточные упаковки. Настоящее изобретение также относится к фармацевтическим композициям и дозированным формам, которые включают один или большее количество агентов, которые регулируют скорость, с которой будет разлагаться соединение, предлагаемое в настоящем изобретении в качестве активного ингредиента. Такие агенты, которые в настоящем изобретении называют "стабилизаторами", включают, но не ограничиваются только ими, антиоксиданты, такие как аскорбиновая кислота, буферные агенты, регулирующие pH, и солевые буферные агенты и т.п. Настоящее изобретение также относится к комбинации соединения формулы (I), (IA) или (IB) соответственно или его фармацевтически приемлемой соли с другим активным веществом. Комбинацию можно приготовить, например, со следующими активными веществами, выбранными из группы, включающей:(i) ингибитор HMG-Co-A редуктазы или его фармацевтически приемлемая соль;(ii) антагонист ангиотензинового рецептора II или его фармацевтически приемлемая соль;(iii) ингибитор ангиотензинпревращающего фермента (АПФ) или его фармацевтически приемлемая соль;(iv) блокатор кальциевых каналов или его фармацевтически приемлемая соль;(v) ингибитор альдостеронсинтазы или его фармацевтически приемлемая соль;(vi) антагонист альдостерона или его фармацевтически приемлемая соль;(vii) двойной ингибитор ангиотензинпревращающего фермента/нейтральной эндопептидазы(АПФ/НЭП) или его фармацевтически приемлемая соль;(viii) антагонист эндотелина или его фармацевтически приемлемая соль;(ix) ингибитор ренина или его фармацевтически приемлемая соль;(х) диуретик или его фармацевтически приемлемая соль;(xi) миметик АроА-I. Антагонист ангиотензинового рецептора II или его фармацевтически приемлемая соль означает активные ингредиенты, которые связываются с подтипом AT1 рецептора ангиотензина II, но не приводят к активации рецептора. Вследствие ингибирования рецептора AT1 эти антагонисты можно, например, использовать в качестве гипотензивных средств или для лечения застойной сердечной недостаточности. Класс антагонистов рецептора AT1 включает соединения, обладающие различной структурой, особенно предпочтительными являются непептидные соединения. Например, можно отметить соединения,которые выбраны из группы, включающей валсартан, лосартан, кандесартан, эпросартан, ирбесартан,саприсартан, тазосартан, телмисартан, соединение, обозначаемое как E-1477, следующей формулы: или в каждом случае его фармацевтически приемлемая соль. Предпочтительными антагонистами рецептора AT1 являются такие средства, которые имеются в продаже, наиболее предпочтительным является валсартан или его фармацевтически приемлемая соль. Ингибиторы HMG-Co-A редуктазы (также называющиеся ингибиторами -гидрокси-метилглутарил-кофермент-A редуктазы) означают такие активные средства, которые можно использовать для снижения содержания в крови липидов, включая холестерин. Класс ингибиторов HMG-Co-A редуктазы включает соединения, обладающие различной структурой. Например, можно отметить соединения, которые выбраны из группы, включающей аторвастатин,церивастатин, компактин, далвастатин, дигидрокомпактин, флуиндостатин, флувастатин, ловастатин,питавастатин, мевастатин, правастатин, ривастатин, симвастатин, и велостатин или в каждом случае его фармацевтически приемлемая соль. Предпочтительными ингибиторами HMG-Co-A редуктазы являются такие средства, которые имеются в продаже, наиболее предпочтительными являются флувастатин и питавастатин или в каждом случае его фармацевтически приемлемая соль. Прекращение ферментативного превращения ангиотензина I в ангиотензин II так называемыми ингибиторами АПФ (также называющимися ингибиторами ангиотензинпревращающего фермента) является эффективным вариантом регулирования артериального давления и тем самым делает доступным терапевтический способ лечения застойной сердечной недостаточности. Класс ингибиторов АПФ включает соединения, обладающие различной структурой. Например,можно отметить соединения, которые выбраны из группы, включающей алацеприл, беназеприл, беназеприлат, каптоприл, церонаприл, цилазаприл, делаприл, эналаприл, энаприлат, фозиноприл, имидаприл,лизиноприл, мовелтоприл, периндоприл, хинаприл, рамиприл, спираприл, темокаприл и трандолаприл,или в каждом случае его фармацевтически приемлемую соль. Предпочтительными ингибиторами АПФ являются такие средства, которые имеются в продаже,наиболее предпочтительным являются беназеприл и эналаприл. Класс БКК (блокаторы кальциевых каналов) в основном включает дигидропиридины (ДГП) и неДГП, такие как БКК типа дилтиазема и типа верапамила. БКК, применимый в указанной комбинации, предпочтительно представляет собой представитель группы ДГП, выбранный из группы, включающей амлодипин, фелодипин, риозидин, исрадипин, лацидипин, никардипин, нифедипин, нигулдипин, нилудипин, нимодипин, нисолдипин, нитрендипин и нивалдипин, и предпочтительно представитель группы не-ДГП, выбранный из группы, включающей флунаризин, прениламин, дилтиазем, фендилин, галлопамил, мибефрадил, анипамил, тиапамил и верапамил,и в каждом случае его фармацевтически приемлемую соль. Все эти БКК применяются в качестве лекарственных средств, например в качестве гипотензивных, противостенокардитических или противоаритмических лекарственных средств. Предпочтительные БКК включают амлодипин, дилтиазем, исрадипин, никардипин, нифедипин, нимодипин, нисолдипин, нитрендипин и верапамил или, например, в зависимости от конкретного БКК его фармацевтически приемлемую соль. Особенно предпочтительным в качестве ДГП является амлодипин или его фармацевтически приемлемая соль, предпочтительно его безилат. Особенно предпочтительным представителем группы не-ДГП является верапамил или его фармацевтически приемлемая соль, предпочтительно его гидрохлорид. Ингибитор альдостеронсинтазы является ферментом, который превращает кортикостерон в альдостерон путем гидроксилирования кортикостерона с образованием 18-OH-кортикостерона и превращением 18-OH-кортикостерона в альдостерон. Класс ингибиторов альдостеронсинтазы, которые, как известно,применяют для лечения гипертензии и первичного альдостеронизма, включает стероидные и нестероидные ингибиторы альдостеронсинтазы, последние являются наиболее предпочтительными. Предпочтение отдается имеющимся в продаже ингибиторам альдостеронсинтазы или тем ингибиторам альдостеронсинтазы, которые утверждены к применению органами здравоохранения. Класс ингибиторов альдостеронсинтазы включает соединения, обладающие различной структурой. Например, можно отметить соединения, которые выбраны из группы, включающей нестероидные ингибиторы ароматазы анастрозол, фадрозол (включая его (+)-энантиомер), а также стероидный ингибитор ароматазы экземестан или в каждом случае, если это применимо, его фармацевтически приемлемую соль.- 22017939 Наиболее предпочтительным нестероидным ингибитором альдостеронсинтазы является (+)энантиомер гидрохлорида фадрозола (патенты US 4617307 и 4889861) формулы Предпочтительным стероидным антагонистом альдостерона является эплеренон формулы или спиронолактон. Предпочтительным двойным ингибитором ангиотензинпревращающего фермента/нейтральной эндопептидазы (АПФ/НЭП) является, например, омапатрилат (см. EP 629627), фазидотрил или фазидотрилат или, если это применимо, его фармацевтически приемлемая соль. Предпочтительным антагонистом эндотелина является, например, босентан (см. EP 526708 А), кроме того, тезосентан (см. WO 96/19459) или в каждом случае его фармацевтически приемлемая соль. Ингибитором ренина является, например, непептидный ингибитор ренина, такой как соединение формулы обладающий химическим названием 2(S),4(S),5(S),7(S)-N-(3-амино-2,2-диметил-3-оксопропил)-2,7-ди(1 метилэтил)-4-гидрокси-5-амино-8-[4-метокси-3-(3-метоксипропокси)фенил]октанамид. Этот представитель специально раскрыт в EP 678503 A. Особенно предпочтительным является его гемифумарат. Диуретиком является, например, производное тиазида, выбранное из группы, включающей хлортиазид, гидрохлортиазид, метилклотиазид и хлорталидон. Наиболее предпочтительным является гидрохлортиазид. Миметиком ApoA-I является, например, пептид D4F предпочтительно формулы D-W-F-K-A-F-Y-DK-V-A-E-K-F-K-E-A-F. Предпочтительно, если совместные терапевтически эффективные количества активных средств,входящих в комбинацию, предлагаемую в настоящем изобретении, можно вводить одновременно или последовательно в любом порядке, по отдельности или в фиксированной комбинации. Структура активных средств, описываемых родовыми или торговыми названиями, приведена в последнем издании стандартного справочника "The Merck Index" или в базах данных, например, IMSLifeCycle (например, IMS World Publications). Соответствующее их содержание включено в настоящее изобретение в качестве ссылки. Любой специалист в данной области техники вполне способен идентифицировать активные средства и на основании этих ссылок также способен получить и исследовать фармацевтические показания и характеристики с помощью стандартных моделей как in vitro, так и in vivo. Кроме того, описанные выше комбинации можно вводить субъекту путем одновременного, раздельного или последовательного введения (применения). Одновременное введение (применение) можно проводить в виде одной фиксированной комбинации двух или большего количества активных ингредиентов или путем одновременного введения двух, трех или большего количества соединений, которые приготовлены в виде отдельных препаратов. Последовательное введение (применение) предпочтительно означает введение одного (или большего количества) соединений или активных ингредиентов комбинации в один момент времени, других соединений или активных ингредиентов в другой момент времени,т.е. хронологически поочередным образом, предпочтительно так, чтобы комбинация проявляла более значительную эффективность, чем отдельные соединения, вводимые независимо (предпочтительно, чтобы проявляла синергизм). Раздельное введение (применение) предпочтительно означает введение соединений или активных ингредиентов комбинации независимо друг от друга в разные моменты времени,предпочтительно означает, что два соединения вводят так, чтобы одновременно оба соединения не находились в крови в измеримых содержаниях (не происходило перекрывания).- 23017939 Также возможны комбинации одного, двух или большего количества последовательных, раздельных и одновременных введений, предпочтительно, чтобы такая комбинация соединение-лекарственные средства проявляла объединенное терапевтическое воздействие, которое превышает воздействие, проявляющееся, когда комбинации соединение-лекарственные средства применяются по отдельности через промежутки времени, столь большие, что не обнаруживается взаимное влияние на терапевтическую эффективность, особенно предпочтительным является синергетическое воздействие. Кроме того, настоящее изобретение относится к фармацевтической композиции или комбинации, предлагаемой в настоящем изобретении, для применения в качестве лекарственного средства; применению фармацевтической композиции или комбинации, предлагаемой в настоящем изобретении, для задержки прогрессирования и/или лечения нарушения или заболевания, опосредуемого БПХЭ или реагирующего на ингибирование БПХЭ; применению фармацевтической композиции или комбинации, предлагаемой в настоящем изобретении, для задержки прогрессирования и/или лечения нарушения или заболевания, выбранного из группы,включающей гиперлипидемию, артериосклероз, атеросклероз, заболевание периферических сосудов,дислипидемию, гипер-бета-липопротеинемию, гипо-альфа-липопротеинемию, гиперхолестеринемию,гипертриглицеридемию, семейную гиперхолестеринемию, сердечно-сосудистое нарушение, коронарную болезнь сердца, заболевание коронарной артерии, заболевание коронарных сосудов, стенокардию, ишемию, ишемию сердца, тромбоз, инфаркт сердца, такой как инфаркт миокарда, удар, заболевание периферических сосудов, реперфузионное поражение, рестеноз после ангиопластики, гипертензию, застойную сердечную недостаточность, диабет, такой как сахарный диабет типа II, сосудистые осложнения при диабете, ожирение и эндотоксикоз и т.п. Фармацевтическая композиция или комбинация, предлагаемая в настоящем изобретении, может содержать в разовой дозе примерно 1-1000 мг активных ингредиентов для субъекта массой примерно 50-70 кг, предпочтительно примерно 5-500 мг активных ингредиентов. Терапевтически эффективная доза соединения, фармацевтической композиции или их комбинаций зависит от вида субъекта, массы тела,возраста и индивидуального состояния, нарушения или заболевания, подвергающегося лечению, и его тяжести. Врач, клиницист или ветеринар с общей подготовкой должен легко определить эффективное количество каждого из активных ингредиентов, необходимое для предупреждения, лечения или подавления прогрессирования нарушения или заболевания. Указанные выше характеристики доз можно определить с помощью проводимых in vitro и in vivo исследований, предпочтительно с использованием млекопитающих, например мышей, крыс, собак,обезьян, или изолированных органов, тканей и их препаратов. Соединения, предлагаемые в настоящем изобретении, можно использовать in vitro в виде растворов, например предпочтительно водных растворов, и in vivo энтерально, парентерально, предпочтительно внутривенно, например в виде суспензии или водного раствора. Доза in vitro может находиться в диапазоне примерно от 10-3 до 10-9 М. Терапевтически эффективное количество in vivo в зависимости от пути введения может находиться в диапазоне примерно 0,1-500 мг/кг, предпочтительно примерно 1-100 мг/кг. Способность соединений, предлагаемых в настоящем изобретении, ингибировать БПХЭ можно продемонстрировать с использованием экспериментальных моделей и исследований, известных в данной области техники. Например, в EP 1115695 B1 описаны исследования активности БПХЭ in vitro, in vivo, и его содержание включено в настоящее изобретение в качестве ссылки. В частности, используют описанные ниже исследования.(1) Исследование БПХЭ in vitro. Набор для исследования активности БПХЭ (RB-RPAK) приобретен у фирмы Roar Biochemical, Inc.(New York, NY, USA). В каждую лунку 96-луночного планшета NBS половинной площади (costar 3686) прибавляют 1,2 нг/лунка раствора донора, 1 мкл раствора акцептора и 5 мкл раствора соединения, разбавленного в 100% ДМСО в 38 мкл буфера, содержащего 10 мМ Tris (трис-(гидроксиметиламинометан,150 мМ NaCl и 2 мМ ЭДТК, pH 7,4. Затем планшет герметизируют с помощью герметизирующего устройства Themowell (costar 6524) и затем перемешивают на устройстве для встряхивания планшетов с использованием перемешивающего устройства MICROPLATE MIXER MPX-96 (IWAKI) в режиме мощности 3 в течение 10 с при комнатной температуре. После инкубации в течение 10 мин при 37C реакцию инициируют путем прибавления 5 мкл раствора rhCETP (Cardiovascular Target, New York, NY, USA) и перемешивают на устройстве для встряхивания планшетов в течение 10 с, затем интенсивность флуоресценции в момент времени 0 мин измеряют с помощью ARVO SX (Perkin Elmerr, USA) при длине волны возбуждения, равной 465 нм, и длине волны испускания, равной 535 нм. После инкубации в течение 120 мин при 37C повторно измеряют интенсивность флуоресценции. Ингибирование активности rhCETP соединением рассчитывают по следующему уравнению: Ингибирование % = 1-(F120-F0)/(f120-f0)100,где F - измеренная интенсивность флуоресценции при добавлении соединения в момент времени 0 или 120 мин;f - измеренная интенсивность флуоресценции без соединения в момент времени 0 или 120 мин. Значения IC50 определяют по зависимости доза-эффект с помощью программного обеспечения Origin. Для соединений, предлагаемых в настоящем изобретении, или их фармацевтически приемлемых солей предпочтительные значения IC50 найдены равными от примерно 0,1 нМ до примерно 50 мкМ.(2) Влияние на содержание ЛВП в плазме у хомяков. Влияние соединений на содержание ЛВП-холестерина у хомяков исследовано с некоторыми изменениями по описанной ранее методике (Eur, J. Phamacol., 466 (2003), 147-154). Вкратце, методика заключается в следующем, самцам сирийских хомяков (SLC, Shizuoka, Japan) в течение 2 недель давали кормовой рацион с высоким содержанием холестерина. Затем животным однократно вводили дозу соединения,суспендированного в растворе карбоксиметилцеллюлозы. Содержание ЛВП-холестерина определяли с помощью имеющегося в продаже набора (Wako Pure Chemical, Japan) после осаждения липопротеинов,содержащих аполипопротеин В (ароВ), с помощью 13% полиэтиленгликоля 6000.(3) Приготовление pro-аполипопротеина AI человека (pro-apoAI). кДНК (комплементарная ДНК) pro-apoAI (NCBI accession number: NM000039) человека клонируют из кДНК печени человека Quick-Clone (Clontech, CA) и вставляют в вектор рЕТ 28 а (Novagen,Germany) для бактериальной экспрессии. Экспрессированный белок в виде белка слияния с 6His-меткой на N-конце в BL-21 Gold (DE3) (Strategene, CA) очищают путем образования хелата с HiTrap (GE(250 нг, Invitrogen, CA) растворяют в 1 мл хлороформа. Раствор выпаривают, затем остаток растворителя удаляют в вакууме в течение еще 1 ч. Высушенную смесь липидов растворяют в 500 мкл буфера для анализа (50 мМ Трис-HCl ([трис-(гидроксиметиламинометан)]) (pH 7,4), содержащем 150 мМ NaCl и 2 мМ ЭДТК (этилендиаминтетрауксусная кислота и обрабатывают ультразвуком при 50C с помощью микронаконечника (MICROSON ULTRASONIC CELL DISRUPTOR, Misonix, Farmingdale, NY) при выходной мощности 006 в течение 2 мин. После обработки ультразвуком раствор охлаждают до 40C, прибавляют к 100 мкг pro-apoAI человека и обрабатывают ультразвуком при выходной мощности 004 в течение 5 мин при 40C. Раствор, содержащий микроэмульсию BODIPY-ХЭ в качестве донорных молекул,фильтруют через фильтр, изготовленный из поливинилиденфторида, с отверстиями размером 0,45 мкм и хранят при 4C.(5) Исследование активности БПХЭ в плазме человека in vitro. Образцы плазмы человека с ЭДТК, взятые у здоровых людей, приобретают у фирмы New DrugDevelopment Research Center, Inc. Раствор донора готовят путем разведения микроэмульсии донора буфером для анализа. Плазму человека (50 мкл), буфер для анализа (35 мкл) и исследуемое соединение,растворенные в диметилсульфоксиде (1 мкл), прибавляют в каждую лунку 96-луночного плоскодонного планшета, половина площади которого зачернена. Реакцию инициируют, прибавляя в каждую лунку раствор донора (14 мкл). Интенсивность флуоресценции измеряют каждые 30 мин при 37C при длине волны возбуждения,равной 485 нм, и длине волны испускания, равной 535 нм. Активность БПХЭ (импульсов флуоресценции/мин) определяют как изменение интенсивности флуоресценции в течение от 30 до 90 мин. ЗначениеIC50 получают с помощью логистического уравнения (Y=Bottom + (Top-Bottom)/(1+(x/IC50)наклон Хилла) с использованием программного обеспечения Origin, version 7.5 SR3. Соединения формулы (I) обладают ингибирующей активностью, характеризующейся значениями IC50, находящимися в диапазоне примерно от 0,001 до 100 мкМ, предпочтительно от 0,01 до 10 мкМ. Соединения, предлагаемые в настоящем изобретении, или их фармацевтически приемлемые соли обладают превосходной способностью ингибировать активность БПХЭ у млекопитающих (например,людей, обезьян, крупного рогатого скота, лошадей, собак, кошек, кроликов, мышей и т.п.), и их можно применять в качестве ингибиторов активности БПХЭ. Кроме того, в связи с превосходной способностью соединения, предлагаемого в настоящем изобретении, или его фармацевтически приемлемой соли ингибировать активность БПХЭ, соединения, предлагаемые в настоящем изобретении, применимы в качестве фармацевтических средств, эффективных для профилактики, или лечения, или замедления развития симптоматики заболеваний, в которых участвует БПХЭ (например, гиперлипидемии, артериосклероза, атеросклероза, заболевания периферических сосудов, дислипидемии, гипер-бета-липопротеинемии, гипоальфа-липопротеинемии, гиперхолестеринемии, гипертриглицеридемии, семейной гиперхолестеринемии, сердечно-сосудистого нарушения, коронарной болезни сердца, заболевания коронарной артерии,заболевания коронарных сосудов, стенокардии, ишемии, ишемии сердца, тромбоза, инфаркта сердца,такого как инфаркт миокарда, удара, заболевания периферических сосудов, реперфузионного поражения,рестеноза после ангиопластики, гипертензии, застойной сердечной недостаточности, диабета, такого как сахарный диабет типа II, сосудистых осложнений при диабете, ожирения или эндотоксикоза и т.п.), в- 25017939 особенности в качестве профилактических или терапевтических средств при гиперлипидемии или артериосклеротических заболеваниях. Таблица 1 Ингибирующая активность соединенийtol - толил; РВКИ - растворимый в воде карбодиимид, 1-этил-3-(3-диметиламинопропил)карбодиимид. Примеры Приведенные ниже примеры предназначены для иллюстрации настоящего изобретения, и их не следует считать ограничивающими. Температуры указаны в градусах Цельсия. Если не указано обратное,все выпаривания проводят при пониженном давлении, предпочтительно при давлении, примерно равном от 15 до 100 мм рт.ст. (= 20-133 мбар). Структуру конечных продуктов, промежуточных продуктов и исходных веществ подтверждают с помощью стандартных аналитических методов, например с помощью микроанализа и спектроскопических методов, например МС, ИК, ЯМР. Использованные аббревиатуры являются такими, как принято в данной области техники. Значения IC50 для соединений в нижеследующих примерах составляют от примерно 0,1 до примерно 10000 нМ или примерно 1000 нМ для БПХЭ. Условия для измерения времени удерживания являются следующими: Условия А (ВЭЖХ). Колонка: ACQUITY UPLC ВЕН C18 1,7 мкм, 502,1 мм. Скорость потока: 0,5 мл/мин. Подвижная фаза: А) ТФК/вода (0,1/100, об./об.), В) ТФК/ацетонитрил (0,1/100, об./об.). Градиентный режим: 5% В в течение 0,5 мин, затем линейное увеличение от 5 до 100% В за 5,0 мин, затем 100% В в течение 1,5 мин. Измерение: УФ при 215 нм. Условия В (ВЭЖХ). Колонка: ACQUITY UPLC ВЕН C18 1,7 мкм, 502,1 мм. Скорость потока: 0,5 мл/мин. Подвижная фаза: А) ТФК/вода (0,1/100, об./об.), В) ТФК/ацетонитрил (0,1/100, об./об.). Градиентный режим: 5% В в течение 0,5 мин, затем линейное увеличение от 5 до 100% В за 5,0 мин, затем 100% В в течение 1,5 мин. Измерение: УФ при 215 нм. Условия С (ВЭЖХ). Колонка: CombiScreen ODS-AM, 504,6 мм. Скорость потока: 2,0 мл/мин. Подвижная фаза: А) ТФК/вода (0,1/100, об./об.), В) ТФК/ацетонитрил (0,1/100, об./об.). Градиентный режим: линейное увеличение от 5 до 100% В за 5 мин, затем 100% В в течение 2 мин. Измерение: УФ при 215 нм. Пример 1. Синтез трет-бутилового эфира (2S,3S,5R)-2-бензил-3-[(3,5-бис-трифторметилбензил)метоксикарбониламино]-5-этилпирролидин-1-карбоновой кислоты- 27017939 ацетонитриле (0,38 мл) при комнатной температуре добавляют метилхлорформиат (0,0754 ммоль; 5,9 мг). Реакционную смесь нагревают до 80C и перемешивают в течение 3,5 ч. К смеси добавляют дополнительное количество метилхлорформиата (0,0754 ммоль; 5,9 мг) и смесь перемешивают в течение еще 0,5 ч и затем охлаждают до комнатной температуры. К смеси добавляют рассол и EtOAc. Органический слой отделяют, сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают с помощью препаративной тонкослойной хроматографии на силикагеле (элюент: нгексан/EtOAc) и получают трет-бутиловый эфир(2S,3S,5R)-2-бензил-3-[(3,5-бистрифторметилбензил)метоксикарбониламино]-5-этилпирролидин-1-карбоновой кислоты (11,5 мг, 52%),ИЭР-МС m/z: 589 [M+1]+, время удерживания 2,63 мин (условия А). Пример 2. Синтез изопропилового эфира (2S,3S,5R)-2-бензил-3-[(5-бромпиримидин-2-ил)-(3-хлор 5-трифторметилбензил)амино]-5-этилпирролидин-1-карбоновой кислоты К суспензии изопропилового эфира (2S,3S,5R)-2-бензил-3-(5-бромпиримидин-2-иламино)-5 этилпирролидин-1-карбоновой кислоты (0,064 ммоль; 28,6 мг) и гидрида натрия (60% дисперсия в минеральном масле, 0,19 ммоль; 7,6 мг) в ДМФ (0,6 мл) в атмосфере N2 при комнатной температуре добавляют 3-хлор-5-трифторметилбензилбромид (0,13 ммоль; 35,6 мг). Через 3,5 ч к суспензии добавляют дополнительное количество гидрида натрия (60% дисперсия в минеральном масле, 0,19 ммоль; 7,6 мг). Реакционную смесь перемешивают в течение 20 мин и реакцию останавливают водой и насыщенным водным раствором хлорида аммония. Продукт три раза экстрагируют с помощью EtOAc. Объединенный органический слой промывают рассолом, сушат над Na2SO4, фильтруют и концентрируют при пониженном давлении. Остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: нгексан/EtOAc) и получают изопропиловый эфир (2S,3S,5R)-2-бензил-3-[(5-бромпиримидин-2-ил)-(3 хлор-5-трифторметилбензил)амино]-5-этилпирролидин-1-карбоновой кислоты (30,0 мг, 73%). ИЭР-МС m/z: 639 [M+1]+, время удерживания 2,68 мин (условия А). Пример 3. Синтез изопропилового эфира (2S,3S,5R)-2-бензил-3-(3-хлор-5-трифторметилбензил)[5-(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино-5-этилпирролидин-1-карбоновой кислоты Изопропиловый эфир (2S,3S,5R)-2-бензил-3-[(5-бромпиримидин-2-ил)-(3-хлор-5-трифторметилбензил)амино]-5-этилпирролидин-1-карбоновой кислоты (0,042 ммоль; 27 мг), тетракис(трифенилфосфин)палладий (0,0042 ммоль; 4,9 мг), пинаконовый эфир 1-метилпиразол-4-бороновой кислоты (0,063 ммоль; 13 мг) и карбонат натрия (0,084 ммоль; 8,9 мг) при комнатной температуре растворяют в 1,2-диметоксиэтане (0,8 мл) и воде (0,08 мл). Смесь перемешивают при 90C в течение 17 ч и затем охлаждают до температуры окружающей среды. К смеси добавляют рассол и раствор три раза экстрагируют с помощью EtOAc. Объединенный органический слой промывают рассолом, сушат надNa2SO4, фильтруют и концентрируют при пониженном давлении. Полученный остаток очищают с помощью колоночной хроматографии на силикагеле (элюент: н-гексан/EtOAc) и получают изопропиловый эфир (2S,3S,5R)-2-бензил-3-(3-хлор-5-трифторметилбензил)-[5-(1-метил-1H-пиразол-4-ил)пиримидин-2 ил]амино-5-этилпирролидин-1-карбоновой кислоты (13,6 мг, 51%). ИЭР-МС m/z: 641 [M+1]+, время удерживания 2,62 мин (условия А). Следующее соединение получают по методике примера 3.(0,101 ммоль; 69 мг) и моногидрат гидроксида лития (0,381 ммоль; 16 мг) растворяют в ТГФ (1 мл), воде(0,5 мл) и MeOH (0,1 мл). Раствор перемешивают при комнатной температуре в течение 3 ч. Реакцию останавливают 1 М водным раствором HCl (0,95 мл) и смесь перемешивают в течение 15 мин. К смеси добавляют дихлорметан и органический слой отделяют и затем концентрируют при пониженном давлении. Искомый продукт, 4-карбоксициклогексиловый эфир (2R,4S)-4-(3,5-бис-трифторметилбензил)-[5(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино-2-этилпирролидин-1-карбоновой кислоты, и получают с выходом 90% (60 мг). ИЭР-МС m/z: 669 [M+1]+, время удерживания 2,13 мин (условия А). Следующие соединения получают по методике примера 4. Пример 4-1. 4-Карбоксициклогексиловый эфир (2R,4S)-4-(3,5-бис-трифторметилбензил)-[5-(1 метил-1H-пиразол-4-ил)пиримидин-2-ил]амино-2-этилпирролидин-1-карбоновой кислоты. Пример 4-2. 2-Карбокси-2-метилпропиловый эфир (2R,4S)-4-(3,5-бис-трифторметилбензил)-[5-(1 метил-1H-пиразол-4-ил)пиримидин-2-ил]амино-2-этилпирролидин-1-карбоновой кислоты. Пример 4-3. 3-Карбокси-3-метилбутиловый эфир (2R,4S)-4-(3,5-бис-трифторметилбензил)-[5-(1 метил-1H-пиразол-4-ил)пиримидин-2-ил]амино-2-этилпирролидин-1-карбоновой кислоты. Пример 4-4. 3-Карбоксициклобутиловый эфир (2R,4S)-4-(3,5-бис-трифторметилбензил)-[5-(1 метил-1H-пиразол-4-ил)пиримидин-2-ил]амино-2-этилпирролидин-1-карбоновой кислоты. Пример 4-5. 4-Карбоксициклогексилметиловый эфир (2R,4S)-4-(3,5-бис-трифторметилбензил)-[5(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино-2-этилпирролидин-1-карбоновой кислоты. Пример 4-6. 3-Карбоксициклобутиловый эфир (2R,4S)-4-(3,5-бис-трифторметилбензил)-[5-(1 метил-1H-пиразол-4-ил)пиримидин-2-ил]амино-2-этилпирролидин-1-карбоновой кислоты. Пример 4-7. 1-Карбоксициклопентилметиловый эфир (2R,4S)-4-(3,5-бис-трифторметилбензил)-[5(1-метил-1H-пиразол-4-ил)пиримидин-2-ил]амино-2-этилпирролидин-1-карбоновой кислоты. Пример 4-8. 4-[2R,4S)-4-(3,5-бис-Трифторметилбензил)-[5-(1-метил-1H-пиразол-4 ил)пиримидин-2-ил]амино-2-этилпирролидин-1-карбонил)этиламино]метилциклогексанкарбоновая кислота. Пример 4-9. 4-Карбоксиметилциклогексилметиловый эфир
МПК / Метки
МПК: C07D 403/12, C07D 403/14, C07D 413/14, C07D 401/14, A61K 31/40, A61P 3/06, C07D 405/14, C07D 207/14
Метки: 4-бензиламинопирролидина, эфира, используемые, ингибиторов, холестерилового, гиперлипидемия, таких, 1,2-дизамещенного, лечения, производные, артериосклероз, заболеваний, качестве, белка-переносчика
Код ссылки
<a href="https://eas.patents.su/30-17939-proizvodnye-12-dizameshhennogo-4-benzilaminopirrolidina-v-kachestve-ingibitorov-belka-perenoschika-holesterilovogo-efira-ispolzuemye-dlya-lecheniya-zabolevanijj-takih-kak-giperlipi.html" rel="bookmark" title="База патентов Евразийского Союза">Производные 1,2-дизамещенного 4-бензиламинопирролидина в качестве ингибиторов белка-переносчика холестерилового эфира, используемые для лечения заболеваний, таких как гиперлипидемия или артериосклероз</a>
Предыдущий патент: Стиральная машина с отжимом
Следующий патент: Бис(сульфониламино)производные для применения в терапии
Случайный патент: Способ изготовления высокопрочного многослойного цветного стекла












