Бис(сульфониламино)производные для применения в терапии
Номер патента: 17940
Опубликовано: 30.04.2013
Авторы: Холенз Йёрг, Валлин Карл С.А., Виклунд Йенни, Бюлунд Йохан, Гравенфорс Ильва, Минидис Александр, Сон Даниель, Нордвалль Гуннар, Эк Мария Е., Фон Берг Стефан
Формула / Реферат
1. Соединение формулы (I) или его фармацевтически приемлемая соль
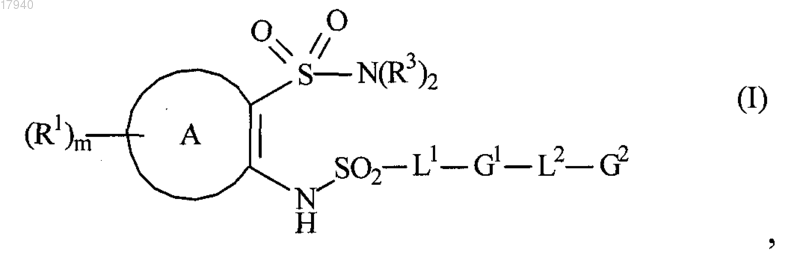
где А представляет собой фенил, пиридил, тиенил или 2,3-дигидроинденил;
R1 независимо выбран из хлоро, фторо, бромо, CN, ОН, CONR5R6, метила, 1-бутинила, метокси, G3, OG3 или OCH2G3; где указанный метил и 1-бутинил возможно замещен ОН или метилом;
m означает целое число 0, 1 или 2;
G3 представляет собой фенил, пиридил или 2-метил-1,3,4-оксадиазол;
R3, R5, R6 и R10 представляют собой водород;
L1 представляет собой прямую связь, этилен, 1-метилэтилен, 2-метилэтилен, этенилен, -С(СН3)СН-,
-СНС(СН3)- или -СН2С(СН2)-;
L2 представляет собой прямую связь, -О-, -ОСН2-, -NHCONH- или -СºС-;
G1 представляет собой фенил, нафтил, пиридил, тиенил, 2,3-дигидроинденил, тетрагидронафтил, 2,3-дигидро-1,4-бензодиоксинил или S,S-диоксодибензотиенил;
G2 представляет собой водород, метил, этил, трет-бутил, изопропил, фенил, пиридил, пиримидил, циклопентил, циклопентенил, циклогексил, фуранил, тетрагидрофуранил, тиенил, тиазолил, пиразолил, бензофуранил, 2,3-дигидробензофуранил, индолил, тетрагидронафтил или дибензофуранил;
любой метил, этил, трет-бутил, изопропил, фенил, пиридил, пиримидил, циклопентил, циклопентенил, циклогексил, фуранил, тетрагидрофуранил, тиенил, тиазолил, пиразолил, бензофуранил, 2,3-дигидробензофуранил, индолил, тетрагидронафтил или дибензофуранил в G1 и G2 возможно замещены одним или более заместителями, независимо выбранными из бромо, хлоро, фторо, CN, ОН, метила, трет-бутила, метилтио, NR12R13, -NHCOC(OH)(CH3)CF3, SO2NR10R11 и метокси; где указанный метил, трет-бутил или метокси возможно замещен ОН или одним или более атомами F;
R11, R12 и R13 представляют собой метил.
2. Соединение по п.1, выбранное из
2-[2-(4-бензофуран-2-илфенил)этилсульфониламино]бензолсульфонамида;
2-[2-[4-(2,3-дигидробензофуран-2-ил)фенил]этилсульфониламино]бензолсульфонамида;
2-[[(Е)-2-(4-бензофуран-2-илфенил)этенил]сульфониламино]бензолсульфонамида;
2-[[(Е)-2-(4-бензофуран-2-илфенил)этенил]сульфониламино]-5-фторбензолсульфонамида;
2-[[(Е)-2-(4-бензофуран-2-илфенил)этенил]сульфониламино]-4-фторбензолсульфонамида;
2-[[(Е)-2-(4-бензофуран-2-илфенил)этенил]сульфониламино]-6-фторбензолсульфонамида;
2-[1-(4-хлорфенил)пропан-2-илсульфониламино]бензолсульфонамида;
2-(1-фенилпропан-2-илсульфониламино)бензолсульфонамида;
2-[[(E)-1-(4-хлорфенил)проп-1-ен-2-ил]сульфониламино]бензолсульфонамида;
2-[1-(4-хлорфенил)пропан-2-илсульфониламино]-4-фторбензолсульфонамида;
2-[[(E)-1-(4-хлорфенил)проп-1-ен-2-ил]сульфониламино]-4-фторбензолсульфонамида;
2-[[(Е)-1-(4-хлорфенил)проп-1-ен-2-ил]сульфониламино]-5-фторбензолсульфонамида;
2-[[(Е)-1-(4-хлорфенил)проп-1-ен-2-ил]сульфониламино]-6-фторбензолсульфонамида;
2-[[(Е)-1-(4-хлорфенил)проп-1-ен-2-ил]сульфониламино]-3-фторбензолсульфонамида;
2-[[(Е)-1-(4-хлорфенил)проп-1-ен-2-ил]сульфониламино]-5-метилбензолсульфонамида;
2-[2-[4-(2-фурил)фенил]этилсульфониламино]бензолсульфонамида;
2-[2-[4-(оксолан-2-ил)фенил]этилсульфониламино]бензолсульфонамида;
2-[[(Е)-2-[4-(2-фурил)фенил]этенил]сульфониламино]бензолсульфонамида;
2-[2-[4-(дифторметокси)фенил]этилсульфониламино]бензолсульфонамида;
2-[[(Е)-2-[4-(дифторметокси)фенил]этенил]сульфониламино]бензолсульфонамида;
2-[2-(4-хлорфенил)этилсульфониламино]-5-фторбензолсульфонамида;
2-[[(Е)-2-(4-хлорфенил)этенил]сульфониламино]-5-фторбензолсульфонамида;
2-[[(Е)-2-(3,4-дихлорфенил)этенил]сульфониламино]-4-фторбензолсульфонамида;
2-[[(Е)-2-(3,4-дихлорфенил)этенил]сульфониламино]-5-фторбензолсульфонамида;
2-[[(Е)-2-(3,4-дихлорфенил)этенил]сульфониламино]-6-фторбензолсульфонамида;
2-[[(Е)-2-(5-бром-2-метоксифенил)этенил]сульфониламино]-4-фторбензолсульфонамида;
2-[[(Е)-2-(5-бром-2-метоксифенил)этенил]сульфониламино]-5-фторбензолсульфонамида;
2-[[(Е)-2-(5-бром-2-метоксифенил)этенил]сульфониламино]-6-фторбензолсульфонамида;
2-[[(Е)-2-(5-бром-2-метоксифенил)этенил]сульфониламино]бензолсульфонамида;
2-[[(Е)-2-(4-цианофенил)этенил]сульфониламино]-4-фторбензолсульфонамида;
2-[[(Е)-2-(4-цианофенил)этенил]сульфониламино]-5-фторбензолсульфонамида;
2-[[(Е)-2-(4-цианофенил)этенил]сульфониламино]-6-фторбензолсульфонамида;
2-[[(Е)-2-(4-цианофенил)этенил]сульфониламино]бензолсульфонамида;
4-фтор-2-[[(Е)-2-[4-(2-фурил)фенил]этенил]сульфониламино]бензолсульфонамида;
5-фтор-2-[[(Е)-2-[4-(2-фурил)фенил]этенил]сульфониламино]бензолсульфонамида;
2-фтор-6-[[(Е)-2-[4-(2-фурил)фенил]этенил]сульфониламино]бензолсульфонамида;
4-фтор-2-[[(Е)-2-(4-метилсульфанилфенил)этенил]сульфониламино]бензолсульфонамида;
5-фтор-2-[[(Е)-2-(4-метилсульфанилфенил)этенил]сульфониламино]бензолсульфонамида;
2-фтор-6-[[(Е)-2-(4-метилсульфанилфенил)этенил]сульфониламино]бензолсульфонамида;
2-[[(Е)-2-(4-метилсульфанилфенил)этенил]сульфониламино]бензолсульфонамида;
2-[[(Е)-2-[4-(дифторметокси)фенил]этенил]сульфониламино]-4-фторбензолсульфонамида;
2-[[(Е)-2-[4-(дифторметокси)фенил]этенил]сульфониламино]-5-фторбензолсульфонамида;
2-[[(Е)-2-[4-(дифторметокси)фенил] этенил]сульфониламино]-6-фторбензолсульфонамида;
2-[2-(4-хлорфенил)этилсульфониламино]-5-(гидроксиметил)бензолсульфонамида;
2-[2-(4-хлорфенил)этансульфониламино]-5-метилбензолсульфонамида;
2-[2-(4-хлорфенил)этилсульфониламино]-5-(пиридин-2-илметокси)бензолсульфонамида;
2-[2-(4-хлорфенил)этилсульфониламино]-5-[(5-метил-1,3,4-оксадиазол-2-ил)метокси]бензолсульфонамида;
2-[2-(2-хлорфенил)этенсульфониламино]бензолсульфонамида;
2-[2-(4-хлор-2-метоксифенил)этенсульфониламино]бензолсульфонамида;
2-фтор-6-[[(Е)-2-(4-фенилфенил)этенил]сульфониламино]бензолсульфонамида;
2-[[(Е)-2-(3-хлорфенил)этенил]сульфониламино]-5-фторбензолсульфонамида;
5-фтор-2-[[(Е)-2-(4-фенилфенил)этенил]сульфониламино]бензолсульфонамида;
4-фтор-2-[[(Е)-2-(4-фенилфенил)этенил]сульфониламино]бензолсульфонамида;
5-фтор-2-[[(Е)-2-[3-(трифторметил)фенил]этенил]сульфониламино]бензолсульфонамида;
5-фтор-2-[[(Е)-2-(2-метоксифенил)этенил]сульфониламино]бензолсульфонамида;
2-[[(Е)-2-(3-хлорфенил)этенил]сульфониламино]-6-фторбензолсульфонамида;
2-фтор-6-[[(Е)-2-(2-метоксифенил)этенил]сульфониламино]бензолсульфонамида;
4-фтор-2-[[(Е)-2-(2-метоксифенил)этенил]сульфониламино]бензолсульфонамида;
3-фтор-2-[[(Е)-2-(4-фенилфенил)этенил]сульфониламино]бензолсульфонамида;
3-фтор-2-[[(Е)-2-(2-метоксифенил)этенил]сульфониламино]бензолсульфонамида;
4-фтор-2-[[(Е)-2-[3-(трифторметил)фенил]этенил]сульфониламино]бензолсульфонамида;
2-фтор-6-[[(Е)-2-(2-фторфенил)этенил]сульфониламино]бензолсульфонамида;
2-[[(Е)-2-(3-хлорфенил)этенил]сульфониламино]-5-метилбензолсульфонамида;
2-[[(Е)-2-(3-хлорфенил)этенил]сульфониламино]-3-фторбензолсульфонамида;
3-фтор-2-[[(Е)-2-[3-(трифторметил)фенил]этенил]сульфониламино]бензолсульфонамида;
2-фтор-6-[[(Е)-2-[3-(трифторметил)фенил]этенил]сульфониламино]бензолсульфонамида;
4-фтор-2-[[(Е)-2-(2-фторфенил)этенил] сульфониламино]бензолсульфонамида;
5-метил-2-[[(Е)-2-[3-(трифторметил)фенил]этенил]сульфониламино]бензолсульфонамида;
2-[2-(4-циклопентилфенил)этилсульфониламино]бензолсульфонамида;
2-[2-(4-трет-бутилфенил)этилсульфониламино]бензолсульфонамида;
4-фтор-2-[2-(4-трет-бутилфенил)этилсульфониламино]бензолсульфонамида;
2-[2-(4-хлорфенил)этилсульфониламино]бензолсульфонамида;
2-[[(Е)-2-(4-хлорфенил)этенил]сульфониламино]бензолсульфонамида;
2-(фенэтилсульфониламино)бензолсульфонамида;
2-[[(Е)-2-фенилэтенил]сульфониламино]бензолсульфонамида;
2-[2-(2-хлорфенил)этилсульфониламино]бензолсульфонамида;
2-[[(Е)-2-(4-метоксифенил)этенил]сульфониламино]бензолсульфонамида;
2-[[(Е)-2-(4-хлорфенил)этенил]сульфониламино]-4-фторбензолсульфонамида;
2-(2-фенилпропилсульфониламино)бензолсульфонамида;
2-[[(Е)-2-(4-хлорфенил)этенил]сульфониламино]-6-фторбензолсульфонамида;
2-[[(Е)-2-(2,6-дихлорфенил)этенил]сульфониламино]бензолсульфонамида;
2-[[(Е)-2-(4-метилфенил)этенил]сульфониламино]бензолсульфонамида;
2-[[(Е)-2-(2-метоксифенил)этенил]сульфониламино]бензолсульфонамида;
2-[[(Е)-2-нафталин-2-илэтенил]сульфониламино]бензолсульфонамида;
2-[2-(4-хлорфенил)этилсульфониламино]-4-фторбензолсульфонамида;
2-[[(Е)-2-(4-хлорфенил)проп-1-енил]сульфониламино]бензолсульфонамида;
2-[2-(4-хлорфенил)проп-2-енилсульфониламино]бензолсульфонамида;
2-фтор-6-[[(Е)-2-нафталин-2-илэтенил]сульфониламино]бензолсульфонамида;
2-фтор-6-[[(Е)-2-[2-(трифторметил)фенил]этенил]сульфониламино]бензолсульфонамида;
2-фтор-6-[[(Е)-2-[4-(трифторметил)фенил]этенил]сульфониламино]бензолсульфонамида;
2-[[(Е)-2-(4-бромфенил)этенил]сульфониламино]-6-фторбензолсульфонамида;
4-фтор-2-[[(Е)-2-нафталин-2-илэтенил]сульфониламино]бензолсульфонамида;
4-фтор-2-[[(Е)-2-[2-(трифторметил)фенил]этенил]сульфониламино]бензолсульфонамида;
4-фтор-2-[[(Е)-2-[4-(трифторметил)фенил]этенил]сульфониламино]бензолсульфонамида;
2-[[(Е)-2-(4-бромфенил)этенил]сульфониламино]-4-фторбензолсульфонамида;
5-метил-2-[[(Е)-2-нафталин-2-илэтенил]сульфониламино]бензолсульфонамида;
5-метил-2-[[(Е)-2-[4-(трифторметил)фенил]этенил]сульфониламино]бензолсульфонамида;
2-[[(Е)-2-(4-бромфенил)этенил]сульфониламино]-5-метилбензолсульфонамида;
5-фтор-2-[[(Е)-2-нафталин-2-илэтенил]сульфониламино]бензолсульфонамида;
5-фтор-2-[[(Е)-2-[2-(трифторметил)фенил]этенил]сульфониламино]бензолсульфонамида;
5-фтор-2-[[(Е)-2-[4-(трифторметил)фенил]этенил]сульфониламино]бензолсульфонамида;
2-[[(Е)-2-(4-бромфенил)этенил]сульфониламино]-5-фторбензолсульфонамида;
2-[[(Е)-2-(2,6-дифторфенил)этенил]сульфониламино]бензолсульфонамида;
2-[[(Е)-2-[2-(трифторметил)фенил]этенил]сульфониламино]бензолсульфонамида;
2-[[(Е)-2-[4-(трифторметил)фенил]этенил]сульфониламино]бензолсульфонамида;
2-[[(Е)-2-(4-бромфенил)этенил]сульфониламино]бензолсульфонамида;
2-[(Е)-2-(4-бромфенил)этилсульфониламино]бензолсульфонамида;
2-[2-(4-хлорфенил)пропилсульфониламино]бензолсульфонамида;
2- [2-(2-метоксифенил)этилсульфониламино]бензолсульфонамида;
2-(2-нафталин-2-илэтилсульфониламино)бензолсульфонамида;
4-фтор-2-(2-нафталин-2-илэтилсульфониламино)бензолсульфонамида;
2-[(4-хлорфенил)метилсульфониламино]бензолсульфонамида;
2-[[3-(2,3-дихлорфенил)фенил]сульфониламино]бензолсульфонамида;
2-[[3-(3,5-дифторфенил)фенил]сульфониламино]бензолсульфонамида;
3-(5-хлор-2-метоксифенил)-N-(2-сульфамоилфенил)бензолсульфонамида;
2-[[3-(3-цианофенил)фенил]сульфониламино]бензолсульфонамида;
2-[[3-(4-цианофенил)фенил]сульфониламино]бензолсульфонамида;
3-(2,4-диметоксипиримидин-5-ил)-N-(2-сульфамоилфенил)бензолсульфонамида;
2-[[3-(3-фурил)фенил]сульфониламино] бензолсульфонамида;
2-[[3-(1Н-индол-5-ил)фенил]сульфониламино]бензолсульфонамида;
2-[[3-[3-(трифторметокси)фенил]фенил]сульфониламино]бензолсульфонамида;
N-(2-сульфамоилфенил)-2,3-дигидро-1Н-инден-5-сульфонамида;
7-метил-N-(2-сульфамоилфенил)-10-окса-7-азабицикло[4.4.0]дека-1,3,5-триен-3-сульфонамида;
2-(3,4-дихлорфенил)-N-(2-сульфамоилфенил)бензолсульфонамида;
2-[[4-[3-хлор-5-(трифторметил)пиридин-2-ил]оксифенил]сульфониламино]бензолсульфонамида;
N-(2-сульфамоилфенил)тетралин-2-сульфонамида;
4-фенилметокси-N-(2-сульфамоилфенил)бензолсульфонамида;
2-[(4-циклогексилфенил)сульфониламино] бензолсульфонамида;
3-фенил-N-(2-сульфамоилфенил)бензолсульфонамида;
5-(1-метил-5-трифторметил-1Н-пиразол-3-ил)тиофен-2-сульфоновой кислоты (2-сульфамоилфенил)амида;
N-(2-сульфамоилфенил)-4-(трифторметил)бензолсульфонамида;
2-[[3-(2,5-дихлорфенил)фенил]сульфониламино]бензолсульфонамида;
3-дибензофуран-4-ил-N-(2-сульфамоилфенил)бензолсульфонамида;
2-[[3-[4-(трифторметил)фенил]фенил]сульфониламино]бензолсульфонамида;
3-(3-метоксифенил)-N-(2-сульфамоилфенил)бензолсульфонамида;
3-бензофуран-2-ил-N-(2-сульфамоилфенил)бензолсульфонамида;
2-[[3-(2,3-дигидробензофуран-5-ил)фенил]сульфониламино]бензолсульфонамида;
3-(6-метоксипиридин-3-ил)-N-(2-сульфамоилфенил)бензолсульфонамида;
2-[[3-(2,4-дихлорфенил)фенил]сульфониламино]бензолсульфонамида;
3-(1-метилиндол-2-ил)-N-(2-сульфамоилфенил)бензолсульфонамида;
2-[[3-[3-(трифторметил)фенил]фенил]сульфониламино]бензолсульфонамида;
4-бензофуран-2-ил-N-(2-сульфамоилфенил)бензолсульфонамида;
2-[[3-(2,4-дифторфенил)фенил]сульфониламино]бензолсульфонамида;
5-бром-2-[[3-(3,4-дихлорфенил)фенил]сульфониламино]бензолсульфонамида;
2-[[3-(3,4-дихлорфенил)фенил]сульфониламино]-5-фенилбензолсульфонамида;
2,3-дифтор-N-(2-сульфамоилфенил)бензолсульфонамида;
2,3-дифтор-N-(4-фтор-2-сульфамоилфенил)бензолсульфонамида;
3-хлор-2-фтор-N-(2-сульфамоилфенил)бензолсульфонамида;
2,3-дихлор-N-(2-сульфамоилфенил)бензолсульфонамида;
2-[[3-(3,4-дихлорфенил)фенил]сульфониламино]-5-метилбензолсульфонамида;
4-[[3-(3,4-дихлорфенил)фенил]сульфониламино]-3-сульфамоилбензамида;
5-метил-2-[[3-[3-(трифторметокси)фенил]фенил]сульфониламино]бензолсульфонамида;
2-(2,3-дихлорбензолсульфониламино)-5-гидроксиметилбензолсульфонамида;
2-(2,3-дихлорбензолсульфониламино)-5-метилбензолсульфонамида;
2-[[3-(3,4-дихлорфенил)фенил]сульфониламино]-5-феноксибензолсульфонамида;
5-фенокси-2-[[3-[3-(трифторметокси)фенил]фенил]сульфониламино]бензолсульфонамида;
2-(2,3-дихлорбензолсульфониламино)-5-гидроксибензолсульфонамида;
(2R)-N-[2-хлор-4-[(2-сульфамоилфенил)сульфамоил]фенил]-3,3,3-трифтор-2-гидрокси-2-метилпропанамида;
5-хлор-N-(2-сульфамоилфенил)тиофен-2-сульфонамида;
4,5-дихлор-N-(2-сульфамоилфенил)тиофен-2-сульфонамида;
3,4-дихлор-N-(2-сульфамоилфенил)бензолсульфонамида;
3-(6-метоксипиридин-2-ил)-N-(2-сульфамоилфенил)бензолсульфонамида;
2-[[4-[(2-хлор-1,3-тиазол-5-ил)метокси]фенил]сульфониламино]бензолсульфонамида;
3-(5-фтор-6-метоксипиридин-3-ил)-N-(2-сульфамоилфенил)бензолсульфонамида;
3-(2-метоксипиримидин-5-ил)-N-(2-сульфамоилфенил)бензолсульфонамида;
3-(4-метилпиридин-3-ил)-N-(2-сульфамоилфенил)бензолсульфонамида;
3-(2-метоксипиридин-3-ил)-N-(2-сульфамоилфенил)бензолсульфонамида;
2-[[3-(5-хлорпиридин-3-ил)фенил]сульфониламино]бензолсульфонамида;
3-(5-хлор-6-метоксипиридин-3-ил)-N-(2-сульфамоилфенил)бензолсульфонамида;
3-(6-диметиламинопиридин-3-ил)-N-(2-сульфамоилфенил)бензолсульфонамида;
2-[[3-[3-(гидроксиметил)фенил]фенил]сульфониламино] бензолсульфонамида;
2-[[3-[4-(гидроксиметил)фенил]фенил]сульфониламино]бензолсульфонамида;
2-[[4-(3,4-дихлорфенил)фенил]сульфониламино]бензолсульфонамида;
2-[[3-(3,4-дихлорфенил)фенил]сульфониламино]бензолсульфонамида;
2-[[4-(4-хлорфенокси)фенил]сульфониламино]бензолсульфонамида;
3-(4-хлорфенил)-1-[3-метил-4-[(2-сульфамоилфенил)сульфамоил]фенил]мочевины;
N-метил-N'-(2-сульфамоилфенил)дибензо[b,d]тиофен-2,8-дисульфонамида 5,5-диоксида;
2,3-дихлор-N-(4,5-дифтор-2-сульфамоилфенил)бензолсульфонамида;
(Е)-2-(2-(3,4-дихлорфенил)винилсульфонамидо)-5-(3-гидрокси-3-метилбут-1-инил)бензолсульфонамида;
4-циано-2-(2-(3,4-дихлорфенил)этилсульфонамидо)бензолсульфонамида;
2-(2-(4-хлор-2-метоксифенил)этилсульфонамидо)-4-цианобензолсульфонамида;
2-(2-(4-хлор-2-метоксифенил)этилсульфонамидо)-5-цианобензолсульфонамида;
2-(2-(4-(3,3-диметилбут-1-инил)фенил)этилсульфонамидо)бензолсульфонамида;
2-(2-(4-(3-гидрокси-3-метилбут-1-инил)фенил)этилсульфонамидо)бензолсульфонамида;
3-(3,3-диметилбут-1-инил)-N-(2-сульфамоилфенил)бензолсульфонамида;
2-(2-(4-хлор-2-метоксифенил)этилсульфонамидо)бензолсульфонамида;
2-(2-(6-(3,3-диметилбут-1-инил)пиридин-3-ил)этилсульфонамидо)бензолсульфонамида;
2-(2-(6-(циклогексилэтинил)пиридин-3-ил)этилсульфонамидо)бензолсульфонамида;
2-(2-(4-бромфенил)этилсульфонамидо)-5-метилбензолсульфонамида;
(Е)-2-(2-(4-бромфенил)винилсульфонамидо)-5-метилбензолсульфонамида;
3-(2-метилтиазол-4-ил)-N-(2-сульфамоилфенил)бензолсульфонамида;
(Е)-2-(2-(3-(трифторметил)фенил)винилсульфонамидо)бензолсульфонамида;
(Е)-2-(2-(2-фторфенил)винилсульфонамидо)бензолсульфонамида;
5-хлор-2-(2-(4-хлор-2-метоксифенил)этилсульфонамидо)бензолсульфонамида;
2,3-дихлор-N-(4-хлор-2-сульфамоилфенил)бензолсульфонамида;
2,3-дихлор-N-(3,5-дифтор-2-сульфамоилфенил)бензолсульфонамида;
2-(2-(3,4-дихлорфенил)этилсульфонамидо)-4,6-дифторбензолсульфонамида;
2-(2-(4-хлор-2-метоксифенил)этилсульфонамидо)-4,6-дифторбензолсульфонамида;
5-циано-2-(2-(3,4-дихлорфенил)этилсульфонамидо)бензолсульфонамида;
(Е)-2-(2-(3,4-дихлорфенил)винилсульфонамидо)-4-метилбензолсульфонамида;
2-(2-(4-хлор-2-метоксифенил)этилсульфонамидо)-4-метилбензолсульфонамида;
5-хлор-2-(2-(3,4-дихлорфенил)этилсульфонамидо)бензолсульфонамида;
4-(3-(5-хлор-6-метоксипиридин-3-ил)фенилсульфонамидо)пиридин-3-сульфонамида;
4-(2-(4-(бензофуран-2-ил)фенил)этилсульфонамидо)пиридин-3-сульфонамида;
2-(2-(4-хлор-2-метоксифенил)этилсульфонамидо)-5-метилбензолсульфонамида;
4-(2-(4-хлор-2-метоксифенил)этилсульфонамидо)пиридин-3-сульфонамида;
(Е)-2-(2-(4-циклопентенилфенил)винилсульфонамидо)бензолсульфонамида;
(Е)-2-(2-(4-(3,3-диметилбут-1-инил)фенил)винилсульфонамидо)бензолсульфонамида;
(Е)-2-(2-(4-(3-гидрокси-3-метилбут-1-инил)фенил)винилсульфонамидо)бензолсульфонамида;
2-{2-[4-(3,3-диметилбут-1-инил)фенил]этансульфониламино}-5-метилбензолсульфонамида;
2-{2-[4-(3,3-диметилбут-1-инил)фенил]этансульфониламино}-5-гидроксиметилбензолсульфонамида;
2-[2-(4-циклопентилэтинилфенил)этансульфониламино]-5-гидроксиметилбензолсульфонамида;
2-[2-(4-хлор-2-метоксифенил)этансульфониламино]-5-гидроксиметилбензолсульфонамида;
3-{2-[4-(3,3-диметилбут-1-инил)фенил]этансульфониламино}тиофен-2-сульфоновой кислоты амида;
3-[3-(5-хлор-6-метоксипиридин-3-ил)бензолсульфониламино]тиофен-2-сульфоновой кислоты амида;
(Е)-2-(2-(4-(1,1,2,2-тетрафторэтокси)фенил)винилсульфонамидо)бензолсульфонамида;
(Е)-2-(2-(2-(дифторметокси)фенил)винилсульфонамидо)бензолсульфонамида;
(Е)-2-(2-(4'-(трифторметил)бифенил-4-ил)винилсульфонамидо)бензолсульфонамида;
(Е)-2-(2-(2-изопропоксифенил)винилсульфонамидо)бензолсульфонамида;
(Е)-2-(2-(2-(метилтио)фенил)винилсульфонамидо)бензолсульфонамида;
(Е)-2-(2-(2-(трифторметокси)фенил)винилсульфонамидо)бензолсульфонамида;
(Е)-2-(2-(2-этоксифенил)винилсульфонамидо)бензолсульфонамида;
2-(2-(4-(1,1,2,2-тетрафторэтокси)фенил)этилсульфонамидо)бензолсульфонамида;
2-(2-(4'-(трифторметил)бифенил-4-ил)этилсульфонамидо)бензолсульфонамида;
2-[2-(2-гидроксифенил)этенсульфониламино]бензолсульфонамида;
4-хлор-2-(2-(4-(дифторметокси)фенил)этилсульфонамидо)бензолсульфонамида;
4-хлор-2-(2-(2-метоксифенил)этилсульфонамидо)бензолсульфонамида;
4-хлор-2-(2-(4-хлор-2-метоксифенил)этилсульфонамидо)бензолсульфонамида;
2-(2-(3,4-дихлорфенил)этилсульфонамидо)-3,5-дифторбензолсульфонамида;
2,3-дихлор-N-(4-фтор-5-метокси-2-сульфамоилфенил)бензолсульфонамида;
4-хлор-2-(2-(3,4-дихлорфенил)этилсульфонамидо)бензолсульфонамида;
5-хлор-2-(2-(4-хлорфенил)этилсульфонамидо)-4-фторбензолсульфонамида;
5-хлор-2-(2-(3,4-дихлорфенил)этилсульфонамидо)-4-фторбензолсульфонамида;
5-(2-(4-(фуран-2-ил)фенил)этилсульфонамидо)-2,3-дигидро-1Н-инден-4-сульфонамида;
6-(2-(4-(фуран-2-ил)фенил)этилсульфонамидо)-2,3-дигидро-1H-инден-5-сульфонамида;
5-(2-(3,4-дихлорфенил)этилсульфонамидо)-2,3-дигидро-1Н-инден-4-сульфонамида;
(Е)-5-(2-(4-хлорфенил)винилсульфонамидо)-2,3-дигидро-1Н-инден-4-сульфонамида;
(Е)-6-(2-(4-хлорфенил)винилсульфонамидо)-2,3-дигидро-1Н-инден-5-сульфонамида;
2-[[3-(3,4-дихлорфенил)фенил]сульфониламино]-N-метилбензолсульфонамида и
2-(2-(6-((4-(трифторметил)фенил)этинил)пиридин-3-ил)этилсульфонамидо)бензолсульфонамида;
и фармацевтически приемлемых солей любого из них.
3. Способ получения соединения формулы (I) или его фармацевтически приемлемой соли, как определено в п.1, включающий
взаимодействие соединения формулы (II)
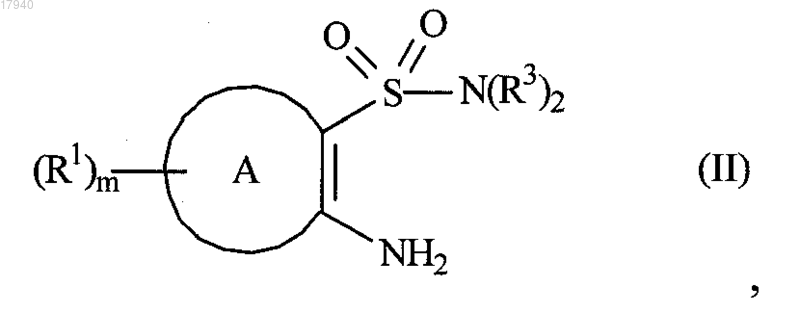
где R1, R3, А и m являются такими, как определено в формуле (I), с соединением формулы (III)
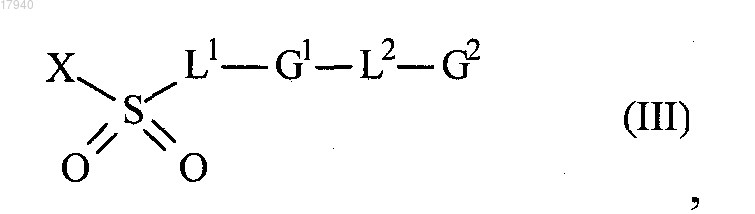
где L1, L2, G1 и G2 являются такими, как определено в формуле (I), и X представляет собой уходящую группу, такую как галоген;
и возможно последующее осуществление одной или более из следующих стадий:
превращение полученного соединения в другое соединение по изобретению,
образование фармацевтически приемлемой соли соединения.
4. Способ получения соединения формулы (I) или его фармацевтически приемлемой соли, как определено в п.1, когда L2 представляет собой прямую связь, и G1 и G2, обе, представляют собой ароматические группировки, включающий
взаимодействие соединения формулы (IV)
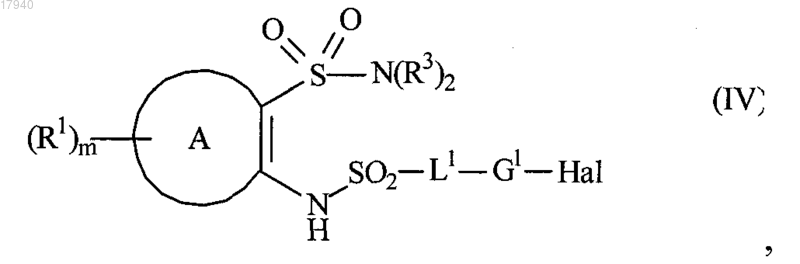
где Hal представляет собой атом галогена и R1, R2, A, m и L1 являются такими, как определено в формуле (I),
с нуклеофилом G2-M, где М представляет собой оловоорганическую группу или группу органической бороновой кислоты;
и возможно последующее осуществление одной или более из следующих стадий:
превращение полученного соединения в другое соединение по изобретению,
образование фармацевтически приемлемой соли соединения.
5. Фармацевтическая композиция, содержащая соединение формулы (I) или его фармацевтически приемлемую соль по п.1 или 2 вместе с фармацевтически приемлемым адъювантом, разбавителем или носителем.
6. Способ получения фармацевтической композиции по п.5, включающий смешивание соединения формулы (I) или его фармацевтически приемлемой соли по п.1 или 2 с фармацевтически приемлемым адъювантом, разбавителем или носителем.
7. Применение соединения формулы (I) или его фармацевтически приемлемой соли по п.1 или 2 в изготовлении лекарственного средства для применения в лечении острой или хронической боли, ноцицептивной боли или невропатической боли.
8. Применение соединения формулы (I) или его фармацевтически приемлемой соли по п.1 или 2 в изготовлении лекарственного средства для применения в лечении остеоартрита, ревматоидного артрита, доброкачественных или злокачественных новообразований, апноэ, внезапной детской смерти (SID), атеросклероза, рака, аневризмы, гипертермии, миозита, болезни Альцгеймера или артрита.
9. Применение соединения формулы (I) или его фармацевтически приемлемой соли по п.1 или 2 в изготовлении лекарственного средства для применения в лечении или снижении риска развития воспалительного заболевания или состояния.
10. Способ лечения или снижения риска развития заболеваний или состояний у человека, при котором модуляция активности микросомальной простагландин-Е-синтазы-1 является благоприятной, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли по п.1 или 2.
Текст
В изобретении предложены соединения формулы (I), где R1, R3, L1, L2, G1, G2, А и m являются такими, как определено в описании, их оптические изомеры, рацематы и таутомеры и их фармацевтически приемлемые соли вместе со способами их получения, содержащими их фармацевтическими композициями и их применением в терапии. Соединения являются ингибиторами микросомальной простагландин-Е-синтазы-1. Бюлунд Йохан, Эк Мария Е.,Гравенфорс Ильва, Холенз Йрг,Минидис Александр, Нордвалль Гуннар, Сон Даниель, Валлин Карл С.А., Виклунд Йенни, Фон Берг Стефан (SE) Поликарпов А.В., Борисова Е.Н. (RU) Область изобретения Настоящее изобретение относится к бис(сульфониламино)производным, способам их получения,содержащим их фармацевтическим композициям и их применению в терапии. Предшествующий уровень изобретения Модуляция метаболизма простагландинов находится в центре современных противовоспалительных терапий. NSAIDs (нестероидные противовоспалительные лекарственные средства) и ингибиторы СОХ-2 блокируют активность циклооксигеназ и их способность превращать арахидоновую кислоту в простагландин Н 2 (PGH2). PGH2 может затем метаболизироваться конечными простагландинсинтазами до соответствующих биологически активных PG, а именно PGI2, тромбоксана (Тх) А 2, PGD2, PGF2 иPGE2. Комбинация фармакологических, генетических подходов и подходов с нейтрализующими антителами демонстрирует важность PGE2 в воспалении. Поэтому превращение PGH2 в PGE2 простагландинЕ-синтазами (PGES) может представлять ключевую стадию в распространении воспалительных стимулов. Микросомальная простагландин-Е-синтаза-1 (mPGES-1) представляет собой индуцибельную PGES после воздействия провоспалительных стимулов. mPGES-1 индуцируется на периферии и в ЦНС воспалением и поэтому является мишенью для острых и хронических воспалительных расстройств.PGE2 представляет собой основной простаноид, запускающий воспалительные процессы. Простаноид продуцируется из арахидоновой кислоты, высвобождаемой фосфолипазами (PLAs). Арахидоновая кислота превращается под действием простагландин-Н-синтазы (PGH-синтаза, циклооксигеназа) в PGH2,который представляет собой субстрат для mPGES-1, которая представляет собой конечный фермент,превращающий PGH2 в провоспалительный PGE2.NSAIDs снижают PGE2 путем ингибирования циклооксигеназы, но в то же время снижая другие простаноиды, давая побочные эффекты, такие как изъязвления в ЖК тракте. Ингибирование mPGES-1 приводит к похожему эффекту на продукцию PGE2, не влияя на образование других простаноидов, и поэтому к более благоприятному профилю. Блокируя образование PGE2 в животных моделях воспалительной боли, продемонстрировали уменьшенное воспаление, боль и температурную реакцию (см., например, Kojima et al., The Journal ofImmunology 2008, 180, 8361-6, Xu et al., The Journal of Pharmacology and Experimental Therapeutics 2008,326, 754-63). При абдоминальной аневризме аорты воспаление приводит к деградации соединительной ткани и апоптозу гладких мышц, в конечном счете приводящих к дилатации и разрыву аорты. У животных с отсутствием mPGES-1 были продемонстрированы более медленное развитие заболевания и тяжесть заболевания (см., например, Wang et al., Circulation, 2008, 117, 1302-1309). Некоторые линии доказательства показывают, что PGE2 вовлечен в злокачественный рост. PGE2 способствует развитию опухоли путем стимуляции клеточной пролиферации и ангиогенеза и путем модуляции иммуносупрессии. В поддержку роли PGE2 в канцерогенезе генетическая делеция mPGES-1 у мышей подавляет образование интестинальной опухоли (Nakanishi et al., Cancer Research 2008, 68 (9),3251-9). У человека mPGES-1 также активируется при злокачественных заболеваниях, таких как колоректальный рак (см., например, Schrder Journal of Lipid Research 2006, 47, 1071-80). Миозит представляет собой хроническое мышечное расстройство, характеризующееся мышечной слабостью и усталостью. В развитие миозита вовлечены провоспалительные цитокины и простаноиды. В скелетно-мышечной ткани от пациентов, страдающих миозитом, было продемонстрировано увеличение циклооксигеназ и mPGES-1, подразумевая mPGES-1 в качестве мишени для лечения этого состояния(см., например, Korotkova Annals of the Rheumatic Diseases 2008, 67, 1596-1602). При атеросклерозе воспаление сосудистой сети приводит к образованию атеромы, которое со временем может развиться в инфаркт. У пациентов с атеросклерозом сонных артерий было обнаружено увеличение mPGES-1 в зонах бляшек (Gmez-Hernandez Atherosclerosis 2006, 187, 139-49). Обнаружили, что в животной модели атеросклероза мыши с отсутствием рецептора mPGES-1 демонстрируют замедленный атерогенез и сопутствующее снижение происходящих из макрофагов пенистых клеток вместе с увеличением сосудистых гладкомышечных клеток (см., например, Wang Proceedings of National Academy ofSciences 2006, 103(39), 14507-12). Настоящее изобретение направлено на новые соединения, которые представляют собой селективные ингибиторы фермента микросомальной простагландин-Е-синтазы-1 и поэтому будут полезными для лечения боли и воспаления при различных заболеваниях или состояниях. Описание изобретения В настоящем изобретении предложены соединения формулы (I) и их фармацевтически приемлемые солиR1 независимо выбран из хлоро, фторо, бромо, CN, ОН, CONR5R6, метила, 1-бутинила, метокси, G3,3OG или OCH2G3; где указанный метил и 1-бутинил возможно замещен ОН или метилом;m означает целое число 0, 1 или 2;L1 представляет собой прямую связь, этилен, 1-метилэтилен, 2-метилэтилен, этенилен, -С(СН 3)СН-,-СНС(СН 3)- или -СН 2 С(СН 2)-;L2 представляет собой прямую связь, -О-, -ОСН 2-, -NHCONH- или -СС-;G2 представляет собой водород, метил, этил, трет-бутил, изопропил, фенил, пиридил, пиримидил,циклопентил, циклопентенил, циклогексил, фуранил, тетрагидрофуранил, тиенил, тиазолил, пиразолил,бензофуранил, 2,3-дигидробензофуранил, индолил, тетрагидронафтил или дибензофуранил; любой метил, этил, трет-бутил, изопропил, фенил, пиридил, пиримидил, циклопентил, циклопентенил, циклогексил, фуранил, тетрагидрофуранил, тиенил, тиазолил, пиразолил, бензофуранил, 2,3 дигидробензофуранил, индолил, тетрагидронафтил или дибензофуранил в G1 и G2 возможно замещены одним или более заместителями, независимо выбранными из бромо, хлоро, фторо, CN, ОН, метила, третбутила, метилтио, NR12R13, -NHCOC(OH)(CH3)CF3, SO2NR10R11 и метокси; где указанный метил, третбутил или метокси возможно замещен ОН или одним или более атомами F;R11, R12 и R13 представляют собой метил. Примеры соединений по изобретению включают в себя 2-[2-(4-бензофуран-2-илфенил)этилсульфониламино]бензолсульфонамид; 2-[2-[4-(2,3-дигидробензофуран-2-ил)фенил]этилсульфониламино]бензолсульфонамид; 2-(Е)-2-(4-бензофуран-2-илфенил)этенил]сульфониламино]бензолсульфонамид; 2-(Е)-2-(4-бензофуран-2-илфенил)этенил]сульфониламино]-5-фторбензолсульфонамид; 2-(Е)-2-(4-бензофуран-2-илфенил)этенил]сульфониламино]-4-фторбензолсульфонамид; 2-(Е)-2-(4-бензофуран-2-илфенил)этенил]сульфониламино]-6-фторбензолсульфонамид; 2-[1-(4-хлорфенил)пропан-2-илсульфониламино]бензолсульфонамид; 2-(1-фенилпропан-2-илсульфониламино)бензолсульфонамид; 2-(E)-1-(4-хлорфенил)проп-1-ен-2-ил]сульфониламино]бензолсульфонамид; 2-[1-(4-хлорфенил)пропан-2-илсульфониламино]-4-фторбензолсульфонамид; 2-(Е)-1-(4-хлорфенил)проп-1-ен-2-ил]сульфониламино]-4-фторбензолсульфонамид; 2-(Е)-1-(4-хлорфенил)проп-1-ен-2-ил]сульфониламино]-5-фторбензолсульфонамид; 2-(Е)-1-(4-хлорфенил)проп-1-ен-2-ил]сульфониламино]-6-фторбензолсульфонамид; 2-(Е)-1-(4-хлорфенил)проп-1-ен-2-ил]сульфониламино]-3-фторбензолсульфонамид; 2-(Е)-1-(4-хлорфенил)проп-1-ен-2-ил]сульфониламино]-5-метилбензолсульфонамид; 2-[2-[4-(2-фурил)фенил]этилсульфониламино]бензолсульфонамид; 2-[2-[4-(оксолан-2-ил)фенил]этилсульфониламино]бензолсульфонамид; 2-(Е)-2-[4-(2-фурил)фенил]этенил]сульфониламино]бензолсульфонамид; 2-[2-[4-(дифторметокси)фенил]этилсульфониламино]бензолсульфонамид; 2- (Е)-2-[4-(дифторметокси)фенил]этенил]сульфониламино]бензолсульфонамид; 2-[2-(4-хлорфенил)этилсульфониламино]-5-фторбензолсульфонамид; 2-(Е)-2-(4-хлорфенил)этенил]сульфониламино]-5-фторбензолсульфонамид; 2-(Е)-2-(3,4-дихлорфенил)этенил]сульфониламино]-4-фторбензолсульфонамид; 2-(Е)-2-(3,4-дихлорфенил)этенил]сульфониламино]-5-фторбензолсульфонамид; 2-(Е)-2-(3,4-дихлорфенил)этенил]сульфониламино]-6-фторбензолсульфонамид; 2-(Е)-2-(5-бром-2-метоксифенил)этенил]сульфониламино]-4-фторбензолсульфонамид; 2-(Е)-2-(5-бром-2-метоксифенил)этенил]сульфониламино]-5-фторбензолсульфонамид; 2-(Е)-2-(5-бром-2-метоксифенил)этенил]сульфониламино]-6-фторбензолсульфонамид; 2-(Е)-2-(5-бром-2-метоксифенил)этенил]сульфониламино]бензолсульфонамид; 2-(Е)-2-(4-цианофенил)этенил]сульфониламино]-4-фторбензолсульфонамид; 2-(Е)-2-(4-цианофенил)этенил]сульфониламино]-5-фторбензолсульфонамид; 2-(Е)-2-(4-цианофенил)этенил]сульфониламино]-6-фторбензолсульфонамид; 2-(Е)-2-(4-цианофенил)этенил]сульфониламино]бензолсульфонамид; 4-фтор-2-(Е)-2-[4-(2-фурил)фенил]этенил]сульфониламино]бензолсульфонамид;(Е)-6-(2-(4-хлорфенил)винилсульфонамидо)-2,3-дигидро-1 Н-инден-5-сульфонамид; 2-3-(3,4-дихлорфенил)фенил]сульфониламино]-N-метил-бензолсульфонамид и 2-(2-(6-4-(трифторметил)фенил)этинил)пиридин-3-ил)этилсульфонамидо)бензолсульфонамид и фармацевтически приемлемые соли любого из них. В настоящем изобретении также предложена фармацевтическая композиция, содержащая соединение формулы (I) или его фармацевтически приемлемую соль, как определено выше в данной заявке, вместе с фармацевтически приемлемым адъювантом, разбавителем или носителем. В изобретении также предложен способ получения фармацевтической композиции по изобретению,включающий смешивание соединения формулы (I) или его фармацевтически приемлемой соли, как определено выше в данной заявке, с фармацевтически приемлемым адъювантом, разбавителем или носителем. Также в настоящем изобретении предложено применение соединения формулы (I) или его фармацевтически приемлемой соли, как определено выше в данной заявке, в изготовлении лекарственного средства для применения в лечении острой или хронической боли, ноцицептивной боли или невропатической боли. Также в настоящем изобретении предложено применение соединения формулы (I) или его фармацевтически приемлемой соли, как определено выше в данной заявке, в изготовлении лекарственного средства для применения в лечении остеоартрита, ревматоидного артрита, доброкачественных или злокачественных новообразований, апноэ, внезапной детской смерти (SID), атеросклероза, рака, аневризмы,гипертермии, миозита, болезни Альцгеймера или артрита. В настоящем изобретении также предложено применение соединения формулы (I) или его фармацевтически приемлемой соли, как определено выше в данной заявке, в изготовлении лекарственного средства для применения в лечении или снижении риска развития воспалительного заболевания или состояния. Кроме того, в настоящем изобретении предложен способ лечения или снижения риска развития заболеваний или состояний у человека, при котором модуляция активности микросомальной простагландин-Е-синтазы-1 является благоприятной, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, как определено выше в данной заявке. В настоящем изобретении также предложен способ (а) получения соединения формулы (I) или его фармацевтически приемлемой соли, как определено выше, включающий взаимодействие соединения формулы (II) где L1, L2, G1 и G2 являются такими, как определено в формуле (I), и X представляет собой уходящую группу, такую как галоген; и возможно последующее осуществление одной или более из следующих стадий: превращение полученного соединения в другое соединение по изобретению,образование фармацевтически приемлемой соли соединения. В настоящем изобретении также предложен способ (б) получения соединения формулы (I) или его фармацевтически приемлемой соли, как определено выше, когда L представляет собой прямую связь иG1 и G2, обе, представляют собой ароматические группировки, включающий взаимодействие соединения формулы (IV) где Hal представляет собой атом галогена, и R1, R3, A, m и L1 являются такими, как определено в формуле (I), с нуклеофилом G2-M, где М представляет собой оловоорганическую группу или группу органической бороновой кислоты; и возможно последующее осуществление одной или более из следующих стадий: превращение полученного соединения в другое соединение по изобретению,образование фармацевтически приемлемой соли соединения. В способе (а) реакция может быть удобно осуществлена в органическом растворителе, таком как ацетонитрил, дихлорметан, N,N-диметилформамид, пиридин или N-метилпирролидинон, при температуре, например, в диапазоне от -20 С до точки кипения растворителя. Уходящая группа представляет собой галоген, такой как фтор, хлор, бром или йод, предпочтительно хлор. Если это необходимо или желательно, то может быть добавлено основание. В одном из воплощений растворитель представляет собой пиридин, и анилин подвергают взаимодействию с сульфонилхлоридом при комнатной температуре. В способе (б) реакция может быть удобно осуществлена путем взаимодействия с подходящей арилбороновой кислотой или арилбороновым сложным эфиром. Реакция может быть осуществлена с использованием подходящего палладиевого катализатора, такого как Pd(PPh3)4, Pd(dppf)Cl2, или Pd(OAc)2, илиPd2(dba)3, вместе с подходящим лигандом, таким как P(трет-бутил)3, 2-(дициклогексилфосфино)бифенил или 2-(2',6'-диметоксибифенил)дициклогексилфосфин, или никелевым катализатором, таким как никель на угле или Ni(dppe)Cl2, вместе с цинком и трифенилфосфинтриметансульфонатом натрия. В реакции,которая может быть осуществлена в температурном диапазоне от +20 до +160 С с использованием масляной бани или микроволновой печи, в подходящем растворителе или смеси растворителей, таких как толуол, тетрагидрофуран, этанол, диметоксиэтан/вода, N,N-диметилформамид или диоксан, может быть использовано подходящее основание, такое как алкиламин, например триэтиламин, или карбонат калия,карбонат натрия, карбонат цезия, гидроксид натрия или фторид цезия. Бороновая кислота или сложный эфир бороновой кислоты могут быть образованы in situ путем взаимодействия соответствующего арилгалогенида (например, арилбромида) с алкиллитиевым реагентом, таким как бутиллитий, с образованием промежуточного соединения ариллития, которое затем подвергают взаимодействию с подходящим соединением бора, например триметилборатом, трибутилборатом или триизопропилборатом. Альтернативно, реакция может быть осуществлена путем взаимодействия с подходящим алкином. Реакция может быть осуществлена с использованием подходящего палладиевого катализатора, такого как Pd(PPh3)4, PdCl2(PPh3)2, [PdCl2(CH3CN)2] или Pd(PPh3)2(OAc)2. Реакция может быть осуществлена в присутствии подходящего лиганда, такого как Xphos. Реакция также может быть осуществлена в присутствии подходящего медного катализатора, такого как йодид меди(I). Подходящее основание, такое как триэтиламин, бутиламин, диизопропиламин, N,N-диизопропилэтиламин или карбонат цезия, может быть использовано в реакции, которая может быть осуществлена в температурном диапазоне от +20 до +160 С с использованием масляной бани или микроволновой печи, в подходящем растворителе или смеси растворителей, таких как N,N-диметилформамид, диметилсульфоксид, ацетонитрил, толуол, тетрагидрофуран, диметоксиэтан/вода или диоксан. Конкретные способы получения соединений формулы (I) описаны в разделе "Примеры настоящего описания". Такие способы образуют аспект настоящего изобретения. Необходимые исходные вещества либо имеются в продаже, известны в литературе, либо могут быть получены с использованием известных методик. Конкретные способы получения некоторых ключевых исходных веществ описаны в разделе "Примеры настоящего описания", и такие способы образуют аспект настоящего изобретения.-7 017940 Некоторые промежуточные соединения являются новыми. Такие новые промежуточные соединения образуют другой аспект изобретения. Соединения формулы (I) могут быть превращены в другие соединения формулы (I) с использованием стандартных процедур. Специалисты в данной области примут во внимание, что в способах по настоящему изобретению некоторые функциональные группы, такие как гидроксильные или аминогруппы, могут нуждаться в защите защитными группами. Таким образом, получение соединений формулы (I) может включать, на соответствующей стадии, добавление и/или удаление одной или более защитных групп. Защита и снятие защиты с функциональных групп описаны в "Protective Groups in OrganicChemistry", изданной J.W.F. McOmie, Plenum Press (1973) и "Protective Groups in Organic Synthesis", 3 е изд., T.W. Greene и P.G.M. Wuts, Wiley-Interscience (1999). Как использовано в данной заявке, фармацевтически приемлемая соль представляет собой соль с фармацевтически приемлемой кислотой или основанием. Фармацевтически приемлемые кислоты включают в себя и неорганические кислоты, такие как соляная, серная, фосфорная, дифосфорная, бромистоводородная или азотная кислота, и органические кислоты, такие как лимонная, фумаровая, малеиновая,яблочная, аскорбиновая, янтарная, винная, бензойная, уксусная, метансульфоновая, этансульфоновая,бензолсульфоновая или паратолуолсульфоновая кислота. Фармацевтически приемлемые основания включают в себя гидроксиды щелочных металлов (например, натрия или калия) и гидроксиды щелочноземельных металлов (например, кальция или магния), и органические основания, такие как алкиламины,аралкиламины и гетероциклические амины. Соединения формулы (I) способны существовать в стереоизомерных формах. Будет понятно, что изобретение охватывает применение всех геометрических и оптических изомеров (включая атропоизомеры) соединений формулы (I) и их смесей, включая рацематы. Применение таутомеров и их смесей также образует аспект настоящего изобретения. Энантиомерно чистые формы являются особенно желательными. Соединения формулы (I) и их фармацевтически приемлемые соли обладают активностью в качестве фармацевтических средств, в частности в качестве селективных ингибиторов фермента микросомальной простагландин-Е-синтазы-1, и поэтому могут быть полезными в лечении или профилактике боли и воспалительных заболеваний и состояний. Более того, посредством селективного ингибирования провоспалительного PGE2, полагают, что соединения по изобретению будут иметь уменьшенный потенциал для побочных эффектов, связанных с ингибированием других простагландинов с помощью традиционных нестероидных противовоспалительных лекарственных средств, таких как желудочно-кишечная и почечная токсичность. Более конкретно соединения формулы (I) и их фармацевтически приемлемые соли могут быть использованы в лечении остеоартрита, ревматоидного артрита, острой или хронической боли, невропатической боли, апноэ/SID (внезапной детской смерти), заживления ран, рака, доброкачественных или злокачественных новообразований, инсульта, атеросклероза и болезни Альцгеймера. Еще более конкретно соединения формулы (I) и их фармацевтически приемлемые соли могут быть использованы в лечении остеоартрита, ревматоидного артрита, доброкачественных или злокачественных новообразований или острой или хронической боли. Таким образом, в настоящем изобретении предложено соединение формулы (I) или его фармацевтически приемлемая соль, как определено выше в данной заявке, для применения в терапии. В другом аспекте в настоящем изобретении предложено применение соединения формулы (I) или его фармацевтически приемлемой соли, как определено выше в данной заявке, в изготовлении лекарственного средства для применения в терапии. В другом аспекте в настоящем изобретении предложено применение соединения формулы (I) или его фармацевтически приемлемой соли, как определено выше в данной заявке, в изготовлении лекарственного средства для лечения заболеваний или состояний у человека, при которых модуляция активности микросомальной простагландин-Е-синтазы-1 является благоприятной. В другом аспекте в настоящем изобретении предложено применение соединения формулы (I) или его фармацевтически приемлемой соли, как определено выше в данной заявке, в изготовлении лекарственного средства для применения в лечении воспалительного заболевания или состояния. В другом аспекте в настоящем изобретении предложено применение соединения формулы (I) или его фармацевтически приемлемой соли, как определено выше в данной заявке, в изготовлении лекарственного средства для применения в лечении остеоартрита, ревматоидного артрита, острой или хронической боли, невропатической боли, апноэ/SID, заживления ран, рака, доброкачественных или злокачественных новообразований, инсульта, атеросклероза или болезни Альцгеймера. В другом аспекте в настоящем изобретении предложено применение соединения формулы (I) или его фармацевтически приемлемой соли, как определено выше в данной заявке, в изготовлении лекарственного средства для применения в лечении остеоартрита, ревматоидного артрита, доброкачественных или злокачественных новообразований или острой или хронической боли. В другом аспекте в изобретении предложено соединение формулы (I) или его фармацевтически-8 017940 приемлемая соль, как определено выше в данной заявке, для применения в качестве лекарственного средства. В другом аспекте в изобретении предложено соединение формулы (I) или его фармацевтически приемлемая соль, как определено выше в данной заявке, для лечения заболеваний или состояний, при которых модуляция активности микросомальной простагландин-Е-синтазы-1 является благоприятной. В другом аспекте в изобретении предложено соединение формулы (I) или его фармацевтически приемлемая соль, как определено выше в данной заявке, для лечения воспалительного заболевания или состояния. В другом аспекте в изобретении предложено соединение формулы (I) или его фармацевтически приемлемая соль, как определено выше в данной заявке, для лечения остеоартрита, ревматоидного артрита, острой или хронической боли, невропатической боли, апноэ/SID, заживления ран, рака, доброкачественных или злокачественных новообразований, инсульта, атеросклероза или болезни Альцгеймера. В другом аспекте в изобретении предложено соединение формулы (I) или его фармацевтически приемлемая соль, как определено выше в данной заявке, для лечения остеоартрита, ревматоидного артрита, доброкачественных или злокачественных новообразований, апноэ, внезапной детской смерти (SID), атеросклероза, рака, аневризмы, гипертермии, миозита, болезни Альцгеймера или артрита. В другом аспекте в изобретении предложено соединение формулы (I) или его фармацевтически приемлемая соль, как определено выше в данной заявке, для лечения остеоартрита, ревматоидного артрита, доброкачественных или злокачественных новообразований или острой или хронической боли. В контексте настоящего описания термин "терапия" также включает в себя "профилактику", если нет конкретных указаний на иное. Термины "терапевтический" и "терапевтически" следует понимать соответствующим образом. Профилактика, как ожидается, особенно значима для лечения лиц, которые страдали от предыдущего эпизода или, как считается, иным образом имеют повышенный риск развития рассматриваемого заболевания или состояния. Лица с риском развития конкретного заболевания или состояния обычно включают в себя лиц, имеющих семейную историю заболевания или состояния, или лиц, которые были идентифицированы путем генетического тестирования или скрининга как особенно восприимчивые к развитию данного заболевания или состояния. В изобретении также предложен способ лечения или снижения риска развития заболевания или состояния, при котором модуляция активности микросомальной простагландин-Е-синтазы-1 является благоприятной, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, как определено выше в данной заявке. В изобретении также предложен способ лечения или снижения риска, развития воспалительного заболевания или состояния, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, как определено выше в данной заявке. В изобретении также предложен способ лечения или снижения риска развития остеоартрита, ревматоидного артрита, острой или хронической боли, невропатической боли, апноэ/SID, заживления ран, рака, инсульта, атеросклероза или болезни Альцгеймера, включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, как определено выше в данной заявке. В изобретении также предложен способ лечения или снижения риска развития остеоартрита, ревматоидного артрита или острой или хронической боли,включающий введение пациенту, нуждающемуся в этом, терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли, как определено выше в данной заявке. Для вышеупомянутых терапевтических применений вводимая дозировка будет, разумеется, варьироваться в зависимости от используемого соединения, способа введения, желаемого лечения и указанного расстройства. Суточная дозировка соединения по изобретению может находиться в диапазоне от 0,05 до 100 мг/кг. Соединения формулы (I) и их фармацевтически приемлемые соли могут быть использованы сами по себе, но обычно будут вводиться в форме фармацевтической композиции, в которой соединение/соль формулы (I) (активный ингредиент) находится вместе с фармацевтически приемлемым адъювантом, разбавителем или носителем. Традиционные процедуры выбора иполучения подходящих фармацевтических препаратов описаны, например, в "Pharmaceuticals - The Science of Dosage Forms Designs", M.E. Aulton, Churchill Livingstone, 1988. В зависимости от способа введения, фармацевтическая композиция предпочтительно будет содержать от 0,05 до 99 мас.%, более предпочтительно от 0,05 до 80 мас.%, еще более предпочтительно от 0,10 до 70 мас.% и еще более предпочтительно от 0,10 до 50 мас.% активного ингредиента, причем все проценты по массе основаны на общей массе композиции. Фармацевтические композиции можно вводить местно (например, на кожу) в форме, например,кремов, растворов или суспензий; или системно, например, посредством перорального введения в форме таблеток, капсул, сиропов, порошков или гранул; или посредством парентерального введения в форме-9 017940 растворов или суспензий; или посредством подкожного введения; или посредством ректального введения в форме суппозиториев; или трансдермально. Для перорального введения соединение по изобретению может быть смешано с адъювантом или носителем, например лактозой, сахарозой, сорбитом, маннитом; крахмалом, например картофельным крахмалом, кукурузным крахмалом или амилопектином; производным целлюлозы; связующим, например желатином или поливинилпирролидоном; и/или смазывающим агентом, например стеаратом магния,стеаратом кальция, полиэтиленгликолем, воском, парафином и тому подобным, и затем спрессовано в таблетки. Если требуются покрытые таблетки, то ядра, полученные как описано выше, могут быть покрыты концентрированным раствором сахара, который может содержать, например гуммиарабик, желатин, тальк и диоксид титана. Альтернативно, таблетка может быть покрыта подходящим полимером, растворенным в хорошо летучем органическом растворителе. Для получения мягких желатиновых капсул соединение по изобретению может быть смешано, например, с растительным маслом или полиэтиленгликолем. Твердые желатиновые капсулы могут содержать гранулы соединения с использованием любого из вышеупомянутых эксципиентов для таблеток. Также жидкие или полутвердые лекарственные формы соединения по изобретению могут быть помещены в твердые желатиновые капсулы. Жидкие препараты для перорального применения могут находиться в форме сиропов или суспензий, например растворов, содержащих соединение по изобретению, причем балансом являются сахар и смесь этанола, воды, глицерина и пропиленгликоля. Такие жидкие препараты возможно могут содержать красители, ароматизаторы, сахарин и/или карбоксиметилцеллюлозу в качестве загустителя или другие эксципиенты, известные специалистам в данной области. Соединения по изобретению также можно вводить совместно с другими соединениями, используемыми для лечения вышеописанных состояний. Таким образом, изобретение также относится к комбинированным терапиям, где соединение формулы (I) или его фармацевтически приемлемая соль, или фармацевтическая композиция, или препарат,содержащие соединение формулы (I), вводят параллельно, одновременно, последовательно или раздельно с другим фармацевтически активным соединением или соединениями, выбранными из следующих:(1) препараты для лечения невропатической боли, включающие, например, габапентин, лидодерм,прегаблин и их эквиваленты и фармацевтически активные изомер(ы) и метаболит(ы);(2) препараты для лечения ноцицептивной боли, такие как целекоксиб, эторикоксиб, лумиракоксиб,рофекоксиб, валдекоксиб, диклофенак, локсопрофен, напроксен, парацетамол и их эквиваленты и фармацевтически активные изомер(ы) и метаболит(ы);(3) препараты для лечения мигрени, включающие, например, алмотриптан, амантадин, бромокриптин, буталбитал, каберголин, дихлоралфеназон, элетриптан, фроватриптан, лисурид, наратриптан, перголид, прамипексол, ризатриптан, ропинирол, суматриптан, золмитриптан, зомитриптан и их эквиваленты и фармацевтически активные изомер(ы) и метаболит(ы). Такие комбинированные продукты содержат соединения по данному изобретению в диапазоне дозировок, описанном в данной заявке, и другое фармацевтически активное соединение или соединения в пределах одобренных диапазонов дозировок и/или дозировок, описанных в их соответствующих справочных публикациях. Теперь настоящее изобретение также будет объяснено посредством ссылки на следующие иллюстративные примеры. Общие способы Все используемые растворители имели аналитическую чистоту, и для реакций рутинно использовались имеющиеся в продаже безводные растворители. Реакции типично проводили в инертной атмосфере азота или аргона. 1 Н, 19F и 13 С ЯМР спектры регистрировали на ЯМР спектрометре Varian Unity + 400, снабженном 5 мм измерительной головкой ВВО (мультиядерный широкополосный датчик) с Z-градиентами, или на ЯМР-спектрометре Varian Gemini 300, снабженном 5 мм измерительной головкой BBI (инверсный широкополосный датчик), или на ЯМР-спектрометре Bruker Avance 400, снабженном 60 мкл измерительной головкой (двойной инверсный поток) с Z-градиентами, или на ЯМР-спектрометре Varian Mercury Plus 400, снабженном зондом Varian 400 АТВ PFG, или на ЯМР-спектрометре Bruker DPX400, снабженном 4 ядерной измерительной головкой, снабженной Z-градиентами, или на ЯМР-спектрометре Bruker Avance 600, снабженном 5 мм измерительной головкой BBI с Z-градиентами, или на ЯМР-спектрометре Brukerav400, работающем при 400 МГц для 1 Н и при 100 МГц для 13 С, снабженном 3 мм проточноинжекционной измерительной головкой SEI 1H/D-13C с Z-градиентами, с использованием жидкостного манипулятора BEST 215 для инжекции образцов, или на ЯМР-спектрометре Bruker DRX600, работающем при 600 МГц для 1 Н, при 150 МГц для 13 С и при 60 МГц для 15N, снабженном 5 мм измерительной головкой TXI с Z-градиентами, или снабженном 5 мм измерительной головкой ВВО с Z-градиентами,или снабженном 2,5 мм измерительной головкой BBI с Z-градиентами, или на ЯМР-спектрометре Bruker 500 МГц Avance III, работающем при 500 МГц для 1 Н, при 125 МГц для 13 С и при 50 МГц для 15N, снабженном 5 мм измерительной головкой TXI с Z-градиентами или снабженном 5 мм криогенно охлаждае- 10017940 мой измерительной головкой TCI с Z-градиентами. Если иное не указано конкретно в примерах, спектры регистрировали при 400 МГц для протона, при 376 МГц для фтора-19 и при 100 МГц для углерода-13. Использовали следующие эталонные сигналы: средняя линия DMSO-d62,50 (1H),39,51 (13 С); средняя линия CD3OD3,31 (1H) или 49,15 (13 С); CDCl37,26 (1H) и средняя линия CDCl377,16(13 С) (если не указано иное). ЯМР-спектры регистрируются либо из сильного в слабое поле, либо из слабого в сильное поле. Масс-спектры регистрировали на Waters LCMS (жидкостной хромато-массспектрометр), состоящем из Alliance 2795 (LC, жидкостной хроматограф), Waters PDA 2996 и одноквадрупольного масс-спектрометра ZQ. Масс-спектрометр был снабжен источником ионизации электрораспылением (ESI), работающим в режиме положительных или отрицательных ионов. Капиллярное напряжение составляло 3 кВ, и напряжение на конусе составляло 30 В. Масс-спектрометр сканировал в диапазоне m/z 100-700 с временем сканирования 0,3 с. Разделения осуществляли либо на Waters Х-Terra MS C8(3,5 мкм, 50 или 100 мм 2,1 мм внутр. диам.), либо на АСЕ 3 AQ (100 мм 2,1 мм внутр. диам.), полученных от ScantecLab. Скорости потока регулировали до 1,0 или 0,3 мл/мин соответственно. Температуру колонки устанавливали на уровне 40 С. Использовали линейный градиент с использованием системы нейтральной или кислотной подвижной фазы, начиная с 100% А (А: 95:5 10 мМ NH4OAc:MeCN, или 95:5 8 мМ HCOOH:MeCN), заканчивая при 100% В (MeCN). Альтернативно, масс-спектры регистрировали на Waters LCMS, состоящем из модуля разделенийAlliance 2690, детектора абсорбции Waters 2487 Dual 1 (220 и 254 нм) и одноквадрупольного массспектрометра Waters ZQ. Масс-спектрометр был снабжен источником ионизации электрораспылением(ESI), работающим в режиме положительных или отрицательных ионов. Капиллярное напряжение составляло 3 кВ, и напряжение на конусе составляло 30 В. Масс-спектрометр сканировал в диапазоне m/z 97-800 с временем сканирования 0,3 или 0,8 с. Разделения осуществляли на Chromolith Performance RP18e (1004,6 мм). Использовали линейный градиент, начиная с 95% А (А: 0,1% НСООН (водн., заканчивая при 100% В (MeCN) через 5 мин. Скорость потока: 2,0 мл/мин. Альтернативно, LC-MS анализы осуществляли на LC-MS системе, состоящей из Waters 5 Alliance 2795 HPLC, детектора на диодной матрице Waters PDA 2996, детектора Sedex 85 ELS (испарительный детектор светорассеяния) и одноквадрупольного масс-спектрометра ZQ. Масс-спектрометр был снабжен источником ионизации электрораспылением (ES), работающим в режиме положительных или отрицательных ионов. Капиллярное напряжение составляло 3,3 кВ, и напряжение на конусе составляло 28 В соответственно. Масс-спектрометр сканировал в диапазоне m/z 100-800 с временем сканирования 0,3 с. Детектор на диодной матрице 10 сканировал в диапазоне 200-400 нм. Температуру ELS детектора доводили до 40 С и давление устанавливали на уровне 1,9 бар (19 кПа). Разделение осуществляли на Gemini С 18, 3,0 мм 50 мм, 3 мкм (Phenomenex), эксплуатируемой при скорости потока 1 мл/мин. Использовали линейный градиент, начиная с 100% А (А: 10 мМ NH4OAc в 5% CH3CN), заканчивая при 100% В (В:CH3CN) через 4,0 мин, после чего пропускали 100% В до достижения 5,5 мин. Температура колоночной печи составляла 15, доводили до 40 С. Альтернативно, LC-MS анализы осуществляли на LC-MS, состоящем из системы управления образцами Waters 2777C, бинарного насоса Waters 1525 , колоночной печи Waters 1500, одноквадрупольного масс-спектрометра Waters ZQ, детектора на диодной матрице Waters PDA2996 и детектора Sedex 85ELS. Масс-спектрометр конфигурировали с источником химической ионизации при атмосферном давлении 20 (APCI), который также был снабжен устройством фотоионизации при атмосферном давлении(APPI). Масс-спектрометр сканировал в положительном режиме, переключаясь между режимами APCI иAPPI. Масс-диапазон устанавливали на m/z 100-800 с использованием времени сканирования 0,1 с. Отражатель APPI и корону APCI устанавливали на уровень 0,58 кВ и 0,70 мкА соответственно. Кроме того,температура десольватации (350 С), десольватационный газ 25 (450 л/ч) и газ на конусе (0 л/ч) были постоянными и для режима APCI, и для режима APPI. Разделение осуществляли с использованием колонкиGemini С 18, 3,0 мм 50 мм, 3 мкм (Phenomenex) и эксплуатировали при скорости потока 0,8 мл/мин. Использовали линейный градиент, начиная с 100% А (А: 10 мМ NH4OAc в 5% МеОН) и заканчивая при 100% В (МеОН) через 4,0 мин, после чего пропускали 100% В до достижения 5,5 мин. Температура колоночной печи составляла 55 С. Микроволновое облучение осуществляли в Creator, Initiator или Smith Synthesizer. Одномодовый микроволновой резонатор производил непрерывное излучение при 2450 МГц.HPLC анализы осуществляли на системе Agilent HP 1000, состоящей из микровакуумного дегазатора G1379A, бинарного насоса G1312A, автодозатора луночного планшета G1367A, термостатируемой колоночной камеры G1316A и детектора на диодной матрице G1315B. Колонка: X-Terra MS, Waters, 3,0100 мм, 3,5 мкм. Температуру колонки устанавливали на уровне 40 С и скорость потока на 1,0 мл/мин. Детектор на диодной матрице сканировал в диапазоне 210-300 нм, ширину шага и пика устанавливали на уровне 2 нм и 0,05 мин соответственно. Использовали линейный градиент, начиная с 100% А (А: 95:5 10 мМ NH40Ac:MeCN) и заканчивая при 100% В (B:MeCN) через 4 мин. Альтернативно, HPLC анализы осуществляли на Gynkotek P580 HPG, состоящем из градиентного насоса с Gynkotek UVD 170S УФ-виз.-детектором, снабженным колонкой Chromolith Performance RP(C18, 100 мм 4,6 мм). Температуру колонки устанавливали на уровне 25 С. Использовали линейный градиент с использованием MeCN/0,1 трифторуксусной кислоты в воде MilliQ, прогоняя с 10 до 100%MeCN через 5 мин. Скорость потока: 3 мл/мин. Тонкослойную хроматографию (TLC) осуществляли на TLC-пластинах Merck (силикагель 60 F254) и пятна визуализировали с помощью УФ. Колоночную хроматографию осуществляли на Combi FlashMerck 60 (0,040-0,063 мм). Типичные растворители, используемые для колоночной хроматографии,представляли собой смеси хлороформ/метанол, дихлорметан/метанол, гептан/этилацетат, хлороформ/метанол/аммиак (водн.) и дихлорметан/метанол/NH3 (водн.). SCX ионообменные колонки осуществляли на колонках Isolute. Хроматографию через ионообменные колонки типично осуществляли в растворителях, таких как метанол. Препаративную хроматографию осуществляли на HPLC с автоматизированной очисткой на Waters с детектором на диодной матрице. Колонка: XTerra MS C8, 19300 мм, 10 мкм. Использовали узкие градиенты с MeCN/(95:5 0,1 М NH4OAc:MeCN) при скорости потока 20 мл/мин. Альтернативно, очистки достигали на полупрепаративной HPLC Shimadzu LC-8A с Shimadzu SPD-10AUV-виз.-детектором, снабженным колонкой Waters Symmetry (C18, 5 мкм, 10019 мм). Узкие градиенты с MeCN/0,1% трифторуксусная кислота в воде MilliQ использовали при скорости потока 10 мл/мин. Альтернативно, препаративную хроматографию осуществляли на системе Waters FractionLynx с автодозатором, объединенным с автоматизированным коллектором франций (Waters 2767), градиентным насосом (Waters 2525), колоночным переключателем (Waters CFO) и PDA (фотодиодная матрица) (Waters 2996). Колонка: XTerra Prep MS C8 10 мкм OBD 19300 мм, с предохранительной колонкой;XTerra Prep MS С 8 10 мкм 1910 мм картридж. Для LC-разделения использовали градиент от 100% А(95% 0,1 М NH4OAc в воде MilliQ и 5% MeCN) до 100% В (100% MeCN) при скорости потока 20 мл/мин.PDA сканировали в диапазоне 210-350 нм. УФ запуск определял сбор фракций. Альтернативно, препаративную хроматографию осуществляли на системе Waters FractionLynx с автодозатором, объединенным с автоматизированным коллектором фракций (Waters 2767), градиентным насосом (Waters 2425), подпиточным насосом (Waters 515), пассивным делителем Waters, колоночным переключателем (Waters SFO), PDA (Waters 2996) и масс-спектрометром Waters ZQ. Колонка: XBridgePrep C8 5 мкм OBD 19250 мм, с предохранительной колонкой; картридж XTerra Prep MS C8 10 мкм 1910 мм. Для LC-разделения использовали градиент от 100% А (95% 0,1 М NH4OAc в воде MilliQ и 5% MeCN) до 100% В (100% MeCN) при скорости потока 20 мл/мин. PDA сканировали в диапазоне 210350 нм. ZQ масс-спектрометр эксплуатировали с ESI в положительном или отрицательном режиме. Капиллярное напряжение составляло 3 кВ, и напряжение на конусе составляло 30 В. Смешанный запуск,УФ и МС сигнал, определял сбор фракций.H-cube (http://thalesnano.com/H-Cube) представляет собой систему гидрогенизации в условиях постоянного потока (используемые типичные установки представляли собой "полный водород", поток 1 мл/мин, этилацетат/метанол 1:1 в качестве элюента, 50 С). Присвоение названий осуществляли с использованием CambridgeSoft MedChem ELN v2.1, ChemDraw Ultra 7.0 или ACDName Аббревиатуры- 12017940 Полученное вещество очищали с помощью препаративной HPLC (колонка XTerra MS C8, ацетонитрил/аммоний-ацетатный буфер) с получением указанного в заголовке соединения (12 мг, 28%) в виде белого твердого вещества. Также получали соединение из примера 2. 1 Н ЯМР (400 МГц, CD3OD)м.д. 7.94 (dd, 1H), 7.75-7.82 (m, 3H), 7.53-7.60 (m, 2 Н), 7.49 (d, 1H),7.29 (d, 2 Н), 7.18-7.29 (m, 3 Н), 7.13 (s, 1H), 3.50-3.58 (m, 2 Н), 3.09-3.17 (m, 2 Н); Указанное в заголовке соединение получали из синтеза из примера 1 в виде белого твердого вещества (12 мг, 28%). 1 Н ЯМР (400 МГц, CD3OD)м.д. 7.93 (dd, 1 Н), 7.76 (dd, 1H), 7.55 (td, 1H), 7.28 (d, 2 Н), 7.24 (t, 1 Н),7.14-7.20 (m, 3 Н), 7.11 (t, 1H), 6.84 (t, 1H), 6.77 (d, 1H), 5.68 (dd, 1H), 3.60 (dd, 1H), 3.46-3.53 (m, 2 Н), 3.033.12 (m, 3 Н);CH2Cl2 (10 мл) при 0 С. Затем ледяную баню удаляли и добавляли (Е)-2-(4-бензофуран-2 илфенил)этенсульфоновую кислоту (0,38 г, 1,18 ммоль) и полученную смесь перемешивали в течение 6 ч при КТ. Добавляли каталитическое количество тетрабутиламмония йодида и реакционную смесь перемешивали в течение еще 12 ч. Затем смесь фильтровали, фильтрат концентрировали в вакууме и продукт очищали с помощью колоночной хроматографии, элюируя смесью 20% EtOAc/гексаны, с получением продукта в виде желтого твердого вещества (0,27 г, 73%). 1 Н ЯМР (400 МГц, CDCl3)м.д. 7.95-8.01 (m, 2H), 7.78 (d, 1H), 7.63-7.70 (m, 3 Н), 7.56-7.59 (m, 1H),7.37 (ddd, 1H), 7.30 (d, 1 Н), 7.27-7.30 (m, 1 Н), 7.21 (d, 1H).b) (Е)-2-(4-Бензофуран-2-илфенил)этенсульфоновая кислота. 1-Бром-4-[(Е)-2-этоксисульфонилэтенил]бензол (1,0 г, 3,4 ммоль) и бензофуран-2-бороновую кислоту (0,61 г, 3,7 ммоль) растворяли в DMF (20 мл). Добавляли карбонат натрия (2 М, 10 мл) и тетракис(трифенилфосфин)палладий(0) (200 мг, 0,17 ммоль) и полученную смесь перемешивали в атмосфере аргона при 90 С в течение 12 ч. К смеси добавляли воду и полученный осадок собирали, промывали водой и сушили с получением продукта в виде натриевой соли, которую использовали на следующей стадии без дополнительной очистки (0,38 г, 35%). 1 Н ЯМР (400 МГц, DMSO-d6)м.д. 7.89 (d, 2H), 7.59-7.69 (m, 4H), 7.48 (s, 1H), 7.33 (td, 1H), 7.27 (td,1H), 6.95 (s, 2H);c) 1-Бром-4-[(Е)-2-этоксисульфонилэтенил]бензол. н-Бутиллитий (59,0 мл, 1,6 М раствор в гексане) добавляли по каплям в течение 25 мин к раствору этилметансульфоната (9,1 мл, 86 ммоль) в THF (200 мл) при -78 С. Реакционную смесь перемешивали в течение 15 мин, затем добавляли по каплям диэтилхлорфосфат (7,2 мл, 50 ммоль). Раствор перемешивали при -78 С в течение 30 мин, оставляли нагреваться до 0 С и затем снова охлаждали до -78 С. Затем по- 13017940 каплям в течение 15 мин добавляли 4-бромбензальдегид (9,2 г, 50 ммоль) в THF (50 мл) и полученную смесь затем оставляли медленно достигать КТ и перемешивали в течение ночи. К смеси добавляли воду(20 мл) и реакционную смесь концентрировали в вакууме. Остаток экстрагировали диэтиловым эфиром и объединенные органические экстракты промывали водным насыщенным хлоридом натрия, сушили над сульфатом магния, фильтровали и растворитель выпаривали в вакууме. В результате очистки с помощью колоночной хроматографии с использованием смеси 15% этилацетат/гексаны в качестве элюента получали указанное в заголовке соединение (9,3 г, 64%). 1 Н ЯМР (600 МГц, CDCl3)м.д. 7.58 (d, 2H), 7.55 (d, 1H), 7.39 (d, 2H), 6.75 (d, 1H), 4.25 (q, 2H), 1.42 Соединение синтезировали с использованием процедуры, аналогичной описанной для примера 3, с получением 23 мг, 44%. 1 Н ЯМР (400 МГц, CD3OD)м.д. 7.91 (d, 2 Н), 7.76 (dd, 1H), 7.58-7.66 (m, 4H), 7.52 (d, 1H), 7.48 (d,1H), 7.27-7.36 (m, 3 Н), 7.24 (t, 1H), 7.16 (d, 1H); Соединение синтезировали с использованием процедуры, аналогичной описанной для примера 3, с получением 31 мг, 16%. 1 Н ЯМР (400 МГц, CD3OD)м.д. 7.88-7.96 (m, 3H), 7.67 (d, 2H), 7.62 (d, 1H), 7.61 (d, 1H), 7.53 (d,1H), 7.48 (dd, 1H), 7.29-7.34 (m, 2 Н), 7.21-7.27 (m, 1H), 7.21 (d, 1H), 6.88-6.99 (m, 1H); Соединение синтезировали с использованием процедуры, аналогичной описанной для примера 3, с получением 39 мг, 19%. 1 Н ЯМР (400 МГц, CD3OD)м.д. 7.92 (d, 2H), 7.67 (d, 2H), 7.62 (d, 1H), 7.60 (d, 1H), 7.49-7.56 (m,3H), 7.32 (td, 1H), 7.29 (s, 1H), 7.24 (td, 1H), 7.15 (d, 1H), 6.94-7.04 (m, 1 Н); 2-(E)-1-(4-Хлорфенил)проп-1-ен-2-ил]сульфониламино]бензолсульфонамид (100 мг, 0,26 ммоль) растворяли в этилацетате (3 мл) и помещали в H-cube (1 мл/мин, полный водород, 10% Pd/C, 3 прогона). Полученное вещество очищали с помощью препаративной HPLC (колонка XTerra MS C8, ацетонитрил/аммоний-ацетатный буфер) с получением указанного в заголовке соединения (38 мг, 38%). Также- 14017940 получали соединение из примера 8. 1 Н ЯМР (400 МГц, CD3OD)м.д. 7.94 (dd, 1H), 7.83 (dd, 1H), 7.56 (ddd, 1H), 7.19-7.30 (m, 3H), 7.14 Указанное в заголовке соединение (12 мг, 12%) получали из синтеза примера 7. Н ЯМР (400 МГц, CD3OD)м.д. 7.94 (dd, 1H), 7.84 (dd, 1H), 7.55 (ddd, 1H), 7.16-7.30 (m, 4 Н), 7.13 2-Аминобензолсульфонамид (61 мг, 0,35 ммоль) растворяли в пиридине (2 мл) и добавляли (Е)-2-(4 бензофуран-2-илфенил)этенсульфонилхлорид (70 мг, 0,22 ммоль) и реакционную смесь перемешивали в течение 2 ч. Растворитель удаляли в вакууме и остаток очищали с помощью препаративной HPLC (колонка XTerra MS C8, ацетонитрил/аммоний-ацетатный буфер) с получением указанного в заголовке соединения (46 мг, 46%). 1 Н ЯМР (400 МГц, DMSO-d6)м.д. 9.14 (s, 1H), 7.88 (s, 2H), 7.85 (d, 1H), 7.54-7.63 (m, 3 Н), 7.49 (s,4 Н), 7.21-7.31 (m, 1H), 2.13 (d, 3H);a) (Е)-1-(4-Хлорфенил)проп-1-ен-2-сульфонилхлорид. Тетрабутиламмония йодид (7,0 г, 19,0 ммоль) добавляли к раствору 1-хлор-4-[(Е)-2-этоксисульфонилпроп-1-енил]бензола (4.5 г, 17,3 ммоль) в ацетоне (40 мл) при КТ. Смесь нагревали до температуры дефлегмации и перемешивали в течение ночи, затем охлаждали до КТ и концентрировали в вакууме. Остаток растворяли в DCM, затем промывали водой, сушили над сульфатом магния, фильтровали и концентрировали в вакууме с получением указанного в заголовке соединения в виде тетрабутиламмониевой соли, которую использовали на следующей стадии без дополнительной очистки. Сульфурилхлорид (3,1 мл, 38,0 ммоль) добавляли к раствору трифенилфосфина (9,73 г, 37,2 ммоль) в DCM (100 мл) при 0 С. Затем водяную баню удаляли и реакционную смесь перемешивали в течение 15 мин. Неочищенную соль (Е)-1-(4-хлорфенил)проп-1-ен-2-сульфоновой кислоты (17,3 ммоль) растворяли в DCM (40 мл), затем добавляли в течение 15 мин и полученную смесь перемешивали в течение 2 ч при КТ. Реакционную смесь концентрировали в вакууме и продукт очищали с помощью колоночной хроматографии с использованием смеси 10% EtOAc/гексаны в качестве элюента с получением продукта (3,3 г, 77%) в виде желтого твердого вещества. 1b) 1-Хлор-4-[(Е)-2-этоксисульфонилпроп-1-енил]бензол. н-Бутиллитий (35,0 мл, 1,6 М раствор в гексанах) добавляли по каплям течение 25 мин к раствору этилэтансульфоната (6,9 г, 50 ммоль) (Synth. Comm. 1985, 15, 1057) в THF (100 мл) при -78 С. Реакционную смесь перемешивали в течение 15 мин, затем добавляли по каплям диэтилхлорфосфат (4,35 мл, 30 ммоль). Раствор перемешивали при -78 С в течение 30 мин, оставляли нагреваться до 0 С и затем снова охлаждали до -78 С. Затем добавляли по каплям в течение 15 мин 4-хлорбензальдегид (4,2 г, 30 ммоль) вTHF (30 мл) и полученную смесь перемешивали в течение 1 ч при -78 С и затем позволяли медленно достичь КТ. К смеси добавляли воду (10 мл) и смесь концентрировали в вакууме. Остаток экстрагировали диэтиловым эфиром и объединенные органические экстракты промывали водным насыщенным хлоридом натрия, сушили над сульфатом магния, фильтровали и растворитель выпаривали в вакууме. В результате очистки с помощью колоночной хроматографии с использованием градиента от 10% этилацетат/гексаны до 15% этилацетат/гексаны в качестве элюента получали указанное в заголовке соединение 2-(Е)-1-(4-Хлорфенил)проп-1-ен-2-ил]сульфониламино]-4-фторбензолсульфонамид (60 мг, 0,15 ммоль) растворяли в этилацетате (3 мл) и смесь подвергали восстановлению с использованием аппаратаH-cube. Реакционную смесь элюировали через картридж Pd/C (10%), используя полный водород (1 атм) при 1 мл/мин. Смесь снова помещали в H-cube, используя такие же условия. Неочищенный продукт очищали с помощью препаративной HPLC (колонка XTerra MS С 8, ацетонитрил/аммоний-ацетатный буфер) с получением указанного в заголовке соединения (25 мг, 38%). 1 Н ЯМР (400 МГц, CD3OD)м.д. 7.87 (dd, 1H), 7.52 (dd, 1H), 7.26 (d, 2H), 7.17 (dd, 2H), 6.74 (ddd,1H), 3.37-3.48 (m, 2H), 2.70 (dd, 1H), 1.22 (d, 3 Н); Соединение синтезировали с использованием процедуры, аналогичной описанной для примера 9, с получением 78 мг, 55%. 1 Н ЯМР (400 МГц, CD3OD)м.д. 7.95 (dd, 1H), 7.63 (s, 1H), 7.35-7.49 (m, 5H), 6.97 (t, 1H), 2.19 (d,3 Н); Соединение синтезировали с использованием процедуры, аналогичной описанной для примера 9, с получением 35 мг, 71%. 1 Соединение синтезировали с использованием процедуры, аналогичной описанной для примера 9, с получением 33 мг, 69%. 1 Н ЯМР (400 МГц, CD3OD)м.д. 7.56 (br s, 1H), 7.47-7.54 (m, 2 Н), 7.38-7.44 (m, 2 Н), 7.31-7.37 (m,2 Н), 6.95-7.04 (m, 1H), 2.18 (d, 3 Н); Соединение синтезировали с использованием процедуры, аналогичной описанной для примера 9, с получением 10 мг, 20%. 1 Соединение синтезировали с использованием процедуры, аналогичной описанной для примера 9, с получением 35 мг, 73%. 1 2-(Е)-2-[4-(2-Фурил)фенил]этенил]сульфониламино]бензолсульфонамид (пример 18) (140 мг, 0,35 ммоль) растворяли в этилацетате (1,5 мл) и метаноле (1,5 мл) и смесь подвергали восстановлению с использованием аппарата H-cube. Реакционную смесь элюировали через картридж Pd/C (10%), используя полный водород (1 атм) при 0,5 мл/мин. Растворитель затем удаляли и неочищенный материал очищали на полупрепаративной HPLC с использованием колонки Х-Terra с получением указанного в заголовке соединения (18 мг, 13%) в виде белого твердого вещества. Также получали соединение из примера 17. 1 Н ЯМР (400 МГц, CD3OD)м.д. 7.95 (dd, 1H), 7.78 (dd, 1H), 7.53-7.61 (m, 3 Н), 7.51 (dd, 1H), 7.27 (t,1H), 7.20 (d, 2 Н), 6.69 (d, 1H), 6.48 (dd, 1 Н), 3.46-3.56 (m, 2 Н), 3.03-3.12 (m, 2 Н); Указанное в заголовке соединение получали из синтеза примера 17 в виде белого твердого вещества 2-Аминобензолсульфонамид (61 мг, 0,35 ммоль) растворяли в пиридине (2,5 мл) и добавляли (Е)-2[4-(2-фурил)фенил]этенсульфонилхлорид) (см. общую процедуру синтеза стиролилсульфонилхлоридов)(95 мг, 0,35 ммоль). Реакционную смесь перемешивали при КТ в течение ночи. Растворитель удаляли,остаток распределяли между водой и этилацетатом, подкисляли (HCl) и смесь дважды экстрагировали этилацетатом. Объединенные органические фазы промывали водой, обрабатывали рассолом, сушилиMS m/z M-H 403, М+Н 405; Rf 3,12 мин (система: колонка Gemini 3 мкм С 18, 503,0 мм, 10 мМ ацетат аммония с 5% ацетонитрил/ацетонитрил 0-100% в течение 6 мин, 1 мл/мин). Пример 19. 2-[2-[4-(Дифторметокси)фенил]этилсульфониламино]бензолсульфонамид Указанное в заголовке соединение (57 мг, 42%) синтезировали способом, аналогичным описанному для получения примера 16. 1 Указанное в заголовке соединение (135 мг, 94%) синтезировали способом, аналогичным описанному для получения примера 18.MS m/z M-H 403, М+Н 405; Rf 3,12 мин (система: колонка Gemini 3 мкм С 18, 503,0 мм, 10 мМ ацетат аммония с 5% ацетонитрил/ацетонитрил 0-100% в течение 6 мин, 1 мл/мин). Пример 21. 2-[2-(4-Хлорфенил)этилсульфониламино]-5-фторбензолсульфонамид Указанное в заголовке соединение (74 мг, 36%) синтезировали способом, аналогичным описанному для получения примера 16. 1 Указанное в заголовке соединение (210 мг, 90%) синтезировали способом, аналогичным описанному для получения примера 18. 1 Н ЯМР (400 МГц, CD3CN-d3)м.д. 7.66 (dd, 1 Н), 7.58 (dd, 1H), 7.51-7.55 (m, 2 Н), 7.51 (d, 1 Н), 7.407.44 (m, 2 Н), 7.31 (ddd, 1H), 7.04 (d, 1H);ESMS: m/z [M-1] 389,0. Общая процедура для примеров 23-43. Исходные растворы: анилины (800 мкмоль) растворяли в пиридине (2 мл); сульфонилхлориды (полученные согласно общей процедуре синтеза стиролилсульфонилхлоридов)(1,2 ммоль) растворяли в пиридине (6 мл). Реакция: (24 реакции). Исходный раствор анилинов (500 мкл, 200 ммоль) смешивали с исходными растворами сульфонилхлоридов (1,0 мл, 200 мкл) в 24 лунках и реакционную смесь помещали в шейкер на ночь. Растворитель удаляли (центрифуга) и осуществляли препаративную хроматографию на системе Waters FractionLynx с автодозатором, объединенным с автоматизированным коллектором фракций (Waters 2767), градиентным насосом (Waters 2525), регенерационным насосом (Waters 600), подпитывающим насосом (Waters 515),активным делителем Waters, колоночным переключателем (Waters CFO), PDA (Waters 2996) и массспектрометром Waters ZQ. Колонка: XBridge Prep C85 мкм OBD 19100 мм, с предохранительной колонкой; картридж XTerraPrep MS C8 10 мкм 1910 мм. Для LC-разделения использовали градиент от 100% А (95% 0,1 М NH4OAc в воде MilliQ и 5% MeCN) до 100% В (100% MeCN) при скорости потока 25 мл/мин. PDA сканировали в диапазоне 210-350 нм. ZQ масс-спектрометр эксплуатировали с ESI в положительном режиме. Капиллярное напряжение составляло 3 кВ, и напряжение на конусе составляло 30 В. Смешанный запуск, УФ и МС сигнал, определял сбор фракций. Анализ чистоты осуществляли на системе Water Acquity с PDA (Waters 2996) и масс-спектрометромWaters ZQ. Колонка: Acquity UPLC ВЕН C8 1,7 мкм 2,150 мм. Температуру колонки устанавливали на уровне 65 С. Для LC-разделения использовали линейный градиент 2 мин 15 с от 100% А (А: 95% 0,01 М NH4OAc в воде MilliQ и 5% MeCN) до 100% В (5% 0,01 М NH4OAc в воде MilliQ и 95% MeCN) при скорости потока 1,0 мл/мин. PDA сканировали в диапазоне 210-350 нм и 254 нм экстрагировали для определения чистоты. Масс-спектрометр ZQ эксплуатировали с ESI в режиме переключения пол./отр. Капиллярное напряжение составляло 3 кВ, и напряжение на конусе составляло 30 В. Пример 23. 2-(Е)-2-(3,4-Дихлорфенил)этенил]сульфониламино]-4-фторбензолсульфонамид К раствору 4-[2-(4-хлорфенил)этансульфониламино]-3-сульфамоилбензойной кислоты (190 мг, 0,45 ммоль) в сухом THF (15 мл) добавляли LiAlH4 (1M в THF, 2 мл, 2 ммоль). Реакционную смесь нагревали при 45 С в течение ночи, затем охлаждали до 0 С и гасили путем добавления воды, затем добавляли 1 н.HCl. Продукт экстрагировали этилацетатом, объединенные органические фазы промывали водой и рассолом и сушили над сульфатом натрия. Летучие вещества удаляли при пониженном давлении и неочищенный продукт очищали с помощью препаративной HPLC с получением указанного в заголовке соединения в виде белого твердого вещества (51 мг, 28%). 1 Н ЯМР (400 МГц, ацетон-d6):м.д. 8.78 (br. s., 1H), 7.97 (d, 1H), 7.75 (d, 1H), 7.58 (dd, 1H), 7.217.35 (m, 4 Н), 7.15 (br. s., 2 Н), 4.66 (s, 2 Н), 3.49-3.66 (m, 2 Н), 3.03-3.16 (m, 2 Н);ESMS: m/z [М-1] 402,93 и 404,82 (изотопы Cl). а) 4-[2-(4-Хлорфенил)этансульфониламино]-3-сульфамоилбензойная кислота. Смесь 2-[2-(4-хлорфенил)этансульфониламино]-5-метилбензолсульфонамида (пример 45) (2,0 г,5,14 ммоль), 2,5 н. NaOH (27 мл, 6,75 ммоль), воды (100 мл) и KMnO4 (3,35 г, 21,19 ммоль) перемешивали при 50 С в течение ночи. Затем реакционную смесь фильтровали через целит и фильтрат подкисляли,используя 2 н. HCl. Продукт экстрагировали этилацетатом и органическую фазу концентрировали при пониженном давлении. Неочищенный продукт очищали с помощью флэш-колоночной хроматографии с использованием градиента от 5 до 10% МеОН в DCM с получением указанного в заголовке соединения Смесь 2-амино-5-метилбензолсульфонамида (5,0 г, 26.84 ммоль), 2-(4-хлорфенил)этансульфонилхлорида (8,0 г, 33,56 ммоль) и пиридина (100 мл) перемешивали при КТ в течение ночи. Реакционную смесь концентрировали при пониженном давлении и остаток распределяли между этилацетатом и 1 н.HCl. Органическую фазу концентрировали в вакууме и неочищенный продукт очищали с помощью флэш-колоночной хроматографии с получением указанного в заголовке соединения (8,0 г, 51%). 1 Н ЯМР (400 МГц, CDCl3):м.д. 8.13 (br. s, 1H), 7.79 (br. s, 1H), 7.56-7.44 (m, 1H), 7.40 (d, 1 Н), 7.327.19 (m, 3 Н), 7.15 (d, 2 Н), 5.26 (br., s, 2 Н), 3.56-3.43 (m, 2 Н), 3.19 (dd, 2H), 2-40 (br, s, 3 Н);a) 2-Амино-5-метилбензолсульфонамид. Смесь 7-метил-1,1-диоксо-1,4-дигидро-2-Н-бензо[1,2,4]тиадиазин-3-она (7,20 г, 36,6 ммоль) в водной H2SO4 (50% об./об., 200 мл) нагревали при 105 С в течение 16 ч. Затем прозрачный раствор охлаждали до 0 С и нейтрализовали с использованием 5 н. NaOH. Продукт экстрагировали этилацетатом. Объединенные экстракты промывали водой и концентрировали при пониженном давлении. Неочищенный-5 С. Суспензию перемешивали при -5 С в течение еще 15 мин и порциями добавляли AlCl3 (17,00 г,129,00 ммоль). Затем реакционную смесь нагревали при 105 С в течение 30 мин. Горячий раствор выливали на лед (1 л) и полученный осадок отфильтровывали и промывали водой (300 мл). Затем твердое вещество растворяли в горячем водном растворе бикарбоната натрия (10 г/200 мл), обрабатывали древесным углем и фильтровали. Охлажденный раствор нейтрализовали с использованием 6 н. HCl и полученный белый осадок отфильтровывали, промывали водой и сушили с получением указанного в заголовке соединения (14 г, 64%). 1 К раствору NaH (57%, 56 мг, 1,33 ммоль) в сухом DMSO (10 мл) добавляли N-Boc-2-[2-(4 хлорфенил)этансульфониламино]-5-гидроксибензолсульфонамид (пример 46b) (220 мг, 0,44 ммоль). Реакционную смесь перемешивали при КТ в течение 2 ч (раствор становился коричневым). Затем добавляли толуол-4-сульфоновой кислоты пиридин-2-илметиловый эфир (141 мг, 0,53 ммоль) и перемешивание продолжали в течение 4 ч при КТ. Реакционную смесь гасили путем добавления насыщенного NH4Cl и продукт экстрагировали EtOAc (330 мл). Объединенные экстракты сушили над безводным MgSO4 и концентрировали в вакууме с получением желтого масла (182 мг), которое затем растворяли в DCM (2 мл). Полученный раствор охлаждали до 0 С, добавляли TFA (1 мл) и реакционную смесь оставляли нагреваться до КТ в течение 3 ч. Летучие вещества удаляли при пониженном давлении и остаток очищали с помощью препаративной HPLC с получением указанного в заголовке соединения в виде белого твердого вещества (TFA соль, 90 мг, 60%). 1 Н ЯМР (400 МГц, CD3OD):м.д. 8.63 (d, 1H), 8.09 (t, 1H), 7.76 (d, 1H) 7.70 (d, 1H), 7.63 (d, 1H),7.57 (t, 1H), 7.29 (m, 1H), 7.24 (d, 2H), 7.18 (d, 2H), 5.30 (s, 2H), 3.47 (m, 2 Н), 3.05 (т, 2 Н); 19ESMS: m/z [M1] 481,89. а) Пиридин-2-илметиловый эфир толуол-4-сульфоновой кислоты. Порошковый KOH (1,74 г, 30,65 ммоль) добавляли к энергично перемешиваемому раствору пиридин-2-ил-метанола (2 мл, 20,72 ммоль) в THF (100 мл) при 0 С. Реакционную смесь перемешивали в течение 15 мин и затем добавляли тозилхлорид (5,13 г, 26,90 ммоль). Реакционную смесь оставляли нагреваться до КТ и перемешивание продолжали в течение ночи. Реакционную смесь гасили насыщеннымNaHCO3 и продукт экстрагировали EtOAc (350 мл). Объединенные экстракты сушили над MgSO4 и концентрировали в вакууме с получением желтого масла. Остаток очищали с помощью флэшколоночной хроматографии с использованием смеси EtOAc:гексан (1:4) с получением указанного в заголовке соединения (4,6 г, 85%) в виде желтоватого твердого вещества. 1 Н ЯМР (400 МГц, CDCl3):м.д. 8.53 (m, 1H), 7.85 (d, 2H), 7.73 (t, 1H), 7.44 (d, 1H), 7.35 (d, 2 Н),7.25 (m, 1H), 5.14 (s, 2H), 2-44 (s, 3 Н);b) N-Вос-2-[2-(4-хлорфенил)этансульфониламино]-5-гидроксибензолсульфонамид. К раствору 2-[2-(4-хлорфенил)этансульфониламино]-5-гидроксибензолсульфонамида (2,50 г, 6,41 ммоль) в DCM (150 мл) при 0 С добавляли Et3N (4.46 мл, 14,07 ммоль), затем добавляли Вос 2 О (3,07 г,14,07 ммоль). Полученную смесь перемешивали в течение 15 мин при 0 С и затем одной порцией добавляли DMAP (0,78 г, 6,41 ммоль) (реакция становилась экзотермической). Реакционную смесь перемешивали при 0 С в течение еще часа, оставляли нагреваться до КТ и перемешивали в течение ночи. Органическую фазу промывали 2 н. HCl (350 мл), водой (330 мл) и сушили над MgSO4. В результате удаления растворителя при пониженном давлении получали 3,5 г (94%) ди-Вос-промежуточного соединения, которое использовали на следующей стадии без очистки. В 1 Н ЯМР спектре наблюдали два синглета при 1,42 и 1,34 м.д., что соответствует группам О-Вос и N-Boc соответственно. К раствору ди-Воспромежуточного соединения (1,20 г, 2,03 ммоль) в EtOH (150 мл) добавляли LiOH (10%-ный водный рас- 24017940 твор, 40 мл) при КТ. Реакционную смесь перемешивали при 55 С в течение 14 ч. Протекание реакции контролировали с помощью 1 Н ЯМР. После завершения реакции не наблюдали синглет при 1,42 м.д. для группы О-Вос. Реакционную смесь концентрировали до приблизительно половины объема и подкисляли путем добавления 5 н. HCl до рН 4-5. Продукт экстрагировали EtOAc (350 мл) и объединенные экстракты сушили над MgSO4 и концентрировали в вакууме. Остаток очищали с помощью колоночной хроматографии, используя 1% MeOH/DCM, с получением продукта в виде желтого твердого вещества (747 мг,75%). 1ESMS: m/z [M-1] 489,25. с) 2-[2-(4-Хлорфенил)этансульфониламино]-5-гидроксибензолсульфонамид. К раствору 2-[2-(4-хлорфенил)этансульфониламино]-5-метоксибензолсульфонамида (4,0 г, 9,90 ммоль) в DCM (250 мл) при -78 С добавляли по каплям BBr3 (1M B DCM, 70 мл, 70 ммоль) в течение 20 мин. Реакционную смесь оставляли нагреваться до КТ и перемешивание продолжали в течение ночи. Затем реакционную смесь охлаждали до -78 С, гасили путем добавления метанола (20 мл) и воды (50 мл) и продукт экстрагировали этилацетатом. Органические экстракты промывали водой, сушили над сульфатом натрия и концентрировали при пониженном давлении. Неочищенный продукт перекристаллизовывали из метанола с получением указанного в заголовке соединения (3,45 г, 92%). 1 Н ЯМР (400 МГц, DMSO-D6):м.д. 10.04 (s, 1H), 8.66 (s, 1H), 7.65 (s, 2 Н), 7.45 (d, 1 Н), 7.35 (m,3 Н), 7.27 (d, 2 Н), 6.99 (dd, 1H), 3.53 (m, 2 Н), 2.97 (m, 2 Н);d) 2-[2-(4-Хлорфенил)этансульфониламино]-5-метоксибензолсульфонамид. К раствору 2-амино-5-метоксибензолсульфонамида (4,0 г, 19.80 ммоль) в пиридине (60 мл) медленно добавляли 2-(4-хлорфенил)этансульфонилхлорид (4,73 г, 19,79 ммоль) при 0 С. Реакционную смесь перемешивали при КТ в течение 16 ч и затем концентрировали при пониженном давлении при 35 С. Затем остаток распределяли между этилацетатом и 1 н. HCl. Органический слой отделяли, сушили над сульфатом натрия и концентрировали в вакууме. Неочищенный продукт очищали с помощью флэшколоночной хроматографии, используя этилацетат/гексан (1:1), с получением указанного в заголовке соединения (7,1 г, 88%). 1 Н ЯМР (400 МГц, CD3OD)м.д. 7.65 (d, 1H), 7.49 (d, 1H), 7.21-7.27 (m, 2H), 7.15-7.19 (m, 2 Н), 7.127.15 (m, 1H), 3.83 (s, 3 Н), 3.42-3.47 (m, 2 Н), 3.02 (dd, 2H). Пример 47. 2-[2-(4-Хлорфенил)этилсульфониламино]-5-[(5-метил-1,3,4-оксадиазол-2-ил)метокси] бензолсульфонамид Следуя общей процедуре, как описано в примере 46, фенолят натрия, полученный из N-Вос-2-[2-(4 хлорфенил)этансульфониламино]-5-гидроксибензолсульфонамида (210 мг, 0,43 ммоль), подвергали взаимодействию с 5-метил-[1,3,4]оксадиазол-2-илметиловым эфиром толуол-4-сульфоновой кислоты с получением 178 мг неочищенного продукта алкилирования. После снятия защиты с сульфонамидной группы неочищенный продукт очищали с помощью препаративной HPLC с получением указанного в заголовке соединения в виде белого твердого вещества (соль TFA, 95 мг, 65%). 1ESMS: m/z [M-1] 484,85. а) 5-Метил-[1,3,4]оксадиазол-2-илметиловый эфир толуол-4-сульфоновой кислоты. Следуя общей процедуре, как описано в примере 46 а, указанное в заголовке соединение получали из имеющегося в продаже 5-метил-[1,3,4]оксадиазол-2-ил)метанола (1,0 г, 80%). 1 Н ЯМР (400 МГц, CD3OD):м.д. 7.80 (d, 2H), 7.41 (d, 2H), 5.30 (s, 2H), 2.50 (s, 3 Н), 2.30 (s, 3 Н);- 25017940 2-Аминобензолсульфонамид (153 мг, 0,89 ммоль) одной порцией добавляли к раствору 2-(2 хлорфенил)этенсульфонилхлорида (150 мг, 0,63 ммоль) в пиридине (2 мл) при КТ. После 30 мин перемешивания исходное вещество больше не определялось с помощью TLC. Реакционную смесь концентрировали при пониженном давлении и остаток растворяли в этилацетате и небольшом количестве метанола. Органическую фазу промывали 1 н. HCl, насыщенным бикарбонатом натрия, сушили над MgSO4 и концентрировали при пониженном давлении. В результате очистки с помощью препаративной TLC получали целевое соединение, которое затем перекристаллизовывали из смеси этилацетат/пентан/диэтиловый эфир с получением указанного в заголовке соединения (85 мг, 36%) в виде белого твердого вещества. 1 2-Аминобензолсульфонамид (194 мг, 1,13 ммоль) одной порцией добавляли к раствору 2-(4-хлор-2 метоксифенил)этенсульфонилхлорида (300 мг, 1,13 ммоль) в пиридине (3 мл) при КТ. После 1 ч перемешивания исходное вещество больше не определялось с помощью TLC. Реакционную смесь концентрировали, и остаток растворяли в этилацетате с небольшим количеством метанола. Органическую фазу промывали 1 н. HCl, насыщенным бикарбонатом натрия, сушили над MgSO4 и концентрировали при пониженном давлении. Неочищенный продукт очищали на силикагеле, используя DCM/метанол, 99:1, с получением вещества, которое дополнительно очищали перекристаллизацией из метанола с получением указанного в заголовке соединения (184 мг, 41%) в виде белого твердого вещества.N, 6,72. а) 2-(4-Хлор-2-метоксифенил)этенсульфонилхлорид. Тионилхлорид (8,1 мл, 111,19 ммоль) добавляли по каплям при 0 С к раствору 2-(4-хлор-2 метоксифенил)этенсульфоновой кислоты (5,53 г, 22,24 ммоль) в DMF (10 мл). Реакционную смесь перемешивали при КТ в течение 3 ч и затем выливали на измельченный лед. К смеси добавляли этилацетат(50 мл). Органическую фазу отделяли, промывали рассолом (320 мл), сушили над MgSO4 и концентрировали при пониженном давлении. Маслянистый остаток очищали на силикагеле, используя гексан/этилацетат, 4:1, с получением целевого соединения, которое затем перекристаллизовывали из смеси пентан/диэтиловый эфир с получением указанного в заголовке соединения (2,30 г, 61% за 3 стадии) в виде белого твердого вещества. 1 Н ЯМР (400 МГц, CDCl3):м.д. 7.78 (d, 1H), 7.52 (d, 1H), 7.38 (d, 1H), 7.04 (dd, 1H), 6.99 (d, 1H),3.97 (s, 3 Н);b) 2-(4-Хлор-2-метоксифенил)этенсульфоновая кислота. Тетрабутиламмония йодид (6,25 г, 16,91 ммоль) добавляли к раствору этилового эфира 2-(4-хлор-2 метоксифенил)этенсульфоновой кислоты (3,90 г, 14,09 ммоль) в ацетоне (300 мл). Реакционную смесь нагревали при температуре дефлегмации в течение ночи, затем охлаждали до КТ и концентрировали при пониженном давлении. Остаток очищали на силикагеле, используя гексан/этилацетат, 1:1, для элюирования примесей, затем DCM/метанол, 95:5, с получением неочищенного вещества, которое содержало тетрабутиламмония йодид. Маслянистый остаток титровали диэтиловым эфиром с получением бежевого твердого вещества (9,15 г), которое использовали на следующей стадии без дополнительной очистки. К перемешиваемому раствору твердого вещества (9,15 г неочищенного вещества из предыдущей стадии) в воде (100 мл) и метаноле (20 мл) добавляли по каплям 3 н. HCl до тех пор, пока рН раствор не достигал приблизительно 1. Реакционную смесь концентрировали при пониженном давлении с получением маслянистого остатка, который очищали на силикагеле, используя DCM/метанол, от 95:5 до 90:10,с получением указанного в заголовке соединения (5,53 г), загрязненного некоторым количеством тетрабутиламмония хлорида, и которое использовали на следующей стадии без дополнительной очистки. 1 Н ЯМР (400 МГц, CDCl3):м.д. 7.52 (d, 1H), 7.13-7.08 (m, 2 Н), 6.97 (dd, 1H), 6.83 (d, 1H), 3.86 (s,- 26017940 3 Н).c) Этиловый эфир 2-(4-хлор-2-метоксифенил)этенсульфоновой кислоты. 2,5 М раствор н-бутиллития в гексанах (6,15 мл, 15,37 ммоль) добавляли по каплям к перемешиваемому раствору этилового эфира (диэтоксифосфорил)метансульфоновой кислоты (4,0 г, 15,37 ммоль) вTHF (200 мл) при -78 С. Реакционную смесь перемешивали при -78 С в течение 15 мин. Затем добавляли по каплям раствор 4-хлор-2-метоксибензальдегида (2-41 г, 14,10 ммоль) в THF (20 мл). После того как добавление завершалось, реакционную смесь нагревали до КТ, перемешивали в течение 1 ч и гасили рассолом. Реакционную смесь концентрировали при пониженном давлении и добавляли DCM (200 мл). Органический слой отделяли, промывали рассолом (3100 мл) и сушили над MgSO4. В результате удаления растворителя при пониженном давлении и последующей очистки на силикагеле с использованием смеси гексан/этилацетат, от 4:1 до 2:1, получали указанное в заголовке соединение (3,90 г, количественный) в виде белого твердого вещества. 1 Н ЯМР (400 МГц, CDCl3):м.д. 7.70 (d, 1H), 7.36 (d, 1H), 6.99 (d, 1H), 6.97-6.92 (m, 2H), 4.22 (q,2H), 3.92 (s, 3 Н), 1.40 (t, 3H); 2-Амино-6-фторбензолсульфонамид (38 мг, 200 мкмоль) и (Е)-2-(4-фенилфенил)этенсульфонилхлорид (56 мг, 200 мкмоль) растворяли в пиридине (1,5 мл) и реакционную смесь встряхивали в течение 12 ч. Растворитель удаляли в вакууме и остатки очищали с помощью HPLC с получением продукта (16,6 мг, 19%).MS m/z M-H 431, Rf 1,1 мин (см. систему выше в общей процедуре для примеров 23-43). Соединения из примеров 51-68 получали с использованием общей процедуры, описанной для примера 50. Пример 51. 2-(Е)-2-(3-Хлорфенил)этенил]сульфониламино]-5-фторбензолсульфонамид
МПК / Метки
МПК: C07D 209/10, C07D 307/79, C07C 311/44, A61K 31/404, C07D 213/30, C07D 409/04, A61K 31/341, C07D 307/38, A61K 31/4402, C07D 233/96, A61K 31/505, A61K 31/4155, A61P 29/00, C07D 333/34, C07D 307/10, A61K 31/426, C07D 271/10, A61K 31/18, A61K 31/343, A61K 31/381, A61K 31/4418, C07D 213/64, C07D 333/76, A61K 31/4245, C07D 277/32
Метки: бис(сульфониламино)производные, применения, терапии
Код ссылки
<a href="https://eas.patents.su/30-17940-bissulfonilaminoproizvodnye-dlya-primeneniya-v-terapii.html" rel="bookmark" title="База патентов Евразийского Союза">Бис(сульфониламино)производные для применения в терапии</a>
Следующий патент: Суспензия, содержащая микрочастицы эзетимиба












