1′,3′-двузамещенные-4-фенил-3,4,5,6-тетрагидро-2н,1′н-[1,4']бипиридинил-2′-оны
Номер патента: 17648
Опубликовано: 28.02.2013
Авторы: Сид-Нуньес Хосе Мария, Дювей Гийом Альбер Жак, Финн Терри Патрик, Лютьенс Роберт Иоганнес, Трабанко-Суарес Андрес Авелино, Макдональд Грегор Джеймс
Формула / Реферат
1. Соединение формулы (I)
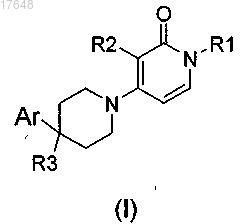
или его стереохимически изомерная форма, где
R1 представляет собой C1-6алкил; или C1-3алкил, замещенный С3-7циклоалкилом, фенил или фенил, замещенный галогеном, трифторметилом или трифторметокси;
R2 представляет собой галоген, трифторметил, C1-3алкил или циклопропил;
R3 представляет собой водород, фтор, гидроксил, гидроксиС1-3алкил, гидроксиС1-3алкилокси, фторС1-3алкил, фторС1-3алкилокси или циано; и
Ar представляет собой незамещенный фенил; или фенил, замещенный n радикалами R4, где n равно 1, 2 или 3;
R4 выбран из группы, состоящей из водорода, галогена, C1-3алкила, гидроксиС1-3алкила, полигалогеноС1-3алкила, циано, гидроксила, амино, карбоксила, C1-3алкилоксиС1-3алкила, C1-3алкилокси, полигалогеноС1-3алкилокси, C1-3алкилкарбонила, моно- и ди(C1-3алкил)амино и морфолинила; или два соседних радикала R4, взятые вместе, образуют бивалентный радикал формулы
-N=CH-NH- (a),
-CH=CH-NH- (б) или
-O-CH2-CH2-NH- (в); или
R3 и радикал R4 в орто-положении, взятые вместе, образуют бивалентный радикал формулы
-СН2-О- (г) или
-О-СН2- (д); или
его фармацевтически приемлемая соль или сольват.
2. Соединение по п.1, где
R1 представляет собой 1-бутил, 2-метил-1-пропил, 3-метил-1-бутил, (циклопропил)метил или 2-(циклопропил)-1-этил;
R3 представляет собой водород, фтор или циано;
Ar представляет собой незамещенный фенил или фенил, замещенный галогеном, трифторметилом, морфолинилом или гидроксиС1-3алкилом;
или его фармацевтически приемлемая соль или сольват.
3. Соединение по п.1, где
R1 представляет собой 1-бутил, 3-метил-1-бутил, (циклопропил)метил или 2-(циклопропил)-1-этил;
R2 представляет собой хлор;
R3 представляет собой водород или фтор и
Ar представляет собой незамещенный фенил или фенил, замещенный гидроксиС1-3алкилом;
или его фармацевтически приемлемая соль или сольват.
4. Соединение по п.1, где указанное соединение представляет собой 3'-хлор-1'-циклопропилметил-4-фенил-3,4,5,6-тетрагидро-2H,1'Н-[1,4']бипиридинил-2'-он или его фармацевтически приемлемую соль или сольват.
5. Соединение по п.1, где указанное соединение представляет собой 1'-бутил-3'-хлор-4-фенил-3,4,5,6-тетрагидро-2H,1'H-[1,4']бипиридинил-2'-он или его фармацевтически приемлемую соль или сольват.
6. Соединение по п.1, где указанное соединение представляет собой
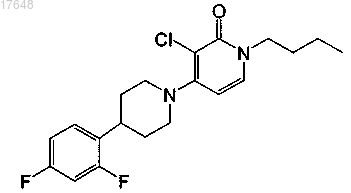
или его фармацевтически приемлемую соль или сольват.
7. Фармацевтическая композиция, содержащая терапевтически эффективное количество соединения по любому из пп.1-6 и фармацевтически приемлемый носитель или эксципиент.
8. Применение соединения по любому из пп.1-6 в качестве лекарственного средства.
9. Применение соединения по любому из пп.1-6 для изготовления лекарственного средства для лечения или предупреждения состояния у млекопитающего, включая человека, лечение или предупреждение которого находится под влиянием или облегчается посредством нейромодуляторного эффекта положительных аллостерических модуляторов mGluR2 (метаботропных глутаматных рецепторов подтипа 2).
10. Применение фармацевтической композиции по п.7 для изготовления лекарственного средства для лечения или предупреждения состояния у млекопитающего, включая человека, лечение или предупреждение которого находится под влиянием или облегчается посредством нейромодуляторного эффекта положительных аллостерических модуляторов mGluR2 (метаботропных глутаматных рецепторов подтипа 2).
11. Применение соединения по любому из пп.1-6 для изготовления лекарственного средства для лечения или предупреждения расстройства центральной нервной системы, выбранного из группы: тревожные расстройства, психотические расстройства, личностные расстройства, расстройства, вызванные веществами, расстройства питания, расстройства настроения, мигрень, эпилепсия или конвульсивные расстройства, детские расстройства, когнитивные расстройства, нейродегенерация, нейротоксичность и ишемия.
12. Применение фармацевтической композиции по п.7 для изготовления лекарственного средства для лечения или предупреждения расстройства центральной нервной системы, выбранного из группы: тревожные расстройства, психотические расстройства, личностные расстройства, расстройства, вызванные веществами, расстройства питания, расстройства настроения, мигрень, эпилепсия или конвульсивные расстройства, детские расстройства, когнитивные расстройства, нейродегенерация, нейротоксичность и ишемия.
13. Применение по п.11, где расстройство центральной нервной системы представляет собой тревожное расстройство, выбранное из группы: агорафобия, генерализованное тревожное расстройство (GAD), обсессивно-компульсивное расстройство (OCD), паническое расстройство, посттравматическое стрессовое расстройство (PTSD), социальная фобия и другие фобии.
14. Применение по п.11, где расстройство центральной нервной системы представляет собой психотическое расстройство, выбранное из группы: шизофрения, бредовое расстройство, шизоаффективное расстройство, шизофреноформное расстройство и психотическое расстройство, вызванное веществом.
15. Применение по п.11, где расстройство центральной нервной системы представляет собой личностное расстройство, выбранное из группы: обсессивно-компульсивное личностное расстройство и шизоидное, шизотипическое расстройство.
16. Применение по п.11, где расстройство центральной нервной системы представляет собой расстройство, вызванное веществом, выбранное из группы: злоупотребление алкоголем, алкогольная зависимость, алкогольная абстиненция, делирий при алкогольной абстиненции, психотическое расстройство, вызванное алкоголем, амфетаминовая зависимость, амфетаминовая абстиненция, кокаиновая зависимость, кокаиновая абстиненция, никотиновая зависимость, никотиновая абстиненция, опиоидная зависимость и опиоидная абстиненция.
17. Применение по п.11, где расстройство центральной нервной системы представляет собой расстройство питания, выбранное из группы: нервная анорексия и нейрогенная булимия.
18. Применение по п.11, где расстройство центральной нервной системы представляет собой расстройство настроения, выбранное из группы: биполярные расстройства (I и II), циклотимическое расстройство, депрессия, дистимическое расстройство, большое депрессивное расстройство и расстройство настроения, вызванное веществом.
19. Применение по п.11, где расстройство центральной нервной системы представляет собой мигрень.
20. Применение по п.11, где расстройство центральной нервной системы представляет собой эпилепсию или конвульсивное расстройство, выбранное из группы: генерализованная неконвульсивная эпилепсия, генерализованная конвульсивная эпилепсия, малый эпилептический припадок, большой эпилептический припадок, парциальная эпилепсия с нарушением сознания или без нарушения сознания, младенческие судороги, непрерывная парциальная эпилепсия и другие формы эпилепсии.
21. Применение по п.11, где детское расстройство представляет собой синдром дефицита внимания/гиперактивности.
22. Применение по п.11, где расстройство центральной нервной системы представляет собой когнитивное расстройство, выбранное из группы: делирий, персистирующий делирий, вызванный веществом, деменция, деменция вследствие ВИЧ-заболевания, деменция вследствие болезни Гентингтона, деменция вследствие болезни Паркинсона, деменция альцгеймеровского типа, персистирующая деменция, вызванная веществом, и легкое когнитивное нарушение.
23. Применение по п.11, где расстройство центральной нервной системы выбрано из группы: тревога, шизофрения, мигрень, депрессия и эпилепсия.
24. Применение по п.11, где расстройство центральной нервной системы представляет собой обсессивно-компульсивное расстройство.
25. Применение соединения по любому из пп.1-6 в комбинации с ортостерическим агонистом mGluR2 для изготовления лекарственного вещества для лечения или предупреждения состояния, указанного в любом из пп.9-24.
26. Применение соединения по любому из пп.1-6 в лечении или предупреждении расстройства центральной нервной системы, выбранного из группы: тревожные расстройства, психотические расстройства, личностные расстройства, расстройства, вызванные веществами, расстройства питания, расстройства настроения, мигрень, эпилепсия или конвульсивные расстройства, детские расстройства, когнитивные расстройства, нейродегенерация, нейротоксичность и ишемия.
27. Способ лечения или предупреждения расстройства центральной нервной системы, выбранного из группы: тревожные расстройства, психотические расстройства, личностные расстройства, расстройства, вызванные веществами, расстройства питания, расстройства настроения, мигрень, эпилепсия или конвульсивные расстройства, детские расстройства, когнитивные расстройства, нейродегенерация, нейротоксичность и ишемия, включающий введение субъекту соединения по любому из пп.1-6.
Текст
1',3'-ДВУЗАМЕЩЕННЫЕ-4-ФЕНИЛ-3,4,5,6-ТЕТРАГИДРО-2 Н,1'Н-[1,4']БИПИРИДИНИЛ-2'-ОНЫ Макдональд Грегор Джеймс (BE),Дювей Гийом Альбер Жак, Лютьенс Роберт Иоганнес, Финн Терри Патрик Изобретение относится к новым соединениям, в частности новым производным пиридинона формулы (I), где все радикалы такие, как определено в заявке и формуле изобретения. Соединения по изобретению являются положительными аллостерическими модуляторами метаботропных рецепторов - подтипа 2 ("mGluR2"), которые полезны для лечения или предупреждения неврологических и психиатрических расстройств, ассоциированных с глутаматной дисфункцией,и заболеваний, в которые вовлечен подтип mGluR2 метаботропных рецепторов. В частности,такие заболевания представляют собой расстройства центральной нервной системы, выбранные из группы тревоги, шизофрении, мигрени, депрессии и эпилепсии. Изобретение также направлено на фармацевтические композиции и способы получения таких соединений и композиций, а также на применение таких соединений для предупреждения и лечения таких заболеваний, в которые вовлечен mGluR2. Сид-Нуньес Хосе Мария, ТрабанкоСуарес Андрес Авелино (ES),017648 Область изобретения Изобретение относится к новым производным пиридинона, которые являются положительными аллостерическими модуляторами метаботропных глутаматных рецепторов подтипа 2 ("mGluR2") и которые полезны для лечения или предупреждения неврологических и психиатрических расстройств, связанных с глутаматной дисфункцией, и заболеваний, в которые вовлечен подтип mGluR2 метаботропных рецепторов. Кроме того, изобретение направлено на фармацевтические композиции, содержащие такие соединения, на способы получения таких соединений и композиций и на применение таких соединений для предупреждения или лечения неврологических и психиатрических расстройств и заболеваний, в которые вовлечен mGluR2. Предшествующий уровень техники Глутамат является важным аминокислотным нейромедиатором в центральной нервной системе млекопитающих. Глутамат играет важную роль в многочисленных физиологических функциях, таких как обучение и память, а также сенсорное восприятие, развитие синаптической пластичности, регуляция моторики, дыхание и регуляция сердечно-сосудистой функции. Кроме того, глутамат находится в центре нескольких разных неврологических и психиатрических заболеваний, в которых имеется нарушение баланса глутаматергической нейротрансмиссии. Глутамат опосредует синаптическую нейротрансмиссию через активацию каналов ионотропных глутаматных рецепторов (iGluRs) и рецепторов NMDA (N-метил-D-аспартат), АМРА (2-альфа-амино-3 гидрокси-5-метил-4-изоксазольпропионовая кислота) и каинатных рецепторов, которые являются ответственными за быструю возбудительную трансмиссию. Кроме того, глутамат активирует метаботропные глутаматные рецепторы (mGluR), играющие дополнительную модуляторную роль, способствующую тонкой корректировке синаптической эффективности. Глутамат активирует mGluR посредством связывания с большим внеклеточным амино-концевым доменом рецептора, называемым в данном описании изобретения ортостерическим центром связывания. Это связывание вызывает конформационное изменение в рецепторе, что приводит к активации G-белка и внутриклеточных сигнальных путей. Подтип mGluR2 негативно связан с аденилатциклазой через активацию Gai-белка, и его активация приводит к ингибированию высвобождения глутамата в синапсе. В центральной нервной системе (CNS) рецепторы mGluR2 распространены главным образом в коре головного мозга, таламическим участкам,придаточной обонятельной луковице, гиппокампе, миндалевидном теле, хвостатом ядре-путамене и прилежащем ядре. Активирование mGluR2, как показали клинические исследования, является эффективным в лечении тревожных расстройств. Кроме того, активирование mGluR2 в различных животных моделях показало их эффективность, таким образом, предоставляя возможный новый терапевтический подход к лечению шизофрении, эпилепсии, аддикции/наркотической зависимости, болезни Паркинсона, боли, расстройств сна и болезни Гентингтона. В настоящее время большинство доступных фармакологических средств, нацеленных на mGluR,представляют собой ортостерические лиганды, которые активируют некоторые члены семейства, так как они являются структурными аналогами глутамата. Новым направлением для развития селективных соединений, действующих на mGluR, является идентификация соединений, которые действуют посредством аллостерических механизмов, модулируя рецептор путем связывания с сайтом, отличным от высококонсервативного ортостерического центра связывания. Недавно положительные аллостерические модуляторы mGluR выступили в качестве новых фармакологических объектов, предлагающих эту привлекательную альтернативу. В качестве положительных аллостерических модуляторов mGIuR2 были описаны различные соединения. В WO 2004/092135 (NPSWO 2006/030032 (AddexJanssen Pharmaceutica) описаны, соответственно, фенилсульфонамид, ацетофенон, инданон, пиридилметилсульфонамид и производные пиридинона в качестве положительных аллостерических модуляторов mGluR2. Ни одно из конкретно раскрытых в них соединений не является структурно родственным соединениям по настоящему изобретению. Показано, что такие соединения не активируют рецептор сами по себе. Быстрее они обеспечивают возможность для рецептора продуцировать максимальный ответ на концентрацию глутамата, которая самостоятельно индуцирует минимальный ответ. Мутационный анализ однозначно продемонстрировал,что связывание положительных аллостерических модуляторов mGluR2 происходит не в ортостерическом центре, но вместо этого на аллостерическом сайте, расположенном внутри семитрансмембранного участка рецептора. Данные на животных позволяют предположить, что положительные аллостерические модуляторыmGluR2 оказывают эффекты в моделях тревоги и психоза, аналогичные полученным с ортостерическими агонистами. Аллостерический модуляторы mGluR2, как было показано, активна в страхе, усиленном испугом, и стресс-индуцирующованных гипертермических моделях тревоги. Кроме того, такие соединения,-1 017648 как показано, активны в реверсировании кетамин- или амфетамин-индуцированной гиперлокомоции и в реверсировании амфетамин-индуцированного нарушения преимпульсного ингибирования акустической реакции испуга в модели шизофрении (J. Pharmacol. Exp. Ther. 2006, 318, стр. 173-185; Psychopharmacology 2005, 179, 271-283). Современные исследования на животных также выявили, что селективный положительный аллостерический модулятор подтипа 2 метаботропных глутаматных рецепторов, бифенилинданон (BINA),блокирует модель психоза на основе галлюциногенных лекарственных средств, подтверждая стратегию нацеливания рецепторов mGluR2 на лечение глутаматергической дисфункции при шизофрении (Mol.Pharmacol. 2007, 72, стр. 477-484). Положительные аллостерические модуляторы обеспечивают возможность потенциирования глутаматного ответа, но, кроме того, было доказано, что они потенциируют ответ на ортостерические агонисты mGluR2, такие как LY379268 или DCG-IV. Такие данные обеспечивают доказательство в отношении еще одного нового терапевтического подхода к лечению указанных выше неврологических и психиатрических заболеваний, в которые вовлечен mGluR2, с использованием комбинацию положительного аллостерического модулятора mGluR2 вместе с ортостерическим агонистом mGluR2. Подробное описание изобретения Настоящее изобретение относится к соединениям, обладающим активностью модулятора метаботропных глутаматных рецепторов 2, где указанные соединения имеют формулу (I), и их стереохимически изомерным формам, гдеAr представляет собой незамещенный фенил; или фенил, замещенный n радикалами R4, где n равен 1, 2 или 3;R4 выбран из группы, состоящей из водорода, галогено, C1-3 алкила, гидроксиС 1-3 алкила, полигалогеноС 1-3 алкила, циано, гидроксила, амино, карбоксила, C1-3 алкилоксиС 1-3 алкила, C1-3 алкилокси, полигалогеноС 1-3 алкилокси, C1-3 алкилкарбонила, моно- и ди(C1-3 алкил)амино и морфолинила; или два соседних радикала R4, взятые вместе, образуют бивалентный радикал формулыR3 и радикал R4 в орто-положении, взятые вместе, образуют бивалентный радикал формулы-О-СН 2- (д); и их фармацевтически приемлемым солям и сольватам. В одном воплощении изобретение относится к соединению формулы (I) или его стереохимически изомерной форме, гдеAr представляет собой незамещенный фенил, или фенил, замещенный n радикалами R4, где n равен 1, 2 или 3;R4 выбран из группы, состоящей из водорода, галогено; C1-3 алкила; гидроксиС 1-3 алкила, полигалогеноС 1-3 алкила; циано; гидрокси; амино; карбоксила; C1-3 алкилоксиС 1-3 алкила; C1-3 алкилокси; полигалогеноС 1-залкилокси; C1-3 алкилкарбонила; моно- и ди(C1-3 алкил)амино и морфолинила; или два соседних радикала R4, взятые вместе, образуют бивалентный радикал формулы-O-CH2-CH2-NH- (в); и его фармацевтически приемлемые соли и сольваты. В одном воплощении изобретение относится к соединению формулы (I) или его стереохимически изомерной форме, гдеAr представляет собой незамещенный фенил; или фенил, замещенный галогено, трифторметилом,морфолинилом или гидроксиС 1-3 алкилом; или их фармацевтически приемлемую соль или сольват. В одном воплощении изобретение относится к соединению формулы (I) или его стереохимически изомерной формы, гдеR3 представляет собой водород или фтор; иAr представляет собой незамещенный фенил; или фенил, замещенный гидроксиС 1-3 алкилом; или его фармацевтически приемлемой соли или сольвату. В одном воплощении изобретение касается соединению 3'-хлор-1'-циклопропилметил-4-фенил 3,4,5,6-тетрагидро-2H,1'Н-[1,4']бипиридинил-2'-ону (Е 1) или 1'-бутил-3'-хлор-4-фенил-3,4,5,6-тетрагидро-2H,1'Н-[1,4']бипиридинил-2'-ону (Е 2). Обозначение C1-3 алкил в виде группы или части группы означает насыщенный, прямой или разветвленный углеводородный радикал, имеющий от 1 до 3 атомов углерода, такой как метил, этил, 1 пропил и 1-метилэтил; например гидроксиС 1-3 алкил, например означает гидроксиметил, 2-гидроксиэтил,3-гидроксипропил и 1-гидрокси-1-метилэтил. Обозначение C1-6 алкил в виде группы или части группы означает насыщенный, прямой или разветвленный углеводородный радикал, имеющий от 1 до 6 атомов углерода, такой как метил, этил, 1 пропил, 1-метилэтил, 1-бутил, 2-метил-1-пропил, 3-метил-1-бутил, 1-пентил, 1-гексил и тому подобное. Обозначение С 3-7 циклоалкил означает насыщенный, циклический углеводородный радикал, имеющий от 3 до 7 атомов углерода, такой как циклопропил, циклобутил, циклопентил, циклогексил и циклогептил. Обозначение галогено или галоген в виде группы или части группы является общим для фтора,хлора, брома и йода. Для терапевтического использования соли соединений формулы (I) представляют собой соли, где противоион является фармацевтически приемлемым. Однако соли кислот и оснований, которые не являются фармацевтически приемлемыми, также могут найти применение, например, в получении или очистке фармацевтически приемлемого соединения. Все соли, как фармацевтически приемлемые, так и фармацевтически неприемлемые, включены в рамки настоящего изобретения. Фармацевтически приемлемые соли, как определено, включают терапевтически активные нетоксичные солевые формы присоединения кислоты, которые способны образовывать соединения формулы(I). Указанные соли могут быть получены с помощью обработки основной формы соединений формулы(I) соответствующими кислотами, например неорганическими кислотами, например гидрогалогеновыми кислотами, в частности соляной кислотой, бромисто-водородной кислотой, серной кислотой, азотной кислотой и фосфорной кислотой; органическими кислотами, например уксусной кислотой, гидроксиуксусной кислотой, пропионовой кислотой, молочной кислотой, пировиноградной кислотой, щавелевой кислотой, малоновой кислотой, янтарной кислотой, малеиновой кислотой, фумаровой кислотой, яблочной кислотой, виннокаменной кислотой, лимонной кислотой, метансульфоновой кислотой, этансульфоновой кислотой, бензолсульфоновой кислотой, паратолуолсульфоновой кислотой, цикламиновой кислоты, салициловой кислотой, парааминосалициловой кислотой и памовой кислотой. С другой стороны, указанные солевые формы можно превращать в форму нейтрального основания посредством обработки соответствующим основанием. Соединения формулы (I), содержащие кислые протоны, также могут быть превращены в их терапевтически активные нетоксичные формы основных солей посредством обработки с соответствующими органическими и неорганическими основаниями. Подходящие формы основных солей включают, например, соли аммония, соли щелочных и щелочноземельных металлов, в частности соли лития, натрия,калия, магния и кальция, соли органических оснований, например бензатина, N-метил-D-глюкамина,гибрамина, и соли аминокислот, например аргинина и лизина. С другой стороны, указанные солевые формы могут быть превращены в формы свободных кислот посредством обработки соответствующей кислотой. Термин "сольват" включает формы присоединения растворителя, а также их соли, которые способны образовывать соединения формулы (I). Примерами таких форм присоединения растворителя являются, например, гидраты, алкоголяты и тому подобное. Термин "стереохимически изомерные формы" при использовании в данном описании изобретения определяют все возможные изомерные формы, которые могут иметь соединения формулы (I). Если не установлено и не указано иное, химическое название соединений означает смесь всех возможных стереохимически изомерных форм, причем указанные смеси содержат все диастереомеры и энантиомеры основной молекулярной структуры. Изобретение также включает каждую из отдельных изомерных форм-3 017648 соединений формулы (I) и их соли и сольваты, по существу, не содержащие, то есть вместе с менее 10%,предпочтительно менее 5%, в частности менее 2% и наиболее предпочтительно менее 1% других изомеров. Таким образом, если соединение формулы (I) обозначено, например, как (R), это означает, что соединение, по существу, не содержит изомера (S). Стереогенные центры могут иметь R- или Sконфигурацию; заместители на бивалентных циклических (частично) насыщенных радикалах могут иметь или цис-, или транс-конфигурацию. Следуя условным обозначениям номенклатуры CAS, если в соединении присутствуют два стереогенных центра с известной абсолютной конфигурацией, дескриптор R или S присваивают (на основе правила последовательного старшинства Кана-Ингольда-Прелога) хиральному центру с самым низким порядковым номером, центру отсчета. Конфигурацию второго стереогенного центра обозначают, используя относительные дескрипторы [R,R] или [R,S], где R всегда указывают в качестве центра отсчета и [R/S] указывает центры с одинаковой хиральностью, и [R,S] указывает центры разной хиральности. Например, если хиральный центр самым низким порядковым номером в соединении имеет Sконфигурацию, и второй центр имеет R-конфигурацию, стереодескриптор следует указать как S-[R,S]. Если используюти : положение заместителя с высшим приоритетом на асимметрическом атоме углерода в кольцевой системе, имеющей самый низкий номер кольца, всегда произвольно является положениемсредней плоскости, определяемой кольцевой системой. Положение заместителя с высшим приоритетет на другом асимметрическом атоме углерода в кольцевой системе (атом водорода в соединениях формулы (I относительно положения заместителя с высшим приоритетом на атоме отсчета обозначают, если он находится на той же стороне средней плоскости, определяемой кольцевой системой, или ,если он находится на другой стороне средней плоскости, определяемой кольцевой системой. В рамках данной заявки, элемент, в частности при упоминании в отношении соединения формулы(I), содержит все изотопы и изотопные смеси данного элемента, или имеющиеся в природе или полученные синтетически, или с распространнностью элементов в природе или в изотопно обогащенной формы. Меченные радиоактивным изотопом соединения формулы (I) могут содержать радиоактивный изотоп,выбранный из группы 3 Н, 11 С, 18F, 122I, 123I, 125I, 131I, 75Br, 76Br, 77Br и 82Br. Предпочтительно радиоактивный изотоп выбран из группы 3 Н, 11 С и 18F. Получение Соединения по изобретению в основном могут быть получены при помощи последовательности стадий, каждая из которых известна специалисту. В частности, соединения могут быть получены согласно следующим методам синтеза. Соединения формулы (I) можно синтезировать в форме рацемических смесей энантиомеров, которые могут быть отделены один от другого, следуя известным в данной области технике методикам разделения. Рацемические соединения формулы (I) могут быть превращены в соответствующие диастереоизомерные солевые формы путем взаимодействия с подходящей хиральной кислотой. Указанные диастереоизомерные солевые формы затем разделяют, например селективной или фракционной кристаллизацией, и энантиомеры выделяют из них щелочами. Альтернативный способ разделения энантиомерных форм соединений формулы (I) включает жидкостную хроматографию с использованием хиральной неподвижной фазы. Указанные чистые стереохимически изомерные формы также могут быть произведены из соответствующих чистых стереохимически изомерных форм соответствующих исходных веществ,при условии что взаимодействие происходит стереоспецифически. А. Получение конечных соединений. Экспериментальная методика 1. Соединения формулы (I), в случае, когда R2 представляет собой галоген, могут быть получены посредством взаимодействия промежуточного соединения формулы (II) с реагентом N-галосукцинимидом,таким как N-хлорсукцинимид, N-бромсукцинимид или N-йодосукцинимид, согласно схеме взаимодействия (1). Данное взаимодействие выполняют в подходящем реакционно-инертном и апротонном растворителе, таком как, например, дихлорметан или 1,2-дихлорэтан, перемешивая реакционную смесь при подходящей температуре, обычно при комнатной температуре, в течение требуемого времени для достижения завершения взаимодействия, обычно 1 ч. В схеме взаимодействия (1) R2 представляет собой галоген, и все другие переменные определены как в формуле (I). Схема взаимодействия 1 Экспериментальная методика 2. Альтернативно, соединения формулы (I) могут быть получены путем взаимодействия промежуточного соединения формулы (III) с промежуточным соединением формулы (IV), которые могут либо-4 017648 иметься в продаже или могут быть синтезированы способами, хорошо известными специалисту в данной области техники, согласно схеме взаимодействия (2). Данное взаимодействие выполняют в подходящем реакционно-инертном растворителе, таком как, например, толуол, в присутствии подходящего основания, такого как, например, трет-бутилат натрия, катализатора на основе металла, конкретно палладиевого катализатора, такого как ацетат палладия(II), и подходящего лиганда, такого как например [1,1'бинафталин]-2,2'-диил-бис[дифенилфосфин] (BINAP), при нагревании в течение подходящего периода времени, которое обеспечивает завершение взаимодействия, например при 100 С в течение 16 ч в герметично закрытой пробирке. В схеме взаимодействия (2) Za представляет собой группу, пригодную для Pdопосредованного сочетания с аминами, такую как, например, галоген или трифлат. Все другие переменные определены как в формуле (I). Схема взаимодействия 2 Такие промежуточные соединения формулы (II) и формулы (III) могут быть получены согласно схемам взаимодействия (3)-(11) (смотри ниже). Превращения разных функциональных групп, присутствующих в конечных соединениях, в другие функциональные группы формулы (I), могут быть выполнены способами синтеза, хорошо известными специалистам в данной области техники. Кроме того, соединения формулы (I) могут быть получены специалистом с использованием известных в данной области техники методик, с помощью дополнительных модификаций соединений формулы(I). Алкилирование соединений формулы (I), которые содержат в своей структуре один или более чем один гидроксизаместитель, подходящим алкилирующим агентом, таким как например 2 фторэтилтозилат, в условиях нагревания, с использованием подходящего основания, такого как например гидрид натрия, в подходящем реакционно-инертном растворителе, таком как например 1,2 диметоксиэтан или диметилформамид. Фторирование соединений формулы (I), которые содержат в своей структуре один или более чем один гидроксизаместитель, подходящим фторирующим агентом, таким как, например, трифторид (диэтилмино)серы. Данное взаимодействие может быть выполнено в подходящем реакционно-инертном растворителе, таком как, например, дихлорметан, при умеренно низкой температуре, такой как, например, температура в диапазоне от -78 до 30 С, в течение например 0,5-12 ч. Взаимодействие соединений формулы (I), которые содержат в своей структуре один или более чем один гидроксизаместитель, с производным спирта, с использованием подходящей системы для сочетания, такой как, например, ди-трет-бутил-азодикарбоксилат/трифенилфосфин в условиях нагревания. В. Получение промежуточных соединений. Экспериментальная методика 3. Промежуточные соединения формулы (II) могут быть получены посредством посредством взаимодействия промежуточного соединения формулы (V) с промежуточным соединением формулы (IV) согласно схеме взаимодействия (3). Данное взаимодействие выполняют в подходящем реакционноинертном растворителе, таком как, например, толуол, в присутствии подходящего основания, такого как,например, трет-бутилат натрия, катализатора на основе металла, более конкретно палладиевого катализатора, такого как ацетат палладия(II), и подходящего лиганда, такого как например [1,1'-бинафталин]2,2'-диил-бис[дифенилфосфин] (BINAP), при нагревании в течение подходящего периода времени, который обеспечивает завершение взаимодействия, например при 100 С в течение 16 ч в герметично закрытой пробирке. В схеме взаимодействия (3) все переменные определены как в формуле (I). Схема взаимодействия 3 Экспериментальная методика 4. Промежуточные соединения формулы (III-а) и (III-b) могут быть получены посредством взаимодействия промежуточного соединения формулы (VI), где Y представляет собой Н или R2 (как определено в Формуле I), с подходящим галогенирующим агентом, таким как, например, бромокись фосфора. Данное взаимодействие можно выполнять в подходящем реакционно-инертном растворителе, таком как, например, DMF, при умеренно повышенной температуре, такой как, например, 110 С, в течение подходящего периода времени, который обеспечивает завершение взаимодействия, например 1 ч. В схеме взаимодействия (4) переменная R1 определена как в формуле (I). Экспериментальная методика 5. Промежуточные соединения формулы (III-с) могут быть получены посредством взаимодействия промежуточного соединения формулы (VI-a) с трифликовым ангидридом (также называемым трифторметансульфоновый ангидрид). Взаимодействие может быть выполнено в подходящем реакционноинертном растворителе, таком как, например, дихлорметан, в присутствии основания, такого как, например, пиридин, при низкой температуре, такой как, например, -78 С. В схеме взаимодействия (5) все переменные определены как в формуле (I). Схема взаимодействия 5 Экспериментальная методика 6. Промежуточные соединения формулы (VI) могут быть получены гидрогенолизом промежуточных соединений формулы (VII-a, VII-b или VII-c) в подходящем реакционно-инертном растворителе, таком как, например, этанол, в присутствии катализатора, такого как, например, 10% палладий на активированном угле, в течение периода времени, который гарантирует завершение взаимодействия, обычно при комнатной температуре и давлении водорода 1 атмосфера (0,1 МПа) в течение 2 ч. В схеме взаимодействия (6) переменная R1 определена как в формуле (I). Схема взаимодействия 6 Экспериментальная методика 7. Альтернативно, промежуточные соединения формулы (VI), где Y=галоген, могут быть получены посредством взаимодействия промежуточного соединения формулы (VII-d) в смеси уксусной кислоты и бромистоводородной кислоты, и нагревания смеси при температуре и в течение времени, требующегося для обеспечения завершения взаимодействия, обычно при 130 С в течение 30 мин, при использовании микроволнового излучения. В схеме взаимодействия (7) переменная R1 определена, как в формуле (I). Схема взаимодействия 7 Экспериментальная методика 8. Промежуточные соединения формулы (VII-a) могут быть получены при помощи известных в данной области техники методик посредством взаимодействия имеющегося в продаже 4-бензилокси-1Hпиридин-2-она с имеющимся в продаже алкилирующим агентом формулы (VIII), где Zb представляет собой уходящую группу, с использованием основания, такого как, например, K2CO3, и возможно соли йода, такой как, например, KI, в инертном растворителе, таком как, например, ацетонитрил или DMF,при умеренно высокой температуре, такой как, например, 80-120 С, в течение соответствующего периода времени, который обеспечивает завершение взаимодействия, например 16 ч. В схеме взаимодействия(8) переменная R1 определена как в формула (I), и Zb представляет собой подходящую уходящую группу,такую как, например, галоген. Схема взаимодействия 8-6 017648 Экспериментальная методика 9. Промежуточные соединения формулы (VII-b) могут быть получены посредством взаимодействия промежуточного соединения формулы (VII-e), где Y представляет собой йод, с имеющимся в продаже метил-2,2-дифтор-2-(фторсульфонил)ацетатом в подходящем реакционно-инертном растворителе, таком как, например, DMF, в присутствии подходящей соли меди, такой как йодид меди(I), при нагревании в течение соответствующего периода времени, которое обеспечивает завершение взаимодействия, например, при 100 С в течение 5 ч. В схеме взаимодействия (9) переменная R1 определена как в формуле (I). Схема взаимодействия 9 Экспериментальная методика 10. Промежуточные соединения формулы (VII-d) могут быть получены посредством взаимодействия промежуточного соединения формулы (VII-a) с имеющимся в продаже N-галосукцинимидом, таким какN-хлор-(NCS), N-бром-(NBS) или N-йодосукцинимид (NIS), в подходящем реакционно-инертном растворителе, таком как например DMF, дихлорметан или уксусная кислота, обычно при комнатной температуре в течение от 1 до 24 ч. В схеме взаимодействия (10) переменная R1 определена как в формуле (I). Схема взаимодействия 10 Экспериментальная методика 11. Промежуточные соединения формулы (VIIc) могут быть получены посредством взаимодействия промежуточного соединения формулы (VII-d) с производным C1-3 алкил- или циклопропилбороновой кислоты, таким как циклопропилбороновая кислота или метилбороновая кислота, в подходящем реакционно-инертном растворителе, таком как, например, 1,4-диоксан, в присутствии подходящего комплекса палладиевого катализатора, такого как, например, комплекс [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II)-DCM, и в присутствии подходящего основания, такого как гидрокарбонат натрия, при нагревании в течение соответствующего периода времени, который обеспечивает завершение взаимодействия, например при 175 С в течение 20 мин, при использовании микроволнового излучения. В схеме взаимодействия (11) переменная R1 определена, как в формуле (I). Схема взаимодействия 11 Экспериментальная методика 12. Промежуточные соединения формулы (IV) могут быть получены посредством снятия защиты с атома азота пиперидина в промежуточном соединении формулы (IX), где L представляет собой подходящую защитную группу для атома азота производного пиперидина, такую как, например, третбутоксикарбонил, этоксикарбонил, бензилоксикарбонил, бензил и метил, с использованием известных в данной области техники методик, согласно схеме взаимодействия (12). В схеме взаимодействия (12) все переменные определены, как в формуле (I). Схема взаимодействия (12) Экспериментальная методика 13. Промежуточные соединения формулы (IV-a) могут быть получены посредством гидрирования промежуточного соединения формулы (X) с использованием известных в данной области техники методик согласно схеме взаимодействия (13). В схеме взаимодействия (13) Ar определен, как в формуле (I). Экспериментальная методика 14. Промежуточные соединения формулы (IX-a) могут быть получены гидрированием промежуточного соединения формулы (XI), где L представляет собой подходящую защитную группу для атома азота производного тетрагидропиридина, такую как, например, трет-бутоксикарбонил, этоксикарбонил, бензилоксикарбонил, бензил и метил, с использованием известных в данной области техники методик, согласно схеме взаимодействия (14). В схеме взаимодействия (14) Ar определен, как формуле (I). Схема взаимодействия (14) Экспериментальная методика 15. Промежуточные соединения формулы (X) могут быть получены путем снятия защиты с атома азота тетрагидропиридина в промежуточном соединении формулы (XI), где L представляет собой подходящую защитную группу для атома азота производного тетрагидропиридина, такую как, например, третбутоксикарбонил, этоксикарбонил, бензилоксикарбонил, бензил и метил, с использованием известных в данной области техники методик, согласно схеме взаимодействия (15). В схеме взаимодействия (15) Ar определен, как в формуле (I). Схема взаимодействия (15) Экспериментальная методика 16. Промежуточные соединения формулы (XI) могут быть получены посредством взаимодействия промежуточного соединения формулы (XII) с промежуточным соединением формулы (XIII) согласно схеме взаимодействия (16). Взаимодействие может быть осуществлено в подходящем реакционноинертном растворителе, таком как, например, 1,4-диоксан, или в смеси инертных растворителей, такой как, например, 1,4-диоксан/DMF, в присутствии подходящего основания, такого как, например, водныйNaHCO3 или Na2CO3, подходящего катализатора, такого как, например, катализатор в виде комплекса Pd,такой как, например, Pd(PPh3)4, при условиях нагревания, таких как, например, нагревание реакционной смеси при 150 С при использовании микроволнового излучения, в течение, например, 10 мин. В схеме взаимодействия (16) все переменные определены, как в формуле (I); Zc представляет собой группу, пригодную для Pd-опосредованного сочетания с бороновыми кислотами или бороновыми эфирами, такую как, например, галоген или трифлат; L представляет собой подходящую защитную группу для атома азота производного тетрагидропиридина, такую как, например, трет-бутоксикарбонил, этоксикарбонил, бензилоксикарбонил, бензил и метил, и R4 и R5 представляют собой водород или С 1-4 алкил, или могут быть взяты вместе с образованием, например, бивалентного радикала формулы -СН 2 СН 2-, -СН 2 СН 2 СН 2- или Экспериментальная методика 17. Промежуточные соединения формулы (IV), где R3 представляет фтор или C1-3 алкил, замещенный фтором, где указанный R3 представлен как -L1-F, где L1 представляет собой C1-3 алкил или ковалентную связь, и указанные промежуточные соединения представлены формулой (IV-b), могут быть получены при помощи известных в данной области техники методик посредством взаимодействия промежуточного соединения формулы (IX-b), где L представляет собой подходящую защитную группу для атома азота пиперидиновой группировки, такую как, например, трет-бутоксикарбонил, этоксикарбонил, бензилоксикарбонил, бензил и метил, с подходящим фторирующим агентом, таким как, например, трифторид (диэтиламино)серы, с получением промежуточного соединения формулы (IX-с) согласно стадии (а) схемы взаимодействия (17). Взаимодействие может быть выполнено в подходящем реакционно-инертном рас-8 017648 творителе, таком как, например, дихлорметан. Взаимодействие может быть выполнено при умеренно низкой температуре, такой как, например, температура в интервале от -78 до 30 С в течение, например,0,5-12 ч. Полученное промежуточное соединение формулы (IX-c) может быть затем превращено согласно стадии (б) схемы взаимодействия (17) в промежуточное соединение формулы (IV-b) посредством удаления защиты с атома азота пиперидина с использованием известных в данной области техники методик,таких как, например, описанные выше в данном описании изобретения в экспериментальной методике 15. В схеме взаимодействия (17) Ar определен как в формуле (I). Схема взаимодействия (17) Экспериментальная методика 18. Промежуточные соединения формулы (IV), где R3 представляет собой C1-3 алкилокси, замещенный фтором, где указанный С 1-3 алкилокси обозначен как Q, указанный R3 обозначен как -Q-F, и где указанные промежуточные соединения представлены формулой (IV-d), могут быть получены с помощью известных в данной области техники методик посредством взаимодействия гидроксилзамещенного промежуточного соединения формулы (IX-d), где L представляет собой подходящую защитную группу для атома азота пиперидиновой группировки, такую как, например, трет-бутоксикарбонил, этоксикарбонил,бензилоксикарбонил, бензил и метил, с подходящим фторирующим агентом, таким как трифторид (диэтиламино)серы, с получением промежуточного соединения формулы (IX-е) согласно стадии (а) схемы взаимодействия (18). Взаимодействие может быть выполнено в подходящем реакционно-инертном растворителе, таком как, например, дихлорметан, при умеренно низкой температуре, такой как, например,температура в диапазоне от -78 до 30 С, в течение, например, 0,5-12 ч. Промежуточное соединение формулы (IX-e) можно затем превращать согласно стадии (б) схемы взаимодействия (18) в промежуточное соединения формулы (IV-d) путем снятия защиты с атома азота пиперидина с использованием известных в данной области техники методик, таких как, например, описанные выше здесь в экспериментальной методике 17. В схеме взаимодействия (18) Ar определен, как в формуле (I). Схема взаимодействия (18) Экспериментальная методика 19. Промежуточные соединения формулы (IX-b), где L1 представляет собой СН 2, указанные промежуточные соединения представлены формулой (IX-f), могут быть получены посредством взаимодействия промежуточного соединения формулы (XIV), где L представляет собой подходящую защитную группу для атома азота пиперидиновой группировки, такую как, например, трет-бутоксикарбонил, этоксикарбонил, бензилоксикарбонил, бензил и метил, с подходящим восстановителем, таким как, например, алюмогидрид лития, согласно схеме взаимодействия (19). Взаимодействие может быть выполнено в подходящем растворителе, таком как, например, тетрагидрофуран, при умеренно низкой температуре, такой как,например, от -20 С. В схеме взаимодействия (19) Ar определен, как в формуле (I) Схема взаимодействия (19) Исходные вещества формул (VIII), (IX-b), (IX-d), (XII), (XIII) и XIV либо имеются в продаже или могут быть получены в соответствии с обычными методиками взаимодействия, хорошо известными любому специалисту в данной области техники. Фармакология Соединения, предложенные в данном изобретении, представляют собой положительные аллостерические модуляторы метаботропных глутаматных рецепторов, в частности они представляют собой положительные аллостерические модуляторы mGluR2. Соединения по настоящему изобретению, как оказалось, не связываются с сайтом узнавания глутамата, сайтом ортостерического лиганда, но вместо этого связываются с аллостерическим сайтом в рамках семитрансмембранной области рецептора. В присутствии глутамата или агониста mGluR2 соединения по данному изобретению усиливают ответ mGluR2. Предполагается, что соединения, предложенные в данном изобретении, оказывают эффект на mGluR2-9 017648 благодаря своей способности повышать ответ таких рецепторов к глутамату или агонистам mGluR2, усиливая ответ рецептора. Таким образом, настоящее изобретение относится к соединениям по настоящему изобретению для применения в качестве лекарственного средства, а также к применению соединения по изобретению или фармацевтической композиции по изобретению для изготовления лекарственного вещества для лечения или предупреждения, в частности лечения, состояния млекопитающего, включая человека, лечение или предупреждение которого находится под влиянием или облегчается нейромодуляторным эффектом аллостерических модуляторов mGluR2, в частности его положительных аллостерических модуляторов. Настоящее изобретение также относится к соединению по настоящему изобретению или к фармацевтической композиции по изобретению для применения в изготовлении лекарственного вещества для лечения или предупреждения, в частности лечения, состояния млекопитающего, включая человека, лечение или предупреждение которого находится под влиянием или облегчается нейромодуляторным эффектом аллостерических модуляторов mGluR2, в частности его положительных аллостерических модуляторов. Настоящее изобретение также относится к соединению по настоящему изобретению или к фармацевтической композиции по изобретению для лечения или предупреждения, в частности лечения, состояния млекопитающего, включая человека, лечение или предупреждение которого находится под влиянием или облегчается нейромодуляторным эффектом аллостерических модуляторов mGluR2, в частности его положительных аллостерических модуляторов. Кроме того, настоящее изобретение относится к использованию соединения по изобретению или фармацевтической композиции по изобретению для изготовления лекарственного средства для лечения,предупреждения, улучшения, управления или снижения риска различных неврологических и психиатрических расстройств, связанных с глутаматной дисфункцией у млекопитающего, включая человека, лечение или предупреждение которых находится под влиянием или облегчается нейромодуляторным эффектом положительных аллостерических модуляторов mGluR2. Если говорится, что изобретение относится к применению соединения или композиции по изобретению для изготовления лекарственного средства, например для лечения млекопитающего, следует понимать, что такое применение следует интерпретировать в некоторых сферах как способ, например, лечения млекопитающего, включающий введение млекопитающему, нуждающемуся в таком, например,лечении, эффективного количества соединения или композиции по изобретению. В частности, неврологические и психиатрические расстройства, связанные с глутаматной дисфункцией, включают одно или более из следующих состояний или заболеваний: острые неврологические и психиатрические расстройства, такие как, например, церебральные недостаточности после операции коронарного шунтирования и имплантации, инсульт, церебральная ишемия, травма спинного мозга, травма головы, перинатальная гипоксия, остановка сердца, гипогликемическое нейронное повреждение, деменция (включая деменцию, вызванную СПИД), болезнь Альцгеймера, хорея Гентингтона, боковой амилотрофический склероз, повреждение зрения, ретинопатия, когнитивные расстройства, идиопатическая и вызванная лекарственным средством болезнь Паркинсона, мышечные судороги и расстройства, связанные с мышечной спастичностью, включая треморы, эпилепсии, судороги, мигрени (включая головную боль, связанную с мигренью), недержание мочи, толерантность к веществам, синдром отмены веществ(включая вещества, такие как, например, опиаты, никотин, табачные продукты, алкоголь, бензодиазепины, кокаин, седативные вещества, снотворные средства и так далее), психоз, шизофрения, тревога (включая генерализованное тревожное расстройство, паническое расстройство и обсессивно-компульсивное расстройство), расстройства настроения (включая депрессию, мании, биполярные расстройства), невралгия тройничного нерва, потеря слуха, шум в ушах, дистрофия желтого ядра глаза, рвота, отек мозга, боль(включая острые и хронические состояния, сильную боль, неустранимую боль, невропатическую боль и посттравматическую боль), позднюю дискинезию, расстройства сна (включая нарколепсию), синдром дефицита внимания и гиперактивности, расстройство поведения. В частности, состояние или заболевание представляет собой расстройство центральной нервной системы, выбранное из группы тревожных расстройств, психотических расстройств, личностных расстройств, расстройств, связанных с веществами, расстройств питания, расстройств настроения, мигрени,эпилепсии или конвульсивных расстройств, детских расстройств, когнитивных расстройств, нейродегенерации, нейротоксичности и ишемии. Предпочтительно расстройство центральной нервной системы представляет собой тревожное расстройство, выбранное из группы: агорафобия, генерализованное тревожное расстройство (GAD), обсессивно-компульсивное расстройство (OCD), паническое расстройство, посттравматическое стрессовое расстройство (PTSD), социальная фобия и другие фобии. Предпочтительно, расстройство центральной нервной системы представляет собой психотическое расстройство, выбранное из группы: шизофрения, делирийовое расстройство, шизоаффективное расстройство, шизофреноформное расстройство и психотическое расстройство, вызванное веществом. Предпочтительно расстройство центральной нервной системы представляет собой личностное расстройство, выбранное из группы: обсессивно-компульсивное личностное расстройство и шизоидное, шизотипическое расстройство. Предпочтительно расстройство центральной нервной системы представляет собой расстройство,- 10017648 связанное с веществом, выбранное из группы: злоупотребление алкоголем, алкогольная зависимость,алкогольная абстиненция, алкогольный абстинентный делирий, психотическое расстройство, вызванное алкоголем, амфетаминовая зависимость, амфетаминовая абстиненция, кокаиновая зависимость, кокаиновая абстиненция, никотиновая зависимость, никотиновая абстиненция, опиоидная зависимость и опиоидная абстиненция. Предпочтительно расстройство центральной нервной системы представляет собой расстройство питания, выбранное из группы нейрогенной анорексии и нейрогенной булимии. Предпочтительно расстройство центральной нервной системы представляет собой расстройство настроения, выбранное из группы: биполярные расстройства (I и II), циклотимическое расстройство, депрессия, дистимическое расстройство, большое депрессивное расстройство и расстройство настроения,вызванное веществом. Предпочтительно расстройство центральной нервной системы представляет собой мигрень. Предпочтительно расстройство центральной нервной системы представляет собой эпилепсию или конвульсивное расстройство, выбранное из группы: генерализованная неконвульсивная эпилепсия, генерализованная конвульсивная эпилепсия, малого эпилептического припадка, большого эпилептического припадка, парциальной эпилепсии с нарушением сознания или без нарушения сознания, младенческих судорог, непрерывной парциальной эпилепсии и других форм эпилепсии. Предпочтительно расстройство центральной нервной системы представляет собой синдром дефицита внимания/гиперактивности. Предпочтительно расстройство центральной нервной системы представляет собой когнитивное расстройство, выбранное из группы: делирий, персистирующий делирий, вызванный веществом, деменция, деменция вследствие ВИЧ-заболевания, деменция вследствие болезни Гентингтона, деменция вследствие болезни Паркинсона, деменция альцгеймеровского типа, персистирующая деменция, вызванная веществом, и легкое когнитивное нарушение. Из расстройств, перечисленных выше, лечение тревоги, шизофрении, мигрени, депрессии и эпилепсии является особенно важным. В настоящее время в четвертом издании DiagnosticStatistical Manual of Mental Disorders (DSMIV) Американской Психиатрической Ассоциации предложено диагностическое средство для идентификации расстройств, описанных в данном описании изобретения. Специалистам в данной области техники понятно, что существуют альтернативные варианты номенклатуры, нозологии и системы классификации неврологических и психиатрических расстройств, описанных в данном описании изобретения, и что они развиваются вместе с медицинским и научным прогрессом. Так как такие положительные аллостерические модуляторы mGluR2, включающие соединения формулы (I), усиливают ответ mGluR2 на глутамат, преимущество состоит в том, что настоящие способы используют эндогенный глутамат. Так как положительные аллостерические модуляторы mGluR2, включающие соединения формулы(I), усиливают ответ mGluR2 на агонисты, понятно, что настоящее изобретение распространяется на лечение неврологических и психиатрических расстройств, связанных с глутаматной дисфункцией, путем введения эффективного количества положительного аллостерического модулятора mGluR2, включающего соединения формулы (I), в комбинации с агонистом mGluR2. Соединения по настоящему изобретению можно использовать в комбинации с одним или более другими лекарственными средствами в лечении, предупреждении, управлении, смягчении или снижении риска заболеваний или состояний, для которых соединения формулы (I) или другие лекарственные средства могут быть полезны, если комбинация лекарственных средств, взятых вместе, является более безопасной или более эффективной, чем любое из этих лекарственных средств поодиночке. Фармацевтические композиции Изобретение также относится к фармацевтической композиции, содержащей фармацевтически приемлемый носитель или разбавитель и, в качестве активного ингредиента, терапевтически эффективное количество соединения по изобретению, в частности соединения формулы (I), его фармацевтически приемлемой соли, его сольвата или его стереохимически изомерной формы. Соединения по изобретению, в частности соединения формулы (I), их фармацевтически приемлемые соли, их сольваты и стереохимически изомерные формы, или любая их подгруппа или комбинация могут быть приготовлены в виде препарата в различных фармацевтических формах с целью введения. В качестве подходящих композиций здесь можно упомянуть все композиции, обычно используемые для системно вводимых лекарственных средств. Для получения фармацевтических композиций по данному изобретению эффективное количество конкретного соединения, возможно в форме соли, в качестве активного ингредиента объединяют в однородную смесь с фармацевтически приемлемым носителем или разбавителем, причем носитель или разбавитель может принимать большое разнообразие форм в зависимости от формы препарата, требующегося для введения. Эти фармацевтические композиций желательно находятся в единичной лекарственной форме, пригодной, в частности, для введения перорально, ректально, чрескожно, посредством парентеральной инъекции или ингаляции. Например, при получении композиций в пероральной лекарственной- 11017648 форме, можно использовать любую из обычных фармацевтических сред, таких как, например, вода, гликоли, масла, спирты и тому подобное в случае пероральных жидких препаратов, таких как, например,суспензии, сиропы, эликсиры, эмульсии и растворы; или твердые носители такие как, например, крахмалы, сахара, каолин, разбавители, смазывающие вещества, связывающие вещества, разрыхлители и тому подобное в случае порошков, драже, капсул и таблеток. Из-за легкости введения предпочтительным является пероральное введение, и таблетки и капсулы представляют наиболее полезные пероральные стандартные лекарственные формы, в этом случае очевидно используют твердые фармацевтические носители. Для парентеральных композиций носитель обычно содержит стерильную воду, по меньшей мере в значительной части, однако могут быть включены другие ингредиенты, например способствующие растворимости. Например, могут быть получены инъецируемые растворы, в которых носитель содержит солевой раствор, раствор глюкозы или смесь солевого и глюкозного растворов. Также могут быть получены инъецируемые суспензии, при этом могут быть использованы подходящие жидкие носители, суспендирующие агенты и тому подобное. Кроме того, включены препараты в твердой форме, которые предназначены для превращения, незадолго до использования, в препараты в жидкой форме. В композициях, подходящих для чрескожного введения, носитель возможно содержит усиливающий проникновение агент и/или подходящий смачивающий агент, возможно объединенный с подходящими вспомогательными веществами любой природы в минимальных соотношениях, которые не оказывают выраженного вредного воздействия на кожу. Указанные вспомогательные вещества могут облегчать введение на кожу и/или могут быть полезны для приготовления желательных композиций. Данные композиции можно вводить различными путями, например в виде трансдермального пластыря, в виде препарата для нанесения на кожу, в виде мази. Особенно выгодно приготовление вышеуказанных фармацевтических композиций в стандартной лекарственной форме для легкого введения и равномерности дозирования. Стандартная лекарственная форма при использовании в данном описании изобретения относится к физически дискретным единицам,пригодным в качестве единичных дозировок, где каждая единица содержит заранее определенное количество активного ингредиента, рассчитанное для получения нужного терапевтического эффекта в сочетании с требующимся фармацевтическим носителем. Примерами таких стандартных лекарственных форм являются таблетки (включая таблетки с риской или покрытые оболочкой таблетки), капсулы, драже, пакетики с порошком, облатки, суппозитории, инъецируемые растворы или суспензии и тому подобное и их отдельные составные части. Точная дозировка и частота введения зависит от конкретного используемого соединения формулы(I), конкретного состояния, подлежащего лечению, тяжести состояния, подлежащего лечению, возраста,массы, пола, степени расстройства и общего физического состояния конкретного пациента, а также другого лечения, которое может принимать индивидуум, как хорошо известно специалистам в данной области техники. Кроме того, очевидно, что указанное эффективное суточное количество может быть уменьшено или увеличено в зависимости от ответа получающего лечение субъекта и/или в зависимости от заключения терапевта, прописывающего соединения по настоящему изобретению. В зависимости от способа введения фармацевтическая композиция содержит от 0,05 до 99 мас.%,предпочтительно от 0,1 до 70 мас.%, более предпочтительно от 0,1 до 50 мас.% активного ингредиента, и от 1 до 99,95 мас.%, предпочтительно от 30 до 99,9 мас.%, более предпочтительно от 50 до 99,9 мас.%. фармацевтически приемлемого носителя, все процентные содержания представлены на основе общей массы композиции. Как уже отмечалось, изобретение также относится к фармацевтической композиции, содержащей соединения по изобретению, и одно или более чем одно другое лекарственное средство, в лечении, предупреждении, контроле, смягчении или снижении риска заболеваний или состояний, для которых могут иметь применение соединения формулы (I) или другие лекарственные средства, а также к использованию такой композиции для изготовления лекарственного средства. Настоящее изобретение также относится к комбинации соединения по настоящему изобретению и ортостерического агониста mGluR2. Настоящее изобретение также относится к такой комбинации для использования в качестве лекарственного средства. Настоящее изобретение также относится к продукту, содержащему (а) соединение по настоящему изобретению, его фармацевтически приемлемую соль или его сольват, и (б) ортостерический агонистmGluR2 в виде комбинированного препарата для одновременного, раздельного или последовательного применения в лечении или предупреждении состояния млекопитающего, включая человека, лечение или предупреждение которого находится под влиянием или облегчается нейромодуляторным эффектом аллостерических модуляторов mGluR2, в частности положительных аллостерических модуляторовmGluR2. Разные лекарственные средства такой комбинации или продукта могут быть объединены в одном препарате вместе с фармацевтически приемлемыми носителями или разбавителями, или каждый из них может присутствовать в отдельном препарате вместе с фармацевтически приемлемыми носителями или разбавителями. Следующие примеры предназначают для иллюстрации, но не для ограничения объема настоящего изобретения.- 12017648 Химия Некоторые способы получения соединений по данному изобретению проиллюстрированы в следующих примерах. Если не указано иное, все исходные вещества были получены от торговых поставщиков и использовались без дополнительной очистки. Ниже в данном описании изобретения "THF" означает тетрагидрофуран; "DMF" означает N,Nдиметилформамид; "EtOAc" означает этилацетат; "DCM" означает дихлорметан; "DME" означает 1,2 диметоксиэтан; "DCE" означает 1,2-дихлорэтан; "DIPE" означает диизопропиловый эфир; "DMSO" означает диметилсульфоксид; "BINAP" означает [1,1'-бинафталин]-2,2'-диил-бис[дифенилфосфин]; "DBU" означает 1,8-диаза-7-бицикло[5.4.0]ундецен;(9,9-диметил-9H-ксантен-4,5 диил)бис[дифенилфосфин]; МеОН означает метанол; "q.s." означает "сколько требуется"; "М.Р." означает точку плавления; Реакции под действием микроволн выполняли в однорежимном реакторе: микроволновом реакторе Бромметилциклопропан (3,68 г, 27,33 ммоль) и карбонат калия (10,3 г, 74,52 ммоль) добавляли к раствору 4-бензилокси-1H-пиридин-2-она (5,0 г, 24,84 ммоль) в ацетонитриле (200 мл), и смесь нагревали с обратным холодильником в течение 16 ч. Реакционную смесь фильтровали через диатомитовую землю и концентрировали в вакууме. Неочищенный остаток затем растирали с диэтиловым эфиром с получением чистого D1 (6,32 г, 98 %) в виде белого твердого вещества. Описание 2. 1-Циклопропилметил-4-гидрокси-1H-пиридин-2-он (D2). Смесь промежуточного соединения D1 (2,0 г, 7,83 ммоль) и каталитического количества 10%-ного палладия на активированном угле в этаноле (300 мл) перемешивали в атмосфере водорода в течение двух часов. Смесь фильтровали через диатомитовую землю, и растворитель выпаривали в вакууме с получением промежуточного соединения D2 (1,3 г, 100 %), которое использовали без дополнительной очистки. Описание 3. 4-Бром-1-циклопропилметил-1H-пиридин-2-он (D3). Бромокись фосфора (5,4 г, 18,9 ммоль) добавляли к раствору промежуточного соединения D2 (1,42 г, 8.6 ммоль) в DMF (140 мл), и смесь нагревали при 110 С в течение 1 ч. После охлаждения на ледяной бане раствор разделяли между водой и EtOAc. После трех экстракций EtOAc объединенные органические фракции сушили (Na2SO4), и растворитель выпаривали в вакууме. Неочищенный продукт очищали колоночной хроматографией (силикагель; DCM в качестве элюента). Нужные фракции собирали и упаривали в вакууме с получением промежуточного соединения D3 (1,82 г, 93%). Описание 7. 4-Бром-1-(3-метилбутил)-1H-пиридин-2-он (D7). Промежуточное соединение D7 получали, следуя методике, используемой для синтеза D3, используя 4-гидрокси-1-(3-метилбутил)-1H-пиридин-2-он в качестве исходного вещества, который получали способом, используемым для синтеза промежуточного соединения D2, путем взаимодействия 4 бензилокси-1H-пиридин-2-она с 1-бром-3-метилбутаном. Описание 4. 4-Бензилокси-1-бутил-1H-пиридин-2-он (D4). 1-Бромбутан (3,75 г, 27,33 ммоль) и карбонат калия (10,3 г, 74,52 ммоль) добавляли к раствору 4 бензилокси-1H-пиридин-2-она (5,0 г, 24,84 ммоль) в ацетонитриле (200 мл), и смесь нагревали с обратным холодильником в течение 16 ч. Реакционную смесь фильтровали через диатомитовую землю и концентрировали в вакууме. Затем неочищенный остаток растирали с диэтиловым эфиром с получением чистого D4 (6.26 г, 98 %) в виде белого твердого вещества. Смесь промежуточного соединения D4 (2,01 г, 7,83 ммоль) и каталитического количества 10%-ного палладия на активированном угле в этаноле (300 мл) перемешивали в атмосфере водорода в течение двух часов. Смесь фильтровали через диатомитовую землю, и растворитель выпаривали в вакууме с получением промежуточного соединения D5 (1,3 г, 100%), которое использовали без дополнительной очистки. Описание 6. 4-Бром-1-бутил-1H-пиридин-2-он (D6). Бромокись фосфора (5,4 г, 18,9 ммоль) добавляли к раствору промежуточного соединения D5 (1,44 г, 8,6 ммоль) в DMF (140 мл), и смесь нагревали при 110 С в течение 1 ч. После охлаждения на ледяной бане раствор разделяли между водой и EtOAc. После трех экстракций EtOAc, объединенные органические фракции сушили (Na2SO4), и растворитель выпаривали в вакууме. Неочищенный продукт очищали колоночной хроматографией (силикагель; DCM в качестве элюента). Нужные фракции собирали и упаривали в вакууме с получением промежуточного соединения D6 (1,82 г, 93%). Описание 8. 1-Бутил-3-хлор-4-гидрокси-1H-пиридин-2-он (D8).N-Хлорсукцинимид (1,6 г, 11,96 ммоль) добавляли к раствору промежуточного соединения D5 (2,0 г, 11,96 ммоль) в DMF (30 мл). Реакционную смесь перемешивали при комнатной температуре в течение ночи и затем концентрировали в вакууме. Неочищенный продукт очищали колоночной хроматографией(силикагель; 0-5% метанол/DCM в качестве элюента) с получением промежуточного соединения D8 (2,0 г, 83 %). Описание 9. 1-Бутил-3-хлор-2-оксо-1,2-дигидропиридин-4-иловый эфир трифторметансульфоновой кислоты (D9). Пиридин (1,60 мл, 19,8 ммоль) добавляли к охлажденному (-78 С) раствору промежуточного соединения D8 (2,0 г, 9,92 ммоль) в DCM (80 мл). Полученный раствор перемешивали в течение 10 минут,после чего добавляли ангидрид трифторметансульфоновой кислоты (1,90 мл, 10,9 ммоль), полученный раствор перемешивали при -78 С в течение 3 ч. Затем смесь нагревали до комнатной температуры и гасили добавлением водного насыщенного хлорида аммония. Смесь разбавляли водой, экстрагировалиDCM, сушили (Na2SO4), и растворитель выпаривали в вакууме, получая промежуточное соединение D9(3,31 г, 100%) в виде неочищенного продукта, который использовали без дополнительной очистки. Описание 10. 4-Бензилокси-1-циклопропилметил-3-йод-1H-пиридин-2-он (D10).N-Йодосукцинимид (2,64 г, 11,74 ммоль) добавляли к раствору промежуточного соединения D1 (3,0 г, 11,74 ммоль) в уксусной кислоте (40 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч, после чего ее концентрировали в вакууме, очищали флэш-хроматографией (силикагель; 0-3% метанол/DCM в качестве элюента) и наконец перекристаллизовывали из диэтилового эфира с получением промежуточного соединения D10 (4,12 г, 92%) в виде твердого вещества. Описание 11. 4-Бензилокси-1-циклопропилметил-3-трифторметил-1H-пиридин-2-он (D11).D10 (1,0 г, 2,63 ммоль) добавляли к раствору иодида меди (I) (0,99 г, 5,24 ммоль) в DMF (30 мл). Затем смесь нагревали при 100 С в течение 5 ч, после чего ее фильтровали через диатомитовую землю, и- 14017648 фильтрат концентрировали в вакууме. Остаток очищали колоночной хроматографией (силикагель; DCM в качестве элюента) с получением промежуточного соединения D11 (0,76 г, 89%). Описание 12. 1-Циклопропилметил-4-гидрокси-3-трифторметил-1H-пиридин-2-он (D12). Смесь промежуточного соединения D11 (2,0 г, 6,19 ммоль), каталитическое количество 10% палладия на активированном угле и этанол (60 мл) перемешивали в атмосфере водорода в течение 2 ч. Смесь фильтровали через диатомитовую землю, и растворитель выпаривали в вакууме с получением неочищенного промежуточного соединения D12 (1,45 г, 100%), которое использовали без дополнительной очистки. Описание 13. 4-Бром-1-циклопропилметил-3-трифторметил-1H-пиридин-2-он (D13). Бромокись фосфора (7,03 г, 24,5 ммоль) добавляли к раствору промежуточного соединения D12(2,60 г, 11,1 ммоль) в DMF (50 мл), и смесь нагревали при 110 С в течение 1 ч. После охлаждения на ледяной бане раствор разделяли между водой и EtOAc. После трех экстракций EtOAc объединенные органические фракции сушили (Na2SO4), и растворитель выпаривали в вакууме. Неочищенный продукт очищали колоночной хроматографией (силикагель; DCM в качестве элюента). Нужные фракции собирали и упаривали в вакууме с получением промежуточного соединения D13 (1,38 г, 42%). Описание 14. 4-Бензилокси-1-(4-трифторметокси-бензил)-1H-пиридин-2-он (D14). 1-Бромметил-4-трифторметоксибензол (3,32 г, 13,04 ммоль) и карбонат калия (3,51 г, 25,46 ммоль) добавляли к смеси 4-бензилокси-1H-пиридин-2-она (2,5 г, 12,42 ммоль) в ацетонитриле (10 мл). Реакционную смесь нагревали с обратным холодильником в течение 24 ч. После охлаждения до комнатной температуры ее фильтровали через диатомитовую землю, твердые остатки промывали метанолом, и объединенные органические экстракты упаривали в вакууме. Полученный таким образом неочищенный остаток осаждали при помощи DIPE с получением промежуточного соединения D14 (4,5 г, 96%) в виде белого твердого вещества. Описание 15. 4-Бензилокси-3-хлор-1-(4-трифторметоксибензил)-1H-пиридин-2-он (D15).N-Хлорсукцинимид (1,68 г, 12,61 ммоль) добавляли к раствору промежуточного соединения D14(4,31 г, 11,47 ммоль) в DMF (30 мл), и смесь перемешивали при комнатной температуре в течение 24 часов. Растворитель выпаривали, и твердый остаток промывали водой (425 мл). Неочищенное твердое вещество промывали DIPE с получением промежуточного соединения D15 (4,5 г, 95%) в виде белого твердого вещества. Описание 16. 3-Хлор-4-гидрокси-1-(4-трифторметоксибензил)-1H-пиридин-2-он (D16). Бромистоводородную кислоту (0,1 мл) добавляли к смеси промежуточного соединения D15 (4,5 г,10,98 ммоль) в уксусной кислоте (20 мл). Раствор нагревали при 130 С в течение 30 мин под микроволновым излучением. После охлаждения до комнатной температуры растворитель выпаривали в вакууме, и остаток обрабатывали водным насыщенным раствором NaHCO3 вплоть до достижения раствором рН приблизительно 8. Белое твердое вещество, которое осаждалось, собирали фильтрацией и промывали холодным DIPE с получением промежуточного соединения D16 (1,1 г, 31%). Описание 17. 4-Бром-3-хлор-1-(4-трифторметоксибензил)-1H-пиридин-2-он (D17). Бромокись фосфора (1,05 г, 3,75 ммоль) добавляли к раствору промежуточного соединения D16 (1,0 г, 3,13 ммоль) в DMF (5 мл), и смесь нагревали при 115 С в течение 4 ч. Растворитель выпаривали в ва- 15017648 кууме, и неочищенный остаток обрабатывали водным насыщенным раствором NaHCO3. Смесь экстрагировали DCM (35 мл), органические фракции сушили (Na2SO4), и растворитель выпаривали в вакууме. Неочищенный продукт очищали колоночной хроматографией (силикагель; диэтиловый эфир в качестве элюента). Нужные фракции собирали и упаривали в вакууме с получением промежуточного соединения 4-Фенилпиперидин (0,45 г, 2,78 ммоль), ацетат палладия(II) (0,016 г, 0,069 ммоль), трет-бутилат натрия (0,34 г, 3,5 ммоль) и BINAP (0,065 г, 0,104 ммоль) добавляли к раствору промежуточного соединения D3 (0,32 г, 1,39 ммоль) в толуоле (5 мл). Реакционную смесь нагревали при 100 С в течение 16 ч в герметично закрытой пробирке, после чего ее охлаждали до комнатной температуры, разбавляли водой(5 мл) и затем экстрагировали EtOAc (35 мл). Объединенные органические фракции сушили (Na2SO4), и растворитель выпаривали в вакууме. Неочищенный продукт очищали колоночной хроматографией (силикагель; 0-4% метанол/DCM в качестве элюента). Нужные фракции собирали и упаривали в вакууме с получением промежуточного соединения D18 (0,33 г, 78%). Описание 19. 1'-Бутил-4-фенил-3,4,5,6-тетрагидро-2H,1'H-[1,4']бипиридинил-2'-он (D19). 4-Фенилпиперидин (0,45 г, 2,78 ммоль), ацетат палладия(II) (0,016 г, 0,069 ммоль), трет-бутилат натрия (0,34 г, 3.5 ммоль) и BINAP (0,065 г, 0,104 ммоль) добавляли к раствору промежуточного соединения D6 (0,32 г, 1,39 ммоль) в толуоле (5 мл). Реакционную смесь нагревали при 100 С в течение 16 ч в герметично закрытой пробирке, после чего ее охлаждали до комнатной температуры и затем разбавляли водой (5 мл) и экстрагировали EtOAc (35 мл). Объединенные органические фракции сушили (Na2SO4), и растворитель выпаривали в вакууме. Неочищенный продукт очищали колоночной хроматографией (силикагель; 0-4% метанол/DCM в качестве элюента). Нужные фракции собирали и упаривали в вакууме с получением промежуточного соединения D19 (0,38 г, 89%). Описание 20. 1'-Циклопропилметил-2'-оксо-4-фенил-3,4,5,6,1',2'-гексагидро-2H-[1,4'] бипиридинил 4-карбонитрил (D20) JNJ-38818468. Гидрохлорид 4-циано-4-фенилпиперидина (0,314 г, 1,41 ммоль), ацетат палладия(II) (0,013 г, 0,059 ммоль), трет-бутилат натрия (0,347 г, 3,54 ммоль) и BINAP (0,051 г, 0,08 ммоль) добавляли к перемешиваемому раствору промежуточного соединения D3 (0,27 г, 1,18 ммоль) в толуоле (5 мл). Реакционную смесь нагревали при 100 С в течение 16 ч в герметично закрытой пробирке. После охлаждения до комнатной температуры смесь разбавляли водой и экстрагировали EtOAc. Объединенную органическую фазу сушили (Na2SO4), и растворитель выпаривали в вакууме. Неочищенный продукт очищали колоночной хроматографией (силикагель; 10% аммоний в метаноле (7M)/DCM в качестве элюента). Нужные фракции собирали и упаривали в вакууме с получением D20 (0,35 г, 87%) в виде светло-желтого масла. Описание 21. трет-Бутиловый эфир 4-гидрокси-4-фенилпиперидин-1-карбоновой кислоты (D21). Метил-2-бромбензоат (1,816 мл, 12,936 ммоль) [CAS 610-94-6] добавляли к раствору 1,2,3,6 тетрагидро-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)-пиридина (4 г, 12,936 ммоль) [CAS 37585382-0] (синтез описан в WO 2004072025 А 2 20040826) в 1,4-диоксане (28 мл) и водном насыщенном растворе NaHCO3 (24 мл). Полученный раствор дегазировали, используя поток азота, и к этому раствору добавляли Pd(PPh3)4 (0,747 г, 0,647 ммоль). Реакционную смесь в герметично закрытой пробирке затем подвергали воздействию микроволнового излучения при 140 С в течение 5 мин. Полученную охлажденную реакционную смесь затем разбавляли EtOAc и фильтровали через слой диатомитовой земли. Фильт- 16017648 рат собирали, сушили над Na2SO4 и концентрировали в вакууме. Неочищенную реакционную смесь затем очищали колоночной хроматографией (силикагель; DCM к DCM/EtOAc вплоть до 6% в качестве элюента). Нужные фракции собирали и упаривали в вакууме с получением D21 (4,04 г, 98%). Описание 22. трет-Бутиловый эфир 4-(2-фтор-4-метоксикарбонилфенил)-3,6-дигидро-2H-пиридин 1-карбоновой кислоты (D22). Метил-4-бром-3-фторбензоат (2,261 г, 9,702 ммоль) [CAS 849758-12-9] добавляли к раствору 1,2,3,6-тетрагидро-4-(4,4,5,5-тетраметил-1,3,2-диоксаборолан-2-ил)пиридина (3 г, 9,702 ммоль) [CAS 375853-82-0] (синтез описан в WO 2004072025 А 2 20040826) в 1,4-диоксане (21 мл) и водном насыщенном растворе NaHCO3 (18 мл). Полученный раствор дегазировали, используя поток азота, и к данному раствору добавляли Pd(PPh3)4 (0,561 г, 0,485 ммоль). Реакционную смесь в герметично закрытой пробирке затем подвергали воздействию микроволнового излучения при 150 С в течение 5 мин. Полученную охлажденную реакционную смесь затем разбавляли EtOAc и фильтровали через слой диатомитовой земли. Фильтрат собирали, сушили над Na2SO4 и концентрировали в вакууме. Неочищенную реакционную смесь затем очищали колоночной хроматографией (силикагель; от DCM до DCM/EtOAc вплоть до 6% в качестве элюента). Нужные фракции собирали и упаривали в вакууме с получением D22 (2,107 г, 65%). Описание 23. трет-Бутиловый эфир 4-(2-фтор-4-метоксикарбонилфенил)пиперидин-1-карбоновой кислоты (D23). Раствор промежуточного соединения D22 (2,81 г, 8,379 ммоль) в метаноле (120 мл) гидрировали при комнатной температуре в присутствие 10%-ного палладия на активированном угле (0,588 г) вплоть до завершения взаимодействия. Твердые вещества отфильтровывали, и фильтрат упаривали в вакууме с получением D23 (2,73 г, 97%). Описание 24. трет-Бутиловый эфир 4-[2-фтор-4-(1-гидрокси-1-метилэтил)фенил]пиперидин-1 карбоновой кислоты (D24). 1,4 М раствор метилмагния бромида в смеси толуол/THF (17,339 мл, 24,274 ммоль) добавляли по каплям к охлажденному (0 С) раствору промежуточного соединения D23 (2,73 г, 8,091 ммоль) в диэтиловом эфире (150 мл) в атмосфере азота. Полученную реакционную смесь затем перемешивали при 50 С в течение 2 ч. После охлаждения на ледяной бане смесь осторожно гасили насыщенным водным раствором хлорида аммония и затем экстрагировали с помощью EtOAc. Объединенную органическую фазу сушили (Na2SO4), и растворитель выпаривали в вакууме с получением D24 (3,16 г, 100%). Описание 25. 2-(3-Фтор-4-пиперидин-4-ил-фенил)пропан-2-ол (D25). Смесь промежуточного соединения D24 (3,067 Г, 7,852 ммоль) и КОН (2,54 г, 45,268 ммоль) в изопропиловом спирте (13,5 мл) и воде (27 мл) в герметично закрытой пробирке подвергали воздействию микроволновым излучением при 180 С в течение 60 мин. Полученную охлажденную реакционную смесь затем разбавляли водой и рассолом и экстрагировали дихлорметаном. Объединенные органические экстракты сушили (Na2SO4), и растворитель выпаривали в вакууме. Остаток обрабатывали дихлорметаном,вызывая образование твердого вещества, которое отфильтровывали с получением 1,03 г промежуточного соединения D25. Фильтрат упаривали в вакууме, и полученный таким образом остаток затем очищали колоночной хроматографией (силикагель; DCM/(NH3 7 н. раствор в МеОН) градиент вплоть до 10% в качестве элюента). Нужные фракции собирали и упаривали в вакууме с получением второй партии 0,5 г Раствор промежуточного соединения D21 (4,04 г, 12,729 ммоль) в метаноле (120 мл) гидрировали при комнатной температуре в присутствие 10% палладия на активированном угле (0,846 г) вплоть до завершения взаимодействия. Твердые вещества отфильтровывали, и фильтрат упаривали в вакууме с получением D26 в виде белого твердого вещества (3,67 г, 90%). Описание 27. трет-Бутиловый эфир 4-[2-(1-гидрокси-1-метилэтил)фенил]пиперидин-1-карбоновой кислоты (D27). 1,4 М раствор метилмагния бромида в смеси толуол/THF (17,443 мл, 24,421 ммоль) добавляли по каплям к охлажденному (0 С) раствору промежуточного соединения D26 (2,6 г, 8,14 ммоль) в диэтиловом эфире (150 мл) в атмосфере азота. Полученную реакционную смесь перемешивали при 45 С в течение 2 ч. После охлаждения на ледяной бане смесь осторожно гасили насыщенным водным раствором хлорида аммония и затем экстрагировали с помощью EtOAc. Объединенную органическую фазу сушили Смесь промежуточного соединения D27 (2,77 г, 5,636 ммоль) и KOH (2,43 г, 43,357 ммоль) в изопропиловом спирте (13,5 мл) и воде (27 мл) в герметично закрытой пробирке подвергали воздействию микроволнового излучения при 180 С в течение 60 мин. Полученную охлажденную реакционную смесь затем разбавляли водой и рассолом и экстрагировали дихлорметаном. Остаток обрабатывали дихлорметаном, вызывая образование твердого вещества, которое отфильтровали. Выход: 0,737 г промежуточного соединения D28. Фильтрат упаривали в вакууме, и остаток затем очищали колоночной хроматографией(силикагель; DCM/(NH3 7 н. раствор в МеОН) градиент вплоть до 10% в качестве элюента). Нужные фракции собирали и упаривали в вакууме с получением второй партии 0,306 г промежуточного соединения D28 (общее количеством=1,04 г, 84 %). М.Р. 219,5 С. Описание 29. трет-Бутиловый эфир 4-гидрокси-4-фенилпиперидин-1-карбоновой кислоты (D29). Ди-трет-бутилдикарбонат (2,95 г, 13,53 ммоль) добавляли к раствору 4-гидрокси-4 фенилпиперидина (2 г, 11,28 ммоль) в DCM (50 мл). Реакционную смесь перемешивали при комнатной температуре в течение 5 ч. Растворитель удаляли в вакууме с получением нужного промежуточного соединения D29 (3,12 г, 100%) в виде неочищенного вещества, которое использовали без дополнительной очистки. Описание 30. трет-Бутиловый эфир 4-фтор-4-фенилпиперидин-1-карбоновой кислоты (D30). Раствор (диэтиламино)серы трифторида (0,74 мл, 5,67 ммоль) в безводном DCM (q.s.) добавляли к охлажденному (-78 С) раствору D29 (1,5 г, 5,4 ммоль) в безводном DCM (30 мл) в атмосфере N2. После завершения добавления реакционную смесь перемешивали при -78 С в течение 1 ч и затем оставляли достигать комнатной температуры и перемешивали в течение еще 30 мин. Добавляли водный насыщенный раствор NaHCO3 (90 мл), и смесь перемешивали в течение 15 мин, затем органический слой отделяли. После этого добавляли 3-хлорпреоксибензойную кислоту (0,2 г, 1,18 ммоль), и реакционную смесь перемешивали при комнатной температуре в течение 30 мин. Реакционную смесь промывали водным- 18017648 насыщенным NaHCO3, Н 2 О и рассолом, сушили над Na2SO4, фильтровали и концентрировали в вакууме с получением нужного промежуточного соединения D30 (1,48 г, 98%) в виде неочищенного вещества, которое использовали без дополнительной очистки. Описание 31. 4-Фтор-4-фенилпиперидина гидрохлорид (D31).D30 (1,48 г, 5,29 ммоль) растворяли в 4 н. HCl в диоксане. Реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Растворитель удаляли. Неочищенный продукт растирали с диэтиловым эфиром и сушили в вакууме с получением нужного промежуточного соединения D31 (1,10 г, 97%) в виде хлоргидрата, который использовали без дополнительной очистки. Описание 32. 1'-Бутил-4-фтор-4-фенил-3,4,5,6-тетрагидро-2H,1'Н-[1,4']бипиридинил-2-он (D32).D31 (0,2 г, 0,94 ммоль), ацетат палладия(II) (0,009 г, 0,04 ммоль), трет-бутилат натрия (0,25 г, 2,58 ммоль) и BINAP (0,037 г, 0,06 ммоль) добавляли к перемешиваемому раствору промежуточного соединения D6 (0,20 г, 0,86 ммоль) в толуоле (5 мл). Реакционную смесь нагревали при 100 С в течение 16 ч в герметично закрытой пробирке. После охлаждения до комнатной температуры смесь разбавляли водой и экстрагировали EtOAc. Объединенную органическую фазу сушили (Na2SO4), и растворитель выпаривали в вакууме. Неочищенный продукт очищали колоночной хроматографией (силикагель; в качестве элюента 10% аммоний в метаноле (7 н.)/DCM). Нужные фракции собирали и упаривали в вакууме с получением Раствор промежуточного соединения D1 (3,0 г, 11,7 ммоль) и N-бромсукцинимида (2,09 г, 11,7 ммоль) в DCM (100 мл) перемешивали при комнатной температуре в течение 1 ч. Растворитель выпаривали в вакууме, и неочищенный остаток очищали колоночной хроматографией (силикагель; DCM в качестве элюента). Нужные фракции собирали и упаривали в вакууме с получением D33 (3,56 г, 91%). Описание 34. 4-Бензилокси-3-циклопропил-1-циклопропилметил-1H-пиридин-2-он (D34).NaHCO3 (1,0 г, избыток), циклопропилборную кислоту (0,74 г, 8,93 ммоль), карбонат калия (1,23 г,8,93 ммоль) и комплекс [1,1'-бис(дифенилфосфино)ферроцен]дихлорпалладий(II)-DCM (0,36 г, 0,45 ммоль) добавляли к раствору промежуточного соединения D10 (1,0 г, 2,98 ммоль) в 1,4-диоксане (10 мл). Полученную смесь нагревали при 175 С в течение 20 мин при использовании микроволнового излучения, после чего ее фильтровали через диатомитовую землю, и растворитель выпаривали в вакууме. Неочищенный остаток очищали колоночной хроматографией (силикагель; 0-3% метанол/DCM в качестве элюента). Нужные фракции собирали и упаривали в вакууме, с получением D34 (0,6 г, 69%). Описание 35. 3-Циклопропил-1-циклопропилметил-4-гидрокси-1H-пиридин-2-он (D35). Смесь промежуточного соединения D34 (1,0 г, 3,38 ммоль) и каталитического количества 10% палладия на активированном угле в этаноле (150 мл) перемешивали в атмосфере водорода в течение 2 ч. Смесь фильтровали через диатомитовую землю, и растворитель выпаривали в вакууме с получением промежуточного соединения D35 (0,69 г, 100%), которое использовали без дополнительной очистки. Описание 36. 4-Бром-3-циклопропил-1-циклопропилметил-1H-пиридин-2-он (D36). Бромокись фосфора (2,4 г, 8,28 ммоль) добавляли к раствору промежуточного соединения D35 (0,85 г, 4,14 ммоль) в DMF (60 мл), и смесь нагревали при 110 С в течение 1 ч. После охлаждения на ледяной бане раствор разделяли между водой и EtOAc. Смесь экстрагировали EtOAc (3200 мл), объединенные- 19017648 органические фракции сушили (Na2SO4), и растворитель выпаривали в вакууме. Неочищенный продукт очищали колоночной хроматографией (силикагель; DCM в качестве элюента). Нужные фракции собирали и упаривали в вакууме с получением промежуточного соединения D36 (0,99 г, 89%). Описание 37. 4-(1'-Циклопропилметил-2'-око-3,4,5,6,1',2'-гексагидро-2H-[1,4']бипиридинил-4-ил)бензойная кислота (D37).(0,015 г, 0,069 ммоль), трет-бутилат натрия (0,34 г, 3,44 ммоль) и BINAP (0,06 г, 0,096 ммоль) добавляли к перемешиваемому раствору промежуточного соединения D3 (0,31 г, 1,37 ммоль) в толуоле (10 мл). Реакционную смесь нагревали при 100 С в течение 16 ч в герметично закрытой пробирке. После охлаждения до комнатной температуры смесь разбавляли с помощью EtOAc и затем фильтровали через диатомитовую землю, после чего растворитель выпаривали в вакууме. Неочищенный остаток обрабатывали смесью DCM/метанол и затем отфильтровали. Фильтрат упаривали досуха в вакууме с получением неочищенного D37 (0,48 г, 100%), который использовали без дополнительной очистки. Описание 38. Метиловый эфир 4-(1'-циклопропилметил-2'-охо-3,4,5,6,1',2'-гексагидро-2H-[1,4']бипиридинил-4-ил)бензойной кислоты (D38) Смесь промежуточного соединения D37 (0,43 г, 1,23 ммоль), DBU (0,18 г, 1,23 ммоль), диметилкарбоната (4,5 мл, избыток, 93 ммоль) и ацетонитрила (5 мл) нагревали при 160 С в течение 20 мин под действием микроволнового излучения. Охлажденную неочищенную смесь разбавляли водой, и добавлялиEtOAc, после чего органический слой промывали 10% водным раствором лимонной кислоты, сушили(Na2SO4), и растворитель выпаривали в вакууме. Неочищенный остаток очищали колоночной хроматографией (силикагель; 0-3% метанол/DCM в качестве элюента). Нужные фракции собирали и упаривали в вакууме с получением D38 (0,19 г, 38%). Описание 39. 1'-Циклопропилметил-4-[4-(1-гидрокси-1-метилэтил)фенил]-3,4,5,6-тетрагидро-2H,1'H-[1,4']бипиридинил-2'-он (D39). 1,4 М раствор метилмагния бромида в смеси толуол/THF (1,12 мл, 1,57 ммоль) добавляли по каплям к охлажденному (0 С) раствору промежуточного соединения D38 (0,19 г, 0,52 ммоль) в THF (20 мл) в атмосфере азота. Полученную реакционную смесь перемешивали при 45 С в течение 2 ч. После охлаждения на ледяной бане смесь осторожно гасили насыщенным водным раствором хлорида аммония и затем экстрагировали EtOAc. Объединенную органическую фазу сушили (Na2SO4), и растворитель выпаривали в вакууме. Остаток очищали колоночной хроматографией (силикагель; 0-5% метанол/DCM в качестве элюента). Нужные фракции собирали и упаривали в вакууме с получением D39 (0,077 г, 40%) в виде масла. Пример 1. 3'-Хлор-1'-циклопропилметил-4-фенил-3,4,5,6-тетрагидро-2H,1'Н-[1,4']бипиридинил-2'он (Е 1). Раствор промежуточного соединения D18 (0,2 г, 0,65 ммоль) и N-хлорсукцинимида (0,09 г, 0,65 ммоль) в DCM (10 мл) перемешивали при комнатной температуре в течение 1 ч. Растворитель выпаривали в вакууме, и неочищенный продукт очищали колоночной хроматографией (силикагель; 0-3% метанол/DCM в качестве элюента). Нужные фракции собирали и упаривали в вакууме, и полученное твердое вещество перекристаллизовывали из диэтилового эфира с получением соединения Е 1 (0,10 г, 47%) в виде Раствор промежуточного соединения D19 (0,43 г, 1,40 ммоль) и N-хлорсукцинимида (0,19 г, 1,40 ммоль) в DCM (10 мл) перемешивали при комнатной температуре в течение 1 ч. Растворитель выпаривали в вакууме, и неочищенный продукт очищали колоночной хроматографией (силикагель; 0-3% метанол/DCM в качестве элюента). Нужные фракции собирали и упаривали в вакууме, и полученное твердое вещество перекристаллизовывали из диэтилового эфира с получением соединения Е 2 (0,39 г, 82%) в виде белого твердого вещества. Точка плавления: 149,4 С. 1 Н ЯМР (400 МГц, CDCl3)м.д. 0.95 (t, J=7,3 Гц, 3 Н), 1.31-1.42 (m, 2 Н), 1.68-1.78 (m, 2 Н), 1.85-1.98 (m, 4 Н), 2.64-2.73 (m, 1 Н), 2.87-2.96 (m, 2 Н), 3.82 (brN-Бромсукцинимид (0,145 г, 0,82 ммоль) добавляли к раствору промежуточного соединения D18(0,25 г, 0,82 ммоль) в DCM (10 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Далее растворитель выпаривали в вакууме, и неочищенный остаток очищали колоночной хроматографией (силикагель; 0-3% метанол/DCM в качестве элюента). Нужные фракции собирали и упаривали в вакууме с получением соединения Е 3 (0,20 г, 64%) в виде белого твердого вещества. Точка плавления: 150 С. 1 Н ЯМР (500 МГц, DMSO-d6)м.д. 0.34-0.40 (m, 2 Н), 0.44-0.50 (m, 2 Н), 1.16-1.26 (m, 1 Н),1.77 (qd, J=12,38, 3,61 Гц, 2 Н), 1.88 (br d, J=12,1 Гц, 2 Н), 2.68-2.78 (m, 1 Н), 2.91 (br t, J=11,9 Гц, 2 Н) 3.69D13 (0,3 г, 1,01 ммоль) в толуоле (7 мл). Реакционную смесь нагревали при 100 С в течение 16 ч в герметично закрытой пробирке, после чего ее охлаждали до комнатной температуры и затем разбавляли водой(5 мл) и экстрагировали EtOAc (35 мл). Объединенные органические фракции сушили (Na2SO4), и растворитель выпаривали в вакууме. Неочищенный продукт очищали колоночной хроматографией (силикагель; 0-4% метанол/DCM в качестве элюента). Нужные фракции собирали и упаривали в вакууме с получением соединения Е 4 (0,11 г, 31%) в виде белого твердого вещества. Точка плавления: 177,2 С. 1 Н ЯМР (500 МГц, DMSO-d6)м.д. 0.33-0.38 (m, 2 Н), 0.45-0.50 (m, 2 Н), 1.13-1.22 (m 1 Н), 1.641.75(m, 2 Н), 1.84 (brd, J=11,0 Гц, 2 Н), 2.72-2.80 (m, 1 Н), 3.14 (br t, J=12,1 Гц, 2 Н), 3.59 (br d, J=13,0 Гц, 2 Н), 3.65 (d, J=7,2 Гц, 2 Н), 6.21 (d, J=7,8 Гц, 1 Н), 7.19-7.23 m, 1 Н), 7.24 - 7.29 (m, 2 Н), 7.29-7.34 (m, 2 Н),7.73 (d, J=7,8 Гц, 1 Н). Пример 5. 3'-Хлор-4-фенил-1'-(4-трифторметоксибензил)-3,4,5,6-тетрагидро-2H,1'H-[1,4']бипиридинил-2'-он (Е 5). Смесь промежуточного соединения D17 (0,2 г, 0,52 ммоль), 4-фенилпиперидина (0,1 г, 0,62 ммоль),ацетата 2-(2'-ди-трет-бутилфосфин)бифенилпалладия(II) (0,01 г, 0,026 ммоль) и фосфат калия (0,23 г, 1,1 ммоль) в 1,4-диоксане (3 мл) перемешивали при 90 С в течение 35 ч. Смесь фильтровали через диатоми- 21017648 товую землю, и фильтрат упаривали досуха после промывания дополнительным 1,4-диоксаном. Неочищенный продукт очищали колоночной хроматографией (силикагель; гептан/диэтиловый эфир 1:1 в качестве элюента). Нужные фракции собирали и упаривали в вакууме с получением соединения Е 5 (0,075 г,31%) в виде белого твердого вещества. Точка плавления: 168,6 С. 1 Н ЯМР (400 МГц, CDCl3)м.д. 1.831.98 (m, 4 Н), 2.65-2.75 (m, 1 Н), 2.89-2.98 (m, 2 Н), 3.84 (brd, J=12,2 Гц, 2 Н), 5.12 (s, 2 Н), 6.06 (d, J=7,6 Гц, 1 Н), 7.14 (d, J=7,6 Гц, 2 Н), 7.15-7.28 (m, 5 Н), 7.29-7.40 (m, 4 Н). Пример 6. 3'-Хлор-1'-циклопропилметил-2'-оксо-4-фенил-3,4,5,6,1',2'-гексагидро-2H-[1,4']бипиридинил-4-карбонитрил (Е 6). Раствор промежуточного соединения D20 (0,35 Г, 1,03 ммоль) и N-хлорсукцинимида (0,14 г, 1,03 ммоль) в DCM (25 мл) перемешивали при комнатной температуре в течение 1 ч. После добавления дополнительного DCM раствор промывали рассолом, сушили (Na2SO4), и растворитель выпаривали в вакууме. Неочищенный продукт очищали колоночной хроматографией (силикагель; 10% аммоний в метаноле (7 н.)/DCM В качестве элюента) и дополнительно очищали посредством препаративной ВЭЖХ. Нужные фракции собирали и упаривали в вакууме с получением соединения Е 6 (0,17 г, 47%) в виде белого твердого вещества. Точка плавления: 173,7 С. 1 Н ЯМР (400 МГц, DMSO-d6)м.д. 0.17-0.23 (m, 2 Н), 0.26-0.33 (m, 2 Н), 0.97-1.09 (m, 1 Н), 1.91-2.02 (m, 2 Н), 2.11 (brd, J=12,9 Гц, 2 Н) 2.98 (brt, J=12,4 Гц, 2 Н), 3.54-3.63 (m, 4 Н), 6.14 (d, J=7,4 Гц, 1 Н), 7.20-7.26 (m, 1 Н), 7.27-7.35 (m, 2 Н), 7.40-7.44 (m, 2 Н), 7.52 Раствор промежуточного соединения D32 (0,21 г, 0,66 ммоль) и N-хлорсукцинимида (0,08 г, 0,66 ммоль) в DCM (30 мл) перемешивали при комнатной температуре в течение 10 мин. После добавления дополнительного DCM раствор промывали рассолом, сушили (Na2SO4), и растворитель выпаривали в вакууме. Неочищенный продукт очищали колоночной хроматографией (силикагель; 10% аммоний в метаноле (7 M)/DCM в качестве элюента) и дополнительно очищали препаративной ВЭЖХ. Нужные фракции собирали и упаривали в вакууме с получением соединения Е 7 (0,065 г, 27%) в виде белого твердого вещества. Точка плавления: 136,7 С. 1 Н ЯМР (400 МГц, DMSO-d6)м.д. 0.89 (t, J=7,4 Гц, 3 Н), 1.21-1.32 4-Фенилпиперидин (0,22 г, 1,34 ммоль), ацетат палладия(II) (0,008 г, 0,034 ммоль), трет-бутилат натрия (0,16 г, 1,68 ммоль) и BINAP (0,032 г, 0,05 ммоль) добавляли к раствору промежуточного соединения D36 (0,18 г, 0,67 ммоль) в толуоле (5 мл). Реакционную смесь нагревали при 100 С в течение 16 ч в герметично закрытой пробирке, после чего ее охлаждали до комнатной температуры и затем разбавляли водой (5 мл) и экстрагировали EtOAc (35 мл). Объединенные органические фракции сушили (Na2SO4), и растворитель выпаривали в вакууме. Неочищенный продукт очищали колоночной хроматографией (силикагель; 0-4% метанол/DCM в качестве элюента). Нужные фракции собирали и упаривали в вакууме с получением соединения Е 8 (0,18 г, 77%) в виде белого твердого вещества. Точка плавления: 201,9 С. 1 Н ЯМР (500 МГц, DMSO-d6)м.д. 0.30-0.35 (m, 2 Н), 0.41-0.47 (m, 2 Н), 0.74-0.80 (m, 2 Н), 0.860.92 (m, 2 Н), 1.11-1.21 (m, 1 Н), 1.60-1.67 (m, 1 Н), 1.73-1.89 (m, 4 Н), 2.63-2.72 (m, 1 Н), 2.87 (br t, J=11,1 Гц, 2 Н), 3.57-3.65 (m, 4 Н), 6.07 (d, J=7,5 Гц, 1H), 7.19-7.24 (m, 1 Н), 7.26-7.37 (m, 4 Н), 7.46 (d, J=7,5 Гц, 1 Раствор промежуточного соединения D39 (0,077 г, 0,21 ммоль) и N-хлорсукцинимида (0,03 г, 0,21 ммоль) в DCM (8 мл) перемешивали при комнатной температуре в течение 5 мин. Неочищенную смесь промывали насыщенным раствором NaHCO3, затем его экстрагировали с помощью DCM, объединенные органические фракции сушили (Na2SO4), и растворитель выпаривали в вакууме. Неочищенный остаток очищали колоночной хроматографией (силикагель; 0-5% метанол/DCM в качестве элюента). Выполняли вторую хроматографию (силикагель; DCM/EtOAc 1:1, и в заключение 100% EtOAc в качестве элюентов). Нужные фракции собирали и упаривали в вакууме, и полученное твердое вещество кристаллизовали из диэтилового эфира с получением соединения Е 9 (0,06 г, 71%) в виде белого твердого вещества. 1 Н ЯМР (400 МГц, CDCl3)м.д. 0.35-0.41 (m, 2 Н), 0.56-0.64 (m, 2 Н), 1.19-1.30 (m, 1 Н), 1.59 (s, 6 Н), 1.73 (s, 1 Н), 1.85-1.99 (m, 4 Н), 2.65-2.76 (m, 1 Н), 2.87-2.97 (m, 2 Н), 3.78-3.87 (m, 4 Н), 6.05 (d, J=7,6 Гц, 1 Н), 7.21-7.26 (m, 3 Н), 7.45 (d, J=8,3 Гц, 2 Н). Пример 20. 3'-Хлор-1'-циклопропилметил-4-(2-фторэтокси)-4-фенил-3,4,5,6-тетрагидро-2H,1'Н[1,4']бипиридинил-2'-он (Е 20). Раствор соединения Е 31 (0,164 г, 0,46 ммоль) в 1,2-диметоксиэтане (3 мл) добавляли по каплям к смеси гидрида натрия (0,023 г, 0,58 ммоль) в 1,2-диметоксиэтане (0,5 мл) при 0 С. Реакционную смесь перемешивали при комнатной температуре в течение 15 мин и затем добавляли раствор 2 фторэтилтозилата [CAS: 383-50-6] (0,222 г, 1 ммоль) в 1,2-диметоксиэтане (1 мл). Реакционную смесь в герметично закрытой пробирке подвергали воздействию микроволнового излучения при 180 С в течение 20 мин. Смесь охлаждали до комнатной температуры и добавляли дополнительное количество гидрида натрия (0,023 г, 0,58 ммоль). Смесь нагревали при 180 С в течение 20 мин при использовании микроволнового излучения. После охлаждения до комнатной температуры добавляли водный насыщенный раствор хлорида аммония, и смесь экстрагировали EtOAc. Органический слой отделяли, сушили (Na2SO4), и растворитель выпаривали. Неочищенный продукт очищали сначала посредством колоночной хроматографии (силикагель; элюент: DCM/EtOAc от 100/0 до 90/10). Нужные фракции собирали и упаривали в вакууме с получением соединения Е 20 (0,041 г, 18%). 1 Н ЯМР (400 МГц, CDCl3)м.д. 0.36-0.40 (m, 2 Н),0.58-0.62 (m, 2 Н), 1.22-1.28 (m, 1 Н), 2.12-2.21 (m, 4 Н), 3.27-3.36 (m, 4 Н), 3.57 (br d, J=12,1 Гц, 2 Н), 3.80(Диэтиламино)серы трифторид (0,046 мл, 0.35 ммоль) добавляли к охлажденному (-78 С) раствору соединения Е 30 (0,119 г, 0,32 ммоль) в DCM (1 мл). Реакционную смесь перемешивали при -78 С в течение 3 ч и затем дополнительно в течение 2 ч при 0 С. Затем добавляли дополнительно (диэтиламино)серы трифторид (0,046 мл, 0,35 ммоль) и смесь перемешивали в течение еще 1 ч при комнатной температуре. Добавляли Na2CO3 (водный насыщенный раствор), и смесь разбавляли DCM. Органический слой отделяли, сушили (Na2SO4) и упаривали досуха. Неочищенный продукт очищали колоночной хроматографией (силикагель; элюент: DCM/EtOAc от 100/0 до 80/20). Нужные фракции собирали, упаривали в вакууме, и наконец сушили сублимацией с получением соединения Е 21 (0,019 г, 16 %) в виде белой пены. 1 Н ЯМР (400 МГц, CDCl3)м.д. 0.33-0.40 (m, 2 Н), 0.52-0.65 (m, 2 Н), 1.17-1.29 (m, 1 Н), 1.74-1.96 4-Гидроксиметил-4-фенилпиперидин (0,172 г, 0,9 ммоль), ацетат палладия(II) (0,007 г, 0,03 ммоль),карбонат цезия (0,391 г, 1,2 ммоль) и Xantphos (0,035 г, 0,06 ммоль) добавляли к раствору промежуточного соединения D9 (0,2 г, 0,6 ммоль) в трифторметилбензоле (2 мл). Реакционную смесь нагревали при 100 С в течение 24 ч в герметично закрытой пробирке, после чего ее охлаждали до комнатной температуры. Затем ее разбавляли DCM, H2O (5 мл) и экстрагировали EtOAc (35 мл). Смесь фильтровали через диатомитовую землю, и фильтрат упаривали досуха. Неочищенный продукт очищали сначала посредством колоночной хроматографии (силикагель; элюент: DCM/EtOAc от 90/10 до 0/100) и затем обращеннофазовой ВЭЖХ. Нужные фракции собирали, упаривали в вакууме и наконец сушили сублимацией с получением соединения Е 22 (0,041 г, 18%) в виде белой пены. 1 Н ЯМР (400 МГц, CDCl3)м.д. 0.93 (t, J=7,3 Гц, 3 Н), 1.13 (br t, J=6,7 Гц, 1 Н), 1.28-1.40 (m, 2 Н),1.64-1.75 (m, 2 Н), 1.98-2.08 (m, 2 Н), 2.31-2.40 (m, 2 Н), 2.98-3.10 (m, 2 Н), 3.41-3.51 (m, 2 Н), 3.63 (d,J=6,5 Гц, 2 Н), 3.90 (t, J=7,3 Гц, 2 Н), 5.92 (d, J=7,5 Гц, 1 Н), 7.04 (d, J=7,5 Гц, 1 Н), 7.27-7.33 (m, 1 Н), 7.367.46 (m, 4 Н). Пример 28. 1'-Бутил-3'-хлор-4-[2-(1-гидрокси-1-метилэтил)фенил]-3,4,5,6-тетрагидро-2H,1'Н-[1,4'] бипиридинил-2'-он (Е 28). Смесь промежуточного соединения D9 (0,254 г, 0,76 ммоль), промежуточного соединения D28 (0,2 г, 0,912 ммоль) и диизопропилэтиламина (0,199 мл, 1,114 ммоль) в ацетонитриле (11 мл) нагревали при 180 С в течение 5 мин при использовании микроволнового излучения. Охлажденную неочищенную смесь упаривали в вакууме. Неочищенный остаток очищали колоночной хроматографией (силикагель;DCM/EtOAc/MeOH в качестве элюента). Нужные фракции собирали и упаривали в вакууме. Полученный твердый остаток обрабатывали диизопропиловым эфиром. Твердое вещество фильтровали с получением соединения Е 28 (0,183 г, 61%). М.Р. 182 С. 1 Н ЯМР (400 МГц, CDCl3)м.д. 0.95 (t, J=7,3 Гц, 3 Н), 1.321.42 (m, 2 Н), 1.70 (s, 6 Н), 1.71-1.77 (m, 2 Н), 1.79 (s, 1 Н), 1.82-1.90 (m, 2 Н), 1.91-2.05 (m, 2 Н), 2.88-2.98 Смесь промежуточного соединения D9 (0,261 г, 0,781 ммоль), промежуточного соединения D25(0,223 г, 0,938 ммоль) и диизопропилэтиламина (0,204 мл, 1,172 ммоль) в ацетонитриле (11 мл) нагревали при 180 С в течение 5 мин при использовании микроволнового излучения. Охлажденную неочищенную смесь упаривали в вакууме. Неочищенный остаток очищали колоночной хроматографией (силикагель;DCM/EtOAc/MeOH/NH3 в качестве элюента). Нужные фракции собирали и упаривали в вакууме. Полученный твердый остаток обрабатывали диизопропиловым эфиром. Твердое вещество отфильтровывали с получением соединения Е 29 (0,239 г, 73%). М.Р. 150,5 С. 1 Н ЯМР (400 МГц, CDCl3)м.д. 0.95 (t, J=7,3 Гц, 3 Н), 1.31-1.43 (m, 2 Н), 1.57 (s, 6 Н), 1.68-1.76 (m, 2 Н), 1.77 (s, 1 Н), 1.87-1.96 (m, 4 Н), 2.86-2.98 (m, 2 Н), 2.98-3.09 (т, 1 Н), 3.81 (br d, J=12,0 Гц, 2 Н), 3.93 (t, J=7,3 Гц, 2 Н), 6.03 (d, J=7,5 Гц, 1 Н), 7.11 (d, J=7,5 Гц, 1 Н), 7.16-7.25 (т, 3 Н). Пример 32. 1-Бутил-3-хлор-4-(1'H,3H-спиро[2-бензофуран-1,4'-пиперидин]-1'-ил)пиридин-2(1H)-он- 24017648 Смесь промежуточного соединения D9 (0,15 г, 0,45 ммоль), 3H-спиро[2-бензофуран-1,4'пиперидина] (0,102 г, 0,54 ммоль) и диизопропилэтиламина (0,097 мл, 0,056 ммоль) в ацетонитриле (4 мл) нагревали при 180 С в течение 5 мин при использовании микроволнового излучения. Охлажденную неочищенную смесь упаривали в вакууме. Неочищенный остаток очищали колоночной хроматографией(силикагель; DCM/EtOAc/MeOH/NH3 в качестве элюента). Нужные фракции собирали и упаривали в вакууме. Полученный твердый остаток обрабатывали диизопропиловым эфиром. Твердое вещество фильтровали с получением соединения Е 32 (0,14 г, 84%). 1 Н ЯМР (400 МГц, CDCl3)м.д. 0.95 (t, J=7,3 Гц, 3 Н),1.30-1.43 (m, 2 Н), 1.67-1.79 (m, 2 Н), 1.85 (dd, J=13,8, 2,20 Гц, 2 Н), 2.12 (dt, J=13,0, 4,7 Гц, 2 Н), 3.25 (dt,J=12,4, 2,31 Гц, 2 Н), 3.57-3.68 (m, 2 Н), 3.94 (t, J=7,3 Гц, 2 Н), 6.06 (d, J=7,4 Гц, 1 Н), 7.12 (d, J=7,4 Гц, 1 Н),7.16-7.34 (m, 7 Н). Пример 33. 1-Бутил-3-хлор-4-(1'H-спиро[1-бензофуран-3,4'-пиперидин]-1'-ил)пиридин-2(1H)-он Смесь промежуточного соединения D9 (0,15 г, 0,45 ммоль), спиро[1-бензофуран-3,4'-пиперидина](0,102 Г, 0,54 ммоль) и диизопропилэтиламина (0,097 мл, 0,056 ммоль) в ацетонитриле (4 мл) нагревали при 180 С в течение 5 мин при использовании микроволнового излучения. Охлажденную неочищенную смесь упаривали в вакууме. Неочищенный остаток очищали посредством колоночной хроматографии(силикагель; DCM/EtOAc/MeOH/NH3 в качестве элюента). Нужные фракции собирали и упаривали в вакууме. Полученный твердый остаток обрабатывали дииизопропиловым эфиром. Твердое вещество отфильтровывали с получением соединения Е 33 (0,116 г, 84%). 1 Н ЯМР (500 МГц, CDCl3)м.д. 0.95 (t,J=7,4 Гц, 3 Н), 1.30-1.43 (m, 2 Н), 1.66-1.79 (m, 2 Н), 1.86 (d, J=13,3 Гц, 2 Н), 2.05-2.19 (m, 2 Н), 2.84-2.97(m, 2 Н), 3.68 (d, J=12,7 Гц, 2 Н), 3.94 (t, J=7,4 Гц, 2 Н), 4.44 (s, 2 Н), 6.01 (d, J=7,5 Гц, 1 Н), 6.83 (d, J=7,8 Гц, 1 H), 6.92 (t, J=7,4 Гц, 1 H), 7.07 - 7.24 (m, 3 H). Соединения Е 10, Е 11, Е 12, Е 13, Е 14, Е 15, Е 16, Е 17, Е 18, Е 19, Е 23, Е 24, Е 25 и Е 26 получали согласно методике взаимодействия, описанной в примере 1. Соединение Е 27 получали согласно методике взаимодействия, описанной в примере 9. Соединение Е 30 и соединению Е 31 получали согласно методике взаимодействия, описанной в примере 22. Физико-химические данныеLCMS (жидкостная хроматомасс-спектрометрия) - общая методика. Измерение посредством ВЭЖХ выполняли, используя HP 1100 от Agilent Technologies, содержащий насос (для четырех- или двухкомпонентной смеси) с дегазатором, автоматический дозатор, термостат для колонок, детектор на диодной матрице (DAD) и колонку, указанную в соответствующих методах ниже. Поток из колонки разделяли для масс-спектрометра (MS). MS-Детектор был оснащен источником ионизации электрораспылением. Азот использовали в качестве газа для распылителя. Источник температуры поддерживали при 140 С. Сбор данных осуществляли с помощью программного обеспечения MassLynxOpenlynx. LCMS Способ: Для всех примеров, за исключением примеров E5, E18, Е 25, E27, E28, E29, E30 и Е 31, использовали следующий метод. В дополнение к общей методике. Обращенно-фазовую ВЭЖХ проводили на картридже XDB-C18 (1,8 мкм, 2,130 мм) от Agilent, со скоростью потока 1 мл/мин при 60 С. Используемые градиентные условия представляют собой; 90% А(0,5 г/л раствор ацетата аммония), 5% В (ацетонитрил), от 5% С (метанол) до 50% В и 50% С за 6,5 мин,до 100% В за 7 мин и уравновешивали к начальным условиям за 7,5-9,0 мин. Объем введенной пробы 2 мкл. Масс-спектры с высоким разрешением (время пролета, TOF) получали только в режиме положительной ионизации, сканируя от 100 до 750 в течение 0,5 с, используя время задержки 0,1 с. Напряжение на капиллярной игле составляло 2,5 кВ, и напряжение на конусе составляло 20 В. Лейцин-энкефалин представлял собой стандартное вещество, используемое для калибровки по фиксированной массе. Методика LCMS. Данный способ использовали для примеров Е 5 и Е 18. В дополнение к общей методике. Обращенно-фазовую ВЭЖХ выполняли на колонке АСЕ-С 18 (3,0 мкм, 4,630 мм) от AdvancedChromatography Technologies, со скоростью потока 1,5 мл/мин при 40 С. Используемые градиентные условия представляют собой: 80% А (0,5 г/л раствора ацетата аммония), 10% В (ацетонитрил), 10% С (метанол) до 50% В и 50% С в 6,5 мин, до 100% В в 7 мин и уравновешивали к начальным условиям в 7,59,0 мин. Объем введенной пробы 5 мкл. Масс-спектры с высоким разрешением (время пролета, TOF) получали только в режиме положительной ионизации, сканируя от 100 до 750 за 0,5 с, используя время задержки 0,1 с. Напряжение на капиллярной игле составляло 2,5 кВ для режима положительной ионизации, и напряжение на конусе равнялось 20 В. Лейцин-энкефалин представлял собой стандартное вещест- 25017648 во, используемое для калибровки по фиксированной массе. Метод LCMS. Данный метод использовали для примера Е 25. В дополнение к общей методике. Обращенно-фазовую ВЭЖХ выполняли на картридже XDB-C18 (1,8 мкм, 2,130 мм) от Agilent со скоростью потока 0,8 мл/мин при 60 С. Используемые градиентные условия представляют собой: 90% А(раствор ацетата аммония 0,5 г/л), 10% В (смесь ацетонитрил/метанол, 1/1), до 100% В в 6,0 мин, выдерживали до 6,5 мин и уравновешивали с начальным условиям в 7,0-9,0 минут. Объем введенной пробы 2 мкл. Масс-спектры с низким разрешением (детектор SQD; квадрупольный) получали только в режиме положительной ионизации, сканируя от 100 до 1000 в 0,1 с, используя межканальную задержку 0,08 с. Напряжение на капиллярной игле составляло 3 кВ и напряжение на конусе составляло 20 В. Метод LCMS. Данный метод использовали для примера Е 27. В дополнение к общей методике. Обращенно-фазовую ВЭЖХ выполняли на колонке Sunfire-C18 (2,5 мкм, 2,130 мм) от Waters со скоростью потока 1,0 мл/мин при 60 С. Используемые градиентные условия представляют собой: 95% А(раствор ацетата аммония 0,5 г/л + 5% ацетонитрила), 2,5% В (ацетонитрил), 2,5% С (метанол) до 50% В и 50% С в 6,5 мин, выдерживали до 7 мин и уравновешивали с начальными условиям в 7,3-9,0 мин. Объем введенной пробы 2 мкл. Масс-спектры с высоким разрешением (время пролета, TOF) получали, сканируя от 100 до 750 в 0,5 с, используя время задержки 0,3 с. Напряжение на капиллярной игле составляло 2,5 кВ для режима положительной ионизации и 2,9 кВ для режима отрицательной ионизации. Напряжение на конусе составляло 20 В для режимов как положительной, так и отрицательной ионизации. Лейцин-энкефалин представлял собой стандартное вещество, используемое для калибровки по фиксированной массе. Метод LCMS. Данный метод использовали для примера Е 28, Е 29, Е 32 и Е 33. В дополнение к общей методике. Обращенно-фазовую ВЭЖХ выполняли на колонке ВЕН-С 18 (1,7 мкм, 2,150 мм) от Waters со скоростью потока 0,8 мл/мин при 60 С без разделения для детектора MS. Используемые градиентные условия представляли собой: 95% А (0,5 г/л раствор ацетата аммония + 5% ацетонитрил), 5% В (смесь ацетонитрил/метанол, 1/1), до 20% А, 80% В в 4,9 мин, до 100% В в 5,3 мин, выдерживали до 5,8 мин и уравновешивали до начальных условий за 6,0-7,0 мин. Объем введенной пробы 0,5 мкл. Масс-спектры с низким разрешением (детектор SQD; квадрупольный) получали, сканируя от 100 до 1000 в 0,1 с, используя межканальную задержку 0,08 с. Напряжение на капиллярной игле составляло 3 кВ. Напряжение на конусе составляло 20 В для режима положительной ионизации и 30 В для режима отрицательной ионизации. Метод LCMS. Данный метод использовали для примеров Е 30 и Е 31. В дополнение к общей методике. Обращенно-фазовую ВЭЖХ выполняли на картридже XDB-C18 (1,8 мкм, 2,130 мм) от Agilent со скоростью потока 1 мл/мин при 60 С. Используемые градиентные условия представляют собой: 90% А(раствор ацетата аммония 0,5 г/л), 5% В (ацетонитрил), 5% С (метанол), выдерживали 0,2 мин, до 50% В,50% С в 3,5 мин, выдерживали до 3,65 мин и уравновешивали до начальных условий в 3,8-5,0 мин. Объем введенной пробы 2 мкл. Масс-спектры с высоким разрешением (время пролета, TOF) получали, сканируя от 100 до 750 в 0,5 с, используя время задержки 0,3 с. Напряжение на капиллярной игле составляло 2,5 кВ для режима положительной ионизации и 2,9 кВ для режима отрицательной ионизации. Напряжение на конусе составляло 20 В для режимов как положительной так и отрицательной ионизации. Лейцинэнкефалин представлял собой стандартное вещество, используемое для калибровки по фиксированной массе. Точки плавления. Для ряда соединений точки плавления определяли в открытых капиллярных пробирках на аппаратеMettler FP62. Точки плавления измеряли с температурным градиентом 3 или 10 С/мин. Максимальная температура составляла 300 С. Точку плавления считывали с цифрового дисплея и получали с погрешностями эксперимента, которые обычно связаны с данным аналитическим способом. Ядерный магнитный резонанс (ЯМР). Спектры 1 Н ЯМР регистрировали на спектрометрах Bruker DPX400 или Bruker AV-500, работающих при 400 и 500 МГц соответственно. Все зарегистрированные химические сдвигивыражали в м.д. относительно тетраметилсилана. В табл. 1 перечислены соединения формулы (I), которые получали согласно одному из указанных выше примеров. н.о.: не определено Таблица 2D. Фармакологические примеры. Соединения, предложенные в настоящем изобретении, являются положительными аллостерическими модуляторами mGluR2. Оказалось, что данные соединения усиливают глутаматные ответы посредством связывания с аллостерическим участком, отличным от участка связывания глутамата. Ответ mGluR2 на концентрацию глутамата усиливается, если присутствуют соединения формулы (I). Ожидается, что соединения формулы (I) будут осуществлять эффект, по существу, в отношении к mGluR2, благодаря их способности усиливать функцию этого рецептора. Поведение положительных аллостерических модуляторов, протестированных на mGluR2, с использованием метода анализа связывания [35S]GTPS, описанного ниже, который является пригодным для идентификации таких соединений, и, более конкретно, соединений формулы (I), показано в табл. 3. Анализ связывания [35S]GTPS. Анализ связывания [35S]GTPS представляет собой анализ на основе функциональных мембран, используемый для изучения функции рецептора, сопряженного с G-белком (GPCR), при помощи которого измеряют включение негидролизуемой формы GTP, [35S]GTPS (гуанозин-5'-трифосфат, меченый гаммаизлучающим 35S). -Субъединица G-белка катализирует обмен гуанозин-5'-дифосфата (GDP) на гуанозин-трифосфат (GTP) и при активации GPCR агонистом, [35S]GTPS включается и не может быть отщеплен для продолжения цикла обмена (Harper (1998) Current Protocols in Pharmacology 2.6.1-10, John WileySons, Inc.). Величина включения радиоактивного [35S]GTPS является непосредственным измерением активности G-белка, и, таким образом, может быть определена активность агониста. Показано, что рецепторы mGluR2 преимущественно сочетаются с Gi-белком преимущественным сочетанием для данно- 28017648 го способа, и, следовательно, их широко используют для изучения рецепторной активации mGluR2 рецепторов как в рекомбинантных клеточных линиях, так и в тканях (Schaffhauser et al. 2003, Pinkerton etPharmacology 53: стр. 228-33). В данном описании изобретения авторы изобретения описывают применение анализа связывания [35S]GTPS с использованием мембран из клеток, трансфицированных человеческим рецептором mGluR2 и адаптированных по Schaffhauser et al 2003) Molecular Pharmacology 4: стр. 798-810) для обнаружения свойств положительного аллостерического модулирования (РАМ) соединений по данному изобретению. Приготовление мембран. СНО-клетки культивировали до начала слияния и стимулировали 5 мМ бутирата в течение 24 часов, затем промывали в PBS, и затем собирали соскабливанием в буфер для гомогенизации (50 мМ буфер Трис-HCl, рН 7,4, 4 С). Клеточные лизаты быстро гомогенизировали (15 с), используя гомогенизаторULTRA-TURRAX. Гомогенат центрифуговали при 23 500g в течение 10 мин, и надосадочную жидкость отбрасывали. Осадок ресуспендировали в 5 мМ Трис-HCl, рН 7,4 и еще раз центрифуговали (30 000g,20 мин, 4 С). Конечный пеллет ресуспендировали в 50 мМ HEPES, рН 7,4 и хранили при -80 С в подходящих аликвотах перед использованием. Концентрацию белка определяли методом Брэдфорда (Bio-Rad,USA) с бычьим сывороточным альбумином в качестве стандарта. Анализ связывания [35S]GTPS. Измерение положительной аллостерической модуляторной активности mGluR2 исследуемыми соединениями в мембранах, содержащих mGluR2 человека, осуществляли, используя замороженные мембраны, которые размораживали и быстро гомогенизировали перед преинкубированием в 96-луночных микропланшетах (15 мкг/аналитическая лунка, 30 мин, 30 С) в буфере для анализа (50 мМ HEPES рН 7,4,100 мМ NaCl, 3 мМ MgCl2, 50 мкМ GDP, 10 мкг/мл сапонина) с возрастающими концентрациями положительного аллостерического модулятора (от 0,3 нМ до 50 мкМ) и либо с минимальной предварительно определенной концентрацией глутамата (анализ РАМ), либо без добавления глутамата. Для РАМанализа мембраны предварительно инкубировали с глутаматом в концентрации ЕС 25, то есть концентрацией, которая обеспечивает 25% максимального ответа глутамата, и соответствует опубликованным данным (Pin et al. (1999) Eur. J. Pharmacol. 375: стр.277-294). После добавления [35S]GTPYS (0,1 нМ, f.c.) для достижения общего реакционного объема 200 мкл, микропланшеты быстро встряхивали и дополнительно инкубировали, чтобы обеспечить включение [35S]GTPS при активации (30 мин, 30 С). Взаимодействие останавливали быстрой вакуум-фильтрацией микропланшета через планшеты из стекловолоконного фильтра (Unifilter 96-well GF/B filter plates, Perkin-Elmer, Downers Grove, USA), используя сборщик клеток для 96-луночного планшета (Filtermate, Perkin-Elmer, USA), и затем промыванием три раза 300 мкл ледяного промывочного буфера (Na2PO42H2O 10 мМ, NaH2PO4H2O 10 мМ, рН=7,4). Затем фильтры сушили на воздухе, и добавляли в каждую лунку 40 мкл жидкой сцинтилляционной смеси (Microscint-O), и измеряли связанный с мембраной [35S]GTPS в 96-луночном сцинтилляционном планшетном ридере(Top-Count, Perkin-Elmer, USA). Неспецифическое связывание [35S]GTPS определяют в присутствие холодного 10 мкМ GTP. Каждую кривую выполняли по меньшей мере один раз, используя двойную выборку на точку на графике и при 11 концентрациях. Анализ данных. Кривые концентрация-ответ типичных соединений по настоящему изобретению в присутствие добавленной ЕС 25 mGluR2 агониста глутамата для определения положительного аллостерического модулирования (РАМ), получали, используя программное обеспечение Prism GraphPad (Graph Pad Inc, SanDiego, USA). Кривые соответствовали четырехпараметрическому логистическому уравнению (Y = Нижнее + (Верхнее-Нижнее)/(1+10LogEC50-Х)Наклон), позволяющему определить значения EC50. EC50 представляет собой концентрацию соединения, которая вызывает полумаксимальное потенциирование глутаматного ответа. Ее рассчитывают путем вычитания максимальных ответов глутамата в присутствии полностью насыщающей концентрации положительного аллостерического модулятора из ответа глутамата в отсутствие положительного аллостерического модулятора. Концентрацию, вызывающую полумаксимальный эффект, рассчитывали затем как ЕС 50. Таблица 3. Фармакологические данные для соединений по изобретению. Все соединения тестировали в присутствии агониста mGluR2, глутамата в предварительно определенной концентрации ЕС 25, для определения положительного аллостерического модулирования (GTPYSPAM). Показанные значения являются средними из парных значений 11 концентраций на кривых ответа,из по меньшей мере одного эксперимента. Все исследуемые соединения демонстрировали значение рЕС 50 (-logEC50) более 5,0, от 6,05 до 7,20. Погрешность определения значения рЕС 50 для единичного эксперимента устанавливают равной примерно 0,3log единиц.
МПК / Метки
МПК: C07D 493/10, A61P 25/00, C07D 401/04, A61K 31/4545
Метки: 1',3'-двузамещенные-4-фенил-3,4,5,6-тетрагидро-2н,1'н-[1,4']бипиридинил-2'-оны
Код ссылки
<a href="https://eas.patents.su/30-17648-13-dvuzameshhennye-4-fenil-3456-tetragidro-2n1n-14bipiridinil-2-ony.html" rel="bookmark" title="База патентов Евразийского Союза">1′,3′-двузамещенные-4-фенил-3,4,5,6-тетрагидро-2н,1′н-[1,4']бипиридинил-2′-оны</a>












