Ингибиторы равновесного переносчика нуклеозидов ent1
Номер патента: 17215
Опубликовано: 30.10.2012
Авторы: Босман Жан-Поль Рене Мари Андре, Вербист Би Мария Питер, Питерс Серж Мария Алоисиус, Де Клейн Михел Анна Йозеф, Бертело Дидье Жан-Клод
Формула / Реферат
1. Соединение формулы (I)
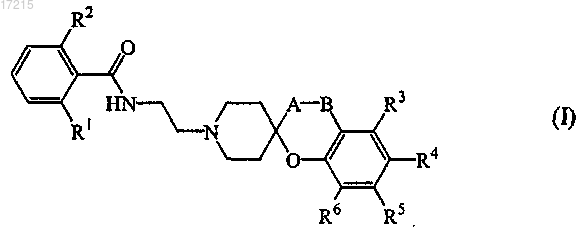
где -А-В- представляет собой
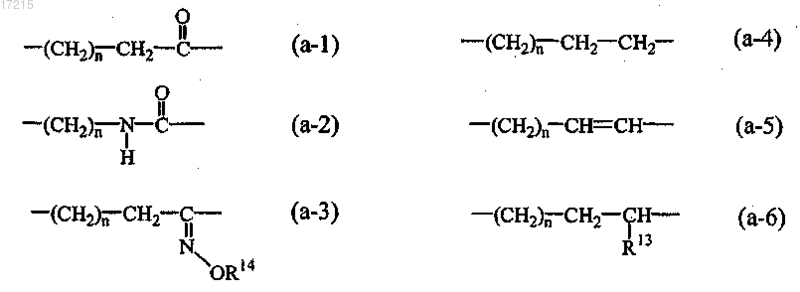
где n равно целому числу 0;
R13 представляет собой гидрокси;
R14 представляет собой водород;
R1 и R2 выбраны, каждый независимо, из галогена или С1-6алкила;
R3, R4, R5 и R6 выбраны, каждый независимо, из водорода, галогена, С1-6алкила, NO2, цикла1 или X-R8, где X представляет собой О или NR9,
где R9 представляет собой водород, С1-6алкил или С1-6алкилоксиС1-6алкил и
где R8 представляет собой водород, С2-6алкенил, С1-6алкилкарбонил, полигалогенС1-6алкилкарбонил, цикл2,
-(СН2)m-цикл2 или C1-6алкил, замещенный гидрокси, С1-6алкилокси, фенилом или циклом2, или NR11R12, где R11 и R12 выбраны, каждый независимо, из водорода, C1-6алкила или С1-6алкилкарбонила;
m равно целому числу 0 или 1;
цикл1 выбран из
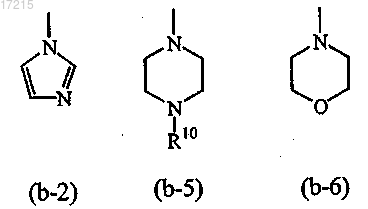
где R10 представляет собой водород; и
цикл2 выбран из
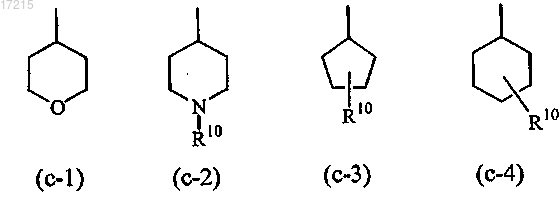
где R10 представляет собой водород, С1-6алкил, C1-6алкилкарбонил или С1-6алкилоксикарбонил;
в том числе любая его стереохимически изомерная форма, фармацевтически приемлемая кислотно-аддитивная соль, сольват или их N-оксидная форма.
2. Соединение по п.1, где R1 и R2 оба представляют собой галоген.
3. Соединение по п.1, где R1 и R2 оба представляют собой С1-4алкил.
4. Соединение по п.1, где радикал -А-В- представляет собой радикал (а-1).
5. Соединение по п.1, где радикал -А-В- представляет собой радикал (а-2).
6. Соединение по п.1, где R3 представляет собой водород или R5 представляет собой X-R8.
7. Соединение по п.1, которое представляет собой N-(2-{7-[(1-ацетилпиперидин-4-ил)окси]-6-хлор-4-оксо-3,4-дигидро-1'H-спиро[хромен-2,4'-пиперидин]-1'-ил}этил)-2,6-дихлорбензамид или его фармацевтически приемлемую кислотно-аддитивную соль.
8. Соединение по п.1, которое представляет собой N-[2-(7-амино-8-хлор-4-оксо-3,4-дигидро-1'Н-спиро-[1,3-бензоксазин-2,4'-пиперидин]-1'-ил)этил]-2,6-дихлорбензамид или его фармацевтически приемлемую кислотно-аддитивную соль.
9. Фармацевтическая композиция, обладающая ингибирующей активностью в отношении равновесного переносчика нуклеозида ENT1, содержащая терапевтически активное количество соединения по любому из пп.1-8 и фармацевтически приемлемый носитель.
10. Способ получения фармацевтической композиции по п.9, в котором терапевтически активное количество соединения по любому из пп.1-8 тщательно смешивают с фармацевтически приемлемым носителем.
11. Соединение по любому из пп.1-8 для применения для лечения опосредуемых равновесным переносчиком нуклеозидов ENT1 заболеваний, включающих воспалительную боль, невропатическую боль, боль при раковом заболевании, состояния, требующие защиты сердца, защиты головного мозга, травматическое повреждение головного мозга (TBI), состояния, требующие защиты спинного мозга, нейрозащиты, хронические пролежни, состояния, требующие заживления раны, состояния, требующие применения противосудорожного средства, нарушения сна, панкреатит, гломерулонефрит, и состояния, требующие применения антитромботического средства.
12. Способ получения соединения формулы (I) по п.1, в котором соединение формулы (III) N-алкилируют соединением формулы (II) в инертном растворителе и необязательно в присутствии подходящего основания
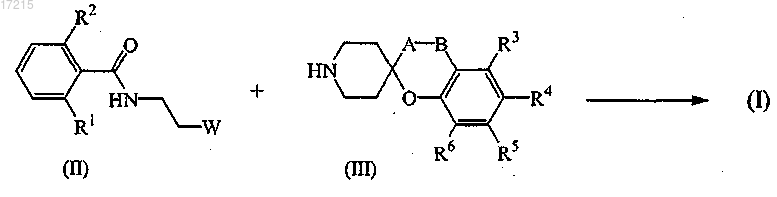
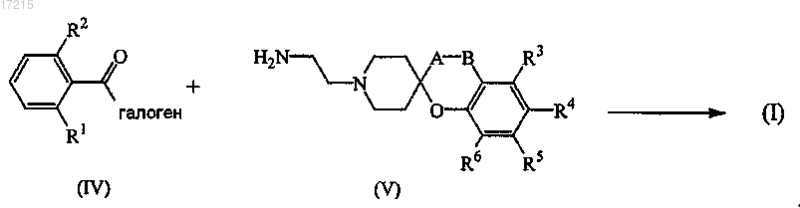
13. Способ получения соединения формулы (I) по п.1, в котором соединение формулы (IV) подвергают реакции с соединением формулы (V) в инертном растворителе и необязательно в присутствии подходящего основания
Текст
ИНГИБИТОРЫ РАВНОВЕСНОГО ПЕРЕНОСЧИКА НУКЛЕОЗИДОВ ENT1 Изобретение относится к новым соединениям формулы (I), где переменные указаны в п.1 формулы изобретения, обладающим ингибирующими свойствами в отношении равновесного переносчика нуклеозида ENT1, фармацевтическим композициям, содержащим эти соединения, химическим способам получения этих соединений и их применению при лечении заболеваний, связанных с ингибированием рецепторов ENT1 у животных, особенно у людей. Босман Жан-Поль Рене Мари Андре,Бертело Дидье Жан-Клод, Питерс Серж Мария Алоисиус, Вербист Би Мария Питер, Де Клейн Михел Анна Йозеф (BE) Медведев В.Н. (RU)(71)(73) Заявитель и патентовладелец: ЯНССЕН ФАРМАЦЕВТИКА НВ (BE) 017215 Изобретение относится к новым соединениям формулы (I), обладающим ингибирующими свойствами в отношении равновесного переносчика (транспортера) нуклеозида ENT1, фармацевтическим композициям, содержащим эти соединения, химическим способам получения этих соединений и их применению при лечении заболеваний, связанных с ингибированием рецепторов ENT1 у животных, особенно у людей. Для проникновения нуклеозидов через клеточные мембраны требуются определенные переносчики. Среди семейства переносчиков нуклеозидов наиболее широко экспрессируемыми являются равновесные переносчики нуклеозидов (ENT) и четыре человеческих ENT идентифицированы у людей: hENT-1,hENT-2, hENT-3 и hENT-4. Наиболее полно охарактеризованными являются hENT-1 и hENT-2, которые являются белками клеточной поверхности и являются в общем селективными как для пуриновых, так и пиримидиновых нуклеозидов. Их можно отличать друг от друга по их чувствительности к ингибированию нитробензилмеркаптопуриновым рибозидом (NBMPR). ENT1 сильно ингибируется наномолярными концентрациями NBMPR и поэтому его называют также белком NBMPR-чувствительного равновесного переноса нуклеозида. ENT2 является нечувствительным к наномолярным концентрациям NBMPR, но его можно ингибировать более высокими (микромолярными) концентрациями NBMPR и поэтому его называют также белком NBMPR-нечувствительного равновесного переноса нуклеозида (iENTP) [см. Griffithet al., Biochim. Bioph. Acta 1286:153-181 (1986)]. Аденозин является эндогенным пуриновым нуклеозидом, который в особенно высокой степени высвобождается в патофизиологических условиях, подобных ишемии, воспалению и боли. В этих случаях он играет важную нейро- и иммуномодулирующую роль. Введение аденозина оказывает анальгезирующее действие при различных ноцицептивных способах воздействия у людей. Вследствие короткого периода полувыведения аденозина из организма и побочных действий, вызванных его введением, появился значительный интерес к поиску путей усиления действий эндогенного аденозина. Ингибирование ENT1 блокирует поглощение аденозина клетками и может усилить его полезные свойства. Настоящее изобретение относится к соединению формулы (I) в том числе к любой его стереохимически изомерной форме, где -А-В- представляет собой где n равно целому числу 0 или 1;R13 представляет собой гидрокси или галоген;R14 представляет собой водород или C1-6 алкил; в двухвалентных радикалах (а-4), (а-5) и (а-6) любой из атомов водорода при одном и том же или разных атомах углерода может быть заменен атомом галогена;m равно целому числу 0, 1 или 2; цикл 1 выбран из-1 017215 где R10 представляет собой водород, С 1-6 алкил, C1-6 алкилкарбонил или С 1-6 алкилоксикарбонил; и цикл выбран из 2 где R10 представляет собой водород, С 1-6 алкил, C1-6 алкилкарбонил, С 1-6 алкилоксикарбонил или С 1-6 алкилоксикарбонил, замещенный галогеном или гидрокси; или его фармацевтически приемлемой кислотно-аддитивной соли или его сольвату, или его Nоксидной форме. Применяемые в вышеупомянутых определениях термины имеют следующие значения: галоген является родовым термином для фтора, хлора, брома и йода; С 1-4 алкил означает насыщенные углеводородные радикалы с неразветвленной или разветвленной цепью, имеющие от 1 до 4 атомов углерода, такие как, например, метил, этил, пропил, бутил, 1 метилэтил, 2-метилпропил и тому подобное;C1-6 алкил, как предполагается, включает С 1-4 алкил и более высокие его гомологи, имеющие 5 или 6 атомов углерода, такие как, например, 2-метилбутил, пентил, гексил и тому подобное; С 3-6 алкенил означает ненасыщенные углеводородные радикалы с неразветвленной или разветвленной цепью, имеющие от 3 до 6 атомов углерода, такие как пропенил, бутенил, пентенил или гексенил; полигалогенС 1-4 алкил означает полигалогензамещенный C1-4 алкил, в частности С 1-4 алкил (имеет значения, указанные в контексте выше), замещенный 2-6 атомами галогена, такой как дифторметил,трифторметил, трифторэтил и тому подобное; полигалогенС 1-6 алкил означает полигалогензамещенный C1-6 алкил, в частности С 1-6 алкил (имеет значения, указанные в контексте выше), замещенный 2-6 атомами галогена, такой как дифторметил,трифторметил, трифторэтил и тому подобное; С 3-6 циклоалкил является родовым термином для циклопропила, циклобутила, циклопентила и циклогексила. Термин "стереохимически изомерные формы", применяемый в контексте ранее, означает все возможные изомерные формы, которые могут иметь соединения формулы (I). Если не упоминается или не указывается иначе, химическое определение соединений означает смесь всех возможных стереохимически изомерных форм, причем указанные смеси содержат все диастереомеры и энантиомеры основной молекулярной структуры. Более конкретно, стереогенные центры могут иметь R- или S-конфигурацию; заместители на двухвалентных циклических (частично) насыщенных радикалах могут иметь либо цис-,либо транс-конфигурацию. Когда заместители R1 и R2 имеют разные значения, связь между арильной группой и карбонильной группой образует ось хиральности. Энантиомеры аксиально хиральных соединений обычно имеют стереохимические обозначения Ra и Sa (или aR и aS) и такие энантиомеры включены также в термин "стереохимически изомерные формы". Несомненно предполагается, что стереохимически изомерные формы соединений формулы (I) включены в объем данного изобретения. Абсолютную стереохимическую конфигурацию соединений формулы (I) и промежуточных продуктов, применяемых при их получении, может легко определить специалист в данной области с применением хорошо известных способов, таких как, например, рентгенография. Кроме того, некоторые из соединений формулы (I) и некоторые из промежуточных продуктов,применяемых при их получении, могут проявлять полиморфизм. Должно быть понятно, что настоящее изобретение включает любые полиморфные формы, обладающие свойствами, применимыми при лечении состояний, указанных в контексте выше. Предполагается, что фармацевтически приемлемые кислотно-аддитивные соли, указываемые в контексте выше, включают формы терапевтически активных нетоксичных кислотно-аддитивных солей, которые способны образовывать соединения формулы (I). Эти фармацевтически приемлемые кислотноаддитивные соли можно подходящим образом получить обработкой формы основания подходящей кислотой. Подходящие кислоты включают, например, неорганические кислоты, такие как галогеноводородные кислоты, например хлористо-водородную или бромисто-водородную кислоту, серную, азотную,фосфорную и подобные кислоты; или органические кислоты, такие как, например, уксусная, пропановая,гидроксиуксусная, молочная, пировиноградная, щавелевая (т.е. этандиовая), малоновая, янтарная (т.е. бутандиовая кислота), малеиновая, фумаровая, яблочная, винная, лимонная, метансульфоновая, этансульфоновая, бензолсульфоновая, п-толуолсульфоновая, цикламовая, салициловая, п-аминосалициловая,памовая и подобные кислоты. И наоборот, указанные формы солей можно превратить обработкой подходящим основанием в форму свободного основания. Соединения формулы (I) могут существовать как в несольватированных, так и сольватированных-2 017215 формах. Термин "сольват", применяемый в контексте, описывает молекулярную ассоциацию, содержащую соединение изобретения и одну или несколько молекул фармацевтически приемлемого растворителя, например воды или этанола. Термин "гидрат" применяют, когда этим растворителем является вода. Предполагается, что N-оксидные формы соединений формулы (I), которые можно получить известными в данной области способами, включают такие соединения формулы (I), у которых один или несколько атомов азота окислены в N-оксид. В частности, рассматриваются такие N-оксиды, у которых атом азота пиперидина является N-окисленным. Интересными соединениями формулы (I) являются такие соединения формулы (I), для которых применяют одно или несколько следующих ограничений:a) R1 и R2 оба представляют собой галоген, в частности хлор; илиb) R1 и R2 оба представляют собой С 1-4 алкил, в частности метил; илиc) радикал -А-В представляет собой радикал (а-1); илиd) радикал -А-В представляет собой радикал (а-2); илиg) R3, R4, R5 и R6 выбраны, каждый независимо, из водорода, галогена, С 1-6 алкила или X-R8, где X представляет собой О и R8 представляет собой Het2, где Het2 представляет собой радикал (с-2); илиi) R3, R4, R5 и R6 выбраны, каждый независимо, из водорода, галогена, C1-6 алкила или X-R8, где R8 представляет собой водород и X представляет собой NR9, где R9 представляет собой водород; илиn) n равно целому числу 0. Другими интересными соединениями являются N-(2-7-[(l-ацетилпиперидин-4-ил)окси]-6-хлор-4 оксо-3,4-дигидро-1'H-спиро[хромен-2,4'-пиперидин]-1'-илэтил)-2,6-дихлорбензамид или N-[2-(7-амино 8-хлор-4-оксо-3,4-дигидро-1'H-спиро[1,3-бензоксазин-2,4'-пиперидин]-1'-ил)этил]-2,6-дихлорбензамид или его фармацевтически приемлемые кислотно-аддитивные соли. В нижеследующих абзацах контекста описаны различные пути получения соединений формулы (I). Для упрощения структурных формул соединений формулы (I) и промежуточных продуктов, принимающих участие в их получении, далее в контексте бензамидная часть будет представлена символом Т. Соединения формулы (I) можно в общем получить N-алкилированием промежуточного продукта формулы (III) промежуточным продуктом формулы (II), где W представляет собой подходящую уходящую группу, такую как, например, галоген, например фтор, хлор, бром, йод, или в некоторых случаях W может быть также сульфонилоксигруппой, например, метансульфонилокси, бензолсульфонилокси, трифторметансульфонилокси и подобные реакционноспособные уходящие группы. Реакцию можно проводить в инертном растворителе, таком как, например, ацетонитрил, дихлорметан или диметилформамид, и необязательно в присутствии подходящего основания, такого как, например, карбонат натрия, карбонат калия, триэтиламин или диизопропилэтиламин (DIPEA). Перемешивание может повысить скорость реакции. Реакцию предпочтительно проводят при температуре приблизительно 0 С. Соединения формулы (I) можно также получить реакцией промежуточного продукта формулы (IV) с промежуточным продуктом формулы (V). Реакцию можно проводить в инертном растворителе, таком как, например, дихлорметан или диметилформамид, и необязательно в присутствии подходящего основания, такого как, например, диизопропилэтиламин (DIPEA). Соединения формулы (I-а), являющиеся соединениями формулы (I), у которых -А-В представляет собой радикал (а-1), у которого n равно 0, можно получить реакцией промежуточных продуктов формулы (VI) с промежуточными продуктами формулы (VII) в инертном растворителе, таком как метанол, в присутствии пирролидина. Соединения формулы (I-b), являющиеся соединениями формулы (I), у которых -А-В представляет собой радикал (а-2), у которого n равно 0, можно получить реакцией промежуточных продуктов формулы (VIII) с промежуточными продуктами формулы (IX) в инертном растворителе, таком как толуол в присутствии пирролидина или толуол в присутствии п-толуолсульфоновой кислоты и молекулярных сит. Соединения формулы (I-c), являющиеся соединениями формулы (I), у которых -А-В представляет собой радикал (а-4), у которого n равно 0, можно превратить в соединения формулы (I-а) с применением условий каталитического гидрирования, например, с применением газообразного водорода и катализатора, такого как никель Ренея, в инертном растворителе, таком как, например, метанол. Соединения формулы (I-а) можно превратить в соединения формулы (I-d-1), являющиеся соединениями формулы (I), у которых -А-В представляет собой радикал (а-б), у которого R11 представляет собой гидрокси и n равно 0, известными в данной области методиками восстановления, такими как, например,обработка борогидридом натрия в подходящем растворителе, например метаноле. Соединения формулы (I-d-1) можно превратить в соединения формулы (I-c) обработкой триэтилсилилгидридом в присутствии трифторуксусной кислоты в инертном растворителе, таком как дихлорметан. Соединения формулы (I-а) можно превратить в соединения формулы (I-е), являющиеся соединениями формулы (I), у которых -А-В представляет собой радикал (а-3), у которого n равно 0, обработкой гидроксиламином в основных условиях. Соединения формулы (I-d-1) можно превратить в соединения формулы (I-f), являющиеся соединениями формулы (I), у которых -А-В представляет собой радикал (а-5), у которого n равно 0, обработкой хлористо-водородной кислотой в инертном растворителе, таком как ТГФ. Соединения формулы (I-f) можно превратить в соединения формулы (I-c) с применением условий каталитического гидрирования, например, с применением газообразного водорода и катализатора, такого как платина на угле, в инертном растворителе, таком как, например, метанол. Соединения формулы (I) можно также превратить в соответствующие N-оксидные формы по известным в данной области методикам для превращения трехвалентного атома азота в его N-оксидную форму. Указанную реакцию N-окисления обычно проводят реакцией исходного соединения формулы (I) с подходящим органическим или неорганическим пероксидом. Подходящие неорганические пероксиды включают, например,пероксид водорода, пероксиды щелочных металлов или щелочноземельных металлов, например пероксид натрия, пероксид калия; подходящие органические пероксиды могут включать пероксикислоты, такие как, например, пероксибензойная кислота или галогензамещенная пероксибензойная кислота, например 3-хлорпероксибензойная кислота, пероксиалкановые кислоты, например, пероксиуксусная кислота, алкилгидропероксиды, например трет-бутилгидропероксид. Подходящими растворителями являются, например, вода, низшие алканолы, например этанол и тому подобное, углеводороды, например, толуол, кетоны, например, 2-бутанон, галогенированные углеводороды, например дихлорметан, и смеси таких растворителей. Исходные вещества и некоторые из промежуточных продуктов являются известными и коммерчески доступными соединениями или их можно получить согласно общепринятым методикам реакций, в общем известным в данной области. Соединения формулы (I), получаемые способами, описанными выше в контексте, можно синтезировать в форме рацемических смесей энантиомеров, которые можно отделить друг от друга по известным в данной области методикам разделения. Те соединения формулы (I),которые получают в рацемической форме, можно превратить в формы соответствующих диастереомерных солей реакцией с подходящей хиральной кислотой. Формы указанных диастереомерных солей затем разделяют, например, селективной или фракционной кристаллизацией и энантиомеры выделяют из них щелочью. Альтернативный способ разделения энантиомерных форм соединений формулы (I) включает жидкостную хроматографию с применением хиральной неподвижной фазы. Указанные чистые стереохимически изомерные формы можно также получить из соответствующих чистых стереохимически изомерных форм подходящих исходных веществ, при условии, что реакция протекает стереоспецифическим образом. Если требуется определенный стереоизомер, указанное соединение предпочтительно можно синтезировать стереоспецифическими способами получения. В этих способах будут преимущественно применять энантиомерно чистые исходные вещества. Соединения формулы (I), их фармацевтически приемлемые соли и стереоизомерные формы обладают ингибирующими свойствами в отношении равновесного переносчика нуклеозида ENT1, как показано в фармакологическом примере С.1. Следовательно, настоящие соединения формулы (I) являются применимыми в качестве лекарственных средств, особенно при лечении состояния или заболевания, опосредуемого равновесным переносчиком нуклеозидов ENT1, в частности обладающие ингибирующей активностью в отношении равновесного переносчика нуклезидов ENT1. Затем настоящие соединения можно применять для изготовления лекарственного средства для лечения состояния или заболевания, опосредуемого активностью равновесного переносчика нуклеозидов ENT1, в частности обладающего ингибирующей активностью в отношении равновесного транспортера нуклеозидов ENT1. Настоящее изобретение относится также к применению соединения формулы (I) или его фармацевтически приемлемой соли для изготовления лекарственного средства для лечения состояний или заболеваний, выбранных из состояний или заболеваний, опосредуемых равновесным переносчиком нуклеозидов ENT1. В варианте осуществления настоящее изобретение относится к соединению формулы (I) для применения в качестве лекарственного средства или для применения при лечении состояний или заболеваний,выбранных из состояний или заболеваний, опосредуемых равновесным переносчиком нуклеозидовENT1. Далее, настоящее изобретение относится также к способу лечения состояния, опосредуемого активностью равновесного переносчика нуклеозидов ENT1, у субъекта-млекопитающего, причем способ включает введение млекопитающему, нуждающемуся в таком лечении, терапевтически эффективного количества соединения формулы (I) или его фармацевтически приемлемой соли.-5 017215 Опосредуемыми равновесным переносчиком нуклеозидов ENT1 состояниями или расстройствами являются, например, острые и хронические болезненные состояния, включающие воспалительную боль,невропатическую боль, боль при раковом заболевании, состояния, требующие защиты сердца, защиты головного мозга, травматическое повреждение головного мозга (TBI), состояния, требующие защиты спинного мозга, нейрозащиты, хронические пролежни, состояния, требующие заживления раны, состояния, требующие применения противосудорожного средства, трансплантацию органа (консервация органа, подобная кардиоплегии), нарушения сна, панкреатит, гломерулонефрит и состояния, требующие применения антитромботического средства (антитромбоцитарного средства). Состояния хронической боли относятся к гипералгезии и аллодинии. Эти состояния могут включать острую боль, боль скелетных мышц, боль нижней части спины и радикулопатию, боль верхних конечностей, фибромиалгию и синдромы миофасциальной боли, челюстно-лицевую боль, брюшную боль, фантомную боль, боль при невралгии тройничного нерва и атипичную боль лица, повреждение нервных корешков и арахноидит, гериатрическую боль, боль области центральной нервной системы, воспалительную боль. Связанная с невропатией боль является результатом повреждений в периферической или центральной нервной системе. Она часто связана с соматосенсорными дефицитами, и распространение боли главным образом связано с областью соматосенсорной дисфункции. Начало боли можно задержать после причинного события даже на месяцы или годы. Имеется несколько случаев невропатической боли со значительной вариабельностью в симптомах и невропатическими дефицитами. Примерами являются повреждения периферических нервов вследствие травматического повреждения при сдавливании, ишемии, воздействия токсинов, дефицитов питательных веществ, вирусных инфекций и осложнений печени и почек. Термин "лечение" и "терапия", применяемый в контексте, относится к терапевтическому, паллиативному и профилактическому лечению, включающему реверсию, ослабление, ингибирование развития или профилактику заболевания, расстройства или состояния, для которого такой термин применяют, или одного или нескольких симптомов такого заболевания, расстройства или состояния. Дополнительно настоящее изобретение относится к фармацевтическим композициям, содержащим по меньшей мере один фармацевтически приемлемый носитель и терапевтически эффективное количество соединения формулы (I). Для получения фармацевтических композиций по данному изобретению эффективное количество конкретного соединения в форме основания или кислотно-аддитивной соли в качестве активного ингредиента комбинируют в виде однородной смеси по меньшей мере с одним фармацевтически приемлемым носителем, который может иметь разнообразные формы в зависимости от формы препарата, требуемого для введения. Эти фармацевтические композиции желательны в виде стандартной лекарственной формы,подходящей предпочтительно для перорального введения, ректального введения, подкожного введения или парентеральной инъекции. Например, при получении композиций в виде пероральной лекарственной формы можно применять любой из обычных жидких фармацевтических носителей, таких как, например, вода, гликоли, масла,спирты и тому подобное, в случае пероральных жидких препаратов, таких как суспензии, сиропы, эликсиры и растворы; или твердых фармацевтических носителей, таких как крахмалы, сахара, каолин, смазывающие вещества, связывающие вещества, дезинтегрирующие агенты и тому подобное, в случае порошков, пилюль, капсул и таблеток. Вследствие легкости их введения, таблетки и капсулы представляют собой наиболее подходящую пероральную дозированную лекарственную форму, в этом случае, несомненно, применяют твердые фармацевтические носители. Для парентеральных инъекционных композиций фармацевтический носитель может в основном содержать стерильную воду, хотя можно включать другие ингредиенты для повышения растворимости активного ингредиента. Инъецируемые растворы можно получить, например, с применением фармацевтического носителя, содержащего солевой раствор,раствор глюкозы или смесь обоих. Инъецируемые суспензии можно также получить с применением подходящих жидких носителей, суспендирующих агентов и тому подобное. В композициях, подходящих для чрескожного введения, фармацевтический носитель может необязательно содержать усиливающий проницаемость агент и/или подходящий смачивающий агент, необязательно комбинированный с небольшими количествами подходящих добавок, которые не оказывают значительное вредное действие на кожу. Указанные добавки могут быть выбраны для облегчения введения активного ингредиента в кожу и/или могут быть полезными для получения требуемых композиций. Эти местные композиции можно вводить различными путями, например, в виде чрескожного пластыря, нанесением пятен или в виде мази. Аддитивные соли соединений формулы (I) благодаря их повышенной растворимости в воде по сравнению с соответствующей формой основания явно являются более подходящими при получении водных композиций. Особенно подходящим является изготовление фармацевтических композиций по изобретению в дозированной лекарственной форме для легкости введения и однородности дозы. Термин "дозированная лекарственная форма", применяемый в контексте, относится к физически дискретным единицам, подходящим в качестве стандартных доз, причем каждая стандартная доза содержит предварительно опреде-6 017215 ленное количество активного ингредиента, вычисленное для продуцирования требуемого терапевтического действия, в сочетании с требуемым фармацевтическим носителем. Примерами таких дозированных лекарственных форм являются таблетки (в том числе таблетки с насечками или таблетки, покрытые оболочками), капсулы, пилюли, пакетики порошков, облатки, инъецируемые растворы или суспензии,полные чайные ложки", "полные столовые ложки" и тому подобное и их сегрегированные множества. Для перорального введения фармацевтические композиции по настоящему изобретению могут быть в форме твердых лекарственных форм, например таблеток (как проглатываемых, так и пережевываемых форм), капсул или гелевых капсул, полученных общепринятыми способами с фармацевтически приемлемыми эксципиентами и носителями, такими как связывающие агенты (например, маисовый крахмал,набухаемый в холодной воде, поливинилпирролидон, гидроксипропилметилцеллюлоза и тому подобное),наполнители (например, лактоза, микрокристаллическая целлюлоза, фосфат кальция и тому подобное),смазывающие вещества (например, стеарат магния, тальк, диоксид кремния и тому подобное), дезинтегрирующие агенты (например, картофельный крахмал, натриевая соль гликоллята крахмала и тому подобное), смачивающие агенты (например, лаурилсульфат натрия) и тому подобное. Такие таблетки могут быть также покрыты оболочкой способами, хорошо известными в данной области. Жидкие препараты для перорального введения могут быть в форме, например, растворов, сиропов или суспензий или могут быть изготовлены в виде сухого продукта для смешивания с водой и/или другим подходящим жидким носителем перед применением. Такие жидкие препараты можно получать общепринятыми способами, необязательно с другими фармацевтически приемлемыми добавками, такими как суспендирующие агенты (например, сироп сорбита, метилцеллюлоза, гидроксипропилметилцеллюлоза или гидрогенизированные пищевые жиры), эмульгирующие агенты (например, лецитин или аравийская камедь), неводные носители (например, миндальное масло, масляные сложные эфиры или этиловый спирт), подслащивающие вещества, корригенты, маскирующие агенты и консерванты (например, метили пропил-п-гидроксибензоаты или сорбиновая кислота). Фармацевтически приемлемые подслащивающие вещества, применимые в фармацевтических композициях по изобретению, содержат предпочтительно по меньшей мере одно интенсивное подслащивающее вещество, такое как аспартам, калиевую соль ацесульфама, цикламат натрия, алитам, дигидрохальконовое подслащивающее вещество, монеллин, стевиозид, сукралоза (4,1',6'-трихлор-4,1',6'тридезоксигалактосахароза) или, что предпочтительно, сахарин, натриевая или кальциевая соль сахарина, и необязательно по меньшей мере одно сыпучее подслащивающее вещество, такое как сорбит, маннит, фруктоза, сахароза, мальтоза, изомальт, глюкоза, сироп гидрированной глюкозы, ксилит, жженый сахар или мед. Интенсивные подслащивающие вещества преимущественно применяют при низких концентрациях. Например, в случае натриевой соли сахарина его концентрация может составлять от приблизительно 0,04% до 0,1% (мас./об.) конечного препарата. Сыпучее подслащивающее вещество можно эффективно применять в более высоких концентрациях, составляющих от приблизительно 10% до приблизительно 35%, предпочтительно от приблизительно 10 до 15% (мас./об.). Фармацевтически приемлемые корригенты, которые маскируют горький вкус ингредиентов в препаратах с низкой дозой, предпочтительно являются фруктовыми корригентами, такими как корригент вишни, малины, черной смородины или клубники. Сочетание двух корригентов может дать очень хорошие результаты. В препаратах с высокой дозой могут требоваться более сильные фармацевтически приемлемые корригенты, такие как Caramel Chocolate, Mint Cool, Fantasy и тому подобное. Каждый корригент может присутствовать в конечной композиции при концентрации, составляющей от приблизительно 0,05 до 1% (мас./об.). Преимущественно применяют комбинации этих сильных корригентов. Предпочтительно применяют корригент, который не подвергается какому-либо изменению или не теряет вкус и/или запах при изготовлении и применении препарата. Соединения формулы (I) можно изготовить в составе препаратов для парентерального введения инъекцией, преимущественно внутривенной, внутримышечной или подкожной инъекцией, например,инъекцией болюса или непрерывной внутривенной инфузией. Препараты для инъекции можно представить в виде дозированной лекарственной формы, например, в ампулах или контейнерах для многих доз,включающей добавленный консервант. Они могут быть в виде таких форм, как суспензии, растворы или эмульсии в масляных или водных наполнителях, и могут содержать агенты, применяемые для изготовления препаратов, такие как изотонизирующие, суспендирующие, стабилизирующие и/или диспергирующие агенты. Альтернативно активный ингредиент может присутствовать в форме порошка для смешивании с подходящим наполнителем, например, стерильной, не содержащей пирогены водой, перед применением. Соединения формулы (I) можно также изготовить в составе ректальных композиций, таких как суппозитории или удерживающие клизмы, например, суппозитории, содержащие общепринятые основы,такие как какао-масло и/или другие глицериды. Специалист по лечению заболеваний, связанных с опосредованием рецепторов каннабиноидов, может легко определить терапевтически эффективное количество соединения формулы (I) из результатов испытания, представленных ниже. В общем, предполагается, что терапевтически эффективная доза может быть от приблизительно 0,001 мг/кг до приблизительно 50 мг/кг массы тела, более предпочтительно-7 017215 от приблизительно 0,01 мг/кг до приблизительно 10 мг/кг массы тела подвергаемого лечению пациента. Может быть подходящим введение терапевтически эффективной дозы в форме двух или более субдоз при подходящих интервалах времени на протяжении дня. Указанные субдозы можно изготовить в виде дозированных лекарственных форм, причем, например, каждая содержит от приблизительно 0,1 мг до приблизительно 1000 мг, более определенно от приблизительно 1 до приблизительно 500 мг активного ингредиента на дозированную лекарственную форму. Применяемый в контексте термин "терапевтически эффективное количество" соединения является количеством соединения, которое при введении индивидууму или животному приводит к достаточно высокому уровню этого соединения в организме индивидуума или животного для индуцирования видимого ингибирования переносчиков ENT1. Точная дозировка и частота введения зависят от конкретного применяемого соединения формулы(I), конкретного состояния, подвергаемого лечению, тяжести подвергаемого лечению состояния, возраста, массы и общего физического состояния конкретного пациента, а также другого лекарственного средства, которое может принимать пациент, что хорошо известно специалисту в данной области. Кроме того, указанное "терапевтически эффективное количество" можно уменьшить или увеличить в зависимости от реакции подвергаемого лечению пациента и/или в зависимости от оценки врача, прописывающего соединения по настоящему изобретению. Интервалы эффективных суточных количеств, указанных в контексте выше, поэтому являются только рекомендациями. Экспериментальная часть В методиках, описанных ниже, применяли следующие аббревиатуры: "СН 3 ОН" означает метанол,"CH2Cl2" означает дихлорметан, "CH3CN" означает ацетонитрил, "DIPE" означает диизопропиловый эфир, "DIPEA" означает диизопропилэтиламин, "MgSO4 означает сульфат магния, "Na2SO4 означает динатриевую соль серной кислоты, "Na2CO3" означает динатриевую соль угольной кислоты, "ТГФ" означает тетрагидрофуран, "EtOH" означает этанол, "ДМФА" означает N,N-диметилформамид, "CF3COOH" означает трифторуксусную кислоту, "H2SO4" означает серную кислоту, "KOAc" означает ацетат калия,"NH3" означает аммиак, "NaBH4" означает борогидрид натрия, "NH4Cl" означает хлорид аммония,"NaOH" означает гидроксид натрия, "NaBH(OAc)3" означает триацетатогидроборат натрия, "Pd(OAc)2" означает ацетат палладия, "BINAP" означает 1,1'-[1,1'-бинафталин]-2,2'-диилбис-[1,1-дифенилфосфин],"Cs2CO3" означает карбонат цезия, "BBr3" означает трибромборан, "BF3" означает трифторборан,"K2CO3" означает карбонат калия, "Et3N" означает триэтиламин, "NH2OH" означает гидроксиламин,"NaHCO3 означает мононатриевую соль угольной кислоты, "NaOAc" означает ацетат натрия, "Et2O" означает диэтиловый эфир, "PTSA" означает п-толуолсульфоновую кислоту, "DMS" означает диметилсульфид, "LiOH" означает гидроксид лития, "HCl" означает хлористо-водородную кислоту, "Pd2(dba)3" означает трис-[-[(1,2-:4,5-)-(1E,4E)-1,5-дифенил-1,4-пентадиен-3-он]дипалладий, "HBTU" означает(1)-3-оксид 1-[бис(диметиламино)метилен]-1 Н-бензотриазолийгексафторфосфата, "NH4HCO3" означает моноаммониевую соль угольной кислоты, "CHCl3" означает трихлорметан, "HNO3" означает азотную кислоту, "CH3NH2" означает метанамин, "NH4OH" означает гидроксид аммония, "ДМСО" означает диметилсульфоксид и "NaBH3CN" означает цианоборогидрид натрия. Способы очистки высокоэффективной жидкостной хроматографией Способ очистки А. Продукт очищали высокоэффективной жидкостной хроматографией с обращенной фазой (Shandon Hyperprep C18 BDS (деактивированный основанием диоксид кремния), 8 мкм, 250 г, I.D. (внутренний диаметр) 5 см). Применяли градиент с тремя подвижными фазами (фаза А: 0,25% раствор NH4HCO3 в воде; фаза В: СН 3 ОН; фаза С: CH3CN). Нужные фракции собирали и обрабатывали. А. Синтез промежуточных продуктов. Пример А.1. Получение промежуточного продукта (1). 4'-Карбамоил-2'-хлор-5'-гидроксиацетанилид (0,081 моль) и H2SO4 (15 мл) в метаноле (150 мл) перемешивали и кипятили с обратным холодильником в течение 1 ч. Метанол выпаривали (в вакууме). Добавляли воду (100 мл). Осадок отделяли фильтрованием и сушили (в вакууме), получая при этом 15,0 г промежуточного продукта (1). Пример А.2. промежуточного продукта (2). а) Получение 1,1-Диметилэтиловый эфир 4-оксо-1-пиперидинкарбоновой кислоты (0,067 моль), промежуточный продукт (1) (0,08 моль) и пирролидин (0,0066 моль) в толуоле (200 мл) перемешивали и кипятили с об-8 017215 ратным холодильником на протяжении ночи. Толуол выпаривали. Осадок отделяли фильтрованием,промывали 3 раза DIPE (200 мл) и сушили, получая при этом 23,3 г промежуточного продукта (2).CF3COOH/CH2Cl2 (100 мл; 50/50) медленно добавляли к перемешиваемой смеси промежуточного продукта (1) (0,0407 моль) в CH2Cl2 (50 мл) и смесь перемешивали в течение 3 ч. Растворитель выпаривали. Остаток кристаллизовали из CH3CN, осадок отделяли фильтрованием и сушили, получая при этом 11,84 г промежуточного продукта (3). промежуточного продукта (4). с) Получение Промежуточный продукт (3) (0,031 моль), 2-хлорацетонитрил (0,046 моль) и DIPEA (0,155 моль) вDIPE и сушили (в вакууме), получая при этом 9,3 г промежуточного продукта (4).d) Получение промежуточного продукта (5). Смесь промежуточного продукта (4) (0,03 моль) в NH3/CH3OH (250 мл) гидрировали при 14 С с применением никеля Ренея (каталитическое количество) в качестве катализатора в присутствии раствора тиофена (1 мл). После поглощения водорода (2 эквивалента; 1500 мл водорода) катализатор отделяли фильтрованием и фильтрат выпаривали. Остаток перекристаллизовывали из CH3CN и осадок отделяли фильтрованием, получая при этом 6,6 г промежуточного продукта (5). Пример А.3. промежуточного продукта (6). а) Получение 1,4-Диокса-8-азаспиро[4.5]декан (2,1 моль) в толуоле (4200 мл) перемешивали при комнатной температуре. К реакционной смеси добавляли DIPEA (2,3 моль). К реакционной смеси медленно добавляли 2-хлорацетонитрил (2,2 моль) и затем перемешивали в течение 2 ч при 80 С. Реакционную смесь охлаждали. Затем реакционную смесь промывали 2 раза водой (2000 мл). Растворитель отделенного органического слоя выпаривали, получая при этом 175,3 г остатка. 2 отделенных водных слоя объединяли и промывали CH2Cl2 (3000 мл). Этот отделенный органический слой сушили (Na2SO4), фильтровали и растворитель выпаривали (и выпаривали вместе с толуолом), получая при этом еще 100 г остатка. Остатки объединяли и растворяли в CH3OH/NH3 и затем гидрировали с применением никеля Ренея (каталитическое количество) в качестве катализатора. После поглощения водорода (2 эквивалента) смесь фильтровали и фильтрат упаривали, получая при этом 242,1 г промежуточного продукта (6).b) Получение Смесь промежуточного продукта (6) (1,04 моль) в DIPEA (5,23 моль) и CH2Cl2 (2000 мл) перемешивали при 0C. К реакционной смеси при 0 С в течение 50 мин медленно, по каплям, добавляли 2,6 дихлорбензоилхлорид (1,25 моль). Реакционной смеси давали возможность нагреться до комнатной температуры. К реакционной смеси добавляли воду (2000 мл). Отделенный органический слой сушили(Na2SO4), фильтровали и растворитель выпаривали. Остаток растворяли в DIPE (1000 мл). Осадок отделяли фильтрованием и сушили (в вакууме), получая при этом 321 г промежуточного продукта (7). промежуточного продукта (8). с) Получение Промежуточный продукт (7) (0,180 моль) растворяли в воде (861 мл) и HCl (430 мл, 12 М). Реакционную смесь перемешивали при 80 С в течение 3 ч. Реакционную смесь выливали в 1 кг льда и подщелачивали Na2CO3. Водную смесь экстрагировали CH2Cl2. Объединенные органические слои сушили,фильтровали и растворитель выпаривали. Остаток перемешивали в течение 2 ч в DIPE, затем фильтровали и сушили в вакууме, получая при этом промежуточный продукт (8). Пример А.4. а) Получение промежуточного продукта (9). Смесь 4-амино-5-хлор-2-гидроксибензамида (8 г, 0,043 моль) в метаноле (250 мл) гидрировали с применением палладия на угле (10%) (1 г) в качестве катализатора в присутствии KOAc (5 г). После поглощения водорода (1212 мл) реакционную смесь применяли как таковую с 4-амино-2 гидроксибензамидом (0,0480 моль) и 4-амино-2-гидроксибензамидом (0,048 моль) и реакционную смесь гидрировали дополнительно при 75 С (давление водорода 101325102 Па (100 атмосфер в присутствии раствора тиофена (1 мл). После поглощения водорода катализатор отделяли фильтрованием и фильтрат упаривали. Остаток растирали с DIPE, фильтровали и сушили, получая при этом 4,8 г промежуточного продукта (9).b) Получение промежуточного продукта (10). Смесь промежуточного продукта (9) (0,0051 моль) и 1-хлор-2,5-пирролидиндиона (0,0051 моль) вCH3CN перемешивали в течение 3 ч при 50 С. Растворитель выпаривали при пониженном давлении. Добавляли воду (50 мл) и образовавшийся белый осадок отделяли фильтрованием и сушили (вакуум, 50 С,16 ч), получая при этом 0,850 г промежуточного продукта (10) (смесь 1:1 двух региоизомеров). Пример А.5. а) Получение промежуточного продукта (11). Смесь 4-амино-2-гидроксибензамида (0,039 моль) и циклопентанона (0,039 моль) в метаноле (100 мл) и ТГФ (50 мл) гидрировали при 50 С с применением палладия на угле (10%) (1 г) в качестве катализатора в присутствии раствора тиофена (0,5 мл). После поглощения водорода (1 эквивалент) катализатор отделяли фильтрованием и фильтрат упаривали. Остаток растирали с DIPE, фильтровали и сушили, получая при этом 4,1 г промежуточного продукта (11). Промежуточный продукт (12) получали по такой же методике с заменой циклопентанона формальдегидом. Получение промежуточного продукта (13). Смесь 4'-ацетил-2'-хлор-5'-гидроксиацетанилида (0,014 моль) в H2SO4 (5 мл) и метанола (100 мл) кипятили с обратным холодильником в течение 1 ч. Метанол выпаривали. Реакционную смесь нейтрализовали до рН 7 1 н. водным раствором NaOH. Эту смесь экстрагировали CH2Cl2 (100 мл). Отделенный органический слой промывали водой (100 мл) и промывали насыщенным раствором соли (100 мл). Отделенный органический слой сушили (MgSO4), фильтровали и растворитель выпаривали (в вакууме), получая при этом 1,6 г промежуточного продукта (13). Пример А.7 Получение промежуточного продукта (14). Смесь 4-амино-2-гидроксибензамида (0,0328 моль) и бензальдегида (0,0328 моль) в метаноле (100 мл) и ТГФ (50 мл) предварительно гидрировали при 50 С с применением палладия на угле (10%) (1 г) в качестве катализатора в присутствии раствора тиофена (0,5 мл). После поглощения водорода (1 эквива- 10017215 лент) реакционную смесь дополнительно подвергали реакции. К сырой реакционной смеси добавляли формальдегид (1,5 г) и всю смесь гидрировали далее (при давлении водорода 101325102 Па (100 атмосфер при 75 С. После поглощения водорода (1 эквивалент) катализатор отделяли фильтрованием и фильтрат упаривали. Остаток дебензилировали восстановительным способом гидрированием в метаноле(150 мл) с применением палладия на угле (10%) (1 г) в качестве катализатора. После поглощения водорода (1 эквивалент) катализатор отделяли фильтрованием и фильтрат упаривали, получая при этом 3,7 г промежуточного продукта (14). Пример А.8. промежуточного продукта (15). Получение Промежуточный продукт (11) (0,0122 моль) растворяли в ДМФА (20 мл). В виде одной порции добавляли 1-хлор-2,5-пирролидиндион (0,0122 моль). Реакционную смесь перемешивали в течение 16 час при 40 С. Растворитель выпаривали при пониженном давлении. К остатку добавляли воду. Осадок отделяли фильтрованием и растворяли в этилацетате. Органический раствор сушили (MgSO4), фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: этилацетат/гексан, 50:50, об./об.). Фракции продукта собирали и растворитель выпаривали, получая при этом 2,5 г промежуточного продукта (15). Промежуточный продукт (16) получали по такой же методике, но исходя из промежуточного продукта (12). промежуточного продукта (17). Получение Метиловый эфир 5-хлор-2-гидрокси-4-(1-метилэтокси)бензойной кислоты (0,0273 моль) растворяли в растворе NH3 в диоксане (0,5 н.) (300 мл) и образовавшуюся реакционную смесь перемешивали на протяжении ночи при 100 С (автоклав). Растворитель выпаривали. Остаток растворяли в 7 н. раствореNH3/CH3OH и этот раствор перемешивали при 100 С в автоклаве на протяжении ночи. Растворитель выпаривали и полученный остаток очищали колоночной хроматографией на силикагеле (элюент:CH2Cl2/CH3OH, 99/1). Фракции продукта собирали и растворитель выпаривали, получая при этом 5,14 г промежуточного продукта (17) (т. пл.: 179,5 С). Промежуточный продукт (17) получали по такой же методике, но исходя из метилового эфира 2 гидрокси-4-изопропоксибензойной кислоты. а) Получение промежуточного продукта (19). К суспензии гидрида натрия (0,0970 моль) в ДМФА (30 г), охлажденной в атмосфере аргона жидким азотом, добавляли метиловый эфир 2,4-дигидроксибензойной кислоты (0,0974 моль) в ДМФА (60 г)(реакцию проводили в 500-мл колбе вследствие устойчивого пенообразования при выделении водорода). Реакционной смеси давали возможность медленно достичь комнатной температуры с перемешиванием магнитной мешалкой. После прекращения выделения водорода смесь перемешивали в течение еще 30 мин. Затем добавляли бромциклопентан (0,1220 моль) и смесь нагревали при 100 С в течение 2 ч. ДМФА выпаривали; к остатку добавляли CH2Cl2 (100 мл); осадок отделяли фильтрованием и промывали CH2Cl2(210 мл). Объединенный раствор в CH2Cl2 выпаривали в вакууме. Сырой продукт растворяли в метаноле (20 г) и полученному раствору давали возможность кристаллизоваться при -10 С (в морозильнике) в течение 15 ч. Кристаллы отделяли фильтрованием, промывали холодным метанолом (220 мл) и сушили- 11017215 в вакууме, получая при этом 10,5 г промежуточного продукта (19) (т. пл.: 42-43 С).b) Получение Промежуточный продукт (19) (0,0797 моль) растворяли в растворе NH3 в СН 3 ОН (7 н.) (300 мл) и смесь перемешивали в автоклаве при 125 С в течение 18 ч. Затем смесь охлаждали до комнатной температуры, концентрировали и выпаривали вместе с метанолом. Остаток очищали колоночной хроматографией (элюент: CH2Cl2/CH3OH, 97/3). Фракции продукта собирали и растворитель выпаривали. Чистые фракции продукта собирали и растворитель выпаривали, получая при этом фракцию А продукта. Менее чистые фракции дополнительно очищали флэш-хроматографией (элюент: CH2Cl2/CH3OH, 99/1). Фракции продукта собирали и растворитель выпаривали, получая при этом фракцию В продукта. Неочищенные фракции продукта (смешанные фракции) также собирали и дополнительно очищали колоночной хроматографией (элюент: CH2Cl2/CH3OH, 99/1). Нужные фракции собирали и растворитель выпаривали, получая при этом фракцию С продукта. Фракции продукта А, В и С объединяли, получая при этом 8,05 г промежуточного продукта (20) (т. пл.: 146 С). Пример А.11. промежуточного продукта (21). Получение Промежуточный продукт (19) (0,0866 моль) растворяли в CH3CN (200 мл). Добавляли 1-хлор-2,5 пирролидиндион (0,0901 моль). Реакционную смесь перемешивали и кипятили с обратным холодильником в течение 16 ч. Растворитель выпаривали. Добавляли CH2Cl2 (300 мл). Смесь промывали водой (200 мл), насыщенным водным раствором NaHCO3 (200 мл), затем сушили (Na2SO4), фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: гептан/этилацетат, от 98/2 до 97/3). Нужные фракции собирали и растворитель выпаривали. Остаток выпаривали вместе с этилацетатом, затем с CH2Cl2. Остаток снова растворяли в ТГФ (110 мл) и метаноле (11 мл). К этому раствору добавляли 1 М NaOH (140 мл) и смесь нагревали до температуры флегмы (85 С) в течение 270 мин. Затем реакционную смесь охлаждали до комнатной температуры и экстрагировали Et2O (150 мл). Реакционную смесь подкисляли 6 н. HCl (25 мл) и экстрагировали этилацетатом (2150 мл). Слой этилацетата промывали насыщенным раствором соли и сушили (Na2SO4). Растворитель фильтрата выпаривали. Полученный остаток превращали в метиловый сложный эфир. Затем остаток растворяли в метаноле и по каплям добавляли H2SO4 (0,792 мл). Реакционную смесь перемешивали и кипятили с обратным холодильником в течение 3 ч. Затем добавляли еще H2SO4 (1 мл) и смесь перемешивали и кипятили с обратным холодильником в течение 1 недели. Растворитель выпаривали. Осторожно добавляли насыщенный водный раствор NaHCO3. Смесь экстрагировали этилацетатом (2150 мл). Отделенный органический слой промывали насыщенным раствором соли, сушили (Na2SO4), фильтровали и растворитель выпаривали вместе с CH2Cl2. Остаток перемешивали в 7 н. растворе NH3 в метаноле (300 мл) на протяжении ночи при 100 С в автоклаве. Затем растворитель выпаривали и остаток очищали колоночной флэшхроматографией (элюент: CH2Cl2/CH3OH). Нужные фракции собирали и растворитель выпаривали. Остаток кристаллизовали из 2-пропанола (90 мл). Осадок отделяли фильтрованием и фильтрат сохраняли на протяжении ночи при комнатной температуре. Вновь образованный осадок отделяли фильтрованием (остаток (I и растворитель фильтрата выпаривали (остаток (II. Остатки (I) и (II) снова объединяли, затем перекристаллизовывали из 2-пропанола. Осадок отделяли фильтрованием и перекристаллизовывали из 2 пропанола, затем фильтровали и сушили, получая при этом 3,69 г промежуточного продукта (21) (т. пл.: 181 С). Пример А.12. промежуточного продукта (22). Получение Промежуточный продукт (14) (0,0144 моль) растворяли в ДМФА (20 мл). В виде одной порции добавляли 1-хлор-2,5-пирролидиндион (0,0144 моль). Реакционную смесь перемешивали в течение 16 ч при 40 С. Растворитель (ДМФА) выпаривали при пониженном давлении. К остатку добавляли воду. Осадок отделяли фильтрованием и растворяли в этилацетате. Органический раствор сушили (MgSO4), фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: этилацетат/гексан, 50/50, об./об.). Фракции продукта собирали и растворитель выпаривали, получая при этом 1,53 г промежуточного продукта (22). Пример А.13. Получение промежуточного продукта (23). Триэтиламин (14 мл) добавляли к раствору 1,1-диметилэтил-4-гидроксипиперидин-1-карбоксилата(0,0670 моль) в CH2Cl2 (300 мл). В атмосфере азота медленно добавляли 4-метилбензолсульфонилхлорид(0,0740 моль). Реакционную смесь перемешивали при комнатной температуре в течение 2 ч. Добавляли воду и смесь экстрагировали, сушили, фильтровали и растворитель выпаривали. Остаток растворяли в пиридине. При 0 С добавляли 4-метилбензолсульфонилхлорид в пиридине. Реакционную смесь перемешивали при комнатной температуре на протяжении ночи в атмосфере азота. Осадок отделяли фильтрованием и растворитель фильтрата выпаривали. Остаток (фильтрат) растворяли в CH2Cl2 и экстрагировали водой. Органический слой сушили, фильтровали и растворитель выпаривали. После совместного выпаривания с толуолом остаток растворяли в гептане и осадок отделяли фильтрованием, получая при этом промежуточный продукт (23). Пример А.14. а) Получение промежуточного продукта (24). Реакцию проводили в атмосфере азота. Хлорид натрия (0,525 моль) добавляли к раствору циклопентанкарбоновой кислоты (0,105 моль) в CH2Cl2 (200 мл) при охлаждении на ледяной бане. Эту смесь кипятили с обратным холодильником в течение 2 ч и растворитель выпаривали. Остаток растворяли вCH2Cl2 (150 мл) и добавляли метиловый эфир 4-амино-5-хлор-2-метоксибензойной кислоты (0,07 моль) иEt3N (19,6 мл, 0,140 моль). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч. Растворитель выпаривали и остаток растворяли в CH2Cl2 (100 мл). Органический слой промывали водой(30 мл), насыщенным раствором соли (30 мл) и затем органический слой сушили (MgSO4), фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: петролейный эфир/CH2Cl2, от 2/1 до 0/1). Фракции продукта собирали и растворитель выпаривали, получая при этом 8 г промежуточного продукта (24).b) Получение промежуточного продукта (25). Реакцию проводили в атмосфере азота. Промежуточный продукт (24) (0,026 моль) растворяли в сухом ТГФ (150 мл). К этому раствору добавляли смесь боран/DMS (2,6 мл, 0,026 моль) и смесь перемешивали при комнатной температуре в течение 1 ч и затем кипятили с обратным холодильником в течение 12 ч. Смесь охлаждали до комнатной температуры и добавляли 1 н. HCl (50 мл). Органическую фазу отделяли и водный слой экстрагировали CH2Cl2 (2100 мл). Объединенные органические слои промывали водой (100 мл), сушили и упаривали. Остаток очищали колоночной хроматографией на силикагеле(элюент: от смеси петролейный эфир/CH2Cl2, 4/1, до 100% CH2Cl2). Фракции продукта собирали и растворитель выпаривали, получая при этом 2,8 г промежуточного продукта (25). с) Получение промежуточного продукта (26). Промежуточный продукт (25) (0,0235 моль) растворяли в сухом ТГФ (147 мл). К этому раствору добавляли LiOH/H2O (147 мл) и реакционную смесь перемешивали в течение 24 ч при 50 С. Затем смесь охлаждали до комнатной температуры и органический растворитель выпаривали. Осадок отделяли фильтрованием и добавляли CH2Cl2. Смесь подкисляли HCl (концентрированной) до полного растворения осадка. Водный слой экстрагировали CH2Cl2 (250 мл). Объединенные органические слои сушили,фильтровали и растворитель выпаривали. Остаток промывали диизопропиловым эфиром, получая при этом 6,00 г промежуточного продукта (26).d) Получение Реакцию проводили в атмосфере азота. Промежуточный продукт (26) (0,0194 моль) растворяли в- 13017215 сухом CH2Cl2 (100 мл). К раствору добавляли 4-метилморфолин (0,0213 моль) и эту смесь охлаждали до 0 С на ледяной бане. Затем медленно добавляли 2-метилпропилхлорформиат (0,0388 моль) и реакционную смесь перемешивали в течение 30 мин при 0 С и затем перемешивали при комнатной температуре в течение 1 ч. В смесь при 0 С на протяжении 30 мин вводили NH3 и затем CH2Cl2 выпаривали, получая при этом 10,6 г промежуточного продукта (27). е) Получение промежуточного продукта (28). Промежуточный продукт (27) (0,0194 моль) растворяли в 1-метил-2-пирролидиноне (100 мл). К этому раствору добавляли пиперазин (0,194 моль) и реакционную смесь перемешивали в течение 16 ч при 140 С. Затем 1-метил-2-пирролидинон выпаривали и к остатку добавляли воду. Осадок отделяли фильтрованием и растворяли в этилацетате. Этот раствор сушили, осушающий агент отделяли фильтрованием и растворитель выпаривали. Остаток промывали смесью петролейного эфира и диизопропилового простого эфира (1/1, об./об.), получая при этом 3,8 г промежуточного продукта (28). Пример А.15. промежуточного продукта (29). а) Получение Раствор метилового эфира 4-бром-2-метоксибензойной кислоты (0,1 моль) и тетрагидро-2 Н-пиран 4-амина (0,3 моль) в 1-метил-2-пирролидиноне (800 мл) перемешивали при 40 С. Добавляли Cs2CO3 (0,2 моль). Реакционную смесь перемешивали в течение 5 мин. Добавляли Pd2(dba)3 (0,002 моль) и BINAP(0,003 моль). Реакционный раствор дегазировали чередующимся применением атмосферы азота и вакуума. Реакционную смесь перемешивали на протяжении ночи при 110 С. Растворитель 1-метил-2 пирролидинон выпаривали. Остаток очищали высокоэффективной жидкостной хроматографией. Фракции продукта собирали и растворитель выпаривали, получая при этом 13 г промежуточного продукта (2 9).b) Получение промежуточного продукта (30). Раствор промежуточного продукта (29) (0,049 моль) и 1-хлор-2,5-пирролидиндиона (0,044 моль) вCH3CN (150 мл) перемешивали и кипятили с обратным холодильником при 100 С в течение 3 ч. Растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (градиентное элюирование; элюент: петролейный эфир/этилацетат, от 100/0 до 50/50). Фракции продукта собирали и растворитель выпаривали, получая при этом 7 г промежуточного продукта (30). с) Получение промежуточного продукта (31). Промежуточный продукт (30) (0,0233 моль) растворяли в ТГФ (100 мл). Добавляли LiOH/H2O (2 н.)(300 мл). Реакционную смесь перемешивали на протяжении ночи при 50 С. Растворитель (ТГФ) выпаривали, рН изменяли до рН 8. Добавляли CH2Cl2 (250 мл). Органический слой отделяли, промывали водой(2), сушили (Na2SO4), фильтровали и растворитель выпаривали при пониженном давлении, получая при этом 6,58 г промежуточного продукта (31).d) Получение Промежуточный продукт (31) (0,0227 моль) растворяли в CH2Cl2 (200 мл), раствор защищали введением газообразного азота. Добавляли 4-метилморфолин (0,02497 моль). Раствор перемешивали в течение нескольких минут. По каплям добавляли 2-метилпропилхлорформиат (0,02497 моль). Образовавшуюся реакционную смесь перемешивали в течение 30 мин при комнатной температуре. В раствор вводили NH3 до исчезновения всего исходного вещества. Реакционную смесь перемешивали в течение получаса. Растворитель выпаривали. Остаток сушили в вакууме, получая при этом 7 г промежуточного промежуточного продукта (33). е) Получение Промежуточный продукт (32) (0,021 моль) растворяли в 1-метил-2-пирролидиноне (120 мл). Добавляли пиперазин (0,21 моль). Реакционную смесь перемешивали на протяжении ночи при 140 С. Растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: петролейный эфир/этилацетат, градиент от 100/0 до 50/50). Фракции продукта собирали и растворитель выпаривали,получая при этом 4,5 г промежуточного продукта (33). Пример А.16.HBTU (0,012 моль) добавляли порциями к смеси 5-хлор-4-(диметиламино)-2-метоксибензойной кислоты (0,010 моль), DIPEA (2 мл) и ДМФА (20 мл) и затем перемешивали в течение 1 ч при комнатной температуре. Реакционную смесь охлаждали до -10 С на бане лед/EtOH. Добавляли NH3 в диоксане (0,5 М) (40 мл) и реакционной смеси давали возможность нагреться до комнатной температуры. Реакционную смесь перемешивали при комнатной температуре в течение 30 мин. Растворитель выпаривали. Остаток растворяли в воде (100 мл) и перемешивали в течение 30 мин при комнатной температуре. Осадок отделяли фильтрованием. Остаток перемешивали в CH3CN. Осадок отделяли фильтрованием и сушили(вакуум), получая при этом 1,7 г промежуточного продукта (34).b) Получение Промежуточный продукт (34) (0,0074 моль) и пиперазин (0,0223 моль) в 1-метил-2-пирролидиноне(7 мл) перемешивали в течение 16 ч при 140 С. Реакционную смесь охлаждали до комнатной температуры и затем выливали в воду (100 мл). Реакционную смесь подкисляли 1 н. водным раствором HCl. Осадок отделяли фильтрованием и сушили (вакуум), получая при этом 1,1 г промежуточного продукта (35). Пример А.17.DIPEA (0,100 моль) в ДМФА (100 мл) перемешивали в течение одного часа при комнатной температуре. Реакционную смесь охлаждали на бане лед-этанол и добавляли NH4HCO3 (0,050 моль). Реакционную смесь перемешивали на протяжении ночи при комнатной температуре. Смесь выливали в смесь лед-вода(500 мл). Образовавшийся осадок отделяли фильтрованием и сушили, получая при этом 1,760 г промежуточного продукта (36).b) Получение Смесь промежуточного продукта (36) (0,010 моль) и пиперазина (0,030 моль) в 1-метил-2 пирролидиноне (10 мл) перемешивали в течение 20 ч при 140 С в закрытом реакционном сосуде. Смесь выливали в смесь лед-вода (180 мл), затем нейтрализовали 1 н. HCl. Эту смесь перемешивали на протяжении времени от субботы до понедельника при комнатной температуре. Осадок отделяли фильтрованием и сушили, получая при этом 1,413 г промежуточного продукта (37). Пример А.18. промежуточного продукта (38). а) Получение Смесь метилового эфира 4-амино-2-метоксибензойной кислоты (0,138 моль) и 1-ацетил-4 пиперидинона (0,14 моль) в метаноле (300 мл) гидрировали при 100 С (107 Па (100 бар в течение 32 ч с- 15017215 применением палладия на угле (10%) (3 г) в качестве катализатора в присутствии раствора тиофена (1 мл). После поглощения водорода (1 эквивалент) катализатор отделяли фильтрованием через дикалит и растворитель фильтрата выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: сначала 100% этилацетат и затем смесь CH2Cl2/CH3OH, 95:5). Фракции продукта собирали и растворитель выпаривали, получая при этом 41,5 г промежуточного продукта (38).b) Получение Промежуточный продукт (38) (0,13 моль) в ДМФА (500 мл) нагревали до 60 С. В виде порций добавляли 1-хлор-2,5-пирролидиндион (0,13 моль) и реакционную смесь перемешивали при 60 С в течение 3 ч. Реакционную смесь охлаждали до комнатной температуры и затем растворитель выпаривали. Остаток перемешивали в воде. Эту смесь экстрагировали 2 раза этилацетатом. Растворитель отделенного органического слоя выпаривали. Остаток перекристаллизовывали из этилацетата, осадок отделяли фильтрованием и сушили (вакуум), получая при этом 16,5 г промежуточного продукта (39). промежуточного продукта (40). с) Получение 1 н. NaOH (водный раствор) (0,094 моль) добавляли к смеси промежуточного продукта (39) (0,047 моль) в ТГФ (188 мл) и воды (94 мл) и затем перемешивали в течение 16 ч при комнатной температуре. Реакционную смесь подкисляли до рН 7. Растворитель выпаривали и остаток растворяли в воде. Осадок отделяли фильтрованием и затем перекристаллизовывали из CH3CN. Этот осадок отделяли фильтрованием и затем сушили (вакуум), получая при этом 7,3 г промежуточного продукта (40).HBTU (0,0106 моль) добавляли к смеси промежуточного продукта (40) (0,00887 моль) в DIPEA(0,0106 моль) и ДМФА (20 мл) и перемешивали в течение 1 ч при комнатной температуре. Реакционную смесь охлаждали до 0-5 С на ледяной бане. К реакционной смеси добавляли NH3 в диоксане (0,5 М) (35 мл) и реакционной смеси давали возможность медленно нагреться до комнатной температуры. Эту смесь перемешивали в течение 1 ч при комнатной температуре. Растворитель выпаривали. Остаток растворяли в воде (100 мл). Осадок отделяли фильтрованием, получая при этом фракцию А. Фильтрат снова экстрагировали этилацетатом. Этот отделенный органический слой и фракцию А объединяли и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2/(CH3OH/NH3), от 100/0 до 97/3). Фракции продукта собирали и растворитель выпаривали. Остаток перекристаллизовывали из CH3CN, осадок отделяли фильтрованием и сушили (вакуум), получая при этом 1,9 г промежуточного продукта (41). промежуточного продукта (42). е) Получение Промежуточный продукт (41) (0,0058 моль), пиперазин (0,018 моль) и 1-метил-2-пирролидинон (6 мл) перемешивали в течение 16 ч при 140 С. Реакционную смесь охлаждали до комнатной температуры и затем выливали в воду (100 мл). Эту смесь подкисляли 1 н. водным раствором HCl. Осадок отделяли фильтрованием и сушили (вакуум), получая при этом 1,5 г промежуточного продукта (42). Пример А.19. а) Получение промежуточного продукта (43). Реакцию проводили в потоке азота. 1-Метил-2-пирролидинон (40 мл) добавляли к смеси метилового эфира 4-бром-2-метоксибензойной кислоты (0,040 моль) и 1-(трет-бутилоксикарбонил)пиперазина(0,048 моль). Смесь перемешивали до полного растворения. Затем добавляли Cs2CO3 (0,06 моль). Реакционную смесь нагревали до 40 С. Затем добавляли Pd2(dba)3 (0,0004 моль) и 98% BINAP (0,0012 моль). Затем реакционную смесь энергично перемешивали в течение 16 ч при 110 С. Реакционную смесь охлаждали до комнатной температуры и затем выливали в воду (200 мл). Затем реакционную смесь экстрагировали этилацетатом (2 цикла). Растворитель отделенного органического слоя выпаривали. Остаток растворяли в CH2Cl2. Затем смесь сушили, фильтровали и CH2Cl2 выпаривали. Остаток очищали колоночной- 16017215 хроматографией на силикагеле (элюент: CH2Cl2/СН 3 ОН, от 100/0 до 98/2). Фракции продукта собирали и растворитель выпаривали. Остаток перекристаллизовывали из DIPE. Осадок отделяли фильтрованием и сушили (вакуум), получая при этом 8 г промежуточного продукта (43).b) Получение Смесь промежуточного продукта (43) (0,0078 моль) и 1-хлор-2,5-пирролидиндиона (0,0078 моль) вCH3CN (50 мл) перемешивали в течение 16 ч при кипячении с обратным холодильником. Затем реакционную смесь охлаждали до комнатной температуры и растворитель выпаривали. Остаток промывали водой и экстрагировали CH2Cl2. Растворитель отделенного органического слоя выпаривали. Остаток очищали высокоэффективной жидкостной хроматографией. Фракции продукта собирали и растворитель выпаривали. Остаток растворяли в гексане. Осадок отделяли фильтрованием и сушили (вакуум), получая при этом 1,8 г промежуточного продукта (44). промежуточного продукта (45). с) Получение 1 н. NaOH (водный раствор) (0,00935 моль) добавляли к смеси промежуточного продукта (44)(18 мл). Реакционную смесь перемешивали в течение 16 ч при комнатной температуре. Затем растворитель выпаривали. Остаток перемешивали в воде (10 мл). Смесь подкисляли 1 н. HCl (водный раствор) (9 мл). Осадок отделяли фильтрованием и снова растворяли в DIPE. Затем перекристаллизованный осадок отделяли фильтрованием и сушили (вакуум), получая при этом 1,5 г промежуточного продуктаDIPEA (0,020 моль) добавляли к смеси промежуточного продукта (45) (0,0088 моль) и HBTU (0,010 моль) в ДМФА (50 мл), перемешивали при комнатной температуре. Реакционную смесь перемешивали в течение одного часа при комнатной температуре. Реакционную смесь охлаждали на бане лед-этанол и добавляли раствор NH3 в диоксане (0,5 М) (0,020 моль). Реакционную смесь перемешивали в течение 1 ч при охлаждении на бане лед-этанол, затем в течение 3 ч при комнатной температуре. Растворитель выпаривали. Остаток перемешивали на протяжении ночи в смеси вода/CH3CN, затем образовавшийся осадок отделяли фильтрованием и сушили, получая при этом 3,27 г промежуточного продукта (46). промежуточного продукта (47). е) Получение Смесь промежуточного продукта (46) (0,003 моль) и пиперазина (0,009 моль) в 1-метил-2 пирролидиноне (3 мл) перемешивали в течение 16 ч при 140 С в закрытом реакционном сосуде. Смесь выливали в воду (10 мл), затем нейтрализовали уксусной кислотой. Эту смесь перемешивали на протяжении времени от субботы до понедельника при комнатной температуре. Осадок отделяли фильтрованием и сушили, получая при этом 0,825 г промежуточного продукта (47). Пример A.20. промежуточного продукта (48). Получение Смесь 1,1-диметилэтилового эфира 4-4-(аминокарбонил)-2-хлор-5-метоксифенил]амино]-1 пиперидинкарбоновой кислоты (0,021 моль) и пиперазина (0,063 моль) в 1-метил-2-пирролидиноне (21 мл) перемешивали в течение 16 ч при 140 С. Реакционную смесь охлаждали до комнатной температуры,затем выливали в смесь лед-вода (300 мл). Смесь подкисляли до рН 4 уксусной кислотой. Образовавшийся осадок отделяли фильтрованием, промывали водой, затем растворяли в CH2Cl2. Отделенный органический слой сушили (MgSO4), фильтровали и растворитель выпаривали. Остаток перемешивали вDIPE, фильтровали и сушили в вакууме, получая при этом 7,3 г промежуточного продукта (48). Пример А.21. промежуточного продукта (49). а) Получение Смесь метилового эфира 4-амино-2-метоксибензойной кислоты (0,29 моль) и циклопентанона (52 мл) в толуоле (400 мл) гидрировали в течение 20 ч при 130 С (давление водорода 490,5 Па (50 кг с применением палладия на угле (10%) (3 г) в качестве катализатора в присутствии 4% раствора тиофена(2 мл). После поглощения водорода (1 эквивалент) катализатор отделяли фильтрованием через дикалит и фильтрат выпаривали, получая при этом 72 г промежуточного продукта (49).b) Получение Раствор промежуточного продукта (49) (0,29 моль) и NaOH (1,5 моль) в воде (1000 мл) перемешивали и кипятили с обратным холодильником в течение 2 ч. Реакционный раствор охлаждали и образовавшийся осадок отделяли фильтрованием и перекристаллизовывали из 2-пропанола. Осадок отделяли фильтрованием и сушили, получая при этом 51,7 г промежуточного продукта (50). с) Получение промежуточного продукта (51). 1-Хлор-2,5-пирролидиндион (0,00935 моль) добавляли к смеси промежуточного продукта (50)(0,00850 моль) в ДМФА (40 мл) и эту реакционную смесь перемешивали в течение 16 ч при комнатной температуре. Реакционную смесь выливали в воду (300 мл) и всю реакционную смесь перемешивали в течение 3 ч при комнатной температуре. Осадок отделяли фильтрованием, промывали водой, перемешивали в DIPE, фильтровали и сушили (вакуум). Полученную фракцию перекристаллизовывали из смесиDIPE/CH3CN. Остаток отделяли фильтрованием и сушили (вакуум), получая при этом 1,0 г промежуточного продукта (51).DIPEA (0,050 моль) добавляли к смеси промежуточного продукта (51) (0,035 моль) в ДМФА (р.а.)(150 мл). К реакционной смеси порциями добавляли HBTU (0,035 моль) и смесь перемешивали в течение 1 ч при комнатной температуре. Реакционную смесь охлаждали на бане лед/EtOH. Добавляли растворNH3 в диоксане (0,5 М) (100 мл) и смесь перемешивали в течение 1 ч на бане лед/EtOH. Реакционную смесь перемешивали еще 12 ч при комнатной температуре. Растворитель выпаривали. Остаток перемешивали в смеси ледяная вода/некоторое количество CH3CN. Осадок отделяли фильтрованием и сушили,получая при этом 11,56 г промежуточного продукта (52). промежуточного продукта (53). е) Получение Смесь промежуточного продукта (52) (0,010 моль) и пиперазина (0,030 моль) в 1-метил-2 пирролидиноне (10 мл) перемешивали в течение 16 ч при 140 С. Реакционную смесь выливали в воду и затем нейтрализовали до рН 7 уксусной кислотой. Смесь перемешивали на протяжении времени от субботы до понедельника при комнатной температуре. Осадок отделяли фильтрованием и сушили, получая при этом 1,960 г промежуточного продукта (53). Пример А.22. а) Получение промежуточного продукта (54). Реакцию проводили в потоке азота. 1-Метил-2-пирролидинон (32 мл) добавляли к смеси метилового эфира 4-бром-2-метоксибензойной кислоты (98%) (0,032 моль) и морфолина (0,038 моль). Смесь перемешивали до полного растворения. Затем добавляли Cs2CO3 (0,048 моль). Реакционную смесь нагрева- 18017215 ли до 40 С. Затем добавляли Pd2(dba)3 (0,00032 моль) и BINAP (98%) (0,00096 моль). Затем реакционную смесь перемешивали в течение 16 ч при 110 С. Реакционную смесь охлаждали до комнатной температуры и затем выливали в воду (200 мл). Затем реакционную смесь экстрагировали этилацетатом (2 цикла). Растворитель отделенного органического слоя выпаривали. Остаток растворяли в CH2Cl2, раствор сушили, фильтровали и упаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент:CH2Cl2/CH3OH, от 100/0 до 98/2). Фракции продукта собирали и растворитель выпаривали. Остаток кристаллизовали из DIPE. Осадок отделяли фильтрованием и сушили (вакуум), получая при этом 3,8 г промежуточного продукта (54).b) Получение 1-Хлор-2,5-пирролидиндион (0,014 моль) добавляли к смеси промежуточного продукта (54) (0,014 моль) в CH3CN (100 мл). Реакционную смесь перемешивали в течение 16 ч при 40 С. Затем растворитель выпаривали. Остаток кристаллизовали из DIPE. Осадок отделяли фильтрованием и сушили, получая при этом 2,6 г промежуточного продукта (55). промежуточного продукта (56). с) Получение 1 н. NaOH (водн. раствор) (0,0182 моль) добавляли к смеси промежуточного продукта (55) (0,0091 моль) в воде (18 мл) и ТГФ (36 мл). Реакционную смесь перемешивали в течение 16 ч при комнатной температуре. Затем растворитель выпаривали. Остаток перемешивали в воде (40 мл). Смесь нейтрализовали 1 н. HCl (водный раствор) (9 мл). Осадок отделяли фильтрованием и промывали водой. Затем осадок сушили (вакуум), получая при этом 2,3 г промежуточного продукта (56).d) Получение Реакцию проводили в потоке азота. HBTU (0,024 моль) добавляли к смеси промежуточного продукта (56) (0,020 моль) и DIPEA (0,026 моль) в ДМФА (100 мл) и смесь перемешивали при комнатной температуре в течение 1 ч. Реакционную смесь затем охлаждали на ледяной бане до 5 С. К реакционной смеси по каплям добавляли раствор NH3 в диоксане (0,5 М) (0,040 моль) и затем смесь перемешивали в течение 2 ч при комнатной температуре. Растворитель выпаривали и остаток растворяли в этилацетате. Смесь промывали водой. Растворитель отделенного органического слоя выпаривали. Этот остаток перемешивали в CH3CN, осадок отделяли фильтрованием и сушили, получая при этом 5,4 г промежуточного продукта (57). промежуточного продукта (58). е) Получение Смесь промежуточного продукта (57) (0,01 моль) и пиперазина (0,03 моль) в 1-метил-2 пирролидиноне (10 мл) перемешивали в течение 16 ч при 140 С. Реакционную смесь охлаждали до комнатной температуры и затем выливали в воду (100 мл). Реакционную смесь подкисляли 1 н. HCl (водный раствор) до рН 6. Смесь фильтровали и остаток на фильтре перемешивали в DIPE. Этот осадок отделяли фильтрованием и сушили (вакуум), получая при этом 1,4 г промежуточного продукта (58). Пример А.23. промежуточного продукта (59). а) Получение Метиловый эфир 4-амино-2-метоксибензойной кислоты (0,3 моль) растворяли в перемешиваемомCHCl3 (1000 мл) при нагревании. Смесь охлаждали до 35 С. По каплям добавляли тиофосген (0,39 моль) и образовавшуюся реакционную смесь медленно нагревали до температуры флегмы, затем перемешивали и кипятили с обратным холодильником на протяжении ночи. Реакционную смесь охлаждали,затем выливали в смесь лед-вода. Органический слой отделяли промывали три раза водой, сушили,фильтровали и растворитель выпаривали. Остаток очищали вакуумной перегонкой (т. кип. при 26,66 Па(0,2 мм Hg): 138 С), получая при этом 56,5 г промежуточного продукта (59). промежуточного продукта (60).(59) (0,24 моль) (экзотермическая температура повышалась до 60 С). Начиналось осаждение. Реакционную смесь перемешивали на протяжении ночи, позволяя ей охладиться до комнатной температуры.- 19017215 Растворитель выпаривали, получая при этом 80 г промежуточного продукта (60). промежуточного продукта (61). с) Получение 10% HCl (480 мл) добавляли к промежуточному продукту (60) (0,24 моль). Реакционную смесь нагревали (до 90 С). Образовывалось твердое вещество. При 90 С добавляли воду (300 мл). Смеси давали возможность медленно охладиться до комнатной температуры. Образовавшийся осадок отделяли фильтрованием, промывали водой, петролейным эфиром и сушили. Одну часть этой фракции (I) снова подвергали реакции в 10% HCl (480 мл). Реакционную смесь перемешивали и кипятили с обратным холодильником в течение 45 мин, затем охлаждали на ледяной бане и образовавшийся осадок отделяли фильтрованием, промывали небольшим количеством воды, затем петролейным эфиром и сушили, получая при этом фракцию (Ia). Другую часть фракции (I) снова подвергали реакции в 10% HCl (480 мл). Реакционную смесь перемешивали и кипятили с обратным холодильником в течение 45 мин, затем охлаждали на ледяной бане и образовавшийся осадок отделяли фильтрованием, промывали небольшим количеством воды, затем петролейным эфиром и сушили, получая при этом фракцию (Ib). Обе фракции продукта (Ia) и (Ib) объединяли, получая при этом 50,7 г промежуточного продукта (61).d) Получение промежуточного продукта (62).HNO3 (53,13 мл) добавляли в воду (127,8 мл). Добавляли NaNO2 (0,42 г) (экзотермическая температура повышалась до 35 С). При 30-35 С порциями добавляли промежуточный продукт (61) (0,106 моль), позволяя температуре сохраняться между 30 и 35 С (реакция экзотермическая; происходило испарение, начало осаждения). После завершения добавления промежуточного продукта (61) реакционную смесь медленно нагревали до 45 С. Реакционную смесь перемешивали в течение 15 мин при 45 С, затем охлаждали до комнатной температуры и образовавшийся осадок отделяли фильтрованием, промывали небольшим количеством воды, затем переносили в небольшое количество воды. Смесь подщелачивали до полного растворения. Добавляли воду (когда необходимо). Смесь подкисляли HCl и образовавшийся осадок отделяли фильтрованием и сушили, получая при этом 18,5 г промежуточного продукта (62). е) Получение промежуточного продукта (63). Смесь промежуточного продукта (62) (0,014 моль) и DIPEA (0,031 моль) в ДМФА (70 мл) перемешивали при комнатной температуре. Добавляли HBTU (0,016 моль). Реакционную смесь перемешивали в течение одного часа при комнатной температуре, затем охлаждали до 5 С на ледяной бане и по каплям добавляли раствор NH3 в диоксане (0,5 М) (56 мл). Реакционную смесь перемешивали в течение 30 мин при 5 С. Смеси давали возможность нагреться до комнатной температуры, затем перемешивали при комнатной температуре в течение 2 ч. Растворитель выпаривали. Остаток переносили в воду. Образовавшийся осадок отделяли фильтрованием, промывали водой, перемешивали в CH3CN, отделяли фильтрованием и сушили (вакуум), получая при этом 2,9 г промежуточного продукта (63).f) Получение Смесь промежуточного продукта (63) (0,013 моль) и пиперазина (0,040 моль) в 1-метил-2 пирролидиноне (13 мл) перемешивали в течение 16 ч при 140 С, затем охлаждали до комнатной температуры, выливали в воду (100 мл), затем подкисляли 1 н. HCl до рН приблизительно 4. Образовавшийся осадок отделяли фильтрованием, промывали водой и сушили (вакуум), получая при этом 1,6 г промежуточного продукта (64). Пример А.24. промежуточного продукта (5). а) Получение Смесь метилового эфира 4-амино-5-хлор-2-метоксибензойной кислоты (0,020 моль), 1,3-дибромпропана (40 мл) и DIPEA (6,6 мл) перемешивали в течение 2 ч при 140 С. Реакционную смесь разбавляли CH2Cl2 и затем промывали водой. Отделенный органический слой сушили (MgSO4), фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент:CH2Cl2/СН 3 ОН, от 100/0 до 99/1). Фракции продукта собирали и растворитель выпаривали. Остаток перемешивали в DIPE. Осадок отделяли фильтрованием и сушили, получая при этом 3,770 г промежуточного продукта (65).b) Получение промежуточного продукта (66). Смесь промежуточного продукта (65) (0,020 моль) в CH3NH2 в метаноле (2 М) (60 мл) перемешивали в течение 24 ч при 50 С в герметизированном сосуде. Растворитель реакционной смеси выпаривали. Остаток очищали высокоэффективной жидкостной хроматографией (стандартное градиентное элюирование с буфером NH4HCO3). Фракции продукта собирали и растворитель выпаривали, получая при этом 5 г промежуточного продукта (66). промежуточного продукта (67). с) Получение Ди-трет-бутилдикарбонат (0,020 моль) в CH2Cl2 (р.а.) (20 мл) добавляли капля за каплей к смеси промежуточного продукта (66) (0,0175 моль) и DIPEA (0,020 моль) в CH2Cl2 (80 мл) и смесь перемешивали при комнатной температуре. Реакционную смесь промывали дважды ледяной водой. Отделенный органический слой сушили (MgSO4), фильтровали и растворитель выпаривали, получая при этом 7,2 г промежуточного продукта (67).d) Получение Смесь промежуточного продукта (67) (0,0175 моль) и LiOHH2O (0,035 моль) в воде (50 мл) и диоксане (150 мл) перемешивали в течение 2 ч при 50 С и затем на протяжении ночи при комнатной температуре. Реакционную смесь перемешивали еще 4 ч при 50 С и затем на протяжении ночи при комнатной температуре. Растворитель выпаривали. Остаток растворяли в холодной воде и затем нейтрализовали 1 н.HCl (водный раствор) (135 мл). Осадок отделяли фильтрованием и сушили, получая при этом 5,53 г промежуточного продукта (68).HBTU (0,015 моль) добавляли порциями к перемешиваемой смеси промежуточного продукта (68)(0,0147 моль) и DIPEA (0,030 мл) в ДМФА (100 мл) и смесь перемешивали в течение 1 ч при комнатной температуре. Реакционную смесь охлаждали на бане EtOH/лед. К реакционной смеси добавляли порциями 10 мл раствор NH3 в диоксане (0,5 М) (0,030 моль) и смесь перемешивали в течение 2 ч на ледяной бане. Затем реакционную смесь перемешивали на протяжении ночи при комнатной температуре. Растворитель выпаривали. Остаток перемешивали в ледяной воде с некоторым количеством CH3CN. Осадок отделяли фильтрованием и сушили, получая при этом 5,3 г промежуточного продукта (69).f) Получение Смесь промежуточного продукта (69) (0,003 моль) и пиперазина (0,009 моль) в 1-метил-2 пирролидиноне (3 мл) перемешивали в течение 16 ч при 140 С. Реакционную смесь выливали в воду и затем нейтрализовали 1 н. водным раствором HCl и уксусной кислотой. Эту смесь экстрагировалиCH2Cl2. Растворитель отделенного водного слоя выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: гексан/этилацетат, от 90/10 до 50/50). Фракции продукта собирали и растворитель выпаривали, получая при этом 0,8 г промежуточного продукта (70). Пример А.25. промежуточного продукта (71). а) Получение Смесь метилового эфира 4-амино-5-хлор-2-метоксибензойной кислоты (0,1 моль), 2-(3 бромпропил)-1H-изоиндол-1,3(2 Н)-диона (0,1 моль) и йодида калия (каталитическое количество) вDIPEA (16,5 мл) перемешивали в течение 2 ч при 130 С. Реакционную смесь перемешивали на протяжении ночи при комнатной температуре. К реакционной смеси снова добавляли 2-(3-бромпропил)-1 Низоиндол-1,3(2 Н)-дион (0,056 моль) и DIPEA (10 мл) и смесь перемешивали в течение 4 ч при 130 С.- 21017215 Реакционную смесь выливали в воду и затем перемешивали в воде (200 мл) и CH3CN (200 мл). Осадок отделяли фильтрованием и сушили, получая при этом 26,1 г промежуточного продукта (71).b) Получение Смесь промежуточного продукта (71) (0,027 моль) и NH4OH (110 мл) перемешивали в течение 2 ч при 125 С в микроволновой печи. Растворитель выпаривали. Остаток перемешивали в кипящей смесиCH3OH/CH3CN и затем перемешивали на протяжении ночи. Осадок отделяли фильтрованием и сушили,получая при этом 8,17 г промежуточного продукта (72). промежуточного продукта (73). с) Получение Смесь промежуточного продукта (72) (0,020 моль), ацетилацетата (40 мл) и CH2Cl2 (6,6 мл) перемешивали в течение 2 ч при 140 С. Реакционную смесь разбавляли CH2Cl2 и затем промывали водой. Отделенный органический слой сушили (MgSO4), фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH, от 100/0 до 99,1). Фракции продукта собирали и растворитель выпаривали. Остаток перемешивали в DIPE. Осадок отделяли фильтрованием и сушили, получая при этом 3,76 г промежуточного продукта (73).d) Получение промежуточного продукта (74). Смесь промежуточного продукта (73) (0,013 моль) и пиперазина (0,039 моль) в 1-метил-2 пирролидиноне (13 мл) перемешивали в течение 20 ч при 140 С. К реакционной смеси добавляли еще некоторое количество пиперазина (0,0395 моль) и смесь перемешивали в течение 24 ч при 140 С. Реакционную смесь охлаждали и выливали в ледяную воду (200 мл). Реакционную смесь фильтровали и остаток выгружали. Фильтрат нейтрализовали уксусной кислотой. Осадок отделяли фильтрованием и сушили, получая при этом 2,42 г промежуточного продукта (74). Пример А.26. промежуточного продукта (75). а) ПолучениеBBr3 (50 мл) медленно по каплям на протяжении 15 мин добавляли к раствору 2-бром-1-хлор-4 метоксибензола (0,448 моль) в CH2Cl2 (600 мл), перемешиваемому при -20 С. Образовавшуюся реакционную смесь перемешивали в течение 20 мин при -20 С, затем ее нагревали до комнатной температуры и перемешивали в течение одного часа при комнатной температуре, получая при этом 85 г промежуточного продукта (75). промежуточного продукта (76).b) Получение Ацетилхлорид (0,036 моль) добавляли медленно к раствору промежуточного продукта (75) (0,024 моль) и Et3N (0,024 моль) в сухом CH2Cl2 (60 мл). Образовавшуюся реакционную смесь перемешивали и кипятили с обратным холодильником в течение 12 ч, затем охлаждали до комнатной температуры, промывали 2,5 M водным раствором NaOH, затем 2,5 М водным раствором HCl. Органический слой отделяли, сушили (Na2SO4), фильтровали и растворитель выпаривали, получая при этом 4,9 г промежуточного продукта (76). промежуточного продукта (77). с) Получение Колбу загружали промежуточным продуктом (76) (0,24 моль) и комплексом уксусная кислотатрифторид бора (2:1) (320 мл). Реакционный раствор перемешивали и кипятили с обратным холодильником в течение 3 ч, затем охлаждали до комнатной температуры. Смесь (содержащую осадок) распределяли между CH2Cl2 и водой. Водный слой экстрагировали дважды CH2Cl2. Органические слои объединяли,промывали водой, затем очищали препаративной тонкослойной хроматографией. Фракции продукта собирали и растворитель выпаривали, получая при этом 33 г промежуточного продукта (77).d) Получение Колбу загружали промежуточным продуктом (77) (0,008 моль), Pd2(dba)3 (0,366 г), BINAP (0,398 г) и Cs2CO3 (0,012 моль). Затем добавляли тетрагидро-2 Н-пиран-4-амин (0,012 моль). Смесь растворяли в- 22017215 ДМФА. Реакционный раствор перемешивали в течение 13 ч при 120 С. Смесь разбавляли этилацетатом(3 х). Органическую фазу промывали насыщенным раствором соли (2 х). Объединенные органические слои сушили, фильтровали и растворитель выпаривали в вакууме. Остаток очищали препаративной высокоэффективной жидкостной хроматографией. Фракции продукта делали щелочными (рН 8-9) добавлением твердого NaHCO3. Добавляли хлорид натрия. Водную фазу промывали этилацетатом (2 х). Объединенные органические слои промывали водой (2 х), сушили (Na2SO4), фильтровали и растворитель выпаривали. Остаток сушили в высоком вакууме, получая при этом 2,16 г промежуточного продукта (78). Пример А.27. промежуточного продукта (79). Получение Колбу загружали промежуточным продуктом (77) (0,012 моль), Pd2(dba)3 (0,549 г), BINAP (0,597 г) и Cs2CO3 (0,018 моль). Затем добавляли 1-метилпиперазин (0,018 моль). Смесь растворяли в ДМФА. Реакционный раствор перемешивали в течение 13 ч при 120 С. Смесь разбавляли этилацетатом (3 х). Органическую фазу промывали насыщенным раствором соли (3 х). Водную фазу промывали дважды этилацетатом. Объединенные органические слои сушили, фильтровали и растворитель выпаривали в вакууме. Остаток очищали колоночной хроматографией, затем препаративной высокоэффективной жидкостной хроматографией. Органическую смесь после очистки насыщали хлоридом натрия. Водную фазу промывали 1 н. NaOH и этилацетатом (2 х). Органический слой отделяли, промывали водой, сушили, фильтровали и растворитель выпаривали в вакууме. Остаток сушили в высоком вакууме, получая при этом 1 г промежуточного продукта (79). Пример А.28. Получение промежуточного продукта (80). Колбу загружали промежуточным продуктом (77) (0,012 моль), Pd2(dba)3 (0,549 г), BINAP (0,597 г) и Cs2CO3 (0,018 моль). Затем добавляли 2-метоксиэтанамин (0,018 моль). Смесь растворяли в ДМФА. Реакционный раствор перемешивали в течение 13 ч при 120 С. Смесь разбавляли этилацетатом (3 х). Органическую фазу промывали насыщенным раствором соли (3 х). Водную фазу промывали дважды этилацетатом. Объединенные органические слои сушили, фильтровали и растворитель выпаривали в вакууме. Остаток очищали колоночной хроматографией, затем препаративной высокоэффективной жидкостной хроматографией. Органическую смесь после очистки насыщали хлоридом натрия. Водную фазу промывали 1 н. NaOH и этилацетатом (2 х). Органический слой отделяли, промывали водой, сушили,фильтровали и растворитель выпаривали в вакууме. Остаток сушили в высоком вакууме, получая при этом 0,600 г промежуточного продукта (80). Пример А.29. а) Получение промежуточного продукта (81). 2,6-Диметилбензойную кислоту (0,0666 моль) растворяли в сухом CH2Cl2 (150 мл). Добавляли каплю ДМФА. В атмосфере азота при комнатной температуре по каплям добавляли тионилхлорид (0,33 моль). Реакционную смесь перемешивали и кипятили с обратным холодильником в течение одного часа. Растворитель выпаривали при пониженном давлении. Остаток сушили (в вакууме, создаваемом масляным насосом), получая при этом промежуточный хлорангидрид кислоты, который растворяли в сухомCH2Cl2 (30 мл), получая при этом раствор (I). Раствор (I) добавляли к раствору 1,4-диокса-8 азаспиро[4.5]декан-8-этанамина (0,0733 моль) и Et3N (0,0666 моль) в сухом CH2Cl2 (150 мл). Реакционную смесь перемешивали и кипятили с обратным холодильником в течение 90 мин. Реакционную смесь охлаждали, промывали насыщенным водным раствором NaHCO3 (30 мл), промывали водой (30 мл), сушили (Na2SO4), фильтровали и растворитель выпаривали при пониженном давлении, получая при этом 23 г промежуточного продукта (81).b) Получение Смесь промежуточного продукта (81) (0,066 моль) и HCl (80 мл) в воде (160 мл) перемешивали и кипятили с обратным холодильником в течение 3 ч. Смесь выливали в лед. Эту смесь делали щелочной до рН 9 добавлением Na2CO3, затем экстрагировали CH2Cl2. Органический слой фильтровали и обрабатывали при пониженном давлении. Остаток сушили в вакууме, получая при этом 17,20 г промежуточного продукта (82). промежуточного продукта (83). Получение Раствор 1-(5-хлор-2,4-дигидроксифенил)этанона (0,0320 моль), K2CO3 (8,87 г) и йодида натрия (0,24 г) в ДМФА (60 мл) перемешивали. Добавляли 2-бромпропан (0,0320 моль). Реакционную смесь перемешивали при 60 С в течение 12 ч. Растворитель выпаривали. Остаток растворяли в CH2Cl2, промывали водой. Органический слой упаривали. Остаток очищали колоночной хроматографией (элюент:CH2Cl2/гептан, 98/2). Фракции продукта собирали, растворитель выпаривали, получая при этом 0,55 г промежуточного продукта (83). Пример А.31.NaHCO3 (9 г) растворяли в сухом CH2Cl2. Растворитель выпаривали. Реакционную смесь нагревали в течение 8 ч при 120 С, затем охлаждали до комнатной температуры и разбавляли CH2Cl2. Органическую смесь промывали водой. Отделенный органический слой сушили, фильтровали и растворитель выпаривали, получая при этом 14,6 г промежуточного продукта (84). Пример А.32. Получение промежуточного продукта (85). Смесь метилового эфира метилового эфира 4-амино-5-хлор-2-метоксибензойной кислоты (0,069 моль), 1-бром-3-метоксипропана (0,088 моль) и DIPEA (0,069 моль) перемешивали в течение 2 ч при 150 С. Затем раствор охлаждали до комнатной температуры и добавляли CH2Cl2. Раствор промывали водой, затем насыщенным раствором соли и затем снова водой. Органический слой сушили, фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией (элюент: смесь петролейный эфир/CH2Cl2, от 1/1 до 0/1). Нужные фракции собирали и растворитель выпаривали. Остаток сушили, получая при этом 10 г промежуточного продукта (85).LiOH в воде (1 М) (80 мл) добавляли к раствору промежуточного продукта (85) (0,0279 моль) в ТГФ(120 мл) и затем смесь перемешивали на протяжении ночи при 40 С. Растворитель выпаривали. Концентрат нейтрализовали до рН 7. Осадок отделяли фильтрованием и сушили (вакуум), получая при этом 4,5 г промежуточного продукта (86). с) Получение промежуточного продукта (87). Реакцию проводили в потоке азота. 4-Метилморфолин (0,0370 моль) добавляли к раствору промежуточного продукта (86) (0,0340 моль) в сухом CH2Cl2 (100 мл). Затем к реакционной смеси медленно добавляли 2-метилпропилхлорформиат и смесь перемешивали при 0 С в течение 30 мин. Реакционную смесь перемешивали в течение 30 мин при комнатной температуре. К реакционной смеси при 0 С в течение 30 мин добавляли NH3. Растворитель выпаривали, получая при этом 10 г промежуточного продукта (87).d) Получение Раствор промежуточного продукта (87) (0,0370 моль) и пиперазина (0,370 моль) в 1-метил-2 пирролидиноне (200 мл) перемешивали при 140 С в течение 14 ч. Растворитель выпаривали. К сырому продукту добавляли воду и эту смесь экстрагировали 3 раза этилацетатом. Отделенный органический- 24017215 слой сушили (MgSO4), фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на диоксиде кремния (элюент: смесь петролейный эфир/CH2Cl2, от 50/50 до 0/100). Фракции требуемого продукта собирали и растворитель выпаривали, получая при этом 7 г промежуточного продукта (88). Пример А.33.(0,9600 моль) растворяли в CH2Cl2 (200 мл). Реакционную смесь перемешивали при комнатной температуре на протяжении ночи. Смесь промывали водой. Органические слои собирали и растворитель выпаривали, получая при этом 21,5 г промежуточного продукта (89).b) Получение 1-(5-Хлор-2,4-дигидроксифенил)этанон (0,0550 моль) растворяли в ДМСО (150 мл), добавляли промежуточный продукт (89) (0,0660 моль) и NaHCO3 (11 г). Реакционную смесь перемешивали при 100 С в течение 3 ч. Добавляли воду. Осадок отделяли фильтрованием и промывали водой, получая при этом промежуточный продукт (90). Пример А.34. Получение промежуточного продукта (91). Смесь N-[5-(ацетилокси)-2-метилфенил]ацетамида (0,087 моль), трихлорида алюминия (0,27 моль) и хлорида натрия (4 г) перемешивали при 160 С в течение 2 ч. Реакционную смесь охлаждали. Добавляли лед. Реакционную смесь экстрагировали дихлорметаном, органический слой отделяли, сушили,фильтровали и растворитель фильтрата удаляли выпариванием. Остаток сушили в вакууме, получая при этом 9 г промежуточного продукта (91). Пример А.35.(23) (0,0730 моль) и K2CO3 (10,1 г) в ДМСО (200 мл) перемешивали при 125 С. Растворитель выпаривали. Остаток промывали водой и CH2Cl2. Растворитель отделенного органического слоя выпаривали, получая при этом 15 г промежуточного продукта (92).b) Получение Смесь промежуточного продукта (92) (0,0375 моль), 2 н. LiOH (500 мл) и ТГФ (150 мл) перемешивали в течение 12 ч при комнатной температуре. К реакционной смеси добавляли HCl до рН между 6 и 7. Реакционную смесь экстрагировали простым эфиром. Растворитель отделенного органического слоя выпаривали, получая при этом 10 г промежуточного продукта (93). с) Получение промежуточного продукта (94). Ди-1 Н-имидазол-1-илметанон (0,0143 моль) добавляли в виде порций к перемешиваемому раствору промежуточного продукта (93) (0,0119 моль) в сухом CH2Cl2 (150 мл) и смесь затем перемешивали в течение 1 ч при комнатной температуре. Эту реакционную смесь добавляли по каплям к раствору NH3 в- 25017215 метаноле (7 н.) (200 мл) в пределах 30 мин. Реакционную смесь перемешивали в течение 1 ч при 0 С и затем 2 ч при комнатной температуре. Растворитель выпаривали, получая при этом промежуточный продукт (94).d) Получение Смесь промежуточного продукта (94) (0,0130 моль) и пиперазина (0,1169 моль) в 1-метил-2 пирролидиноне (50 мл) перемешивали в течение 16 ч при 140 С. Пиперазин и 1-метил-2-пирролидинон выпаривали (вакуум). Остаток очищали колоночной хроматографией (элюент: от смеси петролейный эфир/CH2Cl2, 50/50, до CH2Cl2 и затем смесь CH2Cl2/этилацетат, 4/1). Фракции нужного продукта собирали и растворитель выпаривали, получая при этом 4,1 г промежуточного продукта (95). Пример А.36. Получение промежуточного продукта (96). Смесь 1,1-диметилэтилового эфира 4-4-(аминокарбонил)-2-хлор-5-метоксифенил]амино]-1 пиперидинкарбоновой кислоты (0,021 моль) и пиперазина (0,063 моль) в 1-метил-2-пирролидиноне (21 мл) перемешивали в течение 16 ч при 140 С. Реакционную смесь охлаждали до комнатной температуры,затем выливали в смесь лед-вода (300 мл). Смесь подкисляли до рН 4 уксусной кислотой. Образовавшийся осадок отделяли фильтрованием, промывали водой, затем растворяли в CH2Cl2. Отделенный органический слой сушили (MgSO4), фильтровали и растворитель выпаривали. Остаток перемешивали вDIPE, фильтровали и сушили в вакууме, получая при этом 7,3 г промежуточного продукта (96). Пример А.37. а) Получение промежуточного продукта (97). Раствор 1-хлор-2,5-пирролидиндиона (0,2270 моль) в ДМФА добавляли по каплям к раствору метилового эфира 4-амино-2-гидроксибензойной кислоты (0,2510 моль) в ДМФА и перемешивали на протяжении ночи при 40 С. Растворитель выпаривали. Остаток очищали высокоэффективной жидкостной хроматографией. Фракции нужного продукта собирали и промывали водным раствором Na2CO3 до достижения рН 8-9. Добавляли CH2Cl2 (1000 мл). Отделенный органический слой дважды промывали водой,сушили (MgSO4), фильтровали и растворитель выпаривали, получая при этом 14 г промежуточного продукта (97).b) Получение Раствор промежуточного продукта (97) (0,0496 моль) в СН 3 ОН (600 мл), насыщенный NH3, перемешивали в автоклаве при 125 С в течение 14 ч. Реакционную смесь охлаждали до комнатной температуры и растворитель выпаривали. Остаток промывали DIPE, получая при этом 8,5 г промежуточного продукта (98). Пример А.38. а) Получение промежуточного продукта (99). 1-(2,4-Дигидрокси-5-метилфенил)этанон (0,0120 моль) и 2-бромпропан (0,0120 моль) растворяли в 2-бутаноне (8 мл). Добавляли K2CO3 (0,0210 моль), йодид калия (каталитическое количество) и ДМСО(1,5 мл). Реакционную смесь перемешивали и кипятили с обратным холодильником в течение 5 ч. Смесь охлаждали до 40 С и разбавляли водой (22 мл). Продукт экстрагировали толуолом (2 раза по 30 мл). Раствор в толуоле промывали 0,5 н. NaOH (2 раза по 20 мл), 1 раз 1 н. HCl (20 мл) и 2 раза водой (20 мл). Органический слой сушили, фильтровали и растворитель выпаривали, получая при этом 1,3 г промежуточного продукта (99). Пример А.39. Получение- 26017215 К хорошо перемешиваемой смеси 20% NaOH (водный раствор) (500 мл) и бензола (200 мл) при+3 С (баня лед-соль); затем в течение 20 мин добавляли раствор 2,6-дихлорбензоилхлорида (0,3320 моль) в бензоле (50 мл), поддерживая температуру ниже +7 С. Образовавшуюся смесь перемешивали в течение 15 мин при 20 С. Осажденный продукт отделяли фильтрованием, промывали водой (5200 мл) до рН приблизительно 7, сушили и затем растворяли в CH3CN (200 мл); раствор обрабатывали активированным углем, концентрировали до 135 г и давали продукту возможность кристаллизоваться в течение 15 ч при+25 С и затем в течение 2 ч при -10 С. Кристаллы декантировали, сушили в вакууме, затем растирали до степени мелкозерненного порошка и сушили при 100 С и 5,665 Па (0,05 мм Hg) в течение 1 ч, получая при этом 82 г промежуточного продукта (100) (т. пл.: 110-111 С). Пример А.40. промежуточного продукта (101). а) Получение Смесь промежуточного продукта (91) (0,0220 моль), 1,1-диметилэтилового эфира 4-оксо-1 пиперидинкарбоновой кислоты (0,0250 моль) и пирролидина (0,0480 моль) в метаноле (150 мл) перемешивали при 80 С в течение 20 ч. Реакционную смесь охлаждали, фильтровали и растворитель выпаривали. Остаток распределяли между CH2Cl2 и 1 н. NaOH. Органический слой отделяли, сушили (MgSO4),фильтровали и растворитель выпаривали. Остаток суспендировали в DIPE и CH3CN, отделяли фильтрованием, затем сушили в вакууме при 50 С, получая при этом 3,5 г промежуточного продукта (101).b) Получение промежуточного продукта (102). Промежуточный продукт (101) (0,0130 моль) в ТГФ (100 мл) перемешивали в атмосфере азота. Добавляли гидрид натрия (0,0170 моль). Реакционную смесь перемешивали при 50 С в течение 15 мин. Добавляли 1-бром-3-метоксипропан (0,0250 моль). Реакционную смесь перемешивали и кипятили с обратным холодильником в течение 20 ч. Добавляли дополнительный 1-бром-3-метоксипропан. Растворитель выпаривали. Остаток распределяли между CH2Cl2 и водой. Органический слой отделяли, сушили(MgSO4), фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH, 98/2). Фракции продукта собирали и растворитель выпаривали, получая при этом 4,5 г промежуточного продукта (102). промежуточного продукта (103). с) Получение Смесь промежуточного продукта (102) (0,0100 моль), 6 н. HCl (17 мл) и EtOH (50 мл) перемешивали и кипятили с обратным холодильником в течение 3 ч, затем охлаждали и EtOH выпаривали. Водный слой делали щелочным 50% NaOH (при охлаждении). Смесь экстрагировали CH2Cl2. Отделенный органический слой сушили (MgSO4), фильтровали и растворитель выпаривали, получая при этом 1,8 г промежуточного продукта (103). Пример А.41. а) Получение промежуточного продукта (104). Промежуточный продукт (101) (0,0103 моль) в ТГФ перемешивали в атмосфере азота. Добавляли гидрид натрия (0,0120 моль) и смесь затем перемешивали при 40 С в течение 15 мин. Затем добавляли йодметан (0,0200 моль) и смесь перемешивали при кипячении с обратным холодильником в течение 20 ч. Реакционную смесь охлаждали и растворитель выпаривали. Остаток растворяли в смеси CH2Cl2/вода. Органический слой отделяли, сушили (MgSO4), фильтровали и растворитель выпаривали. Остаток очищали колоночной хроматографией (диоксид кремния, элюент: CH2Cl2/CH3OH, 98/2). Фракции продукта собирали и растворитель выпаривали, получая при этом 3 г промежуточного продукта (104).- 27017215 Смесь промежуточного продукта (104) (0,0075 моль), 6 н. HCl (15 мл) и EtOH (50 мл) кипятили с обратным холодильником в течение 20 ч. Реакционную смесь охлаждали, EtOH выпаривали, остаток делали щелочным 50% NaOH при охлаждении. Эту смесь экстрагировали CH2Cl2, органический слой отделяли, сушили (MgSO4), фильтровали и растворитель выпаривали. Остаток суспендировали в DIPE, фильтровали и сушили в вакууме, получая при этом 1,9 г промежуточного продукта (105). Пример А.42. а) Получение промежуточного продукта (106). К смеси промежуточного продукта (101) (0,0050 моль) и EtOH (25 мл) добавляли 6 н. HCl (7 мл) и образовавшуюся реакционную смесь перемешивали и кипятили с обратным холодильником в течение 1 ч. Реакционную смесь охлаждали и растворитель EtOH выпаривали. Водный кислотный концентрат делали щелочным 50% NaOH при охлаждении на ледяной бане. Твердое вещество отделяли фильтрованием, промывали водой и сушили в вакууме при 50 С, получая при этом 1 г промежуточного продуктаb) Получение Смесь ди-трет-бутилдикарбоната и CHCl3 (5 мл) добавляли к смеси промежуточного продукта (106)(0,0040 моль) и CHCl3 (10 мл) при 0 С. Реакционную смесь перемешивали в течение 5 мин и промывали водой. Органический слой отделяли, сушили (MgSQ4), фильтровали и растворитель выпаривали. Остаток суспендировали в DIPE и сушили в вакууме при 50 С, получая при этом 1 г промежуточного продукта с) Получение промежуточного продукта (108). Циклопентанкарбоксальдегид (0,0080 моль) добавляли к смеси промежуточного продукта (107)(0,0060 моль), CH2Cl2 (120 мл) и уксусной кислоты (1,2 мл), затем добавляли изопропоксид титана (избыток) и реакционную смесь перемешивали в течение 30 мин при комнатной температуре. ДобавлялиNaBH3CN (0,5 г) и реакционную смесь перемешивали в течение 2 ч при комнатной температуре. Смесь промывали 1 н. раствором NaOH. Органический слой отделяли, сушили (MgSO4), фильтровали и растворитель выпаривали. Остаток суспендировали в DIPE, получая при этом 2,5 г промежуточного продуктаd) Получение К смеси промежуточного продукта (108) (0,0060 моль) и CHCl3 (25 мл) на ледяной бане добавляли трифторуксусную кислоту (20 мл). Реакционную смесь перемешивали при комнатной температуре в течение 1 ч и растворитель выпаривали. Остаток промывали смесью CH2Cl2/1 н. NaOH, затем органический слой отделяли, сушили (MgSO4), фильтровали и растворитель выпаривали, получая при этом 1,8 г промежуточного продукта (109). Пример А.43. промежуточного продукта (110). Получение 1-(2,4-Дигидрокси-5-метилфенил)этанон (0,024 моль) и бромциклопентан (2,7 мл) растворяли в 2 бутаноне (16 мл). Добавляли K2CO3 (5,8 г), йодид калия (каталитическое количество) и ДМСО (3 мл). Реакционную смесь перемешивали и кипятили с обратным холодильником в течение 5 ч. Смесь охлаждали до 40 С и разбавляли водой (50 мл). Продукт экстрагировали толуолом (дважды по 30 мл). Раствор в толуоле промывали 0,5 н. NaOH (дважды по 20 мл), 1 н. HCl (один раз 20 мл) и водой (дважды по 20 мл). Органический слой отделяли, сушили, фильтровали и растворитель выпаривали, получая при этом 3,5 г промежуточного продукта (110). Пример А.44. Получение промежуточного продукта (111). 1-(2,4-Дигидрокси-5-метилфенил)этанон (0,018 моль) и промежуточный продукт (23) (0,019 моль) растворяли в 2-бутаноне (12 мл). Добавляли K2CO3 (4,4 г), йодид калия (каталитическое количество) и ДМСО (2,2 мл). Реакционную смесь перемешивали и кипятили с обратным холодильником на протяжении ночи. Смесь охлаждали до 40 С и разбавляли водой (50 мл). Продукт экстрагировали толуолом (2 раза по 30 мл). Раствор в толуоле промывали 0,5 н. NaOH (дважды по 20 мл), 1 н. HCl (один раз 20 мл) и водой (дважды по 20 мл). Органический слой сушили, фильтровали и растворитель выпаривали, получая при этом 4,9 г промежуточного продукта (111). Пример А.45. промежуточного продукта (112). а) Получение Промежуточный продукт (101) (0,013 моль) в ТГФ (150 мл) перемешивали в потоке азота. Добавляли гидрид натрия (0,017 моль). Реакционную смесь перемешивали при 50 С в течение 15 мин. Добавляли 3-бром-1-пропанол (0,025 моль). Реакционную смесь перемешивали и кипятили с обратным холодильником в течение 20 ч, затем охлаждали и растворитель выпаривали. Остаток распределяли между CH2Cl2 и водой. Органический слой отделяли, сушили (MgSO4), фильтровали и растворитель фильтрата выпаривали. Остаток очищали колоночной хроматографией на силикагеле (элюент: CH2Cl2/CH3OH, 98/2). Фракции продукта собирали и растворитель выпаривали, получая при этом 1,8 г промежуточного продуктаb) Получение промежуточного продукта (113). Смесь промежуточного продукта (112) (0,004 моль) и 6 н. HCl (5,4 мл) в EtOH (20 мл) перемешивали и кипятили с обратным холодильником в течение 2 ч. Реакционную смесь охлаждали и растворитель этанол выпаривали. Водный концентрат делали щелочным 50% NaOH. Растворитель выпаривали. Остаток перемешивали в смеси CH2Cl2 (+ СН 3 ОН) /немного воды + хлорид натрия. Смесь перемешивали и фильтровали. Отделенный органический слой сушили (MgSO4), фильтровали и растворитель выпаривали, получая при этом 0,7 г промежуточного продукта (113). Пример А.46. промежуточного продукта (114). а) Получение К смеси 1-(2,4-дигидрокси-5-метилфенил)этенона (12,035 ммоль) и этилового эфира 4-(4 метилфенил)сульфонил]окси]циклогексанкарбоновой кислоты (12,035 ммоль) в 2-бутаноне (8 мл) добавляли йодид калия (каталитическое количество), карбонат калия (3 г) и ДМСО (2 мл). Реакционную смесь кипятили с обратным холодильником в течение 20 ч и охлаждали. Добавляли воду, реакционную смесь экстрагировали толуолом. Органический слой промывали 1 н. гидроксидом натрия, сушили (MgSO4),фильтровали и растворитель выпаривали, получая при этом 1,7 г промежуточного продукта (114). Пример А.47. а) Получение промежуточного продукта (115). 2-Гидрокси-5-метилбензойную кислоту (328,6 ммоль) растворяли в серной кислоте (концентрированная, 175 мл). Смесь охлаждали до 0 С. По каплям добавляли смесь азотной кислоты (концентрированной, 15,2 мл) и серной кислоты (концентрированной, 15,2 мл). Смесь перемешивали при 20 С в течение еще 7 ч. Смесь фильтровали и остаток экстрагировали этилацетатом. Органический слой промывали водой (100 мл, х 3), сушили (Na2SO4), фильтровали, выпаривали. Продукт сушили в вакууме при 60 С в течение 8 ч, получая при этом 30 г промежуточного продукта (115).
МПК / Метки
МПК: A61K 31/537, A61P 29/00, C07D 491/10, C07D 498/10
Метки: ингибиторы, переносчика, нуклеозидов, равновесного
Код ссылки
<a href="https://eas.patents.su/30-17215-ingibitory-ravnovesnogo-perenoschika-nukleozidov-ent1.html" rel="bookmark" title="База патентов Евразийского Союза">Ингибиторы равновесного переносчика нуклеозидов ent1</a>
Предыдущий патент: Столб и конструкция, содержащая столб
Следующий патент: Термически обработанный гальваноотожженный стальной материал и способ его производства
Случайный патент: Штамм blakeslea trispora и способ его применения












